Изобретение относится к области органической химии, а именно к новым индивидуальным соединениям класса пиразоло[3,4-b]пиридина и к способу их получения, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в фармакологии в качестве потенциальных лекарственных средств.
Известны структурные аналоги заявленных соединений - диметил 4-амино-3-метилтио-1-фенил-1H-пиразоло[3,4-b]пиримидин-5,6-дикарбоксилаты, получаемые взаимодействием диметилового эфира ацетилендикарбоновой кислоты с 5-амино-3-метилтио-1-фенил-1H-пиразол-4-карбонитрилом (Tominaga, Yoshinori, Yoshioka, Noriko, Seigo; Aoyama, Norihito; Masunari, Toshiyuki; Miike, Akira // Tetrahedron Letters, 1995, Vol 36, No 47, P.8641-8644) no схеме:
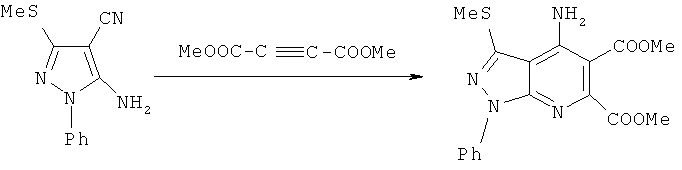
К недостаткам данного способа относится невозможность получения метил 3-метил-5-[2-оксо-2-(4-ариламино)ацетил]-1,6-дифенил-1H-пиразоло[3,4-b]пиридин-4-карбоксилатов и метил 3-метил-5-[2-оксо-2-(4-ариламино)ацетил]-6-стирил-1-фенил-1H-пиразоло[3,4-b]пиридин-4-карбоксилатов.
Задачей изобретения является разработка простого способа синтеза неописанных в литературе метил 3-метил-5-[2-(4-ариламино)-2-оксоацетил]-1,6-дифенил-1H-пиразоло[3,4-b]пиридин-4-карбоксилатов и метил 3-метил-5-[2-(4-ариламино)-2-оксоацетил]-6-стирил-1-фенил-1H-пиразоло[3,4-b]пири-дин-4-карбоксилатов.
Поставленная задача осуществляется путем взаимодействия метил 1-арил-3-бензоил-4,5-диоксо-4,5-дигидро-1H-пиррол-2-карбоксилатов (Ia-в) и метил 1-арил-4,5-диоксо-3-циннамоил-4,5-дигидро-1H-пиррол-2-карбоксила-тов (1г-е) с 5-амино-3-метил-1-фенил-1H-пиразолом (II) в среде инертного апротонного растворителя по схеме:
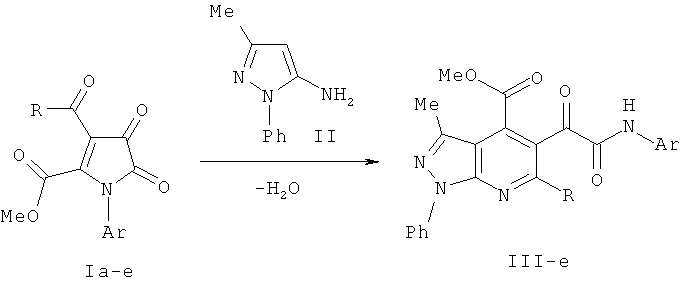
I, III: R=Ph, Ar=C6H4Me-4 (а), C6H4Cl-4 (б), C6H4Br-4 (в); R=Ph-CH=CH, Ar=Ph (г), C6H4Me-4 (д), C6H4OMe-4 (е).
Процесс ведут при температуре 80-84°C, а в качестве растворителя используют абсолютный бензол или 1,2-дихлорэтан.
Из патентной и технической литературы не были выявлены способы получения метил 3-метил-5-[2-(4-ариламино)-2-оксоацетил]-1,6-дифенил-1H-пиразоло[3,4-b]пиридин-4-карбоксилатов и метил 3-метил-5-[2-(4-ариламино)-2-оксоацетил]-6-стирил-1-фенил-1H-пиразоло[3,4-b]пиридин-4-карбоксилатов, имеющие сходные признаки с заявленным способом, а именно, не использовались исходные продукты, растворители, в которых проходит реакция, и интервал температур, на основании чего можно сделать вывод о соответствии заявленного технического решения критерию «новизна» и «изобретательский уровень».
Изобретение иллюстрируется следующими примерами.
Пример 1. Метил 3-метил-5-[2-(4-метилфениламино)-2-оксоацетил]-1,6-дифенил-1H-пиразоло[3,4-6]пиридин-4-карбоксилат (IIIa).
К раствору 1.0 ммоль метил 3-бензоил-1-(4-метилфенил)-4,5-диоксо-4,5-дигидро-1H-пиррол-2-карбоксилата (Ia) в 20 мл абсолютного бензола добавляли 1.0 ммоль 5-амино-3-метил-1-фенил-1H-пиразола (II), кипятили 1 ч, охлаждали, образовавшийся осадок отфильтровывали и перекристаллизовывали из толуола. Выход 80%, т.пл. 195-196°C.
Соединение (IIIa) C30H24N4O4.
Найдено, %: C 71.44; H 4.75, N 11.12.
Вычислено, %: C 71.42; H 4.79, N 11.10.
Соединение (IIIa) - бледно-желтое кристаллическое вещество, легкорастворимое в ДМСО и ДМФА, трудно растворимое в обычных органических растворителях, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (IIIa), снятом в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний группы NH при 3364 см-1, метоксикарбонильной группы при 1727 см-1, кетонной и амидной карбонильных групп оксамоильного фрагмента при 1698 и 1686 см-1.
В спектре ЯМР 1H соединений (IIIa), снятом в растворе ДМСО-d6, кроме сигналов протонов ароматических колец присутствуют синглеты двух метальных групп при 2.26 м.д. и 2.64 м.д., синглет протонов метоксикарбонильной группы при 3.94 м.д. и синглет протона группы NH при 10.74 м.д.
Пример 2. Метил 3-метил-5-[2-оксо-2-(4-хлорфениламино)ацетил]-1,6-дифенил-1H-пиразоло[3,4-6]пиридин-4-карбоксилат (IIIб).
К раствору 1.0 ммоль метил 3-бензоил-1-(4-хлорфенил)-4,5-диоксо-4,5-дигидро-1H-пиррол-2-карбоксилата (16) в 20 мл абсолютного 1,2-дихлорэтана добавляли 1.0 ммоль 5-амино-3-метил-1-фенил-1H-пиразола (II), кипятили 1 ч охлаждали, образовавшийся осадок отфильтровывали и перекристаллизовывали из 1,2-дихлорэтана. Выход 83%, т.пл. 252-253°C.
Соединение (IIIб) C29H21ClN4O4.
Найдено, %: C 66.35; H 4.03, Cl 6.75 N 10.67
Вычислено, %: C 66.37; H 4.00, Cl 6.74 N 10.69.
Соединение (IIIб) - бледно-желтое кристаллическое вещество, легкорастворимое в ДМСО и ДМФА, трудно растворимое в обычных органических растворителях, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (IIIб), снятом в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний группы NH при 3352 см-1, метоксикарбонильной группы при 1739 см-1, кетонной и амидной карбонильных групп оксамоильного фрагмента при 1705 и 1687 см"1
В спектре ЯМР 1H соединений (IIIб), снятом в растворе ДМСО-d6, кроме сигналов протонов ароматических заместителей присутствуют синглетные сигналы протонов метальной и метоксикарбонильной группы при 2.64 и 3,94 м.д. соответственно и группы NH при 10.96 м.д.
Соединения (IIIв-е) синтезировали аналогично.
Предлагаемый способ прост в осуществлении, одностадиен и позволяет получить неописанные в литературе метил 3-метил-5-[2-(4-ариламино)-2-оксоацетил]-1,6-дифенил-1H-пиразоло[3,4-b]пиридин-4-карбоксилаты и метил 3-метил-5-[2-(4-ариламино)-2-оксоацетил]-6-стирил-1-фенил-1H-пиразоло[3,4-b]пиридин-4-карбоксилаты с хорошими выходами, которые найдут применение в качестве исходных продуктов для синтеза гетероциклических систем и в фармакологии в качестве потенциальных лекарственных средств.
Пример 3. Фармакологическое исследование метил 3-метил-5-[2-оксо-2-(4-метилфениламино)ацетил]-1,6-дифенил-1H-пиразоло[3,4-b]пиридин-4-карбоксилата (IIIа), метил 5-[2-оксо-2-(4-хлорфениламино)ацетил]-3-метил-1,6-дифенил-1H-пиразоло[3,4-b]пиридин-4-карбоксилата (IIIб) и метил 3-метил-5-[2-(4-метилфениламино]-2-оксоацетил)-6-стирил-1-фенил-1H-пиразоло[3,4-b]пиридин-4-карбоксилата (IIIд) на наличие анальгетической активности.
Анальгетическую активность соединений (IIIа, б, д) изучали на беспородных мышах массой 18-22 г с помощью теста «горячая пластинка» [Radell Z.O., Selitto J.J. A method for measurement of analgesic activity on inflamed tissue. // Arch. Intermat. Pharmacodun. Et ther. 1957. - Vol.11. - №4 - S.409-419].
Исследуемые соединения вводили внутрибрюшинно в виде 2% крахмальной слизи в дозе 50 мг/кг за 0,5 ч до помещения животных на нагретую до 53,5°C металлическую пластинку. Показателем болевой чувствительности служила длительность пребывания животного на горячей пластинке до момента облизывания задних лапок, измеряемая в секундах. Эффект сравнивали с метамизолом натрия
Статическую обработку экспериментального материала проводили с использованием t критерия Стьюдента (М.Л. Беленький, Элементы количественной оценки фармакологического эффекта. - 2-е изд. - Л., 1963. - с.152). Эффект считали достоверным при p<0,05.
Проведенные исследования показали (см. таблицу), что соединения (IIIа, б, д) обладают анальгетической активностью. Следовательно, предлагаемые соединения (IIIа, б, д) могут найти применение в медицинской практике в качестве анальгетического лекарственного средства.
Изобретение относится к новым индивидуальным соединениям класса пиразоло[3,4-b] пиридина и к способу их получения, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в фармакологии. Описываются метил 3-метил-5-[2-(4-ариламино)-2-оксоацетил]-1,6-дифенил-1Н-пиразоло[3,4-b]пиридин-4-карбоксилаты и метил 3-метил-5-[2-(4-ариламино)-2-оксоацетил]-6-стирил-1-фенил-1Н-пиразоло[3,4-b]пиридин-4-карбоксилаты общей формулы, приведенной ниже, где R=Ph, Ar=С6Н4Ме-4 (а), С6Н4С1-4 (б), C6H4Br-4 (в); R=Ph-CH=CH, Ar=Ph (г), С6Н4Ме-4 (д), C6H4OMe-4 (е). Технический результат - синтез не описанных в литературе метил 3-метил-5-[2-(4-ариламино)-2-оксоацетил]-1,6-дифенил-1Н-пиразоло[3,4-b]пиридин-4-карбоксилатов и метил 3-метил-5-[2-(4-ариламино)-2-оксоацетил]-6-стирил-1-фенил-1Н-пиразоло[3,4-b]пиридин-4-карбоксилатов, которые обладают анальгетической активностью. 2 н. и 2 з.п. ф-лы. 1 табл., 3 пр.
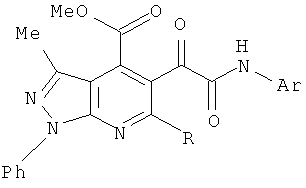
1. Метил 6-арил-3-метил-5-[2-(4-ариламино)-2-оксоацетил]-1-фенил-1Н-пиразоло[3,4-b]пиридин-4-карбоксилаты и метил 3-метил-5-[2-(4-ариламино)-2-оксоацетил]-6-стирил-1-фенил-1Н-пиразоло[3,4-b]пиридин-4-карбоксилаты формулы
где R=Ph, Ar=С6Н4Ме-4 (а), C6H4Cl-4 (б), C6H4Br-4 (в); R=Ph-CH=CH, Ar=Ph (г), С6Н4Ме-4 (д), C6H4OMe-4 (е).
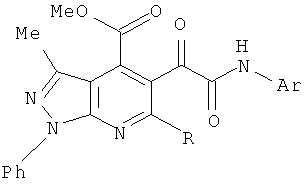
2. Способ получения метил 3-метил-5-[2-(4-ариламино)-2-оксоацетил]-1,6-дифенил-1Н-пиразоло[3,4-b]пиридин-4-карбоксилатов и метил 3-метил-5-[2-(4-ариламино)-2-оксоацетил]-6-стирил-1-фенил-1Н-пиразоло[3,4-b]пиридин-4-карбоксилатов общей формулы

где R=Ph, Ar=С6Н4Ме-4 (а), C6H4Cl-4 (б), C6H4Br-4 (в); R=Ph-CH=CH, Ar=Ph (г), С6Н4Ме-4 (д), C6H4OMe-4 (е),
отличающийся тем, что метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилаты или метил 1-арил-4,5-диоксо-3-циннамоил-4,5-дигидро-1Н-пиррол-2-карбоксилаты подвергают взаимодействию с 5-амино-3-метил-1-фенил-1H-пиразолом в среде инертного апротонного растворителя с последующим выделением целевых продуктов.
3. Способ по п.2, отличающийся тем, что процесс ведется при температуре 80-84°C.
4. Способ по п.2 и 3, отличающийся тем, что в качестве растворителя используют абсолютный бензол или 1,2-дихлорэтан.
| Автоматическая сцепная муфта для гребнечесальных машин | 1955 |
|
SU104522A1 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИДИНА | 2004 |
|
RU2359971C2 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2013-10-10—Публикация
2012-07-31—Подача