Изобретение относится к области органической химии, а именно к новым биологически активным индивидуальным соединениям класса спиро[пиррол-3,3'-пирролизинов], а именно к (1'S*,2'R*,3R*,7a'S*)-2'-нитро-1',2',5',6',7',7а'-гексагидроспиро[пиррол-3,3'-пирролизин]-2(1H)-онам формулы:
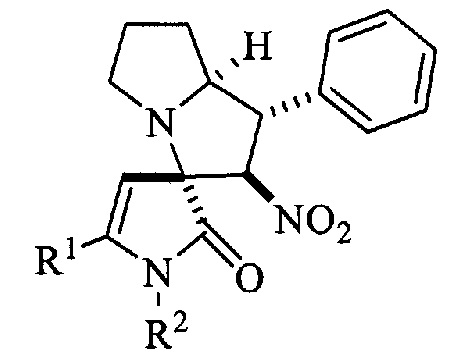
обладающим противомикробной активностью, что позволяет предположить их использование в качестве исходных продуктов для синтеза новых гетероциклических систем, в фармакологии и в медицине в качестве лекарственных средств с противомикробным эффектом.
Известны структурные аналоги заявленных соединений - 1-N-метил-(2,3')-спирооксиндоло-3-нитропирролидины (Poornachandran М., Muruganantham R., Raghunathan R. Regioselective synthesis of novel spirooxindolo and spiroindano nitro pyrrolidines through 3+2 cycloaddition reaction // Synthetic communications. - 2006. - T. 36. - №.2. - C. 141-150) формулы

R=H, Me-4, OMe-4, NO2-3, Cl-4, Cl-2
Эталонами сравнения противомикробной эффективности выбраны антибактериальный препарат диоксидин [Падейская Е.Н. Антибактериальный препарат диоксидин: особенности биологического действия и значение в терапии различных форм гнойной инфекции // Инфекции и антимикробная терапия. - 2001. - №.5. - С. 105-155] и противогрибковый препарат флуконазол [Shilova I.B., Gus'kova Т.А., Glushkov R.G. Modern drugs for treating dermatomycosis // Pharmaceutical Chemistry Journal. - 2004. - T. 38. - №.4. - C. 175-180.], которые широко применяются в лечебной практике и являются аналогами по действию.
Задачей изобретения является поиск в ряду производных спиро[пиррол-3,3'-пирролизинов] веществ с противомикробным действием и расширение арсенала средств воздействия на живой организм.
Поставленная задача достигается получением (1'S*,2'R*,3R*,7a'S*)-2'-нитро-1',2',5',6',7',7а'-гексагидроспиро[пиррол-3,3|-пирролизин]-2(1H)-онов, которые обладают противомикробной активностью.
Заявляемые соединения синтезируют путем трехкомпонентного взаимодействия 1H-пиррол-2,3-дионов (I) с L-пролином и нитростиролами (II) в соотношении 1:1:1 в среде растворителя с последующим выделением целевых продуктов, по следующей схеме:
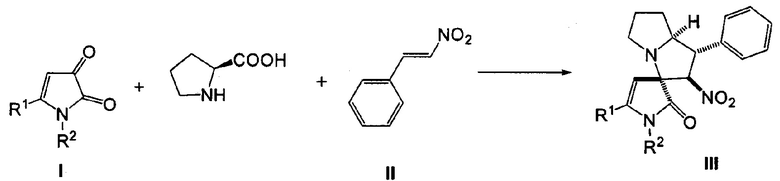
где I: R1=С6Н4ОМе-4, R2=Ph (a); R1=R2=Ph (б); R1=Ph, R2=C6H4Me-4 (в). III: R1=С6Н4ОМе-4, R2=Ph (a); R1=R2=Ph (б); R1=Ph, R2=С6Н4Ме-4 (в).
Процесс ведут при кипячении, а в качестве растворителя используют безводный ацетонитрил либо другие инертные апротонные растворители.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение (1'S*,2'R*,3R*,7a'S*)-5-(4-метоксифенил)-2'-нитро-1,1'-дифенил-1',2',5',6',7',7а'-гексагидроспиро[пиррол-3,3'-пирролизин]-2(1H)-она (IIIa).
К раствору 1.0 ммоль 5-(4-метоксифенил)-1-фенил-1H-пиррол-2,3-диона (Ia) в 10 мл безводного ацетонитрила добавляли 1.0 ммоль L-пролина и 1.0 ммоль нитростирола (II). Реакционную массу кипятили в течение 5 ч. Растворитель упаривали, образовавшийся осадок отфильтровывали и перекристаллизовывали из этилового спирта. Выход 40%, т.пл. 165-168°C.
Соединение (IIIa) C29H27N3O4.
Найдено, %: С 72.41; Н 5.49; N 8.65.
Вычислено, %: С 72.33; Н 5.65; N 8.73.
Соединение (IIIa) - светло-желтое кристаллическое вещество, легкорастворимое в ДМСО, ДМФА, хлороформе, дихлорметане, трудно растворимое в ацетоне, спиртах, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (IIIa), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний лактамной карбонильной группы С2=O при 1732 см-1 и нитро группы при 1549 см-1.
Спектр ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 7.44-7.39 м (2Н), 7.38-7.21 м (6Н), 7.11-7.01 м (4Н), 6.76-6.70 м (2Н), 5.57 д (J=10.1 Гц, 1Н), 5.36 с (1Н), 4.15 ддд (J=9.7, 6.9, 4.1 Гц, 1H), 3.80 т (J=9.9 Гц, 1Н), 3.75 с (3Н), 3.25 дт (J=10.0, 7.1 Гц, 1Н), 3.02 ддд (J=10.0, 6.9, 5.0 Гц, 1Н), 2.10-1.87 м (3Н), 1.82-1.72 м (1Н).
Пример 2. Получение (1'S*,2'R*,3R*,7a'S*)-2,-нитро-1,1',5-трифенил-1',2',5',6',7',7а'-гексагидроспиро[пиррол-3,3'-пирролизин]-2(1H)-она (IIIб).
К раствору 1.0 ммоль 1,5-дифенил-1H-пиррол-2,3-диона (Iб) в 10 мл абсолютного ацетонитрила добавляли 1.0 ммоль L-пролина и 1.0 ммоль нитростирола (II). Реакционную массу кипятили в течение 4 ч. Растворитель упаривали, образовавшийся осадок отфильтровывали и перекристаллизовывали из этилового спирта. Выход 39%, т.пл. 149-151°C. Соединение (IIIб) C28H25N3O3.
Найдено, %: С 74.33; Н 5.67; N 9.25.
Вычислено, %: С 74.48; Н 5.58; N 9.31.
Соединение (IIIб) - светло-желтое кристаллическое вещество, легкорастворимое в ДМСО, ДМФА, хлороформе, дихлорметане, трудно растворимое в ацетоне, спиртах, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (IIIб), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний лактамной карбонильной группы С2'=O при 1737 см-1 и нитро группы при 1548 см-1.
Спектр ЯМР 1H (400 МГц, CDCl3, δ, м.д.): 7.45-7.40 м (2Н), 7.38-7.32 м (2Н), 7.32-7.26 м (4Н), 7.26-7.19 м (3Н), 7.14-7.05 м (4Н), 5.59 д (J=10.2 Гц, 1H), 5.44 с (1Н), 4.15 ддд (J=9.7, 6.9, 4.2 Гц, 1H), 3.81 т (J=9.9 Гц, 1H), 3.25 дт (J=10.1, 7.1 Гц, 1Н), 3.03 ддд (J=10.0, 6.9, 5.0 Гц, 1H), 2.10-1.87 м (3Н), 1.82-1.72 м (1H).
Соединение (IIIв) синтезировано способом, аналогичным описанному в примере 1.
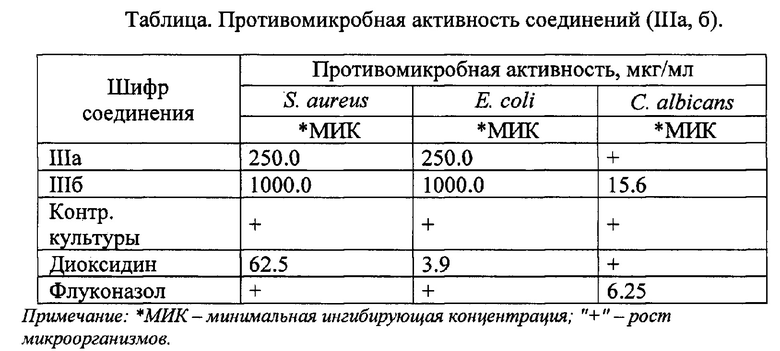
Пример 3. Фармакологическое исследование (1'S*,2'R*,3R*,7a'S*)-2'-нитро-1',2',5',6',7',7а'-гексагидроспиро[пиррол-3,3'-пирролизин]-2(1H)-онов (IIIa, б) на наличие противомикробной активности.
Противомикробные свойства химических веществ изучали на 3-х коллекционных условно-патогенных штаммах микроорганизмов: Staphylococcus aureus (штамм 906), Escherichia coli (штамм 1257), Candida albicans, 1353.
Противомикробное действие выявляли методом двукратных серийных разведений в соответствии с методическими указаниями по изучению противомикробной активности препаратов [Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. - М.: И-во Медицина, 2005. - 832 с.]. Готовили исходные разведения микроорганизмов в физиологическом растворе из суточной агаровой культуры по оптическому стандарту мутности (ОСО) на 5 ME с использованием денситометра. После ряда разведений конечная концентрация клеток в опыте составляла 2.5×105 клеток/мл. В лунках стерильного 96 луночного плоскодонного микропланшета готовили два параллельных ряда двукратных серийных разведений химических соединений в бульоне РПБ. В каждой лунке содержалось 150 мкл определенной концентрации испытуемого вещества и 150 мкл инокулята культуры. В последних рядах содержалась питательная среда и культура в равных объемах (контроль). Максимально испытанная концентрация соответствовала 1000.0 мкг/мл, минимальная - 2.0 мкг/мл. Микропланшет помещали в термостат спектрофотометра Epoch и замеряли оптическую плотности (ОП) при длине волны 540 нм. Через 24 часа вновь регистрировали ОП культуральной жидкости.
Результаты оценивали с помощью программного обеспечения Gen 5 спектрофотометра для микропланшет Epoch. Последняя лунка ряда с задержкой роста и показателями ОП равной оптической плотности контрольной лунки соответствует минимальной подавляющей концентрацией соединения.
Проведенные исследования показали (см. таблицу), что соединения (IIIa, б) проявляют ингибирующее действие относительно штаммов Staphylococcus aureus и Escherichia coli в интервале концентраций - 250.0-1000.0 мкг/мл. Соединение IIIб проявляет выраженное фунгистатическое действие относительно дрожжевых грибков Candida albicans в концентрации 15.6 мкг/мл.
Заявляемые ранее неописанные в литературе (1'S*,2'R*,3R*,7a'S*)-2'-нитро-1',2',5',6',7',7а'-гексагидроспиро[пиррол-3,3'-пирролизин]-2(1H)-оны могут найти применение в качестве исходных продуктов для синтеза гетероциклических систем и в фармакологии в качестве потенциальных лекарственных средств с противомикробными свойствами.
Изобретение относится к (1'S*,2'R*,3R*,7а'S*)-2'-нитро-1',2',5',6',7',7а'-гексагидроспиро[пиррол-3,3'-пирролизин]-2(1H)-онам указанной ниже общей формулы, где R1=C6H4OMe-4, R2=Ph (a); R1=R2=Ph (б); R1=Ph, R2=С6Н4Ме-4 (в). Технический результат: противомикробная активность соединений. 1 табл., 3 пр.

(1'S*,2'R*,3R*,7а'S*)-2'-Нитро-1',2',5',6',7',7а'-гексагидроспиро[пиррол-3,3'-пирролизин]-2(1H)-оны общей формулы
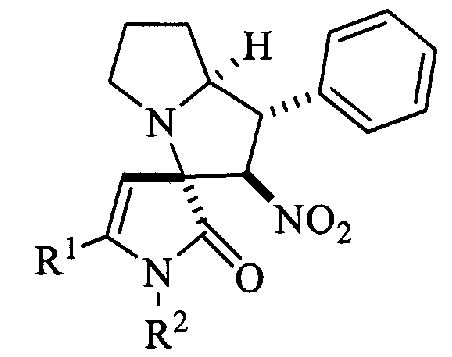 ,
,
где R1=C6H4OMe-4, R2=Ph (a); R1=R2=Ph (б); R1=Ph, R2=С6Н4Ме-4 (в), обладающие противомикробной активностью.
| 5-АРИЛ-1-ФЕНИЛ-4-ГЕТЕРОИЛ-3-ГИДРОКСИ-3-ПИРРОЛИН-2-ОНЫ, ПРОЯВЛЯЮЩИЕ ПРОТИВОМИКРОБНУЮ АКТИВНОСТЬ | 2003 |
|
RU2259369C2 |
| М.В | |||
| ДМИТРИЕВ и А.Н | |||
| МАСЛИВЕЦ, Нуклеофильные превращения 1H-пиррол-2,3-дионов под действием 1,3-бинуклеофилов, ВЕСТНИК ПЕРМСКОГО УНИВЕРСИТЕТА, СЕРИЯ: ХИМИЯ, 2011, вып | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| ЭТИЛ-2-АМИНО-7,7-ДИМЕТИЛ-2',5-ДИОКСО-5'-ФЕНИЛ-1',2',5,6,7,8-ГЕКСАГИДРОСПИРО[ХРОМЕН-4,3'-ПИРРОЛ]-4'-КАРБОКСИЛАТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2010 |
|
RU2435774C1 |
| M.POORNACHANDRAN et al., Regioselective synthesis of novel spirooxindolo and spiroindano nitro pyrrolidines | |||
Авторы
Даты
2021-02-11—Публикация
2020-06-25—Подача