Изобретение относится к ветеринарной медицине, а также к биохимии, а конкретно - к лекарственным препаратам, содержащим генетический материал, для создания генно-терапевтического лекарственного препарата для лечения повреждений и заболеваний преимущественно у домашних собак, вызванных повреждением кожного покрова при травмах. Может быть использовано для восстановления целостности структуры кожных покровов, а также для улучшения морфо-функциональных свойств кожных покровов при травматическом повреждении (например, раны, ожоги) преимущественно домашних собак (canis lupus familiaris).
При исследовании уровня техники заявителем выявлен ряд синтетических препаратов, обладающие регенеративной активностью и используемых для лечения кожных покровов, в том числе и домашних собак.
Например, в патенте на изобретение РФ № 2646793 описаны препараты, такие как натрия нуклеинат, метилурацил и прочие. Известные лекарственные средства обладают восстановительными свойствами, улучшают гемопоэз, однако обладают относительно низкой эффективностью и узконаправленностью действия, при этом обладают рядом противопоказаний, связанных с риском угнетения нервной системы, возникновения брадикардии, обострения онкологических патологий системы крови, возникновения аллергических реакций.
Из исследованного уровня техники заявителем выявлен регенеративный препарат «Лаураболин 50» и другие лекарственные средства, например, ретаболил, нандролона деканоат, которые используются для лечения в том числе и собак, представляющие собой инъекционный анаболический стероид (нандролон лаурат), который применяют в качестве общеукрепляющего средства при лечении терапевтических и хирургических заболеваний с существенным повреждением тканей. Недостатком известного препарата является его стероидная природа, что в совокупности с длительным курсом лечения может оказать негативное, опасное влияние на весь организм (особенно почки, печень и мозг) и отрицательно сказаться на синтезе собственных гормонов организма животного. Указанное лекарственное средство описано более детально в изобретении по патенту РФ №2646793.
Известна также группа изобретений по патенту США №4177261, заключающаяся в использовании свободного от альбумина экстракта крови телят для лечения ран. Сущностью известного изобретения являются фармацевтические композиции, улучшающие и стимулирующие кровообращение, что способствует заживлению ран.
Также известен препарат Солкосерил-гель [4]. Препарат содержит 8,3 мг химически и биологически стандартизированного депротеинизированного гемодиализата из крови молочных телят, а также натриевую соль карбоксиметилцеллюлозы, пропиленгликоль, лактат кальция и парабены Е216 и Е218; показан для лечения длительно незаживающих, особенно мокнущих ран различного генеза, термических, химических и радиационных ожогов.
Недостатками описанных выше двух препаратов являются потенциальная небезопасность препаратов для пациентов, заключающаяся в возможной контаминации препаратов возбудителями заболеваний, которые могут присутствовать в крови крупного рогатого скота (например, вирусы губчатой энцефалопатии). При этом следует акцентировать внимание на том, что Солкосерил эффективен только в начальной фазе заживления ран, далее происходит ингибирование регенерации, что объясняется значительным задерживанием эпителизации и длительным воспалением. Он обладает низкой антимикробной активностью, очень быстро биодеградирует на раневой поверхности, легко впитывается в покрывающую гель повязку, что приводит к снижению антимикробной и абсорбирующей способности препарата [5].
Из исследованного уровня техники выявлено изобретение по патенту № CN105596372 «Способ лечения различных серьезных повреждений кожи с использованием аутологичных мезенхимных стволовых клеток костного мозга». Краткой сущностью известного состава, приведенного в двенадцатом независимом пункте формулы изобретения, являются аутологичные мезенхимные стволовые клетки костного мозга, композиция 1 мл препарата клеток включает 1-3×106 аутологичных мезенхимных стволовых клеток костного мозга, 1 мл аутологичной плазмы, обогащенной тромбоцитами, 20-50 mM CaCl2, 10- 50 единиц тромбина, 10-30 мкг эпидермального фактора роста, 10 мкг ципрофлоксацина.
Недостатками известного технического решения в отношении известного состава, полученного известным способом (по пункту 4 способа), являются:
- возможность осложнений, связанных с возникновением иммунного ответа против трансплантата;
- возможная дифференцировка трансплантированных мезенхимных стволовых клеток в нежелательном направлении;
- возможен риск деления и формирования опухолей в результате онкотрансформации трансплантируемых клеток.
Из исследованного уровня техники выявлен способ лечения ожогов, описанный в патенте на изобретение РФ №2292212, с помощью лекарственного средства на основе кондиционированной среды, полученной при культивировании мезенхимальных стволовых клеток (МСК) костного мозга человека. При этом кондиционированную среду получают на стадии стационарного роста культуры стабильной клеточной линии МСК, находящихся в Go периоде клеточного цикла. Показано, что полученная среда обладает лечебным эффектом при термических ожогах.
Следует отметить, что кондиционированная среда, приготовленная данным способом, содержит эмбриональную бычью сыворотку (ЭБС), являющуюся потенциально опасным агентом при терапевтическом применении, способным вызвать аллергические реакции, вплоть до анафилактического шока.
Известно, что МСК, полученные из костного мозга обладают значительным потенциалом для регенерации ткани, т.к. они выделяют сигнальные молекулы, такие как нейротрофические факторы, факторы роста, такие как VEGF и FGF, или цитокины, которые могут диффундировать в локальной тканевой среде и взаимодействовать с окружающими клетками [8].
Недостатками известного способа является:
- невозможность стандартизировать в качественном и количественном отношении компоненты предлагаемого лекарственного средства и, как следствие, затруднение при дозировании;
- необходимость использования значительных объемов культуральной питательной среды для проведения процессов культивирования клеток и кондиционирования культуральной питательной среды, что приводит к ее неэффективному расходу, что, в свою очередь, ведет к увеличению затрат.
Из заявки на изобретение WO 1998033917 известны природные пептиды - факторы роста эндотелия сосудов, например, изоформа С, стимулирующая, согласно пункту 38 формулы изобретения, деление клеток, образование кровеносных сосудов и, как следствие, усиливающая регенерацию тканей.
Известна также композиция, описанная в патенте РФ №2524655, которая, согласно пункту 1 формулы изобретения, является средством для лечения старения кожи, содержащим основной фактор роста фибробластов (bFGF) как единственный активный ингредиент, которое вводится внутрикожно или подкожно.
Недостатками приведенных выше двух технических решений являются трудоемкость процесса получения пептидов, связанная с тем, что получение пептидов требует генетическую модификацию клеток-продуцентов, многоэтапное выделение и очистку целевых пептидов, что, в свою очередь, невозможно реализовать без привлечения высококвалифицированных специалистов и специализированного оборудования.
По заявке на изобретение WO8602271 выявлен способ лечения эпителиальных и стромальных ран с использованием для стимулирования заживления, нанесения эпидермального фактора роста человека (hEGF) на рану, где указанный hEGF получают путем экспрессии гена hEGF человека в микроорганизме.
Основным недостатком данного способа является трудоемкость получения данного терапевтического полипептида и сложный многоэтапный технологический процесс получения, а также применение человеческих белковых факторов, неспецифичных для собак, вследствие чего известный способ неприменим в ветеринарной практике.
Из публикаций Плотникова М.В., 2013 [13] известен способ стимулирования репаративного ангиогенеза с применением аналогичной генетической конструкции, с теми же генами белковых факторов VEGF и FGF2, но видоспецифичных для человека. Сущностью известного способа является генетическая конструкция на основе двухкассетной плазмиды pBudk-VEGF-FGF2, одновременно экспрессирующей комбинацию двух генов: ангиогенного фактора роста кровеносных сосудов VEGF и фактора роста фибробластов FGF2, видоспецифичных в данном случае для человека. При этом известный способ применяется исключительно для стимуляции репаративного ангиогенеза и является достаточно близким к заявленному способу по достигаемому результату именно и только в области ангиогенеза. Недостатком данного способа является использование генов белковых факторов роста кровеносных сосудов VEGF и фактора роста фибробластов FGF2, видоспецифичных для человека, которые не обладают достаточной эффективностью при лечении повреждений кожи собак.
Работы по использованию VEGF164 в терапевтическом ангиогенезе и FGF2 для улучшения регенерации кожи у человека широко проводятся во всем мире [15]. Однако в настоящее время в литературе отсутствуют данные о разработке генных препаратов на основе видоспецифичных vegf и fgf2 для лечения повреждений кожи животных.
Прототипом изобретения является препарат по патенту РФ №2574017, полученный культивированием МСК жировой ткани человека и содержащий продукты секреции МСК человека, включающие ключевые факторы роста: FGF basic в концентрации от 2 до 4 пкг/мл, HGF в концентрации от 40 до 80 пкг/мл, VEGF в концентрации от 200 до 800 пкг/мл, ангиопоэтин-1 в концентрации от 0,5 до 10,0 пкг/мл. И позволяет стимулировать заживление ожогов и ран за счет регенеративного действия сбалансированного комплекса цитокинов и факторов роста, секретируемых МСК человека в культуральную среду.
Прототип обладает рядом недостатков:
- не стандартизирован качественный и количественный состав предлагаемого препарата;
- требуется предварительное выделение клеток из организма человека, культивирование МСК, что потребует решить проблему поиска здорового донора;
- требуется наличие культуральной лаборатории;
- препарат по прототипу невозможно заготовить заранее и использовать для разных животных, есть риск бактериальной контаминации, а, следовательно, риск инфекционных осложнений;
- для получения препарата по прототипу во избежание аллергической реакции пациента на сыворотку крупного рогатого скота (основной компонент ростовой среды) требуется использование дорогих бессывороточных сред или культивирование на аутосыворотке;
- препарат по прототипу содержит белковые факторы, которые быстро деградируют под действием протеиназ пациента.
Техническим результатом заявленного технического решения является разработка способа стимуляции репаративного ангиогенеза и регенерации кожного покрова преимущественно собак, при его повреждении (раны, ожоги), методом генной терапии с использованием видоспецифичных генов белковых факторов VEGF164 и FGF2, для лечения преимущественно домашних собак, а именно:
- обеспечение восстановления целостности поврежденной ранее кожи в тех местах, где это недоступно сделать классическими методами (например, недостаток кожи для трансплантации при обширных повреждениях);
- сокращение сроков восстановления целостности кожного покрова;
- обеспечение адекватной васкуляризации поврежденной ранее кожи;
- повышение эффективности и технологичности процедуры излечения собак посредством использования заявленного технического решения.
Сущностью заявленного технического решения является способ стимуляции репаративного ангиогенеза и регенерации кожного покрова при его повреждении, в ветеринарии у собак, заключающийся в том, что в организм собаки вводят фармацевтическую композицию, содержащую генетическую ДНК-конструкцию, выполненную в виде двухкассетной экспрессионной плазмиды, реализованной на базе вектора pBudСЕ4.1, в ДНК-конструкцию клонированы гены, стимулирующие экспрессию видоспецифичных для собаки белковых факторов, а именно - сосудистого эндотелиального фактора роста изоформы 164 (VEGF164) и фактора роста фибробластов 2 (FGF2), в эффективном количестве и допустимые вспомогательные вещества. Генетическая ДНК-конструкция для использования в способе по п.1, представляющая собой двухкассетную экспрессионную плазмиду, реализованную на базе вектора pBudCE4.1, в ДНК-конструкцию клонированы гены, стимулирующие экспрессию видоспецифичных для собаки белковых факторов, а именно - сосудистого эндотелиального фактора роста изоформы 164 (VEGF164) и фактора роста фибробластов 2 (FGF2).
Заявленное техническое решение иллюстрируется Фиг. 1 – Фиг.10, где:
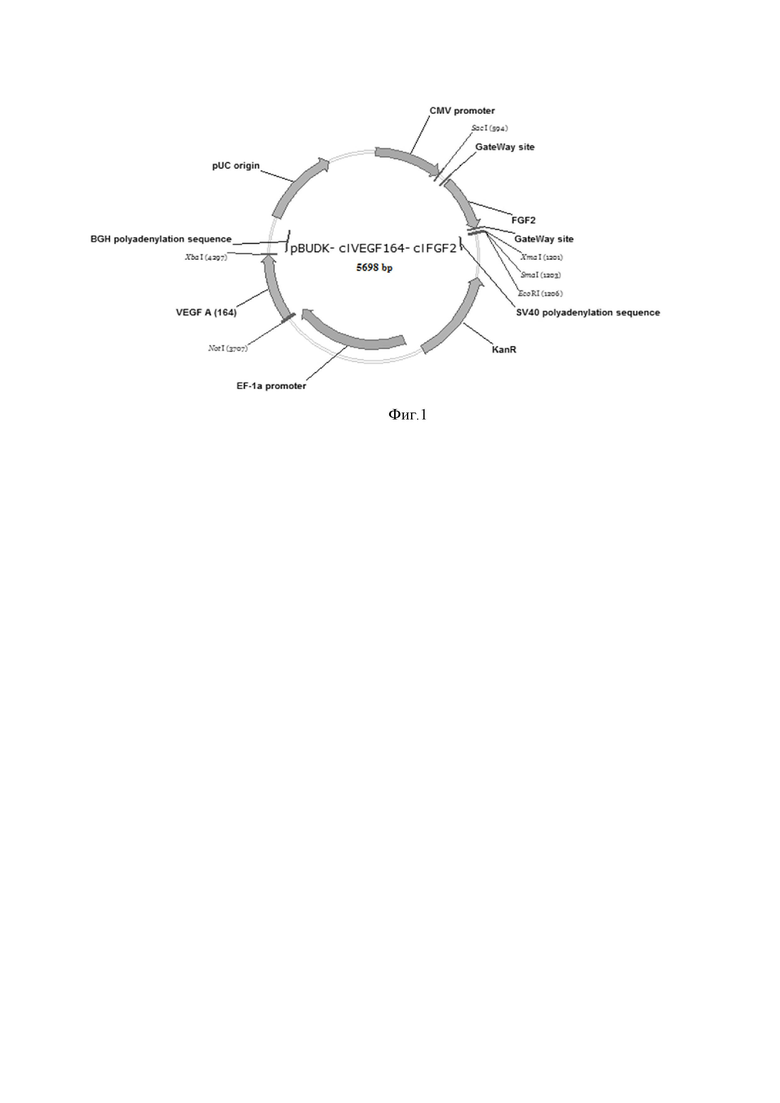
На Фиг.1 - представлена физическая карта плазмидной ДНК pBUDK-clVEGF164-clFGF2. Указаны гены, кодирующие видоспецифические белки VEGF164 и FGF2.
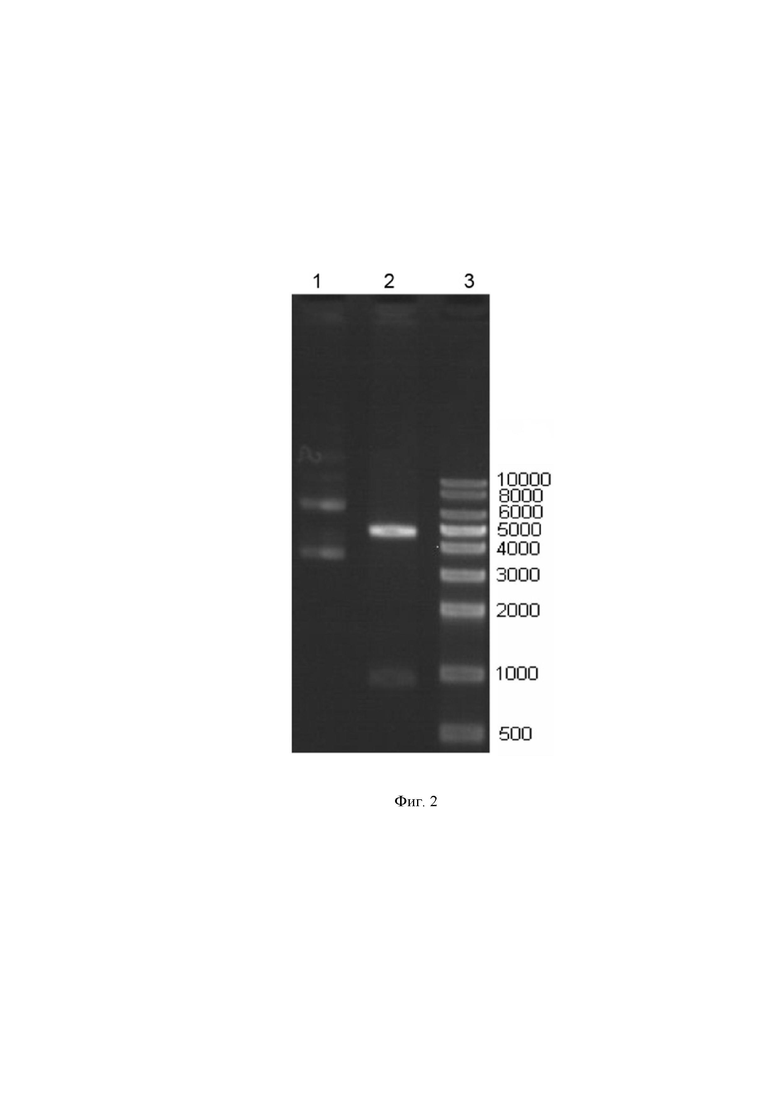
На Фиг. 2 - представлено фото электрофореза плазмидной ДНК в 0,8% агарозном геле, где:
1 - препарат плазмидной ДНК pBUDK-clVEGF164-clFGF2 (верхний бэнд - кольцевая релаксированная форма; нижний бэнд – суперспирализованная форма),
2 - плазмидная ДНК после рестрикции SacI и Mlul,
3 - ДНК маркер ThermoScientific (кол-во пар оснований цепи ДНК, соответствующее каждому бэнду маркера указано справа от каждого бэнда).
Из приведенной фотографии видно, что после рестрикции наибольший фрагмент идет примерно на уровне 5000 п. о., что доказывает соответствие молекулярной массе, созданной генетической плазмидной ДНК-конструкции. Данная фотография является свидетельством того, что заявителем получена требуемая ДНК-конструкция.
На Фиг. 3 - представлена ПЦР оценка экспрессии FGF2 и VEGF164 в МСК собаки после транфекции.
На Фиг.4 - показано количество сформировавшиеся узлов ветвления через 16 ч культивирования.
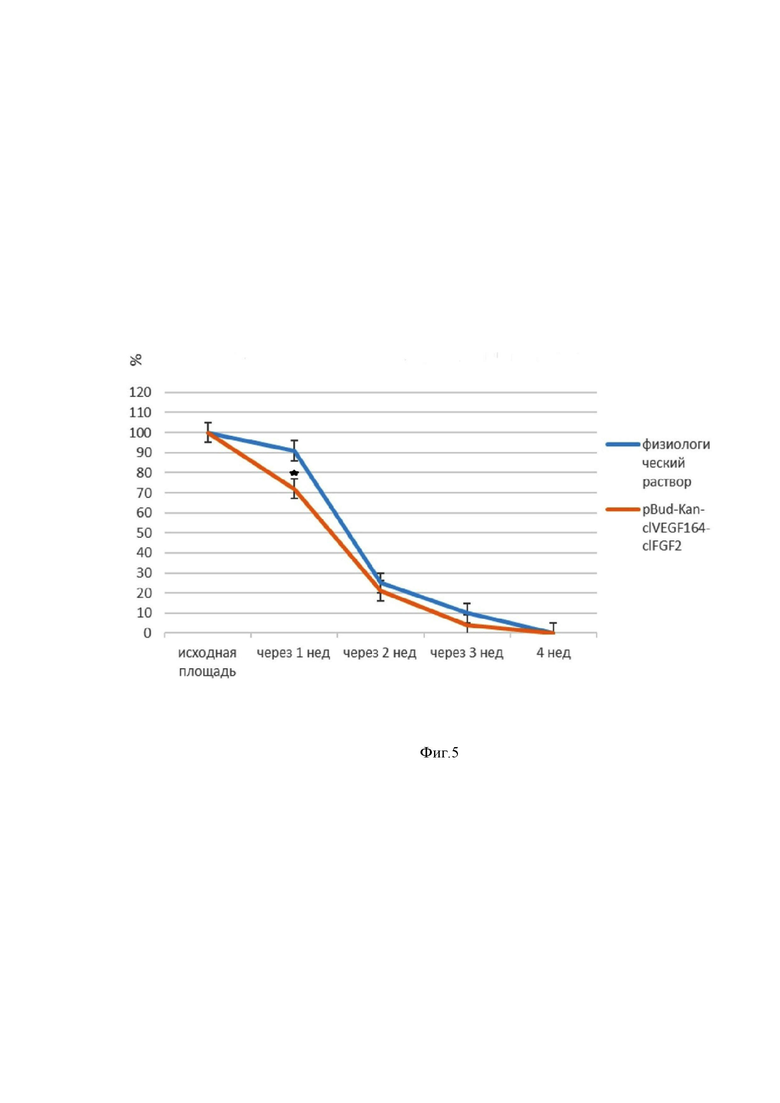
На Фиг.5 - показана динамика изменения площади кожных ран у крыс.
На Фиг. 6 - представлены гистологические препараты кожи крыс из контрольной группы, окрашенные на CD34 (зеленый цвет), синим цветом окрашены ядра клеток (Дапи).
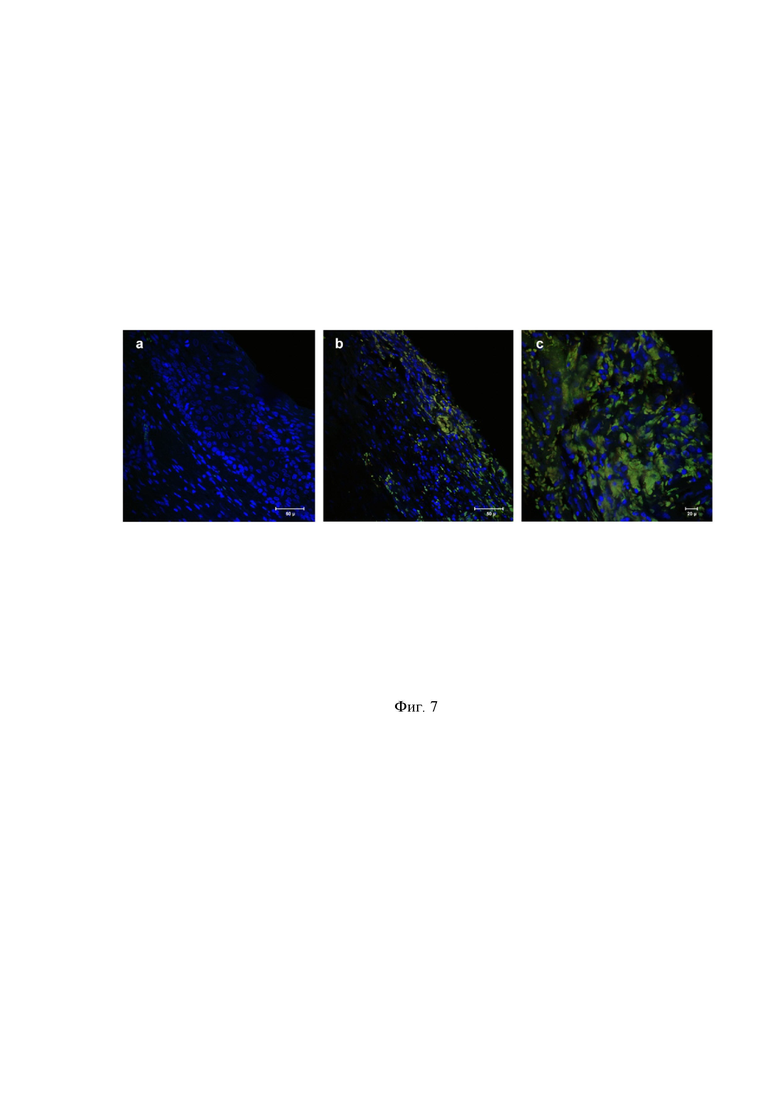
На Фиг. 7 - представлены гистологические препараты кожи крыс из опытной группы, окрашенные на CD34 (зеленый цвет), синим цветом окрашены ядра клеток (Дапи).
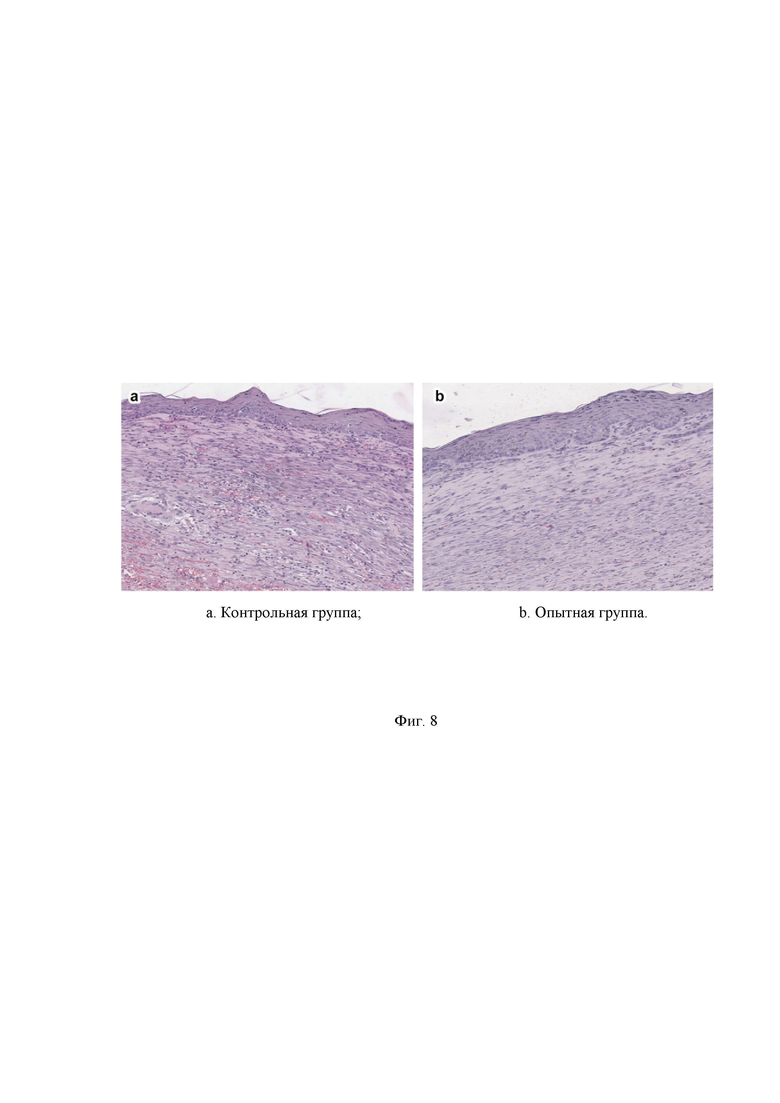
На Фиг. 8 - представлены гистологические срезы кожи крыс в зоне полного заживления раны на 28 сутки эксперимента, окрашивание гематоксилином и эозином, увеличение ×40, где:
a. контрольная группа;
b. опытная группа.
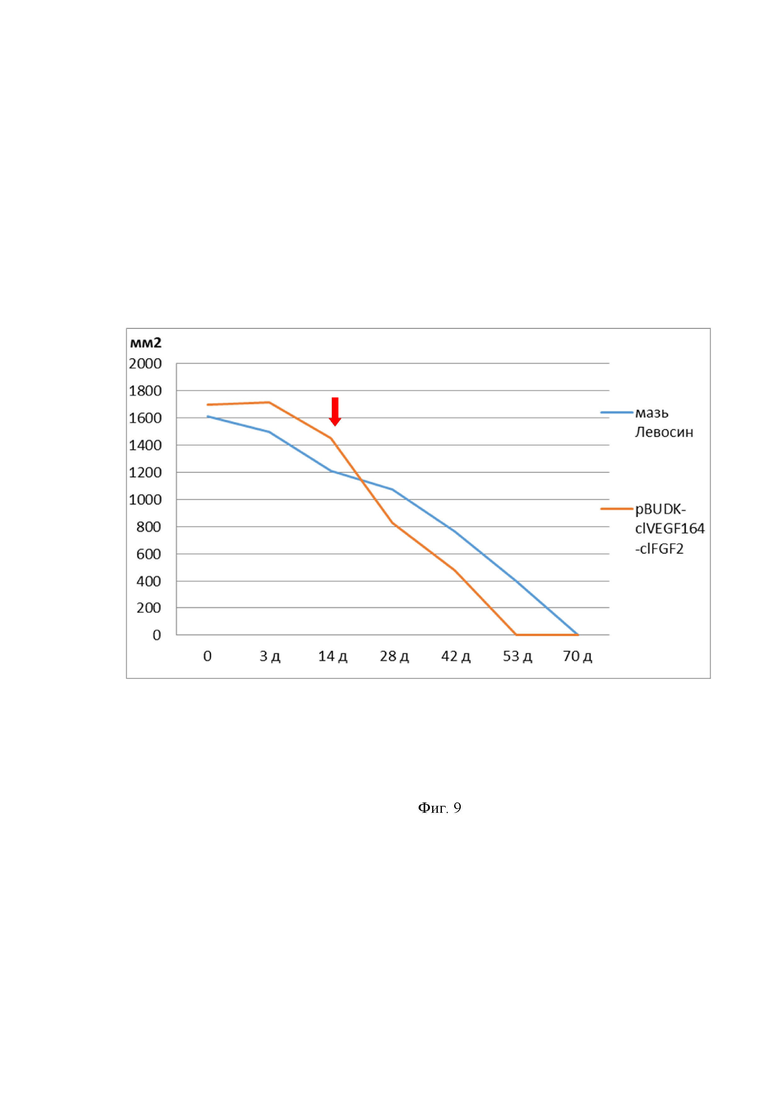
На Фиг. 9 - показана динамика изменения площади кожных ран у собак, при этом стрелкой указан день внутрикожного введения плазмидной ДНК pBUDK-clVEGF164-clFGF2.
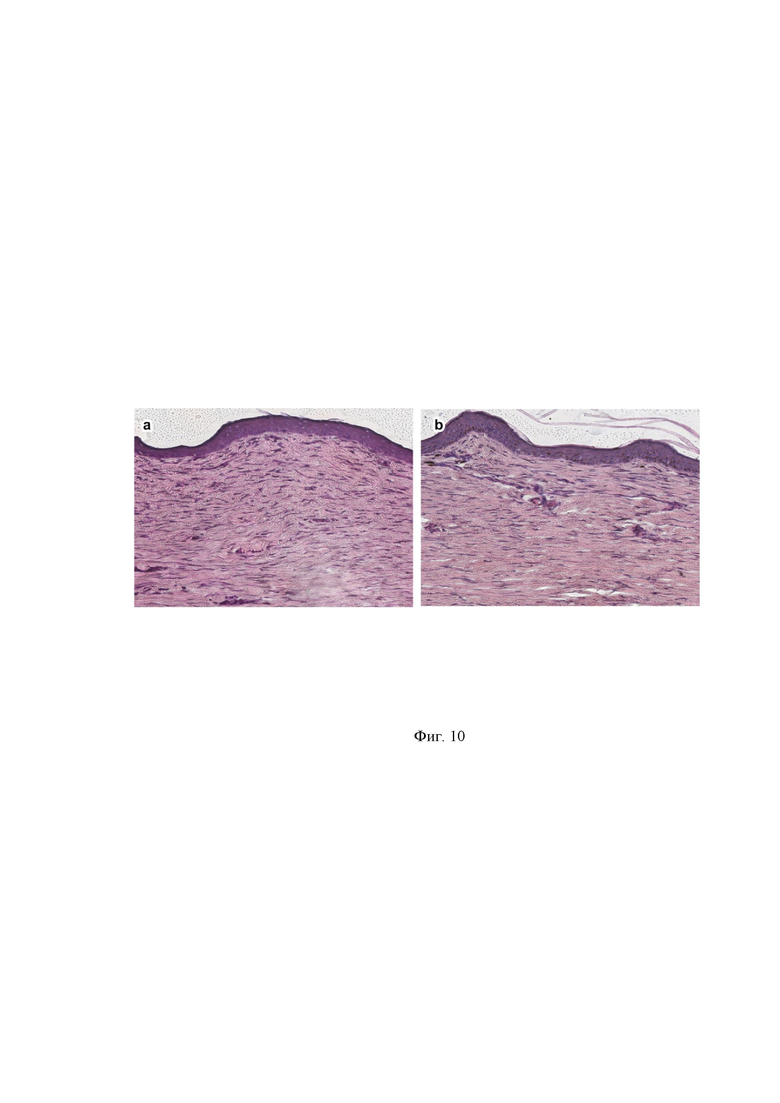
На Фиг.10 - представлены гистологические срезы кожи собак в зоне полного заживления раны на 70 сутки после ранения, окрашивание гематоксилином и эозином, увеличение ×40.
Кроме представленных выше материалов, заявителем приводятся дополнительные материалы к заявке, а именно - последовательность генетической ДНК-конструкции SEQ ID NO: (см. Приложение на 4 листах), на которых приведена генетическая последовательность нуклеотидов генетической плазмидной ДНК-конструкции.
Заявленный способ в целом обеспечивает возможность реализации принципиально нового подхода к стимуляции репаративного ангиогенеза и регенерации кожного покрова посредством использования генно-терапевтического подхода, связанного с применением видоспецифичных (для конкретного вида животного) генов белковых факторов VEGF164 и FGF2. В конечном счете, реализация заявленного технического решения обеспечивает универсальную возможность по созданию новой генетической конструкции, и подход по ее применению в ветеринарии с целью стимуляции репаративного ангиогенеза и регенерации кожного покрова, при его повреждении, у любого вида животного. И создает предпосылку для перспективного развития данного вида терапевтических препаратом в будущем.
В заявленном техническом решении используются генетические конструкции, содержащие одновременно гены vegf164 и fgf2, видоспецифичные для собаки. Принцип получения генетических конструкции основан на том, что берут модифицированный двухкассетный экспрессионный плазмидный вектор pBudCE4.1, в котором ген устойчивости к зеоцину и его про/эукариотический промотор заменены на ген устойчивости к канамицину и его прокариотический промотор, в который, в свою очередь, стандартными методами молекулярной генетики клонированы кДНК генов сосудистого эндотелиального фактора роста VEGF164 и основного фактора роста фибробластов (FGF-2) домашней собаки.
Полученная в результате генная конструкция в составе фармацевтической композиции вводится непосредственно в область повреждения, за этим следует гидравлическая трансфекция клеток окружения, экспрессия в них генов vegf164 и fgf2, после процессинга с мРНК генов vegf164 и fgf2 синтезируются белки VEGF164 и FGF2, проявляющие свою нормальную биологическую активность. В результате происходит стимуляция ангиогенеза и регенерации поврежденного кожного покрова собаки.
Преимуществами заявленного технического решения по сравнению с известными из исследованного уровня техники средствами и способами являются:
- Генно-инженерные конструкции pBUDK-clVEGF164-clFGF2 обладают высокой биобезопасностью за счет использования плазмидной ДНК, которая не встраивается в геном клетки.
- Белковые препараты обладают короткой продолжительностью действия за счет их быстрого расщепления протеазами организма, в то время как плазмидная ДНК внедряется в собственные клетки организма в зоне повреждения, заставляя их самих относительно продолжительно вырабатывать терапевтические белки, постоянно поддерживая их высокие концентрации.
- Объединение генов vegf и fgf2 в одной плазмиде позволяет осуществлять одновременную стимуляцию регенерации, влияя на один из важных аспектов регенерации - рост сосудов, на который положительное влияние оказывает как VEGF164, так FGF2, и стимулирует рост фибробластов, который вызывают рост грануляционной ткани, заполняющей полость раны в начале заживления.
- Видоспецифичность для домашней собаки генно-инженерных конструкции позволяет минимизировать нежелательные иммунологические реакции, которые могут быть связаны с различием в строении белков животных и человека и не позволяет использовать ранее апробированные и успешно применяющиеся для лечения человека препараты в области ветеринарии.
Заявленное техническое решение позволяет получить готовый к применению по мере надобности препарат, который можно хранить достаточно длительный временной интервал, а именно - до года и более в условиях заморозки. Введение предлагаемого заявителем генного препарата не требует от ветеринара дополнительных навыков или специального оборудования.
Далее заявителем представлены основные элементы генетической конструкции заявленного технического решения и последовательность действий для реализации заявленного технического решения.
Основные элементы генетической конструкции:
- Промотор CMV 11–627
- Последовательности Козак 695–698 и 4439–4442
- Сайты Gateway attBI и attBII 670–694 и 1888–1911
- Ген clfgf2 699–1887
- Ген устойчивости к канамицину 2189–3231
- Промотор EF1-α 3247–4414
- Сайты рестрикции HindIII и XbaI 4433–4438 и 5016–5021
- Ген clvegf164 4443–5015
Пример реализации заявленного технического решения.
Для создания генетической конструкции использовали экспрессионный вектор pBudCE4.1. Кодонную оптимизацию состава генов vegf164 и fgf2 проводили, например, с использованием алгоритма OptimumGene или другого. Синтез de novo нуклеотидной последовательности кодон оптимизированных последовательностей кДНК vegf164 и fgf2 собаки осуществляли на оборудовании ДНК-синтезаторе. Субклонирование кДНК в векторную плазмиду pBud4.1СЕ также осуществляли компанией GenScript (США) в соответствии с предоставленным техническим заданием. В результате получили плазмиду pBUDK-clVEGF164-clFGF2, несущую комбинацию генов факторов clvegf164 и clfgf2, видоспецифичных для собаки. Функциональную активность генетической конструкции подтверждали анализом экспрессии трансгенов vegfl64 и fgf2 in vitro после трансфекции МСК собаки генетической конструкцией pBUDK-clVEGF164-clFGF2. Эффективность генетической конструкции проверяли на белых крысах линии Wistar и домашних собаках в условиях ветеринарной клиники.
Заявленное техническое решение осуществляется в 4 этапа.
Первый этап. Создание плазмиды pBUDK-clVEGF164-clFGF2.
Для создания генетической конструкции используют экспрессионный вектор pBudCE4.1 (Invitrogen, Catalog #V532-20, США) в качестве основы, в котором последовательность гена устойчивости к зеоцину и его промотор заменены на последовательность гена устойчивости к канамицину.
Кодонную оптимизацию состава генов vegf164 и fgf2 проводят, например, с использованием алгоритма OptimumGene или другого. В качестве матрицы для кодонной оптимизации берут нуклеотидные последовательности мРНК генов vegfl64 собаки (GenBank: NM_001110502) и fgf2 собаки (GenBank: ХМ_003432481.3).
Синтез de novo нуклеотидной последовательности кодон оптимизированных последовательностей кДНК vegf164 и fgf2 собаки осуществляют, на оборудовании ДНК-синтезаторе например, в компании GenScript (США). Субклонирование кДНК в векторную плазмиду pBud4.1СЕ также осуществляют компанией GenScript (США) в соответствии с предоставленным техническим заданием. В результате получили плазмиду pBUDK-clVEGF164-clFGF2, несущую комбинацию генов факторов clvegf164 и clfgf2, видоспецифичных для собаки. Карта плазмиды представлена на Фиг. 1.
Проводят электрофоретический анализ плДНК в 0,8% агарозном геле в 0,04 М тФиг-ацетатном буфере (рН 7,5-7,8) при силе тока 80 мА. Результаты фиксируют, например, с помощью системы визуализации Molecular Imager® Gel Doc™ System (BioRad). Для анализа размеров полученных ДНК-фрагментов используют ДНК-маркер GenRuler Mix (ThermoScientific). Результаты электрофоретического анализа представлены на Фиг. 2.
Второй этап. Изучение функциональной активности генетической конструкции in vitro.
Функциональную активность генетической конструкции подтверждают анализом экспрессии трансгенов vegfl64 и fgf2 in vitro после трансфекции МСК собаки генетической конструкцией pBUDK-clVEGF164-clFGF2, видоспецифичной для собаки, с использованием трансфекционного агента, например, TurboFect (Thermo Fisher Scientific Inc.) согласно рекомендациям производителя. Анализ экспрессии рекомбинантных белков проводят с помощью полимеразной цепной реакции в режиме реального времени (ПЦР-РВ).
Для ПЦР-РВ анализа МСК собаки трансфицируют генетическими конструкциями с помощью TurboFect, результат оценивают через 24 и 48 часов. ПЦР в реальном времени была проведена на амплификаторе C1000 с оптическим блоком CFX96 (BioRad). Дизайн праймеров был осуществлен с использованием программного пакета Clon Manager 9.0 (США), и проверены на гомологию с помощью анализа последовательностей Blast (Национальный центр биотехнологической информации).
Использовали следующие последовательности праймеров и зондов:
canV164-TM-F:5’-CTCTACCTCCACCATGCCAA-3’;
canV164-TM-R:5’-TCTCAATGGGACGGCAGTAG -3’;
canV164-TM-pr: (6-FAM) –CCCAGGCTGCGCCTATGGCA-(BHQ-1).
canFGF-2-TM-F: 5’-ACCGGTCAAGGAAATACTCCA-3’;
canFGF-2-TM-R: 5’-TTTCTGCCCAGGTCCTGTTT-3’;
canFGF-2-TM-pr: (6-FAM) – TGCCCAGTTCGTTTCAGTGCCACA-(BHQ-2).
Для оценки общей специфичности реакции параллельно использовали отрицательный контроль без матрицы и положительный контроль (интактные МСК). Все реакции были проведены в трех повторностях. Уровень экспрессии гена определяли с помощью 2-ΔΔCt метода. Данные представлены как «относительная экспрессия генов».
qPCR анализ экспрессии генов fgf2 и vegf164 показал увеличение экспрессии мРНК генов vegf164 и fgf2 через 24 ч в 1000 раз для МСК, трансфицированных плазмидой pBud-clVEGF164-clFGF2, через 48 часов - в 3000 раз по сравнению с нативными. Вычисления производили с использованием приложения Microsoft Excel®, входящего в пакет программного обеспечения Microsoft Office®. Статистически значимыми считали результаты с уровнем вероятности не менее 95%. Результат представлен на Фиг. 3.
Таким образом, доказана экспрессия белков VEGF164 и FGF2 с полученной генетической конструкции pBUDK-clVEGF164-clFGF2 после трансфекции ею клеток in vitro.
Ангиогенез in vitro в культурах МСК собаки, выделенных из жировой ткани животного – донора, трансфицированных плДНК pBud-clVEGF164-clFGF2 оценивают методом формирования клетками капилляроподобных структур на матриксе Matrigel™ (Cat.# 356231, Becton Dickinson, США) со сниженной концентрацией факторов роста. Вносят 50 мкл матрикса в лунку 96-луночного планшета, планшет инкубируют в течение 30 мин при 37 °С во влажной атмосфере, содержащей 5% CO2 для полимеризации матрикса, далее на матрикс высевают по 10 000 МСК на лунку. Эксперимент выполняют в трипликатах. В качестве отрицательного контроля на формирование капилляроподобных структур используют нетрансфицированные (интактные) МСК и среду аМЕМ с добавлением 2% FBS (контрольная, обедненная среда). В качестве положительного контроля используют ту же среду с добавлением 10 нг/мл рекомбинантного VEGF (дифференцировочная, обогащенная среда). Планшет инкубируют при 37 °С во влажной атмосфере, содержащей 5% CO2. Формирование капилляроподобных структур оценивают после 16 ч. инкубации с помощью фазово-контрастной микроскопии. Подсчитывают число сформировавшихся узлов ветвления. Результат представлен на Фиг. 4.
Таким образом, МСК собаки, трансдуцированные плазмидной конструкцией pBUDK-clVEGF164-clFGF2, обладают более высокой способностью к формированию капилляроподобной сети на матриксе Matrigel™. Всего выявлено 48 узлов ветвлений по сравнению с МСК собаки, растущими в обедненной среде - 43 узла ветвлений. Это говорит о биологической активности белков, синтезирующихся в трансдуцированных pBUDK-clVEGF164-clFGF2 МСК собаки.
Третий этап. Изучение функциональной активности плазмиды pBUDK-clVEGF164-clFGF2 на лабораторных животных.
Функциональную активность технического решения исследовали на лабораторных животных. Эффективность генетической конструкции проверяли на белых крысах линии Wistar. В экспериментальные группы отбирались клинически здоровые животные. Группы формировались методом случайного отбора по 10 особей в каждой группе с использованием массы тела в качестве ведущего признака (разброс по исходной массе между и внутри групп не превышал ± 20 %). На проведение научного исследования нами было получено разрешение локального этического комитета при К(П)ФУ №1 от 23.02.2015 по теме «Генная и клеточная терапия в регенеративной ветеринарной медицине». Крысы содержались в условиях вивария при свободном доступе к пище и воде.
Для моделирования повреждения кожного покрова крысам вводили внутрибрюшинно наркоз - хлоралгидрат в концентрации 300-500 мг/кг и в межлопаточной области спины вырезали квадратный кожный лоскут площадью 4 см2. Контрольным животным по периметру полученной раны внутрикожно вводили 300 мкл 0,9% NaCl, опытным животным вводили плазмиду pBUDK-clVEGF164-clFGF2 в концентрации 1 мг/мл 0,9% NaCl в том же объеме. Подготовку и введение препарата проводят следующим образом: сухой лиофилизированный препарат хранят при температуре -20 ºС. Примерно за 12 часов до введения препарат растворяют в 0,9% растворе NaCl в нужном объеме для достижения необходимой концентрации и хранили при +4°С и периодическом покачивании. Перед самим введением растворенный препарат нагревают до температуры +37 °С.
Для определения эффективности терапии проводят измерение площади поврежденного участка через 7, 14, 21, 28 суток после введения препарата. Планиметрические исследования проводят следующим образом: на рану накладывают стерильный кусок целлофана и на ней, сверху, чернилами обводят контур раны. Затем целлофан с нанесенным контуром накладывают на миллиметровую бумагу и путем подсчета квадратных миллиметров внутри контура определяют площадь раны.
На 21, 28 сутки у части животных (n=5) из каждой группы проводили забор кожи на гистологическое исследование. После взятия материала на 21 сутки и приготовления гистологических препаратов кожи крыс, проводили иммуноцитохимическое окрашивание образцов на CD34 - маркер эндотелиальных клеток в кровеносных сосудах для определения степени васкуляризации ткани. На 28 сутки проводили взятие материала, после чего подготовленные образцы окрашивали гематоксилин-эозином.
Наблюдение на протяжении 28 суток за животными показало, что внутрикожное введение подопытным крысам плазмиды pBUDK-clVEGF164-clFGF2 не оказывало негативного воздействия на их общее состояние. Животные были умеренно активные, проявляли интерес к корму и воде.
У животных опытной группы отмечали уменьшение площади раны через 7 суток после введения плазмиды на 30%, через 14 суток площадь была меньше на 80%, через 21 сутки площадь раны уменьшалась на 95%. У контрольных животных через 7 суток после введения 0,9% NaCl площадь раны уменьшилась на 10%, на 14 сутки на 75%, через 21 сутки площадь уменьшалась на 90%. Полное закрытие ран произошло на 24-28 сутки наблюдения (Фиг.5).
Согласно данным анализа гистологических препаратов, на 21 сутки эксперимента в контрольной группе животных периферическая часть препарата была представлена нормальным эпителием. На границе между раной и кожей наблюдалось постепенное уменьшение слоев эпителия с переходом в соединительную ткань с умеренной васкуляризацией. На препарате из центральной части раны определяется соединительная ткань с умеренной васкуляризацией и тонкой краевой эпителизацией (Фиг.6).
В опытной группе периферическая часть препарата представлена нормальным эпителием. Граница между кожей и раной представлена богато васкуляризированной соединительной тканью. Центральная часть представлена богато васкуляризированными грануляциями без эпителия (Фиг.7).
На 28 сутки эксперимента в контрольной группе при окрашивании гематоксилином и эозином гистологических срезов кожи крыс в зоне полного заживления раны наблюдается полная эпителизация. Многослойный плоский ороговевающий эпителий расположен ровным пластом, без врастаний в подлежащую ткань. Все слои эпителия четко визуализировались. На всех препаратах выявлено наличие трех слоев кожи: эпидермис, дерма и гиподерма. Дериватов кожи нет. Базальный слой эпидермиса прерывист и представлен не полностью сформированным рядом различных по форме клеток. Сосочковый слой дермы слабо выражен. В ретикулярном слое дермы видны продольно рыхло расположенные утолщенные коллагеновые волокна.
В опытной группе отмечается также полная эпителизация. Многослойный плоский ороговевающий эпителий расположен ровным пластом, без врастаний в подлежащую ткань. Все слои эпителия четко визуализировались. На всех полученных срезах выявлено наличие трех слоев кожи: эпидермис, дерма и гиподерма. Дериваты кожи отсутствуют. Базальный слой эпидермиса, в отличие от контрольной группы, представлен свойственным ему непрерывным рядом палисадообразных цилиндрических клеток с крупными овальными ядрами и имеет общую непрерывную границу с дермой. Благодаря этому слою эпидермиса происходит образование новых тканей и, соответственно, рост кожи. При помощи базального участка происходит замена старых ороговевших тканей вновь образованными молодыми (Гаврилов, Л.Ф., Татаринов В.Г. Анатомия / Л.Ф. Гаврилов, В.Г. Татаринов: Издание второе, переработанное и дополненное - Москва: Медицина,- 1986 - с.368). В подсосочковой области дермы находятся полнокровные кровеносные сосуды, а также щелевидные сосуды, сдавленные рубцово-измененной дермой.
Сосочковый слой дермы хорошо выражен, благодаря чему значительно повышается площадь взаимодействия эпидермиса и дермы. Известно, что этот слой играет большую роль в питании эпидермиса. Питательные вещества из кровеносных сосудов сетчатого слоя дермы проходят сначала через сосочковый слой, затем через базальную мембрану и, наконец, попадают в эпидермис (Гаврилов, Л.Ф., Татаринов В.Г. Анатомия / Л.Ф. Гаврилов, В.Г. Татаринов: Издание второе, переработанное и дополненное - Москва: Медицина,- 1986 - с.368). В ретикулярном слое дермы отмечаются плотно и упорядоченно расположенные пучки утолщенных коллагеновых волокон, ориентированные параллельно поверхности эпидермиса. Сосуды микроциркуляторного русла единичные, имеют небольшие размеры, расположены в подсосочковой области дермы (Фиг.8).
Таким образом, внутрикожное введение плазмиды pBUDK-clVEGF164-clFGF2 по краю кожных ран крысам стимулирует образование сосудов и регенерацию поврежденной ткани и не вызывает отрицательного влияния на организм животных за весь период наблюдения.
Четвертый этап. Изучение терапевтической эффективности плазмиды pBUDK-clVEGF164-clFGF2.
Терапевтическую эффективность плазмиды pBUDK-clVEGF164-clFGF2 оценивали на собаках. Объектом исследования стали 2 собаки с ранами кожного покрова различной этиологии и различной локализации, примерно одинаковые по площади и находящиеся в межлопаточной области. Все животные находились в условиях домашнего содержания. У хозяев было взято письменное информированное согласие на проведение экспериментальной работы. Было сформировано 2 группы: контрольная и опытная группа по 1 особи в каждой группе. Возраст собак 1,5 – 4 года, средняя живая масса – 25 кг, некастрированные кобели.
Лечение ран у всех клинически больных собак начиналось с первичной хирургической обработки. Вначале проводили туалет раны. Шерстный покров вокруг раны выстригали, выбривали, рану санировали 3%-ным раствором перекиси водорода, а края обрабатывали 5%-ным раствором спиртового йода. Далее, скальпелем с лезвием №24 иссекали края раны, которые имели непосредственный контакт с ранящим предметом, а раневую полость скарифицировали. В случае повреждения кровеносных сосудов в зоне иссечения, осуществляли механический гемостаз торзированием с помощью гемостатического зажима.
Манипуляции у всех животных были проведены под потенциированным местным обезболиванием, для которого использовали внутримышечное введение 2%-го раствора препарата Ксила в дозировке 0,15 мл/кг и инфильтрацию области раны 2%-ным раствором новокаина в дозе 10 мл.
Дальнейшее лечение имело вид местной обработки ран, а именно - в первую фазу раневого процесса раневой участок орошали 3 %-ным раствором перекиси водорода, размягчали и удаляли корочки засохшего экссудата, апплицировали мазь Левосин в полость раны и по ее краям. Мазь наносили 2 раза в день. Такое лечение проводилось у животных контрольной группы во все фазы раневого процесса. Данное лечение было одинаковым для животных всех групп на протяжении первой фазы раневого процесса. Общие клинические исследования включали в себя учет общего состояния животного, пульсометрию, подсчет количества дыхательных движений, термометрию, контроль аппетита и проводились ежедневно с первого дня до конца опыта в каждой группе. Планиметрические исследования включали в себя измерение площади раны в динамике по методике, описанной выше.
На протяжении всего наблюдения за собаками показатели температуры тела, пульса и частоты дыхательных движений находились в пределах физиологической нормы для данного вида животных.
На 7 сутки после ранения из полости ран выделялся гнойный экссудат в незначительном объёме. Края раны были отечны, гиперемированы. Раневой процесс находился в первой фазе гидратации и сопровождался биологическим очищением на фоне гнойной экссудации.
Через 14 суток после начала лечения местная клиническая картина характеризовалась тем, что раневая полость очистилась и заполнилась мелкозернистой грануляционной тканью ярко-розового цвета. Гнойной экссудации не наблюдалось. Отмечалось уменьшение отёчности и гиперемии краёв раны. Раневой процесс перешел во вторую фазу дегидратации и сопровождался ростом грануляционной ткани. В этот период собаке из опытной группы внутрикожно ввели плазмиду pBudk-clVEGF164-clFGF2. Объём вводимого препарата составлял 1,0 мл в концентрации 1мг/мл раствора NaCl. Внутрикожное введение препарата производилось равномерно по всему периметру раны. Далее мазь Левосин не применялась для лечения этой собаки. В контрольной группе во вторую и третью фазу раневого процесса продолжали применять Левосин.
На 21 сутки у собаки опытной группы наблюдали активную краевую эпителизацию. У животного контрольной группы краевая эпителизация была выражена в меньшей степени. Это говорит о том, раневой процесс перешел в свою заключительную фазу – рубцевания и эпителизации.
На 28-ые сутки после ранения местный раневой процесс по-прежнему находился в заключительной фазе рубцевания и эпителизации.
В контрольной группе покрытие раны эпителием и полное заживление ран завершилось к 70-м суткам после ранения. Рубец был массивный, плотный, твердый, малоподвижный и болезненный. У собаки опытной группы полное заживление завершилось к 53-м суткам после ранения. Рубец был покрыт эпителием, наблюдался рост единичных волос в области рубца. Рубец был мягким и эластичным, безболезненным при пальпации, не стягивал кожу. Результаты динамических планиметрических измерений области кожного дефекта отражены на Фиг. 9.
На 70 сутки, после полного закрытия раны у собаки контрольной группы, была взята кожа на гистологический анализ у собак обоих групп. Взятие образца кожи проводили под местной анестезией.
На гистологических препаратах кожи собаки контрольной группы в зоне полного заживления раны наблюдается гипертрофическая рубцовая ткань и продольное расположение утолщенных коллагеновых волокон. В образце кожи собаки из опытной группы отмечается нормотрофическая рубцовая ткань с упорядоченным расположением пучков коллагеновых утолщенных волокон, ориентированных параллельно поверхности эпидермиса. Выражена васкуляризация дермы. Базальный слой клеток в обоих случаях лежит на непрерывной базальной мембране и состоит из клеток призматической, грушевидной или треугольной формы. Ядро круглой и овальной формы, четко разграниченное от однородной ацидофильной цитоплазмы. Сосочковый слой эпидермиса не выражен в обоих образцах, что характерно для кожи собаки (12) (Фиг.10).
Толщина эпидермиса у собаки контрольной группы составила 28 мкм, у собаки опытной группы – 23 мкм. По литературным данным, толщина эпидермиса у собаки составляет 12 — 45 мкм [13]. Следовательно, толщина эпидермиса над рубцом у обеих собак не превышает физиологических значений.
Таким образом, установлено, что применение плазмиды pBUDK-clVEGF164-clFGF2 для лечения кожных ран не оказывает отрицательного воздействия на организм собаки, сопровождается уменьшением сроков эпителизации раны и формированием эластичного безболезненного рубца с меньшей площадью.
Основываясь на изложенном выше, принимая во внимание экспериментальны данные, представленные на Фиг. 1 - 10 и прокомментированные в тексте заявочных материалов, представляется возможным сделать вывод о том, что заявленное техническое решение обеспечило реализацию всех поставленных целей, а именно:
- заявленное техническое решение обеспечивает восстановление целостности поврежденной ранее кожи в тех местах, где это недоступно сделать классическими методами (например, недостаток кожи для трансплантации при обширных повреждениях),
- сокращает сроки восстановления целостности кожного покрова (восстановление происходит на 16 дней раньше, чем при использовании классических методов лечения),
- согласно данным, полученным при гистологических исследованиях, заявленное техническое решение обеспечивает адекватную васкуляризацию поврежденной ранее кожи, повышает эффективность и технологичность процедуры излечения собак посредством использования заявленной совокупности признаков.
Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, так как в результате исследований заявителем не обнаружены технические решения, обладающие совокупностью заявленных признаков, приводящих к реализации поставленных целей.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям, так как для специалиста в указанной области техники полученные технические результаты не являются очевидными.
Заявленное техническое решение может быть реализовано в любой ветеринарной клинике, либо на выезде в полевых или домашних условиях с использованием стандартных процедур, оборудования и расходных материалов, что доказывает соответствие заявленного технического решения критерию «промышленная применимость».
Список литературы.
1. Али, С.Г., Искендерова, Н.Э., Лаврик, А.А. Средство для собак обладающее регенеративной активностью // Патент на изобретение №2646793, заявка 2016148716. Зарегистрирован в государственном реестре изобретений РФ 3 июля 2018.
2. Санин, А.В., Данилов Л.Л., Наровлянский А. Н., Мальцев С. Д., Моисеенков А. М., Прозоровский С.В., Шибаев В. Н., Веселовский В.В., Насташенко Т.А., Мисуренко Н. К. Противовирусное средство // Патент на изобретение №2005475, заявка 915004008. Зарегистрирован в государственном реестре изобретений РФ 1 октября 1991.
3. Dietze Gunther; Wicklmayr Matthias. Pharmaceutical composition and method of stimulating blood circulation and wound healing // №4177261
4. Машковский, М.Д. Лекарственные средства: Пособие для врачей. М.: ООО «Новая волна».-2005.- С 724
Wilmink, J.M5. ., Stolk P.W., van Weeren P.R., Barneveld A. The effectiveness of the haemodialysate Solcoseryl for second-intention wound healing in horses and ponies / J.M. Wilmink, P.W. Stolk, P.R. van Weeren, A. Barneveld // J Vet Med A Physiol Pathol Clin Med. 2000 Jun;47(5):311-20.
6. Kevin Y Li; Yasir Sun; Frank Wang // Method for treating various severe skin damages by using autogeneic bone marrow-derived mesenchymal stem cells (BMSCs) // CN105596372
7. Коноплянников, А.Г., Колесников, А.Н., Саенко, А.С., Бардычев, М.С., Пасов, В.В,. Курпешева, А.К., Крикунова, Л.И. Кондиционная среда, обладающая лечебным эффектом // Патент на изобретение №2292212, Заявка 2005116811/15. Приоритет изобретения 2 июля 2005г. Зарегистрирован в государственном реестре изобретений РФ 27 января 2007 г.
8. Lin N, Hu K, Chen S, Xie S, Tang Z, Lin J, et al. Nerve growth factor-mediated paracrine regulation of hepatic stellate cells by multipotent mesenchymal stromal cells
9. Колесникова А. И. Композиция для регенерации клеток кожи и слизистых оболочек // Патент на изобретение №2455354, заявка 2010153950/10. Зарегистрирован в государственном реестре изобретений РФ 29 декабря 2010.
10. Ботин С.А., Онищенко Н.А., Темнов А.А. Композиция для стимулирования роста и регенерации клеток, а также способы ее получения // Патент на изобретение №2341270, заявка 2006146795/15. Зарегистрирован в государственном реестре изобретений РФ 28 декабря 2006
United States11. Patent WO 1998033917 A1. Vascular endothelial growth factor с (VEGF-C) protein and gene, mutants thereof, and uses thereof [Текст] | K. Alitalo, V. Joukov, Ludwig Inst. Cancer Res., Univ. Helsinki Licensing. - Опубл. 06.08.1998
12. Оно Итиро. Средство для лечения старения кожи и рубцов // Патент на изобретение №2524655, заявка 2010138655/15. Зарегистрирован в государственном реестре изобретений РФ 24 марта 2009
13. Плотников, М.В. Первые результаты клинического применения прямой генной терапии VEGF и bFGF при лечении пациентов с хронической ишемией нижних конечностей // Практическая медицина, - Т-2, - №1-2.- 2013.- С 123-125
14. Ткачук, В.А. Акопян, Ж.А. Ефименко, А.Ю., Кочегура, Т.Н., Рубина, К.А., Семина, Е.В., Стамбольский, Д.В., Сысоев, В.Ю., Тарасова, Е.В. Средство для лечения ожогов и ран на основе цитокинов и факторов роста секретируемых мезенхимными клетками человека, способ получения средства и способ лечения ожогов и ран // Патент на изобретение №2574017, Заявка 2014139540/15, приоритет изобретения 30 сентяьря 2014 г. Зарегистрирован в государственном реестре изобретений РФ 27 января 2016 г.
15. Гаврилов, Л.Ф., Татаринов В.Г. Анатомия / Л.Ф. Гаврилов, В.Г. Татаринов: Издание второе, переработанное и дополненное - Москва: Медицина,- 1986 - с.368



Изобретение относится к области биохимии, в частности к способу стимуляции репаративного ангиогенеза и регенерации кожного покрова при его повреждении в ветеринарии у собак. Также раскрыта генетическая ДНК-конструкция для использования в вышеуказанном способе, представляющая собой двухкассетную экспрессионную плазмиду, реализованную на базе вектора pBudCE4.1, в ДНК-конструкцию клонированы гены, стимулирующие экспрессию видоспецифичных для собаки белковых факторов, а именно - сосудистого эндотелиального фактора роста изоформы 164 (VEGF164) и фактора роста фибробластов 2 (FGF2). Изобретение позволяет эффективно стимулировать репаративный ангиогенез и регенерацию кожного покрова при его повреждении в ветеринарии у собак. 2 н.п. ф-лы, 10 ил., 1 пр.
1. Способ стимуляции репаративного ангиогенеза и регенерации кожного покрова при его повреждении в ветеринарии у собак, заключающийся в том, что в организм собаки вводят фармацевтическую композицию, содержащую генетическую ДНК-конструкцию, выполненную в виде двухкассетной экспрессионной плазмиды, реализованной на базе вектора pBudСЕ4.1, в ДНК-конструкцию клонированы гены, стимулирующие экспрессию видоспецифичных для собаки белковых факторов, а именно - сосудистого эндотелиального фактора роста изоформы 164 (VEGF164) и фактора роста фибробластов 2 (FGF2), в эффективном количестве и допустимые вспомогательные вещества.
2. Генетическая ДНК-конструкция для использования в способе по п.1, представляющая собой двухкассетную экспрессионную плазмиду, реализованную на базе вектора pBudCE4.1, в ДНК-конструкцию клонированы гены, стимулирующие экспрессию видоспецифичных для собаки белковых факторов, а именно - сосудистого эндотелиального фактора роста изоформы 164 (VEGF164) и фактора роста фибробластов 2 (FGF2).
| Способ стимуляции репаративного ангиогенеза и регенерации соединительной ткани, при её повреждении, методом генной терапии с использованием видоспецифичных генов белковых факторов vegf и fgf2, в ветеринарии, и генетическая конструкция для реализации заявленного способа | 2015 |
|
RU2614665C1 |
| ЗАКИРОВА Е.Ю | |||
| и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| YANAGITA M | |||
| et al., Cooperative Effects of FGF-2 and VEGF-A in Periodontal Ligament Cells, J Dent Res, 2014, Vol.93, | |||
Авторы
Даты
2020-04-20—Публикация
2019-06-07—Подача