Изобретение относится к области медицины в целом, более точно к терапии ламеллярного ихтиоза (ЛИ), входящего в группу аутосомно-рецессивных врожденных ихтиозов (АРВИ; MIMs №190195, 242100, 242300), которые представляют собой тяжелые наследственные кожные заболевания, возникающие вследствие аномального перекрестного сшивания ороговевшей клеточной оболочки. Заявленное техническое решение заключается в разработке и доставке генетической конструкции, включающей кодон-оптимизированную нуклеотидную последовательность гена TGM1 с помощью рекомбинантного аденоассоциированного вируса (AAV) AAV-TGM1. Доставка нормального гена (без мутации) позволяет восстанавливать дефицит фермента TGM1 и его ферментативную активность, тем самым способствуя замедлению прогрессии ЛИ и излечению пациента.
Далее в тексте заявителем приведены термины, которые необходимы для облегчения однозначного понимания сущности заявленных материалов и исключения противоречий и/или спорных трактовок при выполнении экспертизы по существу.
АРВИ - аутосомно-рецессивный врожденный ихтиоз (АРВИ) представляет собой гетерогенную группу нарушений кератинизации, характеризующихся, прежде всего, аномальным шелушением кожи по всему телу. Эти нарушения ограничены кожей, и примерно у двух третей пациентов проявляются тяжелые симптомы [https://omim.org/entry/242300].
Генетическая конструкция - молекула нуклеиновой кислоты, чаще всего ДНК, используемая в генетической инженерии для передачи генетического материала внутрь клетки [https://ru.wikipedia.org/wiki/].
Рекомбинантный аденоассоциированный вирус - вирусный вектор для доставки целевых генов в молекулярной медицине [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5548848/].
Гетерозиготная или гомозиготная разновидность мутации - клетки человека, содержащие двойной набор всех генов, таким образом мутация может происходить только в одном из парных генов (гетерозиготная форма -/+), либо в обоих парных генах в (гомозиготная форма +/+) [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6418373/].
Гиперкератоз - это утолщение рогового слоя (наружного слоя эпидермиса, или кожи), часто связанное с наличием аномального количества кератина [Chulpanova, D.S.; Shaimardanova, A.A.; Ponomarev, A.S.; Elsheikh, S.; Rizvanov, A.A.; Solovyeva, V.V. Current Strategies for the Gene Therapy of Autosomal Recessive Congenital Ichthyosis and Other Types of Inherited Ichthyosis. Int J Mol Sci 2022, 23, doi:10.3390/ijms23052506], а также обычно сопровождающееся увеличением зернистого слоя [https://www.ncbi.nlm.nih.gov/books/NBK562206/#:~:text=Hyperkeratosis%20refers%20to%20the%20increased,outer%20layer%20of%20the%20skin].
Делеции гена - хромосомные перестройки, при которых происходит потеря участка хромосомы [https://ru.wikipedia.org/wiki/].
Изопептидные белок-белковые связи - изопептидные белок-белковые связи, относящиеся к типу ковалентной связи, которая образуется между двумя аминокислотами в белках посредством образования изопептидной связи. В отличие от пептидных связей, которые образуются между соседними аминокислотами в полипептидной цепи, изопептидные связи возникают между аминокислотами, которые не являются непосредственно соседними друг с другом [https://en.wikipedia.org/wiki/Isopeptide_bond].
кДНК - комплементарная дезоксирибонуклеиновая кислота, синтезированная на матрице зрелой мРНК в реакции, катализируемой обратной транскриптазой [https://ru.wikipedia.org/wiki/];
Кодоная оптимизация нуклеотидной последовательности - процесс подбора оптимального триплета азотистых оснований для повышения эффективности трансляции матричной РНК (мРНК) в полипептиды с рекомбинантной экспрессионной генетической конструкции. Кодонная оптимизация используется, в том числе, для векторов, применяемых в генной терапии [https://www.nature.com/articles/s41598-020-74091-z].
ЛИ - ламеллярный ихтиоз, характеризующийся наличием крупных чешуек по всему телу без значительной эритродермии [https://www.orpha.net/consor/cgi-bin/OC_Exp.php?Lng=GB&Expert=313].
Липосомы - сферические везикулы, имеющие один или несколько липидных бислоёв [https://ru.wikipedia.org/wiki/].
мРНК - матричная рибонуклеиновая кислота, содержащая информацию о первичной структуре (аминокислотной последовательности) белков [https://ru.wikipedia.org/wiki/%D0%9C%D0%B0%D1%82%D1%80%D0%B8%D1%87%D0%BD%D0%B0%D1%8F_%D0%A0%D0%9D%D0%9A].
Неинтегрирующий вирус простого герпеса-1 - используется для создания векторов для генной терапии. Не подтвержден FDA [https://pubmed.ncbi.nlm.nih.gov/32976879/].
Ороговевшая клеточная оболочка - эпидермис функционирует как барьер против окружающей среды посредством нескольких слоев терминально дифференцированных, мертвых кератиноцитов - ороговевшего слоя, который образует конечную точку эпидермальной дифференцировки и гибели. Роговая оболочка заменяет плазматическую мембрану дифференцирующихся кератиноцитов и состоит из кератинов, заключенных в нерастворимую амальгаму белков, сшитых трансглютаминазами и окруженных липидной оболочкой [https://www.nature.com/articles/nrm1619].
ПЦР-РВ - полимеразная цепная реакция в режиме реального времени [https://ru.wikipedia.org/wiki/];
Сплайсинг - процесс вырезания определённых нуклеотидных последовательностей из молекул РНК и соединения последовательностей, сохраняющихся в «зрелой» молекуле, в ходе процессинга РНК [https://ru.wikipedia.org/wiki/].
ТБС - трис-буфер солевой.
ТБС-T - трис-буфер солевой, 0.05 % твин 20.
Трансгенный продукт - рекомбинантный белок, который экспрессируется в результате переноса гена в клетку [https://www.frontiersin.org/articles/10.3389/fbioe.2019.00420/full].
Трансдукция - это процесс, при котором чужеродная ДНК вводится в клетку с помощью вируса или вирусного вектора [https://en.wikipedia.org/wiki/Transduction_(genetics)].
Эндоцитоз - это клеточный процесс, в ходе которого вещества попадают в клетку [https://www.ncbi.nlm.nih.gov/books/NBK9831/].
Эпидермальный барьер - характеристика эпидермиса кожи, основной функцией которой является защита внутренних тканей от внешней воздействий и сохранение их целостности [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8583944/].
Эпидермальные кератиноциты - основной тип клеток эпидермиса, самого внешнего из слоев кожи, составляя около 90 процентов всех клеток [https://promocell.com/cell-culture-basics/keratinocytes/].
AAV - аденоассоциированный вирус, инфицирующий клетки человека и некоторых других приматов. Аденоассоциированный вирус, по-видимому, не вызывает заболевания у человека и, соответственно, вызывает слабый иммунный ответ [https://ru.wikipedia.org/wiki/].
CMV энхансер, промотор - непосредственно-ранний энхансер и промотор цитомегаловируса человека (CMV) обычно используют для транзиторной экспрессии трансгенов [https://link.springer.com/protocol/10.1385/1-59745-037-5:283];
HEK293T - клеточная линия, полученная из эмбриональных почек человека, широко используется в биотехнологической и фармакологической отраслях как продуцент терапевтических белков и вирусов для генной терапии [https://ru.wikipedia.org/wiki/];
MOI - множественность инфекции, представляет собой среднее количество вирусных частиц на одну клетку. MOI рассчитывается путем деления общего количества трансдуцирующих единиц на количество высеянных клеток [https://en.wikipedia.org/wiki/Multiplicity_of_infection].
n^ε-(γ-глутамил)лизин - представляет собой сшивающий белок остаток, который образуется под действием фермента трансглутаминазы 1 (TGM1). TGM1 представляет собой кальций-зависимый фермент, который катализирует образование ковалентных связей между белковыми молекулами, что приводит к образованию межбелковых поперечных связей. Эти сшивки способствуют структурной стабильности тканей, таких как кожа, волосы и ногти [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1223021/].
NCIE - врожденная небуллезная ихтиозиформная эритродермия, характеризующаяся генерализованным шелушением, сопровождающимся более или менее выраженной эритродермией без образования пузырей [https://www.orpha.net/consor/cgibin/Disease_Search.php?lng=EN&data_id=11420&Disease_Disease_Search_diseaseGroup=congenital-non-bullous-ichthyosiform erythroderma&Disease
_Disease_Search_diseaseType=Pat&Disease(s)/group%20of%20diseases=Congenital-ichthyosiform erythroderma&title=Congenital%20ichthyosiform%20erythroderma&search
=Disease_Search_Simple]
TGM1 - ген, кодирующий фермент трансглутаминазу 1 [https://medlineplus.gov/genetics/gene/tgm1/#synonyms];
TGM1 - фермент трансглутаминаза 1 [https://en.wikipedia.org/wiki/Keratinocyte_transglutaminase];
WI - Клетки Вартонова студня, экспрессируют несколько генов стволовых клеток, включая ген, кодирующий теломеразу. Они могут быть извлечены, культивированы и индуцированы, чтобы дифференцироваться в зрелые типы клеток, такие как нейроны, остеобласты, хондробласты и адипоциты [https://ru.wikipedia.org/wiki/].
На дату подачи настоящей заявки в мире существует проблема терапии ЛИ, эффективное лечение которого отсутствует.
Краткая суть ламеллярного ихтиоза (ЛИ) сводится к нарушению формирования эпидермального барьера, что вызывает гиперкератоз, шелушение и воспаление кожи из-за дефицита фермента TGM1. Таким образом, ЛИ представляет собой тяжелое наследственное кожное заболевание, вследствие которого происходит нарушение формирования рогового слоя эпидермиса.
Недостаточность фермента TGM1 или нарушение его функционирования из-за неправильного сплайсинга возникает в результате мутации или делеции гена TGM1 [Chulpanova, D.S.; Shaimardanova, A.A.; Ponomarev, A.S.; Elsheikh, S.; Rizvanov, A.A.; Solovyeva, V.V. Current Strategies for the Gene Therapy of Autosomal Recessive Congenital Ichthyosis and Other Types of Inherited Ichthyosis. Int J Mol Sci 2022, 23, doi:10.3390/ijms23052506].
Трансглутаминаза 1 кератиноцитов необходима для специфического катализа развития ороговевшей клеточной оболочки, определяющей характеристики эпидермальных кератиноцитов, находящихся в завершающей стадии дифференцировки. Специфические поперечные связи, образованные трансглутаминазой кератиноцитов, образуются между n^ε-(γ-глутамил)лизиновыми остатками, которые превращаются в изопептидные белок-белковые связи, что способствует стабилизации ороговевшей клеточной оболочки. Синтез фермента TGM1 наиболее сильно проявляется вдоль биологической мембраны этих полностью сформированных эпителиальных клеток, предотвращающей химические и/или физические повреждения клетки. Меньшая степень ферментативной активности TGM1 (5-10%) приходится на цитоплазматическую фракцию таких клеток, что позволяет завершить перекрестное сшивание, необходимое для полной функциональности ороговевшей клеточной оболочки.
У больных ихтиозом наблюдается снижение активности фермента (приблизительно на 85% от нормы) в результате уменьшения количества транскрипции гена TGM1. Это отсутствие белка происходит из-за разных типов мутации, которые возникают в гене TGM1 на хромосоме 14q11, как показано у всех участников исследования [Zhang, H.; Ericsson, M.; Westrom, S.; Vahlquist, A.; Virtanen, M.; Torma, H. Patients with congenital ichthyosis and TGM1 mutations overexpress other ARCI genes in the skin: Part of a barrier repair response? Exp Dermatol 2019, 28, 1164-1171, doi:10.1111/exd.13813]. Такие мутации были сложной гетерозиготной или гомозиготной разновидностью, приводящих к аномальному перекрестному сшиванию ороговевшей клеточной оболочки и развитию ЛИ и других видов АРВИ.
Осложнения ихтиозов могут обуславливать отставание в росте и физическом развитии ребенка вследствие нарушения теплообмена в раннем детстве. При ихтиозах отмечается трансэпидермальная потеря воды и повышенный риск развития кожных суперинфекций, что может привести к сепсису и летальному исходу [Choate, K.A.; Kinsella, T.M.; Williams, M.L.; Nolan, G.P.; Khavari, P.A. Transglutaminase 1 delivery to lamellar ichthyosis keratinocytes. Hum Gene Ther 1996, 7, 2247-2253, doi:10.1089/hum.1996.7.18-2247].
Заявленное техническое решение основывается на том, что после генетической модификации, а именно после трансдукции рекомбинантным AAV-TGM1 целевых клеток эпидермиса (кератиноциты и клетки-предшественницы), начнется считывание оптимизированной по кодонному составу нуклеотидной последовательности гена TGM1 и секреция дефицитного фермента TGM1. Особенностью рекомбинантного аденоассоциированного вируса (AAV) является его способность эффективно инфицировать клетки и доставлять целевые гены, при этом, не внедряясь в геном клетки-хозяина, таким образом, что вирусная ДНК остается во внехромосомном состоянии. Затем вирусная ДНК выступает матрицей для синтеза мРНК (транскрипция) как другие гены в клетке, располагающиеся на хромосомах или в митохондриях, но не реплицируется, когда клетка подвергается делению. За счет отсутствия интеграции вирусного генома в геном клетки-хозяина отсутствует риск вставочного мутагенеза и онкологической трансформации [Naso, M.F.; Tomkowicz, B.; Perry, W.L., 3rd; Strohl, W.R. Adeno-Associated Virus (AAV) as a Vector for Gene Therapy. BioDrugs 2017, 31, 317-334, doi:10.1007/s40259-017-0234-5]. Известно, что AAV не вызывают инфекционных заболеваний у человека, обладают низкой иммуногенностью, а следовательно рекомбинантные вектора на основе AAV обладают высокой биобезопасностью [Zaiss, A.K.; Muruve, D.A. Immune responses to adeno-associated virus vectors. Curr Gene Ther 2005, 5, 323-331, doi:10.2174/1566523054065039]. Доставка гена TGM1 с помощью AAV-TGM1 в клетки кожи пациента с ЛИ повышает концентрацию фермента до нормального физиологического уровня, таким образом, становится возможным восстановление гомеостаза кожного покрова и улучшение качества жизни пациентов.
Заявленное техническое решение предоставляет возможность разрешения не преодолимых ранее препятствий, а именно то, что ранее, в период развития генной терапии, не были разработаны методы переноса дефицитного гена в клетки эпидермиса человека, на дату же представления заявочных материалов таковая возможность появилась, т.е. восполнение дефицита TGM1 и восстановление ферментативной активности в организме, стало возможным, что обеспечивает улучшение качества жизни пациентов с ЛИ. Это позволяет сделать логически обоснованный вывод о соответствии заявленного технического решения не только критерию мировая новизна, но и критерию изобретательский уровень вследствие заявленного способа генной терапии ЛИ, который представляет собой прямое введение или аппликативное применение рекомбинантного AAV-TGM1, который запускает секрецию фермента TGM1 в инфицированных вирусом клетках. Разработанный рекомбинантный аденоассоциированный вирус обеспечивает возможность доставки недостающего фермента TGM1 в клетки кожи, вследствие чего, по мнению заявителя, обеспечивается возможность остановки патологических процессов рогового слоя эпидермиса и улучшения качества жизни пациентов. В результате реализации заявленного технического решения становится возможным решать нереализуемые на дату подачи заявки проблему, такую, как прямая доставка гена TGM1 в эпидермис.
Рекомбинантный аденоассоциированный вирус AAV-TGM1 содержит кодон-оптимизированную нуклеотидную последовательность гена TGM1, с которой синтезируется функционально активный фермент TGM1. Благодаря способности AAV мигрировать в разные типы тканей в зависимости от серотипа, обеспечивается секреция фермента в коже пациента. Таким образом, восстанавливается нарушенная экспрессия и функционирование фермента TGM1 в коже и достигается излечение пациентов с ЛИ.
Решение проблемы терапии ЛИ представляется актуальным ввиду отсутствия на дату представления настоящей заявки эффективных и безопасных способов терапии ЛИ. В настоящее время терапия АРВИ направлена на снижение симптомов и не дает длительного эффекта. Такой тип лечения направлен на улучшение качества жизни пациента без устранения основной причины заболевания. Симптоматическая терапия включает применение увлажняющих средств, кератолитиков, ретиноидов, аналогов витамина Д, кортикостероидов и ингибиторов кальциневрина [Sussmuth, K.; Traupe, H.; Metze, D.; Oji, V. Ichthyoses in everyday practice: management of a rare group of diseases. J Dtsch Dermatol Ges 2020, 18, 225-243, doi:10.1111/ddg.14049].
Однако активно исследуются новые подходы к терапии этих заболеваний. На стадии разработки находятся перспективные терапевтические стратегии, которые активно исследуется в настоящее время, а именно перенос гена с использованием неинтегрирующего вируса простого герпеса-1 (HSV-1) или перенос липосом, загруженных ферментом TGM1 [Freedman, J.C.; Parry, T.J.; Zhang, P.; Majumdar, A.; Krishnan, S.; Regula, L.K.; O'Malley, M.; Coghlan, S.; Yogesha, S.D.; Ramasamy, S.; et al. Preclinical Evaluation of a Modified Herpes Simplex Virus Type 1 Vector Encoding Human TGM1 for the Treatment of Autosomal Recessive Congenital Ichthyosis. J Invest Dermatol 2021, 141, 874-882 e876, doi:10.1016/j.jid.2020.07.035]. Однако эти методы терапии ЛИ не показали необходимого уровня эффективности и безопасности. В отличие от разработки на основе вируса герпеса, техническое решение, основанное на аденоассоциированном вирусе, имеет значительные преимущества, в том числе; возможность включения как в делящиеся, так и в клетки в состоянии покоя; широкий профиль трансдукции; низкий иммунный ответ; сильная и стабильная экспрессия трансгена, низкая патогенность вируса, репликация без включения в хромосому. Использование липосом показало ряд недостатков стабильности, связанных с быстрым разрушением фермента и низким уровнем эффекта восстановления [Aufenvenne, K.; Larcher, F.; Hausser, I.; Duarte, B.; Oji, V.; Nikolenko, H.; Del Rio, M.; Dathe, M.; Traupe, H. Topical enzyme-replacement therapy restores transglutaminase 1 activity and corrects architecture of transglutaminase-1-deficient skin grafts. Am J Hum Genet 2013, 93, 620-630, doi:10.1016/j.ajhg.2013.08.003]. Требуются дополнительные манипуляции для поддержания эндоцитоза и загрузки липосом терапевтическим агентом.
Таким образом, вышеописанные методы лечения ЛИ являются неэффективными, следовательно, поиск новых препаратов и методов лечения является актуальной задачей. Единственным зарегистрированным лекарственным средством c подтвержденными клиническими исследованиями ЛИ является препарат Trifarotene, однако его применение направлено на снижение симптоматики зaбoлeвaния [Cosio, T.; Di Prete, M.; Gaziano, R.; Lanna, C.; Orlandi, A.; Di Francesco, P.; Bianchi, L.; Campione, E. Trifarotene: A Current Review and Perspectives in Dermatology. Biomedicines 2021, 9, doi:10.3390/biomedicines9030237].
Заявителем проведен анализ существующего уровня техники по научной и патентной информации в области терапии ЛИ и выявлен ряд препаратов, которые используются в настоящее время для облегчения симптомов и для остановки усугубления гиперкератоза верхних слоев кожного покрова.
Из исследованного уровня техники выявлено изобретение по патенту JP2003306448 «Геннотерапевтическая медицина наследственных заболеваний». Сущностью является препарат для генной терапии наследственных заболеваний, содержащий иммунодепрессант и ген, ответственный за наследственное заболевание. Лекарственное средство для генной терапии генетических заболеваний по любому из пп.1-4, в котором ген, ответственный за генетическое заболевание, находится в форме вирусного вектора или "голой" ДНК. Препарат для генной терапии генетических заболеваний по п.6, где рецессивное генетическое заболевание представляет собой аутосомно-рецессивное генетическое заболевание. Способ лечения генетического заболевания, включающий применение препарата для генной терапии генетического заболевания по любому из пп.1-7. Пункт, отличающийся тем, что наследственным заболеванием является рецессивный наследственный дистрофический врожденный буллезный эпидермолиз, узловой врожденный буллезный эпидермолиз, врожденный гемидесмосомальный буллезный эпидермолиз или врожденный ихтиоз.
Недостатком известного технического решения по сравнению с заявленным техническим решением является доставка гена с помощью плазмидной генетической конструкции. Такая доставка имеет особенности, по сравнению с инкапсулированной в вирусный капсид ДНК, включающие: более быстрый распад нуклеиновой кислоты, отсутствие тропизма к тканям и низкий уровень трансфекции клеток.
Из исследованного уровня техники выявлено изобретение по патенту US 20190314430 «Композиции и способы лечения аутосомно-рецессивного врожденного ихтиоза», сущностью является фармацевтическая композиция, содержащая: (a) вирус герпеса, содержащий геном рекомбинантного вируса герпеса, где геном рекомбинантного вируса герпеса содержит один или несколько полинуклеотидов, кодирующих полипептид трансглутаминазы (TGM); и (b) фармацевтически приемлемый эксципиент. Фармацевтический состав, где рекомбинантный геном вируса герпеса является компетентным к репликации. Фармацевтический состав, где геном рекомбинантного вируса герпеса представляет собой геном рекомбинантного вируса простого герпеса типа 1 (HSV-1). Фармацевтический состав, где полипептид TGM представляет собой полипептид TGM человека. Фармацевтический состав, где полипептид TGM имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96% , по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичности последовательности аминокислотной последовательности SEQ ID NO: 5. Фармацевтический состав, где фармацевтическая композиция пригодна для местного применения. Способ, при этом субъект страдает ламеллярным ихтиозом (LI). Способ, где фармацевтическую композицию вводят субъекту местно.
Говоря кратко, известное изобретение частично относится к рекомбинантным нуклеиновым кислотам, вирусам, фармацевтическим композициям и способам их применения для лечения дефицита трансглутаминазы (например, дефицита трансглутаминазы-1 и/или для обеспечения профилактического, паллиативного или терапевтического облегчения ЛИ и/или небуллезной врожденной ихтиозиформной эритродермией (NCIE).
Недостатком известного технического решения по сравнению с заявленным техническим решением является более высокая патогенность вируса простого герпеса типа 1, данный вирус вызывает заболевание у человека в природе, на этот вектор высокий иммунный ответ, а длительность экспрессии трансгена значительно меньше.
Техническим результатом заявленного технического решения является разработка способа терапии ламеллярного ихтиоза с использованием рекомбинантного аденоассоциированного вируса на основе генетической конструкции, кодирующей кодон-оптимизированную нуклеотидную последовательность гена трансглутаминазы 1 с низким иммунным ответом на трансгенный продукт при генной терапии генетического заболевания, такого как рецессивное наследственное заболевание.
Сущностью заявленного технического решения является способ терапии ламеллярного ихтиоза, заключающийся в том, что подкожно вводят рекомбинантный аденоассоциированный вирус на основе генетической конструкции, кодирующей нуклеотидную последовательность гена трансглутаминазы 1.
Заявленное техническое решение иллюстрируется Фиг.1 - Фиг.8.
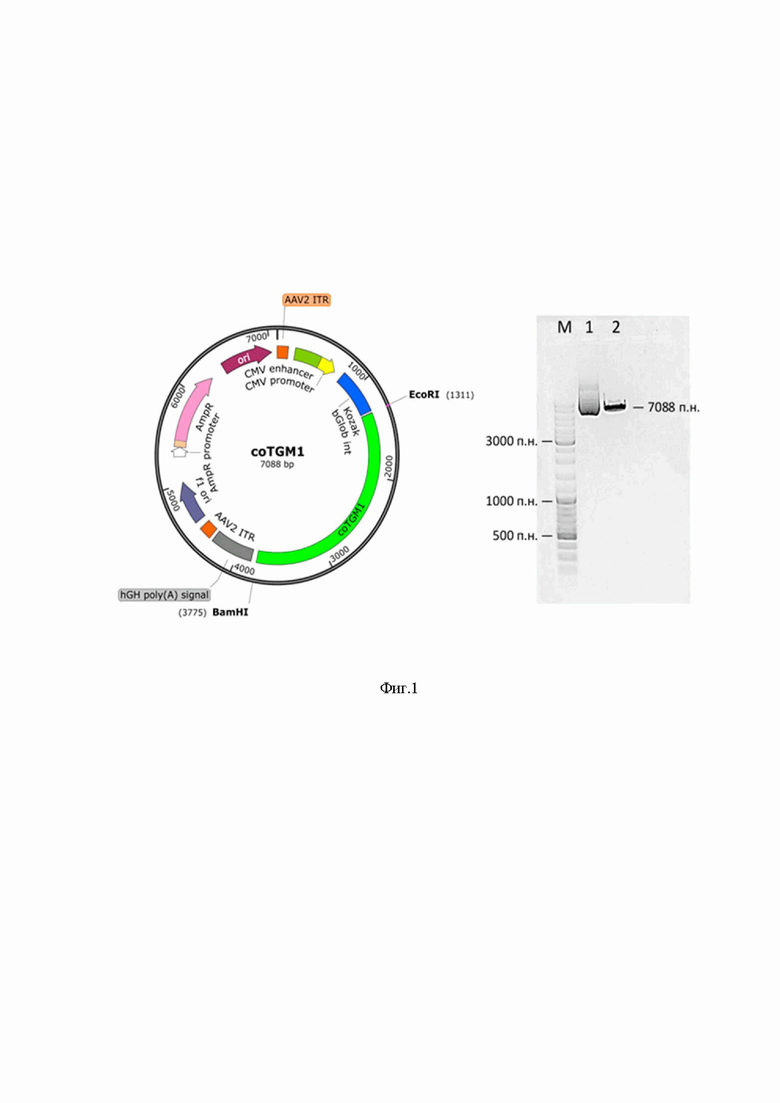
На Фиг.1 представлена разработанная генетическая конструкция pAAV-TGM1, содержащая левый и правый концевые повторы (ITR), промоторную область, включающую энхансер и промотер (CMV enhancer, CMV promoter), интрон β-глобина (bGlob int), последовательность Козак (Kozak), сайт рестрикции EcoRI (EcoRI), кодон-оптимизированную последовательность (coTGM1), последовательность полиаденилирования гормона роста человека (poly-A), сайты репликации (f1 ori; ori), промотор и последовательность сайта резистентности к ампицилину (AmpR promoter, AmpR). Размер синтезированной генетической последовательности (7088 п.н.) был подтвержден рестрикционным анализом.
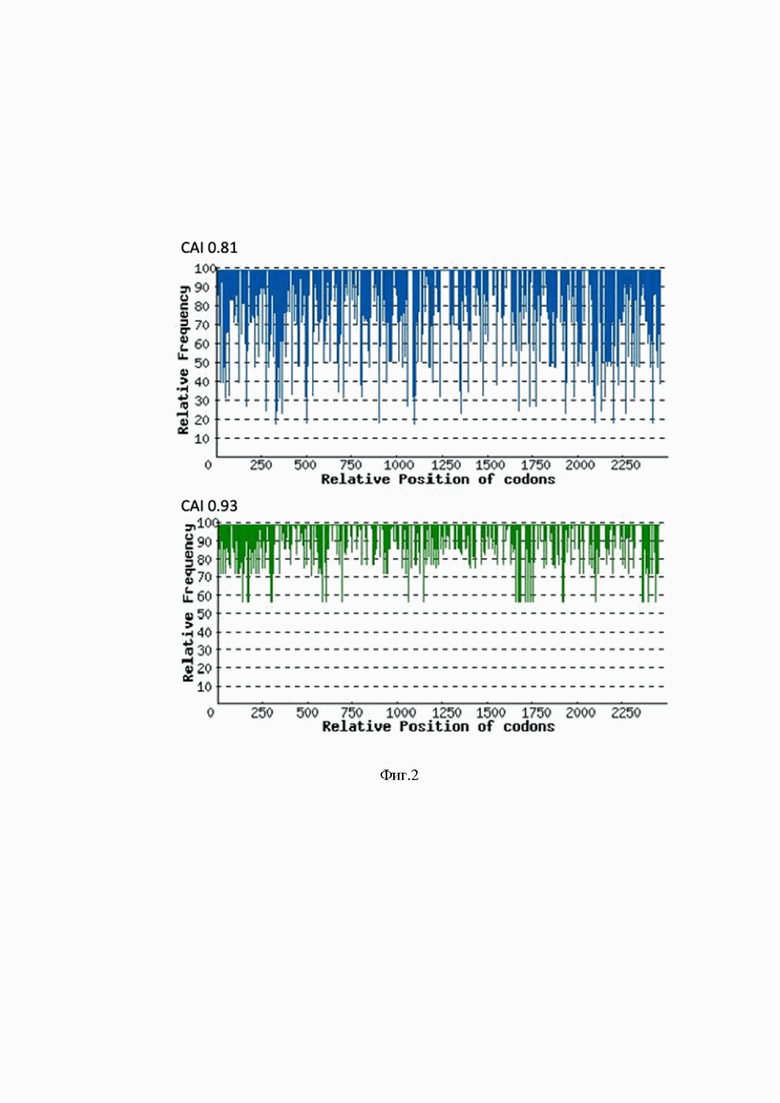
На Фиг.2 представлена оптимизация индекса адаптации кодонов (англ. codon adaptation index, CAI) гена TGM1 (с 0.81 до 0.93) через распределение частоты использования кодонов по длине последовательности гена. По оси Х указано относительное положение кодонов (Relative position of codons), по оси Y указано относительная частота (Relative frequency).
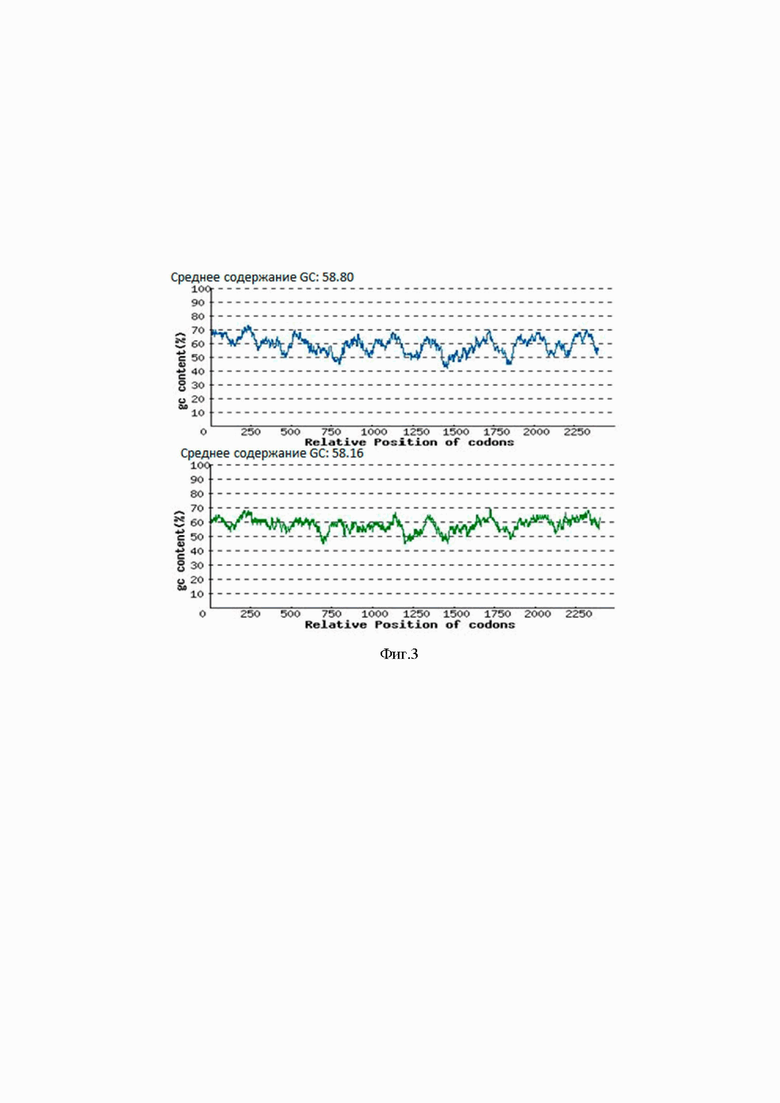
На Фиг.3 представлена оптимизация GC-состава для повышения стабильности мРНК гена TGM1 (с 58.80 до 58.16). По оси Х указано относительное положение кодонов (Relative position of codons), по оси Y указано содержание азотистых оснований gc (%) (gc content (%)).
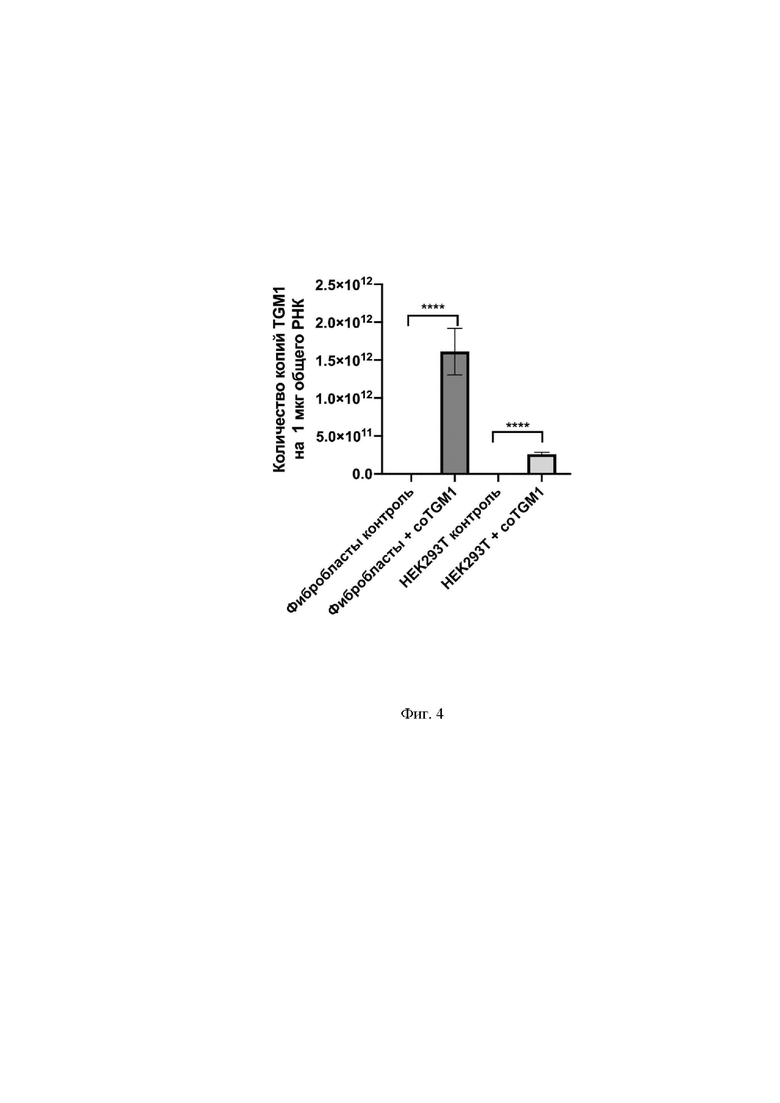
На Фиг.4 представлена оценка экспрессии гена TGM1, выраженная в количестве копий гена на 1 мкг общего РНК в фибробластах человека и клетках HEK293T. По оси Х указаны контрольные и опытные группы, по оси Y указано количество копий целевого гена на 1 мкг общего РНК.
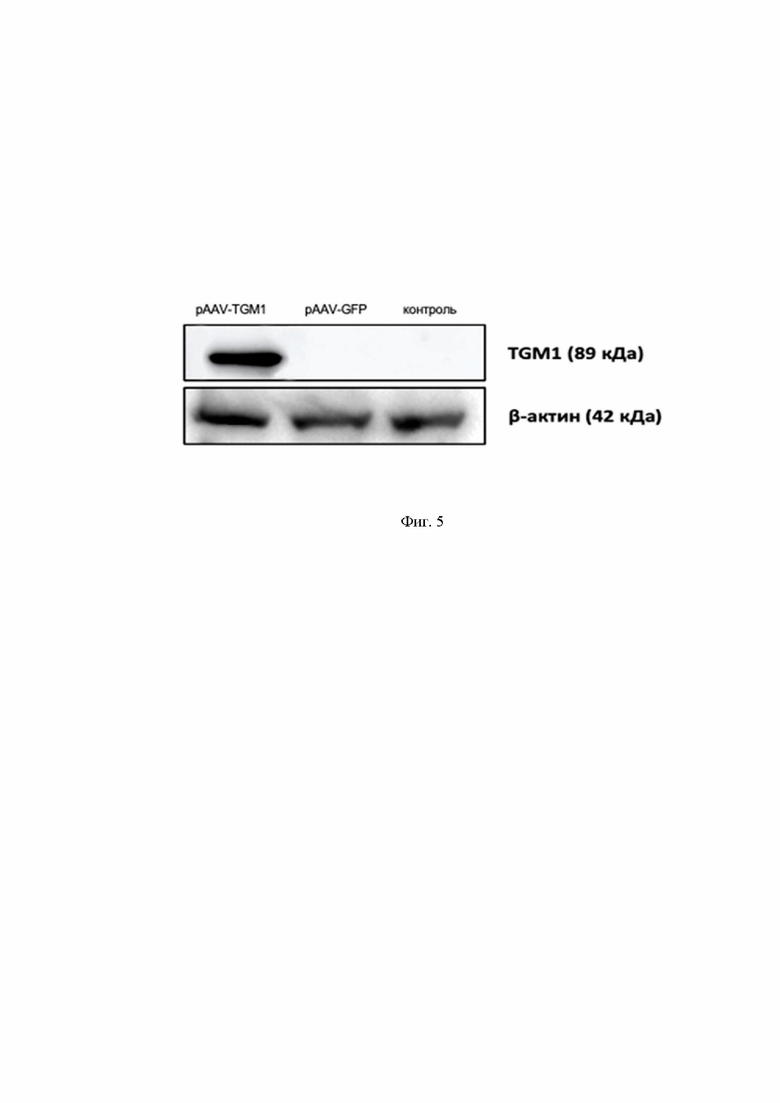
На Фиг.5 представлен вестерн-блот анализ, показывающий наличие сверхэкспрессии TGM1 в клетках HEK293T), трансфицированных плазмидой pAAV-TGM1. Молекулярная масса TGM1 соответствуют 80.9 кДа.
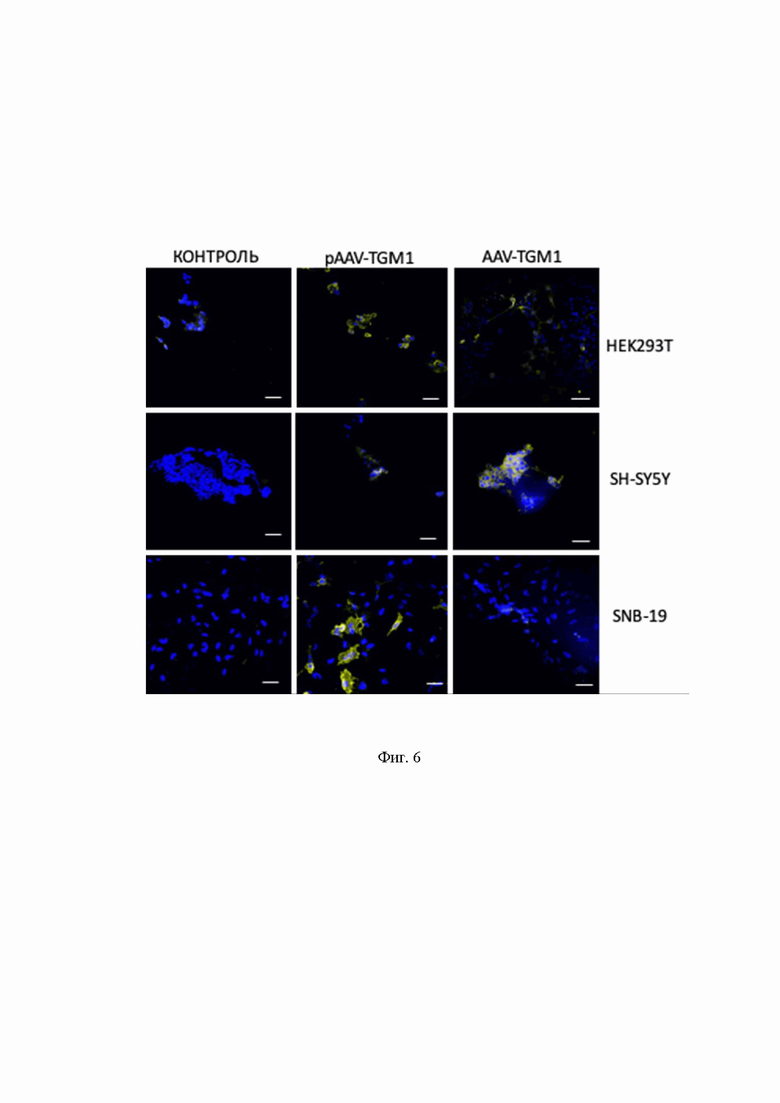
На Фиг.6 представлен иммуноцитохимический анализ, который демонстрирует сверхэкспрессию TGM1 в клетках HEK293T, SH-SY5Y, SNB-19 после трансфекции pAAV-TGM1 и трансдукции AAV-TGM1.
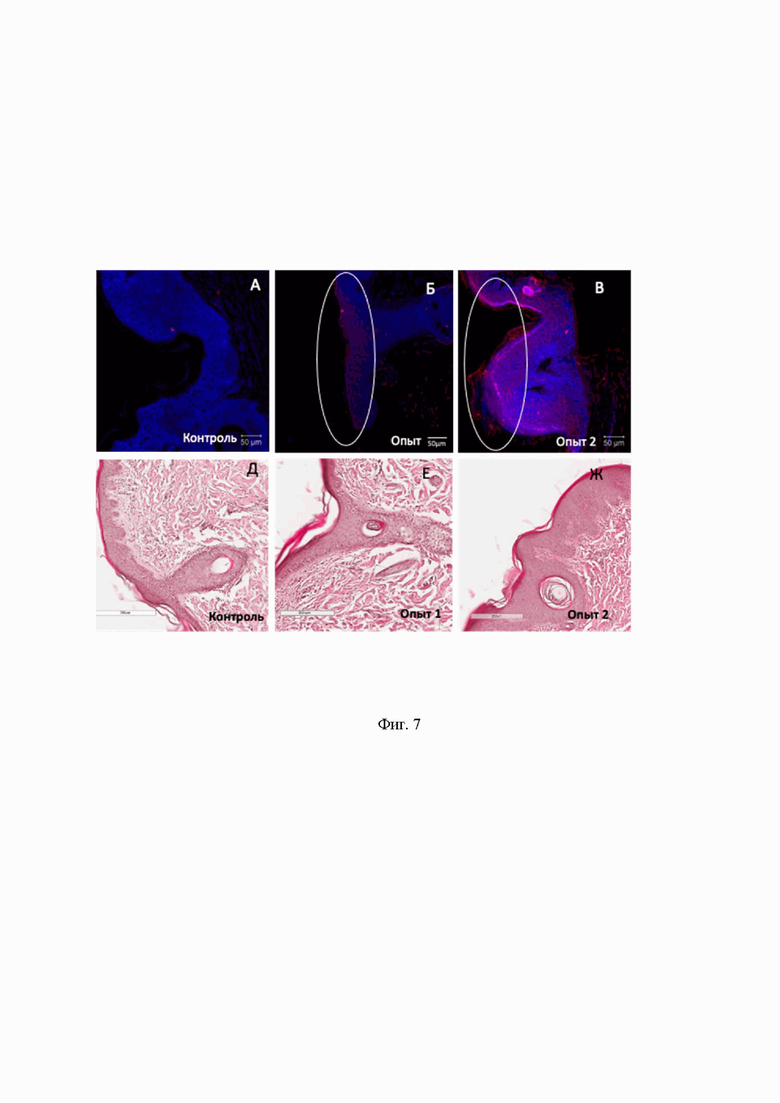
На Фиг.7 представлен иммуногистохимический анализ, демонстрирующий сверхэкспрессию TGM1 в гистологических образцах кожи свиней. Шкала 50 μм
7А - представлено иммуногистохимическое окрашивание эпидермиса контрольной группы свиней,
7Б, 7В - представлено иммуногистохимическое окрашивание эпидермиса опытных групп свиней,
7Д - представлено окрашивание гематоксилин-эозином эпидермиса контрольной группы свиней,
7Е, 7Ж - представлено окрашивание гематоксилин-эозином эпидермиса опытных групп свиней.
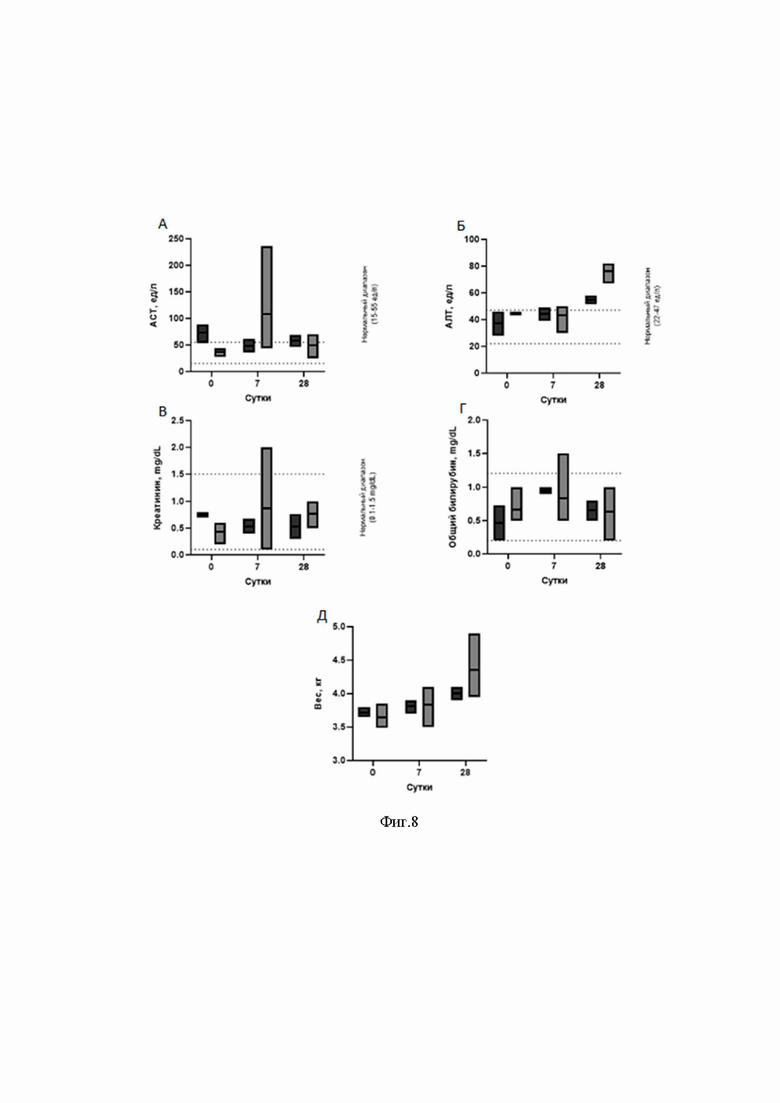
На Фиг.8 представлена оценка биохимических показателей крови свиней после введения рекомбинантного аденоассоциированного вируса.
8А - представлена оценка уровня аспартатаминотрасферазы (АСТ) на 0, 3 и 7 сутки после введения аденоассоциированного вируса, по оси Х указаны сутки после введения, по оси Y указано уровень АСТ;
8Б - представлена оценка уровня аланинаминотрансферазы, по оси Х указаны сутки, по оси Y указано уровень АЛТ;
8В - представлена оценка уровня креатинина, по оси Х указаны сутки, по оси Y указан уровень креатинина (mg/dL);
8Г - представлена оценка общего билирубина, по оси Х указаны сутки, по оси Y указан уровень обещего билирубина (mg/dL);
8Д - представлен замер веса испытуемых свиней, по оси Х указаны сутки, по оси Y указан среднее значение веса контрольных и опытных животных;
В Приложении приведена последовательность кодон-оптимизированного гена TGM1.
Далее заявителем приведено описание заявленного технического решения.
Заявленный технический результат достигается разработкой способа терапии ламеллярного ихтиоза с использованием рекомбинантного аденоассоциированного вируса на основе генетической конструкции, кодирующей кодон-оптимизированную нуклеотидную последовательность гена трансглутаминазы 1.
В последние годы генетическая диагностика стала реальностью в области дерматологии, где существует множество исследований наследственных заболеваний, результаты которых были переведены в клиническую практику. Однако проблемой, которая до сих пор не рассматривалась и которую необходимо решить в реальном клиническом применении, является проблема иммунных ответов на генные продукты, введенные из чужеродных источников. В случае аутосомно-рецессивных генетических заболеваний целевые генные продукты (особенно в случае внеклеточных составляющих белков) отсутствуют на стадии онтогенеза пациента, поэтому иммунная система пациента повреждается в процессе развития и дифференцировки. Были предприняты попытки подавить это путем установления иммунной толерантности к продуктам генов, использования иммунодепрессантов и ингибирования связывания поверхностных молекул иммунных клеток, необходимых для установления иммунных ответов. Такие плазмиды содержат вирусные промоторы, такие как промотор CMV (цитомегаловирус), промотор RSV (вирус саркомы Рауса), промотор гена тимидин киназы (TK) HSV-1, ранний промотор SV40 (обезьяний вирус 40), аденовирусный MLP (главный поздний промотор). Кроме того, он может содержать маркерный ген, позволяющий проводить отбор или идентификацию трансфицированных клеток, например, ген neo (кодирующий неомицинфосфотрансферазу), придающий устойчивость к антибиотику G418, ген dhfr (дигидрофолатредуктазы), ген cat (хлорамфениколацетилтрансферазы). ген pac (пуромицинацетилтрансферазы), ген gpt (ксантингуанинфосфорибозилтрансферазы).
Заявленный способ заключается в подкожном введении векторной конструкции, основанной на аденоассоциированном вирусе, кодирующей кДНК гена TGM1 человека. Генетическая конструкция запускает секрецию фермента TGM1, благодаря ее способности инфицировать клетки эпидермиса, обеспечивая восстановление недостающего фермента TGM1.
Графические материалы, иллюстрирующие примеры конкретного выполнения заявленного технического решения, доказывают возможность достижения заявленных технических результатов, а именно:
- результаты полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) показывают сверхэкспрессию гена TGM1 в клетках HEK293T и фибробластах (Фиг.4);
- вестерн-блот анализ показывает наличие сверхэкспрессии TGM1 в клетках HEK293T), трансфицированных плазмидой pAAV-TGM1. Молекулярная масса TGM1 соответствуют 80.9 кДа (Фиг.5);
- иммуноцитохимический анализ демонстрирует сверхэкспрессию TGM1 в клетках HEK293T, SH-SY5Y, SNB-19 после трансфекции pAAV-TGM1 и трансдукции AAV-TGM1 (Фиг.6);
- иммуногистохимический анализ демонстрирует сверхэкспрессию TGM1 в гистологических образцах кожи свиней (Фиг.7)
- биохимический анализ крови подопытных свиней показывает, что нет статистической разницы в значениях АЛТ, АСТ, общего билирубина, креатинина после внутрикожного введения AAV-TGM1, по сравнению с контрольными животными, которым вводили физиологический раствор. Это указывает на безопасность внутрикожного введения AAV-TGM1 (Фиг.8).
Поставленная цель и заявленный технический результат достигается путем генетической модификации клеток эпидермиса аденоассоциированным вирусом, кодирующем кДНК гена TGM1 человека (AAV-TGM1), и их подкожным введением.
Заявленное изобретение осуществляется в 3 этапа в нижеприведённой последовательности, а именно:
1 этап: Получение и анализ функциональности генетической конструкции pAAV-TGM1 в культуре клеток HEK293T in vitro;
2 этап: Получение и очистка рекомбинантного вируса AAV-TGM1;
3 этап: Анализ эффективности и безопасности способа на лабораторных свиньях.
Далее заявителем приведены подробные примеры, в которых приведено описание этапов осуществления заявленного технического решения.
1 этап: Получение и анализ функциональности нуклеотидной конструкции конструкции pAAV-TGM1.
В процессе разработки генетической конструкции была проведена оптимизации кодонного состава нуклеотидных последовательностей кДНК гена TGM1 с помощью алгоритма OptimumGene™ (GenScript, США). В качестве матрицы для кодонной оптимизации были взяты нуклеотидная последовательность мРНК гена TGM1 (NM_000359.3). Правильность сборки генетических конструкций pAAV-TGM1 подтверждали секвенированием. Секвенирование нуклеотидных последовательностей плазмидных конструкций проводила компания GenScript (США). Субклонирование оптимизированной по кодонному составу кДНК гена TGM1 в плазмидную конструкцию pAAV-MSC (Addgene, США) осуществляет компания GenScript (США). Правильность сборки генной конструкций pAAV-TGM1 подтверждается рестрикционным анализом.
Для подтверждения функциональности генных конструкций, полученной плазмидой трансфицировали (генетическая модификация) иммортализированую линию первичных человеческих эмбриональных клеток почки HEK293T. Для этого использовали трансфекционный агент TurboFect (Thermo Fisher Scientific Inc., США) в соответствии с методикой, рекомендуемой производителем. Для оценки эффективности трансфекции в качестве положительного контроля использовали плазмидный вектор pAAV-GFP, кодирующий репортерный ген зеленого флуоресцентного белка.
Эффективность генетической модификации полученного плазмидного вектора проверяли путем вестрн-блот анализа, полимеразной цепной реакцией в режиме реального времени (ПЦР-РВ) и иммуноцитохимическим анализом.
Для выделения общего белка клеточные осадки инкубировали в течение 30 минут в RIPA буфере (50 мМ Трис, 150 мМ NaCl, 1 % NP-40, 0,5 % дезоксихолат натрия, 0.1 % додецилсульфат натрия), содержащим смесь ингибиторов протеаз и фосфатаз (Thermo Fisher Scientific Inc., США), и далее центрифугировали при 13 200 об/мин в течение 30 минут. Выделенный общий белок хранили при -80°С. Для последующего вестерн-блот анализа концентрацию общего белка измеряли с помощью набора Pierce™ BCA Protein Assay Kit (Кат. №23225, Thermo Fisher Scientific Inc., США) согласно методике, рекомендуемой производителем.
Далее образцы общего белка ресуспендировали в буфере для нанесения образцов (10 % глицерол, 50 мМ Трис рН 6.8, 2 мМ ЭДТА, 2 % додецилсульфат натрия, 144 мМ 2-меркаптоэтанол, 0.01 % бромфеноловый синий) и денатурировали в течение 5 минут при 95°С. Электрофорез образцов проводили в 4-12 % SDS-PAGE градиентном геле на приборе Mini-PROTEAN® 3 Cell (Bio-Rad, США). Затем белки переносили на поливинилиденфторидную мембрану Immun-BlotTM PVDF Membrane (Bio-Rad, США) на приборе Trans-Blot® SD Semi-Dry Electrophoretic Transfer Cell (Bio-Rad, США). Мембраны блокировали инкубацией в блокирующем буфере (Трис-буфер солевой (ТБС), 0.05 % Твин 20, 5 % сухого обезжиренного молока) в течение 1 часа. Далее мембраны инкубировали с первичными поликлональными антителами мыши к TGM1 (Кат. №ab167657, Abcam Corp., Великобритания, разведение 1:500) разведение 1:200 в блокирующем буфере в течение 12 часов при 4°С. После завершения инкубации с первичными антителами мембраны отмывали 3 раза по 10 минут в 30 мл буфера ТБС-T (ТБС, 0.05 % Твин 20) и далее инкубировали со вторичными поликлональными антителами козы к иммуноглобулину G кролика, конъюгированными с пероксидазой хрена (разведение 1:1000, Кат. №A6154, Sigma-Aldrich, США) течение 2 часов при комнатной температуре. После завершения инкубации мембраны отмывали 3 раза по 10 минут в 30 мл буфера ТБС-T. Далее мембраны окрашивали антителами мыши к β-актину, конъюгированными с пероксидазой хрена (разведение 1:5000, Кат. №A00730, THE™ beta Actin Antibody [HRP], GenScript, США), и инкубировали в течение 1 часа, после чего мембраны отмывали 3 раза по 10 минут в 30 мл буфера ТБС-T. Визуализацию иммунного преципитата проводили с использованием субстрата ECL Western Blotting Substrate (Кат. №W1001, Promega, США) на приборе ChemiDocXRS+ (BioRad, США).
Общую РНК (оРНК) выделяли из клеточных осадков нативных и модифицированных pAAV-TGM1 фибробластов, HEK293T с использованием реагента TRIzol (Кат. №15596026, Invitrogen, США) в соответствии с инструкцией, рекомендуемой производителем. Синтез кДНК производили с использованием MMLV RT kit (Кат. №SK021, Евроген, Россия) согласно инструкции производителя. Праймеры и пробы, специфичные к оптимизированным по кодонному составу нуклеотидной последовательности TGM1, были разработаны с помощью программы GenScript Online Real-time PCR (TaqMan) Primer Design Tool (GenScript, США) и синтезированы компанией Евроген (Россия).
Для анализа экспрессии белка TGM1 в клеточных культурах HEK293T, SH-SY5Y, SNB-19 модифицированных pAAV-TGM1 и AAV-TGM1 проводили иммуноцитохимический анализ (ИЦХ). Для этого 5×103 клеток высевали на 24-луночный планшет в 400 мкл полной среды DMEM/F12. Через 24 часа культуральную среду удаляли и клетки фиксировали в 250 мкл холодного метанола в течение 10 минут при комнатной температуре. Фиксированные клетки промывали 3 раза по 5 минут трис-буферным солевым раствором (ТБС; 50 мМ Трис, 150 мМ NaCl, рН 7.6). Затем клетки инкубировали с первичными антителами мыши к TGM1 (Кат. №ab167657, Abcam Corp., Великобритания, разведение 1:500) в течение 1 часа при комнатной температуре. После этого клетки промывали 3 раза по 5 минут в ТБС, а затем инкубировали со вторичными антителами (Alexa Fluor® 647 Goat anti-mouse IgG (H+L), Кат. №A-21235, Invitrogen, США, разведение 1:1000 в TBS) в течение 1 часа при комнатной температуре. После трехкратной промывки в течение 5 минут в ТБС клетки окрашивали флуоресцентным красителем DAPI (4', 6-диамидино-2-фенилиндол; разведение 1 : 50 000 в ТБС; Invitrogen, США) в течение 5 минут и снова промывали. Образцы исследовали под конфокальным микроскопом LSM 780 (Carl Zeiss, Германия) с использованием программного обеспечения Zen black 2012 (Carl Zeiss, Германия). Все образцы были визуализированы с использованием одинаковых конфокальных настроек (интенсивность лазера, усиление и смещение).
2 этап: Получение вирусных векторов AAV-TGM1 in vitro.
На основе плазмидной генетической конструкции pAAV-TGM1 получают рекомбинантный аденоассоциированный вирус AAV-TGM1.
Для получения рекомбинантного AAV клетки AAV293 сеют в количестве 1,5 млн., монослой должен составлять 70-80%. На следующий день проводят ко-трансфекцию с использованием кальций-фосфатного метода тремя плазмидами (векторная плазмида, pAAV-RC и pHelper). Рекомбинантный аденоассоциированный вирус собирают через 72 часа после трансфекции. Клетки собирают скребком, проводят криолиз, центрифугируют при 10 000 × g в течение 10 минут для избавления от клеточного дебриса. Вирусный сток хранят при -80°C. Рекомбинантный аденоассоциированный вирус концентрируют с использованием AAV Purification Mega Kit (Cell Biolabs, Inc., США) в соответствии с методикой, рекомендуемой производителем.
3 этап: Анализ эффективности и безопасности введения рекомбинантного аденоассоциированного вируса AAV-TGM1 на лабораторных свиньях.
Для того чтобы показать эффективность и безопасность применения генетической конструкции на лабораторных животных, AAV-TGM1 подкожно вводят лабораторным свиньям, после чего анализируют экспрессию TGM1 в коже.
В работе используют, например, молодых самок свиней, которые случайным образом распределяют на группы, которым подкожно или внутрикожно вводят:
1) первой группе подкожно вводили генетическую конструкцию AAV-TGM1 в концентрации 1 × 1012 вг/мл на кг веса животного в 500 мкл физиологического раствора;
2) второй группе подкожно вводили 500 мкл физиологического раствора.
Каждая группа состоит из 5 особей животных, которые содержатся в прозрачных пластиковых клетках при следующих условиях: световой режим сменяется каждые 12 часов, температура поддерживается в диапазоне от 21 до 25°C, относительная влажность составляет от 40 до 70%. Животным предлагается корм и вода в неограниченном доступе.
Для биохимического исследования кровь забирали кардиопункцией на 0, 7 и 28 сутки. Кровь, объемом 1 мл собирали в 1.5 мл микропробирки без добавления антикоагулянта. Инкубировали 40 минут при комнатной температуре, затем пробирки с кровью центрифугировали при 4 С, 2000 g в течение 20 минут для получения сыворотки. В сыворотке крови определяли уровни аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), общего билирубина, креатинина с помощью биохимического анализатора ChemWell 2900 (США).
Результаты, описанные на Этапах 1-3, приведены на Фиг. 1 - 8.
Из данных, приведенных на Фиг. 1, видно, что полученный плазмидный вектор имеет тандемные концевые последовательности ITR, CMV энхансер и промотор, интрон бета-глобина человека, кДНК гена TGM1 и сигнал полиаденилирования гормона роста человека. Размер плазмиды анализировали путем рестрикции по сайту BamHI. Было показано соответствие ожидаемому размеру pAAV-TGM1 7088 п.н.
Для создания генетического вектора, в настоящей работе была оптимизирована по кодонному составу нуклеотидная последовательность кДНК гена TGM1. С использованием алгоритма OptimumGene™ (GenScript, США). В качестве матрицы для кодонной оптимизации были взяты нуклеотидные последовательности мРНК гена TGM1 (NM_000359.3) человека. Широкий спектр факторов влияет на уровни экспрессии генов, процесс оптимизации кодонного состава позволяет учитывать многие из них и создавать ту нуклеотидную последовательность гена, которая может достичь максимально возможного уровня экспрессии. Дикие (нативные) тип гена TGM1 содержал тандемные редкие кодоны, которые могут снижать эффективность трансляции или даже отключать механизм трансляции. В результате кодонной оптимизации был повышен индекс адаптации кодонов (англ. codon adaptation index, CAI) гена TGM1 (с 0.81 до 0.93). Результаты представлены на Фиг. 2 - 3. CAI 1.0 считается желаемым для наиболее высокого уровня экспрессии гена.
Содержание GC пар было уменьшено для повышения стабильности мРНК гена TGM1 (с 58.80 до 58.16), результаты представлены на Фиг. 3. Процесс оптимизации удалил потенциальные цис-действующие сайты генов. В результате кодонной оптимизации аминокислотные последовательности генов TGM1 не изменились и составили 781 аминокислотных остатков.
Далее проведен синтез генетической конструкции, состоящей из гена TGM1, который затем клонировали в плазмидный вектор-донор pAAV-MSC. Правильность сборки генетической конструкции pAAV-TGM1 содержащий оптимизированную последовательность TGM1 подтверждали секвенированием. Нуклеотидная последовательность генетического оптимизированной TGM1 представлена в Приложении.
Из данных, приведенных на Фиг.4, видно, что экспрессия гена TGM1, выраженная в количестве копий гена на 1 мкг общего РНК в фибробластах и клетках HEK293TT, повышается в группах с использованием разработанной генетической конструкции pAAV-TGM1. При этом экспрессия в фибробластах в 3 раза выше, чем в клетках HEK293T.
Из данных, приведенных на Фиг. 5, видно наличие выраженных специфичных полос иммунопреципитатов, соответствующих ожидаемой молекулярной массе белка TGM1. Плазмида pAAV-TGM1 экспрессирует ген TGM1, продукт которого равен 80.9 кДа. Таким образом, показана экспрессия белка TGM1 в НЕК293T, генетически модифицированных плазмидами pAAV2-TGM1 что доказывает функциональность полученной плазмидной конструкции.
Из данных, приведенных на Фиг. 6, видно наличие секреции TGM1 в клетках HEK293T, генетически модифицированных AAV-TGM1, ИЦХ анализ премобилизированых клеток. Физраствор - контрольная группа клеток, которым добавлялся физиологический раствор. AAV-TGM1 - экспериментальная группа клеток, в среду которых добавлялся раствор аденоассоциированного вируса, кодирующего трансглутаминазу 1 с концентрацией вирусного вектора MOI 50. Клетки анализировали с помощью окрашивания антителами на TGM1 через 4 суток после добавления.
Из данных, приведенных на Фиг. 7, видно наличие секреции TGM1 в коже свиней, ИГХ анализ парафиновых срезов. Физраствор - контрольная группа свиней, которым подкожно вводили чистый физиологический раствор. AAV-TGM1 - экспериментальная группа свиней, которым подкожно вводили аденоассоциированный вирус, кодирующий трансглутаминазу 1 и анализировали через 7 суток после введения.
Из данных, приведенных на Фиг. 8, видны биохимические показатели крови свиней после инъекции физраствора, AAV-TGM1. Контроль - контрольная группа свиней, которым подкожно вводили чистый физиологический раствор. Экспериментальная А, С, D - экспериментальные группа свиней, которым подкожно вводили AAV-TGM1 и анализировали через 7 суток после введения.
Из вышеизложенного можно сделать общий вывод, что заявителем достигнут заявленный технический результат, а именно разработан способ терапии ламеллярного ихтиоза с использованием рекомбинантного аденоассоциированного вируса на основе генетической конструкции, кодирующей кодон-оптимизированную нуклеотидную последовательность гена трансглутаминазы 1, с низким иммунным ответом на трансгенный продукт при генной терапии генетического заболевания, такого как рецессивное наследственное заболевание
При этом в примерах конкретного выполнения (Этапы 1 - 3) экспериментально доказано, что путем разработанного способа достигается повышение активности фермента TGM1, недостающего у животных с АРВИ и ЛИ, в коже лабораторных свиней.
Заявленное техническое решение удовлетворяет условию патентоспособности «новизна», предъявляемому к изобретениям, так как из исследованного уровня техники не выявлены источники, в которых описаны признаки, совпадающие по исполняемой ими функции и форме выполнения этих признаков, перечисленные в формуле изобретения, включая характеристику назначения.
Заявленное техническое решение удовлетворяет условию патентоспособности «изобретательский уровень», предъявляемому к изобретениям, поскольку из исследованного уровня техники заявителем не выявлены технические решения, характеризующиеся использованием способа терапии АРВИ, в частности ЛИ, подразумевающего подкожное введение генетической конструкции, кодирующей ген TGM1, для восстановления активности фермента в эпидермисе и остановки гиперкератоза. Кроме того, заявленное техническое решение, по мнению заявителя, не является очевидным для специалиста, так как обеспечивает реализацию задачи по лечению практически неизлечимых на дату представления заявочных материалов АРВИ, в частности ЛИ.
Заявленное техническое решение удовлетворяет условию патентоспособности «промышленная применимость», предъявляемому к изобретениям, так как оно может быть использовано в промышленных масштабах для создания препаратов, предназначенных для лечения АРВИ, в частности ЛИ.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ терапии болезни Тея-Сакса и болезни Сандхоффа с помощью генетически модифицированных мезенхимных стволовых клеток человека со сверхэкспрессией β-гексозаминидазы A | 2020 |
|
RU2748383C1 |
| Препарат для лечения метахроматической лейкодистрофии и способ ее лечения | 2021 |
|
RU2769577C1 |
| Рекомбинантная генетическая конструкция, аденоассоциированный вирус для терапии метахроматической лейкодистрофии | 2023 |
|
RU2821568C1 |
| МИНИ-БЕЛОК USH2A, НУКЛЕИНОВАЯ КИСЛОТА, КОДИРУЮЩАЯ МИНИБЕЛОК USH2A, И СОДЕРЖАЩИЙ ЕЕ ЭКСПРЕССИОННЫЙ ВЕКТОР ДЛЯ ГЕННОЙ ТЕРАПИИ | 2023 |
|
RU2822884C1 |
| Препарат для стимулирования регенерации и нейропротекции нервной ткани и способ его использования | 2023 |
|
RU2828544C1 |
| Кодон-оптимизированная последовательность нуклеотидов, кодирующая hAIPL1, и её содержащий экспрессионный вектор | 2021 |
|
RU2785621C1 |
| Экспрессионный аденоассоциированный вектор для лечения множественной эпифизарной дисплазии, вызванной мутациями в гене SLC26A2 | 2024 |
|
RU2836489C1 |
| Пептид митохондриальной локализации, нуклеиновая кислота для аллотопической экспрессии гена MT-ND4, содержащий ее экспрессионный вектор и его применение | 2023 |
|
RU2817420C1 |
| ВЕКТОРЫ И ПОСЛЕДОВАТЕЛЬНОСТИ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ | 2011 |
|
RU2588667C2 |
| Нуклеиновая кислота для аллотопической экспрессии гена MT-ND4 | 2023 |
|
RU2809065C1 |
Изобретение относится к области биотехнологии. Описан способ повышения экспрессии трансглутаминазы 1 в эпидермисе кожи, заключающийся в том, что подкожно вводят рекомбинантный аденоассоциированный вирус на основе генетической конструкции, кодирующей нуклеотидную последовательность гена трансглутаминазы 1, где генетическая конструкция, кодирующая нуклеотидную последовательность гена трансглутаминазы 1 содержит левый и правый концевые повторы (ITR)промоторную область, включающую энхансер и промотер, интрон β-глобина, последовательность Козак, сайт рестрикции EcoRI, кодоноптимизированную последовательность (coTGM1), последовательность полиаденилирования гормона роста человека (poly-A), сайты репликации, промотор и последовательность сайта резистентности к ампицилину, как указано на фигуре 1. Изобретение расширяет арсенал способов повышения экспрессии транглутаминазы 1 в эпидермисе кожи с низким иммунным ответом на трансгенный продукт. 8 ил., 3 пр.
Способ повышения экспрессии трансглутаминазы 1 в эпидермисе кожи, заключающийся в том, что подкожно вводят рекомбинантный аденоассоциированный вирус на основе генетической конструкции, кодирующей нуклеотидную последовательность гена трансглутаминазы 1,
где генетическая конструкция, кодирующая нуклеотидную последовательность гена трансглутаминазы 1 содержит левый и правый концевые повторы (ITR)промоторную область, включающую энхансер и промотер, интрон β-глобина, последовательность Козак, сайт рестрикции EcoRI, кодоноптимизированную последовательность (coTGM1), последовательность полиаденилирования гормона роста человека (poly-A), сайты репликации, промотор и последовательность сайта резистентности к ампицилину, как указано на фигуре 1.
| Дубовскова С | |||
| Д., Шаймарданова А | |||
| А., Соловьева В | |||
| В | |||
| РАЗРАБОТКА И АНАЛИЗ РЕКОМБИНАНТНОЙ ГЕНЕТИЧЕСКОЙ КОНСТРУКЦИИ НА ОСНОВЕ АДЕНОАССОЦИИРОВАННОГО ВИРУСА, ЭКСПРЕССИРУЮЩЕЙ ГЕН ТРАНСГЛУТАМИНАЗЫ-1./Естественно-науные и гуманитарные исследования:теоретические и практические аспекты: материалы XXXI Всероссийской научно-практической конференции (18 мая |
Авторы
Даты
2024-06-25—Публикация
2023-06-27—Подача