Сведения о предшествующем уровне техники
Данное изобретение относится к области лечения грибковых инфекций.
Потребность в новых противогрибковых терапиях является значительной, и особенно острой в области медицины. Для современной системы оказания медицинской помощи едва ли не самую большую проблему представляют иммунокомпромизированные пациенты. За последние три десятка лет частота грибковых инфекций у этих пациентов значительно увеличилась (Herbrecht, Eur. J. Haematol., 56:12, 1996; Cox et al., Curr. Opin. Infect. Dis., 6:422, 1993; Fox, ASM News, 59:515, 1993). Глубокие микозы все в большей степени наблюдаются у пациентов, перенесших трансплантацию органов, и у пациентов, получавших агрессивную химиотерапию по поводу рака (Alexander et al., Drugs, 54:657, 1997). Наиболее распространенными патогенными микроорганизмами, связанными с инвазивными грибковыми инфекциями, являются оппортунистический дрожжевой грибок Candida albicans и плесневый (мицелиальный) гриб Aspergillus fumigatus (Bow, Br. J. Haematol., 101:1, 1998; Wamock, J. Antimicrob. Chemother., 41:95, 1998). Ежегодно насчитывается 200000 пациентов, у которых развиваются нозокомиальные грибковые инфекции (Beck-Sague et al., J. Infect. Dis., 167:1247, 1993). Также, росту числа грибковых инфекций способствует появление синдрома приобретенного иммунодефицита (AIDS), когда практически все пациенты поражаются некоторой формой микоза во время течения заболевания (Alexander et al., Drags, 54:657, 1997; Hood et al., J. Antimicrob. Chemother., 37:71, 1996). Наиболее распространенными организмами, встречающимися у этих пациентов, являются Cryptococcus neoformans, Pneumocystis carinii, и С. albicans (HIV/AIDS Surveillance Report, 1996, 7(2), Year-End Edition; Polis, M. A. et al., AIDS: Biology, Diagnosis, Treatment and Prevention, fourth edition, 1997). Регулярно сообщается о новых оппортунистических грибковых патогенах, таких как Penicillium marneffei, С.krusei, С. glabrata, Histoplasma capsulatum и Coccidioides immitis, у иммунокомпромизированных пациентов по всему миру.
Разработка противогрибковых схем лечения продолжает оставаться проблемой. Имеющиеся в настоящее время лекарственные средства для лечения грибковых инфекций включают амфотерицин В, полиен-макролид, который связывается со стеролами клеточной мембраны грибов, флуцитозин, фторпиримидин, который препятствует биосинтезу белка и ДНК грибов, и различные азолы (например, кетоконазол, итраконазол и флуконазол), которые ингибируют биосинтез стерола грибковой мембраны (Alexander et al., Drags, 54:657, 1997). Несмотря на то, что амфотерицин В обладает широким спектром активности и рассматривается как «золотой стандарт» противогрибковой терапии, его применение ограничено по причине реакций, связанных с инфузией, и нефротоксичности (Wamock, J. Antimicrob. Chemother., 41:95, 1998). Применение флуцитозина также ограничено по причине развития резистентных микроорганизмов и его узкого спектра активности. Широкое применение азолов вызывает появление клинически резистентных штаммов Candida spp. По причине проблем, связанных с существующими в настоящее время терапиями, поиск новых способов лечения продолжается.
Когда эхинокандин каспофунгин был одобрен для продажи в 2001 году, он представлял первый новый класс противогрибковых агентов, который был одобрен за десятилетие. С этого времени два других эхинокандиновых противогрибковых агента, анидулафунгин и микафунгин, были одобрены на различных рынках. Каждый агент в этом классе соединения действует путем ингибирования β-1, 3-глюкансинтазы, которая является ключевым ферментом, участвующим в синтезе глюкана клеточной стенки многих грибов. Все эти три препарата изготовлены полусинтетически, начиная с природных продуктов, полученных посредством ферментации.
Эхинокандины представляют собой широкую группу противогрибковых агентов, которые обычно состоят из циклического гексапептида и липофильного хвоста, который присоединен к гексапептидному ядру посредством амидной связи. Хотя многие эхинокандины являются природными продуктами, клинически значимые члены этого класса все являются полусинтетическими производными. Хотя эхинокандины природного происхождения обладают некоторым уровнем противогрибковой активности, они не пригодны в качестве терапевтических средств, главным образом, из-за слабой растворимости в воде, недостаточной активности и/или гемолитического действия. Одобренные эхинокандины являются продуктами значительных усилий по созданию производных или аналогов, которые оказывают поддерживающее или улучшающее действие в результате ингибирования глюкансинтазы, но не вызывают гемолитических эффектов. В качестве терапевтических агентов они являются привлекательными соединениями в аспекте их периодов полувыведения из системного кровотока, широких терапевтических окон, профилей безопасности и относительного отсутствия взаимодействий с другими лекарственными средствами. К сожалению, слабое всасывание в кишечнике этих соединений обуславливает их доставку путем внутривенного вливания. Хотя пациенты, получающие эти лекарственные средства, часто госпитализируются с серьезными инфекциями, было бы весьма желательным, если бы существовала возможность перевода пациентов с внутривенной доставки в больничных условиях на пероральную доставку в домашних условиях, особенно если учесть, что курс лечения обычно превышает 14 дней. Кроме того, пероральный эхинокандин может расширить применение лекарственных средств этого класса для включения пациентов, у которых присутствуют легкие грибковые инфекции.
Краткое описание изобретения
Авторы изобретения раскрыли режимы дозирования и пероральные лекарственные формы для введения соединений класса эхинокандинов.
В первом аспекте изобретение предлагает способ лечения грибковой инфекции у субъекта путем (i) введения субъекту соединения класса эхинокандинов в дозе насыщения; и (ii) введения субъекту одной или нескольких поддерживающих доз соединения класса эхинокандинов, при этом каждую из дозы насыщения и поддерживающих доз вводят в количестве, которое в совокупности является достаточным для лечения грибковой инфекции. Например, дозу насыщения можно вводить путем инъекции (например, подкожно) или перорально, с последующими поддерживающими дозами, вводимыми перорально, внутривенно, назально, подкожно или трансдермально. В одном варианте осуществления дозу насыщения вводят внутривенно. Например, вводимую внутривенно (например, в виде болюса или инфузии) дозу насыщения можно вводить в количестве, достаточном для достижения средней устойчивой концентрации соединения класса эхинокандинов в плазме от 100 нг/мл до 20000 нг/мл (например, от 100 до 500, от 400 до 1000, от 800 до 3000, от 2000 до 7000, от 6000 до 10000, от 8000 до 14000 или от 12000 до 20000 нг/мл); можно вводить субъекту внутривенно в количестве соединения класса эхинокандинов на массу тела субъекта от 0.5 мг/кг до 20 мг/кг (например, от 0.5 до 2.0, от 1.0 до 4.0, от 3.0 до 10, от 8.0 до 15, от 13 до 20 мг/мг); и/или можно вводить субъекту внутривенно в количестве соединения класса эхинокандинов от 25 мг до 1400 мг (например, от 25 до 50, от 40 до 80, от 75 до 130, от 125 до 170, от 150 до 200, от 190 до 250, от 230 до 500, от 450 до 750, от 650 до 1000 или от 900 до 1400 мг) в течение периода 24 часа. Альтернативно, дозу насыщения можно вводить перорально. Например, субъекту вводят перорально в количестве соединения класса эхинокандинов от 250 мг до 4000 мг (например, от 250 до 500, от 400 до 800, от 750 до 1300, от 1250 до 1700 или от 1500 до 4000 мг) в течение периода 24 часа. В одном варианте осуществления любого из указанных выше способов поддерживающие дозы можно вводить в течение периода от 2 до 45 дней (например, от 2 до 10, от 7 до 14, от 10 до 21 или от 18 до 30 дней, или от 24 до 45 дней) после начала лечения. Поддерживающие дозы можно вводить, например, с частотой от одного раза в неделю до трех раз в день (например, один раз каждые 5-7 дней, один раз каждые 3 дня, через день, один раз в день, дважды в день или три раза в день). Соединение класса эхинокандинов может представлять собой соединение любой из формул (I), (II), (III), (IV), (V), (VI), (VII), (VIII) или (IX), или выбранно из анидулафунгина, каспофунгина, микафунгина, соединения 22, или любого другого соединения класса эхинокандинов, описанного здесь, или их фармацевтически приемлемых солей. В определенных вариантах осуществления доза насыщения включает внутривенное введение от 50 до 400 мг (например, от 50 до 125, от 75 до 300 или от 100 до 400 мг) соединения 22 или его фармацевтически приемлемой соли. В некоторых вариантах осуществления способ включает поддерживающее дозирование, которое включает пероральное введение от 250 до 800 мг (например, от 250 до 300, от 275 до 450, от 425 до 625 или от 600 до 800 мг) соединения 22 или его фармацевтически приемлемой соли каждый день, или через день, или каждые три дня. В некоторых вариантах осуществления способ включает поддерживающее дозирование, которое включает подкожное введение от 25 до 150 мг (например, от 25 до 30, от 35 до 45, от 30 до 70, от 50 до 100, от 70 до 120 или от 110 до 150 мг) соединения 22 или его фармацевтически приемлемой соли каждый день, или через день, или один раз каждые три дня, или один раз каждые пять дней. В некоторых вариантах осуществления способ включает поддерживащее дозирование, которое включает внутривенное болюсное введение от 25 до 150 мг (например, от 25 до 30, от 35 до 45, от 30 до 70, от 50 до 100, от 70 до 120 или от 110 до 150 мг) соединения 22 или его фармацевтически приемлемой соли каждый день или через день, или каждые три дня, или один раз каждые пять дней.
В одном конкретном варианте осуществления любого из указанных выше способов стадия (ii) включает пероральное введение субъекту фармацевтической композиции в виде стандартной лекарственной формы, включающей: (а) лекарственное средство, выбранное из соединений класса эхинокандинов и их солей, и (b) от 0.5% до 90% (масса/масса) (например, от 0.5% до 5%, от 2.5% до 7.5%, от 7% до 12%, от 10% до 25%, от 25% до 35%, от 30% до 50% или от 40% до 90% (масса/масса)) добавки, при этом добавка присутствует в количестве, достаточном для увеличения пероральной биодоступности соединений класса эхинокандинов или их солей. В конкретных вариантах осуществления добавка выбрана из ацилкарнитинов, алкилсахаридов, сахаридов сложных эфиров, жирных амидокислот, поверхностно-активных веществ -сульфоната аммония, желчных кислот и солей желчных кислот (включая холевую кислоту и ее соли), хитозана и его производных, жирных кислот и их солей или сложных эфиров, глицеридов, гидрофильных ароматических спиртов, пегилированных фосфолипидов, пептидных модуляторов плотных контактов эпителия, фосфолипидов, алкиловых эфиров полиэтиленгликоля, полигликозированных глицеридов, сложных эфиров полиглицерина и жирных кислот, поверхностно-активных веществ - полисорбата, карбоновых кислот, полиэтиленгликолей, и их смесей.
В конкретных вариантах осуществления указанных выше способов дозу насыщения вводят внутривенно (например, путем внутривенного болюса или инфузии), и поддерживающую дозу вводят перорально; дозу насыщения вводят подкожно, и поддерживающую дозу вводят перорально; дозу насыщения вводят внутривенно (например, путем внутривенного болюса или инфузии), и поддерживающую дозу вводят подкожно; дозу насыщения вводят подкожно, и поддерживающую дозу вводят подкожно; дозу насыщения вводят перорально, и поддерживающую дозу вводят перорально; или дозу насыщения вводят внутривенно (например, путем внутривенного болюса или инфузии), и поддерживающую дозу вводят путем инъекции (например, путем внутривенного болюса или инфузии, или путем подкожной инъекции). В конкретных вариантах осуществления способа, включающего внутривенный болюс, вводимое количество соединения класса эхинокандинов составляет от 50 мг до 500 мг (например, от 50 до 100, от 100 до 200, от 150 до 225, от 225 до 300, от 275 до 400 или от 400 до 500 мг) в единичной болюсной инъекции.
В связанном аспекте изобретение предлагает фармацевтическую композицию в виде стандартной лекарственной формы, включающей: (а) соединение класса эхинокандинов или его фармацевтически приемлемую соль; и (b) от 0.5% до 90% (масса/масса) (например, от 0.5 до 5%, от 2.5% до 7.5%, от 7% до 12%, от 10% до 25%, от 25% до 35%, от 30% до 50% или от 40% до 90% (масса/масса) добавки, при этом добавка присутствует в количестве, достаточном для увеличения пероральной биодоступности соединения класса эхинокандинов или его солей. В конкретных вариантах осуществления добавка выбрана из ацилкарнитинов, алкилсахаридов, сложных эфирова сахаридов, жирных амидокислот, поверхностно-активных веществ - сульфоната аммония, желчных кислот и солей желчных кислот (включая холевую кислоту и ее соли), хинозана и его производных, жирных кислот и их солей или сложных эфиров, глицеридов, гидрофильных ароматических спиртов, пегилированных фосфолипидов, пептидных модуляторов плотных контактов эпителия, фосфолипидов, алкиловых эфиров полиэтиленгликоля, полигликолизированных глицеридов, сложных эфиров полиглицерина и жирных кислот, поверхностно-активных веществ - полисорбата, карбоновых кислот, полиэтиленгликолей, и их смесей. В определенных вариантах осуществления фармацевтическая композиция может включать от 2% до 90% (масса/масса)_ (например, от 3% до 6%, от 3% до 8%, от 5% до 12%, от 8% до 16%, от 15% до 25%, от 25% до 35%, от 35% до 65% или от 65% до 90% (масса/масса)) алкилсахарида или сложного эфира сахарида, необязательно дополнительно включая от 0.5% до 15% (масса/масса) (например, от 0.5% до 2.5%, от 1% до 4%, от 3% до 7%, от 5% до 10%, от 7% до 12% или от 11% до 15% (масса/масса)) поверхностно-активного вещества - полисорбата. В конкретных вариантах осуществления фармацевтическая композиция может включать от 2% до 90% (масса/масса) (например, от 3% до 6%, от 3% до 8%, от 5% до 12%, от 8% до 16%, от 15% до 25%, от 25% до 35%, от 35% до 65% или от 65% до 90% (масса/масса)) глицерида, необязательно дополнительно включая от 0.5% до 15% (масса/масса) (например, от 0.5% до 2.5%, от 1% до 4%, от 3% до 7%, от 5% до 10%, от 7% до 12% или от 11% до 15% (масса/масса) поверхностно-активного вещества - полисорбата. В некоторых вариантах осуществления фармацевтическая композиция может включать от 1% до 90% (масса/масса) (например, от 2% до 5%, от 3% до 8%, от 5% до 12%, от 10% до 18%, от 15% до 24%, от 20% до 30%, от 25% до 35%, от 30% до 50%, от 50% до 70% или от 65% до 90% (масса/масса)) жирной кислоты, или ее соли или сложного эфира. В определенных вариантах осуществления фармацевтическая композиция может включать от 1% до 90% (масса/масса) (например, от 2% до 6%, от 5% до 12%, от 10% до 18%, от 15% до 25%, от 20% до 35%, от 30% до 45%, от 40% до 60% или от 55% до 90% (масса/масса)) ацилкарнитина, необязательно дополнительно включая буфер с образованием под действием воды раствора, имеющего рН от 2.5 до 8. В некоторых вариантах осуществления фармацевтическая композиция может включать от 1% до 90% (масса/масса) (например, от 2% до 5%, от 3% до 8%, от 5% до 12%, от 10% до 18%, от 15% до 24%, от 20% до 30%, от 25% до 35%, от 30% до 50%, от 50% до 70% или от 65% до 90% (масса/масса)) карбоновой кислоты или ее соли. В определенных вариантах осуществления фармацевтическая композиция может включать от 1% до 90% (масса/масса) (например, от 2% до 5%, от 3% до 8%, от 5% до 12%, от 10% до 18%, от 15% до 24%, от 20% до 30%, от 25% до 35%, от 30% до 50%, от 50% до 70% или от 65% до 90% (масса/масса) полиэтиленгликолей. В конкретных вариантах осуществления фармацевтическая композиция включает аклилсахарид или сложный эфир сахарида, при этом массовое соотношение соединения класса эхинокандинов к алкилсахариду или сложному эфиру сахарида составляет от 1:1 до 1:20 (например, от 1:1 до 1:3, от 1:2 до 1:5, от 1:4 до 1:10 или от 1:5 до 1:20). В определенных вариантах осуществления фармацевтическая композиция включает глицерид, при этом массовое соотношение соединения класса эхинокандинов к глицериду составляет от 1:1 до 1:20 (например, от 1:1 до 1:3, от 1:2 до 1:5, от 1:4 до 1:10 или от 1:5 до 1:20). В некоторых вариантах осуществления фармацевтическая композиция включает жирную кислоту, при этом массовое соотношение соединения класса эхинокандинов к жирной кислоте или ее соли составляет от 1:1 до 1:30 (например, от 1:1 до 1:3, от 1:2 до 1:5, от 1:4 до 1:10 или от 1:10 до 1:30). В конкретных вариантах осуществления фармацевтическая композиция включает ацилкарнитин (например, пальмитоилкарнитин или лауроилкарнитин), при этом массовое соотношение соединения класса эхинокандинов к ацилкарнитиу составляет от 1:1 до 1:30 (например, от 1:1 до 1:3, от 1:2 до 1:5, от 1:4 до 1:10 или от 1:10 до 1:30). В конкретных вариантах осуществления фармацевтическая композиция включает карбоновую кислоту (например, лимонную кислоту, янтарную кислоту, винную кислоту, фумаровую кислоту, малеиновую кислоту, малоновую кислоту, глутаровую кислоту, адипиновую кислоту, молочную кислоту, яблочную кислоту, L-глутаминовую кислоту, L-аспарагиновую кислоту, глюконовую кислоту, глюкуроновую кислоту, салициловую кислоту или их смеси), при этом массовое соотношение соединения класса эхинокандинов к карбоновой кислоте составляет от 1:1 до 1:30 (например, от 1:1 до 1:3, от 1:2 до 1:5, от 1:4 до 1:10 или от 1:10 до 1:30). В конкретных вариантах осуществления фармацевтическая композиция включает полиэтиленгликоль (например, PEG 100, PEG 400, PEG 1000 и т.п.), при этом массовое соотношение соединения класса эхинокандинов к полиэтиленгликолю составляет от 1:1 до 1:30 (например, от 1:1 до 1:3, от 1:2 до 1:5, от 1:4 до 1:10 или от 1:10 до 1:30).
В одном варианте осуществления любой из указанных выше фармацевтических композиций стандартная лекарственная форма включает от 50 до 4000 мг (например, от 50 до 300, от 250 до 750, от 500 до 1500 или от 1000 до 4000 мг) соединения класса эхинокандинов. Стандартная лекарственная форма может быть формулирована для немедленного высвобождения.
Фармацевтическая композиция может содержать соединение класса эхинокандинов любой из формул (I), (II), (III), (IV), (V), (VI), (VII), (VIII) или (IX), или выбрано из анидулафунгина, каспофунгина, микафунгина, соединения 22 или любого другого соединения класса эхинокандинов, описанного здесь, или его фармацевтически приемлемой соли.
В одном варианте осуществления любой из указанных выше фармацевтических композиций добавка присутствует в количестве, достаточном для достижения при пероральном введении субъекту средней биодоступности от 3% до 30% (например, 4±2%, 6±2%, 8±2%, 10±2%, 12±3%, 15±3%, 18±4%, 22±6% или 27±3%).
В связанном аспекте изобретение предлагает способ лечения грибковой инфекции у субъекта путем перорального введения субъекту фармацевтической композиции по изобретению, при этом фармацевтическую композицию вводят в количестве, эффективном для лечения инфекции.
Изобретение дополнительно предлагает способ лечения грибковой инфекции у субъекта путем подкожного введения субъекту водного раствора, включающего соединение 22 или его фармацевтически приемлемую соль, в количестве, которое является достаточным для лечения грибковой инфекции. В конкретных вариантах осуществления водный раствор можно вводить субъекту подкожно два раза в день, один раз в день, через день, каждые три дня или один раз в неделю в течение периода, составляющего, по меньшей мере, 2 недели, 3 недели, 4 недели, 2 месяца, 3 месяца или 4 месяца. Водный раствор может включать от 25 мг/мл до 500 мг/мл соединения 22 или его фармацевтически приемлемой соли (например, 30±5, 40±10, 50±10, 60±10, 70±10, 80±10, 100±15 мг/мл, 130±20 мг/мл, 160±30 мг/мл, 190±30 мг/мл, 250±50 мг/мл или 400±100 мг/мл). В конкретных вариантах осуществления от 0.05 мл до 2.0 мл водного раствора вводят субъекту ежедневно. В некоторых вариантах осуществления количество соединения 22 или его фармацевтически приемлемой соли, вводимое подкожно субъекту, составляет от 10 мг до 100 мг (например, 15±5, 25±10, 50±20, 70±25 или 80±20 мг) ежедневно.
В связанном аспекте изобретение предлагает устройство для инъекции водного раствора соединения 22 или его фармацевтически приемлемой соли субъекту, включающее контейнер, содержащий от 0.05 мл до 10 мл водного раствора (например, от 0.2 мл до 0.5 мл, от 0.5 мл до 3 мл, от 2 мл до 5 мл, от 4 мл до 7 мл или от 6 мл до 10 мл водного раствора), и иглу. Например, устройство может представлять собой ручку-инъектор с предварительно заполненным картриджем, например, дозирующее устройство в виде ручки с микроиглой. В конкретных вариантах осуществления контейнер может представлять собой картридж. В конкретных вариантах осуществления устройство представляет собой предварительно заполненный шприц, содержащий от 0.05 мл до 1 мл (например, от 0.2 мл до 0.5 мл или 0.5 мл до 1 мл) водного раствора. В еще других вариантах осуществления водный раствор включает от 25 мг/мл до 500 мг/мл соединения 22 или его фармацевтически приемлемой соли, например, (30±5, 40±10, 50±10, 60±10, 70±10, 80±10, 100±15 мг/мл, 130±20 мг/мл, 160±30 мг/мл, 190±30 мг/мл, 250±50 мг/мл или 400±100 мг/мл).
Изобретение дополнительно предлагает способ лечения грибковой инфекции у субъекта путем введения субъекту внутривенного болюса водного раствора, включающего соединение 22 или его фармацевтически приемлемую соль, в количестве, которое является достаточным для лечения грибковой инфекции. В конкретном варианте осуществления водный раствор включает от 25 мг/мл до 500 мг/мл (например, 30±5, 40±10, 50±10, 60±10, 70±10, 80±10, 100±15 мг/мл, 130±20 мг/мл, 160±30 мг/мл, 190±30 мг/мл, 250±50 мг/млоr 400±100 мг/мл) соединения 22 или его фармацевтически приемлемой соли. Болюсную инъекцию можно вводить субъекту ежедневно, через день или каждые три дня или каждые 4-7 дней, или каждую неделю в течение периода, составляющего, по меньшей мере, 2 недели, 3 недели. 4 недели, 2 месяца, 3 месяца или 4 месяца. В некоторых вариантах осуществления количество соединения 22 или его фармацевтически приемлемой соли, вводимое в виде внутривенного болюса субъекту, составляет от 25 мг до 500 мг (например, 30±5, 40±10, 50±10, 75±25, 100±25, 150±25, 200±50, 300±100 или 500±100 мг) на болюсное введение.
Изобретение дополнительно предлагает соединение класса эхинокандинов или его соль в виде стандартной лекарственной формы, содержащей от 40 до 90% (масса/масса) неводного растворителя или апротонного растворителя (например, этанола, этиленгликоля, полиэтиленгликоля (например, PEG200, PEG400, PEG800) или пропиленгликоля), и одно или несколько усиливающих абсорбцию вспомогательных веществ, описанных здесь. Необязательно соединение класса эхинокандинов представляет собой соединение 22 или его соль.
Изобретение дополнительно предлагает способ лечения грибковой инфекции у субъекта, нуждающегося в этом, путем введения субъекту посредством внутривенной инфузии водного раствора, включающего соединение 22 или его фармацевтически приемлемую соль в количестве, которое является достаточным для лечения грибковой инфекции. В определенных вариантах осуществления инфузионный раствор включает от 0.5 мг/мл до 3.0 мг/мл (например, 0.75±0.25, 1.0±0.25, 1.5±0.25, 2.0±0.25 или 2.50±0.50 мг/мл) соединения 22 или его фармацевтически приемлемой соли. В конкретных вариантах осуществления способа соединение 22 или его фармацевтически приемлемую соль вводят субъекту в виде двух или более внутривенных инфузий или внутривенных болюсов один раз каждые от 5 до 8 дней (например, еженедельно в течение периода, по меньшей мере, 4 недели, 6 недель, 8 недель или 12 недель). В другом варианте осуществления способ дополнительно включает после внутривенной инфузии пероральное введение от 200 мг до 1000 мг (например, 250±50, 300±50, 400±50, 500±50, 600±50, 700±50, 800±50 или 900±50 мг) соединения 22 или его фармацевтически приемлемой соли субъекту в течение периода, по меньшей мере, от 5 до 8 дней (например, ежедневно в течение периода, по меньшей мере, 2 недели, 4 недели, 6 недель, 8 недель или 12 недель).
Изобретение предлагает фармацевтическую композицию в виде стандартной лекарственной формы, включающей от 25 мл до 500 мл (например, 50±25, 100±25, 150±50, 250±50, 350±50 или 400±100 мл) водного раствора, содержащего от 0.50 мг/мл до 3 мг/мл (например, 0.75±0.25, 1.0±0.25, 1.5±0.25, 2.0±0.25 или 2.50±0.50 мг/мл) соединения 22 или его фармацевтически приемлемой соли, при этом стандартная лекарственная форма является пригодной для внутривенной инфузии субъекту.
В связанном аспекте изобретение предлагает фармацевтическую композицию в виде стандартной лекарственной формы, включающей от 1 мл до 10 мл (например, 1.5±0.5, 3±1, 5±2 или 7.5±2.5 мл) водного раствора, содержащего от 25 мг/мл до 500 мг/мл (например, 30±5, 40±10, 50±10, 60±10, 70±10, 80±10, 100±15 мг/мл, 130±20 мг/мл, 160±30 мг/мл, 190±30 мг/мл, 250±50 мг/млоr 400±100 мг/мл) соединения 22 или его фармацевтически приемлемой соли, при этом стандартная лекарственная форма пригодна для внутривенной болюсной инъекции субъекту.
В еще другом связанном аспекте изобретение предлагает фармацевтическую композицию в виде стандартной лекарственной формы, включающей от 0.05 мл до 1.0 мл (например, 0.2±0.1, 0.5±0.25, 0.75±0.25 или 0.9±0.1 мл) водного раствора, содержащего от 85 мг/мл до 300 мг/мл (например, 100±15 мг/мл, 130±20 мг/мл, 160±30 мг/мл, 190±30 мг/мл, 250±50 мг/мл или 400±100 мг/мл) соединения 22 или его фармацевтически приемлемой соли, при этом стандартная лекарственная форма пригодна для подкожной инъекции субъекту.
В любой из указанных выше фармацевтических композиций, содержащих стандартную дозу, формулированных для инъекции, фармацевтическая композиция может (i) не содержать стабилизирующие сахара (например, фруктозу, сахарозу, трехалозу или их комбинации), (ii) включать поверхностно-активное вещество (например, Твин 20, Твин 80 или любое поверхностно-активное вещество, описанное здесь), (iii) наполнитель (например, маннитол или другой сахарный спирт) и/или (iv) буфер (то есть любой буфер, описанный здесь). Водный раствор в виде стандартной лекарственной формы можно приготовить путем восстановления лиофилизированного порошка, включающего соединение 22 или его фармацевтически приемлемую соль. Альтернативно, водный раствор в виде стандартной лекарственной формы можно приготовить путем восстановления жидкого концентрата, включающего соединение 22 или его фармацевтически приемлемую соль.
Изобретение предлагает набор, включающий (i) стандартную лекарственную форму, содержащую лиофилизированный порошок, включающий соединение 22 или его фармацевтически приемлемую соль, и (ii) инструкции по восстановлению лиофилизированного порошка водным раствором для получения фармацевтической композиции, пригодной для инъекции субъекту.
В связанном аспекте изобретение предлагает набор, включающий (i) стандартную лекарственную форму, содержащую жидкий концентрат, включающий соединение 22 или его фармацевтически приемлемую соль, и (ii) инструкции по восстановлению жидкого концентрата водным раствором для получения фармацевтической композиции, пригодной для инъекции субъекту.
В любом из указанных выше наборов стандартная лекарственная форма может (i) не содержать стабилизирующие сахара (например, фруктозу, сахарозу, трехалозу или их комбинацию), (ii) включать поверхностно-активное вещество (например, Твин 20, Твин 80 или любое поверхностно-активное вещество, описанное здесь), (iii) наполнитель (например, маннитол или другой сахарный спирт) и/или (iv) буфер (то есть любой буфер, описанный здесь).
Изобретение дополнительно предлагает образованную путем добавления кислоты соль соединения класса эхинокандинов в виде стандартной лекарственной формы, при этом образованная путем добавления кислоты соль получена из органической кислоты (например, соли уксусной, молочной, пальмовой (palmoic), малеиновой, лимонной, холевой кислоты, каприновой кислоты, каприловой кислоты, лауриновой кислоты, глутаровой, глюкуроновой, глицериновой, гликоколевой, глиоксиловой, изолимонной, изовалериановой, молочной, яблочной, щавелево-уксусной, щавелево-янтарной, пропионовой, пировиноградной, аскорбиновой, янтарной, бензойной, пальмитиновой, субериновой, салициловой, винной, метансульфоновой, толуолсульфоновой или трифторуксусной кислоты). Необязательно, образованная путем добавления кислоты соль присоединения кислоты включает способствующее всасыванию вещество. Необязательно, соединение класса эхинокандинов представляет собой образованную путем добавления кислоты соль соединения 22. Стандартная лекарственная форма может дополнительно включать одно или несколько вспомогательных веществ, способствующих всасыванию, описанных здесь.
Изобретение дополнительно предлагает соединение класса эхинокандинов или его соль в виде стандартной лекарственной формы, включающей от 2 до 80% (масса/масса) лимонной кислоты. Стандартная лекарственная форма может дополнительно включать одно или несколько вспомогательных веществ, способствующих всасыванию, описанных здесь.
Изобретение также предлагает наборы, включающие: а) любую фармацевтическую композицию по изобретению; и b) инструкции по введению фармацевтической композиции субъекту, у которого диагностирована грибковая инфекция.
Под термином «ацилкарнитин» понимается химическая группа, имеющая формулу:
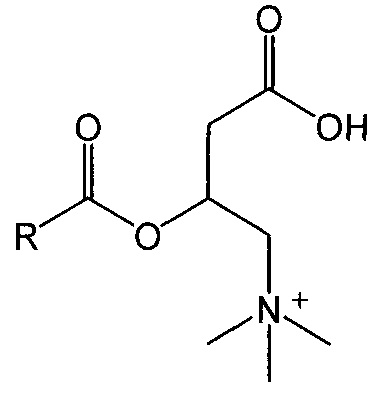
и его соли, где R представляет собой частично насыщеную углеводородную группу с прямой или разветвленной цепью, содержащую от 8 до 26 атомов углерода. Ацилкарнитины являются производными карнитина (D или L форма, или их смесь) и жирной кислоты. Ацилкарнитин может представлять собой сложный эфир жирной кислоты, содержащей 16 атомов углерода и 0, 1 или 2 двойные связи (С16:0, С16:1 и С16:2), 18 атомов углерода и 1, 2 или 3 двойные связи (С18:1, С18:2 и С18:3), 20 атомов углерода и 1, 2 или 4 двойные связи (С20:1, С20:2 и С20:4), или 22 атома углерода и 4, 5 или 6 двойных связей (С22:4, С22:5 и С22:6). Ацилкарнитины включают, без ограничения, 4, 7, 10, 13, 16, 19 докозагексаноилкарнитин, олеоилкарнитин, пальмитоилкартинин, деканоилкарнитин, додеканоилкарнитин, миристоилкарнитин и стеароилкарнитин.
Используемый здесь термин «введение» или «вводимое» относится к введению любым способом, таким как инъекция (например, внутривенное введение путем болюсной инъекции или инфузии, подкожное введение), трансдермальное введение, местное введение, интраназальное или пероральное введение лекарственного средства субъекту.
Под термином «добавка» понимаются такие компоненты фармацевтической композиции, содержащей лекарственное средство (например, соединение класса эхинокандинов), в виде пероральной лекарственной формы, которые увеличивают пероральную биодоступность лекарственного средства при пероральном введении одновременно с лекарственным средством. Добавки по изобретению включают ацилкарнитины, алкилсахариды, сложные эфиры сахаридов, жирные амидокислоты, поверхностно-активные вещества - сульфонат аммония, желчные кислоты и соли желчных кислот (включая холевую кислоту и ее соли), хитозан и его производные, жирные кислоты и их соли или сложные эфиры, глицериды, гидрофильные ароматические спирты, пегилированные фосфолипиды, пептидные модуляторы плотных контактов эпителия, фосфолипиды, алкиловые эфиры полиэтиленгликоля, полигликолизированные глицериды, сложные эфиры полиглицерина и жирных кислот, поверхностно-активные вещества - полисорбат, карбоновые кислоты, полиэтиленгликоли, и их смеси.
Под термином «количество, достаточное» понимается количество добавки, требуемой для увеличения пероральной биодоступности лекарственного средства.
Под термином «грибковая инфекция» понимается заражение хозяина патогенными грибами. Например, инфекция может включать чрезмерный рост грибов, которые обычно присутствуют в организме или на теле человека, или рост грибов, которые обычно не присутствуют в организме или на теле человека. В общих чертах, грибковая инфекция может представлять собой любую ситуацию, в которой присутствие грибковой популяции(й) является вредной для организма хозяина. Таким образом, человек «страдает» грибковой инфекцией, когда чрезмерная численность грибковой популяции присутствует в организме или на теле человека, или когда присутствие грибковой популяции(й) является вредной для клеток или другой ткани человека.
Под термином «каприлокапроил полиоксиглицерид» понимается полигликолизированный глицерид, который представляет собой смесь сложных моноэфиров, диэфиров и триэфиров глицерина и сложных моноэфиров и диэфиров полиэтиленгликолей, имеющий среднюю молекулярную массу между 70 и 400, и полученный трансэтерификацией сложных эфиров каприловых и каприновых глицеридов полиэтиленгликолем. Каприлокапроил полиоксиглицериды включают, без ограничения, PEG-8 каприловый/каприновый глицерид (LABRASOL®, Gattefosse), PEG-4 каприловый/каприновый глицерид (LABRAFAC® Hydro, Gattefosse), и PEG-6 каприловый/каприновый глицерид (SOFTIGEN®767, Huls).
Под термином «эффективное» количество понимается количество лекарственного средства, требуемое для лечения или предупреждения инфекции или заболевания, связанного с инфекцией. Эффективное количество лекарственного средства, используемое для практического осуществления изобретения для терапевтического или профилактического лечения состояний, вызванных или способствующих микробной инфекции, варьирует в зависимости от способа введения, возраста, массы тела и общего состояния здоровья субъекта. Окончательное решение о целесообразном количестве и режиме дозирования будет принимать лечащий врач. Такое количество называется «эффективным» количеством.
Под термином «эмульсия» понимается двухфазная коллоидная система, такая как смесь двух или более несмешиваемых (несмешивающихся) жидкостей. Жидкие эмульсии представляют собой такие эмульсии, в которых обе фазы, диспергированная и непрерывная, представляют собой жидкость. Как правило, для формирования эмульсии необходима энергия, подводимая посредством процессов встряхивания, перемешивания, гомогенизации или распыления. Например, эмульсия может включать водную фазу и неводную фазу, и может включать самоэмульгирующуюся систему, или эмульсия может состоять из наночастиц, содержащая водную фазу и неводную фазу (например, наноэмульсия или микроэмульсия). Под термином «микроэмульсия» понимается прозрачная, стабильная, изотропная жидкая смесь из масла, воды и поверхностно-активного вещества, необязательно в комбинации с вторичным поверхностно-активным веществом. Водная фаза может содержать соль(и) и/или другие ингредиенты, дополнительно к биологически активному агенту. В отличие от обычных эмульсий микроэмульсии образуются в результате простого смешивания компонентов и не требуют условий высокого усилия сдвига, обычно используемых при формировании обычных эмульсий. Двумя основными типами микроэмульсий являются прямые (масло, диспергированное в воде, o/w) и обратные (вода, диспергированная в масле, w/o).
Под термином «вспомогательное вещество» понимаются такие компоненты фармацевтической композиции, содержащей лекарственное средство (например, соединение класса эхинокандинов), в виде пероральной лекарственной формы, которые не увеличивают пероральную биодоступность лекарственного средства при пероральном введении одновременно с лекарственным средством. Вспомогательные вещества, которые можно использовать в лекарственных формах по изобретению, включают, без ограничения, воду, разбавители, связующие, наполнители и вкусовые агенты.
Под термином «жирная кислота» понимается алифатическая карбоновая кислота. Жирные кислоты включают, но не ограничиваются жирными кислотами, содержащими между 8 и 12 атомов углерода, линейными и разветвленными жирными кислотами, насыщенными и ненасыщенными жирными кислотами, и жирными кислотами, содержащими гидроксильную группу в терминальном положении их боковой цепи (то есть жирными кислотами, несущими первичную гидроксильную группу). Примерами жирных кислот служат каприловая кислота (октановая кислота), пеларгоновая кислота (нонановая кислота), каприновая кислота (декановая кислота) и лауриновая кислота (додекановая кислота), и их первичная гидроксильная группа образует 8-гидрокси октановую кислоту, 9-гидрокси нонановую кислоту, 10-гидрокси декановую кислоту и 12-гидрокси додекановую кислоту.
Под термином «твердая капсула» понимается капсула, которая включает мембрану, которая формирует состоящий из двух частей контейнер в форме капсулы, способный выдерживать твердую, полутвердую или жидкую нагрузку лекарственного средства, добавки(ок) и, необязательно, вспомогательных веществ.
Используемое здесь выражение «увеличение пероральной био доступности» означает, что биодоступность перорально вводимого лекарственного средства, измеренная по среднему значению AUC у субъектов-собак (например, как описано в примерах), для пероральной лекарственной формы по изобретению, включающей соединение класса эхинокандинов, формулированное с одной или несколькими добавками, по меньшей мере, на 25%, 50%, 75%, 100% или 300% больше по сравнению с этим же лекарственным средством, формулированным без каких-либо добавок. Для этих исследований желудочно-кишечный тракт у субъектов не подвергался хирургическому воздействию способом, который изменяет пероральную биодоступность лекарственного средства.
Под термином «жидкая лекарственная форма» понимается раствор или суспензия, из которой отмеряется доза (то есть чайная ложка, столовая ложка или некоторое число кубических сантиметров) для перорального введения субъекту.
Под выражением «режим дозы насыщения» понимается режим введения соединения класса эхинокандинов, который включает, по меньшей мере, четыре введения соединения класса эхинокандинов, при этом уровень дозы, вводимой на День 1, составляет, по меньшей мере, 120%, 200%, 300%, 400% или 500% от уровня дозы, вводимой в любой из последующих дней дозирования, скорректированной на различия в биодоступности с использованием формулы: уровень дозы = (% ВА/100) × введенная доза, где % ВА представляет собой процент биодоступности, который для внутривенного и подкожного дозирования равен 100. Для перорального дозирования % ВА определен с использованием способа Примера 3. Для интраназального и других неинъекционных путей введения процент биодоступности может быть определен аналогичными способами, описанными в Примере 3. Под термином «уровень дозы, введенной на День 1» понимается общая сумма всех доз соединения класса эхинокандинов, введенных субъекту в течение первых 24 часов после начального введения. Под «день дозирования» понимается день, в который субъекту вводят соединение класса эхинокандинов, и доза, вводимая в день дозирования, представляет собой общую сумму всех доз соединения класса эхинокандинов, введенных в течение 24-часового периода, начинающегося с первого введения в этот день.
Используемый здесь термин «пероральная биодоступность» относится к среднему количеству лекарственного средства, абсорбированному после перорального введения субъектам, измеренному по циркулирующей концентрации в крови, по сравнению с циркулирующей концентрацией в крови, наблюдаемой для 100% биодоступности при внутривенном или внутриартериальном введении лекарственного средства. Пероральную биодоступность можно оценить для конкретной лекарственной формы, как представлено в Примере 3.
Под «полигликолизированный глицерид» понимается сложный моноэфир полиэтиленгликоля и глицерида, сложный диэфир полиэтиленгликоля и глицерида, сложный триэфир полиэтиленгликоля и глицерида или их смесь, содержащая переменное количество свободного полиэтиленгликоля, такого как продукт трансэтерификации полиэтиленгликоль - масло. Полигликолизированный глицерид может включать либо монодисперсные (то есть одинаковая молекулярная масса) или полидисперстные фрагменты полиэтиленгликоля предварительно определенного размера или диапазона размеров (например, от PEG2 до PEG 40). Глицериды полиэтиленгликоля включают, например: PEG глицерилкапрат, PEG глицерилкаприлат, PEG-20 глицериллаурат (TAGAT® L, Goldschmidt), PEG-30 глицериллаурат (TAGAT ® L2, Goldschmidt), PEG-15 глицериллаурат (Glycerox L series, Croda), PEG-40 глицериллаурат (Glycerox L series, Croda), PEG-20 глицерилстеарат (CAPMUL® EMG, ABITEC) и ALDO® MS-20 KFG, Lonza), PEG-20 глицерилолеат (TAGAT ® O, Goldschmidt), и PEG-30 глицерилолеат (TAGAT ® O2, Goldschmidt). Каприлокаприловые глицериды PEG включают, например, PEG-8 каприловый/каприновый глицерид (LABRASOL®, Gattefosse), PEG-4 каприловый/каприновый глицерид (Labrafac® Hydro, Gattefosse), и PEG-6 каприловый/каприновый глицерид (SOFTIGEN®767, Huls). Олеоил PEG глицерид включает, например, олеоил PEG-6 глицерид, (Labrafil M1944 CS, Gattefosee). Лауроил PEG глицериды включают, например, лауроил PEG-32 глицерид (GELUCIRE® ELUCIRE 44/14, Gattefosse). Стеароил PEG глицериды включают, например, стеароил PEG-32 глицерид (Gelucrire 50/13, Gelucire 53/10, Gattefosse). PEG касторовое масло включает PEG-3 касторовое масло (Nikkol СО-3, Nikko), PEG-5, 9 и 16 касторовое масло (серии ACCONON СА, ABITEC), PEG-20 касторовое масло, (Emalex С-20, Nihon Emulsion), PEG-23 касторовое масло (Emulgante EL23), PEG-30 касторовое масло(Incrocas 30, Croda), PEG-35 касторовое масло (Incrocas-35, Croda), PEG-38 касторовое масло (Emulgante EL 65, Condea), PEG-40 касторовое масло (Emalex C-40, Nihon Emulsion), PEG-50 касторовое масло (Emalex C-50, Nihon Emulsion), PEG-56 касторовое масло (EUMULGIN® PRT 56, Pulcra SA), PEG-60 касторовое масло (Nikkol CO-60TX, Nikko), PEG-100 касторовое масло, PEG-200 касторовое масло (EUMULGIN® PRT 200, Pulcra SA), PEG-5 гидрогенизированное касторовое масло (Nikkol HCO-5, Nikko), PEG-7 гидрогенизированное касторовое масло (Cremophor WO7, BASF), PEG-10 гидрогенизированное касторовое масло (Nikkol НСО-10, Nikko), PEG-20 гидрогенизированное касторовое масло (Nikkol НСО-20, Nikko), PEG-25 гидрогенизированное касторовое масло (Simulsol® 1292, Seppic), PEG-30 гидрогенизированное касторовое масло (Nikkol НСО-30, Nikko), PEG-40 гидрогенизированное касторовое масло (Cremophor RH 40, BASF), PEG-45 гидрогенизированное касторовое масло (Cerex ELS 450, Auschem Spa), PEG-50 гидрогенизированное касторовое масло (Emalex НС-50, Nihon Emulsion), PEG-60 гидрогенизированное касторовое масло (Nikkol НСО-60, Nikko), PEG-80 гидрогенизированное касторовое масло (Nikkol НСО-80, Nikko), и PEG-100 гидрогенизированное касторовое масло (Nikkol НСО-100, Nikko). Дополнительные продукты трансэтерификации полиэтиленгликоль - масло включают, например, стеароил PEG глицерид (GELUCIRE® 50/13, Gattefosse). Полигликолизированные глицериды, полезные в лекарственных формах по изобретению, могут включать сложные моноэфиры, диэфиры и/или триэфиры полиэтиленгликоля и глицерида уксусной, пропионовой, масляной, валериановой, капроновой, гептановой, каприловой, нонановой, каприновой, лауриновой, миристиновой, пальмитиновой, гептадекановой, стеариновой, арахидиновой, бегеновой, лигноцериновой, α-линоленовой, стеаридоновой, эйкозапентаеновой, докозагексаеновой, линолевой, γ-линоленовой, дигомо-γ-линоленовой, олеиновой, элаидиновой, эйкозеновой, эруковой или нервоновой кислоты, или их смесей. Полигликолевый фрагмент в полигликолизированном глицериде может быть полидисперсным; то есть, может иметь различную молекулярную массу.
Используемый здесь термин «соль» относится к любой фармацевтически приемлемой соли, такой как нетоксичная соль, образованная путем добавления кислоты, соль металла или комплекс металлов, обычно используемой в фармацевтической области. Примеры солей, образованных путем добавления кислот, включают органические кислоты, такие как уксусная, молочная, пальмовая (palmoic), малеиновая, лимонная, холевая кислота, каприновая кислота, каприловая кислота, лауриновая кислота, глутаровая, глюкуроновая, глицериновая, гликоколевая, глиоксиловая, изолимонная, изовалериановая, молочная, яблочная, щавелево-уксусная, щавелево-янтарная, пропионовая, пировиноградная, аскорбиновая, янтарная, бензойная, пальмитиновая, субериновая, салициловая, винная, метансульфоновая, толуолсульфоновая или трифторуксусная кислоты, и неорганические кислоты, такие как соляная кислота, бромистоводородная кислота, серная кислота и фосфорная кислота. Репрезентативные соли щелочных или щелочноземельных металлов включают натриевые, литиевые, калиевые, кальциевые и магниевые, среди прочих.
Под термином «мягкая капсула» понимается капсула, формованная в виде одного контейнера, который выдерживает жидкую нагрузку лекарственного средства, добавки(ок) и необязательно вспомогательных веществ.
Под термином «субъект» понимается животное, например, человек, домашнее животное (например, собака или кошка), сельскохозяйственное животное (например, коза, корова, лошадь, овца или свинья), и/или млекопитающее.
Используемый здесь термин «лечение» относится к введению фармацевтической композиции в профилактической и/или терапевтической целях. Выражение «предупреждение заболевания» относится к профилактическому лечению субъекта, который еще не болен, но подвержен или иным образом имеет риск конкретного заболевания. Выражение «лечить заболевание» или «терапевтическое лечение» относится к проведению лечения субъекта, уже страдающего заболеванием, для улучшения или стабилизации состояния субъекта. Таким образом, в формуле изобретения и вариантах осуществления лечение представляет собой введение субъекту в терапевтических или профилактических целях.
Термин «стандартная лекарственная форма» относится к физически дискретным единицам, пригодным в качестве унифицированных дозировок, таких как таблетка, каплет, твердая капсула, мягкая капсула или саше, при этом каждая единица содержит предварительно определенное количество лекарственного средства.
В общих описаниях некоторых соединений количество атомов конкретного типа в группе заместителей может быть представлено в виде диапазона, например, алкильная группа, содержащая от 5 до 8 атомов углерода или С5-8 алкил. Ссылка на такой диапазон предполагает включение конкретных ссылок на группы, имеющие каждое из целых чисел атомов в пределах указанного диапазона. Например, алкильная группа, содержащая от 5 до 8 атомов углерода, включает каждый из С5, С6, С7 и C8. Например, С5-8 гетероалкил включает от 5 до 8 атомов углерода дополнительно к одному или нескольким гетероатомам. Другие количества атомов и другие типы атомов могут быть указаны аналогичным образом.
Используемые здесь термины «алкил» и префикс «акл-» включают группы как с прямой, так и с разветвленной цепью, и циклические группы, например, циклоалкил. Циклические группы могут быть моноциклическими или полициклическими и предпочтительно содержат от 3 до 6 кольцевых атомов углевода, включительно. Иллюстративные циклические группы включают циклопропильную, циклобутильную, циклопентильную и циклогексильную группы. C1-8 алкильная группа может быть замещенной или незамещенной. Иллюстративные заместители включают алкокси, арилокси, сульфидрильную, алкилтио, арилтио, галогенидную, гидроксильную, фторалкильную, перфторалкильную, циано, нитрило, NH-ацильную, амино, аминоалкильную, дизамещенную амино, четвертичную амино, гидроксиалкильную, карбоксиалкильную и карбоксильную группы.
Под термином «С2-10 гетероциклил» понимается стабильное от 3- до 7-членное моноциклическое или от 7- до 14-членное бициклическое гетероциклическое кольцо, которое является насыщенным, частично ненасыщенным или ненасыщенным (ароматическим), и которое состоит из от 2 до 10 атомов, и 1, 2, 3 или 4 гетероатомов, независимо выбранных из группы, состоящей из N, О и S, и включает любую бициклическую группу, в которой любое из указанных выше гетероциклических колец конденсировано с бензольным кольцом. Гетероциклическая группа может быть замещенной или незамещенной. Иллюстративные заместители включают алкокси, арилокси, сульфидрильную, алкилтио, арилтио, галогенидную, гидрокси, фторалкильную, перфторалкильную, циано, нитрило, NH-ацильную, амино, аминоалкильную, дизамещенную амино, четвертичную амино, гидроксиалкильную, карбоксиалкильную и карбоксильную группы. Гетероатомы азота и серы могут необязательно быть окисленными. Гетероциклическое кольцо может быть необязательно ковалентно присоединено через любой гетероатом или атом углерода с образованием стабильной структуры, например, имидазолинильное кольцо может быть присоединено у любого положения атомов углерода кольца или атома азота. Атом азота в гетероцикле может быть необязательно кватернизованным. Предпочтительно, когда общее число атомов S и О в гетероцикле превышает 1, эти гетероатомы не являются смежными друг с другом.
Под термином «С6-12 арил» понимается ароматическая группа, имеющая кольцевую систему, составленную из атомов углерода с конъюгированными π-электронами (например, фенил). Арильная группа имеет от 6 до 12 атомов углерода. Арильные группы могут, необязательно, включать моноциклические, бициклические или трициклические кольца, в которых каждое кольцо, желательно, имеет от пяти до шести членов. Арильная группа может быть замещенной или незамещенной. Иллюстративные заместители включают алкильную, гидрокси-, алкокси-, арилокси-, сульфидрильную, алкилтио-, арилтио-, галогенидную, фторалкильную, карбоксильную, гидроксиалкильную, карбоксиалкильную, амино-, аминоалкильную, монозамещенную амино-, дизамещенную амино- и четвертичную аминогруппы.
Под «С7-16 алкарил» означает алкил, замещенный арильной группой (например, бензил, фенетил или 3,4-дихлорфенетил), содержащий от 7 до 16 атомов углерода.
Под «С3-10 алкгетероциклил» понимается замещенная алкилом гетероциклическая группа, содержащая от 3 до 10 атомов углерода дополнительно к одному или нескольким гетероатомам (например, 3-фуранилметил, 2-фуранилметил, 3-тетрагидрофуранилметил или 2-тетрагидрофуранилметил).
Другие признаки и преимущества изобретения будут понятны из следующего подробного описания, чертежей и формулы изобретения.
Краткое описание чертежей
На Фигурах 1-14 показаны соединения по изобретению.
Фигуры 15А и 15 В представляют собой графики, отражающие стабильность соединения 22 и анидулафунгина в различных образцах плазмы млекопитающих и фосфатно-буферном солевом растворе, как описано в Примере 7. Соединение 22 является более стабильным, чем анидулафунгин во всех тестированных матрицах.
Фигуры 16А и 16 В представляют собой графики, показывающие фармакокинетические кривые, наблюдаемые у шимпанзе, для соединения 22 и анидулафунгина, оба из которых вводили внутривенно (Фигура 16А), и для соединения 22, которое вводили перорально, и анидулафунгина, который вводили внутривенно (Фигура 16 В).
Фигуры 17А-17С представляют собой графики, показывающие фармакокинетические кривые, наблюдаемые для каспофунгина, который вводили внутривенно (IV) (Фигура 17А, шимпанзе и человек, смотри Hajdu et al., Antimicrobial Agents and Chemotherapy, 41:2339 (1997)), анидулафунгина, который вводили внутривенно (IV) (Фигура 17В, шимпанзе и человек, смотри пакет CDER предоставляемый в FDA для Eraxis), и соединения 22, которое вводили внутривенно (IV) (Фигура 17С, шимпанзе, смотри Пример 8).
Фигура 18 представляет собой график, показывающий фармакокинетические кривые, наблюдаемые у шимпанзе для соединения 22, которое вводили внутривенно в дозе 1 мг/кг, и соединения 22, которое вводили перорально в дозе 10 мг/кг.
Фигура 19 представляет собой график, показывающий фармакокинетические кривые, наблюдаемые у крыс для соединения 22, которое вводили внутривенно и подкожно.
Фигура 20 представляет собой график, показывающий фармакокинетические кривые, наблюдаемые у обезьян для соединения 22, которое вводили внутривенно и подкожно.
Фигура 21 представляет собой график, показывающий рассчитанные циркулирующие концентрации у субъектов-людей для 200 мг соединения 22, которое вводили внутривенно один раз каждые 7 дней (сплошная линия), и анидулафунгина 200 мг, который вводили внутривенно в первый день, с последующими 100 мг, вводимыми ежедневно внутривенно (пунктирная линия). Кривая для анидулафунгина построена на кривых, представленных в листке вкладыше для Eraxis. Кривую для соединения 22 рассчитывали на основе клиренса 3.4 мл/ч/кг и периода полувыведения из плазмы 80 ч (значения взяты из данных по исследованиям на шимпанзе).
Фигура 22 представляет собой график, показывающий рассчитанные циркулирующие концентрации у субъектов-людей для 200 мг соединения 22, которое вводили внутривенно на день первый, с последующим ежедневным пероральным введением 500 мг (сплошная линия), и 200 мг анидулафунгина, который вводили внутривенно на день первый, с последующим ежедневным внутривенным введением 100 мг (пунктирная линия). Кривая для анидулафунгина основана на кривых, описанных в листке вкладыше для Eraxis. Кривая для соединения 22 была рассчитана на основе клиренса 3.4 мл/ч/кг, периоде полувыведения из плазмы 80 ч, и биодоступности при пероральном введении 5% (величины основаны на данных по исследованиям на шимпанзе).
Подробное описание
Изобретение предлагает режимы дозирования и фармацевтические лекарственные формы для перорального введения, включающие лекарственное средство (например, соединение класса эхинокандинов), формулированные с усилителем проникновения. Лекарственные формы полезны для увеличения пероральной биодоступности лекарственного средства. Изобретение также предлагает режимы дозирования соединений класса эхинокандинов, в частности соединения 22, при этом частота дозирования является уменьшенной и/или режим допускает самостоятельное введение (то есть подкожное или пероральное введение), таким образом, режим может быть выполнен, по меньшей мере, частично, за пределами лечебного учреждения.
Соединения класса эхинокандинов
Лекарственные формы по изобретению можно использовать для увеличения пероральной биодоступности соединений класса эхинокандинов. Соединения класса эхинокандинов являются ингибиторами синтеза 1,3-β-D-глюкана и включают антибиотический циклический липогексапептид, имеющий основную цепь, показанную в формуле (I).
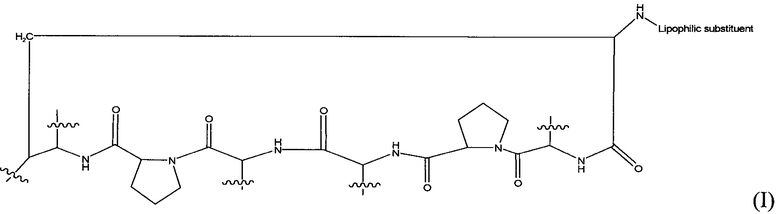
основная цепь соединений класса эхинокандинов
Соединения класса эхинокандинов включают, без ограничения, каспофунгин, эхинокандин В, анидулафунгин, пневмокандин В0, акулеацин Аγ, микафунгин и их производные.
Соединения класса эхинокандинов могут быть синтезированы, например, с помощью реакции сочетания функционализированных или нефункционализированных соединений класса эхинокандинов с соответствующей ацильной, алкильной, гидроксильной и/или аминогруппами в стандартных условиях реакции (смотри РСТ Публикацию No. WO 2011/025875, и предварительную заявку на патент США серийный номер 61/448807, включенные здесь путем отсылки). Как правило, полусинтетические соединения класса эхинокандинов получают путем модифицирования остова эхинокандина природного происхождения. Например, пневмокандин В0 получен с помощью реакций ферментации; при этом ферментация и смешанные бульоны вырабатывают смесь продуктов, которые затем разделяют с получением пневмокандина В0, который используют в синтезе каспофунгина (смотри патент США №6610822, который описывает экстракции соединений класса эхинокандинов, таких как пневмокандин В0, WF 11899 и эхинокандин В, путем выполнения нескольких процессов экстрации; и смотри патент США №6610822, который описывает способы очистки сырых экстрактов). Для полу синтетических подходов к соединениям класса эхинокандинов по изобретению стереохимия соединения будет определяться исходным материалом. Таким образом, стереохимия производных эхинокандина неприродного происхождения будет обычно такой же, что и стереохимия остова эхинокандина природного происхождения, из которого они получены. Соответственно, любой из эхинокандина В, анидулафунгина, микафунгина и каспофунгина можно использовать в качестве исходного материала в синтезе соединений класса эхинокандинов, которые обладают одинаковой стереохимической конфигурацией в каждом из аминокислотных остатков, обнаруживаемых в соединении природного происхождения.
Соединение класса эхинокандинов может быть выбрано из соединений, описанных в РСТ Публикации WO 2011/025875 и предварительной заявке на патент США серийный номер 61/448807, поданной 3 марта 2011 года, каждая из которых включена здесь путем отсылки.
Соединение класса эхинокандинов, вводимое и/или формулированное, как описано здесь, может представлять собой соединение формулы (II):
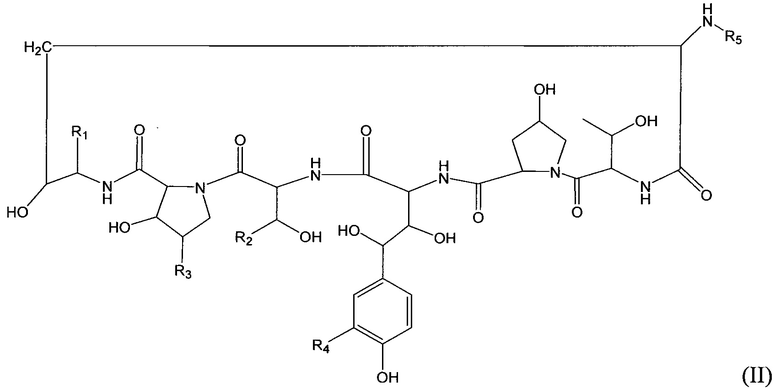
В формуле (II) R1 представляет собой NHCH2CH2NHRA1, NHCH2CH2NRA1RA2, NHCH2CH2NHC(O)RA1, CH2NHRA1, CH2NRA1RA2, CH2NHC(O)RA1 или ORA1; R2 представляет собой H, CH3, CH2CH2NHRB1, CH2CH2NRB1RB2, CH2CH2NHC(O)RB1, CH2C(O)NHRB1, CH2CH2CH(ORB1)NHRB2, CH2CH2CH(ORB1)NRB2RB3 или CH2CH2CH(ORB1)NHC(O)RB2; R3 представляет собой H или СН3; R4 представляет собой Н, OSO3H, CH2NHRC1, CH2NRC1RC2, CH2NHC(O)RC1; R5 представляет собой липофильную группу, выбранную из: PEG; C(O)-PEG; PEG-алкил; С(O)-PEG-алкил; PEG-арил; C(O)-PEG-арил; PEG-алкарил; С(O)-PEG-алкарил; алкил-PEG; С(O)-алкил-PEG; арил-PEG; С(O)-арил-PEG; алкарил-PEG; С(O)-алкарил-PEG;
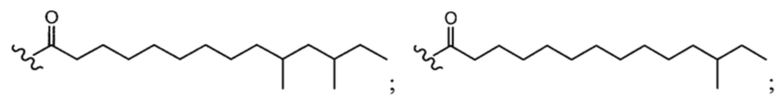
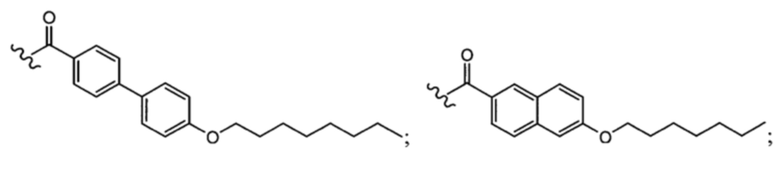
и 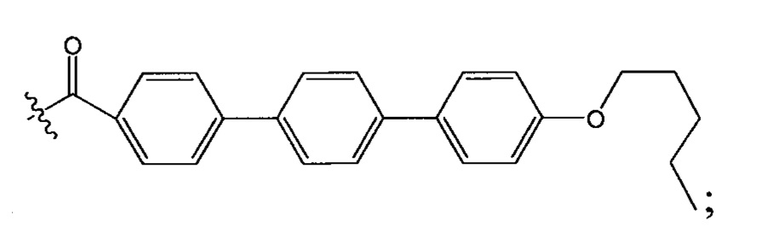 и
и
каждый из RA1, RA2, RB1, RB2, RB3, RC1 и RC2 независимо выбран из H, C1-10 алкила, С2-10 алкенила, С2-10 алкинила, С2-6 гетероциклила, С6-12 арила, С7-14 алкарила, С3-10 алкгетероциклила, C1-10 гетероалкила, PEG, алкил-PEG, арил-PEG, алкиларил-PEG, PEG-алкила, PEG-арила и PEG-алкарила, и их фармацевтически приемлемых солей, при условии, что соединение класса эхинокандинов включает по меньшей мере одну PEG, алкил-PEG, арил-PEG, алкарил-PEG, PEG-алкильную, PEG-арильную или PEG-алкарильную группу. В конкретных вариантах осуществления соединения класса эхинокандинов формулы (II) R4 выбран из: (i) -CH2NH-(CH2CH2O)m-(CH2)n-Me, (ii) -CH2NH-(CH2)q-O-(CH2CH2O)m-Me, (iii) -CH2NH-(CH2)p-NH-(CO)-(CH2)n-O-(CH2CH2O)m-Me и (iv) -CH2NHCH[(CH2O(CH2CH2O)s-Me)(CH2O(CH2CH2O)t-Me)], где n представляет собой целое число от 0 до 11 (например, от 0 до 7, от 1 до 7, от 2 до 7, от 3 до 9 или от 4 до 11), q представляет собой целое число от 3 до 12 (например, от 3 до 7, от 5 до 9 или от 7 до 12), р представляет собой целое число от 2 до 8 (например, от 2 до 4, от 3 до 6, или от 4 до 8), s представляет собой целое число от 0 до 5 (например, 0, 1, 2, 3, 4 или 5), t представляет собой целое число от 0 до 5 (например, 0, 1, 2, 3, 4 или 5), и m представляет собой целое число от 1 до 10 (например, от 1 до 7, от 1 до 5, от 2 до 7, от 2 до 5 или от 3 до 7). В еще других вариантах осуществления соединения класса эхинокандинов формулы (II) R5 выбран из: (i) -(CH2CH2O)m-(CH2)n-Me, (ii) -С(О)-(CH2CH2O)m-(CH2n-Me, (iii) -C(O)CH2-O-(CH2CH2O)m-(CH2)n-Me и (iv) -C(O)-O-(CH2CH2O)m-(CH2)n-Me, где n представляет собой целое число от 0 до 11 (например, от 0 до 7, от 1 до 7, от 2 до 7, от 3 до 9 или от 4 до 11), и m представляет собой целое число от 1 до 10 (например, от 1 до 7, от 1 до 5, от 2 до 7, от 2 до 5 или от 3 до 7).
Соединение класса эхинокандинов, вводимое и/или формулированное, как описано здесь, может представлять собой соединение формулы (III):
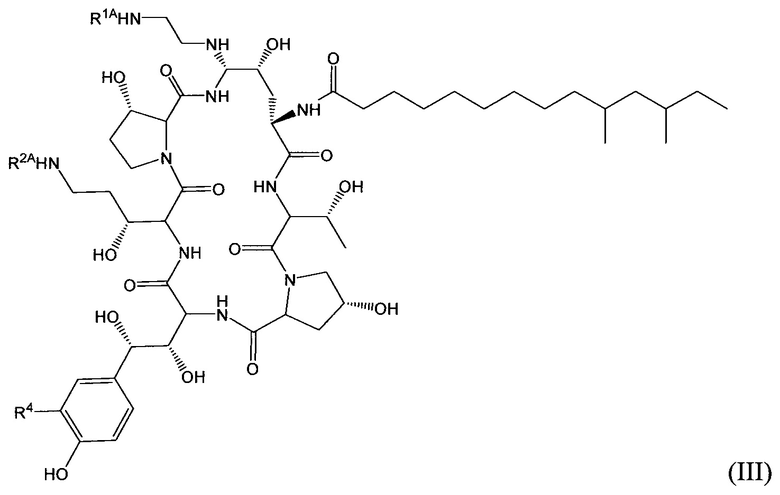
В формуле (III) R1A представляет собой Н, C1-10 алкил, С2-10 алкенил, С2-10 алкинил, С2-6 гетероциклил, С6-12 арил, С7-14 алкарил, С3-10 алкгетероциклил, C1-10 гетероалкил, PEG, алкил-PEG, арил-PEG, алкарил-PEG, PEG-алкил, PEG-арил или PEG-алкарил; R2A представляет собой Н, C1-10 алкил, С2-10 алкенил, С2-10 алкинил, С2-6 гетероциклил, С6-12 арил, С7-14 алкарил, С3-10 алкгетероциклил, C1-10 гетероалкил, PEG, алкил-PEG, арил-PEG, алкарил-PEG, PEG-алкил, PEG-арил или PEG-алкарил; R4 представляет собой Н, OSO3H, CH2NHRC1, CH2NRC1RC2, CH2NHC(O)RC1; и каждый из RC1 и RC2 независимо представляет собой Н, C1-10 алкил, С2-10 алкенил, С2-10 алкинил, С2-6 гетероциклил, С6-12 арил, С7-14 алкарил, С3-10 алкгетероциклил, C1-10 гетероарил, PEG, алкил-PEG, арил-PEG, алкарил-PEG, PEG-алкил, PEG-арил и PEG-алкарил, их фармацевтически приемлемые соли, при условии, что соединение класса эхинокандинов включает по меньшей мере один из PEG, алкил-PEG, арил-PEG, алкарил-PEG, PEG-алкила, PEG-арила или PEG-алкарила. В определенных вариантах осуществления соединения класса эхинокандинов формулы (III) один из R1A, R2A, RC1 и RC2 выбран из: (i) -(СН2)Р-O-(CH2CH2O)m-Ме и (ii) -(CH2CH2O)m-Ме, и (iii) -С(O)(СН2)n-(ОСН2СН2)m-ОМе, где n представляет собой целое число от 0 до 11 (например, от 0 до 7, от 1 до 7, от 2 до 7, от 3 до 9 или от 4 до 11), р представляет собой целое число от 3 до 12 (например, от 3 до 8, от 4 до 10, или от 6 до 12) и m представляет собой целое число от 1 до 10 (например, от 1 до 7, от 1 до 5, от 2 до 7, от 2 до 5 или от 3 до 7). В конкретных вариантах осуществления соединения класса эхинокандинов формулы (II) R1A представляет собой Н, и R2A представляет собой PEG, алкил-PEG, арил-PEG, алкарил-PEG, PEG-алкил, PEG-арил или PEG-алкарил; R1A представляет собой PEG, алкил-PEG, арил-PEG, алкарил-PEG, PEG-алкил, PEG-арил или PEG-алкарил, и R2A представляет собой Н; или каждый из R1A и R2A независимо выбран из PEG, алкил-PEG, арил-PEG, алкарил-PEG, PEG-алкила, PEG-арила и PEG-алкарила.
Соединение класса эхинокандинов, вводимое и/или формулированное, как описано здесь, может представлять собой соединение формулы (IV):
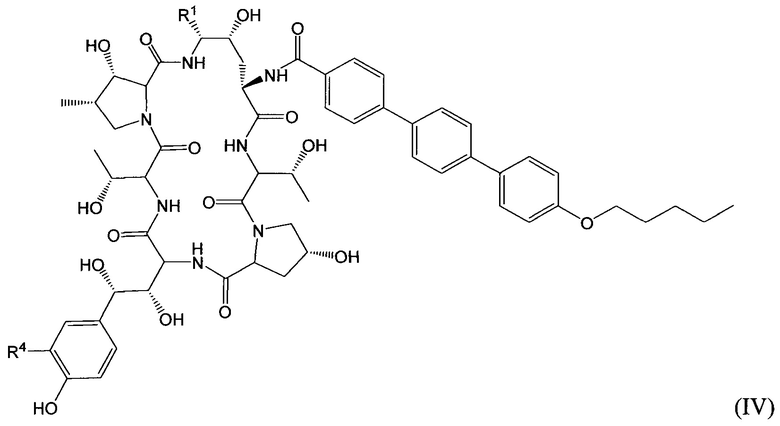
В формуле (IV) R1 представляет собой NHCH2CH2NHRA1, NHCH2CH2NRA1RA2, NHCH2CH2NHC(O)RA1, CH2NHRA1, CH2NRA1RA2, CH2NHC(O)RA1 или ORA1; R4 представляет собой H, OSO3H, CH2NHRC1, CH2NRC1RC2, CH2NHC(O)RC1; и каждый из RA1, RA2, RC1 и RC2 независимо выбран из H, C1-10 алкила, С2-10 алкенила, С2-10 алкинила, С2-6 гетероциклила, С6-12 арила, С7-14 алкарила, С3-10 алкгетероциклила, C1-10 гетероалкила, PEG, алкил-PEG, арил-PEG, алкарил-PEG, PEG-алкила, PEG-арила и PEG-алкарила, и их фармацевтически приемлемых солей, при условии, что соединение класса эхинокандинов включает по меньшей мере одну из PEG, алкил-PEG, арил-PEG, алкарил-PEG, PEG-алкильную, PEG-арильную или PEG-алкарильную группу. В определенных вариантах осуществления соединение класса эхинокандинов формулы (IV) R1 выбран из: (i) -O-(CH2CH2O)m-(CH2)n-Me, (ii) -NH-(CH2CH2O)m-(CH2)n-Me, (iii) -O-(CH2)q-O-(CH2CH2O)m-Me, (iv) -NH-(CH2)q-O-(CH2CH2O)m-Me, (v) -O-(CH2)p-NH-(CO)-(CH2)n-O-(CH2CH2O)m-Me, (vi) -NH-(CH2)p-NH-(CO)-(CH2)n-O-(CH2CH2O)m-Me, (vii) -NHCH[(CH2O(CH2CH2O)s-Me)(CH2O(CH2CH2O)t-Me)] и (viii) -O-CH[(CH2O(CH2CH2O)s-Me)(CH2O(CH2CH2O)t-Me)], где n представляет собой целое число от 0 до 11 (например от 0 до 7, от 1 до 7, от 2 до 7, от 3 до 9 или от 4 до 11), q представляет собой целое число от 3 до 12 (например, от 3 до 7, от 5 до 9 или от 7 до 12), р представляет собой целое число от 2 до 8 (например, от 2 до 4, от 3 до 6 или от 4 до 8), s представляет собой целое число от 0 до 5 (например, 0, 1, 2, 3, 4 или 5), t представляет собой целое число от 0 до 5 (например, 0, 1, 2, 3, 4 или 5), и m представляет собой целое число от 1 до 10 (например, от 1 до 7, от 1 до 5, от 2 до 7, от 2 до 5 или от 3 до 7).
Соединение класса эхинокандинов, вводимое и/или формулированное, как описано здесь, может представлять собой соединение формулы (V):
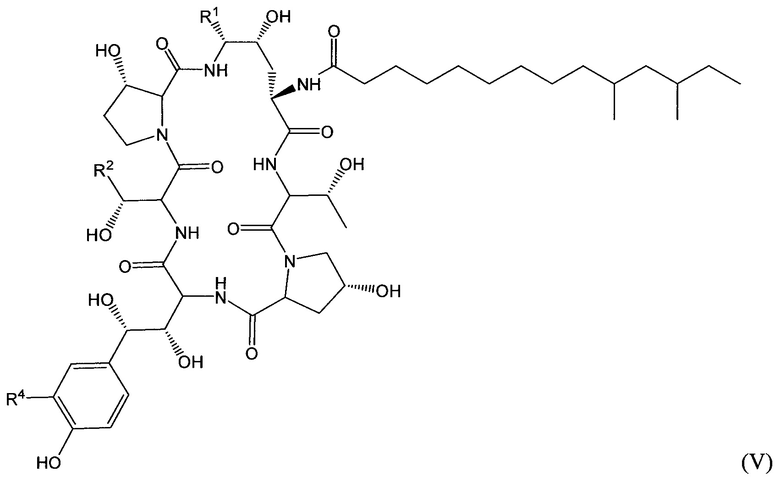
В формуле (V) R1 представляет собой NHCH2CH2NHRA1, NHCH2CH2NRA1RA2, NHCH2CH2NHC(O)RA1, CH2NHRA1, CH2NRA1RA2, CH2NHC(O)RA1 или ORA1; R2 представляет собой H, CH3, CH2CH2NHRB1, CH2CH2NRB1RB2, CH2CH2NHC(O)RB1, CH2C(O)NHRB1, CH2CH2CH(ORB1)NHRB2, CH2CH2CH(ORB1)NRB2RB3 или CH2CH2CH(ORB1)NHC(O)RB2; R4 представляет собой H, OSO3H, CH2NHRC1, CH2NRC1RC2, CH2NHC(O)RC1; и каждый из RA1, RA2, RB1, RB2, RB3, RC1 и RC2 независимо выбран из H, C1-10 алкила, С2-10 алкенила, С2-10 алкинила, С2-6 гетероциклила, С6-12 арила, С7-14 алкарила, С3-10 алкгетероциклила, C1-10 гетероалкила, PEG, алкил-PEG, арил-PEG, алкарил-PEG, PEG-алкила, PEG-арила и PEG-алкарила, и их фармацевтически приемлемых солей, при условии, что соединение класса эхинокандинов включает по меньшей мере одну PEG, алкил-PEG, арил-PEG, алкарил-PEG, PEG-алкильную, PEG-арильную или PEG-алкарильную группу. В определенных вариантах осуществления соединения класса эхинокандинов формулы (V) R1 выбран из: (i) -O-(CH2CH2O)m-(CH2)n-Me, (ii) -NH-(CH2CH2O)m-(CH2)n-Me, (iii) -O-(CH2)q-O-(CH2CH2O)m-Me, (iv) -NH-(CH2)q-O-(CH2CH2O)m-Me, (v) -O-(CH2)p-NH-(CO)-(CH2)n-O-(CH2CH2O)m-Me, (vi) -NH-(CH2)p-NH-(CO)-(CH2)n-O-(CH2CH2O)m-Me, (vii) -NHCH[(CH2O(CH2CH2O)s-Me)(CH2O(CH2CH2O)t-Me)] и (viii) -O-CH[(CH2O(CH2CH2O)s-Me)(CH2O(CH2CH2O)t-Me)], где n представляет собой целое число от 0 до 11 (например, от 0 до 7, от 1 до 7, от 2 до 7, от 3 до 9 или от 4 до 11), q представляет собой целое число от 3 до 12 (например, от 3 до 7, от 5 до 9 или от 7 до 12), р представляет собой целое число от 2 до 8 (например, от 2 до 4, от 3 до 6 или от 4 до 8), s представляет собой целое число от 0 до 5 (например, 0, 1, 2, 3, 4 или 5), t представляет собой целое число от 0 до 5 (например, 0, 1, 2, 3, 4 или 5), и m представляет собой целое число от 1 до 10 (например, от 1 до 7, от 1 до 5, от 2 до 7, от 2 до 5 или от 3 до 7).
Соединение класса эхинокандинов, вводимое и/или формулированное, как описано здесь, может представлять собой соединение формулы (VI):
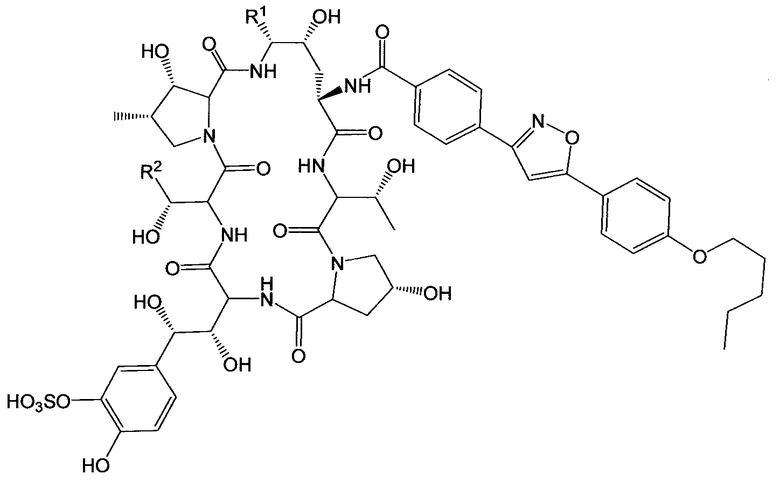
В формуле (VI) R1 представляет собой NHCH2CH2NHRA1, NHCH2CH2NRA1RA2, NHCH2CH2NHC(O)RA1, CH2NHRA1, CH2NRA1RA2, CH2NHC(O)RA1 или ORA1; R2 представляет собой H, CH3, CH2CH2NHRB1, CH2CH2NRB1RB2, CH2CH2NHC(O)RB1, CH2C(O)NHRB1, CH2CH2CH(ORB1)NHRB2, CH2CH2CH(ORB1)NRB2RB3 или CH2CH2CH(ORB1)NHC(O)RB2; и каждый из RA1, RA2, RB1, RB2 и RB3 независимо выбран из H, C1-10 алкила, С2-10 алкенила, С2-10 алкинила, С2-6 гетероциклила, С6-12 арила, С7-14 алкарила, С3-10 алкгетероциклила, C1-10 гетероалкила, PEG, алкил-PEG, арил-PEG, алкарил-PEG, PEG-алкила, PEG-арила и PEG-алкарила, и их фармацевтически приемлемых солей, при условии, что соединение класса эхинокандинов включает по меньшей мере одну PEG, алкил-PEG, арил-PEG, алкарил-PEG, PEG-алкильную, PEG-арильную или PEG-алкарильную группу. В определенных вариантах осуществления соединения класса эхинокандинов формулы (VI) R1 выбран из: (i) -O-(CH2CH2O)m-(CH2)n-Me, (ii) -NH-(CH2CH2O)m-(CH2)n-Me, (iii) -O-(CH2)q-O-(CH2CH2O)m-Me, (iv) -NH-(CH2)q-O-(CH2CH2O)m-Me, (v) -O-(CH2)p-NH-(CO)-(CH2)n-O-(CH2CH2O)m-Me, (vi) -NH-(CH2)p-NH-(CO)-(CH2)n-O-(CH2CH2O)m-Me, (vii) -NHCH[(CH2O(CH2CH2O)s-Me)(CH2O(CH2CH2O)t-Me)] и (viii) -O-CH[(CH2O(CH2CH2O)s-Me)(CH2O(CH2CH2O)t-Me)], где n представляет собой целое число от 0 до 11 (например, от 0 до 7, от 1 до 7, от 2 до 7, от 3 до 9 или от 4 до 11), q представляет собой целое число от 3 до 12 (например, от 3 до 7, от 5 до 9 или от 7 до 12), р представляет собой целое число от 2 до 8 (например, от 2 до 4, от 3 до 6 или от 4 до 8), s представляет собой целое число от 0 до 5 (например, 0, 1, 2, 3, 4 или 5), t представляет собой целое число от 0 до 5 (например, 0, 1, 2, 3, 4 или 5), и m представляет собой целое число от 1 до 10 (например, от 1 до 7, от 1 до 5, от 2 до 7, от 2 до 5 или от 3 до 7).
Соединение класса эхинокандинов, вводимое и/или формулированное, как описано здесь, может представлять собой соединение формулы (VII):
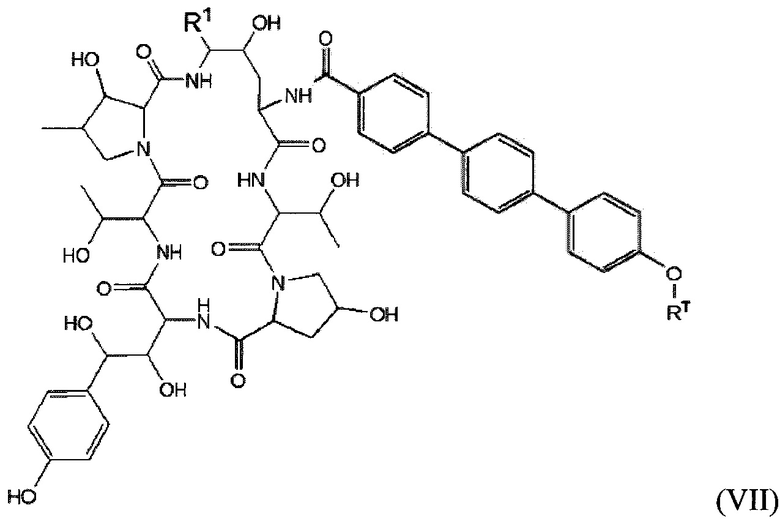
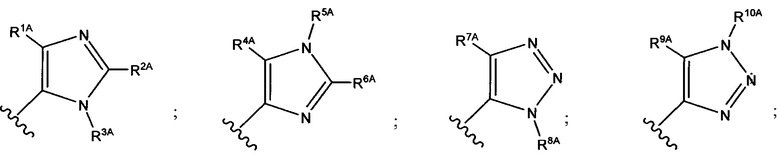
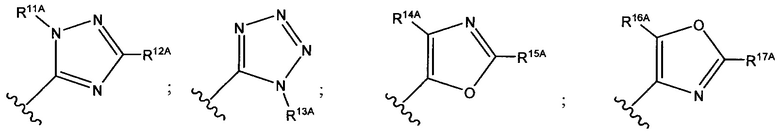
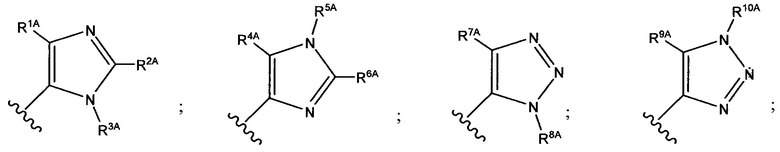
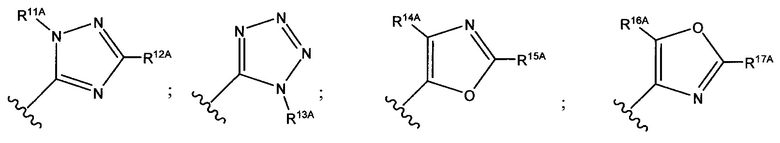
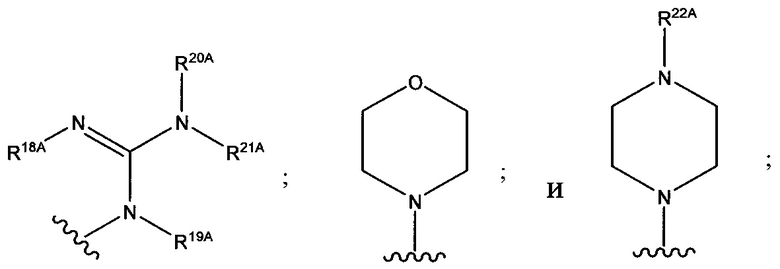
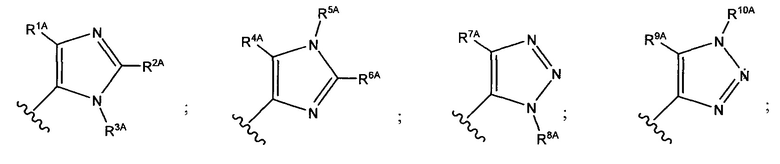
В формуле (VII) R1 представляет собой O(CH2CH2O)nCH2CH2X1, O(CH2CH2CH2O)nCH2CH2X1, NHCH2CH2X2, NH(CH2CH2O)mCH2CH2X2, NH(CH2CH2CH2O)mCH2CH2X2, NH(CH2CH2O)pCH2CH2X3, NH(CH2CH2CH2O)pCH2CH2X3, NHCH2CH2X4, NH[CH2(CH2)aO]bCH{CH2[OCH2(CH2)c]dX5}2, O[CH2(CH2)aO]bCH{CH2[OCH2(CH2)c]dX5}2, NH(CH2CH2NH)rCH2CH2X5, NHCH2(CH2)qX6 или ОСН2(СН2)qX6; RT представляет собой н-пентил, втор-пентил или изопентил; X1 представляет собой NH2, NHRA1, NRA1RA2, NRA1RA2RA3 или NHCH2(CH2)vZ1; X2 представляет собой OH, ORB1 или OCH2(CH2)vZ1; Х3 представляет собой NH2, NHRC1, NRC1RC2 или NRC1RC2RC3, или NHCH2(CH2)vZ1; Х4 представляет собой NRD1RD2RD3 или NHCH2(CH2)vZ1; каждый Х5 независимо выбран из ОН, ORE1, NH2, NHRE1, NRE1RE2, NRE1RE2RE3, OCH2(CH2)vZ1 и NHCH2(CH2)vZ1; X6 выбран из NRF1RF2RF3 или Z1; а представляет собой целое число от 1 до 2; b представляет собой целое число от 0 до 3 (например, 0, 1, 2 или 3); с представляет собой целое число от 1 до 2; d представляет собой целое число от 0 до 3 (например, 0, 1, 2 или 3); n представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); m представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); р представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); r представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); q представляет собой целое число от 1 до 3 (например, 1, 2 или 3); v представляет собой целое число от 1 до 3 (например, 1, 2 или 3); каждый из RA1, RA2, RA3, RB1, RC1, RC2, RC3, RD1, RD2, RD3, RE1, RE2, RE3, RF1, RF2 и RF3 независимо выбран из СН3, СН2СН3, СН2СН2СН3 и СН(СН3)2; Z1 выбран из:
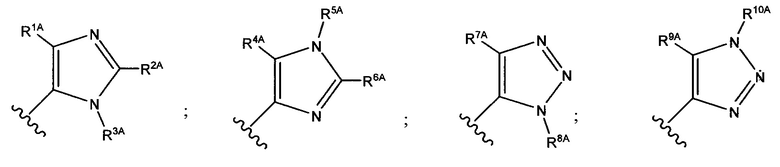 ;
;
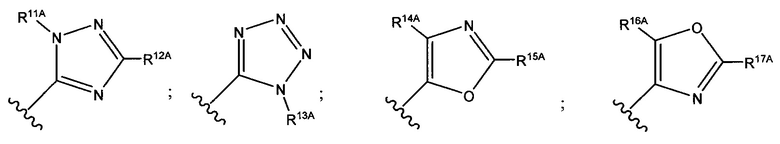
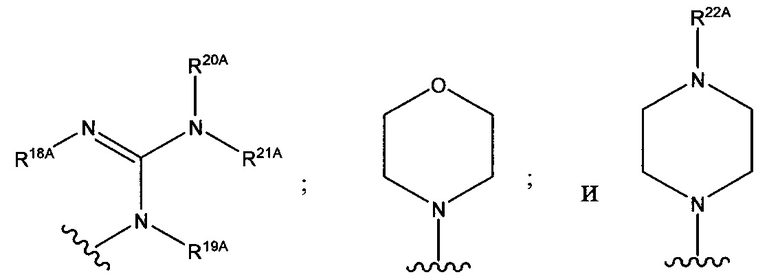 ;
;
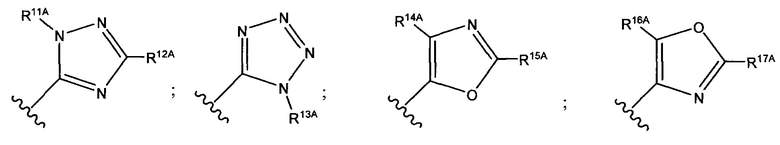
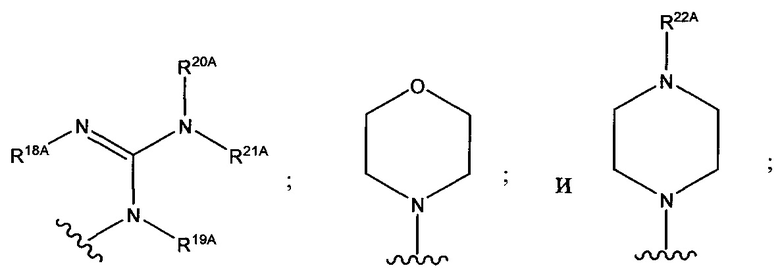
и каждый из R1A, R2A, R3A, R4A, R5A, R6A, R7A, R8A, R9A, R10A, R11A, R12A, R13A, R14A, R15A, R16A, R17A, R18A, R19A, R20A, R21A и R22A независимо выбран из H, СН3, СН2СН3, СН2СН2СН3 и СН(СН3)2, или их фармацевтически приемлемых солей.
В определенных вариантах осуществления соединение формулы (VII) дополнительно описано формулой (VIIa):
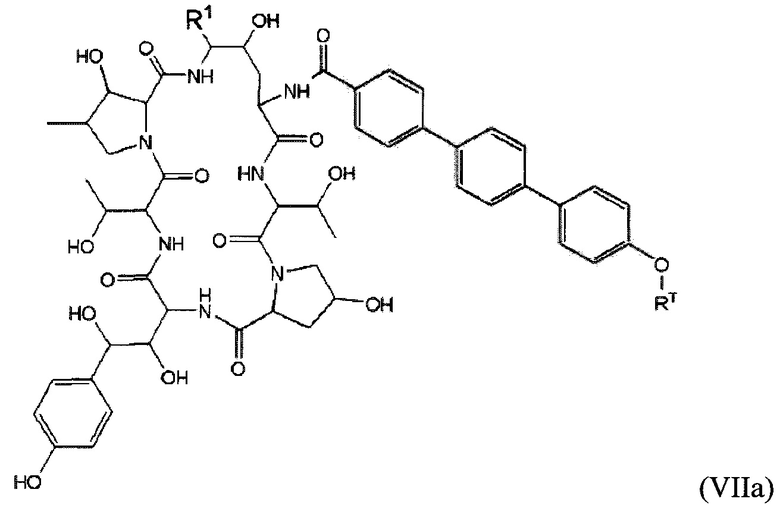 .
.
В формуле (VIIa) R1 представляет собой O(CH2CH2O)nCH2CH2X1, O(CH2CH2CH2O)nCH2CH2X1, NHCH2CH2X2, NH(CH2CH2O)mCH2CH2X2, NH(CH2CH2CH2O)mCH2CH2X2, NH(CH2CH2O)pCH2CH2X3, NH(CH2CH2CH2O)pCH2CH2X3, NHCH2CH2X4, NH[CH2(CH2)aO]bCH{CH2[OCH2(CH2)c]dX5}2, O[CH2(CH2)aO]bCH{CH2[OCH2(CH2)c]dX5}2, NH(CH2CH2NH)rCH2CH2X5, NHCH2(CH2)qX6 или ОСН2(СН2)qX6; RT представляет собой н-пентил, втор-пентил или изопентил; X1 представляет собой NH2, NHRAI, NRA1RA2 или NRA1RA2RA3; Х2 представляет собой ОН или ORB1; Х3 представляет собой NH2, NHRC1, NRC1RC2 или NRC1RC2RC3; Х4 представляет собой NRD1RD2RD3; каждый Х5 независимо выбран из ОН, ORE1, NH2, NHRE1, NRE1RE2 и NRE1RE2RE3; X6 выбран из NRF1RF2RF3; а представляет собой целое число от 1 до 2; b представляет собой целое число от 0 до 3 (например, 0, 1, 2 или 3); с представляет собой целое число от 1 до 2; d представляет собой целое число от 0 до 3 (например, 0, 1, 2 или 3); n представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); m представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); р представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); r представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); q представляет собой целое число от 1 до 3 (например, 1, 2 или 3); и каждый из RA1, RA2, RA3, RB1, RC1, RC2, RC3, RD1, RD2, RD3, RE1, RE2, RE3, RF1, RF2 и RF3 независимо выбран из CH3, СН2СН3, СН2СН2СН3 и СН(СН3)2, или их фармацевтически приемлемых солей. В конкретных вариантах осуществления соединений формулы (I) и (Ia) один из X1, Х3, Х4 и Х5 выбран из N(СН3)3+ и М(СН2СН3)3+. В определенных вариантах осуществления соединений формулы (I) и (Ia) R1 представляет собой NHCH[CH2CH2N(CH3)3+]2, NHCH2CH2OCH[CH2CH2N(CH3)3+]2 или NHCH2CH2OCH[CH2CH2N(CH3)3+] [СН2СН2ОСН2СН2ОН].
В еще других вариантах осуществления соединение формулы (VII) дополнительно описано формулой (VIIb):
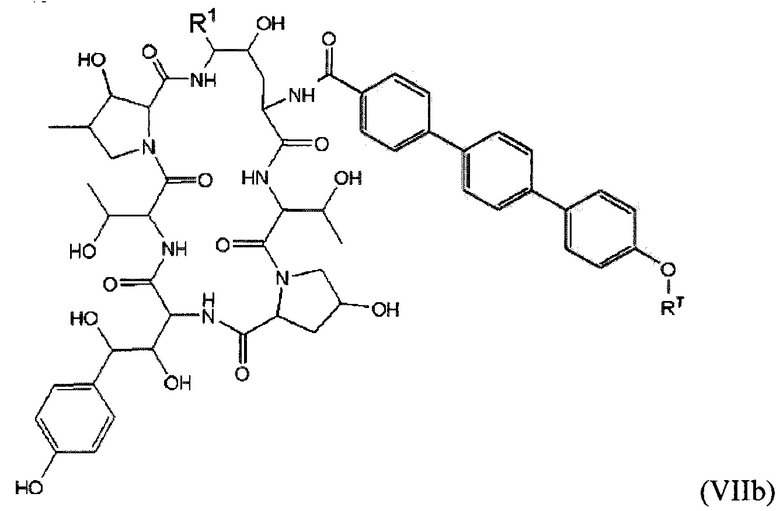
В формуле (VIIb) R1 представляет собой O(CH2CH2O)nCH2CH2X1, O(CH2CH2CH2O)nCH2CH2X1, NHCH2CH2X2, NH(CH2CH2O)mCH2CH2X2, NH(CH2CH2CH2O)mCH2CH2X2, NH(CH2CH2O)рСН2СН2Х3, NH(CH2CH2CH2O)pCH2CH2X3, NHCH2CH2X4, NH[CH2(CH2)aO]bCH{CH2[OCH2(CH2)c]dX5}2, O[СН2(СН2)аО]bCH{СН2[ОСН2(СН2)с]dХ5}2, NH(CH2CH2NH)rCH2CH2X5, NHCH2(CH2)qX6 или ОСН2(СН2)qX6; RT представляет собой н-пентил, втор-пентил или изопентил; X1 представляет собой NHCH2(CH2)vZ1; Х2 представляет собой OCH2(CH2)vZ1; Х3 представляет собой NHCH2(CH2)vZ1; Х4 представляет собой NHCH2(CH2)vZ1; каждый Х5 независимо выбран из OCH2(CH2)vZ1 и NHCH2(CH2)vZ1; Х6 представляет собой Z1; а представляет собой целое число от 1 до 2; b представляет собой целое число от 0 до 3 (например, 0, 1, 2 или 3); с представляет собой целое число от 1 до 2; d представляет собой целое число от 0 до 3 (например, 0, 1, 2 или 3); n представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); m представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); р представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); r представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); q представляет собой целое число от 1 до 3 (например, 1, 2 или 3); v представляет собой целое число от 1 до 3 (например, 1, 2 или 3); Z1 выбран из:
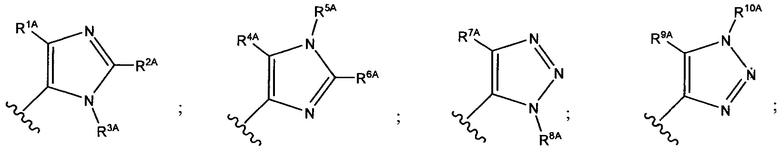
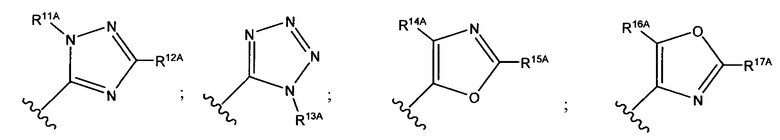
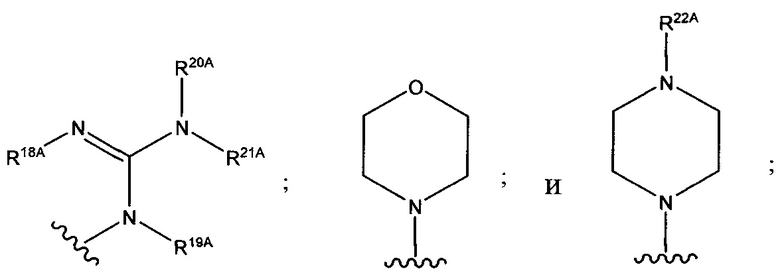
и каждый из R1A, R2A, R3A, R4A, R5A, R6A, R7A, R8A, R9A, R10A, R11A, R12A, R13A, R14A, R15A, R16A, R17A, R18A, R19A, R20A, R21A и R22A независимо выбран из H, СН3, СН2СН3, СН2СН2СН3 и СН(СН3)2, или их фармацевтически приемлемых солей.
В одном конкретном варианте осуществления соединений формулы (VII), (VIIa) и (VIIb) соединение дополнительно описано одной из формул:
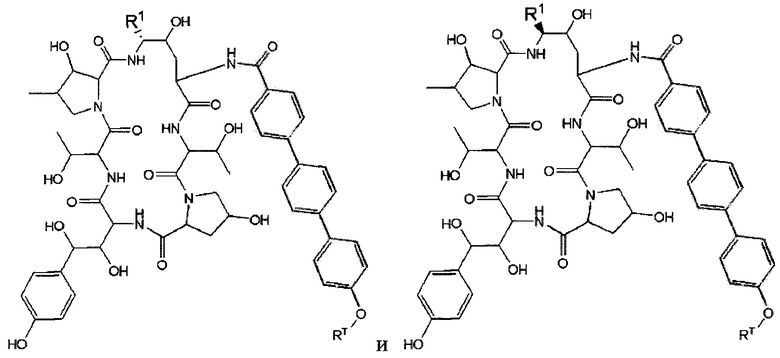 ,
,
где R1 и RT представляют собой такие, которые описаны в формуле (VII).
Соединение класса эхинокандинов, введенное и/или формулированное, как описано здесь, может представлять собой соединение формулы (VIII):
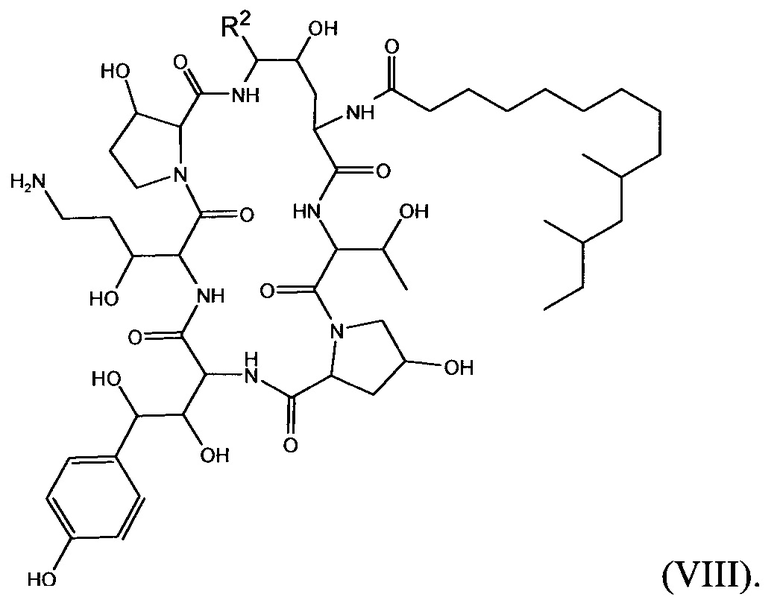
В формуле (VIII) R2 представляет собой NH(CH2CH2O)sCH2X8, NH(CH2CH2CH2O)sCH2CH2X8, NH(CH2CH2NH)tCH2CH2X9, NH[CH2(CH2)aO]bCH{CH2[OCH2(CH2)c]dX9}2, O[CH2(CH2)aO]bCH{CH2[OCH2(CH2)c]dX9}2, NHCH2(CH2)uX10 или OCH2(CH2)uX10; X8 представляет собой OH, ORG1, NH2, NHRG1, NRG1RG2, NRG1RG2RG3, OCH2(CH2)wZ2 или NHCH2(CH2)vZ2; каждый X9 независимо выбран из OH, ORH1, NHRH1, NRH1RH2, NRH1RH2RH3, OCH2(CH2)WZ2 и NHCH2(CH2)vZ2; Х10 выбран из NRI1RI2RI3 или Z2; a представляет собой целое число от 1 до 2; b представляет собой целое число от 0 до 3 (например, 0, 1, 2 или 3); с представляет собой целое число от 1 до 2; d представляет собой целое число от 0 до 3 (например, 0, 1, 2 или 3); s представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); t представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); u представляет собой целое число от 1 до 3 (например, 1, 2 или 3); каждый из RG1, RG2, RG3, RH1, RH2, RH3, RI1, RI2 и RI3 независимо выбран из СН3, СН2СН3, СН2СН2СН3 и СН(СН3)2; w представляет собой целое число от 1 до 3 (например, 1, 2 или 3); Z2 выбран из
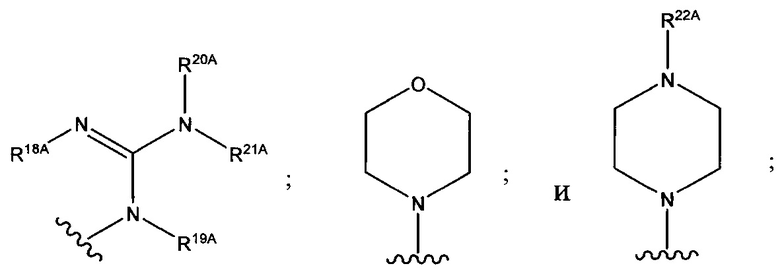
и каждый из R1A, R2A, R3A, R4A, R5A, R6A, R7A, R8A, R9A, R10A, R11A, R12A, R13A, R14A, R15A, R16A, R17A, R18A, R19A, R20A, R21A и R22A независимо выбран из H, СН3, СН2СН3, СН2СН2СН3 и СН(СН3)2, или его фармацевтически приемлемую соль.
В определенных вариантах осуществления соединение формулы (VIII) дополнительно описано формулой (VIIIa):
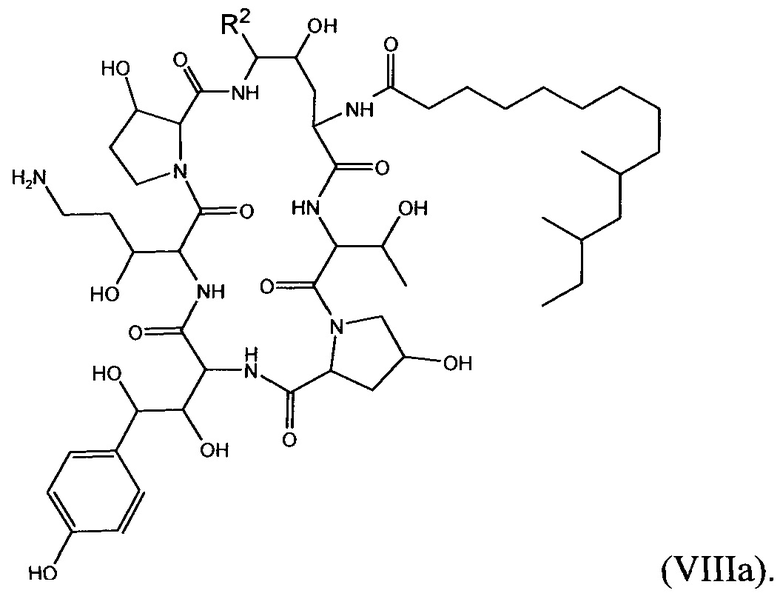
В формуле (VIIIa) R2 представляет собой NH(CH2CH2O)sCH2CH2X8, NH(CH2CH2CH2O)sCH2CH2X8, NH(CH2CH2NH)tCH2CH2X9, NH[CH2(CH2)aO]bCH{CH2[OCH2(CH2)c]dX9}2, O[CH2(CH2)aO]bCH{CH2[OCH2(CH2)c]dX9}2, NHCH2(CH2)uX10 или OCH2(CH2)uX10; X8 представляет собой OH, ORG1, NH2, NHRG1, NRG1RG2 или NRG1RG2RG3; каждый X9 независимо выбран из OH, ORH1, NHRH1, NRH1RH2 и NRH1RH2RH3; Х10 выбран из NRI1RI2RI3; а представляет собой целое число от 1 до 2; b представляет собой целое число от 0 до 3 (например, 0, 1, 2 или 3); с представляет собой целое число от 1 до 2; d представляет собой целое число от 0 до 3 (например, 0, 1, 2 или 3); s представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); t представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); u представляет собой целое число от 1 до 3 (например, 1, 2 или 3); и каждый из RG1, RG2, RG3, RH1, RH2, RH3, RI1, RI2 и RI3 независимо выбран из СН3, СН2СН3, СН2СН2СН3 и СН(СН3)2, или его фармацевтически приемлемую соль. В конкретных вариантах осуществления соединений формулы (II) и (IIa) один из Х8 и Х9 выбран из N(СН3)3+ и N(СН2СН3)3+. В определенных вариантах осуществления соединений формулы (II) и (IIa) R2 представляет собой NHCH[CH2CH2N(CH3)3+]2, NHCH2CH2OCH[CH2CH2N(CH3)3+]2 или NHCH2CH2OCH[CH2CH2N(CH3)3+] [СН2СН2ОСН2СН2ОН].
В еще других вариантах осуществления соединение формулы (I) дополнительно описано формулой (VIIIb):
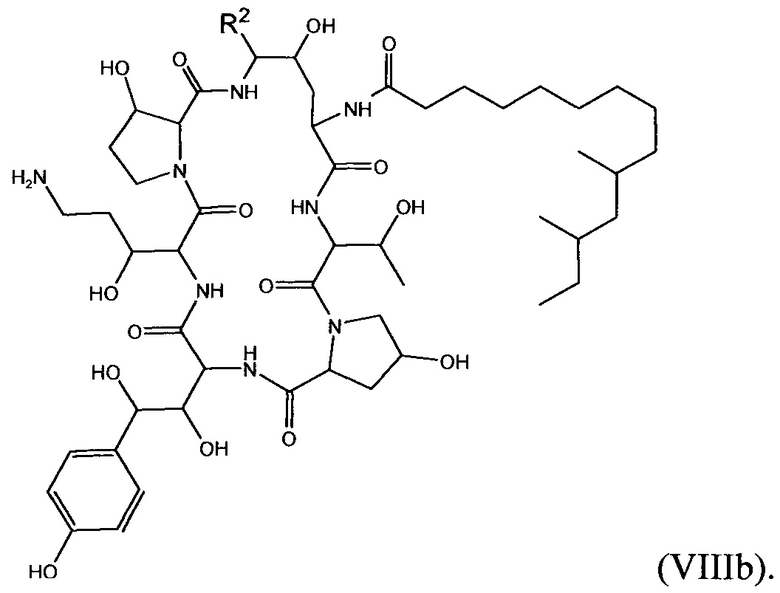
В формуле (VIIIb) R2 представляет собой NH(CH2CH2O)sCH2CH2X8, NH(CH2CH2CH2O)sCH2CH2X8, NH(CH2CH2NH)tCH2CH2X9, NH[CH2(CH2)aO]bCH{CH2[OCH2(CH2)c]dX9}2, O[CH2(CH2)aO]bCH{CH2[OCH2(CH2)c]dX9}2, NHCH2(CH2)uX10 или OCH2(CH2)uX10; X8 представляет собой OCH2(CH2)wZ2 или NHCH2(CH2)vZ2; каждый X5 независимо выбран из OCH2(CH2)wZ2 и NHCH2(CH2)vZ2; Х10 представляет собой Z2; а представляет собой целое число от 1 до 2; b представляет собой целое число от 0 до 3 (например, 0, 1, 2 или 3); с представляет собой целое число от 1 до 2; d представляет собой целое число от 0 до 3 (например, 0, 1, 2 или 3); s представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); t представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); u представляет собой целое число от 1 до 3 (например, 1, 2 или 3); w представляет собой целое число от 1 до 3 (например, 1, 2 или 3); Z2 выбран из
и каждый из R1A, R2A, R3A, R4A, R5A, R6A, R7A, R8A, R9A, R10A, R11A, R12A, R13A, R14A, R15A, R16A, R17A, R18A, R19A, R20A, R21A и R22A независимо выбран из H, СН3, СН2СН3, СН2СН2СН3 и СН(СН3)2, или его фармацевтически приемлемую соль.
В одном конкретном варианте осуществления соединений формулы (VIII), (VIIIa) и (VIIIb) соединение дополнительно описано одной из формул:
где R2 представляет собой такой, который описан в формуле (VIII).
Соединение класса эхинокандинов, вводимое и/или формулированное, как описано здесь, может представлять собой соединение формулы (IX):
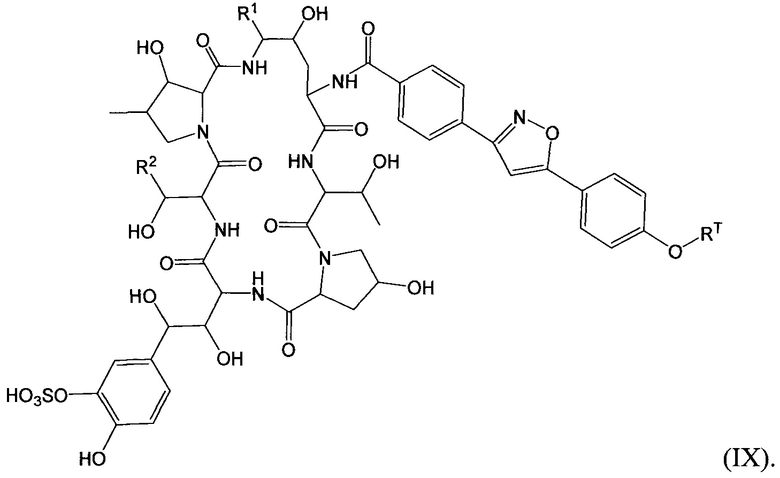
В формуле (IX) R1 представляет собой O(CH2CH2O)nCH2CH2X1, O(CH2CH2CH2O)nCH2CH2X1, NHCH2CH2X2, NH(CH2CH2O)mCH2CH2X2, NH(CH2CH2CH2O)mCH2CH2X2, NH(CH2CH2O)pCH2CH2X3, NH(CH2CH2CH2O)pCH2CH2X3, NHCH2CH2X4, NH[CH2(CH2)aO]bCH{CH2[OCH2(CH2)c]dX5}2, O[CH2(CH2)aO]bCH{CH2[OCH2(CH2)c]dX5}2, NH(CH2CH2NH)rCH2CH2X5, NHCH2(CH2)qX6 или OCH2(CH2)qX6; R2 представляет собой H, CH3, CH2CH2NH2 или CH2C(O)NH2; RT представляет собой н-пентил, втор-пентил или изопентил; X1 представляет собой NH2, NHRA1, NRA1RA2, NRA1RA2RA3 или NHCH2(CH2)vZ1; X2 представляет собой OH, ORB1 или OCH2(CH2)vZ1; Х3 представляет собой NH2, NHRC1, NRC1RC2 или NRC1RC2RC3, или NHCH2(CH2)vZ1; X4 представляет собой NRD1RD2RD3 или NHCH2(CH2)vZ1; каждый X5 независимо выбран из ОН, ORE1, NH2, NHRE1, NRE1RE2, NRE1RE2RE3, OCH2(CH2)vZ1 и NHCH2(CH2)vZ1; X6 выбран из NRF1RF2RF3 или Z1; a представляет собой целое число от 1 до 2; b представляет собой целое число от 0 до 3 (например, 0, 1, 2 или 3); с представляет собой целое число от 1 до 2; d представляет собой целое число от 0 до 3 (например, 0, 1, 2 или 3); n представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); m представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); р представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); r представляет собой целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); q представляет собой целое число от 1 до 3 (например, 1, 2 или 3); v представляет собой целое число от 1 до 3 (например, 1, 2 или 3); каждый из RA1, RA2, RA3, RB1, RC1, RC2, RC3, RD1, RD2, RD3, RE1, RE2, RE3, RF1, RF2 и RF3 независимо выбран из CH3, СН2СН3, СН2СН2СН3и СН(СН3)2; Z1 выбран из:
и каждый из R1A, R2A, R3A, R4A, R5A, R6A, R7A, R8A, R9A, R10A, R11A, R12A, R13A, R14A, R15A, R16A, R17A, R18A, R19A, R20A, R21A и R22A независимо выбран из H, СН3, СН2СН3, СН2СН2СН3 и СН(СН3)2, или его фармацевтически приемлемую соль. В конкретных вариантах осуществления соединений формулы (IX) один из X1, Х3, Х4, X5 и Х6 выбран из N(CH3)3+ и N(CH2CH3)3+.
В одном конкретном варианте осуществления соединений формулы (IX) соединение дополнительно описано формулами:
где R1, R2 и RT представляют собой такие, которые описаны в формуле (IX).
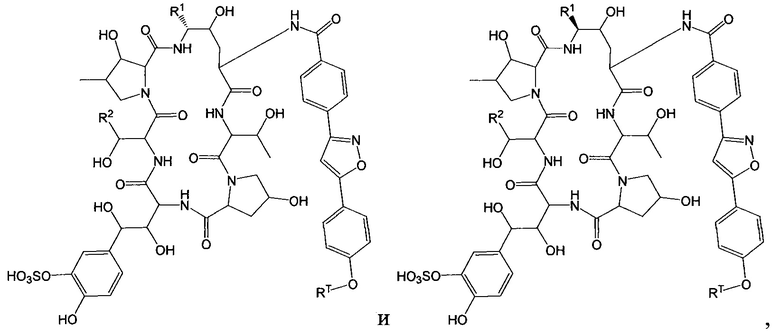
Любое из соединений 1-46 (показанных на фигурах 1-14) или их фармацевтически приемлемые соли можно использовать в способах и композициях по изобретению.
Лекарственные формы для перорального введения
Настоящее изобретение предлагает пероральные лекарственные формы, содержащие добавки, в том числе ацилкарнитины, алкилсахариды, сложные эфиры сахаридов, жирные амидокислоты, поверхностно-активные вещества - сульфонат аммония, желчные кислоты и соли желчных кислот (включая холевую кислоту и ее соли), хитозан и его производные, жирные кислоты и их соли или сложные эфиры, глицериды, гидрофильные ароматические спирты, пегилированные фосфолипиды, пептидные модуляторы плотных контактов эпителия, фосфолипиды, алкиловые эфиры полиэтиленгликоля, полигликолизированные глицериды, сложные эфиры полиглицерина и жирных кислот, поверхностно-активные вещества - полисорбат, карбоновые кислоты, полиэтиленгликоли или их смеси. Эти добавки могут увеличивать пероральную биодоступность соединений класса эхинокандинов и их фармацевтически приемлемых солей.
Ацилкарнитины
Ацилкарнитины можно использовать в пероральных лекарственных формах по изобретению в их цвиттер-ионной форме или в форме соли. Ацилкарнитины могут представлять собой производные карнитина (D или L форма, или их смесь) и жирной кислоты, включая, без ограничения, жирные кислоты, содержащие 16 атомов углерода и 0, 1 или 2 двойные связи (С16:0; С16:1 и С16:2), содержащие 20 атомов углерода и 1, 2 или 4 двойные связи (С20:1; С20:2; и С20:4), и содержащие 22 атома углерода и 4, 5 или 6 двойных связей (С22:4; С22:5 и С22:6). Иллюстративные ацилкарнитины, которые являются полезными добавками в лекарственных формах по изобретению, включают олеоилкарнитин, пальмитоилкарнитин, деканоилкарнитин, додеканоилкарнитин, миристоилкарнитин и стеароилкарнитин.
Алкилсахариды
Алкилсахариды можно использовать в пероральных лекарственных формах по изобретению. Алкилсахариды представляют собой простые эфиры сахаров, содержащие гидрофобную алкильную группу (например, обычно от 9 до 24 атомов углерода в длину). Алкилсахариды включают алкилгликозиды и алкилглюкозиды. В конкретных вариантах осуществления соединение класса эхинокандинов формулировано с C8-14 алкиловым эфиром сахара. Алкилгликозиды, которые можно использовать в пероральных лекарственных формах по изобретению, включают, без ограничения, C8-14 алкиловые (например, октил-, нонил-, децил-, ундецил-, додецил-, тридецил- или тетрадецил-) эфиры α или β -D-мальтозида, -глюкозида или -сукрозида, алкилтиомальтозиды, такие как гептил, октил, додецил-, тридецил- и тетрадецил-β-D-тиомальтозид; алкилтиоглюкозиды, такие как гептил- или октил 1-тио α- или β-D-глюкопиранозид; алкилтиосахарозы; и алкилмальтотриозиды. Например, соединение класса эхинокандинов может быть формулировано с октилмальтозидом, додецилмальтозидом, тридецилмальтозидом или тетрадецилмальтозидом. Алкилглюкозиды, которые можно использовать в пероральных лекарственных формах по изобретению включают, без ограничения, C8-14 алкиловые (например, октил-, нонил-, децил-, ундецил-, додецил-, тридецил- или тетрадецил) эфиры глюкозида, такие как додецилглюкозид или децилглюкозид.
Жирные амидокислоты
Жирные амидокислоты можно использовать в пероральных лекарственных формах по изобретению. Жирные амидокислоты представляют собой длинноцепочечные амиды аминокислот формулы (А) и их соли:
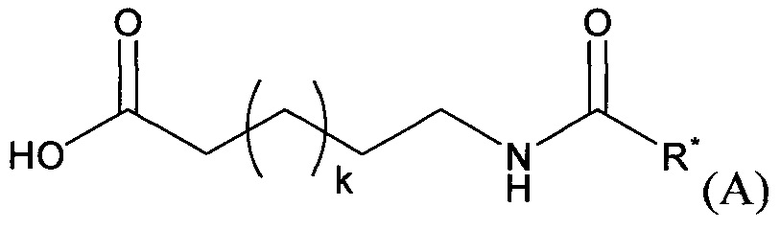
В формуле (А) k представляет собой целое число от 1 до 10, и R* представляет собой С5-8 алкил, С6-12 арил, С7-16 алкарил, С3-10 алкгетероциклил и С2-10 гетероциклил. Жирные амидокислоты включают жирные амидокислоты, описанные в патенте США №5650386 и 8110547, каждый из которых включен здесь путем отсылки. В конкретных вариантах осуществления k представляет собой целое число от 1 до 7, и R* представляет собой С6-12 арил или С7-16 алкарил. Иллюстративные жирные амидокислоты, которые являются полезными добавками в лекарственных формах по изобретению, включают (i) N-[8-(2-гидроксибензоил)амино]каприловую кислоту (также известную как "NAC") и ее соли, включая ее натриевую соль (также известную как "SNAC"); (ii) 8-(N-2-гидрокси-4-метоксибензоил)-аминокаприловую кислоту (также известную как "4-МОАС") и ее соли, включая ее натриевую соль; (iii) N-(8-[2-гидроксибензоил]-амино)деканоевую кислоту (также известную как "NAD") и ее соли, включая ее натриевую соль (также известную как "SNAD"); (iv) N-(8-[2-гидрокси-5-хлорбензоил]-амино)октановую кислоту (также известную как "5-CNAC") и ее соли, включая ее натриевую соль; и (iv) 4-[(2-гидрокси-4-хлорбензоил)амино]бутаноат (также известный как "4-CNAB"), и его соли, включая его натриевую соль.
Сульфонат аммониевые поверхностно-активные вещества
Сульфонат аммониевые поверхностно-активные вещества можно использовать в пероральных лекарственных формах по изобретению. Сульфонат аммониевые поверхностно-активные вещества - представляют собой цвиттер-ионные добавки формулы (В):
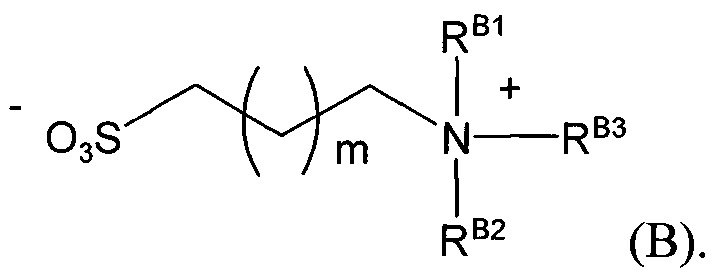
В формуле (В) m представляет собой целое число от 0 до 3, каждый из RB1 и RB2 независимо выбран из метила, этила и пропила; и RB3 представляет собой насыщенный или ненасыщенный алкил, содержащий от 6 до 18 атомов углерода в длину. Иллюстративные сульфонат аммониемвые поверхностно-активные вещества, которые могут быть полезными добавками в лекарственных формах по изобретению, включают N-алкил-N,N-диметиламмонио-1-пропансульфонаты, такие как диметилпальмитил-аминопропансульфонат (DPPS).
Желчные кислоты и соли желчных кислот
Желчные кислоты и соли желчных кислот можно использовать в пероральных лекарственных формах по изобретению. Например, лекарственные формы могут включать, без ограничения, желчные кислоты и соли желчных кислот, такие как холат натрия, гликохолат натрия, гликодеоксихолат натрия, тауродеоксихолат, деоксихолат натрия, тауродигидрофузидат натрия, таурохолат и урсодеоксихолат, литохолат натрия, хенохолат, хенодеоксихолат, уксохолат, урсодеоксихолат, гиодеоксихолат, дегидрохолат, гликохенохолат, таурохенохолат, таурохенодеоксихолат и их соответствующие кислоты.
Хитозан и его производные
Хитозан и его производные можно использовать в пероральных лекарственных формах по изобретению. Хитозан получен путем деацетилирования хитина. Для использования в лекарственных формах по изобретению степень деацетилирования, которая представляет долю N-ацетильных групп, которые были удалены посредством деацетилирования, должна находиться в диапазоне от примерно 40 до примерно 100% (например, от 60 до примерно 96% или от 70 до 95%). Желательно, чтобы молекулярная масса хитозана или производного хитозана составляла от примерно 3000 до примерно 1000000 Da (например, от примерно 10000 до примерно 800000 Da, от примерно 15000 до примерно 600000 Da, или от примерно 30000 или 50000 до примерно 600000 Da). Производные хитозана включают фармацевтически приемлемые органические и неорганические соли (например, соли азотной кислоты, фосфорной кислоты, уксусной кислоты, соляной кислоты, молочной кислоты, лимонной кислоты и глутаминовой кислоты, среди прочего). Производные хитозана могут быть получены путем присоединения фрагментов к гидроксильным или аминогруппам хитозана и могут изменять свойства полимера, такие как параметры растворимости и плотность заряда. Примеры включают О-алкиловые простые эфиры хитозана и сложные О-ациловые эфиры хитозана. Другие примеры производных хитозана включают карбоксиметилхитозан (смотри Thanou et al, J. Pharm. Sci., 90:38 (2001)) и производные N-карбоксиметилхитозана, триметилхитозан (смотри Thanou et al, Pharm. Res., 17:27 (2000)), тиолированные хитозаны (смотри Bernkop-Schnurch et al, Int. J. Pharm., 260:229 (2003)), производные пиперазина (смотри PCT публикацию № WO 2007/034032 и Holappa et al, Macromol. Biosci., 6:139 (2006)), конъюгированный с PEG хитозан (смотри публикацию PCT № WO 99/01498), и производные, раскрытые в Roberts, Chitin Chemistry, MacMillan Press Ltd., London (1992). Иллюстративный хитозан и производные хитозана, которые являются полезными добавками в лекарственных формах по изобретению, включают хитозан, триметилхитозан и хитозан-4-тио-бутиламидин (смотри Sreenivas et al., International Journal of PharmTech Research 1:670 (2009)).
Сложные эфиры сахаридов
Сложные эфиры сахаридов можно использовать в пероральных лекарственных формах по изобретению. Сложные эфиры сахаридов представляют собой сложные эфиры сахаров, содержащие гидрофобную алкильную группу (например, обычно от 8 до 24 атомов углерода в длину). Сложные эфиры сахаридов включают сложные эфиры гликозидов и сложные эфиры глюкозидов. В конкретных вариантах осуществления соединение класса эхинокандинов формулировано с C8-14 алкиловым сложным эфиром сахара. Гликозиды сложных эфиров, которые можно использовать в пероральных лекарственных формах по изобретению, включают, без ограничения, C8-14 алкиловые (например, октил-, нонил-, децил-, ундецил-, додецил-, тридецил- или тетрадецил-) сложные эфиры α или β-D-мальтозида, -гликозида или -сукрозида. Например, соединение класса эхинокандинов может быть формулировано с сахарозы монододеканоатом, сахарозы монотридеканоатом или сахарозы монотетрадеканоатом. Глюкозиды сложных эфиров, которые можно использовать в пероральных лекарственных формах по изобретению, включают, без ограничения, C8-14 алкиловые (например, октил-, нонил-, децил-, ундецил-, додецил-, тридецил- или тетрадецил-) сложные эфиры глюкозида, такие как глюкозы додеканоат или глюкозы деканоат.
Жирные кислоты
Жирные кислоты можно использовать в пероральных лекарственных формах по изобретению. Жирные кислоты, которые можно использовать в пероральных лекарственных формах по изобретению в форме их кислот, в форме солей, в форме сложного моноэфира или в форме глицерида, включают каприловую кислоту (октановую кислоту), пеларгоновую кислоту (нонановую кислоту), каприновую кислоту (декановую кислоту) и лауриновую кислоту (додекановую кислоту), и их первичные гидроксильные группы образуют 8-гидроксиоктановую кислоту, 9-гидроксинонановую кислоту, 10-гидроксидекановую кислоту и 12-гидроксидодекановую кислоту.
Жирные кислоты обычно получают из природных жиров, масел и восков путем гидролиза сложных эфиров и удаления глицерина. Жирные кислоты могут быть титрованы раствором гидроксида натрия с использованием фенолфталеина в качестве индикатора до появления бледно-розового окрашивания. Этот анализ используют для определения содержания свободных жирных кислот в жирах; то есть долю триглицеридов, которые были гидролизованы.
Короткоцепочечные жирные кислоты, такие как уксусная кислота (pKa = 4.76 в воде) являются смешиваемыми с водой и диссоциируют с образованием кислот. Так как длина их цепи увеличивается, pKa жирных кислот значительно не возрастает. Однако, так как длина цепи увеличивается, растворимость жирных кислот в воде понижается очень быстро. Тем не менее, большинство жирных кислот, которые нерастворимы в воде, будут растворяться в теплом этаноле.
Для получения соответствующего сложного эфира жирных кислот можно использовать любой спирт. Спирты могут представлять собой полиспирты, такие как этиленгликоль или глицерин. Спирт может нести постоянный положительный заряд, что делает сложный эфир мукоадгезивным (то есть адгезивным к слизистой оболочке). Способы этерификации хорошо известны в данной области (например, этерификация Фишера путем обработки кислотой). Сложные эфиры жирных кислот включают сложные этиловые эфиры жирных кислот и сложные метиловые эфиры жирных кислот.
Глицериды
Глицериды можно использовать в пероральных лекарственных формах по изобретению. Глицериды представляют собой сложные моно-, ди- и триэфиры глицерина с жирными кислотами. Различные глицериды можно использовать в качестве жирной кислоты с замедленным высвобождением для формулирования соединения класса эхинокандинов. Глицериды включают насыщенные и ненасыщенные моноглицериды, диглицериды (1,2- и 1,3-диглицериды), и триглицериды со смешанной и несмешанной композицией жирной кислоты. Каждый глицерид обозначен здесь как (Cn:m), где n представляет собой длину боковой цепи жирной кислоты, и m представляет собой количество двойных связей (цис- или транс-) в боковой цепи жирной кислоты. Примеры коммерчески доступных моноглицеридов включают: монокаприлин (С8; то есть глицерилмонокаприлат) (Larodan), монокаприн (С10; то есть глицерилмонокапрат) (Larodan), монолаурин (С12; то есть глицерилмонолаурат) (Larodan), монопальмитолеин (C16:l) (Larodan), глицерилмономиристат (С14) (Nikkol MGM, Nikko), глицерилмоноолеат (С18:1) (PECEOL, Gattefosse), глицерилмоноолеат (Myverol, Eastman), глицеринмоноолеат/линолеат (OLICINE, Gattefosse), глицеринмонолинолеат (Maisine, Gattefosse), и моноэлаидин (С18:1) (Larodan). Примеры коммерчески доступных моно/ди и триглицеридов включают Capmul МСМ С8ЕР, (С8:С10 моно/диглицериды) и Capmul МСМ С10 (моно/диглицериды). Примеры коммерчески доступных диглицеридов включают: глицериллаурат (Imwitor® 312, Huls), глицерилкаприлат/капрат (Capmul® МСМ, ABITEC), диглицериды каприловой кислоты (Imwitor® 988, Huls), каприловые/каприновые глицериды (Imwitor® 742, Huls), дикаприлин (С8) (Larodan), дикаприн (С10) (Larodan), дилаурин (С12) (Larodan), глицерилдилаурат (С12) (Capmul® GDL, ABITEC). Примеры коммерчески доступных триглицеридов включают: трикаприлин (С8; то есть глицерилтрикаприлат) (Larodan), Каптекс 100 (С10), трикаприн (С10; то есть глицерилтрикапрат) (Larodan), трилаурин (С12; то есть глицерилтрилаурат) (Larodan), димиристин (С14) (Larodan), дипальмитин (С16) (Larodan), дистеарин (Larodan), глицерилдилаурат (С12) (Capmul® GDL, ABITEC), глицерилдиолеат (Capmul® GDO, ABITEC), сложные эфиры глицерина и жирных кислот (GELUCIRE 39/01, Gattefosse), дипальмитолеин (C16:l) (Larodan), 1,2 и 1,3-диолеин (С18:1) (Larodan), диэлаидин (С18.1) (Larodan), и дилинолеин (С18:2) (Larodan).
Гидрофильные ароматические спирты
Гидрофильные ароматические спирты можно использовать в пероральных лекарственных формах по изобретению. Гидрофильные ароматические спирты включают, без ограничения, феноксиэтанол, бензиловый спирт, фенилэтанол и добавки, описанные в патенте США №7303762, включенном здесь путем отсылки.
Пегилированные фосфолипиды
Пегилированные фосфолипиды можно использовать в пероральных лекарственных формах по изобретению. Пегилированные фосфолипиды представляют собой добавки, которые содержат группу полиэтиленоксида (то есть группу полиэтиленгликоля), ковалентно присоединенную к фосфолипиду, как правило, посредством карбаматной или сложноэфирной связи. Фосфолипиды получены из глицерина и содержат группу фосфатного сложного эфира и две группы сложного эфира жирных кислот. Пригодные жирные кислоты включают в себя насыщенные и ненасыщенные жирные кислоты, содержащие от восьми (8) до двадцати двух (22) атомов углерода (то есть любую жирную кислоту, описанную здесь). Репрезентативные содержащие полиэтиленоксид фосфолипиды включают в себя сложные эфиры насыщенных жирных кислот С8-С22 и соли фосфатидилэтаноламин полиэтиленгликоля. Репрезентативные средние молекулярные массы для групп полиэтиленоксида могут составлять от примерно 200 до примерно 5000 (например, от PEG 200 до PEG 5000). Пегилированные фосфолипиды включают, без ограничения, соли дистеароилфосфатидилэтаноламин полиэтиленгликоля, такие как соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 350 (DSPE-PEG-350), соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 550 (DSPE-PEG-550), соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 750 (DSPE-PEG-750), соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 1000 (DSPE-PEG-1000), соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 1500 (DSPE-PEG-1500) и соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 2000 (DSPE-PEG-2000). Можно использовать также смеси. Для солей дистеароилфосфатидилэтаноламин полиэтиленгликоля число (например, 250, 550, 750, 1000 и 2000) обозначает среднюю молекулярную массу группы полиэтиленоксида. Пригодные соли дистеароилфосфатидилэтаноламин полиэтиленгликоля включают в себя соли аммония и натрия.
Пептидные модуляторы плотных контактов эпителия
Пептидные модуляторы плотных контактов эпителия можно использовать в пероральных лекарственных формах по изобретению. Пероральные лекарственные формы по изобретению могут включать пептидные модуляторы плотных контактов эпителия. Плотные контакты или zonula occludens (в дальнейшем в данном описании «ZO») являются одним из критериев всасывающего и секреторного эпителия (Madara, J. Clin. Invest., 83:1089-1094 (1989); и Madara, Textbook of Secretory Diarrhea Eds, Lebenthal et al, Chapter 11, pages 125-138 (1990)). В качестве барьера между апикальным и базолатеральным отделами они селективно регулируют пассивную диффузию ионов и растворимых в воде веществ при параклеточном транспорте (Gumbiner, Am. J. Physiol., 253 (Cell Physiol. 22):C749-C758 (1987)). Этот барьер сохраняет любой градиент, вызванный активностью направлений, связанных с параклеточным транспортом (Diamond, Physiologist, 20:10-18 (1977)). Отклонения в трансэпителиальной проводимости, как правило, объясняются изменениями проницаемости параклеточного транспорта, поскольку устойчивости плазматических мембран энтероцитов являются относительно высокими. ZO представляет главный барьер в этом параклеточном транспорте, и электрическое сопротивление эпителиальных тканей зависит от числа цепей трансмембранного белка и их сложности в ZO, наблюдаемой с помощью электронной микроскопии скалывания (freeze-fracture electron microscopy) (Madara et al, J. Cell Biol., 101:2124-2133 (1985)). Было идентифицировано шесть белков в цитоплазматической субмембранной бляшке, определяющей контакты мембран. ZO-1 и ZO-2 существуют в виде гетеродимера (Gumbiner et al, Proc. Natl. Acad. Sci., USA, 88:3460-3464 (1991)) в устойчивом к детергенту комплексе с ZO-3. Два других белка, цингулин (Citi et al, Nature (London), 333:272-275 (1988)) и антиген 7H6 (Zhong et al, J. Cell Biol., 120:477-483 (1993)) локализованы дальше от мембраны. Rab 13, GTP-связывающий белок малого размера также был недавно локализован в области контактов (Zahraoui et al, J. Cell Biol., 124:101-115 (1994)). Определенные пептидные модуляторы, действующие в ZO-1, ZO-2, ZO-3, цингулине и/или 7Н6, проявили способность к обратимому открытию плотных контактов в слизистой оболочке кишечника и, следовательно, при совместном введении с терапевтическим агентом способны осуществлять интестиальную доставку терапевтического агента в случае использования в составе пероральной лекарственной формы для интестиальной доставки лекарственного средства (смотри РСТ Публикацию No. WO 96/37196; патенты США №5665389, 5945510, 6458925 и 6733762; и Fasano et al., J. Clin. Invest., 99:1158 (1997); каждый из которых включен здесь путем отсылки). Иллюстративные пептидные модуляторы плотных контактов представляют собой пептид, известный как pn159 (смотри публикацию патента США № US 2006/0062758 A1, включенную здесь путем отсылки).
Фосфолипиды
Фосфолипиды можно использовать в пероральных лекарственных формах по изобретению. Фосфолипиды представляют собой добавки, которые включают сложный диэфир фосфорилированного глицерина и жирной кислоты. Пригодные жирные кислоты включают в себя насыщенные и ненасыщенные жирные кислоты, содержащие от восьми (8) до двадцати двух (22) атомов углерода (то есть любую жирную кислоту, описанную здесь). Репрезентативные фосфолипиды включают сложные эфиры насыщенных жирных кислот С8-С22 и фосфатидилхолина, и 1-пальмитоил-2-глутароил-sn-глицеро-3-фосфохолина (PGPC).
Алкиловые эфиры полиэтиленгликоля
Эфиры полиэтилегликоля и алкиловые спирты можно использовать в пероральных лекарственных формах по изобретению. Предпочтительные алкиловые эфиры полиэтиленгликоля включают в себя Лаурет-9 (Laureth 9), Лаурет-12 (Laureth 12) и Лаурет-20 (Laureth 20). Другие алкиловые эфиры полиэтиленгликоля включают в себя, без ограничения, PEG-2 олеиловый эфир, олет-2 (Brij 92/93, Atlas/ICI); PEG-3 олеиловый эфир, олет-3 (Volpo 3, Croda); PEG-5 олеиловый эфир, олет -5 (Volpo 5, Croda); PEG-10 олеиловый эфир, олет-10 (Volpo 10, Croda, Brij 96/97 12, Atlas/ICI); PEG-20 олеиловый эфир, олет-20 (Volpo 20, Croda, Brij 98/99 15, Atlas/ICI); PEG-4 лауриловый эфир, лаурет-4 (Brij 30, Atlas/ICI); PEG-9 лауриловый эфир; PEG-23 лауриловый эфир, лаурет-23 (Brij 35, Atlas/ICI); PEG-2 цетиловый эфир (Brij 52, ICI); PEG-10 цетиловый эфир (Brij 56, ICI); PEG-20 цетиловый эфир (Brij 58, ICI); PEG-2 стеариловый эфир (Brij 72, ICI); PEG-10 стеариловый эфир (Brij 76, ICI); PEG-20 стеариловый эфир (Brij 78, ICI); и PEG-100 стеариловый эфир (Brij 700, ICI).
Полигликолизированные глицериды
Полигликолизированные глицериды можно использовать в пероральных лекарственных формах по изобретению. Полигликолизированные глицериды представляют собой сложные моно-, ди- и триэфиры глицерина и жирных кислот, содержащие, по меньшей мере, один полигликолевый (например, полиэтиленгликоль или полипропиленгликоль) фрагмент.Полигликолизированные глицериды часто представлены в виде смесей, которые являются продуктом трансэтерификации природных масел соответствующим поликгликолем.
Полигликолизированные глицериды, полезные в лекарственных формах по изобретению, могут включать в себя смеси сложных моноэфиров, диэфиров и/или триэфиров полиэтиленгликоля или полипропиленгликоля и глицеридов уксусной, пропионовой, масляной, валериановой, гексановой, гептановой, каприловой, нонановой, каприновой, лауриновой, миристиновой, пальмитиновой, гептадекановой, стеариновой, арахидоновой, бегеновой, лигноцериновой, α-линоленовой, стеаридоновой, эйкозапентаеновой, докозагексаеновой, линолевой, γ-линоленовой, дигомо-γ-линоленовой, арахидоновой, олеиновой, элаидиновой, эйкозеновой, эруковой или нервоновой кислоты, жирных кислот С12, жирных кислот С14, жирных кислот С16 и жирных кислот С18, и их смеси.
Сложные эфиры полиглицерина и жирных кислот
Сложные эфиры полиглицерина и жирных кислот можно использовать в пероральных лекарственных формах по изобретению. Сложные эфиры полиглицерина и жирных кислот представляют собой сложные эфиры полиглицерина и жирных кислот (например, диглицерина, триглицерина, тетраглицерина, гексаглицерина). Сложные эфиры полиглицерина и жирных кислот, полезные в лекарственных формах по изобретению, могут включать, без ограничения, полиглицерин, несущий сложные эфиры жирных кислот с числом атомов углерода от 1 до 12, включая валериановую, гексановую, гептановую, каприловую, нонановую, каприновую, лауриновую, миристиновую, пальмитиновую, гептадекановую, стеариновую, арахидиновую, бегеновую, лигноцериновую, α-линоленовую, стеаридоновую, эйкозапентаеновую, докозагексаеновую, линолевую, γ-линоленовую, дигомо-γ-линоленовую, арахидоновую, олеиновую, элаидиновую, эйкозеновую, эруковую или нервоновую кислоту, жирные кислоты С12, жирные кислоты С14, жирные кислоты С16 и жирные кислоты С18, и их смеси. Иллюстративные сложные эфиры полиглицерина и жирных кислот включают полиглицерил-олеат (Plurol Oleique), полиглицерил-2 диолеат (Nikkol DGDO), полиглицерил-10 триолеат, полиглицерил-10 лаурат (Nikkol Decaglyn 1-L), полиглицерил-10 олеат (Nikkol Decaglyn 1-0), полиглицерил полирицинолеаты (Polymuls), полиглицерил-2 стеарат (Nikkol DGMS), полиглицерил-2 олеат (Nikkol DGMO), полиглицерил-2 изостеарат Nikkol DGMIS (Nikko), полиглицерил-3 олеат (Caprol, ABITEC), полиглицерил-4 олеат (Nikkol Tetraglyn 1-O), полиглицерил-4 стеарат (Nikkol Tetraglyn 1-S), полиглицерил-6 олеат, полиглицерил-10 лаурат (Nikkol Decaglyn 1-L), полиглицерил-10 олеат (Nikkol Decaglyn 1-O), полиглицерил-10 стеарат (Nikkol Decaglyn 1-S), полиглицерил-6 рицинолеат (Nikkol Hexaglyn PR-15), полиглицерил-10 линолеат (Nikkol Decaglyn 1-LN), и полиглицерил-6 диолеат (PLUROL OLEIQUE).
Полисорбатные поверхностно-активные вещества
Полисорбатные поверхностно-активные вещества можно использовать в пероральных лекарственных формах по изобретению. Поверхностно-активные вещества, полисорбаты, представляют собой маслянистые жидкости, полученные этерификацией пегилированного сорбита жирными кислотами. Общие торговые названия полисорбатов включают Alkest, Canarcel и Tween. Полисорбатные поверхностно-активные вещества включают, без ограничения, полиоксиэтилен 20 сорбитан монолаурат (TWEEN 20), полиоксиэтилен (4) сорбитан монолаурат (TWEEN 21), полиоксиэтилен 20 сорбитан монопальмитат (TWEEN 40), полиоксиэтилен 20 сорбитан моностеарат (TWEEN 60) и полиоксиэтилен 20 сорбитан моноолеат (TWEEN 80).
Карбоновые кислоты
Карбоновые кислоты можно использовать в пероральных лекарственных формах по изобретению. Предпочтительные карбоновые кислоты включают лимонную кислоту, янтарную кислоту, винную кислоту, фумаровую кислоту, малеиновую кислоту, малоновую кислоту, глутаровую кислоту, адипиновую кислоту, молочную кислоту, яблочную кислоту, L-глутаминовую кислоту, L-аспарагиновую кислоту, глюконовую кислоту, глюкуроновую кислоту, салициловую кислоту и их смеси.
Полиэтиленгликоли
Полиэтиленгликоли можно использовать в пероральных лекарственных формах по изобретению. Предпочтительные полиэтиленгликоли включают от PEG2 до PEG 5000 (например, PEG 200, PEG 400, PEG 800, PEG 1,200 и их смеси).
Лекарственные формы с маскировкой вкуса
Лекарственные формы с маскировкой вкуса могут быть приготовлены путем адсорбции добавки и лекарственного средства на матрицу (например, органическую матрицу или неорганическую матрицу) с образованием твердого комплекса, содержащего жидкую добавку и лекарственное средство. Иллюстративные органические матрицы, которые можно использовать в лекарственных формах с маскировкой вкуса по изобретению, включают, без ограничения, ацетат целлюлозы, аморфную целлюлозу, крахмал, полиуретаны, поливиниловый спирт, полиакрилаты, маннит, Авицел РН101 и Авицел РН102. Иллюстративные неорганические матрицы, которые можно использовать в лекарственных формах с маскировкой вкуса по изобретению, включают, без ограничения, диоксид кремния (например, Aerosil, Aeroperl, аморфный кремнезем, коллоидный кремнезем), силикаты (например, Neusilin, гекторит), карбонаты (например, карбонат магния) и оксиды металлов (например, оксид магния).
Например, лекарственные формы с маскировкой вкуса могут быть приготовлены путем адсорбции добавки и лекарственного средства на пористый силикат (смотри РСТ Публикацию № WO 00/38655). Пористый силикат может представлять собой набухаемую глину типа смектит (например, бентонит, вигум, лапонит), гидратированные силикаты алюминия или силикаты щелочноземельных металлов (например, Neusilin, гекторит, среди прочего), или пористый силикагель (например, Syloid, Porasil, Lichrosorp). В типичных лекарственных формах с маскировкой вкуса добавка и лекарственное средство адсорбированы на силикате, выбранном из силиката натрия, силиката калия, силиката магния, силиката кальция (включая синтетический силикат кальция, такой как, например, Hubersorp), силиката цинка, силиката алюминия, алюмосиликата натрия, такого как, например, Zeolex, алюмосиликата магния, алюмометасиликата магния, метасиликата алюминия, Neusilin UFL2 (тип 1-А), Neusilin (SG2), Neusilin (F1) и Neusilin (US2), и их смесей.
Лекарственная форма с маскировкой вкуса может быть разработана в виде порошка, который восстанавливается в воде. Введение добавки и лекарственного средства в матрицу сводит к минимуму контакт с вкусовыми рецепторами субъекта и позволяет контролировать вкус лекарственной формы с помощью одной или нескольких дополнительных вкусовых добавок (например, лимон, ментол и т.д.) и подсластителей (например, сахара, сахарные спирты, аспартам и т.д.).
Способы изготовления лекарственных форм для перорального введения можно найти, например, в "Remington: The Science and Practice of Pharmacy" (20th ed., ed. A.R. Gennaro, 2000, Lippincott Williams & Wilkins). Лекарственные формы для перорального введения (например, таблетки, пилюли, каплеты, твердые капсулы, мягкие капсулы, саше и жидкие лекарственные формы) могут, например, содержать любую одну или комбинацию добавок, описанных выше, вместе с другими добавками и/или вспомогательными веществами, при необходимости. Капсулы, наполненные жидкостью, могут включать любую из описанных здесь добавок. Капсула будет содержать, например, от 10 до примерно 1000 мг соединения класса эхинокандинов. Капсулы, наполненные жидкостью, могут содержать, например, растворы или суспензии соединения класса эхинокандинов, в зависимости от концентрации соединения класса эхинокандинов в капсуле и добавок, используемых в лекарственной форме.
Конкретная лекарственная форма по изобретению может включать множество добавок (например, комбинацию двух или трех) для достижения не только усиления пероральной биодоступности, но также уменьшения массового процентного содержания добавок в лекарственной форме, обеспечивая более высокие нагрузки лекарственного средства. Таким образом, комбинацию (i) жирной кислоты, или ее соли или сложного эфира с алкилсахаридом или сложным эфиром сахарида; (ii) глицерида с ацилкарнитином; (iii) жирной кислоты, или ее соли или сложного эфира с ацилкарнитином; или (iv) глицерида с пегилированным фосфолипидом можно использовать в пероральной лекарственной форме по изобретению. Эти комбинации усилителей могут действовать синергически на увеличение пероральной абсорбции лекарственного средства в течение более длинного периода времени, увеличение общей биодоступности стандартной лекарственной формы и/или уменьшение общего массового процентного содержания добавки, необходимой в лекарственной форме.
Соединения класса эхинокандинов по изобретению могут быть формулированы в виде прозрачной водной дисперсии, как описано в патенте США №6309663 и публикациях патентов США №2005/0096296, 2005/0171193, 2003/104048, 2006/003493 и 2003/0215496, каждая из которых включена здесь путем отсылки. Например, лекарственная форма по изобретению может включать (i) по меньшей мере одно гидрофильное поверхностно-активное вещество, выбранное из ионизированных ионизируемых поверхностно-активных веществ, неионных гидрофильных поверхностно-активных веществ, имеющих значение HLB (показатель гидрофильно-липофильного баланса) больше или равное примерно 10, и их комбинацию, и (ii) по меньшей мере одно гидрофобное поверхностно-активное вещество, выбранное из гидрофобных (а) спиртов, алкиловых эфиров полиоксиэтилена, желчных кислот, сложных моноэфиров глицерина и жирных кислот, сложных диэфиров глицерина и жирных кислот, сложных моноэфиров ацетилированного глицерина и жирных кислот, сложных диэфиров ацетилированного глицерина и жирных кислот, сложных моноэфиров низшего спирта и жирных кислот, сложных диэфиров низшего спирта и жирных кислот, сложных эфиров полиэтиленгликоля и жирных кислот, сложных эфиров полиэтиленгликоля и глицеридов жирных кислот, сложных эфиров полипропиленгликоля и жирных кислот, глицеридов полиоксиэтилена, производных молочной кислоты и моно- и диглицеридов, диглицеридов пропиленгликоля, сложных эфиров сорбитана и жирных кислот, полиоксиэтиленовых эфиров сорбитана и жирных кислот, блоксополимеров полиоксиэтилена-полиоксипропилена, трансэтерифицированных растительных масел, сложных эфиров сахаров, простых эфиров сахаров, сахароглицеридов, полиоксиэтиленовых растительных масел, полиоксиэтиленовых гидрогенизированных растительных масел, продуктов реакции полиолов и по меньшей мере одного члена группы, состоящей из жирных кислот, глицеридов, растительных масел и гидрогенизированных растительных масел, и гидрофорбных (b) неионизированных жирных кислот, сложных эфиров карнитина и жирных кислот, алкилсульфатов, ациллактилатов, моноацетилированных сложных эфиров винной кислоты и моно- и диглицеридов, диацетилированных сложных эфиров винной кислоты и моно- и диглицеридов, сукцинилированных моноглицеридов, глицерилстеарата, сложных эфиров лимонной кислоты и моно- и диглицеридов, и их смесей. Гидрофильные и гидрофобные поверхностно-активные вещества присутствуют в количествах, при которых при смешивании с водным разбавителем при 100-кратном разбавлении композиция образует прозрачную водную дисперсию с поглощением менее чем примерно 0.3 при 400 нм. Прозрачная водная дисперсия может включать желчные кислоты и/или соли желчных кислот. Композиция может быть включена в твердый носитель, например суспензия в носителе в капсуле. Гидрофильные поверхностно-активные вещества, которые можно использовать в лекарственной форме этого типа, включают PEG20 монолаурат сорбитан, PEG20 моноолеат сорбитан и/или полиоксиэтилированные глицериды (например, PEG8 каприловые/каприновые глицериды).
Соединения класса эхинокандинов по изобретению могут быть формулированы с жирной арил-амидокислотой С8-С10 или ее солью, как описано в патенте США №8110547, включенном здесь путем отсылки. Например, лекарственная форма по изобретению может включать (i) N-[8-(2-гидроксибензоил)амино]каприловую кислоту (также известную как "NAC") и ее соли (SNAC), включая ее натриевую соль; (ii) 8-(N-2-гидрокси-4-метоксибензоил)-аминокаприловую кислоту (также известную как "4-МОАС") и ее соли, включая ее натриевую соль; (iii) N-(8-[2-гидроксибензоил]-амино)декановую кислоту (также известную как "NAD") и ее соли (SNAD), включая ее натриевую соль; (iv) N-(8-[2-гидрокси-5-хлорбензоил]-амино)октановую кислоту (также известную как "5-CNAC") и ее соли, включая ее натриевую соль; (iv) 4-[(2-гидрокси-4-хлорбензоил)амино]бутаноат (также известный как "4-CNAB") и его соли, включая его натриевую соль, или их смеси.
Соединения класса эхинокандинов по изобретению могут быть формулированы с использованием системы усиления проницамости (transient permeability enhancer (ТРЕ) system), описанной в патенте США №8241670 и патентных публикациях №2012/0009229, 2010/0105627, 2011/0257095 и 2011/0311621, каждая из которых включена здесь путем отсылки. Например, лекарственная форма по изобретению может быть приготовлена путем (i) объединения соединения класса эхинокандинов с солью жирной кислоты (например, октаноатом натрия, деканоатом натрия, додеканоатом натрия или их комбинацией) в воде с образованием водного раствора; (ii) лиофилизации водного раствора с получением лиофилизата; и (iii) суспендирования лиофилизата в гидрофобной среде (например, алифатических молекулах, циклических молекулах, ди- и триглицеридах длинноцепочечных жирных кислот, ди- и триглицеридах среднецепочечных жирных кислот, минеральном масле, парафине, дистеарате жирных кислот (например, 2-олеоил-дистеарате), дистеарате моноэтиленгликоля, сложных эфирах холестерина и жирных кислот, ароматических молекулах (например, бензилбензолате), или их комбинациях) для получения суспензии. Суспензия может необязательно включать лецитин, соль желчной кислоты, соли среднецепочечных жирных кислот, триглицериды, диглицериды, касторовое масло и/или неионный детергент (например, кремофор, пегилированные эфиры, твердый HS15, полоксамер, сложные эфиры сорбитана и жирных кислот, глицерил три/монокаприлаты, касторовое масло, триглицериды). Терапевтическая композиция может дополнительно включать линейные спирты, разветвленные спирты, циклические спирты и их комбинацию. Например, соединение класса эхинокандинов в виде октаноата натрия в качестве лиофилизата, суспендированного в среде, включающей монокаприлат глицерина, трикаприлат глицерила, касторовое масло и/или твин 80. Композиция может быть формулирована в виде сухой смеси, необязательно в капсуле или в форме таблетки.
Соединения класса эхинокандинов по изобретению могут быть формулированы с ароматическим спиртом, как описано в патенте США №7303762 и патентных публикациях США №2006/0223746, 2006/0122097, 20004/0028736, 2002/0015592 и 2012/0017602, каждая из которых включена здесь путем отсылки. Ароматические спирты, полезные в качестве усилителей абсорбции в лекарственных формах по изобретению, могут включать гидрофильные молекулы, содержащие, по меньшей мере, одно ароматическое кольцо и, по меньшей мере, одну гидроксильную группу. Иллюстративные ароматические спирты, которые можно использовать в лекарственных формах по изобретению, включают феноксиэтанол, бензиловый спирт, фенилэтанол и их производные, в которых один или несколько протонов кольца замещено одним или несколькими атомами галогена, C1-4 алкильной, С1-4 алкокси, С1-4 алкилтио или С2-4 алкенильной группой. Ароматические спирты, полезные в лекарственных формах по изобретению, включают, без ограничения, бутилгидрокситолуол, бутилгидроксианизол, пропилгаллат и их аналоги. Лекарственная форма может необязательно включать амфифильные, такие как содержащие полиоксиэтилен поверхностно-активные вещества с высоким значением HLB, такие как полиоксиэтилен 40 моностеарат, PEG200, PEG 300, PEG 400, частичные глицериды (то есть комбинация глицерина, моноглицеридов и диглицеридов), полиоксиэтилен-20-цетиловый эфир, полисорбат 80; блоксополимеры, такие как Lutrol F68; соли желчных кислот, такие как хелат, глихолат, деоксихолат, гликодеоксихолат, хенодеоксихолат, тауродеоксихолат, урсодеоксихолат и фузидат, или амфифильные полимеры, такие как поливинилпирролидон. Лекарственная форма может дополнительно включать один или более солюбилизаторов, способных увеличивать растворимость ароматического усилителя абсорбции, таких как бигуанид, моноглицериды или линейный спирт (например, этанол). Лекарственная форма может включать 5-85%, 10-85%, 25-85%, 15-70% или 20-60% (масса/масса) ароматического спирта. Лекарственная форма может быть включена в стандартную лекарственную форму, которая имеет энтеросолюбильное покрытие и/или формулирована в виде микродисперсии в капсуле.
Соединение класса эхинокандинов по изобретению может быть формулировано с омега-3 жирной кислотой, как описано в публикации патента США №2007/0087957, включенной здесь путем отсылки. Омега-3 жирные кислоты, полезные в качестве усилителей абсорбции в составах по изобретению, могут быть выбраны из (i) DHA (омега-3, полиненасыщенной жирной кислоты с 22 атомами углерода, называемой также 4,7,10,13,16,19-докозагексаеноевой кислотой; (ii) альфа-линоленовой кислоты (9,12,15-октадекатриеновой кислоты); (iii) стеаридоновой кислоты (6, 9, 12, 15-октадекатетраеновой кислоты); (iv) эйкозатриеновой кислоты (ЕТА; 11,14,17-эйкозатриеновой кислоты); (v) эйкозатетраеновой кислоты (8,11,14,17-эйкозатетраеновой кислоты); (vi) эйкозапентаеновой кислоты (ЕРА; 5,8,11,14,17-эйкозапентаеновой кислоты); (vii) эйкозагексаеновой кислоты (5,7,9,11,14,17-эйкозагексаеновой кислоты): (viii) докозапентаеновой кислоты (DPA; 7,10,13,16,19-докозапентаеновой кислоты); (ix) тетракозагексаеновой кислоты (6,9,12,15,18,21-тетракозагексаеновой кислоты); и их смесей. Лекарственная форма может включать 5-85%, 10-85%, 25-85%, 15-70% или 20-60% (масса/масса) омега-3 жирной кислоты. Лекарственная форма может дополнительно включать желчную кислоту, такую как холевая кислота, хенодеоксихолевая кислота, таурохолевая кислота, таурохенодеоксихолевая кислота, гликохенохолевая кислота, 3-β моногидроксихолевая кислота, литохолевая кислота, 3-α гидроксил-12-кетохолевая кислота, 3-β гидрокси-12-кетохолевая кислота, 12-α-3-β-дигидрохолевая кислота, урсодезоксихолевая кислота, или их соли.
Соединения класса эхинокандинов по изобретению могут быть формулированы с алкилсахаридом или сложным эфиром сахарида, как описано в патенте США №5661130 или в патентных публикациях США №2008/0200418, 2006/0046962, 2006/0045868, 2006/0024577, 2007/0298010, 2010/0209485 и 2008/0194461, каждая из которых включена здесь путем отсылки. Алкилсахариды или сложные эфиры сахаридов, полезные в качестве усилителей абсорции в составах по изобретению, могут быть выбраны из додецилмальтозида, тридецилмальтозида, тетрадецилмальтозида, сахарозы монододеканоата, сахарозы монотридеканоата, сахарозы монотетрадеканоата и их смесей. Лекарственная форма может включать 0.1-1.5%, 0.5-5%, 0.75-6.5%, 1.5-6.5% или 2-10% (масса/масса) алкилсахарида или сложного эфира сахарида. Массовое соотношение лекарственное средство: усилитель абсорции может составлять от 1:0.5 до 1:8.
Соединения класса эхинокандинов по изобретению могут быть формулированы с (i) усилителем абсорбции, выбранным из ацилкарнитинов, ацилхолинов, ациламинокислот, фосфолипидов и желчных кислот, или их солей; и (ii) понижающим рН агентом, описанным в патентах США №№8093207 и 6086918, каждый из которых включен здесь путем отсылки. Усилитель абсорбции может быть выбран из лауроилкарнитина, миристоилкарнитина, пальмитоилкарнитина, лауроилхолина, миристоилхолина, пальмитоилхолина, гексадециллизина, N-ацилфенилаланина, N-ацилглицина и их смесей. Например, лекарственная форма может включать ацилкарнитин и второй усилитель абсорбции, выбранный из фосфолипидов, желчных кислот или их солей. Понижающий рН агент может быть выбран из лимонной кислоты, винной кислоты и аминокислот. Лекарственная форма может включать 1-15%, 5-25%, 1.5-9.5%, 15-25% или 8-30% (масса/масса) усилителя абсорбции. Массовое соотношение понижающего рН агента к усилителю абсорбции может находиться в диапазоне между 3:1 и 20:1. Желательно, чтобы понижающий рН агент присутствовал в количестве, которое при добавлении фармацевтической композиции в виде стандартной лекарственной формы к десяти миллилитрам 0.1М водного раствора бикарбоната натрия будет достаточным для понижения рН раствора до значения не выше 5.5. Массовое соотношение лекарственное средство: усилитель абсорбции может составлять от 0.5:1 до 1:20. Лекарственная форма может дополнительно включать желчные кислоты, катионные и/или анионные производные холестерина, моноглицериды и/или линейные спирты (например, этанол).
Соединения класса эхинокандинов по изобретению могут быть формулированы в виде твердой пероральной лекарственной формы, включающей (i) от примерно 0.5 до 70% (например, от 0.5 до 20%, от 10 до 40%, от 20 до 50% или от 30 до 70%) (масса/масса) соединения класса эхинокандинов или его фармацевтически приемлемой соли и (ii) от примерно 5 до 80% (например, от 5 до 20%, от 10 до 30%, от 15 до 40% или от 20 до 80%) (масса/масса) глицерида. Глицерид может представлять собой любой глицерид, описанный здесь, но предпочтительно выбран из моно- или диглицерида каприновой кислоты, моно- или диглицерида каприловой кислоты, или смеси моно- и диглицеридов каприловой и каприновой кислот, или смеси двух или более из них. Твердая пероральная лекарственная форма может дополнительно включать поверхностно-активное вещество и/или масло (например, неионное поверхностно-активное вещество, такое как этоксилированное касторовое масло; этоксилированные производные С5-29 моноглицеридов; полиоксиэтиленовые производные С15-60 диглицеридов, имеющие от 1 до 90 повторяющихся единиц оксиэтилена (РОЕ); этоксилированные сложные эфиры С8-96 жирных кислот; сложные эфиры сахарозы и С14-130 жирных кислот; и полиоксиэтиленовые производные С20-130 сложных моноэфиров и сложных триэфиров сорбитола и сорбитана, имеющих от 0 до 90 РОЕ повторяющихся единиц, или анионное поверхностно-активное вещество, такое как соли жирных кислот С8-32; деоксихолаты; урсодеоксихолаты; таурохолаты; и лаурилсульфат натрия). В твердых пероральных лекарственных формах соединение класса эхинокандинов или его фармацевтически приемлемая соль, представлена в форме твердых равномерно диспергированных частиц со средним размером от примерно 1 нм до примерно 1 мм. Твердые лекарственные формы могут быть изготовлены с использованием способов, описанных в патенте США №7670626, включенном здесь путем отсылки. Композиция может дополнительно включать биосовместимое масло.
Соединения класса эхинокандинов по изобретению могут быть формулированы в виде частиц, включающих соединение класса эхинокандинов, при этом частица имеет эффективный средний диаметр меньше чем примерно 2000 нм (то есть, как определено с использованием методов светорассеяния), как описано в патентной публикации США №2009/0238867, включенной здесь путем отсылки. Конкретная лекарственная форма может включать, по меньшей мере, один поверхностный стабилизатор, абсорбированный на поверхности частицы (например, поверхностный стабилизатор, выбранный из неионных поверхностных стабилизаторов, ионных поверхностных стабилизаторов, катионных поверхностных стабилизаторов, цвиттер-ионных поверхностных стабилизаторов и анионных поверхностных стабилизаторов, включая идентифицированные в патентной публикации США №2009/0238867, включенной здесь путем отсылки).
Соединения класса эхинокандинов могут быть формулированы с одним или более агентами для образования пары ионов (например, катионными или анионными агентами) для пероральной доставки. Например, соединение 22 может быть модифицировано с использованием анионных групп лимонной кислоты или жирных кислот, или желчных кислот с образованием ион-парной композиции. Полученный комплекс может быть формулирован в биоразлагаемые наночастицы с помощью методов самопроизвольного эмульгирования и диффузии растворителя (смотри Yoo et al., J. Pharmaceut. Sci. 90:194, 2001; и Quintanar-Guerrero et al., Pharmaceut. Res. 14:119, 1997). Лекарственные формы, содержащие ионную пару, могут быть получены из органических кислот, например, кислых солей аминокислот или солей, полученных посредством добавления кислоты (например, солей, полученных посредством добавления уксусной, молочной, пальмовой (palmoic), малеиновой, лимонной, холевой кислоты, каприновой кислоты, каприловой кислоты, лауриновой кислоты, глутаровой, глюкуроновой, глицериновой, гликоколевой, глиоксиловой, изолимонной, изовалериановой, молочной, яблочной, щавелево-уксусной, щавелево-янтарной, пропионовой, пировиноградной, аскорбиновой, янтарной, бензойной, пальмитиновой, субериновой, салициловой, винной, метансульфоновой, толуолсульфоновой или трифторуксусной кислоты). В определенных предпочтительных вариантах осуществления композиция, содержащая ионную пару, включает усилитель абсорбции, такой как соли, полученные посредством добавления лимонной, каприновой, каприловой, фосфолипидов и холевой кислоты.
Трансдермальное введение
Соединения и лекарственные формы по изобретению можно вводить трансдермально. Для увеличения скорости проникновения соединения через кожу соединение можно вводить с физическим усилителем проникновения или химическим усилителем проникновения. Физическое усиление проникновения через кожу включает, например, электрофоретические технологии, такие как ионофорез или электропорацию (смотри патенты США №№6148232; 6597946; 6611706; 6708060; 6711435; и 6275728, каждый из которых включен здесь путем отсылки), включая технологию радиочастотной абляции клеток для создания микроканалов на поверхности кожи (смотри Levin et al., Pharmaceutical Research, 22:550 (2005)). Химические усилители можно вводить вместе с соединением для увеличения проницаемости рогового слоя и, таким образом, обеспечения усиленного проникновения соединения через кожу.
Лекарственные формы для инъекции
Для использования в режимах дозирования по изобретению соединения класса эхинокандинов могут быть формулированы для внутривенной инфузии, болюсной инъекции и/или подкожного введения. Такие лекарственные формы могут необязательно включать наполнитель и, необязательно, вспомогательное поверхностно-активное вещество, упакованные в ампулы. Лекарственные формы представляют собой, необязательно, восстанавливаемые сухие лекарственные формы (например, лиофилизированные стандартные лекарственные формы). Например, соединения класса эхинокандинов могут быть формулированы для инъекции в солевом растворе, необязательно с полисорбатным поверхностно-активным веществом в количестве от 0.1 до 1% (масса/масса), добавленным в качестве поверхностно-активного агента. Например, соединения класса эхинокандинов могут быть формулированы для инъекции в стерильной воде или водном буфере (например, фосфатном, ацетатном, молочном, винном, лимонном, среди прочего). Например, соединение 22 может быть упаковано в инфузионный мешок, содержащий 5%-ный раствор декстрозы или хлорида натрия, или предварительно упаковано в виде твердого или жидкого концентрата для восстановления перед введением.
Альтернативно, соединения класса эхинокандинов могут быть введены в фармацевтически приемлемые лекарственные формы в форме наночастиц, наносфер или нанокапсул. Обычно нанокапсулы могут захватывать соединения стабильным и воспроизводимым образом. Чтобы избежать побочных эффектов из-за внутриклеточной перегрузки полимерами, такие сверхмелкие частицы (размером около 0.1 мкм) должны быть сконструированы с использованием полимеров, способных разлагаться in vivo (например, биоразлагаемые наночастицы полиалкилцианоакрилата). Такие частицы описаны в предшествующем уровне техники (смотри, например, патент США №5145684, включенный здесь путем отсылки). Как правило, лекарственные формы содержат наночастицы с поперечным размером примерно от 5 нм до 400 нм и могут быть получены с использованием природного или искусственного полимера. Полимеры могут представлять собой биоразлагаемые, биоресорбируемые или биоэродируемые полимеры и могут включать, без ограничения, альбумин, коллаген, желатин и проламины, такие как цеин, полисахариды, такие как альгинат, производные целлюлозы и алифатические полиэфиры полигидроксиалканоаты, такие как полигидроксибутират; поли(гликолевую) кислоту и/или ее сополимеры (например, поли(гликолид-триметилен карбонат)); поли(капролактон-гликолид); поли(молочную кислоту) и/или ее изомеры (например, поли-L(молочную кислоту) и/или поли-D(молочную кислоту)), и/или ее сополимеры (например, DL-PLA) с добавками и без них (например, кальций-фосфатного стекла), и/или другие сополимеры (например, поли(капролактон-лактид), поли(лактид-гликолид), поли(молочная кислота-этиленгликоль)); поли(этиленгликоль) (с различной молекулярной массой, то есть 2000 D, 4000 D, 6000 D, 8000 D, и т.д.); поли(этиленгликоль)диакрилат; поли(лактид); полиалкиленсукцинат; полибутиленовый эфир дигликолевой кислоты; полигидроксибутират (РНВ); полигидроксивалерат (PHV); сополимер полигидроксибутират/полигидроксивалерат (PHB/PHV); поли(гидроксибутират-со-валерат); полигидроксиалканоаты (РНА); поликапролактон; сополимер поли(капролактон-полиэтиленгликоль); поли(валеролактон); полиангидриды; сложные поли(ортоэфиры) и/или смеси с полиангидридами; поли(ангидрид-со-имид); поликарбонаты (алифатические); поли(гидроксил-сложные эфиры); полидиоксанон; полиангидриды; сложные эфиры полиангидридов; полицианоакрилаты; поли(алкил 2-цианоакрилаты); поли(аминокислоты); поли(фосфазены); поли(пропиленфумарат); поли(пропиленфумарат-со-этиленгликоль); поли(фумарат ангидриды); фибриноген; фибрин; желатин; целлюлозу и/или производные целлюлозы, и/или полимеры целлюлозы (например, ацетат целлюлозы, ацетат-бутират целлюлозы, бутират целлюлозы, простые эфиры целлюлозы, нитрат целлюлозы, пропионат целлюлозы, целлофан); хитозан и/или производные хитозана (например, хитозан NOCC, хитозан NOOC-G); альгинат; полисахариды; крахмал, амилазу; коллаген; поликарбоновые кислоты; поли(этиловый эфир-со-карбоксилат карбонат) (и/или другие поликарбонаты на основе тирозина); поли(иминокарбонат); поли(ВРА-иминокарбонат); поли(триметиленкарбонат); сополимеры поли(иминокарбонат-амид) и/или другие псевдо-поли(аминокислоты); поли(этиленгликоль); поли(этиленоксид); сополимер поли(этиленоксид)/поли(бутилентерефталат); поли(эпсилон-капролактон-диметилтриметиленкарбонат); поли(сложноэфирный амид); поли(аминокислоты) и их типичные синтетические полимеры; поли(алкиленоксалаты); поли(алкилкарбонат); поли(адипиновый ангидрид); сополиамиды нейлона; N,O-карбоксиметилхитозан NOCC); карбоксиметилцеллюлозу; сополи(простые-сложные эфиры) (например, PEO/PLA декстраны); поликетали; биоразлагаемые простые полиэфиры; биоразлагаемые сложные полиэфиры; полидигидропираны; полидепсипептиды; полиарилаты (производные L-тирозина) и/или свободные кислые полиарилаты; полиамиды (например, Nylon 66, поликапролактам); поли(пропиленфумарат-ко-этиленгликоль) (например, ангидриды фумаратов); гиалуронаты; поли-п-диоксан; полипептиды и белки; сложный полифосфоэфир; сложный полифосфоэфир-уретан; полисахариды; псевдо-поли(аминокислоты); крахмал; терполимер; (сополимеры гликолида, лактида или диметилтриметиленкарбоната); шелк; триацетатный шелк; латекс; и/или сополимеры, смеси, и/или композиты указанных выше. Лекарственные формы, состоящие из множества частиц, можно использовать для доставки с контролируемым, отсроченным или замедленным высвобождением соединения класса эхинокандинов, вводимого субъекту с использованием режима дозирования по изобретению (смотри, например, Chan et al., Biomaterials, 30:1627, 2009; and Gupta et al., Int. J. Res. Pharm. Sci. 1:163, 2010).
Лекарственные формы для инъекции можно вводить, без ограничения, внутривенно, внутримышечно или подкожно.
Лекарственные формы для инъекции можно хранить в однодозных или многодозных контейнерах, например, запечатанных ампулах, предварительно наполненных шприцах или флаконах, в виде водного раствора или в виде лиофилизированного состава (например, высушенного замораживанием) для восстановления. Контейнеры могут представлять собой любые существующие в данной области контейнеры и заполненны обычными способами. Необязательно, лекарственная форма может быть помещена в инъекционное устройство в виде ручки (или картидж, который подходит к устройству в виде ручки), такое как устройства, существующие в данной области (смотри, например, патент США №5370629), которые являются пригодными для доставки лекарственной формы путем инъекции. Лекарственные формы для инъекции можно вводить с использованием инъекционных устройств в виде ручки, таких как EasyJect®, GONAL-F® Pen, Humaject®, Novopen ®, B-D® Pen, AutoPen®, Follistim®-Pen, Puregon®-Pen и OptiPen® или Ypsomed SevoPens.
Терапия
Режимы лечения и фармацевтические композиции, описанные здесь, можно применять для лечения или предупреждения грибковых инфекций.
Грибковая инфекция, по поводу которой проводится лечение, может представлять собой инфекцию, выбранную из глубокой трихофитии, микоза гладкой кожи туловища, микоза стоп, онихомикоза, перионихомикоза, отрубевидного лишая, кандидоза полости рта, вагинального кандидоза, кандидоза дыхательного пути, билиарного кандидоза, эзофагеального кандидоза, кандидоза мочевыводящих путей, системного кандидоза, кандидоза кожи и слизистой оболочки, аспергиллеза, мукоромикоза, паракокцидиоидоза, североамериканского бластомикоза, гистоплазмоза, кокцидиоидомикоза, споротрихоза, грибкового синусита или хронического синусита. Например, инфекция, по поводу которой проводится лечение, может представлять собой инфекцию, вызванную Candida albicans, С. parapsilosis, С. glabrata, С. guilliermondii, С. krusei, С. lusitaniae, С. tropicalis, Aspergillus fumigatus, A. flavus, A. terreus, A. niger, A. candidus, A. clavatus или A. ochraceus.
Режимы лечения и фармацевтические композиции, описанные здесь, можно вводить внутривенно, подкожно, местно, перорально или любым другим путем, описанным здесь. В одном подходе субъекту, нуждающемуся в этом, вводят дозу насыщения соединения класса эхинокандинов с последующим поддерживающим дозированием, производимым перорально.
Режимы лечения и фармацевтичекие композиции, описанные здесь, можно вводить для предупреждения грибковой инфекции у субъекта, нуждающегося в этом. Например, профилактическое лечение могут получать субъекты в период подготовки к инвазивной медицинской процедуре (например, подготовке к хирургической операции, такой как получение трансплантата, терапии стволовыми клетками, графта, протеза, получение длительной или частой внутривенной катетеризации, или получение лечения в отделе реанимации), иммунокомпромитированные субъекты (например, субъекты, имеющие рак, ВИЧ/СПИД, или принимающие иммуносупрессорные средства) или субъекты, подвергающиеся длительной терапии антибиотиками. Альтернативно, режимы лечения и фармацевтические композиции, описанные здесь, можно вводить для лечения инфекции кровотока или инвазивной инфекции (например, инфекций легких, почек или печени) у субъекта.
Следующие примеры приведены далее для того, чтобы обеспечить специалиста в данной области полным раскрытием и описанием того, каким образом способы и соединения, заявленные здесь, выполняются, изготавливаются и оцениваются, и приведены только в целях иллюстрации изобретения и не рассматриваются как ограничивающие.
Пример 1. Фармакокинетика после внутривенного введения собакам породы бигль
Соединения класса эхинокандинов вводили собакам породы бигль массой приблизительно 6-10 кг. Каждое соединение вводили в дозе 1.4 мг/кг в солевом растворе (содержащем 0.05% Твина или без его) в течение 1-10 минут. Дифенгидрамин держали под рукой на случай возникновения у собак реакции на гистамин. Собак не кормили в течение, по меньшей мере, 12 часов до каждого введения дозы и предлагали пищу после взятия образца крови через 4 часа после введения; не давали пить воду в течение 1 часа до каждого введения дозы и 4 часов после каждого введения дозы. Доза для каждого животного основывалась на самой последней массе тела. Тестируемый препарат вводили внутривенно через катетер, помещенный в головную вену, в виде медленного болюса.
Кровь забирали через яремную вену. Все образцы крови (~ 1 мл каждый) собирали в пробирки K3EDTA. После сбора крови образцы сразу же несколько раз переворачивали вверх-вниз и помещали в тающий лед до центрифугирования. Образцы центрифугировали в пределах ~30 минут после сбора в условиях низких температур (~5°С в течение ~10 минут при ~2000 г) для получения плазмы. Плазму сразу же замораживали на сухом льду после отделения. Образы плазмы хранили приблизительно при -70°С до анализа.
Плазму (100 мкл) осаждали 400 мкл 0.1% муравьиной кислоты в ацетонитриле, содержащем внутренний стандарт (пневмокандин 100 нг/мл). Образцы затем закрывали крышкой и перемешивали на вортексе в течение примерно 30 секунд с последующим центрифугированием при 14000 об/мин при комнатной температуре в течение 10 минут. После центрифугирования 200 мкл супернатанта переносили в пластиковые виалы автосамплера, содержащие 200 мкл 0.1% муравьиной кислоты в воде, и перемешивали на вортексе. Образцы затем анализировали с помощью LCMSMS.
Все фармакокинетические расчеты выполняли с помощью программы WinNonlin версия 4.1 (Pharsight Corp), используя некомпартментный анализ. Результаты представлены в Таблице 1 ниже.
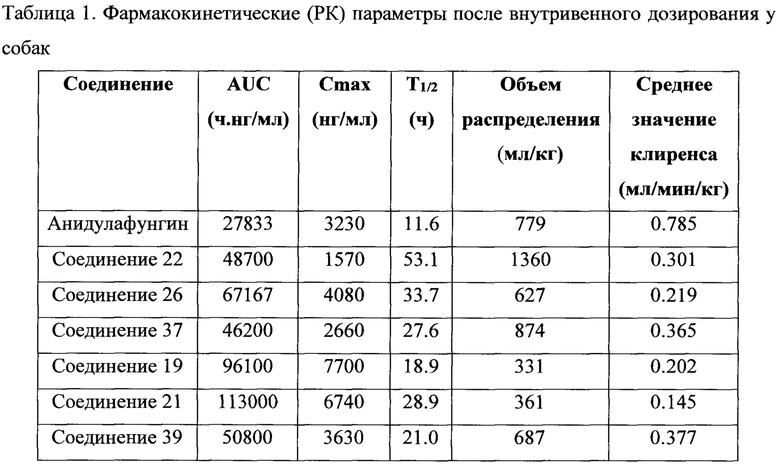
Пример 2. Лекарственная форма для перорального введения
Следующие лекарственные формы можно применять в способах, наборах и композициях по изобретению.
Иллюстративные пероральные лекарственные формы по изобретению описаны в Таблице 2.
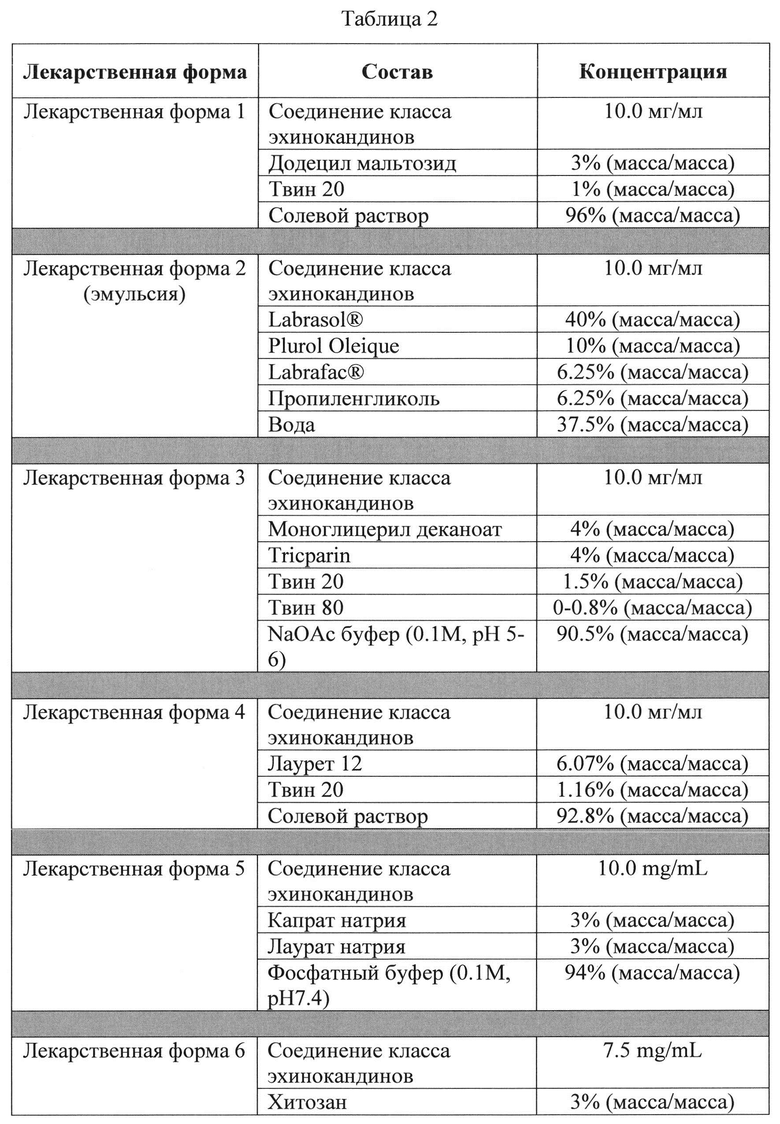
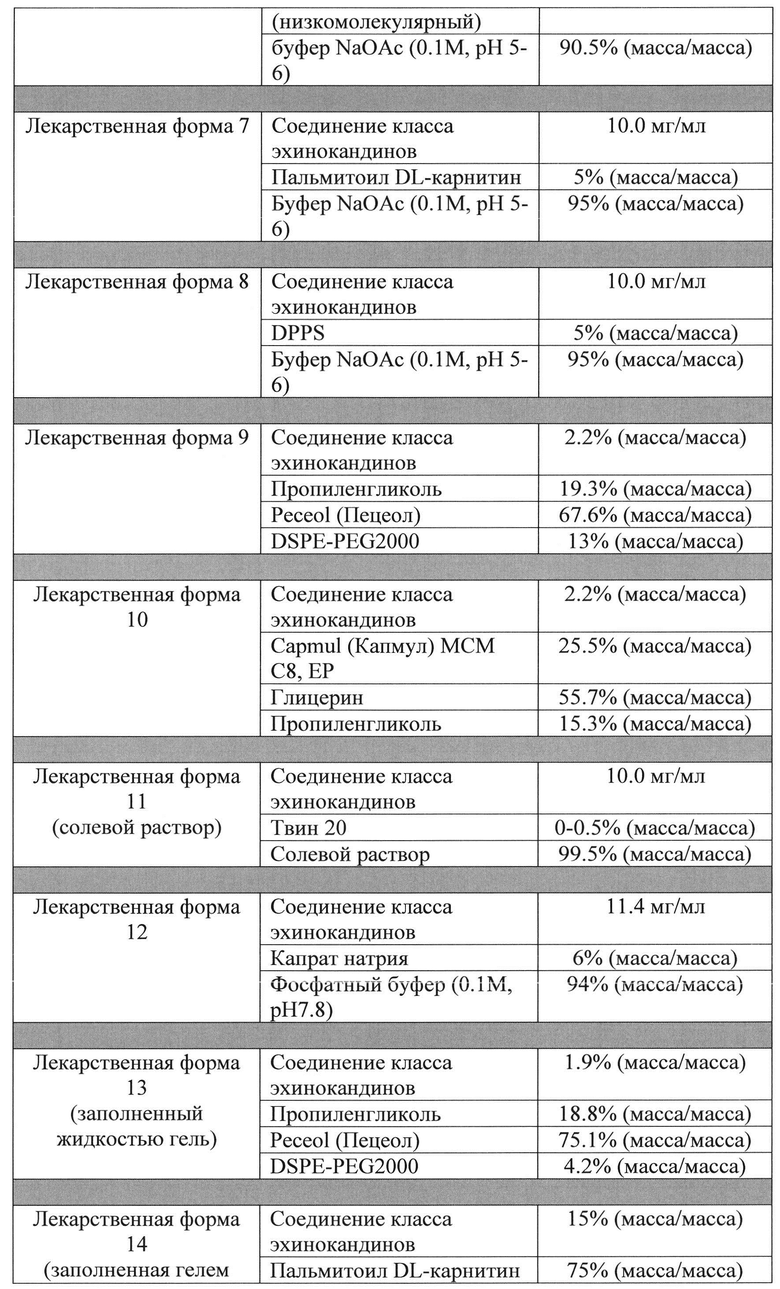
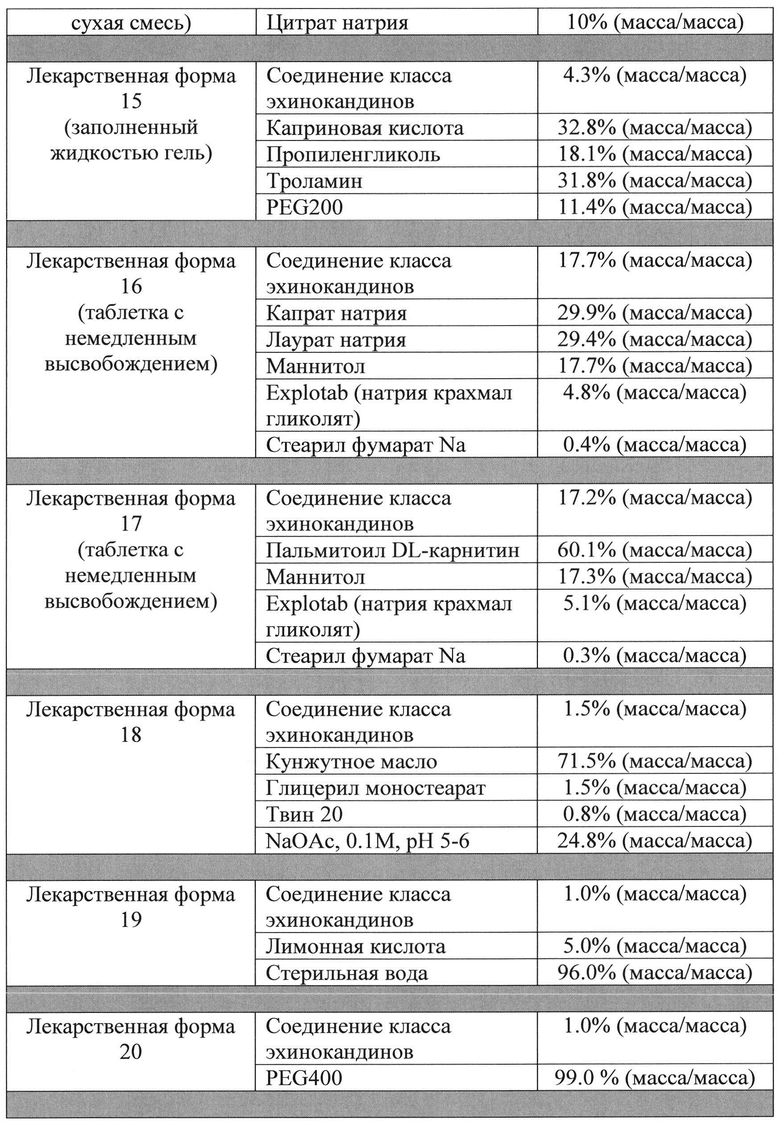
Пример 3. Фармакокинетика после перорального введения у собак породы бигль
Соединения класса эхинокандинов вводили собакам породы бигль массой приблизительно 6-10 кг. Каждое животное получало надлежащим образом приготовленный тестируемый препарат в виде единичной пероральной капсулы в дозе примерно 7-10 мг/кг. Сразу же после дозирования каждому животному предлаггали 20 мл-30 мл воды перорально (Группы 1-4) или 30 мл воды перорально для содействия набуханию капсулы.
Животных обрабатывали, забирали образцы крови и анализировали, как описано в Примере 1.
Биодоступность каждой пероральной лекарственной формы оценивали путем сравнения с данными Примера 1 по концентрации в плазме у собак при внутривенном введении. Результаты, представленные в Таблице 3, показывают пероральную биодоступность соединения класса эхинокандинов в солевом растворе (лекарственная форма 11) и улучшение по сравнению с солевым раствором при использовании лекарственной формы по изобретению.
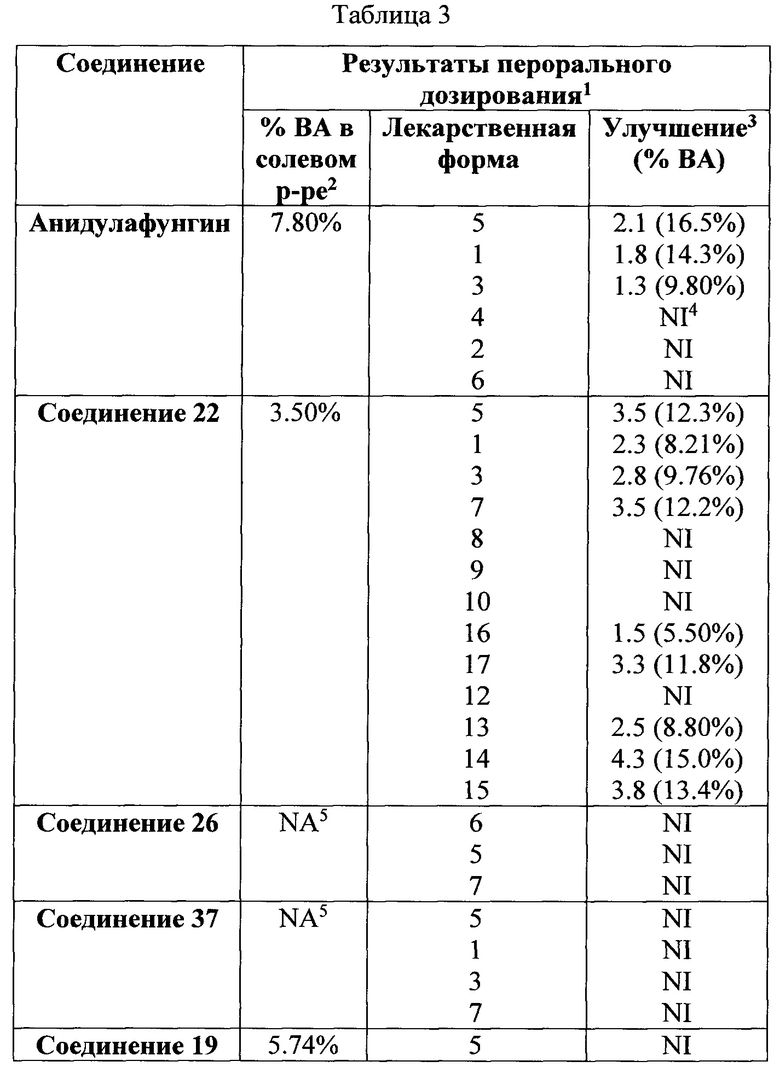

1. Все процентные пероральные биодоступности рассчитаны из данных по AUC.
2. Процентная пероральная биодоступность в лекарственной форме 11.
3. Улучшение, представленное как отношение процентной пероральной биодоступности для лекарственной формы, деленое на пероральную биодоступность при формулировании в солевом растворе.
4. NI = нет улучшения в пероральной биодоступности по сравнению с солевым раствором.
5. NA = данные отсутствуют. Улучшение оценивали на основе наблюдаемой пероральной биодоступности для других соединений из Таблицы 3 в солевом растворе.
Улучшения пероральной биодоступности наблюдались для лекарственных форм, включающих жирные кислоты или их соли (лекарственные формы 7, 14 и 17), глицериды (лекарственные формы 3 и 13), ацилкарнитины (лекарственные формы 7, 14 и 17), алкилсахариды (лекарственная форма 1) и пегилированные фосфолипиды (лекарственная форма 13).
Наибольшие улучшения пероральной биодоступности наблюдались для анидулафунгина и соединения 22.
Пример 4. Профиль растворения таблетированной лекарственной формы 17.
Исследование растворения таблетки лекарственной формы 17 выполняли с использованием в качестве среды 500 мл 100 мМ ацетатного буфера рН 5.2. В способе использовали Прибор 2 со скоростью вращения лопастей 50 об/мин, удерживающим устройством (sinker) для таблеток, и время работы составило 60 минут. После завершения растворения образцы анализировали на содержание соединения 22 с использованием HPLC. Метод HPLC представляет собой градиентный метод с использованием колонки Agilent Zorbax Bonus-RP (250 × 4.6 мм) (температура колонки 60°С, длина волны 300 нм, и Подвижная Фаза А = 33 мМ раствор пентансульфоната натрия рН 4.0 и Подвижная Фаза В = ацетонитрил). Образцы инъецировали без разбавления с объемом инъецирования 15 мкл.
Результаты исследования растворения представлены в Таблице 4.
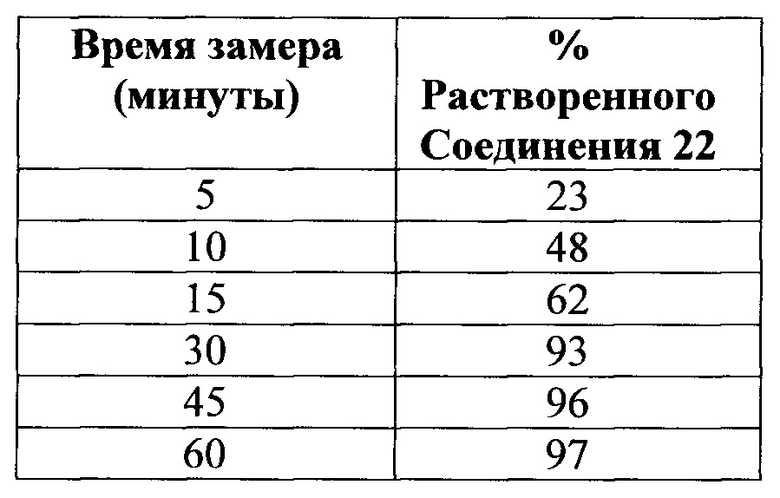
Таблетка лекарственной формы 17 имеет профиль немедленного высвобождения (то есть более 80% растворилось в течение 30 минут). Таким образом, лекарственная форма 17 обеспечивает одновременное высвобождение усиливающей проникновение добавки и соединения 22. По существу одновременное высвобождение обоих, активного вещества и вспомогательных веществ, необходимо для достижения увеличения пероральной биодоступности.
Пример 5. Водная лекарственная форма соединения 22 для инъекции.
Растворимость соединения 22 измеряли в водных буферах с различным рН для оценки пригодности данного соединения для формулирования в водном носителе для введения путем инъекции (например, внутривенного болюса, внутривенной инфузии, подкожной или внутримышечной инъекции).
Результаты представлены в Таблице 5 (ниже) вместе с анидулафунгином в качестве сравнения. Было обнаружено, что соединение 22 имеет значительно большую водную растворимость, чем анидулафунгин в различных водных средах.
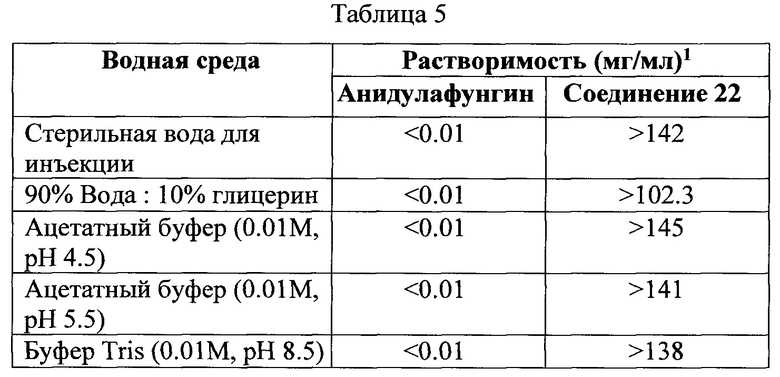
1. Растворимость в мг/мл эквивалента соединения 22, не содержащего соль. Все измерения выполняли при комнатной температуре для ацетатной соли. Точка насыщения не была достигнута в этих измерениях для соединения 22.
Пример 6. Внутривенная инфузия соединения 22
Соединение 22 может поставляться в одноразовых ампулах из стерильного лиофилизированного материала. Соединение 22 может быть восстановлено в стерильной воде и затем разбавлено 5% раствором декстрозы для инъекций или 0.9% раствором хлорида натрия для инъекций, USP (физиологический раствор) для инфузии субъекту.
Ампула, содержащая количество соединения 22, может быть восстановлена объемом стерильной воды или другим пригодным водным носителем для обеспечения концентрации примерно 3.3 мг/мл.
Содержимое восстановленной ампулы (ампул) может быть перенесено в инфузионный мешок для внутривенной (IV) инфузии подходящего размера, содержащий либо 5% раствор декстрозы для инъекций, USP, или от 0.45% до 0.9% раствор хлорида натрия.
Иллюстративные дозы и объемы представлены в Таблице 6 (ниже).
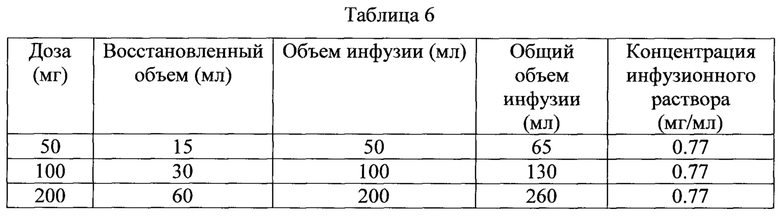
Пример 7. Стабильность соединения 22 и анидулафунгина в различных образцах плазмы млекопитающих и в PBS
Базовые растворы соединения 22 и анидулафунгина готовили в DMSO при концентрации 1 мг/мл. Образцы плазмы готовили путем смешивания плазмы с 10% объемом 1М фосфата натрия, рН 7.4, для сведения к минимуму колебания рН, и базовым раствором для получения образцов плазмы, содержащих приблизительно 10000 нг/мл соединения 22 или анидулафунгина. Для экспериментов на стабильность в буфере PBS плазму заменяли фосфатно-буферным солевым раствором, рН 7.4. Концентрация DMSO составила 1% в конечной инкубации. Готовили ряд индивидуальных аликвот (0.5 мл каждая), закрывали крышкой и инкубировали при 37°С. В каждый момент времени исследования стабильности реакцию останавливали путем удаления образца из инкубатора и добавления 0.5 мл ацетонитрила, содержащего внутренний стандарт. Образцы центрифугировали в течение приблизительно 5 минут при 10000 об/мин для осаждения белков. Стабильность измеряли в пяти различных матрицах (то есть в плазме крови крыс, плазме крови собак, плазме крови обезьян, плазме крови человека и PBS). Аликвоту (100 мкл) супернатанта каждого образца оценивали с помощью HPLC. Процентное содержание анидулафунгина и соединения 22, остающееся в каждый момент времени, рассчитывали путем деления отношения площадей пиков в каждый момент времени на отношение площадей пиков в нулевой момент времени.
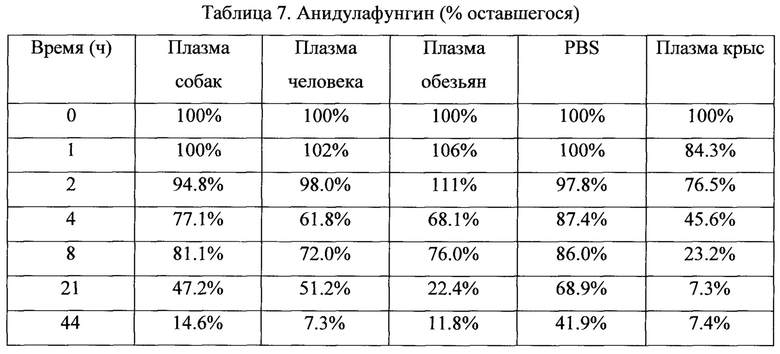
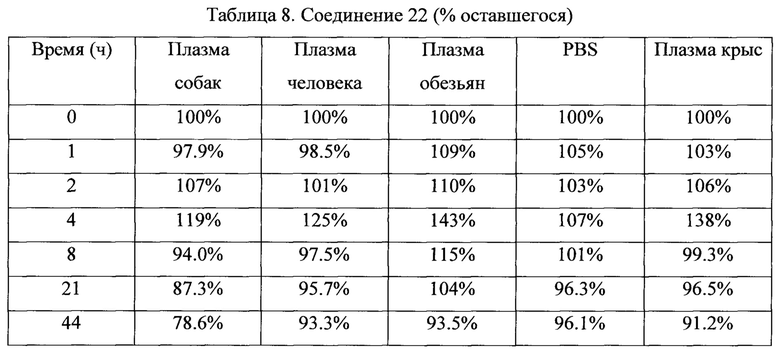
Во всех тестируемых системах (плазма крови от крысы, собаки, обезьяны, человека и PBS) соединение 22 показало большую стабильность по сравнению с анидулафунгином. Учитывая, что основным механизмом клиренса анидулафунгина in vivo является химическая деградация, и учитывая, что соединение 22 проявляет более медленную деградацию, как в плазме, так и в буфере, эта большая стабильность соединения 22 в различных матрицах, по-видимому, является фактором, способствущим более медленному клиренсу, наблюдаемому для этого соединения. Таким образом, увеличенная стабильность может в конечном итоге обеспечить режимы с менее частым дозированием, которое требуется в случае эхинокандинов с меньшей стабильностью.
Стабильность в плазме крови, наблюдаемая для соединения 22, является необходимой, но недостаточной для того, чтобы разрешить его применение в режимах дозирования, в которых терапевтически эффективная устойчивая концентрация достигается при менее частом дозировании.
Пример 8. Фармакокинетика соединения 22 и анидулафунгина у шимпанзе.
Фармакокинетические исследования выполняли на шести взрослых самцах шимпанзе. Два шимпанзе получали соединение 22 в дозе 1 мг/кг IV (внутривенно), формулированное в 5% растворе декстрозы (инфузия в течение 60 минут). Два шимпанзе получали соединение 22 в дозе 10 мг/кг перорально, формулированное в 5% растворе лимонной кислоты (пероральный болюс). Два шимпанзе получали анидулафунгин в дозе 1 мг/кг IV (внутривенно), формулированный согласно инструкции (5% раствор декстрозы, инфузия в течение 60 минут). Образцы плазмы собирали у всех шимпанзе в течение от 10 дней до 22 дней. Фармакокинетические (РК) кривые показаны на Фигурах 16А, 16В и 18. Все фармакокинетические расчеты выполняли с помощью программы WinNonlin версия 4.1 (Pharsight Corp) путем некомпартментного анализа. Результаты представлены в Таблице 9 и 10 ниже.
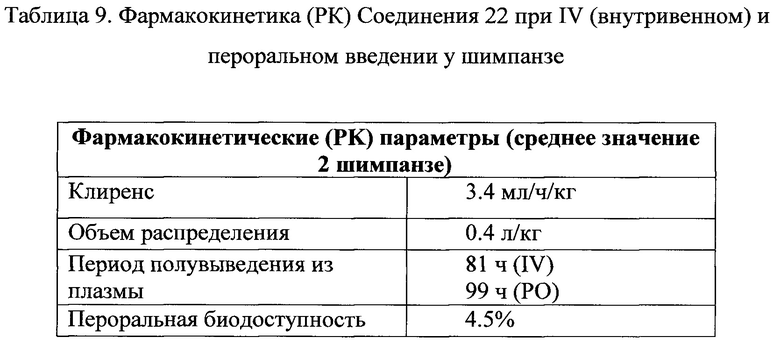


Соединение 22 проявляет более длинный период полувыведения и более низкий показатель клиренса (более высокий показатель AUC для заданной дозы) по сравнением с анидулафунгином у шимпанзе. На основании фармакокинетических (РК) данных для каспофунгина (литература) и анидулафунгина (Seachaid) можно предположить, что шимпанзе являются хорошей моделью для фармакокинетических исследований (РК) эхинокандина (смотри Фигуры 17А-17С, доза IV 1 мг/кг для человека (сплошные линии) и шимпанзе (пунктирные линии)). Проведенные исследования соединений этого класса на человеке и шимпанзе приводят к предположению, что показатель клиренса у человека будет равен или ниже (то есть «лучше»), чем показатели, наблюдаемые у шимпанзе.
Также, оценивали фармакокинетические (РК) показатели соединения 22, вводимого перорально шимпанзе. Соединение 22, формулированное с 5% лимонной кислотой, привело к пероральной биодоступности 4-5%. Уровни от 600 до 1200 нг/мл достигались у шимпанзе после однократной пероральной дозы (смотри Фигуру 18). Низкий показатель клиренса и длинный период полувыведения соединения 22 будут давать возможность перорального дозирования один раз в сутки или два раза в сутки (QD/BID), что обеспечит накопление или поддержание терапевтических концентраций в плазме. Например, соединение 22 можно вводить каждые 5-8 дней в виде внутривенной инфузии или болюса. Альтернативно, соединение 22 можно вводить в дозе насыщения внутривенно с последующим поддерживающим дозированием в течение времени, требуемого для поддержания терапевтически эффективной циркулирующей концентрации. Более того, желательные фармакокинетические свойства соединения 22 позволяют проводить менее частое дозирование.
Пример 9. Периоды полувыведения эхинокандинов у млекопитающих.
Времена полувыведения циркулирующих концентраций соединений класса эхинокандинов представлены в Таблице 11.
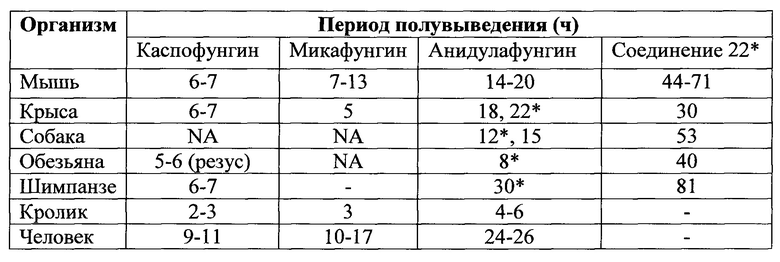
* измерения в анализах выполнялись заявителем, другие представляют собой величины из литературных источников
Пример 10. Лекарственная форма для подкожного и/или внутривенного болюсного введения соединения 22
Следующие лекарственные формы можно применять в способах, наборах и композициях по изобретению. Иллюстративные подкожные и/или внутривенные болюсные лекарственные формы по изобретению описаны в Таблице 12.
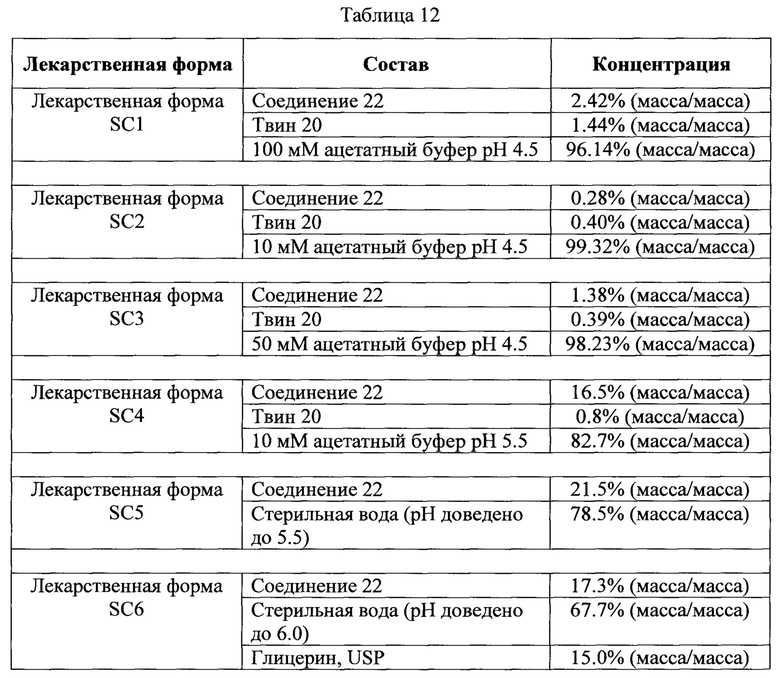

Пример 11. Лекарственная форма для внутривенной инфузии соединения 22
Следующие лекарственные формы можно применять с способах, наборах и композициях по изобретению. Иллюстративные внутривенные лекарственные формы для инфузии по изобретению описаны в Таблице 13. Лекарственные формы могут быть добавлены в IV мешок для инфузии субъекту.
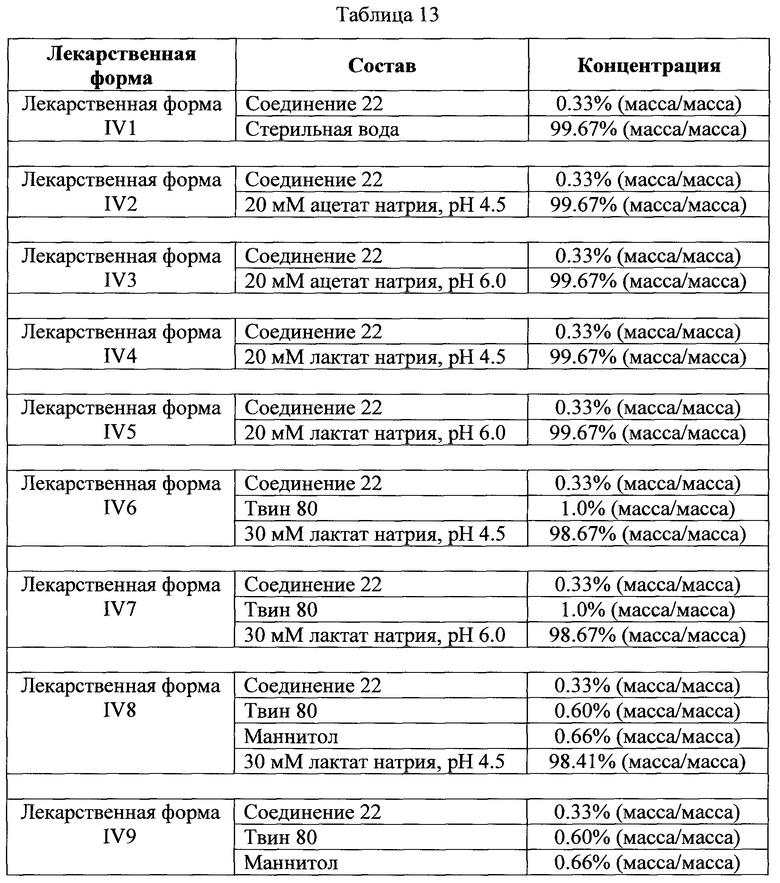
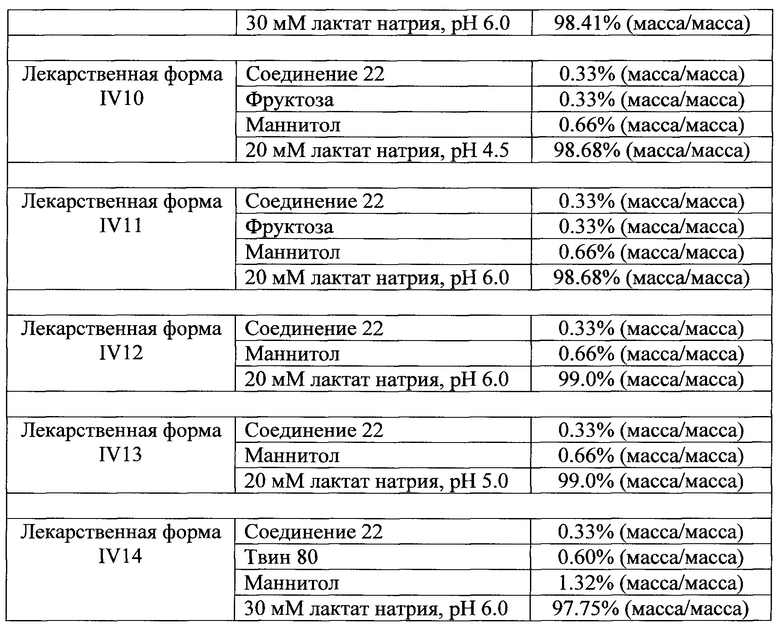
Пример 12. Лиофилизированные лекарственные формы для внутривенной инфузии соединения 22
Следующие лиофилизированные лекарственные формы можно применять в способах, наборах и композициях по изобретению. Иллюстративные лиофилизированные лекарственные формы по изобретению описаны в Таблице 14. Лекарственные формы могут быть восстановлены и добавлены в мешок IV для инфузии субъекту.

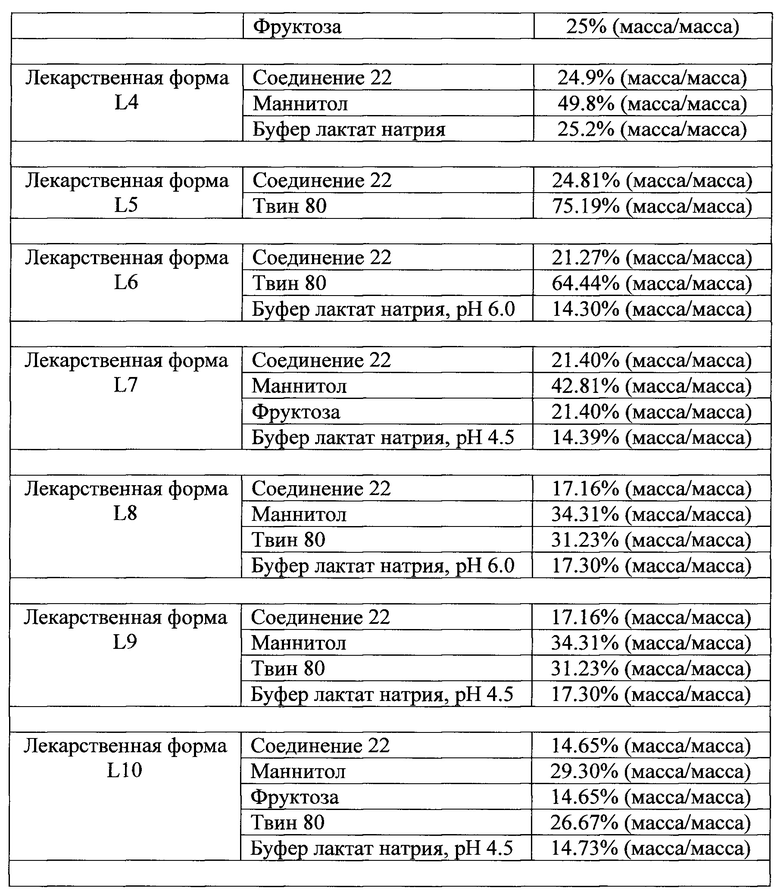
Пример 13. Фармакокинетика соединения 22, вводимого подкожно (SC)
Фармакокинетические исследования выполняли на крысах (2.8 мг/кг IV (внутривенная), 2.8 мг/кг SC (подкожная) инъекция в спину, 2.8 мг/кг SC (подкожная) инъекция в область живота и 2.8 мг/кг SC (подкожная) инъекция в заднюю лапу) и обезьянах Chinese cynomolgus monkeys (2.13 мг/кг IV и 2.8 мг/кг SC). Образцы крови забирали у каждого животного в предварительно установленные моменты времени после дозирования. Образцы общей крови центрифугировали для отделения плазмы. Образцы плазмы анализировали на соединение 22 с использованием LC-MS/MS.
Исследование SC на обезьянах выполняли с использованием лекарственной формы SC1 (смотри Таблицу 12). Исследования на крысах выполняли с использованием SC2 (смотри Таблицу 12) для инъекций в область живота и спину, и лекарственную форму SC3 (смотри Таблицу 12) для инъекции в заднюю лапу. Фармакокинетические (РК) кривые показаны на фигурах 19 (крыса) и 20 (обезьяна). Результаты показывают, что режимы по изобретению могут включать одно или несколько подкожных введений для получения терапевтически эффективной циркулирующей концентрации соединения 22.
Пример 14. Стабильность
Соединение 22 проявляет коммерчески допустимую стабильность при хранении в виде твердого вещества или в растворе.
Растворы соединения 22, формулированные для инъекции в 5% растворе декстрозы (при 1.3 мг/мл и 1.1 мг/мл) и в 0.9% стерильном солевом растворе (1.3 мг/мл) хранили при комнатной температуре в чистом флаконе при комнатном освещении и контролировали разложение с помощью HPLC. Все растворы проявили минимальные потери в активности (менее чем 5%) за период 4 месяца.
Ускоренное старение при 40°С в чистом флаконе при комнатном освещении выполняли в отношении соединения 22, формулированного с 5% раствором декстрозы (3.3 мг/мл), 20 мМ ацетатным буфером рН 4.5 (3.3 мг/мл) и 20 мМ лактатом рН 6.0 (3.3 мг/мл). Все растворы показали незначительные потери активности (менее чем 5%) за период 4 месяца.
Наблюдалось, что лиофилизированные лекарственные формы L6 и L7 (смотри Таблицу 14) проявляют минимальные потери активности (менее чем 5%) за период 3 месяца.
В исследованиях стабильности стабилизаторы не использовали.
Другие варианты осуществления
Все публикации, патенты и патентные заявки, упомянутые в данном описании, включены здесь путем отсылки в той же степени, как если бы каждая отдельная публикация или патентная заявка была особо и индивидуально указана как включенная путем отсылки.
Хотя изобретение описано в связи с его конкретными вариантами осуществления, будет понятно, что возможны дополнительные модификации, и подразумевается, что данная заявка охватывает любые вариации, применения или адаптации изобретения, следуя, в целом, принципам изобретения и включает такие отступления от настоящего раскрытия, которые привносятся известной или общепринятой практикой в области, к которой относится изобретение, и которые можно применить к основным признакам, раскрытым выше, и в соответствии с объемом прилагаемой формулы изобретения.
Данная заявка истребует приоритет предварительной патентной заявки США №61/612676, поданной 19 марта 2012 года и предварительной патентной заявки США №61/707142, поданной 28 сентября 2012 года, каждая из которых включена здесь путем отсылки.
Другие варианты осуществления находятся в объеме формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Режимы дозирования для соединений класса эхинокандинов | 2013 |
|
RU2639483C2 |
| ПЕРОРАЛЬНЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ СЛОЖНЫЙ ЭФИР 17-ГИДРОКСИПРОГЕСТЕРОНА, И СООТВЕТСТВУЮЩИЕ СПОСОБЫ | 2012 |
|
RU2640912C2 |
| АНАЛОГИ ЭХИНОКАНДИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2832679C1 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ ИММУНОВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 2004 |
|
RU2329037C2 |
| ПЕРОРАЛЬНЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ТАКСАНЫ, И СПОСОБЫ ЛЕЧЕНИЯ С ИХ ПРИМЕНЕНИЕМ | 1999 |
|
RU2236226C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ИНГИБИРОВАНИЯ ЭКСПРЕССИИ ГЕНОВ АПОЛИПОПРОТЕИНА С-III (АРОС3) | 2012 |
|
RU2631805C2 |
| ИНГИБИТОРЫ ЦИСТАТИОНИН-Г-ЛИАЗЫ (CSE) | 2013 |
|
RU2640418C2 |
| ИНГАЛЯЦИОННАЯ ЛЕКАРСТВЕННАЯ ФОРМА РАПАМИЦИНА ДЛЯ ЛЕЧЕНИЯ ЛЕГОЧНОЙ ГИПЕРТЕНЗИИ | 2015 |
|
RU2732908C2 |
| СОСТАВЫ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ И РОДСТВЕННЫЕ СПОСОБЫ | 2008 |
|
RU2485975C2 |
| ПЕРОРАЛЬНОЕ ВВЕДЕНИЕ НЕУСТОЙЧИВЫХ ИЛИ ПЛОХО ВСАСЫВАЮЩИХСЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2015 |
|
RU2746548C2 |
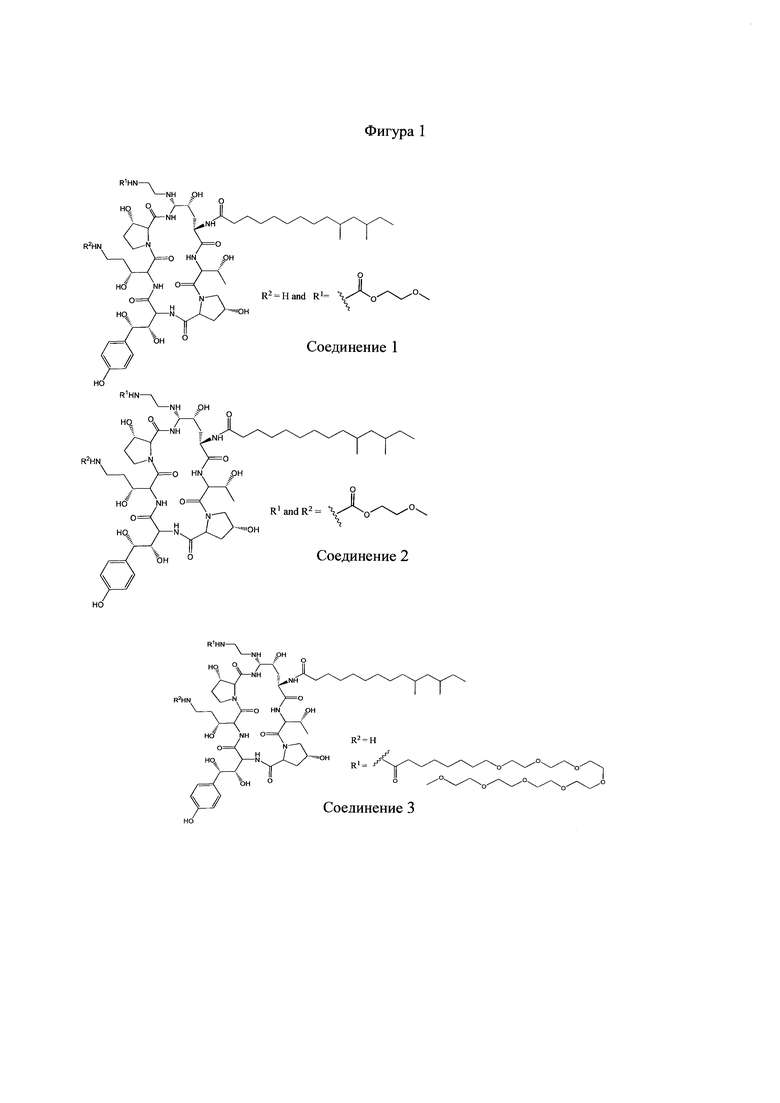
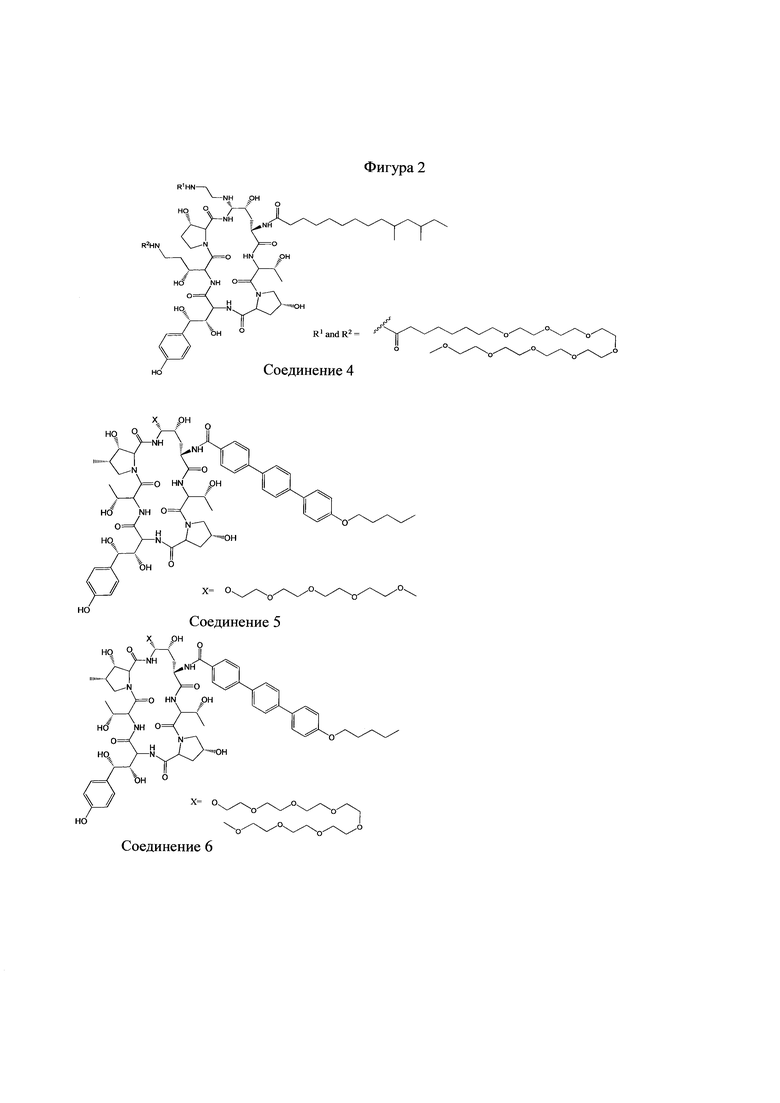
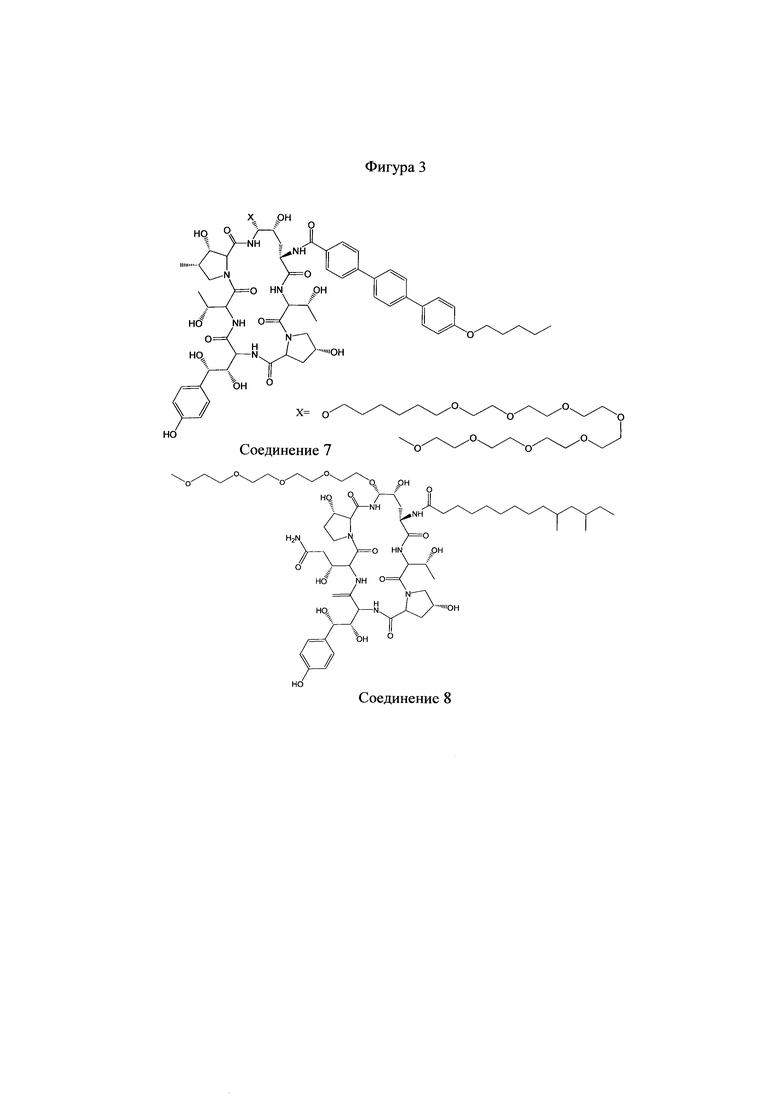
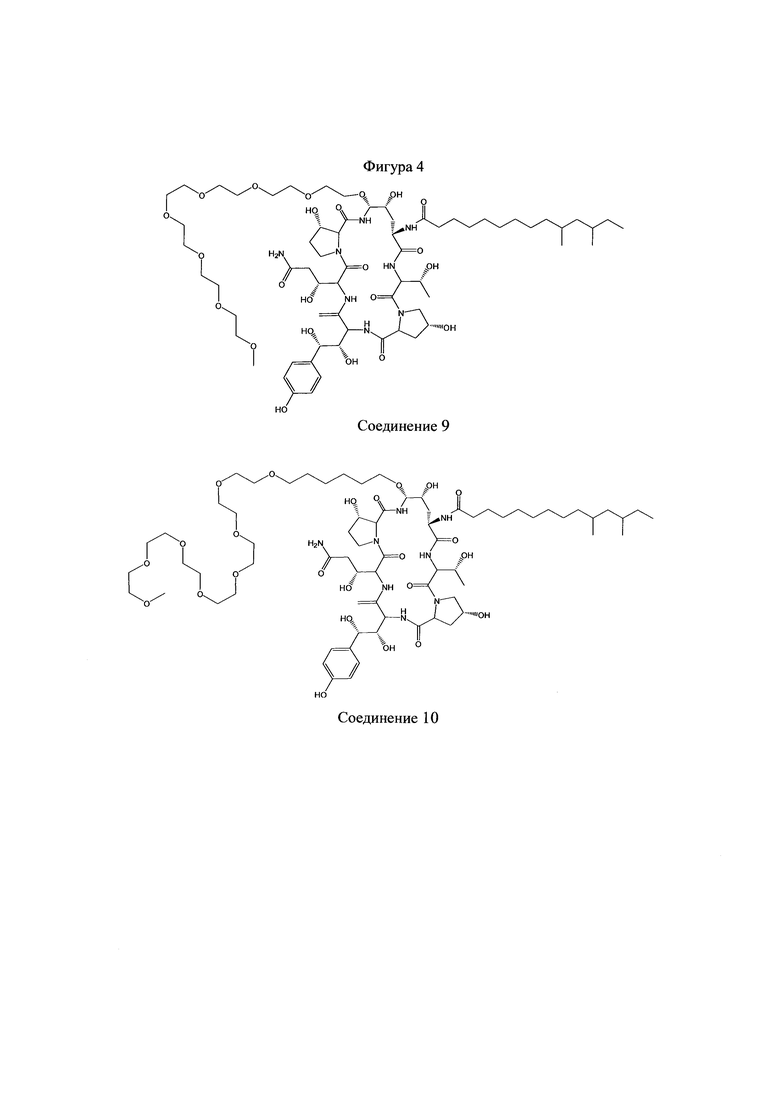
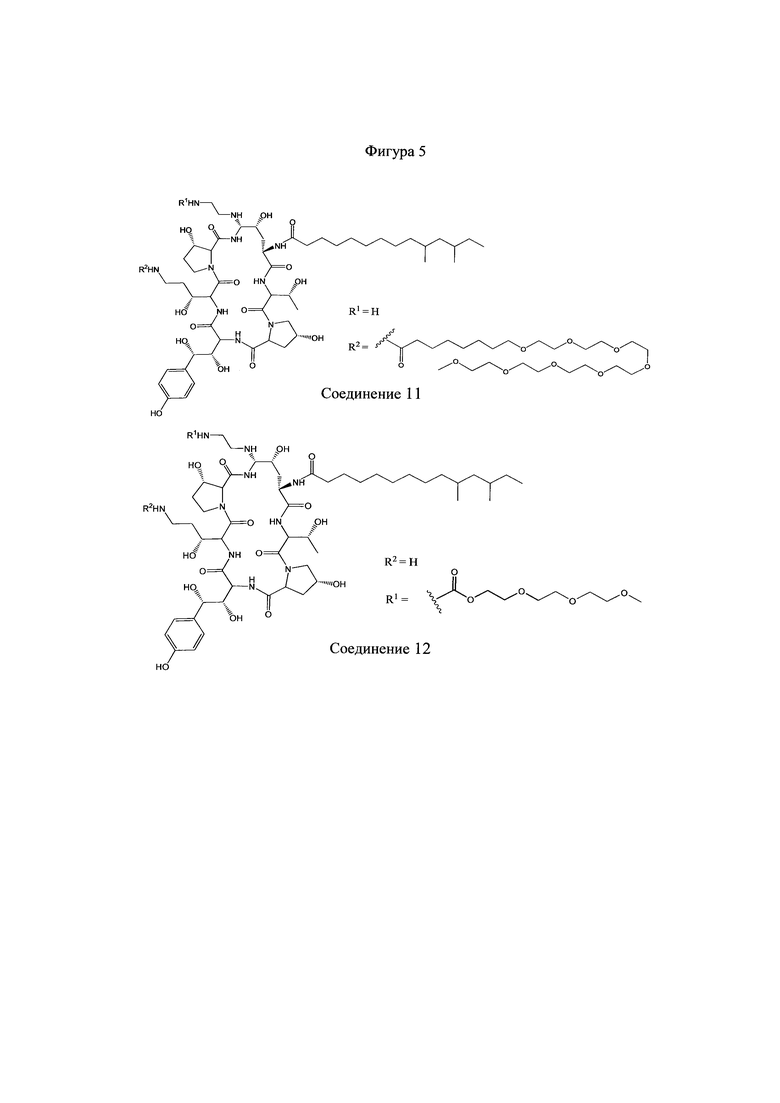
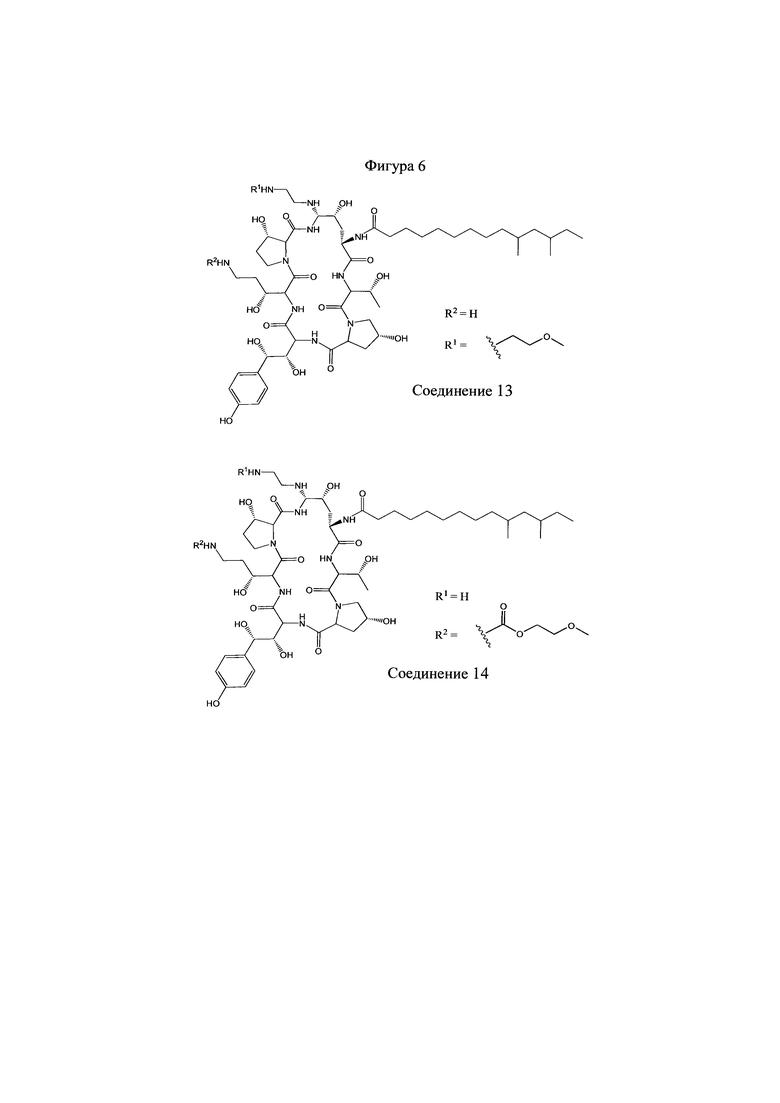
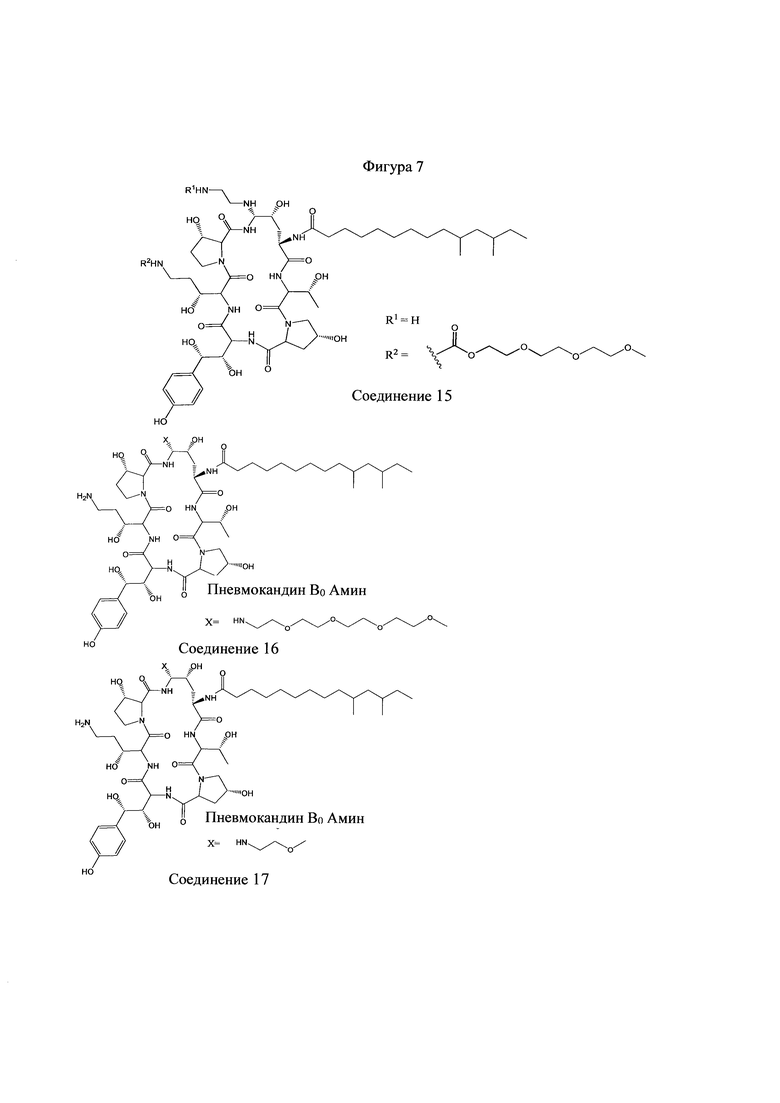
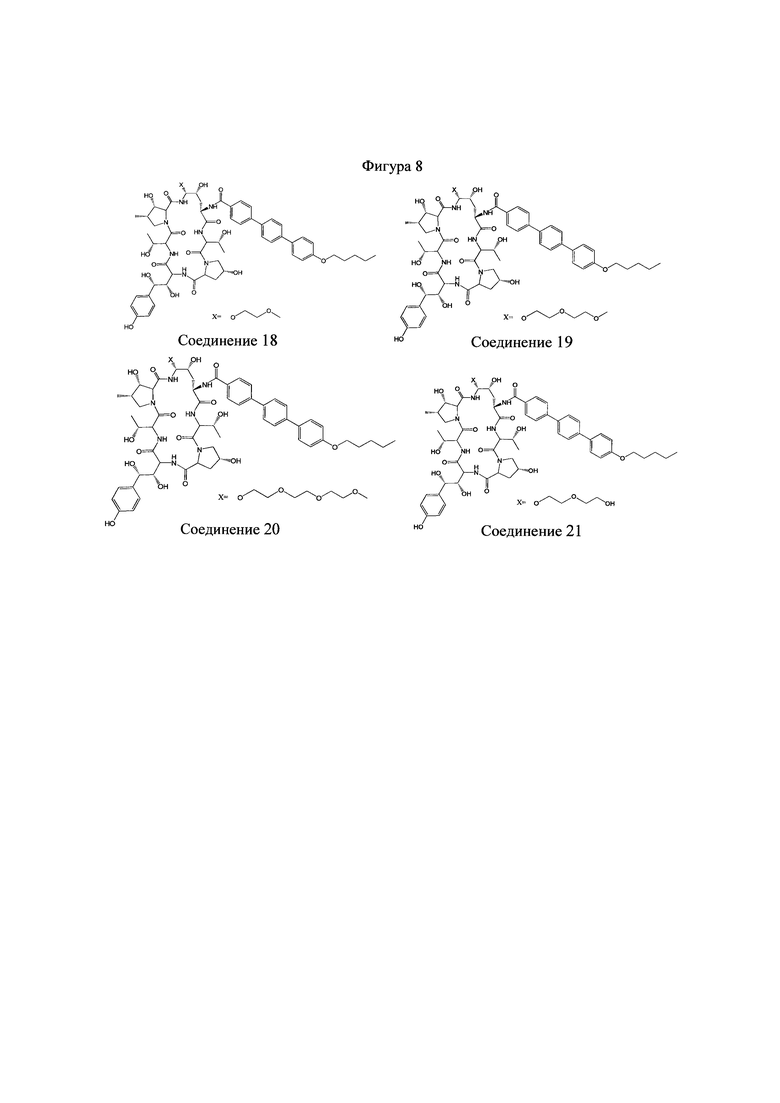
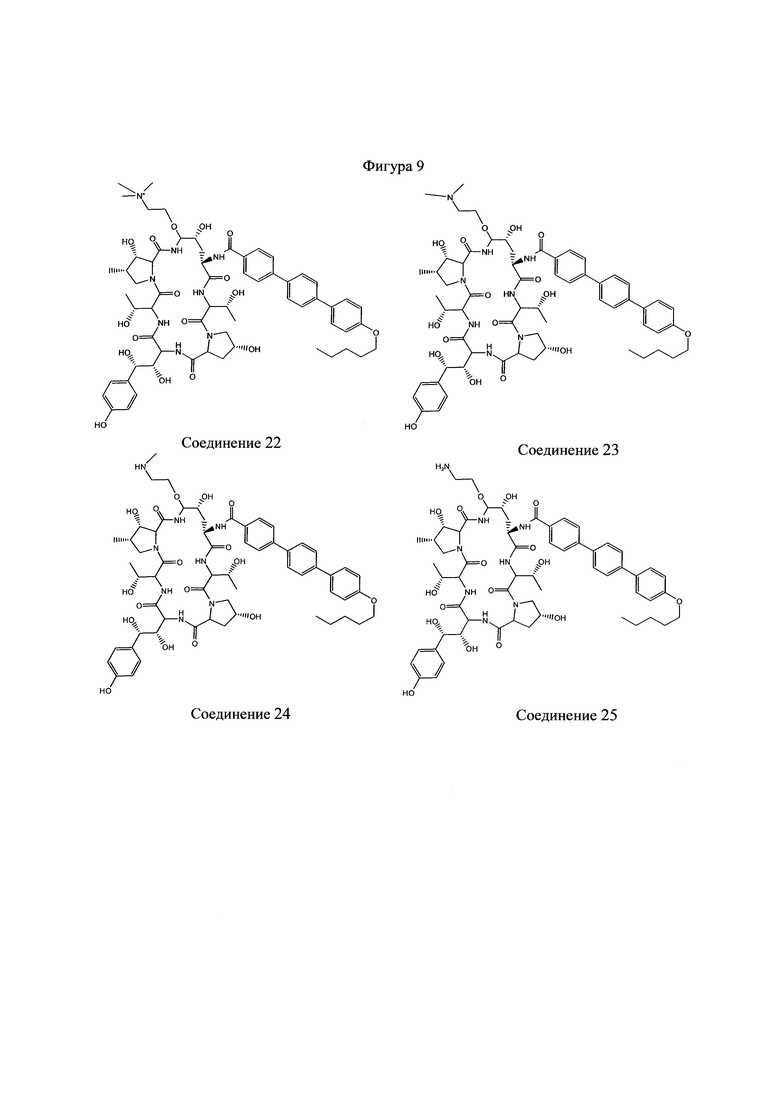
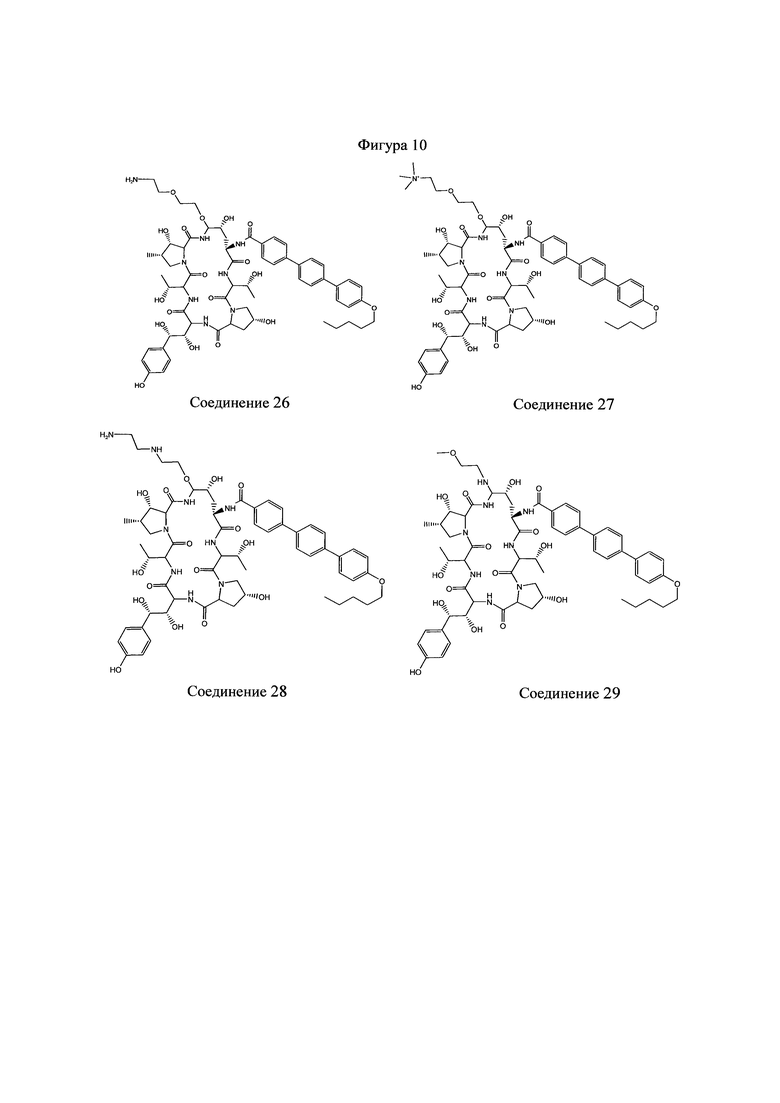
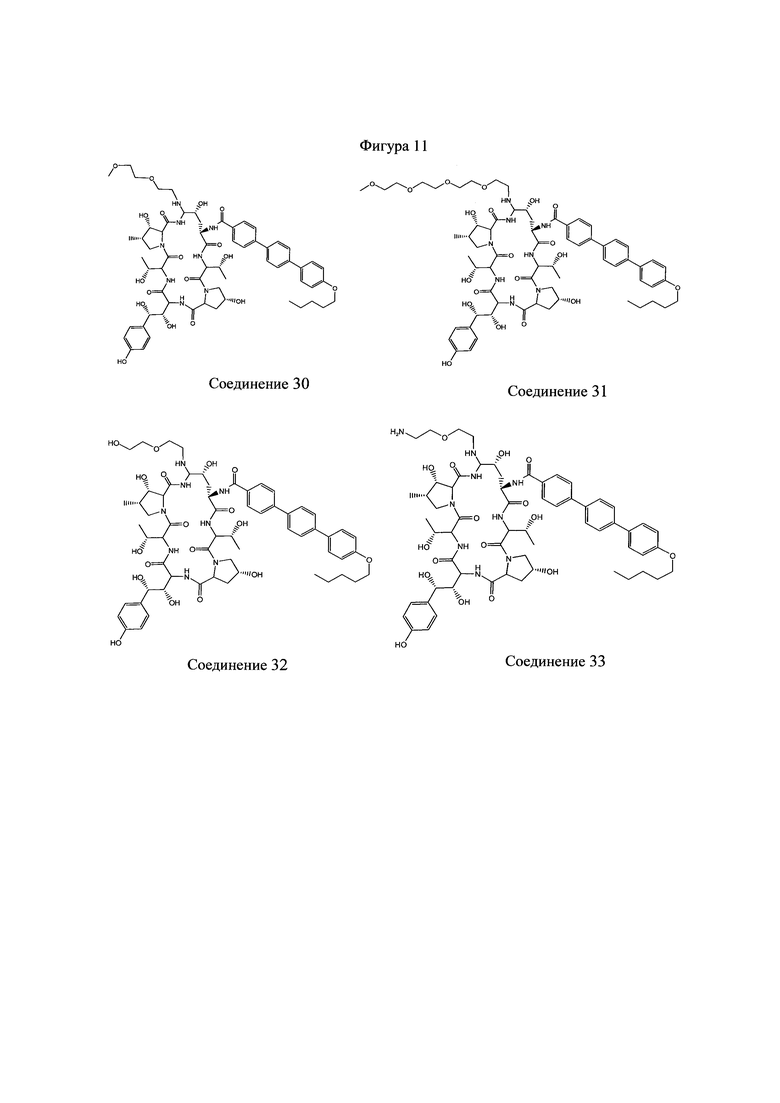
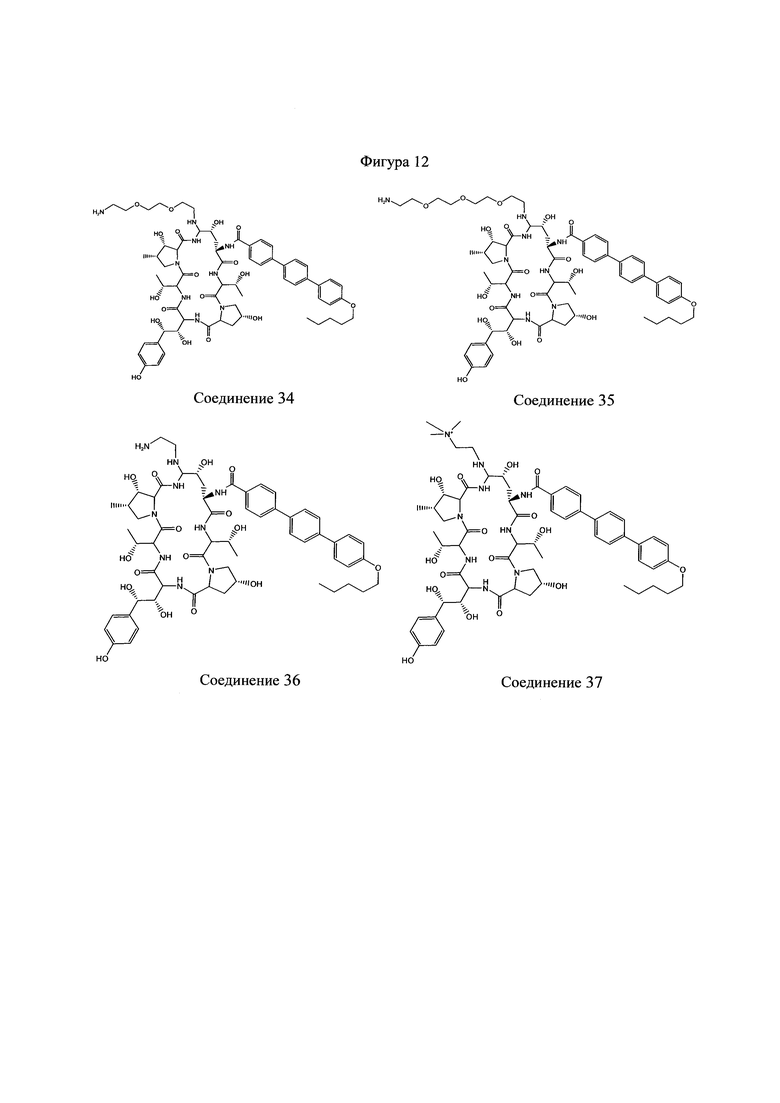
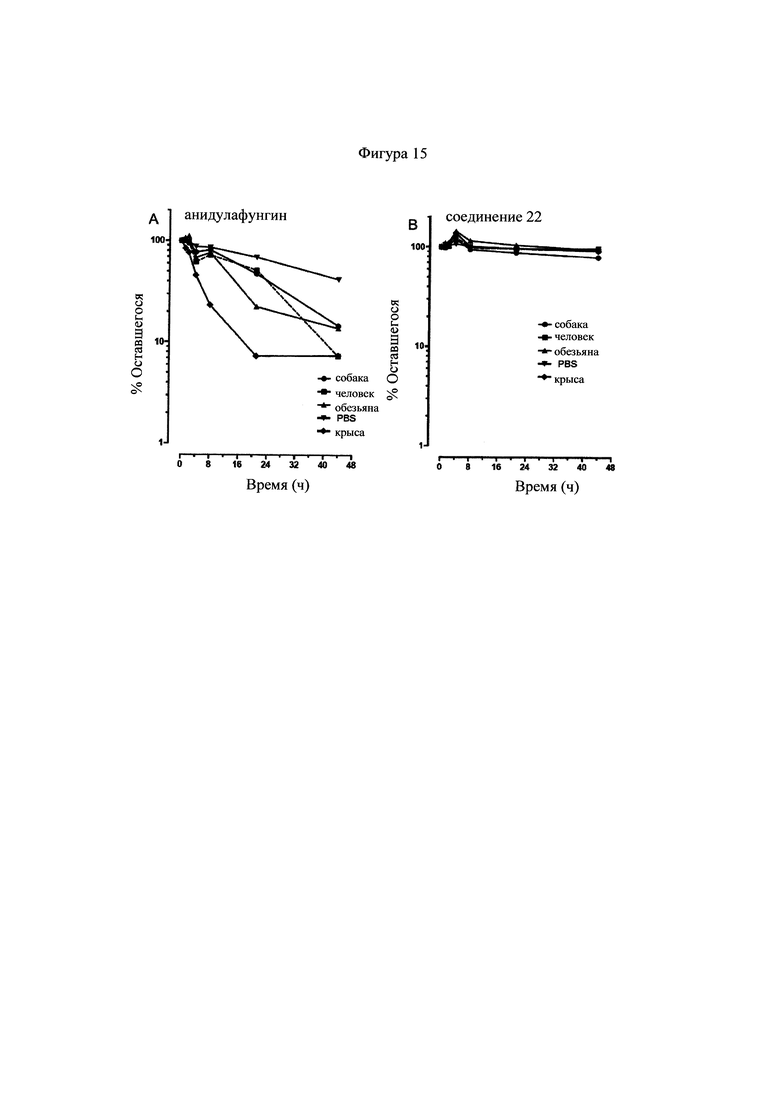
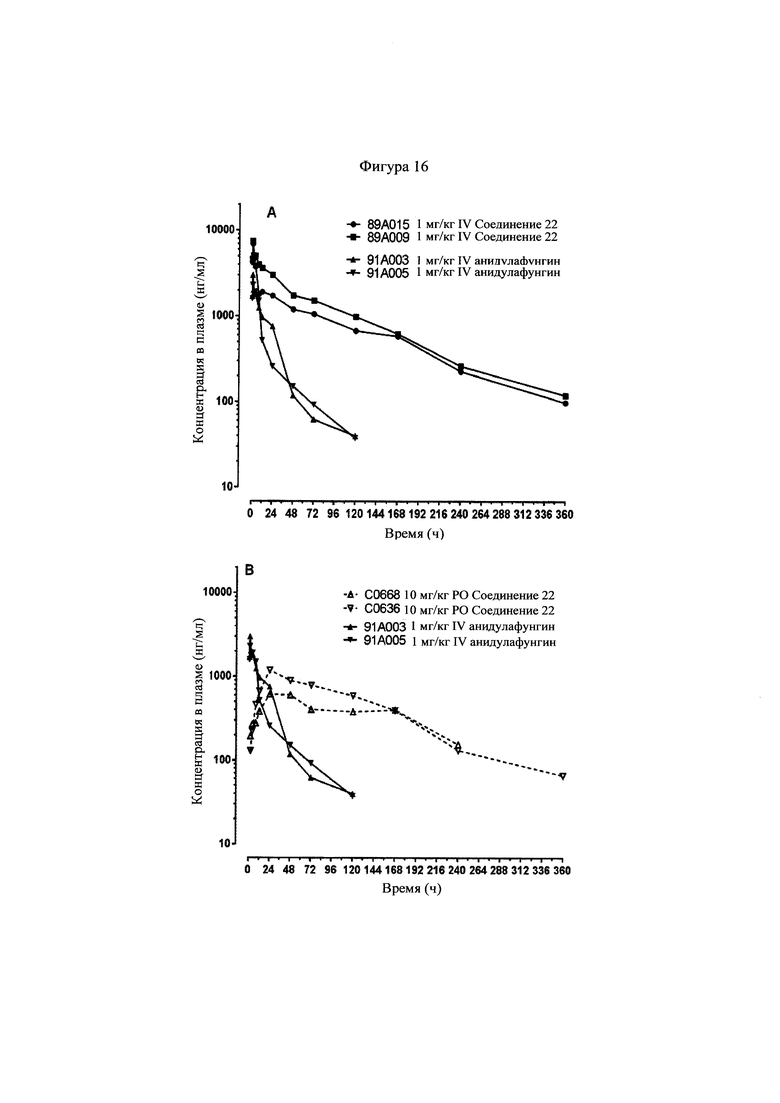
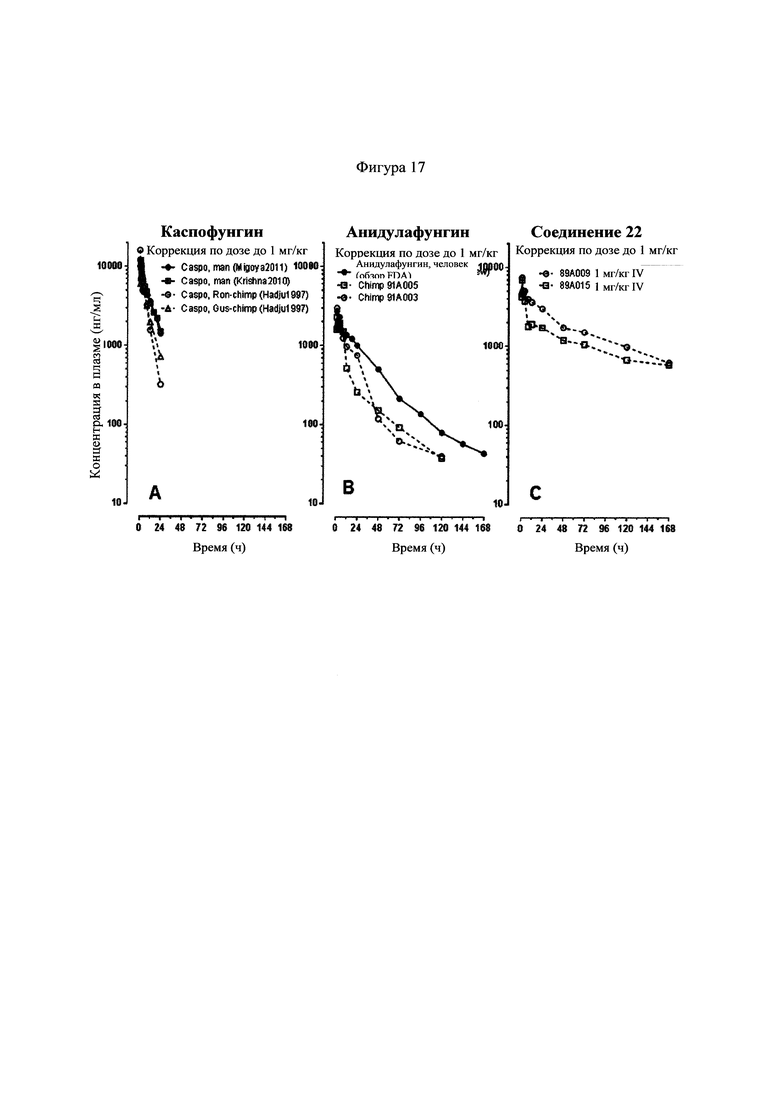
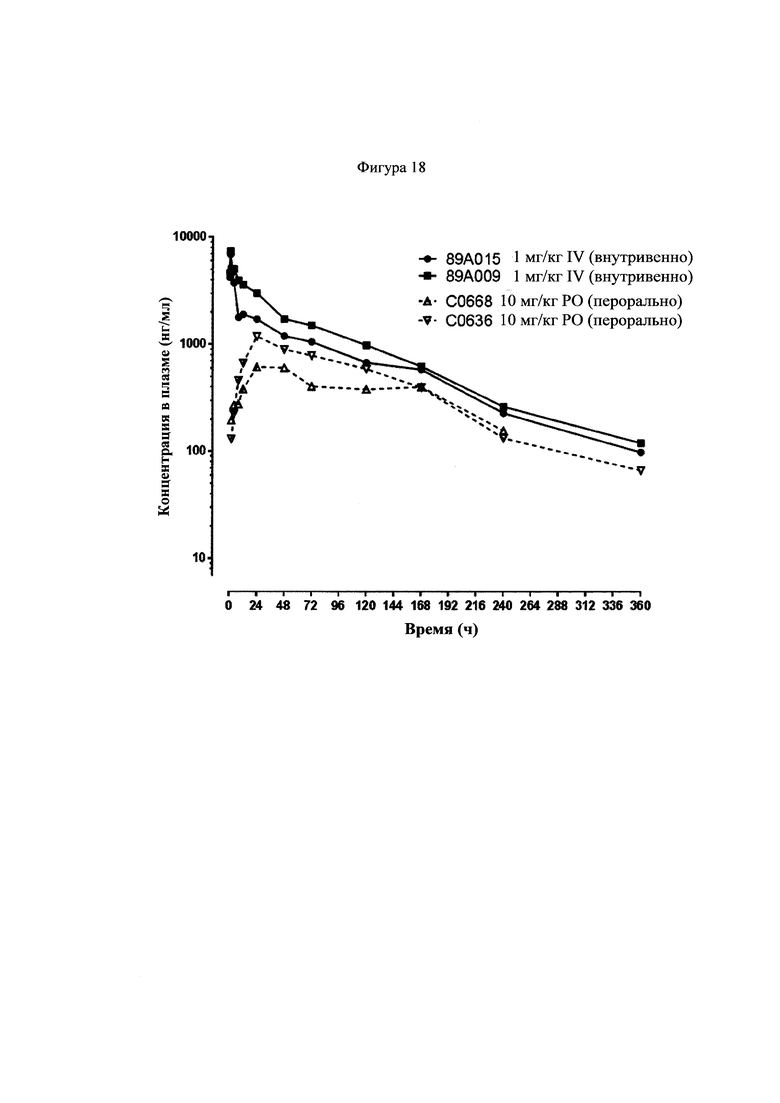
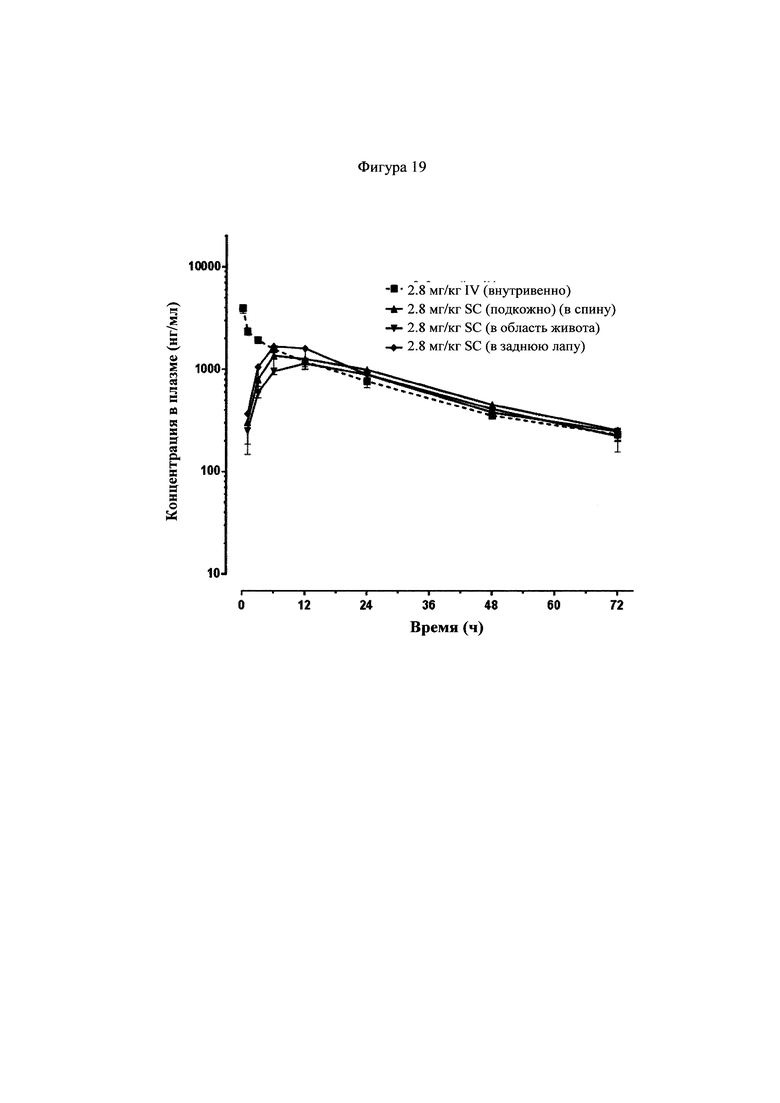
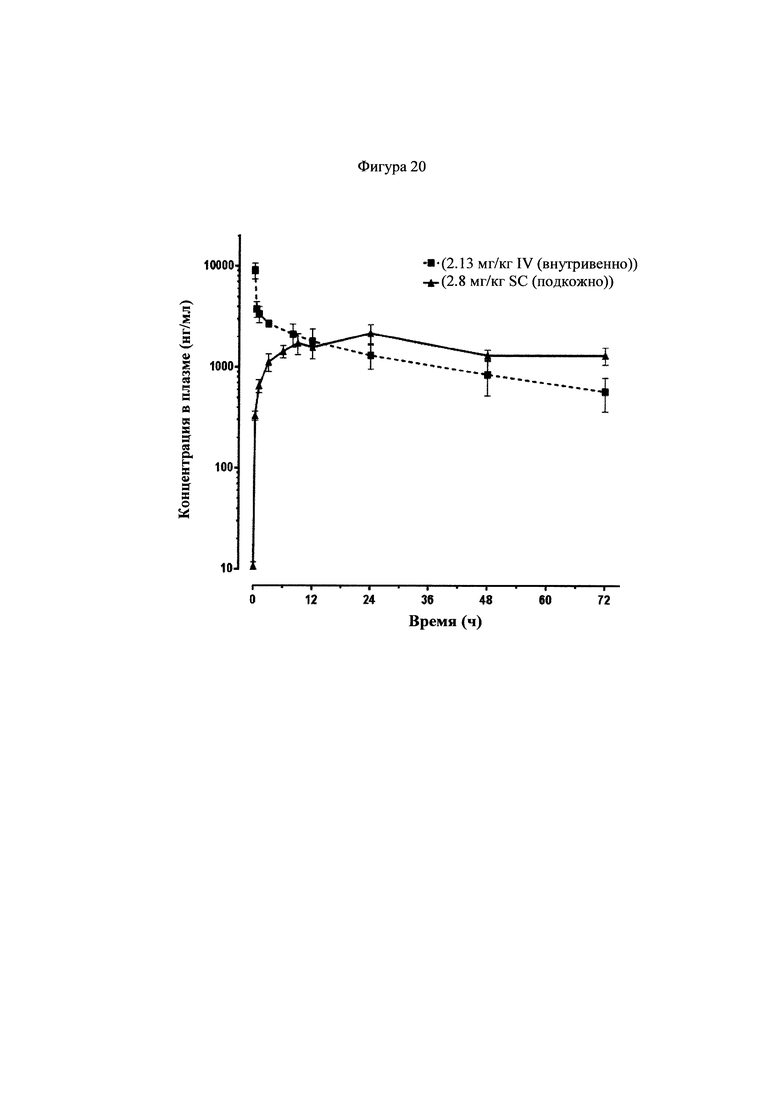
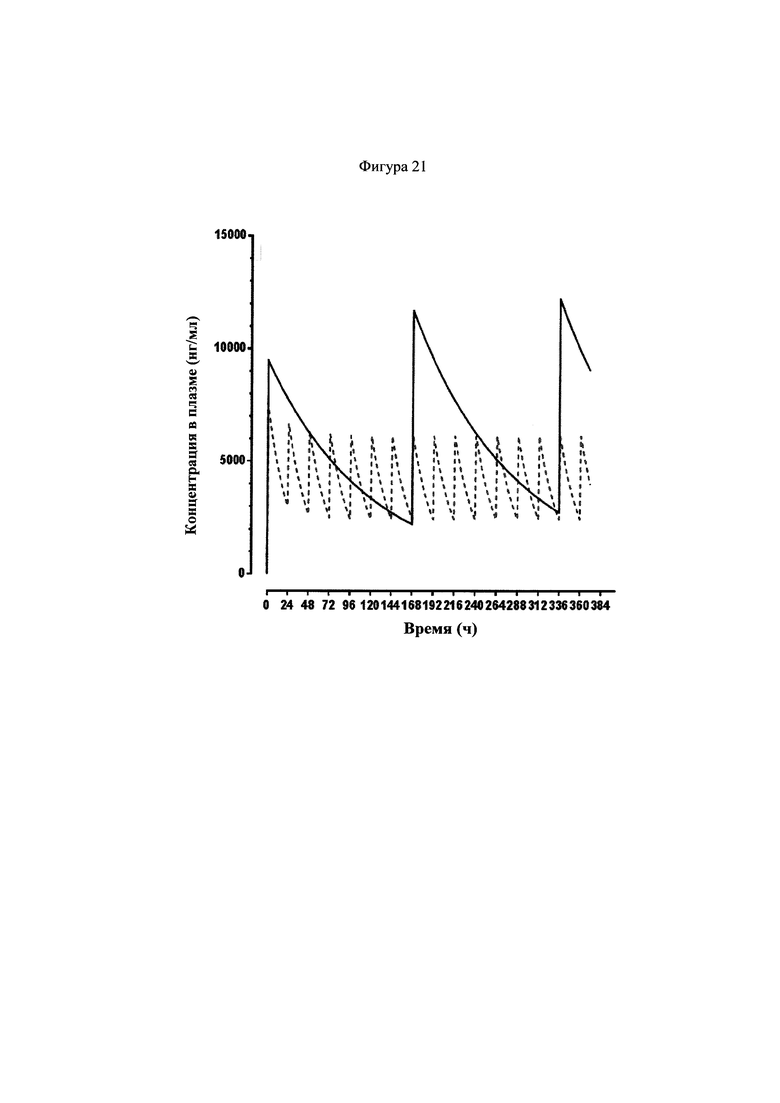
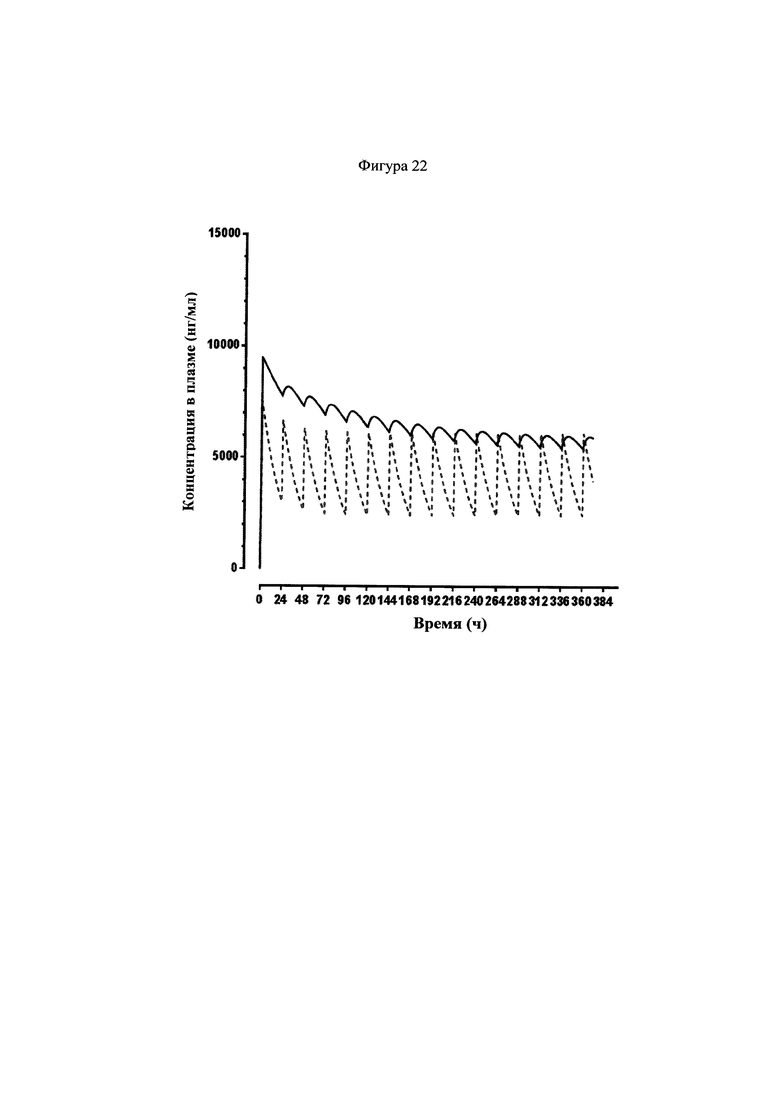
Группа изобретений относится к медицине и может быть использована для лечения грибковой инфекции. Для этого вводят соединение по п.1
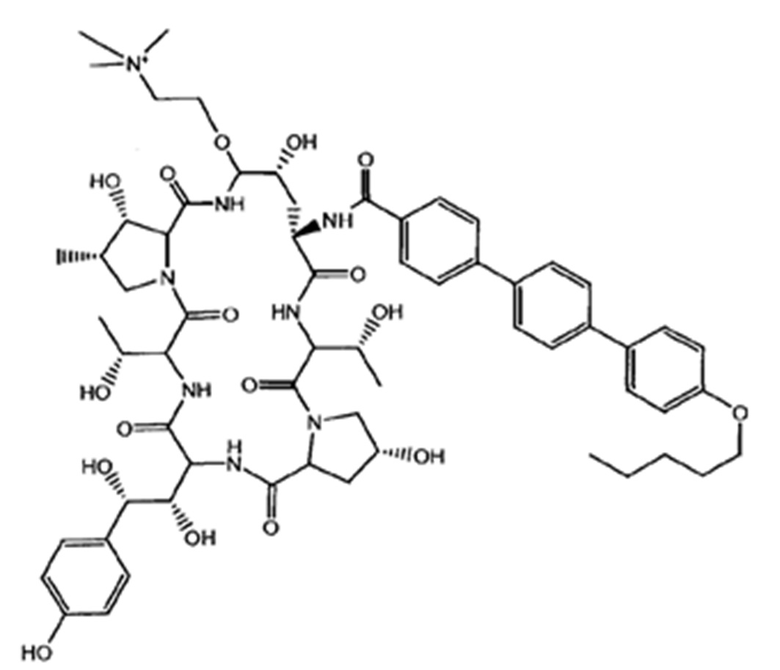
или его фармацевтически приемлемую соль в дозе насыщения или одну или несколько поддерживающих доз соединения по п.1 или его фармацевтически приемлемую соль, причем каждую из указанных доз вводят в количестве, достаточном для лечения грибковой инфекции. Также предложены лекарственная форма для инъекции в однодозных или многодозных контейнерах в виде водного раствора или лиофилизированного состава для восстановления, содержащая соединение по п.1 или его фармацевтически приемлемую соль, и устройство для инъекции водного раствора соединения по п.1 или его фармацевтически приемлемой соли, включающее контейнер, содержащий от 0,05 до 10 мл водного раствора, включающего соединение по п.1 или его фармацевтически приемлемую соль, и иглу. Группа изобретений позволяет эффективно лечить грибковую инфекцию с менее частым дозированием за счет стабильности соединения. 4 н. и 22 з.п. ф-лы, 22 ил.,14 таб., 13пр.
1. Соединение, имеющее формулу:
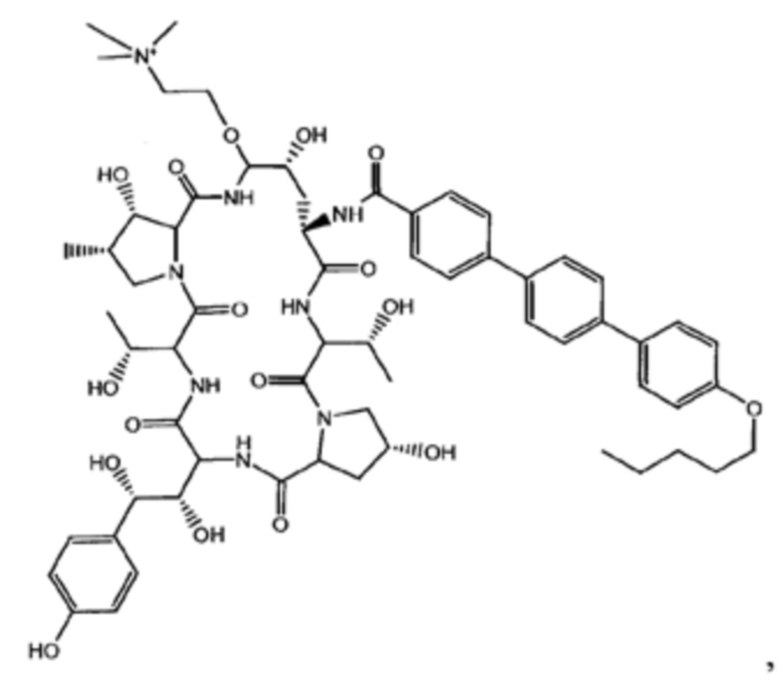
или его фармацевтически приемлемая соль.
2. Соединение по п. 1, где указанное соединение представляет собой ацетатную соль.
3. Соединение по п. 1, где указанное соединение представляет собой хлоридную соль.
4. Фармацевтическая композиция для лечения или профилактического лечения грибковой инфекции, содержащая соединение по п. 1, или его фармацевтически приемлемую соль, и фармацевтически приемлемое вспомогательное вещество.
5. Фармацевтическая композиция по п. 4, где указанное соединение представляет собой ацетатную соль.
6. Фармацевтическая композиция по п. 4, где указанное соединение представляет собой хлоридную соль.
7. Фармацевтическая композиция по п. 4, где указанная фармацевтическая композиция формулирована для перорального введения.
8. Фармацевтическая композиция по п. 4, где указанная фармацевтическая композиция формулирована для внутривенного введения.
9. Фармацевтическая композиция по п. 4, где указанная фармацевтическая композиция формулирована для местного введения.
10. Фармацевтическая композиция по п. 4, где указанная фармацевтическая композиция формулирована для подкожного введения.
11. Фармацевтическая композиция по п. 4, где указанная фармацевтическая композиция формулирована для инъекции.
12. Способ лечения грибковой инфекции у субъекта, где указанный способ включает
(i) введение указанному субъекту соединения по п. 1 или его фармацевтически приемлемой соли в дозе насыщения; и
(ii) введение указанному субъекту одной или нескольких поддерживающих доз соединения по п. 1 или его фармацевтически приемлемой соли, при этом каждую из указанной дозы насыщения и указанных поддерживающих доз вводят в количестве, которое в совокупности является достаточным для лечения указанной грибковой инфекции.
13. Способ по п. 12, где указанную дозу насыщения вводят внутривенно.
14. Способ по п. 13, где указанную дозу насыщения вводят путем внутривенной инфузии.
15. Способ по п. 13. где указанную дозу насыщения вводят в количестве, достаточном для достижения средней устойчивой концентрации соединения по п. 1 в плазме от 100 нг/мл до 20000 нг/мл.
16. Способ по п. 13, где количество соединения по п. 1, вводимого указанному субъекту внутривенно, составляет от 0,5 мг/кг до 20 мг/кг.
17. Способ по п. 13, где количество соединения по п. 1, вводимого указанному субъекту внутривенно, составляет от 25 мг до 1400 мг в течение периода 24 часа.
18. Способ по п. 13, где указанную дозу насыщения вводят внутривенно и поддерживающую дозу вводят путем инъекции.
19. Способ по п. 13, где указанную дозу насыщения вводят внутривенно путем внутривенной инфузии и поддерживающую дозу вводят инъекцией путем внутривенной инфузии.
20. Способ по п. 12, где поддерживающие дозы вводят один раз в неделю.
21. Лекарственная форма для инъекции, хранящаяся в однодозных или многодозных контейнерах в виде водного раствора или в виде лиофилизированного состава для восстановления, где указанная лекарственная форма содержит соединение по п. 1 или его фармацевтически приемлемую соль.
22. Лекарственная форма по п. 21, где лекарственная форма представляет собой восстанавливаемую сухую лекарственную форму.
23. Лекарственная форма по п. 21, где лекарственная форма формулирована для инъекции в стерильной воде или водном буфере.
24. Устройство для инъекции водного раствора соединения по п. 1 или его фармацевтически приемлемой соли субъекту, включающее контейнер, содержащий от 0,05 до 10 мл указанного водного раствора, включающего соединение по п. 1 или его фармацевтически приемлемую соль, и иглу.
25. Устройство по п. 24, где указанный контейнер содержит от 0,2 мл до 0,5 мл, от 0,5 мл до 3 мл, от 2 мл до 5 мл, от 4 мл до 7 мл или от 6 мл до 10 мл указанного водного раствора, включающего соединение по п. 1 или его фармацевтически приемлемую соль.
26. Устройство по п. 24, где указанный водный раствор включает 30±5 мг/мл, 40±10 мг/мл, 50±10 мг/мл, 60±10 мг/мл, 70±10 мг/мл, 80±10 мг/мл, 100±15 мг/мл, 130±20 мг/мл, 160±30 мг/мл, 190±30 мг/мл или 250±50 мг/мл соединения по п. 1 или его фармацевтически приемлемой соли.
| WO 2011025875 A1, 03.03.2011 | |||
| US 20090238867 A1, 24.09.2009 | |||
| US 20090074859 A1, 19.03.2009 | |||
| US 7198796 B2, 03.04.2007 | |||
| WO 2011089214 A1, 28.07.2011 | |||
| ПРОИЗВОДНЫЕ ТРИАЗОЛА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ГРИБКОВЫХ ИНФЕКЦИЙ, ПРОМЕЖУТОЧНЫЙ ПРОДУКТ | 1997 |
|
RU2176244C2 |
| БУРОВА С.А | |||
| Современные представления о грибковой инфекции пищеварительного тракта // Лечащий врач, 2005, No 6, с.55-60 | |||
| GRANDON et al | |||
| Bronchopulmonary disposition in | |||
Авторы
Даты
2020-04-21—Публикация
2013-03-14—Подача