Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к азот-содержащему гетероциклическому соединению, которое полезно в качестве ингибитора хемокина CXCL10.
Предпосылки создания изобретения
[0002]
CXCL10 (C-X-C motif chemokine 10) представляет собой CXC хемокин, известный также в качестве IP-10 (интерферон-гамма-индуцируемый белок 10). При частичном повреждении живых тканей в результате инфекции или тому подобного продуцируются хемотаксические факторы, такие как CXCL10 и MCP-1 (моноцитарный хемотаксический белок-1). В результате, моноциты, лимфоциты и нейтрофилы проникают в воспалительные ткани.
Было высказано предположение, что иммунные заболевания, такие как воспалительное заболевание кишечника, артрит, псориаз, системный склероз, системная красная волчанка и аутоиммунное нейровоспалительное заболевание, развиваются из-за повышенной продукции CXCL10. Поэтому соединение, обладающее превосходной ингибиторной активностью в отношении CXCL10, считается полезным в качестве средства для лечения, такого как профилактика и/или терапия заболевания, связанного с чрезмерной продукцией CXCL10 (Патентная литература 1).
Документы предшествующего уровня техники
Патентный документ
[0003]
Патентный документ 1: Международная публикация № WO 2009/041026
Сущность изобретения
Техническая задача
[0004]
Существует потребность в соединении, которое обладает превосходной активностью ингибирования CXCL10 и полезно в качестве средства для лечения, такого как профилактика и/или терапия заболевания, связанного с чрезмерной продукцией CXCL10.
Целью настоящего изобретения является обеспечение соединения, которое обладает превосходной активностью ингибирования CXCL10 и полезно в качестве средства для лечения, такого как профилактика и/или терапия заболевания, связанного с чрезмерной продукцией CXCL10.
Решение задачи
[0005]
В этих обстоятельствах авторы настоящего изобретения провели тщательные исследования и, в результате, создали настоящее изобретение, обнаружив, что азот-содержащее гетероциклическое соединение, показанное ниже, обладает превосходной активностью ингибирования CXCL10 и полезно в качестве средства для лечения, такого как профилактика и/или терапия заболевания, связанного с чрезмерной продукцией CXCL10.
[0006]
Таким образом, настоящее изобретение обеспечивает следующее:
<1>
Соединение, представленное общей формулой [1] или его соль:
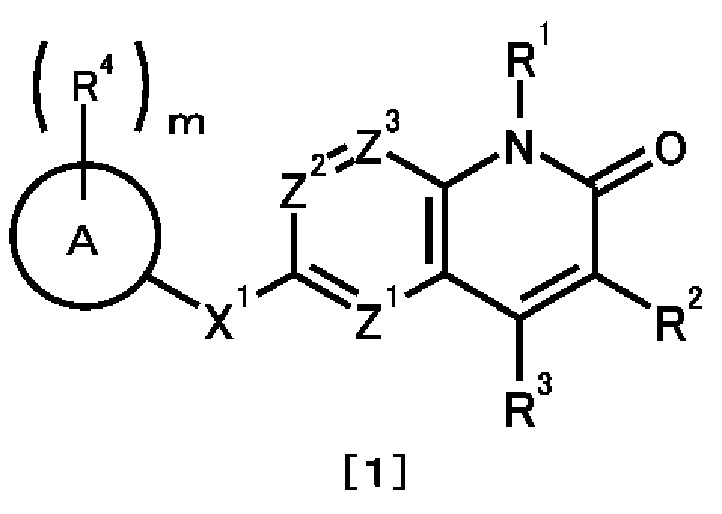
где
R1 представляет собой необязательно замещенную C1-6 алкильную группу;
R2 представляет собой атом водорода, атом галогена или необязательно замещенную C1-6 алкильную группу;
R3 представляет собой атом галогена, необязательно замещенную C1-6 алкильную группу, необязательно замещенную C2-6 алкенильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную C4-8 циклоалкенильную группу, необязательно замещенную арильную группу, необязательно замещенную C1-6 алкокси группу, необязательно замещенную C1-6 алкиламино группу, необязательно замещенную ди(C1-6 алкил)амино группу или необязательно замещенную гетероциклическую группу;
Z1, Z2 и Z3 являются одинаковыми или отличными друг от друга, и каждый представляет собой атом азота или группу, представленную общей формулой CR5, где R5 представляет собой атом водорода, атом галогена или необязательно замещенную C1-6 алкильную группу;
X1 представляет собой
(1) группу, представленную общей формулой C(=O)N(R6), где атом углерода связан с кольцом A, и R6 представляет собой атом водорода, амино-защитную группу или необязательно замещенную C1-6 алкильную группу,
(2) группу, представленную общей формулой N(R7)C(=O), где атом азота связан с кольцом A, и R7 представляет собой атом водорода, амино-защитную группу или необязательно замещенную C1-6 алкильную группу; или R7 представляет собой, вместе с одним заместителем R4 на кольце A, необязательно замещенную C2-4 алкиленовую группу, группу, представленную общей формулой O-Y1, где атом кислорода связан с кольцом A и Y1 представляет собой необязательно замещенную C1-3 алкиленовую группу, группу, представленную общей формулой S(O)n-Y2, где атом серы связан с кольцом A, Y2 представляет собой необязательно замещенную C1-3 алкиленовую группу и n представляет собой целое число от 0 до 2, или группу, представленную общей формулой N(R8)-Y3, где атом азота связан с кольцом A, Y3 представляет собой необязательно замещенную C1-3 алкиленовую группу и R8 представляет собой атом водорода, амино-защитную группу, необязательно замещенную C1-6 алкильную группу или необязательно замещенную арильную группу,
(3) необязательно замещенную двухвалентную циклическую углеводородную группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов, или
(4) необязательно замещенную двухвалентную гетероциклическую группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов;
кольцо А представляет собой циклическую углеводородную группу или гетероциклическую группу;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена, циано группу, нитро группу, амино-защитную группу, необязательно замещенную C1-6 алкильную группу, необязательно замещенную C2-6 алкенильную группу, необязательно замещенную C2-6 алкинильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную C4-8 циклоалкенильную группу, необязательно замещенную арильную группу, необязательно замещенную C1-6 алкокси группу, необязательно замещенную арилокси группу, необязательно замещенную C1-6 алкиламино группу, необязательно замещенную ди(C1-6 алкил)амино группу, необязательно замещенную ариламино группу, необязательно замещенную карбамоильную группу, необязательно замещенную сульфамоильную группу, необязательно замещенную C1-6 алкилтио группу, необязательно замещенную арилтио группу, необязательно замещенную C1-6 алкилсульфонильную группу, необязательно замещенную арилсульфонильную группу, необязательно замещенную гетероциклическую группу, необязательно защищенную амино группу, необязательно защищенную гидроксильную группу, необязательно защищенную карбоксильную группу,
необязательно замещенную C2-5 алкиленовую группу, образованную взятыми вместе двумя смежными R4,
необязательно замещенную C2-4 алкиленовую группу, образованную взятыми вместе одним R4 и R7,
группу, представленную общей формулой O-Y1, образованную взятыми вместе одним R4 и R7, где атом кислорода связан с кольцом A, и Y1 представляет собой необязательно замещенную C1-3 алкиленовую группу,
группу, представленную общей формулой S(O)n-Y2, образованную взятыми вместе одним R4 и R7, где атом серы связан с кольцом A, Y2 представляет собой необязательно замещенную C1-3 алкиленовую группу, и n представляет собой целое число от 0 до 2, или
группу, представленную общей формулой N(R8)-Y3, образованную взятыми вместе одним R4 и R7, где атом азота связан с кольцом A, Y3 представляет собой необязательно замещенную C1-3 алкиленовую группу, и R8 представляет собой атом водорода, амино-защитную группу, необязательно замещенную C1-6 алкильную группу или необязательно замещенную арильную группу; и
m представляет собой целое число от 0 до 5.
[0007]
<2>
Соединение по пункту <1> или его соль, где
R2 представляет собой атом водорода или необязательно замещенную C1-6 алкильную группу; и
каждый из Z1, Z2 и Z3 представляет собой CH.
<3>
Соединение по пункту <1> или <2> или его соль, где
R1 представляет собой C1-3 алкильную группу, и
R3 представляет собой необязательно замещенную C1-6 алкильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную арильную группу или необязательно замещенную гетероциклическую группу.
<4>
Соединение по любому одному из пунктов <1>-<3> или его соль, где кольцо А представляет собой циклическую углеводородную группу.
[0008]
<5>
Соединение по любому одному из пунктов <1>-<4> или его соль, где X1 представляет собой группу, представленную общей формулой C(=O)N(R6), где атом углерода связан с кольцом A, и R6 представляет собой атом водорода, амино-защитную группу или необязательно замещенную C1-6 алкильную группу.
<6>
Соединение по любому одному из пунктов <1>-<4> или его соль, где
X1 представляет собой группу, представленную общей формулой C(=O)N(R6a), где атом углерода связан с кольцом A, и R6a представляет собой атом водорода или необязательно замещенную C1-3 алкильную группу;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена, необязательно замещенную C1-3 алкильную группу, необязательно замещенную C1-3 алкиламино группу или необязательно защищенную амино группу; и
m представляет собой целое число от 0 до 2.
[0009]
<7>
Соединение по любому одному из пунктов <1>-<4> или его соль, где
R3 представляет собой необязательно замещенную C1-6 алкильную группу, необязательно замещенную C3-8 циклоалкильную группу или необязательно замещенную гетероциклическую группу;
X1 представляет собой группу, представленную общей формулой C(=O)N(R6b), где атом углерода связан с кольцом A, и R6b представляет собой необязательно замещенную C1-3 алкильную группу;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена или необязательно замещенную C1-3 алкильную группу; и
m представляет собой целое число от 0 до 2.
<8>
Соединение по пункту <7> или его соль, где
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена; и
m представляет собой целое число от 0 до 2.
[0010]
<9>
Соединение по любому одному из пунктов <1>-<4> или его соль, где
X1 представляет собой группу, представленную общей формулой N(R7)C(=O), где атом азота связан с кольцом A, и R7 представляет собой атом водорода, амино-защитную группу или необязательно замещенную C1-6 алкильную группу; или R7 представляет собой, вместе с одним заместителем R4 на кольце A, необязательно замещенную C2-4 алкиленовую группу, группу, представленную общей формулой O-Y1, где атом кислорода связан с кольцом A и Y1 представляет собой необязательно замещенную C1-3 алкиленовую группу, группу, представленную общей формулой S(O)n-Y2, где атом серы связан с кольцом A, Y2 представляет собой необязательно замещенную C1-3 алкиленовую группу и n представляет собой целое число от 0 до 2, или группу, представленную общей формулой N(R8)-Y3, где атом азота связан с кольцом A, Y3 представляет собой необязательно замещенную C1-3 алкиленовую группу и R8 представляет собой атом водорода, амино-защитную группу, необязательно замещенную C1-6 алкильную группу или необязательно замещенную арильную группу.
<10>
Соединение по любому одному из пунктов <1>-<4> или его соль, где
R3 представляет собой необязательно замещенную C1-6 алкильную группу, необязательно замещенную C3-8 циклоалкильную группу или необязательно замещенную гетероциклическую группу;
X1 представляет собой группу, представленную общей формулой N(R7a)C(=O), где атом азота связан с кольцом A и R7a представляет собой необязательно замещенную C1-3 алкильную группу, или R7a представляет собой, вместе с одним заместителем R4 на кольце A, необязательно замещенную C2-3 алкиленовую группу или группу, представленную общей формулой O-Y1a, где атом кислорода связан с кольцом A и Y1a представляет собой этиленовую группу;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена, необязательно замещенную C1-3 алкильную группу, необязательно замещенную C1-3 алкилсульфонильную группу,
необязательно замещенную C2-3 алкиленовую группу, образованную взятыми вместе двумя смежными R4,
необязательно замещенную C2-3 алкиленовую группу, образованную взятыми вместе одним R4 и R7a, или
группу, представленную общей формулой O-Y1a, образованную взятыми вместе одним R4 и R7a, где атом кислорода связан с кольцом A и Y1a представляет собой этиленовую группу; и
m представляет собой целое число от 0 до 2.
[0011]
<11>
Соединение по любому одному из пунктов <1>-<4> или его соль, где
R3 представляет собой необязательно замещенную гетероциклическую группу;
X1 представляет собой группу, представленную общей формулой N(R7b)C(=O), где атом азота связан с кольцом A и R7b представляет собой необязательно замещенную C1-3 алкильную группу, или R7b представляет собой, вместе с одним заместителем R4 на кольце A, необязательно замещенную C2-3 алкиленовую группу;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой необязательно замещенную C1-3 алкильную группу,
необязательно замещенную C2-3 алкиленовую группу, образованную взятыми вместе двумя смежными R4, или
необязательно замещенную C2-3 алкиленовую группу, образованную взятыми вместе одним R4 и R7b; и
m представляет собой целое число от 0 до 2.
<12>
Соединение по пункту <11> или его соль, где
X1 представляет собой группу, представленную общей формулой N(R7b)C(=O), где атом азота связан с кольцом A и R7b представляет собой необязательно замещенную C1-3 алкильную группу, или R7b представляет собой, вместе с одним заместителем R4 на кольце A, необязательно замещенную C2-3 алкиленовую группу;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой необязательно замещенную C1-3 алкильную группу или
необязательно замещенную C2-3 алкиленовую группу, образованную взятыми вместе одним R4 и R7b; и
m представляет собой целое число от 0 до 2.
[0012]
<13>
Соединение по любому одному из пунктов <1>-<4> или его соль, где X1 представляет собой необязательно замещенную двухвалентную циклическую углеводородную группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов, или необязательно замещенную двухвалентную гетероциклическую группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов.
<14>
Соединение по любому одному из пунктов <1>-<4> или его соль, где
R3 представляет собой необязательно замещенную C1-6 алкильную группу или необязательно замещенную гетероциклическую группу;
X1 представляет собой необязательно замещенную двухвалентную циклическую углеводородную группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов, или необязательно замещенную двухвалентную гетероциклическую группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена; и
m представляет собой целое число от 0 до 2.
[0013]
<15>
Соединение по пункту <14> или его соль, где
R3 представляет собой необязательно замещенную гетероциклическую группу; и
X1 представляет собой необязательно замещенную двухвалентную гетероциклическую группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов.
<16>
Фармацевтическая композиция, включающая соединение по любому одному из пунктов <1>-<15> или его соль.
<17>
Средство для лечения иммунного заболевания, включающее соединение по любому одному из пунктов <1>-<15> или его соль.
Полезные эффекты изобретения
[0014]
Соединение по настоящему изобретению обладает превосходной ингибиторной активностью в отношении CXCL10 и полезно в качестве средства для лечения, такого как профилактика и/или терапия заболевания, связанного с чрезмерной продукцией CXCL10.
Описание вариантов осуществления
[0015]
Настоящее изобретение будет подробно описано ниже.
В настоящем изобретении % означает масс.%, если не указано иное.
В настоящем изобретении каждый термин имеет следующее значение, если не указано иное.
Атом галогена означает атом фтора, атом хлора, атом брома или атом йода.
C1-6 алкильная группа означает линейную или разветвленную C1-6 алкильную группу, такую как метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, втор-бутильная группа, изобутильная группа, трет-бутильная группа, пентильная группа, изопентильная группа и гексильная группа.
C1-3 алкильная группа означает метильную группу, этильную группу, пропильную группу или изопропильную группу.
C2-6 алкенильная группа означает линейную или разветвленную C2-6 алкенильную группу, такую как винильная группа, аллильная группа, пропенильная группа, изопропенильная группа, бутенильная группа, изобутенильная группа, 1,3-бутадиенильная группа, пентенильная группа и гексенильная группа.
C2-6 алкинильная группа означает линейную или разветвленную C2-6 алкинильную группу, такую как этинильная группа, пропинильная группа, бутинильная группа, пентинильная группа и гексинильная группа.
C3-8 циклоалкильная группа означает C3-8 циклоалкильную группу, такую как циклопропильная группа, циклобутильная группа, циклопентильная группа и циклогексильная группа.
C4-8 циклоалкенильная группа означает C4-8 циклоалкенильную группу, такую как циклобутенильная группа, циклопентенильная группа, циклогексенильная группа и циклогексадиенильная группа.
Арильная группа означает фенильную группу или нафтильную группу.
ar-C1-6 алкильная группа означает ar-C1-6 алкильную группу, такую как бензильная группа, дифенилметильная группа, тритильная группа, фенетильная группа и нафтилметильная группа.
[0016]
C2-5 алкиленовая группа означает линейную или разветвленную C2-5 алкиленовую группу, такую как этилиденовая группа, этиленовая группа, триметиленовая группа, пропиленовая группа, тетраметиленовая группа и пентаметиленовая группа.
C2-4 алкиленовая группа означает линейную или разветвленную C2-4 алкиленовую группу, такую как этилиденовая группа, этиленовая группа, триметиленовая группа, пропиленовая группа и тетраметиленовая группа.
C2-3 алкиленовая группа означает этилиденовую группу, этиленовую группу, триметиленовую группу или пропиленовую группу.
C1-3 алкиленовая группа означает метиленовую группу, этилиденовую группу, этиленовую группу, триметиленовую группу или пропиленовую группу.
[0017]
C1-6 алкокси группа означает линейную или разветвленную C1-6 алкилокси группу, такую как метокси группа, этокси группа, пропокси группа, изопропокси группа, бутокси группа, изобутокси группа, втор-бутокси группа, трет-бутокси группа, пентилокси группа и гексилокси группа.
Арилокси группа означает фенокси группу или нафтилокси группу.
C1-6 алкокси-C1-6 алкильная группа означает C1-6 алкилокси-C1-6 алкильную группу, такую как метоксиметильная группа и 1-этоксиэтильная группа.
ar-C1-6 алкокси-C1-6 алкильная группа означает ar-C1-6 алкилокси-C1-6 алкильную группу, такую как бензилоксиметильная группа и фенетилоксиметильная группа.
[0018]
C2-6 алканоильная группа означает линейную или разветвленную C2-6 алканоильную группу, такую как ацетильная группа, пропионильная группа, валерильная группа, изовалерильная группа и пивалоильная группа.
Ароильная группа означает бензоильную группу или нафтоильную группу.
Гетероциклическая карбонильная группа означает фуроильную группу, теноильную группу, пирролидинилкарбонильную группу, пиперидинилкарбонильную группу, пиперазинилкарбонильную группу, морфолинилкарбонильную группу или пиридинилкарбонильную группу.
Ацильная группа означает формильную группу, C2-6 алканоильную группу, ароильную группу или гетероциклическую карбонильную группу.
C1-6 алкоксикарбонильная группа означает линейную или разветвленную C1-6 алкилоксикарбонильную группу, такую как метоксикарбонильная группа, этоксикарбонильная группа, пропоксикарбонильная группа, изопропоксикарбонильная группа, трет-бутоксикарбонильная группа и 1,1-диметилпропоксикарбонильная группа.
Арилоксикарбонильная группа означает фенилоксикарбонильную группу или нафтилоксикарбонильную группу.
ar-C1-6 алкоксикарбонильная группа означает ar-C1-6 алкилоксикарбонильную группу, такую как бензилоксикарбонильная группа и фенетилоксикарбонильная группа.
[0019]
C1-6 алкиламино группа означает линейную или разветвленную C1-6 алкиламино группу, такую как метиламино группа, этиламино группа, пропиламино группа, изопропиламино группа, бутиламино группа, втор-бутиламино группа, трет-бутиламино группа, пентиламино группа и гексиламино группа.
C1-3 алкиламино группа означает линейную или разветвленную C1-3 алкиламино группу, такую как метиламино группа, этиламино группа, пропиламино группа и изопропиламино группа.
Ди(C1-6 алкил)амино группа означает линейную или разветвленную ди(C1-6 алкил)амино группу, такую как диметиламино группа, диэтиламино группа, дипропиламино группа, диизопропиламино группа, дибутиламино группа, ди(трет-бутил)амино группа, дипентиламино группа, дигексиламино группа, (этил)(метил)амино группа и (метил)(пропил)амино группа.
Ариламино группа означает фениламино группу или нафтиламино группу.
[0020]
C1-6 алкилтио группа означает C1-6 алкилтио группу, такую как метилтио группа, этилтио группа и пропилтио группа.
Арилтио группа означает фенилтио группу или нафтилтио группу.
C1-6 алкилсульфонильная группа означает C1-6 алкилсульфонильную группу, такую как метилсульфонильная группа, этилсульфонильная группа и пропилсульфонильная группа.
C1-3 алкилсульфонильная группа означает C1-3 алкилсульфонильную группу, такую как метилсульфонильная группа, этилсульфонильная группа и пропилсульфонильная группа.
Арилсульфонильная группа означает бензолсульфонильную группу, пара-толуолсульфонильную или нафталинсульфонильную группу.
C1-6 алкилсульфонилокси группа означает C1-6 алкилсульфонилокси группу, такую как метилсульфонилокси группа, этилсульфонилокси группа и пропилсульфонилокси группа.
Арилсульфонилокси группа означает бензолсульфонилокси группу, пара-толуолсульфонилокси группу или нафталинсульфонилокси группу.
[0021]
Силильная группа означает триметилсилильную группу, триэтилсилильную группу или трибутилсилильную группу.
[0022]
Циклическая амино группа означает, например, циклическую амино группу, которая содержит один или несколько атомов азота в качестве гетероатомов, входящих в состав кольца, и может дополнительно содержать один или несколько атомов, выбранных из атома кислорода и атома серы, такую как азиридинил, азетидинил, пирролидинил, пиперидинил, гомопиперидинил, пирролил, дигидропирролил, пиразолил, пиразолинил, пиразолидинил, имидазолил, имидазолинил, имидазолидинил, тиазолинил, тиазолидинил, дигидротиадиазолил, пиперазинил, гомопиперазинил, морфолинил, гомоморфолинил, тиоморфолинил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидроизохинолинил, бензоморфолинил, дигидропиридоксазинил и хинуклидинил.
[0023]
Циклическая углеводородная группа означает C3-8 циклоалкильную группу, C4-8 циклоалкенильную группу или арильную группу.
[0024]
Моноциклическая азот-содержащая гетероциклическая группа означает моноциклическую азот-содержащую гетероциклическую группу, которая содержит в качестве гетероатома, входящего в состав кольца, только атом азота и необязательно замещена оксо группой, такую как азетидинильная группа, пирролидинильная группа, оксопирролидинильная группа, пирролинильная группа, пирролильная группа, пиперидильная группа, оксопиперидильная группа, тетрагидропиридильная группа, дигидропиридильная группа, пиридильная группа, гомопиперидинильная группа, октагидроазоцинильная группа, имидазолидинильная группа, оксоимидазолидинильная группа, имидазолинильная группа, дигидрооксоимидазолильная группа, имидазолильная группа, пиразолидинильная группа, пиразолинильная группа, пиразолильная группа, пиперазинильная группа, гомопиперазинильная группа, пиразинильная группа, пиридазинильная группа, пиримидинильная группа, триазолидинильная группа, диоксотриазолидинильная группа, триазолильная группа и тетразолильная группа.
Моноциклическая кислород-содержащая гетероциклическая группа означает оксетанильную группу, тетрагидрофуранильную группу, оксотетрагидрофуранильную группу, фуранильную группу, тетрагидропиранильную группу, оксотетрагидропиранильную группу, дигидропиранильную группу или пиранильную группу.
Моноциклическая содержащая серу гетероциклическая группа означает тетрагидротиенильную группу, оксотетрагидротиенильную группу или тиенильную группу.
Моноциклическая азот- и кислород-содержащая гетероциклическая группа означает моноциклическую азот- и кислород-содержащую гетероциклическую группу, которая содержит в качестве гетероатомов, входящих в состав кольца, только атом азота и атом кислорода и необязательно замещена оксо группой, такую как оксазолильная группа, изоксазолильная группа, оксоизоксазолильная группа, оксадиазолильная группа и морфолинильная группа.
Моноциклическая содержащая азот и серу гетероциклическая группа означает моноциклическую содержащую азот и серу гетероциклическую группу, которая содержит в качестве гетероатомов, входящих в состав кольца, только атом азота и атом серы и необязательно замещена оксо группой, такую как тиазолильная группа, изотиазолильная группа, тиадиазолильная группа, тиоморфолинильная группа, 1-оксидотиоморфолинильная группа и 1,1-диоксидотиоморфолинильная группа.
Моноциклическая гетероциклическая группа означает моноциклическую азот-содержащую гетероциклическую группу, моноциклическую кислород-содержащую гетероциклическую группу, моноциклическую содержащую серу гетероциклическую группу, моноциклическую азот- и кислород-содержащую гетероциклическую группу или моноциклическую содержащую азот и серу гетероциклическую группу.
[0025]
Бициклическая азот-содержащая гетероциклическая группа означает бициклическую азот-содержащую гетероциклическую группу, которая содержит в качестве гетероатома, входящего в состав колец, только атом азота и необязательно замещена оксо группой, такую как индолинильная группа, оксоиндолинильная группа, индолильная группа, изоиндолинильная группа, оксоизоиндолинильная группа, изоиндолильная группа, пирролопиридинильная группа, индазолильная группа, бензимидазолильная группа, бензотриазолильная группа, тетрагидрохинолинильная группа, оксотетрагидрохинолинильная группа, дигидрохинолинильная группа, оксодигидрохинолинильная группа, хинолинильная группа, дигидроизохинолинильная группа, октагидроизохинолинильная группа, оксооктагидроизохинолинильная группа, тетрагидроизохинолинильная группа, декагидроизохинолинильная группа, изохинолинильная группа, дигидрохиназолинильная группа, циннолинильная группа, фталазинильная группа, хиназолинильная группа, тетрагидрохиноксалинильная группа, оксотетрагидрохиноксалинильная группа, гидрохиноксалинильная группа, хиноксалинильная группа, нафтиридинильная группа, пуринильная группа, птеридинильная группа и хинуклидинильная группа.
Бициклическая кислород-содержащая гетероциклическая группа означает бициклическую кислород-содержащую гетероциклическую группу, которая содержит только атом кислорода в качестве гетероатома, входящего в состав колец, и необязательно замещена оксо группой, такую как 2,3-дигидробензофуранильная группа, оксо-2,3-дигидробензофуранильная группа, бензофуранильная группа, изобензофуранильная группа, хроманильная группа, оксохроманильная группа, хроменильная группа, изохроманильная группа, оксоизохроманильная группа, 1,3-бензодиоксолильная группа, 1,3-бензодиоксанильная и 1,4-бензодиоксанильная группа.
Бициклическая содержащая серу гетероциклическая группа означает бициклическую содержащую серу гетероциклическую группу, которая содержит только атом серы в качестве гетероатома, входящего в состав колец, и необязательно замещена оксо группой, такую как 2,3-дигидробензотиенильная группа, оксо-2,3-дигидробензотиенильная группа и бензотиенильная группа.
Бициклическая азот- и кислород-содержащая гетероциклическая группа означает бициклическую азот- и кислород-содержащую гетероциклическую группу, которая содержит только атом азота и атом кислорода в качестве гетероатомов, входящих в состав колец, и необязательно замещена оксо группой, такую как дигидробензоксазолильная группа, оксодигидробензоксазолильная группа, бензоксазолильная группа, бензизоксазолильная группа, бензоксадиазолильная группа, бензоморфолинильная группа, оксобензоморфолинильная группа, дигидропиранопиридильная группа, оксодигидропиранопиридильная группа, дигидродиоксинопиридильная группа, оксодигидродиоксинопиридильная группа и дигидропиридоксазинильная группа.
Бициклическая содержащая азот и серу гетероциклическая группа означает бициклическую содержащую азот и серу гетероциклическую группу, которая содержит атом азота и атом серы в качестве гетероатомов, входящих в состав колец, и необязательно замещена оксо группой, такую как дигидробензотиазолильная группа, оксодигидробензотиазолильная группа, бензотиазолильная группа, бензизотиазолильная группа и бензотиадиазолильная группа.
Бициклическая гетероциклическая группа означает бициклическую азот-содержащую гетероциклическую группу, бициклическую кислород-содержащую гетероциклическую группу, бициклическую содержащую серу гетероциклическую группу, бициклическую азот- и кислород-содержащую гетероциклическую группу или бициклическую содержащую азот и серу гетероциклическую группу.
[0026]
Гетероциклическая группа означает моноциклическую гетероциклическую группу или бициклическую гетероциклическую группу.
[0027]
C3-8 циклоалкан означает циклопропан, циклобутан, циклопентан, циклогексан, циклогептан или циклооктан.
C4-8 циклоалкен означает C4-8 циклоалкен, такой как циклобутен, циклопентен, циклопентадиен, циклогексен, циклогексадиен и циклогептен.
Циклический углеводород означает C3-8 циклоалкан, C4-8 циклоалкен, бензол или нафталин.
[0028]
Азот-содержащее гетероциклическое кольцо означает азот-содержащее гетероциклическое кольцо, которое содержит в качестве гетероатома, входящего в состав кольца, только атом азота, и необязательно замещено оксо группой, такое как азетидин, пирролидин, оксопирролидин, пирролин, пиррол, пиперидин, оксопиперидин, тетрагидропиридин, дигидропиридин, оксодигидропиридин, пиридин, гомопиперидин, октагидроазоцин, имидазолидин, оксоимидазолидин, имидазолин, дигидрооксоимидазол, имидазол, пиразолидин, диоксопиразолидин, пиразолин, оксопиразолин, пиразол, пиперазин, гомопиперазин, пиразин, пиридазин, пиримидин, триазолидин, диоксотриазолидин, триазол, тетразол, 1H-бензимидазол и хиноксалин.
Кислород-содержащее гетероциклическое кольцо означает оксетан, тетрагидрофуран, оксотетрагидрофуран, фуран, тетрагидропиран, оксотетрагидропиран, дигидропиран или пиран.
Содержащее серу гетероциклическое кольцо означает тетрагидротиофен, оксотетрагидротиофен или тиофен.
Азот- и кислород-содержащее гетероциклическое кольцо означает моноциклическое азот- и кислород-содержащее гетероциклическое кольцо, которое содержит только атом азота и атом кислорода в качестве гетероатомов, входящих в состав кольца, и необязательно замещено оксо группой, такое как оксазол, изоксазол, оксоизоксазол, оксадиазол и морфолин.
Содержащее азот и серу гетероциклическое кольцо означает моноциклическое содержащее азот и серу гетероциклическое кольцо, которое содержит только атом азота и атом серы в качестве гетероатомов, входящих в состав кольца, и необязательно замещено оксо группой, такое как тиазол, изотиазол, тиадиазол, тиоморфолин, 1-оксидотиоморфолин и 1,1-диоксидотиоморфолин.
Гетероциклическое кольцо означает азот-содержащее гетероциклическое кольцо, кислород-содержащее гетероциклическое кольцо, содержащее серу гетероциклическое кольцо, азот- и кислород-содержащее гетероциклическое кольцо или содержащее азот и серу гетероциклическое кольцо.
[0029]
Двухвалентная циклическая углеводородная группа, образующаяся в результате удаления одного атома водорода от каждого из двух смежных атомов, означает группу, которая образована путем удаления двух атомов водорода, связанных с двумя смежными атомами из циклического углеводорода, такую как циклопропан-1,2-диил, циклобутан-1,2-диил, циклобутен-1,2-диил, циклопентан-1,2-диил, циклопентен-1,2-диил, циклопентадиен-1,2-диил, циклогексан-1,2-диил, циклогексен-1,2-диил, циклогексадиен-1,2-диил, циклогептан-1,2-диил, циклогептен-1,2-диил, циклооктан-1,2-диил, бензол-1,2-диил, нафталин-1,2-диил и нафталин-2,3-диил.
[0030]
Двухвалентная гетероциклическая группа, образующаяся в результате удаления одного атома водорода от каждого из двух смежных атомов, означает группу, которая образована путем удаления двух атомов водорода, связанных с двумя смежными атомами, из гетероциклического кольца, и необязательно замещенную оксо группой, такую как азетидин-1,2-диил, пирролидин-1,2-диил, оксопирролидин-1,2-диил, оксопирролидин-3,4-диил, пирролин-3,4-диил, пирроли-3,4-диил, пиперидин-2,3-диил, пиперидин-3,4-диил, оксопиперидин-2,3-диил, тетрагидропиридин-1,2-диил, тетрагидропиридин-2,3-диил, тетрагидропиридин-3,4-диил, дигидропиридин-2,3-диил, дигидропиридин-3,4-диил, дигидропиридин-1,2-диил, оксодигидропиридин-1,2-диил, пиридин-2,3-диил, пиридин-3,4-диил, гомопиперидин-2,3-диил, гомопиперидин-3,4-диил, октагидроазоцин-2,3-диил, имидазолидин-1,5-диил, оксоимидазолидин-1,5-диил, 1,2-дигидроимидазол-3,4-диил, 4,5-дигидроимидазол-1,2-диил, дигидроxoимидазол-1,5-диил, 2H-имидазол-4,5-диил, имидазол-1,2-диил, имидазол-1,5-диил, имидазол-4,5-диил, пиразолидин-1,2-диил, диоксопиразолидин-1,2-диил, пиразолин-1,2-диил, оксопиразолин-1,2-диил, пиразолин-1,5-диил, 1H-пиразол-3,4-диил, 1H-пиразол-4,5-диил, 1H-пиразол-1,5-диил, пиперазин-1,2-диил, пиперазин-2,3-диил, гомопиперазин-1,2-диил, гомопиперазин-2,3-диил, пиразин-2,3-диил, пиридазин-3,4-диил, пиримидин-4,5-диил, 1,2,4-триазолидин-1,2-диил, диоксотриазолидин-1,2-диил, 1,2,3-триазол-1,5-диил, 1,2,4-триазол-1,5-диил, 1,2,4-триазол-3,4-диил, тетразол-1,5-диил, 1H-бензимидазол-1,2-диил, хиноксалин-2,3-диил, оксетан-2,3-диил, тетрагидрофуран-2,3-диил, оксотетрагидрофуран-2,3-диил, фуран-2,3-диил, тетрагидропиран-2,3-диил, оксотетрагидропиран-2,3-диил, дигидропиран-2,3-диил, пиран-2,3-диил, тетрагидротиофен-2,3-диил, оксотетрагидротиофен-2,3-диил, тиофен-3,4-диил, оксазол-4,5-диил, изоксазол-3,4-диил, дигидрооксоизоксазол-3,4-диил, 1,2,3-оксадиазол-4,5-диил, морфолин-2,3-диил, морфолин-3,4-диил, тиазол-4,5-диил, изотиазол-4,5-диил, 1,2,3-тиадиазол-4,5-диил, тиоморфолин-2,3-диил, 1-оксидотиоморфолин-2,3-диил и 1,1-диоксидотиоморфолин-2,3-диил.
[0031]
Отщепляемая группа означает атом галогена, C1-6 алкилсульфонилокси группу или арилсульфонилокси группу. C1-6 алкилсульфонилокси группа и арилсульфонилокси группа, каждая, необязательно замещена одной или несколькими группами, выбранными из группы заместителей A.
[0032]
Группа заместителей A: атом галогена, карбамоильная группа, необязательно замещенная одной или несколькими группами, выбранными из заместителей группы B, сульфамоильная группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей B, ацильная группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей B, C1-6 алкильная группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей B, C2-6 алкенильная группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей B, C3-8 циклоалкильная группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей B, C4-8 циклоалкенильная группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей B, C1-6 алкокси группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей B, C1-6 алкилсульфонильная группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей B, арилсульфонильная группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей B, C1-6 алкиламино группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей B, ди(C1-6 алкил)амино группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей B, арильная группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей B, гетероциклическая группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей B, ариламино группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей B, циано группа, необязательно защищенная амино группа, необязательно защищенная гидроксильная группа, необязательно защищенная карбоксильная группа и оксо группа.
[0033]
Группа заместителей B: атом галогена, ацильная группа, C1-6 алкильная группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей C, C3-8 циклоалкильная группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей C, C1-6 алкокси группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей C, C1-6 алкиламино группа, ди(C1-6 алкил)амино группа, арильная группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей C, гетероциклическая группа, необязательно замещенная одной или несколькими группами, выбранными из группы заместителей C, циано группа, необязательно защищенная амино группа, необязательно защищенная гидроксильная группа, необязательно защищенная карбоксильная группа и оксо группа.
[0034]
Группа заместителей C: атом галогена, необязательно защищенная амино группа, необязательно защищенная гидроксильная группа и необязательно защищенная карбоксильная группа.
[0035]
Гидроксил-защитная группа включает любую группу, которую можно использовать в качестве обычной защитной группы для гидроксильной группы. Их примеры включают группы, описанные в Greene's Protective Groups in Organic Synthesis, 5th ed., p. 17-471, 2014, John Wiley & Sons, INC. Их конкретные примеры включают C1-6 алкильную группу, ar-C1-6 алкильную группу, C1-6 алкокси-C1-6 алкильную группу, ацильную группу, C1-6 алкоксикарбонильную группу, ar-C1-6 алкоксикарбонильную группу, C1-6 алкилсульфонильную группу, арилсульфонильную группу, силильную группу, тетрагидрофуранильную группу и тетрагидропиранильную группу. Эти группы могут быть необязательно замещены одной или несколькими группами, выбранными из группы заместителей A.
[0036]
Карбоксил-защитная группа включает любую группу, которую можно использовать в качестве обычной защитной группы для амино группы. Их примеры включают группы, описанные в Greene's Protective Groups in Organic Synthesis, 5th ed., p. 686-836, 2014, John Wiley & Sons, INC. Их конкретные примеры включают C1-6 алкильную группу, ar-C1-6 алкильную группу, C1-6 алкокси-C1-6 алкильную группу, ar-C1-6 алкокси-C1-6 алкильную группу и силильную группу. Эти группы могут быть необязательно замещены одной или несколькими группами, выбранными из группы заместителей A.
[0037]
Амино-защитная группа включает любую группу, которую можно использовать в качестве обычной защитной группы для амино группы. Их примеры включают группы, описанные в Greene's Protective Groups in Organic Synthesis, 5th ed., p. 895-1193, 2014, John Wiley & Sons, INC. Их конкретные примеры включают ar-C1-6 алкильную группу, C1-6 алкокси-C1-6 алкильную группу, ацильную группу, C1-6 алкоксикарбонильную группу, ar-C1-6 алкоксикарбонильную группу, арилоксикарбонильную группу, C1-6 алкилсульфонильную группу, арилсульфонильную группу и силильную группу. Эти группы могут быть необязательно замещены одной или несколькими группами, выбранными из группы заместителей A.
[0038]
Алифатические углеводороды означают пентан, гексан, гептан, циклогексан, метилциклогексан или этилциклогексан.
Галогенированные углеводороды означают дихлорметан, хлороформ или дихлорэтан.
Эфиры означают диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, 2-метилтетрагидрофуран, 1,4-диоксан, анизол, диметилового эфира этиленгликоля, дидиметилового эфира этиленгликоля или диэтиленгликоль диэтиловый эфир.
Спирты означают метанол, этанол, пропанол, 2-пропанол, бутанол, 2-метил-2-пропанол, этиленгликоль, пропиленгликоль или диэтиленгликоль.
Кетоны означают ацетон, 2-бутанон или 4-метил-2-пентанон.
Сложные эфиры означают метилацетат, этилацетат, пропилацетат, изопропилацетат или бутилацетат.
Амиды означают N,N-диметилформамид, N,N-диметилацетамид или N-метилпирролидон.
Нитрилы означают ацетонитрил или пропионитрил.
Сульфоксиды означают диметилсульфоксид или сульфолан.
Ароматические углеводороды означают бензол, толуол или ксилол.
[0039]
Неорганическое основание означает гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат натрия, гидрид натрия, карбонат калия, трикалийфосфат, ацетат калия, фторид цезия или карбонат цезия.
Органическое основание означает метоксид натрия, этоксид натрия, трет-бутоксид натрия, трет-бутоксид калия, триэтиламин, N,N-диизопропилэтиламин, 1,8-диазабицикло(5.4.0)ундец-7-ен (DBU), пиридин, N,N-диметил-4-аминопиридин или 4-метилморфолин.
[0040]
C1-6 алкильная группа, представленная как R1; C1-6 алкильная группа, C2-6 алкенильная группа, C3-8 циклоалкильная группа, C4-8 циклоалкенильная группа, арильная группа, C1-6 алкокси группа, C1-6 алкиламино группа, ди(C1-6 алкил)амино группа и гетероциклическая группа, представленная как R3; C1-6 алкильная группа, C1-3 алкильная группа, C2-6 алкенильная группа, C2-6 алкинильная группа, C3-8 циклоалкильная группа, C4-8 циклоалкенильная группа, арильная группа, C1-6 алкокси группа, арилокси группа, C1-6 алкиламино группа, C1-3 алкиламино группа, ди(C1-6 алкил)амино группа, ариламино группа, карбамоильная группа, сульфамоильная группа, C1-6 алкилтио группа, арилтио группа, C1-6 алкилсульфонильная группа, C1-3 алкилсульфонильная группа, арилсульфонильная группа и гетероциклическая группа, представленная как R4; C2-3 алкиленовая группа и C2-5 алкиленовая группа, образованные взятыми вместе двумя смежными R4; C1-6 алкильная группа, представленнач как R5; C1-6 алкильная группа, представленная как R6; C1-3 алкильная группа, представленная как R6a; C1-3 алкильная группа, представленная как R6b; C1-6 алкильная группа, представленная как R7; C1-3 алкиленовая группа, представленная как Y1; C1-3 алкиленовая группа, представленная как Y2; C1-3 алкиленовая группа, представленная как Y3; C1-3 алкильная группа, представленная как R7a; C1-3 алкильная группа, представленная как R7b; C2-4 алкиленовая группа, образованная взятыми вместе R4 и R7; C2-3 алкиленовая группа, образованная взятыми вместе R4 и R7a; C2-3 алкиленовая группа, образованная взятыми вместе R4 и R7b; C1-6 алкильная группа и арильная группа, представленная как R8; двухвалентная циклическая углеводородная группа, образующаяся в результате удаления одного атома водорода от каждого из двух смежных атомов, и двухвалентная гетероциклическая группа, образующаяся в результате удаления одного атома водорода от каждого из двух смежных атомов, представленные как X1; двухвалентная циклическая углеводородная группа, образующаяся в результате удаления одного атома водорода от каждого из двух смежных атомов, и двухвалентная гетероциклическая группа, образующаяся в результате удаления одного атома водорода от каждого из двух смежных атомов, представленные как X1A; C1-6 алкильная группа, представленная как Ra; C1-6 алкильная группа группа, представленная как Rb; C1-3 алкиленовая группа, образованная взятыми вместе Ra и Rb; C1-6 алкильная группа, представленная как Rc; C1-6 алкильная группа, представленная как Rd; и C1-3 алкиленовая группа, образованная взятыми вместе Rc и Rd, являются, каждая, необязательно замещенными одной или несколькими группами, выбранными из группы заместителей A.
C1-6 алкильная группа, представленная как R2, необязательно замещена одной или несколькими группами, выбранными из группы заместителей B.
[0041]
В настоящем изобретении примеры предпочтительных соединений включают следующие соединения или их соли.
R1 представляет собой необязательно замещенную C1-6 алкильную группу.
Соединение, в котором R1 представляет собой C1-3 алкильную группу, является предпочтительным. Соединение, в котором R1 представляет собой этильную группу, является более предпочтительным.
[0042]
R2 представляет собой атом водорода, атом галогена или необязательно замещенную C1-6 алкильную группу.
Соединение, в котором R2 представляет собой атом водорода или необязательно замещенную C1-6 алкильную группу, является предпочтительным. Соединение, в котором R2 представляет собой атом водорода, является более предпочтительным.
[0043]
R3 представляет собой атом галогена, необязательно замещенную C1-6 алкильную группу, необязательно замещенную C2-6 алкенильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную C4-8 циклоалкенильную группу, необязательно замещенную арильную группу, необязательно замещенную C1-6 алкокси группу, необязательно замещенную C1-6 алкиламино группу, необязательно замещенную ди(C1-6 алкил)амино группу или необязательно замещенную гетероциклическую группу.
Соединение, в котором R3 представляет собой атом галогена, необязательно замещенную C1-6 алкильную группу, необязательно замещенную C2-6 алкенильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную C4-8 циклоалкенильную группу, необязательно замещенную арильную группу, необязательно замещенную ди(C1-6 алкил)амино группу или необязательно замещенную гетероциклическую группу, является предпочтительным.
Соединение, в котором R3 представляет собой необязательно замещенную C1-6 алкильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную арильную группу или необязательно замещенную гетероциклическую группу является более предпочтительным.
Соединение, в котором R3 представляет собой необязательно замещенную C1-6 алкильную группу, необязательно замещенную C3-8 циклоалкильную группу или необязательно замещенную гетероциклическую группу, является еще более предпочтительным.
Соединение, в котором R3 представляет собой необязательно замещенную C1-6 алкильную группу или необязательно замещенную гетероциклическую группу, является еще более предпочтительным.
Соединение, в котором R3 представляет собой необязательно замещенную гетероциклическую группу, является особенно предпочтительным.
[0044]
Z1, Z2 и Z3 являются одинаковыми или отличными друг от друга и каждый представляет собой атом азота или группу, представленную общей формулой CR5, где R5 такой, как определен выше.
Соединение, в котором каждый из Z1, Z2 и Z3 представляет собой группу, представленную общей формулой CR5, где R5 такой, как определен выше, является предпочтительным. Соединение, в котором каждый из Z1, Z2 и Z3 представляет собой CH, является более предпочтительным.
[0045]
X1 представляет собой (1) группу, представленную общей формулой C(=O)N(R6), где R6 такой, как определен выше, (2) группу, представленную общей формулой N(R7)C(=O), где R7 такой, как определен выше, (3) необязательно замещенную двухвалентную циклическую углеводородную группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов, или (4) необязательно замещенную двухвалентную гетероциклическую группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов.
[0046]
Соединение, в котором X1 представляет собой группу, представленную общей формулой C(=O)N(R6), где R6 такой, как определен выше, является предпочтительным. Соединение, в котором X1 представляет собой группу, представленную общей формулой C(=O)N(R6a), где R6a такой, как определен выше, является более предпочтительным. Соединение, в котором X1 представляет собой группу, представленную общей формулой C(=O)N(R6b), где R6b такой, как определен выше, является еще более предпочтительным.
[0047]
В альтернативном варианте осуществления соединение, в котором X1 представляет собой группу, представленную общей формулой N(R7)C(=O), где R7 такой, как определен выше, является предпочтительным. Соединение, в котором X1 представляет собой группу, представленную общей формулой N(R7a)C(=O), где R7a такой, как определен выше, является более предпочтительным. Соединение, в котором X1 представляет собой группу, представленную общей формулой N(R7b)C(=O), где R7b такой, как определен выше, является еще более предпочтительным.
[0048]
В другом альтернативном варианте осуществления соединение, в котором X1 представляет собой необязательно замещенную двухвалентную циклическую углеводородную группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов или необязательно замещенную двухвалентную гетероциклическую группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов, является предпочтительным.
Соединение, в котором X1 представляет собой необязательно замещенную двухвалентную гетероциклическую группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов, является более предпочтительным.
[0049]
Кольцо A представляет собой циклическую углеводородную группу или гетероциклическую группу.
Соединение, в котором кольцо А представляет собой циклическую углеводородную группу, является предпочтительным.
Соединение, в котором кольцо А представляет собой фенильную группу, является более предпочтительным.
[0050]
Присутствующие в ʺmʺ количестве группы R4 являются одинаковым или отличными друг от друга, и каждая представляет собой атом галогена, циано группу, нитро группу, амино-защитную группу, необязательно замещенную C1-6 алкильную группу, необязательно замещенную C2-6 алкенильную группу, необязательно замещенную C2-6 алкинильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную C4-8 циклоалкенильную группу, необязательно замещенную арильную группу, необязательно замещенную C1-6 алкокси группу, необязательно замещенную арилокси группу, необязательно замещенную C1-6 алкиламино группу, необязательно замещенную ди(C1-6 алкил)амино группу, необязательно замещенную ариламино группу, необязательно замещенную карбамоильную группу, необязательно замещенную сульфамоильную группу, необязательно замещенную C1-6 алкилтио группу, необязательно замещенную арилтио группу, необязательно замещенную C1-6 алкилсульфонильную группу, необязательно замещенную арилсульфонильную группу, необязательно замещенную гетероциклическую группу, необязательно защищенную амино группу, необязательно защищенную гидроксильную группу или необязательно защищенную карбоксильную группу. В этом контексте два смежных заместителя R4 могут совместно образовывать необязательно замещенную C2-5 алкиленовую группу и один заместитель R4 может образовывать, вместе с R7, необязательно замещенную C2-4 алкиленовую группу, группу, представленную общей формулой O-Y1, где Y1 такой, как определен выше, группу, представленную общей формулой S(O)n-Y2, где Y2 и n такие, как определены выше, или группу, представленную общей формулой N(R8)-Y3, где Y3 и R8 такие, как определены выше.
[0051]
Соединение, в котором каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена, циано группу, необязательно замещенную C1-6 алкильную группу, необязательно замещенную C2-6 алкенильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную C4-8 циклоалкенильную группу, необязательно замещенную арильную группу, необязательно замещенную C1-6 алкокси группу, необязательно замещенную C1-6 алкиламино группу, необязательно замещенную ди(C1-6 алкил)амино группу, необязательно замещенную ариламино группу, необязательно замещенную карбамоильную группу, необязательно замещенную сульфамоильную группу, необязательно замещенную C1-6 алкилсульфонильную группу, необязательно замещенную гетероциклическую группу, необязательно защищенную амино группу, необязательно защищенную гидроксильную группу или необязательно защищенную карбоксильную группу, является предпочтительным.
Соединение, в котором каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена, необязательно замещенную C1-3 алкильную группу, необязательно замещенную C1-3 алкиламино группу, необязательно замещенную C1-3 алкилсульфонильную группу или необязательно защищенную амино группу, является более предпочтительным.
Соединение, в котором каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена, необязательно замещенную C1-3 алкильную группу, необязательно замещенную C1-3 алкиламино группу или необязательно защищенную амино группу, является еще более предпочтительным.
Соединение, в котором каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена или необязательно замещенную C1-3 алкильную группу, еще предпочтительнее. Соединение, в котором каждая из m числа групп R4 представляет собой атом галогена, является особенно предпочтительным.
[0052]
В альтернативном варианте осуществления соединение, в котором
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена, циано группу, необязательно замещенную C1-6 алкильную группу, необязательно замещенную C1-6 алкокси группу, необязательно замещенную карбамоильную группу, необязательно замещенную C1-6 алкилсульфонильную группу, необязательно замещенную гетероциклическую группу, необязательно защищенную амино группу, необязательно защищенную карбоксильную группу,
необязательно замещенную C2-5 алкиленовую группу, образованную взятыми вместе двумя смежными R4, необязательно замещенную C2-4 алкиленовую группу, образованную взятыми вместе одним R4 и R7,
группу, представленную общей формулой O-Y1, образованную взятыми вместе одним R4 и R7, где Y1 такой, как определен выше,
группу, представленную общей формулой S(O)n-Y2, образованную взятыми вместе одним R4 и R7, где Y2 такой, как определен выше или
группу, представленную общей формулой N(R8)-Y3, образованную взятыми вместе одним R4 и R7, где R8 и Y3 такие, как определены выше,
является предпочтительным.
[0053]
Соединение, в котором
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена, необязательно замещенную C1-3 алкильную группу, необязательно замещенную C1-3 алкиламино группу, необязательно замещенную C1-3 алкилсульфонильную группу, необязательно защищенную амино группу,
необязательно замещенную C2-5 алкиленовую группу, образованную взятыми вместе двумя смежными R4, необязательно замещенную C2-4 алкиленовую группу, образованную взятыми вместе одним R4 и R7,
группу, представленную общей формулой O-Y1, образованную взятыми вместе одним R4 и R7, где Y1 такой, как определен выше,
группу, представленную общей формулой S(O)n-Y2, образованную взятыми вместе одним R4 и R7, где Y2 такой, как определен выше, или
группу, представленную общей формулой N(R8)-Y3, образованную взятыми вместе одним R4 и R7, где R8 и Y3 такие, как определены выше,
является более предпочтительным.
[0054]
Соединение, в котором
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена, необязательно замещенную C1-3 алкильную группу, необязательно замещенную C1-3 алкилсульфонильную группу,
необязательно замещенную C2-3 алкиленовую группу, образованную взятыми вместе двумя смежными R4, необязательно замещенную C2-4 алкиленовую группу, образованную взятыми вместе одним R4 и R7,
группу, представленную общей формулой O-Y1, образованную взятыми вместе одним R4 и R7, где Y1 такой, как определен выше,
группу, представленную общей формулой S(O)n-Y2, образованную взятыми вместе одним R4 и R7, где Y2 такой, как определен выше или
группу, представленную общей формулой N(R8)-Y3, образованную взятыми вместе одним R4 и R7, где R8 и Y3 такие, как определены выше,
является еще более предпочтительным.
[0055]
Соединение, в котором
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена, необязательно замещенную C1-3 алкильную группу, необязательно замещенную C1-3 алкилсульфонильную группу,
необязательно замещенную C2-3 алкиленовую группу, образованную взятыми вместе двумя смежными R4, необязательно замещенную C2-3 алкиленовую группу, образованную взятыми вместе одним R4 и R7a, или
группу, представленную общей формулой O-Y1a, образованную взятыми вместе одним R4 и R7a, где Y1a такой, как определен выше,
является еще предпочтительнее.
[0056]
Соединение, в котором
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой необязательно замещенную C1-3 алкильную группу,
необязательно замещенную C2-3 алкиленовую группу, образованную взятыми вместе двумя смежными R4, или
необязательно замещенную C2-3 алкиленовую группу, образованную взятыми вместе одним R4 и R7b,
является особенно предпочтительным.
Соединение, в котором
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой необязательно замещенную C1-3 алкильную группу или необязательно замещенную C2-3 алкиленовую группу, образованную взятыми вместе одним R4 и R7b,
является наиболее предпочтительным.
[0057]
В другом альтернативном варианте осуществления соединение, в котором каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена, является предпочтительным.
[0058]
ʺmʺ представляет собой целое число от 0 до 5.
Соединение, в котором m представляет собой целое число от 0 до 2, является предпочтительным.
[0059]
R5 представляет собой атом водорода, атом галогена или необязательно замещенную C1-6 алкильную группу.
Соединение, в котором R5 представляет собой атом водорода, является предпочтительным.
[0060]
R6 представляет собой атом водорода, амино-защитную группу или необязательно замещенную C1-6 алкильную группу.
Соединение, в котором R6 представляет собой атом водорода или необязательно замещенную C1-3 алкильную группу, является предпочтительным. Соединение, в котором R6 представляет собой необязательно замещенную C1-3 алкильную группу, является более предпочтительным.
[0061]
R7 представляет собой атом водорода, амино-защитную группу или необязательно замещенную C1-6 алкильную группу. Альтернативно, R7 представляет собой, вместе с одним заместителем R4 на кольце A, необязательно замещенную C2-4 алкиленовую группу, группу, представленную общей формулой O-Y1, где Y1 такой, как определен выше, группу, представленную общей формулой S(O)n-Y2, где Y2 и n такие, как определены выше, или группу, представленную общей формулой N(R8)-Y3, где Y3 и R8 такие, как определены выше.
Соединение, в котором R7 представляет собой необязательно замещенную C1-3 алкильную группу, или соединение, в котором R7 представляет собой, вместе с одним заместителем R4 на кольце A, необязательно замещенную C2-3 алкиленовую группу, группу, представленную общей формулой O-Y1a, где Y1a такой, как определен выше, или группу, представленную общей формулой N(R8a)-Y3, где R8a представляет собой необязательно замещенную C1-3 алкильную группу; и Y3 такой, как определен выше, является предпочтительным.
Соединение, в котором R7 представляет собой необязательно замещенную C1-3 алкильную группу, или соединение, в котором R7 представляет собой, вместе с одним заместителем R4 на кольце A, необязательно замещенную C2-3 алкиленовую группу или группу, представленную общей формулой O-Y1a, где Y1a такой, как определен выше, является более предпочтительным.
Соединение, в котором R7 представляет собой необязательно замещенную C1-3 алкильную группу, или соединение, в котором R7 представляет собой, вместе с одним заместителем R4 на кольце A, необязательно замещенную C2-3 алкиленовую группу, также является предпочтительным.
[0062]
R8 представляет собой атом водорода, амино-защитную группу, необязательно замещенную C1-6 алкильную группу или необязательно замещенную арильную группу.
Соединение, в котором R8 представляет собой атом водорода или необязательно замещенную C1-6 алкильную группу, является предпочтительным. Соединение, в котором R8 представляет собой атом водорода, является более предпочтительным.
[0063]
Y1 представляет собой необязательно замещенную C1-3 алкиленовую группу.
Соединение, в котором Y1 представляет собой этиленовую группу, является предпочтительным.
Y2 представляет собой необязательно замещенную C1-3 алкиленовую группу.
Соединение, в котором Y2 представляет собой C1-3 алкиленовую группу, является предпочтительным.
Y3 представляет собой необязательно замещенную C1-3 алкиленовую группу.
Соединение, в котором Y3 представляет собой C1-3 алкиленовую группу, является предпочтительным.
[0064]
В альтернативном варианте осуществления соединение, в котором
R2 представляет собой атом водорода или необязательно замещенную C1-6 алкильную группу; и
каждый из Z1, Z2 и Z3 представляет собой CH,
является предпочтительным.
[0065]
В альтернативном варианте осуществления соединение, в котором
R1 представляет собой C1-3 алкильную группу и
R3 представляет собой необязательно замещенную C1-6 алкильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную арильную группу или необязательно замещенную гетероциклическую группу,
является предпочтительным.
[0066]
В альтернативном варианте осуществления соединение, в котором
X1 представляет собой группу, представленную общей формулой C(=O)N(R6a), где R6a такой, как определен выше;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена, необязательно замещенную C1-3 алкильную группу, необязательно замещенную C1-3 алкиламино группу или необязательно защищенную амино группу; и
m представляет собой целое число от 0 до 2,
является предпочтительным.
[0067]
В альтернативном варианте осуществления соединение, в котором
R3 представляет собой необязательно замещенную C1-6 алкильную группу, необязательно замещенную C3-8 циклоалкильную группу или необязательно замещенную гетероциклическую группу;
X1 представляет собой группу, представленную общей формулой C(=O)N(R6b), где R6b такой, как определен выше;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена или необязательно замещенную C1-3 алкильную группу; и
m представляет собой целое число от 0 до 2,
является предпочтительным.
[0068]
В альтернативном варианте осуществления соединение, в котором
R3 представляет собой необязательно замещенную C1-6 алкильную группу, необязательно замещенную C3-8 циклоалкильную группу или необязательно замещенную гетероциклическую группу;
X1 представляет собой группу, представленную общей формулой N(R7a)C(=O), где R7a такой, как определен выше;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена, необязательно замещенную C1-3 алкильную группу, необязательно замещенную C1-3 алкилсульфонильную группу,
необязательно замещенную C2-3 алкиленовую группу, образованную взятыми вместе двумя смежными R4,
необязательно замещенную C2-3 алкиленовую группу, образованную взятыми вместе одним R4 и R7a, или
группу, представленную общей формулой O-Y1a, образованную взятыми вместе одним R4 и R7a, где Y1a такой, как определен выше; и
m представляет собой целое число от 0 до 2,
является предпочтительным.
[0069]
Соединение, в котором
R3 представляет собой необязательно замещенную гетероциклическую группу;
X1 представляет собой группу, представленную общей формулой N(R7b)C(=O), где R7b такой, как определен выше;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой необязательно замещенную C1-3 алкильную группу,
необязательно замещенную C2-3 алкиленовую группу, образованную взятыми вместе двумя смежными R4, или
необязательно замещенную C2-3 алкиленовую группу, образованную взятыми вместе одним R4 и R7b; и
m представляет собой целое число от 0 до 2,
является более предпочтительным.
[0070]
Соединение, в котором
R3 представляет собой необязательно замещенную гетероциклическую группу;
X1 представляет собой группу, представленную общей формулой N(R7b)C(=O), где R7b такой, как определен выше;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой необязательно замещенную C1-3 алкильную группу или
необязательно замещенную C2-3 алкиленовую группу, образованную взятыми вместе одним R4 и R7b; и
m представляет собой целое число от 0 до 2,
является еще более предпочтительным.
[0071]
В альтернативном варианте осуществления соединение, в котором
R3 представляет собой необязательно замещенную C1-6 алкильную группу или необязательно замещенную гетероциклическую группу;
X1 представляет собой необязательно замещенную двухвалентную циклическую углеводородную группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов, или необязательно замещенную двухвалентную гетероциклическую группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена;
m представляет собой целое число от 0 до 2,
является предпочтительным.
Соединение, в котором
R3 представляет собой необязательно замещенную гетероциклическую группу;
X1 представляет собой необязательно замещенную двухвалентную гетероциклическую группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом галогена; и
m представляет собой целое число от 0 до 2,
является более предпочтительным.
[0072]
Примеры предпочтительных соединений по настоящему изобретению включают следующие соединения.
[0073]
6-(3,4-дигидрохинолин-1(2H)-илкарбонил)-1-этил-4-(1-метилпиперидин-4-ил)хинолин-2(1H)-он, 1-этил-N-метил-N-(4-метилфенил)-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид, N-(2,3-дигидро-1H-инден-5-ил)-1-этил-N-метил-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид, 6-(5-(4-хлорфенил)-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-он, 6-(5-(4-хлорфенил)-3-метил-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-он, 1-этил-4-(морфолин-4-ил)-6-(2-оксо-5-фенил-3-(пропан-2-ил)-2,3-дигидро-1H-имидазол-1-ил)хинолин-2(1H)-он, 1-этил-N-(3-фтор-4-метилфенил)-N-метил-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид, N-(3-хлор-4-метилфенил)-1-этил-N-метил-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид и N-(3,4-диметилфенил)-1-этил-N-метил-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид.
[0074]
Примеры соли соединения, представленного общей формулой [1], могут включать обычно известную соль основной группы, такой как амино группа, или кислотной группы, такой как гидроксильная группа или карбоксильная группа.
[0075]
Примеры соли основной группы включают: соль с минеральной кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, азотная кислота и серная кислота; соль с органической карбоновой кислотой, такой как муравьиная кислота, уксусная кислота, лимонная кислота, щавелевая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, яблочная кислота, винная кислота, аспарагиновая кислота, трихлоруксусная кислота и трифторуксусная кислота; и соль с сульфоновой кислотой, такой как метансульфоновая кислота, бензолсульфоновая кислота, пара-толуолсульфоновая кислота, мезитиленсульфоновая кислота и нафталинсульфоновая кислота.
[0076]
Примеры соли кислотной группы включают: соль с щелочным металлом, таким как натрий и калий; соль с щелочно-земельным металлом, таким как кальций и магний; аммониевую соль; и соль с азот-содержащим органическим основанием, таким как триметиламин, триэтиламин, трибутиламин, пиридин, N,N-диметиланилин, N-метилпиперидин, 4-метилморфолин, диэтиламин, дициклогексиламин, прокаин, дибензиламин, N-бензил-β-фенетиламин, 1-эфенамин и N,N'-дибензилэтилендиамин.
[0077]
Среди описанных выше солей, примеры предпочтительных солей включают фармакологически приемлемые соли.
Когда соединение, представленное общей формулой [1], имеет изомеры (например, оптические изомеры, геометрические изомеры и таутомеры), настоящее изобретение охватывает эти изомеры, а также включает сольваты, гидраты и различные формы кристаллов.
[0078]
Далее будут описаны способы получения соединения по настоящему изобретению.
Соединение по настоящему изобретению получают с использованием комбинации хорошо известных в данной области способов, и его можно получить в соответствии с, например, следующими способами получения:
[0079]
[Способ получения 1]

где L1 представляет собой гидроксильную группу или отщепляемую группу; и R1, R2, R3, R4, R6, Z1, Z2, Z3, A и m такие, как определены выше.
[0080]
(1-1) В случае, когда L1 представляет собой гидроксильную группу,
Например, пара-хлорбензойная кислота известна как соединение, представленное общей формулой [3].
Соединение, представленное общей формулой [1a], можно получить путем взаимодействия соединения, представленного общей формулой [2], с соединением, представленным общей формулой [3], в присутствии конденсирующего агента или галогенангидрида кислоты и в присутствии основания.
Растворитель для использования в этой реакции конкретно не ограничивается, при условии, что растворитель не влияет на реакцию. Его примеры включают галогенированные углеводороды, эфиры, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители можно использовать в виде смеси.
Предпочтительные примеры растворителя включают галогенированные углеводороды, эфиры, сложные эфиры и амиды. Галогенированные углеводороды и амиды более предпочтительны.
Количество используемого растворителя конкретно не ограничивается и может быть 1-500-кратным (об/масс) по отношению к количеству соединения, представленного общей формулой [2].
Примеры основания для использования в этой реакции включают неорганическое основание и органическое основание.
Предпочтительные примеры основания включают органическое основание. Более предпочтительны триэтиламин, N,N-диизопропилэтиламин и 4-метилморфолин, и еще более предпочтительны N,N-диизопропилэтиламин и 4-метилморфолин.
Количество используемого основания может быть 1-50-кратным, предпочтительно 1-10-кратным по отношению к количеству в молях соединения, представленного общей формулой [2].
[0081]
Примеры конденсирующего агента для использования в этой реакции включают: карбодиимиды, такие как N,N'-диизопропилкарбодиимид (DIC), N,N'-ди-(трет-бутил)карбодиимид, N,N'-дициклогексилкарбодиимид (DCC), N-(трет-бутил)-N'-этилкарбодиимид (BEC), N-циклогексил-N'-(2-морфолинoэтил)карбодиимид (CMC) и 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC); имидазолы, такие как 1,1'-карбонилдиимидазол (CDI) и 1,1'-карбонилди(1,2,4-триазол) (CDT); кислотные азиды, такие как дифенилфосфорилазид; кислотные цианиды, такие как диэтилфосфорилцианид; 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин; и уронии, такие как O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат (HBTU), O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфат (HATU), O-(бензотриазол-1-ил)-N,N,N',N'-бис(тетраметилен)уронийгексафторфосфат (HBPyU), O-(бензотриазол-1-ил)-N,N,N',N'-бис(пентаметилен)уронийгексафторфосфат (HBPipU), O-(6-хлорбензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат (HCTU), O-(3,4-дигидро-4-оксо-1,2,3-бензотриазин-3-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат (HDBTU), O-(2-оксо-1(2H)пиридил)-N,N,N',N'-тетраметилуронийгексафторфосфат (TPTU), O-((этоксикарбонил)цианометиленамино)-N,N,N',N'-тетраметилуронийгексафторфосфат (HOTU), O-((этоксикарбонил)цианометиленамино)-N,N,N',N'-тетраметилуронийтетрафторборат (TOTU), N,N,N',N'-тетраметил-O-(N-сукцинимидил)уронийгексафторфосфат (HSTU), N,N,N',N'-тетраметил-O-(N-сукцинимидил)уронийтетрафторборат (TSTU) дипирролидино(N-сукцинимидилокси)карбенийгексафторфосфат (HSPyU) и S-(1-оксидо-2-пиридил)-N,N,N',N'-тетраметилтиоуронийтетрафторборат (TOTT).
Предпочтительные примеры конденсирующего агента включают карбодиимиды. Более предпочтительным является EDC.
Количество используемого конденсирующего агента может быть 1-50-кратным, предпочтительно 1-5-кратным по отношению к количеству в молях соединения, представленного общей формулой [2].
[0082]
В случае использования карбодиимида в качестве конденсирующего агента, предпочтительно добавлять добавку.
Примеры добавки включают 1-гидроксибензотриазол (HOBT), 1-гидрокси-7-азабензотриазол (HOAT) и этил(гидроксиимино)цианоацетат. HOBT и этил(гидроксиимино)цианоацетат являются предпочтительными.
Количество используемой добавки может быть 0,01-10-кратным, предпочтительно 0,1-1-кратным по отношению к количеству в молях соединения, представленного общей формулой [2].
[0083]
Примеры галогенангидрида кислоты для использования в этой реакции включают: оксалилхлорид; галогенангидриды карбоновых кислот, такие как ацетилхлорид и трифторацетилхлорид; галогенангидриды сульфоновых кислот, такие как метансульфонилхлорид и тозилхлорид; и сложные эфиры хлормуравьиной кислоты, такие как этилхлороформиат и изобутилхлороформиат.
Количество используемого соединения, представленного общей формулой [3], конкретно не ограничивается и может быть 1-10-кратным по отношению к количеству в молях соединения, представленного общей формулой [2].
Эту реакцию можно осуществлять при температуре от -30 до 150°C, предпочтительно от 0 до 100°C, в течение от 30 минут до 48 часов.
[0084]
(1-2) В случае, когда L1 представляет собой отщепляемую группу
Например, пара-хлорбензоилхлорид известен как соединение, представленное общей формулой [3].
Соединение, представленное общей формулой [1a] можно получить путем взаимодействия соединения, представленного общей формулой [2], с соединением, представленным общей формулой [3], в присутствии основания.
Растворитель для использования в этой реакции конкретно не ограничивается, при условии, что растворитель не влияет на реакцию. Его примеры включают галогенированные углеводороды, эфиры, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители можно использовать в виде смеси.
Предпочтительные примеры растворителя включают галогенированные углеводороды, эфиры и сложные эфиры. Более предпочтительны галогенированные углеводороды.
Количество используемого растворителя конкретно не ограничивается и может быть 1-500-кратным (об/масс) по отношению к количеству соединения, представленного общей формулой [2].
[0085]
Примеры основания для использования в этой реакции включают неорганическое основание и органическое основание.
Предпочтительные примеры основания включают органическое основание. Более предпочтительны триэтиламин, N,N-диизопропилэтиламин, 4-метилморфолин и пиридин и еще более предпочтительны N,N-диизопропилэтиламин, 4-метилморфолин и пиридин.
Количество используемого основания может быть 1-50-кратным, предпочтительно 1-10-кратным по отношению к количеству в молях соединения, представленного общей формулой [2].
Количество используемого соединения, представленного общей формулой [3], конкретно не ограничивается и может быть 1-10-кратным по отношению к количеству в молях соединения, представленного общей формулой [2].
Эту реакцию можно осуществлять при температуре от -30 до 150°C, предпочтительно от 0 до 100°C, в течение от 30 минут до 48 часов.
[0086]
[Способ получения 2]
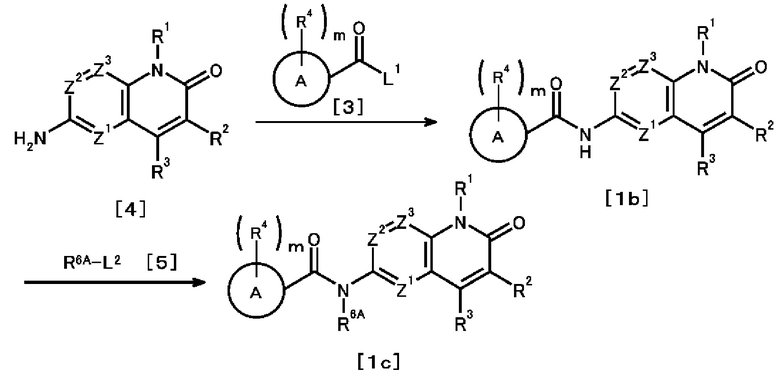
где R6A представляет собой необязательно замещенную C1-6 алкильную группу; L2 представляет собой отщепляемую группу; и R1, R2, R3, R4, L1, Z1, Z2, Z3, A и m такие, как определены выше.
[0087]
<Стадия 1>
Соединение, представленное общей формулой [1b] можно получить путем взаимодействия соединения, представленного общей формулой [4], с соединением, представленным общей формулой [3].
Эту реакцию можно осуществлить в соответствии со Способом получения 1.
[0088]
<Стадия 2>
Например, метилйодид известен как соединение, представленное общей формулой [5].
Соединение, представленное общей формулой [1c], можно получить путем взаимодействия соединения, представленного общей формулой [1b], с соединением, представленным общей формулой [5], в присутствии основания.
Растворитель для использования в этой реакции конкретно не ограничивается, при условии, что растворитель не влияет на реакцию. Его примеры включают галогенированные углеводороды, эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители можно использовать в виде смеси.
Предпочтительные примеры растворителя включают эфиры и амиды. Более предпочтительны амиды.
Количество используемого растворителя конкретно не ограничивается и может быть 1-500-кратным (об/масс) по отношению к количеству соединения, представленного общей формулой [1b].
[0089]
Примеры основания для использования в этой реакции включают: органическое основание, такое как метоксид натрия, этоксид натрия, трет-бутоксид калия, пиридин, диметиламинопиридин и триэтиламин; и неорганическое основание, такое как гидрид натрия, гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат калия и карбонат натрия. Предпочтительные примеры основания включают гидрид натрия и карбонат калия.
Количество используемого основания конкретно не ограничивается и может быть 1-20-кратным, предпочтительно 1-5-кратным по отношению к количеству в молях соединения, представленного общей формулой [1b].
Количество используемого соединения, представленного общей формулой [5], конкретно не ограничивается и может быть 1-10-кратным по отношению к количеству в молях соединения, представленного общей формулой [1b].
Эту реакцию можно осуществлять при температуре от -30 до 150°C, предпочтительно от 0 до 100°C, в течение от 30 минут до 48 часов.
[0090]
[Способ получения 3]

где L3 представляет собой гидроксильную группу или отщепляемую группу; и R1, R2, R3, R4, R7, Z1, Z2, Z3, A и m такие, как определены выше.
[0091]
Например, N-метиланилин известен как соединение, представленное общей формулой [7].
Соединение, представленное общей формулой [1d], можно получить путем взаимодействия соединения, представленного общей формулой [6], с соединением, представленным общей формулой [7].
Эту реакцию можно осуществлять в соответствии со Способом получения 1.
[0092]
[Способ получения 4]
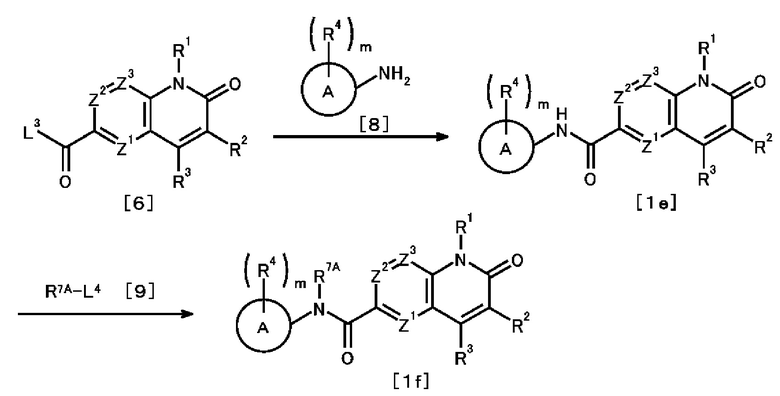
где R7A представляет собой необязательно замещенную C1-6 алкильную группу; L4 представляет собой отщепляемую группу; и R1, R2, R3, R4, L3, Z1, Z2, Z3, A и m такие, как определены выше.
[0093]
<Стадия 1>
Соединение, представленное общей формулой [1e], можно получить путем взаимодействия соединения, представленного общей формулой [6], с соединением, представленным общей формулой [8].
Эту реакцию можно осуществлять в соответствии со Способом получения 1.
[0094]
<Стадия 2>
Например, метилйодид известен как соединение, представленное общей формулой [9].
Соединение, представленное общей формулой [1f], можно получить путем взаимодействия соединения, представленного общей формулой [1e], с соединением, представленным общей формулой [9].
Эту реакцию можно осуществлять в соответствии со <Стадией 2> Способа получения 2.
[0095]
[Способ получения 5]

где Ra представляет собой атом водорода или необязательно замещенную C1-6 алкильную группу; Rb представляет собой атом водорода или необязательно замещенную C1-6 алкильную группу; или Ra и Rb вместе представляют собой необязательно замещенную C1-3 алкиленовую группу; L5 представляет собой отщепляемую группу; X1A представляет собой необязательно замещенную двухвалентную циклическую углеводородную группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов, или необязательно замещенную двухвалентную гетероциклическую группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов; и R1, R2, R3, R4, Z1, Z2, Z3, A и m такие, как определены выше.
[0096]
Например, 2-бифенилборная кислота известна как соединение, представленное общей формулой [11].
Соединение, представленное общей формулой [1g], можно получить путем взаимодействия соединения, представленного общей формулой [10], с соединением, представленным общей формулой [11], в присутствии или в отсутствие основания, в присутствии палладиевого катализатора и в присутствии или в отсутствие лиганда.
Растворитель для использования в этой реакции конкретно не ограничивается, при условии, что растворитель не влияет на реакцию. Его примеры включают воду, спирты, галогенированные углеводороды, эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители можно использовать в виде смеси.
Предпочтительные примеры растворителя включают смешанные растворители, состоящие из ароматических углеводородов и воды, и смешанные растворители, состоящие из эфиров и воды.
Количество используемого растворителя конкретно не ограничивается и может быть 1-500-кратным (об/масс) по отношению к количеству соединения, представленного общей формулой [10].
[0097]
Примеры палладиевого катализатора для использования в этой реакции включают: металлический палладий, такой как палладий на углероде и палладиевая чернь; неорганическую соль палладия, такую как хлорид палладия; органическую соль палладия, такую как ацетат палладия; хлор(2-(дициклогексилфосфино)-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил)(2-(2-аминоэтил)фенил)палладий(II); органический палладиевый комплекс, такой как тетракис(трифенилфосфин)палладий(0), бис(трифенилфосфин)палладий(II) дихлорид, бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладий(II), 1,1'-бис(дифенилфосфино)ферроцен палладий(II) дихлорид, (E)-ди(μ-ацетато)бис(o-(ди-o-толилфосфино)бензил)дипалладий(II) и трис(дибензилиденацетон)дипалладий(0); и органический палладиевый комплекс на полимерной подложке, такой как бис(ацетато)трифенилфосфин палладий(II) на полимерной подложке и ди(ацетато)дициклогексилфенилфосфин палладий(II) на полимерной подложке. Органический палладиевый комплекс является предпочтительным.
Количество используемого палладиевого катализатора может быть 0,00001-1-кратным, предпочтительно 0,01-0,2-кратным, по отношению к количеству в молях соединения, представленного общей формулой [10].
[0098]
Примеры лиганда, который используют в этой реакции, если необходимо, включают: триалкилфосфины, такие как триметилфосфин и три-трет-бутилфосфин; трициклоалкилфосфины, такие как трициклогексилфосфин; триарилфосфины, такие как трифенилфосфин и тритолилфосфин; триалкилфосфиты, такие как триметилфосфит, триэтилфосфит и трибутилфосфит; трициклоалкилфосфиты, такие как трициклогексилфосфит; триарилфосфиты, такие как трифенилфосфит; имидазолиевые соли, такие как 1,3-бис(2,4,6-триметилфенил)имидазолий хлорид; дикетоны, такие как ацетилацетон и октафторацетилацетон; амины, такие как триметиламин, триэтиламин, трипропиламин, триизопропиламин и трибутиламин; 1,1'-бис(дифенилфосфино)ферроцен; 2,2'-бис(дифенилфосфино)-1,1'-бинафтил; 2-дициклогексилфосфино-2',6'-диметоксибифенил; 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил; 2-(ди-трет-бутилфосфино)-2',4',6'-триизопропилбифенил; 2-дициклогексилфосфино-2'-(N,N-диметиламино)бифенил; 4,5-бис(дифенилфосфино)-9,9-диметилксантен; и 2-(ди-трет-бутилфосфино)бифенил.
Количество используемого лиганда может быть 0,00001-1-кратным, предпочтительно 0,02-0,5-кратным по отношению к количеству в молях соединения, представленного общей формулой [10].
[0099]
Примеры основания, которое используют в этой реакции, если необходимо, включают неорганическое основание и органическое основание. Неорганическое основание, такое как бикарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия и трикалийфосфат, является предпочтительным.
Количество используемого основания может быть 1-50-кратным, предпочтительно 2-10-кратным по отношению к количеству в молях соединения, представленного общей формулой [10].
Количество используемого соединения, представленного общей формулой [11], может быть 1-50-кратным, предпочтительно 1-2-кратным по отношению к количеству в молях соединения, представленного общей формулой [10].
Эту реакцию обычно осуществляют при температуре от 0 до 160°C, предпочтительно от 20 до 120°C, в течение от 1 минуты до 96 часов в атмосфере инертного газа (например, азота и/или аргона).
[0100]
[Способ получения 6]

где L6 представляет собой отщепляемую группу; и R1, R2, R3, R4, Ra, Rb, X1A, Z1, Z2, Z3, A и m такие, как определены выше.
[0101]
Соединение, представленное общей формулой [1h], можно получить путем взаимодействия соединения, представленного общей формулой [12], с соединением, представленным общей формулой [13].
Эту реакцию можно осуществлять в соответствии со Способом получения 5.
[0102]
[Способ получения 7]
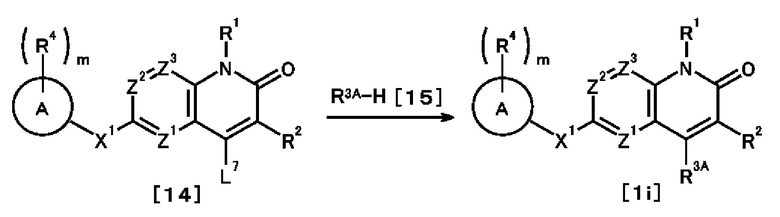
где R3A представляет собой необязательно замещенную C1-6 алкиламино группу, необязательно замещенную ди(C1-6 алкил)амино группу или необязательно замещенную циклическую амино группу; L7 представляет собой отщепляемую группу; и R1, R2, R4, X1, Z1, Z2, Z3, A и m такие, как определены выше.
[0103]
Например, морфолин известен как соединение, представленное общей формулой [15].
Соединение, представленное общей формулой [1i], можно получить путем взаимодействия соединения, представленного общей формулой [14], с соединением, представленным общей формулой [15], в присутствии или в отсутствие основания.
Растворитель для использования в этой реакции конкретно не ограничивается, при условии, что растворитель не влияет на реакцию. Его примеры включают галогенированные углеводороды, эфиры, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители можно использовать в виде смеси.
Предпочтительные примеры растворителя включают галогенированные углеводороды, эфиры, сложные эфиры и амиды. Амиды более предпочтительны.
Количество используемого растворителя конкретно не ограничивается и может быть 1-500-кратным (об/масс) по отношению к количеству соединения, представленного общей формулой [14].
Примеры основания для использования в этой реакции включают неорганическое основание и органическое основание.
Предпочтительные примеры основания включают органическое основание. Более предпочтительны триэтиламин, N,N-диизопропилэтиламин и 4-метилморфолин, и еще более предпочтительны N,N-диизопропилэтиламин и 4-метилморфолин.
Количество используемого основания может быть 1-50-кратным, предпочтительно 1-10-кратным, по отношению к количеству в молях соединения, представленного общей формулой [14].
Количество используемого соединения, представленного общей формулой [15], конкретно не ограничивается и может быть 1-10-кратным по отношению к количеству в молях соединения, представленного общей формулой [14].
Эту реакцию можно осуществлять при температуре от -30 до 150°C, предпочтительно от 0 до 150°C, в течение от 30 минут до 48 часов.
[0104]
Далее будут описаны способы получения исходных веществ для получения соединения по настоящему изобретению.
[0105]
[Способ получения A]
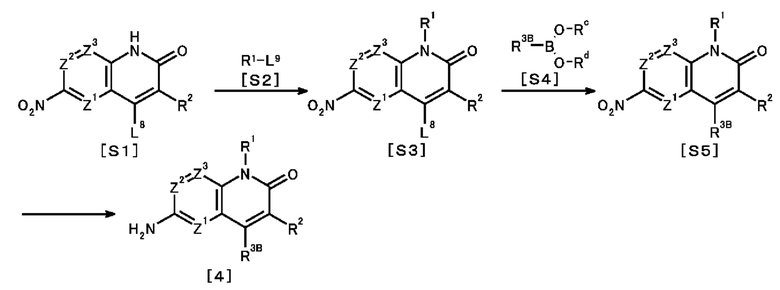
где R3B представляет собой необязательно замещенную C1-6 алкильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную арильную группу или необязательно замещенную гетероциклическую группу; Rc представляет собой атом водорода или необязательно замещенную C1-6 алкильную группу; Rd представляет собой атом водорода или необязательно замещенную C1-6 алкильную группу; или Rc и Rd вместе представляют собой необязательно замещенную C1-3 алкиленовую группу; L8 представляет собой отщепляемую группу; L9 представляет собой отщепляемую группу; и R1, R2, Z1, Z2 и Z3 такие, как определены выше.
[0106]
<Стадия 1>
Например, 4-хлор-6-нитрохинолин-2(1H)-он известен как соединение, представленное общей формулой [S1].
Например, этилйодид известен как соединение, представленное общей формулой [S2].
Соединение, представленное общей формулой [S3], можно получить путем взаимодействия соединения, представленного общей формулой [S1], с соединением, представленным общей формулой [S2], в присутствии основания.
Растворитель для использования в этой реакции конкретно не ограничивается, при условии, что растворитель не влияет на реакцию. Его примеры включают галогенированные углеводороды, эфиры, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители можно использовать в виде смеси.
Предпочтительные примеры растворителя включают амиды и сульфоксиды. Амиды более предпочтительны.
Количество используемого растворителя конкретно не ограничивается и может быть 1-500-кратным (об/масс) по отношению к количеству соединения, представленного общей формулой [S1].
Примеры основания для использования в этой реакции включают неорганическое основание и органическое основание.
Предпочтительные примеры основания включают неорганическое основание. Более предпочтительным является карбонат цезия.
Количество используемого основания может быть 1-50-кратным, предпочтительно 1-10-кратным, по отношению к количеству в молях соединения, представленного общей формулой [S1].
Количество используемого соединения, представленного общей формулой [S2], конкретно не ограничивается и может быть 1-10-кратным по отношению к количеству в молях соединения, представленного общей формулой [S1].
Эту реакцию можно осуществлять при температуре от -30 до 150°C, предпочтительно от 0 до 100°C, в течение от 30 минут до 48 часов.
[0107]
<Стадия 2>
Например, циклопропилборная кислота известна как соединение, представленное общей формулой [S4].
Соединение, представленное общей формулой [S5], можно получить путем взаимодействия соединения, представленного общей формулой [S3], с соединением, представленным общей формулой [S4], в присутствии основания, в присутствии палладиевого катализатора и в присутствии или в отсутствие лиганда.
Эту реакцию можно осуществить в соответствии со Способом получения 5.
[0108]
<Стадия 3>
Соединение, представленное общей формулой [4], можно получить, подвергая соединение, представленное общей формулой [S5], реакции восстановления. Эту реакцию можно осуществлять в соответствии со способом, описанным в Richard C. Larock et al., Comprehensive Organic Transformations, 2nd edition, p. 823-827, 1999, John Wiley & Sons, INC., или эквивалентным этому способом. Его конкретные примеры включают реакцию каталитического гидрирования с использованием металлического катализатора и реакцию восстановления с использованием металла, такого как железо или цинк.
[0109]
В случае, когда соединение, представленное общей формулой [S5], подвергают реакции каталитического гидрирования, используемый растворитель конкретно не ограничивается, при условии, что растворитель не оказывает неблагоприятного воздействия на реакцию. Его примеры включают воду, спирты, амиды, галогенированные углеводороды, ароматические углеводороды, эфиры, ацетонитрил, кетоны, сложные эфиры, уксусная кислота и пиридин. Эти растворители можно использовать в виде смеси.
Примеры металлического катализатора для использования в этой реакции включают: металлический палладий, такой как палладий на углероде и палладиевая чернь; палладиевую соль, такую как оксид палладия и гидроксид палладия; металлический никель, такой как никель Ренея; и соль платины, такую как оксид платины.
Количество используемого металлического катализатора является 0,001-5-кратным (масс/масс), предпочтительно 0,01-1-кратным (масс/масс) по отношению к количеству соединения, представленного общей формулой [S5].
Примеры источника водорода включают: водород; муравьиную кислоту; формиат, такой как формиат натрия, формиат аммония и формиат триэтиламмония; циклогексен; и циклогексадиен.
Количество используемого источника водорода может быть 2-100-кратным, предпочтительно 2-10-кратным по отношению к количеству в молях соединения, представленного общей формулой [S5].
Эту реакцию можно осуществлять при температуре 0 до 200°C, предпочтительно от 0 до 100°C, в течение 1 минуты до 24 часов.
[0110]
В случае, когда соединение, представленное общей формулой [S5], подвергают реакции восстановления с использованием металла, используемый растворитель конкретно не ограничивается, при условии, что растворитель не оказывает неблагоприятного воздействия на реакцию. Его примеры включают воду, спирты, амиды, галогенированные углеводороды, ароматические углеводороды, эфиры, ацетонитрил, кетоны и сложные эфиры. Эти растворители можно использовать в виде смеси.
Примеры металла для использования в этой реакции включают железо, цинк, олово и хлорид олова(II).
Количество используемого металла может быть 1-50-кратным, предпочтительно 1-10-кратным, по отношению к количеству в молях соединения, представленного общей формулой [S5].
Примеры кислоты, которую используют в этой реакции, если необходимо, включают хлористый водород, бромистый водород, уксусную кислоту и хлорид аммония.
Количество используемой кислоты может быть 0,001-100-кратным (об/масс), предпочтительно 0,01-20-кратным (об/масс), по отношению к количеству соединения, представленного общей формулой [S5].
Эту реакцию можно осуществлять при температуре от 0 до 200°C, предпочтительно от 0 до 100°C, в течение от 1 минуты до 24 часов.
[0111]
[Способ получения B]

где Re представляет собой карбоксил-защитную группу; и R1, R2, R3B, Rc, Rd, L5, L8, Z1, Z2 и Z3 такие, как определены выше.
[0112]
<Стадия 1>
Например, N-этил-4-йоданилин известен как соединение, представленное общей формулой [S6].
Например, 3-трет-бутокси-3-оксопропионовая кислота известна как соединение, представленное общей формулой [S7].
Соединение, представленное общей формулой [S8], можно получить путем взаимодействия соединения, представленного общей формулой [S6], с соединением, представленным общей формулой [S7], в присутствии конденсирующего агента или галогенангидрида кислоты и в присутствии основания.
Эту реакцию можно осуществить в соответствии со Способом получения 1.
[0113]
<Стадия 2>
Соединение, представленное общей формулой [S9] можно получить путем взаимодействия соединения, представленного общей формулой [S8], с агентом дегидратации.
Растворитель для использования в этой реакции конкретно не ограничивается, при условии, что растворитель не влияет на реакцию. Его примеры включают галогенированные углеводороды, эфиры, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители можно использовать в виде смеси.
Предпочтительные примеры растворителя включают амиды и сульфоксиды. Амиды более предпочтительны.
Количество используемого растворителя конкретно не ограничивается и может быть 1-500-кратным (об/масс) по отношению к количеству соединения, представленного общей формулой [S8].
Примеры дегидратирующего агента для использования в этой реакции включают пентаоксид дифосфора, пентахлорид фосфора, фосфорилхлорид и тионилхлорид.
Количество используемого дегидратирующего агента может быть 1-50-кратным, предпочтительно 1-10-кратным, по отношению к количеству в молях соединения, представленного общей формулой [S8].
Эту реакцию можно осуществлять при температуре от -30 до 150°C, предпочтительно от 0 до 100°C, в течение от 30 минут до 48 часов.
[0114]
<Стадия 3>
Когда L8 представляет собой, например, атом галогена, соединение, представленное общей формулой [S10], можно получить путем взаимодействия соединения, представленного общей формулой [S9], с галогенирующим агентом.
Растворитель для использования в этой реакции конкретно не ограничивается, при условии, что растворитель не влияет на реакцию. Его примеры включают алифатические углеводороды, галогенированные углеводороды, эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители можно использовать в виде смеси.
Предпочтительные примеры растворителя включают ароматические углеводороды.
Количество используемого растворителя конкретно не ограничивается и может быть 1-500-кратным (об/масс) по отношению к количеству соединения, представленного общей формулой [S9].
Примеры галогенирующего агента для использования в этой реакции включают оксихлорид фосфора, фосфорилхлорид и тионилхлорид.
Количество используемого галогенирующего агента может быть 1-50-кратным, предпочтительно 1-10-кратным, по отношению к количеству в молях соединения, представленного общей формулой [S9]. Также, галогенирующий агент можно использовать в качестве растворителя.
Эту реакцию можно осуществлять при температуре от -30 до 150°C, предпочтительно от 0 до 100°C, в течение от 30 минут до 48 часов.
[0115]
<Стадия 4>
Соединение, представленное общей формулой [S11], можно получить путем взаимодействия соединения, представленного общей формулой [S10], с формиатом натрия в присутствии основания и в присутствии палладиевого катализатора.
Растворитель для использования в этой реакции конкретно не ограничивается, при условии, что растворитель не влияет на реакцию. Его примеры включают галогенированные углеводороды, эфиры, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители можно использовать в виде смеси.
Предпочтительные примеры растворителя включают амиды и сульфоксиды. Амиды более предпочтительны.
Количество используемого растворителя конкретно не ограничивается и может быть 1-500-кратным (об/масс) по отношению к количеству соединения, представленного общей формулой [S10].
Примеры основания для использования в этой реакции включают органическое основание.
Количество используемого основания может быть 1-50-кратным, предпочтительно 1-10-кратным, по отношению к количеству в молях соединения, представленного общей формулой [S10].
Примеры палладиевого катализатора для использования в этой реакции включают: металлический палладий, такой как палладий на углероде и палладиевая чернь; неорганическую соль палладия, такую как хлорид палладия; органическую соль палладия, такую как ацетат палладия; хлор(2-(дициклогексилфосфино)-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил)(2-(2-аминоэтил)фенил)палладий(II); органический палладиевый комплекс, такой как тетракис(трифенилфосфин)палладий(0), бис(трифенилфосфин)палладий(II) дихлорид, бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладий(II), 1,1'-бис(дифенилфосфино)ферроценпалладий(II) дихлорид, (E)-ди(μ-ацетато)бис(o-(ди-o-толилфосфино)бензил)дипалладий(II) и трис(дибензилиденацетон)дипалладий(0); и органический палладиевый комплекс на полимерной подложке, такой как бис(ацетато)трифенилфосфинпалладий(II) на полимерной подложке и ди(ацетато)дициклогексилфенилфосфинпалладий(II) на полимерной подложке. Органический палладиевый комплекс является предпочтительным.
Количество используемого палладиевого катализатора может быть 0,00001-1-кратным, предпочтительно 0,01-0,2-кратным, по отношению к количеству в молях соединения, представленного общей формулой [S10].
Количество используемого формиата натрия может быть 1-50-кратным, предпочтительно 1-10-кратным по отношению к количеству в молях соединения, представленного общей формулой [S10].
Эту реакцию можно осуществлять при температуре от -30 до 150°C, предпочтительно от 0 до 100°C, в течение от 30 минут до 48 часов.
[0116]
<Стадия 5>
Например, трет-бутил 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,6-дигидропиридин-1(2H)-карбоксилат известен как соединение, представленное общей формулой [S4].
Соединение, представленное общей формулой [6a], можно получить путем взаимодействия соединения, представленного общей формулой [S11], с соединением, представленным общей формулой [S4], в присутствии основания, в присутствии палладиевого катализатора и в присутствии или в отсутствие лиганда.
Эту реакцию можно осуществить в соответствии со Способом получения 5.
[0117]
Когда любое из соединений, используемых в этих способах получения, имеет сольваты, гидраты и различные формы кристаллов, эти сольваты, гидраты и различные формы кристаллов также можно использовать.
Из соединений, используемых в этих способах получения, соединение, содержащее, например, аминогруппу, гидроксильную группу или карбоксильную группу, можно предварительно подвергнуть процедуре защиты такой группы при помощи обычной защитной группы, и после реакции защитную группу можно удалить при помощи известного в данной области способа.
Каждое соединение, полученное этими способами получения, можно преобразовать в различные соединения, например, подвергая соединение реакции, известной в данной области, такой как реакция конденсации, присоединения, окисления, восстановления, дислокации, замещения, галогенирования, дегидратации или гидролиза, или путем соответствующего объединения этих реакций.
[0118]
В случае использования соединения, представленного общей формулой [1], в качестве лекарственного средства, соединение, представленное общей формулой [1], можно подходящим образом смешать с фармацевтическим вспомогательным веществом, обычно используемым в композиции, таким как эксципиент, носитель и разбавитель. Такой препарат можно вводить перорально или парентерально в форме, такой как таблетка, капсула, порошок, сироп, гранулы, пилюля, суспензия, эмульсия, раствор, дуст, суппозиторий, глазные капли, назальные капли, ушные капли, пластырь, мазь или инъекция, в соответствии с обычным способом. Способ введения, доза и количество доз могут быть соответствующим образом подобраны в зависимости от возраста, массы тела и симптомов пациента. Обычно соединение, представленное общей формулой [1], можно вводить перорально или парентерально (например, вводят путем инъекции, вводят внутривенным капельным путем и вводят ректально) взрослым в суточной дозе от 0,01 до 1000 мг/кг, которое вводят одной порцией или несколькими порциями.
[0119]
Примеры заболевания, включающего сверхпродуцирование CXCL10, включают иммунное заболевание, такое как воспалительное заболевание кишечника, артрит, псориаз, системный склероз, системную красную волчанку и аутоиммунное нейровоспалительное заболевание.
Фармацевтическая композиция означает композицию, содержащую соединение по настоящему изобретению или его соль в качестве активного ингредиента, смешанное подходящим образом с фармацевтическим вспомогательным веществом, обычно используемым в композиции, таким как эксципиент, носитель и разбавитель.
Средство для лечения означает фармацевтическую композицию, предназначенную для лечения.
Лечение включает профилактику или терапию. Профилактика включает ингибирование развития, снижение риска возникновения и задержку развития. Терапия включает улучшение целевого заболевания или состояния и подавление (сдерживание или задержку) прогрессирования заболевания или состояния. Реципиент для лечения включает человека или нечеловекоподобное животное, нуждающееся в лечении.
[0120]
Далее настоящее изобретение будет описано со ссылкой на Ссылочные Примеры, Примеры и Примеры испытаний. Однако настоящее изобретение не должно ограничиваться ими.
[0121]
Для очистки методом колоночной хроматографии использовали устройство автоматической очистки ISOLERA (Biotage Japan Ltd.) или жидкостный хроматограф среднего давления YFLC-W Prep 2XY.N (Yamazen Corp.), если не указано иное.
Носитель, используемый в колоночной хроматографии на силикагеле, представлял собой SNAP KP-Sil Cartridge (Biotage Japan Ltd.) или Hi-Flash Column W001, W002, W003, W004 или W005 (Yamazen Corp.), и носитель, используемый в колоночной хроматографии на щелочном силикагеле, представлял собой SNAP KP-NH Cartridge (Biotage Japan Ltd.), если не указано иное.
Соотношение в смеси элюента представляет собой объемное соотношение. Например, "градиентное элюирование гексан:этилацетат=100:0-50:50" означает, что элюент, состоящий из 100% гексана и 0% этилацетата, окончательно преобразуется в элюент, состоящий из 50% гексана и 50% этилацетата.
[0122]
Использовали проточное устройство для гидрирования H-Cube (ThalesNano Nanotechnology Inc.).
В качестве микроволнового устройства использовали Initiator+ или Initiator Sixty (оба от Biotage Japan Ltd.).
МС спектры измеряли с использованием ЖХ/МС системы ACQUITY SQD (Waters Corp., метод ионизации: ESI (ионизация методом электрораспыления), модель M-8000 (Hitachi, Ltd., ионизация: ESI), LCMS-2010EV (Shimadzu Corp., ионизация: метод одновременной ионизации ESI и APCI (химическая ионизация при атмосферном давлении)) или JMS-T100LP (DART) (JEOL Ltd., ионизация: DART (прямой анализ в режиме реального времени)).
ЯМР спектры измеряли с использованием тетраметилсилана в качестве внутреннего стандарта и Bruker AV300 (Bruker Corp.) или модель JNM-AL400 (JEOL Ltd.), и общие δ значения указаны в миллионных долях.
[0123]
Аббревиатуры при измерении ЯМР имеют следующие значения:
с: синглет
шир.с: широкий синглет
д: дублет
дд: двойной дублет
т: триплет
кв.: квартет
квинт.: квинтет
м: мультиплет
DMSO-D6: дейтерированный диметилсульфоксид
[0124]
Аббревиатуры в Ссылочных Примерах и Примерах имеют следующие значения:
Bn: Бензил
Me: Метил
[0125]
Ссылочный Пример 1

К суспензии 18,5 г 4-хлор-6-нитрохинолин-2(1H)-она в 150 мл N,N-диметилацетамида добавляли 53,8 г карбоната цезия при 40-50°C. К реакционной смеси при охлаждении льдом добавляли 7,91 мл этилйодида и затем смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли этилацетат и воду и pH смеси доводили до 2,0 раствором 2 моль/л хлористоводородной кислоты. Твердое вещество фильтровали и промывали водой с получением слегка коричневого твердого вещества. К полученному твердому веществу добавляли этилацетат и диизопропиловый эфир и затем твердое вещество фильтровали и промывали этилацетатом с получением 8,88 г 4-хлор-1-этил-6-нитрохинолин-2(1H)-она в виде слегка коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,39 (3H, т, J=7,3 Гц), 4,39 (2H, кв, J=7,3 Гц), 7,01 (1H, с), 7,51 (1H, д, J=9,9 Гц), 8,48 (1H, дд, J=9,2, 2,6 Гц), 8,94 (1H, д, J=2,6 Гц).
[0126]
Ссылочный Пример 2

Смесь 5,17 г 4-хлор-1-этил-6-нитрохинолин-2(1H)-она, 4,26 г моногидрата циклопропилборной кислоты, 10,9 г карбоната натрия, 0,44 г бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 50 мл диметилового эфира этиленгликоля и 5,0 мл воды нагревали при кипячении с обратным холодильником в атмосфере азота в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду. Органический слой фракционировали, промывали последовательно водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при помощи дистилляции при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир, этилацетат и гексан и твердое вещество фильтровали и промывали диизопропиловым эфиром с получением 4,81 г 4-циклопропил-1-этил-6-нитрохинолин-2(1H)-она в виде слегка коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,79-0,87 (2H, м), 1,15-1,24 (2H, м), 1,37 (3H, т, J=7,3 Гц), 2,11-2,23 (1H, м), 4,37 (2H, кв, J=7,1 Гц), 6,54 (1H, с), 7,47 (1H, д, J=9,2 Гц), 8,42 (1H, дд, J=9,2, 2,6 Гц), 9,00 (1H, д, J=2,6 Гц).
[0127]
Ссылочный Пример 3

Смесь 4,8 г 4-циклопропил-1-этил-6-нитрохинолин-2(1H)-она, 0,68 г хлорида аммония, 3,91 г порошка железа, 48 мл этанола и 9,6 мл воды нагревали при кипячении с обратным холодильником в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, затем добавляли воду и этилацетат и нерастворимое вещество отфильтровывали. Остаток на фильтре промывали этилацетатом и водой. Фильтрат объединяли с промывочным раствором и органический слой фракционировали, промывали водой и насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом магния и растворитель отгоняли при помощи дистилляции при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и этилацетат и твердое вещество фильтровали с получением 3,92 г 6-амино-4-циклопропил-1-этилхинолин-2(1H)-она в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,71-0,79 (2H, м), 0,99-1,08 (2H, м), 1,33 (3H, т, J=7,3 Гц), 1,96-2,08 (1H, м), 3,74 (2H, шир.с) 4,31 (2H, кв, J=7,1 Гц), 6,42 (1H, с), 6,99 (1H, дд, J=9,2, 2,6 Гц), 7,23 (1H, д, J=9,2 Гц), 7,38 (1H, д, J=2,6 Гц).
[0128]
Ссылочный Пример 4

Смесь 2,0 г 4-хлор-1-этил-6-нитрохинолин-2(1H)-она, 10 мл N,N-диметилацетамида и 3,46 мл морфолина перемешивали при температуре окружающей среды 130-140°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли воду и твердое вещество фильтровали и промывали диизопропиловым эфиром с получением 2,29 г 1-этил-4-(морфолин-4-ил)-6-нитрохинолин-2(1H)-она в виде слегка коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,37 (3H, т, J=7,3 Гц), 3,10-3,18 (4H, м), 3,95-4,03 (4H, м), 4,36 (2H, кв, J=7,0 Гц), 6,27 (1H, с), 7,46 (1H, д, J=9,2 Гц), 8,38 (1H, дд, J=9,2, 2,6 Гц), 8,71 (1H, д, J=2,6 Гц).
[0129]
Ссылочный Пример 5
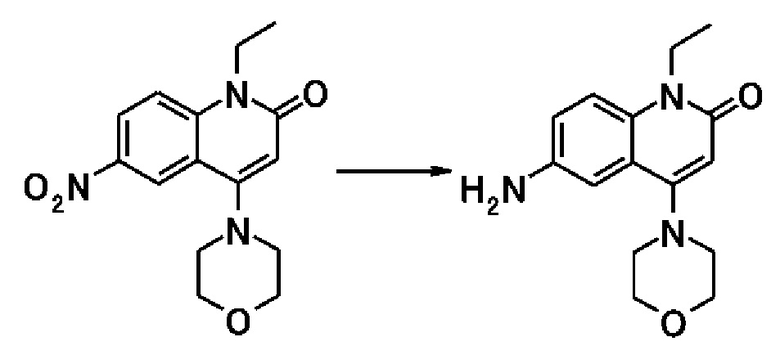
Смесь 2,27 г 1-этил-4-(морфолин-4-ил)-6-нитрохинолин-2(1H)-она, 0,26 г хлорида аммония, 1,46 г порошка железа, 20 мл этанола и 4,0 мл воды нагревали при кипячении с обратным холодильником в течение 3 часов и 20 минут. К реакционной смеси добавляли 20 мл диоксана и 20 мл этилацетата и смесь нагревали при кипячении с обратным холодильником в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, давали выстояться в течение ночи и затем нагревали при кипячении с обратным холодильником в течение 1 часа. К реакционной смеси добавляли 100 мл хлороформа и смесь нагревали при кипячении с обратным холодильником в течение 1 часа. К реакционной смеси добавляли 0,26 г хлорида аммония и 0,73 г порошка железа и смесь нагревали при кипячении с обратным холодильником в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры и нерастворимое вещество отфильтровывали. Остаток на фильтре промывали хлороформом и водой. Фильтрат объединяли с промывочным раствором и затем органический слой фракционировали, промывали насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и твердое вещество фильтровали с получением 1,76 г 6-амино-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-она в виде слегка коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,32 (3H, т, J=7,3 Гц), 3,04-3,12 (4H, м), 3,71 (2H, шир.с) 3,89-3,96 (4H, м), 4,29 (2H, кв, J=7,0 Гц), 6,18 (1H, с), 6,96 (1H, дд, J=8,6, 2,6 Гц), 7,09 (1H, д, J=3,3 Гц), 7,24 (1H, д, J=9,2 Гц).
[0130]
Ссылочный Пример 6
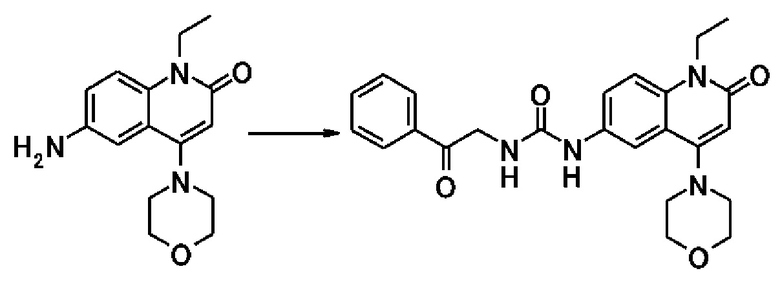
К раствору 0,7 г 6-амино-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-она в 14 мл дихлорметана добавляли 0,46 г 1,1'-карбонилдиимидазола и смесь перемешивали при комнатной температуре в течение 4 часов. К реакционной смеси добавляли 0,54 мл триэтиламина. К реакционной смеси при охлаждении льдом добавляли 0,48 г 2-амино-1-фенилэтанон гидрохлорида и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли хлороформ и воду и pH смеси доводили до 2,0 раствором 2 моль/л хлористоводородной кислоты. Органический слой фракционировали, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и этилацетат, и твердое вещество фильтровали с получением 0,86 г 1-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-дигидрохинолин-6-ил)-3-(2-оксо-2-фенилэтил)мочевины в виде слегка коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,34 (3H, т, J=6,9 Гц), 3,10-3,17 (4H, м), 3,89-3,97 (4H, м), 4,32 (2H, кв, J=7,0 Гц), 4,86 (2H, д, J=4,0 Гц), 5,93-6,01 (1H, м), 6,22 (1H, с), 6,98 (1H, с), 7,34 (1H, д, J=9,2 Гц), 7,42-7,56 (3H, м), 7,59-7,68 (1H, м), 7,96-8,03 (3H, м).
[0131]
Ссылочный Пример 7

К раствору 5 мл N-этиланилина в 50 мл дихлорметана и 25 мл метанола добавляли 6,7 г бикарбоната натрия при комнатной температуре, с последующим добавлением 13,8 г бензилтриметиламмоний дихлорйодата. После перемешивания реакционной смеси при комнатной температуре в течение 30 минут, к смеси добавляли этилацетат и воду. Органический слой фракционировали, промывали последовательно водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении с получением 9,8 г N-этил-4-йоданилина в виде слегка коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,24 (3H, т, J=6,9 Гц), 3,12 (2H, кв, J=7,0 Гц), 3,60 (1H, шир.с) 6,34-6,42 (2H, м), 7,37-7,45 (2H, м).
[0132]
Ссылочный Пример 8

К смеси 9,8 г N-этил-4-йоданилина, 7,0 г 3-трет-бутокси-3-оксопропионовой кислоты и 50 мл дихлорметана добавляли 8,38 г 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли 6,1 мл триэтиламина и 5,34 г N,N-диметил-4-аминопиридина и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 1,75 г 3-трет-бутокси-3-оксопропионовой кислоты и 4,2 г 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду и этилацетат. Органический слой фракционировали, промывали дважды насыщенным водным раствором гидрокарбоната натрия и 1 моль/л раствором хлористоводородной кислоты и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и этилацетат, и твердое вещество фильтровали и промывали диизопропиловым эфиром с получением 8,1 г трет-бутил 3-(этил-(4-йодфенил)амино)-3-оксопропаноата в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,12 (3H, т, J=7,3 Гц), 1,42 (9H, с), 3,07 (2H, с), 3,75 (2H, кв, J=7,0 Гц), 6,94-7,01 (2H, м), 7,71-7,79 (2H, м).
[0133]
Ссылочный Пример 9
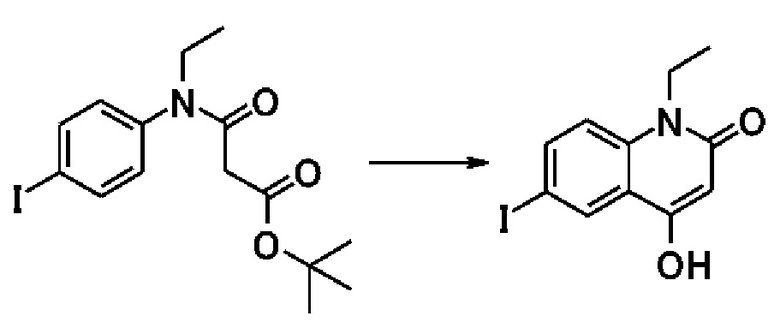
К 40 мл метансульфоновой кислоты при комнатной температуре добавляли 8,1 г трет-бутил 3-(этил(4-йодфенил)амино)-3-оксопропаноата. К полученной смеси добавляли 5,91 г пентаоксида дифосфора и затем смесь перемешивали при температуре окружающей среды 50-60°C в течение 30 минут. Реакционную смесь нагревали и перемешивали при температуре окружающей среды 100-110°C в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры и затем смесь помещали в ледяную воду. Твердое вещество фильтровали и промывали водой с получением 6,55 г 1-этил-4-гидрокси-6-йодхинолин-2(1H)-она в виде слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,14 (3H, т, J=7,3 Гц), 4,17 (2H, кв, J=7,0 Гц), 5,86 (1H, с), 7,36 (1H, д, J=9,2 Гц), 7,88 (1H, дд, J=8,6, 2,0 Гц), 8,14 (1H, д, J=2,0 Гц), 11,56 (1H, шир.с).
[0134]
Ссылочный Пример 10
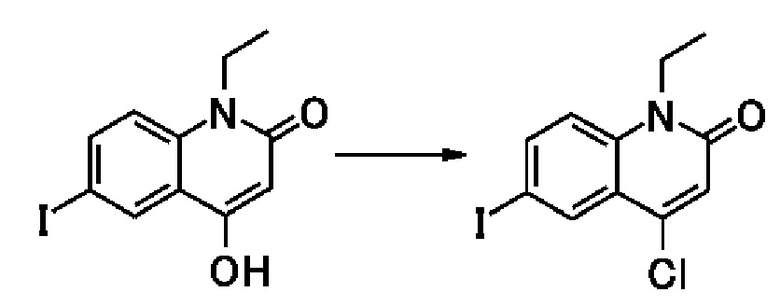
К 25 мл оксихлорида фосфора добавляли 6,5 г 1-этил-4-гидрокси-6-йодхинолин-2(1H)-она при комнатной температуре и смесь перемешивали при температуре окружающей среды 90-100°C в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры и затем смесь помещали в воду. К полученной смеси добавляли этилацетат, органический слой фракционировали, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [этилацетат]. К полученному остатку добавляли диизопропиловый эфир, этилацетат и гексан и твердое вещество фильтровали с получением 4,87 г 4-хлор-1-этил-6-йодхинолин-2(1H)-она в виде слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,19 (3H, т, J=7,3 Гц), 4,25 (2H, кв, J=7,0 Гц), 6,98 (1H, с), 7,52 (1H, д, J=9,2 Гц), 8,01 (1H, дд, J=9,2, 2,0 Гц), 8,19 (1H, д, J=2,0 Гц).
[0135]
Ссылочный Пример 11

Смесь 1,48 г 4-хлор-1-этил-6-йодхинолин-2(1H)-она, 0,9 г формиата натрия, 0,56 г хлорида лития, 1,51 мл N,N-диизопропилэтиламина, 0,86 мл уксусного ангидрида, 0,12 г трис(дибензилиденацетон)дипалладия (0) и 10 мл N,N-диметилацетамида перемешивали в атмосфере азота при температуре окружающей среды 90°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры и нерастворимое вещество отфильтровывали. Остаток на фильтре промывали 5 моль/л водным раствором гидроксида натрия и водой. После объединения фильтрата с промывочным раствором и доведения pH до 2,0 раствором 6 моль/л хлористоводородной кислоты к смеси добавляли диизопропиловый эфир и этилацетат. Твердое вещество фильтровали и промывали диизопропиловым эфиром с получением 1,06 г 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты в виде слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,23 (3H, т, J=7,3 Гц), 4,31 (2H, кв, J=7,0 Гц), 7,06 (1H, с), 7,80 (1H, д, J=9,2 Гц), 8,22 (1H, дд, J=8,6, 2,0 Гц), 8,51 (1H, д, J=2,0 Гц), 13,27 (1H, шир.с).
[0136]
Ссылочный Пример 12

Смесь 10,1 г 4-хлор-1-этил-6-нитрохинолин-2(1H)-она, 8,07 г пинаколового эфира изопропенилбороновой кислоты, 17,38 г трикалийфосфата, 0,28 г бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 225 мл диоксана и 90 мл воды нагревали при кипячении с обратным холодильником в атмосфере азота в течение 3 часов и 10 минут. К реакционной смеси добавляли 0,28 г бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II) и смесь нагревали при кипячении с обратным холодильником в течение 30 минут. К реакционной смеси добавляли 0,28 г бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II) и смесь нагревали при кипячении с обратным холодильником в течение 1 часа и 30 минут. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду. Органический слой фракционировали и водный слой экстрагировали дважды этилацетатом. Органический слой объединяли с экстрактом, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и этилацетат и твердое вещество фильтровали с получением 10,19 г 1-этил-6-нитро-4-(проп-1-ен-2-ил)хинолин-2(1H)-она в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,40 (3H, т, J=7,2 Гц), 2,14-2,19 (3H, м), 4,40 (2H, кв, J=7,2 Гц), 5,13-5,18 (1H, м), 5,49-5,53 (1H, м), 6,66 (1H, с), 7,48 (1H, д, J=9,3 Гц), 8,40 (1H, дд, J=9,3, 2,7 Гц), 8,64 (1H, д, J=2,7 Гц).
[0137]
Ссылочный Пример 13

К раствору 5,0 г 1-этил-6-нитро-4-(проп-1-ен-2-ил)хинолин-2(1H)-она в 450 мл метанола и 50 мл диоксана добавляли 2,5 г 10% палладия на углероде и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 2 часов. Нерастворимое вещество отфильтровывали и растворитель отгоняли при пониженном давлении с получением 3,86 г 6-амино-1-этил-4-(пропан-2-ил)хинолин-2(1H)-она в виде желтой пены.
1H-ЯМР (CDCl3) δ: 1,31 (6H, д, J=6,8 Гц), 1,27-1,38 (3H, м), 3,23-3,35 (1H, м), 4,32 (2H, кв, J=7,2 Гц), 6,63 (1H, с), 6,98 (1H, дд, J=9,0, 2,4 Гц), 7,10 (1H, д, J=2,4 Гц), 7,23-7,30 (1H, м).
[0138]
Ссылочный Пример 14
К суспензии 1,01 г 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты в 5 мл N,N-диметилформамида добавляли 0,83 г карбоната калия и 0,51 мл бензилхлорида и смесь перемешивали при температуре окружающей среды 80°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду и pH смеси доводили до 2,0 раствором 6 моль/л хлористоводородной кислоты. Органический слой фракционировали и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, промывали последовательно водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [градиент элюирования гексан:этилацетат=80:20-70:30]. К полученному остатку добавляли диизопропиловый эфир и твердое вещество фильтровали с получением 1,09 г бензил 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоксилата в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,36 (3H, т, J=7,2 Гц), 4,36 (2H, кв, J=7,2 Гц), 5,43 (2H, с), 6,93 (1H, с), 7,34-7,52 (6H, м), 8,30 (1H, дд, J=9,0, 2,0 Гц), 8,75 (1H, д, J=2,0 Гц).
[0139]
Ссылочный Пример 15

Смесь 1,09 г бензил 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоксилата, 1,18 г трет-бутил 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,6-дигидропиридин-1(2H)-карбоксилата, 1,36 г трикалийфосфата, 68 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 23 мл диоксана и 9 мл воды нагревали при кипячении с обратным холодильником в атмосфере азота в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду. Органический слой фракционировали и водный слой экстрагировали дважды этилацетатом. Органический слой объединяли с экстрактом, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [градиент элюирования гексан:этилацетат=70:30 to 60:40] с получением бензил 4-(1-(трет-бутоксикарбонил)-1,2,3,6-тетрагидропиридин-4-ил)-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоксилата в виде желтого масла.
К раствору полученного бензил 4-(1-(трет-бутоксикарбонил)-1,2,3,6-тетрагидропиридин-4-ил)-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоксилата в 4 мл муравьиной кислоты добавляли 2,5 мл 37% водного раствора формальдегида и смесь перемешивали при температуре окружающей среды 80°C в течение 1 часа и 30 минут. К водному раствору гидрокарбоната натрия добавляли реакционную смесь и этилацетат. Органический слой фракционировали и водный слой экстрагировали дважды этилацетатом. Органический слой объединяли с экстрактом, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [градиент элюирования хлороформ:метанол=100:0-70:30] с получением 1,17 г бензил 1-этил-4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксилата в виде светло-коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,37 (3H, т, J=7,2 Гц), 2,45 (3H, с), 2,42-2,53 (2H, м), 2,71 (2H, т, J=5,6 Гц), 3,13-3,21 (2H, м), 4,37 (2H, кв, J=7,2 Гц), 5,39 (2H, с), 5,80-5,87 (1H, м), 6,58 (1H, с), 7,33-7,50 (6H, м), 8,21 (1H, дд, J=9,0, 2,0 Гц), 8,45 (1H, д, J=2,0 Гц).
[0140]
Ссылочный Пример 16

К раствору 118 мг бензил 1-этил-4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксилата в 20 мл метанола добавляли 118 мг 10% палладия на углероде и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 3 часов и 15 минут. Нерастворимое вещество отфильтровывали и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли этилацетат и твердое вещество фильтровали с получением 62 мг 1-этил-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты.
1H-ЯМР (D2O) δ: 1,12 (3H, т, J=7,3 Гц), 1,70-1,85 (2H, м), 2,01-2,12 (2H, м), 2,81 (3H, с), 3,13-3,23 (2H, м), 3,24-3,34 (1H, м), 3,48-3,57 (2H, м), 4,13 (2H, кв, J=7,3 Гц), 6,41 (1H, с), 7,51 (1H, д, J=9,0 Гц), 7,98 (1H, д, J=9,0 Гц), 8,25 (1H, с).
[0141]
Ссылочный Пример 17
Смесь 0,39 г 4-хлор-1-этил-6-йодхинолин-2(1H)-она, 2,0 мл N,N-диметилацетамида и 0,51 мл морфолина перемешивали в плотно закрытой пробирке при температуре окружающей среды 130-140°C в течение 1 часа и 30 минут. Реакционную смесь охлаждали до комнатной температуры и затем растворитель отгоняли при пониженном давлении. К полученному остатку добавляли этилацетат и воду и pH смеси доводили до 2,0 раствором 2 моль/л хлористоводородной кислоты. Органический слой фракционировали, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и гексан и твердое вещество фильтровали с получением 0,33 г 1-этил-6-йод-4-(морфолин-4-ил)хинолин-2(1H)-она в виде слегка коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,32 (3H, т, J=7,3 Гц), 3,04-3,13 (4H, м), 3,90-3,99 (4H, м), 4,28 (2H, кв, J=7,3 Гц), 6,18 (1H, с), 7,14 (1H, д, J=9,2 Гц), 7,79 (1H, дд, J=8,9, 2,3 Гц), 8,10 (1H, д, J=8,9 Гц).
[0142]
Ссылочный Пример 18

Смесь 0,25 г 1-этил-6-йод-4-(морфолин-4-ил)хинолин-2(1H)-она, 53 мг 1,1'-бис(дифенилфосфино)ферроценпалладий(II) дихлорида, 0,19 г ацетата калия, 0,17 г бис(пинаколато)дибора и 3,0 мл диоксана нагревали при кипячении с обратным холодильником в атмосфере азота в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду. Органический слой фракционировали, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [градиентное элюирование гексан:этилацетат=80:20-0:100] с получением 66 мг 1-этил-4-(морфолин-4-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)хинолин-2(1H)-она в виде слегка коричневого масла.
1H-ЯМР (CDCl3) δ: 1,20-1,45 (15H, м), 3,05-3,22 (4H, м), 3,90-4,05 (4H, м), 4,25-4,41 (2H, м), 6,14-6,22 (1H, м), 7,33-7,43 (1H, м), 7,89-8,00 (1H, м), 8,23-8,33 (1H, м).
[0143]
Ссылочный Пример 19

К раствору 1,0 г 6-амино-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-она в 10 мл дихлорметана добавляли 0,65 г 1,1'-карбонилдиимидазола и смесь перемешивали при температуре окружающей среды 40-50°C в течение 2 часов. К реакционной смеси при охлаждении льдом добавляли 0,76 мл триэтиламина и 0,84 г 2-амино-1-(4-хлорфенил)этанон гидрохлорида и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли хлороформ и воду и pH смеси доводили до 2,0 раствором 2 моль/л хлористоводородной кислоты. Органический слой фракционировали, промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [градиентное элюирование хлороформ:метанол=100:0-90:10]. К полученному остатку добавляли диизопропиловый эфир и этилацетат и твердое вещество фильтровали с получением 0,74 г 1-(2-(4-хлорфенил)-2-оксоэтил)-3-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-дигидрохинолин-6-ил)мочевины в виде слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,17 (3H, т, J=7,0 Гц), 3,01-3,08 (4H, м), 3,79-3,86 (4H, м), 4,20 (2H, кв, J=7,1 Гц), 4,70 (2H, д, J=5,1 Гц), 5,99 (1H, с), 6,50 (1H, т, J=5,2 Гц), 7,47 (1H, д, J=9,3 Гц), 7,56 (1H, дд, J=9,1, 2,6 Гц), 7,61-7,67 (2H, м), 8,01-8,07 (3H, м), 9,07 (1H, с).
[0144]
Ссылочный Пример 20
Смесь 11,14 г 4-хлор-1-этил-6-йодхинолин-2(1H)-она, 7,93 г трет-бутил 1-фенилгидразинкарбоксилата, 581 мг три-трет-бутилфосфоний тетрафторбората, 375 мг ацетата палладия, 16,32 г карбоната цезия и 160 мл толуола нагревали при кипячении с обратным холодильником в атмосфере азота в течение 1 часа и 30 минут. Реакционную смесь охлаждали до комнатной температуры и затем добавляли воду. Органический слой фракционировали и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [градиентное элюирование гексан:этилацетат=80:20-60:40] с получением 6,01 г трет-бутил 2-(4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-1-фенилгидразинкарбоксилата в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,33 (3H, т, J=7,2 Гц), 1,43 (9H, с), 4,31 (2H, кв, J=7,1 Гц), 6,58 (1H, с), 6,87 (1H, с), 7,13-7,20 (2H, м), 7,29-7,39 (3H, м), 7,45 (1H, д, J=2,7 Гц), 7,54-7,60 (2H, м).
[0145]
Ссылочный Пример 21
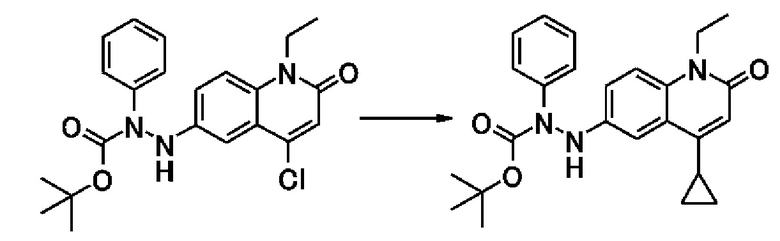
Смесь 690 мг трет-бутил 2-(4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-1-фенилгидразинкарбоксилата, 172 мг циклопропилборной кислоты, 1,06 г трикалийфосфата, 35 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 12 мл диоксана и 4,0 мл воды перемешивали при 140°C в течение 5 минут с использованием микроволнового устройства. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду. Органический слой фракционировали и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [градиентное элюирование гексан:этилацетат=60:40-40:60] с получением 527 мг трет-бутил 2-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-1-фенилгидразинкарбоксилата в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,67-0,73 (2H, м), 0,94-1,01 (2H, м), 1,32 (3H, т, J=7,1 Гц), 1,41 (9H, с), 1,90-2,00 (1H, м), 4,31 (2H, кв, J=7,2 Гц), 6,44 (1H, д, J=0,98 Гц), 6,56 (1H, с), 7,08-7,19 (2H, м), 7,25-7,39 (3H, м), 7,52 (1H, д, J=2,4 Гц), 7,57-7,63 (2H, м).
[0146]
Ссылочный Пример 22
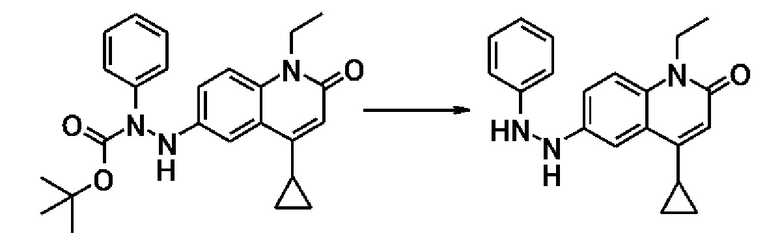
Смесь 200 мг трет-бутил 2-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-1-фенилгидразинкарбоксилата и 2 мл 20% раствора этоксид натрия-этанол перемешивали при 140°C в течение 2 минут с использованием микроволнового устройства. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду. Органический слой фракционировали, промывали последовательно водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и твердое вещество фильтровали и промывали диизопропиловым эфиром с получением 115 мг 4-циклопропил-1-этил-6-(2-фенилгидразинил)хинолин-2(1H)-она в виде светло-желтого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 0,62-0,69 (2H, м), 0,87-0,95 (2H, м), 1,15 (3H, т, J=7,0 Гц), 1,90-2,00 (1H, м), 4,18 (2H, кв, J=7,0 Гц), 6,20 (1H, с), 6,65 (1H, т, J=7,2 Гц), 6,74-6,81 (2H, м), 7,08-7,15 (3H, м), 7,41 (1H, д, J=9,3 Гц), 7,45 (1H, д, J=2,4 Гц), 7,69-7,77 (2H, м).
[0147]
Ссылочный Пример 23

К суспензии 4,0 г 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты в 25 мл тетрагидрофурана при комнатной температуре добавляли 2,6 мл оксалилхлорида и 10 мкл N,N-диметилформамида и смесь перемешивали в течение 3 часов. К 28% водному раствору аммиака при охлаждении льдом добавляли реакционную смесь и 100 мл воды. Твердое вещество фильтровали и промывали водой с получением 3,70 г 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоксамида в виде слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,22 (3H, т, J=7,1 Гц), 4,31 (2H, кв, J=7,2 Гц), 7,02 (1H, с), 7,52 (1H, шир.с) 7,76 (1H, д, J=9,0 Гц), 8,22 (1H, дд, J=8,9, 2,1 Гц), 8,25 (1H, шир.с) 8,50 (1H, д, J=2,2 Гц).
[0148]
Ссылочный Пример 24

Смесь 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоксамида и 10 мл 1,1-диметокси-N,N-диметилэтанамина нагревали при кипячении с обратным холодильником в течение 4 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляли диизопропиловый эфир, твердое вещество фильтровали и промывали диизопропиловым эфиром с получением 2,13 г 4-хлор-N-((1E)-1-(диметиламино)этилиден)-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоксамида в виде слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,22 (3H, т, J=7,1 Гц), 2,31 (3H, с), 3,16 (3H, с), 3,19 (3H, с), 4,30 (2H, кв, J=7,1 Гц), 7,00 (1H, с), 7,72 (1H, д, J=8,8 Гц), 8,33 (1H, дд, J=8,8, 2,0 Гц), 8,64 (1H, д, J=2,0 Гц).
[0149]
Ссылочный Пример 25
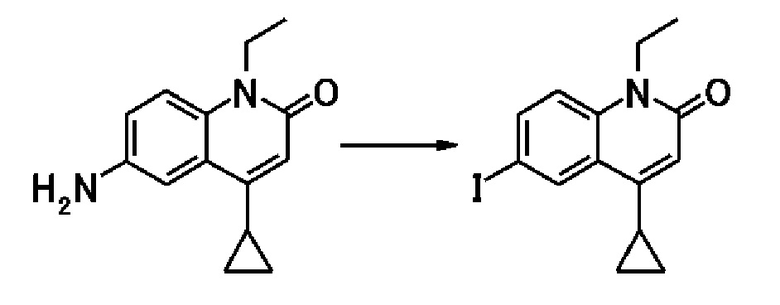
К раствору 0,50 г 6-амино-4-циклопропил-1-этилхинолин-2(1H)-она в 9 мл ацетонитрила добавляли 1,25 г моногидрата пара-толуолсульфоновой кислоты с последующим добавлением 1,3 мл водного раствора 0,91 г йодида калия и 0,30 г нитрита натрия при охлаждении льдом. Смесь перемешивали в течение 10 минут и затем перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду, насыщенный водный раствор карбоната натрия, 1% водный раствор тиосульфата натрия и этилацетат. Органический слой фракционировали и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [градиентное элюирование гексан:этилацетат=70:30-40:60]. К полученному остатку добавляли диизопропиловый эфир и твердое вещество фильтровали с получением 0,31 г 4-циклопропил-1-этил-6-йодхинолин-2(1H)-она в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,75-0,79 (2H, м), 1,07-1,12 (2H, м), 1,32 (3H, т, J=7,2 Гц), 2,01-2,08 (1H, м), 4,30 (2H, кв, J=7,2 Гц), 6,43 (1H, д, J=1,2 Гц), 7,14 (1H, д, J=8,8 Гц), 7,81 (1H, дд, J=8,8, 2,0 Гц), 8,38 (1H, д, J=2,0 Гц).
[0150]
Ссылочный Пример 26

Способом, аналогичным описанному в Ссылочном Примере 18, из 4-хлор-1-этил-6-йодхинолин-2(1H)-она получали 4-хлор-1-этил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)хинолин-2(1H)-он.
1H-ЯМР (CDCl3) δ: 1,35 (3H, т, J=7,2 Гц), 1,38 (12H, с), 4,36 (2H, кв, J=7,2 Гц), 6,88 (1H, с), 7,39 (1H, д, J=8,5 Гц), 8,03 (1H, дд, J=8,5, 1,5 Гц), 8,46 (1H, д, J=1,5 Гц).
[0151]
Ссылочный Пример 27
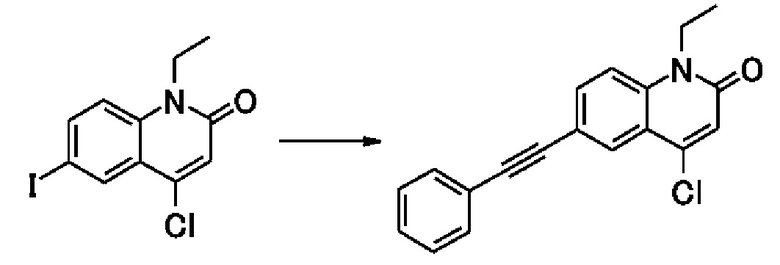
Смесь 334 мг 4-хлор-1-этил-6-йодхинолин-2(1H)-она, 112 мг этинилбензола, 2 мг йодида меди (I), 5 мг трифенилфосфина, 2 мг дихлорпалладия, 0,42 мл триэтиламина и 5 мл тетрагидрофурана перемешивали в атмосфере азота при комнатной температуре в течение 2 часов. К реакционной смеси добавляли этилацетат, воду и 1 моль/л хлористоводородной кислоты. Органический слой фракционировали и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и твердое вещество фильтровали с получением 160 мг 4-хлор-1-этил-6-(фенилэтинил)хинолин-2(1H)-она в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,37 (3H, т, J=7,2 Гц), 4,36 (2H, кв, J=7,2 Гц), 6,92 (1H, с), 7,35-7,42 (4H, м), 7,55-7,60 (2H, м), 7,76 (1H, дд, J=8,8, 2,0 Гц), 8,20 (1H, д, J=2,0 Гц).
[0152]
Ссылочный Пример 28

Смесь 154 мг 4-хлор-1-этил-6-(фенилэтинил)хинолин-2(1H)-она, 52 мг циклопропилборной кислоты, 318 мг трикалийфосфата, 11 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 3 мл диоксана и 1 мл воды перемешивали при 140°C в течение 15 минут с использованием микроволнового устройства. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат, воду и 2 моль/л раствор хлористоводородной кислоты. Органический слой фракционировали и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи хроматографии на силикагеле [градиентное элюирование гексан:этилацетат=80:20-60:40]. К полученному остатку добавляли диизопропиловый эфир и твердое вещество фильтровали с получением 100 мг 4-циклопропил-1-этил-6-(фенилэтинил)хинолин-2(1H)-она в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,77-0,83 (2H, м), 1,08-1,16 (2H, м), 1,36 (3H, т, J=7,1 Гц), 2,08-2,19 (1H, м), 4,35 (2H, кв, J=7,2 Гц), 6,45-6,49 (1H, м), 7,34-7,42 (4H, м), 7,55-7,61 (2H, м), 7,71 (1H, дд, J=8,9, 1,8 Гц), 8,27 (1H, д, J=2,0 Гц).
[0153]
Ссылочный Пример 29

Смесь 31 мг 4-циклопропил-1-этил-6-(фенилэтинил)хинолин-2(1H)-она, 24 мг сульфата магния, 19 мг перманганата калия, 5 мг гидрокарбоната натрия, 3 мл ацетона и 1,7 мл воды перемешивали при комнатной температуре в течение 20 минут. К реакционной смеси добавляли 43 мг перманганата калия и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 30 мг нитрита натрия и 10% водный раствор серной кислоты и затем нерастворимое вещество отфильтровывали. Остаток на фильтре промывали этилацетатом и водой. Фильтрат объединяли с промывочным раствором и органический слой фракционировали и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи хроматографии на силикагеле [градиентное элюирование гексан:этилацетат=60:40-30:70] с получением 20 мг 1-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-2-фенилэтан-1,2-диона.
1H-ЯМР (CDCl3) δ: 0,74-0,80 (2H, м), 1,05-1,12 (2H, м), 1,35 (3H, т, J=7,1 Гц), 2,07-2,16 (1H, м), 4,36 (2H, кв, J=7,2 Гц), 6,46-6,49 (1H, м), 7,46 (1H, д, J=9,0 Гц), 7,54 (2H, т, J=7,9 Гц), 7,69 (1H, т, J=7,4 Гц), 8,02 (2H, дд, J=8,3, 1,2 Гц), 8,14 (1H, дд, J=8,9, 2,1 Гц), 8,77 (1H, д, J=2,0 Гц).
[0154]
Ссылочный Пример 30

Смесь 503 мг 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты, 639 мг 8-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-(1,4-диоксаспиро[4.5]дец-7-ена, 849 мг трикалийфосфата, 42 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 12 мл диоксана и 4 мл воды перемешивали при 140°C в течение 5 минут с использованием микроволнового устройства. Реакционную смесь охлаждали до комнатной температуры и затем к реакционной смеси добавляли этилацетат и воду. Водный слой фракционировали и промывали дважды этилацетатом. К водному слою добавляли 6 моль/л хлористоводородной кислоты для доведения pH до 2,0 и затем добавляли тетрагидрофуран. Органический слой фракционировали и водный слой экстрагировали дважды этилацетатом. Органический слой объединяли с экстрактом, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли этилацетат и твердое вещество фильтровали с получением 590 мг 4-(1,4-диоксаспиро[4,5]дец-7-ен-8-ил)-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты в виде светло-коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,21 (3H, т, J=7,0 Гц), 1,85 (2H, т, J=6,2 Гц), 2,39-2,56 (4H, м), 3,94-4,00 (4H, м), 4,29 (2H, кв, J=7,1 Гц), 5,71-5,76 (1H, м), 6,41 (1H, с), 7,69 (1H, д, J=9,0 Гц), 8,11 (1H, дд, J=8,9, 2,1 Гц), 8,26 (1H, д, J=2,2 Гц), 13,02 (1H, шир.с).
[0155]
Ссылочный Пример 31
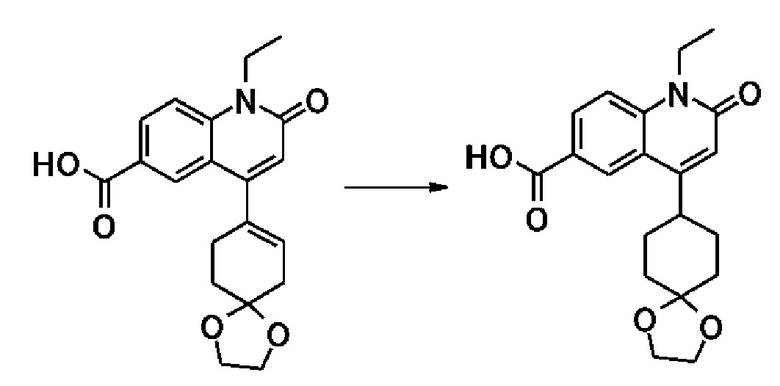
К смеси 583 мг 4-(1,4-диоксаспиро[4,5]дец-7-ен-8-ил)-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты, 20 мл диоксана и 100 мл метанола добавляли 291 мг 20% гидроксида палладия на углероде и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 30 минут. Нерастворимое вещество отфильтровывали и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир, твердое вещество фильтровали с получением 502 мг 4-(1,4-диоксаспиро[4,5]дец-8-ил)-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты в виде белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,22 (3H, т, J=7,0 Гц), 1,60-1,93 (8H, м), 3,10-3,25 (1H, м), 3,87-3,96 (4H, м), 4,29 (2H, кв, J=6,9 Гц), 6,46-6,51 (1H, м), 7,66-7,73 (1H, м), 8,13 (1H, дд, J=8,7 Гц, 1,6 Гц), 8,45 (1H, д, J=1,5 Гц), 13,06 (1H, шир.с).
[0156]
Ссылочный Пример 32

К суспензии 250 мг 4-(1,4-диоксаспиро[4,5]дец-8-ил)-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты в 10 мл тетрагидрофурана при комнатной температуре добавляли 1,0 мл концентрированной хлористоводородной кислоты и смесь перемешивали в течение 4 часов. Твердое вещество фильтровали и промывали этилацетатом с получением 182 мг 1-этил-2-оксо-4-(4-оксоциклогексил)-1,2-дигидрохинолин-6-карбоновой кислоты в виде белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,22 (3H, т, J=7,1 Гц), 1,83-2,00 (2H, м), 2,09-2,19 (2H, м), 2,26-2,37 (2H, м), 2,71-2,83 (2H, м), 3,67-3,77 (1H, м), 4,30 (2H, кв, J=7,1 Гц), 6,58-6,62 (1H, м), 7,73 (1H, д, J=9,0 Гц), 8,16 (1H, дд, J=8,9 Гц, 1,8 Гц), 8,57 (1H, д, J=2,0 Гц).
[0157]
Пример 1
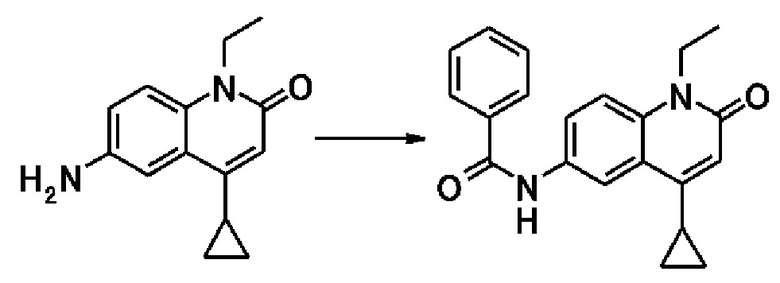
К суспензии 1,2 г 6-амино-4-циклопропил-1-этилхинолин-2(1H)-она в 6 мл пиридина добавляли 0,73 мл бензоилхлорида и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли этилацетат и воду и pH смеси доводили до 2,0 раствором 2 моль/л хлористоводородной кислоты. Органический слой фракционировали, промывали водой и насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и этилацетат и твердое вещество фильтровали с получением 1,75 г N-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)бензамида в виде слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 0,75-0,84 (2H, м), 1,02-1,11 (2H, м), 1,20 (3H, т, J=6,9 Гц), 2,09-2,21 (1H, м), 4,26 (2H, кв, J=7,1 Гц), 6,32 (1H, с), 7,44-7,66 (4H, м), 7,91-8,09 (3H, м), 8,65 (1H, д, J=2,0 Гц), 10,45 (1H, с).
[0158]
Пример 2

К раствору 1,75 г N-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)бензамида в 15 мл N,N-диметилацетамида добавляли 0,25 г 60% гидрида натрия при охлаждении льдом и смесь перемешивали в течение 10 минут. К реакционной смеси при охлаждении льдом добавляли 0,43 мл метилйодида, смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли этилацетат и воду и pH смеси доводили до 2,0 раствором 6 моль/л хлористоводородной кислоты и затем твердое вещество фильтровали. Органический слой фильтрата фракционировали, промывали водой и насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. К полученному остатку и отфильтрованному твердому веществу добавляли диизопропиловый эфир, этилацетат и воду и затем твердое вещество фильтровали, промывали водой и диизопропиловым эфиром с получением 1,45 г N-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-N-метилбензамида в виде слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 0,48-0,57 (2H, м), 0,86-0,95 (2H, м), 1,13 (3H, т, J=6,9 Гц), 1,93-2,06 (1H, м), 3,44 (3H, с), 4,19 (2H, кв, J=6,8 Гц), 6,24 (1H, с), 7,16-7,33 (5H, м), 7,46-7,58 (2H, м), 7,76-7,81 (1H, м).
[0159]
Пример 3

К суспензии 0,86 г 1-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-дигидрохинолин-6-ил)-3-(2-оксо-2-фенилэтил)мочевины в 5,0 мл диоксана при комнатной температуре добавляли 5,0 мл концентрированной хлористоводородной кислоты и смесь перемешивали в течение 2 часов. К реакционной смеси добавляли воду и твердое вещество фильтровали и промывали водой и диизопропиловым эфиром с получением 0,72 г 1-этил-4-(морфолин-4-ил)-6-(2-оксо-5-фенил-2,3-дигидро-1H-имидазол-1-ил)хинолин-2(1H)-она в виде слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,19 (3H, т, J=7,3 Гц), 2,54-2,65 (4H, м), 3,44-3,53 (4H, м), 4,17-4,29 (2H, м), 5,98 (1H, с), 6,87 (1H, д, J=2,6 Гц), 7,05-7,12 (2H, м), 7,14-7,31 (4H, м), 7,59-7,68 (2H, м), 10,57-10,63 (1H, м).
[0160]
Пример 4

К суспензии 3,0 г 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты в 30 мл тетрагидрофурана при комнатной температуре добавляли 1,25 мл оксалилхлорида и 10 мкл N,N-диметилформамида и смесь перемешивали в течение 2 часов. К реакционной смеси при охлаждении льдом добавляли 1,55 мл N-метиланилина и 1,81 мл триэтиламина и затем смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли этилацетат и воду. Органический слой фракционировали, промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [градиентное элюирование гексан:этилацетат=50:50-20:80]. К полученному остатку добавляли диизопропиловый эфир и этилацетат и затем твердое вещество фильтровали с получением 2,01 г 4-хлор-1-этил-N-метил-2-оксо-N-фенил-1,2-дигидрохинолин-6-карбоксамида в виде слегка коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,28 (3H, т, J=6,9 Гц), 3,55 (3H, с), 4,26 (2H, кв, J=7,3 Гц), 6,81 (1H, с), 7,07-7,13 (2H, м), 7,15-7,32 (4H, м), 7,65 (1H, дд, J=9,2, 2,0 Гц), 7,94 (1H, д, J=2,0 Гц).
[0161]
Пример 5
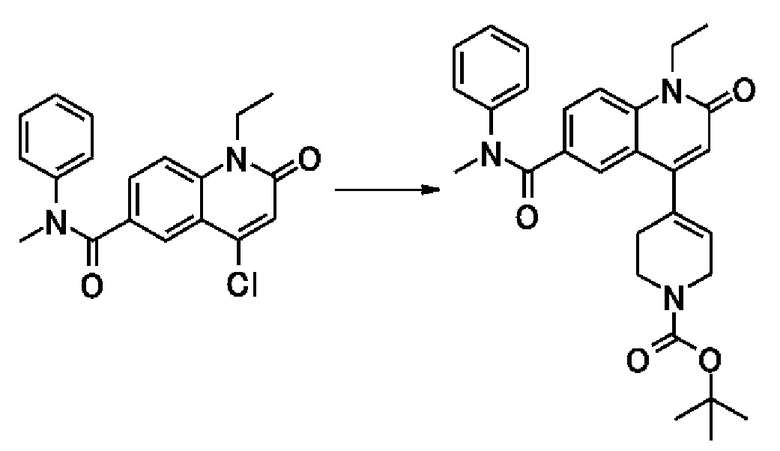
Смесь 2,0 г 4-хлор-1-этил-N-метил-2-оксо-N-фенил-1,2-дигидрохинолин-6-карбоксамида, 2,18 г трет-бутил 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,6-дигидропиридин-1(2H)-карбоксилата, 1,24 г карбоната натрия, 0,21 г бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 20 мл диметилового эфира этиленгликоля и 4,0 мл воды нагревали при кипячении с обратным холодильником в атмосфере азота в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду. Органический слой фракционировали, промывали последовательно водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи хроматографии на силикагеле [градиентное элюирование гексан:этилацетат=50:50-0:100] с получением 2,9 г трет-бутил 4-(1-этил-6-(метил(фенил)карбамоил)-2-оксо-1,2-дигидрохинолин-4-ил)-3,6-дигидропиридин-1(2H)-карбоксилата в виде слегка коричневой пены.
1H-ЯМР (CDCl3) δ: 1,32 (3H, т, J=6,9 Гц), 1,56 (9H, с), 1,94-2,14 (2H, м), 3,53 (3H, с), 3,57 (2H, т, J=5,6 Гц), 3,99-4,06 (2H, м), 4,30 (2H, кв, J=7,0 Гц), 5,42 (1H, шир.с) 6,41 (1H, с), 6,99-7,07 (2H, м), 7,10-7,19 (1H, м), 7,22-7,33 (3H, м), 7,35-7,41 (1H, м), 7,77 (1H, дд, J=9,2, 2,0 Гц).
[0162]
Пример 6
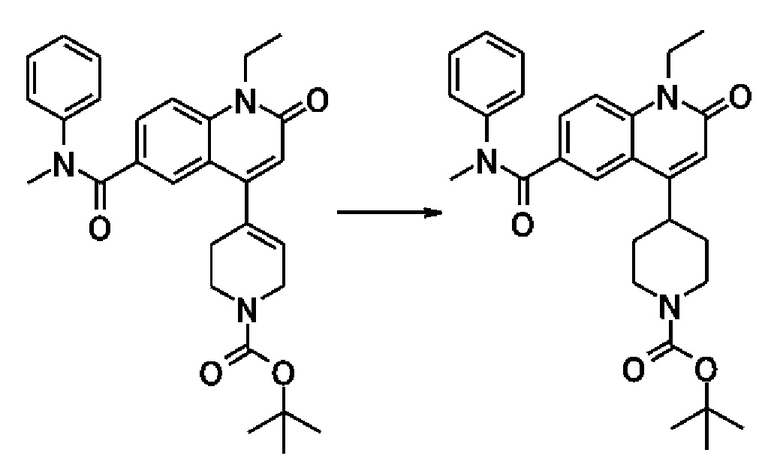
Смесь 1,47 г трет-бутил 4-(1-этил-6-(метил(фенил)карбамоил)-2-оксо-1,2-дигидрохинолин-4-ил)-3,6-дигидропиридин-1(2H)-карбоксилата, 0,44 г 5% палладия на углероде, 0,29 г формиата аммония и 15 мл метанола нагревали при кипячении с обратным холодильником в атмосфере азота в течение 1 часа и 30 минут. Реакционную смесь охлаждали до комнатной температуры и нерастворимое вещество отфильтровывали. Остаток на фильтре промывали этилацетатом. Фильтрат объединяли с промывочным раствором и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли 0,44 г 5% палладия на углероде, 0,29 г формиата аммония и 15 мл метанола и смесь нагревали при кипячении с обратным холодильником в атмосфере азота в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и нерастворимое вещество отфильтровывали. Остаток на фильтре промывали этилацетатом. Фильтрат объединяли с промывочным раствором и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и твердое вещество фильтровали и промывали диизопропиловым эфиром с получением 1,26 г трет-бутил 4-(1-этил-6-(метил(фенил)карбамоил)-2-оксо-1,2-дигидрохинолин-4-ил)пиперидин-1-карбоксилата в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,31 (3H, т, J=7,3 Гц), 1,40-1,58 (4H, м), 1,50 (9H, с), 2,62-2,85 (3H, м), 3,56 (3H, с), 4,15-4,34 (4H, м), 6,49 (1H, с), 7,04-7,11 (2H, м), 7,12-7,20 (1H, м), 7,23-7,33 (3H, м), 7,61 (1H, д, J=2,0 Гц), 7,73 (1H, дд, J=8,6, 2,0 Гц).
[0163]
Пример 7
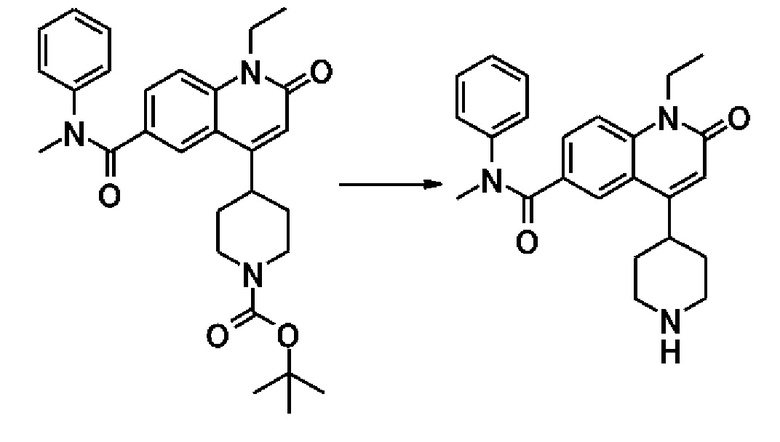
Смесь 1,26 г трет-бутил 4-(1-этил-6-(метил(фенил)карбамоил)-2-оксо-1,2-дигидрохинолин-4-ил)-пиперидин-1-карбоксилата в 5 мл дихлорметана и 5 мл трифторуксусной кислоты перемешивали при комнатной температуре в течение 30 минут и затем растворитель отгоняли при пониженном давлении. К полученному остатку добавляли этилацетат и насыщенный водный раствор гидрокарбоната натрия и органический слой фракционировали. Водный слой экстрагировали этилацетатом и дважды дополнительно экстрагировали хлороформом. Органический слой объединяли с экстрактом и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении с получением 1,0 г 1-этил-N-метил-2-оксо-N-фенил-4-(пиперидин-4-ил)-1,2-дигидрохинолин-6-карбоксамида в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,31 (3H, т, J=7,3 Гц), 1,55-1,67 (4H, м), 2,67-2,90 (3H, м), 3,22-3,34 (2H, м), 3,56 (3H, с), 4,29 (2H, кв, J=7,3 Гц), 6,55 (1H, с), 7,05-7,20 (3H, м), 7,22-7,32 (3H, м), 7,62 (1H, д, J=2,0 Гц), 7,71 (1H, дд, J=8,6, 2,0 Гц).
[0164]
Пример 8

К суспензии 1,0 г 1-этил-N-метил-2-оксо-N-фенил-4-(пиперидин-4-ил)-1,2-дигидрохинолин-6-карбоксамида в 15 мл ацетона и 8 мл тетрагидрофурана добавляли 0,71 г карбоната калия и 0,25 мл этилйодида и смесь перемешивали при комнатной температуре в течение 30 минут и затем перемешивали при температуре окружающей среды 40°C в течение 2 часов. После добавления к реакционной смеси 0,24 г карбоната калия и 82 мкл этилйодида и перемешивания при температуре окружающей среды 40°C в течение 1 часа растворитель отгоняли при пониженном давлении. К полученному остатку добавляли этилацетат и воду, органический слой фракционировали, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на щелочном силикагеле [градиентное элюирование гексан:этилацетат=50:50-0:100]. К полученному остатку добавляли диизопропиловый эфир и твердое вещество фильтровали с получением 0,76 г 1-этил-4-(1-этилпиперидин-4-ил)-N-метил-2-оксо-N-фенил-1,2-дигидрохинолин-6-карбоксамида в виде белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,05 (3H, т, J=7,3 Гц), 1,15 (3H, т, J=7,3 Гц), 1,31-1,52 (4H, м), 1,92-2,06 (2H, м), 2,40 (2H, кв, J=7,0 Гц), 2,47-2,63 (1H, м), 2,86-2,98 (2H, м), 3,43 (3H, с), 4,20 (2H, кв, J=7,0 Гц), 6,36 (1H, с), 7,10-7,32 (5H, м), 7,50-7,58 (2H, м), 7,73 (1H, дд, J=8,9, 1,7 Гц).
[0165]
Пример 9
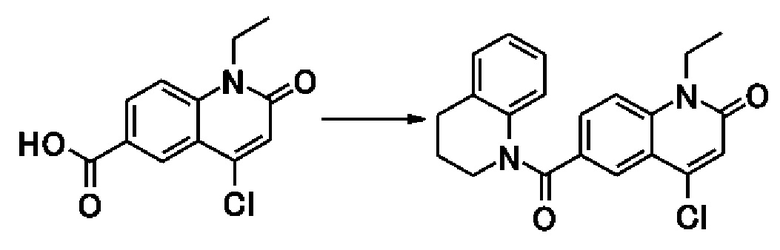
Способом, аналогичным описанному в Примере 4, из 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты получали 4-хлор-6-(3,4-дигидрохинолин-1(2H)-илкарбонил)-1-этилхинолин-2(1H)-он.
1H-ЯМР (CDCl3) δ: 1,31 (3H, т, J=7,2 Гц), 2,10 (2H, квинт., J=6,6 Гц), 2,88 (2H, т, J=6,6 Гц), 3,96 (2H, т, J=6,7 Гц), 4,30 (2H, кв, J=7,2 Гц), 6,65 (1H, д, J=7,8 Гц), 6,83-6,90 (2H, м), 7,00-7,06 (1H, м), 7,18-7,28 (2H, м), 7,56 (1H, дд, J=8,8, 2,0 Гц), 8,09 (1H, д, J=2,2 Гц).
[0166]
Пример 10
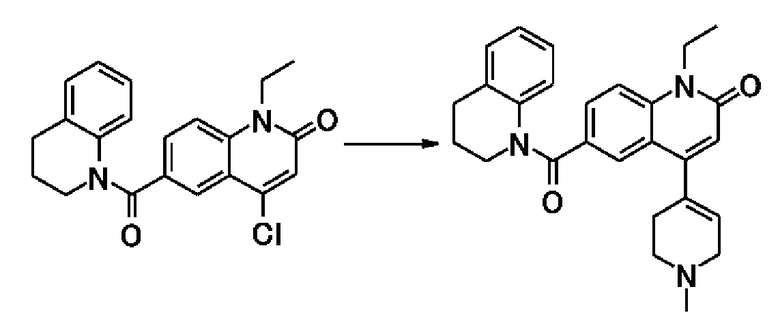
Смесь 64 мг 4-хлор-6-(3,4-дигидрохинолин-1(2H)-илкарбонил)-1-этилхинолин-2(1H)-она, 47 мг 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2,3,6-тетрагидропиридина, 55 мг карбоната натрия, 12,3 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 2 мл диметилового эфира этиленгликоля и 0,2 мл воды нагревали при кипячении с обратным холодильником в атмосфере азота в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду. Органический слой фракционировали, промывали последовательно водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи основной колоночной хроматографии на силикагеле [градиентное элюирование гексан:этилацетат=50:50-0:100] с получением 62 мг 6-(3,4-дигидрохинолин-1(2H)-илкарбонил)-1-этил-4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)хинолин-2(1H)-она в виде слегка коричневой пены.
1H-ЯМР (CDCl3) δ: 1,35 (3H, т, J=6,9 Гц), 2,05-2,18 (4H, м), 2,41 (3H, с), 2,45-2,55 (2H, м), 2,87 (2H, т, J=6,6 Гц), 2,94-3,02 (2H, м), 3,95 (2H, т, J=6,6 Гц), 4,33 (2H, кв, J=7,1 Гц), 5,29-5,36 (1H, м), 6,47 (1H, с), 6,54 (1H, д, J=7,9 Гц), 6,80-6,89 (1H, м), 6,94-7,02 (1H, м), 7,18 (1H, д, J=7,3 Гц), 7,35 (1H, д, J=9,2 Гц), 7,49 (1H, д, J=2,0 Гц), 7,77 (1H, дд, J=8,6, 2,0 Гц).
[0167]
Пример 11

Смесь 60 мг 6-(3,4-дигидрохинолин-1(2H)-илкарбонил)-1-этил-4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)хинолин-2(1H)-она в 15 мл метанола и 15 мл этилацетата подвергали реакции гидрирования (25°C, 1 бар, скорость потока 2 мл/мин, 10% палладий на углероде) с использованием аппарата для гидрирования проточного типа. Растворитель отгоняли при пониженном давлении и затем полученный остаток очищали при помощи колоночной хроматографии на щелочном силикагеле [градиентное элюирование гексан:этилацетат=50:50-0:100]. К полученному остатку добавляли диизопропиловый эфир и этилацетат и твердое вещество фильтровали с получением 10 мг 6-(3,4-дигидрохинолин-1(2H)-илкарбонил)-1-этил-4-(1-метилпиперидин-4-ил)хинолин-2(1H)-она в виде белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,18 (3H, т, J=6,9 Гц), 1,24-1,52 (4H, м), 1,80-1,94 (2H, м), 1,95-2,10 (2H, м), 2,19 (3H, с), 2,50-2,65 (1H, м), 2,70-2,81 (2H, м), 2,87 (2H, т, J=6,3 Гц), 3,81 (2H, т, J=6,6 Гц), 4,24 (2H, кв, J=6,8 Гц), 6,38 (1H, с), 6,58 (1H, д, J=7,9 Гц), 6,84 (1H, т, J=7,3 Гц), 6,96 (1H, т, J=7,3 Гц), 7,22 (1H, д, J=7,3 Гц), 7,50-7,55 (1H, м), 7,62 (1H, д, J=9,2 Гц), 7,73-7,81 (1H, м).
[0168]
Пример 12
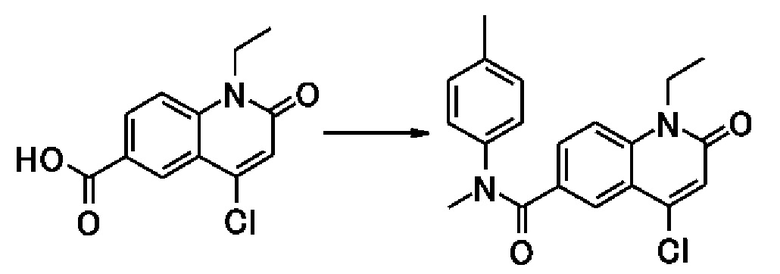
Способом, аналогичным описанному в Примере 4, из 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты получали 4-хлор-1-этил-N-метил-N-(4-метилфенил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид.
1H-ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,2 Гц), 2,29 (3H, с), 3,51 (3H, с), 4,26 (2H, кв, J=7,1 Гц), 6,81 (1H, с), 6,98 (2H, д, J=8,3 Гц), 7,07 (2H, д, J=8,3 Гц), 7,20 (1H, д, J=8,8 Гц), 7,65 (1H, дд, J=8,8, 2,0 Гц), 7,94 (1H, д, J=2,0 Гц).
[0169]
Пример 13

Способом, аналогичным описанному в Примере 10, из 4-хлор-1-этил-N-метил-N-(4-метилфенил)-2-оксо-1,2-дигидрохинолин-6-карбоксамида получали 1-этил-N-метил-N-(4-метилфенил)-4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид.
1H-ЯМР (CDCl3) δ: 1,31 (3H, т, J=7,2 Гц), 2,14-2,21 (2H, м), 2,26 (3H, с), 2,45 (3H, с), 2,61 (2H, т, J=5,6 Гц), 3,04-3,11 (2H, м), 3,50 (3H, с), 4,29 (2H, кв, J=7,1 Гц), 5,36-5,42 (1H, м), 6,45 (1H, с), 6,92 (2H, д, J=8,3 Гц), 7,03 (2H, д, J=8,5 Гц), 7,27 (1H, д, J=8,8 Гц), 7,51 (1H, д, J=2,0 Гц), 7,69 (1H, дд, J=8,9, 2,1 Гц).
[0170]
Пример 14

Способом, аналогичным описанному в Ссылочном Примере 13, из 1-этил-N-метил-N-(4-метилфенил)-4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамида получали 1-этил-N-метил-N-(4-метилфенил)-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид.
1H-ЯМР (CDCl3) δ: 1,30 (3H, т, J=7,1 Гц), 1,50-1,71 (4H, м), 1,99-2,10 (2H, м), 2,26 (3H, с), 2,36 (3H, с), 2,48-2,59 (1H, м), 2,91-3,00 (2H, м), 3,53 (3H, с), 4,28 (2H, кв, J=7,2 Гц), 6,55 (1H, с), 6,96 (2H, д, J=8,3 Гц), 7,06 (2H, д, J=8,0 Гц), 7,25-7,30 (1H, м), 7,60 (1H, д, J=2,0 Гц), 7,71 (1H, дд, J=8,8, 2,0 Гц).
[0171]
Пример 15

Способом, аналогичным описанному в Примере 1, из 6-амино-1-этил-4-(пропан-2-ил)хинолин-2(1H)-она и 4-хлорбензоилхлорида получали 4-хлор-N-(1-этил-2-оксо-4-(пропан-2-ил)-1,2-дигидрохинолин-6-ил)бензамид.
1H-ЯМР (CDCl3) δ: 1,34 (6H, д, J=6,6 Гц), 1,31-1,40 (3H, м), 3,34-3,47 (1H, м), 4,37 (2H, кв, J=7,1 Гц), 6,67 (1H, с), 7,42 (1H, д, J=9,2 Гц), 7,48 (2H, д, J=8,3 Гц), 7,77 (1H, дд, J=9,2, 2,3 Гц), 7,91 (2H, д, J=8,3 Гц), 8,23 (1H, с), 8,33 (1H, д, J=2,3 Гц).
[0172]
Пример 16
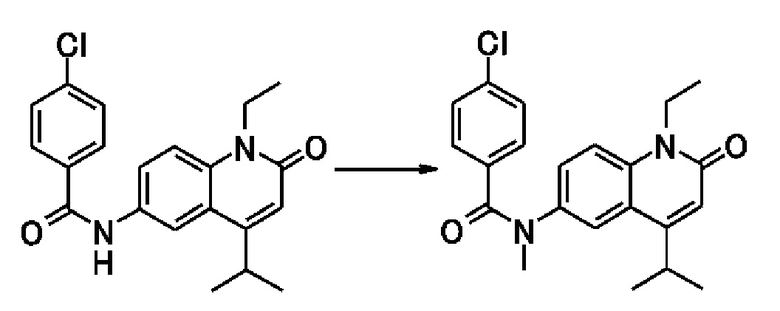
Способом, аналогичным описанному в Примере 2, из 4-хлор-N-(1-этил-2-оксо-4-(пропан-2-ил)-1,2-дигидрохинолин-6-ил)бензамида получали 4-хлор-N-(1-этил-2-оксо-4-(пропан-2-ил)-1,2-дигидрохинолин-6-ил)-N-метилбензамид.
1H-ЯМР (CDCl3) δ: 1,12 (6H, д, J=6,8 Гц), 1,34 (3H, т, J=7,2 Гц), 3,01-3,14 (1H, м), 3,53 (3H, с), 4,31 (2H, кв, J=7,2 Гц), 6,61 (1H, с), 7,12-7,19 (2H, м), 7,24-7,29 (2H, м), 7,31-7,37 (3H, м).
[0173]
Пример 17

Смесь 80 мг 1-этил-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты, 80 мкл N-метил-2,3-дигидро-1H-инден-5-амина, 3 мл дихлорметана, 90 мг 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида, 63 мг 1-гидрокси-7-азабензотриазола и 0,3 мл триэтиламина перемешивали в плотно закрытой пробирке при температуре окружающей среды 70-80°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и затем растворитель отгоняли при пониженном давлении. К полученному остатку добавляли 1 мл 2 моль/л водного раствора гидроксида натрия, 4 мл тетрагидрофурана и 2 мл метанола и смесь перемешивали при температуре окружающей среды 40-50°C в течение 20 минут и растворитель отгоняли при пониженном давлении. К реакционной смеси добавляли этилацетат и насыщенный водный раствор хлорида натрия, органический слой фракционировали и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [градиентное элюирование хлороформ:метанол=100:0-80:20] с получением 8 мг N-(2,3-дигидро-1H-инден-5-ил)-1-этил-N-метил-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамида в виде белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,15 (3H, т, J=7,0 Гц), 1,36-1,57 (4H, м), 1,89-2,06 (4H, м), 2,24 (3H, с), 2,69-2,89 (6H, м), 3,29-3,37 (1H, м), 3,39 (3H, с), 4,21 (2H, кв, J=7,1 Гц), 6,38 (1H, с), 6,84-6,92 (1H, м), 7,07 (1H, д, J=8,0 Гц), 7,15 (1H, с), 7,52-7,61 (2H, м), 7,75 (1H, дд, J=8,9, 1,6 Гц).
[0174]
Пример 18
Способом, аналогичным описанному в Ссылочном Примере 2, из 1-этил-4-(морфолин-4-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)хинолин-2(1H)-она и 4-бром-1-метил-5-фенил-1H-пиразола получали 1-этил-6-(1-метил-5-фенил-1H-пиразол-4-ил)-4-(морфолин-4-ил)хинолин-2(1H)-он.
1H-ЯМР (DMSO-D6) δ: 1,17 (3H, т, J=6,9 Гц), 2,65-2,76 (4H, м), 3,42-3,53 (4H, м), 3,74 (3H, с), 4,21 (2H, кв, J=6,8 Гц), 5,95 (1H, с), 7,35 (1H, д, J=2,0 Гц), 7,37-7,64 (7H, м), 7,81 (1H, с).
[0175]
Примеры 19-244
В соответствии с описанной в описании процедурой, соединения, указанные в Таблицах 1-25, получали при помощи общеизвестных реакций, таких как конденсация, присоединение, окисление, восстановление, перегруппировка, замещение, галогенирование, дегидратация, гидролиз или подобные, или с использованием соответствующих комбинацией этих реакций.
[0176]
№
N-(1-этил-4-(октагидроизохинолин-2(1H)-ил)-2-оксо-1,2-дигидрохинолин-6-ил)-N-метилбензамид
N-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-
дигидрохинолин-6-ил)-2-гидрокси-N-
метилбензамид
дигидрохинолин-6-ил)-N-метил-2-
(трифторметокси)бензамид

N-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-
дигидрохинолин-6-ил)-N-метил-4-
пропилбензамид
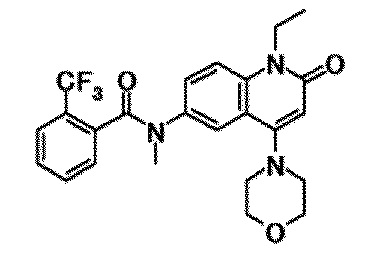
дигидрохинолин-6-ил)-N-метил-2-
(трифторметил)бензамид
N-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-
дигидрохинолин-6-ил)-2-фтор-N-
метилбензамид
[0177]
№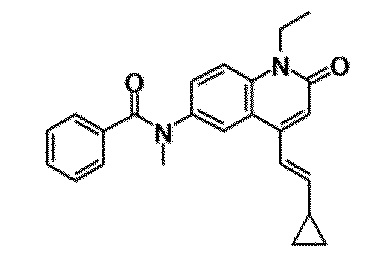
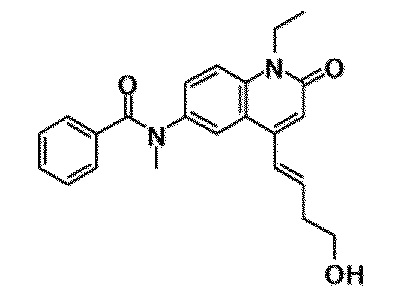

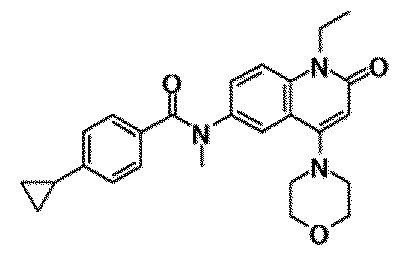
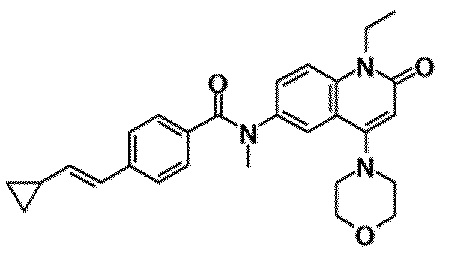
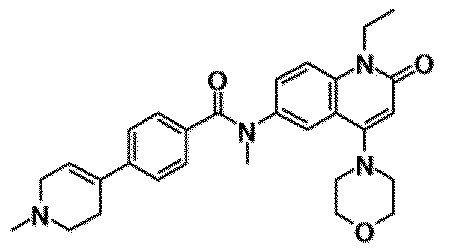


[0178]
№
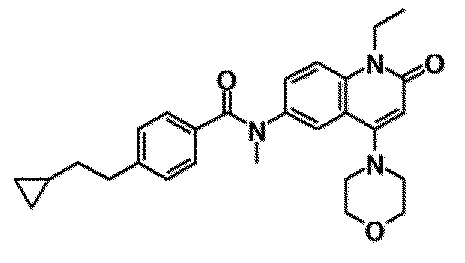
-4-ил)-2-оксо-1,2-дигидрохинолин-6-ил)-N-
метилбензамид
дигидрохинолин-6-ил)-N-метил-4-(1-
метилпиперидин-4-ил)бензамид

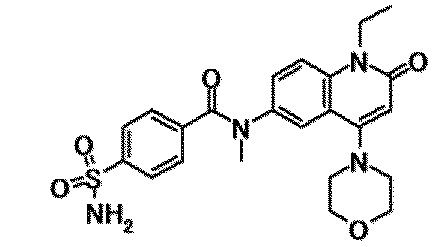
дигидрохинолин-6-ил)-N-метил-4-
сульфамоилбензамид
дигидрохинолин-6-ил)-N-метил-4-
(метилсульфонил)бензамид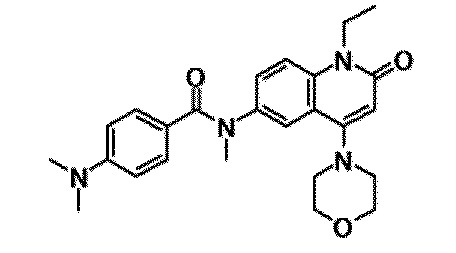

[0179]
№
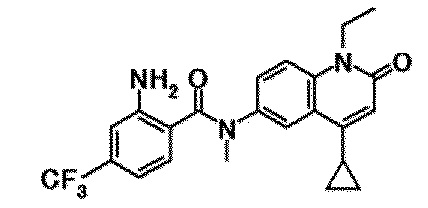
дигидрохинолин-6-ил)-N-метил-4-(трифторметил)бензамид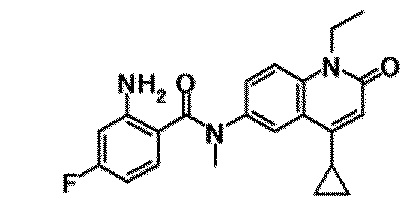
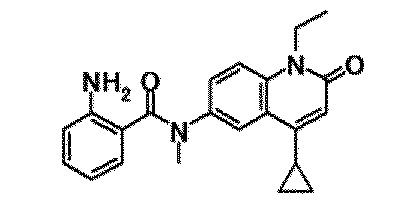
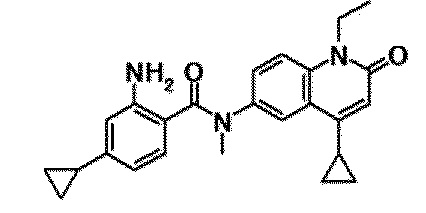

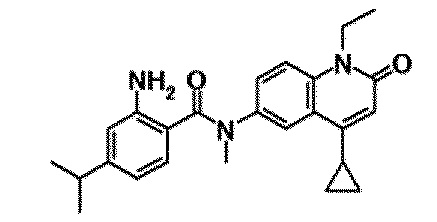
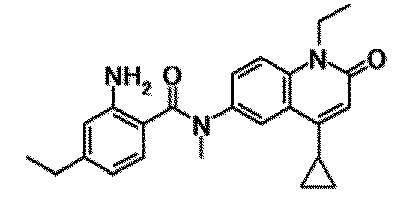
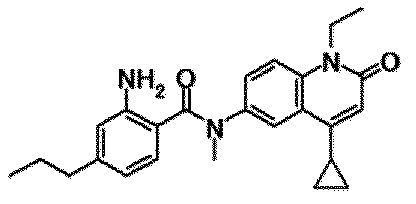
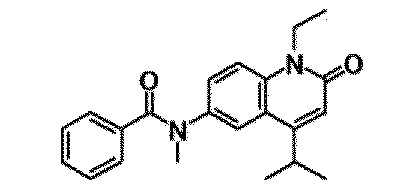
[0180]
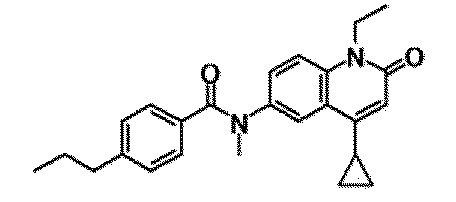

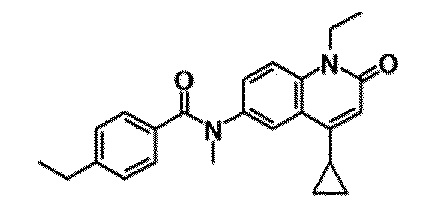
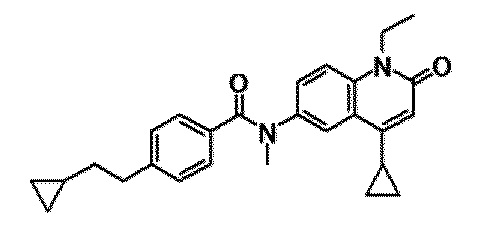






[0181]

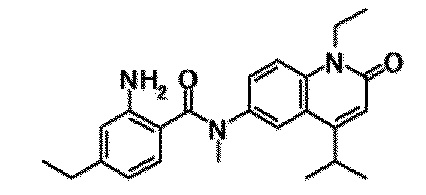


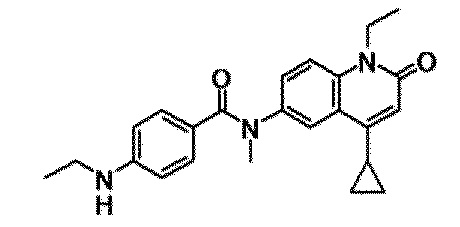
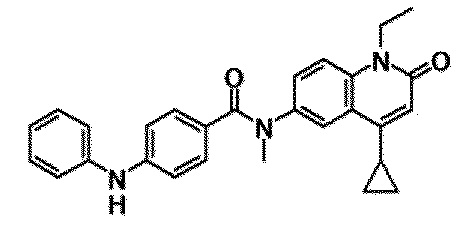

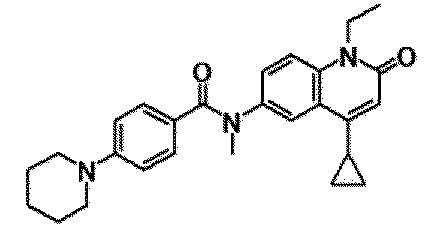
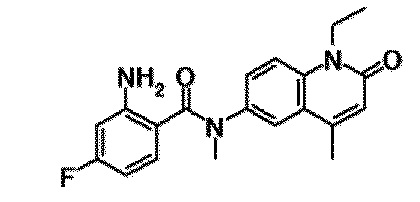

[0182]


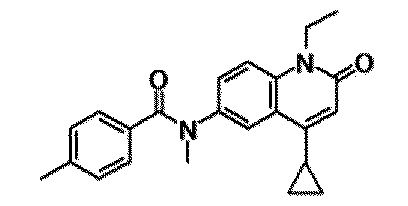
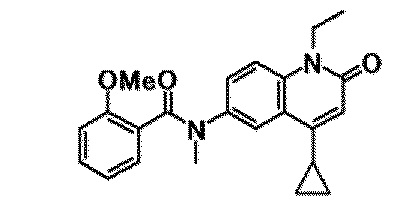

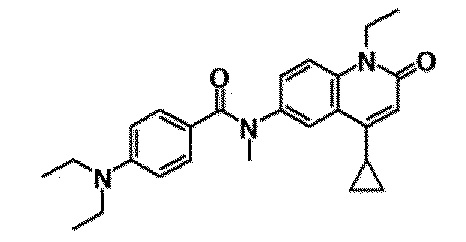
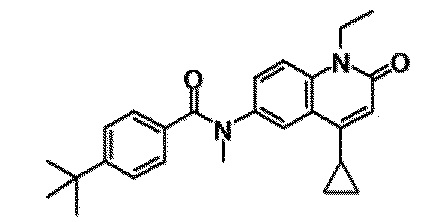


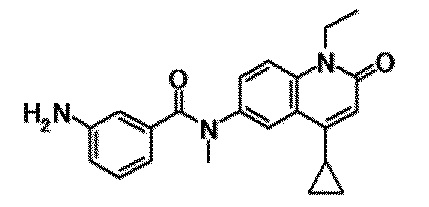
[0183]
№
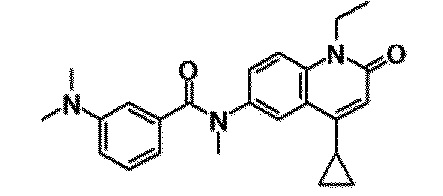
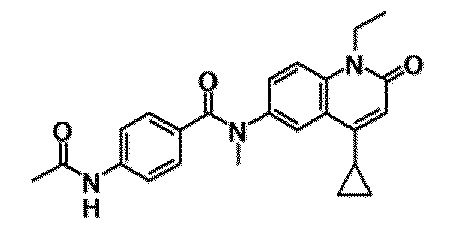



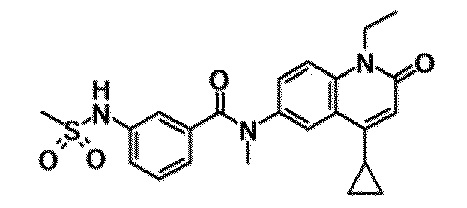


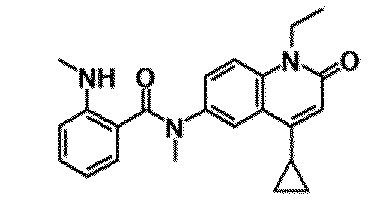

[0184]

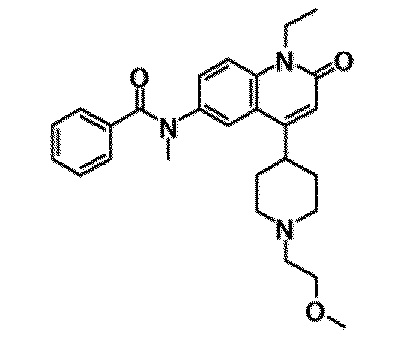
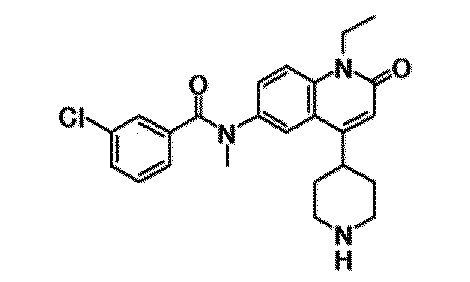
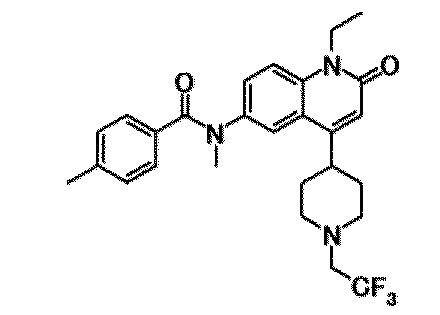
пиперидин-4-ил)-1,2-дигидрохинолин-6-ил)-N,4-
диметилбензамид
трифторэтил)пиперидин-4-ил)-1,2-
дигидрохинолин-6-ил)-N-метилбензамид

[0185]
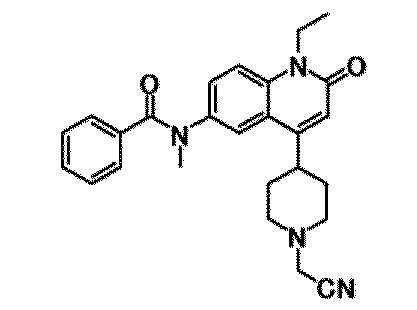
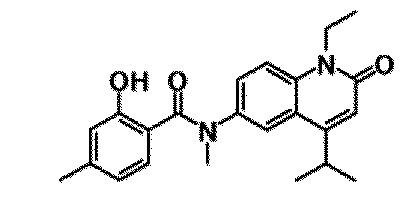

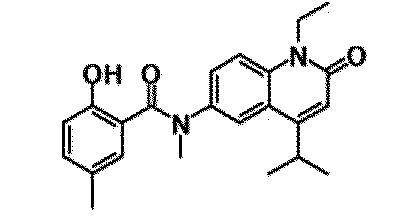


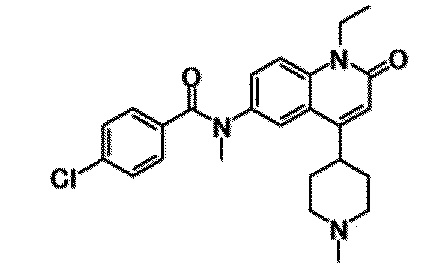



[0186]




дигидрохинолин-6-ил)-N-метилбензамид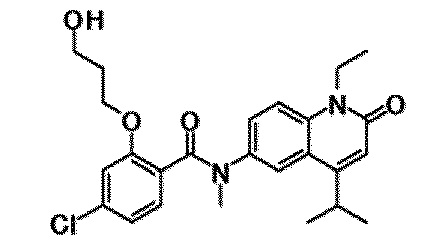

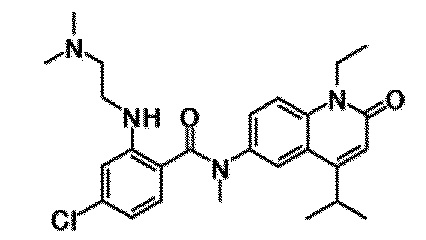



[0187]
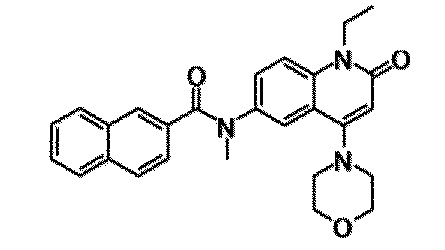






[0188]
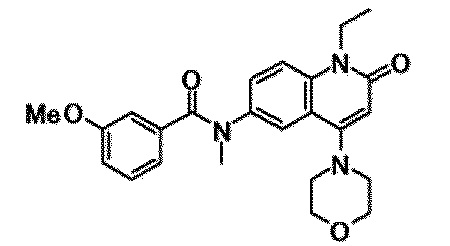


дигидрохинолин-6-ил)-4-фтор-N-метилбензамид
дигидрохинолин-6-ил)-N-метил-4-(трифторметил)бензамид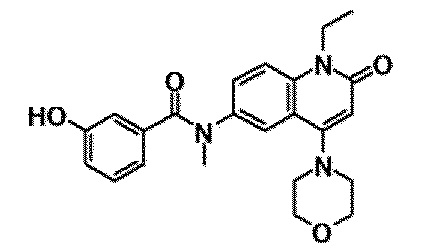


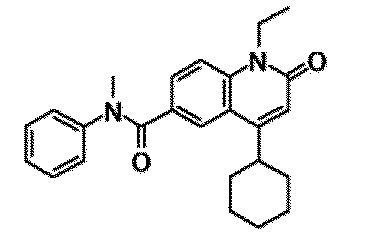
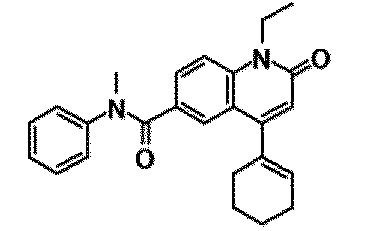
[0189]

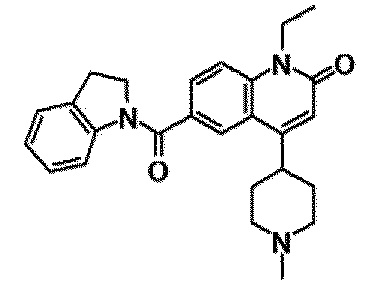

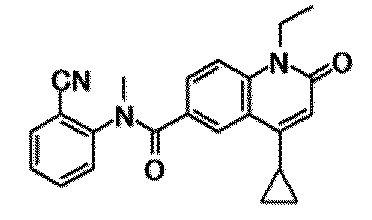
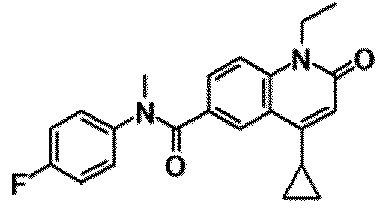


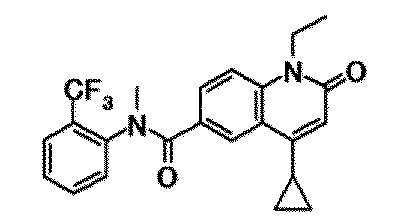
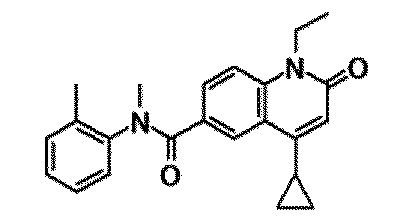
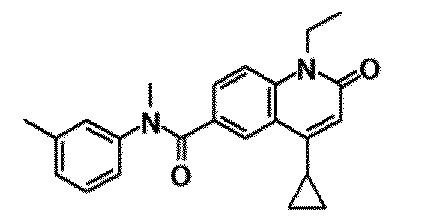
[0190]
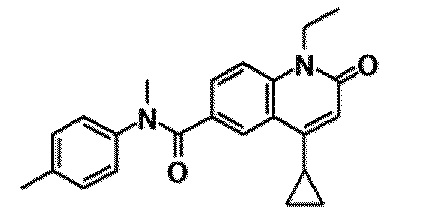


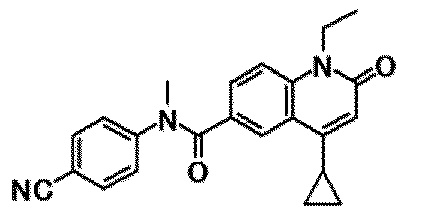

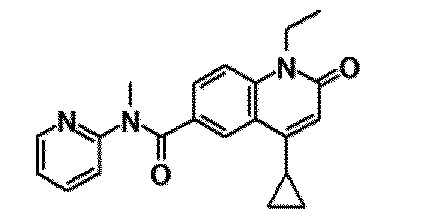
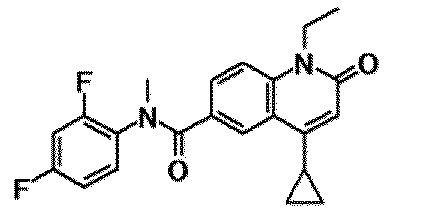


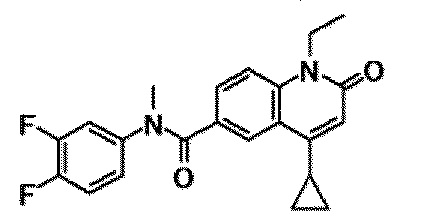
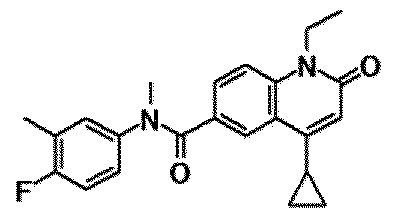
[0191]




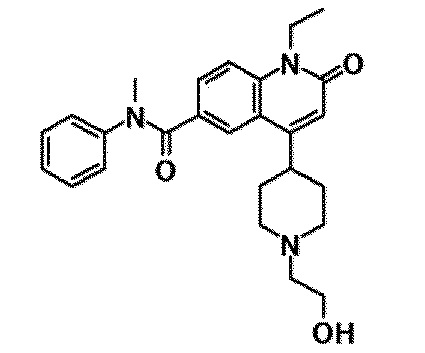

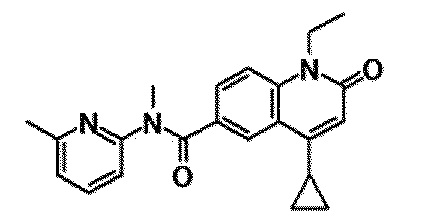
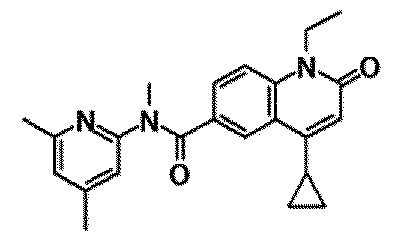

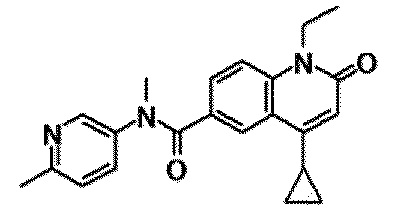
[0192]
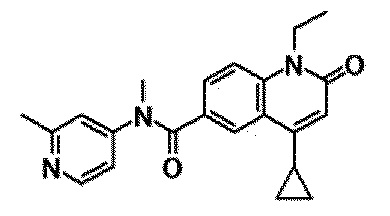
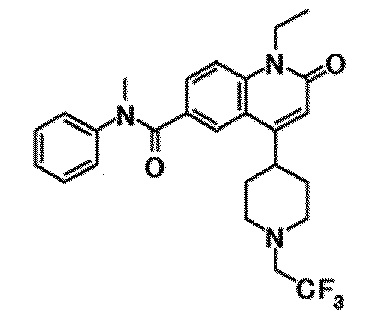

(метил)амино)бензоат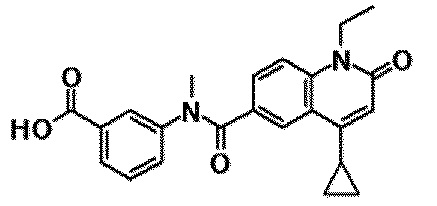
амино)бензойная кислота
(метил)амино)бензоат
амино)бензойная кислота

[0193]



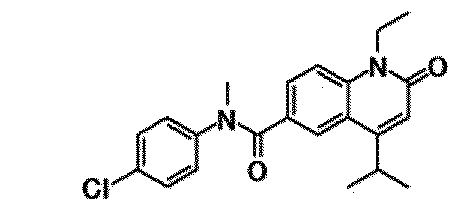
-6-карбоксамид
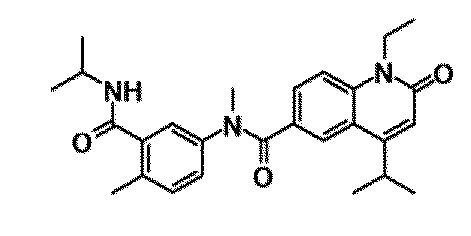

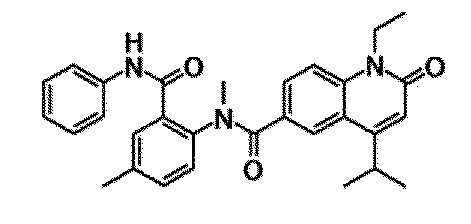

[0194]
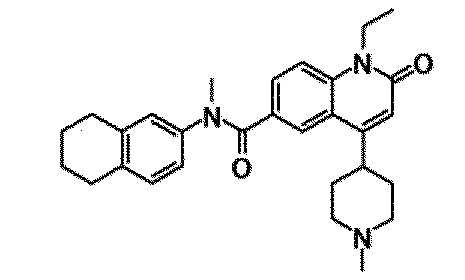

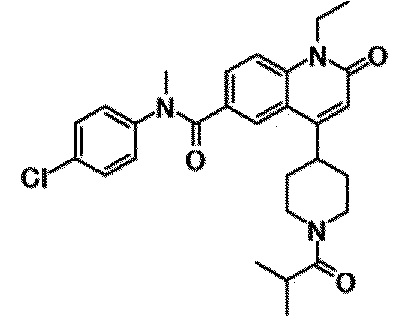





[0195]
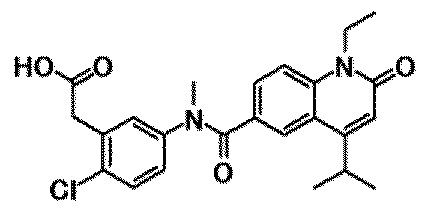
(метил)амино)фенил)уксусная кислота
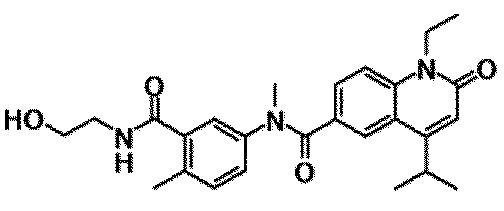

метил-2-оксо-4-(пропан-2-ил)-1,2-дигидрохинолин-6-карбоксамид
метил-2-оксо-4-(пропан-2-ил)-1,2-дигидрохинолин-6-карбоксамид
фенил)-2-оксо-4-(пропан-2-ил)-1,2-
дигидрохинолин-6-карбоксамид

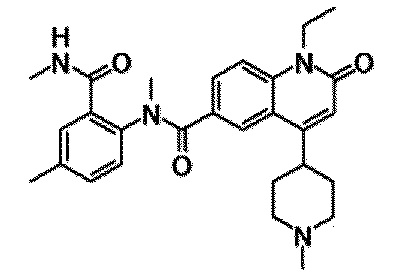
[0196]
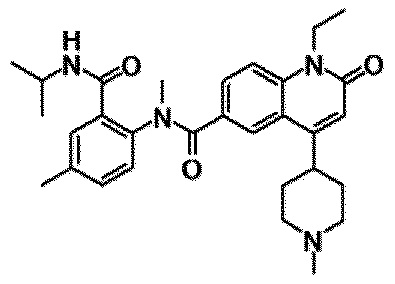
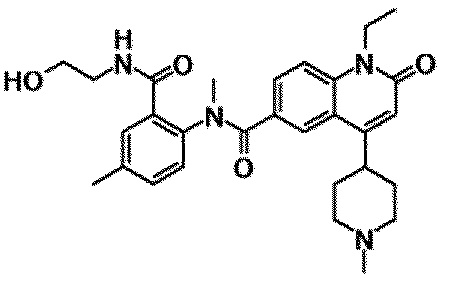

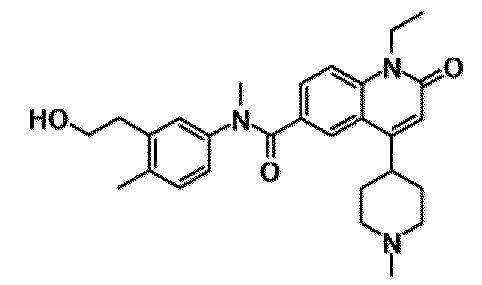


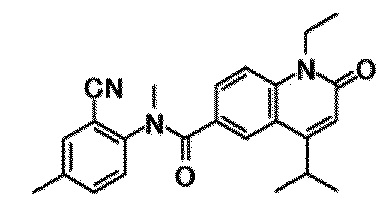
дигидрохинолин-6-карбоксамид
[0197]
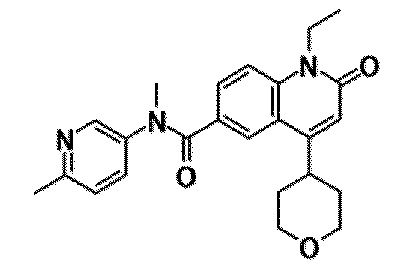

оксо-4-(пропан-2-ил)-1,2-дигидрохинолин
-6-карбоксамид


2-ил)-1,2-дигидрохинолин-6-карбоксамид

(метилсульфонил)фенил)-2-оксо-4-(пропан-2-ил)-1,2-дигидрохинолин-6-карбоксамид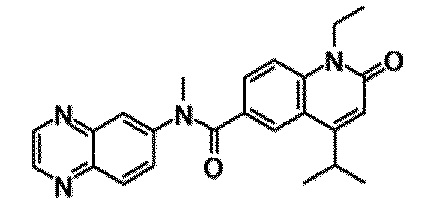
N-(хиноксалин-6-ил)-1,2-дигидрохинолин-6-карбоксамид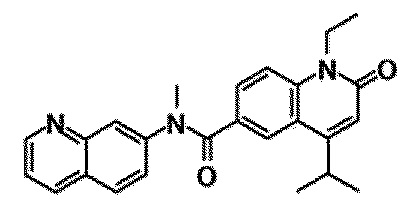

дигидрохинолин-6-карбоксамид
[0198]
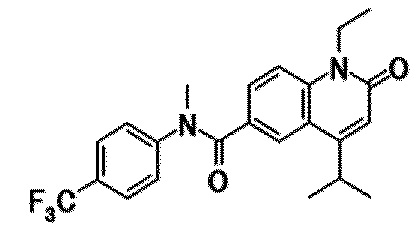
N-(4-(трифторметил)фенил)-1,2-
дигидрохинолин-6-карбоксамид

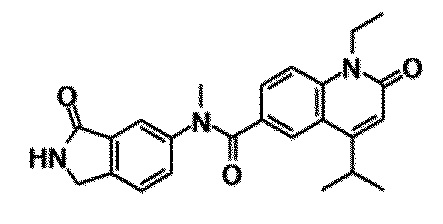
1,2-дигидрохинолин-6-карбоксамид
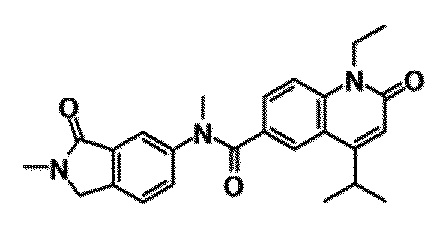
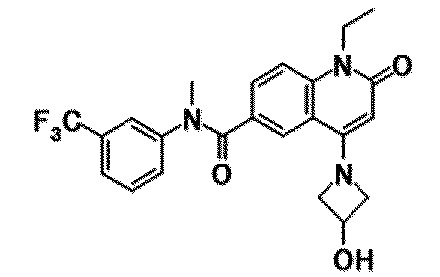

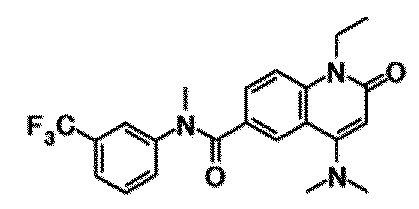
дигидрохинолин-6-карбоксамид
[0199]

метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид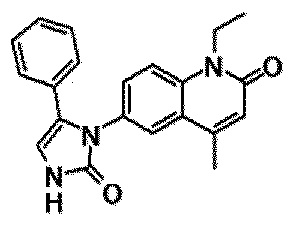

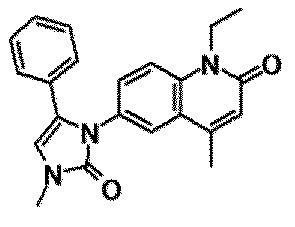
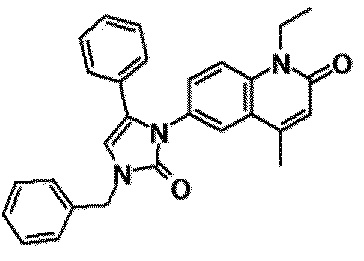

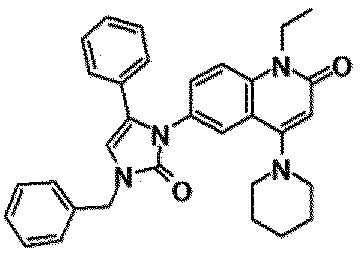
[0200]


[0201]
Пример 245

К суспензии 0,70 г 1-(2-(4-хлорфенил)-2-оксоэтил)-3-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-дигидрохинолин-6-ил)мочевины в 4,0 мл диоксана добавляли 4,0 мл концентрированной хлористоводородной кислоты при комнатной температуре и смесь перемешивали в течение 2 часов. К реакционной смеси добавляли воду и твердое вещество фильтровали и промывали водой и диизопропиловым эфиром. Полученное твердое вещество очищали при помощи колоночной хроматографии на силикагеле [градиентное элюирование хлороформ:метанол=100:0-90:10]. К полученному остатку добавляли диизопропиловый эфир и твердое вещество фильтровали с получением 0,59 г 6-(5-(4-хлорфенил)-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-она в виде белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,19 (3H, т, J=6,8 Гц), 2,64-2,73 (4H, м), 3,50-3,57 (4H, м), 4,23 (2H, кв, J=6,8 Гц), 6,00 (1H, с), 6,95 (1H, с), 7,07-7,13 (2H, м), 7,24 (1H, д, J=2,4 Гц), 7,32-7,38 (2H, м), 7,57 (1H, дд, J=9,1, 2,3 Гц), 7,65 (1H, д, J=9,0 Гц), 10,67 (1H, с).
МС (ESI, m/z):451(M+H), 449(M-H)
[0202]
Пример 246
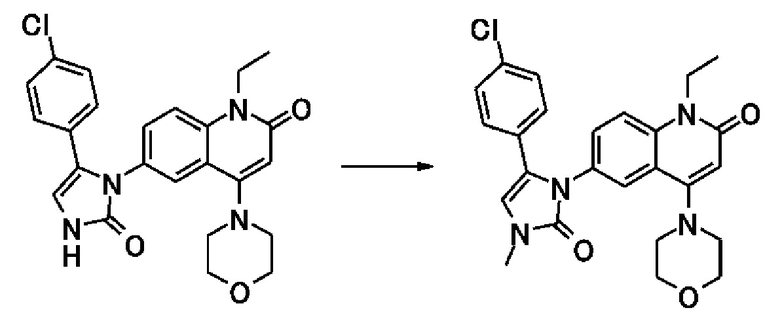
К раствору 300 мг 6-(5-(4-хлорфенил)-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-она в 3 мл N,N-диметилформамида добавляли при охлаждении льдом 30 мг 60% гидрида натрия и смесь перемешивали в течение 5 минут. К реакционной смеси при охлаждении льдом добавляли 50 мкл метилйодида, смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли при охлаждении льдом этилацетат и воду и pH смеси доводили до 2,0 раствором 1 моль/л хлористоводородной кислоты, твердое вещество фильтровали и промывали водой и диизопропиловым эфиром с получением 203 мг 6-(5-(4-хлорфенил)-3-метил-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-она в виде белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,19 (3H, т, J=7,0 Гц), 2,64-2,72 (4H, м), 3,28 (3H, с), 3,50-3,57 (4H, м), 4,23 (2H, кв, J=6,8 Гц), 6,01 (1H, с), 7,05-7,12 (2H, м), 7,07 (1H, с), 7,26 (1H, д, J=2,4 Гц), 7,34-7,39 (2H, м), 7,57 (1H, дд, J=9,0, 2,4 Гц), 7,66 (1H, д, J=9,0 Гц).
МС (ESI, m/z):465(M+H)
[0203]
Пример 247

К суспензии 330 мг 1-этил-4-(морфолин-4-ил)-6-(2-оксо-5-фенил-2,3-дигидро-1H-имидазол-1-ил)хинолин-2(1H)-она в 2 мл N,N-диметилацетамида при охлаждении льдом добавляли 35 мг 60% гидрида натрия и смесь перемешивали в течение 5 минут. К реакционной смеси при охлаждении льдом добавляли 119 мкл 2-йодпропана и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 60 мкл 2-йодпропана и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси при охлаждении льдом добавляли этилацетат и воду и pH смеси доводили до 2,0 раствором 1 моль/л хлористоводородной кислоты. Органический слой фракционировали, промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [градиентное элюирование этилацетат - хлороформ:метанол=95:5-90:10]. К полученному остатку добавляли диизопропиловый эфир и этилацетат и твердое вещество фильтровали. Полученный твердое вещество очищали при помощи колоночной хроматографии на силикагеле [этилацетат]. К полученному остатку добавляли диизопропиловый эфир и этилацетат и твердое вещество фильтровали с получением 68 мг 1-этил-4-(морфолин-4-ил)-6-(2-оксо-5-фенил-3-(пропан-2-ил)-2,3-дигидро-1H-имидазол-1-ил)хинолин-2(1H)-она в виде светло-коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,36 (3H, т, J=7,1 Гц), 1,43 (6H, д, J=6,8 Гц), 2,63-2,70 (4H, м), 3,55-3,62 (4H, м), 4,32 (2H, кв, J=7,2 Гц), 4,55 (1H, квинт., J=6,8 Гц), 6,09 (1H, с), 6,51 (1H, с), 7,07-7,12 (2H, м), 7,15-7,28 (3H, м), 7,33 (1H, д, J=2,4 Гц), 7,43 (1H, д, J=9,0 Гц), 7,72 (1H, дд, J=9,0, 2,4 Гц).
[0204]
Пример 248

Смесь 100 мг 4-циклопропил-1-этил-6-(2-фенилгидразинил)хинолин-2(1H)-она, 46 мг этилкарбамоилкарбамата и 3 мл толуола перемешивали при 140°C в течение 1 часа и 30 минут с использованием микроволнового устройства. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду. Органический слой фракционировали, промывали последовательно водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [градиентное элюирование гексан:этилацетат=50:50-0:100]. К полученному остатку добавляли хлороформ и твердое вещество фильтровали с получением 15 мг 1-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-2-фенил-1,2,4-триазолидин-3,5-диона в виде светло-коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 0,57-0,65 (2H, м), 0,92-1,01 (2H, м), 1,14 (3H, т, J=7,0 Гц), 2,03-2,14 (1H, м), 4,20 (2H, кв, J=7,1 Гц), 6,29 (1H, с), 7,20-7,27 (1H, м), 7,34-7,47 (4H, м), 7,60 (1H, д, J=9,3 Гц), 7,70 (1H, дд, J=9,1, 2,6 Гц), 8,03 (1H, д, J=2,4 Гц), 12,09 (1H, с).
[0205]
Пример 249

К суспензии 2,0 г 6-амино-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-она в 10 мл пиридина при охлаждении льдом добавляли 1,12 мл 4-хлорбензоилхлорида и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси при охлаждении льдом добавляли этилацетат и воду и pH смеси доводили до 2,0 раствором 2 моль/л хлористоводородной кислоты. Твердое вещество фильтровали и промывали водой и диизопропиловым эфиром с получением 3,01 г 4-хлор-N-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-дигидрохинолин-6-ил)бензамида в виде белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,19 (3H, т, J=7,0 Гц), 3,03-3,13 (4H, м), 3,81-3,90 (4H, м), 4,24 (2H, кв, J=7,1 Гц), 6,04 (1H, с), 7,59 (1H, д, J=9,3 Гц), 7,64 (2H, д, J=8,5 Гц), 7,98 (1H, дд, J=9,3, 2,4 Гц), 8,01 (2H, д, J=8,5 Гц), 8,35 (1H, д, J=2,2 Гц), 10,48 (1H, с).
[0206]
Пример 250

К суспензии 3,0 г 4-хлор-N-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-дигидрохинолин-6-ил)бензамида в 24 мл N,N-диметилацетамида добавляли 0,35 г 60% гидрида натрия при охлаждении льдом и смесь перемешивали в течение 10 минут. К реакционной смеси при охлаждении льдом добавляли 0,68 мл метилйодида, смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли этилацетат и ледяную воду и pH смеси доводили до 2,0 раствором 2 моль/л хлористоводородной кислоты. Органический слой фракционировали, промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и этилацетат, твердое вещество фильтровали, промывали диизопропиловым эфиром с получением 2,55 г 4-хлор-N-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-дигидрохинолин-6-ил)-N-метилбензамида в виде белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,16 (3H, т, J=7,1 Гц), 2,45-2,60 (4H, м), 3,42 (3H, с), 3,60-3,71 (4H, м), 4,19 (2H, кв, J=6,9 Гц), 5,96 (1H, с), 7,21 (1H, с), 7,28 (2H, д, J=8,3 Гц), 7,33 (2H, д, J=8,3 Гц), 7,60 (1H, д, J=9,0 Гц), 7,68 (1H, дд, J=9,0, 2,2 Гц).
[0207]
Пример 251

Смесь 1,5 г 4-хлор-N-((1E)-1-(диметиламино)этилиден)-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоксамида, 0,51 мл фенилгидразина и 12 мл уксусной кислоты перемешивали при температуре окружающей среды 120°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и затем растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и этилацетат и твердое вещество фильтровали и промывали диизопропиловым эфиром с получением 1,37 г 4-хлор-1-этил-6-(3-метил-1-фенил-1H-1,2,4-(триазол-5-ил)хинолин-2(1H)-она в виде светло-коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,18 (3H, т, J=7,1 Гц), 2,41 (3H, с), 4,25 (2H, кв, J=6,9 Гц), 6,97 (1H, с), 7,44-7,58 (5H, м), 7,72 (1H, д, J=9,0 Гц), 7,77 (1H, дд, J=9,0, 2,0 Гц), 7,99 (1H, д, J=2,0 Гц).
[0208]
Пример 252

Смесь 1,37 г 4-хлор-1-этил-6-(3-метил-1-фенил-1H-1,2,4-триазол-5-ил)хинолин-2(1H)-она, 0,48 г циклопропилборной кислоты, 1,6 г трикалийфосфата, 0,26 г бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 15 мл диоксана и 3,0 мл воды перемешивали в атмосфере азота при температуре окружающей среды 100-110°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду. Органический слой фракционировали, промывали последовательно водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [градиентное элюирование гексан:этилацетат=50:50-0:100]. К полученному остатку добавляли диизопропиловый эфир и циклогексан и твердое вещество фильтровали с получением 1,10 г 4-циклопропил-1-этил-6-(3-метил-1-фенил-1H-1,2,4-(триазол-5-ил)хинолин-2(1H)-она в виде слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 0,54-0,61 (2H, м), 0,70-0,79 (2H, м), 1,17 (3H, т, J=7,1 Гц), 1,70-1,79 (1H, м), 2,40 (3H, с), 4,23 (2H, кв, J=7,1 Гц), 6,31 (1H, с), 7,42-7,57 (5H, м), 7,64 (1H, д, J=9,0 Гц), 7,81 (1H, дд, J=8,9, 2,1 Гц), 8,03 (1H, д, J=2,0 Гц).
[0209]
Пример 253
Смесь 41 мг 1-этил-6-йод-4-(морфолин-4-ил)хинолин-2(1H)-она, 17 мг (5S)-5-фенилпирролидин-2-она, 1 мг йодида меди (I), 4 мг 4,7-диметокси-1,10-фенантролина, 48 мг карбоната цезия и 0,5 мл N-метил-2-пирролидона перемешивали при температуре окружающей среды 130-135°C в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры и затем к реакционной смеси добавляли этилацетат и нерастворимое вещество отфильтровывали. К фильтрату добавляли воду и насыщенный водный раствор хлорида натрия и органический слой фракционировали, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на щелочном силикагеле [градиентное элюирование гексан:этилацетат=70:30-40:60]. К полученному остатку добавляли диизопропиловый эфир и твердое вещество фильтровали с получением 23 мг 1-этил-4-(морфолин-4-ил)-6-((5S)-2-оксо-5-фенилпирролидин-1-ил)хинолин-2(1H)-она в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,2 Гц), 2,02-2,08 (1H, м), 2,60-2,97 (7H, м), 3,73-3,80 (4H, м), 4,20-4,33 (2H, м), 5,29-5,32 (1H, м), 6,11 (1H, с), 7,23-7,35 (6H, м), 7,75 (1H, д, J=2,4 Гц), 7,81 (1H, дд, J=8,8, 2,4 Гц).
[0210]
Пример 254

Смесь 38 мг 4-циклопропил-1-этил-6-йодхинолин-2(1H)-она, 18 мг (5S)-5-фенилпирролидин-2-она, 1 мг йодида меди (I), 4 мг 4,7-диметокси-1,10-фенантролина, 51 мг карбоната цезия и 0,5 мл N-метил-2-пирролидона перемешивали при температуре окружающей среды 130-135°C в течение 1 часа и 15 минут. Реакционную смесь охлаждали до комнатной температуры и затем к реакционной смеси добавляли этилацетат и нерастворимое вещество отфильтровывали. К фильтрату добавляли воду и насыщенный водный раствор хлорида натрия, органический слой фракционировали, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на щелочном силикагеле [градиентное элюирование гексан:этилацетат=80:20-60:40] с получением 22 мг 4-циклопропил-1-этил-6-((5S)-2-оксо-5-фенилпирролидин-1-ил)хинолин-2(1H)-она в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,50-0,57 (1H, м), 0,64-0,71 (1H, м), 0,82-0,99 (2H, м), 1,28 (3H, т, J=7,2 Гц), 1,79-1,86 (1H, м), 2,05-2,12 (1H, м), 2,63-2,85 (3H, м), 4,26 (2H, кв, J=7,5 Гц), 5,27-5,30 (1H, м), 6,39 (1H, д, J=1,2 Гц), 7,25-7,40 (6H, м), 7,79 (1H, дд, J=9,2, 2,4 Гц), 7,99 (1H, д, J=2,4 Гц).
[0211]
Пример 255
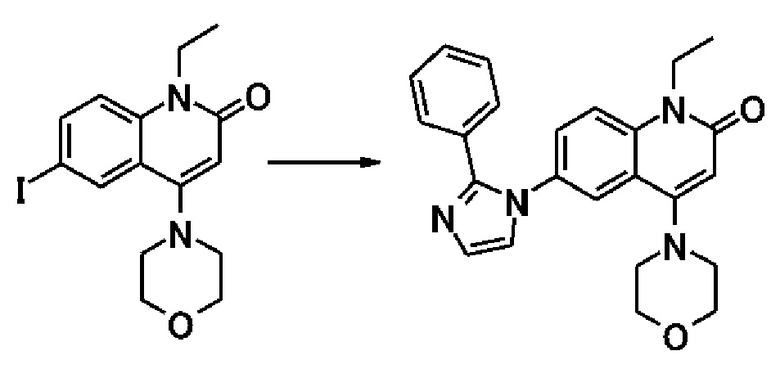
Смесь 60 мг 1-этил-6-йод-4-(морфолин-4-ил)хинолин-2(1H)-она, 25 мг 2-фенил-1H-имидазола, 1,1 мг оксида меди (I), 5,6 мг 4,7-диметокси-1,10-фенантролина, 29 мг полиэтиленгликоля, 71 мг карбоната цезия и 4 мл бутиронитрила перемешивали в атмосфере азота при 170°C в течение 40 минут с использованием микроволнового устройства. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду. Органический слой фракционировали, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи тонкослойной хроматографии для фракционирования. К полученному остатку добавляли гексан и твердое вещество фильтровали с получением 10 мг 1-этил-4-(морфолин-4-ил)-6-(2-фенил-1H-имидазол-1-ил-хинолин-2(1H)-она в виде белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,20 (3H, т, J=7,3 Гц), 2,57-2,66 (4H, м), 3,42-3,52 (4H, м), 4,26 (2H, кв, J=6,8 Гц), 6,03 (1H, с), 7,22 (1H, д, J=1,3 Гц), 7,28-7,38 (6H, м), 7,59 (1H, с), 7,71-7,77 (2H, м).
МС (ESI, m/z):401(M+H)
[0212]
Пример 256
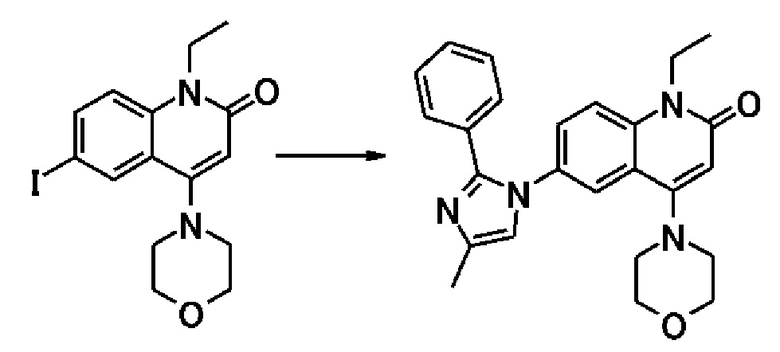
Смесь 50 мг 1-этил-6-йод-4-(морфолин-4-ил)хинолин-2(1H)-она, 23 мг 4-метил-2-фенил-1H-имидазола, 1,9 мг оксида меди (I), 6,2 мг 4,7-диметокси-1,10-фенантролина, 25 мг полиэтиленгликоля, 64 мг карбоната цезия и 1,5 мл бутиронитрила перемешивали в атмосфере азота при 210°C в течение 45 минут с использованием микроволнового устройства. К реакционной смеси добавляли 1,9 мг оксида меди (I) и смесь перемешивали при 225°C в течение 45 минут с использованием микроволнового устройства. К реакционной смеси добавляли 6,0 мг оксида меди (I) и 6,2 мг 4,7-диметокси-1,10-фенантролина и смесь перемешивали при 230°C в течение 1 часа и 30 минут с использованием микроволнового устройства. Реакционную смесь охлаждали до комнатной температуры и затем нерастворимое вещество отфильтровывали и добавляли этилацетат и воду. Органический слой фракционировали, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи тонкослойной хроматографии для фракционирования. К полученному остатку добавляли диизопропиловый эфир и твердое вещество фильтровали с получением 5 мг 1-этил-6-(4-метил-2-фенил-1H-имидазол-1-ил)-4-(морфолин-4-ил)хинолин-2(1H)-она в виде белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,20 (3H, т, J=6,9 Гц), 2,23 (3H, с), 2,56-2,66 (4H, м), 3,41-3,51 (4H, м), 4,20-4,30 (2H, м), 6,02 (1H, с), 7,22-7,36 (7H, м), 7,67-7,76 (2H, м).
МС (ESI, m/z):415(M+H)
[0213]
Пример 257

Смесь 50 мг 1-этил-6-йод-4-(морфолин-4-ил)хинолин-2(1H)-она, 28 мг 1-фенил-1H-имидазола, 50 мг йодида меди (I), 1,5 мг ацетата палладия и 2 мл N,N-диметилацетамида перемешивали в атмосфере азота при 185°C в течение 30 минут с использованием микроволнового устройства. Смесь далее перемешивали при 205°C в течение 20 минут. Реакционную смесь охлаждали до комнатной температуры и затем N,N-диметилацетамид отгоняли при пониженном давлении. К полученному остатку добавляли метанол и твердое вещество фильтровали. К полученному твердому веществу добавляли хлороформ и смесь нагревали при кипячении с обратным холодильником в течение 10 минут. Реакционную смесь охлаждали до комнатной температуры и затем нерастворимое вещество отфильтровывали. Фильтрат очищали при помощи колоночной хроматографии на силикагеле [хлороформ:метанол]. К полученному остатку добавляли гексан и этилацетат и твердое вещество фильтровали с получением 10 мг 1-этил-4-(морфолин-4-ил)-6-(1-фенил-1H-имидазол-2-ил)хинолин-2(1H)-она в виде светло-коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,16 (3H, т, J=6,9 Гц), 2,64-2,73 (4H, м), 3,47-3,57 (4H, м), 4,19 (2H, кв, J=7,0 Гц), 5,97 (1H, с), 7,23-7,38 (3H, м), 7,39-7,63 (6H, м), 7,74-7,85 (1H, м).
МС (ESI, m/z):401(M+H)
[0214]
Пример 258
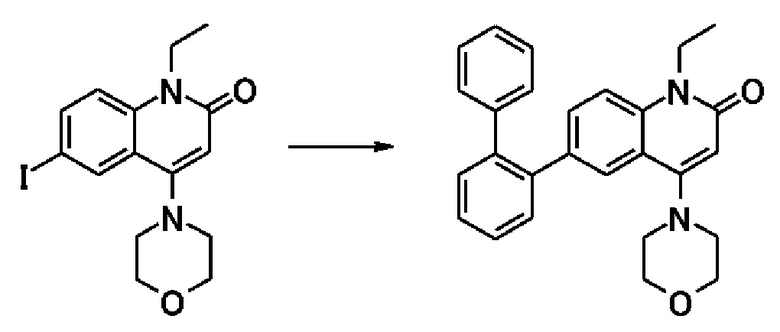
Смесь 50 мг 1-этил-6-йод-4-(морфолин-4-ил)хинолин-2(1H)-она, 28 мг бифенил-2-илбороновой кислоты, 6 мг трис(дибензилиденацетон)дипалладия(0), 85 мг карбоната цезия и 2 мл диоксана перемешивали в атмосфере азота при 150°C в течение 30 минут с использованием микроволнового устройства. Смесь далее перемешивали при 160°C в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры и затем нерастворимое вещество отфильтровывали и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [гексан:этилацетат]. К полученному остатку добавляли гексан и этилацетат и твердое вещество фильтровали с получением 6 мг 6-(бифенил-2-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-она в виде белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,19 (3H, т, J=6,9 Гц), 2,46-2,55 (4H, м), 3,50-3,58 (4H, м), 4,23 (2H, кв, J=7,0 Гц), 5,93 (1H, с), 7,13-7,22 (3H, м), 7,23-7,31 (3H, м), 7,42-7,53 (4H, м), 7,59-7,70 (2H, м).
МС(ESI, m/z):411(M+H)
[0215]
Примеры 259-276
В соответствии с описанной в описании процедурой, соединения, указанные в Таблицах 26-28, получали при помощи общеизвестных реакций, таких как конденсация, присоединение, окисление, восстановление, перегруппировка, замещение, галогенирование, дегидратация, гидролиз или подобные, или с использованием соответствующих комбинаций этих реакций.
[0216]
№
(2-(пиперидин-1-ил)этил)-2,3-дигидро-1H-имидазол-1-ил)хинолин-2(1H)-он

2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-он
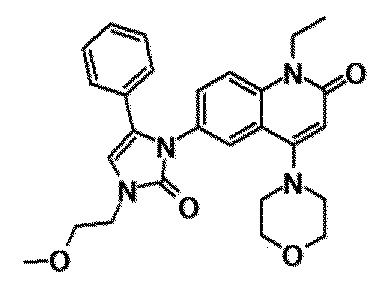
2,3-дигидро-1H-имидазол-1-ил)-4-(морфолин-4-ил)хинолин-2(1H)-он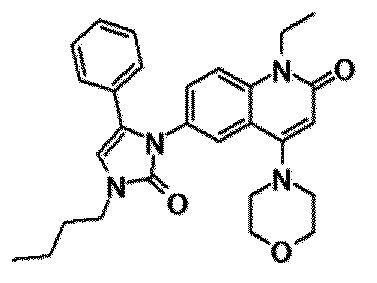
имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-он

[0217]
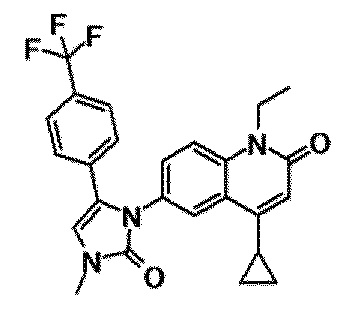

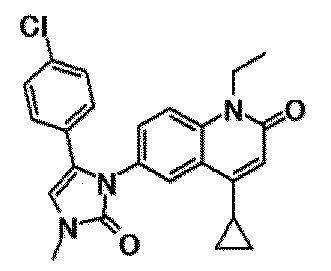

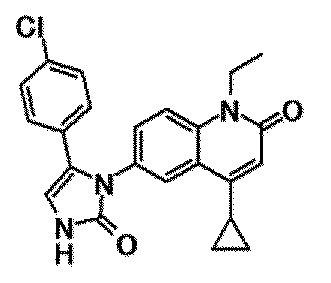
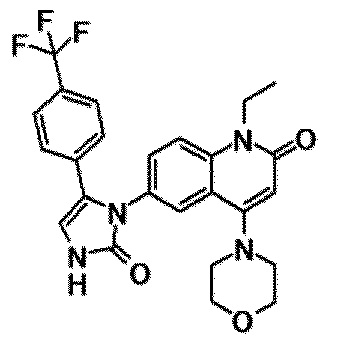
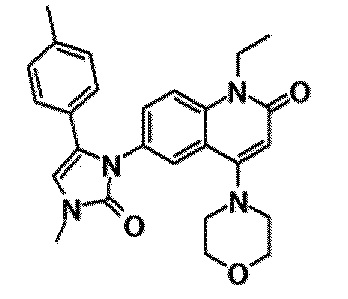
[0218]
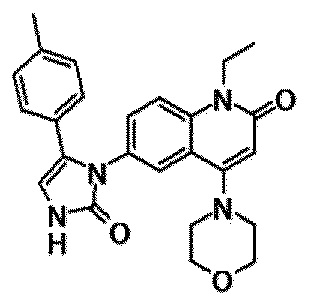
2(1H)-он
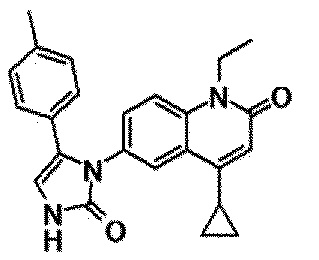
[0219]
Пример 277

Смесь 0,17 г 4-хлор-1-этил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)хинолин-2(1H)-она, 0,11 г 3-бром-2-фенилпиридина, 0,20 г трикалийфосфата, 33 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 6 мл диоксана и 2 мл воды перемешивали в атмосфере азота при температуре окружающей среды 100-110°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду. Органический слой фракционировали и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи хроматографии на силикагеле [градиентное элюирование гексан:этилацетат=100:0-60:40] с получением 134 мг 4-хлор-1-этил-6-(2-фенилпиридин-3-ил)хинолин-2(1H)-она в виде белой пены.
1H-ЯМР (CDCl3) δ: 1,33 (3H, т, J=7,1 Гц), 4,31 (2H, кв, J=7,1 Гц), 6,89 (1H, с), 7,24-7,29 (3H, м), 7,32-7,42 (5H, м), 7,81 (1H, дд, J=7,6, 1,7 Гц), 7,94 (1H, д, J=2,2 Гц), 8,74 (1H, дд, J=4,8, 1,7 Гц).
[0220]
Пример 278

Смесь 36 мг 4-хлор-1-этил-6-(2-фенилпиридин-3-ил)хинолин-2(1H)-она, 17 мг циклопропилборной кислоты, 43 мг трикалийфосфата, 8 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 0,6 мл диоксана и 0,2 мл воды перемешивали при 120°C в течение 15 минут с использованием микроволнового устройства. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду. Органический слой фракционировали и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи хроматографии на силикагеле [градиентное элюирование гексан:этилацетат=100:0-50:50]. К полученному остатку добавляли гексан и твердое вещество фильтровали с получением 3 мг 4-циклопропил-1-этил-6-(2-фенилпиридин-3-ил)хинолин-2(1H)-она в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,53-0,59 (2H, м), 0,81-0,92 (2H, м), 1,34 (3H, т, J=7,1 Гц), 1,71-1,80 (1H, м), 4,33 (2H, кв, J=7,3 Гц), 6,39-6,44 (1H, м), 7,20-7,49 (8H, м), 7,82 (1H, дд, J=7,6, 1,5 Гц), 7,87 (1H, д, J=2,2 Гц), 8,73 (1H, дд, J=4,6, 1,5 Гц).
[0221]
Пример 279

Смесь 30 мг 4-хлор-1-этил-6-(2-фенилпиридин-3-ил)хинолин-2(1H)-она, 0,7 мл N,N-диметилформамида, 35 мг карбоната калия и 21,5 мкл морфолина перемешивали при 150°C в течение 5 минут с использованием микроволнового устройства. Смесь далее перемешивали при 200°C в течение 40 минут. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду. Органический слой фракционировали и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи хроматографии на силикагеле [градиентное элюирование от гексан:этилацетат=100:0-0:100 до хлороформ:метанол=95:5]. К полученному остатку добавляли гексан и этилацетат и твердое вещество фильтровали с получением 8 мг 1-этил-4-(морфолин-4-ил)-6-(2-фенилпиридин-3-ил)хинолин-2(1H)-она в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,38 (3H, т, J=7,1 Гц), 2,57-2,65 (4H, м), 3,57-3,66 (4H, м), 4,34 (2H, кв, J=7,2 Гц), 6,09 (1H, с), 7,20-7,29 (2H, м), 7,35-7,49 (6H, м), 7,61 (1H, дд, J=8,7, 2,1 Гц), 7,74 (1H, дд, J=7,6, 1,7 Гц), 8,73 (1H, дд, J=4,9, 1,7 Гц).
[0222]
Пример 280
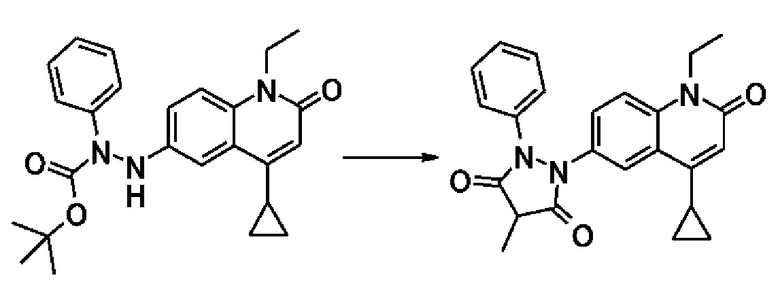
Смесь 20 мг трет-бутил 2-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-1-фенилгидразинкарбоксилата, 0,5 мл диэтилметилмалоната и 1 мл 20% раствора этоксид натрия-этанол перемешивали при 180°C в течение 3 минут с использованием микроволнового устройства. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду и pH смеси доводили до 1,0 раствором 2 моль/л хлористоводородной кислоты. Органический слой фракционировали и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [градиентное элюирование хлороформ:метанол=100:0-95:5]. К полученному остатку добавляли этилацетат и твердое вещество фильтровали с получением 6 мг 1-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-4-метил-2-фенилпиразолидин-3,5-диона в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,58-0,65 (2H, м), 0,95-1,03 (2H, м), 1,30 (3H, т, J=7,1 Гц), 1,64 (3H, д, J=7,8 Гц), 1,84-1,94 (1H, м), 3,47 (1H, кв, J=7,7 Гц), 4,27 (2H, кв, J=7,2 Гц), 6,44 (1H, д, J=1,2 Гц), 7,18-7,24 (1H, м), 7,31-7,39 (5H, м), 7,61 (1H, дд, J=9,1 Гц, 2,6 Гц), 7,94 (1H, д, J=2,4 Гц).
[0223]
Пример 281
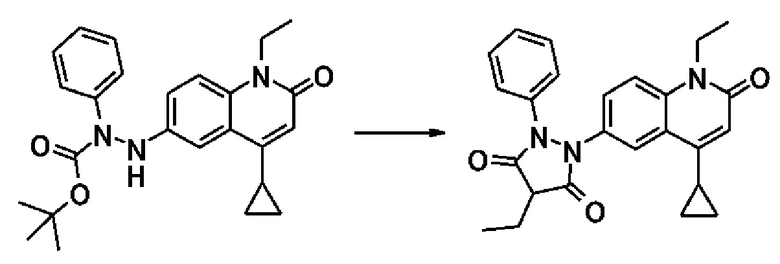
Смесь 20 мг трет-бутил 2-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-1-фенилгидразинкарбоксилата, 0,5 мл диэтилдиэтилмалоната и 1 мл 20% раствора этоксид натрия-этанол перемешивали при 150°C в течение 3 минут с использованием микроволнового устройства. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду и pH смеси доводили до 1,0 раствором 2 моль/л хлористоводородной кислоты. Органический слой фракционировали и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [градиентное элюирование хлороформ:метанол=100:0-95:5]. К полученному остатку добавляли диизопропиловый эфир и твердое вещество фильтровали с получением 8 мг 1-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-4-этил-2-фенилпиразолидин-3,5-диона в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,58-0,65 (2H, м), 0,95-1,02 (2H, м), 1,10-1,18 (3H, м), 1,30 (3H, т, J=7,2 Гц), 1,85-1,94 (1H, м), 2,15-2,24 (2H, м), 3,42 (1H, т, J=5,5 Гц), 4,27 (2H, кв, J=7,2 Гц), 6,42-6,45 (1H, м), 7,18-7,24 (1H, м), 7,31-7,40 (5H, м), 7,61 (1H, дд, J=9,1 Гц, 2,6 Гц), 7,95 (1H, д, J=2,4 Гц).
[0224]
Примеры 282a, 282b

Смесь 56 мг 4-циклопропил-1-этил-6-(2-фенилгидразинил)хинолин-2(1H)-она, 14 мкл 4-метилиденоксетан-2-она, 27 мкл триэтиламина и 1 мл хлороформа нагревали при кипячении с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [градиентное элюирование этилацетат:метанол=100:0-95:5] с получением 7 мг a) 4-циклопропил-1-этил-6-(3-метил-5-оксо-2-фенил-2,5-дигидро-1H-пиразол-1-ил)хинолин-2(1H)-она в виде белого твердого вещества и 4 мг b) 4-циклопропил-1-этил-6-(5-метил-3-оксо-2-фенил-2,3-дигидро-1H-пиразол-1-ил)хинолин-2(1H)-она в виде белого твердого вещества.
a) 4-циклопропил-1-этил-6-(3-метил-5-оксо-2-фенил-2,5-дигидро-1H-пиразол-1-ил)хинолин-2(1H)-он
1H-ЯМР (CDCl3) δ: 0,63-0,69 (2H, м), 0,99-1,05 (2H, м), 1,28 (3H, т, J=7,2 Гц), 1,91-2,00 (1H, м), 2,12 (3H, д, J=1,0 Гц), 4,26 (2H, кв, J=7,0 Гц), 5,61 (1H, д, J=0,7 Гц), 6,40 (1H, д, J=1,0 Гц), 7,21-7,39 (6H, м), 7,71 (1H, дд, J=9,3 Гц, 2,4 Гц), 7,95 (1H, д, J=2,4 Гц).
b) 4-циклопропил-1-этил-6-(5-метил-3-оксо-2-фенил-2,3-дигидро-1H-пиразол-1-ил)хинолин-2(1H)-он
1H-ЯМР (CDCl3) δ: 0,64-0,70 (2H, м), 1,02-1,09 (2H, м), 1,30 (3H, т, J=7,1 Гц), 1,90-1,99 (1H, м), 2,14 (3H, с), 4,27 (2H, кв, J=7,0 Гц), 5,61-5,65 (1H, м), 6,44-6,48 (1H, м), 7,13 (1H, т, J=7,3 Гц), 7,22-7,42 (6H, м), 7,87 (1H, д, J=2,2 Гц).
[0225]
Пример 283

Смесь 40 мг 1-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-2-фенилэтан-1,2-диона, 1 мл уксусной кислоты, 89 мг ацетата аммония и 32 мкл ацетальдегида перемешивали при 120°C в течение 5 минут с использованием микроволнового устройства. Реакционную смесь далее перемешивали при 140°C в течение 5 минут. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и насыщенный водный раствор гидрокарбоната натрия. Органический слой фракционировали и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи хроматографии на силикагеле [градиентное элюирование этилацетат:метанол=100:0-90:10]. К полученному остатку добавляли диизопропиловый эфир и твердое вещество фильтровали с получением 4,7 мг 4-циклопропил-1-этил-6-(2-метил-5-фенил-1H-имидазол-4-ил)хинолин-2(1H)-она в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,59-0,67 (2H, м), 0,75-0,85 (2H, м), 1,34 (3H, т, J=7,2 Гц), 1,79-1,90 (1H, м), 2,55 (3H, с), 4,33 (2H, кв, J=7,2 Гц), 6,36-6,42 (1H, м), 6,72 (1H, с), 7,20-7,41 (4H, м), 7,42-7,55 (1H, м), 7,75-7,79 (1H, м), 8,19-8,26 (1H, м).
[0226]
Пример 284

Смесь 27 мг 1-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-2-фенилэтан-1,2-диона и 1 мл полиэтиленгликоля 400 перемешивали при 100°C в течение 5 минут с использованием микроволнового устройства. К реакционной смеси добавляли 5,2 мкл этан-1,2-диамина и смесь перемешивали при 150°C в течение 7 минут с использованием микроволнового устройства. Реакционную смесь далее перемешивали при 160°C в течение 10 минут. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат и воду. Органический слой фракционировали, промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи хроматографии на силикагеле [градиентное элюирование гексан:этилацетат=50:50-0:100]. К полученному остатку добавляли диизопропиловый эфир и твердое вещество фильтровали с получением 2 мг 4-циклопропил-1-этил-6-(3-фенилпиридин-2-ил)хинолин-2(1H)-она в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,52-0,58 (2H, м), 0,77-0,85 (2H, м), 1,34 (3H, т, J=7,2 Гц), 1,65-1,75 (1H, м), 4,33 (2H, кв, J=7,2 Гц), 6,37-6,41 (1H, м), 7,31-7,41 (4H, м), 7,47-7,54 (2H, м), 7,86 (1H, дд, J=8,9 Гц, 2,1 Гц), 8,13 (1H, д, J=2,2 Гц), 8,63 (2H, дд, J=6,8 Гц, 2,4 Гц).
[0227]
Пример 285
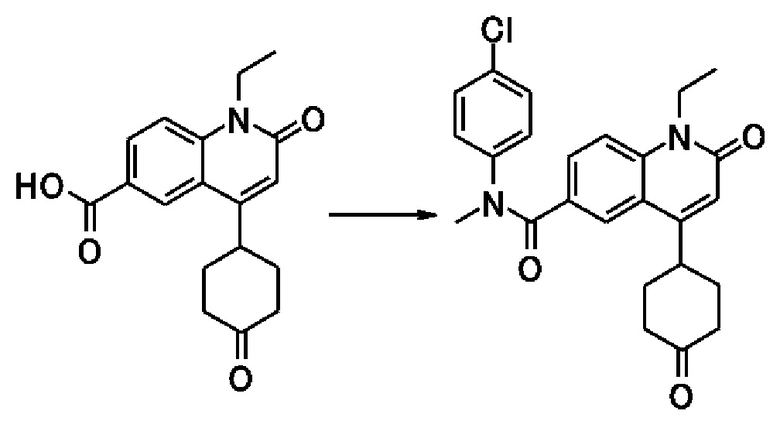
К суспензии 134 мг 1-этил-2-оксо-4-(4-оксоциклогексил)-1,2-дигидрохинолин-6-карбоновой кислоты в 5 мл дихлорметана добавляли 72 мг 4-хлор-N-метиланилина, 0,27 мл триэтиламина и 216 мг хлорангидрида бис(2-оксо-3-оксазолидинил)фосфиновой кислоты и смесь перемешивали при комнатной температуре в течение 9 часов. К реакционной смеси добавляли 72 мг N-метил-4-хлоранилина, 0,27 мл триэтиламина и 216 мг хлорангидрида бис(2-оксо-3-оксазолидинил)фосфиновой кислоты и смесь перемешивали при комнатной температуре в течение 15 часов. Из полученной реакционной смеси отгоняли растворитель при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [этилацетат]. К полученному остатку добавляли диизопропиловый эфир и этилацетат, твердое вещество фильтровали с получением 73 мг N-(4-хлорфенил)-1-этил-N-метил-2-оксо-4-(4-оксоциклогексил)-1,2-дигидрохинолин-6-карбоксамида в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,32 (3H, т, J=7,2 Гц), 1,74-1,88 (2H, м), 1,95-2,04 (2H, м), 2,42-2,61 (4H, м), 3,07-3,17 (1H, м), 3,55 (3H, с), 4,30 (2H, кв, J=7,1 Гц), 6,55-6,58 (1H, м), 7,03 (2H, д, J=8,8 Гц), 7,22-7,33 (3H, м), 7,66 (1H, дд, J=8,9 Гц, 2,1 Гц), 7,71 (1H, д, J=1,7 Гц).
[0228]
Пример 286
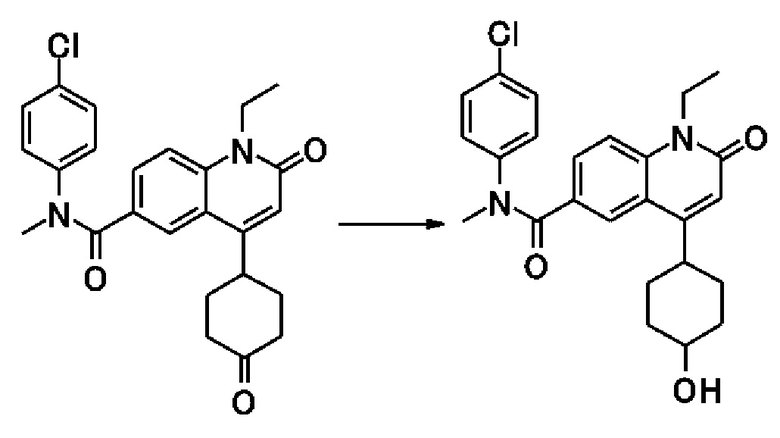
Смесь 51 мг N-(4-хлорфенил)-1-этил-N-метил-2-оксо-4-(4-оксоциклогексил)-1,2-дигидрохинолин-6-карбоксамида, 8,8 мг боргидрида натрия и 1,0 мл метанола перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли этилацетат и 1 моль/л хлористоводородной кислоты. Органический слой фракционировали и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле [этилацетат:метанол градиентное элюирование=100:0-90:10]. К полученному остатку добавляли диизопропиловый эфир и твердое вещество фильтровали с получением 41 мг N-(4-хлорфенил)-1-этил-4-(4-гидроксициклогексил)-N-метил-2-оксо-1,2-дигидрохинолин-6-карбоксамида в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,32 (3H, т, J=7,2 Гц), 1,36-1,70 (6H, м), 2,09-2,20 (2H, м), 2,50-2,61 (1H, м), 3,54 (3H, с), 3,60-3,75 (1H, м), 4,29 (2H, кв, J=7,0 Гц), 6,51-6,55 (1H, м), 7,02 (2H, д, J=8,8 Гц), 7,20-7,35 (3H, м), 7,55 (1H, д, J=2,0 Гц), 7,72 (1H, дд, J=8,8 Гц, 2,0 Гц).
[0229]
Пример 287

Способом, аналогичным описанному в Примере 5, из 4-хлор-1-этил-N-метил-N-(4-метилфенил)-2-оксо-1,2-дигидрохинолин-6-карбоксамида получали трет-бутил 4-(1-этил-6-(метил(4-метилфенил)карбамоил)-2-оксо-1,2-дигидрохинолин-4-ил)-3,6-дигидропиридин-1(2H)-карбоксилат.
МС (ESI, m/z):502(M+H)
[0230]
Пример 288

Способом, аналогичным описанному в Примере 6, из трет-бутил 4-(1-этил-6-(метил(4-метилфенил)карбамоил)-2-оксо-1,2-дигидрохинолин-4-ил)-3,6-дигидропиридин-1(2H)-карбоксилата получали трет-бутил 4-(1-этил-6-(метил(4-метилфенил)карбамоил)-2-оксо-1,2-дигидрохинолин-4-ил)пиперидин-1-карбоксилат.
МС (ESI, m/z):504(M+H)
[0231]
Пример 289

Способом, аналогичным описанному в Примере 7, из трет-бутил 4-(1-этил-6-(метил(4-метилфенил)карбамоил)-2-оксо-1,2-дигидрохинолин-4-ил)пиперидин-1-карбоксилата получали 1-этил-N-метил-N-(4-метилфенил)-2-оксо-4-пиперидин-4-ил)-1,2-дигидрохинолин-6-карбоксамид.
МС (ESI, m/z):404(M+H)
[0232]
Пример 290

Смесь 50 мг 1-этил-N-метил-N-(4-метилфенил)-2-оксо-4-(пиперидин-4-ил)-1,2-дигидрохинолин-6-карбоксамида, 20 мкл ацетилхлорида, 0,1 мл триэтиламина и 1 мл дихлорметана перемешивали при комнатной температуре в течение 20 минут. Реакционную смесь очищали при помощи колоночной хроматографии на силикагеле [градиентное элюирование хлороформ:метанол=100:0 -80:20]. К полученному остатку добавляли гексан и этилацетат и твердое вещество фильтровали с получением 13 мг 4-(1-ацетилпиперидин-4-ил)-1-этил-N-метил-N-(4-метилфенил)-2-оксо-1,2-дигидрохинолин-6-карбоксамида в виде желтого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,12-1,55 (7H, м), 2,05 (3H, с), 2,20 (3H, с), 2,57-2,69 (1H, м), 2,86-2,99 (1H, м), 3,10-3,23 (1H, м), 3,40 (3H, с), 3,87 (1H, д, J=13,9 Гц), 4,20 (2H, кв, J=6,9 Гц), 4,49 (1H, д, J=12,9 Гц), 6,37 (1H, с), 7,06-7,13 (4H, м), 7,52-7,62 (2H, м), 7,74 (1H, д, J=8,8 Гц).
[0233]
Пример 291

Смесь 30 мг 4-хлор-1-этил-6-(2-фенилпиридин-3-ил)хинолин-2(1H)-она, 10 мг метилборной кислоты, 35 мг трикалийфосфата, 6 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 0,5 мл диоксана и 0,2 мл воды перемешивали при 120°C в течение 10 минут с использованием микроволнового устройства. Реакционную смесь охлаждали до комнатной температуры. Реакционную смесь очищали при помощи хроматографии на силикагеле [градиентное элюирование гексан:этилацетат=100:0-30:70]. К полученному остатку добавляли гексан и твердое вещество фильтровали с получением 5 мг 1-этил-4-метил-6-(2-фенилпиридин-3-ил)хинолин-2(1H)-она в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,34 (3H, т, J=7,3 Гц), 2,21 (3H, д, J=1,0 Гц), 4,33 (2H, кв, J=7,3 Гц), 6,55 (1H, д, J=0,96 Гц), 7,23-7,32 (4H, м), 7,34-7,42 (4H, м), 7,48 (1H, д, J=1,9 Гц), 7,81 (1H, дд, J=7,8, 1,7 Гц), 8,73 (1H, дд, J=4,9, 1,7 Гц).
МС(ESI, m/z):341(M+H)
[0234]
Примеры 292-294
В соответствии с описанной в описании процедурой, соединения, указанные в Таблице 29, получали при помощи общеизвестных реакций, таких как конденсация, присоединение, окисление, восстановление, перегруппировка, замещение, галогенирование, дегидратация, гидролиз или подобные, или с использованием соответствующих комбинаций этих реакций.
[0235]

(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид

[0236]
Пример испытаний 1
(Испытание ингибирования продуцирования CXCL10)
0,5 × 104 или 1 × 104 эндотелиальных клеток, выделенных из пуповины человека, суспендировали в 100 мкл среды EGM-2 BulletKit (без GA) или среды Medium-200, дополненной набором EGM-2 SingleQuots (без GA), инокулировали в 96-луночный планшет и культивировали в течение ночи. 100 мкл раствора каждого испытываемого соединения, разбавленного той же средой, которую испоьзовали для инокуляции, добавляли к культивированным клеткам (конечная концентрация испытываемого соединения: 0,1 мкмоль/л). Через 1 час после этого к этой смеси добавляли TNFα в конечной концентрации 10 нг/мл. Через 72 часа после стимуляции супернатант извлекали и количество CXCL10, продуцированного в культуральном супернатанте, определяли с использованием набора ELISA (Peprotech, 900-K39).
Процент ингибирования рассчитывали в соответствии со следующим выражением:
[0237]
Ингибирование (%)=100-(Количество CXCL10, продуцируемого в присутствии испытываемого соединения/Количество CXCL10, продуцируемого в отсутствие испытываемого соединения) × 100
Соединения Примера 2, Примера 3, Примера 8, Примера 11, Примера 14, Примера 16, Примера 17, Примеров 245-248, Примера 250, Примеров 252-276, Примеров 278-281, Примера 282a, Примера 282b, Примера 283, Примера 284, Примера 286 и Примеров 290-294 ингибировали 50% или более CXCL10 продукции при концентрации 0,1 мкмоль/л.
Соединение по настоящему изобретению показали превосходный ингибирующий эффект продуцирования CXCL10.
Промышленная применимость
[0238]
Соединение, представленное общей формулой [1], или его соль обладает превосходной ингибиторной активностью в отношении CXCL10 и является полезным в качестве средства для лечения, такого как профилактика и/или терапия заболевания, связанного с чрезмерной продукцией CXCL10.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО И ИНГИБИТОР БРОМОДОМЕНА | 2017 |
|
RU2752163C2 |
| НОВОЕ ПРОИЗВОДНОЕ АМИНА ИЛИ ЕГО СОЛЬ | 2013 |
|
RU2668550C2 |
| АРИЛ-ИЛИ ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ БЕНЗОЛЬНЫЕ СОЕДИНЕНИЯ | 2012 |
|
RU2632193C2 |
| АЗОТСОДЕРЖАЩЕЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ ИЛИ ЕГО СОЛЬ | 2013 |
|
RU2632253C2 |
| МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2005 |
|
RU2528046C2 |
| МОДУЛЯТОРЫ АТФ-СВЯЗЫВАЮЩИХ ТРАНСПОРТЕРОВ | 2010 |
|
RU2552353C2 |
| МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2005 |
|
RU2556984C2 |
| СПОСОБ МОДУЛЯЦИИ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2005 |
|
RU2525115C2 |
| МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2005 |
|
RU2382779C2 |
| ЗАМЕЩЕННЫЕ БЕНЗОЛЬНЫЕ СОЕДИНЕНИЯ | 2012 |
|
RU2629118C2 |
Изобретение относится к области органической химии, а именно к соединению общей формулой [1] или к его соли, где R1 представляет собой метильную или этильную группу; R2 представляет собой атом водорода; R3 представляет собой атом хлора, метил, этил, изопропил, бутил, циклопропилэтил, метилпропил, гидроксибутил, трифторметил, циклопропилвинил, гидроксибутенил, циклопропил, циклогексил, гидроксициклогексил, оксоциклогексил, циклогексенил, диметиламиногруппу или необязательно замещенную гетероциклическую группу, где гетероциклическая группа выбрана из группы, включающей азетидинил, октагидроизохинолинил, морфолинил, пиперидинил, тетрагидропиранил и тетрагидропиридинил, и заместитель выбран из группы, включающей метил, этил, гидроксиэтил, метоксиэтил, трифторэтил, цианометил, ацетил, метилпропаноил, трет-бутоксикарбонил, бензоил, метилсульфонил, и гидрокси группы; Z1, Z2 и Z3 представляют собой CН; X1 представляет собой (1) группу, представленную общей формулой C(=O)N(R6), где атом углерода связан с кольцом A и R6 представляет собой атом водорода или метил; (2) группу, представленную общей формулой N(R7)C(=O), где атом азота связан с кольцом A и R7 представляет собой метил; или R7 представляет собой, вместе с одним заместителем R4 на кольце A, этиленовую или пропиленовую группу, или группу, представленную общей формулой NН-Y3, где атом азота связан с кольцом A, Y3 представляет собой оксо замещенную этиленовую группу; (3) двухвалентную циклическую углеводородную группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов в бензоле; или (4) необязательно замещенную 1-3 заместителями двухвалентную гетероциклическую группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов в имидазоле, дигидроимидазоле, пиразоле, дигидропиразоле, триазолидине, триазоле, пирролидине, пиридине, пиразолидине или пиразине, где группа заместителя выбрана из группы включающей: метил, этил, изопропил, бутил, гидроксиэтил, метоксиэтил, диметиламиноэтил, пиперидинилэтил, морфолинилэтил, бензил и оксо группу; кольцо А представляет собой фенил, нафтил, тиенил, пирролил, пиридил, индолил, индолинил, изоиндолинил, замещенный оксо, хинолил, изохинолил или хиноксалил; каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом фтора, атом хлора, циано группу, метил, этил, пропил, изопропил, трет-бутил, трифторметил, карбоксиметил, гидроксиэтил, метоксиэтил, циклопропилэтил, циклопропилвинил, гидроксибутенил, циклопропил, циклогексил, циклогексенил, фенил, метокси, этокси, трифторметокси, гидроксипропокси, (диметиламино)пропокси, этиламино, бутиламинокарбонил, диметиламино, метил(пропил)амино, диэтиламино, фениламино, метилкарбамоил, диметилкарбамоил, изопропилкарбамоил, (гидроксиэтил) карбамоил, фенилкарбамоил, сульфамоил, метилсульфонил, метилтетрагидропиридил, пиперидил, метилпиперидил, тетразолил, амино, ацетиламино, (метилсульфонил)амино, гидроксиэтиламино, ((диметиламино)этил)амино группу, гидроксильную группу, карбоксильную, метоксикарбонильную, трет-бутоксикарбонильную группу, C3-5 алкиленовую группу, образованную взятыми вместе двумя смежными R4, C2 алкиленовую группу, образованную взятыми вместе одним R4 и R7, или группу, представленную общей формулой NН-Y3, образованную взятыми вместе одним R4 и R7, где атом азота связан с кольцом A, Y3 представляет собой оксо замещенную этиленовую группу; и m представляет собой целое число от 0 до 3. Технический результат: получены новые гетероциклические соединения, полезные для лечения или профилактики заболевания, связанного с чрезмерной продукцией хемокина CXCL10. 13 з.п. ф-лы, 29 табл., 295 пр.

1. Соединение, представленное общей формулой [1], или его соль:

где
R1 представляет собой метильную или этильную группу;
R2 представляет собой атом водорода;
R3 представляет собой атом хлора, метил, этил, изопропил, бутил, циклопропилэтил, метилпропил, гидроксибутил, трифторметил, циклопропилвинил, гидроксибутенил, циклопропил, циклогексил, гидроксициклогексил, оксоциклогексил, циклогексенил, диметиламиногруппу или необязательно замещенную гетероциклическую группу, где гетероциклическая группа выбрана из группы, включающей азетидинил, октагидроизохинолинил, морфолинил, пиперидинил, тетрагидропиранил и тетрагидропиридинил, и заместитель выбран из группы, включающей метил, этил, гидроксиэтил, метоксиэтил, трифторэтил, цианометил, ацетил, метилпропаноил, трет-бутоксикарбонил, бензоил, метилсульфонил, и гидрокси группы;
Z1, Z2 и Z3 представляют собой CН;
X1 представляет собой
(1) группу, представленную общей формулой C(=O)N(R6), где атом углерода связан с кольцом A и R6 представляет собой атом водорода или метил,
(2) группу, представленную общей формулой N(R7)C(=O), где атом азота связан с кольцом A и R7 представляет собой метил; или R7 представляет собой, вместе с одним заместителем R4 на кольце A, этиленовую или пропиленовую группу, или группу, представленную общей формулой NН-Y3, где атом азота связан с кольцом A, Y3 представляет собой оксо замещенную этиленовую группу,
(3) двухвалентную циклическую углеводородную группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов в бензоле, или
(4) необязательно замещенную 1-3 заместителями двухвалентную гетероциклическую группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов в имидазоле, дигидроимидазоле, пиразоле, дигидропиразоле, триазолидине, триазоле, пирролидине, пиридине, пиразолидине или пиразине, где группа заместителя выбрана из группы включающей: метил, этил, изопропил, бутил, гидроксиэтил, метоксиэтил, диметиламиноэтил, пиперидинилэтил, морфолинилэтил, бензил и оксо группу;
кольцо А представляет собой фенил, нафтил, тиенил, пирролил, пиридил, индолил, индолинил, изоиндолинил, замещенный оксо, хинолил, изохинолил или хиноксалил;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом фтора, атом хлора, циано группу, метил, этил, пропил, изопропил, трет-бутил, трифторметил, карбоксиметил, гидроксиэтил, метоксиэтил, циклопропилэтил, циклопропилвинил, гидроксибутенил,циклопропил, циклогексил, циклогексенил, фенил, метокси, этокси, трифторметокси, гидроксипропокси, (диметиламино)пропокси, этиламино, бутиламинокарбонил, диметиламино, метил(пропил)амино, диэтиламино, фениламино, метилкарбамоил, диметилкарбамоил, изопропилкарбамоил, (гидроксиэтил) карбамоил, фенилкарбамоил, сульфамоил, метилсульфонил, метилтетрагидропиридил, пиперидил, метилпиперидил, тетразолил, амино, ацетиламино, (метилсульфонил)амино, гидроксиэтиламино, ((диметиламино)этил)амино группу, гидроксильную группу, карбоксильную, метоксикарбонильную, трет-бутоксикарбонильную группу,
C3-5 алкиленовую группу, образованную взятыми вместе двумя смежными R4,
C2 алкиленовую группу, образованную взятыми вместе одним R4 и R7,
или
группу, представленную общей формулой NН-Y3, образованную взятыми вместе одним R4 и R7, где атом азота связан с кольцом A, Y3 представляет собой оксо замещенную этиленовую группу; и
m представляет собой целое число от 0 до 3.
2. Соединение по п. 1 или его соль, где
R1 представляет метильную или этильную группу и
R3 представляет собой метил, этил, изопропил, бутил, циклопропилэтил, метилпропил, гидроксибутил или трифторметил, циклопропил, циклогексил, гидроксициклогексил, оксоциклогексил или необязательно замещенную гетероциклическую группу, где гетероциклическая группа выбрана из группы, включающей азетидинил, октагидроизохинолинил, морфолинил, пиперидинил, тетрагидропиранил и тетрагидропиридинил, и заместитель выбран из группы, включающей метил, этил, гидроксиэтил, метоксиэтил, трифторэтил, цианометил, ацетил, метилпропаноил, трет-бутоксикарбонил, бензоил, метилсульфонил, и гидрокси группы.
3. Соединение по п. 1 или 2 или его соль, где кольцо А представляет собой фенил или нафтил.
4. Соединение по любому одному из пп. 1-3 или его соль, где X1 представляет собой группу, представленную общей формулой C(=O)N(R6), где атом углерода связан с кольцом A и R6 представляет собой атом водорода или метил.
5. Соединение по любому одному из пп. 1-3 или его соль, где
X1 представляет собой группу, представленную общей формулой C(=O)N(R6a), где атом углерода связан с кольцом A и R6a представляет собой атом водорода или метил;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом фтора, атом хлора, метил, этил, пропил, изопропил, трет-бутил, трифторметил, карбоксиметил, гидроксиэтил, метоксиэтил, циклопропилэтил, этиламино, бутиламинокарбонил, амино, ацетиламино, (метилсульфонил)амино, гидроксиэтиламино или ((диметиламино)этил)амино группу; и
m представляет собой целое число от 0 до 2.
6. Соединение по любому одному из пп. 1-3 или его соль, где
R3 представляет собой метил, этил, изопропил, бутил, циклопропилэтил, метилпропил, гидроксибутил, трифторметил, циклопропил, циклогексил, гидроксициклогексил, оксоциклогексил или необязательно замещенную гетероциклическую группу, где гетероциклическая группа выбрана из группы, включающей азетидинил, октагидроизохинолинил, морфолинил, пиперидинил, тетрагидропиранил и тетрагидропиридинил, и заместитель выбран из группы, включающей метил, этил, гидроксиэтил, метоксиэтил, трифторэтил, цианометил, ацетил, метилпропаноил, трет-бутоксикарбонил, бензоил, метилсульфонил, и гидрокси группы;
X1 представляет собой группу, представленную общей формулой C(=O)N(R6b), где атом углерода связан с кольцом A и R6b представляет собой метил;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом фтора, атом хлора или метил, этил, пропил, изопропил, трет-бутил, трифторметил, карбоксиметил, гидроксиэтил, метоксиэтил, циклопропилэтил; и
m представляет собой целое число от 0 до 2.
7. Соединение по п. 6 или его соль, где
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом фтора или атом хлора; и
m представляет собой целое число от 0 до 2.
8. Соединение по любому одному из пп. 1-3 или его соль, где
X1 представляет собой группу, представленную общей формулой N(R7)C(=O), где атом азота связан с кольцом A и R7 представляет собой метил; или R7 представляет собой, вместе с одним заместителем R4 на кольце A, этиленовую или пропиленовую группу, или группу, представленную общей формулой NН-Y3, где атом азота связан с кольцом A, Y3 представляет собой оксо замещенную этиленовую группу.
9. Соединение по любому одному из пп. 1-3 или его соль, где
R3 представляет собой метил, этил, изопропил, бутил, циклопропилэтил, метилпропил, гидроксибутил, трифторметил, циклопропил, циклогексил, гидроксициклогексил, оксоциклогексил или необязательно замещенную гетероциклическую группу, где гетероциклическая группа выбрана из группы, включающей азетидинил, октагидроизохинолинил, морфолинил, пиперидинил, тетрагидропиранил и тетрагидропиридинил, и заместитель выбран из группы, включающей метил, этил, гидроксиэтил, метоксиэтил, трифторэтил, цианометил, ацетил, метилпропаноил, трет-бутоксикарбонил, бензоил, метилсульфонил, и гидрокси группы;
X1 представляет собой группу, представленную общей формулой N(R7a)C(=O), где атом азота связан с кольцом A и R7a представляет собой метил, или R7a представляет собой, вместе с одним заместителем R4 на кольце A, этиленовую или пропиленовую группу.
10. Соединение по любому одному из пп. 1-3 или его соль, где
R3 представляет собой необязательно замещенную гетероциклическую группу, где гетероциклическая группа выбрана из группы, включающей азетидинил, октагидроизохинолинил, морфолинил, пиперидинил, тетрагидропиранил и тетрагидропиридинил, и заместитель выбран из группы, включающей метил, этил, гидроксиэтил, метоксиэтил, трифторэтил, цианометил, ацетил, метилпропаноил, трет-бутоксикарбонил, бензоил, метилсульфонил, и гидрокси группы;
X1 представляет собой группу, представленную общей формулой N(R7b)C(=O), где атом азота связан с кольцом A и R7b представляет собой метил, или R7b представляет собой, вместе с одним заместителем R4 на кольце A, этиленовую или пропиленовую группу;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой метил, этил, пропил, изопропил, трет-бутил, трифторметил, карбоксиметил, гидроксиэтил, метоксиэтил, циклопропилэтил,
C3 алкиленовую группу, образованную взятыми вместе двумя смежными R4, или
C2 алкиленовую группу, образованную взятыми вместе одним R4 и R7b; и
m представляет собой целое число от 0 до 2.
11. Соединение по п. 10 или его соль, где
X1 представляет собой группу, представленную общей формулой N(R7b)C(=O), где атом азота связан с кольцом A и R7b представляет собой метил, или R7b представляет собой, вместе с одним заместителем R4 на кольце A, C2-3 алкиленовую группу;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой метил, этил, пропил, изопропил, трет-бутил, трифторметил, карбоксиметил, гидроксиэтил, метоксиэтил, циклопропилэтил, или
C2 алкиленовую группу, образованную взятыми вместе одним R4 и R7b; и
m представляет собой целое число от 0 до 2.
12. Соединение по любому одному из пп. 1-3 или его соль, где
X1 представляет собой двухвалентную циклическую углеводородную группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов в бензоле, или необязательно замещенную двухвалентную гетероциклическую группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов в имидазоле, дигидроимидазоле, пиразоле, дигидропиразоле, триазолидине, триазоле, пирролидине, пиридине, пиразолидине или пиразине, где группа заместителя выбрана из группы включающей: метил, этил, изопропил, бутил, гидроксиэтил, метоксиэтил, диметиламиноэтил, пиперидинилэтил, морфолинилэтил, бензил и оксо группу.
13. Соединение по любому одному из пп. 1-3 или его соль, где
R3 представляет собой метил, этил, изопропил, бутил, циклопропилэтил, метилпропил, гидроксибутил, трифторметил или необязательно замещенную гетероциклическую группу, где гетероциклическая группа выбрана из группы, включающей азетидинил, октагидроизохинолинил, морфолинил, пиперидинил, тетрагидропиранил и тетрагидропиридинил, и заместитель выбран из группы, включающей метил, этил, гидроксиэтил, метоксиэтил, трифторэтил, цианометил, ацетил, метилпропаноил, трет-бутоксикарбонил, бензоил, метилсульфонил, и гидрокси группы;
X1 представляет собой двухвалентную циклическую углеводородную группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов в бензоле, или необязательно замещенную двухвалентную гетероциклическую группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов в имидазоле, дигидроимидазоле, пиразоле, дигидропиразоле, триазолидине, триазоле, пирролидине, пиридине, пиразолидине или пиразине, где группа заместителя выбрана из группы включающей: метил, этил, изопропил, бутил, гидроксиэтил, метоксиэтил, диметиламиноэтил, пиперидинилэтил, морфолинилэтил, бензил и оксо группу;
каждая из m числа групп R4, которые являются одинаковыми или отличными друг от друга, представляет собой атом фтора или атом хлора; и
m представляет собой целое число от 0 до 2.
14. Соединение по п. 13 или его соль, где
R3 представляет собой необязательно замещенную гетероциклическую группу, где гетероциклическая группа выбрана из группы, включающей азетидинил, октагидроизохинолинил, морфолинил, пиперидинил, тетрагидропиранил и тетрагидропиридинил, и заместитель выбран из группы, включающей метил, этил, гидроксиэтил, метоксиэтил, трифторэтил, цианометил, ацетил, метилпропаноил, трет-бутоксикарбонил, бензоил, метилсульфонил, и гидрокси группы; и
X1 представляет собой необязательно замещенную двухвалентную гетероциклическую группу, образующуюся в результате удаления одного атома водорода от каждого из двух смежных атомов в имидазоле, дигидроимидазоле, пиразоле, дигидропиразоле, триазолидине, триазоле, пирролидине, пиридине, пиразолидине или пиразине, где группа заместителя выбрана из группы включающей: метил, этил, изопропил, бутил, гидроксиэтил, метоксиэтил, диметиламиноэтил, пиперидинилэтил, морфолинилэтил, бензил и оксо группу.
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| JPH07252228 А, 03.10.1995 | |||
| US 7884204 В2, 08.02.2011 | |||
| Система рессор для железнодорожных повозок и автомобилей | 1926 |
|
SU7464A1 |
Авторы
Даты
2020-04-27—Публикация
2016-07-15—Подача