Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к противоопухолевому средству и ингибитору бромодомена.
Уровень техники
[0002]
Бромодомен представляет собой домен белка, который, как известно, обладает функцией распознавания ацетилированного лизина гистона и функцией собирания регуляторных белков для контроля структуры хроматина и экспрессии генов (непатентный документ 1). В организме человека присутствуют приблизительно 50 типов белков, содержащих бромодомен. Примером белка, содержащего бромодомен, может быть семейство белков, содержащих бромодомен и экстратерминальный домен (BET), имеющий повторяющуюся последовательность бромодомена и специфическую терминальную последовательность. В качестве такого белка семейства BET известны бромодоменсодержащие белок 2 (BRD2), BRD3, BRD4 и BRDT. Каждый из этих белков имеет бромодомен 1 (BD1) и бромодомен 2 (BD2) в качестве N-терминальных бромодоменов.
Гистон является основным белком, который обычно присутствует в ядре эукариотических клеток организмов, начиная, например, от многоклеточных организмов, включая людей, до одноклеточных организмов, включая грибы (плесень и/или дрожжи), и который связывается с геномной ДНК через ионную связь. Такой гистон обычно состоит из 5 типов компонентов (H1, H2A, H2B, H3 и H4), и они очень похожи друг на друга, независимо от вида организма. Гистон подвергается модификациям, таким как ацетилирование, метилирование, фосфорилирование, убиквитилирование и модификация с участием небольшого убиквитин-подобного модифицирующего белка (называемая сумоилированием) (SUMO), в N-терминальной части, называемой "хвостом гистона", и структура хроматина сохраняется или специфически преобразуется в другую структуру, в результате чего могут контролироваться реакции, происходящие на хромосомной ДНК, такие как экспрессия генов, репликация ДНК и репарация ДНК. Пост-трансляционная модификация гистона представляет собой эпигенетический регуляторный механизм, и считается, что эта модификация имеет важное значение для регуляции генов эукариотических клеток. Например, ацетилирование гистона регулируется парой модифицирующих ферментов (то есть ферментом ацетилирования гистона и ферментом деацетилирования гистона). Как правило, в основном работает фермент деацетилирования, и, в силу этого, гистон поддерживается в деацетилированном состоянии. Однако после стимуляции клеток и, соответственно, их активации, аминогруппа остатка лизина гистона подвергается ацетилированию под воздействием фермента ацетилирования гистона, и положительный заряд аминогруппы нейтрализуется, в результате чего ослабляется взаимодействие между нуклеосомами, рекрутируется фактор транскрипции, и инициируется транскрипция.
В последние годы было сделано предположение, что ацетилированный гистон H3 или ацетилированный гистон H4, которые образуются в результате ацетилирования гистона H3 или гистона H4, могут взаимодействовать с BRD2, BRD3 и BRD4, В разработке ингибитора бромодомена, который нацелен на эти семейства белков BET, уже достигнуты определенные успехи (патентные документы 1 и 2 и непатентные документы 1 и 2), также как уже и достигнуты положительные результаты при применении такого ингибитора бромодомена в качестве противоопухолевого средства.
Документы, характеризующие предшествующий уровень техники
Патентные документы
[0003]
Патентный документ 1: International Publication WO 2016/016316
Патентный документ 2: International Publication WO 2009/084693
Непатентные документы
[0004]
Непатентный документ 1: Panagis F et al., Nature Reviews Drug Discovery, Vol. 13, pp. 337 to 356, 2014
Непатентный документ 2: Suzuki et al., Magazine of Kyoto Prefectural University of Medicine, Vol. 124, pp. 839 to 847, 2015
Сущность изобретения
Задача, решаемая изобретением
[0005]
Задачей настоящего изобретения является создание противоопухолевого средства, которое обладает дополнительными преимуществами в качестве лекарственного средства, применяемого при предотвращении и/или лечении ассоциированной с бромодоменом опухоли. Кроме того, еще одной задачей настоящего изобретения является создание ингибитора бромодомена, который может применяться в качестве лекарственного средства при ассоциированных с бромодоменом заболеваниях или состояниях.
Способы решения задачи
[0006]
В результате проведения глубоких исследований с целью решения поставленных выше задач, авторы настоящего изобретения обнаружили, что азотсодержащее гетероциклическое соединение, имеющее специфическую структуру, или его соль обладает высокой ингибирующей активностью в отношении бромодомена. Кроме того, авторы настоящего изобретения также обнаружили, что соединение по настоящему изобретению, обладающее высокой ингибирующей активностью в отношении бромодомена, может также применяться в качестве противоопухолевого средства, в результате чего и было создано настоящее изобретение.
[0007]
А именно, в настоящем изобретении предлагается следующее.
<1>
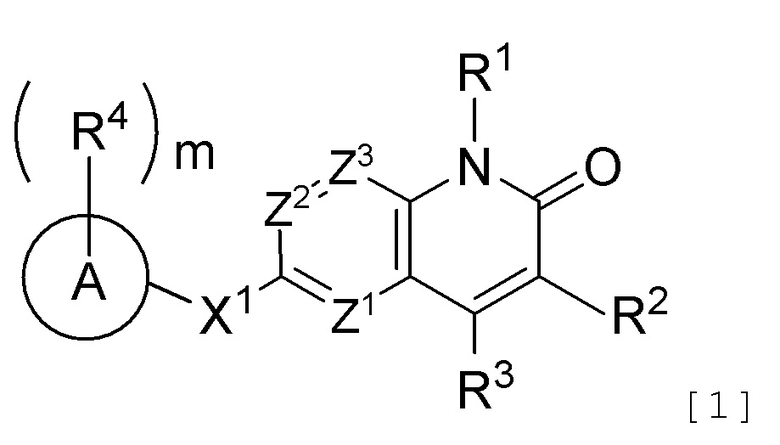
Противоопухолевое средство, включающее соединение, представленное следующей формулой [1] (далее называемое в изобретении как "соединение A"), или его соль:
[Формула 1]

где R1 представляет атом водорода или необязательно замещенную C1-6 алкильную группу;
R2 представляет атом водорода, атом галогена или необязательно замещенную C1-6 алкильную группу;
R3 представляет атом галогена, необязательно замещенную C1-6 алкильную группу, необязательно замещенную C2-6 алкенильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную C4-8 циклоалкенильную группу, необязательно замещенную арильную группу, необязательно замещенную C1-6 алкоксильную группу, необязательно замещенную C1-6 алкиламиногруппу, необязательно замещенную ди(C1-6 алкил)аминогруппу или необязательно замещенную гетероциклическую группу;
Z1, Z2 и Z3, которые являются одинаковыми или различными, каждый представляет атом азота или группу, представленную формулой CR5 (где R5 представляет атом водорода, атом галогена или необязательно замещенную C1-6 алкильную группу);
X1 представляет
(1) группу, представленную формулой C(=O)N(R6) (где углеродный атом связан с кольцом A, и R6 представляет атом водорода, защитную группу для аминогруппы или необязательно замещенную C1-6 алкильную группу),
(2) группу, представленную формулой N(R7)C(=O) (где атом азота связан с кольцом A, и R7 представляет атом водорода, защитную группу для аминогруппы или необязательно замещенную C1-6 алкильную группу; или R7 представляет, вместе с одним заместителем R4 кольца A, необязательно замещенную C2-4 алкиленовую группу, группу, представленную формулой O-Y1 (где атом кислорода связан с кольцом A, и Y1 представляет необязательно замещенную C1-3 алкиленовую группу), группу, представленную формулой S(O)n-Y2 (где атом серы связан с кольцом A, Y2 представляет необязательно замещенную C1-3 алкиленовую группу, и n представляет целое число от 0 до 2), или группу, представленную формулой N(R8)-Y3 (где атом азота связан с кольцом A, Y3 представляет необязательно замещенную C1-3 алкиленовую группу, и R8 представляет атом водорода, защитную группу для аминогруппы, необязательно замещенную C1-6 алкильную группу или необязательно замещенную арильную группу)),
(3) необязательно замещенную двухвалентную циклическую углеводородную группу, которая образуется в результате удаления каждого одного атома водорода на двух смежных атомах, или
(4) необязательно замещенную двухвалентную гетероциклическую группу, которая образуется в результате удаления каждого одного атома водорода на двух смежных атомах;
кольцо A представляет циклическую углеводородную группу или гетероциклическую группу;
m число R4, которые являются одинаковыми или различными, каждый представляет атом галогена, цианогруппу, нитрогруппу, защитную группу для аминогруппы, необязательно замещенную C1-6 алкильную группу, необязательно замещенную C2-6 алкенильную группу, необязательно замещенную C2-6 алкинильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную C4-8 циклоалкенильную группу, необязательно замещенную арильную группу, необязательно замещенную C1-6 алкоксильную группу, необязательно замещенную арилоксильную группу, необязательно замещенную C1-6 алкиламиногруппу, необязательно замещенную ди(C1-6 алкил)аминогруппу, необязательно замещенную ариламиногруппу, необязательно замещенную карбамоильную группу, необязательно замещенную сульфамоильную группу, необязательно замещенную C1-6 алкилтиогруппу, необязательно замещенную арилтиогруппу, необязательно замещенную C1-6 алкилсульфонильную группу, необязательно замещенную арилсульфонильную группу, необязательно замещенную гетероциклическую группу или необязательно защищенную аминогруппу, необязательно защищенную гидроксильную группу, необязательно защищенную карбоксильную группу,
необязательно замещенную C2-5 алкиленовую группу, образованную совместно двумя смежными R4,
необязательно замещенную C2-4 алкиленовую группу, образованную одним R4 совместно с R7,
группу, представленную формулой O-Y1 (где атом кислорода связан с кольцом A, и Y1 представляет необязательно замещенную C1-3 алкиленовую группу), которая образована одним R4 совместно с R7,
группу, представленную формулой S(O)n-Y2 (где атом серы связан с кольцом A, Y2 представляет необязательно замещенную C1-3 алкиленовую группу, и n представляет целое число от 0 до 2), которая образована одним R4 совместно с R7, или
группу, представленную формулой N(R8)-Y3 (где атом азота связан с кольцом A, Y3 представляет необязательно замещенную C1-3 алкиленовую группу, и R8 представляет атом водорода, защитную группу для аминогруппы, необязательно замещенную C1-6 алкильную группу или необязательно замещенную арильную группу), которая образована одним R4 совместно с R7; и
m представляет целое число от 0 до 5,
[0008]
<2>
Противоопухолевое средство по приведенному выше пункту <1>, где
R2 представляет атом водорода или C1-6 алкильную группу; и
Z1, Z2 и Z3 каждый представляет CH.
<3>
Противоопухолевое средство по приведенному выше пункту <1> или <2>, где
R3 представляет необязательно замещенную C3-8 циклоалкильную группу или необязательно замещенную гетероциклическую группу.
<4>
Противоопухолевое средство по любому одному из приведенных выше пунктов <1> - <3>, где
R3 представляет любую одну из следующих гетероциклических групп:
[Формула 2]
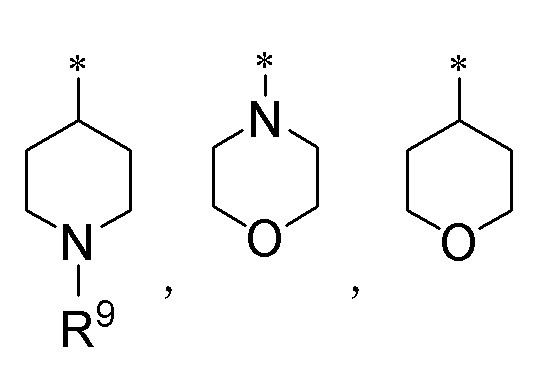
где R9 представляет атом водорода, защитную группу для аминогруппы или необязательно замещенную C1-6 алкильную группу, и символ * обозначает место присоединения.
<5>
Противоопухолевое средство по любому одному из приведенных выше пунктов <1> - <4>, где кольцо A представляет циклическую углеводородную группу.
[0009]
<6>
Противоопухолевое средство по любому одному из приведенных выше пунктов <1> - <5>, где X1 представляет
(2) группу, представленную формулой N(R7)C(=O) (где атом азота связан с кольцом A, и R7 представляет атом водорода, защитную группу для аминогруппы или необязательно замещенную C1-6 алкильную группу; или R7 представляет, вместе с одним заместителем R4 кольца A, необязательно замещенную C2-4 алкиленовую группу, группу, представленную формулой O-Y1 (где атом кислорода связан с кольцом A, и Y1 представляет необязательно замещенную C1-3 алкиленовую группу), группу, представленную формулой S(O)n-Y2 (где атом серы связан с кольцом A, Y2 представляет необязательно замещенную C1-3 алкиленовую группу, и n представляет целое число от 0 до 2), или группу, представленную формулой N(R8)-Y3 (где атом азота связан с кольцом A, Y3 представляет необязательно замещенную C1-3 алкиленовую группу, и R8 представляет атом водорода, защитную группу для аминогруппы, необязательно замещенную C1-6 алкильную группу или необязательно замещенную арильную группу)),или
(4) необязательно замещенную двухвалентную гетероциклическую группу, которая образуется в результате удаления каждого одного атома водорода на двух смежных атомах.
[0010]
<7>
Противоопухолевое средство по любому одному из приведенных выше пунктов <1> - <5>, где
соединение представлено следующей формулой [1-1]:
[Формула 3]

где R1 представляет атом водорода или необязательно замещенную C1-6 алкильную группу;
R3a представляет необязательно замещенную C1-6 алкильную группу, необязательно замещенную C3-8 циклоалкильную группу или необязательно замещенную гетероциклическую группу;
кольцо A1 представляет циклическую углеводородную группу;
R7a представляет защитную группу для аминогруппы или необязательно замещенную C1-6 алкильную группу; или
R7a представляет, вместе с одним заместителем R4a кольца A1, необязательно замещенную C2-3 алкиленовую группу, группу, представленную формулой O-Y1a (где атом кислорода связан с кольцом A1, и Y1a представляет необязательно замещенную C1-3 алкиленовую группу), группу, представленную формулой S(O)n-Y2a (где атом серы связан с кольцом A1, Y2a представляет необязательно замещенную C1-3 алкиленовую группу, и n представляет целое число от 0 до 2), или группу, представленную формулой N(R8a)-Y3a (где атом азота связан с кольцом A1, Y3a представляет необязательно замещенную C1-3 алкиленовую группу, и R8a представляет атом водорода или необязательно замещенную C1-6 алкильную группу),
m1 число R4a, которые являются одинаковыми или различными, каждый представляет атом галогена, цианогруппу, необязательно замещенную C1-3 алкильную группу, необязательно замещенную карбамоильную группу, необязательно замещенную C1-3 алкилсульфонильную группу, необязательно защищенную карбоксильную группу,
необязательно замещенную C2-5 алкиленовую группу, образованную совместно двумя смежными R4a,
необязательно замещенную C2-3 алкиленовую группу, образованную одним R4a совместно с R7a,
группу, представленную формулой O-Y1a (где атом кислорода связан с кольцом A1, и Y1a представляет необязательно замещенную C1-3 алкиленовую группу), которая образована одним R4a совместно с R7a,
группу, представленную формулой S(O)n-Y2a (где атом серы связан с кольцом A1, Y2a представляет необязательно замещенную C1-3 алкиленовую группу, и n представляет целое число от 0 до 2), которая образована одним R4a совместно с R7a, или
группу, представленную формулой N(R8a)-Y3a (где атом азота связан с кольцом A1, Y3a представляет необязательно замещенная C1-3 алкиленовую группу, и R8a представляет атом водорода или необязательно замещенную C1-6 алкильную группу), которая образована одним R4a совместно с R7a; и
m1 представляет целое число от 0 до 2,
[0011]
<8>
Противоопухолевое средство по любому одному из приведенных выше пунктов <1> - <6>, где
X1 представляет необязательно замещенную дигидрооксоимидазол-1,5-диильную группу, необязательно замещенную имидазол-1,2-диильную группу, необязательно замещенную имидазол-4,5-диильную группу, необязательно замещенную 1,2,4-триазол-1,5-диильную группу, необязательно замещенную 1H-пиразол-4,5-диильную группу, необязательно замещенную оксопирролидин-1,2-диильную группу, необязательно замещенную диоксотриазолидин-1,2-диильную группу, необязательно замещенную диоксопиразолидин-1,2-диильную группу, необязательно замещенную оксопиразолин-1,2-диильную группу, необязательно замещенную пиридин-2,3-диильную группу или необязательно замещенную пиразин-2,3-диильную группу.
[0012]
<9>
Противоопухолевое средство по любому одному из приведенных выше пунктов <1> - <5>, где
соединение представлено следующей формулой [1-2]:
[Формула 4]

где R1 представляет атом водорода или необязательно замещенную C1-6 алкильную группу;
R3b представляет необязательно замещенную C1-6 алкильную группу, необязательно замещенную C3-8 циклоалкильную группу или необязательно замещенную гетероциклическую группу;
X1b представляет необязательно замещенную дигидрооксоимидазол-1,5-диильную группу;
кольцо A2 представляет циклическую углеводородную группу;
m2 число R4b, которые являются одинаковыми или различными, каждый представляет атом галогена или необязательно замещенную C1-6 алкильную группу; и
m2 представляет целое число от 0 до 2,
[0013]
<10>
Противоопухолевое средство по приведенному выше пункту <1>, где
соединение представляет собой, по меньшей мере, соединение, выбранное из группы, состоящей из следующих соединений:
N-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-N-метилбензамид,
1-этил-4-(1-этилпиперидин-4-ил)-N-метил-2-оксо-N-фенил-1,2-дигидрохинолин-6-карбоксамид,
6-(3,4-дигидрохинолин-1(2H)-илкарбонил)-1-этил-4-(1-метил-пиперидин-4-ил)хинолин-2(1H)-он,
1-этил-N-метил-N-(4-метилфенил)-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид,
N-(2,3-дигидро-1H-инден-5-ил)-1-этил-N-метил-4-(1-метил-пиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6- карбоксамид,
6-(5-(4-хлорфенил)-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-он,
6-(5-(4-хлорфенил)-3-метил-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-он,
1-этил-4-(морфолин-4-ил)-6-(2-оксо-5-фенил-3-(пропан-2-ил)-2,3-дигидро-1H-имидазол-1-ил)хинолин-2(1H)-он,
1-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-2-фенил-1,2,4-триазолидин-3,5-дион,
4-хлор-N-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-дигидро-хинолин-6-ил)-N-метилбензамид,
4-(1-ацетилпиперидин-4-ил)-1-этил-N-метил-N-(4-метил-фенил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид,
1-этил-N-(3-фтор-4-метилфенил)-N-метил-4-(1-метил- пиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид,
N-(3-хлор-4-метилфенил)-1-этил-N-метил-4-(1-метил- пиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид, и
N-(3,4-диметилфенил)-1-этил-N-метил-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид.
<11>
Противоопухолевое средство по любому одному из приведенных выше пунктов <1> - <10>, где опухоль представляет собой рак крови, тимому, миелому, рак печени, рак поджелудочной железы, рак яичников, рак предстательной железы, рак легких, остеосаркому, рак толстой кишки, рак молочной железы, рак кожи или эпителиально-клеточный рак.
[0014]
<12>
Ингибитор бромодомена, включающий соединение A или его соль.
<13>
Ингибитор бромодомена по приведенному выше пункту <12>, который ингибирует связывание бромодомена с ацетилированным гистоном.
<14>
Ингибитор бромодомена по приведенному выше пункту <12> или <13>, где бромодомен представляет собой домен белка, входящего в семейство белков BET.
<15>
Фармацевтическая композиция для применения в терапии опухоли, включающая соединение A или его соль.
<16>
Фармацевтическая композиция для применения в терапии заболевания, ассоциированного с бромодоменом, включающая соединение A или его соль.
<17>
Способ терапии опухоли, включающий стадию введения терапевтически эффективного количества соединения A или его соли млекопитающим, включая человека.
<18>
Способ лечения заболевания, ассоциированного с бромодоменом, включающий стадию введения терапевтически эффективного количества соединения A или его соли млекопитающим, включая человека.
<19>
Соединение A или его соль для применения в терапии опухоли.
<20>
Соединение A или его соль для применения в терапии заболевания или симптома, ассоциированного с бромодоменом.
<21>
Применение соединения A или его соли для приготовления фармацевтической композиции для лечения опухоли.
<22>
Применение соединения A или его соли для приготовления фармацевтической композиции для лечения заболевания, ассоциированного с бромодоменом.
Полезные эффекты изобретения
[0015]
Противоопухолевое средство и ингибитор бромодомена по настоящему изобретению обладают высокой ингибирующей активностью в отношении бромодомена и могут применяться в качестве лекарственных средств для предотвращения и/или терапии опухоли, ассоциированной с бромодоменом, и других подобных опухолей.
Краткое описание чертежей
[0016]
[Фигура 1]. На фигуре 1 в графическом виде представлены данные по уровню экспрессии мРНК гена c-Myc, с учетом корректировки относительно гена GAPDH, (глицеральдегид-3-фосфатдегидрогеназы) в клетках линии MV4-11, подвергнутых обработке соединением примера 14.
[Фигура 2]. На фигуре 2 в графическом виде представлены данные по уровню экспрессии мРНК гена HXIM1, с учетом корректировки относительно гена GAPDH, в клетках линии MV4-11, подвергнутых обработке соединением примера 14.
[Фигура 3]. На фигуре 3 в графическом виде представлены данные по уровню экспрессии мРНК гена IL-7R, с учетом корректировки относительно гена GAPDH, в клетках линии MV4-11, подвергнутых обработке соединением примера 14.
[Фигура 4]. На фигуре 4 в графическом виде представлены данные по уровню экспрессии мРНК гена c-Myc, с учетом корректировки относительно гена GAPDH, в опухоли в случае внутривенного введения соединения примера 14 в экспериментальной модели рака на мыши, которой подкожно были трансплантированы клетки линии MV4-11.
[Фигура 5]. На фигуре 5 в графическом виде представлены данные по уровню экспрессии мРНК гена c-Myc, с учетом корректировки относительно гена GAPDH, в опухоли в случае перорального введения соединения примера 14 в экспериментальной модели рака на мыши, которой подкожно были трансплантированы клетки линии MV4-11.
Вариант осуществления изобретения
[0017]
Далее, настоящее изобретение будет описано более подробно.
В настоящем изобретении, символ % обозначает % по массе, если специально не указано иначе.
В настоящем изобретении, индивидуальные термины имеют следующие значения, если специально не указано иначе.
Атом галогена обозначает атом фтора, атом хлора, атом брома или атом йода.
C1-6 алкильная группа обозначает линейные или разветвленные C1-6 алкильные группы, такие как метильная, этильная, пропильная, изопропильная, бутильная, вторбутильная, изобутильная, трет-бутильная, пентильная, изопентильная и гексильная группы.
C1-3 алкильная группа обозначает метильную, этильную, пропильную или изопропильную группу.
C2-6 алкенильная группа обозначает линейные или разветвленные C2-6 алкенильные группы, такие как винильная, аллильная, пропенильная, изопропенильная, бутенильная, изобутенильная, 1,3-бутадиенильная, пентенильная и гексенильная группы.
C2-6 алкинильная группа обозначает линейные или разветвленные C2-6 алкинильные группы, такие как этинильная, пропинильная, бутинильная, пентинильная и гексинильная группы.
C3-8 циклоалкильная группа обозначает C3-8 циклоалкильные группы, такие как циклопропильная, циклобутильная, циклопентильная и циклогексильная группы.
C4-8 циклоалкенильная группа обозначает C4-8 циклоалкенильные группы, такие как циклобутенильная, циклопентенильная, циклогексенильная и циклогександиенильная группы.
Арильная группа обозначает фенильную или нафтильную группу.
Арил C1-6 алкильная группа обозначает арил C1-6 алкильные группы, такие как бензильная, дифенилметильная, тритильная, фенетильная и нафтилметильная группы.
[0018]
C2-5 алкиленовая группа обозначает линейные или разветвленные C2-5 алкиленовые группы, такие как этилиденовая, этиленовая, триметиленовая, пропиленовая, тетраметиленовая и пентаметиленовая группы.
C2-4 алкиленовая группа обозначает линейные или разветвленные C2-4 алкиленовые группы, такие как этилиденовая, этиленовая, триметиленовая, пропиленовая и тетраметиленовая группы.
C2-3 алкиленовая группа обозначает этилиденовую, этиленовую, триметиленовую или пропиленовую группу.
C1-3 алкиленовая группа обозначает метиленовую, этилиденовую, этиленовую, триметиленовую или пропиленовую группу.
[0019]
C1-6 алкоксильная группа обозначает линейные или разветвленные C1-6 алкилоксильные группы, такие как метоксильная, этоксильная, пропоксильная, изопропоксильная, бутоксильная, изобутоксильная, вторбутоксильная, трет-бутоксильная, пентилоксильная и гексилоксильная группы.
Арилоксильная группа обозначает феноксильную или нафтилоксильную группу.
C1-6 алкокси C1-6 алкильная группа обозначает C1-6 алкилокси C1-6 алкильные группы, такие как метоксиметильная и 1-этокси-этильная группы.
Арил C1-6 алкокси C1-6 алкильная группа обозначает арил C1-6 алкилокси C1-6 алкильные группы, такие как бензилоксиметильная и фенетилоксиметильная группы.
[0020]
C2-6 алканоильная группа обозначает линейные или разветвленные C2-6 алканоильные группы, такие как ацетильная, пропионильная, валерильная, изовалерильная и пивалоильная группы.
Ароильная группа обозначает бензоильную или нафтоильную группу.
Гетероциклическая карбонильная группа обозначает фуроильную, теноильную, пирролидинилкарбонильную, пиперидинилкарбонильную, пиперазинилкарбонильную, морфолинилкарбонильную или пиридинилкарбонильную группу.
Ацильная группа обозначает формильную группу, C2-6 алканоильную группу, ароильную группу или гетероциклическую карбонильную группу.
C1-6 алкоксикарбонильная группа обозначает линейные или разветвленные C1-6 алкилоксикарбонильные группы, такие как метоксикарбонильная, этоксикарбонильная, пропоксикарбонильная, изопропоксикарбонильная, трет-бутоксикарбонильная и 1,1-диметилпропоксикарбонильная группы.
Арилоксикарбонильная группа обозначает фенилоксикарбонильную или нафтилоксикарбонильную группу.
Арил C1-6 алкоксикарбонильная группа обозначает арил C1-6 алкилоксикарбонильные группы, такие как бензилоксикарбонильная и фенетилоксикарбонильная группы.
[0021]
C1-6 алкиламиногруппа обозначает линейные или разветвленные C1-6 алкиламиногруппы, такие как метиламино-, этиламино-, пропиламино-, изопропиламино-, бутиламино-, вторбутиламино-, трет-бутиламино-, пентиламино- и гексиламиногруппы.
Ди(C1-6 алкил)аминогруппа обозначает линейные или разветвленные ди(C1-6 алкил)аминогруппы, такие как диметиламино-, диэтиламино-, дипропиламино-, диизопропиламино-, дибутиламино-, ди(трет-бутил)амино-, дипентиламино-, дигексиламино-, (этил)(метил)амино- и (метил)(пропил)аминогруппы.
Ариламиногруппа обозначает фениламино- или нафтиламиногруппу.
[0022]
C1-6 алкилтиогруппа обозначает линейные или разветвленные C1-6 алкилтиогруппы, такие как метилтио-, этилтио- и пропилтиогруппы.
Арилтиогруппа обозначает фенилтио- или нафтилтиогруппу.
C1-6 алкилсульфонильная группа обозначает линейные или разветвленные C1-6 алкилсульфонильные группы, такие как метилсульфонильная, этилсульфонильная и пропилсульфонильная группы.
C1-3 алкилсульфонильная группа обозначает линейные или разветвленные C1-3 алкилсульфонильные группы, такие как метилсульфонильная, этилсульфонильная и пропилсульфонильная группы.
Арилсульфонильная группа обозначает бензолсульфонильную, п-толуолсульфонильную или нафталинсульфонильную группу.
C1-6 алкилсульфонилоксильная группа обозначает линейные или разветвленные C1-6 алкилсульфонилоксильные группы, такие как метилсульфонилоксильная, этилсульфонилоксильная и пропилсульфонилоксильная группы.
Арилсульфонилоксильная группа обозначает бензолсульфонилоксильную, п-толуолсульфонилоксильную или нафталинсульфонилoоксильную группу.
[0023]
Силильная группа обозначает триметилсилильную, триэтилсилильную или трибутилсилильную группу.
[0024]
Циклическая аминогруппа обозначает циклическую аминогруппу, которая включает один или более атомов азота в качестве гетероатомов, образующих описанное выше кольцо, и которая может дополнительно включать один или более атомов кислорода или атомов серы, такую как, например, азиридинил, азетидинил, пирролидинил, пиперидинил, гомопиперидинил, пирролил, дигидропирролил, пиразолил, пиразолинил, пиразолидинил, имидазолил, имидазолинил, имидазолидинил, тиазолинил, тиазолидинил, дигидротиадиазоил, пиперазинил, гомопиперазинил, морфолинил, гомоморфолинил, тиоморфолинил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидроизохинолинил, бензоморфолинил, дигидропиридоксазинил и хинуклидинил.
[0025]
Циклическая углеводородная группа обозначает C3-8 циклоалкильную группу, C4-8 циклоалкенильную группу или арильную группу.
[0026]
Моноциклическая азотсодержащая гетероциклическая группа обозначает моноциклическую азотсодержащую гетероциклическую группу, которая может быть необязательно замещенной с помощью оксогруппы, и которая включает только атомы азота в качестве гетероатомов, образующих описанное выше кольцо, такую как азетидинильная, пирролидинильная, оксопирролидинильная, пирролинильная, пирролильная, пиперидильная, оксопиперидильная, тетрагидропиридильная, дигидропиридильная, пиридильная, гомопиперидинильная, октагидроазоцинильная, имидазолидинильная, оксоимидазолидинильная, имидазолинильная, дигидрооксоимидазолильная, имидазолильная, пиразолидинильная, пиразолинильная, пиразолильная, пиперазинильная, гомопиперазинильная, пиразинильная, пиридазинильная, пиримидинильная, триазолидинильная, диоксотриазолидинильная, триазолильная и тетразолильная группы.
Моноциклическая кислородсодержащая гетероциклическая группа обозначает оксетанильную, тетрагидрофурильную, оксотетрагидрофурильную, фурильную, тетрагидропиранильную, оксотетрагидропиранильную, дигидропиранильную или пиранильную группу.
Моноциклическая серосодержащая гетероциклическая группа обозначает тетрагидротиенильную, оксотетрагидротиенильную или тиенильную группу.
Моноциклическая азот-кислородсодержащая гетероциклическая группа обозначает моноциклическую азот-кислородсодержащую гетероциклическую группу, которая может быть необязательно замещенной с помощью оксогруппы, и которая только содержит атомы азота и атомы кислорода в качестве гетероатомов, образующих описанное выше кольцо, такую как оксазолильная, изооксазолильная, оксоизооксазолильная, оксадиазолильная и морфолинильная группы.
Моноциклическая азот-серосодержащая гетероциклическая группа обозначает моноциклическую азот-серосодержащую гетероциклическую группу, которая может быть необязательно замещенной с помощью оксогруппы, и которая только содержит атомы азота и атомы серы в качестве гетероатомов, образующих описанное выше кольцо, такую как тиазолильная, изотиазолильная, тиадиазоильная, тиоморфолинильная, 1-оксидотиоморфолинильная и 1,1-диоксидотиоморфолинильная группы.
Моноциклическая гетероциклическая группа обозначает моноциклическую азотсодержащую гетероциклическую группу, моноциклическую кислородсодержащую гетероциклическую группу, моноциклическую серосодержащую гетероциклическую группу, моноциклическую азот-кислородсодержащую гетероциклическую группу или моноциклическую азот-серосодержащую гетероциклическую группу.
[0027]
Бициклическая азотсодержащая гетероциклическая группа обозначает бициклическую азотсодержащую гетероциклическую группу, которая может быть необязательно замещенной с помощью оксогруппы, и которая содержит только атомы азота в качестве гетероатомов, образующих описанное выше кольцо, такую как индолинильная, оксоиндолинильная, индолильная, изоиндолинильная, оксоизоиндолинильная, изоиндолильная, пирролопиридинильная, индазолильная, бензоимидазолильная, бензотриазолильная, тетрагидрохинолинильная, оксотетрагидрохинолинильная, дигидрохинолинильная, оксодигидрохинолинильная, хинолинильная, дигидроизохинолинильная, октагидроизохинолинильная, оксооктагидроизохинолинильная, тетрагидроизохинолинильная, декагидроизохинолинильная, изохинолинильная, дигидрохиназолинильная, циннолинильная, фталазинильная, хиназолинильная, тетрагидрохиноксалинильная, оксотетрагидрохиноксалинильная, гидрохиноксалинильная, хиноксалинильная, нафтиридинильная, пуринильная, птеридинильная и хинуклидинильная группы.
Бициклическая кислородсодержащая гетероциклическая группа обозначает бициклическую кислородсодержащую гетероциклическую группу, которая может быть необязательно замещенной с помощью оксогруппы, и которая только содержит атомы кислорода в качестве гетероатомов, образующих описанное выше кольцо, такую как 2,3-дигидробензофуранильная, оксо-2,3-дигидробензофуранильная, бензофуранильная, изобензофуранильная, хроманильная, оксохроманильная, хроменильная, изохроманильная, оксоизохроманильная, 1,3-бензодиоксолильная, 1,3-бензодиоксанильная и 1,4-бензодиоксанильная группы.
Бициклическая серосодержащая гетероциклическая группа обозначает бициклическую серосодержащую гетероциклическую группу, которая может быть необязательно замещенной с помощью оксогруппы, и которая только содержит атомы серы в качестве гетероатомов, образующих описанное выше кольцо, такую как 2,3-дигидробензотиенильная, оксо-2,3-дигидробензотиенильная и бензотиенильная группы.
Бициклическая азот-кислородсодержащая гетероциклическая группа обозначает бициклическую азот-кислородсодержащую гетероциклическую группу, которая может быть необязательно замещенной с помощью оксогруппы, и которая только содержит атомы азота и атомы кислорода в качестве гетероатомов, образующих описанное выше кольцо, такую как дигидробензоксазолильная, оксодигидробензоксазолильная, бензоксазолильная, бензизоксазолильная, бензоксадиазолильная, бензоморфолинильная, оксобензоморфолинильная, дигидропиранопиридильная, оксодигидропиранопиридильная, дигидродиоксинопиридильная, оксодигидродиоксинопиридильная и дигидропиридоксазинильная группы.
Бициклическая азот-серосодержащая гетероциклическая группа обозначает бициклическую азот-серосодержащую гетероциклическую группу, которая может быть необязательно замещенной с помощью оксогруппы, и которая только содержит атомы азота и атомы серы в качестве гетероатомов, образующих описанное выше кольцо, такую как дигидробензотиазолильная, оксодигидробензотиазолильная, бензотиазолильная, бензоизотиазолильная и бензотиадиазоильная группы.
Бициклическая гетероциклическая группа обозначает бициклическую азотсодержащую гетероциклическую группу, бициклическую кислородсодержащую гетероциклическую группу, бициклическую серосодержащую гетероциклическую группу, бициклическую азот-кислородсодержащую гетероциклическую группу или бициклическую азот-серосодержащую гетероциклическую группу.
[0028]
Гетероциклическая группа обозначает моноциклическую гетероциклическую группу или бициклическую гетероциклическую группу.
[0029]
C3-8 циклоалкан обозначает циклопропан, циклобутан, циклопентан, циклогексан, циклогептан или циклооктан.
C4-8 циклоалкен обозначает C4-8 циклоалкены, такие как циклобутен, циклопентен, циклопентадиен, циклогексен, циклогексадиен и циклогептен. Циклический углеводород обозначает C3-8 циклоалкан, C4-8 циклоалкен, бензол или нафталин.
[0030]
Азотсодержащее гетероциклическое кольцо обозначает азотсодержащее гетероциклическое кольцо, которое может быть необязательно замещенным с помощью оксогруппы, и которое содержит только атомы азота в качестве гетероатомов, образующих описанное выше кольцо, такое как азетидин, пирролидин, оксопирролидин, пирролин, пиррол, пиперидин, оксопиперидин, тетрагидропиридин, дигидропиридин, оксодигидропиридин, пиридин, гомопиперидин, октагидроазоцин, имидазолидин, оксоимидазолидин, имидазолин, дигидрооксоимидазол, имидазол, пиразолидин, диоксопиразолидин, пиразолин, оксопиразолин, пиразол, пиперазин, гомопиперазин, пиразин, пиридазин, пиримидин, триазолидин, диоксотриазолидин, триазол, тетразол, 1H-бензимидазол и хиноксалин.
Кислородсодержащее гетероциклическое кольцо обозначает оксетан, тетрагидрофуран, оксотетрагидрофуран, фуран, тетрагидропиран, оксотетрагидропиран, дигидропиран или пиран.
Серосодержащее гетероциклическое кольцо обозначает тетрагидротиофен, оксотетрагидротиофен или тиофен.
Азот-кислородсодержащее гетероциклическое кольцо обозначает моноциклическое азот-кислородсодержащее гетероциклическое кольцо, которое может быть необязательно замещенным с помощью оксогруппы, и которое содержит только атомы азота и атомы кислорода в качестве гетероатомов, образующих описанное выше кольцо, такое как оксазол, изоксазол, оксоизоксазол, оксадиазол и морфолин.
Азот-серосодержащее гетероциклическое кольцо обозначает моноциклическое азот-серосодержащее гетероциклическое кольцо, которое может быть необязательно замещенным с помощью оксогруппы, и которое содержит только атомы азота и атомы серы в качестве гетероатомов, образующих описанное выше кольцо, такое как тиазол, изотиазол, тиадиазол, тиоморфолин, 1-оксидотиоморфолин и 1,1-диоксидотиоморфолин.
Гетероциклическое кольцо обозначает азотсодержащее гетероциклическое кольцо, кислородсодержащее гетероциклическое кольцо, серосодержащее гетероциклическое кольцо, азот-кислородсодержащее гетероциклическое кольцо азот-серосодержащее гетероциклическое кольцо.
[0031]
Двухвалентная циклическая углеводородная группа, образованная путем удаления каждого одного атома водорода на двух смежных атомах, обозначает группу, которая образована путем удаления двух атомов водорода, присоединенных к двум смежным атомам, из циклического углеводорода, такую как циклопропан-1,2-диил, циклобутан-1,2-диил, циклобутен-1,2-диил, циклопентан-1,2-диил, циклопентен-1,2-диил, циклопентадиен-1,2-диил, циклогексан-1,2-диил, циклогексен-1,2-диил, циклогексадиен-1,2-диил, циклогептан-1,2-диил, циклогептен-1,2-диил, циклооктан-1,2-диил, бензол-1,2-диил, нафталин-1,2-диил и нафталин-2,3-диил.
[0032]
Двухвалентная гетероциклическая группа, образованная путем удаления каждого одного атома водорода на двух смежных атомах, обозначает группу, которая образована путем удаления двух атомов водорода, присоединенных к двум смежным атомам, из гетероциклического кольца, и которая может быть необязательно замещенной с помощью оксогруппы, такую как азетидин-1,2-диил, пирролидин-1,2-диил, оксопирролидин-1,2-диил, оксопирролидин-3,4-диил, пирролин-3,4-диил, пиррол-3,4-диил, пиперидин-2,3-диил, пиперидин-3,4-диил, оксопиперидин-2,3-диил, тетрагидропиридин-1,2-диил, тетрагидропиридин-2,3-диил, тетрагидропиридин-3,4-диил, дигидропиридин-2,3-диил, дигидропиридин-3,4-диил, дигидропиридин-1,2-диил, оксодигидропиридин-1,2-диил, пиридин-2,3-диил, пиридин-3,4-диил, гомопиперидин-2,3-диил, гомопиперидин-3,4-диил, октагидроазоцин-2,3-диил, имидазолидин-1,5-диил, оксоимидазолидин-1,5-диил, 1,2-дигидроимидазол-3,4-диил, 4,5-дигидроимидазол-1,2-диил, дигидрооксоимидазол-1,5-диил, 2H-имидазол-4,5-диил, имидазол-1,2-диил, имидазол-1,5-диил, имидазол-4,5-диил, пиразолидин-1,2-диил, диоксопиразолидин-1,2-диил, пиразолин-1,2-диил, оксопиразолин-1,2-диил, пиразолин-1,5-диил, 1H-пиразол-3,4-диил, 1H-пиразол-4,5-диил, 1H-пиразол-1,5-диил, пиперазин-1,2-диил, пиперазин-2,3-диил, гомопиперазин-1,2-диил, гомопиперазин-2,3-диил, пиразин-2,3-диил, пиридазин-3,4-диил, пиримидин-4,5-диил, 1,2,4-триазолидин-1,2-диил, диоксотриазолидин-1,2-диил, 1,2,3-триазол-1,5-диил, 1,2,4-триазол-1,5-диил, 1,2,4-триазол-3,4-диил, тетразол-1,5-диил, 1H-бензимидазол-1,2-диил, хиноксалин-2,3-диил, оксетан-2,3-диил, тетрагидрофуран-2,3-диил, оксотетрагидрофуран-2,3-диил, фуран-2,3-диил, тетрагидропиран-2,3-диил, оксотетрагидропиран-2,3-диил, дигидропиран-2,3-диил, пиран-2,3-диил, тетрагидротиофен-2,3-диил, оксотетрагидротиофен-2,3-диил, тиофен-3,4-диил, оксазол-4,5-диил, изоксазол-3,4-диил, дигидрооксоизоксазол-3,4-диил, 1,2,3-оксадиазол-4,5-диил, морфолин-2,3-диил, морфолин-3,4-диил, тиазол-4,5-диил, изотиазол-4,5-диил, 1,2,3-тиадиазол-4,5-диил, тиоморфолин-2,3-диил, 1-оксидотиоморфолин-2,3-диил и 1,1-диоксидотиоморфолин-2,3-диил.
[0033]
Уходящая группа обозначает атом галогена, C1-6 алкилсульфонилоксильную группу или арилсульфонилоксильную группу. C1-6 алкилсульфонилоксильная группа и арилсульфонилоксильная группа может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
[0034]
Группа заместителей A: атом галогена, карбамоильная группа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей B, сульфамоильная группа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей B, ацильная группа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей B, C1-6 алкильная группа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей B, C2-6 алкенильная группа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей B, C3-8 циклоалкильная группа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей B, C4-8 циклоалкенильная группа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей B, C1-6 алкоксильная группа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей B, C1-6 алкилсульфонильная группа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей B, арилсульфонильная группа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей B, C1-6 алкиламиногруппа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей B, ди(C1-6 алкил)аминогруппа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей B, арильная группа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей B, гетероциклическая группа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей B, ариламиногруппа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей B, цианогруппа, необязательно защищенная аминогруппа, необязательно защищенная гидроксильная группа, необязательно защищенная карбоксильная группа и оксогруппа.
[0035]
Группа заместителей B: атом галогена, ацильная группа, C1-6 алкильная группа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей C, C3-8 циклоалкильная группа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей C, C1-6 алкоксильная группа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей C, С1-6 алкиламиногруппа, ди(C1-6 алкил)аминогруппа, арильная группа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей C, гетероциклическая группа, необязательно замещенная с помощью одной или более групп, выбранных из группы заместителей C, цианогруппа, необязательно защищенная аминогруппа, необязательно защищенная гидроксильная группа, необязательно защищенная карбоксильная группа и оксогруппа.
[0036]
Группа заместителей C: атом галогена, необязательно защищенная аминогруппа, необязательно защищенная гидроксильная группа и необязательно защищенная карбоксильная группа.
[0037]
Защитная группа для гидроксильной группы включает все группы, которые могут быть использованы в качестве обычно применяемых защитных групп для гидроксильной группы. Примеры такой защитной группы для гидроксильной группы включают группы, описанные в монографии Greene's Protective Groups in Organic Synthesis, 5th edition, pp. 17 - 471, 2014, John Wiley & Sons, INC. Конкретные примеры включают C1-6 алкильную группу, арил C1-6 алкильную группу, C1-6 алкокси C1-6 алкильную группу, ацильную группу, C1-6 алкоксикарбонильную группу, арил C1-6 алкоксикарбонильную группу, C1-6 алкилсульфонильную группу, арилсульфонильную группу, силильную группу, тетрагидрофурильную группу и тетрагидропиранильную группу. Эти группы могут быть необязательно замещенными с помощью одной или более групп, выбранных из группы заместителей A.
[0038]
Защитная группа для карбоксильной группы включает все группы, которые могут быть использованы в качестве обычно применяемых защитных групп для карбоксильной группы. Примеры такой защитной группы для карбоксильной группы включают группы, описанные в монографии Greene's Protective Groups in Organic Synthesis, 5th edition, pp. 17 - 471, 2014, John Wiley & Sons, INC. Конкретные примеры включают C1-6 алкильную группу, арил C1-6 алкильную группу, C1-6 алкокси C1-6 алкильную группу, арил C1-6 алкокси C1-6 алкильную группу и силильную группу. Эти группы могут быть необязательно замещенными с помощью одной или более групп, выбранных из группы заместителей A.
[0039]
Защитная группа для аминогруппы включает все группы, которые могут быть использованы в качестве обычно применяемых защитных групп для аминогруппы. Примеры такой защитной группы для аминогруппы включают группы, описанные в монографии Greene's Protective Groups in Organic Synthesis, 5th edition, pp. 17 - 471, 2014, John Wiley & Sons, INC. Конкретные примеры включают арил C1-6 алкильную группу, C1-6 алкокси C1-6 алкильную группу, ацильную группу, C1-6 алкоксикарбонильную группу, арил C1-6 алкоксикарбонильную группу, арилоксикарбонильную группу, C1-6 алкилсульфонильную группу, арилсульфонильную группу и силильную группу. Эти группы могут быть необязательно замещенными с помощью одной или более групп, выбранных из группы заместителей A.
[0040]
Алифатические углеводороды обозначают пентан, гексан, гептан, циклогексан, метилциклогексан или этилциклогексан.
Галогенированные углеводороды обозначают дихлорметан, хлороформ или дихлорэтан.
Простые эфиры обозначают диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, 2-метилтетрагидрофуран, 1,4-диоксан, анизол, диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля или диэтиловый эфир диэтиленгликоля.
Спирты обозначают метанол, этанол, пропанол, 2-пропанол, бутанол, 2-метил-2-пропанол, этиленгликоль, пропиленгликоль или диэтиленгликоль.
Кетоны обозначают ацетон, 2-бутанон или 4-метил-2-пентанон.
Сложные эфиры обозначают метилацетат, этилацетат, пропилацетат, изопропилацетат или бутилацетат.
Амиды обозначают N,N-диметилформамид, N,N-диметилацетамид или N-метилпирролидон.
Нитрилы обозначают ацетонитрил и пропионитрил.
Сульфоксиды обозначают диметилсульфоксид или сульфолан.
Ароматические углеводороды обозначают бензол, толуол или ксилол.
[0041]
Неорганическое основание обозначает гидроксид натрия, гидроксид калия, гидрокарбонат натрия, карбонат натрия, гидрид натрия, карбонат калия, ортофосфат калия, ацетат калия, фторид цезия или карбонат цезия.
Органическое основание обозначает метоксид натрия, этоксид натрия, трет-бутоксид натрия, трет-бутоксид калия, триэтиламин, N,N-диизопропилэтиламин, 1,8-диазабицикло(5,4,0)ундец-7-ен (DBU), пиридин, N,N-диметил-4-аминопиридин или 4-метилморфолин.
[0042]
Настоящее изобретение относится к противоопухолевому средству и ингибитору бромодомена, включающему соединение, представленное формулой [1], или его соль.
[0043]
В настоящем изобретении, под опухолью подразумевают доброкачественную опухоль, злокачественную опухоль, карциному, рак и другие подобные опухолевые заболевания.
В настоящем изобретении, предпочтительно, чтобы противоопухолевое средство представляло собой антибластомное средство, и под антибластомным средством подразумевают канцеростатическое средство, противораковое средство или другое подобное средство. Противоопухолевое средство по настоящему изобретению обладает способностью уменьшать или уничтожать злокачественную опухоль, или подавлять увеличение злокачественной опухоли для предотвращения и/или лечения карциномы.
Предотвращение означает торможение начала возникновения заболевания, снижение риска возникновения заболевания, замедление возникновения заболевания или другие подобные воздействия.
Терапия означает действие по улучшению заболевания или состояния, на которое она направлена, подавление (предотвращение или замедление) развития или другие подобные воздействия.
Лечение означает предотвращение, терапию или другие подобные действия, проводимые в отношении различных типов заболеваний
Лечебное средство означает вещество, которое применяют при различных типах заболеваний с целью их предотвращения, терапии или других подобных действий.
Мишенью, в отношении которой направлены эти меры, является человек или не принадлежащее к человеческому роду животное, которые нуждаются в лечении.
[0044]
На тип опухоли, в отношении которой применяют противоопухолевое средство по настоящему изобретению, не накладывают специальных ограничений. Конкретные примеры включают рак крови, тимому, миелому, рак печени, рак поджелудочной железы, рак яичников, рак предстательной железы, рак легких, остеосаркому, рак толстой кишки, рак молочной железы, рак кожи и эпителиально-клеточный рак; предпочтительные примеры включают рак крови, тимому, рак матки, рак легких, рак толстой кишки и рак поджелудочной железы; и более предпочтительные примеры включают рак крови и тимому. В настоящем изобретении, рак крови включает лимфому и лейкоз, и предпочтительным примером является острый миелолейкоз.
[0045]
Предполагается, что противоопухолевое средство и ингибитор бромодомена по настоящему изобретению ингибируют связывание бромодомена в белке с ацетилированным гистоном.
Было создано соединение, ингибирующее связывание такого бромодомена с ацетилированным белком, более конкретно, соединение, ингибирующее связывание бромодомена с остатком ацетилированного лизина. В настоящем изобретении, такое соединение называют "ингибитором бромодомена".
В настоящем изобретении, предпочтительно применять соединение, которое ингибирует связывание ацетилированного гистона H3 или ацетилированного гистона H4, который образуется в результате ацетилирования гистона H3 или гистона H4, с бромодомен-содержащим белком. Предпочтительно, чтобы бромодомен-содержащий белок представлял собой белок, принадлежащий семейству BET. В качестве белка семейства BET, хорошо известны не только белок, образующийся у человека, но также белки, образующиеся у мух и в дрожжах, и в других подобных организмах. В настоящем изобретении, желательно применять соединение, которое, как предполагается, ингибирует связывание человеческого белка семейства BET с ацетилированным гистоном. Конкретные примеры человеческого белка семейства BET включают BRD2, BRD3, BRD4 и BRDT. Предпочтительные примеры включают BRD2, BRD3 и BRD4,
[0046]
Кроме того, в настоящем изобретении предлагается фармацевтическая композиция для применения в терапии опухоли, и фармацевтическая композиция для применения в терапии заболевания, ассоциированного с бромодоменом, обе из которых включают описанное выше соединение A или его соль.
Кроме того, в настоящем изобретении предлагаются: применение соединения A или его соли для приготовления описанной выше фармацевтической композиции; способ лечения опухоли, включающий стадию введения терапевтически эффективного количества описанного выше соединения A или его соли млекопитающим, включая человека; и способ лечения заболевания, ассоциированного с бромодоменом, включающий стадию введения терапевтически эффективного количества описанного выше соединения A или его соли млекопитающим, включая человека.
[0047]
Заболевание, ассоциированное с бромодоменом, обозначает все заболевания, которые могут быть предотвращены или подвергнуты лечению путем ингибирования бромодомена.
Примером заболевания, ассоциированного с бромодоменом, является опухоль. Примеры опухоли включают рак крови, тимому, миелому, рак печени, рак поджелудочной железы, рак яичников, рак предстательной железы, рак легких, остеосаркому, рак толстой кишки, рак молочной железы, рак кожи и эпителиально-клеточный рак.
В настоящем изобретении, считается, что ингибитор бромодомена характеризуется эффективностью при терапии заболевания или патологического состояния, в случае которых его применяют. Ингибитор бромодомена предпочтительно применять в случае опухоли.
[0048]
В настоящем изобретении, предпочтительным является следующее соединение:
Формула [1]
[Формула 5]
R1 представляет атом водорода или необязательно замещенную C1-6 алкильную группу.
C1-6 алкильная группа R1 может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Соединение, в котором R1 представляет собой C1-6 алкильную группу, является предпочтительным, соединение, в котором R1 представляет собой C1-3 алкильную группу, является более предпочтительным, и соединение, в котором R1 представляет собой этильную группу, является еще более предпочтительным.
[0049]
R2 представляет атом водорода, атом галогена или необязательно замещенную C1-6 алкильную группу.
C1-6 алкильная группа R2 может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей B.
Соединение, в котором R2 представляет собой атом водорода или необязательно замещенную C1-6 алкильную группу, является предпочтительным, соединение, в котором R2 представляет собой атом водорода или C1-6 алкильную группу, является более предпочтительным, и соединение, в котором R2 представляет собой атом водорода, является еще более предпочтительным.
[0050]
R3 представляет атом галогена, необязательно замещенную C1-6 алкильную группу, необязательно замещенную C2-6 алкенильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную C4-8 циклоалкенильную группу, необязательно замещенную арильную группу, необязательно замещенную C1-6 алкоксильную группу, необязательно замещенную C1-6 алкиламиногруппу, необязательно замещенную ди(C1-6 алкил)аминогруппу или необязательно замещенную гетероциклическую группу.
C1-6 алкильная группа, C2-6 алкенильная группа, C3-8 циклоалкильная группа, C4-8 циклоалкенильная группа, арильная группа, C1-6 алкоксильная группа, C1-6 алкиламиногруппа, ди(C1-6 алкил)аминогруппа и гетероциклическая группа R3 может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Соединение, в котором R3 представляет собой атом галогена, необязательно замещенную C1-6 алкильную группу, необязательно замещенную C2-6 алкенильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную C4-8 циклоалкенильную группу, необязательно замещенную арильную группу, необязательно замещенную ди(C1-6 алкил)аминогруппу или необязательно замещенную гетероциклическую группу, является предпочтительным.
Соединение, в котором R3 представляет собой необязательно замещенную C1-6 алкильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную арильную группу или необязательно замещенную гетероциклическую группу, является более предпочтительным.
Соединение, в котором R3 представляет собой необязательно замещенную C1-6 алкильную группу, необязательно замещенную C3-8 циклоалкильную группу или необязательно замещенную гетероциклическую группу, является даже еще более предпочтительным.
Соединение, в котором R3 представляет собой необязательно замещенную C3-8 циклоалкильную группу или необязательно замещенную гетероциклическую группу, является еще более предпочтительным.
Соединение, в котором R3 представляет собой необязательно замещенную гетероциклическую группу, является особенно предпочтительным.
Соединение, в котором R3 представляет собой любую одну из гетероциклических групп, представленных следующими формулами:
[Формула 6]

где R9 и * определены выше, является наиболее предпочтительным.
R9 представляет атом водорода, защитную группу для аминогруппы или необязательно замещенную C1-6 алкильную группу.
C1-6 алкильная группа R9 может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Соединение, в котором R9 представляет собой защитную группу для аминогруппы или необязательно замещенную C1-6 алкильную группу, является предпочтительным.
Соединение, в котором R9 представляет собой необязательно замещенную C1-6 алкильную группу, является более предпочтительным.
Соединение, в котором R9 представляет собой необязательно замещенную C1-3 алкильную группу, является еще более предпочтительным.
[0051]
Z1, Z2 и Z3, которые являются одинаковыми или различными, каждый представляет атом азота или группу, представленную формулой CR5 (где R5 определен выше).
Соединение, в котором Z1, Z2 и Z3 каждый представляет группу, представленную формулой CR5 (где R5 определен выше), является предпочтительным, и соединение, в котором Z1, Z2 и Z3 каждый представляет CH, является более предпочтительным.
[0052]
R5 представляет атом водорода, атом галогена или необязательно замещенную C1-6 алкильную группу.
C1-6 алкильная группа R5 может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Соединение, в котором R5 представляет собой атом водорода или атом галогена, является предпочтительным, и соединение, в котором R5 представляет собой атом водорода, является более предпочтительным.
[0053]
X1 представляет (1) группу, представленную формулой C(=O)N(R6) (где R6 определен выше), (2) группу, представленную формулой N(R7)C(=O) (где R7 определен выше), (3) необязательно замещенную двухвалентную циклическую углеводородную группу, которая образуется в результате удаления каждого одного атома водорода на двух смежных атомах, или (4) необязательно замещенную двухвалентную гетероциклическую группу, которая образуется в результате удаления каждого одного атома водорода на двух смежных атомах.
Необязательно замещенная двухвалентная циклическая углеводородная группа, которая образуется в результате удаления каждого одного атома водорода на двух смежных атомах, и необязательно замещенная двухвалентная гетероциклическая группа, которая образуется в результате удаления каждого одного атома водорода на двух смежных атомах, которые представлены X1, может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
[0054]
Соединение, в котором X1 представляет (2) группу, представленную формулой N(R7)C(=O) (где R7 определен выше) или (4) необязательно замещенную двухвалентную гетероциклическую группу, которая образуется в результате удаления каждого одного атома водорода на двух смежных атомах, является предпочтительным.
[0055]
R7 представляет атом водорода, защитную группу для аминогруппы или необязательно замещенную C1-6 алкильную группу. Или же, R7 представляет, вместе с одним заместителем R4 кольца A, необязательно замещенную C2-4 алкиленовую группу, группу, представленную формулой O-Y1 (где Y1 и n определены выше), группу, представленную формулой S(O)n-Y2 (где Y2 и n определены выше), или группу, представленную формулой N(R8)-Y3 (где Y3 и R8 определены выше).
C1-6 алкильная группа R7 может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
C2-4 алкиленовая группа, образованная R7 вместе с одним заместителем R4 кольца A, может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Соединение, в котором R7 представляет защитную группу для аминогруппы или необязательно замещенную C1-6 алкильную группу, или представляет, вместе с одним заместителем R4 кольца A, необязательно замещенную C2-3 алкиленовую группу, группу, представленную формулой O-Y1a (где Y1a и n определены выше), группу, представленную формулой S(O)n-Y2a (где Y2a и n определены выше), или группу, представленную формулой N(R8a)-Y3a (где Y3a и R8a определены выше), является предпочтительным.
Соединение, в котором R7 представляет необязательно замещенную C1-3 алкильную группу, или представляет, вместе с одним заместителем R4 кольца A, необязательно замещенную C2-3 алкиленовую группу или группу, представленную формулой N(R8a)-Y3a (где Y3a и R8a определены выше), является более предпочтительным.
Соединение, в котором R7 представляет необязательно замещенную C1-3 алкильную группу, или представляет, вместе с одним заместителем R4 кольца A, необязательно замещенную C2-3 алкиленовую группу, является еще более предпочтительным.
Соединение, в котором R7 представляет C1-6 алкильную группу, необязательно замещенную с помощью одной или более групп, выбранных из группы, состоящей из гидроксильной группы, арильной группы и C1-6 алкоксильной группы, является еще более предпочтительным.
[0056]
Y1 представляет необязательно замещенную C1-3 алкиленовую группу.
C1-3 алкиленовая группа Y1 может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Соединение, в котором Y1 представляет C1-3 алкиленовую группу, является предпочтительным, и соединение, в котором Y1 представляет этиленовую группу, является более предпочтительным.
Y1a представляет необязательно замещенную C1-3 алкиленовую группу.
C1-3 алкиленовая группа Y1a может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Соединение, в котором Y1a представляет C1-3 алкиленовую группу, является предпочтительным, и соединение, в котором Y1a представляет этиленовую группу, является более предпочтительным.
[0057]
Y2 представляет необязательно замещенную C1-3 алкиленовую группу.
C1-3 алкиленовая группа Y2 может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Соединение, в котором Y2 представляет C1-3 алкиленовую группу, является предпочтительным, и соединение, в котором Y2 представляет этиленовую группу, является более предпочтительным.
Y2a представляет необязательно замещенную C1-3 алкиленовую группу.
C1-3 алкиленовая группа Y2a может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Соединение, в котором Y2a представляет C1-3 алкиленовую группу, является предпочтительным, и соединение, в котором Y2a представляет этиленовую группу, является более предпочтительным.
[0058]
Y3 представляет необязательно замещенную C1-3 алкиленовую группу.
C1-3 алкиленовая группа Y3 может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Соединение, в котором Y3 представляет C1-3 алкиленовую группу, является предпочтительным, и соединение, в котором Y3 представляет этиленовую группу, является более предпочтительным.
Y3a представляет необязательно замещенную C1-3 алкиленовую группу.
C1-3 алкиленовая группа Y3a может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Соединение, в котором Y3a представляет C1-3 алкиленовую группу, является предпочтительным, и соединение, в котором Y3a представляет этиленовую группу, является более предпочтительным.
n представляет целое число от 0 до 2,
Соединение, в котором n представляет 0 или 2, является предпочтительным, и соединение, в котором n представляет 0, является более предпочтительным.
[0059]
R8 представляет атом водорода, защитную группу для аминогруппы, необязательно замещенную C1-6 алкильную группу или необязательно замещенную арильную группу.
C1-6 алкильная группа и арильная группа, которые представлены R8, может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Соединение, в котором R8 представляет атом водорода или необязательно замещенную C1-6 алкильную группу, является предпочтительным, и соединение, в котором R8 представляет атом водорода, является более предпочтительным.
R8a представляет атом водорода или необязательно замещенную C1-6 алкильную группу.
C1-6 алкильная группа R8a может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Соединение, в котором R8a представляет атом водорода или C1-3 алкильную группу, является предпочтительным, и соединение, в котором R8a представляет атом водорода, является более предпочтительным.
[0060]
В другом аспекте, соединение, в котором X1 представляет собой группу, представленную формулой N(R7)C(=O) (где R7 определен выше), является предпочтительным.
Соединение, в котором X1 представляет собой группу, представленную формулой N(R7a)C(=O) (где R7a определен выше), является более предпочтительным.
Область предпочтительных значений R7 и R7a является такой же, как и область предпочтительных значений R7 в соединении, представленном формулой [1].
[0061]
В другом аспекте, соединение, в котором X1 представляет необязательно замещенную двухвалентную гетероциклическую группу, которая образуется в результате удаления каждого одного атома водорода на двух смежных атомах, является предпочтительным.
Соединение, в котором X1 представляет необязательно замещенную дигидрооксоимидазол-1,5-диильную группу, необязательно замещенную имидазол-1,2-диильную группу, необязательно замещенную имидазол-4,5-диильную группу, необязательно замещенную 1,2,4-триазол-1,5-диильную группу, необязательно замещенную 1H-пиразол-4,5-диильную группу, необязательно замещенную оксопирролидин-1,2-диильную группу, необязательно замещенную диоксотриазолидин-1,2-диильную группу, необязательно замещенную диоксопиразолидин-1,2-диильную группу, необязательно замещенную оксопиразолин-1,2-диильную группу, необязательно замещенную пиридин-2,3-диильную группу или необязательно замещенную пиразин-2,3-диильную группу, является более предпочтительным.
Соединение, в котором X1 представляет необязательно замещенную дигидрооксоимидазол-1,5-диильную группу, является еще более предпочтительным.
Дигидрооксоимидазол-1,5-диильная группа, имидазол-1,2-диильная группа, имидазол-4,5-диильная группа, 1,2,4-триазол-1,5-диильная группа, 1H-пиразол-4,5-диильная группа, оксопирролидин-1,2-диильная группа, диоксотриазолидин-1,2-диильная группа, диоксопиразолидин-1,2-диильная группа, оксопиразолин-1,2-диильная группа, пиридин-2,3-диильная группа и пиразин-2,3-диильная группа, которые представлены X1, может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
[0062]
В дополнительном аспекте, соединение, в котором X1 представляет группу, представленную формулой C(=O)N(R6) (где R6 определен выше), или необязательно замещенную двухвалентную циклическую углеводородную группу, которая образуется в результате удаления каждого одного атома водорода на двух смежных атомах, является предпочтительным.
[0063]
Кольцо A представляет циклическую углеводородную группу или гетероциклическую группу.
Соединение, в котором кольцо A представляет циклическую углеводородную группу, является предпочтительным, соединение, в котором кольцо A представляет арильную группу, является более предпочтительным, и соединение, в котором кольцо A представляет фенильную группу, является еще более предпочтительным.
[0064]
m число R4, которые являются одинаковыми или различными, каждый представляет атом галогена, цианогруппу, нитрогруппу, защитную группу для аминогруппы, необязательно замещенную C1-6 алкильную группу, необязательно замещенную C2-6 алкенильную группу, необязательно замещенную C2-6 алкинильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную C4-8 циклоалкенильную группу, необязательно замещенную арильную группу, необязательно замещенную C1-6 алкоксильную группу, необязательно замещенную арилоксильную группу, необязательно замещенную C1-6 алкиламиногруппу, необязательно замещенную ди(C1-6 алкил)аминогруппу, необязательно замещенную ариламиногруппу, необязательно замещенную карбамоильную группу, необязательно замещенную сульфамоильную группу, необязательно замещенную C1-6 алкилтиогруппу, необязательно замещенную арилтиогруппу, необязательно замещенную C1-6 алкилсульфонильную группу, необязательно замещенную арилсульфонильную группу, необязательно замещенную гетероциклическую группу, необязательно замещенную аминогруппу, необязательно замещенную гидроксильную группу или необязательно замещенную карбоксильную группу. В изобретении, два смежных R4 могут вместе образовывать необязательно замещенную C2-5 алкиленовую группу. Кроме того, один R4 может образовывать, совместно с R7, необязательно замещенную C2-4 алкиленовую группу, группу, представленную формулой O-Y1 (где Y1 определен выше), группу, представленную формулой S(O)n-Y2 (где Y2 и n определены выше), или группу, представленную формулой N(R8)-Y3 (где Y3 и R8 определены выше).
[0065]
C1-6 алкильная группа, C2-6 алкенильная группа, C2-6 алкинильная группа, C3-8 циклоалкильная группа, C4-8 циклоалкенильная группа, арильная группа, C1-6 алкоксильная группа, арилоксильная группа, C1-6 алкиламиногруппа, ди(C1-6 алкил)аминогруппа, ариламиногруппа, карбамоильная группа, сульфамоильная группа, C1-6 алкилтиогруппа, арилтиогруппа, C1-6 алкилсульфонильная группа, арилсульфонильная группа и гетероциклическая группа, которые представлены R4, может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
C2-5 алкиленовая группа, образованная совместно двумя смежными R4, может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
C2-4 алкиленовая группа, образованная R4 совместно с R7, может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
[0066]
Предпочтительным является соединение, в котором m число R4, которые являются одинаковыми или различными, каждый представляет атом галогена, цианогруппу, защитную группу для аминогруппы, необязательно замещенную C1-6 алкильную группу, необязательно замещенную C2-6 алкенильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную C4-8 циклоалкенильную группу, необязательно замещенную арильную группу, необязательно замещенную C1-6 алкоксильную группу, необязательно замещенную C1-6 алкиламиногруппу, необязательно замещенную ди(C1-6 алкил)аминогруппу, необязательно замещенную ариламиногруппу, необязательно замещенную карбамоильную группу, необязательно замещенную сульфамоильную группу, необязательно замещенную C1-6 алкилсульфонильную группу, необязательно замещенную гетероциклическую группу, необязательно защищенную аминогруппу, необязательно защищенную гидроксильную группу, необязательно защищенную карбоксильную группу,
необязательно замещенную C2-5 алкиленовую группу, образованную совместно двумя смежными R4,
необязательно замещенную C2-3 алкиленовую группу, образованную одним R4 совместно с R7,
группу, представленную формулой O-Y1a (где Y1a определен выше), которая образована одним R4 совместно с R7,
группу, представленную формулой S(O)n-Y2a (где Y2a определен выше), которая образована одним R4 совместно с R7, или
группу, представленную формулой N(R8a)-Y3a (где R8a и Y3a определены выше), которая образована одним R4 совместно с R7,
[0067]
Более предпочтительным является соединение, в котором m число R4, которые являются одинаковыми или различными, каждый представляет атом галогена, цианогруппу, необязательно замещенную C1-6 алкильную группу, необязательно замещенную арильную группу, необязательно замещенную C1-6 алкоксильную группу, необязательно замещенную ди(C1-6 алкил)аминогруппу, необязательно замещенная карбамоильную группу, необязательно замещенную C1-6 алкилсульфонильную группу, необязательно замещенную гетероциклическую группу, необязательно защищенную аминогруппу, необязательно защищенную гидроксильную группу, необязательно защищенную карбоксильную группу,
необязательно замещенную C2-5 алкиленовую группу, образованную совместно двумя смежными R4,
необязательно замещенную C2-3 алкиленовую группу, образованную одним R4 совместно с R7, или
группу, представленную формулой N(R8a)-Y3a (где R8a и Y3a определены выше), которая образована одним R4 совместно с R7,
[0068]
Более предпочтительным является соединение, в котором m число R4, которые являются одинаковыми или различными, каждый представляет атом галогена, цианогруппу, необязательно замещенную C1-3 алкильную группу, необязательно замещенную C1-3 алкоксильную группу, необязательно замещенную карбамоильную группу, необязательно замещенную C1-3 алкилсульфонильную группу, необязательно замещенную гетероциклическую группу, необязательно защищенную аминогруппу, необязательно защищенную карбоксильную группу,
необязательно замещенную C2-5 алкиленовую группу, образованную совместно двумя смежными R4,
необязательно замещенную C2-3 алкиленовую группу, образованную одним R4 совместно с R7, или
группу, представленную формулой N(R8a)-Y3a (где R8a т Y3a определены выше), которая образована одним R4 совместно с R7,
[0069]
m представляет целое число от 0 до 5,
Соединение, в котором m представляет целое число от 0 до 2, является предпочтительным.
[0070]
В другом аспекте, предпочтительно, чтобы соединение представляло собой соединение, представленное следующей формулой [1-1]:
[Формула 7]
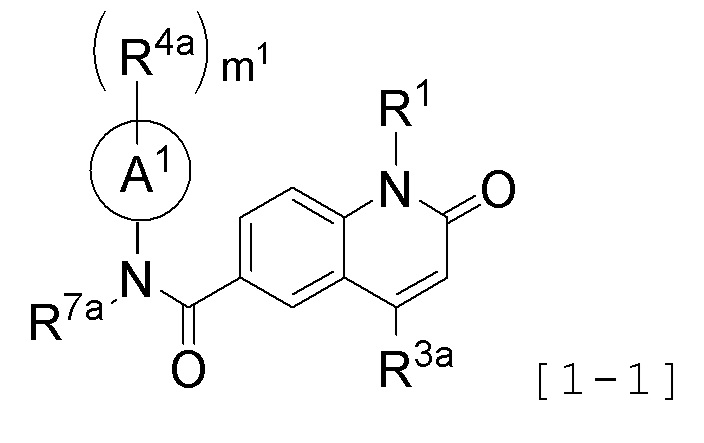
где R1, R3a, R4a, R7a, A1 и m1 определены выше.
[0071]
Предпочтительный диапазон значений R1 является таким же, как диапазон значений R1 в соединении, представленном формулой [1].
[0072]
R3a представляет необязательно замещенную C1-6 алкильную группу, необязательно замещенную C3-8 циклоалкильную группу или необязательно замещенную гетероциклическую группу.
C1-6 алкильная группа, C3-8 циклоалкильная группа и гетероциклическая группа, которые представлены R3a, может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Соединение, в котором R3a представляет необязательно замещенную гетероциклическую группу, является предпочтительным.
Более предпочтительным является соединение, в котором R3a представляет гетероциклическую группу, представленную любой одной из следующих формул:
[Формула 8]

где R9 и * определены выше.
R9 представляет атом водорода, защитную группу для аминогруппы или необязательно замещенную C1-6 алкильную группу.
Предпочтительный диапазон значений R9 является таким же, как диапазон значений R9 в соединении, представленном формулой [1].
[0073]
R7a представляет защитную группу для аминогруппы или необязательно замещенную C1-6 алкильную группу.
C1-6 алкильная группа R7a может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Соединение, в котором R7a представляет необязательно замещенную C1-3 алкильную группу, является предпочтительным.
Более предпочтительным является соединение, в котором R7a представляет C1-6 алкильную группу, необязательно замещенную с помощью одной или более групп, выбранных из гидроксильной группы, арильной группы и C1-6 алкоксильной группы.
[0074]
Кольцо A1 представляет циклическую углеводородную группу.
Соединение, в котором кольцо A1 представляет арильную группу является предпочтительным, и соединение, в котором кольцо A1 представляет фенильную группу, является более предпочтительным.
[0075]
m1 число R4a, которые являются одинаковыми или различными, каждый представляет атом галогена, цианогруппу, необязательно замещенную C1-3 алкильную группу, необязательно замещенную карбамоильную группу, необязательно замещенную C1-3 алкилсульфонильную группу, необязательно защищенную карбоксильную группу,
необязательно замещенную C2-5 алкиленовую группу, образованную совместно двумя смежными R4a,
необязательно замещенную C2-3 алкиленовую группу, образованную одним R4a совместно с R7a,
группу, представленную формулой O-Y1a (где атом кислорода связан с кольцом A1, и Y1a представляет необязательно замещенную C1-3 алкиленовую группу), которая образована одним R4a совместно с R7a,
группу, представленную формулой S(O)n-Y2a (где атом серы связан с кольцом A1, Y2a представляет необязательно замещенную C1-3 алкиленовую группу, и n представляет целое число от 0 до 2), которая образована одним R4a совместно с R7a, или
группу, представленную формулой N(R8a)-Y3a (где атом азота связан с кольцом A1, и R8a и Y3a определены выше), которая образована одним R4a совместно с R7a.
C1-3 алкильная группа, карбамоильная группа и C1-3 алкилсульфонильная группа, которые представлены R4a, может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Предпочтительным является соединение, в котором m1 число R4a, которые являются одинаковыми или различными, каждый представляет атом галогена, цианогруппу, необязательно замещенную C1-3 алкильную группу, необязательно замещенную карбамоильную группу, необязательно замещенную C1-3 алкилсульфонильную группу, необязательно защищенную карбоксильную группу,
необязательно замещенную C2-5 алкиленовую группу, образованную совместно двумя смежными R4a,
необязательно замещенную C2-3 алкиленовую группу, образованную одним R4a совместно с R7a, или
группу, представленную формулой N(R8a)-Y3a (где R8a и Y3a определены выше), которая образована одним R4a совместно с R7a.
Более предпочтительным является соединение, в котором m1 число R4a, которые являются одинаковыми или различными, каждый представляет атом галогена, цианогруппу, необязательно замещенную C1-3 алкильную группу, необязательно замещенную карбамоильную группу, необязательно замещенную C1-3 алкилсульфонильную группу, необязательно защищенную карбоксильную группу,
необязательно замещенную C2-5 алкиленовую группу, образованную совместно двумя смежными R4a, или
необязательно замещенную C2-3 алкиленовую группу, образованную одним R4a совместно с R7a.
[0076]
R8a представляет атом водорода или необязательно замещенную C1-6 алкильную группу.
C1-6 алкильная группа R8a может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Соединение, в котором R8a представляет атом водорода или C1-6 алкильную группу, является предпочтительным, и соединение, в котором R8a представляет атом водорода, является более предпочтительным.
m1 представляет целое число от 0 до 2,
[0077]
Предпочтительный диапазон значений Y1a является таким же, как диапазон значений Y1a в соединении, представленном формулой [1].
Предпочтительный диапазон значений Y2a является таким же, как диапазон значений Y2a в соединении, представленном формулой [1].
Предпочтительный диапазон значений Y3a является таким же, как диапазон значений Y3a в соединении, представленном формулой [1].
Предпочтительный диапазон значений n является таким же, как диапазон значений n в соединении, представленном формулой [1].
[0078]
В другом аспекте, предпочтительно, чтобы соединение представляло собой соединение, представленное следующей формулой [1-2]:
[Формула 9]

где R1, R3b, R4b, X1b, A2 и m2 определены выше.
[0079]
Предпочтительный диапазон значений R1 является таким же, как диапазон значений R1 в соединении, представленном формулой [1].
[0080]
R3b представляет необязательно замещенную C1-6 алкильную группу, необязательно замещенную C3-8 циклоалкильную группу или необязательно замещенную гетероциклическую группу.
C1-6 алкильная группа, C3-8 циклоалкильная группа и гетероциклическая группа, которые представлены R3b, может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Предпочтительный диапазон значений R3b является таким же, как диапазон значений R3a в соединении, представленном формулой [1-1].
[0081]
X1b представляет необязательно замещенную дигидрооксоимидазол-1,5-диильную группу.
Дигидрооксоимидазол-1,5-диильная группа X1b может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Предпочтительным является соединение, в котором X1b представляет необязательно замещенную дигидрооксоимидазол-1,5-диильную группу, представленную следующей формулой:
[Формула 10]
где R10 представляет атом водорода, необязательно замещенную C1-6 алкильную группу, необязательно замещенную арильную группу или необязательно замещенную гетероциклическую группу, R11 представляет атом водорода, атом галогена, необязательно замещенную C1-6 алкильную группу, необязательно замещенную C1-6 алкоксильную группу, необязательно замещенную арильную группу или необязательно замещенную гетероциклическую группу, и * обозначает место присоединения.
C1-6 алкильная группа, арильная группа и гетероциклическая группа, которые представлены R10, может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Более предпочтительным является соединение, в котором R10 представляет атом водорода, необязательно замещенную C1-6 алкильную группу или необязательно замещенную арильную группу; еще более предпочтительным является соединение, в котором R10 представляет атом водорода или необязательно замещенную C1-6 алкильную группу; и еще более предпочтительным является соединение, в котором R10 представляет атом водорода.
C1-6 алкильная группа, C1-6 алкоксильная группа, арильная группа и гетероциклическая группа, которые представлены R11, может быть необязательно замещенной с помощью одной или более групп, выбранных из группы заместителей A.
Соединение, в котором R11 представляет атом водорода или необязательно замещенную C1-6 алкильную группу, является более предпочтительным, и соединение, в котором R11 представляет атом водорода, является еще более предпочтительным.
Соединение, в котором R10 представляет атом водорода, и R11 представляет атом водорода, является особенно предпочтительным.
[0082]
Кольцо A2 представляет циклическую углеводородную группу.
Соединение, в котором кольцо A2 представляет арильную группу, является предпочтительным, и соединение, в котором кольцо A2 представляет фенильную группу, является более предпочтительным.
[0083]
Примеры предпочтительного соединения в настоящем изобретении включают следующие соединения:
[0084]
N-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-N-метилбензамид,
1-этил-4-(1-этилпиперидин-4-ил)-N-метил-2-оксо-N-фенил-1,2-дигидрохинолин-6-карбоксамид,
6-(3,4-дигидрохинолин-1(2H)-илкарбонил)-1-этил-4-(1-метил-пиперидин-4-ил)хинолин-2(1H)-он,
1-этил-N-метил-N-(4-метилфенил)-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид,
N-(2,3-дигидро-1H-инден-5-ил)-1-этил-N-метил-4-(1-метил-пиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид,
6-(5-(4-хлорфенил)-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-он,
6-(5-(4-хлорфенил)-3-метил-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-он,
1-этил-4-(морфолин-4-ил)-6-(2-оксо-5-фенил-3-(пропан-2-ил)-2,3-дигидро-1H-имидазол-1-ил)хинолин-2(1H)-он,
1-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-2-фенил-1,2,4-триазолидин-3,5-дион,
4-хлор-N-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-дигидро-хинолин-6-ил)-N-метилбензамид,
4-(1-ацетилпиперидин-4-ил)-1-этил-N-метил-N-(4-метилфенил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид,
1-этил-N-(3-фтор-4-метилфенил)-N-метил-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид,
N-(3-хлор-4-метилфенил)-1-этил-N-метил-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид, и
N-(3,4-диметилфенил)-1-этил-N-метил-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид.
[0085]
Более предпочтительным является, по меньшей мере, одно соединение, выбранное из следующих соединений, или его соль:
N-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-N-метилбензамид,
1-этил-4-(1-этилпиперидин-4-ил)-N-метил-2-оксо-N-фенил-1,2-дигидрохинолин-6-карбоксамид,
6-(3,4-дигидрохинолин-1(2H)-илкарбонил)-1-этил-4-(1-метил-пиперидин-4-ил)хинолин-2(1H)-он,
1-этил-N-метил-N-(4-метилфенил)-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид,
N-(2,3-дигидро-1H-инден-5-ил)-1-этил-N-метил-4-(1-метил-пиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид,
6-(5-(4-хлорфенил)-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-он,
6-(5-(4-хлорфенил)-3-метил-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-он,
1-этил-4-(морфолин-4-ил)-6-(2-оксо-5-фенил-3-(пропан-2-ил)-2,3-дигидро-1H-имидазол-1-ил)хинолин-2(1H)-он,
1-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-2-фенил-1,2,4-триазолидин-3,5-дион и
4-хлор-N-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-дигидро-хинолин-6-ил)-N-метилбензамид; и
особенно предпочтительным является, по меньшей мере, одно соединение, выбранное из следующих соединений, или его соль:
6-(3,4-дигидрохинолин-1(2H)-илкарбонил)-1-этил-4-(1-метил-пиперидин-4-ил)хинолин-2(1H)-он,
1-этил-N-метил-N-(4-метилфенил)-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид,
N-(2,3-дигидро-1H-инден-5-ил)-1-этил-N-метил-4-(1-метил-пиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид,
6-(5-(4-хлорфенил)-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-он,
6-(5-(4-хлорфенил)-3-метил-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-он и
1-этил-4-(морфолин-4-ил)-6-(2-оксо-5-фенил-3-(пропан-2-ил)-2,3-дигидро-1H-имидазол-1-ил)хинолин-2(1H)-он.
[0086]
Примеры соли соединения, представленного формулой [1], включают, как правило, хорошо известные соли групп с основными свойствами, таких как аминогруппы, и соли групп с кислотными свойствами, таких как гидроксильная или карбоксильная группы.
[0087]
Примеры солей групп с основными свойствами включают: соли с минеральными кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, азотная кислота и серная кислота; соли с органическими карбоновыми кислотами, такими как муравьиная кислота, уксусная кислота, лимонная кислота, щавелевая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, яблочная кислота, винная кислота, аспарагиновая кислота, трихлоруксусная кислота и трифторуксусная кислота; и соли с сульфоновыми кислотами, такими как метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, мезителенсульфоновая кислота и нафталинсульфоновая кислота.
[0088]
Примеры солей групп с кислотными свойствами включают: соли с щелочными металлами, такими как натрия и калий; соли с щелочноземельными металлами, такими как кальций и магний; соли аммония; и соли с азотсодержащими органическими основаниями, такими как триметиламин, триэтиламин, трибутиламин, пиридин, N,N-диметиланилин, N-метилпиперидин, 4-метилморфолин, диэтиламин, дициклогексиламин, прокаин, дибензиламин, N-бензил-β-фенетиламин, 1-эфенамин и N,N'-дибензилэтилендиамин.
[0089]
Среди описанных выше солей, фармакологически приемлемые соли являются предпочтительными.
В случае присутствия изомеров (например, оптических изомеров, геометрических изомеров, таутомеров, и других изомеров) в соединении, представленном формулой [1], настоящее изобретение включает эти изомеры, и также включает сольваты, гидраты и различные формы кристаллов.
[0090]
Далее, будет описан метод получения соединения по настоящему изобретению.
Соединение по настоящему изобретению получают путем объединения известных методов. Настоящее соединение может быть получено, например, следующим методом.
[0091]
[Метод получения 1]
[Формула 11]
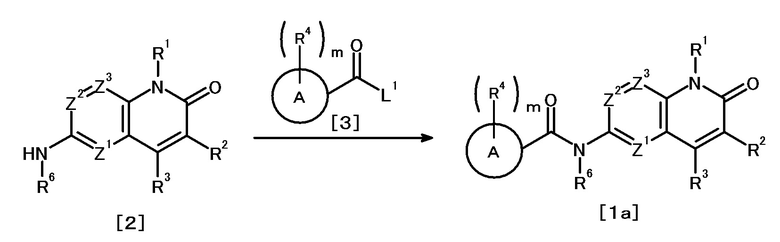
где L1 представляет гидроксильную группу или уходящую группу; и R1, R2, R3, R4, R6, Z1, Z2, Z3, A и m определены выше.
[0092]
(1-1) Случай, когда L1 представляет собой гидроксильную группу
В качестве соединения, представленного формулой [3], подразумевается, например, п-хлорбензойная кислота или другое подобное соединение.
Соединение, представленное формулой [1a], может быть получено путем реакции соединения, представленного формулой [3], с соединением, представленным формулой [2], в присутствии конденсирующего агента или галогенангидрида, и в присутствии основания.
На используемый в этой реакции растворитель не накладывают конкретных ограничений, при условии, что он не оказывает негативного воздействия на протекание реакции. Примеры растворителей включают галогенированные углеводороды, простые эфиры, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители могут использоваться в комбинации.
Предпочтительные растворители включают галогенированные углеводороды, простые эфиры, сложные эфиры и амиды. Среди них, галогенированные углеводороды и амиды являются более предпочтительными.
На количество используемого растворителя не накладывают конкретных ограничений, но растворитель может использоваться в количестве от 1 до 500 раз большем (объем/масса) количества соединения, представленного формулой [2].
Примеры используемого в этой реакции основания включают неорганические основания и органические основания.
Предпочтительными основаниями являются органические основания. Среди органических оснований, триэтиламин, N,N-диизопропилэтиламин и 4-метилморфолин являются более предпочтительными; и N,N-диизопропилэтиламин и 4-метилморфолин являются еще более предпочтительными.
Основание может использоваться в количестве от 1 до 50 раз и, предпочтительно, от 1 до 10 раз, большем молярного количества соединения, представленного формулой [2].
[0093]
Примеры используемого в этой реакции конденсирующего агента включают: карбодиимиды, такие как N,N'-диизопропилкарбодиимид (DIC), N,N'-ди-(трет-бутил)карбодиимид, N,N'-дициклогексилкарбодиимид (DCC), N-(трет-бутил)-N'-этилкарбодиимид (BEC), N-циклогексил-N'-(2-морфолинoэтил)карбодиимид (CMC) и 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC); имидазолы, такие как 1,1'-карбонилдиимидазол (CDI) и 1,1'-карбонилди(1,2,4-триазол) (CDT); азиды кислот, такие как дифенилфосфорилазид; цианиды кислот, такие как диэтилфосфорилцианид; 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин; и уронии, такие как O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU), O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU), O-(бензотриазол-1-ил)-N,N,N',N'-бис(тетраметилен)урония гексафторфосфат (HBPyU), O-(бензотриазол-1-ил)-N,N,N',N'-бис(пентаметилен)урония гексафторфосфат (HBPipU), O-(6-хлорбензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HCTU), O-(3,4-дигидро-4-оксо-1,2,3-бензотриазин-3-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HDBTU), O-(2-оксо-1(2H)пиридил)-N,N,N',N'-тетраметилурония гексафторфосфат (TPTU), O-((этоксикарбонил)цианометиленамино)-N,N,N',N'-тетраметилурония гексафторфосфат (HOTU), O-((этоксикарбонил)цианометиленамино)-N,N,N',N'-тетраметилурония тетрафторборат (TOTU), N,N,N',N'-тетраметил-O-(N-сукцинимидил)урония гексафторфосфат (HSTU), N,N,N',N'-тетраметил-O-(N-сукцинимидил)урония тетрафторборат (TSTU), дипирролидино(N-сукцинимидилoxy)карбениума гексафторфосфат (HSPyU) и S-(1-оксидо-2-пиридил)-N,N,N',N'-тетраметилтиоурония тетрафторборат (TOTT).
Предпочтительными конденсирующими агентами являются карбодиимиды, и среди карбодиимидов, EDC является более предпочтительным.
Конденсирующий агент может использоваться в количестве от 1 до 50 раз и, предпочтительно, от 1 до 5 раз большем молярного количества соединения, представленного формулой [2].
[0094]
При использовании карбодиимидов в качестве конденсирующих агентов, предпочтительно вводить добавку.
Предпочтительные примеры такой добавки включают 1-гидроксибензотриазол (HOBT), 1-гидрокси-7-азабензотриазол (HOAT) (гидроксиимино)цианоацетат. Среди них HOBT и этил- (гидроксиимино)цианоацетат являются предпочтительными.
Добавка может использоваться в количестве от 0,01 до 10 раз и, предпочтительно, от 0,1 до 1 раза, большем молярного количества соединения, представленного формулой [2].
[0095]
Примеры используемого в этой реакции галогенангидрида включают: оксалилхлорид; галогенангидриды карбоновых кислот, такие как ацетилхлорид и трифторацетилхлорид; галогениды сульфоновых кислот, такие как метансульфонилхлорид и тозилхлорид; и сложные эфиры хлоромуравьиной кислоты, такие как этилхлороформиат и изобутилхлороформиат.
На используемое количество соединения, представленного формулой [3], не накладывают конкретных ограничений, но соединение, представленное формулой [3], может использоваться в количестве от 1 до 10 раз большем молярного количества соединения, представленного формулой [2].
Эта реакция может быть проведена при температуре от -30°C до 150°C, предпочтительно, от 0°C до 100°C, в течение времени от 30 минут до 48 часов.
[0096]
(1-2) Случай, когда L1 представляет собой уходящую группу
В качестве соединения, представленного формулой [3], подразумевается, например, п-хлорбензойная кислота или другое подобное соединение.
Соединение, представленное формулой [1a], может быть получено реакцией соединения, представленного формулой [3], с соединением, представленным формулой [2], в присутствии основания.
На используемый в этой реакции растворитель не накладывают конкретных ограничений, при условии, что он не оказывает негативного воздействия на протекание реакции. Примеры растворителей включают галогенированные углеводороды, простые эфиры, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители могут использоваться в комбинации.
Предпочтительные растворители включают галогенированные углеводороды, простые эфиры, и сложные эфиры. Среди них, галогенированные углеводороды являются более предпочтительными.
На количество используемого растворителя не накладывают конкретных ограничений, но растворитель может использоваться в количестве от 1 до 500 раз (объем/масса) большем количества соединения, представленного формулой [2].
[0097]
Примеры используемого в этой реакции основания включают неорганические основания и органические основания.
Предпочтительными основаниями являются органические основания. Среди органических оснований, триэтиламин, N,N-диизопропилэтиламин, 4-метилморфолин и пиридин являются более предпочтительными; и N,N-диизопропилэтиламин, 4-метилморфолин и пиридин являются еще более предпочтительными.
Основание может использоваться в количестве от 1 до 50 раз и, предпочтительно, от 1 до 10 раз большем молярного количества соединения, представленного формулой [2].
На используемое количество соединения, представленного формулой [3], не накладывают конкретных ограничений, но соединение, представленное формулой [3], может использоваться в количестве от 1 до 10 раз большем молярного количества соединения, представленного формулой [2].
Эта реакция может быть проведена при температуре от -30°C до 150°C, предпочтительно, от 0°C до 100°C, в течение времени от 30 минут до 48 часов.
[0098]
[Метод получения 2]
[Формула 12]

где R6A представляет необязательно замещенную C1-6 алкильную группу; L2 представляет уходящую группу; и R1, R2, R3, R4, L1, Z1, Z2, Z3, A и m определены выше.
[0099]
< Первая стадия >
Соединение, представленное формулой [1b], может быть получено реакцией соединения, представленного формулой [3], с соединением, представленным формулой [4].
Эта реакция может быть проведена в соответствии с методом получения 1,
[0100]
< Вторая стадия >
В качестве соединения, представленного формулой [5], подразумевается, например, метилйодид или другое подобное соединение.
Соединение, представленное формулой [1c], может быть получено реакцией соединения, представленного формулой [5], с соединением, представленным формулой [1b], в присутствии основания.
На используемый в этой реакции растворитель не накладывают конкретных ограничений, при условии, что он не оказывает негативного воздействия на протекание реакции. Примеры растворителей включают галогенированные углеводороды, простые эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются простые эфиры и амиды. Среди них, амиды являются более предпочтительными.
На количество используемого растворителя не накладывают конкретных ограничений, но растворитель может использоваться в количестве от 1 до 500 раз (объем/масса) большем количества соединения, представленного формулой [1b].
[0101]
Примеры используемого в этой реакции основания включают: органические основания, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия, пиридин, диметиламинопиридин и триэтиламин; и неорганические основания, такие как гидрид натрия, гидроксид натрия, гидроксид калия, гидрокарбонат натрия, карбонат калия и карбонат натрия. Предпочтительными основаниями являются гидрид натрия и карбонат калия.
На используемое количество основания не накладывают конкретных ограничений, но основание может использоваться в количестве от 1 до 20 раз и, предпочтительно, от 1 до 5 раз, большем молярного количества соединения, представленного формулой [1b].
На используемое количество соединения, представленного формулой [5], не накладывают конкретных ограничений, но соединение, представленное формулой [5], может использоваться в количестве от 1 до 10 раз большем молярного количества соединения, представленного формулой [1b].
Эта реакция может быть проведена при температуре от -30°C до 150°C, предпочтительно, от 0°C до 100°C, в течение времени от 30 минут до 48 часов.
[0102]
[Метод получения 3]
[Формула 13]
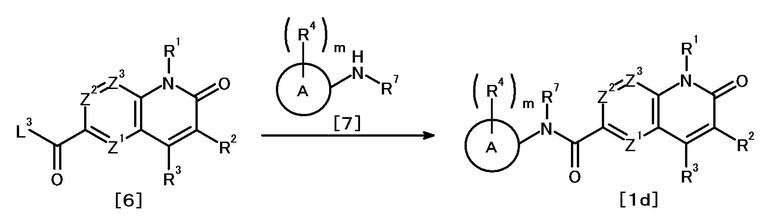
где L3 представляет гидроксильную группу или уходящую группу; и R1, R2, R3, R4, R7, Z1, Z2, Z3, A и m определены выше.
[0103]
В качестве соединения, представленного формулой [7], подразумевается, например, N-метиланилин или другое подобное соединение.
Соединение, представленное формулой [1d], может быть получено реакцией соединения, представленного формулой [7], с соединением, представленным формулой [6].
Эта реакция может быть проведена в соответствии с методом получения 1,
[0104]
[Метод получения 4]
[Формула 14]
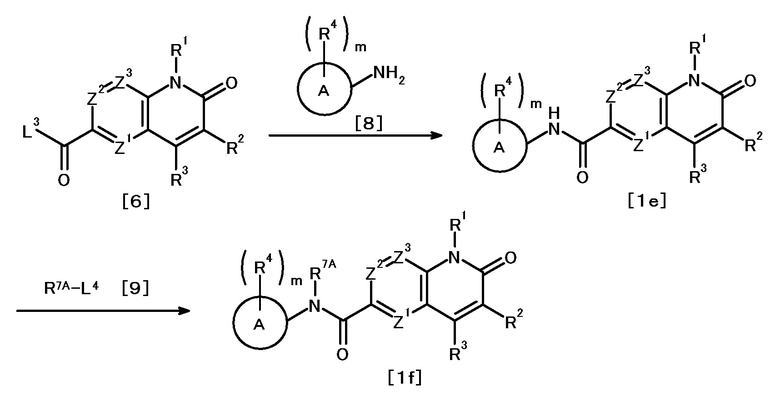
где R7A представляет необязательно замещенную C1-6 алкильную группу; L4 представляет уходящую группу; и R1, R2, R3, R4, L3, Z1, Z2, Z3, A и m определены выше.
[0105]
< Первая стадия >
Соединение, представленное формулой [1e], может быть получено реакцией соединения, представленного формулой [8], с соединением, представленным формулой [6].
Эта реакция может быть проведена в соответствии с методом получения 1,
[0106]
< Вторая стадия >
В качестве соединения, представленного формулой [9], подразумевается, например, метилйодид или другое подобное соединение.
Соединение, представленное формулой [1f], может быть получено реакцией соединения, представленного формулой [9], с соединением, представленным формулой [1e].
Эта реакция может быть проведена в соответствии со < второй стадией > метода получения 2,
[0107]
[Метод получения 5]
[Формула 15]

где Ra представляет атом водорода или необязательно замещенную C1-6 алкильную группу; Rb представляет атом водорода или необязательно замещенную C1-6 алкильную группу; или Ra и Rb вместе представляют необязательно замещенную C1-3 алкиленовую группу; L5 представляет уходящую группу; X1A представляет необязательно замещенную двухвалентную циклическую углеводородную группу, которая образуется в результате удаления каждого одного атома водорода на двух смежных атомах, или необязательно замещенную двухвалентную гетероциклическую группу, которая образуется в результате удаления каждого одного атома водорода на двух смежных атомах; и R1, R2, R3, R4, Z1, Z2, Z3, A и m определены выше.
[0108]
В качестве соединения, представленного формулой [11], предполагается, например, 2-бифенилборная кислота или другое подобное соединение.
Соединение, представленное формулой [1g], может быть получено реакцией соединения, представленного формулой [11], с соединением, представленным формулой [10], в присутствии или отсутствии основания, в присутствии палладиевого катализатора, и в присутствии или отсутствии лиганда.
На используемый в этой реакции растворитель не накладывают конкретных ограничений, при условии, что он не оказывает негативного воздействия на протекание реакции. Примеры растворителей включают воду, спирты, галогенированные углеводороды, простые эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители могут использоваться в комбинации.
Предпочтительные растворители включают смешанные растворители из ароматических углеводородов и воды, и смешанные растворители из простых эфиров и воды.
На количество используемого растворителя не накладывают конкретных ограничений, но растворитель может использоваться в количестве от 1 до 500 раз (объем/масса) большем количества соединения, представленного формулой [10].
[0109]
Примеры палладиевого катализатора, используемого в этой реакции, включают: палладий в форме металла, такой как палладий на угле и палладиевая чернь; неорганические соли палладия, такие как хлорид палладия; органические соли палладия, такие как ацетат палладия; хлор(2-(дициклогексилфосфино)-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил)(2-(2-аминоэтил)фенил)-палладий(II); органические комплексные соединения палладия, такие как тетракис(трифенилфосфин)палладий(0), бис(трифенилфосфин)палладия(II) дихлорид, бис(дитрет-бутил(4-диметиламинофенил)фосфин)дихлорпалладий(II), 1,1'-бис(дифенилфосфино)ферроценпалладия(II) дихлорид, (E)-ди(μ-ацетато)бис(o-(ди-o-толилфосфино)бензил)дипалладий(II) и трис(дибензилиденацетон)дипалладий(0); и нанесенные на полимер органические комплексы палладия, такие как нанесенный на полимер бис(ацетато)трифенилфосфинпалладий(II) и нанесенный на полимер ди(ацетато)дициклогексилфенилфосфинпалладий(II). Среди них, органические комплексы палладия являются предпочтительными.
Палладиевый катализатор может использоваться в количестве от 0,00001 до 1 раза и, предпочтительно, от 0,01 до 0,2 раз меньшим молярного количества соединения, представленного формулой [10].
[0110]
Примеры лиганда, используемого в случае необходимости в этой реакции, включают: триалкилфосфины, такие как триметилфосфин и тритрет-бутилфосфин; трициклоалкилфосфины, такие как трициклогексилфосфин; триарилфосфины, такие как трифенилфосфин и тритолилфосфин; триалкилфосфиты, такие как триметилфосфит, триэтилфосфит и трибутилфосфит; трициклоалкилфосфиты, такие как трициклогексилфосфит; триарилфосфиты такие как трифенилфосфит; соли имидазолия, такие как 1,3-бис(2,4,6-триметилфенил)имидазолия хлорид; дикетоны, такие как ацетилацетон и октафторацетилацетон; амины, такие как триметиламин, триэтиламин, трипропиламин, триизопропиламин и трибутиламин; 1,1'-бис(дифенилфосфино)ферроцен; 2,2'-бис(дифенилфосфино)-1,1'-бинафтил; 2-дициклогексилфосфино-2',6'-диметоксибифенил; 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил; 2-(дитрет-бутилфосфино)-2',4',6'-триизопропилбифенил; 2-дициклогексилфосфино-2'-(N,N-диметиламино)бифенил; 4,5-бис(дифенилфосфино)-9,9-диметилксантен; и 2-(дитрет-бутилфосфино)бифенил.
Лиганд может использоваться в количестве от 0,00001 до 1 раза и, предпочтительно, от 0,02 до 0,5 раза, меньшим молярного количества соединения, представленного формулой [10].
[0111]
Примеры основания, используемого в случае необходимости в этой реакции, включают неорганические основания и органические основания. Среди них, неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия и ортофосфат калия являются предпочтительными.
Основание может использоваться в количестве от 1 до 50 раз и, предпочтительно, от 2 до 10 раз большем молярного количества соединения, представленного формулой [10].
Соединение, представленное формулой [11], может использоваться в количестве от 1 до 50 раз и, предпочтительно, от 1 до 2 раз большем молярного количества соединения, представленного формулой [10].
Эта реакция может проводиться, как правило, в атмосфере инертного газа (например, в атмосфере азота и/или аргона) при температуре от 0°C до 160°C, предпочтительно, от 20°C до 120°C, в течение времени от 1 минуты до 96 часов.
[0112]
[Метод получения 6]
[Формула 16]
где L6 представляет уходящую группу; и R1, R2, R3, R4, Ra, Rb, X1A, Z1, Z2, Z3, A и m определены выше.
[0113]
Соединение, представленное формулой [1h], может быть получено реакцией соединения, представленного формулой [13], с соединением, представленным формулой [12].
Эта реакция может быть проведена в соответствии с методом получения 5,
[0114]
[Метод получения 7]
[Формула 17]

где R3A представляет необязательно замещенную C1-6 алкиламиногруппу, необязательно замещенную ди(C1-6 алкил)аминогруппу или необязательно замещенную циклическую аминогруппу; L7 представляет уходящую группу; и R1, R2, R4, X1, Z1, Z2, Z3, A и m определены выше.
[0115]
В качестве соединения, представленного формулой [15], подразумевается, например, морфолин или другое подобное соединение.
Соединение, представленное формулой [1i], может быть получено реакцией соединения, представленного формулой [15], с соединением, представленным формулой [14], в присутствии или отсутствии основания.
На используемый в этой реакции растворитель не накладывают конкретных ограничений, при условии, что он не оказывает негативного воздействия на протекание реакции. Примеры растворителей включают галогенированные углеводороды, простые эфиры, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители могут использоваться в комбинации.
Предпочтительные растворители включают галогенированные углеводороды, простые эфиры, сложные эфиры и амиды. Среди них, амиды являются более предпочтительными.
На количество используемого растворителя не накладывают конкретных ограничений, но растворитель может использоваться в количестве от 1 до 500 раз (объем/масса) большем количества соединения, представленного формулой [14].
Примеры используемого в этой реакции основания включают неорганические основания и органические основания.
Предпочтительными основаниями являются органические основания. Среди органических оснований, триэтиламин, N,N-диизопропилэтиламин и 4-метилморфолин являются более предпочтительными; и N,N-диизопропилэтиламин и 4-метилморфолин являются еще более предпочтительными.
Основание может использоваться в количестве от 1 до 50 раз и, предпочтительно, от 1 до 10 раз большем молярного количества соединения, представленного формулой [14].
На используемое количество соединения, представленного формулой [15], не накладывают конкретных ограничений, но соединение, представленное формулой [15], может использоваться в количестве от 1 до 10 раз большем молярного количества соединения, представленного формулой [14].
Эта реакция может быть проведена при температуре от -30°C до 150°C, предпочтительно, от 0°C до 150°C, в течение времени от 30 минут до 48 часов.
[0116]
Далее, будут описаны методы получения исходных материалов, используемых для получения соединения по настоящему изобретению.
[0117]
[Метод получения A]
[Формула 18]

где R3B представляет необязательно замещенную C1-6 алкильную группу, необязательно замещенную C3-8 циклоалкильную группу, необязательно замещенную арильную группу или необязательно замещенную гетероциклическую группу; Rc представляет атом водорода или необязательно замещенную C1-6 алкильную группу; Rd представляет атом водорода или необязательно замещенную C1-6 алкильную группу; или Rc и Rd вместе представляют необязательно замещенную C1-3 алкиленовую группу; L8 представляет уходящую группу; L9 представляет уходящую группу; и R1, R2, Z1, Z2и Z3 определены выше.
[0118]
< Первая стадия >
В качестве соединения, представленного формулой [S1], подразумевается, например, 4-хлор-6-нитрохинолин-2(1H)-он или другое подобное соединение.
В качестве соединения, представленного формулой [S2], подразумевается, например, этилйодид или другое подобное соединение.
Соединение, представленное формулой [S3], может быть получено реакцией соединения, представленного формулой [S2], с соединением, представленным формулой [S1], в присутствии основания.
На используемый в этой реакции растворитель не накладывают конкретных ограничений, при условии, что он не оказывает негативного воздействия на протекание реакции. Примеры растворителей включают галогенированные углеводороды, простые эфиры, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются амиды и сульфоксиды. Среди них, амиды являются более предпочтительными.
На количество используемого растворителя не накладывают конкретных ограничений, но растворитель может использоваться в количестве от 1 до 500 раз (объем/масса) большем количества соединения, представленного формулой [S1].
Примеры используемого в этой реакции основания включают неорганические основания и органические основания.
Предпочтительными основаниями являются неорганическое основание. Среди неорганических оснований, карбонат цезия является более предпочтительным.
Основание может использоваться в количестве от 1 до 50 раз и, предпочтительно, от 1 до 10 раз большем молярного количества соединения, представленного формулой [S1].
На используемое количество соединения, представленного формулой [S2], не накладывают конкретных ограничений, но соединение, представленное формулой [S2], может использоваться в количестве от 1 до 10 раз большем молярного количества соединения, представленного формулой [S1].
Эта реакция может быть проведена при температуре от -30°C до 150°C, предпочтительно, от 0°C до 100°C, в течение времени, от 30 минут до 48 часов.
[0119]
< Вторая стадия >
В качестве соединения, представленного формулой [S4], подразумевается, например, циклопропилборная кислота или другое подобное соединение.
Соединение, представленное формулой [S5], может быть получено реакцией соединения, представленного формулой [S4], с соединением, представленным формулой [S3], в присутствии основания, в присутствии палладиевого катализатора и в присутствии или отсутствии лиганда.
Эта реакция может быть проведена в соответствии с методом получения 5,
[0120]
< Третья стадия >
Соединение, представленное формулой [4], может быть получено путем проведения реакции восстановления соединения, представленного формулой [S5]. Эта реакция может быть проведена в соответствии с методом, описанным в монографии Richard C. Larock et al., Comprehensive Organic Transformations, 2nd edition, pp. 823 - 827, 1999, John Wiley & Sons, INC., или эквивалентным ему методом. Конкретно, применяют реакцию каталитического гидрирования с использованием металлического катализатора, реакцию восстановления с использованием металла, такого как железа или цинк, и другого подобного металла.
[0121]
При проведении реакции каталитического гидрирования соединения, представленного формулой [S5], на используемый растворитель не накладывают конкретных ограничений, при условии, что он не оказывает негативного воздействия на протекание реакции. Примеры используемого в данном случае растворителя включают воду, спирты, амиды, галогенированные углеводороды, ароматические углеводороды, простые эфиры, ацетонитрил, кетоны, сложные эфиры, уксусную кислоту и пиридин. Эти растворители могут использоваться в комбинации.
Примеры металлического катализатора, используемого в этой реакции, включают: палладий в форме металла, такой как палладий на угле и палладиевая чернь; соединения палладия, такие как оксид палладия и гидроксид палладий; никель в форме металла, такой как никель Ренея; и соединения платины, такие как оксид платины.
Металлический катализатор может использоваться в количестве от 0,001 до 5 раз (по массе) и, предпочтительно от 0,01 до 1 раза (по массе) относительно количества соединения, представленного формулой [S5].
Примеры источника водорода включают: водород; муравьиную кислоту; формиаты, такие как формиат натрия, формиат аммония и формиат триэтиламминия; циклогексен; и циклогексадиен.
Источник водорода может использоваться в количестве от 2 до 100 раз и, предпочтительно, от 2 до 10 раз большем молярного количества соединения, представленного формулой [S5].
Эта реакция может быть проведена при температуре от 0°C до 200°C, предпочтительно, от 0°C до 100°C, в течение времени от 1 минуты до 24 часов.
[0122]
При проведении реакции восстановления соединения, представленного формулой [S5], с использованием металла, на используемый растворитель не накладывают конкретных ограничений, при условии, что он не оказывает негативного воздействия на протекание реакции. Примеры используемого в данном случае растворителя включают воду, спирты, амиды, галогенированные углеводороды, ароматические углеводороды, простые эфиры, ацетонитрил, кетоны и сложные эфиры. Эти растворители могут использоваться в комбинации.
Примеры металла, используемого в этой реакции, включают железо, цинк, олово и хлорид олова(II).
Металл используют в количестве от 1 до 50 раз и, предпочтительно, от 1 до 10 раз большем молярного количества соединения, представленного формулой [S5].
Примеры кислоты, используемые в случае необходимости в этой реакции, включают хлористый водород, бромистый водород, уксусную кислоту и хлорид аммония.
Кислота может использоваться в количестве от 0,001 до 100 раз (объем/масса) и, предпочтительно, от 0,01 до 20 раз большем (объем/масса) количества соединения, представленного формулой [S5].
Эта реакция может быть проведена при температуре от 0°C до 200°C, предпочтительно, от 0°C до 100°C, в течение времени от 1 минуты до 24 часов.
[0123]
[Метод получения B]
[Формула 19]
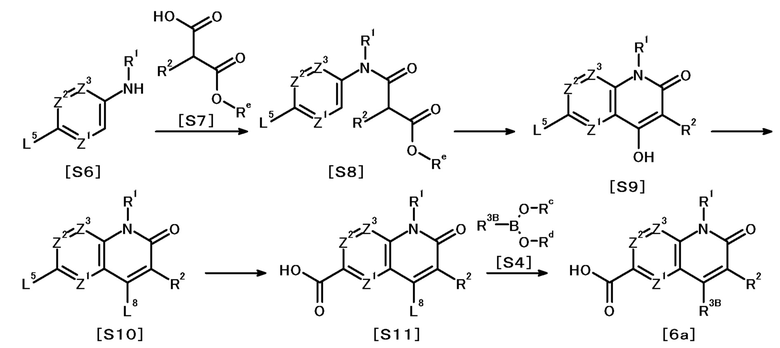
где Re представляет защитную группу для карбоксильной группы; и R1, R2, R3B, Rc, Rd, L5, L8, Z1, Z2 и Z3 определены выше.
[0124]
< Первая стадия >
В качестве соединения, представленного формулой [S6], предполагается, например, N-этил-4-йоданилин или другое подобное соединение.
В качестве соединения, представленного формулой [S7], предполагается, например, 3-трет-бутокси-3-оксопропионовая кислота или другое подобное соединение.
Соединение, представленное формулой [S8], может быть получено реакцией соединения, представленного формулой [S7], с соединением, представленным формулой [S6], в присутствии конденсирующего агента или галогенангидрида, и в присутствии основания.
Эта реакция может быть проведена в соответствии с методом получения 1,
[0125]
< Вторая стадия >
Соединение, представленное формулой [S9], может быть получено в результате взаимодействия дегидратирующего реагента с соединением, представленным формулой [S8].
На используемый в этой реакции растворитель не накладывают конкретных ограничений, при условии, что он не оказывает негативного воздействия на протекание реакции. Примеры растворителей включают галогенированные углеводороды, простые эфиры, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются амиды и сульфоксиды. Среди них, амиды являются более предпочтительными.
На количество используемого растворителя не накладывают конкретных ограничений, но растворитель может использоваться в количестве от 1 до 500 раз (объем/масса) большем количества соединения, представленного формулой [S8].
Примеры используемого в этой реакции дегидратирующего реагента включают пентоксид фосфора, пентахлорид фосфора, фосфорилхлорид и тионилхлорид.
Дегидратирующий реагент может использоваться в количестве от 1 до 50 раз и, предпочтительно, от 1 до 10 раз большем молярного количества соединения, представленного формулой [S8].
Эта реакция может быть проведена при температуре от -30°C до 150°C, предпочтительно, от 0°C до 100°C, в течение времени от 30 минут до 48 часов.
[0126]
< Третья стадия >
Когда L8 представляет собой, например, атом галогена, соединение, представленное формулой [S10], может быть получено реакцией галогенирующего реагента с соединением, представленным формулой [S9].
На используемый в этой реакции растворитель не накладывают конкретных ограничений, при условии, что он не оказывает негативного воздействия на протекание реакции. Примеры растворителей включают алифатические углеводороды, галогенированные углеводороды, простые эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются ароматические углеводороды.
На количество используемого растворителя не накладывают конкретных ограничений, но растворитель может использоваться в количестве от 1 до 500 раз (объем/масса) большем количества соединения, представленного формулой [S9].
Примеры используемого в этой реакции галогенирующего реагента включают оксихлорид фосфора, фосфорилхлорид и тионилхлорид.
Галогенирующий реагент может использоваться в количестве от 1 до 50 раз и, предпочтительно, от 1 до 10 раз большем молярного количества соединения, представленного формулой [S9]. Кроме того, такой галогенирующий реагент может также использоваться в качестве растворителя.
Эта реакция может быть проведена при температуре от -30°C до 150°C, предпочтительно, от 0°C до 100°C, в течение времени от 30 минут до 48 часов.
[0127]
< Четвертая стадия >
Соединение, представленное формулой [S11], может быть получено реакцией формиата натрия с соединением, представленным формулой [S10], в присутствии основания и в присутствии палладиевого катализатора.
На используемый в этой реакции растворитель не накладывают конкретных ограничений, при условии, что он не оказывает негативного воздействия на протекание реакции. Примеры растворителей включают галогенированные углеводороды, простые эфиры, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются амиды и сульфоксиды. Среди них, амиды являются более предпочтительными.
На количество используемого растворителя не накладывают конкретных ограничений, но растворитель может использоваться в количестве от 1 до 500 раз (объем/масса) большем количества соединения, представленного формулой [S10].
Основание, используемое в этой реакции, может представлять собой, например, органическое основание.
Основание может использоваться в количестве от 1 до 50 раз и, предпочтительно, от 1 до 10 раз, большем молярного количества соединения, представленного формулой [S10].
Примеры палладиевого катализатора, используемого в этой реакции, включают: палладий в форме металла, такой как палладий на угле и палладиевая чернь; неорганические соли палладия, такие как хлорид палладия; органические соли палладия, такие как ацетат палладия; хлор(2-(дициклогексилфосфино)-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил)(2-(2-аминоэтил)фенил)-палладий(II); органические комплексные соединения палладия, такие как тетракис(трифенилфосфин)палладий(0), бис(трифенилфосфин)палладия(II) дихлорид, бис(дитрет-бутил(4-диметиламинофенил)фосфин)дихлорпалладий(II), 1,1'-бис(дифенил-фосфино)ферроценпалладия(II) дихлорид, (E)-ди(μ-ацетато)бис(o-(ди-o-толилфосфино)бензил)дипалладий(II), и трис(дибензилиден-ацетон)дипалладий(0); и нанесенные на полимер органические комплексные соединения палладия, такие как нанесенный на полимер бис(ацето)трифенилфосфинпалладий(II) и нанесенный на полимер ди(ацето)дициклогексилфенилфосфинпалладий(II). Среди них, органические комплексные соединения палладия являются предпочтительными.
Палладиевый катализатор может использоваться в количестве от 0,00001 до 1 раза и, предпочтительно, от 0,01 до 0,2 раза, меньшем молярного количества соединения, представленного формулой [S10].
Формиат натрия может использоваться в количестве от 1 до 50 раз и, предпочтительно, от 1 до 10 раз, большем молярного количества соединения, представленного формулой [S10].
Эта реакция может быть проведена при температуре от -30°C до 150°C, предпочтительно, от 0°C до 100°C, в течение времени от 30 минут до 48 часов.
[0128]
< Пятая стадия >
В качестве соединения, представленного формулой [S4], предполагается, например, трет-бутил 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,6-дигидропиридин-1(2H)-карбоксилат или другое подобное соединение.
Соединение, представленное формулой [6a], может быть получено реакцией соединения, представленного формулой [S4], с соединением, представленным формулой [S11], в присутствии основания, в присутствии палладиевого катализатора и в присутствии или отсутствии лиганда.
Эта реакция может быть проведена в соответствии с методом получения 5,
[0129]
Что касается соединений, используемых в описанных выше методах получения, то в случае присутствия сольватов, гидратов и различных форм кристаллов, могут также использоваться эти сольваты, гидраты и различные формы кристаллов.
Что касается соединений, используемых в описанных выше методах получения, которые имеют, например, аминогруппы, гидроксильные группы или карбоксильные группы, то эти группы могут быть заранее защищены с помощью общеизвестных защитных групп, и после завершения реакции, эти защитные группы могут быть удалены известными методами.
Соединения, полученные описанными выше методами получения, могут быть превращены в другие соединения путем проведения известной реакции, такой как конденсация, присоединение, окисление, восстановление, перегруппировка, замещение, галогенирование, дегидратация или гидролиз, или, в соответствующих случаях, путем объединения этих реакций с еще одной реакцией.
[0130]
Когда соединение, представленное формулой [1], применяют в качестве лекарственного препарата, вспомогательные вещества, которые обычно используют в лекарственных формах, такие как наполнители, носители и разбавители, в соответствующих случаях, могут быть смешаны с соединением. Они могут быть перорально или парентерально введены обычным способом в форме таблетки, капсулы, порошка, сиропа, гранулы, пилюли, суспензии, эмульсии, жидкости, порошкообразного препарата, суппозитория, глазных капель, назальных капель, ушных капель, пластыря, мази или инъекции. Кроме того, способ введения, применяемая доза и число введений могут быть выбраны, в соответствующих случаях, исходя из возраста, массы тела и симптомов пациента. Как правило, лекарственный препарат может быть введен взрослому пациенту перорально или парентерально (например, инъекцией, капельно внутривенно, введением непосредственно в соответствующее место кишки, и так далее) в суточной дозе от 0,01 до 1000 мг/кг одноразово или разделенным на несколько введений.
[0131]
Фармацевтическая композиция обозначает композицию, включающую вспомогательные вещества, используемые, в соответствующих случаях, при приготовлении лекарственной формы, такие как наполнители, носители и разбавители, а также соединение по настоящему изобретению или его соль, служащие в качестве активного ингредиента.
[0132]
Далее, настоящее изобретение будет описано с помощью следующих сравнительных примеров, примеров и примеров испытаний. Однако предполагается, что эти примеры не ограничивают объем настоящего изобретения.
[0133]
Если не указано иначе, то при проведении очистки использовали колоночную хроматографию, автоматизированное устройство для очистки ISOLERA (Biotage) или жидкостной хроматограф среднего давления YFLC-Wprep2XY.N (YAMAZEN CORPORATION).
Если не указано иначе, то для колоночной хроматографии на силикагеле использовали картридж SNAP KP-Sil Cartridge (Biotage) или колонку HI-FLASH COLUMN W001, W002, W003, W004 или W005 (YAMAZEN CORPORATION). Для колоночной хроматографии на основном силикагеле использовали картридж SNAP KP-NH Cartridge (Biotage).
Соотношение компонентов в элюенте обозначает объемное соотношение. Например, фраза "градиентное элюирование гексан: этилацетат=100: 0-50: 50" означает, что элюент 100% гексан/0% этилацетат был в конечном счете превращен в элюент 50% гексан/50% этилацетат.
[0134]
В качестве проточного реактора гидрирования использовали реактор H-Cube (ThalesNano).
В качестве микроволной установки использовали Initiator+ или Initiator Sixty (обе производства фирмы Biotage).
Масс-спектры (MS) регистрировали с помощью системы ACQUITY SQD LC/MS (Waters, метод ионизации: метод ESI (метод электрораспылительной ионизации), M-8000 (Hitachi, Ltd., метод ионизации: метод ESI), LCMS-2010EV (Shimadzu Corporation, метод ионизации: метод ионизации, при котором одновременно происходит ESI и APCI (химическая ионизация при атмосферном давлении)) или JMS-T100LP (DART) (JEOL, метод ионизации: метод DART (прямой анализ в режиме реального времени)).
Спектры ЯМР регистрировали относительно тетраметилсилана в качестве внутреннего эталона, используя масс-спектрометр Bruker AV300 (Bruker) или JNM-AL400 (JEOL). Все значения химического сдвига δ указаны в ppm.
[0135]
Условные сокращения, используемые в спектрах ЯМР, имеют следующие значения.
с: синглет
уш.с: уширенный синглет
д: дуплет
дд: дуплет дуплета
т: триплет
кв: квартет
квинт: квинтет
м: мультиплет
DMSO-D6: дейтерированный диметилсульфоксид
[0136]
Условные сокращения, используемые в сравнительных примерах и примерах, имеют следующие значения.
Bn: бензил
Me: метил
[0137]
Сравнительный пример 1
[Формула 20]

53,8 г карбоната цезия добавляли к суспензии 18,5 г 4-хлор-6-нитрохинолин-2(1H)-она в 150 мл N,N-диметилацетамида при 40°C - 50°C. После охлаждения на льду, к реакционной смеси добавляли 7,91 мл этилйодида, и полученную смесь затем перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли этилацетат и воду, и полученную смесь затем доводили до рН 2,0 с помощью 2 моль/л хлористоводородной кислоты. Твердое вещество собирали фильтрацией и затем промывали водой с получением слегка коричневого твердого вещества. К полученному твердому веществу добавляли этилацетат и диизопропиловый эфир, и твердое вещество собирали фильтрацией и затем промывали его этилацетатом с получением 8,88 г 4-хлор-1-этил-6-нитрохинолин-2(1H)-она в форме слегка коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,39 (3H, т, J=7,3 Гц), 4,39 (2H, кв, J=7,3 Гц), 7,01 (1H, с), 7,51 (1H, д, J=9,9 Гц), 8,48 (1H, дд, J=9,2, 2,6 Гц), 8,94 (1H, д, J=2,6 Гц).
[0138]
Сравнительный пример 2
[Формула 21]

Смесь 5,17 г 4-хлор-1-этил-6-нитрохинолин-2(1H)-она, 4,26 г моногидрата циклопропилборной кислоты, 10,9 г карбоната натрия, 0,44 г бис(дитрет-бутил(4-диметиламинофенил)фосфин)дихлор-палладия(II), 50 мл диметилового эфира этиленгликоля и 5,0 мл воды кипятили с обратным холодильником в атмосфере азота в течение 3 часов. Затем реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду. Органический слой отделяли, затем его последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир, этилацетат и гексан, и твердое вещество собирали фильтрацией и затем промывали его диизопропиловым эфиром с получением 4,81 г 4-циклопропил-1-этил-6-нитрохинолин-2(1H)-она в форме слегка коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,79-0,87 (2H, м), 1,15-1,24 (2H, м), 1,37 (3H, т, J=7,3 Гц), 2,11-2,23 (1H, м), 4,37 (2H, кв, J=7,1 Гц), 6,54 (1H, с), 7,47 (1H, д, J=9,2 Гц), 8,42 (1H, дд, J=9,2, 2,6 Гц), 9,00 (1H, д, J=2,6 Гц).
[0139]
Сравнительный пример 3
[Формула 22]

Смесь 4,8 г 4-циклопропил-1-этил-6-нитрохинолин-2(1H)-она, 0,68 г хлорида аммония, 3,91 г порошка железа, 48 мл этанола и 9,6 мл воды кипятили с обратным холодильником в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, затем добавляли воду и этилацетат, и нерастворимые вещества удаляли фильтрацией. Осадок на фильтре промывали этилацетатом и водой. Фильтрат объединяли с промывочным раствором, и органический слой затем отделяли. Органический слой промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и этилацетат, и твердое вещество собирали фильтрацией с получением 3,92 г 6-амино-4-циклопропил-1-этилхинолин-2(1H)-она в форме светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,71-0,79 (2H, м), 0,99-1,08 (2H, м), 1,33 (3H, т, J=7,3 Гц), 1,96-2,08 (1H, м), 3,74 (2H, уш.с), 4,31 (2H, кв, J=7,1 Гц), 6,42 (1H, с), 6,99 (1H, дд, J=9,2, 2,6 Гц), 7,23 (1H, д, J=9,2 Гц), 7,38 (1H, д, J=2,6 Гц).
[0140]
Сравнительный пример 4
[Формула 23]

Смесь 2,0 г 4-хлор-1-этил-6-нитрохинолин-2(1H)-она, 10 мл N,N-диметилацетамида и 3,46 мл морфолина перемешивали при внешней температуре от 130°C до 140°C в течение 2 часов. Затем реакционную смесь охлаждали до комнатной температуры, и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли воду, и твердое вещество собирали фильтрацией и затем промывали диизопропиловым эфиром с получением 2,29 г 1-этил-4-(морфолин-4-ил)-6-нитрохинолин-2(1H)-она в форме слегка коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,37 (3H, т, J=7,3 Гц), 3,10-3,18 (4H, м), 3,95-4,03 (4H, м), 4,36 (2H, кв, J=7,0 Гц), 6,27 (1H, с), 7,46 (1H, д, J=9,2 Гц), 8,38 (1H, дд, J=9,2, 2,6 Гц), 8,71 (1H, д, J=2,6 Гц).
[0141]
Сравнительный пример 5
[Формула 24]

Смесь 2,27 г 1-этил-4-(морфолин-4-ил)-6-нитрохинолин-2(1H)-она, 0,26 г хлорида аммония, 1,46 г порошка железа, 20 мл этанола и 4,0 мл воды кипятили с обратным холодильником в течение 3 часов 20 минут. Затем к реакционной смеси добавляли 20 мл диоксана и 20 мл этилацетата, и полученную смесь затем кипятили с обратным холодильником в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, и выдерживали в течение ночи. Затем реакционную смесь кипятили с обратным холодильником в течение 1 часа. После чего, к реакционной смеси добавляли 100 мл хлороформа, и полученную смесь кипятили с обратным холодильником в течение 1 часа. К реакционной смеси добавляли 0,26 г хлорида аммония и 0,73 г порошка железа, и полученную смесь кипятили с обратным холодильником в течение 5 часов. Затем реакционную смесь охлаждали до комнатной температуры, и нерастворимые вещества удаляли фильтрацией. Осадок на фильтре промывали хлороформом и водой. Фильтрат объединяли с промывочным раствором, и органический слой затем отделяли. Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир, и твердое вещество затем собирали фильтрацией с получением 1,76 г 6-амино-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-она в форме слегка коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,32 (3H, т, J=7,3 Гц), 3,04-3,12 (4H, м), 3,71 (2H, уш.с), 3,89-3,96 (4H, м), 4,29 (2H, кв, J=7,0 Гц), 6,18 (1H, с), 6,96 (1H, дд, J=8,6, 2,6 Гц), 7,09 (1H, д, J=3,3 Гц), 7,24 (1H, д, J=9,2 Гц).
[0142]
Сравнительный пример 6
[Формула 25]

0,46 г 1,1'-карбонилдиимидазола добавляли к раствору 0,7 г 6-амино-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-она в 14 мл дихлорметана, и полученную смесь затем перемешивали при комнатной температуре в течение 4 часов. Затем к реакционной смеси добавляли 0,54 мл триэтиламина при комнатной температуре. К реакционной смеси после охлаждения на льду добавляли 0,48 г 2-амино-1-фенилэтанона гидрохлорида, и полученную смесь перемешивали при комнатной температуре в течение 3 часов. Затем к реакционной смеси добавляли хлороформ и воду, и полученную смесь доводили до рН 2,0 с помощью 2 моль/л хлористоводородной кислоты. Органический слой отделяли, затем промывали его насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и этилацетат, и твердое вещество собирали фильтрацией с получением 0,86 г 1-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-дигидрохинолин-6-ил)-3-(2-оксо-2-фенилэтил)мочевины в форме слегка коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,34 (3H, т, J=6,9 Гц), 3,10-3,17 (4H, м), 3,89-3,97 (4H, м), 4,32 (2H, кв, J=7,0 Гц), 4,86 (2H, д, J=4,0 Гц), 5,93-6,01 (1H, м), 6,22 (1H, с), 6,98 (1H, с), 7,34 (1H, д, J=9,2 Гц), 7,42-7,56 (3H, м), 7,59-7,68 (1H, м), 7,96-8,03 (3H, м).
[0143]
Сравнительный пример 7
[Формула 26]
6,7 г of гидрокарбоната натрия добавляли к раствору 5 мл N-этиланилина в дихлорметане (50 мл) и метаноле (25 мл) при комнатной температуре, и затем добавляли 13,8 г бензилтриметиламмония дихлорйодата. Полученную смесь перемешивали при комнатной температуре в течение 30 минут, и к реакционной смеси добавляли этилацетат и воду. Органический слой отделяли, затем последовательно промывали его водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении с получением 9,8 г N-этил-4-йоданилина в форме слегка коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,24 (3H, т, J=6,9 Гц), 3,12 (2H, кв, J=7,0 Гц), 3,60 (1H, уш.с), 6,34-6,42 (2H, м), 7,37-7,45 (2H, м).
[0144]
Сравнительный пример 8
[Формула 27]
8,38 г 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида добавляли после охлаждения на льду к смеси 9,8 г N-этил-4-йоданилина, 7,0 г 3-трет-бутокси-3-оксопропионовой кислоты и 50 мл дихлорметана, и полученную смесь затем перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли 6,1 мл триэтиламина и 5,34 г N,N-диметил-4-аминопиридина, и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 1,75 г 3-трет-бутокси-3-оксопропионовой кислоты и 4,2 г 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида, и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду и этилацетат. Органический слой отделяли, затем промывали насыщенным водным раствором гидрокарбоната натрия и 1 моль/л хлористоводородной кислотой два раза, и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и этилацетат, и твердое вещество собирали фильтрацией и затем промывали его диизопропиловым эфиром с получением 8,1 г трет-бутил 3-(этил(4-йодфенил)амино)-3-оксопропаноата в форме белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,12 (3H, т, J=7,3 Гц), 1,42 (9H, с), 3,07 (2H, с), 3,75 (2H, кв, J=7,0 Гц), 6,94-7,01 (2H, м), 7,71-7,79 (2H, м).
[0145]
Сравнительный пример 9
[Формула 28]

8,1 г трет-бутил 3-(этил(4-йодфенил)амино)-3-оксопропаноата добавляли к 40 мл метансульфоновой кислоты при комнатной температуре. К полученной смеси добавляли 5,91 г пентаоксида фосфора, и полученную смесь затем перемешивали при внешней температуре от 50°C до 60°C в течение 30 минут. Затем температуру реакционной смеси понижали, и реакционную смесь перемешивали при внешней температуре от 100°C до 110°C в течение 30 минут. Затем, реакционную смесь охлаждали до комнатной температуры, и к реакционной смеси добавляли ледяную воду. Твердое вещество собирали фильтрацией и затем промывали его водой с получением 6,55 г 1-этил-4-гидрокси-6-йодхинолин-2(1H)-она в форме слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,14 (3H, т, J=7,3 Гц), 4,17 (2H, кв, J=7,0 Гц), 5,86 (1H, с), 7,36 (1H, д, J=9,2 Гц), 7,88 (1H, дд, J=8,6, 2,0 Гц), 8,14 (1H, д, J=2,0 Гц), 11,56 (1H, уш.с).
[0146]
Сравнительный пример 10
[Формула 29]

6,5 г 1-этил-4-гидрокси-6-йодхинолин-2(1H)-она добавляли к 25 мл оксихлорида фосфора при комнатной температуре, и полученную смесь затем перемешивали при внешней температуре от 90°C до 100°C в течение 30 минут. Затем реакционную смесь охлаждали до комнатной температуры, и к реакционной смеси добавляли воду. К полученной смеси добавляли этилацетат, и органический слой отделяли. Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [этилацетат]. К полученному остатку добавляли диизопропиловый эфир, этилацетат и гексан, и твердое вещество затем собирали фильтрацией с получением 4,87 г 4-хлор-1-этил-6-йодхинолин-2(1H)-она в форме слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,19 (3H, т, J=7,3 Гц), 4,25 (2H, кв, J=7,0 Гц), 6,98 (1H, с), 7,52 (1H, д, J=9,2 Гц), 8,01 (1H, дд, J=9,2, 2,0 Гц), 8,19 (1H, д, J=2,0 Гц).
[0147]
Сравнительный пример 11
[Формула 30]

Смесь 1,48 г 4-хлор-1-этил-6-йодхинолин-2(1H)-она, 0,9 г формиата натрия, 0,56 г хлорида лития, 1,51 мл N,N-диизопропилэтиламина, 0,86 мл уксусного ангидрида, 0,12 г трис(дибензилиденацетон)дипалладия(0) и 10 мл N,N-диметил-ацетамида перемешивали в атмосфере азота при внешней температуре 90°C в течение 4 часов. Затем реакционную смесь охлаждали до комнатной температуры, и нерастворимые вещества удаляли фильтрацией. Осадок на фильтре промывали 5 моль/л водным раствором гидроксида натрия и водой. Фильтрат объединяли с промывочным раствором, и полученную смесь затем доводили до рН 2,0 с помощью 6 моль/л хлористоводородной кислоты. Затем к смеси добавляли диизопропиловый эфир и этилацетат. Твердое вещество собирали фильтрацией и промывали его диизопропиловым эфиром с получением 1,06 г 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты в форме слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,23 (3H, т, J=7,3 Гц), 4,31 (2H, кв, J=7,0 Гц), 7,06 (1H, с), 7,80 (1H, д, J=9,2 Гц), 8,22 (1H, дд, J=8,6, 2,0 Гц), 8,51 (1H, д, J=2,0 Гц), 13,27 (1H, уш.с).
[0148]
Сравнительный пример 12
[Формула 31]

Смесь 10,1 г 4-хлор-1-этил-6-нитрохинолин-2(1H)-она, 8,07 г пинаколового эфира изопропенилбороновой кислоты, 17,38 г ортофосфата калия, 0,28 г бис(дитрет-бутил(4-диметиламинофенил)-фосфин)дихлорпалладия(II), 225 мл диоксана и 90 мл воды кипятили с обратным холодильником в атмосфере азота в течение 3 часов 10 минут. Затем к реакционной смеси добавляли 0,28 г бис(дитрет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), и полученную смесь кипятили с обратным холодильником в течение 30 минут. Затем к реакционной смеси добавляли 0,28 г бис(дитрет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), и полученную смесь кипятили с обратным холодильником в течение 1 часа 30 минут. После чего, реакционную смесь охлаждали до комнатной температуры, и затем добавляли этилацетат и воду. Органический слой отделяли, и водный слой экстрагировали этилацетатом два раза. Органический слой объединяли с экстрактом, и полученную смесь промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и этилацетат, и твердое вещество затем собирали фильтрацией с получением 10,19 г 1-этил-6-нитро-4-(проп-1-ен-2-ил)хинолин-2(1H)-она в форме желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,40 (3H, т, J=7,2 Гц), 2,14-2,19 (3H, м), 4,40 (2H, кв, J=7,2 Гц), 5,13-5,18 (1H, м), 5,49-5,53 (1H, м), 6,66 (1H, с), 7,48 (1H, д, J=9,3 Гц), 8,40 (1H, дд, J=9,3, 2,7 Гц), 8,64 (1H, д, J=2,7 Гц).
[0149]
Сравнительный пример 13
[Формула 32]
2,5 г 10% палладия на угле добавляли к раствору 5,0 г 1-этил-6-нитро-4-(проп-1-ен-2-ил)хинолин-2(1H)-она в метаноле (450 мл) и диоксане (50 мл), и полученную смесь затем перемешивали в атмосфере водорода при комнатной температуре в течение 2 часов. Затем нерастворимые вещества удаляли фильтрацией, и растворитель отгоняли при пониженном давлении с получением 3,86 г 6-амино-1-этил-4-(пропан-2-ил)хинолин-2(1H)-она в форме желтой пены.
1H-ЯМР (CDCl3) δ: 1,31 (6H, д, J=6,8 Гц), 1,27-1,38 (3H, м), 3,23-3,35 (1H, м), 4,32 (2H, кв, J=7,2 Гц), 6,63 (1H, с), 6,98 (1H, дд, J=9,0,2,4 Гц), 7,10 (1H, д, J=2,4 Гц), 7,23-7,30 (1H, м).
[0150]
Сравнительный пример 14
[Формула 33]
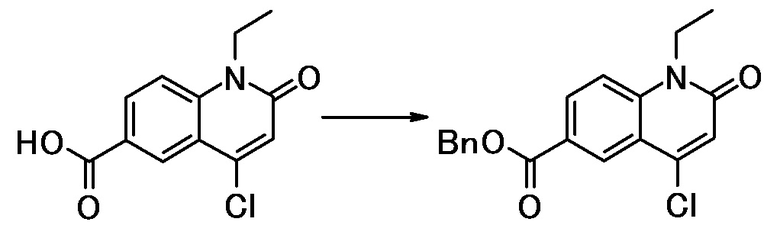
0,83 г карбоната калия и 0,51 мл бензилхлорида добавляли к суспензии 1,01 г 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты в 5 мл N,N-диметилформамида, и полученную смесь затем перемешивали при внешней температуре 80°C в течение 1 часа. Затем реакционную смесь охлаждали до комнатной температуры, добавляли этилацетат и воду, и полученную смесь доводили до рН 2,0 с помощью 6 моль/л хлористоводородной кислоты. Органический слой отделяли, и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, затем последовательно промывали его водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [градиентное элюирование гексан: этилацетат=80: 20-70: 30]. К полученному остатку добавляли диизопропиловый эфир, и твердое вещество затем собирали фильтрацией с получением 1,09 г бензил 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоксилата в форме белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,36 (3H, т, J=7,2 Гц), 4,36 (2H, кв, J=7,2 Гц), 5,43 (2H, с), 6,93 (1H, с), 7,34-7,52 (6H, м), 8,30 (1H, дд, J=9,0, 2,0 Гц), 8,75 (1H, д, J=2,0 Гц).
[0151]
Сравнительный пример 15
[Формула 34]
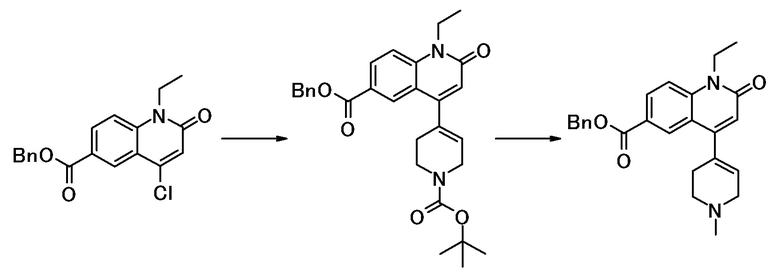
Смесь 1,09 г бензил 4-хлор-1-этил-2-оксо-1,2-дигидро-хинолин-6-карбоксилата, 1,18 г трет-бутил 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,6-дигидропиридин-1(2H)-карбоксилата, 1,36 г ортофосфата калия, 68 мг бис(дитрет-бутил(4-диметил-аминофенил)фосфин)дихлорпалладия(II), 23 мл диоксана и 9 мл воды кипятили с обратным холодильником в атмосфере азота в течение 30 минут. Затем реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду. Органический слой отделяли, и водный слой экстрагировали этилацетатом два раза. Органический слой объединяли с экстрактом, и полученную смесь промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [градиентное элюирование гексан: этилацетат=70: 30-60: 40] с получением бензил 4-(1-(трет-бутоксикарбонил)-1,2,3,6-тетрагидропиридин-4-ил)-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоксилата в форме желтого маслянистого вещества.
К раствору полученного бензил 4-(1-(трет-бутоксикарбонил)-1,2,3,6-тетрагидропиридин-4-ил)-1-этил-2-оксо-1,2-дигидро-хинолин-6-карбоксилата в 4 мл муравьиной кислоты добавляли 2,5 мл 37% водного раствора формальдегида, и полученную смесь затем перемешивали при внешней температуре 80°C в течение 1 часа 30 минут. Затем реакционную смесь и этилацетат добавляли к водному раствору гидрокарбоната натрия. Органический слой отделяли, и водный слой экстрагировали этилацетатом два раза. Органический слой объединяли с экстрактом, и полученную смесь промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [градиентное элюирование хлороформ: метанол=100: 0-70: 30] с получением 1,17 г бензил 1-этил-4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксилата в форме светло-коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,37 (3H, т, J=7,2 Гц), 2,45 (3H, с), 2,42-2,53 (2H, м), 2,71 (2H, т, J=5,6 Гц), 3,13-3,21 (2H, м), 4,37 (2H, кв, J=7,2 Гц), 5,39 (2H, с), 5,80-5,87 (1H, м), 6,58 (1H, с), 7,33-7,50 (6H, м), 8,21 (1H, дд, J=9,0,2,0 Гц), 8,45 (1H, д, J=2,0 Гц).
[0152]
Сравнительный пример 16
[Формула 35]

118 мг 10% палладия на угле добавляли к раствору 118 мг бензил 1-этил-4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксилата в 20 мл метанола, и полученную смесь затем перемешивали в атмосфере водорода при комнатной температуре в течение 3 часов 15 минут. Затем нерастворимые вещества удаляли фильтрацией, и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли этилацетат, и затем фильтрацией собирали твердое вещество с получением 62 мг 1-этил-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты в форме белого твердого вещества.
1H-ЯМР (D2O) δ: 1,12 (3H, т, J=7,3 Гц), 1,70-1,85 (2H, м), 2,01-2,12 (2H, м), 2,81 (3H, с), 3,13-3,23 (2H, м), 3,24-3,34 (1H, м), 3,48-3,57 (2H, м), 4,13 (2H, кв, J=7,3 Гц), 6,41 (1H, с), 7,51 (1H, д, J=9,0 Гц), 7,98 (1H, д, J=9,0 Гц), 8,25 (1H, с).
[0153]
Сравнительный пример 17
[Формула 36]
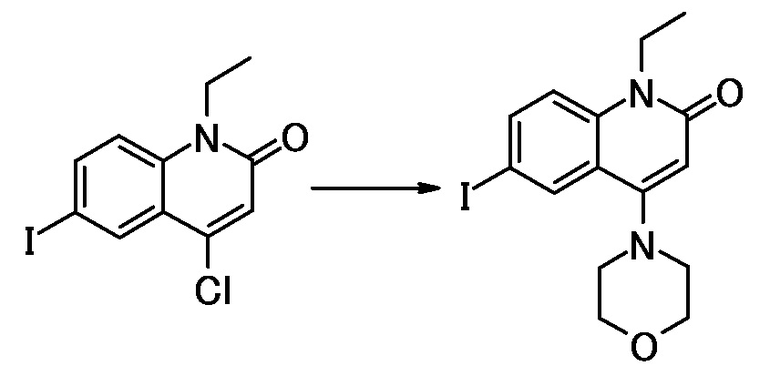
Смесь 0,39 г 4-хлор-1-этил-6-йодхинолин-2(1H)-она, 2,0 мл N,N-диметилацетамида и 0,51 мл морфолина перемешивали в герметизированной пробирке при внешней температуре от 130°C до 140°C в течение 1 часа 30 минут. Затем реакционную смесь охлаждали до комнатной температуры, и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли этилацетат и воду, и полученную смесь доводили до рН 2,0 с помощью 2 моль/л хлористоводородной кислоты. Органический слой отделяли, затем промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и гексан, и твердое вещество затем собирали фильтрацией с получением 0,33 г 1-этил-6-йод-4-(морфолин-4-ил)хинолин-2(1H)-она в форме слегка коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,32 (3H, т, J=7,3 Гц), 3,04-3,13 (4H, м), 3,90-3,99 (4H, м), 4,28 (2H, кв, J=7,3 Гц), 6,18 (1H, с), 7,14 (1H, д, J=9,2 Гц), 7,79 (1H, дд, J=8,9, 2,3 Гц), 8,10 (1H, д, J=8,9 Гц).
[0154]
Сравнительный пример 18
[Формула 37]
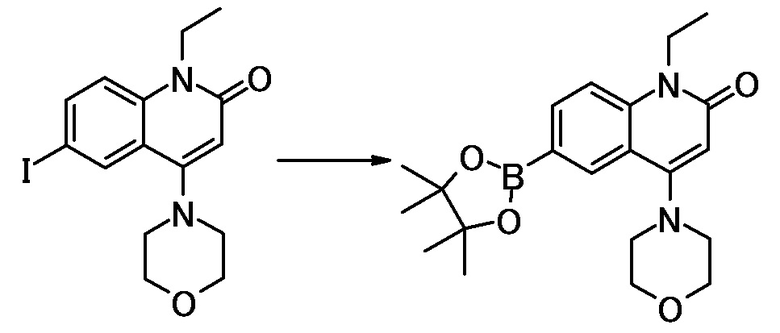
Смесь 0,25 г 1-этил-6-йод-4-(морфолин-4-ил)хинолин-2(1H)-она, 53 мг 1,1'-бис(дифенилфосфино)ферроценпалладия(II) дихлорида, 0,19 г ацетата калия, 0,17 г бис(пинаколато)дибора и 3,0 мл диоксана кипятили с обратным холодильником в атмосфере азота в течение 4 часов. Затем реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду. Органический слой отделяли, затем промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [градиентное элюирование гексан: этилацетат=80: 20-0: 100] с получением 66 мг 1-этил-4-(морфолин-4-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)хинолин-2(1H)-она в форме слегка коричневого маслянистого вещества.
1H-ЯМР (CDCl3) δ: 1,20-1,45 (15H, м), 3,05-3,22 (4H, м), 3,90-4,05 (4H, м), 4,25-4,41 (2H, м), 6,14-6,22 (1H, м), 7,33-7,43 (1H, м), 7,89-8,00 (1H, м), 8,23-8,33 (1H, м).
[0155]
Сравнительный пример 19
[Формула 38]
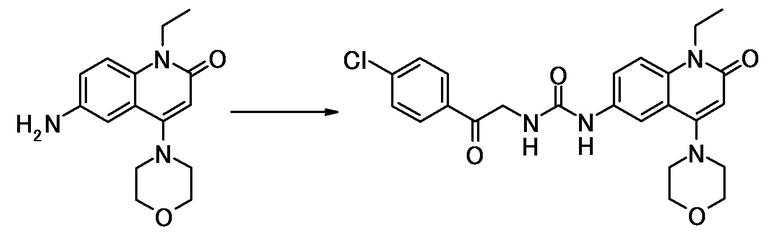
0,65 г 1,1'-карбонилдиимидазола добавляли к раствору 1,0 г 6-амино-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-она в 10 мл дихлорметана, и полученную смесь затем перемешивали при внешней температуре от 40°C до 50°C в течение 2 часов. Затем к реакционной смеси после охлаждения на льду добавляли 0,76 мл триэтиламина и 0,84 г 2-амино-1-(4-хлорфенил)этанона гидрохлорида, и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Затем к реакционной смеси добавляли хлороформ и воду, и полученную смесь доводили до рН 2,0 с помощью 2 моль/л хлористоводородной кислоты. Органический слой отделяли, затем промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [градиентное элюирование хлороформ: метанол=100: 0-90: 10]. К полученному остатку добавляли диизопропиловый эфир и этилацетат, и твердое вещество затем собирали фильтрацией с получением 0,74 г 1-(2-(4-хлорфенил)-2-оксоэтил)-3-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-дигидрохинолин-6-ил)мочевины в форме слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,17 (3H, т, J=7,0 Гц), 3,01-3,08 (4H, м), 3,79-3,86 (4H, м), 4,20 (2H, кв, J=7,1 Гц), 4,70 (2H, д, J=5,1 Гц), 5,99 (1H, с), 6,50 (1H, т, J=5,2 Гц), 7,47 (1H, д, J=9,3 Гц), 7,56 (1H, дд, J=9,1,2,6 Гц), 7,61-7,67 (2H, м), 8,01-8,07 (3H, м), 9,07 (1H, с).
[0156]
Сравнительный пример 20
[Формула 39]

Смесь 11,14 г 4-хлор-1-этил-6-йодхинолин-2(1H)-она, 7,93 г трет-бутил 1-фенилгидразинкарбоксилата, 581 мг тритрет-бутил-фосфония тетрафторбората, 375 мг ацетата палладия, 16,32 г карбоната цезия и 160 мл толуола кипятили с обратным холодильником в атмосфере азота в течение 1 часа 30 минут. Затем реакционную смесь охлаждали до комнатной температуры и добавляли воду. Органический слой отделяли, и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, и полученную смесь промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (градиентное элюирование гексан: этилацетат=80: 20-60: 40) с получением 6,01 г трет-бутил 2-(4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-1-фенилгидразинкарбоксилата в форме желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,33 (3H, т, J=7,2 Гц), 1,43 (9H, с), 4,31 (2H, кв, J=7,1 Гц), 6,58 (1H, с), 6,87 (1H, с), 7,13-7,20 (2H, м), 7,29-7,39 (3H, м), 7,45 (1H, д, J=2,7 Гц), 7,54-7,60 (2H, м).
[0157]
Сравнительный пример 21
[Формула 40]

Смесь 690 мг трет-бутил 2-(4-хлор-1-этил-2-оксо-1,2-дигидро-хинолин-6-ил)-1-фенилгидразинкарбоксилата, 172 мг циклопропил-борной кислоты, 1,06 г ортофосфата калия, 35 мг бис(дитрет-бутил-(4-диметиламинофенил)фосфин)дихлорпалладия(II), 12 мл диоксана и 4,0 мл воды перемешивали с использованием микроволновой установки при 140°C в течение 5 минут. Затем реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду. Органический слой отделяли, и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, и полученную смесь промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (градиентное элюирование гексан: этилацетат=60: 40-40: 60) с получением 527 мг трет-бутил 2-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-1-фенилгидразинкарбоксилата в форме светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,67-0,73 (2H, м), 0,94-1,01 (2H, м), 1,32 (3H, т, J=7,1 Гц), 1,41 (9H, с), 1,90-2,00 (1H, м), 4,31 (2H, кв, J=7,2 Гц), 6,44 (1H, д, J=0,98 Гц), 6,56 (1H, с), 7,08-7,19 (2H, м), 7,25-7,39 (3H, м), 7,52 (1H, д, J=2,4 Гц), 7,57-7,63 (2H, м).
[0158]
Сравнительный пример 22
[Формула 41]

Смесь 200 мг трет-бутил 2-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-1-фенилгидразинкарбоксилата и 2 мл 20% этанольного раствора этоксида натрия перемешивали с использованием микроволновой установки при 140°C в течение 2 минут. Затем реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду. Органический слой отделяли, затем последовательно промывали водой и насыщенным водным раствором хлорида натрия, и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир, и твердое вещество собирали фильтрацией и затем промывали диизопропиловым эфиром с получением 115 мг 4-циклопропил-1-этил-6-(2-фенилгидразинил)хинолин-2(1H)-она в форме светло-желтого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 0,62-0,69 (2H, м), 0,87-0,95 (2H, м), 1,15 (3H, т, J=7,0 Гц), 1,90-2,00 (1H, м), 4,18 (2H, кв, J=7,0 Гц), 6,20 (1H, с), 6,65 (1H, т, J=7,2 Гц), 6,74-6,81 (2H, м), 7,08-7,15 (3H, м), 7,41 (1H, д, J=9,3 Гц), 7,45 (1H, д, J=2,4 Гц), 7,69-7,77 (2H, м).
[0159]
Сравнительный пример 23
[Формула 42]

2,6 мл оксалилхлорида и 10 мкл N,N-диметилформамида добавляли к суспензии 4,0 г 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты в 25 мл тетрагидрофурана при комнатной температуре, и полученную смесь затем перемешивали в течение 3 часов. Затем после охлаждения на льду, реакционную смесь и 100 мл воды добавляли к 28% водному раствору аммиака. Твердое вещество собирали фильтрацией и затем промывали его водой с получением 3,70 г 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоксамида в форме слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,22 (3H, т, J=7,1 Гц), 4,31 (2H, кв, J=7,2 Гц), 7,02 (1H, с), 7,52 (1H, уш.с), 7,76 (1H, д, J=9,0 Гц), 8,22 (1H, дд, J=8,9, 2,1 Гц), 8,25 (1H, уш.с), 8,50 (1H, д, J=2,2 Гц).
[0160]
Сравнительный пример 24
[Формула 43]

Смесь 2,0 г 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоксамида и 10 мл 1,1-диметокси-N,N-диметилэтанамина кипятили с обратным холодильником в течение 4 часов. Затем реакционную смесь охлаждали до комнатной температуры, и к реакционной смеси добавляли диизопропиловый эфир. Твердое вещество собирали фильтрацией и затем промывали диизопропиловым эфиром с получением 2,13 г 4-хлор-N-((1E)-1-(диметиламино)этилиден)-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоксамида в форме слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,22 (3H, т, J=7,1 Гц), 2,31 (3H, с), 3,16 (3H, с), 3,19 (3H, с), 4,30 (2H, кв, J=7,1 Гц), 7,00 (1H, с), 7,72 (1H, д, J=8,8 Гц), 8,33 (1H, дд, J=8,8,2,0 Гц), 8,64 (1H, д, J=2,0 Гц).
[0161]
Сравнительный пример 25
[Формула 44]

1,25 г моногидрата п-толуолсульфоновой кислоты добавляли к раствору 0,50 г 6-амино-4-циклопропил-1-этилхинолин-2(1H)-она в 9 мл ацетонитрила. После охлаждения на льду, к смеси добавляли 0,91 г йодида калия и 0,30 г нитрита натрия в 1,3 мл водного раствора, и полученную смесь перемешивали в течение 10 минут, и затем перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли воду, насыщенный водный раствор карбоната натрия, 1% водный раствор тиосульфата натрия и этилацетат. Органический слой отделяли, и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, и полученную смесь промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [градиентное элюирование гексан: этилацетат=70: 30-40: 60]. К полученному остатку добавляли диизопропиловый эфир, и твердое вещество затем собирали фильтрацией с получением 0,31 г 4-циклопропил-1-этил-6-йодхинолин-2(1H)-она в форме светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,75-0,79 (2H, м), 1,07-1,12 (2H, м), 1,32 (3H, т, J=7,2 Гц), 2,01-2,08 (1H, м), 4,30 (2H, кв, J=7,2 Гц), 6,43 (1H, д, J=1,2 Гц), 7,14 (1H, д, J=8,8 Гц), 7,81 (1H, дд, J=8,8, 2,0 Гц), 8,38 (1H, д, J=2,0 Гц).
[0162]
Сравнительный пример 26
[Формула 45]
4-Хлор-1-этил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)хинолин-2(1H)-он получали из 4-хлор-1-этил-6-йодхинолин-2(1H)-она таким же методом, как метод в сравнительном примере 18.
1H-ЯМР (CDCl3) δ: 1,35(3H, т, J=7,2 Гц), 1,38 (12H, с), 4,36 (2H, кв, J=7,2 Гц), 6,88 (1H, с),7,39 (1H, д, J=8,5 Гц), 8,03 (1H, дд, J=8,5, 1,5 Гц), 8,46 (1H, д, J=1,5 Гц).
[0163]
Сравнительный пример 27
[Формула 46]

Смесь 334 мг 4-хлор-1-этил-6-йодхинолин-2(1H)-она, 112 мг этинилбензола, 2 мг йодида меди(I), 5 мг трифенилфосфина, 2 мг дихлорида палладия, 0,42 мл триэтиламина и 5 мл тетрагидрофурана перемешивали в атмосфере азота при комнатной температуре в течение 2 часов. Затем к реакционной смеси добавляли этилацетат, воду и 1 моль/л хлористоводородной кислоты. Органический слой отделяли, и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, и полученную смесь промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир, и твердое вещество затем собирали фильтрацией с получением 160 мг 4-хлор-1-этил-6-(фенилэтинил)хинолин-2(1H)-она в форме коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,37 (3H, т, J=7,2 Гц), 4,36 (2H, кв, J=7,2 Гц), 6,92 (1H, с), 7,35-7,42 (4H, м), 7,55-7,60 (2H, м), 7,76 (1H, дд, J=8,8, 2,0 Гц), 8,20 (1H, д, J=2,0 Гц).
[0164]
Сравнительный пример 28
[Формула 47]

Смесь 154 мг 4-хлор-1-этил-6-(фенилэтинил)хинолин-2(1H)-она, 52 мг циклопропилборной кислоты, 318 мг ортофосфата калия, 11 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлор-палладия(II), 3 мл диоксана и 1 мл воды перемешивали с использованием микроволновой установки при 140°C в течение 15 минут. Затем, реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат, воду и 2 моль/л хлористоводородной кислоты. Органический слой отделяли, и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, и полученную смесь промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле [градиентное элюирование гексан: этилацетат=80: 20-60: 40]. К полученному остатку добавляли диизопропиловый эфир, и твердое вещество затем собирали фильтрацией, с получением 100 мг 4-циклопропил-1-этил-6-(фенилэтинил)хинолин-2(1H)-она в форме белого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,77-0,83 (2H, м), 1,08-1,16 (2H, м), 1,36 (3H, т, J=7,1 Гц), 2,08-2,19 (1H, м), 4,35 (2H, кв, J=7,2 Гц), 6,45-6,49 (1H, м), 7,34-7,42 (4H, м), 7,55-7,61 (2H, м), 7,71 (1H, дд, J=8,9, 1,8 Гц), 8,27 (1H, д, J=2,0 Гц).
[0165]
Сравнительный пример 29
[Формула 48]

Смесь 31 мг 4-циклопропил-1-этил-6-(фенилэтинил)хинолин-2(1H)-она, 24 мг сульфата магния, 19 мг перманганата калия, 5 мг гидрокарбоната натрия, 3 мл ацетона и 1,7 мл воды перемешивали при комнатной температуре в течение 20 минут. Затем к реакционной смеси добавляли 43 мг перманганата калия, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли 30 мг нитрита натрия и 10% водный раствор серной кислоты, и нерастворимые вещества удаляли фильтрацией. Осадок на фильтре промывали этилацетатом и водой. Фильтрат объединяли с промывочным раствором. Органический слой отделяли, и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, и полученную смесь промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле [градиентное элюирование гексан: этилацетат=60: 40-30: 70], с получением 20 мг 1-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-2-фенилэтан-1,2-диона.
1H-ЯМР (CDCl3) δ: 0,74-0,80 (2H, м), 1,05-1,12 (2H, м), 1,35 (3H, т, J=7,1 Гц), 2,07-2,16 (1H, м), 4,36 (2H, кв, J=7,2 Гц), 6,46-6,49 (1H, м), 7,46 (1H, д, J=9,0 Гц), 7,54 (2H, т, J=7,9 Гц), 7,69 (1H, т, J=7,4 Гц), 8,02 (2H, дд, J=8,3, 1,2 Гц), 8,14 (1H, дд, J=8,9, 2,1 Гц), 8,77 (1H, д, J=2,0 Гц).
[0166]
Сравнительный пример 30
[Формула 49]

Смесь 503 мг 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты, 639 мг 8-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,4-диоксаспиро[4,5]дец-7-ена, 849 мг ортофосфата калия, 42 мг бис(ди-трет-бутил(4-диметиламинофенил)-фосфин)дихлорпалладия(II), 12 мл диоксана и 4 мл воды перемешивали с использованием микроволновой установки при 140°C в течение 5 минут. Затем реакционную смесь охлаждали до комнатной температуры, и к реакционной смеси добавляли этилацетат и воду. Водный слой отделяли и затем промывали этилацетатом два раза. Водный слой доводили до pH 2,0 путем добавления 6 моль/л хлористоводородной кислоты, и затем добавляли тетрагидрофуран. Органический слой отделяли, и водный слой экстрагировали этилацетатом два раза. Органический слой объединяли с экстрактом, и полученную смесь промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. К полученному остатку добавляли этилацетат, и твердое вещество затем собирали фильтрацией с получением 590 мг 4-(1,4-диоксаспиро[4,5]дец-7-ен-8-ил)-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты в форме светло-коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,21 (3H, т, J=7,0 Гц), 1,85 (2H, т, J=6,2 Гц), 2,39-2,56 (4H, м), 3,94-4,00 (4H, м), 4,29 (2H, кв, J=7,1 Гц), 5,71-5,76 (1H, м), 6,41 (1H, с), 7,69 (1H, д, J=9,0 Гц), 8,11 (1H, дд, J=8,9, 2,1 Гц), 8,26 (1H, д, J=2,2 Гц), 13,02 (1H, уш.с).
[0167]
Сравнительный пример 31
[Формула 50]

291 мг 20% гидроксида палладия на угле добавляли к смеси 583 мг 4-(1,4-диоксаспиро[4,5]дец-7-ен-8-ил)-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты, 20 мл диоксана и 100 мл метанола. Полученную смесь перемешивали в атмосфере водорода при комнатной температуре в течение 30 минут. Затем нерастворимые вещества удаляли фильтрацией, и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир, и твердое вещество затем собирали фильтрацией, с получением 502 мг 4-(1,4-диоксаспиро[4,5]дец-8-ил)-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты в форме белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,22 (3H, т, J=7,0 Гц), 1,60-1,93 (8H, м), 3,10-3,25 (1H, м), 3,87-3,96 (4H, м), 4,29 (2H, кв, J=6,9 Гц), 6,46-6,51 (1H, м), 7,66-7,73 (1H, м), 8,13 (1H, дд, J=8,7 Гц, 1,6 Гц), 8,45 (1H, д, J=1,5 Гц), 13,06 (1H, уш.с).
[0168]
Сравнительный пример 32
[Формула 51]

1,0 мл концентрированной хлористоводородной кислоты добавляли к суспензии 250 мг 4-(1,4-диоксаспиро[4,5]дец-8-ил)-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты в 10 мл тетрагидрофурана при комнатной температуре, и полученную смесь затем перемешивали в течение 4 часов. Затем твердое вещество собирали фильтрацией и промывали этилацетатом с получением 182 мг 1-этил-2-оксо-4-(4-оксоциклогексил)-1,2-дигидрохинолин-6-карбоновой кислоты в форме белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,22 (3H, т, J=7,1 Гц), 1,83-2,00 (2H, м), 2,09-2,19 (2H, м), 2,26-2,37 (2H, м), 2,71-2,83 (2H, м), 3,67-3,77 (1H, м), 4,30 (2H, кв, J=7,1 Гц), 6,58-6,62 (1H, м), 7,73 (1H, д, J=9,0 Гц), 8,16 (1H, дд, J=8,9 Гц, 1,8 Гц), 8,57 (1H, д, J=2,0 Гц).
[0169]
Пример 1
[Формула 52]
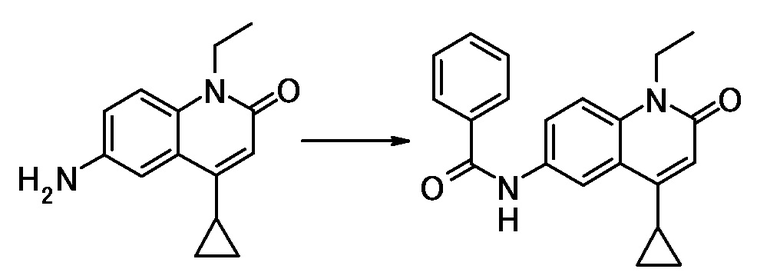
0,73 мл бензоилхлорида добавляли к суспензии 1,2 г 6-амино-4-циклопропил-1-этилхинолин-2(1H)-она в 6 мл пиридина, и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. После этого, к реакционной смеси добавляли этилацетат и воду, и полученную смесь доводили до рН 2,0 с помощью 2 моль/л хлористоводородной кислоты. Органический слой отделяли, затем промывали водой и насыщенным водным раствором хлорида натрия, и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и этилацетат, и твердое вещество затем собирали фильтрацией, с получением 1,75 г N-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)бензамида в форме слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 0,75-0,84 (2H, м), 1,02-1,11 (2H, м), 1,20 (3H, т, J=6,9 Гц), 2,09-2,21 (1H, м), 4,26 (2H, кв, J=7,1 Гц), 6,32 (1H, с), 7,44-7,66 (4H, м), 7,91-8,09 (3H, м), 8,65 (1H, д, J=2,0 Гц), 10,45 (1H, с).
[0170]
Пример 2
[Формула 53]

0,25 г 60% гидрида натрия после охлаждения на льду добавляли к раствору 1,75 г N-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)бензамида в 15 мл N,N-диметилацетамида, и полученную смесь затем перемешивали в течение 10 минут. Затем после охлаждения на льду, к реакционной смеси добавляли 0,43 мл метил йодида, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли этилацетат и воду, полученную смесь затем доводили до рН 2,0 с помощью 6 моль/л хлористоводородной кислоты, и твердое вещество собирали фильтрацией. Органический слой в фильтрате отделяли, затем промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир, этилацетат и воду, и твердое вещество собирали фильтрацией, и затем промывали водой и диизопропиловым эфиром с получением 1,45 г N-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-N-метилбензамида в форме слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 0,48-0,57 (2H, м), 0,86-0,95 (2H, м), 1,13 (3H, т, J=6,9 Гц), 1,93-2,06 (1H, м), 3,44 (3H, с), 4,19 (2H, кв, J=6,8 Гц), 6,24 (1H, с), 7,16-7,33 (5H, м), 7,46-7,58 (2H, м), 7,76-7,81 (1H, м).
[0171]
Пример 3
[Формула 54]

5,0 мл концентрированной хлористоводородной кислоты добавляли к суспензии 0,86 г 1-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-дигидрохинолин-6-ил)-3-(2-оксо-2-фенилэтил)мочевины в 5,0 мл диоксана при комнатной температуре, и полученную смесь затем перемешивали в течение 2 часов. Затем к реакционной смеси добавляли воду, и твердое вещество собирали фильтрацией и затем промывали водой и диизопропиловым эфиром с получением 0,72 г 1-этил-4-(морфолин-4-ил)-6-(2-оксо-5-фенил-2,3-дигидро-1H-имидазол-1-ил)хинолин-2(1H)-она в форме слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,19 (3H, т, J=7,3 Гц), 2,54-2,65 (4H, м), 3,44-3,53 (4H, м), 4,17-4,29 (2H, м), 5,98 (1H, с), 6,87 (1H, д, J=2,6 Гц), 7,05-7,12 (2H, м), 7,14-7,31 (4H, м), 7,59-7,68 (2H, м), 10,57-10,63 (1H, м).
[0172]
Пример 4
[Формула 55]
1,25 мл оксалилхлорида и 10 мкл N,N-диметилформамида добавляли к суспензии 3,0 г 4-хлор-1-этил-2-оксо-1,2-дигидро-хинолин-6-карбоновой кислоты в 30 мл тетрагидрофурана при комнатной температуре, и полученную смесь затем перемешивали в течение 2 часов. Затем после охлаждения на льду, к реакционной смеси добавляли 1,55 мл N-метиланилина и 1,81 мл триэтиламина, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли этилацетат и воду. Органический слой отделяли, затем промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [градиентное элюирование гексан: этилацетат=50: 50-20: 80]. К полученному остатку добавляли диизопропиловый эфир и этилацетат, и твердое вещество затем собирали фильтрацией с получением 2,01 г 4-хлор-1-этил-N-метил-2-оксо-N-фенил-1,2-дигидрохинолин-6-карбоксамида в форме слегка коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,28 (3H, т, J=6,9 Гц), 3,55 (3H, с), 4,26 (2H, кв, J=7,3 Гц), 6,81 (1H, с), 7,07-7,13 (2H, м), 7,15-7,32 (4H, м), 7,65 (1H, дд, J=9,2, 2,0 Гц), 7,94 (1H, д, J=2,0 Гц).
[0173]
Пример 5
[Формула 56]
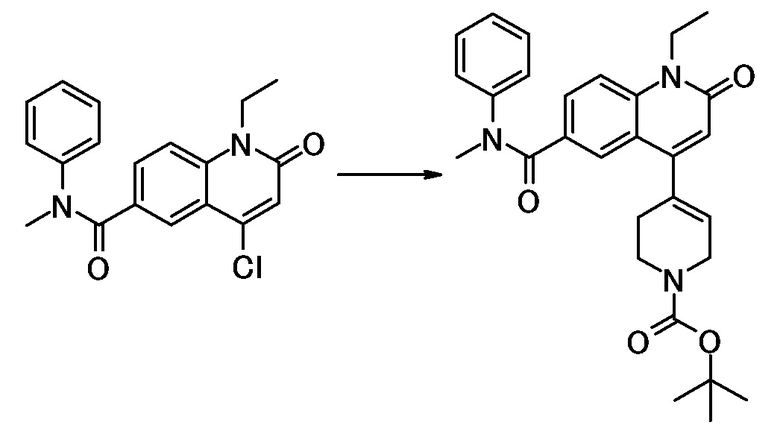
Смесь 2,0 г 4-хлор-1-этил-N-метил-2-оксо-N-фенил-1,2-дигидрохинолин-6-карбоксамида, 2,18 г трет-бутил 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,6-дигидропиридин-1(2H)-карбоксилата, 1,24 г карбоната натрия, 0,21 г бис(дитрет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 20 мл диметилового эфира этиленгликоля и 4,0 мл воды кипятили с обратным холодильником в атмосфере азота в течение 3 часов. Затем реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду. Органический слой отделяли, затем его последовательно промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле [градиентное элюирование гексан: этилацетат=50: 50-0: 100] с получением 2,9 г трет-бутил 4-(1-этил-6-(метил(фенил)карбамоил)-2-оксо-1,2-дигидрохинолин-4-ил)-3,6-дигидропиридин-1(2H)-карбоксилата в форме слегка коричневой пены.
1H-ЯМР (CDCl3) δ: 1,32 (3H, т, J=6,9 Гц), 1,56 (9H, с), 1,94-2,14 (2H, м), 3,53 (3H, с), 3,57 (2H, т, J=5,6 Гц), 3,99-4,06 (2H, м), 4,30 (2H, кв, J=7,0 Гц), 5,42 (1H, уш.с), 6,41 (1H, с), 6,99-7,07 (2H, м), 7,10-7,19 (1H, м), 7,22-7,33 (3H, м), 7,35-7,41 (1H, м), 7,77 (1H, дд, J=9,2, 2,0 Гц).
[0174]
Пример 6
[Формула 57]

Смесь 1,47 г трет-бутил 4-(1-этил-6-(метил(фенил)карбамоил)-2-оксо-1,2-дигидрохинолин-4-ил)-3,6-дигидропиридин-1(2H)-карбоксилата, 0,44 г 5% палладия на угле, 0,29 г формиата аммония 15 мл метанола кипятили с обратным холодильником в атмосфере азота в течение 1 часа 30 минут. Затем реакционную смесь охлаждали до комнатной температуры, и нерастворимые вещества удаляли фильтрацией. Осадок на фильтре промывали этилацетатом. Фильтрат объединяли с промывочным раствором, и растворитель затем отгоняли при пониженном давлении. К полученному остатку добавляли 0,44 г 5% палладия на угле, 0,29 г формиата аммония и 15 мл метанола, и полученную смесь затем кипятили с обратным холодильником в атмосфере азота в течение 2 часов. Затем реакционную смесь охлаждали до комнатной температуры, и нерастворимые вещества удаляли фильтрацией. Осадок на фильтре промывали этилацетатом. Фильтрат объединяли с промывочным раствором, и растворитель затем отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир, и твердое вещество собирали фильтрацией и затем промывали диизопропиловым эфиром, с получением 1,26 г трет-бутил 4-(1-этил-6-(метил(фенил)карбамоил)-2-оксо-1,2-дигидрохинолин-4-ил)пиперидин-1-карбоксилата в форме белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,31 (3H, т, J=7,3 Гц), 1,40-1,58 (4H, м), 1,50 (9H, с), 2,62-2,85 (3H, м), 3,56 (3H, с), 4,15-4,34 (4H, м), 6,49 (1H, с), 7,04-7,11 (2H, м), 7,12-7,20 (1H, м), 7,23-7,33 (3H, м), 7,61 (1H, д, J=2,0 Гц), 7,73 (1H, дд, J=8,6, 2,0 Гц).
[0175]
Пример 7
[Формула 58]
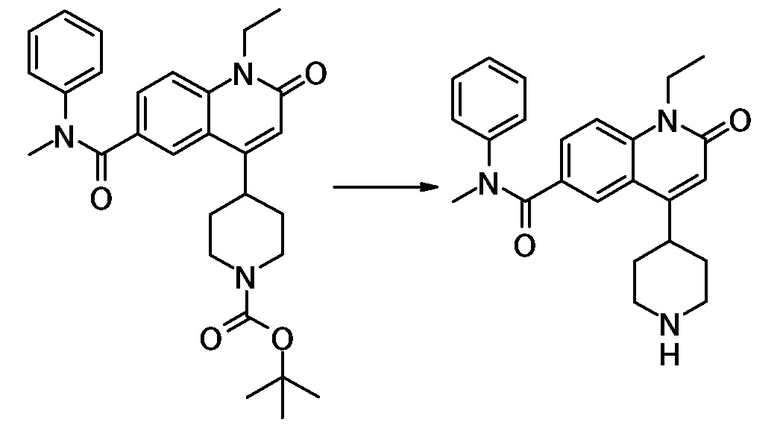
Смесь 1,26 г трет-бутил 4-(1-этил-6-(метил(фенил)карбамоил)-2-оксо-1,2-дигидрохинолин-4-ил)пиперидин-1-карбоксилата в 5 мл дихлорметана и 5 мл трифторуксусной кислоты перемешивали при комнатной температуре в течение 30 минут, и затем растворитель отгоняли при пониженном давлении. К полученному остатку добавляли этилацетат и насыщенный водный раствор гидрокарбоната натрия, и органический слой отделяли. Водный слой экстрагировали этилацетатом, и затем экстрагировали два раза хлороформом. Органический слой объединяли с экстрактом, и полученную смесь сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении с получением 1,0 г 1-этил-N-метил-2-оксо-N-фенил-4-(пиперидин-4-ил)-1,2-дигидро-хинолин-6-карбоксамида в форме белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,31 (3H, т, J=7,3 Гц), 1,55-1,67 (4H, м), 2,67-2,90 (3H, м), 3,22-3,34 (2H, м), 3,56 (3H, с), 4,29 (2H, кв, J=7,3 Гц), 6,55 (1H, с), 7,05-7,20 (3H, м), 7,22-7,32 (3H, м), 7,62 (1H, д, J=2,0 Гц), 7,71 (1H, дд, J=8,6, 2,0 Гц).
[0176]
Пример 8
[Формула 59]

0,71 г карбоната калия и 0,25 мл этилйодида добавляли к суспензии 1,0 г 1-этил-N-метил-2-оксо-N-фенил-4-(пиперидин-4-ил)-1,2-дигидрохинолин-6-карбоксамида в ацетоне (15 мл) и тетрагидрофуране (8 мл), и затем полученную смесь перемешивали при комнатной температуре в течение 30 минут, и затем перемешивали при внешней температуре 40°C в течение 2 часов. Затем к реакционной смеси добавляли 0,24 г карбоната калия и 82 мкл этилйодида, и полученную смесь перемешивали при внешней температуре 40°C в течение 1 часа. Затем растворитель отгоняли при пониженном давлении. К полученному остатку добавляли этилацетат и воду, и органический слой отделяли. Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на основном силикагеле [градиентное элюирование гексан: этилацетат=50: 50-0: 100]. К полученному остатку добавляли диизопропиловый эфир, и твердое вещество затем собирали фильтрацией, с получением 0,76 г 1-этил-4-(1-этилпиперидин-4-ил)-N-метил-2-оксо-N-фенил-1,2-дигидро-хинолин-6-карбоксамида в форме белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,05 (3H, т, J=7,3 Гц), 1,15 (3H, т, J=7,3 Гц), 1,31-1,52 (4H, м), 1,92-2,06 (2H, м), 2,40 (2H, кв, J=7,0 Гц), 2,47-2,63 (1H, м), 2,86-2,98 (2H, м), 3,43 (3H, с), 4,20 (2H, кв, J=7,0 Гц), 6,36 (1H, с), 7,10-7,32 (5H, м), 7,50-7,58 (2H, м), 7,73 (1H, дд, J=8,9, 1,7 Гц).
[0177]
Пример 9
[Формула 60]

4-Хлор-6-(3,4-дигидрохинолин-1(2H)-илкарбонил)-1-этил-хинолин-2(1H)-он получали из 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты таким же методом, как метод в примере 4.
1H-ЯМР (CDCl3) δ: 1,31 (3H, т, J=7,2 Гц), 2,10 (2H, квинт, J=6,6 Гц), 2,88 (2H, т, J=6,6 Гц), 3,96 (2H, т, J=6,7 Гц), 4,30 (2H, кв, J=7,2 Гц), 6,65 (1H, д, J=7,8 Гц), 6,83-6,90 (2H, м), 7,00-7,06 (1H, м), 7,18-7,28 (2H, м), 7,56 (1H, дд, J=8,8, 2,0 Гц), 8,09 (1H, д, J=2,2 Гц).
[0178]
Пример 10
[Формула 61]

Смесь 64 мг 4-хлор-6-(3,4-дигидрохинолин-1(2H)-илкарбонил)-1-этилхинолин-2(1H)-она, 47 мг 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2,3,6-тетрагидропиридина, 55 мг карбоната натрия, 12,3 мг бис(дитрет-бутил(4-диметиламинофенил)-фосфин)дихлорпалладия(II), 2 мл диметилового эфира этиленгликоля и 0,2 мл воды кипятили с обратным холодильником в атмосфере азота в течение 2 часов. Затем реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду. Органический слой отделяли, затем его последовательно промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на основном силикагеле [градиентное элюирование гексан: этилацетат=50: 50-0: 100] с получением 62 мг 6-(3,4-дигидрохинолин-1(2H)-илкарбонил)-1-этил-4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)хинолин-2(1H)-она в форме слегка коричневой пены.
1H-ЯМР (CDCl3) δ: 1,35 (3H, т, J=6,9 Гц), 2,05-2,18 (4H, м), 2,41 (3H, с), 2,45-2,55 (2H, м), 2,87 (2H, т, J=6,6 Гц), 2,94-3,02 (2H, м), 3,95 (2H, т, J=6,6 Гц), 4,33 (2H, кв, J=7,1 Гц), 5,29-5,36 (1H, м), 6,47 (1H, с), 6,54 (1H, д, J=7,9 Гц), 6,80-6,89 (1H, м), 6,94-7,02 (1H, м), 7,18 (1H, д, J=7,3 Гц), 7,35 (1H, д, J=9,2 Гц), 7,49 (1H, д, J=2,0 Гц), 7,77 (1H, дд, J=8,6, 2,0 Гц).
[0179]
Пример 11
[Формула 62]

Смесь 60 мг 6-(3,4-дигидрохинолин-1(2H)-илкарбонил)-1-этил-4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)хинолин-2(1H)-она в метаноле (15 мл) и этилацетате (15 мл) подвергали реакции гидрирования (25°C, 0,1 МПа, расход водорода 2 мл/мин, 10% палладия на угле), используя проточный реактор гидрирования. Растворитель отгоняли при пониженном давлении, и полученный остаток очищали колоночной хроматографией на основном силикагеле [градиентное элюирование гексан: этилацетат=50: 50-0: 100]. К полученному остатку добавляли диизопропиловый эфир и этилацетат, и твердое вещество затем собирали фильтрацией с получением 10 мг 6-(3,4-дигидрохинолин-1(2H)-илкарбонил)-1-этил-4-(1-метилпиперидин-4-ил)хинолин-2(1H)-она в форме белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,18 (3H, т, J=6,9 Гц), 1,24-1,52 (4H, м), 1,80-1,94 (2H, м), 1,95-2,10 (2H, м), 2,19 (3H, с), 2,50-2,65 (1H, м), 2,70-2,81 (2H, м), 2,87 (2H, т, J=6,3 Гц), 3,81 (2H, т, J=6,6 Гц), 4,24 (2H, кв, J=6,8 Гц), 6,38 (1H, с), 6,58 (1H, д, J=7,9 Гц), 6,84 (1H, т, J=7,3 Гц), 6,96 (1H, т, J=7,3 Гц), 7,22 (1H, д, J=7,3 Гц), 7,50-7,55 (1H, м), 7,62 (1H, д, J=9,2 Гц), 7,73-7,81 (1H, м).
[0180]
Пример 12
[Формула 63]

4-Хлор-1-этил-N-метил-N-(4-метилфенил)-2-оксо-1,2-дигидро-хинолин-6-карбоксамид получали из 4-хлор-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты таким же методом, как метод в примере 4.
1H-ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,2 Гц), 2,29 (3H, с), 3,51 (3H, с), 4,26 (2H, кв, J=7,1 Гц), 6,81 (1H, с), 6,98 (2H, д, J=8,3 Гц), 7,07 (2H, д, J=8,3 Гц), 7,20 (1H, д, J=8,8 Гц), 7,65 (1H, дд, J=8,8,2,0 Гц), 7,94 (1H, д, J=2,0 Гц).
[0181]
Пример 13
[Формула 64]

1-Этил-N-метил-N-(4-метилфенил)-4-(1-метил-1,2,3,6-тетра-гидропиридин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид получали из 4-хлор-1-этил-N-метил-N-(4-метилфенил)-2-оксо-1,2-дигидрохинолин-6-карбоксамида таким же методом, как метод в примере 10.
1H-ЯМР (CDCl3) δ: 1,31 (3H, т, J=7,2 Гц), 2,14-2,21 (2H, м), 2,26 (3H, с), 2,45 (3H, с), 2,61 (2H, т, J=5,6 Гц), 3,04-3,11 (2H, м), 3,50 (3H, с), 4,29 (2H, кв, J=7,1 Гц), 5,36-5,42 (1H, м), 6,45 (1H, с), 6,92 (2H, д, J=8,3 Гц), 7,03 (2H, д, J=8,5 Гц), 7,27 (1H, д, J=8,8 Гц), 7,51 (1H, д, J=2,0 Гц), 7,69 (1H, дд, J=8,9,2,1 Гц).
[0182]
Пример 14
[Формула 65]

1-Этил-N-метил-N-(4-метилфенил)-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид получали из 1-этил-N-метил-N-(4-метилфенил)-4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамида таким же методом, как метод в сравнительном примере 13.
1H-ЯМР (CDCl3) δ: 1,30 (3H, т, J=7,1 Гц), 1,50-1,71 (4H, м), 1,99-2,10 (2H, м), 2,26 (3H, с), 2,36 (3H, с), 2,48-2,59 (1H, м), 2,91-3,00 (2H, м), 3,53 (3H, с), 4,28 (2H, кв, J=7,2 Гц), 6,55 (1H, с), 6,96 (2H, д, J=8,3 Гц), 7,06 (2H, д, J=8,0 Гц), 7,25-7,30 (1H, м), 7,60 (1H, д, J=2,0 Гц), 7,71 (1H, дд, J=8,8, 2,0 Гц).
[0183]
Пример 15
[Формула 66]
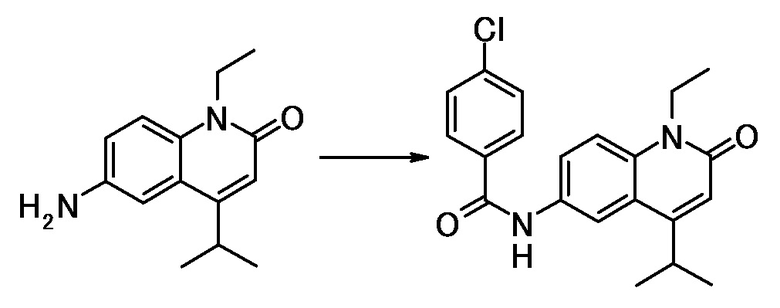
4-Хлор-N-(1-этил-2-оксо-4-(пропан-2-ил)-1,2-дигидрохинолин-6-ил)бензамид получали из 6-амино-1-этил-4-(пропан-2-ил)хинолин-2(1H)-она и 4-хлорбензоилхлорида таким же методом, как метод в примере 1.
1H-ЯМР (CDCl3) δ: 1,34 (6H, д, J=6,6 Гц), 1,31-1,40 (3H, м), 3,34-3,47 (1H, м), 4,37 (2H, кв, J=7,1 Гц), 6,67 (1H, с), 7,42 (1H, д, J=9,2 Гц), 7,48 (2H, д, J=8,3 Гц), 7,77 (1H, дд, J=9,2, 2,3 Гц), 7,91 (2H, д, J=8,3 Гц), 8,23 (1H, с), 8,33 (1H, д, J=2,3 Гц).
[0184]
Пример 16
[Формула 67]

4-Хлор-N-(1-этил-2-оксо-4-(пропан-2-ил)-1,2-дигидрохинолин-6-ил)-N-метилбензамид получали из 4-хлор-N-(1-этил-2-оксо-4-(пропан-2-ил)-1,2-дигидрохинолин-6-ил)бензамида таким же методом, как метод в примере 2.
1H-ЯМР (CDCl3) δ: 1,12 (6H, д, J=6,8 Гц), 1,34 (3H, т, J=7,2 Гц), 3,01-3,14 (1H, м), 3,53 (3H, с), 4,31 (2H, кв, J=7,2 Гц), 6,61 (1H, с), 7,12-7,19 (2H, м), 7,24-7,29 (2H, м), 7,31-7,37 (3H, м).
[0185]
Пример 17
[Формула 68]
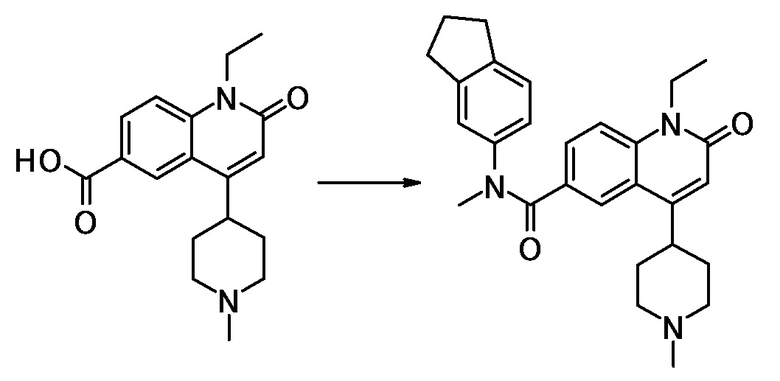
Смесь 80 мг 1-этил-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоновой кислоты, 80 мкл N-метил-2,3-дигидро-1H-инден-5-амина, 3 мл дихлорметана, 90 мг 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида, 63 мг 1-гидрокси-7-азабензотриазола и 0,3 мл триэтиламина перемешивали при внешней температуре от 70°C до 80°C в герметизированной пробирке в течение 3 часов. Затем, реакционную смесь охлаждали до комнатной температуры, и растворитель затем отгоняли при пониженном давлении. К полученному остатку добавляли 1 мл 2 моль/л водного раствора гидроксида натрия, 4 мл тетрагидрофурана и 2 мл метанола, и полученную смесь затем перемешивали при внешней температуре от 40°C до 50°C в течение 20 минут. Затем растворитель отгоняли при пониженном давлении. К реакционной смеси добавляли этилацетат и насыщенный водный раствор хлорида натрия, органический слой отделяли, и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, и полученную смесь сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [градиентное элюирование хлороформ: метанол=100: 0-80: 20] с получением 8 мг N-(2,3-дигидро-1H-инден-5-ил)-1-этил-N-метил-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамида в форме белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,15 (3H, т, J=7,0 Гц), 1,36-1,57 (4H, м), 1,89-2,06 (4H, м), 2,24 (3H, с), 2,69-2,89 (6H, м), 3,29-3,37 (1H, м), 3,39 (3H, с), 4,21 (2H, кв, J=7,1 Гц), 6,38 (1H, с), 6,84-6,92 (1H, м), 7,07 (1H, д, J=8,0 Гц), 7,15 (1H, с), 7,52-7,61 (2H, м), 7,75 (1H, дд, J=8,9, 1,6 Гц).
[0186]
Пример 18
[Формула 69]

1-Этил-6-(1-метил-5-фенил-1H-пиразол-4-ил)-4-(морфолин-4-ил)хинолин-2(1H)-он получали из 1-этил-4-(морфолин-4-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)хинолин-2(1H)-она и 4-бром-1-метил-5-фенил-1H-пиразол таким же методом, как метод в сравнительном примере 2.
1H-ЯМР (DMSO-D6) δ: 1,17 (3H, т, J=6,9 Гц), 2,65-2,76 (4H, м), 3,42-3,53 (4H, м), 3,74 (3H, с), 4,21 (2H, кв, J=6,8 Гц), 5,95 (1H, с), 7,35 (1H, д, J=2,0 Гц), 7,37-7,64 (7H, м), 7,81 (1H, с).
[0187]
Примеры 19-244
В соответствии с методиками, описанными в настоящем изобретении, полученные соединения подвергали известной реакции, такой как реакция конденсации, присоединения, окисления, восстановления, перегруппировки, замещения, галогенирования, дегидратации или гидролиза, или использовали объединение этих реакций друг с другом, в соответствующих случаях, для получения соединений, представленных в таблицах 1-25.
[0188]
[Таблица 1]









[0189]
[Таблица 2]
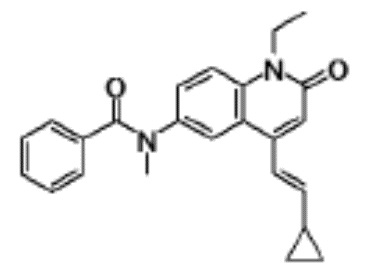


метилбензамид

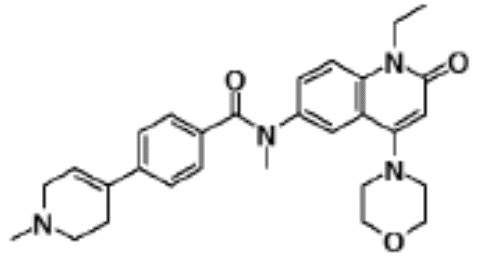



дигидрохинолин-6-ил)-N-метилбензамид
[0190]
[Таблица 3]







[0191]
[Таблица 4]


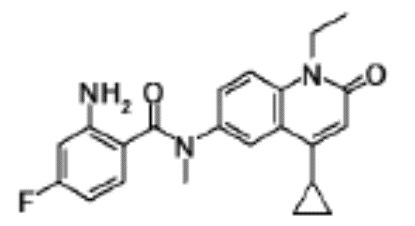






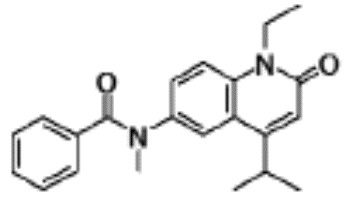
[0192]
[Таблица 5]
формула

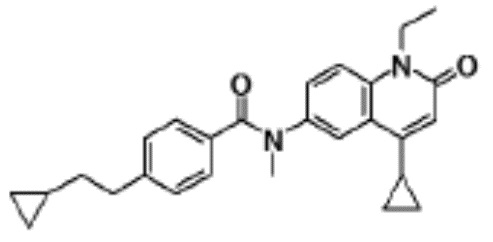





[0193]
[Таблица 6]
формула
N-метилбензамид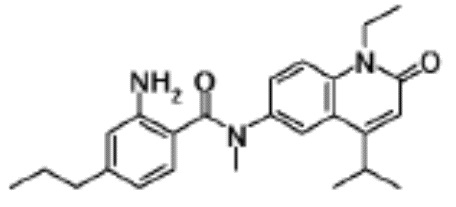


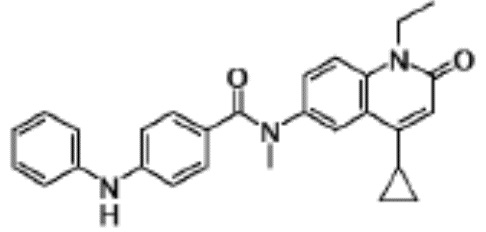




[0194]
[Таблица 7]
формула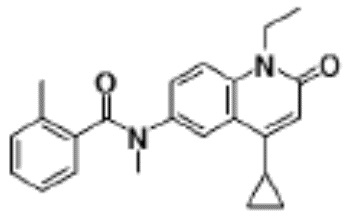






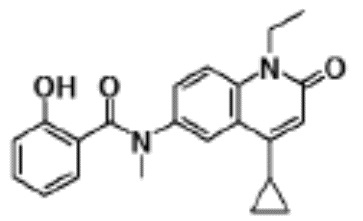
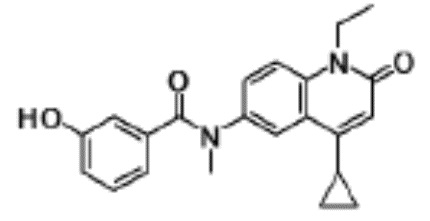

[0195]
[Таблица 8]
формула
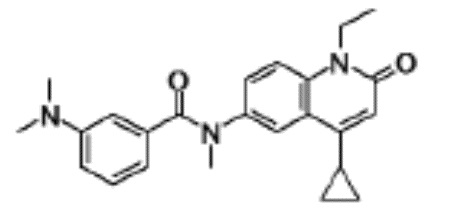

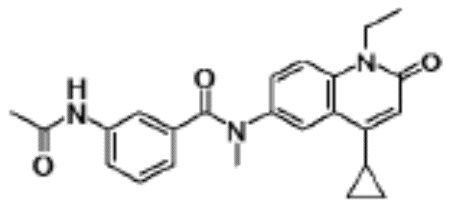


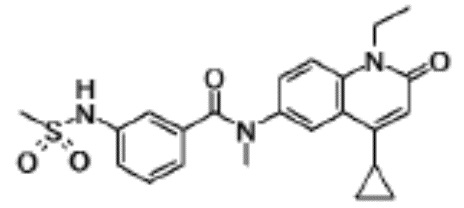




[0196]
[Таблица 9]
формула

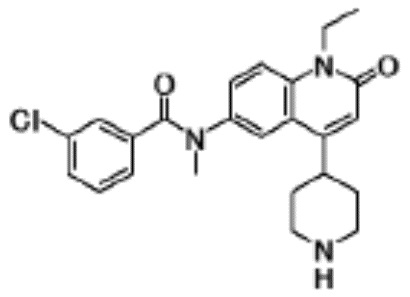

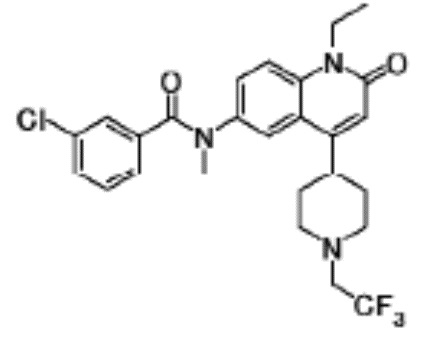


[0197]
[Таблица 10]
формула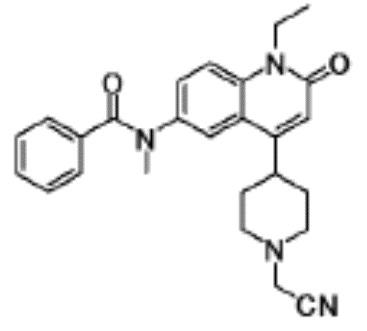



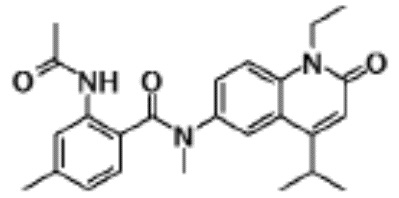

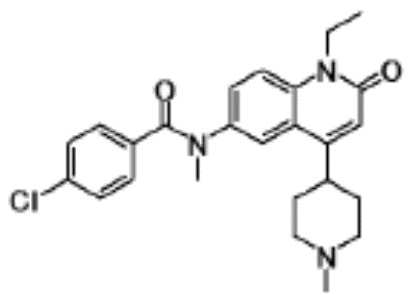
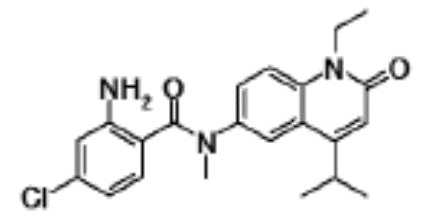

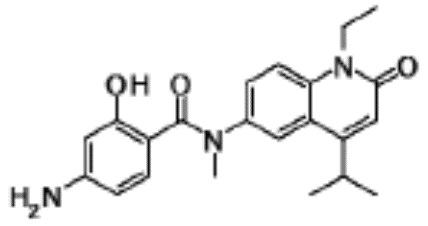
[0198]
[Таблица 11]
формула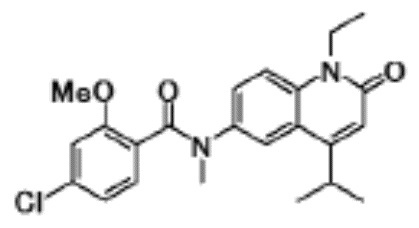
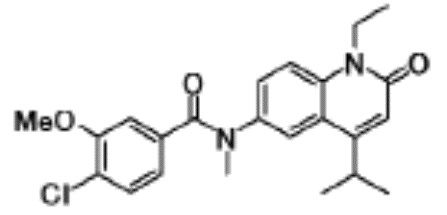
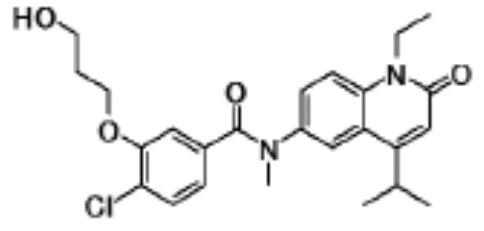



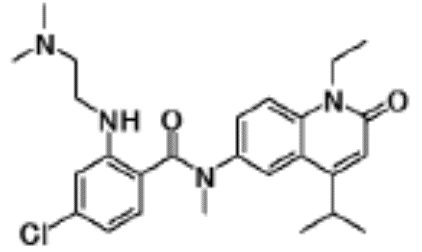

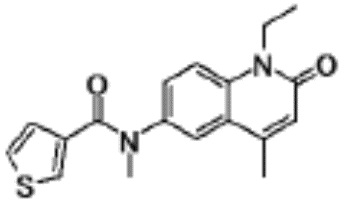
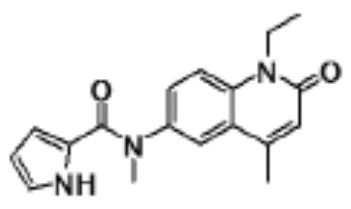
[0199]
[Таблица 12]
формула



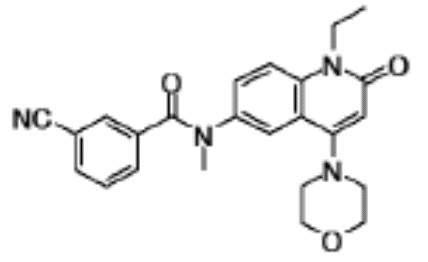
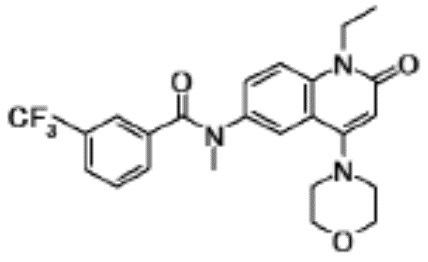
[0200]
[Таблица 13]
формула








[0201]
[Таблица 14]
формула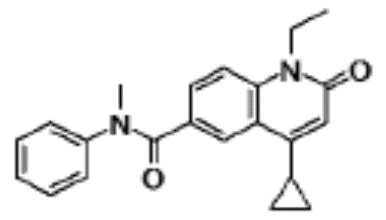
дигидрохинолин-6-карбоксамид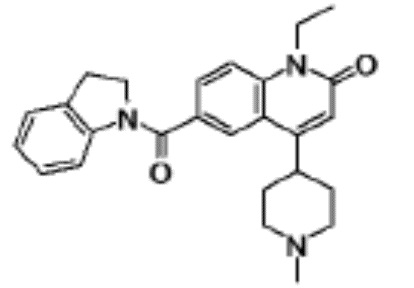
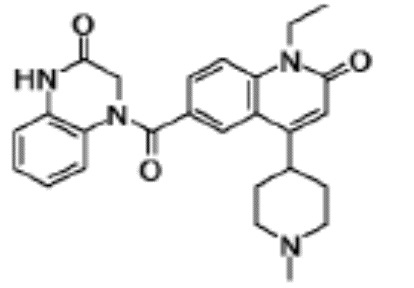





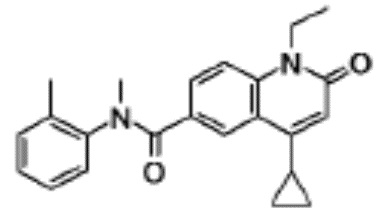

[0202]
[Таблица 15]
формула







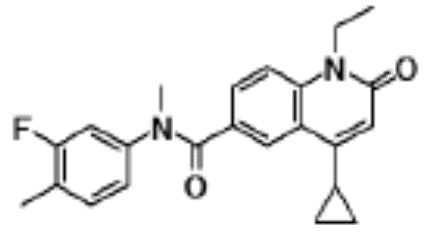

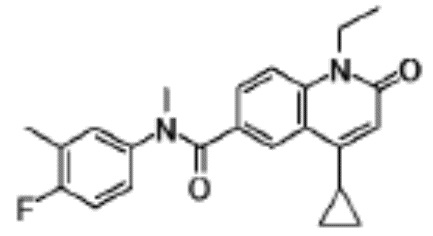
[0203]
[Таблица 16]
формула
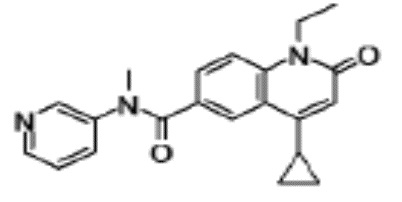








[0204]
[Таблица 17]
формула
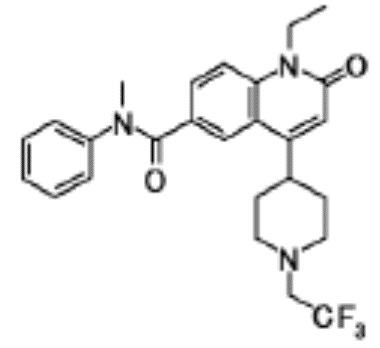




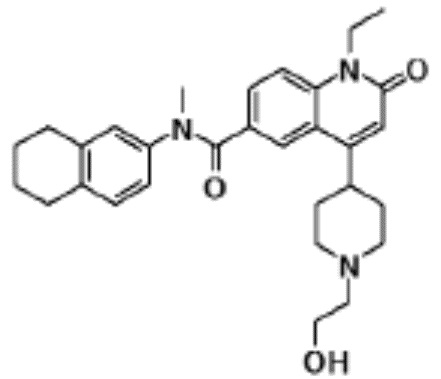

[0205]
[Таблица 18]
формула
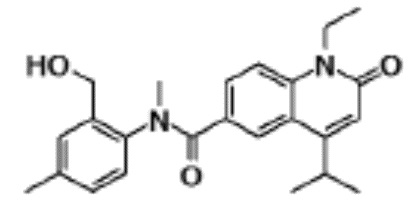
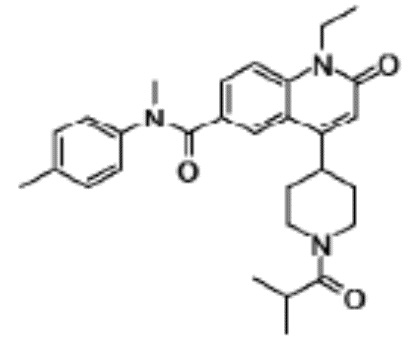


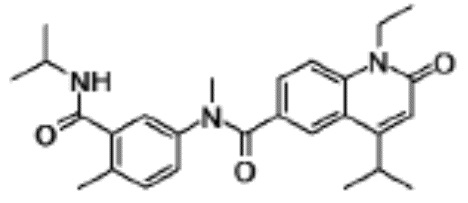


[0206]
[Таблица 19]
формула

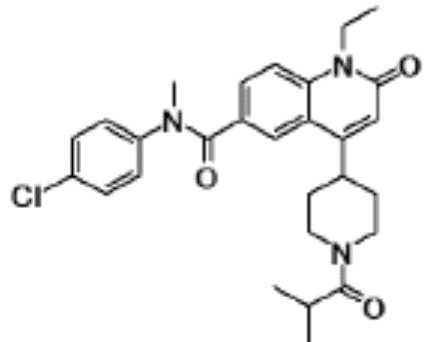

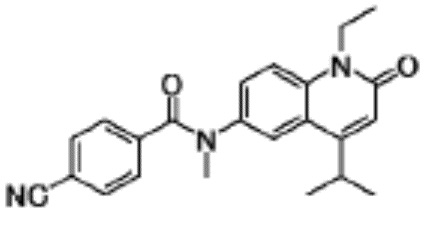
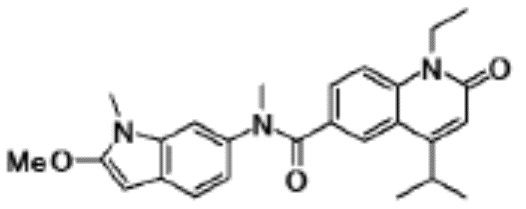

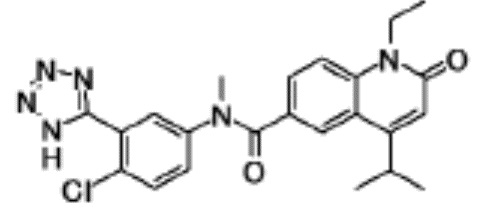
[0207]
[Таблица 20]
формула



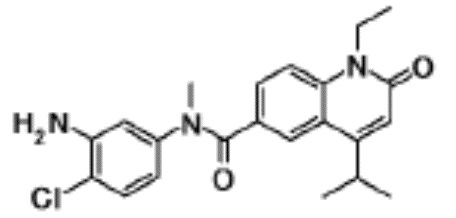
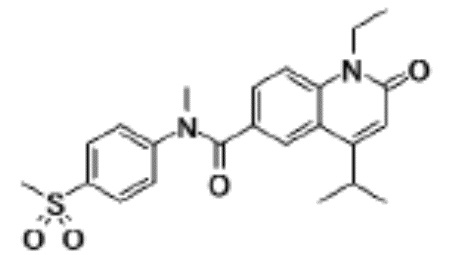



[0208]
[Таблица 21]
формула

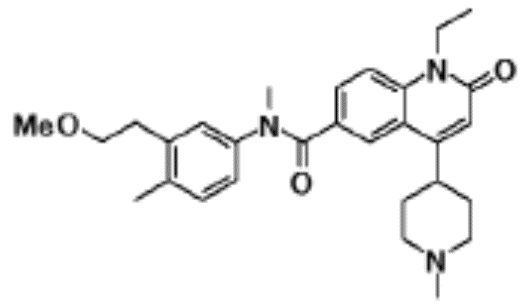




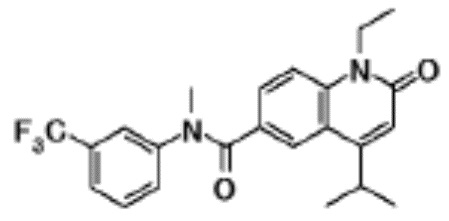

[0209]
[Таблица 22]
формула
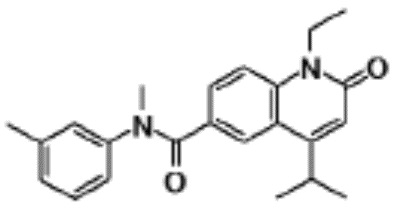


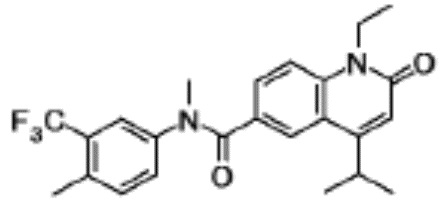




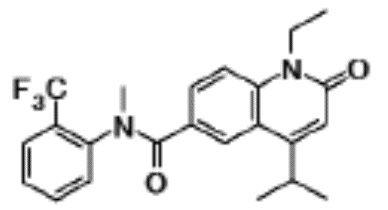
[0210]
[Таблица 23]
формула
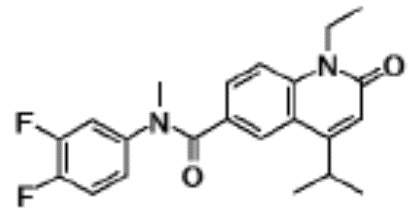
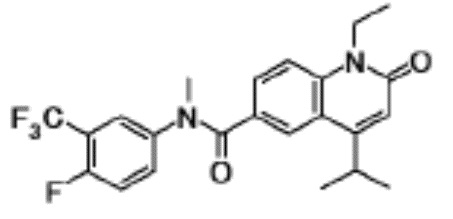
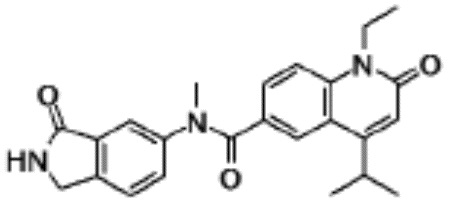


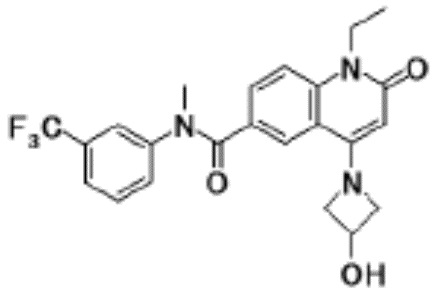


[0211]
[Таблица 24]
формула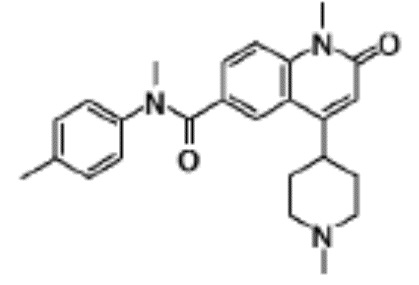

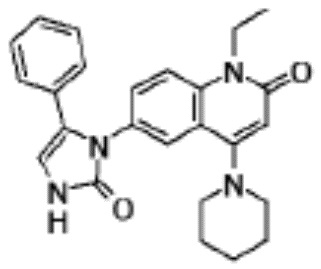

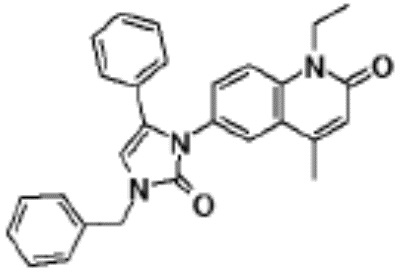
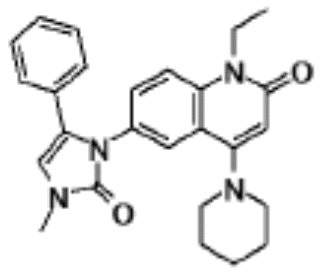
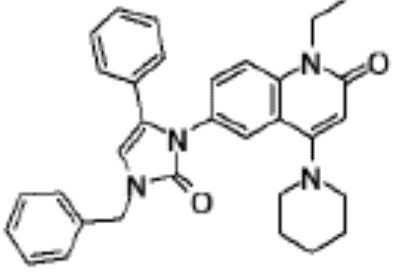
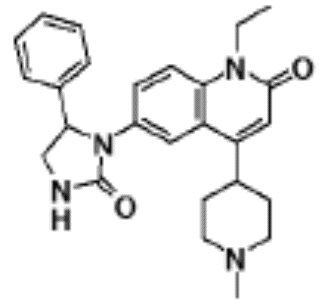
[0212]
[Таблица 25]
формула
[0213]
Пример 245
[Формула 70]

4,0 мл концентрированной хлористоводородной кислоты добавляли к суспензии 0,70 г 1-(2-(4-хлорфенил)-2-оксоэтил)-3-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-дигидрохинолин-6-ил)-мочевины в 4,0 мл диоксана при комнатной температуре, и полученную смесь перемешивали в течение 2 часов. Затем к реакционной смеси добавляли воду, и твердое вещество собирали фильтрацией и затем промывали водой и диизопропиловым эфиром. Полученное твердое вещество очищали колоночной хроматографией на силикагеле [градиентное элюирование хлороформ: метанол=100: 0-90: 10]. К полученному остатку добавляли диизопропиловый эфир, и твердое вещество затем собирали фильтрацией с получением 0,59 г 6-(5-(4-хлорфенил)-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-она в форме белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,19 (3H, т, J=6,8 Гц), 2,64-2,73 (4H, м), 3,50-3,57 (4H, м), 4,23 (2H, кв, J=6,8 Гц), 6,00 (1H, с), 6,95 (1H, с), 7,07-7,13 (2H, м), 7,24 (1H, д, J=2,4 Гц), 7,32-7,38 (2H, м), 7,57 (1H, дд, J=9,1, 2,3 Гц), 7,65 (1H, д, J=9,0 Гц), 10,67 (1H, с).
MS(ESI,m/z):451(M+H),449(M-H)
[0214]
Пример 246
[Формула 71]

30 мг 60% гидрида натрия после охлаждения на льду добавляли к раствору 300 мг 6-(5-(4-хлорфенил)-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-она в 3 мл N,N-диметилформамида, и полученную смесь перемешивали в течение 5 минут. Затем к реакционной смеси после охлаждения на льду добавляли 50 мкл метилйодида, и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Затем после охлаждения на льду, к реакционной смеси добавляли этилацетат и воду, и полученную смесь доводили до рН 2,0 с помощью 1 моль/л хлористоводородной кислоты. Твердое вещество собирали фильтрацией и затем промывали водой и диизопропиловым эфиром с получением 203 мг 6-(5-(4-хлорфенил)-3-метил-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-она в форме белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,19 (3H, т, J=7,0 Гц), 2,64-2,72 (4H, м), 3,28 (3H, с), 3,50-3,57 (4H, м), 4,23 (2H, кв, J=6,8 Гц), 6,01 (1H, с), 7,05-7,12 (2H, м), 7,07 (1H, с), 7,26 (1H, д, J=2,4 Гц), 7,34-7,39 (2H, м), 7,57 (1H, дд, J=9,0, 2,4 Гц), 7,66 (1H, д, J=9,0 Гц).
MS(ESI,m/z):465(M+H)
[0215]
Пример 247
[Формула 72]
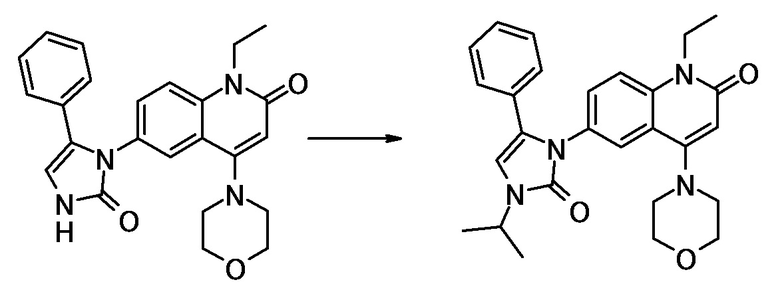
После охлаждения на льду, 35 мг 60% гидрида натрия добавляли к суспензии 330 мг 1-этил-4-(морфолин-4-ил)-6-(2-оксо-5-фенил-2,3-дигидро-1H-имидазол-1-ил)хинолин-2(1H)-она в 2 мл N,N-диметилацетамида, и полученную смесь перемешивали в течение 5 минут. Затем после охлаждения на льду, к реакционной смеси добавляли 119 мкл 2-йодпропана, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли 60 мкл 2-йодпропана, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. После охлаждения на льду, к реакционной смеси добавляли этилацетат и воду, и полученную смесь затем доводили до рН 2,0 с помощью 1 моль/л хлористоводородной кислоты. Органический слой отделяли, затем промывали водой и насыщенным водным раствором хлорида натрия, и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [этилацетат → градиентное элюирование хлороформ: метанол=95: 5-90: 10]. К полученному остатку добавляли диизопропиловый эфир и этилацетат, и твердое вещество собирали фильтрацией. Полученное твердое вещество очищали колоночной хроматографией на силикагеле [этилацетат]. К полученному остатку добавляли диизопропиловый эфир и этилацетат, и твердое вещество затем собирали фильтрацией с получением 68 мг 1-этил-4-(морфолин-4-ил)-6-(2-оксо-5-фенил-3-(пропан-2-ил)-2,3-дигидро-1H-имидазол-1-ил)хинолин-2(1H)-она в форме светло-коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,36 (3H, т, J=7,1 Гц), 1,43 (6H, д, J=6,8 Гц), 2,63-2,70 (4H, м), 3,55-3,62 (4H, м), 4,32 (2H, кв, J=7,2 Гц), 4,55 (1H, квинт, J=6,8 Гц), 6,09 (1H, с), 6,51 (1H, с), 7,07-7,12 (2H, м), 7,15-7,28 (3H, м), 7,33 (1H, д, J=2,4 Гц), 7,43(1H, д, J=9,0 Гц), 7,72 (1H, дд, J=9,0, 2,4 Гц).
[0216]
Пример 248
[Формула 73]

Смесь 100 мг 4-циклопропил-1-этил-6-(2-фенилгидразинил)-хинолин-2(1H)-она, 46 мг этил карбамоилкарбамата и 3 мл толуола перемешивали с использованием микроволновой установки при 140°C в течение 1 часа 30 минут. Затем реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду. Органический слой отделяли, затем последовательно промывали его водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [градиентное элюирование гексан: этилацетат=50: 50-0: 100]. К полученному остатку добавляли хлороформ, и твердое вещество собирали фильтрацией с получением 15 мг 1-(4-циклопропил-1-этил-2-оксо-1,2-дигидро-хинолин-6-ил)-2-фенил-1,2,4-триазолидин-3,5-диона в форме светло-коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 0,57-0,65 (2H, м), 0,92-1,01 (2H, м), 1,14 (3H, т, J=7,0 Гц), 2,03-2,14 (1H, м), 4,20 (2H, кв, J=7,1 Гц), 6,29 (1H, с), 7,20-7,27 (1H, м), 7,34-7,47 (4H, м), 7,60 (1H, д, J=9,3 Гц), 7,70 (1H, дд, J=9,1,2,6 Гц), 8,03(1H, д, J=2,4 Гц), 12,09 (1H, с).
[0217]
Пример 249
[Формула 74]

После охлаждения на льду, 1,12 мл 4-хлорбензоилхлорида добавляли к суспензии 2,0 г 6-амино-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-она в 10 мл пиридина, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем после охлаждения на льду, к реакционной смеси добавляли этилацетат и воду, и полученную смесь доводили до рН 2,0 с помощью 2 моль/л хлористоводородной кислоты. Твердое вещество собирали фильтрацией и затем промывали водой и диизопропиловым эфиром с получением 3,01 г 4-хлор-N-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-дигидрохинолин-6-ил)бензамида в форме белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,19 (3H, т, J=7,0 Гц), 3,03-3,13 (4H, м), 3,81-3,90 (4H, м), 4,24 (2H, кв, J=7,1 Гц), 6,04 (1H, с), 7,59 (1H, д, J=9,3 Гц), 7,64 (2H, д, J=8,5 Гц), 7,98 (1H, дд, J=9,3, 2,4 Гц), 8,01 (2H, д, J=8,5 Гц), 8,35 (1H, д, J=2,2 Гц), 10,48 (1H, с).
[0218]
Пример 250
[Формула 75]
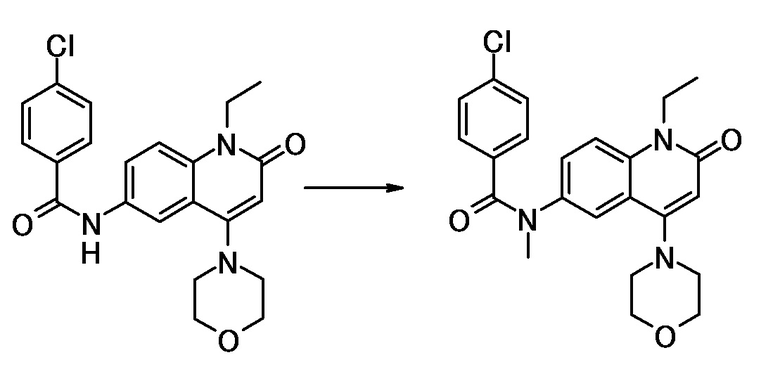
После охлаждения на льду, 0,35 г 60% гидрида натрия добавляли к суспензии 3,0 г 4-хлор-N-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-дигидрохинолин-6-ил)бензамида в 24 мл N,N-диметил-ацетамида, и полученную смесь перемешивали в течение 10 минут. Затем, после охлаждения на льду, к реакционной смеси добавляли 0,68 мл метилйодида, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли этилацетат и ледяную воду, и полученную смесь доводили до рН 2,0 с помощью 2 моль/л хлористоводородной кислоты. Органический слой отделяли, затем промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и этилацетат, и твердое вещество собирали фильтрацией и затем промывали диизопропиловым эфиром с получением 2,55 г 4-хлор-N-(1-этил-4-(морфолин-4-ил)-2-оксо-1,2-дигидрохинолин-6-ил)-N-метилбензамида в форме белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,16 (3H, т, J=7,1 Гц), 2,45-2,60 (4H, м), 3,42 (3H, с), 3,60-3,71 (4H, м), 4,19 (2H, кв, J=6,9 Гц), 5,96 (1H, с), 7,21 (1H, с), 7,28 (2H, д, J=8,3 Гц), 7,33 (2H, д, J=8,3 Гц), 7,60 (1H, д, J=9,0 Гц), 7,68 (1H, дд, J=9,0, 2,2 Гц).
[0219]
Пример 251
[Формула 76]
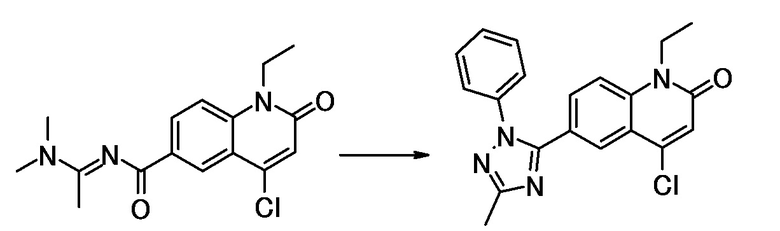
Смесь 1,5 г 4-хлор-N-((1E)-1-(диметиламино)этилиден)-1-этил-2-оксо-1,2-дигидрохинолин-6-карбоксамида, 0,51 мл фенил-гидразин и 12 мл уксусной кислоты перемешивали при внешней температуре 120°C в течение 2 часов. Затем реакционную смесь охлаждали до комнатной температуры, и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир и этилацетат, и твердое вещество собирали фильтрацией и затем промывали диизопропиловым эфиром с получением 1,37 г 4-хлор-1-этил-6-(3-метил-1-фенил-1H-1,2,4-триазол-5-ил)хинолин-2(1H)-она в форме светло-коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,18 (3H, т, J=7,1 Гц), 2,41 (3H, с), 4,25 (2H, кв, J=6,9 Гц), 6,97 (1H, с), 7,44-7,58 (5H, м), 7,72 (1H, д, J=9,0 Гц), 7,77 (1H, дд, J=9,0, 2,0 Гц), 7,99 (1H, д, J=2,0 Гц).
[0220]
Пример 252
[Формула 77]

Смесь 1,37 г 4-хлор-1-этил-6-(3-метил-1-фенил-1H-1,2,4-триазол-5-ил)хинолин-2(1H)-она, 0,48 г циклопропилборной кислоты, 1,6 г ортофосфата калия, 0,26 г бис(дитрет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 15 мл диоксана и 3,0 мл воды перемешивали в атмосфере азота при внешней температуре от 100°C до 110°C в течение 3 часов. Затем реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду. Органический слой отделяли, затем последовательно промывали его водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [градиентное элюирование гексан: этилацетат=50: 50-0: 100]. К полученному остатку добавляли диизопропиловый эфир и циклогексан, и твердое вещество собирали фильтрацией с получением 1,10 г 4-циклопропил-1-этил-6-(3-метил-1-фенил-1H-1,2,4-триазол-5-ил)хинолин-2(1H)-она в форме слегка коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 0,54-0,61 (2H, м), 0,70-0,79 (2H, м), 1,17 (3H, т, J=7,1 Гц), 1,70-1,79 (1H, м), 2,40 (3H, с), 4,23 (2H, кв, J=7,1 Гц), 6,31 (1H, с), 7,42-7,57 (5H, м), 7,64 (1H, д, J=9,0 Гц), 7,81 (1H, дд, J=8,9, 2,1 Гц), 8,03 (1H, д, J=2,0 Гц).
[0221]
Пример 253
[Формула 78]

Смесь 41 мг 1-этил-6-йод-4-(морфолин-4-ил)хинолин-2(1H)-она, 17 мг (5S)-5-фенилпирролидин-2-она, 1 мг йодида меди(I), 4 мг 4,7-диметокси-1,10-фенантролина, 48 мг карбоната цезия и 0,5 мл N-метил-2-пирролидона перемешивали при внешней температуре от 130°C до 135°C в течение 30 минут. Затем реакционную смесь охлаждали до комнатной температуры, к реакционной смеси добавляли этилацетат, и нерастворимые вещества удаляли фильтрацией. К фильтрату добавляли воду и насыщенный водный раствор хлорида натрия. Органический слой отделяли, затем промывали его насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на основном силикагеле [градиентное элюирование гексан: этилацетат=70: 30-40: 60]. К полученному остатку добавляли диизопропиловый эфир, и твердое вещество затем собирали фильтрацией с получением 23 мг 1-этил-4-(морфолин-4-ил)-6-((5S)-2-оксо-5-фенилпирролидин-1-ил)хинолин-2(1H)-она в форме светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,2 Гц), 2,02-2,08 (1H, м), 2,60-2,97 (7H, м), 3,73-3,80 (4H, м), 4,20-4,33 (2H, м), 5,29-5,32 (1H, м), 6,11 (1H, с), 7,23-7,35 (6H, м), 7,75 (1H, д, J=2,4 Гц), 7,81 (1H, дд, J=8,8, 2,4 Гц).
[0222]
Пример 254
[Формула 79]

Смесь 38 мг 4-циклопропил-1-этил-6-йодхинолин-2(1H)-она, 18 мг (5S)-5-фенилпирролидин-2-она, 1 мг йодида меди(I), 4 мг 4,7-диметокси-1,10-фенантролина, 51 мг карбоната цезия и 0,5 мл N-метил-2-пирролидона перемешивали при внешней температуре от 130°C до 135°C в течение 1 часа 15 минут. Затем реакционную смесь охлаждали до комнатной температуры, к реакционной смеси добавляли этилацетат, и нерастворимые вещества удаляли фильтрацией. К фильтрату добавляли воду и насыщенный водный раствор хлорида натрия. Органический слой отделяли, затем промывали его насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на основном силикагеле [градиентное элюирование гексан: этилацетат=80: 20-60: 40], с получением 22 мг 4-циклопропил-1-этил-6-((5S)-2-оксо-5-фенилпирролидин-1-ил)-хинолин-2(1H)-она в форме светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,50-0,57 (1H, м), 0,64-0,71 (1H, м), 0,82-0,99 (2H, м), 1,28 (3H, т, J=7,2 Гц), 1,79-1,86 (1H, м), 2,05-2,12 (1H, м), 2,63-2,85 (3H, м), 4,26 (2H, кв, J=7,5 Гц), 5,27-5,30 (1H, м), 6,39 (1H, д, J=1,2 Гц), 7,25-7,40 (6H, м), 7,79 (1H, дд, J=9,2,2,4 Гц), 7,99 (1H, д, J=2,4 Гц).
[0223]
Пример 255
[Формула 80]
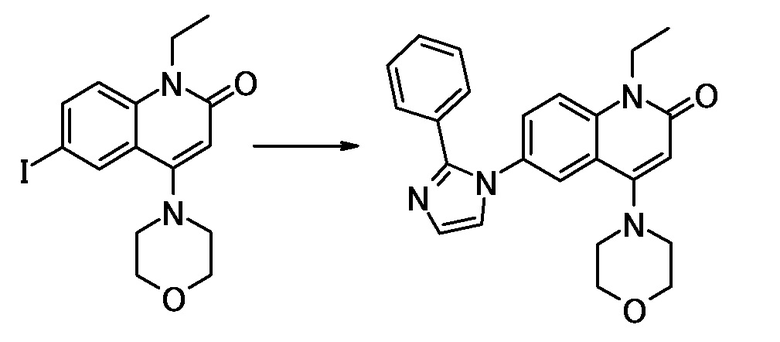
Смесь 60 мг 1-этил-6-йод-4-(морфолин-4-ил)хинолин-2(1H)-она, 25 мг 2-фенил-1H-имидазола, 1,1 мг оксида меди(I), 5,6 мг 4,7-диметокси-1,10-фенантролина, 29 мг полиэтиленгликоля, 71 мг карбоната цезия и 4 мл бутиронитрила перемешивали в атмосфере азота с использованием микроволновой установки при 170°C в течение 40 минут. Затем реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду. Органический слой отделяли, затем промывали его насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали препаративной тонкослойной хроматографией. К полученному остатку добавляли гексан, и твердое вещество затем собирали фильтрацией с получением 10 мг 1-этил-4-(морфолин-4-ил)-6-(2-фенил-1H-имидазол-1-ил)хинолин-2(1H)-она в форме белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,20 (3H, т, J=7,3 Гц), 2,57-2,66 (4H, м), 3,42-3,52 (4H, м), 4,26 (2H, кв, J=6,8 Гц), 6,03 (1H, с), 7,22 (1H, д, J=1,3 Гц), 7,28-7,38 (6H, м), 7,59 (1H, с), 7,71-7,77 (2H, м).
MS(ESI,m/z):401(M+H)
[0224]
Пример 256
[Формула 81]
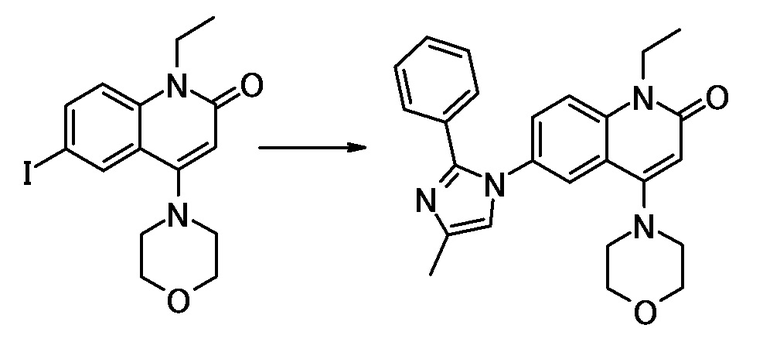
Смесь 50 мг 1-этил-6-йод-4-(морфолин-4-ил)хинолин-2(1H)-она, 23 мг 4-метил-2-фенил-1H-имидазола, 1,9 мг оксида меди(I), 6,2 мг 4,7-диметокси-1,10-фенантролина, 25 мг полиэтиленгликоля, 64 мг карбоната цезия и 1,5 мл бутиронитрила перемешивали в атмосфере азота с использованием микроволновой установки при 210°C в течение 45 минут. Затем к реакционной смеси добавляли 1,9 мг оксида меди(I), и полученную смесь перемешивали с использованием микроволновой установки при 225°C в течение 45 минут. Затем к реакционной смеси добавляли 6,0 мг оксида меди(I) и 6,2 мг 4,7-диметокси-1,10-фенантролина, и полученную смесь перемешивали с использованием микроволновой установки при 230°C в течение 1 часа 30 минут. Затем реакционную смесь охлаждали до комнатной температуры, нерастворимые вещества удаляли фильтрацией, и к остатку добавляли этилацетат и воду. Органический слой отделяли, затем промывали его насыщенным водным раствором хлорида натрия, и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали препаративной тонкослойной хроматографией. К полученному остатку добавляли диизопропиловый эфир, и затем твердое вещество собирали фильтрацией с получением 5 мг 1-этил-6-(4-метил-2-фенил-1H-имидазол-1-ил)-4-(морфолин-4-ил)хинолин-2(1H)-она в форме белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,20 (3H, т, J=6,9 Гц), 2,23 (3H, с), 2,56-2,66 (4H, м), 3,41-3,51 (4H, м), 4,20-4,30 (2H, м), 6,02 (1H, с), 7,22-7,36 (7H, м), 7,67-7,76 (2H, м).
MS(ESI,m/z):415(M+H)
[0225]
Пример 257
[Формула 82]
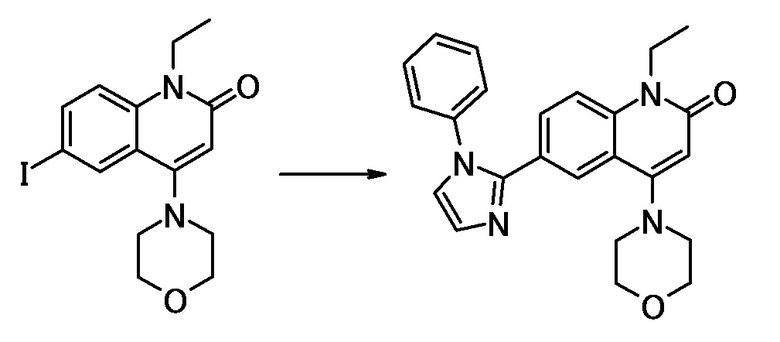
Смесь 50 мг 1-этил-6-йод-4-(морфолин-4-ил)хинолин-2(1H)-она, 28 мг 1-фенил-1H-имидазола, 50 мг йодида меди(I), 1,5 мг ацетата палладия и 2 мл N,N-диметилацетамида перемешивали в атмосфере азота с использованием микроволновой установки при 185°C в течение 30 минут. Реакционную смесь дополнительно перемешивали при 205°C в течение 20 минут. Затем реакционную смесь охлаждали до комнатной температуры, и отгоняли N,N-диметилацетамид при пониженном давлении. К полученному остатку добавляли метанол, и твердое вещество затем собирали фильтрацией. К полученному твердому веществу добавляли хлороформ, и полученную смесь кипятили с обратным холодильником в течение 10 минут. Затем реакционную смесь охлаждали до комнатной температуры, нерастворимые вещества удаляли фильтрацией, и фильтрат очищали колоночной хроматографией на силикагеле [хлороформ: метанол]. К полученному остатку добавляли гексан и этилацетат, и твердое вещество затем собирали фильтрацией с получением 10 мг 1-этил-4-(морфолин-4-ил)-6-(1-фенил-1H-имидазол-2-ил)хинолин-2(1H)-она в форме светло-коричневого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,16 (3H, т, J=6,9 Гц), 2,64-2,73 (4H, м), 3,47-3,57 (4H, м), 4,19 (2H, кв, J=7,0 Гц), 5,97 (1H, с), 7,23-7,38 (3H, м), 7,39-7,63 (6H, м), 7,74-7,85 (1H, м).
MS(ESI,m/z):401(M+H)
[0226]
Пример 258
[Формула 83]
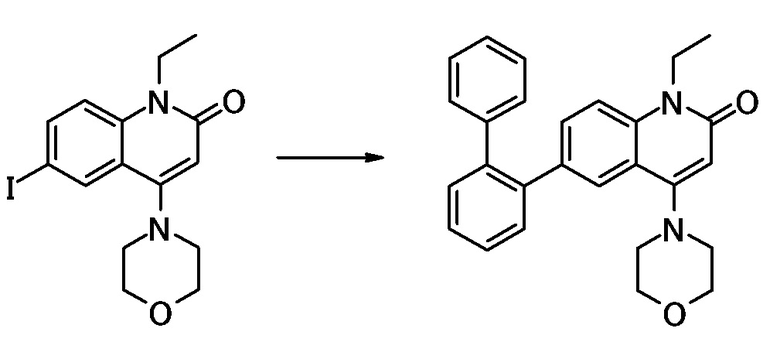
Смесь 50 мг 1-этил-6-йод-4-(морфолин-4-ил)хинолин-2(1H)-она, 28 мг бифенил-2-илбороновой кислоты, 6 мг трис(дибензилиденацетон)дипалладия(0), 85 мг карбоната цезия и 2 мл диоксана перемешивали в атмосфере азота с использованием микроволновой установки при 150°C в течение 30 минут. Затем реакционную смесь дополнительно перемешивали при 160°C в течение 30 минут. Затем реакционную смесь охлаждали до комнатной температуры, нерастворимые вещества удаляли фильтрацией, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [гексан: этилацетат]. К полученному остатку добавляли гексан и этилацетат, и твердое вещество затем собирали фильтрацией с получением 6 мг 6-(бифенил-2-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-она в форме белого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,19 (3H, т, J=6,9 Гц), 2,46-2,55 (4H, м), 3,50-3,58 (4H, м), 4,23 (2H, кв, J=7,0 Гц), 5,93 (1H, с), 7,13-7,22 (3H, м), 7,23-7,31 (3H, м), 7,42-7,53 (4H, м), 7,59-7,70 (2H, м).
MS(ESI,m/z):411(M+H)
[0227]
Примеры 259-276
В соответствии с методиками, описанными в настоящем изобретении, полученные соединения подвергали известной реакции, такой как реакция конденсации, присоединения, окисления, восстановления, перегруппировки, замещения, галогенирования, дегидратации или гидролиза, или использовали объединение этих реакций друг с другом, в соответствующих случаях, для получения соединений, представленных в таблицах 26-28.
[0228]
[Таблица 26]



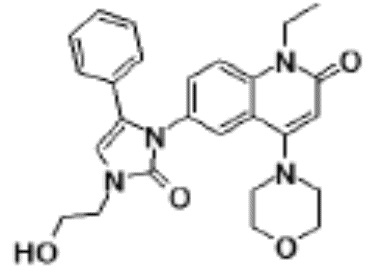
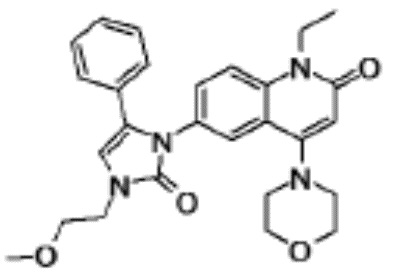


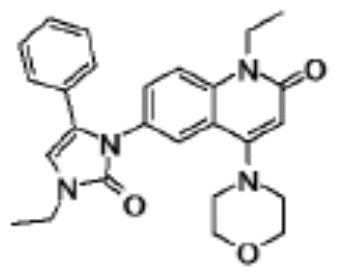
[0229]
[Таблица 27]
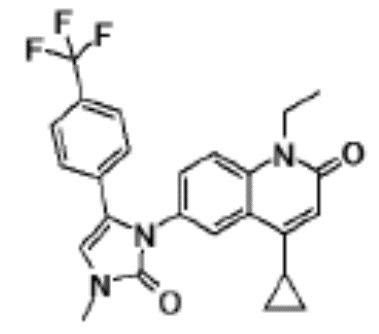
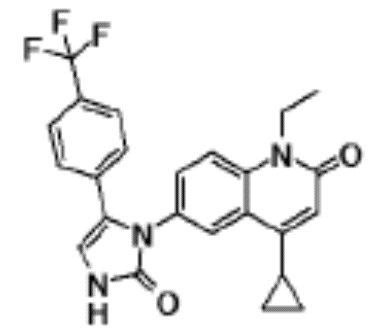
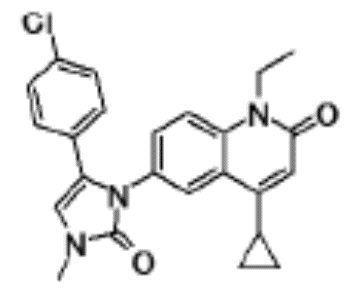
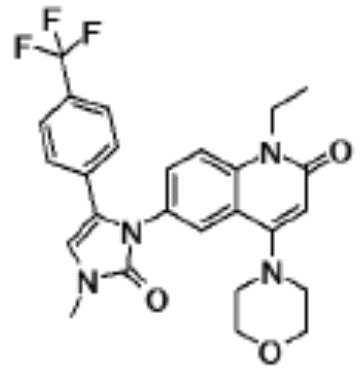


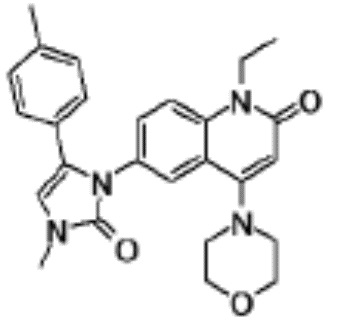
[0230]
[Таблица 28]
формула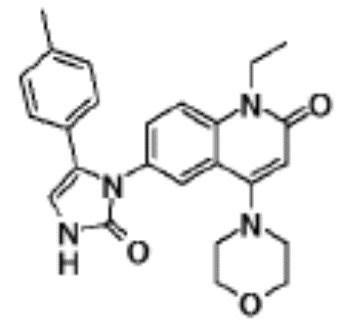
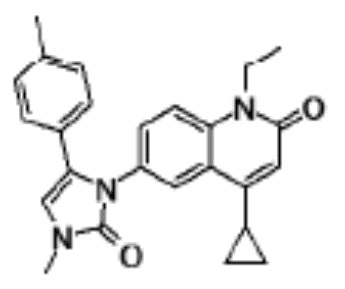
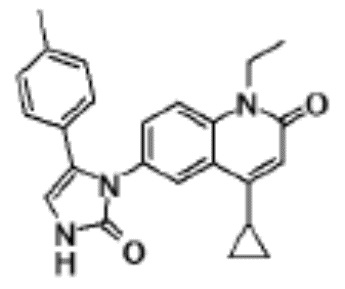
[0231]
Пример 277
[Формула 84]
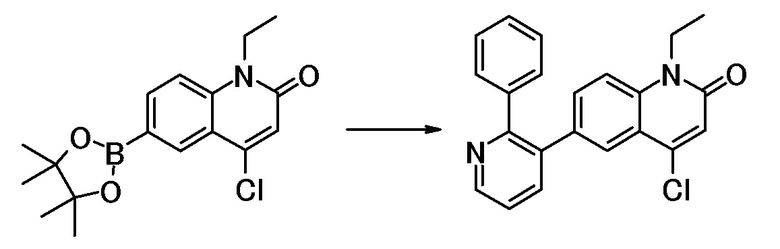
Смесь 0,17 г 4-хлор-1-этил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)хинолин-2(1H)-она, 0,11 г 3-бром-2-фенил-пиридина, 0,20 г ортофосфата калия, 33 мг бис(дитрет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 6 мл диоксана и 2 мл воды перемешивали в атмосфере азота при внешней температуре от 100°C до 110°C в течение 1 часа. Затем реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду. Органический слой отделяли, и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, и полученную смесь затем промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле [градиентное элюирование гексан: этилацетат=100: 0-60: 40] с получением 134 мг 4-хлор-1-этил-6-(2-фенилпиридин-3-ил)хинолин-2(1H)-она в форме белой пены.
1H-ЯМР (CDCl3) δ: 1,33 (3H, т, J=7,1 Гц), 4,31 (2H, кв, J=7,1 Гц), 6,89 (1H, с), 7,24-7,29 (3H, м), 7,32-7,42 (5H, м), 7,81 (1H, дд, J=7,6, 1,7 Гц), 7,94 (1H, д, J=2,2 Гц), 8,74 (1H, дд, J=4,8,1,7 Гц).
[0232]
Пример 278
[Формула 85]

Смесь 36 мг 4-хлор-1-этил-6-(2-фенилпиридин-3-ил)хинолин-2(1H)-она, 17 мг циклопропилборной кислоты, 43 мг ортофосфата калия, 8 мг бис(дитрет-бутил(4-диметиламинофенил)фосфин)-дихлорпалладия(II), 0,6 мл диоксана и 0,2 мл воды перемешивали с использованием микроволновой установки при 120°C в течение 15 минут. Затем реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду. Органический слой отделяли, и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, и растворитель затем отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле [градиентное элюирование гексан: этилацетат=100: 0-50: 50]. К полученному остатку добавляли гексан, и твердое вещество собирали фильтрацией с получением 3 мг 4-циклопропил-1-этил-6-(2-фенилпиридин-3-ил)хинолин-2(1H)-она в форме белого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,53-0,59 (2H, м), 0,81-0,92 (2H, м), 1,34 (3H, т, J=7,1 Гц), 1,71-1,80 (1H, м), 4,33 (2H, кв, J=7,3 Гц), 6,39-6,44 (1H, м), 7,20-7,49 (8H, м), 7,82 (1H, дд, J=7,6, 1,5 Гц), 7,87 (1H, д, J=2,2 Гц), 8,73 (1H, дд, J=4,6, 1,5 Гц).
[0233]
Пример 279
[Формула 86]

Смесь 30 мг 4-хлор-1-этил-6-(2-фенилпиридин-3-ил)хинолин-2(1H)-она, 0,7 мл N,N-диметилформамида, 35 мг карбоната калия и 21,5 мкл морфолина перемешивали с использованием микроволновой установки при 150°C в течение 5 минут. Затем реакционную смесь дополнительно перемешивали при 200°C в течение 40 минут. Затем реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду. Органический слой отделяли, и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, и растворитель затем отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле [градиентное элюирование гексан: этилацетат=100: 0-0: 100 → хлороформ: метанол=95: 5]. К полученному остатку добавляли гексан и этилацетат, и твердое вещество затем собирали фильтрацией с получением 8 мг 1-этил-4-(морфолин-4-ил)-6-(2-фенилпиридин-3-ил)хинолин-2(1H)-она в форме коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,38 (3H, т, J=7,1 Гц), 2,57-2,65 (4H, м), 3,57-3,66 (4H, м), 4,34 (2H, кв, J=7,2 Гц), 6,09 (1H, с), 7,20-7,29 (2H, м), 7,35-7,49 (6H, м), 7,61 (1H, дд, J=8,7, 2,1 Гц), 7,74 (1H, дд, J=7,6, 1,7 Гц), 8,73 (1H, дд, J=4,9, 1,7 Гц).
[0234]
Пример 280
[Формула 87]

Смесь 20 мг трет-бутил 2-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-1-фенилгидразинкарбоксилата, 0,5 мл диэтил метилмалоната и 1 мл 20% этанольного раствора этоксида натрия перемешивали с использованием микроволновой установки при 180°C в течение 3 минут. Затем реакционную смесь охлаждали до комнатной температуры, добавляли этилацетат и воду, и полученную смесь затем доводили до рН 1,0 с помощью 2 моль/л хлористоводородной кислоты. Органический слой отделяли, и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, и полученную смесь промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [градиентное элюирование хлороформ: метанол=100: 0-95: 5]. К полученному остатку добавляли этилацетат, и твердое вещество затем собирали фильтрацией с получением 6 мг 1-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-4-метил-2-фенилпиразолидин-3,5-диона в форме белого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,58-0,65 (2H, м), 0,95-1,03 (2H, м), 1,30 (3H, т, J=7,1 Гц), 1,64 (3H, д, J=7,8 Гц), 1,84-1,94 (1H, м), 3,47 (1H, кв, J=7,7 Гц), 4,27 (2H, кв, J=7,2 Гц), 6,44 (1H, д, J=1,2 Гц), 7,18-7,24 (1H, м), 7,31-7,39 (5H, м), 7,61 (1H, дд, J=9,1 Гц, 2,6 Гц), 7,94 (1H, д, J=2,4 Гц).
[0235]
Пример 281
[Формула 88]

Смесь 20 мг трет-бутил 2-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-1-фенилгидразинкарбоксилата, 0,5 мл диэтил диэтилмалоната и 1 мл 20% этанольного раствора этоксида натрия перемешивали с использованием микроволновой установки при 150°C в течение 3 минут. Затем реакционную смесь охлаждали до комнатной температуры, добавляли этилацетат и воду, и полученную смесь затем доводили до рН 1,0 с помощью 2 моль/л хлористоводородной кислоты. Органический слой отделяли, и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, и полученную смесь промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [градиентное элюирование хлороформ: метанол=100: 0-95: 5]. К полученному остатку добавляли диизопропиловый эфир, и твердое вещество затем собирали фильтрацией с получением 8 мг 1-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-4-этил-2-фенилпиразолидин-3,5-диона в форме светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,58-0,65 (2H, м), 0,95-1,02 (2H, м), 1,10-1,18 (3H, м), 1,30 (3H, т, J=7,2 Гц), 1,85-1,94 (1H, м), 2,15-2,24 (2H, м), 3,42 (1H, т, J=5,5 Гц), 4,27 (2H, кв, J=7,2 Гц), 6,42-6,45 (1H, м), 7,18-7,24 (1H, м), 7,31-7,40 (5H, м), 7,61 (1H, дд, J=9,1 Гц, 2,6 Гц), 7,95 (1H, д, J=2,4 Гц).
[0236]
Пример 282a, 282b
[Формула 89]

Смесь 56 мг 4-циклопропил-1-этил-6-(2-фенилгидразинил)-хинолин-2(1H)-она, 14 мкл 4-метилиденоксетан-2-она, 27 мкл триэтиламина и 1 мл хлороформа кипятили с обратным холодильником в течение 2 часов. Затем, реакционную смесь охлаждали до комнатной температуры, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [градиентное элюирование этилацетата: метанол=100: 0-95: 5] с получением 7 мг a) 4-циклопропил-1-этил-6-(3-метил-5-оксо-2-фенил-2,5-дигидро-1H-пиразол-1-ил)хинолин-2(1H)-она в форме белого твердого вещества, и 4 мг b) 4-циклопропил-1-этил-6-(5-метил-3-оксо-2-фенил-2,3-дигидро-1H-пиразол-1-ил)хинолин-2(1H)-она в форме белого твердого вещества.
a) 4-Циклопропил-1-этил-6-(3-метил-5-оксо-2-фенил-2,5-дигидро-1H-пиразол-1-ил)хинолин-2(1H)-он
1H-ЯМР (CDCl3) δ: 0,63-0,69 (2H, м), 0,99-1,05 (2H, м), 1,28 (3H, т, J=7,2 Гц), 1,91-2,00 (1H, м), 2,12 (3H, д, J=1,0 Гц), 4,26 (2H, кв, J=7,0 Гц), 5,61 (1H, д, J=0,7 Гц), 6,40 (1H, д, J=1,0 Гц), 7,21-7,39 (6H, м), 7,71 (1H, дд, J=9,3 Гц, 2,4 Гц), 7,95 (1H, д, J=2,4 Гц).
b) 4-Циклопропил-1-этил-6-(5-метил-3-оксо-2-фенил-2,3-дигидро-1H-пиразол-1-ил)хинолин-2(1H)-он
1H-ЯМР (CDCl3) δ: 0,64-0,70 (2H, м), 1,02-1,09 (2H, м), 1,30 (3H, т, J=7,1 Гц), 1,90-1,99 (1H, м), 2,14 (3H, с), 4,27 (2H, кв, J=7,0 Гц), 5,61-5,65 (1H, м), 6,44-6,48 (1H, м), 7,13 (1H, т, J=7,3 Гц), 7,22-7,42 (6H, м), 7,87 (1H, д, J=2,2 Гц).
[0237]
Пример 283
[Формула 90]

Смесь 40 мг 1-(4-циклопропил-1-этил-2-оксо-1,2-дигидро-хинолин-6-ил)-2-фенилэтан-1,2-диона, 1 мл уксусной кислоты, 89 мг ацетата аммония и 32 мкл ацетальдегида перемешивали с использованием микроволновой установки при 120°C в течение 5 минут. Затем реакционную смесь дополнительно перемешивали при 140°C в течение 5 минут. Затем реакционную смесь охлаждали до комнатной температуры, и добавляли этилацетат и насыщенный водный раствор гидрокарбоната натрия. Органический слой отделяли, и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, и полученную смесь промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле [градиентное элюирование этилацетата: метанол=100: 0-90: 10]. К полученному остатку добавляли диизопропиловый эфир, и твердое вещество затем собирали фильтрацией с получением 4,7 мг 4-циклопропил-1-этил-6-(2-метил-5-фенил-1H-имидазол-4-ил)хинолин-2(1H)-она в форме белого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,59-0,67 (2H, м), 0,75-0,85 (2H, м), 1,34 (3H, т, J=7,2 Гц), 1,79-1,90 (1H, м), 2,55 (3H, с), 4,33 (2H, кв, J=7,2 Гц), 6,36-6,42 (1H, м), 6,72 (1H, с), 7,20-7,41 (4H, м), 7,42-7,55 (1H, м), 7,75-7,79 (1H, м), 8,19-8,26 (1H, м).
[0238]
Пример 284
[Формула 91]

Смесь 27 мг 1-(4-циклопропил-1-этил-2-оксо-1,2-дигидро-хинолин-6-ил)-2-фенилэтан-1,2-диона и 1 мл полиэтиленгликоля 400 перемешивали с использованием микроволновой установки при 100°C в течение 5 минут. К реакционной смеси добавляли 5,2 мкл этан-1,2-диамина, и полученную смесь затем перемешивали с использованием микроволновой установки при 150°C в течение 7 минут. Затем реакционную смесь дополнительно перемешивали при 160°C в течение 10 минут. Затем реакционную смесь охлаждали до комнатной температуры, и добавляли этилацетат и воду. Органический слой отделяли, затем промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле [градиентное элюирование гексан: этилацетат=50: 50-0: 100]. К полученному остатку добавляли диизопропиловый эфир, и твердое вещество затем собирали фильтрацией с получением 2 мг 4-циклопропил-1-этил-6-(3-фенилпиразин-2-ил)хинолин-2(1H)-она в форме белого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,52-0,58 (2H, м), 0,77-0,85 (2H, м), 1,34 (3H, т, J=7,2 Гц), 1,65-1,75 (1H, м), 4,33 (2H, кв, J=7,2 Гц), 6,37-6,41 (1H, м), 7,31-7,41 (4H, м), 7,47-7,54 (2H, м), 7,86 (1H, дд, J=8,9 Гц, 2,1 Гц), 8,13 (1H, д, J=2,2 Гц), 8,63 (2H, дд, J=6,8 Гц, 2,4 Гц).
[0239]
Пример 285
[Формула 92]
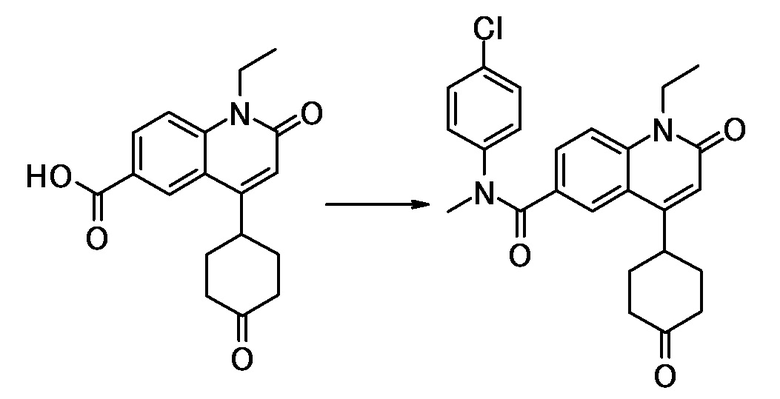
Смесь 72 мг 4-хлор-N-метиланилина, 0,27 мл триэтиламина и 216 мг бис(2-оксо-3-оксазолидинил)фосфинового хлорида добавляли к суспензии 134 мг 1-этил-2-оксо-4-(4-оксоциклогексил)-1,2-дигидрохинолин-6-карбоновой кислоты в 5 мл дихлорметана, и полученную смесь затем перемешивали при комнатной температуре в течение 9 часов. Затем к реакционной смеси добавляли 72 мг N-метил-4-хлоранилина, 0,27 мл триэтиламина и 216 мг бис(2-оксо-3- оксазолидинил)фосфинового хлорида, и полученную смесь перемешивали при комнатной температуре в течение 15 часов. Затем из полученной реакционной смеси отгоняли при пониженном давлении растворитель. Полученный остаток очищали колоночной хроматографией на силикагеле [этилацетат]. К полученному остатку добавляли диизопропиловый эфир и этилацетат, и твердое вещество затем собирали фильтрацией с получением 73 мг N-(4-хлорфенил)-1-этил-N-метил-2-оксо-4-(4-оксоциклогексил)-1,2-дигидрохинолин-6-карбоксамида в форме белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,32 (3H, т, J=7,2 Гц), 1,74-1,88 (2H, м), 1,95-2,04 (2H, м), 2,42-2,61 (4H, м), 3,07-3,17 (1H, м), 3,55 (3H, с), 4,30 (2H, кв, J=7,1 Гц), 6,55-6,58 (1H, м), 7,03 (2H, д, J=8,8 Гц), 7,22-7,33 (3H, м), 7,66 (1H, дд, J=8,9 Гц, 2,1 Гц), 7,71 (1H, д, J=1,7 Гц).
[0240]
Пример 286
[Формула 93]

Смесь 51 мг N-(4-хлорфенил)-1-этил-N-метил-2-оксо-4-(4-оксоциклогексил)-1,2-дигидрохинолин-6-карбоксамида, 8,8 мг боргидрида натрия и 1,0 мл метанола перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли этилацетат и 1 моль/л хлористоводородной кислоты. Органический слой отделяли, и водный слой экстрагировали этилацетатом. Органический слой объединяли с экстрактом, и полученную смесь промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [градиентное элюирование этилацетата: метанол=100: 0-90: 10]. К полученному остатку добавляли диизопропиловый эфир, и твердое вещество затем собирали фильтрацией с получением 41 мг N-(4-хлорфенил)-1-этил-4-(4-гидроксициклогексил)-N-метил-2-оксо-1,2-дигидрохинолин-6-карбоксамида в форме белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,32 (3H, т, J=7,2 Гц), 1,36-1,70 (6H, м), 2,09-2,20 (2H, м), 2,50-2,61 (1H, м), 3,54 (3H, с), 3,60-3,75 (1H, м), 4,29 (2H, кв, J=7,0 Гц), 6,51-6,55 (1H, м), 7,02 (2H, д, J=8,8 Гц), 7,20-7,35 (3H, м), 7,55 (1H, д, J=2,0 Гц), 7,72 (1H, дд, J=8,8 Гц, 2,0 Гц).
[0241]
Пример 287
[Формула 94]

Трет-бутил 4-(1-этил-6-(метил(4-метилфенил)карбамоил)-2-оксо-1,2-дигидрохинолин-4-ил)-3,6-дигидропиридин-1(2H)-карбоксилат получали из 4-хлор-1-этил-N-метил-N-(4-метилфенил)-2-оксо-1,2-дигидрохинолин-6-карбоксамида таким же методом, как метод в примере 5.
MS(ESI,m/z):502(M+H)
[0242]
Пример 288
[Формула 95]

Трет-бутил 4-(1-этил-6-(метил(4-метилфенил)карбамоил)-2-оксо-1,2-дигидрохинолин-4-ил)пиперидин-1-карбоксилат получали из трет-бутил 4-(1-этил-6-(метил(4-метилфенил)карбамоил)-2-оксо-1,2-дигидрохинолин-4-ил)-3,6-дигидропиридин-1(2H)-карбоксилата таким же методом, как метод в примере 6.
MS(ESI,m/z):504(M+H)
[0243]
Пример 289
[Формула 96]

1-Этил-N-метил-N-(4-метилфенил)-2-оксо-4-(пиперидин-4-ил)-1,2-дигидрохинолин-6-карбоксамид получали из трет-бутил 4-(1-этил-6-(метил(4-метилфенил)карбамоил)-2-оксо-1,2-дигидрохинолин-4-ил)пиперидин-1-карбоксилата таким же методом, как метод в примере 7.
MS(ESI,m/z):404(M+H)
[0244]
Пример 290
[Формула 97]

Смесь 50 мг 1-этил-N-метил-N-(4-метилфенил)-2-оксо-4-(пиперидин-4-ил)-1,2-дигидрохинолин-6-карбоксамида, 20 мкл ацетилхлорида, 0,1 мл триэтиламина и 1 мл дихлорметана перемешивали при комнатной температуре в течение 20 минут. Затем реакционную смесь очищали колоночной хроматографией на силикагеле [градиентное элюирование хлороформ: метанол=100: 0-80: 20]. К полученному остатку добавляли гексан и этилацетат, и твердое вещество затем собирали фильтрацией с получением 13 мг 4-(1-ацетилпиперидин-4-ил)-1-этил-N-метил-N-(4-метилфенил)-2-оксо-1,2-дигидрохинолин-6-карбоксамида в форме желтого твердого вещества.
1H-ЯМР (DMSO-D6) δ: 1,12-1,55 (7H, м), 2,05 (3H, с), 2,20 (3H, с), 2,57-2,69 (1H, м), 2,86-2,99 (1H, м), 3,10-3,23 (1H, м), 3,40 (3H, с), 3,87 (1H, д, J=13,9 Гц), 4,20 (2H, кв, J=6,9 Гц), 4,49 (1H, д, J=12,9 Гц), 6,37 (1H, с), 7,06-7,13 (4H, м), 7,52-7,62 (2H, м), 7,74 (1H, д, J=8,8 Гц).
[0245]
Пример 291
[Формула 98]
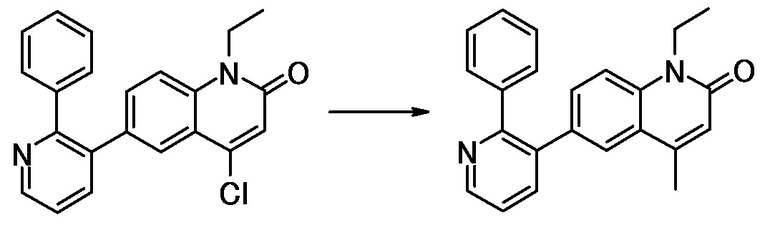
Смесь 30 мг 4-хлор-1-этил-6-(2-фенилпиридин-3-ил)хинолин-2(1H)-она, 10 мг метилборной кислоты, 35 мг ортофосфата калия, 6 мг бис(дитрет-бутил(4-диметиламинофенил)фосфин)дихлор-палладия(II), 0,5 мл диоксана и 0,2 мл воды перемешивали с использованием микроволновой установки при 120°C в течение 10 минут. Затем, реакционную смесь охлаждали до комнатной температуры. Реакционную смесь очищали хроматографией на силикагеле [градиентное элюирование гексан: этилацетат=100: 0-30: 70]. К полученному остатку добавляли гексан, и твердое вещество затем собирали фильтрацией с получением 5 мг 1-этил-4-метил-6-(2-фенилпиридин-3-ил)хинолин-2(1H)-она в форме белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,34 (3H, т, J=7,3 Гц), 2,21 (3H, д, J=1,0 Гц), 4,33 (2H, кв, J=7,3 Гц), 6,55 (1H, д, J=0,96 Гц), 7,23-7,32 (4H, м), 7,34-7,42 (4H, м), 7,48 (1H, д, J=1,9 Гц), 7,81 (1H, дд, J=7,8, 1,7 Гц), 8,73 (1H, дд, J=4,9, 1,7 Гц).
MS(ESI,m/z):341(M+H)
[0246]
Примеры 292-294
В соответствии с методиками, описанными в настоящем изобретении, полученные соединения подвергали известной реакции, такой как реакция конденсации, присоединения, окисления, восстановления, перегруппировки, замещения, галогенирования, дегидратации или гидролиза, или использовали объединение этих реакций друг с другом, в соответствующих случаях, для получения соединений, представленных в таблице 29.
[0247]
[Таблица 29]
формула


[0248]
Пример испытания 1
(Исследование связывания)
Для проведения исследования использовали BRD2 BD1, BRD3 BD1 и BRD4 BD1 (Cisbio), [Lys(Ac)5/8/12/16]-Histone H4(1-25)-GSGSK (Biotin) (далее называемый "Peptide-Biotin", AnaSpec) и набор для исследования связывания домена EPIgeneous (зарегистрированный товарный знак) Binding Domain Kit A (Cisbio). А именно, в каждую лунку 384-луночного планшета (Corning) добавляли 4 мкл BRD2 BD1, BRD3 BD1 или BRD4 BD1, которые доводили до концентрации 20 нмоль/л с помощью буфера для разбавления; 4 мкл 25 нмоль/л Peptide-Biotin; 2 мкл буфера для разбавления (Cisbio), содержащего диметилсульфоксид (DMSO) или испытуемое соединение, последовательно разбавленное с помощью DMSO; 5 мкл 2,5 нмоль/л стрептавидин-d2; и 5 мкл конъюгата антитела Anti-Gst-Eu+3+ Cryptate, разбавленного в 50 раз с помощью буфера для детектирования.
Кроме того, для проведения исследования использовали BRD2 BD2, BRD3 BD2 и BRD4 BD2 (Cisbio), Peptide-Biotin (AnaSpec) и набор для исследования связывания домена EPIgeneous (зарегистрированный товарный знак) Binding Domain Kit B (Cisbio). А именно, в каждую лунку 384-луночного планшета (Corning) добавляли 4 мкл BRD2 BD2, BRD3 BD2 или BRD4 BD2, которые доводили до концентрации 20 нмоль/л с помощью буфера для разбавления; 4 мкл 250 нмоль/л Peptide-Biotin; 2 мкл буфера для разбавления (Cisbio), содержащего DMSO или испытуемое соединение, последовательно разбавленное с помощью DMSO; 5 мкл 25 нмоль/л стрептавидин-XL665; 5 мкл конъюгата антитела Anti-Gst-Eu+3+ Cryptate, разбавленного в 50 раз с помощью буфера для детектирования.
Полученную смесь выдерживали при комнатной температуре в течение 20 часов, и затем измеряли интенсивность флуоресценции при 665 нм и 620 нм, используя планшет-ридер Envision (Perkin Elmer), и в результате рассчитывали для испытуемого соединения процент ингибирования (%) в отношении связывания бромодомена в бромодомен-содержащем белке с ацетилированным гистоном.
[0249]
Процент ингибирования связывания (%)=[1-{(интенсивность флуоресценции при 665 нм лунки с добавленным в нее испытуемым соединением)/(интенсивность флуоресценции при 620 нм лунки с добавленным в нее испытуемым соединением)}/{( интенсивность флуоресценции при 665 нм лунки с добавленным в нее DMSO)/(интенсивность флуоресценции при 665 нм лунки с добавленным в нее DMSO)}] x 100
[0250]
Кроме того, используя программное обеспечение Graphpad prism 5 (GraphPad software), рассчитывали концентрацию при 50% ингибировании [IC50 (нмоль/л)] методом нелинейного регрессионного анализа (log (ингибитор) против ответной реакции - переменный угол наклона (четыре параметра)). Результаты представлены в таблице 30.
[0251]
[Таблица 30]
[0252]
Что касается других испытуемых соединений, то каждое соединение разбавляли с помощью DMSO до конечной концентрации 300 нмоль/л таким же методом, как описанный выше, и рассчитывали для каждого испытуемого соединения при концентрации 300 нмоль/л процент ингибирования связывания (%) в отношении связывания бромодомена в бромодомен-содержащем белке с ацетилированным гистоном. Результаты представлены в таблице 31.
[0253]
[Таблица 31]
Анализ приведенных выше результатов показал, что соединение примера настоящего изобретения обладает способностью ингибировать связывание бромодомена в бромодомен-содержащем белке с ацетилированным гистоном.
[0254]
Пример испытания 2
(Испытание воздействия на рост клеток, проводимое на раковых клетках)
Для проведения испытания использовали клетки линии Ty-82 (JCRB) недифференцированной тимомы человека, клетки линии MV4-11 (ATCC), MOLM-13 (ATCC) и RS4-11 (ATCC) острого миелолейкоза человека, клетки линии Raji (JCRB) лимфомы человека, клетки линии Hela (JCRB) цервикальной эпидермоидной карциномы человека, клетки линии A549 (ATCC) аденокарциномы легкого человека, клетки линии DLD1 (DS Pharma) и HCT116 (DS Pharma) рака толстой кишки человека и клетки линии MIAPACA-2 (ATCC) рака поджелудочной железы человека.
В лунке планшета высевали каждую линию клеток Ty-82, MV4-11, MOLM-13, RS4-11, Raji и DLD1, которая содержала среду Онкологический институт имени Розуэлла Парка (RPMI)-1640, дополненную пенициллином/стрептомицином и фетальной бычьей сывороткой (FBS) с конечной концентрацией 10%. Клетки линии Hela высевали в модифицированной по способу Дульбекко среде Игла (DMEM), дополненной пенициллином/стрептомицином и FBS с конечной концентрацией 10%. Каждые из клеток линии A549 и MIAPACA-2 высевали в лунке планшета, которая содержала минимально обогащенную среду (MEM), дополненную пенициллином/стрептомицином и FBS с конечной концентрацией 10%. Линию клеток HCT116 высевали в лунке планшета, которая содержала среду McCoy’s 5A, дополненную пенициллином/стрептомицином и FBS с конечной концентрацией 10%.
Затем в каждую лунку планшета, в которой были посеяны клетки, добавляли среду, содержащую испытуемое соединение, последовательно разбавленное с помощью DMSO, или DMSO, и полученную смесь затем культивировали при 37°C и 5% CO2 в течение от 3 до 5 дней. К культуре клеток добавляли реакционный раствор Cell Titer Glo (Promega), и затем измеряли величину люминесценции, используя планшет-ридер Envision (PerkinElmer). Так как величина люминесценции пропорциональна концентрации аденозинтрифосфата (ATP) в клетках, величину люминесценции использовали в качестве показателя числа живых клеток. Процент ингибирования роста клеток для испытуемого соединения при каждой его концентрации рассчитывали согласно следующему уравнению.
[0255]
Процент ингибирования роста клеток (%)=(величина люминесценции в лунке с добавленным испытуемым соединением)/(величина люминесценции в лунке с добавленным DMSO) x 100
[0256]
Строили графическую зависимость процента ингибирования роста клеток для испытуемого соединения при каждой его концентрации методом нелинейного регрессионного анализа (log (ингибитор) против ответной реакции - переменный угол наклона (четыре параметра)], используя программное обеспечение Graphpad prism 5, и затем рассчитывали концентрацию соединения, при которой достигалось 50% ингибирование роста клеток [GI50 (нмоль/л)].
Величины GI50 (нмоль/л) в случае клеток линии Ty-82, MV4-11 и MOLM-13 представлены в таблице 32.
[0257]
[Таблица 32]
[0258]
Величины GI50 (нмоль/л) в случае других клеточных линий представлены в таблице 33.
[0259]
[Таблица 33]
[0260]
Кроме того, проводили испытание соединения из примера 14 на его воздействие на клеточный рост при использовании различных типов клеточных линий.
Все клеточные линии, которые не относятся к указанным ниже клеткам, высевали в лунке планшета, которая содержала среду RPMI-1640, дополненную пенициллином/стрептомицином и FBS с конечной концентрацией 10%. Клетки линии VCaP (ATCC) рака предстательной железы человека высевали в лунке планшета, которая содержала среду DMEM, дополненную пенициллином/стрептомицином и FBS с конечной концентрацией 10%. Клетки линии OCI-Ly7 (DSMZ) лимфомы человека высевали в лунке планшета, которая содержала среду Дульбекко, модифицированную по способу Исков (IMDM), дополненную гентамицином с конечной концентрацией 0,05 мг/мл и FBS с конечной концентрацией 20%. Затем в каждую лунку планшета, в которой были посеяны клетки, добавляли среду, содержащую испытуемое соединение, последовательно разбавленное с помощью DMSO, или DMSO, и полученную смесь затем культивировали при 37°C и 5% CO2 в течение 3 дней. К культуре клеток добавляли реакционный раствор Cell Titer Glo (Promega), и полученную смесь культивировали в течение 4 часов. Затем, используя многорежимный планшет-ридер Enspire (PerkinElmer), измеряли величину флуоресценции при длине волны возбуждения 531 нм и величину флуоресценции при длине волны 615 нм. Так как величина флуоресценции пропорциональна концентрации флуоресцентного вещества резоруфина, который образуется из резазурина, используемого в качестве окислительно-восстановительного красителя в живых клетках, величину флуоресценции использовали в качестве показателя числа живых клеток. Процент ингибирования роста клеток для испытуемого соединения при каждой его концентрации рассчитывали согласно следующему уравнению.
[0261]
Процент ингибирования роста клеток (%)=(величина люминесценции в лунке с добавленным испытуемым соединением)/(величина люминесценции в лунке с добавленным DMSO) × 100
[0262]
Строили графическую зависимость процента ингибирования роста клеток для испытуемого соединения при каждой его концентрации методом нелинейного регрессионного анализа (log (ингибитор) против ответной реакции - переменный угол наклона (четыре параметра)], используя программное обеспечение Oncotest Data Warehouse Software, и затем рассчитывали величину GI50 (нмоль/л). Результаты представлены в таблице 34.
[0263]
[Таблица 34]
[0264]
Анализ приведенных выше результатов показал, что соединение примера настоящего изобретения проявляет ингибирующую активность в отношении роста различных типов раковых клеток.
[0265]
Пример испытания 3
(Испытание соединений на их лечебное воздействие с использованием экспериментальных моделей мышей с подкожно трансплантированными раковыми клетками линии MV4-11)
Клетки линии MV4-11 (ATCC) острого миелолейкоза человека суспендировали в смеси среды RPMI-1640 и матригеля (Corning), и полученную смесь затем подкожно трансплантировали самкам мышей линии BALB/c nu/nu (CLEA Japan, Inc.) в возрасте 6 недель. После подтверждения того, что средний объем опухоли превышал 200 мм3, испытуемое соединение растворяли в растворителе (0,5% водный раствор метилцеллюлозы или вода, содержащая 1 эквивалент хлористоводородной кислоты), и полученный раствор затем перорально вводили мышам в суточной дозе 10 и 30 мг/кг один раз в сутки в течение 14 дней. В качестве отрицательного контроля использовали группу, в которой вводили растворитель, включающий 0,5% водный раствор метилцеллюлозы. Диаметр опухоли измеряли ежедневно, и вычисляли объем опухоли. Объем опухоли рассчитывали путем измерения длинной оси и короткой оси опухоли и использования следующего уравнения.
[0266]
Объем опухоли (мм3)=[длинная ось (мм) × короткая ось (мм) × короткая ось (мм)]/2
[0267]
T/C (%) рассчитывали из среднего объема опухоли в каждой группе в соответствии со следующим уравнением, и затем оценивали лечебные воздействия.
T/C (%)=[1 - (средний объем опухоли в группе, в которой вводили лекарственное средство)/(средний объем опухоли в группе, в которой вводили растворитель)] × 100%
Результаты представлены в таблице 35.
[0268]
[Таблица 35]
[0269]
Кроме того, используя описанные выше экспериментальные модели на мышах, оценивали лечебные воздействия при внутривенном введении.
Клетки линии MV4-11 (ATCC) острого миелолейкоза человека суспендировали в смеси среды RPMI-1640 и матригеля (Corning), и полученную смесь затем подкожно трансплантировали самкам мышей линии BALB/c nu/nu (CLEA Japan, Inc.) в возрасте 6 недель. После подтверждения того, что средний объем опухоли превышал 200 мм3, испытуемое соединение растворяли в растворителе (физиологический раствор, содержащий 1 эквивалент хлористоводородной кислоты), и полученный раствор затем внутривенно вводили мышам в суточной дозе 10 и 30 мг/кг один раз в сутки в течение 25 дней. В качестве отрицательного контроля использовали группу, в которой вводили растворитель, включающий физиологический раствор. Диаметр опухоли измеряли ежедневно, и вычисляли объем опухоли. Объем опухоли и T/C (%) рассчитывали таким же способом, как описано выше, и затем оценивали лечебные воздействия.
Результаты представлены в таблице 36.
[0270]
[Таблица 36]
[0271]
Анализ приведенных выше результатов показал, что соединения примеров настоящего изобретения обладают ингибирующим воздействием на рост опухоли в описанных выше моделях, и было очевидно, что соединения по настоящему изобретению могут применяться в качестве противоопухолевых средств.
[0272]
Пример испытания 4
(Подтверждение фармакологического воздействия испытуемых соединений на раковые клетки)
Известно, что противоопухолевое действие ингибитора бромодомена связано с белком c-Myc. Смотрите, например, непатентный документ 3: Delmore J.E. et al., Cell, Vol. 146, pp. 904 - 917, 2011,
В соответствии с методом, описанным в непатентном документе 3, способность соединения настоящего примера ингибировать экспрессию белка c-Myc в раковых клетках оценивали методом вестерн-блоттинга.
Клетки линии Ty-82 (JCRB) недифференцированной тимомы человека, использовавшиеся при оценке, высевали в 6-луночном планшете, в котором содержалась среда RPMI-1640, дополненная пенициллином/стрептомицином и FBS с конечной концентрацией 10%. В каждую лунку 6-луночного планшета, в котором были посеяны клетки, добавляли среду, содержащую испытуемое соединение, последовательно разбавленное диметилсульфоксидом (DMSO), или DMSO, и полученную смесь культивировали при 37°C и 5% CO2 в течение 24 часов. Затем клетки извлекали и промывали с помощью PBS. После чего к полученным клеткам добавляли буфер для лизиса (разбавленный в 10 раз буфер для лизиса клеток Cell Lysis Buffer (10X) (CST Japan), к которому добавляли коктейль ингибиторов протеазы и фосфатазы Halt (Thermofisher Scientific)). Описанную выше суспензию клеток подвергали ультразвуковой обработке с целью дезинтеграции клеток, и затем центрифугировали для извлечения надосадочной жидкости. Добавляли буфер для приготовления образца, и полученную смесь нагревали при 95°C в течение 5 минут.
[0273]
Образец, приготовленный из описанной выше надосадочной жидкости, загружали при массе белка 10 мкг/дорожка на гель XV PANTERA GEL 7,5% - 15% (D.R.C), и затем проводили электрофорез. Подвергнутый электрофорезу белок считывали на мембране транскрипции и затем инокулировали с помощью антитела против-Myc (CST, Catalog No. 9402) и затем с помощью IRDye® 680LT ослиного анти-кроличьего IgG (H+L) (LI-COR). Используя Odessey (LI-COR), измеряли интенсивность флуоресценции при длине волны возбуждения 700 нм, и затем количественно определяли уровень экспрессии белка c-Myc.
Когда соединения примера 14, примера 17 и примера 245 использовали при концентрации 100 нмоль/л, уровень экспрессии c-Myc значимо снижался.
[0274]
Пример испытания 5
(Анализ флуктуация экспрессии генов c-Myc, IL-7R и HEXIM1 в клетках линии MV4-11)
Известно, что экспрессия генов c-Myc и α-субъединицы рецептора интерлейкина-7 (IL-7R) снижается в результате обработки с помощью ингибитора бромодомена, в то время как экспрессия гексаметилен бис ацетамид индуцибельного гена 1 (HEXIM1) увеличивается. Смотрите, например, непатентный документ 4: Dyana T. Saenz et al., Leukemia, Vol. 31, pp. 678 to 687, 2017,
Флуктуации экспрессии генов c-Myc, IL-7R и HEXIM1 в клетках линии MV4-11 (ATCC), обработанных испытуемым соединением, исследовали методом полимеразной цепной реакции с обратной транскриптазой (RT-PCR).
Клетки линии MV4-11 культивировали в течение 6 часов в среде RPMI-1640, дополненной пенициллином/стрептомицином и FBS с конечной концентрацией 10%, в которую добавляли соединение примера 14 в концентрации 10 нмоль/л, 30 нмоль/л или 100 нмоль/л. С другой стороны, формировали не подвергавшуюся обработке группу (без обработки) путем культивирования клеток линии MV4-11 в течение 6 часов в описанной выше среде, в которую соединение примера 14 не добавляли. Используя устройство Rneasy (зарегистрированный товарный знак) (Qiagen), из описанных выше клеток линии MV4-11 извлекали РНК в соответствии с руководством по эксплуатации, прилагаемым к упомянутому выше устройству. К клеткам добавляли буфер RLT, и затем клетки дезинтегрировали. После чего, лизат непосредственно добавляли в центрифужную колонку QIAshredder, используя пипетку, и затем центрифугировали при 20000 g в течение 2 минут. Полученный продукт добавляли в центрифужную колонку для удаления геномной ДНК, и затем центрифугировали при 8000 g в течение 1 минуты, и затем к полученному продукту добавляли этанол. Затем полученную смесь добавляли в центрифужную колонку RNeasy, и промывали с помощью буфера RW1 и буфера RPE. После этого, к полученному продукту добавляли не содержащую рибонуклеазу воду (RNase-Free Water) для извлечения. Затем, используя набор реагентов PrimeScript RT (Takara), проводили реакцию обратной транскрипции при 42°C в течение 30 минут, и затем инактивировали фермент при 95°C в течение 5 минут, для того чтобы получить комплементарную ДНК. Полученную кДНК использовали в качестве матричной ДНК, и проводили исходную денатурацию при 95°C в течение 30 секунд, и использовали описанные ниже праймеры. Затем проводили 40 циклов реакции ПЦР (цикл, включающий 95°C - 5 секунд и 60°C - 30 секунд). Вслед за этим измеряли полученный продукт реакции.
[0275]
Праймер GAPDH: PrimePCR SYBR (зарегистрированный товарный знак) Green Assay: GAPDH, человеческий (BioRad)
Праймер c-Myc: PrimePCR SYBR (зарегистрированный товарный знак) Green Assay: MYC, человеческий (BioRad)
Праймер IL-7R: PrimePCR SYBR (зарегистрированный товарный знак) Green Assay: IL7R, человеческий (BioRad)
Праймер HEXIM1: PrimePCR SYBR (зарегистрированный товарный знак) Green Assay: HEXIM1, человеческий (BioRad)
[0276]
Кроме того, оценивали уровень экспрессии GAPDH (глицеральдегид-3-фосфатдегидрогеназы) в качестве конститутивного гена. Рассчитывали отношение уровня экспрессии мРНК каждого из c-Myc, IL-7R и HEXIM1 к уровню экспрессии GAPDH, и затем количественно определяли уровень экспрессии каждого гена (относительный уровень экспрессии). В этой RT-PCR, использовали SYBR (зарегистрированный товарный знак) Premix Ex Taq II (Takara).
Результаты, приведенные на фигурах 1-3, позволяют подтвердить то, что в случае обработки клеток линии MV4-11 с помощью соединения примера 14, экспрессия c-Myc и IL-7R уменьшалась в зависимости от концентрации соединения, в то время как экспрессия HEXIM1 увеличивалась.
[0277]
Пример испытания 6
(Анализ флуктуация внутриопухолевой экспрессии гена c-Myc с использованием экспериментальных моделей мышей с подкожно трансплантированными раковыми клетками линии MV4-11)
С использованием метода RT-PCR проводили анализ флуктуации внутриопухолевой экспрессии гена c-Myc в экспериментальных моделях мышей с подкожно трансплантированными раковыми клетками линии MV4-11, которым вводили испытуемое соединение.
Соединение примера 14 растворяли в растворителе (0,5% водный раствор метилцеллюлозы или вода, содержащая 1 эквивалент хлористоводородной кислоты), и полученный раствор затем перорально вводили мышам в дозе 30 мг/кг. В качестве отрицательного контроля использовали группу, в которой вводили растворитель (плацебо), включающий 0,5% водный раствор метилцеллюлозы. Кроме того, испытуемое соединение растворяли в растворителе (физиологический раствор, содержащий 1 эквивалент хлористоводородной кислоты), и полученный раствор затем внутривенно вводили мышам в суточной дозе 30 мг/кг. В качестве отрицательного контроля использовали группу, в которой вводили растворитель (плацебо), включающий физиологический раствор. У мышей с подкожно трансплантированными раковыми клетками линии MV4-11, которым перорально или внутривенно вводили испытуемое соединение, иссекали опухоль через 1, 3, 6 и 24 часа после введения. Иссеченную опухоль измельчали в замороженном состоянии, используя измельчитель Multi-beads Shocker (Yasui Kikai Corporation). Используя устройство Rneasy (Qiagen), из измельченного образца опухоли извлекали РНК в соответствии с руководством по эксплуатации, и затем приготавливали комплементарную ДНК, используя набор реагентов PrimeScript RT (Takara). Проводили реакцию ПЦР таким же методом, как в примере испытания 5, и затем оценивали флуктуацию экспрессии генов GAPDH и c-Myc в опухоли.
Результаты, приведенные на фигурах 4-5, позволяют подтвердить то, что внутриопухолевая экспрессия гена c-Myc снижалась в результате введения соединения примера 14.
[0278]
Пример испытания 7
(Испытание на крысах токсичности внутривенного введения)
Ранее сообщалось, что пероральное введение ингибитора бромодомена приводит к снижению массы тела. Кроме того, также сообщалось о том, что активность и площадь под кривой концентрации ингибитора бромодомена в крови от времени (AUC) коррелирует с процентом потери массы тела. Более того, дополнительно сообщалось, что ингибирование BRD4 вызывает нарушения в эпителиальных стволовых клетках желудочно-кишечного тракта. Смотрите, например, непатентный документ 5: P. Newham et al., "In vivo and in vitro models of bromodomain and extraterminal domain inhibitor-induced intestinal stem cell loss and villous atrophy reveal differential human vs pre-clinal species sensitivity", Basel Life Sciences Week 2015, Reference Document for Poster Session, September 21, 2015).
Принимая во внимание описанные выше результаты исследований, соединение настоящего примера вводили крысам путем повторяющегося внутривенного введения, и затем оценивали влияние соединения на массу тела и пищеварительный тракт.
Соединение примера 14 растворяли в растворителе (физиологический раствор, содержащий 1 эквивалент хлористоводородной кислоты), и полученный раствор затем внутривенно вводили самцам крыс линии SD (Charles River Laboratories Japan) в возрасте 6 недель в дозе 30 и 60 мг/кг один раз в сутки в течение 7 дней. В качестве отрицательного контроля использовали группу, в которой вводили растворитель, представляющий собой физиологический раствор. На момент последнего введения, измеряли концентрацию соединения примера 14 в плазме. Полученные результаты позволяли подтвердить, что концентрация соединения в плазме возрастала пропорционально применяемой дозе. Более того, в период введения соединения не наблюдалась потеря массы тела. Кроме того, на следующий день после последнего введения соединения, проводили медико-патологическую оценку. В результате, не было обнаружено нарушений в эпителиальных клетках желудочно-кишечного тракта, в том числе в эпителиальных стволовых клетках желудочно-кишечного тракта.
В случае использования соединение примера 14, снижение массы тела не наблюдалось при площади AUC, которая была в 3,8 раза выше, чем площадь AUC после внутривенного введения в примере испытания 3. В непатентном документе 4, сообщалось, что ингибирование BRD4 вызывает нарушения в эпителиальных стволовых клетках желудочно-кишечного тракта. Однако, было однозначно показано, что такие гастроинтестинальные эпителиальные нарушения не возникают в результате внутривенного введения соединения примера 14.
Промышленная применимость
[0279]
Противоопухолевое средство и ингибитор бромодомена, которые представлены формулой [1], обладают высокой ингибирующей активностью в отношении бромодомена и могут применяться в качестве лечебных средств при предотвращении и/или терапии опухолей, ассоциированных с бромодоменом, и других подобных опухолей.
| название | год | авторы | номер документа |
|---|---|---|---|
| АЗОТСОДЕРЖАЩЕЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 2016 |
|
RU2720205C2 |
| МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2005 |
|
RU2528046C2 |
| МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2005 |
|
RU2556984C2 |
| СПОСОБ МОДУЛЯЦИИ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2005 |
|
RU2525115C2 |
| МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2005 |
|
RU2382779C2 |
| МОДУЛЯТОРЫ АТФ-СВЯЗЫВАЮЩИХ ТРАНСПОРТЕРОВ | 2010 |
|
RU2552353C2 |
| ХИНОЛИНИЛ-СОДЕРЖАЩЕЕ СОЕДИНЕНИЕ И ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2020 |
|
RU2803116C2 |
| ПРОИЗВОДНЫЕ ТИЕНО[2,3-с]ХИНОЛИНА-4-ОНА, ПОЛЕЗНЫЕ ПРИ ЛЕЧЕНИИ РВК-ЗАВИСИМОГО ЗАБОЛЕВАНИЯ | 2011 |
|
RU2574398C2 |
| СОЕДИНЕНИЯ ДЛЯ ИНГИБИРОВАНИЯ КИНАЗЫ EGFR, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2020 |
|
RU2832925C2 |
| НОВОЕ ПРОИЗВОДНОЕ АМИНА ИЛИ ЕГО СОЛЬ | 2013 |
|
RU2668550C2 |


Группа изобретений относится к области медицины и фармацевтики, а именно к противоопухолевому средству и ингибитору бромодомена, включающим соединение, представленное формулой 1 (заместители определены в формуле изобретения):
[Формула 1]

которое обладает высокой ингибирующей активностью в отношении бромодомена и может применяться в качестве лекарственных средств при предотвращении и/или терапии опухоли, ассоциированной с бромодоменом, и другой подобной опухоли. Группа изобретений обеспечивает создание противоопухолевого средства, которое может применяться в качестве лекарственного средства при ассоциированных с бромодоменом заболеваниях или состояниях. 2 н. и 8 з.п. ф-лы, 5 ил., 36 табл., 7 пр.
1. Противоопухолевое средство, включающее соединение, представленное следующей формулой [1], или его соль:
[Формула 1]
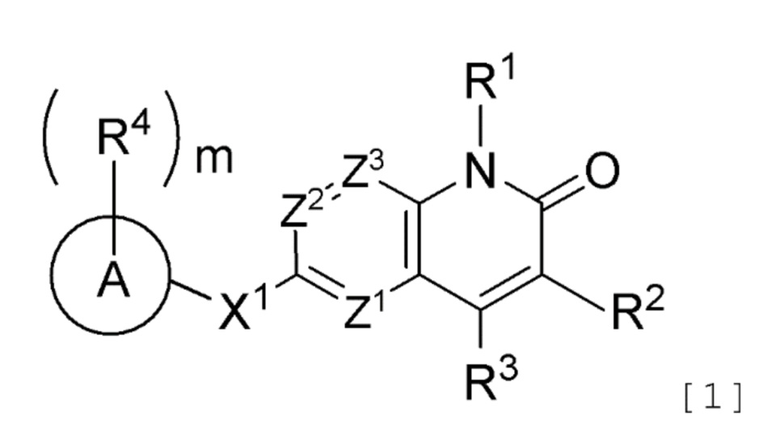
где R1 представляет C1-6 алкильную группу;
R2 представляет атом водорода;
R3 представляет:
C1-6 алкильную группу,
C3-8 циклоалкильную группу, необязательно замещенную гидроксильной группой,
пиперидинильную группу, необязательно замещенную ацильной группой или C1-6 алкильной группой, необязательно замещенной гидроксильной группой, или
морфолинильную группу;
Z1, Z2 and Z3, каждый представляет группу, представленную формулой CR5 (где R5 представляет атом водорода);
X1 представляет
группу, представленную формулой N(R7)C(=O) (где атом азота связан с кольцом A, и R7 представляет C1-6 алкильную группу; или R7 представляет, вместе с одним заместителем R4 кольца A, C2-4 алкиленовую группу), или
дигидроксоимидазол-1,5-диильную группу, необязательно замещенную одной или более группами, выбранными из группы, содержащей C1-6 алкильную группу, оксогруппу и C1-6 алкильную группу, которая замещена гидроксильной группой или морфолинильной группой,
имидазол-1,2-диильную группу, которая необязательно замещена одной или несколькими группами, выбранными из группы, состоящей из C1-6 алкильной группы, оксогруппы или C1-6 алкильной группы, которая замещена гидроксильной группой или морфолинильной группой,
1,2,4-триазол-1,5-диильную группу, необязательно замещенную C1-6 алкильной группой,
1H-пиразол-4,5-диильную группу, необязательно замещенную C1-6 алкильной группой,
оксопирролидин-1,2-диильную группу,
диоксотриазолидин-1,2-диильную группу,
диоксопиразолидин-1,2-диильную группу, необязательно замещенную C1-6 алкильной группой,
оксопиразолин-1,2-диильную группу, необязательно замещенную C1-6 алкильной группой,
пиридин-2,3-диильную группу, или
пиразин-2,3-диильную группу;
кольцо A представляет фенильную группу;
m число R4, которые являются одинаковыми или различными, каждый представляет атом галогена, C1-6 алкильную группу, необязательно замещенную одним или более атомами галогена,
C2-5 алкиленовую группу, образованную совместно двумя смежными R4,
C2-4 алкиленовую группу, образованную одним R4 совместно с R7; и
m представляет целое число от 0 до 2.
2. Противоопухолевое средство по п. 1, где
R3 представляет
C3-8 циклоалкильную группу, необязательно замещенную гидроксильной группой,
пиперидинильную группу, необязательно замещенную ацильной группой или C1-6 алкильной группой, необязательно замещенной гидроксильной группой, или
морфолинильную группу.
3. Противоопухолевое средство по п. 1 или 2, где R3 представляет любую одну из следующих гетероциклических групп:
[Формула 2]

где R9 представляет атом водорода, ацильную группу или C1-6 алкильную группу, необязательно замещенную одной или более гидроксильными группами, и * обозначает место присоединения.
4. Противоопухолевое средство по любому одному из пп. 1-3, где соединение представлено следующей формулой [1-1]:
[Формула 3]

где R1 представляет C1-6 алкильную группу;
R3a представляет
C1-6 алкильную группу,
C3-8 циклоалкильную группу, необязательно замещенную гидроксильной группой, или
пиперидинильную группу, необязательно замещенную ацильной группой или C1-6 алкильной группой, необязательно замещенной гидроксильной группой, или
морфолинильную группу;
кольцо A1 представляет фенильную группу;
R7a представляет C1-6 алкильную группу; или
R7a представляет, вместе с одним заместителем R4a кольца A1, C2-3 алкиленовую группу,
m1 число R4a, которые являются одинаковыми или различными, каждый представляет атом галогена, C1-3 алкильную группу, необязательно замещенную одним или более атомами галогена, C2-5 алкиленовую группу, образованную совместно двумя смежными R4a,
C2-3 алкиленовую группу, образованную одним R4a совместно с R7a,
и
m1 представляет целое число от 0 до 2.
5. Противоопухолевое средство по любому одному из пп. 1-3, где соединение представлено формулой [1-2]:
[Формула 4]
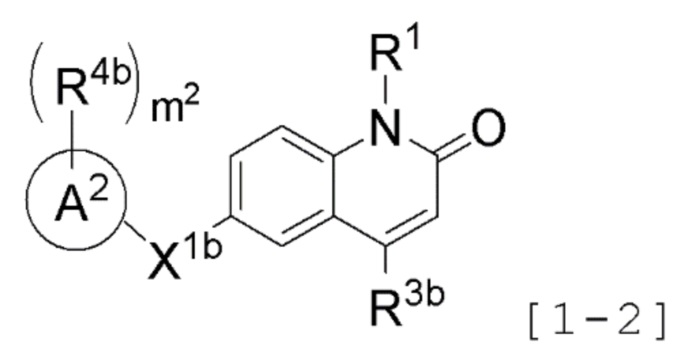
где R1 представляет C1-6 алкильную группу;
R3b представляет C1-6 алкильную группу,
C3-8 циклоалкильную группу, необязательно замещенную гидроксильной группой,
пиперидинильную группу, необязательно замещенную ацильной группой или C1-6 алкильной группой, необязательно замещенной гидроксильной группой, или
морфолинильную группу;
X1b представляет дигидрооксоимидазол-1,5-диильную группу, необязательно замещенную одной или более группами, выбранными из группы, содержащей C1-6 алкильную группу, оксогруппу и C1-6 алкильную группу, которая замещена гидроксильной группой или морфолинильной группой;
кольцо A2 представляет фенильную группу;
m2 число R4b, которые являются одинаковыми или различными, каждый представляет атом галогена или C1-6 алкильную группу, необязательно замещенную одним или более атомами галогена; и
m2 представляет целое число от 0 до 2.
6. Противоопухолевое средство по п. 1, где соединение представляет собой, по меньшей мере, одно соединение, выбранное из группы, состоящей из следующих соединений:
1-этил-4-(1-этилпиперидин-4-ил)-N-метил-2-оксо-N-фенил-1,2-дигидрохинолин-6-карбоксамид,
6-(3,4-дигидрохинолин-1(2H)-илкарбонил)-1-этил-4-(1-метил-пиперидин-4-ил)хинолин-2(1H)-он,
1-этил-N-метил-N-(4-метилфенил)-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид,
N-(2,3-дигидро-1H-инден-5-ил)-1-этил-N-метил-4-(1-метил-пиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид,
6-(5-(4-хлорфенил)-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-он,
6-(5-(4-хлорфенил)-3-метил-2-оксо-2,3-дигидро-1H-имидазол-1-ил)-1-этил-4-(морфолин-4-ил)хинолин-2(1H)-он,
1-этил-4-(морфолин-4-ил)-6-(2-оксо-5-фенил-3-(пропан-2-ил)-2,3-дигидро-1H-имидазол-1-ил)хинолин-2(1H)-он,
1-(4-циклопропил-1-этил-2-оксо-1,2-дигидрохинолин-6-ил)-2-фенил-1,2,4-триазолидин-3,5-дион,
4-(1-ацетилпиперидин-4-ил)-1-этил-N-метил-N-(4-метилфенил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид,
1-этил-N-(3-фтор-4-метилфенил)-N-метил-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид,
N-(3-хлор-4-метилфенил)-1-этил-N-метил-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид и
N-(3,4-диметилфенил)-1-этил-N-метил-4-(1-метилпиперидин-4-ил)-2-оксо-1,2-дигидрохинолин-6-карбоксамид.
7. Противоопухолевое средство по любому одному из пп. 1-6, где опухоль представляет собой рак крови, тимому, миелому, рак печени, рак поджелудочной железы, рак яичников, рак предстательной железы, рак легких, остеосаркому, рак толстой кишки, рак молочной железы, рак кожи или эпителиально-клеточный рак.
8. Ингибитор бромодомена, включающий соединение, представленное формулой [1], или его соль:
[Формула 5]
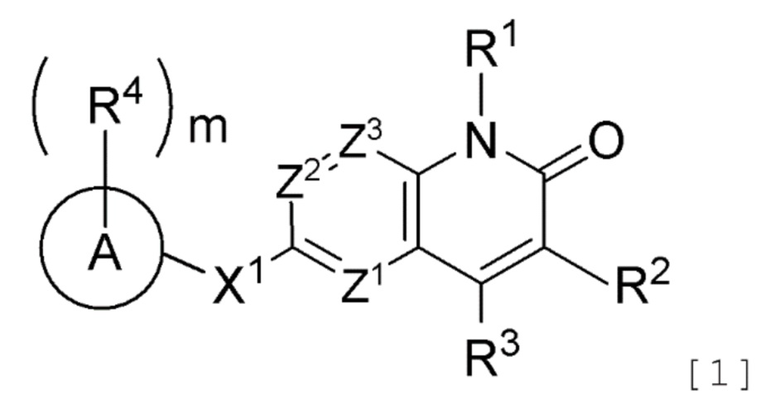
где R1 представляет C1-6 алкильную группу;
R2 представляет атом водорода;
R3 представляет:
C1-6 алкильную группу,
C3-8 циклоалкильную группу, необязательно замещенную гидроксильной группой,
пиперидинильную группу, необязательно замещенную ацильной группой или C1-6 алкильной группой, необязательно замещенной гидроксильной группой, или
морфолинильную группу;
Z1, Z2 and Z3, каждый представляет группу, представленную формулой CR5 (где R5 представляет атом водорода);
X1 представляет
группу, представленную формулой N(R7)C(=O) (где атом азота связан с кольцом A, и R7 представляет C1-6 алкильную группу; или R7 представляет, вместе с одним заместителем R4 кольца A, C2-4 алкиленовую группу); или
дигироксоимидазол-1,5-диильную группу, необязательно замещенную группой, содержащей C1-6 алкильную группу, оксогруппу и C1-6 алкильную группу, которая замещена гидроксильной группой или морфолинильной группой,
имидазол-1,2-диильную группу, необязательно замещенную одной или более группами, выбранными из группы, состоящей из C1-6 алкильной группы, оксогруппы или C1-6 алкильной группы, которая замещена гидроксильной группой или морфолинильной группой,
1,2,4-триазол-1,5-диильную группу, необязательно замещенную C1-6 алкильной группой,
1H-пиразол-4,5-диильную группу, необязательно замещенную C1-6 алкильной группой,
оксопирролидин-1,2-диильную группу,
диоксотриазолидин-1,2-диильную группу,
диоксопиразолидин-1,2-диильную группу, необязательно замещенную C1-6 алкильной группой,
оксопиразолин-1,2-диильную группу, необязательно замещенную C1-6 алкильной группой,
пиридин-2,3-диильную группу, или
пиразин-2,3-диил-группу;
кольцо A представляет фенильную группу;
m число R4, которые являются одинаковыми или различными, каждый представляет атом галогена, C1-6 алкильную группу, необязательно замещенную одним или более атомами галоген, C2-5 алкиленовую группу, образованную совместно двумя смежными R4,
C2-4 алкиленовую группу, образованную одним R4 совместно с R7, и
m представляет целое число от 0 до 2.
9. Ингибитор бромодомена по п. 8, который ингибирует связывание бромодомена с ацетилированным гистоном.
10. Ингибитор бромодомена по п. 8 или 9, где бромодомен представляет собой домен белка, входящий в семейство белков BET.
| WO 2016016316 A1, 04.02.2016 | |||
| WO 2014159837 A1, 02.10.2014 | |||
| WO 2013027168 A1, 28.02.2013 | |||
| WO 2016077656 A2, 19.05.2016 | |||
| WO 2009140769 A1, 26.11.2009 | |||
| БЕЛИКОВ В.Г | |||
| Фармацевтическая химия | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| - М.: Высшая школа, 1993 | |||
| ПЛУГ С ВРАЩАЮЩИМИСЯ РАБОЧИМИ ПОВЕРХНОСТЯМИ | 1925 |
|
SU432A1 |
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| и доп | |||
| - М.: Новая волна, 2012 | |||
| Приспособление для отсчитывания папирос в укладочных машинах | 1916 |
|
SU1216A1 |
Авторы
Даты
2021-07-23—Публикация
2017-12-27—Подача