ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Раскрыты способы лечения инфекции, вызванной вирусом иммунодефицита человека, или синдрома приобретенного иммунодефицита (СПИД) у человека с использованием комбинации, включающей долутегравир и рилпивирин, а также композиций, содержащих долутегравир и рилпивирин. Кроме того, предложены способы смены схемы противовирусной терапии у человека, инфицированного вирусом иммунодефицита человека (ВИЧ), нуждающегося в этом, со схемы терапии, включающей три или более противовирусных агента, на схему терапии, включающую только два противовирусных агента. Более того, раскрыты композиции, содержащие комбинацию двух антиретро вирусных соединений, полезных против ВИЧ. В частности, предложена двухслойная комбинированная лекарственная форма, содержащая долутегравир натрия и гидрохлорид рилпивирина. В дополнение, раскрытая лекарственная форма относится к таблетке с комбинацией фиксированных доз долутегравира натрия и гидрохлорида рилпивирина, обладающей хорошими физическими свойствами, а также обеспечивающую эффективную доставку двух активных лекарственных соединений.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Инфекция, вызванная вирусом иммунодефицита человека (ВИЧ), и связанные с ней заболевания во всем мире являются серьезной проблемой для здравоохранения. Вирус иммунодефицита человека 1-го типа (ВИЧ-1) кодирует три фермента, необходимые для вирусной репликации: обратную транскриптазу, протеазу и интегразу. Несмотря на широкое применение и доказанную эффективность лекарственных средств, направленных на обратную транскриптазу и протеазу, особенно при их использовании в комбинации, их применимость ограничена токсичностью и развитием резистентных штаммов (Palella, et al. N. Engl. J. Med. (1998) 338:853-860; Richman, D. D. Nature (2001) 410:995-1001).
Задача антиретровирусной (противовирусной) терапии состоит в подавлении вируса у ВИЧ-инфицированного пациента. Согласно руководствам по лечению, опубликованным Министерством здравоохранения и социального обеспечения США, для достижения подавления вируса необходимо применять комбинированную терапию, то есть несколько лекарственных средств из по меньшей мере двух или более классов лекарственных средств. (Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents. Department of Health and Human Services. Доступно по адресу: http://aidsinfo.nih.gov/ContentFiles/AdultandAdolescentGL.pdf. Дата доступа: 14 марта 2013 г). Кроме того, принятие решений относительно лечения ВИЧ-инфицированных пациентов осложняется, когда пациент нуждается в лечении других медицинских состояний. Стандартное лечение, направленное на подавление ВИЧ, требует использования множества различных лекарственных средств, а также лечения других состояний, которые могут быть у пациента. Поэтому одним из критериев выбора лекарственной схемы является возможность лекарственных взаимодействий. По сути, существует потребность в антиретровирусной терапии со сниженным потенциалом лекарственных взаимодействий и еще большей терапевтической активностью. Стандартный курс лечения пациента, инфицированного ВИЧ, включает лечение комбинацией трех или более противовирусных агентов. При таком лечении часто применяют по меньшей мере один антиретровирусный агент, направленный на обратную транскриптазу ВИЧ («основа»), и/или один или более чем один агент, активный против одной или более чем одной другой мишени ВИЧ, такие как ингибитор протеазы ВИЧ, ненуклеозидный или ненуклеотидный ингибитор обратной транскриптазы ВИЧ, нуклеозидный или нуклеотидный ингибитор обратной транскриптазы ВИЧ, ингибитор интегразы ВИЧ, ингибитор некаталитического сайта (или аллостерический ингибитор) интегразы ВИЧ или их комбинация. У определенных пациентов с ВИЧ-инфекцией или диагностированным СПИД существует неудовлетворенная медицинская потребность в лечении с использованием меньшего числа противовирусных агентов.
Несмотря на то, что антиретровирусная терапия (APT) привела к существенному росту продолжительности и качества жизни ВИЧ-инфицированных людей, ВИЧ-инфекция требует пожизненного лечения. Это означает, что, по мере того как продолжительность жизни ВИЧ-инфицированных индивидов приближается к продолжительности жизни людей без ВИЧ, ВИЧ-инфицированные индивиды, также как и неинфицированные, начинают получать лечение по поводу обычных состояний, не связанных с ВИЧ, таких как диабет, сердечно-сосудистые заболевания, артрит, остеопороз или другие возрастные состояния и заболевания. (Zhou et al., Total Daily Pill Burden in HIV-infected Patients in the Southern United States, 2014 AIDS PATIENT CARE and STDs 28(6): 311-317.) Эта повышенная лекарственная нагрузка (у пациентов с ВИЧ, которые теперь принимают препараты по показаниям, не связанным с ВИЧ) увеличивает риски лекарственных взаимодействий и перекрывающейся токсичности, не говоря о росте затрат на лечение пациента и сложностях, вызванных частым приемом лекарственных средств. (Zhou et al., AIDS PATIENT CARE and STDs 28(6): 311-317.) Кроме того, усложнение лекарственной терапии может отрицательно влиять на соблюдение схем лечения и подавление вируса. (Zhou et al., AIDS PATIENT CARE and STDs 28(6): 311-317.)
Уменьшение числа лекарственных средств, применяемых ВИЧ-инфицированными пациентами, также желательно у тех пациентов, у которых хорошая переносимость более вероятна при применении двух, но не большего числа лекарственных средств, таких как пожилые пациенты и пациенты с поздними стадиями ВИЧ-инфекции или других заболеваний, или с целью избежать лекарственных взаимодействий и ограничить побочные эффекты. Таким образом, существует потребность в новых схемах лечения, уменьшающих вирусную нагрузку у людей с ВИЧ и включающих только два противовирусных агента.
Кроме того, применение лекарственных средств против ВИЧ, включая долутегравир и рилпивирин, связано с проблемой соблюдения схемы лечения пациентом. Поскольку все лекарственные средства против ВИЧ необходимо принимать в составе комбинированной схемы, необходимы лучшие пути обеспечения надлежащего приема лекарственных средств пациентом в соответствии с назначениями врача. При необходимости приема слишком большого числа таблеток со слишком большим числом временных интервалов их прием становится неудобным и сложным, что снижает вероятность соблюдения схемы лечения пациентом.
Поэтому существует потребность в новых комбинированных композициях, простых в применении и содержащих активные антиретровирусные лекарственные средства, которые можно будет применять в лечении ВИЧ-инфекции. Эти новые композиции с двумя лекарственными средствами должны быть удобны и просты в применении, а также демонстрировать хорошую физическую стабильность и низкие уровни продуктов разложения.
В частности, желательны стабильные простые в использовании комбинации фиксированных доз (FDC) долутегравира и рилпивирина.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном воплощении данного изобретения предложены способы лечения или предупреждения инфекции, вызванной вирусом иммунодефицита человека (ВИЧ), у пациента, нуждающегося в этом, включающие введение пациенту фармацевтической композиции, содержащей только два антиретровирусных агента, состоящей по существу из первого антиретровирусного агента и второго антиретровирусного агента, где первый антиретровирусный агент представляет собой терапевтически эффективное количество соединения формулы I
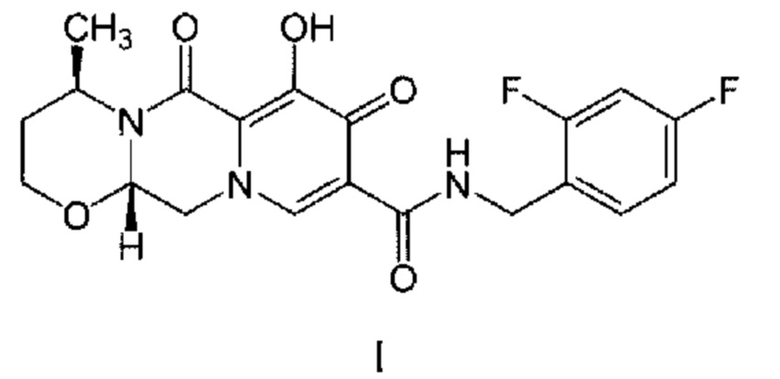
или его дополнительную фармацевтически приемлемую соль; и
второй антиретровирусный агент представляет собой терапевтически эффективное количество соединения формулы II:
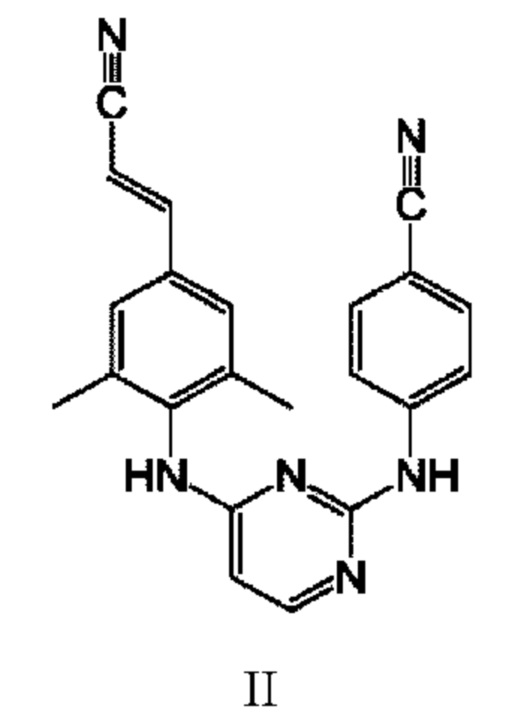
или его дополнительную фармацевтически приемлемую соль.
В другом воплощении данного изобретения предложены способы лечения инфекции, вызванной вирусом иммунодефицита человека 1-го типа (ВИЧ-1) или вирусом иммунодефицита человека 2-го типа (ВИЧ-2) (в особенности ВИЧ-1), у пациента с вирусологическим подавлением, нуждающегося в этом, включающие переход пациента со схемы антиретровирусной терапии, включающей по меньшей мере три антиретровирусных агента, на схему терапии, включающую только два антиретровирусных агента.
В одном воплощении данного изобретения предложены способы лечения пациента, инфицированного ВИЧ-1 или ВИЧ-2 (в особенности ВИЧ-1), с использованием схемы терапии двумя лекарственными средствами, состоящей по существу из ингибитора интегразы и ненуклеозидного ингибитора обратной транскриптазы, где настоящая схема антиретровирусной терапии у пациента включает три или более противовирусных агента.
В еще одном воплощении данного изобретения предложены наборы, содержащие:
(1) композицию, содержащую соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль; и
(2) инструкции по их совместному введению.
В одном воплощении данного изобретения предложена комбинация только двух противовирусных агентов, представляющих собой соединение формулы I или его фармацевтически приемлемую соль и соединение формулы II или его фармацевтически приемлемую соль, для применения в лечении инфекции, вызванной ВИЧ-1 или ВИЧ-2 (в особенности ВИЧ-1), у пациента с вирусологическим подавлением, нуждающегося в этом, включающем переход пациента со схемы антиретровирусной терапии, включающей по меньшей мере три антиретровирусных агента, на схему терапии, включающую только два антиретровирусных агента.
В другом воплощении предложена многослойная таблетка, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль.
В одном воплощении таблетка содержит 50 мг эквивалента свободной кислоты долутегравира и 25 мг эквивалента свободного основания рилпивирина.
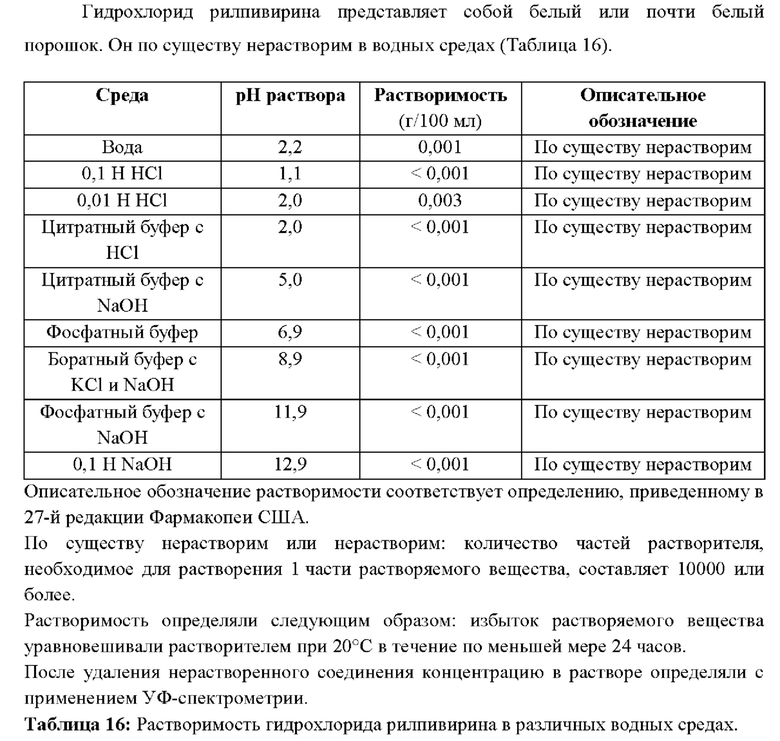
В одном воплощении таблетка содержит 52,6 мг долутегравира натрия и 27,5 мг гидрохлорида рилпивирина.
В одном воплощении предложена многослойная таблетка, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль. В одном воплощении таблетка содержит 50 мг эквивалента свободной кислоты долутегравира и 25 мг эквивалента свободного основания рилпивирина. В одном воплощении таблетка содержит 52,6 мг долутегравира натрия и 27,5 мг гидрохлорида рилпивирина.
В одном воплощении предложена многослойная таблетка, содержащая (а) долутегравир или его фармацевтически приемлемую соль и (б) рилпивирин или его фармацевтически приемлемую соль, где (а) и (б) присутствуют в отдельных слоях многослойной таблетки. В одном воплощении многослойная таблетка содержит (а) 50 мг эквивалента свободной кислоты долутегравира и (б) 25 мг эквивалента свободного основания рилпивирина, где (а) и (б) присутствуют в отдельных слоях многослойной таблетки. В одном воплощении многослойная таблетка содержит (а) 52,6 мг долутегравира натрия и (б) 27,5 мг гидрохлорида рилпивирина, где (а) и (б) присутствуют в отдельных слоях многослойной таблетки.
В одном воплощении предложена многослойная таблетка, покрытая оболочкой, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль. В одном воплощении таблетка, покрытая оболочкой, содержит 50 мг эквивалента свободной кислоты долутегравира и 25 мг эквивалента свободного основания рилпивирина. В одном воплощении таблетка, покрытая оболочкой, содержит 52,6 мг долутегравира натрия и 27,5 мг гидрохлорида рилпивирина.
В одном воплощении предложена многослойная таблетка, покрытая оболочкой, содержащая (а) долутегравир или его фармацевтически приемлемую соль и (б) рилпивирин или его фармацевтически приемлемую соль, где (а) и (б) присутствуют в отдельных слоях многослойной таблетки. В одном воплощении многослойная таблетка, покрытая оболочкой, содержит (а) 50 мг эквивалента свободной кислоты долутегравира и (б) 25 мг эквивалента свободного основания рилпивирина, где (а) и (б) присутствуют в отдельных слоях многослойной таблетки. В одном воплощении многослойная таблетка, покрытая оболочкой, содержит (а) 52,6 мг долутегравира натрия и (б) 27,5 мг гидрохлорида рилпивирина, где (а) и (б) присутствуют в отдельных слоях многослойной таблетки.
В одном воплощении слои долутегравира и рилпивирина непосредственно контактируют друг с другом.
Было обнаружено, что применение комбинации фиксированных доз может способствовать достижению подходящих фармакокинетических параметров и/или адекватной стабильности таблетки. Кроме того, применение многослойной таблетки как комбинации фиксированных доз может также обеспечить фармакокинетические преимущества и/или повысить стабильность.
Также предложен способ лечения пациентов, инфицированных ВИЧ, включающий введение многослойной таблетки, содержащей долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль. В одном воплощении предложен способ лечения пациентов, инфицированных ВИЧ, включающий введение многослойной таблетки, содержащей долутегравир натрия и гидрохлорид рилпивирина. В одном воплощении предложен способ лечения пациентов, инфицированных ВИЧ, включающий введение многослойной таблетки, содержащей (а) 50 мг эквивалента свободной кислоты долутегравира и (б) 25 мг эквивалента свободного основания рилпивирина, где (а) и (б) присутствуют в отдельных слоях многослойной таблетки. В одном воплощении предложен способ лечения пациентов, инфицированных ВИЧ, включающий введение многослойной таблетки, содержащей (а) 52,6 мг долутегравира натрия и (б) 27,5 мг гидрохлорида рилпивирина, где (а) и (б) присутствуют в отдельных слоях многослойной таблетки.
Также предложена многослойная таблетка, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, для применения в лечении ВИЧ-инфекции. В одном воплощении предложена многослойная таблетка, содержащая долутегравир натрия и гидрохлорид рилпивирина, для применения в лечении ВИЧ-инфекции. В одном воплощении предложена многослойная таблетка, содержащая (а) 50 мг эквивалента свободной кислоты долутегравира и (б) 25 мг эквивалента свободного основания рилпивирина, где (а) и (б) присутствуют в отдельных слоях многослойной таблетки, для применения в лечении ВИЧ-инфекции. В одном воплощении предложена многослойная таблетка, содержащая (а) 52,6 мг долутегравира натрия и (б) 27,5 мг гидрохлорида рилпивирина, где (а) и (б) присутствуют в отдельных слоях многослойной таблетки, для применения в лечении ВИЧ-инфекции.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1: Высвобождение долутегравира из однослойных таблеток при хранении в открытых условиях.
Фиг. 2: Высвобождение рилпивирина из однослойных таблеток при хранении в открытых условиях.
Фиг. 3: XRPD(порошковая рентгеновская дифракция)-спектр двухкомпонентной смеси долутегравира натрия и гидрохлорида рилпивирина в исходной временной точке и через 3 недели при 50°C/75%RH в сравнении с гидрохлоридной солью рилпивирина и свободным основанием рилпивирина.
Фиг. 4: 19F SSNMR(ЯМР твердого тела)-спектр двухкомпонентной смеси долутегравира натрия и гидрохлорида рилпивирина в исходной временной точке и через 3 недели при 50°C/75%RH в сравнении с натриевой солью долутегравира и свободной кислотой долутегравира.
Фиг. 5: XRPD-спектр однослойной композиции 1 долутегравира натрия и гидрохлорида рилпивирина в исходной временной точке и через 4 недели при 40°C/75%RH в сравнении с гидрохлоридной солью рилпивирина и свободным основанием рилпивирина.
Фиг. 6: 19F SSNMR-спектр однослойной композиции 1 долутегравира натрия и гидрохлорида рилпивирина в исходной временной точке и через 2 недели при 40°C/75%RH в сравнении с натриевой солью долутегравира и свободной кислотой долутегравира.
Фиг. 7: XRPD-спектр однослойной композиции 4 долутегравира натрия и гидрохлорида рилпивирина в исходной временной точке и через 4 недели при 40°C/75%RH в сравнении с гидрохлоридной солью рилпивирина и свободным основанием рилпивирина.
Фиг. 8: 19F SSNMR-спектр однослойной композиции 4 долутегравира натрия и гидрохлорида рилпивирина в исходной временной точке и через 2 недели при 40°C/75%RH в сравнении с натриевой солью долутегравира и свободной кислотой долутегравира.
Фиг. 9: XRPD-спектр однослойной композиции 5 долутегравира натрия и гидрохлорида рилпивирина в исходной временной точке и через 4 недели при 40°C/75%RH в сравнении с гидрохлоридной солью рилпивирина и свободным основанием рилпивирина.
Фиг. 10: 19F SSNMR-спектр однослойной композиции 5 долутегравира натрия и гидрохлорида рилпивирина в исходной временной точке и через 2 недели при 40°C/75%RH в сравнении с натриевой солью долутегравира и свободной кислотой долутегравира.
Фиг. 11: XRPD-спектр однослойной композиции 6 долутегравира натрия и гидрохлорида рилпивирина в исходной временной точке и через 4 недели при 40°C/75%RH в сравнении с гидрохлоридной солью рилпивирина и свободным основанием рилпивирина.
Фиг. 12: 19F SSNMR-спектр однослойной композиции 6 долутегравира натрия и гидрохлорида рилпивирина в исходной временной точке и через 2 недели при 40°C/75%RH в сравнении с натриевой солью долутегравира и свободной кислотой долутегравира.
Фиг. 13: Наблюдаемый средний размер высушенных частиц как функция пиковой LOD (потеря в массе при высушивании), отражающей содержание влаги в продукте в конце добавления жидкости при влажном гранулировании.
Фиг. 14: Схема получения смеси долутегравира для прессования.
Фиг. 15: Схема получения смеси рилпивирина для прессования.
Фиг. 16: Средние концентрации (A) DTG и (В) RPV в плазме, нанесенные на график против планируемого относительного времени после введения. DTG - долутегравир; RPV - рилпивирин.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ Определения
При использовании здесь термины, заключенные ниже в кавычки, имеют следующие значения.
«% масс./масс.» обозначает массу компонента как процент от общей массы, например, слоя или лекарственной формы, в которых присутствует данный компонент. Например, композиция, содержащая «5% масс/масс. X», относится к композиции, в которой масса компонента X составляет 5% от общей массы композиции.
Символ «↓» обозначает снижение дозы или частоты введения.
Символ «↑» обозначает повышение дозы или частоты введения.
Символ «↔» обозначает сохранение той же дозы или частоты введения.
Термин «приблизительно» означает в пределах погрешности, применимых к области или объекту, к которым он относится. При использовании в связи с количеством термин «приблизительно» включает указанную величину, и его значение продиктовано контекстом (например, включает степень погрешности измерения рассматриваемого количества). Например, в определенном неограничивающем примере термин «приблизительно» применительно к числовой величине х относится к х±10%, х±5% или х±1%.
Термин «алкил» относится к насыщенной углеводородной цепи, имеющей указанное число атомов углерода. Например, «С1-6алкил» относится к алкильной группе, имеющей от 1 до 6 атомов углерода, например, от 1 до 2 атомов углерода.
Применительно к человеку термины «получавший АРТ» или «получавший антиретровирусную терапию» означают, что человек в настоящее время получает или в прошлом получал лечение одним или более чем одним противовирусным агентом, используемым для лечения ВИЧ-инфекции или синдрома приобретенного иммунодефицита (СПИД). При использовании здесь «получавший АРТ» включает ВААРТ (высоко активная антиретровирусная терапия), которая представляет собой применение нескольких лекарственных средств, действующих на разные вирусные мишени.
При использовании здесь «площадь под кривой» или «AUC» представляет собой площадь под кривой на графике концентрация вещества в плазме против времени. AUC может представлять собой значение интеграла мгновенных концентраций за временной интервал и имеет размерность «масса х время/объем», что может также быть выражено как произведение молярной концентрации и времени, например, в нМ х сутки. AUC обычно рассчитывают методом трапеций (например, линейным, линейно-логарифмическим). Обычно AUC представлена для временного интервала от нуля до бесконечности или с указанием других временных интервалов (например, AUC(t1,t2), где t1 и t2 представляют собой начальное и конечное время интервала). Таким образом, при использовании здесь «AUC0-24h» относится к AUC за 24-часовой период, а «AUC0-4h» относится к AUC за 4-часовой период.
Термин «от… до…» применительно к двум значениям включает эти два значения, например, диапазон «от 10 мг до 20 мг» включает, например, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 и 20 мг.
Термин «С1-6спирт» означает С1-6алкильную группу, замещенную -ОН.
При использовании здесь термин «совместное введение» относится к введению двух или более агентов, где интервал между их введением составляет не более 24 часов, например, в рамках клинической схемы лечения. В других воплощениях «совместное введение» относится к введению двух или более агентов, где интервал между их введением составляет не более 2 часов. В других воплощениях «совместное введение» относится к введению двух или более агентов, где интервал между их введением составляет не более 30 минут. В других воплощениях «совместное введение» относится к введению двух или более агентов, где интервал между их введением составляет не более 15 минут. В других воплощениях «совместное введение» относится к одновременному введению в составе одной композиции или в форме нескольких композиций, вводимых одним или разными путями.
Термин «сокристалл» относится к кристаллическому соединению, содержащему два или более молекулярных компонента, например, с частичным или неполным переносом протонов между молекулярными компонентами.
При использовании здесь «коэффициент вариации (CV)» является мерой дисперсии, и его определяют как отношение стандартного отклонения к среднему значению. Его указывают как процент (%), умножая полученное отношение на 100 (% CV).
«Комбинация по изобретению» представляет собой комбинацию соединения формулы I или его фармацевтически приемлемой соли и соединения формулы II или его фармацевтически приемлемой соли, где формула I представляет собой долутегравир, а формула II представляет собой рилпивирин.
«Композиция(и) по изобретению» обозначает композицию (композиции), содержащую только два противовирусных агента, представляющих собой соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль, где формула I представляет собой долутегравир, а формула II представляет собой рилпивирин, но указанная композиция может содержать и другие компоненты.
Термин «содержать» и его варианты, такие как «содержит» и «содержащий» следует трактовать в открытом включительном смысле, то есть как «включая, без ограничения».
При использовании здесь «доверительный интервал» или «ДИ» представляет собой интервал, в который попадает результат измерения или испытания, в соответствии с заданной вероятностью р, относящейся к 90%-му или 95%-му ДИ, и который рассчитывают от среднего арифметического, среднего геометрического или среднего, полученного методом наименьших квадратов. При использовании здесь среднее геометрическое представляет собой среднее значений, прошедших трансформацию с применением натурального логарифма и обратную трансформацию посредством возведения в степень, а среднее, полученное методом наименьших квадратов, может также быть или не быть средним геометрическим, но его получают в модели дисперсионного анализа (ANOVA) с фиксированными эффектами.
Термин «состоять» и его варианты, такие как «состоит» и «состоящий», следует трактовать узко, то есть как «включая только».
Термин «эффективное количество» относится к количеству, которое может быть эффективным с точки зрения получения желаемого биологического или медицинского ответа, включая то количество соединения, которое, при его введении субъекту для лечения заболевания, является достаточным для такого лечения заболевания. Эффективное количество будет варьировать в зависимости от соединения, заболевания и его тяжести, а также возраста, массы тела и других характеристик субъекта, у которого необходимо проводить лечение. Эффективное количество может включать диапазон количеств.
Фразы «в одном воплощении», используемые в различных местах данной заявки, не обязательно относятся к одному и тому же воплощению. Кроме того, определенные признаки, структуры или характеристики можно комбинировать любым подходящим образом в одном или более чем одном воплощении.
Термин «после еды» применительно к введению твердой лекарственной формы субъекту-человеку обозначает пероральное введение лекарственной формы после приема пищи (с умеренным содержанием жира), например, введение в течение приблизительно 30 минут после стандартного приема пищи с энергетической ценностью приблизительно от 300 до 600 калорий и содержанием жира от приблизительно 10 до приблизительно 15 граммов. В некоторых воплощениях «после еды» относится к введению в течение приблизительно 30 минут после приема пищи с высоким содержанием жира.
«ВИЧ» или «вирус иммунодефицита человека» обозначает ВИЧ-1 или ВИЧ-2 (в особенности ВИЧ-2), или их любого мутанта, группу, клинический изолят, подтип или таксономическую группу.
«Схема (схемы) по изобретению» обозначает схему (схемы), включающие аспекты введения, композиции, пути введения, дозы, интервала введения и продолжительности терапии с использованием только двух противовирусных агентов, представляющих собой соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль, но указанная схема может также включать другие компоненты или подразумевать применение других компонентов.
При использовании здесь «максимальная концентрация в плазме» или «Cmax» обозначает максимальную наблюдаемую концентрацию вещества (например, долутегравира или рилпивирина) в плазме млекопитающего после введения этого вещества указанному млекопитающему.
При использовании здесь термин «пациент» относится к млекопитающему, включая человека.
Термин «фармацевтически приемлемый» применительно к веществу относится к такому веществу, которое обычно рассматривается как безопасное и подходящее для применения без чрезмерной токсичности, раздражения, аллергического ответа и тому подобного, при соразмерном и разумном соотношении пользы и риска. «Фармацевтически приемлемый» применительно к эксципиентам включает, без ограничения, любой адъювант, носитель, эксципиент, смазывающее вещество, подсластитель, разбавитель, консервант, краситель, усилитель вкуса и запаха, поверхностно-активное вещество, смачивающий агент, диспергирующий агент, суспендирующий агент, стабилизатор, изотонический агент, растворитель или эмульгатор, которые были утверждены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США как приемлемые для использования у человека или домашних животных.
«Фармацевтически приемлемая соль» относится к соли соединения, которая является фармацевтически приемлемой и обладает (или может быть превращена в форму, которая обладает) желаемой фармакологической активностью исходного соединения. Такие соли включают соли присоединения кислот, полученные с использованием неорганических кислот, таких как соляная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобные; или полученные с использованием органических кислот, таких как уксусная кислота, бензолсульфоновая кислота, бензойная кислота, камфорсульфоновая кислота, лимонная кислота, этансульфоновая кислота, фумаровая кислота, глюкогептоновая кислота, глюконовая кислота, молочная кислота, малеиновая кислота, малоновая кислота, миндальная кислота, метансульфоновая кислота, 2-нафталинсульфоновая кислота, олеиновая кислота, пальмитиновая кислота, пропионовая кислота, стеариновая кислота, янтарная кислота, винная кислота, n-толуолсульфоновая кислота, триметилуксусная кислота и тому подобные; и соли полученные при замене кислотного протона, присутствующего в исходном соединении, на ион металла, например, ион щелочного металла, ион щелочно-земельного металла или ион алюминия; или координационные соединения с органическим основанием, таким как диэтаноламин, триэтаноламин, N-метилглюкамин и тому подобные. Данное определение также включает аммониевые и замещенные или четвертичные аммониевые соли. Неограничивающие перечни типичных фармацевтически приемлемых солей приведены в S.M. Berge et al., J. Pharma Sci., 66(1), 1-19 (1977), и Remington: The Science and Practice of Pharmacy, R. Hendrickson, ed., 21st edition, Lippincott, Williams & Wilkins, Philadelphia, PA, (2005), на с. 732, Таблица 38-5; оба этих источника включены сюда посредством ссылки.
«Предупреждение» или «профилактика» заболевания включает снижение риска развития заболевания, то есть обеспечение отсутствия развития клинических симптомов заболевания у субъекта, у которого может возникнуть заболевание или есть предрасположенность к нему, но еще нет симптомов заболевания.
При использовании здесь термин «соли» включает сокристаллы.
Термин «разделенный» при использовании применительно к определенным компонентам (например, А и В) таблетки означает, что эти компоненты физически отделены друг от друга таким образом, что присутствие одного отдельного компонента (например, А) не оказывает существенного влияния на стабильность другого отдельного компонента (компонентов) (например, В) при хранении. Обычно, когда компоненты таблетки разделены, они будут присутствовать в отдельных слоях многослойной таблетки. В качестве примера, компоненты А и В могут присутствовать в отдельных слоях многослойной таблетки, где (а) слой, содержащий компонент А, по существу свободен от компонента В, и (б) слой, содержащий компонент В, по существу свободен от компонента А. Отдельные слои могут непосредственно контактировать друг с другом или могут быть разделены, например, одним или более чем одним дополнительным слоем.
При использовании здесь «период полувыведения из сыворотки или плазмы» относится ко времени, необходимому для метаболизма или выведения половины количества вещества, введенного млекопитающему, из сыворотки или плазмы млекопитающего нормальными биологическими процессами.
Термин «сольват» обозначает молекулярный комплекс, содержащий соединение и одну или более чем одну молекулу фармацевтически приемлемого растворителя.
Примеры молекул растворителя включают воду и C1-6спирты, например, этанол. Когда растворителем является вода, может быть использован термин «гидрат».
Термин «по существу свободный», применительно к присутствию указанного компонента, например, в композиции, означает, что этот компонент составляет менее 5% композиции по массе (например, менее 1% композиции по массе). Слова «по существу» не исключают «полностью», например, композиция, «по существу свободная» от Y, может быть полностью свободной от Y. По необходимости, слова «по существу» в определении изобретения могут быть опущены.
«Терапевтически эффективное количество» или «эффективное количество» относится к такому количеству вводимого соединения, которое будет предотвращать состояние (расстройство) или в некоторой степени облегчать один или более чем один симптом расстройства, по поводу которого проводят лечение. Фармацевтические композиции, подходящие для применения здесь, включают композиции, где активные ингредиенты присутствуют в количестве, достаточном для достижения предполагаемой цели. Терапевтически эффективное количество может быть определено специалистами в данной области, особенно с учетом приведенного здесь подробного описания.
При использовании здесь «лечение» относится к подавлению, уменьшению, устранению или облегчению заболевания у пациента или улучшению поддающегося измерению параметра, связанного с определенным расстройством, и может включать подавление рецидивирования симптомов у пациента без симптомов, такого как пациент, у которого вирусная инфекция стала латентной.
При использовании здесь «Tmax» относится к наблюдаемому времени достижения максимальной концентрации вещества в плазме млекопитающего после введения этого вещества данному млекопитающему.
«Вирусологическое подавление» обозначает выявление числа копий рибонуклеиновой кислоты (РНК) ВИЧ, которое меньше заданного числа копий на мл. Например, заданное число копий составляет менее 50 копий/мл. Например, при использовании TaqMan2.0 (Roche Diagnostics, Indianapolis, IN, USA).
При использовании здесь «средневзвешенная AUC» представляет собой AUC, разделенную на временной интервал, за который она рассчитана. Например, средневзвешенная AUC0-24h будет представлять собой AUC0-24h, разделенную на 24 часа.
Как известно в данной области, для сбора, измерения и оценки фармакокинетических данных, таких как концентрация активного соединения в крови, плазме и/или другой ткани, могут быть применены различные методы.
Соединения
Долутегравир ингибирует интегразу ВИЧ, связываясь с активным сайтом интегразы и блокируя стадию переноса цепи при интеграции ретровирусной дезоксирибонуклеиновой кислоты (ДНК), которая необходима для цикла репликации ВИЧ. DTG является ингибитором переноса цепи интегразой (integrase strand transfer inhibitor, ИПЦИ). В биохимических анализах переноса цепи с использованием очищенной интегразы ВИЧ-1 и предварительно обработанной субстратной ДНК были получены значения IC50 (50%-й ингибирующей концентрации) 2,7 нМ (Kalama and Murphy, Dolutegravir for the Treatment of HIV, 2012 Exp. Op. Invest. Drugs 21(4): 523-530).
Химическим названием долутегравира является (4R,12aS)-N-[(2,4-дифторфенил)метил]-7-гидрокси-4-метил-6,8-диоксо-3,4,12,12а-тетрагидро-2Н-пиридо[5,6]пиразино[2,6-b][1,3]оксазин-9-карбоксамид (регистрационный номер CAS 1051375-16-6). Определенные схемы и композиции по изобретению включают/содержат фармацевтически приемлемую форму долутегравира, такую как его фармацевтически приемлемая соль, гидрат и/или сольват. Примером фармацевтически приемлемой соли долутегравира является долутегравир натрия (представленный на рынке под названием ТИВИКАЙ ("TIVICAY")). Натриевая соль долутегравира и определенная кристаллическая форма этой натриевой соли или ее гидрат раскрыты в патенте США №8624023. Аморфный долутегравир натрия описан, например, в патенте США №9206197. Настоящим изобретением также предусмотрены полиморфы, изомеры, пролекарства и эфиры долутегравира. Если не указано иное, масса (мг) долутегравира основана на массе долутегравира в его свободной форме.
Долутегравир имеет следующую структурную формулу:

Основным путем метаболизма долутегравира является глюкуронирование. Долутегравир считается субстратом CYP3A4, но лишь в незначительной степени, составляющей приблизительно 15%. Кроме того, долутегравир демонстрирует индукцию или ингибирование изоферментов цитохрома Р450 (CYP) in vitro. См. заявку на патент США (U.S. Pregrant Publication) 2016/0184332.
При использовании здесь «схема на основе долутегравира», или «схема на основе DTG», или «схема, включающая долутегравир», обозначает схему, включающую введение долутегравира или его фармацевтически приемлемой соли (например, введение фармацевтической композиции, содержащей долутегравир или его фармацевтически приемлемую соль).
Долутегравир одобрен к применению у широкого круга ВИЧ-инфицированных пациентов. Долутегравир был одобрен FDA в августе 2013 г., Министерством здравоохранения Канады в ноябре 2013 г. и ЕМА в Европе в январе 2014 г. Его можно применять для лечения ВИЧ-инфицированных взрослых, никогда не получавших терапию по поводу ВИЧ-инфекции (не получавших лечение), и ВИЧ-инфицированных взрослых, получавших ранее терапию по поводу ВИЧ-инфекции (получавших лечение), включая тех, которые получали лечение другими ингибиторами переноса цепи интегразой. ТИВИКАЙ утвержден также для детей в возрасте 12 лет и старше с массой тела по меньшей мере 40 килограммов (кг), не получавших лечение или получавших лечение, но не принимавших ранее другие ингибиторы переноса цепи интегразой.
При использовании здесь термин «DTG» предназначен для обозначения долутегравира натрия. Химическим названием долутегравира натрия является (4R,12aS)-9-{[(2,4-дифторфенил)метил]карбамоил}-4-метил-6,8-диоксо-3,4,6,8,12,12а-гексагидро-2H-пиридо[1',2':4,5]пиразино[2,1-b][1,3]оксазин-7-олат натрия. Его эмпирическая формула представляет собой C20H18F2N3NaO5, а молекулярная масса составляет 441,36 г/моль. Он имеет следующую структурную формулу:


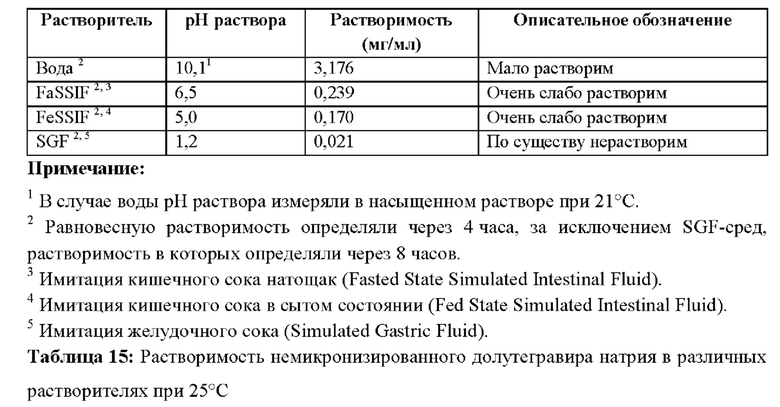
В водных средах немикронизированный долутегравир натрия очень мало растворим при рН 5,0 и 6,5 и по существу нерастворим при рН 1,2.
Способы получения долутегравира описаны, например, в патенте США №9573965. См. также патент США №8217034 и заявку на патент США (Pregrant Publication) 2016/0184332.
Рилпивирин имеет химическую формулу C22H18N6 и химическое название 4-[[4-[[4-[(Е)-2-цианоэтил]-2,6-диметилфенил]амино]-2-пиримидинил]амино]бензонитрил.
Он имеет структурную формулу, изображенную ниже:
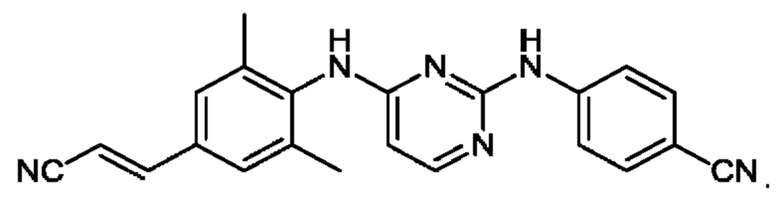
Данное соединение описано и заявлено, среди прочего, в WO 2003016306 и связанных с ней национальных заявках, содержание которых включено сюда посредством ссылки.
Рилпивирин доступен от Janssen Sciences Ireland UC как ЭДЮРАНТ (гидрохлорид рилпивирина).
При использовании здесь термин «RPV» предназначен для обозначения гидрохлорида рилпивирина. Химическим названием гидрохлорида рилпивирина является гидрохлорид 4-[[4-[[4-[(Е)-2-цианоэтил]-2,6-диметилфенил]амино]-2-пиримидинил]амино]бензонитрила. Его молекулярная формула представляет собой C22H18N6⋅HCl, а молекулярная масса составляет 402,88 г/моль. Гидрохлорид рилпивирина имеет следующую структурную формулу:

СПОСОБ ЛЕЧЕНИЯ
В одном воплощении изобретения предложены способы лечения или предупреждения инфекции, вызванной ВИЧ-1 или ВИЧ-2 (в особенности ВИЧ-1), у пациента, нуждающегося в этом, включающие введение пациенту фармацевтической композиции, содержащей только два антиретровирусных агента, состоящей по существу из первого антиретровирусного агента и второго антиретровирусного агента, где первый антиретровирусный агент представляет собой терапевтически эффективное количество соединения формулы I или его дополнительной фармацевтически приемлемой соли, и второй антиретровирусный агент представляет собой терапевтически эффективное количество соединения формулы II или его дополнительной фармацевтически приемлемой соли.
В другом воплощении предложены способы лечения пациента, инфицированного вирусом иммунодефицита человека 1-го типа (ВИЧ-1) или его мутантом, вирусом иммунодефицита человека 2-го типа (ВИЧ-2) (в особенности ВИЧ-1) или его мутантом, включающие введение пациенту схемы, включающей только два антиретровирусных агента, состоящей по существу из первого антиретровирусного агента и второго антиретровирусного агента, где первый антиретровирусный агент представляет собой терапевтически эффективное количество соединения формулы I или его дополнительной фармацевтически приемлемой соли и второй антиретровирусный агент представляет собой терапевтически эффективное количество соединения формулы II или его дополнительной фармацевтически приемлемой соли.
В другом воплощении предложена фармацевтическая композиция, содержащая только два антиретровирусных агента, как описано здесь, состоящая по существу из соединения формулы I или его дополнительной фармацевтически приемлемой соли и соединения формулы II или его дополнительной фармацевтически приемлемой соли.
В другом воплощении фармацевтическая композиция, содержащая два антиретровирусных агента, состоящая по существу из соединения формулы I или его дополнительной фармацевтически приемлемой соли и соединения формулы II или его дополнительной фармацевтически приемлемой соли, дополнительно содержит один или более чем один фармацевтически приемлемый носитель, разбавитель или эксципиент.
В другом воплощении предложены способы лечения или предупреждения ВИЧ-инфекции у пациента, включающие введение пациенту терапевтически эффективного количества соединения формулы I или его дополнительной фармацевтически приемлемой соли; и второй антиретровирусный агент представляет собой терапевтически эффективное количество соединения формулы II или его дополнительной фармацевтически приемлемой соли и один или более чем один фармацевтически приемлемый носитель, разбавитель или эксципиент.
Несмотря на возможность введения активных агентов в форме соединения или в форме соединений, в одном воплощении изобретения их вводят в форме фармацевтической композиции, которая может содержать компоненты, полученные в результате контакта с кислотой или основанием, представленные в ионно-солевой форме или в контакте с основанием или кислотой (то есть в форме сокомпонентов) без обмена ионами. Соль, сокомпонент с кислотой или основанием или разбавитель должны быть приемлемыми в смысле их совместимости с другими ингредиентами и безвредности для реципиента. Фармацевтически приемлемые эксципиенты для различных лекарственных форм хорошо известны в данной области и включают носители, разбавители, наполнители, связывающие агенты, смазывающие агенты, разрыхлители, скользящие агенты, красители, пигменты, вкусомаскирующие агенты, подсластители, корригенты, пластификаторы и любые приемлемые вспомогательные вещества, такие как усилители всасывания, усилители проникновения, поверхностно-активные вещества, дополнительные поверхностно-активные вещества и специальные масла. Подходящий эксципиент (эксципиенты) выбирают, отчасти, на основании лекарственной формы, предполагаемого способа введения, предполагаемой скорости высвобождения и производственной надежности. Примеры носителей или разбавителей для перорального введения включают, без ограничения, кукурузный крахмал, лактозу, стеарат магния, тальк, микрокристаллическую целлюлозу, стеариновую кислоту, повидон, кросповидон, двухосновный фосфат кальция, крахмал гликолят натрия, гидроксипропилцеллюлозу, (например, гидроксипропилцеллюлозу с низкой степенью замещения), гидроксипропилметилцеллюлозу (например, гидроксипропилметилцеллюлозу 2910), лаурилсульфат натрия, маннит, стеарилфумарат натрия и тальк. Примеры солей и сокомпонентов с кислотами или основаниями включают, фумарат, гемифумарат, натрий и гидрохлорид.
В другом воплощении согласно данному изобретению предложена комбинация соединения формулы I или его дополнительной фармацевтически приемлемой соли и соединения формулы II или его дополнительной фармацевтически приемлемой соли для применения в лекарственной терапии. Активные агенты раскрытой комбинированной терапии могут быть введены человеку любым известным способом.
В другом воплощении фармацевтическая композиция дополнительно содержит по меньшей мере один активный агент, не являющийся антиретровирусным (АРВ) агентом. В другом воплощении соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль вводят совместно в отдельных лекарственных формах. В другом воплощении соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль вводят совместно в одной лекарственной форме. В другом воплощении соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль принимают один раз в сутки. В другом воплощении соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль вводят совместно в форме комбинации фиксированных доз. В другом воплощении предложен прием одной или более чем одной такой комбинации один, два, три или более раз в сутки, в зависимости от дозы, подходящей для данного пациента. В другом воплощении соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль вводят совместно в форме одной таблетки. В другом воплощении соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль вводят совместно перорально. В другом воплощении соединение формулы I или его дополнительная фармацевтически приемлемая соль и соединение формулы II или его дополнительная фармацевтически приемлемая соль представлены в жидкой форме, или в твердой форме, или в другой форме (например, гель, золь или эмульсия), или в комбинации таких форм, подходящей для любого из различных путей введения пациенту. В другом воплощении соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль вводят совместно в форме одной таблетки, принимаемой перорально один раз в сутки. Предпочтительно, таблетка представляет собой таблетку для глотания. Возможно, она может быть покрыта пленочной оболочкой, содержащей, по существу, любое подходящее инертное вещество для покрытия оболочкой, известное в данной области.
Другие воплощения включают фармацевтические композиции, изготовленные в виде различных типов лекарственных форм, например, в форме растворов или суспензий или в форме таблеток, капсул, гранул, пеллет или саше для перорального введения. Приведенный выше перечень форм не является исчерпывающим. Фармацевтическая композиция по настоящему изобретению может быть изготовлена стандартными методами, известными в данной области. Грануляты по изобретению могут быть получены сухим прессованием или влажным гранулированием. Затем эти грануляты могут быть смешаны, например, с подходящими разрыхлителями, скользящими агентами и смазывающими агентами, и полученная смесь может быть использована для прессования таблеток или заполнения саше или капсул подходящего размера.
Таблетки могут также быть получены прямым прессованием подходящей порошковой смеси, то есть без какого-либо предшествующего гранулирования эксципиентов. Подходящие порошковые или гранулятные смеси по изобретению могут также быть получены распылительной сушкой, лиофилизацией, экструзией расплава, наслоением на пеллеты, нанесением активного фармацевтического ингредиента или любым другим подходящим методом. Полученные таким образом порошки или грануляты можно смешивать с одним или более чем одним подходящим ингредиентом, и полученные смеси можно использовать для прессования таблеток или заполнения саше или капсул. Указанные выше методы, известные в данной области, также включают методики размалывания и просеивания, позволяющие достичь желаемого распределения частиц по размеру.
В одном воплощении единую лекарственную форму, содержащую в качестве двух единственных антиретровирусных агентов соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль, вводят за 4 часа до или через 6 часов после приема антацидов, содержащих алюминий, гидроксид магния и/или карбонат кальция. В одном воплощении единую лекарственную форму, содержащую соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль, вводят за 4 часа до или через 6 часов после приема препаратов, содержащих поливалентные катионы (например, Mg или Al). В одном воплощении единую лекарственную форму, содержащую соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль, вводят за 4 часа до или через 6 часов после приема кальций- или железосодержащих добавок. Альтернативно, единую лекарственную форму, содержащую соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль, и добавки, содержащие кальций или железо, принимают вместе с пищей.
В еще одном воплощении предложены способы, где один или оба противовирусных агента, состоящие из соединения формулы I или его дополнительной фармацевтически приемлемой соли и соединения формулы II или его дополнительной фармацевтически приемлемой соли, принимают с пищей, такой как пища с по меньшей мере умеренным или более высоким содержанием жира. В одном аспекте содержание жира в пище считается высоким, если он обеспечивает более 30% ее энергетической ценности. В некоторых случаях жир обеспечивает более 35% энергетической ценности пищи с высоким содержанием жира. В одном аспекте содержание жира в пище считается умеренным, если он обеспечивает от 20% до 35% или от 25% до 35% ее энергетической ценности.
В еще одном воплощении у пациента, принимающего композицию соединения формулы I или его дополнительной фармацевтически приемлемой соли и соединения формулы II или его дополнительной фармацевтически приемлемой соли с пищей с по меньшей мере умеренным или более высоким содержанием жира, AUC(0-∞) соединения формулы I или его дополнительной фармацевтически приемлемой соли увеличена по меньшей мере на 80% и Cmax соединения формулы I или его дополнительной фармацевтически приемлемой соли повышена по меньшей мере на 70% по сравнению с приемом натощак. В некоторых аспектах прием пищи с умеренным или высоким содержанием жира вместе с двумя антиретровирусными агентами увеличивает AUC(0-∞) соединения формулы I или его дополнительной фармацевтически приемлемой соли приблизительно на 87% и Cmax соединения формулы I или его дополнительной фармацевтически приемлемой соли приблизительно на 75%. В некоторых случаях при приеме с пищей с умеренным или высоким содержанием жира AUC(0-∞) соединения формулы I или его дополнительной фармацевтически приемлемой соли у пациента увеличивается приблизительно на 70%, 75%, 80%, 85%, 90%, 95% или 100% по сравнению с приемом натощак. В некоторых случаях при приеме с пищей с умеренным или высоким содержанием жира Cmax соединения формулы I или его дополнительной фармацевтически приемлемой соли у пациента повышается приблизительно на 70%, 75%, 80%, 85%, 90%, 95% или 100% по сравнению с приемом натощак.
В одном случае при приеме соединения формулы II или его дополнительной фармацевтически приемлемой соли с пищей с умеренным и высоким содержанием жира AUC(0-∞) увеличивается на 57% и 72%, а Cmax - на 89% и 117%, соответственно, по сравнению с приемом натощак. В некоторых случаях при приеме с пищей с умеренным или высоким содержанием жира AUC(0-∞) соединения формулы II или его дополнительной фармацевтически приемлемой соли у пациента увеличивается приблизительно на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% по сравнению с приемом натощак. В некоторых случаях при приеме с пищей с умеренным или высоким содержанием жира Cmax соединения формулы II или его дополнительной фармацевтически приемлемой соли у пациента увеличивается приблизительно на 70%, 75%, 80%, 85%, 90%, 95%, 100%, 105%, 110%, 115% или 120% по сравнению с приемом натощак. При приеме соединения формулы II или его дополнительной фармацевтически приемлемой соли только с питательным напитком с высоким содержанием белка экспозиция была на 50% ниже, чем после приема с пищей.
В еще одном воплощении у пациента, принимающего фармацевтическую композицию соединения формулы I или его дополнительной фармацевтически приемлемой соли и соединения формулы II или его дополнительной фармацевтически приемлемой соли с пищей с по меньшей мере умеренным или более высоким содержанием жира, AUC(0-∞) соединения формулы II или его дополнительной фармацевтически приемлемой соли увеличена по меньшей мере на 50% и Cmax соединения формулы II или его дополнительной фармацевтически приемлемой соли повышена по меньшей мере на 80% по сравнению с приемом натощак.
В дополнительном воплощении формула I представляет собой (4R,12aS)-9-{+[(2,4-дифторфенил)метил]карбамоил}-4-метил-6,8-диоксо-3,4,6,8,12,12а-гексагидро-2Н-пиридо[1',2':4,5]пиразино[2,1-b][1,3]оксазин-7-олат.
В другом воплощении формула I представляет собой долутегравир натрия (формула 1а) и/или эквивалент 50 мг долутегравира в форме свободной кислоты.
В дополнительном воплощении формула II представляет собой 4-[[4-[[4-[(Е)-2-цианоэтил]-2,6-диметилфенил]амино]-2-пиримидинил]амино]бензонитрил.
В другом воплощении формула II представляет собой гидрохлорид рилпивирина (формула IIa) и/или эквивалент 25 мг рилпивирина в форме свободного основания.
В другом воплощении соединение формулы I или его дополнительная фармацевтически приемлемая соль не оказывает статистически значимого влияния на значение Cmax соединения формулы II или его дополнительной фармацевтически приемлемой соли по сравнению со значением Cmax соединения формулы II или его дополнительной фармацевтически приемлемой соли при их приеме в виде монотерапии. Как известно в данной области, фармакокинетические параметры, такие как Cmax и AUC, можно измерять у отельного человека или пациента или от исходного значения до выбранной конечной точки в группе пациентов. В качестве примера, значение Cmax соединения формулы II можно сравнивать у отдельного пациента или как среднее значение у пациента (пациентов), получающего соединение формулы II или его дополнительную фармацевтически приемлемую соль в виде монотерапии или в комбинации с соединением формулы I или его дополнительной фармацевтически приемлемой солью. Статистическая значимость может быть рассчитана рядом методов, известных в данной области, включая, без ограничения, расчет доверительного интервала (ДИ) и/или р-значения.
При пероральном введении долутегравира пиковые концентрации в плазме наблюдались через 2-3 часа после введения. При введении один раз в сутки фармакокинетическое равновесное состояние достигается приблизительно за 5 суток со средними коэффициентами накопления по AUC, Cmax и C24h от 1,2 до 1,5. Долутегравир является субстратом P-gp in vitro. Абсолютная биодоступность долутегравира не оценивалась.
После перорального введения максимальная концентрация (Cmax) рилпивирина в плазме обычно достигается за 4-5 часов. Абсолютная биодоступность рилпивирина неизвестна.
В другом воплощении до получения фармацевтической композиции долутегравира и рилпивирина пациент получал три или более противовирусных агента. Например, пациент мог получать терапию по антиретровирусной схеме (два нуклеозидных ингибитора обратной транскриптазы (НИОТ) и третий агент). Третий агент может представлять собой ингибитор интегразы (ИИ), ненуклеозидный ингибитор обратной транскриптазы (ННИОТ) или ингибитор протеазы (ИП). В одном воплощении до получения фармацевтической композиции долутегравира и рилпивирина пациент получал терапию по антиретровирусной схеме, включавшей биктегравир, тенофовир или пролекарство тенофовира, такое как тенофовира дизопроксил фумарат (TDF) или TAF (включая гемифумарат и монофумарат), или эмтрицитабин. В другом воплощении до получения фармацевтической композиции долутегравира и рилпивирина пациент пациент продемонстрировал устойчивость к биктегравиру, тенофовиру и/или эмтрицитабину. В более предпочтительном воплощении пациент переходит на фармацевтическую композицию долутегравира и рилпивирина со схемы, включающей биктегравир (например, комбинация биктегравира, TAF и эмтрицитабина), когда он/она инфицирован штаммом, устойчивым к биктегравиру, имеющим мутацию (мутации) Q148R и/или Q148K.
В одном воплощении изобретения предложены способы лечения или предупреждения инфекции, вызванной ВИЧ-1 или ВИЧ-2 (в особенности ВИЧ-1), у пациента с вирусологическим подавлением, нуждающегося в этом, включающие переход пациента со схемы антиретровирусной терапии, включающей по меньшей мере три антиретровирусных агента, на схему терапии, включающую только два антиретровирусных агента.
В другом воплощении изобретения предложен способ лечения инфекции, вызванной ВИЧ-1 или ВИЧ-2 (в особенности ВИЧ-1), у пациента с вирусологическим подавлением, нуждающегося в этом, включающий переход пациента со схемы антиретровирусной терапии, включающей по меньшей мере три антиретровирусных агента, на схему терапии, включающую только два антиретровирусных агента, где первый противовирусный агент представляет собой терапевтически эффективное количество соединения формулы I или его дополнительной фармацевтически приемлемой соли и второй противовирусный агент представляет собой терапевтически эффективное количество соединения формулы II или его дополнительной фармацевтически приемлемой соли. Таким образом, в одном воплощении изобретения предложены способы лечения инфекции, вызванной ВИЧ-1 или ВИЧ-2 (в особенности ВИЧ-1), у пациента с вирусологическим подавлением, нуждающегося в этом, включающие переход пациента со схемы антиретровирусной терапии, включающей по меньшей мере три антиретровирусных агента, на схему терапии, включающую только два антиретровирусных агента, состоящую по существу из долутегравира натрия (или другого подходящего катиона), эквивалентного 50 мг свободной кислоты долутегравира, и гидрохлорида (или другой подходящей кислоты) рилпивирина, эквивалентного 25 мг свободного основания рилпивирина, и по меньшей мере одного неактивного ингредиента.
В другом воплощении изобретения предложен способ лечения или предупреждения инфекции, вызванной ВИЧ-1 или ВИЧ-2 (в особенности ВИЧ-1), у пациента с вирусологическим подавлением, нуждающегося в этом, включающий переход пациента со схемы антиретровирусной терапии, включающей по меньшей мере три антиретровирусных агента, на схему терапии, включающую только два антиретровирусных агента, состоящую по существу из приблизительно 50 мг на дозу соединения формулы I или его дополнительной фармацевтически приемлемой соли и приблизительно 25 мг на дозу соединения формулы II или его дополнительной фармацевтически приемлемой соли. В другом воплощении способ или композиция включает/содержит приблизительно от 1 мг до 200 мг соединения формулы I или его дополнительной фармацевтически приемлемой соли и приблизительно от 1 мг до 200 мг соединения формулы II или его дополнительной фармацевтически приемлемой соли. В другом воплощении способ или композиция включает/содержит от 10 мг до 100 мг соединения формулы I или его дополнительной фармацевтически приемлемой соли и от 10 мг до 100 мг соединения формулы II или его дополнительной фармацевтически приемлемой соли.
Еще одно воплощение включает такие эквиваленты 10 мг, 20 мг, 25 мг, 30, мг, 35 мг, 40 мг, 45 мг, 50 мг, 75 мг, 100 мг соединения формулы I или его дополнительной фармацевтически приемлемой соли и 10 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, 45 мг, 50 мг, 75 мг, 100 мг соединения формулы II или его дополнительной фармацевтически приемлемой соли. В другом воплощении таблетка или другая композиция может содержать дополнительную фармацевтически приемлемую форму долутегравира, эквивалентную 50 мг свободной кислоты долутегравира, и содержать дополнительную фармацевтически приемлемую форму рилпивирина, эквивалентную 25 мг свободного основания рилпивирина. Предполагается, что для любого диапазона доз по изобретению его воплощения включают каждое целое значение дозы между крайними значениями диапазона доз. Например, диапазон доз от 15 мг до 50 мг также включает 16 мг, 17 мг и так далее до 49 мг (включая все десятичные знаки, доли и целые числа между указанными значениями). Значение приблизительно 50 мг включает значения более 45 мг, а также значения менее 55 мг. Другие терапевтически эффективные дозы долутегравира и рилпивирина могут быть определены или оптимизированы с применением известных фармацевтических или клинических методик.
В одном воплощении каждая из противовирусных схем может включать любое число стадий или прохождение любого числа манипуляций, а композиции, используемые в каждой схеме, могут содержать любое число компонентов, таких как эксципиенты или биологически активные соединения (например, фармацевтические соединения, не являющиеся противовирусными); тем не менее, применительно к числу противовирусных агентов в первой противовирусной схеме и соответствующей композиции, это число ограничено тремя или более противовирусными агентами, но не менее, а применительно к числу противовирусных агентов во второй противовирусной схеме и соответствующей композиции, это число ограничено двумя противовирусными агентами, не более и не менее.
В одном воплощении предложена схема терапии, включающая переход со схемы противовирусной терапии, включающей по меньшей мере три противовирусных агента, включая одно или более чем одно противовирусное соединение, выбранное из следующей группы: ингибитор протеазы ВИЧ, ненуклеозидный или ненуклеотидный ингибитор обратной транскриптазы ВИЧ, нуклеозидный или нуклеотидный ингибитор обратной транскриптазы ВИЧ, ингибитор интегразы ВИЧ, MK8591 (EFdA), ингибитор некаталитического сайта (или аллостерический ингибитор) интегразы ВИЧ, ингибитор проникновения ВИЧ (например, ингибитор CCR5, ингибитор gp41 (то есть ингибитор слияния) или ингибитор связывания с CD4 (например, комбинектин), ингибитор CXCR4, ингибитор gp120), ингибитор G6PD или NADH-оксидазы, вакцина от ВИЧ-инфекции, агент реверсирования латентности (latency reversing agent) (например, ингибитор гистондеацетилазы, ингибитор протеасом, активатор протеинкиназы С (PKC) или ингибитор BRD4), соединение, действующее на капсид ВИЧ («ингибитор капсида», например, ингибитор полимеризации капсида или соединение, нарушающее целостность капсида, ингибитор нуклеокапсида р7 (NCp7) ВИЧ, ингибитор белка капсида р24 ВИЧ), фармакокинетический усилитель, иммунная терапия (например, модулятор PD-1, модулятор PD-L1, модулятор CTLA4, модулятор ICOS, модулятор ОХ40 или тому подобное), модулятор Toll-подобных рецепторов, агонист IL-15, антитело против ВИЧ, биспецифичное антитело или «антитело подобный» терапевтический белок (например, DART, DUOBODY, BITE, XmAb, TandAb, производное Fab), включая действующие на gp120 или gp41 ВИЧ, комбинированное лекарственное средство от ВИЧ-инфекции, ингибитор матричного белка р17 ВИЧ, антагонист IL-13, модулятор пептидилпролил-цис-транс-изомеразы А, ингибитор протеиндисульфидизомеразы, антагонист рецептора комплемента С5а, ингибитор ДНК-метилтрансферазы, модулятор гена vif ВИЧ, антагонист димеризации Vif, ингибитор фактора инфекционности ВИЧ-1, ингибитор белка ТАТ, модулятор Nef ВИЧ-1, модулятор тирозинкиназы Hck, ингибитор киназы смешанного происхождения 3-го типа (mixed lineage kinase-3, MLK-3), ингибитор сплайсинга ВИЧ-1, ингибитор белка aRev, антагонист интегрина, ингибитор нуклеопротеина, модулятор фактора сплайсинга, модулятор белка 1, содержащего домен СОММ, ингибитор рибонуклеазы Н ВИЧ, модулятор ретроциклина, ингибитор CDK-9, специфичный для дендритных клеток ICAM-3-связывающий неинтегрин 1 (dendritic ICAM-3 grabbing nonintegrin 1), ингибитор белка GAG ВИЧ, ингибитор белка POL ВИЧ, модулятор фактора комплемента И, ингибитор убиквитинлигазы, ингибитор дезоксицитидинкиназы, ингибитор циклин-зависимых киназ, стимулятор пропротеиновой конвертазы РС9, ингибитор АТФ-зависимой РНК-хеликазы DDX3X, ингибитор праймирующего комплекса обратной транскриптазы (reverse transcriptase priming complex), генная терапия ВИЧ-инфекции, ингибитор PI3K, соединение, как раскрытые в WO 2013/006738 (Gilead Sciences), US 2013/0165489 (Пенсильванский университет), WO 2013/091096 A1 (Boehringer Ingelheim), WO 2009/062285 (Boehringer Ingelheim), US 2014/0221380 (Japan Tobacco), US 2014/0221378 (Japan Tobacco), WO 2010/130034 (Boehringer Ingelheim), WO 2013/159064 (Gilead Sciences), WO 2012/145728 (Gilead Sciences), WO 2012/003497 (Gilead Sciences), WO 2014/100323 (Gilead Sciences), WO 2012/145728 (Gilead Sciences), WO 2013/159064 (Gilead Sciences) и WO 2012/003498 (Gilead Sciences) и WO 2013/006792 (Pharma Resources), и другие лекарственных средства для лечения ВИЧ-инфекции.
В одном воплощении предложена схема терапии, включающая переход со схемы противовирусной терапии, включающей по меньшей мере три противовирусных агента. В другом воплощении предложена схема терапии, включающая переход со схемы противовирусной терапии, включающей биктегравир, тенофовир или пролекарство тенофовира, такое как тенофовира дизопроксил фумарат (TDF) или TAF (включая гемифумарат и монофумарат), и/или эмтрицитабин.
В другом воплощении схема включает переход от использования композиции по изобретению к использованию композиции, содержащей комбинацию, включающую одно или более чем одно из указанных выше противовирусных соединений. Согласно другому воплощению предложен способ, включающий антиретровирусную схему, включающую два НИОТ и один или более чем один антиретровирусный агент, выбранный из группы, состоящей из ИИ, ННИОТ или ИП.
В другом воплощении способа человек или пациент представляет собой человека или пациента с вирусологическим подавлением. В качестве примера, вирусологическое подавление определяют у пациента при числе копий ВИЧ от 0 до 200 копий/мл, менее 20 копий/мл, 50 копий/мл, 100 копий/мл и/или 200 копий/мл. Также предполагается, что для любого числа копий по изобретению его воплощения включают каждое целое число копий между крайними значениями диапазона числа копий. Например, диапазон числа копий от 20 копий/мл до 50 копий/мл также включает 21, 22, 23 и до 49 копий/мл.
Согласно одному воплощению изобретения предложена композиция по изобретению, вводимая пациенту, инфицированному ВИЧ-1 или ВИЧ-2 дикого типа (в особенности ВИЧ-1), ВИЧ подтипа В, ВИЧ группы М подтипов А, В, С, D, Е, F, G или Н, ВИЧ группы О или их мутантами.
Согласно одному воплощению схемы по изобретению предложено введение композиции по изобретению пациенту, инфицированному определенным мутантом ВИЧ-1 или ВИЧ-2 (в особенности ВИЧ-1), таким как мутантный вирус, содержащий одну аминокислотную замену или две или более замены. Согласно определенным таким схемам предложено введение композиции по изобретению пациенту, инфицированному мутантом с заменой, придающей устойчивость к ИПЦИ, таким как мутант, устойчивый к ралтегравиру, или мутант, устойчивый к элвитегравиру.
Мутации ВИЧ, демонстрирующие устойчивость к НИОТ, хорошо задокументированы. Примеры мутаций ВИЧ, демонстрирующих устойчивость к TAF (тенофовира алафенамид фумарат) (профиль устойчивости к TAF идентичен профилю устойчивости к тенофовиру и тенофовира дизопроксилу) и FTC (эмтрицитабину), опубликованы, например, в Characterization of HIV-1 Resistance to Tenofovir Alafenamide In vitro, Antimicrobial Agents and Chemotherapy, vN. A. Margot et al., Volume 59 Number 10 (2015). Также опубликовано в режиме онлайн по адресу https://hivdb.stanford.edu/dr-summary/resistance-notes/NRTE.
Также предложено воплощение, представляющее собой схему по изобретению или композицию по изобретению, вводимую или применяемую для лечения пациента, получавшего антиретровирусную терапию (APT). Кроме того, согласно одному воплощению этот пациент представляет собой пациента с вирусологическим подавлением.
Схемы по изобретению и композиции по изобретению применяют для лечения пациентов, инфицированных ВИЧ дикого типа, мутантным ВИЧ или вирусом, содержащим гомолог интегразы ВИЧ. В другом воплощении согласно изобретению предложен способ введения композиции по изобретению пациенту, получавшему лечение, такому как пациент с вирусологическим подавлением.
В другом воплощении содержание РНК ВИЧ-1 или ВИЧ-2 (в особенности ВИЧ-1) у пациента до перехода со схемы антиретровирусной терапии, включающей по меньшей мере три антиретровирусных агента, на схему терапии, включающую только два антиретровирусных агента, составляет менее 50 копий/мл. В другом воплощении содержание РНК ВИЧ-1 или ВИЧ-2 (в особенности ВИЧ-1) у пациента до перехода со схемы антиретровирусной терапии, включающей по меньшей мере три антиретровирусных агента, на схему терапии, включающую соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль, составляет менее 50 копий/мл. В другом воплощении переход на схему терапии, включающую соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль, происходит после по меньшей мере 6 месяцев вирусологического подавления (РНК ВИЧ-1 менее 50 копий/мл) без неэффективности терапии в анамнезе и подтвержденных замен, ассоциированных с устойчивостью к соединению формулы I или соединению формулы II.
В другом воплощении согласно настоящему изобретению предложен способ сохранения содержания РНК ВИЧ-1 или ВИЧ-2 (в особенности ВИЧ-1) менее 50 копий/мл введением пациенту фармацевтической композиции по изобретению, содержащей соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль. В другом воплощении фармацевтическая композиция содержит соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль и один или более чем один фармацевтически приемлемый эксципиент, разбавитель или носитель. В дополнительном воплощении содержание РНК ВИЧ-1 или ВИЧ-2 (в особенности ВИЧ-1) менее 50 копий/мл сохраняется на протяжении 48 недель после перехода со схемы антиретровирусной терапии, включающей по меньшей мере три антиретровирусных агента, на схему терапии, включающую соединение формулы I или его дополнительную фармацевтически приемлемую соль, соединение формулы II или его дополнительную фармацевтически приемлемую соль и по меньшей мере один эксципиент, разбавитель или носитель.
В другом воплощении схема лечения, включающая два антиретровирусных агента, дополнительно включает еще от 20 мг до 30 мг соединения формулы II или его дополнительной фармацевтически приемлемой соли и рифабутин. Другое воплощение включает способ, где дополнительные 20-30 мг соединения формулы II или его дополнительной фармацевтически приемлемой соли принимают с пищей, такой как пища с по меньшей мере умеренным или более высоким содержанием жира. Другое воплощение включает способ, где продолжительность введения дополнительных 20-30 мг соединения формулы II или его дополнительной фармацевтически приемлемой соли соответствует продолжительности одновременного введения рифабутина.
В еще одном воплощении схема лечения, включающая два антиретровирусных агента, дополнительно включает еще 25 мг соединения формулы II или его дополнительной фармацевтически приемлемой соли и рифабутин. Другое воплощение включает способ, где дополнительные 25 мг соединения формулы II или его дополнительной фармацевтически приемлемой соли принимают с пищей, такой как пища с по меньшей мере умеренным или более высоким содержанием жира. Еще одно воплощение включает способ, где продолжительность введения дополнительных 25 мг соединения формулы II или его дополнительной фармацевтически приемлемой соли соответствует продолжительности одновременного введения рифабутина.
В другом воплощении средняя плотность костей у пациента возрастает после перехода со схемы антиретровирусной терапии, включающей по меньшей мере три антиретровирусных агента, на схему терапии, включающую только два антиретровирусных агента. В другом воплощении пациент получал ранее терапию тенофовиром или пролекарством тенофовира, таким как тенофовира дизопроксил фумарат (TDF) или TAF (включая гемифумарат и монофумарат). В другом воплощении средняя минеральная плотность костей у пациента возрастает приблизительно на 1,5% за 48 недель. Как известно в данной области, плотность костей может быть измерена по всей бедренной кости и/или поясничному отделу позвоночника. В некоторых аспектах повышение плотности приблизительно на 1,5% включает любое повышение плотности костей более чем на 1,0%, включая, без ограничения, приблизительно 1,0%, 1,1%, 1,2%, 1,3%, 1,4%, 1,5%, 1,6%, 1,7%, 1,8% 1,9% и 2,0%. В другом воплощении общая минеральная плотность бедренной кости у пациента возрастает приблизительно на 1,3% за 48 недель. В другом воплощении общая минеральная плотность поясничного отдела позвоночника у пациента возрастает приблизительно на 1,5% за 48 недель. В другом воплощении изобретения у пациента, перешедшего со схемы APT, включающей TDF, на схему, включающую соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль, средняя минеральная плотность костей по результатам двухэнергетической рентгеновской абсорбциометрии (ДРА) возрастает от исходного уровня до 48 недели в большей степени(1,34% по всей бедренной кости и 1,46% по поясничному отделу позвоночника), чем у пациентов, продолживших получать терапию по антиретровирусной схеме, включавшей TDF (0,05% по всей бедренной кости и 0,15% по поясничному отделу позвоночника).
В одном воплощении предложен способ лечения пациента, инфицированного вирусом иммунодефицита человека, с применением схемы терапии двумя лекарственными средствами, состоящей из ингибитора интегразы и ненуклеозидного ингибитора обратной транскриптазы, где текущая схема антиретровирусной терапии у пациента включает три или более противовирусных агента. Как известно в данной области, схема антиретровирусной терапии, включающая три или более противовирусных агента, может включать три, четыре, пять, шесть, семь или более противовирусных агентов. В другом воплощении ингибитор интегразы представляет собой соединение формулы I:

или его дополнительную фармацевтически приемлемую соль. В другом воплощении ненуклеозидный ингибитор обратной транскриптазы представляет собой соединение формулы II:

или его дополнительную фармацевтически приемлемую соль.
В другом воплощении текущая схема антиретровирусной терапии у пациента включает два нуклеозидных ингибитора обратной транскриптазы (НИОТ) с ИПЦИ, ННИОТ или ингибитором протеазы (ИП). В другом воплощении текущая схема антиретровирусной терапии у пациента включает ингибитор интегразы, такой как биктегравир, или его дополнительную фармацевтически приемлемую соль. В другом воплощении текущая схема антиретровирусной терапии у пациента включает по меньшей мере три нуклеозидных ингибитора обратной транскриптазы (НИОТ).
В одном воплощении согласно настоящему изобретению предложены комбинации только двух противовирусных агентов, представляющих собой соединение формулы I или его фармацевтически приемлемую соль и соединение формулы II или его фармацевтически приемлемую соль, для применения в лечении инфекции, вызванной ВИЧ-1 или ВИЧ-2 (в особенности ВИЧ-1), у пациента с вирусологическим подавлением, нуждающегося в этом, включающем переход пациента со схемы антиретровирусной терапии, включающей по меньшей мере три антиретровирусных агента, на схему терапии, включающую только два антиретровирусных агента.
В одном воплощении предложены наборы, содержащие соединение формулы I или его дополнительную фармацевтически приемлемую соль, соединение формулы II или его дополнительную фармацевтически приемлемую соль и инструкции по их совместному введению.
В одном воплощении предложены наборы, содержащие соединение формулы I или его дополнительную фармацевтически приемлемую соль и соединение формулы II или его дополнительную фармацевтически приемлемую соль в лекарственных формах для перорального введения. В одном воплощении предложены описанные выше композиции, наборы или комбинации для применения в лекарственной терапии. В другом воплощении предложены описанные выше композиции, наборы или комбинации для применения в любом из описанных выше способов.
Композиции по настоящему изобретению могут быть использованы в качестве лекарственного средства или в изготовлении лекарственного средства. Оно может поставляться в упаковках или в наборах.
Согласно другому воплощению предложен способ предупреждения ВИЧ-инфекции или СПИД, включающий введение человеку терапевтически эффективного количества соединения формулы I или его дополнительной фармацевтически приемлемой соли и терапевтически эффективного количества соединения формулы II или его дополнительной фармацевтически приемлемой соли пациенту, подверженному риску заражения ВИЧ-инфекцией. Например, способы могут представлять собой профилактику для человека, употребляющего наркотики внутривенно; человека, который контактирует или может контактировать с биологической жидкостью человека, инфицированного ВИЧ; или человека, который вступает или может вступать в половой или иной контакт, связанный с риском заражения ВИЧ-инфекцией.
Согласно одному воплощению изобретения предложена терапевтически эффективная схема по изобретению или терапевтически эффективная композиция по изобретению. Любое воплощение изобретения, включающее или относящееся к пациенту, также включает или относится к человеку. Любая композиция по изобретению может быть введена человеку. Любая схема по изобретению может быть применена у человека, например, для лечения человека, такого как человек, инфицированный ВИЧ.
В одном воплощении данного изобретения предложены комбинации только двух противовирусных агентов, представляющих собой соединение формулы I или его фармацевтически приемлемую соль и соединение формулы II или его фармацевтически приемлемую соль, для применения в лечении инфекции, вызванной ВИЧ-1 или ВИЧ-2 (в особенности ВИЧ-1), у пациента с вирусологическим подавлением, нуждающегося в этом, включающем переход пациента со схемы антиретровирусной терапии, включающей по меньшей мере три антиретровирусных агента, на схему терапии, включающую только два антиретровирусных агента. В некоторых воплощениях комбинация дополнительно включает по меньшей мере один фармацевтически приемлемый эксципиент, разбавитель и/или носитель. Комбинации по настоящему изобретению могут содержать первый антиретровирусный агент, представляющий собой долутегравир, и второй антиретровирусный агент, представляющий собой рилпивирин. Применения этих комбинаций включают лечение или предупреждение инфекции, вызванной ВИЧ-1 или ВИЧ-2 (в особенности ВИЧ-1), у пациента с вирусологическим подавлением, нуждающегося в этом. Раскрытые способы лечения и применения могут быть применены в связи с указанными комбинациями.
Пример таблетки
Как часть данного изобретения предложена многослойная таблетка, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль.
В одном воплощении лекарственная форма содержит 50 мг эквивалента свободной кислоты долутегравира и 25 мг эквивалента свободного основания рилпивирина.
В одном воплощении лекарственная форма содержит 52,6 мг долутегравира натрия и 27,5 мг гидрохлорида рилпивирина.
В ранних исследованиях совместимости было обнаружено, но взаимодействие между долутегравиром натрия и гидрохлоридом рилпивирина приводило к диспропорционированию обоих соединений. Было показано, что хранение твердого долутегравира натрия и гидрохлорида рилпивирина, тщательно смешанных в стрессовых условиях, приводит к высоким уровням образования долутегравира в форме свободной кислоты и рилпивирина в форме свободного основания. Изменение их соотношения также наблюдали при хранении исходных однослойных таблеток (где оба лекарственных вещества были включены в однослойную таблетку) в открытых условиях.
На Фиг. 1 и Фиг. 2 показан профиль растворения долутегравира и рилпивирина после открытого хранения однослойных таблеток продолжительностью до 4 недель при 40°C/75%RH.
Значительное диспропорционирование долутегравира натрия и гидрохлорида рилпивирина с образованием соответствующих свободной кислоты и свободного основания приводит к тому, что композиция не соответствует заявленному количеству солей (не позволяя контролировать количество, вводимое пациенту).
Для оценки стабильности однослойных композиций долутегравира натрия и гидрохлорида рилпивирина было проведено исследование стабильности шести однослойных композиций (от композиции №1 до композиции №6; Таблица 17) с применением спектроскопии с XRPD (дифракция рентгеновских лучей на порошке) и 19F SSNMR (твердотельный ядерный магнитный резонанс).


Твердотельные 19F NMR-спектры и XRPD-спектры композиций 1, 4, 5 и 6 показаны на Фиг. 5-12. На этих спектрах отчетливо видно, что после 2 или 4 недель хранения пики солевых форм долутегравира и рилпивирина больше не визуализируются, но появляются пики свободной кислоты или свободного основания, что указывает не только на диспропорционирование, но и на значительное уменьшение количества долутегравира натрия и гидрохлорида рилпивирина. Диспропорционирование не ограничено какой-либо конкретной однослойной композицией, но наблюдалось во всех 4 исследованных однослойных композициях.
Решение проблемы диспропорционирования состоит в разделении долутегравира натрия и гидрохлорида рилпивирина и изготовлении многослойной таблетки.
Таким образом, в одном аспекте предложена многослойная таблетка, содержащая долутегравир натрия и гидрохлорид рилпивирина.
В одном воплощении многослойная таблетка представляет собой двухслойную таблетку.
В одном воплощении многослойная таблетка представляет собой таблетку, покрытую оболочкой.
В одном воплощении многослойная таблетка представляет собой двухслойную таблетку, покрытую оболочкой.
Для дальнейшего изучения потенциала диспропорционирования была проведена разработка и валидация метода 19F SSNMR для количественного определения свободной кислоты долутегравира в таблетках DTG/RPV. Этот метод применялся для измерения свободной кислоты долутегравира в таблетках DTG/RPV после их изготовления и для их анализа в разных временных точках в первичных исследованиях стабильности (исключительно в информационных целях). Данные, представленные в Таблицах 18 и 19, демонстрируют, что свободная кислота долутегравира не образуется при изготовлении таблеток DTG/RPV или при их хранении в предложенной коммерческой упаковке после ее вскрытия и до 6 месяцев при 40°C/75%RH и 12 месяцев при 30°C/75%RH.



Из Таблиц 18 и 19 видно, что свободная кислота долутегравира не наблюдается, на уровнях, поддающихся выявлению, ни после изготовления, ни при длительном хранении/хранении в условиях ускоренного старения, ни в исследованиях со вскрытием упаковки.
В заключение, аналитические данные продемонстрировали, что использование двухслойных таблеток минимизирует потенциал диспропорционирования долутегравира натрия в таблетках DTG/RPV.
Для дальнейшего изучения потенциала диспропорционирования была проведена разработка и валидация метода XRPD для количественного определения свободного основания рилпивирина в таблетках DTG/RPV с пределом количественного определения 10% масс./масс. Этот метод применялся для измерения свободного основания рилпивирина в таблетках DTG/RPV после их изготовления и во время исследований стабильности.
Кроме того, были проведены исследования со вскрытием упаковки и использованием партий для первичного изучения стабильности с оценкой стабильности лекарственного средства при его применении пациентом и ежедневном извлечении одной таблетки из упаковки.
Свободное основание рилпивирина остается ниже предела количественного определения после длительного хранения на протяжении 12 месяцев при 25°C/60%RH и при 30°C/75%RH (партии для первичного изучения стабильности) и 18 месяцев при 30°C/75%RH (партия изучения относительной биодоступности), после хранения в условиях ускоренного старения при 40°C/75%RH на протяжении 6 месяцев (партии для первичного изучения стабильности) и в исследованиях со вскрытием упаковки при 25°C/60%RH.
В исходной двухслойной композиции рилпивириновый слой был меньше долутегравирового слоя (масса рилпивирина после прессования 110 мг против 300 мг долутегравира). Это затрудняло контроль массы рилпивиринового слоя и, таким образом, содержания лекарственного средства, и отклонение на 15 мг от целевой массы соответствовало 5% долутегравирового слоя, но 13,6% рилпивиринового слоя. При сохранении общей массы двух слоев любое отклонение массы долутегравирового слоя приводило бы, таким образом, к примерно в 3 раза большему отклонению массы рилпивиринового слоя.
Решением стало увеличение размера рилпивиринового слоя, состоящего из гранулярной композиции рилпивирина и экстрагранулярных эксципиентов. Было решено оставить гранулят рилпивирина без изменений и смешать его с большим количеством дополнительных эксципиентов.
Приемлемые диапазоны параметров процесса гранулирования рилпивирина необходимо было уменьшить во избежание увеличения размеров гранул, как показано на Фиг. 13, поскольку гранулы больших размеров приводят к расслоению композиции рилипивириноыого слоя при ее подаче в пресс с использованием вакуумной системы. Результатом расслоения является снижение однородности соответствующего слоя (разделение компонентов слоя), что может привести к изменению содержания лекарственного средства.
На Фиг. 13 видно, что выше пиковой LOD (потеря по массе при сушке), составляющей 12,3% масс./масс., незначительное изменение LOD оказывает существенное влияние на средний размер частиц. Ниже пиковой LOD 12,3% масс./масс., незначительное изменение LOD приводит к значительно меньшему влиянию на средний размер частиц («х50» или «d50») и, соответственно, меньшему риску снижения однородности. При изготовлении рилпивиринового слоя важно удерживать пиковую LOD ниже 12,3% масс/масс. Таким образом, при гранулировании с псевдоожиженным слоем распыление воды нельзя продолжать после достижения LOD выше 12,3% масс./масс.
Для измерения потери в массе при высушивании образец фиксированного размера и известной массы взвешивают до сушки и в различных временных точках во время сушки до достижения равновесия.
Таким образом, в одном воплощении предложен способ изготовления композиции рилпивирина, где пиковая LOD составляет менее 12,3% масс./масс.
Было обнаружено, что применение комбинации фиксированных доз может способствовать достижению подходящих фармакокинетических параметров и/или адекватной стабильности таблетки. Кроме того, применение многослойной таблетки как комбинации фиксированных доз может также обеспечить фармакокинетические преимущества и/или повысить стабильность.
В одном воплощении предложена многослойная таблетка, содержащая (а) долутегравир или его фармацевтически приемлемую соль и (б) рилпивирин или его фармацевтически приемлемую соль. В одном воплощении таблетка содержит (а) первый слой, содержащий долутегравир или его фармацевтически приемлемую соль, и (б) второй слой, содержащий рилпивирин или его фармацевтически приемлемую соль. В одном воплощении таблетка содержит (а) первый слой, содержащий 50 мг эквивалента свободной кислоты долутегравира, и (б) второй слой, содержащий 25 мг эквивалента свободного основания рилпивирина. В одном воплощении таблетка содержит (а) первый слой, содержащий 52,6 мг долутегравира натрия, и (б) второй слой, содержащий 27,5 мг гидрохлорида рилпивирина. В одном воплощении таблетка содержит (а) первый слой, содержащий 52,6 мг долутегравира натрия, и (б) второй слой, содержащий 27,5 мг гидрохлорида рилпивирина, где общая масса первого слоя составляет менее чем приблизительно 350 мг, например, 300 мг, а общая масса второго слоя составляет менее чем приблизительно 250 мг, например, 200 мг.
Если не указано иное, термины «первый слой», «второй слой» и так далее не указывают на конкретный порядок или ориентацию композиций в форме многослойных таблеток, раскрытых здесь. Вместо этого, эти термины используются, чтобы отличать части композиции друг от друга и для указания характеристик или компонентов каждого слоя, или части, или компонента. Первый слой может быть синтезирован первым или может быть синтезирован вторым. Первый слой может быть наверху или может быть внизу, или в него может быть инкапсулирован второй слой. Термин «первый слой» не является ограничивающим применительно к порядку или ориентации.
Твердость таблеток, раскрытых здесь, будет обычно в пределах 14-21 кгс и, в определенных воплощениях, составляет 17 кгс. Твердость может обычно быть оценена перемещением валика для сжатия таблетки с постоянной нагрузкой до ее разламывания в соответствии с USP 1217.
Таблетки по изобретению будут обычно содержать один или более чем один эксципиент. Эксципиенты должны быть совместимы с другими ингредиентами композиции и физиологически безвредны для ее реципиента. Примеры подходящих эксципиентов хорошо известны специалисту в области изготовления таблеток и могут быть обнаружены, среди прочего, в "Handbook of Pharmaceutical Excipients", 7th Ed, 2012. При использовании здесь термин «эксципиенты» предназначен для обозначения, среди прочего, агентов, повышающих основность, солюбилизаторов, скользящих агентов, наполнителей, связывающих агентов, смазывающих агентов, поверхностно-активных агентов, диспергирующих агентов и тому подобного. Термин также включает такие агенты, как подсластители, корригенты, красители, консерванты и агенты для покрытия оболочкой. Такие эксципиенты будут обычно присутствовать в таблетки в форме смеси.
Примеры солюбилизаторов включают, без ограничения, ионные поверхностно-активные вещества (включая как ионные, так и неионные поверхностно-активные вещества), такие как лаурилсульфат натрия, бромид цетилтриметил аммония, полисорбаты (такие как полисорбат 20 или 80), полоксамеры (такие как полоксамер 188 или 207) и макроголы. В одном воплощении солюбилизатор представляет собой полисорбат 20.
Примеры смазывающих агентов, скользящих агентов и агентов для повышения текучести включают, без ограничения, стеарат магния, стеарат кальция, стеариновую кислоту, гидрогенизированное растительное масло, глицерилпальмитостеарат, глицерилбегенат, стеарилфумарат натрия, коллоидный диоксид кремния и тальк. Количество смазывающего агента в таблетке обычно составляет приблизительно 0,5-5% по массе. В одном воплощении смазывающий агент представляет собой стеарилфумарат натрия или стеарат магния.
Примеры разрыхлителей включают, без ограничения, крахмалы, целлюлозы, поперечно сшитый PVP (кросповидон), крахмалгликолят натрия, кроскармеллозу натрия и так далее. В одном воплощении разрыхлитель представляет собой крахмалгликолят натрия.
Примеры наполнителей (также известных как объемообразующие агенты или разбавители) включают, без ограничения, крахмалы, мальтодекстрины, полиолы (такие как лактоза) и целлюлозы. В одном воплощении наполнитель выбран из D-маннита, микрокристаллической целлюлозы, силикатизированной микрокристаллической целлюлозы, моногидрата лактозы.
Примеры связывающих агентов включают, без ограничения, поперечно сшитый PVP, НРМС, сахарозу, крахмалы и так далее. В одном воплощении связывающий агент представляет собой повидон. В одном воплощении связывающий агент выбран из повидона K29/32 и повидона K30.
В одном воплощении таблетки, предложенные здесь, не покрыты оболочкой. В одном воплощении таблетки, предложенные здесь, покрыты оболочкой (в этом случае они содержат оболочку). Несмотря на возможность использования таблеток без оболочки, в клинических условиях чаще применяют таблетки, покрытые оболочкой, в этом случае может быть использована обычная оболочка, не являющаяся кишечнорастворимой. Пленочные оболочки известны в данной области и могут состоять из гидрофильных полимерных веществ, без ограничения, полисахаридных веществ, таких как гидроксипропилметилцеллюлоза (НРМС), метилцеллюлоза, гидроксиэтилцеллюлоза (НЕС), гидроксипропилцеллюлоза (НРС), сополимера винилового спирта и этиленгликоля и других водорастворимых полимеров. Несмотря на то, что в одном воплощении водорастворимое вещество, включенное в пленочную оболочку по воплощениям, раскрытым здесь, содержит одно полимерное вещество, в определенных других воплощениях оно получено с использованием смеси более чем одного полимера. В одном воплощении оболочка розовая. Подходящие оболочки включают, без ограничения, полимерные пленочные оболочки, такие как оболочки, содержащие поливиниловый спирт, например, OPADRY II (содержащая частично гидролизованный PV А, диоксид титана, макрогол 3350 (PEG) и тальк, возможно, с красителем, таким как оксид железа (например, красный оксид железа, или черный оксид железа, или индигокармин, или желтый оксид железа, или FD&C желтый №6). В одном воплощении оболочка представляет собой OPADRY II Pink (содержащую поливиниловый спирт, диоксид титана, макрогол/PEG, тальк, желтый оксид железа и красный оксид железа). Количество оболочки обычно составляет приблизительно 2-4% массы сердцевины, а в определенных воплощениях приблизительно 3%. Если прямо не указано иное, в случаях, когда лекарственная форма покрыта оболочкой, следует понимать, что ссылка на % по массе таблетки относится к массе всей таблетки, то есть включая оболочку.
Для изготовления композиции по изобретению предпочтительно сначала по отдельности получить грануляты долутегравира и рилпивирина, перед изготовлением готовых таблеток долутегравира-рилпивирина.
Для получения гранулята долутегравира активное вещество сначала смешивают с одним или более чем одним из указанных выше эксципиентов в подходящей мешалке для смешивания веществ. В одном воплощении долутегравир (в форме долутегравира натрия) смешивают с первым количеством эксципиентов гранулированием с большим усилием сдвига. Проводят влажное гранулирование и влажное размалывание этой смеси, после чего гранулы сушат и проводят сухое размалывание. Затем к гранулам добавляют второе количество эксципиентов и проводят дополнительное смешивание. Готовый гранулят долутегравира собирают в подходящий контейнер. Схема получения долутегравира показана на Фиг. 14.
В одном воплощении используемое количество долутегравира будет таким, чтобы обеспечить доставку 50 мг долутегравира (в форме свободной кислоты) в готовой композиции в форме таблетки. В одном воплощении количество долутегравира натрия составляет 52,6 мг долутегравира натрия (эквивалентное 50 мг долутегравира в форме свободной кислоты).
Для получения гранулята рилпивирина как части таблеток долутегравира-рилпивирина рилпивирин (в форме гидрохлорида рилпивирина) предварительно смешивают с первым количеством эксципиентов. Проводят гранулирование этой смеси в псевдоожиженном слое, после чего гранулы сушат и проводят сухое размалывание. Гранулы перемешивают, затем добавляют к ним второе количество эксципиентов и проводят дополнительное смешивание. Добавляют скользящее вещество, способствующее смазыванию, и готовый гранулят рилпивирина собирают в подходящий контейнер.
В одном воплощении используемое количество рилпивирина будет таким, чтобы обеспечить доставку 25 мг рилпивирина (в форме свободного основания) в готовой композиции в форме таблетки. В одном воплощении количество гидрохлорида рилпивирина составляет 27,5 мг гидрохлорида рилпивирина (эквивалентное 25 мг рилпивирина в форме свободного основания).
Для получения готовых таблеток, содержащих долутегравир и рилпивирин, гранулированную смесь долутегравира и гранулированную смесь рилпивирина прессуют с получением двухслойных таблеток, используя оборудование, доступное в данной области. В одном воплощении для изготовления таблеток, описанных здесь, применяют методику с использованием инструментов для изготовления двухслойных таблеток. В одном воплощении таблетки по изобретению не являются однослойными таблетками.
Двухслойные таблетки по изобретению получают с использованием автоматических таблетировочных машин, где смесь веществ первого слоя помещают в форму для прессования, аналогично прессованию однослойных таблеток, и спрессовывают до низкой твердости. Затем на первый слой наносят смесь веществ второго слоя и полученную 2-слойную систему прессуют с получением двухслойной таблетки.
В одном воплощении многослойная таблетка содержит 50±13 мг эквивалента свободной кислоты долутегравира. В одном воплощении многослойная таблетка содержит 25±7 мг эквивалента свободного основания рилпивирина.
В одном воплощении многослойная таблетка содержит 50±5 мг эквивалента свободной кислоты долутегравира. В одном воплощении многослойная таблетка содержит 25±3 мг эквивалента свободного основания рилпивирина.
В одном воплощении многослойная таблетка содержит 50±16 мг долутегравира натрия. В одном воплощении многослойная таблетка содержит 25±7 мг гидрохлорида рилпивирина.
В одном воплощении многослойная таблетка содержит 50±5 мг долутегравира натрия. В одном воплощении многослойная таблетка содержит 25±3 мг гидрохлорида рилпивирина.
В одном воплощении первый слой многослойной таблетки содержит один или более чем один эксципиент.
В одном воплощении первый слой многослойной таблетки содержит:

В одном воплощении первый слой многослойной таблетки состоит из:


В одном воплощении первый слой многослойной таблетки содержит:

В одном воплощении первый слой многослойной таблетки состоит из:
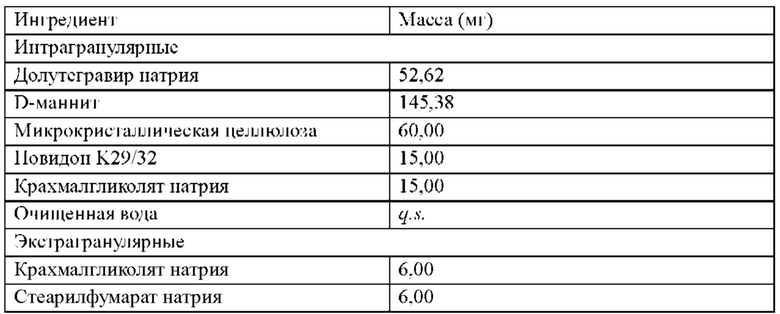
В одном воплощении второй слой многослойной таблетки содержит один или более чем один эксципиент.
В одном воплощении второй слой многослойной таблетки содержит:

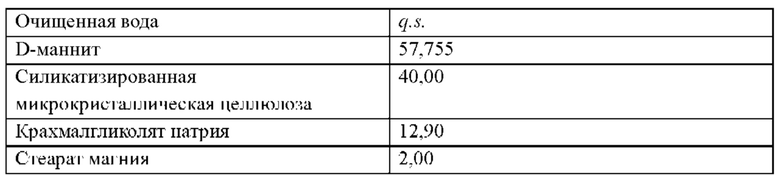
В одном воплощении второй слой многослойной таблетки состоит из:

В одном воплощении второй слой многослойной таблетки содержит:

В одном воплощении второй слой многослойной таблетки состоит из:


В одном воплощении первый слой многослойной таблетки состоит из:

В одном воплощении второй слой многослойной таблетки состоит из:

В одном воплощении композиции в форме многослойной таблетки первый слой контактирует со вторым слоем.
В одном воплощении первый слой получают первым с последующим получением второго слоя. То есть, в одном воплощении первый слой получают и прессуют с получением первого слоя, после чего получают второй слой и прессуют его с первым слоем с получением многослойной таблетки. В одном воплощении второй слой получают первым с последующим получением первого слоя. То есть, в одном воплощении второй слой получают и прессуют с получением второго слоя, после чего получают первый слой и прессуют его со вторым слоем с получением многослойной таблетки.
При использовании здесь в описании многослойных таблеток, раскрытых здесь, термины «первый слой» и «второй слой» не предназначены для указания способа изготовления таблеток, в частности порядка получения слоев.
В одном воплощении многослойная таблетка дополнительно содержит дополнительные слои. В одном воплощении дополнительный слой или слои расположены между первым слоем и вторым слоем. В одном воплощении дополнительный слой или слои расположены по обе стороны от первого и/или второго слоя, таким образом, что они представляют собой наружный слой таблетки и/или расположены между первым и/или вторым слоем и слоем оболочки. В некоторых воплощениях первый и второй слои инкапсулированы в дополнительный слой или слои.
В одном воплощении многослойная таблетка дополнительно содержит пленочную оболочку. В одном воплощении многослойная таблетка дополнительно содержит от приблизительно 1 мг до приблизительно 30 мг пленочной оболочки. В одном воплощении многослойная таблетка дополнительно содержит от приблизительно 10 мг до приблизительно 20 мг пленочной оболочки. В одном воплощении многослойная таблетка дополнительно содержит приблизительно 15 мг пленочной оболочки. В одном воплощении пленочная оболочка содержит поливиниловый спирт, диоксид титана, макрогол/PEG, тальк, желтый и красный оксид железа.
В одном воплощении многослойная таблетка дополнительно содержит пленочную оболочку. В одном воплощении многослойная таблетка дополнительно содержит от приблизительно 0,2% до приблизительно 6% масс./масс. пленочной оболочки. В одном воплощении многослойная таблетка дополнительно содержит от приблизительно 2% до приблизительно 4% масс./масс. пленочной оболочки. В одном воплощении многослойная таблетка дополнительно содержит от приблизительно 3% масс./масс. пленочной оболочки.
В одном воплощении предложена таблетка, содержащая первый слой, состоящий из:

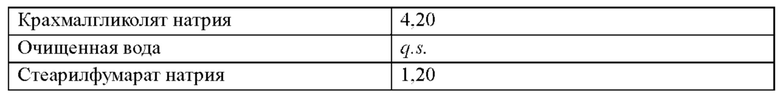
и второй слой, состоящий из:
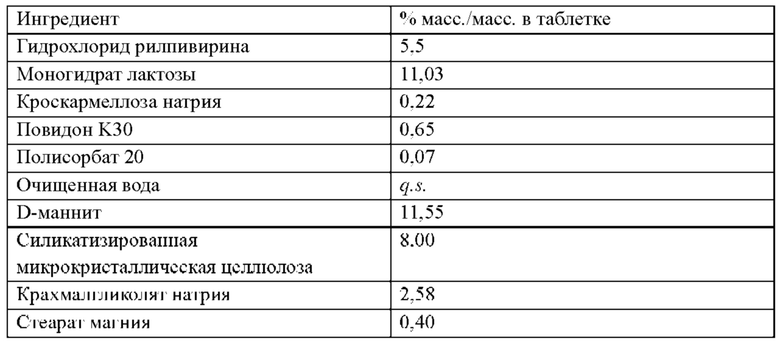
и, возможно, пленочную оболочку. В одном воплощении таблетка покрыта пленочной оболочкой.
В одном воплощении слой представляет собой слой, как в любом из описанных выше воплощений, но D-маннит частично или полностью заменен лактозой. В одном воплощении слой представляет собой слой, как в любом из описанных выше воплощений, но D-маннит частично или полностью заменен двухосновным фосфатом кальция. В одном воплощении слой представляет собой слой, как в любом из описанных выше воплощений, но D-маннит частично или полностью заменен дигидратом сульфата кальция.
В одном воплощении слой представляет собой слой, как в любом из описанных выше воплощений, но микрокристаллическая целлюлоза частично или полностью заменена прежелатинизированным крахмалом.
В одном воплощении слой представляет собой слой, как в любом из описанных выше воплощений, но повидон частично или полностью заменен гипромеллозой.
В одном воплощении слой представляет собой слой, как в любом из описанных выше воплощений, но крахмалгликолят натрия частично или полностью заменен кросповидоном. В одном воплощении слой представляет собой слой, как в любом из описанных выше воплощений, но крахмал гликолят натрия частично или полностью заменен кроскармеллозой натрия.
В одном воплощении слой представляет собой слой, как в любом из описанных выше воплощений, но стеарилфумарат натрия частично или полностью заменен одним или комбинацией из стеарата магния, стеарата кальция, стеарата цинка, стеариновой кислоты, глицерилдибегената или гидрогенизированного растительного масла.
В одном воплощении таблетка представляет собой розовую овальную двояковыпуклую таблетку, покрытую пленочной оболочкой.
Способы изготовления
Также предложены способы изготовления композиций и лекарственных форм (в частности таблеток), раскрытых здесь. В некоторых воплощениях способ включает (а) смешивание долутегравира натрия, D-маннита, микрокристаллической целлюлозы, повидона K29/32, крахмалгликолята натрия, очищенной воды и стеарилфумарата натрия с получением смеси долутегравирового слоя; (б) смешивание гидрохлорида рилпивирина, моногидрата лактозы, кроскармеллозы натрия, повидона K30, полисорбата 20, очищенной воды, D-маннита, силикатизированной микрокристаллической целлюлозы, крахмалгликолята натрия и стеарата магния с получением смеси рилпивиринового слоя; с последующим (в) прессованием смеси долутегравирового слоя как первого слоя; и (г) прессованием смеси рилпивиринового слоя как второго слоя. В одном воплощении способ включает стадии (а) и (б), как описано выше, с последующим (в) прессованием смеси рилпивиринового слоя с последующим (г) прессованием смеси долутегравирового слоя как второго слоя. В других воплощениях способ включает стадии (а) и (б), как описано выше, с последующим (в) прессованием смеси долутегравирового слоя как одного слоя с последующим (г) прессованием смеси рилпивиринового слоя как второго слоя. Первый слой и второй слой можно прессовать по отдельности с их последующим объединением. Тем не менее, чаще первый слой получают прессованием и затем второй слой прессуют непосредственно на первый слой. В одном воплощении выбор порядка слоев при таблетировании многослойных таблеток может оказывать влияние на свойства таблеток (например, на адгезию слоев в таблетке).
В некоторых воплощениях предложена таблетка, где первый слой может быть получен способом (а) прессования смеси долутегравирового слоя как первого слоя и (б) прессованием смеси рилпивиринового слоя как второго слоя. В других воплощениях предложена таблетка, где второй слой может быть получен способом (а) прессования смеси долутегравирового слоя как первого слоя и (б) прессованием смеси рилпивиринового слоя как второго слоя.
В одном воплощении способы будут включать стадию покрытия сердцевин таблеток оболочкой после прессования, например, пленочной оболочкой, как описано выше.
В целом, способы таблетирования хорошо известны в области фармацевтики. Методики и композиции обычно представлены в Remington's Pharmaceutical Sciences (Mack Publishing Co., Easton, PA), полностью включенной сюда посредством ссылки.
Таблетка может быть изготовлена прессованием или формованием, возможно, с одним или более чем одним эксципиентом. Прессованные таблетки могут быть получены прессованием активного ингредиента в свободно текучей форме, такой как порошок или гранулы, возможно, в смеси с эксципиентами, в подходящем аппарате.
Фармакокинетика
Cmax представляет собой максимальную наблюдаемую концентрацию лекарственного средства в плазме/сыворотке и отражает пиковую системную экспозицию.
AUC(0-t) представляет собой наблюдаемую экспозицию лекарственного средства в момент времени t после введения и циркуляции в плазме/сыворотке.
AUC(0-∞) представляет собой наблюдаемую общую экспозицию лекарственного средства с течением времени.
CV или коэффициент вариации является мерой вариабельности выборки, выраженной как процент среднего. Он рассчитывается как отношение стандартного отклонения выборки к среднему выборки, выраженное как процент.
AUClast (также называемая AUC(0-t), когда t представляет собой tlast) представляет собой площадь под кривой концентрация в плазме/сыворотке против времени от момента времени ноль до последней измеряемой временной точки. Эти значения отражают общую экспозицию лекарственного средства с течением времени.
В Таблицах 20 и 21 обобщены фармакокинетические параметры двухслойной таблетки рилпивирина и долутегравира по изобретению в сравнении с одновременным введением отдельных композиций долутегравира и рилпивирина. Видно, что двухслойная композиция демонстрирует фармакокинетические параметры, эквивалентные совместному введению рилпивирина и долутегравира.
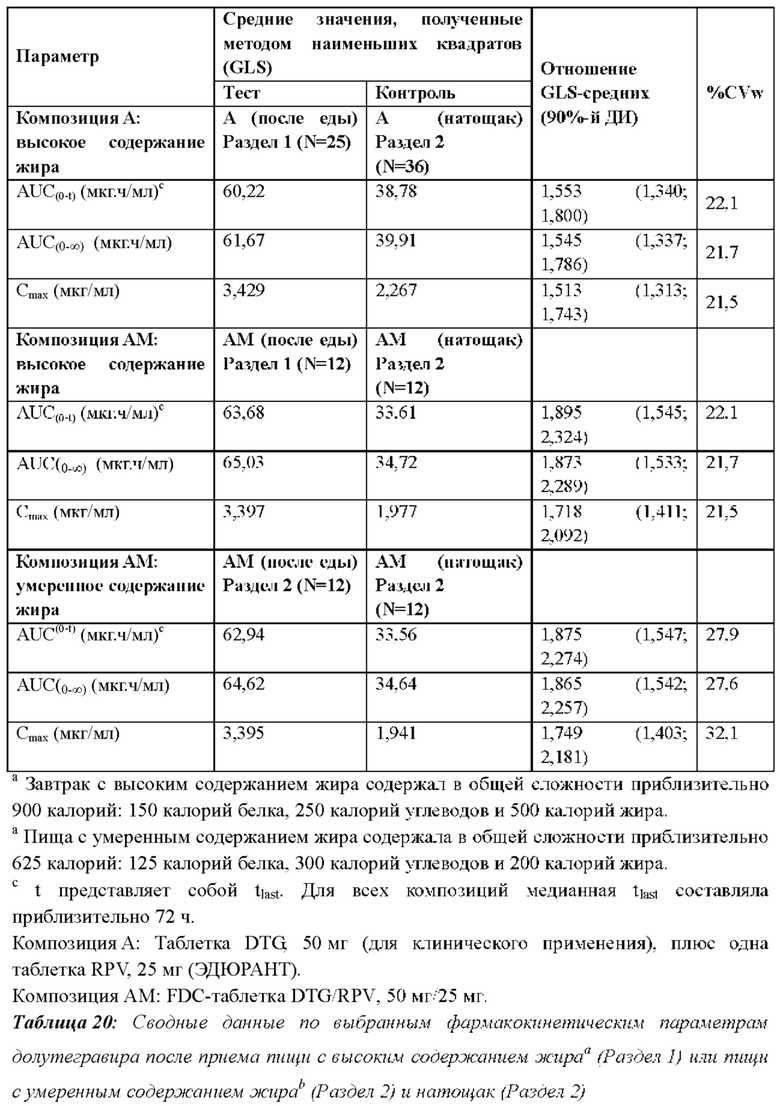
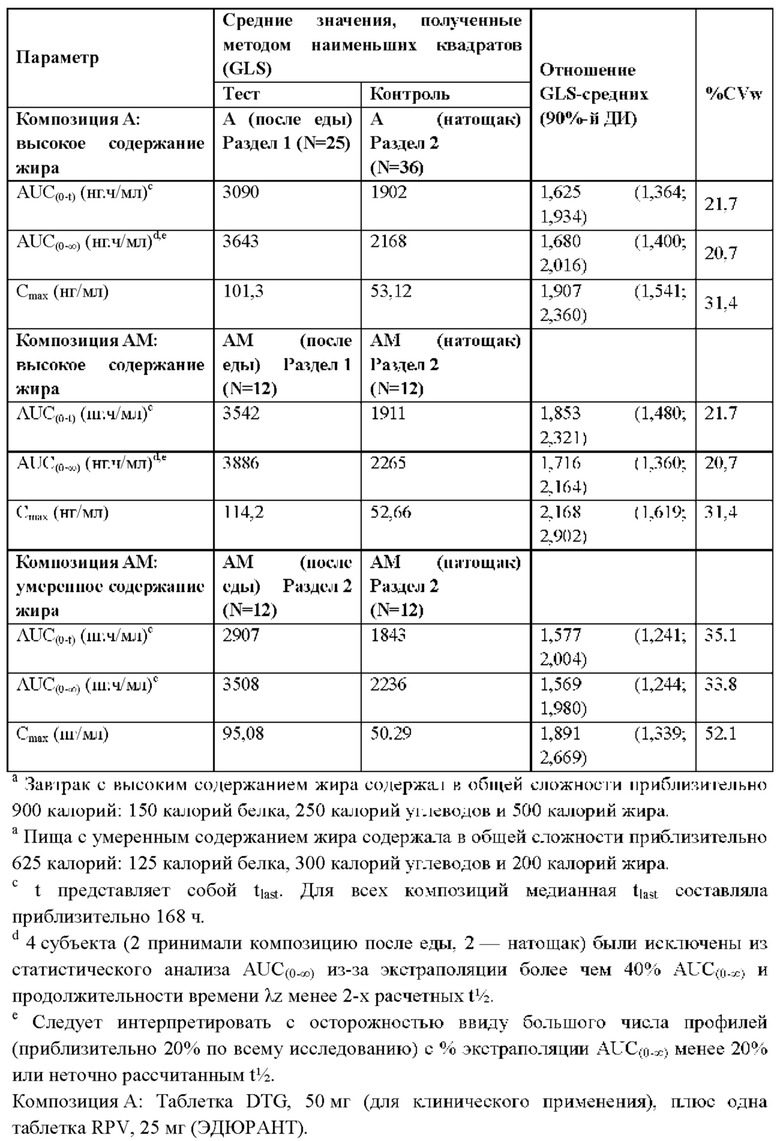

Cmax, AUC0-t, AUC0-∞ и AUClast являются стандартными фармакокинетическими параметрами, которые могут быть оценены вручную или с использованием программного обеспечения для моделирования, хорошо известного в данной области, такого как пакет Pharsight WinNonlin, с применением некомпартментной модели. Общее обоснование расчета этих величин хорошо известно (например, см. Rowland & Tozer (2010) Clinical Pharmacokinetics and Pharmacodynamics: Concepts and Applications ISBN 978-0781750097, или Jambhekar & Breen (2012) Basic Pharmacokinetics ISBN 978-0853699804). Обычно параметры будут оцениваться как среднее (например, геометрическое или арифметическое среднее) в группе из по меньшей мере 12 (и обычно от 24 до 36) здоровых взрослых людей. Параметры следует измерять в соответствии со стандартами и практиками, приемлемыми для фармацевтических регуляторных органов, таких как FDA, EMA, MHLW или ВОЗ. Их значения могут быть основаны на измерениях, проведенных с подходящими интервалами после приема таблетки, например, каждый час или с нарастающими интервалами, например, через 1, 3, 5, 7, 9, 11, 13, 15, 20 и 24 часа после приема. Их можно оценивать после однократного введения лекарственного средства или в равновесном состоянии, но обычно их будут оценивать после однократного введения.
В области исследований биодоступности и биоэквивалентности хорошо известно, как определить, соответствует ли какая-либо определенная таблетка регуляторным требованиям по эквивалентной биодоступности и фармакокинетической биоэквивалентности, например, см. Niazi (2014) Handbook of Bioequivalence Testing, 2nd Edition, ISBN 914-1482226379; Guidance for Industry Bioavailability and Bioequivalence Studies for Orally Administered Drug Products - General Considerations FDA March 2003; и Guideline On The Investigation Of Bioequivalence, EMEA 2010 CPMP/EWP/QWP/1401/98 Rev. 11 Corr **. Для обеспечения статистической мощности исследование по измерению значений Cmax и AUClast будет проводиться у множества субъектов, например, в группе из по меньшей мере 12 (и обычно от 24 до 36) здоровых взрослых людей.
Ввиду того, что определение значений Cmax и AUClast приводит к разруцшению, эти параметры будут определяться не непосредственно для рассматриваемой лекарственной формы (в частности таблетки), а для лекарственной формы, изготовленной с использованием того же технологического процесса и с использованием тех же компонентов. Таким образом, с использованием определенного процесса может быть изготовлена партия лекарственной формы (например, таблеток), и на выборке этих таблеток будет проведена оценка 90%-х доверительных интервалов для Cmax и AUClast. Если эти значения соответствуют требуемым 80-125%, как указано выше, то таблетки, изготовленные с применением рассматриваемого технологического процесса, являются таблетками по настоящему изобретению.
В одном воплощении предложена фармацевтическая композиция, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, обеспечивающая Cmax долутегравира у пациентов, принимающих ее после стандартного завтрака с умеренным содержанием жира, от приблизительно 2800 нг/мл до приблизительно 4200 нг/мл. В одном воплощении предложена фармацевтическая композиция, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, обеспечивающая Cmax долутегравира у пациентов, принимающих ее после стандартного завтрака с умеренным содержанием жира, от приблизительно 2900 нг/мл до приблизительно 4000 нг/мл. В одном воплощении предложена фармацевтическая композиция, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, обеспечивающая Cmax долутегравира у пациентов, принимающих ее после стандартного завтрака с умеренным содержанием жира, от приблизительно 3000 нг/мл до приблизительно 3900 нг/мл. В одном воплощении предложена фармацевтическая композиция, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, обеспечивающая Cmax долутегравира у пациентов, принимающих ее после стандартного завтрака с умеренным содержанием жира, от приблизительно 3500 нг/мл до приблизительно 3900 нг/мл. В одном воплощении предложена фармацевтическая композиция, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, обеспечивающая Cmax долутегравира у пациентов, принимающих ее после стандартного завтрака с умеренным содержанием жира, от приблизительно 3600 нг/мл до приблизительно 3800 нг/мл.
В одном воплощении предложена фармацевтическая композиция, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, обеспечивающая AUC0-t долутегравира у пациентов, принимающих ее после стандартного завтрака с умеренным содержанием жира, от приблизительно 56 ч.мкг/мл до приблизительно 72 ч.мкг/мл. В одном воплощении предложена фармацевтическая композиция, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, обеспечивающая AUC0-t долутегравира у пациентов, принимающих ее после стандартного завтрака с умеренным содержанием жира, от приблизительно 53 ч.мкг/мл до приблизительно 75 ч.мкг/мл. В одном воплощении предложена фармацевтическая композиция, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, обеспечивающая AUC0-t долутегравира у пациентов, принимающих ее после стандартного завтрака с умеренным содержанием жира, от приблизительно 51 ч.мкг/мл до приблизительно 77 ч.мкг/мл. В одном воплощении предложена фармацевтическая композиция, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, обеспечивающая AUC0-t долутегравира у пациентов, принимающих ее после стандартного завтрака с умеренным содержанием жира, от приблизительно 61 ч.мкг/мл до приблизительно 72 ч.мкг/мл. В одном воплощении предложена фармацевтическая композиция, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, обеспечивающая AUC0-t долутегравира у пациентов, принимающих ее после стандартного завтрака с умеренным содержанием жира, от приблизительно 62 ч.мкг/мл до приблизительно 71 ч.мкг/мл. В одном воплощении предложена фармацевтическая композиция, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, обеспечивающая AUC0-t долутегравира у пациентов, принимающих ее после стандартного завтрака с умеренным содержанием жира, от приблизительно 63 ч.мкг/мл до приблизительно 70 ч.мкг/мл.
В одном воплощении предложена фармацевтическая композиция, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, обеспечивающая AUC0-∞ долутегравира у пациентов, принимающих ее после стандартной пищи с умеренным содержанием жира, от приблизительно 51 ч.мкг/мл до приблизительно 80 ч.мкг/мл. В одном воплощении предложена фармацевтическая композиция, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, обеспечивающая AUC0-∞ долутегравира у пациентов, принимающих ее после стандартной пищи с умеренным содержанием жира, от приблизительно 54 ч.мкг/мл до приблизительно 77 ч.мкг/мл. В одном воплощении предложена фармацевтическая композиция, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, обеспечивающая AUC0-∞ долутегравира у пациентов, принимающих ее после стандартной пищи с умеренным содержанием жира, от приблизительно 57 ч.мкг/мл до приблизительно 74 ч.мкг/мл. В одном воплощении предложена фармацевтическая композиция, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, обеспечивающая AUC0-∞ долутегравира у пациентов, принимающих ее после стандартной пищи с умеренным содержанием жира, от приблизительно 61 ч.мкг/мл до приблизительно 72 ч.мкг/мл. В одном воплощении предложена фармацевтическая композиция, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, обеспечивающая AUC0-∞ долутегравира у пациентов, принимающих ее после стандартной пищи с умеренным содержанием жира, от приблизительно 63 ч.мкг/мл до приблизительно 72 ч.мкг/мл. В одном воплощении предложена фармацевтическая композиция, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, обеспечивающая AUC0-∞ долутегравира у пациентов, принимающих ее после стандартной пищи с умеренным содержанием жира, от приблизительно 63 ч.мкг/мл до приблизительно 71 ч.мкг/мл.
Терапевтические способы
Также предложен способ лечения пациента, инфицированного ВИЧ, включающий введение многослойной таблетки, содержащей долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль. В одном воплощении предложен способ лечения пациента, инфицированного ВИЧ, включающий введение многослойной таблетки, содержащей долутегравир натрия и гидрохлорид рилпивирина. В одном воплощении предложен способ лечения пациента, инфицированного ВИЧ, включающий введение многослойной таблетки, содержащей (а) 50 мг эквивалента свободной кислоты долутегравира и (б) 25 мг эквивалента свободного основания рилпивирина, где (а) и (б) присутствуют в отдельных слоях многослойной таблетки. В одном воплощении предложен способ лечения пациента, инфицированного ВИЧ, включающий введение многослойной таблетки, содержащей (а) 52,6 мг долутегравира натрия и (б) 27,5 мг гидрохлорида рилпивирина, где (а) и (б) присутствуют в отдельных слоях многослойной таблетки.
В одном воплощении предложен способ лечения пациента, инфицированного ВИЧ, включающий введение двухслойной таблетки, содержащей долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль.
Также предложена многослойная таблетка, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, для применения в лечении ВИЧ-инфекции. В одном воплощении предложена двухслойная таблетка, содержащая долутегравир или его фармацевтически приемлемую соль и рилпивирин или его фармацевтически приемлемую соль, для применения в лечении ВИЧ-инфекции.
Соответственно, предложены способы лечения пациента, инфицированного ВИЧ, включающие введение пациенту многослойной таблетки, как раскрыто здесь. Сходным образом, предложена многослойная таблетка, как раскрыто здесь, для применения в лечении ВИЧ-инфекции. Также предложено применение долутегравира или его фармацевтически приемлемой соли и рилпивирина или его фармацевтически приемлемой соли в изготовлении многослойной таблетки, раскрытой здесь, для лечения ВИЧ-инфекции.
В одном воплощении многослойные таблетки, раскрытые здесь, используют для доконтактной профилактики (ДКП), направленной на снижения риска полового заражения ВИЧ-1. Соответственно, предложены способы предупреждения инфекции у пациента, подверженного риску инфицирования ВИЧ-1, включающие введение пациенту многослойной таблетки, как раскрыто здесь. Сходным образом, предложена многослойная таблетка, как раскрыто здесь, для применения в предупреждении ВИЧ-инфекции у пациента, подверженного риску инфицирования ВИЧ-1. Согласно изобретению также предложено применение долутегравира или его фармацевтически приемлемой соли и рилпивирина или его фармацевтически приемлемой соли в изготовлении многослойной таблетки, раскрытой здесь, для предупреждения инфекции, вызванной ВИЧ-1, у пациента, подверженного риску инфицирования.
Способы, раскрытые здесь, включают введение многослойной таблетки пациенту, обычно человеку, и будут в большинстве случаев включать многократное введение, обычно один раз в сутки. Лечение может представлять собой профилактическое или терапевтическое лечение.
В одном воплощении многослойную таблетку принимают перорально один раз в сутки с пищей.
ПРИМЕРЫ
Следующие примеры иллюстрируют различные неограничивающие аспекты данного изобретения.
Пример 1
Рилпивирин метаболизируется главным образом через CYP3A, и поэтому лекарственные средства, индуцирующие или ингибирующие CYP3A, могут влиять на клиренс рилпивирина. Совместное введение композиции по изобретению и лекарственных средств, индуцирующих CYP3A, может привести к снижению концентраций рилпивирина в плазме, потере вирусологического ответа и возможной устойчивости к рилпивирину или к классу ННИОТ. Совместное введение композиции по изобретению и лекарственных средств, ингибирующих CYP3A, может привести к повышению концентраций рилпивирина в плазме. Совместное введение композиции по изобретению и лекарственных средств, повышающих рН в желудке, может привести к снижению концентраций рилпивирина в плазме, потере вирусологического ответа и возможной устойчивости к рилпивирину или к классу ННИОТ. Рилпивирин, 25 мг один раз в сутки, вероятно, не будет оказывать клинически значимого влияния на экспозицию лекарственных средств, метаболизируемых CYP-ферментами.
Долутегравир метаболизируется UGT1A1 при некотором участии CYP3A. Долутегравир также является субстратом UGT1A3, UGT1A9, BCRP и P-gp in vitro. Совместное введение композиции по изобретению и лекарственных средств, индуцирующих эти ферменты и переносчики, может привести к снижению концентрации долутегравира в плазме и уменьшению терапевтического эффекта долутегравира. Совместное введение композиции по изобретению и лекарственных средств, ингибирующих эти ферменты и переносчики, может привести к повышению концентраций долутегравира в плазме.
Информация о возможных лекарственных взаимодействиях долутегравира, рилпивирина или композиции по изобретению представлена в Таблицах 1-5. Для применения данной композиции по изобретению представлена определенная информация для справки или указания лекарственных взаимодействий, которых необходимо избегать. Другим воплощением изобретения является схема по изобретению, где композиция по изобретению содержит соединение формулы I или его дополнительную фармацевтически приемлемую соль, которую, в случае введения пациенту одного или более чем одного из соединений, указанных в Таблице 1 или Таблице 2, используют в большей или меньшей дозе или вводят с большей или меньшей частотой, чем при ее использовании или введении пациенту без этих соединений.
Другим воплощением изобретения является схема по изобретению, где композиция по изобретению содержит рилпивирин или его дополнительную фармацевтически приемлемую соль, которую, в случае введения пациенту одного или более чем одного из соединений, указанных в Таблицах 1-5, используют в большей или меньшей дозе или вводят с большей или меньшей частотой, чем при ее использовании или введении пациенту без этих соединений.
Долутегравир метаболизируется главным образом через UGT1A1 при некотором участии CYP3A. После однократного перорального введения [14С]-долутегравира 53% общей введенной перорально дозы выводятся с калом в неизмененном виде. Тридцать один процент общей введенной перорально дозы выводится с мочой и представлен глюкуронидом долутегравира (18,9% общей дозы), метаболитом, образованным окислением по бензильному углероду (3,0% общей дозы) или продуктом его гидролитического N-деалкилирования (3,6% общей дозы). В виде неизмененного лекарственного средства выводилось менее 1% дозы. Исходя из популяционных фармакокинетических анализов, терминальный период полувыведения долутегравира составляет приблизительно 14 часов, а кажущийся клиренс (CL/F) - 1,0 л в час.
Фармакокинетические свойства долутегравира были изучены у здоровых взрослых субъектов и у взрослых субъектов, инфицированных ВИЧ-1. Экспозиция долутегравира у здоровых субъектов и субъектов, инфицированных ВИЧ-1, была обычно сходной.
Эксперименты, проведенные in vitro, указывают на то, что рилпивирин подвержен, в первую очередь, окислительному метаболизму, опосредованному системой цитохрома Р450 CYP3A. Терминальный период полувыведения рилпивирина составляет приблизительно 50 часов. После однократного перорального введения [14С]-рилпивирина в кале и моче можно было обнаружить в среднем 85% и 6,1% радиоактивности, соответственно. Количество неизмененного рилпивирина в кале составляло в среднем 25% введенной дозы. В моче были выявлены лишь следовые количества неизмененного рилпивирина (менее 1% дозы).
Фармакокинетические свойства рилпивирина были изучены у здоровых взрослых субъектов и у взрослых субъектов, инфицированных ВИЧ-1, не получавших ранее антиретровирусную терапию. У субъектов, инфицированных ВИЧ-1, экспозиция рилпивирина была обычно меньше, чем у здоровых субъектов.
Согласно другому воплощению предложено прекращение применения композиции по изобретению, если у пациента развивается тяжелая кожная реакция или реакция гиперчувствительности, включая, без ограничения, тяжелую сыпь или сыпь, сопровождающуюся лихорадкой, недомогание, общую слабость, боли в мышцах или суставах, образование пузырей или шелушение кожи, поражение слизистых оболочек (образование пузырей или очагов в полости рта), конъюнктивит, отек лица, гепатит, эозинофилию, ангионевротический отек, затрудненное дыхание.
Установленные и другие потенциально значимые лекарственные взаимодействия
Информация о возможных лекарственных взаимодействиях долутегравира, рилпивирина представлена в Таблицах 1-5. Эти рекомендации основаны на исследованиях лекарственного взаимодействия отдельных компонентов или предполагаемых взаимодействиях ввиду ожидаемой степени взаимодействия и возможности развития серьезных нежелательных явлений или снижения эффективности.







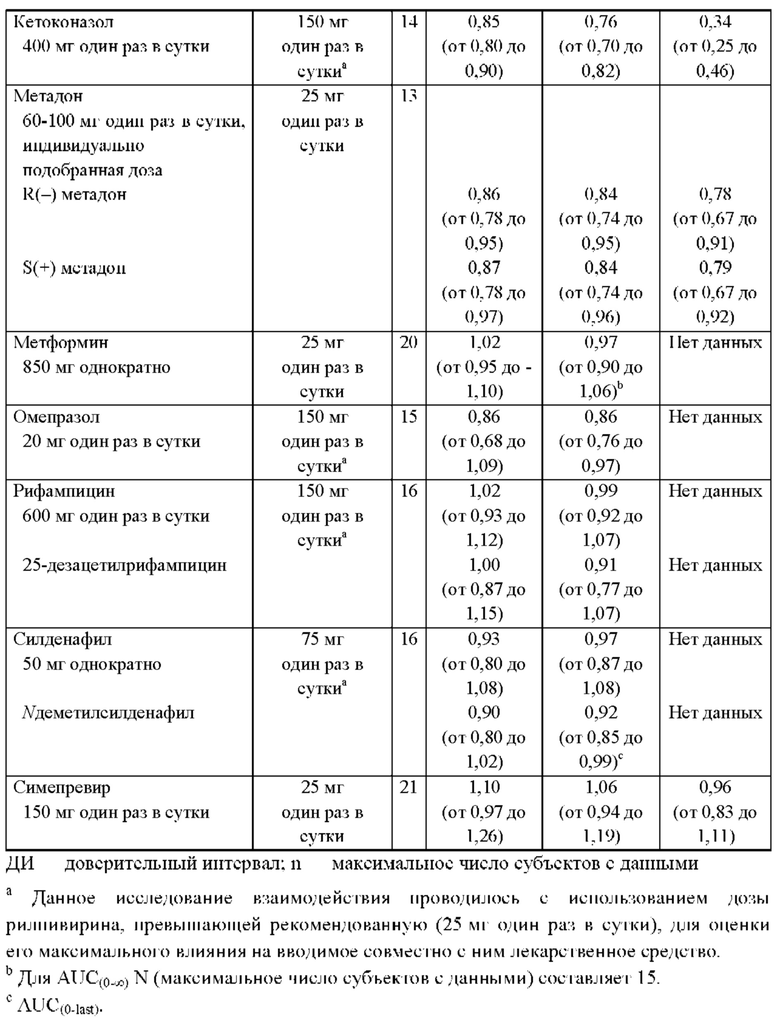

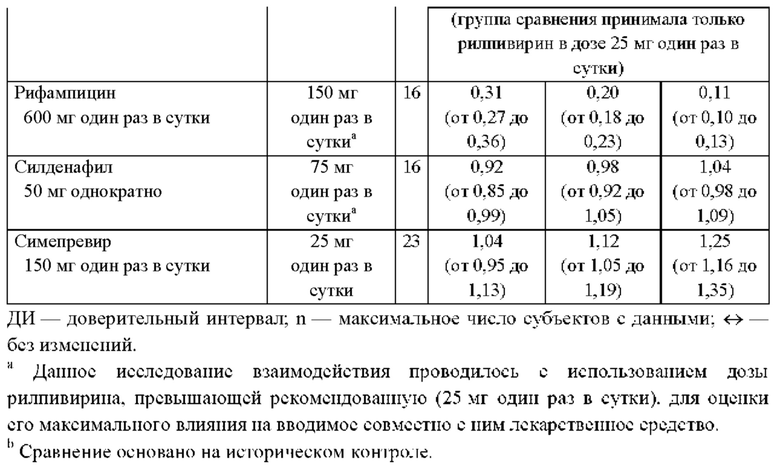
Противопоказания
Применение JULUCA противопоказано у пациентов:
• с предшествующей реакцией гиперчувствительности к долутегравиру или рилпивирину;
• одновременно получающих лекарственные средства, указанные в Таблице 1, повышенные концентрации которых в плазме связаны с серьезными и/или жизнеугрожающими явлениями, или которые значительно снижают концентрации рилпивирина в плазме.


Пример 2
Описания Примеров 2-5 включены в приведенную ниже Таблицу 7.



Первая группа участников получала DTG, 50 миллиграммов (мг), и RPV, 25 мг, совместно, один раз в сутки, приблизительно в одно и то же время, вместе с пищей и без маскировки до 52 недели ранней переходной фазы. Вторая группа пациентов продолжала получать терапию по исходной антиретровирусной схеме (два нуклеозидных ингибитора обратной транскриптазы (НИОТ) и третий агент). Третий агент включал ингибитор интегразы (ИИ), ненуклеозидный ингибитор обратной транскриптазы (ННИОТ) или ингибитор протеазы (ИП). CAR применяли в соответствии с утвержденными инструкциями без маскировки до 52 недели ранней переходной фазы.
Результаты представлены ниже в Таблице 8 и Таблице 9.

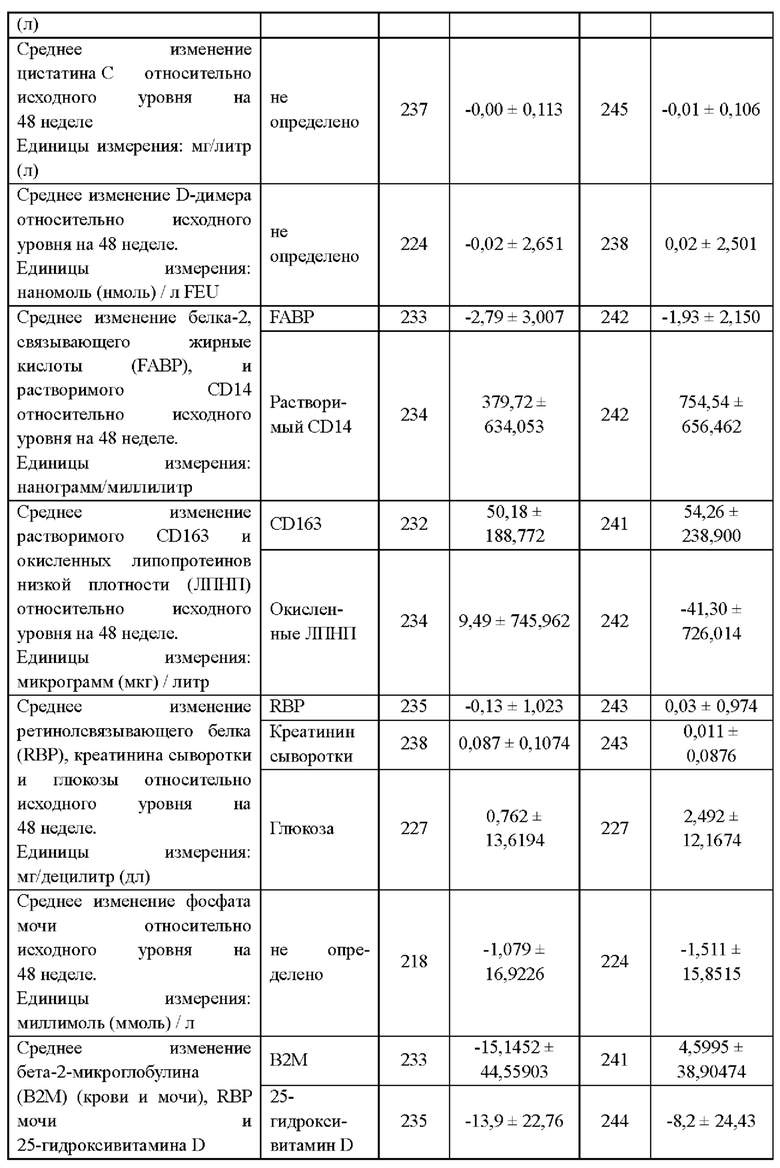






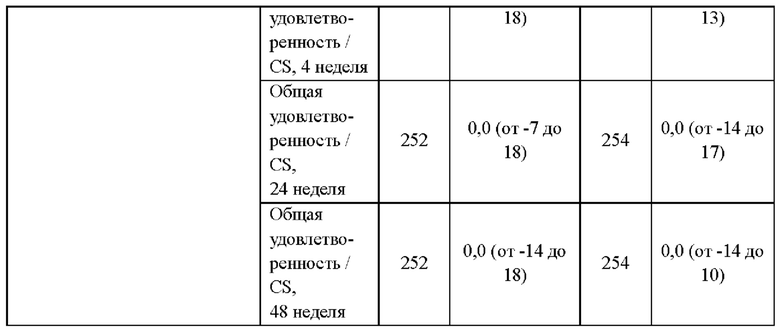
Пример 3
Первая группа участников (DTG, 50 мг) получала DTG, 50 мг, и RPV, 25 мг, совместно, один раз в сутки, вместе с пищей и без маскировки до 52 недели ранней переходной фазы. Вторая группа участников (RPV, 25 мг) также получала DTG, 50 мг, и RPV, 25 мг, совместно, один раз в сутки, вместе с пищей и без маскировки до 52 недели ранней переходной фазы.
Результаты представлены ниже в Таблице 10.

Пример 4
Первая группа участников (DTG+RPV) получала DTG, 50 миллиграммов (мг), и RPV, 25 мг, совместно, один раз в сутки, приблизительно в одно и то же время, вместе с пищей и без маскировки до 52 недели ранней переходной фазы. Вторая группа пациентов (CAR) продолжала получать терапию по исходной антиретровирусной схеме (два нуклеозидных ингибитора обратной транскриптазы (НИОТ) и третий агент). Третий агент включал ингибитор интегразы (ингибитор переноса цепи интегразой, ИПЦИ), ненуклеозидный ингибитор обратной транскриптазы (ННИОТ) или ингибитор протеазы (ИП). CAR применяли в соответствии с утвержденными инструкциями без маскировки до 52 недели ранней переходной фазы.
Результаты представлены ниже в Таблице 11 и Таблице 12.




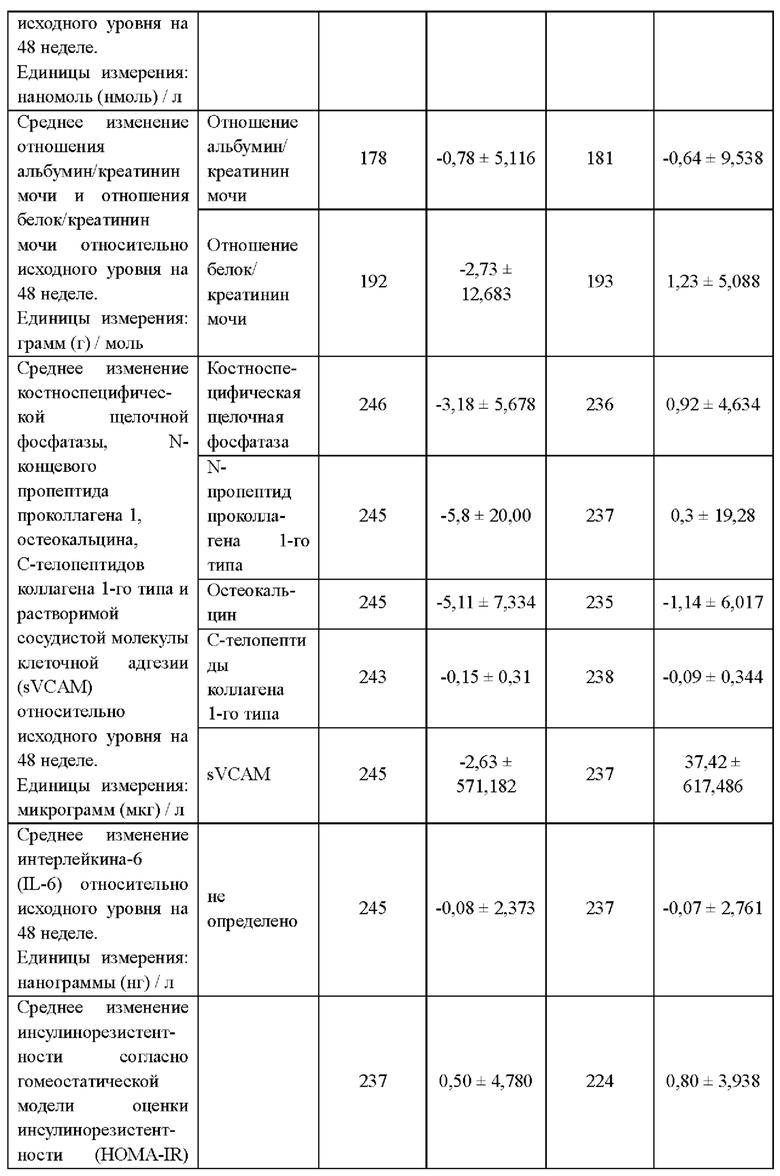
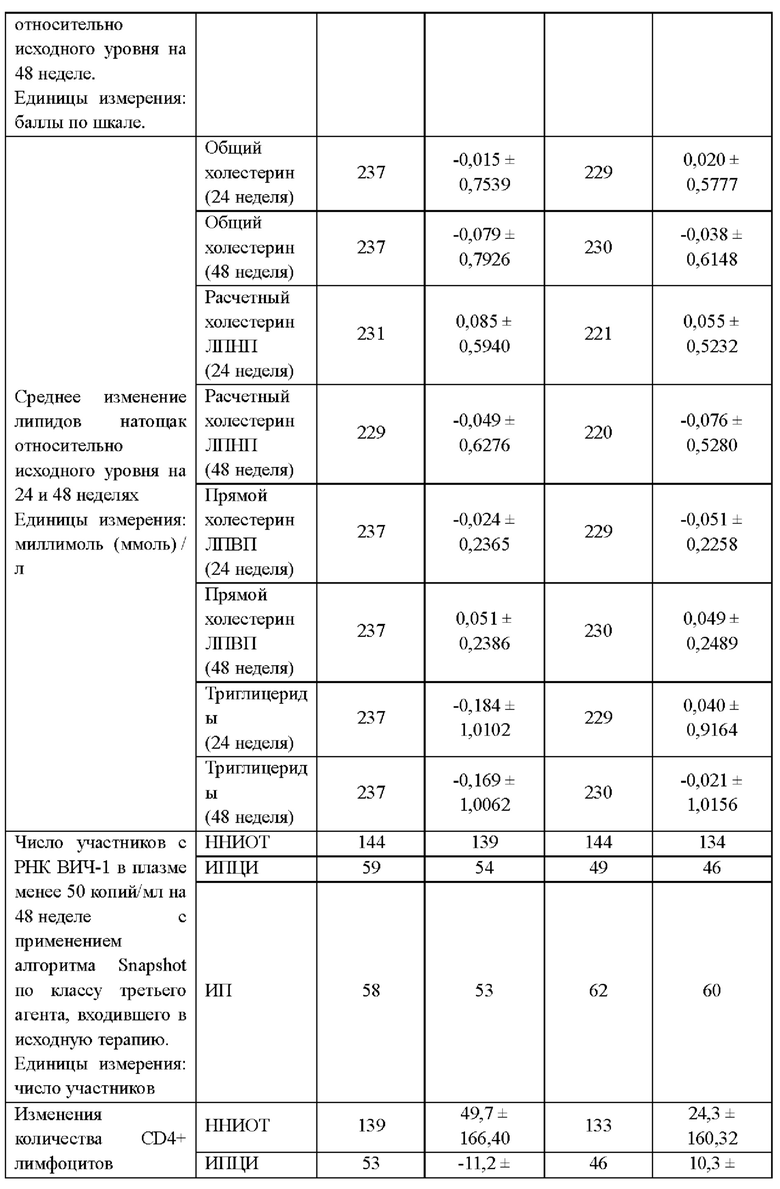





Пример 5
Первая группа участников (DTG, 50 мг) получала DTG, 50 мг, и RPV, 25 мг, совместно, один раз в сутки, вместе с пищей и без маскировки до 52 недели ранней переходной фазы. Вторая группа участников (RPV, 25 мг) также получала DTG, 50 мг, и RPV, 25 мг, совместно, один раз в сутки, вместе с пищей и без маскировки до 52 недели ранней переходной фазы.
Результаты представлены ниже в Таблице 13.


Пример 6
Клинические исследования Клинические исследования у взрослых субъектов, перешедших на JULUCA
Эффективность JULUCA подтверждена данными 2 открытых контролируемых исследований (SWORD-1 (NCT02429791) и SWORD-2 (NCT02422797)) у пациентов с вирусологическим подавлением, перешедших с используемой ими антиретровирусной схемы на долутегравир с рилпивирином.
SWORD-1 и SWORD-2 являются идентичными рандомизированными многоцентровыми исследованиями не меньшей эффективности III фазы продолжительностью 148 недель с параллельными группами. В этих исследованиях терапию получали в общей сложности 1024 взрослых субъекта, инфицированные ВИЧ-1, применявшие антиретровирусную схему (включавшую 2 НИОТ с ИПЦИ, ННИОТ или ИП), которая обеспечивала стабильное подавление, в течение по меньшей мере 6 месяцев (РНК ВИЧ-1 менее 50 копий/мл) без неэффективности терапии в анамнезе и подтвержденных замен, ассоциированных с устойчивостью к долутегравиру или рилпивирину. Субъектов рандомизировали в отношении 1:1 для продолжения применения текущей антиретровирусной схемы или перехода на долутегравир с рилпивирином, вводимые один раз в сутки. Основной конечной точкой эффективности в исследованиях SWORD была доля пациентов с РНК ВИЧ-1 в плазме менее 50 копий/мл на 48 неделе.
Исходно в объединенном анализе медианный возраст субъектов составлял 43 года (разброс: от 21 до 79), 22% были женщинами, 20% - не европеоидной расы, 11% соответствовали классу С по классификации CDC (СПИД), и у 11% количество CD4+ клеток было меньше 350 клеток на мм3; эти показатели были сходными в разных группах терапии. В объединенном анализе 54%, 26% и 20% субъектов получали ННИОТ, ИП или ИПЦИ (соответственно) в качестве третьего агента, входившего в их исходную терапию до рандомизации. В разных группах терапии это распределение было сходным.
Основная конечная точка и другие исходы (включая исходы по ключевым исходным ковариантам) для объединенных исследований SWORD-1 и SWORD-2, показаны в Таблице 14. Результаты SWORD-1 и SWORD-2 по вирусологическим исходам были сходны с соответствующими объединенными результатами исследований SWORD-1 и SWORD-2.

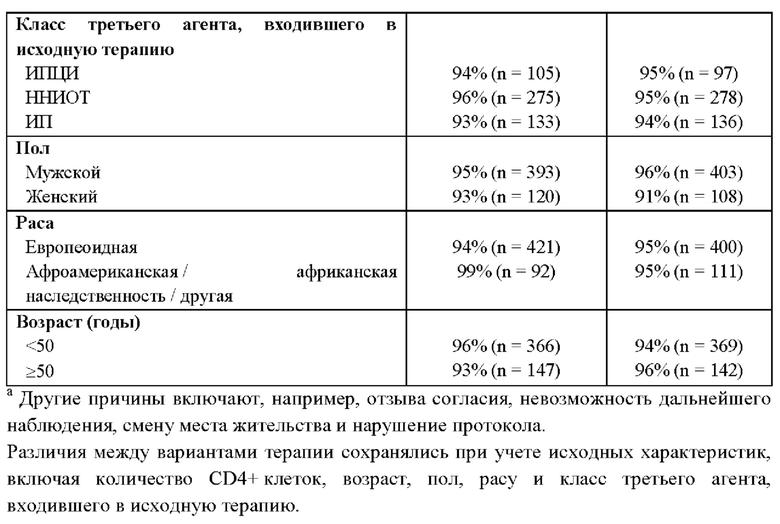
Пример 7 - Двухслойные таблетки долутегравира/рилпивирина
Композицию долутегравира и рилпивирина в форме двухслойной таблетки изготавливали с использованием методики таблетирования, описанной ранее. Состав композиции представлен в таблице ниже.
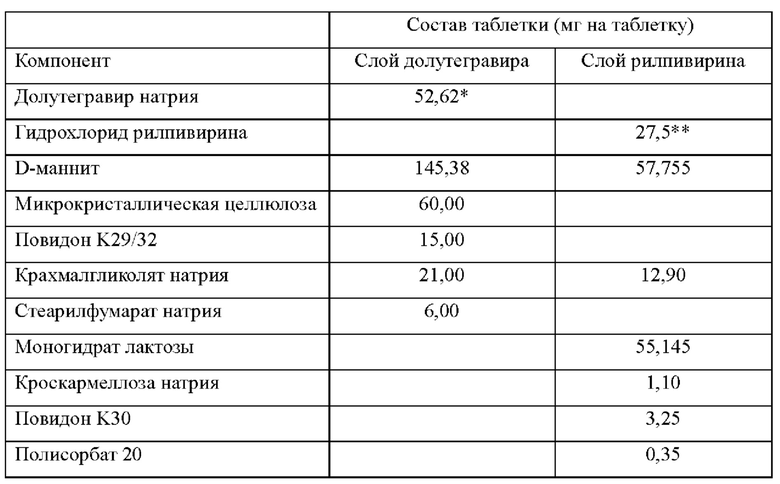
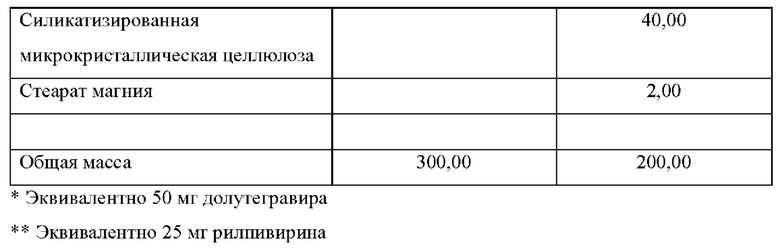
В исследованиях биоэквивалентности, описанных в Примере 8, таблетки по Примеру 7 были покрыты оболочкой Opadry II Pink 85.
Пример 8 - Исследования биоэквивалентности
Биоэквивалентность таблеток с комбинацией фиксированных доз (FDC) по Примеру 7 оценивали в сравнении с совместным введением раздельных композиций долутегравира (DTG), 50 мг (Тивикай), и рилпивирина (RPV), 25 мг (Эдюрант), в форме таблеток после еды. Исследование проводили согласно открытому рандомизированному двойному перекрестному дизайну в одном центре у здоровых субъектов.

Сто восемнадцать субъектов были включены в исследование и рандомизированы для однократного введения каждого из вариантов вводимых композиций. Композиции, вводимые в рамках исследования, представлены ниже.

Оба периода (варианта вводимых композиций) данного исследования завершили в общей сложности сто тринадцать субъектов.
Результаты статистического анализа Cmax (максимальная концентрация лекарственного средства), AUC(0-t) (площадь под кривой концентрации в плазме против времени от момента времени «0» до последней измеряемой временной точки), AUC(0-∞) (площадь под кривой концентрации в плазме против времени от момента времени «О» с экстраполяцией на бесконечность) и С24 (концентрация лекарственного средства через 24 часа после введения) долутегравира, полученных с использованием времени фактического забора образцов, представлены ниже (Таблица 22). Для всех 4 ФК-параметров долутегравира, полученных с использованием фактического времени, отношения скорректированных средних геометрических были близки к 1, и все 90%-е ДИ этих отношений были в пределах биоэквивалентности (0,80; 1,25).

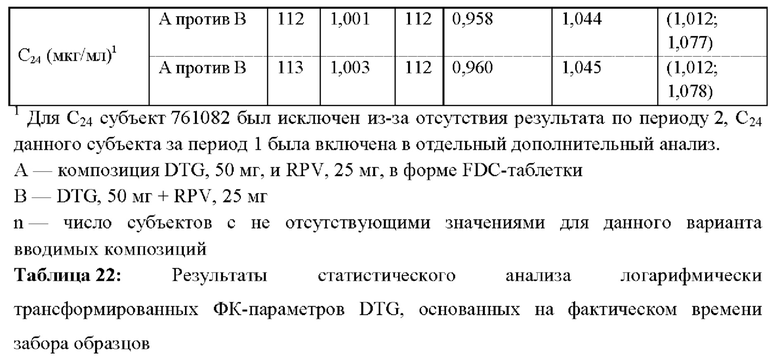
Результаты статистического анализа Cmax, AUC(0-t), AUC(0-∞) и C24 рилпивирина, полученных с использованием времени фактического забора образцов, представлены ниже (Таблица 23). Для всех 4 ФК-параметров рилпивирина, полученных с использованием фактического времени, отношения скорректированных средних геометрических были близки к 1, и все 90%-е ДИ этих отношений были в пределах биоэквивалентности (0,80; 1,25).


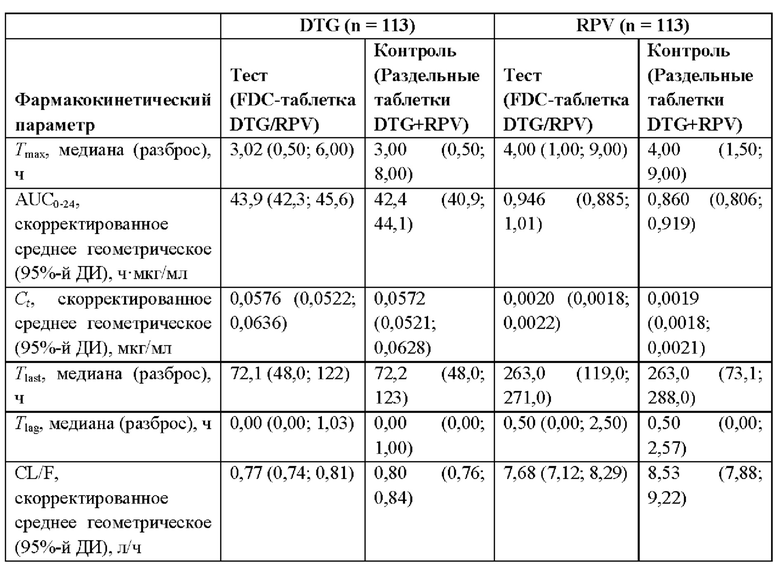

CL/F (кажущийся клиренс при пероральном введении) представляет собой кажущийся общий клиренс лекарственного средства из плазмы после перорального введения. t1/2 (период полувыведения) представляет собой время, необходимое для снижения концентрации лекарственного средства в плазме на 50%. Tlag (время задержки введения) представляет собой время задержки от введения лекарственного средства до первого определения концентрации выше LOQ (предел количественного определения) в плазме. Tlast (время последней концентрации, поддающейся количественному определению) представляет собой время последней концентрации выше LOQ (предел количественного определения) в плазме.
Кривые медианной концентрации аналитов DTG и RPV против времени при введении контрольных и тестовой композиции были сходны (Фиг. 16). Отношения скорректированных средних геометрических AUC0-∞, AUC0-t, Cmax и концентрации в плазме через 24 часа после введения (C24) для аналитов DTG и RPV были близки к 1 с 90%-ми ДИ в пределах предварительно заданного диапазона биоэквивалентности от 0,80 до 1,25 (Таблицы 22 и 23). Дополнительные фармакокинетические параметры представлены описательной статистикой в Таблице 24 и соответствуют сходным фармакокинетическим профилям раздельных таблеток DTG+RPV и FDC-таблетки DTG/RPV.
Результаты данного исследования подтвердили, что FDC-композиция долутегравира-рилпивирина биологичекси эквивалентна раздельным композициям долутегравира, 50 мг, и рилпивирина, 25 мг, в форме таблеток при введении после приема пищи с умеренным содержанием жира.
Таблетки с комбинациями фиксированных доз, содержащие все компоненты схемы APT, стали широко доступными и рассматриваются как важный вариант упрощения поддерживающей терапии и повышения ее удобства для пациентов. Поэтому наличие полноценной FDC-таблетки DTG/RPV без НИОТ, биологически эквивалентной раздельным таблеткам DTG+RPV при приеме после еды, обеспечит полезную новую возможность лечения инфекции, вызванной ВИЧ-1. Данное исследование обеспечило фар макокинетиче скую связь FDC-таблеток DTG/RPV с продолжающимися исследованиями III фазы SWORD, участники которых принимали DTG+RPV в форме раздельных таблеток вместе с пищей.
В определенных обстоятельствах любая информация, представленная здесь или имеющая происхождение от информации, представленной здесь, относящаяся к схеме по изобретению или к композиции по изобретению, может быть включена в инструкцию по применению лекарственного средства. Такие обстоятельства могут включать, например, требования регуляторного органа, исходы или данные клинических исследований или решение изготовителя или другой компании.
Могут быть применены другие воплощения, и логические или иные изменения возможны без выхода за рамки объема изобретения. Таким образом, представленное выше подробное описание изобретения не следует рассматривать как ограничивающее, и объем изобретения определен только приложенной формулой изобретения и всеми ее эквивалентами.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДВУХСЛОЙНАЯ ФАРМАЦЕВТИЧЕСКАЯ ЛЕКАРСТВЕННАЯ ФОРМА В ВИДЕ ТАБЛЕТОК | 2018 |
|
RU2803050C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АНТИРЕТРОВИРУСНОЕ ЛЕКАРСТВО И УЛУЧШИТЕЛЬ ФАРМАКОКИНЕТИКИ | 2017 |
|
RU2745204C2 |
| Схемы лечения ВИЧ-инфекций и СПИД | 2018 |
|
RU2784810C2 |
| НОВАЯ АНТИРЕТРОВИРУСНАЯ КОМБИНАЦИЯ | 2008 |
|
RU2508105C2 |
| СПОСОБ ЛЕЧЕНИЯ ВИЧ КАБОТЕГРАВИРОМ И РИЛПИВИРИНОМ | 2020 |
|
RU2840867C1 |
| ДИСПЕРГИРУЕМЫЕ КОМПОЗИЦИИ | 2017 |
|
RU2826218C2 |
| ФАРМАЦЕВТИЧЕСКАЯ АНТИРЕТРОВИРУСНАЯ КОМПОЗИЦИЯ | 2013 |
|
RU2648457C2 |
| АНТИРЕТРОВИРУСНАЯ КОМБИНАЦИЯ | 2008 |
|
RU2531089C2 |
| АНТИРЕТРОВИРУСНАЯ КОМБИНАЦИЯ | 2014 |
|
RU2675831C2 |
| Комбинированный лекарственный препарат для терапии вирусных инфекций | 2017 |
|
RU2662160C9 |

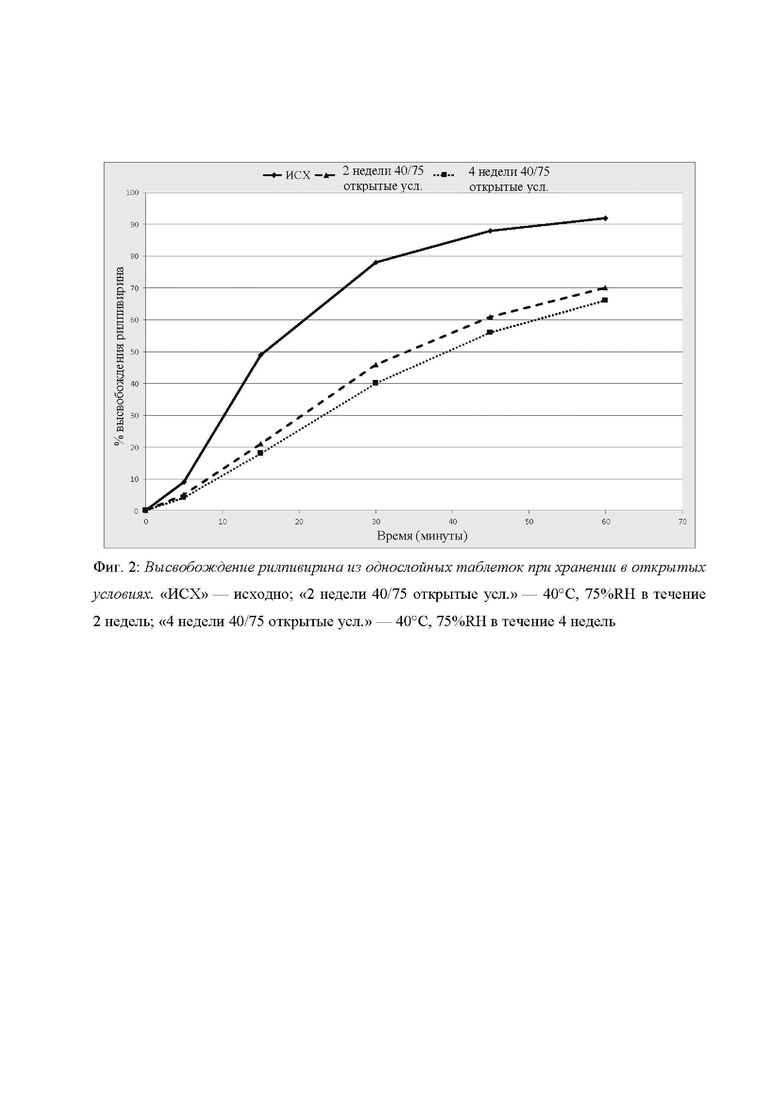




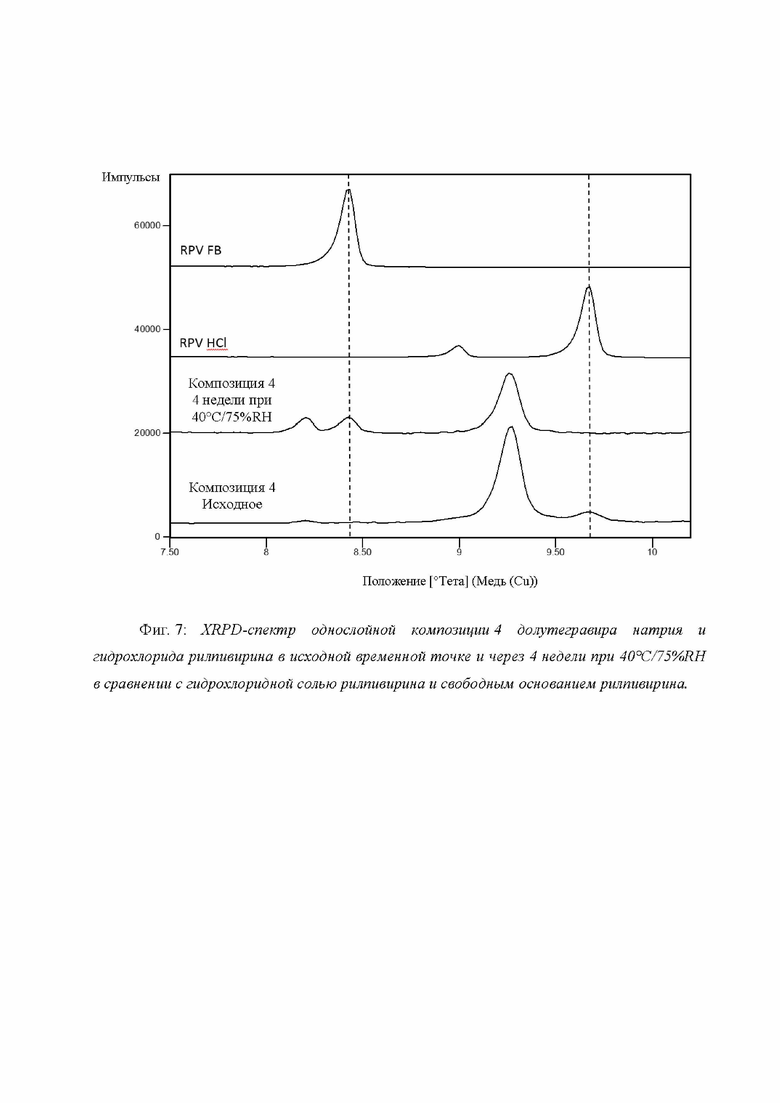
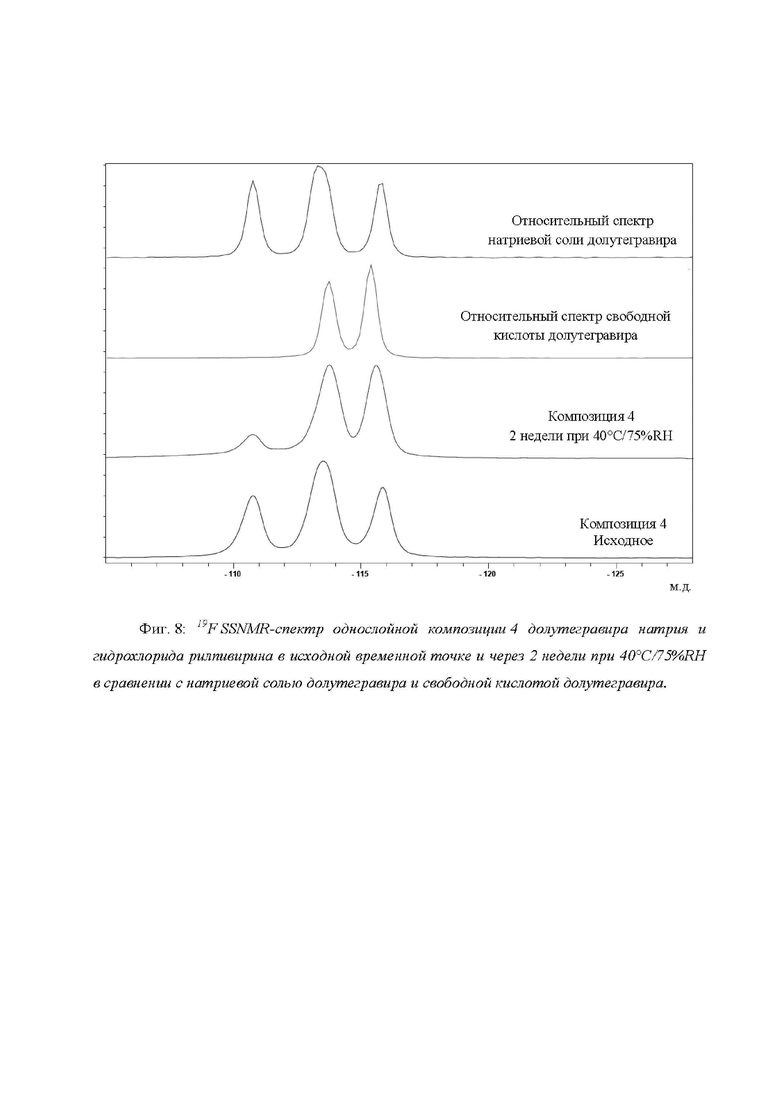


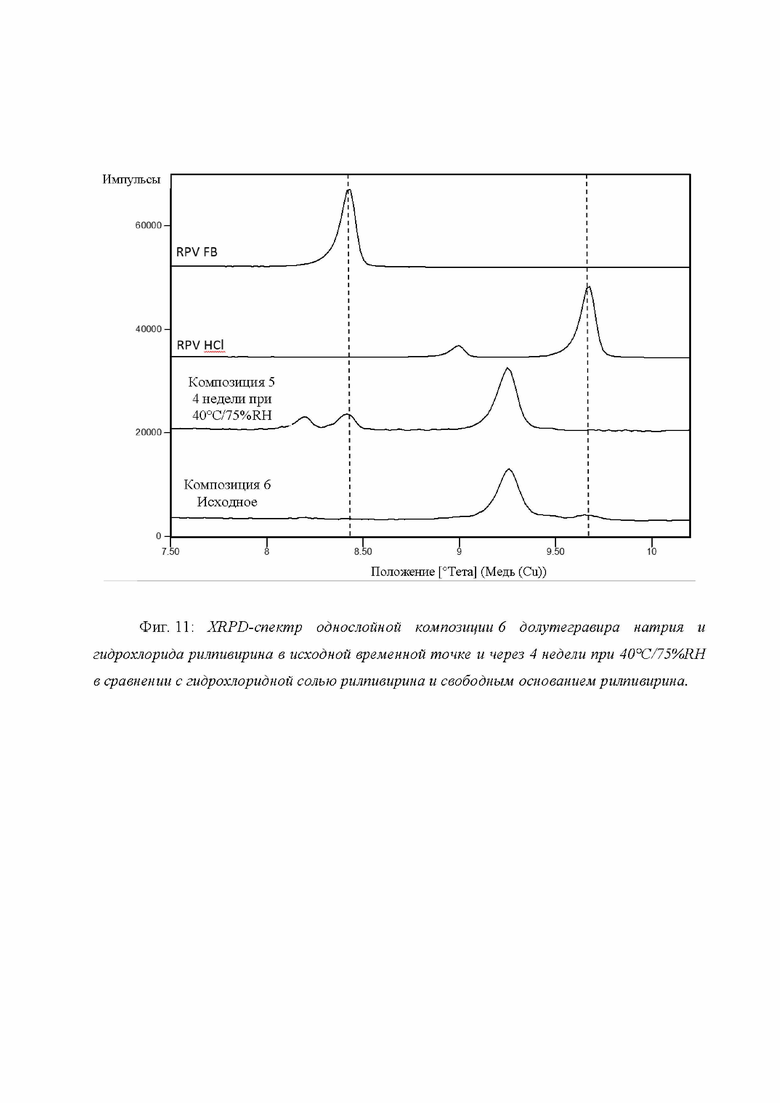
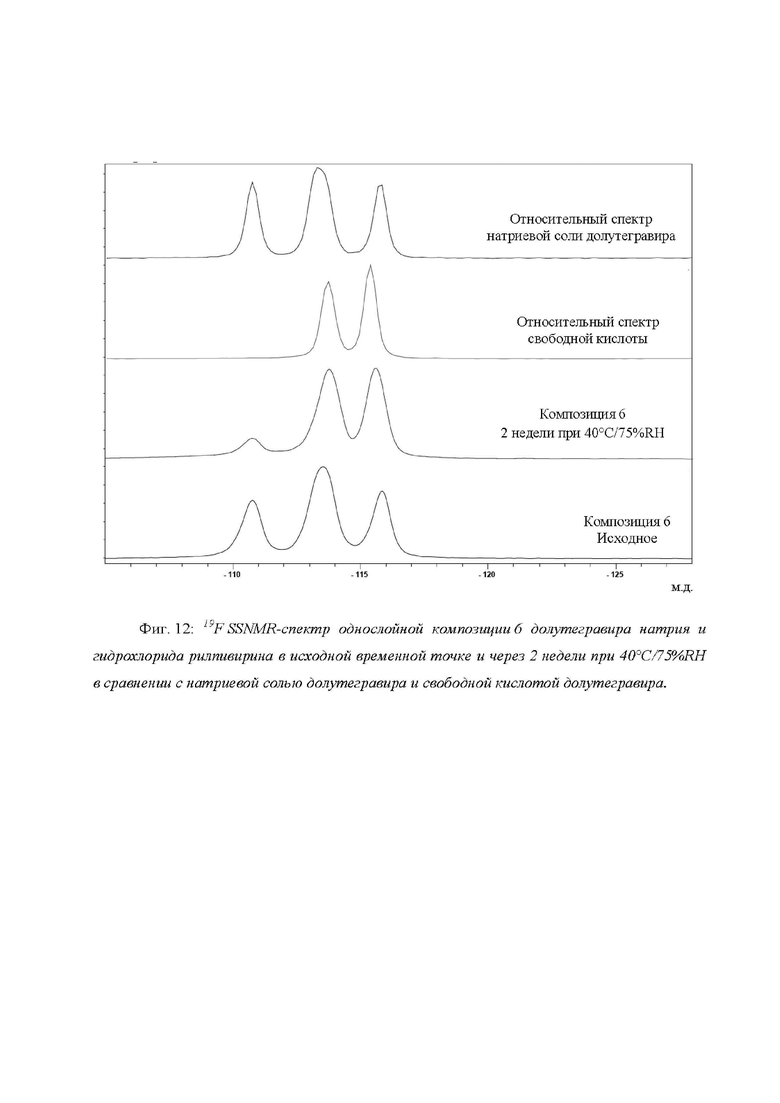




Группа изобретений относится к области медицины и фармацевтики, а именно к двухслойной таблетке для лечения ВИЧ инфекции, где первый слой содержит (в мг): интрагранулярные ингредиенты: долутегравир натрия - 52,62, D-маннит - 145,38, микрокристаллическая целлюлоза - 60,00, повидон К29/32 - 15,00, крахмалгликолят натрия - 15,00, очищенная вода - q.s.; экстрагранулярные ингредиенты: крахмалгликолят натрия - 6,00, стеарилфумарат натрия 6,00; и второй слой содержит (в мг): гидрохлорид рилпивирина - 27,50, моногидрат лактозы - 55,145, кроскармеллоза натрия - 1,10, повидон К30 - 3,25, полисорбат 20 - 0,35, очищенная вода - q.s., D-маннит - 57,755, силикатизированная микрокристаллическая целлюлоза - 40,00, крахмалгликолят натрия - 12,90, стеарат магния - 2,00; а также к способу лечения ВИЧ-инфекции включающему введение пациенту указанной таблетки. Группа изобретений обеспечивает повышенную стабильность активных компонентов за счет предотвращения диспропорционирования их солевых форм. 2 н.п. ф-лы, 16 ил., 24 табл., 8 пр.
1. Двухслойная таблетка для лечения ВИЧ-инфекции, содержащая:
первый слой, содержащий долутегравир натрия; и
второй слой, содержащий гидрохлорид рилпивирина;
где указанная двухслойная таблетка содержит примерно 50 мг эквивалента свободной кислоты долутегравира натрия, и примерно 25 мг эквивалента свободного основания гидрохлорида рилпивирина; и где указанный первый слой и указанный второй слой непосредственно контактируют друг с другом;
где первый слой содержит:
и второй слой содержит:
2. Способ лечения ВИЧ-инфекции у пациента, включающий введение указанному пациенту таблетки по п. 1.
| WO 2015140569 A1, 24.09.2015 | |||
| WO 2016016279 A1, 04.02.2016 | |||
| CAPETTI A.F | |||
| et al | |||
| Switch to Dolutegravir plus Rilpivirine Dual Therapy in cART-Experienced Subjects: An Observational Cohort // PLoS ONE | |||
| Vol | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| МЕХАНИЗМ СЦЕПЛЕНИЯ | 0 |
|
SU164753A1 |
| DESHPANDE R.D | |||
| et al | |||
| Bi-layer tablets - an emerging trend: a review // IJPSR | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Vol | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| P | |||
| Реле переменного тока | 1924 |
|
SU2534A1 |
| ПЕРЦЕВ И.М | |||
Авторы
Даты
2021-09-20—Публикация
2018-06-27—Подача