Перекрестная ссылка на родственную заявку
Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США № 62/169272, поданной 1 июня 2015 года, раскрытие которой включено в данный документ с помощью ссылки во всей своей полноте.
Ссылка на перечень последовательностей, предоставленный в электронном виде
Содержание предоставленного в электронном виде перечня последовательностей в текстовом файле ASCII под названием FLUAB_100WO1_SL.txt, созданном 31 мая 2016 г. и имеющем размер 162315 байт, поданного вместе с настоящей заявкой, включено в данный документ с помощью ссылки во всей своей полноте.
Область техники, к которой относится изобретение
Настоящее изобретение относится к биспецифичным антителам, которые характеризуются нейтрализующей активностью широкого спектра действия против вируса гриппа А и B, а также к применениям таких антител.
Предпосылки изобретения
Вирусы гриппа вызывают ежегодные эпидемии гриппа и периодические пандемии, которые представляют значительную угрозу для здоровья населения во всем мире. Сезонная инфекция, вызванная вирусом гриппа, связана с 200000-500000 смертей каждый год, особенно у маленьких детей, пациентов с ослабленным иммунитетом и у лиц пожилого возраста. Уровень смертности обычно дополнительно возрастает в периоды со вспышками пандемического гриппа. Сохраняется значительная неудовлетворенная медицинская потребность в эффективных противовирусных терапевтических средствах для предупреждения и лечения инфекций, вызванных вирусом гриппа, в частности у малообеспеченного населения.
Существует три типа вирусов гриппа: типы A, B и C. Большинство заболеваний гриппом вызывают вирусы гриппа A и B (Thompson et al. (2004) JAMA. 292:1333-1340: и Zhou et al. (2012) Clin Infect. Dis. 54:1427-1436). Общая структура вирусов гриппа A, B и C является подобной и включает вирусную оболочку, которая окружает центральную часть. Вирусная оболочка включает в себя два поверхностных гликопротеина, гемагглютинин (HA) и нейраминидазу (NA); при этом HA опосредует связывание вируса с целевыми клетками и его проникновение в целевые клетки, тогда как NA вовлечена в высвобождение вирусного потомства из инфицированных клеток.
Белок HA отвечает за связывание с рецептором клетки-хозяина, а также за слияние мембран вируса и клетки-хозяина, и является основной целью защитных гуморальных иммунных ответных реакций. Белок HA является тримерным по структуре и включает в себя три идентичных копии одного полипептида-предшественника HA0, который в ходе протеолитического созревания расщепляется на метастабильное промежуточное соединение, содержащее глобулярную головку (HA1) и стволовую область (HA2) (Wilson et al. (1981) Nature. 289:366-373). "Глобулярная головка", дистальная по отношению к мембране, составляет большую часть структуры HA1 и содержит связывающий карман для сиаловой кислоты для вхождения вируса, а также основные антигенные домены. Проксимальная к мембране "стволовая" структура, составленная из остатков HA2 и HA1, содержит аппарат слияния, который подвергается конформационному изменению в среде с низким значением рН поздних эндосом для запуска слияния с мембраной и вхождения в клетки. Степень гомологии последовательностей между подтипами вируса A является меньшей в участке HA1 (гомология между подтипами 34%-59%), чем в области HA2 (гомология 51% - 80%).
Вирусы гриппа A можно разделить на подтипы на основании генетических вариаций генов гемагглютинина (HA) и нейраминидазы (NA). Серологически грипп A может быть разделен на 18 подтипов HA, которые далее разделяются на две отдельных филогенетических группы: группу 1 (подтипы H1, H2, H5, H6, H8, H9, H11, H12, H13, H16, H17 и H18) и группу 2 (подтипы H3, H4, H7, H10, H14 и H15). В настоящее время, в период сезонных эпидемий, подтипы HA H1 и H3 вируса гриппа A главным образом связаны с заболеванием у людей, тогда как вирусы, кодирующие H5, H7, H9 и H10, вызывали спорадические вспышки заболевания у людей вследствие непосредственной передачи от животных. В отличие от вирусов гриппа А, вирусы гриппа В ограничиваются инфекцией человека, и вирусы гриппа В не разделяются на подтипы на основании двух поверхностных гликопротеинов. Фактически, до 1970 годов вирусы гриппа В классифицировали как одну однородную группу. Однако на протяжении 1970-х годов вирусы гриппа B начали дивергировать на две линии, отличающиеся по антигенам, которые назвали линиями Victoria и Yamagata по названию их первых представителей, соответственно B/Victoria/2/87 и B/Yamagata/16/88. (Biere et al. (2010) J Clin Microbiol. 48(4):1425-7; doi: 10.1128/JCM.02116-09. Epub 2010 Jan 27). Обе линии Yamagata и Victoria принимают участие в ежегодных эпидемиях. Несмотря на то что частота заболеваний, вызываемых вирусами гриппа B, более низкая, чем частота заболеваний, связанных с вирусом гриппа A H3N2, она выше, чем частота заболеваний, связанных с вирусом гриппа A H1N1 (Zhou et al. (2012) Clin Infect. Dis. 54:1427-1436).
Нейтрализующие антитела, активированные инфекцией, вызванной вирусом гриппа, в норме направлены на вариабельную глобулярную головку HA1 с целью предупреждения связывания рецептора вируса и обычно штаммоспецифичны. Перекрестно реагирующие антитела широкого спектра действия, которые нейтрализуют один или несколько подтипов или линий, являются редкостью. Недавно было обнаружено несколько антител, которые способны нейтрализовать несколько подтипов вирусов гриппа А как в группе 1, так и в группе 2 (Corti et al. (2011) Science 333(6044):850-856, Li et al. (2012) PNAS 109(46):18897-18902, Dreyfus et al. (2012) Science 337(6100):1343-1348, и Nakamura et al. (2013) Cell Host and Microbe 14:93-103), или вирусы гриппа B обеих линий (Dreyfus et al. (2012) Science 337(6100):1343-1348, и Yasugi et al. (2013) PLoS Path 9(2): e1003150. doi: 10.1371/journal.ppat.1003150), хотя большинство из них имеют ограничения в степени охвата, профиля устойчивости или эффективности. Было описано только одно антитело для связывания с белками HA вируса гриппа A и B, хотя это антитело не нейтрализует функционально вирусы гриппа B или не ослабляет заболевание при терапевтическом назначении (Dreyfus et al. (2012) Science 337(6100):1343-1348). К настоящему времени отсутствуют антитела широкого спектра действия, которые полностью нейтрализуют или ингибируют широкий спектр инфекций, вызванных вирусами гриппа А и B, или ослабляют симптомы заболеваний, вызванных вирусами гриппа А и B. Таким образом, существует потребность в идентификации новых антител, обеспечивающих защиту от многих вирусов гриппа.
Краткое описание изобретения
В одном варианте осуществления предусматривается выделенная связывающая молекула, которая специфически связывается с вирусом гриппа А и вирусом гриппа В. В одном варианте осуществления выделенная связывающая молекула включает в себя первый связывающий домен, который способен связываться с гемагглютинином (НА) вируса гриппа А и нейтрализовать по меньшей мере один подтип группы 1 и по меньшей мере 1 подтип группы 2 вируса гриппа А; и второй связывающий домен, который способен связываться с гемагглютинином (НА) вируса гриппа В и нейтрализовать вирус гриппа В по меньшей мере из двух филогенетически различных линий. В одном варианте осуществления первый связывающий домен способен нейтрализовать один или несколько подтипов группы 1 вируса гриппа А, выбранных из H1, H2, H5, H6, H8, H9, H11, H12, H13, H16, H17, H18 и их вариантов; и один или нескольких подтипов группы 2 вируса гриппа A, выбранных из H3, H4, H7, H10, H14 и H15 и их вариантов. В одном варианте осуществления второй связывающий домен способен нейтрализовать вирус гриппа В обеих линий Yamagata и Victoria.
В одном варианте осуществления первый связывающий домен связывающей молекулы включает в себя антитело к вирусу гриппа А или его антигенсвязывающий фрагмент. В одном варианте осуществления второй связывающий домен связывающей молекулы включает в себя антитело к вирусу гриппа В или его антигенсвязывающий фрагмент. В одном варианте осуществления связывающая молекула включает в себя по меньшей мере одну VH тяжелой цепи антитела и по меньшей мере одну VL легкой цепи антитела. В более конкретном варианте осуществления первый связывающий домен включает в себя по меньшей мере одну VH тяжелой цепи антитела и по меньшей мере одну VL легкой цепи антитела. В одном варианте осуществления второй связывающий домен включает в себя по меньшей мере одну VH тяжелой цепи антитела и по меньшей мере одну VL легкой цепи антитела.
В одном варианте осуществления первый связывающий домен связывающей молекулы включает в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, при этом набор из шести CDR характеризуется аминокислотной последовательностью, выбранной из:
(a) аминокислотной последовательности, которая по меньшей мере на 75% идентична HCDR1 под SEQ ID NO: 8, HCDR2 под SEQ ID NO: 9, HCDR3 под SEQ ID NO: 10, LCDR1 под SEQ ID NO: 3, LCDR2 под SEQ ID NO: 4 и LCDR3 под SEQ ID NO: 5;
(b) аминокислотной последовательности HCDR1 под SEQ ID NO: 8, HCDR2 под SEQ ID NO: 9, HCDR3 под SEQ ID NO: 10, LCDR1 под SEQ ID NO: 3, LCDR2 под SEQ ID NO: 4 и LCDR3 под SEQ ID NO: 5;
(c) аминокислотной последовательности, которая по меньшей мере на 75% идентична HCDR1 под SEQ ID NO: 18, HCDR2 под SEQ ID NO: 19, HCDR3 под SEQ ID NO: 20, LCDR1 под SEQ ID NO: 13, LCDR2 под SEQ ID NO: 14, LCDR3 под SEQ ID NO: 15; и
(d) аминокислотной последовательности HCDR1 под SEQ ID NO: 18, HCDR2 под SEQ ID NO: 19, HCDR3 под SEQ ID NO: 20, LCDR1 под SEQ ID NO: 13, LCDR2 под SEQ ID NO: 14, LCDR3 под SEQ ID NO: 15.
В одном варианте осуществления первый связывающий домен связывающей молекулы включает в себя VH, имеющую аминокислотную последовательность, которая по меньшей мере на 75% идентична аминокислотной последовательности, выбранной из SEQ ID NO: 7; и SEQ ID NO: 17. В одном варианте осуществления первый связывающий домен связывающей молекулы включает в себя VL, имеющую аминокислотную последовательность, которая по меньшей мере на 75% идентична аминокислотной последовательности, выбранной из SEQ ID NO: 2; и VL под SEQ ID NO: 12. В более конкретном варианте осуществления первый связывающий домен связывающей молекулы включает в себя VH и VL, которые по меньшей мере на 75% идентичны аминокислотной последовательности соответственно VH и VL, выбранных из VH под SEQ ID NO: 7 и VL под SEQ ID NO: 2; и VH под SEQ ID NO: 17 и VL под SEQ ID NO: 12. В одном варианте осуществления первый связывающий домен включает в себя VH и VL, выбранные из VH под SEQ ID NO: 7 и VL под SEQ ID NO: 2; и VH под SEQ ID NO: 17 и VL под SEQ ID NO: 12.
В одном варианте осуществления второй связывающий домен предусматривает набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, при этом набор из шести CDR характеризуется аминокислотной последовательностью, выбранной из:
(a) аминокислотной последовательности, которая по меньшей мере на 75% идентична HCDR1 под SEQ ID NO: 28, HCDR2 под SEQ ID NO: 29, HCDR3 под SEQ ID NO: 30, LCDR1 под SEQ ID NO: 23, LCDR2 под SEQ ID NO: 24 и LCDR3 под SEQ ID NO: 25;
(b) аминокислотной последовательности HCDR1 под SEQ ID NO: 28, HCDR2 под SEQ ID NO: 29, HCDR3 под SEQ ID NO: 30, LCDR1 под SEQ ID NO: 23, LCDR2 под SEQ ID NO: 24 и LCDR3 под SEQ ID NO: 25;
(c) аминокислотной последовательности, которая по меньшей мере на 75% идентична аминокислотной последовательности HCDR1 под SEQ ID NO: 44, HCDR2 под SEQ ID NO: 45, HCDR3 под SEQ ID NO: 46, LCDR1 под SEQ ID NO: 39, LCDR2 под SEQ ID NO: 40 и LCDR3 под SEQ ID NO: 41;
(d) аминокислотной последовательности HCDR1 под SEQ ID NO: 44, HCDR2 под SEQ ID NO: 45, HCDR3 под SEQ ID NO: 46, LCDR1 под SEQ ID NO: 39, LCDR2 под SEQ ID NO: 40 и LCDR3 под SEQ ID NO: 41;
(e) аминокислотной последовательности, которая по меньшей мере на 75% идентична HCDR1 под SEQ ID NO: 60, HCDR2 под SEQ ID NO: 61, HCDR3 под SEQ ID NO: 62, LCDR1 под SEQ ID NO: 55, LCDR2 под SEQ ID NO: 56, LCDR3 под SEQ ID NO: 57; и
(f) аминокислотной последовательности HCDR1 под SEQ ID NO: 60, HCDR2 под SEQ ID NO: 61, HCDR3 под SEQ ID NO: 62, LCDR1 под SEQ ID NO: 55, LCDR2 под SEQ ID NO: 56, LCDR3 под SEQ ID NO: 57.
В одном варианте осуществления второй связывающий домен связывающей молекулы включает в себя VH, имеющую аминокислотную последовательность, которая по меньшей мере на 75% идентична аминокислотной последовательности VH, выбранной из:
(a) VH под SEQ ID NO: 27;
(b) VH под SEQ ID NO: 33;
(c) VH под SEQ ID NO: 36;
(d) VH под SEQ ID NO: 43;
(e) VH под SEQ ID NO: 49;
(f) VH под SEQ ID NO: 52;
(g) VH под SEQ ID NO: 59 и
(h) VH под SEQ ID NO: 65.
В одном варианте осуществления второй связывающий домен связывающей молекулы включает в себя VL, имеющую аминокислотную последовательность, которая по меньшей мере на 75% идентична аминокислотной последовательности VL, выбранной из:
(a) VL под SEQ ID NO: 22;
(b) VL под SEQ ID NO: 32;
(c) VL под SEQ ID NO: 35;
(d) VL под SEQ ID NO: 38;
(e) VL под SEQ ID NO: 48;
(f) VL под SEQ ID NO: 51;
(g) VL под SEQ ID NO: 54 и
(h) VL под SEQ ID NO: 64.
В одном варианте осуществления второй связывающий домен связывающей молекулы включает в себя VH и VL, которые по меньшей мере на 75% идентичны аминокислотной последовательностям соответственно VH и VL, выбранных из:
(a) VH под SEQ ID NO: 27 и VL под SEQ ID NO: 22;
(b) VH под SEQ ID NO: 33 и VL под SEQ ID NO: 32;
(c) VH под SEQ ID NO: 36 и VL под SEQ ID NO: 35;
(d) VH под SEQ ID NO: 43 и VL под SEQ ID NO: 38;
(e) VH под SEQ ID NO: 49 и VL под SEQ ID NO: 48;
(f) VH под SEQ ID NO: 52 и VL под SEQ ID NO: 51;
(g) VH под SEQ ID NO: 59 и VL под SEQ ID NO: 54 и
(h) VH под SEQ ID NO: 65 и VL под SEQ ID NO: 64.
В одном варианте осуществления второй связывающий домен связывающей молекулы включает в себя VH и VL, выбранные из:
(a) VH под SEQ ID NO: 27 и VL под SEQ ID NO: 22;
(b) VH под SEQ ID NO: 33 и VL под SEQ ID NO: 32;
(c) VH под SEQ ID NO: 36 и VL под SEQ ID NO: 35;
(d) VH под SEQ ID NO: 43 и VL под SEQ ID NO: 38;
(e) VH под SEQ ID NO: 49 и VL под SEQ ID NO: 48;
(f) VH под SEQ ID NO: 52 и VL под SEQ ID NO: 51;
(g) VH под SEQ ID NO: 59 и VL под SEQ ID NO: 54 и
(h) VH под SEQ ID NO: 65 и VL под SEQ ID NO: 64.
В одном варианте осуществления связывающая молекула включает в себя по меньшей мере две тяжелых цепи антитела и по меньшей мере две легких цепи антитела. В одном варианте осуществления связывающая молекула включает в себя биспецифичное антитело. В одном варианте осуществления один или несколько связывающих доменов связывающей молекулы включают в себя домен вариабельного фрагмента (Fv). В одном варианте осуществления один или несколько связывающих доменов связывающей молекулы включают в себя молекулу scFv. В одном варианте осуществления один или несколько связывающих доменов связывающей молекулы включают в себя Fv-домен, а один или несколько связывающих доменов включают в себя молекулу scFv. В более конкретном варианте осуществления первый связывающий домен связывающей молекулы включает в себя Fv-домен антитела к вирусу гриппа А. В одном варианте осуществления связывающая молекула включает в себя Fv-домен, включающий в себя вариабельный домен тяжелой цепи антитела и вариабельный домен легкой цепи антитела, и специфически связывает антиген вируса гриппа А. В одном варианте осуществления второй связывающий домен связывающей молекулы включает в себя молекулу scFv антитела к вирусу гриппа В.
В одном варианте осуществления первый связывающий домен включает в себя Fv-домен антитела к вирусу гриппа А, и второй связывающий домен включает в себя молекулу scFv антитела к вирусу гриппа В. В одном варианте осуществления Fv-домен первого связывающего домена содержит тяжелую цепь (HC) с полипептидной цепью, имеющей амино-конец и карбокси-конец, и легкую цепь (LC) с полипептидной цепью, имеющей амино-конец и карбокси-конец, и при этом
(a) второй связывающий домен ковалентно связан с карбокси-концом HC первого связывающего домена;
(b) второй связывающий домен ковалентно связан с амино-концом HC первого связывающего домена;
(c) второй связывающий домен ковалентно связан с амино-концом LC первого связывающего домена; или
(d) второй связывающий домен встроен посредством ковалентного связывания в полипептидную цепь HC первого связывающего домена.
В одном варианте осуществления связывающая молекула включает в себя антитело или его фрагмент, имеющие один или несколько N-концевых доменов, где одна или несколько молекул scFv ковалентно присоединяются к одному или нескольким N-концевым доменам антитела или его фрагмента. В одном варианте осуществления N-концевой домен антитела или его фрагмента включает в себя один или несколько Fv-доменов, и одна или несколько молекул scFv ковалентно присоединяются к одному или нескольким Fv-доменам антитела или его фрагмента. В одном варианте осуществления N-концевой домен включает в себя Fv-домен, включающий в себя вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL). В одном варианте осуществления одна или несколько молекул scFv ковалентно присоединяются к одному или нескольким вариабельным доменам легкой цепи (VL) антитела или его фрагмента. В одном варианте осуществления связывающая молекула включает в себя антитело или его фрагмент, включающие в себя легкую цепь антитела, характеризующуюся формулой scFv-L1-VL-CL, где scFv представляет собой молекулу scFv, L1 представляет собой линкер, VL представляет собой вариабельный домен легкой цепи, CL представляет собой константный домен легкой цепи и VL представляет собой вариабельный домен легкой цепи. В одном варианте осуществления одна или несколько молекул scFv ковалентно присоединяются к одному или нескольким вариабельным доменам тяжелой цепи (VН) антитела или его фрагмента. В одном варианте осуществления тяжелая цепь включает в себя формулу scFv-L1-VH-CH1-CH2-CH3, где scFv представляет собой молекулу scFv, L1 представляет собой линкер, VH представляет собой вариабельный домен тяжелой цепи, CH1 представляет собой домен-1 константного домена тяжелой цепи, CH2 представляет собой домен-2 константного домена тяжелой цепи, и CH3 представляет собой домен-3 константного домена тяжелой цепи.
В одном варианте осуществления связывающая молекула включает в себя вариабельный домен тяжелой цепи (VH) с аминокислотной последовательностью, которая по меньшей мере на 75% идентична аминокислотной последовательности VH-домена, выбранной из SEQ ID NO: 7 и SEQ ID NO: 17. В одном варианте осуществления связывающая молекула включает в себя вариабельный домен легкой цепи (VL) с аминокислотной последовательностью, которая по меньшей мере на 75% идентична аминокислотной последовательности VL-домена, выбранной из SEQ ID NO: 2 и SEQ ID NO: 12.
В одном варианте осуществления связывающая молекула включает в себя антитело или его фрагмент с C-концевым доменом, где одна или несколько молекул scFv ковалентно присоединяются к C-концевому домену антитела или его фрагмента. В одном варианте осуществления связывающая молекула включает в себя первую и вторую тяжелые цепи соответственно с первым и вторым C-концевыми доменами, где одна или несколько молекул scFv ковалентно присоединяются к C-концевому домену первой тяжелой цепи, второй тяжелой цепи или их комбинациям. В одном варианте осуществления связывающая молекула включает в себя антитело или его фрагмент, включающие в себя один или несколько константных доменов тяжелой цепи, где одна или несколько молекул scFv вставляются в тяжелую цепь между одним или несколькими константными доменами тяжелой цепи одной или нескольких тяжелых цепей. В одном варианте осуществления одна или несколько тяжелых цепей включают в себя формулу VH-CH1-CH2-CH3, где VH представляет собой вариабельный домен тяжелой цепи, CH1 представляет собой домен-1 константного домена тяжелой цепи, CH2 представляет собой домен-2 константного домена тяжелой цепи, и CH3 представляет собой домен-3 константного домена тяжелой цепи. В одном варианте осуществления одна или несколько тяжелых цепей включают в себя формулу VH-CH1-L1-scFv-L2-CH2-CH3, где L1 и L2 независимо представляют собой линкер, и scFv представляет собой молекулу scFv. В одном варианте осуществления одна или несколько тяжелых цепей включают в себя формулу VH-CH1-CH2-L1-scFv-L2-CH3, где L1 и L2 независимо представляют собой линкер, и scFv представляет собой молекулу scFv. В одном варианте осуществления L1 и L2 независимо включают в себя (a) [GGGGS]n, где n равняется 0, 1, 2, 3, 4 или 5, (SEQ ID NO:93) (b) [GGGG]n, где n равняется 0, 1, 2, 3, 4 или 5 (SEQ ID NO:106), или комбинацию (a) и (b).
В одном варианте осуществления scFv включает в себя формулу: VH-LS-VL, и где VH представляет собой вариабельный домен тяжелой цепи, LS представляет собой линкер, и VL представляет собой вариабельный домен легкой цепи. В одном варианте осуществления LS включает в себя (a) [GGGGS]n, где n равняется 0, 1, 2, 3, 4 или 5 (SEQ ID NO:93), (b) [GGGG]n, где n равняется 0, 1, 2, 3, 4 или 5 (SEQ ID NO:106), или комбинацию (a) и (b).
В одном варианте осуществления тяжелая цепь и легкая цепи первого связывающего домена соединяются одной или несколькими дисульфидными связями. В более конкретном варианте осуществления scFv второго связывающего домена включает в себя вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), и VH из scFv включает в себя цистеиновый остаток в положении, выбранном из положений 43, 44, 100, 101, 105 и их комбинаций, и VL из scFv включает в себя цистеиновый остаток в положении, выбранном из положений 43, 44, 46, 49, 50, 100 и их комбинаций. В одном варианте осуществления VL и VH из scFv связываются дисульфидной связью, выбранной из VL100-VH44, VL43-VH105, VL46-VH101, VL49-VH100, VL50-VH100 и их комбинаций. В одном варианте осуществления VH и VL из scFv связываются дисульфидной связью, выбранной из VH44-VL100, VH100-VL49, VH100-VL50, VH101-VL46, VH105-VL43 и их комбинаций.
В одном варианте осуществления VH включает в себя набор из трех CDR: HCDR1, HCDR2, HCDR3, при этом набор из трех CDR выбран из:
(a) аминокислотной последовательности, которая по меньшей мере на 75% идентична HCDR1 под SEQ ID NO: 28, HCDR2 под SEQ ID NO: 29, HCDR3 под SEQ ID NO: 30;
(b) аминокислотной последовательности HCDR1 под SEQ ID NO: 28, HCDR2 под SEQ ID NO: 29, HCDR3 под SEQ ID NO: 30;
(c) аминокислотной последовательности, которая по меньшей мере на 75% идентична HCDR1 под SEQ ID NO: 44, HCDR2 под SEQ ID NO: 45, HCDR3 под SEQ ID NO: 46;
(d) аминокислотной последовательности HCDR1 под SEQ ID NO: 44, HCDR2 под SEQ ID NO: 45, HCDR3 под SEQ ID NO: 46;
(e) аминокислотной последовательности, которая по меньшей мере на 75% идентична HCDR1 под SEQ ID NO: 60, HCDR2 под SEQ ID NO: 61, HCDR3 под SEQ ID NO: 62; и
(f) аминокислотной последовательности HCDR1 под SEQ ID NO: 60, HCDR2 под SEQ ID NO: 61, HCDR3 под SEQ ID NO: 62.
В одном варианте осуществления VL включает в себя набор из трех CDR: LCDR1, LCDR2, LCDR3, при этом набор из трех CDR выбран из:
(a) аминокислотной последовательности, которая по меньшей мере на 75% идентична LCDR1 под SEQ ID NO: 23, LCDR2 под SEQ ID NO: 24 и LCDR3 под SEQ ID NO: 25;
(b) аминокислотной последовательности LCDR1 под SEQ ID NO: 23, LCDR2 под SEQ ID NO: 24 и LCDR3 под SEQ ID NO: 25;
(c) аминокислотной последовательности, которая по меньшей мере на 75% идентична LCDR1 под SEQ ID NO: 39, LCDR2 под SEQ ID NO: 40 и LCDR3 под SEQ ID NO: 41;
(d) аминокислотной последовательности LCDR1 под SEQ ID NO: 39, LCDR2 под SEQ ID NO: 40 и LCDR3 под SEQ ID NO: 41;
(e) аминокислотной последовательности, которая по меньшей мере на 75% идентична LCDR1 под SEQ ID NO: 55, LCDR2 под SEQ ID NO: 56, LCDR3 под SEQ ID NO: 57; и
(f) аминокислотной последовательности LCDR1 под SEQ ID NO: 55, LCDR2 под SEQ ID NO: 56, LCDR3 под SEQ ID NO: 57.
В одном варианте осуществления scFv имеет аминокислотную последовательность, которая по меньшей мере на 75% идентична аминокислотной последовательности, выбранной из SEQ ID NO:31, SEQ ID NO:34, SEQ ID NO:47, SEQ ID NO:50, SEQ ID NO:63.
В одном варианте осуществления связывающая молекула представляет собой биспецифичное антитело, которое специфически связывается с вирусом гриппа А и вирусом гриппа В, включает в себя легкую цепь с аминокислотной последовательностью, которая по меньшей мере на 75% идентична аминокислотной последовательности под SEQ ID NO:66 или SEQ ID NO:68. В одном варианте осуществления биспецифичное антитело включает в себя легкую цепь с аминокислотной последовательностью под SEQ ID NO:66 или SEQ ID NO:68. В одном варианте осуществления связывающая молекула представляет собой биспецифичное антитело, которое специфически связывается с вирусом гриппа А и вирусом гриппа В, включает в себя тяжелую цепь с аминокислотной последовательностью, которая по меньшей мере на 75% идентична аминокислотной последовательности под SEQ ID NO:67 или SEQ ID NO:69. В одном варианте осуществления тяжелая цепь имеет аминокислотную последовательность под SEQ ID NO:67 или SEQ ID NO:69. В одном варианте осуществления связывающая молекула представляет собой биспецифичное антитело, которое специфически связывается с вирусом гриппа А и вирусом гриппа В, и включает в себя легкую цепь с аминокислотной последовательностью, которая по меньшей мере на 75% идентична аминокислотной последовательности под SEQ ID NO:66 или SEQ ID NO:68, и тяжелую цепь с аминокислотной последовательностью, которая по меньшей мере на 75% идентична аминокислотной последовательности под SEQ ID NO:67 или SEQ ID NO:69.
В одном варианте осуществления биспецифичное антитело включает в себя:
(a) легкую цепь с аминокислотной последовательностью, включающей в себя SEQ ID NO:66, и тяжелую цепь с аминокислотной последовательностью, включающей в себя SEQ ID NO:67; или
(b) легкую цепь с аминокислотной последовательностью, включающей в себя SEQ ID NO:68, и тяжелую цепь с аминокислотной последовательностью, включающей в себя SEQ ID NO:69.
Также предусматривается клетка, которая включает в себя или продуцирует связывающую молекулу или биспецифичное антитело или фрагмент, описанные в данном документе.
Также предусматривается выделенный полинуклеотид, который кодирует связывающую молекулу или биспецифичное антитело, описанные в данном документе. В одном варианте осуществления предусматривается вектор, который включает в себя полинуклеотид, кодирующий связывающую молекулу или биспецифичное антитело, описанные в данном документе.
В другом варианте осуществления предусматривается клетка-хозяин, которая включает в себя полинуклеотид, кодирующий связывающую молекулу или биспецифичное антитело, описанные в данном документе.
Также в данном документе предусматривается композиция, которая включает в себя связывающую молекулу или биспецифичное антитело или его фрагмент, как описано в данном документе, и фармацевтически приемлемый носитель. Также предусматривается набор, который включает в себя такую композицию. В другом варианте осуществления предусматривается способ предупреждения или лечения инфекции вируса гриппа А или вируса гриппа В у субъекта, при этом способ предусматривает введение субъекту эффективного количества такой композиции.
Также в данном документе предусматривается способ получения связывающей молекулы или биспецифичного антитела или его фрагмента, описанных в данном документе. В одном варианте осуществления способ предусматривает культивирование клетки-хозяина в условиях, подходящих для экспрессии связывающей молекулы или биспецифичного антитела или его фрагмента. В одном варианте осуществления способ дополнительно предусматривает выделение связывающей молекулы из культуры клетки-хозяина.
Также предусмотрены способы применения связывающей молекулы или биспецифичного антитела или его фрагмента, описанных в данном документе. В одном варианте осуществления связывающую молекулу или биспецифичное антитело или его фрагмент используют в профилактике или лечении у субъекта инфекции, представляющей собой грипп А, инфекции, представляющей собой грипп B, или их комбинации.
В другом варианте осуществления связывающая молекула или биспецифичное антитело или его фрагмент, описанные в данном документе, подходят для применения в изготовлении лекарственного средства для профилактики или лечения у субъекта инфекции, представляющей собой грипп А, инфекции, представляющей собой грипп B, или их комбинации. В одном варианте осуществления связывающую молекулу или биспецифичное антитело или его фрагмент, описанные в данном документе, используют в изготовлении лекарственного средства для профилактики или лечения у субъекта инфекции, представляющей собой грипп А, и инфекции, представляющей собой грипп B. В одном варианте осуществления предусматривается способ профилактики или лечения инфекции, представляющей собой грипп А, инфекции, представляющей собой грипп B, или их комбинации у субъекта, который включает введение субъекту эффективного количества связывающей молекулы или биспецифичного антитела или его фрагмента, описанных в данном документе.
В одном варианте осуществления предусматривается способ профилактики или лечения у субъекта инфекции, представляющей собой грипп А, и инфекции, представляющей собой грипп B, который включает введение субъекту эффективного количества связывающей молекулы или биспецифичного антитела или его фрагмента, описанных в данном документе.
В одном варианте осуществления связывающая молекула или биспецифичное антитело или его фрагмент, описанные в данном документе, подходят для in vitro диагностики у субъекта инфекции, представляющей собой грипп А, инфекции, представляющей собой грипп B, или их комбинации.
Краткое описание графических материалов
На фигуре 1 показан общий структурный формат остовов пяти разных биспецифичных антител (BiS) -BiS1, BiS2, BiS3, BiS4 и BiS5. scFv показан темно-серым, а IgG Fv показан светло-серым.
На фигуре 2A-D показана ADCC-активность первичных природных клеток-киллеров (NK) человека, инкубируемых в присутствии возрастающих количеств GL20/39 BiS4 43/105 (Flu BiS), GL20 или FBC39. Киллинг клеток, инфицированных линией (A) A/California/07/2009 H1N1 (B) A/Hong Kong/8/68 H3N2 (C) B/Malaysia/2506/2004 victoria, и клеток A549, инфицированных линией (D) B/Sichuan/379/99 yamagata, измеряли с помощью высвобождения лактатдегидрогеназы (LDH).
На фигурах 3A-C показана ADCP- и CDC-активности антител к НА GL20/39 BiS4 43/105 (Flu BiS), GL20 или FBC39. ADCP-активность представлена процентным отношением человеческих макрофагов, которые фагоцитировали целевые клетки MDCK, экспрессирующие белок НА (A) A/South Dakota/6/2007 H1N1 и (B) A/Hong Kong/8/68 H3N2. (C) CDC-опосредованный киллинг клеток измеряли с помощью высвобождения LDH из инфицированных A/Puerto Rico/8/34 клеток MDCK в присутствии комплемента детеныша кролика.
На фигуре 4A-D показан коэффициент выживаемости (A и C) и легочные титры вируса в день 5 после инфицирования (B и D) в каждой группе исследования при введении различных концентраций GL20/39 BiS4 43/105 (Flu BiS), GL20 и нерелевантного контрольного антитела (Ctl. mAb) мышам за 4 часа до инфицирования летальной дозой вирусов гриппа A/Wilson Smith N/33 H1N1 (A и B), rA/HK/68 H3N2 (C и D).
На фигуре 5A-D показан коэффициент выживаемости (A и C) и легочные титры вируса в день 5 после инфицирования (B и D) в каждой группе исследования при введении различных концентраций GL20/39 BiS4 43/105 (Flu BiS), FBC39 и нерелевантного контрольного антитела (Ctl. mAb) мышам за 4 часа до инфицирования летальной дозой вируса гриппа (A и B) линии B/Florida/4/2006 yamagata и (C и D) линии B/Malaysia/2506/2004 victoria.
На фигуре 6A-F показан коэффициент выживаемости (A и B), легочные титры вируса в день 5 после инфицирования (C и D) и легочная функция, измеренная с помощью пульсовой оксиметрии в день 6 после инфицирования (E и F) в каждой группе исследования, в котором мышей инфицировали летальной дозой вируса гриппа (A, C, E) A/Wilson Smith N/33 H1N1 или вируса (B, D, F) линии B/Florida/4/2006 yamagata. Лечение 25 мг/кг дважды в сутки (BID) осельтамивира в течение 5 суток, 10 мг/кг GL20/39 BiS4 43/105 (Flu BiS) или 10 мг/кг нерелевантного контрольного антитела (Ctl. mAb) начинали в разные временные точки (день 1, день 2, день 3, день 4 после инфицирования).
Подробное описание
Введение
В данном документе описываются связывающие молекулы, например антитела, в том числе без ограничения биспецифичные антитела, человеческие антитела, антигенсвязывающие фрагменты, их производные или конъюгаты, которые включают в себя по меньшей мере два домена, связывающих антиген вируса гриппа. В одном варианте осуществления связывающая молекула включает в себя первый связывающий домен, который специфически связывает вирус гриппа А, и второй связывающий домен, который специфически связывает вирус гриппа В. Антитела, которые специфически связывают вирус гриппа А, описываются в предварительных заявках на патент США № 61/885808, поданной 2 октября 2013 г., и № 62/002414, поданной 23 мая 2014 г., а антитела, которые специфически связывают вирус гриппа В, описываются в предварительной заявке на патент США № 62/024804, поданной 15 июля 2014 г., где раскрытие каждой из которых тем самым включено в данный документ с помощью ссылки во всей своей полноте.
В одном варианте осуществления первый связывающий домен специфически связывает "ствол" гемагглютинина (HA) вируса гриппа А. В более конкретном варианте осуществления первый связывающий домен специфически связывает "ствол" гемагглютинина (HA) вируса гриппа А и нейтрализует по меньшей мере один подтип группы 1 и по меньшей мере один подтип группы 2 вируса гриппа А.
В одном варианте осуществления второй связывающий домен специфически связывает гемагглютинин (HA) вируса гриппа В. В более конкретном варианте осуществления второй связывающий домен специфически связывает гемагглютинин (HA) вируса гриппа В и нейтрализует вирус гриппа В из двух филогенетически различных линий. В одном варианте осуществления второй связывающий домен специфически связывает гемагглютинин (HA) вируса гриппа В и нейтрализует вирус гриппа В обеих линий Yamagata и Victoria. В другом варианте осуществления второй связывающий домен специфически связывает гемагглютинин (HA) вируса гриппа В и гемагглютинин (HA) вируса гриппа А и нейтрализует по меньшей мере один вирус гриппа В линии Yamagata; по меньшей мере один вирус гриппа В линии Victoria; по меньшей мере один подтип вируса гриппа А и их комбинации.
В одном варианте осуществления связывающая молекула представляет собой биспецифичное антитело с повышенной нейтрализующей активностью против одного или нескольких штаммов вируса гриппа А и/или вируса гриппа В по сравнению с любым исходным антителом. В одном варианте осуществления связывающая молекула представляет собой биспецифичное антитело с повышенной нейтрализующей активностью против одного или нескольких штаммов вируса гриппа A группы 1 или группы 2. В более конкретном варианте осуществления связывающая молекула представляет собой биспецифичное антитело с повышенной нейтрализующей активностью против штамма вируса гриппа А группы 1, выбранного из подтипов H1, H2, H5, H6, H8, H9, H11, H12, H13, H16, H17 и H18. В более конкретном варианте осуществления связывающая молекула представляет собой биспецифичное антитело с повышенной нейтрализующей активностью против штамма вируса гриппа А группы 2, выбранного из подтипов H3, H4, H7, H10, H14 и H15. В одном варианте осуществления связывающая молекула представляет собой биспецифичное антитело с повышенной нейтрализующей активностью против подтипа Н9 вируса гриппа А.
Термин "нейтрализовать", используемый в данном документе, относится к способности связывающей молекулы, такой как антитело или его антигенсвязывающий фрагмент, связываться с инфекционным агентом, например вирусом гриппа A и/или B, и снижать биологическую активность инфекционного агента, например вирулентность. В одном варианте осуществления связывающая молекула иммуноспецифически связывает по меньшей мере один определенный эпитоп или антигенную детерминанту вируса гриппа А, вируса гриппа B или их комбинаций. Связывающая молекула может нейтрализовать активность возбудителя инфекции, такого как вирус гриппа А и/или вирус гриппа B, в различные моменты в течение жизненного цикла вируса. Например, антитело может препятствовать прикреплению вируса к клетке-мишени, препятствуя взаимодействию вируса и одного или нескольких рецепторов клеточной поверхности. Как альтернатива, антитело может препятствовать одному или нескольким видам взаимодействия вируса со своими рецепторами после прикрепления, например препятствуя интернализации вируса в результате эндоцитоза, опосредованного рецепторами.
Терминология
Прежде чем подробно описывать настоящее изобретение, следует понимать, что настоящее изобретение не ограничивается конкретными композициями или стадиями способов, поскольку таковые могут изменяться. Следует отметить, что используемые в данном описании и прилагаемой формуле изобретения формы единственного числа включают определяемые объекты во множественном числе, если из контекста явно не следует иное.
Термин "приблизительно" относится к вариации числовой количественной величины, которая может иметь место, например, при типичных процедурах измерения и обработки, используемых для получения соединений, композиций, концентратов или составов; при непреднамеренной ошибке в этих процедурах; при различиях в изготовлении, источнике или чистоте исходных материалов или ингредиентов, используемых для выполнения способов и подобных соображений. Термин "приблизительно" также охватывает количества, которые отличаются из-за окисления соединений, композиций, концентратов или составов с определенной начальной концентрацией или смесью, и количества, которые отличаются из-за смешивания или обработки соединений, композиций, концентратов или составов с определенной начальной концентрацией или смесью. При изменении с помощью термина "приблизительно" прилагаемая формула изобретения включает в себя эквиваленты этих количеств.
Если не определено иное, то все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимается специалистом в данной области техники, к которой относится настоящее изобретение. Например, The Concise Dictionary of Biomedicine and Molecular Biology, Juo, Pei-Show (2002), 2nd ed., CRC Press; The Dictionary of Cell and Molecular Biology, 3rd ed., (1999), Academic Press and Oxford Dictionary Of Biochemistry And Molecular Biology, Revised, (2000), Oxford University Press, обеспечивают специалиста общим словарем многих выражений, используемых в настоящем изобретении.
Аминокислоты могут называться в данном документе по их общеизвестным трехбуквенным символам либо по однобуквенным символам, рекомендованным комиссией по биохимической номенклатуре IUPAC-IUB. Аналогично, нуклеотиды могут называться по их общепринятым однобуквенным кодам.
Определения
Термины "нуклеиновая кислота" или "полинуклеотид" охватывают любую физическую нить мономерных единиц, которая соответствует нити нуклеотидов, в том числе без ограничения полимер нуклеотидов, включающий в себя полимеры ДНК и РНК, и модифицированные олигонуклеотиды, например олигонуклеотиды с основаниями, которые являются нетипичными для биологических РНК или ДНК в растворе, такие как 2'-O-метилированные олигонуклеотиды. Полинуклеотид может включать в себя обычные фосфодиэфирные связи или необычные связи, например амидную связь, такую как встречающаяся в пептидных нуклеиновых кислотах (РНК). Нуклеиновая кислота может быть однонитевой или двухнитевой. Если не указано иное, то последовательность нуклеиновой кислоты охватывает комплементарные последовательности, в дополнение к специально указанной последовательности.
Термин "ген" широко используется в отношении нуклеиновой кислоты, связанной с биологической функцией. Таким образом, гены включают в себя кодирующие последовательности и/или регуляторные последовательности, необходимые для их экспрессии. Термин "ген" применяют по отношению к специфической геномной последовательности, а также к cDNA или mRNA, кодируемым данной геномной последовательностью. Гены также включают в себя неэкспрессированные последовательности нуклеиновой кислоты, которые например образуют последовательности распознавания для других белков. Неэкспрессированные регуляторные последовательности включают в себя "промоторы" и "энхансеры", с которыми связываются регуляторные белки, такие как факторы транскрипции, что приводит к транскрипции смежных или соседних последовательностей. Например, полинуклеотид, который кодирует полипептид, может включать в себя промотор и/или другие элементы, осуществляющие контроль транскрипции или трансляции, функционально связанные с одной или несколькими кодирующими областями. Термин "функционально связанный" относится к кодирующей области для генного продукта, которая ассоциирована с одной или несколькими регуляторными последовательностями таким образом, что экспрессия продукта гена находится под влиянием или контролем регуляторной последовательности(-ей). Термины "экспрессия гена" или "экспрессия нуклеиновой кислоты" относятся к транскрипции ДНК в РНК, трансляции РНК в полипептид или как к транскрипции, так и к трансляции, как указано контекстом.
Термин "кодирующая область", используемый в данном документе, относится к части нуклеиновой кислоты, которая включает в себя кодон, который может быть транслирован в аминокислоты. Хотя "стоп-кодон" (TAG, TGA или TAA) не транслируется в аминокислоту, его обычно считают частью кодирующей области. Однако фланкирующие последовательности, например промоторы, участки связывания с рибосомой, терминаторы транскрипции и интроны, не считаются частью кодирующей области. Вектор может содержать единственную кодирующую область или может включать в себя две или более кодирующих области. Кроме того, вектор, полинуклеотид или нуклеиновая кислота могут кодировать гетерологичные кодирующие области, либо слитые, либо не слитые с нуклеиновой кислотой, кодирующей генный продукт, представляющий интерес, например, антитело или его антигенсвязывающий фрагмент, вариант или производное. Гетерологичные кодирующие области включают в себя без ограничения специализированные элементы или мотивы, такие как секреторный сигнальный пептид или гетерологичный функциональный домен.
Термин "вектор" относится к средству, с помощью которого нуклеиновая кислота может размножаться и/или переноситься между организмами, клетками или клеточными компонентами. Векторы включают в себя без ограничения плазмиды, вирусы, бактериофаги, провирусы, фагмиды, транспозоны и искусственные хромосомы, которые способны реплицироваться автономно или интегрироваться в хромосому клетки-хозяина. Векторы также включают в себя без ограничения депротеинизированный РНК-полинуклеотид, депротеинизированный ДНК-полинуклеотид, полинуклеотид, включающий в себя и ДНК, и РНК в пределах одной нити, конъюгированную с полилизином ДНК или РНК, конъюгированную с пептидом ДНК или РНК, конъюгированную с липосомой ДНК, которые автономно не реплицируются. "Вектор экспрессии" представляет собой вектор, такой как плазмида, который способен стимулировать экспрессию, а также репликацию внедренной в нее нуклеиновой кислоты. Как правило, нуклеиновая кислота, подлежащая экспрессии, является "функционально связанной" с промотором и/или энхансером, и подвергается регуляторному контролю транскрипции промотором и/или энхансером.
Термин "клетка-хозяин" относится к клетке, которая содержит гетерологичную нуклеиновую кислоту, такую как вектор, и поддерживает репликацию и/или экспрессию нуклеиновой кислоты. Клетки-хозяева могут представлять собой прокариотические клетки, такие как E. coli, или эукариотические клетки, такие как клетки дрожжей, насекомых, амфибий, птиц или млекопитающих, в том числе клетки человека, например клетки HEp-2 и клетки Vero.
Термин "введенная" в отношении гетерологичной или выделенной нуклеиновой кислоты относится к переносу нуклеиновой кислоты в эукариотическую или прокариотическую клетку, при этом нуклеиновая кислота может быть включена в геном клетки, превращена в автономный репликон или транзиентно экспрессирована. Термин включает такие способы как "инфекция", "трансфекция", "трансформация" и "трансдукция". Для введения нуклеиновых кислот в клетки-хозяева может использоваться ряд способов, в том числе без ограничения электропорация, осаждение фосфатом кальция, трансфекция, опосредованная липидом, и липофекция.
Термин "экспрессия" относится к процессу, с помощью которого информация из гена используется в синтезе функционального генного продукта. Генными продуктами зачастую являются белки, однако также может быть функциональная РНК. Генная экспрессия может быть выявлена с помощью определения присутствия соответствующих rRNA, tRNA, mRNA, snRNA и/или генных продуктов на уровне белка.
Термин "полипептид" относится к молекуле, которая включает в себя два или более аминокислотных остатка, линейно связанных амидными связями (также известными как пептидные связи), такой как пептид или белок. Термин "полипептид" относится к любой цепи или цепям из двух или более аминокислот и не относится к конкретной длине продукта. Таким образом, пептиды, дипептиды, трипептиды, олигопептиды, "белок", "аминокислотная цепь" или любой другой термин, используемый для обозначения цепи или цепей из двух или более аминокислот, включены в определение "полипептид", и термин "полипептид" можно использовать вместо любого из этих терминов или взаимозаменяемо с любым из них. Также подразумевается, что термин "полипептид" относится к продуктам пост-экспрессионных модификаций полипептида, включая без ограничения гликозилирование, ацетилирование, фосфорилирование, амидирование, получение производных с помощью известных защитных/блокирующих групп, протеолитическое расщепление или модификацию с помощью аминокислот, не встречающихся в природе. Полипептид может быть получен из природного биологического источника или создан с помощью рекомбинантной технологии, и не обязательно быть транслированным из определенной последовательности нуклеиновой кислоты. Он может быть получен любым способом, в том числе путем химического синтеза. Аминокислотные остатки полипептида могут быть природными и неприродными, и могут быть незамещенными, немодифицированными, замещенными или модифицированными. "Аминокислотная последовательность" представляет собой полимер из аминокислотных остатков, например, белок или полипептид, или последовательность символов, представляющую аминокислотный полимер, в зависимости от контекста.
Термин "антитело", используемый в данном документе, относится к полипептиду или группе полипептидов, которые включают в себя по меньшей мере один домен связывания, который образуется в результате сворачивания полипептидных цепей, имеющий трехмерные углубления для связывания с формами внутренних поверхностей и распределения зарядов, комплементарные особенностям антигенной детерминанты антигена. Как правило, антитело имеет тетрамерную форму с двумя парами полипептидных цепей, при этом каждая пара имеет одну "легкую" и одну "тяжелую" цепи, где вариабельные области каждой пары легкой/тяжелой цепи образуют связывающий участок антитела. Как правило, каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, при этом среди тяжелых цепей разных изотипов иммуноглобулина количество дисульфидных связей различается. Каждая тяжелая и легкая цепь также имеет дисульфидные мостики между цепями, расположенные с равными интервалами. Как правило, каждая тяжелая цепь имеет на одном конце вариабельный домен (VH) с последующим рядом константных доменов (CH), и каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен (CL) на другом своем конце, в которых константный домен легкой цепи расположен на одной линии с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи расположен на одной линии с вариабельным доменом тяжелой цепи.
Термины "антитело", "антитела" и "иммуноглобулины", используемые в данном документе, охватывают моноклональные антитела (включающие в себя моноклональные антитела полной длины), поликлональные антитела, мультиспецифичные антитела, образованные по меньшей мере из двух разных эпитопсвязывающих фрагментов (например, биспецифичные антитела), CDR-привитые, человеческие антитела, гуманизированные антитела, верблюжьи антитела, химерные антитела, одноцепоченые Fv (scFv), одноцепоченые антитела, однодоменные антитела, Fab-фрагменты, Fab'-фрагменты, F(ab')2-фрагменты, фрагменты антител, которые проявляют требуемую биологическую активность (например, антигенсвязывающую часть), связанные дисульфидными мостиками Fv (dsFv) и антиидиотипические (анти-Id) антитела, интратела и эпитопсвязывающие фрагменты или производные любого из вышеупомянутых. В частности, антитела включают молекулы иммуноглобулинов и иммунологически активные фрагменты молекул иммуноглобулинов, т. е. молекулы, которые содержат по меньшей мере один антигенсвязывающий участок. Молекулы иммуноглобулина могут быть любого изотипа (например, IgG, IgE, IgM, IgD, IgA и IgY), субизотипа (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или аллотипа (например, Gm, например, G1m(f, z или x), G2m(n), G3m(g, b или c), Am, Em, и Km(1, 2 или 3)). Антитела могут быть получены от любых видов млекопитающих, в том числе без ограничения людей, обезьян, свиней, лошадей, кроликов, собак, котов, мышей и т. д., или других животных, таких как птицы (например, куры). Для облегчения очистки антитела могут быть слитыми с гетерологичной полипептидной последовательностью, например меткой.
Термин "специфически связывает" относится к более легкому связыванию связывающей молекулы, такой как антитело или его фрагмент, вариант или производное, с эпитопом через его антигенсвязывающий домен, чем связывание его с рандомным, неродственным эпитопом. Термин "специфичность" используется в данном документе для обозначения относительной аффинности, с которой определенная связывающая молекула связывается с определенным эпитопом.
Термин "аффинность", используемый в данном документе, относится к показателю силы связывания индивидуального эпитопа со связывающим доменом молекулы иммуноглобулина.
Термин "эпитоп", используемый в данном документе, относится к детерминанте белка, способной связываться со связывающим доменом антитела. Эпитопы обычно включают химически активные поверхностные группировки молекул, таких как аминокислоты или боковые цепи сахаров, и обычно обладают специфическими характеристиками трехмерной структуры, а также специфическими характеристиками заряда. Конформационные и неконформационные эпитопы отличаются тем, что связывание с первыми, но не с последними, утрачивается в присутствии денатурирующих растворителей.
Термин "выделенный" относится к биологическому материалу, такому как нуклеиновая кислота или белок, который практически не содержит компонентов, которые обычно сопровождают его или взаимодействуют с ним в его природной среде. С другой стороны, выделенный материал может включать в себя материал, не обнаруживаемый с материалом в его природной среде. Например, если материал находится в его природной среде, такой как клетка, то материал может быть помещен в определенное место в клетке, не присущее материалу, обнаруживаемому в этой среде. Например, встречающаяся в природе нуклеиновая кислота может считаться выделенной, если ее вводят не встречающимися в природе средствами в локус генома, не являющегося нативным для этой нуклеиновой кислоты. Такие нуклеиновые кислоты также называют "гетерологичными" нуклеиновыми кислотами.
Термин "рекомбинантный" относится к материалу, который был искусственно или синтетически изменен вмешательством человека. Изменение может быть выполнено с материалом в его природной среде или состоянии или вне его природной среды или состояния. Например, термин "рекомбинантная нуклеиновая кислота" может относиться к нуклеиновой кислоте, которая получена путем рекомбинации нуклеиновых кислот, например при клонировании, шаффлинге ДНК или других процедурах, или путем химического или иного мутагенеза; а термины "рекомбинантный полипептид" или "рекомбинантный белок" могут относиться к полипептиду или белку, которые получают с помощью экспрессии рекомбинантной нуклеиновой кислоты.
Термин "сконструированный", используемый в данном документе, включает воздействие на молекулы нуклеиновых кислот или полипептидов с помощью способов синтеза, включающих в себя, например, методики рекомбинации, синтез пептидов in vitro, ферментативное или химическое сочетание пептидов или их комбинации.
Термины "эффективное количество" или "терапевтически эффективное количество", используемые в данном документе, относятся к количеству терапевтической композиции, необходимому или достаточному для реализации требуемого клинического результата для данного состояния и режима введения, например к количеству, достаточному для достижения концентрации соединения, способной предупреждать или лечить инфекцию гриппа у субъекта. Такие количества и концентрации могут быть определены специалистами в данной области техники. Фактически вводимое количество терапевтической композиции, как правило, будет определяться врачом, в свете соответствующих обстоятельств, включающих в себя без ограничения состояние, подлежащее лечению, выбранный путь введения, фактическое вводимое соединение, возраст, массу и ответную реакцию отдельного пациента, а также тяжесть симптомов пациента.
Термин "терапевтическая композиция", используемый в данном документе, относится к соединению или композиции с терапевтическим применением, и включает в себя без ограничения биологические соединения, такие как антитела, белки и нуклеиновые кислоты, а также низкомолекулярные органические соединения, которые синтезированы химическим путем.
Термин "фармацевтическая композиция", используемый в данном документе, относится к композиции, которая включает в себя терапевтически эффективное количество терапевтического средства вместе с фармацевтически приемлемым носителем и, при необходимости, одним или несколькими разбавителями или вспомогательными веществами. Термин "фармацевтически приемлемый", используемый в данном документе, означает одобренный регулирующим ведомством федерального правительства США или правительства штата, или перечисленный в Фармакопее США или другой общепризнанной фармакопее для применения у млекопитающих, а более конкретно у человека.
Термин "синергический эффект", используемый в данном документе, относится к большему чем аддитивный терапевтическому эффекту, производимому комбинацией соединений, причем терапевтический эффект, полученный с помощью комбинации, превышает аддитивные эффекты, которые могли бы возникать в других случаях в результате независимого введения соединений по отдельности. Определенные варианты осуществления включают в себя способы получения синергического эффекта при лечении инфекций вируса гриппа А и/или вируса гриппа В, причем указанный эффект по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 200%, по меньшей мере на 500% или по меньшей мере на 1000% превышает соответствующий аддитивный эффект.
Термины "лечение" или "процесс лечения", используемые в данном документе, относятся как к терапевтическому лечению, так и профилактическим или предупреждающим мерам, где целью является стабилизировать, предупредить, облегчить или уменьшить один или несколько симптомов инфекции гриппа или замедлить, предупредить или ингибировать прогрессирование инфекции гриппа. Лечение также может относиться к выведению или сокращению инфекционного агента, такого как вирус гриппа A и/или вирус гриппа B у субъекта. Термин "лечение" также может означать увеличение выживаемости по сравнению с ожидаемой выживаемостью, если лечение не осуществляется. Лечение не обязательно означает, что инфекция полностью излечивается.
Термины "субъект" или "пациент", используемые в данном документе, относятся к любому представителю подтипа хордовых, включая без ограничения людей и других приматов, в том числе приматов, не относящихся к человеку, таких как шимпанзе, и других видов человекообразных обезьян и прочих обезьян. Сельскохозяйственные животные, такие как крупный рогатый скот, овцы, свиньи, козы и лошади; домашние млекопитающие, такие как собаки и кошки; лабораторные животные, в том числе грызуны, такие как мыши, крысы и морские свинки; птицы, в том числе домашние, дикие и пернатая дичь, такие как куры, индейки и другие куриные, утки, гуси и т. п., являются неограничивающими примерами. В это определение включены термины "млекопитающие" и "животные". Предусматриваются как взрослые, так и новорожденные особи млекопитающих.
Связывающие молекулы
В данном документе описываются связывающие молекулы, которые специфически связываются с вирусом гриппа А и/или вирусом гриппа В. Термин "связывающая молекула", используемый в данном документе, относится к молекуле, которая способна связываться с целевой молекулой или антигеном по аналогии с антителом, связывающимся с антигеном. Примеры связывающих молекул включают интактные антитела, а также антигенсвязывающие фрагменты, варианты, аналоги или производные таких антител, например встречающееся в природе молекулы антител или иммуноглобулинов или сконструированные молекулы антител или фрагменты, в том числе биспецифичные антитела. Связывающая молекула может включать в себя один или несколько связывающих доменов. Поскольку связывающая молекула может предусматривать каноническую структуру антитела, то связывающие молекулы могут иметь другие структуры, которые предусматривают один или несколько связывающих доменов. В одном варианте осуществления связывающая молекула включает в себя по меньшей мере два связывающих домена и по меньшей мере две связывающих специфичности.
Термин "связывающий домен", используемый в данном документе, относится к части, области или участку связывающей молекулы, которые отвечают за специфическое связывание с целевыми молекулой или антигеном. В одном варианте осуществления связывающий домен включает в себя вариабельный фрагмент (Fv) антитела. В одном варианте осуществления связывающий домен включает в себя вариабельную последовательность тяжелой цепи (VH) и вариабельную последовательность легкой цепи (VL) антитела. В одном варианте осуществления связывающий домен включает в себя один или несколько, две, три, четыре, пять или шесть областей, определяющих комплементарность (CDR), из антитела, расположенного с подходящими каркасными областями (FR). Связывающий домен может быть получен из одного вида, или связывающий домен может включать в себя CDR от одного вида и каркасные последовательности от другого вида, например как в гуманизированном антителе.
Связывающие молекулы могут происходить от любого животного, в том числе без ограничения от птиц и млекопитающих. Антитела или их фрагменты в связывающей молекуле могут представлять собой антитела человека, мышиных, осла, кролика, козы, морской свинки, верблюда, ламы, лошади или курицы. Термин антитела "человека", используемый в данном документе, включает антитела с аминокислотной последовательностью иммуноглобулина человека, и включает антитела, выделенные из библиотек иммуноглобулинов человека или из животных, трансгенных по одному или нескольким иммуноглобулинам человека и не экспрессирующих эндогенные иммуноглобулины.
В одном варианте осуществления связывающая молекула включает в себя по меньшей мере один связывающий домен, который способен связываться с вирусом гриппа А и/или нейтрализовать его. В другом варианте осуществления связывающая молекула включает в себя по меньшей мере один связывающий домен, который способен связываться с вирусом гриппа В и/или нейтрализовать его. В одном варианте осуществления связывающая молекула включает в себя первый связывающий домен, который способен связываться с вирусом гриппа А и/или нейтрализовать его, и второй связывающий домен, который способен связываться с вирусом гриппа В и/или нейтрализовать его. В более конкретном варианте осуществления связывающая молекула включает в себя первый связывающий домен, который способен связываться с гемагглютинином (НА) вируса гриппа А и нейтрализовать по меньшей мере один подтип группы 1 и по меньшей мере один подтип группы 2 вируса гриппа А; и второй связывающий домен, который способен связываться с гемагглютинином (НА) вируса гриппа В и нейтрализовать вирус гриппа В по меньшей мере из двух филогенетически различных линий. В одном варианте осуществления первый связывающий домен способен нейтрализовать один или несколько подтипов группы 1 вируса гриппа А, выбранных из H1, H2, H5, H6, H8, H9, H11, H12, H13, H16, H17, H18 и их вариантов; и один или нескольких подтипов группы 2 вируса гриппа A, выбранных из H3, H4, H7, H10, H14 и H15 и их вариантов. В одном варианте осуществления второй связывающий домен способен нейтрализовать вирус гриппа В обеих линий Yamagata и Victoria.
Антитела
Связывающая молекула может включать в себя полноразмерное антитело или интактное антитело, фрагмент антитела, включающий в себя антигенсвязывающий фрагмент, человеческое, гуманизированное, посттрансляционно модифицированное, химерное или слитое антитело, иммуноконъюгат или его функциональный фрагмент. В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые включают в себя антитело полной длины или интактное антитело или один или несколько фрагментов антитела, включающих в себя антигенсвязывающие фрагменты.
Примеры "антигенсвязывающих фрагментов" антитела включают (i) Fab-фрагмент, моновалентный фрагмент, который включает в себя домены VL, VH, CL и CH1 антитела; (ii) F(ab')2-фрагмент, двухвалентный фрагмент, который включает в себя два Fab-фрагмента, соединенных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, который включает в себя VH- и CH1-домены; (iv) Fv-фрагмент, который включает в себя VL- и VH-домены одного плеча антитела, (v) dAb-фрагмент (Ward et al., (1989) Nature 341:544-546), который включает в себя VH-домен; и (vi) выделенную область, определяющую комплементарность (CDR). Антигенсвязывающие фрагменты можно получить с помощью методик рекомбинантных ДНК или с помощью ферментативного или химического расщепления интактных иммуноглобулинов.
В одном варианте осуществления антигенсвязывающий фрагмент включает в себя одноцепочечное антитело, включающее в себя например "одноцепочечный вариабельный фрагмент" или "scFv." Термин "одноцепочечный вариабельный фрагмент" или "scFv" относится к белку слияния, который включает в себя по меньшей мере одну вариабельную область тяжелой цепи (VH) и по меньшей мере одну вариабельную область легкой цепи (VL) иммуноглобулина. Эти одноцепочечные фрагменты антитела могут быть получены с использованием обычных методик, известных специалистам в данной области техники. Например, VH- и VL-домены Fv-фрагмента, которые кодируются отдельными генами, могут быть соединены с использованием рекомбинантных способов, с помощью синтетического линкера, который обеспечивает возможность их получения в виде единой полипептидной цепи, в которой VL- и VH-области соединяются попарно с образованием одновалентной молекулы (см. Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). В одном варианте осуществления VH- и VL-области scFv соединяются с коротким линкерным пептидом, состоящим по меньшей мере из приблизительно 5, 10, 15 или 20 и до приблизительно 10, 15, 20, 25 или 30 аминокислот. Линкеры ScFv известны и включают в себя линкеры, которые богаты глицином (для гибкости), а также линкеры, которые включают в себя серин или треонин (для растворимости). В одном варианте осуществления линкер соединяет N-конец VH с C-концом VL. В других вариантах осуществления линкер соединяет C-конец VH с N-концом VL. В одном варианте осуществления scFv сохраняет специфичность оригинального иммуноглобулина, несмотря на удаление константных областей и введение линкера. Способы получения одноцепочечных Fv включают в себя таковые, описанные в патентах США №№ 4946778 и 5258498; Huston et al., (1991) Methods in Enzymology 203:46-88; Shu et al., (1993) PNAS 90:7995-7999; и Skerra et al., (1988) Science 240:1038-1040.
В одном варианте осуществления связывающая молекула включает в себя по меньшей мере один связывающий домен, который включает в себя антитело к вирусу гриппа А или его антигенсвязывающий фрагмент. В другом варианте осуществления связывающая молекула включает в себя по меньшей мере один связывающий домен, который включает в себя антитело к вирусу гриппа В или его антигенсвязывающий фрагмент. В более конкретном варианте осуществления связывающая молекула включает в себя по меньшей мере один связывающий домен, который включает в себя антитело к вирусу гриппа А или его антигенсвязывающий фрагмент, и по меньшей мере один связывающий домен, который включает в себя антитело к вирусу гриппа В или его антигенсвязывающий фрагмент.
Термины "антитело" и "антитела", используемые в данном документе, также известные как иммуноглобулины, охватывают моноклональные антитела, включающие в себя моноклональные антитела полной длины, человеческие антитела, гуманизированные антитела, верблюжьи антитела, химерные антитела, одноцепочечные антитела, одноцепочечные Fv (scFv), однодоменные антитела, доменные антитела, Fab-фрагменты, F(аb')2-фрагменты, фрагменты антител с требуемой биологической активностью, например антигенсвязывающие фрагменты, Fv c дисульфидными связями (dsFv) и антиидиотипические (анти-Id) антитела, интратела и их антигенсвязывающие фрагменты.
Подходящие молекулы иммуноглобулина могут быть любого изотипа (например, IgG, IgE, IgM, IgD, IgA и IgY), субизотипа (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или аллотипа (например, Gm, например, G1m(f, z или x), G2m(n), G3m(g, b или c), Am, Em, и Km(1, 2 или 3)). Молекулы иммуноглобулина могут включать в себя легкие цепи, классифицируемые как лямбда-цепи или каппа-цепи на основе аминокислотной последовательности константной области легкой цепи.
Типичная структурная единица иммуноглобулина (антитела) представляет собой тетрамер массой приблизительно 150 кДа, который включает в себя две пары полипептидных цепей, при этом каждая пара имеет одну "легкую" цепь (приблизительно 25 кДа) и одну "тяжелую" цепь (приблизительно 50-70 кДа). Как правило, каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, хотя среди тяжелых цепей разных изотипов иммуноглобулина количество дисульфидных связей варьирует. Каждая тяжелая и легкая цепь также имеет дисульфидные мостики между цепями, расположенные с равными интервалами. У большинства встречающихся в природе антител две пары полипептидных цепей идентичны. Однако в сконструированных антителах две пары полипептидных цепей не являются обязательно идентичными, например в трифункциональных антителах.
Как легкая, так и тяжелая цепи антитела могут быть разделены на "константные" и "вариабельные" домены. C-концевая часть тяжелой и легкой цепей называется константным доменом. "CH1-домен" относится к константному домену тяжелой цепи иммуноглобулина, расположенному между вариабельным доменом тяжелой цепи (VH) и шарнирной областью. "CH2-домен" относится к константному домену тяжелой цепи иммуноглобулина, расположенному между шарнирной областью и CH3-доменом. "CH3-домен" относится к константному домену тяжелой цепи иммуноглобулина, который расположен на C-конце CH2-домена. "CH4-домен" относится к константному домену тяжелой цепи иммуноглобулина, который расположен на C-конце CH3-домена в антителах IgM и IgE. Термин "шарнирная область" относится к части тяжелой цепи молекулы, которая присоединяет CH1-домен к CH2-домену. "CL-домен" относится к константному домену легкой цепи иммуноглобулина, который расположен C-терминально к вариабельному домену легкой цепи (VL).
N-конец каждой тяжелой и легкой цепей определяет трехмерную вариабельную область антигенсвязывающего участка, называемую вариабельным доменом. Вариабельные домены как легкой (VL), так и тяжелой (VH) цепей включают в себя приблизительно 100-110 или больше аминокислот и отвечают главным образом за распознавание антигена и специфичность. Константные домены легкой цепи (CL) и тяжелой цепи (CH1, CH2 или CH3) обеспечивают биологические свойства, такие как секреция, способность к переносу через плаценту, связывание с Fc-рецептором и связывание с комплементом. Традиционно нумерация доменов константной области возрастает по мере удаления доменов от антигенсвязывающего участка или N-конца антитела.
Термин "часть тяжелой цепи", используемый в данном документе, относится к аминокислотным последовательностям, полученным из тяжелой цепи иммуноглобулина, которые включают в себя по меньшей мере одно из VH-, CH1-домена, шарнирной области, CH2-домена, CH3-домена или их варианта или фрагмента. Термин "часть легкой цепи", используемый в данном документе, относится к аминокислотным последовательностям, полученным из легкой цепи иммуноглобулина, которые включают в себя по меньшей мере один из VL- или CL-домена.
Вариабельные области антитела
В одном варианте осуществления связывающая молекула включает в себя по меньшей мере один антигенсвязывающий домен, который включает в себя домен вариабельного фрагмента (Fv). В одном варианте осуществления связывающая молекула включает в себя по меньшей мере один связывающий домен, который включает в себя по меньшей мере одну VH тяжелой цепи антитела и по меньшей мере одну VL легкой цепи антитела. В более конкретном варианте осуществления связывающая молекула включает в себя первый связывающий домен, который включает в себя по меньшей мере одну VH тяжелой цепи антитела и по меньшей мере одну VL легкой цепи антитела, и второй связывающий домен, который включает в себя по меньшей мере одну VH тяжелой цепи антитела и по меньшей мере одну VL легкой цепи антитела. В одном варианте осуществления связывающая молекула включает в себя первый связывающий домен, который связывается с вирусом гриппа А и включает в себя по меньшей мере одну VH тяжелой цепи антитела и по меньшей мере одну VL легкой цепи антитела, и второй связывающий домен, который связывается с вирусом гриппа В и включает в себя по меньшей мере одну VH тяжелой цепи антитела и по меньшей мере одну VL легкой цепи антитела. Типичные VH- и VL-домены антитела, которые связываются с вирусом гриппа А и вирусом гриппа В, показаны соответственно в таблицах 1 и 2.
Таблица 1. Антитело к вирусу гриппа А
нуклеиновая кислота
SEQ ID NO:
аминокислота
SEQ ID NO:
нуклеиновая кислота
SEQ ID NO:
аминокислота
SEQ ID NO:
Таблица 2. Антитело к вирусу В
нуклеиновая кислота
SEQ ID NO:
аминокислота
SEQ ID NO:
нуклеиновая кислота
SEQ ID NO:
аминокислота
SEQ ID NO:
В одном варианте осуществления связывающая молекула включает в себя один или несколько VH- и/или VL-доменов, характеризующихся по меньшей мере определенным процентом идентичности с одной или несколькими VH- и/или VL-последовательностями, раскрытыми в таблицах 1 и 2. Термины "процент (%) идентичности последовательности" или "гомология", используемые в данном документе, относятся к процентной доле аминокислотных остатков или нуклеотидов в последовательности-кандидате, которые идентичны аминокислотным остаткам или нуклеотидам в эталонной последовательности, такой как последовательность исходного антитела, после выравнивания последовательностей и введения гэпов, при необходимости, для достижения максимального процента идентичности последовательностей, и не учитывает какие-либо консервативные замены как часть идентичности последовательностей. Выравнивания последовательностей могут быть осуществлены вручную или с использованием алгоритма гомологии Smith and Waterman, (1981) Ads App. Math. 2, 482, или Neddleman and Wunsch, (1970) J. MoI. Biol. 48, 443, с использованием способа поиска подобия Липмана-Пирсона, (1988) Proc. Natl Acad. Sci. USA 85, 2444, или с использованием компьютерных программ на основании одного или нескольких из этих алгоритмов (GAP, BESTFIT, FASTA, BLAST P, BLAST N и TFASTA в пакете программного обеспечения Wisconsin Genetics, Genetics Computer Group, 575 Science Drive, Мэдисон, Висконсин).
В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов с аминокислотной последовательностью VH, характеризующейся по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичностью с аминокислотной последовательностью VH, описанной в данном документе, включающей в себя, например, показанные в таблице 1 или 2. В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов с аминокислотной последовательностью VH, характеризующейся по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с аминокислотной последовательностью VH, описанной в данном документе, включающей в себя, например, показанные в таблице 1 или 2.
В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов с аминокислотной последовательностью VL, характеризующейся по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичностью с аминокислотной последовательностью VL, описанной в данном документе, включающей в себя, например, показанные в таблице 1 или 2. В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов с аминокислотной последовательностью VL, характеризующейся по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с аминокислотной последовательностью VL, описанной в данном документе, включающей в себя, например, показанные в таблице 1 или 2.
В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов с аминокислотной последовательностью VH и VL, характеризующейся по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичностью с аминокислотной последовательностью соответственно VH и VL, описанной в данном документе, включающей в себя, например, показанные в таблице 1 или 2. В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов с аминокислотной последовательностью VH и VL, характеризующейся по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с аминокислотной последовательностью соответственно VH и VL, описанной в данном документе, включающей в себя, например, показанные в таблице 1 или 2.
В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов с аминокислотной последовательностью VH и VL, характеризующейся по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичностью с аминокислотной последовательностью соответственно VH и VL, показанной в таблице 1. В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов с аминокислотной последовательностью VH и VL, характеризующейся по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с аминокислотной последовательностью соответственно VH и VL, показанной в таблице 1.
В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов с аминокислотной последовательностью VH и VL, характеризующейся по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичностью с аминокислотной последовательностью соответственно VH и VL, показанной в таблице 2. В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов с аминокислотной последовательностью VH и VL, характеризующейся по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с аминокислотной последовательностью соответственно VH и VL, показанной в таблице 2.
В одном варианте осуществления связывающая молекула включает в себя первый связывающий домен с аминокислотной последовательностью VH и VL, характеризующейся по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичностью с аминокислотной последовательностью соответственно VH и VL, показанной в таблице 1, и второй связывающий домен с аминокислотной последовательностью VH и VL, характеризующейся по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичностью с аминокислотной последовательностью соответственно VH и VL, показанной в таблице 2. В одном варианте осуществления связывающая молекула включает в себя первые связывающие домены с аминокислотной последовательностью VH и VL, характеризующейся по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с аминокислотной последовательностью соответственно VH и VL, показанной в таблице 1, и второй связывающий домен с аминокислотной последовательностью VH и VL, характеризующейся по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с аминокислотной последовательностью соответственно VH и VL, показанной в таблице 2.
В одном варианте осуществления первый связывающий домен связывающей молекулы включает в себя VH, имеющую аминокислотную последовательность, которая по меньшей мере на 75% идентична аминокислотной последовательности, выбранной из SEQ ID NO: 7; и SEQ ID NO: 17. В одном варианте осуществления первый связывающий домен связывающей молекулы включает в себя VL, имеющую аминокислотную последовательность, которая по меньшей мере на 75% идентична аминокислотной последовательности, выбранной из SEQ ID NO: 2; и VL под SEQ ID NO: 12. В более конкретном варианте осуществления первый связывающий домен связывающей молекулы включает в себя VH и VL, которые по меньшей мере на 75% идентичны аминокислотной последовательности соответственно VH и VL, выбранных из VH под SEQ ID NO: 7 и VL под SEQ ID NO: 2; и VH под SEQ ID NO: 17 и VL под SEQ ID NO: 12. В одном варианте осуществления первый связывающий домен включает в себя VH и VL, выбранные из VH под SEQ ID NO: 7 и VL под SEQ ID NO: 2; и VH под SEQ ID NO: 17 и VL под SEQ ID NO: 12.
Области, определяющие комплементарность (CDR)
В антителах, встречающихся в природе, в каждом антигенсвязывающем домене присутствуют шесть коротких несмежных последовательностей аминокислот, называемых "областями, определяющими комплементарность" или "CDR". Остальные аминокислоты в антигенсвязывающих доменах называются "каркасными" областями. Функцией каркасных областей является образование остова, который обеспечивает позиционирование CDR в правильной ориентации с помощью нековалентных взаимодействий между цепями. Три CDR тяжелой цепи обозначают CDRH1, CDRH2 и CDRH3, а три CDR легкой цепи обозначают CDRL1, CDRL2 и CDRL3.
Аминокислоты, которые составляют CDR и каркасные области, могут быть легко идентифицированы специалистом в данной области техники и описываются в Kabat et al., (1983) U.S. Dept. of Health and Human Services, "Sequences of Proteins of Immunological Interest", и в Chothia et al., (1987) J. Mol. Biol. 196:901-917. Определения согласно Kabat et al. и Chothia et al. включают в себя перекрывающиеся аминокислотные остатки. Аминокислотные остатки, которые составляют CDR, определяемые согласно Kabat et al. и Chothia et al., изложены ниже в таблице 3. Точное число остатков, которые составляют конкретную CDR, может варьировать в зависимости от последовательности и размера CDR. Специалисты в данной области техники могут обычным образом определить, какие остатки составляют конкретную данную CDR, с учетом аминокислотной последовательности вариабельной области антитела.
ТАБЛИЦА 3. Типичные определения CDR1
1Нумерация CDR соответствует правилам нумерации, изложенным Kabat et al.
Использование одного из двух определений предусматривается объемом термина "CDR", определяемого и используемого в данном документе. Однако, если не указано иное, то ссылки на нумерацию специфических положений аминокислотных остатков в связывающей молекуле, антителе, его антигенсвязывающем фрагменте, варианте или производном в данном документе приведены в соответствии с системой нумерации согласно Kabat et al.
В одном варианте осуществления аминокислоты в вариабельном домене, области, определяющей комплементарность (CDR), и каркасных областях (FR) антитела определяются согласно Kabat et al. Нумерация остатков согласно Kabat может быть определена для данного антитела с помощью выравнивания по областям гомологии последовательности антитела со "стандартной" последовательностью, пронумерованной согласно Kabat. Для максимального выравнивания каркасных остатков может потребоваться вставка "спейсерных" остатков в систему нумерации. Кроме того, идентичность определенных отдельных остатков в любом данном участке с нумерацией согласно Kabat может варьироваться от цепи антитела к цепи антитела из-за межвидовой или аллельной дивергенции.
В соответствии с системой нумерации согласно Kabat et al., HCDR1 начинается примерно с аминокислоты 31 (т. е. примерно через 9 остатков от первого цистеинового остатка), включает в себя примерно 5-7 аминокислот и заканчивается на следующем тирозиновом остатке. HCDR2 начинается с пятнадцатого остатка от конца CDRH1, включает в себя примерно 16-19 аминокислот и заканчивается на следующем аргининовом или лизиновом остатках. HCDR3 начинается примерно с тридцать третьего аминокислотного остатка от конца HCDR2; включает в себя 3-25 аминокислот и заканчивается на последовательности W-G-X-G, где X представляет собой любую аминокислоту. LCDR1 начинается примерно с остатка 24 (т. е. после цистеинового остатка), включает в себя примерно 10-17 остатков и заканчивается на следующем тирозиновом остатке. LCDR2 начинается примерно с шестнадцатого остатка от конца LCDR1 и включает в себя примерно 7 остатков. LCDR3 начинается примерно с тридцать третьего остатка от конца LCDR2, включает в себя примерно 7-11 остатков и заканчивается на последовательности F-G-X-G, где X представляет собой любую аминокислоту. CDR значительно изменяются от антитела к антителу (и по определению не будут проявлять гомологию с консенсусными последовательностями согласно Kabat). Последовательности CDR тяжелой цепи и легкой цепи антител по настоящему изобретению, пронумерованные с помощью системы Kabat, показаны в таблицах 4 и 5 ниже.
В одном варианте осуществления связывающая молекула включает в себя по меньшей мере одну, две, три, четыре, пять или шесть CDR. В одном варианте осуществления связывающая молекула включает в себя по меньшей мере одну, две, три, четыре, пять или шесть CDR тяжелой цепи (HCDR), показанные в таблицах 4 и 5. В одном варианте осуществления связывающая молекула включает в себя по меньшей мере одну, две, три, четыре, пять или шесть CDR легкой цепи (LCDR), показанные в таблицах 4 и 5. В одном варианте осуществления связывающая молекула включает в себя по меньшей мере одну, две, три, четыре, пять или шесть HCDR, показанные в таблицах 4 и 5, и по меньшей мере одну, две, три, четыре, пять или шесть LCDR, показанные в таблицах 4 и 5.
Таблица 4. CDR антитела к вирусу гриппа А, определяемые согласно Kabat et al.
SEQ ID:
SEQ ID:
SEQ ID:
SEQ ID:
SEQ ID:
SEQ ID:
Таблица 5. CDR антитела к вирусу гриппа В, определяемые согласно Kabat et al.
SEQ ID:
SEQ ID:
SEQ ID:
SEQ ID:
SEQ ID:
SEQ ID:
В другом варианте осуществления аминокислоты в вариабельном домене, областях, определяющих комплементарность (CDR), и каркасных областях (FR) антитела можно идентифицировать с помощью базы данных Immunogenetics (IMGT) (http://imgt.cines.fr). Lefranc et al. (2003) Dev Comp Immunol. 27(1):55-77. База данных IMGT была разработана с использованием информации о последовательностях иммуноглобулинов (IgG), T-клеточных рецепторов (TcR) и молекул главного комплекса гистосовместимости (MHC), и она унифицирует нумерацию в легких цепях лямбда и каппа, тяжелых цепях и цепях T-клеточных рецепторов, а также позволяет избежать применения кодов вставки для всех, за исключением чрезвычайно длинных вставок. IMGT также учитывает и объединяет в себе определение каркасных областей (FR) и областей, определяющих комплементарность (CDR), согласно Kabat et al., определение характеристик гипервариабельных петель согласно Chothia et al., а также данные о структуре на основании рентгеноструктурных исследований. Последовательности CDR тяжелой цепи и легкой цепи, пронумерованные с использованием системы IMGT, показаны в таблице 6 ниже.
Таблица 6. CDR антитела к вирусу гриппа В, определяемые по IMGT
SEQ ID NO:
SEQ ID NO:
SEQ ID NO:
SEQ ID NO:
SEQ ID NO:
SEQ ID NO:
В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые включают в себя одну или несколько, в том числе одну, две, три, четыре, пять или шесть CDR, выбранных из HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3. В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые включают в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR выбраны из HCDR и LCDR, показанных в таблицах 4-6. В другом варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые включают в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR включают в себя аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% идентична аминокислотной последовательности HCDR и LCDR, показанных в таблицах 4-6. В другом варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые включают в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR включают в себя аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности HCDR и LCDR, показанных в таблицах 4-6.
В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые включают в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR выбраны из HCDR и LCDR, показанных в таблице 4. В другом варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые включают в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR включают в себя аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% идентична аминокислотной последовательности HCDR и LCDR, показанных в таблице 4. В другом варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые включают в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR включают в себя аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности HCDR и LCDR, показанных в таблице 4.
В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые включают в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR выбраны из HCDR и LCDR, показанных в таблицах 5 и 6. В другом варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые включают в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR включают в себя аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% идентична аминокислотной последовательности HCDR и LCDR, показанных в таблицах 5 и 6. В другом варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые включают в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR включают в себя аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности HCDR и LCDR, показанных в таблицах 5 и 6.
В одном варианте осуществления связывающая молекула включает в себя первый связывающий домен, который включают в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, показанных в таблице 4, и второй связывающий домен, который включает в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, выбранных из HCDR и LCDR, показанных в таблицах 5 и 6. В другом варианте осуществления связывающая молекула включает в себя первый связывающий домен, который включает в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR включают в себя аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% идентична аминокислотной последовательности HCDR и LCDR, показанных в таблице 4, и второй связывающий домен, который включает в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR включают в себя аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% идентична аминокислотной последовательности HCDR и LCDR, показанных в таблицах 5 и 6. В другом варианте осуществления связывающая молекула включает в себя первый связывающий домен, который включает в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR включают в себя аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности HCDR и LCDR, показанных в таблице 4, и второй связывающий домен, который включает в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR включают в себя аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности HCDR и LCDR, показанных в таблицах 5 и 6.
В одном варианте осуществления первый связывающий домен связывающей молекулы включает в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, при этом по отдельности CDR имеют аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% идентична аминокислотной последовательности:
(a) HCDR1 под SEQ ID NO: 8, HCDR2 под SEQ ID NO: 9, HCDR3 под SEQ ID NO: 10, LCDR1 под SEQ ID NO: 3, LCDR2 под SEQ ID NO: 4 и LCDR3 под SEQ ID NO: 5, соответственно; или
(b) HCDR1 под SEQ ID NO: 18, HCDR2 под SEQ ID NO: 19, HCDR3 под SEQ ID NO: 20, LCDR1 под SEQ ID NO: 13, LCDR2 под SEQ ID NO: 14, LCDR3 под SEQ ID NO: 15, соответственно.
В одном варианте осуществления первый связывающий домен связывающей молекулы включает в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, при этом по отдельности CDR имеют аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности:
(a) HCDR1 под SEQ ID NO: 8, HCDR2 под SEQ ID NO: 9, HCDR3 под SEQ ID NO: 10, LCDR1 под SEQ ID NO: 3, LCDR2 под SEQ ID NO: 4 и LCDR3 под SEQ ID NO: 5, соответственно; или
(b) HCDR1 под SEQ ID NO: 18, HCDR2 под SEQ ID NO: 19, HCDR3 под SEQ ID NO: 20, LCDR1 под SEQ ID NO: 13, LCDR2 под SEQ ID NO: 14, LCDR3 под SEQ ID NO: 15, соответственно.
В одном варианте осуществления второй связывающий домен предусматривает набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, при этом по отдельности CDR имеют аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% идентична аминокислотной последовательности:
(a) HCDR1 под SEQ ID NO: 28, HCDR2 под SEQ ID NO: 29, HCDR3 под SEQ ID NO: 30, LCDR1 под SEQ ID NO: 23, LCDR2 под SEQ ID NO: 24 и LCDR3 под SEQ ID NO: 25, соответственно;
(b) HCDR1 под SEQ ID NO: 44, HCDR2 под SEQ ID NO: 45, HCDR3 под SEQ ID NO: 46, LCDR1 под SEQ ID NO: 39, LCDR2 под SEQ ID NO: 40 и LCDR3 под SEQ ID NO: 41, соответственно; или
(c) HCDR1 под SEQ ID NO: 60, HCDR2 под SEQ ID NO: 61, HCDR3 под SEQ ID NO: 62, LCDR1 под SEQ ID NO: 55, LCDR2 под SEQ ID NO: 56, LCDR3 под SEQ ID NO: 57, соответственно.
В одном варианте осуществления второй связывающий домен предусматривает набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, при этом по отдельности CDR имеют аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности:
(a) HCDR1 под SEQ ID NO: 28, HCDR2 под SEQ ID NO: 29, HCDR3 под SEQ ID NO: 30, LCDR1 под SEQ ID NO: 23, LCDR2 под SEQ ID NO: 24 и LCDR3 под SEQ ID NO: 25, соответственно;
(b) HCDR1 под SEQ ID NO: 44, HCDR2 под SEQ ID NO: 45, HCDR3 под SEQ ID NO: 46, LCDR1 под SEQ ID NO: 39, LCDR2 под SEQ ID NO: 40 и LCDR3 под SEQ ID NO: 41, соответственно; или
(c) HCDR1 под SEQ ID NO: 60, HCDR2 под SEQ ID NO: 61, HCDR3 под SEQ ID NO: 62, LCDR1 под SEQ ID NO: 55, LCDR2 под SEQ ID NO: 56, LCDR3 под SEQ ID NO: 57, соответственно.
Каркасные области
Каждый из вариабельных доменов тяжелой и легкой цепей включает в себя четыре каркасных области (FR1, FR2, FR3, FR4), которые являются наиболее высококонсервативными частями вариабельных доменов. Четыре FR тяжелой цепи обозначают FRH1, FRH2, FRH3 и FRH4, а четыре FR легкой цепи обозначают FRL1, FRL2, FRL3 и FRL4. При использовании системы нумерации согласно Kabat FRH1 начинается в положении 1 и заканчивается примерно на аминокислоте 30, FRH2 расположена примерно от аминокислоты 36 до 49, FRH3 расположена примерно от аминокислоты 66 до 94 и FRH4 расположена примерно от аминокислоты 103 до 113. В одном варианте осуществления одна или несколько модификаций, таких как замены, делеции или вставки одного или нескольких остатков FR, могут быть введены, например, для улучшения или оптимизации аффинности связывания одного или нескольких связывающих доменов связывающей молекулы для вируса гриппа А и/или вируса гриппа В. Примеры остатков каркасных областей, которые могут быть модифицированы, включают таковые, которые непосредственно нековалентно связывают антиген (Amit et al., Science, 233:747-753 (1986)); взаимодействуют с CDR/влияют на ее конформацию (Chothia et al., J. Mol. Biol., 196:901-917 (1987)) и/или участвуют в образовании области контакта VL-VH (патент США № 5225539).
В одном варианте осуществления FR одного или нескольких связывающих доменов связывающей молекулы включает в себя одно или несколько аминокислотных изменений с целью "модифицирования на уровне генов зародышевой линии". При модифицировании на уровне генов зародышевой линии аминокислотные последовательности тяжелой цепи и/или легкой цепи антитела сравниваются с аминокислотными последовательностями тяжелой и легкой цепей зародышевой линии. Если определенные каркасные остатки тяжелой цепи и/или легкой цепи отличаются от конфигурации зародышевой линии, например в результате соматической мутации генов иммуноглобулина, используемых для получения фаговой библиотеки, то может быть желательно "подвергнуть обратной мутации" измененные каркасные остатки выбранных антител до конфигурации зародышевой линии (т. е. изменить каркасные аминокислотные последовательности с тем, чтобы они стали аналогичными каркасным аминокислотным последовательностям зародышевой линии). Такую "обратную мутацию" (или "модифицирование на уровне генов зародышевой линии") остатков каркасных областей можно осуществить с помощью стандартных способов молекулярной биологии для внедрения специфических мутаций (например, сайт-направленного мутагенеза; ПЦР-опосредованного мутагенеза и т. п.).
Дисульфидные связи
Термин "дисульфидная связь", используемый в данном документе, относится к ковалентной связи, образованной между двумя атомами серы. Аминокислота цистеин содержит тиольную группу, которая способна образовывать дисульфидную связь или мостик со второй тиольной группой. В большинстве встречающихся в природе молекул IgG CH1- и CL-области связываются дисульфидной связью, а две тяжелые цепи связываются двумя дисульфидными связями в гибкой области тяжелой цепи, известной как шарнирная область (как правило, в положениях, соответствующих 239 и 242, с использованием системы нумерации согласно Kabat).
В одном варианте осуществления одна или несколько аминокислотных замен могут быть выполнены в каркасной области, например для улучшения связывания антитела с его антигеном. В одном варианте осуществления аминокислотная последовательность каркасной области может быть модифицирована для осуществления аминокислотной замены или делеции одного или нескольких цистеиновых остатков, участвующих во внутрицепочечной дисульфидной связи, например для образования связывающей молекулы без одной или нескольких внутрицепочечных дисульфидных связей, для образования связывающей молекулы с одной или несколькими дополнительными внутрицепочечными дисульфидными связями или для изменения расположения одной или нескольких внутрицепочечных дисульфидных связей.
В одном варианте осуществления связывающая молекула включает в себя один или несколько scFv. В одном варианте осуществления scFv включает в себя VH и VL, при этом C-конец первого домена вариабельной области соединяется с N-концом второго домена вариабельной области посредством гибкого пептидного линкера. В одном варианте осуществления C-конец вариабельного домена тяжелой цепи (VH) соединяется с N-концом вариабельного домена легкой цепи (VL). Это может называться ориентацией "VH-VL" или "HL". В других вариантах осуществления C-конец вариабельного домена легкой цепи (VL) соединяется с N-концом вариабельного домена тяжелой цепи (VН). Это может называться ориентацией "VL-VH" или "LH". Длина линкера (LS), соединяющего VH и VL из scFv, может варьировать. В одном варианте осуществления линкер (LS) имеет аминокислотную последовательность [GGGGS]n, где n равняется 0, 1, 2, 3, 4 или 5 (SEQ ID NO: 93). В другом варианте осуществления линкер (LS) имеет аминокислотную последовательность [GGGG]n, где n равняется 0, 1, 2, 3, 4 или 5 (SEQ ID NO: 106). В других вариантах осуществления линкер включает в себя комбинацию двух последовательностей. В более конкретном варианте осуществления линкер включает в себя аминокислотную последовательность GGGGSGGGGSGGGGSGGGGS (SEQ ID NO:92).
В других вариантах осуществления положение дисульфидной связи между VH и VL из scFv можно изменять путем добавления, удаления или изменения расположения одного или нескольких цистеиновых остатков в scFv. В одном варианте осуществления VH из scFv включает в себя цистеиновый остаток в положениях 43, 44, 100, 101, 105 и их комбинации (пронумерованных согласно Kabat). В одном варианте осуществления VL из scFv включает в себя цистеиновый остаток в положениях 43, 44, 46, 49, 50, 100 и их комбинации (пронумерованных согласно Kabat). В одном варианте осуществления scFv характеризуется ориентацией VL-VH, при которой VL и VH связываются дисульфидной связью по VL100-VH44, VL43-VH105, VL46-VH101, VL49-VH100, VL50-VH100 или их комбинациям. В другом варианте осуществления scFv характеризуется ориентацией VH-VL, при которой VH и VL связываются дисульфидной связью по VH44-VL100, VH100-VL49, VH100-VL50, VH101-VL46, VH105-VL43 или их комбинациям.
Биспецифичные антитела
В одном варианте осуществления связывающая молекула включает в себя "биспецифичное антитело." Термин "биспецифичное антитело", используемый в данном документе, относится к антителу или его антигенсвязывающему фрагменту с двумя или более связывающими доменами, которые способны специфически связывать две разные целевые молекулы или антигены. Как правило, биспецифичные антитела предусматривают специфичности и свойства одного или нескольких, зачастую по меньшей мере двух и, как правило, двух разных моноклональных антител, называемых "исходными антителами", в одной молекуле. Некоторые биспецифичные антитела демонстрируют синергетические активности. В одном варианте осуществления биспецифичное антитело демонстрирует повышенную нейтрализующую активность против одного или нескольких штаммов вируса гриппа А и/или вируса гриппа В по сравнению с исходным антителом.
В одном варианте осуществления биспецифичные антитела, описанные в данном документе, обладают расширенным диапазоном действия по сравнению с одинарным mAb, а также могут демонстрировать проявлять нейтрализацию в отношении одного или нескольких штаммов вируса гриппа А. В одном варианте осуществления связывающая молекула представляет собой биспецифичное антитело с повышенной нейтрализующей активностью против одного или нескольких штаммов вируса гриппа A группы 1 или группы 2. В более конкретном варианте осуществления связывающая молекула представляет собой биспецифичное антитело с повышенной нейтрализующей активностью против штамма вируса гриппа А группы 1, выбранного из подтипов H1, H2, H5, H6, H8, H9, H11, H12, H13, H16, H17 и H18. В более конкретном варианте осуществления связывающая молекула представляет собой биспецифичное антитело с повышенной нейтрализующей активностью против штамма вируса гриппа А группы 2, выбранного из подтипов H3, H4, H7, H10, H14 и H15. В одном варианте осуществления связывающая молекула представляет собой биспецифичное антитело с повышенной нейтрализующей активностью против подтипа Н9 вируса гриппа А.
В одном варианте осуществления связывающая молекула включает в себя биспецифичное антитело с более чем двумя валентностями. Например, в одном варианте осуществления связывающая молекула включает в себя триспецифичное антитело. Триспецифичные антитела известны, и могут быть получены с использованием способов, известных специалисту в данной области техники (Tutt et al., (1991) J. Immunol., 147:60).
Биспецифичные антитела могут быть экспрессированы линиями клеток, такими как триомы и межвидовые гибридомы, или могут быть сконструированы рекомбинантными средствами. (Ströhlein and Heiss, Future Oncol. 6:1387-94 (2010); Mabry and Snavely, IDrugs. 13:543-9 (2010)).
В одном варианте осуществления связывающая молекула включает в себя биспецифичное антитело, которое включает в себя по меньшей мере две пары тяжелой и легкой цепей или их связывающих фрагментов, где первая пара происходит от первого "исходного" антитела и обладает первичной специфичностью связывания, а вторая пара происходит от второго "исходного" антитела и обладает вторичной специфичностью связывания. В одном варианте осуществления связывающая молекула включает в себя первую пару тяжелой и легкой цепей или их фрагментов, которые специфически связывают вирус гриппа А, и вторую пару тяжелой и легкой цепей или их фрагментов, которые специфически связывают вирус гриппа В. В одном варианте осуществления связывающая молекула включает в себя биспецифичное антитело, которое включает в себя две или более химически соединенных Fab-области, направленных против двух разных целевых молекул или антигенов. В более конкретном варианте осуществления связывающая молекула включает в себя одну или несколько Fab-областей, которые специфически связывают вирус гриппа А. В другом варианте осуществления связывающая молекула включает в себя одну или несколько Fab-областей, которые специфически связывают вирус гриппа В. В другом варианте осуществления связывающая молекула включает в себя биспецифичное антитело, которое включает в себя один или несколько одноцепочечных вариабельных фрагментов (scFv). В одном варианте осуществления связывающая молекула включает в себя по меньшей мере один scFv, который специфически связывает вирус гриппа А. В другом варианте осуществления связывающая молекула включает в себя по меньшей мере один scFv, который специфически связывает вирус гриппа В.
В одном варианте осуществления связывающая молекула представляет собой биспецифичное антитело, образованное путем слияния антитела IgG и одного или нескольких одноцепочечных связывающих доменов. В одном варианте осуществления связывающая молекула сохраняет коровую структуру антитела (IgA, IgD, IgE, IgG или IgM). В другом варианте осуществления коровая структура антитела (IgA, IgD, IgE, IgG или IgM) не сохраняется, например, в диа-, тира- или тетрателах, минителах и одноцепочечных форматах (scFv, Bis-scFv). В другом варианте осуществления биспецифичное антитело может включать в себя слияние F(ab)2, где два или более Fab-фрагментов сливаются с химическим кросслинкером. Во многих форматах биспецифичных антител применяются один или несколько линкеров, например для слияния коровой части антитела (IgA, IgD, IgE, IgG или IgM) со связывающим доменом (например, scFv) или для слияния двух или более Fab-фрагментов или scFv. В некоторых вариантах осуществления Fc-домен, а следовательно эффекторная функция Fc, сохраняются. В других вариантах осуществления Fc-домен не сохраняется.
В одном варианте осуществления связывающая молекула включает в себя асимметрическую IgG-подобную структуру с двумя тяжелыми и двумя легкими цепями, которые образуют "Y"-образную молекулу, где первое "плечо" антитела специфически связывает первый антиген, а второе "плечо" антитела связывает второй антиген.
В одном варианте осуществления связывающая молекула включает в себя один или несколько фрагментов антитела, таких как одноцепочечные антитела, которые включают в себя одну или несколько вариабельных областей тяжелой цепи (VH) отдельно или в комбинации с ни одним, некоторыми или всеми из следующего: шарнирная область (H), домены CH1, CH2 и CH3, и/или одну или несколько вариабельных областей легкой цепи (VL) отдельно или в комбинации с CL-доменом.
В одном варианте осуществления биспецифичное антитело включает в себя один или несколько одноцепочечных Fv (scFv). В одном варианте осуществления биспецифичное антитело включает в себя два или более scFv. В другом варианте осуществления биспецифичное антитело включает в себя часть или всю иммуноглобулиновую "основную" структуру, например структуру IgA, IgD, IgE, IgG или IgM, которая включает в себя один или несколько Fv-доменов, например одну или несколько тяжелых цепей и одну или несколько легких цепей, где один или несколько scFv сливаются с иммуноглобулиновой "основной" структурой. В более конкретном варианте осуществления связывающая молекула включает в себя IgG-структуру, которая включает в себя две тяжелых цепи и две легких цепи, при этом один или несколько scFv сливаются с ними.
В одном варианте осуществления форматом антитела может быть любой формат, раскрываемый в данном документе. В другом варианте осуществления форматом является любой из Bis1, Bis2, Bis3, Bis4 или Bis5. В одном варианте осуществления Fv-домен первого связывающего домена включает в себя тяжелую цепь (HC), имеющую амино-конец и карбокси-конец, и легкую цепь (LC), имеющую амино-конец и карбокси-конец, а второй связывающий домен ковалентно связан с карбокси-концом HC первого связывающего домена с использованием одного или двух линкеров. В одном варианте осуществления Fv-домен первого связывающего домена включает в себя тяжелую цепь (HC), имеющую амино-конец и карбокси-конец, и легкую цепь (LC), имеющую амино-конец и карбокси-конец, а второй связывающий домен ковалентно связан с карбокси-концом HC первого связывающего домена с использованием одного линкера. В одном варианте осуществления Fv-домен первого связывающего домена включает в себя тяжелую цепь (HC), имеющую амино-конец и карбокси-конец, и легкую цепь (LC), имеющую амино-конец и карбокси-конец, а второй связывающий домен ковалентно связан с карбокси-концом HC первого связывающего домена с использованием двух линкеров. В одном варианте осуществления Fv-домен первого связывающего домена включает в себя тяжелую цепь (HC), имеющую амино-конец и карбокси-конец, и легкую цепь (LC), имеющую амино-конец и карбокси-конец, а второй связывающий домен ковалентно связан с амино-концом HC первого связывающего домена. В одном варианте осуществления Fv-домен первого связывающего домена включает в себя тяжелую цепь (HC), имеющую амино-конец и карбокси-конец, и легкую цепь (LC), имеющую амино-конец и карбокси-конец, а второй связывающий домен ковалентно связан с амино-концом LC первого связывающего домена. В другом варианте осуществления Fv-домен первого связывающего домена включает в себя тяжелую цепь (HC), имеющую амино-конец и карбокси-конец, и легкую цепь (LC), имеющую амино-конец и карбокси-конец, а второй связывающий домен встроен посредством ковалентного связывания вдоль полипептидной цепи HC первого связывающего домена.
В одном варианте осуществления связывающая молекула включает в себя биспецифичное антитело, которое включает в себя тяжелую цепь антитела, характеризующуюся формулой VH-CH1-H-CH2-CH3, где VH представляет собой вариабельный домен тяжелой цепи, CH1 представляет собой домен-1 константной области тяжелой цепи, H представляет собой шарнирную область, CH2 представляет собой домен-2 константной области тяжелой цепи, и CH3 представляет собой домен-3 константной области тяжелой цепи. В одном варианте осуществления связывающая молекула представляет собой биспецифичное антитело, которое включает в себя легкую цепь антитела, характеризующуюся формулой VL-CL, где VL представляет собой вариабельный домен легкой цепи, а CL представляет собой константный домен легкой цепи.
В одном варианте осуществления связывающая молекула включает в себя тяжелую цепь антитела с N-концевым доменом, где тяжелая цепь антитела характеризуется формулой VH-CH1-H-CH2-CH3, где VH представляет собой вариабельный домен тяжелой цепи, CH1 представляет собой домен-1 константной области тяжелой цепи, H представляет собой шарнирную область, CH2 представляет собой домен-2 константной области тяжелой цепи, а CH3 представляет собой домен-3 константной области тяжелой цепи, и легкую цепь антитела с N-концевым доменом, где легкая цепь антитела характеризуется формулой VL-CL, где VL представляет собой вариабельный домен легкой цепи, а CL представляет собой константный домен легкой цепи, и где одна или несколько молекул scFv ковалентно присоединяются к одному или нескольким N-концевым доменам тяжелой цепи антитела или легкой цепи антитела (фигура 1).
В более конкретном варианте осуществления N-концевой домен антитела или его фрагмента включает в себя один или несколько Fv-доменов, и одна или несколько молекул scFv ковалентно присоединяются к одному или нескольким Fv-доменам антитела или его фрагмента (фигура 1). В более конкретном варианте осуществления одна или несколько молекул scFv ковалентно присоединяются к N-концевому домену одного или нескольких вариабельных доменов легкой цепи (VL) антитела или его фрагмента (фигура 1). В более конкретном варианте осуществления связывающая молекула включает в себя легкую цепь антитела, характеризующуюся формулой scFv-L1-VL-CL, где scFv представляет собой молекулу scFv, L1 представляет собой линкер, VL представляет собой вариабельный домен легкой цепи, VL представляет собой вариабельный домен легкой цепи, и CL представляет собой константный домен легкой цепи (фигура 1).
В одном варианте осуществления одна или несколько молекул scFv ковалентно присоединяются к N-концевому домену одного или нескольких вариабельных доменов тяжелой цепи (VH) антитела или его фрагмента (фигура 1). В одном варианте осуществления тяжелая цепь характеризуется формулой scFv-L1-VH-CH1-CH2-CH3, где scFv представляет собой молекулу scFv, L1 представляет собой линкер, VH представляет собой вариабельный домен тяжелой цепи, CH1 представляет собой домен-1 константного домена тяжелой цепи, CH2 представляет собой домен-2 константного домена тяжелой цепи, и CH3 представляет собой домен-3 константного домена тяжелой цепи (фигура 1).
В другом варианте осуществления связывающая молекула включает в себя антитело или его фрагмент с C-концевым доменом, где одна или несколько молекул scFv ковалентно присоединяются к C-концевому домену антитела или его фрагмента (фигура 1). В одном варианте осуществления связывающая молекула включает в себя первую и вторую тяжелые цепи соответственно с первым и вторым C-концевыми доменами, где одна или несколько молекул scFv ковалентно присоединяются к C-концевому домену первой тяжелой цепи, второй тяжелой цепи или их комбинациям (фигура 1). В одном варианте осуществления одна или несколько тяжелых цепей характеризуются формулой VH-CH1-CH2-CH3, где VH представляет собой вариабельный домен тяжелой цепи, CH1 представляет собой домен-1 константного домена тяжелой цепи, CH2 представляет собой домен-2 константного домена тяжелой цепи, и CH3 представляет собой домен-3 константного домена тяжелой цепи (фигура 1). В одном варианте осуществления одна или несколько тяжелых цепей характеризуются формулой VH-CH1-CH2-CH3-L1-scFv, где L1 представляет собой линкер, и scFv представляет собой молекулу scFv (фигура 1).
В другом варианте осуществления связывающая молекула включает в себя антитело или его фрагмент с C-концевым доменом, где одна или несколько молекул scFv ковалентно присоединяются к C-концевому домену антитела или его фрагмента (фигура 1). В одном варианте осуществления связывающая молекула включает в себя первую и вторую тяжелые цепи соответственно с первым и вторым C-концевыми доменами, где одна или несколько молекул scFv ковалентно присоединяются к C-концевому домену первой тяжелой цепи, второй тяжелой цепи или их комбинациям (фигура 1). В одном варианте осуществления одна или несколько тяжелых цепей характеризуются формулой VH-CH1-CH2-CH3, где VH представляет собой вариабельный домен тяжелой цепи, CH1 представляет собой домен-1 константного домена тяжелой цепи, CH2 представляет собой домен-2 константного домена тяжелой цепи, и CH3 представляет собой домен-3 константного домена тяжелой цепи (фигура 1). В одном варианте осуществления одна или несколько тяжелых цепей характеризуются формулой VH-CH1-CH2-CH3-L1-scFvL2, где L1 и L2 независимо представляют собой линкеры, и scFv представляет собой молекулу scFv (фигура 1).
В одном варианте осуществления связывающая молекула включает в себя антитело или его фрагмент, имеющие один или несколько константных доменов тяжелой цепи, где одна или несколько молекул scFv вставляются между одним или несколькими константными доменами тяжелой цепи в одной или нескольких тяжелых цепях (фигура 1). В одном варианте осуществления одна или несколько тяжелых цепей характеризуются формулой VH-CH1-CH2-CH3, где VH представляет собой вариабельный домен тяжелой цепи, CH1 представляет собой домен-1 константного домена тяжелой цепи, CH2 представляет собой домен-2 константного домена тяжелой цепи, и CH3 представляет собой домен-3 константного домена тяжелой цепи (фигура 1). В одном варианте осуществления одна или несколько тяжелых цепей характеризуются формулой VH-CH1-L1-scFv-L2-CH2-CH3, где L1 и L2 независимо представляют собой линкер, и scFv представляет собой молекулу scFv (фигура 1). В одном варианте осуществления одна или несколько тяжелых цепей характеризуются формулой VH-CH1-CH2-L1-scFv-L2-CH3, где L1 и L2 независимо представляют собой линкеры, и scFv представляет собой молекулу scFv.
В одном варианте осуществления связывающая молекула включает в себя иммуноглобулиновую структуру, например IgG-структуру, имеющую один или несколько Fv-доменов. В одном варианте осуществления Fv-домен включает в себя VH- и VL-последовательность с аминокислотной последовательностью, характеризующейся по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичностью с VH- или VL-последовательностью, показанной в таблице 1. В другом варианте осуществления Fv-домен включает в себя VH- и VL-последовательность, характеризующуюся по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с VH- или VL-последовательностью, показанной в таблице 1. В одном варианте осуществления Fv-домен включает в себя VH- и VL-последовательность с аминокислотной последовательностью, характеризующейся по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичностью с VH- или VL-последовательностью, показанной в таблице 2. В другом варианте осуществления Fv-домен включает в себя VH- и VL-последовательность, характеризующуюся по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с VH- или VL-последовательностью, показанной в таблице 2.
В одном варианте осуществления связывающая молекула включает в себя иммуноглобулиновую структуру, имеющую один или несколько связывающих доменов, которые включают в себя одну или несколько, в том числе одну, две, три, четыре, пять или шесть CDR, выбранных из HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3. В одном варианте осуществления связывающая молекула включает в себя иммуноглобулиновую структуру, имеющую один или несколько связывающих доменов, которые включают в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR выбраны из HCDR и LCDR, показанных в таблицах 4-6. В другом варианте осуществления связывающая молекула включает в себя иммуноглобулиновую структуру, имеющую один или несколько связывающих доменов, которые включают в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR включают в себя аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% идентична аминокислотной последовательности HCDR и LCDR, показанных в таблицах 4-6. В другом варианте осуществления связывающая молекула включает в себя иммуноглобулиновую структуру, имеющую один или несколько связывающих доменов, которые включают в себя набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR включают в себя аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности HCDR и LCDR, показанных в таблицах 4-6.
В одном варианте осуществления связывающая молекула включает в себя один или несколько scFv, характеризующихся формулой VH-LS-VL, или как альтернатива VL-LS-VH, где LS представляет собой линкерную последовательность. В одном варианте осуществления scFv включает в себя VH- и VL-последовательность с аминокислотной последовательностью, характеризующейся по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичностью с VH- или VL-последовательностью, показанной в таблице 1. В другом варианте осуществления scFv включает в себя VH- и VL-последовательность, характеризующуюся по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с VH- или VL-последовательностью, показанной в таблице 1. В одном варианте осуществления scFv включает в себя VH- и VL-последовательность с аминокислотной последовательностью, характеризующейся по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичностью с VH- или VL-последовательностью, показанной в таблице 2. В другом варианте осуществления scFv включает в себя VH- и VL-последовательность, характеризующуюся по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с VH- или VL-последовательностью, показанной в таблице 2.
В одном варианте осуществления связывающая молекула включает в себя один или несколько scFv с одной или несколькими, в том числе одной, двумя, тремя, четырьмя, пятью или шестью CDR, выбранными из HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3. В одном варианте осуществления связывающая молекула включает в себя один или несколько scFv с набором из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR выбраны из HCDR и LCDR, показанных в таблицах 4-6. В другом варианте осуществления связывающая молекула включает в себя один или несколько scFv с набором из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR включают в себя аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% идентична аминокислотной последовательности HCDR и LCDR, показанных в таблицах 4-6. В другом варианте осуществления связывающая молекула включает в себя один или несколько scFv с набором из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, где CDR включают в себя аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности HCDR и LCDR, показанных в таблицах 4-6.
В одном варианте осуществления линкер LS имеет аминокислотную последовательность: (a) [GGGGS]n, где n равняется 0, 1, 2, 3, 4 или 5 (SEQ ID NO: 93), (b) [GGGG]n, где n равняется 0, 1, 2, 3, 4 или 5, (SEQ ID NO: 106) или комбинацию (a) и (b). Например, типичный линкер включает в себя: GGGGSGGGGSGGGGSGGGGS (SEQ ID NO:92). В одном варианте осуществления scFv сливается с иммуноглобулиновой структурой, например IgG-структурой через линкер (L1 или L2) с аминокислотной последовательностью: (a) [GGGGS]n, где n равняется 0, 1, 2, 3, 4 или 5 (SEQ ID NO: 93), (b) [GGGG]n, где n равняется 0, 1, 2, 3, 4 или 5, (SEQ ID NO: 106) или комбинация (a) и (b), включающая в себя, например, аминокислотную последовательность GGGGSGGGGSGGGGSGGGGS (SEQ ID NO:92).
В более конкретном варианте осуществления связывающая молекула включает в себя иммуноглобулиновую структуру, например IgG-структуру с одним или несколькими Fv-доменами, которые включают в себя VH- и VL-последовательность с аминокислотной последовательностью, характеризующейся по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичностью с VH- или VL-последовательностью, показанной в таблице 1, или VH- и VL-последовательность, характеризующуюся по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с VH- или VL-последовательностью, показанной в таблице 1. В одном варианте осуществления один или несколько scFv, характеризующихся формулой VH-LS-VL, или как альтернатива VL-LS-VH, где LS представляет собой линкерную последовательность, сливаются с иммуноглобулиновой структурой, и scFv включает в себя VH- и VL-последовательность с аминокислотной последовательностью, характеризующейся по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичностью с VH- или VL-последовательностью, показанной в таблице 2. В другом варианте осуществления scFv включает в себя VH- и VL-последовательность, характеризующуюся по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с VH- или VL-последовательностью, показанной в таблице 2. В одном варианте осуществления линкер LS имеет аминокислотную последовательность: (a) [GGGGS]n, где n равняется 0, 1, 2, 3, 4 или 5 (SEQ ID NO: 93), (b) [GGGG]n, где n равняется 0, 1, 2, 3, 4 или 5, (SEQ ID NO: 106) или комбинацию (a) и (b). Например, типичный линкер включает в себя: GGGGSGGGGSGGGGSGGGGS (SEQ ID NO:92). В одном варианте осуществления scFv сливается с иммуноглобулиновой структурой, например IgG-структурой через линкер (L1 или L2) с аминокислотной последовательностью: (a) [GGGGS]n, где n равняется 0, 1, 2, 3, 4 или 5 (SEQ ID NO: 93), (b) [GGGG]n, где n равняется 0, 1, 2, 3, 4 или 5, (SEQ ID NO: 106) или комбинация (a) и (b), включающая в себя, например, аминокислотную последовательность GGGGSGGGGSGGGGSGGGGS (SEQ ID NO:92).
В одном варианте осуществления первый связывающий домен связывающей молекулы включает в себя антитело к вирусу гриппа А или его антигенсвязывающий фрагмент. В одном варианте осуществления второй связывающий домен связывающей молекулы включает в себя антитело к вирусу гриппа В или его антигенсвязывающий фрагмент. В одном варианте осуществления первый связывающий домен включает в себя Fv-домен антитела к вирусу гриппа А. В более конкретном варианте осуществления связывающая молекула включает в себя домен вариабельного фрагмента (Fv), имеющий вариабельный домен тяжелой цепи антитела и вариабельный домен легкой цепи антитела, где Fv специфически связывает антиген вируса гриппа А. В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые включают в себя молекулу scFv антитела к вирусу гриппа В. В одном варианте осуществления связывающая молекула включает в себя первый связывающий домен, который включает в себя Fv-домен антитела к вирусу гриппа А, и второй связывающий домен, который включает в себя молекулу scFv антитела к вирусу гриппа В.
В одном варианте осуществления связывающая молекула включает в себя легкую цепь с аминокислотной последовательностью, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности под SEQ ID NO:66 или SEQ ID NO:68. В одном варианте осуществления связывающая молекула включает в себя легкую цепь с аминокислотной последовательностью под SEQ ID NO:66 или SEQ ID NO:68.
В одном варианте осуществления связывающая молекула представляет собой биспецифичное антитело, которое специфически связывается с вирусом гриппа А и вирусом гриппа В, имеющее тяжелую цепь с аминокислотной последовательностью, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности под SEQ ID NO:67 или SEQ ID NO:69. В одном варианте осуществления связывающая молекула представляет собой биспецифичное антитело, которое специфически связывается с вирусом гриппа А и вирусом гриппа В, имеющее тяжелую цепь с аминокислотной последовательностью под SEQ ID NO:67 или SEQ ID NO:69.
В одном варианте осуществления связывающая молекула включает в себя легкую цепь с аминокислотной последовательностью, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности под SEQ ID NO:66 или SEQ ID NO:68. В одном варианте осуществления связывающая молекула включает в себя тяжелую цепь с аминокислотной последовательностью, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности под SEQ ID NO:67 или SEQ ID NO:69. В одном варианте осуществления связывающая молекула представляет собой биспецифичное антитело, которое специфически связывается с вирусом гриппа А и вирусом гриппа В, включает в себя легкую цепь с аминокислотной последовательностью, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности под SEQ ID NO:66 или SEQ ID NO:68, и тяжелую цепь с аминокислотной последовательностью, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности под SEQ ID NO:67 или SEQ ID NO:69.
В одном варианте осуществления связывающая молекула представляет собой биспецифичное антитело, которое специфически связывается с вирусом гриппа А и вирусом гриппа В, включает в себя легкую цепь с аминокислотной последовательностью под SEQ ID NO:66 или SEQ ID NO:68 и тяжелую цепь с аминокислотной последовательностью под SEQ ID NO:67 или SEQ ID NO:69. В одном варианте осуществления связывающая молекула представляет собой биспецифичное антитело, имеющее легкую цепь с аминокислотной последовательностью под SEQ ID NO:66 и тяжелую цепь с аминокислотной последовательностью под SEQ ID NO:67. В одном варианте осуществления связывающая молекула представляет собой биспецифичное антитело, имеющее легкую цепь с аминокислотной последовательностью под SEQ ID NO:68 и тяжелую цепь с аминокислотной последовательностью под SEQ ID NO:69.
В одном варианте осуществления молекула scFv включает в себя VH-домен с набором из трех CDR: HCDR1, HCDR2, HCDR3, при этом набор из трех CDR включает в себя аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% идентична аминокислотной последовательности HCDR, показанных в таблицах 5 и 6. В другом варианте осуществления связывающая молекула включает в себя VH-домен с набором из трех CDR: HCDR1, HCDR2, HCDR3, при этом набор из трех CDR включает в себя аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности HCDR, показанных в таблицах 5 и 6.
В одном варианте осуществления молекула scFv включает в себя VL-домен с набором из трех CDR: LCDR1, LCDR2, LCDR3, при этом набор из трех CDR включает в себя аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% идентична аминокислотной последовательности LCDR, показанных в таблицах 5 и 6. В другом варианте осуществления связывающая молекула включает в себя VL-домен с набором из трех CDR: LCDR1, LCDR2, LCDR3, при этом набор из трех CDR включает в себя аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности LCDR, показанных в таблицах 5 и 6.
В более конкретном варианте осуществления связывающая молекула включает в себя один или несколько scFv, имеющих аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности, показанной в SEQ ID NO:31, SEQ ID NO:34, SEQ ID NO:47, SEQ ID NO:50 и SEQ ID NO:63. В одном варианте осуществления связывающая молекула включает в себя один или несколько scFv, имеющих аминокислотную последовательность, показанную в SEQ ID NO:31, SEQ ID NO:34, SEQ ID NO:47, SEQ ID NO:50 и SEQ ID NO:63.
Связывающий домен вируса гриппа А
В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые иммуноспецифически связывают по меньшей мере один определенный эпитоп вируса гриппа А. Термины "связывающий домен" или "антигенсвязывающий домен", используемые в данном документе, означают участок, который специфически связывается с эпитопом антигена. Антигенсвязывающий домен антитела обычно включает в себя по меньшей мере часть вариабельной области тяжелой цепи иммуноглобулина и по меньшей мере часть вариабельной области легкой цепи иммуноглобулина, при этом участок связывания, образованный этими вариабельными областями, определяет специфичность антитела.
В более конкретном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые иммуноспецифически связывают по меньшей мере один определенный эпитоп белка НА вируса гриппа А. Термин "эпитоп", используемый в данном документе, относится к детерминанте белка, способной связываться с антителом. Эпитопы обычно включают химически активные поверхностные группировки молекул, таких как аминокислоты или боковые цепи сахаров, и обычно обладают специфическими характеристиками трехмерной структуры, а также специфическими характеристиками заряда. Конформационные и неконформационные эпитопы отличаются тем, что связывание с первыми, но не с последними, утрачивается в присутствии денатурирующих растворителей.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент связываются с эпитопом, является консервативным по меньшей мере у 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 или всех подтипов вируса гриппа A. В другом варианте осуществления антитело или его антигенсвязывающий фрагмент связываются с эпитопом, который является консервативным среди одного или нескольких, или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 подтипов группы 1 вируса гриппа A, выбранных из H1, H2, H5, H6, H8, H9, H11, H12, H13, H16, H17 и H18, и одного или нескольких, или по меньшей мере 1, 2, 3, 4, 5 или 6 подтипов группы 2, выбранных из H3, H4, H7, H10, H14 и H15.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент связывают по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 или 17 или все подтипы вируса гриппа A с EC50, составляющей от приблизительно 0,01 мкг/мл до приблизительно 5 мкг/мл, или от приблизительно 0,01 мкг/мл до приблизительно 0,5 мкг/мл, или от приблизительно 0,01 мкг/мл до приблизительно 0,1 мкг/мл, или менее чем приблизительно 5 мкг/мл, 1 мкг/мл, 0,5 мкг/мл, 0,1 мкг/мл или 0,05 мкг/мл. В другом варианте осуществления антитело или его антигенсвязывающий фрагмент связывают по меньшей мере один или несколько, или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 подтипов группы 1 вируса гриппа А, выбранных из H1, H2, H5, H6, H8, H9, H11, H12, H13, H16, H17 и H18, и один или несколько, или по меньшей мере 1, 2, 3, 4, 5 или 6 подтипов группы 2, выбранных из H3, H4, H7, H10, H14 и H15, с EC50, составляющей от приблизительно 0,01 мкг/мл до приблизительно 5 мкг/мл, или от приблизительно 0,01 мкг/мл до приблизительно 0,5 мкг/мл, или от приблизительно 0,01 мкг/мл до приблизительно 0,1 мкг/мл, или менее чем приблизительно 5 мкг/мл, 1 мкг/мл, 0,5 мкг/мл, 0,1 мкг/мл или 0,05 мкг/мл.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент распознают эпитоп, который является линейным эпитопом или непрерывным эпитопом. В другом варианте осуществления антитело или его антигенсвязывающий фрагмент распознают нелинейный или конформационный эпитоп. В одном варианте осуществления эпитоп расположен в высококонсервативной стволовой области HA2. В более конкретном варианте осуществления антитело или его антигенсвязывающий фрагмент связываются с конформационным эпитопом в высококонсервативной стволовой области HA2. (Wilson et al. (1981) Nature. 289:366-373). В одном варианте осуществления эпитоп включает в себя, в качестве контактирующих остатков, одну или несколько аминокислот, выбранных из 18, 19, 42, 45, 156 и 196 в стволовой области HA2. В более конкретном варианте осуществления эпитоп содержит, в качестве контактных остатков, одну или несколько аминокислот, выбранных из положений 18, 19, 42 и 45 в стволовой области HA2. В дополнительном варианте осуществления эпитоп содержит, в качестве контактных остатков, аминокислоты 18, 19, 42 и 45 в стволовой области HA2. В еще одном дополнительном варианте осуществления эпитоп содержит, в качестве контактных остатков, аминокислоты 18, 19 и 42 в стволовом участке HA2.
Связывающий домен вируса гриппа В
В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые иммуноспецифически связывают по меньшей мере один определенный эпитоп вируса гриппа В. В более конкретном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые иммуноспецифически связывают по меньшей мере один определенный эпитоп белка НА вируса гриппа В. В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые специфически связываются с эпитопом, присутствующим на вирусах гриппа B по меньшей мере двух филогенетически разных линий. В более конкретном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые связываются с эпитопом, присутствующим по меньшей мере в одном штамме вируса гриппа B линии Yamagata и по меньшей мере одном штамме вируса гриппа B линии Victoria. В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые связываются с эпитопом, присутствующим в вирусе гриппа B как линии Yamagata, так и линии Victoria. В одном варианте осуществления связывающий элемент включает в себя один или несколько связывающих доменов, которые связываются с эпитопом, который является консервативным среди вирусов гриппа B как линии Yamagata, так и линии Victoria.
В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые связываются по меньшей мере с одним вирусом гриппа B штамма Yamagata и по меньшей мере с одним вирусом гриппа B штамма Victoria при полумаксимальной эффективной концентрации (EC50), составляющей от приблизительно 1 нг/мл до приблизительно 500 нг/мл, или от приблизительно 1 нг/мл до приблизительно 250 нг/мл, или от приблизительно 1 нг/мл до приблизительно 50 нг/мл, или менее чем приблизительно 500 нг/мл, 250 нг/мл, 100 нг/мл, 50 нг/мл, 40 нг/мл, 30 нг/мл, 20 нг/мл или 15 мкг/мл. В другом варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые связываются с вирусом гриппа B линий Yamagata и Victoria при EC50, составляющей от приблизительно 1 нг/мл до приблизительно 500 нг/мл, или от приблизительно 1 нг/мл до приблизительно 250 нг/мл, или от приблизительно 1 нг/мл до приблизительно 50 нг/мл, или менее чем приблизительно 500 нг/мл, 250 нг/мл, 100 нг/мл, 50 нг/мл, 40 нг/мл, 30 нг/мл, 20 нг/мл или 15 мкг/мл. В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые связываются с эпитопом, присутствующим у вируса гриппа B как линии Yamagata, так и линии Victoria, при EC50, составляющей от приблизительно 1 нг/мл до приблизительно 500 нг/мл, или от приблизительно 1 нг/мл до приблизительно 250 нг/мл, или от приблизительно 1 нг/мл до приблизительно 50 нг/мл, или менее чем приблизительно 500 нг/мл, 250 нг/мл, 100 нг/мл, 50 нг/мл, 40 нг/мл, 30 нг/мл, 20 нг/мл или 15 мкг/мл.
В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые связываются с эпитопом, присутствующим на вирусе гриппа B линии Yamagata, при EC50, составляющей от приблизительно 1 нг/мл до приблизительно 100 нг/мл, от 1 нг/мл до приблизительно 50 нг/мл, или от приблизительно 1 нг/мл до приблизительно 25 нг/мл, или менее чем приблизительно 50 нг/мл или 25 нг/мл; и эпитопом, присутствующим на вирусе гриппа B линии Victoria, при EC50, составляющей от приблизительно 1 нг/мл до приблизительно 500 нг/мл, или от приблизительно 1 нг/мл до приблизительно 250 нг/мл, или от приблизительно 1 нг/мл до приблизительно 50 нг/мл, или менее чем приблизительно 500 нг/мл, 250 нг/мл, 100 нг/мл или 50 нг/мл.
В другом варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые связываются с эпитопом, присутствующим на вирусе гриппа B линии Yamamoto, при EC50, составляющей от приблизительно 1 нг/мл до приблизительно 100 нг/мл, от 1 нг/мл до приблизительно 50 нг/мл, или от приблизительно 1 нг/мл до приблизительно 25 нг/мл, или менее чем приблизительно 50 нг/мл или 25 нг/мл; с эпитопом, присутствующим на вирусе гриппа B линии Victoria, при EC50, составляющей от приблизительно 1 нг/мл до приблизительно 500 нг/мл, или от приблизительно 1 нг/мл до приблизительно 250 нг/мл, или от приблизительно 1 нг/мл до приблизительно 50 нг/мл, или менее чем приблизительно 500 нг/мл, 250 нг/мл или 100 нг/мл; и эпитопом, присутствующим на HA вируса гриппа A, при EC50, составляющей от приблизительно 1 мкг/мл до приблизительно 50 мкг/мл, или менее чем приблизительно 50 мкг/мл, 25 мкг/мл, 15 мкг/мл или 10 мкг/мл. В другом варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые связываются с эпитопом, присутствующим на вирусе гриппа B линии Yamagata, при EC50, составляющей от приблизительно 1 нг/мл до приблизительно 100 нг/мл, от 1 нг/мл до приблизительно 50 нг/мл, или от приблизительно 1 нг/мл до приблизительно 25 нг/мл, или менее чем приблизительно 50 нг/мл или 25 нг/мл; с эпитопом, присутствующим на вирусе гриппа B линии Victoria, при EC50, составляющей от приблизительно 1 нг/мл до приблизительно 500 нг/мл, или от приблизительно 1 нг/мл до приблизительно 250 нг/мл, или от приблизительно 1 нг/мл до приблизительно 50 нг/мл, или менее чем приблизительно 500 нг/мл, 250 нг/мл или 100 нг/мл; и эпитопом, присутствующим на HA H9 вируса гриппа A, при EC50, составляющей от приблизительно 1 мкг/мл до приблизительно 50 мкг/мл, или менее чем приблизительно 50 мкг/мл, 25 мкг/мл, 15 мкг/мл или 10 мкг/мл.
В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые распознают эпитоп, который является линейным эпитопом или непрерывным эпитопом. В другом варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые распознают нелинейный или конформационный эпитоп. В одном варианте осуществления эпитоп расположен на гликопротеине гемагглютинине (HA) вируса гриппа B. В более конкретном варианте осуществления эпитоп расположен в области гликопротеина HA, представляющей собой головку, вируса гриппа B. В одном варианте осуществления эпитоп включает в себя одну или несколько аминокислот в положениях 128, 141, 150 или 235 в области HA, представляющей собой головку, вируса гриппа B в качестве контактирующих остатков, которые пронумерованы в соответствии с системой нумерации H3, как описано в Wang et al. (2008) J. Virol. 82(6):3011-20. В одном варианте осуществления эпитоп включает в себя аминокислоту 128 из последовательности области HA, представляющей собой головку, вируса гриппа B в качестве контактирующего остатка. В другом варианте осуществления эпитоп включает в себя аминокислоты 141, 150 и 235 из последовательности области HA, представляющей собой головку, вируса гриппа B в качестве контактирующих остатков.
Перекрестная реактивность
В одном варианте осуществления связывающая молекула может быть описана или определена в отношении эпитопа(-ов) или части(-ей) антигена, который связывающая молекула распознает или специфически связывает. Часть целевой молекулы, которая специфически взаимодействует с антигенсвязывающим доменом антитела, представляет собой "эпитоп" или "антигенную детерминанту". Целевой антиген может включать в себя любое число эпитопов, в зависимости от размера, конформации и типа антигена. В одном варианте осуществления связывающая молекула специфически связывается с тем же эпитопом, что и один или несколько антител, описанных в данном документе, и/или будет конкурентно ингибировать связывание антитела, описанного в данном документе, с эпитопом.
В одном варианте осуществления один или несколько связывающих доменов связывающей молекулы демонстрируют перекрестную реактивность с вирусом гриппа А и вирусом гриппа В. Термин "перекрестная реактивность", используемый в данном документе, относится к способности связывающего домена связывающей молекулы, которая является специфической для одного антигена, реагировать со вторым антигеном. Таким образом, связывающая молекула является перекрестно реактивной, если она связывается с эпитопом, отличным от того, который индуцировал ее образование.
Fc-область
В одном варианте осуществления связывающей молекулой является антитело, которое модифицировано в Fc-области для обеспечения требуемых эффекторных функций или периода полужизни в сыворотке крови. В одном варианте осуществления Fc-область может индуцировать цитотоксичность, например, посредством антителозависимой клеточной цитотоксичности (ADCC), или с помощью привлечения компонентов системы комплемента в комплементзависимой цитотоксичности (CDC), или с помощью привлечения неспецифических цитотоксических клеток, которые экспрессируют один или несколько эффекторных лигандов, распознающих антитело, связанное с вирусом гриппа А и/или вирусом гриппа В, и впоследствии вызвать фагоцитоз клетки по типу антителозависимого клеточноопосредованного фагоцитоза (ADCP) или какого-либо другого механизма. В других вариантах осуществления может быть желательным устранение или снижение эффекторной функции с тем, чтобы минимизировать побочные эффекты или осложнения от терапевтических средств. Известны способы повышения, а также снижения или устранения Fc-эффекторной функции. В других вариантах осуществления Fc-область может быть модифицирована для повышения аффинности связывания с FcRn и, таким образом, увеличения периода полужизни в сыворотке крови. В следующих вариантах осуществления Fc-область может быть конъюгирована с PEG или альбумином для увеличения периода полужизни в сыворотке крови. Fc-варианты более подробно описаны в предварительных заявках на патенты США № 61/885808, поданной 2 октября 2013 г., № 62/002414, поданной 23 мая 2014 г., и № 62/024804, поданной 15 июля 2014 г., раскрытия которых тем самым включены в данный документ с помощью ссылки во всей своей полноте.
Характеристики связывания
Как описано выше, связывающие молекулы, описанные в данном документе, иммуноспецифически связываются по меньшей мере с одним определенным эпитопом или антигенной детерминантой белка вируса гриппа А и/или вируса гриппа В, пептидом, субъединицей, фрагментом, частью или любой их комбинацией либо исключительно, либо преимущественно по отношению к другим полипептидам. Термины "эпитоп" или "антигенная детерминанта", используемые в данном документе, относятся к белковой детерминанте, способной связываться с антителом. В одном варианте осуществления термин "связывание" в данном документе относится к специфичному связыванию. Эти белковые детерминанты или эпитопы обычно включают в себя химически активные поверхностные группировки молекул, таких как аминокислоты или боковые цепи сахаров, и обычно обладают специфическими характеристиками трехмерной структуры, а также специфическими характеристиками заряда. Конформационные и неконформационные эпитопы отличаются тем, что связывание с первыми, но не с последними, утрачивается в присутствии денатурирующих растворителей. Термин "прерывистый эпитоп", используемый в данном документе, относится к конформационному эпитопу на белковом антигене, который образован по меньшей мере из двух разделенных областей в первичной последовательности белка.
Взаимодействия между антигенами и антителами являются такими же, как и другие нековалентные белок-белковые взаимодействия. В целом, между антигенами и антителами существуют четыре типа связывающих взаимодействий: (i) водородные связи, (ii) дисперсионные силы, (iii) электростатические силы между кислотами Льюиса и основаниями Льюиса и (iv) гидрофобные взаимодействия. Гидрофобные взаимодействия являются основной движущей силой для взаимодействия антитела и антигена, и основаны на отталкивании воды неполярными группами, а не на притяжении молекул (Tanford, (1978) Science. 200:1012-8). Однако определенные физические силы также способствуют связыванию антигена и антитела, например совместимость или комплементарность форм эпитопов и различных связывающих участков антител. Кроме того, другие материалы и антигены могут перекрестно реагировать с антителом, конкурируя таким образом за доступное свободное антитело.
Измерение константы аффинности и специфичности связывания между антигеном и антителом может облегчить определение эффективности профилактических, терапевтических, диагностических и исследовательских способов, в которых применяются связывающие молекулы, описанные в данном документе. Термин "аффинность связывания" в целом относится к силе суммы всех нековалентных взаимодействий между одним связывающим участком молекулы (например, антитела) и его партнером по связыванию (например, антигеном). Если не указано иное, то термин "аффинность связывания", используемый в данном документе, относится к присущей аффинности связывания, которая отражает взаимодействие 1:1 между членами связывающейся пары (например, антителом и антигеном). Аффинность молекулы X к ее партнеру Y в целом можно представить равновесной константой диссоциации (Kd), которую рассчитывают в виде соотношения koff/kon. См., например, Chen et al. (1999) J. Mol Biol. 293:865-881. В основном антитела с низкой аффинностью связывают антиген медленно и склонны легко диссоциировать, тогда как антитела с высокой аффинностью обычно связывают антиген быстрее и склонны оставаться в связанном состоянии дольше. Из уровня техники известен ряд способов измерения аффинности связывания.
В одном варианте осуществления связывающая молекула включает в себя одно или несколько аминокислотных изменений, например одну или несколько замен, делеций и/или добавлений, веденных в одну или несколько вариабельных областей антитела. В другом варианте осуществления аминокислотные изменения вводят в каркасные области. Одно или несколько изменений остатков каркасных областей могут приводить к улучшению аффинности связывания связывающей молекулы по отношению к антигену. В одном варианте осуществления могут быть изменены от приблизительно одного до приблизительно пяти остатков каркасных областей.
Один способ определения аффинности связывания включает измерение константы диссоциации "Kd" c помощью анализа связывания меченного радиоактивным изотопом антигена (RIA), проводимого с Fab-вариантом антитела, представляющего интерес, и его антигеном, как описано в Chen et al. (1999) J. Mol Biol. 293:865-881. Как альтернатива, значение Kd можно измерить с помощью анализов поверхностного плазмонного резонанса с применением BIAcore™-2000 или BIAcore™-3000 (BIAcore, Inc., Пискатауэй, Нью-Джерси). Если на основании анализа поверхностного плазмонного резонанса скорость прямой реакции превышает 106 М-1 с-1, то скорость прямой реакции можно определить с помощью применения методики гашения флуоресценции, при которой измеряют повышение или снижение интенсивности излучения флуоресценции в присутствии возрастающих концентраций антигена. "Скорость прямой реакции", или "скорость ассоциации", или "kon" можно также определить с помощью такой же методики поверхностного плазмонного резонанса, описанной выше.
Способы и реактивы, подходящие для определения характеристик связывающей молекулы, известны из уровня техники и/или коммерчески доступны (патенты США №№ 6849425; 6632926; 6294391; 6143574). Кроме того, коммерчески доступно оборудование и программное обеспечение, предназначенные для таких кинетических анализов (например, приборы Biacore® A100 и Biacore® 2000; Biacore International AB, Уппсала, Швеция).
В одном варианте осуществления связывающие молекулы, включающие в себя антигенсвязывающие фрагменты или их варианты, могут быть описаны или определены с точки зрения их аффинности связывания в отношении вируса гриппа А, вируса гриппа В или их комбинации. Обычно антитела с высокой аффинностью характеризуются Kd менее 10-7 M. В одном варианте осуществления связывающая молекула или ее антигенсвязывающие фрагменты связывают вирус гриппа А, вирус гриппа В, их фрагменты или варианты, или их комбинацию с константой диссоциации или Kd, меньшей или равной 5×10-7 M, 10-7 M, 5×10-8 M, 10-8 M, 5×10-9 M, 10-9 M, 5×10-10 M, 10-10 M, 5×10-11 M, 10-11 M, 5×10-12 M, 10-12 M, 5×10-13 M, 10-13 M, 5×10-14 M, 10-14 M, 5×10-15 M или 10-15 M. В более конкретном варианте осуществления связывающая молекула или ее антигенсвязывающие фрагменты связывают вирус гриппа А, вирус гриппа В, их фрагменты или варианты, или их комбинации с константой диссоциации или Kd, меньшей или равной 5×10-10 M, 10-10 M, 5×10-11 M, 10-11 M, 5×10-12 M или 10-12 M. Настоящее изобретение охватывает связывающие молекулы или их антигенсвязывающие фрагменты, которые связывают вирус гриппа А, вирус гриппа В или их комбинацию с константой диссоциации или Kd, которая находится в диапазоне между любыми из отдельных упомянутых значений.
В другом варианте осуществления связывающая молекула или ее антигенсвязывающие фрагменты связывают вирус гриппа А, вирус гриппа В, их фрагменты или варианты, или их комбинации со скоростью диссоциации (koff), меньшей или равной 5×10-2 с-1, 10-2 с-1, 5×10-3 с-1 или 10-3 с-1, 5×10-4 с-1, 10-4 с-1, 5×10-5 с-1, или 10-5 с-1, 5×10-6 с-1, 10-6 с-1, 5×10-7 с-1 или 10-7 с-1. В более конкретном варианте осуществления связывающая молекула или ее антигенсвязывающие фрагменты связывают полипептиды вируса гриппа или их фрагменты или варианты со скоростью диссоциации (koff), меньшей или равной 5×10-4 с-1, 10-4 с-1, 5×10-5 с-1, или 10-5 с-1, 5×10-6 с-1, 10-6 с-1, 5×10-7 с-1 или 10-7 с-1. Настоящее изобретение также охватывает связывающие молекулы или их антигенсвязывающие фрагменты, которые связывают вирус гриппа А, вирус гриппа В или их комбинации со скоростью диссоциации (koff), которая находится в диапазоне между любыми из отдельных упомянутых значений.
В другом варианте осуществления связывающая молекула или ее антигенсвязывающий фрагмент связывают вирус гриппа А, вирус гриппа В, их фрагменты или варианты, или их комбинации со скоростью прямой реакции (kon), большей или равной 103 M-1 с-1, 5×103 M-1 с-1, 104 M-1 с-1, 5×104 M-1 с-1, 105 M-1 с-1, 5×105 M-1 с-1, 106 M-1 с-1, 5×106 M-1 с-1, 107 M-1 с-1 или 5×107 M-1 с-1. В более конкретном варианте осуществления связывающая молекула или ее антигенсвязывающие фрагменты связывают вирус гриппа А, вирус гриппа В, их фрагменты или варианты, или их комбинации со скоростью прямой реакции (kon), большей или равной 105 M-1 с-1, 5×105 M-1 с-1, 106 M-1 с-1, 5×106 M-1 с-1, 107 M-1 с-1 или 5×107 M-1 с-1. Настоящее изобретение охватывает антитела, которые связывают вирус гриппа А, вирус гриппа В или их комбинации со скоростью прямой реакции (kon), которая находится в диапазоне между любыми из отдельных упомянутых значений.
В одном варианте осуществления анализ связывания можно проводить или в виде анализа прямого связывания, или в виде анализа конкурентного связывания. Связывание можно выявить с применением стандартных анализов ELISA или стандартных анализов по методу проточной цитометрии. При анализе прямого связывания кандидатную связывающую молекулу или антитело тестируют в отношении связывания с их когнатным антигеном. С другой стороны, при анализе конкурентного связывания оценивают способность кандидатной связывающей молекулы или антитела конкурировать с известным антителом или другим соединением, которое связывается с конкретным антигеном, например НА вируса гриппа А или HA вируса гриппа В. В целом, любой способ, который обеспечивает связывание связывающей молекулы с НА вируса гриппа А и/или НА вируса гриппа В, которые могут быть выявлены, может быть использован для выявления и измерения характеристик связывания связывающих молекул, раскрываемых в данном документе.
В одном варианте осуществления связывающая молекула способна иммуноспецифически связываться с НА вируса гриппа А и/или НА вируса гриппа В, и способна нейтрализовать инфекцию вируса гриппа А и/или вируса гриппа В.
В одном варианте осуществления по меньшей мере один связывающий домен связывающей молекулы способен иммуноспецифически связываться с НА вируса гриппа А, и способен нейтрализовать инфекцию вируса гриппа А. Подтипы гемагглютинина вирусов гриппа A разделяются на две основные филогенетические группировки, идентифицируемые как группа 1, которая включает подтипы H1, H2, H5, H6, H8, H9, H11, H12, H13, H16, Н17 и H18, и группа 2, которая включает подтипы H3, H4, H7, H10, H14 и H15. В одном варианте осуществления по меньшей мере один связывающий домен связывающей молекулы или ее связывающего фрагмента способен связывать и/или нейтрализовать один или несколько подтипов группы 1 вируса гриппа A, выбранных из H1, H2, H5, H6, H8, H9, H11, H12, H13, H16, H17 и H18, а также их вариантов. В другом варианте осуществления по меньшей мере один связывающий домен связывающей молекулы или ее связывающего фрагмента способен связывать и/или нейтрализовать один или несколько подтипов группы 2 вируса гриппа A, выбранных из H3, H4, H7, H10, H14 и H15, а также их вариантов. В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые способны иммуноспецифически связываться с подтипом H9 группы 1 вируса гриппа А. В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые способны иммуноспецифически связывать и нейтрализовать подтип H9 группы 1 вируса гриппа А.
В одном варианте осуществления по меньшей мере один связывающий домен связывающей молекулы способен иммуноспецифически связывать и нейтрализовать по меньшей мере один вирус гриппа В линии Yamagata и по меньшей мере один вирус гриппа В линии Victoria. В другом варианте осуществления по меньшей мере один связывающий домен связывающей молекулы иммуноспецифически связывает и нейтрализует вирус гриппа В как линии Yamagata, так и линии Victoria.
В одном варианте осуществления по меньшей мере один связывающий домен связывающей молекулы или ее антигенсвязывающего фрагмента способен иммуноспецифически связываться с как с НА вируса гриппа А, так и с НА вируса гриппа В, и нейтрализовать как инфекцию вируса гриппа А, так и инфекцию вируса гриппа В. Анализы нейтрализации могут быть выполнены с использованием способов, известных из уровня техники. Термин "50% ингибирующая концентрация" (сокращенно "IC50") представляет собой концентрацию ингибитора (например, связывающей молекулы, описываемой в данном документе), которая требуется для 50% нейтрализации вируса гриппа A и/или вируса гриппа B. Специалисту в данной области техники будет понятно, что более низкое значение IC50 соответствует более эффективному ингибитору.
В одном варианте осуществления связывающая молекула или ее связывающий фрагмент характеризуются IC50 для нейтрализации вируса гриппа А и/или вируса гриппа В в диапазоне от приблизительно 0,001 мкг/мл до приблизительно 5 мкг/мл, или в диапазоне от приблизительно 0,001 мкг/мл до приблизительно 1 мкг/мл антитела, или менее 5 мкг/мл, менее 2 мкг/мл, менее 1 мкг/мл, менее 0,5 мкг/мл, менее 0,1 мкг/мл, менее 0,05 мкг/мл или менее 0,01 мкг/мл в анализе микронейтрализации.
В одном варианте осуществления связывающая молекула или ее связывающий фрагмент имеют первый связывающий домен с IC50 для нейтрализации вируса гриппа А в диапазоне от приблизительно 0,001 мкг/мл до приблизительно 5 мкг/мл, или в диапазоне от приблизительно 0,001 мкг/мл до приблизительно 1 мкг/мл антитела, или менее 5 мкг/мл, менее 2 мкг/мл, менее 1 мкг/мл, менее 0,5 мкг/мл, менее 0,1 мкг/мл, менее 0,05 мкг/мл или менее 0,01 мкг/мл в анализе микронейтрализации. В одном варианте осуществления связывающая молекула или ее связывающий фрагмент имеют второй связывающий домен с IC50 для нейтрализации вируса гриппа В в диапазоне от приблизительно 0,001 мкг/мл до приблизительно 50 мкг/мл, или в диапазоне от приблизительно 0,001 мкг/мл до приблизительно 5 мкг/мл антитела, или в диапазоне от приблизительно 0,001 мкг/мл до приблизительно 1 мкг/мл антитела, или менее 10 мкг/мл, менее 5 мкг/мл, менее 1 мкг/мл, менее 0,5 мкг/мл, менее 0,1 мкг/мл, менее 0,05 мкг/мл или менее 0,01 мкг/мл в анализе микронейтрализации.
В одном варианте осуществления связывающая молекула имеет связывающий домен или его связывающий фрагмент с IC50 для нейтрализации вируса гриппа B в диапазоне от приблизительно 0,001 мкг/мл до приблизительно 5 мкг/мл, или в диапазоне от приблизительно 0,001 мкг/мл до приблизительно 1 мкг/мл антитела, или менее 5 мкг/мл, менее 2 мкг/мл, менее 1 мкг/мл, менее 0,5 мкг/мл, менее 0,1 мкг/мл, менее 0,05 мкг/мл или менее 0,01 мкг/мл в анализе микронейтрализации; и IC50 для нейтрализации вируса гриппа A в диапазоне от приблизительно 0,1 мкг/мл до приблизительно 5 мкг/мл, или в диапазоне от приблизительно 0,1 мкг/мл до приблизительно 2 мкг/мл антитела, или менее 5 мкг/мл, менее 2 мкг/мл, менее 1 мкг/мл или менее 0,5 мкг/мл для нейтрализации вируса гриппа A в анализе микронейтрализации.
В определенных вариантах осуществления связывающие молекулы, описанные в данном документе, могут индуцировать гибель клеток. Антитело, которое "индуцирует гибель клеток", приводит к тому, что жизнеспособная клетка становится нежизнеспособной. Гибель клеток in vitro может быть определена в отсутствие системы комплемента и иммунных эффекторных клеток, чтобы различить гибель клеток, индуцированную антителозависимой клеточноопосредованной цитотоксичностью (ADCC) или комплементзависимой цитотоксичностью (CDC). Таким образом, анализ гибели клеток можно выполнить с применением сыворотки, инактивированной нагреванием (т. е. в отсутствие системы комплемента) и в отсутствие иммунных эффекторных клеток. Чтобы определить, способно ли антитело индуцировать гибель клеток, можно оценить потерю целостности мембран, определяемую с помощью поглощения йодида пропидия (PI), трипанового синего (см., Moore et al. (1995) Cytotechnology 17:1-11), 7AAD или других способов, хорошо известных из уровня техники, по сравнению с необработанными клетками.
В одном варианте осуществления связывающая молекула может индуцировать гибель клеток путем апоптоза. Связывающая молекула, которая "индуцирует апоптоз", представляет собой молекулу, которая индуцирует запрограммированную гибель клетки, определяемую по связыванию аннексина V, фрагментации ДНК, сжатию клеток, расширению эндоплазматической сети, фрагментации клетки и/или образованию мембранных пузырьков (называемых апоптическими тельцами). Для оценки клеточных событий, связанных с апоптозом, доступны различные способы. Например, транслокацию фосфатидилсерина (PS) можно измерить по связыванию аннексина; фрагментацию ДНК можно оценить с помощью электрофоретической картины расщепления ДНК; и конденсацию ядерного хроматина наряду с фрагментацией ДНК можно оценить по какому-либо увеличению количества гиподиплоидных клеток. В одном варианте осуществления антитело, которое индуцирует апоптоз, представляет собой антитело, которое приводит к приблизительно 2-50-кратной, в одном варианте осуществления приблизительно 5-50-кратной и в одном варианте осуществления приблизительно 10-50-кратной индукции связывания аннексина по сравнению с необработанной клеткой в анализе связывания аннексина.
В другом варианте осуществления связывающие молекулы, описанные в данном документе, могут индуцировать гибель клеток посредством антителозависимой клеточной цитотоксичности (ADCC), и/или комплементзависимой клеточноопосредованной цитотоксичности (CDC), и/или антителозависимого клеточноопосредованного фагоцитоза (ADCP). Проявление ADCC-активности и CDC-активности антител подкласса IgG1 человека обычно предусматривает связывание Fc-области антитела с рецептором для антитела (далее в данном документе называемого "FcγR"), присутствующим на поверхности эффекторных клеток, таких как клетки-киллеры, природные клетки-киллеры или активированные макрофаги. Связанными могут быть различные компоненты системы комплемента. В отношении связывания предполагалось, что важными являются несколько аминокислотных остатков в шарнирной области и втором домене C-области (далее называемом "Cγ2-домен") антитела (Greenwood et al. (1993) Eur. J. Immunol. 23(5):1098-104; Morgan et al. (1995) Immunology. 86(2):319-324; Clark, M. (1997) Chemical Immunology. 65:88-110) и что важной также является сахарная цепь в Cγ2-домене (Clark, M. (1997) Chemical Immunology. 65:88-110).
Для оценки ADCC-активности можно использовать анализ ADCC in vitro, такой как описанный в патенте США № 5500362. Анализ также можно проводить с применением коммерчески доступного набора, например CytoTox 96 ® (Promega). Подходящие эффекторные клетки для таких анализов включают в себя без ограничения мононуклеарные клетки периферической крови (PBMC), природные клетки-киллеры (NK) и линии клеток NK. Линии клеток NK, экспрессирующие трансгенный Fc-рецептор (например, CD16) и соответствующий сигнальный полипептид (например, FCεRI-γ), могут также выполнять роль эффекторных клеток (WO 2006/023148). В одном варианте осуществления линия NK-клеток включает в себя CD16 и содержит ген люциферазы под контролем промотора NFAT, и это можно использовать для измерения активации NK-клеток, вместо лизиса клеток или гибели клеток. Подобную технологию реализует Promega, в ней применяются клетки Jurkat вместо NK-клеток (биологический анализ ADCC с репортером № G7010 от Promega). Например, можно определить способность любого конкретного антитела опосредовать лизис с помощью активации системы комплемента и/или ADCC. Клетки, представляющие интерес, выращивают и метят in vitro; связывающую молекулу добавляют к культуре клеток в комбинации с иммунными клетками, которые могут быть активированы комплексами антиген-антитело, т. е. эффекторными клетками, участвующими в ADCC-ответной реакции. Связывающую молекулу также можно исследовать в отношении активации системы комплемента. В любом случае цитолиз выявляют с помощью высвобождения метки из лизированных клеток. Степень лизиса клеток может быть также определена с помощью выявления высвобождения белков цитоплазмы (например, LDH) в надосадочную жидкость. Фактически, антитела можно подвергать скринингу с использованием собственной сыворотки крови пациента в качестве источника системы комплемента и/или иммунных клеток. Связывающие молекулы, которые способны опосредовать ADCC у человека в тесте in vitro, можно затем применять с терапевтической целью у данного конкретного пациента. Также может быть проведена оценка ADCC-активности связывающей молекулы in vivo, например в животной модели, такой как раскрытая в Clynes et al. (1998) Proc. Natl. Acad. Sci. USA 95:652-656. Кроме того, методики для модулирования (т. е. увеличения или уменьшения) уровня ADCC и, необязательно, CDC-активности антитела хорошо известны из уровня техники (например, патенты США №№ 5624821; 6194551; 7317091). Связывающие молекулы, описанные в данном документе, могут быть способны или могли быть модифицированы с получением способности к индуцированию ADCC и/или CDC. Анализы для определения ADCC-функции можно выполнять с использованием человеческих эффекторных клеток для оценки ADCC-функции у человека. Такие анализы могут также включать те, которые направлены на скрининг антител, которые индуцируют, опосредуют, усиливают, блокируют гибель клеток с помощью механизмов некроза и/или апоптоза. Такие способы, включающие анализы, в которых используются прижизненные красители, способы выявления и анализа каспаз, а также анализы, в которых измеряют разрывы ДНК, можно применять для оценки апоптотической активности клеток, культивируемых in vitro с антителом, представляющим интерес.
Полинуклеотиды
Также в данном документе предусмотрены нуклеотидные последовательности, соответствующие аминокислотным последовательностям и кодирующие связывающие молекулы, описанные в данном документе. В одном варианте осуществления настоящее изобретение относится к полинуклеотидам, которые включают в себя нуклеотидную последовательность, кодирующую связывающую молекулу, описанную в данном документе, или ее фрагменты, в том числе например полинуклеотидные последовательности, кодирующие VH- и VL-области, включающие в себя CDR и FR, а также векторы экспрессии для эффективной экспрессии в клетках (например, клетках млекопитающих). Способы получения связывающих молекул с использованием полинуклеотидов известны и кратко описываются ниже.
Также включены полинуклеотиды, которые гибридизуются в жестких условиях гибридизации или в условиях более низкой жесткости, например которые определены в данном документе, с полинуклеотидами, которые кодируют связывающую молекулу, описанную в данном документе, или ее фрагмент. Термин "жесткость", используемый в данном документе, относится к экспериментальным условиям (например, температуре и концентрации солей) эксперимента по гибридизации для обозначения степени гомологии между зондом и связанной на фильтре нуклеиновой кислотой; при этом чем выше жесткость, тем выше процент гомологии между зондом и связанной на фильтре нуклеиновой кислотой.
Жесткие условия гибридизации включают без ограничения гибридизацию со связанной на фильтре ДНК в 6X хлориде натрия/цитрате натрия (SSC) при приблизительно 45°C, за которой следует одна или несколько промывок в 0,2X SSC/0,1% SDS при приблизительно 50-65°C, условия высокой жесткости, такие как гибридизация со связанной на фильтре ДНК в 6X SSC при приблизительно 45°C, за которой следует одна или несколько промывок в 0,1X SSC/0,2% SDS при приблизительно 65°C, или любые другие жесткие условия гибридизации, известные специалисту в данной области техники (см., например, Ausubel et al., eds. (1989) Current Protocols in Molecular Biology, vol. 1, Green Publishing Associates, Inc. и John Wiley and Sons, Inc., NY на страницах 6.3.1-6.3.6 и 2.10.3).
Практически идентичные последовательности включают в себя полиморфные последовательности, т.е. альтернативные последовательности или аллели в популяции. Различие между аллелями может составлять до одной пары оснований. Практически идентичные последовательности могут также включать подвергнутые мутагенезу последовательности, в том числе последовательности, содержащие молчащие мутации. Мутация может включать в себя изменения одного или нескольких остатков, делецию одного или нескольких остатков или вставку одного или нескольких дополнительных остатков.
С помощью любого способа, известного из уровня техники, можно получить полинуклеотиды и можно определить нуклеотидную последовательность полинуклеотидов. Например, если известна нуклеотидная последовательность связывающей молекулы, то полинуклеотид, кодирующий связывающую молекулу, можно собрать из химически синтезированных олигонуклеотидов (например, как описано в Kutmeier et al. (1994) BioTechniques. 17:242), что, вкратце, предусматривает синтез перекрывающихся олигонуклеотидов, содержащих части последовательности, кодирующей связывающую молекулу, отжиг и лигирование этих олигонуклеотидов, а затем амплификацию лигированных олигонуклеотидов с помощью ПЦР.
Полинуклеотид, кодирующий связывающую молекулу, можно также получить из нуклеиновой кислоты, взятой из подходящего источника. Если клон, содержащий нуклеиновую кислоту, которая кодирует конкретную связывающую молекулу, недоступен, а последовательность связывающей молекулы известна, то нуклеиновую кислоту, кодирующую иммуноглобулин, можно химически синтезировать или получить из подходящего источника (например, библиотеки cDNA антител, или библиотеки cDNA, полученной из нее, или нуклеиновой кислоты, в одном варианте осуществления поли(A)+РНК, выделенной из любой ткани или клеток, экспрессирующих антитело, таких как клетки гибридомы, выбранные для экспрессии антитела) с помощью ПЦР-амплификации с применением синтетических праймеров, гибридизируемых с 3'- и 5'-концами последовательности, или с помощью клонирования с применением олигонуклеотидного зонда, специфичного в отношении конкретной последовательности гена, подлежащей идентификации, например клона cDNA из библиотеки cDNA, кодирующего антитело. Амплифицированные нуклеиновые кислоты, полученные с помощью ПЦР, затем можно клонировать в клонирующие векторы, реплицируемые с помощью любого способа, хорошо известного из уровня техники.
Как только нуклеотидная последовательность и соответствующая аминокислотная последовательность связывающей молекулы определены, с этой нуклеотидной последовательностью для связывающей молекулы можно производить манипуляции с помощью хорошо известных из уровня техники способов манипуляции с нуклеотидными последовательностями, например, методик рекомбинантных ДНК, сайт-направленного мутагенеза, ПЦР и т. д. (см. например методики, описанные в Sambrook et al. (1990) Molecular Cloning, A Laboratory Manual, 2d Ed., Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., и Ausubel et al. eds. (1998), Current Protocols in Molecular Biology, John Wiley & Sons, NY), с образованием связывающих молекул, имеющих отличающуюся аминокислотную последовательность, например для того, чтобы произвести замены, делеции и/или вставки аминокислот.
Получение связывающих молекул
Способы использования рекомбинантной ДНК для получения и скрининга полипептидов, таких как связывающие молекулы, описанные в данном документе, являются обычными и хорошо известными из уровня техники (например, из патента США № 4816567). ДНК, кодирующую связывающие молекулы или их фрагменты, например ДНК, кодирующую VH-домен, VL-домен, scFv или их комбинации, можно вставлять в подходящий вектор экспрессии, который затем трансфицируют в подходящую клетку-хозяина, такую как клетки E. coli, клетки COS обезьяны, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые иным путем не продуцируют белок антитела, с целью получения связывающей молекулы.
В одном варианте осуществления вектор экспрессии, содержащий полинуклеотид, который кодирует связывающую молекулу, тяжелую или легкую цепь связывающей молекулы или ее связывающий домен, вариабельный домен тяжелой или легкой цепи связывающего домена или тяжелую или легкую цепь CDR, функционально связанной с промотором. Такие векторы могут содержать нуклеотидную последовательность, кодирующую константную область молекулы антитела (см., например, патенты США №№ 5981216; 5591639; 5658759 и 5122464), а вариабельный домен антитела можно клонировать в такой вектор для экспрессии полной тяжелой, полной легкой цепи или полных как тяжелой, так и легкой цепей.
Вектор экспрессии может быть трансфицирован в клетку-хозяина с помощью обычных методик, и трансфицированные клетки можно культивировать с помощью обычных методик для получения связывающей молекулы. В одном варианте осуществления предусмотрены клетки-хозяева, содержащие полинуклеотид, кодирующий связывающую молекулу или ее фрагменты или их тяжелую или легкую цепь, или их части, или одноцепочечное антитело, функционально связанное с гетерологичным промотором.
Линии клеток млекопитающих, подходящие в качестве хозяев для экспрессии рекомбинантных антител, хорошо известны из уровня техники и включают многие иммортализированные линии клеток, доступные в Американской коллекции типовых культур (ATCC), в том числе без ограничения клетки яичника китайского хомячка (CHO), клетки HeLa, клетки почки новорожденного хомячка (BHK), клетки почки обезьяны (COS), клетки гепатоцеллюлярной карциномы человека (например, Hep G2), клетки почечного эпителия человека 293 и ряд других линий клеток. Различные клетки-хозяева имеют характерные и специфические механизмы посттрансляционного процессинга и модификаций белков, а также продуктов генов. Подходящие линии клеток или системы-хозяева можно выбрать для того, чтобы обеспечить правильную модификацию и процессинг экспрессируемого антитела или его части. В связи с этим можно использовать эукариотические клетки-хозяева, которые обладают клеточным аппаратом для надлежащего процессинга первичного транскрипта, гликозилирования и фосфорилирования продукта гена. Такие клетки-хозяева млекопитающих включают без ограничения клетки CHO, VERY, BHK, HeLa, COS, MDCK, 293, 3T3, W138, BT483, Hs578T, HTB2, BT2O и T47D, NS0 (линия клеток мышиной миеломы, которая не продуцирует эндогенно каких-либо функциональных цепей иммуноглобулинов), SP20, CRL7O3O и HsS78Bst. Линии клеток человека, разработанные путем иммортализации лимфоцитов человека, можно применять для рекомбинантного получения моноклональных антител. Линию клеток человека PER.C6® (Crucell, Нидерланды) можно использовать для рекомбинантного получения моноклональных антител.
Дополнительные линии клеток, которые можно применять в качестве хозяев для экспрессии рекомбинантных антител, включают без ограничения клетки насекомых (например, Sf21/Sf9, Trichoplusia ni Bti-Tn5b1-4) или клетки дрожжей (например, S. cerevisiae, Pichia, US 7326681 и т. д.), растительные клетки (US 2008/0066200) и куриные клетки (WO 2008/142124).
В одном варианте осуществления связывающая молекула стабильно экспрессируется в линии клеток. Стабильную экспрессию можно применять для длительного высокопродуктивного получения рекомбинантных белков. Для стабильной экспрессии клетки-хозяева можно трансформировать с помощью подходящим образом сконструированного вектора, который включает в себя элементы контроля экспрессии (например, промотор, энхансер, терминаторы транскрипции, участки полиаденилирования и т. д.) и ген селектируемого маркера. После введения чужеродной ДНК обеспечивают рост клеток в течение 1-2 суток на обогащенной среде, а затем их переносят на селективную среду. Селектируемый маркер в рекомбинантной плазмиде придает устойчивость к отбору и позволяет клеткам со стабильно интегрированной плазмидой в их хромосомах расти и образовывать очаги, которые в свою очередь можно клонировать и наращивать с получением линий клеток. Способы получения стабильных линий клеток с высокой продуктивностью хорошо известны из уровня техники, а реактивы обычно являются коммерчески доступными.
В других вариантах осуществления связывающие молекулы транзиентно экспрессируются в линию клеток. Транзиентная трансфекция представляет собой процесс, при котором нуклеиновая кислота, вводимая в клетку, не интегрируется в геномную или хромосомную ДНК такой клетки и сохраняется в клетке как внехромосомный элемент, например как эписома.
Линию клеток, подвергнутую стабильной или транзиентной трансфекции, поддерживают в среде для культивирования и при условиях, хорошо известных из уровня техники, что приводит к экспрессии и продуцированию связывающей молекулы. В определенных вариантах осуществления в основе среды для культивирования клеток млекопитающих лежат коммерчески доступные составы сред, в том числе например DMEM или среды Хэма F12. В других вариантах осуществления среду для культивирования клеток модифицируют с целью поддержки как роста клеток, так и биологической экспрессии белка. Термины "среда для культивирования клеток", "культуральная среда" и "состав среды", используемые в данном документе, относятся к питательному раствору для поддержания, роста, размножения или наращивания клеток в искусственном окружении in vitro вне многоклеточного организма или ткани. Среду для культивирования можно оптимизировать для использования в конкретной культуре клеток, в том числе например ростовую среду для культивирования клеток, которая составлена для стимуляции клеточного роста, или продуктивную среду для культивирования клеток, которая составлена для стимуляции выработки рекомбинантного белка. Термины "питательное вещество", "ингредиент" и "компонент", используемые в данном документе взаимозаменяемо, относятся к составляющим компонентам, которые образуют среду для культивирования клеток.
В одном варианте осуществления линии клеток поддерживают с применением способа периодического культивирования с подпиткой. Термин "способ периодического культивирования с подпиткой", используемый в данном документе, относится к способу, при котором культуру клеток подпитывают дополнительными питательными веществами после начального инкубирования с базальной средой. Например, способ периодического культивирования с подпиткой может включать добавление среды с добавками в соответствии с определенным режимом подпитки в течение определенного периода времени. Таким образом, "подпитываемая культура клеток" относится к культуре клеток, где в сосуд для культивирования изначально добавляют клетки, как правило млекопитающего, и культуральную среду, и дополнительные питательные вещества для культуры подают непрерывно или отдельными шагами в культуру во время культивирования с периодическим сбором или без периодического сбора клеток и/или продукта до завершения культивирования.
Среда для культивирования клеток и питательные вещества, содержащиеся в ней, известны специалисту в данной области техники. В одном варианте осуществления среда для культивирования клеток включает базальную среду и по меньшей мере один гидролизат, например, гидролизат на основе сои, гидролизат на основе дрожжей или комбинацию двух типов гидролизатов, что приводит в результате к модифицированной базальной среде. В другом варианте осуществления дополнительные питательные вещества могут включать в себя только базальную среду, такую как концентрированная базальная среда, или могут включать в себя только гидролизаты или концентрированные гидролизаты. Подходящие базальные среды включают без ограничения среду Игла в модификации Дульбекко (DMEM), DME/F12, минимальную питательную среду (MEM), базальную среду Игла (BME), RPMI 1640, F-10, F-12, минимальную питательную среду α (α-MEM), минимальную питательную среду Глазго (G-MEM), PF CHO (см., например, не содержащую белков среду для CHO (Sigma) или не содержащую белков бессывороточную среду для клеток CHO EX-CELL™ 325 PF CHO (SAFC Bioscience)) и среду Дульбекко в модификации Искова. Другие примеры базальных сред, которые можно применять в настоящем изобретении, включают базальную среду BME (Gibco-Invitrogen; см. также Eagle, H (1965) Proc. Soc. Exp. Biol. Med. 89, 36); среду Игла в модификации Дульбекко (DMEM, порошок) (Gibco-Invitrogen (№ 31600); см. также Dulbecco and Freeman (1959) Virology. 8:396; Smith et al. (1960) Virology. 12:185. Tissue Culture Standards Committee, In Vitro 6:2, 93); среду CMRL 1066 (Gibco-Invitrogen (№ 11530); см. также Parker et al (1957) Special Publications, N.Y. Academy of Sciences, 5:303).
Базальная среда может быть бессывороточной, что означает, что среда не содержит сыворотки (например, фетальной бычьей сыворотки (FBS), лошадиной сыворотки, козьей сыворотки или сыворотки, полученной от любого другого животного, известной специалисту в данной области техники), или средой, не содержащей животных белков, или средой с определенным химическим составом.
Базальную среду можно модифицировать с целью удаления определенных компонентов, не являющихся питательными веществами, находящихся в стандартной базальной среде, таких как разнообразные неорганические и органические буферы, поверхностно-активное вещество(-а) и хлорид натрия. Удаление таких компонентов из базальной среды для клеток позволяет повысить концентрацию остальных питательных компонентов и может улучшить общий рост клеток и экспрессию белка. Кроме того, изъятые компоненты можно добавлять обратно в среду для культивирования клеток, содержащую модифицированную базальную среду для клеток в соответствии с требованиями условий культивирования клеток. В определенных вариантах осуществления среда для культивирования клеток содержит модифицированную базальную среду для клеток и по меньшей мере одно из следующих питательных веществ: источника железа, рекомбинантного фактора роста; буфера; поверхностно-активного вещества; регулятора осмолярности; источника энергии и гидролизатов неживотного происхождения. Кроме того, модифицированная базальная среда для клеток может необязательно содержать аминокислоты, витамины или комбинацию как аминокислот, так и витаминов. В другом варианте осуществления модифицированная базальная среда дополнительно содержит глутамин, например L-глутамин и/или метотрексат.
Очистка и выделение
Непосредственно после получения связывающей молекулы ее можно очистить любым способом, известным из уровня техники, для очистки молекулы иммуноглобулина, например с помощью хроматографии (например, ионообменной, аффинной, в частности по аффинности к специфичным антигенам белку A или белку G, и колоночной хроматографией размеров), центрифугирования, дифференциальной растворимости или любой другой стандартной методики очистки белков. Кроме того, антитела по настоящему изобретению или их фрагменты могут быть слиты с гетерологичными полипептидными последовательностями (называемыми в данном документе "меткамиʺ) для облегчения очистки.
В одном варианте осуществления предусматривается практически очищенная/выделенная связывающая молекула. В одном варианте осуществления эти выделенные/очищенные рекомбинантно экспрессируемые связывающие молекулы можно вводить пациенту с тем, чтобы опосредовать профилактический или терапевтический эффект. Профилактика представляет собой использование лекарственных препаратов или лечение, разработанное и применяемое для предупреждения возникновения заболевания, нарушения или инфекции. Терапевтическое средство связано определенным образом с лечением конкретного заболевания, нарушения или инфекции. Терапевтическая доза представляет собой количество, необходимое для лечения конкретного заболевания, нарушения или инфекции. В другом варианте осуществления эти выделенные/очищенные антитела можно применять для диагностики инфекции вируса гриппа, например инфекции вируса гриппа А, инфекции вируса гриппа В или их комбинаций.
Гликозилирование
В дополнение к способности гликозилирования изменять эффекторную функцию антител, модифицированное гликозилирование в вариабельной области способно изменять аффинность антитела к антигену. В одном варианте осуществления профиль гликозилирования в вариабельной области антител по настоящему изобретению является модифицированным. Например, можно создать негликозилированное антитело (т. е. антитело, у которого отсутствует гликозилирование). Гликозилирование можно изменить, например с тем, чтобы повысить аффинность антитела к антигену. Таких углеводных модификаций можно достичь с помощью, например, изменения одного или нескольких участков гликозилирования в пределах последовательности антитела. Например, можно осуществить одну или несколько аминокислотных замен, что приводит к удалению одного или нескольких участков гликозилирования из каркаса вариабельной области, с устранением таким образом гликозилирования в данном участке. Такое гликозилирование может повышать аффинность антитела к антигену. Такой подход более подробно описан в патентах США №№ 5714350 и 6350861. Также могут быть получены одна или несколько аминокислотных замен, результатом чего является удаление участка гликозилирования, присутствующего в Fc-области (например, аспарагина 297 IgG). Более того, негликозилированные антитела можно получать в бактериальных клетках, которые не имеют необходимого аппарата гликозилирования.
Варианты и конъюгаты
В одном варианте осуществления связывающая молекула включает в себя один или несколько связывающих доменов, которые включают в себя один или несколько аминокислотных остатков и/или полипептидных замен, добавлений и/или делеций в вариабельном домене легкой цепи (VL) и/или вариабельном домене тяжелой цепи (VH), и/или Fc-области, и посттрансляционных модификаций. В одном варианте осуществления связывающая молекула включает в себя одну или несколько консервативных аминокислотных замен. Консервативные аминокислотные замены могут быть выполнены на основе сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы включенных остатков. Например, неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; полярные нейтральные аминокислоты включают глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин; положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин; и отрицательно заряженные (кислые) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту. Кроме того, глицин и пролин являются остатками, которые могут влиять на ориентацию цепи. Неконсервативные замены повлекут за собой замену члена одного из этих классов членом другого класса. Более того, если требуется, неклассические аминокислоты или химические аналоги аминокислот могут быть введены в последовательность антитела в виде замены или добавления. Неклассические аминокислоты включают без ограничения D-изомеры стандартных аминокислот, α-аминоизомасляную кислоту, 4-аминомасляную кислоту, Abu, 2-аминомасляную кислоту, γ-Abu, ε-Ahx, 6-аминогексановую кислоту, Aib, 2-аминоизомасляную кислоту, 3-аминопропионовую кислоту, орнитин, норлейцин, норвалин, гидроксипролин, саркозин, цитруллин, цистеиновую кислоту, трет-бутилглицин, трет-бутилаланин, фенилглицин, циклогексилаланин, β-аланин, фторсодержащие аминокислоты, сконструированные аминокислоты, такие как β-метиламинокислоты, Cα-метиламинокислоты, Nα-метиламинокислоты и, как правило, аналоги аминокислот.
В одном варианте осуществления один или несколько цистеиновых остатков могут быть замещены, обычно серином, с целью улучшения устойчивости молекулы к окислению и для предупреждения аберрантного перекрестного связывания. Наоборот, цистеиновая связь(-и) может быть добавлена(-ы) к антителу для улучшения его стабильности (особенно если антитело представляет собой фрагмент антитела, такой как Fv-фрагмент).
В одном варианте осуществления одну или несколько мутаций вводят в одну или несколько каркасных областей молекулы антитела. В другом варианте осуществления одну или несколько мутаций вводят в одну или несколько CDR-областей молекулы антитела.
В одном варианте осуществления связывающая молекула конъюгируется или ковалентно присоединяется к гетерологичной аминокислотной последовательности или другому фрагменту или веществу с использованием способов, известных из уровня техники. В одном варианте осуществления присоединенное вещество представляет собой терапевтическое средство, детектируемую метку (также называемую в данном документе репортерной молекулой) или твердую подложку. Подходящие вещества для присоединения к антителу включают без ограничения аминокислоту, пептид, белок, полисахарид, нуклеозид, нуклеотид, олигонуклеотид, нуклеиновую кислоту, гаптен, лекарственное средство, гормон, липид, набор липидов, синтетический полимер, полимерную микрочастицу, биологическую клетку, вирус, флуорофор, хромофор, краситель, токсин, фермент, антитело, фрагмент антитела, радиоактивный изотоп, твердые матрицы, полутвердые матрицы и их комбинации. Известны способы конъюгации или ковалентного присоединения другого вещества к антителу.
В одном варианте осуществления связывающая молекула конъюгируется с твердой подложкой. Связывающие молекулы могут быть конъюгированы с твердой подложкой в качестве части процесса скрининга, и/или очистки, и/или получения. Как альтернатива, связывающие молекулы могут быть конъюгированы с твердой подложкой в качестве части способа диагностики или композиции. Как правило, твердая подложка является практически нерастворимой в жидких фазах. Специалисту в данной области техники доступно и известно большое число подложек.
В одном варианте осуществления связывающая молекула конъюгируется с меткой с целью диагностики и других анализов, где связывающие молекулы и/или их соответствующий лиганд могут быть выявлены. Метка включает в себя собой любой химический компонент, органический или неорганический, который характеризуется максимумом поглощения при длинах волн более 280 нм и сохраняет свои спектральные свойства при ковалентном присоединении к связывающей молекуле. Метки включают без ограничения хромофор, флуорофор, флуоресцентный белок, фосфоресцентный краситель, тандемный краситель, частицу, гаптен, фермент и радиоактивный изотоп.
В определенных вариантах осуществления меткой является фермент. Ферменты могут представлять собой требуемые метки, поскольку можно получить усиление поддающегося выявлению сигнала, приводящее к повышению чувствительности анализов. Сам фермент не вызывает поддающейся выявлению ответной реакции, а действует путем разрушения субстрата, когда он вступает в контакт с соответствующим субстратом, так что превращаемый субстрат испускает флуоресцентный, колориметрический или люминесцентный сигналы. Ферменты усиливают поддающийся выявлению сигнал, поскольку один фермент в реактиве для мечения может приводить к превращению нескольких субстратов в поддающийся выявлению сигнал. Субстрат для фермента выбирают так, чтобы получить предпочтительный поддающийся измерению продукт, например, колориметрический, флуоресцентный или хемилюминесцентный. Такие субстраты широко применяются в данной области техники и хорошо известны специалисту в данной области техники.
В другом варианте осуществления меткой является гаптен, такой как биотин. Биотин является подходящим, поскольку он может функционировать в ферментной системе с дополнительным усилением детектируемого сигнала, и он может выполнять функцию в качестве маркера для использования в аффинной хроматографии для целей выделения. В целях выявления используют конъюгат фермента, который характеризуется аффинностью к биотину, такому как авидин-HRP. Затем добавляют субстрат для пероксидазы с целью получения поддающегося выявлению сигнала. Гаптены также включают в себя гормоны, встречающиеся в природе и синтетические лекарственные средства, загрязнители, аллергены, эффекторные молекулы, факторы роста, хемокины, цитокины, лимфокины, аминокислоты, пептиды, промежуточные химические соединения, нуклеотиды и т. п.
В определенных вариантах осуществления флуоресцентные белки могут быть использованы в качестве метки. Примеры флуоресцентных белков включают зеленый флуоресцентный белок (GFP) и фикобилипротеины и их производные.
В определенных вариантах осуществления меткой является радиоактивный изотоп. Примеры подходящих радиоактивных материалов включают без ограничения йод (121I, 123I, 125I, 131I), углерод (14C), серу (35S), тритий (3H), индий (111In, 112In, 113mIn, 115mIn), технеций (99Tc, 99mTc), таллий (201Ti), галлий (68Ga, 67Ga), палладий (103Pd), молибден (99Mo), ксенон (135Xe), fluorine (18F), 153Sm, 177Lu, 159Gd, 149Pm, 140La, 175Yb, 166Ho, 90Y, 47Sc, 186Re, 188Re, 142Pr, 105Rh и 97Ru.
Способы медицинского лечения и пути применения
Связывающие молекулы и их антигенсвязывающие фрагменты, описанные в данном документе, могут быть использованы для лечения инфекции вируса гриппа А и/или инфекции вируса гриппа В, для предупреждения инфекции вируса гриппа А и/или инфекции вируса гриппа В; для выявления, диагноза и/или прогноза инфекции вируса гриппа А и/или инфекции вируса гриппа В или их комбинаций.
Способы диагностики могут предусматривать приведение связывающей молекулы или ее фрагмента в контакт с образцом. Такими образцами могут быть образцы тканей, полученные, например, из носовых ходов, околоносовых пазух, слюнных желез, легкого, печени, поджелудочной железы, почки, уха, глаза, плаценты, пищеварительного канала, сердца, яичников, гипофиза, надпочечников, щитовидной железы, головного мозга или кожи. Способы выявления, диагностики и/или прогнозирования могут также включать выявление комплекса антиген/антитело.
В одном варианте осуществления предусматривается способ лечения субъекта, который включает введение субъекту эффективного количества связывающей молекулы или ее связывающего фрагмента, или фармацевтической композиции, которая включает в себя связывающую молекулу или ее связывающий фрагмент. В одном варианте осуществления связывающая молекула или ее связывающий фрагмент являются фактически очищенными (т. е. практически не содержащими соединений, которые ограничивают их эффект или вызывают нежелательные побочные эффекты). В одном варианте осуществления связывающую молекулу или ее связывающий фрагмент вводят после воздействия, или после того, как субъект подвергался воздействию вируса гриппа А и/или вируса гриппа В или был инфицирован вирусом гриппа А и/или вирусом гриппа В. В другом варианте осуществления связывающую молекулу или ее связывающий фрагмент вводят до воздействия, или субъекту, который еще не подвергался воздействию вируса гриппа А и/или вируса гриппа В или еще не был инфицирован вирусом гриппа А и/или вирусом гриппа В.
В одном варианте осуществления связывающую молекулу или ее связывающий фрагмент вводят субъекту, который является серонегативным в отношении одного или нескольких подтипов вируса гриппа А и/или штаммов вируса гриппа В. В другом варианте осуществления связывающую молекулу или ее антигенсвязывающий фрагмент вводят субъекту, который является серопозитивным в отношении одного или нескольких подтипов вируса гриппа А и/или штаммов вируса гриппа В. В одном варианте осуществления связывающую молекулу или ее связывающий фрагмент вводят субъекту в пределах периода времени 1, 2, 3, 4, 5 суток после проявления инфекции или симптома. В другом варианте осуществления связывающую молекулу или ее связывающий фрагмент вводят субъекту через 1, 2, 3, 4, 5, 6 или 7 дней, или в пределах периода времени 2, 3, 4, 5, 6, 7, 8, 9 или 10 суток после проявления инфекции или симптома.
В одном варианте осуществления с помощью способа ослабляют инфекцию вируса гриппа А и/или вируса гриппа В у субъекта. В другом варианте осуществления с помощью способа предупреждают инфекцию, вызванную вирусом гриппа A и/или вирусом гриппа B, снижают риск ее развития или замедляют ее развитие у субъекта. В одном варианте осуществления субъектом является животное. В одном варианте осуществления субъект является представителем подтипа хордовых, включающего в себя, например, людей и других приматов, в том числе отличных от человека приматов, таких как шимпанзе, и других видов человекообразных обезьян и прочих обезьян. В другом варианте осуществления субъектом является сельскохозяйственное животное, такое как крупный рогатый скот, овцы, свиньи, козы и лошади; домашнее млекопитающее, такое как собаки и кошки; лабораторные животные, в том числе грызуны, такие как мыши, крысы и морские свинки; птицы, в том числе домашние, дикие и пернатая дичь, такие как куры, индейки и другие куриные, утки, гуси. В одном варианте осуществления субъект предусматривает без ограничения субъекта, который особенно подвержен риску развития инфекции, вызванной вирусом гриппа А и/или вирусом гриппа В, или восприимчив к ней, в том числе например субъекта с ослабленным иммунитетом.
Лечение может проходить по схеме введения однократной дозы или по схеме введения многократных доз, и связывающую молекулу или ее антигенсвязывающий фрагмент можно применять при пассивной иммунизации или активной вакцинации.
В одном варианте осуществления связывающую молекулу или ее связывающий фрагмент вводят субъекту в комбинации с одним или несколькими противовирусными лекарственными препаратами. В одном варианте осуществления связывающую молекулу или ее связывающий фрагмент вводят субъекту в комбинации с одним или несколькими низкомолекулярными противовирусными препаратами, в том числе без ограничения с ингибиторами нейраминидазы, такими как осельтамивир (TAMIFLU®), занамивир (RELENZA®) и адамантаны, такие как амантадин и римантадин.
В другом варианте осуществления предусматривается композиция для применения в качестве лекарственного средства для предупреждения или лечения инфекции вируса гриппа А и/или вируса гриппа В. В другом варианте осуществления связывающую молекулу или ее связывающий фрагмент, и/или белок с эпитопом, с которым связывается связывающая молекула или ее антигенсвязывающий фрагмент, используют в изготовлении лекарственного средства для лечения субъекта и/или диагностики у субъекта.
Связывающие молекулы и их фрагменты, описанные в данном документе, можно также применять в наборе для диагностики инфекции, вызванной вирусом гриппа А; инфекции, вызванной вирусом гриппа В, или их комбинаций. Связывающие молекулы, фрагмент антитела или их варианты и производные, описанные в данном документе, можно также применять в наборе для мониторинга иммуногенности вакцин.
В одном варианте осуществления предусматривается способ получения фармацевтической композиции, который включает стадию смешивания связывающей молекулы, описанной в данном документе, с одним или несколькими фармацевтически приемлемыми носителями.
Для введения связывающей молекулы или ее связывающего фрагмента, описанных в данном документе, известны и могут применяться различные системы доставки, в том числе без ограничения инкапсулирование в липосомы, микрочастицы, микрокапсулы, рекомбинантные клетки, способные к экспрессии связывающей молекулы или фрагмента, эндоцитоз, опосредованный рецепторами, электропорация, конструирование нуклеиновой кислоты как части ретровирусного или другого вектора и т. д. Способы введения включают без ограничения внутрикожные, внутримышечные, внутрибрюшинные, внутривенные, подкожные, интраназальные, эпидуральные и пероральные пути. В одном варианте осуществления связывающая молекула может быть введена в виде плазмиды с ДНК или РНК, кодирующей связывающую молекулу, например с помощью электропорации. Композиции могут быть введены вместе с другими биологически активными средствами, включающими в себя без ограничения низкомолекулярные противовирусные композиции. Введение может быть системным или местным. Также можно применять введение пульмональным способом, например путем применения ингалятора или распылителя и состава с аэрозольным средством. В еще одном варианте осуществления композиция может доставляться в системе с контролируемым высвобождением.
Также в данном документе предусмотрены фармацевтические композиции, которые включают в себя терапевтически эффективное количество связывающей молекулы или ее связывающего фрагмента и фармацевтически приемлемый носитель. Термин "фармацевтически приемлемый", используемый в данном документе, означает одобренный регулирующим ведомством федерального правительства или правительства штата или указанный в Фармакопее США или другой общепризнанной фармакопее как применяемый у животных, и более конкретно у людей. Термин "носитель" относится к разбавителю, вспомогательному веществу, наполнителю или основе, с которыми вводят терапевтическое средство. Такие фармацевтические носители могут быть стерильными жидкостями, такими как вода и масла, в том числе нефтяного, животного, растительного или синтетического происхождения, такими как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т. п. Вода является предпочтительным носителем, если фармацевтическую композицию вводят внутривенно. Солевые растворы и водные растворы декстрозы и глицерина также можно использовать в качестве жидких носителей, в частности для растворов для инъекций. Подходящие фармацевтические вспомогательные вещества включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропиленгликоль, воду, этанол и т. п. Композиция, если требуется, также может содержать незначительные количества смачивающих или эмульгирующих веществ или рН-буферных средств. Эти композиции могут иметь форму растворов, суспензий, эмульсии, таблеток, пилюль, капсул, порошков, составов с замедленным высвобождением и т. п. Композицию также можно составлять в виде суппозитория с традиционными связывающими средствами и носителями, такими как триглицериды. Состав для перорального применения может включать в себя стандартные носители, такие как фармацевтической степени чистоты маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния и т. д. В одном варианте осуществления фармацевтическая композиция содержит терапевтически эффективное количество антитела или его антигенсвязывающего фрагмента, предпочтительно в очищенной форме, вместе с подходящим количеством носителя, чтобы обеспечить придание формы для надлежащего введения пациенту. Состав должен соответствовать способу введения. Обычно для терапевтических средств на основе антител доза, вводимая пациенту, составляет от приблизительно 0,1 мг/кг до 100 мг/кг веса тела пациента.
Наборы
В одном варианте осуществления предусмотрены готовые изделия, которые включают в себя по меньшей мере связывающую молекулу, как описано в данном документе, например стерильные дозированные формы и наборы. Могут быть предусмотрены наборы, которые содержат связывающие молекулы для выявления и количественного определения вируса гриппа in vitro, например в ELISA или вестерн-блоттинге. Связывающие молекулы, пригодные для выявления, можно обеспечить меткой, такой как флуоресцентная или радиоизотопная метка.
Типичные варианты осуществления
1. Выделенная связывающая молекула, которая специфически связывается с вирусом гриппа А и вирусом гриппа В, содержащая:
(a) первый связывающий домен, который способен связываться с гемагглютинином (НА) вируса гриппа А и нейтрализовать по меньшей мере один подтип группы 1 и по меньшей мере 1 подтип группы 2 вируса гриппа А; и
(b) второй связывающий домен, который способен связываться с гемагглютинином (НА) вируса гриппа В и нейтрализовать вирус гриппа В по меньшей мере из двух филогенетически различных линий.
2. Выделенная связывающая молекула по пункту 1, где первый связывающий домен способен нейтрализовать один или несколько подтипов группы 1 вируса гриппа А, выбранных из H1, H2, H5, H6, H8, H9, H11, H12, H13, H16, H17, H18 и их вариантов; и один или нескольких подтипов группы 2 вируса гриппа A, выбранных из H3, H4, H7, H10, H14 и H15 и их вариантов.
3. Выделенная связывающая молекула по пункту 1, где второй связывающий домен способен нейтрализовать вирус гриппа В обеих линий Yamagata и Victoria.
4. Связывающая молекула по любому из предыдущих пунктов, где первый связывающий домен содержит антитело к вирусу гриппа А или его антигенсвязывающий фрагмент.
5. Связывающая молекула по любому из предыдущих пунктов, где второй связывающий домен содержит антитело к вирусу гриппа В или его антигенсвязывающий фрагмент.
6. Связывающая молекула по любому из предыдущих пунктов, содержащая по меньшей мере одну VH тяжелой цепи антитела и по меньшей мере одну VL легкой цепи антитела.
7. Связывающая молекула по любому из предыдущих пунктов, где первый связывающий домен содержит по меньшей мере одну VH тяжелой цепи антитела и по меньшей мере одну VL легкой цепи антитела.
8. Связывающая молекула по любому из предыдущих пунктов, где второй связывающий домен содержит по меньшей мере одну VH тяжелой цепи антитела и по меньшей мере одну VL легкой цепи антитела.
9. Выделенная связывающая молекула по любому из предыдущих пунктов, где первый связывающий домен предусматривает набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, при этом набор из шести CDR характеризуется аминокислотной последовательностью, выбранной из:
(a) аминокислотной последовательности, которая по меньшей мере на 75% идентична HCDR1 под SEQ ID NO: 8, HCDR2 под SEQ ID NO: 9, HCDR3 под SEQ ID NO: 10, LCDR1 под SEQ ID NO: 3, LCDR2 под SEQ ID NO: 4 и LCDR3 под SEQ ID NO: 5;
(b) аминокислотной последовательности HCDR1 под SEQ ID NO: 8, HCDR2 под SEQ ID NO: 9, HCDR3 под SEQ ID NO: 10, LCDR1 под SEQ ID NO: 3, LCDR2 под SEQ ID NO: 4 и LCDR3 под SEQ ID NO: 5;
(c) аминокислотной последовательности, которая по меньшей мере на 75% идентична HCDR1 под SEQ ID NO: 18, HCDR2 под SEQ ID NO: 19, HCDR3 под SEQ ID NO: 20, LCDR1 под SEQ ID NO: 13, LCDR2 под SEQ ID NO: 14, LCDR3 под SEQ ID NO: 15; и
(d) аминокислотной последовательности HCDR1 под SEQ ID NO: 18, HCDR2 под SEQ ID NO: 19, HCDR3 под SEQ ID NO: 20, LCDR1 под SEQ ID NO: 13, LCDR2 под SEQ ID NO: 14, LCDR3 под SEQ ID NO: 15.
10. Выделенная связывающая молекула по любому из предыдущих пунктов, где первый связывающий домен содержит VH, имеющую аминокислотную последовательность, которая по меньшей мере на 75% идентична аминокислотной последовательности VH, выбранной из:
(a) VH под SEQ ID NO: 7 и
(b) VH под SEQ ID NO: 17.
11. Выделенная связывающая молекула по любому из предыдущих пунктов, где первый связывающий домен содержит VL, имеющую аминокислотную последовательность, которая по меньшей мере на 75% идентична аминокислотной последовательности VL, выбранной из:
(a) VL под SEQ ID NO: 2 и
(b) VL под SEQ ID NO: 12.
12. Выделенная связывающая молекула по любому из предыдущих пунктов, где первый связывающий домен содержит VH и VL, которые по меньшей мере на 75% идентичны аминокислотной последовательности соответственно VH и VL, выбранных из:
(a) VH под SEQ ID NO: 7 и VL под SEQ ID NO: 2; и
(b) VH под SEQ ID NO: 17 и VL под SEQ ID NO: 12.
13. Выделенная связывающая молекула по любому из предыдущих пунктов, где первый связывающий домен содержит VH и VL, выбранные из:
(a) VH под SEQ ID NO: 7 и VL под SEQ ID NO: 2; и
(b) VH под SEQ ID NO: 17 и VL под SEQ ID NO: 12.
14. Выделенная связывающая молекула по любому из предыдущих пунктов, где второй связывающий домен предусматривает набор из шести CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, при этом набор из шести CDR характеризуется аминокислотной последовательностью, выбранной из:
(a) аминокислотной последовательности, которая по меньшей мере на 75% идентична HCDR1 под SEQ ID NO: 28, HCDR2 под SEQ ID NO: 29, HCDR3 под SEQ ID NO: 30, LCDR1 под SEQ ID NO: 23, LCDR2 под SEQ ID NO: 24 и LCDR3 под SEQ ID NO: 25;
(b) аминокислотной последовательности HCDR1 под SEQ ID NO: 28, HCDR2 под SEQ ID NO: 29, HCDR3 под SEQ ID NO: 30, LCDR1 под SEQ ID NO: 23, LCDR2 под SEQ ID NO: 24 и LCDR3 под SEQ ID NO: 25;
(c) аминокислотной последовательности, которая по меньшей мере на 75% идентична аминокислотной последовательности HCDR1 под SEQ ID NO: 44, HCDR2 под SEQ ID NO: 45, HCDR3 под SEQ ID NO: 46, LCDR1 под SEQ ID NO: 39, LCDR2 под SEQ ID NO: 40 и LCDR3 под SEQ ID NO: 41;
(d) аминокислотной последовательности HCDR1 под SEQ ID NO: 44, HCDR2 под SEQ ID NO: 45, HCDR3 под SEQ ID NO: 46, LCDR1 под SEQ ID NO: 39, LCDR2 под SEQ ID NO: 40 и LCDR3 под SEQ ID NO: 41;
(e) аминокислотной последовательности, которая по меньшей мере на 75% идентична HCDR1 под SEQ ID NO: 60, HCDR2 под SEQ ID NO: 61, HCDR3 под SEQ ID NO: 62, LCDR1 под SEQ ID NO: 55, LCDR2 под SEQ ID NO: 56, LCDR3 под SEQ ID NO: 57; и
(f) аминокислотной последовательности HCDR1 под SEQ ID NO: 60, HCDR2 под SEQ ID NO: 61, HCDR3 под SEQ ID NO: 62, LCDR1 под SEQ ID NO: 55, LCDR2 под SEQ ID NO: 56, LCDR3 под SEQ ID NO: 57.
15. Выделенная связывающая молекула по любому из предыдущих пунктов, где второй связывающий домен содержит VH, имеющую аминокислотную последовательность, которая по меньшей мере на 75% идентична аминокислотной последовательности VH, выбранной из:
(a) VH под SEQ ID NO: 27;
(b) VH под SEQ ID NO: 33;
(c) VH под SEQ ID NO: 36;
(d) VH под SEQ ID NO: 43;
(e) VH под SEQ ID NO: 49;
(f) VH под SEQ ID NO: 52;
(g) VH под SEQ ID NO: 59 и
(h) VH под SEQ ID NO: 65.
16. Выделенная связывающая молекула по любому из предыдущих пунктов, где второй связывающий домен содержит VL, имеющую аминокислотную последовательность, которая по меньшей мере на 75% идентична аминокислотной последовательности VL, выбранной из:
(a) VL под SEQ ID NO: 22;
(b) VL под SEQ ID NO: 32;
(c) VL под SEQ ID NO: 35;
(d) VL под SEQ ID NO: 38;
(e) VL под SEQ ID NO: 48;
(f) VL под SEQ ID NO: 51;
(g) VL под SEQ ID NO: 54 и
(h) VL под SEQ ID NO: 64.
17. Выделенная связывающая молекула по любому из предыдущих пунктов, где второй связывающий домен содержит VH и VL, которые по меньшей мере на 75% идентичны аминокислотной последовательности соответственно VH и VL, выбранных из:
(a) VH под SEQ ID NO: 27 и VL под SEQ ID NO: 22;
(b) VH под SEQ ID NO: 33 и VL под SEQ ID NO: 32;
(c) VH под SEQ ID NO: 36 и VL под SEQ ID NO: 35;
(d) VH под SEQ ID NO: 43 и VL под SEQ ID NO: 38;
(e) VH под SEQ ID NO: 49 и VL под SEQ ID NO: 48;
(f) VH под SEQ ID NO: 52 и VL под SEQ ID NO: 51;
(g) VH под SEQ ID NO: 59 и VL под SEQ ID NO: 54 и
(h) VH под SEQ ID NO: 65 и VL под SEQ ID NO: 64.
18. Выделенная связывающая молекула по любому из предыдущих пунктов, где второй связывающий домен содержит VH и VL, выбранные из:
(a) VH под SEQ ID NO: 27 и VL под SEQ ID NO: 22;
(b) VH под SEQ ID NO: 33 и VL под SEQ ID NO: 32;
(c) VH под SEQ ID NO: 36 и VL под SEQ ID NO: 35;
(d) VH под SEQ ID NO: 43 и VL под SEQ ID NO: 38;
(e) VH под SEQ ID NO: 49 и VL под SEQ ID NO: 48;
(f) VH под SEQ ID NO: 52 и VL под SEQ ID NO: 51;
(g) VH под SEQ ID NO: 59 и VL под SEQ ID NO: 54 и
(h) VH под SEQ ID NO: 65 и VL под SEQ ID NO: 64.
19. Связывающая молекула по любому из предыдущих пунктов, содержащая биспецифичное антитело.
20. Связывающая молекула по любому из предыдущих пунктов, где один или несколько связывающих доменов содержат домен вариабельного фрагмента (Fv).
21. Связывающая молекула по любому из предыдущих пунктов, где один или несколько связывающих доменов содержат молекулу scFv.
22. Связывающая молекула по любому из предыдущих пунктов, где один или несколько связывающих доменов содержат Fv-домен, и один или несколько связывающих доменов содержат молекулу scFv.
23. Связывающая молекула по любому из предыдущих пунктов, где первый связывающий домен содержит Fv-домен антитела к вирусу гриппа А.
24. Связывающая молекула по любому из предыдущих пунктов, содержащая две тяжелых цепи антитела и две легких цепи антитела.
25. Связывающая молекула по любому из предыдущих пунктов, содержащая Fv-домен, который содержит вариабельный домен тяжелой цепи антитела и вариабельный домен легкой цепи антитела, где Fv специфически связывает антиген вируса гриппа А.
26. Связывающая молекула по любому из предыдущих пунктов, где второй связывающий домен содержит молекулу scFv антитела к вирусу гриппа В.
27. Связывающая молекула по любому из предыдущих пунктов, где первый связывающий домен содержит Fv-домен антитела к вирусу гриппа А, и второй связывающий домен содержит молекулу scFv антитела к вирусу гриппа В.
28. Связывающая молекула по пункту 27, где Fv-домен первого связывающего домена содержит тяжелую цепь (HC), которая содержит полипептидную цепь, имеющую амино-конец и карбокси-конец, и легкую цепь (LC), которая содержит полипептидную цепь, имеющую амино-конец и карбокси-конец, и при этом
(a) второй связывающий домен ковалентно связан с карбокси-концом HC первого связывающего домена;
(b) второй связывающий домен ковалентно связан с амино-концом HC первого связывающего домена;
(c) второй связывающий домен ковалентно связан с амино-концом LC первого связывающего домена; или
(d) второй связывающий домен встроен посредством ковалентного связывания в полипептидную цепь HC первого связывающего домена.
29. Связывающая молекула по пункту 28, где связывающая молекула содержит антитело или его фрагмент, содержащие легкую цепь антитела, характеризующуюся формулой scFv-L1-VL-CL, где scFv представляет собой молекулу scFv, L1 представляет собой линкер, VL представляет собой вариабельный домен легкой цепи, CL представляет собой константный домен легкой цепи, и VL представляет собой вариабельный домен легкой цепи.
30. Связывающая молекула по пункту 28, где тяжелая цепь характеризуется формулой scFv-L1-VH-CH1-CH2-CH3, где scFv представляет собой молекулу scFv, L1 представляет собой линкер, VH представляет собой вариабельный домен тяжелой цепи, CH1 представляет собой домен-1 константного домена тяжелой цепи, CH2 представляет собой домен-2 константного домена тяжелой цепи, и CH3 представляет собой домен-3 константного домена тяжелой цепи.
31. Связывающая молекула по любому из пунктов 28-30, содержащая вариабельный домен тяжелой цепи (VH) с аминокислотной последовательностью, которая по меньшей мере на 75% идентична аминокислотной последовательности VH-домена, выбранной из SEQ ID NO: 7 и SEQ ID NO: 17.
32. Связывающая молекула по любому из пунктов 28-31, содержащая вариабельный домен легкой цепи (VL) с аминокислотной последовательностью, которая по меньшей мере на 75% идентична аминокислотной последовательности VL-домена, выбранной из SEQ ID NO: 2 и SEQ ID NO: 12.
33. Связывающая молекула по пункту 28, где связывающая молекула содержит первую и вторую тяжелые цепи соответственно с первым и вторым C-концевыми доменами, где одна или несколько молекул scFv ковалентно присоединяются к C-концевому домену первой тяжелой цепи, второй тяжелой цепи или их комбинациям.
34. Связывающая молекула по пункту 28, где одна или несколько тяжелых цепей характеризуются формулой VH-CH1-CH2-CH3, где VH представляет собой вариабельный домен тяжелой цепи, CH1 представляет собой домен-1 константного домена тяжелой цепи, CH2 представляет собой домен-2 константного домена тяжелой цепи, и CH3 представляет собой константный домен-3 тяжелой цепи.
35. Связывающая молекула по пункту 34, где одна или несколько тяжелых цепей характеризуются формулой VH-CH1-L1-scFv-L2-CH2-CH3, где L1 и L2 независимо представляют собой линкер, и scFv представляет собой молекулу scFv.
36. Связывающая молекула по пункту 34, где одна или несколько тяжелых цепей характеризуются формулой VH-CH1-CH2-L1-scFV-L2-CH3, где L1 и L2 независимо представляют собой линкер, и scFv представляет собой молекулу scFv.
37. Связывающая молекула по пункту 34, где одна или несколько тяжелых цепей характеризуются формулой VH-CH1-CH2-CH3-L1-scFV-L2-CH3, где L1 и L2 независимо представляют собой линкер, и scFv представляет собой молекулу scFv.
38. Связывающая молекула по пунктам 35, 36 или пункту 37, где L1 и L2 независимо содержат (a) [GGGGS]n, где n равняется 0, 1, 2, 3, 4 или 5, (b) [GGGG]n, где n равняется 0, 1, 2, 3, 4 или 5, или комбинацию (a) и (b).
39. Связывающая молекула по пунктам 21-38, где scFv характеризуется формулой: VH-LS-VL, и где VH представляет собой вариабельный домен тяжелой цепи, LS представляет собой линкер, и VL представляет собой вариабельный домен легкой цепи.
40. Связывающая молекула по пункту 39, где LS содержит (a) [GGGGS]n, где n равняется 0, 1, 2, 3, 4 или 5, (b) [GGGG]n, где n равняется 0, 1, 2, 3, 4 или 5, или комбинацию (a) и (b).
41. Связывающая молекула по пункту 28, где тяжелая цепь и легкая цепь второго связывающего домена соединяются одной или несколькими дисульфидными связями.
42. Связывающая молекула по пункту 41, где scFv второго связывающего домена содержит вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), и VH из scFv включает в себя цистеиновый остаток в положении, выбранном из положений 43, 44, 100, 101, 105 и их комбинаций, и VL из scFv включает в себя цистеиновый остаток в положении, выбранном из положений 43, 44, 46, 49, 50, 100 и их комбинаций.
43. Связывающая молекула по пункту 42, где VL и VH из scFv связываются дисульфидной связью, выбранной из VL100-VH44, VL43-VH105, VL46-VH101, VL49-VH100, VL50-VH100 и их комбинаций.
44. Связывающая молекула по пункту 42, где VH и VL из scFv связываются дисульфидной связью, выбранной из VH44-VL100, VH100-VL49, VH100-VL50, VH101-VL46, VH105-VL43 и их комбинаций.
45. Связывающая молекула по пункту 39, где VH содержит набор из трех CDR: HCDR1, HCDR2, HCDR3, при этом набор из трех CDR выбран из:
(a) аминокислотной последовательности, которая по меньшей мере на 75% идентична HCDR1 под SEQ ID NO: 28, HCDR2 под SEQ ID NO: 29, HCDR3 под SEQ ID NO: 30;
(b) аминокислотной последовательности HCDR1 под SEQ ID NO: 28, HCDR2 под SEQ ID NO: 29, HCDR3 под SEQ ID NO: 30;
(c) аминокислотной последовательности, которая по меньшей мере на 75% идентична HCDR1 под SEQ ID NO: 44, HCDR2 под SEQ ID NO: 45, HCDR3 под SEQ ID NO: 46;
(d) аминокислотной последовательности HCDR1 под SEQ ID NO: 44, HCDR2 под SEQ ID NO: 45, HCDR3 под SEQ ID NO: 46;
(e) аминокислотной последовательности, которая по меньшей мере на 75% идентична HCDR1 под SEQ ID NO: 60, HCDR2 под SEQ ID NO: 61, HCDR3 под SEQ ID NO: 62; и
(f) аминокислотной последовательности HCDR1 под SEQ ID NO: 60, HCDR2 под SEQ ID NO: 61, HCDR3 под SEQ ID NO: 62.
46. Связывающая молекула по пункту 39, где VL содержит набор из трех CDR: LCDR1, LCDR2, LCDR3, при этом набор из трех CDR выбран из:
(a) аминокислотной последовательности, которая по меньшей мере на 75% идентична LCDR1 под SEQ ID NO: 23, LCDR2 под SEQ ID NO: 24 и LCDR3 под SEQ ID NO: 25;
(b) аминокислотной последовательности LCDR1 под SEQ ID NO: 23, LCDR2 под SEQ ID NO: 24 и LCDR3 под SEQ ID NO: 25;
(c) аминокислотной последовательности, которая по меньшей мере на 75% идентична LCDR1 под SEQ ID NO: 39, LCDR2 под SEQ ID NO: 40 и LCDR3 под SEQ ID NO: 41;
(d) аминокислотной последовательности LCDR1 под SEQ ID NO: 39, LCDR2 под SEQ ID NO: 40 и LCDR3 под SEQ ID NO: 41;
(e) аминокислотной последовательности, которая по меньшей мере на 75% идентична LCDR1 под SEQ ID NO: 55, LCDR2 под SEQ ID NO: 56, LCDR3 под SEQ ID NO: 57; и
(f) аминокислотной последовательности LCDR1 под SEQ ID NO: 55, LCDR2 под SEQ ID NO: 56, LCDR3 под SEQ ID NO: 57.
47. Связывающая молекула по любому из пунктов 21-46, где scFv имеет аминокислотную последовательность, выбранную из SEQ ID NO:31, SEQ ID NO:34, SEQ ID NO:47, SEQ ID NO:50, SEQ ID NO:63.
48. Биспецифичное антитело, которое специфически связывается с вирусом гриппа А и вирусом гриппа В, содержит по меньшей мере одну легкую цепь с аминокислотной последовательностью, которая по меньшей мере на 75% идентична аминокислотной последовательности под SEQ ID NO:66 или SEQ ID NO:68.
49. Биспецифичное антитело по пункту 48, содержащее по меньшей мере одну легкую цепь с аминокислотной последовательностью, содержащей SEQ ID NO:66 или SEQ ID NO:68.
50. Биспецифичное антитело, которое специфически связывается с вирусом гриппа А и вирусом гриппа В, содержит по меньшей мере одну тяжелую цепь с аминокислотной последовательностью, которая по меньшей мере на 75% идентична аминокислотной последовательности под SEQ ID NO:67 или SEQ ID NO:69.
51. Биспецифичное антитело по пункту 50, содержащее по меньшей мере одну тяжелую цепь с аминокислотной последовательностью, содержащей SEQ ID NO:67 или SEQ ID NO:69.
52. Биспецифичное антитело, которое специфически связывается с вирусом гриппа А и вирусом гриппа В, содержит по меньшей мере одну легкую цепь с аминокислотной последовательностью, которая по меньшей мере на 75% идентична аминокислотной последовательности под SEQ ID NO:66 или SEQ ID NO:68, и по меньшей мере одну тяжелую цепь с аминокислотной последовательностью, которая по меньшей мере на 75% идентична аминокислотной последовательности под SEQ ID NO:67 или SEQ ID NO:69.
53. Биспецифичное антитело по пункту 52, содержащее:
(a) по меньшей мере одну легкую цепь с аминокислотной последовательностью, содержащей SEQ ID NO:66, и по меньшей мере одну тяжелую цепь с аминокислотной последовательностью, содержащей SEQ ID NO:67; или
(b) по меньшей мере одну легкую цепь с аминокислотной последовательностью, содержащей SEQ ID NO:68, и по меньшей мере одну тяжелую цепь с аминокислотной последовательностью, содержащей SEQ ID NO:69
54. Клетка, содержащая или продуцирующая связывающую молекулу по любому из пунктов 1-47, биспецифичное антитело или его фрагмент по пунктам 48-53 или любую их комбинацию.
55. Выделенный полинуклеотид, содержащий нуклеиновую кислоту, которая кодирует связывающую молекулу по любому из пунктов 1-47 или биспецифичное антитело или его фрагмент по пунктам 48-53.
56. Вектор, содержащий полинуклеотид по пункту 55.
57. Клетка-хозяин, содержащая полинуклеотид по пункту 55 или вектор по пункту 56.
58. Композиция, содержащая связывающую молекулу по любому из пунктов 1-47, биспецифичное антитело или его фрагмент по пунктам 48-53 и фармацевтически приемлемый носитель.
59. Набор, содержащий композицию по пункту 58.
60. Способ предупреждения или лечения инфекции вируса гриппа А или вируса гриппа В у субъекта при необходимости этого, предусматривающий введение субъекту эффективного количества композиции по пункту 58.
61. Способ получения связывающей молекулы по любому из пунктов 1-47 или биспецифичного антитела или его фрагмента по пунктам 48-53, предусматривающий культивирование клетки-хозяина по пункту 57 в условиях, подходящих для экспрессии связывающей молекулы или биспецифичного антитела или его фрагмента.
62. Способ по пункту 61, дополнительно предусматривающий выделение связывающей молекулы из культуры клетки-хозяина.
63. Связывающая молекула по любому из пунктов 1-47 или биспецифичное антитело или его фрагмент по пунктам 48-53 для применения в профилактике или лечении у субъекта инфекции, представляющей собой грипп А, инфекции, представляющей собой грипп B, или их комбинации.
64. Применение связывающей молекулы по любому из пунктов 1-47 или биспецифичного антитела или его фрагмента по пунктам 48-53 в изготовлении лекарственного средства для профилактики или лечения у субъекта инфекции, представляющей собой грипп А, инфекции, представляющей собой грипп B, или их комбинации.
65. Применение связывающей молекулы по любому из пунктов 1-47 или биспецифичного антитела или его фрагмента по пунктам 48-53 в изготовлении лекарственного средства для профилактики или лечения у субъекта инфекции, представляющей собой грипп А, и инфекции, представляющей собой грипп B.
66. Способ профилактики или лечения у субъекта инфекции, представляющей собой грипп А, инфекции, представляющей собой грипп B, или их комбинации, предусматривающий введение субъекту эффективного количества связывающей молекулы по любому из пунктов 1-47 или биспецифичного антитела или его фрагмента по пунктам 48-53.
67. Способ профилактики или лечения у субъекта инфекции, представляющей собой грипп А, и инфекции, представляющей собой грипп B, предусматривающий введение субъекту эффективного количества связывающей молекулы по любому из пунктов 1-47 или биспецифичного антитела или его фрагмента по пунктам 48-53.
68. Применение связывающей молекулы по любому из пунктов 1-47 или биспецифичного антитела или его фрагмента по пунктам 48-53 для in vitro диагностики у субъекта инфекции, представляющей собой грипп А, инфекции, представляющей собой грипп B, или их комбинации.
Примеры
Пример 1. Получение конструкции биспецифичного антитела
Антитела IgG к НА, которые специфически связывают вирус гриппа А, описаны в предварительных заявках на патенты США №№ 61/885808, поданной 2 октября 2013 г., и 62/002414, поданной 23 мая 2014 г., а антитела IgG к НА, которые специфически связывают вирус гриппа В, описываются в предварительной заявке на патент США № 62/024804, поданной 15 июля 2014 г.. Вкратце, эти антитела являются перекрестно-реагирующими антителами широкого спектра действия, которые распознают вирус гриппа А (FY1 и GL20) и вирус гриппа В (FBD94, FBC39 и FBC39 FTL). Серии биспецифичных (BiS) антител конструировали с использованием VH- и VL-последовательностей гена IgG этих антител. Полученные биспецифичные антитела объединяют комплементарные активности отдельных mAb к НА вируса гриппа A или B с получением одного антитела, такого как молекулы, способные нейтрализовать все штаммы вирусов гриппа A и B.
На фигуре 1 схематически показана ориентация пяти остовов разных BiS. В случае, например, созданных антител Bis-Flu A+B, антитело к Flu A (FY1 или его оптимизированную форму GL20) использовали как IgG, и антитело к Flu B (FBD94, FBC39 или его оптимизированную форму FBC39FTL) использовали как scFv, где scFv вставляли в разные положения вдоль IgG-структуры в разных форматах Bis. Конструкции BiS называли с использованием сокращения двух IgG, из которых происходило антитело Bis, с последующим использованием формата BiS, а затем аминокислотного положения двух цистеиновых остатков, используемых для образования стабилизирующей дисульфидной связи в scFv.
A. FY1/39 BiS2 100/44
Для создания конструкции FY1/39 BiS2 100/44, которая включает в себя легкую цепь FY1/39 Bis2 100/44 (SEQ ID NO:107) и тяжелую цепь FY1/39 Bis2 100/44 (SEQ ID NO:108), использовали следующий способ. Вкратце, вектор, содержащий VH- и VL-последовательности FY1 (вектор pOE-FY1) расщепляли с BssHII/BsiWI с получением ДНК VL FY1 (SEQ ID NO:1). Затем ДНК VL FY1 (SEQ ID NO:1) очищали с помощью геля и клонировали в вектор, содержащий последовательности легкой цепи, scFv и тяжелой цепи (вектор BiS2), который расщепляли с помощью BssHII/BsiWI с образованием вектора FY1 LC-BiS2.
ДНК VH FBC39 scFv-FY1 (SEQ ID NO:111) синтезировали с помощью Geneart и ПЦР-амплифицировали с использованием следующих праймеров, которые содержат последовательности распознавания для BsrGI/Sall на 5'- и 3'-концах.
Прямой праймер: TTCTCTCCACAGGTGTaCActccGACATCCAGATGACCCAGTCTC (SEQ ID NO: 70).
Обратный праймер: gGATGGGCCCTTGGTcGAcGCGCTTGACACGGTGACCATAGTC (SEQ ID NO: 71).
Подтверждали амплификацию ДНК VH FBC39 scFv-FY1 (SEQ ID NO:111) и ДНК очищали с помощью геля.
Затем вектор FY1-LC-BiS2 расщепляли с помощью BsrGI/SalI и полосу вектора очищали с помощью геля. Очищенный вектор FY1-LC-BiS2 внедряли с ПЦР-продуктом FBC39 scFv-VH-FY1 (SEQ ID NO:111) с использованием системы In-Fusion (Clontech®) с образованием конструкции FY1/39 BiS2 100/44. Компетентные клетки Stellar трансформировали с помощью конструкции FY1/39 BiS2 100/44 и колонии секвенировали по корректным последовательностям VL, VH и FBC39 scFv FY1.
B. FY1/39 BiS4 100/44
Аналогичный способ использовали для образования конструкции FY1/39 BiS4 100/44, которая включает в себя легкую цепь FY1/39 Bis4 100/44 (SEQ ID NO: 109) и тяжелую цепь FY1/39 Bis4 100/44 (SEQ ID NO: 110). Вкратце, вектор pOE-FY1-VL расщепляли с помощью BssHII/BsiWI с получением ДНК VL FY1 (SEQ ID NO:1). Затем ДНК VL FY1 (SEQ ID NO:1) очищали с помощью геля и клонировали в вектор, содержащий последовательности легкой цепи, VH, CH1, scFv, CH2 и CH3 (вектор BiS4), которые расщепляли с помощью BssHII/BsiWI с образованием вектора BiS4 FY1-LC.
ДНК FBC39 scFv (SEQ ID NO:112) амплифицировали из ДНК VH FBC39 scFv-FY1 (SEQ ID NO:111), которую синтезировали с помощью Geneart, с использованием следующих праймеров.
Прямой праймер:
CTCTGGCGGAGGGggatccGACATCCAGATGACCCAGTCTC (SEQ ID NO: 72)
Обратный праймер:
GTGAGTTTTGTCggatccCCCTCCGCCAGAGCCACCTCCGCCTGAGGAGACGGTGACCGTGG (SEQ ID NO: 73)
Затем вектор FY1-LC-BiS4 расщепляли с помощью BsrGI/SalI и полосу вектора очищали с помощью геля. Вектор, содержащий последовательности VL и VH FY1 (pOE-FY1), расщепляли с помощью BsrGI/SalI с получением VH FY1 (SEQ ID NO:6).
Вектор FY1-LC-BiS4 (расщепленный с BsrGI/SalI, описанным в строке 5 и 6) затем лигировали с VH FY1 (SEQ ID NO:6) с получением вектора BiS4-FY1, который расщепляли с помощью BamHI и очищали с помощью геля. Затем очищенный вектор BiS4-FY1 внедряли с ПЦР-продуктом FBC39 scFv, полученным выше, с использованием системы In-Fusion (Clontech®) с получением конструкции FY1/39 BiS4 100/44. Компетентные клетки Stellar трансформировали с помощью конструкции FY1/39 BiS4 100/44 и колонии секвенировали по корректным последовательностям VL, VH и FBC39 scFv FY1.
C. FY1/39 BiS1 100/44
Подобный способ использовали для создания конструкции FY1/39 BiS1 100/44, которая включает в себя легкую цепь FY1/39 Bis1 100/44 (SEQ ID NO:113) и тяжелую цепь FY1/39 Bis1 100/44 (SEQ ID NO:114).
VL FY1 амплифицировали из FY1/FBC39 BiS4 100/44 (SEQ ID NO:109), описанного выше, с использованием следующих праймеров.
Прямой праймер BiS1 FY1-VL:
AGGGGGATCCGGCGGAGGGGGCTCTGATATTCAGATGACCCAGAGCCC (SEQ ID NO: 76)
Обратный праймер BiS1 FY1-VL:
TGGTGCAGCCACCGTACGTTTGATCTCCACCTTAGTGCCC (SEQ ID NO: 77)
FBC39 scFv амплифицировали из ДНК VH FBC39 scFv-FY1 (SEQ ID NO:111), которую синтезировали с помощью Geneart, с использованием следующих праймеров.
Прямой праймер BiS1 FBC39:
CTGGCTCCCCGGGGCgcgcTGTGACATCCAGATGACCCAGTCTCC
(SEQ ID NO: 74)
Обратный праймер BiS1 FBC39:
CCCCTCCGCCGGATCCCCCTCCGCCTGAGGAGACGGTGACCGTGGTC
(SEQ ID NO: 75)
ПЦР-полосы FBC39 scFv и FY1-VL очищали с помощью геля.
FY1/FBC39 BiS4 100/44 расщепляли с помощью BsrGI/SalI с получением VH FY1, полосу VH FY1 очищали с помощью геля. VH FY1 (SEQ ID NO:6) лигировали с вектором, содержащим последовательности scFv, LC и HC (вектор BiS1), который также расщепляли с помощью BsrGI/SalI.
Затем полученный вектор FY1 HC BiS1 расщепляли с помощью BssHII/BsiWI, полосу вектора очищали с помощью геля и внедряли с ПЦР-продуктами FBC39 scFv и FY1 VL с использованием системы In-Fusion (Clontech®), с образованием конструкции FY1/39 BiS1 100/44. Компетентные клетки Stellar трансформировали с помощью конструкции FY1/39 BiS1 100/44, и колонии секвенировали по корректным последовательностям VL, VH и FBC39 scFv FY1.
D. FY1/39 BiS3 100/44
Конструкцию FY1/39 BiS3 100/44, содержащую легкую цепь FY1/39 Bis3 100/44 (SEQ ID NO:115) и тяжелую цепь FY1/39 Bis3 100/44 (SEQ ID NO:116), конструировали аналогичным образом.
Для амплификации FBC39 scFv (SEQ ID NO:112) из ДНК VH FBC39 scFv-FY1 (SEQ ID NO:111), которую синтезировали с помощью Geneart, использовали следующие праймеры.
Прямой праймер:
AAAGGCGGAGGGGGATCCGGCGGAGGGGGCTCTGACATCCAGATGACCCAGTCTC (SEQ ID NO: 78)
Обратный праймер:
TCAATGAATTCGCGGCCGCTCATGAGGAGACGGTGACCGTGGTC (SEQ ID NO: 79)
Амплификацию ДНК FBC scFv подтверждали и очищали с помощью геля.
FY1/FBC39 BiS4 100/44 расщепляли с помощью BssHII/SalI с получением LC/VH FY1. Полосу LC/VH FY1 очищали с помощью геля и лигировали с вектором, содержащим последовательности LC, HC и scFv (вектор BiS3), который также расщепляли с помощью BssHII/SalI с образованием вектора FY1 BiS3.
Затем вектор FY1 BiS3 вектор расщепляли с помощью BamHI и очищали с помощью геля. Очищенный вектор FY1 BiS3 внедряли с ПЦР-продуктами FBC39 scFv (SEQ ID NO:112) с использованием системы In-Fusion (Clontech®), с образованием конструкции FY1/39 BiS3 100/44. Компетентные клетки Stellar трансформировали с помощью конструкции FY1/39 BiS3 100/44, и колонии секвенировали по корректным последовательностям VL, VH и FBC39 scFv FY1.
E. FY1/94 BiS2 100/44
FY1/94 BiS2 100/44, который содержит легкую цепь FY1/94 Bis2 100/44 (SEQ ID NO: 117) и тяжелую цепь FY1/94 Bis2 100/44 (SEQ ID NO: 118), конструировали следующим образом.
ДНК FBD94 scFv (SEQ ID NO: 119) синтезировали с помощью Eurofin и амплифицировали для вставки в вектор BiS2 с использованием следующих праймеров.
Прямой праймер:
TTCTCTCCACAGGTGTaCActccGAAATTGTGTTGACACAGTCTC (SEQ ID NO: 80)
Обратный праймер:
CCCCTCCGCCGGATCCCCCTCCGCCTGAGGAGACGGTGACCGTGGTC
(SEQ ID NO: 81)
VH FY1 (SEQ ID NO:6) ПЦР-амплифицировали из FY1/39 BiS4 100/44 (SEQ ID NO:110) с использованием следующих праймеров.
Прямой праймер:
AGGGGGATCCGGCGGAGGGGGCTCTCAGGTCCAGCTGCAGGAGAGC
(SEQ ID NO: 82)
Обратный праймер:
gGATGGGCCCTTGGTcGAcGCGCTTGACACGGTGACCATAGTC (SEQ ID NO: 83)
Амплификацию ПЦР-продуктов, ДНК FBD94 scFv (SEQ ID NO:119) и VH FY1 (SEQ ID NO:6), подтверждали и ПЦР-продукты очищали с помощью геля. Вектор BiS2-FY1-LC линеаризовывали с расщеплением с помощью BsrGI/SalI и внедряли с ДНК FBD94 scFv (SEQ ID NO:119) и VH FY1 (SEQ ID NO:6) с использованием системы In-Fusion (Clontech®). Ориентацию ПЦР-продуктов в векторе контролировали с использованием праймеров, содержащих последовательности, перекрывающиеся с вектором. Компетентные клетки Stellar трансформировали с помощью конструкции FY1/94 BiS2 100/44, и колонии секвенировали по корректным последовательностям VL, VH и FBD94 scFv FY1.
F. FY1/94 BiS4 100/44
FY1/94 BiS4 100/44 конструировали следующим образом:
FBD94 scFv (SEQ ID NO:119) синтезировали с помощью Eurofin и амплифицировали для вставки в вектор, содержащий последовательности легкой цепи, VH, CH1, scFv, CH2 и CH3 (вектор BiS4), с использованием следующих праймеров.
Прямой праймер:
CTCTGGCGGAGGGggatccGAAATTGTGTTGACACAGTCTC
(SEQ ID NO: 84).
Обратный праймер:
GTGAGTTTTGTCggatccCCCTCCGCCAGAGCCACCTCCGCCTGAGGAGACGGTGACCGTGG (SEQ ID NO: 85)
Амплификацию ПЦР-продукта подтверждали, и FBD94 очищали с помощью геля.
Вектор BiS4-FY1 (описанный выше) линеаризовывали с использованием BamHI и внедряли с FBD94 с использованием системы In-Fusion (Clontech®). Компетентные клетки Stellar трансформировали с помощью конструкции FY1/94 BiS4 100/44, и колонии секвенировали по корректным последовательностям VL, VH и FBD94 scFv FY1.
G. FY1/39 BiS4 43/105
FY1/39 BiS4 43/105, который содержит легкую цепь FY1/39 Bis4 43/105 (SEQ ID NO:120) и тяжелую цепь FY1/39 Bis4 43/105 (SEQ ID NO: 121), конструировали следующим образом.
ДНК FBC39-43/105 scFv синтезировали с помощью Eurofin и амплифицировали для вставки в вектор BiS4 с использованием следующих праймеров.
Прямой праймер:
CTCTGGCGGAGGGggatccGACATCCAGATGACCCAGTCTC (SEQ ID NO: 86)
Обратный праймер:
GTGAGTTTTGTCggatccCCCTCCGCCAGAGCCACCTCCGCCTGAGGAGACGGTGACCGTGG (SEQ ID NO: 87)
Амплификацию ПЦР-продукта подтверждали и очищали с помощью геля.
Вектор BiS4-FY1 линеаризовывали с помощью BamHI и внедряли с ДНК FBC39-43/105 scFv (SEQ ID NO:124), полученной выше, с использованием системы In-Fusion (Clontech®). Компетентные клетки Stellar трансформировали с помощью конструкции FY1/39 BiS4 43/105, и колонии секвенировали по корректным последовательностям VL, VH и FBC39-43/105 scFv FY1.
H. GL20/39 BiS4 100/44
GL20/39 BiS4 100/44, который включает в себя тяжелую цепь GL20/39 BiS4 100/44 (SEQ ID NO: 66) и легкую цепь GL20/39 BiS4 100/44 (SEQ ID NO:67), конструировали аналогичным образом.
Вектор, содержащий LC и HC FY-GL20 (pOE-FY1-GL20), расщепляли с помощью BssHII/SalI с получением LC GL20 (VL-CL) и VH (SEQ ID NO:123), которые очищали с помощью геля. Вектор FY1/39 BiS4 100/44 расщепляли с помощью BssHII/SalI и лигировали с LC/VH GL20 (SEQ ID NO:123). Колонии секвенировали по корректным последовательностям GL20 VL, VH и FBC39 scFv.
I. GL20/39 BiS4 43/105
GL20/39 BiS4 43/105, который включает в себя тяжелую цепь GL20/39 BiS4 43/105 (SEQ ID NO:68) и легкую цепь GL20/39 BiS4 43/105 (SEQ ID NO:69), конструировали аналогичным образом. Расщепляли pOE-FY1-GL20 с помощью BssHII/SalI с получением LC/VH GL20 (SEQ ID NO: 123), который очищали с помощью геля. Легкую цепь FY1/39 BiS4 43/105 (SEQ ID NO:120) расщепляли с помощью BssHII/SalI и лигировали с LC/VH GL20 (SEQ ID NO:123). Колонии секвенировали по корректным последовательностям GL20 VL, VH и FBC39-43/105 scFv.
J. GL20/39FTL BiS4 100/44
GL20/39FTL BiS4 100/44 конструировали аналогичным образом.
ДНК FBC39FTL scFv (SEQ ID NO:124) синтезировали с помощью Eurofin и амплифицировали для вставки в вектор BiS4 с использованием следующих праймеров.
Прямой праймер:
CTCTGGCGGAGGGggatccGACATCCAGATGACCCAGTCTC (SEQ ID NO: 88)
Обратный праймер:
GTGAGTTTTGTCggatccCCCTCCGCCAGAGCCACCTCCGCCTGAGGAGACGGTGACCGTGG (SEQ ID NO: 89)
Амплификацию ПЦР-продукта подтверждали, и ДНК FBC39FTL scFv (SEQ ID NO:124) очищали. Вектор GL20/39 BiS4 43/105 линеаризовывали с помощью BamHI и внедряли с ДНК FBC39FTL scFv (SEQ ID NO:124) с использованием системы In-Fusion (Clontech®). Колонии секвенировали по корректным последовательностям GL20 VL, VH и FBC39FTL scFv.
K. GL20/39FTL BiS4 43/105
GL20/39FTL BiS4 43/105, который включает в себя легкую цепь GL20/39FTL BiS4 43/105 (SEQ ID NO:125) и тяжелую цепь GL20/39FTL BiS4 43/105 (SEQ ID NO: 126), конструировали аналогичным образом.
ДНК FBC39FTL43/105 scFv (SEQ ID NO:127) синтезировали с помощью Eurofin и амплифицировали для вставки в вектор BiS4 с использованием следующих праймеров.
Прямой праймер:
CTCTGGCGGAGGGggatccGACATCCAGATGACCCAGTCTC (SEQ ID NO: 90)
Обратный праймер:
GTGAGTTTTGTCggatccCCCTCCGCCAGAGCCACCTCCGCCTGAGGAGACGGTGACCGTGG (SEQ ID NO: 91)
Амплифицированный ПЦР-продукт очищали и внедряли с линеаризованным вектором GL20/39 BiS4 43/105 (расщепленным с помощью BamHI), и колонии секвенировали по корректным последовательностям GL20 VL, VH и FBC39FTL-43/105 scFv.
L. BiS5 GL20-FBC39
FY1GL20VL-Ckappa
DIQMTQSPSSLSASVGDRVTITCRTSQSLSSYTHWYQQKPGKAPKLLIYAASSRGSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:128)
FY1GL20VH - Fc (CH3-) - линкер - FBC39 scFv - линкер - Fc (-CH3)
QVQLQQSGPGLVKPSQTLSLTCAISGDSVSSYNAVWNWIRQSPSRGLEWLGRTYYRSGWYNDYAESVKSRITINPDTSKNQFSLQLNSVTPEDTAVYYCARSGHITVFGVNVDAFDMWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGGGGSGGGGSDIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQANSFPPTFGCGTKLEIKGGGGSGGGGSGGGGSGGGGSEVQLVVSGGGLVKPGGSLRLSCAASGLSFLNAWMSWVRQAPGKCLEWVGRIKSNTDGGTTDYAAPVKGRFSISRDDSKNMLFLHMSSLRTEDTAVYYCATDGPYSDDFRSGYAARYRYFGMDVWGQGTTVTVSSGGGGSGGGGSGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ ID NO:129)
M. BiS5 GL20-FBC39-43-105
FY1GL20VL-Ckappa
DIQMTQSPSSLSASVGDRVTITCRTSQSLSSYTHWYQQKPGKAPKLLIYAASSRGSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:130)
FY1GL20VH - Fc (CH3-) - линкер - FBC39 (43-105) scFv - линкер - Fc (-CH3)
QVQLQQSGPGLVKPSQTLSLTCAISGDSVSSYNAVWNWIRQSPSRGLEWLGRTYYRSGWYNDYAESVKSRITINPDTSKNQFSLQLNSVTPEDTAVYYCARSGHITVFGVNVDAFDMWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGGGGSGGGGSDIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKCPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQANSFPPTFGQGTKLEIKGGGGSGGGGSGGGGSGGGGSEVQLVVSGGGLVKPGGSLRLSCAASGLSFLNAWMSWVRQAPGKGLEWVGRIKSNTDGGTTDYAAPVKGRFSISRDDSKNMLFLHMSSLRTEDTAVYYCATDGPYSDDFRSGYAARYRYFGMDVWGCGTTVTVSSGGGGSGGGGSGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:131)
Пример 2. Экспрессия конструкции BiS
Рекомбинантные антитела получали с помощью транзиентной трансфекции линий клеток млекопитающих, происходящих из клеток 293F или CHO. Супернатанты трансфицированных клеток собирали после 7-10 дней культивирования. Очистку осуществляли с использованием колонки с белком A (HiTrap Protein A HP от GE Healthcare). Содержание мономеров определяли с помощью анализа HPLC-SEC, и агрегаты удаляли с помощью эксклюзионной хроматографии.
Пример 3. Оптимизация конструкции BiS4
Конструкцию BiS4 FY1/39 использовали в качестве остова для оптимизированного scFv с целью создания высокомономерной экспрессирующей конструкции, которая все еще оставалась активной. Для этих исследований ориентацию scFv изменяли с VL/VH на VH/VL, длину линкера scFv изменяли с 20 аминокислот до 10, 15 или 25 аминокислот, стабилизирующие дисульфидные связи удаляли или изменяли их расположение с 100/44 на четыре разных расположения, и каркасные области FBC39 полностью модифицировали на уровне генов зародышевой линии. В таблице 7 предусматривается специфическая информация по конструкциям.
Таблица 7
аггрегация
Экспрессия и активность этих оптимизированных конструкций BiS4 не сильно зависели от длины линкера. Однако положение дисульфидной связи было важным как для экспрессии, так и для активности. Лучший профиль экспрессии наблюдали в конструкциях, не содержащих дисульфидные связи, с изменением расположения дисульфидной связи на 43/105, 46/101 или 49/100, или модифицированной на уровне генов зародышевой линии конструкции FBC39 с дисульфидной связью по 100/44. Однако, хотя экспрессия улучшалась, многие из этих клонов теряли противовирусную активность, измеренную с помощью связывания и нейтрализации НА, как описывается в нижеприведенных примерах 4 и 5. Одна конструкция (FY1/39 BiS4 43/105) демонстрировала лучший профиль экспрессии, чем FY1/39 BiS4 100/44, и сохраняла функциональную противовирусную активность. Поскольку эти две конструкции (FY1/FBC39 BiS4 100/44 и BiS 43/105) демонстрировали хорошую экспрессию, а также хорошую функциональную активность, то конструировали оптимизированные клоны BiS (GL20/FBC39 Bis) соответственно с ориентациями BiS4 100/44 и BiS 43/105.
Пример 4. Конструкции Flu A+B BiS, связывающиеся с белками НА вирусов гриппа A и B
Конструкции Flu A+B BiS тестировали для определения того, сохраняют ли они специфичность конструкций исходного IgG, с использованием анализа связывания ELISA перекрестной реактивности в отношении НА. 384-луночные планшеты Maxisorb ELISA (Nunc) покрывали в течение ночи при 4°C 1 мкг/мл рекомбинантного HA, полученного из штаммов вируса гриппа A, A/California/07/2009 H1N1 (A/CA/09) и A/Perth/2009 H3N2 (A/PTH/09), и штаммов вируса гриппа B, B/Florida/4/2006 линии Yamagata (B/FLA/06) и B/Brisbane/60/2008 линии Victoria (B/BNE/08), в PBS. Планшет промывали с помощью PBS, содержащего 0,1% об./об. Tween-20, с целью удаления несвязавшегося белка, и на 1 ч. при комнатной температуре добавляли блокирующий раствор, содержащий 1% (вес/об.) казеина (Thermo Scientific). Блокирующий раствор удаляли, добавляли 3-кратное серийное разбавление в PBS каждого из IgG к НА и антител BiS в PBS и инкубировали в течение 1 ч. при комнатной температуре. Планшет промывали три раза, и связанные антитела IgG и BiS выявляли с помощью конъюгированного с пероксидазой антитела козы к IgG человека (H+L) (KPL). Активность связывания рассчитывали путем измерения изменения цвета при 450 нм после инкубирования с однокомпонентным субстратом (KPL) тетраметилбензидином (TMB) с последующим добавлением 2 н. серной кислоты для остановки реакции.
В таблице 8 показаны значения EC50, вычисленные по кривым связывания. Как и ожидалось, mAb IgG Flu A (FY1 и GL20) связывались с белками НА вируса гриппа А, а три mAb IgG Flu B (FBD94, FBC39 и FBC39FTL) связывались с белками НА вируса гриппа B. Все конструкции BiS связывались со всеми четырьмя белками НА вируса гриппа, принадлежащего к типу A и типу B. Конструкции BiS4 для FBC39 и FBD94 демонстрировали наилучшее общее связывание. При помещении оптимизированных IgG в конструкции BiS4, имеющие дисульфидные связи по 100/44 или 43/105, GL20/39 BiS4 43/105 демонстрировала наилучшее общее связывание со значениями EC50 <1 нM для A/CA/09, A/PTH/09 и B/FL/06, и менее 10 нM для более сложного в отношении связывания B/BNE/08.
Таблица 8
-=связывание отсутствует
Для дополнительной характеристики кинетических показателей связывающего взаимодействия проводили измерения аффинности с помощью кинетического анализатора ForteBio Octet QK 384 (Менло-Парк, Калифорния), с использованием 384-луночных планшетов со скошенными краями. Все реактивы разбавляли в буфере для кинетического анализа Octet (ForteBio). His-меченный HA разных вирусов гриппа: подтипа H1 вируса гриппа А (A/California/7/04 (H1N1)), подтипа H3 вируса гриппа А (A/Perth/16/09 (H3N2)), линии Victoria вируса гриппа В (B/Brisbane/60/2008 (Victoria)) и линии Yamagata вируса гриппа В (B/Florida/4/2006 (Yamagata)), иммобилизовали на сенсорах Ni-NTA с антителами к His при 8 мкг/мл. Затем ассоциацию/диссоциацию mAb к НА отслеживали в 2-кратных разбавлениях от 100 нМ, и к тому же использовали нулевое контрольное mAb. Затем в первичные данные по ассоциации и диссоциации вносили поправку на любое смещение в нулевых контрольных mAb, и затем экспортировали их в GraphPad Prism (Сан-Диего, Калифорния) для аппроксимации кривой аффинности. Аппроксимацию данных проводили с применением глобального уравнения ассоциации/диссоциации с заданным пределом >5×10-6 с-1. Как показано в таблице 9, обе конструкции BiS демонстрировали высокую аффинность связывания со всеми четырьмя белками НА, принадлежащими штаммам вируса гриппа A и B.
Таблица 9
(e3 M-1с-1)
(e-6 с-1)
(нМ)
(e3 M-1
с-1)
(e-6
с-1)
(нМ)
Пример 5. In vitro нейтрализующая активность конструкций BiS в отношении Flu A+B
Модифицированный анализ микронейтрализации был основан на ранее описанном анализе ускоренного ингибирования вируса с применением активности нейраминидазы (NA) в качестве регистрируемого показателя (Hassantoufighi, A. et al. 2010, Vaccine 28:790). Вкратце, анализы проводили на клетках MDCK, которые культивировали в среде MEM (Invitrogen), дополненной антибиотиками, глутамином (полная среда MEM) и 10% (об./об.) фетальной бычьей сывороткой. Добавляли 60 TCID50 (50% инфицирующие дозы для культуры тканей) вируса в 384-луночном планшете к трехкратным разбавлениям антитела в среде MEM, содержащей 0,75 мкг/мл TPCK-трипсина (Worthington) в двух повторностях лунок. После 30-минутной инкубации при комнатной температуре в планшет добавляли 2×104 клеток/лунка. После инкубирования при 33°C в инкубаторе с 5% CO2 в течение примерно 40 ч. активность NA измеряли путем добавления в каждую лунку флуоресцентно-меченого субстрата, метилумбеллиферил-N-ацетилнейраминовой кислоты (MU-NANA) (Sigma), и инкубирования при 37°C в течение 1 ч. Репликацию вируса, представленную активностью NA, количественно определяли путем считывания данных о флуоресценции с помощью флуорометра Envision (PerkinElmer) с использованием следующих установочных параметров: длина волны возбуждения 355 нм, длина волны испускания 460 нм; 10 вспышек на лунку. Титр нейтрализации (50% ингибирующая концентрация [IC50]) выражали в виде конечной концентрации антитела, которая ослабляла сигнал флуоресценции на 50% по сравнению с лунками с контрольными клетками.
Штаммы вируса гриппа А и B, используемые в таблицах 10 и 11, перечислены ниже.
В таблице 10: A/WSN/33 (A/Wilson Smith N/33 (H1N1)); A/BJ/95 (A/Beijing/262/95 (H1N1)); A/SI/06 (A/Solomon Island/3/2006 (H1N1)); A/CA/09 (A/California/07/2009 (H1N1)); A/HK/68 (A/Hong Kong/8/68 (H3N2)); A/VIC/75 (A/Victoria/3/75 (H3N2)); A/SD/93 (A/Shangdong/9/93 (H3N3)); A/Pan/99 (cold-adapted (ca) A/Panama//2007/99 (H3N2)); B/BJ/97 (ca B/ Beijing/243/97 (Vic)); B/HK/01 (B/Hong Kong/330/2001 (Vic)); B/MY/04 (B/Malaysia/2506/2004 (Vic)); B/OH/05 (B/Ohio/1/2005 (Vic)); B/YI/98 (B/Yamanashi/166/98 (Yam)); B/SIC/99 (B/Sichuan/379/99 (Yam)) и B/FLA/06 (B/Florida/4/2006 (Yam)).
В таблице 11: A/WSN/33 H1 (A/Wilson Smith N/33 (H1N1)); A/PR/34 H1 (A/Puerto Rico/8/34 (H1N1)); A/FM/47 H1 (A/Fort Monmouth/1/47 (H1N1)); A/BJ/95 H1 (ca A/Beijing/262/95 (H1N1)); A/SZ/95 H1 (A/Shenzhen/227/95 (H1N1)); A/NC/99 H1 (ca A/New Caledonia/20/99 (H1N1)); A/SI/06 H1 (A/Solomon Island/3/2006 (H1N1)); A/SD/07 H1 (ca A/South Dakota/6/2007 (H1N1)); A/CA/09 H1 (ca A/California/7/2009 (H1N1)); A/BS/10 H1 (A/Brisbane/10/2010 (H1N1)); A/HK/10 H1 (A/Hong Kong/2212/2010 (H1N1)); A/NH/10 H1 (A/New Hampshire/04/2010 (H1N1)); A/WS/12 H1 (A/Washington/24/2012 (H1N1)); A/NY/12 H1 (A/New York/36/2012 (H1N1)); A/BO/13 H1 (A/Bolivia/559/2013 (H1N1)); A/Jap/57 H2 (ca A/Japan/57 (H2N2)); A/VN/04 H5 (ca A/Vietnam/1203/04 (H5N1)); A/Alb/85 H6 (ca A/mallard/Alberta/89/85 (H6N2)); A/HK/97 H9 (ca A/chicken/Hong Kong/G9/97 (H9N2)); A/HK/68 H3 (A/Hong Kong/8/68 (H3N2)); A/Vic/75 H3 (A/Victoria/3/75 (H3N2)); A/SD/93 H3 (A/Shan dong/9/93 (H3N2)); A/WH/95 H3 (ca A/Wuhan/359/95 (H3N2)); A/SY/97 H3 (ca A/Sydney/5/97 (H3N2)); APA/99 H3 (ca A/Panama/2007/99 (H3N2)); A/CA/04 H3 (A/California/7/2004 (H3N2)); A/WS/05 H3 (A/Wisconsin/67/2005 (H3N2)); A/Perth/09 H3 (ca A/Perth/16/2009 (H3N2)), A/VC/11 H3 (A/Victoria/361/2011 (H3N2)); A/BR/11 H3 (A/Berlin/93/2011 (H3N2)); A/NY/12 H3 A/New York/39/2012 (H3N2)); A/X/12 H3 (A/Texas/50/2012 (H3N2)); A/AS/13 H3 (A/AmericanSomoa/4786/2013 (H3N2)); A/SW/13 H3 (A/Switzerland/9715293/2013 (H3N2)); A/PU/14 H3 (A/Palau/6759/2014 (H3N2)); A/NC/14 H3 (A/New Caledonia/71/2014 (H3N2)); A/IN/11 H3v (A/Indiana/10/2011 (H3N2v)); A/MN/10 H3v (A/Minnesota/11/2010 (H3N2v)); A/BC/04 H7 (ca A/Brit. Columbia/CN-6/04 (H7N3-LP); B/Lee/40 (B/Lee/40); B/AA/66 (ca B/Ann Arbor/1/66); B/HK/72 (B/Hong Kong/5/72); B/BJ/97 (ca B/Beijing/243/97 (victoria)), B/HK/01 (B/Hong Kong/330/2001 (victoria)); B/MY/04 (B/Malaysia/2506/2004 (victoria)); B/OH/05 (B/Ohio/1/2005 (victoria)); B/BNE/08 (ca B/Brisbane/60/2008 (victoria)); B/NV/11 (B/Nevada/3/2011 (victoria)); B/NJ/12 (B/New Jersey/01/2012 (victoria)); B/TX/13 (B/Texas/2/2013 (victoria)); B/Wis/13 (B/Wisconsin/5/2013 (victoria)); B/Yam/88 (B/Yamagata/16/88 (yamagata)); B/AA/94 (ca B/Ann Arbor/2/94 (yamagata)); B/geo/98 (ca B/Georgia/02/98 (yamagata)); B/YSI/98 (ca B/Yamanashi/166/98 (yamagata)); B/Joh/99 (ca B/Johannesburg/5/99 (yamagata)); B/Sic/99 (B/Sichuan/379/99 (yamagata)); B/Vic/00 (ca B/Victoria/504/2000 (yamagata)); B/Shg/02 (B/Shanghai/361/02 (yamagata)); и B/FL/06 (B/Florida/4/2006 (yamagata)); B/WS/10 (B/Wisconsin/1/2010 (yamagata)); B/Mass/12 (B/Massachusetts/2/2012 (yamagata)); B/AZ/13 (B/Arizona/8/2013 (yamagata)); B/PH/13 (B/Phuket/3073/2013 (yamagata)).
Таблица 10
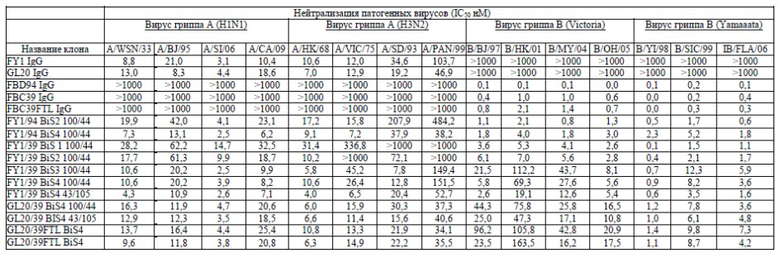
В таблице 10 показаны средние значения IC50 двух независимых экспериментов. Исходные IgG FY1 и GL20 нейтрализовали все штаммы вируса гриппа А и демонстрировали отсутствие перекрестной реактивности в отношении тестируемых штаммов вируса гриппа В. Как и предполагали, IgG FBD94, FBC39 и FBC39 LTL нейтрализовали все штаммы вируса гриппа В при отсутствии активности в отношении тестируемых штаммов вируса гриппа А. Однако аналогично экспериментам по связыванию, конструкции BiS4 демонстрировали наилучший профиль полной нейтрализации с нейтрализующей активностью в отношении всех тестируемых штаммов вируса гриппа А и В. Конструкция BiS4, созданная с оптимизированными клонами антитела, GL20/39 BiS4 100/44 и GL20/39 BiS4 43/105, демонстрировала улучшенную полную нейтрализацию в отношении всех тестируемых штаммов по сравнению с исходным BiS4. GL20/39 BiS4 43/105 давали значения IC50 <50 нM в отношении всех 15 тестируемых вирусов Flu A и B.
Для подтверждения того, что степень охвата для оптимизированных конструкций BiS4 сохраняется, тестировали более крупную панель из 39 вирусов гриппа A и 25 вирусов гриппа В в отношении нейтрализации. В таблице 11 показаны средние значения IC50 двух независимых экспериментов. GL20/39 BiS4 100/44 и GL20/39 BiS4 43/105 демонстрировали нейтрализующую активность в отношении всех тестируемых вирусов. Средние значения IC50 (нM) в отношении вирусов гриппа А составляли 8,2, 8,0 и 7,5 соответственно для GL20 IgG, GL20/39 BiS4100/44 и GL20/39 BiS4 43/105, что показывает, что конструкции BiS сохраняли полную нейтрализующую активность исходного IgG. Средние значения IC50 в отношении вирусов гриппа В составляли 0,4, 13,9 и 9,0 соответственно для FBC39 IgG, GL20/39 BiS4100/44 и GL20/39 BiS4 43/105. Конструкции BiS демонстрировали >10-кратное снижение активности в отношении вирусов гриппа B по сравнению с исходным IgG mAb, однако полная нейтрализующая активность сохранялась на уровнях, аналогичным таковым в отношении вирусов гриппа А. Хотя обе конструкции BiS, GL20/39 BiS4100/44 и GL20/39 BiS4 43/105, демонстрировали аналогичные профили, GL20/39 BiS4 43/105 демонстрировала лучший профиль полной нейтрализации со значениями IC50 <50 нM в отношении всех вирусов. Как описывалось ранее, подобно mAb к вирусу гриппа А GL20, mAb FBC39 было способно нейтрализовать штамм вируса гриппа A/HK/97 H9 в дополнение к штаммам вируса гриппа B. При конструировании в формат BiS4, антитела BiS4 демонстрировали усиленную нейтрализующую активность в отношении A/HK/97 H9 по сравнению с любым исходным mAb со значениями IC50 (нM) 1,6 и 1,1 для GL20/39 BiS4 100/44 и GL/20/39 BiS4 43/105, а также 3,0 и 13,3 для GL20 и FBC39, соответственно.
Таблица 11
Пример 6. Активность в отношении ингибирования гемагглютинации
Часть mAb к вирусу гриппа В в конструкции BiS связывается с глобулярной головкой белка НА и ингибирует вход вируса в клетку-хозяина. Чтобы определить, является ли тот же самый механизм действия важным для функциональности вируса гриппа B в конструкции BiS, предварительно проводили анализ ингибирования гемагглютинации (HAI) с использованием разнообразной группы штаммов вируса гриппа В. С помощью HAI-анализа выявляли антитела, которые блокируют связывание с вирусными рецепторами, представляющими собой сиаловую кислоту, экспрессируемую на поверхности клеток, путем измерения ингибирования агглютинации эритроцитов, опосредованной вирусами. Концентрацию вирусов гриппа B (сокращения описаны в примере 5) доводили до 4 единиц HA, что определяли путем инкубирования с 0,05% эритроцитов индюка (Lampire Biological Laboratories) в отсутствие антитела. В 96-луночном планшете с U-образным дном серийно разбавляли IgG GL20/39 BiS4 100/44, GL20/39 BiS4 43/105 и FBC39 с двукратным шагом и разбавленный вирус добавляли в лунки. Через 30-60 мин. инкубирования добавляли 50 мкл 0,05% эритроцитов индюка. Планшеты инкубировали в течение дополнительных 30-60 мин. и исследовали на предмет агглютинации. Титр для HAI определяли как минимально эффективную концентрацию (нМ) антитела, при которой происходило полное ингибирование агглютинации. В таблице 12 показано, что конструкции GL20/39 BiS4 обладали HAI-активностью в отношении всех тестируемых штаммов вируса гриппа B, это доказывает то, что конструкции BiS связываются с глобулярной головкой HA вируса гриппа B. Общая эффективность HAI-активности варьировала в этих двух конструкциях, при этом GL20/39 BiS4 43/105 давала в результате более эффективное ингибирование, чем GL20/39 BiS4 100/44, с активностью, аналогичной исходному mAb FBC39 в отношении многих тестируемых вирусов.
Таблица 12
Пример 7. In vitro Fc-эффекторная функция конструкций BiS в отношении Flu A+B
Моноклональные антитела к НА вируса гриппа обладают потенциалом для устранения инфицированных вирусом клеток посредством Fc-эффекторной функции, такой как антителозависимая клеточная цитотоксичность (ADCC), антителозависимый клеточный фагоцитоз (ADCP) и комплементзависимый киллинг (CDC). Для подтверждения того, что конструкции BiS проявляли уровни их эффекторных функций, подобные их исходным mAb IgG, их тестировали в трех разных in vitro анализах для определения ADCC-, ADCP- и CDC-активности. В анализе ADCC измеряли способность первичных NK-клеток человека уничтожать инфицированные вирусом гриппа клетки при активации антитела. Клетки A549 инфицировали с помощью A/California/07/2009 H1N1 при множественности инфекции (MOI) 10, A/Hong Kong/8/68 H3N2 при MOI 10, линии B/Malaysia/2506/2004 victoria при MOI 20 и линии B/Sichuan/379/99 yamagata при MOI 10 и инкубировали при 37°C в течение 15 часов. Инфицированные клетки инкубировали в сериях разбавлений GL20, FBC39 или GL20/39 BiS4 43/105, а затем инкубировали с очищенными NK-клетками, которые подвергали положительному отбору из человеческих мононуклеарных клеток периферической крови (PBMC) (Miltenyi), при соотношении эффектор-цель 6:1. Инфицированные клетки, антитело и NK-клетки инкубировали в течение 4 часов и киллинг клеток измеряли с помощью высвобождения LDH (Roche). На фигуре 2 показано, что GL20/39 BiS4 43/105 демонстрировала примерно 3-кратное снижение дозозависимого киллинга клеток A549, инфицированных вирусом гриппа А, по сравнению с GL20 со значениями IC50 (нM) 0,024 и 0,086 в отношении A/California/07/2009 H1N1 и 0,018 и 0,052 в отношении A/Hong Kong/8/68 H3N2 для GL20 и GL20/39 BiS4 43/105, соответственно (A и B). GL20/39 BiS4 43/105 демонстрировала ту же дозозависимую ответную реакцию, что и FBC39 IgG, с вычисленными значениями IC50 (нM) 1,45 и 1,50 в отношении B/Malaysia/2506/2004 victoria и 0,85 и 0,42 в отношении B/Sichuan/379/99 yamagata для FBC39 и GL20/39 BiS4 43/105, соответственно (C и D).
С целью измерения способности антител BiS к НА опосредовать фагоцитоз в анализе ADCP, использовали клетки MDCK, стабильно трансфицированные белками НА, полученными соответственно от A/South Dakota/6/2007 H1N1 и A/Hong Kong/8/68 H3N2 в качестве целевых клеток. Человеческие моноциты выделяли из PBMC и культивировали в течение 7 дней в присутствии M-CSF с дифференциацией в макрофаги. Человеческие макрофаги и экспрессирующие HA клетки-мишени флуоресцентно метили соответственно фиолетовым и зеленым красителями (CellTrace фиолетовым или CSFE, Invitrogen). Меченые эффекторные и целевые клетки инкубировали при отношении 6:1 в присутствии антител IgG или BiS в серии разбавлений в течение 2 часов, а затем анализировали с помощью проточной цитометрии. Процент фагоцитоза измеряли в виде процента окрашенных фиолетовым макрофагов, которые также были положительными в отношении зеленых клеток-мишеней (двойными положительными). На фигуре 3 показано, что GL20/39 BiS4 43/105 характеризовалась аналогичной ADCP-активностью, как и GL20 IgG в отношении H1-экспрессирующих клеток и H3-экспрессирующих клеток, как и предполагали, FBC39 IgG демонстрировала отсутствие фагоцитоза клеток, экспрессирующих вирус гриппа А.
Для измерения опосредованного антителом BiS к НА комплементзависимого киллинга клеток, в качестве целей использовали клетки MDCK, инфицированные вирусом гриппа. В данном анализе CDC клетки MDCK инфицировали A/Puerto Rico/8/34 при MOI 2, инкубировали в серии разбавлений GL20 IgG, GL20/39 BiS4 43/105 или нерелевантного контрольного mAb в присутствии комплемента, полученного от кролика (Cedarlane), при отношении эффектор-цель 1:18. Киллинг клеток измеряли по высвобождению LDH (Roche). На фигуре 3 C показано, что GL20/39 BiS 43/105 демонстрировала уровень способностей киллинга клеток, подобный таковому для GL20 IgG.
Пример 8. In vivo профилактическая защита конструкций BiS Flu A+B на летальных мышиных моделях инфекции, представляющей собой грипп A и грипп B
Для тестирования профилактической эффективности мышам BALB/c (Harlan Laboratories) возрастом шесть - восемь недель вводили однократную внутрибрюшинную инъекцию (IP) GL20 IgG при 3, 0,3 или 0,03 мг/кг или равный молярный эквивалент GL20/39 BiS4 43/105 в объеме 100 мкл. Через четыре часа после введения дозы мышей инокулировали интраназально 2,5-кратной пятидесяти-процентной мышиной летальной дозой (2,5 MLD50) A/Wilson Smith N/33 H1N1 (A/WSN/33) или 7 MLD50 7:1 реассортанта A/Puerto Rico/8/34:A/Hong Kong/8/68 HA (rA/HK/68) в объеме 50 мкл для исследования на модели инфекции, представляющей собой грипп A, или 7 MLD50 линии B/Florida/4/2006 yamagata (B/FLA/06), или 10 MLD50 линии B/Malaysia//2506/2004 victoria (B/MAL/04) в объеме 50 мкл в исследовании с использованием модели инфекции, представляющей собой грипп В. Группы из 8-10 мышей взвешивали в день заражения вирусом, и в течение 14 дней ежедневно отслеживали потерю веса и выживание (мышей с потерей веса тела ≥25% подвергали эвтаназии). Кроме того, для вирусного титрования собирали легкие у 4 дополнительных животных в день 5 после инфицирования. Легкие гомогенезировали с использованием Teen Lysing Matrix A в 10% вес/об. растворе и гомогенезатора Fastprep24. Количественное определение TCID50 осуществляли в серийно разбавленном гомогенате легких в 384-луночном планшете с черными стенками для культуры тканей в четырех повторностях. Затем в гомогенат при 2,0 × 104 клеток/лунка добавляли трипсинизированные клетки MDCK и планшеты инкубировали при 33℃ с 5% CO2 в течение примерно 40 часов. Вирусную репликацию измеряли путем добавления 40 мкM MU-NANA, как описано выше. Титры вирусной инфекции вычисляли с использованием способа Karber (Karber et al, 1931 Arch. Exp. Pathol. Pharmak. 162:480-3) и положительных образцов, определяемых как те, что показывают более 10 стандартных отклонений выше среднего значения клеток отдельно.
Профилактическая активность в отношении инфекции, представляющей собой грипп А
Как GL20/39 BiS4 43/105, так и исходный IgG GL20 обеспечивали защиту мышей от летального заражения вирусом гриппа A аналогичным дозозависимым образом. Подобно GL20 IP, инъекция эквивалента 3 мг/кг молекулы BiS на 100% защищала животных, зараженных вирусом A/WSN/33 H1, а IP инъекция эквивалента 3 и 0,3 мг/кг предотвращала летальность у 100% животных, зараженных вирусом rA/HK/68 H3 (фигура 4 A и C). При оценке вирусного титра в легких, собранных в день 5 после инфицирования, обе молекулы антитела обеспечивали вирусные титры в легких с более выраженным снижением при эквивалентной дозе 3 мг/кг. При сравнении BiS с IgG видны сходные снижения вирусных титров в двух группах животных, обработанных GL20, с чуть более низкими вирусными тирами в модели H1, тогда как BiS демонстрировал более низкие вирусные титры в модели H3 (фигура 4 B и D). В целом эти данные показывают, что GL20/39 BiS4 43/105 может предотвращать летальность и уменьшать репликацию вирусов в легких в той же степени, что и GL20 IgG.
Профилактическая активность в отношении инфекции, представляющей собой грипп В
Как GL20/39 BiS4 43/105, так и исходный FBC39 IgG обеспечивали защиту от летальной инфекции, представляющей собой грипп В, дозозависимым образом. Инъекция IP эквивалента 3 мг/кг молекулы BiS защищала 100% животных, зараженных вирусами линии B/FLA/06 yamagata и линии B/MAL/04 victoria (фигура 5 A и C, сплошные линии). Хотя BiS и FBC39 при дозе 3 мг/кг обеспечивали полную защиту со 100% коэффициентом выживаемости, FBC39 демонстрировала более эффективную защиту чем FBC39 при уровне дозы 0,3 мг/кг в обеих моделях инфекции, представляющей собой грипп B. При оценке вирусного титра в легких, собранных в день 5 после инфицирования, обе молекулы антитела снижали вирусные титры в легких, что было наиболее очевидным при эквивалентной дозе 3 мг/кг. При сравнении BiS с IgG видны аналогичные снижения вирусных титров в модели инфекции B/FLA/06 yamagata, однако BiS был менее эффективным чем FBC39 в снижении вирусного титра в легких у мышей, инфицированных штаммом B/Mal/04 victoria (фигура 5 B и D). Совместно эти данные на фигурах 4 и 5 показывают, что GL20/39 BiS4 43/105 может эффективно предотвращать летальность и уменьшать репликацию вирусов в легких в обеих моделях летальной инфекции вируса гриппа A и B.
Пример 9. In vivo терапевтическая защита конструкции BiS Flu A+B по сравнению с осельтамивиром на летальной мышиной модели инфекции, представляющей собой грипп A и грипп B
Для непосредственного сравнения терапевтической эффективности молекулы BiS с низкомолекулярным ингибитором NA, осельтамивиром, для инфекции вируса гриппа A и B использовали мышиную модель гриппа.
Терапевтическое сравнение GL20/39 BiS4 43/105 и осельтамивира (фигура 5)
Мышей инокулировали 2,5 MLD50 вируса A/WSN/33 H1 или 7 MLD50 вируса линии B/FLA/06 yamagata, а затем обрабатывали однократной IV дозой осельтамивира при эквиваленте 10 мг/кг (14,1 мг/кг) GL20/39 BiS4 43/105 или 25мг/кг BID перорально в течение 5 суток, начиная либо с дня 1, дня 2, дня 3, либо дня 4 после инфицирования. В отношении потери массы тела и выживаемости контролировали 10 животных на группу, а 4 животных умерщвляли для измерения легочного титра вируса, как описано выше. Кроме того, в качестве неинвазивного считывания легочной функции измеряли уровень насыщения крови кислородом с использованием пульсовой оксиметрии (MouseОx) в день 6 после инфицирования у 4 животных на группу.
Обработка молекулой BiS защищала 100% мышей от летальной инфекции A/WSN/33 или B/FLA/06 при введении в день 2 после инфицирования (фигура 6 A и B). Даже когда лечение откладывали до дня 3 после инфицирования, молекула BiS все еще предотвращала летальность у 50% животных, инфицированных вирусом гриппа A или B. На модели инфекции, представляющей собой грипп А, осельтамивир демонстрировал отсутствие защиты при обработке, осуществляемой в день 1 или позже, однако он обеспечивал хорошую защиту с 90-100% коэффициентами выживаемости при начале введения в день 1 или день 2 после инфицирования гриппом B. Хотя осельтамивир обеспечивал хорошую защиту в модели инфекции вируса гриппа B, BiS демонстрировала тенденцию лучшей защиты с более высокими коэффициентами выживаемости чем осельтамивир при введении в день 2, день 3 и день 4 после инфицирования (фигура 6 A и B).
На фигуре 6 (C и D) показан легочный титр вируса у мышей, обработанных BiS или осельтамивиром, через 5 дней после инфицирования. Обработкой молекулой BiS в различные моменты времени после инфицирования вирусом A/WSN/33 H1N1 ингибировали репликацию вирусов в легких времязависимым образом от более 3 log снижения вирусного титра при начале обработки в день 1 после инфицирования до 1 log снижения вирусного титра при начале обработки в день 4 после инфицирования (фигура 6 C). По сравнению с осельтамивиром, молекула BiS демонстрировала большее на 1-2 log снижение при начале обработки в день 2, день 3 или день 4 после инфицирования.
Для оценки эффекта различных обработок в отношении легочной функции измеряли уровень насыщения кислородом с помощью пульсовой оксиметрии (фигура 6 E и F). Инфицированные животные, обработанные только нерелевантным контрольным mAb, демонстрировали снижение процентного насыщения кислородом до 80% для A/WSN/33 и 78% в день 6 после инфицирования по сравнению с 98% для необработанных животных. Обработка с помощью GL20/39 BiS4 43/105 предотвращала снижение уровней насыщения кислородом ниже 90%, даже когда лечение откладывали до дня 4 после инфицирования, тогда как обработанные осельтамивиром животные демонстрировали сниженное насыщение кислородом при тех же уровнях, что и обработанные нерелевантным контрольным mAb (фигура 6 E). Если мышей инфицировали B/FLA/06, а затем обрабатывали BiS или осельтамивиром, то оба средства защищали легочную функцию, при этом обработанные BiS животные характеризовались немного более высоким уровнем насыщения кислородом, если обработку начинали в день 1 после инфицирования (фигура 6 F). Если обработку начинали в день 2 после инфицирования, то обработанные BiS животные демонстрировали значительно улучшенную легочную функцию у 3 их 4 обработанных животных по сравнению с обработанными осельтамивиром животными (в среднем 92% против 86%). В целом, эти два исследования показали, что GL20/39 BiS4 43/105 может предотвращать летальность, снижать вирусные титры и защищать легочную функцию у животных, инфицированных летальной дозой вируса гриппа A и B, в случае если обработка начинается до дня 3 после инфицирования.
Включение с помощью ссылки
Все ссылки, цитируемые в данном документе, в том числе патенты, заявки на патенты, статьи, учебники и т. п., и ссылки, цитируемые в данном документе, до той степени, в которой они уже не являются таковыми, включены в данный документ с помощью ссылки во всей своей полноте.
--->
Последовательности
SEQ ID NO: 1 (последовательность нуклеиновой кислоты VL FY1)
GACATCCAGATGACCCAGTCGCCATCCTCCCTGTCTGCATCTGTAGGAGACAGAGTAACCATCACTTGCCGGACAAGTCAGAGCCTTAGTAGCTATTTACATTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATGCTGCATCCAGTTTGCAAAGTGGGGTCCCATCAAGGTTCAGTGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGTAGTCTGCAACCTGAAGATTTTGCAACTTACTACTGTCAACAGAGTCGGACGTTCGGCCAAGGGACCAAGGTGGAAATCAAA
SEQ ID NO: 2 (аминокислотная последовательность VL FY1)
DIQMTQSPSSLSASVGDRVTITCRTSQSLSSYLHWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSRTFGQGTKVEIK
SEQ ID NO: 3 LCDR1 RTSQSLSSYLH
SEQ ID NO: 4 LCDR2 AASSLQS
SEQ ID NO: 5 LCDR3 QQSRT
SEQ ID NO: 6(последовательность нуклеиновой кислоты VН FY1)
CAGGTACAGCTGCAGGAGTCGGGTCCAGGACTGGTGAAGCCCTCGCAGACCCTCTCACTCACCTGTGCCATCTCCGGGGACAGTGTCTCTAGCAACAATGCTGTTTGGAACTGGATCAGGCAGTCCCCATCGAGAGGCCTTGAGTGGCTGGGAAGGACATACTACAGGTCCAAGTGGTATAATGATTATGCAGAATCTGTGAAAAGTCGAATAACCGTCAATCCAGACACATCCAAGAACCAGTTCTCCCTGCACCTGAAGTCTGTGACTCCCGAGGACACGGCTGTGTTTTACTGTGTACGATCTGGCCACATTACGGTTTTTGGAGTGAATGTTGACGCTTTTGATATGTGGGGCCAAGGGACAATGGTCACCGTCTCTTCAG
SEQ ID NO: 7 (аминокислотная последовательность VН FY1)
QVQLQESGPGLVKPSQTLSLTCAISGDSVSSNNAVWNWIRQSPSRGLEWLGRTYYRSKWYNDYAESVKSRITVNPDTSKNQFSLHLKSVTPEDTAVFYCVRSGHITVFGVNVDAFDMWGQGTMVTVSS
SEQ ID NO: 8 HCDR1 SNNAVWN
SEQ ID NO: 9 HCDR2 RTYYRSKWYNDYAESVKS
SEQ ID NO: 10 HCDR3 SGHITVFGVNVDAFDM
SEQ ID NO: 11 (последовательность нуклеиновой кислоты VL GL20)
GATATTCAGATGACCCAGAGCCCTTCCAGCCTGTCCGCTTCAGTGGGGGATCGAGTGACCATTACCTGCCGAACCAGCCAGAGCCTGAGCTCCTACACGCACTGGTATCAGCAGAAGCCCGGCAAAGCCCCTAAGCTGCTGATCTACGCCGCTTCTAGTCGGGGGTCCGGAGTGCCAAGCCGGTTCTCCGGATCTGGGAGTGGAACCGACTTTACCCTGACAATTTCAAGCCTGCAGCCCGAGGATTTCGCTACATACTACTGTCAGCAGAGCAGAACTTTCGGGCAGGGCACTAAGGTGGAGATCAAA
SEQ ID NO: 12(аминокислотная последовательность VL GL20)
DIQMTQSPSSLSASVGDRVTITCRTSQSLSSYTHWYQQKPGKAPKLLIYAASSRGSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSRTFGQGTKVEIK
SEQ ID NO: 13 LCDR1 RTSQSLSSYTH
SEQ ID NO: 14 LCDR2 AASSRGS
SEQ ID NO: 15 LCDR3 QQSRT
SEQ ID NO: 16 (последовательность нуклеиновой кислоты VН GL20)
CAGGTCCAGCTGCAGCAGAGCGGCCCCGGACTGGTCAAGCCTTCACAGACACTGAGCCTGACATGCGCCATTAGCGGAGATAGCGTGAGCTCCTACAATGCCGTGTGGAACTGGATCAGGCAGTCTCCAAGTCGAGGACTGGAGTGGCTGGGACGAACATACTATAGATCCGGGTGGTACAATGACTATGCTGAATCAGTGAAAAGCCGAATTACTATCAACCCCGATACCTCCAAGAATCAGTTCTCTCTGCAGCTGAACAGTGTGACCCCTGAGGACACAGCCGTGTACTACTGCGCCAGAAGCGGCCATATCACCGTCTTTGGCGTCAATGTGGATGCTTTCGATATGTGGGGGCAGGGGACTATGGTCACCGTGTCAAGC
SEQ ID NO: 17 (аминокислотная последовательность VН GL20)
QVQLQQSGPGLVKPSQTLSLTCAISGDSVSSYNAVWNWIRQSPSRGLEWLGRTYYRSGWYNDYAESVKSRITINPDTSKNQFSLQLNSVTPEDTAVYYCARSGHITVFGVNVDAFDMWGQGTMVTVSS
SEQ ID NO: 18 HCDR1 SYNAVWN
SEQ ID NO: 19 HCDR2 RTYYRSGWYNDYAESVKS
SEQ ID NO: 20 HCDR3 SGHITVFGVNVDAFDM
SEQ ID NO:21(ДНК VL FBC39)
GACATCCAGATGACCCAGTCTCCATCTTCCGTGTCTGCATCTGTGGGAGACAGAGTCACCATCACTTGTCGGGCGAGTCAGGATATTAGCACCTGGTTAGCCTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATGCTGCATCCAGTTTGCAAAGTGGGGTCCCATCAAGATTCAGCGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGCCTGCAGCCTGAAGATTTTGCAACTTACTTTTGTCAGCAGGCTAACAGTTTCCCTCCGACTTTTGGCCAGGGGACCAAGCTGGAGATCAAAC
SEQ ID NO:22 (белок FBC39 VL)
DIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQANSFPPTFGQGTKLEIK
SEQ ID NO:23(FBC39 LCDR-1 - Kabat): RASQDISTWLA
SEQ ID NO:24 (FBC39 LCDR-2 - Kabat): AASSLQS
SEQ ID NO:25 (FBC39 LCDR-3 - Kabat): QQANSFPPT
SEQ ID NO:26 (ДНК VH FBC39)
GAGGTGCAGCTGGTGGTGTCTGGGGGAGGCTTGGTAAAGCCTGGGGGGTCCCTTAGACTCTCCTGTGCAGCCTCTGGACTCAGTTTCCTTAACGCCTGGATGAGCTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGGTTGGCCGTATTAAAAGTAATACTGATGGTGGGACAACAGACTACGCCGCACCCGTGAAAGGCAGATTCAGCATCTCAAGAGACGATTCAAAGAACATGCTGTTTCTGCATATGAGCAGCCTGAGAACCGAGGACACAGCCGTCTATTACTGCGCCACAGATGGACCTTACTCTGACGATTTTAGAAGTGGTTATGCCGCACGCTACCGTTATTTCGGAATGGACGTCTGGGGCCAAGGGACCACGGTCACCGTCTCCTCAG
SEQ ID NO:27(белок FBC39 VH)
EVQLVVSGGGLVKPGGSLRLSCAASGLSFLNAWMSWVRQAPGKGLEWVGRIKSNTDGGTTDYAAPVKGRFSISRDDSKNMLFLHMSSLRTEDTAVYYCATDGPYSDDFRSGYAARYRYFGMDVWGQGTTVTVSS
SEQ ID NO:28 (FBC39 HCDR-1 - Kabat): NAWMS
SEQ ID NO:29 (FBC39 HCDR-2 - Kabat): RIKSNTDGGTTDYAAPVKG
SEQ ID NO:30 (FBC39 HCDR-3 - Kabat): DGPYSDDFRSGYAARYRYFGMDV
SEQ ID NO: 31 (аминокислотная последовательность scFv FBC39):
DIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQANSFPPTFGCGTKLEIKGGGGSGGGGSGGGGSGGGGSEVQLVVSGGGLVKPGGSLRLSCAASGLSFLNAWMSWVRQAPGKCLEWVGRIKSNTDGGTTDYAAPVKGRFSISRDDSKNMLFLHMSSLRTEDTAVYYCATDGPYSDDFRSGYAARYRYFGMDVWGQGTTVTVSS
SEQ ID NO:32 (белок FBC39 VL - scFv)
DIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQANSFPPTFGCGTKLEIK
SEQ ID NO:33 (белок FBC39 VH - scFv)
EVQLVVSGGGLVKPGGSLRLSCAASGLSFLNAWMSWVRQAPGKCLEWVGRIKSNTDGGTTDYAAPVKGRFSISRDDSKNMLFLHMSSLRTEDTAVYYCATDGPYSDDFRSGYAARYRYFGMDVWGQGTTVTVSS
SEQ ID NO: 34 (аминокислотная последовательность scFv FBC39-43/105):
DIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKCPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQANSFPPTFGQGTKLEIKGGGGSGGGGSGGGGSGGGGSEVQLVVSGGGLVKPGGSLRLSCAASGLSFLNAWMSWVRQAPGKGLEWVGRIKSNTDGGTTDYAAPVKGRFSISRDDSKNMLFLHMSSLRTEDTAVYYCATDGPYSDDFRSGYAARYRYFGMDVWGCGTTVTVSS
SEQ ID NO:35(белок FBC39 VL - scFv 43/105)
DIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKCPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQANSFPPTFGQGTKLEIK
SEQ ID NO:36 (белок FBC39 VH - scFv 43/105)
EVQLVVSGGGLVKPGGSLRLSCAASGLSFLNAWMSWVRQAPGKGLEWVGRIKSNTDGGTTDYAAPVKGRFSISRDDSKNMLFLHMSSLRTEDTAVYYCATDGPYSDDFRSGYAARYRYFGMDVWGCGTTVTVSS
SEQ ID NO:37 (ДНК VL FBC39 FTL)
GACATCCAGATGACCCAGTCTCCATCTTCCGTGTCTGCATCTGTGGGAGACAGAGTCACCATCACTTGTCGGGCGAGTCAGGATATTAGCACCTGGTTAGCCTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATGCTGCATCCAGTTTGCAAAGTGGGGTCCCATCAAGATTCAGCGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGCCTGCAGCCTGAAGATTTTGCAACTTACTATTGTCAGCAGGCTAACAGTTTCCCTCCGACTTTTGGCCAGGGGACCAAGCTGGAGATCAAAC
SEQ ID NO:38 (белок FBC39 FTL VL)
DIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQANSFPPTFGQGTKLEIK
SEQ ID NO:39 (FBC39 FTL LCDR-1 - Kabat): RASQDISTWLA
SEQ ID NO:40 (FBC39 FTL LCDR-2 - Kabat): AASSLQS
SEQ ID NO:41 (FBC39 FTL LCDR-3 - Kabat): QQANSFPPT
SEQ ID NO:42 (ДНК VH FBC39 FTL)
GAGGTGCAGCTGGTGGAGTCTGGGGGAGGCTTGGTAAAGCCTGGGGGGTCCCTTAGACTCTCCTGTGCAGCCTCTGGATTCACTTTCCTTAACGCCTGGATGAGCTGGGTCCGCCAGGCTCCAGGGAAGGGCCTGGAGTGGGTTGGCCGTATTAAAAGTAATACTGATGGTGGGACAACAGACTACGCCGCACCCGTGAAAGGCAGATTCACCATCTCAAGAGACGATTCAAAGAACACGCTGTATCTGCAAATGAGCAGCCTGAAAACCGAGGACACAGCCGTCTATTACTGCACCACAGATGGACCTTACTCTGACGATTTTAGAAGTGGTTATGCCGCACGCTACCGTTATTTCGGAATGGACGTCTGGGGCCAAGGGACCACGGTCACCGTCTCCTCA
SEQ ID NO:43 (белок FBC39 FTL VH)
EVQLVESGGGLVKPGGSLRLSCAASGFTFLNAWMSWVRQAPGKGLEWVGRIKSNTDGGTTDYAAPVKGRFTISRDDSKNTLYLQMSSLKTEDTAVYYCTTDGPYSDDFRSGYAARYRYFGMDVWGQGTTVTVSS
SEQ ID NO:44 (FBC39 FTL HCDR-1 - Kabat): NAWMS
SEQ ID NO:45 (FBC39 FTL HCDR-2 - Kabat): RIKSNTDGGTTDYAAPVKG
SEQ ID NO:46 (FBC39 FTL HCDR-3 - Kabat): DGPYSDDFRSGYAARYRYFGMDV
SEQ ID NO: 47 (аминокислотная последовательность scFv FBC39FTL):
DIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQANSFPPTFGCGTKLEIKGGGGSGGGGSGGGGSGGGGSEVQLVESGGGLVKPGGSLRLSCAASGFTFLNAWMSWVRQAPGKCLEWVGRIKSNTDGGTTDYAAPVKGRFTISRDDSKNTLYLQMSSLKTEDTAVYYCTTDGPYSDDFRSGYAARYRYFGMDVWGQGTTVTVSS
SEQ ID NO:48 (белок FBC39 FTL VL - scFv)
DIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQANSFPPTFGCGTKLEIK
SEQ ID NO:49 (белок FBC39 FTL VH - scFv)
EVQLVESGGGLVKPGGSLRLSCAASGFTFLNAWMSWVRQAPGKCLEWVGRIKSNTDGGTTDYAAPVKGRFTISRDDSKNTLYLQMSSLKTEDTAVYYCTTDGPYSDDFRSGYAARYRYFGMDVWGQGTTVTVSS
SEQ ID NO: 50: (аминокислотная последовательность scFv FBC39FTL-43/105):
DIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKCPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQANSFPPTFGQGTKLEIKGGGGSGGGGSGGGGSGGGGSEVQLVESGGGLVKPGGSLRLSCAASGFTFLNAWMSWVRQAPGKGLEWVGRIKSNTDGGTTDYAAPVKGRFTISRDDSKNTLYLQMSSLKTEDTAVYYCTTDGPYSDDFRSGYAARYRYFGMDVWGCGTTVTVSS
SEQ ID NO:51 (белок FBC39 FTL VL - scFv 43/105)
DIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKCPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQANSFPPTFGQGTKLEIK
SEQ ID NO:52 (белок FBC39 FTL VH - scFv 43/105)
EVQLVESGGGLVKPGGSLRLSCAASGFTFLNAWMSWVRQAPGKGLEWVGRIKSNTDGGTTDYAAPVKGRFTISRDDSKNTLYLQMSSLKTEDTAVYYCTTDGPYSDDFRSGYAARYRYFGMDVWGCGTTVTVSS
SEQ ID NO:53(ДНК VL FBD94)
GAAATTGTGTTGACACAGTCTCCAGCCACTCTGTCTTTGTCTCCAGGGGAAAGAGCCACCCTCTCCTGCAGGGCCAGTCGGAGTATTACCACCTTCTTAGCCTGGTACCAACAAAAACCTGGCCAGGCTCCCAGGCTCCTCATCTACGATGCATCCAACAGGGCCACTGGCGTCCCAGCCAGGTTCAGTGGCAGTGGGTCTGGGACAGACTTCACTCTCACCATCAACAGCCTAGAGCCTGACGATTTTGCAATTTATTACTGTCAGCAGCGTGACCACTGGCCTCCGATCTTCGGCCAAGGGACACGACTGGAGATTAAAC
SEQ ID NO:54 (белок FBD94 VL)
EIVLTQSPATLSLSPGERATLSCRASRSITTFLAWYQQKPGQAPRLLIYDASNRATGVPARFSGSGSGTDFTLTINSLEPDDFAIYYCQQRDHWPPIFGQGTRLEIK
SEQ ID NO:55 (FBD94 LCDR-1 - Kabat): RASRSITTFLA
SEQ ID NO:56 (FBD94 LCDR-2 - Kabat): DASNRAT
SEQ ID NO:57 (FBD94 LCDR-3 - Kabat): QQRDHWPPI
SEQ ID NO:58(ДНК VH FBD94)
GAAGTGCAGCTGGTGGAGTCTGGGGGAGGCTTGGTGCAACCTGGCAGGTCCCTGAGACTCTCCTGTGCAGTTTCTGGATTCATCTTTGAAGATTATGCCATAAACTGGGTCCGGCAAGCTCCAGGGAAGGGCCTGGAGTGGGTCTCAATTATTAGTTGGGACAGTGGTAGGATAGGCTACGCGGACTCTGTGAGGGGCCGATTCACCATCTCCAGAGACAACGCCAAGAACTCCTCGTTTCTGCAAATGAACAGTCTGAGACCCGAAGACACGGCCGTGTATTATTGTGTAAAAGATATGTTGGCGTATTATTATGATGGTAGCGGCATCAGGTACAACCTCTACGGTATGGACGTCTGGGGCCAAGGGACCACGGTCACCGTCTCCTCAG
SEQ ID NO:59 (белок FBD94 VH)
EVQLVESGGGLVQPGRSLRLSCAVSGFIFEDYAINWVRQAPGKGLEWVSIISWDSGRIGYADSVRGRFTISRDNAKNSSFLQMNSLRPEDTAVYYCVKDMLAYYYDGSGIRYNLYGMDVWGQGTTVTVSS
SEQ ID NO:60 (FBD94 HCDR-1 - Kabat): DYAIN
SEQ ID NO:61 (FBD94 HCDR-2 - Kabat): IISWDSGRIGYADSVRG
SEQ ID NO:62 (FBD94 HCDR-3 - Kabat): DMLAYYYDGSGIRYNLYGMDV
SEQ ID NO: 63 (аминокислотная последовательность scFv FBD94):
EIVLTQSPATLSLSPGERATLSCRASRSITTFLAWYQQKPGQAPRLLIYDASNRATGVPARFSGSGSGTDFTLTINSLEPDDFAIYYCQQRDHWPPIFGCGTRLEIKGGGGSGGGGSGGGGSGGGGSEVQLVESGGGLVQPGRSLRLSCAVSGFIFEDYAINWVRQAPGKCLEWVSIISWDSGRIGYADSVRGRFTISRDNAKNSSFLQMNSLRPEDTAVYYCVKDMLAYYYDGSGIRYNLYGMDVWGQGTTVTVSS
SEQ ID NO:64 (белок FBD94 VL -scFv)
EIVLTQSPATLSLSPGERATLSCRASRSITTFLAWYQQKPGQAPRLLIYDASNRATGVPARFSGSGSGTDFTLTINSLEPDDFAIYYCQQRDHWPPIFGCGTRLEIK
SEQ ID NO:65 (белок FBD94 VH - scFv)
EVQLVESGGGLVQPGRSLRLSCAVSGFIFEDYAINWVRQAPGKCLEWVSIISWDSGRIGYADSVRGRFTISRDNAKNSSFLQMNSLRPEDTAVYYCVKDMLAYYYDGSGIRYNLYGMDVWGQGTTVTVSS
SEQ ID NO: 66 (легкая цепь GL20/39 BiS4 100/44):
DIQMTQSPSSLSASVGDRVTITCRTSQSLSSYTHWYQQKPGKAPKLLIYAASSRGSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 67 (тяжелая цепь GL20/39 BiS4 100/44):
QVQLQQSGPGLVKPSQTLSLTCAISGDSVSSYNAVWNWIRQSPSRGLEWLGRTYYRSGWYNDYAESVKSRITINPDTSKNQFSLQLNSVTPEDTAVYYCARSGHITVFGVNVDAFDMWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCGGGGSGGGGSDIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQANSFPPTFGCGTKLEIKGGGGSGGGGSGGGGSGGGGSEVQLVVSGGGLVKPGGSLRLSCAASGLSFLNAWMSWVRQAPGKCLEWVGRIKSNTDGGTTDYAAPVKGRFSISRDDSKNMLFLHMSSLRTEDTAVYYCATDGPYSDDFRSGYAARYRYFGMDVWGQGTTVTVSSGGGGSGGGGSDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 68 (легкая цепь GL20/39 BiS4 43/105):
DIQMTQSPSSLSASVGDRVTITCRTSQSLSSYTHWYQQKPGKAPKLLIYAASSRGSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:69 (тяжелая цепь GL20/39 BiS4 43/105):
QVQLQQSGPGLVKPSQTLSLTCAISGDSVSSYNAVWNWIRQSPSRGLEWLGRTYYRSGWYNDYAESVKSRITINPDTSKNQFSLQLNSVTPEDTAVYYCARSGHITVFGVNVDAFDMWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCGGGGSGGGGSDIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKCPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQANSFPPTFGQGTKLEIKGGGGSGGGGSGGGGSGGGGSEVQLVVSGGGLVKPGGSLRLSCAASGLSFLNAWMSWVRQAPGKGLEWVGRIKSNTDGGTTDYAAPVKGRFSISRDDSKNMLFLHMSSLRTEDTAVYYCATDGPYSDDFRSGYAARYRYFGMDVWGCGTTVTVSSGGGGSGGGGSDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 70 (ДНК VH FBC39 scFv-FY1 для прямого праймера FY1/39 BiS2 100/44)
TTCTCTCCACAGGTGTaCActccGACATCCAGATGACCCAGTCTC
SEQ ID NO: 71 (ДНК VH FBC39 scFv-FY1 для обратного праймера FY1/39 BiS2 100/44)
gGATGGGCCCTTGGTcGAcGCGCTTGACACGGTGACCATAGTC
SEQ ID NO: 72 (прямой праймер FBC39 scFv FY1/39 BiS4 100/44)
CTCTGGCGGAGGGggatccGACATCCAGATGACCCAGTCTC
SEQ ID NO: 73 (обратный праймер FBC39 scFv FY1/39 BiS4 100/44)
GTGAGTTTTGTCggatccCCCTCCGCCAGAGCCACCTCCGCCTGAGGAGACGGTGACCGTGG
SEQ ID NO: 74 (прямой праймер BiS1 FBC39):
CTGGCTCCCCGGGGCgcgcTGTGACATCCAGATGACCCAGTCTCC
SEQ ID NO: 75 (обратный праймер BiS1 FBC39):
CCCCTCCGCCGGATCCCCCTCCGCCTGAGGAGACGGTGACCGTGGTC
SEQ ID NO: 76(прямой праймер BiD1 FY1-VL):
AGGGGGATCCGGCGGAGGGGGCTCTGATATTCAGATGACCCAGAGCCC
SEQ ID NO: 77 (обратный праймер BiS1 FY1-VL):
TGGTGCAGCCACCGTACGTTTGATCTCCACCTTAGTGCCC
SEQ ID NO: 78 (прямой праймер FY1/39 BiS3 100/44 - FBC39 scFv):
AAAGGCGGAGGGGGATCCGGCGGAGGGGGCTCTGACATCCAGATGACCCAGTCTC
SEQ ID NO: 79 (обратный праймер FY1/39 BiS3 100/44 - FBC39 scFv):
TCAATGAATTCGCGGCCGCTCATGAGGAGACGGTGACCGTGGTC
SEQ ID NO: 80 (прямой праймер FY1/94 BiS2 100/44 - FBD94 scFv):
TTCTCTCCACAGGTGTaCActccGAAATTGTGTTGACACAGTCTC
SEQ ID NO: 81 (обратный праймер FY1/94 BiS2 100/44 - FBD94 scFv):
CCCCTCCGCCGGATCCCCCTCCGCCTGAGGAGACGGTGACCGTGGTC
SEQ ID NO: 82 (прямой праймер FY1/94 BiS2 100/44 - VH FY1):
AGGGGGATCCGGCGGAGGGGGCTCTCAGGTCCAGCTGCAGGAGAGC
SEQ ID NO: 83 (обратный праймер FY1/94 BiS2 100/44 - VH FY1):
gGATGGGCCCTTGGTcGAcGCGCTTGACACGGTGACCATAGTC
SEQ ID NO: 84 (прямой праймер FY1/94 BiS4 100/44 - FBD94 scFv):
CTCTGGCGGAGGGggatccGAAATTGTGTTGACACAGTCTC
SEQ ID NO: 85 (обратный праймер FY1/94 BiS4 100/44 - FBD94 scFv):
GTGAGTTTTGTCggatccCCCTCCGCCAGAGCCACCTCCGCCTGAGGAGACGGTGACCGTGG
SEQ ID NO: 86 (прямой праймер FY1/39 BiS4 43/105 - FBC39-43/105 scFv):
CTCTGGCGGAGGGggatccGACATCCAGATGACCCAGTCTC
SEQ ID NO: 87 (обратный праймер FY1/39 BiS4 43/105 - FBC39-43/105 scFv):
GTGAGTTTTGTCggatccCCCTCCGCCAGAGCCACCTCCGCCTGAGGAGACGGTGACCGTGG
SEQ ID NO: 88 (прямой праймер GL20/39FTL BiS4 100/44 - FBC39FTL scFv):
CTCTGGCGGAGGGggatccGACATCCAGATGACCCAGTCTC
SEQ ID NO: 89 (обратный праймер GL20/39FTL BiS4 100/44 - FBC39FTL scFv):
GTGAGTTTTGTCggatccCCCTCCGCCAGAGCCACCTCCGCCTGAGGAGACGGTGACCGTGG
SEQ ID NO: 90 (прямой праймер GL20/39FTL BiS4 43/105 - FBC39FTL43/105 scFv):
CTCTGGCGGAGGGggatccGACATCCAGATGACCCAGTCTC
SEQ ID NO: 91 (обратный праймер GL20/39FTL BiS4 43/105 - FBC39FTL43/105 scFv):
GTGAGTTTTGTCggatccCCCTCCGCCAGAGCCACCTCCGCCTGAGGAGACGGTGACCGTGG
SEQ ID NO: 92 (линкер Gly/ser)
GGGGSGGGGSGGGGSGGGGS
SEQ ID NO: 93 (линкер Gly/ser)
[GGGGS]n, где n равняется 0, 1, 2, 3, 4 или 5
SEQ ID NO:94 (FBC-39 LCDR-1 - IMGT):QDISTW
SEQ ID NO:95 (FBC-39 LCDR-2 - IMGT):AAS
SEQ ID NO:96 (FBC-39 LCDR-3 - IMGT):QQANSFPPT
SEQ ID NO:97 (FBC-39 HCDR-1 - IMGT):GLSFLNAW
SEQ ID NO:98 (FBC-39 HCDR-2 - IMGT): IKSNTDGGTT
SEQ ID NO:99 (FBC-39 HCDR-3 - IMGT):TDGPYSDDFRSGYAARYRYFGMDVW
SEQ ID NO:100 (FBC-39 FTL LCDR-1 - IMGT):QDISTW
SEQ ID NO:101(FBC-39 FTL LCDR-2 - IMGT):AAS
SEQ ID NO:102 (FBC-39 FTL LCDR-3 - IMGT):QQANSFPPT
SEQ ID NO:103 (FBC-39 FTL HCDR-1 - IMGT):GFTFLNAW
SEQ ID NO:104 (FBC-39 FTL HCDR-2 - IMGT):IKSNTDGGTT
SEQ ID NO:105 (FBC-39 FTL HCDR-3 - IMGT):TTDGPYSDDFRSGYAARYRYFGMDV
SEQ ID NO: 106 (линкер Gly/ser)
[GGGG]n, где n равняется 0, 1, 2, 3, 4 или 5
SEQ ID NO: 107 (легкая цепь FY1/39 Bis2 100/44)
DIQMTQSPSSLSASVGDRVTITCRTSQSLSSYLHWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 108 (тяжелая цепь FY1/39 Bis2 100/44)
DIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQANSFPPTFGCGTKLEIKGGGGSGGGGSGGGGSGGGGSEVQLVVSGGGLVKPGGSLRLSCAASGLSFLNAWMSWVRQAPGKCLEWVGRIKSNTDGGTTDYAAPVKGRFSISRDDSKNMLFLHMSSLRTEDTAVYYCATDGPYSDDFRSGYAARYRYFGMDVWGQGTTVTVSSGGGGSGGGGSQVQLQESGPGLVKPSQTLSLTCAISGDSVSSNNAVWNWIRQSPSRGLEWLGRTYYRSKWYNDYAESVKSRITVNPDTSKNQFSLHLKSVTPEDTAVFYCVRSGHITVFGVNVDAFDMWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 109 (легкая цепь FY1/39 Bis4 100/44)
DIQMTQSPSSLSASVGDRVTITCRTSQSLSSYLHWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 110 (тяжелая цепь FY1/39 Bis4 100/44)
QVQLQESGPGLVKPSQTLSLTCAISGDSVSSNNAVWNWIRQSPSRGLEWLGRTYYRSKWYNDYAESVKSRITVNPDTSKNQFSLHLKSVTPEDTAVFYCVRSGHITVFGVNVDAFDMWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCGGGGSGGGGSDIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQANSFPPTFGCGTKLEIKGGGGSGGGGSGGGGSGGGGSEVQLVVSGGGLVKPGGSLRLSCAASGLSFLNAWMSWVRQAPGKCLEWVGRIKSNTDGGTTDYAAPVKGRFSISRDDSKNMLFLHMSSLRTEDTAVYYCATDGPYSDDFRSGYAARYRYFGMDVWGQGTTVTVSSGGGGSGGGGSDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:111 (ДНК VH FBC39 scFv-FY1):
GACATCCAGATGACCCAGTCTCCATCTTCCGTGTCTGCATCTGTGGGAGACAGAGTCACCATCACTTGTCGGGCGAGTCAGGATATTAGCACCTGGTTAGCCTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATGCTGCATCCAGTTTGCAAAGTGGGGTCCCATCAAGATTCAGCGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGCCTGCAGCCTGAAGATTTTGCAACTTACTTTTGTCAGCAGGCTAACAGTTTCCCTCCGACTTTTGGCTGCGGGACCAAGCTGGAGATCAAAGGCGGAGGGGGCTCTGGGGGAGGGGGCAGCGGCGGCGGAGGATCTGGGGGAGGGGGCAGCGAGGTGCAGCTGGTGGTGTCTGGGGGAGGCTTGGTAAAGCCTGGGGGGTCCCTTAGACTCTCCTGTGCAGCCTCTGGACTCAGTTTCCTTAACGCCTGGATGAGCTGGGTCCGCCAGGCTCCAGGGAAGTGCCTGGAGTGGGTTGGCCGTATTAAAAGTAATACTGATGGTGGGACAACAGACTACGCCGCACCCGTGAAAGGCAGATTCAGCATCTCAAGAGACGATTCAAAGAACATGCTGTTTCTGCATATGAGCAGCCTGAGAACCGAGGACACAGCCGTCTATTACTGCGCCACAGATGGACCTTACTCTGACGATTTTAGAAGTGGTTATGCCGCACGCTACCGTTATTTCGGAATGGACGTCTGGGGCCAAGGGACCACGGTCACCGTCTCCTCAGGCGGAGGGGGATCCGGCGGAGGGGGCTCTCAGGTCCAGCTGCAGGAGAGCGGCCCCGGACTGGTCAAGCCTTCACAGACACTGAGCCTGACATGCGCCATTAGCGGAGATAGCGTGAGCTCCAACAATGCCGTGTGGAACTGGATCAGGCAGTCTCCAAGTCGAGGACTGGAGTGGCTGGGACGAACATACTATAGATCCAAGTGGTACAATGACTATGCTGAATCAGTGAAAAGCCGAATTACTGTCAACCCCGATACCTCCAAGAATCAGTTCTCTCTGCACCTGAAAAGTGTGACCCCTGAGGACACAGCCGTGTTCTACTGCGTCAGAAGCGGCCATATCACCGTCTTTGGCGTCAATGTGGATGCTTTCGATATGTGGGGGCAGGGGACTATGGTCACCGTGTCAAGC
SEQ ID NO:112 (ДНК scFv FBC39):
GACATCCAGATGACCCAGTCTCCATCTTCCGTGTCTGCATCTGTGGGAGACAGAGTCACCATCACTTGTCGGGCGAGTCAGGATATTAGCACCTGGTTAGCCTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATGCTGCATCCAGTTTGCAAAGTGGGGTCCCATCAAGATTCAGCGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGCCTGCAGCCTGAAGATTTTGCAACTTACTTTTGTCAGCAGGCTAACAGTTTCCCTCCGACTTTTGGCTGCGGGACCAAGCTGGAGATCAAAGGCGGAGGGGGCTCTGGGGGAGGGGGCAGCGGCGGCGGAGGATCTGGGGGAGGGGGCAGCGAGGTGCAGCTGGTGGTGTCTGGGGGAGGCTTGGTAAAGCCTGGGGGGTCCCTTAGACTCTCCTGTGCAGCCTCTGGACTCAGTTTCCTTAACGCCTGGATGAGCTGGGTCCGCCAGGCTCCAGGGAAGTGCCTGGAGTGGGTTGGCCGTATTAAAAGTAATACTGATGGTGGGACAACAGACTACGCCGCACCCGTGAAAGGCAGATTCAGCATCTCAAGAGACGATTCAAAGAACATGCTGTTTCTGCATATGAGCAGCCTGAGAACCGAGGACACAGCCGTCTATTACTGCGCCACAGATGGACCTTACTCTGACGATTTTAGAAGTGGTTATGCCGCACGCTACCGTTATTTCGGAATGGACGTCTGGGGCCAAGGGACCACGGTCACCGTCTCCTCA
SEQ ID NO: 113(легкая цепь FY1/39 Bis1 100/44)
DIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQANSFPPTFGCGTKLEIKGGGGSGGGGSGGGGSGGGGSEVQLVVSGGGLVKPGGSLRLSCAASGLSFLNAWMSWVRQAPGKCLEWVGRIKSNTDGGTTDYAAPVKGRFSISRDDSKNMLFLHMSSLRTEDTAVYYCATDGPYSDDFRSGYAARYRYFGMDVWGQGTTVTVSSGGGGSGGGGSDIQMTQSPSSLSASVGDRVTITCRTSQSLSSYLHWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 114(тяжелая цепь FY1/39 Bis1 100/44)
QVQLQESGPGLVKPSQTLSLTCAISGDSVSSNNAVWNWIRQSPSRGLEWLGRTYYRSKWYNDYAESVKSRITVNPDTSKNQFSLHLKSVTPEDTAVFYCVRSGHITVFGVNVDAFDMWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 115(легкая цепь FY1/39 Bis3 100/44)
DIQMTQSPSSLSASVGDRVTITCRTSQSLSSYLHWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 116(тяжелая цепь FY1/39 Bis3 100/44)
QVQLQESGPGLVKPSQTLSLTCAISGDSVSSNNAVWNWIRQSPSRGLEWLGRTYYRSKWYNDYAESVKSRITVNPDTSKNQFSLHLKSVTPEDTAVFYCVRSGHITVFGVNVDAFDMWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKGGGGSGGGGSDIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQANSFPPTFGCGTKLEIKGGGGSGGGGSGGGGSGGGGSEVQLVVSGGGLVKPGGSLRLSCAASGLSFLNAWMSWVRQAPGKCLEWVGRIKSNTDGGTTDYAAPVKGRFSISRDDSKNMLFLHMSSLRTEDTAVYYCATDGPYSDDFRSGYAARYRYFGMDVWGQGTTVTVSS
SEQ ID NO: 117 (легкая цепь FY1/94 Bis2 100/44)
DIQMTQSPSSLSASVGDRVTITCRTSQSLSSYLHWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 118 (тяжелая цепь FY1/94 Bis2 100/44)
EIVLTQSPATLSLSPGERATLSCRASRSITTFLAWYQQKPGQAPRLLIYDASNRATGVPARFSGSGSGTDFTLTINSLEPDDFAIYYCQQRDHWPPIFGCGTRLEIKGGGGSGGGGSGGGGSGGGGSEVQLVESGGGLVQPGRSLRLSCAVSGFIFEDYAINWVRQAPGKCLEWVSIISWDSGRIGYADSVRGRFTISRDNAKNSSFLQMNSLRPEDTAVYYCVKDMLAYYYDGSGIRYNLYGMDVWGQGTTVTVSSGGGGSGGGGSQVQLQESGPGLVKPSQTLSLTCAISGDSVSSNNAVWNWIRQSPSRGLEWLGRTYYRSKWYNDYAESVKSRITVNPDTSKNQFSLHLKSVTPEDTAVFYCVRSGHITVFGVNVDAFDMWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:119 (ДНК scFv FBD94):
GAAATTGTGTTGACACAGTCTCCAGCCACTCTGTCTTTGTCTCCAGGGGAAAGAGCCACCCTCTCCTGCAGGGCCAGTCGGAGTATTACCACCTTCTTAGCCTGGTACCAACAAAAACCTGGCCAGGCTCCCAGGCTCCTCATCTACGATGCATCCAACAGGGCCACTGGCGTCCCAGCCAGGTTCAGTGGCAGTGGGTCTGGGACAGACTTCACTCTCACCATCAACAGCCTAGAGCCTGACGATTTTGCAATTTATTACTGTCAGCAGCGTGACCACTGGCCTCCGATCTTCGGCTGTGGGACACGACTGGAGATTAAAGGAGGCGGAGGATCTGGTGGTGGTGGATCTGGCGGCGGAGGAAGTGGTGGCGGAGGCTCTGAAGTGCAGCTGGTGGAGTCTGGGGGAGGCTTGGTGCAACCTGGCAGGTCCCTGAGACTCTCCTGTGCAGTTTCTGGATTCATCTTTGAAGATTATGCCATAAACTGGGTCCGGCAAGCTCCAGGGAAGTGCCTGGAGTGGGTCTCAATTATTAGTTGGGACAGTGGTAGGATAGGCTACGCGGACTCTGTGAGGGGCCGATTCACCATCTCCAGAGACAACGCCAAGAACTCCTCGTTTCTGCAAATGAACAGTCTGAGACCCGAAGACACCGCCGTGTATTATTGTGTAAAAGATATGTTGGCGTATTATTATGATGGTAGCGGCATCAGGTACAACCTCTACGGTATGGACGTCTGGGGCCAAGGGACCACGGTCACCGTCTCCTCA
SEQ ID NO: 120 (легкая цепь FY1/39 Bis4 43/105)
DIQMTQSPSSLSASVGDRVTITCRTSQSLSSYLHWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 121 (тяжелая цепь FY1/39 Bis4 43/105)
QVQLQESGPGLVKPSQTLSLTCAISGDSVSSNNAVWNWIRQSPSRGLEWLGRTYYRSKWYNDYAESVKSRITVNPDTSKNQFSLHLKSVTPEDTAVFYCVRSGHITVFGVNVDAFDMWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCGGGGSGGGGSDIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKCPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQANSFPPTFGQGTKLEIKGGGGSGGGGSGGGGSGGGGSEVQLVVSGGGLVKPGGSLRLSCAASGLSFLNAWMSWVRQAPGKGLEWVGRIKSNTDGGTTDYAAPVKGRFSISRDDSKNMLFLHMSSLRTEDTAVYYCATDGPYSDDFRSGYAARYRYFGMDVWGCGTTVTVSSGGGGSGGGGSDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:122 (ДНК scFv FBC39-43/105):
GACATCCAGATGACCCAGTCTCCATCTTCCGTGTCTGCATCTGTGGGAGACAGAGTCACCATCACTTGTCGGGCGAGTCAGGATATTAGCACCTGGTTAGCCTGGTATCAGCAGAAACCAGGGAAATGCCCTAAGCTCCTGATCTATGCTGCATCCAGTTTGCAAAGTGGGGTCCCATCAAGATTCAGCGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGCCTGCAGCCTGAAGATTTTGCAACTTACTTTTGTCAGCAGGCTAACAGTTTCCCTCCGACTTTTGGCCAGGGGACCAAGCTGGAGATCAAAGGAGGCGGAGGATCTGGTGGTGGTGGATCTGGCGGCGGAGGAAGTGGTGGCGGAGGCTCTGAGGTGCAGCTGGTGGTGTCTGGGGGAGGCTTGGTAAAGCCTGGGGGGTCCCTTAGACTCTCCTGTGCAGCCTCTGGACTCAGTTTCCTTAACGCCTGGATGAGCTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGGTTGGCCGTATTAAAAGTAATACTGATGGTGGGACAACAGACTACGCCGCACCCGTGAAAGGCAGATTCAGCATCTCAAGAGACGATTCAAAGAACATGCTGTTTCTGCATATGAGCAGCCTGAGAACCGAGGACACAGCCGTCTATTACTGCGCCACAGATGGACCTTACTCTGACGATTTTAGAAGTGGTTATGCCGCACGCTACCGTTATTTCGGAATGGACGTCTGGGGCTGCGGGACCACGGTCACCGTCTCCTCA
SEQ ID NO:123 (LC/VH GL20):
GATATTCAGATGACCCAGAGCCCTTCCAGCCTGTCCGCTTCAGTGGGGGATCGAGTGACCATTACCTGCCGAACCAGCCAGAGCCTGAGCTCCTACACGCACTGGTATCAGCAGAAGCCCGGCAAAGCCCCTAAGCTGCTGATCTACGCCGCTTCTAGTCGGGGGTCCGGAGTGCCAAGCCGGTTCTCCGGATCTGGGAGTGGAACCGACTTTACCCTGACAATTTCAAGCCTGCAGCCCGAGGATTTCGCTACATACTACTGTCAGCAGAGCAGAACTTTCGGGCAGGGCACTAAGGTGGAGATCAAACGTACGGTGGCTGCACCATCTGTCTTCATCTTCCCGCCATCTGATGAGCAGTTGAAATCTGGAACTGCCTCTGTTGTGTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGTACAGTGGAAGGTGGATAACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGACAGCACCTACAGCCTCAGCAGCACCCTGACGCTGAGCAAAGCAGACTACGAGAAACACAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGTCACAAAGAGCTTCAACAGGGGAGAGTGTTAGTGAGCTAGCGATGATAATCAGCCATACCACATTTGTAGAGGTTTTACTTGCTTTAAAAAACCTCCCACACCTCCCCCTGAACCTGAAACATAAAATGAATGCAATTGTTGTTGTTAACTTGTTTATTGCAGCTTATAATGGTTACAAATAAAGCAATAGCATCACAAATTTCACAAATAAAGCATTTTTTTCACTGCATTCTAGTTGTGGTTTGTCCAAACTCATCAATGTATCTTATCATGTCTGGATgggcccGTTTAAACCCGCTGATCAGCCTCGACTGTGCCTTCTAGTTGCCAGCCATCTGTTGTTTGCCCCTCCCCCGTGCCTTCCTTGACCCTGGAAGGTGCCACTCCCACTGTCCTTTCCTAATAAAATGAGGAAATTGCATCGCATTGTCTGAGTAGGTGTCATTCTATTCTGGGGGGTGGGGTGGGGCAGGACAGCAAGGGGGAGGATTGGGAAGACAATAGCAGGCATGCTGGGGATGCGGTGGGCTCTATGGCTTCTGAGGCGGAAAGAACCAGCTGGGGCtctagcTAGTTATTAATAGTAATCAATTACGGGGTCATTAGTTCATAGCCCATATATGGAGTTCCGCGTTACATAACTTACGGTAAATGGCCCGCCTGGCTGACCGCCCAACGACCCCCGCCCATTGACGTCAATAATGACGTATGTTCCCATAGTAACGCCAATAGGGACTTTCCATTGACGTCAATGGGTGGAGTATTTACGGTAAACTGCCCACTTGGCAGTACATCAAGTGTATCATATGCCAAGTACGCCCCCTATTGACGTCAATGACGGTAAATGGCCCGCCTGGCATTATGCCCAGTACATGACCTTATGGGACTTTCCTACTTGGCAGTACATCTACGTATTAGTCATCGCTATTACCATGGTGATGCGGTTTTGGCAGTACATCAATGGGCGTGGATAGCGGTTTGACTCACGGGGATTTCCAAGTCTCCACCCCATTGACGTCAATGGGAGTTTGTTTTGGCACCAAAATCAACGGGACTTTCCAAAATGTCGTAACAACTCCGCCCCATTGACGCAAATGGGCGGTAGGCGTGTACGGTGGGAGGTCTATATAAGCAGAGCTCGTTTAGTGAACCGTCAGATCGCCTGGAGACGCCATCCACGCTGTTTTGACCTCCATAGAAGACACCGGGACCGATCCAGCCTCCGCGGCCGGGAACGGTGCATTGGAACGCGGATTCCCCGTGCCAAGAGTGACGTAAGTACCGCCTATAGACTCTATAGGCACACCCCTTTGGCTCTTATGCATGAATTAATACGACTCACTATAGGGAGACAGACTGTTCCTTTCCTGGGTCTTTTCTGCAGGCACCGTCgccgccaccatgGGATGGAGCTGTATCATCCTCTTCTTGGTAGCAACAGCTACAGGTAAGGGGCTCACAGTAGCAGGCTTGAGGTCTAGACATATATATGGGTGACAATGACATCCACTTTGCCTTTCTCTCCACAGGTGTaCActccCAGGTCCAGCTGCAGCAGAGCGGCCCCGGACTGGTCAAGCCTTCACAGACACTGAGCCTGACATGCGCCATTAGCGGAGATAGCGTGAGCTCCTACAATGCCGTGTGGAACTGGATCAGGCAGTCTCCAAGTCGAGGACTGGAGTGGCTGGGACGAACATACTATAGATCCGGGTGGTACAATGACTATGCTGAATCAGTGAAAAGCCGAATTACTATCAACCCCGATACCTCCAAGAATCAGTTCTCTCTGCAGCTGAACAGTGTGACCCCTGAGGACACAGCCGTGTACTACTGCGCCAGAAGCGGCCATATCACCGTCTTTGGCGTCAATGTGGATGCTTTCGATATGTGGGGGCAGGGGACTATGGTCACCGTGTCAAGC
SEQ ID NO:124 (ДНК scFv FBC39FTL):
GACATCCAGATGACCCAGTCTCCATCTTCCGTGTCTGCATCTGTGGGAGACAGAGTCACCATCACTTGTCGGGCGAGTCAGGATATTAGCACCTGGTTAGCCTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATGCTGCATCCAGTTTGCAAAGTGGGGTCCCATCAAGATTCAGCGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGCCTGCAGCCTGAAGATTTTGCAACTTACTATTGTCAGCAGGCTAACAGTTTCCCTCCGACTTTTGGCTGCGGGACCAAGCTGGAGATCAAAGGAGGCGGAGGATCTGGTGGTGGTGGATCTGGCGGCGGAGGAAGTGGTGGCGGAGGCTCTGAGGTGCAGCTGGTGGAGTCTGGGGGAGGCTTGGTAAAGCCTGGGGGGTCCCTTAGACTCTCCTGTGCAGCCTCTGGATTCACTTTCCTTAACGCCTGGATGAGCTGGGTCCGCCAGGCTCCAGGGAAGTGCCTGGAGTGGGTTGGCCGTATTAAAAGTAATACTGATGGTGGGACAACAGACTACGCCGCACCCGTGAAAGGCAGATTCACCATCTCAAGAGACGATTCAAAGAACACGCTGTATCTGCAAATGAGCAGCCTGAAAACCGAGGACACAGCCGTCTATTACTGCACCACAGATGGACCTTACTCTGACGATTTTAGAAGTGGTTATGCCGCACGCTACCGTTATTTCGGAATGGACGTCTGGGGCCAAGGGACCACGGTCACCGTCTCCTCA
SEQ ID NO: 125 (легкая цепь GL20/39FTL Bis4 43/105)
DIQMTQSPSSLSASVGDRVTITCRTSQSLSSYTHWYQQKPGKAPKLLIYAASSRGSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 126(тяжелая цепь GL20/39FTL Bis4 43/105)
QVQLQQSGPGLVKPSQTLSLTCAISGDSVSSYNAVWNWIRQSPSRGLEWLGRTYYRSGWYNDYAESVKSRITINPDTSKNQFSLQLNSVTPEDTAVYYCARSGHITVFGVNVDAFDMWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCGGGGSGGGGSDIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKCPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQANSFPPTFGQGTKLEIKGGGGSGGGGSGGGGSGGGGSEVQLVESGGGLVKPGGSLRLSCAASGFTFLNAWMSWVRQAPGKGLEWVGRIKSNTDGGTTDYAAPVKGRFTISRDDSKNTLYLQMSSLKTEDTAVYYCTTDGPYSDDFRSGYAARYRYFGMDVWGCGTTVTVSSGGGGSGGGGSDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:127(ДНК, кодирующая scFv FBC39FTL43/105):
GACATCCAGATGACCCAGTCTCCATCTTCCGTGTCTGCATCTGTGGGAGACAGAGTCACCATCACTTGTCGGGCGAGTCAGGATATTAGCACCTGGTTAGCCTGGTATCAGCAGAAACCAGGGAAATGCCCTAAGCTCCTGATCTATGCTGCATCCAGTTTGCAAAGTGGGGTCCCATCAAGATTCAGCGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGCCTGCAGCCTGAAGATTTTGCAACTTACTATTGTCAGCAGGCTAACAGTTTCCCTCCGACTTTTGGCCAGGGGACCAAGCTGGAGATCAAAGGAGGCGGAGGATCTGGTGGTGGTGGATCTGGCGGCGGAGGAAGTGGTGGCGGAGGCTCTGAGGTGCAGCTGGTGGAGTCTGGGGGAGGCTTGGTAAAGCCTGGGGGGTCCCTTAGACTCTCCTGTGCAGCCTCTGGATTCACTTTCCTTAACGCCTGGATGAGCTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGGTTGGCCGTATTAAAAGTAATACTGATGGTGGGACAACAGACTACGCCGCACCCGTGAAAGGCAGATTCACCATCTCAAGAGACGATTCAAAGAACACGCTGTATCTGCAAATGAGCAGCCTGAAAACCGAGGACACAGCCGTCTATTACTGCACCACAGATGGACCTTACTCTGACGATTTTAGAAGTGGTTATGCCGCACGCTACCGTTATTTCGGAATGGACGTCTGGGGCTGCGGGACCACGGTCACCGTCTCCTCA
SEQ ID NO:128 (легкая цепь GL20/39FTL Bis5 43/105)
DIQMTQSPSSLSASVGDRVTITCRTSQSLSSYTHWYQQKPGKAPKLLIYAASSRGSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:129 (GL20-FBC39 BiS5 - GL20VH - Fc (CH3-) - линкер - FBC39 scFv - линкер - Fc (-CH3))
QVQLQQSGPGLVKPSQTLSLTCAISGDSVSSYNAVWNWIRQSPSRGLEWLGRTYYRSGWYNDYAESVKSRITINPDTSKNQFSLQLNSVTPEDTAVYYCARSGHITVFGVNVDAFDMWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGGGGSGGGGSDIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQANSFPPTFGCGTKLEIKGGGGSGGGGSGGGGSGGGGSEVQLVVSGGGLVKPGGSLRLSCAASGLSFLNAWMSWVRQAPGKCLEWVGRIKSNTDGGTTDYAAPVKGRFSISRDDSKNMLFLHMSSLRTEDTAVYYCATDGPYSDDFRSGYAARYRYFGMDVWGQGTTVTVSSGGGGSGGGGSGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 130 (легкая цепь GL20/39FTL Bis5 43/105)
DIQMTQSPSSLSASVGDRVTITCRTSQSLSSYTHWYQQKPGKAPKLLIYAASSRGSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 131 (GL20VH BiS5 - Fc (CH3-) - линкер - FBC39 (43-105) scFv - линкер - Fc (-CH3))
QVQLQQSGPGLVKPSQTLSLTCAISGDSVSSYNAVWNWIRQSPSRGLEWLGRTYYRSGWYNDYAESVKSRITINPDTSKNQFSLQLNSVTPEDTAVYYCARSGHITVFGVNVDAFDMWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGGGGSGGGGSDIQMTQSPSSVSASVGDRVTITCRASQDISTWLAWYQQKPGKCPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQANSFPPTFGQGTKLEIKGGGGSGGGGSGGGGSGGGGSEVQLVVSGGGLVKPGGSLRLSCAASGLSFLNAWMSWVRQAPGKGLEWVGRIKSNTDGGTTDYAAPVKGRFSISRDDSKNMLFLHMSSLRTEDTAVYYCATDGPYSDDFRSGYAARYRYFGMDVWGCGTTVTVSSGGGGSGGGGSGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| МОЛЕКУЛЫ АНТИТЕЛ ЧЕЛОВЕКА К IL-13 | 2004 |
|
RU2387667C2 |
| АНТИТЕЛА ПРОТИВ ВИРУСА ГЕПАТИТА В И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2803082C2 |
| ПАРТНЕРЫ СПЕЦИФИЧЕСКОГО СВЯЗЫВАНИЯ С NGF | 2006 |
|
RU2406728C2 |
| АНТИГЕН, АССОЦИИРОВАННЫЙ С РЕВМАТОИДНЫМ АРТРИТОМ | 2013 |
|
RU2649368C2 |
| АНТИТЕЛА К ICOS | 2016 |
|
RU2742241C2 |
| ЧЛЕНЫ СВЯЗЫВАНИЯ ПРОТИВ IL-1R1 | 2009 |
|
RU2555532C2 |
| Антитело против IL-4R и его применение | 2018 |
|
RU2758091C1 |
| АНТИТЕЛА, ОБЛАДАЮЩИЕ СПЕЦИФИЧНОСТЬЮ К BTN2, И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2794996C2 |
| МОЛЕКУЛЫ АНТИТЕЛ К КОМПОНЕНТУ 5 КОМПЛЕМЕНТА И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2830091C2 |
| РЕЖИМЫ ДОЗИРОВАНИЯ ДЛЯ АНТИТЕЛ ПРОТИВ TIM-3 И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2804775C2 |
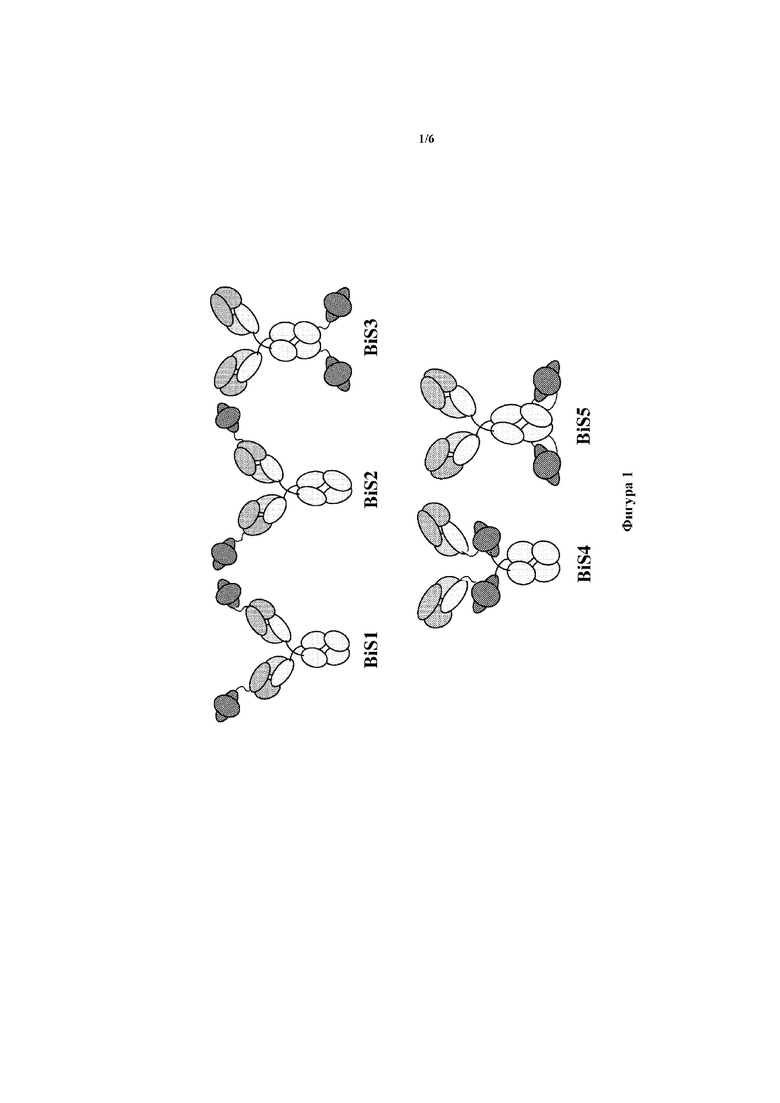
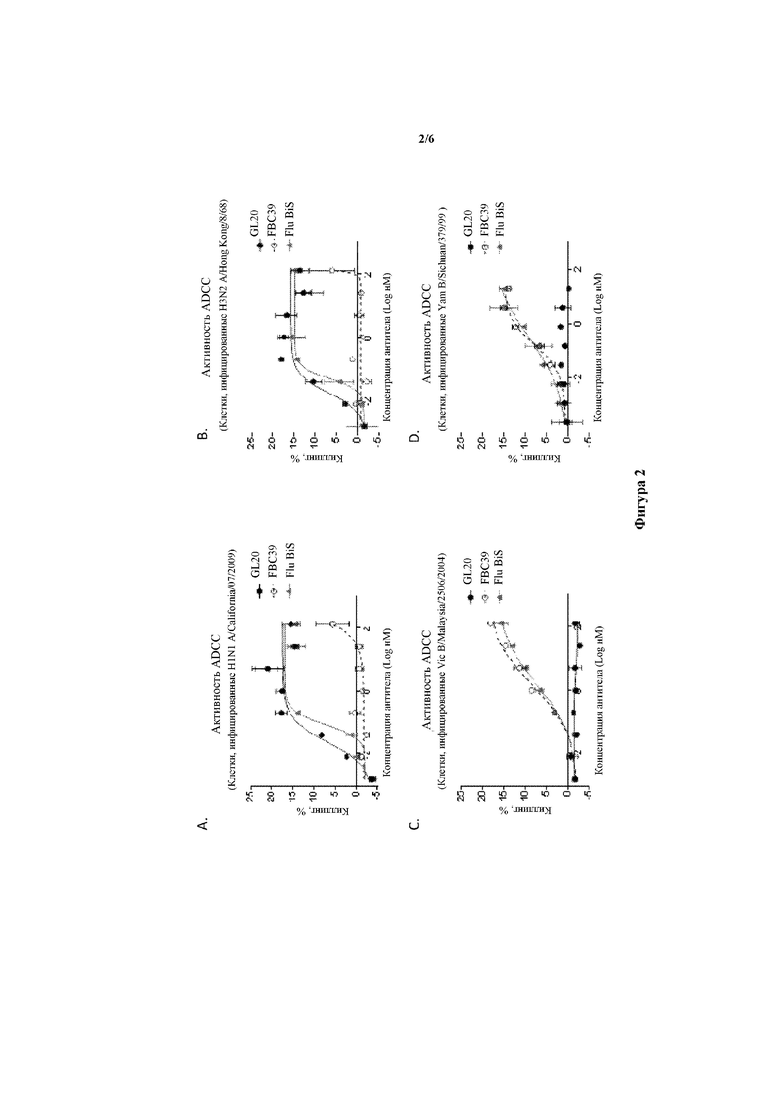


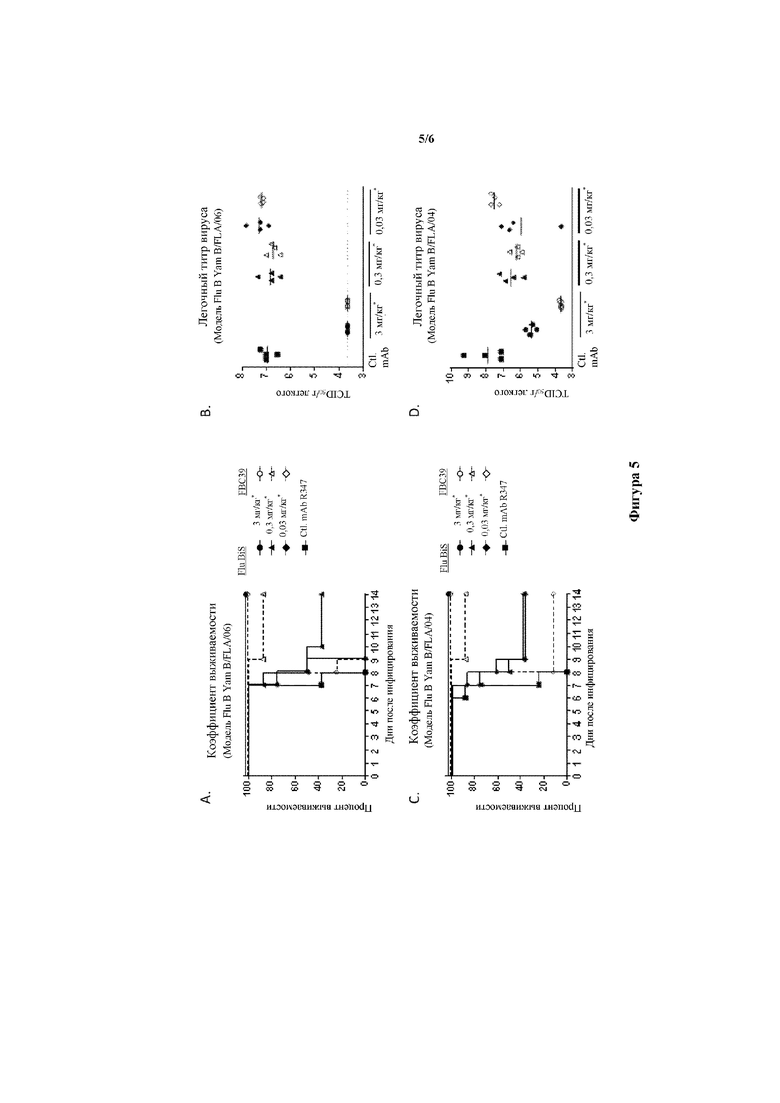

Изобретение относится к области биохимии. Описана группа изобретений, включающая выделенную связывающую молекулу, которая специфически связывается с вирусом гриппа А и вирусом гриппа В, выделенный полинуклеотид, кодирующий вышеуказанную связывающую молекулу, вектор, кодирующий вышеуказанную связывающую молекулу, клетку-хозяина, способную экспрессировать вышеуказанную молекулу, композицию для профилактики или лечения инфекции гриппа А, инфекции гриппа B или их комбинации у пациента, способ получения вышеуказанной связывающей молекулы, способ профилактики или лечения инфекции гриппа А, инфекции гриппа B или их комбинации у пациента. В одном из вариантов реализации выделенная связывающая молекула содержит в себе домен Fv первого антитела, который способен связываться с гемагглютинином (НА) вируса гриппа А и нейтрализовать по меньшей мере один подтип группы 1 и по меньшей мере один подтип группы 2 вируса гриппа А и домен Fv второго антитела, который способен связываться с НА вируса гриппа В и нейтрализовать вирус гриппа В двух филогенетически различных линий. Изобретение расширяет арсенал средств, связывающихся с вирусом гриппа А и вирусом гриппа В. 7 н. и 5 з.п. ф-лы, 6 ил., 12 табл., 9 пр.
1. Выделенная связывающая молекула, которая специфически связывается с вирусом гриппа А и вирусом гриппа В, содержащая:
(a) первый связывающий домен, содержащий домен Fv первого антитела, который способен связываться с гемагглютинином (НА) вируса гриппа А и нейтрализовать по меньшей мере один подтип группы 1 и по меньшей мере один подтип группы 2 вируса гриппа А, причем первое антитело содержит VH и VL, выбранные из:
(i) VH под SEQ ID NO: 7 и VL под SEQ ID NO: 2; и
(ii) VH под SEQ ID NO: 17 и VL под SEQ ID NO: 12; и
(b) второй связывающий домен, содержащий домен Fv второго антитела, который способен связываться с гемагглютинином (НА) вируса гриппа В и нейтрализовать вирус гриппа В по меньшей мере из двух филогенетически различных линий, причем второе антитело содержит VH и VL, выбранные из:
(i) VH под SEQ ID NO: 27 и VL под SEQ ID NO: 22;
(ii) VH под SEQ ID NO: 33 и VL под SEQ ID NO: 32;
(iii) VH под SEQ ID NO: 36 и VL под SEQ ID NO: 35;
(iv) VH под SEQ ID NO: 43 и VL под SEQ ID NO: 38;
(v) VH под SEQ ID NO: 49 и VL под SEQ ID NO: 48;
(vi) VH под SEQ ID NO: 52 и VL под SEQ ID NO: 51;
(vii) VH под SEQ ID NO: 59 и VL под SEQ ID NO: 54 и
(viii) VH под SEQ ID NO: 65 и VL под SEQ ID NO: 64.
2. Выделенная связывающая молекула по п. 1, где первый связывающий домен способен нейтрализовать один или несколько подтипов группы 1 вируса гриппа А, выбранных из H1, H2, H5, H6, H8, H9, H11, H12, H13, H16, H17, H18 и их вариантов; и один или нескольких подтипов группы 2 вируса гриппа A, выбранных из H3, H4, H7, H10, H14 и H15 и их вариантов.
3. Выделенная связывающая молекула по любому из предыдущих пунктов, где второй связывающий домен способен нейтрализовать вирус гриппа В обеих линий Yamagata и Victoria.
4. Выделенная связывающая молекула по любому из пп. 1-3, где связывающая молекула представляет собой биспецифичное антитело.
5. Выделенная связывающая молекула по п.4, где первый связывающий домен содержит Fv-домен антитела к вирусу гриппа А, и второй связывающий домен содержит молекулу scFv антитела к вирусу гриппа В.
6. Выделенная связывающая молекула по п.5, где Fv-домен первого связывающего домена содержит тяжелую цепь (HC), которая содержит полипептидную цепь, имеющую амино-конец и карбокси-конец, и легкую цепь (LC), которая содержит полипептидную цепь, имеющую амино-конец и карбокси-конец, и при этом
(a) второй связывающий домен ковалентно связан с карбокси-концом HC первого связывающего домена;
(b) второй связывающий домен ковалентно связан с амино-концом HC первого связывающего домена;
(c) второй связывающий домен ковалентно связан с амино-концом LC первого связывающего домена; или
(d) второй связывающий домен встроен посредством ковалентного связывания в полипептидную цепь HC первого связывающего домена.
7. Выделенный полинуклеотид, кодирующий выделенную связывающую молекулу, которая специфически связывается с вирусом гриппа А и вирусом гриппа В, содержащий нуклеиновую кислоту, которая кодирует выделенную связывающую молекулу по любому из пп. 1-6.
8. Вектор, кодирующий выделенную связывающую молекулу, которая специфически связывается с вирусом гриппа А и вирусом гриппа В, содержащий полинуклеотид по п.7.
9. Клетка-хозяин, способная экспрессировать выделенную связывающую молекулу, которая специфически связывается с вирусом гриппа А и вирусом гриппа В, содержащая полинуклеотид по п.7.
10. Композиция для профилактики или лечения инфекции гриппа А, инфекции гриппа B или их комбинации у пациента, содержащая выделенную связывающую молекулу по любому из пп. 1-6 и фармацевтически приемлемый носитель.
11. Способ получения выделенной связывающей молекулы, которая специфически связывается с вирусом гриппа А и вирусом гриппа В, по любому из пп. 1-6, включающий культивирование клетки-хозяина, способной экспрессировать выделенную связывающую молекулу, которая специфически связывается с вирусом гриппа А и вирусом гриппа В, в условиях, подходящих для экспрессии связывающей молекулы.
12. Способ профилактики или лечения инфекции гриппа А, инфекции гриппа B или их комбинации у пациента, включающий введение пациенту эффективного количества выделенной связывающей молекулы по любому из пп. 1-6.
| WO 2010010466 A2, 28.01.2010 | |||
| WO 2013132007 A1, 12.09.2013 | |||
| С.М | |||
| Деев, Е.Н | |||
| Лебеденко | |||
| "Современные технологии создания неприродных антител для клинического применения" | |||
| Acta naturae, 2009(1), стр | |||
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| ПРОТИВОВИРУСНОЕ ОДНОДОМЕННОЕ МИНИ-АНТИТЕЛО, НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ, ЭКСПРЕССИРУЮЩИЙ РЕКОМБИНАНТНЫЙ ВИРУСНЫЙ ВЕКТОР, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПРОФИЛАКТИКИ ИЛИ ТЕРАПИИ ГРИППА ТИПА А | 2013 |
|
RU2536956C1 |
Авторы
Даты
2020-05-21—Публикация
2016-05-31—Подача