Область техники
Настоящее изобретение относится к области биотехнологии, конкретно к клеткам живых культур, касается создания и способа применения нового мутантного штамма актиномицета рода Streptomyces для получения природного макролидного антибиотика такролимуса (FR-900506, FK-506) и может быть использовано в промышленной биотехнологии, а также в фармацевтической промышленности, для производства медицинских препаратов на его основе.
Уровень техники
Такролимус (FR-900506, FK-506) - 23-членный макроциклический поликетид (17-алкил-1,14-дигидрокси-12-(2'-(4''-гидрокси-3''-метоксициклогексил)-1'-метилвинил)-23,25-диметокси-13,19,21,27-тетраметил-11,28-диокса-4-азатрицикло-(22.3.1.04,9)-октакос)-18-ен-2,3,10,16-тетраон, C44H69NO12, М.в. 804.018, CAS №104987-11-3), относящийся к классу природных макролидов, который был открыт в 1984 году [Kino Т., Hatanaka Н., Hashimoto М., Nishiyama М., Goto Т., Okuhara М., Kohsaka М., Aoki Н., Imanaka Н. Journal of Antibiotics (Tokyo). 1987, V. 40, №9, p. 1249-1255].
Такролимус широко используется в иммуносупрессивной терапии для предотвращения отторжения органов и тканей при их пересадке [Trede N.S., Warwick А.В., Rosoff P.M., Rohrer R., Bierer B.E., Guinan E. Bone Marrow Transplant. 1997, V. 20, p. 257-260; Meier-Kriesche H.-U., Li S., Gruessner R.W.G., Fung J.J., Bustami R.T., Barr M.L., Leichtman A.B. Am. J. Transplant. 2006, V. 6, p. 1111-1131; McCormack P.L., Keating G.M. Drugs. 2006, V. 66, p. 2269-2279], при лечении атопических дерматитов [Ingram J.R., Martin J.A., Finlay A.Y. Am. J. Clin. Dermatol. 2009, V. 10, p. 229-237; Remitz A., Reitamo S. Expert Opin. Drug Saf. 2009, V. 8, p. 501-506], иммунных заболеваний (ревматоидный артрит и кишечные воспалительные заболевания) [Akimoto K., Kusunoki Y., Nishio S., Takagi K., Kawai S. Clin. Rheumatol. 2008, V. 27, p. 1393-1397; Benson A., Barrett Т., Sparberg M., Buchman A.L. Inflamm. Bowel Dis. 2008, V. 14, p. 7-12]. Такролимус проявляет противовирусную активность против ортопоксвируса, ВИЧ и вируса иммунодефицита кошек (FIV) [Reis S.A.,  N., Damaso C.R.A. J. Appl. Microbiol. 2006, V. 100, p. 1373-1380; Karpas A., Lowdell M., Jacobson S.K., Hill F. Proc. Natl. Acad. Sci. USA. 1992, V. 89, p. 8351-8355; Briggs C.J., Ott D.E., Coren L.V., Oroszlan S.,
N., Damaso C.R.A. J. Appl. Microbiol. 2006, V. 100, p. 1373-1380; Karpas A., Lowdell M., Jacobson S.K., Hill F. Proc. Natl. Acad. Sci. USA. 1992, V. 89, p. 8351-8355; Briggs C.J., Ott D.E., Coren L.V., Oroszlan S.,  J. Arch. Virol. 1999, V. 144, p. 2151-2160; Mortola E., Endo Y., Ohno K., Watari Т., Tsujimoto H., Hasegawa A. Vet. Res. Commun. 1998, V. 22, p. 553-563], обладает нейропротекторными и нейрорегенеративными свойствами [Klettner A., Herdegen Т. Curr. Drug Targets CNS Neurol. Disord. 2003, V. 2, p. 153-162; Sierra-Paredes G.,
J. Arch. Virol. 1999, V. 144, p. 2151-2160; Mortola E., Endo Y., Ohno K., Watari Т., Tsujimoto H., Hasegawa A. Vet. Res. Commun. 1998, V. 22, p. 553-563], обладает нейропротекторными и нейрорегенеративными свойствами [Klettner A., Herdegen Т. Curr. Drug Targets CNS Neurol. Disord. 2003, V. 2, p. 153-162; Sierra-Paredes G.,  G. CNS Neurosci. Ther. 2008, V. 14, p. 36-46; Konofaos P., Terzis J.K. J. Reconstr. Microsurg. 2013, V. 29, p. 141-148], также сообщается о его потенциальном применении в лечении рака [Periyasamy S., Warrer М., Tillekeratne М.Р.М., Shou W., Sanchez E.R. Endocrinology. 2007, V. 148, p. 4716-4726].
G. CNS Neurosci. Ther. 2008, V. 14, p. 36-46; Konofaos P., Terzis J.K. J. Reconstr. Microsurg. 2013, V. 29, p. 141-148], также сообщается о его потенциальном применении в лечении рака [Periyasamy S., Warrer М., Tillekeratne М.Р.М., Shou W., Sanchez E.R. Endocrinology. 2007, V. 148, p. 4716-4726].
Из уровня техники известно, что биосинтез такролимуса осуществляют исключительно штаммы рода Streptomyces [Motamedy Н., Shafiee A. Eur. J. Biochem. 1998, V. 256, p. 528-534; Soo K.H., Park Y.I. J. Ind. Microb. Biotec. 2007, V. 7, №10, p. 1638-1644; EP 2272963 A1, 2011; Jung S., Moon S., Lee K., Park Y.J., Yoon S., Yoo J. Y. J. Ind. Microb. Biotec. 2009, V. 36, p. 1467-1471]. В последние десятилетия опубликовано значительное количество вариантов биосинтеза такролимуса. Так, известны патенты, описывающие его получение как на уровне колб, так и в ферментерах [US 5116756, 1992; US 5194378, 1993; US 5624842, 1997; WO 2005/063963, 2005; WO 2006/011156, 2006; US 20070191415, 2007; US 0318289, 2008; US 20080318289 A1, 2008; RU 2495937, 2013; CN 103695496 B, 2016; CN 105624068 A, 2016; CN 107090477 A, 2017; CN 108384819 A, 2018].
Однако довольно часто промышленные штаммы обладают низкими и/или нестабильными уровнями биосинтетической активности такролимуса [Barreiro С.,  М. Applied Microbiology and Biotechnology. 2014, V. 98, №2, p. 497-507]. В настоящее время улучшение производства FK-506 достигается путем оптимизации состава питательных сред [WO 2005/063963, 2005; Singh В.Р., Behera В.K. Lett. Appl. Microbiol. 2009, V. 49, №2, p. 254-259] и генетической инженерии штаммов [Mo S., Ban Y.H., Park J.W., Yoo Y.J., Yoon Y.J. J. Ind. Microbiol. Biotechnol. 2009, V. 36, №12, p. 1473-1482; Mo S., Lee S.K., Jin Y.Y., Oh C.H., Suh J.W. Appl. Microbiol. Biotechnol. 2013, V. 97, №7, p. 3053-3062; Mo S., Lee S.K., Jin Y.Y., Suh J.W. J. Microbiol. Biotechnol. 2016, V. 26, №2, p. 233-240; Ban Y.H., Park S.R., Yoon Y.J. J. Ind. Microbiol. Biotechnol. 2016, V. 43, №2-3, p. 389-400].
М. Applied Microbiology and Biotechnology. 2014, V. 98, №2, p. 497-507]. В настоящее время улучшение производства FK-506 достигается путем оптимизации состава питательных сред [WO 2005/063963, 2005; Singh В.Р., Behera В.K. Lett. Appl. Microbiol. 2009, V. 49, №2, p. 254-259] и генетической инженерии штаммов [Mo S., Ban Y.H., Park J.W., Yoo Y.J., Yoon Y.J. J. Ind. Microbiol. Biotechnol. 2009, V. 36, №12, p. 1473-1482; Mo S., Lee S.K., Jin Y.Y., Oh C.H., Suh J.W. Appl. Microbiol. Biotechnol. 2013, V. 97, №7, p. 3053-3062; Mo S., Lee S.K., Jin Y.Y., Suh J.W. J. Microbiol. Biotechnol. 2016, V. 26, №2, p. 233-240; Ban Y.H., Park S.R., Yoon Y.J. J. Ind. Microbiol. Biotechnol. 2016, V. 43, №2-3, p. 389-400].
Так, в статье Mo S.J. и соавт. [Mo S.J., Lee S.-K., Jin Y.-Y., Oh C.-H., Suh J.-W. Appl. Microbiol. Biotechnol. 2013, V. 97, p. 3053-3062] сообщалось, что продукция такролимуса мутантным штаммом Streptomyces sp. RM7011, полученным в результате обработки родительского штамма Streptomyces sp. KCCM 11116Р N-метил-N'-нитро-N-нитрозогуанидином и ультрафиолетовым светом, была улучшена в 11.63 раза и составила 94.24 мг/л. Последующее введение в мутантный штамм Streptomyces sp. RM7011 плазмиды, предназначенной для экспрессии пропионил-КоА-карбоксилазы (pSJ1003), приводило к увеличению титра такролимуса до 252 мг/л при подпитке винил пропионатом.
Недостатком данного способа на уровне колб является низкая биосинтетическая активность. Общеизвестно, что существует возможность утраты штаммом плазмиды, что может привести к снижению его продуктивности.
Известен способ получения такролимуса (Yang Т., Li J., Li L., Zhang H., Ma J., Chen Z., Hu C, Ju X., Fu J. J. Korean Soc. Appl. Biol. Chem. 2014, V. 57, №6, P. 715-722) с помощью мутантного штамма Streptomyces tsukubaensis CZ-19, который был получен из родительского штамма S. tsukubaensis LLZ-1 путем мутации нитрозогуанидином и адаптации к 4-аминомасляной кислоте (аналог структуры предшественника FK-506). В опытах в колбах титр FK-506 со штаммом CZ-19 составил 532.44 мг/л, что на 65.13% выше, чем титр у исходного штамма. Оптимизацией состава среды титр такролимуса в колбах был увеличен до 914.25 мг/л.
Известен способ получения FK-506 [CN 108192908 А, 2018] с помощью генетически улучшенного штамма Streptomyces tsukubaensis NRRL 18488, в геном которого были встроены положительные регуляторные гены tsuZ и tsuS2. Биосинтез такролимуса по указанному способу проводили в колбах на среде следующего состава (г/л): глюкоза - 10, растворимый крахмал - 24, декстрин - 35, пептон - 4, дрожжевой порошок - 5, СаСО3 - 1, K2HPO4 - 0.5, MnCl2×6H2O - 0.5, (NH4)2SO4 - 1, соевое масло - 2.5, Tween-80 - 1.25, рН 7.0. Титр такролимуса после 7 суток культивирования составлял 324 мг/л, что было на 36% выше, чем у родительского штамма.
Способ твердофазной ферментации с производством такролимуса приведен в статье [Mo S.J., Yang H.S. J. Appl. Biol. Chem. 2016, V. 59, №4, P. 289-298]. Описано получение сверхурожайного мутанта ТСМ8594 из штамма Streptomyces tsukubaensis NRRL 18488 путем мутагенеза с использованием N-метил-N'-нитро-N-нитрозогуанидина, ультрафиолетового облучения и последовательного отбора устойчивости к FK-506. Продукция FK-506 штаммом ТСМ8594 улучшилась в 45.1 раза (титр такролимуса составил 505.4 мг/л) по сравнению с родительским штаммом (11.2 мг/л). Были оптимизированы параметры процесса при твердофазной ферментации, влияющие на производство FK-506. Максимальный выход FK-506, составивший 897.4 мг/кг твердого субстрата, был достигнут путем оптимизации параметров процесса, таких как: использование пшеничных отрубей с добавлением 5% (вес/вес) декстрина и дрожжевого экстракта в качестве дополнительных питательных веществ; начальное содержание влаги в твердом субстрате (70% вес.); начальное значение рН среды (7.2); температура инкубации (30°С); уровень инокулята 10% (вес/вес); продолжительность инкубации (10 суток).
Недостатками указанного способа являются отсутствие описания методики расчета выхода такролимуса при твердофазной ферментации.
Также описан способ [Bhanu Р Singh, Punit Kumar, Shafiul Haque, Arshad Jawed, Kashyap Kumar Dubey. Braz. Arch. Biol. Technol. 2017, V. 60, e17160366. http://dx.doi.org/10.1590/1678-4324-2016160366], согласно которому 24-часовую посевную культуру мутантного штамма, полученного из родительского штамма Streptomyces tacrolimicus АТСС 55098 (N-нитрозогуанидин + этилметансульфонат + УФ), засевали в колбы Эрленмейера объемом 500 мл, содержащие по 100 мл продуктивной среды следующего состава (г/л): лактоза - 35, пептон - 11.25, FeSO4 - 0.477, MgSO4 - 0.257, глюкоза - 10, дрожжевой экстракт - 10, NaCl - 1, CaCl2 - 0.8 и KNO3 - 0.5. После инкубирования при 28°С на термостатируемом орбитальном шейкере (220 об/мин) в течение 120 часов уровень продукции такролимуса составил 82.5 мг/л. При инкубировании в 7-литровом биореакторе и добавлении L-лизина (0.2 г/л) на 28 ч инкубирования выработка такролимуса увеличивалась до ~ 102 мг/л.
Основным недостатком данного способа получения такролимуса является низкий выход продукта в биореакторе, не отвечающий требованиям промышленного уровня.
Таким образом, из уровня техники следует, что генно-инженерные манипуляции с родительским штаммом-продуцентом такролимуса и/или мутагенез с применением ультрафиолетового облучения или нитрозогуанидина, а также оптимизация состава продуктивной среды, могут привести к увеличению его продуктивности.
Раскрытие изобретения
Технической задачей, решаемой с помощью настоящего изобретения, является расширение номенклатуры микроорганизмов, способных продуцировать такролимус, а именно, создание нового мутантного штамма актиномицета Streptomyces tsukubensis ВКМ Ac-2832D, способного продуцировать такролимус, обладающего в сравнении с родительским штаммом более стабильным уровнем биосинтетической активности как продуцента такролимуса в условиях масштабирования процесса, а также расширение ассортимента методов применения штаммов-продуцентов такролимуса, эффективных для получения такролимуса в ферментерах, а именно, методов, которые могут быть адаптированы для условий промышленного производства, характеризующиеся более простой технологией производственного цикла, удешевлением технологического процесса и снижением трудоемкости производства.
Поставленная техническая задача решалась созданием нового мутантного штамма актиномицета Streptomyces tsukubensis Т27 из родительского штамма Streptomyces sp. ВКМ Ас-2618Д методом ультрафиолетового мутагенеза, способного продуцировать такролимус, и способом его применения для получения такролимуса методом микробиологического синтеза. Штамм депонирован во Всероссийской Коллекции Микроорганизмов (ВКМ) под регистрационным номером Ac-2832D.
Мутантный штамм S. tsukubensis ВКМ Ac-2832D новый, получен впервые. Его способность продуцировать такролимус установлена впервые. Он впервые применен для биосинтеза такролимуса. Стабильность биосинтетической активности штамма как продуцента такролимуса подтверждена масштабируемостью процесса биосинтеза при переходе от уровня колб к процессам в ферментерах. Масштабируемость биотехнологии обеспечивается использованием 10-л ферментера АНКУМ (Аппарат для Непрерывного КУльтивирования Микроорганизмов в асептических контролируемых условиях) в качестве стандартного технологического оборудования (http://ckp-rf.ru/usu/279918/).
Мутантный штамм S. tsukubensis ВКМ Ac-2832D получают путем облучения вегетативного мицелия родительского штамма Streptomyces sp. ВКМ Ас-2618Д коротковолновым ультрафиолетовым светом (254 нм) в камере Vilber Lourmat UV Darkroom 312/254nm CN-15.MC.
Техническим результатом настоящего изобретения является создание нового мутантного штамма актиномицета рода Streptomyces и способ его применения для биокаталитического получения такролимуса с достижением стабильного выхода такролимуса не менее 700 мг/л и выше при осуществлении биосинтеза с применением биотехнологического оборудования, обеспечивающего масштабируемость параметров биосинтетического процесса при укорочении производственной цепочки и снижении трудоемкости процесса.
Для достижения указанного выше технического результата предлагается использовать новый мутантный штамм S. tsukubensis ВКМ Ac-2832D по заявляемому изобретению в качестве биокатализатора для биотехнологического процесса биосинтеза такролимуса.
Способ применения нового мутантного штамма S. tsukubensis ВКМ Ac-2832D реализуется с использованием биотехнологического оборудования, обеспечивающего масштабируемость параметров биосинтетического процесса, высокий выход целевого продукта, а также укорочение технологической цепи производства, удешевление технологического процесса и снижение его трудоемкости.
Способ применения мутантного штамма S. tsukubensis ВКМ Ac-2832D имеет преимущества перед известным из уровня техники способом получения такролимуса микробиологическим методом с применением родительского штамма Streptomyces sp. МТ246 (ВКМ Ас-2618Д) [RU 2495937, 2013], которые состоят в следующем.
1. Хранение культуры в криогенном состоянии позволяет минимизировать потери в целевой активности, связанные с характерной для стрептомицетов генетически обусловленной диссоциацией, выражающейся в расщеплении на линии с различным уровнем биосинтетической активности в отношении продукции такролимуса.
2. Сокращение этапа получения посевного материала при использовании криогенной культуры продуцента.
Для достижения технического результата по настоящему изобретению мутантный штамм S. tsukubensis ВКМ Ac-2832D использован в качестве биокатализатора для биотехнологического процесса в виде криогенной культуры на этапе засева.
Использование криогенной культуры продуцента такролимуса известно. Так, известен способ [CN 105624068 А, 2016] получения такролимуса, который заключается в применении криогенной (замороженной в 30%-ном глицерине культуры в вегетативной фазе роста) культуры Streptomyces tsukubaensis HDW68.
По настоящему изобретению получение посевного материала с использованием криогенной культуры предполагает выращивание посевной культуры с применением замороженной в 50%-ном глицерине вегетативной биомассы продуцента (или криогенной культуры) до температуры минус 70°С. При этом криогенная культура обладает рядом преимуществ:
- для получения посевного материала используется стандартизированная культура с известной активностью (ее получают при выращивании в ферментере (с рабочим объемом 3 литра), разделяют на порции (от 10 мл до 100 мл) и хранят при температуре минус 70°С;
- при использовании криогенной культуры технологическая цепочка укорачивается: вместо посевной культуры первой (48 часов) и второй генераций (24 часа) выращивают одну посевную культуру в течение 48 часов;
- риск контаминации, соответственно, снижается в два раза.
3. Замена дорогостоящего дезоксисахарида рамнозы на палевый декстрин.
Для достижения высокой активности штамма в процессе биосинтеза такролимуса вместо рамнозы использовали палевый декстрин. Растворимость палевого декстрина в холодной воде составляет 78%. Палевый декстрин является продуктом неполного термического гидролиза нативного картофельного крахмала. При этом цена 1 кг палевого декстрина меньше стоимости 1 кг рамнозы в 55 раз (https://www.dia-m.ru/reactive.php?productid=54804).
4. Применение сорбента типа SP, конкретно Sepabeads SP-207, вместо сорбента типа XAD, конкретно Amberlite XAD-7HP.
Сорбент SP-207 представляет собой синтетический адсорбент на основе ароматических соединений, в котором бром включен в ароматическое кольцо, что обеспечивает отличные характеристики адсорбции органических молекул. Сорбент SP-207 характеризуется более высоким удельным объемом пор (~ 1.2 см3/г) и удельной площадью поверхности пор (650 м2/г) в отличие от XAD-7HP (0.5 см3/г и 380 м2/г соответственно). Кроме того, сорбент SP-207 обладает более высокой плотностью (1.19 г/л), чем сорбент XAD-7HP (до 1 г/л) [https://www.sigmaaldrich.com/catalog], что позволяет не только упростить стадию отделения сорбента от биомассы продуцента и проведение регенеративной очистки сорбента восходящим потоком воды, но и включить эти стадии в технологическую цепочку за счет возможности многократной регенерации сорбента и возврата его в производственный цикл.
5. Замена подпитки раствором крахмала на подпитку раствором палевого декстрина.
Применение нетекучих растворов крахмала создает проблемы при реализации биосинтеза в ферментере, что приводит к значительной потере продуктивности штамма: титр такролимуса в ферментере всегда значительно ниже титра такролимуса, полученного в контрольных колбах (таблица 1).
Использование высококонцентрированных растворов палевого декстрина позволило исключить применение добавок крахмала, раствор которого в используемом интервале концентраций и температур, в отличие от растворов палевого декстрина, образует гель, что исключает возможность использования стандартного технологического оборудования.
Культурально-морфологические особенности использованного штамма.
Штамм S. tsukubensis ВКМ Ac-2832D на агаризованной среде образует колонии оранжевого цвета размером 0.8-1.4 см округлой формы, матово-суховатые, возвышающиеся над поверхностью агара. Структура колонии грубо-морщинистой архитектоники. Контур колонии фестончатый, закончен гиалиновым уплощенным с морщинистой структурой краем оранжево-желтого цвета. Реверс колонии ярко-оранжевого цвета. Спорообразование слабое, преимущественное по краю колонии.
Основным свойством штамма по настоящему изобретению является наличие способности осуществлять биосинтез такролимуса в оптимизированной продуктивной среде с устойчивым выходом целевого продукта с использованием биотехнологического оборудования, обеспечивающего масштабируемость параметров биосинтетического процесса.
Таким образом, сущность заявленного изобретения заключается в создании нового мутантного штамма S. tsukubensis ВКМ Ac-2832D и способе его применения для получения такролимуса с использованием криогенной культуры, причем биосинтез проводят в биореакторе, применяют палевый декстрин в качестве подпитки как источник углерода в процессе биосинтеза, а также используют в качестве сорбента смолу Sepabeads SP-207.
Осуществление изобретения
Родительский штамм Streptomyces sp. ВКМ Ас-2618Д депонирован в коллекции культур Всероссийской коллекции микроорганизмов Института биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН (ВКМ ИБФМ РАН).
Растворимые картофельные крахмалы были приобретены у компаний «Sigma-Aldrich» (США) и «ЗАО Купавнареактив» (РФ); палевый декстрин - у «ЗАО Декстринзавод» (г. Муром, РФ); дрожжи пекарские - у «Саф-Момент» (Франция); кукурузный экстракт лиофилизированный, рамноза, сорбент XAD-7HP - у «Sigma-Aldrich» (США); моногидрохлорид L-лизина - у «Диа-М» (РФ); сорбент SP-207 - у «Mitsubishi chemical corporation» (Япония); стандартный препарат такролимуса для ВЭЖХ - у «Zhejiang Hisun Pharmaceutical Co. Ltd.» (Китай). Другие реагенты и растворители являются коммерчески доступными, были приобретены у российских производителей.
Для приготовления сред для культивирования и биосинтеза, водных растворов кислот, солей и щелочей использовали дистиллированную воду.
Все процедуры, если не оговорено особо, осуществляли при комнатной температуре или температуре окружающей среды, то есть в диапазоне от 20 до 25°С.
Культивирование микроорганизмов в колбах, а также контроль биосинтетической активности культуры, осуществляли аэробно на шейкере-инкубаторе Multitron Standard (Infors НТ, Швейцария) при температуре 25°С в режиме перемешивания 200-220 об/мин.
Биосинтез такролимуса в ферментерах осуществляли в аппарате непрерывного культивирования АНКУМ с рабочим объемом 10 л.
Определение содержания продуктов (такролимуса и его родственных соединений) в осадке культуральной среды на момент завершения процесса биосинтеза осуществляли методом ВЭЖХ. Анализ проводили на колонке LiChrospher®100 RP-18 5 мкм, 125 мм × 4 мм («Merck», США) с предколонкой Daltosil 100 RP-18 4 мкм, 4.6 мм × 76 мм («Serva», Германия) в следующих условиях: мобильная фаза (об./об.): вода - ацетонитрил - метилтретбутиловый эфир - трифторуксусная кислота (58.3:34.4:7.3:0.01); скорость потока - 1.5 мл/мин, температура - 60°С; детекция при λ=200 нм, расчет концентрации такролимуса проводили по калибровке с внешним стандартом на основании значений площадей пиков.
Выходы такролимуса, полученные биосинтезом с применением нового мутантного штамма S. tsukubensis ВКМ Ac-2832D по настоящему изобретению и приведенные в примерах заявляемого изобретения, подтверждают эффективность предлагаемого способа применения штамма и его пригодность для использования в промышленных процессах. Однако примеры даны лишь для иллюстрации биокаталитической способности штамма продуцировать такролимус и не ограничиваются применением иных биореакторов и сред.
В настоящем изобретении впервые использована совокупность следующих условий: создание нового мутантного штамма S. tsukubensis ВКМ Ac-2832D, осуществление биосинтеза такролимуса с применением этого мутантного штамма в виде криогенной культуры на этапе получения посевного материала, в биореакторах типа АНКУМ на этапе биосинтеза с применением палевого декстрина, а также применение в качестве сорбента смолы Sepabeads SP-207. Выходы могут быть улучшены за счет оптимизации условий проведения биосинтеза (создание насыщенной кислородом воздуха среды биосинтеза при избыточном давлении в пределах 0.3-0.5 ати, максимальном перемешивании и снабжении аппарата стерильным воздухом).
Возможность реализации заявляемого изобретения показана, но не ограничена, в примерах конкретного выполнения.
Пример 1. Получение мутантного штамма S. tsukubensis ВКМ Ac-2832D.
Мицелий 7-суточной культуры родительского штамма Streptomyces sp. ВКМ Ас-2618Д смывали с поверхности агаризованной среды МДА стерильной водой. Суспензию вегетативной культуры помещали в камеру для просмотра хроматограмм Vilber Lourmat UV Darkroom 312/254nm CN-15.MC с УФ-лампой с длиной волны 254 нм (расстояние до источника УФ-света 25 см), время воздействия составляло от 5 до 20 минут. После облучения суспензию клеток стрептомицета в количестве 0.2 мл высевали на поверхность агаризованной среды МДА и культивировали при температуре 30°С в течение 10-14 дней. Отбор мутантов производили на основании изменений морфологии колоний и их биосинтетической активности в отношении такролимуса.
Пример 2. Применение мутантного штамма S. tsukubensis ВКМ Ac-2832D для получения такролимуса в условиях патента RU 2495937 (2013 г.)
Для приготовления посевной культуры первой генерации (первого инокулята) культуру (споры и мицелий) смывали с поверхности скошенной агаризованной среды 2 мл стерильной воды и переносили в колбу объемом 750 мл с 50 мл питательной среды следующего состава (г/л): растворимый крахмал - 20, глюкоза - 5, дрожжевой экстракт - 5, кукурузный экстракт жидкий - 5 (или лиофилизованный - 7.5), СаСО3 - 3 (рН до автоклавирования 7.0-7.2). Затем культуру первой генерации инкубировали при 200 об/мин и температуре 30°С в течение 44-48 часов.
Посевную культуру второй генерации (второй инокулят) выращивали в среде вышеуказанного состава в аналогичных условиях в течение 24 часов, используя для засева первый инокулят в количестве 10% об.
Биосинтез такролимуса проводили растущей культурой в колбах объемом 750 мл, содержащих по 50 мл среды следующего состава (г/л): растворимый крахмал - 75, кукурузный экстракт лиофилизированный - 15, сухие дрожжи - 20, СаСО3 - 3 (значение рН до автоклавирования 6.8-7.0). После автоклавирования среды вносили стерильные растворы 2.5 мг сульфата марганца в 1 мл дистиллированной воды (0.05 г/л) и 1 г моносахарида рамнозы в 2 мл дистиллированной воды (20 г/л). Второй инокулят вносили в количестве 5% об.
На 3 сутки культивирования в каждую колбу вносили по 2 г стерильного сорбента XAD-7HP (40 г/л). На 4-7 сутки биосинтеза в среду вносили раствор 2.9 г крахмала в 3 мл дистиллированной воды (до конечной концентрации в среде 5.8 г/л). Крахмал предварительно нагревали до 44°±2°С для повышения его текучести и вносили в колбы. Биосинтез осуществляли при температуре 25°С и 220 об/мин в течение 10 суток.
Выход такролимуса достигал 949.8 мг/л.
Пример 3. Общий метод биосинтеза такролимуса в ферментере АНКУМ штаммом Streptomyces sp. ВКМ Ас-2618Д и новым мутантным штаммом S. tsukubensis BKM Ac-2832D
3.1 Получение криогенной культуры
3.1.1 Получение колоний олигоспорового штамма-продуцента. Штаммы выращивают на среде следующего состава (г/л): растворимый крахмал - 10, дрожжевой экстракт - 4, солодовый экстракт - 10, агар - 20 (значение рН до автоклавирования 6.8-7.0). Рост и формирование колоний на чашках Петри с указанной средой проводят при температуре 28-30°С в течение 10-14 суток.
3.1.2 Получение жидкой культуры для криохранения. Культуру получают в две генерации.
Приготовление посевной культуры первой генерации
Колонии переносят в колбу объемом 750 мл, содержащую 200-250 мл (что соответствует 10% от объемного количества среды в ферментере) жидкой среды следующего состава, г/л: растворимый крахмал - 75, кукурузный экстракт лиофилизированный - 12.5, пекарские дрожжи - 16.6, MnSO4 - 0.05, СаСО3 - 3 (рН до автоклавирования 6.8-7.0). После автоклавирования вносят стерильный раствор 1 г глюкозы в 4 мл дистиллированной воды (или 1.25 г в 5 мл в зависимости от количества среды в колбе - 200 или 250 мл) (конечная концентрация глюкозы в среде 5 г/л), инкубируют при 220 об/мин и температуре 25°С в течение 44-48 часов.
Приготовление посевной культуры второй генерации (криогенной культуры)
2 литра свежей питательной среды вышеуказанного состава в ферментере АНКУМ (объемом 3 л, рабочим объемом - 2 л) засевают выросшей культурой первой генерации в количестве 10% об. Вместе с инокулятом вносят стерильный раствор 10 г глюкозы в 50 мл дистиллированной воды (конечная концентрация 5 г/л). Режим ферментации: температура - 25°С, скорость перемешивания (пропеллерная мешалка) - 450 об/мин первые 12 часов и 1000 об/мин следующие 12 часов, аэрация - 6 л/мин первые 12 часов и 8 л/мин следующие 12 часов, содержание растворенного кислорода (pO2) поддерживают на уровне 60%, время культивирования - 24 часа.
Полученную культуру стерильно разливают в пробирки с 50%-ным водным раствором глицерина в соотношении 1:1 для хранения в морозильной камере при температуре минус 70°С.
3.2 Получение посевного материала из криогенной культуры
Криогенную культуру в количестве 5% об. переносят в колбу объемом 750 мл, содержащую 250 мл жидкой среды состава, указанного в п. 3.1.2, и культивируют аэробно при температуре 25°С и 220 об/мин в течение 44-48 часов.
3.3 Биосинтез такролимуса в 10-литровом ферментере АНКУМ в условиях патента RU 2495937 (2013 г.)
В биореактор АНКУМ, содержащий 5 л стерильной продуктивной среды, описанной в п. 2, сорбент XAD-7HP (40 г/л) и пеногаситель (0.04%), вносят посевной материал, полученный из криогенной культуры, в объеме 5% (250 мл на 5 л). Вместе с инокулятом в биореактор вносят стерильный раствор 100 г рамнозы в 200 мл дистиллированной воды (конечная концентрация 20.0 г/л). На 4-7 сутки биосинтеза ежедневно в среду добавляют стерильный раствор 29 г крахмала в 300 мл дистиллированной воды (концентрация раствора крахмала 9.6%, конечная концентрация крахмала в среде 5.8 г/л). Культивирование проводят при температуре 25°С.Концентрацию растворенного кислорода (pO2) поддерживают на уровне 80% постепенным увеличением оборотов мешалки от 350 до 1000 об/мин, а также подачей стерильного воздуха в аппарат с 0.4 до 10 л/мин. Продолжительность ферментации - 10 суток. В течение всего периода биосинтеза рН среды поддерживают в интервале 6.8-7.2 титрованием 10% раствором КОН или 10% раствором H2SO4. Результаты биосинтеза такролимуса родительским штаммом Streptomyces sp. ВКМ Ас-2618Д и новым мутантным штаммом по настоящему изобретению S. tsukubaensis BKM Ac-2832D в ферментере в трех повторностях представлены в таблице 2.
3.4 Биосинтез такролимуса в 10-литровом ферментере АНКУМ в условиях по настоящему изобретению
В биореактор АНКУМ, содержащий 5 л стерильной продуктивной среды, описанной в п. 3.1.2, сорбент SP-207 (40 г/л) и пеногаситель (0.04%), вносят посевной материал, полученный из криогенной культуры, в объеме 5% (250 мл на 5 л). Вместе с инокулятом в биореактор вносят стерильный раствор 25 г глюкозы в 100 мл дистиллированной воды (конечная концентрация 5.0 г/л). На 3-и сутки биосинтеза в среду вносят стерильный раствор 25 г моногидрохлорида-L-лизина в 100 мл дистиллированной воды (конечная концентрация 5.0 г/л). На 2-8 сутки биосинтеза ежедневно в среду добавляют стерильный раствор 27 г палевого декстрина в 300 мл дистиллированной воды (концентрация раствора декстрина 9%, конечная концентрация декстрина в среде 5.4 г/л). Культивирование проводят при температуре 25°С. Концентрацию растворенного кислорода (pO2) поддерживают на уровне 60% увеличением оборотов мешалки от 600 до 800 об/мин после 12 часов культивирования, а также увеличением подачи стерильного воздуха в аппарат с 6 до 8 л/мин после 12 часов культивирования. Продолжительность ферментации - 10 суток. В течение всего периода биосинтеза рН среды поддерживают в интервале 6.5-7.5 титрованием 10% раствором КОН или 10% раствором H2SO4. Результаты биосинтеза такролимуса родительским штаммом Streptomyces sp. ВКМ Ас-2618Д и новым мутантным штаммом по настоящему изобретению S. tsukubaensis BKM Ac-2832D в ферментере в трех повторностях представлены в таблице 2.
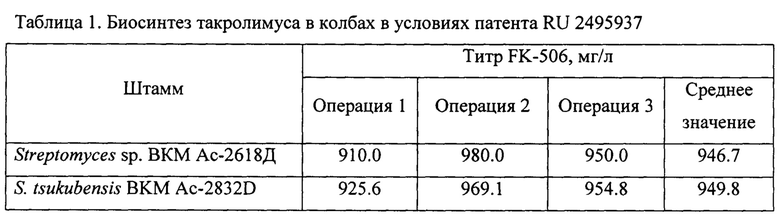
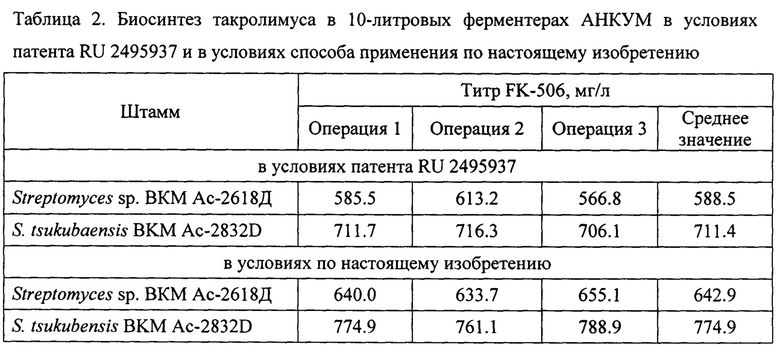
Как видно из таблицы 1, титр такролимуса при проведении биосинтеза в колбах в условиях патента RU 2495937 с применением нового мутантного штамма по настоящему изобретению не уступает титру для родительского штамма и в среднем составляет 949.8 мг/л (по патенту RU 2495937 для родительского штамма - 946.7 мг/л). Однако, как видно из таблицы 2, среднее значение титра такролимуса при проведении биосинтеза в ферментерах с применением нового мутантного штамма как в условиях патента RU 2495937, так и в условиях по настоящему изобретению, составляет 711.4 мг/л и 774.9 мг/л соответственно, что значительно превосходит титр такролимуса, синтезированного родительским штаммом, а именно, превышает титр родительского штамма в одинаковых условиях биосинтеза в ферментерах на 20.9% и 20.5% соответственно. Кроме того, среднее значение титра такролимуса, полученного в ферментерах с применением родительского штамма в условиях способа по настоящему изобретению, выше титра, полученного в ферментерах в условиях патента RU 2495937, на 9.2%.
Таким образом, проведение биосинтеза в условиях патента RU 2495937 и в предлагаемых условиях проведения биосинтеза по настоящему изобретению в биореакторах показало не только преимущество мутантного штамма перед родительским штаммом, но и преимущество продуктивной среды.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ STREPTOMYCES TSUKUBENSIS - ПРОДУЦЕНТ ТАКРОЛИМУСА И СПОСОБ ПОЛУЧЕНИЯ ТАКРОЛИМУСА | 2018 |
|
RU2686779C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТАКРОЛИМУСА МЕТОДОМ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА | 2012 |
|
RU2495937C1 |
| Штамм Streptomyces virginiae - продуцент вирджиниамицина и способ получения вирджиниамицина | 2016 |
|
RU2637857C1 |
| ШТАММ STREPTOMYCES HYGROSCOPICUS BKM AC-2737D - ПРОДУЦЕНТ АНТИБИОТИКА РАПАМИЦИНА И СПОСОБ УВЕЛИЧЕНИЯ ЕГО ПРОДУКТИВНОСТИ | 2018 |
|
RU2679051C1 |
| СПОСОБ СОРБЦИОННО-ХРОМАТОГРАФИЧЕСКОГО ВЫДЕЛЕНИЯ И ОЧИСТКИ ТАКРОЛИМУСА | 2018 |
|
RU2694354C1 |
| Штамм Streptomyces sp. YVZ014 - продуцент антибиотика лизолипина X | 2023 |
|
RU2817695C1 |
| Штамм Streptomyces sp. YVZ012 - продуцент суругамида А | 2023 |
|
RU2821907C1 |
| Штамм Streptomyces sp. YVZ013 - продуцент антибиотика поликетомицина | 2023 |
|
RU2813975C1 |
| Штамм Streptomyces rochei MP21 - продуцент антибиотика кирромицина | 2022 |
|
RU2798207C1 |
| РЕКОМБИНАНТНЫЕ МИКОБАКТЕРИАЛЬНЫЕ ШТАММЫ-ПРОДУЦЕНТЫ И ИХ ИСПОЛЬЗОВАНИЕ ДЛЯ ПОЛУЧЕНИЯ 22-ФУНКЦИОНАЛИЗИРОВАННЫХ СТЕРОИДОВ | 2019 |
|
RU2767610C2 |
Группа изобретений относятся к биотехнологии. Предложены штамм актиномицета Streptomyces tsukubensis ВКМ Ac-2832D, обладающий способностью продуцировать такролимус, и способ получения такролимуса путем культивирования заявленного штамма на питательной среде, содержащей крахмал 75 г/л и глюкозу 5 г/л, лиофилизированный кукурузный экстракт 12.5 г/л и пекарские дрожжи 16.6 г/л, моногидрохлорид L-лизина 5 г/л, сульфат марганца (II) 0.05 г/л и карбонат кальция 3 г/л, в присутствии высокопористого неионогенного сорбента Sepabeads SP-207 в количестве 40 г/л питательной среды с ежедневной подпиткой 9% стерильным раствором палевого декстрина. Изобретения обеспечивают повышение выхода целевого продукта и возможность масштабирования процесса получения такролимуса в промышленных условиях. 2 н.п. ф-лы, 2 табл., 3 пр.
1. Штамм актиномицета Streptomyces tsukubensis ВКМ Ac-2832D, обладающий способностью продуцировать макролидный антибиотик такролимус FK-506.
2. Способ получения такролимуса путем биосинтеза культивированием штамма Streptomyces tsukubensis ВКМ Ac-2832D на питательной среде, содержащей крахмал 75 г/л и глюкозу 5 г/л в качестве источников углерода, лиофилизированный кукурузный экстракт 12.5 г/л и пекарские дрожжи 16.6 г/л в качестве источников азота, моногидрохлорид L-лизина 5 г/л как структурный предшественник такролимуса, а также соли металлов - сульфат марганца (II) 0.05 г/л и карбонат кальция 3 г/л, в присутствии высокопористого неионогенного сорбента Sepabeads SP-207 в количестве 40 г/л питательной среды с ежедневной подпиткой 9% стерильным раствором палевого декстрина.
| ГЛАГОЛЕВ В.И | |||
| и др | |||
| Разработка высокопродуктивного штамма продуцента иммунодепрессанта такролимус и оптимизация ферментационной среды для его культивирования.// Международный научно-исследовательский журнал, Екатеринбург, 2017, N 11 (65), часть 3, с.64-69 | |||
| ПОШЕХОНЦЕВА В.Ю | |||
| и др | |||
| Биосинтез такролимуса актинобактериями рода Streptomyces и селекция |
Авторы
Даты
2020-06-03—Публикация
2019-04-26—Подача