Настоящее изобретение относится к области биотехнологии, конкретно касается синтеза природного макролидного антибиотика такролимус (FR-900506, FK-506) с помощью клеток микроорганизмов, обладающих направленной ферментативной активностью, и может быть использовано в микробиологической и фармацевтической промышленности.
Такролимус (FR-900506, FK-506), 23-членный макроциклический поликетид (C44H69NO12, М.в. - 804.018): 17-алкил-1,14-дигидрокси-12-(2′-(4′′-гидрокси-3′′-метоксициклогексил)-1′-метилвинил)-23,25-диметокси-13,19,21,27-тетраметил-11,28-диокса-4-азатрицикло-(22.3.1.04,9)-октакос)-18-ен-2,3,10,16-тетраон) - относится к классу природных макролидов, небольших органических молекул с циклической структурой углеродных атомов, был открыт в 1984 году [Kino T, Hatanaka H, Hashimoto M, Nishiyama M, Goto T, Okuhara M, Kohsaka M, Aoki H, Imanaka H. J. Antibiot. 1987, v.XL, N.9, p.1249-1255; Kino T, Hatanaka H, Miyata S, Inamura N, Nishiyama M, Yajima T, Goto T, Okuhara M, Kohsaka M, Aoki H, et al. J. Antibiot. 1987, v.40, p.1256-1265; US 4,956,352, 1990].
Такролимус наряду с другими известными макролидными антибиотиками рапамицином (сиролимус), аскомицином (иммуномицин) и их некоторыми производными подавляет иммунный ответ in vivo, также как in vitro. Интенсивные клинические испытания, впервые начатые в 1989 году и проведенные в университете г.Питтсбурга, показали, что нейтральный макролидный антибиотик FK-506 в 100-150 раз более эффективен в качестве лекарственного препарата по сравнению с циклоспорином А, хорошо известным метаболитом грибов, и востребован в хирургической практике для предотвращения отторжения органов при их пересадке, а также в терапии атипичных дерматитов: псориаза, гангренозной пиодермии и др., при лечении гемолитической болезни новорожденных, аутоиммунных болезней: ревматоидного артрита, красной волчанки и др. [Yocum D.E. Rheum. Dis. Clin. North Am. 1996. v.22(1), p.133-154; Hananaka H., Shimomura K., Nihon yakurigaku zasshi. 1997, 110 Suppl. 1, p.69-71; SOO K.H., Park Y. J. Microbiol. Biotechnol. 2007, v.17(10), p.1638-1644; Nighiem P., Pearson G., Langley R.G. J. Am. Acad. Dermatol. 2002, v.46, p.228-241; US 4,894,366, 1990; WO 2005/063963 A1, 2005].
Также такролимус и другие макролидные антибиотики проявляют антибактериальную активность против различных бактерий, дрожжей, паразитов и грибов, ингибируя их рост [High K.P. Am. J. Transplant. 1994, v.57, p.1689-1700; Wong G.K., Grifith S., Kojima I., Demain A.L. J. Antibiot. 1998. v. 51, p.487-491; Arndt C., Cruz M.C., Cardenas M.E., Heitman J. Microbiol. 1999, v.145, p.1989-2000]. Показано, что FK-506 активен, в частности, против Candida albicans, Cryptococcus neoformans, Saccharomyces cerevisiae [Steinbach W.J., Schell W.A., Blankenship J.R., Onyewu C, Heitman J., Perfect J.R. Antimicrob. Agents Chemother. 2004, v.48, N.5, p.1664-1669], а также против Aspergillus fumigatus IFO 5840 и Fusahum oxysporum IFO 5942 [US 5110811, 1992].
FK-506, выделенный из Streptomyces tsukubaensis, обладает активностью против вируса ветряной оспы, возможно, воздействуя на репликацию ДНК при заражении ортопоксвирусом [Reis SA., Moussatche N., Damaso CR. J. Appl. Microbiol. 2006, v.100(6), p.1373-1380].
Биосинтез такролимуса осуществляют определенные природные, мутантные и генетически модифицированные штаммы рода Streptomyces: Streptomyces tsukubaensis No.9993 (Streptomyces tsukubaensis No.9993 FERM-BP-927), Streptomyces tsukubaensis F-499, Streptomyces tsukubaensis F-872, Streptomyces tsukubaensis F-917, Streptomyces clavuligerus CKD 1119, Streptomyces sp. штамм Р5СЗ, Streptomyces sp. (MA 6858) ATCC No.55098, Streptomyces glaucescens ATCC 5115, Streptomyces clavuligerus Tc-XII-15322, Streptomyces clavuligerus Tc-IX-12303, Streptomyces clavuligerus Tc-V-05813, Streptomyces hydroscopicus subsp. ascomyceticus ATCC 14891, Streptomyces hydroscopicus ATCC 29253, Streptomyces sp. TST8 [Motamedy H., Shafiee A. Eur. J. Biochem. 1998, v.256, p.528-534; SOO K.H., Park Y.I. J. Ind. Microb. Biotec. 2007, 7(10), p.1638-1644; EP 2272963 A1, 2011, Jung S., Moon S., Lee K., Park Y.J., Yoon S., Yoo J. Y. J. Ind. Microb. Biotec. 2009, v.36, p.1467-1471].
Как правило, штаммы Streptomyces выращивают и поддерживают на дрожжевой-солодовой агаризованной среде состава, г/л: дрожжевой экстракт-4.0, солодовый экстракт-4.0, растворимый крахмал-10, а также на картофельном агаре. Жидкие среды включают один или два источника углерода, азота, минеральные соли. В качестве источников углерода используют моносахара, дисахара, полисахара, органические кислоты. Источниками азота служат кукурузный экстракт, дрожжевой экстракт, гидролизаты казеина, аминокислоты, а также неорганические соли.
Непосредственными предшественниками синтеза FK-506 микроорганизмами являются ацетат, пропионат, бутират, метионин, пипеколиновая кислота, шикимовая кислота [Byrne K.M., Shafiee A., Nielsen J.B., Arison В., Monaghan R.C., Kaplan L In: Developments in Industrial Microbiology Series (Nash C, Hunter-Cevera J, Cooper R, Eveleigh D.E, Hamill R.) p.29-47, Wm. C.Brown Publisher, Iowa; Kojima I., Cheng Y.R., Mohan V., Demain A.L. J. Ind. Microbiol. 1995, v.14, p.436-439; Nielsen J.B, Hsu M-Jo, Byrne K.M., Kaplan L. Biochem. 1991, v.30, p.5789-5796].
В связи с востребованностью такролимуса в медицинской практике разработка эффективного и экономичного способа его получения является в настоящее время одной из приоритетных задач.
В России такролимус не производится, до настоящего времени технология его получения не разработана.
Решение задачи первоначально было основано на поиске природных микроорганизмов, способных к синтезу FK-506. Первым выделенным микроорганизмом, способным осуществлять биосинтез такролимуса, был штамм Streptomyces tsukubaensis No. 9993 [Kino T, Hatanaka H, Hashimoto M, Nishiyama M, Goto T, Okuhara M, Kohsaka M, Aoki H, Imanaka H. J. Antibiot. 1987, v.XL, N.9, p.1249-1255].
Данный штамм был выделен из почвы Тойосато-те, район Цукуба-ган, префектура Ибараки, Япония. Способ получении такролимуса штаммом Streptomyces tsukubaensis No. 9993 (Streptomyces tsukubaensis No. 9993 FERM-BP-927) впервые описан в статье [Kino T, Hatanaka H, Hashimoto M, Nishiyama M, Goto Т, Okuhara M, Kohsaka M, Aoki H, Imanaka H.J. Antibiot. 1987, v.XL, N.9, p.1249-1255] и в патенте [US 5624842, 1997], в котором заявляется биологически чистая культура Streptomyces tsukubaensis No. 9993 FERM BP-927. Изобретение также включает использование каких-либо мутантов, способных продуцировать FR-900506.
В соответствии с заявленным способом биосинтез такролимуса штаммом Streptomyces tsukubaensis No. 9993, FERM BP-927 проводят:
1) в 200 л ферментере со 150 л среды (пример 1, 3);
2) в 2000 л ферментере с 1600 л продуктивной среды (пример 2).
При этом состав продуктивной среды в 200 л ферментере (пример 1) и 2000 л ферментере (пример 2) идентичен, г/л: растворимый крахмал-45, жидкий кукурузный экстракт-10, сухие дрожжи-10, СаСО3-1 и адеканоль (производственной марки Asahi Denka Co.)-1. Однако для засева 200 л ферментера используют первый инокулят, выращенный в колбах Эрленмейера объемом 500 мл со 160 мл среды состава, г/л: глицерин-10, растворимый крахмал-10, глюкоза-5, мука из семян хлопчатника-5, сухие дрожжи-5, жидкий кукурузный экстракт-5 и СаСО3-2, рН 6.5 при 30°C в условиях активного перемешивания на роторной качалке в течение 4 суток (пример 1), а при засеве 2000 л ферментера используют второй инокулят, который выращивают на среде того же состава в 30 л ферментере с 20 л среды в течение 2 суток (пример 2).
После выделения такролимуса из 150 л продуктивной среды получают 1054 мг белого порошка FR-900506, после его очистки - 147.56 мг (пример 1).
Из 1600 л продуктивной среды (пример 2) выделяют 34 г первичного такролимуса в виде белого порошка. Порошок растворяют в ацетонитриле и концентрируют. Концентрат выдерживают ночь при 5°C и получают 22.7 г порошка такролимуса, после рекристаллизации - 13.6 г кристаллов такролимуса в виде бесцветных призм (пример 2).
При сохранении условий культивирования (рН 6.8, 30°C, аэрация 150 л/мин при скорости вращения мешалки 250 об/мин) в 200 л ферментере со 150 л продуктивной среды в течение того же периода биосинтеза - 4 суток, но при изменении состава продуктивной среды, г/л: растворимый крахмал - 50, порошок земляного ореха (арахис) - 5, сухие дрожжи - 5, мука с клейковиной - 5, СаСО3 - 1 и в качестве пеногасителя адеканоль (производственной марки Asahi Denka Co) - 1, из продуктивной среды выделяют, при сохранении стандартных операций, 3.0 г вещества FR-900506 в виде желтого порошка (пример 3).
При выращивании инокулята, используемого в этом примере, растворимый крахмал при сохранении концентрации 10 г/л заменяют на кукурузный, концентрацию муки из семян хлопчатника повышают с 5 до 10 г/л, остальные компоненты и их концентрации не изменяют и культивируют в условиях, аналогичных примеру 1: при 30°C в условиях перемешивания на роторной качалке в течение 4 суток.
Основным и самым существенным недостатком данного способа получения такролимуса является низкая продуктивность. При отсутствии данных по содержанию такролимуса в продуктивной среде при остановке биосинтеза расчет, проведенный по данным первичного выделенного продукта, показывает, что титр такролимуса в среде составляет 7.02 мг/л в примере 1; 21.25 мг/л - в примере 2, и 20.0 мг/л - в примере 3. Выход очищенного продукта составляет 0.98 мг/л (пример 1) и 14.18 мг/л (пример 2).
Кроме того, в примере 3 приведены данные выхода только неочищенного первичного продукта, полученного в виде желтого порошка, что не позволяет провести:
1. сравнительный анализ с первичным выделенным продуктом, описанным в примере 1, в котором первичный продукт представлен белым порошком, что свидетельствует о различной степени чистоты первичного продукта;
2. анализ продуктивности процесса в зависимости от состава компонентов продуктивной среды;
3. достоверную оценку индивидуального влияния измененного состава компонентов ростовой и продуктивной сред на биосинтетическую активность культуры.
Известен способ получения FK-506 с использованием другого природного штамма Streptomyces clavuligerus CKD 1119, который был получен из образцов почв в результате скрининга 127 видов Streptomyces и описанный Kim H.S., Park Y.I. в 2008 году [Kim H.S., Park.Y.I. J. Biosci. Bioeng. 2008, v.105, N.4, p.418-421]. В качестве источника углерода используют растительное масло. Процесс биосинтеза FK-506 проводят в 7 л ферментере (KF-7, KOBio Tech, Корея) с рабочим объемом 4.5 л на среде состава, г/л: глицерин-15, соевая мука-38.5, масло из рисовых зерен-23, КН2РО4-2, MOPS (натриевая соль (3-N-морфолино)-пропансульфоновой кислоты)-20, рН 6.8. Максимальный титр такролимуса 58 мг/л достигают на 8 сутки культивирования. При культивировании на среде того же состава в колбах Эрленмейера объемом 100 мл с 20 мл биосинтетической среды выход FK-506 составляет 52 мг/л.
Значимость данной работы заключается в открытии нового штамма Streptomyces clavuligerus CKD 1119, способного к синтезу такролимуса. Однако титр такролимуса, ограниченный 52-58 мг/л, свидетельствует о низкой ферментативной активности и предлагаемый способ синтеза такролимуса с участием Streptomyces clavuligerus CKD 1119, в настоящее время не представляет практической значимости.
Условия повышения ферментативной активности этого штамма и выхода такролимуса рассматривают в международной патентной заявке WO 2005/063963 А1. Описывают:
1. Культуру Streptomyces clavuligerus, вид, продуцирующий такролимус.
2. Штамм Streptomyces clavuligerus, как указано в п.1, где этот штамм представляет собой Streptomyces clavuligerus CKD 1119 (каталожный номер КСТС 10561 ВР).
3. Способ получения такролимуса путем культивирования штамма по п.1.
4. Способ получения такролимуса, как указано в п.3, где культивирование проводится в среде, содержащей малоновую кислоту, этанол, метионин, источники углерода и азота.
5. Способ получения такролимуса, как указано в п.4, где источник углерода выбирают из группы, состоящей из крахмала, глюкозы, кукурузного масла, мальтозы, маннозы, глицерина и инозитола.
6. Способ получения такролимуса как указано в п.5, где источником углерода служит крахмал, глюкоза или кукурузное масло.
7. Способ получения такролимуса, как указано в п.4, где источник азота выбирают из группы, состоящей из муки из семян хлопчатника, жидкого кукурузного экстракта, порошка кукурузного экстракта, соевой муки, пептона и дрожжевого экстракта.
8. Способ получения такролимуса, как указано в п.7, где источником азота является мука из семян хлопчатника или жидкий кукурузный экстракт.
В результате сравнительного анализа влияния источников углерода и азота на рост и биосинтетическую активность культуры и последующего применения выбранного состава ростовой среды, г/л: крахмал - 40, глюкоза - 5, мука из семян хлопчатника-10, дрожжевой экстракт - 10, жидкий кукурузный экстракт-10, СаСО3 - 2 и биосинтетической среды, г/л: крахмал - 40, глюкоза - 5, кукурузное масло - 20, мука из семян хлопчатника - 30, жидкий кукурузный экстракт - 10, малонат - 2, метионин - 0.5, этанол - 0.3, сульфид железа - 0.1, твин-80 - 2, СаСО3 - 2 при проведении биосинтеза в 30 л ферментере с 18 л среды в течение 7-9 суток при 28°C получают титр FK-506, равный 350 мг/л (пример 6).
Оптимизацией состава компонентов продуктивной среды для Streptomyces clavuligerus CKD 1119 удалось увеличить выход такролимуса более чем в 5.5 раза с 58 мг/л до 350 мг/л. Однако и обозначенный более высокий выход такролимуса не отвечает условиям промышленного уровня, что и определяет существенный недостаток данного способа.
Решение проблемы создания высокоэффективной технологии получения такролимуса не ограничивается поиском природных штаммов, способных синтезировать такролимус, оптимизацией состава ростовой и биосинтетической сред и условий культивирования. Исследуется также взаимосвязь роста культуры и биосинтетической активности, проявляемой полиферментной системой микроорганизмов. При этом синтез макролида в одних случаях авторы связывают с активной фазой роста, в других случаях - с истощением в среде источников углерода и азота, при переходе культуры в стационарную фазу роста [Gesheva V., Ivanova V., Gesheva G. Microbiol. Res. 2005, p.243-248; Kim H.S., Park Y.I. J. Biosci. Bioeng. 2008, v.105, N.4, p.418-421].
В публикации Turlo B.J. с соавторами [Turlo B.J., Gutkowska В., Gajzlerska W. Ada Pol. Pharm. 2006, v.63(5), p.463-465] показано, что фаза активного роста Streptomyces tsukubaensis FERM BP-927 совпадает с периодом активного накопления FK-506, однако его уровень не превышает 5.83 мг/л.
В патенте US 5116756, 1992, в котором заявляется биологически чистая культура микроорганизма Streptomyces sp. ATCC No. 55098 (Meek Culture Collection No. MA 6858, ATCC No. 55098), проводят детальный поиск источников углерода, азота и микроэлементов, обеспечивающих рост культуры и активный биосинтез FK-506.
Аналогичный подход к исследованию с изложением идентичных данных представлены в патенте US 5194378, 1993 «Процесс получения FK-506» в котором рассматривают:
1. Процесс получения иммуносупресанта FK-506, включающий этап культивирования вида Streptomyces sp. ATCC No. 55098 в условиях погруженной аэробной ферментации в водной углеводной среде, содержащей источник азота, в течение времени, достаточного для синтеза FK-506, и выделение и отделение указанного FK-506 и его очистка от указанной ферментационной среды.
2. Процесс по п.1, где микроорганизм, продуцирующий FK-506, представлен мутантным штаммом ATCC No. 55098.
3. Процесс по п.1, где среда представлена ферментационной средой (FKA) и включает растворимый крахмал, жидкий кукурузный экстракт, сухие дрожжи, СаСОз в дистиллированной воде.
4. Процесс по п.1, где среда представлена ферментационной средой (KJ-2) и включает глюкозу, жидкий кукурузный экстракт, растворимые вещества барды, муку из зародышей хлопчатника, CaCl2 и СаСО3.
5. Культуральная среда, полученная в результате процесса по п.1, содержащая FK-506 и клетки Streptomyces sp. ATCC No. 55098, указанная среда проявляет положительное ингибирование активности Т-клеток.
Проведенное детальное исследование показало, что на среде (FKA) достигаемый титр такролимуса 33.3-37.8 мг/л более, чем в 3 раза выше титра такролимуса, полученного на среде, KJ-2. При этом подчеркивают, что биосинтетическая активность культуры и выход такролимуса зависят только от состава продуктивной среды. Отсутствует зависимость активности культуры и от состава компонентов ростовой среды и от возраста инокулята.
Представленные данные расширяют спектр штаммов Streptomyces, способных к синтезу такролимуса и при этом подтверждают, что регуляция биосинтетической активности основана, главным образом, на оптимизации состава продуктивной среды.
Недостатком заявленного способа является низкая эффективность биосинтетического процесса. Изменение состава ростовой и продуктивной сред с использованием различных источников углерода, азота, микроэлементов не приводит к значимым различиям в способности культуры продуцировать FK-506, что, возможно, в данном случае, свидетельствует о генетически обусловленной низкой биосинтетической активности культуры. Вследствие низкой эффективности процесса предлагаемый способ получения такролимуса не может быть рекомендован для масштабирования и получения FK-506 в промышленном масштабе.
Способность природных и мутантных штаммов рода Streptomyces к синтезу FK-506 может значительно увеличиваться или полностью ингибироваться не только при изменении природы и типа источника углерода, азота, а также при дефиците фосфора, определенных ионов металлов [Hassan M.A., El-Naggar M.Y., Said W.Y. Proc. First Int. Conf. (EBB Soc.) Eg. J. Biol. 2001, v.3, p.1-10].
Влияние различных индивидуальных источников углерода с использованием моносахаров (глюкоза, фруктоза, галактоза, ксилоза, арабиноза), дисахаров (мальтоза, лактоза, сахароза), полисахаров (крахмал, декстрины), органических кислот (ацетат, лактат, пропионат, бутират), спиртов (глицерин, инозитол) и комбинации крахмала с глюкозой (20.0 г/л) и азота аминокислот (метионин, лейцин, аспарагин, изолейцин, валин, фенилаланин, треонин, глицин, лизин, серии, глютамат), неорганического азота ((NH4)2SO4, KNO3) и их различных композиционных смесей на рост инокулята и биосинтез FK-506 штаммом Streptomyces sp.MA 6858 (АТСС 55098) были предприняты также группой ученых Yoon Y.J., Choi C.Y. в 1997 году [Yoon Y.J., Choi C.Y. J. Ferment. Bioeng. 1997, v.83, N.6, p.599-603]. Получены данные, показывающие, что одни соединения или их комбинация определяют активный рост, но слабую биосинтетическую активность, при других комбинациях компонентов среды активный синтез FK-506 протекает при относительно слабом накоплении биомассы. В результате был достигнут уровень FK-506, составляющий 38 мг/л.
В результате этого детального исследования, направленного на оптимизацию состава продуктивной среды и условий культивирования, не выявлены условия создания эффективного способа получения FK-506, не выявлены также основные компоненты сред, которые могли бы обеспечить более активный синтез такролимуса в среде и его более высокий выход. Низкая эффективность процесса биосинтеза в богатой по составу компонентов среде является существенным недостатком и данного способа получения FK-506.
В другом исследовании, описанном в WO2006/011156, рассматривают:
1. Процесс получения иммуносупрессанта такролимус FK-506, используя штаммы из группы, объединяющей виды: Streptomyces sp. P5C3, Streptomyces sp. FERM BP 0927, Streptomyces sp. (MA 6858) ATCC No. 55098.
2. Процесс по п.1, включающий культивирование мутантного штамма Streptomyces sp.в аэробных условиях ферментации при перемешивании в водной питательной среде, содержащей растительное масло в качестве источника углерода.
3. Процесс по п.2, где растительное масло выбрано из группы, содержащей хлопковое масло, соевое масло, подсолнечное масло, арахисовое масло.
4. Процесс по п.2, где источник масла предпочтительно соевое масло.
5. Фармацевтический состав, где активный ингредиент получен согласно п.1.
6. Процесс с подпиткой, где по п.1. соевое масло выступает в качестве источника углерода.
7. Процесс получения иммуносупрессанта такролимус (FK-506), описанный здесь.
Культура Steptomyces tsukubaensis на биосинтетической среде (50 мл) с декстрином (80 г/л), декстрозой (25 г/л) и глицерином (100 г/л) в качестве источников углерода, соевым пептоном (10 г/л) и соевой мукой (10 г/л) в качестве источников азота за 10 суток продуцирует лишь 30-60 мг/л такролимуса (пример 2).
При введении в биосинтетическую среду соевого масла в концентрации 40 г/л титр такролимуса за тот же период времени увеличивают до 90-120 мг/л. (пример 3).
В ферментере, объемом 6000 л при сохранении состава биосинтетической среды достигают концентрацию такролимуса в среде порядка 127-180 мг/л за 6-8 суток культивирования (пример 4).
Сохраняя условия выращивания инокулята и состав ростовой и биосинтетической сред, путем ввода добавок соевого масла в продуктивную среду до уровня 0.2-0.7%, начиная с 48 часов, за тот же период времени титр такролимуса увеличивают до 180-330 мг/л (пример 5).
В данном патенте продемонстрирована возможность проведения процесса биосинтеза FK-506 в промышленном масштабе, однако предложенный способ имеет существенные недостатки - многокомпонентность сред, необходимость с целью увеличения выхода FK-506 до 330 мг/л введения подпитки соевым маслом, что усложняет технологию, увеличивает затраты, главным образом, на стадии выделения продукта и его очистки, и определяет низкий конечный выход. Совокупность указанных недостатков данного способа ставит под сомнение целесообразность промышленного производства ввиду вероятной низкой его экономичности.
В патентной заявке US 20080318289 А1 рассматривают биосинтез такролимуса с использованием периодического культивирования с подпиткой.
1. Процесс получения такролимуса или его соли или производного, где процесс включает инкубирование микроорганизма, способного продуцировать такролимус или его соли или производное в питательной среде в аэробных условиях при перемешивании при культивировании с подпиткой при высокой скорости аэрации.
2. Процесс согласно п.1, при котором высокая скорость аэрации составляет 1.5 об/об/мин и более в отношении рабочего объема биореактора.
3. Процесс согласно п.2, где высокая скорость аэрации составляет 1.5-2.5 об/об/мин в отношении рабочего объема биореактора.
4. Процесс согласно п.3, где скорость аэрации составляет 1.5 об/об/мин отношении рабочего объема биореактора.
5. Процесс согласно п.1, где микроорганизм представляет собо суперпродуцентный мутантный или рекомбинантный штамм Streptomyce tsukubaensis.
6. Процесс по п.1, дополнительно включающий предоставление источник углерода.
7. Процесс по п.6, отличающийся тем, что источник углерода подаете: периодически.
8. Процесс согласно п.7, отличающийся тем, что источник углероде подается в течение продуктивной стадии ферментации.
9. Процесс согласно п.7, отличающийся тем, что источник углероде выбирается из одного или более из группы декстрин, крахмал, глюкоза, глицерин ксилоза, галактоза, мальтоза, манноза, салицин, раффиноза, арабиноза, и натрий сукцинат.
10. Процесс согласно п.9, где источник углерода представлен крахмалом или декстрином.
11. Процесс согласно п.1, где рН культуральной среды от 6.5 до 7.8.
12. Процесс согласно п.11, где рН 7.0-7.5.
В качестве биокатализатора используют суперпродуцентный мутантный штамм Streptomyces tsukubaensis.
Представленное изобретение относится к улучшенному процессу получения такролимуса. Выход такролимуса увеличивают с 50-60 мг/л (пример 1) до 130-150 мг/л в режиме культивирования с подпиткой при внесении раствора крахмала (пример 2). Титр такролимуса в среде, равный 160-170 мг/л, достигают при замене дрожжевого экстракта (10 г/л) и пшеничного пептона (2.5 г/л) на соевую муку (10 г/л) и соевый пептон (10 г/л) (пример 3).
При изменении скорости аэрации с 1/1 (об/об) до 2/1 (об/об) и при использовании 30%-ного раствора декстрина в качестве дополнительного источника углерода увеличивают титр такролимуса до 300-310 мг/л.
Существенными недостатками заявленного способа является использование богатой по составу компонентов продуктивной среды, сочетающейся с относительно низким выходом продукта на микробиологической стадии, что определит высокую себестоимость конечного продукта. При этом не указаны объемы реакторов, в которых проводят процесс биосинтеза. Титр такролимуса, составивший 300-310 мг/л в условиях ферментации с подпиткой, был получен только благодаря двукратному увеличению биомассы в процессе ферментации, а не увеличению удельной активности клеток микроорганизмов. Способы увеличения удельной активности биокатализатора не рассматриваются.
Наиболее высокий выход такролимуса описан Jang S. с соавторами [Jung S., Moon S., Lee К., Park Y.J., Yoon S., Yoo J.Y. J. Ind. Microb. Biotec. 2009, v.36, p.1467-1471].
В соответствии с данным способом авторы включают дополнительный этап адаптации к такролимусу используемого штамма Streptomyces sp. TST8. Выросшую при возрастающей концентрации такролимуса от 600 до 1600 мг/л культуру используют в качестве инокулята для засева продуктивной среды состава, г/л: окисленный крахмал - 70, сухие дрожжи - 17, соевая мука - 5, (NH4)2SO4 - 1, СаСО3 - 1, рН 6.2 и проводят биосинтез такролимуса в течение 7 суток в 500 мл колбах с 30 мл указанной среды. Конечный титр такролимуса достигает 400-600 мг/л. В единичном случае при засеве продуктивной среды инокулятом, рост которого протекал при концентрации такролимуса 700 мг/л, достигают титр такролимуса 700 мг/л.
Конечный титр такролимуса 507, 827 и 757 мг/л в биосинтетической среде с использованием штаммов Streptomyces sp. TST9, TST10 и TST11, соответственно, достигают в случае использования в качестве инокулята размороженной культуральной жидкости, в которой рост микроорганизмов протекал при концентрации такролимуса в среде, составляющей 600 мг/л, 900 и 1600 мг/л.
Научная достоверность представленных данных вызывает обоснованные сомнения. Известно, что растворимость такролимуса в воде составляет менее 100 нанограмм/мл (Venkataramanan R. et.al. Pharmacokinetics of FK-506 in Transplant Patiens. Transplant Prog. 1991, 23(6), 2736-2740), т.е. реальная концентрация такролимуса в описанных водных средах не зависит от его вносимого количества и составляет величину, равную его растворимости, а значит, порядка 100 нанограмм/мл. В связи с этим, не ясно, каким способом авторы получают устойчивые к такролимусу морфотипы культуры, в условиях, как они отмечают, возрастающей концентрации такролимуса в среде: 600 мг/л, 900 и 1600 мг/л.
Из текста работы не ясно, в продуктивную среду вносят осадок клеток или гомогенную суспензию, в каком объеме и в каком количестве. Соответственно, не представляется возможным определить содержание такролимуса в ростовой среде, и исходное содержание такролимуса в продуктивной среде. Таким образом, и в этом случае начальный уровень содержания такролимуса в продуктивной среде не упомянут, и, по нашему мнению, он однозначно превышает нулевой.
Кроме того, существенным недостатком способа, как указывают сами авторы, является использование смешанной культуры, что указывает на полиморфность используемых штаммов и обусловленную этим нестабильность биосинтетической активности, что требует дополнительных исследований по условиям сохранения и поддержания активных морфотипов в популяции, обеспечивающих высокую продуктивность.
Наиболее близким по сущности к предложенному способу является метод синтеза такролимуса известным природным штаммом Streptomuces glaucescens MTCC 5115, который был выделен из почв различных географических районов Индии (WO 2005/038009). Представленные в патенте данные продублированы в заявке на патент US 2007/0191415 А1 и в патенте ЕР 1751272 В8, 2009.
В патенте WO 2005/038009 «Производство такролимуса (FK-506) с использованием новых видов Streptomyces species» заявляют:
1. Выделенный микроорганизм Streptomyces glaucescens MTCC 5115.
2. Ферментационный процесс для получения такролимуса (FK-506) и этот процесс, включающий использование выделенного штамма Streptomyces glaucescens MTCC 5115.
3. Процесс получения такролимуса - процесс, включающий этапы культивирования штамма Streptomyces glaucescens MTCC 5115 или его мутанта при условиях погруженной аэробной ферментации в водной питательной среде; выделение такролимуса из указанной среды.
4. Процесс согласно п.3, где питательная среда включает один или более источников углерода, источников азота, минеральных солей.
5. Процесс по п.4, где источник углерода представляет собой углеводную среду.
6. Процесс согласно п.5, где углеводный источник - один или более - глюкоза, ксилоза, галактоза, глицерин, декстроза, крахмал, декстрин, мальтоза, полиэтиленгликоль, соевое масло, рамноза, раффиноза, арабиноза, манноза, салицин и натрий сукцинат.
7. Процесс согласно п.4, где источник азота - один или более - дрожжевой экстракт, соевый пептон, соевая мука, мука из семян хлопчатника, жидкий кукурузный экстракт, пшеничный пептон, молочный порошок.
8. Процесс согласно п.4, где минеральные соли - одна или более - соли кальция, магния, натрия, кобальта, меди и калия.
9. Процесс согласно п.4, где питательная среда включает пеногаситель.
10. Процесс согласно п.3, где температура в течение ферментации поддерживается от 20°C до 40°C.
11. Процесс согласно п.10, где температура поддерживается от 24°C до 35°C.
12. Процесс согласно п.3, где рН в течение ферментации поддерживалась от 6.0 до 8.0.
13. Процесс согласно п.12, где рН поддерживается около 6.8-7.5.
14. Процесс согласно п.3, где питательная среда представлена жидким культуральным бульоном.
15. Процесс по п.3, где выделение такролимуса включает одну или более фильтраций, центрифугирование, концентрирование, концентрирование под вакуумом, лиофилизацию, закисление, экстракцию соответствующим растворителем, обработку адсорбентами, обработку смолами, очистку, рекристаллизацию.
16. Процесс по п.15 дополнительно содержит рекристаллизацию выделенного продукта.
17. Процесс по п.16 дополнительно содержит формирование продукта, полученного в готовой лекарственной форме.
18. Способ лечения или предотвращения трансплантационного отторжения органов и тканей в теплокровных животных, этот способ, включающий предоставление лекарственной формы для теплокровных животных, который включает такролимус, полученный по п.3 патентной формулы.
19. Способ по п.18, где орган или ткань представлены сердцем, почками, печенью, костным мозгом и кожей.
20. Фармацевтическая композиция, включающая терапевтически эффективное количество такролимуса, полученного по процессу п.3 патентной формулы, и один или более фармацевтически приемлемых носителей, наполнителей или разбавителей.
Оптимальный композиционный состав ростовой, биосинтетической, агаризованной сред, концентрации компонентов определяют при скрининге широкого ряда Сахаров, органических и неорганических источников азота, минеральных солей.
За 240-310 часов культивирования штамма Streptomyces glaucescens MTCC 5115 колбах Эрленмейера объемом 500 мл с 25 мл среды в условиях перемешивания и аэрации на роторной качалке, при рН 7.0-7.2, 24°C при оптимально подобранном, по мнению авторов, составе компонентов продуктивной среды состава, г/л: декстроза - 5, декстрин - 120, глицерин - 10, мука из семян хлопчатника - 10, соевая мука - 10, соевый пептон - 10, KH2PO4 - 0.8, полиэтиленгликоль - 1 получают в культуральной жидкости FK-506 в концентрации 5-10 мг/л.
Проводят выделение продукта, выделенный продукт соответствует аутентичному FK-506 (пример 5), однако выход выделенного продукта не указывают.
Основным недостатком данного способа является крайне малая продуктивность, обусловленная низкой биосинтетической активностью выделенного штамма. При длительности процесса 240-310 часов титр такролимуса составляет 5-10 мг/л.
Способ демонстрирует синтез такролимуса культурой только в объеме среды 25 мл, и только на одной среде, в которой источниками углерода являются декстрин, декстроза и глицерин. Рамноза, как возможный источник углерода, упоминается в общем виде среди широкого ряда различных по природе источников углерода.
По совокупности признаков данный процесс не экономичен и не имеет практической значимости.
Общими недостатками ближайших рассмотренных способов микробиологического синтеза такролимуса являются:
- ограниченность культур, способных к синтезу такролимуса, родом Streptomyces;
- низкий уровень биосинтетической активности природных и мутантных штаммов Streptomyces;
- необходимость создания сложных по составу и оптимизированных по содержанию компонентов сред: агаризованной, ростовой, биосинтетической, обеспечивающих наиболее высокий уровень направленной ферментативной активности каждой из использованных культур;
- морфологическая и физиолого-биохимическая неоднородность популяции стрептомицетов, необходимость постоянного отбора и поддержания активных морфотипов.
Технической задачей заявляемого изобретения является достижение титра такролимуса в продуктивной среде, превышающего 900 мг/л, упрощение технологии выделения целевого продукта, сокращение объемов используемого для этой цели органического растворителя.
Техническая задача решается способом получения такролимуса методом микробиологического синтеза в водной среде, содержащей один или более источников углерода, азота, с использованием минеральных солей в режиме культивирования с подпиткой в диапазоне рН 6.8-7.8, при 25-35°C, с применением клеток микроорганизмов, способных к синтезу такролимуса, отличающуюся тем, что процесс биосинтеза такролимуса осуществляют с использованием клеток бактерий Streptomyces sp. BKM Ас-2618Д, популяцию которой поддерживают в морфологически однородном состоянии со стабильно высокой биосинтетической активностью.
В качестве дополнительного источника углерода используют рамнозу, в качестве необходимого компонента среды - MnSO4 и процесс проводят в присутствии сорбента, в качестве сорбента используют нейтральные амберлиты - ХАД.
Подпитку проводят дробно на 4-7 сутки культивирования, используя растворимый крахмал.
Выделение такролимуса ограничивают сорбентом.
Техническим результатом является создание эффективного, конкурентного способа микробиологического синтеза такролимуса формулы I
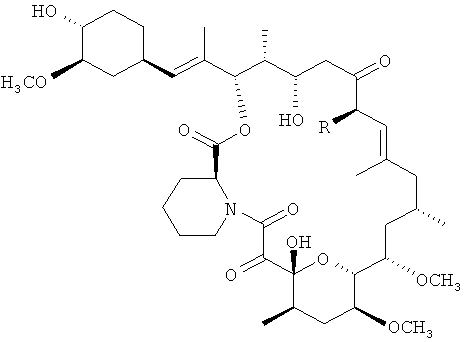
с выходом, достигающим 980 мг/л, упрощение технологии выделения продукта из среды за счет использования сорбента, снижение объемов органического растворителя при экстракции продукта только с сорбента, использование дешевого, нетоксичного растворителя.
Применение на стадии синтеза такролимуса рамнозы в сочетании с MnSO4 и введение амберлитного сорбента в среду не является очевидным и ранее совокупность указанных признаков в процессах биосинтеза такролимуса не использовались.
Преимущества заявляемого способа получения такролимуса методом микробиологического синтеза состоят в следующем:
Процесс характеризуется активным накоплением такролимуса, титр на 10 сутки культивирования достигает 980 мг/л.
Использование амберлитного сорбента исключает выделение такролимуса из всего объема продуктивной среды, ограничивая процесс экстракцией такролимуса с сорбента, отделенного от среды, что также выражается в сокращении расхода органического растворителя.
Сохранение и использование активного морфотипа культуры стрептомицета позволяет длительное время поддерживать высокую биосинтетическую активность и ее стабильность.
Способ может быть реализован на стандартном технологическом оборудовании в перспективе.
Ниже приводится подробное описание сущности изобретения.
Способ получения такролимуса формулы I:
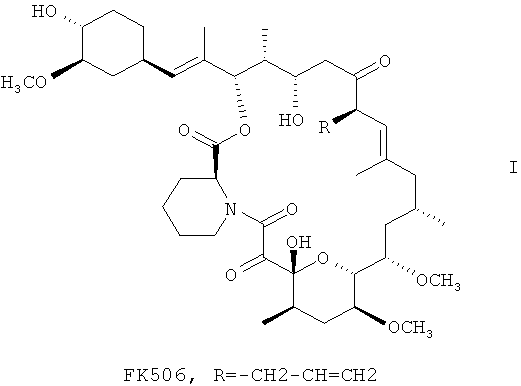
осуществляют методом микробиологического синтеза с участием клеток Streptomyces sp.BKM Ас-2618Д. Процесс проводят в питательной среде, содержащей в качестве дополнительного источника углерода рамнозу, необходимого компонента среды MnSO4 и сорбент из группы амберлитов-XAD.
При этом внесение рамнозы и MnSO4 проводят одновременно с инокулятом.
Кроме того, концентрация рамнозы в среде составляет не менее 20 г/л, концентрация MnSO4 не менее 0.05 г/л.
В качестве сорбентов используют амберлиты XAD-4 или XAD-7HP или XAD-16 или XAD-1180. Предпочтительно использование сорбента амберлит XAD-7HP.
Использование рамнозы, MnSCU и дробное добавление крахмала обеспечивает активный и длительный синтез такролимуса.
Анализ такролимуса, связанного с сорбентом, проводят в динамике процесса биосинтеза методом тонкослойной хроматографии (ТСХ) или высокоэффективной жидкостной хроматографии (ВЭЖХ), используя сорбент, отделенный от продуктивной среды. При отсутствии сорбента накопление такролимуса контролируют методом ТСХ или ВЭЖХ, используя аликвоты среды. Экстракцию такролимуса проводят этанолом.
Аналитическая ВЭЖХ для количественного определения такролимуса выполняется с использованием колонки LiChrospher®100 (RP-18, 5 мкм, 125 мм × 4 мм, фирмы Merck) с предколонкой Daltosil 100 (RP-18, 4 мкм, 4.6 мм × 76 мм, фирмы Serva). Условия хроматографии: мобильная фаза - 65% (об/об) водный ацетонитрил, 0.01% (об/об) трифторуксусная кислота; скорость потока 1 мл/мин; 50°C. Детекция при 200 нм.
Приготовление проб: 0,5 мл этанольного экстракта разводят равным объемом 50%-ного водного раствора ацетонитрила, затем центрифугируют 20 мин при 13000 об/мин.
Расчет концентрации такролимуса ведут по калибровке с внешним стандартом на основании значений площадей пиков.
Выделение такролимуса с амберлитного сорбента может быть проведено экстракцией органическим растворителем: метанолом, этанолом, этилацетатом, диметилсульфоксидом и др.
Заявленная группа изобретений иллюстрируется нижеследующими примерами.
Пример 1.
Штамм Streptomyces sp. BKM Ас-2618Д поддерживают на среде состава, г/л: растворимый крахмал-10, дрожжевой экстракт - 4, солодовый экстракт - 10, агар - 20, рН до автоклавирования 6.8-7.0. Рост и формирование колоний на чашках Петри с агаризованной средой проводят при 28-30°C в течение 10-14 суток. Колонии пересевают на косяки со скошенной агаризованной средой и выращивают в аналогичных условиях.
Приготовление инокулята.
Приготовление первого инокулята: смыв культуры (споры и мицелий) с поверхности скошенной агаризованной среды 2 мл стерильной воды вносят в колбу Эрленмейера объемом 750 мл с 50 мл жидкой среды состава, г/л: растворимый крахмал - 20, глюкоза - 5, дрожжевой экстракт - 5, кукурузный экстракт жидкий - 5 или лиофилизованный-7.5, СаСО3 - 3, рН до автоклавирования 7.0-7.2 и инкубируют при 30°C на роторной качалке при 200 об/мин в течение 44-48 часов.
Приготовление второго инокулята: второй инокулят выращивают в среде того же состава в аналогичных условиях в течение 24 часов, используя для засева 5 мл первого инокулята (10%).
Биосинтез такролимуса.
Биосинтез такролимуса проводят растущей культурой в колбах Эрленмейера объемом 750 мл с 50 мл продуктивной среды состава, г/л: растворимый крахмал - 90, кукурузный экстракт жидкий - 10, сухие дрожжи - 20, СаСО3 - 3, рН до автоклавирования 6.8-7.0. Инокулят вносят в объеме 5%.
Анализ накапливающегося в среде такролимуса проводят методом ТСХ и ВЭЖХ.
Описание метода ТСХ. В динамике процесса отбирают аликвоты в объеме 1 мл, добавляют 2 мл 96% этанола и экстрагируют при интенсивном перемешивании в течение 30 мин. Этанольную фракцию, содержащую от 1 до 4 мкг такролимуса, после отделения осадка, в рассчитанном объеме наносят на пластинку Sorbfil UV-254. На эту пластинку наносят также стандартный раствор такролимуса, также содержащий от 1 до 4 мкг. Разделение соединений проводят в системе бензол/ацетон в соотношении 5/3 об/об. Пластинку просушивают, обрабатывают раствором состава: фосфоромолибденовая кислота - 2.5 г, сульфат церия тетрагидрат - 1 г, серная кислота конц. - 6 мл, вода-94 мл, просушивают и нагревают при 120°C до проявления пятен продукта.
При завершении процесса на 10 сутки культивирования культуральную жидкость центрифугируют при 4°C, 8000 g в течение 30 мин, содержание такролимуса определяют в осадке клеток и супернатанте. Для этого к осадку клеток добавляют 50 мл этанола и проводят экстракцию такролимуса при 30°C на роторной качалке в течение 2 часов с последующим центрифугированием в указанных условиях. Экстракцию повторяют в аналогичных условиях. Объединенный этанольный экстракт используют для анализа содержания такролимуса в описанных выше условиях методами ТСХ и ВЭЖХ. Супернатант высушивают на чашках Петри при 30°C и экстрагируют этанолом при соотношении первоначального объема к этанолу 1/0.2 и анализируют методами ТСХ и ВЭЖХ.
Описание метода ВЭЖХ. 0,5 мл полученного этанольного экстракта осадка клеток разводят равным объемом 50%-ного водного раствора ацетонитрила, затем центрифугируют 20 мин при 13000 об/мин. Условия хроматографии: мобильная фаза - 65% (об/об) водный ацетонитрил, 0.01% (об/об) трифторуксусная кислота; скорость потока 1 мл/мин; 50°C. Детекция при 200 нм.
Расчет концентрации такролимуса ведут по калибровке с внешним стандартом на основании значений площадей пиков.
За 7 суток культивирования при 25°C на роторной качалке при 220 об/мин получают 139 мг/л такролимуса в культуральной жидкости.
Пример 2.
Влияние концентрации крахмала в среде на синтез такролимуса Streptomyces sp. BKM Ас-2618Д и его выход.
Вариант 1.
Биосинтез такролимуса проводят растущей культурой Streptomyces sp. BKM Ас-2618Д в колбах Эрленмейера объемом 750 мл с 50 мл продуктивной среды состава, г/л: растворимый крахмал - 75, кукурузный экстракт лиофилизированный - 15, сухие дрожжи - 20, СаСО3 - 3, рН до автоклавирования 6.8-7.0. Инокулят вносят в объеме 5%. Биосинтез осуществляют при 25°C на роторной качалке при 220 об/мин в течение 7 суток. Анализ такролимуса проводят методом ТСХ и ВЭЖХ. Титр такролимуса за тот же период времени составляет 137 мг/л.
Вариант 2.
Способ осуществляют по варианту 1, но концентрация крахмала снижена до 50 г/л. Титр такролимуса за тот же период времени составляет 95 мг/л.
Пример 3.
Влияние рамнозы на биосинтетическую активность Streptomyces sp. BKM Ас-2618Д и выход такролимуса.
Вариант 1.
Биосинтез такролимуса проводят растущей культурой Streptomyces sp. BKM Ac 2618D в колбах Эрленмейера объемом 750 мл с 48 мл продуктивной среды состава, г/л: растворимый крахмал - 75, кукурузный экстракт лиофилизированный - 15, сухие дрожжи - 20, СаСО3 - 3, рН до автоклавирования 6.8-7.0. После автоклавирования вносят стерильный раствор рамнозы - 0.5 г (10 г/л) в 2 мл дистиллированной воды. Инокулят вносят в объеме 5%. Биосинтез осуществляют при 25°C на роторной качалке при 220 об/мин в течение 7 суток. Анализ такролимуса проводят методом ТСХ и ВЭЖХ. Титр такролимуса составляет 160 мг/л.
Вариант 2.
Способ осуществляют по варианту 1, но после автоклавирования вносят стерильный раствор рамнозы - 1.0 г (20 г/л) в 2 мл дистиллированной воды. Титр такролимуса за тот же период времени составляет 185 мг/л.
Вариант 3.
Способ осуществляют по варианту 1, но после автоклавирования вносят стерильный раствор рамнозы - 1.5 г(30 г/л) в 2 мл дистиллированной воды. Титр такролимуса составляет 168 мг/л.
Пример 4.
Влияние сульфата марганца на биосинтетическую активность Streptomyces sp. ВКМ Ас-2618Д и выход такролимуса.
Вариант 1.
Биосинтез такролимуса проводят растущей культурой Streptomyces sp. BKM Ас 2618D в колбах Эрленмейера объемом 750 мл с 49 мл продуктивной среды состава, г/л: растворимый крахмал - 75, кукурузный экстракт лиофилизированный - 15, сухие дрожжи - 20, СаСО3 - 3, рН до автоклавирования 6.8-7.0. После автоклавирования вносят стерильный раствор сульфата марганца - 1.5 мг (0.03 г/л) в 1 мл дистиллированной воды. Инокулят вносят в объеме 5%. Биосинтез осуществляют при 25°C на роторной качалке при 220 об/мин в течение 7 суток. Анализ такролимуса проводят методом ТСХ и ВЭЖХ. Титр такролимуса составляет 165 мг/л.
Вариант 2.
Способ осуществляют по варианту 1, но после автоклавирования вносят стерильный раствор сульфата марганца - 2.5 мг (0.05 г/л) в 1 мл дистиллированной воды. Титр такролимуса составляет 180 мг/л.
Вариант 3.
Способ осуществляют по варианту 1, но после автоклавирования вносят стерильный раствор сульфата марганца - 3.5 мг (0.07 г/л) в 1 мл дистиллированной воды. Титр такролимуса составляет 175 мг/л.
Пример 5.
Синтез такролимуса Streptomyces sp. BKM Ас-2618Д в средах с сорбентом - ХАД-4.
Вариант 1.
Биосинтез такролимуса проводят растущей культурой Streptomyces sp. BKM Ас-2618Д в колбах Эрленмейера объемом 750 мл с 50 мл продуктивной среды состава, г/л: растворимый крахмал - 75, кукурузный экстракт лиофилизированный - 15, сухие дрожжи - 20, СаСО3 - 3, рН до автоклавирования 6.8-7.0. Инокулят вносят в объеме 5%. На 3 сутки культивирования вносят сорбент - 2 г ХАД-4. Сорбент предварительно стерилизуют при 112°C, 30 мин. Биосинтез осуществляют при 25°C на роторной качалке при 220 об/мин в течение 10 суток. После отделения осадка методом центрифугирования добавляют 50 мл этанола и проводят экстракцию такролимуса при 30°C на роторной качалке в течение 2 часов с последующим центрифугированием при 5000 об/мин в течение 20 мин. Экстракцию повторяют в аналогичных условиях, используя 30 мл этанола. Объединенный этанольный экстракт используют для анализа содержания такролимуса. Анализ такролимуса проводят методом ТСХ и ВЭЖХ. Титр такролимуса составляет 410 мг/л.
Вариант 2.
Способ осуществляют по варианту 1, но после автоклавирования среды, объемом 47 мл, вносят стерильные растворы: 2.5 мг сульфата марганца (0.05 г/л) в 1 мл дистиллированной воды и 1 г рамнозы (20 г/л) в 2 мл дистиллированной воды. Титр такролимуса составляет 655 мг/л.
Вариант 3.
Способ осуществляют по варианту 2, но на 4-7 сутки биосинтеза в среду вносят крахмал - 0.29 г (5.8 г/л) в 3 мл дистиллированной воды. Титр такролимуса составляет 780 мг/л.
Пример 6.
Синтез такролимуса Streptomyces sp. BKM Ас-2618Д в средах с сорбентами: ХАД-16, ХАД-7НР, ХАД-1180.
Вариант 1.
Биосинтез такролимуса проводят растущей культурой Streptomyces sp. BKM Ас-2618Д в колбах Эрленмейера объемом 750 мл с 50 мл продуктивной среды состава, г/л: растворимый крахмал - 75, кукурузный экстракт лиофилизированный - 15, сухие дрожжи - 20, СаСО3 - 3, рН до автоклавирования 6.8-7.0. После автоклавирования среды, объемом 47 мл, вносят стерильные растворы: 2.5 мг сульфата марганца (0.05 г/л) в 1 мл дистиллированной воды и 1 г рамнозы (20 г/л) в 2 мл дистиллированной воды. Инокулят вносят в объеме 5%. На 3 сутки культивирования вносят сорбент - 2 г ХАД-16. Сорбент предварительно стерилизуют при 112°C, 30 мин. На 4-7 сутки биосинтеза в среду вносят крахмал - 2.9 г (5.8 г/л) в 3 мл воды. Биосинтез осуществляют при 25°C на роторной качалке при 220 об/мин в течение 10 суток. После отделения сорбента методом фильтрации к сорбенту добавляют 50 мл этанола и проводят экстракцию такролимуса при 30°C на роторной качалке в течение 2 часов с последующим центрифугированием при 5000 об/мин в течение 20 мин. Экстракцию повторяют в аналогичных условиях, используя 30 мл этанола. Объединенный этанольный экстракт используют для анализа содержания такролимуса. Анализ такролимуса проводят методом ТСХ и ВЭЖХ. Титр такролимуса составляет 910 мг/л.
Вариант 2.
Способ осуществляют по варианту 1, но в качестве сорбента используют ХАД-7НР. Титр такролимуса составляет 980 мг/л.
Вариант 3.
Способ осуществляют по варианту 1, но в качестве сорбента используют ХАД-1180. Титр такролимуса составляет 950 мг/л.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм актиномицета Streptomyces tsukubensis -продуцент такролимуса и способ получения такролимуса | 2019 |
|
RU2722699C1 |
| СПОСОБ СОРБЦИОННО-ХРОМАТОГРАФИЧЕСКОГО ВЫДЕЛЕНИЯ И ОЧИСТКИ ТАКРОЛИМУСА | 2018 |
|
RU2694354C1 |
| ШТАММ STREPTOMYCES TSUKUBENSIS - ПРОДУЦЕНТ ТАКРОЛИМУСА И СПОСОБ ПОЛУЧЕНИЯ ТАКРОЛИМУСА | 2018 |
|
RU2686779C1 |
| Штамм Streptomyces virginiae - продуцент вирджиниамицина и способ получения вирджиниамицина | 2016 |
|
RU2637857C1 |
| Штамм Streptomyces sp. YVZ013 - продуцент антибиотика поликетомицина | 2023 |
|
RU2813975C1 |
| Штамм Streptomyces sp. YVZ014 - продуцент антибиотика лизолипина X | 2023 |
|
RU2817695C1 |
| Штамм Streptomyces sp. YVZ012 - продуцент суругамида А | 2023 |
|
RU2821907C1 |
| Штамм Streptomyces iakyrus Pe6 ВКПМ Ас-2084 - продуцент антибиотика нибомицина | 2018 |
|
RU2696029C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЛАВУЛАНОВОЙ КИСЛОТЫ | 1997 |
|
RU2188868C2 |
| СПОСОБ ОТБОРА ВЫСОКОПРОДУКТИВНОГО ШТАММА - ПРОДУЦЕНТА ОКСИТЕТРАЦИКЛИНА И ШТАММ STREPTOMYCES RIMOSUS - ПРОДУЦЕНТ ОКСИТЕТРАЦИКЛИНА | 1995 |
|
RU2110576C1 |
Изобретение относится к биотехнологии, в частности к новому, высокоэффективному способу получения такролимуса (FK-506) методом микробиологического синтеза. Способ предусматривает приготовление инокулята клеток Streptomyces sp. MT246 (ВКМ Ас-2618Д), приготовление питательной среды, содержащей один или более источников углерода, азота, ионов металлов в виде растворимых солей с дробной подачей источника углерода в течение продуктивной стадии. При этом в качестве дополнительного источника углерода питательная среда содержит рамнозу, а необходимого компонента питательной среды - MnSO4 и сорбент из группы амберлитов XAD. Внесение инокулята клеток Streptomyces sp. MT246 (ВКМ Ас-2618Д) в питательную среду совместно с рамнозой и MnSO4 в заданном соотношении и инкубирование при рН среды 7,0-7,5, температуре 25-35°C в течение 7-10 суток. Отделение осадка проводят центрифугированием. К полученному осадку добавляют этанол в заданном соотношении с последующей экстракцией такролимуса при 30° в течение 2 часов и центрифугированием с получением экстракта, содержащего такролимус. Изобретение позволяет повысить выход такролимуса до 980 мг/л. 8 з.п. ф-лы, 6 пр.
1. Способ получения такролимуса (FK 506) формулы I

методом микробиологического синтеза с участием клеток микроорганизмов рода Streptomyces, способного к биосинтезу такролимуса, в водной питательной среде, содержащей один или более источников углерода, азота, ионов металлов в виде растворимых солей, с дробной подачей источника углерода в течение продуктивной стадии, при рН среды 7.0-7.5, 25°C-35°C, отличающийся тем, что синтез проводят с участием Streptomyces sp.MT246 (ВКМ Ас-2618Д) в среде, содержащей рамнозу в качестве дополнительного источника углерода, и в присутствии MnSO4 и сорбента амберлит XAD.
2. Способ по п.1, отличающийся тем, что MnSO4 вносят в среду на стадии инокулирования среды.
3. Способ по п.2, отличающийся тем, что концентрация MnSO4 составляет 0,03-0,07 г/л.
4. Способ по п.2, отличающийся тем, что предпочтительная концентрация MnSO4 составляет 0,05 г/л.
5. Способ по п.1, отличающийся тем, что рамнозу вносят при инокулировании среды.
6. Способ по п.5, отличающийся тем, что концентрация рамнозы составляет 10-30 г/л.
7. Способ по п.5, отличающийся тем, что предпочтительная концентрация рамнозы 20 г/л.
8. Способ по п.1, отличающийся тем, в качестве сорбента используют амберлиты XAD-4, или XAD-7HP, или XAD-16, или XAD-1180.
9. Способ по п.8, отличающийся тем, что предпочтительно использование сорбента амберлит XAD-7HP.
| US 2007191415 А1, 16.08.2007 | |||
| LEE et al., Improved production of teicoplanin using adsorbent resin in fermentations, Letters in Applied Microbiology, 2003, 37, 196-200 | |||
| XIAO et al., Batch and column study: Sorption of perfluorinated surfactants from water and cosolvent systems by Amberlite XAD resins, Journal of Colloid and Interface Science 368 (2012), 505-511 | |||
| DE 102008049306 A1, 01.04.2010 | |||
| RU 23117991 C1, 27.02.2008. |
Авторы
Даты
2013-10-20—Публикация
2012-04-02—Подача