Область техники
Изобретение относится к микробной биотехнологии, микробиологической промышленности и касается штамма микроорганизма вида Streptomyces sp. YVZ012, продуцирующего суругамид А - нерибосомальный циклический октапептид с антидрожжевой активностью. Изобретение может быть использовано для получения суругамида А - вещества, обладающего антигрибной активностью, а также способностью ингибировать каталитическую активность внутриклеточного протеолитического фермента катепсина В. Практическое применение суругамида А возможно как для разработки фунгицидных препаратов, так и в качестве блокатора активности катепсина В, востребованного при терапии широкого спектра паталогических процессов в организме человека.
Уровень техники
Впервые суругамиды A-E - циклические октапептиды с четырьмя D-аминокислотами в составе были выделены из культуральной жидкости актиномицетного изолята Streptomyces sp. JAMM992 морского происхождения [Takada K, Ninomiya A, Naruse M, Sun Y, Miyazaki M, Nogi Y, Okada S, Matsunaga S. 2013. Surugamides A-E, cyclic octapeptides with four d-Amino acid residues, from a marine Streptomyces sp.: LC-MS-aided inspection of partial hydrolysates for the distinction of d- and l-amino acid residues in the sequence. J Org Chem 78:6746-6750. 10.1021/jo400708u].
В 2016 году был впервые описан, а впоследствии уточнен, биосинтетический кластер суругамидов, содержащий четыре гена нерибосомальных пептидсинтаз. Гены surA/surD кодируют нерибосомальные пептидсинтазы, ответственные за сборку циклических октапептидов, а surB/surC - циклического декапептида циклосуругамида F и его линейного производного суругамида F [Ninomiya A, Katsuyama Y, Kuranaga T, Miyazaki M, Nogi Y, Okada S, Wakimoto T, Ohnishi Y, Matsunaga S, Takada K. 2016. Biosynthetic gene cluster for surugamide A encompasses an unrelated decapeptide, surugamide F. ChemBioChem 17:1709-1712. doi: 10.1002/cbic.201600350. Matsuda K., Kuranaga T., Sano A., Ninomiya A., Takada K., Wakimoto T. 2019. The Revised Structure of the Cyclic Octapeptide Surugamide A, Chemical and Pharmaceutical Bulletin. Vol. 67. Is. 5. P. 476-480, https://doi.org/10.1248/cpb.c19-00002].
В in vitro тестах циклические пептиды данной группы проявляли способность ингибировать протеиназную активность катепсина В - фермента, координирующего физиологические и патологические процессы, связанные с гидролизом белков в организме, и там образом способствующего поддержанию воспалительной реакции. Уровень катепсина В, как и других родственных цистеиновых катепсинов, повышается при различных «катепсин-зависимых» состояниях, включающих онкологические, сердечно-сосудистые, нейро-дегенеративные, аутоиммунные и другие заболевания [EA 201001262].
Для суругамида А в литературе не представлено данных о подавляющем действии на дрожжевые грибы.
Однако, в 2017 году используя приемы модификации генома, направленные на активацию так называемых «молчащих генов», группе исследователей из Принстонского университета (США) удалось выделить ранее неизвестное вещество, названное ацил-суругамидом А (моноизотопная масса 982,669 г/моль), продемонстрировавшее антигрибную активность в отношении дрожжей Saccharomyces cerevisiae [Xu F., Nazari B., Moon K., Bushin L.B., Seyedsayamdost M.R. Discovery of a cryptic antifungal compound from Streptomyces albus J1074 using high-throughput elicitor screens. Journal of the American Chemical Society 2017 139 (27), 9203-9212 https://doi.org/10.1021/jacs.7b02716].
Таким образом, на основании литературных данных суругамид А обладает значительным потенциалом, как блокатор катепсина В, а также на оснований данных, полученных авторами показал себя как ингибитор роста дрожжевых грибов, и таким образом может быть использован для разработки лекарственных препаратов для терапии широкого ряда заболеваний.
Известны несколько штаммов продуцентов суругамида А, выделенные из различных местообитаний, филогенетически близкие стрептомицеты, родственные типовым штаммам в настоящеее время рассматриваемым как вид Streptomyces albidoflavus:
Streptomyces sp. JAMM992, выделенный из морских осадков в заливе Суруга (Япония), продуцирует суругамиды А-D, с преобладанием суругамида А. Данные по продуктивности штамма приведены некорректно - отсутствует ссылка на объем [Takada et al., 2013 - по ссылке выше]
Streptomyces sp. SM17, выделен из морской губки Haliclona simulans, обитавшей в заливе Киркелан (Ирландия), продуктивность данного штамма была установлена на уровне 4 мг суругамида А в литре культуральной жидкости [Almeida E.L., Kaur N., Jennings L.K., Carrillo Rincón A.F., Jackson S.A., Thomas O.P., & Dobson, A.D.W. 2019. Genome Mining Coupled with OSMAC-Based Cultivation Reveal Differential Production of Surugamide A by the Marine Sponge Isolate Streptomyces sp. SM17 When Compared to Its Terrestrial Relative S. albidoflavus J1074. Microorganisms, 7(10), 394. https://doi.org/10.3390/microorganisms7100394].
Streptomyces albidoflavus J1074, хорошо изученный модельный штамм, используемый для генетических манипуляций, происходящий от природного почвенного изолята Streptomyces albus G [Myronovskyi, M., Tokovenko, B., Brötz, E., Rückert, C., Kalinowski, J., & Luzhetskyy, A. 2014. Genome rearrangements of Streptomyces albus J1074 lead to the carotenoid gene cluster activation. Applied microbiology and biotechnology, 98(2), 795-806. https://doi.org/10.1007/s00253-013-5440-6]. У данного штамма также была показана продукция суругамидов, однако, продуктивность была минимум втрое ниже, чем у штамма Streptomyces sp. SM17.
S. albidoflavus LHW3101, выделенный из морских губок обнаружил способность к синтезу суругамидов A-F, и стал объектом для изучения функции белка, кодируемого геном surE и его роли в биосинтезе суругамидов [Zhou Y., Lin X., Xu C., Shen Y., Wang S.-P., Liao H., Li L., Deng H., H.-W. Lin. Investigation of Penicillin Binding Protein (PBP)-like Peptide Cyclase and Hydrolase in Surugamide Non-ribosomal Peptide Biosynthesis. 2019. Cell Chemical Biology. Vol. 26. Is. 5. P.737-744. https://doi.org/10.1016/j.chembiol.2019.02.010]. Однако, продуктивность данного штамма и полученных на его основе мутантных штаммов не известна.
Таким образом, к серьезным недостаткам выше указанных штаммов, как продуцентов суругамида А, можно отнести низкую продуктивность или отсутствие данных о таковой.
Техническая проблема, решаемая посредством заявляемого изобретения, заключается в необходимости преодоления недостатков, присущих аналогам и прототипу за счет получения бактериального штамма, способного продуцировать ферментационную жидкость с высоким содержанием суругамида А.
Раскрытие изобретения
Техническим результатом изобретения является получение бактериального штамма, способного продуцировать ферментационную жидкость с высоким содержанием суругамида A, не менее 10 мг/л.
Технический результат достигается штаммом Streptomyces sp. YVZ012 ВКМ Ас-3000D - продуцентом суругамида А.
В ходе широкомасштабного поиска новых продуцентов антибиотиков из кишечника медоносных пчел был выделен природный высокопродуктивный штамм Streptomyces sp. YVZ012 ВКМ Ас-3000D, в продуктах биосинтеза которого были обнаружены суругамиды А-Е, с преобладанием до 97% суругамида А.
Штамм Streptomyces sp. YVZ012 ВКМ Ас-3000D был выделен при поверхностном посеве на минеральный агар №1 Гаузе [Гаузе ГФ, Преображенская ТП, Свешникова МА и др. Определитель актиномицетов. Роды Streptomyces, Streptoverticillium, Chainia; Наука: Москва, 1983] из кишечника медоносных пчел Apis mellifera carpatica. Рабочие особи были отобраны в Москве на учебной пасеке МГАВМиБ - МВА имени К.И. Скрябина в октябре 2022 года.
Штамм депонирован во Всероссийской Коллекции Микроорганизмов ФГБУ «ФИЦ «Пущинский Научный Центр Биологических Исследований Российской Академии Наук» (Россия, 142290, Московская обл., Пущино, пр. Науки, 5, ИБФМ) под регистрационным номером ВКМ Ас-3000D.
Идентификация штамма основывалась на так называемом полифазном подходе, сочетающем оценку молекулярно-генетических, культурально-морфологических и физиологических признаков, что в настоящее время признано наиболее рациональным подходом к определению таксономической принадлежности актиномицетов.
Анализ данных секвенирования нуклеотидной последовательности гена 16S рРНК и сопоставления этих данных с последовательностями типовых штаммов актиномицетов, депонированными в базу GenBank (https://www.ncbi.nlm.nih.gov/genbank) показал, что штамм YVZ012 наиболее близко (99,83%) кластеризуется со штаммами, в настоящее время реклассифицированными как представители вида Streptomyces sp. [Rong X, Guo Y, Huang Y. Proposal to reclassify the Streptomyces albidoflavus clade on the basis of multilocus sequence analysis and DNA-DNA hybridization, and taxonomic elucidation of Streptomyces griseus subsp. solvifaciens. Syst Appl Microbiol 2009; 32:314-322. https://doi.org/10.1016/j.syapm.2009.05.003].
Культурально-морфологические признаки
Культуральные (табл. 1) признаки штамма Streptomyces sp. YVZ012 ВКМ Ас-3000D описаны на спектре традиционно используемых твердых питательных сред, рекомендованных для фенотипического описания в рамках Международного проекта по изучению стрептомицетов International Streptomyces Project [Shirling EB & Gottlieb D. Methods for Characterization of Streptomyces Species. Int J System Bacteriol. 1966;16(3):313-340. doi: 10.1099/00207713-16-3-313].
Таблица 1
Культуральные характеристики штамма
Морфологические характеристики исследованы на 12-е сутки роста на овсяном агаре ISP3 (Фиг.1): штамм Streptomyces sp. YVZ012 образует разветвленный субстратный мицелий, на воздушном мицелии формируются прямые длинные цепочки спор. Споры в цепочках имеют бочонко-образную форму с закругленными концами и гладкую поверхность. Диаметр воздушного мицелия составляет около 0,6 мкм, размеры спор варьируются (0,5-0,6×0,4-0,6 мкм).
Физиолого-биохимические признаки
Штамм растет в аэробных условиях, в диапазоне температур от +15 до +35°С, с оптимумом роста при 28±2°С. Отношение к pH: нейтрофил. Галотолерант (растет при 8% NaCl в среде).
В качестве источников углерода утилизирует глюкозу, фруктозу, галактозу, арабинозу, трегалозу, маннитол, мальтозу, маннозу, ксилозу. Не использует сорбитол, раффинозу, сахарозу, рамнозу, инозитол.
Штамм Streptomyces sp. YVZ012 ВКМ Ас-3000D не патогенен.
Таким образом, сравнение молекулярно-генетических, культурально-морфологических и физиологических признаков штамма с таковыми штаммов, размещенных в международных коллекциях микроорганизмов (German Collection of Microorganisms and Cell Cultures, American Type Culture Collection и других) с использованием материалов из баз данных GenBank, BacDive, позволяет установить, что YVZ012 принадлежит к виду Streptomyces sp.
Хранение и поддержание жизнеспособности штамма
Штамм можно хранить при +4°С и поддерживать путем пересева раз в 2-3 недели в пробирки со скошенным агаром, содержащим овсяный агар ISP3.
Длительное хранение штамма обеспечивается при низких температурах от -20 до -80°С в пластиковых криопробирках путем создания споровой суспензии (не менее 107 клеток/мл) с добавлением стерильного раствора глицерина (конечная концентрация должна составлять 25%) в качестве криопротекторного вещества.
Предпочтительный вариант культивирования
Штамм Streptomyces sp. YVZ012 ВКМ Ас-3000D культивируют в пробирках со скошенным овсяным агаром (ISP3): овсяная мука - 20 г, агар - 20 г, воды 1 литр, рН среды перед посевом должен составлять 7,0-7,2. Спустя 12±2 суток культивирования при 28±2°С в пробирку добавляют 1-2 мл стерильной воды (допускается использовать физиологический раствор, фосфатно-солевой буфер с рН 7,0-7,4 с добавлением детергента твин 80 в концентрации 0,01%) и смывают споры путем встряхивания на настольном шейкере в течении 3 минут. Полученную суспензию отбирают, фильтруют через стерильный бумажный фильтр и смешивают с равным объемом стерильного раствора 50% глицерина. Криопробирки со споровой суспензией хранят при -20°С не более 2х лет и не более 5х лет при -70°С.
Краткое описание чертежей
Изобретение поясняется следующими чертежами.
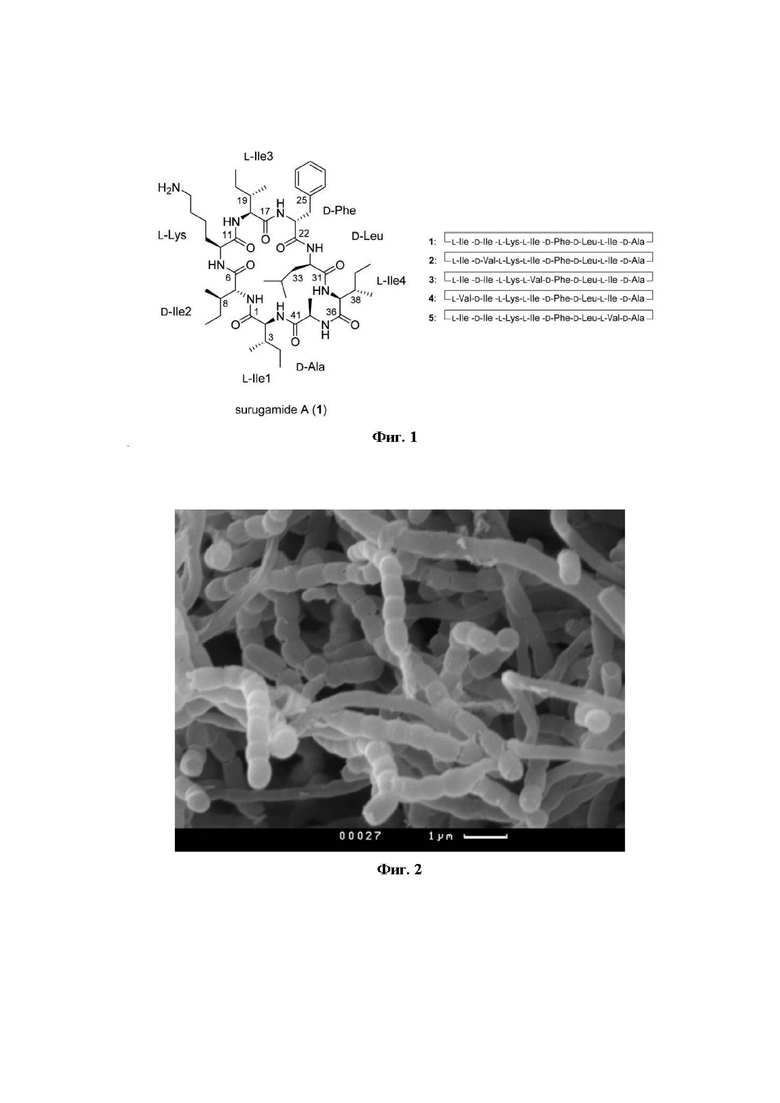
На фиг. 1 изображена структурная формула суругамида А (слева) и схематические последовательности аминокислот для суругамидов А-Е (справа) [Takada et al, 2013 - по ссылке выше].
На фиг. 2 представлена электронная микрофотография мицелия и спор штамма Streptomyces sp. YVZ012 ВКМ Ас-3000D, сделанная на 12-е сутки роста культуры на овсяном агаре при 28°С (Cambridge Instruments CamScan S2).
На фиг. 3 представлено антагонистическое действие, оказываемое на дрожжевой гриб Sac. cerevisiae культуральной жидкостью Streptomyces sp. YVZ012 ВКМ Ас-3000D - исходной (КЖ) и подкисленной ТФУ (КЖ кисл) - до нанесения на колонку; КЖ, просочившейся через колонку (проскок); фракциями, элюированными 0 %, 10%, 25%, 50%, 75%, 100% водными растворами ацетонитрила; клетками, отделенными от исходной культуральной жидкости центрифугированием (биомасса).
На фиг. 4 представлены результаты масс-спектрометрического исследования активной фракции, которая была получена на 35-й минуте ВЭЖ-хроматографического разделения экстракта, извлеченного 50% водным раствором ацетонитрила из культуральной жидкости Streptomyces sp. YVZ012 ВКМ Ас-3000D. Активность извлекаемых фракций оценивали по подавлению роста Saccharomyces cerevisiae на плотной среде. Крестиком на хроматограмме отмечен пик, соответствующий точной моноизотопной массе суругамида А (911,62 г/моль).
На фиг. 5а представлен представлен спектр фрагментации MS2 иона [M+H]+ (соотношение масса/заряд 912,625) образца YVZ012_35min RT_6.2 min, полученный путем тандемной масс-спектрометрии высокого разрешения с применением времяпролетного детектора из ВЭЖХ-образца выделенного на 35й минуте, обладавшего максимальной антидрожжевой активностью. По оси абсцисс отношение массы к заряду (m/z), по оси ординат интенсивность сигнала. Спектр фрагментации совпадает с литературными данными вещества, описанного как суругамид А, размещенными в базе данных GNPS (Global Natural Products Social Networking) c регистрационным номером CCMSLIB00009945825 [https://gnps.ucsd.edu/ProteoSAFe/static/gnps-splash.jsp] (Фиг. 5б).
Осуществление изобретения
Выделение и культивирование Streptomyces sp. YVZ012 ВКМ Ас-3000D.
Для исследования отбирали из улья взрослых рабочих пчел Apis mellifera carpatica, в стерильных контейнерах доставляли в лабораторию, перед посевом усыпляли эфиром и асептически извлекали кишечник от пищевода до толстой кишки, который помещали в стерильную микропробирку с 500 мкл 0,9% стерильного физиологического раствора. Затем кишечник гомогенизировали с помощью микропестика и в течении 3 минут перемешивали на вортекс-шейкере. Посев производили на минеральный агар №1 Гаузе (г/л): крахмал - 20, NaCl - 0,5, K2HPO4 - 0,5, MgSO4 - 0,5, FeSO4 - 0,01, агар - 20, остальное вода водопроводная (рН 7,2-7,4) [Гаузе и др., 1983 - по ссылке выше]. Для ограничения роста грибов и грамотрицательных бактерий в среды перед разливом добавляли нистатин (250 мкг/мл) и налидиксовую кислоту (10 мкг/мл) соответственно. Засеянные чашки Петри инкубировали при 28°С в течение двух недель.
Выросшие колонии мицелиальных прокариот выделяли в отдельные изоляты, среди которых проводился скриннинг за антагонистическую активность в отношении ряда тест-культур бактерий и грибов. Таким образом, был выявлен штамм YVZ012, вызывавший ингибирование роста дрожжевых грибов Saccharomyces cerevisiae.
Получение суругамидов с использованием нового штамма-продуцента
Пример 1
Культивирование штамма-продуцента. Клетки Streptomyces sp. YVZ012 ВКМ Ас-3000D выращивают выращивают в 50 мл жидкой питательной среды следующего состава (г/л): глюкоза - 10, пептон - 10, дрожжевой экстракт - 2, гидролизат казеина - 2, NaCl - 6,0, вода - остальное (после автоклавирования при 0,5 атм рН составляет 7,0). Культивирование производили в 250 мл конических колбах, которые засевали свежей суспензией споры-мицелий (в концентрации 106 кл/мл) и инкубируют при 28°С и перемешивании на орбитальном шейкере в течение 2 суток. Полученную культуральную жидкость с клетками продуцента используют как посевной материал, засевая им (объем внесения 5%) конические колбы общим объемом 750 мл, содержащие 100-150 мл жидкой среды следующего состава (г/л): глицерин - 15, L-аспарагин - 1, L-тирозин - 0,5, K2HPO4 - 0,5, MgSO4×7H2O - 0,5, NaCl - 0,5, вода - остальное (до автоклавирования при 1,0 атм рН должен составлять 7,2, при необходимости довести с помощью 1М NaOH). Засеянные колбы культивировали на шейкере при 28°С до в течение 8 суток.
К концу ферментации содержание активных веществ в культуральной жидкости составляло 12,5 мг/л.
По окончании срока ферментации культуральную жидкость с клетками микроорганизмов сливали из колб и центрифугировали 10 минут при скорости 4500 об/мин, чтобы отделить кондиционированную культуральную жидкость от клеточной биомассы.
Подготовка хроматографической колонки . Сорбент LPS-500H (сополимер дивинилбензола/ гидрофильного мономера) помещали в колонку для твердофазной экстракции, заливали 10% (v/v) раствором ацетонитрила в воде, закрывали колонку парафином, взбалтывали. После чего колонку открывали с обоих концов и последовательно промывали растворами ацетонитрила с концентрациями 10% и 50%, а затем трижды - дистиллированной водой. Данная процедура применяется для гарантированной очистки сорбента от посторонних соединений.
Идентификация и выделение суругамидов из культуральной жидкости
Освобожденную от клеток культуральную жидкость Streptomyces sp. YVZ012 ВКМ Ас-3000D подкисляли 0,1% трифторуксусной кислотой (ТФУ) и наносили на хроматографическую колонку с вышеуказанным сорбентом. После нанесения всей культуральной жидкости на колонку, ее промывали дистилированной водой, а затем элюировали серией водных растворов с возрастающей концентрацией ацетонитрила 10, 25, 50, 75, 100 % (v/v). Фракции, экстрагированные 50%-75% растворами ацетонитрила, демонстрировали наибольшую антагонистическую активность в отношении штамма дрожжевого гриба Sac. cerevisiae (фиг. 3).
Для хроматографического разделения была использована более активная порция, элюированная 50% раствором ацетонитрила (v/v): при помощи высокоэффективной жидкостной хроматографии высокого давления на 35-й минуте была детектирована фракция, обладавшая антидрожжевым действием. Данную фракцию подвергли концентрированию на роторном испарителе и использовали для идентификация активного вещества методом тандемной хроматомасс-спектрометрии высокого разрешения (фиг. 4).
В соответствии с точной молекулярной массой (911.62 г/моль) был определен атомарный состав и молекулярная формула активного вещества C48H81N9O8, а с помощью сравнительного анализа спектров фрагментации иона MS2 (Фиг. 5а) и сопоставления со спектрами фрагментаций веществ, размещенными в базе данных GNPS (Global Natural Products Social Networking) было установлено соответствие с данными вещества, описанного как суругамид А (Фиг. 5б).
Также в ВЭЖХ-фракциях, собранных на 32, 33, 34 и 35-й минутах с помощью выше описанного подхода был детектирован пик вещества с массой 897,602 г/моль, принадлежащей суругамидам B-E (C47H79N9O8, 897,6051 г/моль), однако суммарное расчетное содержание данных конгенеров не превышало 3%.
Таким образом, установлено, что фракция, полученная экстракцией 50% v/v раствором ацетонила из культуральной жидкости Streptomyces sp. YVZ012 ВКМ Ас-3000D, ингибирует рост дрожжевого гриба Sac. cerevisiae, и представлена антибиотиками суругамидами А-Е с преобладанием суругамида А (97%).
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм Streptomyces sp. YVZ020 ВКМ Ас-3001D - продуцент метаболитов, обладающих фитостимулирующим и фитозащитным действием против возбудителя бактериоза Clavibacter michiganensis | 2024 |
|
RU2840021C1 |
| Штамм Streptomyces sp. YVZ016 ВКМ Ас-2999D - продуцент веществ, способствующих защите сельскохозяйственных культур от заболеваний, вызываемых бактериями Clavibacter michiganensis | 2024 |
|
RU2840022C1 |
| Штамм Streptomyces sp. YVZ013 - продуцент антибиотика поликетомицина | 2023 |
|
RU2813975C1 |
| Штамм Streptomyces sp. YVZ014 - продуцент антибиотика лизолипина X | 2023 |
|
RU2817695C1 |
| Штамм актиномицета Streptomyces pratensis - продуцент антибиотиков, используемый для защиты овощных культур от мягкой гнили, вызываемой фитопатогенными бактериями Pectobacterium caratovorum | 2022 |
|
RU2798572C1 |
| Штамм Streptomyces sp., выделенный из байкальских эндемичных амфипод - продуцент антибиотика актифенола | 2018 |
|
RU2704862C1 |
| Штамм Streptomyces rochei MP21 - продуцент антибиотика кирромицина | 2022 |
|
RU2798207C1 |
| Штамм Streptomyces hygroscopicus 18 - продуцент нафтохиноновых антибиотиков - астолидов А и В с противогрибковой и цитотоксической активностью и способ их получения | 2018 |
|
RU2681828C1 |
| Штамм Amycolatopsis rifamycinica - продуцент антибиотика тетраценомицина Х | 2019 |
|
RU2724537C1 |
| Штамм Streptomyces iakyrus Pe6 ВКПМ Ас-2084 - продуцент антибиотика нибомицина | 2018 |
|
RU2696029C1 |

Изобретение относится к области микробной биотехнологии, микробиологической промышленности и касается штамма Streptomyces sp. YVZ012 ВКМ Ас-3000D, продуцирующего суругамид А - природный октапептид, обладающий антигрибной активностью, а также способностью ингибировать внутриклеточную протеазу катепсин В. 5 ил., 1 табл., 1 пр.
Штамм Streptomyces sp. YVZ012 ВКМ Ас-3000D – продуцент суругамида А.
| ZHOU Y | |||
| et al | |||
| Investigation of Penicillin Binding Protein (PBP)-like Peptide Cyclase and Hydrolase in Surugamide Non-ribosomal Peptide Biosynthesis, Cell Chemical Biology, 2019, Vol | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| Is | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| МУСОРОСОЖИГАТЕЛЬНАЯ ШАХТНАЯ ПЕЧЬ | 1923 |
|
SU737A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| MYRONOVSKYI M | |||
| et al | |||
| ПАРОВОЙ ВОДОТРУБНЫЙ КОТЕЛ | 1925 |
|
SU1074A1 |
Авторы
Даты
2024-06-27—Публикация
2023-12-23—Подача