Изобретение относится к способу получения N6-производных фосфорилсиднониминов и конкретно касается ряда фторсодержащих производных.
К настоящему времени получены сведения об антибактериальной, противоопухолевой, психотропной и других видах биологической активности ряда производных сиднониминов [3-5]. После успешного использования фторсодержащих стероидов и других фторсодержащих соединений в качестве лекарственных средств стало понятно, что фтор в различных положениях молекулы может усиливать физиологическое действие препаратов на организм [1].
Однако фторсодержащие сиднонимины на данный момент представлены лишь несколькими примерами N6-перфторацильных производных [3]. Перфторалкилсиднонимины предположительно являются физиологически активными веществами широкого спектра действия. Некоторые из соединений этого класса, например, сиднофен, сиднокарб, молсидомин, успешно применяются в медицинской практике [5-7].
Синтез экзоциклических N-производных (иначе, N6-производных) этих гетероциклов осуществляется из соответствующих солей [2, 3].

где X - Cl-, Br- или I-.
Проявляя типичные свойства сильных аминов, соли сиднониминов в присутствии основных агентов в мягких условиях взаимодействуют с ангидридами и хлорангидридами карбоновых кислот, образуя соответствующие N6-ацилсиднонимины [3]:

Известны способы получения N6-ацетильных производных, R=СН3 [8, 9, 10], которые можно приготовить действием уксусного ангидрида на соль в отсутствие основания; N6-карбамоильных производных с общей формулой:

где X=О, R и R'=Alk [11] или с X=О, R=Alk и R'=диалкиламин [12, 13, 14, 15].
Наиболее близким к предлагаемому техническому решению является предложенный [3] способ получения производных сиднониминов, содержащих фторсодержащие радикалы в положении N6, основанный на реакции соответствующих хлоргидратов с диалкоксихлорфосфатами:
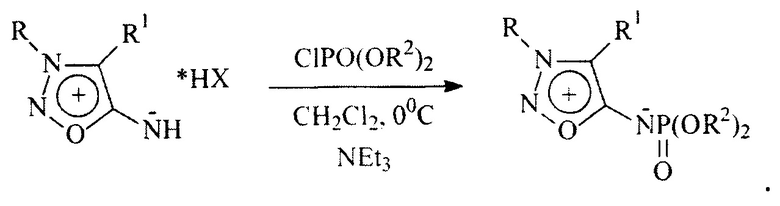
Недостатком данного метода является тот факт, что при взаимодействии хлоргидрата 3-изопропилсиднонимина с ди-(2,2,3,3-тетрафторпропокси)хлорфосфатом в присутствии триэтиламина при 0°С практически с количественным выходом образуется N-нитрозоизопропиламиноацетонитрил - продукт раскрытия мезоионного кольца, а не желаемый фторсодержащий сиднонимин, что приводит в указанных условиях синтеза к значительному уменьшению выхода целевого продукта и загрязняет его. Получаемая смесь трудноразделима.
Целью данного изобретения является разработка способа синтеза N6-фторпроизводных фосфорилсиднониминов, позволяющего увеличить выход целевого продукта за счет замены исходного сырья - фторсодержащего компонента, а также условий синтеза.
Сущность предлагаемого способа заключается в следующем. Соответствующий хлоргидрат сиднонимина, полученный по известной методике [2, 3], смешивают с хлорокисью фосфора в хлороформе. Смесь нагревают до кипения, после чего к ней медленно прикапывают раствор триэтиламина. После длительного кипячения реакционную массу охлаждают до комнатной температуры, добавляют спирт-теломер и оставляют на ночь. Затем содержимое колбы промывают водой в делительной воронке. Органический слой отделяют, сушат над сульфатом натрия и упаривают на роторном испарителе. Остаток кристаллизуют из смеси бензол - гексан.
Данная методика позволяет получать N6-фторпроизводные фосфорилсиднониминов с выходом от 38 до 51%, и не оказывает влияния на чистоту конечного продукта.
Таким образом, отличительными признаками изобретения являются увеличение выхода целевого продукта N6-фторпроизводных фосфорилсиднониминов.
Способ получения N6-фторпроизводных фосфорилсиднониминов в соответствии с предлагаемым изобретением иллюстрируют следующие примеры.
Пример 1. N6-ди(2,2,3,3-тетрафторпропокси)фосфорил-3-метилсиднонимин. В круглодонной колбе, снабженной капельной воронкой и обратным холодильником, смешивают 2 г (0,015 моль) хлоргидрата 3-метилсиднонимина, и 1,39 мл (2,3 г, 0,015 моль) хлорокиси фосфора в 50 мл хлороформа. Смесь нагревают до кипения и медленно (в течение 1 часа) прикапывают 8,8 мл (0,063 моль) триэтиламина. После этого реакционную массу кипятят еще 2 часа, затем охлаждают до комнатной температуры, добавляют 4,4 г (0,0315 моль) 2,2,3,3-тетрафторпропанола и оставляют на ночь. Затем содержимое колбы выливают в делительную воронку и промывают водой. Органический слой отделяют, сушат над сульфатом натрия и упаривают на роторном испарителе. Остаток кристаллизуют из смеси бензол - гексан.
Выход 2,5 г (41%). Тпл 98 - 98,5°С.
Спектр ЯМР 1Н (CDCl3, δ м.д.): 4,13 (с., 1 Н, СН3); 4,45-4,48 (м., 4Н, (OCH2CF2CF2H)); 5,53-6,02 (м., 2Н, (OCH2CF2CF2H)); 8,0 (с., 1Н, 4-Н).
Пример 2. N6-ди(2,2,3,3-тетрафторпропокси)фосфорил-3-изопропилсиднонимин получен по вышеуказанной методике из 1 г (0,0061 моль) хлоргидрата 3-изопропилсиднонимина, 0,6 мл (0,0061 моль) хлорокиси фосфора, 3,5 мл (2,6 г, 0,025 моль) триэтиламина и 1,7 г (0,0128 моль) 2,2,3,3-тетрафторпропанола. Выход 1,4 г (53%). Тпл 92°С.
Спектр ЯМР 1Н (CDCl3, δ м.д.): 1,69-1,72 (д., 6Н, (СН3)2СН); 4,23-4,52 (м., 5Н, (СН3)2СН + OCH2CF2CF2H); 5,70-5,88 (м., 2 Н, (OCH2CF2CF2H)); 8,25 (с., 1Н, 4-Н)
Пример 3. N6-ди(2,2,3,3-тетрафторпропокси)фосфорил-3-метил-4-фенилсиднонимин получен по вышеуказанной методике из 2 г (0,0094 моль) хлоргидрата 3-метил-4-фенилсиднонимина, 0,87 мл (1,45 г, 0,0094 моль) хлорокиси фосфора, 5,26 мл (3,82 г, 0,378 моль) триэтиламина и 2,47 г (0,0197 моль) 2,2,3,3-тетрафторпропанола. Выход 1,7 г (38%). Тпл 123-124°С.
Спектр ЯМР 1Н (CDCl3, 5 м.д.): 4,12 (с., 1Н, СН3); 4,47-4,50 (м., 2Н, (OCH2CF2CF2H)2); 5,55-6,07 (м., 2Н, (OCH2CF2CF2H)2); 7,28-7,76 (м., 5Н, С6Н5).
Предлагаемое техническое решение позволяет предотвратить раскрытие мезоионного кольца в процессе синтеза и получать целевые продукты с достаточно высоким выходом, а также существенно увеличить их фармакологическую активность за счет увеличения растворимости в жировой ткани благодаря введению в состав тетрафторпропоксифосфорильную группу атомов.
Структура и состав синтезированных продуктов подтверждены методами ИК- и ЯМР-спектроскопии, что дает возможность использовать их по назначению.
Литература
1. Фурин Г.Г. Фторсодержащие гетероциклические соединения: Синтез и применение. - Новосибирск: Наука, 2001. - 304 с.
2. Рамсден С.А. Мезоионные гетероциклы. В кн. «Общая органическая химия» / Под ред. Д. Бартона и У.Д. Оллиса. Т. 9. - Пер. с англ. / под ред. Н.К. Кочеткова - М.: Химия, 1985. - С. 720-778.
3. Яшунский В.Г., Холодов Л.Е. Химия сиднониминов // Успехи химии. - 1980. - XLIX, №1. - С. 54-91.
4. В.Г. Яшунский, В.Г. Ермолаева. Сидноны и сиднонимины. VII. Изопропил- и 3-циклогексилсиднонимины и сульфаниламинопроизводные ряда сиднониминов // Ж. орг. химии. - 1960. - Т. 32. - С. 186-191.
5. H.U. Daeniker, J. Druey. Heilmittelchemische Studien in der heterocyclischen Reiheueber Sydnonimine. III. N-Sulfanilyl-sydnonimine // Helvetica Chemica Acta. - 1962 - Vol. 45, №278. - P. 2462-2465.
6. B. Rosenkranz, B.R. Winkelmann, M.J. Parnham. Clinical pharmacorinetics of molsidomin //Clin. Pharmacokinet. - 1996. 1996. - V. 30, №5. - P. 372-374.
7. М.Д. Машковский. Лекарственные средства. Изд. 16-е, перераб., испр. и доп. - М.: Новая волна, 2014. - 1216 с.
8. Бельг. пат. 618822 (1962); С. А., 59, 2840 (1963).
9. Бельг. пат. 618823 (1962); С. А., 59, 2838 (1963).
10. Бельг. пат. 618824 (1962); С. А., 59, 2839 (1963).
11. Япон. пат. 7026088 (1970); С. А., 74, 13161 (1971).
12. Япон. пат. 7006265 (1969); С. А., 73, 25485 (1970).
13. Пат. США 3833589 (1974); С. А., 81, 152276 (1974).
14. Пат. США 3769283 (1973); РЖХим, 1974, 20 Н, 376.
16. Пат. США 3812128 (1974); РЖХим, 1975, 6 О, 112.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОСТЫХ ПОЛИФТОРАЛКИЛОВЫХ ЭФИРОВ | 2007 |
|
RU2346926C1 |
| 2-ХЛОР-3-ПОЛИФТОРАЛКОКСИ-[1,4]-НАФТОХИНОНЫ, ПОВЫШАЮЩИЕ ТЕРМОСТОЙКОСТЬ ПОЛИМЕТИЛМЕТАКРИЛАТА | 2021 |
|
RU2772749C1 |
| N -ФОСФОРИЛИРОВАННЫЕ ПРОИЗВОДНЫЕ 3- β -ФЕНИЛИЗОПРОПИЛСИДНОНИМИНА, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2036914C1 |
| Способ получения бис (полифторалкил) хлорфосфатов | 1981 |
|
SU1010064A1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЬФА-ГИДРОПОЛИФТОРАЛКАНТИОЛОВ | 2004 |
|
RU2284991C2 |
| Способ флотации сульфидных медно-никелевых руд | 2017 |
|
RU2672895C1 |
| Симметричный полифторалкилсодержащий аминодисульфид в качестве присадки к индустриальному маслу и способ его получения | 2016 |
|
RU2625450C1 |
| ПОЛУЧЕНИЕ НОВОГО КЛАССА ЖИДКОКРИСТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ, СОДЕРЖАЩИХ ЧЕТЫРЕХАТОМНЫЙ ФТОРСОДЕРЖАЩИЙ ФРАГМЕНТ МОСТИКОГО ТИПА | 2012 |
|
RU2511009C2 |
| СПОСОБ ПОЛУЧЕНИЯ 6α-МЕТИЛГИДРОКОРТИЗОНА | 2006 |
|
RU2297423C1 |
| 3,6-ДИМЕТОКСИ-17-МЕТИЛ-7АЛЬФА-(ТРИФТОРАЦЕТИЛ)-4,5АЛЬФА-ЭПОКСИ-6АЛЬФА,14АЛЬФА-ЭТЕНОИЗОМОРФИНАН И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2503677C1 |
Изобретение относится к способу получения N6-ди(перфторалкокси)фосфорилсиднониминов и может быть использовано в химической промышленности. Предложен способ получения N6-ди(перфторалкокси)фосфорилсиднониминов из соответствующих хлоргидратов сиднониминов, заключающийся в том, что соответствующий хлоргидрат сиднонимина смешивают с хлорокисью фосфора в хлороформе, смесь нагревают до кипения, после чего к ней медленно прикапывают раствор триэтиламина, после длительного кипячения реакционную массу охлаждают до комнатной температуры, добавляют теломерные спирты общей формулой H(CF2 CF2)nCH2OH, где n=3-4, оставляют на ночь с последующим выделением целевого продукта в свободном виде. Предложен новый эффективный способ получения N6-ди(перфторалкокси)фосфорилсиднониминов с высоким выходом. 3 пр.
Способ получения N6-ди(перфторалкокси)фосфорилсиднониминов из соответствующих хлоргидратов сиднониминов, заключающийся в том, что соответствующий хлоргидрат сиднонимина смешивают с хлорокисью фосфора в хлороформе, смесь нагревают до кипения, после чего к ней медленно прикапывают раствор триэтиламина, после длительного кипячения реакционную массу охлаждают до комнатной температуры, добавляют теломерные спирты общей формулой H(CF2 CF2)nCH2OH, где n=3-4, оставляют на ночь с последующим выделением целевого продукта в свободном виде.
| Яшунский В.Г | |||
| и др | |||
| Успехи химии, 1980, XLIX, N1, стр | |||
| Видоизменение прибора для получения стереоскопических впечатлений от двух изображений различного масштаба | 1919 |
|
SU54A1 |
| Рамсден С.А | |||
| "Общая органическая химия" под ред | |||
| Н.К | |||
| Кочеткова, М.: Химия, 1985, т | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| ПРИСПОСОБЛЕНИЕ ДЛЯ УПОРА ГОЛОВЫ ПРИ ВОСПРОИЗВЕДЕНИИ ВОКАЛЬНЫХ УПРАЖНЕНИЙ | 1921 |
|
SU714A1 |
| US 3277108 A1, 04.10.1966 | |||
| US 3769283 A1, 30.10.1973 | |||
| US 3812128 A1, 21.05.1974 | |||
| US 3833589 A1, 03.09.1974 | |||
| Линейный асинхронных двигатель | 1976 |
|
SU618824A1 |
| Линейный электродвигатель постоянного тока | 1974 |
|
SU618823A1 |
Авторы
Даты
2020-06-03—Публикация
2019-01-09—Подача