Изобретение относится к области биохимии, а более конкретно к молекулярной биологии, и может быть использовано в качестве способа выделения и очистки дезоксирибонуклеиновых кислот (ДНК) из послеоперационного костного материала при подготовке проб для молекулярно-генетических исследований в медицинских целях.
Из уровня техники известен способ выделения ДНК, включающий гомогенизацию образца путем вибрации в присутствии мелющих тел в растворе, содержащем гуанидин HCl, натрий-фосфатный буфер, TrisHCl, додецилсульфат натрия (SDS), смесь фенол-хлороформ, с последующим центрифугированием и осаждением ДНК изопропанолом, при этом раствор для гомогенизации дополнительно содержит детергент лаурилсаркозинат натрия, см. патент RU, №2696052, кл. C12N 15/10, опубликован 30.07.2019. Способ позволяет повысить выход метагеномной ДНК в том числе и за счет гомогенизации образца, а также применения центрифугирования в процессе осаждения. Способ имеет ограниченную область применения.
Известен набор реактивов для выделения ДНК, включающий лизирующий буферный раствор, содержащий гуанидин тиоцианат, трис гидрохлорид, тритон и сорбент в виде суспензии из магнитных микросфер в солевом растворе, промывочный буфер №1 содержащий гуанидин тиоцианат, трис гидрохлорид и этиловый спирт, промывочный буфер №2 содержащий трис гидрохлорид, хлорид натрия и этиловый спирт, элюирующий раствор, который представляет собой деионизированную воду, см. патент RU, №2650865, кл. C12N 15/10, опубликован 17.04.2018. Известный набор позволяет увеличить выход ДНК, однако условно применим для выделения ДНК из костного материала поскольку не содержит средств для приготовления и кондиционирования образцов биологических объектов.
Известен способ выделения ДНК, заключающийся в том, что костную ткань измельчают и помещают в пробирку с лизирующим буферным раствором состава: 0,1 М Трис-HCl, 0,1 М ЭДТА, 0,1 М NaCl, 0,5% N-лаурилсаркозил Na и протеиназы K, рН 6-7, получают клеточный лизат, к лизату добавляют сорбент магнитных наночастиц, модифицированных хитозаном, перемешивают и инкубируют в течение 25-35 мин, пробирку помещают на магнитный штатив, разделяют смесь на фракции - сорбент, связанный с ДНК, и надосадочная жидкость, надосадок удаляют, а к осадку приливают элюирующий буферный раствор состава: 10 мМ трис-HCl, рН 7,4; 100 мМ NaCl; 1 мМ ЭДТА, инкубируют, пробирки помещают на магнитный штатив, разделяют смесь на фракции - сорбент - осадок и надосадок - ДНК, растворенная в элюирующем буферном растворе, осадок удаляют, в надосадке остается ДНК-конечный продукт. см. патент RU, №2485178, кл. C12N 15/10, опубликован 20.06.2013. Способ характеризуется повышенной производительностью и универсальностью. Указанный известный объект изобретения способ принят в качестве прототипа как наиболее близкий по технической сущности и достигаемому результату аналог.
Недостатком прототипа является маленький выход ДНК, который составляет до 200 нг (нанограмм) ДНК из 5 г костного порошка. Указанный недостаток является следствием, в том числе, и трудоемкого и неэффективного процессов механического помола костного материала и магнитного разделения. Указанные недостатки прототипа накладывают существенные ограничения на возможность его широкого применения и не позволяют использовать для целей настоящего изобретения.
Предлагаемое изобретение направлено на достижение технического результата, который выражается в повышении качества получаемого препарата нуклеиновых кислот и сокращении времени его получения за счет оптимизации режимов проведения основных процессов и составов реагентов. Способ предоставляет достаточные возможности для осуществления как экспресс исследований так и углубленного изучения материала в простых лабораторных условиях. В конечном итоге указанный технический результат позволяет повысить эффективность применения и способа. При этом в предлагаемом способе максимально сохранены положительные свойства прототипа, к числу которых относится его высокая производительность.
Указанный положительный результат обеспечивается тем, что способ выделения ДНК из костного материала включающий, измельчение костного материала, приготовление лизата, выделение нуклеиновых кислот из лизата, отмывку и элюцию, отличается от прототипа тем, что, измельчение костного материала проводят в среде жидкого азота до порошкообразного состояния, приготовление лизата осуществляют путем инкубации в термостате с последующим центрифугированием, причем инкубацию осуществляют в два этапа, где на первом этапе навеску измельченного костного материала с добавлением буфера 50 мМ Tris-HCl, 50 мМ EDTA, рН 8.0, 1% SDS и 20 мкл протеиназы К, инкубируют с перемешиванием в течение 8÷12 часов при температуре 56°С, на втором этапе добавляют буфер 4М Gu-HCl и инкубируют в течение 10 минут при температуре 70°С, выделение нуклеиновых кислот из лизата осуществляют путем пропускания лизата через силикатную мембрану, при этом последняя выполняет роль сорбента нуклеиновых кислот, отмывку осуществляют путем добавления в центр силикатной мембраны буфера 10 мМ Tris-HCl, рН 7.5, 80% этанол и последующего ее центрифугирования, при этом отмывку осуществляют дважды, элюцию осуществляют путем добавления в центр силикатной мембраны буфера 10 мМ Tris-HCl, 0.5 мМ EDTA, рН 8.0 и инкубирования при комнатной температуре в течение 5 минут, с последующим центрифугированием силикатной мембраны.
Согласно способу предпочтительно проведение измельчения в металлическом лабораторном блендере. Наиболее полно целям изобретения соответствует центрифугирование приготовленного лизата для отделения супернатанта в течение одной минуты при ускорении 20×103 g, а при проведении отмывки центрифугирование в течение одной минуты при ускорении 6,0×103 g. Во всех случаях реализации способа при проведении элюции центрифугирование силикатной мембраны осуществляют в течение одной минуты при ускорении 20×103 g.
Костный материал является сложным объектом для молекулярно-генетических исследований. В костной ткани содержится большое количество ионов кальция (Са2+) и магния (Mg2+), присутствие которых приводит к образованию хелатных соединений с нуклеиновыми кислотами и препятствуют оптимальному выходу ДНК. Повысить эффективность экстракции ДНК можно с помощью проведения деминерализации, однако при использовании агрессивных деминерализующих агентов, например азотной кислоты, молекула ДНК подвергается деградации без возможности восстановления. В молекулярно-генетических исследованиях (в том числе и в прототипе) в качестве декальцинирующего агента часто используют раствор этилендиаминтетрауксусной кислоты (EDTA), но при этом деминерализация может занимать несколько недель и проба требует постоянного перемешивания. Собственно процедура выделения ДНК состоит из предварительной ночной инкубации, экстракции и очистки нуклеиновой кислоты на колонках с диоксидом кремния.
Важнейшую роль в технологии выделения ДНК из биологических объектов играет подбор эффективного, сбалансированного и экономичного комплекса реактивов для осуществления процессов лизиса, промывки и элюции. Кроме того, для повышения выхода нуклеиновой кислоты достаточной концентрации и необходимого качества, важно обеспечить на всех стадиях высокую степень разделения и очистки компонентов.
В основу заявляемого способа выделения ДНК из костного материала положены принципы комплексного использования современных физических и химических методов воздействия на исходный образец в совокупности с применением перспективных материалов и оборудования.
Исходный образец послеоперационного костного материала, имеющий температуру хранения около - 20°С подвергают воздействию жидкого азота с температурой около - 200°С, в результате чего материал становиться хрупким и легко подвергается измельчению до порошкообразного состояния путем механического дробления. От степени однородности и измельчения в большой степени зависит длительность и полнота последующей инкубации и экстракции нуклеиновой кислоты. В процессе криогенного измельчения костного материала не возникает деструкции ДНК на молекулярном уровне. Следует отметить, что разрушение ткани, предварительно замороженной в жидком азоте известно (RU, №2463354), однако измельчение костного материала в криогенной среде является новым техническим решением.
Подбор оптимальной композиции буфера для лизиса, отмывки и элюции является важнейшей научно-практической задачей в процессе выделения ДНК и в основном зависит от вида исходного биологического материала. Критерием эффективности буфера является качество и выход искомого продукта, однако немаловажную роль при этом игранет экономика реализации процесса. Решение указанной задачи основано как на общих принципах, так и на конкретных исследованиях, опыте и квалификации исследователя.
Наиболее известными и универсальными веществами, применяемыми при выделения ДНК в качестве буферных растворов, являются аминометан гидрохлорид (Tris-HCl) и поверхностно-активное вещество додецилсульфат натрия (SDS). Концентрация (молярная, М моль/л, или мМ ммоль/л) указанных веществ, в совокупности с их водородным показателем (рН), являются, в том числе, предметом настоящего изобретения, поскольку в основном определяют свойства используемого буферного раствора. Умеренно щелочной характер буферных растворов (рН 7,5÷9,0) способствует сохранению структуры ДНК и в то же время обеспечивает необходимую скорость протекания процессов. Рациональные комбинации буферных растворов состава Tris-HCl, SDS и их водородные показатели подобраны опытным путем, являются оптимальными и наиболее полно соответствуют целям достижения заявленного технического результата.
Процесс инкубации осуществляют в два этапа, что вызвано необходимостью применения хлорида гуанидиния (GuHCl) с концентрацией 4М который является сильным хаотропом и одним из сильнейших денатурантов. Процесс воздействия хлорида гуанидиния с высокой концентрацией на костный материал, является высокоэффективным и сравнительно скоротечным (~10 минут), поэтому его добавление в качестве буфера на стадии инкубации реализовано на завершающей стадии. На первом этапе в состав буфера, как и в прототипе, включен фермент протеиназа К, который является традиционным компонентом при лизисе ДНК.
Для отмывки нуклеиновых кислот применен буферных растворов состава 10 мМ Tris-HCl, рН 7.5, 80% этанол. Этанол является основной частью буфера отмывки как по содержанию так и по свойствам. Этанол обеспечивает отмывку нуклеиновых кислот находящихся на силикатной мембраны от хаотропных солей. Однако чистый 80% этанол денатурирует двухцепочечную ДНК во время промывки, для предотвращения указанного процесса в отмывочном буфере присутствует Tris-HCl. Отмывку указанным буфером проводят дважды, поскольку на практике установлено что последовательная двукратная отмывка всегда эффективнее однократной при одинаковом расходе буфера и времени центрифугирования.
Режимы центрифугирования определены из возможностей лабораторного оборудования. Максимальное ускорение 20×103 g (перегрузка) достигается при угловой скорости вращения центрифуги 14×103 об/мин и обеспечивает минимальное время реализации процесса разделения. Температурные режимы проведения процессов выбраны из условия максимального ускорения протекания реакций и предотвращения термодиструкции молекул ДНК. Временные режимы прямо связаны с температурными и гарантируют достаточную полноту завершения процессов.
Таким образом, способ выделения ДНК из костного материала, характеризующийся описанной совокупностью существенных признаков, направленных на достижение технического результата, имеет преимущество в сравнении с прототипом, является новым, промышленно применимым и обладает изобретательским уровнем.
Реализация способа выделения ДНК из костного материала осуществляется следующим образом.
В качестве пробоподготовки для молекулярно-генетических исследований брали 2 свежезамороженных послеоперационных костных фрагмента средним размером ~5 мм, суммарным весом 4 грамма, помещали в лабораторный металлический блендер, заполняли 30 мл жидкого азота и измельчали до консистенции мелкодисперсного костного порошка. Время измельчения зависит от размеров фрагментов и режимов блэндера. 30 мл жидкого азота является достаточным для полного погружения в него костных фрагментов. Часть жидкого азота испаряется в процессе измельчения. Применение блендера с металлической рабочей емкостью обусловлено мерами безопасности при работе с криогенными материалами.
Полученный в результате помола материал представляет собой однородный мелкодисперсный сыпучий порошок, 100 мг которого помещали в стерильную пробирку типа эппендорф для дальнейшей инкубации. На первом этапе инкубации в эппендорф с навеской костного порошка заливали 360 мкл буфера 50 мМ Tris-HCl, 50 мМ EDTA, рН 8.0, 1% SDS и 20 мкл протеиназы К. Инкубировали в течение 10 часов при температуре 56°С в твердотельном термостате с функцией перемешивания 900 об/мин. На втором этапе инкубации в эппендорф добавляли 300 мкл буфера 4М Gu-HCl, перемешивали на лабораторном пробирочном вортексе в течение 10 с, затем помещали в твердотельный термостат. Длительность повторной инкубации составила 10 минут при температуре 70°С. Для отделения супернатанта (надосадочная жидкость) от осадка провели центрифугирование в течение одной минуты при ускорении 20×103 g (максимальная скорость пробирок типа эппендорф). Лизат перемещали в чистую 1,5 мл пробирку для центрифугирования с добавлением 150 мкл этанола 96% и перемешиванием на вортексе в течение 10 с. Для выделение нуклеиновых кислот весь объем полученного лизата пропускали через силикатную мембрану путем центрифугирования в течение 1 минуты при ускорении 6,0×103 g. Силикатная мембрана представляет собой колонку с диоксидом кремния и выполняет роль сорбента нуклеиновых кислот.
Отмывку нуклеиновых кислот от белков и примесей осуществляли путем добавления в центр силикатной мембраны 500 мкл буфера 10 мМ Tris-HCl, рН 7.5, 80% этанол и последующего ее центрифугирования в течение одной минуты при ускорении 6,0×103 g. Отмывку указанным методом осуществляли дважды.
Для осуществления элюции ДНК в центр силикатной мембраны наносили 45 мкл буфера 10 мМ Tris-HCl, 0.5 мМ EDTA, рН 9.0 и инкубировали при комнатной температуре в течение 5 минут. После завершения процесса инкубирования, элюцию завершали путем центрифугирования в течение 1 минуты при максимальном ускорении 20,0×103 g. В результате опробирования заявленного способа была получена бесцветная проба выделенной костной ДНК объемом 40 мкл. Полученные посредством настоящего способа пробы удобны для дальнейшего использования и могут храниться длительное время при температуре -20°С.
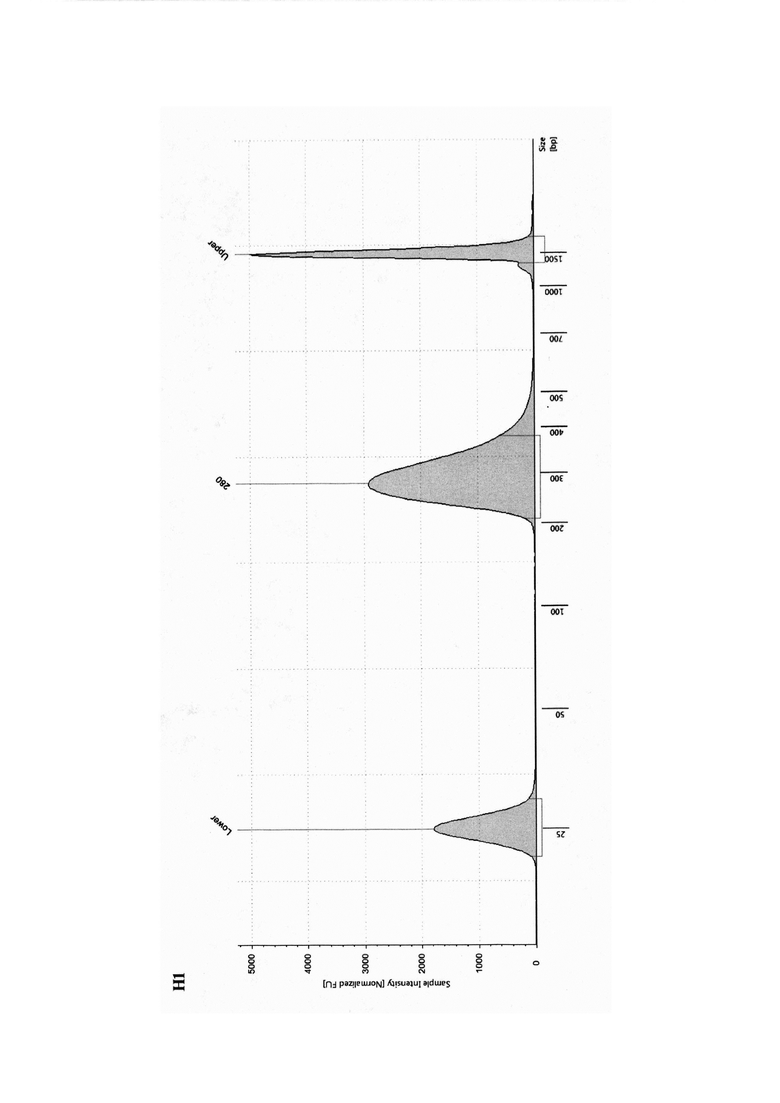
На чертеже представлена электрофореграмма капиллярного электрофореза ДНК-библиотеки свежезамороженного послеоперационного костного материала. Подготовка ДНК-библиотек является одним из этапов секвенирования нового поколения (англ. next generation sequencing (NGS), включающий фрагментирование ДНК, лигирование адаптеров, клональную амплификацю для увеличения количества ДНК-фрагментов. На электрофореграмме зафиксированы нижний и верхний маркеры, а также пик с максимумом 280 п. о. (пар оснований). Проба с пиком 280 п. о. подходит для проведения полноэкзомного секвенирования, поскольку соответствует диапазону допустимых граничных размеров 250÷350 п. о. Капиллярный электрофорез проводили на оборудовании 4200 TapeStation, Agilent, а анализ размеров готовой библиотеки, произведен с использованием Agilent D1000 ScreenTape.
Заявленный способ выделения ДНК из костного материала позволяет стабильно выделять ДНК концентрацией 150÷170 нг/мкл при объеме элюции 35÷45 мкл. Реализация изобретения позволяет получить препарат нуклеиновых кислот достаточной концентрации и качества для проведения дальнейших молекулярно-генетических исследований, полимеразной цепной реакции (ПЦР) или NGS. Способ менее трудоемкий и менее длительный в сравнении с протоколом со стандартной декальцинацией, не требует специальных навыков и оборудования.
| название | год | авторы | номер документа |
|---|---|---|---|
| Универсальный способ выделения ДНК и лизирующая смесь для его осуществления | 2022 |
|
RU2807254C1 |
| Способ выделения РНК и ДНК из сухих биологических образцов, хранившихся на бумажном носителе, и набор для его осуществления | 2016 |
|
RU2628695C1 |
| Способ выделения ДНК из растений, пригодный для постановки ПЦР | 2017 |
|
RU2672378C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ЦИРКУЛИРУЮЩИХ ДНК ИЗ ПЛАЗМЫ ИЛИ СЫВОРОТКИ КРОВИ | 2015 |
|
RU2603098C1 |
| СМЕННЫЙ МИКРОФЛЮИДНЫЙ МОДУЛЬ ДЛЯ АВТОМАТИЗИРОВАННОГО ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ ИЗ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ И СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ С ЕГО ИСПОЛЬЗОВАНИЕМ | 2008 |
|
RU2380418C1 |
| СПОСОБ ВЫДЕЛЕНИЯ РИБОНУКЛЕИНОВЫХ КИСЛОТ | 2002 |
|
RU2232810C1 |
| СПОСОБ ВЫДЕЛЕНИЯ НУКЛЕИНОВЫХ КИСЛОТ | 2004 |
|
RU2272072C1 |
| СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ ДЕЗОКСИРИБОНУКЛЕИНОВЫХ КИСЛОТ | 2008 |
|
RU2400537C2 |
| СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ | 2008 |
|
RU2382081C2 |
| СПОСОБ ВЫДЕЛЕНИЯ ДНК COCCIDIOIDES IMMITIS ДЛЯ ПРОВЕДЕНИЯ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2005 |
|
RU2295569C1 |
Изобретение относится к молекулярной биологии. Согласно способу выделения ДНК из костного материала его измельчение проводят в среде жидкого азота, приготовление лизата осуществляют путем инкубации в термостате с последующим центрифугированием, причем инкубацию осуществляют в два этапа, где на первом этапе навеску измельченного костного материала с добавлением буфера 50 мМ Tris-HCl, 50 мМ EDTA, рН 8,0, 1% SDS и 20 мкл протеиназы К, инкубируют с перемешиванием в течение 8-12 часов при температуре 56°С, на втором этапе добавляют буфер 4М Gu-HCl и инкубируют в течение 10 минут при температуре 70°С, затем проводят стадию отделения супернатанта центрифугированием, выделение нуклеиновых кислот из лизата осуществляют путем пропускания лизата через силикатную мембрану, отмывку осуществляют путем добавления в центр силикатной мембраны буфера 10 мМ Tris-HCl, рН 7,5, 80% этанол и последующего ее центрифугирования, при этом отмывку осуществляют дважды, а элюцию осуществляют путем добавления в центр силикатной мембраны буфера 10 мМ Tris-HCl, 0,5 мМ EDTA, рН 8,0 и инкубирования при комнатной температуре в течение 5 минут, с последующим центрифугированием силикатной мембраны. Изобретение позволяет повысить качество получаемого препарата нуклеиновых кислот и сократить время его получения. 4 з.п. ф-лы, 1 ил.
1. Способ выделения ДНК из костного материала, включающий измельчение костного материала, приготовление лизата, отделение супернатанта, выделение нуклеиновых кислот из лизата, отмывку и элюцию, отличающийся тем, что измельчение костного материала проводят в среде жидкого азота до порошкообразного состояния, приготовление лизата осуществляют путем инкубации в термостате с последующим центрифугированием, причем инкубацию осуществляют в два этапа, где на первом этапе навеску измельченного костного материала с добавлением буфера 50 мМ Tris-HCl, 50 мМ EDTA, рН 8.0, 1% SDS и 20 мкл протеиназы К, инкубируют с перемешиванием в течение 8÷12 часов при температуре 56°С, на втором этапе добавляют буфер 4М Gu-HCl и инкубируют в течение 10 минут при температуре 70°С, отделение супернатанта осуществляют центрифугированием, выделение нуклеиновых кислот из лизата осуществляют путем пропускания лизата через силикатную мембрану, при этом последняя выполняет роль сорбента нуклеиновых кислот, отмывку осуществляют путем добавления в центр силикатной мембраны буфера 10 мМ Tris-HCl, рН 7.5, 80% этанол и последующего ее центрифугирования, при этом отмывку осуществляют дважды, а элюцию осуществляют путем добавления в центр силикатной мембраны буфера 10 мМ Tris-HCl, 0.5 мМ EDTA, рН 8.0 и инкубирования при комнатной температуре в течение 5 минут, с последующим центрифугированием силикатной мембраны.
2. Способ по п. 1, отличающийся тем, что измельчение проводят в металлическом лабораторном блендере.
3. Способ по п. 2, отличающийся тем, что приготовленный лизат центрифугируют для отделения супернатанта в течение одной минуты при ускорении 20×103 g.
4. Способ по п. 3, отличающийся тем, что при проведении отмывки центрифугирование осуществляют в течение одной минуты при ускорении 6,0×103 g.
5. Способ по любому из пп. 1-4, отличающийся тем, что при проведении элюции центрифугирование силикатной мембраны осуществляют в течение одной минуты при ускорении 20×103 g.
| СПОСОБ ВЫДЕЛЕНИЯ ДНК | 2011 |
|
RU2485178C2 |
| СПОСОБ ВЫДЕЛЕНИЯ НУКЛЕИНОВЫХ КИСЛОТ | 2004 |
|
RU2272072C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ДНК | 1991 |
|
RU2026864C1 |
| Способ выделения ДНК из парафиновых блоков с гистологическим биоматериалом | 2016 |
|
RU2637360C1 |
| ЧЕРВОНАЯ Г.В., ХАЙДАРШИН С.Г | |||
| К вопросу о выделении геномной ДНК из содержимого костного канала фрагментов трубчатых костей, Актуальные вопросы судебной медицины и экспертной практики, Барнаул-Новосибирск, 2011, Вып.17, найдено в интернет | |||
Авторы
Даты
2020-06-23—Публикация
2019-08-23—Подача