Изобретение относится к области молекулярной биологии, а именно к способу выделения и очистки дезоксирибонуклеиновых кислот из образцов тканей растений, а также продуктов переработки растительного и животного происхождения. Возможно использование изобретения в медицине, биотехнологии, при осуществлении санитарно-эпидемиологического контроля.
Выделение и очистка дезоксирибонуклеиновой кислоты (ДНК) из фрагментов органов растений и продуктов переработки сырья растительного и животного происхождения с целью проведения полимеразной цепной реакции (ПЦР) является одной из основных задач молекулярной биологии. В настоящее время используются следующие способы выделения ДНК.
Известен способ выделения ДНК из растительных тканей с использованием лизирующего буфера, последующей очисткой смесью хлороформа и изоамилового спирта и осаждением изопропанолом [1]. Способ заключается в том, что 100 мг фрагмента растения лизируют в 400 мкл буферного раствора (2% СТАВ, 1.4М NaCI, 20 мМ EDTA, 100 мМ TrisHCI), после добавления 10 мкл РНКазы инкубируют при 65°C в течение 60 мин. После этого проводят двукратную промывку лизата 400 мкл смеси хлороформа и изоамилового спирта (92:8) с промежуточным центрифугированием и переносом супернатанта в чистую пробирку. Далее проводят осаждение ДНК в присутствии 350 мкл изопропанола, центрифугирование и удаление супернатанта. Осадок ДНК промывают 400 мкл 70% этанола, сушат в течение 60 мин при комнатной температуре.
Недостатком данного способа является продолжительность выделения ДНК (более 2 часов), необходимость использования высокотоксичных летучих веществ (хлороформа и изоамилового спирта), низкое качество ДНК при высоком содержании блокирующих ПЦР веществ (хлорофилла, танинов), многостадийность способа.
Известен способ выделения и очистки ДНК, основанный на адсорбции нуклеиновых кислот на твердом сорбенте [2]. Образец смешивают с буферным раствором на основе хоатропного агента. Нуклеиновую кислоту сорбируют на стекловолокнистом сорбенте, предварительно обработанном 0,1-7% раствором плавиковой кислоты в течение 1-6 часов. В дальнейшем проводят отмывку сорбента от полимерных составляющих ненуклеиновой природы. Элюцию ДНК проводят буферным раствором или дистиллированной водой.
Недостатком данного способа является зависимость количества выделенной ДНК от объема сорбента (2,3 мкг ДНК на 1 мг сорбента), снижение выхода ДНК в результате необратимой адсорбции и потерей в результате отмывки сорбента.
Известен способ выделения и очистки ДНК, основанный на адсорбции нуклеиновых кислот на твердом сорбенте [3]. Нуклеиновую кислоту сорбируют на аэросиле (А-300) при нужной концентрации хаотропного агента путем добавления к пробе аэросила до конечной концентрации от 0,3 до 0,6%, смесь инкубируют 1-2 мин, аэросил с сорбированной НК осаждают центрифугированием, промывают 80%-ным изопропанолом. ДНК элюируют водой или буфером с низким содержанием солей.
Недостатком данного метода является трудоемкость, повреждение ДНК при большой концентрации, связанное с необходимостью проведения механического ресуспендирования сорбента во время отмывки ДНК, снижение выхода ДНК в результате необратимой адсорбции.
Из известных технических решений наиболее близким (прототипом) по назначению и технической сущности к заявляемому объекту является SDS-метод выделения ДНК [4] с использованием лизирующего буфера на основе додецилсульфата натрия (SDS). Примерно 2 см2 листьев растений положили в 1,5 мл пробирку, добавляли 400 мкл экстрактионного буфера ((200 мМ Tris-НС1, 250 мМ NaCl, 25 мМ EDTA, 0,5% SDS, рН 7,5) 10 мкл РНКазы и инкубировали 15 мин при температуре 65°C. Далее добавляли 200 мкл 5М ацетата калия, перемешивали и на 10 мин ставили в ледяную воду. После 15 мин центрифугирования при максимальном ускорении 500 мкл верхней фазы переносили в новую пробирку. Добавляли 400 мкл очистительного раствора (92% хлороформа и 8% изоамилового спирта), 1 мин центрифугировали при 12000 g. Верхнюю фазу переносили в чистую пробирку и повторяли промывку раствором на основе хлороформа и изоамилового спирта. ДНК осаждали 500 мкл изопропанола, 10 мин центрифугировали при 12000 g. Надосадочную жидкость удаляли, осадок промывали в 70% этаноле. Этанол удаляют; осадок ДНК просушивают в течение 1 часа при комнатной температуре и растворяют в 100 мкл дистиллированной воды или ТЕ-буфера.
Прототип имеет следующие недостатки, устраняемые заявляемым изобретением.
Многостадийность метода, необходимость задействования 4-х пробирок в каждом выделении и, соответственно, 3-кратного переноса раствора ДНК, в результате чего происходит механическое повреждение молекул при прохождении через наконечник пипетки.
Необходимость работы с токсичными веществами - хлороформом и изоамиловым спиртом - наносит вред здоровью исследователя и налагает ограничение на широкое использование метода.
Часто невозможно полностью очистить ДНК от хлорофилла и других пигментов, в результате чего происходит ингибирование ПЦР, сокращается срок хранения выделенной ДНК.
Сущность способа выделения и очистки ДНК заключается в том, что, в отличие от прототипа, очистку биологического раствора после лизиса образца в буфере на основе анионного детергента (например, додецил сульфата натрия - SDS) проводят суспензией предварительно отожженного в вакууме детонационного наноалмаза, являющегося гидрофильным сорбентом со слабым положительным зарядом и сильно развитой удельной поверхностью. В результате из раствора удаляются примеси, ингибирующие полимеразную цепную реакцию - пептиды, пигменты, танины, липиды. Последующее центрифугирование раствора позволяет разделить детонационный наноалмаз с адсорбированными примесями и супернатант, содержащий ДНК. Далее ДНК осаждают спиртом (изопропанолом или этанолом) и растворяют в дистиллированной воде.
Осуществление способа выделения и очистки ДНК достигается следующим образом.
Предварительно проводят подготовку суспензии 30 мг отожженного в течение 1-2 часа в вакууме (10-2 - 10-3 Торр) при температуре 300-700°C детонационного наноалмаза в 100 мкл буферного раствора (200 мМ Tris-HCl, 250 мМ NaCl, 25 мМ EDTA, 0,5% SDS, pH 7,5).
Лизис 50 мг образца тканей растений или продукта на основе сырья растительного или животного происхождения проводят в 400-500 мкл буферного раствора с добавлением 10 мкл рибонуклеазы в течение 15-20 мин при температуре 65°C в 1,5 мл пробирке. Полученный лизат центрифугируют при ускорении 12000 g в течение 2 мин. Надосадочную жидкость в объеме 300-400 мкл (в зависимости от влажности образца тканей) переносят в чистую 1,5 мл пробирку.
Очистку 300-400 мкл полученного биологического раствора проводят добавляя суспензию до конечной концентрации детонационного наноалмаза 5-10% и перемешивают в течение 1 мин. После этого добавляют 200 мкл 5М ацетата калия или натрия, перемешивают 1 мин и охлаждают до температуры 0°C в течение 10 мин.
Разделение смеси проводят центрифугированием в течение 5-10 мин при 12000 g. Супернатант, содержащий ДНК, переносят в чистую 1,5 мл пробирку. В результате из раствора удаляются примеси ингибирующие полимеразную цепную реакцию - пептиды, пигменты, танины, низкомолекулярные соединения.
Из подготовленного раствора ДНК осаждают 1 мл 96% этанола или 400 мкл изопропанола, центрифугируют 2-3 мин при ускорении 12000 g, надосадочную жидкость удаляют.
Осадок промывают в 70% этаноле, сушат в открытой пробирке 2 мин при температуре 65°C и растворяют в 100 мкл бидистиллированной воды.
Пример 1
Для выявления оптимальных условий предварительной подготовки сорбента проводят прокаливание 6 образцов детонационного наноалмаза (ТУ 84-112-87, производство ФНПЦ «Алтай») в вакууме (10-2 Toрр) при температуре от 300°C до 700°C в течение 1 часа.
Выделение ДНК производят из 6-и проб 50 мг живых тканей листа Allium sativum L. Предварительно проводят подготовку суспензии на каждую пробу 30 мг детонационного наноалмаза в 100 мкл буферного раствора (200 мМ Tris-HCl, 250 мМ NaCl, 25 мМ EDTA, 0,5% SDS, pH 7,5).
Лизис 6 одинаковых образцов тканей растений проводят в 400 мкл буферного раствора с добавлением 10 мкл РНКазы в течение 15 мин при температуре 65°C в 1,5 мл пробирках. Полученный лизат центрифугируют 2 мин при 12000 g. Надосадочную жидкость переносят в чистые 1,5 мл пробирки.
Очистку полученного биологического раствора проводят введением суспензии детонационного наноалмаза и затем перемешивают в течение 1 мин переворачиванием пробирок. Очистку проб проводят различно подготовленными детонационными наноалмазами в следующей комбинации:
проба №1 - предварительный отжиг наноалмазов при 300°C;
проба №2 - предварительный отжиг наноалмазов при 400°C;
проба №3 - предварительный отжиг наноалмазов при 500°C;
проба №4 - предварительный отжиг наноалмазов при 600°C;
проба №5 - предварительный отжиг наноалмазов при 700°C.
После этого добавляют 200 мкл 5М ацетата натрия и охлаждают до температуры 0°C в течение 10 мин.
Разделение смеси проводят центрифугированием в течение 10 мин при 12000 g. Супернатант, содержащий ДНК, переносят в чистую 1,5 мл пробирку. Из раствора ДНК осаждают 400 мкл изопропанола.
Осадок промывают в 70% этаноле и растворяют в 100 мкл бидистиллированной воды.
В итоге было получено 6 образцов раствора ДНК, качество которых проверяют спектрофотометрически, результаты измерений представлены в таблице 1.
Соотношение угасания на длинах волн ДНК и белка (OD260/OD280) для очень чистой ДНК имеет диапазон от 1,7-1,8 и выше. Таким образом, максимальное выделение ДНК (OD260/OD280=2,1) получают при прокаливании детонационного наноалмаза при 500°C в течение 1 часа, наилучшее качество - при прокаливании детонационного наноалмаза в температурном интервале от 400 до 700°C в течение 1 часа.
Пример 2
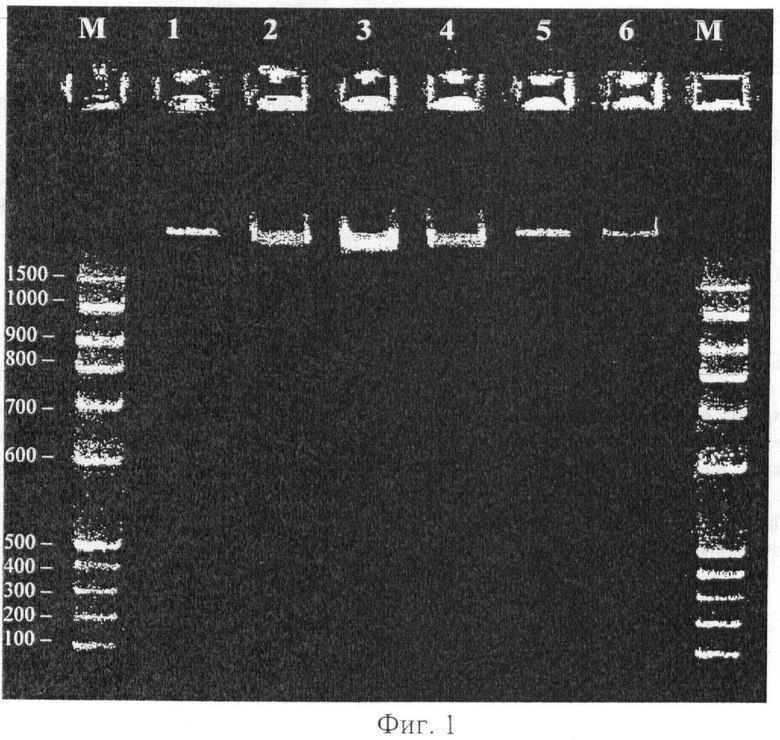
Для оценки качества ДНК проводят выделение из засушенных и хранившихся в течение 5 лет листьев Hedysarum neglectum Ledeb. с подготовкой 6 образцов детонационного наноалмаза аналогично примеру 1, за исключением того, что лизис проводят в течение 40 мин. В результате получают 6 образцов ДНК в зависимости от температуры подготовки детонационного алмаза. Длину полученных фрагментов ДНК оценивают постановкой электрофореза в 1% агарозном геле в течение 3 ч при напряжении 2,5 В/см, используя для оценки длины эталона 100 bp (базовых пар нуклеотидов) маркер молекулярного веса. После окрашивания геля раствором бромида этидия ДНК фотографируют в УФ-излучении 312 нм (Фиг.1). Выявляют стабильность длины фрагментов выделенной ДНК вне зависимости от условий подготовки детонационного наноалмаза. Наибольшее содержание ДНК выявляют по свечению для образца №3, что соответствует температуре подготовки детонационного наноалмаза 500°C.
Пример 3
Для подбора RAPD-праймеров и выявления видоспецифичных маркеров проводят выделение ДНК из 30 мг листьев Papaver somniferum L. и Papaver orientale Bieb.
Лизис двух образцов тканей разных видов растений проводят в 500 мкл буферного раствора с добавлением 10 мкл РНКазы в течение 30 мин при температуре 65°C в 1,5 мл пробирках. Полученный лизат центрифугируют 2 мин при 12000 g. Надосадочную жидкость переносят в чистые 1,5 мл пробирки.
Очистку полученного биологического раствора, проводят введением в каждую пробу суспензии 100 мкл буфера и 30 мг детонационного наноалмаза предварительно отожженного при 450°C в течение 2 часов в вакууме (10-3 Toрр). После этого добавляют 200 мкл 5М ацетата натрия и охлаждают в морозильной камере в течение 10 мин.
Разделение смеси проводят центрифугированием в течение 5 мин при 12000 g. Супернатант, содержащий ДНК, переносят в чистую 1,5 мл пробирку. Из раствора ДНК осаждают 800 мкл 96% этанола. После центрифугирования надосадочную жидкость сливают, и после сушки осадок ДНК растворяют в 100 мкл бидистиллированной воды.
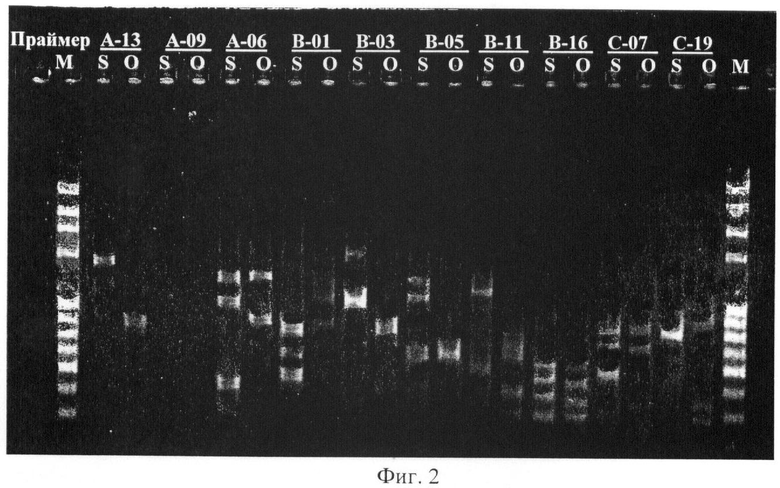
Амплификацию проводили с коммерческими RAPD-праймеами. Амплифицированную ДНК разгоняют на агарозном 1,5% геле при 5 В/см в течение 2,5 часов параллельно с маркером молекулярного веса. Гель окрашивают раствором бромида этидия и визуализируют в УФ-излучении (Фиг.2). По фотографии геля выявляют различия в паттернах образцов S и O, что соответствует различию геномов двух видов.
Данный пример подтверждает возможность использования выделенной с помощью разработанного метода ДНК для решения задач типификации и молекулярной систематики растений с помощью RAPD-метода.
Пример 4
Выделение ДНК производят из свежевысушенных листьев Hedysamm theinum Krasnob, аналогично примеру 3, полученную ДНК используют для амплификации ITS 1-фрагмента в термальном цикл ере BioRad с помощью ПЦР-набора «Медиген». Использовали праймеры:
ITS-1 (5'-TCCGTAGGTGAACCTGCGG-3'),
ITS-2 (5'-GCTGCGTTCTTCАТСGATGC-3').
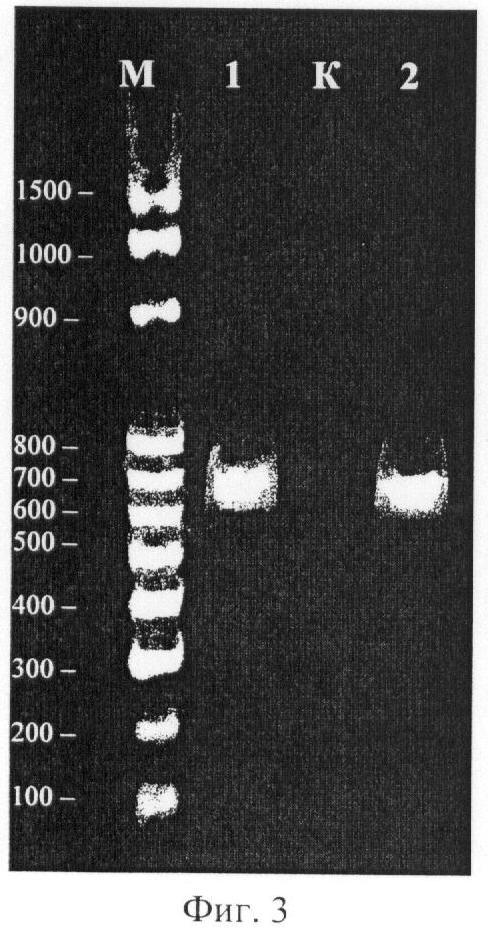
Амплифицированную ДНК разгоняют на агарозном 1,5% геле при 5 В/см в течение 2,5 часов параллельно с маркером молекулярного веса и контрольной пробой. Гель окрашивают раствором бромида этидия и визуализируют в УФ-излучении (Фиг.3). Выявляют амплифицированный участок ДНК (паттерны №1 и №3) длиной около 700 bp. Впоследствии амплифицированный участок очищают из геля с использованием набора NucleoSpin и секвенируют. Расшифрованная последовательность амплифицированного участка сравнивают с сиквенсом ITS 1-фрагментом других видов рода Hedysarum, взятых из свободно доступных Интернет-баз данных. Таким образом, нуклеотидная последовательность ДНК, в случае выделения указанным способом, не нарушается и молекула ДНК не модифицируется. Данный пример подтверждает возможность использования полученной с помощью разработанного метода ДНК для расшифровки ее последовательности методом секвенирования.
Предлагаемый способ выделения и очистки ДНК позволяет избежать использования таких высокотоксичных соединений как фенол и хлороформ. Полученный таким способом раствор ДНК содержит как короткие, так и длинные фрагменты. Предотвращается загрязнение полученной ДНК химически активными веществами. Благодаря характерной черной окраске детонационного наноалмаза облегчается процесс разделения фракций - после центрифугирования отчетливо видна граница разделения фаз. При случайном попадании детонационного наноалмаза в конечный раствор полимеразная цепная реакция не блокируется, при этом имеется возможность отделить нерастворимый осадок детонационного наноалмаза от раствора ДНК. Ввиду постоянства размеров наночастиц детонационного наноалмаза, вне зависимости от условий синтеза сохраняется стабильность величины адсорбционной емкости очистительной суспензии.
Литература
1. Doyle J.J. and J.L.Doyle. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. // Phytochemical Bulletin, 1987. - T.19. - P.11-15.
2. Патент РФ №2272072, кл. C12N 15/10, опубл. 20.03.2006.
3. Патент РФ №2119954, кл. C12N 15/10, С07Н 21/00, С07Н 21/02, С07Н 21/04, опубл. 10.10.1998.
4. Фризен Н. Молекулярные методы, используемые в систематике растений. - Барнаул: Азбука, 2007. - 64 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выделения ДНК из растений, пригодный для постановки ПЦР | 2017 |
|
RU2672378C1 |
| СПОСОБ ВЫСОКОПРОИЗВОДИТЕЛЬНОГО ВЫДЕЛЕНИЯ ДНК ИЗ ПРОРОСТКОВ СОИ | 2024 |
|
RU2833968C1 |
| Универсальный способ выделения ДНК и лизирующая смесь для его осуществления | 2022 |
|
RU2807254C1 |
| Способ выделения ДНК из почвы | 2018 |
|
RU2696052C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ТОТАЛЬНОЙ ДНК БАКТЕРИЙ ИЗ ОБРАЗЦОВ ПОЧВЫ, СПОСОБ ОЦЕНКИ БАКТЕРИАЛЬНОГО СОСТАВА ПОЧВ ПОСРЕДСТВОМ МЕТАГЕНОМНОГО СЕКВЕНИРОВАНИЯ И НАБОРЫ ДЛЯ ОСУЩЕСТВЛЕНИЯ СПОСОБОВ | 2024 |
|
RU2829656C1 |
| СПОСОБ ПОДГОТОВКИ БИОЛОГИЧЕСКОГО МАТЕРИАЛА ДЛЯ ПЦР ГЕНАМПЛИФИКАЦИОННОЙ ДИАГНОСТИКИ | 1998 |
|
RU2134871C1 |
| СПОСОБ ВЫДЕЛЕНИЯ НУКЛЕИНОВЫХ КИСЛОТ | 2014 |
|
RU2584346C2 |
| СПОСОБ ВЫДЕЛЕНИЯ ДНК COCCIDIOIDES IMMITIS ДЛЯ ПРОВЕДЕНИЯ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2005 |
|
RU2295569C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ДНК ИЗ МИКРООРГАНИЗМОВ И КЛЕТОК ЖИВОТНЫХ, ПРИГОДНОЙ ДЛЯ ПОСТАНОВКИ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 1997 |
|
RU2129610C1 |
| СПОСОБ ВЫДЕЛЕНИЯ РИБОНУКЛЕИНОВЫХ КИСЛОТ | 2002 |
|
RU2232810C1 |
Изобретение относится к области молекулярной биологии, а именно к способу выделения и очистки дезоксирибонуклеиновых кислот (ДНК) из образцов тканей растений, а также продуктов переработки растительного и животного происхождения. Возможно использование изобретения в медицине, биотехнологии, осуществлении санитарно-эпидемиологического контроля. Способ выделения и очистки ДНК основан на том, что образец подвергают лизису в буфере на основе анионного детергента (SDS), лизат подвергают очистке и дезоксирибонуклеиновую осаждают этанолом или изопропанолом. Очистку лизата проводят суспензией детонационного наноалмаза, избирательно сорбирующим примеси ненуклеиновой природы. Детонационный наноалмаз предварительно отжигают в температурном интервале 400-700°С в вакууме 10-2-10-3 Торр. Полученный раствор ДНК содержит как короткие, так и длинные фрагменты. Предлагаемый способ выделения и очистки ДНК позволяет избежать использования таких высокотоксичных соединений, как фенол и хлороформ. Предотвращается загрязнение полученной ДНК химически активными веществами. При случайном попадании детонационного наноалмаза в конечный раствор полимеразная цепная реакция не блокируется, при этом имеется возможность отделить нерастворимый осадок детонационного наноалмаза от раствора ДНК. 3 ил, 1 табл.
Способ выделения и очистки дезоксирибонуклеиновых кислот, заключающийся в том, что после лизиса образца в буфере на основе анионного детергента проводят очистку раствора и ДНК осаждают спиртом, отличающийся тем, что для очистки раствора используют суспензию детонационного наноалмаза до конечной концентрации от 5 до 10% при рН 7,5, предварительно отожженного при температуре от +400° до +700°С в вакууме от 10-2 до 10-3 Торр, затем добавляют ацетат калия или натрия, перемешивают, охлаждают смесь при 0°С, центрифугируют и разделяют детонационный наноалмаз, сорбирующий вещества ненуклеиновой природы, и супернатант, содержащий ДНК.
| RU 2001122054, 10.06.2004 | |||
| БОНДАРЬ B.C | |||
| и др | |||
| Применение наноалмазов для разделения и очистки белка | |||
| - Физика твердого тела, 2004, т,46, №6, стр.737-739 | |||
| PURTOV K.V | |||
| ЕТ AL.: "Nanodiamond sorbents: new carriers for column chromatography of proteins", Doklady biochemistry and biophysics, 2008, v.419, p.72-74 | |||
| PURTOV K.V | |||
| ET AL.: "The |
Авторы
Даты
2010-09-27—Публикация
2008-11-05—Подача