Изобретение относится к области эстетической, пластической и реконструкционной косметологии/медицины, а именно к биоактивным композитам, в том числе на основе микрочастиц синтетического гидроксиапатита (СаНА), помещенных в гидрогель, предназначенный для коррекции эстетических и возрастных изменений кожи лица и тела и способам их получения.
Гидроксиапатит - является основной неорганической составляющей костной ткани живых существ. Дермальные филлеры на основе различных материалов, в том числе гидроксиапатита, используются не только в косметических целях - устранения морщи, но и для увеличения объема мягких тканей. Например, для коррекции деформаций носа широко применяются препараты на основе стабилизированной гиалуроновой кислоты (ГК), гидроксиапатита (СаНА) и жидкого силикона. Однако силикон может вызывать тяжелую гранулематозную реакцию у некоторых пациентов, поэтому его использование не рекомендуется. Гиалуроновая кислота и СаНА являются достаточно безопасными материалами. В настоящее время ГК и СаНА являются оптимальными материалами для коррекции различных деформаций после ринопластики или для увеличения объема дефицита мягких тканей, полученных в результате травм, оперативного вмешательства или у ВИЧ-инфицированных.
Целью изобретения является разработка биоактивных и биосовместимых материалов с длительным эффектом клинического действия для использования их в качестве эстетических лицевых наполнителей объема мягких тканей агентами, а также способов их получения.
Идеальные свойства имплантатов мягких тканей - это биосовместимость, неиммуногенность, неконцерогенность,
долговременный эффект при использовании, простота применения и минимальная миграция в отдаленные места организма.
Известен биоактивный композит для наращивания ткани [RU 2641053, C1, A61K 8/04, A61K 8/85, A61K 9/19, A61F 2/00, A61L 27/18, A61L 27/50, A61L 27/58, A61Q 19/00, A61Q 19/08, 15.01.2018], включающий гиалуроновую кислоту или ее соль в качестве матрицы и микрочастицы полилактида или его сополимеров с гликолидом, как наполнителем, характеризующийся тем, что он получен тем, что, осуществляют взаимодействие твердофазных порошков гиалуроновой кислоты или ее соли и полилактида или его сополимеров с гликолидом в условиях одновременного воздействия давления в пределах от 20 до 50 МПа и деформации сдвига в механохимическом реакторе при температуре от 20 до -20°С.
Недостатком этого биоактивного композита является относительно слабые биоактивные свойства.
Наиболее близким по технической сущности и достигаемому результату является состав дермального наполнителя [ЕР 1080698, А1, A61L 27/00, A61L 27/40, A61L 27/44, 07.03.2001] на основе сшитой гиалуроновой кислоты и карбоксиметилцеллюлозной связки, включающих гиалуроновую кислоту (НА), карбоксиметилцеллюлозу (КМЦ) и содержащий тонкоизмельченные биосовместимые керамические частицы фосфатов кальция - гидроксиапатита и трикальцийфосфата, распределенные в жидком носителе, представляющим собой биосовместимый полимер, выбранный из группы полисахаридов, а именно: гиалуроновую кислоту и гель карбоксиметилцелюлозу, содержащим дополнительно биосовместимую жидкую связку раствор глицерина. При этом, размеры частиц биосовместимых фосфатов кальция распределены в диапазоне 15-150 мкм и керамические частицы объединяются в жидкости - носителе в количестве от 15 до 50 об.% от общего состава.
Недостатком известного состава дермального филлера является невысокая биологическая активность синтетического гидроксиапатита и геля-носителя, входящего в состав известного филлера.
Задача, которая решается в предложенном изобретении относительно композиционного материала для коррекции эстетических и возрастных изменений кожи, является создание материала с более высокой биологической активностью.
Требуемый технический результат заключается в повышении биологической активности.
Поставленная задача решается, а требуемый технический результат относительно композиционного материала для коррекции эстетических и возрастных изменений кожи, достигается тем, что, в композиционный материал, содержащий гель-носитель и гиалуроновую кислоту, согласно изобретению, дополнительно введен глицерин и гидроксиапатит модифицированный при следующем соотношении компонентов в композиционном материале мас.%:
альгинат натрия - 1-2;
глицерин - 3,0-6,0;
гидроксиапатит, модифицированный с соотношением Са/Р=1,67-5,0-30,0;
бидистиллированная вода - остальное,
причем, в качестве гидроксиапатита модифицированного используют синтетический гидроксиапатит, который модифицируют магнием (Mg2+)-0,67±0,02 масс %, карбонатом (СО32-)-5,1±0,02 мас.%, и силикат-ионами (Si4+)-0,07±0,02 масс %.
Кроме того, известны способы получения композиционного материала для коррекции эстетических и возрастных изменений кожи.
В частности, известен твердофазный способ получения биоактивного композита для наращивания ткани на основе гиалуроновой кислоты и микрочастиц полилактида или его сополимеров [RU 2641053, C1, A61K 8/04, A61K 8/85, A61K 9/19, A61F 2/00, A61L 27/18, A61L 27/50, A61L 27/58, A61Q 19/00, A61Q 19/08, 15.01.2018], заключающийся в том, что осуществляют взаимодействие твердофазных порошков гиалуроновой кислоты или ее соли и полилактида или его сополимеров с гликолидом в условиях одновременного воздействия давления в пределах от 20 до 50 МПа и деформации сдвига в механохимическом реакторе при температуре от 20 до -20°С.
Недостатком этого способа является относительно узкая область применения и относительно низкая эффективность, поскольку получаемый с его помощью биоактивный композит обладает слабыми биоактивными свойствами.
Кроме этого, при разложении в биологических жидкостях организма получаемый композит приводят к образованию молочной кислоты, повышение концентрации которой в организме дает болезненные ощущения.
Дополнительно следует отметить, что, гиалуроновая кислота дает временный эффект максимально на 6-12 месяцев, поскольку увеличение объема тканей связано с гидрофильными свойствами гиалуроновой кислоты. Причем, выработка организмом собственной гиалуроновой кислоты при введении ее извне уменьшается, и поэтому для поддержания эффекта время между инъекциями сокращается.
Известен также способ получения комплексного препарата [RU 2396083, C1, A61K 31/65, А61Р 31/00, А61Р 37/04, 10.08.2010], включающий смешивание 90 мас.ч. 0,2-0,3%-ной суспензии агара, 2,5 мас.ч. концентрата очищенного полисахаридного комплекса, 3,5 мас.ч. (-)2,3,5,6-тетрагидро-6-фенилимидазо-[2,1-b]-тиазола гидрохлорида и 0,2 мас.ч. формалина, при этом, при смешивании дополнительно вводят 0,1 мас.ч. тетрациклина гидрохлорида, объем доводят до 100 мас.ч.
Недостатком этого способа его относительно высокие сложность и длительность приготовления препарата, а также относительно ограниченная область применения, обусловленная и необходимостью использования аутологичной дермальной ткани, выделенной из собственной кожи пациента, что связано с дополнительным травматизмом пациента.
Наиболее близким по технической сущности и достигаемому результату является относительно способа получения композиционного материала для коррекции эстетических и возрастных изменений кожи (состава дермального наполнителя) является способ [ЕР 1080698, А1, A61L 27/00, A61L 27/40, A61L 27/44, 07.03.2001], заключающийся в том, что, в жидком носителе, представляющим собой биосовместимый полимер, выбранный из группы полисахаридов, а именно, гиалуроновую кислоту и гель карбоксиметилцелюлозу, вводят в количестве от 15 до 50 об.% от общего состава тонкоизмельченные биосовместимые керамические частицы фосфатов кальция - гидроксиапатита и трикальцийфосфата, размеры которых распределены в диапазоне 15-150 мкм количестве от 15 до 50 об.% от общего состава.
Недостатком наиболее близкого технического решения относительно способа является его узкая область применения и относительно низкая эффективность, поскольку получаемый с его помощью биоактивный композит обладает слабыми биоактивными свойствами.
Кроме этого, при разложении в биологических жидкостях организма получаемый композит приводят к образованию молочной кислоты, повышение концентрации которой в организме дает болезненные ощущения.
Дополнительно следует отметить, что, гиалуроновая кислота дает временный эффект максимально на 6-12 месяцев, поскольку увеличение объема тканей связано с гидрофильными свойствами гиалуроновой кислоты. Причем, выработка организмом собственной гиалуроновой кислоты при введении ее извне уменьшается, и поэтому для поддержания эффекта время между инъекциями сокращается.
Задача, которая решается в предложенном изобретении относительно способа получения композиционного материала для коррекции эстетических и возрастных изменений кожи, является расширение области его применения путем обеспечения получения материала с более высокой биологической активностью, что позволит расширить арсенал технических средств, используемых для этих целей.
Требуемый технический результат заключается в расширении области применения способа путем обеспечения получения материала с более высокой биологической активностью и расширении арсенала технических средств, используемых для этих целей.
Поставленная задача решается, а требуемый технический результат относительно способа, достигается тем, что, в способе, заключающемся в получении раствора компонентов, в который входит раствор гиалуроновой кислоты, согласно изобретению, в раствор компонентов вводят раствор альгината натрия, глицерин и гидроксиапатит модифицированный при следующем соотношении компонентов, мас.%:
альгинат натрия - 1,0-2,0%;
глицерин - 3,0-6,0%;
гидроксиапатит модифицированный (с соотношением Са/Р=1,67) - 5,0-30,0%
бидистиллированная вода - остальное,
причем, гидроксиапатит модифицированный получают путем модификации гидроксиапатита синтетического магнием (Mg2+) - 0,67±0,02 масс %, карбонатом (СО32-)-5,1±0,02 масс %, и силикат-ионами (Si4+) - 0,07±0,02 масс %.
Кроме того, поставленная задача решается, а требуемый технический результат относительно способа достигается тем, что, модификацию гидроксиапатита магнием и карбонатом производят перед его осаждением путем введения растворов солей хлорида магния и солей карбоната натрия.
Кроме того, поставленная задача решается, а требуемый технический результат относительно способа достигается тем, что, модификацию гидроксиапатита силикат-ионами производят путем введения силиката калия в суспензию свежеосажденного гидроксиапатита, который затем фильтруют и многократно промывают дистиллированной водой.
Кроме того, поставленная задача решается, а требуемый технический результат относительно способа достигается тем, что, отфильтрованный гидроксиапатит сушат при ступенчатом подъеме температуры 80-150°С с шагом 30°С в течение 5 ч, затем прокаливают при 500°С в течение часа и при 800°С в течение 2 ч.
Кроме того, поставленная задача решается, а требуемый технический результат достигается тем, что, при получении раствора компонентов вначале смешивают порошок синтетического модифицированного гидроксиапатита с раствором глицерина до состояния устойчивой суспензии и однородного распределения гидроксиапатита, затем добавляют гель альгината натрия и продолжают смешивание в течение 15-20 минут при средней скорости смешивания 100-150 об/мин.
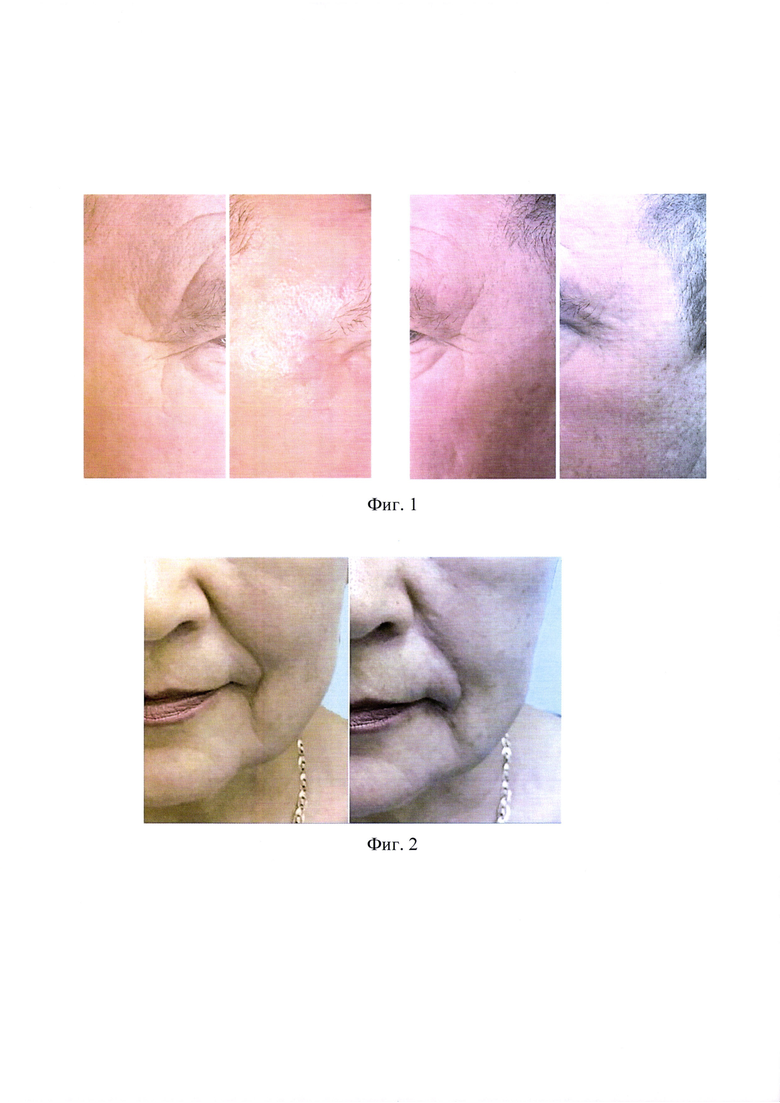
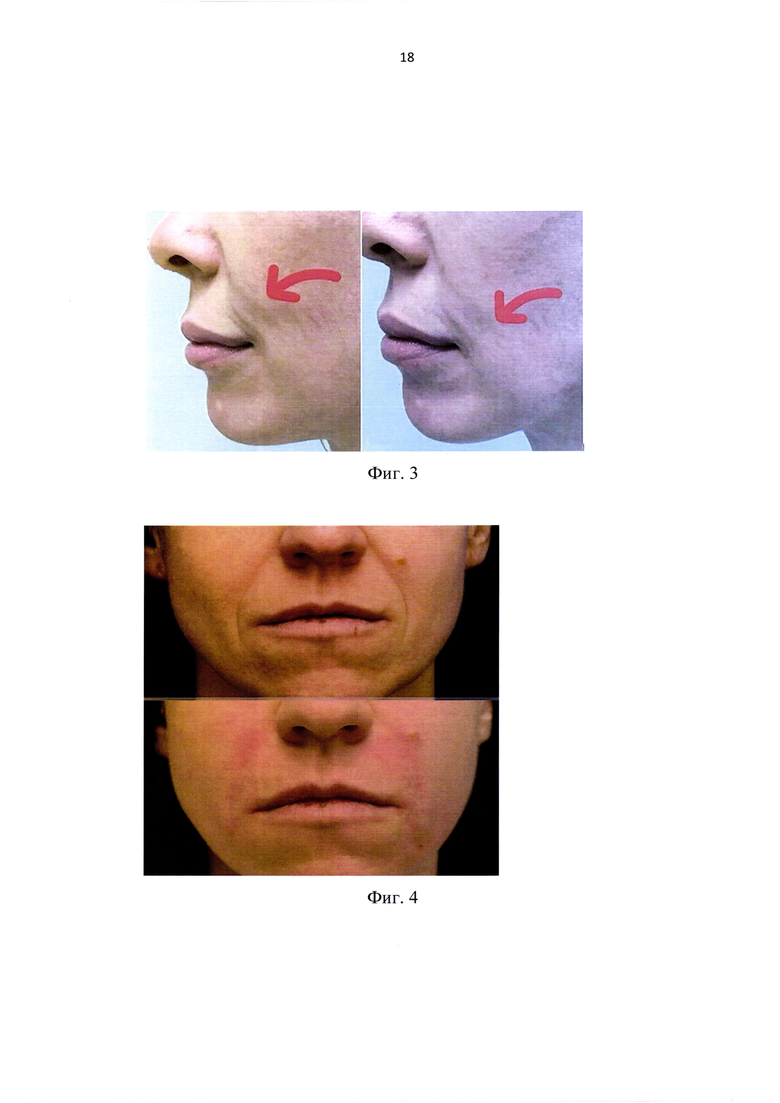
На изображениях представлены:
на фиг. 1 - примеры результатов введения предложенного композиционного материала - заполнение мимических морщин «гусиные лапки»);
на фиг. 2 - примеры результатов заполнения носогубных складок и устранение морщинок «марионеток»;
на фиг. 3 - примеры результатов при заполнении носогубных складок и устранения морщинок «марионеток»;
на фиг. 4 - примеры результатов при заполнении носогубных складок;
на фиг. 5 - примеры результатов при заполнении носогубных складок и устранение морщинок «марионеток».
Композиционный материал для коррекции эстетических и возрастных изменений кожи получают и используют следующим образом.
Элементный состав сухого порошка гидроксиапатита должен соответствовать следующим данным:
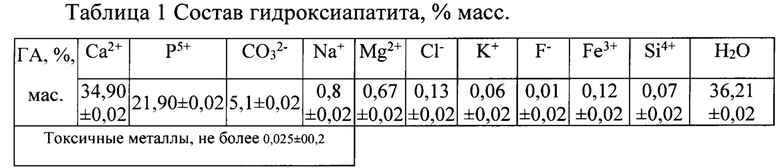
Гидроксиапатит синтезируют из раствора хлорида кальция, в который дополнительно вводятся растворимые соли (хлориды) магния, железа, в количествах, соответствующих расчетным значениям в конечном продукте; кремний вводится в раствор для осаждения в виде гидратированного хлорида кремния. Осаждение проводят по реакции:
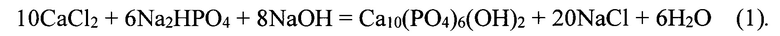
Осаждение проводят до установления рН=8-8,5. Реакции модифицирования гидроксиапатита карбонат ионами, магнием и кремнием представлены уравнениями 2-3:
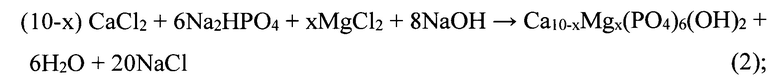
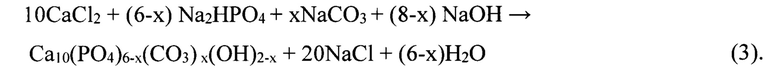
Модификацию кремнием осуществляют введением микроколичеств силиката калия в суспензию свежеосажденного гидроксиапатита, который затем фильтруют и многократно промывают дистиллированной водой, сушат при ступенчатом подъеме температуры 80-150°С с шагом 30°С в течение 5 ч, затем прокаливают при 500°С в течение часа и при 800°С в течение 2 часов. Порошок гидроксиапатита остужают в печи прокаливания в течение 8 часов, измельчают, выбирают фракцию 20-40 мкм.
Пример осуществления 1. Приготавливают гель из альгината натрия смешиванием 1,5 г сухого порошка и 50 мл бидистиллированной воды и гель гиалуроновой кислоты смешиванием 0,4 г сухого порошка и 48,1 мл бидистиллированной воды. Затем полученные гели смешивают в электрическом смесителе 10-15 минут при средней скорости смешивания 100-120 об/мин. Полученным гелем в количестве 0,8 и 1 мл, заполняют в стерильные шприцы объемом 1,5 и 2 мл, соответственно, и дополнительно стерилизуют паровой стерилизацией при температуре 120-130°С, хранят готовые филлеры при температуре 5-15°С. Для инъецирования используют иглы 27G и канюли.
Пример осуществления 2. Приготавливают гель из альгината натрия смешиванием 2 г сухого порошка и 50 мл бидистиллированной воды и гель гиалуроновой кислоты смешиванием 0,5 г сухого порошка и 47,5 мл бидистиллированной воды. Затем полученные гели смешивают в электрическом смесителе 10-15 минут при средней скорости смешивания 100-120 об/мин. Полученным гелем в количестве 0,8 и 1 мл, заполняют в стерильные шприцы объемом 1,5 и 2 мл, соответственно, и дополнительно стерилизуют паровой стерилизацией при температуре 120-130°С, хранят готовые филлеры при температуре 5-15°С. Для инъецирования используют иглы 27G и канюли.
Пример осуществления 3. Приготавливают смесь из 5 г порошка синтетического модифицированного гидроксиапатита с соотношением Са/Р=1,67, с размерами частиц 20-40 мкм и 95 г геля, содержащего 2 г альгината натрия и 5 г (3,97 мл) 99,9% глицерина и 88,5 г бидистиллированной воды. Предварительно перед смешиванием приготавливают гель из альгината натрия смешиванием 1,5 г сухого порошка и 50 мл воды и раствор глицерина смешиванием 5 г (3,97 99,9% глицерина) с 37,5 г воды. Порошок гидроксиапатита сначала тщательно перемешивают с раствором глицерина в электрическом смесителе до состояния устойчивой суспензии и однородного распределения гидроксиапатита, затем добавляют гель альгината натрия и продолжают смешивание в течение 15-20 минут при средней скорости смешивания 100-150 об/мин.
Полученной суспензией в количестве 0,8 и 1 мл, заполняют в стерильные шприцы объемом 1,5 и 2 мл, соответственно, и дополнительно стерилизуют паровой стерилизацией при температуре 120-130°С, хранят готовые филлеры при температуре 5-15°С. Для инъецирования используют иглы 27G и канюли.
Пример осуществления 4. Приготавливают смесь из 10 г порошка синтетического модифицированного гидроксиапатита с соотношением Са/Р=1,67, с размерами частиц 20-40 мкм и 90 г геля, содержащего 1,5 г альгината и 4 г (3,17 мл) 99,9% глицерина и 85 г бидистиллированной воды. Предварительно перед смешиванием приготавливают гель из альгината натрия смешиванием 1,0 г сухого порошка и 40 мл воды и раствор глицерина смешиванием 5 г (3,17 мл 99,9% глицерина) с 45 г воды. Последовательность и условия смешивания раствора глицерина, порошка гидроксиапатита и геля такая же, как в примере 1.
Полученной суспензией в количестве 0,8 и 1 мл заполняют в стерильные шприцы объемом 1,5 и 2 мл, соответственно, и дополнительно стерилизуют паровой стерилизацией при температуре 120-130°С, хранят готовые филлеры при температуре 5-15°С. Для инъецирования используют иглы 27G и канюли.
Пример осуществления 5. Приготавливают смесь из 20 г порошка синтетического модифицированного гидроксиапатита с соотношением Са/Р=1,67, с размерами частиц 20-40 мкм и 80 г геля, содержащего 1,5 г альгината и 6 г (4,76 мл) 99,9% глицерина и 72,5 г бидистиллированной воды. Предварительно перед смешиванием приготавливают гель из альгината натрия смешиванием 2 г сухого порошка и 35 мл воды и раствор глицерина смешиванием 6 г (4,76 мл 99,9% глицерина) с 37,5 г воды. Последовательность и условия смешивания раствора глицерина, порошка гидроксиапатита и геля такая же, как в примере 1.
Полученной суспензией в количестве 0,8 и 1 мл, заполняют в стерильные шприцы объемом 1,5 и 2 мл, соответственно, и дополнительно стерилизуют паровой стерилизацией при температуре 120-130°С, хранят готовые филлеры при температуре 5-15°С. Для инъецирования используют иглы 27G и канюли.
Пример осуществления 6. Приготавливают смесь из 30 г порошка синтетического модифицированного гидроксиапатита с соотношением Са/Р=1,67, с размерами частиц 20-40 мкм и 70 г геля, содержащего 1,0 г альгината и 5 г (3,97 мл) 99,9% глицерина и 63 г бидистиллированной воды. Предварительно перед смешиванием приготавливают гель из альгината натрия смешиванием 2 г сухого порошка и 30 мл воды и раствор глицерина смешиванием 6 г (4,76 мл 99,9% глицерина) с 33 г воды. Последовательность и условия смешивания раствора глицерина, порошка гидроксиапатита и геля такая же, как в примере 1. Полученной суспензией в количестве 0,8 и 1 мл, заполняют в стерильные шприцы объемом 1,5 и 2 мл, соответственно, и дополнительно стерилизуют паровой стерилизацией при температуре 120-130°С, хранят готовые филлеры при температуре 5-15°С. Для инъецирования используют иглы 27G и канюли.
Использование в составе филлера микрочастиц синтетического модифицированного гидроксиапатита, содержащего магний, карбонат- и силикат-ионы в качестве микропримесей, соответствующих составу природной кости, повышает биоактивность состава и будет способствовать улучшению процесса неоколлагенеза, как было установлено исследованиями по использованию биологического гидроксиапатита, получаемого из костей животных [1] и используемого в составе костнозамещающих материалов цементов и покрытий имплантатов. Способ введения микропримесей в состав путем совместного осаждения их из растворов позволяет равномерно распределять их по всему объему синтетического гидроксиапатита и встраивать их в структуру по механизму замещения, подобно биологическому гидроксиапатиту. При использовании синтетического модифицированного микропримесями гидроксиапатита отсутствует опасность иммунного ответа организма, возможная при использовании биологического гидроксиапатита. Использование гидроксиапатита в составе филлера менее 5% неэффективно из-за малой доли неоколлагенеза, а при концентрации выше 30% вязкость суспензии повышается, и требуются большие усилия при введении материала филлера в ткани организма, при этом повышается риск травматизма тканей.
Использование в составе филлера в качестве геля носителя полисахарида - альгината натрия, получаемого из морских водорослей, являющегося биологически активным веществом, содержащим йод и представляющим соль альгиновой кислоты, которая состоит из двух мономерных кислот - маннуровой и гулуроновой и способна адсорбировать воду весом в 300 раз больше собственного. Альгинат натрия при растворении в воде образуют вязкие растворы. При добавлении в раствор альгината натрия легко образуется гель. Альгинат натрия обладает целым рядом чрезвычайно полезных свойств: является иммунным регулятором, сорбентам холестерина и жирных кислот, снижает концентрацию атерогенных веществ в крови. Альгинаты, стимулируя фагоцитоз, оказывают противоопухолевый эффект, используется в составе ранозаживляющих покрытий и т.д. [2]. Диапазон концентраций альгината натрия 1-2% определяется по следующим параметрам: при концентрации менее 1% эффект аугментации в момент введения материала филлера будет менее заметен, а при концентрации более 2% вязкость состава повышается, и возникают трудности при инъецировании препарата.
Гиалуроновая кислота - один из основных компонентов нашей кожи и регулятор ее водного баланса. Она превосходно увлажняет, это ее главная ценность. ГК, или гиалуронат, является не сульфатированным гликозаминогликаном, который в норме находится в коже и других тканях (особенно соединительной, эпителиальной и нервной), заполняя пространство внеклеточного матрикса. ГК имеется у всех животных, поэтому она не является иммуногенной. Этот полисахарид способен связывать объем воды, в 1000 раз превышающий объем полисахарида. Механизм возникновения биологического эффекта ГК является предсказуемым. Вещество увеличивает объем и степень увлажнения с помощью водосодержащей гибкой структуры, которая склеивается с коллагеном, эластином и клетками. Повышенная концентрация ГК, выше значения 5 мг/мл (выше 0,5 мас.%) приводит к дозозависимому снижению выживаемости фибробластов, ниже 0,3% - производит незначительный эффект.
Глицерин в составе материала филлера действует как смазка, кроме этого, он обволакивает микросферы гидроксиапатита и препятствует конгломерации. Концентрация 3-6% обеспечивая улучшение инъецирования суспензии биоматериала.
Филлеры вышеуказанного состава были опробованы на группе добровольцев. Были использованы разновозрастные группы по 4 человека на каждый состав. Наиболее типичные случаи приведены на Фиг. 1-5. Пациенты после процедуры чувствовали себя великолепно.
Сразу после процедуры виден результат: заполнены межбровные морщины, на лбу, мимические «гусиные лапки», носогубные складки, улучшен овал лица. Эстетически процедура соблюдена и не оставляет следов на коже. Сразу после процедуры пациент может вернуться к обычному распорядку дня. Препарат начинает активно работать через 3-4 месяца и качество кожи улучшается. Кожа становится более плотной и эластичной.
Таким образом, в предложенном изобретении достигается требуемый технический результат, заключающийся в расширении области применения способа путем обеспечения получения материала с более высокой биологической активностью и расширении арсенала технических средств, используемых для этих целей.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ изготовления дермального филлера и его подготовки к применению | 2022 |
|
RU2833246C2 |
| БИОАКТИВНЫЙ КОМПОЗИЦИОННЫЙ МАТЕРИАЛ ДЛЯ ЗАМЕЩЕНИЯ КОСТНЫХ ДЕФЕКТОВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2016 |
|
RU2617050C1 |
| СПОСОБ НАНЕСЕНИЯ БИОАКТИВНОГО ПОКРЫТИЯ НА ТИТАНОВЫЕ ИМПЛАНТАТЫ | 2018 |
|
RU2684617C1 |
| ДЕРМАЛЬНЫЙ ФИЛЛЕР НА ОСНОВЕ ПОПЕРЕЧНОСШИТОЙ ГИАЛУРОНОВОЙ КИСЛОТЫ И КАРБОКСИМЕТИЛЦЕЛЛЮЛОЗЫ В КАЧЕСТВЕ ЛУБРИКАНТА | 2015 |
|
RU2712641C2 |
| КОМПОЗИЦИОННЫЙ МАТЕРИАЛ ДЛЯ ВОССТАНОВЛЕНИЯ ДЕФЕКТОВ КОСТНОЙ ТКАНИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2012 |
|
RU2476236C1 |
| ИНЪЕКЦИОННЫЙ СОСТАВ С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ, СОДЕРЖАЩИЙ КОНЪЮГАТ ФИЛЛЕРА С ПОЛИ-L-МОЛОЧНОЙ КИСЛОТОЙ, ФИЛЛЕРА С ГИАЛУРОНОВОЙ КИСЛОТОЙ И БИОАКТИВНЫЙ МАТЕРИАЛ, И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2020 |
|
RU2777623C1 |
| Способ лечения гиперкоррекции, возникающей при проведении контурной пластики филлерами на основе гиалуроновой кислоты | 2023 |
|
RU2837953C2 |
| МОДИФИЦИРОВАННАЯ ГИАЛУРОНОВАЯ КИСЛОТА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ЕЕ ПРИМЕНЕНИЯ | 2017 |
|
RU2733444C2 |
| МОДИФИЦИРОВАННАЯ АЛЬДЕГИДОМ ГИАЛУРОНОВАЯ КИСЛОТА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ЕЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2810057C2 |
| Биоактивное покрытие для восстановления костной ткани | 2019 |
|
RU2717676C1 |

Группа изобретений относится к области эстетической косметологии/медицины, а именно к композиционному материалу для коррекции эстетических и возрастных изменений кожи, содержащему гель-носитель, отличающемуся тем, что, дополнительно введен глицерин и гидроксиапатит, модифицированный при следующем соотношении компонентов в композиционном материале мас.%: альгинат натрия – 1-2; глицерин – 3,0-6,0; гидроксиапатит, модифицированный с соотношением Са/Р=1,67 – 5,0-30,0; бидистиллированная вода – остальное; причем, в качестве гидроксиапатита модифицированного используют синтетический гидроксиапатит, который модифицируют магнием (Mg2+) 0,67±0,02 мас.%, карбонатом (СО32-) 5,1±0,02 мас.%, и силикат-ионами (Si4+)-0,07±0,02 мас.%; а также к способу получения указанного материала, заключающемуся в получении раствора указанных компонентов. Группа изобретений обеспечивает расширение арсенала технических средств, используемых для целей эстетической косметологии и медицины. 2 н. и 4 з.п. ф-лы, 1 табл., 6 пр., 5 ил.
1. Композиционный материал для коррекции эстетических и возрастных изменений кожи, содержащий гель-носитель, отличающийся тем, что, дополнительно введен глицерин и гидроксиапатит, модифицированный при следующем соотношении компонентов в композиционном материале, мас.%:
альгинат натрия – 1,0-2,0;
глицерин – 3,0-6,0;
гидроксиапатит, модифицированный с соотношением Са/Р=1,67 – 5,0-30,0;
бидистиллированная вода – остальное,
причем, в качестве гидроксиапатита модифицированного используют синтетический гидроксиапатит, который модифицируют магнием (Mg2+) 0,67±0,02 мас.%, карбонатом (СО32-) 5,1±0,02 мас.%, и силикат-ионами (Si4+) 0,07±0,02 мас.%.
2. Способ получения композиционного материала по п. 1, заключающийся в получении раствора компонентов, отличающийся тем, что, в раствор компонентов вводят раствор альгината натрия, глицерин и гидроксиапатит модифицированный при следующем соотношении компонентов, мас.%:
альгинат натрия – 1,0-2,0;
глицерин – 3,0-6,0;
гидроксиапатит модифицированный с соотношением Са/Р=1,67 – 5,0-30,0
бидистиллированная вода – остальное,
причем, гидроксиапатит модифицированный получают путем модификации гидроксиапатита синтетического магнием (Mg2+) 0,67±0,02 мас.%, карбонатом (СО32-) 5,1±0,02 мас.%, и силикат-ионами (Si4+) 0,07±0,02 мас.%.
3. Способ получения композиционного материала по п. 2, отличающийся тем, что, модификацию гидроксиапатита магнием и карбонатом производят перед его осаждением путем введения растворов солей хлорида магния и солей карбоната натрия.
4. Способ получения композиционного материала по п. 2, отличающийся тем, что, модификацию гидроксиапатита силикат-ионами производят путем введения силиката калия в суспензию свежеосажденного гидроксиапатита, который затем фильтруют и многократно промывают дистиллированной водой.
5. Способ получения композиционного материала по п. 4, отличающийся тем, что, отфильтрованный гидроксиапатит сушат при ступенчатом подъеме температуры 80-150°С с шагом 30°С в течение 5 ч, затем прокаливают при 500°С в течение ч и при 800°С в течение 2 ч.
6. Способ получения композиционного материала по п. 2, отличающийся тем, что, при получении раствора компонентов вначале смешивают порошок синтетического модифицированного гидроксиапатита с раствором глицерина до состояния устойчивой суспензии и однородного распределения гидроксиапатита, затем добавляют гель альгината натрия и продолжают смешивание в течение 15-20 мин при средней скорости смешивания 100-150 об/мин.
| US 2010100179 A1, 22.04.2010 | |||
| СОСТАВ ДЛЯ ИНЪЕКЦИИ ПРИ ЭНДОПРОТЕЗИРОВАНИИ | 1992 |
|
RU2034465C1 |
| Государственная Фармакопея XIII, 2015, ФС.2.2.0020.15 | |||
| РАССКАЗОВА Л.А | |||
| Технология получения магний- и кремний-модифицированных гидроксиапатитов и биорезорбируемых композиционных материалов с использованием полимеров молочной кислоты // Дисс | |||
| к.т.н | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| CARDOSO D.A | |||
| et al | |||
| Effects | |||
Авторы
Даты
2020-06-25—Публикация
2019-09-27—Подача