Изобретение относится к микробиологии и биотехнологии и касается получения рекомбинантного штамма дрожжей Pichia pastoris, способного продуцировать ксиланазу.
Ксилан является основным структурным полисахаридом растительных клеткок и вторым после целлюлозы наиболее распространенным полисахаридом в природе [Biotech. Genet. Eng. Rev. 1995, 13, 100-131]. Это комплексный полисахарид, основная цепь которого состоит из β-(1-4) связанного ксилозного скелета с небольшим количеством β-(1-3) ответвлений [Macromol Rapid Commun., 2000, 21(9), 542-556. doi: 10.1002/1521-3927(20000601)21:9<542::AID-MARC542>3.0.CO;2-7].
Полная деградация ксилана требует комплекса ксиланолитических ферментов, включающих эндо-ксиланазу, ксилозидазу, глюкуронидазу, ацетилэстеразу и арабинофуранозидазу [Crit Rev Biotechnol, 2002, 22, 33-64, doi: 10.1080/073 88550290789450].
Основную роль в разрушении ксилана играет эндо-ксиланаза (эндо-1,4-β-ксиланаза, ЕС 3.2.1.8), которая катализирует случайный гидролиз ксилана до ксилололигосахаридов.
Ксиланазы широко используются в различных отраслях промышленности.
Так при кормопроизводстве введение ксиланаз уменьшает содержание некрахмальных полисахаридов, тем самым снижая вязкость корма в кишечнике животных и улучшая усвояемость и питательную ценность плохо разлагаемых кормов. [J. Anim. Sci., 2002, 80, 2773-2779; Br. Poult. Sci., 2003, 44, 60-66; Br. Poult. Sci., 2003, 44, 291-298]
Природными источниками ксиланаз являются различные микроорганизмы: бактерии, грибы, дрожжи и актиномицеты [FEMS Microbiology Reviews, 2005, 29 (1), 3-23].
Традиционно ферментные препараты, в состав которых входят ксиланазы, получают на основе нерекомбинантных или рекомбинантньгх штаммов грибов рода Trichoderma, Aspergillus или Penicillium. Однако грибные штаммы, помимо ксиланазы, продуцируют ряд других ферментов, относящихся к карбогидразам, а именно: целлюлазу, глюканазу, пектиназу и маннаназу, что не позволяет использовать их при производстве моноферментных препаратов.
Анаэробные грибы семейства Neocallimastigomycota, выделенные из рубца животных, производят комплекс гидролитических ферментов, позволяющих разрушать клеточную стенку растений, высвобождая питательные вещества [Appl. Environ. Microbiol, 2000, 66(9), 3807-3813]. Кроме того, целлюлолитические ферменты анаэробных грибов обладают значительно большей удельной активностью, чем у аэробных грибов [Annals of microbiology, 2008,58(1), 115-119].
Для данной группы микроорганизмов описаны все известные ферменты гидролиза целлюлоз и гемицеллюлоз клеточных стенок растений, таких как 0-глюканы, маннаны и ксиланы [Appl. Environ. Microbiol., 1989, 55(5), 1066-1073], что подтверждает высокий потенциал анаэробных грибов в качестве источника высокоэффективных гидролитических ферментов. Однако, анаэробные грибы не могут быть использованы в промышленном производстве ферментов из-за их строго анаэробного и медленного роста. Создание рекомбинантных штаммов-продуцентов ферментов из анаэробных грибов на основе высокоэффективных дрожжевых экспрессионных систем является актуальной задачей.
Наиболее перспективным является создание продуцентов ферментов на основе рекомбинантньгх штаммов метилотрофных дрожжей Pichia pastoris. При использовании несбраживаемых источников углерода (глицерина, метанола и т.п.) дрожжи Pichia pastoris способны к росту с образованием биомассы высокой плотности, что позволяет получать значительные количества гетерологичного белка [Appl. Microbiol. Biotechnol., 2000, 54(6), 741-750]. При этом процесс культивирования метилотрофных дрожжей достаточно прост, поскольку их рост не блокируется продуктами метаболизма [FEMS Microbiol. Rev., 2000, 24:45-66, doi: 10.1111/j.l574-6976.2000.tb00532.x].
Известны примеры создания продуцентов ксиланазы на основе дрожжей Pichia pastoris.
Показано [Protein Expression and Purification 57 (2008), 101-107], что ген reBlxA из Bacillus licheniformis, кодирующий ксиланазу А, эффективно экспрессируется в клетках дрожжей Pichia pastoris, при этом активность рекомбинантной ксиланазы в культуральной жидкости составляет 122.9 ед/мг.
Известны также рекомбинантные штаммы Pichia pastoris, продуцирующие ксиланазу из Streptomyces sp.FA1 [CN107142225A] и ксиланазу из Neocallimastix frontalis [CN104130951A].
В работе [Биотехнология, 2019, 35, 4, 24-32] описан ген xylP из Pyromyces finnis кодирующий фермент эндо-1,4-β-ксиланазу (ЕС 3.2.1.8).
Поскольку гены ксиланаз различного происхождения экспрессируются в дрожжах Pichia pastoris с различной эффективностью [Биотехнология, 2018, 34(4), 26-36] выбор генов, кодирующих ксиланазу и эффективно работающих в дрожжах Pichia pastoris. важен для конструирования эффективных продуцентов.
Задачей заявляемого изобретения является расширение арсенала рекомбинантньгх микроорганизмов, продуцирующих ксиланазу.
Задача решена путем конструирования штамма дрожжей Pichia pastoris 98 ВКПМ Y-4622, содержащего ген xylP, кодирующий эндо-1,4-β-ксиланазу из Pyromyces finnis и продуцирующего ксиланазу.
Рекомбинантный штамм Pichia pastoris XylP.fin получен путем интеграции экспрессионной кассеты, содержащей ген xylP из Pyromyces finnis, в состав хромосомы штамма Pichia pastoris ВКПМ Y-4392.
Штамм является продуцентом эндо-1,4-β-ксиланазы и депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) НИЦ «Курчатовский институт» - ГосНИИгенетика как Pichia pastoris XylP.fin ВКПМ Y-4622.
Культурально-морфологические характеристики заявляемого штамма:
При культивировании при температуре 28°С в течение 48 часов на агаризованной среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, агар - 2, вода - остальное) с добавлением глюкозы (2 мас. %) клетки имеют овальную форму, 3-4 мкм в диаметре. Клетки почкуются, при этом почкование истинное, многостороннее.
Истинного мицелия не образуют.
Споруляция происходит при инкубации культуры на агаризованной среде следующего состава (мас. %): хлорид калия - 1.0, ацетат натрия - 0.5, глюкоза - 1.0, агар - 2.0, вода - остальное. Аски имеют тетраэдрическую форму, включают 4 аскоспора.
На агаризованной среде YP с добавлением глюкозы (2 мас. %) колонии светло-бежевого цвета с ровным краем, матовой поверхностью, линзовидным профилем и пастообразной консистенцией.
При росте в жидкой среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, вода -остальное) с добавлением глюкозы (2 мас. %), при 28°С в течение 24 ч культивирования - жидкость мутная, осадок белый, коагуляции не наблюдается, пристеночных пленок не образует.
Физиолого-биохимические признаки:
Штамм способен к росту как в аэробных, так и в анаэробных условиях.
В качестве единственного источника углерода способен использовать метанол, этанол, глюкозу, глицерин, лактат, сукцинат, не способен ассимилировать мальтозу, сахарозу, ацетат, крахмал, лактозу.
При культивировании в присутствии метанола штамм способен синтезировать ксиланазу.
Изобретение проиллюстрировано следующими фигурами.
Фиг. 1 Экспрессионная кассета 1
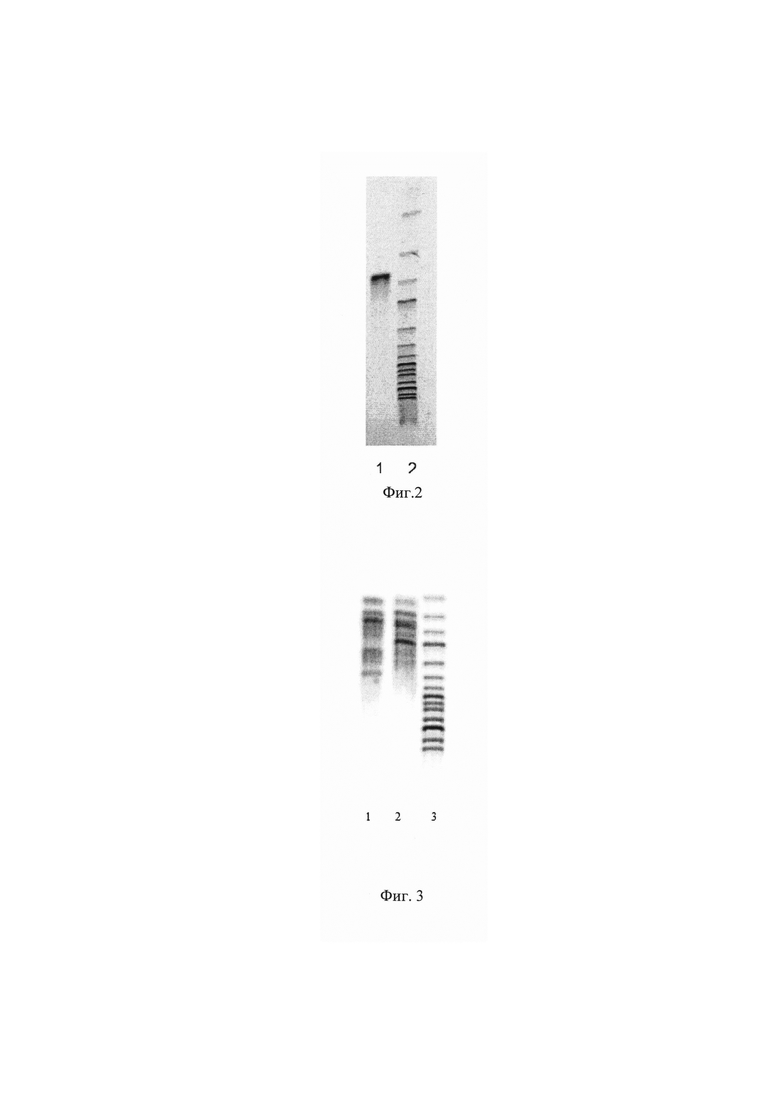
Фиг. 2 Электрофорез гена xylP Pyromyces finnis.
Фиг. 3 Фингерпринт штамма Pichia pastoris ВКПМ XylP.fin Y-4622
Изобретение подтверждено следующими примерами.
Пример 1. Конструирование заявляемого штамма.
Синтетическую последовательность гена xylP встраивают в состав интегративной экспрессионной кассеты методом "фьюжн-пцр" [Gene., 1989, 15, 77(1), 61-68.].
Полученную последовательность ДНК встраивают в состав экспрессионной кассеты 1 (фиг. 1), в состав которой входят следующие генетические элементы:
1. Ген xylP Pyromyces finnis, встроенный в единую рамку считывания с нуклеотидной последовательностью сигнального пептида α-фактора, под контролем АОХ1 промотора;
2. Терминатор транскрипции ТТАОХ1;
3. Дрожжевой селективный маркер kan, фланкированный сайтами lox 66 и lox 71, под контролем дрожжевого TEF промотора и обуславливающий у дрожжей Pichia pastoris устойчивость к антибиотику генетицину (G418) [Nature Biotechnology. - 1994. - Т. 12. - №. 2. - С. 181];
4. Область интеграции - нуклеотидная последовательность гена АОХ2.
Указанную интегративную экспрессионную кассету трансформируют в штамм Pichia pastoris ВКПМ Y-4622, полученный на основе штамма Pichia pastoris DSMZ 70877 интеграцией в хромосому кассеты Pcup-cre, состоящей из гена cre, кодирующего рекомбиназу бактериофага Р1 под контролем Pcup промотора из Saccharomyces cerevisiae.
Штамм Pichia pastoris ВКПМ Y-4622 предварительно выращивают в жидкой питательной среде YP с добавлением глюкозы (2 мас. %) до концентрации 1×108 клеток на 1 мл. Клетки центрифугируют, промывают в ледяной стерильной воде, а затем в ледяном растворе 1М сорбитола. Затем клетки инкубируют в 25 мМ растворе дитиотрейтола в течение 15 минут и промывают в ледяном растворе 1М сорбитола. Обработанные таким образом клетки ресуспендируют в ледяном растворе 1 М сорбитола в концентрации 1-5×109 клеток на 1 мл. Аликвоту, объемом 40 мкл клеточной суспензии, переносят в охлажденный эппендорф, добавляют 400 нг ДНК экспрессионной интеграционной кассеты, и инкубируют во льду 5 минут. Смесь клеток и ДНК переносят в предварительно охлажденную кювету для электропорации. Электропорацию проводят при следующих условиях: 1,5 кВ, 400 Ом, 25uF. После порации добавляют 1 мл ледяного раствора 1М сорбитола.
Селекцию трансформантов ведут на агаризованной среде YP с добавлением глюкозы (2 мас. %) в течение 5 суток при температуре 30°С. В качестве селективного агента добавляют антибиотик G418 в количестве 500 мкг/мл.
Для отбора наиболее продуктивных трансформантов проводят их культивирование в жидкой ферментационной питательной среде YP с добавлением метанола (3 мас. %) в 96-луночных планшетах при 30°С в течение 72 ч на качалке (250 об/мин). В качестве контроля используют штамм Pichia pastoris Y-4622.
Определение активности ксиланазы в культуральной жидкости проводят с использованием динитросалициловой кислоты (ДНС - метод) [Anal. Chem., 1959, 31 (3), 426-428] в 96-луночном планшете следующим образом: в каждой лунке смешивают 25 мкл 1% раствора субстрата ксилана березы в 0,5 М ацетатном буфере (рН 6) и 25 мкл культуральной жидкости. Инкубацию проводят при 50°С 10 минут, после чего добавляют в лунку 50 мкл раствора ДНС. Планшет прогревают при 99°С 10 минут и измеряют оптическую плотность окрашенного раствора при длине волны 546 нм. В качестве стандарта используют раствор глюкозы.
По результатам ферментации отбирают наиболее продуктивный трансформант №98, который при культивировании в планшете синтезирует ксиланазу в количестве 534 ед/мл культуральной жидкости.
Для выщепления маркерного гена kanMX из экспрессионной кассеты, интегрированной в хромосому трансформанта №98, проводят индукцию гена cre, кодирующего рекомбиназу бактериофага Р1, встроенного в хромосому штамма Pichia pastoris Y-4622 (Mut+, INS Pcup-cre) и находящегося под контролем промотора Pcup.Индукция происходит в присутствии ионов меди. Для этого клетки трансформанта №378 выращивают в жидкой питательной среде YP с добавлением глюкозы (2 мас. %). до концентрации 1×108 клеток на 1 мл, после чего добавляют раствор сульфата меди до концентрации 0,3 М, инкубируют в течении 3 часов, после чего клетки высевают на агаризованную питательную среду YP с добавлением глюкозы (2 мас. %). Отбирают колонии, не способные к росту в присутствии антибиотика G418.
Отобранный трансформант №98 с выщепленным маркерным геном kanMX, способный к синтезу фермента эндо-1,4-β-ксиланазы Pyromyces finnis, депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) НИЦ «Курчатовский институт» - ГосНИИгенетика как Pichia pastoris XylP.fin ВКПМ Y-4622.
Наличие в хромосоме штамма вставки гена xylP Pyromyces finnis подтверждают методом полимеразной цепной реакции (ПЦР), для чего используют хромосомальную ДНК, выделенную из клеток штамма Pichia pastoris XylP.fin ВКПМ Y-4622 и специфические праймеры XylPfin-f и XylPfin-r
XylPftn-f 5'-CAATCTTTCTGTTCTTCTGCTTCT-3',
XylPffin-r 5'-TTAGATGTAAACCTTAGCGTATGG-3'
Режим реакции ПЦР:
95°С - 3 мин - 1 цикл
30 циклов:
95°С - 30 сек.
54°С - 30 сек.
72°С - 60 сек.
72°С - 5 мин. - 1 цикл
Для контроля величины амплифицированного фрагмента ДНК при электрофорезе использован молекулярный маркер GeneRuler 1 kb DNA Ladder (Fermentas) (линия 2, фиг. 2, размер фрагментов снизу вверх 10000, 8000, 6000, 5000, 4000, 3500, 3000, 2500, 2000, 1500, 1000, 750, 500, 250 п.н.). Наработка фрагмента ДНК размером 672 п.н. (линия 1 фиг. 2) свидетельствует о присутствии в хромосоме штамма вставки гена xylP Pyromyces finnis
Результаты ПЦР-фингерпринта [Applied and Environmental Microbiology, Oct, 1999, 4351-4356] штамма Pichia pastoris XylP.fin ВКПМ Y-4622 представлены на фиг 3.
Фингерпринт проведен путем полимеразной цепной реакции с использованием неспецифических праймеров М13 (линия 1 фиг. 3) и 1254 (линия 2 фиг. 3).
Праймер М13 gagggtggcggttct
режим реакции:
1 цикл
95°С - 3 мин.
39 циклов
95°С - 30 сек.
45°С - 30 сек.
72°С - 2 мин.
1 цикл
72°С - 5 мин
Праймер 1254 ccgcagccaa
режим реакции:
1 цикл
95°С - 3 мин.
39 циклов
95°С - 30 сек.
48°С - 30 сек.
72°С - 1 мин.
1 цикл
72°С - 5 мин
Для контроля величины фрагментов ДНК при электрофорезе использован молекулярный маркер 1kb DNA GeneRuler (Fermentas) (линия 3, фиг. 3 размер фрагментов снизу вверх 10000, 8000, 6000, 5000, 4000, 3500, 3000, 2500, 2000, 1500, 1000, 750, 500, 250 п.н.).
Пример 2. Продукция ксиланазы заявляемым штаммом.
Посевную культуру выращивают в пробирках (50 мл) с 10 мл жидкой питательной среды YP с добавлением глюкозы (2 мас. %) при 30°С в течение 24 ч на качалке с 250 об/мин. Посев ферментационной среды осуществляют в соотношении 1/10.
Ферментацию проводят при 30°С на качалке (250 об/мин) в питательной среде состава (мас. %): дрожжевой экстракт - 0,5, пептон - 1, вода - остальное с добавлением глюкозы (1 мас. %) в пробирках (50 мл) с рабочим объемом 5 мл. Через 18 часов добавляют метанол (1 мас. %) Ферментацию продолжают в течение 72 часов, добавляя метанол (1 мас. %) через каждые 24 часа. После окончания ферментации определяют количество фермента ксиланазы в культуральной жидкости с использованием ДНС метода [Anal. Chem., 1959, 31 (3), 426-428].
Через 72 часа ферментации количество фермента составила 1916 ед/мл культуральной жидкости.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм дрожжей Pichia pastoris, продуцирующий ксиланазу из Paenibacillus brasilensis | 2019 |
|
RU2728243C1 |
| Рекомбинантный штамм дрожжей Pichia pastoris - продуцент ксиланазы | 2018 |
|
RU2701308C1 |
| Трансформант дрожжей Pichia pastoris, продуцирующий эндо-1,4-β-ксиланазу из Paenibacillus brasilensis | 2019 |
|
RU2728033C1 |
| Трансформант дрожжей Pichia pastoris, продуцирующий ксиланазу | 2019 |
|
RU2714113C1 |
| Штамм дрожжей Pichia pastoris - продуцент ксиланазы | 2018 |
|
RU2701642C1 |
| Рекомбинантный штамм дрожжей Pichia pastoris - продуцент бета-глюканазы | 2018 |
|
RU2701494C1 |
| Рекомбинантный штамм дрожжей Komagataella kurtzmanii - продуцент бета-глюканазы из Paenibacillus jamilae | 2019 |
|
RU2730577C1 |
| Рекомбинантный штамм дрожжей Komagataella kurtzmanii - продуцент бета-глюканазы | 2018 |
|
RU2701640C1 |
| Дрожжи Komagataella kurtzmanii - рекомбинантный продуцент бета-глюканазы | 2019 |
|
RU2736440C1 |
| Штамм дрожжей Komagataella kurtzmanii, продуцирующий бета-глюканазу из Bacillus pumilus и бета-глюканазу из Paenibacillus jamilae | 2019 |
|
RU2736441C1 |

Изобретение относится к микробиологии и биотехнологии. Предложен рекомбинантный штамм дрожжей Pichia pastoris, способный продуцировать ксиланазу. Штамм дрожжей Pichia pastoris содержит ген xylP, кодирующий эндо-1,4-β-ксиланазу из Pyromyces finnis. Указанный штамм депонирован под номером ВКПМ Y-4622. Изобретение позволяет расширить арсенал рекомбинантных микроорганизмов, продуцирующих ксиланазу. 3 ил., 2 пр.
Рекомбинантный штамм дрожжей Pichia pastoris ВКПМ Y-4622, содержащий ген xylP, кодирующий эндо-1,4-β-ксиланазу из Pyromyces finnis - продуцент ксиланазы.
| КАЛИНИНА А.Н | |||
| И ДР | |||
| Экспрессия гена ксиланазы из Pyromyces finnis в Pichia pastoris и характеристика рекомбинантного белка | |||
| Биотехнология, 2019, Т.35, N 4, С.24-32 | |||
| CN 107142225 A, 08.09.2017 | |||
| CN 104388451 A, 04.03.2015 | |||
| КАЛИНИНА А.Н | |||
| И ДР | |||
| Сравнение ксиланаз различного происхождения в экспрессионной системе Pichia pastoris: экспрессия, |
Авторы
Даты
2020-07-02—Публикация
2019-09-25—Подача