Настоящее изобретение относится к способу пептидного синтеза в растворителе, выбранном из группы, состоящей из воды, спирта и смеси воды и спирта, к использованным в этом способе соединениям и к устройству для осуществления способа твердофазного пептидного синтеза.
Уровень техники
Пептиды являются соединенными цепями аминокислот и представляют собой предшественников белков. Пептиды и белки являются элементарными составляющими всех живых систем и вовлечены в различные процессы жизни. Они имеют множество применений в медицине и биологических науках. Как следствие этого, возможность синтезировать пептиды и белки имеет большое значение для жизни человека.
Таким образом, синтетическое производство пептидов представляет существенный интерес. Пептиды синтезируются путем присоединения карбоксильной группы (С-конца) одной аминокислоты к аминогруппе, или N-концу, другой. Твердофазный пептидный синтез (ТФПС) был предложен Merrifield с соавторами в 1963 году с тем, чтобы преодолеть проблемы промежуточной очистки, связанные со сборкой пептидов в растворе (см. Stewart и Young, "Solid Phase Peptide Synthesis" (Pierce Chemical Co., 2-е изд., 1984), Chan и White, Fmoc Solid Phase Peptide Synthesis: A Practical Approach (Oxford University Press, 2000)). При твердофазном синтезе аминокислоты последовательно присоединяются, что приводит к образованию пептида, обладающего желаемой последовательностью, тогда как С-конец прикреплен к нерастворимой полимерной подложке (твердая фаза). Как только желаемая последовательность собрана, пептид отщепляют от твердой подложки.
Эта синтетическая схема требует защиты α-аминогруппы поступающей аминокислоты для того, чтобы избежать самополимеризации. Стандартными защитными группами для α-аминофункций являются кислото-лабильная трет-бутилоксикарбонильная (Воc) группа, основно-лабильная флуоренилметилоксикарбонильная (Fmoc) группа и аллилоксикарбонильная (Alloc) группа, которую удаляют с помощью Pd-катализа в нейтральных условиях в присутствии PhSiH3 в качестве акцептора аллильной системы.
Способы твердофазного пептидного синтеза в соответствии с любой из трех вышеупомянутых схем защиты α-аминогрупп обычно требуют дополнительной защиты реакционноспособных боковых цепей составляющих аминокислот от нежелательных химических трансформаций. Поэтому необходимо, чтобы данные защитные группы являлись устойчивыми к агентам, используемым во время цикла конденсации. Кроме того, связь растущего пептида с твердофазной подложкой должна быть стабильна по отношению к условиям снятия защиты с α-аминогрупп и сборке цепи.
В случае основанной на Fmoc защиты α-аминогрупп группы боковых цепей должны быть устойчивыми к основным реагентам, используемым для удаления Fmoc-фрагмента. Защитные группы боковых цепей, как правило, удаляют мягкими кислотными реагентами после того, как пептидная цепь собрана. Эти защитные группы боковых цепей обычно отщепляют с помощью безводного HF (фтороводород), трифторметансульфоновой кислоты или трифторуксусной кислоты (ТФК) после того, как желаемый пептид собран.
Процедуру сборки пептида обычно осуществляют в полярных апротонных органических растворителях, таких как диметилформамид (DMF), N-метилпирролидон (NMP), диметилсульфоксид (DMSO) и дихлорметан (DCM), или смеси данных органических растворителей из-за сильного гидрофобного характера Fmoc- и Воc- защитных групп α-аминогруппы, нерастворимых в воде и часто используемых в ТФПС. Кроме того, широко используемые в ТФПС защитные группы боковых цепей обычно гидрофобны и делают аминокислоту нерастворимой в воде.
Подходы ТФПС, использующие Fmoc- и Вос-защиту, широко используются, однако испытывают нужду в вышеуказанных органических растворителях, являющихся дорогостоящими и токсичными. DMF, например, обладает значимыми рисками для здоровья и окружающей среды, связан с раком у человека и предположительно вызывает пороки развития. Следовательно, применение этих токсических растворителей требует специального технического оснащения и предосторожностей, таких как, например, проведение реакции в вытяжном шкафу и осуществление высокоспециализированным персоналом. Кроме того, утилизация использованного растворителя проблематична и дорога. В результате ТФПС с применением органических растворителей дорог и ограничен специализированными лабораториями со специальным оборудованием для органического химического синтеза.
Соответственно, во избежание вышеупомянутых проблем чрезвычайно актуальна схема пептидного синтеза, ТФПС в частности, в водной среде.
В попытке преодолеть данную проблему, Hojo с соавторами предложили применение водорастворимых защитных групп (Chem. Pharm. Bull. 2004, 52, 422-427 и Tetrahedron Lett. 2004, 45, 9293). С этой целью они разработали несколько защитных групп, среди них 2-(фенил(метил)сульфонил)этилоксикарбонилтетратиоборатная (Pms), этансульфонилэтоксикарбонильная (Esc) и 2-(4-сульфофенилсульфонил)этоксикарбонильная (Sps). В WO 2013115813 А1 СЕМ Corporation заявила снятие защиты с α,β-ненасыщенных сульфонов в воде или водных системах и их использование в ТФПС в водной среде.
Тем не менее, вышеупомянутые защитные группы обладают несколькими основными недостатками, которыми являются ограниченная стабильность (например, для Pms), умеренная растворимость (Esc) и их дорогой и сложный синтез, а также ограниченная сфера применения, которая, например, исключает цистеин и метионин, поскольку происходит автоокисление их серных групп (Sps). В качестве вторичной причины данные защитные группы α-аминогруппы не проявляют селективной абсорбции, УФ (ультрафиолетовых) или флуоресцентных сигналов, которые могут быть использованы для определения количества присоединенных аминокислот или для обеспечения индикации степени, которой достигло снятие защиты. В отличие от общепринятой Fmoc-группы, Pms и Esc не могут быть отслежены с помощью общепринятого УФ-наблюдения. За Sps можно наблюдать с помощью УФ, однако трудный и дорогостоящий синтез Sps обычно затрудняет применение группы. В результате повышенная растворимость данных соединений в воде, в целом, не является достаточным решением проблем ТФПС в водной среде.
Таким образом, целью изобретения являют создание усовершенствованного способа и устройства для водосовместимых реакционных систем для пептидного синтеза в целом и твердофазного пептидного синтеза в частности.
Описание изобретения
В варианте осуществления настоящее изобретение относится к защитному агенту, подходящему для образования защитных групп на функциональных группах пептида и/или аминокислоты в ходе пептидного синтеза в водной среде, где защищаемую функциональную группу предпочтительно выбирают из аминной, спиртовой, тиольной и карбоксильной групп, где защитный агент включает
I. структуру основной цепи,
II. по меньшей мере одну функциональную группу, повышающую водорастворимость, и
III. по меньшей мере одну реакционноспособную группу,
- где структура основной цепи включает фрагмент, выбранный из группы, состоящей из 9-метилфлуорена, трет-бутана и/или моно-, ди- или трифенилметана, предпочтительно структура основной цепи состоит из такого фрагмента,
- где функциональную группу, повышающую водорастворимость, выбирают из группы, состоящей из SO3-, РО32-, N(CH3)2, N(CH3)3+, CN, OSO3- сложного эфира, ОРO32- сложного эфира и их комбинаций, и
- где функциональная группа, повышающая водорастворимость, и реакционноспособная группа присоединены к структуре основной цепи по меньшей мере одной ковалентной связью.
Настоящее изобретение также относится к применению указанных соединений для защиты функциональной группы в химической реакции. В предпочтительных вариантах осуществления агенты используют для образования защитных групп на функциональных группах пептида и/или аминокислоты в ходе пептидного синтеза в водной среде. Предпочтительно, защищаемая функциональная группа предпочтительно выбрана из аминной, спиртовой, тиольной и карбоксильной групп.
В предпочтительных вариантах осуществления функциональную группу, повышающую водорастворимость, выбирают из заряженных функциональных групп SO3-, РO32-, OSO3- сложного эфира, ОРO32- сложного эфира и N(CH3)3+. Использование заряженных функциональных групп в качестве функциональной группы, повышающей водорастворимость, признано более эффективным, чем использование незаряженных функциональных групп. Защитный агент может включать одну или более функциональных групп, повышающих водорастворимость, в предпочтительных вариантах осуществления защитный агент включает более одной функциональной группы, повышающей водорастворимость. В дополнительных предпочтительных вариантах осуществления защитный агент включает по меньшей мере две функциональные группы, повышающие водорастворимость. В других предпочтительных вариантах осуществления защитный агент включает от 1 до 8, от 2 до 7, или от 3 до 4 функциональных групп, повышающих водорастворимость. Авторы обнаружили, что может оказаться полезным иметь в молекуле защитного агента более одной функциональной группы, повышающей водорастворимость, так как водорастворимость повышается в большей степени. В вариантах осуществления, где структура основной цепи представляет собой трет-бутан или фенилметан, может быть достаточно одной функциональной группы, повышающей водорастворимость.
В предпочтительных вариантах осуществления настоящего изобретения защитный агент включает функциональные группы, повышающие водорастворимость, одного типа, в частности, типа SO3-. В альтернативных вариантах осуществления защитный агент включает разные типы функциональных групп, повышающих водорастворимость. Если функциональная группа, повышающая водорастворимость, представляет собой SO3- группу, предпочтительно, чтобы защитный агент включал по меньшей мере 2 таких функциональных группы. Синтез защитного агента может быть более эффективным и легким, если все функциональные группы, повышающие водорастворимость, имеют один тип.
Структура основной цепи включает фрагмент, выбранный из группы, состоящей из 9-метилфлуорена, трет-бутана и/или моно-, ди- или трифенилметана. В предпочтительных вариантах осуществления структуру основной цепи выбирают из 9-метилфлуорена и трет-бутана.
Реакционноспособная группа подходит, т.е. обладает требуемой химической активностью, для того, чтобы вступать в химическую реакцию с защищаемой функциональной группой. Ее предпочтительно выбирают из группы, состоящей из оксикарбонилгалогенидной, оксикарбонил-О-сукцинимидной, сложного эфира оксикарбонила Oxyma (этил(гидроксиимино)цианоацетат), оксикарбонилангидридной, галогенидной, оксиметилгалогенидной, гидроксильной и тиольной групп. Когда структура основной цепи представляет собой 9-метилфлуорен, реакционноспособную группу предпочтительно выбирают из оксикарбонилгалогенидной, сложного эфира оксикарбонила Oxyma и оксикарбонил-О-сукцинимидной. Когда структура основной цепи представляет собой трет-бутан, реакционноспособную группу предпочтительно выбирают из гидроксильной, галогенидной, тиольной, оксикарбонил-О-сукцинимидной и оксикарбонилангидридной. Когда структуру основной цепи выбирают из моно-, ди- или трифенилметана, реакционноспособную группу предпочтительно выбирают из галогенидной, оксиметилгалогенидной и оксикарбонилгалогенидной.
Предпочтительные защитные агенты по настоящему изобретению, имеющие 9-метилфлуореновую структуру основной цепи, могут быть представлены следующей общей формулой 1:
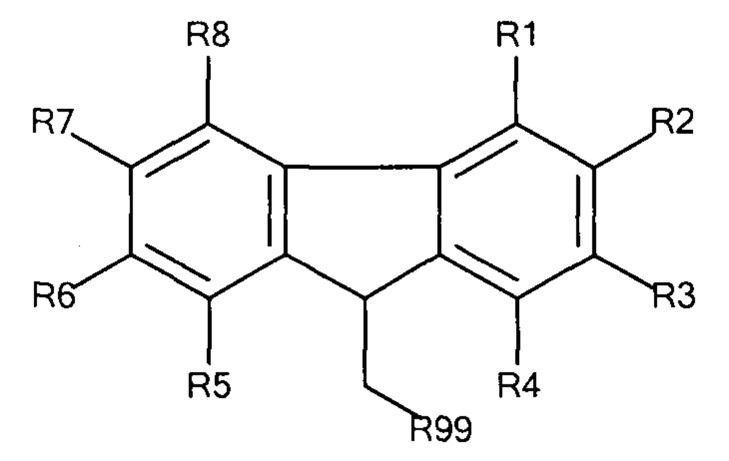
Общая формула 1
где R1 - R8 независимо выбирают из водорода, SO3-, РО32-, N(CH3)2, N(CH3)3+, OSO3- сложного эфира, ОРO32- сложного эфира и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два из R1 - R8 выбирают из SO3-, РO32-, N(CH3)2, N(CH3)3+, OSO3- сложного эфира, ОРO32- сложного эфира и CN. В предпочтительных вариантах осуществления все из R1 - R8, не представляющие собой SO3-, РO32-, N(CH3)2, N(CH3)3+, OSO3- сложный эфир, ОРO32- сложный эфир или CN, представляют собой водород.
R99 предпочтительно выбирают из группы, состоящей из оксикарбонилгалогенидной, оксикарбонил-О-сукцинимидной, сложного эфира оксикарбонила Oxyma, оксикарбонилангидридной, галогенидной, оксиметилгалогенидной, гидроксильной и тиольной групп, где R99 предпочтительно выбирают из оксикарбонилгалогенида, сложного эфира оксикарбонила Oxyma и оксикарбонил-О-сукцинимида.
В предпочтительных вариантах осуществления R2 и R7 выбирают из SO3-, РO32-, N(CH3)2, N(CH3)3+, OSO3- сложного эфира, ОРO32- сложного эфира и CN, в частности R2 и R7 представляют собой SO3-. Предпочтительно, R1, R3 - R6 и R8 представляют собой водород.
В предпочтительных вариантах осуществления R3 и R6 выбирают из SO3-, РO32-, N(CH3)2, N(CH3)3+, OSO3- сложного эфира, ОРO32- сложного эфира и CN, в частности R3 и R6 представляют собой SO3-. Предпочтительно, R1, R2, R4, R5, R7 и R8 представляют собой водород.
В предпочтительных вариантах осуществления R2 и R6 выбирают из SO3-, РO32-, N(CH3)2, N(CH3)3+, OSO3- сложного эфира, ОРO32- сложного эфира и CN, в частности R2 и R6 представляют собой SO3-. Предпочтительно, R1, R3, R4, R5, R7 и R8 представляют собой водород.
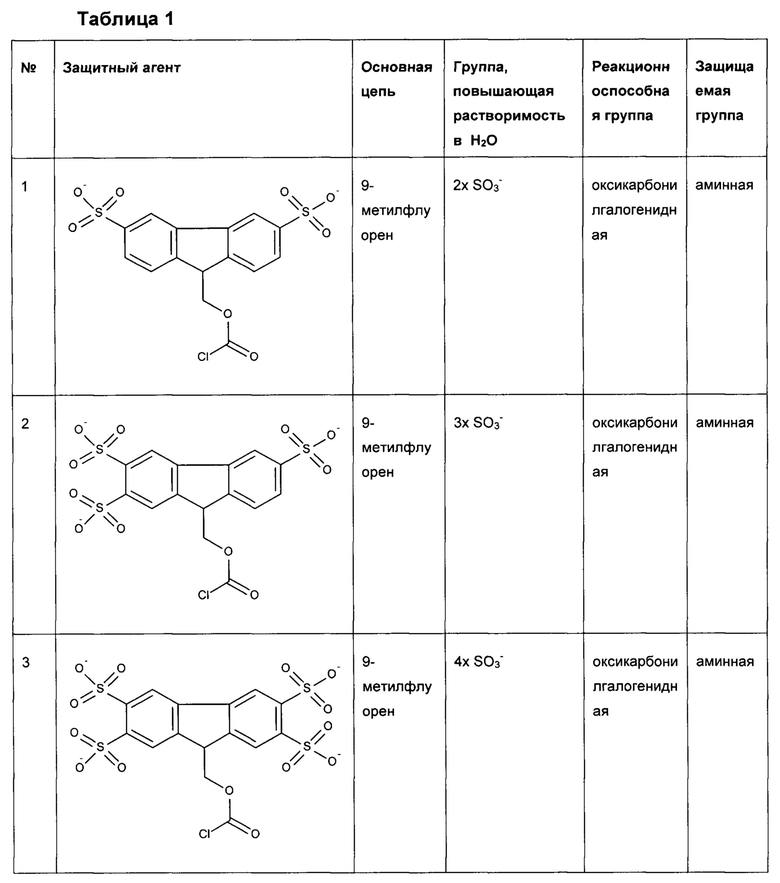
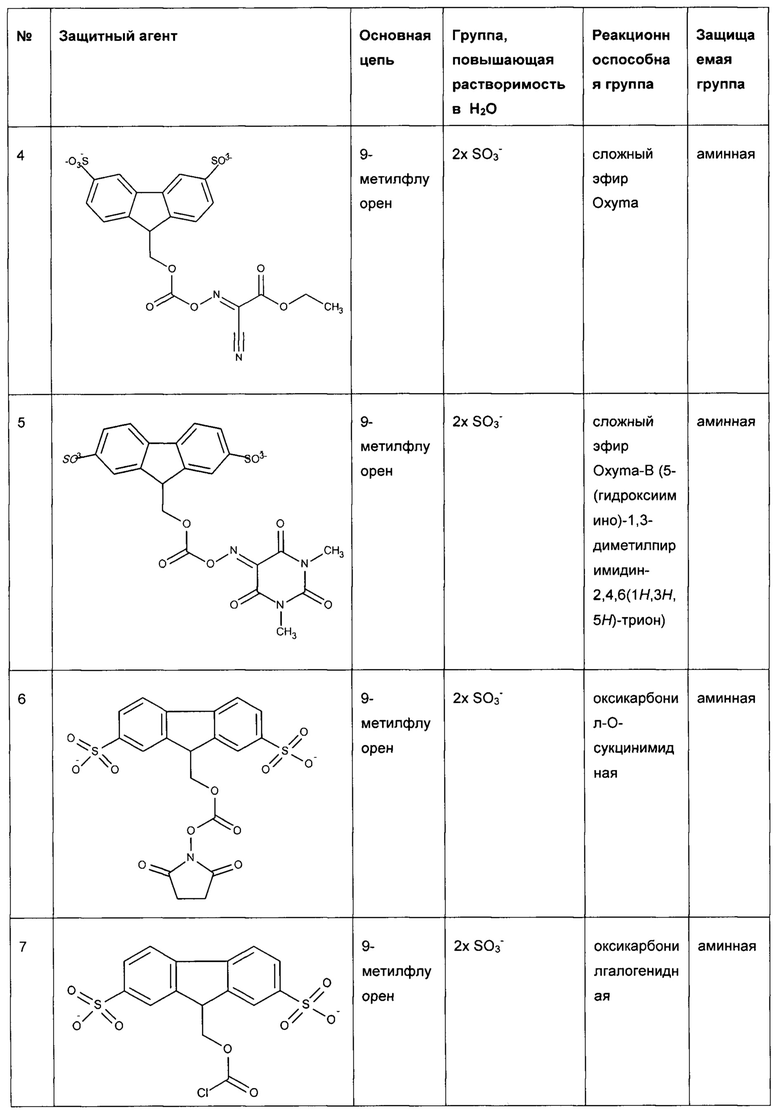
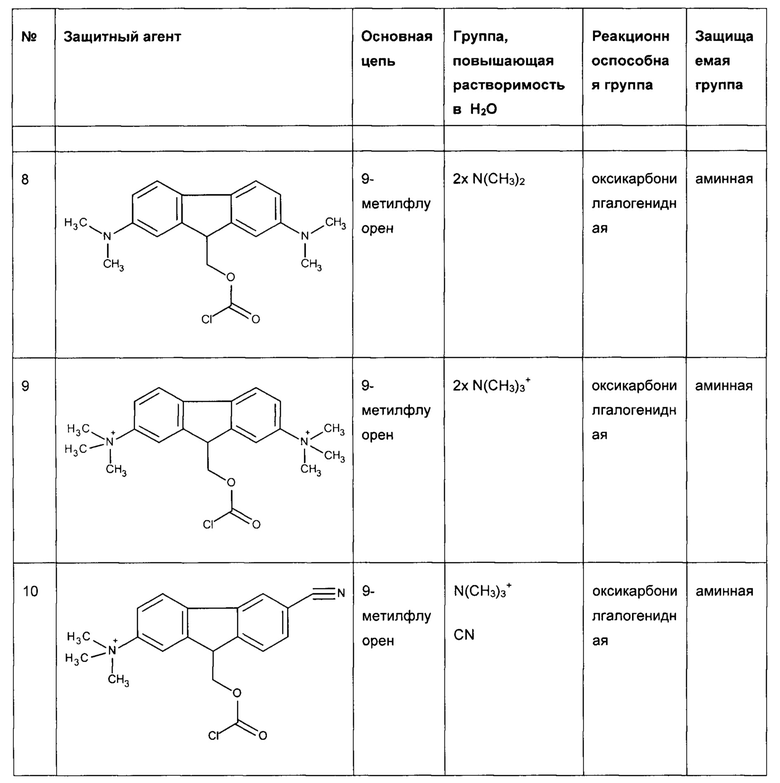
Предпочтительные защитные агенты по настоящему изобретению, имеющие 9-метилфлуореновую структуру основной цепи, приведены в следующей таблице 1. Соединения, перечисленные в таблице, ни в коей мере не ограничивают объем настоящего изобретения. Они представляют собой иллюстративные и предпочтительные защитные агенты согласно настоящему изобретению.
Предпочтительные защитные агенты по настоящему изобретению, имеющие трет-бутановую структуру основной цепи, могут быть представлены следующей общей формулой 2:
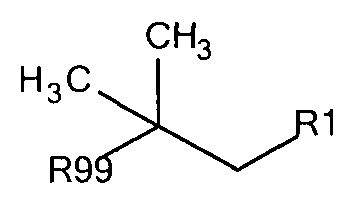
Общая формула 2
где R1 выбирают из SO3-, РО32-, N(СН3)2, N(CH3)3+, OSO3- сложного эфира, ОРО32- сложного эфира и CN. В предпочтительных вариантах осуществления R1 представляет собой SO3-. R99 предпочтительно выбирают из группы, состоящей из оксикарбонилгалогенидной, оксикарбонил-О-сукцинимидной, оксикарбонилангидридной, галогенидной, оксиметилгалогенидной, гидроксильной и тиольной групп, где R99 более предпочтительно выбирают из гидроксида, галогенида, тиола, оксикарбонил-О-сукцинимида и оксикарбонилангидрида.
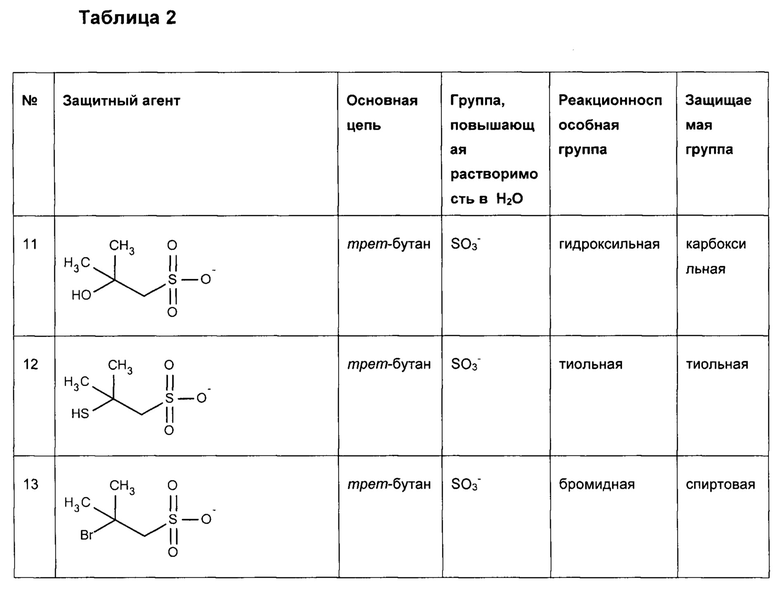
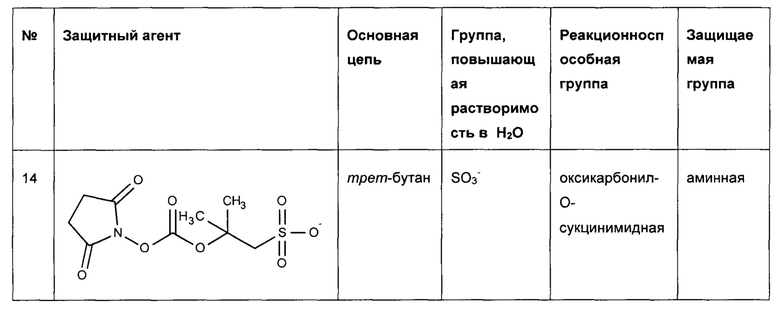
Предпочтительные защитные агенты по настоящему изобретению, имеющие трет-бутановую структуру основной цепи, приведены в следующей таблице 2. Соединения, перечисленные таблице, ни в коем случае не ограничивают объем настоящего изобретения. Они представляют собой иллюстративные и предпочтительные защитные агенты согласно настоящему изобретению.
Предпочтительные защитные агенты по настоящему изобретению, имеющие моно-, ди- или трифенилметановую структуру основной цепи, могут быть представлены следующей общей формулой 3, 4 или 5, соответственно:
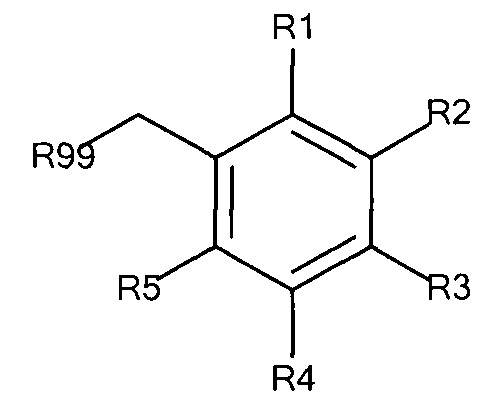
Общая формула 3
где R1 - R5 независимо выбирают из водорода, SO3-, РO32-, N(CH3)2, N(CH3)3+, OSO3- сложного эфира, ОРO32- сложного эфира и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два из R1 - R5 выбирают из SO3-, РO32-, N(CH3)2, N(CH3)3+, OSO3- сложного эфира, ОРO32- сложного эфира и CN. В предпочтительных вариантах осуществления все из R1 - R5, не представляющие собой SO3-, РO32-, N(CH3)2, N(CH3)3+, OSO3- сложный эфир, ОРO32- сложный эфир или CN, представляют собой водород.
R99 предпочтительно выбирают из группы, состоящей из оксикарбонилгалогенидной, сложного эфира оксикарбонила Oxyma, оксикарбонил-О-сукцинимидной, оксикарбонилангидридной, галогенидной, оксиметилгалогенидной, гидроксильной и тиольной групп, где R99 более предпочтительно выбирают из галогенида, оксиметилгалогенида и оксикарбонилгалогенида.
В предпочтительных вариантах осуществления R3 выбирают из SO3-, РO32-, N(CH3)2, N(CH3)3+, OSO3- сложного эфира, ОРO32- сложного эфира и CN, в частности R3 представляет собой SO3-. Предпочтительно, R1, R2, R4 и R5 представляют собой водород.
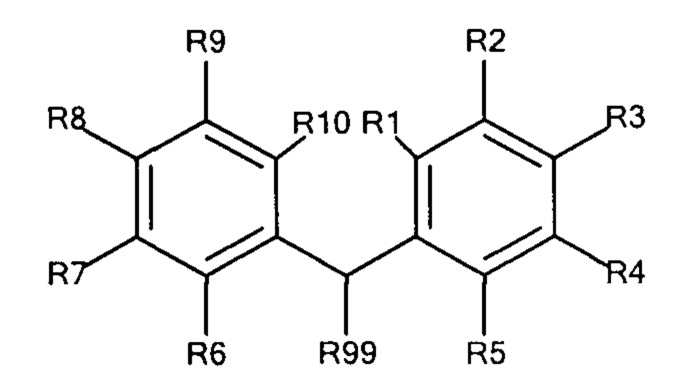
Общая формула 4
где R1 - R10 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два из R1 - R10 выбирают из SO3-, РO32-, OSO3- сложного эфира, ОРO32- сложного эфира, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R10, не представляющие собой SO3-, РO32-, N(CH3)2, OSO3- сложный эфир, ОРO32- сложный эфир, N(CH3)3+ или CN, представляют собой водород.
R99 предпочтительно выбирают из группы, состоящей из оксикарбонилгалогенидной, сложного эфира оксикарбонила Oxyma, оксикарбонил-О-сукцинимидной, оксикарбонилангидридной, галогенидной, оксиметилгалогенидной, гидроксильной и тиольной групп, где R99 более предпочтительно выбирают из галогенида, оксиметилгалогенида и оксикарбонилгалогенида.
В предпочтительных вариантах осуществления R3 и R8 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN, в частности R3 и R8 выбирают из SO3-. Предпочтительно, R1, R2, R4 - R7, R9 и R10 представляют собой водород.
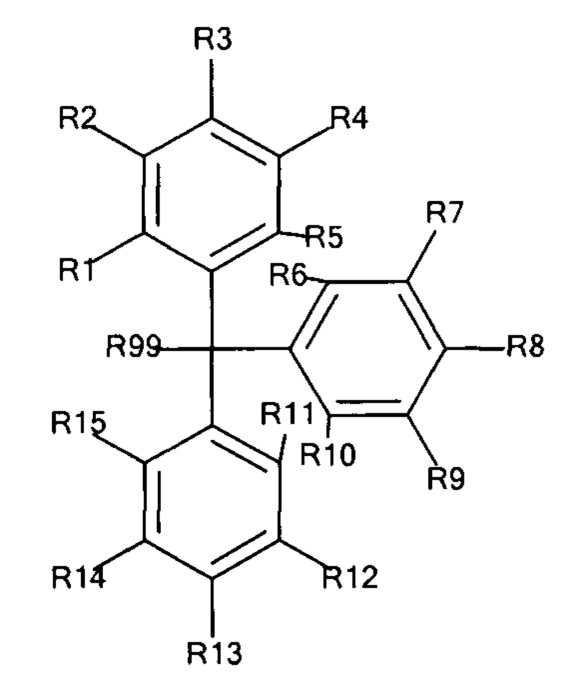
Общая формула 5
где R1 - R15 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два, наиболее предпочтительно по меньшей мере три из R1 - R15 выбирают из SO3-, РО32-, OSO3- сложного эфира, ОРO32- сложного эфира, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R15, не представляющие собой SO3-, РО32-, N(CH3)2, OSO3- сложный эфир, ОРО32- сложный эфир, N(CH3)3+ или CN, представляют собой водород.
R99 предпочтительно выбирают из группы, состоящей из оксикарбонилгалогенидной, сложного эфира оксикарбонила Oxyma, оксикарбонил-О-сукцинимидной, оксикарбонилангидридной, галогенидной, оксиметилгалогенидной, гидроксильной и тиольной групп, где R99 более предпочтительно выбирают из галогенида, оксиметилгалогенида и оксикарбонилгалогенида. В особенно предпочтительном варианте осуществления R99 не представляет собой галогенид, когда R3, R8 и R13 представляют собой SO3-. В другом особенно предпочтительном варианте осуществления R99 не представляет собой хлорид, когда R3, R8 и R13 представляют собой SO3-. В предпочтительном варианте осуществления R99 предпочтительно выбирают из группы, состоящей из оксикарбонилгалогенидной, сложного эфира оксикарбонила Oxyma, оксикарбонил-О-сукцинимидной, оксикарбонилангидридной, оксиметилгалогенидной, гидроксильной и тиольной групп. В особенно предпочтительном варианте осуществления R99 не представляет собой галогенид, в частности не представляет собой хлорид.
В предпочтительных вариантах осуществления R3, R8 и R13 выбирают из SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN, в частности R3, R8 и R13 представляют собой SO3-. Предпочтительно, R1, R2, R4 - R7, R9 - R12, R14 и R15 представляют собой водород.
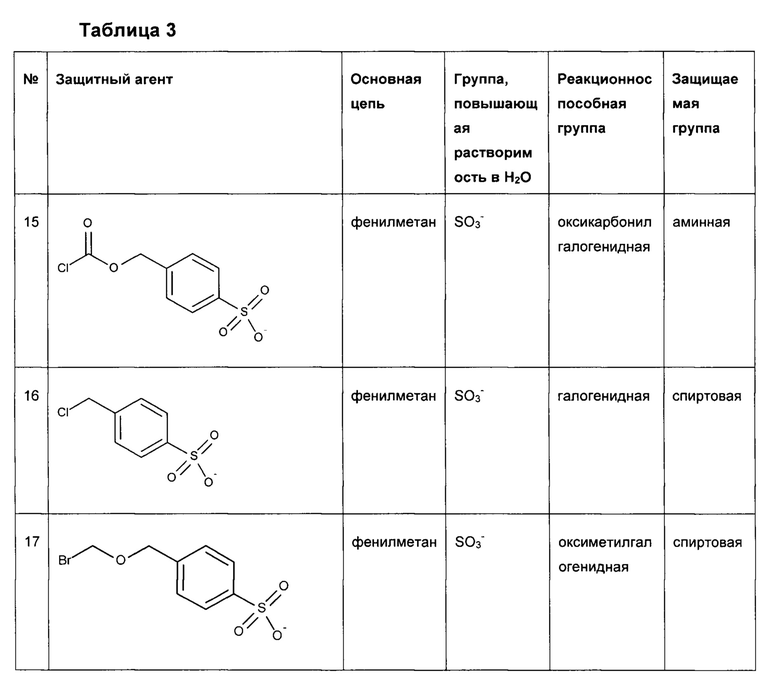
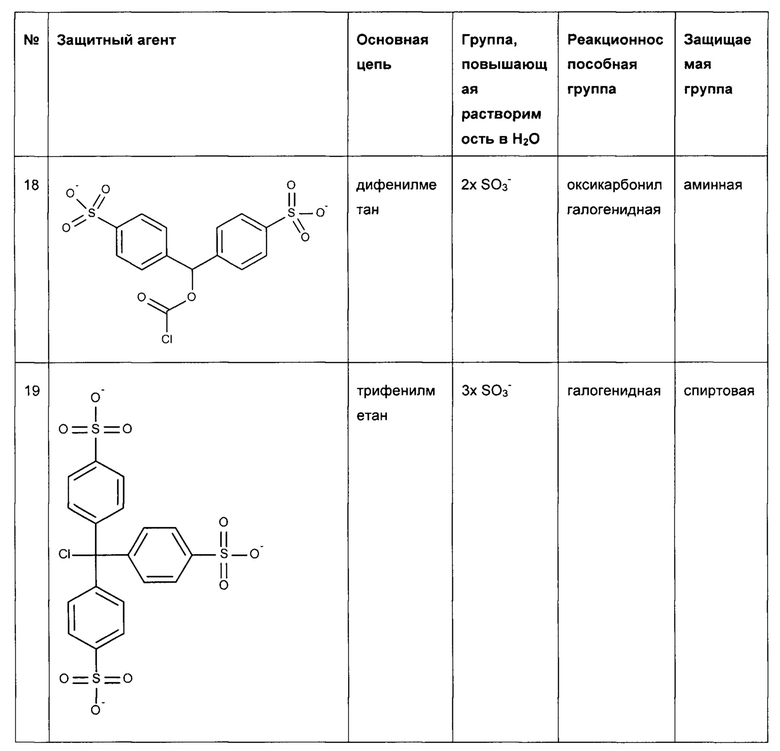
Предпочтительные защитные агенты по настоящему изобретению, имеющие моно-, ди- или трифенилметановую структуру основной цепи, приведены в следующей таблице 3. Соединения, перечисленные в таблице, ни в коей мере не ограничивают объем настоящего изобретения. Они представляют собой иллюстративные и предпочтительные защитные агенты согласно настоящему изобретению.
Настоящее изобретение также относится к применению защитных агентов для защиты функциональной группы в химической реакции. Предпочтительно, функциональная группа находится на аминокислоте, пептиде или белке, и химическая реакция представляет собой пептидный или белковый синтез в растворителе, выбранном из воды, спирта или смеси воды и спирта.
Способ
Настоящее изобретение относится к способу пептидного синтеза, включающему стадии взаимодействия первой аминокислоты или первого пептида со второй аминокислотой или вторым пептидом, защищенными по α-аминогруппе, в растворителе, выбранном из группы, состоящей из воды, спирта и смеси воды и спирта, и удаления защитной группы α-аминогруппы с помощью раствора для снятия защиты, отличающемуся тем, что защитная группа α-аминогруппы является продуктом взаимодействия одного из описанных здесь защитных агентов с функциональной α-аминогруппой второй аминокислоты или второго пептида. В предпочтительных вариантах осуществления защитная группа α-аминогруппы представляет собой по меньшей мере одну из следующих формул 6-10. В каждом случае азот, показанный на следующей общей формуле, принадлежит защищаемой аминогруппе:
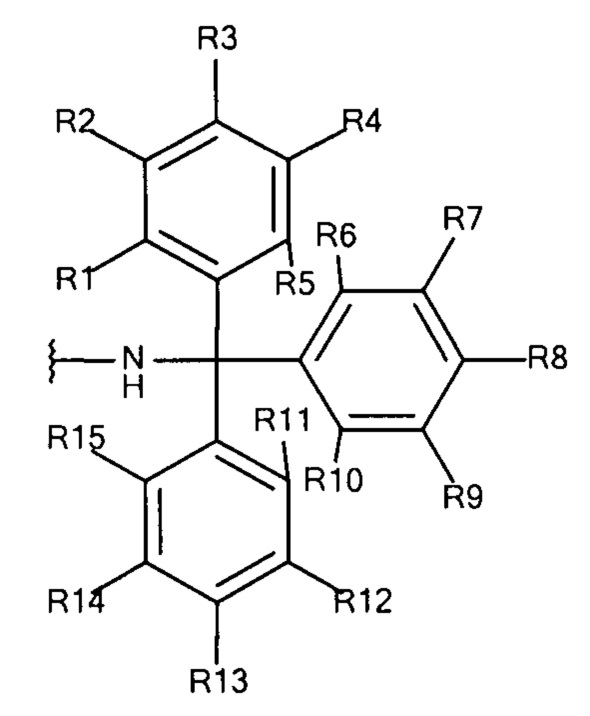
Общая формула 6
где R1 - R15 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РО32-, N(CH3)2, N(СН3)3+ и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два, наиболее предпочтительно по меньшей мере три из R1 - R15 выбирают из SO3-, РО32-, N(CH3)2, OSO3- сложного эфира, ОРO32- сложного эфира, N(CH3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R15, не представляющие собой SO3-, РО32-, N(CH3)2, OSO3- сложный эфир, ОРO32- сложный эфир, N(CH3)3+ или CN, представляют собой водород.
В предпочтительных вариантах осуществления R3, R8 и R13 выбирают из SO3-, РО32-, OSO3- сложного эфира, ОРО32- сложного эфира, N(СН3)2, N(CH3)3+ и CN, в частности R3, R8 и R13 представляют собой SO3-. Предпочтительно, R1, R2, R4 - R7, R9 - R12, R14 и R15 представляют собой водород.
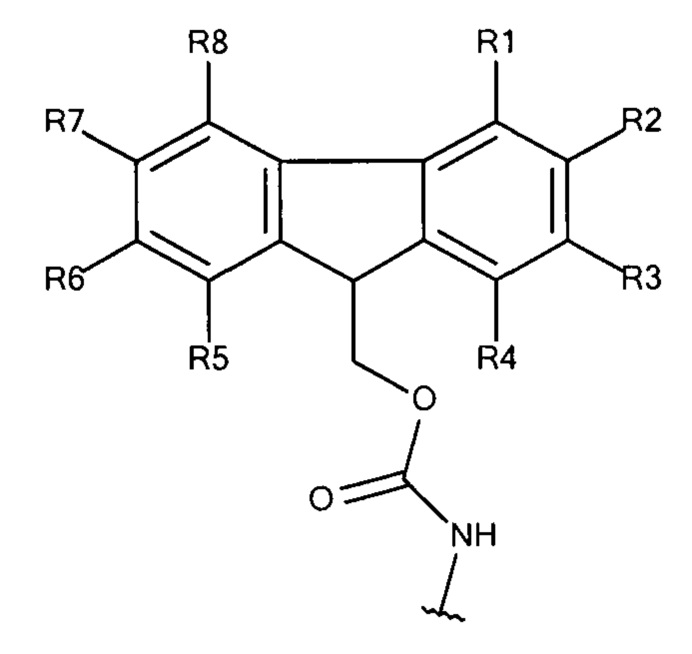
Общая формула 7
где R1 - R8 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два из R1 - R8 выбирают из SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РO3-, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R8, не представляющие собой SO3-, РО32-, OSO3- сложный эфир, ОРO32- сложный эфир, N(CH3)2, N(CH3)3+ или CN, представляют собой водород.
В предпочтительных вариантах осуществления R2 и R7 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN, в частности R2 и R7 представляют собой SO3-. Предпочтительно, R1, R3 - R6 и R8 представляют собой водород.
В предпочтительных вариантах осуществления R3 и R6 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN, в частности R3 и R6 представляют собой SO3-. Предпочтительно, R1, R2, R4, R5, R7 и R8 представляют собой водород.
В предпочтительных вариантах осуществления R2 и R6 выбирают из SO3-, РO32-, OSO3- сложного эфира, ОРO32- сложного эфира, N(CH3)2, N(CH3)3+ и CN, в частности R2 и R6 представляют собой SO3-. Предпочтительно, R1, R3, R4, R5, R7 и R8 представляют собой водород.
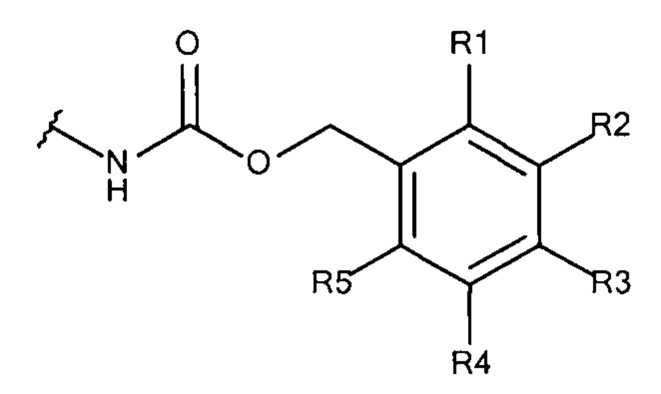
Общая формула 8
где R1 - R5 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два из R1 - R5 выбирают из SO3-, РО32-, OSO3- сложного эфира, ОРО32- сложного эфира, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R5, не представляющие собой SO3-, РО32-, N(CH3)2, OSO3- сложный эфир, ОРО32- сложный эфир, N(CH3)3+ или CN, представляют собой водород.
В предпочтительных вариантах осуществления R3 выбирают из SO3-, РO32-, OSO3- сложного эфира, ОРO32- сложного эфира, N(CH3)2, N(CH3)3+ и CN, в частности R3 представляют собой SO3. Предпочтительно, R1, R2, R4 и R5 представляют собой водород.
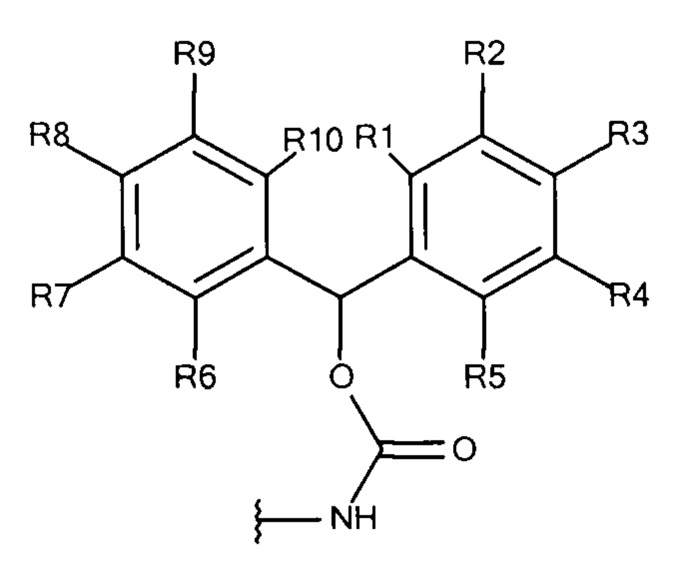
Общая формула 9
где R1 - R10 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два из R1 - R10 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R10, не представляющие собой SO3-, OSO3- сложный эфир, ОРО32- сложный эфир, РО32-, N(CH3)2, N(CH3)3+ или CN, представляют собой водород.
В предпочтительных вариантах осуществления R3 и R8 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN, в частности R3 и R8 выбирают из SO3-. Предпочтительно, R1, R2, R4 - R7, R9 и R10 представляют собой водород.
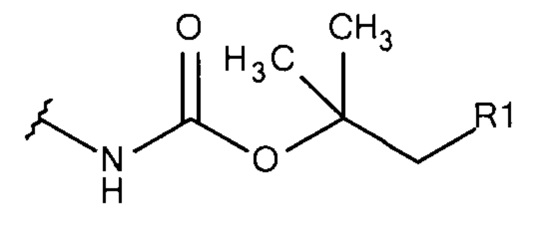
Общая формула 10
где R1 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления R1 представляют собой SO3-.
В особенно предпочтительных вариантах осуществления защитная группа α-аминогруппы представляет собой 9-(3,6-дисульфо)флуоренилметилоксикарбонильную группу, 9-(2,7-дисульфо)флуоренилметилоксикарбонильную группу или трет-бутил-(2-сульфонат)оксикарбонильную группу (Sboc). При использовании в настоящем описании термин "Smoc" обозначает 9-(3,6-дисульфо)флуоренилметилоксикарбонильную группу или 9-(2,7-дисульфо)флуоренилметилоксикарбонильную группу.
Структура защищенных аминокислот и пептидов согласно настоящему изобретению, в частности Smoc- и Sboc-защищенных аминокислот, более растворима в воде по сравнению с защищенными аминокислотами или пептидами, известными из уровня техники, в частности, по сравнению с Fmoc- и Вос-защищенными аминокислотами. Причина этого заключается в том, что в настоящем изобретении к защищающим агентам добавляют функциональные группы, повышающие водорастворимость, в частности сульфогруппы (SO3-). Следовательно, одним из преимуществ настоящего изобретения является применение аминокислоты и/или пептида, растворимых в воде в своей защищенной форме, и возможность использовать только воду, только спирт или только водно-спиртовую смесь для пептидного синтеза, т.е. без других повышающих растворимость добавок и без необходимости применения токсичных растворителей. Проведение пептидного синтеза в нетоксичном водой/или спиртосодержащем растворителе предоставляет различные преимущества для применения в фармацевтике и биологии.
Предпочтительные растворители представляют собой воду и водно-спиртовые смеси, причем наиболее предпочтительный растворитель представляет собой воду. Предпочтительные спирты представляют собой метанол, этанол, изопропанол, пропанол-2, н-пропанол, н-бутанол, изобутанол, втор-бутанол, трет-бутанол или их смесь.
При использовании в настоящем описании термин «растворимый в воде в своей защищенной форме» означает, что композиция обладает степенью растворимости, необходимой для проведения желаемой реакции в системе водного растворителя. Как и в случае с любой другой композицией, термин «растворимый» не подразумевает неограниченную растворимость в любых возможных количествах.
Растворы для снятия защиты, подходящие для применения в настоящем изобретении, предпочтительно содержат кислоту или основание, предпочтительно водную кислоту или основание, т.е. кислота и/или основание предпочтительно водорастворимы. Предпочтительные кислоты представляют собой фосфорную кислоту, соляную кислоту или трифторуксусную кислоту. Предпочтительные основания представляют собой амины и аммиак. Предпочтительные растворы для снятия защиты представляют собой растворы аминов и/или аммиака. Основание используют в количестве и степени, необходимых для снятия защиты с функциональной группы. Растворимость некоторых органических оснований может ограничить количество, которое может быть растворено в воде, спирте или смеси воды и спирта. Подходящими основаниями являются те, которые обладают растворимостью, позволяющей раствориться в достаточном количестве для проведения снятия защиты в выбранном растворителе.
Раствор для снятия защиты, для удаления Sboc-группы предпочтительно содержит водную кислоту, такую как фосфорная, соляная или трифторуксусная кислота.
Раствор для снятия защиты, для удаления Smoc-группы предпочтительно содержит водорастворимое основание, такое как амин или аммиак. Водорастворимое основание используют в количестве и степени, необходимой для снятия защиты с пептида. Растворимость определенных органических оснований может ограничить количество, которое может быть растворено в воде, спирте или смеси воды и спирта. Подходящими основаниями являются те, которые обладают растворимостью, позволяющей раствориться в достаточном количестве для проведения снятия защиты в выбранном растворителе.
Ясно, что после снятия защиты стадии взаимодействия и снятия защиты могут повторяться с использованием последующих аминокислот или последующих пептидов, где α-аминогруппа указанной последующей аминокислоты и/или последующего пептида предпочтительно защищена защитной группой согласно настоящему изобретению, в частности, Smoc-группой или Sboc-группой, до получения желаемого целевого пептида.
В предпочтительном варианте осуществления изобретения любая реакционноспособная функциональная группа боковой цепи указанной первой аминокислоты или первого пептида и/или указанной второй аминокислоты или второго пептида защищена защитной группой боковой цепи, которая предпочтительно включает по меньшей мере одну функциональную группу, повышающую водорастворимость. Защитная группа боковой цепи может включать сульфоновую группу или сульфоновый сложный эфир. Способ предпочтительно включает стадию удаления защитных групп боковой цепи. Повышающая водорастворимость функциональная группа защитной группы боковой цепи обеспечивает водорастворимость аминокислоте или пептиду с защищенной боковой цепью. Подходящие защитные группы боковой цепи представляют собой продукты взаимодействия одного из защитных агентов, упомянутых выше, с соответствующей функциональной группой боковой цепи аминокислоты или пептида.
Для защитных групп боковой цепи предпочтительными защитными группами аминогруппы являются представленные следующими формулами 11-15, где азот принадлежит защищаемой аминогруппе.
Общая формула 11
где R1 - R15 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два, наиболее предпочтительно по меньшей мере три из R1 - R15 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R15, не представляющие собой SO3-, РО32-, OSO3- сложный эфир, ОРO32- сложный эфир, N(CH3)2, N(CH3)3+ или CN, представляют собой водород.
В предпочтительных вариантах осуществления R3, R8 и R13 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN, в частности R3, R8 и R13 представляют собой SO3-. Предпочтительно, R1, R2, R4 - R7, R9 - R12, R14 и R15 представляют собой водород.
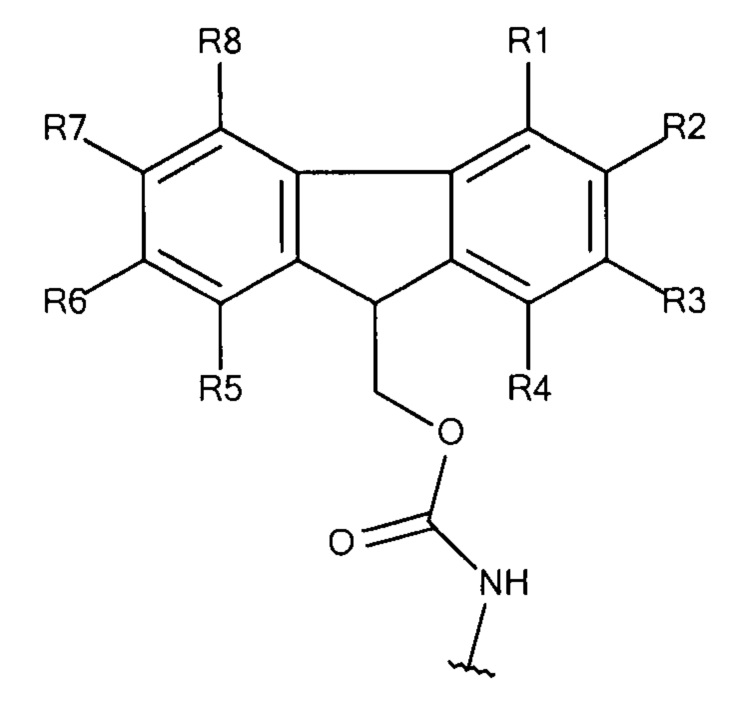
Общая формула 12
где R1 - R8 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два из R1 - R8 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R8, не представляющие собой SO3-, РO32-, OSO3- сложный эфир, ОРO32- сложный эфир, N(CH3)2, N(CH3)3+ или CN, представляют собой водород.
В предпочтительных вариантах осуществления R2 и R7 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN, в частности R2 и R7 представляют собой SO3-. Предпочтительно, R1, R3 - R6 и R8 представляют собой водород.
В предпочтительных вариантах осуществления R3 и R6 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN, в частности R3 и R6 представляют собой SO3-. Предпочтительно, R1, R2, R4, R5, R7 и R8 представляют собой водород.
В предпочтительных вариантах осуществления R2 и R6 выбирают из SO3-, РO32-, OSO3- сложного эфира, ОРO32- сложного эфира, N(CH3)2, N(CH3)3+ и CN, в частности R2 и R6 представляют собой SO3-. Предпочтительно, R1, R3, R4, R5, R7 и R8 представляют собой водород.
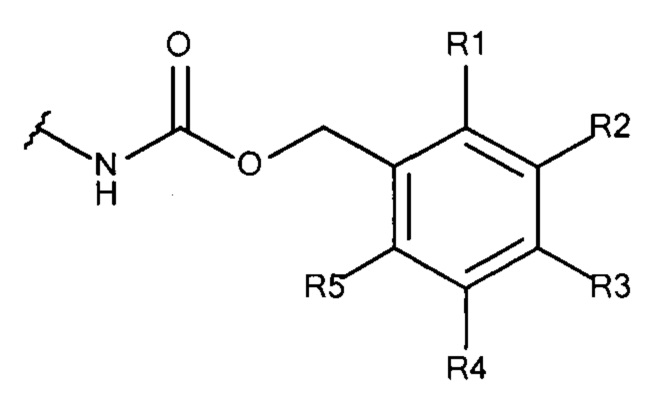
Общая формула 13
где R1 - R5 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два из R1 - R5 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R5, не представляющие собой SO3-, РO32-, OSO3- сложный эфир, ОРO32- сложный эфир, N(CH3)2, N(CH3)3+ или CN, представляют собой водород.
В предпочтительных вариантах осуществления R3 выбирают из SO3-, РO32-, OSO3- сложного эфира, ОРO32- сложного эфира, N(CH3)2, N(CH3)3+ и CN, в частности R3 представляет собой SO3-. Предпочтительно, R1, R2, R4 и R5 представляют собой водород.
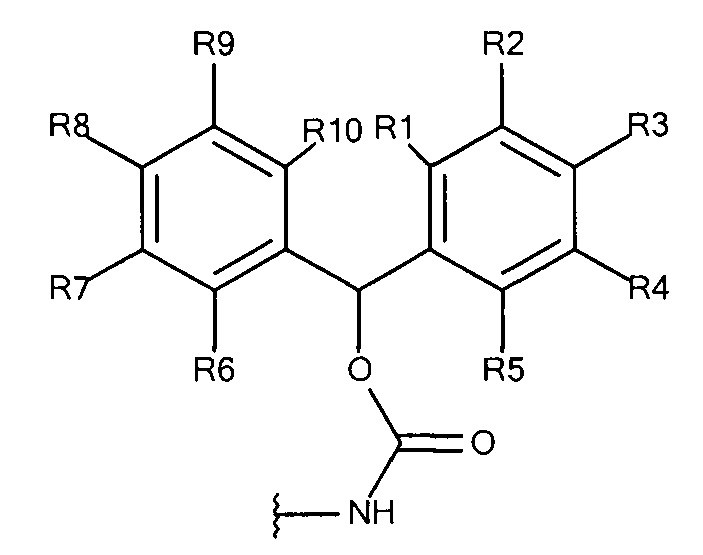
Общая формула 14
где R1 - R10 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два из R1 - R10 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R10, не представляющие собой SO3-, РО32-, OSO3- сложный эфир, ОРO32- сложный эфир, N(CH3)2, N(CH3)3+ или CN, представляют собой водород.
В предпочтительных вариантах осуществления R3 и R8 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN, в частности R3 и R8 выбирают из SO3-. Предпочтительно, R1, R2, R4 - R7, R9 и R10 представляют собой водород.
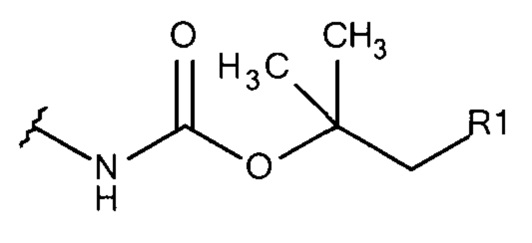
Общая формула 15
где R1 выбирают из SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления R1 представляет собой SO3-.
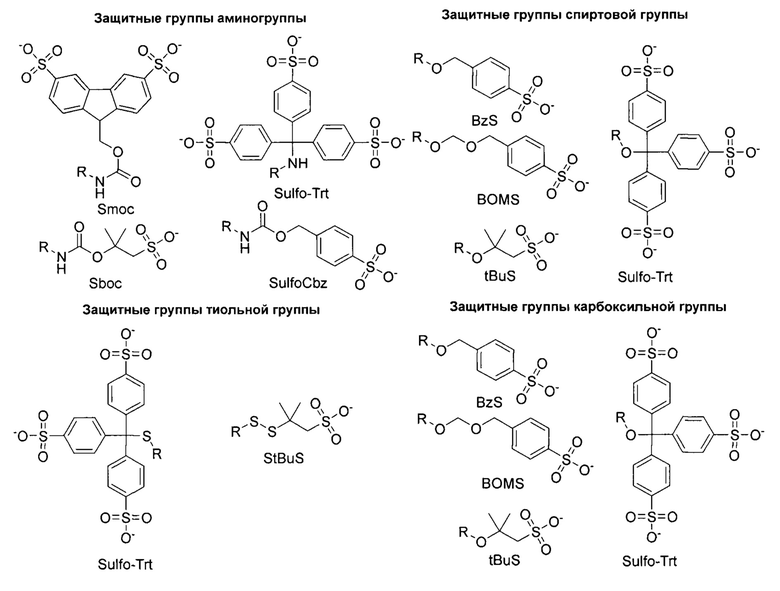
В особенно предпочтительных вариантах осуществления, защитную группу аминогруппы боковой цепи выбирают из 9-(3,6-дисульфо)флуоренилметилоксикарбонильной группы, 9-(2,7-дисульфо)флуоренилметилоксикарбонильной группы, три(4-сульфофенил)метильной группы (Sulfo-Trt), трет-бутил-(2-сульфонат)оксикарбонильной группы (Sboc) и 4-сульфокарбобензилоксигруппы (SulfoCBz).
Предпочтительные защитные группы спиртовой группы представлены следующими формулами 16-19:
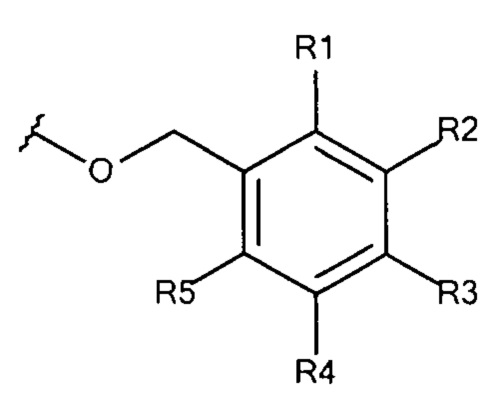
Общая формула 16
где R1 - R5 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два из R1 - R5 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R5, не представляющие собой SO3-, РO32-, OSO3- сложный эфир, ОРO32- сложный эфир, N(CH3)2, N(CH3)3+ или CN, представляют собой водород.
В предпочтительных вариантах осуществления R3 выбирают из SO3-, РO32-, OSO3- сложного эфира, ОРO32- сложного эфира, N(CH3)2, N(CH3)3+ и CN, в частности R3 представляет собой SO3-. Предпочтительно, R1, R2, R4 и R5 представляют собой водород.
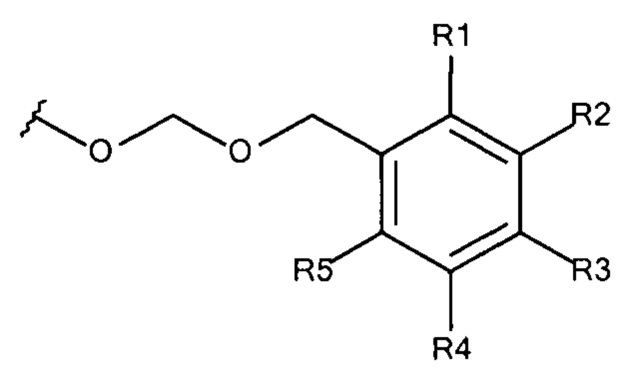
Общая формула 17
где R1 - R5 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN при условии, что по меньшей мере один, предпочтительно меньшей мере два из R1 - R5 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R5, не представляющие собой SO3-, OSO3- сложный эфир, ОРO32- сложный эфир, РO32-, N(CH3)2, N(CH3)3+ или CN, представляют собой водород.
В предпочтительных вариантах осуществления R3 выбирают из SO3-, РO32-, OSO3- сложного эфира, ОРO32- сложного эфира, N(CH3)2, N(CH3)3+ и CN, в частности R3 представляет собой SO3-. Предпочтительно, R1, R2, R4 и R5 представляют собой водород.
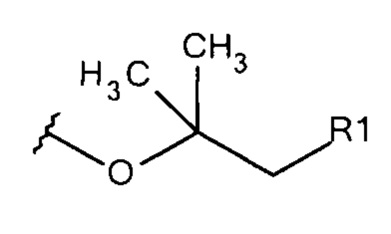
Общая формула 18
где R1 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления R1 представляет собой SO3-.
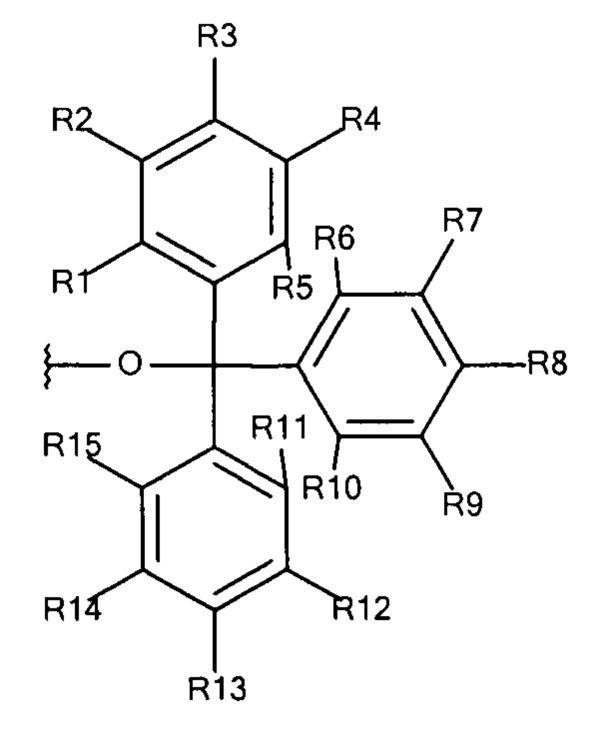
Общая формула 19
где R1 - R15 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два, наиболее предпочтительно по меньшей мере три из R1 - R15 выбирают из SO3-, РО32-, OSO3- сложного эфира, ОРО32- сложного эфира, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R15, не представляющие собой SO3-, РО32-, OSO3- сложный эфир, ОРО32- сложный эфир, N(CH3)2, N(CH3)3+ или CN, представляют собой водород.
В предпочтительных вариантах осуществления R3, R8 и R13 выбирают из SO3-, РО32-, OSO3- сложного эфира, ОРO32- сложного эфира, N(CH3)2, N(CH3)3+ и CN, в частности R3, R8 и R13 представляют собой SO3-. Предпочтительно, R1, R2, R4 - R7, R9 - R12, R14 и R15 представляют собой водород.
В особенно предпочтительных вариантах осуществления защитные группы спиртовой группы выбирают из 4-сульфобензильной группы (BzS), 4-сульфобензилоксиметильной группы (BOMS), три(4-сульфофенил)метильной группы (SulfoTrt) и трет-бутил-1-сульфонатной группы (tBuS).
Предпочтительные защитные группы тиольной группы представлены следующими формулами 20 и 21:
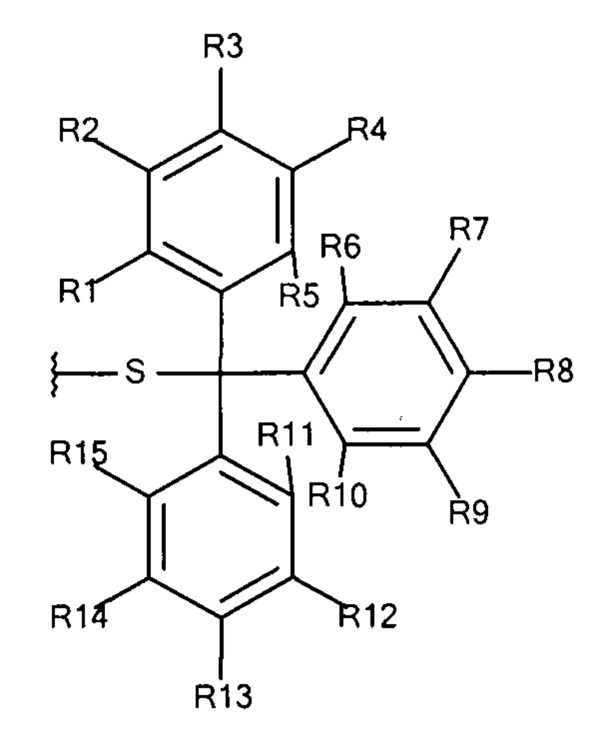
Общая формула 20
где R1 - R15 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РО32-, N(СН3)2, N(CH3)3+ и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два, наиболее предпочтительно по меньшей мере три из R1 - R15 выбирают из SO3-, РO32-, OSO3- сложного эфира, ОРО32- сложного эфира, N(СН3)2, N(СН3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R15, не представляющие собой SO3-, РО32-, OSO3- сложный эфир, ОРО32- сложный эфир, N(CH3)2, N(CH3)3+ или CN, представляют собой водород.
В предпочтительных вариантах осуществления R3, R8 и R13 выбирают из SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN, в частности R3, R8 и R13 представляют собой SO3-. Предпочтительно, R1, R2, R4 - R7, R9 - R12, R14 и R15 представляют собой водород.
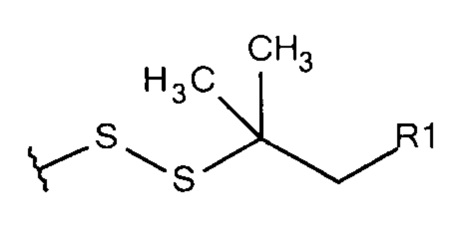
Общая формула 21
где R1 выбирают из SO3-, РO32-, OSO3- сложного эфира, ОРO32- сложного эфира, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления R1 представляет собой SO3-.
В особенно предпочтительных вариантах осуществления защитную группу тиольной группы выбирают из три(4-сульфофенил)метильной группы (SulfoTrt) и 1-сульфо-2-метил-2-пропантиольной группы (StBuS).
Предпочтительные защитные группы карбоксильной группы представлены следующими формулами 22-25:
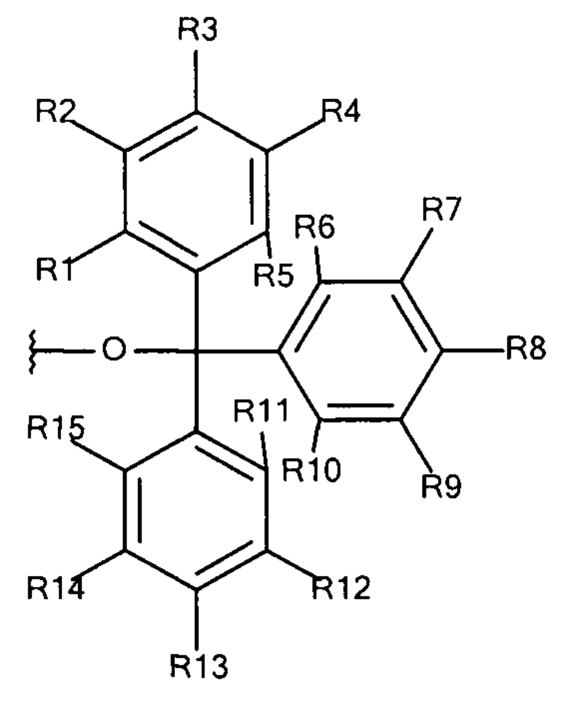
Общая формула 22
где R1 - R15 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два, наиболее предпочтительно по меньшей мере три из R1 - R15 выбирают из SO3-, РО32-, OSO3- сложного эфира, ОРО32- сложного эфира, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R15, не представляющие собой SO3-, РО32-, OSO3- сложный эфир, ОРО32- сложный эфир, N(CH3)2, N(CH3)3+ или CN, представляют собой водород.
В предпочтительных вариантах осуществления R3, R8 и R13 выбирают из SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN, в частности R3, R8 и R13 представляют собой SO3-. Предпочтительно, R1, R2, R4 - R7, R9 - R12, R14 и R15 представляют собой водород.
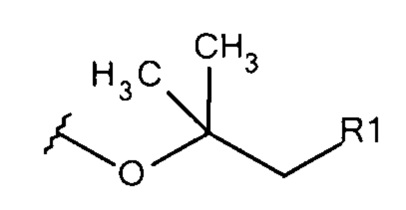
Общая формула 23
где R1 выбирают из SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления R1 представляет собой SO3-.
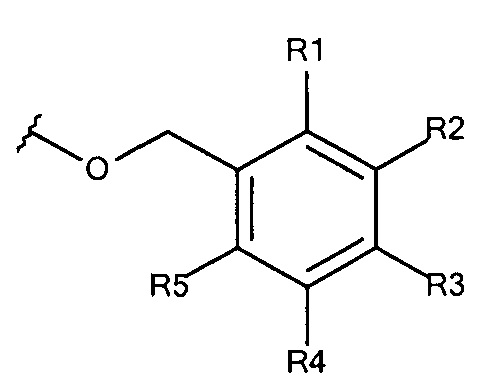
Общая формула 24
где R1 - R5 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РО32-, N(CH3)2, N(СН3)3+ и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два из R1 - R5 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R5, не представляющие собой SO3-, OSO3- сложный эфир, ОРO32- сложный эфир, РO32-, N(CH3)2, N(CH3)3+ или CN, представляют собой водород.
В предпочтительных вариантах осуществления R3 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN, в частности R3 представляет собой SO3-. Предпочтительно, R1, R2, R4 и R5 представляют собой водород.
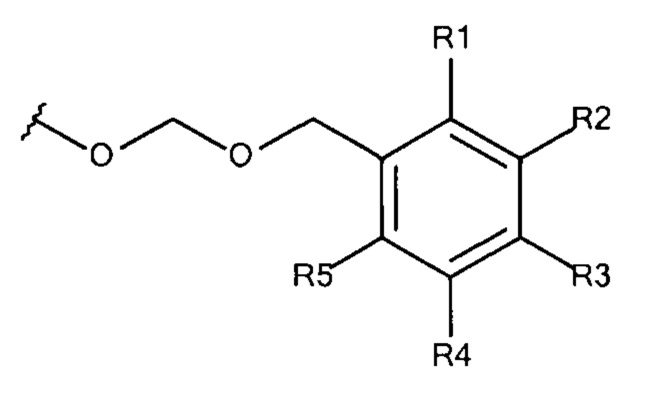
Общая формула 25
где R1 - R5 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два из R1 - R5 выбирают из SO3-, РO32-, OSO3- сложного эфира, ОРO32- сложного эфира, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R5, не представляющие собой SO3-, OSO3- сложный эфир, ОРО32- сложный эфир, РО32-, N(CH3)2, N(CH3)3+ или CN, представляют собой водород.
В предпочтительных вариантах осуществления R3 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN, в частности R3 представляет собой SO3-. Предпочтительно, R1, R2, R4 и R5 представляют собой водород.
В особенно предпочтительных вариантах осуществления защитные группы карбоксильной группы выбирают из 4-сульфобензильной группы (BzS), 4-сульфобензилоксиметильной группы (BOMS), три(4-сульфофенил)метильной группы (SulfoTrt) и трет-бутил-1-сульфонатной группы (tBuS).
Ниже приведен обзор наиболее предпочтительных защитных групп.
В дополнительном предпочтительном варианте осуществления изобретения этот способ является усовершенствованием твердофазного пептидного синтеза, где С-конец указанной первой аминокислоты или первого пептида прикреплен к нерастворимой подложке, предпочтительно полимерной. Путем использования нерастворимой подложки усилия по промежуточной очистке растущего пептида минимизированы. Очистка может быть легко осуществлена путем промывки прикрепленного пептида после каждой стадии взаимодействия в растворителе, предпочтительно выбранном из группы, состоящей из воды, спирта и смесей воды и спирта.
В варианте осуществления способ дополнительно включает стадию отщепления полученного пептида от полимерной подложки с помощью отщепляющей композиции после завершения синтеза пептида.
Подходящие отщепляющие композиции и способы хорошо известны специалисту. Обычно для проведения стадии отщепления используют кислоту, такую как трифторуксусная кислота и фтороводородная кислота (HF). Предпочтительно, кислота, подходящая для отщепления желаемого пептида от полимерной подложки, одновременно удаляет защитные группы боковой цепи, присоединенные к аминокислотам целевого пептида.
Предпочтительно, отщепление осуществляют в присутствии акцепторных композиций (например, воды, фенола, ДТТ (дитиотреитола), триэтилсилана и анизола), которые защищают пептид от нежелательных побочных реакций во время и после стадии отщепления. Специалист может выбирать подходящий акцептор с учетом присутствующих защитных групп.
Отщепляемый пептид может быть отделен от отщепляемой подложки (например, полимера) путем фильтрации, после чего пептид может быть восстановлен из фильтрата путем традиционной стадии, такой как выпаривание или осаждение растворителем.
В особенно предпочтительном варианте осуществления изобретения защитная группа α-аминогруппы включает флуоресцентную структуру, в частности 9-метилфлуореновую структуру основной цепи, и способ дополнительно включает стадию наблюдения за степенью образования пептидных связей и/или наблюдения за степенью удаления защитных групп α-аминогрупп путем измерения флуоресценции, генерируемой защитными группами α-аминогрупп, соединенными с первой аминокислотой или первым пептидом. В предпочтительных вариантах осуществления защитная группа, включающая 9-метилфлуореновую структуру основной цепи, представляет собой 9-(3,6-дисульфо)флуоренилметилоксикарбонильную группу или 9-(2,7-дисульфо)флуоренилметилоксикарбонильную группу.
В твердофазном пептидном синтезе наблюдение за степенью образования пептидных связей и/или наблюдение за степенью удаления флуоресцентной защитной группы (например, Smoc) достигается путем наблюдения за изменениями в интенсивности флуоресценции после облучения подложки УФ-излучением и измерения флуоресценции, генерируемой флуоресцентными защитными группами, соединенными с нерастворимым материалом подложки через первую аминокислоту или первый пептид.
Неожиданно было обнаружено, что защитные группы, включающие 9-метилфлуорен, например, 9-(3,6-дисульфо)флуоренилметилоксикарбонильная группа и 9-(2,7-дисульфо)флуоренилметилоксикарбонильная группа, обладают характеристическими флуоресцентными свойствами. Флуоресцентное свойство этих защитных групп создает возможности для наблюдения за завершением любой или обоих из реакций снятия защиты и конденсирования. В некоторых предпочтительных вариантах осуществления настоящего изобретения защитные агенты и соответствующие защитные группы включают две и более сульфогруппы, присоединенные к ароматической системе флуоренильного кольца, например, 9-(3,6-дисульфо)флуоренилметилоксикарбонильную группу и 9-(2,7-дисульфо) флуоренилметилоксикарбонильную группу. Две и более сульфогруппы (SO3-), присоединенные к ароматической системе флуоренильного кольца в этих соединениях, уникальны по сравнению с обычными реагентами, используемыми во время постадийной сборки пептида в ходе ТФПС. Эти соединения, такие как Smoc, можно контролировать с помощью их характеристической флуоресценции, чтобы определить количественное содержание соединения, присутствующего в конце каждой стадии реакции.
Признаки флуоресцентной (например, Smoc) группы на подложке могут быть использованы для определения успешного присоединения флуоресцентно защищенной аминокислоты, чтобы решить, должна ли быть повторена стадия конденсации для того, чтобы в значительной степени завершить образование пептидных связей. Подобным образом, признаки флуоресцентной группы на подложке могут быть использованы для определения незавершенного удаления флуоресцентной группы в конце стадии снятия защиты для того, чтобы решить, должна ли быть повторена стадия снятия защиты для того, чтобы в значительной степени завершить удаление флуоресцентной защитной группы.
Обычно, стадия конденсации, на которой первая аминокислота или первый пептид реагируют со второй аминокислотой или вторым пептидом, защищенными по α-аминогруппе, включает добавление конденсирующего агента.
Данное изобретение также относится к конденсирующим агентам, подходящим для применения в способах настоящего изобретения. Обычные конденсирующие агенты выбирают из группы, состоящей из карбодиимидов и триазолов. Предпочтительными карбодиимидами являются диизопропилкарбодиимид (ДИК), дициклогексилкарбодиимид (ДЦК), 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), 2-(((этилимино)метилен)амино)-2-метилпропан-1-сульфонат (ESC) и 2,2'-(метандиилиден-бис-(азанилилиден))-бис-(2-метилпропан-1-сульфонат) (DSC). Предпочтительными триазолами являются O-бензотриазолил-N,N,N',N'-тетраметилуронийгексафторфосфат (HBTU), 2-(1Н-Бензотриазол-1-ил)-1,1,3,3-тетраметилуронийтетрафторборат (TBTU), Вос-гистидин(тозил); В01' и B01'-Cl, (бензотриазол-1-илокси)трипирролидинфосфония гексафторфосфат (РуВОВ) и 1-гидроксибензотриазол (HOBt).
В предпочтительном варианте осуществления изобретения конденсирующий агент включает сульфоновую группу. Сульфоновая группа повышает растворимость конденсирующего агента в водосодержащих растворителях, и обеспечивает последующее отделение конденсирующего реагента путем анионного обмена.
Предпочтительные конденсирующие агенты представлены следующими формулами 26-30:
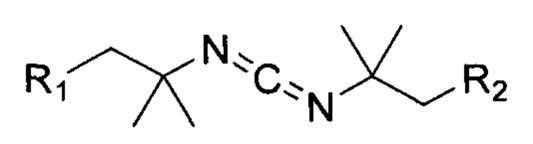
Общая формула 26
где R1 предпочтительно выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РO32-, N(CH3)2, N(CH3)3+ и CN, в частности R1 представляет собой SO3-. R2 предпочтительно выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN, в частности R2 представляет собой SO3-. R1 и R2 могут быть одинаковыми или разными.
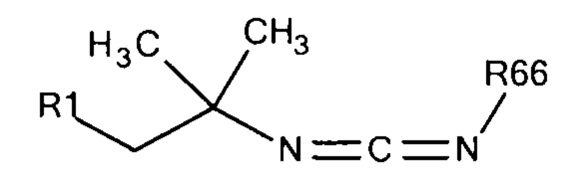
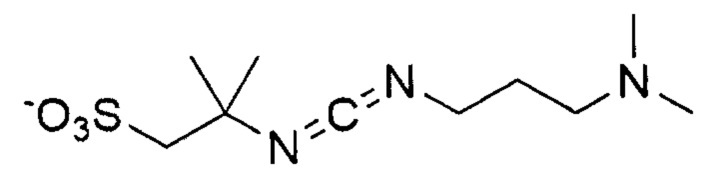
Общая формула 27
где R1 выбирают из SO3-, РO32-, OSO3- сложного эфира, ОРО32- сложного эфира, N(CH3)2, N(CH3)3+ и CN, в частности R1 представляет собой SO3-. R66 предпочтительно выбирают из короткоцепочечного алкила, предпочтительно C1 - C8 алкила, более предпочтительно С1 - С4 алкила.
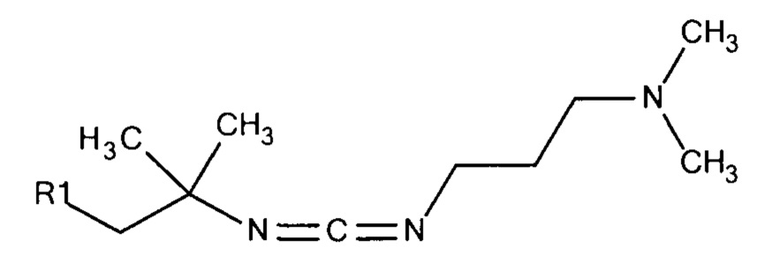
Общая формула 28
где R1 выбирают из SO3-, РО32-, OSO3- сложного эфира, ОРО32- сложного эфира, N(CH3)2, N(CH3)3+ и CN, в частности R1 представляет собой SO3-.
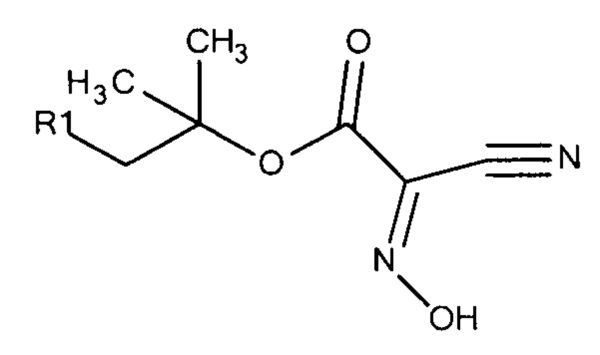
Общая формула 29
где R1 выбирают из SO3-, OSO3- сложного эфира, ОРO32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN, в частности R1 представляет собой SO3-.
Общая формула 30
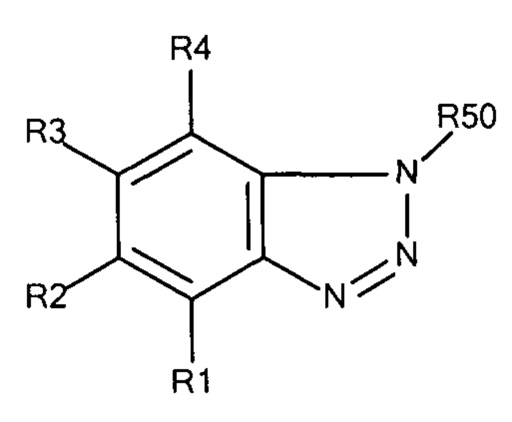
где R1 - R4 независимо выбирают из водорода, SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN при условии, что по меньшей мере один, предпочтительно по меньшей мере два из R1 - R4 выбирают из SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN. В предпочтительных вариантах осуществления все из R1 - R4, не представляющие собой SO3-, РО32-, OSO3- сложный эфир, ОРO32- сложный эфир, N(CH3)2, N(CH3)3+ или CN, представляют собой водород.
В предпочтительных вариантах осуществления R3 выбирают из SO3-, OSO3- сложного эфира, ОРО32- сложного эфира, РО32-, N(CH3)2, N(CH3)3+ и CN, в частности R3 представляет собой SO3-. Предпочтительно, R1, R2, R4 и R5 представляют собой водород.
В предпочтительных вариантах осуществления R50 выбирают из одной или более гидроксильных групп или одного из заместителей, представленных формулами 30.1 - 30.4 ниже, где В обозначает структуру общей формулы 30:
Формула 30.1
Формула 30.2
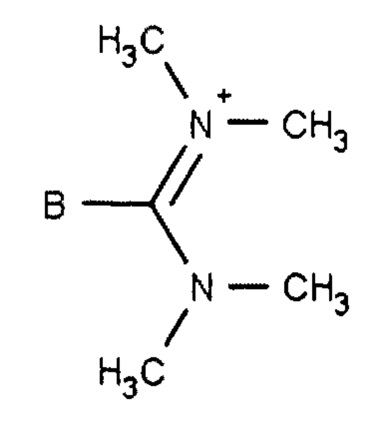
Формула 30.3
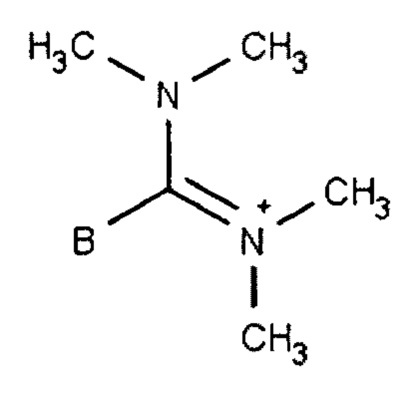
Формула 30.4
Особенно предпочтительные конденсирующие агенты выбирают из группы, состоящей из 2-(((этилимино)метилен)амино)-2-метилпропан-1-сульфоната (ESC), 2,2'-(метандиилиден-бис-(азанилилиден))-бис-(2-метилпропан-1-сульфоната) (DSC), 2-((((3-(диметиламино)пропил)имино)метилен)амино)-2-метилпропан-1-сульфоната (MPSC), N-гидроксисульфосукцинимида (Sulfo-NHS) и 2-(2-циано-2-(гидроксиимино)ацетокси)-2-метилпропан-1-сульфоната (Cyms).
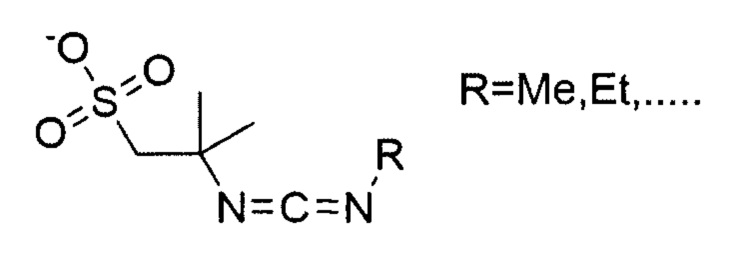
где R выбирают из C1 - C8 алкила, предпочтительно C1 - С4 алкила.
Формула 31 (ESC)
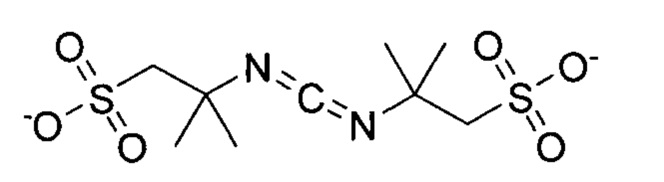
Формула 32 (DSC)
Формула 33 (MPSC)
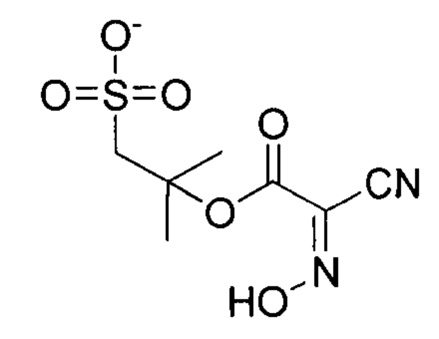
Формула 34 (Cyms)
Стадия конденсации может дополнительно включать добавление блокирующего реагента. Описываемые блокирующие агенты и их применение для блокирования свободных аминов в способе пептидного синтеза образуют независимую часть настоящего изобретения. Блокирующие агенты могут быть использованы в способе по настоящему изобретению, однако также они могут быть использованы и в других способах пептидного синтеза. Преимуществом блокирующих агентов является способствование простой, безопасной и рентабельной очистке итоговых составов продукта. Блокирующий агент позволяет блокировать свободные амины после стадий конденсации для предотвращения образования побочных продуктов, где блокирующий агент включает
I. структуру основной цепи,
II. по меньшей мере одну функциональную группу, повышающую водорастворимость, и
III. по меньшей мере одну реакционноспособную группу,
- где структура основной цепи включает фрагмент, выбранный из группы, состоящей из короткоцепочечного алкила, предпочтительно C1 - С8 алкила, циклических алкильных цепей или ароматических соединений, более предпочтительно C1 - С4 алкила или бензила,
- где функциональную группу, повышающую водорастворимость, выбирают из группы, состоящей из SO3-, РО32-, OSO3- сложного эфира, ОРО32- сложного эфира, N(CH3)2, N(CH3)3+, CN и их комбинаций, и
- где функциональная группа, повышающая водорастворимость, и реакционноспособная группа присоединены к структуре основной цепи по меньшей мере одной ковалентной связью.
Реакционноспособную группу предпочтительно выбирают из группы, состоящей из карбоновой кислоты, галогенида карбоновой кислоты, О-сукцинимида карбоновой кислоты, сложного эфира карбоновой кислоты Oxyma, ангидрида карбоновой кислоты, галогенидной и тиольной групп.
В варианте осуществления настоящего изобретения блокирующие агенты добавляют в способе пептидного синтеза согласно настоящему изобретению. В альтернативном варианте осуществления блокирующие агенты добавляют в альтернативном способе пептидного синтеза, включающем стадию взаимодействия первой аминокислоты или первого пептида со второй аминокислотой или вторым пептидом, защищенными по α-аминогруппе, в растворителе, и стадию удаления защитной группы α-аминогруппы с помощью раствора для снятия защиты, отличающемся тем, что блокирующий агент добавляют в реакционную смесь для блокирования свободных аминов. Блокирующие агенты выбирают из упомянутых выше. После завершения взаимодействия реакционную смесь пропускают через аффинную колонку для очистки реакционной смеси. Аффинную колонку предпочтительно выбирают из анионо- или катионообменной колонки.
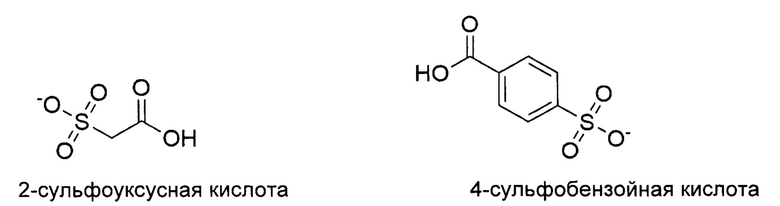
Функциональная группа, повышающая водорастворимость, обеспечивает легкую очистку после конденсации. В предпочтительном варианте осуществления изобретения блокирующий агент включает сульфоновую группу.
Предпочтительные блокирующие реагенты представляют собой 2-сульфоуксусную кислоту или 4-сульфобензойную кислоту.
В другом предпочтительном варианте осуществления изобретения способ дополнительно включает по меньшей мере одну стадию промывки с использованием растворителя, выбранного из группы, состоящей из воды, спирта и смеси воды и спирта, и стадию сбора отработанных растворов, полученных на стадиях промывки, стадию приведения отработанных растворов в контакт с колонкой для аффинной хроматографии, предпочтительно с твердым анионо- и/или катионообменным носителем, удерживая таким образом отходы, такие как функциональную группу, повышающую водорастворимость, в частности такую заряженную функциональную группу, как SO3-, OSO3- сложноэфирная, ОРO32- сложноэфирная, РO32- и N(CH3)3+. Особенно эффективным было использование анионообменного носителя для удаления соединений, которые включают по меньшей мере одну сульфоновую группу. Впоследствии отходы могут быть собраны путем регенерации колонки для аффинной хроматографии, предпочтительно с твердым анионо- и/или катионообменным носителем, и утилизированы. В качестве альтернативы, содержащая отходы колонка для аффинной хроматографии, предпочтительно с анионо- и/или катионообменным материалом носителя, может быть утилизирована.
Стадии промывки обычно осуществляют после стадии конденсации и после стадии снятия защиты. Стадия анионного и/или катионного обмена обеспечивает удаление всех сульфосодержащих соединений, таких как непрореагировавшие или отщепленные защитные группы и реагенты, например конденсирующие агенты и блокирующие агенты, как описано здесь, из промывочных растворов. Отходы удерживаются на анионо- или катионообменной колонке и получают очищенный растворитель. Удерживаемые соединения могут быть утилизированы вместе с анионо- или катионообменным материалом или после элюирования, и лишь минимальное количество химических отходов подлежит утилизации.
В дополнительном предпочтительном варианте осуществления изобретения способ дополнительно включает стадию очистки после стадии отщепления, где раствор, содержащий незащищенный и отщепленный целевой белок или пептид, приводят в контакт с колонкой для аффинной хроматографии, предпочтительно с твердым анионо- и/или катионообменным носителем, удерживая таким образом отходы, такие, как содержащие сульфоновую группу, и собирая очищенный целевой белок. В предпочтительных вариантах осуществления отходы включают по меньшей мере одну сульфоновую группу в качестве части защитных групп и других реагентов. Благодаря сульфосодержащим защитным группам и сульфосодержащим реагентам существует возможность удалить в значительной степени все избыточные химические реагенты и побочные продукты, образованные во время реакций конденсации, снятия защиты и реакций отщепления в растворителе, выбранном из группы, состоящей из воды, спирта и смеси воды и спирта с помощью колонки для аффинной хроматографии, предпочтительно ионообменными методами. Разумеется, этот способ подходит также и для других заряженных функциональных групп. Только целевой пептид способен пройти через ионообменную колонку, тогда как побочные продукты пептида, остатки защитных групп и избыточные реагенты удерживаются на колонке. После регенерации колонки лишь минимальное количество химических отходов подлежит утилизации. Это является полезным эффектом применения заряженных функциональных групп, таких как SO3-, OSO3- сложноэфирной, ОРO32- сложноэфирной, РO32- и N(СН3)3+. Но даже если используются одна или более незаряженных функциональных групп, способ все еще может быть осуществлен в воде, что сокращает количество отработанных химических веществ по сравнению со способами, известными из уровня техники.
Предпочтительный аспект настоящего изобретения связан с защитным агентом, выбранным из группы, состоящей из 9-(3,6-дисульфо)флуоренилметилоксикарбонилгалогенидов (Smoc галогенид), 9-(3,6-дисульфо)флуоренилметилоксикарбонил-N-гидроксисукцинимида (Smoc-NHS), 9-(3,6-дисульфо)флуоренилметилоксикарбонил-O-сукцинимида (Smoc-OSu), 9-(2,7-дисульфо)флуоренилметилоксикарбонилгалогенидов (Smoc галогенид), 9-(2,7-дисульфо)флуоренилметилоксикарбонил-N-гидроксисукцинимида (Smoc-NHS), 9-(2,7-дисульфо)флуоренилметилоксикарбонил-O-сукцинимида (Smoc-OSu), три(4-сульфофенил)метилгалогенидов (SulfoTrt галогенид), трет-бутил-(2-сульфонат)оксикарбонилангидрида (Sboc2O), трет-бутил-(2-сульфонат)оксикарбонил-O-сукцинимида (Sboc-OSu), 4-сульфо-карбобензилоксигалогенидов (SulfoCBz галогенид), 2-гидрокси-2-метилпропан-1-сульфоната (tBuS), 2-бром-2-метилпропан-1-сульфоната (tBuS), 2-меркапто-2-метилпропан-1-сульфоната (StBuS), 4-сульфобензилгалогенидов (BzS-галогенид) и 4-сульфо-бензилоксиметилгалогенидов (BOMS галогенид).
Предпочтительные галогениды согласно настоящему изобретению представляют собой хлорид и бромид. Вышеуказанные соединения являются полезными реагентами для защиты функциональной группы, например, аминогруппы, спиртовой группы, тиольной группы или карбоксильной группы в химической реакции в органической химии.
Другой аспект настоящего изобретения относится к модифицированным аминокислотам, пептидам и их солям, включающим защитную группу, выбранную из группы, состоящей из вышеприведенных соединений, представленных формулами 6-25, более предпочтительно выбранную из вышеприведенных соединений, представленных формулами 6-10. В особенно предпочтительных вариантах осуществления данные защитные группы включают 9-(3,6-дисульфо)флуоренилметилоксикарбонильную группу, 9-(2,7-дисульфо)флуоренилметилоксикарбонильную группу, три(4-сульфофенил)метильную группу (SulfoTrt), трет-бутил-(2-сульфонат)оксикарбонильную группу (Sboc), 4-сульфо-карбобензилоксигруппу (SulfoCBz), трет-бутил-1-сульфонатную группу (tBuS), 1-сульфо-2-метил-2-пропантиольную группу (StBuS), 4-сульфобензильную группу (BzS) и 4-сульфобензилоксиметильную группу (BOMS).
Дополнительный аспект изобретения относится к устройству для осуществления способа твердофазного пептидного синтеза. Указанное устройство содержит реакционную емкость для приема нерастворимого (например, полимерного) материала подложки и флуориметр, предназначенный для наблюдения за изменениями в интенсивности флуоресценции, генерируемой защитной группой, присоединенной к нерастворимому материалу подложки. Из-за характеристической флуоресценции защитных агентов по настоящему изобретению (например, Smoc) количественный анализ интенсивности флуоресценции нерастворимого материала подложки дает информацию о ходе реакции конденсации или реакции снятия защиты в вышеупомянутом способе ТФПС. Интеграция флуориметра в устройство пептидного синтеза позволяет ускорить автоматизированный синтез.
В предпочтительном варианте осуществления изобретения устройство дополнительно содержит по меньшей мере один твердый анионо- и/или катионообменный носитель, предназначенный для отделения отходов. Твердый анионо- и/или катионообменный носитель может быть расположен внутри потока продукта для отделения целевого белка от отходов, таких как сульфосодержащие побочные продукты пептидов, остатки защитных групп и избыточные реагенты. В качестве альтернативы или дополнительно в потоке отходов может быть расположен твердый анионообменный носитель для отделения отходов, таких как избыточные реагенты и побочные продукты из промывочных растворов, полученные после стадий конденсации и снятия защиты.
Для наглядности изобретение будет описано далее со ссылкой на сопровождающий чертеж, где Фиг. 1 представляет собой схематическую иллюстрацию устройства согласно настоящему изобретению.
Фиг. 1 схематически иллюстрирует общий план автоматического устройства для твердофазного пептидного синтеза для применения в осуществлении предпочтительного способа как описано выше. Устройство содержит реакционную емкость 1, содержащую первую аминокислоту или первый пептид, прикрепленные к нерастворимой полимерной подложке, контейнер для реагентов 2, включающий множество резервуаров для подачи конденсирующих реагентов, блокирующих реагентов, отщепляющих реагентов и т.д., контейнер для растворителя 3 и контейнер для аминокислот и/или пептидов 4, включающий множество резервуаров для подачи защищенных аминокислот и/или пептидов.
Реакционная емкость 1 и контейнеры 2, 3, 4 соединены трубками и клапанами, расположенными таким образом, что определенные количества определенных реагентов, аминокислот и/или пептидов могут быть доставлены в реакционную емкость 1 в определенной последовательности под контролем средств управления (не показаны) традиционным образом.
Устройство включает флуориметр 5, предназначенный для измерительного наблюдения за изменениями в интенсивности флуоресценции содержимого реакционной емкости 1. Понятно, что в качестве альтернативы реакционная емкость 1 может содержать интегрированный флуориметр 5.
Реакционный сосуд оборудован сливным отверстием 6 для удаления потока отходов после каждой стадии промывки и выходным отверстием 7 для продукта для удаления потока продукта после стадии отщепления. Сливное отверстие 6 для отходов соединено через сливную трубу 8 с камерой 9, где значение рН потока регулируют для последующего отделения, и с первой ионообменной колонкой 10. Выходное отверстие 7 для продукта соединено трубкой 11 для продукта со второй ионообменной колонкой 12.
Ионообменные колонки 10, 11 предназначены для удерживания сульфированных отходов, таких как побочные продукты, избыточные реагенты и остатки защитных групп, которые впоследствии должны быть утилизированы. Поток очищенного растворителя из первой ионообменной колонки 10 может быть подведен к сточной системе или повторно использован. Очищенный поток продукта из второй ионообменной колонки 12 используют для получения целевого белка.
Изобретение проиллюстрировано, но не ограничено следующими примерами.
Примеры:
Пример 1: Синтез 9-(3,6-дисульфо)флуоренилметилоксикарбонилхлорида (Smoc-Cl)
2 г (7,73 ммоль) Fmoc -хлорида обрабатывали 20 мл концентрированной серной кислоты. После выделения продукта реакции из реакционной смеси получали 2,96 г (7,07 ммоль, 91,4%) неочищенного Smoc-хлорида в виде желтоватого твердого вещества.
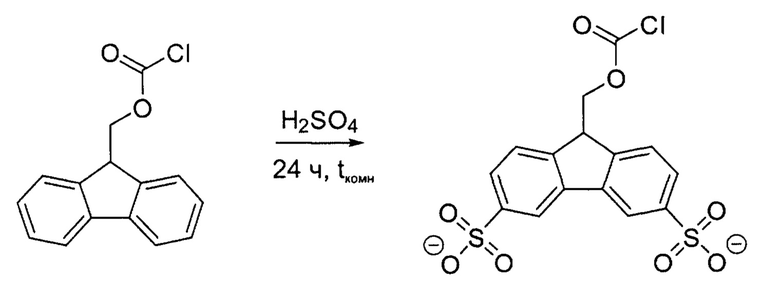
Аналитические данные по Smoc -хлориду:
1Н-ЯМР (ядерный магнитный резонанс) (500 МГц, D2O) δ=7,80 (с, 2Н), 7,69 (д, J=7,9 Гц, 2Н), 7,48 (д, J=7,8 Гц, 2Н), 3,84 (д, J=4,8 Гц, 2Н), 3,45 (t, J=4,7 Гц, 1Н).
13С-ЯМР (126 МГц, D2O) δ=145,57, 142,54, 141,65, 125,16, 121,61, 120,90, 62,54, 49,65.
Пример 2: Синтез 9-(2,7-дисульфо)флуоренилметилоксикарбонилхлорида (Smoc-Cl)
2 г (7,73 ммоль) Fmoc-хлорида обрабатывали 20 мл концентрированной серной кислоты и нагревали до 100°С. Серную кислоту нейтрализовывали с помощью NaOH (рН 9,5), растворитель удаляли при пониженном давлении, и аналитические данные ЯМР подтверждали образование целевого промежуточного соединения. Промежуточное соединение снова растворяли в 20%-ной серной кислоте в воде, перемешивали в течение 6 ч с образованием 9-(2,7-дисульфо)флуоренилметанола. Серную кислоту нейтрализовали NaOH (рН 6,7) и растворитель удаляли при пониженном давлении. Раствор 1,2 экв. фосгена в 25 мл DCM охлаждали до 0°С и медленно при перемешивании добавляли 9-(2,7-дисульфо)флуоренилметанол (Carpino и Han, Journal of Organic Chemistry 1972, 37, (22), 3404-3409). Раствор перемешивали в течение 1 часа на ледяной бане и затем оставляли на 4 часа при температуре ледяной бани. Растворитель и избыток фосгена удаляли при пониженном давлении с получением соответствующего продукта.
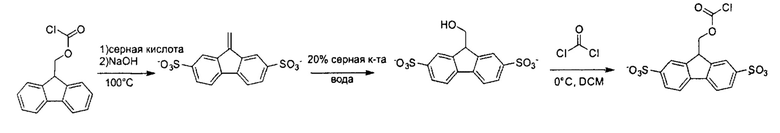
ЯМР - спектроскопия промежуточного соединения:
1Н-ЯМР (300 МГц, D2O) δ: 6,09 (s, 2Н), 7,23-7,40 (m, 2Н), 7,72 (s, 2Н), 7,95 (d, J=6,2 Гц, 2Н).
13С-ЯМР (75 МГц, D2O) δ: 142,61, 132,99, 131,74, 130,23, 129,28, 127,22, 125,57, 124,69.
Данные LC-APCI-MS (тандемная масс-спектрометрия и жидкостная хроматография с химической ионизацией при атмосферном давлении) для 9-(2,7-дисульфо)-флуоренилметилоксикарбонилхлорида:
Данные LC-APCI-MS: рассчитано для C15H9ClO22 ⋅ m/z: 256,03. Найдено m/z: 256,94 [M-H-2×SO3]-.
Пример 3: Синтез Smoc-Gly-OH (Smoc-глицин)
2.5 г (8,41 ммоль) Fmoc-глицина обрабатывали 30 мл концентрированной серной кислоты. После выделения продукта реакции из реакционной смеси получали 3,7 г (8,09 ммоль, 96,2%) неочищенного Smoc-глицина в виде желтоватого порошка.
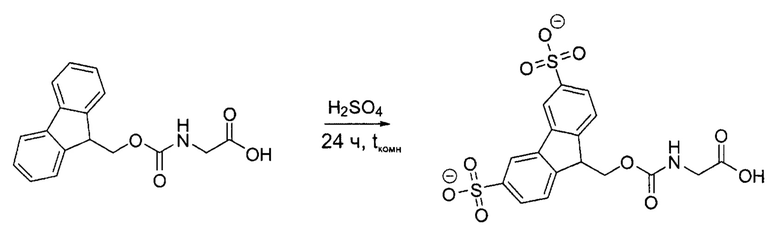
Аналитические данные по Smoc-глицину:
Данные LC-APCI-MS: рассчитано для C17H14NO10S2- m/z: 456,01. Найдено m/z: 455,85 [M-H]-.
1Н-ЯМР (500 МГц, D2O) δ=8,01 (s, 2Н), 7,87 (d, J=7,9 Гц, 2Н), 7,79 (d, J=8,0 Hz, 2H), 5,95 (s, NH), 4,41 (d, J=6,2 Гц, 2H), 4,01 (t, J=6,2 Гц, 1H), 3,67 (s, 2H).
13C-ЯМР (126 МГц, D2O) δ=158,21, 144,94, 142,41, 141,88, 125,51, 122,09, 121,09, 65,75, 46,95, 44,39.
Пример 4: Синтез Smoc-L-Ala-OH (Smoc-аланин)
2,5 г (8,03 ммоль) Fmoc-L-аланина обрабатывали 30 мл концентрированной серной кислоты. После выделения продукта реакции из реакционной смеси получали 3,8 г (7,64 ммоль, 95,1%) неочищенного Smoc-L-аланина в виде белого порошка.
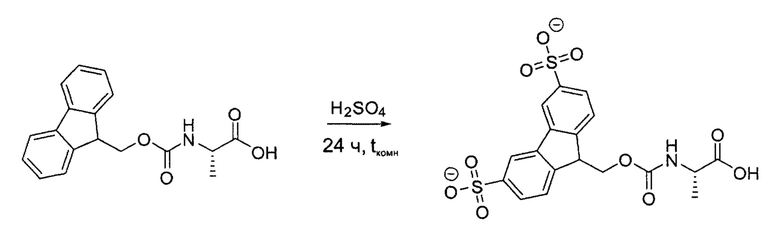
Аналитические данные по Smoc-аланину:
Данные LC-APCI-MS: рассчитано для C18H16NO7S• m/z: 390,06. Найдено m/z: 389,96 [M-HSO3]-.
1Н-ЯМР (500 МГц, MeOD) δ=7,78 (d, J=19.6 Гц, 2Н), 7,57 (d, J=8,1 Гц, 2Н), 7,55 (dd, 2Н), 5,94 (s, NH), 3,95 (m, ОН+2Н), 3,85 (q, J=7,4 Гц, 1H), 2,93 (t, J=1,64 Гц, 1H), 1,01 (d, J=7,3 Гц, 3Н).
13С-ЯМР (126 МГц, MeOD) δ=175,11, 158,10, 146,21, 145,89, 145,44, 143,54, 127,09, 124,04, 123,90, 121,40, 67,23, 51,05, 48,51, 17,58.
Пример 5: Синтез Smoc-L-Ile-OH (Smoc-изолейцин)
2,5 г (7,07 ммоль) Fmoc-L-изолейцина обрабатывали 30 мл концентрированной серной кислоты. После выделения продукта реакции из реакционной смеси получали 3,8 г (6,82 ммоль, 96,4%) неочищенного Smoc-L-изолейцина в виде белого порошка.
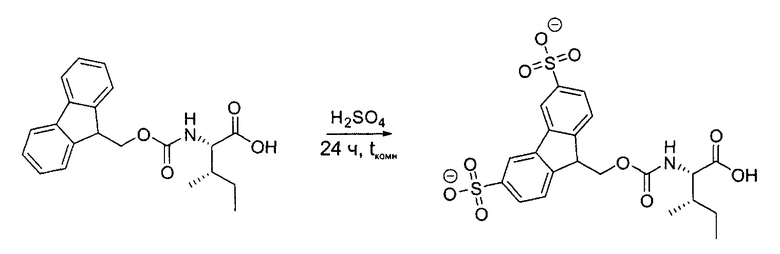
Аналитические данные по Smoc-изолейцину:
Данные LC-APCI-MS: рассчитано для C21H22NO7S• m/z: 432,11. Найдено m/z: 432,06 [M-HSO3]-.
1Н-ЯМР (500 МГц, MeOD (тетродейтерометанол)) δ=7,79 (d, J=16,5 Гц, 2Н), 7,57 (d, J=8,0 Гц, 2Н), 7,55 (dd, J=8,0, 1,5 Гц, 2Н), 4,15-3,89 (m, ОН+2Н), 3,77 (d, J=6,2 Гц, 1Н), 2,93 (t, J=1,6 Гц, 1Н), 1,50 (dtd, J=13,2, 10,1, 6,7 Гц, 1Н), 1,20-1,05 (m, 1Н), 0,97-0,81 (m, 1Н), 0,55 (d, J=6,86 Гц, 3Н), 0,54 (t, J=7,43 Гц, 3Н).
13С-ЯМР (126 МГц, MeOD) δ=173,98, 158,49, 146,15, 145,45, 143,48, 127,09, 124,02, 123,95, 121,38, 67,33, 60,30, 48,55, 38,31, 26,30, 15,98, 11,66.
Пример 6: Синтез Smoc-L-Leu-OH (Smoc-лейцин)
2,5 г (7,07 ммоль) Fmoc-L-лейцина обрабатывали 30 мл концентрированной серной кислоты. После выделения продукта реакции из реакционной смеси получали 3,6 г (7,01 ммоль, 99,1%) неочищенного Smoc-L-лейцина в виде белого порошка.
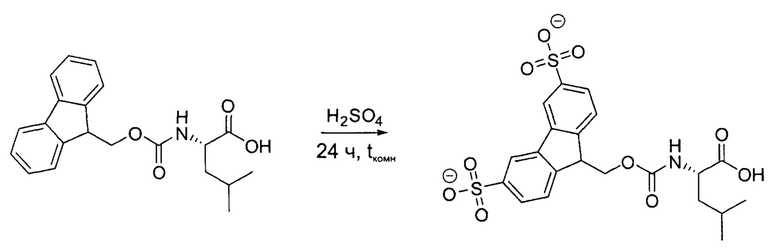
Аналитические данные по Smoc-лейцину:
Данные LC-APCI-MS: рассчитано для C21H22NO7S• m/z: 432,11. Найдено m/z: 432,06 [M-HSO3]-.
1Н - ЯМР (500 МГц, MeOD) δ=7,80 (d, J=18,0 Гц, 2Н), 7,58 (d, J=8,1 Гц, 2Н), 7,57 (dd, J=8,3, 4,1 Гц 2Н), 4,11-3,93 (m, ОН+2Н), 3,86 (dd, J=9,9, 5,3 Гц, 1Н), 2,94 (t, 1Н), 1,41-1,31 (m, 1Н), 1,30-1,17 (m, 2Н), 0,57 (dd, J=14,7, 6,5 Гц, 6Н).
13С-ЯМР (126 МГц, MeOD) δ=175,08, 158,41, 146,18, 145,95, 145,38, 143,52, 127,10, 124,07, 123,97, 121,40, 67,27, 53,99, 48,54, 41,47, 25,86, 23,27, 21,78.
Пример 7: Синтез Sulfo-Trt
В нагреваемой круглодонной колбе в атмосфере азота суспендировали 237 мг (9,75 ммоль, 3,0 экв.) магния в 10 мл ТГФ (тетрагидрофуран). К этой смеси добавляли 1/10 раствора 1,878 г (9,75 ммоль, 3 экв.) 4-хлорбензолсульфоновой кислоты в 15 мл ТГФ при интенсивном перемешивании. Для начала реакции Гриньяра смесь кипятили с обратным холодильником и добавляли каплю брома. После этого по каплям добавляли оставшуюся часть раствора 4-хлорбензолсульфоновой кислоты и смесь кипятили с обратным холодильником еще в течение 30 минут, прежде чем давали ей остыть до комнатной температуры.
На втором этапе был использован метод конденсирования Кочи (Kochi). Для этой цели трехгорлую колбу помещали в атмосферу азота и охлаждали до -78°С с использованием суспензии сухого льда в метаноле. Затем добавляли 50 мл ТГФ, затем 0,361 мл (3,25 ммоль, 1 экв.) четыреххлористого углерода и 0,325 мл (0,03 ммоль, 0,01 экв., 0,1 моль/л раствора в ТГФ) двухлитиевого тетрахлоркупрата (II). К этому раствору добавляли по каплям предварительно приготовленный реактив Гриньяра. После перемешивания в течение 1 ч при -78°С и 6 ч при 0°С смеси давали нагреться до комнатной температуры и перемешивали еще 18 ч. Раствор гасили добавлением 20 мл воды. Летучие компоненты удаляли при пониженном давлении, в результате чего получали 1,69 г неочищенного 4,4',4''-(гидроксиметантриил)трибензолсульфоната (Sulfo-Trt) в виде коричневого твердого вещества. Продукт выделяли полупрепаративной ОФ-ВЭЖХ (обращеннофазовая высокоэффективная жидкостная хроматография). Обработка 4,4',4''-(гидроксиметантриил)трибензолсульфоната тионилхлоридом (SOCl2) приводила к образованию три(4-сульфофенил)метилхлорида (Sulfo-Trt хлорида). Растворитель удаляли при пониженном давлении.
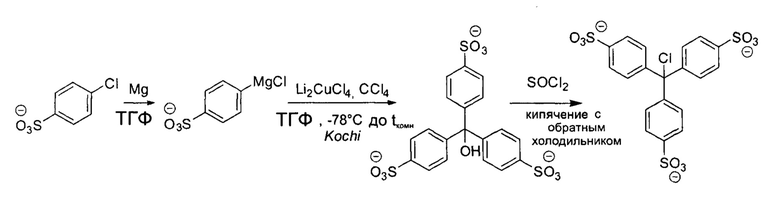
Аналитические данные по Sulfo-Trt:
1Н-ЯМР (500 МГц, D2O) δ=7,68 (d, J=8,6 Гц, 6Н), 7,44 (d, J=8,6 Гц, 6Н).
13С-ЯМР (126 МГц, D2O) δ=140,99, 136,88, 128,96, 127,02, 75,45.
Пример 8: Синтез 2-гидрокси-2-метилпропан-1-сульфоната (tBuS-OH).
6,00 г натриевой соли 2-метил-2-пропен-1-сульфоновой кислоты разбавляли в 50 мл воды. Добавляли 10 мл серной кислоты и реакционную смесь перемешивали при комнатной температуре в течение ночи. Серную кислоту удаляли осаждением с помощью СаСО3. Растворитель удаляли при пониженном давлении. Продукт получали в виде белого порошка. Аналитические данные LC-MS и ЯМР подтвердили целевое соединение.
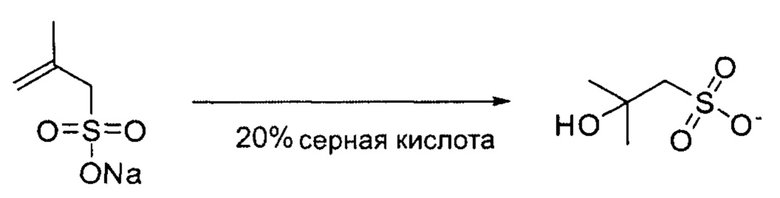
Аналитические данные по tBuS-OH:
Данные ESI-MS (тандемная масс-спектрометрия с ионизацией электрораспылением): рассчитано для C4H9O4S- m/z: 153,18, Найдено m/z: 152.9 [М-Н]-.
1Н-ЯМР (500 МГц, DMSO-d6) δ: 1,18 (s, 6Н), 2,67 (s, 2Н), 5,20 (s, 1Н).
13С-ЯМР (126 МГц, DMSO) δ: 67,84, 61,81, 39,52, 29,65.
Пример 9: Синтез 2-бром-2-метилпропан-1-сульфоната (tBuS-Br).
6,00 г натриевой соли 2-метил-2-пропен-1-сульфоновой кислоты растворяли в 20 мл HBr (48 масс. %). Растворитель удаляли при пониженном давлении. Продукт получали в виде бело-коричневого порошка. Аналитические данные LC-MS и ЯМР подтвердили целевое соединение.
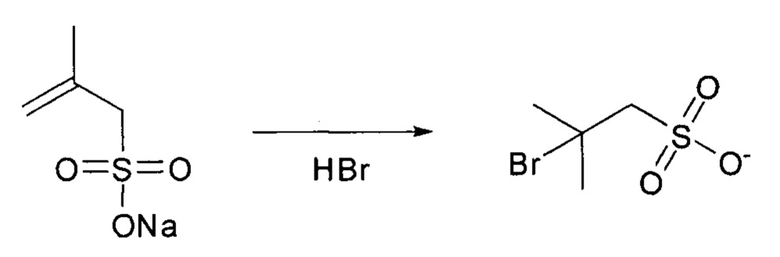
Аналитические данные по tBuS-Br:
Данные ESI-MS: рассчитано для C4H8BrO3S- m/z: 216,07, найдено m/z: 216,8[М-Н]-.
Пример 10: Синтез 2-меркапто-2-метилпропан-1-сульфоната (StBuS).
3,00 г натриевой соли 2-метил-2-пропен-1-сульфоновой кислоты растворяли в 25 мл концентрированной HCl и реакционный раствор перемешивали в течение ночи. После этого кислоту нейтрализовали NaOH (рН 6,8) и растворитель удаляли при пониженном давлении. В нагреваемой круглодонной колбе в атмосфере азота суспендировали 233,67 мг магния в 20 мл ТГФ. При интенсивном перемешивании добавляли суспензию 1,5 г tBuS-Cl в 15 мл ТГФ. Для начала реакции Гриньяра смесь кипятили с обратным холодильником (70°С), добавляли каплю брома и кипятили смесь с обратным холодильником еще в течение 90 минут, после чего давали ей остыть до комнатной температуры. 4 экв. серы добавляли к реактиву Гриньяра и перемешивали в течение 8 часов. Затем добавляли 200 мл воды. Смесь перемешивали 2 ч при комнатной температуре. Затем растворитель удаляли при пониженном давлении и полученный белый порошок анализировали с помощью ЯМР.
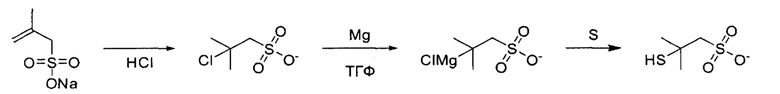
Аналитические данные по StBuS:
1Н-ЯМР (500 МГц, оксид дейтерия) δ: 1,56 (s, 6Н), 2,18 (s, J=1,3 Гц, 1Н), 3,67 (s, 2Н).
13С-ЯМР (126 МГц, D2O) δ: 61,66, 32,13, 28,48.
Пример 11: Синтез (9-BBN)-Lys(SBoc).
1,68 г лизина суспендировали в сухом ТГФ и добавляли в атмосфере инертного газа 24,28 мл 9-борабицикло(3.3.1)нонана (9-BBN) в ТГФ (0,5 моль/л). Полученную суспензию кипятили с обратным холодильником в течение 18 ч при 100°С. Растворитель удаляли при пониженном давлении. (9-BBN)-Lys разбавляли в 20 мл ТГФ и добавляли 1,97 г 1,1'-карбонилдиимидазола и 2,54 г tBuS-OH в атмосфере инертного газа. Полученный раствор перемешивали в течение 5 часов. Растворитель удаляли при пониженном давлении и полученный неочищенный продукт промывали трижды в DCM для удаления остатков имидазола.
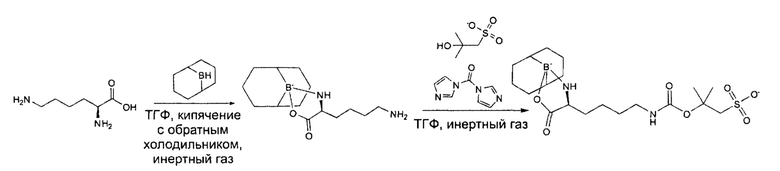
Аналитические данные по (9-BBN)-Lys(SBoc):
Данные ESI-MS: рассчитано для C19H33BN2O7S2- m/z: 444,35, найдено m/z:443,2[M-H]-.
Пример 12: Синтез (9-BBN)-Tyr(tBus).
2,00 г тирозина суспендировали в сухом ТГФ и в атмосфере инертного газа добавляли 25 мл 9-BBN в ТГФ (0,5 моль/л). Полученную суспензию кипятили с обратным холодильником в течение 18 ч при 100°С. Растворитель удаляли при пониженном давлении. (9-BBN)Tyr суспендировали в 20 мл ТГФ и добавляли 2,39 г tBuS-Br в атмосфере инертного газа. Полученный раствор перемешивали в течение 2 дней. Растворитель удаляли при пониженном давлении и полученный неочищенный продукт промывали трижды в ТГФ для удаления остатков брома.
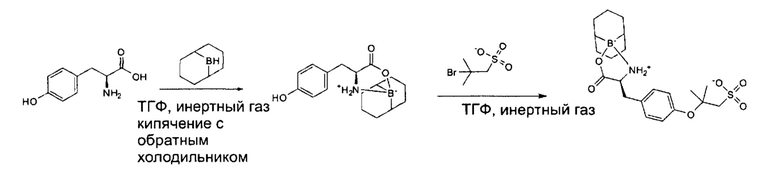
Аналитические данные по (9-BBN)-Tyr(tBuS):
Данные ESI-MS: рассчитано для C21H31BNO6S- m/z: 436,35, найдено m/z: 436,2[М+Н]+, 453,2[М+Н2O]+.
Пример 13: Исследование стабильности Smoc-защищенных аминокислот.
Для определения стабильности Smoc-защищенных аминокислот в водной среде Smoc-глицин и Smoc-L-лейцин растворяли в воде и инкубировали при температуре окружающей среды в течение восьми дней. Состояние аминокислот проверяли через 3, 6 и 8 дней с использованием аналитической ОФ-ВЭЖХ. Соединения должны были быть стабильными в водной среде в течение значительного периода времени. Для доказательства этой стабильности Smoc-глицин и Smoc-лейцин растворяли в минимальном количестве воды и выдерживали при температуре окружающей среды. Результаты экспериментов контролировали с помощью ОФ-ВЭЖХ, проводимой через 3, 6 и 8 дней. В результате не наблюдали существенных изменений в составе аминокислот.
Пример 14: N-концевое снятие защиты у Smoc-защищенных аминокислот
Для использования в ТФПС защитные группы должны быть легко и эффективно лишаемы защиты в безопасных условиях. Для определения условий снятия защиты со Smoc-защищенных аминокислот провели серию экспериментов путем растворения 1 мг Smoc-глицина в 1 мл воды или этанола. К этому раствору добавляли одно из следующих оснований
аммиак (10% водный раствор),
этаноламин (50% водный раствор),
этилендиамин (50% водный раствор) или
пиперидин (50% водный раствор)
и смесь инкубировали при встряхивании в течение 5 мин при комнатной температуре. Результат анализировали с помощью аналитических методов ОФ-ВЭЖХ и ESI-MS.
Результаты показали, что для снятия Smoc-защиты при комнатной температуре достаточно растворов аммиака или амина в воде
В дополнение к пиперидину, который является стандартным основанием, используемым в снятии Fmoc-защиты в ТФПС, оказалось возможным использование водорастворимых оснований, таких как аммиак, этаноламин и этилендиамин. Это позволяет получить доступ к значительно более дешевым и простым процедурам по сравнению с удалением защитной группы пиперидином.
Пример 15: Очистка с помощью аффинной хроматографии
Smoc-аланин смешали с незащищенным аланином в качестве искусственной примеси, растворяли в 1М муравьиной кислоте и загружали в ионообменную колонку DEAE Sephadex А-25. После дополнительной промывки колонки муравьиной кислотой, Smoc-аланин элюировали 4М раствором формиата аммония. Раствор перед загрузкой, раствор после загрузки и элюированную фракцию анализировали с помощью ОФ-ВЭЖХ.
Результаты продемонстрировали, что незащищенный аланин беспрепятственно проходил через ионообменную колонку, в то время как Smoc-защищенный аланин связывался с колонкой. При замене подвижной фазы на 4М раствор формиата аммония, Smoc-аланин элюировался с колонки без какого-либо остатка примеси. Тем самым было показано, что Smoc-группа может быть успешно использована в аффинной хроматографии в целях очистки.
Пример 16: Синтез пробного пептида H-V-G-G-V-G-OH в соответствии со Smoc-подходом.
Конденсацию аминокислот, защищенных с помощью Smoc, осуществляли следующим образом. Так, 3 экв. соответствующей Smoc-защищенной аминокислоты, 2,8 экв. активатора 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC), 3,0 экв. N-гидроксисукцинимида (NHS) и 6 экв. гидрокарбоната натрия в качестве общей основы растворяли в минимальном количестве воды и предварительно активировали в течение 3 мин. Типичная конденсация занимала 60 мин при температуре окружающей среды. Удаление N-концевой защиты пептидной смолы проводили как двойную стадию снятия защиты с 10%-ным водным раствором аммиака. После отщепления от подложки исследуемый пептид анализировали с помощью ОФ-ВЭЖХ и ESI-MS.
Аналитические данные по пептиду H-V-G-G-V-G-OH:
ОФ-ВЭЖХ, от 10 до 60% MeCN (метилнитрил), tR=19,1 мин.
Данные ESI-M: рассчитано для C16H29N5O6 m/z: 387,21, найдено: 387,0 [М+Н]+
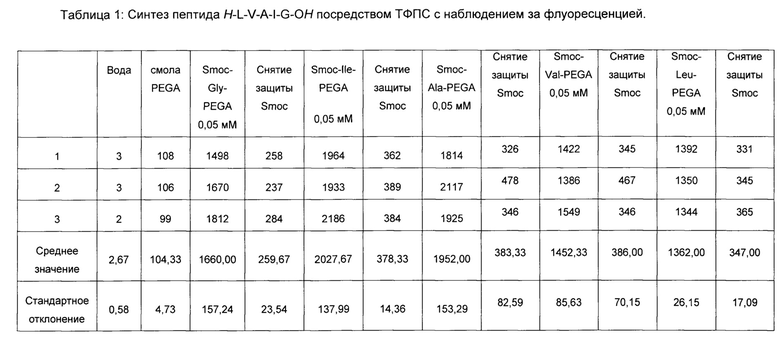
Флуоресценцию воды, твердой подложки (смола PEGA (сополимер полиэтиленгликоля и полиакриламида)) и смолы PEGA с пептидом определяли после каждой стадии конденсации и последующих стадий снятия защиты. Результаты представлены в таблице 1. Таким образом, после каждой стадии конденсации значение интенсивности флуоресценции возрастает из-за присоединенной Smoc-группы, и после каждой стадии снятия защиты значение флуоресценции снова уменьшается, показывая, что возможно наблюдение за ходом реакции в реальном времени.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИДНЫЕ ЭПОКСИКЕТОНЫ ДЛЯ ИНГИБИРОВАНИЯ ПРОТЕАСОМЫ | 2007 |
|
RU2450016C2 |
| ПЕПТИДНЫЕ СОЕДИНЕНИЯ | 2005 |
|
RU2393167C2 |
| СПОСОБ ТВЕРДОФАЗНОГО СИНТЕЗА ПЕПТИДОВ | 1991 |
|
RU2043362C1 |
| ПЕПТИДНЫЕ ЛИГАНДЫ СОМАТОСТАТИНОВЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2525468C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИЦИКЛИЧЕСКИХ ПЕПТИДНЫХ СОЕДИНЕНИЙ | 2003 |
|
RU2330045C9 |
| СИНТЕЗ ИНСУЛИНОТРОПНЫХ ПЕПТИДОВ | 2007 |
|
RU2448978C2 |
| ПЕПТИДНЫЕ СОЕДИНЕНИЯ | 2007 |
|
RU2415149C2 |
| МОДИФИЦИРОВАННЫЕ 2- И 3-НУКЛЕОЗИДЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА, ОБЛАДАЮЩЕГО ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСА ГЕПАТИТА С | 2003 |
|
RU2437892C2 |
| ПРОЛЕКАРСТВА МОДИФИЦИРОВАННЫХ 2'- И 3'-НУКЛЕОЗИДОВ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИЙ FLAVIVIRIDAE | 2003 |
|
RU2366661C2 |
| МОДИФИЦИРОВАННЫЕ 2'- И 3'-НУКЛЕОЗИДЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИЙ FLAVIVIRIDAE | 2011 |
|
RU2483075C2 |
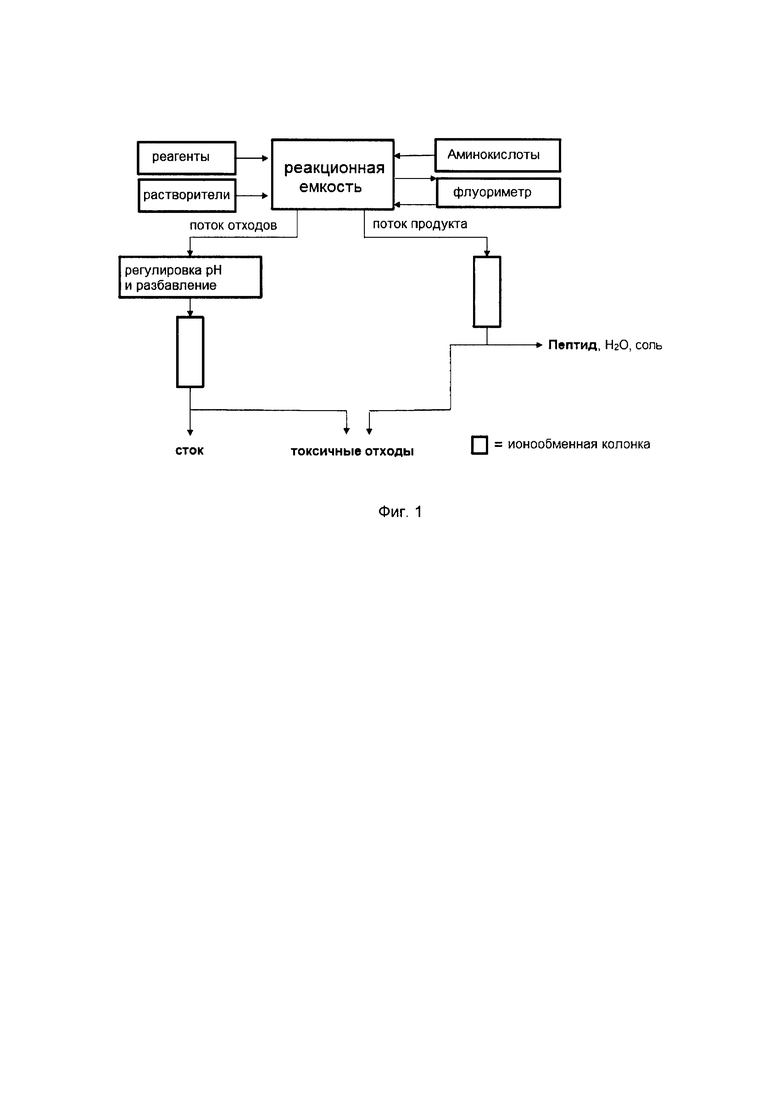
Изобретение относится к способу пептидного синтеза, где указанный способ включает стадии взаимодействия первой аминокислоты или первого пептида с защищенной по α-аминогруппе второй аминокислотой в растворителе, выбранном из группы, состоящей из воды, спирта и смеси воды и спирта, и удаления защитной группы α-аминогруппы с помощью раствора для снятия защиты. Изобретение дополнительно относится к защитным агентам, их применению и устройству для осуществления способа твердофазного пептидного синтеза. 4 н. и 8 з.п. ф-лы, 4 табл., 16 пр., 1 ил.
1. Способ пептидного синтеза, включающий стадии взаимодействия первой аминокислоты или первого пептида со второй аминокислотой или вторым пептидом, защищенными по α-аминогруппе, в растворителе, выбранном из группы, состоящей из воды, спирта и смеси воды и спирта, где С-конец указанной первой аминокислоты или первого пептида прикреплен к нерастворимой подложке, и способ дополнительно включает стадию отщепления полученного пептида или белка от полимерной подложки с помощью отщепляющей композиции и удаления защитной группы α-аминогруппы с помощью раствора для снятия защиты, где защитную группу α-аминогруппы образуют путем взаимодействия защитного агента с функциональной группой аминокислоты или пептида,
где указанный защитный агент имеет общую формулу 1:
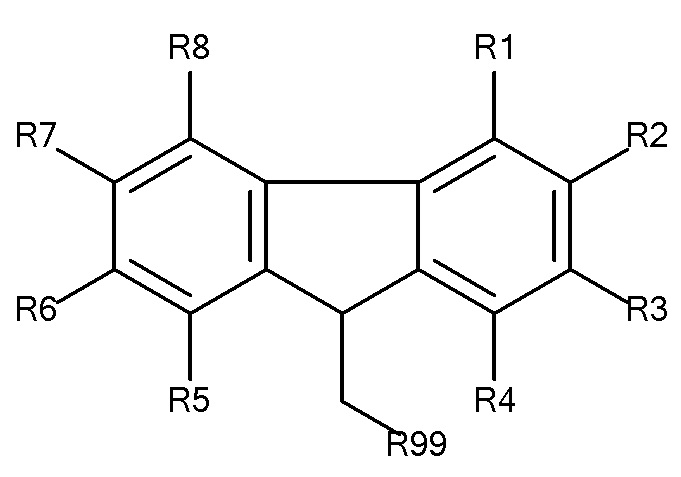
Общая формула 1,
где R1 - R8 независимо выбирают из водорода, SO3-, PO32-, N(CH3)2, N(CH3)3+, OSO3- сложного эфира, OPO32- сложного эфира и CN при условии, что по меньшей мере один из R1 - R8 выбирают из SO3-, PO32-, N(CH3)2, N(CH3)3+, OSO3- сложного эфира, OPO32- сложного эфира и CN;
R99 выбирают из группы, состоящей из оксикарбонилгалогенидной, оксикарбонил-О-сукцинимидной, сложного эфира оксикарбонила Oxyma (этил(гидроксиимино)цианоацетат), оксикарбонилангидридной, галогенидной, оксиметилгалогенидной, гидроксильной и тиольной групп;
или где указанный защитный агент имеет общую формулу 2:
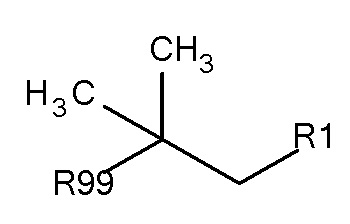
Общая формула 2,
где R1 выбирают из SO3-, PO32-, N(CH3)2, N(CH3)3+, OSO3- сложного эфира, OPO32- сложного эфира и CN;
R99 выбирают из группы, состоящей из оксикарбонилгалогенидной, оксикарбонил-О-сукцинимидной, оксикарбонилангидридной, галогенидной, оксиметилгалогенидной, гидроксильной и тиольной групп.
2. Способ по п. 1, отличающийся тем, что любую реакционноспособную функциональную группу боковой цепи указанной первой аминокислоты или первого пептида и указанной второй аминокислоты или второго пептида защищают с помощью защитной группы боковой цепи, включающей по меньшей мере одну функциональную группу, повышающую водорастворимость, и тем, что он дополнительно включает стадию удаления защитных групп боковой цепи.
3. Способ по п. 1 или 2, где защитная группа α-аминогруппы включает флуоресцентную структуру, дополнительно включающий стадию наблюдения за степенью образования пептидных связей и/или наблюдения за степенью удаления защитной группы α-аминогруппы путем измерения флуоресценции, генерируемой защитными группами α-аминогрупп, присоединенными к первой аминокислоте или первому пептиду.
4. Способ по любому из пп. 1-3, где R99 в общей формуле 1 выбирают из группы, состоящей из оксикарбонилгалогенидной, сложного эфира оксикарбонила Oxyma, оксикарбонил-O-сукцинимидной, оксикарбонилангидридной, галогенидной, гидроксильной и тиольной групп.
5. Способ по любому из пп. 1-4, где R1 - R8 в общей формуле 1 или R1 в общей формуле 2 представляют собой SO3-.
6. Способ по любому из пп. 1-5, где блокирующий агент добавляют в реакционную смесь для блокирования свободных аминов и где после завершения взаимодействия реакционную смесь пропускают через аффинную колонку, где указанный блокирующий агент имеет:
I. структуру основной цепи,
II. по меньшей мере одну функциональную группу, повышающую водорастворимость и
III. по меньшей мере одну реакционноспособную группу,
где структура основной цепи представляет собой фрагмент, выбранный из группы, состоящей из C1-C4 алкила или бензила,
где функциональную группу, повышающую водорастворимость, выбирают из группы, состоящей из SO3-, PO32-, N(CH3)2, N(CH3)3+, CN, OSO3- сложного эфира, OPO32- сложного эфира и их комбинаций,
где реакционноспособную группу выбирают из карбоновой кислоты и
где функциональная группа, повышающая водорастворимость, и реакционноспособная группа присоединены к структуре основной цепи по меньшей мере одной ковалентной связью.
7. Защитный агент, подходящий для образования защитных групп на функциональных группах пептида и/или аминокислоты в ходе пептидного синтеза в водной среде, где указанный защитный агент имеет общую формулу 1:
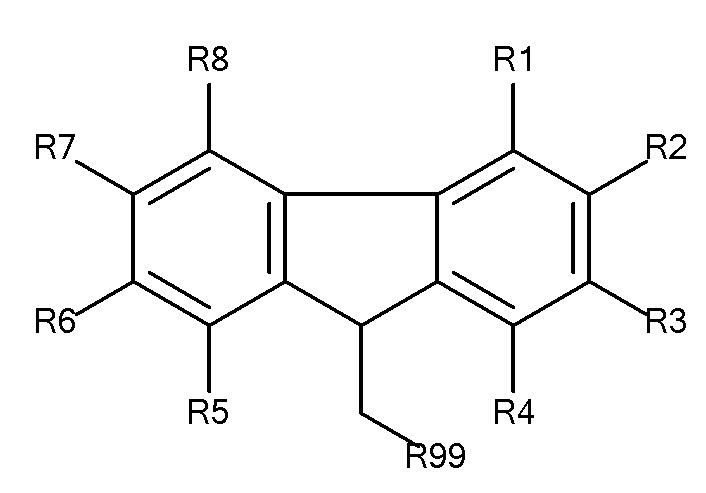
Общая формула 1,
где R1 - R8 независимо выбирают из водорода, SO3-, PO32-, N(CH3)2, N(CH3)3+, OSO3- сложного эфира, OPO32- сложного эфира и CN при условии, что по меньшей мере два из R1 - R8 выбирают из SO3-, PO32-, N(CH3)2, N(CH3)3+, OSO3- сложного эфира, OPO32- сложного эфира и CN;
R99 выбирают из группы, состоящей из оксикарбонилгалогенидной, оксикарбонил-О-сукцинимидной, сложного эфира оксикарбонила Oxyma, оксикарбонилангидридной, галогенидной, оксиметилгалогенидной, гидроксильной и тиольной групп.
8. Защитный агент по п. 7, где R99 выбирают из группы, состоящей из оксикарбонилгалогенидной, сложного эфира оксикарбонила Oxyma, оксикарбонил-O-сукцинимидной, оксикарбонилангидридной, галогенидной, гидроксильной и тиольной групп.
9. Защитный агент по п. 7 или 8, где R1 - R8 представляют собой SO3-.
10. Защитный агент, подходящий для образования защитных групп на функциональных группах пептида и/или аминокислоты в ходе пептидного синтеза в водной среде,
где указанный защитный агент имеет общую формулу 2:
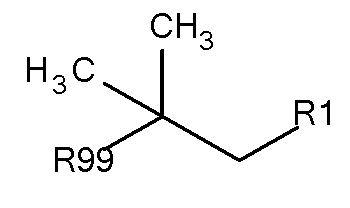
Общая формула 2,
где R1 выбирают из SO3-, PO32-, N(CH3)2, N(CH3)3+, OSO3- сложного эфира, OPO32- сложного эфира и CN;
R99 выбирают из группы, состоящей из оксикарбонилгалогенидной, оксикарбонил-О-сукцинимидной, оксикарбонилангидридной, галогенидной, оксиметилгалогенидной, гидроксильной и тиольной групп.
11. Защитный агент по п. 10, где R1 представляет собой SO3-.
12. Защитный агент, имеющий структуру, как определено в любом из пп. 7-11, где группа R99 указанного защитного агента связана с функциональной группой аминокислоты, пептида, белка или их соли, где функциональную группу выбирают из α-аминогруппы, аминогруппы боковой цепи, тиольной, карбоксильной и гидроксильной групп.
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| ПЕПТИДНЫЕ АНТИБИОТИКИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2428429C2 |
Авторы
Даты
2020-07-21—Публикация
2015-09-29—Подача