ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение предлагает культуральную среду, которую можно использовать для устранения недифференцированных стволовых клеток (SC), а также для очистки и оптимизации кардиомиоцитов (CM).
УРОВЕНЬ ТЕХНИКИ
[0002] У взрослых индивидуумов кардиомиоциты утрачивают пролиферативную активность, поэтому традиционные способы лечения серьезных заболеваний миокарда, таких как инфаркт миокарда и кардиомиопатия, отсутствуют и остается полагаться только на трансплантацию сердца. Однако благодаря исследованиям, проводимым в последние годы на плюрипотентных стволовых клетках (PSC), таких как эмбриональные стволовые клетки (ESC) и индуцированные плюрипотентные стволовые клетки (iPSC), стало возможным индуцировать дифференциацию таких PSC до CM и использовать такие индуцированные CM в медицинской трансплантации.
[0003] Однако в данной связи следует отметить, что дифференциация до кардиомиоцитов в нефизиологических условиях (т.е. в условиях in vitro) протекает аналогично физиологическому развитию CM: вначале образуются недифференцированные мезодермальные клетки и затем недифференцированные мезодермальные клетки дифференцируются, причем некоторые из них дифференцируются через предполагаемых предшественников кардиомиоцитов (прекардиальную мезодерму), в CM. Кроме того, PSC могут дифференцироваться практически во все типы клеток, составляющих органы. По данной причине технически трудно обеспечить дифференциацию PSC до отдельного ограниченного типа клеток, т.е. только до CM, путем простой индукции дифференциации PSC. Кроме того, в нефизиологических условиях (т.е. в условиях in vitro) трудно индуцировать нужную дифференциацию PSC, а некоторые PSC могут оставаться недифференцированными после индукции дифференциации.
[0004] Таким образом, при индукции дифференциации SC в CM in vitro остаются разные факторы, оказывающие вредное воздействие при клинических применениях, включающих в себя трансплантацию: например, все PSC могут продуцировать в качестве побочного продукта клетки других типов, отличные от CM, а некоторые PSC могут оставаться недифференцированными. В частности, оставшиеся недифференцированные SC обладают пролиферативной активностью и могут дифференцироваться в широкий ряд клеток; следовательно, если в клетках, трансплантированных в организм с целью лечения, остались недифференцированные SC, существует очень высокий риск образования тератом из недифференцированных SC (непатентный документ 1 (Miura, et al., Nature Biotech., 743-745, 2009)). В силу описанных причин CM-содержащие клеточные массы, полученные после индукции диференциации PSC, опасно трансплантировать в организм, как есть, и использовать в терапевтических целях. Таким образом, чтобы обеспечить безопасное проведение способов лечения с использованием CM, полученных из PSC, и достичь идеальной эффективности указанных способов лечения, необходимо разработать способ полного устранения недифференцированных SC и получения высокоочищенных CM (т.е., способ устранения клеток других типов, отличных от CM).
[0005] К настоящему времени описано несколько способов устранения недифференцированных SC в условиях культивирования (непатентный документ 2 (Ben-David, et al., Cell Stem Cell, 2013 12, pp. 167-179), непатентный документ 3 (Wang, et al., Science, 325, 435-439, 2009)) и непатентный документ 4 (Shiraki, et al., Cell Metabolism, 2014, 19, 1-15). В непатентном документе 2 описано, что для поддержания человеческих недифференцированные PSC нужен олеат, и, что, допуская от противного, человеческие недифференцированные PSC можно селективно устранить путем ингибирования биосинтеза олеата в человеческих недифференцированных PSC. В непатентном документе 3 описано, что мышиные ESC можно инокулировать в культуральные среды, полученные путем удаления одной из аминокислот, отличных от треонина, но нельзя инокулировать в культуральную среду, лишенную треонина, и что мышиные недифференцированные ESC можно селективно устранить путем культивирования их в культуральной среде, не содержащей треонина. В непатентном документе 4 описано, что метионин играет такую же роль в отношении человеческих PSC, что и треонин в отношении мышиных ESC, и что человеческие недифференцированные SC можно селективно устранить в культуральной среде, не содержащей метионин, в которой недифференцированные SC погибают или дифференцируются.
[0006] Однако способы, раскрытые в указанных документах, позволяют устранить недифференцированные PSC, но не позволяют устранить отличные от кардиомиоцитов клетки (клетки, отличные от CM), которые образуются в результате дифференциации PSC в клетки других типов, отличных от CM. Кроме того, в способах, описанных в непатентных документах 3 и 4, удаляют некоторые необходимые аминокислоты, которые очень важны для белкового синтеза, поэтому существует опасность, что отсутствие данных аминокислот может оказывать влияние на целевые выжившие клетки.
[0007] Вследствие вышесказанного исследовательская группа, включающая в себя авторов настоящего изобретения, сосредоточила свое внимание не на незаменимых аминокислотах, которые очень важны для синтеза белка, а на заменимых аминокислотах, которые могут синтезироваться или поставляться из других источников, и провела исследования по достижению эффективного устранения не только недифференцированных SC, остающихся при отсутствии стимуляции дифференцировки, когда индуцируют дифференциацию PSC в CM, но и клеток, отличных от CM, которые образуются в качестве побочного продукта индукции дифференциации CM. В результате группа авторов изобретения обнаружила специфические физиологические характеристики, которыми обладают CM, но не клетки других типов, и разработала способ отделения CM от отличных от CM клеток и недифференцированных SC с использованием указанных физиологических характеристик.
[0008] Патентный документ 1: способ выделения CM из CM-содержащей клеточной смеси без генетического изменения CM на основе относительного содержания митохондрий в клетках и/или относительного митохондриального трансмембранного потенциала клеток; способ обогащения кардиомиоцитами клеточной смеси, содержащей CM, без генетического изменения CM; способ получения CM без генетического изменения CM; и способ определения доли CM в CM-содержащей смеси клеток (WO 2006/022377);
патентный документ 2: CM, полученные из ESC, можно эффективно выделить и очистить с достижением высокой степени чистоты путем культивирования CM в культуральной среде, имеющей следующие характеристики: низкое содержание сыворотки, низкое содержание глюкозы, низкое содержание питательных веществ, низкое содержание кальция, слабо кислое значение pH, присутствие лактата, присутствие аспартата/глутамата и/или присутствие пирувата (WO 2007/088874);
патентный документ 3: способ получения клеточных масс CM из PSC, включающий в себя культивирование очищенных CM, полученных из PSC путем диссоциации агрегированных клеточных масс, содержащих CM, образованные в результате дифференциации индуцированных PSC, на отдельные клетки, в культуральной среде в отсуствии сыворотки, в процессе чего происходит повторная агрегация очищенных CM (WO 2009/017254);
патентный документ 4: способ, включающий в себя высокоэффективную индукцию гибели клеток, отличных от CM, путем добавления вещества, которое заведомо обладает физической токсичностью или способностью индуцировать клеточную гибель в отношении PSC или клеток, отличных от CM, в условиях культивирования (WO 2010/114136); и
патентный документ 5: способ измерения потенциала действия культивируемых CM, который включает в себя приведение в контакт потенциал-чувствительного флуорохрома с CM, культивируемыми в культуральной среде, добавление витамина E и/или холестерина в культуральную среду, и измерение изменения интенсивности флуоресценции потенциал-чувствительного флуорохрома, зависящего от изменения потенциала или ионной силы (WO 2011/052801).
[0009] Важное значение имеет открытие, описанное в патентном документе 2, заключающееся в том, что CM в высокой степени устойчивы к культивированию в условиях, которые обычно считаются тяжелыми для культивирования клеток (например, низкое содержание глюкозы, низкое содержание сыворотки, слабокислое значение pH, низкое содержание кальция, низкое содержание питательных веществ, присутствие лактата, присутствие аспартата/глутамата и/или присутствие пирувата), и что в таких условиях выживют только CM, а другие клетки (т.е., клетки, отличные от CM, и недифференцированные SC) гибнут, что позволяет выделить CM. Кроме того, поскольку исследование, проведенное на мышиных PSC, демонстрирует, что среди вышеуказанных условий низкое содержание глюкозы и присутствие лактата вносят наиболее значительный вклад в отбор CM, проводят исследование, чтобы определить, можно ли использовать условия, характеризующиеся низким содержанием глюкозы и присутствием лактата, для отбора CM, полученных из человеческих PSC (hPSC).
[0010] Однако исследование, проведенное на CM, полученных из hPSC, демонстрирует, что в условиях культивирования, характеризующихся низким содержанием глюкозы и присутствием лактата, можно устранить недифференцированные SC и выбрать CM, но устранение недифференцированных SC занимает время и в условиях клинического применения, когда используются сотни миллионов клеток, существует высокая вероятность того, что недифференцированные SC будут присутствовать в смеси с CM. Соответственно, существует потребность в системе, которая способствовала бы более полному устранению недифференцированных SC в течение более короткого периода времени.
[0011] Основным источником энергии, необходимой для выживания клеток, является ATP, продуцирующийся посредством разных механизмов, в основе которых лежат реакции катаболизма глюкозы. Известно, что пути продукции ATP, основанные на реакциях катаболизма глюкозы, в основном состоят из: гликолитической системы, которая обеспечивает деградацию глюкозы, поступившей в клетки, до пирувата; цикла TCA (цитратный цикл), в котором используется ацетил-КоА, образующийся при деградации пирувата; и системы переноса электронов, которая участвует в образовании ATP из NADH, NADPH и FADH2, образовавшихся в гликолитической системе и цикле TCA.
[0012] Как правило, необходимым условием получения энергии является поглощение клетками глюкозы из окружающей среды. Если клетки получают энергию с использованием данного условия, активируется гликолитическая система, которая обеспечивает деградацию глюкозы, после чего цикл TCA (цитратный цикл) и система переноса электронов обеспечивают выработку энергии. Если требуется быстрое получение энергии, активируется анаэробное дыхание с использованием только гликолитической системы; при этом продукция пирувата превосходит его потребление, что приводит к активации пути ферментативного расщепления лактата. С другой стороны, практически отсутствует активация обратной реакции, включающей в себя превращение лактата в пируват.
СПИСОК ЛИТЕРАТУРЫ
ПАТЕНТНЫЕ ДОКУМЕНТЫ
[0013] [Патентный документ 1] WO 2006/022377
[Патентный документ 2] WO 2007/088874
[Патентный документ 3] WO 2009/017254
[Патентный документ 4] WO 2010/114136
[Патентный документ 5] WO 2011/052801
НЕПАТЕНТНЫЕ ДОКУМЕНТЫ
[0014] [Непатентный документ 1] Miura et al., Nature Biotech., 743-745, 2009
[Непатентный документ 2] Ben-David, et al., Cell Stem Cell, 2013 12, pp.167-179
[Непатентный документ 3] Wang, et al., Science, 325, 435-439, 2009
[Непатентный документ 4] Shiraki, et al., Cell Metabolism, 2014, 19, 1-15
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
[0015] Как указано выше, в соответствии с патентным документом 2, при культивировании клеток в условиях низкого содержания глюкозы и присутствия лактата выживает лишь небольшое число клеток, отличных от CM, или недифференцированных SC, в зависимости от условий. Следовательно, существует потребность в поиске новых условий, которые могли бы сделать возможным устранение недифференцированных SC в течение более короткого времени и, следовательно, индуцировать более полную гибель клеток, отличных от CM, или недифференцированных SC, и обеспечить выделение одних CM.
РЕШЕНИЕ ЗАДАЧИ
[0016] Для достижения вышеуказанных целей настоящее изобретение предлагает: среду для культивирования клеток, способную индуцировать гибель недифференцированных SC, где среда для культивирования клеток содержит профиль аминокислот, в котором отсутствует глутамин; и способ индуцирования гибели недифференцированных SC путем культивирования клеток в указанной среде. Кроме того, настоящее изобретение предлагает: среду для культивирования клеток, которую можно использовать для отбора CM, где среда для культивирования клеток содержит жирную кислоту, лактат или пируват, не содержит сахар, и содержит профиль аминокислот, в котором отсутствует глутамин; а также способ отбора CM путем культивирования смеси CM и клеток, отличных от CM, в указанной среде для культивирования клеток.
ПОЛЕЗНЫЕ ЭФЕКТЫ ИЗОБРЕТЕНИЯ
[0017] В первом аспекте настоящее изобретение предлагает среду для культивирования клеток, которую можно использовать для индукции гибели недифференцированных SC; где гибель недифференцированных SC легко индуцируется путем простого культивирования в указанной среде. Во втором аспекте настоящее изобретение предлагает среду для культивирования клеток, которую можно использовать для отбора CM; где путем простого культивирования в указанной среде можно легко индуцировать гибель не только недифференцированных SC, таких как PSC, включающие в себя человеческие ESC (hESC) и человеческие iPSC (hiPSC), но и дифференцированных клеток, отличных от CM, и клеток стабильных линий, описанных ниже, и, следовательно, провести отбор CM.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0018] На фиг. 1 показано изменение в среде концентраций аминокислот и глюкозы, потребляемых при культивировании 2,5×105 hESC в течение 3 дней. Концентрации аминокислот и глюкозы в среде на 0 день, до добавления клеток, принимают за 100%.
На фиг. 2 показаны результаты наблюдения окрашивания щелочной фосфатазой (ALP) hESC, культивированных в разных условиях (в присутствии/отсутствии глюкозы, в присутствии/отсутствии лактата, и в отсутствии одной из ряда заменимых аминокислот, характеризующихся высоким уровнем потребления в соответствии с результатами, приведенными на фиг. 1).
На фиг. 3 показаны результаты наблюдения выживания или гибели hESC, культивированных в разных условиях (в присутствии/отсутствии глюкозы, в присутствии/отсутствии лактата, и в отсутствии одной из ряда заменимых аминокислот, характеризующихся высоким уровнем потребления в соответствии с результатами, приведенными на фиг. 1).
На фиг. 4 показаны результаты наблюдения окрашивания щелочной фосфатазой (ALP) hiPSC, культивированных в разных условиях (в присутствии/отсутствии глюкозы, в присутствии/отсутствии лактата, и в отсутствии одной из ряда заменимых аминокислот, характеризующихся высоким уровнем потребления в соответствии с результатами, приведенными на фиг. 1).
На фиг. 5 показаны результаты наблюдения окрашивания щелочной фосфатазой (ALP) hESC, культивированных в разных условиях, включающих в себя отсутствие глюкозы и отсутствие одной из ряда аминокислот.
На фиг. 6 показаны результаты наблюдения выживания или гибели мышиных неонатальных CM, культивированных в разных условиях (в присутствии/отсутствии глюкозы, в присутствии/отсутствии лактата, и в отсутствии одной из ряда заменимых аминокислот, характеризующихся высоким уровнем потребления в соответствии с результатами, приведенными на фиг. 1).
На фиг. 7 показаны фотографии клеточных масс, полученных путем индукции двухмерной дифференциации hiPSC в CM и последующего культивирования в среде, содержащей лактат и не содержащей глюкозу (Gluc-, All+, Лактат+) или в среде, содержащей лактат и не содержащей глюкозу и глутамин (Gluc-, Gln-, Лактат+).
На фиг. 8 показано, что, если клеточные массы, изображенные на фиг. 7, подвергнуть диссоциации с использованием EDTA, содержащей 0,25% трипсина, с последующим культивированием в чашках для культивирования, покрытых фибронектином, выживают только CM. B: Большая часть α-актинин-положительных CM являются положительными по тропонину I. C: Приведены результаты, подтверждающие, что после оптимизации и очистки с использованием среды, содержащей лактат и не содержащей глюкозу и глутамин (Gluc-, Gln-, Лактат+), недифференцированные SC, положительные по Tra1-60, совсем не выживают.
На фиг. 9 показаны результаты анализа методом QPCR оставшихся недифференцированных SC после индукции дифференциации в CM, или после оптимизации и очистки. Lin28 детектируют после оптимизации и очистки с использованием среды, содержащей глутамин и лактат и не содержащей глюкозу (Gluc-, All+, Лактат+), однако Lin28 совсем не детектируется после оптимизации и очистки с использованием среды, содержащей лактат и не содержащей глюкозу и глутамин (Gluc-, Gln-, Лактат+).
На фиг. 10 показано различие в метаболизме лактата в мышиных неонатальных CM и hESC в условиях культивирования в отсутствии глюкозы и глутамина. Метаболизм лактата можно анализировать путем обработки клеточных образцов культуральной средой, содержащей 13C-меченный лактат, с последующим количественным определением метаболитов, образующихся в цикле TCA и биосинтезе глутамата. На фиг. 10A показана схематическая карта метаболического пути, в котором участвует лактат. Обнаружено, что общее количество метаболитов лактата, образовавшихся в цикле TCA, значительно выше в CM. Кроме того, метку 13C обнаруживают в значительно больших количествах в составе 2-оксоглутарата и глутамата в CM. Приведенные выше результаты свидетельствуют о том, что в CM лактат вносит гораздо больший вклад в биосинтез глутамата. *p<0,05, **p<0,01.
На фиг. 11 показаны результаты определения методом FACS процента тропонин T-положительных клеток в совокупности клеток, полученной после индукции дифференциации hiPSC.
На фиг. 12 показаны результаты наблюдения окрашивания щелочной фосфатазой (ALP) hESC, культивированных в разных условиях (в отсутствии глюкозы, в присутствии/отсутствии глутамина, в присутствии/отсутствии α-кетоглутарата и в присутствии/отсутствии пирувата).
На фиг. 13 показаны результаты наблюдения выживания или гибели мышиных неонатальных CM, культивированных в разных условиях (в отсутствии глюкозы, в присутствии/отсутствии глутамина, в присутствии/отсутствии пирувата и в присутствии/отсутствии лактата).
На фиг. 14A показаны результаты определения чувствительности метода детекции оставшихся недифференцированных SC (Tano, et al., PLOS ONE, 2014). На фиг. 14B показаны результаты определения присутствия оставшихся недифференцированных SC после индукции дифференциации в CM или после оптимизации и очистки с помощью метода, результаты тестирования которого приведены на фиг. 14A. TRA1-60, маркер, используемый для детекции недифференцированных SC, обнаруживают после оптимизации и очистки с использованием среды, содержащей лактат и глутамин и не содержащей глюкозу (Gluc-, Gln+, Lac+), однако TRA1-60 не обнаруживают после оптимизации и очистки с использованием среды, содержащей лактат и не содержащей глюкозу и глутамин (Gluc-, Gln-, Лактат+).
На фиг. 15 показаны результаты наблюдения выживания или гибели клеток, полученных из hESC (в результате пролиферации) и отличных от CM, культивированных в условиях отсутствия глюкозы и присутствия глутамина, и в условиях отсутствия глюкозы и глутамина и присутствия лактата.
На фиг. 16 показаны результаты наблюдения разных групп hiPSC, культивированных в каждой из сред, содержащих лактат и не содержащих глюкозу и глутамин (Gluc-, Gln-, Lac+), и дополнительно содержащих аскорбат (25 мг/л) или альбумин (0,1%).
На фиг. 17 показаны результаты наблюдения разных групп клеток, полученных из hiPSC и отличных от CM, культивированных в каждой из сред, содержащих лактат и не содержащих глюкозу и глутамин (Gluc-, Gln-, Lac+), и дополнительно содержащих аскорбат (25 мг/л) или альбумин (0,1%).
На фиг. 18 показаны результаты наблюдения разных групп CM, полученных из hiPSC, культивированных в каждой из сред, содержащих лактат и не содержащих глюкозу и глутамин (Gluc-, Gln-, Lac+), и дополнительно содержащих аскорбат (25 мг/л) или альбумин (0,1%).
На фиг. 19 показаны результаты наблюдения разных групп CM, полученных из hiPSC, культивированных в течение 744 часов в каждой из сред, содержащих лактат и не содержащих глюкозу и глутамин (Gluc-, Gln-, Lac+), и дополнительно содержащих аскорбат (25 мг/л) или альбумин (0,1%).
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0019] Гликолитическая система является фундаментальной системой получения энергии, присутствующей в большинстве организмов, и представляет собой метаболический путь, в котором глюкоза анаэробно деградирует до пирувата или лактата. В организме животных в качестве первой реакции глюкоза фосфорилируется γ-фосфатной группой ATP, или в результате активации гликогенолиза образуется глюкоза-6-фосфат. Затем глюкозо-6-фосфат последовательно метаболизируется до фруктозо-1,6-бифосфата, который расщепляется до триозофосфата, после чего триозофосфат превращается в пируват и при этом образуется ATP. В данном процессе на моль глюкозы образуется 2 моля ATP и восстанавливается 2 моля NAD+ с образованием 2 молей NADH. Конечный продукт данного метаболического пути, пируват, превращается в лактат и высвобождается из клеток, или транспортируется в митохондрии, где используется в качестве субстрата в цитратном цикле.
[0020] Цикл трикарбоновой кислоты (цикл TCA или цитратный цикл) представляет собой метаболический путь в конечном счете полного окисления углеродного скелета сахаров, жирных кислот, многих аминокислот и т.п. Например, конечный продукт гликолитической системы, пируват, деградирует с образованием ацетил-КоА, после чего ацетил-КоА вступает в реакцию конденсации с оксалоацетатом с образованием цитрата. Затем цитрат превращается посредством последовательных реакций (через цис-аконитрат) в изоцитрат, который подвергается дегидродекарбоксилированию с образованием 2-оксоглутарата. Затем 2-оксоглутарат последовательно подвергается реакциям дегидродекарбоксилирования, отщепления CoA, дегидрирования, гидратации, дегидрирования, а также другим реакциям с образованием сукцинил-CoA, сукцината, фумарата, малата и, в конечном счете, оксалоацетата. На одной стадии цикла TCA ацетильные группы в ацетил-КоА полностью окисляются; в результате деградации одной молекулы ацетил-КоА высвобождается две молекулы CO2, образуется три молекулы NADH, одна молекула восстановленного FAD и одна молекула GTP.
[0021] Однако цикл TCA является не только процессом деградации, но и регулятором, переключающим метболические системы сахаров, аминокислот и жирных кислот с одной на другую, а также служит важной исходной точкой для ассимиляторных процессов метаболизма. Например, по мере протекания гликолиза концентрации цитрата и других метаболитов становятся высокими и активируется ацетил-КоА-карбоксилаза, в результате чего функционирование цикла TCA подавляется до определенного предела и ацетил-КоА направляется на синтез жирных кислот. Кроме того, например, оксалоацетат трансформируется в аспартат. Таким образом, поскольку промежуточные соединения цикла TCA переводятся на биосинтез разных органических веществ, количество оксалоацетата, продуцируемого в одном цикле TCA, обычно уменьшается. Следовательно, чтобы поддержать устойчивое функционирование цикла TCA, требуются отдельные системы пополнения оксалоацетата; примеры таких систем включают в себя: (наряду с отдельными системами деградации аланина, глицина, цистеина, серина и треонина до пирувата) систему деградации пирувата под действием пируваткарбоксилазы с получением оксалоацетата; систему трансаминирования аспартата под действием аспартаттрансаминазы с получением оксалоацетата; систему деградации фенилаланина и тирозина с получением фумарата; и систему деградации аргинина, глутамина, гистидина и пролина до глутамата с последующим окислением глутамата под действием глутаматдегидрогеназы с получением 2-оксоглутарата.
[0022] В системах получения энергии, присутствующих в животных клетках, атомы волорода и электроны, образующиеся в разных реакциях гидрирования, участвующих в гликолитической системе и цикле TCA, как описано выше, транспортируются в митохондрии донорами электронов, такими как NADH, NADPH или FADH2, и передаются ряду окислительно-восстановительных ферментов, т.е. оксидоредуктаз (в виде комплексов), и переносчикам электронов (таким как цитохромы), присутствующим на внутренней мембране митохондрий. Ферменты восстанавливаются переносчиками электронов, переносящими атомы водорода и электроны, с образованием молекул воды. В данном процессе ионы H+ транспортируются через мембрану в одном направлении, создавая разность электрохимических потенциалов ионов H+, и, наконец, с использованием указанной разности электрохимических потенциалов синтезируются высокоэнергетические фосфатные связи, присутствующие, например, в ATP.
[0023] Поскольку при культивировании клеток в разных известных условиях, описанных в патентном документе 2, могут оставаться в небольших количествах выжившие клетки, отличные от CM, или недифференцированные SC, авторы настоящего изобретения провели интенсивные исследования, направленные на обнаружение новых условий, позволяющих достичь более полную гибель клеток, отличных от CM, или недифференцированных SC, в течение более короткого периода времени, с целью выделения исключительно CM.
[0024] Вначале авторы изобретения исследовали аминокислоты, активно потребляемые hPSC, путем измерения концентраций аминокислот в свежей культуральной среде и в культуральной среде после ее применения для культивирования клеток. В результате было обнаружено, что hPSC, как правило, потребляют серин (Ser), глутамин (Gln), аргинин (Arg) и цистин (Cys2) на высоком уровне. Также было обнаружено, что потребление лейцина (Leu), метионина (Met) и триптофана (Trp) является относительно высоким (фиг. 1). Однако, поскольку известно, что отсутствие незаменимых аминокислот, необходимых для синтеза белков, как описано в патентных документах 3 и 4, может влиять на предполагаемое выживание клеток, авторы настоящего изобретения предприняли дополнительные исследования, направленные на заменимые аминокислоты, которые могут синтезироваться или поставляться из других источников.
[0025] В результате культивирования hESC или hiPSC в присутствии глюкозы и разных аминокислот, было обнаружено, что после культивирования hESC или hiPSC в культуральной среде, содержащей глюкозу (Gluc), но не содержащей серин (Ser), глицин (Gly), глутамин (Gln) или аргинин (Arg), число колоний hESC или hiPSC уменьшается (фиг. 2A и 4A). Кроме того, анализ влияния условий культивирования на число колоний hESC/hiPSC демонстрирует, что в условиях культивирования, включающих в себя отсутствие глюкозы, глутамин (Gln), серин (Ser), глицин (Gly) и аргинин (Arg) в указанном порядке оказывают наиболее мощный эффект (фиг. 3B).
[0026] На основе полученных результатов авторы изобретения обнаружили, что, в соответствии с настоящим изобретением, при проведении культивирования в культуральной среде, в аминокислотном профиле которой отсутствует глутамин (Gln-), индуцируется гибель недифференцированных SC, таких как PSC, включающие в себя hESC и hiPSC, а также дифференцированных клеток, отличных от CM, как указано ниже; таким образом авторы данного изобретения завершили настоящее изобретение.
[0027] Соответственно, в первом аспекте настоящее изобретение предлагает среду для культивирования клеток, в профиле аминокислот которой отсутствует глутамин (Gln-). В соответствии с вышеуказанными результатами, среда для культивирования клеток, предлагаемая в первом аспекте данного изобретения, может дополнительно характеризоваться отсутствием серина и/или глицина (Ser-, Gly-), а также отсутствием аргинина (Arg-). Конкретные примеры среды для культивирования клеток, подходящей для применения в настоящем изобретении, включают в себя, без ограничения:
- среду для культивирования клеток, в аминокислотном профиле которой отсутствует глутамин (Gln-);
- среду для культивирования клеток, в аминокислотном профиле которой отсутствуют глутамин и серин (Gln-, Ser-);
[0028]- среду для культивирования клеток, в аминокислотном профиле которой отсутствуют глутамин и глицин (Gln-, Gly-);
- среду для культивирования клеток, в аминокислотном профиле которой отсутствуют глутамин, серин и глицин (Gln-, Ser-, Gly-);
- среду для культивирования клеток, в аминокислотном профиле которой отсутствуют глутамин и аргинин (Gln-, Arg-);
- среду для культивирования клеток, в аминокислотном профиле которой отсутствуют глутамин, серин и аргинин (Gln-, Ser-, Arg-);
- среду для культивирования клеток, в аминокислотном профиле которой отсутствуют глутамин, глицин и аргинин (Gln-, Gly-, Arg-); и
- среду для культивирования клеток, в аминокислотном профиле которой отсутствуют глутамин, серин, глицин и аргинин (Gln-, Ser-, Gly-, Arg-).
[0029] Все вышеупомянутые аминокислоты связаны с метаболизмом сахаров и циклом TCA, как описано выше в разделе, озаглавленном "ОБЛАСТЬ ТЕХНИКИ". Глутамин деградирует до глутамата, который затем окисляется глутаматдегидрогеназой до 2-оксоглутарата, который вводится в цикл TCA. Серин и глицин оба деградируют до пирувата, который затем расщепляется пируваткарбоксилазой с получением оксалоацетата, который вводится в цикл TCA.
[0030] Вышеуказанная среда для культивирования клеток, предлагаемая в первом аспекте настоящего изобретения, представляет собой культуральную среду, не содержащую сыворотку или средство, альтернативное сыворотке, причем другие компоненты среды настоящего изобретения, помимо конкретных аминокислот (т.е. глутамина, серина и/или глицина, или аргинина), могут совпадать с компонентами традиционной среды для культивирования клеток (такой как среда Игла, модифицированная по Дульбекко (DMEM), культуральная среда MEM (например, α-MEM, MEM [BSS Хэнкса]), культуральная среда RPMI (например, RPMI 1640), культуральная среда F12, StemPro34 и mTeSR1).
[0031] В соответствии с результатами исследований, проведенных авторами настоящего изобретения, вышеуказанные среды для культивирования клеток, имеющие уникальные аминокислотные профили, можно использовать для индукции гибели недифференцированных SC, а также дифференцированных клеток, отличных от CM, как описано ниже. Однако, чтобы обеспечить более эффективную индукцию гибели клеток, к вышеуказанным условиям, связанным с аминокислотным профилем, добавляют низкое содержание глюкозы (Gluc-), которое соответствует отсутствию сахара.
[0032] В данном документе термин "недифференцированные стволовые клетки (SC)" относится к стволовым клеткам, обладающим плюрипотентностью или мультипотентностью, которые часто используют в области техники, к которой принадлежит настоящее изобретение, и которые включают в себя ESC, все другие типы PSC (например, iPSC), имеющие такие же характерные признаки, как и ESC, и мультипотентные SC, обнаруженные среди клеток органов/тканей, клеток костного мозга и клеток крови взрослых млекопитающих. Приведенная выше фраза "такие же характерные признаки, как и у ESC" может относится к биологическим признакам, специфичным для ESC, таким как присутствие поверхностных (антигенных) маркеров, специфичных для ESC, экспрессия ESC-специфичных генов, или способность к образованию тератом, или способность к генерированию химерных мышей. В данном изобретении недифференцированные SC предпочтительно представляют собой PSC.
[0033] Недифференцированные SC также можно определить по наличию у них уникальных клеточных маркеров, таких как OCT3/4, NANOG, TRA1-60, TRA1-81, SSEA-3 и SSEA-4.
[0034] Что касается получения CM из PSC, полагают, что в процессе дифференциации PSC превращаются в недифференцированную мезодерму, затем в кардиальную мезодерму (или в предшественников кардиомиоцитов) и после этого дифференцируются в CM. Следовательно, термин "кардиомиоциты (CM)", в соответствии с данным изобретением включает в себя все типы клеток, образующихся в результате индукции дифференциации недифференцированных SC в CM, и охватывает всю недифференцированную мезодерму, кардиальную мезодерму (или предшественники кардиомиоцитов), а также образующиеся в конечном счете кардиомиоциты. Упомянутая выше "недифференцированная мезодерма" включает в себя клетки, экспрессирующие белки брахиурии, специфичные для недифференцированной мезодермы. Термин "кардиальная мезодерма (или предшественники кардиомиоцитов)" относится к клеткам, которые экспрессируют такие белки, как Mesp-1, специфичные для мезодермы, дифференцирующейся в ткани сердца, но еще не экспрессируют CM-специфичные белки, такие как Nkx2.5 и актинин, и которые обладают способностью дифференцироваться исключительно в CM, без необходимости в последующей дополнительной индукции. Кроме того, термин "кардиомиоциты" относится к живым клеткам, способным к спонтанному биению, или к иммобилизованным клеткам, экспрессирующим такие маркеры, как Nkx2.5, GATA4 и актинин.
[0035] В эбриональном периоде концентрация жирных кислот в крови составляет 0,1 мМ или менее, а концентрация лактата в крови находится в диапазоне 5-7 нМ; поэтому CM используют лактат в качестве основного источника энергии (Tohyama S., et al., Cell Stem Cell., 2013;12:127-137). В постнатальном периоде концентрация жирных кислот в крови увеличивается до 0,2-0,4 мМ, а концентрация лактата в крови уменьшается до 0,5 мМ; поэтому CM используют жирные кислоты в качестве основного источника энергии (Lopaschuk G.D., et al., Am J Physiol., 1991; 261:H1698-1705; Werner J.C., et al., 1987;22:552-556; Medina J.M., Biol Neonate., 1985;48:237-244; Lopaschuk G.D., et al., J Cardiovasc Pharmacol., 2010;56:130-140). Если постнатальные CM подвергаются стрессу вследствие ишемии, перегрузки давлением и др., характер экспрессии генов в них меняется на эмбриональный и они становятся способны использовать лактат в качестве основного источника энергии, как фетальные CM. Как правило, "кардиомиоциты (CM)", в отличие от клеток других типов, имеют общую характерную особенность, заключающуюся в том, что они могут использовать в качестве источника энергии лактат, пируват и жирные кислоты вместо глюкозы. И в настоящем изобретении такую характерную особенность, свойственную только CM, но не клеткам других типов, используют для очистки CM. Таким образом, термин "CM", используемый в данном изобретении, не ограничивается их происхождением или способом их получения. Примеры CM включают в себя, без ограничения: "CM", полученные путем индукции дифференциации PSC; "CM", собранные от человеческих зародышей, новорожденных и взрослых людей; "CM", собранные зародышей, новорожденных и взрослых особей животных, относящихся к млекопитающим; и "CM", полученные в результате непосредственного перепрограммирования дифференцированных клеток, отличных от CM.
[0036] В данном документе термин "клетки стабильных линий" относится к иммортализованным клеткам, способным к само-репликации в условиях культивирования клеток.
[0037] В настоящем изобретении, если среду для культивирования клеток определяют как "не содержащую" одну из конкретных аминокислот (например, серин, глицин, глутамин или аргинин) и/или сахар, желательно, чтобы в конечном счете культуральная среда совсем не содержала указанных компонентов, однако для достижения цели настоящего изобретения не является необходимым, чтобы культуральная среда была лишена указанных компонентов на 100%, и содержание указанных аминокислот в среде в следовых количествах является приемлемым. Приемлемым является такое содержание конкретных аминокислот и сахара, которое при культивировании клеток в данных условиях индуцирует гибель и обеспечивает отсутствие пролиферации недифференцированных SC, клеток, отличных от CM, и клеток стабильных линий. Например, содержание конкретных аминокислот или сахара в среде для культивирования клеток настоящего изобретения может составлять менее 10%, предпочтительно менее 5%, более предпочтительно менее 1% от содержания данных компонентов в коммерчески доступной культуральной среде, традиционно используемой для культивирования клеток. В качестве примеров можно привести такие среды, как
- среда Игла, модифицированная по Дульбекко (DMEM, Sigma-Aldrich), которая представляет собой культуральную среду, содержащую 0,042 г/л L-серина, 0,03 г/л глицина, 0,584 г/л L-глутамина, 0,84 г/л или 0,084 г/л L-аргинина HCl и 4,5-10 г/л сахара (D-глюкозы);
- среда F-12 (Sigma-Aldrich), которая представляет собой культуральную среду, содержащую 0,02102 или 0,0105 г/л L-серина, 0,015014 г/л или 0,00751 г/л глицина, 0,1460-2922 г/л L-глутамина, 0,4214 или 0,211 г/л L-аргинина HCl и 1,26-1,802 г/л сахара (D-глюкозы); и
- среда RPMI 1640 (Sigma-Aldrich), которая представляет собой культуральную среду, содержащую 0,03-0,3 г/л L-серина, 0,01-0,1 г/л глицина, 0,3 г/л L-глутамина, 0,2-2 г/л L-аргинина и 2,0-20,0 г/л сахара (D-глюкозы). Таким образом, если культуральную среду определяют, как "не содержащую" одну из конкретных аминокислот и/или сахар, это означает, что с учетом приведенного выше химического состава коммерческой культуральной среды, традиционно используемой для культивирования клеток, содержание указанных компонентов должно составлять менее 10%, предпочтительно менее 5%, более предпочтительно менее 1% от их содержания в коммерческой среде. Кроме того, термин "сахар" в соответствии с данным документом охватывает все сахара (т.е. полисахариды и моносахариды (такие как глюкоза, галактоза, фруктоза, манноза)), которые могут входить в состав культуральных сред.
[0038] В соответствии с описанным выше первым аспектом настоящего изобретения, гибель недифференцированных SC можно индуцировать путем культивирования клеток в среде для культивирования, в аминокислотном профиле которой отсутствует глутамин, или в среде для культивирования клеток, в аминокислотном профиле которой отсутствуют глутамин, а также серин и глицин, или в среде для культивирования клеток, в аминокислотном профиле которой отсутствуют глутамин, серин и глицин, а также аргинин; и, как следствие, авторы настоящего изобретения раскрывают способ индуцирования гибели недифференцированных SC.
[0039] В первом аспекте настоящего изобретения, чтобы индуцировать гибель недифференцированных SC, культивирование клеток в одном из вышеописанных условий, включающих в себя отсутствие конкретных аминокислот, продолжают в течение 12-360 часов, предпочтительно 24-240 часов, более предпочтительно 48-120 часов.
[0040] Как указано выше, если разные условия культивирования CM, описанные в патентном документе 2, применяют к человеческим клеткам, выжившие клетки, отличные от CM, или недифференцированные SC могут присутствовать в небольших количествах, в зависимости от условий. Соответственно, авторы настоящего изобретения предпринимают исследование, чтобы определить, можно ли осуществить более эффективный отбор CM путем объединения результатов по условиям культивирования, обеспечивающим селективное получение CM, описанным в патентном документе 2, с результатами по условиям культивирования, обеспечивающим индукцию гибели недифференцированные SC, полученными в первом аспекте настоящего изобретения.
[0041] В результате было обнаружено, что и в случае человеческих клеток отбор CM можно осуществить более эффективно с использованием, среди разных условий культивирования, описанных в патентном документе 2, условия с низким содержанием глюкозы и присутствием лактата, пирувата или жирной кислоты, которые могут случить источниками энергии для CM, и путем объединения указанных выбранных условий с условиями культивирования, обеспечивающими индукцию гибели недифференцированных SC, описанными выше в данном документе.
[0042] На основе полученных результатов авторы настоящего изобретения обнаружили, что, в соответствии с настоящим изобретением, путем культивирования клеток в культуральной среде, содержащей жирную кислоту, лактат или пируват, не содержащей сахар и имеющей аминокислотный профиль, в котором отсутствует глутамин (лактат+, Gluc-, Gln-; или Pyr+, Gluc-, Gln-), можно индуцировать гибель недифференцированных SC, таких как PSC, включающие в себя hESC и hiPSC, а также дифференцированных клеток, отличных от CM (фиг. 2B, 3B и 4B), и, следовательно, можно осуществить селективный отбор CM; таким образом авторы завершили настоящее изобретение.
[0043] Далее, с учетом того факта, что потребление Cys2 и Met является относительно высоким, авторы настоящего изобретения предприняли исследование, чтобы определить, можно ли достичь гибели недифференцированных SC (hESC) с использованием культуральной среды, которая содержит лактат и не содержит сахар (лактат+, Gluc-) и вышеупомянутые аминокислоты. В результате было обнаружено, что среда, содержащая лактат и не содержащая глюкозу и глутамин (лактат+, Gluc-, Gln-), среда, содержащая лактат и не содержащая глюкозу и Cys2 (лактат+, Gluc-, Cys2-), и среда, содержащая лактат и не содержащая глюкозу и Met (Лактат+, Gluc-, Met-) обладают способностью индуцировать гибель клеток, сравнимую с аналогичной способностью среды, содержащей лактат и не содержащей глюкозу и треонин (лактат+, Gluc-, Thr-), используемой в качестве контроля, причем среда, содержащая лактат и не содержащая глюкозу и глутамин (лактат+, Gluc-, Gln-), обладает наиболее высокой способностью индуцировать гибель клеток (фиг. 5). Полученные результаты позволяют предположить, что способность среды, не содержащей глюкозу и глутамин, устранять оставшиеся недифференцированные SC превосходит аналогичную способность сред, не содержащих треонин или метионин, описанных в непатентных документах 3 и 4.
[0044] Соответственно, во втором аспекте настоящее изобретение предлагает среду для культивирования клеток, характеризующуюся наличием лактата, пирувата или жирной кислоты (лактат+ или Pyr+), отсутствием глюкозы (Gluc-) и отсутствием глутамина в аминокислотном профиле (Gln-). Среда для культивирования клеток, в соответствии со вторым аспектом данного изобретения, дополнительно характеризуется отсутствием серина и/или глицина (Ser-, Gly-) и отсутствием аргинина (Arg-). Конкретные примеры сред для культивирования клеток, подходящих для применения в соответствии с настоящим изобретением, включают в себя, без ограничения:
- среду для культивирования клеток, характеризующуюся наличием лактата, низким содержанием сахара и отсутствием глутамина в аминокислотном профиле (лактат+, Gluc-, Gln-);
- среду для культивирования клеток, характеризующуюся наличием лактата, низким содержанием сахара и отсутствием глутамина и серина в аминокислотном профиле (лактат+, Gluc-, Gln-, Ser-);
- среду для культивирования клеток, характеризующуюся наличием лактата, низким содержанием сахара и отсутствием глутамина и глицина в аминокислотном профиле (лактат+, Gluc-, Gln-, Gly-);
- среду для культивирования клеток, характеризующуюся наличием лактата, низким содержанием сахара и отсутствием глутамина, серина и глицина в аминокислотном профиле (лактат+, Gluc-, Gln-, Ser-, Gly-);
- среду для культивирования клеток, характеризующуюся наличием лактата, низким содержанием сахара и отсутствием глутамина и аргинина в аминокислотном профиле (лактат+, Gluc-, Gln-, Arg-);
- среду для культивирования клеток that is supplemented with лактат, low in sugar, and free of глутамин, серин and аргинин в аминокислотном профиле (Лактат+, Gluc, Gln, Ser, Arg );
- среду для культивирования клеток, характеризующуюся наличием лактата, низким содержанием сахара и отсутствием глутамина, глицина и аргинина в аминокислотном профиле (лактат+, Gluc-, Gln-, Gly-, Arg-);
- среду для культивирования клеток, характеризующуюся наличием лактата, низким содержанием сахара и отсутствием глутамина, серина, глицина и аргинина в аминокислотном профиле (лактат+, Gluc-, Gln-, Ser-, Gly-, Arg-);
- среду для культивирования клеток, характеризующуюся наличием пирувата, низким содержанием сахара и отсутствием глутамина в аминокислотном профиле (Pyr+, Gluc-, Gln-);
- среду для культивирования клеток, характеризующуюся наличием пирувата, низким содержанием сахара и отсутствием глутамина и серина в аминокислотном профиле (Pyr+, Gluc-, Gln-, Ser-);
- среду для культивирования клеток, характеризующуюся наличием пирувата, низким содержанием сахара и отсутствием глутамина и глицина в аминокислотном профиле (Pyr+, Gluc-, Gln-, Gly-);
- среду для культивирования клеток, характеризующуюся наличием пирувата, низким содержанием сахара и отсутствием глутамина, серина и глицина в аминокислотном профиле (Pyr+, Gluc-, Gln-, Ser-, Gly-);
- среду для культивирования клеток, характеризующуюся наличием пирувата, низким содержанием сахара и отсутствием глутамина и аргинина в аминокислотном профиле (Pyr+, Gluc-, Gln-, Arg-);
- среду для культивирования клеток, характеризующуюся наличием пирувата, низким содержанием сахара и отсутствием глутамина, серина и аргинина в аминокислотном профиле (Pyr+, Gluc-, Gln-, Ser-, Arg-);
- среду для культивирования клеток, характеризующуюся наличием пирувата, низким содержанием сахара и отсутствием глутамина, глицина и аргинина в аминокислотном профиле (Pyr+, Gluc-, Gln-, Gly-, Arg-);
- среду для культивирования клеток, характеризующуюся наличием пирувата, низким содержанием сахара и отсутствием глутамина, серина, глицина и аргинина в аминокислотном профиле (Pyr+, Gluc-, Gln-, Ser-, Gly-, Arg-);
- среду для культивирования клеток, характеризующуюся наличием жирной кислоты, низким содержанием сахара и отсутствием глутамина в аминокислотном профиле;
- среду для культивирования клеток, характеризующуюся наличием жирной кислоты, низким содержанием сахара и отсутствием глутамина и серина в аминокислотном профиле;
- среду для культивирования клеток, характеризующуюся наличием жирной кислоты, низким содержанием сахара и отсутствием глутамина и глицина в аминокислотном профиле;
- среду для культивирования клеток, характеризующуюся наличием жирной кислоты, низким содержанием сахара и отсутствием глутамина, серина и глицина в аминокислотном профиле;
- среду для культивирования клеток, характеризующуюся наличием жирной кислоты, низким содержанием сахара и отсутствием глутамина и аргинина в аминокислотном профиле;
- среду для культивирования клеток, характеризующуюся наличием жирной кислоты, низким содержанием сахара и отсутствием глутамина, серина и аргинина в аминокислотном профиле;
- среду для культивирования клеток, характеризующуюся наличием жирной кислоты, низким содержанием сахара и отсутствием глутамина, глицина и аргинина в аминокислотном профиле;
- среду для культивирования клеток, характеризующуюся наличием жирной кислоты, низким содержанием сахара и отсутствием глутамина, серина, глицина и аргинина в аминокислотном профиле.
[0045] Среда для культивирования клеток настоящего изобретения может содержать аскорбат или альбумин, или тот и другой. Добавление аскорбата и/или альбумина не влияет на способность среды для культивирования клеток индуцировать гибель клеток.
[0046] Вышеупомянутая среда для культивирования клеток, предлагаемая во втором аспекте настоящего изобртеения, представляет собой культуральную среду, не содержащую сыворотку или средство, альтернативное сыворотке, при этом другие компоненты среды настоящего изобретения, помимо лактата, пирувата и жирной кислоты, глюкозы и отдельных аминокислот (т.е., глутамина, серина и/или глицина, или аргинина), могут совпадать с компонентами традиционной среды для культивирования клеток (такой как среда Игла, модифицированная по Дульбекко (DMEM), культуральная среда MEM (например, α-MEM, MEM [BSS Хэнкса]), культуральная среда RPMI (например, RPMI 1940), культуральная среда F12, StemPro34 и mTeSR1).
[0047] В соответствии с результатами исследований, проведенных авторами настоящего изобретения, упомянутая выше среда для культивирования клеток, имеющая уникальный аминокислотный профиль, может индуцировать гибель недифференцированныех SC, дифференцированных клеток, отличных от CM, и клеток стабильных линий, но не может индуцировать гибель CM. Следовательно, среду для культивирования клеток, предлагаемую во втором аспекте настоящего изобретения, можно использовать для выделения CM из клеточной смеси, содержащей CM и клетки, отличные от CM.
[0048] В настоящем изобретении под утверждением, что в среду для культивирования клеток добавляют лактат, подразумевают, что в используемую среду для культивирования клеток добавляют лактат до концентрации 0,1-10 мМ. Под утверждением, что в среду для культивирования клеток добавляют пируват, подразумевают, что в используемую среду для культивирования клеток добавляют пируват (пировиноградная кислота) до концентрации 0,1-10 мМ. Под утверждением, что в среду для культивирования клеток добавляют жирную кислоту, подразумевают, что в используемую среду для культивирования клеток добавляют среднецепочечную жирную кислоту (жирную кислоту, содержащую 5-12 атомов углерода) или длинноцепочечную жирную кислоту (жирную кислоту, содержащую более 12 атомов углерода). Например, можно добавить олеат, линолеат, пальмитат и т.п. в концентрации 0,05-0,5 мМ.
[0049] И наоборот, в отношении других компонентов, если среду для культивирования клеток определяют как "не содержащую" одну из конкретных аминокислот (например, серин, глицин, глутамин или аргинин) и/или сахар, желательно, чтобы в конечном счете культуральная среда совсем не содержала указанных компонентов, однако для достижения цели настоящего изобретения не является необходимым, чтобы культуральная среда была лишена указанных компонентов на 100%.
[0050] В соответствии со вторым аспектом настоящего изобретения гибель клеток, отличных от CM, можно индуцировать путем проведения культивирования клеток в культуральной среде, которая содержит лактат, пируват или жирную кислоту, не содержит глюкозу и не содержит глутамин в аминокислотном профиле, или в среде, которая содержит лактат/пируват/жирную кислоту, не содержит глюкозу и не содержит глутамин, а также серин и глицин в аминокислотном профиле, или в среде, которая содержит лактат/пируват/жирную кислоту, не содержит глюкозу и не содержит глутамин, серин и глицин, а также аргинин в аминокислотном профиле; и, следовательно, настоящее изобретение раскрывает способ индукции гибели клеток, отличных от CM, и отбор CM с использованием данного способа, путем культивирования смеси, содержащей CM и клетки, отличные от CM. Используемый в данном изобретении термин "клетки, отличные от кардиомиоцитов (клетки, отличные от CM)" охватывает клетки всех типов, отличные от CM, а также клетки, которые собираются индуцировать с целью дифференциации в CM, например, недифференцированные SC, дифференцированные клетки, отличные от CM, или клеток стабильных линий.
[0051] В соответствии со вторым аспектом настоящего изобретения, чтобы индуцировать гибель клеток, отличных от CM, культивирование клеток проводят в одной из вышеуказанных сред, не содержащей конкретные аминокислоты, в течение 12-360 часов, предпочтительно 24-240 часов, более предпочтительно 48-120 часов.
[0052] Среда для культивирования клеток настоящего изобретения может содержать аскорбат или альбумин, или тот и другой. Добавление аскорбата и/или альбумина не влияет на способность среды для культивирования клеток индуцировать гибель клеток, а также на степень очистки CM, причем CM можно культивировать в течение, по меньшей мере, 600 часов.
[0053] Ниже приведены рабочие примеры настоящего изобретения. Данные примеры предназначены для описания изобретения и никаким образом не ограничивают его.
ПРИМЕРЫ
[0054] Пример 1: Культивирование клеток
В данном примере культивируют недифференцированные SC (ESC и iPSC), культивируют дифференцированные клетки и индуцируют дифференциацию недифференцированных SC в CM.
[0055] Человеческие ESC (hESC) получают от профессора Norio Nakatsuji, Центр по исследованию стволовых клеток, Институт новых медицинских технологий, Университет Киото Национальной корпорации университетов. Человеческие iPSC получают от профессора Shinya Yamanaka, Центр по исследованию и применению клеток iPS, Университет Киото Национальной корпорации университетов. hESCs и hiPSCs культивируют в условиях, поддерживающих недифференцированное состояние, с использованием матригеля (BD Bioscience, Cat No. 354277). В качестве культуральной среды используют mTeSR1 (STEMCELL Technologies Inc., № по каталогу 11875-119). Помимо mTeSR1 в качестве культуральной среды, поддерживающей недифференцированное состояние, можно использовать любую другую культуральную среду, такую как Essential 8 (Life Technologies) или TeSR2 (STEMCELL Technologies Inc.), традиционно используемую в качестве среды, не содержащей фидер. Кроме того, помимо матригеля можно использовать любой другой матрикс, такой как витронектин (Life Technologies) или iMatrix-511 (Takara № 892001), традиционно используемый в качестве не содержащего фидер матрикса.
[0056] Чтобы провести пассирование, колонии hESC и hiPSC подвергают диссоциации с использованием раствора CTK (Repro CELL) при 37°C в течение 5 минут. Помимо раствора CTK для диссоциации клеток можно использовать StemPro Accutase (Life Technologies № 1110501) или TrypLE Express/Select (Life Technologies).
[0057] В данном исследовании дифференциацию недифференцированных SC в CM индуцируют с помощью нижеследующего способа.
- Чтобы провести дифференциацию в CM, после достижения 50-90% слияния hESC или hiPSC, среду заменяют на среду RPMI (Invitrogen), содержащую B27 (без инсулина; Invitrogen) и 6 мкМ CHIR99021 (Selleckchem or Wako) (0 день).
- На 1-2 день культивирование клеток проводят в среде RPMI/B27-инсулин(-).
- На 3-5 день культивирование клеток проводят в среде RPMI/B27-инсулин(-), дополнительно содержащей 5 мкМ IWP2 или 5 мкм IWR-1 (Sigma I0161).
- На 6-7 день культивирование клеток проводят в среде RPMI/B27-инсулин(-).
- На 8 день и позже культивирование клеток проводят в среде RPMI/B27-инсулин(+) (Lian, X., et al., Nat Protocol, 2013, 8, 162-175). На 8-11 день наблюдается присутствие способных к биению CM.
[0058] Чтобы гарантировать как можно более полное отсутствие сахара в культуральной среде, проводят промывание PBS два раза (Gluc-). После этого клетки культивируют в течение 3-4 дней в культуральной среде D-MEM, содержащей 4 мМ лактат (Wako Pure Chemical, № по каталогу 129-02666) (лактат+), в присутствии (Gln+) или в отсутствии глутамина (Gln ). Концентрация лактата должна варьировать в диапазоне 1-10 мМ, в данном примере она составляет 4 мМ.
[0059] Пример 2: Потребности культивируемых недифференцированных SC в разных аминокислотах в условиях культивирования
В данном примере проводят исследование на hESC или hiPSC, используемых в качестве недифференцированных SC, чтобы определить, какие аминокислоты необходимы для недифференцированных SC в условиях культивирования.
[0060] Чтобы определить, какие заменимые и полузаменимые аминокислоты особенно активно потребляются hESC, измеряют концентрации аминокислот в культуральной среде. А именно, 1,5×106 клеток каждого типа культивируют в чашке размером 3,5 см, анализируя состав культуральной среды до и после культивирования клеток.
[0061] Анализ аминокислот проводят, используя систему Shimbo, et al. (Shimbo, K., Rapid Commun. Mass Spectrom., 2009, 23, 1483-1492). После культивирования клеток каждый супернатант помещают в пробирку объемом 1,5 мл и хранят при -80°C до измерения. Образцы подвергают депротеинизации, дериватизируют с помощью реагента APDS и помещают в анализатор. Концентрации аминокислот в образцах определяют с помощью калибровочной кривой. Анализируют 37 следующих аминокислот: глицин (Gly), саркозин (Sar), аланин (Ala), γ-аминомасляная кислота (GABA), β-изоаминомасляная кислота (b-AiBA), α-аминомасляная кислота (a-ABA), серин (Ser), пролин (Pro), валин (Val), треонин (Thr), таурин (Tau), гидроксипролин (HyPro), изолейцин (Ile), лейцин (Leu), аспарагин (Asn), орнитин (Orn), аспартат (Asp), глутамин (Gln), лизин (Lys), глутамат (Glu), метионин (Met), гистидин (His), α-аминоадипиновая кислота (a-AAA), гидроксилизин (HyLys), фенилаланин (Phe), 1-метилгистидин (1MeHis), 3-метилгистидин (3MeHis), аргинин (Arg), цитруллин (Cit), тирозин (Tyr), триптофан (Trp), цистатионин (Cysthi), карносин (Car), ансерин (Ans), цистин (Cys2), аланин-глутамин (Ala-Gln) и глицин-глутамин (Gly-Gln).
[0062] Обнаружено, что в процессе культивирования особенно сильно уменьшаются концентрации серина, аргинина, цистина и глутамина в среде.
[0063] Затем, чтобы определить жизнеспособность клеток, культивированных в разных условиях, анализируют способность hESC (фиг. 2) и hiPSC (фиг. 4) реагировать на разные аминокислотные условия путем определения активности щелочной фосфатазы (ALP) в данных клетках, где клетки, окрашиваемые с помощью набора для окрашивания щелочной фосфатазы StemTAGTM (Sigma 86-R), считают живыми.
[0064] Используя в качестве основы состав DMEM с высоким содержанием глюкозы (Invitrogen) ("Gluc+" на фиг. 2A и 4A), получают культуральную среду, не содержащую четыре аминокислоты (т.е., глутамин, серин, глицин и аргинин), а также культуральные среды, каждая из которых не содержит одну из указанных аминокислот (т.е., не содержит только серин, только серин/глицин, только аргинин и только глутамин) ("Ser-", "Ser-Gly-", "Arg-" и "Gln-", соответственно). Путем культивирования hESCs и hiPSCs в каждой из вышеуказанных культуральных сред в течение примерно 48 часов с последующим окрашиванием культивированных клеток ALP, обнаружено, что число колоний hESC или hiPSC уменьшается после культивирования клеток, даже в присутствии глюкозы, в среде, не содержащей серин (Ser-), в среде, не содержащей серин/глицин (Ser-Gly-), в среде, не содержащей глутамин (Gln-), или в среде, не содержащей аргинин (Arg-). Однако даже после культивирования клеток в течение 48 часов наблюдается большое число колоний ALP-положительных недифференцированных клеток (фиг. 2A, 4A).
[0065] Затем на основе состава DMEM, не содержащей глюкозу (Invitrogen) и содержащей лактат (4 мМ) ("Gluc-, Лактат+" на фиг. 2B и 4B), получают культуральную среду, не содержащую четыре аминокислоты (т.е. серин, глицин, аргинин и глутамин), а также культуральные среды, каждая из которых не содержит одну из указанных аминокислот (т.е., не содержит только серин, только серин/глицин, только аргинин и только глутамин) ("Ser-", "Ser-Gly-", "Arg-" и "Gln-", соответственно). Путем культивирования hESCs и hiPSCs в каждой из вышеуказанных культуральных сред в течение примерно 48 часов с последующим окрашиванием культивированных клеток ALP, обнаружено, что в группах образцов, культивированных в среде, имеющей состав не содержащей глюкозы DMEM, в котором отсутствуют четыре аминокислоты, или в среде, имеющей состав не содержащей глюкозы DMEM, в котором отсутствует только глутамин (Gln-), колонии ALP-положительных hESC или hiPSC большей частью исчезают через 24 часа и полностью исчезают через 48 часов (фиг. 2B, 4B).
[0066] С учетом результатов, приведенных на фиг. 1, которые демонстрируют, что hESC поглощают Cys2 и Met на относительно высоком уровне, проводят исследование, чтобы определить, могут ли недифференцированные SC (hESC) выживать при культивировании в культуральной среде, содержащей лактат и не содержащей сахар (лактат+, Gluc-), в которой также отсутствует одна из вышеуказанных аминокислот. На основе состава не содержащей глюкозы DMEM (Invitrogen), в который добавлен лактат (4 мМ) ("Gluc-, Лактат+"), получают и используют культуральные среды, каждая из которых не содержит одну из четырех аминокислот (т.е., не содержит только глутамин, только цистин, только метионин и только треонин) ("Gln-", "Cys2-", "Met-" и "Thr-", соответственно). После культивирования в течение 24 часов с использованием каждой из культуральных сред, определяют жизнеспособность клеток по активности щелочной фосфатазы (ALP) путем окрашивания клеток набором для окрашивания щелочной фосфатазы StemTAGTM (Sigma 86-R) и наблюдения окрашенных в красный цвет клеток как жизнеспособных. В результате обнаружено, что среда, содержащая лактат и не содержащая глюкозу и глутамин (лактат+, Gluc-, Gln-), среда, содержащая лактат и не содержащая глюкозу и Cys2 (лактат+, Gluc-, Cys2-), и среда, содержащая лактат и не содержащая глюкозу и Met (лактат+, Gluc-, Met-), обладают способностью индуцировать гибель клеток, сравнимой с аналогичной способностью среды, содержащей лактат и не содержащей глюкозу и треонин (Gluc-, лактат+, Thr-), используемой в качестве контроля, причем наиболее высокой способностью индуцировать гибель клеток обладает среда, содержащая лактат и не содержащая глюкозу и глутамин (Gluc-, лактат+, Gln-) (фиг. 5). Полученные результаты позволяют предположить, что способность среды, не содержащей глюкозу и глутамин, устранять оставшиеся недифференцированные SC, превосходит аналогичную способность среды, не содержащей треонин или метионин, описанной в непатентных документах 3 и 4.
[0067] Пример 3: Способность клеток реагировать на разные культуральные среды
В данном примере определяют, как степень выживания недифференцированных SC и CM изменяется в зависимости от культуральной среды, в котрой проводят культивирование.
[0068] В данном примере на основе состава не содержащей глюкозу культуральной среды DMEM (Invitrogen), которая либо содержит лактат (4 мМ) (Gluc-, лактат+), либо не содержит лактат (Gluc-, лактат-), получают культуральные среды, каждая из которых не содержит одну из четырех аминокислот (т.е., не содержит только аргинин, только глутамин, только серин и только глицин) ("Arg-", "Gln-", "Ser-" и "Gly-", соответственно). После культивирования недифференцированных SC (hESC) или мышиных неонатальных CM в течение примерно 24 часов в каждом из вышеуказанных условий культивирования, клетки окрашивают, используя набор для двойного окрашивания живых/мертвых клеток (TaKaRa Bio, Inc.), визуализируют (фиг. 3A и 6A) и считают, чтобы определить степени выживания (фиг. 3B и 6B).
[0069] На фиг. 3 показаны результаты наблюдения выживания или гибели недифференцированных SC (hESC) после культивирования в разных условиях, включающих в себя отсутствие одной из разных, интенсивно потребляемых, заменимых аминокислот, как показано на фиг. 1, а также степени выживания клеток, определенные на основе данных результатов. Результаты демонстрируют, что степень выживания недифференцированных SC значительно уменьшается после культивирования их в культуральной среде, не содержащей глутамин, независимо от того, содержит ли эта среда лактат ("лактат+, Gluc-, Gln-" или "лактат-, Gluc-, Gln-ʺ) (фиг. 3).
[0070] На фиг. 6 приведены результаты, полученные аналогичным образом, путем наблюдения выживания или гибели мышиных неонатальных CM после культивирования в разных условиях, включающих в себя отсутствие одной из разных, интенсивно потребляемых, заменимых аминокислот, как показано на фиг. 1, а также степени выживания клеток, определенные на основе данных результатов. Результаты демонстрируют, что степень выживания неонатальных CM значительно повышается после культивирования их в культуральной среде, не содержащей глутамин, но содержащей лактат (лактат+, Gluc-, Gln-), или, другими словами, что способность среды, не содержащей глутамин (Gln-), индуцировать гибель клеток уменьшается после добавления лактата (фиг. 6).
[0071] Пример 4: Индукция дифференциации iPSC в кардиомиоциты (CM) в условиях культивирования
Данный пример предназначен для разъяснения процедуры индуцирования дифференциации hiPSC в CM.
- Чтобы индуцировать дифференциацию в CM, после достижения 50-90% слияния hiESC, среду заменяют на среду RPMI (Invitrogen), содержащую B27 (без инсулина; Invitrogen) и 6 мкМ CHIR99021 (Selleckchem или Wako) (0 день).
- На 1-2 дни культивирование клеток проводят в среде RPMI/B27-инсулин(-).
- На 3-5 дни культивирование клеток проводят в среде RPMI/B27-инсулин(-), дополнительно содержащей 5 мкМ IWP2 или 5 мкМ IWR-1.
- На 6-7 дни культивирование клеток проводят в среде RPMI/B27-инсулин(-).
- На 8 день и позже культивирование клеток проводят в среде RPMI/B27-инсулин(+) (Lian, X., et al., Nat Protocol, 2013, 8, 162-175). В период 8-11 дней наблюдается появление CM, способных к биению (фиг. 4A).
[0072] Чтобы гарантировать практически полное отсутствие сахара в культуральной среде, проводят промывание PBS два раза (Gluc-). После этого клетки культивируют в течение 3-4 дней в культуральной среде D-MEM, содержащей 4 мМ лактат (Wako Pure Chemical, № по каталогу 129-02666) (лактат+), в присутствии (Gln+) или в отсутствии глутамина (Gln-). Концентрация лактата должна варьировать в диапазоне 1-10 мМ, в данном примере она составляет 4 мМ.
[0073] Пример 5: Потребности дифференцированных CM в разных аминокислотах в условиях культивирования
В данном примере проводят исследование CM, образовавшихся в результате дифференциации hiPSC, чтобы определить, какие аминокислоты необходимы для дифференцированных CM в условиях культивирования.
[0074] На фиг. 7 показаны фотографии клеток, культивированных в течение 3 дней в среде, содержащей глюкозу (фиг. 7A), в среде, не содержащей глюкозу и содержащей лактат (Cell Stem Cell, 2013 12:127-37) (Gluc-, All+, лактат+) (фиг. 7B), или в среде, содержащей лактат и не содержащей глюкозу и глутамин (Gluc-, Gln-, лактат+) (фиг. 7C), и затем подвергнутых иммуноокрашиванию.
[0075] Чтобы провести иммуноокрашивание, клетки иммобилизуют 4% параформальдегидом в течение 15-30 минут и затем обрабатывают DAPI (Invitrogen), окрашивающим клеточные ядра, и антителом против α-актинина (Sigma) и Alexa -слиным антителом против мышиных IgG (Invitrogen), окрашивающими полосчатые структуры, с последующей детекцией испускания флуоресценции.
[0076] В соответствии с результатами иммуноокрашивания, полученными после культивирования клеток в течение 3 дней, только несколько клеток, культивированных в среде, не содержащей глюкозу и содержащей лактат (и глутамин) (Gluc, Gln+, лактат+), и имеющих ядра, окрашенные DAPI, являются отрицательными по α-актинину, являющемуся маркером CM (фиг. 7B), тогда как около 100% клеток, культивированных в среде, содержащей лактат, не содержащей глюкозу и глутамин (Gluc-, Gln-, лактат+), и имеющих ядра, окрашенные DAPI, являются положительными по α-актинину (фиг. 7C).
[0077] Полученные результаты свидетельствуют о том, что при культивировании в присутствии глутамина (фиг. 7B), клетки других типов, отличных от CM, выживают в небольших количествах, а при культивировании в отсутствии глутамина (фиг. 7C) CM выживают, а клетки других типов, отличных от CM (т.е. недифференцированные SC, клетки, отличные от CM), полностью исчезают вследствие индукции клеточной гибели.
[0078] В соответствии с предлагаемым механизмом, который может объяснить указанное различие в свете метаболических путей сахаров, полагают, что в обычных клетках (недифференцированные SC и клетки, отличные от CM), путь гликолитической системы, поставляющий пируват, и путь образования α-кетоглутарата из глутамина через глутамат, среди последовательных реакций метаболизма сахаров вносят большой вклад в выживание клеток, однако путь образования пирувата из лактата, как правило, вносит гораздо меньший вклад в выживание клеток. И наоборот, в CM, не только путь гликолитической системы, поставляющий пируват, и путь образования α-кетоглутарата из глутамина через глутамат, но и путь образования пирувата из лактата, вносят значительный вклад в выживание CM.
[0079] В результате обнаружено, что CM можно селективно выделить с большей эффективностью и в течение более короткого времени путем культивирования CM, полученных в результате индукции hESC или hiPSC (т.е. CM в смеси с недифференцированными SC и клетками, отличными от CM), в условиях присутствия лактата и отсутствия глюкозы и глутамина (Gluc-, Gln-, Лактат+), чем при культивировании клеток в условиях присутствия лактата и отсутствия глюкозы (в присутствии глутамина) (Gluc-, Gln+, лактат+) (фиг. 7B).
[0080] На фиг. 8 показано, что CM-содержащие массы, культивированные в течение 4 дней в среде, содержащей лактат и не содержащей глюкозу и глутамин (Gluc-, Gln-, лактат+), подвергают диссоциации с использованием 0,25% трипсин-ЭДТА, высевают на культуральные чашки, покрытые фибронектином (Sigma) и подвергают иммуноокрашиванию. Перед проведением иммуноокрашивания клетки иммобилизуют, используя 4% параформальдегид, и затем окрашивают, используя антитело против α-актинина (Sigma), антитело против тропонина I (Santacruz) и антитело против Tra1-60 (Millipore). α-Актинин и тропонин I используют здесь в качестве CM-специфичных маркеров, а Tra1-60 используют в качестве PSC-специфичного маркера.
[0081] Результаты показывают, что почти все клетки, ядра которых окрашены DAPI, являются положительными по α-актинину и тропонину I (фиг. 8A и 8B). Чтобы подтвердить, действительно ли культивируемые клетки представляют собой CM, клетки подвергают перекрывающемуся окрашиванию по α-актинину и тропонину I, и обнаруживают, что клетки, окрашенные по α-актинину, полностью соответствуют клеткам, окрашенным по тропонину I (фиг. 8C). Кроме того, чтобы подтвердить присутствие оставшихся недифференцированных SC, культивируемые клетки анализируют на присутствие Tra1-60-положительных клеток и обнаруживают, что все клетки являются отрицательными по Tra1-60 (верхняя правая панель на фиг. 8D). Соответственно, полученные результаты свидетельствуют о том, что недифференцированные SC полностью устранены.
[0082] Пример 6: Детекция оставшихся недифференцированных SC
В качестве способа детекции оставшихся недифференцированных SC предлагается высоко чувствительный способ качественного определения экспрессии гена Lin28 методом Q-PCR (PLOS ONE, 2012; 7(5): e37342). Дифференциацию hiPSC в CM индуцируют в среде, содержащей лактат и не содержащей глюкозу (Gluc-, All+, лактат+), и в среде, содержащей лактат и не содержащей глюкозу и глутамин (Gluc-, Gln-, лактат+), и затем клетки во всех флаконах, после оптимизации и очистки в течение 4 дней, подвергают экстракции мРНК с получением кДНК. Результаты, полученные путем нормализации уровней экспрессии по 18S, демонстрируют, что Lin28 экспрессируется в клетках, культивированных в среде, содержащей лактат и не содержащей глюкозу (Gluc-, All+, лактат+), но данный маркер совсем не экспрессируется в клетках, культивированных в среде, содержащей лактат и не содержащей глюкозу и глутамин (Gluc-, Gln-, лактат+) (фиг. 9). Полученные результаты свидетельствуют о том, что способность среды, содержащей лактат и не содержащей глюкозу и глутамин (Gluc-, Gln-, лактат+), устранять недифференцированные SC превосходит аналогичную способность среды, содержащей лактат и не содержащей глюкозу (Gluc-, All+, лактат+).
[0083] Пример 7: Анализ потока лактата (метаболического потока) в CM при культивировании в среде, не содержащей глюкозу и глутамин
В данном примере механизм метаболизма лактата в CM и выживания CM в условиях культивирования, включающих в себя отсутствие глюкозы и глутамина, исследуют методом капиллярного электрофореза и масс-спектрометрии.
[0084] В процессе культивирования hESC и мышиных неонатальных CM культуральную среду заменяют на модифицированную DMEM (Invitrogen), которая не содержит глюкозу и содержит 4 мМ [13C]-меченный лактат (Isotec). Через час клетки промывают 10% маннитом (Wako) и погружают в метанол, содержащий внутренние стандарты (200 мкМ L-метионинсульфон в качестве катионного стандарта и 200 мкМ MES в качестве анионного стандарта). После сбора клеток и культуральной среды проводят анализы методом масс-спектрометрии и капиллярного электрофореза, используя систему для капиллярного электрофореза Agilent, включающую в себя нагнетательный насос, масс-спектрометр серии Agilent 1100 в качестве масс-селективного детектора, насос для изократической высокоэффективной жидкостной хроматографии серии Agilent 1100, набор приспособлений для капиллярного электрофореза и масс-спектрометрии G1603A Agilent, и набор для введения образцов в систему капиллярного электрофореза и масс-спектрометра G1607A Agilent (Agilent Technologies). Полученные результаты корректируют по числу клеток. В CM метаболиты цикла TCA обнаруживают в гораздо больших количествах (фиг. 10A, 10B). А в hESC метаболиты присутствуют лишь в небольших количествах (фиг. 10B). Это позволяет предположить, что в CM экзогенный лактат более интенсивно метаболизируется через цикл TCA, чем в клетках, отличных от CM, включающих в себя ESC. Неожиданно было обнаружено, что в CM [13C]-меченные 2-оксоглутарат и глутамат присутствуют в гораздо больших количествах (фиг. 10C, 10D). Полученные результаты не только свидетельствуют о том, что лактат вносит большой вклад в продукцию ATP через цикл TCA, но и позволяют предположить, что даже при культивировании в среде, не содержащей глутамин и глутамат, лактат участвует в биосинтезе 2-оксоглутарата и глутамата, компенсируя их отсутствие, что позволяет объяснить выживание CM.
[0085] Пример 8: Влияние культивирования групп клеток, полученных в результате индукции дифференциации hiPSC, в условиях присутствия лактата и отсутствия глюкозы и глутамина
С помощью способа, описанного в примере 4, индуцируют дифференциацию hiPSC в CM. Перед проведением оптимизации и очистки полученную группу клеток (hiPSC-CM) культивируют в среде, полученной на основе состава DMEM (Invitrogen), содержащей лактат и не содержащей глюкозу и глутамин (Gluc-, Gln-, Lac+), в течение 5 дней.
[0086] На 2 и 5 дни после начала культивирования в условиях присутствия лактата и отсутствия глюкозы и глутамина (Gluc-, Gln-, Lac+) группу клеток анализируют методом FACS. Результаты приведены на фиг. 11. По данным FACS процент тропонин T-положительных клеток в группе клеток составляет 93,5% на 2 день и 98,7% на 5 день.
[0087] Полученные результаты свидетельствуют о том, что CM можно очистить путем проведения культивирования в условиях отсутствия глюкозы и глутамина и присутствия лактата в качестве источника энергии для CM (Gluc-, Gln-, Lac+).
[0088] Пример 9: Жизнеспособность недифференцированных SC и CM в условиях культивирования, включающих в себя присутствие пирувата и отсутствие глутамина
В данном примере определяют, могут ли выживать hESC, используемые в качестве недифференцированных SC, и мышиные неонатальные CM, используемые в качестве CM, в условиях культивирования, включающих в себя присутствие пирувата и отсутствие глутамина.
[0089] На основе состава не содержащей глюкозы DMEM (Invitrogen) получают среду, содержащую все аминокислоты в основном составе DMEM (условие "Gluc-, ALL+"), среду, не содержащую глутамин в основном составе DMEM (условие "Gluc-, Gln-"), среду, не содержащую глутамин в основном составе DMEM, но содержащую 4 мМ α-кетоглутарат ("Gluc-, Gln-, DM-αKG+"), и среду, не содержащую глутамин в основном составе DMEM, но содержащую 2 мМ пируват ("Gluc-, Gln-, Pyr+"). В каждой из вышеуказанных культуральных сред hESC культивируют в течение 48 часов. Затем определяют активность щелочной фосфатазы (ALP) в hESC путем окрашивания их набором для окрашивания щелочной фосфатазы StemTAGTM (Sigma 86-R) и наблюдения окрашенных в красный цвет или жизнеспособных клеток (фиг. 12). В результате наблюдают большое число колоний ALP-положительных недифференцированных клеток в среде, содержащей α-кетоглутарат, тогда как в среде, содержащей пируват, колонии ALP-положительных недифференцированных клеток отсутствуют. Полученные данные свидетельствуют о том, что в условиях отсутствия глутамата недифференцированные клетки гибнут в течение короткого периода времени, даже в присутствии пирувата.
[0090] Затем для культивирования мышиных неонатальных CM на основе состава не содержащей глюкозы DMEM (Invitrogen) получают среду, содержащую все аминокислоты в основном составе DMEM (условие "Gluc-, ALL+"), среду, не содержащую глутамин в основном составе DMEM, но содержащую 2 мМ пируват ("Gluc-, Gln-, Pyr+"), и среду, не содержащую глутамин в основном составе DMEM, но содержащую 4 мМ лактат ("Gluc-, Gln-, Lac+"). Мышиные неонатальные CM культивируют в каждой из вышеуказанных культуральных сред в течение 48 часов, окрашивают с помощью набора для двойного окрашивания живых/мертвых клеток (TaKaRa Bio, Inc.), и визуализируют (фиг. 13). Жизнеспособные клетки окрашиваются в зеленый цвет, а апоптотические клетки окрашиваются в красный цвет. В условиях отсутствия глюкозы и глутамина степень выживания CM, культивируемых в среде, содержащей лактат или пируват в качестве источника энергии для CM, значительно превышает степень выживания CM, культивируемых в отсутствии лактата и пирувата. Полученные результаты свидетельствуют о том, что способность среды, не содержащей глутамин (Gln-), вызывать гибель CM уменьшается после добавления пирувата.
[0091] Пример 10: Детекция оставшихся недифференцированных SC
В данном примере определяют чувствительность другого способа детекции, используемого для определения оставшихся недифференцированных SC, и проводимого с применением сочетания ламинина-521 и среды Essential 8 (Tano, et al., PLOS ONE, 2014). Определяют чувствительность детекции недифференцированных SC с помощью способа, в котором используют mTeSR1 в качестве культуральной среды и iMatrix (производимый Nippi, Inc.) в качестве трехмерной подложки. Вначале проводят визуализацию групп клеток HEK293, не содержащих hiPSC (0%), или содержащих 0,1%, 0,01% или 0,001% hiPSC (фиг. 14A). Тот факт, что hiPSC детектируют даже в группе клеток, содержащих 0,001% hiPSC, подтверждает, что данный способ позволяет детектировать недифференцированные SC, присутствующие на уровне, составляющем всего лишь 0,001%.
[0092] Затем клетки, образовавшиеся в результате дифференциации hiPSC, анализируют на присутствие оставшихся недифференцированных SC. Вначале с помощью способа, описанного в примере 4, индуцируют дифференциацию hiPSC в CM, после чего клетки визуализируют (фиг. 14B). Затем, чтобы провести оптимизацию и очистку групп клеток после индукции дифференциации в тех же условиях, на основе состава DMEM (Invitrogen) получают среду, содержащую лактат и не содержащую глюкозу и глутамин (Gluc, Gln+, Lac+), и среду, содержащую лактат и не содержащую глюкозу и глутамин (Gluc-, Gln-, Lac+), после чего группы клеток культивируют в каждой из указанных культуральных сред в течение 4 дней и затем визуализируют (фиг. 14B). TRA1-60-положительные клетки наблюдаются в группе клеток до оптимизации и очистки, и в группе клеток после оптимизации и очистки в условиях присутствия 4 мМ лактата, отсутствия глюкозы и присутствия 4 мМ глутамина (Gluc-, Gln+, Lac+). И наоборот, TRA1-60-положительные клетки не наблюдаются в группе клеток после оптимизации и очистки в условиях присутствия лактата, отсутствия глюкозы и глутамина (Gluc-, Gln-, Lac+).
[0093] Полученные результаты демонстрируют, что степень выживания оставшихся недифференцированных SC после культивирования в условиях присутствия лактата и отсутствия глюкозы и глутамина (Gluc-, Gln-, Lac+) составляет менее 0,001%
[0094] Пример 11: Способность индуцировать гибель пролиферирующих клеток, отличных от CM
В данном примере исследуют способность культуральной среды, не содержащей глутамин, индуцировать гибель пролиферирующих клеток, отличных от CM.
[0095] Вначале hESC культивируют в среде DMEM (содержащей 10% FBS и не содержащей bFGF) в течение 2 недель с получением группы пролиферирующих, отличных от CM клеток, которая не содержит CM. Данная группа клеток содержит фибробласты и дифференцированные клетки, отличные от CM. После культивирования группы клеток в течение 48 часов в среде, не содержащей глюкозу и содержащей 4 мМ глутамин (Gluc-, Gln+), полученной на основе состава DMEM (Invitrogen), наблюдается присутствие жизнеспособных клеток (фиг. 15). И наоборот, после культивирования пролиферирующих клеток, отличных от CM, в течение 48 часов в среде, содержащей 4 мМ лактат и не содержащей глюкозу и глутамин (Gluc-, Gln-, Lac+), жизнеспособные клетки совсем отсутствуют и, следовательно, культивируемые клетки полностью гибнут (фиг. 15).
[0096] Полученные результаты демонстрируют, что условия, включающие в себя присутствие лактата и отсутствие глюкозы и глутамина, могут индуцировать гибель пролиферирующих клеток, отличных от CM. В последние годы опубликованы данные, свидетельствующие о том, что образование опухоли после трансплантации вызывается не только недифференцированными SC, но и незрелыми пролиферирующими клетками (Nori, et al., Stem Cell Report, 2015). Однако способ настоящего изобретения позволяет индуцировать быструю гибель не только недифференцированных SC, но и пролиферирующих клеток.
[0097] Пример 12: Соединения, которые можно добавлять к среде, используемой для очистки
В данном примере исследуют условия, в которых недифференцированные SC и дифференцированные клетки, отличные от CM, не выживают, а выживают только CM в течение более длительного времени при проведении культивирования в культуральной среде для очистки, содержащей соединение, являющее питательным веществом для CM.
[0098] На основе состава DMEM (Invitrogen) получают культуральные среды, содержащие лактат и не содержащие глюкозу и глутамин (Gluc-, Gln-, Lac+), каждая из которых дополнительно содержит аскорбат (25 мг/л) или альбумин (0,1%).
[0099] Затем hiPSC культивируют в каждой из полученных сред. Через 24 часа после начала культивирования определяют гибель клеток hiPSC в обоих средах (фиг. 16).
[0100] Далее hiPSC культивируют в среде DMEM (содержащей 10% FBS и не содержащей bFGF) в течение 2 недель с получением группы пролиферирующих, отличных от CM клеток, которая не содержит CM. Полученную группу клеток культивируют в каждой из полученных сред. Через 48 часов после начала культивирования определяют гибель клеток (фиг. 17).
[0101] Затем с помощью способа, описанного в примере 4, индуцируют дифференциацию hiPSC в CM. После культивирования полученных клеточных масс в течение 600 часов в каждой из сред, содержащих аскорбат или альбумин, определяют выживание CM (фиг. 18).
[0102] Кроме того, культивирование клеток продолжают до 744 часов, после чего в обоих условиях культивирования все еще наблюдается присутствие большого числа способных к биению CM. Затем проводят окрашивание клеток и наблюдают наличие мертвых клеток, окрашенных флуоресцентным красителем PI (пропидия иодид) (фиг. 19). В присутствии аскорбата или альбумина живые клетки наблюдаются в большем количестве, чем в отсутствии аскорбата или альбумина ("среда, не содержащая (-)"). Приведенные выше результаты демонстрируют, что CM можно очистить с помощью культуральной среды, не содержащей глюкозу и глутамин и содержащей лактат в качестве источника энергии для CM, и дополнительно содержащей аскорбат или альбумин. Результаты также демонстрируют, что при культивировании в культуральной среде настоящего изобретения CM могут выживать в течение более длительного периода времени.
ПРИМЕНЕНИЕ В ПРОМЫШЛЕННОСТИ
[0103] В соответствии с первым аспектом настоящее изобретение предлагает среду для культивирования клеток, предназначенную для индукции гибели недифференцированных SC, где среда для культивирования клеток имеет аминокислотный профиль, в котором отсутствует глутамин. Просто путем проведения культивирования в среде для культивирования клеток, предлагаемой в первом аспекте настоящего изобретения, можно легко индуцировать гибель недифференцированных SC. Кроме того, во втором аспекте изобретение предлагает среду для культивирования клеток, предназначенную для отбора CM, где среда для культивирования клеток содержит лактат, пируват или жирную кислоту, не содержит сахар (глюкозу) и имеет аминокислотный профиль, в котором отсутствует глутамин. Просто путем проведения культивирования в среде для культивирования клеток, предлагаемой во втором аспекте настоящего изобретения, можно легко индуцировать гибель недифференцированных SC, таких как PSC, включающие в себя hESC и hiPSC, а также дифференцированных клеток, отличных от CM, и клеток стабильных линий, как определено ниже, и, следовательно, можно осуществить отбор CM.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИНДУКЦИИ ГИБЕЛИ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК И ДИФФЕРЕНЦИРОВАННЫХ КЛЕТОК, ОТЛИЧНЫХ ОТ КАРДИОМИОЦИТОВ | 2010 |
|
RU2551778C2 |
| СПОСОБ СЕЛЕКЦИИ КАРДИОМИОЦИТОВ (ВАРИАНТЫ) | 2007 |
|
RU2426784C2 |
| СПОСОБ ОЧИСТКИ КАРДИОМИОЦИТОВ | 2021 |
|
RU2813532C1 |
| СПОСОБ ИНДУКЦИИ ДИФФЕРЕНЦИАЦИИ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК В КАРДИОМИОЦИТЫ | 2007 |
|
RU2433174C2 |
| Аналоги инсулина с пониженной аффинностью к рецептору инсулина и их применение | 2017 |
|
RU2764197C1 |
| СПОСОБ ДИФФЕРЕНЦИАЦИИ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК В КЛЕТКИ СОСУДИСТОГО РУСЛА | 2012 |
|
RU2618871C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНДОТЕЛИАЛЬНЫХ КЛЕТОК ИЗ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА (ВАРИАНТЫ) | 2008 |
|
RU2359030C1 |
| Способ контроля гликозилирования рекомбинантного гликопротеина | 2015 |
|
RU2670889C9 |
| СПОСОБ ПОЛУЧЕНИЯ КАРДИОМИОЦИТАРНОЙ МАТРИЦЫ | 2010 |
|
RU2430159C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИПЕПТИДА (ВАРИАНТЫ) | 2005 |
|
RU2316596C2 |


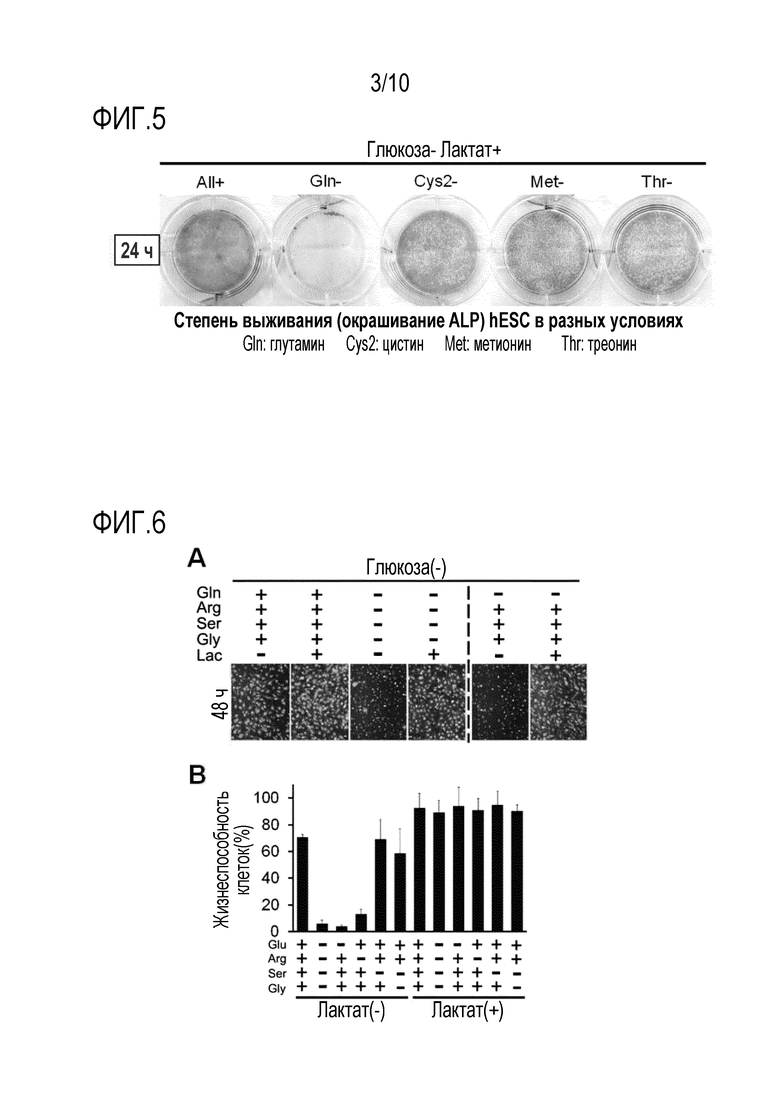
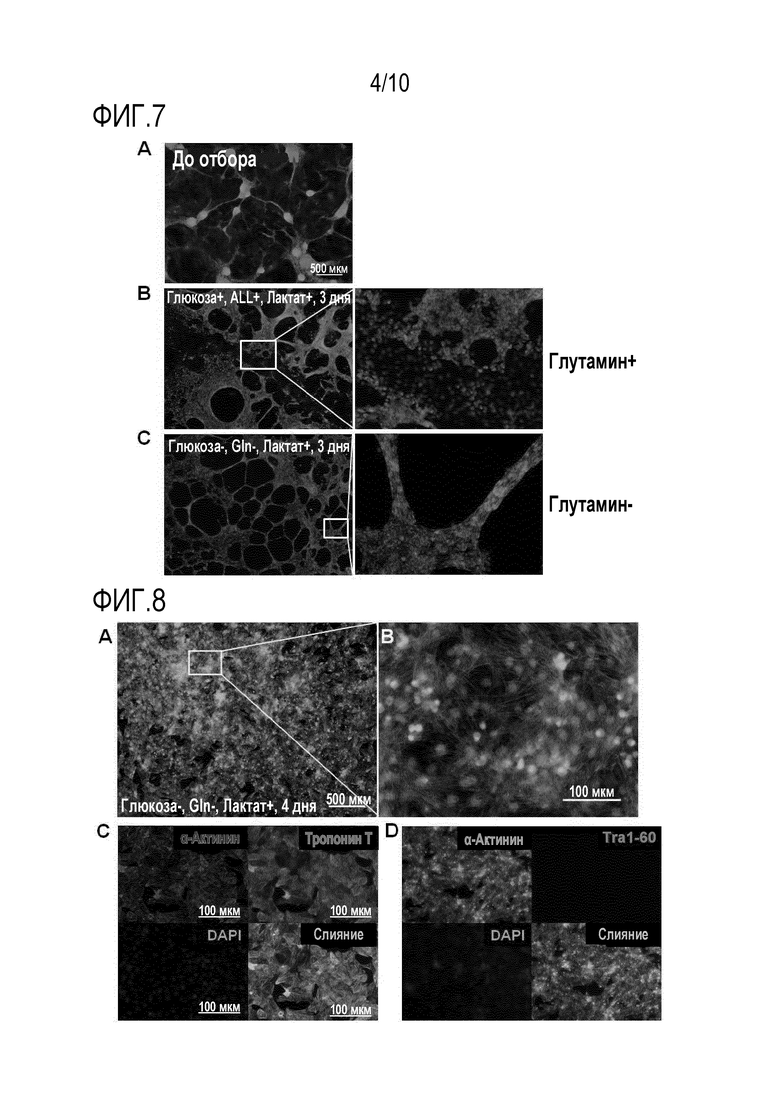
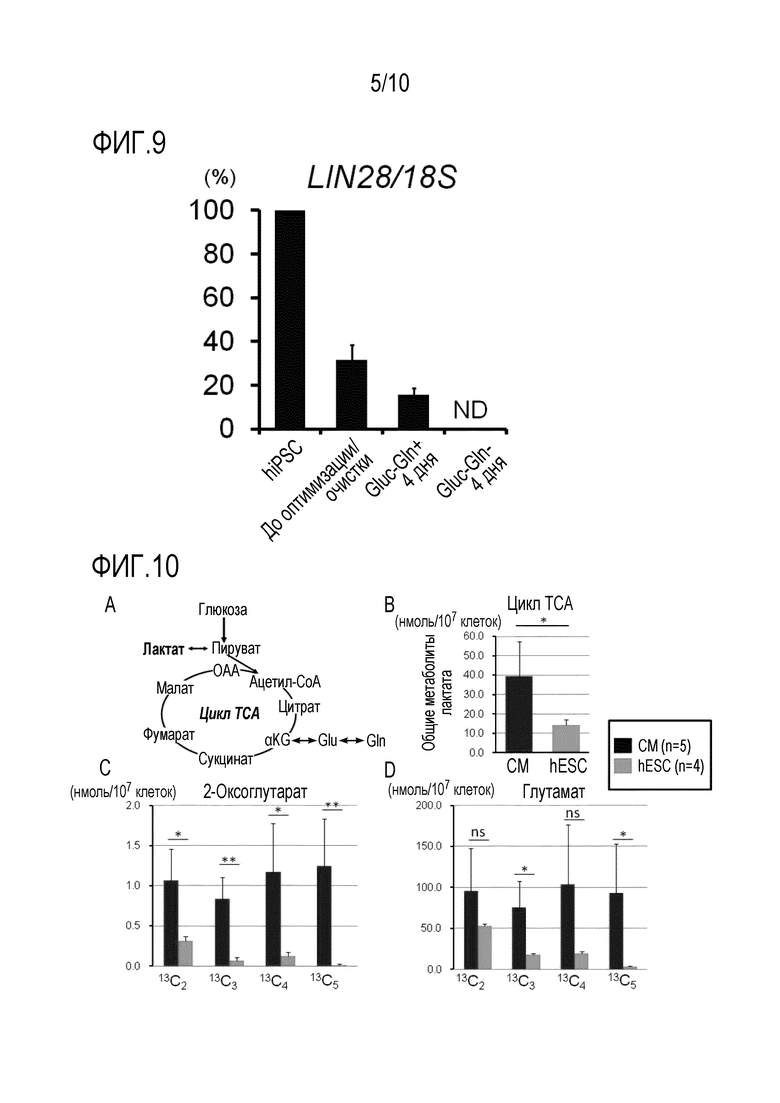



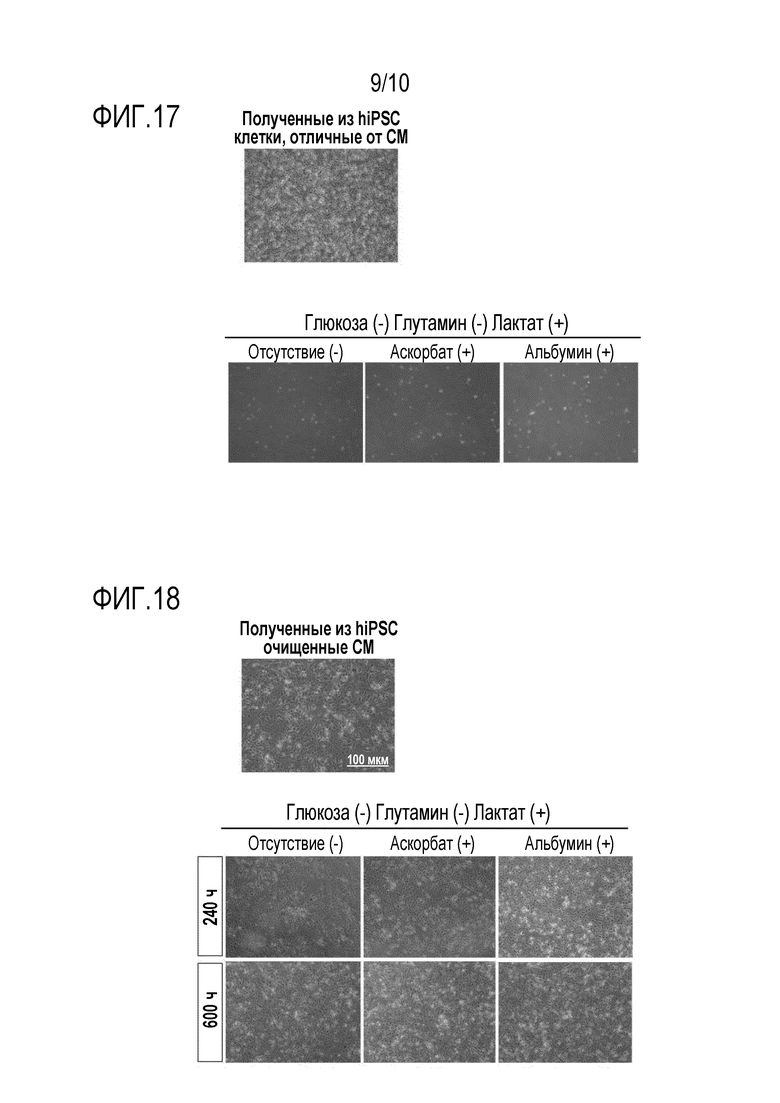
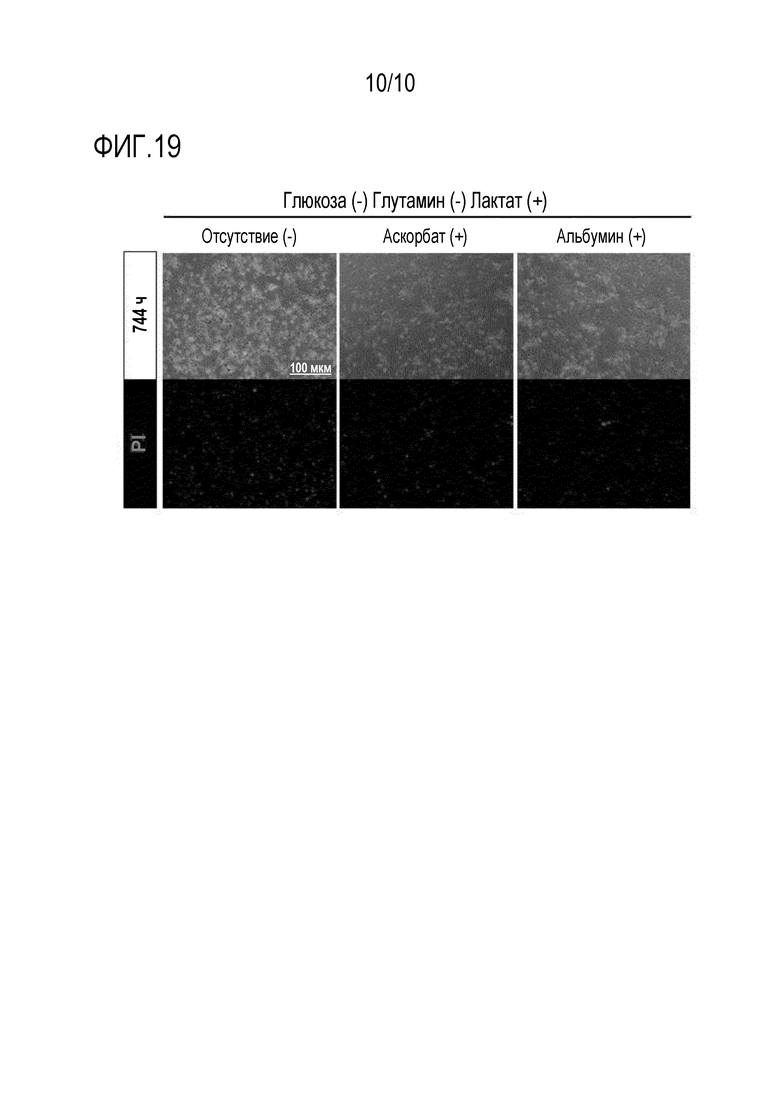
Изобретение относится к области биотехнологии, а именно к индуцированию гибели неэмбриональных недифференцированных стволовых клеток без индукции гибели кардиомиоцитов и выделению кардиомиоцитов. Способ включает проведение культивирования в среде для культивирования клеток, которая имеет меньше чем 10% глутамина в аминокислотном профиле. Способ включает культивирование смеси, содержащей кардиомиоциты и отличные от кардиомиоцитов клетки, для получения кардиомиоцитов в среде для культивирования клеток, которая содержит лактат, пируват или жирную кислоту, не содержит сахар и имеет меньше чем 10% глутамина в аминокислотном профиле. Изобретение позволяет расширить арсенал технических средств. 4 н. и 9 з.п. ф-лы, 19 ил., 11 пр.
1. Способ индуцирования гибели недифференцированных стволовых клеток без индукции гибели кардиомиоцитов, который включает проведение культивирования в среде для культивирования клеток, которая имеет меньше чем 10% глутамина в аминокислотном профиле, где недифференцированные стволовые клетки не являются эмбрионными стволовыми клетками человека.
2. Способ по п. 1, где недифференцированные стволовые клетки представляют собой плюрипотентные стволовые клетки или мультипотентные стволовые клетки.
3. Способ по п. 1 или 2, где в аминокислотном профиле среды для культивирования клеток также отсутствуют серин и глицин.
4. Способ по любому из пп. 1-3, где в аминокислотном профиле среды для культивирования клеток также отсутствует аргинин.
5. Способ по любому из пп. 1-4, где культивирование клеток проводят в течение 12-360 часов в одной из вышеописанных сред, не содержащих отдельные аминокислоты.
6. Способ выделения кардиомиоцитов, включающий в себя культивирование смеси, содержащей кардиомиоциты и отличные от кардиомиоцитов клетки, для получения кардиомиоцитов в среде для культивирования клеток, которая содержит лактат, не содержит сахар и имеет меньше чем 10% глутамина в аминокислотном профиле.
7. Способ выделения кардиомиоцитов, включающий в себя культивирование смеси, содержащей кардиомиоциты и отличные от кардиомиоцитов клетки, для получения кардиомиоцитов в среде для культивирования клеток, которая содержит пируват, не содержит сахар и имеет меньше чем 10% глутамина в аминокислотном профиле.
8. Способ выделения кардиомиоцитов, включающий в себя культивирование смеси, содержащей кардиомиоциты и отличные от кардиомиоцитов клетки, для получения кардиомиоцитов в среде для культивирования клеток, которая содержит жирную кислоту, не содержит сахар и имеет меньше чем 10% глутамина в аминокислотном профиле.
9. Способ по любому из пп. 6-8, где отличные от кардиомиоцитов клетки представляют собой недифференцированные стволовые клетки, дифференцированные отличные от кардиомиоцитов клетки или клетки стабильных линий.
10. Способ по любому из пп. 6-9, где среда для культивирования клеток имеет аминокислотный профиль, в котором также отсутствуют серин и глицин.
11. Способ по любому из пп. 6-10, где среда для культивирования клеток имеет аминокислотный профиль, в котором также отсутствует аргинин.
12. Способ по любому из пп. 6-11, где культивирование клеток проводят в течение 12-360 часов в одной из вышеописанных сред, не содержащих отдельные аминокислоты.
13. Способ по любому из пп. 6-12, где среда для культивирования клеток содержит аскорбат или альбумин.
| WANG J | |||
| et al | |||
| "Dependence of Mouse Embryonic Stem Cells on Threonine Catabolism", Science | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| US 20160002604 A1, 07.01.2016 | |||
| СПОСОБ ПОЛУЧЕНИЯ ЭМБРИОНОВ СВИНЕЙ IN VITRO | 2007 |
|
RU2340177C1 |
| WICHA M.S | |||
| et al | |||
| "Effects of Free Fatty Acids on the Growth of Normal and Neoplastic Rat Mammary Epithelial Cells", Cancer Research | |||
| Дверной замок, автоматически запирающийся на ригель, удерживаемый в крайних своих положениях помощью серии парных, симметрично расположенных цугальт | 1914 |
|
SU1979A1 |
| НЕКРАСОВ Е.Д | |||
Авторы
Даты
2020-07-28—Публикация
2015-07-16—Подача