Предшествующий уровень техники настоящего изобретения
Настоящее изобретение относится к ингибиторам индоламин-2,3-Диоксигеназы (IDO) и в частности к ингибиторам IDO для применения в медицине. Ингибиторы согласно настоящему изобретению можно использовать в фармацевтических композициях и в частности в фармацевтических композициях для лечения злокачественной опухоли, воспалительного состояния, инфекционного заболевания, заболевания или нарушения центральной нервной системы и других заболеваний, состояний и нарушений. Настоящее изобретение также относится к способам получения таких ингибиторов и способам лечения с использованием таких ингибиторов.
Метаболизм триптофана - Кинурениновый путь метаболизма (KP) отвечает за >95% разложения незаменимой аминокислоты триптофана. Кинурениновый путь метаболизма триптофана приводит к продукции необходимого пиридинового нуклеотида NAD+ и ряда нейроактивных метаболитов, включая в себя кинуренин (KYN), кинуреновую кислоту (KYNA), нейротоксический генератор свободных радикалов 3-гидроксикинуренин (3-HK), антраниловую кислоту, 3-НАА, пиколиновую кислоту (PIC) и возбуждающий агонист рецептора N-метил-D-аспартата (NMDA) и нейротоксин, хинолиновую кислоту (QUIN) (см. фигуру 1). Оставшиеся 5% триптофана метаболизируются триптофангидроксилазой до 5-гидрокситриптофана и затем в дальнейшем до 5-гидрокситриптамина (серотонина) и мелатонина.
Как истощение триптофана, так и накопление иммуносупрессорных катаболитов триптофана действуют для подавления ответов антигенспецифических Т-клеток и клеток-натуральных киллеров и индукции формирования регуляторных Т-клеток. Поскольку катаболизм триптофана индуцирован медиаторами воспаления, в частности IFN-γ, считают, что он представляет собой эндогенный механизм, который ограничивает избыточные иммунные ответы, тем самым предотвращая иммунопатологию. Тем не менее, существует доказательство того, что в болезненных состояниях эта петля обратной связи может являться неэффективной (обзор в (Munn and Mellor, 2013).
IDO - Первая стадия катаболизма триптофана катализируется либо TDO, либо IDO. Оба фермента катализируют окислительное расщепление 2,3-двойной связи в индольном кольце, превращая триптофан в N-формилкинуренин. Это является лимитирующей скорость стадией в катаболизме триптофана по кинурениновому пути (Grohmann et al., 2003; Stone and Darlington, 2002). TDO представляет собой гомотетрамер, в котором каждый мономер характеризуется молекулярной массой, составляющей 48 кДа, тогда как IDO характеризуется молекулярной массой, составляющей 45 кДа, и мономерной структурой (Sugimoto et al., 2006; Thackray et al., 2008; Zhang et al., 2007). Несмотря на то, что они опосредуют одну и ту же реакцию, TDO и IDO структурно различны, обладая лишь 10% гомологией, главным образом, в пределах активного сайта (Thackray et al., 2008).
IDO представляет собой преобладающий катаболизирующий триптофан фермент за пределами печени, встречающийся в многочисленных клетках, включая в себя макрофаги, микроглию, нейроны и астроциты (Guillemin et al., 2007; Guillemin et al., 2001; Guillemin et al., 2003; Guillemin et al., 2005). Транскрипция IDO находится под строгим контролем, отвечая на специфические медиаторы воспаления. Промоторы гена IDO мыши и человека содержат множественные элементы последовательностей, придающие чувствительность к интерферонам I типа (IFN-α/β) и более выраженно к интерферонам II типа (IFN-γ) (Chang et al., 2011; Dai and Gupta, 1990; Hassanain et al., 1993; Mellor et al., 2003). Различные типы клеток, включая в себя определенные клетки миелоидной линии дифференцировки (происходящие из моноцитов макрофаги и DC), фибробласты, эндотелиальные клетки и некоторые опухолевые клеточные линии, экспрессируют IDO после воздействия IFN-γ (Burke et al., 1995; Hwu et al., 2000; Mellor et al., 2003; Munn et al., 1999; Varga et al., 1996). Тем не менее, контроль транскрипции IDO является сложным и специфическим по отношению к типу клеток. Обнаружено, что активность IDO является конститутивной на трансплацентарном барьере, экспрессируясь клетками вневорсинчатого трофобласта человека (Kudo and Boyd, 2000). За пределами плаценты экспрессия функциональной IDO, как сообщалось, является самой высокой в мышином эпидидимисе, кишечнике (дистальном отделе подвздошной кишки и толстой кишке), лимфатических узлах, селезенке, тимусе и легких (Takikawa et al., 1986).
Было показано, что другой недавно обнаруженный вариантный фермент IDO катализирует эту же ферментативную стадию: индоламин-2,3-диоксигеназа 2 (IDO2). Тем не менее, его физиологическая релевантность остается неясной вследствие его очень низкой активности, присутствия общих полиморфизмов, которые инактивируют его ферментативную активность приблизительно у половины представителей европеоидной и монголоидной рас, и присутствия множественных сплайс-вариантов (Lob et al., 2008; Meininger et al., 2011; Metz et al., 2007).
Дефицитные в отношении IDO мыши находятся на общем уровне фенотипической нормы (Mellor et al., 2003), тем не менее, они несколько более склонны к индукции аутоиммунитета и стимуляции врожденной иммунной системы. IDO -/- нокаутные мыши также проявляют усиленный опосредованный воспалением карциногенез толстой кишки и проявляют устойчивость к вызванным воспалением злокачественным опухолям легкого и кожи (Chang et al., 2011; Yan et al., 2010).
Имуномодуляция: Истощение триптофана и накопление кинуренина
Иммунорегуляция с помощью метаболизма триптофана модулирует иммунную систему с помощью истощения субстрата TDO/IDO (триптофана) в микроокружении и накопления таких продуктов, как кинуренин.
Эффекторные Т-клетки особенно чувствительны к низким концентрациям триптофана, следовательно, к истощению незаменимой аминокислоты триптофана в локальном микроокружении, что приводит к анергии эффекторных Т-клеток и апоптозу. Истощение триптофана обнаруживается киназой общего контроля с постоянной репрессией 2 (GCN2) (Munn et al., 2005). Активация GCN2 запускает программу реакции на стресс, которая приводит к аресту клеточного цикла, дифференцировке, адаптации или апоптозу. Т-клетки, не содержащие GCN2 у мышей, являются нечувствительными к IDO-опосредованной анергии за счет миелоидных клеток, включая в себя дендритные клетки, в дренирующих опухоль лимфатических узлах (Munn et al., 2005).
Такие метаболиты триптофана, как кинуренин, кинуреновая кислота, 3-гидрокси-кинуренин и 3-гидрокси-антраниловая кислота, подавляют Т-клеточную функцию и способны индуцировать апоптоз Т-клеток. Недавние исследования показали, что рецептор ароматических углеводородов (AHR) представляет собой прямую мишень кинуренина (Mezrich et al., 2010; Nguyen et al., 2010; Opitz et al., 2011). AHR представляет собой основной фактор транскрипции семейства спираль-петля-спираль Per-Arnt-Sim (PAS). Поскольку кинуренин накапливается в опухоли, KYN связывает AHR, транслоцируется в ядро и активирует транскрипцию целевых генов, регулируемых чувствительными к диоксину элементами (DRE). В Т-хелперных клетках кинуренин приводит к созданию регуляторных Т-клеток (Treg).
Фармакологические ингибиторы IDO характеризуются применимостью в широком спектре назначений, включая в себя инфекционные заболевания, злокачественную опухоль, неврологические состояния и многие другие заболевания.
Инфекционные заболевания и воспаление - Инфекция бактериями, простейшими или вирусами индуцирует сильный IFN-γ-зависимый воспалительный ответ. IDO может ослабить защитный иммунитет хозяина, тем самым опосредованно приводя к увеличенным патогенным нагрузкам. Например, активность IDO ослабляет репликацию Toxoplasma gondii в легком, и воспалительное повреждение значительно уменьшается путем введения ингибитора IDO 1МТ после инфицирования (Murakami et al., 2012). Кроме того, у мышей, инфицированных вирусом лейкоза мышей (MuLV), было обнаружено, что IDO экспрессируется на высоком уровне, и удаление IDO усиливало контроль вирусной репликации и увеличивало выживаемость (Hoshi et al., 2010). В модели инфекции гриппа, иммуносупрессорные эффекты IDO могли вызвать предрасположенность легких ко вторичной бактериальной инфекции (van der Sluijs., et al 2006). При болезни Шагаса, вызываемой простейшими Trypanosoma cruzi, содержание кинуренина у пациентов увеличивается и коррелирует с тяжестью заболевания (Maranon et al., 2013). Следовательно, ингибиторы IDO можно использовать для улучшения исходов у пациентов с широким спектром инфекционных заболеваний и воспалительных состояний.
IDO и иммунитет к кишечным бактериям - IDO играет роль в регулировании слизистого иммунитета к микробиоте кишечника. Было показано, что IDO регулирует индуцируемую синантропными бактериями продукцию антител в кишечнике; дефицитные в отношении IDO мыши характеризовались повышенными исходными содержаниями иммуноглобулина A (IgA) и иммуноглобулина G (IgG) в сыворотке и увеличенным содержанием IgA в кишечных секретах. Вследствие повышенной продукции антител дефицитные в отношении IDO мыши являлись более устойчивыми к колонизации кишечника грамотрицательным кишечным бактериальным патогеном Citrobacter rodentium, чем мыши дикого типа. Дефицитные в отношении IDO мыши также проявляли усиленную устойчивость к колиту, вызванному инфекцией С. rodentium (Harrington et al., 2008).
Следовательно, фармакологическое нацеленное воздействие на активность IDO может представлять новый подход в управлении иммунитета кишечника и контроле патологии, вызванной кишечными патогенам, включая в себя колит (Harrington et al., 2008).
Инфекция ВИЧ - Инфицированные ВИЧ пациенты характеризуются постоянно сниженными содержаниями триптофана в плазме и повышенными содержаниями кинуренина, а также повышенной экспрессией IDO (Fuchs et al., 1990 и Zangerle et al., 2002).
У пациентов с ВИЧ положительная регуляция IDO действует для подавления иммунных ответов на антигены ВИЧ, что вносит вклад в иммунную эвазию вируса. ВИЧ запускает высокие уровни экспрессии IDO, когда он инфицирует макрофаги человека in vitro (Grant et al., 2000), и инфицирование головного мозга вирусом иммунодефицита обезьян (SIV) in vivo индуцирует экспрессию IDO клетками линии дифференцировки макрофагов (Burudi et al., 2002).
Патогенез ВИЧ характеризуется истощением CD4+ Т-клеток и хронической Т-клеточной активацией, что приводит в конце концов к СПИД (Douek et al., 2009). CD4+ Т-хелперные (ТН) клетки обеспечивают защитный иммунитет и иммунную регуляцию посредством различных функциональных подклассов иммунных клеток, включая в себя ТН1, ТН2, регуляторные Т-клетки (Treg) и ТН17-клетки. Прогрессирующий ВИЧ ассоциирован с потерей ТН17-клеток и реципрокным увеличением доли иммуносупрессорных Treg-клеток. Потеря равновесия TH17/Treg ассоциирована с индукцией IDO миелоидными антигенпрезентирующими дендритными клетками (Favre et al., 2010). In vitro потеря равновесия TH17/Treg напрямую опосредована проксимальным катаболитом триптофана из метаболизма IDO, 3-гидроксиантраниловой кислотой. Следовательно, при прогрессирующий инфекции ВИЧ индукция IDO вносит свой вклад в инверсию равновесия TH17/Treg и поддержание состояния хронического воспаления (Favre et al., 2010). Следовательно, ингибиторы IDO могут характеризоваться применимостью в решении проблемы с равновесием TH17/Treg при ВИЧ.
Индуцированная сепсисом гипотензия - Такое системное воспаление, как сепсис, характеризуется артериальной гипотензией и синдромом системной воспалительной реакции (Riedemann et al., 2003). Ассоциированное увеличение циркулирующих в кровотоке провоспалительных цитокинов, включая в себя интерферон-γ (IFN-γ), приводит к неконтролируемой продукции таких эффекторных молекул, как реакционноспособные формы кислорода и азота, которые сами по себе могут вносить вклад в патологию (Riedemann et al, 2003).
Метаболизм триптофана до кинуренина с помощью IDO, экспрессированной в эндотелиальных клетках, вносит свой вклад в расслабление артериальных сосудов и контроль кровяного давления (Wang et al., 2010). Инфицирование мышей малярийными паразитами (Plasmodium berghei) и экспериментальная индукция эндотоксемии вызывали эндотелиальную экспрессию IDO, приводя к сниженному содержанию триптофана в плазме, увеличенному содержанию кинуренина и гипотензии. Фармакологическое ингибирование IDO увеличивало кровяное давление у мышей с системным воспалением, но не у мышей, дефицитных в отношении IDO или интерферона-γ, который необходим для индукции IDO. Расслабление артерий с помощью кинуренина было опосредовано активацией аденилатного пути и пути растворимой гуанилатциклазы. (Wang et al., 2010). Следовательно, ингибиторы IDO могут характеризоваться применимостью в лечении индуцированной сепсисом гипотензии.
Нарушения ЦНС - В центральной нервной системе оба метаболических пути TRP, который действует как предшественник кинуренина и серотонина, являются представляющими интерес и важность путями. Метаболиты, производимые кинурениновым путем метаболизма, согласно наблюдениям играют роль в патологическом механизме нейровоспалительного и нейродегенеративного нарушения (обобщенно представлено на фигуре 2). Первое стабильное промежуточное соединение из кинуренинового пути метаболизма представляет собой KYN. Впоследствии образуются несколько нейроактивных промежуточных соединений. Они включают в себя кинуреновую кислоту (KYNA), 3-гидроксикинуренин (3-HK) и хинолиновую кислоту (QUIN). 3-HK и QUIN являются нейротоксическими по различным механизмам; 3-HK представляет собой высокоактивный генератор свободных радикалов (Hiraku et al., 1995; Ishii et al., 1992; Thevandavakkam et al., 2010), тогда как QUIN представляет собой эксайтотоксический агонист рецептора N-метил-D-аспартата (NMDA) (Schwarcz et al., 1983; Stone and Perkins, 1981). KYNA, с другой стороны, характеризуется нейропротекторными свойствами в качестве антагониста возбуждающих аминокислотных рецепторов и ловушки свободных радикалов (Carpenedo et al., 2001; Foster et al., 1984; Goda et al., 1999; Vecsei and Beal, 1990). Изменения в уровнях концентрации кинуренинов могут сдвинуть равновесие к патологическим состояниям. Способность воздействовать на метаболизм по нейропротекторной ветке кинуренинового пути метаболизма, т.е. в направлении синтеза кинуреновой кислоты (KYNA), может являться одним вариантом в профилактике нейродегенеративных заболеваний.
В ЦНС кинурениновый путь метаболизма присутствует в различной степени в большинстве типов клеток. Инфильтрирующие макрофаги, активированная микроглия и нейроны характеризуются полным репертуаром ферментов кинуренинового пути метаболизма (Guillemin et al., 2000; Lim et al., 2007).
Учитывая роль IDO в патогенезе некоторых нарушений ЦНС, ингибиторы IDO можно использовать для улучшения исходов пациентов с широким разнообразием заболеваний ЦНС и нейродегенерации.
Боковой амиотрофический склероз - Боковой амиотрофический склероз (ALS), или болезнь Лу Герига, представляет собой прогрессирующее и неизлечимое нейродегенеративное заболевание, поражающее двигательную систему. ALS приводит к избирательному поражению и разрушению двигательных нейронов в двигательной коре, стволе головного мозга и спинном мозге.
Несмотря на то, что множественные механизмы, вероятно, вносят свой вклад в ALS, кинурениновый путь метаболизма, активированный во время нейровоспаления, становится фактором, способствующим его возникновению. Первоначальное воспаление может нанести нелетальное повреждение моторных нейронов у индивидуумов с предрасположенной генетической конституцией, в свою очередь, запуская прогрессирующий воспалительный процесс, который активирует микроглию для продукции нейротоксических метаболитов кинуренина, которые в дальнейшем разрушают двигательные нейроны.
В головном и спинном мозге пациентов с ALS наблюдали большие количества активированной микроглии, реакционноспособных астроцитов, Т-клеток и инфильтрирующих макрофагов (Graves et al., 2004; Henkel et al., 2004). Указанные клетки высвобождают воспалительное и нейротоксические медиаторы, среди прочего, IFN-γ, наиболее высокоактивный индуктор IDO (McGeer and McGeer 2002). Нейрональная и микроглиальная экспрессия IDO увеличивается в двигательной коре головного мозга и спинном мозге при ALS (Chen et al., 2010). Предположили, что высвобождение активирующих иммунитет средств активирует лимитирующий скорость фермент KP, IDO, который генерирует такие метаболиты, как нейротоксин QUIN. Следовательно, ингибирование IDO должно снижать синтез нейротоксического QUIN, который был явно вовлечен в патогенез ALS.
Болезнь Гентингтона - Болезнь Гентингтона (HD) представляет собой генетическое аутосомное доминантное нейродегенеративное нарушение, вызванное экспансией повторов CAG в гене генгтинтин (htt). У пациентов, пораженных HD, проявляются прогрессирующие двигательные дисфункции, характеризующиеся аномалией произвольных и непроизвольных движений (хореоатетоз), а также психиатрические и когнитивные расстройства. Прижизненный мониторинг метаболитов в пределах пути метаболизма KYN обеспечивает один из немногих биомаркеров, который коррелирует с числом повторов CAG и, следовательно, тяжестью нарушения (Forrest et al., 2010). Обнаружено, что очень высокие содержания QUIN после смерти локализованы в областях нейродегенерации, при этом стриарные глутаматергические нейроны, на которые QUIN действует в качестве эксайтотоксина, являются основным классом, утрачиваемым при заболевании.
Болезнь Альцгеймера - Болезнь Альцгеймера (AD) представляет собой связанное со старением нейродегенеративное нарушение, характеризующееся потерей нейронов и деменцией. Гистопатология заболевания проявляется в накоплении внутриклеточного β-амилоида (Аβ) и последующем образованием нейритических бляшек, а также присутствием нейрофибриллярных клубков в конкретных областях головного мозга, связанных с обучением и памятью. Патологические механизмы, лежащие в основе этого заболевания, по-прежнему противоречивы, однако растут данные, свидетельствующие об участии метаболитов KP в развитии и прогрессировании AD.
Было показано, что Аβ (1-42) может активировать первичную культивированную микроглию и индуцировать экспрессию IDO (Guillemin et al., 2003; Walker et al., 2006).
Более того, избыточную экспрессию IDO и увеличенную продукцию QUIN наблюдали в микроглии, ассоциированной с амилоидными бляшками в головном мозге пациентов с AD (Guillemin et al., 2005). Было показано, что QUIN приводит к гиперфосфорилированию тау-белка в кортикальных нейронах человека (Rahman et al., 2009). Таким образом, избыточная экспрессия IDO и избыточная активация КР в микроглии вовлечены в патогенез AD.
Психиатрические нарушения и боль - Основная доля триптофана перерабатывается посредством кинуренинового пути метаболизма. Небольшая доля триптофана перерабатывается до 5-НТ и, следовательно, до мелатонина, оба из которых также являются субстратами для IDO. Давно известно, что среди других эффектов острое истощение триптофана может запускать депрессивный эпизод и вызывает глубокое изменение настроения даже у здоровых индивидуумов. Эти наблюдения хорошо сочетаются с благоприятными клиническими эффектами серотонинергических лекарственных средств как для улучшения настроения, так и для стимуляции нейрогенеза.
Коморбидность депрессивных симптомов и участия кинуренинового пути метаболизма в воспалении также указывает на роль в лечении хронической боли (Stone and Darlington, 2013).
Пациенты с шизофренией проявляют повышенные содержания KYN как в CSF (спинномозговая жидкость), так и ткани головного мозга, в частности во фронтальной коре. Это было связано с "гипофронтальностью", наблюдаемой при шизофрении. Действительно, грызуны, получившие лечение нейролептиками, демонстрируют заметное снижение содержаний KYN во фронтальной коре. Указанные изменения были связаны со сниженными KMO и 3НАО. Доказательства включают в себя взаимосвязь между полиморфизмом KMO, повышенным содержанием KYN в CSF и шизофренией (Holtze et. al., 2012). В целом, существует потенциал для воздействия в указанный путь, чтобы он стал как когнатным, так и нейролептическим.
Боль и депрессия часто являются сопутствующими нарушениями. Было показано, что IDO1 играет ключевую роль в этой коморбидности. Недавние исследования показали, что активность IDO связана с (а) пониженным содержанием серотонина и депрессией (Dantzer et al., 2008; Sullivan et al., 1992) и (b) повышенным содержанием кинуренина и нейропластическими изменениями посредством эффекта таких его производных, как хинолиновая кислота, на глутаматные рецепторы (Heyes et al., 1992).
У крыс хроническая боль индуцировала депрессивное поведение и билатеральную положительную регуляцию IDO в гиппокампе. Положительная регуляция IDO приводила к билатеральному повышенному соотношению кинуренина к триптофану и пониженному соотношению серотонина к триптофану в гиппокампе. Более того, нокаут гена IDO или фармакологическое ингибирование активности гиппокампальной IDO ослабляли как ноцицептивное, так и депрессивное поведение (Kim et al., 2012).
Поскольку провоспалительные цитокины были вовлечены в патофизиологию как боли, так и депрессии, регуляция IDO головного мозга с помощью провоспалительных цитокинов служит в качестве критически важной механистической связи в коморбидном взаимоотношении между болью и депрессией посредством регуляции метаболизма триптофана.
Рассеянный склероз - Рассеянный склероз (MS) представляет собой аутоиммунное заболевание, характеризующееся воспалительными поражениями в белом веществе нервной системы, заключающее в специфическом иммунном ответе на миелиновую оболочку, приводя к воспалению и потере аксонов (Trapp et al., 1999; Owens, 2003).
Накопление нейротоксических метаболитов кинуренина, вызванное активацией иммунной системы, вовлечено в патогенез MS. Было обнаружено, что QUIN селективно повышается в спинном мозге крыс с ЕАЕ, аутоиммунной моделью MS на животных (Flanagan et al., 1995). Источником повышенного содержания QUIN при ЕАЕ считали макрофаги. QUIN представляет собой инициатор перекисного окисления липидов, и высокие локальные содержания QUIN вблизи миелина могут вносить свой вклад в демиелинизацию при ЕАЕ и, вероятно, MS.
Интерферон-бета 1b (IFN-β1b) индуцирует метаболизм KP в макрофагах при концентрациях, сравнимых с концентрациями, обнаруженными в сыворотках получивших лечение с помощью IFN-b пациентов, что может являться ограничивающим фактором в его эффективности при лечении MS (Guillemin et al., 2001). После введения IFN-β повышенные содержания кинуренина и соотношение кинуренина к триптофану обнаружены в плазме пациентов с MS, получающих инъекцию IFN-b, по сравнению со здоровыми субъектами, что указывает на индукцию IDO с помощью IFN-β (Amirkhani et al., 2005). IFN-β1b приводит к продукции QUIN в концентрациях, достаточных для нарушения способности нейрональных дендритов интегрировать входящие сигналы и уничтожать олигодендроциты (Cammer, 2001). У получивших лечение с помощью IFN-β1b пациентов сопутствующая блокада KP с помощью ингибитора IDO может улучшать его эффективность IFN-β1b.
Болезнь Паркинсона - Болезнь Паркинсона (PD) представляет собой распространенное нейродегенеративное нарушение, характеризующееся потерей дофаминергических нейронов и локализованным нейровоспалением.
Болезнь Паркинсона ассоциирована с хронической активацией микроглии (Gao and Hong, 2008). Активация микроглии высвобождает нейротоксические вещества, включая в себя реакционноспособные формы кислорода (ROS) и провоспалительные цитокины, такие как IFN-γ (Block et al., 2007), высокоактивный активатор KP посредством индукции экспрессии IDO. KP в активированной микроглии приводит к положительной регуляции 3HK и QUIN. 3HK является токсическим, главным образом, в результате превращения в ROS (Okuda et al., 1998). Комбинированные эффекты ROS и опосредованной рецептором NMDA эксайтотоксичности за счет QUIN вносят свой вклад в дисфункцию нейронов и их гибель (Braidy et al., 2009; Stone and Perkins, 1981). Тем не менее, пиколиновая кислота (PIC), производимая посредством активации KP в нейронах, характеризуется способностью защищать нейроны от индуцированной QUIN нейротоксичности, являясь агонистом NMDA (Jhamandas et al., 1990). Микроглия может становиться избыточно активированной за счет провоспалительных медиаторов и стимулов из умирающих нейронов и вызывать повторяющийся цикл дальнейшей активации микроглии, микроглиозу. Избыточный микроглиоз будет вызывать нейротоксичность по отношению к соседним нейронам и приводит к гибели нейронов, внося свой вклад в прогрессирование болезни Паркинсона. (Zinger et al 2011)
Следовательно, PD ассоциирована с дисбалансом между двумя основными ветками KP в пределах головного мозга. Синтез KYNA астроцитами понижается, и одновременно с этим продукция QUIN микроглией увеличивается.
ВИЧ - Пациенты с ВИЧ, особенно пациенты со связанной с ВИЧ деменцией (Kandanearatchi and Brew 2012), часто характеризуются значительно повышенными содержаниями KYN в CSF. Указанные содержания напрямую связаны с нейрокогнитивным расстройством и часто наличием тяжелых психотических симптомов (Stone and Darlington 2013).
Злокачественная опухоль - Ясно, что опухоли могут вызывать толерантность к своим собственным антигенам. Катаболизм триптофана в злокачественной опухоли все чаще признают важным фактором микроокружения, который подавляет противоопухолевые иммунные ответы. Истощение триптофана и накопление иммуносупрессорных катаболитов триптофана, таких как кинуренин, создают иммуносупрессорную среду в опухолях и в дренирующих опухоль лимфатических узлах путем индукции анергии Т-клеток и апоптоза. Такая иммуносупрессия в микроокружении опухоли может помогать злокачественным опухолям избегать иммунного ответа и усиливать способность образовывать опухоли (обзор Adam et al., 2012).
Недавно было показано, что IDO вовлечена в прогрессирование опухоли. Было обнаружено, что IDO избыточно экспрессируется в различных злокачественных опухолях. IDO опосредует иммуносупрессорные эффекты посредством метаболизирования Trp до кинуренина, запуская нисходящие сигналы посредством GCN2, mTOR и AHR, что может оказывать воздействие на дифференцировку и пролиферацию Т-клеток. Кроме того, экспрессия IDO активированными дендритными клетками может служить для активации регуляторных Т-клеток (Treg) и ингибирования опухолеспецифических эффекторных CD8+ Т-клеток, тем самым формируя механизм, посредством которого иммунная система может ограничивать избыточную реактивность лимфоцитов (обзор Platten et al., 2012).
IDO - Было показано, что увеличенная экспрессия IDO является независимой прогностической переменной для сниженной выживаемости у пациентов с острым миелоидным лейкозом (AML), мелкоклеточным раком легкого, меланомой, злокачественными опухолями яичника, толстой и прямой кишки, поджелудочной железы и эндометрия (Okamoto et al., 2005; Ino et al., 2006). В действительности, сыворотки от пациентов со злокачественными опухолями характеризуются более высокими соотношениями кинуренина к триптофану, чем сыворотки от нормальных испытуемых (Liu et al., 2010; Weinlich et al., 2007; Huang et al., 2002). Кроме того, показано, что уровень экспрессии IDO коррелирует с количеством инфильтрирующих опухоль лимфоцитов у пациентов с карциномой толстой и прямой кишки (Brandacher et al., 2006).
В доклинических моделях трансфекция иммуногенньгх опухолевых клеток рекомбинантной IDO предотвращала их отторжение у мышей (Uyttenhove et al., 2003). При этом устранение экспрессии IDO приводило к снижению частоты возникновения и роста индуцированных 7,12-диметилбенз(а)антраценом кожных папиллом в состоянии злокачественного перерождения (Muller et al., 2008). Более того, ингибирование IDO замедляет рост опухоли и восстанавливает противоопухолевый иммунитет (Koblish et al., 2010), а также ингибирование IDO действует синергически с цитотоксическими средствами, вакцинами и цитокинами для индукции высокой противоопухолевой активности (Uyttenhove et al., 2003; Muller et al., 2005; Zeng et al., 2009).
Ингибирование IDO будет резко снижать содержания кинуренина, снимая тормозящее действие с иммунной системы, позволяя ей атаковать и устранять опухоли. Несмотря на то, что имеются доказательства того, что ингибитор IDO будет являться применимым в качестве отдельного средства, ингибиторы этого типа будут особенно эффективны при использовании в комбинации с другими видами иммунотерапии злокачественной опухоли. Известно, что положительную регуляцию экспрессии IDO идентифицировали в качестве механизма, посредством которого опухоли развивают устойчивость к блокирующему CTLA-4 антителу ипилимумабу. Ипилимумаб блокирует костимулирующую молекулу CTLA-4, вызывая сохранение опухольспецифических Т-клеток в активированном состоянии. Мыши с нокаутом IDO, которые получили лечение с помощью антитела к CTLA-4, демонстрируют выраженную задержку роста опухоли меланомы В16 и повышенную общую выживаемость по сравнению с мышами дикого типа. Кроме того, блокада CTLA-4 действует в выраженном синергизме с ингибиторами IDO, опосредуя отторжение опухоли. Сходные данные также сообщались в отношении ингибиторов IDO в комбинации с антителами к PD1 и к PDL-1 (Holmgaard et al., 2013).
Средства, которые будут воздействовать на иммуносупрессорное окружение, могут также иметь отношение к видам Т-клеточной терапии с помощью химерного антигенного рецептора (CAR-T) для усиления эффективности и ответов пациентов.
Другие заболевания - Хотя указанные эффекты являются защитными стратегиями для борьбы с инфекцией и воспалением, они могут иметь непредвиденные последствия, поскольку кинуренины, образовавшиеся во время опосредованной IDO деградации триптофана, могут химически модифицировать белки и, как было показано, являются цитотоксическими (Morita et al., 2001; Okuda et al., 1998). При ишемической болезни сердца воспаление и иммунная активация связаны с повышенными содержаниями кинуренина в крови (Wirleitner et al., 2003), возможно, через опосредованную интерфероном-γ активацию IDO. При экспериментальной хронической почечной недостаточности активация IDO приводит к увеличенным содержаниям кинуренинов в крови (Tankiewicz et al., 2003), а у пациентов с уремией модифицированные кинуренином белки присутствуют в моче (Sala et al., 2004). Кроме того, экспрессия IDO в почках может причинять вред во время воспаления, поскольку она усиливает повреждение клеток почечного канальца.
К сожалению, общая анестезия имитирует многие из этих эффектов, вызывающих стресс и воспалительные процессы. Когнитивная дисфункция после применения анестезии часто коррелировала с указанными последствиями. Недавно было показано, что эти дефициты коррелируют с изменениями маркеров кинуренинового пути метаболизма, но не цитокинов, после кардиохирургии и в восстановлении пациентов с инсультом (Stone and Darlington 2013).
Виды катаракты - Катаракта представляет собой помутнение хрусталика внутри глаза, которое приводит к снижению зрения. Недавние исследования показывают, что кинуренины могут химически изменять структуру белка в хрусталике глаза человека, что приводит к образованию катаракты. В хрусталике глаза человека активность IDO наблюдается в основном в эпителии переднего отдела (Takikawa et al., 1999). В хрусталике глаза обнаружено несколько кинуренинов, таких как кинуренин (KYN), 3-гидроксикинуренин (3OHKYN) и 3-гидроксикинуренинглюкозид (3OHKG); где они, как полагали, защищали сетчатку, поглощая УФ-излучение, и поэтому их обычно называют УФ-фильтрами. Тем не менее, несколько недавних исследований показывают, что кинуренины подвержены дезаминированию и окислению с образованием α,β-ненасыщенных кетонов, которые химически реагируют и модифицируют белки хрусталика глаза (Taylor et al., 2002). Модификация, опосредованная кинуренином, может способствовать модификации белков хрусталика во время старения и катарактогенеза. Они также могут снизить функцию шаперона α-кристаллина, необходимого для поддержания прозрачности хрусталика.
У трансгенных линий мышей, которые избыточно экспрессируют IDO человека в хрусталике, развивалась двусторонняя катаракта в течение 3 месяцев после рождения. Было продемонстрировано, что опосредованная IDO продукция кинуренинов приводит к дефектам в дифференцировке клеток волокон и их апоптозу (Mailankot et al., 2009). Следовательно, ингибирование IDO может замедлить прогрессирование образования катаракты.
Эндометриоз - Эндометриоз, наличие эндометрия вне полости матки, представляет собой распространенное гинекологическое нарушение, вызывающее боли в области живота, диспареунию и бесплодие. С помощью микрочипового анализа было обнаружено, что экспрессия IDO повышается в эутопическом эндометрии у женщин с эндометриозом (Burney et al., 2007 and Aghajanova et al., 2011). Кроме того, показано, что IDO повышает выживаемость и инвазивность стромальных клеток эндометрия (Mei et al., 2013). Следовательно, ингибитор IDO можно использовать в качестве лечения эндометриоза.
Контрацепция и прерывание беременности - Процесс имплантации эмбриона нуждается в механизмах, которые предотвращают отторжение аллотрансплантата; и толерантность к фетальному аллотрансплантату представляет собой важный механизм поддержания беременности. Клетки, экспрессирующие IDO в трансплацентарном барьере, защищают аллогенный плод от летального отторжения иммунными ответами матери. Ингибирование IDO путем воздействия на беременных мышей с помощью 1-метил-триптофана индуцировало опосредованное Т-клетками отторжение аллогенных концептусов, тогда как сингенные концептусы не были затронуты; это указывает на то, что экспрессия IDO в трансплацентарном барьере необходима для предотвращения отторжения фетального аллотрансплантата (Munn et al., 1998). Накапливающиеся доказательства указывают на то, что продукция IDO и нормальная функция в трансплацентарном барьере может играть важную роль в толерантности при беременности (Durr and Kindler., 2013). Следовательно, ингибитор IDO можно использовать в качестве противозачаточного средства или средства прерывания беременности.
Исходя из вышеизложенного, авторы настоящего изобретения установили, что существует веское обоснование терапевтической применимости лекарственных средств, которые блокируют активность IDO, в лечении вышеупомянутых заболеваний, состояний и нарушений.
Принимая во внимание вышесказанное, целью настоящего изобретения является получение ингибиторов IDO и в частности ингибиторов IDO для применения в медицине. Еще одной целью является получение фармацевтических композиций, содержащих такие ингибиторы, и в частности получение соединений и фармацевтических композиций для лечения злокачественной опухоли (рака), воспалительного состояния, инфекционного заболевания, заболевания или нарушения центральной нервной системы и других заболеваний, состояний и нарушений. Кроме того, целью является обеспечение способов синтеза соединений.
В международной патентной публикации WO 2012/084971 раскрыты индоламидные соединения с профилями замещений, которые отличаются от предусмотренных в настоящем документе. Указанные соединения раскрыты в качестве прямых антибактериальных средств. Ингибирование IDO не упомянуто, и отсутствует раскрытие того, что соединения характеризуются ингибирующей IDO активностью или фармакологически ассоциированы с механизмом IDO.
В каждой из международных патентных публикаций WO 94/19321 и WO 2014/009794 раскрыты соединения для лечения ВИЧ. Наиболее сходные соединения представляют собой индоламиды с профилями замещений, которые отличаются от предусмотренных в настоящем документе. В международной патентной публикации WO 94/19321 указано, что соединения являются прямыми ингибиторами обратной транскриптазы, в то время как в международной патентной публикации WO 2014/009794 они указаны как прямые противовирусные средства. Ингибирование IDO не упомянуто, и отсутствует раскрытие того, что соединения характеризуются ингибирующей IDO активностью или фармакологически ассоциированы с механизмом IDO.
В международных патентных публикациях WO 2008/002674 и WO 03/035621 раскрыты ингибиторы протеинкиназы и фосфатазы, которые можно использовать inter alia в лечении злокачественной опухоли. Некоторые такие соединения представляют собой индоламиды с профилями замещений, которые отличаются от исследованных авторами настоящего изобретения. Ингибирование IDO не упомянуто, и отсутствует раскрытие того, что соединения характеризуются ингибирующей IDO активностью или фармакологически ассоциированы с механизмом IDO, т.е. устранением истощения триптофана/продукции кинуренина, с ассоциированным увеличением Т-клеточной пролиферации и опухолевого иммунного ответа.
Ранее Dolusic с соавт. исследовали индольные соединения для определения их ингибирующей IDO активности (European Journal of Medicinal Chemistry 46 (2011) 3058-3065; Bioorganic and Medicinal Chemistry, Vol. 19(4), 2011, pp 1550-1561). В указанном исследовании установили, что определенные индольные соединения с кетоновыми заместителями в 2-положении могут являться применимыми ингибиторами IDO. Тем не менее, было обнаружено, что активность таких соединений в лучшем случае оказалась предельно низкой. Сделали вывод о том, что амидное соединение того типа, которое исследовали авторы настоящего изобретения, не являлось эффективным ингибитором по сравнению с кетоновыми соединениями. Тем не менее, авторы настоящего изобретения в настоящее время установили, что Dolusic с соавт. ошибались относительно таких амидных соединений в том, что определенные варианты являются высокоактивными.
Краткое раскрытие настоящего изобретения
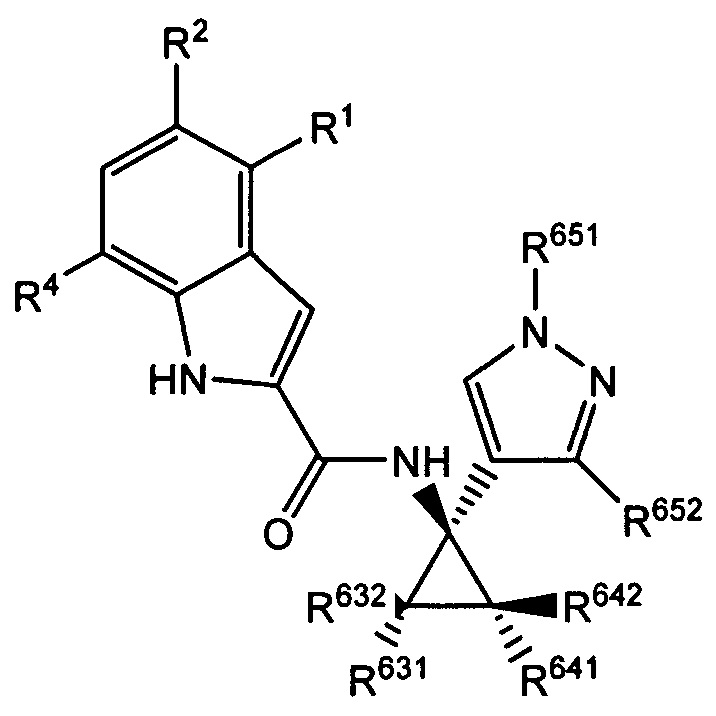
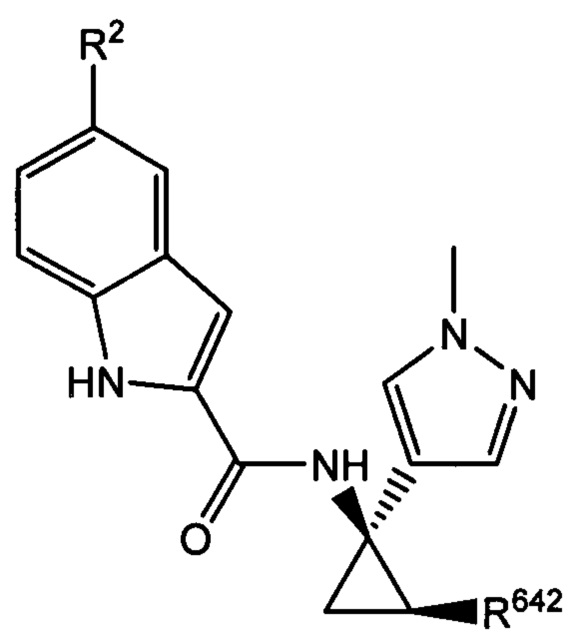
В настоящем документе раскрыты соединения, характеризующиеся формулой (I):
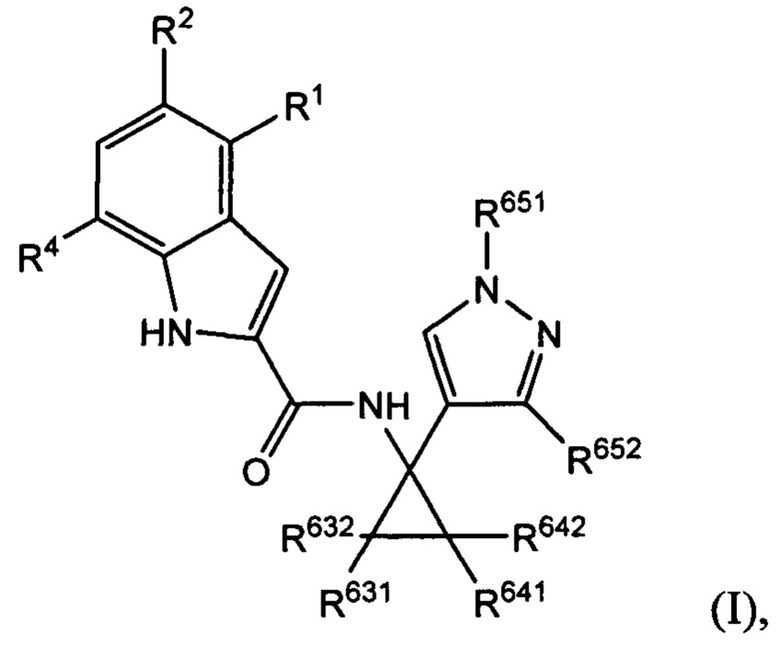
где R2 выбран из -Cl, -Br и -CN; R1 и R4 независимо выбраны из -Н и -F; R631, R632, R641 и R642 независимо выбраны из -Н, -F и замещенных или незамещенных С1-С3 алкильных групп; и R651 и R652 независимо выбраны из -Н и замещенных или незамещенных С1-С3 алкильных групп и замещенных или незамещенных фенильных групп; и где по меньшей мере один из R631, R632, R641, R642 и R652 не представляет собой -Н, или где если все из R631, R632, R641, R642 и R652 представляют собой -Н, R651 не представляет собой Me или Et.
Краткое описание графических материалов
На фигуре 1 показано схематическое представление катаболизма триптофана по кинурениновому пути метаболизма (из "The Kynurenine Pathway in Brain Tumour Pathogenesis", Adam et al, 2012, Cancer Res 72:5649-57).
На фигуре 2 показано схематическое обобщенное представление участие кинуренина в нарушения ЦНС (из "The kynurenine pathway as a therapeutic target in cognitive and neurodegenerative disorders", Stone and Darlington. Br. J. Pharmacol. 2013 169(6):1211-27).
Подробное раскрытие настоящего изобретения
В настоящем документе установлено, что соединения, характеризующиеся формулой (I), показанной выше, характеризуются сильной ингибирующей IDO активностью. Такие соединения обладают значительным потенциалом для применения в медицине. Таким образом, соединения можно использовать в качестве ингибиторов IDO, например, для лечения любого заболевания, ассоциированного с механизмом IDO. Типичные заболевания, ассоциированные с механизмом IDO, описаны выше и ниже в настоящем документе, и, следовательно, настоящее изобретение охватывает соединения для применения в лечении таких заболеваний.
Согласно настоящему контексту R1 и R4 могут являться одинаковыми или различными, поскольку они выбраны независимо. Согласно типичным вариантам осуществления оба из R1 и R4 представляют собой -Н. Согласно другим типичным вариантам осуществления R1 представляет собой -F, и R4 представляет собой -Н, или R1 представляет собой -Н, и R4 представляет собой -F, или R1 представляет собой -F, и R4 представляет собой -F. Согласно одному варианту осуществления оба из R1 и R4 представляют собой -Н, или один из R1 и R4 представляет собой -F, а другой представляет собой -Н, хотя согласно некоторым менее типичным вариантам осуществления оба из R1 и R4 могут представлять собой -F.
R631, R632, R641 и R642 могут являться одинаковыми или различными, поскольку они выбраны независимо. Согласно типичным вариантам осуществления по меньшей мере один из R631, R632, R641 и R642 не представляет собой -Н. Согласно другим вариантам осуществления два или больше, три или больше или все из R631, R632, R641 и R642 не представляют собой -Н. Согласно одному варианту осуществления R641 и/или R642 не представляет собой -Н. Согласно одному варианту осуществления R642 не представляет собой -Н. Тем не менее, другие варианты осуществления, в которых все из R631, R632, R641 и R642 представляют собой -Н, не исключены. Если один или несколько из R631, R632, R641 и R642 представляют собой замещенную или незамещенную С1-С3 алкильную группу, C1-С3 альсильную группу, как правило, можно выбрать из метальной (Me), этильной (Et), пропильной (Pr) и изопропильной (i-Pr) групп. Если С1-С3 алкильная группа представляет собой замещенную С1-С3 алкильную группу, ее, как правило, можно выбрать из алкильных групп со фторсодержащими заместителями, таких как -CH2F, -CHF2 и -CF3.
R651 и R652 могут являться одинаковыми или различными, поскольку они выбраны независимо. Согласно типичным вариантам осуществления по меньшей мере один из R651 и R652 не представляет собой -Н. Согласно другим типичным вариантам осуществления оба из R651 и R652 не представляют собой -Н. Тем не менее, другие варианты осуществления, в которых оба из R651 и R652 представляют собой -Н, не исключены. Если один или оба из R651 и R652 представляют собой замещенную или незамещенную С1-С3 алкильную группу, С1-С3 алкильную группу, как правило, можно выбрать из метальной (Me), этильной (Et), пропильной (Pr) и изопропильной (i-Pr) групп. Если С1-С3 алкильная группа представляет собой замещенную С1-С3 алкильную группу, ее, как правило, можно выбрать из алкильных групп со фторсодержащими заместителями, таких как -CH2F, -CHF2 и -CF3. Если один или оба из R651 и R652 представляют собой замещенную или незамещенную фенильную группу, как правило, фенильная группа является незамещенной, т.е. представляет собой -Ph. Согласно одному варианту осуществления если одна из указанных групп представляет собой фенильную группу, R651 представляет собой фенил, а не R652.
Подразумевается, что в формулах в настоящем документе включены все таутомерные формы кольцевой системы (включая в себя таутомерные формы 6-членного кольца и таутомерные формые 5-членного кольца). Кроме того, подразумевается, что в формулах в настоящем документе, где явно не указана стереохимия, включены все стереоизомеры формул, включая в себя энантиомеры, цис-транс изомеры, мезосоединения и тому подобное. Таким образом, если стереохимия не показана в хиральном центре, настоящее изобретение также включает в себя как выделенные энантиомеры, так и рацемическую смесь. Таким образом, соединения согласно настоящему изобретению распространяются на выделенные энантиомеры, и/или смесь двух или больше энантиомеров, и/или смесь двух или больше диастереомеров (например, если существует больше одного хирального центра), и/или смесь двух или больше эпимеров, и/или рацемические смеси.
Согласно настоящему контексту согласно некоторым вариантам осуществления любой из R631, R632, R641 и R642 может образовывать кольцо с любым другим из R631, R632, R641 и R642. Согласно одному варианту осуществления кольцо не образуется. Таким образом, согласно некоторым вариантам осуществления следующие заместители могут вместе образовывать кольцо: R631 и R632, R631 и R641, R631 и R642, R632 и R641, R632 и R642, и R641 и R642. Согласно одному варианту осуществления группы R, прикрепленные к одному и тому же атому, вместе не образуют кольцо, хотя это не исключено.
Согласно контексту настоящего изобретения соединение считают ингибитором IDO, если его присутствие способно предотвращать, снижать или замедлять превращение триптофана в N-формилкинуренина с помощью IDO по сравнению с тем же превращением при его отсутствии. Согласно одному варианту осуществления соединение считают ингибитором IDO, если его ингибирующая активность показывает значение pIC50, составляющее 4,50 или больше в анализе с использованием клеток аденокарциномы яичника SKOV-3, представленном в примерах. Как правило, соединения согласно настоящему изобретению характеризуются таким значением pIC50, которое превышает это значение для соединения REF 1, и более типично соединения согласно настоящему изобретению характеризуются таким значением pIC50, которое превышает 7,00.
Согласно всем вариантам осуществления настоящего изобретения (как выше, так и ниже в настоящем документе), если не указано иное, если группа R представляет собой замещенную группу R, отсутствуют особые ограничения в отношении заместителя при условии, что он не препятствует возникновению ингибирующей IDO функции. Согласно всем вариантам осуществления, упомянутым в связи с настоящим изобретением, как выше, так и далее, если не указано иное, заместитель на замещенной группе R можно выбрать из -Н, -F и -Me. Кроме того, любой заместитель может содержать комбинацию двух или больше заместителей, определенных выше.
Как было описано, раскрытое в настоящем документе соединение характеризуется формулой (I):
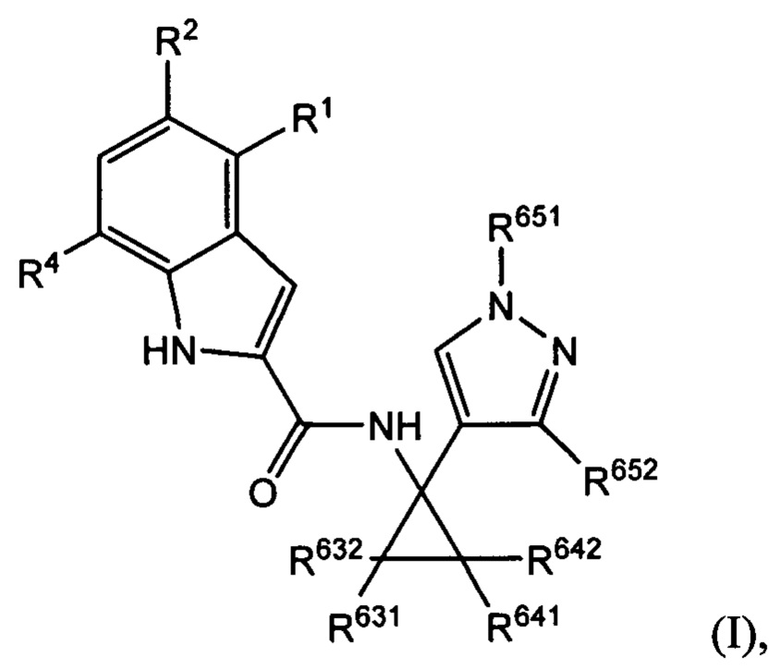
где R2 выбран из -Cl, -Br и -CN; R1 и R4 независимо выбраны из -Н и -F; R631, R632, R641 и R642 независимо выбраны из -Н, -F и замещенных или незамещенных С1-С3 алкильных групп; и R651 и R652 независимо выбраны из -Н и замещенных или незамещенных C1-C3 алкильных групп и замещенных или незамещенных фенильных групп; и где по меньшей мере один из R631, R632, R641, R642 и R652 не представляет собой -Н, или где если все из R631, R632, R641, R642 и R652 представляют собой -Н, R651 не представляет собой Me или Et.
Таким образом, с учетом уже описанных типичных вариантов осуществления, согласно определенным вариантам осуществления настоящее изобретение относится к соединению, как определено выше, причем указанное соединение представляет собой соединение согласно следующей формуле:
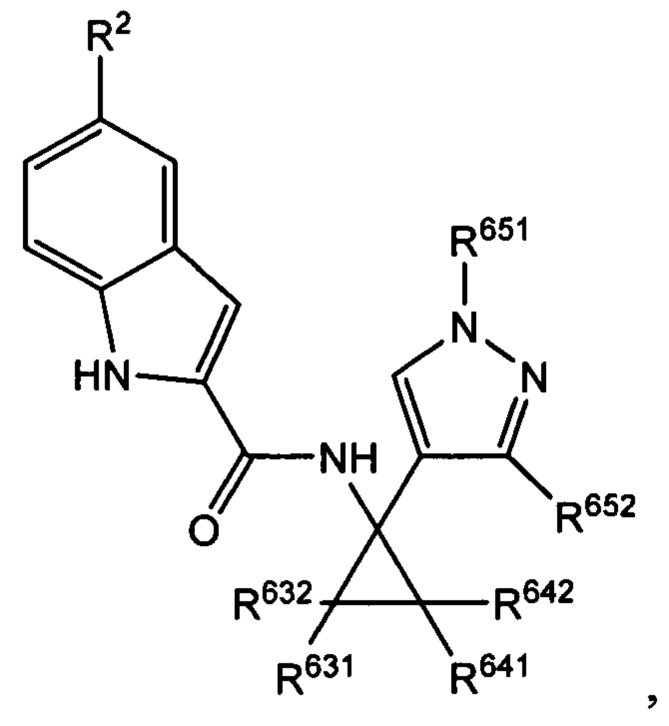
где R2, R631, R632, R641, R642, R651 и R652 характеризуются теми же значениями,
которые описаны выше и в настоящем документе, и где по меньшей мере один из R631, R632, R641, R642 и R652 не представляет собой -Н, или где если все из R631, R632, R641, R642 и R652 представляют собой -Н, R651 не представляет собой -Me или -Et.
Более того, с учетом уже описанных типичных вариантов осуществления, согласно определенным вариантам осуществления настоящее изобретение относится к соединению, как определено выше, причем указанное соединение представляет собой соединение согласно следующей формуле:
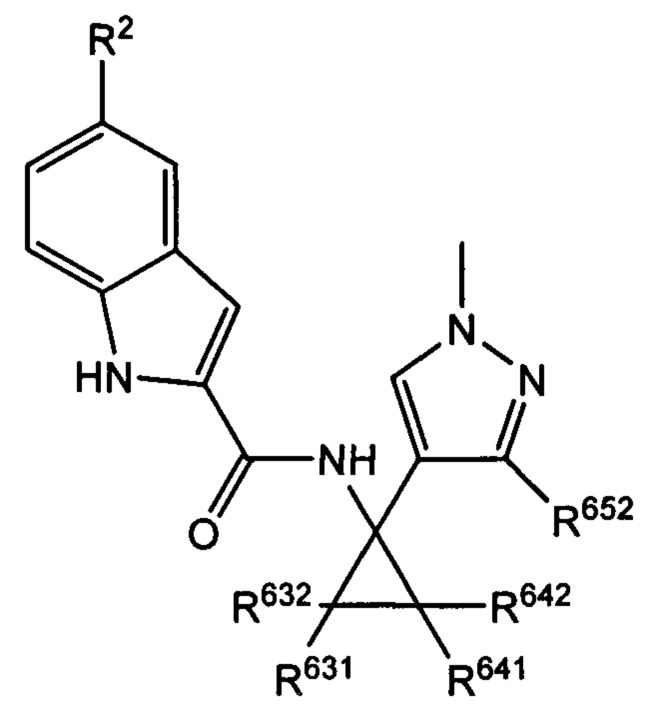
где R2, R631, R632, R641, R642 и R652 характеризуются теми же значениями, которые описаны выше и в настоящем документе, и где по меньшей мере один из R631, R632, R641, R642 и R652 не представляет собой -Н.
Более того, с учетом уже описанных типичных вариантов осуществления, согласно определенным вариантам осуществления настоящее изобретение относится к соединению, как определено выше, причем указанное соединение представляет собой соединение согласно следующей формуле:
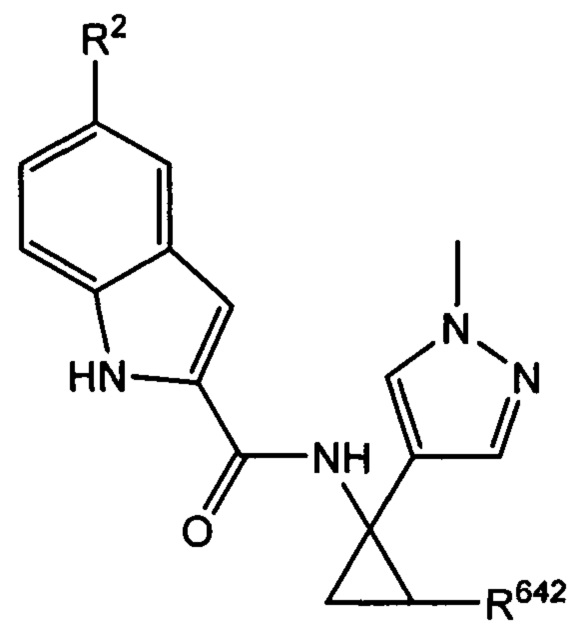
где R2 и R642 характеризуются теми же значениями, которые описаны выше и в настоящем документе, и где R642 не представляет собой -Н. Согласно одному варианту осуществления R2 представляет собой -Br, и/или R642 представляет собой С1-С3 алкил. Согласно другому варианту осуществления R2 представляет собой -О, и/или R642 представляет собой С1-С3 алкил. Согласно другому варианту осуществления R представляет собой -CN, и/или R642 представляет собой С1-С3 алкил. Согласно одному варианту осуществления R2 представляет собой -Br, и R642 представляет собой метил. Согласно другому варианту осуществления R2 представляет собой -Cl, и R642 представляет собой метил. Согласно другому варианту осуществления R представляет собой -CN, и R642 представляет собой метил.
Согласно одному варианту осуществления соединение выбрано из следующего:
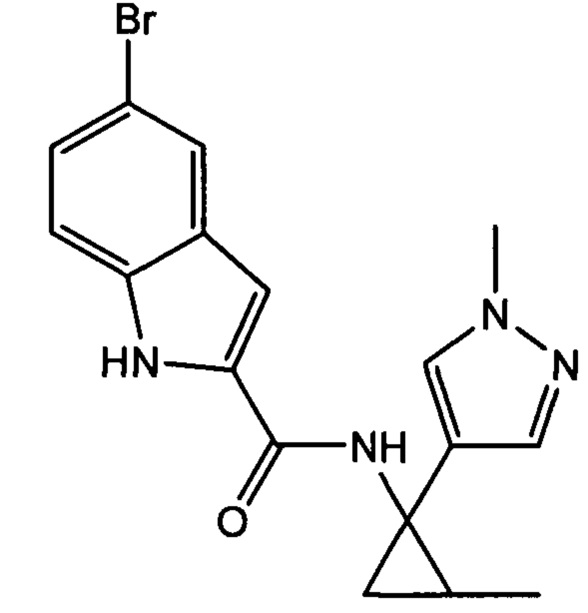 ,
, 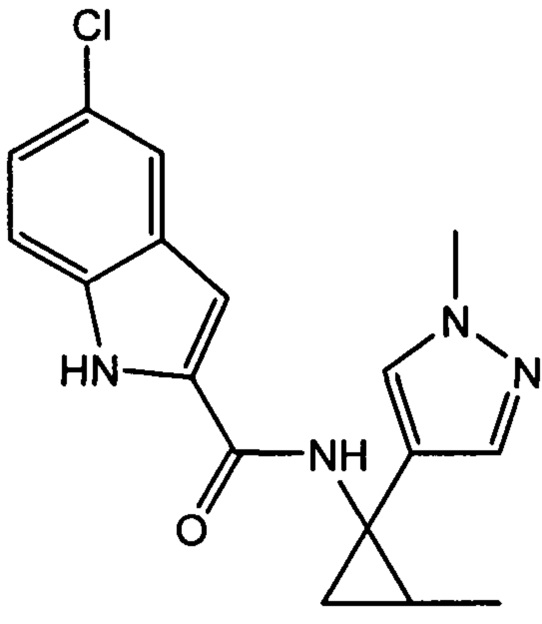 и
и 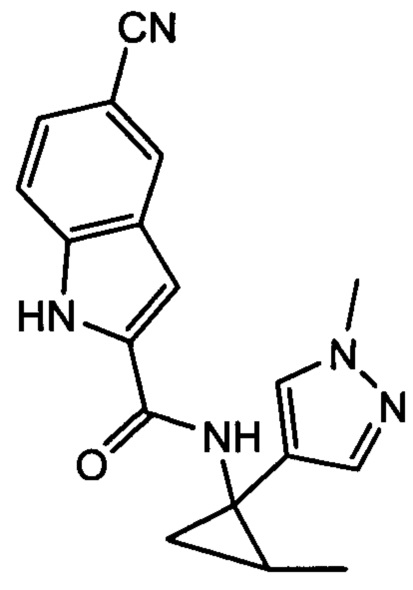 .
.
Как было упомянуто, подразумевается, что любое из представленных в настоящем документе соединений, когда оно изображено без указания стереохимии, включает в себя все возможные стереохимические варианты соединений. Таким образом, соединения, изображенные выше и ниже в настоящем документе, включают в себя все возможные выделенные энантиомеры (включая в себя все возможные выделенные (+) энантиомеры и все возможные выделенные (-) энантиомеры), все возможные выделенные цис-изомеры и все возможные выделенные транс-изомеры, и все возможные мезосоединения и тому подобное. Согласно настоящему изобретению также предусмотрены все возможные смеси энантиомеров в любых пропорциях и все возможные рацемические смеси. Таким образом, соединения согласно настоящему изобретению распространяются на смесь двух или больше энантиомеров, и/или смесь двух или больше диастереомеров (например, если существует больше одного хирального центра), и/или смесь двух или больше эпимеров.
Согласно более типичным вариантам осуществления предпочтительны конкретные стереохимии. Таким образом, выделенные транс-изомеры (транс-расположение относительно циклопропанового кольца) соединения являются предпочтительными в настоящем документе. В определенных более конкретных случаях выделенные (+) энантиомеры соединений являются предпочтительными в настоящем документе.
Таким образом, согласно типичным вариантам осуществления настоящего изобретения соединения, в которых индолсодержащая группа на циклопропильном кольце
находится в транс-расположении относительно стерически самой большой из групп R631, R632, R641 и R642, являются особенно предпочтительными. В таких соединениях более предпочтительным является то, что стерически самая большая из групп R631, R632, R641 и R642 представляет собой группу R642, и, таким образом, в таких случаях индолсодержащая группа на циклопропильном кольце более предпочтительно находится в трансрасположении относительно группы R642. Более того, (+) энантиомеры таких соединений являются предпочтительными, хотя также предусмотрены (-) энантиомеры, рацематы и смеси энантиомеры в любой пропорции. Тем не менее, также предусмотрены соединения, в которых индолсодержащая группа на циклопропильном кольце находится в цис-расположении относительно стерически самой большой из групп R631, R632, R641 и R642. Как и в случае транс-соединений, в указанных цис-соединениях также предпочтительно, что группа R является стерически самой большой из групп R631, R632, R641 и R642, так что индолсодержащая группа на циклопропильном кольце находится в цис-расположении относительно группы R642.
Более того, с учетом уже описанных типичных вариантов осуществления, согласно определенным вариантам осуществления настоящее изобретение относится к соединению, как определено выше, причем указанное соединение представляет собой хиральное соединение, содержащее рацемическую смесь или выделенный энантиомер, характеризующиеся одной (выделенный энантиомер) или обеими (рацемическая смесь) из следующих формул:
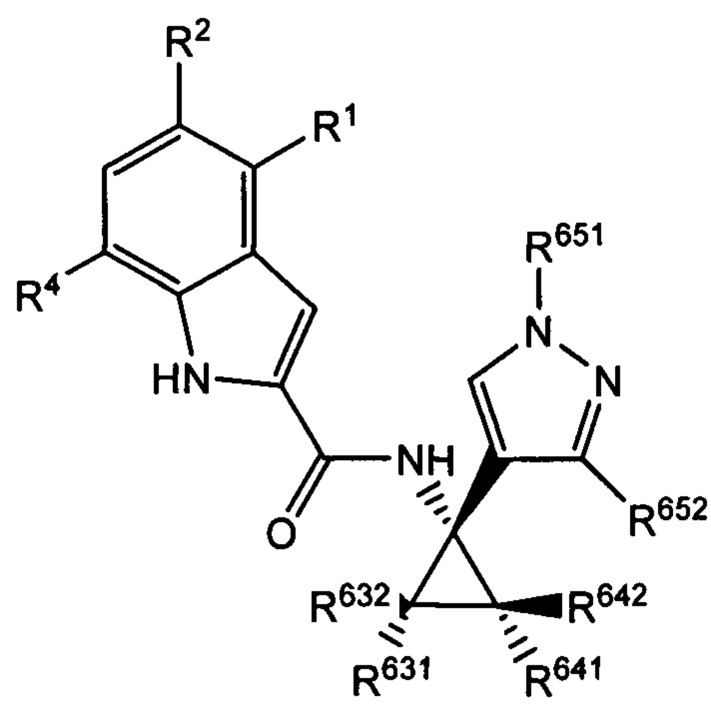 и
и 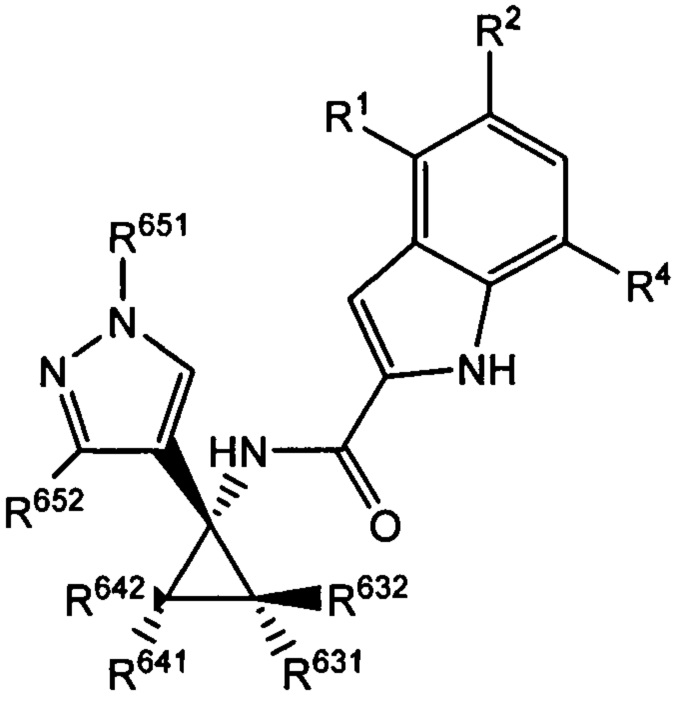 ,
,
где R2 выбран из -Cl, -Br и -CN; R1 и R4 независимо выбраны из -Н и -F; R631, R632, R641 и R642 независимо выбраны из -Н, -F и замещенных или незамещенных С1-С3 алкильных групп; и R651 и R652 независимо выбраны из -Н и замещенных или незамещенных С1-С3 алкильных групп и замещенных или незамещенных фенильных групп; и где R642 представляет собой стерически большую группу, чем любая из R631, R632 и R641.
Таким образом, согласно типичным вариантам осуществления согласно настоящему изобретению, настоящее изобретение относится к соединению, как определено выше, причем указанное соединение представляет собой хиральное соединение, содержащее рацемическую смесь или выделенный энантиомер, характеризующиеся одной (выделенный энантиомер) или обеими (рацемическая смесь) из следующих формул:
 и
и 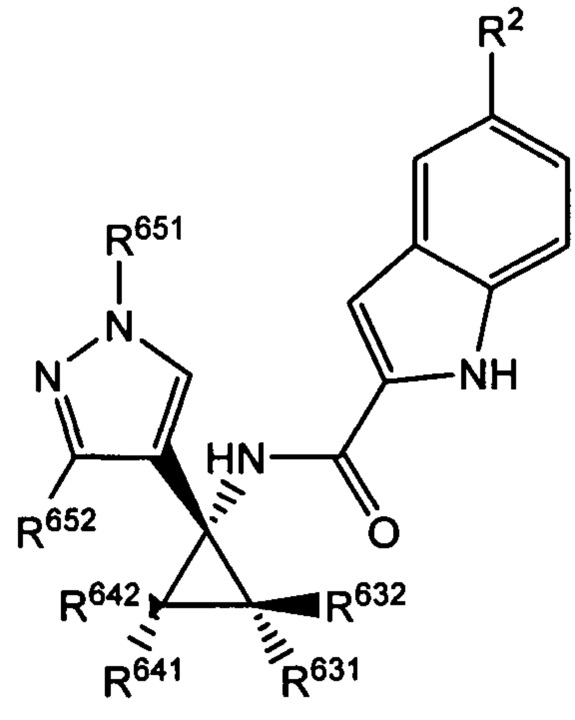 ,
,
где R2 выбран из -Cl, -Br и -CN; R631, R632, R641 и R642 независимо выбраны из -Н, -F и замещенных или незамещенных С1-С3 алкильных групп; R651 и R652 независимо выбраны из -Н и замещенных или незамещенных С1-С3 алкильных групп и замещенных или незамещенных фенильных групп; и где R642 представляет собой стерически большую группу, чем любая из R631, R632 и R641.
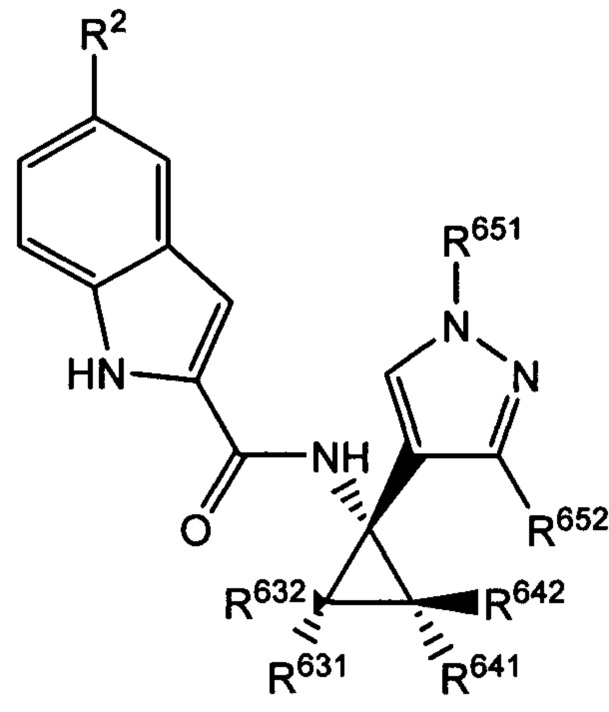
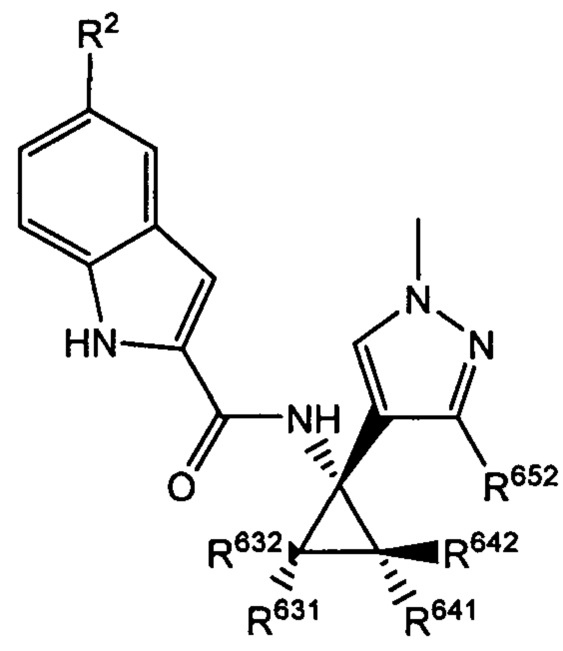
Согласно дополнительным типичным вариантам осуществления настоящего изобретения настоящее изобретение относится к соединению, как определено выше, причем указанное соединение представляет собой хиральное соединение, содержащее рацемическую смесь или выделенный энантиомер, характеризующиеся одной (выделенный энантиомер) или обеими (рацемическая смесь) из следующих формул:
 и
и 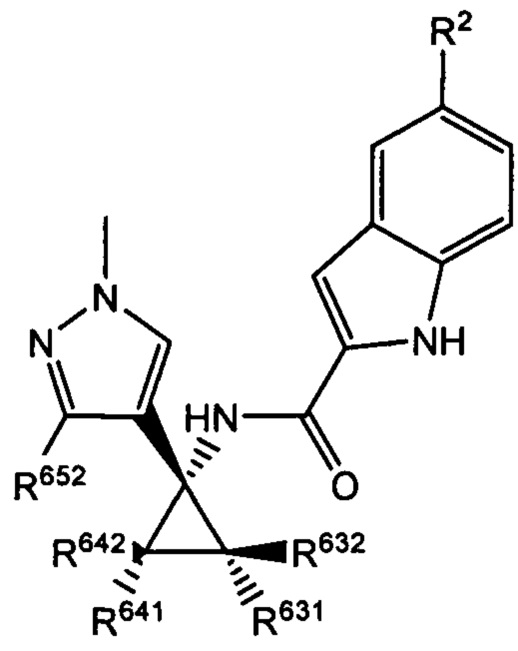 ,
,
где R2 выбран из -Cl, -Br и -CN; R631, R632, R641 и R642 независимо выбраны из -Н, -F и замещенных или незамещенных С1-С3 алкильных групп; R652 выбран из -Н и замещенных или незамещенных С1-С3 алкильных групп и замещенных или незамещенных фенильных групп; и где R642 представляет собой стерически большую группу, чем любая из R631, R632 и R641.
Согласно дополнительным типичным вариантам осуществления настоящего изобретения настоящее изобретение относится к соединению, как определено выше, причем указанное соединение представляет собой хиральное соединение, содержащее
рацемическую смесь или выделенный энантиомер, характеризующиеся одной (выделенный энантиомер) или обеими (рацемическая смесь) из следующих формул:
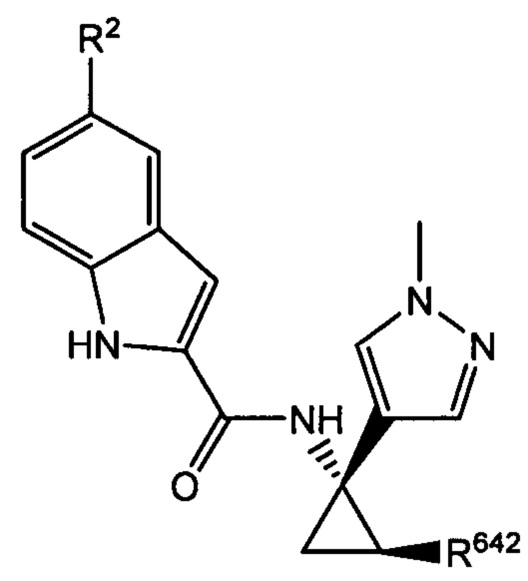 и
и 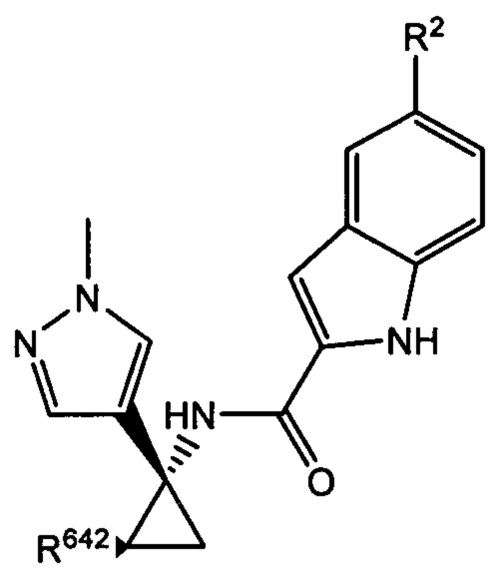 ,
,
где R2 выбран из -Cl, -Br и -CN; и где R642 независимо выбран из -F и замещенных или незамещенных С1-С3 алкильных групп. Выделенные (+) энантиомеры таких соединений являются предпочтительными.
Таким образом, согласно типичным вариантам осуществления настоящего изобретения выделенные энантиомеры и рацемические смеси следующих хиральных соединений являются особенно предпочтительными:
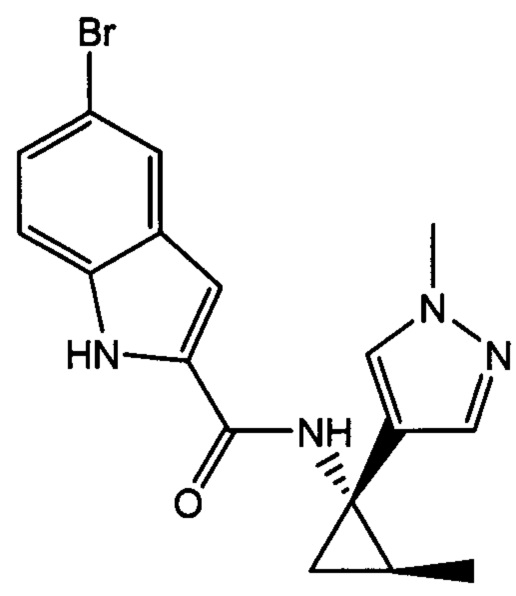 ,
, 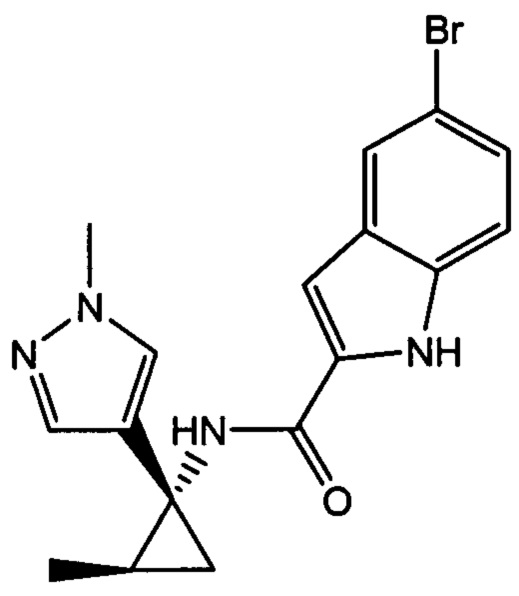 ,
, 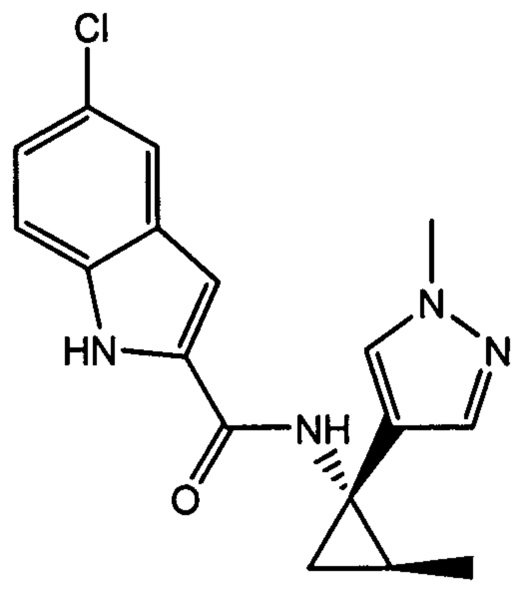 ,
, 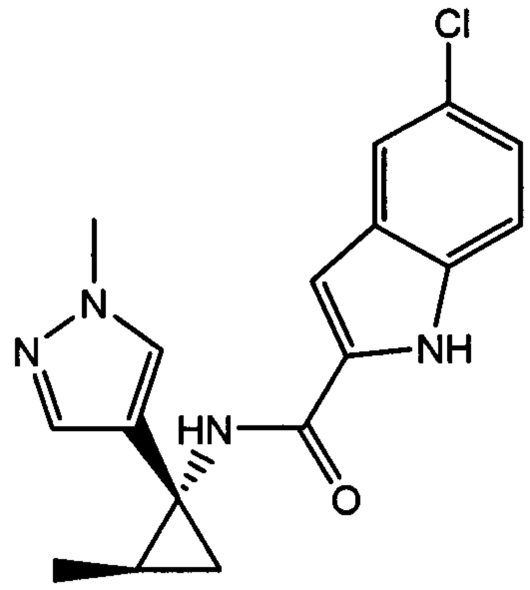 ,
,
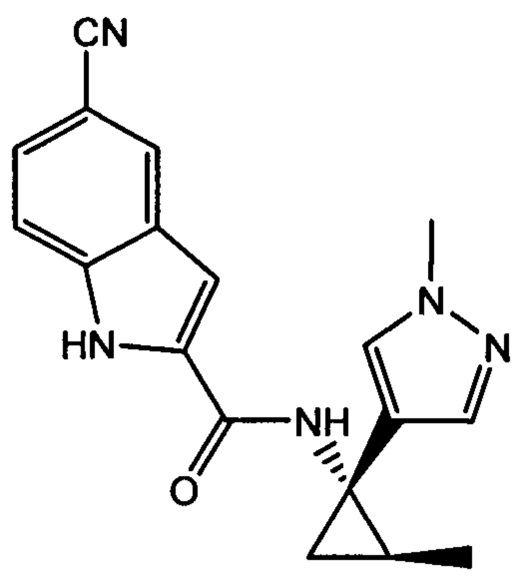 и
и 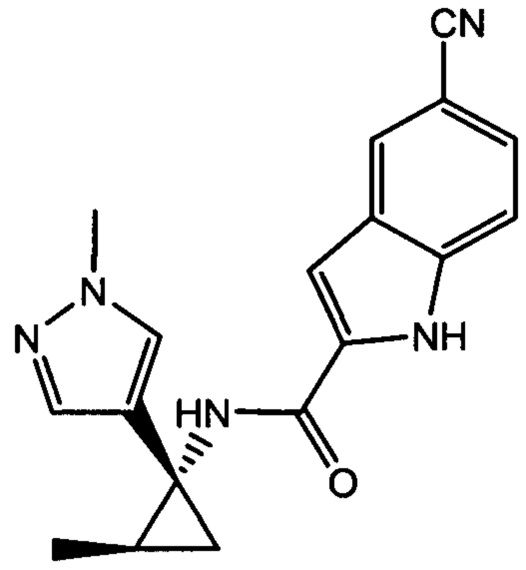 .
.
Как упомянуто выше, выделенные (+) энантиомеры таких соединений являются особенно предпочтительными.
Согласно альтернативным вариантам осуществления, которые являются менее предпочтительными, но не исключены, настоящее изобретение дополнительно относится к хиральным соединениям, содержащим рацемическую смесь или выделенный энантиомер, характеризующиеся одной (выделенный энантиомер) или обеими (рацемическая смесь) из следующих формул:
 и
и 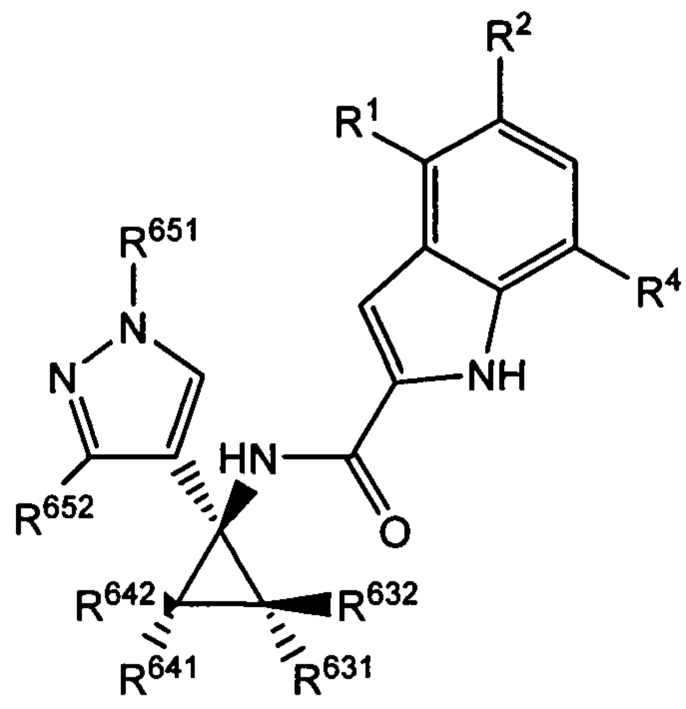 ,
,
где R2 выбран из -Cl, -Br и -CN; R1 и R4 независимо выбраны из -Н и -F; R631, R632, R641 и R642 независимо выбраны из -Н, -F и замещенных или незамещенных С1-С3 алкильных групп; и R651 и R652 независимо выбраны из -Н и замещенных или незамещенных C1-С3 алкильных групп и замещенных или незамещенных фенильных групп; и где R642 представляет собой стерически большую группу, чем любая из R631, R632 и R641.
Таким образом, согласно некоторым вариантам осуществления настоящего изобретения используют следующие хиральные соединения, характеризующиеся одной (выделенный энантиомер) или обеими (рацемическая смесь) из следующих формул:
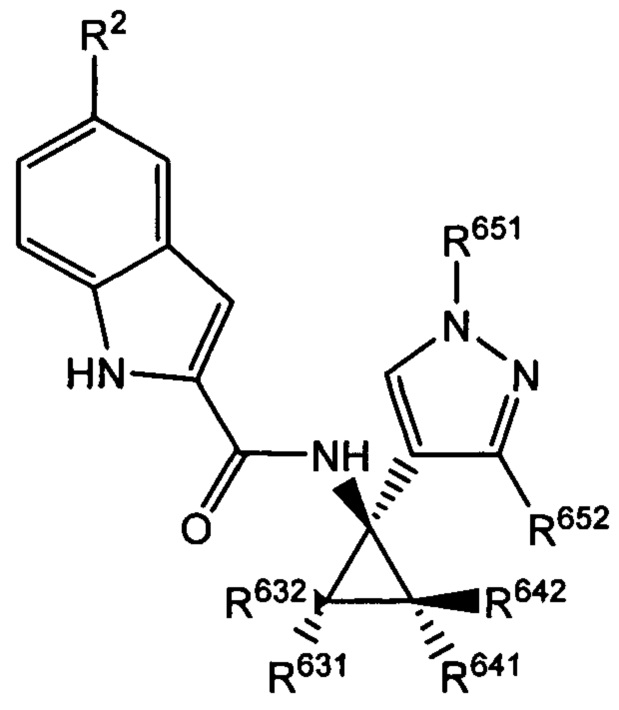 и
и 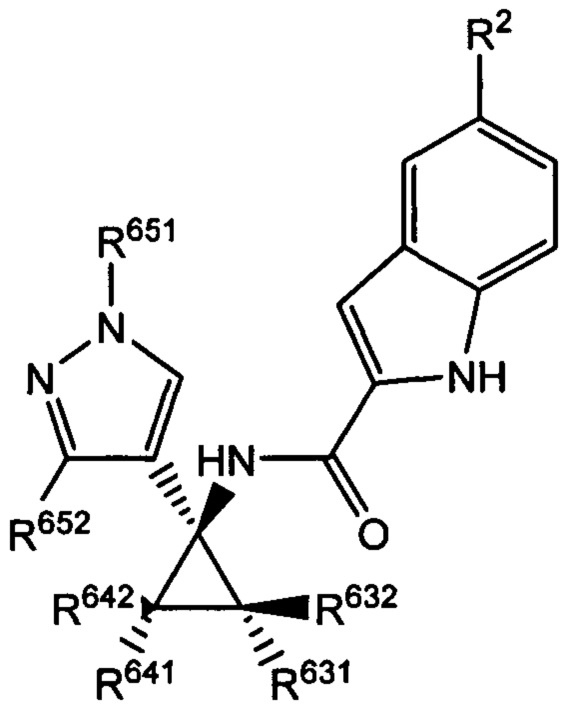 ,
,
где R2 выбран из -Cl, -Br и -CN; R631, R632, R641 и R642 независимо выбраны из -Н, -F и замещенных или незамещенных С1-С3 алкильных групп; R651 и R652 независимо выбраны из -Н и замещенных или незамещенных С1-С3 алкильных групп и замещенных или незамещенных фенильных групп; и где R642 представляет собой стерически большую группу, чем любая из R631, R632 и R641.
Согласно дополнительным вариантам осуществления настоящего изобретения используют следующие хиральные соединения, характеризующиеся одной (выделенный энантиомер) или обеими (рацемическая смесь) из следующих формул:
 и
и  ,
,
где R2 выбран из -Cl, -Br и -CN; R631, R632, R641 и R642 независимо выбраны из -Н, -F и замещенных или незамещенных С1-С3 алкильных групп; R652 выбран из -Н и замещенных или незамещенных С1-С3 алкильных групп и замещенных или незамещенных фенильных групп; и где R642 представляет собой стерически большую группу, чем любая из R631, R632 и R641.
Согласно дополнительным вариантам осуществления настоящего изобретения используют следующие хиральные соединения, характеризующиеся одной (выделенный энантиомер) или обеими (рацемическая смесь) из следующих формул:
 и
и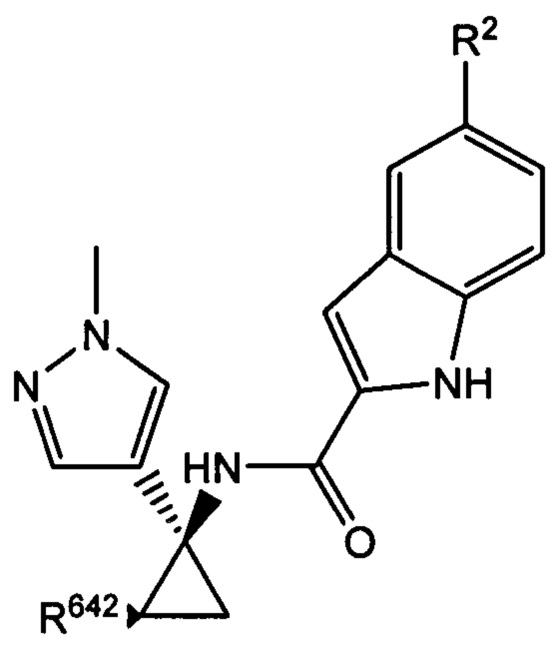
где R2 выбран из -Cl, -Br и -CN; и где R642 независимо выбран из -F и замещенных или незамещенных С1-С3 алкильные группы.
Таким образом, согласно вариантам осуществления настоящего изобретения можно использовать выделенные энантиомеры и рацемические смеси следующих хиральных соединений:
 ,
,  ,
, 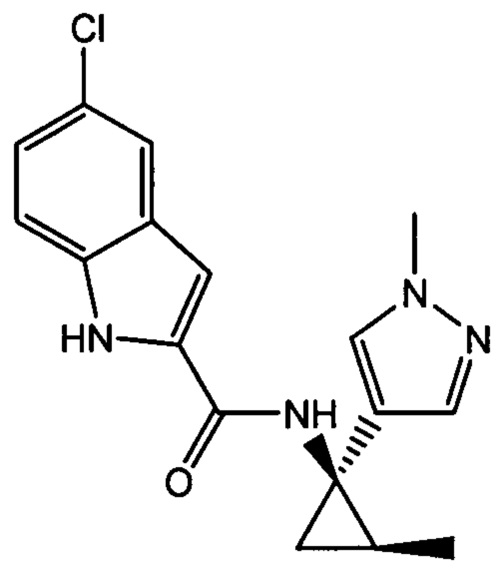 ,
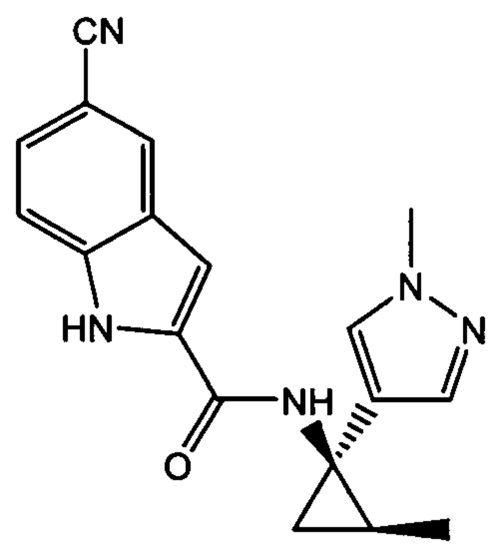
, 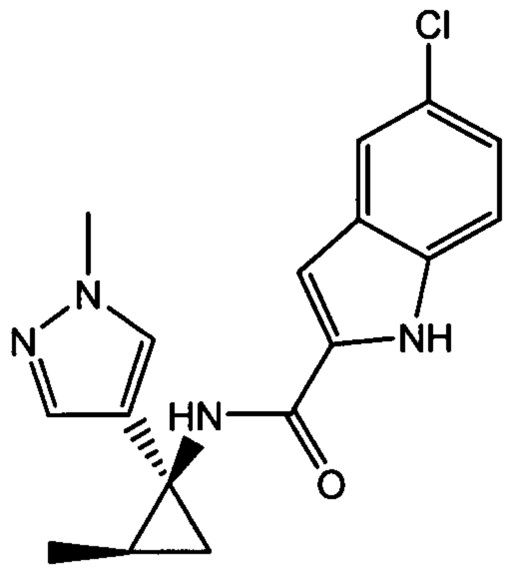 ,
,
 и
и 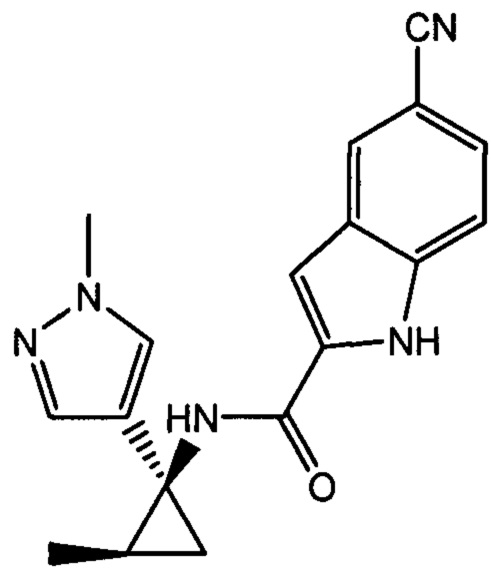 .
.
Природа групп R теперь будет описана более подробно.
Согласно типичным вариантам осуществления оба из R1 и R4 представляют собой -Н. Тем не менее, согласно альтернативным вариантам осуществления R1 представляет собой -F, и R4 представляет собой -Н, или R1 представляет собой -Н, и R4 представляет собой -F, или R1 представляет собой -F, и R4 представляет собой -F. Наиболее предпочтительным является то, что оба из R1 и R4 представляют собой -Н, и предпочтительно, что один из R1 и R4 представляет собой -F, а другой -Н, тогда как согласно менее типичным вариантам осуществления оба из R1 и R4 могут представлять собой -F.
Согласно типичным вариантам осуществления по меньшей мере один из R631, R632, R641 и R642 не представляет собой -Н. Согласно другим вариантам осуществления два или больше, три или больше, или все из R631, R632, R641 и R642 не представляют собой -Н. Согласно таким вариантам осуществления предпочтительным является то, что один или оба из R641 и R642 не представляют собой -Н, и более предпочтительным является то, что R642 не представляет собой -Н. Таким образом, согласно наиболее предпочтительным вариантам осуществления R631, R632 и R641 представляют собой -Н, и R642 не представляет собой -Н. Тем не менее, другие варианты осуществления, в которых все из R631, R632, R641 и R642 представляют собой -Н, не исключены.
Если один или несколько из R631, R632, R641 и R642 представляют собой замещенную или незамещенную С1-С3 алкильную группу, С1-С3 алкильную группу, как правило, можно выбрать из метальной (Me), этильной (Et), пропильной (Pr) и изопропильной (i-Pr) групп. Если С1-С3 алкильная группа представляет собой замещенную С1-С3 алкильную группу, ее, как правило, можно выбрать из алкильных групп со фторсодержащими заместителями, таких как -CH2F, -CHF2 и -CF3.
Согласно более предпочтительным вариантам осуществления R642 представляет собой предпочтительно -Me, -CF3 или -F. Согласно таким вариантам осуществления особенно предпочтительным является то, что R631, R632 и R641 представляют собой -Н.
R651 и R652 могут являться одинаковыми или различными, поскольку они выбраны независимо. Согласно типичным вариантам осуществления по меньшей мере один из R651 и R652 не представляет собой -Н. Согласно другим типичным вариантам осуществления оба из R651 и R652 не представляют собой -Н. Тем не менее, другие варианты осуществления, в которых оба из R651 и R652 представляют собой -Н, не исключены.
Если один или оба из R651 и R652 представляют собой замещенную или незамещенную С1-С3 алкильную группу, С1-С3 алкильную группу, как правило, можно выбрать из метальной (Me), этильной (Et), пропильной (Pr) и изопропильной (i-Pr) групп. Если С1-С3 алкильная группа представляет собой замещенную С1-С3 алкильную группу, ее, как правило, можно выбрать из алкильных групп со фторсодержащими заместителями, таких как -CH2F, -CHF2 и -CF3.
Если один или оба из R651 и R652 представляют собой замещенную или незамещенную фенильную группу, как правило, фенильная группа является незамещенной, т.е. представляет собой -Ph. Если одна из указанных групп представляет собой фенильную группу, более предпочтительным является то, что R651 представляет собой фенил, а не R652.
Согласно другим вариантам осуществления R651 представляет собой -Me, и R652 представляет собой -Н, -Et или -iPr.
Таким образом, настоящее изобретение относится к выделенным энантиомерам, рацемическим смесям и ахиральным соединениям, характеризующимся следующими формулами (абсолютные стереохимии пока не известны, но (+) энантиомеры являются предпочтительными и их можно идентифицировать стандартными способами (например, путем измерения их оптического вращения, как продемонстрировано в примерах в настоящем документе):
 ,
,  ,
,
выделенные (+) и (-) энантиомеры и рацемическая смесь 1: [(+) 1, (-) 1 и rac 1],
 9
9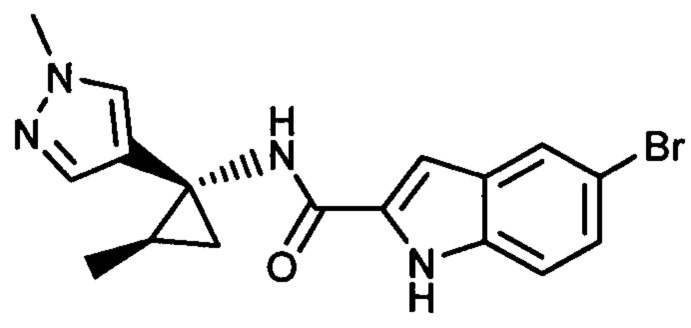 9
9
выделенные (+) и (-) энантиомеры и рацемическая смесь 2: [(+) 2, (-) 2 и rac 2],
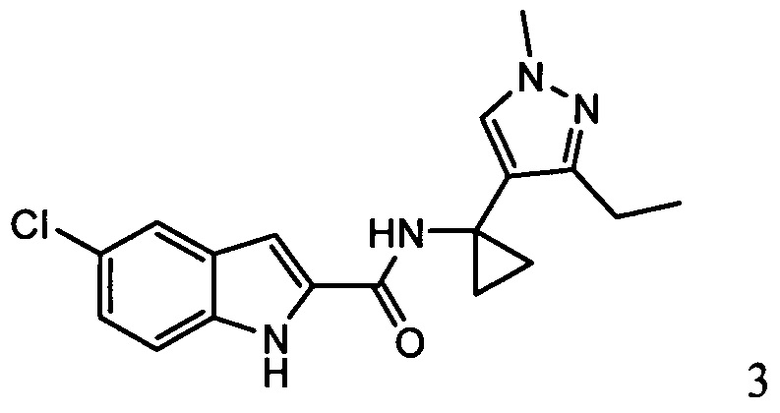 ахиралыюе,
ахиралыюе,
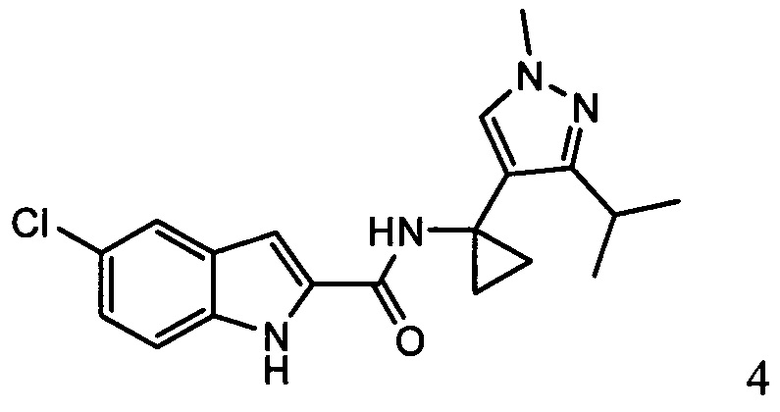 ахиральное,
ахиральное,
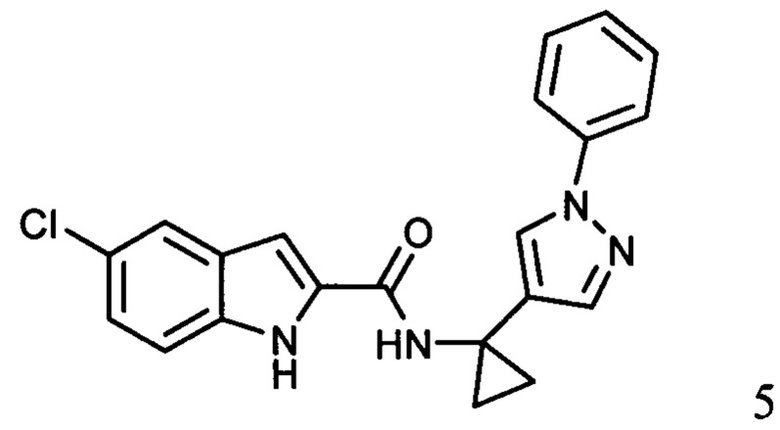 ахиральное,
ахиральное,
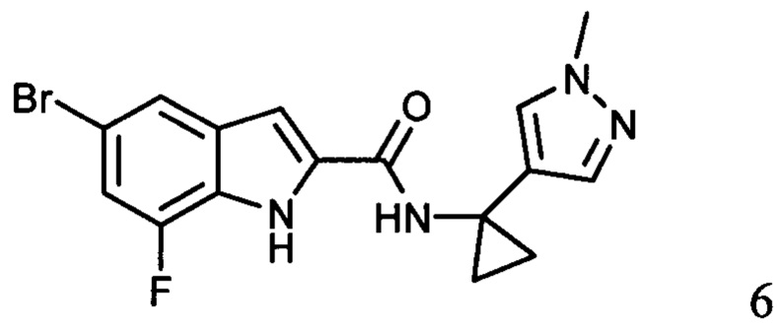 ахиральное,
ахиральное,
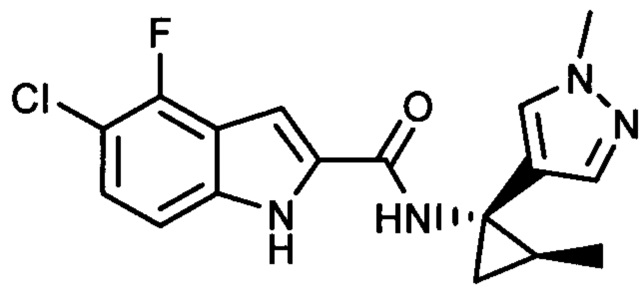 ,
, 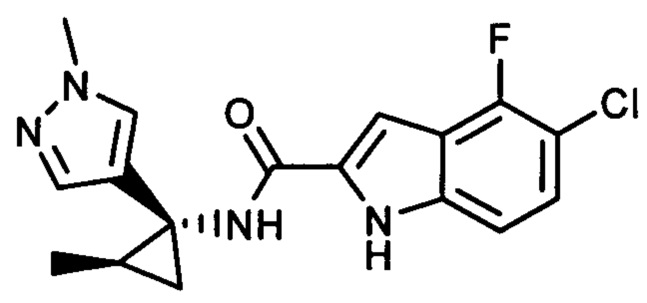 ,
,
выделенные (+) и (-) энантиомеры и рацемическая смесь 7: [(+) 7, (-) 7 и rac 7],
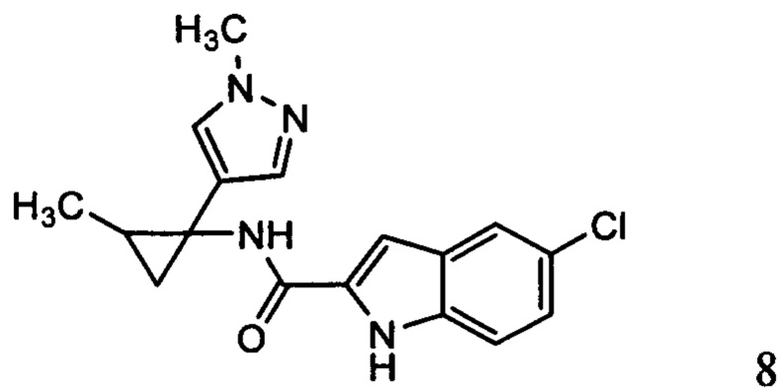 ,
,
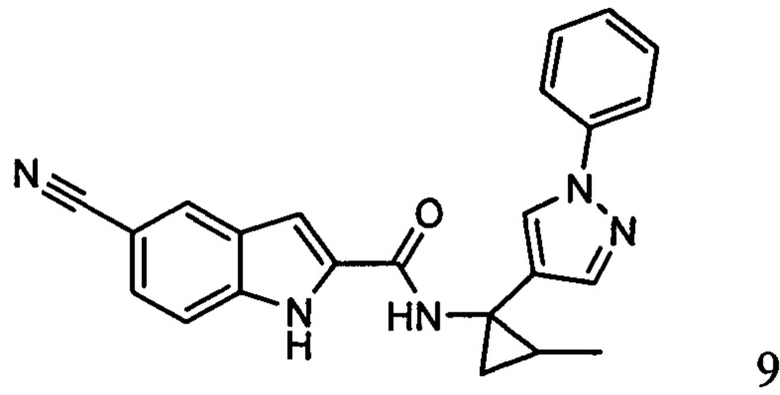 ,
,
 ,
,
 и
и
 .
.
В некоторых случаях формулы в настоящем документе показаны в нестереоизомерной форме, в других случаях в стереоизомерной форме. Во избежание неопределенности, если стереохимия не указана явно, в настоящем контексте одна формула предназначена для представления всех возможных стереоизомеров конкретной структуры, включая в себя все возможные выделенные энантиомеры, соответствующие формуле, все возможные смеси энантиомеров, соответствующих формуле, все возможные смеси диастереомеров, соответствующих формуле (например, где существует больше одного хирального центра), все возможные смеси эпимеров, соответствующих формуле, все возможные рацемические смеси, соответствующие формуле, и все возможные цис- и транс-изомеры, соответствующие формуле. В дополнение к указанному, подразумевается, что представленные выше формулы (и все формулы в настоящем документе) представляют все таутомерные формы, эквивалентные соответствующей формуле.
Согласно контексту настоящего изобретения, отсутствуют особые ограничения в отношении медицинского применения при условии, что оно представляет собой применение, которому содействует ингибирующий IDO эффект соединения. Таким образом, соединения согласно настоящему изобретению могут быть предусмотрены для применения при любом заболевании, состоянии или нарушении, которое можно предотвратить, уменьшить интенсивность или вылечить с использованием ингибитора IDO. Как правило, указанное включает в себя болезненное состояние и/или нарушение, выбранное из следующего: злокачественная опухоль, воспалительное состояние, инфекционное заболевание, заболевание или нарушение центральной нервной системы, ишемическая болезнь сердца, хроническая почечная недостаточность, послеоперационная когнитивная дисфункция, болезненное состояние и/или нарушение, связанное с женским репродуктивным здоровьем, включая в себя контрацепцию или прерывание беременности, и виды катаракты.
Если заболевание, состояние или нарушение представляет собой воспалительное заболевание, состояние или нарушение, оно особо не ограничено при условии, что заболевание, состояние или нарушение представляет собой заболевание, состояние или нарушение, которое можно лечить, предотвращать или снижать интенсивность путем использования ингибитора IDO. Тем не менее, как правило, воспалительное состояние представляет собой состояние, связанное с дисрегуляцией иммунных В-клеток, Т-клеток, дендритных клеток, клеток-натуральных киллеров, макрофагов и/или нейтрофилов.
Если заболевание, состояние или нарушение представляет собой злокачественную опухоль, оно особо не ограничено при условии, что злокачественная опухоль представляет собой злокачественную опухоль, которую можно лечить, предотвращать или снижать интенсивность путем использования ингибитора IDO. Таким образом, злокачественная опухоль может представлять собой злокачественную опухоль, выбранную из следующего: солидная опухоль или опухоль жидких тканей, включая в себя злокачественную опухоль глаза, головного мозга (такую как глиомы, глиобластомы, медуллобластомы, краниофарингиома, эпендимома и астроцитома), спинного мозга, почки, рта, губы, горла, ротовой полости, носовой полости, тонкой кишки, толстой кишки, паращитовидной железы, желчного пузыря, головы и шеи, молочной железы, кости, желчного протока, шейки матки, сердца, железы гортаноглотки, легкого, бронха, печени, кожи, мочеточника, мочеиспускательного канала, яичек, влагалища, ануса, железы гортани, яичника, щитовидной железы, пищевода, носоглоточной железы, гипофиза, слюнной железы, предстательной железы, поджелудочной железы, надпочечников; рак эндометрия, злокачественная опухоль ротовой полости, меланома, нейробластома, рак желудка, ангиоматоз, гемангиобластома, феохромоцитома, киста поджелудочной железы, почечноклеточная карцинома, опухоль Вильмса, плоскоклеточная карцинома, саркома, остеосаркома, саркома Калоши, рабдомиосаркома, печеночноклеточная карцинома, синдром множественной гамартомы и неоплазии (PHTS) (такой как болезнь Лермитта-Дюкло, синдром Каудена, синдром Протея и подобный синдрому Протея синдром), лейкозы и лимфомы (такие как острый лимфобластный лейкоз, хронический лимфоцитарный лейкоз, острый миелогенный лейкоз, хронический миелогенный лейкоз, волосатоклеточный лейкоз, Т-клеточный пролимфоцитарный лейкоз (T-PLL), лейкоз из больших зернистых лимфоцитов, Т-клеточный лейкоз взрослых, ювенильный миеломоноцитарный лейкоз, лимфома Ходжкина, неходжкинская лимфома, лимфома из клеток мантийной зоны, фолликулярная лимфома, первичная эффузионная лимфома, СПИД-ассоциированная лимфома, лимфома Ходжкина, диффузная В-клеточная лимфома, лимфома Беркитта и кожная Т-клеточная лимфома). Более типично (но не исключительно) злокачественная опухоль представляет собой злокачественную опухоль, выбранную из следующего: острый миелоидньш лейкоз (AML), мелкоклеточный рак легкого, меланома, рак яичника, рак толстой и прямой кишки, рак поджелудочной железы, рак эндометрия и папиллома кожи.
Если заболевание представляет собой инфекционное заболевание, оно особо не ограничено при условии, что заболевание представляет собой заболевание, которое можно лечить, предотвращать или снижать интенсивность путем использования ингибитора IDO. Тем не менее, как правило, инфекционное заболевание выбрано из следующего: бактериальная инфекция и вирусная инфекция, предпочтительно инфекция кишечника, сепсис, индуцированная сепсисом гипотензия, инфекция ВИЧ и инфекция ВГС (вирус гепатита С).
Если заболевание, состояние или нарушение представляет собой заболевание, состояние или нарушение центральной нервной системы, оно особо не ограничено при условии, что заболевание, состояние или нарушение представляет собой заболевание, состояние или нарушение, которое можно лечить, предотвращать или снижать интенсивность путем использования ингибитора IDO. Тем не менее, заболевание, состояние или нарушение центральной нервной системы, как правило, выбрано из следующего: боковой амиотрофический склероз (ALS), болезнь Гентингтона, болезнь Альцгеймера, боль, психиатрическое нарушение, рассеянный склероз, болезнь Паркинсона и связанное с ВИЧ нейрокогнитивное расстройство.
Если заболевание, состояние или нарушение представляет собой состояние или нарушение, связанное с женским репродуктивным здоровьем, оно особо не ограничено при условии, что заболевание, состояние или нарушение представляет собой заболевание, состояние или нарушение, которое можно лечить, предотвращать или снижать интенсивность путем использования ингибитора IDO. Согласно типичным вариантам осуществления заболевание, состояние или нарушение выбрано из таких гинекологических нарушений, как эндометриоз. Состояния, относящиеся к женскому репродуктивному здоровью, которые предусмотрены в настоящем изобретении, включают в себя контрацепцию и прерывание беременности, так что соединения согласно настоящему изобретению можно использовать в качестве противозачаточного средства или средства прерывания беременности.
Настоящее изобретение также относится к фармацевтической композиции, содержащей соединение, как определено выше. Наряду с тем, что отсутствуют особые ограничения в отношении фармацевтической композиции, как правило, композиция дополнительно содержит фармацевтически приемлемую добавку и/или вспомогательное вещество. В фармацевтической композиции соединение, как определено выше, может находиться в форме, описанной выше, но альтернативно может находиться в форме, подходящей для улучшения биодоступности, растворимости и/или активности, и/или может находиться в форме, подходящей для улучшения состава. Таким образом, соединение может находиться в форме фармацевтически приемлемой соли, гидрата, кислоты, сложного эфира или другой альтернативной подходящей форме. Как правило, композиция предусмотрена для лечения заболевания, состояния или нарушения, как определено выше. В некоторых случаях соединение может присутствовать в композиции в виде фармацевтически приемлемой соли или другой альтернативной форме соединения для улучшения фармацевтического состава.
Согласно некоторым вариантам осуществления фармацевтическая композиция представляет собой композицию для лечения злокачественной опухоли, дополнительно содержащую дополнительное средство для лечения злокачественной опухоли. Отсутствуют особые ограничения в отношении дополнительного средства для лечения злокачественной опухоли при условии, что оно обеспечивает некоторую применимость для лечения злокачественной опухоли. Тем не менее, как правило, дополнительно средство для лечения злокачественной опухоли выбрано из следующего: антимикротубулиновые средства, координационные комплексы платины, алкилирующие средства, антибиотики, ингибиторы топоизомеразы II, антиметаболиты, ингибиторы топоизомеразы I, гормоны и аналоги гормонов, ингибиторы путей передачи сигналов, ингибиторы ангиогенеза - ингибиторы нерецепторной тирозинкиназы, иммунотерапевтические средства, проапоптозные средства и ингибиторы передачи сигналов клеточного цикла. Иммунотерапевтическое средство может состоять без ограничения из следующего: противоопухолевая вакцина, онколитический вирус, такое стимулирующее иммунитет антитело, как антитело к CTLA4, к PD1, к PDL-1, к ОХ40, к 41ВВ, к CD27, к CD40, к LAG3, к TIM3 и к GITR, новый адъювант, пептид, цитокин, Т-клеточная терапия с помощью химерного антигенного рецептора (CAR-T), низкомолекулярный иммуномодулятор, модуляторы микроокружения опухоли и антиангиогенные средства.
Более того, согласно настоящему изобретению предусмотрен способ лечения заболевания и/или состояния и/или нарушения, причем способ предусматривает введение пациенту соединения или композиции, как определено выше. Способ, как правило, представляет собой способ лечения любого болезненного состояния или нарушения, упомянутого в настоящем документе. Согласно типичным вариантам осуществления способ представляет собой способ лечения злокачественной опухоли. Предпочтительно такой способ предусматривает введение пациенту соединения или композиции, как определено выше, и дополнительного средства для лечения злокачественной опухоли, как определено выше. Соединение или композиция и дополнительное средство можно вводить одновременно, последовательно или отдельно, в зависимости от предусмотренных средств и пациентов, а также указанного типа злокачественной опухоли.
Как правило, согласно всем вариантам осуществления настоящего изобретения, представленным как выше, так и ниже, пациент представляет собой животное, как правило, млекопитающее и более типично представляет собой человека.
Более того, согласно настоящему изобретению предусмотрен способ синтеза соединения, как определено выше, причем способ предусматривает проведение реакции сочетания (такой как реакция амидного сочетания) на заместителе в 2-положении индола.
Настоящее изобретение далее будет описано более подробно, исключительно в качестве примера, со ссылкой на следующие конкретные варианты осуществления.
Экспериментальная часть
Подразумевается, что следующие примеры являются исключительно иллюстративными и неограничивающими каким бы то ни было образом. Используемые сокращения являются общепринятыми в настоящей области техники или следующими.
ACN ацетонитрил
°С градус Цельсия
DCM дихлорметан
DMA диметиламин
DMF N,N-диметилформамид
DMSO диметилсульфоксид
EtOAc этилацетат
EtOH этанол
г грамм
ч час(ы)
ВЭЖХ высокоэффективная жидкостная хроматография
кг килограмм
л литр
ЖХ жидкостная хроматография
ЖХ/МС жидкостная хроматография и масс-спектрометрия
Me метил
МеОН метанол
MS масс-спектрометрия
МТВЕ трет-бутилметиловый эфир
мин минуты
мл миллилитр(ы)
m/z отношение массы к заряду
нм нанометр
нМ наномолярный
н. нормальный
ЯМР ядерный магнитный резонанс
кт или КТ комнатная температура
насыщ. насыщенный
TEA триэтиламин
FA трифторуксусная кислота
THF тетрагидрофуран
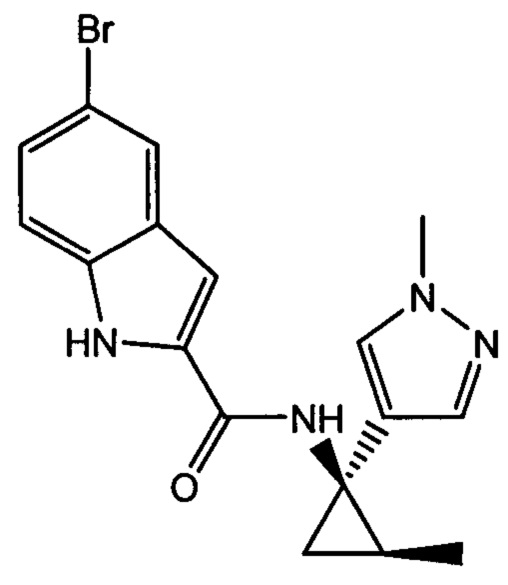
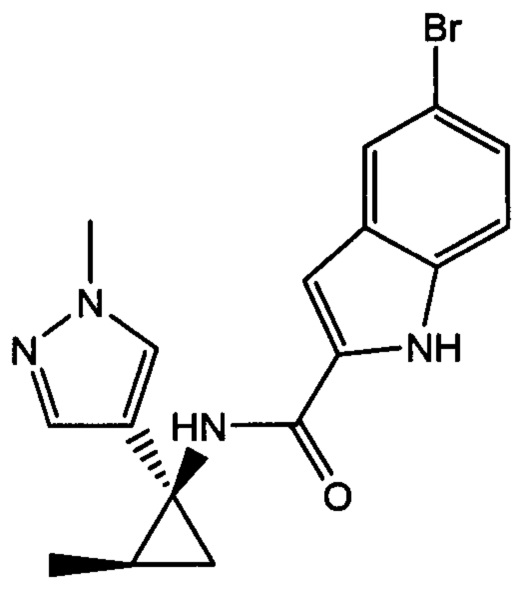
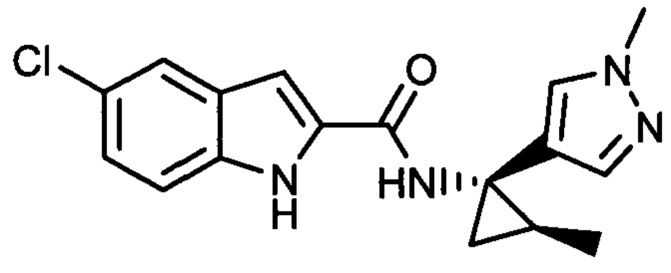
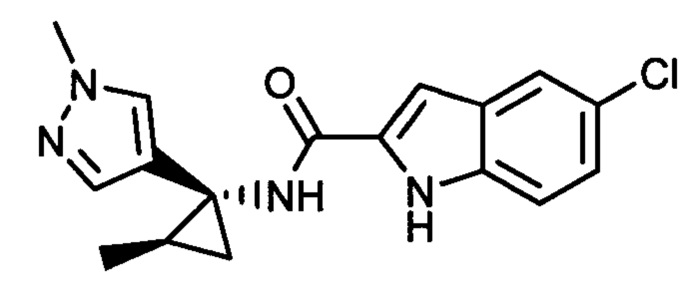
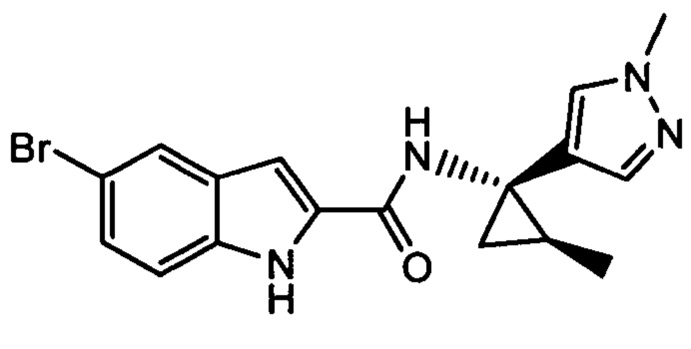
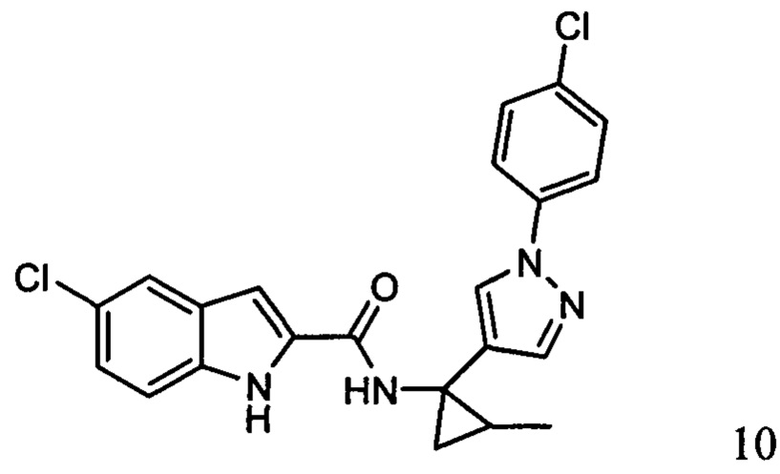
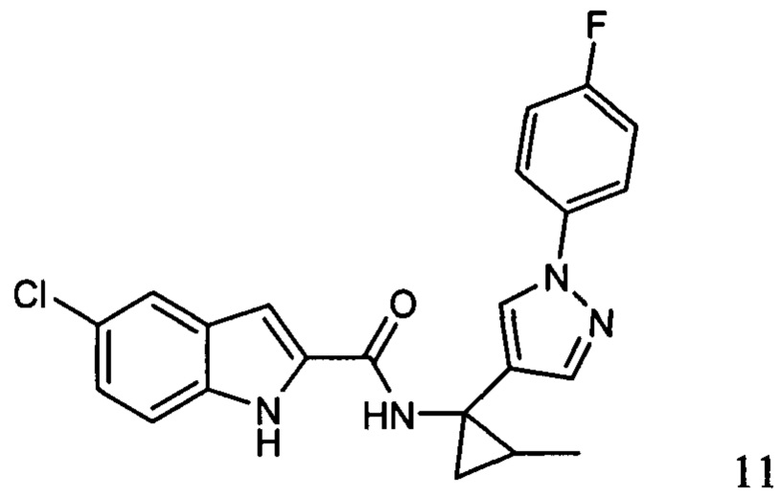
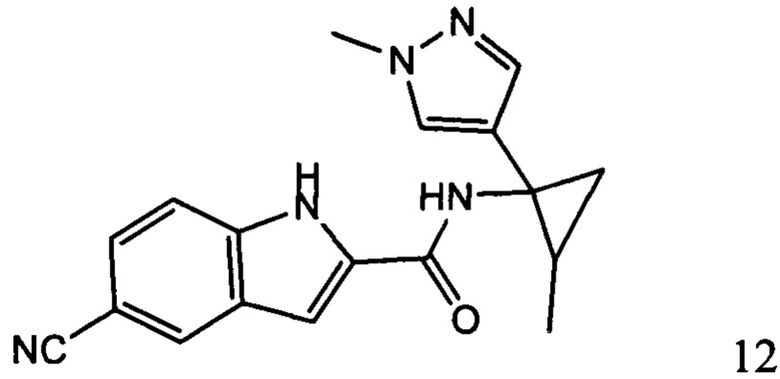
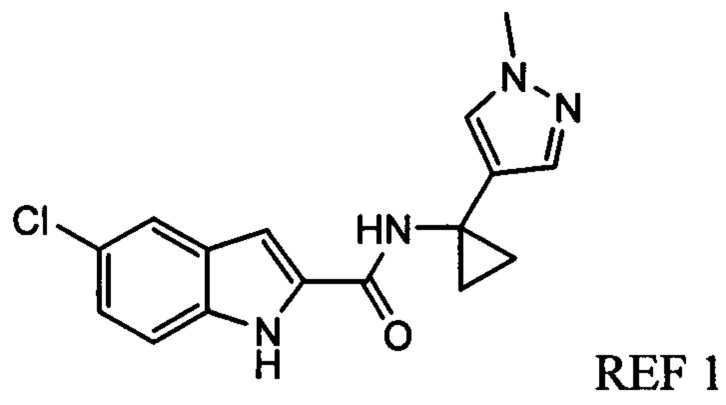
Иллюстративные соединения согласно настоящему изобретению получали и исследовали для определения их эффекта в качестве ингибиторов IDO. Их сравнивали с эталонными соединениями REF 1, REF 2 и REF 3, которые раскрыты в патентной публикации согласно РСТ № WO 2015150097:
 ,
,
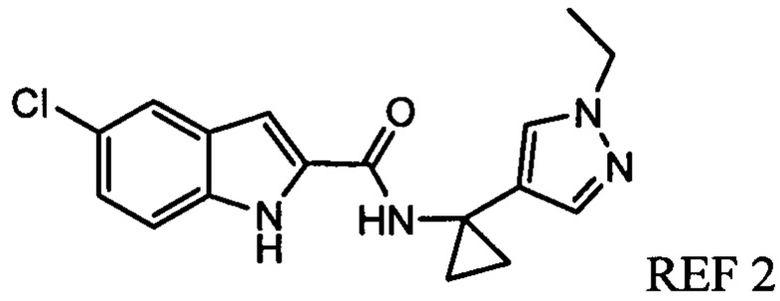 и
и
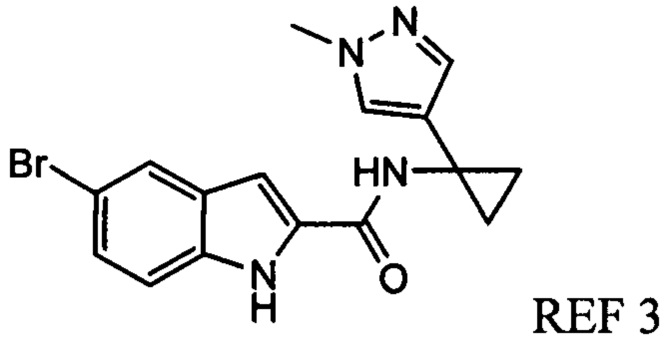 .
.
Примеры
Как было упомянуто, раскрытые в настоящем документе соединения можно синтезировать с использованием известных реакций сочетания и исходных материалов, которые являются коммерчески доступными. Иллюстративные синтезы соединений 1-9 показаны ниже.
Пример 1: Синтез соединения 1 (рацемическая смесь энантиомеров (+) 1 и (-) 1)
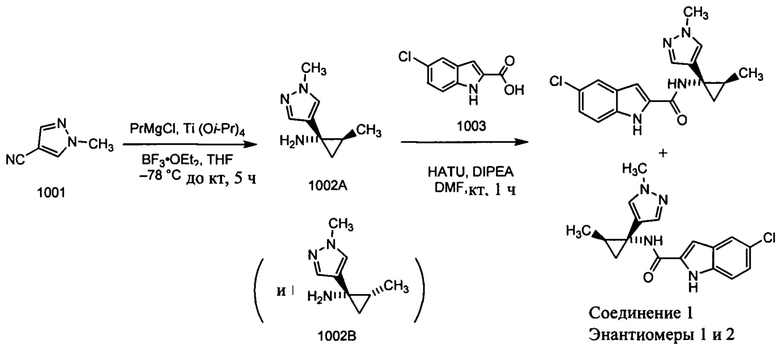
Получение рацемического соединения 1002А и рацемического соединения 1002В
К раствору нитрила 1001 (25,0 г, 0,23 моль) в THF (135 мл) добавляли Ti(O-i-Pr)4 (73 мл, 0,46 моль) при комнатной температуре. К указанной выше реакционной смеси в атмосфере аргона при -78°С реагент Гриньяра (500 мл, 0,58 моль) добавляли по каплям и реакционную смесь перемешивали при -78°С в течение 0,5 ч. Затем реакционную смесь перемешивали при окружающей температуре в течение 1 ч. BF3⋅OEt2 (67,0 мл, 0,46 моль) добавляли к указанной выше реакционной смеси при комнатной температуре и перемешивали в течение 1 ч. После завершения реакции реакционную смесь гасили с помощью воды (17 мл), HCl (2 н., 30 мл) для доведения рН до 3 и перемешивали в течение 15 мин и затем подщелачивали с помощью 6 н. NaOH (доведение рН до 10). Органический слой разделяли и водный слой экстрагировали с помощью 10% CH2Cl2/CH3OH (200 мл × 2). Комбинированные органические слои высушивали на безводном Na2SO4 и концентрировали при пониженном давлении. Сырой остаток дополнительно очищали с помощью колоночной хроматографии с использованием системы Combiflash (CH2Cl2/CH3OH, от 0 до 10%) для разделения рацемического соединения 1002А (4,0 г, 11%) (транс) и рацемического соединения 1002В (6,0 г, 14%) (цис) в виде красновато-коричневых масел. MS (MM) m/z 152,1 [М+Н]+.
1Н ЯМР 2А (300 МГц, DMSO-d6): δ 7,61 (с, 1Н), 7,38 (с, 1Н), 4,32 (уш.с, 3Н), 4,02 (с, 3Н), 1,25-1,21 (м, 1H), 1,20-1,16 (м, 1H), 1,00 (д, 2Н), 0,78 (т, 1Н).
Получение соединения 1 (рацемическая смесь энантиомеров (+) 1 и (-) 1) К раствору 1003 (9,0 г, 0,046 моль) в DMF добавляли рацемическое соединение 1002А (7,0 г, 0,046 моль) с последующим добавлением HATU (26,0 г, 0,06 моль) и DIPEA (16,0 мл, 0,092 моль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь разбавляли с помощью воды (200 мл) и фильтровали, полученное твердое вещество дополнительно очищали с помощью колоночной хроматографии с использованием системы Combiflash (гексан/EtOAc, 1:1) с получением рацемической смеси соединения 1 (2,42 г, 16%) в виде твердого вещества. MS (MM) m/z 329,1 [М+Н]+; ВЭЖХ: 96,9%, Zorbax-SB-CN, 220 нм
1Н ЯМР (300 МГц, DMSO-d6): δ 11,66 (с, 1Н), 9,11 (с, 1H), 7,65 (д, 1Н), 7,56 (с, 1Н), 7,41 (д, 1H), 7,32 (с, 1Н), 7,15 (дд, 1Н), 7,07 (д, 1Н) 3,76 (с, 3Н), 1,32 (м, 1Н), 1,26 (м, 1Н), 0,89 (м, 4Н).
Хиральное разделение соединения 1 на энантиомеры (+) 1 и (-) 1
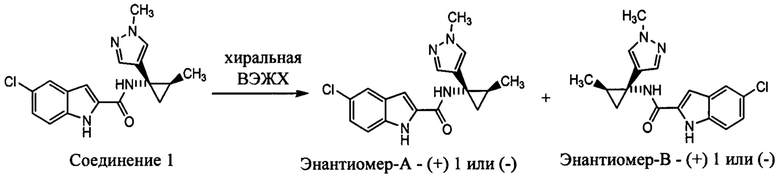
Соединение 1 (110 мг) подвергали хиральной хроматографии для разделения энантиомеров. Выделенный энантиомер (-) 1 соединения (30,0 мг, 54%) получали в виде грязно-белого твердого вещества и выделенный энантиомер (+) 1 соединения (21,9 мг) также получали в виде грязно-белого твердого вещества.
Условия ВЭЖХ, используемые для очистки
Колонка: Chiralcel OD-H 250×20 мм, 5 мкм (серия № 00H0CJ-QH004; партия №14245).
Подвижная фаза: гексан: IPA (75:25% объем/объем); УФ: 220 нм.
Аналитические данные для (-) 1
MS (MM) m/z 329,1 [М+Н]+; ВЭЖХ: >99%, Zorbax-SB-CN, 220 нм;
(-) 1: [α]25D -125,7° (с 0,1, метанол);
1Н ЯМР (300 МГц, DMSO-d6): δ 11,66 (с, 1Н), 9,11 (с, 1H), 7,65 (д, 1Н), 7,56 (с, 1H), 7,41 (д, 1H), 7,32 (с, 1H), 7,15 (дд, 1Н), 7,07 (д, 1Н) 3,76 (с, 3Н), 1,32 (м, 1Н), 1,26 (м, 1Н), 0,89 (м, 4Н).
Аналитические данные для (+) 1
MS (MM) m/z 329,1 [М+Н]+; ВЭЖХ: >99%, Zorbax-SB-CN, 220 нм;
(+) 1: [α]25D +119,2° (с 0,1, метанол);
1Н ЯМР (300 МГц, DMSO-d6): δ 11,66 (с, 1H), 9,11 (с, 1Н), 7,65 (д, 1Н), 7,56 (с, 1Н), 7,41 (д, 1Н), 7,32 (с, 1Н), 7,15 (дд, 1Н), 7,07 (д, 1Н) 3,76 (с, 3Н), 1,32 (м, 1Н), 1,26 (м, 1Н), 0,89 (м, 4Н).
Пример 2: Синтез соединения 2 (рацемическая смесь энантиомеров (+) 2 и (-) 2)
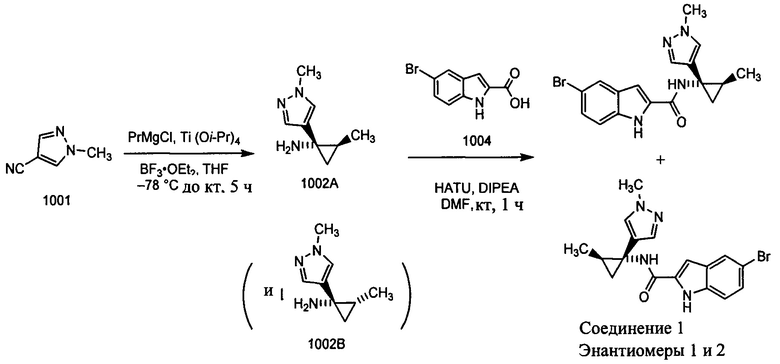
Получение соединения 2 (рацемическая смесь энантиомеров (+) 2 и (-) 2) К раствору 1004 (9,0 г, 0,037 моль) в DMF добавляли сырую смесь рацемического соединения 1002А и рацемического соединения 1002В (19,0 г, полученную из превращения соединения 1001 в 1002А/1002В, как описано выше, но без разделения транс- и цис-изомеров) с последующим добавлением HATU (21,0 г, 0,056 моль) и DIPEA (13,0 мл, 0,075 моль) при комнатной температуре. Полученную реакционную смесь перемешивали при комнатной температуре в течение 1 ч. После завершения реакции, реакционную смесь выливали в воду (200 мл), фильтровали и полученное твердое вещество затем дополнительно очищали для разделения транс- и цис-изомеров с помощью колоночной хроматографии с использованием системы Combiflash с использованием 120 г колонки redisep® (гексан/EtOAc, 1:1) с получением рацемической смеси соединения 2 (2,40 г, 14%) в виде твердого вещества. MS (MM) m/z 373,1 [М+Н]+; ВЭЖХ: 96,9%, Zorbax-SB-CN, 220 нм.
1H ЯМР (300 МГц, DMSO-d6): δ 11,68 (с, 1H), 9,13 (с, 1Н), 7,80 (с, 1Н), 7,56 (с, 1Н), 7,35 (т, 2Н), 7,25 (д, 1Н), 7,07 (с, 1Н), 3,76 (с, 3Н), 1,32 (м, 1Н), 1,26 (м, 1Н), 0,89 (м, 4Н).
Хиральное разделение соединения 2 на энантиомеры (+) 2 и (-) 2
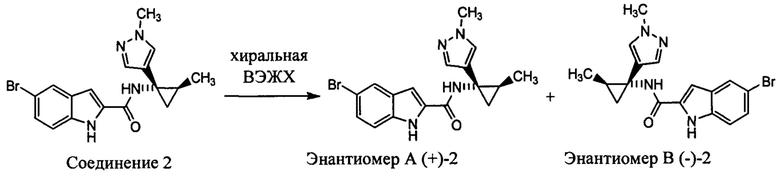
Соединение 2 (110 мг) подвергали очистке с помощью хиральной ВЭЖХ для разделения энантиомеров. Выделенный энантиомер (-) 2 соединения 2 (20 мг, кт, 9,64) и энантиомер (+) 2 соединения 2 (20 мг, кт, 13, 59) получали в виде твердых веществ.
Условия препаративной ВЭЖХ, используемые для очистки
Колонка: Chiralcel OD-H 250×20 мм, 5 мкм (серия № 00H0CJ-QH004; партия №14245). Подвижная фаза: гексан: IPA (75:25% объем/объем).
УФ: 220 нм
Аналитические данные для (-) 2
MS (MM) m/z 373,1 [М+Н]+; ВЭЖХ: >99%, Zorbax-SB-CN, 220 нм;
(-) 2: [α]25D -120° (с 0,1, метанол);
1Н ЯМР (300 МГц, DMSO-d6): δ 11,68 (с, 1Н), 9,12 (с, 1Н), 7,80 (дд, 1H), 7,56 (с, 1Н), 7,35 (т, 2Н), 7,25 (дд, 1Н), 7,07 (дд, 1Н), 3,76 (с, 3Н), 1,32 (м, 1Н), 1,26 (м, 1Н), 0,89 (м, 4Н).
Аналитические данные для (+) 2
MS (MM) m/z 373,1 [М+Н]+; ВЭЖХ: 99,0%, Zorbax-SB-CN, 220 нм;
(+) 2: [α]25D +110° (с 0,1, метанол);
1Н ЯМР (300 МГц, DMSO-d6): δ 11,68 (с, 1Н), 9,12 (с, 1H), 7,80 (дд, 1H), 7,56 (с, 1H), 7,35 (т, 2Н), 7,25 (дд, 1H), 7,07 (дд, 1Н), 3,76 (с, 3Н), 1,32 (м, 1H), 1,26 (м, 1Н), 0,89 (м, 4Н).
Пример 3: Синтез соединения 7 (рацемическая смесь энантиомеров (+) 7 и (-) 7)
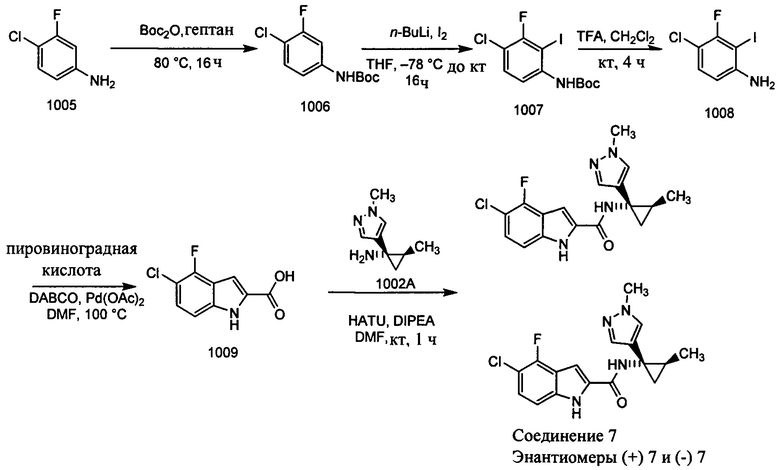
Получение 1006
К раствору 1005 (10,0 г, 68,7 ммоль) в гептане (100 мл) добавляли (Вос)2О (16,4 мл, 76,6 ммоль). После перемешивания реакционной смеси при 80°С в течение 16 ч растворитель испаряли и остаток очищали с помощью колоночной хроматографии с использованием системы Combiflash (гексан/EtOAc, 1:2) с получением 1006 (7,0 г, 43%) в виде твердого вещества.
1Н ЯМР (400 МГц, CDCl3): δ 7,44 (дд, 1Н), 7,27 (т, 1Н), 6,94 (дд, 1Н), 6,53 (с, 1Н). 1,50 (с, 9Н).
Получение 1007
К раствору 1006 (7,0 г, 28,5 ммоль) в THF (70 мл) добавляли н-BuLi (2,5М) (34,2 мл, 85,5 ммоль) при -78°С. После перемешивания реакционной смеси в течение 0,5 ч йод (25,2 г, 99,7 ммоль) в THF добавляли при -78°С. Затем реакционную смесь перемешивали при -78°С в течение 2 ч и гасили с помощью водн. NH4Cl (50 мл) и экстрагировали с помощью EtOAc (2×100 мл). Комбинированные органические слои высушивали на безводном Na2SO4 и очищали с помощью колоночной хроматографии с использованием системы Combiflash (гексан/EtOAc, 1:2) с получением 1007 (5,0 г, сырой продукт) в виде твердого вещества.
Получение 1008
К раствору 1007 (3,0 г, 8,0 ммоль) в CH2Cl2 (30 мл) добавляли TFA (10,0 мл) при комнатной температуре. После перемешивания реакционной смеси при комнатной температуре в течение 16 ч, растворитель испаряли и сырой продукт отмывали с помощью гексана (20 мл) с получением 1008 (1,0 г, сырой продукт) в виде твердого вещества.
Получение 1009
К раствору 1008 (3,0 г, 11,07 ммоль) в DMF (40 мл) добавляли пировиноградную кислоту (2,4 мл, 33,2 ммоль) и DABCO (3,7 мл, 33,2 ммоль). Затем реакционную смесь дегазировали с помощью аргона в течение 10 мин и добавляли Pd(OAc)2 (246 мг). После перемешивания реакционной смеси при 100°С в течение 3 ч воду (15 мл) добавляли к реакционной смеси и затем экстрагировали с помощью EtOAc (2×30 мл). Комбинированные органические слои высушивали на безводном Na2SO4 и концентрировали при пониженном давлении. Сырой остаток очищали с помощью колоночной хроматографии с использованием системы Combiflash (гексан/EtOAc, 1:2) с получением 1009 (1,0 г, 43%) в виде твердого вещества.
1H ЯМР (300 МГц, DMSO-d6): δ 12,32 (с, 1H), 7,31 (кв., 2Н), 7,12 (с, 1Н).
Получение соединения 7 (рацемическая смесь энантиомеров (+) 7 и (-) 7) К раствору 1009 (100 мг, 4,69 ммоль) в DMF добавляли 1002А (полученный из превращения соединения 1001 в 1002А/1002В, как описано выше) (71 мг, 4,69 ммоль) с последующим добавлением HATU (267 мг, 7,03 ммоль) и DIPEA (0,16 мл, 9,38 ммоль). После перемешивания при комнатной температуре в течение 1 ч реакционную смесь разбавляли с помощью воды (20 мл) и затем твердое вещество собирали с помощью фильтрования и дополнительно очищали с помощью колоночной хроматографии с использованием системы Combiflash (гексан/EtOAc, 1:1) с получением рацемической смеси соединения 7 (42 мг, 26%) в виде твердого вещества. MS (MM) m/z 347,1 [М+Н]+; ВЭЖХ: 96,9%, Zorbax-SB-CN, 220 нм.
1H ЯМР (300 МГц, DMSO-d6): δ 12,0 (с, 1Н), 9,18 (с, 1Н), 7,56 (с, 1Н), 7,33 (с, 1Н), 7,24 (т, 3Н), 3,76 (с, 3Н), 1,32 (м, 1Н), 1,18 (м, 1Н), 0,91 (м, 4Н).
Пример 4: Синтез соединения 5
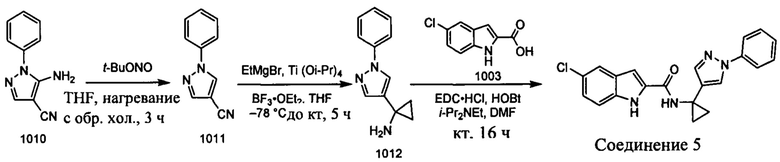
Получение 1011
К раствору 1010 (1,0 г, 5,43 ммоль) в THF (12 мл) добавляли t-BuONO (0,67 г, 6,52 ммоль). После перемешивания с обратным холодильником в течение 3 ч реакционную смесь разбавляли с помощью воды (20 мл) и экстрагировали с помощью EtOAc (25 мл × 3). Комбинированные органические слои высушивали на безводном Na2SO4 и концентрировали при пониженном давлении. Сырой остаток очищали с помощью колоночной хроматографии с использованием системы Combiflash (гексан/EtOAc, 1:1) с получением 1011 (800 мг, 87%) в виде твердого вещества.
1Н ЯМР (300 МГц, CDCl3): δ 8,31 (д, 1Н), 8,00 (с, 1Н), 7,68 (м, 2Н), 7,52 (м, 2Н), 7,43 (м, 1Н).
Получение 1012
К раствору нитрила 1011 (300 мг, 1,77 ммоль) в THF (3 мл) добавляли Ti(O-i-Pr)4 (0,6 мл, 1,94 ммоль) при комнатной температуре. Реагент Гриньяра (4,5 мл, 4,43 ммоль) добавляли к реакционной смеси по каплям в атмосфере аргона при -78°С и реакционную смесь перемешивали при -78°С в течение 0,5 ч и затем при окружающей температуре в течение 1 ч. К указанной выше реакционной смеси при комнатной температуре добавляли BF3⋅OEt2 (0,5 мл, 3,54 ммоль) и перемешивали в течение 1 ч. После завершения реакции реакционную смесь гасили с помощью воды (3,0 мл), 2 М HCl (2,0 мл) вплоть до рН=3 и перемешивали в течение 15 мин и затем подщелачивали с помощью 6 н. NaOH вплоть до рН=10. Реакционную смесь экстрагировали с помощью 10% CH2Cl2/МеОН (15 мл × 3). Комбинированные органические слои высушивали на безводном Na2SO4 и концентрировали при пониженном давлении. Сырой остаток дополнительно очищали с помощью колоночной хроматографии с использованием системы Combiflash (CH2Cl2/МеОН, 0 to 10%) с получением 1012 (60 мг, 17%) в виде масла. MS (MM) m/z 199,1 [М+Н]+.
Получение соединения 5
К раствору 1012 (60 мг, 0,30 ммоль) в DMF (1,2 мл) добавляли 1003 (58 мг, 0,30 ммоль) с последующим добавлением EDC⋅HCl (115 мг, 0,60 ммоль), НОВТ (81 мг, 0,60 ммоль) и DIPEA (0,15 мл, 0,60 моль). После перемешивания реакционной смеси при комнатной температуре в течение 16 ч реакционную смесь разбавляли с помощью воды (15 мл), твердое вещество собирали с помощью фильтрования и дополнительно очищали с помощью колоночной хроматографии с использованием системы Combiflash (гексан/EtOAc, 1:1) с получением соединения 5 (10 мг, 11%) в виде твердого вещества. MS (MM) m/z 377,0 [М+Н]+; ВЭЖХ: >99%, Eclipse XDB С18, 220 нм
1Н ЯМР (400 МГц, DMSO-d6): δ 11,73 (с, 1Н), 9,22 (с, 1Н), 8,26 (с, 1Н), 7,77 (д, 2Н), 7,69 (с, 1Н), 7,58 (с, 1Н), 7,44 (м, 3Н), 7,26 (т, 1Н), 7,18 (т, 2Н), 1,22 (д, 4Н).
Пример 5: Синтез соединения 4
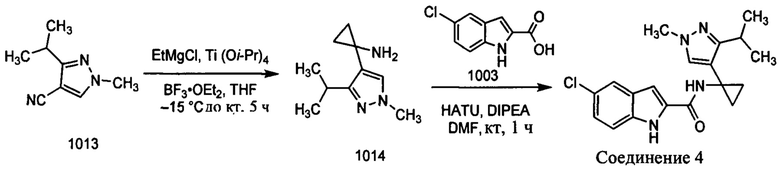
Получение 1014
К раствору нитрила 1013 (500 мг, 3,3 ммоль) в THF (10 мл) добавляли Ti(O-i-Pr)4 (1 мл, 8,3 ммоль) при комнатной температуре. К указанной выше реакционной смеси в атмосфере аргона при -15°С добавляли по каплям реагент Гриньяра (2,7 мл, 8,3 ммоль) и реакционную смесь перемешивали при -15°С в течение 0,5 ч и затем раствор перемешивали при окружающей температуре в течение 1 ч. BF3⋅OEt2 (1,4 мл, 9,9 ммоль) добавляли к указанной выше реакционной смеси при комнатной температуре и перемешивали в течение 1 ч. После завершения реакции реакционную смесь гасили с помощью воды (1 мл), 2 М HCl (3 мл) вплоть до рН=3 и перемешивали в течение 15 мин и затем подщелачивали с помощью 6 н. NaOH вплоть до рН=10. Органический слой собирали и водный слой экстрагировали с помощью EtOAc (20 мл × 2). Комбинированные органические слои высушивали на безводном Na2SO4 и концентрировали при пониженном давлении с получением 1014 (500 мг), которое использовали на следующей стадии без очистки.
Получение соединения 4
К раствору 1003 (200 мг, 1,0 ммоль) в DMF (10 мл) добавляли 1014 (196 мг, 1,1 ммоль) с последующим добавлением HATU (760 мг, 2,0 ммоль), и DIPEA (0,5 мл, 3,0 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь разбавляли с помощью воды (20 мл) и фильтровали и полученное твердое вещество дополнительно очищали с помощью колоночной хроматографии с использованием системы Combiflash (гексанз/EtOAc, 1:1) с получением соединения 4 (95 мг, 24%) в виде твердого вещества. MS (MM) m/z 357,9 [М+Н]+; ВЭЖХ: 98%, Eclipse XDB С18, 220 нм.
1Н ЯМР (300 МГц, DMSO-d6): δ 11,66 (с, 1Н), 8,91 (с, 1Н), 7,65 (с, 1H), 7,45 (с, 1H), 7,34 (д, 1H), 7,15 (м, 2Н), 3,69 (с, 3Н), 2,56 (м, 1Н), 1,19 (д, 6Н), 1,19 (м, 4Н).
Пример 6: Синтез соединения 3
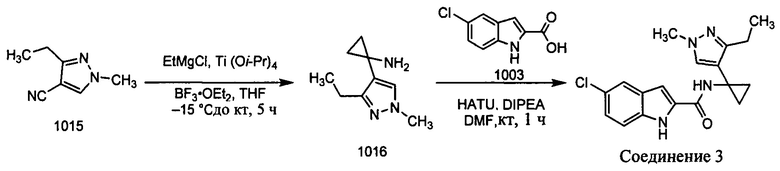
Получение 1016
К раствору нитрила 1015 (500 мг, 3,7 ммоль) в THF (10 мл) добавляли Ti(O-i-Pr)4 (1,1 мл, 4,0 ммоль) при комнатной температуре. К указанной выше реакционной смеси в атмосфере аргона при -15°С ) добавляли по каплям реагент Гриньяра (3,0 мл, 9,2 ммоль и реакционную смесь перемешивали при -15°С в течение 0,5 ч и затем раствор перемешивали при окружающей температуре в течение 1 ч. BF3⋅OEt2 (1,0 мл, 7,4 ммоль) добавляли к указанной выше реакционной смеси при комнатной температуре и перемешивали в течение 1 ч. После завершения реакции реакционную смесь гасили с помощью воды (1 мл), 2 М HCl (3 мл) вплоть до рН=3 и перемешивали в течение 15 мин и затем подщелачивали с помощью 6 н. NaOH вплоть до рН=10. Органический слой собирали и водный слой экстрагировали с помощью EtOAc (20 мл × 2). Комбинированные органические слои высушивали на безводном Na2SO4 и концентрировали при пониженном давлении с получением 1016 (300 мг), которое использовали на следующей стадии без очистки.
Получение соединения 3
К раствору 1003 (200 мг, 1,0 ммоль) в DMF (10 мл) добавляли 1016 (186 мг, 1,1 ммоль) с последующим добавлением HATU (760 мг, 2,0 ммоль) и DIPEA (0,5 мл, 3 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь разбавляли с помощью воды (20 мл), фильтровали и полученное твердое вещество дополнительно очищали с помощью колоночной хроматографии с использованием системы Combiflash (гексан/EtOAc, 1:1) с получением соединения 3 (55 мг, 13%) в виде твердого вещества.
MS (MM) m/z 342,8 [М+Н]+; ВЭЖХ: 99%, Eclipse XDB С18, 220 нм.
1Н ЯМР (300 МГц, DMSO-d6): δ 11,66 (с, 1H), 8,99 (с, 1Н), 7,67 (с, 1Н), 7,56 (с, 1Н), 7,35 (д, 1Н), 7,16 (д, 1Н), 7,09 (с, 1Н), 3,67 (с, 3Н), 2,69 (кв., 2Н), 1,15 (м, 5Н), 0,96 (м, 2Н).
Пример 7: Синтез соединения 6
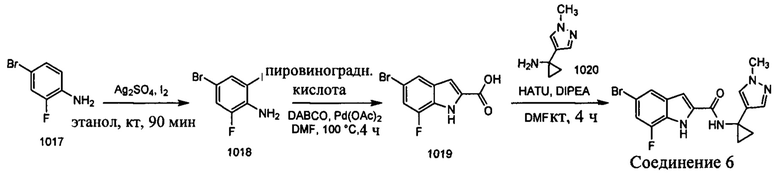
Получение 1018
К раствору 1017 (10,0 г, 52,6 ммоль) в этаноле (50 мл) добавляли сульфат серебра (16,4 г, 52,6 ммоль) и I2 (25,2 г, 99,9 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Растворитель испаряли из реакционной смеси, сырое соединение отмывали с помощью раствора тиосульфата натрия (3×20 мл), затем экстрагировали с помощью EtOAC (3×50 мл). Комбинированные органические слои высушивали на безводном Na2SO4 и концентрировали при пониженном давлении. Сырой остаток очищали с помощью колоночной хроматографии с использованием системы Combiflash (гексан/EtOAc, 1:2) с получением 1018 (13 г, 79%) в виде твердого вещества. 1Н ЯМР (300 МГц, CDCl3): δ 7,54 (с, 1H), 7,15 (дд, 1Н), 4,12 (с, 1H).
Получение 1019
К раствору 1018 (13,0 г, 41,2 ммоль) в DMF (50 мл) добавляли пировиноградную кислоту (10,89 мл, 123,8 ммоль) и DABCO (13,8 мл, 123,8 ммоль). Реакционную смесь дегазировали с помощью аргона в течение 10 мин и Pd(OAc)2 (923 мг, 4,12 ммоль) добавляли при комнатной температуре. После перемешивания реакционной смеси при 100°С в течение 3 ч воду (50 мл) добавляли к реакционной смеси, которую затем экстрагировали с помощью EtOAc (2×50 мл). Комбинированные органические слои высушивали на безводном Na2SO4 и концентрировали при пониженном давлении. Сырой остаток очищали с помощью колоночной хроматографии с использованием системы Combiflash (гексан/ЕЮАс, 1:2) с получением 1019 (2,0 г, 19%) в виде твердого вещества. 1Н ЯМР (300 МГц, DMSO-d6): δ 13,25 (уш.с, 1Н), 12,52 (с, 1Н), 7,71 (с, 1Н), 7,33 (д, 1H), 7,15 (с, 1Н).
Получение соединения 6
К раствору 1019 (200 мг, 0,77 ммоль) в DMF (10 мл) добавляли 1020 (116 мг, 0,85 ммоль) с последующим добавлением HATU (585 мг, 1,54 ммоль) и DIPEA (0,4 мл, 2,31 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь разбавляли с помощью воды (20 мл), фильтровали и полученное твердое вещество дополнительно очищали с помощью колоночной хроматографии с использованием системы Combiflash (гексан/EtOAc, 1:1) с получением соединения 6 (65 мг, 22%) в виде твердого вещества. MS (MM) m/z 377,1 [М+Н]+; ВЭЖХ: 90,5%, Eclipse XDB С18, 220 нм.
1Н ЯМР (300 МГц, DMSO-d6): δ 12,26 (с, 1Н), 9,17 (с, 1Н), 7,70 (с, 1Н), 7,49 (с, 1Н), 7,25 (м, 3Н), 3,73 (с, 3Н), 1,16 (м, 4Н).
Пример 8: Синтез соединения 8 - энантиомеров 1 и 2
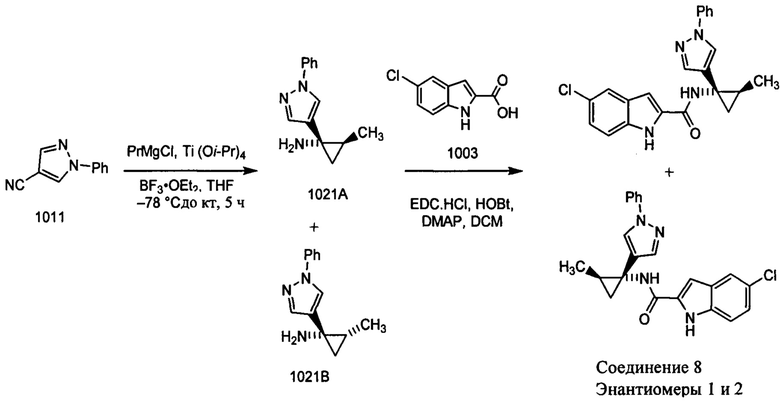
Получение рацемического соединения 1021А и рацемического соединения 1021В
К раствору нитрила 1011 (6,0 г, 35,5 ммоль) в THF (70 мл) при 0°С добавляли Ti(O-i-Pr)4 (11,09 мл, 39,05 ммоль). К указанной выше реакционной смеси в атмосфере аргона 1 М раствор реагента Гриньяра в THF (78,1 мл, 78,1 ммоль) добавляли по каплям и реакционную смесь перемешивали при -78°С в течение 0,5 ч. Затем реакционную смесь перемешивали при 0°С в течение 1,5 ч. BF3⋅OEt2 (10,0 мл, 71,1 ммоль) добавляли к указанной выше реакционной смеси, которую перемешивали в течение 0,5 ч. После завершения реакции реакционную смесь обрабатывали с помощью HCl (2 н., 30 мл) и перемешивали в течение 15 мин и затем подщелачивали с помощью 6 н. NaOH. Смесь экстрагировали с помощью этилацетата (3×100 мл) и органические слои высушивали на безводном Na2SO4 и концентрировали при пониженном давлении. Сырой остаток дополнительно очищали с помощью колоночной хроматографии с использованием системы Combiflash (этилацетат/гексан, от 0 до 100%) для разделения рацемического соединения 1021А (1,0 г) (транс) и рацемического соединения 1021В (0,8 г) (цис) в виде масел.
MS (MM) m/z: 214,1 [М+Н]+.
Получение энантиомеров 1 и 2 соединения 8
К раствору 1003 (0,546 г, 2,8 ммоль) в DCM (20 мл) добавляли рацемическое соединение 1101А (0,5 г, 2,8 ммоль) с последующим добавлением этилкарбодиимидгидрохлорида (1,07 г, 5,6 ммоль), гидроксибензотриазола (0,756 г, 0,056 моль) и 4-диметиламинопиридина (0,34 г, 2,8 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 18 ч. После завершения реакции реакционную смесь выливали в воду (30 мл), затем экстрагировали с помощью этилацетата (3×20 мл). Комбинированные органические слои высушивали на безводном сульфате натрия и испаряли. Очистка с помощью колоночной хроматографии с использованием системы Combiflash с использованием 40 г колонки redisep® (EtOAc/гексан, 0-70%) давала на выходе рацемическое соединение 8 в виде твердого вещества.
Рацемическое соединение 8 (400 мг) подвергали очистке с помощью хиральной ВЭЖХ для разделения энантиомеров. Выделенный энантиомер 1 соединения 8 (142 мг, кт, 20,39) и энантиомер 2 соединения 8 (129 мг, кт, 25,81) получали в виде твердых веществ.
Условия препаративной ВЭЖХ, используемые для очистки
Колонка: Chiralpak IC 250×20 мм, 5 мкм (серия № IC00CJ-RC003; партия №83345). Подвижная фаза: н-гексан: этанол: DEA (95:5:0,1% объем/объем/объем).
Энантиомер 1 соединения 8: MS (MM) m/z: 391,1 [М+Н]+. Хиральная ВЭЖХ: 99,1%,
1Н ЯМР (300 МГц, DMSO-d6): δ 11,70 (с, 1Н), 9,21 (с, 1Н), 8,34 (с, 1H), 7,80 (д, J=7,8 Гц, 2Н), 7,69 (с, 1H), 7,67 (д, J=1,5 Гц, 1Н), 7,49-7,40 (м, 3Н), 7,27 (т, J=7,5 Гц, 1Н), 7,16 (дд, J=9,0, 2,1 Гц, 2Н), 7,12 (с, 1Н), 1,46-1,37 (м, 1Н), 1,27-1,22 (м, 1Н), 1,09 (т, J=6,0 Гц, 1Н), 0,97(д, J=6,0 Гц, 3Н).
Энантиомер 2 соединения 8: MS (MM) m/z: 391,1 [М+Н]+. Хиральная ВЭЖХ: 97,9%,
1Н ЯМР (300 МГц, DMSO-d6): δ 11,69 (с, 1H), 9,20 (с, 1Н), 8,34 (с, 1Н), 7,80 (д, J=7,8 Гц, 2Н), 7,69 (с, 2Н), 7,67 (д, J=1,2 Гц, 1Н), 7,49-7,40 (м, 3Н), 7,27 (т, J=7,2 Гц, 1H), 7,16 (дд, J=9,0, 2,1 Гц, 2Н), 7,12 (с, 1H), 1,46-1,37 (м, 1Н), 1,27-1,22 (м, 1H), 1,09 (т, J=6,0 Гц, 1Н), 0,97 (д, J=6,0 Гц, 3Н).
Пример 9: Получения соединений 9-11
С использованием общей методологии, раскрытой для получения соединения 8 и общего уровня знаний в области органического синтеза получали соединения 9-11 в представленной ниже таблице.
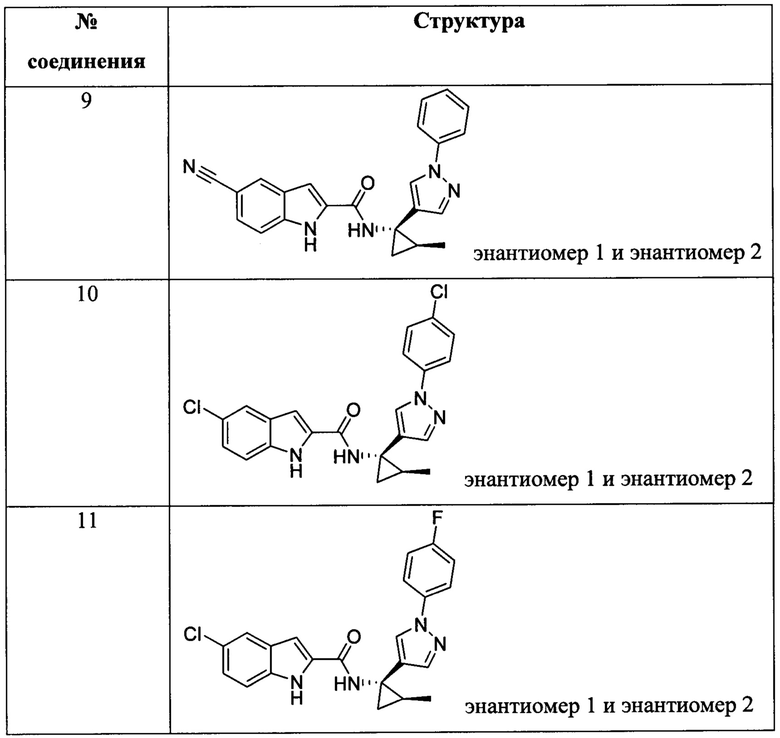
Пример 10: Синтез соединения 12
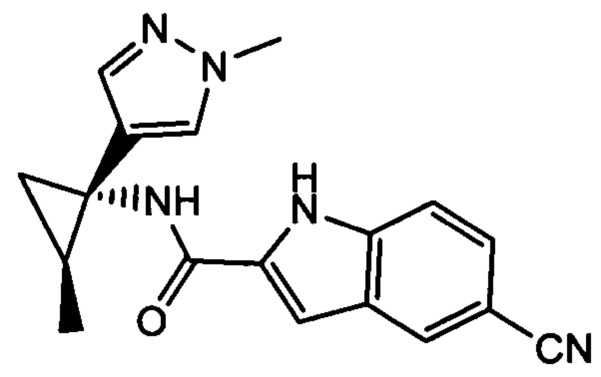
В 20 мл флакон, содержащий 5-циано-1Н-индол-2-карбоновую кислоту (250 мг, 1,34 ммоль) и HATU (664 мг, 1,75 ммоль) добавляли DMF (5040 мкл). Реакционную смесь перемешивали при комнатной температуре в течение 5 минут. Затем (1R, 2R)-2-метил-1-(1-метил-1Н-пиразол-4-ил)циклопропанамин (229 мг, 1,52 ммоль), растворенный в DMF (1680 мкл), добавляли к реакционной смеси активированной кислоты с последующим добавлением диизопропилэтиламина (DIPEA) (1060 мкл, 6,04 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут, затем разбавляли с помощью этилацетата и отмывали с помощью насыщенного NaHCO3. Комбинированные органические слои высушивали на безводном сульфате магния, фильтровали и концентрировали in vacuo с получением масла.
Сырой продукт очищали с помощью колоночной хроматографии, элюируя с помощью градиента 100% гексанов до 100% этилацетата. Полученное масло дополнительно очищали с помощью ахиральной SFC (сверхкритическая флюидная хроматография) (колонка: Chiralcel OJ-H, 21×250 (мм); модификатор: метанол +0,25% диметилэтиламин; % модификатора в СО2: 20) с получением 5-циано-N-((1R,2R)-2-метил-1-(1-метил-1Н-пиразол-4-ил)циклопропил)-1Н-индол-2-карбоксамида в виде твердого вещества с получением соединения 12.
Расчетное значение с помощью MS ESI (масс-спектрометрия с электрораспылительной ионизацией) для C18H17N5O [М+Н]+ 320, полученное значение 320.
1H ЯМР (600 МГц, DMSO-d6) δ 12,06 (с, 1Н), 9,25 (с, 1Н), 8,21 (с, 1Н), 7,57-7,49 (м, 3Н), 7,33 (с, 1Н), 7,24 (с, 1Н), 3,77 (с, 3Н), 1,35-1,30 (м, 1Н) 0,92-0,88 (м, 5Н).
Биологические анализы
Для REF1-REF3 и соединений 1-11 использовали два различных типа анализа: 1. Биохимический сопряженный анализ IDO, в котором используют рекомбинантно полученный и очищенный фермент IDO в комбинации с ферментом формамидазой. Эта сопряженная ферментная система обеспечивает превращение N-формилкинуренина, произведенного с помощью активности IDO, в кинуренин, который затем количественно определяли с помощью флуоресценции после добавления реагента Эрлиха. 2. Клеточный анализ для обнаружения эффекта исследуемых соединений на продукцию кинуренина в злокачественных клетках. В указанном анализе используют злокачественные клетки, которые экспрессировали IDO и, в связи с этим, их использовали как средство для испытания активности соединений на фермент в клеточном контексте. Протоколы указанных анализов представлены ниже.
Биохимические анализы IDO
0,17 мкМ белка IDO человека предварительно инкубировали в течение 120 мин при КТ с исследуемыми соединениями в присутствии 50 мМ KPO4, рН 7,0, 0,5 мМ EDTA, 0,5 мМ EGTA, 0,05% Triton Х-100, 20 мМ аскорбата, 500 ед/мл каталазы, 10 мкМ метиленового синего при КТ в 384-луночном планшете. 0,05 мкг/мкл кинуренинформамидазы и 45 мкМ L-триптофана (L-Trp) добавляли и анализы инкубировали при КТ в течение 40 мин. Анализы останавливали и содержание кинуренина определяли путем инкубации с реагентом Эрлиха до конечной концентрации, составляющей 1,33% при КТ в течение 5 мин. Интенсивность флуоресценции регистрировали при 475 нм/530 нм.
Клеточный анализ IDO
Клетки аденокарцинома яичника SKOV-3 (АТСС) выращивали в среде McCoys 5А + L-glutamax, дополненной 15% фетальной бычьей сыворотки. В день анализа клетки открепляли с использованием смеси трипсин-EDTA (0,25% объем/объем), ресуспендировали в средах для анализа (RPMI 1640, не содержащая феноловый красный + L-глутамин, дополненная 10% дуализированной фетальной бычьей сывороткой). Клетки SKOV-3 высевали с плотностью 40000 клеток на лунку в 96-луночные планшеты, содержащие исследуемые образцы/контроль-несущую среду, вместе с 500 мкМ L-Trp. Клетки затем инкубировали в течение 48 ч при 37°С, 5% СО2. IFNγ также добавляли в концентрации, составляющей 500 нг/мл для 48 ч инкубации для индукции экспрессии IDO. Планшеты центрифугировали и супернатант удаляли и инкубировали в течение 5 мин в присутствии 1% реагента Эрлиха. Содержания кинуренина затем количественно определяли путем измерения поглощения при 490 нм.
Значения pIC50 для REF1-REF3 и соединений 1-11 показаны в таблице 1.
Таблица 1 - значения pIC50 для ингибирования IDO (клетки SKOV-3)
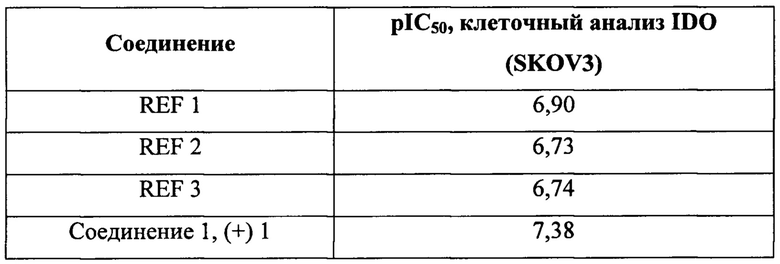
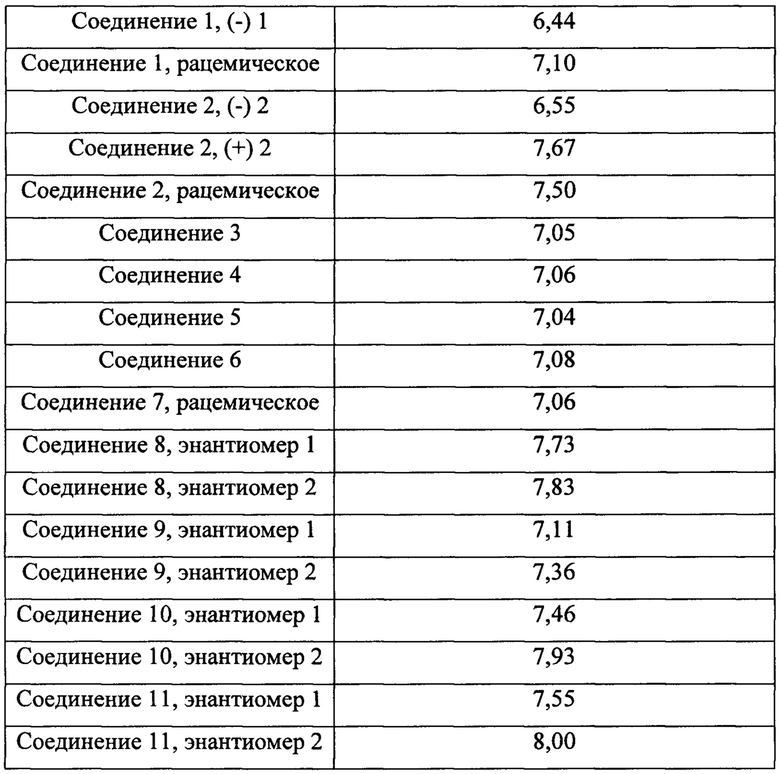
В таблице показано, что исследуемые соединения показывают сильно выраженную ингибирующую IDO функция в клеточных анализах. Это значительно отличается от эталонных соединений REF, которые в каждом из испытаний демонстрировали меньшие показатели.
Биохимические ферментные анализы проводили согласно протоколам, описанным выше, и результаты подтвердили надежную активность соединений в качестве ингибиторов фермента. Результаты показаны в таблице 2.
Таблица 2 - значения pIC50 для ингибирования IDO для REF1-REF3 и соединений 1-7
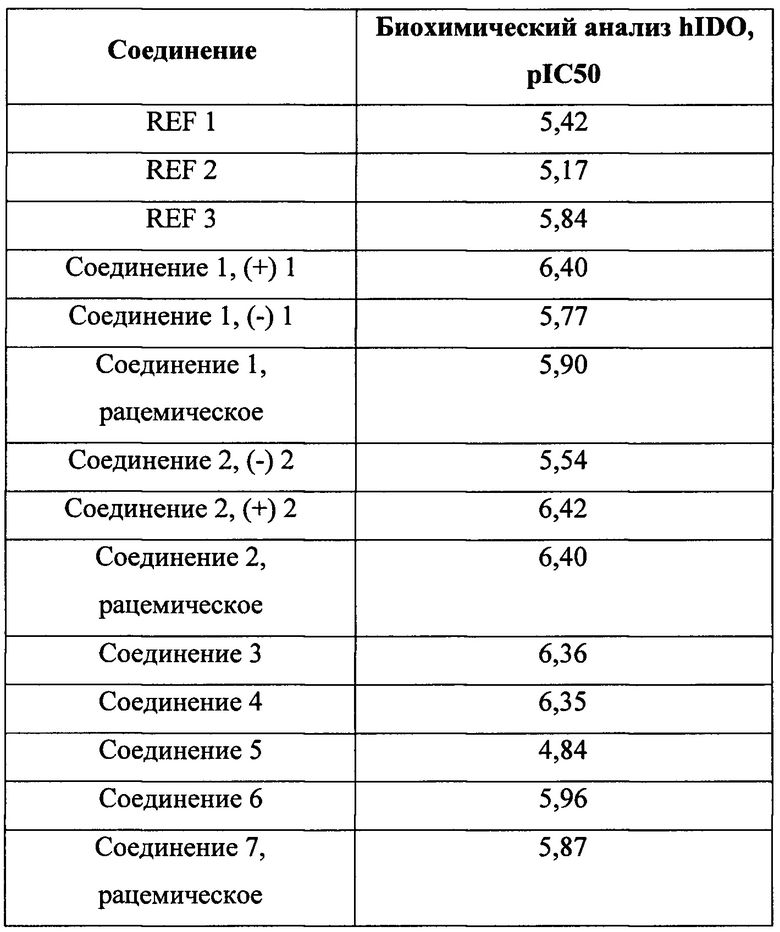
Клеточный анализ IDO1 для соединения 12
Подлежащие исследованию соединения серийно разводили в десяти 3-кратных стадиях в DMSO, начиная с 10 мМ маточных растворов DMSO. Разведения соединений или DMSO отдельно затем распределяли из планшета для разведения в черный 384-луночный аналитический планшет Greiner (№ по кат. 781086) с использованием акустического жидкостного манипулятора Echo 550 (Labcyte).
Осадки клеток HEK293 ресуспендировали с концентрацией 5×105 клеток/мл в полных средах культивирования HEK293 (89% DMEM, 10% FBS, 1% пенициллин/стрептомицин). Суспендированные клетки (2 мл) переносили в каждую лунку 6-луночного планшета Corning (№ по кат. 3516). Клеткам давали прикрепиться и инкубировали в течение 20 ч при 37°С в термостате с атмосферой 5% СО2. Вектор Flag-IDO1 (Genscript True ORF Gold, 2 мкг) в 150 мкл среды Opti-MEM добавляли к каждой лунке 24-луночного планшета Corning (№ по кат. 3527) и инкубировали в течение 5 минут при комнатной температуре. К каждой лунке 24-луночного планшета добавляли 150 мкл липофектамина 2000 (Gibco) и планшет инкубировали при комнатной температуре в течение 20-30 минут. К каждой лунке прикрепленных клеток в 6-луночном планшете 250 мкл смеси для трансфекции из 24-луночного планшета аккуратно добавляли к каждой лунке и обеспечивали возможность экспрессии белка IDO1 в течение 24-30 часов при 37°С в термостате с атмосферой 5% СО2.
Среды удаляли от клеток, которые затем отмывали с помощью 2 мл фосфатно-солевого буфера Дюльбекко (DPBS). После удаления DPBS 0,5 мл TrypLE (Gibco) добавляли и инкубировали в течение 5 минут, пока клетки не поднимались с поверхности лунок. Полные среды культивирования HEK293 (4 мл) добавляли к каждой лунке и клетки собирали и объединяли в конической пробирке. Клетки осаждали при 200×g в течение 5 минут и ресуспендировали в равном объеме полной среды DMEM. Клетки разводили до 4×105 клеток на мл в полных средах HEK293. L-Триптофан добавляли до получения конечной концентрации, составляющей 200 мкМ. Разведенные трансфицированные клетки (50 мкл) или нетрансфицированные клетки (50 мкл) распределяли в лунки черных 384-луночных аналитических планшетов Greiner (№ по кат. 781086), содержащие предварительно разведенные соединения. Планшет кратковременно перемешивали и центрифугировали при 200×g в течение 10 секунд для сбора клеток на дне планшета. Планшеты закрывали и инкубировали в течение 20-24 ч при 37°С в термостате с атмосферой 5% СО2. После этого 10 мкл 0,5 М метилизонипекотата в диметилсульфоксиде добавляли к каждой лунке, перемешивали, герметически закрывали и центрифугировали при 500 об/мин в течение 10 секунд. Планшеты инкубировали при 37°С в термостате с атмосферой 5% СО2 в течение ночи для развития флуоресценции. Планшетам давали остыть и затем центрифугировали в течение 1 минуты при 1000×g. Полученную флуоресценцию измеряли в устройстве для прочтения планшетов Envision (Perkin Elmer) с 400/25 нм фильтром возбуждения и 510/20 нм эмиссионным фильтром.
Интенсивность флуоресценции каждой лунки корректировали на фоновое значение, наблюдаемое в лунках с нетрансфицированными клетками, и выражали как долю интенсивности, наблюдаемой в лунках трансфицированных IDO1 клеток и только DMSO. Активность рассчитывали с помощью линейной аппроксимации методом наименьших квадратов к четырехпараметрическому логистическому уравнению IC50.
С использованием описанного выше анализа соединение 12 характеризуется значением IC50, составляющим 202 нМ (n=1) в клеточной линии HEK293, транзиентно экспрессирующей hIDO1.
Наряду с тем, что настоящее изобретение было описано и проиллюстрировано со ссылкой на некоторые его конкретные варианты осуществления, специалистам в настоящей области техники будет понятно, что можно произвести различные адаптации, изменения, модификации, замены, удаления или дополнения процедур и протоколов, не отклоняясь от сущности и объема настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Новые замещенные соединения имидазопиридина в качестве ингибиторов индоламин-2,3-диоксигеназы и/или триптофан-2,3-диоксигеназы | 2017 |
|
RU2741911C2 |
| НОВЫЕ ЗАМЕЩЕННЫЕ N-ГИДРОКСИКАРБАМИМИДОИЛ-1,2,5-ОКСАДИАЗОЛЬНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ИНДОЛАМИН-2,3-ДИОКСИГЕНАЗЫ (IDO) | 2018 |
|
RU2765371C2 |
| ЗАМЕЩЕННЫЕ ИНДАЗОЛЫ, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ И ПРЕДУПРЕЖДЕНИЯ АЛЛЕРГИЧЕСКИХ И/ИЛИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ У ЖИВОТНЫХ | 2017 |
|
RU2743170C2 |
| ПРОИЗВОДНЫЕ ИМИНОМОЧЕВИНЫ | 2018 |
|
RU2780118C2 |
| АНАЛОГИ ГАММА-АМИНОМАСЛЯНОЙ КИСЛОТЫ (ГАМК) ДЛЯ ЛЕЧЕНИЯ БОЛИ И ДРУГИХ ЗАБОЛЕВАНИЙ | 2014 |
|
RU2679407C1 |
| ПРОИЗВОДНЫЕ ПИРИДОПИРИМИДИНОНА И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРА АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ | 2021 |
|
RU2818954C1 |
| ЗАМЕЩЕННЫЕ 2-МЕТИЛИДЕН-5-(ФЕНИЛАМИНО)-2,3-ДИГИДРОТИОФЕН-3-ОНЫ ДЛЯ ЛЕЧЕНИЯ ЛЕЙКОЗОВ С ТРАНСЛОКАЦИЯМИ MLL-ГЕНА И ДРУГИХ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2017 |
|
RU2656603C1 |
| Ингибитор CDK4/6 | 2017 |
|
RU2747311C2 |
| N3-АЛКИЛИРОВАННЫЕ БЕНЗИМИДАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ МЕК | 2003 |
|
RU2300528C2 |
| БИЦИКЛИЧЕСКИЕ АГОНИСТЫ СТИМУЛЯТОРА ГЕНОВ ИНТЕРФЕРОНА STING | 2020 |
|
RU2800072C1 |

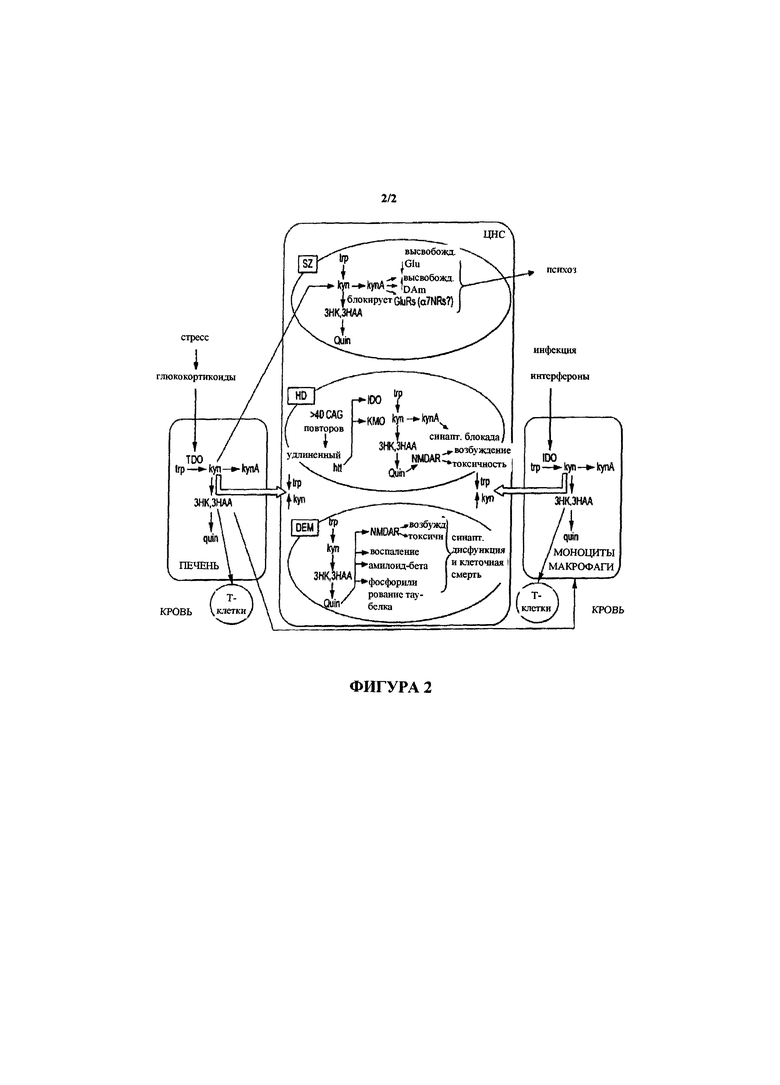
Настоящее изобретение относится к области органической химии, а именно к соединению формулы (I)
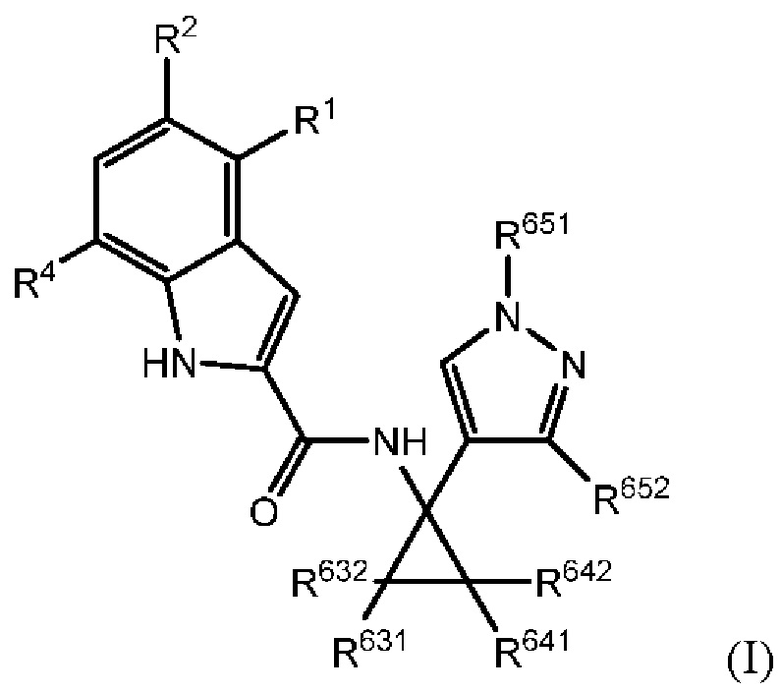
или его фармацевтически приемлемой соли. В формуле (I) R2 выбран из -Cl, Br и –CN, R1 и R4 независимо выбраны из -Н и –F, R631, R632, R641 и R642 независимо выбраны из -Н, -F и C1-С3 алкила, R651 и R652 независимо выбраны из Н и C1-С3 алкила, и по меньшей мере один из R631, R632, R641, R642 и R652 не представляет собой -Н или если все из R631, R632, R641, R642 и R652 представляют собой -Н, R651 не представляет собой Me или Et. Также предложен вариант соединения, фармацевтическая композиция и применение указанных соединений. Технический результат: предложены новые органические соединения, которые относятся к ингибиторам индоламин-2,3-Диоксигеназы (IDO) и могут быть использованы для изготовления лекарственных средств для лечения яичника путем ингибирования IDO. 4 н. и 8 з.п. ф-лы, 2 ил., 2 табл., 10 пр.
1. Соединение формулы (I) или его фармацевтически приемлемая соль
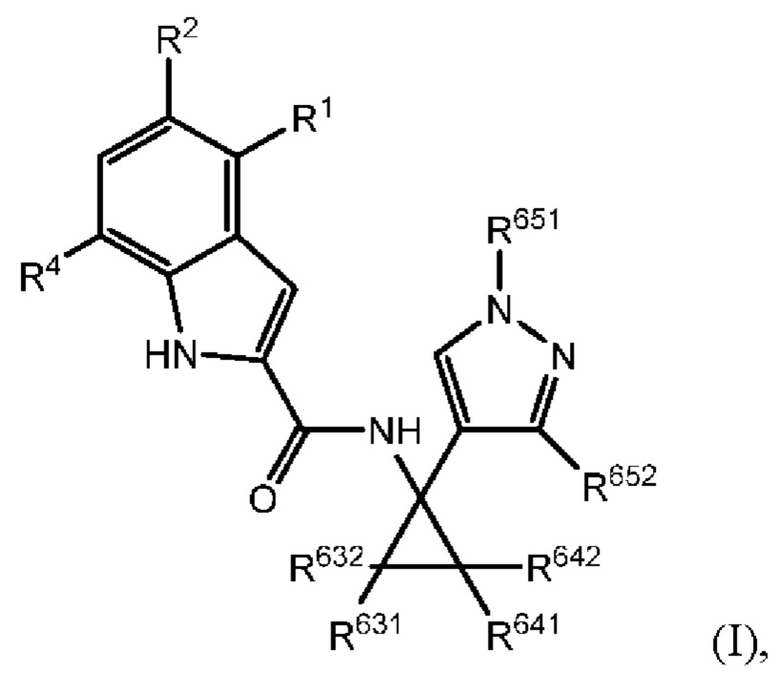
где R2 выбран из -Cl, Br и -CN;
R1 и R4 независимо выбраны из -Н и -F;
R631, R632, R641 и R642 независимо выбраны из -Н, -F и C1-С3 алкила;
R651 и R652 независимо выбраны из Н и C1-С3 алкила; и
где по меньшей мере один из R631, R632, R641, R642 и R652 не представляет собой -Н; или где если все из R631, R632, R641, R642 и R652 представляют собой -Н, R651 не представляет собой Me или Et.
2. Соединение по п. 1 или его фармацевтически приемлемая соль, причем соединение представляет собой соединение согласно следующей формуле:
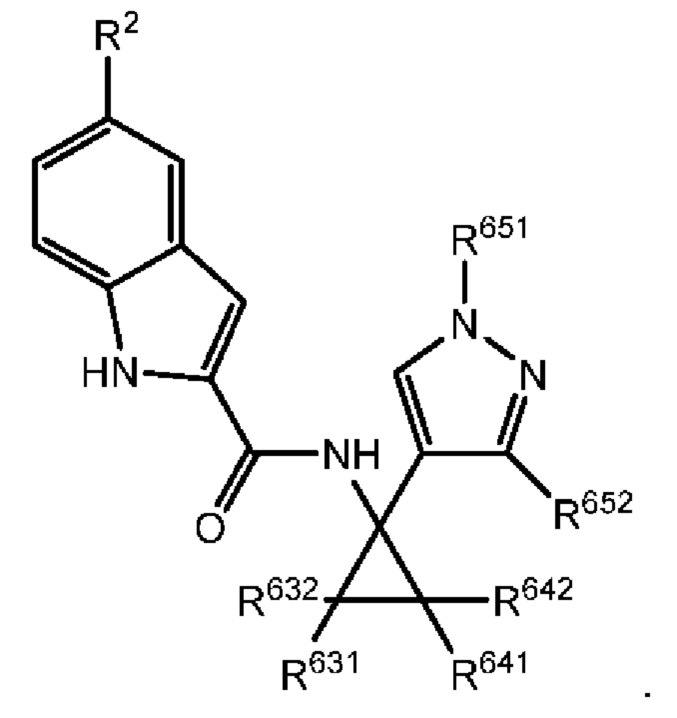
3. Соединение по п. 1 или его фармацевтически приемлемая соль, причем соединение представляет собой соединение согласно следующей формуле:
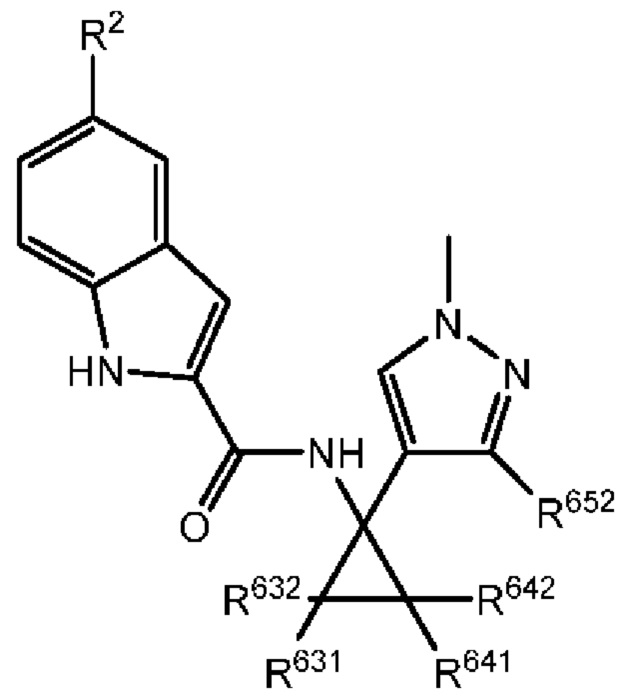 ,
,
где по меньшей мере один из R631, R632, R641, R642 и R652 не представляет собой -Н.
4. Соединение по п. 1 или его фармацевтически приемлемая соль, причем соединение представляет собой соединение согласно следующей формуле:
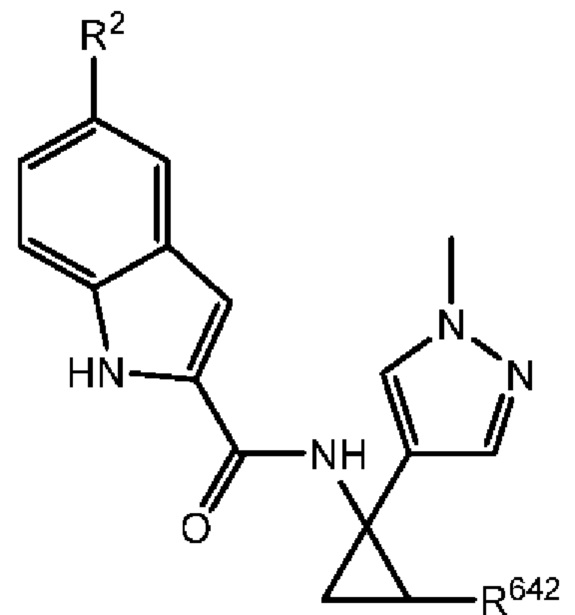 ,
,
где R642 представляет собой метил или этил.
5. Соединение по п. 1 или его фармацевтически приемлемая соль, причем соединение представляет собой соединение, характеризующееся одной из следующих формул:
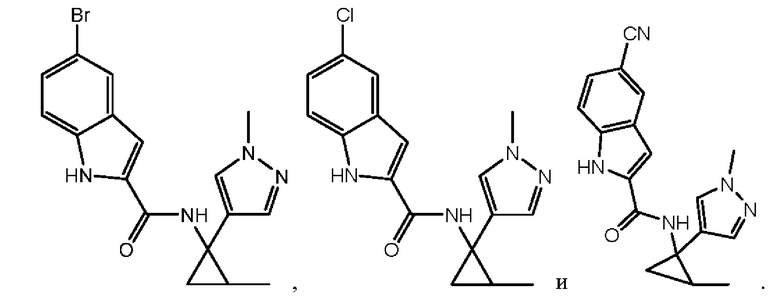
6. Соединение п. 1 или его фармацевтически приемлемая соль, причем соединение представляет собой выделенный энантиомер или рацемическую смесь, характеризующиеся одной или обеими из следующих формул:
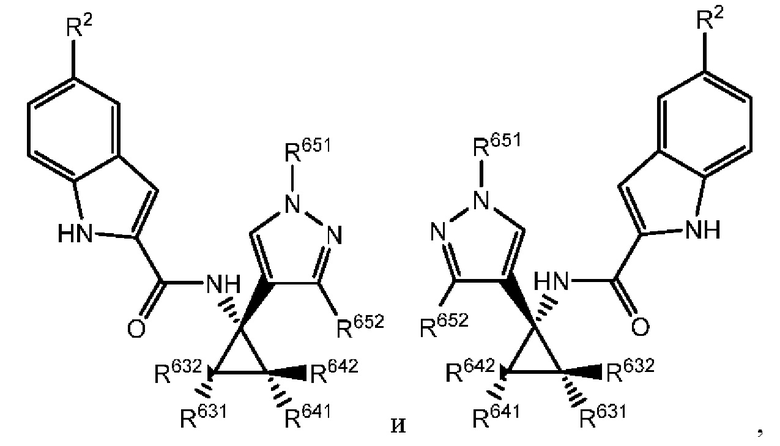
где R642 представляет собой стерически большую группу, чем любая из R631, R632 и R641.
7. Соединение по п. 1, причем соединение представляет собой выделенный энантиомер или рацемическую смесь, характеризующиеся одной или обеими из следующих формул:
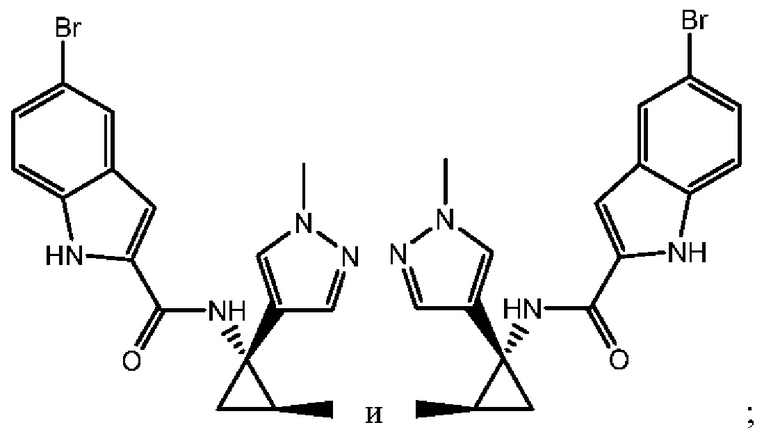
или одной или обеими из одной из следующих формул:
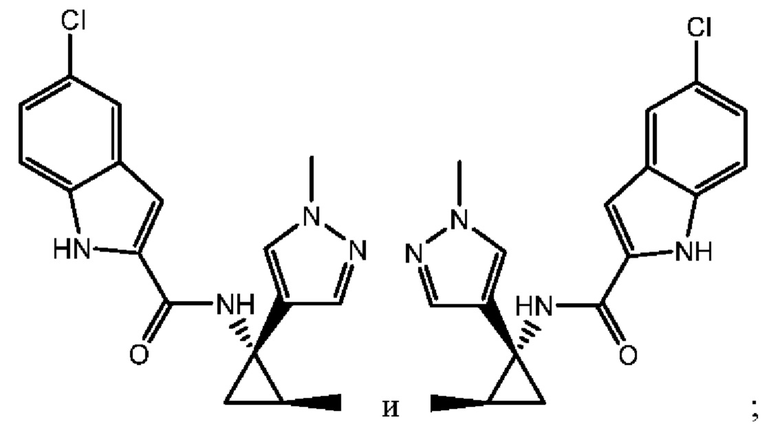
или одной или обеими из одной из следующих формул:
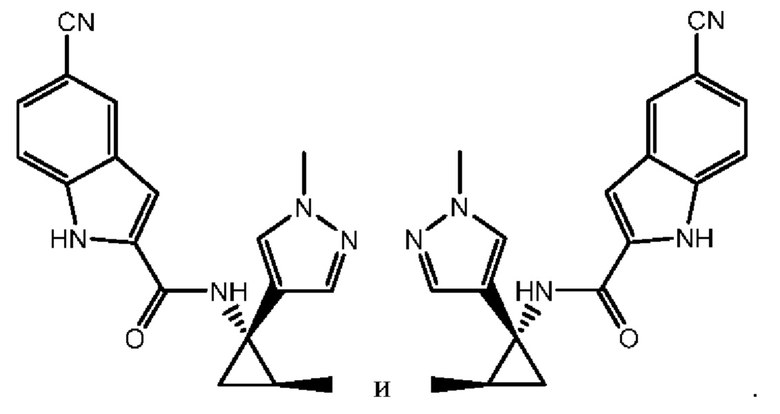
8. Соединение по п. 1, которое представляет собой выделенный энантиомер, рацемическую смесь или ахиральное соединение согласно любой из следующих формул:
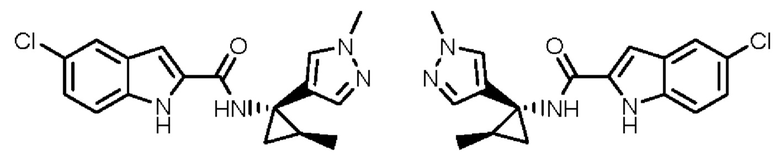
выделенные (+) и (-) энантиомеры и рацемическая смесь 1: [(+) 1, (-) 1 и rac 1],
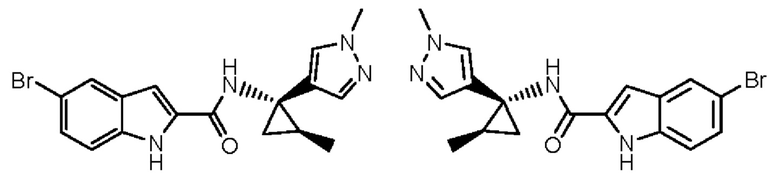
выделенные (+) и (-) энантиомеры и рацемическая смесь 2: [(+) 2, (-) 2 и rac 2],
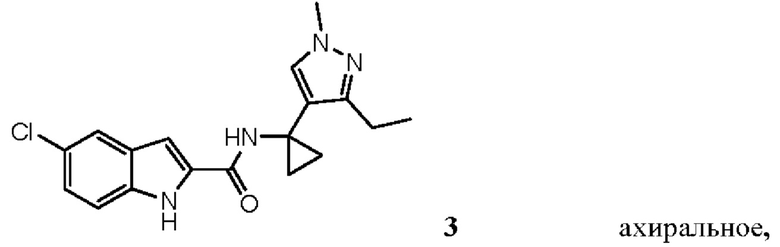
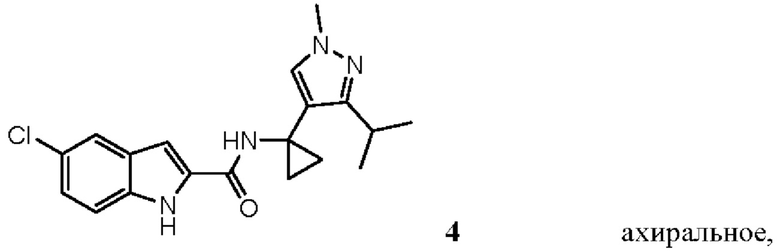
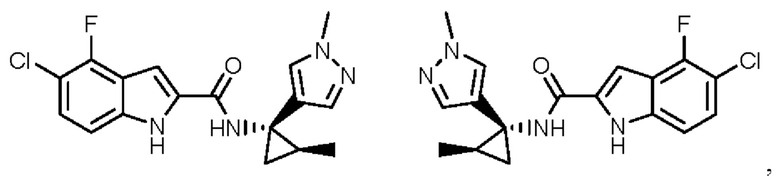
выделенные (+) и (-) энантиомеры и рацемическая смесь 7: [(+) 7, (-) 7 и rac 7],
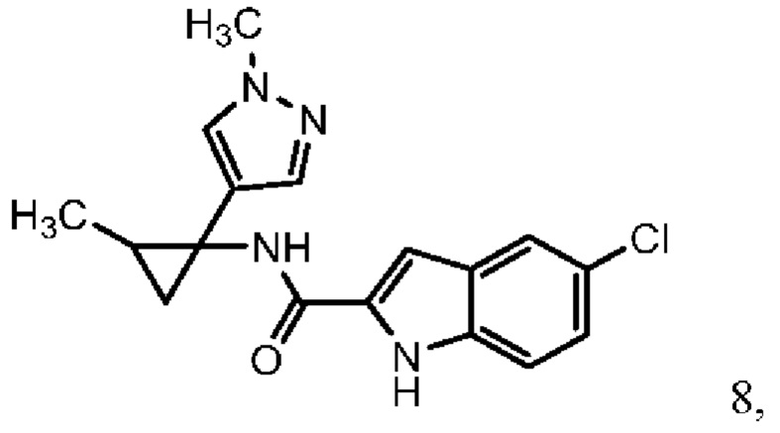
и
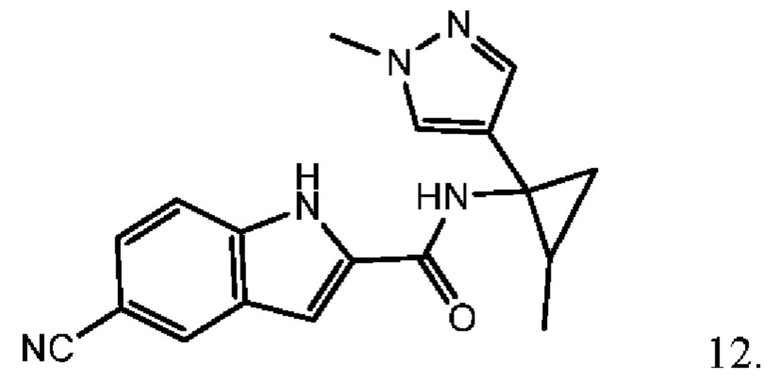
9. Соединение по любому из пп. 1-8 или его фармацевтически приемлемая соль, причем соединение содержит следующее:
- выделенный энантиомер;
- смесь двух или больше энантиомеров,
- смесь двух или больше диастереомеров и/или эпимеров,
- рацемическая смесь,
- транс-изомер; и/или
- один или несколько таутомеров соединения.
10. Соединение, которое представляет собой
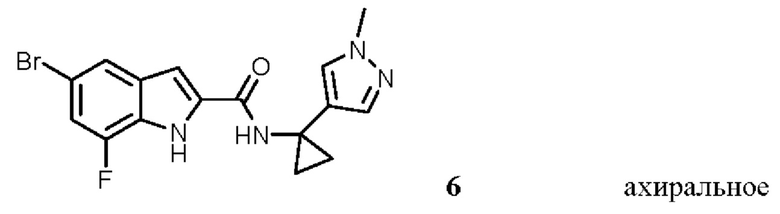 ,
,
или его фармацевтически приемлемая соль.
11. Фармацевтическая композиция, ингибирующая индоламин-2,3-диоксигеназу (IDO), содержащая соединение по любому из пп. 1-10 или его фармацевтически приемлемую соль и фармацевтически приемлемую добавку и/или вспомогательное вещество.
12. Применение соединения по любому из пп. 1-10 для изготовления лекарственного средства для лечения яичника путем ингибирования IDO.
| EA 0327760 В1, 31.07.19 | |||
| WO 2015082499 A2, 11.06.2015 | |||
| E | |||
| DOLUSIC et al., Discovery and preliminary SARs of keto-indoles as novel indoleamine 2,3- dioxygenase (IDO) inhibitors, European Journal of Medicinal Chemistry, 2011, v | |||
| Способ изготовления звездочек для французской бороны-катка | 1922 |
|
SU46A1 |
| Котел для нагревания жидкостей и сыпучих тел | 1917 |
|
SU3058A1 |
Авторы
Даты
2020-08-26—Публикация
2016-09-12—Подача