Область, к которой относится изобретение
Настоящее изобретение относится к области биотехнологии и может быть использовано для регуляции внутриклеточной и внеклеточной ферментативной активности и управления клеточным метаболизмом на уровне трансляции.
Предпосылки создания изобретения
Общая стратегия, которую используют микроорганизмы для выживания и размножения в естественных условиях, основана на максимально возможном потреблении доступных питательных веществ, зачастую за счет эффективности их утилизации. Это свойство микроорганизмов может быть причиной значительных осложнений, когда клетки выращивают в искусственных условиях на средах с высоким содержанием питательных веществ, используемых в лабораторных и промышленных ферментациях. Несбалансированный метаболизм, сопровождающий быстрый рост в этих искусственных условиях, обычно приводит к снижению выхода биомассы по потребленному субстрату, накоплению в культуральной жидкости высоких концентраций побочных продуктов метаболизма, некоторые из которых токсичны для клеток, к повышенной потребности в кислороде и к высокому уровню выделения тепла. Все эти факторы значительно снижают продуктивность и экономичность промышленных ферментационных процессов. Вследствие выше перечисленных причин существует необходимость создания новой технологии, которая позволит модифицировать микробные продуценты таким образом, чтобы экзогенное лимитирование потребления питательных веществ клетками могло быть заменено эндогенным лимитированием. В результате этого модифицированные микроорганизмы возможно выращивать при оптимальных условиях с пониженной скоростью роста, тем самым удлинив фазу нелимитированного роста. Таким образом, вместо неэффективного потребления питательных веществ, ресурсы микробной клетки-продуцента могут быть направлены на синтез целевого продукта.
Предшествующий уровень техники
В настоящее время в промышленной биотехнологии скорость потребления субстрата микроорганизмами и, соответственно, их скорость роста регулируются посредством внешних факторов: либо посредством доступности питательных веществ из базовой питательной среды и использования различных схем подпитки, ограничивающих рост, либо используя суб-оптимальные физико-химические условия роста (низкой температуры, например). Однако, ограничение скорости роста за счет снижения доступности питательных веществ, широко используемое в ферментационной промышленности, индуцирует в клетках как «строгий ответ», так и «общую стрессовую реакцию». Кроме того, при этих условиях синтез целевого продукта может быть ограничен скоростью подачи питательных веществ. Применение любой из используемых в настоящее время схем подпитки в промышленных ферментациях сопровождается образованием в ферментере градиентов концентраций питательных веществ, кислорода и побочных продуктов микробного метаболизма, секретируемых в ферментационную среду, что также является источником стресса для клеток и негативно влияет на продуктивность процесса. Культивирование микроорганизмов при субоптимальных температурах не всегда технически возможно в промышленных условиях и, помимо этого, субоптимальные температуры являются фактором внешнего стресса для микроорганизмов, который вызывает синтез белков холодового шока.
В связи с этим, существует необходимость в создании способа управления метаболизмом микроорганизмов для промышленного применения.
Краткое описание сущности изобретения
Сущностью настоящего изобретения является способ управления метаболизмом клетки за счет создания механизма регуляции активности внутри- и внеклеточных ферментов на уровне трансляции. Технический результат достигается за счет регулируемой экспрессии компонентов токсин/антитоксин (ТА) модуля, состоящего из сиквенс-специфичной мРНК интерферазы и соответствующего ей белка антитоксина.
мРНК-интерферазы представляют собой сайт-специфические эндорибонуклеазы, которые расщепляют мРНК независимо от рибосом, лишая их субстратов для трансляции. Эти ферменты токсичны для клеток, так как вызывают деградацию мРНК, которая приводит к ингибированию синтеза белков в клетке, и, как следствие, останавливают клеточный рост.
В бактериях мРНК-интерферазы обычно располагаются в одном опероне с родственным антитоксином, и транскрибируются вместе. При нормальных условиях роста токсин и антитоксин вырабатываются совместно, образуя стабильный комплекс, поэтому токсичное действие интерфераз не проявляется. Однако, белок антитоксина неустойчив, любой стресс влияет на баланс между токсином и антитоксином, что приводит к высвобождению токсина, и его присутствие в клетке в несвязанном виде и вызывает торможение роста. В несвязанном виде токсин атакует и расщепляет мРНК, тем самым ингибируя синтез белков в клетке и рост клеток, что может привести к окончательной остановке роста клеток.
Система MazE/MazF является наиболее изученной хромосомной парой токсин/антитоксин Echerichia coli. Белок MazF - это эндонуклеаза, который расщепляет клеточные мРНК по АСА-нуклеотидным последовательностям. Модуль MazE-MazF представляет собой линейный гетерогексамер, состоящий из чередующихся токсина MazF и антитоксина MazE (MazF2-MazE2-MazF2). В отличие от стабильного токсина MazF, антитоксин MazE достаточно лабилен и легко разрушается АТФ-зависимой сериновой протеазой ClpA. Белок MazE подавляет MazF, отрицательно регулируя его экспрессию.
MazE/MazF опосредованная остановка клеточного роста возникает, когда экспрессия оперона подавляется; MazE разрушается, в результате чего освобождается MazF. Разрушение MazE индуцируется различными факторами: аминокислотным голоданием, высокой или низкой температурой, окислительным стрессом, УФ-излучением. Сверхэкспрессия MazF с плазмид в клетках кишечной палочки полностью ингибирует клеточный рост как результат деградации всех клеточных мРНК. Однако, индукция MazF не влияет на синтез ДНК и РНК, что свидетельствует о том, что метаболические процессы, необходимые для производства АТФ и биосинтеза нуклеотидов сохраняются в клетках при сверхэкспресии MazF. Это физиологическое состояние клетки было обозначено как «квази-покой». Последующая сверэкспрессия антитоксина MazE восстанавливает синтез белков в клетке.
Экспрессия MazF при использовании определенных промоторов может привести к установлению такой внутриклеточной концентрации MazF, при которой синтез клеточного белка не прекращается, а лишь частично снижается. Экспрессия в этих клетках гомо- и гетерологичных белков, мРНК которых устойчивы к воздействию MazF, позволит направить ресурсы клетки на синтез этих белков без остановки клеточного роста. Индуцибельность и независимость друг от друга экспрессии MazF и MazE позволят изменять соотношение их внутриклеточных концентраций и таким образом модулировать скорость роста клетки, скорость синтеза белка или скорость потоков внутриклеточных метаболитов.
Подробное описание изобретения
Способ по настоящему изобретению разработан на примере экспрессионного штамма Е. coli, а также штамма, у которого предварительно был делетирован оперон mazEF, и включает этапы клонирования генов токсина MazF и антитоксина MazE; экспрессию этих генов с отдельных индуцибельных промоторов на плазмидном векторе или на хромосоме. Кроме того, варьирование коэффициента соотношения токсина и антитоксина, присутствующих в клетке, позволяет регулировать рост и метаболизм клетки.
Данное изобретение также предусматривает дальнейшую модификацию эндогенных или гетерогенных целевых генов для замены всех мРНК-последовательностей, узнаваемых и расщепляемых эндонуклеазой MazF на MazF-не чувствительные последовательности, без изменения аминокислотной последовательности белка, кодируемого целевым геном.
Техническим результатом является создание нового способа управления клеточным метаболизмом на примере штаммов клеток Echerichia coli Т7 Express iq, содержащих плазмиду pet22b-B93MazF, pet22b-B138MazF, а также штаммов клеток Echerichia coli Т7 Express iq, содержащих модуль B93MazF-KanR, B139MazF-KanR на хромосоме, включая этапы клонирования гена MazF под соответсвующими промоторами.
Микроорганизмы с управляемым метаболизмом обладают стабильными культуральными и морфологическими свойствами и способностью регулировать метаболические потоки на уровне трансляции.
Культурально-морфологические признаки
Грамотрицательные прямые палочки, одиночные, неподвижные, 1.1-1.5×2.0 в диаметре, мутноватые, выпуклые влажные колонии с ровным краем с гладкой блестящей поверхностью, спор и капсул не образуют.
Физико-биологические признаки
Условия хранения штаммов. Штамм хранится при -70°С (до 6 месяцев) в 10%-ном растворе глицерина в питательной среде М9+1% глюкозы. Для возобновления роста штамм высеивают на агаризованную минимальную питательную среду М9+1% глюкозы и выращивают при 37°С. Все среды содержат канамицин в концентрации 100 мкг/мл. Условия индукции белков MazF и MazE: 1 мМ IPTG.
Описание чертежей
Фиг. 1 - генетическая карта плазмиды pkD46, содержащая гены рекомбинации фага λ, Gam, Beta, Ехо, используемые для рекомбинации генов MazF и MazE на хромосому.
Фиг. 2 - нуклеотидная последовательность мутантных промоторов, использованных в изобретении.
Фиг. 3 - генетическая карта плазмид pet22b-B93MazF, содержащая ген Maz под мутантным промотором В93.
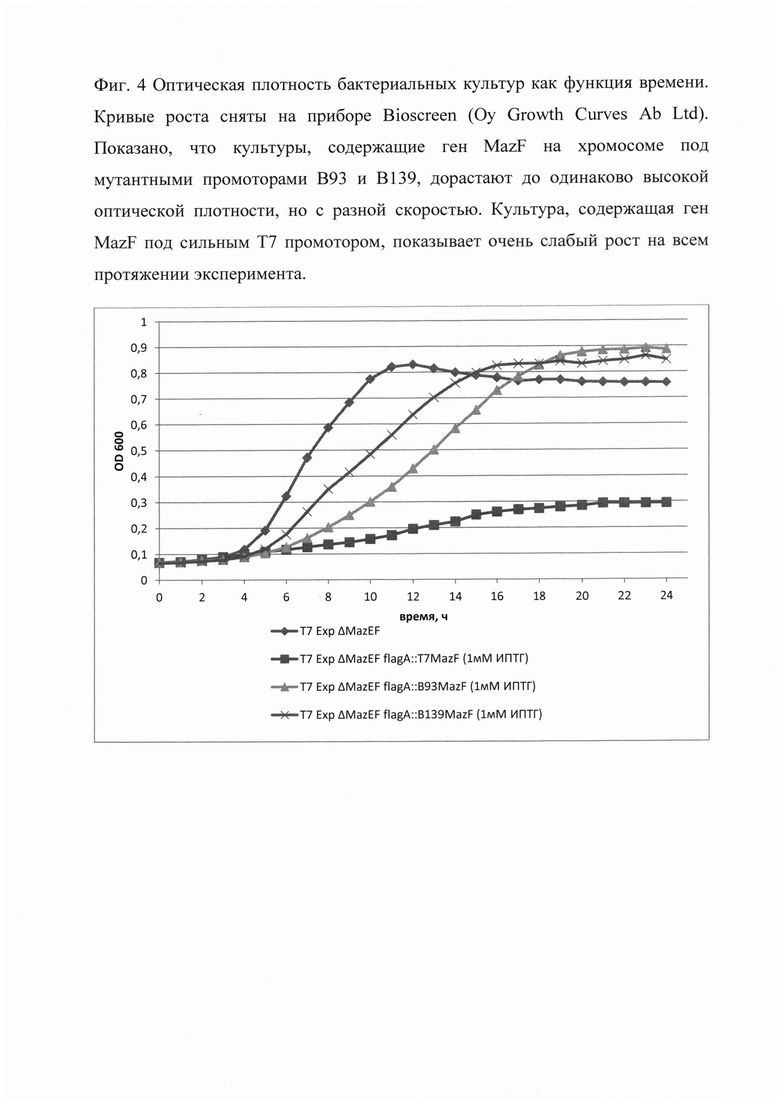
Фиг. 4 Оптическая плотность бактериальных культур как функция времени. Кривые роста сняты на приборе Bioscreen (Оу Growth Curves Ab Ltd). Показано, что культуры, содержащие ген MazF на хромосоме под мутантными промоторами В93 и В139, дорастают до высокой оптической плотности, но с разной скоростью. Культура, содержащая ген MazF под сильным Т7 промотором, показывает очень слабый рост на всем протяжении эксперимента.
Варианты осуществления изобретения.
Выделение/синтез гена мРНК интерферазы и его антитоксина.
мРНК гена, кодирующего мРНК интерферазу (MazF, например, амплифицируют из генома Е. coli и клонируют в виде ДНК в любой удобный для клонирования вектор, такой, например, как pBluescript (Stratagene, La Jolla, Calif), который можно размножать в клетках Е. coli. Кроме того, молекулы нуклеиновых кислот, кодирующие мРНК интерферазу, могут быть синтезированы из соответствующих нуклеотидтриозофосфатов химическим способом по стандартной методике в ДНК синтезаторе. Молекулы нуклеиновых кислот, кодирующие антитоксины, блокирующие действие мРНА интерфераз, (MazE, например) получают тем же способом.
Существенным признаком заявленного способа являются промоторы, подходящие для экспрессии белков мРНК интерферазы, антитоксина и целевых продуктов в различных микроорганизмах. Обычно, при экспрессии гетерологичных белков в Е. coli используют сильные и строго контролируемые промоторы, применение которых обеспечивает максимальную продукцию и снижение токсичных эффектов во время фазы роста. Среди наиболее часто используемых для суперэкспрессии в Е. coli промоторов находятся системы, основанные на Т7 РНК полимеразном и PL терморегулируемом промоторах. Однако, сверхвысокая транскрипционная активность этих систем создает избыточную метаболическую нагрузку на продуцирующие клетки, что снижает синтез целевого продукта в процессах, не связанных с получением гетерогичного белка. Поэтому некоторые менее сильные промоторы, такие как lac, tac, trc, PBAD, rhaPBAD и другие используются при создании штаммов Е. coli - продуцентов биохимикатов. При метаболической инженерии дрожжей часто используются эндогенные конститутивные промоторы PTEF, РНХТ7, PGPD, или промоторы, индуцируемые галактозой.
В связи с тем, что при метаболической инженерии микроорганизмов суперэкспрессия белков не всегда бывает полезна для получения целевого продукта, инженерия промоторов стала необходимой частью заявленного способа. Инженерия промоторов основана на особенностях их архитектуры. Так, прокариотические промоторы содержат два обязательных мотива, окруженных вариабельными регионами (спейсерные области) ДНК. Внося мутации в эти спейсерные области, можно модулировать экспрессию белков, находящихся под контролем этих промоторов.
Для модулирования активности промоторов будут использованы один или несколько из следующих методов: Ep-PCR, насыщающий мутагенез нуклеотидных спейсерных областей, конструирование гибридных промоторов, направленные модификации TFBS. Все эти методы подробно описаны в литературе.
При более узконаправленном мутировании промотора мутациям подвергаются только вариабельные участки, в то время как консенсусная последовательность остается незатронутой. Прокариотичакие промоторы содержат -35 и -10 консенсусный мотив, разделенный и окруженный вариабельными последовательностями. Насыщающий мутагенез этих спейсерных областей представляет собой более рациональный метод изменения силы прокариотичекого промотора по сравнению с Ep-PCR. Мутации, приводящие к изменению длины спейсерных областей, значительно снижают силу промотора.
Преимущество конструирования гибридных промоторов заключается в том, что позволяет достигнуть усиления активности даже самых сильных нативных промоторов. Этот способ является единственной известной методологией, позволяющей систематически увеличивать транскрипционную активность организма посредством изменения структуры промотора. Гибридные промоторы очень часто используются для метаболической инженерии S. cerevisiae и других дрожжей, поскольку сила эндогенных промоторов эукариот может быть легко усилена посредством добавления UAS.
Определенные короткие последовательности нуклеотидов, осуществляющие связывание элементов механизма транскрипции клетки, оказывают кумулятивное воздействие на силу промотора и его регуляцию. Конструирование гибридных промоторов предполагает слияние тандема UAS (который содержит TFBS, чтобы локализовать специфические транскрипционные активаторы) для того, чтобы усилить, тонко настроить или регулировать транскрипционную активность промотора. Ep-PCR мутагенез позволяет конструировать промотор, посредством случайных мутаций ДНК вокруг или внутри TFBS, а мутагенез спейсерных областей позволяет контролировать промотор посредством только мутаций ДНК вокруг консервативных мотивов. Таким образом, подходы к конструированию промоторов включают в себя добавление, удаление, или модифицирование TFBS, а также зависят от генетического контекста TFBS, что бы изменить транскрипционные свойства промотора. Вследствие этого, достижение строгого контроля транскрипции на уровне промотора нуждается в систематическом направленном модифицировании зоны TFBS.
Клонирование
Для подбора оптимальных комбинаций корового элемента, энхансеров, сайтов связывания транскрипционных факторов и других регуляторных элементов требуется создание большого количества различных векторов несущих гены MazF, MazE или различные репортерные гены под их контролем. Для сравнительно просто клонирования данной комбинаторной коллекции будет использован метод GoldenGate клонирования. Данный метод позволяет с помощью эндонуклеаз рестрикции IIs типа и Т4 ДНК-лигазы направленно и одновременно собрать несколько фрагментов ДНК в единое целое. В отличие от стандартных эндонуклеаз рестрикции II типа, эндонуклеазы IIs типа разрезают последовательность ДНК за пределами сайта узнавания, а использование нуклеаз BsaI, BsmBI или BbsI позволяет скомбинировать до 256 различных последовательностей. Более того, данные последовательности могут быть соединены друг с другом без «молекулярных швов», т.е. последовательностей, кодирующих сайты рестрикции. Таким образом, просто комбинирую в пробирке различные фрагменты ДНК, концевые участки которых были предварительно подобраны особым образом, можно получить огромную комбинаторную библиотеку векторов для поиска промоторов с необходимым уровнем экспрессии.
Трудности одновременной экспрессии нескольких клонированных на плазмидах гетерологичных белков вызываются тем, что доза гена может быть токсична, и, кроме того, добавление антибиотика в среду часто бывает нежелательно. Поэтому интегриривание гетерологичных генов в хромосому в ряде случаев является предпочтительней, чем использование плазмид. В настоящее время имеются хорошо разработанные методы для достижения контролируемой и одновременной экспрессии нескольких гетерологичных белков, гены которых интегрированы в хромосому клетки-хозяина.
В модифицированной версии «рекомбинационной инженерии» линейный фрагмент вставляют в геном, используя методы фаговой рекомбинации. Этот фрагмент ДНК состоит из селективного маркера, ограниченного двумя мегануклеазными участками I-SceI и двумя гомологичными участками (boxes А и С) и заменяет нужный сегмент хромосомы. Этот интегрируемый фрагмент ДНК содержит третий гомологичный домен (box В) слитый cbox A. Box В соответствует региону, предшествующему box С, и вставка фрагмента ДНК приводит к дупликации box B в хромосоме. После индукции экспрессии I-SceI с плазмиды, образуются разрывы двойной нити ДНК, после чего происходит их репарация. При использовании этой системы проведению рекомбинации помогают короткие гомологичные участки box В, которые могут рекомбинировать посредством RecA.
Модификация экспрессируемых генов
Любая нуклеотидная последовательность АСА, по которой мРНК интерфераза MazF расщепляет мРНК, может быть заменена в гене таким образом, чтобы мРНК, соответствующая гену, не содержала этих последовательностей, а, следовательно, была не чувствительна к воздействию MazF, при этом аминокислотная последовательность белка, кодируемого этим геном, не изменялась. Приготовление таких генов, не содержащих нуклеотидные последовательности АСА, являются следующей ступенью предлагаемой технологии.
Если ген содержит только несколько последовательностей АСА, каждая из них может быть изменена олигонуклеотид-направленным сайт-специфическим мутагенезом. Однако, если ген большой, в нем может содержаться большое количество АСА последовательностей (в среднем одна АСА последовательность на 64 нуклеотидных основания). В этих случаях сайт-специфический мутагенез с целью удаления АСА последовательностей из этого гена будет чрезмерно трудо- и время затратным. Эту проблему можно решить посредством химического синтеза целого гена, что в настоящее время является экономически оправданным. Этот подход позволяет не только устранить все АСА последовательности, но и осуществлять оптимизацию кодонового состава, чтобы обеспечить оптимальный уровень экспрессии.
Культивирование полученных рекомбинантных микроорганизмов
Ростовые и технологические характеристики полученных рекомбинантных штаммов с управляемым метаболизмом, оценивают в процессах периодических ферментаций, осуществляемых при оптимальных физиологических условиях в качалочных колбах и лабораторных ферментерах. Эти эксперименты проводят как с использованием стандартных потальных сред, так и дополнительно обогащенных питательными веществами. Максимальная скорость роста и величина энергии поддержания определяют при культивировании этих микроорганизмов в режиме хемостата. На основании полученных данных возможно создавать новые ферментационные процессы.
Примеры
Пример 1. Процедура получения мутантного штамма бактерий Е. coli Т7 Express iq с делецией MazE/MazF.
Удаление с хромосомы оперона MazE/MazF с заменой на маркерную устойчивость (Stm) проводили методом гомологичной рекомбинации с помощью плазмиды pkD46, содержащей гены белков фаговой рекомбинации Exo, Bet, Gam под индуцибельным промотором araBAD. Штамм дикого типа Т7 Express iq трансформировали плазмидой pKD46, рост колоний происходил на агаризованной среде LB при 30°С. Линейную ДНК, содержащую ген устойчивости к стептомицину, нарабатывали методом полимеразной цепной реакции на матрице pISA с использованием праймеров из 90 нп, из которых 65 нп являются гомологичными промоторной области удаляемого оперона и 25 нп - гомологичны последовательности матрицы pISA. Далее линейную ДНК вводили в клетки Т7 Express iq с плазмидой pKD46 методом электропорации, колоний растили при 37С, и отбирали устойчивые к стрептомицину колонии Т7 Express iq MazEF::StmR. Отобранные клоны пересевали на свежую среду LBагар + Stm.
Удаление Stm-устойчивости с хромосомы Е coli Т7 Express iq MazEF::StmR проводили с помощью плазмиды pIntXis (Amp-resistant), содержащей гены белков рекомбинации фага λ int, xis под индуцибельным Plac промотором. Трансформацию pIntXis в штамм Е coli Т7 Express iq MazEF::StmR производили методом электропорации, рост колоний на среде LB + Amp + Iptg 1 mM для индукции генов рекомбинации. Селективный отбор клонов производили пересевами, рост колоний при 42С для элиминации плазмиды pIntXis.
Пример 2. Получение плазмиды pet22b-B93MazF, содержащий ген токсина MazF под мутантным промотором.
Нуклеотидная последовательность гена MazF была амплифицирванна из генома Е coli BL21 с праймерами Pr (+) CAT ATG GTA AGC CGA ТАС GTA СС и Pr (-) AAG СТТ СТА ССС ААТ CAG ТАС GTT АА и заклонирована в вектор рЕТ32а по сайтам рестрикции NdeI, Hind III под Т7 промотор. Мутантные промоторы (В93, В139) были получены с помощью ПЦР с прямым праймером (Евроген, Москва), содержащем соответствующую мутацию (TAATACGACTCAATATAGG GAGA) и обратным праймером T7rev (TAATACGACTCACTATAGGG), и ПЦР-продукт был заклонирован в плазмиду pet22b (фигура 1).
Пример 3. Получение штамма T7Express iq ΔMazEF flagA::B93MazF-KanR, содержащего ген MazF на хромосоме под контролем мутантного промотора В93.
Для интегрирования на хромосому Е coli Т7 Express iq был выбран флагеллярный регион. Линейная ДНК для вставки на хромосому (B93MazF-KanR) была создана лигированием двух отдельных линейных ПЦР последовательностей с целевым геном MazF под мутантным промотором В93 и геном устойчивости к канамицину. При наработке каждой из этих последовательностей по отдельности были использованы пары праймеров, один из которых имеет гомологию к выбранной области флагеллярного региона на хромосоме Е coli в виде 65 нп, а другой - 25 нп, гомологичных соответствующей плазмиде. Далее линейную ДНК для интеграции на хромосому вводили в клетки Т7 Express iq ΔMazEF с плазмидой pKD46 электропорацией, колонии растили при 37С. Проверку полученных колоний поводили с праймерами на ген MazF.
Некоторые из положительных клонов перештриховывали на свежую агаризованную минимальную среду М9 + 1% глюкозы + Km. Из положительных клонов выделялась геномная ДНК, и полученная мутация подтверждалась секвенированием (Евроген, Москва).
Пример 4. В данном примере показано культивирование штамма Е coli с управляемым метаболизмом. Рост мутантного штамма T7Express iq ΔMazEF flagA::B93MazF-KanR, постоянно экспрессирующего MazF под контролем мутантногопромотора В93 на минимальной среде с добавлением глюкозы.
Несколько колоний мутантного штамма T7Express iq ΔMazEF flagA::B93MazF-KanR, полученного, как описано в Примерах 1 и 3, были инокулированы в 10 мл среды М9 с добавлением 1 г/л глюкозы и инкубированы при 250 об/мин, 37°С. 500 мкл полученной культуры использовали для обновления в 50 мл среды свежей среды, процесс культивирования проводили в стеклянной колбе на 500 мл при 250 об/мин, 37°С.
Использовали питательную среду М9 + 1% глюкозы, а именно (на 1 л): 900 мл автоклавированной воды + 100 мл 10 × М9 соли + 1 мл 1 М MgSO4, 0,1 мл 1М CaCl2, 10 мл 40% глюкозы, 4 мл 0,5 мг/мл витамин В. 10 × М9 соли (на 100 мл): 6,8 г Na2HPO4, 3 г KH2PO4, 0,5 г NaCl, 1,0 г NH4Cl.
Индукцию 1 мМ IPTG проводили через 2 часа после начала роста. Культура росла экспоненциально, рост прекращается примерно через 15 часов. Конечная концентрация биомассы составляет около 2,1 г/л.
Основные характеристики клеток:
1. Родовое и видовое название штамма-хозяина (реципиента) - Escherichia coli.
2. Наименование штаммов: Escherichia coli T7Express iq ΔMazEF flagA::T7MazF-KanR; Escherichia coli T7Express iq ΔMazEF flagA::B93MazF-KanR; Escherichia coli T7Express iq ΔMazEF flagA::B139MazF-KanR
3. Способ получения штамма: гомологичная рекомбинация.
4. Способ, условия и состав сред для длительного хранения штаммов: среда М9+10% глицерина при -70°С.
5. Способ, условия и состав сред для размножения штамма: среда М9+1% глюкозы + 100 мкг/мл канамицина.
6. Генетические особенности штаммов:
a). fhuA2 lacZ::T7 gene1 [lon] ompT gal sulA11 R(mcr-73::miniTn10--TetS)2 [dcm] R(zgb-210::Tn10--TetS) endA1 Δ(mcrC-mrr)114::IS10 ΔMazEF flagA::T7MazF-KanR
б). fhuA2 lacZ::T7 gene1 [lon] ompT gal sulA11 R(mcr-73::miniTn10--TetS)2 [dcm] R(zgb-210::Tn10--TetS) endA1 Δ(mcrC-mrr)114::IS10 ΔMazEF flagA::B93MazF-KanR
в). a). fhuA2 lacZ::T7 gene1 [lon] ompT gal sulA11 R(mcr-73::miniTn10--TetS)2 [dcm] R(zgb-210::Tn10--TetS) endA1 Δ(mcrC-mrr)114::IS10 ΔMazEF flagA::B139MazF-KanR
Сведения о клонированной ДНК:
Видовая принадлежность донорного организма: Escherichia coli
Размер клонированного фрагмента и включенные в его состав гены: 1750 п.н.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA, В КОТОРОЙ ИНАКТИВИРОВАН ОПЕРОН mazEF | 2005 |
|
RU2313573C2 |
| ПЛАЗМИДНЫЙ ВЕКТОР pHYP С ПОВЫШЕННОЙ СЕГРЕГАЦИОННОЙ СТАБИЛЬНОСТЬЮ ДЛЯ ЭКСПРЕССИИ РЕКОМБИНАНТНОГО БЕЛКА, БАКТЕРИЯ - ПРОДУЦЕНТ ПРЕДШЕСТВЕННИКА РЕКОМБИНАНТНОГО БЕЛКА И СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА | 2011 |
|
RU2496877C2 |
| НОВАЯ СИСТЕМА СЕЛЕКЦИИ | 2006 |
|
RU2415935C2 |
| 6-ФОСФОГЛЮКОНОЛАКТОНАЗА ИЗ ESCHERICHIA COLI, ФРАГМЕНТ ДНК, БАКТЕРИЯ, ПРИНАДЛЕЖАЩАЯ К РОДУ ESCHERICHIA - ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ | 2005 |
|
RU2288268C2 |
| Рекомбинантная плазмида pFM-FliC_syn, обеспечивающая экспрессию рекомбинантного белка флагеллина Salmonella (FliC), моноплазмидный штамм бактерий Escherichia coli FM-FliC_syn и способ получения рекомбинантного белка флагеллина Salmonella (FliC) | 2023 |
|
RU2831404C1 |
| ШТАММ Escherichia coli BL21 (DE3)[pAYC-ET-(hIFN-α2b)-IacI]-ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО АЛЬФА-2b ИНТЕРФЕРОНА И СПОСОБ ЕГО КУЛЬТИВИРОВАНИЯ | 2005 |
|
RU2303063C2 |
| РЕКОМБИНАНТНЫЕ ПЛАЗМИДНЫЕ ДНК, КОДИРУЮЩИЕ ГИБРИДНЫЕ ПОЛИПЕПТИДЫ СО СВОЙСТВАМИ КРАСНОГО ФЛУОРЕСЦЕНТНОГО БЕЛКА mCherry, ДЛЯ ПРОДУЦИРОВАНИЯ ГИБРИДНЫХ ФЛУОРЕСЦЕНТНЫХ БЕЛКОВ В Escherichia coli | 2013 |
|
RU2527171C1 |
| ВЕКТОР НА ОСНОВЕ РЕПЛИКОНА БАКТЕРИОФАГА N15 И РЕКОМБИНАНТНЫЙ ВЕКТОР ДЛЯ РЕГУЛИРУЕМОЙ ЭКСПРЕССИИ ЦЕЛЕВОГО ГЕНА В КЛЕТКАХ ESCHERICHIA COLI, ШТАММ ESCHERICHIA COLI, ОБЕСПЕЧИВАЮЩИЙ ВОЗМОЖНОСТЬ РЕГУЛЯЦИИ ЧИСЛА КОПИЙ ВЕКТОРА, И СИСТЕМА ЭКСПРЕССИИ | 2006 |
|
RU2312146C1 |
| ПЛАЗМИДА БЕЗ УСТОЙЧИВОСТИ К АНТИБИОТИКУ | 2010 |
|
RU2548809C2 |
| БАКТЕРИЯ Escherichia coli - ПРОДУЦЕНТ ЯНТАРНОЙ КИСЛОТЫ И СПОСОБ ПОЛУЧЕНИЯ ЯНТАРНОЙ КИСЛОТЫ | 2010 |
|
RU2466186C2 |

Изобретение относится к области биотехнологии и касается способа управления метаболизмом клетки. Сущность способа состоит в том, что метаболизм микроорганизмов регулируется на уровне трансляции за счет раздельной регуляции экспрессии генов, кодирующих белки, составляющие единый токсин-антитоксин модуль MazE/MazF. 4 ил., 4 пр.
Способ управления метаболизмом клетки, включающий раздельную регуляцию экспрессии генов, кодирующих белки токсина MazF и антитоксина MazE, составляющие единый токсин-антитоксин модуль на хромосоме Esherichia coli, где раздельная регуляция экспрессии генов токсина MazF и антитоксина MazE осуществляется путем удаления оперона mazEF с хромосомы Esherichia coli, клонирования генов белков MazE и/или MazF на плазмидный вектор или на хромосому, экспрессии этих белков с отдельных индуцибельных промоторов на плазмидном векторе или на хромосоме.
| Lieven Buts et,al | |||
| Toxin-antitoxin modules as bacterial metabolic stress managers, Trends in Biochemical Sciences, Volume 30, Issue 12, December 2005, Pages 672-679 | |||
| Arti Tripathi et.al | |||
| MazF-induced Growth Inhibition and Persister Generation in Escherichia coli, The Journal of Biological Chemistry, VOL | |||
| РЕЛЬСОВАЯ ПЕДАЛЬ | 1920 |
|
SU289A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| СТАНОК ДЛЯ ВЫВЕРКИ ПРОПЕЛЛЕРОВ | 1925 |
|
SU4191A1 |
Авторы
Даты
2020-09-09—Публикация
2019-03-15—Подача