Настоящее изобретение относится к способу продуцирования рекомбинантного белка, включающему использование отличного от антибиотиков способа селекции. В частности, оно относится к стабильной системе «хозяин/вектор», основанной на комплементации гена pyrC, разработанной для продуцирования высокого уровня гетерологичного рекомбинантного белка в Escherichia coli.
Уровень техники
Гетерологичные системы для экспрессии белка обычно используют плазмиды для клонирования и экспрессии представляющих интерес генов в микроорганизмах. Когда эти автономно реплицирующиеся фрагменты ДНК используют в качестве векторов экспрессии белка, их конструкция всегда основывается на: I) репликаторе для гарантии автономного ответа; II) промоторе для проведения транскрипции представляющего интерес гена; и III) гене селекции для облегчения селекции содержащих плазмиды клеток.
Гены селекции обычно кодируют ферменты, придающие резистентность к антибиотикам, которые используются во время стадий клонирования и роста культуры. Присутствие антибиотика в чашках Петри во время клонирования допускает селекцию клеток, включивших плазмиду во время трансформации, облегчая идентификацию рекомбинантной колониеобразующей единицы (cfu). В случае роста культуры в жидкой среде добавление соответствующего антибиотика в культуральный бульон предотвратит потерю плазмиды и будет поддерживать популяцию клеток гомогенной. С течением времени вектор экспрессии утрачивается, поскольку общие метаболические затраты микроорганизма оказывают предпочтение росту клетки в отсутствие плазмиды. Это уменьшает выход экспрессии рекомбинантного белка. Поэтому наличие гомогенной культуры, в которой каждая клетка выступает в роли хозяина вектора экспрессии, очень важно для получения повышенного производства рекомбинантного белка. Постепенное разбавление микроорганизмов, продуцирующих рекомбинантный белок, приведет к "растворению" рекомбинантного белка в хозяине. Это явление далее усиливается, если культуральный бульон является бедной средой, такой как синтетический бульон, в котором микроорганизм должен синтезировать большинство своих метаболитов.
Для предотвращения потери плазмиды к среде культуры, где ген, кодирующий резистентность, клонируют в вектор экспрессии, обычно добавляют давление отбора, такое как получающееся в результате использования антибиотика. Самая обычная система использует ампициллин и связанный ген β-лактамазы, продукты которого гидролизируют антибиотик, присутствующий в среде. Этот тип механизма действия приводит к прогрессивному исчезновению ампициллина в среде, по мере того, как культура продолжает развиваться, и число клеток увеличивается. Так как ампициллин является бактериостатическим лекарственным препаратом, свободные от плазмид клетки (то есть нетрансформированные клетки) начинают пролиферировать, как только остающаяся концентрация антибиотика начинает это допускать. Это явление отсроченного роста является особенно видимым в чашках Петри, где через некоторое время вокруг главной колониеобразующей единицы (cfu) начинают расти так называемые "спутники".
Для того чтобы помешать отсроченному росту нетрансформированных клеток и таким образом получить значительную однородность культуры, концентрация ампициллина в предкультуре может быть увеличена(1) или заменена бактерицидными соединениями, такими как канамицин или тетрациклин. Канамицин взаимодействует с 30s-рибосомным комплексом и предотвращает инициирование трансляции белка. Тетрациклин действует на ту же самую цель и блокирует добавление новых аминокислот во время синтеза полипептида. Эта последняя стратегия работает достаточно хорошо и имеет более высокую склонность стабилизировать присутствие вектора экспрессии в клетке.
К сожалению эти подходы к стабилизации вектора экспрессии не могут использоваться для продуцирования белков для лечения человека согласно протоколам Good Manufacturing Practice (GMP). Например, ампициллин исключается в этих протоколах из-за проблем аллергенности, тогда как для других антибиотиков требуется ратификация для демонстрации удаления из организма антибиотиков во время процесса очистки(2). Другим пунктом, достойным внимания, является демонстрация стабильности структуры на протяжении поколений клеточной культуры. Следовательно, системы стабилизации плазмиды, отличные от резистентности к лекарствам, все еще очень необходимы.
О естественном механизме стабилизации плазмиды с помощью постсегрегационного уничтожения свободных от плазмид клеток с использованием системы hoc/sok уже сообщалось в литературе(3). Генный продукт hok является мощным уничтожающим клетку белком, тогда как ген sok кодирует маленькую антисмысловую РНК, комплементарную мРНК hok. Оба гена расположены на плазмиде и считываются в противоположных направлениях. мРНК hok необычно стабильна (часы), в то время как РНК sok распадается быстро (менее 30 с). В клетках, утративших плазмиду, остается стабильный транскрипт мРНК hok, и его продукт уничтожает клетку путем мембранной деполяризации в отсутствии нестабильной РНК sok(4).
Естественную потерю плазмиды в отсутствии давления отбора трудно минимизировать, и поэтому требуется новая система стабилизации вектора, не основанная на антибиотическом давлении отбора, которая является соответствующей GMP.
Стабильность вектора экспрессии является важной проблемой, когда продуцирование рекомбинантного белка выполняют в прокариотическом хозяине, таком как Escherichia coli, где плазмиды остаются эписомными и поэтому имеют независимый механизм сегрегации по сравнению с бактериальной хромосомой. Стабильные векторы экспрессии являются необходимыми, так как общий выход продуцирования рекомбинантного белка будет зависеть от присутствия плазмиды, которое в свою очередь является зависимым от способности микроорганизма поддерживать его (метаболическая нагрузка). На лабораторном уровне проблему потери плазмиды можно обойти с помощью добавления антибиотика в культуральную среду, которое вынудит бактерии поддерживать кодирование плазмиды для резистентности к антибиотикам и, следовательно, представляющего интерес гена. Напротив, когда производство белка для использования у человека должно быть выполнено согласно GMP, присутствие антибиотика в культуральной среда не приемлемо. Однако чтобы начать культивирование с гомогенной популяции, давление отбора абсолютно необходимо для изоляции бактерии, содержащей плазмиду. Кроме того, во время культивирования клеток давление отбора предотвратит рост свободных от плазмид клеток, которые продуцируют только белки хозяина и могут рассматриваться как нежелательные "загрязнители". До сих пор антибиотическая селекция использовалась во время реализации Главного и Рабочего банков клеток, в то время как, начиная с гомогенной популяции, антибиотик исключали во время культивирования клеток, таким образом допуская потерю плазмиды. Поэтому было бы удобно разработать систему, основанную не на резистентности к антибиотикам, для поддержания давления отбора во время всего процесса.
Детальное описание изобретения
Основываясь на вышеупомянутых соображениях, мы разработали новую систему селекции, подходящую для GMP-продуцирования и основанную на паре «хозяин/вектор», в которой рост микроорганизма в селективной минимальной среде строго зависит от присутствия плазмиды. Минимальная среда выгодна для продуцирования белка для использования у человека, так как она не содержит, например, BSE или GMO из различных источников. Другим преимуществом является низкая тенденция к вспениванию этих сред, которые благоприятствуют переносу кислорода и возможность навязывания источника углерода для роста микроорганизма. С тех пор, как метаболизм Escherichia coli был подробно описан, многочисленные штаммы являются доступными, и среди них можно выбрать лучший штамм для этого эксперимента комплементации с учетом доступного или желаемого источника углерода.
В первой пробе фермент β-галактозидазу определили в качестве желаемого кандидата для создания простого комплементарного дуэта «хозяин/вектор». Этот ключевой фермент в метаболизме лактозы гидролизует лактозу в глюкозу и галактозу, которые затем усваиваются. Остатки аминокислот N-концевой части β-галактозидазы являются ответственными за ее тетрамеризацию, которая представляет активную четвертичную структуру для этого специфического фермента. Среди многочисленных мутантов, произведенных за эти годы, М 15 β-галактозидаза является усеченной формой, представляющей делецию от остатков 11 до 41. Мутант М 15 является пассивным димером, но может быть дополнен до активной тетрамерной формы путем добавления α-пептида lacZ, содержащего удаленные остатки и представленного в многочисленных векторах клонирования(11,12). Эта комплементация использовалась в течение многих лет для клонирования, но никогда не использовалась для оказания давления отбора на рост штамма XLI Escherichia coli и принуждения его поддерживать плазмиду. Для демонстрации этого штаммы XLI и XLI::pUC19 поместили в минимальную среду с лактозой в качестве источника углерода. Мутированный штамм XLI в чистом виде, испытывающий недостаток активности β-галактозидазы, был неспособен к росту вследствие его неспособности метаболизировать лактозу, которая была единственным присутствующим источником углерода в чашке Петри. При транс-комплементации α-пептида lacZ, кодируемой коммерчески доступной плазмидой PUC 19, или при помещении на минимальную среду с другим источником углерода (таким как глюкоза) было возможно восстановить рост штамма XLI. Этот оригинальный и простой метод допускает отбор клеток, содержащих плазмиду очень эффективным способом без какого-либо другого компонента в культуральной среде. Так как рост штамма XLIblue ограничивается только когда лактоза является единственным доступным источником углерода, возможно подготовить отвечающие требованиям клетки классическим путем с использованием стандартной среды LB. Также трансформанты могут быть отобраны путем посева их на минимальную среду с лактозой в качестве единственного источника углерода.
Эта автоселекционная пара хозяин/вектор является очень привлекательной системой для GMP продуцирования рекомбинантных белков микроорганизмами, где обычно используются синтетические среды.
Поскольку усвоение лактозы может быть не самым удобным источником углерода для промышленных применений, для допуска использования любого адекватного источника углерода разработали другой комплементарный генный дуэт «хозяин/вектор» экспрессии. Тогда для разработки новой системы комплементации «хозяин/вектор» рассмотрели ген pyrC Escherichia coli. Ген и его промотор амплифицировали с помощью ПЦР от бактериальной хромосомы и клонировали в вектор экспрессии. Этот ген отрицательно регулируется наличием пиримидина в цитоплазме бактерий путем формирования шпилькообразной структуры на 5'-конце транскрипта pyrC, которая перекрывает место связывания рибосомы pyrC, и требуется для подавления экспрессии pyrC. Формирование шпилькообразной структуры зависит от внутриклеточной концентрации CTP и GTP. В условиях ограничения пиримидина транскрипты pyrC с готовностью транслируются, что приводит к высокому уровню синтеза дигидрооротазы (13).
Это напряженное генное регулирование является преимуществом с энергетической точки зрения и помогает поддерживать метаболическую нагрузку клетки настолько низкой, насколько возможно, предотвращая трансляцию, когда она не требуется.
Ген pyrC также выбрали потому, что он присутствует в хромосоме Escherichia coli как изолированный ген и не как часть оперона, в отличие от большей части генов, вовлеченных в синтез пиримидина (14). Другим возможным кандидатом являлся ген pyrD, но так как локализация кодируемого белка находится в мембране (15), его сверхэкспрессия была бы вредна для целей настоящего изобретения. Данные относительно стабилизации плазмиды с помощью комплементации гена pyrC показали, что с использованием системы настоящего изобретения возможно получить почти эквивалентные, и даже лучшие, результаты по сравнению с классической системой резистентности к антибиотикам. Это происходит частично из-за непрерывного давления отбора, которое применяется к штамму, как только он начинает расти в минимальной среде, где он должен синтезировать свои пиримидиновые основания. Так как система действует на синтез ДНК/РНК, метаболизм клетки блокируется, когда мутированная клетка Escherichia coli утрачивает вектор экспрессии. Эта система сильно отличается от процедуры стабилизации hok/sok, о которой ранее сообщалось, где оба гена кодируются плазмидой и которая внедряет в свободные от плазмид клетки генный продукт hok, соответствующий мощному уничтожающему клетки белку.
Система pyrC является транс-комплементацией естественного гена Escherichia coli, который удалили из бактериальной хромосомы и клонировали в плазмиду и который при его утрате приводит к ауксотрофности штамма и последующему прекращению роста. Эта система отличается от системы, описанной Fiedler и Skerra (16), которая является ауксотрофной системой комплементации, основанной на синтезе аминокислоты пролина. Этот тип комплементации используется авторами как второй механизм селекции вместе с резистентностью к хлорамфениколу для прекращения потери плазмиды и продуцирования штамма Escherichia coli JM83. Гены proAB не удаляли намеренно из штамма, поскольку штамм уже носил мутацию (как со многими штаммами Escherichia coli), и эти гены клонировали в вектор экспрессии, чтобы дать возможность штамму расти в синтетической среде. Не продемонстрировано, однако, что только лишь эта система может использоваться для предотвращения потери плазмиды во время ферментации. Это вероятно является следствием того, что только лишь пролин-ауксотрофность может быть недостаточно селективна во время ферментации, поскольку микроорганизм может найти некоторое количество пролина в культуральном бульоне, где белки накапливаются через некоторое время. Этот тип регуляции блокирует синтез белка, тогда как pyrC затрагивает синтез РНК или ДНК, который является более ранним событием в метаболизме клетки. Но даже в присутствии хлорамфеникола в качестве основного селективного агента общее продуцирование не превышает 20 мгл-1, что ниже системы настоящего изобретения.
Degryse сообщил о системе комплементации, снова основанной на ауксотрофной аминокислоте (лизин). Автор дополнил штамм Escherichia coli, не имеющий диаминопимелата (DAP), который является метаболическим предшественником лизина и стенки бактериальной клетки (17). Снова систему комплементации использовали параллельно с геном cer, который продемонстрировал ослабление мультимерной структуры и увеличение стабильности плазмиды (18). Ген cer имеет лучший эффект стабилизации, чем непосредственно ауксотрофная комплементация. Хотя автор стабилизировал вектор экспрессии, они действительно признают, что, как это ни парадоксально, никакое увеличение уровня экспрессии рекомбинантного белка не может быть обнаружено.
О других системах генной комплементации сообщают, что они нуждаются в высоких числах копий плазмид (19; 28). Эти системы трудно использовать в процессе ферментации, где высокое число копий вектора вызывает слишком высокий метаболический стресс у бактериального штамма, который неизбежно приводит к лизису клетки.
Таким образом в первом аспекте настоящее изобретение предоставляет способ продуцирования рекомбинантного белка, включающий:
(a) преобразование клетки-хозяина, испытывающей недостаток в гене, кодирующем фермент, требуемый для синтеза нуклеотида с помощью вектора, включающего ген, кодирующий рекомбинантный белок и ген, кодирующий фермент; и
(b) рост вышеупомянутой клетки-хозяина.
Клетка-хозяин является предпочтительно прокариотической, более предпочтительно бактерией, наиболее предпочтительно Escherichia coli. В одном предпочтительном варианте осуществления фермент является PyrC или его гомологом. Ген для фермента предпочтительно присутствует в некультивированной клетке-хозяине как одиночный ген, в противоположность тому, чтобы быть частью оперона.
Используемый здесь термин "гомолог" относится к белкам, которые имеют сходную последовательность аминокислот, например белки или полипептиды, которые включают одно или более добавление, делеции, замены или подобное, охватываются настоящим изобретением. Кроме того, может быть возможным заменить одну аминокислоту другой сходного "типа". Например, заменяя одну гидрофобную аминокислоту другой.
Можно использовать такую программу, как программа CLUSTAL для сравнения последовательностей аминокислот. Эта программа сравнивает последовательности аминокислоты и находит оптимальное совмещение путем вставки областей в каждую соответствующую последовательность. Возможно вычислить идентичность или сходство аминокислоты (идентичность плюс сохранение типа аминокислоты) для оптимального совмещения. Такая программа, как BLASTx совмещает самый длинный отрезок сходных последовательностей и дает оценку соответствия. Таким образом возможно получить сопоставление, где найдены несколько областей сходства, каждая из которых имеет различную оценку. Оба типа анализа идентичности рассматриваются в настоящем изобретении.
В случае гомологов и производных описанная здесь степень идентичности с белком или полипептидом менее важна, чем то, что гомолог или производная должны сохранять функцию оригинального белка или полипептида. Однако соответственно предоставляются гомологи или производные, имеющие по крайней мере 60% сходство (как обсуждалось выше) с белками или полипептидами, описанными здесь. Предпочтительно, чтобы предоставлялись гомологи или производные, имеющие по крайней мере 70% сходство, более предпочтительно по крайней мере 80% сходство. Наиболее предпочтительно, чтобы предоставлялись гомологи или производные, имеющие по крайней мере 90% или даже 95% сходство.
Метод используется предпочтительно для продуцирования человеческих белков в специфических антителах или их фрагментах, предпочтительно фрагментах Fab. Фрагменты антитела включают, например, фрагменты Fab, F(ab')2 и Fv. Фрагменты Fv могут быть изменены для продуцирования синтетической структуры, известной как одноцепочечная молекула Fv (scFv). Она включает пептидный линкер, ковалентно присоединяющийся к областям Vh и Vl, который способствует стабильности молекулы. Другие синтетические структуры, которые могут использоваться, включают пептиды CDR. Они являются синтетическими пептидами, включающими антиген-связывающие детерминанты. Также может использоваться пептид-подражатель. Эти молекулы обычно являются конформационно ограниченными органическими кольцами, которые подражают структуру петли CDR и включают взаимодействующие с антигеном боковые цепи.
Во втором аспекте настоящее изобретение предоставляет клетку-хозяина, из которой удаляется ген, кодирующий любой фермент, требуемый для синтеза нуклеотида. В одном предпочтительном варианте осуществления клеткой-хозяином является BW 25113[дельта]pyrC. В дальнейшем слово [дельта] может быть обозначено греческим символом "Δ".
В третьем аспекте настоящее изобретение предоставляет вектор, включающий ген, кодирующий фермент, требуемый для синтеза нуклеотида. В одном предпочтительном варианте осуществления вектор дополнительно включает один или более промотор, или другие регулирующие элементы. Подходящие промоторы известны специалистам в данной области техники. Используемый здесь термин "регулирующий элемент" означает другие элементы последовательности нуклеиновой кислоты, которые вовлечены в регулирование генной экспрессии, такие как последовательности полиаденилирования, элементы энхансера, терминаторы транскрипции и т.д. Подходящие последовательности известны специалисту в данной области техники. Вектор также должен содержать последовательности, требуемые для репликации вектора, например репликатор. Вектор предпочтительно содержит участок множественного клонирования.
В другом аспекте настоящее изобретение обеспечивает использование вектора, как определено здесь, в способе экспрессии рекомбинантного белка.
В четвертом аспекте настоящее изобретение предоставляет набор для экспрессии рекомбинантного белка, включающий: (a) клетку-хозяина, как определено здесь; и (b) вектор, как определено здесь.
Настоящее изобретение теперь будет подробно описано на основе следующих примеров. Предпочтительные особенности каждого аспекта изобретения являются таковыми для каждого из других аспектов с соответствующими поправками. Упомянутые здесь документы предшествующей области техники приведены в наиболее полном объеме, разрешенном действующим законодательством.
Пример 1
Сначала демонстрировалось, что возможно использовать генную комплементацию в качестве давления отбора, чтобы вынудить микроорганизм, например Escherichia coli, поддерживать вектор экспрессии в процессе роста клеток. К этому моменту штамм Escherichia coli XLI-blue (5) и вектор экспрессии pUC19 (6), оба коммерчески доступные, определили в качестве возможных кандидатов для выполнения испытания генной комплементации. Штамм XLI-blue представляет мутацию Δ(lacZ)M15, которая соответствует делеции "а-фрагмента" фермента β-галактозидазы. Фрагмент кодируется многими клонирующими векторами, такими как pUC19, и может восстановить с помощью генной комплементации ферментативную активность β-галактозидазы штамма Escherichia coli, представляющего хромосомную делецию Δ(lacZ)M15. Штамм, несущий эту делецию, будет выглядеть бесцветным при выращивании на чашках Петри с X-gal, но когда происходит комплементация пептида, то есть когда плазмида присутствует, тот же самый штамм вырабатывает синий фенотип. Клонирующий вектор pUC19, с одной стороны, кодирует ген β-лактамазы и, с другой стороны, обладает многократно клонируемыми участками, помещенными в α-пептид. Эти многократно клонируемые участки преднамеренно поместили в эту область, чтобы облегчить отбор плазмид, в которые, после сшивания, поместили фрагмент ДНК. Вставка ДНК в α-пептид разрушает его открытую рамку считывания или сворачивание и прекращает деятельность β-галактозидазы, что приводит к бесцветному фенотипу при выращивании на чашках Петри с X-gal.
β-галактозидаза гидролизует лактозу в глюкозу и β-галактозу и является одним из ключевых ферментов в пути усвоения лактозы. Для проверки гипотезы штамм XLI-blue бактерии преобразовывали с использованием pUC19, и высевали клетки на LB-агар/ампициллин.
Выбранные клоны, все содержащие вектор экспрессии, затем перемещали на чашки Петри с минимальной средой M9, содержащей глюкозу или лактозу в качестве источника углерода. Параллельно непреобразованный штамм проверяли на рост на тех же самых средах (Таблица I).
Взаимозависимость между активностью β-галактозидазы и ростом клеток
Как представлено в таблице I, только клетки, содержащие вектор экспрессии, способны усвоить лактозу и поэтому расти, когда она является единственным доступным источником углерода. Этот эксперимент показывает, что генная комплементация между плазмидой и хозяином для выработки критического метаболического фермента может успешно использоваться в качестве давления отбора, чтобы вынудить клетки поддерживать вектор экспрессии. Эта простая система не требует добавления какого-либо антибиотика к среде для отбора содержащих плазмиды клеток, и ограничивается только использованием определенной среды с лактозой в качестве источника углерода.
Пример 2
Продемонстрировав, что подход является правильным, спроектировали более подходящую систему для продуцирования рекомбинантного белка. Ключевой фермент в метаболизме Escherichia coli определили как фермент, отсутствие которого предотвращает рост на минимальных средах, но не на богатых: фермент дигидрооротаза (7), который является продуктом гена pyrC.
Дигидрооротаза преобразовывает дигидрооротат в оротат, который затем преобразовывается в оротидилат, который дает, после декарбоксилирования, уридилат или UMP, необходимый пиримидиновый нуклеотид. После фосфорилирования UMP преобразовывается в UTP, который в свою очередь обеспечивает клетке CTP. Таким образом, путем удаления этого фермента возможно блокировать синтез РНК и ДНК на его ранних стадиях. В сложных средах CTP и UTP уже присутствуют в культуральном бульоне, таким образом отсутствие дигидрооротазы не имеет никакого воздействия на рост микроорганизма в богатых средах, тогда как оно предотвращает рост штамма на минимальных средах.
Ген pyrC полностью удалили из хромосомы (8) штамма Escherichia coli BW25113 для предотвращения возможной гомологичной рекомбинации с вектором экспрессии, содержащим его. Новый штамм Escherichia coli BW25113ΔpyrC помещен на хранение до регистрации настоящей заявки в Collection Nationale de Cultures de Microorganismes (CNCM), Institut Pasteur, 25, Rue du Docteur Roux, Paris, в соответствии с Будапештским Соглашением, и несет следующее обозначение: CNCM I-3447.
Параллельно цельный ген pyrC с его собственным промотором амплифицировали с помощью ПЦР и клонировали в pUC18 для создания pUC18-pyrC. В качестве первого подхода и для ратификации системы комплементации pUC18-pyrC преобразовывали в штамм BW 25113ΔpyrC, и получающиеся колонии высевали на нескольких селективных средах (Таблица II).
Взаимозависимость между присутствием pyrC и ростом штамма BW 25113ΔpyrC на минимальной среде
(+канамицин)
Знаки + или - отражают способность микроорганизма развиваться на данной среде. Недостаточный рост на источнике углерода арабинозе является следствием мутации штамма AaraBADAH33 (см. Материалы и Методы). Резистентность штамма к канамицину является следствием включения гена резистентности к канамицину в хромосому Escherichia coli в локусе pyrC. Знак ++ относится к более высокому росту, чем знак +.
Эти результаты подтверждают: I) что штамм BW 25113ΔpyrC сам по себе не способен расти на минимальных средах, если он не дополнен геном pyrC; II) функциональные возможности клонированного гена pyrC и его точную делецию в бактериальном штамме; III) неспособность этого штамма использовать арабинозу в качестве источника углерода, которая является важным параметром для генной экспрессии от промотора арабинозы (см. ниже).
Пример 3
Для проверки стабильности плазмиды разведения ночной культуры в минимальной среде высевали на LB-агар и через день некоторые cfu перемещали на минимальную среду M9/глюкоза с или без ампициллина (Таблица III).
Стабильность плазмиды после ночного культивирования. После ночного культивирования клетки разводили до соответствующей густоты и высевали на LB-агар. Сорок cfu затем переносили на селективную среду для определения присутствия плазмиды
Этот эксперимент демонстрирует, что плазмида присутствовала во всех проверенных клетках даже после ночного культивирования, так как присутствующие на чашке Петри с LB cfu сохраняют способность к росту на минимальной среде.
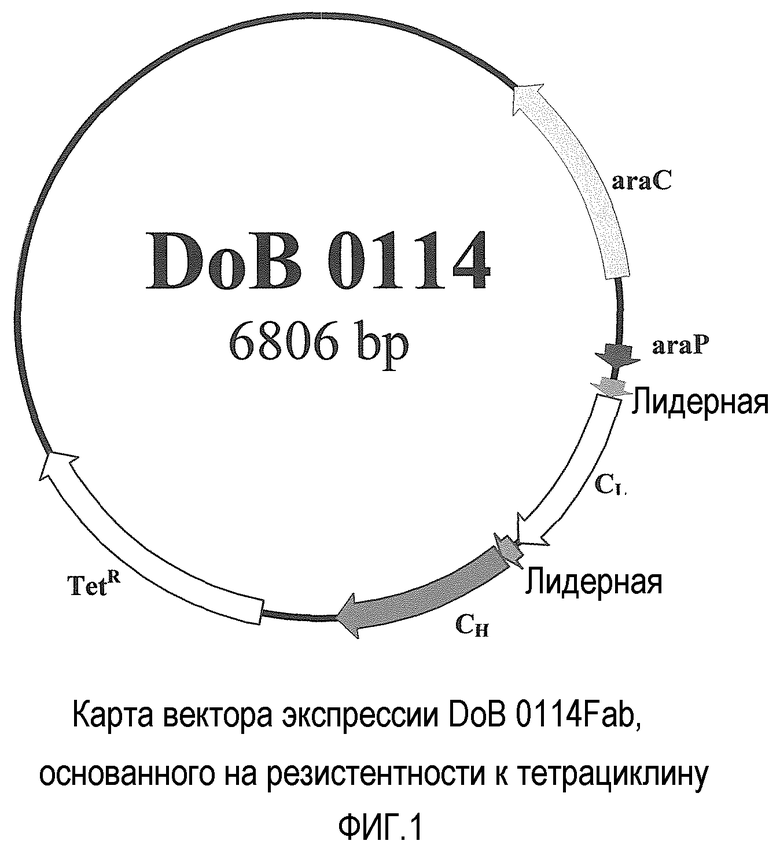
Затем определяли, осталась бы исследуемая система стабилизации, основанная на pyrC, эффективной даже в присутствии высокой метаболической нагрузки на микроорганизм, такой как во время продуцирования рекомбинантного белка, которое обычно побуждает штамм выбросить вектор экспрессии. Для этого в качестве эталонной плазмиды использовали DoB 0114 (фиг. 1), производный вектора экспрессии pBAD (InvitrogeneTM), в котором ген bla заменяли геном резистентности к тетрациклину. Этот искусственно созданный бицистронный вектор экспрессии разработали для экспрессии фрагмента C4 (9) человеческого Fab в периплазматическом пространстве Escherichia coli. Так как фрагмент Fab является маленьким и раcтворимым белком, он диффундирует из периплазматического пространства E.coli в супернатант культуры, где его забирают и легко очищают.
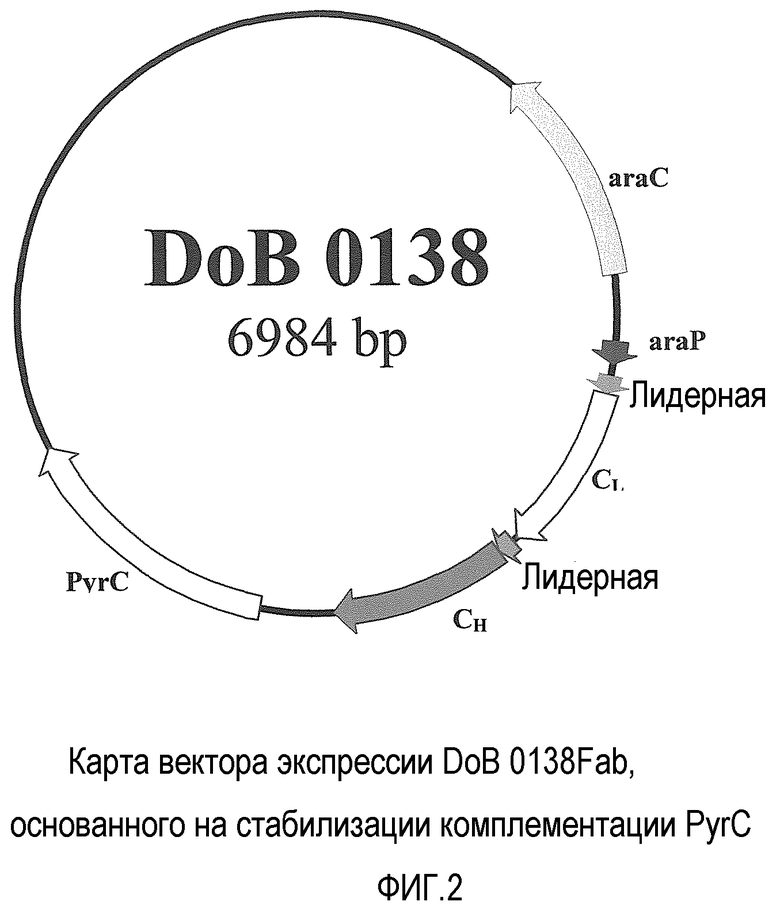
DoB 0138 (фиг. 2) получали из DoB 0114 путем замены гена резистентности к антибиотику на pyrC. Векторы экспрессии DoB 0114 и DoB 0138 соответственно преобразовывали в штамм W3110 ara (10) и штамм BW 25113ΔpyrC. После преобразования, чтобы выбрать одну cfu, содержащую вектор экспрессии для засевания культуры, W3110::DoB 0114 высевали на LB-агар/тетрациклин, тогда как BW 25113ΔpyrC::DoB 0138 высевали на минимальную среду M9 с глюкозой в качестве источника углерода. Одиночную cfu использовали для засевания 10 мл встряхиваемой колбы для культуры в минимальной среде, с добавлением сахара в качестве источника углерода (и тетрациклина для DoB 0114). После 15 часов при 30°C 10 мл использовали для засевания 90 мл того же самого бульона и инкубировали в течение 13 часов при 37°C. 100 мл встряхиваемую колбу для культуры использовали для засевания 1-литрового ферментора. Когда OD600 достигал 10-12, определяли процент клеток, содержащих плазмиды, и инициировали продуцирование рекомбинантного белка с помощью добавления 5 г арабинозы (T0). После 16 часов индуцирования, когда OD600 достигает 30 (T16), ферментацию останавливали и определяли количество рекомбинантных фрагментов Fab и белков в супернатанте культуры (Таблица IV).
Определение процента преобразованных клеток и связанный с ним выход рекомбинантного белка
Концентрацию Fab определяли с помощью RP-HPLC, тогда как полную концентрацию белка оценивали методом Брэдфорда.
*Тетрациклин добавляли только к культуре посевного материала и не добавляли во время ферментации.
Результаты этого эксперимента демонстрируют, что даже если в момент индуцирования число преобразованных клеток эквивалентно для обоих векторов, в конце культивирования полный промышленный выход DoB 0138 удивительно составляет более чем в три раза больше, чем у DoB 0114, тогда как общая концентрации белка, присутствующего в супернатанте культуры, остается почти неизменной. Эти результаты можно объяснить более высокой стабильностью плазмиды для DoB 0138, чем для DoB 0114 во время фазы индуцирования культуры. Процент преобразованных клеток определяли как предварительно описано: клетки сначала высевали на LB-агар и затем перемещали на селективные среды (LB-агар + тетрациклин для DoB 0114 или M9 глюкоза для DoB 0138). Если эти способы действительно работают превосходно перед индуцированием, высокая метаболическая нагрузка индуцированного микроорганизма замедляет его рост таким резким образом, что становилось почти невозможно наблюдать какое-либо колониеобразование на чашках Петри. Эту гипотезу подтвердили путем высевания неиндуцированной cfu из чашки Петри с LB на чашку Петри с M9 и M9/арабинозой. Любой рост, наблюдаемый на минимальной среде M9, не может возникать на M9/арабинозе. Этот чрезвычайно медленный рост, приписываемый повышенным метаболическим нагрузкам индуцированного микроорганизма, не позволяет изолировать отдельные клетки с целью определения процента поддержки вектора во время фазы индуцирования.
Пример 4
Продемонстрировав, что система стабилизации с помощью генной комплементации дает лучшие результаты, чем классическая система, ферментацию выполняли в масштабе десяти литров, включая на этот раз систему дозированной подпитки для исследования универсальности способа. Концентрацию субстрата поднимали до 60 г/л, и в ферментор (начиная с 7,2 литров) засевали 800 мл пре-культуры. После периода единовременной заправки длительностью приблизительно 17 часов, подпитку начинали с раствора сахара в качестве источника углерода и арабинозы в качестве индуктора. Контроль дозированной подпитки осуществляли путем определения растворенного кислорода (DO), и когда его значение превышало 50%, включался питающий насос. После 20 часов подпитки OD600 культуры достигал 150-160 и супернатант, содержащий Fab, собирали (Таблица V).
Определение процента клеток, содержащих плазмиды и связанный с ним выход рекомбинантного белка после ферментации с дозированной подпиткой
Эти результаты демонстрируют универсальность способа и то, что даже после большего числа поколений стабильность вектора экспрессии все еще соответствовала ожиданиям. На этот раз благодаря системе дозированной подпитки полный выход Fab составлял в десять раз больше однолитровой партии культуры, а система комплементации PyrC все еще продуцирует удвоенное количество "классического" вектора DoB 0114.
Пример 5
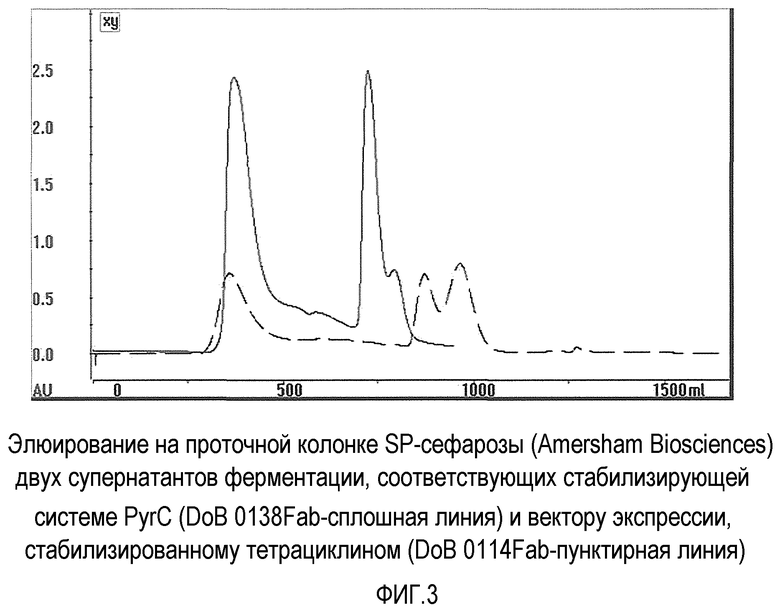
Для демонстрации того, что наблюдаемые различия в выходе продукции Fab являются независимыми от штамма (то есть W3110 против BW25113), был спланирован окончательный эксперимент, в котором два вектора экспрессии преобразовывали в BW25113. Протокол ферментации немного изменили, и фазу индуцирования продлили еще на 6 дополнительных часов.
В конце ферментации супернатант подкисляли до pH 6 и пропускали через проточную колонку SP-сефарозы (Amersham Biosciences). Вследствие того, что Fab повышает изоэлектрическую точку, в тех условиях и при этом pH, Fab является почти единственным белком для удержания на смоле и элюирования в первом пике, где представлено более 80% белков. После адсорбции и промывания смолы элюировали и фракцию, соответствующую собранному Fab. Результат эксперимента представлен на фиг.3. Объем производства Fab оценивали как приблизительно 100 мг на литр для системы PyrC (DoB 0138 - сплошная линия), и выход менее 50% получили для стабилизированного вектора экспрессии TET (DoB 0114 - пунктирная линия).
Во время ферментации мы наблюдали более быстрый рост для DoB 0114, которые перерабатывают два литра раствора подпитки после 22 часов индуцирования, тогда как в то же самое время DoB 0138 потреблял только 1,35 литра. Этот показатель быстрого роста действительно правильно коррелирует с более низким метаболическим выходом микроорганизма, относительно низким продуцированием рекомбинантного белка и с высоким продуцированием белков клетки-хозяина. Фактически Fab DoB 0114 представляет намного более низкий процент от белков, присутствующих в супернатанте по сравнению с DoB 0138. Во втором случае, имеющем более высокий общий выход рекомбинантного белка, предоставляется легче очищаемый материал, поскольку рекомбинантный белок, который можно оценить как 10% растворимого белка, является уже на 10% "чистым".
Так как единственным различием между двумя системами является давление отбора, которое является непрерывным в случае pyrC, мы установили протокол ПЦР для проверки присутствия вектора экспрессии во время ферментации. Пару праймеров, соответствующих углеродному окончанию тяжелой цепи Fab, использовали для амплификации с помощью ПЦР вектора экспрессии непосредственно из культурального бульона, соответствующе нормализованного до 0,1 OD600nm для компенсации размножения клеток (и следовательно, темплата). Как представлено на фиг.4, сигнал, соответствующий DoB 0138, стабилен в течение времени ферментации, тогда как для DoB 0114 он уменьшается до слабой незаметной полосы после 26 часов индуцирования.
Материал и Методы
Среда
Компоненты минерально-солевой среды вместе с водой автоклавировали при 121°C в течение 20 мин in situ. Исходный сахар стерилизовали отдельно с помощью фильтрации 0,22 мкм и добавляли в биореактор, устанавливая концентрацию 40,0 г/л для создания маленькой фазы единовременной заправки перед началом фазы подпитки. Десять миллилитров раствора микроэлементов и витаминов добавляли с помощью стерилизующего фильтрования в уже стерильный биореактор. Состав раствора микроэлементов (г на литр): C6H5Na3O7·2H2O, 100,0; I CaCl2·2H2O, 3,40; ZnSO4·7H2O, 2,40; MnSO4·2H2O, 1,50; CuSO4·5H2O, 0,50; CoCl2·6H2O; FeCl3·6H2O, 9,70; H3BO3, 0,03; Na2MoO4·2H2O, 0,02; KCl, 74,5. Подпитка содержала 70% раствор сахара. Состав раствора для индуцирования подпитки: сахар 70%; витамины и арабиноза. При необходимости контроля пенообразования добавляли Antifoam 204.
Культивирование
Первичную засевную культуру готовили путем выращивания клеток в 100 мл встряхиваемой колбе, содержащей 25 мл среды биореактора за исключением концентрации сахара 5,0 г/л. Эту культуру выращивали при 37°C и 245 оборотах в минуту в течение 15 ч. Шестнадцать мл первичной засевной культуры использовали в качестве посевного материала для двух 2-литровых baffled-колб, содержащих 400 мл той же самой среды, и выращивали в тех же самых условиях. Вторичную засевную культуру перемещали в биореактор CF 3000 (Chemap) 15-1 с рабочим объемом 10 л. Ферментор оборудовали воздушным разбрызгивателем, и поток воздуха первоначально устанавливали на уровне 8 л/мин и пошагово повышали до 10 л/мин после начала подпитки. Скорость мешалки увеличивали от 800 до 1200 оборотов в минуту во время периода единовременной заправки и уменьшали до 1000 оборотов в минуту во время периода порционной подпитки. Полярографический кислородный электрод использовали для регистрации растворенного кислорода (DO). Ферментор оборудовали титрованием pH для поддержания pH 6,95 путем добавления 30% (вес/вес) нашатырного спирта. Температуру поддерживали на уровне 37°C. Подпитку начинали, когда DO увеличивался после исчерпывания исходно добавленного сахара. Во время первой фазы порционной подпитки 230 мл питательного раствора сахара добавляли при использовании контроля DO-STAT с заданной величиной концентрации кислорода, установленной на уровне 50% насыщенности. Фазу экспрессии белка начинали путем перемещения к питательному раствору, содержащему арабинозу в качестве индуктора, поддерживая ту же самую стратегию DO-STAT в течение 30 ч.
Отбор образцов
Отбор образцов выполняли каждый час в течение всего культивирования.
Анализы
Измерение концентрации белка: концентрацию белка определяли с помощью белкового спектра Bio-Rad. Испытание выполняли в 96-луночных микропланшетах. Увеличиваемые количества (от 0,25 до 8 мкг на лунку) BSA включали для создания калибровочной кривой концентрации эталонного белка. В каждой лунке 50 мкл красильной жидкости смешивали с 150 мкл образца, затем считывали A595 на Model 450 Microplate Reader (Bio-Rad).
Экспрессия рекомбинантного белка (гель-электрофорез и вестерн-блоттинг)
Образцы подвергали воздействию невосстановленного 15% SDS-PAGE согласно Laemmeli (21), с незначительной модификацией, в аппарате Mini-Protean II (Bio-Rad). В некоторых экспериментах гели применяли при восстановительных условиях. Широкие стандарты молекулярной массы (Bio-Rad) использовали для определения средней молекулярной массы электрофоретических полос. Минигели толщиной 1,0 мм подвергали воздействию электрического тока 50 мА в течение 1 ч, прокрашивая с вечера 0,02% раствором Phast Gel Blue R (Pharmacia) в 40% CH3OH, 10% CH3COOH и обесцвечивая в 20% CH3OH, 5% CH3COOH.
Вестерн-блоттинг выполняли согласно Towbin et al. (22), с незначительной модификацией. Образцы, обработанные 15% SDS-PAGE, перемещали на 0,45 мкм нитроцеллюлозную мембрану при 1 мА/см в течение 90 минут в multiphor II semidry apparatus (Pharmacia). Мембраны прокрашивали раствором Ponceau-S (Sigma, USA). Отмечали соответствующие стандарты молекулярной массы и достигали полного обесцвечивания с помощью ополаскивания в 20 ммоль Трис-HCl, pH 7,40, 150 ммоль NaCl (TBS). Мембраны пропитывали с вечера 2% раствором BSA в TBS (BT), затем инкубировали в течение 1 ч с 1:2000 раствором Peroxidase-Conjugated Rabbit Anti-Human lambda Light Chains (DAKO) в BT, содержащем 0,05% твин 20 (BTT). Впоследствии мембрану промывали один раз в течение 10 минут в BTT, один раз с 0,25% твином 20 в TBS, и несколько раз в TBS. Все инкубации выполняли на качающейся платформе при комнатной температуре. Активность пероксидазы выявляли с помощью SuperSignal West Fico Chemiluminescent Substrate (PIERCE).
HPLC-анализ
Определение количества растворимого Fab в бульоне ферментации выполняли после стадии отстаивания, проведенной путем центрифугирования при 17000×g в течение 15 мин, с помощью HPLC, оборудованной Дифенилом 219TP54, 250×4,6 мм ID, 300Е колонкой VYDAC и флуоресцентным детектором (ex λ=285 нм; em λ=360 нм; коэффициент усиления 1000). Кроме того, те же самые определенные количества супернатанта анализировали на сахар, ацетат и арабинозу с помощью HPLC, оборудованной PL Hi-Plex H 8 мкм, 300×7,7 мм, 8 мкм или эквивалентной колонкой и детектором коэффициента преломления.
Молекулярная биология
Создание штамма BW25113 Escherichia coli, ΔpyrC
pyrC мутант реализовали согласно Datsenko and Wanner, которые допускают определенные делеции в хромосоме Escherichia coli. Выбрали BW25113 (lacIq, rrnBT14, ΔlacZWJ16, hsdR514, ΔaraBA-DAH33, ΔrhaBADLD78). Весь ген с его собственным промотором удалили, чтобы избежать гомологичной рекомбинации с копией плазмиды. Праймеры, используемые для удаления этого гена
dispyrC-f: SEQ ID NO:1: 5'-AATTGTCATT CCATTTACTG ATTAATCACG AGGGCGCATT GTGTAGGCTG GAGCTGCTTC-3' и
dispyrC-r: SEQ ID NO:2: 5'-ACAGGTAAAA TAACCTAATG ACAACAGGAA GCTACGATTT ATTCCGGGGA TCCGTCGACC-3'.
Ген резистентности к канамицину не удаляли из хромосомы штамма, чтобы он служил в качестве потенциальной положительной селекции непосредственно для штамма.
PUC18-pyrC:
Ген pyrC восстанавливали с помощью ПЦР от хромосомы Escherichia coli с использованием следующих праймеров:
pyrC-fwd: SEQ ID NO:3: 5'-ATATACCATG GCGCGCCCTT TATTTTTCGT GC-3';
pyrC-rev: SEQ ID NO:4: 5'-GTT AACCA TG GTT А TTGTTT AACGGACCAG CGT AC-3' и клонировали в участок SmaI pUC18 и получающийся вектор назвали pUC-pyrC.
Создание DoB 0114:
Вектор DoB 0114 получали из вектора pBAD/Myc-His A,B,C (Invitrogen) путем замены гена ампициллина геном тетрациклина из PBR322. Полигенный экспрессирующий кластер C4 объединяли со следующим олионуклеотидами и вектором экспрессии pHEN1 (9) в качестве темплата: "P1 C4" SEQ ID NO:5: 5'-AAA AAA AAC ATC GCA TTC CTG CTG GCA TCT ATG TTC GTT TTC TCT ATC GCA ACC AAC GCA TAC GCA CAG TCT GCC CTG ACT CAG CCT-3';
"P2 C4" SEQ ID NO:6: 5'- GGT TAA TTT CTC CTT CTA TGA ACA TTC TGT AGG GG-3';
"P3 C4" SEQ ID NO:7: 5'- TCA TAG AAG GAG AAA TTA ACC ATG AAA AAA AAC ATC GCT TTC CTG CTG GCT TCC ATG TTC GTT TTC TCC A TC GCT ACC AAC GCT T AC GCT CAG GTG CAG CTG GTG GAG TCT-3';
"P4 C4" SEQ ID NO:8: 5'- TCA GGA GGT TTT GTC GCA GGA TTT GGG CTC AAC T-3';
"P5 C4" SEQ ID NO:9: 5'- AAA AAA AAC ATC GCA TTC CTG CTG GCA-3',
"P6 C4" SEQ ID NO:10: 5'- CCC GCT CGA GTC AGG AGG TTT TGT CGC AGG A-3'.
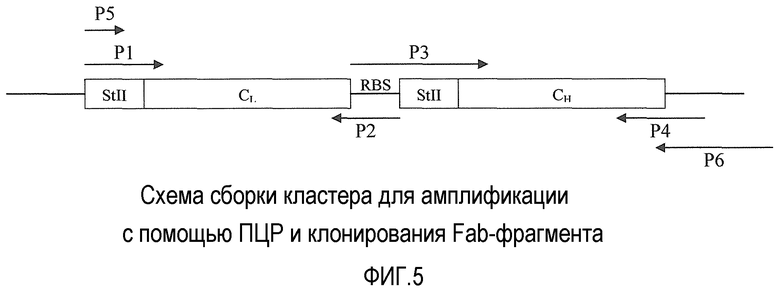
Праймеры P1 и P2 использовали в первой ПЦР для амплификации легкой цепи Fab и добавления внутрь рамки считывания лидерной последовательности StII. Вторую ПЦР выполняли, чтобы отдельно амплифицировать тяжелую цепь Fab и добавить лидерную последовательность StII и межгенную последовательность. Так как эти две последовательности накладываются (см. мультфильм), продукты ПЦР, получившиеся в первых двух амплификациях смешивали вместе в третьей реакции элонгации, в течение десяти циклов, где никакие праймеры не добавляли. После стадии элонгации праймеры P5 и P6 добавляли к ПЦР, и полигенный экспрессирующий кластер полный длины амплифицировали как представлено на фиг.5.
Заключительный продукт ПЦР подвергали воздействию рестриктазы Xhol и клонировали в вектор pBAD, открытый с Ncol (klenow) Xhol. Cfu отбирали с помощью ПЦР и положительные клоны упорядочивали для всего полигенного экспрессирующего кластера Fab. Клон, представляющий ожидаемую последовательность, называли DoB 0114 (фиг.1).
Создание DoB 0138:
Этот вектор экспрессии получали путем замены фрагмента ДНК Hindlll-NruI DoB 0114, кодирующего резистентность к тетрациклину, геном pyrC, полученным путем обработки плазмиды pUC-pyrC с помощью EcoRl/klenow-Hindlll (фиг.2).
Обнаружение вектора экспрессии с помощью ПЦР
Для обнаружения/амплификации вектора экспрессии выполняли ПЦР на образце культурального бульона, разведенного до 0,1 OD600nm для нормализации числа клеток. Циклы ПЦР устанавливали как представлено в следующей таблице.
Праймеры:
247 CH sense PCN 5' SEQ ID NO:11: - GGAGTGGGTCTCATCCATT-3' Tm=61,4
248 CH AS PCN5' SEQ ID NO:12: - GACCTTGGTGTTGCTGGG-3' Tm=64,3
Продукт ПЦР составляет приблизительно 500 bp для тяжелой цепи Fab.
Система экспрессии настоящего изобретения позволяет осуществлять быструю селекцию клеток, содержащих плазмиды во время фаз клонирования, и приводит к высокой экспрессии белка во время ферментации. Эта система имеет сильную селективную эффективность, особенно во время фазы индуцирования, приводя к селекции почти гомогенной популяции клеток, содержащих плазмиды. Кроме того, производительность культуры является в высокой степени лучшей, чем основанная на резистентности к антибиотикам. Эта повышенная стабильность вектора, объединенная с его высокой производительностью, выполняет требования для продуцирования гетерологичного белка в Escherichia coli на промышленном уровне. Дополнительно продемонстрировано, что разработанный штамм является лучшим штаммом для продуцирования Fab, чем классический W3110, и что его pyrC-производная подходит для ферментации с порционной подпиткой с высокой плотностью клеток и поэтому доступна для промышленной эксплуатации.
SEQ ID NO:13: Последовательность гена PyrC, включенного в клонирующий вектор pUC18


Список литературы
1. B. Hoffman; J. A. Broadwater; P. Johnson; J. Harper; B. G. Fox and W. R. Kenealy. Proto Exp. Punf. 6, 646-654 (1995). Lactose fed-btach overexpression of recombinant metalloproteins in Escherichia coli BL21(DE3): process control yielding high levels of metal-incorporated, soluble protein.
2. Murphy, D.B. and Epstein, S.L. (1998) Guidance for Industry. Guidance for Human Somatic Cell Therapy and Gene Therapy. Food and Drug Administration, Rockville, MD.
3. Gerdes K, Helin K, Christensen OW, Lobner-Olesen A. J Mol Biol 1988 Sep 5;203(1): 119-29. Translational control and differential RNA decay are key elements regulating postsegregational expression of the killer protein encoded by the parB locus of plasmid R1.
4. Pecota DC, Osapay G, Selsted ME, Wood TK. J Biotechnol 2003 Jan 9;100(1):1-12. Antimicrobial properties of the Escherichia coli R1 plasmid host killing peptide.
5. Bullock, W.O., J. M. Fernandez, and J. M. Short. 1987. XII-Blue, a high efficiency plasmid transforming recA Escherichia coli strain with beta galactosidase selection. Focus 5:376-378.
6. Yanisch-Perron C; Vieira J and Messing J. Gene. 1985;33(1):103-19. Improved M13 phage cloning vectors and host strains: nucleotide sequences of the M13mp18 and pUC19 vectors.
7. Backstrom D, Sjoberg RM, Lundberg LG. Eur J Biochem 1986 Oct 1;160(1):77-82 Nucleotide sequence of the structural gene for dihydroorotase of Escherichia coli K12.
8. Datsenko KA, Wanner BL. Proc Natl Acad Sci USA. 2000 Jun 6;97(12):6640-5. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products.
9. Figini M, Obici L, Mezzanzanica D, Griffiths A, Colnaghi MI, Winter G, Canevari S. Cancer Res. 1998 Mar 1;58(5):991-6. Panning phage antibody libraries on cells: isolation of human Fab fragments against ovarian carcinoma using guided selection.
10. Duenas M, et al. Biotechniques 1994 Mar; 16(3):476-7,480-3. Intra- and extracellular expression of an scFv antibody fragment in E. coli: effect of bacterial strains and pathway engineering using GroES/L chaperonins.
11. Gallagher CN, Huber RE. J Protein Chern 1998 Feb; 17(2): 131-41 Studies of the M15 beta-galactosidase complementation process.
12. Langley KE, Zabin I. Biochemistry 1976 Nov 2;15(22):4866-75: beta-Galactosidase alpha complementation: properties of the complemented enzyme and mechanism of the complementation reaction.
13. Wilson HR, Archer CD, Liu JK, Turnbough CL Jr. J Bacteriol l992 Jan;174(2):514-24; Translational control of pyrC expression mediated by nucleotide-sensitive selection of transcriptional start sites in Escherichia coli.
14. Sato T, Ohki M, Yura T, Ito K. J Bacteriol 1979 May; 138(2):305-13; Genetic studies of an Escherichia coli K-12 temperature-sensitive mutant defective in membrane protein synthesis.
15. Larsen IN, Jensen KF. Eur J Biochem 1985 Aug 15;151(1):59-65; Nucleotide sequence of the pyrD gene of Escherichia coli and characterization of the flavoprotein dihydroorotate dehydrogenase.
16. Fiedler M, Skerra A. Gene. 2001 Aug 22;274(1-2): 111-8; proBA complementation of an auxotrophic E. coli strain improves plasmid stability and expression yield during fermenter production of a recombinant antibody fragment.
17. Degryse E. J Biotechnol. 1991 Apr; 18(1-2):29-39. "Stability of a host-vector system based on complementation of an essential gene in Escherichia coli."
18. Summers DK, Sherratt DJ. Cell. 1984 Apr;36(4): 1097-103. Multimerization of high copy number plasmids causes instability: ColE 1 encodes a determinant essential for plasmid monomerization and stability.
19. Porter RD, Black S. J Bacteriol. 1991 Apr;173(8):2720-3. The single-stranded-DNA-binding protein encoded by the Escherichia coli F factor can complement a deletion of the chromosomal ssb gene.
20. Rocky M. Cranenburgh, Julian A. J. Hanak, Steven G. Williams and David J. Sherratt; Nucleic Acids Research, 2001, Vol. 29, No.5 e26; 2001 Escherichia coli strains that allow antibiotic-free plasmid selection and maintenance by repressor titration.
21. Laemmli, U.K. (1970) Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 277,680-685.
22. Towbin, R., Staehelin, T. and Gordon, J. (1979) Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets. Proc. Natl. Acad. Sci. USA 76,4350-4354.




Изобретение относится к биотехнологии и представляет собой способ продуцирования рекомбинантного антитела или его фрагмента, включающий трансформирование клетки E.coli, у которой отсутствует ген, кодирующий pyrC, или его гомолог, вектором, включающим ген, кодирующий указанные рекомбинантное антитело или его фрагмент, и ген pyrC E.coli дикого типа, выращивание указанной клетки E.coli в условиях ограничения пиримидина и выделение указанного антитела или его фрагмента. Изобретение позволяет получать рекомбинантные антитела с высокой степенью эффективности. 5 н. и 5 з.п. ф-лы, 5 ил., 5 табл.
1. Способ продуцирования рекомбинантного антитела или его фрагмента, включающий:
(a) трансформирование клетки Е.coli, у которой отсутствует ген, кодирующий pyrC или его гомолог, вектором, включающим ген, кодирующий указанные рекомбинантное антитело или его фрагмент, и ген pyrC E.coli дикого типа,
(b) выращивание указанной клетки E.coli в условиях ограничения пиримидина и
(c) выделение указанного антитела или его фрагмента.
2. Способ по п.1, в котором указанные рекомбинантное антитело или его фрагмент являются человеческими.
3. Способ по п.2, в котором указанный фрагмент антитела является Fab-фрагментом.
4. Клетка E.coli для продуцирования рекомбинантного антитела или его фрагмента, где у указанной клетки E.coli отсутствует ген, кодирующий pyrC или его гомолог, и ее трансформируют вектором, включающим ген, кодирующий указанные рекомбинантное антитело или его фрагмент, и ген pyrC E.coli дикого типа.
5. Клетка E.coli по п.4, которая является BW25113ΔpyrC.
6. Клетка E.coli по п.5, имеющая численное обозначение CNCM 1-3447.
7. Экспрессионный вектор pUC18-pyrC, включающий ген, кодирующий рекомбинантное антитело или его фрагмент.
8. Вектор по п.7, который является DoB 0138 или DoB 0126.
9. Применение вектора по п.7 или 8 в способе продуцирования рекомбинантного антитела или его фрагмента.
10. Набор для экспрессии рекомбинантного антитела или его фрагмента, включающий:
(a) клетку Е.coli, как она определена в любом из пп.4-6; и
(b) вектор, как он определен в п.7 или 8.
| SCHNEIDER JC et | |||
| al | |||
| Auxotrophic markers pyrF and proC can replace antibiotic markers on protein production plasmids in high-cell-density Pseudomonas fluorescens fermentation | |||
| Biotechnol Prog | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| СПОСОБ ПОЛУЧЕНИЯ ВАЗЕЛИНА | 1981 |
|
SU972838A1 |
| АНТИТЕЛО ПРОТИВ БЕЛКА, РОДСТВЕННОГО ПАРАЩИТОВИДНОМУ ГОРМОНУ ЧЕЛОВЕКА, ДНК, ВЕКТОР, СПОСОБ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЕ АНТИТЕЛА | 1997 |
|
RU2198220C2 |
Авторы
Даты
2011-04-10—Публикация
2006-10-04—Подача