ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому применению антитела, специфично связывающегося с N-концом лизил-тРНК синтетазы, и более конкретно к фармацевтической композиции, содержащей антитело, специфично связывающееся с эпитопом, содержащим последовательность SEQ ID NO: 117 на N-конце лизил-тРНК синтетазы (KRS), или его функциональный фрагмент в качестве эффективного ингредиента для предупреждения или лечения заболевания, связанного с миграцией иммунных клеток.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Данная заявка испрашивает приоритет от патентной заявки Кореи №10-2017-0118917, поданной 15 сентября 2017 г., содержание которой полностью включено в настоящий документ посредством ссылки.
Во многих тканях организма каждая клетка мигрирует различными путями в зависимости от ее генетических характеристик и окружения. Неконтролируемая миграция клеток включает различные болезненные состояния, такие как воспалительное заболевание и метастазы рака, но характеристики передачи сигналов и механизмов миграции каждой клетки не полностью охарактеризованы. В частности, согласно опубликованным данным каждая клетка характеризуется своим путем взаимодействия с некоторыми факторами, что дополнительно повышает сложность идентификации процессов и механизмов передачи сигналов. Например, известно, что водный канал аквапорин-1 (AQP1) стимулирует клеточную миграцию в эпителиальных клетках и т.п. и, в частности, стимулирует метастазирование злокачественных новообразований (Нага-Chikuma М et al., Aquaporin-1 facilitates epithelial cell migration in kidney proximal tubule, J Am Soc Nephrol. 2006 Jan; 17(1):39-45; Jiang Y, Aquaporin-1 activity of plasma membrane affects HT20 colon cancer cell migration, IUBMB Life. 2009 Oct; 61(10): 1001-9), но согласно опубликованным данным аквапорин-1 ингибирует миграцию макрофагов несмотря на то, макрофаги экспрессируют AQP1 (Tyteca D et al., Regulation of Macrophage Motility by the Water Channel Aquaporin-1: Crucial Role of M0/M2 Phenotype Switch, PLoS One. 2015 Feb 26; 10(2):e0117398). Показано, что лекарственные средства, предназначенные для предотвращения миграции конкретных клеток, достаточно ограничены и обладают недостаточной эффективностью, поскольку данные разные типы клеток имеют различные пути и характеристики в своей миграции. Таким образом, существует потребность в новой стратегии контроля переключения миграции клеток и лечения заболеваний, обусловленных миграцией клеток.
С другой стороны, хотя иммунные клетки также составляют первую защитную систему организма, избыточная активация иммунных клеток недавно описана как один из основных видов патогенеза. Как правило, увеличение подвижности иммунных клеток наблюдается при активации воспалительных иммунных клеток. В частности, описано, что такая миграция и инвазия иммунных клеток тесно связана с патологией болезни при описанных ниже заболеваниях.
Сердечно-сосудистые заболевания, например, представляют собой заболевания сердца и главных артерий, включая атеросклероз и болезнь коронарных артерий (Ross R et al., New Engl J Med, 1999: 340 (2): 115-26, Poli G et al., Redox Biol 2013; 1 (1): 125-30, Libby P et al., Circulation 2002; 5; 105 (9): 1135-43). Атеросклероз представляет собой воспалительное заболевание, связанное с холестерином и вызванное бляшками, состоящими из отложений холестерина на внутренней мембране артерий и иммунных клеток, которые мигрируют из крови в артерии. Иными словами, бляшки образуются за счет миграции иммунных клеток, таких как моноциты, к месту вызванного оксидом холестерина воспаления. При образовании бляшек внутренняя поверхность кровеносного сосуда становится жесткой, а стенка утолщается, и внутренний диаметр кровеносного сосуда сужается, что создает проблему для кровообращения. При разрыве фиброзной покрышки вокруг бляшки в кровеносных сосудах образуются сгустки крови, и кровотечение в атеромах вызывает резкое сужение внутреннего диаметра или закупорку сосуда. Это происходит главным образом в кровеносных сосудах, снабжающих кровью сердце, в кровеносных сосудах, снабжающих кровью головной мозг, в кровеносных сосудах и периферических кровеносных сосудах, снабжающих кровью почки, вызывая ишемическую болезнь сердца, ишемическое цереброваскулярное заболевание (инсульт), почечную недостаточность и ишемическую болезнь артерий конечностей. Общеизвестно, что в возникновении и развитии таких сердечно-сосудистых заболеваний важную роль играет CCL2 (лиганд 2 СС-хемокина, МСР-1), который вызывает воспалительные реакции за счет индукции миграции моноцитов. Предложен новый способ лечения таких сердечнососудистых заболеваний посредством ингибирования действия CCL2 и, следовательно, миграции моноцитов (Gu L et al., Mol Cell, 1998; 2(2):275-81; Aiello RJ et al., Arterioscler Thromb Vase Biol 1999; 19(6): 1518-25; Gosling Jl et al., Clin Invest 1999; 103(6):773-8; Harrington JR et al., Stem Cells 2000;18(l):65-6; IkedaU et al., Clin Cardiol 2002; 25(4): 143-7).
В дополнение к этому даже при высоком артериальном давлении различные иммунные клетки, секретирующие воспалительные цитокины, интенсивно перемещаются в кровеносные сосуды, что приводит к патологиям, при которых стенки кровеносных сосудов становятся толстыми, а эластичность кровеносных сосудов утрачивается.
Легочную артериальную гипертензию (ЛАГ) в клинической системе классификации Всемирной организации здравоохранения (ВОЗ) относят к группе 1 (ESC Guidelines, European Heart Journal 2015); она представляет собой редкое заболевание, клинически характеризующимся затруднением дыхания, повышением среднего давления крови в легочной артерии (ДЛАср) ДЛАср более 25 мм рт.ст.) и дисфункцией правого желудочка. Хотя в легочной гипертензии задействовано множество предсуществующих факторов, таких как наследственность, инфекция и сопутствующие заболевания, известно, что ключевым патологическим фактором является иммунный ответ на повреждение эндотелиальных клеток (Huertas et al., Circulation, 129:1332-1340, 2014). Известно, что патологический механизм при этом явлении глубоко связан с рядом процессов, вызванных инвазией и нарушением функции иммунных клеток. В частности, при ЛАГ имеют значение взаимодействия иммунных и эндотелиальных клеток кровеносных сосудов. В дополнение к этому недавно описано, что инвазия моноцитов и макрофагов стимулирует прогрессирование заболевания при синдроме Альпорта.
С другой стороны, при фиброзных заболеваниях устойчивый (хронический) воспалительный ответ активирует программу заживления раны, приводящую к фиброзу. После повреждения ткани воспалительные иммунные клетки, такие как моноциты, макрофаги, нейтрофилы, эозинофилы и тучные клетки, быстро проникают в участок повреждения и активируют несколько цитокинов, которые заново активируют окружающие фибробласта, эпителиальные клетки и гладкие мышцы, при этом они активируются до клеток типа миобластов. Данные клетки типа миобластов вырабатывают и секретируют большое количество белков внеклеточного матрикса, что, в конечном счете, приводит к накоплению больших количеств выходящих из раны белков внеклеточного матрикса в ткани и к индукции фиброза, или разрастания ткани (Gurtner GC et al., Trends Cell Biol. 15: 599-607, 2005). Данный патологический механизм является одной из фундаментальных причин образования рубца в кожной ткани, вызванного ранами, ожогами и пролежнями, или склерогенного фиброза тканей, таких как печень, почки, кровеносные сосуды и легкие. Фиброз также является основным патологическим признаком при хронических аутоиммунных заболеваниях, таких как склеродерма, ревматоидный артрит, болезнь Крона, язвенный колит, миелофиброз и системная красная волчанка. В дополнение к этому известно, что активация воспалительных иммунных клеток вносит вклад в патологию атопических заболеваний, бронхиальной астмы, хронической обструктивной болезни легких (ХОБЛ), псориаза, келоида и пролиферативной ретинопатии.
В частности, фибробласты, активированные клетками типа миобластов в программе заживления раны, называют миофибробластами. Поскольку миофибробласт находится в центре всех фиброзных патологических состояний, устранение молекулярно-биологических или иммунологических механизмов, которые индуцируют активность миофибробластов, является ключевым компонентов лечения заболевания. Хорошо известно, что для активности и дифференцировки фибробластов важны многие врожденные или адаптивные иммунные ответы. Таким образом, устранение воспалительного ответа в ране является ключевым фактором, чтобы остановить ремоделирование ткани фиброзом и сохранить нормальную морфологию ткани. Однако, на практике устранить воспалительный ответ нелегко, поэтому, чтобы замедлить развитие фиброза, важно понимать механизмы врожденного или адаптивного иммунитета, позволяющие найти их ключевые медиаторы.
Моноциты, макрофаги и т.п. вносят вклад в заживление раны, но они высвобождают активные формы кислорода и азота, что может оказывать вредное влияние на окружающие клетки. Поэтому недостаточно быстрое удаление моноцитов и макрофагов вызовет большее повреждение ткани и приведет к фиброзу. Таким образом, в качестве терапевтической стратегии при различных хронических воспалительных и фиброзных заболеваниях рассматривают ограничение моноцитов и макрофагов, которые первыми отвечают на заболевание на ранних стадиях.
При запуске фиброзных реакции посредством механизма заживления раны тромбоцитарный фактор роста (PDGF), вовлеченный в гемагглютинацию, привлекает в рану другие воспалительные иммунные клетки, и известно, что TGF-β1 стимулирует синтез внеклеточного матрикса местными фибробластами. Тем не менее сообщали, что факторы, связанные с реакцией гемагглютинации, индуцируют фиброз даже при их недостаточном количестве.
Как упомянуто выше, выдвинуто предположение о целевых факторах, предотвращающих миграцию (и инвазию) предшественников иммунных клеток при заболеваниях, при которых проблема состоит в избыточной активации иммунных клеток. Предприняты попытки разработать терапевтические способы для этого заболевания, но описаны их ограничения. Соответственно, сохраняется потребность в том, чтобы найти ключевые медиаторы и стратегии контроля миграции иммунных клеток для эффективного лечения заболевания.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
Таким образом, в то время как авторы настоящего изобретения проводили поиск новой терапевтической стратегии для заболеваний, связанных с миграцией (инвазией) иммунных клеток, было подтверждено, что повышение концентрации KRS в области клеточной мембраны иммунных клеток (моноцитов/макрофагов) является важным патологическим явлением для заболеваний, обусловленных миграцией и инвазией иммунных клеток. Авторы выполнили настоящее изобретение после подтверждения, что антитело, связывающее N-конец KRS, предложенное в настоящем изобретении, уменьшает повышенную концентрацию KRS в области клеточной мембраны иммунных клеток и обладает эффектом для лечения соответствующих заболеваний посредством фактического ингибирования миграции и инвазии иммунных клеток.
Соответственно, один аспект настоящего изобретения состоит в применении антитела или его функциональных фрагментов, которое специфично связывается с эпитопом, содержащим последовательность SEQ ID NO: 117 на N-конце лизил-тРНК синтетазы (KRS), для профилактики или лечения заболевания, связанного с миграцией иммунных клеток.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
Соответственно, один аспект настоящего изобретения предлагает фармацевтическую композицию, содержащую в качестве эффективного ингредиента антитело или его функциональный фрагмент, специфично связывающееся с эпитопом, содержащим последовательность SEQ ID NO: 117 на N-конце лизил-тРНК синтетазы (KRS), для профилактики или лечения заболевания, связанного с миграцией иммунных клеток.
Другой аспект настоящего изобретения состоит предлагает применение антитела или его функциональных фрагментов, которое специфично связывается с эпитопом, содержащим последовательность SEQ ID NO: 117 на N-конце лизил-тРНК синтетазы (KRS), для получения агента для профилактики или лечения заболевания, связанного с миграцией иммунных клеток.
Еще один другой аспект настоящего изобретения предлагает способ лечения заболеваний, связанных с миграцией иммунных клеток, у субъекта, включающий введение нуждающемуся в этом субъекту эффективного количества композиции, содержащей в качестве эффективного ингредиента антитело или его функциональный фрагмент, специфично связывающееся с эпитопом, содержащим последовательность SEQ ID NO: 117 на N-конце лизил-тРНК синтетазы (KRS).
Определение
Если не указано иное, все используемые в настоящем документе технические и научные термины имеют такое же значение, как обычно понимают средние специалисты в данной области техники. В приведенных ниже ссылках предложено одно из практических руководств, имеющих общее определение нескольких терминов, используемых в настоящем изобретении: Singleton et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY (2d ed. 1994); THE CAMBRIDGE DICTIONARY OF SCIENCE AND TECHNOLOGY (Walker ed., 1988); и Hale and Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY. Кроме того, представленные ниже определения предложены в помощь читателям в осуществлении настоящего изобретения.
Используемые в настоящем документе однобуквенные (трехбуквенные) обозначения аминокислот означают следующие аминокислоты в соответствии со стандартными условиями сокращения в области биохимии: A (Ala); С (Cys); D (Asp); Е (Glu); F (Phe); G (Gly); H (His); I (Ile); К (Lys); L (Leu); M (Met); N (Asn); О (Ply); P (Pro); Q (Gin); R (Arg); S (Ser); T (Thr); U (Sec); V (Val); W (Trp); Y (Tyr).
При использовании в настоящем документе «экспрессия» относится к продукции белков или нуклеиновых кислот в клетках.
В настоящем изобретении термин «клетка-хозяин» относится к прокариотической или эукариотической клетке, содержащей гетерологичную ДНК, введенную в клетку любыми способами (например, путем электрошока, кальций-фосфатной преципитации, микроинъекции, трансформации, вирусной инфекции и т.д.).
Используемый в настоящем документе термин «полипептид» используется взаимозаменяемо с терминами «белок» или «пептид» и относится, например, к полимеру из аминокислотных остатков, обычно обнаруживаемых в природных белках.
Используемые в настоящем документе «нуклеиновая кислота», «последовательность ДНК» или «полинуклеотид» относится к дезоксирибонуклеотидам или рибонуклеотидам в однонитевой или двунитевой форме. Термин «полинуклеотид» или «нуклеиновая кислота» в настоящем изобретении относится к дезоксирибонуклеотидам или рибонуклеотидам в однонитевой или двунитевой форме. При отсутствии других ограничений они также включают аналоги природных нуклеотидов, которые гибридизуются с нуклеиновыми кислотами аналогично природным нуклеотидам.
В настоящем изобретении термин «ламинин» представляет собой гетеротримерную молекулу, состоящую из α, β и γ цепей, и представляет собой белок внеклеточного матрикса, существующий в виде изоформ (субформ), имеющих различные составы цепей субъединиц. В частности, ламинин образует около 15 типов изоформ при комбинировании гетеротримеров из пяти видов α цепей, четырех видов β цепей и трех видов γ цепей. Названия ламинина определяют путем комбинирования соответствующих количеств α цепей (α1-α5), β цепей (β1-β4) и γ цепей (γ1-γ3). Например, ламинин, образованный путем комбинирования α1 цепи, β1 цепи и γ1 цепи, называют LN111, ламинин, образованный путем комбинирования α5 цепи, β1 цепи и γ1 цепи, называют LN511 и ламинин, образованный путем комбинирования α5 цепи, β2 цепи и γ1 цепи, называют LN521. В настоящем изобретении термин «ламинин» может относиться к одному компоненту одного подтипа ламинина или может означать смесь ламининов, в которой смешаны два или более подтипов ламинина.
В одном воплощении изобретения указанный «белок LN421» относится к полипептиду, известному как ламинин подтипа α4β2γ1. Если он известен в данной области техники как LN421, его конкретное происхождение и последовательность (конфигурация аминокислотной последовательности) конкретно не ограничены, но предпочтительно α4 цепь в LN421 может содержать аминокислотную последовательность, определенную как SEQ ID NO: 120, P2 цепь может содержать аминокислотную последовательность, определенную номером 122, a γ1 цепь может содержать аминокислотную последовательность, определенную как SEQ ID NO: 124. Более предпочтительно α4 цепь LN421 может состоять из аминокислотной последовательности, определенной SEQ ID NO: 120, Р2 цепь может состоять из аминокислотной последовательности, определенной SEQ ID NO: 122, и γ1 цепь может состоять из аминокислотной последовательности, определенной SEQ ID NO: 124, но не ограничены ими.
В дополнение к этому используемый в настоящем документе LN421 включает его функциональные эквиваленты. Его функциональные эквиваленты описаны ниже для функциональных эквивалентов KRS, в которых «по существу однородная физиологическая активность» относится к регулированию специфичной (селективной) миграции иммунных клеток, таких как моноциты, макрофаги и нейтрофилы
В настоящем изобретении «N-конец или N-концевой участок лизил-тРНК синтетазы (KRS)» относится к конкретной последовательности, которая экспонирована во внеклеточной области или на поверхности клеточной мембраны, когда продуцируемая в клетке KRS перемещается и локализуется на клеточной мембране (или плазматической мембране). В качестве конкретной последовательности он может означать полноразмерную или частичную последовательность участка из аминокислот 1-72 N-конца KRS. В более предпочтительном примере последовательность человека содержит последовательность, определенную SEQ ID NO: 148, последовательность мыши содержит последовательность, определенную SEQ ID NO: 149, а последовательность крысы содержит последовательность, определенную SEQ ID NO: 150. N-концевая область KRS имеет идентичность последовательности между различными биологическими видами, в частности, содержит аминокислотную последовательность, определенную SEQ ID NO: 117.
«Белок KRS» в настоящем изобретении относится к полипептидам, известным как лизил-тРНК-синтетазы. KRS представляет собой фермент, опосредующий реакцию аминоацилирования лизина, аминокислоты и тРНК. В настоящем изобретении KRS конкретно не ограничен определенной последовательностью, известной в данной области техники как лизил-тРНК синтетаза, и может предпочтительно содержать аминокислотную последовательность, определенную SEQ ID NO: 117 (в частности, в N-конце). Например, KRS по настоящему изобретению содержит: последовательность человеческого происхождения (Homo sapiens), известную под номером доступа NP_005539.1 в базе данных (Genbank) Национального центра биотехнологической информации (NCBI) и т.п.; последовательность мышиного происхождения (Mus musculus), известную под номером доступа NP_444322.1 NCBI (Genbank) и т.п.; и последовательность крысиного происхождения (Rattus norvegicus), известную под номером доступа ХР_006255692.1 NCBI (Genbank) и т.п.; кроме того, может быть сделана ссылка на приведенную ниже информацию о последовательностях, но без ограничений: ХР_005004655.1 (морская свинка: Cavia porcellus), ХР_021503253.1 (песчанка, Meriones unguiculatus), ХР_002711778.1 (кролик, Oryctolagus cuniculus), ХР_536777.2 (собака, Canis lupus familiaris), ХР_003126904.2 (свинья, Sus scrofa), ХР_011755768.1 (мартышка, Масаса nemestrina), ХР_008984479.1 (игрунка, Callithrix jacchus), XP_019834275.1 (корова, Bos indicus), ХР_511115.2 (шимпанзе, Pan troglodytes).
В настоящем изобретении полноразмерный белок KRS может содержать аминокислотную последовательность, определенную SEQ ID NO: 118, и более предпочтительно может представлять собой полипептид, состоящий из аминокислотной последовательности, определенной SEQ ID NO: 118 (номер доступа Genbank NP 005539.1). В настоящем изобретении KRS также включает его функциональные эквиваленты.
Белок KRS в настоящем изобретении предпочтительно означает внутриклеточный KRS или KRS, свойственный клеточной мембране, который отличается от KRS, который полностью секретируется во внеклеточное пространство.
Внутриклеточный KRS имеет два подтипа (две изоформы): цитоплазматическую форму (лизил-тРНК-синтетаза, цитоплазматическая) и митохондриальную форму (лизил-тРНК-синтетаза, митохондриальная). В настоящем изобретении KRS предпочтительно представляет собой цитоплазматическую форму.
Функциональный эквивалент относится к полипептиду, имеющему гомологию (или идентичность) последовательности 70% или более, предпочтительно 80% или более, более предпочтительно 90% или более с аминокислотными последовательностями, состоящими из известного белка KRS (в качестве предпочтительного примера эта аминокислотная последовательность определена SEQ ID NO: 118).
Например, он включает полипептиды, имеющие гомологию последовательности 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и 100%, и относится к полипептиду, проявляющему по существу такую же физиологическую активность, как и известный белок KRS в качестве родительского (в качестве предпочтительного примера эта аминокислотная последовательность определена SEQ ID NO: 118).
В настоящем документе термин «по существу однородная физиологическая активность» означает регуляцию миграции иммунных клеток. Предпочтительно функциональный эквивалент KRS в настоящем изобретении может быть результатом добавления, замены или делеции части аминокислотной последовательности SEQ ID NO: 118. Замена аминокислот, как описано выше, предпочтительно представляет собой консервативную замену. Примерами консервативных замен представленных в природе аминокислот являются следующие замены: алифатические аминокислоты (Gly, Ala, Pro), гидрофобные аминокислоты (Ile, Leu, Val), ароматические аминокислоты (Phe, Tyr, Тгр), кислые аминокислоты (Asp, Glu), основные аминокислоты (His, Lys, Arg, Gin, Asn) и серосодержащие аминокислоты (Cys, Met). Функциональный эквивалент KRS также включает варианты, в которых некоторые из аминокислот в аминокислотной последовательности белка KRS делетированы. Делеция или замена аминокислоты предпочтительно локализована в области, непосредственно не связанной с физиологической активностью KRS.
Кроме того, делеция или замена аминокислоты предпочтительно локализована в области, непосредственно не вовлеченной в физиологическую активность KRS. Также включены варианты, в которых аминокислоты присоединены с обоих концов аминокислотной последовательности или последовательности KRS. В объем функциональных эквивалентов по настоящему изобретению также включены производные полипептидов, в которых некоторые химические структуры полипептида модифицированы, но при этом сохранен основной каркас KRS и его физиологическая активность. Например, они включают модификации, изменяющие стабильность, способность к хранению, летучесть или растворимость белка.
Гомологию и идентичность последовательностей в настоящем документе определяют как процент идентичных совпадающих остатков (аминокислотных остатков или оснований) в последовательности-кандидате с исходной последовательностью после выравнивания исходной последовательности (в качестве примеров SEQ ID NO: 118 для предпочтительных аминокислотных последовательностей или SEQ ID NO: 119 для предпочтительных нуклеиново-кислотных последовательностей) и последовательностей-кандидатов и введения гэпов. При необходимости, чтобы получить максимальный процент однородности последовательностей, консервативные замены в рамках однородности последовательности не учитывают. В случае определения однородности или гомологии белковой последовательности N-конец, С-конец или внутреннее удлинение, делецию или вставку аминокислотной последовательности KRS также не следует интерпретировать как влияющие на однородность или гомологию последовательности. Кроме того, однородность последовательности может быть определена обычными стандартными методами, используемыми для сравнения подобных участков аминокислотных последовательностей двух белков или полипептидов. С помощью компьютерных программ, таких как BLAST или FASTA, два полипептида выравнивают так, чтобы их соответствующие аминокислоты оптимально совпадали (вдоль всей длины одной или двух последовательностей или вдоль предсказанного участка одной или двух последовательностей). Программа обеспечивает открытие гэпа по умолчанию и штраф на гэп по умолчанию, а также обеспечивает матрицу баллов, такую как РАМ250 (стандартная матрица баллов; Dayhoff et al., в: Atlas of Protein SEQuence and Structure, vol 5, supp 3, 1978), которую можно использовать в сочетании с компьютерной программой. Например, процент однородности можно рассчитать, как описано ниже. Суммарное число идентичных совпадений умножают на 100, а затем делят на суммарную длину самой длинной последовательности в совпадающем отрезке и число гэпов, введенных в самую длинную последовательность для выравнивания двух последовательностей.
Используемый в настоящем документе термин «перенос белков KRS к клеточной мембране», если не указано иное, относится к тому, что эндогенный белок (белки, синтезируемые внутри клеток, например, находящиеся в цитоплазме) клетки перемещается к клеточной мембране во внутриклеточном направлении одной и той же клетки. В этом случае KRS может полностью находится во внутриклеточном направлении или может быть частично экспонирован (предпочтительно N-концевой частью KRS) вне клетки, поскольку расположен между мембранами клеток. Однако в любом случае может быть желательным исключить полное отделение полученного в результате белка от клеток. Таким образом, в настоящем изобретении, если не указано иное, перемещение к клеточной мембране отличается от внеклеточного взаимодействия белков, полностью отделенных и секретируемых в одной клетке, с другими клетками или тканями.
В настоящем изобретении подразумевается, что в термин «область клеточной мембраны» включена как сама клеточная мембрана, так и области, расположенные по соседству (вблизи) очень близко к клеточной мембране и по существу взаимодействующие с клеточной мембраной.
В настоящем изобретении «антитело» также называется иммуноглобулином (Ig) и является общим термином для белков, которые избирательно связываются с антигенами и вовлечены в биологический иммунитет. Все обнаруживаемые в природе антитела обычно состоят из двух пар легких цепей (LC) и тяжелых цепей (НС), представляющих собой полипептиды из нескольких доменов, или основаны на двух парах HC/LC. Антитела млекопитающих составляет пять типов тяжелых цепей, обозначаемых греческими буквами α, δ, ε, γ и μ, и различные типы антител, такие как IgA, IgD, IgE, IgG и IgM соответственно, конструируют в зависимости от типа тяжелой цепи. Антитела млекопитающих составляет два вида легких цепей, определяемых как λ и κ.
Тяжелые и легкие цепи антитела структурно разделяются на вариабельные и константные области в соответствии с вариабельностью аминокислотной последовательности. Константная область тяжелой цепи состоит из трех или четырех константных доменов тяжелой цепи, таких как CH1, СН2 и СН3 (антитела IgA, IgD и IgG) и СН4 (антитела IgE и IgM) в зависимости от типа антитела. Легкая цепь состоит из одного константного домена CL. Вариабельная область тяжелой цепи и вариабельная область легкой цепи состоят из одного домена вариабельной области тяжелой цепи (VH) или одного домена вариабельной области легкой цепи (VL) соответственно. Легкие и тяжелые цепи расположены параллельно, при этом каждая вариабельная и константная область соединены одной ковалентной дисульфидной связью, и тяжелые цепи из двух молекул, связанных с легкой цепью, соединены посредством двух ковалентных дисульфидных связей с образованием полноразмерного антитела. Полноразмерное антитело специфично связывается с антигеном посредством вариабельных областей тяжелых и легких цепей, и в связи с тем, что полноразмерное антитело состоит из двух пар тяжелых и легких цепей (HC/LC), полноразмерное антитело из одной молекулы обладает двухвалентной моноспецифичностью, благодаря которой оно связывается с одними и теми же двумя антигенами посредством двух вариабельных областей.
Вариабельная область, включающая участок, где антитело связывается с антигеном, подразделена на каркасную область (FR), имеющую низкую вариабельность последовательности, и область, определяющую комплементарность (CDR), которая представляет собой гипервариабельную область с высокой вариабельностью последовательности. Каждая из VH и VL имеет три CDR и четыре FR, расположенные в порядке FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4 в направлении от N-конца к С-концу. CDR с самой высокой вариабельностью внутри вариабельной области антитела, непосредственно связывающаяся с антигеном, наиболее важна для антигенной специфичности антитела.
При использовании в настоящем документе «лечение» относится к ингибированию возникновения или рецидива заболевания, облегчению симптомов, уменьшению прямых или косвенных последствий заболевания, снижению скорости прогрессирования заболевания, улучшению статуса заболевания, улучшению, облегчению или улучшению прогноза. При использовании в настоящем документе термин «профилактика» относится к любому действию, которое ингибирует начало заболевания или отсрочивает его прогрессирование.
Далее настоящее изобретение будет описано подробно.
Авторами изобретения впервые был идентифицирован важный патологическое явление, состоящее в том, что концентрация KRS на мембране клетки повышается до определенного уровня относительно концентрации в цитоплазме иммунных клеток в связи с миграцией и инвазивным состоянием иммунных клеток, и, в частности, идентифицировали специфическую регуляторную функцию KRS в миграции иммунных клеток с особой связью с LN421 (подтип ламинина α4β2γ1). Таким образом, специфичное связывание антитела со специфичным эпитопом (область SEQ ID NO: 117) N-конца KRS, предложенного в настоящем изобретении, приводит к значимому снижению концентрации KRS на клеточной мембране, и более того показано, что оно оказывает значимые терапевтические эффекты при заболеваниях, таких как легочная гипертензия, которые глубоко взаимосвязаны с миграцией и инвазией иммунных клеток.
Соответственно, в настоящем изобретении, таким образом, предложено применение антитела или его функционального фрагмента, которое специфично связывается с эпитопом, содержащим последовательность SEQ ID NO: 117 на N-конце лизил-тРНК синтетазы (KRS), для производства агента для профилактики или лечения заболеваний, обусловленных миграцией иммунных клеток.
Настоящее изобретение предлагает фармацевтическую композицию, содержащую в качестве эффективного ингредиента антитело или его функциональный фрагмент, специфично связывающееся с эпитопом, содержащим последовательность SEQ ID NO: 117 на N-конце лизил-тРНК синтетазы (KRS), для профилактики или лечения заболевания, связанного с миграцией иммунных клеток.
Настоящее изобретение также предлагает фармацевтическую композицию, состоящую из антитела или его функционального фрагмента, специфично связывающихся с эпитопом, содержащим последовательность SEQ ID NO: 117 на N-конце лизил-тРНК синтетазы (KRS), для профилактики или лечения заболевания, обусловленного миграцией иммунных клеток.
Настоящее изобретение предлагает фармацевтическую композицию, по существу состоящую из антитела или его функционального фрагмента, специфично связывающихся с эпитопом, содержащим последовательность SEQ ID NO: 117 на N-конце лизил-тРНК синтетазы (KRS), для профилактики или лечения заболевания, обусловленного миграцией иммунных клеток.
В настоящем изобретении термин «содержащий» используют так же, как «включающий» или «характерный», и он не исключает дополнительные составляющие элементы или стадии способа, не указанные в композиции или способе. Термин «состоящий из» используется так же, как «составленный из» и означает исключение дополнительных составляющих элементов или стадий способа, которые отдельно не описаны. Термин «состоящий по существу из» в объеме композиции или способа означает включение описанных составляющих элементов или стадий, а также составляющих элементов или стадий, которые по существу не влияют на их основные свойства.
В настоящем изобретении термин «эпитоп» относится к конкретной части антитела, которая конкретно определяет специфичность реакции антиген-антитело в любом объекте, с которым специфично связывается антитело. В настоящем изобретении эпитоп имеет происхождение из N-концевой последовательности KRS (независимо от биологического вида), и его специфичная последовательность конкретно не ограничена, если она представляет собой непрерывную область, содержащую (по существу) аминокислотную последовательность SEQ ID NO: 117. Как правило, аминокислотная последовательность SEQ ID NO: 117 может состоять из 13-52, более предпочтительно из 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41 или 42 аминокислотных последовательностей.
В предпочтительном примере в настоящем изобретении эпитоп, имеющий происхождение от N-конца KRS человека, может состоять из SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136 или SEQ ID NO: 148. Эпитоп, имеющий происхождение от N-конца KRS мыши, может состоять из SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141 или SEQ ID NO: 149 Эпитоп, имеющий происхождение от N-конца KRS крысы, может состоять из SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146 или SEQ ID NO: 150.
Антитела или их функциональные фрагменты по настоящему изобретению характеризуются тем, что они снижают уровни KRS в клеточных мембранах посредством специфичного связывания в эпитопе. Авторами настоящего изобретения было впервые идентифицировано, что миграцию и инвазию иммунных клеток можно ингибировать при специфичном снижении концентрации KRS в клеточной мембране и, следовательно, возможен терапевтический эффект для соответствующих заболеваний. Авторы настоящего изобретения подтвердили, что антитело, специфично связывающееся с эпитопом (N3-антитело и усовершенствованные антитела из него), эффективно ингибирует и снижает (посредством эндоцитоза) уровни KRS, повышенные в мембране иммунной клетки, сопровождающиеся миграцией и инвазией иммунных клеток, и ингибирует миграцию иммунных клеток. Более того, они подтвердили, что это антитело оказывает значимый терапевтический эффект при применении в биологических моделях заболеваний (например, легочной гипертензией и т.д.), патогенез которых состоит в усиленной миграции иммунных клеток.
Специфичная последовательность конкретно не ограничена, пока антитело или его функциональный фрагмент, специфично связывающиеся с эпитопом, содержащим последовательность SEQ ID NO: 117 на N-конце лизил-тРНК синтетазы (KRS), проявляет по существу однородную физиологическую активность.
Однако, например, оно может характеризоваться тем, что включает вариабельную область тяжелой цепи, содержащую определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 1 определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 3, и определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 5, и вариабельную область легкой цепи, включающую определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 7, определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 9, и определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 11. В настоящем изобретении антитела, имеющие эти последовательности, обозначены как антитела N3.
Более предпочтительно антитело или его функциональный фрагмент в соответствии с настоящим изобретением может включать вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность, определенную SEQ ID NO: 31; и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность, определенную SEQ ID NO: 33. В настоящем изобретении антитела, имеющие эти последовательности, обозначены как антитела N3.
Антитело в соответствии с настоящим изобретением может быть выбрано из группы, состоящей из IgG, IgA, IgM, IgE и IgD, и предпочтительно может представлять собой антитело IgG, но не ограничено ими. Наиболее предпочтительно антитело по настоящему изобретению может состоять из тяжелой цепи, содержащей аминокислотную последовательность, определенную SEQ ID NO: 89, и легкую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 91 (названо антителом N3, как используют в настоящем документе).
В дополнение к этому авторами настоящего изобретения были получены усовершенствованные антитела (N3-1, N3-3, N3-4, N3-5, N3-6, N3-7, N3-8, N3-9, N3-8-1, N3-8-2, N3-8-3, N3-8-4, N3-8-5, N3-8-6, N3-8-7), обладающие высокими полезными эффектами в качестве терапевтических антител, основанные на последовательности вариабельной области антитела N3 (вариабельной области тяжелой цепи (VH), содержащей аминокислотную последовательность, определенную SEQ ID NO: 31; и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность, определенную SEQ ID NO: 33). Антитела N3 и их усовершенствованные антитела имеют унифицированные и уникальные признаки последовательностей CDR по п. (а) и (b) ниже.
Следовательно, в настоящем изобретении в качестве усовершенствованного антитела предложено антитело или его функциональный фрагмент, включающие
(а) вариабельную область тяжелой цепи (VH), включающую
(а-1) определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность SYDMS;
(а-2) определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность X1IX2X3X4X5GX6X7YYADSVKG, где X1 представляет собой А или V, Х2 представляет собой S, D или G, Х3 представляет собой Y, Р, S или А, и Х4 представляет собой D, Q, L или Y, Х5 представляет собой N, М, S или G, Х6 представляет собой N, R или Р, Х7 представляет собой Т, V, I или S; и
(а-3) определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность X8ALDFDY, где X8 представляет собой М или L, и
(b) вариабельную область легкой цепи (VL), включающую
(b-1) определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность TGSSSNIGSNYVT;
(b-2) определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность X9NX10X11RPS, где Х9 представляет собой D, S или R, Х10 представляет собой S или N, и Х11 представляет собой N или Q и
(b-3) определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность X12SFSDELGAYV и где Х12 представляет собой А или S.
В частности, антитело и его функциональный фрагмент, предложенные в настоящем изобретении, включает (а) вариабельную область тяжелой цепи (VH), где VH содержит определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 1; и определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 21, SEQ ID NO: 23 и SEQ ID NO: 151, и определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5 и SEQ ID NO: 25.
(b) вариабельную область легкой цепи (VL), где VL включает определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 7; и определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 9, SEQ ID NO: 27 и SEQ ID NO: 29; определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 13 и SEQ ID NO: 15.
Антитела, состоящие из последовательностей CDR (антитело N3 и антитела N3 с производными), обладают превосходной способностью к специфичному связыванию с N-концевой областью KRS, экспонированной на внешней мембране, и значительно ингибируют и уменьшают миграцию/инвазию иммунных клеток, проявляя превосходный терапевтический эффект при заболеваниях, связанных миграцией иммунных клеток. Это хорошо продемонстрировано в примерах и описании настоящего изобретения.
Антитело или его фрагмент (функциональный фрагмент), которое специфично связывается с N-концевой областью KRS, экспонированной на внеклеточной мембране, в соответствии с настоящим изобретением, предпочтительно, но без ограничений, представляет собой антитело, включающее CDR вариабельной области тяжелой цепи и вариабельной области легкой цепи, как описано ниже, и следующие ниже пункты i, ii, iii, iv, v, vi, vii, viii, ix, x, xi, xii и xiii представляют собой комбинации CDR антител N3-1, N3-3, N3-4, N3-5, N3-6, N3-7, N3-8, N3-9, N3-8-1, N3-8-2, N3-8-3, N3-8-4, N3-8-5 и N3-8-6, а также антитела N3-8-7 примера соответственно:
Антитела или их фрагменты включают:
i) вариабельную область тяжелой цепи (VH), включающую определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 1, определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 3, и определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 5, и вариабельную область легкой цепи (VL), включающую определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 7, определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 9, и определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 13;
ii) вариабельную область тяжелой цепи (VH), включающую определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 1, определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 3, и определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 5, и вариабельную область легкой цепи (VL), включающую определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 7, определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 9, и определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 15;
iii) вариабельную область тяжелой цепи (VH), включающую определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 1, определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 151, и определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 5, и вариабельную область легкой цепи (VL), включающую определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 7, определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 9, и определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 13;
iv) вариабельную область тяжелой цепи (VH) антитела, включающую определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 1, определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 151, и определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 5, и вариабельную область легкой цепи (VL), включающую определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 7, определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 9, и определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 15;
v) вариабельную область тяжелой цепи (VH), включающую определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 1, определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 17, и определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 5, и вариабельную область легкой цепи (VL), включающую определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 7, определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 9, и определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 15;
vi) вариабельную область тяжелой цепи (VH), включающую определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 1, определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 19, и определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 5, и вариабельную область легкой цепи (VL), включающую определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 7, определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 9, и определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 15;
vii) вариабельную область тяжелой цепи (VH), включающую определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 1, определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 21, и определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 5, и вариабельную область легкой цепи (VL), включающую определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 7, определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 9, и определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 15;
viii) вариабельную область тяжелой цепи (VH), включающую определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 1, определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 23, и определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 5, и вариабельную область легкой цепи (VL), включающую определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 7, определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 9, и определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 15;
ix) вариабельную область тяжелой цепи (VH), включающую определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 1, определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 21, и определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 5, и вариабельную область легкой цепи (VL), включающую определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 7, определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 27, и определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 15;
x) вариабельную область тяжелой цепи (VH), включающую определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 1, определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 21, и определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 5, и вариабельную область легкой цепи (VL), включающую определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 7, определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 29, и определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 15;
xi) вариабельную область тяжелой цепи (VH), включающую определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 1, определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 21, и определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 25, и вариабельную область легкой цепи (VL), включающую определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 7, определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 9, и определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 15;
xii) вариабельную область тяжелой цепи (VH), включающую определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 1, определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 21, и определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 25, и вариабельную область легкой цепи (VL), включающую определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 7, определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 27, и определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 15 и
xiii) вариабельную область тяжелой цепи (VH), включающую определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 1, определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 21, и определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 25, и вариабельную область легкой цепи (VL), включающую определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 7, определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 29, и определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 15.
Наиболее предпочтительно антитело или его фрагмент в соответствии с настоящим изобретением включает вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL), как описано ниже: В антителе или его фрагменте вариабельная область тяжелой цепи содержит по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 31, SEQ ID NO: 35, SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 41, SEQ ID NO: 43, SEQ ID NO: 45 и SEQ ID NO: 47, а вариабельная область легкой цепи содержит по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 53 и SEQ ID NO: 55.
Предпочтительно оно представляет собой антитело, включающее вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 31, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 49; вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 31, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 51; вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 35, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 49; вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 35, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 51; вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 37, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 51; вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 39, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 51; вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 41, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 51; вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 43, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 51; вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 45, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 51; вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 45, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 53; вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 45, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 55; вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 47, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 51; вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 47, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 53; вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 47, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 55.
Антитело типа IgG, включающее вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL), может, в частности, представлять собой антитело, отличающееся тем, что оно состоит из тяжелой цепи (НС), содержащей по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 89, SEQ ID NO: 93, SEQ ID NO: 95, SEQ ID NO: 97, SEQ ID NO: 99, SEQ ID NO: 101, SEQ ID NO: 103 и SEQ ID NO: 105 и легкой цепи (LC), содержащей по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 107, SEQ ID NO: 109, SEQ ID NO: 111, SEQ ID NO: 113 и SEQ ID NO: 115. Оно представляет собой антитело, наиболее предпочтительно содержащее тяжелую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 89 и легкую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 107; тяжелую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 89 и легкую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 109; тяжелую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 93 и легкую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 107; тяжелую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 93 и легкую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 109; тяжелую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 95 и легкую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 109; тяжелую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 97 и легкую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 109; тяжелую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 99 и легкую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 109; тяжелую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 101 и легкую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 109; тяжелую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 103 и легкую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 111; тяжелую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 103 и легкую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 113; тяжелую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 103 и легкую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 115; тяжелую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 105 и легкую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 111; тяжелую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 105 и легкую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 113; тяжелую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 105 и легкую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 115; тяжелую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 99 и легкую цепь, содержащую аминокислотную последовательность, определенную SEQ ID NO: 111.
Антитело по настоящему изобретению относится к антителу, включающему моноклональное антитело, поликлональное антитело и рекомбинантное антитело. Для целей настоящего изобретения может быть желательным, чтобы моноклональное антитело представляло собой популяцию антител, в которой аминокислотные последовательности тяжелых и легких цепей антитела были по существу идентичными. Моноклональные антитела могут быть получены с использованием гибридомных методов (Kohler and Milstein (1976) European Jounral of Immunology 6:511-519) или методик фаговых библиотек антител (Clackson et al, Nature, 352:624-628, 1991; Marks et al, J. Mol. Biol., 222:58, 1-597, 1991), хорошо известных в данной области техники.
Антитела по изобретению могут иметь происхождение от млекопитающих, включая человека, или от любого животного, включая птиц и предпочтительно могут представлять собой химерное антитело, включающее участок антитела, имеющий происхождение от человека, или участок антитела, имеющий происхождение от вида животного, отличающегося от человека. Таким образом, настоящее изобретение включает все химерные антитела, гуманизированные антитела и человеческие антитела, и предпочтительно могут представлять собой человеческие антитела.
Антитела по изобретению также включают функциональные фрагменты молекул антител, а также полноразмерные формы, имеющие, например, две полноразмерные легкие цепи и две полноразмерные тяжелые цепи, такие как IgG. Функциональный фрагмент относится к фрагменту антитела, сохраняющему способность к антигенспецифичному связыванию полноразмерного антитела, и предпочтительно обладает аффинностью связывания с N-концом KRS родительского антитела по меньшей мере 50%, 60%, 70%, 80%, 90%, 95% или 90%, 95%, 100% или более. В частности, он может принимать форму Fab, F(ab)2, Fab', F(ab')2, Fv, диатела и scFv. Fab (антигенсвязывающий фрагмент) представляет собой антигенсвязывающий фрагмент антитела и состоит из вариабельного домена и константного домена каждой из тяжелой и легкой цепей. F(ab')2 представляет собой фрагмент, полученный путем гидролиза антитела пепсином, и два Fab соединены дисульфидными связями в шарнирных областях тяжелых цепей. F(ab') представляет собой мономерный фрагмент антитела, в котором шарнирная область тяжелой цепи присоединена к Fab, отделенному путем восстановления дисульфидной связи фрагмента F(ab')2. Вариабельный фрагмент (Fv) представляет собой фрагмент антитела, состоящий только из вариабельных областей каждой из тяжелых и легких цепей. Одноцепочечный вариабельный фрагмент (scFv) представляет собой фрагмент рекомбинантного антитела, в котором вариабельная область тяжелой цепи (VH) и вариабельная область легкой цепи (VL) связаны гибким пептидным линкером. Диатело, в котором VH и VL scFv связаны очень коротким линкером и не могут быть связаны друг с другом, относится к форме фрагмента, который связывается с VL и VH другого scFv такой же формы соответственно с образованием димера.
Функциональный фрагмент антитела для целей настоящего изобретения не ограничен по структуре и форме, если он сохраняет связывающую специфичность к N-концевому участку KRS человека, экспонированному снаружи клетки и проявляющему такую же физиологическую активность, но предпочтительно может представлять собой scFv. В соответствии с настоящим изобретением scFv конкретно не ограничен, если он обладает по существу такой же физиологической активностью, как описанное выше антитело, но предпочтительно имеет специфическую конфигурацию CDR или конфигурацию VH и VL к N-концевой области KRS. VH и VL могут быть соединены посредством линкера. Линкер конкретно не ограничен, если в данной области техники известно, что он представляет собой линкер, применимый к scFv. Предпочтительно пептид может содержать аминокислотную последовательность, определенную SEQ ID NO: 57. Предпочтительно scFv N3 в настоящем изобретении может конкретно содержать аминокислотную последовательность, определенную SEQ ID NO: 59, и более предпочтительно может состоять из аминокислотной последовательности, определенной SEQ ID NO: 59. В дополнение к этому в соответствии с конфигурацией последовательностей VH и VL усовершенствованного антитела N3 в настоящем изобретении могут быть предложены следующие scFV: scFV, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 61, SEQ ID NO: 63, SEQ ID NO: 65, SEQ ID NO: 67, SEQ ID NO: 69, SEQ ID NO: 71, SEQ ID 73, SEQ ID 75, SEQ ID 77, SEQ ID 79, SEQ ID 81, SEQ ID 83, SEQ ID 85 и SEQ ID 87.
Антитело или его фрагмент по изобретению может включать консервативные замены (называемые консервативными вариантами антитела), делеции или добавления аминокислот, которые по существу не изменяют их биологическую активность. В настоящем изобретении «по существу однородная физиологическая активность» означает связывание с N-концевой областью KRS и ингибирование миграции и инвазии иммунных клеток.
В настоящем изобретении полинуклеотидная последовательность для получения антитела или его фрагмента конкретно не ограничена определенной конфигурацией нуклеотидной последовательности, пока указанная выше последовательность является удовлетворительной. Последовательность полинуклеотида, предложенного в настоящем изобретении, конкретно не ограничена, пока она кодирует антитело или его фрагмент по настоящему изобретению. Последовательность полинуклеотида, кодирующего описанные выше последовательности CDR в антителе в соответствии с настоящим изобретением, конкретно не ограничена, но предпочтительно может содержать последовательность пар оснований, определенную SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 30 или SEQ ID NO: 152. Белки, кодируемые каждой из этих последовательностей, включены в перечень последовательностей.
Кроме того, полинуклеотид, кодирующий указанные выше последовательности VH и VL в антителе в соответствии с настоящим изобретением, конкретно не ограничена, но предпочтительно может содержать нуклеотидную последовательность, определенную SEQ ID NO: 32 (VH), SEQ ID NO: 36 (VH), SEQ ID NO: 38 (VH), последовательность SEQ ID NO: 40 (VH), SEQ ID NO: 42 (VH), SEQ ID NO: 44 (VH), SEQ ID NO: 46 (VH), SEQ ID NO: 48 (VH), SEQ ID NO: 34 (VL), SEQ ID NO: 50 (VL), SEQ ID NO: 52 (VL), SEQ ID NO: 54 (VL) или SEQ ID NO: 56 (VL).
В одном воплощении изобретения полинуклеотид, кодирующий антитело в форме IgG, включающее вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL), предпочтительно может содержать следующую последовательность пар оснований: Полинуклеотид, кодирующий тяжелую цепь (НС), может содержать по меньшей мере одну нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 90, SEQ ID NO: 94, SEQ ID NO: 96, SEQ ID NO: 98, SEQ ID NO: 100, SEQ ID NO: 102, SEQ ID NO: 104 и SEQ ID NO: 106. Полинуклеотид, кодирующий легкую цепь (LC), может содержать одну или более нуклеотидных последовательностей, выбранных из группы, состоящей из SEQ ID NO: 92, SEQ ID NO: 108, SEQ ID NO: ПО, SEQ ID NO: 112, SEQ ID NO: 114 и SEQ ID NO: 116.
Кроме того, полинуклеотид, кодирующий фрагмент антитела, может предпочтительно содержать любую последовательность пар оснований, выбранную из группы, состоящей из SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80, SEQ ID NO: 82, SEQ ID NO: 84, SEQ ID NO: 86 и SEQ ID NO: 88, кодирующую scFv в соответствии с настоящим изобретением.
Полинуклеотиды, кодирующие антитела или их фрагменты в настоящем изобретении, могут быть получены способами, хорошо известными в данной области техники. Например, на основании последовательностей ДНК или соответствующих аминокислотных последовательностей, полностью или частично кодирующих тяжелые и легкие цепи антитела, могут быть синтезированы олигонуклеотиды, хорошо известные в данной области техники, используя методику синтеза, такой как полимеразная цепная реакция (ПНР).
Полинуклеотид вводят в подходящую клетку-хозяина посредством вектора, а затем экспрессируют белок антитела по настоящему изобретению. Клетку-хозяина трансформируют рекомбинантным экспрессионным вектором, функционально связанным с полинуклеотидом, кодирующим антитело или его фрагмент. Специальные методы выделения и получения антител после культивирования трансформированной клетки-хозяина с получением полипептида тяжелой цепи, легкой цепи или фрагмента антитела с рекомбинантного экспрессионного вектора, введенного в эту клетку-хозяина, хорошо известны в данной области техники.
Сначала конструируют кодирующую антитело нуклеиновую кислоту в соответствии с традиционным методом. Эта нуклеиновая кислота может быть получена путем амплификации ПЦР с использованием подходящих праймеров. Альтернативно последовательности ДНК можно синтезировать стандартными методами, известными в данной области техники, такими как с использованием автоматических синтезаторов ДНК (таких как продаются компанией Biosearch или Applied Biosystems). Сконструированную нуклеиновую кислоту вставляют в вектор, содержащий одну или более контрольных последовательностей экспрессии (например, промоторов, энхансеров и т.д.), функционально связанных для регуляции экспрессии нуклеионовой кислоты и клетка-хозяин трансформируется рекомбинантным экспрессионным вектором, образованным из него.
Термин «трансформация» относится к модификации генотипа клетки-хозяина в результате введения экзогенного полинуклеотида и относится к введению экзогенного полинуклеотида в клетку-хозяина независимо от способа, используемого для трансформации. Введенные в клетку-хозяина экзогенные полинуклеотиды могут интегрироваться или не интегрироваться в геном клетки-хозяина и изобретение включает оба случая.
Для получения антител или их фрагментов рекомбинантные экспрессионные векторы, экспрессирующие антитела или их фрагменты в соответствии с настоящим изобретением, которые специфично связываются с N-концевой областью KRS, могут быть введены в клетки и трансформированы известными в данной области техники способами, например, транзиторной трансфекции, микроинъекции, трансдукции, слияния клеток, кальций-фосфатной преципитации, опосредованной липосомами трансфекции, опосредованной ДЭАЭ-декстраном (ДЭАЭ - диэтиламиноэтил) трансфекции, опосредованной полибреном трансфекции, электропорации, «генного ружья», и известными способами введения нуклеиновых кислот в клетки, но не ограничиваясь указанными способами. Специалист в данной области техники может выбрать и выполнить подходящий способ трансформации в соответствии с выбранной клеткой-хозяином и рекомбинантным экспрессионным вектором.
Рекомбинантные экспрессионные векторы, содержащие последовательности тяжелых и легких цепей, могут быть трансформированы в одну и ту же клетку-хозяина так, чтобы тяжелые и легкие цепи экспрессировались в одной клетке и рекомбинантные экспрессионные векторы, содержащие нуклеотидные последовательности тяжелых и легких цепей, могут быть трансформированы в отдельные клетки-хозяева соответственно, чтобы тяжелые и легкие цепи экспрессировались по-отдельности. Состав среды, условия культивирования и время культивирования для выращивания клетки-хозяина могут быть соответствующим образом выбраны в соответствии с известными в данной области техники способами. Молекула антитела, которая вырабатывается в клетке-хозяине, может накапливаться в цитоплазме клетки, секретироваться вне клетки или в культуральную среду посредством соответствующей сигнальной последовательности или направляться в периплазму. Также предпочтительно, чтобы антитела в соответствии с изобретением в результате применения способов, известных в данной области техники, характеризовались свертыванием белка и функциональной конформацией, при которых сохраняется специфичность связывания с N-концом KRS. Кроме того, при получении антитела формы IgG тяжелые и легкие цепи могут экспрессироваться в отдельных клетках и приведение тяжелых и легких цепей в контакт с образованием полноразмерного антитела может быть выполнено на отдельной стадии. Тяжелые и легкие цепи могут экспрессироваться в одних и тех же клетках, а также могут быть получены так, чтобы образовать полноразмерное антитело внутри клетки.
Специалисты в данной области техники могут соответствующим образом выбрать и контролировать способ получения с учетом характеристик антитела или полипептидного фрагмента, вырабатываемого в клетке-хозяине, характеристик клетки-хозяина, способа экспрессии или полипептида, на который они нацелены. Например, антитело, секретируемое в культуральную среду, или его фрагменты можно выделить путем получения среды, в которой культивируются клетки-хозяева, и центрифугирования для удаления примесей. При необходимости в целях высвобождения и выделения антитела, находящегося в определенной органелле или в цитоплазме клетки, клетки можно лизировать в таком диапазоне условий, который не повлияет на функциональную структуру антитела или его фрагмента. Кроме того, полученное антитело может дополнительно включать процесс дополнительного удаления примесей и концентрирования посредством фильтрования и диализа с помощью хроматографии и фильтров.
Полипептид способа производства (получения) по настоящему изобретению может представлять собой антитело или его фрагмент по настоящему изобретению и полипептид, с которым дополнительно связывается другая аминокислотная последовательность, отличающаяся от антитела или его фрагмента по настоящему изобретению. В этом случае аминокислотную последовательность можно удалить из антитела или его фрагмента по настоящему изобретению, используя способы, хорошо известные специалистам в данной области техники.
Ссылки на методы генной инженерии для синтеза полипептидов по настоящему изобретению можно найти в следующих документах: Maniatis et al., Molecular Cloning; A laboratory Manual, Cold Spring Harbor laboratory, 1982; Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, N.Y., Second (1998) and Third (2000) Editions; Gene Expression Technology, Method in Enzymology, Genetics and Molecular Biology, Method in Enzymology, Guthrie and Fink (eds.), Academic Press, San Diego, Calif, 1991;  Hitzeman et al., J. Biol. Chem., 255:12073-12080, 1990.
Hitzeman et al., J. Biol. Chem., 255:12073-12080, 1990.
В настоящем изобретении термин «иммунные клетки» относится к клеткам, вовлеченным в иммунный ответ организма. Если в данной области техники клетка известна как иммунная клетка, и в частности, если она известна как иммунная клетка, присутствующая в организме человека, ее тип конкретно не ограничен, но включает моноциты, макрофаги, нейтрофилы, эозинофилы, базофилы, дендритные клетки, естественные киллеры, мегакариоциты, Т-клетки и В-клетки. Предпочтительно клетка относится к моноцитам, макрофагам или нейтрофилам. Иммунные клетки экспрессируют KRS.
В настоящем изобретении заболевание, связанное с миграцией иммунных клеток, например, может быть выбрано из группы, состоящей из сердечно-сосудистых заболеваний, фиброзного заболевания, воспалительного заболевания и синдрома Альпорта, но если в данной области техники известно, что основным патогенезом является избыточная миграция (и/или инвазия) иммунных клеток, то конкретный тип заболевания особо не ограничен.
Сердечно-сосудистое заболевание может быть, например, выбрано из группы, состоящей из гипертензии (включая вызванные гипертензией воспалительные осложнения), легочной артериальной гипертензии, атеросклероза, стенокардии, инфаркта миокарда, ишемического цереброваскулярного заболевания, артериосклероза и мезентериального склероза, но конкретный вид заболевания особо не ограничен.
Фиброзные заболевание может быть выбрано из группы, состоящей из, например, склеродермии, ревматоидного артрита, болезни Крона, язвенного колита, миелофиброза, фиброза легких, фиброза печени, цирроза печени, фиброза почек, гломерулосклероза, миофиброза, миофиброза сердца, интерстициального фиброза, фиброза поджелудочной железы, фиброза селезенки, фиброза средостения, сосудистого фиброза, фиброза кожи, фиброза глаза, макулярной дегенерации, фиброза суставов, фиброза щитовидной железы, эндомиокардиального фиброза, перитонеального фиброза, ретроперитонеального фиброза, массивного прогрессивного фиброза, нефрогенного системного фиброза, системной красной волчанки, наследственного фиброза, инфекционного фиброза, раздражающего фиброза, фиброза вследствие хронического аутоиммунитета, фиброза вследствие антигенной несовместимости при трансплантации органа, фиброзных осложнений во время операции, фиброза вследствие гиперлипидемии, фиброза вследствие ожирения, диабетического фиброза, фиброза вследствие гипертензии и окклюзии вследствие фиброза во время установки стента, но конкретный тип заболевания особо не ограничен.
В настоящем изобретении воспалительное заболевание может предпочтительно быть выбрано из группы, состоящей из аутоиммунного заболевания, воспалительного заболевания кишечника, дерматита (например, атопического дерматита, экземы, псориаза и т.д.), диабетического глазного заболевания (диабетической ретинопатии и т.д.), перитонита, остеомиелита, флегмоны подкожной жировой клетчатки, менингита, энцефалита, панкреатита, травматического шока, бронхиальной астмы, ринита, синусита, тимпанита, пневмонии, гастрита, энтерита, муковисцидоза, апоплексии (апоплексии, инсульта и т.д.), бронхита, бронхиолита, гепатита (цирроза печени, неалкогольного стеатогепатита и т.д.), нефрита (диабетической почечной недостаточности и т.д.), протеинурии, артрита (такого как псориатический артрит, остеоартрит), неврита (диабетической нейропатии, рассеянного склероза и т.д.), подагры, спондилита, синдрома Рейтера, узлового полиартериита, васкулита, бокового амиотрофического склероза, гранулематоза Вегенера, гиперцитокинемии, ревматической полимиалгии, гигантоклеточного артериита, артрита, индуцированного кристаллическими фосфатами кальция, псевдоподагры, несуставного ревматоидного заболевания, бурсита, тендосиновиита, эпикондилита (локоть теннисиста), сустава Шарко, гемартроза, пурпуры Шенлейна-Геноха, гипертрофического остеоартрита, многоочаговой ретикулоцитомы, саркоидоза, гемохроматоза, дрепаноцитоза, гиперлипопротеинемии, гипогаммаглобулинемии, гипепаратиреоза, акромегалии, семейной средиземноморской лихорадки, болезни Бехчета, системной красной волчанки, рецидивирующей лихорадки, псориаза, рассеянного склероза, сепсиса, септического шока, острого респираторного дистресс-синдрома, полиорганной дисфункции, хронической обструктивной болезни легких, острого повреждения легких и бронхолегочной дисплазии, а также включает хронические воспалительные заболевания, но конкретный тип заболевания особо не ограничен.
В настоящем изобретении аутоиммунные заболевания могут быть выбраны из группы, состоящей из ревматоидного артрита, системной склеродермии, системной красной волчанки, псориаза, бронхиальной астмы, язвенного колита, болезни Бехчета, болезни Крона, рассеянного склероза, дерматита, коллагеновой болезни, васкулита, артрита, гранулематоза, аутоиммунные заболевания органной специфичности и GvHD (болезни трансплантат-против-хозяина).
Хроническое воспалительное заболевание относится к состоянию, при котором они переходят в хроническую форму, со ссылкой на тип заболевания и их предпочтительные примеры включают астму, атопический дерматит, экзему, псориаз, остеоартрит, подагру, псориатический артрит, цирроз, неалкогольный стеатогепатит, хроническую обструктивную болезнь легких, ринит, диабетическую ретинопатию, диабетическую почечную недостаточность, диабетическую нейропатию и рассеянный склероз, но не ограничено ими.
Фармацевтические композиции в соответствии с изобретением могут содержать только антитела или их функциональные фрагменты по изобретению или могут быть включены в подходящую лекарственную форму с одним или более фармацевтически приемлемых носителей и могут дополнительно содержать вспомогательные вещества или разбавители. При использовании в настоящем документе «фармацевтически приемлемый» относится к нетоксичной композиции, которая является физиологически приемлемой и при введении человеку не вызывает аллергических реакций или таких реакций, как желудочно-кишечные расстройства и головокружение.
Фармацевтически приемлемые носители могут дополнительно включать, например, носители для перорального введения или носители для парентерального введения. Носители для перорального введения могут включать лактозу, крахмал, производные целлюлозы, стеарат магния и стеариновую кислоту. Кроме того, он может включать различные вещества для доставки лекарственных препаратов, применяемых для перорального введения пептидного агента. Кроме того, носители для парентерального введения могут включать воду, подходящие масла, физиологический раствор, водный раствор глюкозы и гликоли и дополнительно включают стабилизаторы и консерванты. Подходящие стабилизаторы включают антиоксиданты, такие как гидросульфит натрия, сульфит натрия или аскорбиновая кислота. Подходящие консерванты включают бензалкония хлорид, метил- или пропилпарабены и хлорбутанол.
Фармацевтическая композиция по настоящему изобретению может, кроме перечисленных выше компонентов, дополнительно включать смазывающий агент, увлажняющий агент, подсластитель, вкусоароматическую добавку, эмульгатор и суспензионный агент. Другие фармацевтически приемлемые носители и лекарственные формы могут относиться к таким, как описано в следующих документах.
Композицию по настоящему изобретению можно вводить любому млекопитающему, включая человека. Например, ее можно вводить перорально или парентерально. В частности, путь введения композиции по настоящему изобретению может представлять собой известный способ введения антитела, например, инъекцию или инфузию внутривенным, интраперитонеальным, интракраниальным, подкожным, внутримышечным, внутриглазным, внутриартериальным, цереброспинальным или внутриочаговым путем, либо инъекцию или инфузию с помощью системы замедленного высвобождения, описанной ниже. Например, антитело по настоящему изобретению можно вводить системным или местным путем.
Фармацевтическую композицию по настоящему изобретению можно включать в состав для перорального или парентерального введения в соответствии с описанным выше путем введения.
В фармацевтической композиции в соответствии с настоящим изобретением при клиническом применении антитело или его фрагмент можно вводить в нескольких пероральных и парентеральных лекарственных формах. Антитело или его фрагмент при изготовлении, можно получить используя обычно применяемый разбавитель или вспомогательное вещество, такой как наполнитель, объемообразующий агент, связующее вещество, смачивающий агент, разрыхлитель или поверхностно-активное вещество (ПАВ). Твердые лекарственные формы для перорального введения включают таблетку, пилюлю, порошок, гранулы, капсулу, пастилку и т.п. Данные твердые лекарственные формы включают по меньшей мере, одно вспомогательное вещество, например, крахмал, карбонат кальция, сахарозу или лактозу или желатин. Кроме того, помимо простых вспомогательных веществ, можно использовать смазывающие вещества, такие как стеарат магния и тальк. Жидкие лекарственные формы для перорального введения включают суспензию, раствор для приема внутрь, эмульсию, сироп и т.п. Помимо часто используемых простых вспомогательных веществ, таких как вода и вазелиновое масло, в жидких лекарственных формах могут содержаться несколько вспомогательных веществ, например смачивающий агент, подсластитель, ароматизатор, консервант и т.п.
Агенты для парентерального введения включают стерильные водные раствора, неводные растворители, суспензии, эмульсии, лиофилизированные препараты и суппозитории. Терапевтические композиции по изобретению можно получить в форме лиофилизированной таблетки или водного раствора для хранения после смешивания с любым физиологически приемлемым носителем, вспомогательным веществом или стабилизатором (Remington: The Science and Practice of Pharmacy, 19th Edition, Alfonso, R., ed, Mack Publishing Co. (Easton, PA: 1995)), при этом антитело характеризуется желаемой чистотой. Приемлемые носители, вспомогательные вещества или стабилизаторы в применяемых дозах и концентрациях нетоксичны для реципиентов, и включают готовые растворы, такие как фосфорная кислота, лимонная кислота и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярные (менее чем около 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТК; сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как ион натрия и (или) неионные ПАВ, такие как Твин, плюроники или полиэтиленгликоль (ПЭГ).
Агенты для парентерального введения могут быть изготовлены способами, известными в данной области техники, в форме инъекционных препаратов, кремов, лосьонов, наружных препаратов, масел, увлажняющих средств, гелей, аэрозолей и назальных ингаляционных препаратов. Эти лекарственные формы описаны в литературе, содержащей общие рекомендации, известные в области фармацевтической химии (Remington's Pharmaceutical Science, 19th ed., Mack Publishing Company, Easton, РАД995).
Общее эффективное количество антитела или его функционального фрагмента по настоящему изобретению можно вводить в однократной дозе или по протоколу лечения фракционированными дозами, в котором вводят многократные дозы в течение длительного времени.
Содержание активного ингредиента (антитела или его функционального фрагмента) в фармацевтической композиции по настоящему изобретению может изменяться в соответствии со степенью и/или целью лечения заболевания, но эффективная доза, которую можно вводить многократно несколько раз в сутки, обычно составляет от 0,01 мкг до 10000 мг или предпочтительно от 0,1 мкг до 1000 мг в однократной дозе. Однако, дозировку фармацевтической композиции определяют с учетом различных факторов, таких как метод изготовления препарата, путь введения и частота применения, а также таких различных факторов, как возраст, масса, состояние здоровья, пол пациента, тяжесть заболевания, рацион питания и скорость экскреции. С учетом всех этих данных обычные специалисты в данной области техники смогут определить соответствующую эффективную дозировку композиций по настоящему изобретению Фармацевтическая композиция в соответствии с настоящим изобретением особо не ограничена лекарственной формой, путем введения и способом применения, если показан эффект настоящего изобретения.
Настоящее изобретение также предлагает способ лечения заболеваний, связанных с миграцией иммунных клеток, включающего введение нуждающемуся в этом субъекту эффективного количества композиции, содержащей антитело, специфично связывающееся с эпитопом, содержащим последовательность SEQ ID NO: 117 на N-конце лизил-тРНК синтетазы (KRS) или его функциональный фрагмент в качестве эффективного ингредиента.
В одном варианте воплощения в соответствии с одним аспектом настоящего изобретения предложен способ лечения заболеваний, связанных с миграцией иммунных клеток, включающий введение нуждающемуся в этом субъекту эффективного количества композиции, состоящей из антитела, специфично связывающегося с эпитопом, содержащим последовательность SEQ ID NO: 117 в N-концевом домене лизил-тРНК синтетазы (KRS), или его функционального фрагмента.
В одном варианте воплощения в соответствии с другим аспектом настоящего изобретения предложен способ лечения заболеваний, связанных с миграцией иммунных клеток, включающий введение нуждающемуся в этом субъекту эффективного количества композиции, по существу состоящей из антитела, специфично связывающегося с эпитопом, содержащим последовательность SEQ ID NO: 117 в N-концевом домене лизил-тРНК синтетазы (KRS), или его функционального фрагмента.
При использовании в настоящем документе «лечение» относится к понятию, включающему ингибирование возникновения или рецидива заболевания, облегчение симптомов, уменьшение прямых или косвенных последствий заболевания, снижение скорости прогрессирования заболевания, улучшение течения заболевания, нормализация, облегчение или улучшение прогноза и/или профилактику. При использовании в настоящем документе термин «профилактика» относится к любому действию, которое ингибирует начало заболевания или отсрочивает его прогрессирование.
«Эффективное количество» по настоящему изобретению при введении субъекту относится к количеству, которое приводит к изменению миграции иммунных клеток или инвазии иммунных клеток или к улучшению, лечению и профилактическому эффекту в отношении обусловленного ими заболевания, и этот термин понимают со ссылкой на описанное выше в отношении дозировки.
«Субъект» может представлять собой животное, предпочтительно млекопитающее, в частности животное, включающее человека или может представлять собой клетку, ткань, орган и т.п., полученные от животного. Субъект может представлять собой пациента, нуждающегося в лечении.
«Агент или композиция» может принимать форму пищевой композиции, косметической композиции, фармацевтической композиции и т.д. и предпочтительно может представлять собой фармацевтическую композицию. Подробное описание фармацевтической композиции приведено выше.
ПОЛЕЗНЫЙ ЭФФЕКТ
Предложенные в настоящем изобретении антитела, специфичные к N-концу KRS, способны регулировать миграцию иммунных клеток, проявляя за счет этого весьма существенный эффект при профилактике, улучшении состояния и лечении при заболеваниях, обусловленных миграцией иммунных клеток.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На ФИГ. 1, где показаны микроскопические изображения мигрирующих клеток в трансвел-анализе миграции, представлен результат сравнения действий коллагена, фибронектина и ламинина на миграцию иммунных клеток (моноцитов/макрофагов).
На ФИГ. 2 показан график, на котором представлено количество клеток, измеренное (подсчитанное) на микроскопическом изображении на ФИГ. 1.
На ФИГ. 3, где показаны микроскопические изображения мигрирующих клеток в трансвел-анализе миграции, представлен результат сравнения действий различных подтипов ламинина (LN111, LN211, LN221, LN411, LN421, LN511, LN521) на миграцию иммунных клеток (моноцитов/макрофагов).
На ФИГ. 4 показан график, на котором представлено количество клеток, измеренное (подсчитанное) на микроскопическом изображении на ФИГ. 3.
На ФИГ. 5 представлены результаты Вестерн-блоттинга, подтверждающие увеличение количества KRS в мембране моноцита/макрофага в результате обработки LN421.
На ФИГ. 6, где показаны микроскопические изображения мигрирующих клеток в трансвел-анализе миграции, представлен результат сравнения ингибирующего действия антитела N3 (антитела, связывающегося с N-концом KRS) по настоящему изобретению на миграцию моноцита/макрофага, специфичного к LN421.
На ФИГ. 7 показан график, на котором представлено количество клеток, измеренное (подсчитанное) на микроскопическом изображении на ФИГ. 6.
На ФИГ. 8 показаны результаты Вестерн-блоттинга, подтверждающие, что повышенные концентрации KRS в мембранах моноцитов/макрофагов в результате воздействия LN421 снижались под действием антитела N3 (антитела, связывающегося с N-концом KRS), составляющего предмет изобретения.
На ФИГ. 9 показаны результаты подтверждения того, что KRS в области клеточной мембраны является эндоциторованным под действием под действием антитела N3 (антитела, связывающегося с N-концом KRS). Антитело к KRS (N3), меченое флуоресцентным зондом Alexa fluor 488 (Thermofisher), и имитационный IgG (Thermofisher), контрольную группу, обрабатывали и отслеживали перемещение антитела со временем. В это же время для подтверждения эндоцитоза использовали маркер лизосом Lysotracker (Лизотрекер) (Thermofisher).
На Фиг. 10 показаны результаты эксперимента по определению сайта связывания и относительной прочности связывания антитела N3 по настоящему изобретению с соответствующим участком N-концевой области KRS человека методом SPR (поверхностного плазмонного резонанса) (серая полоса внизу последовательности указывает на связывающую способность антитела N3 с соответствующим участком (F1-F5), где более темный цвет полосы указывает на более высокую прочность связывания). Серая полоса внизу последовательности показывает связывающую способность антитела N3 с соответствующим участком (F1-F5), где более темный цвет полосы указывает на более высокую прочность связывания.
На ФИГ. 11 показан сайт связывания и относительная связывающая способность антитела N3 к соответствующему участку по настоящему изобретению с N-концевой областью KRS человека (h), мыши (m) или крысы (r) по данным SPR. Показана последовательность эпитопа (серая полоса внизу последовательности показывает связывающую способность антитела N3 с соответствующим участком (F1-F5), где более темный цвет полосы указывает на более высокую прочность связывания).
На ФИГ. 12 показано изменение конечно-систолического давления правого желудочка (RVESP) в моделях легочной артериальной гипертензии (ЛАГ) в результате введения антитела N3 по настоящему изобретению (имитационный IgG: отрицательный контроль, Ат (антитело) 1 мг/кг: антитело N3 1 мг/кг, Ат 10 мг/кг: антитело N3 10 мг/кг, силденафил: положительный контроль).
На ФИГ. 13 показано изменение конечно-систолического давления левого желудочка (LVESP) в моделях легочной артериальной гипертензии (ЛАГ) в результате введения антитела N3 по настоящему изобретению (имитационный IgG: отрицательный контроль, Ат 1 мг/кг: антитело N3 1 мг/кг, Ат 10 мг/кг: антитело N3 10 мг/кг, силденафил: положительный контроль).
На ФИГ. 14 показан результат, подтверждающий на основании иммуногистохимического (ИГХ) окрашивания, что миграция и инвазия иммунных клеток уменьшаются в результате введения антитела N3 по настоящему изобретению в моделях легочной артериальной гипертензии (ЛАГ).
На ФИГ. 15 показан результат, подтверждающий, что общее количество иммунных клеток, увеличенное в БАЛ (жидкости бронхоальвеолярного лаважа) в мышиных моделях острого повреждения легких, уменьшалось в зависимости от концентрации вводимого антитела N3 (антитела, связывающегося с N-концом KRS).
На ФИГ. 16 показан результат, подтверждающий, что концентрация нейтрофилов, которое, в частности, увеличивается в жидкости бронхоальвеолярного лаважа (БАЛ) в мышиных моделях острого повреждения легких, уменьшалось в зависимости от концентрации вводимого антитела N3 (антитела, связывающегося с N-концом KRS).
На ФИГ. 17 показан результат, подтверждающий методом сортировки флуоресцентно-активированных клеток (FACS), что усиленная миграция и инвазия макрофагов (ГМ, CD11b+/F4/80+) в ткань легкого в мышиных моделях острого повреждения легких, уменьшалось в зависимости от концентрации вводимого антитела N3 (антитела, связывающегося с N-концом KRS).
На ФИГ. 18 представлен график результатов количественного определения ФИГ. 17.
На ФИГ. 19 представлено изображение ткани, показывающее ингибирование прогрессирующего тканевого фиброза в легочной ткани в мышиных моделях острого повреждения легких в результате лечения антителом N3 (антитела, связывающегося с N-концом KRS). Ткани каждой экспериментальной группы и контрольной группы наблюдали под микроскопом после окраски трихром по Массону.
На ФИГ. 20 показаны результаты измерения аффинности к N-концу KRS антитела N3-1, представляющего собой усовершенствованное антитело, отобранное на основании его высокой аффинности и специфичности к N-концевому пептиду KRS (остатки 1-72), и антитела N3 в качестве контроля способом твердофазного иммуноферментного анализа (ИФА)
На ФИГ. 21 показаны результаты измерения аффинности к N-концу KRS антитела N3-1, антитела N3-3, антитела N3-4 и антитела N3-5, отобранных на основании их высокой аффинности и специфичности к N-концевому пептиду KRS (остатки 1-72), способом твердофазного иммуноферментного анализа (ИФА).
На ФИГ. 22 показан результат сравнения аффинности к KRS антитела N3 и антитела N3-1 методом SPR (поверхностного плазмонного резонанса).
На ФИГ. 23 показаны результаты ИФА измерения аффинности антитела N3-1, антитела N3-6, антитела N3-7, антитела N3-8 и антитела N3-9 к N-концу KRS.
На ФИГ. 24 показаны результаты сравнения аффинности к KRS методом поверхностного плазмонного резонанса (SPR), при этом подтверждающие основной связывающий участок антитела N3-6, антитела N3-7, антитела N3-8 и антитела N3-9.
На ФИГ. 25 показано изменение конечно-систолического давления правого желудочка (RVESP) в моделях легочной артериальной гипертензии (ЛАГ) в результате введения антитела N3, антитела N3-6 и антитела N3-8 соответственно.
На ФИГ. 26 показан результат, подтверждающий на основании ИГХ окрашивания, что миграция и инвазия иммунных клеток уменьшаются в результате введения антитела N3, антитела N3-6 и антитела N3-8 по настоящему изобретению соответственно в моделях легочной артериальной гипертензии (ЛАГ).
На ФИГ. 27 представлено изображение ткани, показывающее ингибирование прогрессирующего тканевого фиброза в легочной ткани в мышиных моделях острого повреждения легких в результате введения антител N3, N3-6 и N3-8 по настоящему изобретению соответственно.
СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение будет описано подробно.
Однако, приведенные ниже примеры являются иллюстративными для настоящего изобретения и настоящее изобретение не ограничено приведенными ниже примерами.
Пример 1. Проверка сигнальной роли ламинина в миграции и инвазии иммунных клеток
Во внеклеточном матриксе (ВКМ), составляющем кровеносные сосуды, были идентифицированы факторы, стимулирующие миграцию и инвазию моноцитов/макрофагов. С использованием коллагена (коллаген, Col), фибронектина (FN) и ламинина (LN) в качестве внеклеточного матрикса был проведен трансвел-анализ миграции. Конкретный экспериментальный способ описан ниже. После покрытия трансвелов (Corning, №3421-5 мм) желатином (0,5 мг/мл), в верхнюю камеру высевали клетки RAW 264,7 (1×105 клеток/лунка). Фибронектин или коллаген помещали в нижнюю камеру. В нижнюю камеру помещали не содержащую сыворотку среду DMEM (500 мкл), содержащую 10 мкг/мл ламинина (смесь ламининов, Biolamina), фибронектина или коллагена соответственно. Через 24 часа клетки обрабатывали 70% метанолом в течение 30 минут и фиксировали, а затем окрашивали 50% гематоксилином в течение 30 минут.
После извлечения не мигрировавших клеток с поверхности мембраны с помощью ватного тампона мембраны извлекали и помещали на предметное стекло. Мигрировавшие клетки с нижней стороны мембраны наблюдали и подсчитывали под микроскопом с высоким увеличением.
Как показано на Фиг. 1 и 2, подтвердили, что ламинин в различных внеклеточных матриксах сильнее всего стимулирует миграцию моноцитов/макрофагов. Таким образом, подтвердили, что миграция моноцитов/макрофагов сильнее всего реагировала на сигналы ламининов (LN) во внеклеточном матриксе (ВКМ).
Пример 2. Влияние различных подтипов ламинина на миграцию и инвазию иммунных клеток
Была проведена оценка влияния различных подтипов ламинина на миграцию и инвазию иммунных клеток. Трансвел-анализ миграции в проводили так же, как описано в примере 1, используя в качестве различных подтипов ламинина белки LN111, LN211, LN221, LN411, LN421, LN511 и LN521 в концентрации 1 мкг/мл (приобретенные у компании Biolamina). Конкретные последовательности подтипов ламинина обозначают в соответствии с цепями, составляющими каждый подтип ламинина, цепь α4 SEQ ID NO: 120, цепь α2 SEQ ID NO: 126, цепь α5 SEQ ID NO: 127, цепь β2 SEQ ID NO: 122, цепь β1 SEQ ID NO: 128, цепь γ1 SEQ ID NO: 124
Как показано на ФИГ. 3 и ФИГ. 4, было подтверждено, что среди различных подтипов ламинина моноциты/макрофаги специфично перемещаются в ответ на подтип α4β2γ1 (LN421). Таким образом, было подтверждено, что миграция моноцитов/макрофагов среди других подтипов ламинина специфична для LN421.
Пример 3. Перемещение цитоплазматического KRS к клеточной мембране после обработки иммунных клеток ламинином: идентификация новой патологии заболеваний, обусловленных миграцией иммунных клеток
После рассева клеток RAW 264,7 (2×106 клеток) в дисковом планшете на 100 лунок и инкубации в течение 18 ч в среде DMEM, не содержащей сыворотку, их обрабатывали 1 мкг/мл LN421, и клетки собирали через 0 ч, 12 ч и 24 ч. Белки клеток RAW 264,7 разделяли на цитозольную и мембранную фракции с помощью набора реактивов для экстракции субклеточного протеома ProteoExtract® (Calbiotech, № по каталогу 539790). Полученный белок подвергали электрофорезу, переносили на поливинилиденфторидную (ПВДФ) мембрану (Millipore) и блокировали 3% обезжиренным молоком. Затем KRS определяли методом Вестерн-блоттинга. В частности, поликлональное антитело к KRS (кролик, Neomics, Co. Ltd. №NMS-01-0005) добавляли для связывания на 1 час. Несвязанное антитело удаляли и затем вносили антикроличье второе антитело (Thermo Fisher Scientific, №31460). После реакции со вторым антителом пленку проявлялась в темном помещении, используя в качестве субстрата реактив ECL. Выявленные полосы сравнивали со стандартными маркерами молекулярной массы, чтобы идентифицировать полосы, соответствующие размеру KRS. Для идентификации маркеров цитоплазматической мембраны и цитозоля соответственно использовали антитела к Na+/K+ АТФазе (Abcam, ab76020) и тубулину (Santa cruz SC-5286).
Как показано на ФИГ. 5, было подтверждено, что количество KRS, обнаруживаемое в области клеточной мембраны, увеличивалось сопоставимо с частичным снижением количества KRS, обнаруживаемого в области цитозоля, при обработке моноцитов/макрофагов LN421. Данные результаты позволяют предположить, что KRS при экспрессии в моноцитах/макрофагах, обычно присутствующий в области цитоплазмы, под действием LN421 мигрирует в область клеточной мембраны. Считают, что специфичное увеличение количества KRS в области мембраны иммунных клеток представляет собой важное патологическое явление при заболеваниях, обусловленных миграцией и инвазией иммунных клеток.
Пример 4. Контроль миграции/инвазии иммунных клеток посредством снижения концентраций KRS, локализованного в области клеточной мембраны и подтверждение терапевтических эффектов для заболеваний, связанного с миграцией иммунных клеток. Применение соединений, ингибирующих миграцию KRS в направлении клеточной мембраны
По результатам описанных выше примеров авторы настоящего изобретения подтвердили, что внутриклеточное поведение KRS значительно влияет на миграцию моноцитов/макрофагов. В частности, явление специфичного возрастания концентрации KRS в области клеточной мембраны иммунных клеток по мере перемещения KRS в направлении клеточной мембраны считают важным патологическим механизмом заболеваний, обусловленных миграцией и инвазией иммунных клеток. Таким образом, авторы настоящего изобретения подтвердили, что подавление этого патологического поведения KRS можно применять в качестве одной из терапевтических стратегий при заболеваниях, связанных с миграцией и инвазией иммунных клеток, как раскрыто в заявках на патенты Кореи 10-2017-0076718 и 10-2018-0069146.
В описанном выше документе авторы настоящего изобретения раскрыли соединения, которые ингибируют перемещение KRS к клеточной мембране, в целях ингибирования увеличения концентрации KRS в мембране иммунных клеток при заболеваниях, связанных миграцией иммунных клеток и их терапевтический эффект при заболеваниях, связанных с миграцией иммунных клеток, был подтвержден и изучен.
В кратком изложении, в целях подавления увеличения концентрации KRS в мембране иммунных клеток были обнаружены соединения, такие как BC-KI-00053 (4-({(7-фторбензо[d]тиазол-2-ил)[2-(4-метоксифенил)этил]амино}метил)бензойная кислота) в качестве репрезентативного примера ингибитора миграции KRS к клеточным мембранам. При воспалительных состояниях, таких как острые воспалительные реакции (например, модели кожной раны уха) и ишемические иммунные ответы (например, модели ишемически-реперфузионного повреждения печени), было также подтверждено ингибирование миграции и инвазии иммунных клеток в результате введения ингибиторов миграции KRS в направлении клеточной мембраны (в частности, BC-KI-00053) и выявлен эффект облегчения заболевания. Кроме того, в моделях заболеваний, связанных с миграцией иммунных клеток, in vivo, таких как фиброз печени, легочная артериальная гипертензия (ЛАГ), гипертензия, протеинурия, гломерулосклероз, фиброз почек и миофиброз сердца, а также синдром Альпорта, болезненное состояние, вызванное миграцией и инвазией иммунных клеток, было подтверждено болезненное состояние, и в данном случае был подтвержден эффект лечения заболевания соединением, ингибирующим миграцию KRS в направлении клеточной мембраны.
Пример 5. Конструирование антитела, снижающего концентрацию KRS в области клеточной мембраны, и проверка эффекта контроля миграции/инвазии иммунных клеток
5-1. Конструирование антитела, специфично связывающегося с KRS-N-концом: антитело N3
Поскольку соединение примера 4 проявляло эффект лечения и улучшения при заболеваниях, связанных с миграцией/инвазией иммунных клеток, посредством ингибирования увеличения концентрации KRS в области клеточной мембраны, авторы настоящего изобретения, основываясь на аналогичном принципе, предприняли попытку создания антитела, обладающего превосходной терапевтической эффективностью. С другой стороны, авторы настоящего изобретения определили, что при перемещении KRS из цитоплазмы и локализации в клеточной мембране также происходила экспозиция некоторых N-концевых областей (обычно аминокислотных остатков 1-72 N-конца KRS) на внеклеточной мембране. Таким образом, они посчитали, что среди антител к KRS наиболее значимым преимуществом при ингибировании миграции/инвазии иммунных клеток in vivo будет обладать антитело, способное к связыванию KRS-N-конца, и в качестве репрезентативного примера авторы настоящего изобретения подтвердили эти терапевтические преимущества путем конструирования антитела N3, как описано ниже. Антитело N3 было получено описанным ниже методом.
В частности, чтобы подобрать scFv, который будет специфично связываться только с N-концевой областью KRS (SEQ ID NO: 148), экспонированной на внешней мембране при перемещении в направлении клеточной мембраны в ответ на сигнал ламинина, на полноразмерной последовательности KRS человека (SEQ ID NO: 118), был проведен эксперимент по пэннингу библиотеки фагового дисплея с использованием фаговой библиотеки scFv, полученной из В-клеток человека, меченной НА меткой. Библиотека фагового дисплея scFv (размер библиотеки: прибл. 7,6×109; библиотека создана проф. Hyunbo Shim), использованная в этом эксперименте, описана в патенте Кореи 10-0961392.
В качестве антигенных белков для эксперимента по пэннингу фагового дисплея использовали полноразмерные последовательности KRS человека и фрагменты KRS различных конкретных участков N-концевой области.
Конкретно эксперимент по пэннингу фагового дисплея проводили, как описано ниже. 1-10 мкг антигенного белка вносили в пробирку для иммунологических реакций, содержащую 1 мл 1-кратного фосфатно-солевого буферного раствора, и наносили антиген в виде покрытия на внутреннюю поверхность пробирки путем проведения реакции при 37°С и 200 об/мин в течение 1 часа. Раствор антигена осушали, и несвязанные антигены удаляли, промывая один раз водопроводной водой. Для предотвращения неспецифического связывания между антигенным белком и фагом в иммунопробирке проводили реакцию библиотеки scFv с 1-кратным раствором ФСБ-Т (ФСБ (фосфатно-солевого буферного раствора), содержащим 0,05% Твин 20), содержащим 3% обезжиренное молоко, при комнатной температуре в течение 1 часа. После удаления обезжиренного молока из иммунопробирки добавляли библиотеку scFv и проводили реакцию при 37°С и 150 об/мин в течение 1 часа для связывания фага scFv с антигеном. ScFv фага, специфично связавшийся с каждым антигеном, отделяли в течение 10 минут добавлением 1 мл триэтиламина (100 мМ) при комнатной температуре и нейтрализовали Трис (1 М, рН 7,4). Отфильтрованный фаг scFv добавляли к штамму ER2537 Е. coli, инкубируемому при оптической плотности (OD) менее 1, а затем инфицировали в ходе инкубации при 37°С и 120 об/мин в течение 1 часа и 30 минут. Инфицированные фагом Е. coli центрифугировали, чтобы удалить некоторую часть супернатанта культуры, и повторно диспергировали для рассева на чашки диаметром 15 см с агарозой, содержащей ампициллин и глюкозу (2%). На следующий день на чашках распределяли 5 мл среды SB, чтобы получить все клетки, выросшие на чашке, и добавляли глицерин (50%) до 0,5-кратного общего объема, перемешивали и делили на аликвоты по 1 мл для хранения при минус 80°С (исходная культура для пэннинга scFv). Двадцать мкл подготовленной исходной культуры инокулировали в 20 мл раствора SB, культивировали и использовали фаг-помощник для подготовки фаговой библиотеки scFv (1 мл) к фаговому пэннингу на следующей стадии. Для выделения фага, экспрессирующего специфичный к антигену scFv, описанную выше процедуру повторяли 2-3 раза.
После биопэннинга проводили Вестерн-блоттинг и дополнительно проводили иммунопреципитацию, чтобы отобрать клоны scFv, обладающие высокой способностью к связыванию с белком-мишенью.
Отобранные фрагменты scFv преобразовывали в IgG (полноразмерное антитело) и использовали следующие конкретные способы. Сначала полинуклеотиды, кодирующие scFv в геноме клона scFv, амплифицировали с помощью ПЦР. Для амплификации генов области VH scFv использовали следующие последовательности оснований праймеров: прямой (AGA GAG TGT АСА СТС С СА GGC GGC CGA GGT GCA G, SEQ ID NO: 129) и обратный (CGC CGC TGG GCC CTT GGT GGA GGC) TGA GCT САС GGT GAC CAG, SEQ ID NO: 130). Для амплификации генов области VL scFv использовали следующие последовательности оснований праймеров: прямой (AAG CGG CCG ССА ССА TGG GAT GGA GCT GTA ТСА ТСС ТСТ ТСТ TGG TAG САА CAG СТА CAG GTG ТАС ACT CCC AGT CTG TGC TGA СТС AG, SEQ ID NO: 131) и обратный (CGC CGC CGT ACG TAG GAC CGT CAG CTT GGT, SEQ ID NO: 132). ПЦР с каждой фаговой ДНК (50 нг) в качестве матрицы проводили с использованием этих праймеров (10 пмоль каждого) в следующих условиях: 95°С/3 мин; 95°С/30 с, 60°С/30 с, 72°С/30 с, 30 циклов; 72°С/5 мин, в результате чего амплифицировали гены VH или VL scFv. Продукт ПЦР встраивали с помощью ферментов рестрикции в вектор pcDNA3.4 (Thermo Fisher Scientific), используемый для продуцирования IgG. Белки тяжелой и легкой цепи IgG соответственно экспрессировали отдельно на плазмидах.
Подготовленный таким путем вектор, содержащий ДНК, кодирующую тяжелые и легкие цепи IgG, включающие вариабельную область scFv, котрансформировали в клетки 293F FreeStyle (ATCC), чтобы обеспечить в этих клетках совместную экспрессию легких и тяжелых цепей. Для получения супернатанта трансформированные клетки 293F инкубировали в условиях 37°С и 8% CO2 в течение 7 дней. Супернатанты фильтровали с помощью фильтра из целлюлозоацетатной мембраны (размер пор 0,22 мкм, Coming) и очищали на колонке с белком A CaptivA™ PriMAB (Repligen, США). Концентрацию полученного антитела измеряли с помощью набора реактивов ВСА (Pierce, 23225) и проводили анализ белка антитела IgG в восстанавливающих и невосстанавливающих условиях с помощью биоанализатора (Agilent 2100 Bioanalyzer).
5-2. Идентификация эффективности ингибирования на миграцию и инвазии иммунных клеток
Было подтверждено влияние различных антител-кандидатов, полученных, как описано в разделе 5-1 на миграцию и инвазию иммунных клеток. Конкретная экспериментальная методика описан ниже. Трансвелы (Corning, №3421-5 мм) покрывали желатином (0,5 мг/мл), а затем в верхнюю камеру высевали клетки RAW 264,7 (1×105 клеток/лунка). В нижнюю камеру помещали не содержащую сыворотку среду DMEM (500 мкл), содержащую Ламинин 421 (1 мкг/мл). Каждое антитело обрабатывали в верхней камере в концентрации 100 нМ. Через 24 часа клетки фиксировали 70% метанолом в течение 30 мин, а затем окрашивали 50% гематоксилином в течение 30 мин. После удаления не мигрировавших клеток с верхней части мембраны ватным тампоном мембрану извлекали и помещали на предметное стекло. Мигрировавшие клетки с нижней стороны мембраны наблюдали под микроскопом с высоким увеличением (ФИГ. 6), определяли количество клеток на полученном изображении и отображали графически (ФИГ. 7).
Кроме того, после добавления Ламинина 421 (1 мкг/мл) и антитела (100 нМ) в клетки RAW 264,7 клетки инкубировали и собирали в течение 24 часов. Впоследствии, используя набор реактивов для экстракции субклеточного протеома ProteoExtractte (Calbiochem), образцы разделяли на мембранные и цитозольные фракции, а затем проводили Вестерн-блоттинг на KRS. Конкретная методика описана в примере 2.
В результате было подтверждено, что моноклональное антитело N3 (антитело, специфично связывающееся с N-концом KRS) по настоящему изобретению эффективно ингибирует LN421-зависимую миграцию моноцитов/макрофагов, как показано на ФИГ. 6 и 7. В дополнение к этому, как показано на ФИГ. 8, обработка LN421 приводила к повышению уровня KRS моноцитов/макрофагов в области клеточной мембраны, и было подтверждено, что уровень KRS в области клеточной мембраны эффективно снижался в результате обработки моноклональным антителом N3. Кроме того, как показано на Фиг. 9, было подтверждено, что при связывании антитела N3 с областью KRS (в частности, с N-концевой областью), экспонированной во внеклеточном пространстве, происходит эндоцитоз. Это антитело не только ингибирует миграцию KRS из цитоплазмы к клеточной мембране, но также можно предположить, что оно ингибирует миграцию иммунных клеток и дает возможность лечить заболевания, связанные с миграцией иммунных клеток, путем активного удаления KRS, уже мигрировавшего к клеточной мембране, с помощью соединения (в частности, агента, специфично связывающегося с N-концом, экспонированным снаружи клетки), которое специфично связывается с KRS. Данные результаты подтвердили, что антитело, связывающееся с N-концом KRS, возможно применять в качестве нового терапевтического агента для лечения заболеваний, обусловленных миграцией/инвазией иммунных клеток.
5-3. Секвенирование антитела N3
Последовательности антител N3 scFv (SEQ ID NO: 59) и N3 IgG (SEQ ID NO: 89 и SEQ ID NO: 91) были подтверждены с использованием праймера Omp в соответствии с методикой, описанной в работе Hye young Yang, et. al., 2009, Mol. Cells 27, 225-235. В полученной таким образом последовательности была подтверждена последовательность области CDR с помощью программы Bioedit. Результаты секвенирования антигенсвязывающего участка представлены в таблице 1, и scFv дополнительно содержит линкер SEQ ID NO: 57.


5-4. Проверка связывающего участка KRS моноклонального антитела N3
Для подтверждения участка связывания моноклонального антитела N3 в N-концевой области KRS человека был проведен следующий эксперимент. Сначала, как показано на ФИГ. 10 и в таблице 2, анализ связывающей способности антитела N3 был проведен методом поверхностного плазмонного резонанса (SPR) с использованием пептидных фрагментов KRS F1-F5 для несколько различающихся участков в N-концевой области KRS SEQ ID NO: 148 в качестве антигена (эпитопа). Эксперимент SPR был проведен с использованием прибора Biacore T200 (GE Healthcare), оборудованного сенсорным чипом СМ5 серии S (GE Healthcare), при 25°С. После фиксации антитела на чипе с помощью набора реактивов для аминосочетания (GE Healthcare) каждый антигенный пептид растворяли в растворе ФСБ, а затем разводили в два раза в диапазоне концентраций от 156 до 15 000 нМ и оставляли протекать в течение 60 секунд. Затем ФСБ протекал в течение 300 секунд. Полученные данные анализировали с помощью программного обеспечения для оценки результатов Biacore T200 версии 2.0 (GE Healthcare).


Как показано на ФИГ. 10, связывание антитела N3 IgG с пептидом F5 отсутствует полностью, и показана его связывающая способность в порядке F4>F3>F2>F1. Фрагменты F4, F3, F2 и F1 имеют общие аминокислоты 15-29 на N-конце KRS человека, определяемые SEQ ID NO: 148. На основании этого было подтверждено, что участок 15-29 ак (аминоксилота) (участок 15-29 аминоксилотных остатков) играет важную роль в связывании антитела N3 с KRS человека, и аминокислоты в положении 15-42 в KRS человека, и основным связывающим участком антитела N3 в пределах этого участка считают аминокислоты в положении 15-29 в KRS человека, соответствующие полипептиду F4.
5-5. Проверка оценки эффективности моноклонального антитела N3 в других биологических моделях
Чтобы подтвердить, можно ли оценивать эффективность антитела N3 по настоящему изобретению путем конструирования биологических моделей заболевания на мышах и крысах, был проведен анализ подобия последовательностей в N-концевых последовательностях KRS у этих биологических видов. Как показано на ФИГ. 11 и в таблице 2, в качестве антигенов (эпитопов) использовали пептидные фрагменты KRS F1-F5 для несколько различающихся участков в N-концевых областях KRS человека (h), мыши (m) и крысы (r). Анализ связывающей способности антитела N3 проводили методом поверхностного плазмонного резонанса (SPR). Конкретная методика описана в примере <5-4>.
Как показано на ФИГ. 11, поскольку антитело N3 проявляет одинаковый характер связывания у человека (h), мыши (m) и крысы (r), его связывание с пептидом F5 полностью отсутствует. Антитело проявляет связывающую активность в порядке F4>F3>F2>F1. При сравнении последовательностей F1-F4 каждого вида они содержали общую последовательность KLSKNELKRRLKA. Считают, что участок, состоящий из аминокислот 17-29 (SEQ ID NO: 117), играет важную роль в связывании антитела в пределах аминокислот 15-29 в KRS, идентифицированных в примере 5-4. На основании результатов этого эксперимента считают, что возможна перекрестная реактивность антитела N3 между биологическими видами; этот факт свидетельствует о том, что модели на мышах и крысах можно использовать для исследования токсичности и эффективности антитела N3 in vivo.
Пример 6. Проверка эффективности антител, специфично связывающих N-конец KRS, в in vivo моделях заболеваний, связанных с миграцией иммунных клеток. In vivo: модели легочной гипертензии in vivo
Обработка антителом, которое специфично связывается с N-концом KRS, ингибирует миграцию/инвазию иммунных клеток посредством снижения уровней KRS (в результате эндоцитоза и т.д.) в области клеточной мембраны, приводя к такому же эффекту, что и соединение примера 4 (снижение уровня KRS в клеточной мембране). Поэтому очевидно, что антитело, специфичное к N-концу KRS, по настоящему изобретению (в характерном случае антитело N3) будет проявлять терапевтический эффект при таком же показании к применению (заболевания, связанные с миграцией иммунных клеток), что и соединение примера 4, что дополнительно продемонстрировано в следующих примерах.
Способы эксперимента
1) Конструирование моделей легочной гипертензии (ЛАГ) и введение исследуемого вещества
Для индукции ЛАГ у крыс линии SD (Oriental Bio) 7-недельного возраста им вводили подкожно 60 мг/кг МСТ (монокроталина). Затем крыс делили на четыре группы (по пять экспериментальных животных в каждой группе) и вводили 1 мг/кг имитационного IgG человека (Thermo Fisher Scientific, отрицательный контроль), 1 мг/кг антитела N3 IgG, 101 мг/кг антитела N3 IgG и 25 1 мг/кг силденафила (положительный контроль) в течение 3 недель. Все антитела вводили в/в два раза в неделю, а силденафил вводили перорально ежедневно.
2) Измерение кровотока и артериального давления
Через три недели крыс анестезировали изофлураном и проводили измерения кровотока и артериального давления с помощью системы измерения сердечно-сосудистого давления и объема MPVS (название модели: MPVS Ultra, производитель: Millar Instruments). Конечно-систолическое давление правого желудочка (RVESP), конечно-диастолическое давление правого желудочка, конечно-систолическое давление левого желудочка, конечно-диастолическое давление левого желудочка измеряли, используя эксклюзивный катетер (катетер для измерения давления у крыс Mikro-Tip, производитель: Millar Instruments). Сердечный выброс измеряли с помощью преобразователя периваскулярного кровотока (преобразователи Transonic Flow, производитель: Millar Instruments), и экспериментальную методику выполняли так же, как раскрыто в следующих литературный источниках: Pacher P, Nagayama Т, Mukhopadhyay P, Batkai S, Kass DA. Measurement of cardiac function using pressure-volume conductance catheter technique in mice and rats. Nat Protoc 2008; 3(9): 1422-34.
3) Иммуногистохимия (ИГХ)
Собранные образцы легких фиксировали в ПФА (параформальдегиде) в соответствии с традиционной методикой, а затем проводили заливку в парафин посредством промывания, обезвоживания и очистки. Получали срезы парафиновых блоков легочной ткани крыс толщиной 3 мкм и помещали на предметное стекло. Сначала образец обрабатывали ксилолом три раза по 5 мин, обрабатывали 100%-м этанолом, 95%-м этанолом, 90%-м этанолом и 70%-м этанолом и деионизированной водой (ДВ) по 2 мин в указанном порядке и промывали ФСБ в течение 5 мин. После обработки 0,3% Н2О2 образец промывали ФСБ два раза по 5 мин. После погружения в 0,01 М цитратный буферный раствор и нагревания образец промывали ФСБ-Т (0,03% Твин 20), а затем проводили блокирование при комнатной температуре в течение 30 минут (2% бычий сывороточный альбумин (БСА) и 2% козья сыворотка в ФСБ). Образец окрашивали в течение ночи при 4°С антителом к CD68 (1: 200, клон ED1, Abcam). После промывания образца ФСБ-Т три раза по 5 минут образец обрабатывали антимышиным полимером, меченым пероксидазой хрена (HRP), из набора реактивов Envision (DAKO) в течение 1 часа при 4°С. После промывания образца ФСБ-Т его проявляли буферным раствором для субстрата DAB с хромогенным красителем DAB 20. Окрашенную ткань обрабатывали гематоксилином Майера (Sigma) в течение 1 минуты, а затем обрабатывали два раза по 2 минуты в следующем порядке: 70%-м этанол, 90%-м этанол, 95%-м этанол и 100%-м этанол. Наконец, ткань обрабатывали ксилолом три раза по 5 мин, а затем наблюдали под световым микроскопом.
Результаты
6-1. Проверка изменений артериального давления и сердечного выброса. В моделях ЛАГ, которая представляет собой заболевание, имеющее тесную взаимосвязь патологических явлений с инвазией иммунных клеток, вводили антитело N3 IgG (1 мг/кг или 10 мг/кг) в течение 3 недель (в/в (внутривенно), два раза в неделю), а затем измеряли конечно-систолическое давление правого желудочка (RVESP), конечно-диастолическое давление правого желудочка (RVEDP), конечно-систолическое давление левого желудочка (LVESP), конечно-диастолическое давление левого желудочка (LVEDP) и сердечный выброс (СО). Результаты представлены в таблице 3.
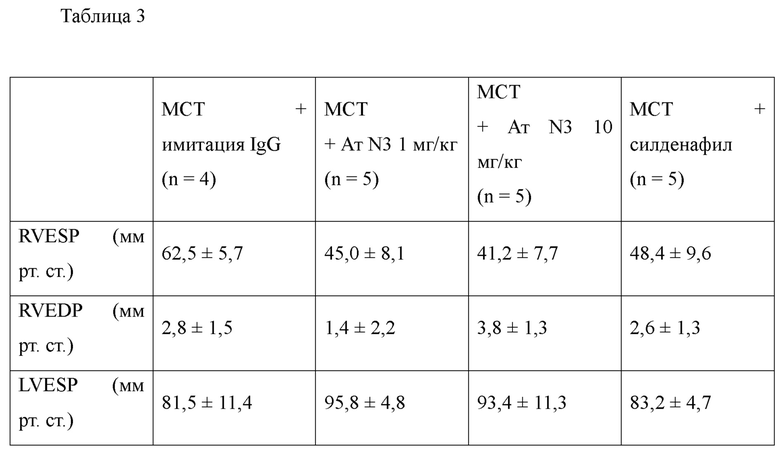

(СО не измеряли в одном животном в группе МСТ + имитация IgG и одно животное в группе лечения силденафилом, поскольку они погибли во время анестезии и во время операции, соответственно)
Легочная гипертензия приводит к повышению давления в правом желудочке сердца из-за сужения легочной артерии, что приводит к недостаточности правого желудочка. В дополнение к этому при разрушении механизма подкрепления вследствие стойкой гипертензии впоследствии наступает расширение правого желудочка. Это вызывает сдавливание левого желудочка за счет перемещения межжелудочковой перегородки и снижение конечно-диастолического объема левого желудочка и сердечного выброса (Lee Woo-seok et al., 2007; 37: 265-270). В результате легочная гипертензия связана, в основном, с правым желудочком, но также влияет на функцию левого желудочка.
У пациентов с ЛАГ показано повышение RVESP, что также было подтверждено на животной модели ЛАГ в данном эксперименте. Напротив, как показано на ФИГ. 12, антитело N3 (антитело, специфично связывающееся с N-концом KRS) в обеих концентрациях вызывало значительное снижение RVESP, и в частности вызывало большее снижение RVESP, чем положительный контрольный лекарственный препарат силденафил.
В дополнение к этому после введения антитела N3 (антитела, специфично связывающегося с N-концом KRS) снижение конечно-систолического давления в левом желудочке (LVESP) отсутствовало. Вместо этого в группе, которой вводили антитело по настоящему изобретению, LVESP значительно повышалось, как показано на ФИГ. 13. Это, напротив, не приводит к риску снижения системного артериального давления за счет расширения легочной артерии, а также системного расширения артерии в случае силденафила, который применяется в качестве традиционного терапевтического препарата для лечения легочной гипертензии. Таким образом, было подтверждено, что антитело по настоящему изобретению проявляется тенденцию к незначительному воздействию на системное артериальное давление по сравнению с силденафилом и этот эффект считают благоприятной характеристикой терапевтического агента с учетом того, что введение силденафила в условиях клинического применения может вызывать риск развития гипотензии. Кроме того, тяжелая легочная артериальная гипертензия вызывает систолическую недостаточность правого желудочка, которая может сопровождаться уменьшением сердечного выброса и системной гипотензией. Принимая во внимание эти данные, ожидают, что введение антитела N3 по настоящему изобретению для облегчения легочной гипертензии приведет к увеличению сердечного выброса и повышению системного артериального давления, в результате чего артериальное давление нормализуется.
В итоге, было подтверждено, что введение антитела, специфично связывающееся с N-концом KRS (в частности, антитела N3), по настоящему изобретению снижает риск побочных эффектов, характерных для существующих терапевтических препаратов, и показано ослабление симптомов ЛАГ и эффекты лечения.
6-2. Эхокардиография
D-образная форма левого желудочка, указывающая на перегрузку давления в правом желудочке, была обнаружена у трех животных в группе, которой вводили только МСТ (т.е. в модели ЛАГ без введения исследуемого вещества) и у трех животных в группе, которой вводили МСТ и силденафил, но этого не наблюдалось в группах, которым вводили терапевтическое антитело.
Кроме того, как показано ниже в таблице 4, масса тела в каждой группе увеличивалась в одинаковой степени без значимых различий. Таким образом, результаты, указывающие на признаки патологии, включая патологическое снижение массы тела, вызванное введением терапевтического антитела, не отмечены.

6-3. Проверка степени миграции и инфильтрации моноцитов/макрофагов
С использованием легочной ткани от каждой экспериментальной группы проводили ИГХ окрашивание на CD68, который является маркером моноцитов/макрофагов. Как показано на ФИГ. 14, было подтверждено, что в группе, получавшей антитело N3 (антитело, связывающееся с N-концом KRS) по настоящему изобретению, явным образом уменьшалась инфильтрация моноцитов/макрофагов в легочные ткани, и такой эффект значительно превосходил эффект силденафила.
Пример 7. Проверка эффекта антитела, специфично связывающего N-конец KRS, в моделях заболеваний, обусловленных миграцией иммунных клеток, in vivo: модели острого повреждения легких
Способы
1) Конструирование моделей индуцированного ЛПС (полисахарид) острого повреждения легких и введение исследуемого вещества
Мышиные модели острого повреждения легких конструировали путем интратрахеального введения 2,5 мг/кг липополисахарида (ЛПС) (Sigma) 7-недельным самцам мышей C57BL/6 (Duothermal Bio). Для изучения эффектов ингибиторов KRS по отношению к острому повреждению легких мышам C57BL/6 сначала проводили внутривенную инъекцию антитела N3 IgG в дозе 1 мг/кг или 10 мг/кг соответственно, а затем через 24 часа проводили эндотрахеальное введение 2,5 мг/кг ЛПС. Через двадцать четыре часа после введения ЛПС каждую мышь умерщвляли и собирали на анализ образцы легочной ткани и БАЛ (жидкости бронхоальвеолярного лаважа).
2) Количество иммунных клеток в жидкости бронхоальвеолярного лаважа (БАЛ) Собирали БАЛ, полученную после промывания легких ФСБ, и осадки собирали центрифугированием при 800×g в течение 10 минут при 4°С. После суспендирования клеток эритроциты удаляли с помощью буфера для лизиса эритроцитов (eBioscience, № по каталогу 00-4333-57). После остановки реакции ФСБ клетки промывали два раза и суспендировали в 400 мкл ФСБ для измерения количества клеток с помощью гемоцитометра и количества нейтрофилов путем окрашивания Гема3.
3) Сортировка флуоресцентно-активированных клеток (FACS) на иммунных клетках в легочной ткани
Ткани легких собирали и вращали в течение 45 мин при 37°С в gentleMACS Octo Dissociator (MACS Miltenyi Biotec, № по каталогу 130-095-937), чтобы разрушить ткань. После фильтрования с помощью клеточного сита (40 мкм) клетки центрифугировали при комнатной температуре в течение 5 минут при 1500 об/мин. Осадок собирали и эритроциты удаляли с помощью буфера для лизиса эритроцитов (eBioscience, №по каталогу 00-4333-57). Клетки собирали и ресуспендировали в буферном растворе для FACS (ФСБ, содержащем 1% NaN3 и 3% фетальную телячью сыворотку (ФТС)), 50 мкл помещали в пробирку, тщательно перемешивали с тем же количеством смеси антител и окрашивали в защищенном от света месте при 4°С в течение 1 часа. Для анализа перемещения интерстициальных макрофагов (IM) использовали меченое флуоресцеинизотиоцианатом (ФИТЦ) крысиное антитело к CD11b (BD Pharmingen) и меченое фикоэритрином (ФЭ) крысиное антимышиное антитело к F4/80 (BD Pharmingen). После промывания два раза при 400×g по 5 минут буферным раствором FACS, клетки анализировали с помощью цитометра Navios Flow Cytometer (Beckman).
4) Окрашивание легочной ткани методом трихром по Массону
Легочную ткань заливали в парафин по оригинальной методике, а затем получали срезы. Затем предметное стекло со срезом ткани, из которого парафин был удален с помощью ксилола, промывали деионизированной водой, после чего обрабатывали раствором Буэна при 56-60°С в течение 1 часа. После окрашивания раствором железного гематоксилина Вейгерта в течение 10 минут предметное стекло промывали. Затем снова проводили окрашивание раствором Бибрих алый - кислый фуксин и в течение 10-15 минут стекло промывали. Затем стекла обрабатывали раствором фосфомолибденовой и фосфовольфрамовой кислот в течение 10-15 минут, и затем стекла переносили в раствор анилинового синего и окрашивали в течение 5-10 минут. После промывания стекла обрабатывали 1% раствором уксусной кислоты в течение 2-5 минут. После промывания и сушки, предметное стекло обрабатывали ксилолом и размещали.
Результаты
7-1. Проверка ингибирующего эффекта на миграцию иммунных клеток в жидкости бронхоальвеолярного лаважа (БАЛ)
Как показано на ФИГ. 15, было подтверждено, что общее количество иммунных клеток в БАЛ у мышей с индуцированным ЛПС острым повреждением легких уменьшалось в зависимости от концентрации после введения антитела N3 (антитела, связывающегося с N-концом KRS). В частности, как показано на ФИГ. 16, было подтверждено, что у мышей с индуцированным ЛИС острым повреждением легких увеличивалось количество нейтрофилов, которое уменьшалось после введения антитела N3 (антитела, связывающегося с N-концом KRS). В результате было подтверждено значительное ингибирование инфильтрации в легкие иммунных клеток, в частности нейтрофилов, обнаруживаемых в БАЛ, в результате введения антитела, специфично связывающегося с N-концом KRS.
7-2. Проверка ингибирующего действия антитела на миграцию иммунных клеток в ткань легкого
На ФИГ. 17 и 18 показаны результаты анализа FACS мигрировавших макрофагов в ткань легкого вследствие острого повреждения легких. Интерстициальные макрофаги (IM) представляют собой клетки CD11b+/F4/80+, которые являются мигрирующими макрофагами, не находящимися в ткани легкого постоянно, но мигрирующими в легкое в определенных ситуациях. В результате введения ЛПС инфильтрация IM в легкое увеличивалась, но в результате введения антитела N3 миграция IM в легкое уменьшалась зависимым от концентрации образом. На этом основании было подтверждено ингибирование миграции и инвазии иммунных клеток, таких как макрофаги/моноциты, в ткань легкого в результате лечения антителами (в характерном случае антитела N3), специфично связывающихся с N-концом KRS. Избыточная миграция и инвазия иммунных клеток, таких как макрофаги/моноциты, является важным патологическим явлением в фиброзном поражении ткани. По результатам наблюдения окрашенной методом трихрома по Массону легочной ткани в модели острого повреждения легкого (ФИГ. 19) было подтверждено значительное прогрессирование фиброза в легочной ткани. Напротив, было подтверждено, что такое лечение введением антитела N3 ингибировало фиброз (антитела, специфично связывающегося с N-концом KRS).
Пример 8. Конструирование модифицированного антитела N3 с повышенной аффинностью к N-концу KRS
Авторы настоящего изобретения предприняли попытку получить антитело, обладающее лучшей аффинностью к N-концевой области KRS, путем модификации антитела N3 с целью получения антитела, проявляющего лучшие характеристики в качестве терапевтического антитела. Таким образом, вариабельная область легкой цепи и вариабельная область тяжелой цепи антитела N3 были усовершенствованы с помощью описанной ниже серии процессов.
8-1. Конструирование библиотеки scFab на основании вариантов последовательности антитела N3 (дрожжевая библиотека экспрессии на поверхности клеток): первичная библиотека
Для конструирования библиотеки с помощью способа гомологичного моделирования была предсказана приблизительная структура антитела N3, и на основании этого в область CDR вводили случайные мутации, которые предположительно играют важную роль в связывании антигена. В частности, в библиотеке, основанной на вариабельной области тяжелой цепи, использовали NNK который представляет собой вырожденный кодон и может включать все 20 остатков аминокислотных последовательностей в CDR2 или CDR3 тяжелой цепи. В библиотеке вариабельной области легкой цепи, использовали вырожденный кодон NNK, который может содержать 20 остатков аминокислотных последовательностей в CDR2 или CDR3 легкой цепи антитела N3. ДНК, кодирующую сконструированную библиотеку, амплифицировали методом ПЦР, а затем концентрировали методом осаждения этанолом.
Затем была сконструирована библиотека scFab, экспрессируемая на поверхности дрожжевых клеток, содержащая различные варианты вариабельной области легкой цепи, со ссылкой на способы, описанные в следующем литературном источнике: Baek DS and Kim YS, Construction of a large synthetic human Fab antibody library on yeast cell surface by optimized yeast mating, J Microbiol Biotechnol. 2014 Mar 28; 24(3):408-20.
Кратко, дрожжевые экспрессионные векторы для экспрессии на поверхности клетки (C-aga2: pYDS), экспрессирующие белок aga2 на С-конце для гомологичной рекомбинации, обрабатывали ферментами рестрикции NheI и MluI, очищали путем экстракции из агарозного геля и концентрировали методом осаждения этанолом.
4 мкг вектора, обработанного ферментом рестрикции, в 12 мкг ДНК, кодирующей каждую библиотеку, трансформировали методом электропорации в штамм дрожжей EBY100 (дрожжи для экспрессии на поверхности) и подтверждали размер библиотеки путем измерения количества колоний, выросших на селективной среде SD-CAA (20 г/л глюкозы, 6,7 г/л дрожжевых азотистых оснований без аминокислот, 5,4 г/л Na2HPO4, 8,6 г/л NaH2PO4, 5 г/л казаминовых кислот) в результате серийного разведения.
8-2. Скрининг scFab с улучшенной аффинностью к пептиду KRS (остатки 1-72 ак (аминокислота)): первый отбор библиотеки
Fab с повышенной аффинностью отбирали из библиотеки, сконструированной в примере 8-1, с помощью конъюгированного с глутатион-8-трансферазой (GST) пептида KRS (остатки 1-72 ак N-конца) в качестве антигена.
В частности, 10 нМ GST-конъюгированного пептида KRS (остатки 1-72 ак; в очищенном состоянии), используя среду SG-CAA (20 г/л галактозы, 6,7 г/л дрожжевых азотистых оснований без аминокислот, 5,4 г/л Na2HPO4, 8,6 г/л NaH2PO4, 5 г/л казаминовых кислот) для первичного скрининга FACS, подвергали взаимодействию с дрожжами с индуцированной экспрессией библиотеки scFab на поверхности клеток примера 8-1 в течение 1 часа при комнатной температуре. Затем GST-конъюгированный пептид KRS (остатки 1-72) и дрожжи, экспрессирующие библиотеку, подвергали реакции с фикоэритриновым конъюгатом, представляющим собой конъюгированный с фикоэритрином (ФЭ) стрептавидин-R(SA-РЕ), при 4°С в течение 20 минут и суспендировали в FACS (прибор для сортировки флуоресцентно-активированных клеток, FACS Caliber; BD biosciences). Впоследствии проводили второй скрининг FACS с пептидом KRS (остатки 1-72), конъюгированным с 1 нМ GST и третий скрининг FACS с пептидом KRS (остатки 1-72), конъюгированным с 0,5 нМ GST.
На протяжении всего процесса отбора с помощью FACS клоны с высокой аффинностью к KRS (остатки 1-72) сравнивали с антителом N3. Таким путем было отобрано три превосходных клона (N3-1, N3-3, N3-4), обладающих высокой аффинностью и специфичностью к пептиду KRS (остатки 1-72) на основании анализа связывающей способности отдельных клонов, и для конструирования другого уникального клона N3-5 объединяли другую вариабельную область легкой цепи с вариабельной областью тяжелой цепи. Было также подтверждено, что клон N3-5 обладает превосходной аффинностью и специфичностью к пептиду KRS (остатки 1-72), и, в конечном счете, было отобрано в общей сложности четыре уникальных (на основании активируемой магнитным полем сортировки клеток) клона N3-1, N3-3, N3-4 и N3-5.
Последовательности CDR вариабельной области легкой цепи и вариабельной области тяжелой цепи четырех отдельных клонов N3-1, N3-3, N3-4 и N3-5, проявляющих высокую аффинность связывания с пептидом KRS (остатки 1-72), представлены в таблице 5, а в таблице 6 представлены полноразмерные последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи.
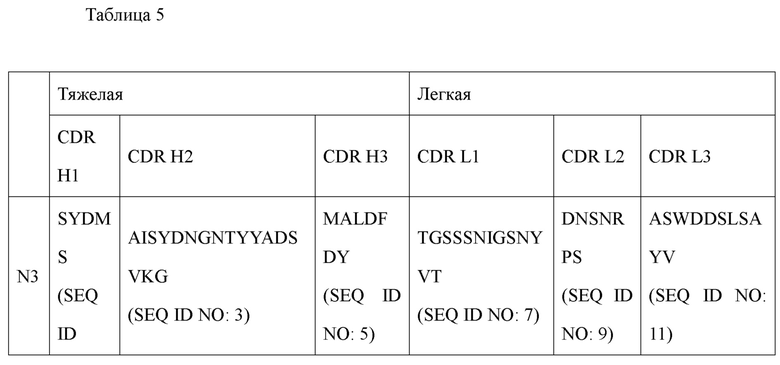
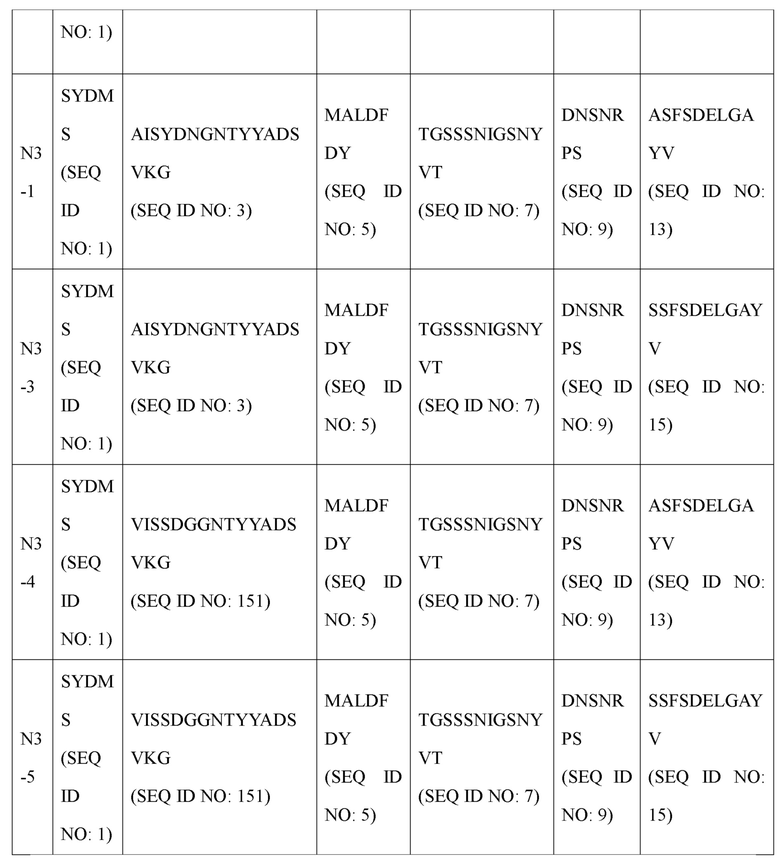

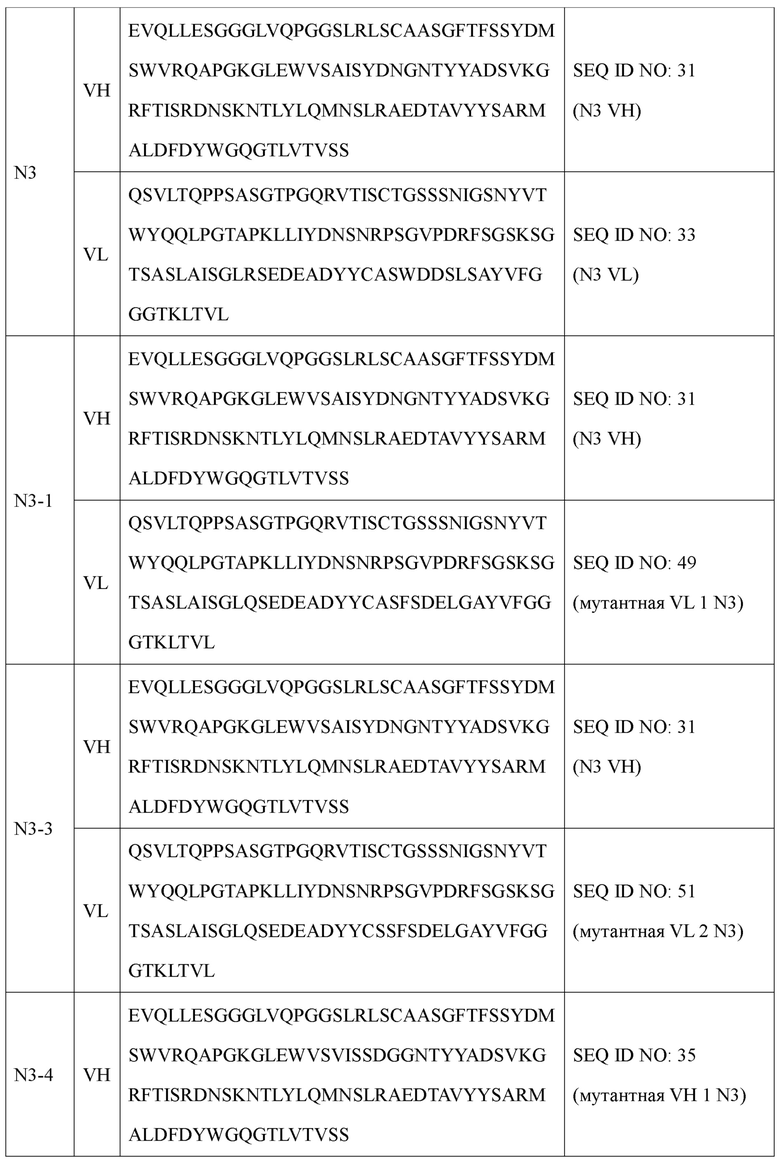

Кроме того, аффинность отдельных отобранных клонов N3-1, N3-3, N3-4 и N3-5 к N-концу KRS была дополнительно подтверждена с использованием метода ИФА. В этом эксперименте были исследованы клоны, преобразованные в антитело IgG. Преобразование антитела в IgG относится к методике, описанной выше в примере 5-1.
В частности, пептид N-концевой области (остатки 1-72) KRS обрабатывали в 96-луночном планшете для иммуноферментного/радиоиммунологического анализа (РИА) (COSTAR Corning) и проводили связывание при 25°С в течение 1 часа с последующим промыванием ФСБ (рН 7,4, 137 мМ NaCl, 12 мМ фосфат, 2,7 мМ KCl) (SIGMA) 3 раза по 10 минут. Затем проводили обработку 4% БСА в ФСБ (4%-й бычий сывороточный альбумин, рН 7,4, 137 мМ NaCl, 12 мМ фосфат, 2,7 мМ KCl) (SIGMA) в течение 1 часа, а затем промывали ФСБ 3 раза по 10 минут. Затем проводили обработку и связывание антитела N3, антитела N3-1, антитела N3-3, антитела N3-4 и антитела N3-5 IgG-типа соответственно, а затем промывали 0,1% ФСБ-Т три раза по 10 минут. В качестве меченого антитела использовали конъюгированное пероксидазой хрена мАт против человека (SIGMA). После этого проводили реакцию с ТМВ (3,3',5,5'-тетраметилбензидин) (Sigma) и измеряли оптическую плотность при 450 нм для количественного определения.
В результате, как показано на ФИГ. 20 и 21, подтвердили, что аффинность антител N3-1, N3-3, N3-4 и N3-5 в качестве усовершенствованных антител была значимо повышена по сравнению с антителом N3. Было обнаружено, что ни один из клонов не связывается с GST или NRP1-b1b2, используемыми в качестве отрицательного контроля. Значительных различий по связывающей способности между мутантными антителами N3-1, N3-3, N3-4 и N3-5 с KRS не было (см. ФИГ. 21).
8-3. Сравнение аффинности между антителом N3 и первичным усовершенствованным антителом и проверка его ингибирующего эффекта на миграцию клеток
Значительных различий по связывающей способности KRS между усовершенствованными антителами N3-1, N3-3, N3-4 и N3-5 не было. Таким образом, используя репрезентативное антитело N3-1 IgG из усовершенствованных антител, отобранных в примере 8-2, было проведено его более специфичное сравнение аффинности с родительским антителом N3 к N-концу KRS. Используя в качестве антигена очищенный фрагмент белка KRS (1-207 ак), проводили анализ связывающей способности антитела N3 и антитела N3-1 (IgG) методом поверхностного плазмонного резонанса (SPR). Эксперимент SPR был проведен с использованием прибора Biacore T200 (GE Healthcare), оборудованного сенсорным чипом СМ5 серии S (GE Healthcare), при 25°С. После иммобилизации антитела на чипе с помощью набора реактивов для аминосочетания (GE Healthcare) антиген разводили в 4 раза в растворе ФСБ в диапазоне концентраций от 4,8 до 1250 нМ и оставляли протекать 60 секунд. Затем ФСБ протекал в течение 300 секунд. Полученные данные анализировали с помощью программного обеспечения для оценки результатов Biacore T200 версии 2.0 (GE Healthcare).
В результате, как показано на ФИГ. 22, значение константы диссоциации (KD) антитела N3-1 было определено как 31 нМ, что указывает на повышение связывающей способности с белком KRS по сравнению с антителом N3. Кроме того, был подтвержден результат по ингибирующему действию лечения антителом на миграцию клеток (см. приведенные выше примеры), где антитело N3-1 специфично ингибировало миграцию клеток по сравнению с антителом N3.
8-4. Конструирование библиотеки scFab на основании вариантов последовательности антитела N3 (дрожжевая библиотека экспрессии на поверхности клеток). Вторичная библиотека
Антитела N3-1, N3-3, N3-4 и N3-5, нацеленные на N-конец KRS, полученные в примере 8-2, обладают сходной аффинностью к KRS и как показал результат для антитела N3-1 в примере 8-3, значение этой аффинности было определено как 31 нМ. С целью получения более эффективных антител за счет повышения их аффинности к KRS (в частности, к N-концевой области), было проведено интенсивное усовершенствование вариабельной области тяжелой цепи.
Последовательность вариабельной области легкой цепи была фиксированной и представляла собой последовательность из антитела N3-3 (SEQ ID NO: 51) и библиотеку конструировали с различными вариабельными последовательностями в вариабельной области тяжелой цепи. Сначала для прогнозирования приблизительной модели структуры антитела N3-3 применили способ моделирования гомологии и на этом основании в область CDR вводили случайные мутации, для которых предполагалась важная роль в связывании антигена. В частности, для остатков CDR2 и CDR3 вариабельной области тяжелой цепи антитела N3-3 использовали вырожденный кодон NNK, способный содержать все 20 аминокислотных последовательностей и библиотеку scFab конструировали так же, как описано в примере 8-1.
8-5. Скрининг scFab с улучшенной аффинностью к KRS (остатки 1-72). Скрининг вторичной библиотеки
Используя GST-конъюгированный пептид KRS (остатки 1-72) в качестве антигена, из библиотеки, сконструированной в примере 8-4, отбирали Fab с повышенной аффинностью. Поскольку было определено, что аффинность N3-3 и N3-1 почти одинакова, а последовательности почти идентичны, сравнительный эксперимент проводили с N3-1.
Сперва, GTP-конъюгированный пептид (GTP - гамма-глутамилтранасфераза) KRS (остатки 1-72) обрабатывали дрожжами, экспрессирующими библиотеку, сконструированную в примере 8-4. Впоследствии дрожжи, экспрессирующие библиотеку, связанные с GTP-конъюгированным KRS (остатки 1-72), подвергали реакции с Streptavidin Microbead™ (Miltenyi Biotec) при 4°C в течение 20 минут и дрожжи, экспрессирующие scFab, обладающие высокой аффинностью к пептиду KRS (1-72 ак), суспендировали с помощью активируемой магнитным полем сортировки клеток (MACS). Дрожжи, экспрессирующие библиотеку, отобранные посредством MACS, культивировали в среде SG-CAA (20 г/л галактозы, 6,7 г/л дрожжевых азотистых оснований без аминокислот, 5,4 г/л Na2HPO4, 8,6 г/л NaH2PO4, 5 г/л казаминовых кислот) для индукции экспрессии библиотеки. Впоследствии так же, как в примере 8-2, проводили последовательный скрининг с использованием FACS. Кратко, первый скрининг FACS проводили с пептидом KRS (1-72), связанным с 10 нМ GST, второй скрининг FACS проводили с пептидом KRS (1-72), связанным с 1 нМ GST, третий скрининг FACS проводили с пептидом KRS (1-72), связанным с 0,5 нМ GST, и четвертый скрининг FACS проводили с пептидом KRS (1-72), связанным с 0,1 нМ GST.
Посредством процесса скрининга с использованием активируемой магнитным полем сортировки клеток (MACS) и сортировки флуоресцентно-активированных клеток (FACS) были отобраны клоны с высокой, зависимой от вариабельной области тяжелой цепи (VH) аффинностью к пептиду KRS (1-72 ак) по сравнению с антителом N3-1 (проявляющим аналогичную аффинность с антителом N3-3). Таким путем было отобрано четыре превосходящих клона N3-6, N3-7, N3-8 и N3-9 с высокой аффинностью и специфичностью к пептиду KRS (остатки 1-72) посредством анализа связывающей способности отдельных клонов.
Последовательности CDR вариабельной области легкой цепи и вариабельной области тяжелой цепи четырех отдельных клонов N3-6, N3-7, N3-8, и N3-9, проявляющих высокую аффинность связывания с пептидом KRS (1-72 ак), представлены в таблице 7 и в таблице 8 представлены полноразмерные последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи.

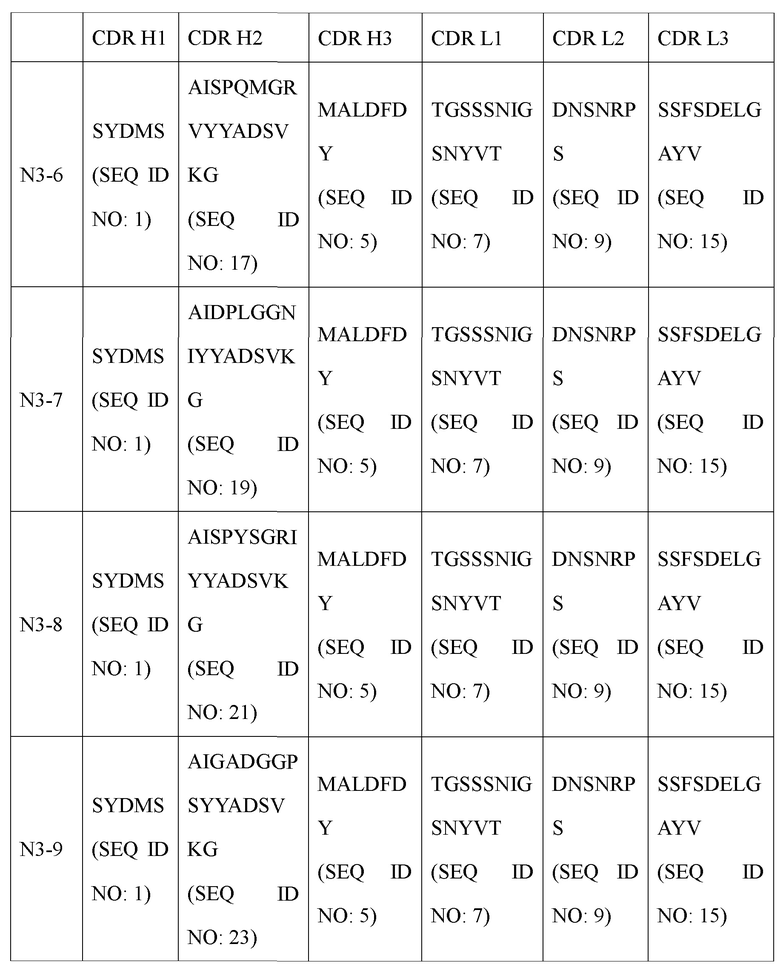

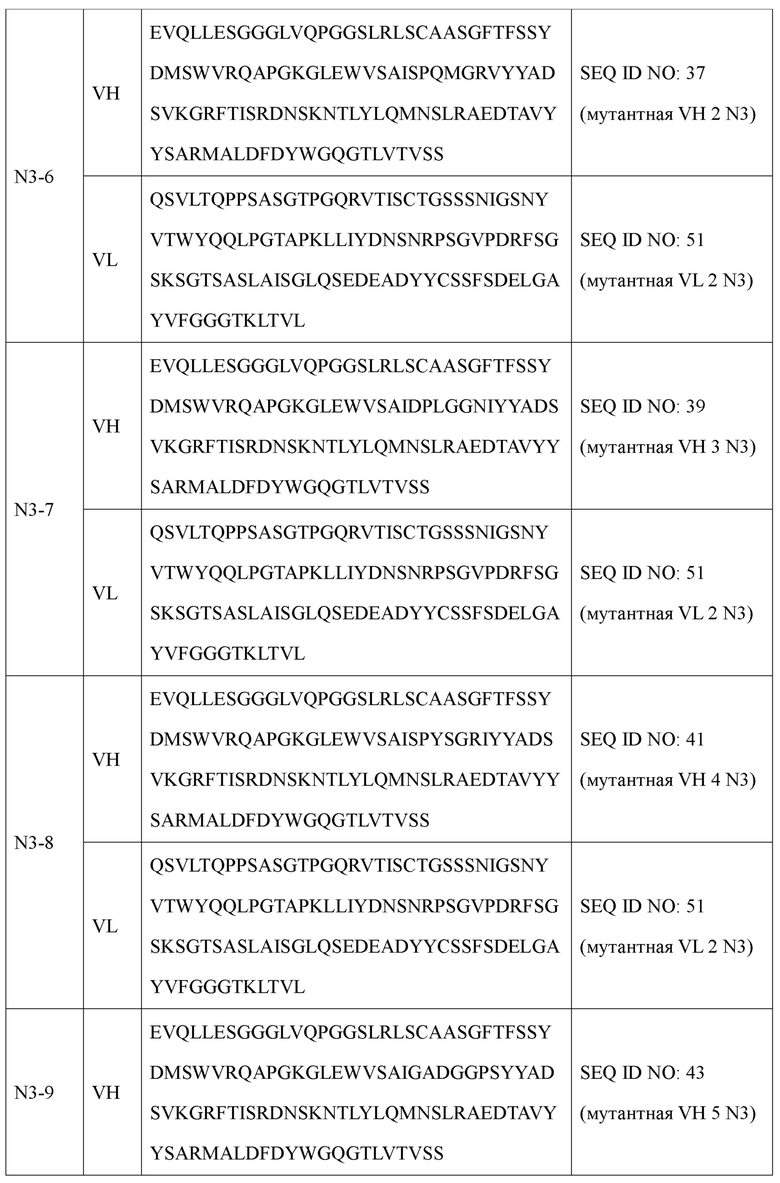

Кроме того, аффинность отдельных отобранных клонов N3-6, N3-7, N3-8 и N3-9 к N-концу KRS была дополнительно подтверждена с использованием метода ИФА. После преобразования клонов в антитела IgG в этом эксперименте они были использованы в экспериментах ИФА, методика которых описана выше в примере 5-1.
В результате, как показано на ФИГ. 23, было подтверждено, что аффинность усовершенствованных антител N3-6, N3-7, N3-8 и N3-9 повышена по сравнению с антителом N3-1 (сходная с N3-3). Для NRP1-b1b2, используемого в качестве отрицательного контроля, было обнаружено, что ни один клон не был связан.
Кроме того, был подтвержден результат ингибирующих эффектов на миграцию клеток путем лечения усовершенствованными антителами: антителом N3-6, антителом N3-7, антителом N3-8 и антителом N3-9 (IgG) (методики см. в описанных выше примерах), и было подтверждено, что усовершенствованные антитела ингибируют миграцию клеток значимо лучше, чем антитело N3-1. Значимого различия ингибирующего действия среди антителом N3-6, антителом N3-7, антителом N3-8 и антителом N3-9 не было.
8-6. Проверка эпитопов и аффинности усовершенствованных антител N3-6, N3-7, N3-8 и N3-9
С использованием пептида F4 эпитопа KRS (EPKLSKNELKRRLKAEKKVAEKEAKQKE: SEQ ID NO: 136) в качестве антигенного эпитопа был проведен анализ связывающей способности антитела N3, антитела N3-6, антитела N3-7, антитела N3-8 и антитела N3-9 методом поверхностного плазмонного резонанса (SPR). Эксперимент SPR проводили так же, как в примере 5-4. Эпитоп разводили в растворе ФСБ и разводили в 2 раза в диапазоне от 15,7 до 4000 нМ, и выдерживали в течение 90 секунд. Затем ФСБ протекал в течение 2400 секунд. Полученные данные анализировали с помощью программного обеспечения для оценки результатов Biacore T200 версии 2.0 (GE Healthcare).
В результате, как показано на ФИГ. 24, было также подтверждено, что усовершенствованные антитела: антитело N3-6, антитело N3-7, антитело N3-8 и антитело N3-9, имеют основной связывающий участок, аналогичный антителу N3 (см. пример 5-4). Дополнительно был проведен анализ ИФА для идентификации остатков, которые важны для связывания антитела с эпитопом, с использованием пептидов, в которых соответствующие аминокислоты эпитопа пептида KRS F4 (SEQ ID NO: 136) были соответственно заменены аланином (А). В результате в эпитопе KRS, соответствующем пептиду F4, можно определить остатки, которые важны для связывания с каждым антителом.
Как показано на ФИГ. 24, была также выявлена превосходная KD антитела N3-8 (KD=0,8613 нМ); KD антител N3-9 (KD=2,842 нМ) и N3-6 (KD=4,114 нМ) были сходными, и наибольшее значение KD было у антитела N3-7 (KD=18,77 нМ). Время диссоциации антитела N3-6 было больше по сравнению с N3-7 и N3-9, и на сенсограмме показано более длительное связывание.
8-7. Получение антитела с улучшенной продуктивностью и стабильностью на основе антитела N3-8 (оптимизация последовательности антитела N3-8)
В приведенном выше примере было подтверждено, что антитело N3-8 обладает наилучшей аффинностью к KRS (особенно к N-концу). Таким образом, чтобы подтвердить такие свойства, как продуктивность и стабильность антитела N3-8, и дополнительно улучшить эти свойства, были получены производные N3-8 путем индукции мутаций последовательности антитела N3-8 в последовательностях, предположительно влияющих на стабильность.
В результате были получены две последовательности тяжелой цепи (SEQ ID NO: 45, SEQ ID NO: 47), в которых были введены мутации в вариабельную область тяжелой цепи антитела N3-8. В дополнение к этому было получено три последовательности легкой цепи (SEQ ID NO: 51, SEQ ID NO: 53, SEQ ID NO: 55), в которых были введены мутации в вариабельную область легкой цепи антитела N3-8. Семь типов последовательностей производных N3-8 в соответствии с комбинированием последовательностей тяжелой и легкой цепи представлено ниже в таблицах 9 и 10, и они сохраняют свойство аффинности антитела N3-8.
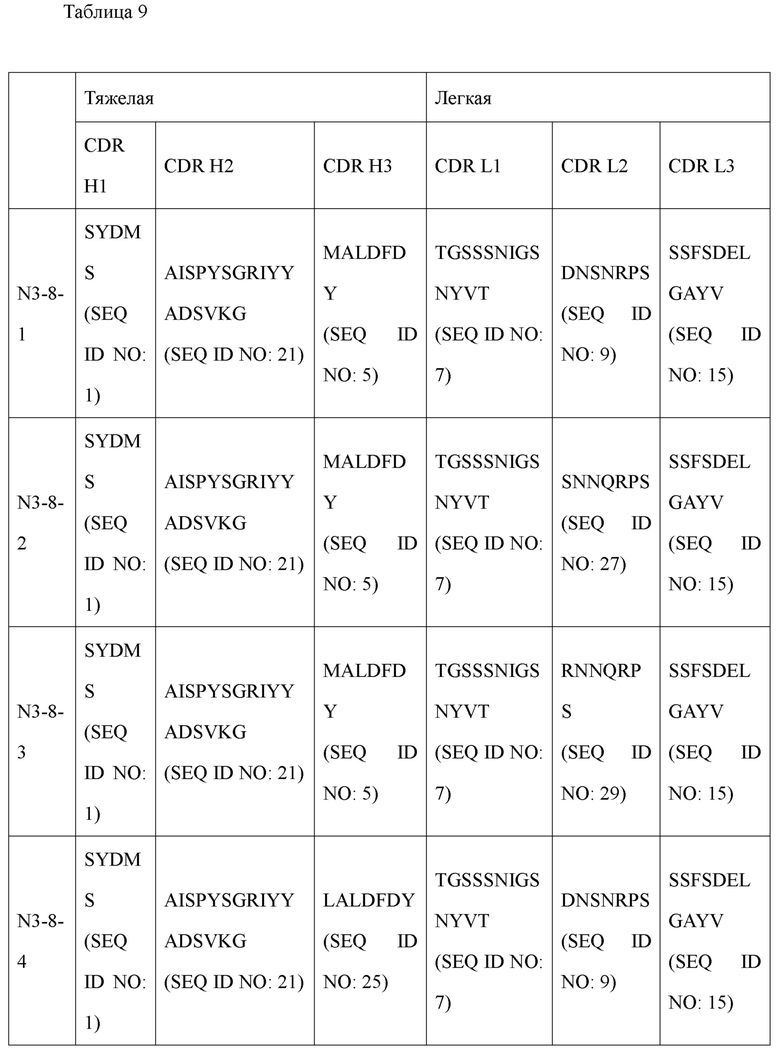
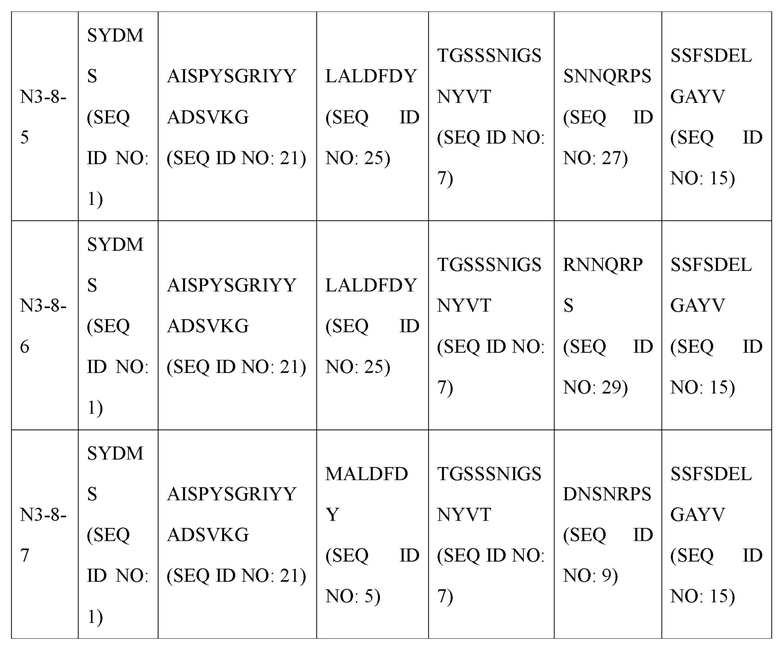

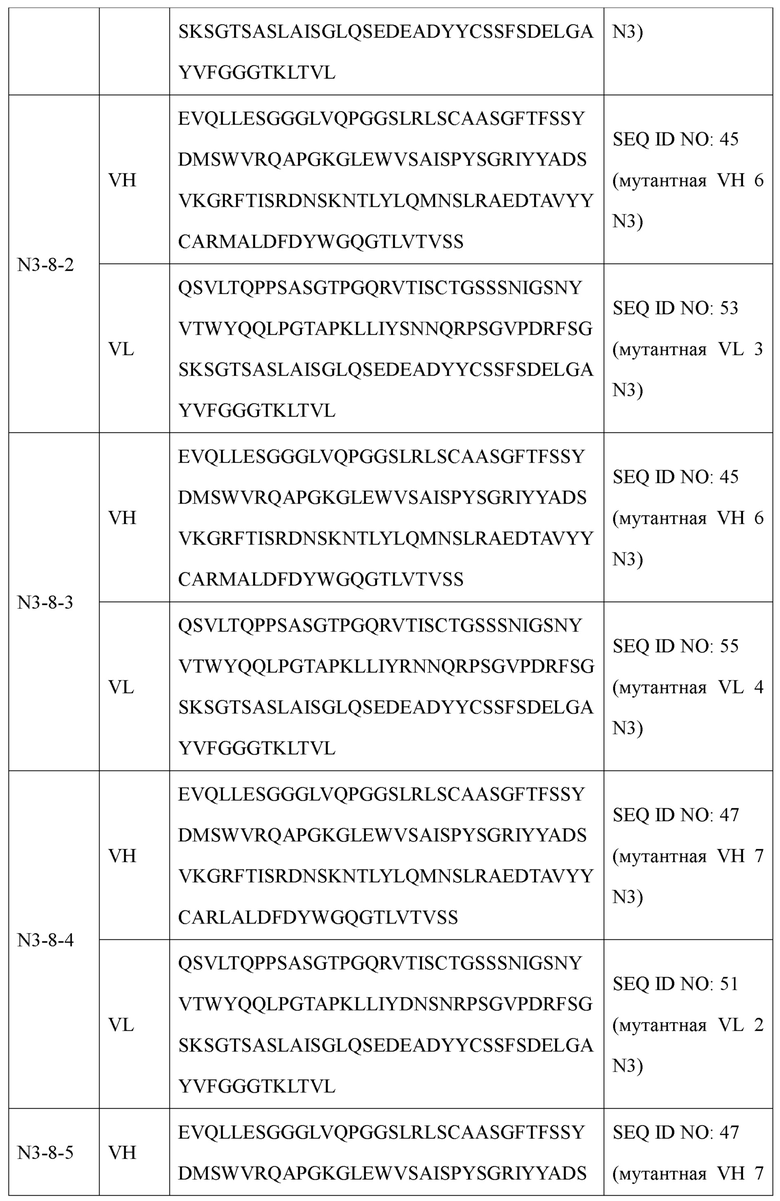
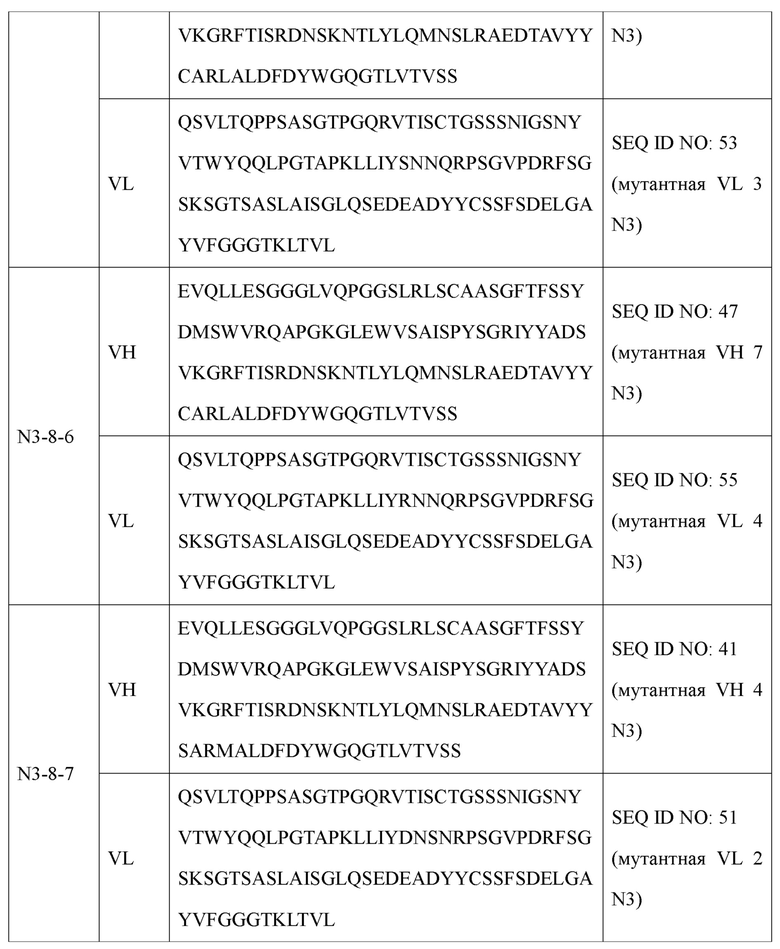
В таблице 11 представлены последовательности тяжелой цепи (НС) и легкой цепи (LC) полноразмерных антител IgG, использованных в описанных выше примерах.
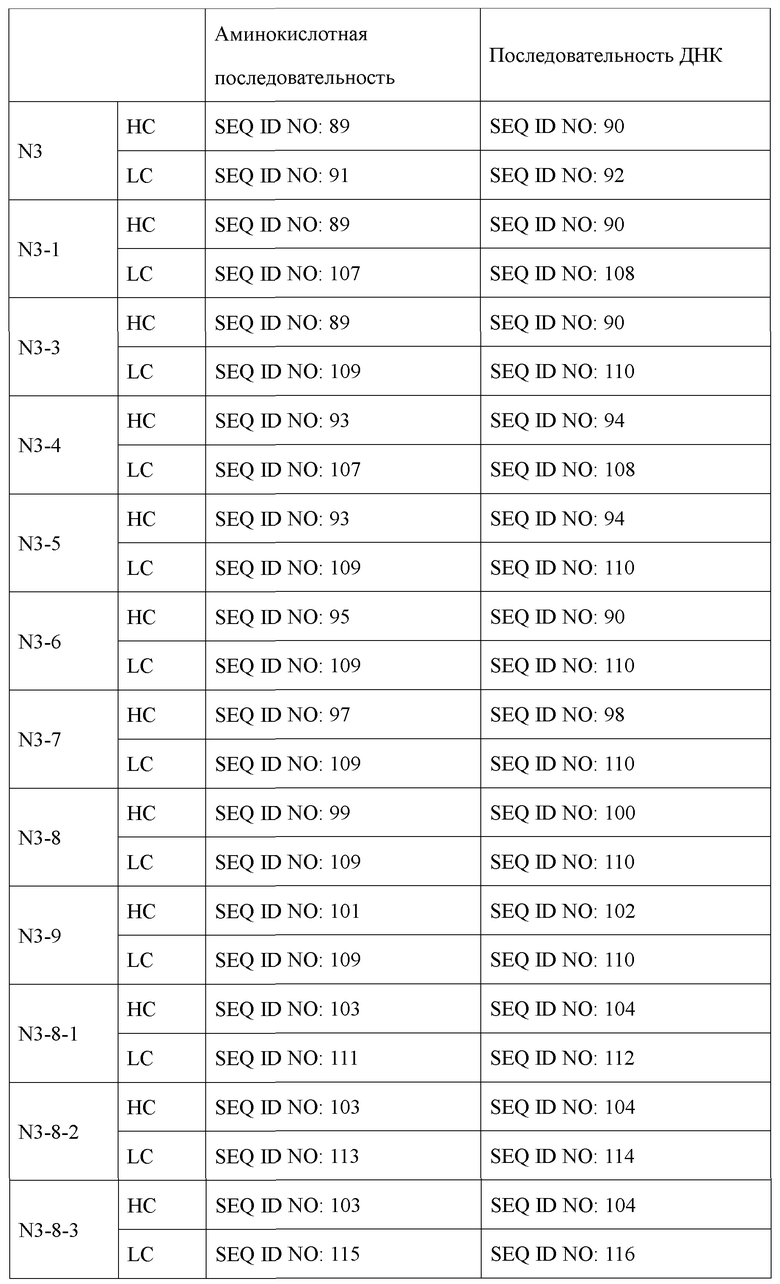
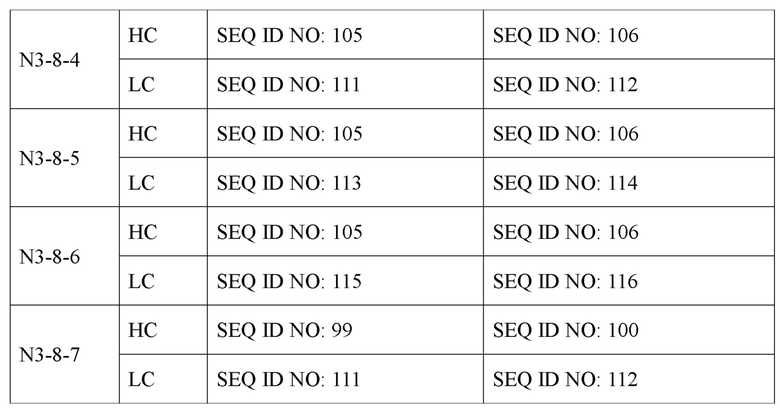
8-8. Измерение продуктивности и стабильности производных N3-8 (измерение Tm)
Каждый белок экспрессировали и очищали, используя методику транзиторной трансфекции плазмидами, экспрессирующими тяжелые и легкие цепи антитела N3-8, полученного в примере 8-7. Трансфекцию плазмидой клеток HEK293-F (Invitrogen), суспендированных в не содержащей сыворотку среде FreeStyle 293 для экспрессии (Invitrogen), проводили во встряхиваемой колбе с помощью полиэтиленимина (Полиэтиленимин, Polyscience).
В частности, в процессе трансфекции клетки HEK293-F высевали во встряхиваемую колбу емкостью 200 мл в 100 мл среды при плотности 2×106 клеток/мл и культивировали при 150 об/мин и 37°С при 8% СО2. Плазмиду тяжелой цепи и плазмиду легкой цепи, подходящие для получения каждого моноклонального антитела, трансфицировали, обрабатывая их в соотношении ДНК тяжелой цепи: легкой цепи 1:1 или 1:2 (обработка в смеси с 10 мл среды FreeStyle 293 для экспрессии). Сначала при использовании ДНК в соотношении тяжелая цепь легкая цепь 1:1 смешивали 125 мкг тяжелой цепи, 125 мкг легкой цепи, и суммарное количество 250 мкг (2,5 мкг/мл) смешивали с 10 мл среды, в которой разводили 750 мкг ПЭИ (7,5 мкг/мл), при комнатной температуре. Реакцию проводили в течение 10 минут. В случае соотношения 1:2 концентрацию ДНК легкой цепи удваивали. Затем смешанной средой обрабатывали клетки HEK293-F, предварительно разделенные на аликвоты по 100 мл, и инкубировали при 150 об/мин и 37°С при 8% CO2 в течение 4 часов. Добавляли остальные 100 мл среды FreeStyle 293 для экспрессии и культивировали в течение 6 дней.
Затем раствор клеточной культуры переносили в пробирки емкостью 50 мл и центрифугировали в течение 5 минут при 3000 об/мин. Затем белок очищали из собранного супернатанта клеточной культуры. Супернатант наносили на колонку с сефарозой с белком А, а затем промывали ФСБ (рН 7,4). После элюирования антитела при рН 3,0 0,1 М буферным раствором глицина образец сразу нейтрализовали 1 М Трис буфером. Элюированную фракцию антитела концентрировали методом диализа путем обмена буфера на ФСБ (рН 7,4). Очищенный белок определяли количественно, используя коэффициент поглощения и оптической плотности при длине волны 280 нм.
Кроме того, проводили измерение термической стабильности антитела, используя 100 мкл очищенных антител при концентрации 1 мг/мл. Эксперимент по определению температурного сдвига белка проводили с набором красителей (Thermofisher) 4 раза с помощью оборудования для ПЦР в реальном времени Quant Studio 3 (Thermofisher).
В результате, как показано ниже в таблице 12, было подтверждено, что выход всех исследованных производных антитела N3-8 был улучшен по сравнению с антителом N3-8. В дополнение к этому, как показано в таблице 12, были получены значения температуры плавления (Tm), и в зависимости от антитела наблюдали различный температурный переход Tm1-Tm2, но было обнаружено, что значение Tm повышалось у всех производных антитела N3-8.
На этом основании было подтверждено, что производные антитела N3-8 характеризуются повышенным выходом и улучшенной термической стабильностью по сравнению с антителом N3-8.

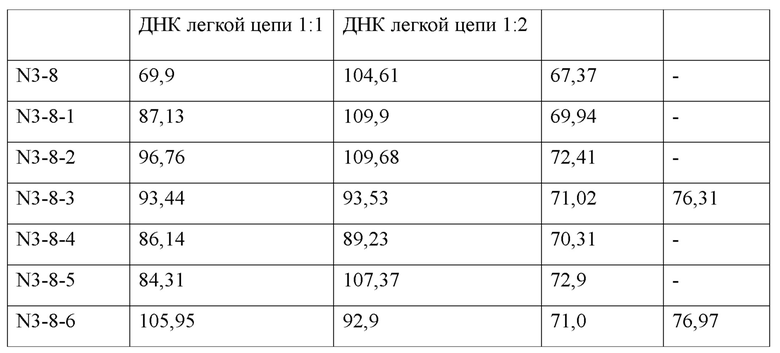
(В приведенной выше таблице «-» относится к такому же значению, как и Tm1)
Пример 9. Подтверждение повышенной терапевтической эффективности усовершенствованного антитела N3
В отношении усовершенствованных антител N3, полученных в приведенном выше примере, подтверждали, значительно ли улучшается их терапевтический эффект для лечения заболеваний, обусловленных миграцией иммунных клеток, даже in vivo. В качестве модели заболевания использовали модель легочной артериальной гипертензии, и в качестве усовершенствованных антител, как правило, использовали антитело N3-6 и антитело N3-8.
Для индукции легочной артериальной гипертензии у крыс линии SD (Oriental Bio) 7-недельного возраста им вводили подкожно 60 мг/кг МСТ (монокроталина). После индукции заболевания в течение 2 недель их делили на четыре группы (по пять экспериментальных животных на группу) и вводили ФСБ, 1 мг/кг антитела N3, 1 мг/кг антитела N3-6 и 1 мг/кг антитела N3-8 в течение 3 недель соответственно. Все антитела вводили в/в два раза в неделю. Для каждой экспериментальной группы проводили измерение кровотока и артериального давления и иммуногистохимическое (ИГХ) окрашивание так же, как описано выше в примере 6. В дополнение к этому легочную ткань каждой экспериментальной группы окрашивали способом трихром по Массону для определения степени легочного фиброза, и способ окрашивания трихром по Массону был таким же, как описано в примере 7.
В легких животных, которых лечили только МСТ, наблюдали эндотелит легочных кровеносных сосудов, пролиферацию артериол в гладких мышцах, гиперплазию интимы и окклюзию кровеносных сосудов. Таким образом, было подтверждено, что действительно была получена биологическая модель легочной артериальной гипертензии.
В результате лечения антителом по настоящему изобретению явления, проявляющиеся при легочной артериальной гипертензии, значимо уменьшались. В частности, как показано на ФИГ. 25, было подтверждено, что повышенное RVESP в результате легочной артериальной гипертензии (группа, которую лечили только МСТ), значительно снижалось в результате введения антитела N3 и усовершенствованного антитела N3 по настоящему изобретению, и, в частности, антитело N3-8 проявляло превосходный эффект снижения RVESP.
На ФИГ. 26 показаны результаты ИГХ окрашивания легочной ткани каждой из контрольной и экспериментальных групп. Было подтверждено, что в легких животных с легочной артериальной гипертензией (группа, которой вводили только МСТ) наблюдалось значительное окрашивание CD68+ моноцитов/макрофагов, при этом в группах, которым вводили антитело N3 или антитело N3-6, степень окрашивания была ослаблена, а в группе, которой вводили антитело N3-8, интенсивность окрашивания была существенно снижена до уровня, подобного отрицательному контролю. Это означает, что введение антитела по настоящему изобретению ингибировало инфильтрацию моноцитов/макрофагов в ткань, и, в частности, показан превосходный эффект антитела N3-8.
В дополнение к этому, как показано на ФИГ. 27, было подтверждено, что в легочной ткани животных с легочной артериальной гипертензией (группа, которую лечили только МСТ) наблюдалась значительная степень фиброза легких, при этом в группах, которым вводили антитело N3 или антитело N3-6, степень симптомов фиброза была значительно ослаблена, а в группе, которой вводили антитело N3-8, фиброз уменьшался до уровня, подобного отрицательному контролю. Это означает, что введение антитела по настоящему изобретению уменьшает фиброз, и, в частности, показан превосходный эффект антитела N3-8.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Настоящее изобретение относится к новому применению антитела, специфично связывающегося с N-концом лизил-тРНК синтетазы и более конкретно к фармацевтической композиции, содержащей антитело, специфично связывающееся с эпитопом, содержащим последовательность SEQ ID NO: 117 в N-концевом домене лизил-тРНК синтетазы (KRS), или его функциональный фрагмент в качестве эффективного ингредиента для профилактики и лечения заболевания, обусловленного миграцией иммунных клеток. Предложенное настоящим изобретением антитело, специфичное к N-концу KRS, может регулировать миграцию иммунных клеток и, следовательно, может быть весьма полезным для применения в профилактике, ослаблении и лечении заболеваний, связанных с миграцией иммунных клеток, и, таким образом, характеризуется высокой промышленной применимостью.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> МЕДИСИНАЛ БАЙОКОНВЕРДЖЕНС РЕСЕРЧ
<120> ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО,
СПЕЦИФИЧНО СВЯЗЫВАЮЩЕЕСЯ С N-КОНЦОМ
ЛИЗИЛ-ТРНК-СИНТЕТАЗЫ, В КАЧЕСТВЕ ЭФФЕКТИВНОГО
ИНГРЕДИЕНТА ДЛЯ ПРЕДУПРЕЖДЕНИЯ ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ,
СВЯЗАННОГО С МИГРАЦИЕЙ ИММУННЫХ КЛЕТОК
<130> OP20-0023/PCT/RU
<150> KR 10-2017-0118917
<151> 2017-09-15
<150> PCT/KR 2018/010903
<151> 2018-09-17
<160> 152
<170> КоПатентИн версии 3,0
<210> 1
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> аминокислотная N3 Ат CDR H1
<400> 1
Ser Tyr Asp Met Ser
1 5
<210> 2
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК N3 Ат CDR H1
<400> 2
agttatgata tgagc 15
<210> 3
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> аминокислотная N3 Ат CDR H2
<400> 3
Ala Ile Ser Tyr Asp Asn Gly Asn Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 4
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК N3 Ат CDR H2
<400> 4
gcgatctctt atgataatgg taatacatat tacgctgatt ctgtaaaagg t 51
<210> 5
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> аминокислотная N3 Ат CDR H3
<400> 5
Met Ala Leu Asp Phe Asp Tyr
1 5
<210> 6
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК N3 Ат CDR H3
<400> 6
atggcgcttg atttcgacta c 21
<210> 7
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> аминокислотная N3 Ат CDR L1
<400> 7
Thr Gly Ser Ser Ser Asn Ile Gly Ser Asn Tyr Val Thr
1 5 10
<210> 8
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК N3 Ат CDR L1
<400> 8
actggctctt catctaatat tggcagtaat tatgtcacc 39
<210> 9
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> аминокислотная N3 Ат CDR L2
<400> 9
Asp Asn Ser Asn Arg Pro Ser
1 5
<210> 10
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК N3 Ат CDR L2
<400> 10
gataatagta atcggccaag c 21
<210> 11
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> аминокислотная N3 Ат CDR L3
<400> 11
Ala Ser Trp Asp Asp Ser Leu Ser Ala Tyr Val
1 5 10
<210> 12
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК N3 Ат CDR L3
<400> 12
gcttcttggg atgatagcct gagtgcttat gtc 33
<210> 13
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная аминокислота 1 CDR L3
<400> 13
Ala Ser Phe Ser Asp Glu Leu Gly Ala Tyr Val
1 5 10
<210> 14
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутантная ДНК 1 CDR L3
<400> 14
gcttctttta gtgatgagtt gggggcttat gtc 33
<210> 15
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная аминокислота 2 CDR L3
<400> 15
Ser Ser Phe Ser Asp Glu Leu Gly Ala Tyr Val
1 5 10
<210> 16
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутантная ДНК 2 CDR L3
<400> 16
tcttctttta gtgatgagtt gggggcttat gtc 33
<210> 17
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная аминокислота 1 CDR H2
<400> 17
Ala Ile Ser Pro Gln Met Gly Arg Val Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 18
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутантная ДНК 1 CDR H2
<400> 18
gcgatctcgc cgcagatggg tcgggtgtat tacgctgatt ctgtaaaagg t 51
<210> 19
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная аминокислота 2 CDR H2
<400> 19
Ala Ile Asp Pro Leu Gly Gly Asn Ile Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 20
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутантная ДНК 2 CDR H2
<400> 20
gcgatcgatc cgttgggggg taatatttat tacgctgatt ctgtaaaagg t 51
<210> 21
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная аминокислота 3 CDR H2
<400> 21
Ala Ile Ser Pro Tyr Ser Gly Arg Ile Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 22
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутантная ДНК 3 CDR H2
<400> 22
gcgatctctc cgtattcggg taggatttat tacgctgatt ctgtaaaagg t 51
<210> 23
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная аминокислота 4 CDR H2
<400> 23
Ala Ile Gly Ala Asp Gly Gly Pro Ser Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 24
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутантная ДНК 4 CDR H2
<400> 24
gcgatcgggg ctgatggggg tccgtcttat tacgctgatt ctgtaaaagg t 51
<210> 25
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная аминокислота 1 CDR H3
<400> 25
Leu Ala Leu Asp Phe Asp Tyr
1 5
<210> 26
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутантная ДНК 1 CDR H3
<400> 26
ctggcgcttg atttcgacta c 21
<210> 27
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная аминокислота 1 CDR L2
<400> 27
Ser Asn Asn Gln Arg Pro Ser
1 5
<210> 28
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутантная ДНК 1 CDR L2
<400> 28
agtaataatc agcggccaag c 21
<210> 29
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная аминокислота 2 CDR L2
<400> 29
Arg Asn Asn Gln Arg Pro Ser
1 5
<210> 30
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутантная ДНК 2 CDR L2
<400> 30
cggaataatc agcggccaag c 21
<210> 31
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3 VH
<400> 31
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Tyr Asp Asn Gly Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 32
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3 VH
<400> 32
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctcttatg ataatggtaa tacatattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctca 348
<210> 33
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3 VL
<400> 33
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Arg
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ser Trp Asp Asp Ser Leu
85 90 95
Ser Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 34
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3 VL
<400> 34
cagtctgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgtactg gctcttcatc taatattggc agtaattatg tcacctggta ccagcagctc 120
ccaggaacgg cccccaaact cctcatctat gataatagta atcggccaag cggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccgg 240
tccgaggatg aggctgatta ttactgtgct tcttgggatg atagcctgag tgcttatgtc 300
ttcggcggag gcaccaagct gacggtccta 330
<210> 35
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VH 1
<400> 35
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Ser Asp Gly Gly Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 36
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VH 1
<400> 36
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagtg atctcttctg atggtggtaa tacatattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctca 348
<210> 37
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VH 2
<400> 37
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Pro Gln Met Gly Arg Val Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 38
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VH 2
<400> 38
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctcgccgc agatgggtcg ggtgtattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctca 348
<210> 39
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VH 3
<400> 39
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Asp Pro Leu Gly Gly Asn Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 40
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VH 3
<400> 40
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atcgatccgt tggggggtaa tatttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctca 348
<210> 41
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VH 4
<400> 41
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Pro Tyr Ser Gly Arg Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 42
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VH 4
<400> 42
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctctccgt attcgggtag gatttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctca 348
<210> 43
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VH 5
<400> 43
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Ala Asp Gly Gly Pro Ser Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 44
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VH 5
<400> 44
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atcggggctg atgggggtcc gtcttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctca 348
<210> 45
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VH 6
<400> 45
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Pro Tyr Ser Gly Arg Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 46
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VH 6
<400> 46
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctctccgt attcgggtag gatttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactgtgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctca 348
<210> 47
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VH 7
<400> 47
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Pro Tyr Ser Gly Arg Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 48
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VH 7
<400> 48
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctctccgt attcgggtag gatttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactgtgc gagactggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctca 348
<210> 49
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VL 1
<400> 49
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ser Phe Ser Asp Glu Leu
85 90 95
Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 50
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VL 1
<400> 50
cagtctgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgtactg gctcttcatc taatattggc agtaattatg tcacctggta ccagcagctc 120
ccaggaacgg cccccaaact cctcatctat gataatagta atcggccaag cggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tccgaggatg aggctgatta ttactgtgct tcttttagtg atgagttggg ggcttatgtc 300
ttcggcggag gcaccaagct gacggtccta 330
<210> 51
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VL 2
<400> 51
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser Asp Glu Leu
85 90 95
Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 52
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VL 2
<400> 52
cagtctgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgtactg gctcttcatc taatattggc agtaattatg tcacctggta ccagcagctc 120
ccaggaacgg cccccaaact cctcatctat gataatagta atcggccaag cggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tccgaggatg aggctgatta ttactgttct tcttttagtg atgagttggg ggcttatgtc 300
ttcggcggag gcaccaagct gacggtccta 330
<210> 53
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VL 3
<400> 53
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser Asp Glu Leu
85 90 95
Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 54
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VL 3
<400> 54
cagtctgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgtactg gctcttcatc taatattggc agtaattatg tcacctggta ccagcagctc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcggccaag cggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tccgaggatg aggctgatta ttactgttct tcttttagtg atgagttggg ggcttatgtc 300
ttcggcggag gcaccaagct gacggtccta 330
<210> 55
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VL 4
<400> 55
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Arg Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser Asp Glu Leu
85 90 95
Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 56
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3 мутантная VL 4
<400> 56
cagtctgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgtactg gctcttcatc taatattggc agtaattatg tcacctggta ccagcagctc 120
ccaggaacgg cccccaaact cctcatctat cggaataatc agcggccaag cggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tccgaggatg aggctgatta ttactgttct tcttttagtg atgagttggg ggcttatgtc 300
ttcggcggag gcaccaagct gacggtccta 330
<210> 57
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкер для scFv
<400> 57
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 58
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Линкер для scFv
<400> 58
ggtggaggcg gttcaggcgg aggtggatcc ggcggtggcg gatcg 45
<210> 59
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3 scFv (VH+линкер+VL)
<400> 59
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Tyr Asp Asn Gly Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr
130 135 140
Pro Gly Gln Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile
145 150 155 160
Gly Ser Asn Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp
180 185 190
Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser
195 200 205
Gly Leu Arg Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ser Trp Asp
210 215 220
Asp Ser Leu Ser Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val
225 230 235 240
Leu
<210> 60
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3 scFv (VH+линкер+VL)
<400> 60
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctcttatg ataatggtaa tacatattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagg tggaggcggt 360
tcaggcggag gtggatccgg cggtggcgga tcgcagtctg tgctgactca gccaccctca 420
gcgtctggga cccccgggca gagggtcacc atctcttgta ctggctcttc atctaatatt 480
ggcagtaatt atgtcacctg gtaccagcag ctcccaggaa cggcccccaa actcctcatc 540
tatgataata gtaatcggcc aagcggggtc cctgaccgat tctctggctc caagtctggc 600
acctcagcct ccctggccat cagtgggctc cggtccgagg atgaggctga ttattactgt 660
gcttcttggg atgatagcct gagtgcttat gtcttcggcg gaggcaccaa gctgacggtc 720
cta 723
<210> 61
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3-1 scFv (VH+линкер+VL)
<400> 61
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Tyr Asp Asn Gly Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr
130 135 140
Pro Gly Gln Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile
145 150 155 160
Gly Ser Asn Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp
180 185 190
Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser
195 200 205
Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ser Phe Ser
210 215 220
Asp Glu Leu Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val
225 230 235 240
Leu
<210> 62
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3-1 scFv (VH+линкер+VL)
<400> 62
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctcttatg ataatggtaa tacatattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagg tggaggcggt 360
tcaggcggag gtggatccgg cggtggcgga tcgcagtctg tgctgactca gccaccctca 420
gcgtctggga cccccgggca gagggtcacc atctcttgta ctggctcttc atctaatatt 480
ggcagtaatt atgtcacctg gtaccagcag ctcccaggaa cggcccccaa actcctcatc 540
tatgataata gtaatcggcc aagcggggtc cctgaccgat tctctggctc caagtctggc 600
acctcagcct ccctggccat cagtgggctc cagtccgagg atgaggctga ttattactgt 660
gcttctttta gtgatgagtt gggggcttat gtcttcggcg gaggcaccaa gctgacggtc 720
cta 723
<210> 63
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3-3 scFv (VH+линкер+VL)
<400> 63
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Tyr Asp Asn Gly Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr
130 135 140
Pro Gly Gln Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile
145 150 155 160
Gly Ser Asn Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp
180 185 190
Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser
195 200 205
Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser
210 215 220
Asp Glu Leu Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val
225 230 235 240
Leu
<210> 64
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3-3 scFv (VH+линкер+VL)
<400> 64
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctcttatg ataatggtaa tacatattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagg tggaggcggt 360
tcaggcggag gtggatccgg cggtggcgga tcgcagtctg tgctgactca gccaccctca 420
gcgtctggga cccccgggca gagggtcacc atctcttgta ctggctcttc atctaatatt 480
ggcagtaatt atgtcacctg gtaccagcag ctcccaggaa cggcccccaa actcctcatc 540
tatgataata gtaatcggcc aagcggggtc cctgaccgat tctctggctc caagtctggc 600
acctcagcct ccctggccat cagtgggctc cagtccgagg atgaggctga ttattactgt 660
tcttctttta gtgatgagtt gggggcttat gtcttcggcg gaggcaccaa gctgacggtc 720
cta 723
<210> 65
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3-4 scFv (VH+линкер+VL)
<400> 65
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Ser Asp Gly Gly Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr
130 135 140
Pro Gly Gln Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile
145 150 155 160
Gly Ser Asn Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp
180 185 190
Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser
195 200 205
Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ser Phe Ser
210 215 220
Asp Glu Leu Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val
225 230 235 240
Leu
<210> 66
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3-4 scFv (VH+линкер+VL)
<400> 66
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagtg atctcttctg atggtggtaa tacatattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagg tggaggcggt 360
tcaggcggag gtggatccgg cggtggcgga tcgcagtctg tgctgactca gccaccctca 420
gcgtctggga cccccgggca gagggtcacc atctcttgta ctggctcttc atctaatatt 480
ggcagtaatt atgtcacctg gtaccagcag ctcccaggaa cggcccccaa actcctcatc 540
tatgataata gtaatcggcc aagcggggtc cctgaccgat tctctggctc caagtctggc 600
acctcagcct ccctggccat cagtgggctc cagtccgagg atgaggctga ttattactgt 660
gcttctttta gtgatgagtt gggggcttat gtcttcggcg gaggcaccaa gctgacggtc 720
cta 723
<210> 67
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3-5 scFv (VH+линкер+VL)
<400> 67
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Ser Asp Gly Gly Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr
130 135 140
Pro Gly Gln Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile
145 150 155 160
Gly Ser Asn Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp
180 185 190
Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser
195 200 205
Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser
210 215 220
Asp Glu Leu Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val
225 230 235 240
Leu
<210> 68
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3-5 scFv (VH+линкер+VL)
<400> 68
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagtg atctcttctg atggtggtaa tacatattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagg tggaggcggt 360
tcaggcggag gtggatccgg cggtggcgga tcgcagtctg tgctgactca gccaccctca 420
gcgtctggga cccccgggca gagggtcacc atctcttgta ctggctcttc atctaatatt 480
ggcagtaatt atgtcacctg gtaccagcag ctcccaggaa cggcccccaa actcctcatc 540
tatgataata gtaatcggcc aagcggggtc cctgaccgat tctctggctc caagtctggc 600
acctcagcct ccctggccat cagtgggctc cagtccgagg atgaggctga ttattactgt 660
tcttctttta gtgatgagtt gggggcttat gtcttcggcg gaggcaccaa gctgacggtc 720
cta 723
<210> 69
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3-6 scFv (VH+линкер+VL)
<400> 69
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Pro Gln Met Gly Arg Val Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr
130 135 140
Pro Gly Gln Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile
145 150 155 160
Gly Ser Asn Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp
180 185 190
Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser
195 200 205
Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser
210 215 220
Asp Glu Leu Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val
225 230 235 240
Leu
<210> 70
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3-6 scFv (VH+линкер+VL)
<400> 70
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctcgccgc agatgggtcg ggtgtattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagg tggaggcggt 360
tcaggcggag gtggatccgg cggtggcgga tcgcagtctg tgctgactca gccaccctca 420
gcgtctggga cccccgggca gagggtcacc atctcttgta ctggctcttc atctaatatt 480
ggcagtaatt atgtcacctg gtaccagcag ctcccaggaa cggcccccaa actcctcatc 540
tatgataata gtaatcggcc aagcggggtc cctgaccgat tctctggctc caagtctggc 600
acctcagcct ccctggccat cagtgggctc cagtccgagg atgaggctga ttattactgt 660
tcttctttta gtgatgagtt gggggcttat gtcttcggcg gaggcaccaa gctgacggtc 720
cta 723
<210> 71
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3-7 scFv (VH+линкер+VL)
<400> 71
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Asp Pro Leu Gly Gly Asn Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr
130 135 140
Pro Gly Gln Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile
145 150 155 160
Gly Ser Asn Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp
180 185 190
Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser
195 200 205
Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser
210 215 220
Asp Glu Leu Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val
225 230 235 240
Leu
<210> 72
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3-7 scFv (VH+линкер+VL)
<400> 72
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atcgatccgt tggggggtaa tatttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagg tggaggcggt 360
tcaggcggag gtggatccgg cggtggcgga tcgcagtctg tgctgactca gccaccctca 420
gcgtctggga cccccgggca gagggtcacc atctcttgta ctggctcttc atctaatatt 480
ggcagtaatt atgtcacctg gtaccagcag ctcccaggaa cggcccccaa actcctcatc 540
tatgataata gtaatcggcc aagcggggtc cctgaccgat tctctggctc caagtctggc 600
acctcagcct ccctggccat cagtgggctc cagtccgagg atgaggctga ttattactgt 660
tcttctttta gtgatgagtt gggggcttat gtcttcggcg gaggcaccaa gctgacggtc 720
cta 723
<210> 73
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3-8 scFv, N3-8-7 scFv (VH+линкер+VL)
<400> 73
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Pro Tyr Ser Gly Arg Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr
130 135 140
Pro Gly Gln Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile
145 150 155 160
Gly Ser Asn Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp
180 185 190
Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser
195 200 205
Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser
210 215 220
Asp Glu Leu Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val
225 230 235 240
Leu
<210> 74
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3-8 scFv, N3-8-7 scFv (VH+линкер+VL)
<400> 74
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctctccgt attcgggtag gatttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagg tggaggcggt 360
tcaggcggag gtggatccgg cggtggcgga tcgcagtctg tgctgactca gccaccctca 420
gcgtctggga cccccgggca gagggtcacc atctcttgta ctggctcttc atctaatatt 480
ggcagtaatt atgtcacctg gtaccagcag ctcccaggaa cggcccccaa actcctcatc 540
tatgataata gtaatcggcc aagcggggtc cctgaccgat tctctggctc caagtctggc 600
acctcagcct ccctggccat cagtgggctc cagtccgagg atgaggctga ttattactgt 660
tcttctttta gtgatgagtt gggggcttat gtcttcggcg gaggcaccaa gctgacggtc 720
cta 723
<210> 75
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3-9 scFv (VH+линкер+VL)
<400> 75
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Ala Asp Gly Gly Pro Ser Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr
130 135 140
Pro Gly Gln Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile
145 150 155 160
Gly Ser Asn Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp
180 185 190
Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser
195 200 205
Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser
210 215 220
Asp Glu Leu Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val
225 230 235 240
Leu
<210> 76
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3-9 scFv (VH+линкер+VL)
<400> 76
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atcggggctg atgggggtcc gtcttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagg tggaggcggt 360
tcaggcggag gtggatccgg cggtggcgga tcgcagtctg tgctgactca gccaccctca 420
gcgtctggga cccccgggca gagggtcacc atctcttgta ctggctcttc atctaatatt 480
ggcagtaatt atgtcacctg gtaccagcag ctcccaggaa cggcccccaa actcctcatc 540
tatgataata gtaatcggcc aagcggggtc cctgaccgat tctctggctc caagtctggc 600
acctcagcct ccctggccat cagtgggctc cagtccgagg atgaggctga ttattactgt 660
tcttctttta gtgatgagtt gggggcttat gtcttcggcg gaggcaccaa gctgacggtc 720
cta 723
<210> 77
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3-8-1 scFv (VH+линкер+VL)
<400> 77
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Pro Tyr Ser Gly Arg Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr
130 135 140
Pro Gly Gln Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile
145 150 155 160
Gly Ser Asn Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp
180 185 190
Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser
195 200 205
Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser
210 215 220
Asp Glu Leu Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val
225 230 235 240
Leu
<210> 78
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3-8-1 scFv (VH+линкер+VL)
<400> 78
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctctccgt attcgggtag gatttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactgtgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagg tggaggcggt 360
tcaggcggag gtggatccgg cggtggcgga tcgcagtctg tgctgactca gccaccctca 420
gcgtctggga cccccgggca gagggtcacc atctcttgta ctggctcttc atctaatatt 480
ggcagtaatt atgtcacctg gtaccagcag ctcccaggaa cggcccccaa actcctcatc 540
tatgataata gtaatcggcc aagcggggtc cctgaccgat tctctggctc caagtctggc 600
acctcagcct ccctggccat cagtgggctc cagtccgagg atgaggctga ttattactgt 660
tcttctttta gtgatgagtt gggggcttat gtcttcggcg gaggcaccaa gctgacggtc 720
cta 723
<210> 79
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3-8-2 scFv (VH+линкер+VL)
<400> 79
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Pro Tyr Ser Gly Arg Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr
130 135 140
Pro Gly Gln Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile
145 150 155 160
Gly Ser Asn Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp
180 185 190
Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser
195 200 205
Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser
210 215 220
Asp Glu Leu Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val
225 230 235 240
Leu
<210> 80
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3-8-2 scFv (VH+линкер+VL)
<400> 80
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctctccgt attcgggtag gatttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactgtgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagg tggaggcggt 360
tcaggcggag gtggatccgg cggtggcgga tcgcagtctg tgctgactca gccaccctca 420
gcgtctggga cccccgggca gagggtcacc atctcttgta ctggctcttc atctaatatt 480
ggcagtaatt atgtcacctg gtaccagcag ctcccaggaa cggcccccaa actcctcatc 540
tatagtaata atcagcggcc aagcggggtc cctgaccgat tctctggctc caagtctggc 600
acctcagcct ccctggccat cagtgggctc cagtccgagg atgaggctga ttattactgt 660
tcttctttta gtgatgagtt gggggcttat gtcttcggcg gaggcaccaa gctgacggtc 720
cta 723
<210> 81
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3-8-3 scFv (VH+линкер+VL)
<400> 81
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Pro Tyr Ser Gly Arg Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr
130 135 140
Pro Gly Gln Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile
145 150 155 160
Gly Ser Asn Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Arg Asn Asn Gln Arg Pro Ser Gly Val Pro Asp
180 185 190
Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser
195 200 205
Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser
210 215 220
Asp Glu Leu Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val
225 230 235 240
Leu
<210> 82
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3-8-3 scFv (VH+линкер+VL)
<400> 82
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctctccgt attcgggtag gatttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactgtgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagg tggaggcggt 360
tcaggcggag gtggatccgg cggtggcgga tcgcagtctg tgctgactca gccaccctca 420
gcgtctggga cccccgggca gagggtcacc atctcttgta ctggctcttc atctaatatt 480
ggcagtaatt atgtcacctg gtaccagcag ctcccaggaa cggcccccaa actcctcatc 540
tatcggaata atcagcggcc aagcggggtc cctgaccgat tctctggctc caagtctggc 600
acctcagcct ccctggccat cagtgggctc cagtccgagg atgaggctga ttattactgt 660
tcttctttta gtgatgagtt gggggcttat gtcttcggcg gaggcaccaa gctgacggtc 720
cta 723
<210> 83
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3-8-4 scFv (VH+линкер+VL)
<400> 83
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Pro Tyr Ser Gly Arg Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr
130 135 140
Pro Gly Gln Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile
145 150 155 160
Gly Ser Asn Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp
180 185 190
Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser
195 200 205
Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser
210 215 220
Asp Glu Leu Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val
225 230 235 240
Leu
<210> 84
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3-8-4 scFv (VH+линкер+VL)
<400> 84
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctctccgt attcgggtag gatttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactgtgc gagactggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagg tggaggcggt 360
tcaggcggag gtggatccgg cggtggcgga tcgcagtctg tgctgactca gccaccctca 420
gcgtctggga cccccgggca gagggtcacc atctcttgta ctggctcttc atctaatatt 480
ggcagtaatt atgtcacctg gtaccagcag ctcccaggaa cggcccccaa actcctcatc 540
tatgataata gtaatcggcc aagcggggtc cctgaccgat tctctggctc caagtctggc 600
acctcagcct ccctggccat cagtgggctc cagtccgagg atgaggctga ttattactgt 660
tcttctttta gtgatgagtt gggggcttat gtcttcggcg gaggcaccaa gctgacggtc 720
cta 723
<210> 85
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3-8-5 scFv (VH+линкер+VL)
<400> 85
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Pro Tyr Ser Gly Arg Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr
130 135 140
Pro Gly Gln Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile
145 150 155 160
Gly Ser Asn Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp
180 185 190
Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser
195 200 205
Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser
210 215 220
Asp Glu Leu Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val
225 230 235 240
Leu
<210> 86
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3-8-5 scFv (VH+линкер+VL)
<400> 86
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctctccgt attcgggtag gatttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactgtgc gagactggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagg tggaggcggt 360
tcaggcggag gtggatccgg cggtggcgga tcgcagtctg tgctgactca gccaccctca 420
gcgtctggga cccccgggca gagggtcacc atctcttgta ctggctcttc atctaatatt 480
ggcagtaatt atgtcacctg gtaccagcag ctcccaggaa cggcccccaa actcctcatc 540
tatagtaata atcagcggcc aagcggggtc cctgaccgat tctctggctc caagtctggc 600
acctcagcct ccctggccat cagtgggctc cagtccgagg atgaggctga ttattactgt 660
tcttctttta gtgatgagtt gggggcttat gtcttcggcg gaggcaccaa gctgacggtc 720
cta 723
<210> 87
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N3-8-6 scFv (VH+линкер+VL)
<400> 87
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Pro Tyr Ser Gly Arg Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr
130 135 140
Pro Gly Gln Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile
145 150 155 160
Gly Ser Asn Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Arg Asn Asn Gln Arg Pro Ser Gly Val Pro Asp
180 185 190
Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser
195 200 205
Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser
210 215 220
Asp Glu Leu Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val
225 230 235 240
Leu
<210> 88
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> N3-8-6 scFv (VH+линкер+VL)
<400> 88
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctctccgt attcgggtag gatttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactgtgc gagactggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagg tggaggcggt 360
tcaggcggag gtggatccgg cggtggcgga tcgcagtctg tgctgactca gccaccctca 420
gcgtctggga cccccgggca gagggtcacc atctcttgta ctggctcttc atctaatatt 480
ggcagtaatt atgtcacctg gtaccagcag ctcccaggaa cggcccccaa actcctcatc 540
tatcggaata atcagcggcc aagcggggtc cctgaccgat tctctggctc caagtctggc 600
acctcagcct ccctggccat cagtgggctc cagtccgagg atgaggctga ttattactgt 660
tcttctttta gtgatgagtt gggggcttat gtcttcggcg gaggcaccaa gctgacggtc 720
cta 723
<210> 89
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь N3 IgG
<400> 89
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Tyr Asp Asn Gly Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 90
<211> 1338
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь N3 IgG
<400> 90
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctcttatg ataatggtaa tacatattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagc ctccaccaag 360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tggtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac 600
gtgaatcaca agcccagcaa caccaaggtg gacaagaaag ttgagcccaa atcttgtgac 660
aaaactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc 720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc 780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc 840
gtggaggtgc ataatgccaa gacaaagccg cgggaggagc agtacaacag cacgtaccgt 900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc 960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg 1020
cagccccgag aaccacaggt gtataccctg cccccatccc gggatgagct gaccaagaac 1080
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg 1140
gagagcaatg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac 1200
ggctccttct tcctctacag caagctcacc gtggacaaga gcaggtggca gcaggggaac 1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc 1320
tccctgtccc cgggtaaa 1338
<210> 91
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Легкая цепь N3 IgG
<400> 91
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Arg
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ser Trp Asp Asp Ser Leu
85 90 95
Ser Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Arg Thr
100 105 110
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
115 120 125
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
130 135 140
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
145 150 155 160
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
165 170 175
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
180 185 190
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
195 200 205
Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 92
<211> 651
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Легкая цепь N3 IgG
<400> 92
cagtctgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgtactg gctcttcatc taatattggc agtaattatg tcacctggta ccagcagctc 120
ccaggaacgg cccccaaact cctcatctat gataatagta atcggccaag cggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccgg 240
tccgaggatg aggctgatta ttactgtgct tcttgggatg atagcctgag tgcttatgtc 300
ttcggcggag gcaccaagct gacggtccta cgtacggtgg ctgcaccatc tgtcttcatc 360
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 420
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 480
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 540
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 600
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg t 651
<210> 93
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 1 IgG
<400> 93
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Ser Asp Gly Gly Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 94
<211> 1338
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 1 IgG
<400> 94
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagtg atctcttctg atggtggtaa tacatattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagc ctccaccaag 360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tggtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac 600
gtgaatcaca agcccagcaa caccaaggtg gacaagaaag ttgagcccaa atcttgtgac 660
aaaactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc 720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc 780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc 840
gtggaggtgc ataatgccaa gacaaagccg cgggaggagc agtacaacag cacgtaccgt 900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc 960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg 1020
cagccccgag aaccacaggt gtataccctg cccccatccc gggatgagct gaccaagaac 1080
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg 1140
gagagcaatg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac 1200
ggctccttct tcctctacag caagctcacc gtggacaaga gcaggtggca gcaggggaac 1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc 1320
tccctgtccc cgggtaaa 1338
<210> 95
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 2 IgG
<400> 95
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Pro Gln Met Gly Arg Val Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 96
<211> 1338
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 2 IgG
<400> 96
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctcgccgc agatgggtcg ggtgtattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagc ctccaccaag 360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tggtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac 600
gtgaatcaca agcccagcaa caccaaggtg gacaagaaag ttgagcccaa atcttgtgac 660
aaaactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc 720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc 780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc 840
gtggaggtgc ataatgccaa gacaaagccg cgggaggagc agtacaacag cacgtaccgt 900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc 960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg 1020
cagccccgag aaccacaggt gtataccctg cccccatccc gggatgagct gaccaagaac 1080
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg 1140
gagagcaatg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac 1200
ggctccttct tcctctacag caagctcacc gtggacaaga gcaggtggca gcaggggaac 1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc 1320
tccctgtccc cgggtaaa 1338
<210> 97
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 3 IgG
<400> 97
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Asp Pro Leu Gly Gly Asn Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 98
<211> 1338
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 3 IgG
<400> 98
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atcgatccgt tggggggtaa tatttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagc ctccaccaag 360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tggtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac 600
gtgaatcaca agcccagcaa caccaaggtg gacaagaaag ttgagcccaa atcttgtgac 660
aaaactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc 720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc 780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc 840
gtggaggtgc ataatgccaa gacaaagccg cgggaggagc agtacaacag cacgtaccgt 900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc 960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg 1020
cagccccgag aaccacaggt gtataccctg cccccatccc gggatgagct gaccaagaac 1080
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg 1140
gagagcaatg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac 1200
ggctccttct tcctctacag caagctcacc gtggacaaga gcaggtggca gcaggggaac 1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc 1320
tccctgtccc cgggtaaa 1338
<210> 99
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 4 IgG
<400> 99
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Pro Tyr Ser Gly Arg Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 100
<211> 1338
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 4 IgG
<400> 100
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctctccgt attcgggtag gatttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagc ctccaccaag 360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tggtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac 600
gtgaatcaca agcccagcaa caccaaggtg gacaagaaag ttgagcccaa atcttgtgac 660
aaaactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc 720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc 780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc 840
gtggaggtgc ataatgccaa gacaaagccg cgggaggagc agtacaacag cacgtaccgt 900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc 960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg 1020
cagccccgag aaccacaggt gtataccctg cccccatccc gggatgagct gaccaagaac 1080
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg 1140
gagagcaatg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac 1200
ggctccttct tcctctacag caagctcacc gtggacaaga gcaggtggca gcaggggaac 1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc 1320
tccctgtccc cgggtaaa 1338
<210> 101
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 5 IgG
<400> 101
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Ala Asp Gly Gly Pro Ser Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Ser
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 102
<211> 1338
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 5 IgG
<400> 102
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atcggggctg atgggggtcc gtcttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactctgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagc ctccaccaag 360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tggtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac 600
gtgaatcaca agcccagcaa caccaaggtg gacaagaaag ttgagcccaa atcttgtgac 660
aaaactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc 720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc 780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc 840
gtggaggtgc ataatgccaa gacaaagccg cgggaggagc agtacaacag cacgtaccgt 900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc 960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg 1020
cagccccgag aaccacaggt gtataccctg cccccatccc gggatgagct gaccaagaac 1080
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg 1140
gagagcaatg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac 1200
ggctccttct tcctctacag caagctcacc gtggacaaga gcaggtggca gcaggggaac 1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc 1320
tccctgtccc cgggtaaa 1338
<210> 103
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 6 IgG
<400> 103
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Pro Tyr Ser Gly Arg Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Met Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 104
<211> 1338
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 6 IgG
<400> 104
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctctccgt attcgggtag gatttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactgtgc gagaatggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagc ctccaccaag 360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tggtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac 600
gtgaatcaca agcccagcaa caccaaggtg gacaagaaag ttgagcccaa atcttgtgac 660
aaaactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc 720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc 780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc 840
gtggaggtgc ataatgccaa gacaaagccg cgggaggagc agtacaacag cacgtaccgt 900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc 960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg 1020
cagccccgag aaccacaggt gtataccctg cccccatccc gggatgagct gaccaagaac 1080
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg 1140
gagagcaatg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac 1200
ggctccttct tcctctacag caagctcacc gtggacaaga gcaggtggca gcaggggaac 1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc 1320
tccctgtccc cgggtaaa 1338
<210> 105
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 7 IgG
<400> 105
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Pro Tyr Ser Gly Arg Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Ala Leu Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 106
<211> 1338
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 7 IgG
<400> 106
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agttatgata tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagcg atctctccgt attcgggtag gatttattac 180
gctgattctg taaaaggtcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactgtgc gagactggcg 300
cttgatttcg actactgggg ccagggtaca ctggtcaccg tgagctcagc ctccaccaag 360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tggtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac 600
gtgaatcaca agcccagcaa caccaaggtg gacaagaaag ttgagcccaa atcttgtgac 660
aaaactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc 720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc 780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc 840
gtggaggtgc ataatgccaa gacaaagccg cgggaggagc agtacaacag cacgtaccgt 900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc 960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg 1020
cagccccgag aaccacaggt gtataccctg cccccatccc gggatgagct gaccaagaac 1080
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg 1140
gagagcaatg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac 1200
ggctccttct tcctctacag caagctcacc gtggacaaga gcaggtggca gcaggggaac 1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc 1320
tccctgtccc cgggtaaa 1338
<210> 107
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Легкая цепь 1 IgG
<400> 107
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ser Phe Ser Asp Glu Leu
85 90 95
Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Arg Thr
100 105 110
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
115 120 125
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
130 135 140
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
145 150 155 160
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
165 170 175
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
180 185 190
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
195 200 205
Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 108
<211> 651
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Легкая цепь 1 IgG
<400> 108
cagtctgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgtactg gctcttcatc taatattggc agtaattatg tcacctggta ccagcagctc 120
ccaggaacgg cccccaaact cctcatctat gataatagta atcggccaag cggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tccgaggatg aggctgatta ttactgtgct tcttttagtg atgagttggg ggcttatgtc 300
ttcggcggag gcaccaagct gacggtccta cgtacggtgg ctgcaccatc tgtcttcatc 360
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 420
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 480
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 540
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 600
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg t 651
<210> 109
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Легкая цепь 2 IgG
<400> 109
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser Asp Glu Leu
85 90 95
Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Arg Thr
100 105 110
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
115 120 125
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
130 135 140
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
145 150 155 160
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
165 170 175
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
180 185 190
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
195 200 205
Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 110
<211> 651
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Легкая цепь 2 IgG
<400> 110
cagtctgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgtactg gctcttcatc taatattggc agtaattatg tcacctggta ccagcagctc 120
ccaggaacgg cccccaaact cctcatctat gataatagta atcggccaag cggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tccgaggatg aggctgatta ttactgttct tcttttagtg atgagttggg ggcttatgtc 300
ttcggcggag gcaccaagct gacggtccta cgtacggtgg ctgcaccatc tgtcttcatc 360
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 420
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 480
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 540
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 600
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg t 651
<210> 111
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Легкая цепь 3 IgG
<400> 111
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Asp Asn Ser Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser Asp Glu Leu
85 90 95
Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105 110
Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu
115 120 125
Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr
130 135 140
Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys
145 150 155 160
Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr
165 170 175
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
180 185 190
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
195 200 205
Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 112
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Легкая цепь 3 IgG
<400> 112
cagtctgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgtactg gctcttcatc taatattggc agtaattatg tcacctggta ccagcagctc 120
ccaggaacgg cccccaaact cctcatctat gataatagta atcggccaag cggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tccgaggatg aggctgatta ttactgttct tcttttagtg atgagttggg ggcttatgtc 300
ttcggcggag gcaccaagct gacggtccta ggtcagccca aggctgcccc ctcggtcacg 360
ctcttcccac cctcctctga ggagcttcaa gccaacaagg ccacactggt gtgtctcata 420
agtgacttct acccgggagc cgtgacagtg gcctggaagg cagatagcag ccccgtcaag 480
gcgggagtgg agaccaccac accctccaaa caaagcaaca acaagtacgc ggccagcagc 540
tacctgagcc tgacgcctga gcagtggaag tcccacagaa gctacagctg ccaggtcacg 600
catgaaggga gcaccgtgga gaagacagtg gcccctacag aatgctct 648
<210> 113
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Легкая цепь 4 IgG
<400> 113
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser Asp Glu Leu
85 90 95
Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105 110
Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu
115 120 125
Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr
130 135 140
Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys
145 150 155 160
Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr
165 170 175
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
180 185 190
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
195 200 205
Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 114
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Легкая цепь 4 IgG
<400> 114
cagtctgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgtactg gctcttcatc taatattggc agtaattatg tcacctggta ccagcagctc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcggccaag cggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tccgaggatg aggctgatta ttactgttct tcttttagtg atgagttggg ggcttatgtc 300
ttcggcggag gcaccaagct gacggtccta agtcagccca aggctgcccc ctcggtcacg 360
ctcttcccac cctcctctga ggagcttcaa gccaacaagg ccacactggt gtgtctcata 420
agtgacttct acccgggagc cgtgacagtg gcctggaagg cagatagcag ccccgtcaag 480
gcgggagtgg agaccaccac accctccaaa caaagcaaca acaagtacgc ggccagcagc 540
tacctgagcc tgacgcctga gcagtggaag tcccacagaa gctacagctg ccaggtcacg 600
catgaaggga gcaccgtgga gaagacagtg gcccctacag aatgctct 648
<210> 115
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Легкая цепь 5 IgG
<400> 115
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Tyr Val Thr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Arg Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Phe Ser Asp Glu Leu
85 90 95
Gly Ala Tyr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105 110
Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu
115 120 125
Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr
130 135 140
Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys
145 150 155 160
Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr
165 170 175
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
180 185 190
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
195 200 205
Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 116
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Легкая цепь 5 IgG
<400> 116
cagtctgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgtactg gctcttcatc taatattggc agtaattatg tcacctggta ccagcagctc 120
ccaggaacgg cccccaaact cctcatctat cggaataatc agcggccaag cggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tccgaggatg aggctgatta ttactgttct tcttttagtg atgagttggg ggcttatgtc 300
ttcggcggag gcaccaagct gacggtccta ggtcagccca aggctgcccc ctcggtcacg 360
ctcttcccac cctcctctga ggagcttcaa gccaacaagg ccacactggt gtgtctcata 420
agtgacttct acccgggagc cgtgacagtg gcctggaagg cagatagcag ccccgtcaag 480
gcgggagtgg agaccaccac accctccaaa caaagcaaca acaagtacgc ggccagcagc 540
tacctgagcc tgacgcctga gcagtggaag tcccacagaa gctacagctg ccaggtcacg 600
catgaaggga gcaccgtgga gaagacagtg gcccctacag aatgctct 648
<210> 117
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> основной сайт связывания серий N3 Ат
<400> 117
Lys Leu Ser Lys Asn Glu Leu Lys Arg Arg Leu Lys Ala
1 5 10
<210> 118
<211> 597
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность Лизил-тРНК синтетазы
(KRS, Человек разумный)_Номер доступа Genbank
NP_005539.1
<400> 118
Met Ala Ala Val Gln Ala Ala Glu Val Lys Val Asp Gly Ser Glu Pro
1 5 10 15
Lys Leu Ser Lys Asn Glu Leu Lys Arg Arg Leu Lys Ala Glu Lys Lys
20 25 30
Val Ala Glu Lys Glu Ala Lys Gln Lys Glu Leu Ser Glu Lys Gln Leu
35 40 45
Ser Gln Ala Thr Ala Ala Ala Thr Asn His Thr Thr Asp Asn Gly Val
50 55 60
Gly Pro Glu Glu Glu Ser Val Asp Pro Asn Gln Tyr Tyr Lys Ile Arg
65 70 75 80
Ser Gln Ala Ile His Gln Leu Lys Val Asn Gly Glu Asp Pro Tyr Pro
85 90 95
His Lys Phe His Val Asp Ile Ser Leu Thr Asp Phe Ile Gln Lys Tyr
100 105 110
Ser His Leu Gln Pro Gly Asp His Leu Thr Asp Ile Thr Leu Lys Val
115 120 125
Ala Gly Arg Ile His Ala Lys Arg Ala Ser Gly Gly Lys Leu Ile Phe
130 135 140
Tyr Asp Leu Arg Gly Glu Gly Val Lys Leu Gln Val Met Ala Asn Ser
145 150 155 160
Arg Asn Tyr Lys Ser Glu Glu Glu Phe Ile His Ile Asn Asn Lys Leu
165 170 175
Arg Arg Gly Asp Ile Ile Gly Val Gln Gly Asn Pro Gly Lys Thr Lys
180 185 190
Lys Gly Glu Leu Ser Ile Ile Pro Tyr Glu Ile Thr Leu Leu Ser Pro
195 200 205
Cys Leu His Met Leu Pro His Leu His Phe Gly Leu Lys Asp Lys Glu
210 215 220
Thr Arg Tyr Arg Gln Arg Tyr Leu Asp Leu Ile Leu Asn Asp Phe Val
225 230 235 240
Arg Gln Lys Phe Ile Ile Arg Ser Lys Ile Ile Thr Tyr Ile Arg Ser
245 250 255
Phe Leu Asp Glu Leu Gly Phe Leu Glu Ile Glu Thr Pro Met Met Asn
260 265 270
Ile Ile Pro Gly Gly Ala Val Ala Lys Pro Phe Ile Thr Tyr His Asn
275 280 285
Glu Leu Asp Met Asn Leu Tyr Met Arg Ile Ala Pro Glu Leu Tyr His
290 295 300
Lys Met Leu Val Val Gly Gly Ile Asp Arg Val Tyr Glu Ile Gly Arg
305 310 315 320
Gln Phe Arg Asn Glu Gly Ile Asp Leu Thr His Asn Pro Glu Phe Thr
325 330 335
Thr Cys Glu Phe Tyr Met Ala Tyr Ala Asp Tyr His Asp Leu Met Glu
340 345 350
Ile Thr Glu Lys Met Val Ser Gly Met Val Lys His Ile Thr Gly Ser
355 360 365
Tyr Lys Val Thr Tyr His Pro Asp Gly Pro Glu Gly Gln Ala Tyr Asp
370 375 380
Val Asp Phe Thr Pro Pro Phe Arg Arg Ile Asn Met Val Glu Glu Leu
385 390 395 400
Glu Lys Ala Leu Gly Met Lys Leu Pro Glu Thr Asn Leu Phe Glu Thr
405 410 415
Glu Glu Thr Arg Lys Ile Leu Asp Asp Ile Cys Val Ala Lys Ala Val
420 425 430
Glu Cys Pro Pro Pro Arg Thr Thr Ala Arg Leu Leu Asp Lys Leu Val
435 440 445
Gly Glu Phe Leu Glu Val Thr Cys Ile Asn Pro Thr Phe Ile Cys Asp
450 455 460
His Pro Gln Ile Met Ser Pro Leu Ala Lys Trp His Arg Ser Lys Glu
465 470 475 480
Gly Leu Thr Glu Arg Phe Glu Leu Phe Val Met Lys Lys Glu Ile Cys
485 490 495
Asn Ala Tyr Thr Glu Leu Asn Asp Pro Met Arg Gln Arg Gln Leu Phe
500 505 510
Glu Glu Gln Ala Lys Ala Lys Ala Ala Gly Asp Asp Glu Ala Met Phe
515 520 525
Ile Asp Glu Asn Phe Cys Thr Ala Leu Glu Tyr Gly Leu Pro Pro Thr
530 535 540
Ala Gly Trp Gly Met Gly Ile Asp Arg Val Ala Met Phe Leu Thr Asp
545 550 555 560
Ser Asn Asn Ile Lys Glu Val Leu Leu Phe Pro Ala Met Lys Pro Glu
565 570 575
Asp Lys Lys Glu Asn Val Ala Thr Thr Asp Thr Leu Glu Ser Thr Thr
580 585 590
Val Gly Thr Ser Val
595
<210> 119
<211> 1794
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК последовательность KRS
<400> 119
atggcggccg tgcaggcggc cgaggtgaaa gtggatggca gcgagccgaa actgagcaag 60
aatgagctga agagacgcct gaaagctgag aagaaagtag cagagaagga ggccaaacag 120
aaagagctca gtgagaaaca gctaagccaa gccactgctg ctgccaccaa ccacaccact 180
gataatggtg tgggtcctga ggaagagagc gtggacccaa atcaatacta caaaatccgc 240
agtcaagcaa ttcatcagct gaaggtcaat ggggaagacc catacccaca caagttccat 300
gtagacatct cactcactga cttcatccaa aaatatagtc acctgcagcc tggggatcac 360
ctgactgaca tcaccttaaa ggtggcaggt aggatccatg ccaaaagagc ttctggggga 420
aagctcatct tctatgatct tcgaggagag ggggtgaagt tgcaagtcat ggccaattcc 480
agaaattata aatcagaaga agaatttatt catattaata acaaactgcg tcggggagac 540
ataattggag ttcaggggaa tcctggtaaa accaagaagg gtgagctgag catcattccg 600
tatgagatca cactgctgtc tccctgtttg catatgttac ctcatcttca ctttgggctc 660
aaagacaagg aaacaaggta tcgccagaga tacttggact tgatcctgaa tgactttgtg 720
aggcagaaat ttatcatccg ctctaagatc atcacatata taagaagttt cttagatgag 780
ctgggattcc tagagattga aactcccatg atgaacatca tcccaggggg agccgtggcc 840
aagcctttca tcacttatca caacgagctg gacatgaact tatatatgag aattgctcca 900
gaactctatc ataagatgct tgtggttggt ggcatcgacc gggtttatga aattggacgc 960
cagttccgga atgaggggat tgatttgacg cacaatcctg agttcaccac ctgtgagttc 1020
tacatggcct atgcagacta tcacgatctc atggaaatca cggagaagat ggtttcaggg 1080
atggtgaagc atattacagg cagttacaag gtcacctacc acccagatgg cccagagggc 1140
caagcctacg atgttgactt caccccaccc ttccggcgaa tcaacatggt agaagagctt 1200
gagaaagccc tggggatgaa gctgccagaa acgaacctct ttgaaactga agaaactcgc 1260
aaaattcttg atgatatctg tgtggcaaaa gctgttgaat gccctccacc tcggaccaca 1320
gccaggctcc ttgacaagct tgttggggag ttcctggaag tgacttgcat caatcctaca 1380
ttcatctgtg atcacccaca gataatgagc cctttggcta aatggcaccg ctctaaagag 1440
ggtctgactg agcgctttga gctgtttgtc atgaagaaag agatatgcaa tgcgtatact 1500
gagctgaatg atcccatgcg gcagcggcag ctttttgaag aacaggccaa ggccaaggct 1560
gcaggtgatg atgaggccat gttcatagat gaaaacttct gtactgccct ggaatatggg 1620
ctgcccccca cagctggctg gggcatgggc attgatcgag tcgccatgtt tctcacggac 1680
tccaacaaca tcaaggaagt acttctgttt cctgccatga aacccgaaga caagaaggag 1740
aatgtagcaa ccactgatac actggaaagc acaacagttg gcacttctgt ctag 1794
<210> 120
<211> 1823
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность ламинина субъединицы
альфа-4 (Человек разумный)
<400> 120
Met Ala Leu Ser Ser Ala Trp Arg Ser Val Leu Pro Leu Trp Leu Leu
1 5 10 15
Trp Ser Ala Ala Cys Ser Arg Ala Ala Ser Gly Asp Asp Asn Ala Phe
20 25 30
Pro Phe Asp Ile Glu Gly Ser Ser Ala Val Gly Arg Gln Asp Pro Pro
35 40 45
Glu Thr Ser Glu Pro Arg Val Ala Leu Gly Arg Leu Pro Pro Ala Ala
50 55 60
Glu Lys Cys Asn Ala Gly Phe Phe His Thr Leu Ser Gly Glu Cys Val
65 70 75 80
Pro Cys Asp Cys Asn Gly Asn Ser Asn Glu Cys Leu Asp Gly Ser Gly
85 90 95
Tyr Cys Val His Cys Gln Arg Asn Thr Thr Gly Glu His Cys Glu Lys
100 105 110
Cys Leu Asp Gly Tyr Ile Gly Asp Ser Ile Arg Gly Ala Pro Gln Phe
115 120 125
Cys Gln Pro Cys Pro Cys Pro Leu Pro His Leu Ala Asn Phe Ala Glu
130 135 140
Ser Cys Tyr Arg Lys Asn Gly Ala Val Arg Cys Ile Cys Asn Glu Asn
145 150 155 160
Tyr Ala Gly Pro Asn Cys Glu Arg Cys Ala Pro Gly Tyr Tyr Gly Asn
165 170 175
Pro Leu Leu Ile Gly Ser Thr Cys Lys Lys Cys Asp Cys Ser Gly Asn
180 185 190
Ser Asp Pro Asn Leu Ile Phe Glu Asp Cys Asp Glu Val Thr Gly Gln
195 200 205
Cys Arg Asn Cys Leu Arg Asn Thr Thr Gly Phe Lys Cys Glu Arg Cys
210 215 220
Ala Pro Gly Tyr Tyr Gly Asp Ala Arg Ile Ala Lys Asn Cys Ala Val
225 230 235 240
Cys Asn Cys Gly Gly Gly Pro Cys Asp Ser Val Thr Gly Glu Cys Leu
245 250 255
Glu Glu Gly Phe Glu Pro Pro Thr Gly Met Asp Cys Pro Thr Ile Ser
260 265 270
Cys Asp Lys Cys Val Trp Asp Leu Thr Asp Ala Leu Arg Leu Ala Ala
275 280 285
Leu Ser Ile Glu Glu Gly Lys Ser Gly Val Leu Ser Val Ser Ser Gly
290 295 300
Ala Ala Ala His Arg His Val Asn Glu Ile Asn Ala Thr Ile Tyr Leu
305 310 315 320
Leu Lys Thr Lys Leu Ser Glu Arg Glu Asn Gln Tyr Ala Leu Arg Lys
325 330 335
Ile Gln Ile Asn Asn Ala Glu Asn Thr Met Lys Ser Leu Leu Ser Asp
340 345 350
Val Glu Glu Leu Val Glu Lys Glu Asn Gln Ala Ser Arg Lys Gly Gln
355 360 365
Leu Val Gln Lys Glu Ser Met Asp Thr Ile Asn His Ala Ser Gln Leu
370 375 380
Val Glu Gln Ala His Asp Met Arg Asp Lys Ile Gln Glu Ile Asn Asn
385 390 395 400
Lys Met Leu Tyr Tyr Gly Glu Glu His Glu Leu Ser Pro Lys Glu Ile
405 410 415
Ser Glu Lys Leu Val Leu Ala Gln Lys Met Leu Glu Glu Ile Arg Ser
420 425 430
Arg Gln Pro Phe Phe Thr Gln Arg Glu Leu Val Asp Glu Glu Ala Asp
435 440 445
Glu Ala Tyr Glu Leu Leu Ser Gln Ala Glu Ser Trp Gln Arg Leu His
450 455 460
Asn Glu Thr Arg Thr Leu Phe Pro Val Val Leu Glu Gln Leu Asp Asp
465 470 475 480
Tyr Asn Ala Lys Leu Ser Asp Leu Gln Glu Ala Leu Asp Gln Ala Leu
485 490 495
Asn Tyr Val Arg Asp Ala Glu Asp Met Asn Arg Ala Thr Ala Ala Arg
500 505 510
Gln Arg Asp His Glu Lys Gln Gln Glu Arg Val Arg Glu Gln Met Glu
515 520 525
Val Val Asn Met Ser Leu Ser Thr Ser Ala Asp Ser Leu Thr Thr Pro
530 535 540
Arg Leu Thr Leu Ser Glu Leu Asp Asp Ile Ile Lys Asn Ala Ser Gly
545 550 555 560
Ile Tyr Ala Glu Ile Asp Gly Ala Lys Ser Glu Leu Gln Val Lys Leu
565 570 575
Ser Asn Leu Ser Asn Leu Ser His Asp Leu Val Gln Glu Ala Ile Asp
580 585 590
His Ala Gln Asp Leu Gln Gln Glu Ala Asn Glu Leu Ser Arg Lys Leu
595 600 605
His Ser Ser Asp Met Asn Gly Leu Val Gln Lys Ala Leu Asp Ala Ser
610 615 620
Asn Val Tyr Glu Asn Ile Val Asn Tyr Val Ser Glu Ala Asn Glu Thr
625 630 635 640
Ala Glu Phe Ala Leu Asn Thr Thr Asp Arg Ile Tyr Asp Ala Val Ser
645 650 655
Gly Ile Asp Thr Gln Ile Ile Tyr His Lys Asp Glu Ser Glu Asn Leu
660 665 670
Leu Asn Gln Ala Arg Glu Leu Gln Ala Lys Ala Glu Ser Ser Ser Asp
675 680 685
Glu Ala Val Ala Asp Thr Ser Arg Arg Val Gly Gly Ala Leu Ala Arg
690 695 700
Lys Ser Ala Leu Lys Thr Arg Leu Ser Asp Ala Val Lys Gln Leu Gln
705 710 715 720
Ala Ala Glu Arg Gly Asp Ala Gln Gln Arg Leu Gly Gln Ser Arg Leu
725 730 735
Ile Thr Glu Glu Ala Asn Arg Thr Thr Met Glu Val Gln Gln Ala Thr
740 745 750
Ala Pro Met Ala Asn Asn Leu Thr Asn Trp Ser Gln Asn Leu Gln His
755 760 765
Phe Asp Ser Ser Ala Tyr Asn Thr Ala Val Asn Ser Ala Arg Asp Ala
770 775 780
Val Arg Asn Leu Thr Glu Val Val Pro Gln Leu Leu Asp Gln Leu Arg
785 790 795 800
Thr Val Glu Gln Lys Arg Pro Ala Ser Asn Val Ser Ala Ser Ile Gln
805 810 815
Arg Ile Arg Glu Leu Ile Ala Gln Thr Arg Ser Val Ala Ser Lys Ile
820 825 830
Gln Val Ser Met Met Phe Asp Gly Gln Ser Ala Val Glu Val His Ser
835 840 845
Arg Thr Ser Met Asp Asp Leu Lys Ala Phe Thr Ser Leu Ser Leu Tyr
850 855 860
Met Lys Pro Pro Val Lys Arg Pro Glu Leu Thr Glu Thr Ala Asp Gln
865 870 875 880
Phe Ile Leu Tyr Leu Gly Ser Lys Asn Ala Lys Lys Glu Tyr Met Gly
885 890 895
Leu Ala Ile Lys Asn Asp Asn Leu Val Tyr Val Tyr Asn Leu Gly Thr
900 905 910
Lys Asp Val Glu Ile Pro Leu Asp Ser Lys Pro Val Ser Ser Trp Pro
915 920 925
Ala Tyr Phe Ser Ile Val Lys Ile Glu Arg Val Gly Lys His Gly Lys
930 935 940
Val Phe Leu Thr Val Pro Ser Leu Ser Ser Thr Ala Glu Glu Lys Phe
945 950 955 960
Ile Lys Lys Gly Glu Phe Ser Gly Asp Asp Ser Leu Leu Asp Leu Asp
965 970 975
Pro Glu Asp Thr Val Phe Tyr Val Gly Gly Val Pro Ser Asn Phe Lys
980 985 990
Leu Pro Thr Ser Leu Asn Leu Pro Gly Phe Val Gly Cys Leu Glu Leu
995 1000 1005
Ala Thr Leu Asn Asn Asp Val Ile Ser Leu Tyr Asn Phe Lys His Ile
1010 1015 1020
Tyr Asn Met Asp Pro Ser Thr Ser Val Pro Cys Ala Arg Asp Lys Leu
1025 1030 1035 1040
Ala Phe Thr Gln Ser Arg Ala Ala Ser Tyr Phe Phe Asp Gly Ser Gly
1045 1050 1055
Tyr Ala Val Val Arg Asp Ile Thr Arg Arg Gly Lys Phe Gly Gln Val
1060 1065 1070
Thr Arg Phe Asp Ile Glu Val Arg Thr Pro Ala Asp Asn Gly Leu Ile
1075 1080 1085
Leu Leu Met Val Asn Gly Ser Met Phe Phe Arg Leu Glu Met Arg Asn
1090 1095 1100
Gly Tyr Leu His Val Phe Tyr Asp Phe Gly Phe Ser Gly Gly Pro Val
1105 1110 1115 1120
His Leu Glu Asp Thr Leu Lys Lys Ala Gln Ile Asn Asp Ala Lys Tyr
1125 1130 1135
His Glu Ile Ser Ile Ile Tyr His Asn Asp Lys Lys Met Ile Leu Val
1140 1145 1150
Val Asp Arg Arg His Val Lys Ser Met Asp Asn Glu Lys Met Lys Ile
1155 1160 1165
Pro Phe Thr Asp Ile Tyr Ile Gly Gly Ala Pro Pro Glu Ile Leu Gln
1170 1175 1180
Ser Arg Ala Leu Arg Ala His Leu Pro Leu Asp Ile Asn Phe Arg Gly
1185 1190 1195 1200
Cys Met Lys Gly Phe Gln Phe Gln Lys Lys Asp Phe Asn Leu Leu Glu
1205 1210 1215
Gln Thr Glu Thr Leu Gly Val Gly Tyr Gly Cys Pro Glu Asp Ser Leu
1220 1225 1230
Ile Ser Arg Arg Ala Tyr Phe Asn Gly Gln Ser Phe Ile Ala Ser Ile
1235 1240 1245
Gln Lys Ile Ser Phe Phe Asp Gly Phe Glu Gly Gly Phe Asn Phe Arg
1250 1255 1260
Thr Leu Gln Pro Asn Gly Leu Leu Phe Tyr Tyr Ala Ser Gly Ser Asp
1265 1270 1275 1280
Val Phe Ser Ile Ser Leu Asp Asn Gly Thr Val Ile Met Asp Val Lys
1285 1290 1295
Gly Ile Lys Val Gln Ser Val Asp Lys Gln Tyr Asn Asp Gly Leu Ser
1300 1305 1310
His Phe Val Ile Ser Ser Val Ser Pro Thr Arg Tyr Glu Leu Ile Val
1315 1320 1325
Asp Lys Ser Arg Val Gly Ser Lys Asn Pro Thr Lys Gly Lys Ile Glu
1330 1335 1340
Gln Thr Gln Ala Ser Glu Lys Lys Phe Tyr Phe Gly Gly Ser Pro Ile
1345 1350 1355 1360
Ser Ala Gln Tyr Ala Asn Phe Thr Gly Cys Ile Ser Asn Ala Tyr Phe
1365 1370 1375
Thr Arg Val Asp Arg Asp Val Glu Val Glu Asp Phe Gln Arg Tyr Thr
1380 1385 1390
Glu Lys Val His Thr Ser Leu Tyr Glu Cys Pro Ile Glu Ser Ser Pro
1395 1400 1405
Leu Phe Leu Leu His Lys Lys Gly Lys Asn Leu Ser Lys Pro Lys Ala
1410 1415 1420
Ser Gln Asn Lys Lys Gly Gly Lys Ser Lys Asp Ala Pro Ser Trp Asp
1425 1430 1435 1440
Pro Val Ala Leu Lys Leu Pro Glu Arg Asn Thr Pro Arg Asn Ser His
1445 1450 1455
Cys His Leu Ser Asn Ser Pro Arg Ala Ile Glu His Ala Tyr Gln Tyr
1460 1465 1470
Gly Gly Thr Ala Asn Ser Arg Gln Glu Phe Glu His Leu Lys Gly Asp
1475 1480 1485
Phe Gly Ala Lys Ser Gln Phe Ser Ile Arg Leu Arg Thr Arg Ser Ser
1490 1495 1500
His Gly Met Ile Phe Tyr Val Ser Asp Gln Glu Glu Asn Asp Phe Met
1505 1510 1515 1520
Thr Leu Phe Leu Ala His Gly Arg Leu Val Tyr Met Phe Asn Val Gly
1525 1530 1535
His Lys Lys Leu Lys Ile Arg Ser Gln Glu Lys Tyr Asn Asp Gly Leu
1540 1545 1550
Trp His Asp Val Ile Phe Ile Arg Glu Arg Ser Ser Gly Arg Leu Val
1555 1560 1565
Ile Asp Gly Leu Arg Val Leu Glu Glu Ser Leu Pro Pro Thr Glu Ala
1570 1575 1580
Thr Trp Lys Ile Lys Gly Pro Ile Tyr Leu Gly Gly Val Ala Pro Gly
1585 1590 1595 1600
Lys Ala Val Lys Asn Val Gln Ile Asn Ser Ile Tyr Ser Phe Ser Gly
1605 1610 1615
Cys Leu Ser Asn Leu Gln Leu Asn Gly Ala Ser Ile Thr Ser Ala Ser
1620 1625 1630
Gln Thr Phe Ser Val Thr Pro Cys Phe Glu Gly Pro Met Glu Thr Gly
1635 1640 1645
Thr Tyr Phe Ser Thr Glu Gly Gly Tyr Val Val Leu Asp Glu Ser Phe
1650 1655 1660
Asn Ile Gly Leu Lys Phe Glu Ile Ala Phe Glu Val Arg Pro Arg Ser
1665 1670 1675 1680
Ser Ser Gly Thr Leu Val His Gly His Ser Val Asn Gly Glu Tyr Leu
1685 1690 1695
Asn Val His Met Lys Asn Gly Gln Val Ile Val Lys Val Asn Asn Gly
1700 1705 1710
Ile Arg Asp Phe Ser Thr Ser Val Thr Pro Lys Gln Ser Leu Cys Asp
1715 1720 1725
Gly Arg Trp His Arg Ile Thr Val Ile Arg Asp Ser Asn Val Val Gln
1730 1735 1740
Leu Asp Val Asp Ser Glu Val Asn His Val Val Gly Pro Leu Asn Pro
1745 1750 1755 1760
Lys Pro Ile Asp His Arg Glu Pro Val Phe Val Gly Gly Val Pro Glu
1765 1770 1775
Ser Leu Leu Thr Pro Arg Leu Ala Pro Ser Lys Pro Phe Thr Gly Cys
1780 1785 1790
Ile Arg His Phe Val Ile Asp Gly His Pro Val Ser Phe Ser Lys Ala
1795 1800 1805
Ala Leu Val Ser Gly Ala Val Ser Ile Asn Ser Cys Pro Ala Ala
1810 1815 1820
<210> 121
<211> 5472
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК последовательность ламинина субъединицы альфа-4
(Человека разумный)
<400> 121
atggctttga gctcagcctg gcgctcggtt ctgcctctgt ggctcctctg gagcgctgcc 60
tgctcccgcg ccgcgtccgg ggacgacaac gcttttcctt ttgacattga agggagctca 120
gcggttggca ggcaagaccc gcctgagacg agcgaacccc gcgtggctct gggacgcctg 180
ccgcctgcgg ccgagaaatg caatgctgga ttctttcaca ccctgtcggg agaatgtgtg 240
ccctgcgact gtaatggcaa ttccaacgag tgtttggacg gctcaggata ctgtgtgcac 300
tgccagcgga acacaacagg agagcactgt gaaaagtgtc tggatggtta tatcggagat 360
tccatcaggg gagcacccca attctgccag ccgtgcccct gtcccctgcc ccacttggcc 420
aattttgcag aatcctgcta taggaaaaat ggagctgttc ggtgcatttg taacgaaaat 480
tatgctggac ctaactgtga aagatgtgct cccggttact atggaaaccc cttactcatt 540
ggaagcacct gtaagaaatg tgactgcagt ggaaattcag atcccaacct gatctttgaa 600
gattgtgatg aagtcactgg ccagtgtagg aattgcttac gcaacaccac cggattcaag 660
tgtgaacgtt gcgctcctgg ctactatggg gacgccagga tagccaagaa ctgtgcagtg 720
tgcaactgcg ggggaggccc atgtgacagt gtaaccggag aatgcttgga agaaggtttt 780
gaacccccta caggcatgga ctgcccaacc ataagctgtg ataagtgcgt ctgggacctg 840
actgatgacc tgcggttagc agcgctctcc atcgaggaag gcaaatccgg ggtgctgagc 900
gtatcctctg gggccgccgc tcataggcac gtgaatgaaa tcaacgccac catctacctc 960
ctcaaaacaa aattgtcaga aagagaaaac caatacgccc taagaaagat acaaatcaac 1020
aatgctgaga acacgatgaa aagccttctg tctgacgtag aggaattagt tgaaaaggaa 1080
aatcaagcct ccagaaaagg acaacttgtt cagaaggaaa gcatggacac cattaaccac 1140
gcaagtcagc tggtagagca agcccatgat atgagggata aaatccaaga gatcaacaac 1200
aagatgctct attatgggga agagcatgaa cttagcccca aggaaatctc tgagaagctg 1260
gtgttggccc agaagatgct tgaagagatt agaagccgtc aaccattttt cacccaacgg 1320
gagctcgtgg atgaggaggc agatgaggct tacgaactac tgagccaggc tgagagctgg 1380
cagcggctgc acaatgagac ccgcactctg tttcctgtcg tcctggagca gctggatgac 1440
tacaatgcta agttgtcaga tctccaggaa gcacttgacc aggcccttaa ctatgtcagg 1500
gatgccgaag acatgaacag ggccacagca gccaggcagc gggaccatga gaaacaacag 1560
gaaagagtga gggaacaaat ggaagtggtg aacatgtctc tgagcacatc tgcggactct 1620
ctgacaacac ctcgtctaac tctttcagaa cttgatgata taataaagaa tgcgtcaggg 1680
atttatgcag aaatagatgg agccaaaagt gaactacaag taaaactatc taacctaagt 1740
aacctcagcc atgatttagt ccaagaagct attgaccatg cacaggacct tcaacaagaa 1800
gctaatgaat tgagcaggaa gttgcacagt tcagatatga acgggctggt acagaaggct 1860
ttggatgcat caaatgtcta tgaaaatatt gttaattatg ttagtgaagc caatgaaaca 1920
gcagaatttg ctttgaacac cactgaccga atttatgatg cggtgagtgg gattgatact 1980
caaatcattt accataaaga tgaaagtgag aacctcctca atcaagccag agaactgcaa 2040
gcaaaggcag agtctagcag tgatgaagca gtggctgaca ctagcaggcg tgtgggtgga 2100
gccctagcaa ggaaaagtgc ccttaaaacc agactcagtg atgccgttaa gcaactacaa 2160
gcagcagaga gaggggatgc ccagcagcgc ctggggcagt ctagactgat caccgaggaa 2220
gccaacagga cgacgatgga ggtgcagcag gccactgccc ccatggccaa caatctaacc 2280
aactggtcac agaatcttca acattttgac tcttctgctt acaacactgc agtgaactct 2340
gctagggatg cagtaagaaa tctgaccgag gttgtccctc agctcctgga tcagcttcgt 2400
acggttgagc agaagcgacc tgcaagcaac gtttctgcca gcatccagag gatccgagag 2460
ctcattgctc agaccagaag tgttgccagc aagatccaag tctccatgat gtttgatggc 2520
cagtcagctg tggaagtgca ctcgagaacc agtatggatg acttaaaggc cttcacgtct 2580
ctgagcctgt acatgaaacc ccctgtgaag cggccggaac tgaccgagac tgcagatcag 2640
tttatcctgt acctcggaag caaaaacgcc aaaaaagagt atatgggtct tgcaatcaaa 2700
aatgataatc tggtatacgt ctataatttg ggaactaaag atgtggagat tcccctggac 2760
tccaagcccg tcagttcctg gcctgcttac ttcagcattg tcaagattga aagggtggga 2820
aaacatggaa aggtgttttt aacagtcccg agtctaagta gcacagcaga ggaaaagttc 2880
attaaaaagg gggaattttc gggagatgac tctctgctgg acctggaccc tgaggacaca 2940
gtgttttatg ttggtggagt gccttccaac ttcaagctcc ctaccagctt aaacctgcct 3000
ggctttgttg gctgcctgga actggccact ttgaataatg atgtgatcag cttgtacaac 3060
tttaagcaca tctataatat ggacccctcc acatcagtgc catgtgcccg agataagctg 3120
gccttcactc agagtcgggc tgccagttac ttcttcgatg gctccggtta tgccgtggtg 3180
agagacatca caaggagagg gaaatttggt caggtgactc gctttgacat agaagttcga 3240
acaccagctg acaacggcct tattctcctg atggtcaatg gaagtatgtt tttcagactg 3300
gaaatgcgca atggttacct acatgtgttc tatgattttg gattcagcgg tggccctgtg 3360
catcttgaag atacgttaaa gaaagctcaa attaatgatg caaaatacca tgagatctca 3420
atcatttacc acaatgataa gaaaatgatc ttggtagttg acagaaggca tgtcaagagc 3480
atggataatg aaaagatgaa aatacctttt acagatatat acattggagg agctcctcca 3540
gaaatcttac aatccagggc cctcagagca caccttcccc tagatatcaa cttcagagga 3600
tgcatgaagg gcttccagtt ccaaaagaag gacttcaatt tactggagca gacagaaacc 3660
ctgggagttg gttatggatg cccagaagac tcacttatat ctcgcagagc atatttcaat 3720
ggacagagct tcattgcttc aattcagaaa atatctttct ttgatggctt tgaaggaggt 3780
tttaatttcc gaacattaca accaaatggg ttactattct attatgcttc agggtcagac 3840
gtgttctcca tctcactgga taatggtact gtcatcatgg atgtaaaggg aatcaaagtt 3900
cagtcagtag ataagcagta caatgatggg ctgtcccact tcgtcattag ctctgtctca 3960
cccacaagat atgaactgat agtagataaa agcagagttg ggagtaagaa tcctaccaaa 4020
gggaaaatag aacagacaca agcaagtgaa aagaagtttt acttcggtgg ctcaccaatc 4080
agtgctcagt atgctaattt cactggctgc ataagtaatg cctactttac cagggtggat 4140
agagatgtgg aggttgaaga tttccaacgg tatactgaaa aggtccacac ttctctttat 4200
gagtgtccca ttgagtcttc accattgttt ctcctccata aaaaaggaaa aaatttatcc 4260
aagcctaaag caagtcagaa taaaaaggga gggaaaagta aagatgcacc ttcatgggat 4320
cctgttgctc tgaaactccc agagcggaat actccaagaa actctcattg ccacctttcc 4380
aacagcccta gagcaataga gcacgcctat caatatggag gaacagccaa cagccgccaa 4440
gagtttgaac acttaaaagg agattttggt gccaaatctc agttttccat tcgtctgaga 4500
actcgttcct cccatggcat gatcttctat gtctcagatc aagaagagaa tgacttcatg 4560
actctatttt tggcccatgg ccgcttggtt tacatgttta atgttggtca caaaaaactg 4620
aagattagaa gccaggagaa atacaatgat ggcctgtggc atgatgtgat atttattcga 4680
gaaaggagca gtggccgact ggtaattgat ggtctccgag tcctagaaga aagtcttcct 4740
cctactgaag ctacctggaa aatcaagggt cccatttatt tgggaggtgt ggctcctgga 4800
aaggctgtga aaaatgttca gattaactcc atctacagtt ttagtggctg tctcagcaat 4860
ctccagctca atggggcctc catcacctct gcttctcaga cattcagtgt gaccccttgc 4920
tttgaaggcc ccatggaaac aggaacttac ttttcaacag aaggaggata cgtggttcta 4980
gatgaatctt tcaatattgg attgaagttt gaaattgcat ttgaagtccg tcccagaagc 5040
agttccggaa ccctggtcca cggccacagt gtcaatgggg agtacctaaa tgttcacatg 5100
aaaaatggac aggtcatagt gaaagtcaat aatggcatca gagatttttc cacctcagtt 5160
acacccaagc agagtctctg tgatggcaga tggcacagaa ttacagttat tagagattct 5220
aatgtggttc agttggatgt ggactctgaa gtgaaccatg tggttggacc cctgaatcca 5280
aaaccaattg atcacaggga gcctgtgttt gttggaggtg ttccagaatc tctactgaca 5340
ccacgcttgg cccccagcaa acccttcaca ggctgcatac gccactttgt gattgatgga 5400
cacccagtga gcttcagtaa agcagccctg gtcagcggcg ccgtaagcat caactcctgt 5460
ccagcagcct ga 5472
<210> 122
<211> 1798
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность ламинина субъединицы
бета-2 (Человека разумный)
<400> 122
Met Glu Leu Thr Ser Arg Glu Arg Gly Arg Gly Gln Pro Leu Pro Trp
1 5 10 15
Glu Leu Arg Leu Gly Leu Leu Leu Ser Val Leu Ala Ala Thr Leu Ala
20 25 30
Gln Ala Pro Ala Pro Asp Val Pro Gly Cys Ser Arg Gly Ser Cys Tyr
35 40 45
Pro Ala Thr Gly Asp Leu Leu Val Gly Arg Ala Asp Arg Leu Thr Ala
50 55 60
Ser Ser Thr Cys Gly Leu Asn Gly Pro Gln Pro Tyr Cys Ile Val Ser
65 70 75 80
His Leu Gln Asp Glu Lys Lys Cys Phe Leu Cys Asp Ser Arg Arg Pro
85 90 95
Phe Ser Ala Arg Asp Asn Pro His Ser His Arg Ile Gln Asn Val Val
100 105 110
Thr Ser Phe Ala Pro Gln Arg Arg Ala Ala Trp Trp Gln Ser Glu Asn
115 120 125
Gly Ile Pro Ala Val Thr Ile Gln Leu Asp Leu Glu Ala Glu Phe His
130 135 140
Phe Thr His Leu Ile Met Thr Phe Lys Thr Phe Arg Pro Ala Ala Met
145 150 155 160
Leu Val Glu Arg Ser Ala Asp Phe Gly Arg Thr Trp His Val Tyr Arg
165 170 175
Tyr Phe Ser Tyr Asp Cys Gly Ala Asp Phe Pro Gly Val Pro Leu Ala
180 185 190
Pro Pro Arg His Trp Asp Asp Val Val Cys Glu Ser Arg Tyr Ser Glu
195 200 205
Ile Glu Pro Ser Thr Glu Gly Glu Val Ile Tyr Arg Val Leu Asp Pro
210 215 220
Ala Ile Pro Ile Pro Asp Pro Tyr Ser Ser Arg Ile Gln Asn Leu Leu
225 230 235 240
Lys Ile Thr Asn Leu Arg Val Asn Leu Thr Arg Leu His Thr Leu Gly
245 250 255
Asp Asn Leu Leu Asp Pro Arg Arg Glu Ile Arg Glu Lys Tyr Tyr Tyr
260 265 270
Ala Leu Tyr Glu Leu Val Val Arg Gly Asn Cys Phe Cys Tyr Gly His
275 280 285
Ala Ser Glu Cys Ala Pro Ala Pro Gly Ala Pro Ala His Ala Glu Gly
290 295 300
Met Val His Gly Ala Cys Ile Cys Lys His Asn Thr Arg Gly Leu Asn
305 310 315 320
Cys Glu Gln Cys Gln Asp Phe Tyr Arg Asp Leu Pro Trp Arg Pro Ala
325 330 335
Glu Asp Gly His Ser His Ala Cys Arg Lys Cys Glu Cys His Gly His
340 345 350
Thr His Ser Cys His Phe Asp Met Ala Val Tyr Leu Ala Ser Gly Asn
355 360 365
Val Ser Gly Gly Val Cys Asp Gly Cys Gln His Asn Thr Ala Gly Arg
370 375 380
His Cys Glu Leu Cys Arg Pro Phe Phe Tyr Arg Asp Pro Thr Lys Asp
385 390 395 400
Leu Arg Asp Pro Ala Val Cys Arg Ser Cys Asp Cys Asp Pro Met Gly
405 410 415
Ser Gln Asp Gly Gly Arg Cys Asp Ser His Asp Asp Pro Ala Leu Gly
420 425 430
Leu Val Ser Gly Gln Cys Arg Cys Lys Glu His Val Val Gly Thr Arg
435 440 445
Cys Gln Gln Cys Arg Asp Gly Phe Phe Gly Leu Ser Ile Ser Asp Arg
450 455 460
Leu Gly Cys Arg Arg Cys Gln Cys Asn Ala Arg Gly Thr Val Pro Gly
465 470 475 480
Ser Thr Pro Cys Asp Pro Asn Ser Gly Ser Cys Tyr Cys Lys Arg Leu
485 490 495
Val Thr Gly Arg Gly Cys Asp Arg Cys Leu Pro Gly His Trp Gly Leu
500 505 510
Ser His Asp Leu Leu Gly Cys Arg Pro Cys Asp Cys Asp Val Gly Gly
515 520 525
Ala Leu Asp Pro Gln Cys Asp Glu Gly Thr Gly Gln Cys His Cys Arg
530 535 540
Gln His Met Val Gly Arg Arg Cys Glu Gln Val Gln Pro Gly Tyr Phe
545 550 555 560
Arg Pro Phe Leu Asp His Leu Ile Trp Glu Ala Glu Asp Thr Arg Gly
565 570 575
Gln Val Leu Asp Val Val Glu Arg Leu Val Thr Pro Gly Glu Thr Pro
580 585 590
Ser Trp Thr Gly Ser Gly Phe Val Arg Leu Gln Glu Gly Gln Thr Leu
595 600 605
Glu Phe Leu Val Ala Ser Val Pro Lys Ala Met Asp Tyr Asp Leu Leu
610 615 620
Leu Arg Leu Glu Pro Gln Val Pro Glu Gln Trp Ala Glu Leu Glu Leu
625 630 635 640
Ile Val Gln Arg Pro Gly Pro Val Pro Ala His Ser Leu Cys Gly His
645 650 655
Leu Val Pro Lys Asp Asp Arg Ile Gln Gly Thr Leu Gln Pro His Ala
660 665 670
Arg Tyr Leu Ile Phe Pro Asn Pro Val Cys Leu Glu Pro Gly Ile Ser
675 680 685
Tyr Lys Leu His Leu Lys Leu Val Arg Thr Gly Gly Ser Ala Gln Pro
690 695 700
Glu Thr Pro Tyr Ser Gly Pro Gly Leu Leu Ile Asp Ser Leu Val Leu
705 710 715 720
Leu Pro Arg Val Leu Val Leu Glu Met Phe Ser Gly Gly Asp Ala Ala
725 730 735
Ala Leu Glu Arg Gln Ala Thr Phe Glu Arg Tyr Gln Cys His Glu Glu
740 745 750
Gly Leu Val Pro Ser Lys Thr Ser Pro Ser Glu Ala Cys Ala Pro Leu
755 760 765
Leu Ile Ser Leu Ser Thr Leu Ile Tyr Asn Gly Ala Leu Pro Cys Gln
770 775 780
Cys Asn Pro Gln Gly Ser Leu Ser Ser Glu Cys Asn Pro His Gly Gly
785 790 795 800
Gln Cys Leu Cys Lys Pro Gly Val Val Gly Arg Arg Cys Asp Leu Cys
805 810 815
Ala Pro Gly Tyr Tyr Gly Phe Gly Pro Thr Gly Cys Gln Ala Cys Gln
820 825 830
Cys Ser His Glu Gly Ala Leu Ser Ser Leu Cys Glu Lys Thr Ser Gly
835 840 845
Gln Cys Leu Cys Arg Thr Gly Ala Phe Gly Leu Arg Cys Asp Arg Cys
850 855 860
Gln Arg Gly Gln Trp Gly Phe Pro Ser Cys Arg Pro Cys Val Cys Asn
865 870 875 880
Gly His Ala Asp Glu Cys Asn Thr His Thr Gly Ala Cys Leu Gly Cys
885 890 895
Arg Asp His Thr Gly Gly Glu His Cys Glu Arg Cys Ile Ala Gly Phe
900 905 910
His Gly Asp Pro Arg Leu Pro Tyr Gly Gly Gln Cys Arg Pro Cys Pro
915 920 925
Cys Pro Glu Gly Pro Gly Ser Gln Arg His Phe Ala Thr Ser Cys His
930 935 940
Gln Asp Glu Tyr Ser Gln Gln Ile Val Cys His Cys Arg Ala Gly Tyr
945 950 955 960
Thr Gly Leu Arg Cys Glu Ala Cys Ala Pro Gly His Phe Gly Asp Pro
965 970 975
Ser Arg Pro Gly Gly Arg Cys Gln Leu Cys Glu Cys Ser Gly Asn Ile
980 985 990
Asp Pro Met Asp Pro Asp Ala Cys Asp Pro His Thr Gly Gln Cys Leu
995 1000 1005
Arg Cys Leu His His Thr Glu Gly Pro His Cys Ala His Cys Lys Pro
1010 1015 1020
Gly Phe His Gly Gln Ala Ala Arg Gln Ser Cys His Arg Cys Thr Cys
1025 1030 1035 1040
Asn Leu Leu Gly Thr Asn Pro Gln Gln Cys Pro Ser Pro Asp Gln Cys
1045 1050 1055
His Cys Asp Pro Ser Ser Gly Gln Cys Pro Cys Leu Pro Asn Val Gln
1060 1065 1070
Gly Pro Ser Cys Asp Arg Cys Ala Pro Asn Phe Trp Asn Leu Thr Ser
1075 1080 1085
Gly His Gly Cys Gln Pro Cys Ala Cys His Pro Ser Arg Ala Arg Gly
1090 1095 1100
Pro Thr Cys Asn Glu Phe Thr Gly Gln Cys His Cys Arg Ala Gly Phe
1105 1110 1115 1120
Gly Gly Arg Thr Cys Ser Glu Cys Gln Glu Leu His Trp Gly Asp Pro
1125 1130 1135
Gly Leu Gln Cys His Ala Cys Asp Cys Asp Ser Arg Gly Ile Asp Thr
1140 1145 1150
Pro Gln Cys His Arg Phe Thr Gly His Cys Ser Cys Arg Pro Gly Val
1155 1160 1165
Ser Gly Val Arg Cys Asp Gln Cys Ala Arg Gly Phe Ser Gly Ile Phe
1170 1175 1180
Pro Ala Cys His Pro Cys His Ala Cys Phe Gly Asp Trp Asp Arg Val
1185 1190 1195 1200
Val Gln Asp Leu Ala Ala Arg Thr Gln Arg Leu Glu Gln Arg Ala Gln
1205 1210 1215
Glu Leu Gln Gln Thr Gly Val Leu Gly Ala Phe Glu Ser Ser Phe Trp
1220 1225 1230
His Met Gln Glu Lys Leu Gly Ile Val Gln Gly Ile Val Gly Ala Arg
1235 1240 1245
Asn Thr Ser Ala Ala Ser Thr Ala Gln Leu Val Glu Ala Thr Glu Glu
1250 1255 1260
Leu Arg Arg Glu Ile Gly Glu Ala Thr Glu His Leu Thr Gln Leu Glu
1265 1270 1275 1280
Ala Asp Leu Thr Asp Val Gln Asp Glu Asn Phe Asn Ala Asn His Ala
1285 1290 1295
Leu Ser Gly Leu Glu Arg Asp Arg Leu Ala Leu Asn Leu Thr Leu Arg
1300 1305 1310
Gln Leu Asp Gln His Leu Asp Leu Leu Lys His Ser Asn Phe Leu Gly
1315 1320 1325
Ala Tyr Asp Ser Ile Arg His Ala His Ser Gln Ser Ala Glu Ala Glu
1330 1335 1340
Arg Arg Ala Asn Thr Ser Ala Leu Ala Val Pro Ser Pro Val Ser Asn
1345 1350 1355 1360
Ser Ala Ser Ala Arg His Arg Thr Glu Ala Leu Met Asp Ala Gln Lys
1365 1370 1375
Glu Asp Phe Asn Ser Lys His Met Ala Asn Gln Arg Ala Leu Gly Lys
1380 1385 1390
Leu Ser Ala His Thr His Thr Leu Ser Leu Thr Asp Ile Asn Glu Leu
1395 1400 1405
Val Cys Gly Ala Pro Gly Asp Ala Pro Cys Ala Thr Ser Pro Cys Gly
1410 1415 1420
Gly Ala Gly Cys Arg Asp Glu Asp Gly Gln Pro Arg Cys Gly Gly Leu
1425 1430 1435 1440
Ser Cys Asn Gly Ala Ala Ala Thr Ala Asp Leu Ala Leu Gly Arg Ala
1445 1450 1455
Arg His Thr Gln Ala Glu Leu Gln Arg Ala Leu Ala Glu Gly Gly Ser
1460 1465 1470
Ile Leu Ser Arg Val Ala Glu Thr Arg Arg Gln Ala Ser Glu Ala Gln
1475 1480 1485
Gln Arg Ala Gln Ala Ala Leu Asp Lys Ala Asn Ala Ser Arg Gly Gln
1490 1495 1500
Val Glu Gln Ala Asn Gln Glu Leu Gln Glu Leu Ile Gln Ser Val Lys
1505 1510 1515 1520
Asp Phe Leu Asn Gln Glu Gly Ala Asp Pro Asp Ser Ile Glu Met Val
1525 1530 1535
Ala Thr Arg Val Leu Glu Leu Ser Ile Pro Ala Ser Ala Glu Gln Ile
1540 1545 1550
Gln His Leu Ala Gly Ala Ile Ala Glu Arg Val Arg Ser Leu Ala Asp
1555 1560 1565
Val Asp Ala Ile Leu Ala Arg Thr Val Gly Asp Val Arg Arg Ala Glu
1570 1575 1580
Gln Leu Leu Gln Asp Ala Arg Arg Ala Arg Ser Trp Ala Glu Asp Glu
1585 1590 1595 1600
Lys Gln Lys Ala Glu Thr Val Gln Ala Ala Leu Glu Glu Ala Gln Arg
1605 1610 1615
Ala Gln Gly Ile Ala Gln Gly Ala Ile Arg Gly Ala Val Ala Asp Thr
1620 1625 1630
Arg Asp Thr Glu Gln Thr Leu Tyr Gln Val Gln Glu Arg Met Ala Gly
1635 1640 1645
Ala Glu Arg Ala Leu Ser Ser Ala Gly Glu Arg Ala Arg Gln Leu Asp
1650 1655 1660
Ala Leu Leu Glu Ala Leu Lys Leu Lys Arg Ala Gly Asn Ser Leu Ala
1665 1670 1675 1680
Ala Ser Thr Ala Glu Glu Thr Ala Gly Ser Ala Gln Gly Arg Ala Gln
1685 1690 1695
Glu Ala Glu Gln Leu Leu Arg Gly Pro Leu Gly Asp Gln Tyr Gln Thr
1700 1705 1710
Val Lys Ala Leu Ala Glu Arg Lys Ala Gln Gly Val Leu Ala Ala Gln
1715 1720 1725
Ala Arg Ala Glu Gln Leu Arg Asp Glu Ala Arg Asp Leu Leu Gln Ala
1730 1735 1740
Ala Gln Asp Lys Leu Gln Arg Leu Gln Glu Leu Glu Gly Thr Tyr Glu
1745 1750 1755 1760
Glu Asn Glu Arg Ala Leu Glu Ser Lys Ala Ala Gln Leu Asp Gly Leu
1765 1770 1775
Glu Ala Arg Met Arg Ser Val Leu Gln Ala Ile Asn Leu Gln Val Gln
1780 1785 1790
Ile Tyr Asn Thr Cys Gln
1795
<210> 123
<211> 5397
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК последовательность ламинина субъединицы бета-2
(Человека разумный)
<400> 123
atggagctga cctcaaggga aagagggagg ggacagcctc tgccctggga acttcgactg 60
ggcctactgc taagcgtgct ggctgccaca ctggcacagg cccctgcccc ggatgtgcct 120
ggctgttcca ggggaagctg ctaccccgcc acgggcgacc tgctggtggg ccgagctgac 180
agactgactg cctcatccac ttgtggcctg aatggccccc agccctactg catcgtcagt 240
cacctgcagg acgaaaagaa gtgcttcctt tgtgactccc ggcgcccctt ctctgctaga 300
gacaacccac acagccatcg catccagaat gtagtcacca gctttgcacc acagcggcgg 360
gcagcctggt ggcagtcaga gaatggtatc cctgcggtca ccatccagct ggacctggag 420
gctgagtttc atttcacaca cctcattatg accttcaaga catttcgccc tgctgccatg 480
ctggtggaac gctcagcaga ctttggccgc acctggcatg tgtaccgata tttctcctat 540
gactgtgggg ctgacttccc aggagtccca ctagcacccc cacggcactg ggatgatgta 600
gtctgtgagt cccgctactc agagattgag ccatccactg aaggcgaggt catctatcgt 660
gtgctggacc ctgccatccc tatcccagac ccctacagct cacggattca gaacctgttg 720
aagatcacca acctacgggt gaacctgact cgtctacaca cgttgggaga caacctactc 780
gacccacgga gggagatccg agagaagtac tactatgccc tctatgagct ggttgtacgt 840
ggcaactgct tctgctacgg acacgcctca gagtgtgcac ccgccccagg ggcaccagcc 900
catgctgagg gcatggtgca cggagcttgc atctgcaaac acaacacacg tggcctcaac 960
tgcgagcagt gtcaggattt ctatcgtgac ctgccctggc gtccggctga ggacggccat 1020
agtcatgcct gtaggaagtg tgagtgccat gggcacaccc acagctgcca cttcgacatg 1080
gccgtatacc tggcatctgg caatgtgagt ggaggtgtgt gtgatggatg tcagcataac 1140
acagctgggc gccactgtga gctctgtcgg cccttcttct accgtgaccc aaccaaggac 1200
ctgcgggatc cggctgtgtg ccgctcctgt gattgtgacc ccatgggttc tcaagacggt 1260
ggtcgctgtg attcccatga tgaccctgca ctgggactgg tctccggcca gtgtcgctgc 1320
aaagaacatg tggtgggcac tcgctgccag caatgccgtg atggcttctt tgggctcagc 1380
atcagtgacc gtctgggctg ccggcgatgt caatgtaatg cacggggcac agtgcctggg 1440
agcactcctt gtgaccccaa cagtggatcc tgttactgca aacgtctagt gactggacgt 1500
ggatgtgacc gctgcctgcc tggccactgg ggcctgagcc acgacctgct cggctgccgc 1560
ccctgtgact gcgacgtggg tggtgctttg gatccccagt gtgatgaggg cacaggtcaa 1620
tgccactgcc gccagcacat ggttgggcga cgctgtgagc aggtgcaacc tggctacttc 1680
cggcccttcc tggaccacct aatttgggag gctgaggaca cccgagggca ggtgctcgat 1740
gtggtggagc gcctggtgac ccccggggaa actccatcct ggactggctc aggcttcgtg 1800
cggctacagg aaggtcagac cctggagttc ctggtggcct ctgtgccgaa ggctatggac 1860
tatgacctgc tgctgcgctt agagccccag gtccctgagc aatgggcaga gttggaactg 1920
attgtgcagc gtccagggcc tgtgcctgcc cacagcctgt gtgggcattt ggtgcccaag 1980
gatgatcgca tccaagggac tctgcaacca catgccaggt acttgatatt tcctaatcct 2040
gtctgccttg agcctggtat ctcctacaag ctgcatctga agctggtacg gacaggggga 2100
agtgcccagc ctgagactcc ctactctgga cctggcctgc tcattgactc gctggtgctg 2160
ctgccccgtg tcctggtgct agagatgttt agtgggggtg atgctgctgc cctggagcgc 2220
caggccacct ttgaacgcta ccaatgccat gaggagggtc tggtgcccag caagacttct 2280
ccctctgagg cctgcgcacc cctcctcatc agcctgtcca ccctcatcta caatggtgcc 2340
ctgccatgtc agtgcaaccc tcaaggttca ctgagttctg agtgcaaccc tcatggtggt 2400
cagtgcctgt gcaagcctgg agtggttggg cgccgctgtg acctctgtgc ccctggctac 2460
tatggctttg gccccacagg ctgtcaagcc tgccagtgca gccacgaggg ggcactcagc 2520
agtctctgtg aaaagaccag tgggcaatgt ctctgtcgaa ctggtgcctt tgggcttcgc 2580
tgtgaccgct gccagcgtgg ccagtgggga ttccctagct gccggccatg tgtctgcaat 2640
gggcatgcag atgagtgcaa cacccacaca ggcgcttgcc tgggctgccg tgatcacaca 2700
gggggtgagc actgtgaaag gtgcattgct ggtttccacg gggacccacg gctgccatat 2760
gggggccagt gccggccctg tccctgtcct gaaggccctg ggagccaacg gcactttgct 2820
acttcttgcc accaggatga atattcccag cagattgtgt gccactgccg ggcaggctat 2880
acggggctgc gatgtgaagc ttgtgcccct gggcactttg gggacccatc aaggccaggt 2940
ggccggtgcc aactgtgtga gtgcagtggg aacattgacc caatggatcc tgatgcctgt 3000
gacccccaca cggggcaatg cctgcgctgt ttacaccaca cagagggtcc acactgtgcc 3060
cactgcaagc ctggcttcca tgggcaggct gcccgacaga gctgtcaccg ctgcacatgc 3120
aacctgctgg gcacaaatcc gcagcagtgc ccatctcctg accagtgcca ctgtgatcca 3180
agcagtgggc agtgcccatg cctccccaat gtccagggcc ctagctgtga ccgctgtgcc 3240
cccaacttct ggaacctcac cagtggccat ggttgccagc cttgtgcctg ccacccaagc 3300
cgggccagag gccccacctg caacgagttc acagggcagt gccactgccg tgccggcttt 3360
ggagggcgga cttgttctga gtgccaagag ctccactggg gagaccctgg gttgcagtgc 3420
catgcctgtg attgtgactc tcgtggaata gatacacctc agtgtcaccg cttcacaggt 3480
cactgcagct gccgcccagg ggtgtctggt gtgcgctgtg accagtgtgc ccgtggcttc 3540
tcaggaatct ttcctgcctg ccatccctgc catgcatgct tcggggattg ggaccgagtg 3600
gtgcaggact tggcagcccg tacacagcgc ctagagcagc gggcgcagga gttgcaacag 3660
acgggtgtgc tgggtgcctt tgagagcagc ttctggcaca tgcaggagaa gctgggcatt 3720
gtgcagggca tcgtaggtgc ccgcaacacc tcagccgcct ccactgcaca gcttgtggag 3780
gccacagagg agctgcggcg tgaaattggg gaggccactg agcacctgac tcagctcgag 3840
gcagacctga cagatgtgca agatgagaac ttcaatgcca accatgcact aagtggtctg 3900
gagcgagata ggcttgcact taatctcaca ctgcggcagc tcgaccagca tcttgacttg 3960
ctcaaacatt caaacttcct gggtgcctat gacagcatcc ggcatgccca tagccagtct 4020
gcagaggcag aacgtcgtgc caatacctca gccctggcag tacctagccc tgtgagcaac 4080
tcggcaagtg ctcggcatcg gacagaggca ctgatggatg ctcagaagga ggacttcaac 4140
agcaaacaca tggccaacca gcgggcactt ggcaagctct ctgcccatac ccacaccctg 4200
agcctgacag acataaatga gctggtgtgt ggggcaccag gggatgcacc ctgtgctaca 4260
agcccttgtg ggggtgccgg ctgtcgagat gaggatgggc agccgcgctg tgggggcctc 4320
agctgcaatg gggcagcggc tacagcagac ctagcactgg gccgggcccg gcacacacag 4380
gcagagctgc agcgggcact ggcagaaggt ggtagcatcc tcagcagagt ggctgagact 4440
cgtcggcagg caagcgaggc acagcagcgg gcccaggcag ccctggacaa ggctaatgct 4500
tccaggggac aggtggaaca ggccaaccag gaacttcaag aacttatcca gagtgtgaag 4560
gacttcctca accaggaggg ggctgatcct gatagcattg aaatggtggc cacacgggtg 4620
ctagagctct ccatcccagc ttcagctgag cagatccagc acctggcggg tgcgattgca 4680
gagcgagtcc ggagcctggc agatgtggat gcgatcctgg cacgtactgt aggagatgtg 4740
cgtcgtgccg agcagctact gcaggatgca cggcgggcaa ggagctgggc tgaggatgag 4800
aaacagaagg cagagacagt acaggcagca ctggaggagg cccagcgggc acagggtatt 4860
gcccagggtg ccatccgggg ggcagtggct gacacacggg acacagagca gaccctgtac 4920
caggtacagg agaggatggc aggtgcagag cgggcactga gctctgcagg tgaaagggct 4980
cggcagttgg atgctctcct ggaggctctg aaattgaaac gggcaggaaa tagtctggca 5040
gcctctacag cagaagaaac ggcaggcagt gcccagggtc gtgcccagga ggctgagcag 5100
ctgctacgcg gtcctctggg tgatcagtac cagacggtga aggccctagc tgagcgcaag 5160
gcccaaggtg tgctggctgc acaggcaagg gcagaacaac tgcgggatga ggctcgggac 5220
ctgttgcaag ccgctcagga caagctgcag cggctacagg aattggaagg cacctatgag 5280
gaaaatgagc gggcactgga gagtaaggca gcccagttgg acgggttgga ggccaggatg 5340
cgcagcgtgc ttcaagccat caacttgcag gtgcagatct acaacacctg ccagtga 5397
<210> 124
<211> 1609
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность ламинина субъединицы
гамма-1 (Человека разумный)
<400> 124
Met Arg Gly Ser His Arg Ala Ala Pro Ala Leu Arg Pro Arg Gly Arg
1 5 10 15
Leu Trp Pro Val Leu Ala Val Leu Ala Ala Ala Ala Ala Ala Gly Cys
20 25 30
Ala Gln Ala Ala Met Asp Glu Cys Thr Asp Glu Gly Gly Arg Pro Gln
35 40 45
Arg Cys Met Pro Glu Phe Val Asn Ala Ala Phe Asn Val Thr Val Val
50 55 60
Ala Thr Asn Thr Cys Gly Thr Pro Pro Glu Glu Tyr Cys Val Gln Thr
65 70 75 80
Gly Val Thr Gly Val Thr Lys Ser Cys His Leu Cys Asp Ala Gly Gln
85 90 95
Pro His Leu Gln His Gly Ala Ala Phe Leu Thr Asp Tyr Asn Asn Gln
100 105 110
Ala Asp Thr Thr Trp Trp Gln Ser Gln Thr Met Leu Ala Gly Val Gln
115 120 125
Tyr Pro Ser Ser Ile Asn Leu Thr Leu His Leu Gly Lys Ala Phe Asp
130 135 140
Ile Thr Tyr Val Arg Leu Lys Phe His Thr Ser Arg Pro Glu Ser Phe
145 150 155 160
Ala Ile Tyr Lys Arg Thr Arg Glu Asp Gly Pro Trp Ile Pro Tyr Gln
165 170 175
Tyr Tyr Ser Gly Ser Cys Glu Asn Thr Tyr Ser Lys Ala Asn Arg Gly
180 185 190
Phe Ile Arg Thr Gly Gly Asp Glu Gln Gln Ala Leu Cys Thr Asp Glu
195 200 205
Phe Ser Asp Ile Ser Pro Leu Thr Gly Gly Asn Val Ala Phe Ser Thr
210 215 220
Leu Glu Gly Arg Pro Ser Ala Tyr Asn Phe Asp Asn Ser Pro Val Leu
225 230 235 240
Gln Glu Trp Val Thr Ala Thr Asp Ile Arg Val Thr Leu Asn Arg Leu
245 250 255
Asn Thr Phe Gly Asp Glu Val Phe Asn Asp Pro Lys Val Leu Lys Ser
260 265 270
Tyr Tyr Tyr Ala Ile Ser Asp Phe Ala Val Gly Gly Arg Cys Lys Cys
275 280 285
Asn Gly His Ala Ser Glu Cys Met Lys Asn Glu Phe Asp Lys Leu Val
290 295 300
Cys Asn Cys Lys His Asn Thr Tyr Gly Val Asp Cys Glu Lys Cys Leu
305 310 315 320
Pro Phe Phe Asn Asp Arg Pro Trp Arg Arg Ala Thr Ala Glu Ser Ala
325 330 335
Ser Glu Cys Leu Pro Cys Asp Cys Asn Gly Arg Ser Gln Glu Cys Tyr
340 345 350
Phe Asp Pro Glu Leu Tyr Arg Ser Thr Gly His Gly Gly His Cys Thr
355 360 365
Asn Cys Gln Asp Asn Thr Asp Gly Ala His Cys Glu Arg Cys Arg Glu
370 375 380
Asn Phe Phe Arg Leu Gly Asn Asn Glu Ala Cys Ser Ser Cys His Cys
385 390 395 400
Ser Pro Val Gly Ser Leu Ser Thr Gln Cys Asp Ser Tyr Gly Arg Cys
405 410 415
Ser Cys Lys Pro Gly Val Met Gly Asp Lys Cys Asp Arg Cys Gln Pro
420 425 430
Gly Phe His Ser Leu Thr Glu Ala Gly Cys Arg Pro Cys Ser Cys Asp
435 440 445
Pro Ser Gly Ser Ile Asp Glu Cys Asn Ile Glu Thr Gly Arg Cys Val
450 455 460
Cys Lys Asp Asn Val Glu Gly Phe Asn Cys Glu Arg Cys Lys Pro Gly
465 470 475 480
Phe Phe Asn Leu Glu Ser Ser Asn Pro Arg Gly Cys Thr Pro Cys Phe
485 490 495
Cys Phe Gly His Ser Ser Val Cys Thr Asn Ala Val Gly Tyr Ser Val
500 505 510
Tyr Ser Ile Ser Ser Thr Phe Gln Ile Asp Glu Asp Gly Trp Arg Ala
515 520 525
Glu Gln Arg Asp Gly Ser Glu Ala Ser Leu Glu Trp Ser Ser Glu Arg
530 535 540
Gln Asp Ile Ala Val Ile Ser Asp Ser Tyr Phe Pro Arg Tyr Phe Ile
545 550 555 560
Ala Pro Ala Lys Phe Leu Gly Lys Gln Val Leu Ser Tyr Gly Gln Asn
565 570 575
Leu Ser Phe Ser Phe Arg Val Asp Arg Arg Asp Thr Arg Leu Ser Ala
580 585 590
Glu Asp Leu Val Leu Glu Gly Ala Gly Leu Arg Val Ser Val Pro Leu
595 600 605
Ile Ala Gln Gly Asn Ser Tyr Pro Ser Glu Thr Thr Val Lys Tyr Val
610 615 620
Phe Arg Leu His Glu Ala Thr Asp Tyr Pro Trp Arg Pro Ala Leu Thr
625 630 635 640
Pro Phe Glu Phe Gln Lys Leu Leu Asn Asn Leu Thr Ser Ile Lys Ile
645 650 655
Arg Gly Thr Tyr Ser Glu Arg Ser Ala Gly Tyr Leu Asp Asp Val Thr
660 665 670
Leu Ala Ser Ala Arg Pro Gly Pro Gly Val Pro Ala Thr Trp Val Glu
675 680 685
Ser Cys Thr Cys Pro Val Gly Tyr Gly Gly Gln Phe Cys Glu Met Cys
690 695 700
Leu Ser Gly Tyr Arg Arg Glu Thr Pro Asn Leu Gly Pro Tyr Ser Pro
705 710 715 720
Cys Val Leu Cys Ala Cys Asn Gly His Ser Glu Thr Cys Asp Pro Glu
725 730 735
Thr Gly Val Cys Asn Cys Arg Asp Asn Thr Ala Gly Pro His Cys Glu
740 745 750
Lys Cys Ser Asp Gly Tyr Tyr Gly Asp Ser Thr Ala Gly Thr Ser Ser
755 760 765
Asp Cys Gln Pro Cys Pro Cys Pro Gly Gly Ser Ser Cys Ala Val Val
770 775 780
Pro Lys Thr Lys Glu Val Val Cys Thr Asn Cys Pro Thr Gly Thr Thr
785 790 795 800
Gly Lys Arg Cys Glu Leu Cys Asp Asp Gly Tyr Phe Gly Asp Pro Leu
805 810 815
Gly Arg Asn Gly Pro Val Arg Leu Cys Arg Leu Cys Gln Cys Ser Asp
820 825 830
Asn Ile Asp Pro Asn Ala Val Gly Asn Cys Asn Arg Leu Thr Gly Glu
835 840 845
Cys Leu Lys Cys Ile Tyr Asn Thr Ala Gly Phe Tyr Cys Asp Arg Cys
850 855 860
Lys Asp Gly Phe Phe Gly Asn Pro Leu Ala Pro Asn Pro Ala Asp Lys
865 870 875 880
Cys Lys Ala Cys Asn Cys Asn Leu Tyr Gly Thr Met Lys Gln Gln Ser
885 890 895
Ser Cys Asn Pro Val Thr Gly Gln Cys Glu Cys Leu Pro His Val Thr
900 905 910
Gly Gln Asp Cys Gly Ala Cys Asp Pro Gly Phe Tyr Asn Leu Gln Ser
915 920 925
Gly Gln Gly Cys Glu Arg Cys Asp Cys His Ala Leu Gly Ser Thr Asn
930 935 940
Gly Gln Cys Asp Ile Arg Thr Gly Gln Cys Glu Cys Gln Pro Gly Ile
945 950 955 960
Thr Gly Gln His Cys Glu Arg Cys Glu Val Asn His Phe Gly Phe Gly
965 970 975
Pro Glu Gly Cys Lys Pro Cys Asp Cys His Pro Glu Gly Ser Leu Ser
980 985 990
Leu Gln Cys Lys Asp Asp Gly Arg Cys Glu Cys Arg Glu Gly Phe Val
995 1000 1005
Gly Asn Arg Cys Asp Gln Cys Glu Glu Asn Tyr Phe Tyr Asn Arg Ser
1010 1015 1020
Trp Pro Gly Cys Gln Glu Cys Pro Ala Cys Tyr Arg Leu Val Lys Asp
1025 1030 1035 1040
Lys Val Ala Asp His Arg Val Lys Leu Gln Glu Leu Glu Ser Leu Ile
1045 1050 1055
Ala Asn Leu Gly Thr Gly Asp Glu Met Val Thr Asp Gln Ala Phe Glu
1060 1065 1070
Asp Arg Leu Lys Glu Ala Glu Arg Glu Val Met Asp Leu Leu Arg Glu
1075 1080 1085
Ala Gln Asp Val Lys Asp Val Asp Gln Asn Leu Met Asp Arg Leu Gln
1090 1095 1100
Arg Val Asn Asn Thr Leu Ser Ser Gln Ile Ser Arg Leu Gln Asn Ile
1105 1110 1115 1120
Arg Asn Thr Ile Glu Glu Thr Gly Asn Leu Ala Glu Gln Ala Arg Ala
1125 1130 1135
His Val Glu Asn Thr Glu Arg Leu Ile Glu Ile Ala Ser Arg Glu Leu
1140 1145 1150
Glu Lys Ala Lys Val Ala Ala Ala Asn Val Ser Val Thr Gln Pro Glu
1155 1160 1165
Ser Thr Gly Asp Pro Asn Asn Met Thr Leu Leu Ala Glu Glu Ala Arg
1170 1175 1180
Lys Leu Ala Glu Arg His Lys Gln Glu Ala Asp Asp Ile Val Arg Val
1185 1190 1195 1200
Ala Lys Thr Ala Asn Asp Thr Ser Thr Glu Ala Tyr Asn Leu Leu Leu
1205 1210 1215
Arg Thr Leu Ala Gly Glu Asn Gln Thr Ala Phe Glu Ile Glu Glu Leu
1220 1225 1230
Asn Arg Lys Tyr Glu Gln Ala Lys Asn Ile Ser Gln Asp Leu Glu Lys
1235 1240 1245
Gln Ala Ala Arg Val His Glu Glu Ala Lys Arg Ala Gly Asp Lys Ala
1250 1255 1260
Val Glu Ile Tyr Ala Ser Val Ala Gln Leu Ser Pro Leu Asp Ser Glu
1265 1270 1275 1280
Thr Leu Glu Asn Glu Ala Asn Asn Ile Lys Met Glu Ala Glu Asn Leu
1285 1290 1295
Glu Gln Leu Ile Asp Gln Lys Leu Lys Asp Tyr Glu Asp Leu Arg Glu
1300 1305 1310
Asp Met Arg Gly Lys Glu Leu Glu Val Lys Asn Leu Leu Glu Lys Gly
1315 1320 1325
Lys Thr Glu Gln Gln Thr Ala Asp Gln Leu Leu Ala Arg Ala Asp Ala
1330 1335 1340
Ala Lys Ala Leu Ala Glu Glu Ala Ala Lys Lys Gly Arg Asp Thr Leu
1345 1350 1355 1360
Gln Glu Ala Asn Asp Ile Leu Asn Asn Leu Lys Asp Phe Asp Arg Arg
1365 1370 1375
Val Asn Asp Asn Lys Thr Ala Ala Glu Glu Ala Leu Arg Lys Ile Pro
1380 1385 1390
Ala Ile Asn Gln Thr Ile Thr Glu Ala Asn Glu Lys Thr Arg Glu Ala
1395 1400 1405
Gln Gln Ala Leu Gly Ser Ala Ala Ala Asp Ala Thr Glu Ala Lys Asn
1410 1415 1420
Lys Ala His Glu Ala Glu Arg Ile Ala Ser Ala Val Gln Lys Asn Ala
1425 1430 1435 1440
Thr Ser Thr Lys Ala Glu Ala Glu Arg Thr Phe Ala Glu Val Thr Asp
1445 1450 1455
Leu Asp Asn Glu Val Asn Asn Met Leu Lys Gln Leu Gln Glu Ala Glu
1460 1465 1470
Lys Glu Leu Lys Arg Lys Gln Asp Asp Ala Asp Gln Asp Met Met Met
1475 1480 1485
Ala Gly Met Ala Ser Gln Ala Ala Gln Glu Ala Glu Ile Asn Ala Arg
1490 1495 1500
Lys Ala Lys Asn Ser Val Thr Ser Leu Leu Ser Ile Ile Asn Asp Leu
1505 1510 1515 1520
Leu Glu Gln Leu Gly Gln Leu Asp Thr Val Asp Leu Asn Lys Leu Asn
1525 1530 1535
Glu Ile Glu Gly Thr Leu Asn Lys Ala Lys Asp Glu Met Lys Val Ser
1540 1545 1550
Asp Leu Asp Arg Lys Val Ser Asp Leu Glu Asn Glu Ala Lys Lys Gln
1555 1560 1565
Glu Ala Ala Ile Met Asp Tyr Asn Arg Asp Ile Glu Glu Ile Met Lys
1570 1575 1580
Asp Ile Arg Asn Leu Glu Asp Ile Arg Lys Thr Leu Pro Ser Gly Cys
1585 1590 1595 1600
Phe Asn Thr Pro Ser Ile Glu Lys Pro
1605
<210> 125
<211> 4830
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК последовательность ламинина субъединицы гамма-1
(Человек разумный)
<400> 125
atgagaggga gccatcgggc cgcgccggcc ctgcggcccc gggggcggct ctggcccgtg 60
ctggccgtgc tggcggcggc cgccgcggcg ggctgtgccc aggcagccat ggacgagtgc 120
acggacgagg gcgggcggcc gcagcgctgc atgcccgagt tcgtcaacgc cgccttcaac 180
gtgactgtgg tggccaccaa cacgtgtggg actccgcccg aggaatactg tgtgcagacc 240
ggggtgaccg gggtcaccaa gtcctgtcac ctgtgcgacg ccgggcagcc ccacctgcag 300
cacggggcag ccttcctgac cgactacaac aaccaggccg acaccacctg gtggcaaagc 360
cagaccatgc tggccggggt gcagtacccc agctccatca acctcacgct gcacctggga 420
aaagcttttg acatcaccta tgtgcgtctc aagttccaca ccagccgccc ggagagcttt 480
gccatttaca agcgcacacg ggaagacggg ccctggattc cttaccagta ctacagtggt 540
tcctgtgaga acacctactc caaggcaaac cgcggcttca tcaggacagg aggggacgag 600
cagcaggcct tgtgtactga tgaattcagt gacatttctc ccctcactgg gggcaacgtg 660
gccttttcta ccctggaagg aaggcccagc gcctataact ttgacaatag ccctgtgctg 720
caggaatggg taactgccac tgacatcaga gtaactctta atcgcctgaa cacttttgga 780
gatgaagtgt ttaacgatcc caaagttctc aagtcctatt attatgccat ctctgatttt 840
gctgtaggtg gcagatgtaa atgtaatgga cacgcaagcg agtgtatgaa gaacgaattt 900
gataagctgg tgtgtaattg caaacataac acatatggag tagactgtga aaagtgtctt 960
cctttcttca atgaccggcc gtggaggagg gcaactgcgg aaagtgccag tgaatgcctg 1020
ccctgtgatt gcaatggtcg atcccaggaa tgctacttcg accctgaact ctatcgttcc 1080
actggccatg ggggccactg taccaactgc caggataaca cagatggcgc ccactgtgag 1140
aggtgccgag agaacttctt ccgccttggc aacaatgaag cctgctcttc atgccactgt 1200
agtcctgtgg gctctctaag cacacagtgt gatagttacg gcagatgcag ctgtaagcca 1260
ggagtgatgg gggacaaatg tgaccgttgc cagcctggat tccattctct cactgaagca 1320
ggatgcaggc catgctcttg tgatccctct ggcagcatag atgaatgtaa tattgaaaca 1380
ggaagatgtg tttgcaaaga caatgtcgaa ggcttcaatt gtgaaagatg caaacctgga 1440
ttttttaatc tggaatcatc taatcctcgg ggttgcacac cctgcttctg ctttgggcat 1500
tcttctgtct gtacaaacgc tgttggctac agtgtttatt ctatctcctc tacctttcag 1560
attgatgagg atgggtggcg tgcggaacag agagatggct ctgaagcatc tctcgagtgg 1620
tcctctgaga ggcaagatat cgccgtgatc tcagacagct actttcctcg gtacttcatt 1680
gctcctgcaa agttcttggg caagcaggtg ttgagttatg gtcagaacct ctccttctcc 1740
tttcgagtgg acaggcgaga tactcgcctc tctgcagaag accttgtgct tgagggagct 1800
ggcttaagag tatctgtacc cttgatcgct cagggcaatt cctatccaag tgagaccact 1860
gtgaagtatg tcttcaggct ccatgaagca acagattacc cttggaggcc tgctcttacc 1920
ccttttgaat ttcagaagct cctaaacaac ttgacctcta tcaagatacg tgggacatac 1980
agtgagagaa gtgctggata tttggatgat gtcaccctgg caagtgctcg tcctgggcct 2040
ggagtccctg caacttgggt ggagtcctgc acctgtcctg tgggatatgg agggcagttt 2100
tgtgagatgt gcctctcagg ttacagaaga gaaactccta atcttggacc atacagtcca 2160
tgtgtgcttt gcgcctgcaa tggacacagc gagacctgtg atcctgagac aggtgtttgt 2220
aactgcagag acaatacggc tggcccgcac tgtgagaagt gcagtgatgg gtactatgga 2280
gattcaactg caggcacctc ctccgattgc caaccctgtc cgtgtcctgg aggttcaagt 2340
tgtgctgttg ttcccaagac aaaggaggtg gtgtgcacca actgtcctac tggcaccact 2400
ggtaagagat gtgagctctg tgatgatggc tactttggag accccctggg tagaaacggc 2460
cctgtgagac tttgccgcct gtgccagtgc agtgacaaca tcgatcccaa tgcagttgga 2520
aattgcaatc gcttgacggg agaatgcctg aagtgcatct ataacactgc tggcttctat 2580
tgtgaccggt gcaaagacgg attttttgga aatcccctgg ctcccaatcc agcagacaaa 2640
tgcaaagcct gcaattgcaa tctgtatggg accatgaagc agcagagcag ctgtaacccc 2700
gtgacggggc agtgtgaatg tttgcctcac gtgactggcc aggactgtgg tgcttgtgac 2760
cctggattct acaatctgca gagtgggcaa ggctgtgaga ggtgtgactg ccatgccttg 2820
ggctccacca atgggcagtg tgacatccgc accggccagt gtgagtgcca gcccggcatc 2880
actggtcagc actgtgagcg ctgtgaggtc aaccactttg ggtttggacc tgaaggctgc 2940
aaaccctgtg actgtcatcc tgagggatct ctttcacttc agtgcaaaga tgatggtcgc 3000
tgtgaatgca gagaaggctt tgtgggaaat cgctgtgacc agtgtgaaga aaactatttc 3060
tacaatcggt cttggcctgg ctgccaggaa tgtccagctt gttaccggct ggtaaaggat 3120
aaggttgctg atcatagagt gaagctccag gaattagaga gtctcatagc aaaccttgga 3180
actggggatg agatggtgac agatcaagcc ttcgaggata gactaaagga agcagagagg 3240
gaagttatgg acctccttcg tgaggcccag gatgtcaaag atgttgacca gaatttgatg 3300
gatcgcctac agagagtgaa taacactctg tccagccaaa ttagccgttt acagaatatc 3360
cggaatacca ttgaagagac tggaaacttg gctgaacaag cgcgtgccca tgtagagaac 3420
acagagcggt tgattgaaat cgcatccaga gaacttgaga aagcaaaagt cgctgctgcc 3480
aatgtgtcag tcactcagcc agaatctaca ggggacccaa acaacatgac tcttttggca 3540
gaagaggctc gaaagcttgc tgaacgtcat aaacaggaag ctgatgacat tgttcgagtg 3600
gcaaagacag ccaatgatac gtcaactgag gcatacaacc tgcttctgag gacactggca 3660
ggagaaaatc aaacagcatt tgagattgaa gagcttaata ggaagtatga acaagcgaag 3720
aacatctcac aggatctgga aaaacaagct gcccgagtac atgaggaggc caaaagggcc 3780
ggtgacaaag ctgtggagat ctatgccagc gtggctcagc tgagcccttt ggactctgag 3840
acactggaga atgaagcaaa taacataaag atggaagctg agaatctgga acaactgatt 3900
gaccagaaat taaaagatta tgaggacctc agagaagata tgagagggaa ggaacttgaa 3960
gtcaagaacc ttctggagaa aggcaagact gaacagcaga ccgcagacca actcctagcc 4020
cgagctgatg ctgccaaggc cctcgctgaa gaagctgcaa agaagggacg ggatacctta 4080
caagaagcta atgacattct caacaacctg aaagattttg ataggcgtgt gaacgataac 4140
aagacggccg cagaggaggc actaaggaag attcctgcca tcaaccagac catcactgaa 4200
gccaatgaaa agaccagaga agcccagcag gccctgggca gtgctgcggc ggatgccaca 4260
gaggccaaga acaaggccca tgaggcggag aggatcgcga gcgctgtcca aaagaatgcc 4320
accagcacca aggcagaagc tgaaagaact tttgcagaag ttacagatct ggataatgag 4380
gtgaacaata tgttgaagca actgcaggaa gcagaaaaag agctaaagag aaaacaagat 4440
gacgctgacc aggacatgat gatggcaggg atggcttcac aggctgctca agaagccgag 4500
atcaatgcca gaaaagccaa aaactctgtt actagcctcc tcagcattat taatgacctc 4560
ttggagcagc tggggcagct ggatacagtg gacctgaata agctaaacga gattgaaggc 4620
accctaaaca aagccaaaga tgaaatgaag gtcagcgatc ttgataggaa agtgtctgac 4680
ctggagaatg aagccaagaa gcaggaggct gccatcatgg actataaccg agatatcgag 4740
gagatcatga aggacattcg caatctggag gacatcagga agaccttacc atctggctgc 4800
ttcaacaccc cgtccattga aaagccctag 4830
<210> 126
<211> 3122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность ламинина субъединицы
альфа-2 (Человек разумный)
<400> 126
Met Pro Gly Ala Ala Gly Val Leu Leu Leu Leu Leu Leu Ser Gly Gly
1 5 10 15
Leu Gly Gly Val Gln Ala Gln Arg Pro Gln Gln Gln Arg Gln Ser Gln
20 25 30
Ala His Gln Gln Arg Gly Leu Phe Pro Ala Val Leu Asn Leu Ala Ser
35 40 45
Asn Ala Leu Ile Thr Thr Asn Ala Thr Cys Gly Glu Lys Gly Pro Glu
50 55 60
Met Tyr Cys Lys Leu Val Glu His Val Pro Gly Gln Pro Val Arg Asn
65 70 75 80
Pro Gln Cys Arg Ile Cys Asn Gln Asn Ser Ser Asn Pro Asn Gln Arg
85 90 95
His Pro Ile Thr Asn Ala Ile Asp Gly Lys Asn Thr Trp Trp Gln Ser
100 105 110
Pro Ser Ile Lys Asn Gly Ile Glu Tyr His Tyr Val Thr Ile Thr Leu
115 120 125
Asp Leu Gln Gln Val Phe Gln Ile Ala Tyr Val Ile Val Lys Ala Ala
130 135 140
Asn Ser Pro Arg Pro Gly Asn Trp Ile Leu Glu Arg Ser Leu Asp Asp
145 150 155 160
Val Glu Tyr Lys Pro Trp Gln Tyr His Ala Val Thr Asp Thr Glu Cys
165 170 175
Leu Thr Leu Tyr Asn Ile Tyr Pro Arg Thr Gly Pro Pro Ser Tyr Ala
180 185 190
Lys Asp Asp Glu Val Ile Cys Thr Ser Phe Tyr Ser Lys Ile His Pro
195 200 205
Leu Glu Asn Gly Glu Ile His Ile Ser Leu Ile Asn Gly Arg Pro Ser
210 215 220
Ala Asp Asp Pro Ser Pro Glu Leu Leu Glu Phe Thr Ser Ala Arg Tyr
225 230 235 240
Ile Arg Leu Arg Phe Gln Arg Ile Arg Thr Leu Asn Ala Asp Leu Met
245 250 255
Met Phe Ala His Lys Asp Pro Arg Glu Ile Asp Pro Ile Val Thr Arg
260 265 270
Arg Tyr Tyr Tyr Ser Val Lys Asp Ile Ser Val Gly Gly Met Cys Ile
275 280 285
Cys Tyr Gly His Ala Arg Ala Cys Pro Leu Asp Pro Ala Thr Asn Lys
290 295 300
Ser Arg Cys Glu Cys Glu His Asn Thr Cys Gly Asp Ser Cys Asp Gln
305 310 315 320
Cys Cys Pro Gly Phe His Gln Lys Pro Trp Arg Ala Gly Thr Phe Leu
325 330 335
Thr Lys Thr Glu Cys Glu Ala Cys Asn Cys His Gly Lys Ala Glu Glu
340 345 350
Cys Tyr Tyr Asp Glu Asn Val Ala Arg Arg Asn Leu Ser Leu Asn Ile
355 360 365
Arg Gly Lys Tyr Ile Gly Gly Gly Val Cys Ile Asn Cys Thr Gln Asn
370 375 380
Thr Ala Gly Ile Asn Cys Glu Thr Cys Thr Asp Gly Phe Phe Arg Pro
385 390 395 400
Lys Gly Val Ser Pro Asn Tyr Pro Arg Pro Cys Gln Pro Cys His Cys
405 410 415
Asp Pro Ile Gly Ser Leu Asn Glu Val Cys Val Lys Asp Glu Lys His
420 425 430
Ala Arg Arg Gly Leu Ala Pro Gly Ser Cys His Cys Lys Thr Gly Phe
435 440 445
Gly Gly Val Ser Cys Asp Arg Cys Ala Arg Gly Tyr Thr Gly Tyr Pro
450 455 460
Asp Cys Lys Ala Cys Asn Cys Ser Gly Leu Gly Ser Lys Asn Glu Asp
465 470 475 480
Pro Cys Phe Gly Pro Cys Ile Cys Lys Glu Asn Val Glu Gly Gly Asp
485 490 495
Cys Ser Arg Cys Lys Ser Gly Phe Phe Asn Leu Gln Glu Asp Asn Trp
500 505 510
Lys Gly Cys Asp Glu Cys Phe Cys Ser Gly Val Ser Asn Arg Cys Gln
515 520 525
Ser Ser Tyr Trp Thr Tyr Gly Lys Ile Gln Asp Met Ser Gly Trp Tyr
530 535 540
Leu Thr Asp Leu Pro Gly Arg Ile Arg Val Ala Pro Gln Gln Asp Asp
545 550 555 560
Leu Asp Ser Pro Gln Gln Ile Ser Ile Ser Asn Ala Glu Ala Arg Gln
565 570 575
Ala Leu Pro His Ser Tyr Tyr Trp Ser Ala Pro Ala Pro Tyr Leu Gly
580 585 590
Asn Lys Leu Pro Ala Val Gly Gly Gln Leu Thr Phe Thr Ile Ser Tyr
595 600 605
Asp Leu Glu Glu Glu Glu Glu Asp Thr Glu Arg Val Leu Gln Leu Met
610 615 620
Ile Ile Leu Glu Gly Asn Asp Leu Ser Ile Ser Thr Ala Gln Asp Glu
625 630 635 640
Val Tyr Leu His Pro Ser Glu Glu His Thr Asn Val Leu Leu Leu Lys
645 650 655
Glu Glu Ser Phe Thr Ile His Gly Thr His Phe Pro Val Arg Arg Lys
660 665 670
Glu Phe Met Thr Val Leu Ala Asn Leu Lys Arg Val Leu Leu Gln Ile
675 680 685
Thr Tyr Ser Phe Gly Met Asp Ala Ile Phe Arg Leu Ser Ser Val Asn
690 695 700
Leu Glu Ser Ala Val Ser Tyr Pro Thr Asp Gly Ser Ile Ala Ala Ala
705 710 715 720
Val Glu Val Cys Gln Cys Pro Pro Gly Tyr Thr Gly Ser Ser Cys Glu
725 730 735
Ser Cys Trp Pro Arg His Arg Arg Val Asn Gly Thr Ile Phe Gly Gly
740 745 750
Ile Cys Glu Pro Cys Gln Cys Phe Gly His Ala Glu Ser Cys Asp Asp
755 760 765
Val Thr Gly Glu Cys Leu Asn Cys Lys Asp His Thr Gly Gly Pro Tyr
770 775 780
Cys Asp Lys Cys Leu Pro Gly Phe Tyr Gly Glu Pro Thr Lys Gly Thr
785 790 795 800
Ser Glu Asp Cys Gln Pro Cys Ala Cys Pro Leu Asn Ile Pro Ser Asn
805 810 815
Asn Phe Ser Pro Thr Cys His Leu Asp Arg Ser Leu Gly Leu Ile Cys
820 825 830
Asp Gly Cys Pro Val Gly Tyr Thr Gly Pro Arg Cys Glu Arg Cys Ala
835 840 845
Glu Gly Tyr Phe Gly Gln Pro Ser Val Pro Gly Gly Ser Cys Gln Pro
850 855 860
Cys Gln Cys Asn Asp Asn Leu Asp Phe Ser Ile Pro Gly Ser Cys Asp
865 870 875 880
Ser Leu Ser Gly Ser Cys Leu Ile Cys Lys Pro Gly Thr Thr Gly Arg
885 890 895
Tyr Cys Glu Leu Cys Ala Asp Gly Tyr Phe Gly Asp Ala Val Asp Ala
900 905 910
Lys Asn Cys Gln Pro Cys Arg Cys Asn Ala Gly Gly Ser Phe Ser Glu
915 920 925
Val Cys His Ser Gln Thr Gly Gln Cys Glu Cys Arg Ala Asn Val Gln
930 935 940
Gly Gln Arg Cys Asp Lys Cys Lys Ala Gly Thr Phe Gly Leu Gln Ser
945 950 955 960
Ala Arg Gly Cys Val Pro Cys Asn Cys Asn Ser Phe Gly Ser Lys Ser
965 970 975
Phe Asp Cys Glu Glu Ser Gly Gln Cys Trp Cys Gln Pro Gly Val Thr
980 985 990
Gly Lys Lys Cys Asp Arg Cys Ala His Gly Tyr Phe Asn Phe Gln Glu
995 1000 1005
Gly Gly Cys Thr Ala Cys Glu Cys Ser His Leu Gly Asn Asn Cys Asp
1010 1015 1020
Pro Lys Thr Gly Arg Cys Ile Cys Pro Pro Asn Thr Ile Gly Glu Lys
1025 1030 1035 1040
Cys Ser Lys Cys Ala Pro Asn Thr Trp Gly His Ser Ile Thr Thr Gly
1045 1050 1055
Cys Lys Ala Cys Asn Cys Ser Thr Val Gly Ser Leu Asp Phe Gln Cys
1060 1065 1070
Asn Val Asn Thr Gly Gln Cys Asn Cys His Pro Lys Phe Ser Gly Ala
1075 1080 1085
Lys Cys Thr Glu Cys Ser Arg Gly His Trp Asn Tyr Pro Arg Cys Asn
1090 1095 1100
Leu Cys Asp Cys Phe Leu Pro Gly Thr Asp Ala Thr Thr Cys Asp Ser
1105 1110 1115 1120
Glu Thr Lys Lys Cys Ser Cys Ser Asp Gln Thr Gly Gln Cys Thr Cys
1125 1130 1135
Lys Val Asn Val Glu Gly Ile His Cys Asp Arg Cys Arg Pro Gly Lys
1140 1145 1150
Phe Gly Leu Asp Ala Lys Asn Pro Leu Gly Cys Ser Ser Cys Tyr Cys
1155 1160 1165
Phe Gly Thr Thr Thr Gln Cys Ser Glu Ala Lys Gly Leu Ile Arg Thr
1170 1175 1180
Trp Val Thr Leu Lys Ala Glu Gln Thr Ile Leu Pro Leu Val Asp Glu
1185 1190 1195 1200
Ala Leu Gln His Thr Thr Thr Lys Gly Ile Val Phe Gln His Pro Glu
1205 1210 1215
Ile Val Ala His Met Asp Leu Met Arg Glu Asp Leu His Leu Glu Pro
1220 1225 1230
Phe Tyr Trp Lys Leu Pro Glu Gln Phe Glu Gly Lys Lys Leu Met Ala
1235 1240 1245
Tyr Gly Gly Lys Leu Lys Tyr Ala Ile Tyr Phe Glu Ala Arg Glu Glu
1250 1255 1260
Thr Gly Phe Ser Thr Tyr Asn Pro Gln Val Ile Ile Arg Gly Gly Thr
1265 1270 1275 1280
Pro Thr His Ala Arg Ile Ile Val Arg His Met Ala Ala Pro Leu Ile
1285 1290 1295
Gly Gln Leu Thr Arg His Glu Ile Glu Met Thr Glu Lys Glu Trp Lys
1300 1305 1310
Tyr Tyr Gly Asp Asp Pro Arg Val His Arg Thr Val Thr Arg Glu Asp
1315 1320 1325
Phe Leu Asp Ile Leu Tyr Asp Ile His Tyr Ile Leu Ile Lys Ala Thr
1330 1335 1340
Tyr Gly Asn Phe Met Arg Gln Ser Arg Ile Ser Glu Ile Ser Met Glu
1345 1350 1355 1360
Val Ala Glu Gln Gly Arg Gly Thr Thr Met Thr Pro Pro Ala Asp Leu
1365 1370 1375
Ile Glu Lys Cys Asp Cys Pro Leu Gly Tyr Ser Gly Leu Ser Cys Glu
1380 1385 1390
Ala Cys Leu Pro Gly Phe Tyr Arg Leu Arg Ser Gln Pro Gly Gly Arg
1395 1400 1405
Thr Pro Gly Pro Thr Leu Gly Thr Cys Val Pro Cys Gln Cys Asn Gly
1410 1415 1420
His Ser Ser Leu Cys Asp Pro Glu Thr Ser Ile Cys Gln Asn Cys Gln
1425 1430 1435 1440
His His Thr Ala Gly Asp Phe Cys Glu Arg Cys Ala Leu Gly Tyr Tyr
1445 1450 1455
Gly Ile Val Lys Gly Leu Pro Asn Asp Cys Gln Gln Cys Ala Cys Pro
1460 1465 1470
Leu Ile Ser Ser Ser Asn Asn Phe Ser Pro Ser Cys Val Ala Glu Gly
1475 1480 1485
Leu Asp Asp Tyr Arg Cys Thr Ala Cys Pro Arg Gly Tyr Glu Gly Gln
1490 1495 1500
Tyr Cys Glu Arg Cys Ala Pro Gly Tyr Thr Gly Ser Pro Gly Asn Pro
1505 1510 1515 1520
Gly Gly Ser Cys Gln Glu Cys Glu Cys Asp Pro Tyr Gly Ser Leu Pro
1525 1530 1535
Val Pro Cys Asp Pro Val Thr Gly Phe Cys Thr Cys Arg Pro Gly Ala
1540 1545 1550
Thr Gly Arg Lys Cys Asp Gly Cys Lys His Trp His Ala Arg Glu Gly
1555 1560 1565
Trp Glu Cys Val Phe Cys Gly Asp Glu Cys Thr Gly Leu Leu Leu Gly
1570 1575 1580
Asp Leu Ala Arg Leu Glu Gln Met Val Met Ser Ile Asn Leu Thr Gly
1585 1590 1595 1600
Pro Leu Pro Ala Pro Tyr Lys Met Leu Tyr Gly Leu Glu Asn Met Thr
1605 1610 1615
Gln Glu Leu Lys His Leu Leu Ser Pro Gln Arg Ala Pro Glu Arg Leu
1620 1625 1630
Ile Gln Leu Ala Glu Gly Asn Leu Asn Thr Leu Val Thr Glu Met Asn
1635 1640 1645
Glu Leu Leu Thr Arg Ala Thr Lys Val Thr Ala Asp Gly Glu Gln Thr
1650 1655 1660
Gly Gln Asp Ala Glu Arg Thr Asn Thr Arg Ala Lys Ser Leu Gly Glu
1665 1670 1675 1680
Phe Ile Lys Glu Leu Ala Arg Asp Ala Glu Ala Val Asn Glu Lys Ala
1685 1690 1695
Ile Lys Leu Asn Glu Thr Leu Gly Thr Arg Asp Glu Ala Phe Glu Arg
1700 1705 1710
Asn Leu Glu Gly Leu Gln Lys Glu Ile Asp Gln Met Ile Lys Glu Leu
1715 1720 1725
Arg Arg Lys Asn Leu Glu Thr Gln Lys Glu Ile Ala Glu Asp Glu Leu
1730 1735 1740
Val Ala Ala Glu Ala Leu Leu Lys Lys Val Lys Lys Leu Phe Gly Glu
1745 1750 1755 1760
Ser Arg Gly Glu Asn Glu Glu Met Glu Lys Asp Leu Arg Glu Lys Leu
1765 1770 1775
Ala Asp Tyr Lys Asn Lys Val Asp Asp Ala Trp Asp Leu Leu Arg Glu
1780 1785 1790
Ala Thr Asp Lys Ile Arg Glu Ala Asn Arg Leu Phe Ala Val Asn Gln
1795 1800 1805
Lys Asn Met Thr Ala Leu Glu Lys Lys Lys Glu Ala Val Glu Ser Gly
1810 1815 1820
Lys Arg Gln Ile Glu Asn Thr Leu Lys Glu Gly Asn Asp Ile Leu Asp
1825 1830 1835 1840
Glu Ala Asn Arg Leu Ala Asp Glu Ile Asn Ser Ile Ile Asp Tyr Val
1845 1850 1855
Glu Asp Ile Gln Thr Lys Leu Pro Pro Met Ser Glu Glu Leu Asn Asp
1860 1865 1870
Lys Ile Asp Asp Leu Ser Gln Glu Ile Lys Asp Arg Lys Leu Ala Glu
1875 1880 1885
Lys Val Ser Gln Ala Glu Ser His Ala Ala Gln Leu Asn Asp Ser Ser
1890 1895 1900
Ala Val Leu Asp Gly Ile Leu Asp Glu Ala Lys Asn Ile Ser Phe Asn
1905 1910 1915 1920
Ala Thr Ala Ala Phe Lys Ala Tyr Ser Asn Ile Lys Asp Tyr Ile Asp
1925 1930 1935
Glu Ala Glu Lys Val Ala Lys Glu Ala Lys Asp Leu Ala His Glu Ala
1940 1945 1950
Thr Lys Leu Ala Thr Gly Pro Arg Gly Leu Leu Lys Glu Asp Ala Lys
1955 1960 1965
Gly Cys Leu Gln Lys Ser Phe Arg Ile Leu Asn Glu Ala Lys Lys Leu
1970 1975 1980
Ala Asn Asp Val Lys Glu Asn Glu Asp His Leu Asn Gly Leu Lys Thr
1985 1990 1995 2000
Arg Ile Glu Asn Ala Asp Ala Arg Asn Gly Asp Leu Leu Arg Thr Leu
2005 2010 2015
Asn Asp Thr Leu Gly Lys Leu Ser Ala Ile Pro Asn Asp Thr Ala Ala
2020 2025 2030
Lys Leu Gln Ala Val Lys Asp Lys Ala Arg Gln Ala Asn Asp Thr Ala
2035 2040 2045
Lys Asp Val Leu Ala Gln Ile Thr Glu Leu His Gln Asn Leu Asp Gly
2050 2055 2060
Leu Lys Lys Asn Tyr Asn Lys Leu Ala Asp Ser Val Ala Lys Thr Asn
2065 2070 2075 2080
Ala Val Val Lys Asp Pro Ser Lys Asn Lys Ile Ile Ala Asp Ala Asp
2085 2090 2095
Ala Thr Val Lys Asn Leu Glu Gln Glu Ala Asp Arg Leu Ile Asp Lys
2100 2105 2110
Leu Lys Pro Ile Lys Glu Leu Glu Asp Asn Leu Lys Lys Asn Ile Ser
2115 2120 2125
Glu Ile Lys Glu Leu Ile Asn Gln Ala Arg Lys Gln Ala Asn Ser Ile
2130 2135 2140
Lys Val Ser Val Ser Ser Gly Gly Asp Cys Ile Arg Thr Tyr Lys Pro
2145 2150 2155 2160
Glu Ile Lys Lys Gly Ser Tyr Asn Asn Ile Val Val Asn Val Lys Thr
2165 2170 2175
Ala Val Ala Asp Asn Leu Leu Phe Tyr Leu Gly Ser Ala Lys Phe Ile
2180 2185 2190
Asp Phe Leu Ala Ile Glu Met Arg Lys Gly Lys Val Ser Phe Leu Trp
2195 2200 2205
Asp Val Gly Ser Gly Val Gly Arg Val Glu Tyr Pro Asp Leu Thr Ile
2210 2215 2220
Asp Asp Ser Tyr Trp Tyr Arg Ile Val Ala Ser Arg Thr Gly Arg Asn
2225 2230 2235 2240
Gly Thr Ile Ser Val Arg Ala Leu Asp Gly Pro Lys Ala Ser Ile Val
2245 2250 2255
Pro Ser Thr His His Ser Thr Ser Pro Pro Gly Tyr Thr Ile Leu Asp
2260 2265 2270
Val Asp Ala Asn Ala Met Leu Phe Val Gly Gly Leu Thr Gly Lys Leu
2275 2280 2285
Lys Lys Ala Asp Ala Val Arg Val Ile Thr Phe Thr Gly Cys Met Gly
2290 2295 2300
Glu Thr Tyr Phe Asp Asn Lys Pro Ile Gly Leu Trp Asn Phe Arg Glu
2305 2310 2315 2320
Lys Glu Gly Asp Cys Lys Gly Cys Thr Val Ser Pro Gln Val Glu Asp
2325 2330 2335
Ser Glu Gly Thr Ile Gln Phe Asp Gly Glu Gly Tyr Ala Leu Val Ser
2340 2345 2350
Arg Pro Ile Arg Trp Tyr Pro Asn Ile Ser Thr Val Met Phe Lys Phe
2355 2360 2365
Arg Thr Phe Ser Ser Ser Ala Leu Leu Met Tyr Leu Ala Thr Arg Asp
2370 2375 2380
Leu Arg Asp Phe Met Ser Val Glu Leu Thr Asp Gly His Ile Lys Val
2385 2390 2395 2400
Ser Tyr Asp Leu Gly Ser Gly Met Ala Ser Val Val Ser Asn Gln Asn
2405 2410 2415
His Asn Asp Gly Lys Trp Lys Ser Phe Thr Leu Ser Arg Ile Gln Lys
2420 2425 2430
Gln Ala Asn Ile Ser Ile Val Asp Ile Asp Thr Asn Gln Glu Glu Asn
2435 2440 2445
Ile Ala Thr Ser Ser Ser Gly Asn Asn Phe Gly Leu Asp Leu Lys Ala
2450 2455 2460
Asp Asp Lys Ile Tyr Phe Gly Gly Leu Pro Thr Leu Arg Asn Leu Ser
2465 2470 2475 2480
Met Lys Ala Arg Pro Glu Val Asn Leu Lys Lys Tyr Ser Gly Cys Leu
2485 2490 2495
Lys Asp Ile Glu Ile Ser Arg Thr Pro Tyr Asn Ile Leu Ser Ser Pro
2500 2505 2510
Asp Tyr Val Gly Val Thr Lys Gly Cys Ser Leu Glu Asn Val Tyr Thr
2515 2520 2525
Val Ser Phe Pro Lys Pro Gly Phe Val Glu Leu Ser Pro Val Pro Ile
2530 2535 2540
Asp Val Gly Thr Glu Ile Asn Leu Ser Phe Ser Thr Lys Asn Glu Ser
2545 2550 2555 2560
Gly Ile Ile Leu Leu Gly Ser Gly Gly Thr Pro Ala Pro Pro Arg Arg
2565 2570 2575
Lys Arg Arg Gln Thr Gly Gln Ala Tyr Tyr Ala Ile Leu Leu Asn Arg
2580 2585 2590
Gly Arg Leu Glu Val His Leu Ser Thr Gly Ala Arg Thr Met Arg Lys
2595 2600 2605
Ile Val Ile Arg Pro Glu Pro Asn Leu Phe His Asp Gly Arg Glu His
2610 2615 2620
Ser Val His Val Glu Arg Thr Arg Gly Ile Phe Thr Val Gln Val Asp
2625 2630 2635 2640
Glu Asn Arg Arg Tyr Met Gln Asn Leu Thr Val Glu Gln Pro Ile Glu
2645 2650 2655
Val Lys Lys Leu Phe Val Gly Gly Ala Pro Pro Glu Phe Gln Pro Ser
2660 2665 2670
Pro Leu Arg Asn Ile Pro Pro Phe Glu Gly Cys Ile Trp Asn Leu Val
2675 2680 2685
Ile Asn Ser Val Pro Met Asp Phe Ala Arg Pro Val Ser Phe Lys Asn
2690 2695 2700
Ala Asp Ile Gly Arg Cys Ala His Gln Lys Leu Arg Glu Asp Glu Asp
2705 2710 2715 2720
Gly Ala Ala Pro Ala Glu Ile Val Ile Gln Pro Glu Pro Val Pro Thr
2725 2730 2735
Pro Ala Phe Pro Thr Pro Thr Pro Val Leu Thr His Gly Pro Cys Ala
2740 2745 2750
Ala Glu Ser Glu Pro Ala Leu Leu Ile Gly Ser Lys Gln Phe Gly Leu
2755 2760 2765
Ser Arg Asn Ser His Ile Ala Ile Ala Phe Asp Asp Thr Lys Val Lys
2770 2775 2780
Asn Arg Leu Thr Ile Glu Leu Glu Val Arg Thr Glu Ala Glu Ser Gly
2785 2790 2795 2800
Leu Leu Phe Tyr Met Ala Arg Ile Asn His Ala Asp Phe Ala Thr Val
2805 2810 2815
Gln Leu Arg Asn Gly Leu Pro Tyr Phe Ser Tyr Asp Leu Gly Ser Gly
2820 2825 2830
Asp Thr His Thr Met Ile Pro Thr Lys Ile Asn Asp Gly Gln Trp His
2835 2840 2845
Lys Ile Lys Ile Met Arg Ser Lys Gln Glu Gly Ile Leu Tyr Val Asp
2850 2855 2860
Gly Ala Ser Asn Arg Thr Ile Ser Pro Lys Lys Ala Asp Ile Leu Asp
2865 2870 2875 2880
Val Val Gly Met Leu Tyr Val Gly Gly Leu Pro Ile Asn Tyr Thr Thr
2885 2890 2895
Arg Arg Ile Gly Pro Val Thr Tyr Ser Ile Asp Gly Cys Val Arg Asn
2900 2905 2910
Leu His Met Ala Glu Ala Pro Ala Asp Leu Glu Gln Pro Thr Ser Ser
2915 2920 2925
Phe His Val Gly Thr Cys Phe Ala Asn Ala Gln Arg Gly Thr Tyr Phe
2930 2935 2940
Asp Gly Thr Gly Phe Ala Lys Ala Val Gly Gly Phe Lys Val Gly Leu
2945 2950 2955 2960
Asp Leu Leu Val Glu Phe Glu Phe Arg Thr Thr Thr Thr Thr Gly Val
2965 2970 2975
Leu Leu Gly Ile Ser Ser Gln Lys Met Asp Gly Met Gly Ile Glu Met
2980 2985 2990
Ile Asp Glu Lys Leu Met Phe His Val Asp Asn Gly Ala Gly Arg Phe
2995 3000 3005
Thr Ala Val Tyr Asp Ala Gly Val Pro Gly His Leu Cys Asp Gly Gln
3010 3015 3020
Trp His Lys Val Thr Ala Asn Lys Ile Lys His Arg Ile Glu Leu Thr
3025 3030 3035 3040
Val Asp Gly Asn Gln Val Glu Ala Gln Ser Pro Asn Pro Ala Ser Thr
3045 3050 3055
Ser Ala Asp Thr Asn Asp Pro Val Phe Val Gly Gly Phe Pro Asp Asp
3060 3065 3070
Leu Lys Gln Phe Gly Leu Thr Thr Ser Ile Pro Phe Arg Gly Cys Ile
3075 3080 3085
Arg Ser Leu Lys Leu Thr Lys Gly Thr Gly Lys Pro Leu Glu Val Asn
3090 3095 3100
Phe Ala Lys Ala Leu Glu Leu Arg Gly Val Gln Pro Val Ser Cys Pro
3105 3110 3115 3120
Ala Asn
<210> 127
<211> 3695
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность ламинина субъединицы
альфа-5 (Человек разумный)
<400> 127
Met Ala Lys Arg Leu Cys Ala Gly Ser Ala Leu Cys Val Arg Gly Pro
1 5 10 15
Arg Gly Pro Ala Pro Leu Leu Leu Val Gly Leu Ala Leu Leu Gly Ala
20 25 30
Ala Arg Ala Arg Glu Glu Ala Gly Gly Gly Phe Ser Leu His Pro Pro
35 40 45
Tyr Phe Asn Leu Ala Glu Gly Ala Arg Ile Ala Ala Ser Ala Thr Cys
50 55 60
Gly Glu Glu Ala Pro Ala Arg Gly Ser Pro Arg Pro Thr Glu Asp Leu
65 70 75 80
Tyr Cys Lys Leu Val Gly Gly Pro Val Ala Gly Gly Asp Pro Asn Gln
85 90 95
Thr Ile Arg Gly Gln Tyr Cys Asp Ile Cys Thr Ala Ala Asn Ser Asn
100 105 110
Lys Ala His Pro Ala Ser Asn Ala Ile Asp Gly Thr Glu Arg Trp Trp
115 120 125
Gln Ser Pro Pro Leu Ser Arg Gly Leu Glu Tyr Asn Glu Val Asn Val
130 135 140
Thr Leu Asp Leu Gly Gln Val Phe His Val Ala Tyr Val Leu Ile Lys
145 150 155 160
Phe Ala Asn Ser Pro Arg Pro Asp Leu Trp Val Leu Glu Arg Ser Met
165 170 175
Asp Phe Gly Arg Thr Tyr Gln Pro Trp Gln Phe Phe Ala Ser Ser Lys
180 185 190
Arg Asp Cys Leu Glu Arg Phe Gly Pro Gln Thr Leu Glu Arg Ile Thr
195 200 205
Arg Asp Asp Ala Ala Ile Cys Thr Thr Glu Tyr Ser Arg Ile Val Pro
210 215 220
Leu Glu Asn Gly Glu Ile Val Val Ser Leu Val Asn Gly Arg Pro Gly
225 230 235 240
Ala Met Asn Phe Ser Tyr Ser Pro Leu Leu Arg Glu Phe Thr Lys Ala
245 250 255
Thr Asn Val Arg Leu Arg Phe Leu Arg Thr Asn Thr Leu Leu Gly His
260 265 270
Leu Met Gly Lys Ala Leu Arg Asp Pro Thr Val Thr Arg Arg Tyr Tyr
275 280 285
Tyr Ser Ile Lys Asp Ile Ser Ile Gly Gly Arg Cys Val Cys His Gly
290 295 300
His Ala Asp Ala Cys Asp Ala Lys Asp Pro Thr Asp Pro Phe Arg Leu
305 310 315 320
Gln Cys Thr Cys Gln His Asn Thr Cys Gly Gly Thr Cys Asp Arg Cys
325 330 335
Cys Pro Gly Phe Asn Gln Gln Pro Trp Lys Pro Ala Thr Ala Asn Ser
340 345 350
Ala Asn Glu Cys Gln Ser Cys Asn Cys Tyr Gly His Ala Thr Asp Cys
355 360 365
Tyr Tyr Asp Pro Glu Val Asp Arg Arg Arg Ala Ser Gln Ser Leu Asp
370 375 380
Gly Thr Tyr Gln Gly Gly Gly Val Cys Ile Asp Cys Gln His His Thr
385 390 395 400
Thr Gly Val Asn Cys Glu Arg Cys Leu Pro Gly Phe Tyr Arg Ser Pro
405 410 415
Asn His Pro Leu Asp Ser Pro His Val Cys Arg Arg Cys Asn Cys Glu
420 425 430
Ser Asp Phe Thr Asp Gly Thr Cys Glu Asp Leu Thr Gly Arg Cys Tyr
435 440 445
Cys Arg Pro Asn Phe Ser Gly Glu Arg Cys Asp Val Cys Ala Glu Gly
450 455 460
Phe Thr Gly Phe Pro Ser Cys Tyr Pro Thr Pro Ser Ser Ser Asn Asp
465 470 475 480
Thr Arg Glu Gln Val Leu Pro Ala Gly Gln Ile Val Asn Cys Asp Cys
485 490 495
Ser Ala Ala Gly Thr Gln Gly Asn Ala Cys Arg Lys Asp Pro Arg Val
500 505 510
Gly Arg Cys Leu Cys Lys Pro Asn Phe Gln Gly Thr His Cys Glu Leu
515 520 525
Cys Ala Pro Gly Phe Tyr Gly Pro Gly Cys Gln Pro Cys Gln Cys Ser
530 535 540
Ser Pro Gly Val Ala Asp Asp Arg Cys Asp Pro Asp Thr Gly Gln Cys
545 550 555 560
Arg Cys Arg Val Gly Phe Glu Gly Ala Thr Cys Asp Arg Cys Ala Pro
565 570 575
Gly Tyr Phe His Phe Pro Leu Cys Gln Leu Cys Gly Cys Ser Pro Ala
580 585 590
Gly Thr Leu Pro Glu Gly Cys Asp Glu Ala Gly Arg Cys Leu Cys Gln
595 600 605
Pro Glu Phe Ala Gly Pro His Cys Asp Arg Cys Arg Pro Gly Tyr His
610 615 620
Gly Phe Pro Asn Cys Gln Ala Cys Thr Cys Asp Pro Arg Gly Ala Leu
625 630 635 640
Asp Gln Leu Cys Gly Ala Gly Gly Leu Cys Arg Cys Arg Pro Gly Tyr
645 650 655
Thr Gly Thr Ala Cys Gln Glu Cys Ser Pro Gly Phe His Gly Phe Pro
660 665 670
Ser Cys Val Pro Cys His Cys Ser Ala Glu Gly Ser Leu His Ala Ala
675 680 685
Cys Asp Pro Arg Ser Gly Gln Cys Ser Cys Arg Pro Arg Val Thr Gly
690 695 700
Leu Arg Cys Asp Thr Cys Val Pro Gly Ala Tyr Asn Phe Pro Tyr Cys
705 710 715 720
Glu Ala Gly Ser Cys His Pro Ala Gly Leu Ala Pro Val Asp Pro Ala
725 730 735
Leu Pro Glu Ala Gln Val Pro Cys Met Cys Arg Ala His Val Glu Gly
740 745 750
Pro Ser Cys Asp Arg Cys Lys Pro Gly Phe Trp Gly Leu Ser Pro Ser
755 760 765
Asn Pro Glu Gly Cys Thr Arg Cys Ser Cys Asp Leu Arg Gly Thr Leu
770 775 780
Gly Gly Val Ala Glu Cys Gln Pro Gly Thr Gly Gln Cys Phe Cys Lys
785 790 795 800
Pro His Val Cys Gly Gln Ala Cys Ala Ser Cys Lys Asp Gly Phe Phe
805 810 815
Gly Leu Asp Gln Ala Asp Tyr Phe Gly Cys Arg Ser Cys Arg Cys Asp
820 825 830
Ile Gly Gly Ala Leu Gly Gln Ser Cys Glu Pro Arg Thr Gly Val Cys
835 840 845
Arg Cys Arg Pro Asn Thr Gln Gly Pro Thr Cys Ser Glu Pro Ala Arg
850 855 860
Asp His Tyr Leu Pro Asp Leu His His Leu Arg Leu Glu Leu Glu Glu
865 870 875 880
Ala Ala Thr Pro Glu Gly His Ala Val Arg Phe Gly Phe Asn Pro Leu
885 890 895
Glu Phe Glu Asn Phe Ser Trp Arg Gly Tyr Ala Gln Met Ala Pro Val
900 905 910
Gln Pro Arg Ile Val Ala Arg Leu Asn Leu Thr Ser Pro Asp Leu Phe
915 920 925
Trp Leu Val Phe Arg Tyr Val Asn Arg Gly Ala Met Ser Val Ser Gly
930 935 940
Arg Val Ser Val Arg Glu Glu Gly Arg Ser Ala Thr Cys Ala Asn Cys
945 950 955 960
Thr Ala Gln Ser Gln Pro Val Ala Phe Pro Pro Ser Thr Glu Pro Ala
965 970 975
Phe Ile Thr Val Pro Gln Arg Gly Phe Gly Glu Pro Phe Val Leu Asn
980 985 990
Pro Gly Thr Trp Ala Leu Arg Val Glu Ala Glu Gly Val Leu Leu Asp
995 1000 1005
Tyr Val Val Leu Leu Pro Ser Ala Tyr Tyr Glu Ala Ala Leu Leu Gln
1010 1015 1020
Leu Arg Val Thr Glu Ala Cys Thr Tyr Arg Pro Ser Ala Gln Gln Ser
1025 1030 1035 1040
Gly Asp Asn Cys Leu Leu Tyr Thr His Leu Pro Leu Asp Gly Phe Pro
1045 1050 1055
Ser Ala Ala Gly Leu Glu Ala Leu Cys Arg Gln Asp Asn Ser Leu Pro
1060 1065 1070
Arg Pro Cys Pro Thr Glu Gln Leu Ser Pro Ser His Pro Pro Leu Ile
1075 1080 1085
Thr Cys Thr Gly Ser Asp Val Asp Val Gln Leu Gln Val Ala Val Pro
1090 1095 1100
Gln Pro Gly Arg Tyr Ala Leu Val Val Glu Tyr Ala Asn Glu Asp Ala
1105 1110 1115 1120
Arg Gln Glu Val Gly Val Ala Val His Thr Pro Gln Arg Ala Pro Gln
1125 1130 1135
Gln Gly Leu Leu Ser Leu His Pro Cys Leu Tyr Ser Thr Leu Cys Arg
1140 1145 1150
Gly Thr Ala Arg Asp Thr Gln Asp His Leu Ala Val Phe His Leu Asp
1155 1160 1165
Ser Glu Ala Ser Val Arg Leu Thr Ala Glu Gln Ala Arg Phe Phe Leu
1170 1175 1180
His Gly Val Thr Leu Val Pro Ile Glu Glu Phe Ser Pro Glu Phe Val
1185 1190 1195 1200
Glu Pro Arg Val Ser Cys Ile Ser Ser His Gly Ala Phe Gly Pro Asn
1205 1210 1215
Ser Ala Ala Cys Leu Pro Ser Arg Phe Pro Lys Pro Pro Gln Pro Ile
1220 1225 1230
Ile Leu Arg Asp Cys Gln Val Ile Pro Leu Pro Pro Gly Leu Pro Leu
1235 1240 1245
Thr His Ala Gln Asp Leu Thr Pro Ala Met Ser Pro Ala Gly Pro Arg
1250 1255 1260
Pro Arg Pro Pro Thr Ala Val Asp Pro Asp Ala Glu Pro Thr Leu Leu
1265 1270 1275 1280
Arg Glu Pro Gln Ala Thr Val Val Phe Thr Thr His Val Pro Thr Leu
1285 1290 1295
Gly Arg Tyr Ala Phe Leu Leu His Gly Tyr Gln Pro Ala His Pro Thr
1300 1305 1310
Phe Pro Val Glu Val Leu Ile Asn Ala Gly Arg Val Trp Gln Gly His
1315 1320 1325
Ala Asn Ala Ser Phe Cys Pro His Gly Tyr Gly Cys Arg Thr Leu Val
1330 1335 1340
Val Cys Glu Gly Gln Ala Leu Leu Asp Val Thr His Ser Glu Leu Thr
1345 1350 1355 1360
Val Thr Val Arg Val Pro Lys Gly Arg Trp Leu Trp Leu Asp Tyr Val
1365 1370 1375
Leu Val Val Pro Glu Asn Val Tyr Ser Phe Gly Tyr Leu Arg Glu Glu
1380 1385 1390
Pro Leu Asp Lys Ser Tyr Asp Phe Ile Ser His Cys Ala Ala Gln Gly
1395 1400 1405
Tyr His Ile Ser Pro Ser Ser Ser Ser Leu Phe Cys Arg Asn Ala Ala
1410 1415 1420
Ala Ser Leu Ser Leu Phe Tyr Asn Asn Gly Ala Arg Pro Cys Gly Cys
1425 1430 1435 1440
His Glu Val Gly Ala Thr Gly Pro Thr Cys Glu Pro Phe Gly Gly Gln
1445 1450 1455
Cys Pro Cys His Ala His Val Ile Gly Arg Asp Cys Ser Arg Cys Ala
1460 1465 1470
Thr Gly Tyr Trp Gly Phe Pro Asn Cys Arg Pro Cys Asp Cys Gly Ala
1475 1480 1485
Arg Leu Cys Asp Glu Leu Thr Gly Gln Cys Ile Cys Pro Pro Arg Thr
1490 1495 1500
Ile Pro Pro Asp Cys Leu Leu Cys Gln Pro Gln Thr Phe Gly Cys His
1505 1510 1515 1520
Pro Leu Val Gly Cys Glu Glu Cys Asn Cys Ser Gly Pro Gly Ile Gln
1525 1530 1535
Glu Leu Thr Asp Pro Thr Cys Asp Thr Asp Ser Gly Gln Cys Lys Cys
1540 1545 1550
Arg Pro Asn Val Thr Gly Arg Arg Cys Asp Thr Cys Ser Pro Gly Phe
1555 1560 1565
His Gly Tyr Pro Arg Cys Arg Pro Cys Asp Cys His Glu Ala Gly Thr
1570 1575 1580
Ala Pro Gly Val Cys Asp Pro Leu Thr Gly Gln Cys Tyr Cys Lys Glu
1585 1590 1595 1600
Asn Val Gln Gly Pro Lys Cys Asp Gln Cys Ser Leu Gly Thr Phe Ser
1605 1610 1615
Leu Asp Ala Ala Asn Pro Lys Gly Cys Thr Arg Cys Phe Cys Phe Gly
1620 1625 1630
Ala Thr Glu Arg Cys Arg Ser Ser Ser Tyr Thr Arg Gln Glu Phe Val
1635 1640 1645
Asp Met Glu Gly Trp Val Leu Leu Ser Thr Asp Arg Gln Val Val Pro
1650 1655 1660
His Glu Arg Gln Pro Gly Thr Glu Met Leu Arg Ala Asp Leu Arg His
1665 1670 1675 1680
Val Pro Glu Ala Val Pro Glu Ala Phe Pro Glu Leu Tyr Trp Gln Ala
1685 1690 1695
Pro Pro Ser Tyr Leu Gly Asp Arg Val Ser Ser Tyr Gly Gly Thr Leu
1700 1705 1710
Arg Tyr Glu Leu His Ser Glu Thr Gln Arg Gly Asp Val Phe Val Pro
1715 1720 1725
Met Glu Ser Arg Pro Asp Val Val Leu Gln Gly Asn Gln Met Ser Ile
1730 1735 1740
Thr Phe Leu Glu Pro Ala Tyr Pro Thr Pro Gly His Val His Arg Gly
1745 1750 1755 1760
Gln Leu Gln Leu Val Glu Gly Asn Phe Arg His Thr Glu Thr Arg Asn
1765 1770 1775
Thr Val Ser Arg Glu Glu Leu Met Met Val Leu Ala Ser Leu Glu Gln
1780 1785 1790
Leu Gln Ile Arg Ala Leu Phe Ser Gln Ile Ser Ser Ala Val Phe Leu
1795 1800 1805
Arg Arg Val Ala Leu Glu Val Ala Ser Pro Ala Gly Gln Gly Ala Leu
1810 1815 1820
Ala Ser Asn Val Glu Leu Cys Leu Cys Pro Ala Ser Tyr Arg Gly Asp
1825 1830 1835 1840
Ser Cys Gln Glu Cys Ala Pro Gly Phe Tyr Arg Asp Val Lys Gly Leu
1845 1850 1855
Phe Leu Gly Arg Cys Val Pro Cys Gln Cys His Gly His Ser Asp Arg
1860 1865 1870
Cys Leu Pro Gly Ser Gly Val Cys Val Asp Cys Gln His Asn Thr Glu
1875 1880 1885
Gly Ala His Cys Glu Arg Cys Gln Ala Gly Phe Val Ser Ser Arg Asp
1890 1895 1900
Asp Pro Ser Ala Pro Cys Val Ser Cys Pro Cys Pro Leu Ser Val Pro
1905 1910 1915 1920
Ser Asn Asn Phe Ala Glu Gly Cys Val Leu Arg Gly Gly Arg Thr Gln
1925 1930 1935
Cys Leu Cys Lys Pro Gly Tyr Ala Gly Ala Ser Cys Glu Arg Cys Ala
1940 1945 1950
Pro Gly Phe Phe Gly Asn Pro Leu Val Leu Gly Ser Ser Cys Gln Pro
1955 1960 1965
Cys Asp Cys Ser Gly Asn Gly Asp Pro Asn Leu Leu Phe Ser Asp Cys
1970 1975 1980
Asp Pro Leu Thr Gly Ala Cys Arg Gly Cys Leu Arg His Thr Thr Gly
1985 1990 1995 2000
Pro Arg Cys Glu Ile Cys Ala Pro Gly Phe Tyr Gly Asn Ala Leu Leu
2005 2010 2015
Pro Gly Asn Cys Thr Arg Cys Asp Cys Thr Pro Cys Gly Thr Glu Ala
2020 2025 2030
Cys Asp Pro His Ser Gly His Cys Leu Cys Lys Ala Gly Val Thr Gly
2035 2040 2045
Arg Arg Cys Asp Arg Cys Gln Glu Gly His Phe Gly Phe Asp Gly Cys
2050 2055 2060
Gly Gly Cys Arg Pro Cys Ala Cys Gly Pro Ala Ala Glu Gly Ser Glu
2065 2070 2075 2080
Cys His Pro Gln Ser Gly Gln Cys His Cys Arg Pro Gly Thr Met Gly
2085 2090 2095
Pro Gln Cys Arg Glu Cys Ala Pro Gly Tyr Trp Gly Leu Pro Glu Gln
2100 2105 2110
Gly Cys Arg Arg Cys Gln Cys Pro Gly Gly Arg Cys Asp Pro His Thr
2115 2120 2125
Gly Arg Cys Asn Cys Pro Pro Gly Leu Ser Gly Glu Arg Cys Asp Thr
2130 2135 2140
Cys Ser Gln Gln His Gln Val Pro Val Pro Gly Gly Pro Val Gly His
2145 2150 2155 2160
Ser Ile His Cys Glu Val Cys Asp His Cys Val Val Leu Leu Leu Asp
2165 2170 2175
Asp Leu Glu Arg Ala Gly Ala Leu Leu Pro Ala Ile His Glu Gln Leu
2180 2185 2190
Arg Gly Ile Asn Ala Ser Ser Met Ala Trp Ala Arg Leu His Arg Leu
2195 2200 2205
Asn Ala Ser Ile Ala Asp Leu Gln Ser Gln Leu Arg Ser Pro Leu Gly
2210 2215 2220
Pro Arg His Glu Thr Ala Gln Gln Leu Glu Val Leu Glu Gln Gln Ser
2225 2230 2235 2240
Thr Ser Leu Gly Gln Asp Ala Arg Arg Leu Gly Gly Gln Ala Val Gly
2245 2250 2255
Thr Arg Asp Gln Ala Ser Gln Leu Leu Ala Gly Thr Glu Ala Thr Leu
2260 2265 2270
Gly His Ala Lys Thr Leu Leu Ala Ala Ile Arg Ala Val Asp Arg Thr
2275 2280 2285
Leu Ser Glu Leu Met Ser Gln Thr Gly His Leu Gly Leu Ala Asn Ala
2290 2295 2300
Ser Ala Pro Ser Gly Glu Gln Leu Leu Arg Thr Leu Ala Glu Val Glu
2305 2310 2315 2320
Arg Leu Leu Trp Glu Met Arg Ala Arg Asp Leu Gly Ala Pro Gln Ala
2325 2330 2335
Ala Ala Glu Ala Glu Leu Ala Ala Ala Gln Arg Leu Leu Ala Arg Val
2340 2345 2350
Gln Glu Gln Leu Ser Ser Leu Trp Glu Glu Asn Gln Ala Leu Ala Thr
2355 2360 2365
Gln Thr Arg Asp Arg Leu Ala Gln His Glu Ala Gly Leu Met Asp Leu
2370 2375 2380
Arg Glu Ala Leu Asn Arg Ala Val Asp Ala Thr Arg Glu Ala Gln Glu
2385 2390 2395 2400
Leu Asn Ser Arg Asn Gln Glu Arg Leu Glu Glu Ala Leu Gln Arg Lys
2405 2410 2415
Gln Glu Leu Ser Arg Asp Asn Ala Thr Leu Gln Ala Thr Leu His Ala
2420 2425 2430
Ala Arg Asp Thr Leu Ala Ser Val Phe Arg Leu Leu His Ser Leu Asp
2435 2440 2445
Gln Ala Lys Glu Glu Leu Glu Arg Leu Ala Ala Ser Leu Asp Gly Ala
2450 2455 2460
Arg Thr Pro Leu Leu Gln Arg Met Gln Thr Phe Ser Pro Ala Gly Ser
2465 2470 2475 2480
Lys Leu Arg Leu Val Glu Ala Ala Glu Ala His Ala Gln Gln Leu Gly
2485 2490 2495
Gln Leu Ala Leu Asn Leu Ser Ser Ile Ile Leu Asp Val Asn Gln Asp
2500 2505 2510
Arg Leu Thr Gln Arg Ala Ile Glu Ala Ser Asn Ala Tyr Ser Arg Ile
2515 2520 2525
Leu Gln Ala Val Gln Ala Ala Glu Asp Ala Ala Gly Gln Ala Leu Gln
2530 2535 2540
Gln Ala Asp His Thr Trp Ala Thr Val Val Arg Gln Gly Leu Val Asp
2545 2550 2555 2560
Arg Ala Gln Gln Leu Leu Ala Asn Ser Thr Ala Leu Glu Glu Ala Met
2565 2570 2575
Leu Gln Glu Gln Gln Arg Leu Gly Leu Val Trp Ala Ala Leu Gln Gly
2580 2585 2590
Ala Arg Thr Gln Leu Arg Asp Val Arg Ala Lys Lys Asp Gln Leu Glu
2595 2600 2605
Ala His Ile Gln Ala Ala Gln Ala Met Leu Ala Met Asp Thr Asp Glu
2610 2615 2620
Thr Ser Lys Lys Ile Ala His Ala Lys Ala Val Ala Ala Glu Ala Gln
2625 2630 2635 2640
Asp Thr Ala Thr Arg Val Gln Ser Gln Leu Gln Ala Met Gln Glu Asn
2645 2650 2655
Val Glu Arg Trp Gln Gly Gln Tyr Glu Gly Leu Arg Gly Gln Asp Leu
2660 2665 2670
Gly Gln Ala Val Leu Asp Ala Gly His Ser Val Ser Thr Leu Glu Lys
2675 2680 2685
Thr Leu Pro Gln Leu Leu Ala Lys Leu Ser Ile Leu Glu Asn Arg Gly
2690 2695 2700
Val His Asn Ala Ser Leu Ala Leu Ser Ala Ser Ile Gly Arg Val Arg
2705 2710 2715 2720
Glu Leu Ile Ala Gln Ala Arg Gly Ala Ala Ser Lys Val Lys Val Pro
2725 2730 2735
Met Lys Phe Asn Gly Arg Ser Gly Val Gln Leu Arg Thr Pro Arg Asp
2740 2745 2750
Leu Ala Asp Leu Ala Ala Tyr Thr Ala Leu Lys Phe Tyr Leu Gln Gly
2755 2760 2765
Pro Glu Pro Glu Pro Gly Gln Gly Thr Glu Asp Arg Phe Val Met Tyr
2770 2775 2780
Met Gly Ser Arg Gln Ala Thr Gly Asp Tyr Met Gly Val Ser Leu Arg
2785 2790 2795 2800
Asp Lys Lys Val His Trp Val Tyr Gln Leu Gly Glu Ala Gly Pro Ala
2805 2810 2815
Val Leu Ser Ile Asp Glu Asp Ile Gly Glu Gln Phe Ala Ala Val Ser
2820 2825 2830
Leu Asp Arg Thr Leu Gln Phe Gly His Met Ser Val Thr Val Glu Arg
2835 2840 2845
Gln Met Ile Gln Glu Thr Lys Gly Asp Thr Val Ala Pro Gly Ala Glu
2850 2855 2860
Gly Leu Leu Asn Leu Arg Pro Asp Asp Phe Val Phe Tyr Val Gly Gly
2865 2870 2875 2880
Tyr Pro Ser Thr Phe Thr Pro Pro Pro Leu Leu Arg Phe Pro Gly Tyr
2885 2890 2895
Arg Gly Cys Ile Glu Met Asp Thr Leu Asn Glu Glu Val Val Ser Leu
2900 2905 2910
Tyr Asn Phe Glu Arg Thr Phe Gln Leu Asp Thr Ala Val Asp Arg Pro
2915 2920 2925
Cys Ala Arg Ser Lys Ser Thr Gly Asp Pro Trp Leu Thr Asp Gly Ser
2930 2935 2940
Tyr Leu Asp Gly Thr Gly Phe Ala Arg Ile Ser Phe Asp Ser Gln Ile
2945 2950 2955 2960
Ser Thr Thr Lys Arg Phe Glu Gln Glu Leu Arg Leu Val Ser Tyr Ser
2965 2970 2975
Gly Val Leu Phe Phe Leu Lys Gln Gln Ser Gln Phe Leu Cys Leu Ala
2980 2985 2990
Val Gln Glu Gly Ser Leu Val Leu Leu Tyr Asp Phe Gly Ala Gly Leu
2995 3000 3005
Lys Lys Ala Val Pro Leu Gln Pro Pro Pro Pro Leu Thr Ser Ala Ser
3010 3015 3020
Lys Ala Ile Gln Val Phe Leu Leu Gly Gly Ser Arg Lys Arg Val Leu
3025 3030 3035 3040
Val Arg Val Glu Arg Ala Thr Val Tyr Ser Val Glu Gln Asp Asn Asp
3045 3050 3055
Leu Glu Leu Ala Asp Ala Tyr Tyr Leu Gly Gly Val Pro Pro Asp Gln
3060 3065 3070
Leu Pro Pro Ser Leu Arg Arg Leu Phe Pro Thr Gly Gly Ser Val Arg
3075 3080 3085
Gly Cys Val Lys Gly Ile Lys Ala Leu Gly Lys Tyr Val Asp Leu Lys
3090 3095 3100
Arg Leu Asn Thr Thr Gly Val Ser Ala Gly Cys Thr Ala Asp Leu Leu
3105 3110 3115 3120
Val Gly Arg Ala Met Thr Phe His Gly His Gly Phe Leu Arg Leu Ala
3125 3130 3135
Leu Ser Asn Val Ala Pro Leu Thr Gly Asn Val Tyr Ser Gly Phe Gly
3140 3145 3150
Phe His Ser Ala Gln Asp Ser Ala Leu Leu Tyr Tyr Arg Ala Ser Pro
3155 3160 3165
Asp Gly Leu Cys Gln Val Ser Leu Gln Gln Gly Arg Val Ser Leu Gln
3170 3175 3180
Leu Leu Arg Thr Glu Val Lys Thr Gln Ala Gly Phe Ala Asp Gly Ala
3185 3190 3195 3200
Pro His Tyr Val Ala Phe Tyr Ser Asn Ala Thr Gly Val Trp Leu Tyr
3205 3210 3215
Val Asp Asp Gln Leu Gln Gln Met Lys Pro His Arg Gly Pro Pro Pro
3220 3225 3230
Glu Leu Gln Pro Gln Pro Glu Gly Pro Pro Arg Leu Leu Leu Gly Gly
3235 3240 3245
Leu Pro Glu Ser Gly Thr Ile Tyr Asn Phe Ser Gly Cys Ile Ser Asn
3250 3255 3260
Val Phe Val Gln Arg Leu Leu Gly Pro Gln Arg Val Phe Asp Leu Gln
3265 3270 3275 3280
Gln Asn Leu Gly Ser Val Asn Val Ser Thr Gly Cys Ala Pro Ala Leu
3285 3290 3295
Gln Ala Gln Thr Pro Gly Leu Gly Pro Arg Gly Leu Gln Ala Thr Ala
3300 3305 3310
Arg Lys Ala Ser Arg Arg Ser Arg Gln Pro Ala Arg His Pro Ala Cys
3315 3320 3325
Met Leu Pro Pro His Leu Arg Thr Thr Arg Asp Ser Tyr Gln Phe Gly
3330 3335 3340
Gly Ser Leu Ser Ser His Leu Glu Phe Val Gly Ile Leu Ala Arg His
3345 3350 3355 3360
Arg Asn Trp Pro Ser Leu Ser Met His Val Leu Pro Arg Ser Ser Arg
3365 3370 3375
Gly Leu Leu Leu Phe Thr Ala Arg Leu Arg Pro Gly Ser Pro Ser Leu
3380 3385 3390
Ala Leu Phe Leu Ser Asn Gly His Phe Val Ala Gln Met Glu Gly Leu
3395 3400 3405
Gly Thr Arg Leu Arg Ala Gln Ser Arg Gln Arg Ser Arg Pro Gly Arg
3410 3415 3420
Trp His Lys Val Ser Val Arg Trp Glu Lys Asn Arg Ile Leu Leu Val
3425 3430 3435 3440
Thr Asp Gly Ala Arg Ala Trp Ser Gln Glu Gly Pro His Arg Gln His
3445 3450 3455
Gln Gly Ala Glu His Pro Gln Pro His Thr Leu Phe Val Gly Gly Leu
3460 3465 3470
Pro Ala Ser Ser His Ser Ser Lys Leu Pro Val Thr Val Gly Phe Ser
3475 3480 3485
Gly Cys Val Lys Arg Leu Arg Leu His Gly Arg Pro Leu Gly Ala Pro
3490 3495 3500
Thr Arg Met Ala Gly Val Thr Pro Cys Ile Leu Gly Pro Leu Glu Ala
3505 3510 3515 3520
Gly Leu Phe Phe Pro Gly Ser Gly Gly Val Ile Thr Leu Asp Leu Pro
3525 3530 3535
Gly Ala Thr Leu Pro Asp Val Gly Leu Glu Leu Glu Val Arg Pro Leu
3540 3545 3550
Ala Val Thr Gly Leu Ile Phe His Leu Gly Gln Ala Arg Thr Pro Pro
3555 3560 3565
Tyr Leu Gln Leu Gln Val Thr Glu Lys Gln Val Leu Leu Arg Ala Asp
3570 3575 3580
Asp Gly Ala Gly Glu Phe Ser Thr Ser Val Thr Arg Pro Ser Val Leu
3585 3590 3595 3600
Cys Asp Gly Gln Trp His Arg Leu Ala Val Met Lys Ser Gly Asn Val
3605 3610 3615
Leu Arg Leu Glu Val Asp Ala Gln Ser Asn His Thr Val Gly Pro Leu
3620 3625 3630
Leu Ala Ala Ala Ala Gly Ala Pro Ala Pro Leu Tyr Leu Gly Gly Leu
3635 3640 3645
Pro Glu Pro Met Ala Val Gln Pro Trp Pro Pro Ala Tyr Cys Gly Cys
3650 3655 3660
Met Arg Arg Leu Ala Val Asn Arg Ser Pro Val Ala Met Thr Arg Ser
3665 3670 3675 3680
Val Glu Val His Gly Ala Val Gly Ala Ser Gly Cys Pro Ala Ala
3685 3690 3695
<210> 128
<211> 1786
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность ламинина субъединицы
бета-1 (Человек разумный)
<400> 128
Met Gly Leu Leu Gln Leu Leu Ala Phe Ser Phe Leu Ala Leu Cys Arg
1 5 10 15
Ala Arg Val Arg Ala Gln Glu Pro Glu Phe Ser Tyr Gly Cys Ala Glu
20 25 30
Gly Ser Cys Tyr Pro Ala Thr Gly Asp Leu Leu Ile Gly Arg Ala Gln
35 40 45
Lys Leu Ser Val Thr Ser Thr Cys Gly Leu His Lys Pro Glu Pro Tyr
50 55 60
Cys Ile Val Ser His Leu Gln Glu Asp Lys Lys Cys Phe Ile Cys Asn
65 70 75 80
Ser Gln Asp Pro Tyr His Glu Thr Leu Asn Pro Asp Ser His Leu Ile
85 90 95
Glu Asn Val Val Thr Thr Phe Ala Pro Asn Arg Leu Lys Ile Trp Trp
100 105 110
Gln Ser Glu Asn Gly Val Glu Asn Val Thr Ile Gln Leu Asp Leu Glu
115 120 125
Ala Glu Phe His Phe Thr His Leu Ile Met Thr Phe Lys Thr Phe Arg
130 135 140
Pro Ala Ala Met Leu Ile Glu Arg Ser Ser Asp Phe Gly Lys Thr Trp
145 150 155 160
Gly Val Tyr Arg Tyr Phe Ala Tyr Asp Cys Glu Ala Ser Phe Pro Gly
165 170 175
Ile Ser Thr Gly Pro Met Lys Lys Val Asp Asp Ile Ile Cys Asp Ser
180 185 190
Arg Tyr Ser Asp Ile Glu Pro Ser Thr Glu Gly Glu Val Ile Phe Arg
195 200 205
Ala Leu Asp Pro Ala Phe Lys Ile Glu Asp Pro Tyr Ser Pro Arg Ile
210 215 220
Gln Asn Leu Leu Lys Ile Thr Asn Leu Arg Ile Lys Phe Val Lys Leu
225 230 235 240
His Thr Leu Gly Asp Asn Leu Leu Asp Ser Arg Met Glu Ile Arg Glu
245 250 255
Lys Tyr Tyr Tyr Ala Val Tyr Asp Met Val Val Arg Gly Asn Cys Phe
260 265 270
Cys Tyr Gly His Ala Ser Glu Cys Ala Pro Val Asp Gly Phe Asn Glu
275 280 285
Glu Val Glu Gly Met Val His Gly His Cys Met Cys Arg His Asn Thr
290 295 300
Lys Gly Leu Asn Cys Glu Leu Cys Met Asp Phe Tyr His Asp Leu Pro
305 310 315 320
Trp Arg Pro Ala Glu Gly Arg Asn Ser Asn Ala Cys Lys Lys Cys Asn
325 330 335
Cys Asn Glu His Ser Ile Ser Cys His Phe Asp Met Ala Val Tyr Leu
340 345 350
Ala Thr Gly Asn Val Ser Gly Gly Val Cys Asp Asp Cys Gln His Asn
355 360 365
Thr Met Gly Arg Asn Cys Glu Gln Cys Lys Pro Phe Tyr Tyr Gln His
370 375 380
Pro Glu Arg Asp Ile Arg Asp Pro Asn Phe Cys Glu Arg Cys Thr Cys
385 390 395 400
Asp Pro Ala Gly Ser Gln Asn Glu Gly Ile Cys Asp Ser Tyr Thr Asp
405 410 415
Phe Ser Thr Gly Leu Ile Ala Gly Gln Cys Arg Cys Lys Leu Asn Val
420 425 430
Glu Gly Glu His Cys Asp Val Cys Lys Glu Gly Phe Tyr Asp Leu Ser
435 440 445
Ser Glu Asp Pro Phe Gly Cys Lys Ser Cys Ala Cys Asn Pro Leu Gly
450 455 460
Thr Ile Pro Gly Gly Asn Pro Cys Asp Ser Glu Thr Gly His Cys Tyr
465 470 475 480
Cys Lys Arg Leu Val Thr Gly Gln His Cys Asp Gln Cys Leu Pro Glu
485 490 495
His Trp Gly Leu Ser Asn Asp Leu Asp Gly Cys Arg Pro Cys Asp Cys
500 505 510
Asp Leu Gly Gly Ala Leu Asn Asn Ser Cys Phe Ala Glu Ser Gly Gln
515 520 525
Cys Ser Cys Arg Pro His Met Ile Gly Arg Gln Cys Asn Glu Val Glu
530 535 540
Pro Gly Tyr Tyr Phe Ala Thr Leu Asp His Tyr Leu Tyr Glu Ala Glu
545 550 555 560
Glu Ala Asn Leu Gly Pro Gly Val Ser Ile Val Glu Arg Gln Tyr Ile
565 570 575
Gln Asp Arg Ile Pro Ser Trp Thr Gly Ala Gly Phe Val Arg Val Pro
580 585 590
Glu Gly Ala Tyr Leu Glu Phe Phe Ile Asp Asn Ile Pro Tyr Ser Met
595 600 605
Glu Tyr Asp Ile Leu Ile Arg Tyr Glu Pro Gln Leu Pro Asp His Trp
610 615 620
Glu Lys Ala Val Ile Thr Val Gln Arg Pro Gly Arg Ile Pro Thr Ser
625 630 635 640
Ser Arg Cys Gly Asn Thr Ile Pro Asp Asp Asp Asn Gln Val Val Ser
645 650 655
Leu Ser Pro Gly Ser Arg Tyr Val Val Leu Pro Arg Pro Val Cys Phe
660 665 670
Glu Lys Gly Thr Asn Tyr Thr Val Arg Leu Glu Leu Pro Gln Tyr Thr
675 680 685
Ser Ser Asp Ser Asp Val Glu Ser Pro Tyr Thr Leu Ile Asp Ser Leu
690 695 700
Val Leu Met Pro Tyr Cys Lys Ser Leu Asp Ile Phe Thr Val Gly Gly
705 710 715 720
Ser Gly Asp Gly Val Val Thr Asn Ser Ala Trp Glu Thr Phe Gln Arg
725 730 735
Tyr Arg Cys Leu Glu Asn Ser Arg Ser Val Val Lys Thr Pro Met Thr
740 745 750
Asp Val Cys Arg Asn Ile Ile Phe Ser Ile Ser Ala Leu Leu His Gln
755 760 765
Thr Gly Leu Ala Cys Glu Cys Asp Pro Gln Gly Ser Leu Ser Ser Val
770 775 780
Cys Asp Pro Asn Gly Gly Gln Cys Gln Cys Arg Pro Asn Val Val Gly
785 790 795 800
Arg Thr Cys Asn Arg Cys Ala Pro Gly Thr Phe Gly Phe Gly Pro Ser
805 810 815
Gly Cys Lys Pro Cys Glu Cys His Leu Gln Gly Ser Val Asn Ala Phe
820 825 830
Cys Asn Pro Val Thr Gly Gln Cys His Cys Phe Gln Gly Val Tyr Ala
835 840 845
Arg Gln Cys Asp Arg Cys Leu Pro Gly His Trp Gly Phe Pro Ser Cys
850 855 860
Gln Pro Cys Gln Cys Asn Gly His Ala Asp Asp Cys Asp Pro Val Thr
865 870 875 880
Gly Glu Cys Leu Asn Cys Gln Asp Tyr Thr Met Gly His Asn Cys Glu
885 890 895
Arg Cys Leu Ala Gly Tyr Tyr Gly Asp Pro Ile Ile Gly Ser Gly Asp
900 905 910
His Cys Arg Pro Cys Pro Cys Pro Asp Gly Pro Asp Ser Gly Arg Gln
915 920 925
Phe Ala Arg Ser Cys Tyr Gln Asp Pro Val Thr Leu Gln Leu Ala Cys
930 935 940
Val Cys Asp Pro Gly Tyr Ile Gly Ser Arg Cys Asp Asp Cys Ala Ser
945 950 955 960
Gly Tyr Phe Gly Asn Pro Ser Glu Val Gly Gly Ser Cys Gln Pro Cys
965 970 975
Gln Cys His Asn Asn Ile Asp Thr Thr Asp Pro Glu Ala Cys Asp Lys
980 985 990
Glu Thr Gly Arg Cys Leu Lys Cys Leu Tyr His Thr Glu Gly Glu His
995 1000 1005
Cys Gln Phe Cys Arg Phe Gly Tyr Tyr Gly Asp Ala Leu Gln Gln Asp
1010 1015 1020
Cys Arg Lys Cys Val Cys Asn Tyr Leu Gly Thr Val Gln Glu His Cys
1025 1030 1035 1040
Asn Gly Ser Asp Cys Gln Cys Asp Lys Ala Thr Gly Gln Cys Leu Cys
1045 1050 1055
Leu Pro Asn Val Ile Gly Gln Asn Cys Asp Arg Cys Ala Pro Asn Thr
1060 1065 1070
Trp Gln Leu Ala Ser Gly Thr Gly Cys Asp Pro Cys Asn Cys Asn Ala
1075 1080 1085
Ala His Ser Phe Gly Pro Ser Cys Asn Glu Phe Thr Gly Gln Cys Gln
1090 1095 1100
Cys Met Pro Gly Phe Gly Gly Arg Thr Cys Ser Glu Cys Gln Glu Leu
1105 1110 1115 1120
Phe Trp Gly Asp Pro Asp Val Glu Cys Arg Ala Cys Asp Cys Asp Pro
1125 1130 1135
Arg Gly Ile Glu Thr Pro Gln Cys Asp Gln Ser Thr Gly Gln Cys Val
1140 1145 1150
Cys Val Glu Gly Val Glu Gly Pro Arg Cys Asp Lys Cys Thr Arg Gly
1155 1160 1165
Tyr Ser Gly Val Phe Pro Asp Cys Thr Pro Cys His Gln Cys Phe Ala
1170 1175 1180
Leu Trp Asp Val Ile Ile Ala Glu Leu Thr Asn Arg Thr His Arg Phe
1185 1190 1195 1200
Leu Glu Lys Ala Lys Ala Leu Lys Ile Ser Gly Val Ile Gly Pro Tyr
1205 1210 1215
Arg Glu Thr Val Asp Ser Val Glu Arg Lys Val Ser Glu Ile Lys Asp
1220 1225 1230
Ile Leu Ala Gln Ser Pro Ala Ala Glu Pro Leu Lys Asn Ile Gly Asn
1235 1240 1245
Leu Phe Glu Glu Ala Glu Lys Leu Ile Lys Asp Val Thr Glu Met Met
1250 1255 1260
Ala Gln Val Glu Val Lys Leu Ser Asp Thr Thr Ser Gln Ser Asn Ser
1265 1270 1275 1280
Thr Ala Lys Glu Leu Asp Ser Leu Gln Thr Glu Ala Glu Ser Leu Asp
1285 1290 1295
Asn Thr Val Lys Glu Leu Ala Glu Gln Leu Glu Phe Ile Lys Asn Ser
1300 1305 1310
Asp Ile Arg Gly Ala Leu Asp Ser Ile Thr Lys Tyr Phe Gln Met Ser
1315 1320 1325
Leu Glu Ala Glu Glu Arg Val Asn Ala Ser Thr Thr Glu Pro Asn Ser
1330 1335 1340
Thr Val Glu Gln Ser Ala Leu Met Arg Asp Arg Val Glu Asp Val Met
1345 1350 1355 1360
Met Glu Arg Glu Ser Gln Phe Lys Glu Lys Gln Glu Glu Gln Ala Arg
1365 1370 1375
Leu Leu Asp Glu Leu Ala Gly Lys Leu Gln Ser Leu Asp Leu Ser Ala
1380 1385 1390
Ala Ala Glu Met Thr Cys Gly Thr Pro Pro Gly Ala Ser Cys Ser Glu
1395 1400 1405
Thr Glu Cys Gly Gly Pro Asn Cys Arg Thr Asp Glu Gly Glu Arg Lys
1410 1415 1420
Cys Gly Gly Pro Gly Cys Gly Gly Leu Val Thr Val Ala His Asn Ala
1425 1430 1435 1440
Trp Gln Lys Ala Met Asp Leu Asp Gln Asp Val Leu Ser Ala Leu Ala
1445 1450 1455
Glu Val Glu Gln Leu Ser Lys Met Val Ser Glu Ala Lys Leu Arg Ala
1460 1465 1470
Asp Glu Ala Lys Gln Ser Ala Glu Asp Ile Leu Leu Lys Thr Asn Ala
1475 1480 1485
Thr Lys Glu Lys Met Asp Lys Ser Asn Glu Glu Leu Arg Asn Leu Ile
1490 1495 1500
Lys Gln Ile Arg Asn Phe Leu Thr Gln Asp Ser Ala Asp Leu Asp Ser
1505 1510 1515 1520
Ile Glu Ala Val Ala Asn Glu Val Leu Lys Met Glu Met Pro Ser Thr
1525 1530 1535
Pro Gln Gln Leu Gln Asn Leu Thr Glu Asp Ile Arg Glu Arg Val Glu
1540 1545 1550
Ser Leu Ser Gln Val Glu Val Ile Leu Gln His Ser Ala Ala Asp Ile
1555 1560 1565
Ala Arg Ala Glu Met Leu Leu Glu Glu Ala Lys Arg Ala Ser Lys Ser
1570 1575 1580
Ala Thr Asp Val Lys Val Thr Ala Asp Met Val Lys Glu Ala Leu Glu
1585 1590 1595 1600
Glu Ala Glu Lys Ala Gln Val Ala Ala Glu Lys Ala Ile Lys Gln Ala
1605 1610 1615
Asp Glu Asp Ile Gln Gly Thr Gln Asn Leu Leu Thr Ser Ile Glu Ser
1620 1625 1630
Glu Thr Ala Ala Ser Glu Glu Thr Leu Phe Asn Ala Ser Gln Arg Ile
1635 1640 1645
Ser Glu Leu Glu Arg Asn Val Glu Glu Leu Lys Arg Lys Ala Ala Gln
1650 1655 1660
Asn Ser Gly Glu Ala Glu Tyr Ile Glu Lys Val Val Tyr Thr Val Lys
1665 1670 1675 1680
Gln Ser Ala Glu Asp Val Lys Lys Thr Leu Asp Gly Glu Leu Asp Glu
1685 1690 1695
Lys Tyr Lys Lys Val Glu Asn Leu Ile Ala Lys Lys Thr Glu Glu Ser
1700 1705 1710
Ala Asp Ala Arg Arg Lys Ala Glu Met Leu Gln Asn Glu Ala Lys Thr
1715 1720 1725
Leu Leu Ala Gln Ala Asn Ser Lys Leu Gln Leu Leu Lys Asp Leu Glu
1730 1735 1740
Arg Lys Tyr Glu Asp Asn Gln Arg Tyr Leu Glu Asp Lys Ala Gln Glu
1745 1750 1755 1760
Leu Ala Arg Leu Glu Gly Glu Val Arg Ser Leu Leu Lys Asp Ile Ser
1765 1770 1775
Gln Lys Val Ala Val Tyr Ser Thr Cys Leu
1780 1785
<210> 129
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для scFv VH
<400> 129
agagagtgta cactcccagg cggccgaggt gcag 34
<210> 130
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер для scFv VH
<400> 130
cgccgctggg cccttggtgg aggctgagct cacggtgacc ag 42
<210> 131
<211> 89
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для scFv VL
<400> 131
aagcggccgc caccatggga tggagctgta tcatcctctt cttggtagca acagctacag 60
gtgtacactc ccagtctgtg ctgactcag 89
<210> 132
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер для scFv VL
<400> 132
cgccgccgta cgtaggaccg tcagcttggt 30
<210> 133
<211> 29
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Эпитоп F1 N3
<400> 133
Met Ala Ala Val Gln Ala Ala Glu Val Lys Val Asp Gly Ser Glu Pro
1 5 10 15
Lys Leu Ser Lys Asn Glu Leu Lys Arg Arg Leu Lys Ala
20 25
<210> 134
<211> 30
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Эпитоп F2 N3
<400> 134
Gln Ala Ala Glu Val Lys Val Asp Gly Ser Glu Pro Lys Leu Ser Lys
1 5 10 15
Asn Glu Leu Lys Arg Arg Leu Lys Ala Glu Lys Lys Val Ala
20 25 30
<210> 135
<211> 29
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Эпитоп F3 N3
<400> 135
Lys Val Asp Gly Ser Glu Pro Lys Leu Ser Lys Asn Glu Leu Lys Arg
1 5 10 15
Arg Leu Lys Ala Glu Lys Lys Val Ala Glu Lys Glu Ala
20 25
<210> 136
<211> 28
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Эпитоп F4 N3
<400> 136
Glu Pro Lys Leu Ser Lys Asn Glu Leu Lys Arg Arg Leu Lys Ala Glu
1 5 10 15
Lys Lys Val Ala Glu Lys Glu Ala Lys Gln Lys Glu
20 25
<210> 137
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Эпитоп F5 N3
<400> 137
Lys Arg Arg Leu Lys Ala Glu Lys Lys Val Ala Glu Lys Glu Ala Lys
1 5 10 15
Gln Lys Glu Leu Ser Glu Lys Gln Leu Ser
20 25
<210> 138
<211> 28
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мышиный эпитоп F1 (mF1) N3
<400> 138
Met Ala Thr Leu Gln Glu Ser Glu Val Lys Val Asp Gly Glu Gln Lys
1 5 10 15
Leu Ser Lys Asn Glu Leu Lys Arg Arg Leu Lys Ala
20 25
<210> 139
<211> 29
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мышиный эпитоп F2 (mF2)N3
<400> 139
Gln Glu Ser Glu Val Lys Val Asp Gly Glu Gln Lys Leu Ser Lys Asn
1 5 10 15
Glu Leu Lys Arg Arg Leu Lys Ala Glu Lys Lys Leu Ala
20 25
<210> 140
<211> 28
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мышиный эпитоп F3 (mF3)N3
<400> 140
Lys Val Asp Gly Glu Gln Lys Leu Ser Lys Asn Glu Leu Lys Arg Arg
1 5 10 15
Leu Lys Ala Glu Lys Lys Leu Ala Glu Lys Glu Ala
20 25
<210> 141
<211> 27
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мышиный эпитоп F4 (mF4)N3
<400> 141
Gln Lys Leu Ser Lys Asn Glu Leu Lys Arg Arg Leu Lys Ala Glu Lys
1 5 10 15
Lys Leu Ala Glu Lys Glu Ala Lys Gln Lys Glu
20 25
<210> 142
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мышиный эпитоп F5 (mF5) N3
<400> 142
Arg Arg Leu Lys Ala Glu Lys Lys Leu Ala Glu Lys Glu Ala Lys Gln
1 5 10 15
Lys Glu Leu Ser Glu Lys Gln Leu Asn
20 25
<210> 143
<211> 28
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Крысиный эптоп F1 (rF1) N3
<400> 143
Met Ala Thr Leu Arg Glu Gly Glu Val Lys Leu Asp Gly Glu Pro Lys
1 5 10 15
Leu Ser Lys Asn Glu Leu Lys Arg Arg Leu Lys Ala
20 25
<210> 144
<211> 29
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Крысиный эпитоп F2 (rF2) N3
<400> 144
Arg Glu Gly Glu Val Lys Leu Asp Gly Glu Pro Lys Leu Ser Lys Asn
1 5 10 15
Glu Leu Lys Arg Arg Leu Lys Ala Glu Lys Lys Leu Ala
20 25
<210> 145
<211> 28
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Крысиный эпитоп F3 (rF3) N3
<400> 145
Lys Leu Asp Gly Glu Pro Lys Leu Ser Lys Asn Glu Leu Lys Arg Arg
1 5 10 15
Leu Lys Ala Glu Lys Lys Leu Ala Glu Lys Glu Ala
20 25
<210> 146
<211> 27
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Крысиный эпитоп F4 (rF4) N3
<400> 146
Pro Lys Leu Ser Lys Asn Glu Leu Lys Arg Arg Leu Lys Ala Glu Lys
1 5 10 15
Lys Leu Ala Glu Lys Glu Ala Lys Gln Lys Glu
20 25
<210> 147
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Крысиный эпитоп F5 (rF5) N3
<400> 147
Arg Arg Leu Lys Ala Glu Lys Lys Leu Ala Glu Lys Glu Ala Lys Gln
1 5 10 15
Lys Glu Leu Ser Glu Lys Gln Leu Asn
20 25
<210> 148
<211> 52
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Экспонированный на мембране N-конец лизил-тРНК
синтетазы (Человек разумный)
<400> 148
Met Ala Ala Val Gln Ala Ala Glu Val Lys Val Asp Gly Ser Glu Pro
1 5 10 15
Lys Leu Ser Lys Asn Glu Leu Lys Arg Arg Leu Lys Ala Glu Lys Lys
20 25 30
Val Ala Glu Lys Glu Ala Lys Gln Lys Glu Leu Ser Glu Lys Gln Leu
35 40 45
Ser Gln Ala Thr
50
<210> 149
<211> 48
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N-конец лизил-тРНК синтетазы (мышь)
<400> 149
Met Ala Thr Leu Gln Glu Ser Glu Val Lys Val Asp Gly Glu Gln Lys
1 5 10 15
Leu Ser Lys Asn Glu Leu Lys Arg Arg Leu Lys Ala Glu Lys Lys Leu
20 25 30
Ala Glu Lys Glu Ala Lys Gln Lys Glu Leu Ser Glu Lys Gln Leu Asn
35 40 45
<210> 150
<211> 48
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N-конец лизил-тРНК синтетазы (крыса)
<400> 150
Met Ala Thr Leu Arg Glu Gly Glu Val Lys Leu Asp Gly Glu Pro Lys
1 5 10 15
Leu Ser Lys Asn Glu Leu Lys Arg Arg Leu Lys Ala Glu Lys Lys Leu
20 25 30
Ala Glu Lys Glu Ala Lys Gln Lys Glu Leu Ser Glu Lys Gln Leu Asn
35 40 45
<210> 151
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная аминокислота 5 CDR H2
<400> 151
Val Ile Ser Ser Asp Gly Gly Asn Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 152
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутантная ДНК 5 CDR H2
<400> 152
gtgatctctt ctgatggtgg taatacatat tacgctgatt ctgtaaaagg t 51
<---

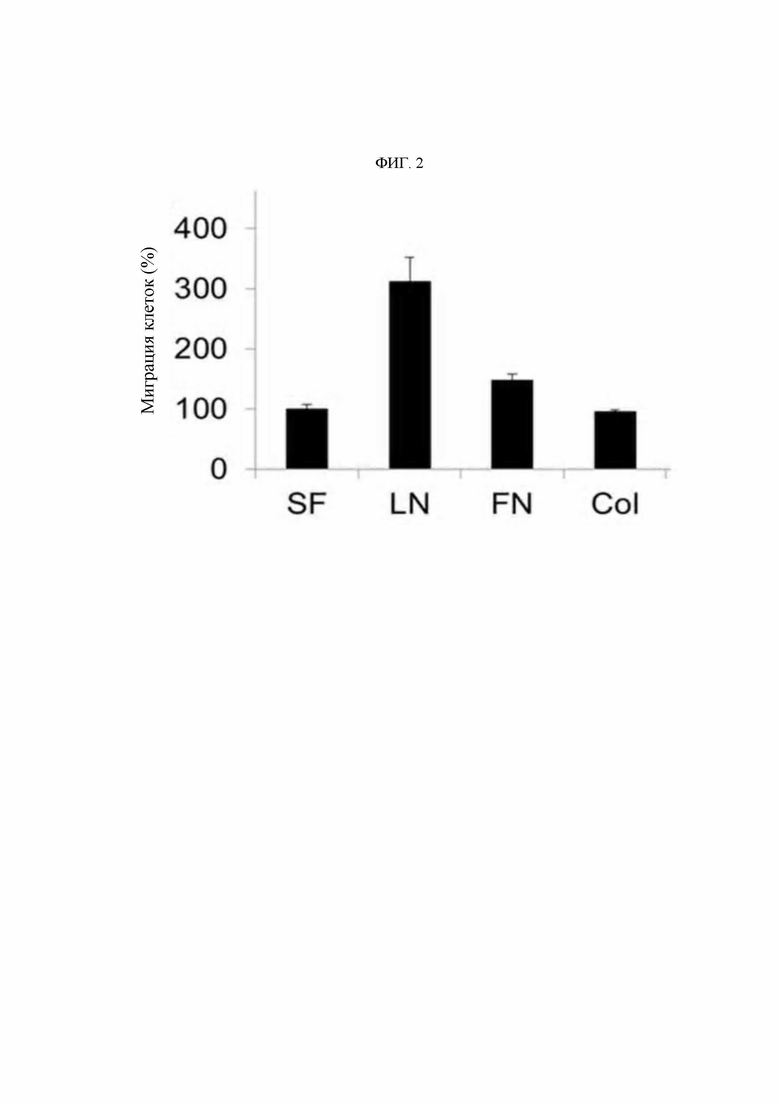
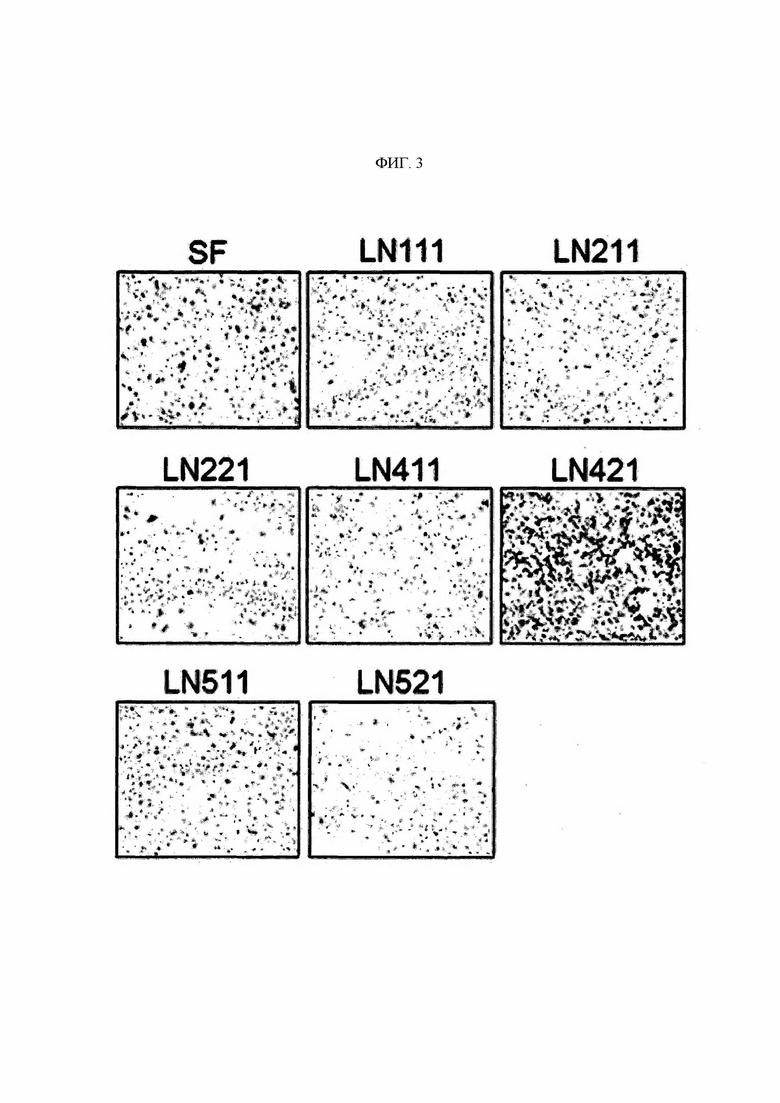
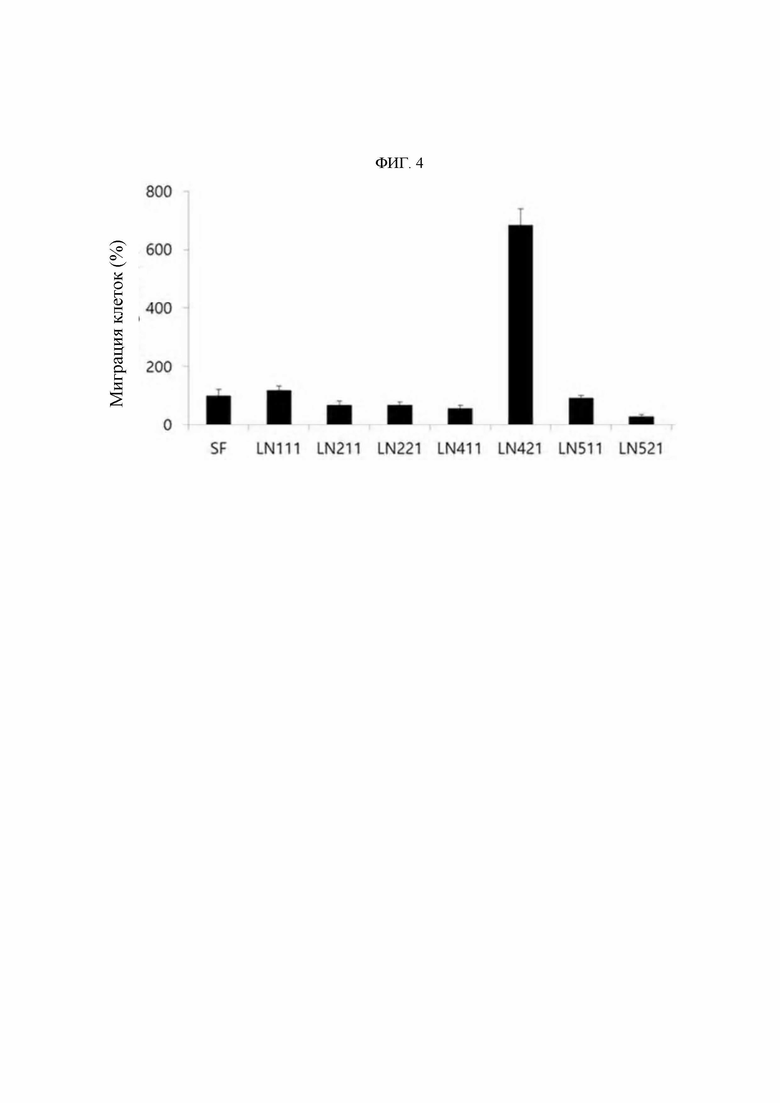
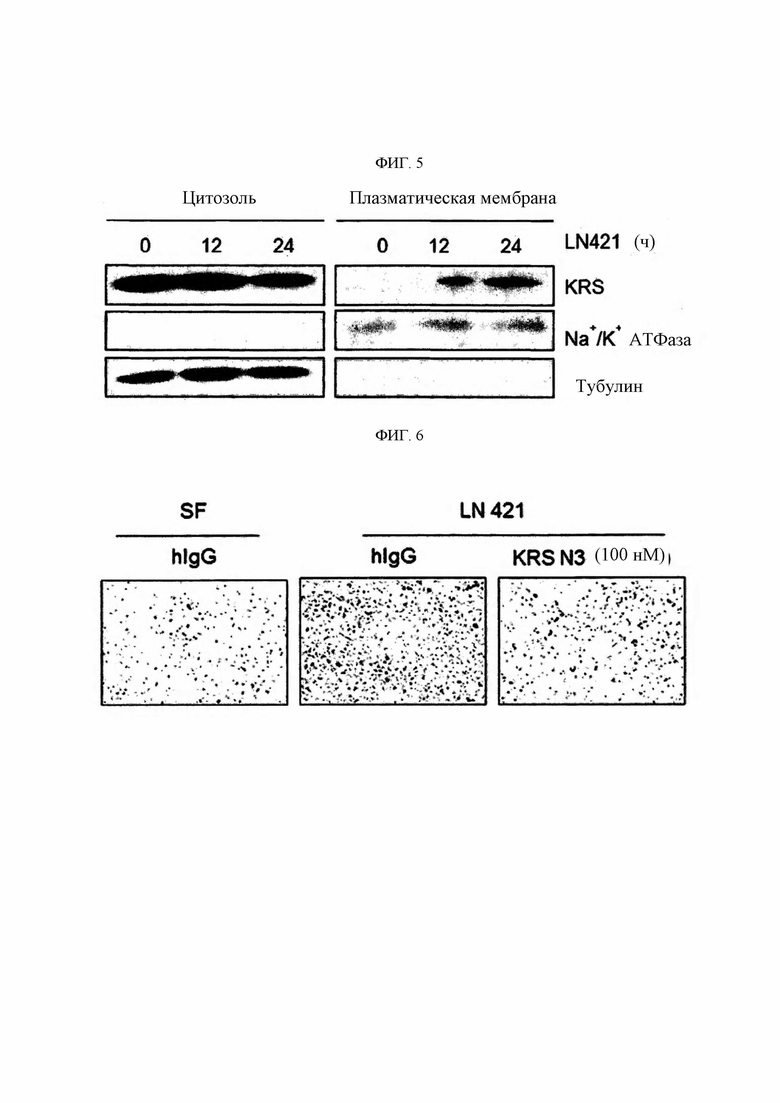
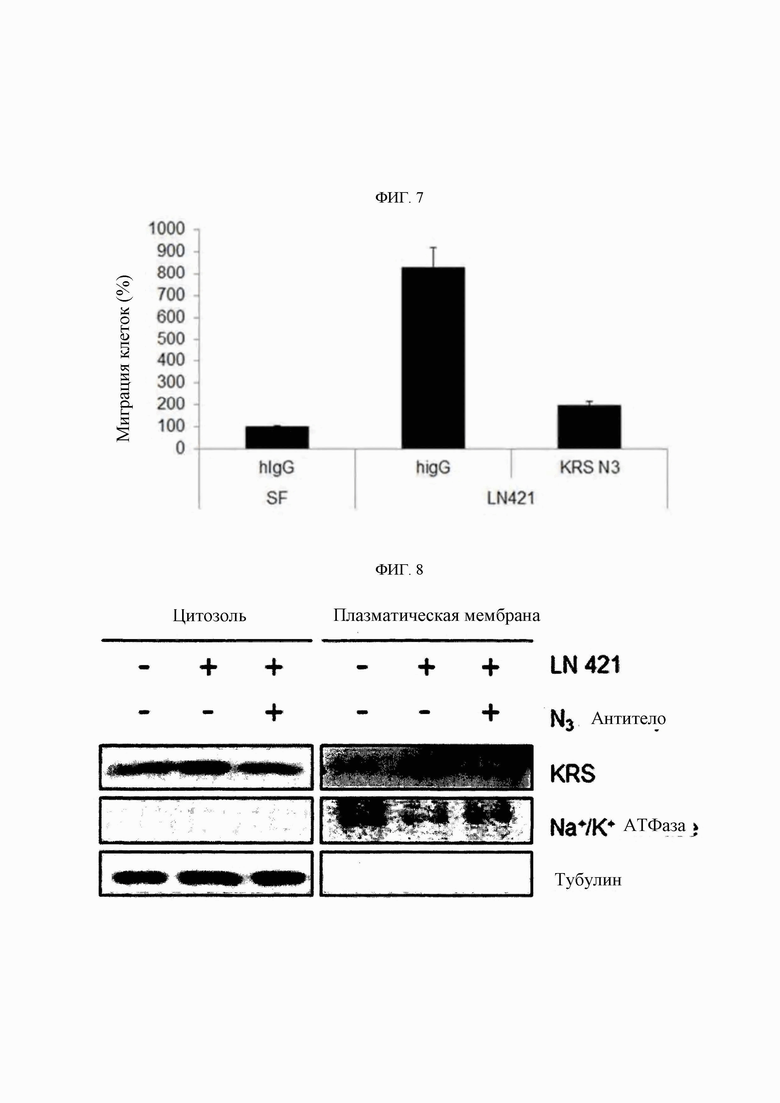

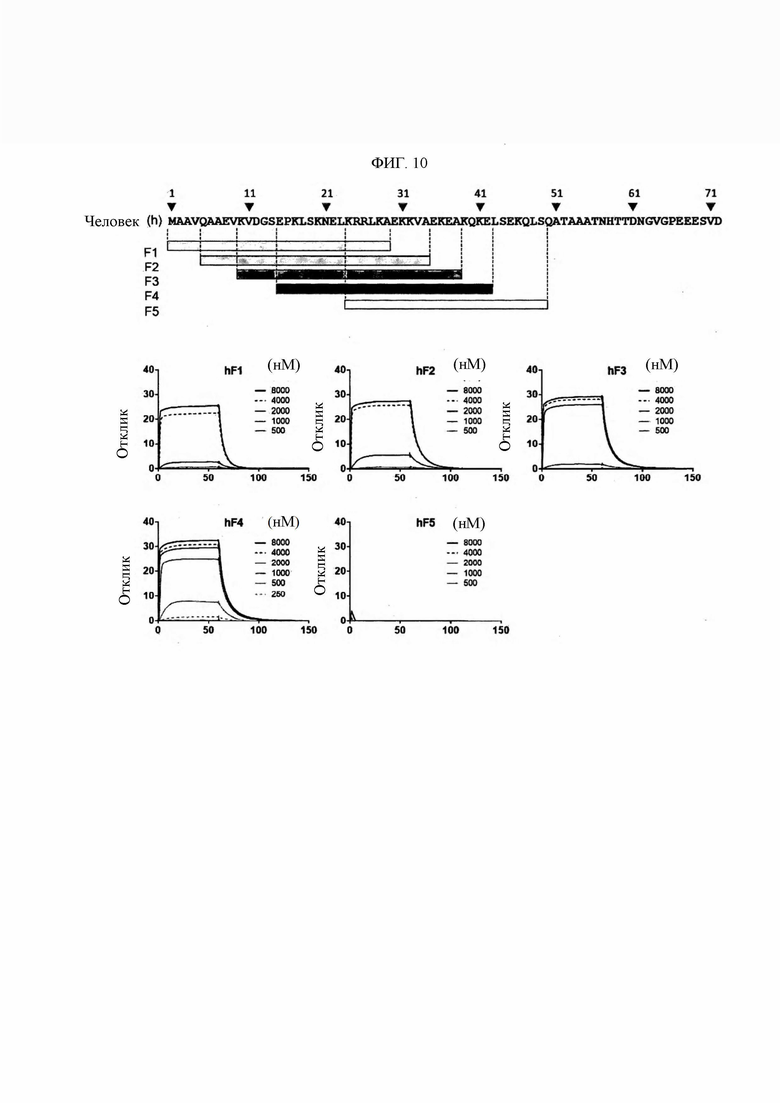
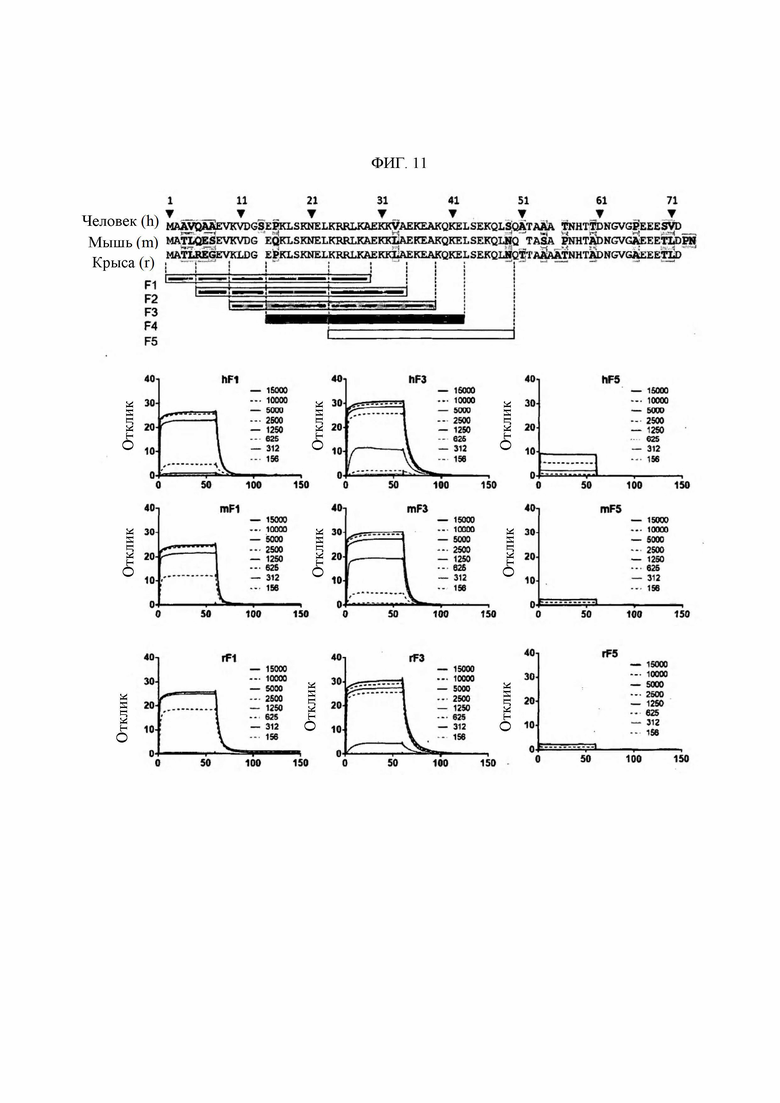
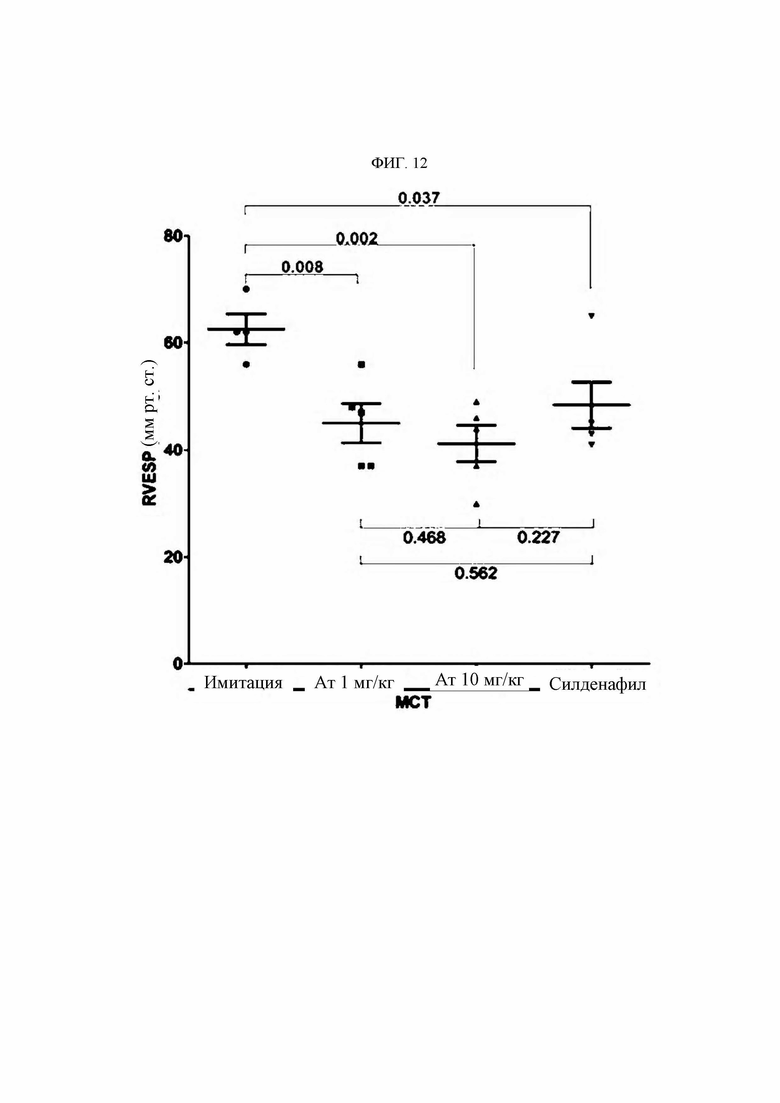
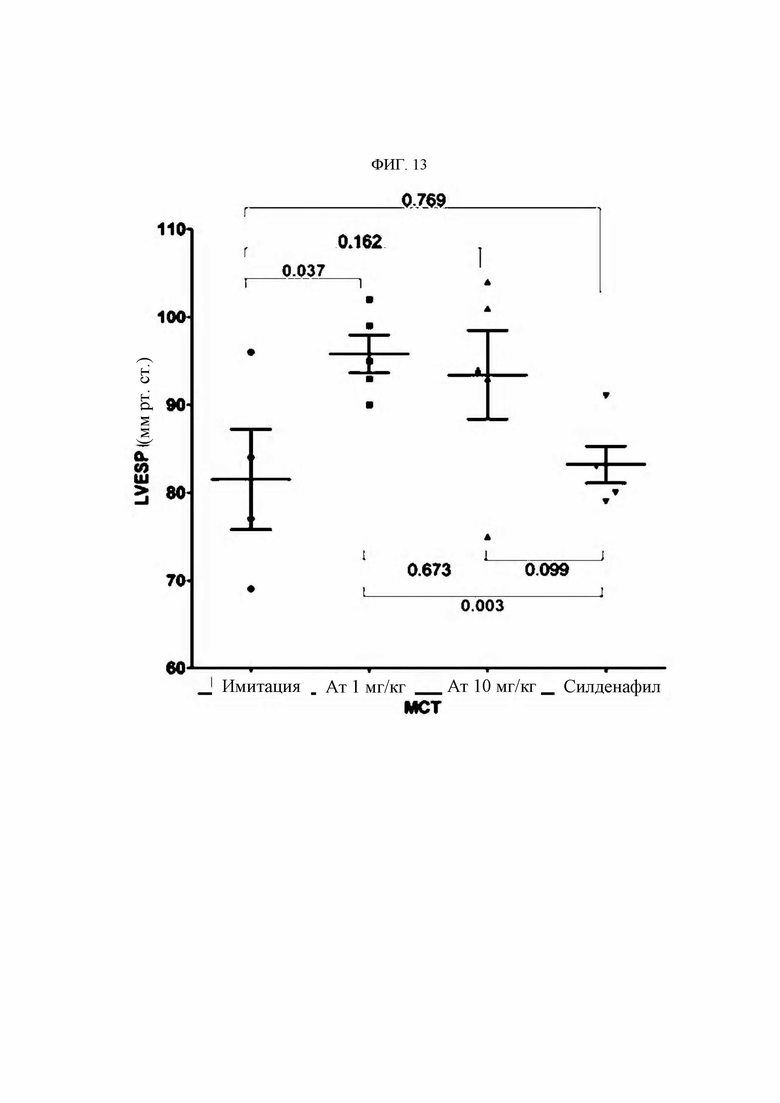

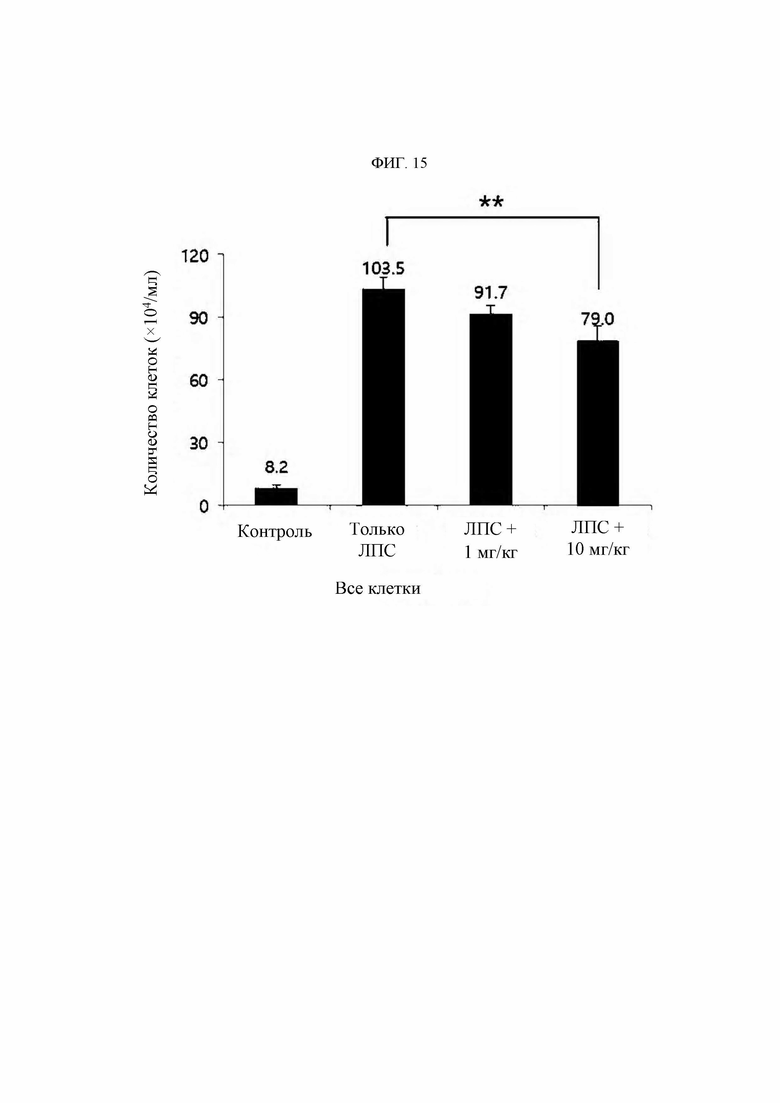
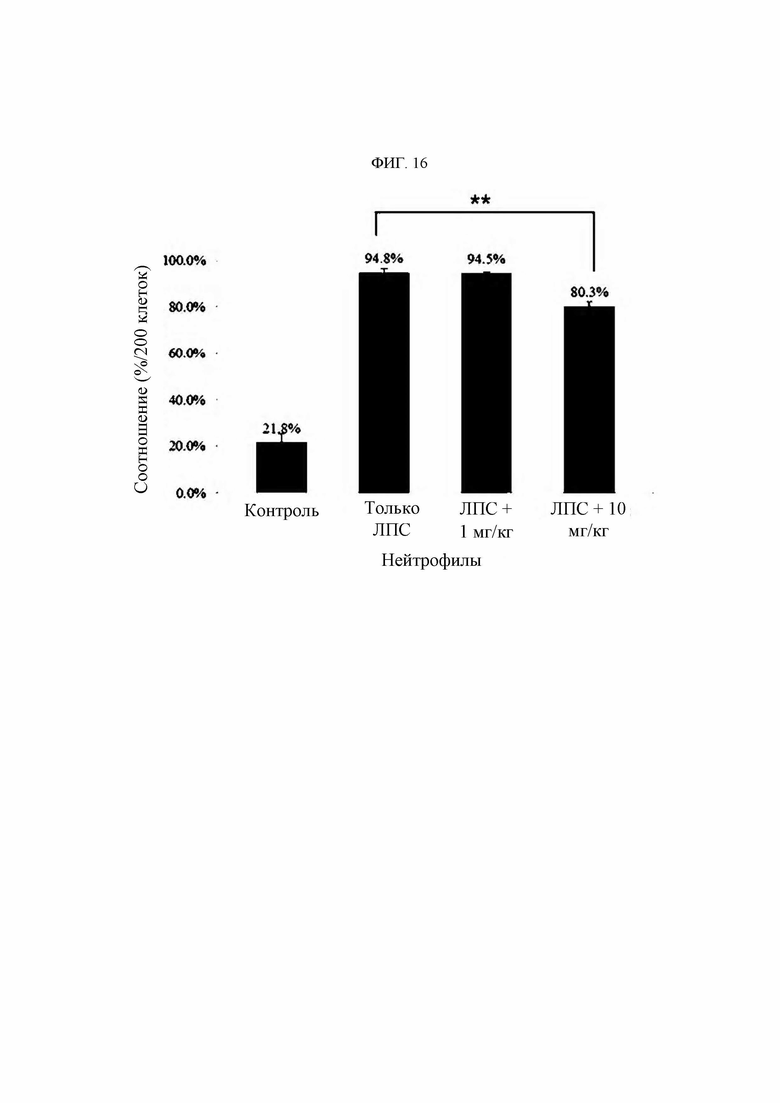
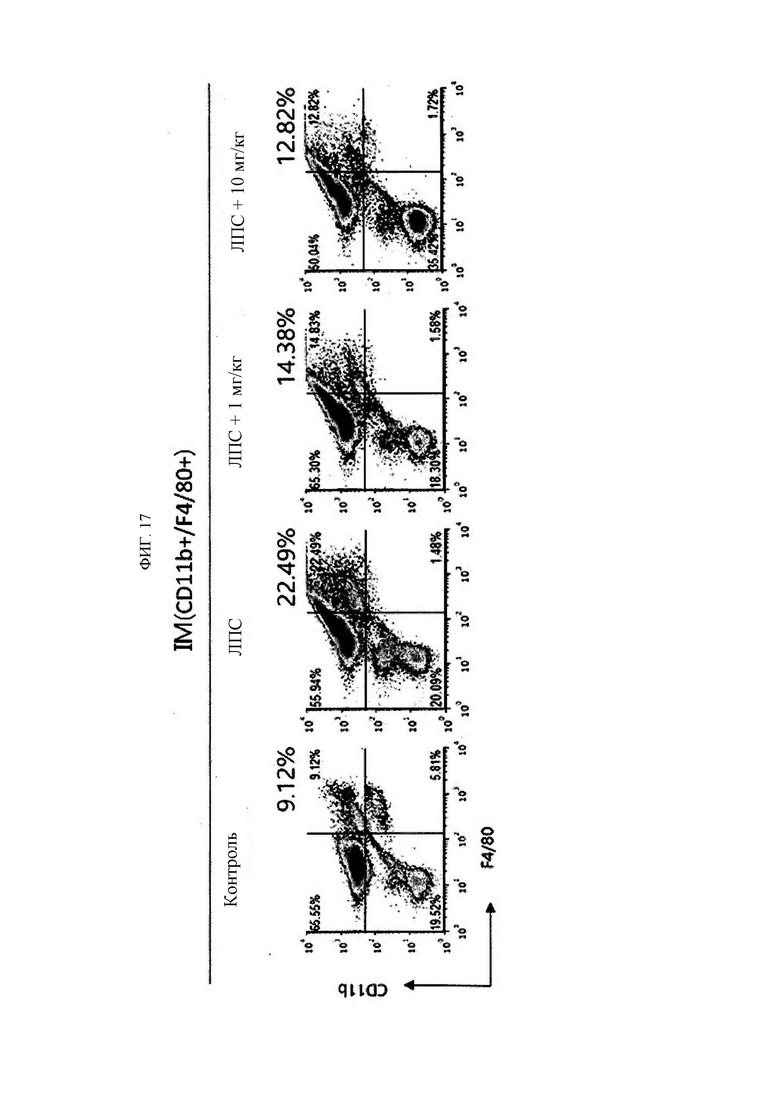
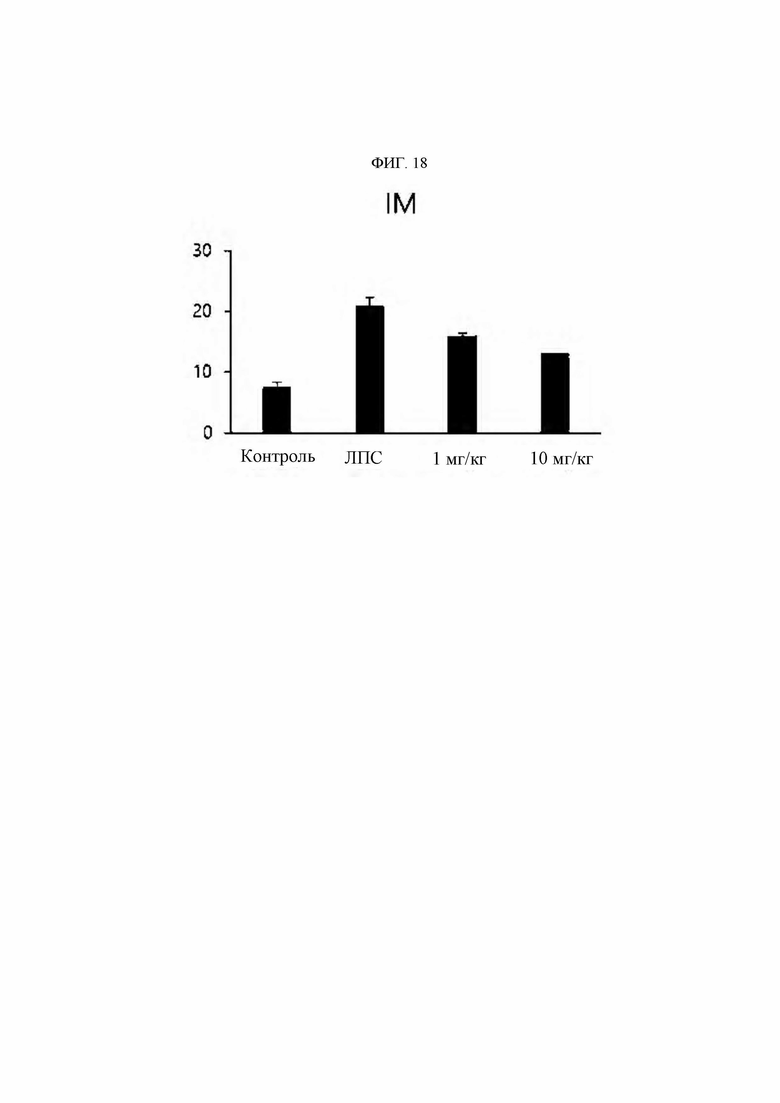

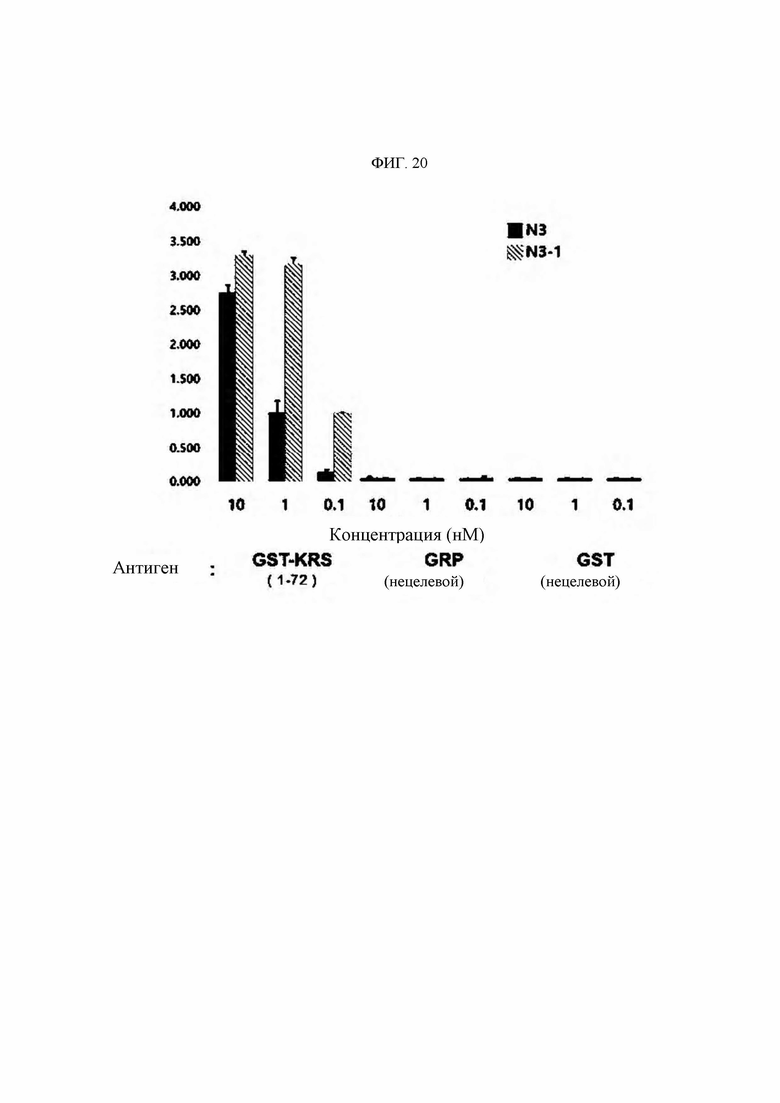
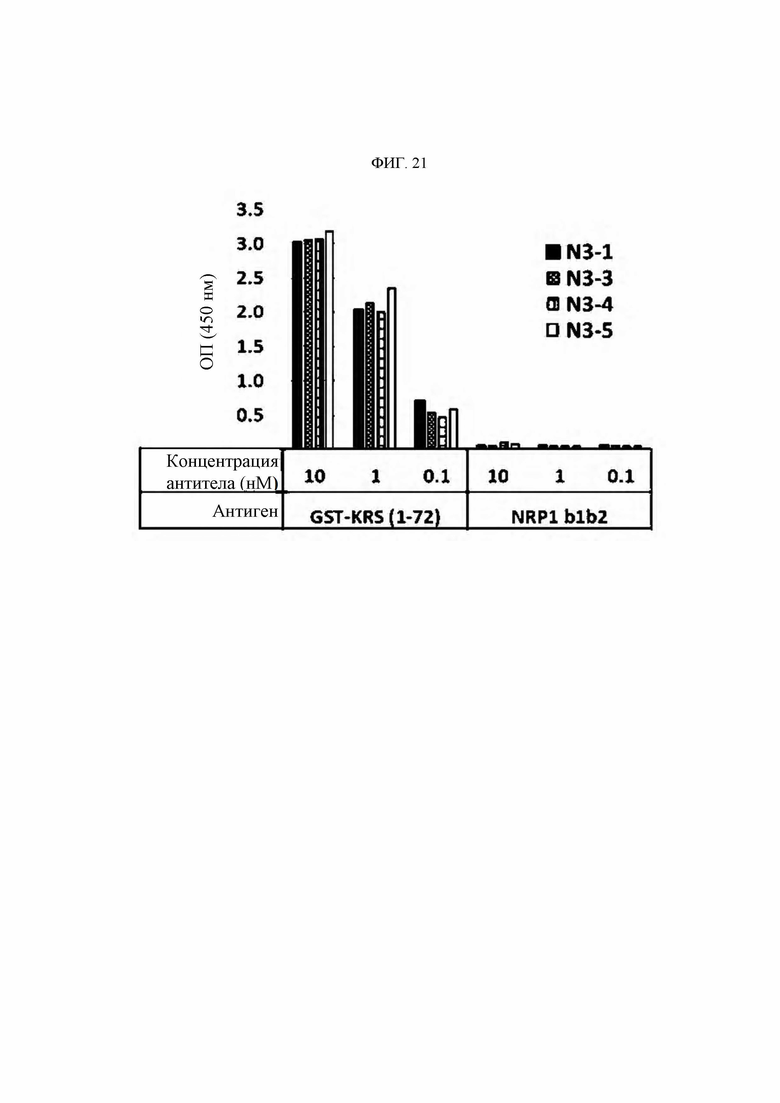
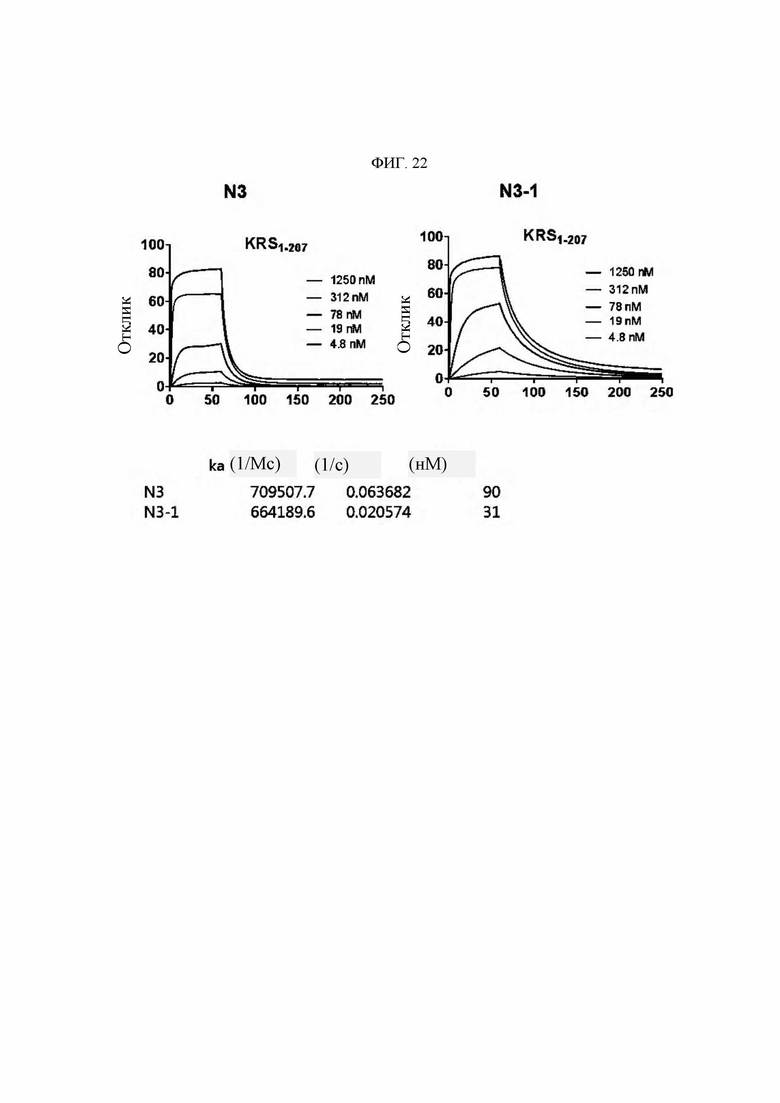
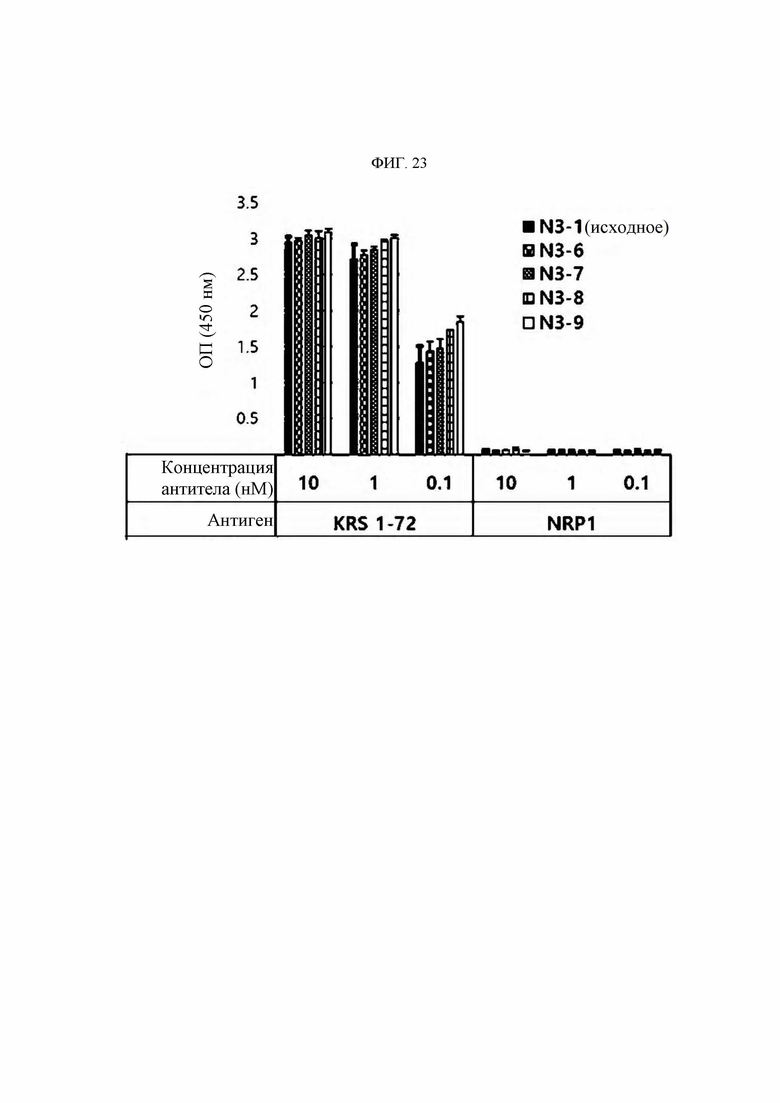
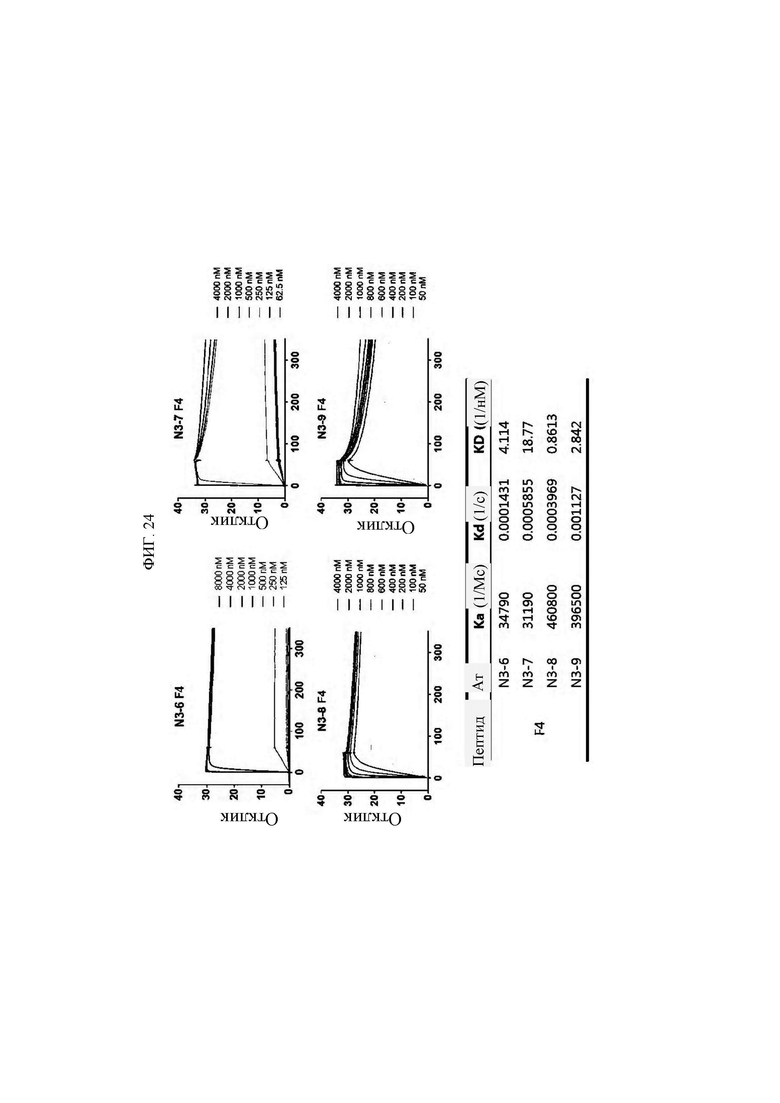
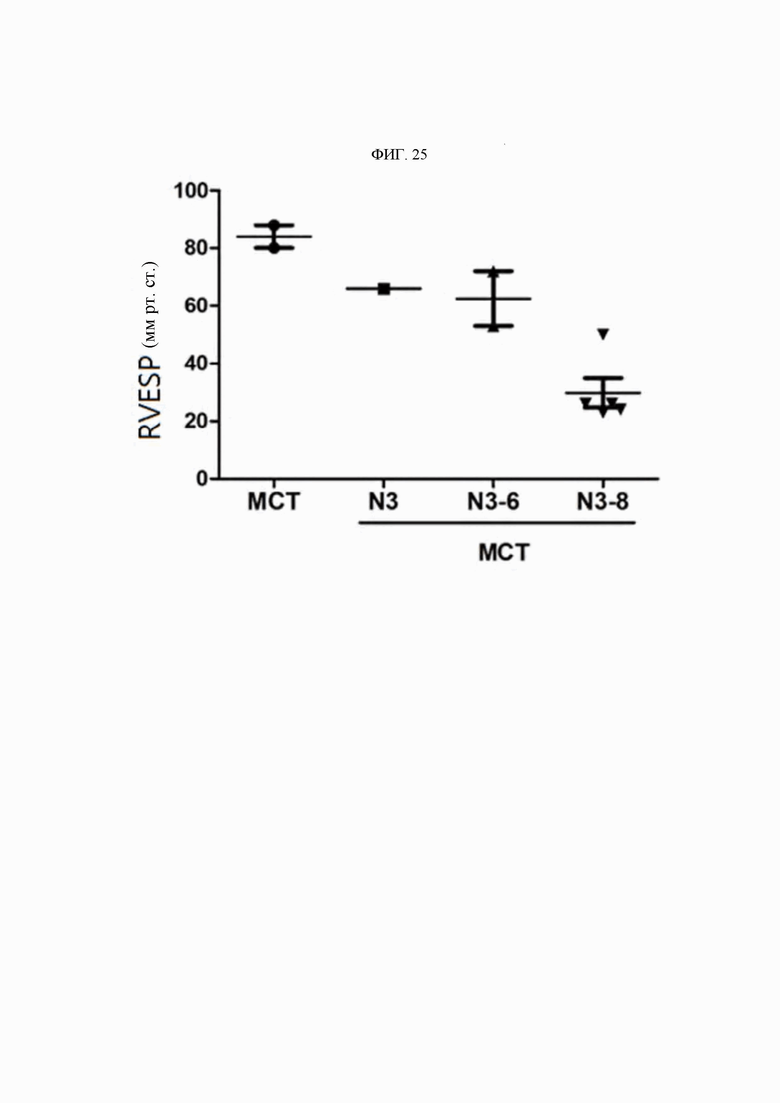


Группа изобретений относится к области медицины и фармацевтики. Первый объект представляет собой фармацевтическую композицию, содержащую эффективное количество антитела или его функционального фрагмента, специфично связывающихся с N-концом лизил-тРНК-синтетазы (KRS), для профилактики или лечения заболевания, связанного с миграцией иммунных клеток, выбранного из группы, состоящей из сердечно-сосудистого заболевания, фиброзного заболевания, воспалительного заболевания и синдрома Альпорта, где антитело содержит: (a) вариабельную область тяжелой цепи, включающую CDR1, содержащую последовательность SYDMS; CDR2, содержащую последовательность X1IX2X3X4X5GX6X7YYADSVKG, и где X1 представляет собой A или V, X2 – S, D или G, X3 – Y, P, S или A, X4 – D, Q, L или Y, X5 – N, M, S или G, X6 – N, R или P, X7 – T, V, I или S; и CDR3, содержащую последовательность X8ALDFDY, где X8 представляет собой M или L, и (b) вариабельную область легкой цепи, включающую CDR1, содержащую последовательность TGSSSNIGSNYVT; CDR2, содержащую последовательность X9NX10X11RPS, где X9 представляет собой D, S или R, X10 – S или N и X11 – N или Q; и CDR3, содержащую последовательность X12SFSDELGAYV, где X12 представляет собой A или S. Второй и третий объекты – применение антитела или его функционального фрагмента для получения агента для профилактики или лечения заболеваний и способ лечения заболеваний, связанных с миграцией иммунных клеток. Технический результат заключается в эффективности применения антитела для профилактики или лечения заболеваний, обусловленных миграцией иммунных клеток, за счет связывания N-конца KRS. 3 н. и 5 з.п. ф-лы, 27 ил., 12 табл., 9 пр.
1. Фармацевтическая композиция, содержащая эффективное количество антитела или его функционального фрагмента, специфично связывающихся с N-концом лизил-тРНК-синтетазы (KRS), для профилактики или лечения заболевания, связанного с миграцией иммунных клеток, выбранного из группы, состоящей из сердечно-сосудистого заболевания, фиброзного заболевания, воспалительного заболевания и синдрома Альпорта,
где антитело содержит:
(a) вариабельную область тяжелой цепи (VH), включающую:
(a-1) определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность SYDMS;
(a-2) определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность X1IX2X3X4X5GX6X7YYADSVKG, и где X1 представляет собой A или V, X2 представляет собой S, D или G, X3 представляет собой Y, P, S или A, X4 представляет собой D, Q, L или Y, X5 представляет собой N, M, S или G, X6 представляет собой N, R или P, X7 представляет собой T, V, I или S; и
(a-3) определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность X8ALDFDY, где X8 представляет собой M или L, и
(b) вариабельную область легкой цепи (VL), включающую
(b-1) определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность TGSSSNIGSNYVT;
(b-2) определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность X9NX10X11RPS, где X9 представляет собой D, S или R, X10 представляет собой S или N и X11 представляет собой N или Q; и
(b-3) определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность X12SFSDELGAYV, где X12 представляет собой A или S,
где сердечно-сосудистое заболевание выбрано из группы, состоящей из гипертензии, легочной артериальной гипертензии, атеросклероза, стенокардии, инфаркта миокарда, ишемического цереброваскулярного заболевания, атеросклероза и мезентериального склероза,
где фиброзное заболевание выбрано из группы, состоящей из склеродермии, ревматоидного артрита, болезни Крона, язвенного колита, миелофиброза, фиброза легких, фиброза печени, цирроза печени, фиброза почек, гломерулосклероза, миофиброза, миофиброза сердца, интерстициального фиброза, фиброза поджелудочной железы, фиброза селезенки, фиброза средостения, сосудистого фиброза, фиброза кожи, фиброза глаза, макулярной дегенерации, фиброза суставов, фиброза щитовидной железы, эндомиокардиального фиброза, перитонеального фиброза, ретроперитонеального фиброза, массивного прогрессивного фиброза, нефрогенного системного фиброза, системной красной волчанки, наследственного фиброза, инфекционного фиброза, раздражающего фиброза, фиброза вследствие хронического аутоиммунитета, фиброза вследствие антигенной несовместимости при трансплантации органа, фиброзных осложнений во время операции, фиброза вследствие гиперлипидемии, фиброза вследствие ожирения, диабетического фиброза, фиброза вследствие гипертензии и окклюзии вследствие фиброза во время установки стента,
где воспалительное заболевание выбрано из группы, состоящей из аутоиммунного заболевания, воспалительного заболевания кишечника, дерматита, атопического дерматита, экземы, псориаза, диабетического глазного заболевания, диабетической ретинопатии, перитонита, остеомиелита, флегмоны подкожной жировой клетчатки, менингита, энцефалита, панкреатита, травматического шока, бронхиальной астмы, ринита, синусита, тимпанита, пневмонии, гастрита, энтерита, муковисцидоза, апоплексии, инсульта, бронхита, бронхиолита, гепатита, цирроза, неалкогольного стеатогепатита, нефрита, диабетической почечной недостаточности, протеинурии, артрита, псориатического артрита, остеоартрита, неврита, диабетической нейропатии, рассеянного склероза, подагры, спондилита, синдрома Рейтера, узелкового полиартериита, васкулита, бокового амиотрофического склероза, гранулематоза Вегенера, гиперцитокинемии, ревматической полимиалгии, гигантоклеточного артериита, артрита, индуцированного кристаллическими фосфатами кальция, псевдоподагры, несуставного ревматоидного заболевания, бурсита, тендовагинита, эпикондилита, локтя теннисиста, сустава Шарко, гемартроза, пурпуры Шенлейна-Геноха, гипертрофического остеоартрита, многоочаговой ретикулоцитомы, саркоидоза, гемохроматоза, дрепаноцитоза, гиперлипопротеинемии, гипогаммаглобулинемии, гиперпаратиреоза, акромегалии, семейной средиземноморской лихорадки, болезни Бехчета, системной красной волчанки, рецидивирующей лихорадки, сепсиса, септического шока, острого респираторного дистресс-синдрома, полиорганной дисфункции, хронической обструктивной болезни легких, острого повреждения легких и бронхолегочной дисплазии.
2. Композиция по п. 1, где антитело выбрано из группы, состоящей из IgG, IgA, IgM, IgE и IgD, и функциональный фрагмент выбран из группы, состоящей из диатела, Fab, Fab', F (ab)2, F (ab')2, Fv и scFv.
3. Композиция по п. 1, где аутоиммунное заболевание выбрано из группы, состоящей из ревматоидного артрита, системной склеродермии, системной красной волчанки, псориаза, бронхиальной астмы, язвенного колита, болезни Бехчета, болезни Крона, рассеянного склероза, дерматита, коллагеновой болезни, васкулита, артрита, гранулематоза, аутоиммунных заболеваний органной специфичности и GvHD (болезни трансплантат-против-хозяина).
4. Композиция по п. 1, где (a) вариабельная область тяжелой цепи (VH) включает определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 1, и определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 21, SEQ ID NO: 23 и SEQ ID NO: 151, и определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5 и SEQ ID NO: 25.
5. Композиция по п. 1, где (b) вариабельная область легкой цепи (VL) включает определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность, определенную SEQ ID NO: 7, и определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 9, SEQ ID NO: 27 и SEQ ID NO: 29, определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 13 и SEQ ID NO: 15.
6. Композиция по п. 2, где scFv содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 61, SEQ ID NO: 63, SEQ ID NO: 65, SEQ ID NO: 67, SEQ ID NO: 69, SEQ ID NO: 71, SEQ ID NO: 73, SEQ ID NO: 75, SEQ ID NO: 77, SEQ ID NO: 79, SEQ ID NO: 81, SEQ ID NO: 83, SEQ ID NO: 85 и SEQ ID NO: 87.
7. Применение антитела или его функционального фрагмента, которые специфично связываются с N-концом лизил-тРНК-синтетазы (KRS), для получения агента для профилактики или лечения заболевания, связанного с миграцией иммунных клеток, выбранного из группы, состоящей из сердечно-сосудистого заболевания, фиброзного заболевания, воспалительного заболевания и синдрома Альпорта,
где антитело содержит:
(a) вариабельную область тяжелой цепи (VH), включающую:
(a-1) определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность SYDMS;
(a-2) определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность X1IX2X3X4X5GX6X7YYADSVKG, и где X1 представляет собой A или V, X2 представляет собой S, D или G, X3 представляет собой Y, P, S или A, X4 представляет собой D, Q, L или Y, X5 представляет собой N, M, S или G, X6 представляет собой N, R или P, X7 представляет собой T, V, I или S; и
(a-3) определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность X8ALDFDY, где X8 представляет собой M или L, и
(b) вариабельную область легкой цепи (VL), включающую
(b-1) определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность TGSSSNIGSNYVT;
(b-2) определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность X9NX10X11RPS, где X9 представляет собой D, S или R, X10 представляет собой S или N и X11 представляет собой N или Q; и
(b-3) определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность X12SFSDELGAYV, где X12 представляет собой A или S,
где сердечно-сосудистое заболевание выбрано из группы, состоящей из гипертензии, легочной артериальной гипертензии, атеросклероза, стенокардии, инфаркта миокарда, ишемического цереброваскулярного заболевания, атеросклероза и мезентериального склероза,
где фиброзное заболевание выбрано из группы, состоящей из склеродермии, ревматоидного артрита, болезни Крона, язвенного колита, миелофиброза, фиброза легких, фиброза печени, цирроза печени, фиброза почек, гломерулосклероза, миофиброза, миофиброза сердца, интерстициального фиброза, фиброза поджелудочной железы, фиброза селезенки, фиброза средостения, сосудистого фиброза, фиброза кожи, фиброза глаза, макулярной дегенерации, фиброза суставов, фиброза щитовидной железы, эндомиокардиального фиброза, перитонеального фиброза, ретроперитонеального фиброза, массивного прогрессивного фиброза, нефрогенного системного фиброза, системной красной волчанки, наследственного фиброза, инфекционного фиброза, раздражающего фиброза, фиброза вследствие хронического аутоиммунитета, фиброза вследствие антигенной несовместимости при трансплантации органа, фиброзных осложнений во время операции, фиброза вследствие гиперлипидемии, фиброза вследствие ожирения, диабетического фиброза, фиброза вследствие гипертензии и окклюзии вследствие фиброза во время установки стента,
где воспалительное заболевание выбрано из группы, состоящей из аутоиммунного заболевания, воспалительного заболевания кишечника, дерматита, атопического дерматита, экземы, псориаза, диабетического глазного заболевания, диабетической ретинопатии, перитонита, остеомиелита, флегмоны подкожной жировой клетчатки, менингита, энцефалита, панкреатита, травматического шока, бронхиальной астмы, ринита, синусита, тимпанита, пневмонии, гастрита, энтерита, муковисцидоза, апоплексии, инсульта, бронхита, бронхиолита, гепатита, цирроза, неалкогольного стеатогепатита, нефрита, диабетической почечной недостаточности, протеинурии, артрита, псориатического артрита, остеоартрита, неврита, диабетической нейропатии, рассеянного склероза, подагры, спондилита, синдрома Рейтера, узелкового полиартериита, васкулита, бокового амиотрофического склероза, гранулематоза Вегенера, гиперцитокинемии, ревматической полимиалгии, гигантоклеточного артериита, артрита, индуцированного кристаллическими фосфатами кальция, псевдоподагры, несуставного ревматоидного заболевания, бурсита, тендовагинита, эпикондилита, локтя теннисиста, сустава Шарко, гемартроза, пурпуры Шенлейна-Геноха, гипертрофического остеоартрита, многоочаговой ретикулоцитомы, саркоидоза, гемохроматоза, дрепаноцитоза, гиперлипопротеинемии, гипогаммаглобулинемии, гиперпаратиреоза, акромегалии, семейной средиземноморской лихорадки, болезни Бехчета, системной красной волчанки, рецидивирующей лихорадки, сепсиса, септического шока, острого респираторного дистресс-синдрома, полиорганной дисфункции, хронической обструктивной болезни легких, острого повреждения легких и бронхолегочной дисплазии.
8. Способ лечения заболеваний, связанных с миграцией иммунных клеток, выбранных из группы, состоящей из сердечно-сосудистого заболевания, фиброзного заболевания, воспалительного заболевания и синдрома Альпорта, у субъекта, включающий введение нуждающемуся в этом субъекту эффективного количества композиции, содержащей в качестве эффективного ингредиента антитело или его функциональный фрагмент, специфично связывающиеся с N-концом лизил-тРНК-синтетазы (KRS),
где антитело содержит:
(a) вариабельную область тяжелой цепи (VH), включающую:
(a-1) определяющую комплементарность область 1 (CDR1) тяжелой цепи, содержащую аминокислотную последовательность SYDMS;
(a-2) определяющую комплементарность область 2 (CDR2) тяжелой цепи, содержащую аминокислотную последовательность X1IX2X3X4X5GX6X7YYADSVKG, и где X1 представляет собой A или V, X2 представляет собой S, D или G, X3 представляет собой Y, P, S или A, X4 представляет собой D, Q, L или Y, X5 представляет собой N, M, S или G, X6 представляет собой N, R или P, X7 представляет собой T, V, I или S; и
(a-3) определяющую комплементарность область 3 (CDR3) тяжелой цепи, содержащую аминокислотную последовательность X8ALDFDY, где X8 представляет собой M или L, и
(b) вариабельную область легкой цепи (VL), включающую:
(b-1) определяющую комплементарность область 1 (CDR1) легкой цепи, содержащую аминокислотную последовательность TGSSSNIGSNYVT;
(b-2) определяющую комплементарность область 2 (CDR2) легкой цепи, содержащую аминокислотную последовательность X9NX10X11RPS, где X9 представляет собой D, S или R, X10 представляет собой S или N и X11 представляет собой N или Q; и
(b-3) определяющую комплементарность область 3 (CDR3) легкой цепи, содержащую аминокислотную последовательность X12SFSDELGAYV, где X12 представляет собой A или S,
где сердечно-сосудистое заболевание выбрано из группы, состоящей из гипертензии, легочной артериальной гипертензии, атеросклероза, стенокардии, инфаркта миокарда, ишемического цереброваскулярного заболевания, атеросклероза и мезентериального склероза,
где фиброзное заболевание выбрано из группы, состоящей из склеродермии, ревматоидного артрита, болезни Крона, язвенного колита, миелофиброза, фиброза легких, фиброза печени, цирроза печени, фиброза почек, гломерулосклероза, миофиброза, миофиброза сердца, интерстициального фиброза, фиброза поджелудочной железы, фиброза селезенки, фиброза средостения, сосудистого фиброза, фиброза кожи, фиброза глаза, макулярной дегенерации, фиброза суставов, фиброза щитовидной железы, эндомиокардиального фиброза, перитонеального фиброза, ретроперитонеального фиброза, массивного прогрессивного фиброза, нефрогенного системного фиброза, системной красной волчанки, наследственного фиброза, инфекционного фиброза, раздражающего фиброза, фиброза вследствие хронического аутоиммунитета, фиброза вследствие антигенной несовместимости при трансплантации органа, фиброзных осложнений во время операции, фиброза вследствие гиперлипидемии, фиброза вследствие ожирения, диабетического фиброза, фиброза вследствие гипертензии и окклюзии вследствие фиброза во время установки стента,
где воспалительное заболевание выбрано из группы, состоящей из аутоиммунного заболевания, воспалительного заболевания кишечника, дерматита, атопического дерматита, экземы, псориаза, диабетического глазного заболевания, диабетической ретинопатии, перитонита, остеомиелита, флегмоны подкожной жировой клетчатки, менингита, энцефалита, панкреатита, травматического шока, бронхиальной астмы, ринита, синусита, тимпанита, пневмонии, гастрита, энтерита, муковисцидоза, апоплексии, инсульта, бронхита, бронхиолита, гепатита, цирроза, неалкогольного стеатогепатита, нефрита, диабетической почечной недостаточности, протеинурии, артрита, псориатического артрита, остеоартрита, неврита, диабетической нейропатии, рассеянного склероза, подагры, спондилита, синдрома Рейтера, узелкового полиартериита, васкулита, бокового амиотрофического склероза, гранулематоза Вегенера, гиперцитокинемии, ревматической полимиалгии, гигантоклеточного артериита, артрита, индуцированного кристаллическими фосфатами кальция, псевдоподагры, несуставного ревматоидного заболевания, бурсита, тендовагинита, эпикондилита, локтя теннисиста, сустава Шарко, гемартроза, пурпуры Шенлейна-Геноха, гипертрофического остеоартрита, многоочаговой ретикулоцитомы, саркоидоза, гемохроматоза, дрепаноцитоза, гиперлипопротеинемии, гипогаммаглобулинемии, гиперпаратиреоза, акромегалии, семейной средиземноморской лихорадки, болезни Бехчета, системной красной волчанки, рецидивирующей лихорадки, сепсиса, септического шока, острого респираторного дистресс-синдрома, полиорганной дисфункции, хронической обструктивной болезни легких, острого повреждения легких и бронхолегочной дисплазии.
| WO 2011153277 A2, 08.12.2011 | |||
| СПОСОБ ИНГИБИРОВАНИЯ МЕТАСТАЗИРОВАНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ ИЛИ МИГРАЦИИ ЗЛОКАЧЕСТВЕННЫХ КЛЕТОК ПОСРЕДСТВОМ СНИЖЕНИЯ КЛЕТОЧНОГО УРОВНЯ ЛИЗИЛ-тРНК-СИНТЕТАЗЫ (ВАРИАНТЫ), КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ ВЕКТОРА ЭКСПРЕССИИ ИЛИ АНТИТЕЛА ПРОТИВ KRS ДЛЯ ИНГИБИРОВАНИЯ МЕТАСТАЗИРОВАНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ ИЛИ МИГРАЦИИ ЗЛОКАЧЕСТВЕННЫХ КЛЕТОК | 2008 |
|
RU2465330C1 |
| US 2016377619 A1, 29.12.2016 | |||
| US 2013108630 A1, 02.05.2013 | |||
| NECHUSHTAN H | |||
| et al | |||
| The physiological role of lysyl tRNA synthetase in the immune system // Advances in immunology | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| - Vol | |||
| Клапанный регулятор для паровозов | 1919 |
|
SU103A1 |
| - P | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2021-06-15—Публикация
2018-09-17—Подача