ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к фармацевтически приемлемой соли алкилкарбамоилнафталенилоксиоктеноилгидроксиамида или его производного и к способу ее получения, в частности, к соединению в форме соли, способной улучшить физико-химическую стабильность, и к способу его получения.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Гистоны представляют собой основные белки, которые связываются с ДНК в ядре эукариотических клеток и подвергаются обратимому ацетилированию аминогрупп остатков лизина в определенных положениях каждой молекулы гистонов. Ацетилирование гистонов сопряжено с образованием более высоких структур хроматина или циклом клеточного деления и, таким образом, участвует в регуляции экспрессии генетической информации и стабильно регулируется гистонацетилтрансферазами (HAT, от англ. "histone acetyltransferase") и гистондеацетилазами (HDAC, от англ. "histone deacetylases"). Известно, что эти ферменты нейтрализуют положительные заряды лизиновых остатков (четыре остатка для Н4) на аминоконце гистонов путем ацетилирования для индукции транскрипционной активности или дезацетилируют их, снова наделяя зарядом для ингибирования транскрипции, обеспечивая тем самым равновесие уровней ацетилирования гистонов и регулируя экспрессию генов в фазе транскрипции.
Недавно было обнаружено, что благодаря высокой экспрессии в неблагоприятных условиях окружающей среды, таких как гипоксия, низкий уровень глюкозы и клеточный канцерогенез, HDAC играют роль в стимулировании клеточной пролиферации, ингибируя экспрессию ингибиторов пролиферации клеток. По этой причине они были признаны важным фактором регуляции канцерогенности и дифференциации клеток. Другими словами, если высокое ацетилирование хроматина ингибирует клеточную пролиферацию и способствует клеточной дифференциации, то HDAC играют важную роль в индуцировании клеточной пролиферации посредством деацетилирования гистонов. Это подтверждается тем фактом, что лечение ингибиторами HDAC приводит к ингибированию клеточной пролиферации и ангиогенеза. Существует необходимость в разработке более селективных и эффективных ингибиторов HDAC. В этой связи была подтверждена возможность применения алкилкарбамоилнафталенилоксиоктеноилгидроксиамида в качестве ингибитора HDAC, и исследования в этой области продолжаются.
Однако такой алкилкарбамоилнафталенилоксиоктеноилгидроксиамид обладает свойством поглощать влагу из воздуха, а потому существует опасение, что возникнет проблема, связанная с чувствительностью физико-химической стабильности к внешним воздействиям. Чтобы решить эту проблему, необходимо провести несколько дополнительных процессов очистки для удаления сопутствующих примесей, обусловленных способностью поглощать влагу, а это может привести к увеличению производственных расходов. В случае свободного основания его сложно сохранить в твердом состоянии из-за гигроскопичности, что затрудняет его массовое производство. Соответственно, имеются недостатки, связанные с потребностью в таких средствах, как отдельное устройство для хранения в замороженном состоянии или упаковка.
Таким образом, существует необходимость в исследовании алкилкарбамоилнафталенилоксиоктеноилгидроксиамида в качестве физико-химически стабильного ингибитора HDAC.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Предметом настоящего изобретения является обеспечение фармацевтически приемлемой соли алкилкарбамоилнафталенилоксиоктеноилгидроксиамида или его производного.
Другим предметом настоящего изобретения является обеспечение способа получения соли.
Еще одним предметом настоящего изобретения является обеспечение фармацевтической композиции противоопухолевого средства, включающей соль в качестве активного ингредиента.
Для решения обозначенных выше проблем настоящее изобретение предлагает фармацевтически приемлемую соль алкилкарбамоилнафталенилоксиоктеноилгидроксиамида следующей формулы (1) или его производного:
[Формула 1]
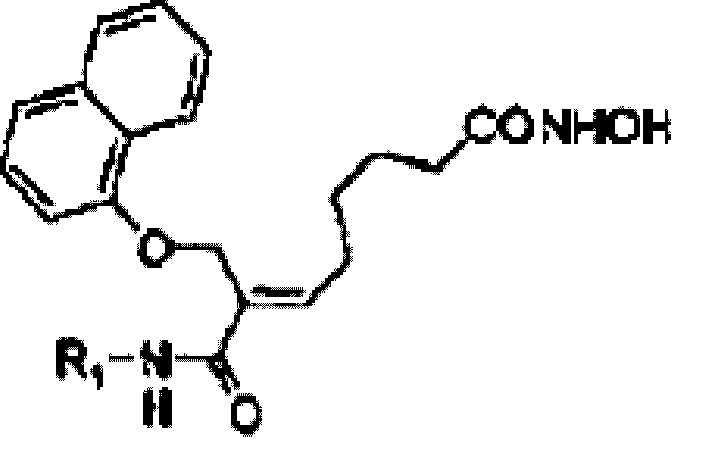
где
R1 представляет собой С1-3-алкил, незамещенный или замещенный одним или более заместителями, выбранными из группы, состоящей из галогенфенила, C1-3-алкокси, С1-3-алкакси-С1-3-алкмла, циклогекганила, фуранила, тиофенила, имидазола, имидазолил-С1-3-алкила, С1-3-алкиламино, ди-С1-3-алкиламино, гидроксилфенила, тетрагидрофуранила, циклогексила, циклогексенила, оксоопирролидинила, C1-3-алкоксифенила, ди-С1-3-алкиламинофенила, C1-3-алкил пиррол иди нил а и трифторметокгифенила; пирролидин, незамещенный или замещенный С3-8-циклоал килом, С3-8-циклоалкил-С1-3-алкилом, бензилом, С1-3-алкилом или С3-8-циклоалкилкарбонилом; пиперидин, замещенный С1-3-алкилом или С3-8-циклоалкилом; фуран; или С3-8-циклоалкил,
при условии, что незамещенный С1-2-алкил и С1-2-алкил, замещенный С1-2-алкилпирролидинилом, исключены,
где соль выбрана из соли фосфорной кислоты, соли винной кислоты, соли стеариновой кислоты, соли глюконовой кислоты, соли фумаровой кислоты, соли нафтойной кислоты, соли 1-гидрокси-2-нафтойной кислоты и их смеси.
Кроме того, настоящее изобретение предлагает способ получения фармацевтически приемлемой соли алкилкарбамоилнафталенилоксиоктеноилгидроксиамида или его производного, включающий стадии, на которых:
1) добавляют органический растворитель в алкилкарбамоилнафталенилоксиоктеноилгидроксиамид формулы (1) или его производное для экстракции свободного основания, и
2) добавляют кислое вещество в раствор свободного основания,
при этом кислое вещество выбрано из фосфорной кислоты, винной кислоты, стеариновой кислоты, глюконовой кислоты, фумаровой кислоты, нафтойной кислоты, 1-гидрокси-2-нафтойной кислоты и их комбинации.
Кроме того, настоящее изобретение предлагает фармацевтическую композицию противоопухолевого средства, включающую в качестве активного ингредиента фармацевтически приемлемую соль алкилкарбамоилнафталенилоксиоктеноилгидроксиамида формулы (1) или его производного.
Другие конкретные варианты осуществления настоящего изобретения включены в следующее подробное описание.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению, можно улучшить устойчивость к воздействию влаги при сохранении таких свойств, как эффективность лекарственного средства и эффективное количество фармацевтически приемлемой соли алкилкарбамоилнафталенилоксиоктеноилгидроксиамида или его производного. Кроме того, за счет улучшения гигроскопичности можно упростить производственный процесс и коммерциализацию получения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1 представляет собой снимок, демонстрирующий каждое из свойств соединения.
Фиг. 2 представляет собой график, показывающий изменения содержании влаги в Примерах и Сравнительных примерах.
Фиг. 3 представляет собой график, показывающий изменения количества сопутствующих примесей, образующихся в примерах и сравнительных примерах.
Фиг. 4 представляет собой график, показывающий изменения количества сопутствующих примесей, образующихся в Примере 1.
Фиг. 5 представляет собой график, показывающий изменения количества сопутствующих примесей, образующихся в Примере 2.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
С учетом того факта, что в настоящее изобретение могут быть внесены различные модификации и изменения, конкретные варианты осуществления проиллюстрированы графическими материалами и будут в деталях описаны в подробном описании. Однако следует понимать, что изобретение не ограничивается конкретными вариантами осуществления, а включает в себя все модифицированные, эквивалентные и альтернативные варианты, подпадающие под сущность и объем изобретения. В следующем описании настоящего изобретения подробное описание известных функций будет опущено, если определено, что оно может затруднить понимание сути настоящего изобретения.
Термин "фармацевтически приемлемая соль" при использовании в данном контексте может быть представлен в сочетании с термином "фармацевтическая соль" и означает любую композицию неорганических и органических соединений, которая может быть относительно нетоксичной для субъекта, которому ее вводят, и имеет безопасное эффективное действие. Кроме того, этот термин может означать любую композицию неорганических или органических соединений, для которой побочные эффекты, возникающие в результате использования соли, не ухудшают эффективности лекарственного средства, не вызывают серьезного раздражения у субъекта, которому вводят соединение, и не ухудшают биологической активности и свойств соединения.
Фармацевтическая соль может включать соли присоединения кислоты, образованные кислотами, дающими нетоксичные соли присоединения кислоты, содержащие фармацевтически приемлемый анион, например, неорганическими кислотами, такими как соляная кислота, серная кислота, азотная кислота, фосфорная кислота, бромистоводородная кислота и йодистоводородная кислота, органическими кислотами, такими как винная кислота, муравьиная кислота, лимонная кислота, уксусная кислота, трихлоруксусная кислота, трифторуксусная кислота, глюконовая кислота, бензойная кислота, малоновая кислота, гликоновая кислота, молочная кислота, фумаровая кислота, малеиновая кислота, салициловая кислота и янтарная кислота, сульфокислотами, такими как метансульфокислота, этансульфокислота, бензолсульфокислота, п-толуолсульфокислота и нафтален-2-сульфокислота. Например, фармацевтически приемлемая соль карбоновой кислоты включает соли металлов или соли щелочноземельных металлов, образованные с литием, натрием, калием, кальцием и магнием, соли аминокислот, таких как лизин, аргинин и гуанидин, органические соли, такие как дициклогексиламин, N-метил-О-глюкамин, трис(гидроксиметил)метиламин, диэтаноламин, холин и триэтиламин.
Далее будут более подробно описаны фармацевтически приемлемые соли алкилкарбамоилнафталенилоксиоктеноилгидроксиамида или его производного в соответствии с вариантами осуществления настоящего изобретения.
Было подтверждено, что алкилкарбамоилнафталенилоксиоктеноилгидроксиамид или его производное могут быть использованы в качестве ингибитора гистонацетилазы (HDAC) (патент Кореи, регистрационный номер No. 0814092).
Согласно настоящему изобретению, можно получить фармацевтический препарат в форме соли с улучшенной устойчивостью к воздействию влаги при сохранении таких свойств, как эффективность лекарственного средства и эффективное количество алкилкарбамоилнафталенилоксиоктеноилгидроксиамида или его производного.
Для решения описанных выше проблем настоящее изобретение предлагает фармацевтически приемлемую соль алкилкарбамоилнафталенилоксиоктеноилгидроксиамида следующей формулы (1) или его производного.
[Формула 1]

где
R1 представляет собой С1-3-алкил, незамещенный или замещенный одним или более заместителями, выбранными из группы, состоящей из галогенфенила, С1-3-алкокси, С1-3-алкокси-С1-3-алкила, циклогексанила, фуранила, тиофенила, имидазола, имидазолил-С1-3-алкила, С1-3-алкиламино, ди-С1-3-алкиламино, гидроксилф енила, тетрагидрофуранила, циклогексила, циклогексенила, оксопирролидинила, С1-3-алкоксифенила, ди-С1-3-алкиламинофенила, C1-3-алкилпирролидинила и трифторметоксифенила; пирролидин, незамещенный или замещенный С3-8-циклоал килом, С3-8-циклоалкил-С1-3-алкилом, бензилом, С1-3-алкилом или С3-8-циклоалкилкарбонилом; пиперидин, замещенный С1-3-алкилом или С3-8-циклоалкилом; фуран; или С3-8-циклоалкил,
при условии, что незамещенный C1-2-алкил и С1-2-алкил, замещенный С1-2-алкилпирролидинилом, исключены,
где соль может быть выбрана из соли фосфорной кислоты, соли винной кислоты, соли стеариновой кислоты, соли глюконовой кислоты, соли фумаровой кислоты, соли нафтойной кислоты, соли 1-гидрокси-2-нафтойной кислоты и их смеси.
Согласно одному из вариантов осуществления, соль может быть выбрана из соли фосфорной кислоты, соли винной кислоты и их смеси, которые имеют относительно высокую стабильность и растворимость в воде, например, она может включать соль фосфорной кислоты.
Предпочтительные производные алкилкарбамоилнафталенилоксиоктеноилгидроксиамида формулы (1) могут быть выбраны из группы, состоящей из следующих соединений:
1) (E)-N1-(3-(1Н-имидазол-1-ил)пропил)-N8-гидрокси-2-((нафтален-1-илокси)метил)октендиамида,
2) (E)-N8-гидрокси-N1-(4-гидроксифенетил)-2-((нафтален-1-илокси)метил)-2-октендиамида,
3) (Е)-N1-(3-(диметиламино)-2,2-диметилпропил)-N8-гидрокси-2-((нафтален-1- илокси)метил)октендиамида,
4) (E)-N1-(2-(диизопропиламино)этил)-N8-гидрокси-2-((нафтален-1-илокси)метил)октендиамида,
5) (Е)-N8-гидрокси-N1-(1-метоксипропан-2-ил)-2-((нафтален-1-илокси)метил)-2- октендиамида,
6) (Е)-N8-гидрокси-N1-(4-метоксибензил)-2-((нафтален-1-илокси)метил)-2-октендиамида,
7) (Е)-N1-(4-фторфенетил)-N8-гидрокси-2-((нафтален-1-илокси)метил)-2-октендиамида,
8) (Е)-N8-гидрокси-2-((нафтален-1-илокси)метил)-N1-(тетрагидрофуран-2-ил)метил)-2-октендиамида,
9) (Е)-N1-(2-циклогексенилэтил)-N8-гидрокси-2-((нафтален-1-илокси)метил)-2-октендиамида,
10) (Е)-N8-гидрокси-2-((нафтален-1-илокси)метил)-N1-(3-(2-оксопирролидин-1-ил)пропил)-2-октендиамида,
11) (E)-N1-(фуран-2-илметил)-N8-гидрокси-2-((нафтален-1-илокси)метил)-2-октендиамида,
12) (E)-N1-(4-(диметиламино)бензил)-N8-гидрокси-2-((нафтален-1-илокси)метил)-2-октендиамида,
13) (Е)-N8-гидрокси-N1-(2-метоксиэтил)-2-((нафтален-1-илокси)метил)-2-октендиамида,
14) (Е)-N1-циклогексил-N8-гидрокси-2-((нафтален-1-илокси)метил)-2-октендиамида,
15) (E)-N8-гидрокси-2-((нафтален-1-илокси)метил)-N1-(тиофен-2-илметил)-2-октендиамида,
16) (Е)-N8-гидрокси-N1-(4-метоксифенетил)-2-((нафтален-1-илокси)метил)-2-октендиамида,
17) (Е)-N8-гидрокси-2-((нафтален-1-илокси)метил)-N1-(4-(трифторметокси)бензил)-2-октендиамида,
18) (Е)-N1-(1-(цикпогексилметил)пирролидин-3-ил)-N8-гидрокси-2-((нафтален-1-илокси)метил)-2-октендиамида,
19) (E)-N1-(1-цикпопентилпиперидин-4-ил)-N8-гидрокси-2-((нафтален-1-илокси)метил)-2-октендиамида,
20) (E)-N1-(1-бензил пирролидин-3-ил)-N8-гидрокси-2-((нафтален-1-илокси)метил)-2-октендиамида,
21) (E)-N8-гидрокси-N1-(1-изопропилпирролидин-3-ил)-2-((нафтален-1-илокси)метил)-2-октендиамида,
22) (Е)-N1-(1-(циклогексанкарбонил)пирролидин-3-ил)-N8-гидрокси-2-((нафтален-1-илокси)метил)-2-октендиамида,
23) сложного трет-бутилового эфира (Е)-3-(8-(гидроксиамино)-2-((нафтален-1-илокси)метил)-8-оксо-2-октенамидо)пирролидин-1-карбоновой кислоты,
24) (Е)-N8-гидрокси-2-((нафтален-1-илокси)метил)-N1-(пирролидин-3-ил)2-октендиамида,
25) (Е)-N1-(1-циклогексилпирролидин-3-ил)-N8-гидрокси-2-((нафтален-2-илокси)метил)-2-октендиамида,
26) (Е)-N1-(1-цикпопропилпирролидин-3-ил)-N8-гидрокси-2-((нафтален-1-илокси)метил)-2-октендиамида,
27) (Е)-N1-(1-цикпопропилпиперидин-4-ил)-N8-гидрокси-2-((нафтален-1-илокси)метил)-2-октендиамида,
28) (Е)-N1-(1-этилпиперидин-4-ил)-N8-гидрокси-2-((нафтален-1-илокси)метил)-2-октендиамида,
29) (Е)-N1-(1-этилпирролидин-3-ил)-N8-гидрокси-2-((нафтален-1-илокси)метил)-2-октендиамида,
30) (Е)-N8-гидрокси-N1-(2-(1-метилпирролидин-2-ил)этил)-2-((нафтален-1-илокси)метил)-2-октендиамида и
31) (Е)-N8-гидрокси-N1-(1-изопропилпиперидин-4-ил)-2-((нафтален-1-илокси)метил)-2-октендиамида.
Кроме того, настоящее изобретение предлагает способ получения фармацевтически приемлемой соли алкилкарбамоилнафталенилоксиоктеноилгидроксиамида или его производного, включающий стадии, на которых:
1) добавляют органический растворитель в алкилкарбамоилнафталенилоксиоктеноилгидроксиамид формулы (1) или его производное для экстракции свободного основания, и
2) добавляют кислое вещество в раствор свободного основания,
при этом кислое вещество выбрано из фосфорной кислоты, винной кислоты, стеариновой кислоты, глюконовой кислоты, фумаровой кислоты, нафтойной кислоты, 1-гидрокси-2-нафтойной кислоты и их комбинации.
Согласно одному из вариантов осуществления, алкилкарбамоилнафталенилоксиоктеноилгидроксиамид или его производное может быть в твердом состоянии, в состоянии геля или в состоянии раствора, при этом состояние раствора может относиться к состоянию полного растворения в органическом растворителе или к состоянию суспензии.
Согласно одному из вариантов осуществления, органический растворитель может быть выбран из метанола, этанола, пропанола, тетрагидрофурана, хлороформа, N,N-диметилформамида (ДМФА, англ. DMF), диметилсульфоксида (ДМСО, англ. DMSO), ацетонитрила, этилацетата и их комбинации, например, он может включать метанол, этанол, пропанол, тетрагидрофуран, хлороформ, N,N-диметилформамид (ДМФА), диметилсульфоксид (ДМСО) и их комбинацию, имеющие относительно высокую растворяющую способность.
Согласно одному из вариантов осуществления, кислое вещество может включать фосфорную кислоту, винную кислоту и их комбинацию, имеющие относительно высокую растворимость в воде, например, оно может включать фосфорную кислоту.
Согласно одному из вариантов осуществления, способ получения фармацевтически приемлемой соли алкилкарбамоилнафталенилоксиоктеноилгидроксиамида или его производного может также включать стадию дополнительного добавления растворителя, обладающего более низкой растворяющей способностью, чем растворяющая способность растворителя на стадии 1). Растворитель, имеющий более низкую растворяющую способность, чем растворитель на стадии 1), может быть выбран из спиртов, включая метанол, этанол и пропанол, тетрагидрофурана, ацетонитрила, ацетона и их комбинации. Например, органический растворитель добавляют к свободной соли алкилкарбамоилнафталенилокси октеноилгидроксиамида или его производного и затем наблюдают, выпадает ли осадок, то есть образуется ли соль. При необходимости, чтобы посмотреть, выпадает ли осадок, может быть дополнительно добавлен растворитель, имеющий более низкую растворяющую способность, чем растворяющая способность добавленного органического растворителя. Для получения соли добавление растворителя, имеющего более низкую растворяющую способность, можно повторять от 2 до 5 раз, например, 2 раза.
Фармацевтически приемлемая соль алкилкарбамоилнафталенилоксиоктеноилгидроксиамида или его производного согласно настоящему изобретению имеет содержание воды менее 3% при хранении при температуре от 20 до 25°С и влажности 50% или меньше в течение 3 дней, например, 2% или меньше.
Согласно одному из вариантов осуществления, соединение по настоящему изобретению может иметь количество образующихся сопутствующих примесей менее 5% при хранении при температуре от 20 до 25°С в течение 3 дней, например, менее 1%, например, менее 0,5%, например, 0,05% или меньше. Сопутствующая примесь может относиться к примеси или побочному продукту, которые могут образовываться наряду с требуемым соединением в процессе получения соединения.
Согласно настоящему изобретению, за счет получения алкилкарбамоилнафталенилоксиоктеноилгидроксиамида или его производного в форме фармацевтически приемлемой соли можно улучшить стабильность препарата, способствуя тем самым массовому производству фармацевтической композиции противоопухолевого средства, содержащей его в качестве активного ингредиента. В частности, могут быть упразднены некоторые дополнительные процессы очистки, необходимые для предотвращения образования сопутствующих примесей, обусловленных способностью сорбировать влагу, что сделает процесс более экономичным. Кроме того, можно дополнительно решить проблему дополнительной потребности в хранении при низкой температуре или технологии упаковки, необходимых для поддержания нестабильного состояния затвердевшего препарата при комнатной температуре и сведения к минимуму контакта с влагой.
Для того чтобы специалисты в данной области техники могли легко осуществить настоящее изобретение, далее будут подробно описаны варианты осуществления данного изобретения. Однако настоящее изобретение может быть осуществлено во многих других формах, и его не следует рассматривать как ограниченное изложенными в данной работе вариантами осуществления.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Подготовительный пример 1
Выбор органического растворителя
Для того чтобы выбрать подходящий органический растворитель, определяли растворимость соединения алкилкарбамоилнафталенилоксиоктеноилгидроксиамида формулы (1) в каждом из органических растворителей. Для испытания на растворимость брали приблизительно по 10 мл каждого органического растворителя при комнатной температуре и добавляли алкилкарбамоилнафталенилоксиоктеноилгидроксиамид до степени перенасыщения. Массу перемешивали в течение 2 часов, после чего центрифугировали при 10000 об/мин для получения надосадочной жидкости. Надосадочную жидкость разбавляли метанолом и методом ВЭЖХ (англ. HPLC, High Performance Liquid Chromatography - высокоэффективная жидкостная хроматография) определяли растворимость в каждом из органических растворителей. Результаты представлены в Таблице 1 ниже.
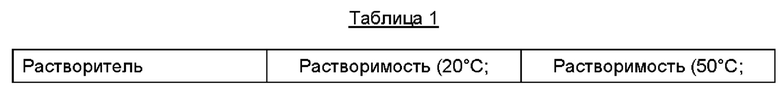
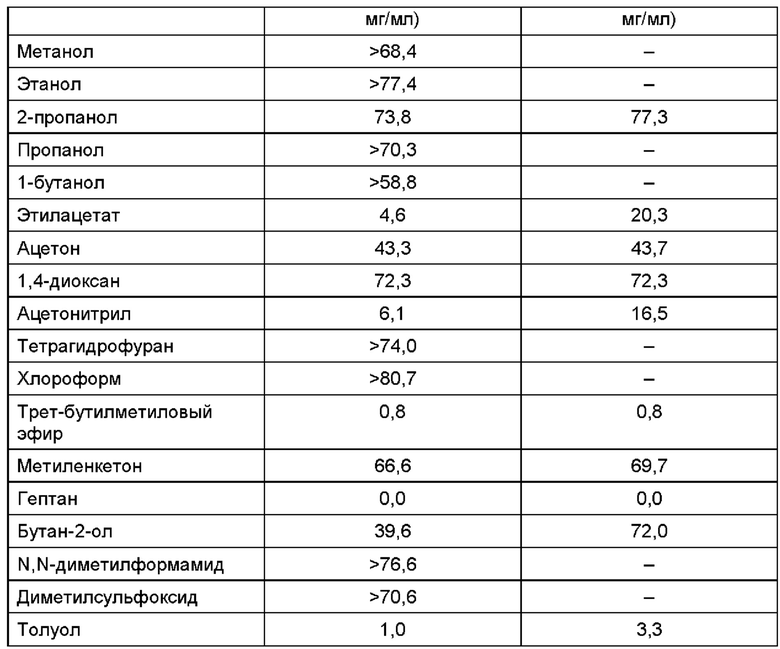
На основании данных Таблицы 1 можно утверждать, что растворимость соединения алкилкарбамоилнафталенилоксиоктеноилгидроксиамида формулы (1) является относительно высокой в случаях, когда в качестве органического растворителя используют метанол, этанол, пропанол, тетрагидрофуран, хлороформ, N,N-диметилформамид (ДМФА) или диметилсульфоксид (ДМСО). Кроме того, можно утверждать, что при растворении его в ацетонитриле или этилацетате растворимость является относительно низкой, а в трет-бутилметиловом эфире (ТБМЭ, англ. ТВМЕ), гептане или толуоле соединение практически не растворяется.
Подготовительный пример 2
Получение соли
Для оценки возможности образования соли соединения алкилкарбамоилнафталенилоксиоктеноилгидроксиамида формулы (1) проводили скрининг солей.
Каждое из кислых веществ, упомянутых в Таблице 2, полностью растворяли в метаноле и затем медленно прибавляли к свободной соли соединения алкилкарбамоилнафталенилоксиоктеноилгидроксиамида формулы (1) с последующим заполнением азотом и герметизацией. Смесь хранили при комнатной температуре в течение 24 часов, наблюдая за выпадением осадка, и при необходимости при испытании на растворимость выбирали и дополнительно добавляли растворитель со значительно меньшей растворимостью соединения формулы (1) с последующим наблюдением за выпадением осадка.
После добавления растворителя с низкой растворяющей способностью наблюдение за выпадением осадка повторяли до двух раз. И, наконец, осуществляли вакуумную сушку при пониженном давлении, после чего оценивали стабильность. Результаты представлены в Таблице 3 ниже.


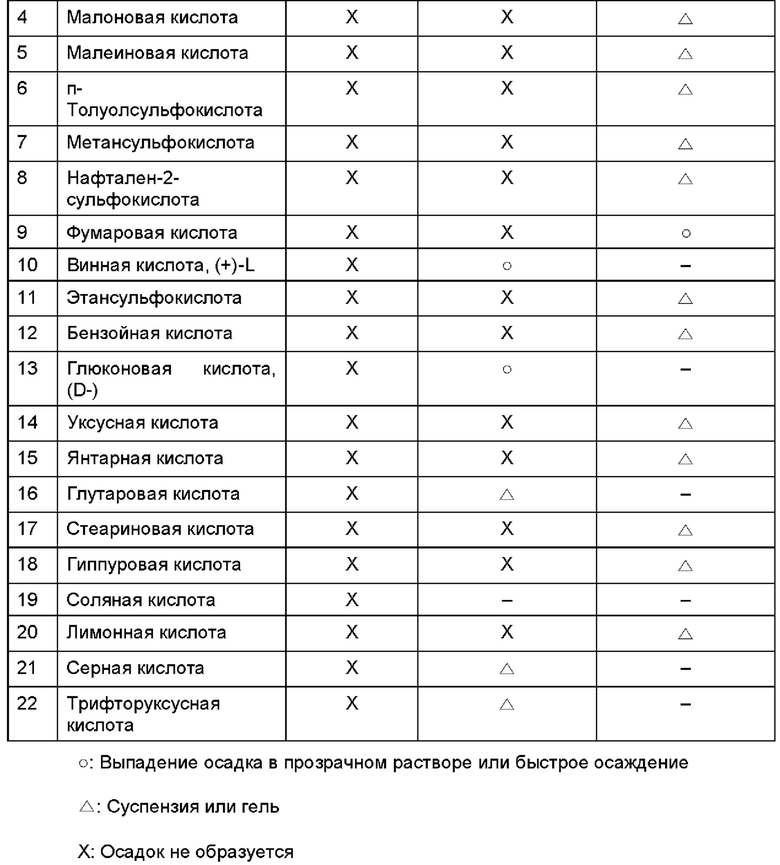
Как видно из приведенных выше Таблиц 2 и 3, при добавлении фосфорной кислоты к свободной соли алкилкарбамоилнафталенилоксиоктеноилгидроксиамида формулы (1) постепенно образуется осадок, то есть соль образуется при комнатной температуре. В случае винной кислоты и глюконовой кислоты осадок выпадает при первом добавлении растворителя с низкой растворяющей способностью (антирастворителя), а в случае фумаровой кислоты, нафтойной кислоты и 1-гидрокси-2-нафтойной кислоты осадок выпадает при втором добавлении растворителя с низкой растворяющей способностью. При этом в случае других кислот образуются мутная суспензия или гель высокой вязкости.
Экспериментальный пример 1
Изменение внешнего вида при комнатной температуре
Для оценки изменения внешнего вида солей в соответствии с Подготовительным примером 2 соответствующие осадки отфильтровывали и сушили в вакууме. В случае суспензии и геля их, во-первых, сушили в вакууме при пониженном давлении, а во-вторых, сушили в вакууме в течение от 24 до 48 часов.
Полученный таким образом высушенный материал оставляли при комнатной температуре на 24 часа, после чего осматривали внешний вид соединений. Результаты представлены в Таблице 4 ниже, а снимки соответствующего внешнего вида показаны на Фиг. 1 ниже.

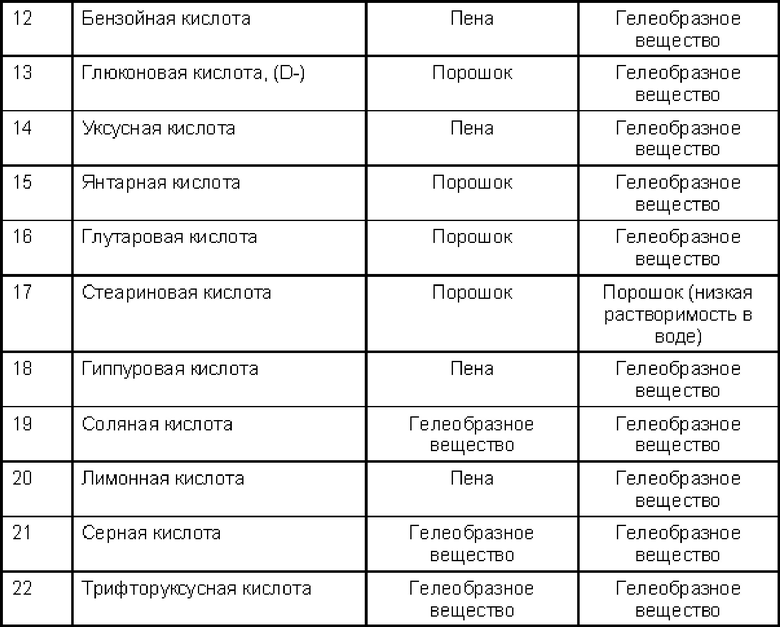
Как видно из Таблицы 4, в случае соли фосфорной кислоты, соли винной кислоты, соли стеариновой кислоты и тому подобного изменения внешнего вида не наблюдалось.
Пример Приготовление соли
[Формула 2]
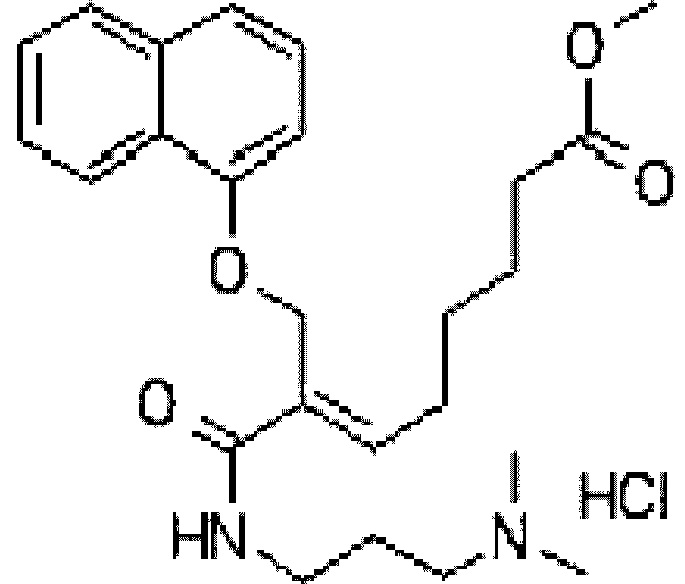
Пример 1
Приготовление тартрата алкилкарбамоилнафталенилоксиоктеноилгидроксиамида
NH2OH⋅HCl (0,75 г) добавляют в трехгорлую колбу емкостью 50 мл, прибавляют безводный МеОН (7,5 мл, содержание воды 0,01% или меньше) и перемешивают при температуре от 10 до 20°С, затем охлаждают до температуры от -25 до -30°С. В перемешанный раствор добавляют 30% раствор NaOMe в МеОН (4,67 г, 12 эквивалентов), поддерживая при этом температуру на уровне от -25 до -30°С, и перемешивают при этой температуре в течение 40 минут. В реакционную массу добавляют соединение формулы (2) (1 г), являющееся промежуточным продуктом, и перемешивают при этой температуре в течение 2 часов. После завершения реакции медленно прибавляют 50% водный раствор L-TTA (2,2 г) при температуре -20°С или ниже, затем добавляют очищенную воду (12 мл), поддерживая температуру на уровне -10°С, и дополнительно добавляют очищенную воду (12 мл) при температуре 0°С или ниже. После добавления DCM (англ. dichloromethane - дихлорметан) (7 мл) при комнатной температуре и перемешивания в течение 5 минут органический слой отделяют и собирают водный слой. После трехкратного повторения такой операции промывки водный слой охлаждают до температуры 5°С, величину рН доводят до 9,3 с помощью 25%-ного водного раствора Na2CO3 (4 г), добавляют этилацетат (15 мл) и перемешивают в течение 5 минут для экстракции. Операцию повторяют четыре раза для сбора органического растворителя. В отделенный органический слой добавляют 50% раствор L-TTA (2 г), разбавленный очищенной водой (18 мл), перемешивают в течение 5 минут и затем экстрагируют водный слой (температуру поддерживают ниже 5°С, а величину рН водного слоя поддерживают на уровне 3,5~4,0). В экстрагированный водный слой добавляют 50% L-TTA (2,8 г) для регулирования величины рН 2,5~2,8. В экстрагированный водный слой добавляют промытый НР20 (23 г) и перемешивают при температуре от 0 до 5°С в течение 1 часа для адсорбции, после чего фильтруют. Избыток промытого НР20 (3 г) помещают в нижнюю часть трубки колонки, загружают адсорбированный НР20 в водном слое и элюируют в условиях, приведенных в таблице ниже.


Собирают только элюат, полученный при помощи 30% ACN (англ. acetonitrile - ацетонитрил) в очищенной воде, и концентрируют его при пониженном давлении и температуре ниже 30°С для удаления ACN. Концентрированный раствор отверждают при помощи лиофильной установки и получают соль ТТА CG0200745 (получено: 520 мг, выход: 48%, чистота: 99,57%).
Пример 2
Приготовление Фосфата алкилкарбамоилнафталенилоксиоктеноилгидроксиамида
В реактор помещают HO-NH2HCl (13,66 г, 196,58 ммоль, 5 эквивалентов), добавляют МеОН (136,6 мл) и перемешивают, затем охлаждают до температуры от -25 до -30°С. Добавляют NaOMe (30% в МеОН, 85,0 г, 472,01 ммоль, 12 эквивалентов), поддерживая температуру ниже -10°С, охлаждают до температуры -25 ~ -30°С и перемешивают в течение 40 минут. В реакционную массу добавляют соединение формулы (2) (18,2 г, 39,31 ммоль), являющееся промежуточным продуктом, и проводят реакцию в течение от 2 до 3 часов, поддерживая температуру в диапазоне от -20 до -25°С. После завершения реакции добавляют 50% водный раствор L-винной кислоты (40,0 г), приготовленный заранее, при температуре ниже -20°С, затем добавляют очищенную воду (436,8 мл) при температуре ниже 0°С. После растворения при температуре ниже 5°С величину рН доводят до от 6,5 до 7, добавляя 50% водный раствор L-винной кислоты (13,5 г) (после регулирования рН водный раствор ТТА выбрасывают, если он остался, в противном случае готовят дополнительно). Когда температура повышается до 15-20°С, реакционную массу промывают МС (273 мл). После разделения слоев в водный слой добавляют активированный уголь SA-1500 (5,4 г) и перемешивают в течение 20 минут. Активированный уголь SA-1500 отфильтровывают и промывают очищенной водой. Доводят величину рН полученного водного раствора до от 9,3 до 9,5, добавляя в него 25% водный раствор Na2CO3 (72,8 г). Поддерживая температуру на уровне от 15 до 20°С, в водный раствор добавляют МС (273 мл) для экстрагирования органических соединений. Отделенный органический слой охлаждают до температуры 5~10°С и затем экстрагируют водным раствором Н3РO4 (85% Н3РO4, растворяют 4,53 г Н3РO4 в 72,8 мл очищенной воды). В отделенный водный слой добавляют ацетон (491,4 мл), и смесь перемешивают при температуре от 15 до 20°С в течение 1 часа. Выпавшие кристаллы отфильтровывают и промывают ацетоном (36,4 мл). Влажный продукт сушат при пониженном давлении в течение 6 часов при температуре ниже 30°C с получением технической соли Н3РO4 CG200745 (получено: 11,77 г, выход: 57,0%). Полученную соль полностью растворяют в очищенной воде (58,8 мл), затем добавляют ацетон (353 мл) и перемешивают при температуре от 15 до 20°С в течение 1 часа. Выпавшие кристаллы отфильтровывают и промывают ацетоном (36,4 мл). Влажный продукт сушат при пониженном давлении в течение 6 часов при температуре ниже 30°С с получением соли Н3РО4 CG200745 (Получено: 10 г, выход: 85,0%, ВЭЖХ чистота: 99,5%, менее 0,1% каждой примеси).
Пример 1-1
Приготовление лиофилизированной инъекции тартрата алкилкарбамоилнафталенилоксиоктеноилгидроксиамида 120,0 г тартрата алкилкарбамоилнафталенилоксиоктеноилгидроксиамида добавляют в 4,0 л воды для инъекций при барботировании азота в течение 15 минут и растворяют в течение 30 минут при перемешивании со скоростью 400 об/мин. После фильтрации смесь разделяют на порции по 1 мл в стерильные промытые флаконы коричневого цвета и лиофилизуют для приготовления инъекции (30 мг/флакон). Инъекция соли винной кислоты хранится в прозрачных стеклянных флаконах коричневого цвета в виде твердого вещества от белого до бледно-розового цвета и может быть растворена при использовании.
Пример 2.1
Приготовление лиофилизированной инъекции фосфата алкилкарбамоилнафталенилоксиоктеноилгидроксиамида 125,0 г и 250,0 г фосфата алкилкарбамоилнафталенилоксиоктеноилгидроксиамида добавляют в 4 л воды для инъекций при барботировании азота в течение 15 минут, соответственно, и растворяют в течение 30 минут при перемешивании со скоростью 400 об/мин. После фильтрации смесь разделяют на порции по 4 мл в стерильные промытые флаконы коричневого цвета и лиофилизуют для приготовления инъекции (125 мг/флакон и 250 мг/флакон). Инъекция соли фосфорной кислоты хранится в прозрачных стеклянных флаконах коричневого цвета в виде твердого вещества от белого до бледно-розового цвета и может быть растворена при использовании.
Экспериментальный пример
Оценка стабильности
Для оценки стабильности соединения в соответствии с описанными выше примерами в качестве Сравнительного примера 1 определяли каждый из следующих параметров - внешний вид, содержание воды и количество сопутствующих примесей - для свободной соли алкилкарбамоилнафталенилоксиоктеноилгидроксиамида формулы (1).
Оценка стабильности включает в себя наблюдение за изменениями при хранении в условиях комнатной температуры (от 20 до 25°С, 50% или меньше), при длительном хранении (25±2°С и 60±5% RH (англ. relative humidity - относительная влажность воздуха)), ускоренном старении (40±2°С и 75±5% RH) и в жестких условиях (60±2°С).
Экспериментальный пример 1
Оценка изменения содержания влаги
Для оценки изменения содержания влаги соединения в соответствии с Примерами и Сравнительными примерами хранили в открытом виде при комнатной температуре (от 20 до 25°С, 50% или меньше) и определяли изменение по разнице между начальным содержанием влаги и содержанием влаги по истечении 3 дней. Результаты представлены на Фиг. 2 ниже.
Как показано на Фиг. 2, в Сравнительном примере 1 содержание влаги увеличилось приблизительно на 3%, в Примере 1 содержание влаги увеличилось на 2%, а в Примере 2 изменение содержания влаги составило приблизительно 0,01%, то есть было очень незначительным.
Экспериментальный пример 2
Оценка изменения внешнего вида
Для оценки изменения внешнего вида соединений в соответствии со Сравнительными примерами и Примерами наблюдали за изменениями каждого из соединений после их хранения в соответствии с условиями, указанными ниже в Таблице 6.

Из Таблицы 6 можно видеть, что в случае Сравнительного примера 1 происходило поглощение влаги, а внешний вид изменялся от исходной пены, такой как губка, до высоковязкой жидкой или гелеобразной структуры после 1 дня (24 часов), в случае же Примера 2 внешний вид оставался без изменения независимо от условий.
Экспериментальный пример 3
Оценка изменения содержания
Для оценки изменения содержания соединений в соответствии с Примерами каждое из соединений хранили в открытом виде или упакованным в полиэтиленовый флакон (с добавлением силикагеля). Результаты, полученные при хранении в открытом виде, представлены в Таблице 7 ниже, а результаты, полученные при хранении в упаковке, представлены в Таблице 8 ниже.
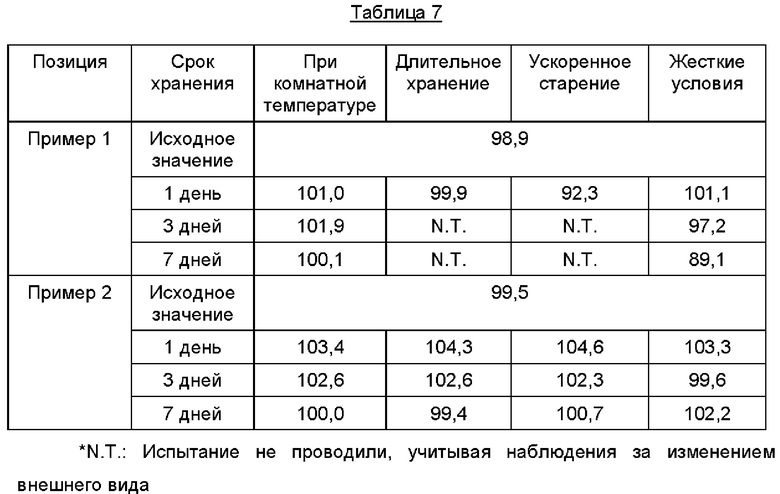

Как видно из Таблиц 7 и 8, в случае Примера 1 содержание сохраняется постоянным при комнатной температуре независимо от состояния упаковки, а в случае Примера 2 содержание сохраняется постоянным независимо от состояния упаковки, воздействия тепла и влажности.
Экспериментальный пример 4
Оценка изменения количества сопутствующих примесей
Для оценки изменения количества сопутствующих примесей в соединениях в соответствии со Сравнительными примерами и Примерами каждое из соединений хранили в открытом виде при комнатной температуре в течение 3 дней. Результаты представлены на Фиг. 3. Как показано на Фиг. 3, в случае Сравнительного примера 1 количество сопутствующих примесей увеличилось приблизительно на 10%, тогда как в случае Примера 1 изменение составило 0,05%, а в случае Примера 2 - 0,02%, что указывает на относительно небольшое увеличение.
В дополнение к этому, для соединений в соответствии с Примерами 1 и 2 на представленных ниже Фиг. 4 и 5 показано изменение количества образования сопутствующих примесей в зависимости от температуры и срока хранения. Как видно из Фиг. 4, в случае Примера 1 количество образования сопутствующих примесей сохранялось в определенном диапазоне при относительно низкой температуре. Как показано на Фиг. 5, в случае Примера 2 можно видеть, что количество образования сопутствующих примесей сохраняется одинаковым в определенном диапазоне приблизительно 0,22% независимо от температуры и времени хранения.
Как можно видеть из результатов приведенного выше экспериментального примера, было подтверждено, что фармацевтическая соль алкилкарбамоилнафталенилоксиоктеноилгидроксиамида согласно настоящему изобретению обладает улучшенной стабильностью за счет сведения к минимуму влияния условий хранения, температуры, влажности и т.д.
Хотя настоящее изобретение было частным образом показано и описано применительно к конкретным вариантам его осуществления, специалистам в данной области техники должно быть очевидно, что это конкретное описание является лишь предпочтительным вариантом осуществления и что объем изобретения не ограничивается этим. Исходя из этого предполагается, что объем изобретения будет определяться прилагаемой формулой изобретения и ее эквивалентами.





Настоящее изобретение относится к соли фосфорной кислоты или соли винной кислоты алкилкарбамоилнафталенилоксиоктеноилгидроксиамида формулы (1), где R1 представляет собой C1-3-алкил, замещенный одним заместителем, выбранным из ди-C1-3-алкиламино. Изобретение также относится к способу получения указанных солей. Технический результат: получены новые соли алкилкарбамоилнафталенилоксиоктеноилгидроксиамида с улучшенной стабильностью и гигроскопичностью, которые могут найти применение в медицине в качестве противоопухолевого средства. 2 н. и 6 з.п. ф-лы, 8 табл., 2 пр., 5 ил.
[Формула 1]

1. Соль фосфорной кислоты или соль винной кислоты алкилкарбамоилнафталенилоксиоктеноилгидроксиамида формулы (1):
[Формула 1]
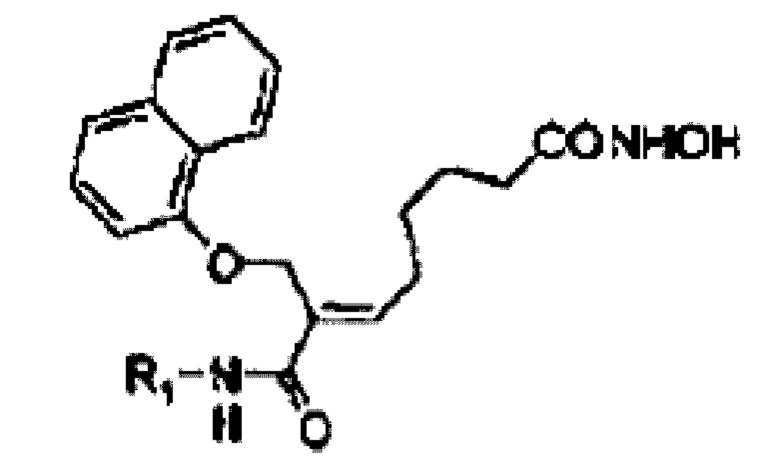
где R1 представляет собой C1-3-алкил, замещенный одним заместителем, выбранным из ди-C1-3-алкиламино.
2. Соль фосфорной кислоты алкилкарбамоилнафталенилоксиоктеноилгидроксиамида по п. 1, где алкилкарбамоилнафталенилоксиоктеноилгидроксиамид представляет собой (E)-N1-(3-(диметиламино)пропил)-N8-гидрокси-2-((нафтален-1-илокси)метил)октендиамид.
3. Способ получения соли по п. 1, включающий стадии, на которых:
1) добавляют органический растворитель в алкилкарбамоилнафталенилоксиоктеноилгидроксиамид формулы (1) для экстракции свободного основания и
2) добавляют кислоту в раствор свободного основания, при этом кислота выбрана из фосфорной кислоты, винной кислоты и их комбинации.
4. Способ по п. 3, где способ также включает стадию 3) дополнительного добавления растворителя с более низкой растворяющей способностью, чем растворяющая способность растворителя на стадии 1).
5. Способ по п. 4, где растворитель, имеющий более низкую растворяющую способность, чем растворяющая способность растворителя на стадии 1), выбран из спиртов, включая метанол, этанол и пропанол, тетрагидрофурана, ацетонитрила, ацетона и их комбинации.
6. Способ по п. 3, где органический растворитель на стадии 1) выбран из метанола, этанола, пропанола, тетрагидрофурана, хлороформа, N,N-диметилформамида (ДМФА), диметилсульфоксида (ДМСО), ацетонитрила, этилацетата и их комбинации.
7. Соль по п. 1, где соль имеет содержание воды менее 3% при хранении при комнатной температуре в течение 3 дней.
8. Соль по п. 1, где количество образующихся сопутствующих примесей составляет менее 3% при хранении при температуре от 20 до 30°C в течение 3 дней.
| WO 2008054154 A1, 08.05.2008 | |||
| WO 2007052938 A1, 10.05.2007 | |||
| WO 2010067980 A2, 17.06.2010 | |||
| СОЛИ ВАЛНЕМУЛИНА И ОРГАНИЧЕСКИХ КИСЛОТ | 2006 |
|
RU2401256C2 |
| ПРОИЗВОДНЫЕ АРИЛАЛКИЛКАРБАМАТОВ, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ | 2004 |
|
RU2400472C2 |
Авторы
Даты
2020-11-12—Публикация
2018-04-18—Подача