Область техники
Настоящее изобретение относится к применению антигенсвязывающих молекул для элиминации антигенов из плазмы; к способам элиминации антигенов из плазмы, которые включают введение антигенсвязывающих молекул; к фармацевтическим композициям, содержащим антигенсвязывающие молекулы, которые способны элиминировать антигены из плазмы; и к способам получения антигенсвязывающих молекул для элиминации антигенов из плазмы.
Уровень техники
Антитела привлекают внимание в качестве лекарственных средств, так как они обладают высокой стабильностью в плазме и обладают малым количеством побочных эффектов. В настоящее время ряд терапевтических антител IgG-типа являются коммерчески доступными, и на сегодняшний день разрабатываются многие терапевтические антитела (непатентные документы 1 и 2). Между тем, описаны различные способы, применимые для второго поколения терапевтичских антител, включающие способы, которые усиливают эффекторную функцию, антигенсвязывающую способность, фармакокинетику и стабильность, и способы, которые снижают риск развития иммуногенности (непатентный документ 3). Как правило, требуемая доза терапевтического антитела является очень высокой. Это, в свою очередь, привело к возникновению проблем, таких как высокая стоимость производства, а также к трудностям при получении подкожных составов. В теории, доза терапевтического антитела может быть снижена путем улучшения фармакокинетики антитела или повышения аффинности между антителами и антигенами.
В литературе описаны способы улучшения фармакокинетики антител с использованием искусственных замен аминокислот в константных областях (непатентные документы 4 и 5). Аналогично описано созревание аффинности в качестве способа улучшения антигенсвязывающей активности антитела и/или активности антитела в отношении нейтрализации антигена (непатентный документ 6). Этот способ дает возможность увеличения антигенсвязывающей способности посредством внесения аминокислотной мутации в области CDR вариабельной области и т.п. Повышение антигенсвязывающей способности обеспечивает улучшение биологической активности in vitro или обеспечивает возможность снижения дозы и дополнительно обеспечивает повышенную эффективность in vivo (непатентный документ 7).
Способность одной молекулы антитела, обладающей нейтрализующей активностью, нейтрализовать антиген зависит от ее аффинности. Таким образом, аффинность антител усиливают с использованием различных способов для нейтрализации антигенов небольшим количеством антител (непатентный документ 6). Более того, если бы аффинность антитела к антигену можно было сделать бесконечной посредством ковалентного связывания антигена, одна молекула антитела могла бы нейтрализовать одну молекулу антигена (двухвалентное антитело могло бы нейтрализовать две молекулы антигена). Однако стехиометрия реакции нейтрализации одной молекулы антитела против одной молекулы антигена (одного двухвалентного антитела против двух антигенов) является лимитирующим фактором для таких способов, и, таким образом, невозможно полностью нейтрализовать антиген количеством антитела, меньшим, чем количество антигена. Иными словами, эффект нейтрализации антигена путем усиления аффинности имеет предел (непатентный документ 8). Для продления нейтрализующего эффекта нейтрализующего антитела в течение определенного периода антитело должно быть введено в дозе, более высокой, чем количество антигенов, продуцируемых в организме в течение такого же периода. Таким образом, в случае улучшения только фармакокинетики антител или технологии созревания аффинности, как описано выше, существует ограничение в отношении снижения требуемой дозы антитела. Таким образом, для поддержания эффекта нейтрализации антигена в течение заданного периода времени с помощью антител в количестве, меньшем, чем количество антигена, одно антитело должно нейтрализовать множество антигенов. Недавно была описана антигенсвязывающая молекула, которая связывается с антигеном зависимым от pH и/или концентрации ионов металла образом, в качестве нового способа для достижения описанной выше задачи (патентные документы 1 и 2). Зависимые от концентрации ионов антигенсвязывающие молекулы, которые прочно связываются с антигеном в условиях нейтральных значений pH и/или высокой концентрации ионов кальция в плазме и диссоциируют от антигена в условиях кислых значений pH и/или низкой концентрации ионов кальция в эндосоме, могут диссоциировать от антигена в эндосоме. Когда зависимая от концентрации ионов антигенсвязывающая молекула диссоциирует от антигена и рециркулирует в плазму посредством FcRn, она может повторно связываться с другим антителом. Таким образом, одна зависимая от концентрации ионов антигенсвязывающая молекула может многократно связываться с несколькими антигенами.
С другой стороны, удержание антигена в плазме является очень кратковременным по сравнению с антителами, рециклирующими посредством связывания FcRn. Однако, даже несмотря на то, что время удержания в плазме самого антигена является коротким, когда типичное антитело с таким длительным временем удержания в плазме связывается с антигеном, время удержания комплекса антиген-антитело в плазме увеличивается подобно времени удержания антитела. Таким образом, обычно, когда вводят антитело, антиген, связанный антителом, существует в форме комплекса антиген-антитело, который продлевает время удержания антигена в плазме (антиген нелегко элиминируется из плазмы), и вызывает увеличение концентрации антигена в плазме. С другой стороны, зависимая от концентрации ионов антигенсвязывающая молекула может подавлять увеличение концентрации антигена в плазме путем диссоциации от антигена в эндосоме. Однако на это подавление увеличения концентрации антигена в плазме оказывает влияние количество антигенов, продуцируемых in vivo. Таким образом, рассматривалась возможность того, что введение таких зависимых от концентрации ионов антигенсвязывающих молекул может увеличивать концентрацию антигена в плазме по сравнению с тем, что было до введения (патентный документ 3).
Недавно были получены антигенсвязывающие молекулы, которые связываются с FcRn в нейтральных условиях. Введение антигенсвязывающей молекулы, которая связывается с антигеном зависимым от концентрации ионов образом и связывается с FcRn в нейтральных условиях, показало, что молекула может снижать концентрацию антигена в плазме по сравнению с тем, что было до введения (патентный документ 3). В то время как типичные антитела увеличивают концентрацию антигена в плазме при введении, антигенсвязывающие молекулы, обладающие активностью связывания FcRn в условиях нейтральных значений pH, и антигенсвязывающие молекулы, которые связываются с антигеном зависимым от концентрации ионов образом и обладают активностью связывания FcRn в условиях нейтральных значений pH, могут снижать концентрацию антигена в плазме, когда их вводят. Поскольку такие антигенсвязывающие молекулы могут активно элиминировать антигены из плазмы посредством эндоцитоза, который происходит в результате связывания с FcRn, эти молекулы являются в высокой степени пригодными в качестве фармацевтических средств.
С другой стороны, помимо FcRn, существует несколько Fcγ-рецепторов (FcγRI, FcγRIIa, FcγRIIb и FcγRIIIa) в качестве рецепторов для IgG (непатентный документ 9). Поскольку активность связывания антител с активирующими Fcγ-рецепторами играет важную роль в цитотоксичности антитела, на настоящий момент разработаны антитела, нацеленные на антигены мембраны, цитотоксичность которых усилена путем усиления их активности связывания с активирующими Fcγ-рецепторами (непатентные документы 10 и 11). Аналогично, поскольку активность связывания с ингибиторным Fcγ-рецептором (FcγRIIb) играет важную роль в активности иммунной супрессии (непатентные документы 12, 13 и 14), агонистической активности (непатентные документы 15 и 16) и т.п., в настоящее время исследуются антитела, нацеленные на мембранные антигены, которые обладают усиленной активностью связывания с ингибиторными Fcγ-рецепторами (непатентные документы 17 и 18).
Эффекты антител, которые связываются с растворимыми антигенами, на связывание FcγR исследовались в основном с точки зрения побочных эффектов. Например, известно, что риск тромбоэмболии увеличивался в группе пациентов, которым вводили бевацизумаб, антитело против VEGF (непатентный документ 19). Аналогично, тромбоэмболию наблюдали в тестах клинического испытания антител против CD40-лиганда, и клиническое испытание было прекращено (непатентный документ 20). FcγRIIa, активирующий Fcγ-рецептор, экспрессируется на тромбоцитах, в то время как ингибиторный Fcγ-рецептор FcγRIIb не экспрессируется на них (непатентный документ 21), и последующие исследования с использованием моделей на животных и т.п. позволили предположить, что оба из введенных антител агрегируют тромбоциты через связывание с FcγRIIa на тромбоцитах, и в результате формируют кровяные сгустки (непатентные документы 22 и 23). У пациентов с системной красной волчанкой, которая представляет собой аутоиммунное заболевание, тромбоциты активируются посредством FcγRIIa-зависимого механизма, и сообщалось, что активация тромбоцитов коррелирует с тяжестью симптомов (непатентный документ 24). Более того, существуют сообщения, что, когда антитело с усиленным связыванием FcγRIIb используют в качестве фармацевтического средства, можно ожидать снижения риска продукции антител (непатентный документ 25), и антитело, которое связывается с мембранным антигеном, у которого усилено связывание FcγRIIa, усиливает антителозависимый фагоцитоз клеток (ADCP) через макрофаги и дендритные клетки (непатентный документ 26). Однако не было известно, что активность связывания с активирующими и/или ингибиторными Fcγ-рецепторами антител, нацеленных на растворимые антигены, обладает эффектом на кинетику в плазме антител или антигенов, связанных антителами, в организмах, в которые вводили антитела.
Документы уровня техники
[Патентные документы]
[Патентный документ 1] WO 2009/125825
[Патентный документ 2] WO 2012/073992
[Патентный документ 3] WO 2011/122011
[Непатентные документы]
[Непатентный документ 1] Janice M. Reichert, Clark J. Rosensweig, Laura B. Faden & Matthew C. Dewitz, Monoclonal antibody successes in the clinic., Nat. Biotechnol. (2005) 23, 1073-1078
[Непатентный документ 2] Pavlou A.K., Belsey M.J., The therapeutic antibodies market to 2008., Eur. J. Pharm. Biopharm., (2005) 59(3), 389-396
[Непатентный документ 3] Kim S.J., Park Y., Hong H.J., Antibody engineering for the development of therapeutic antibodies., Mol. Cells, (2005) 20(1), 17-29
[Непатентный документ 4] Hinton P.R., Xiong J.M., Johlfs M.G., Tang M.T., Keller S., Tsurushita N., An engineered human IgGl antibody with longer serum half-life., J. Immunol. (2006) 176(1), 346-356
[Непатентный документ 5] Ghetie V., Popov S., Borvak J., Radu C., Matesoi D., Medesan C., Ober R.J., Ward E.S., Increasing the serum persistence of an IgG fragment by random mutagenesis., Nat, Biotechnol. (1997) 15(7), 637-640
[Непатентный документ 6] Rajpal A., Beyaz N., Haber L., Cappuccilli G., Yee H., Bhatt R.R., Takeuchi T., Lemer R.A., Crea R., A general method for greatly improving the affinity of antibodies by using combinatorial libraries., Proc. Natl. Acad. Sci. U. S. A. (2005) 102(24), 8466-8471
[Непатентный документ 7] Wu H., Pfarr D.S., Johnson S., Brewah Y.A., Woods R.M., Patel N.K., White W.I., Young J.F., Kiener P.A., Development of Motavizumab, an Ultra-potent Antibody for the Prevention of Respiratory Syncytial Virus Infection in the Upper and Lower Respiratory Tract., J. Mol. Biol. (2007) 368, 652-665
[Непатентный документ 8] Hanson C.V., Nishiyama Y., Paul S., Catalytic antibodies and their applications., Curr. Opin. Biotechnol. (2005) 16(6), 631-636
[Непатентный документ 9] Jefferis R., Lund J., Interaction sites on human IgG-Fc for FcgammaR: current models., Immunol. Lett. (2002) 82, 57-65
[Непатентный документ 10] Clynes, R., Yoshizumi, T., Moroi, Y., Houghton, A.N., and Ravetch, J.V., Fc Receptors are required for passive and active immunity to melanoma., Proc. Natl. Acad. Sci. U. S. A. (1998) 95, 652-656
[Непатентный документ 11] Clynes R.A., Towers T.L., Presta L.G., Ravetch J.V., Inhibitory Fc receptors modulate in vivo cytoxicity against tumor targets., Nat. Med. (2000) 6, 443-446
[Непатентный документ 12] Wernersson S., Karlsson M.C., Dahlstrom J., Mattsson R., Verbeek J.S., Heyman B., IgG-mediated enhancement of antibody responses is low in Fc receptor gamma chain-deficient mice and increased in Fc gamma RII-deficient mice., J. Immunol. (1999) 163(2), 618-622
[Непатентный документ 13] Yuasa T., Kubo S., Yoshino T., Ujike A., Matsumura K., Ono M., Ravetch J.V., Takai T., Deletion of fcgamma receptor IIB renders H-2(b) mice susceptible to collagen-induced arthritis., J. Exp. Med. (1999) 189(1), 187-194
[Непатентный документ 14] Nakamura A., Yuasa T., Ujike A., Ono M., Nukiwa T., Ravetch J.V., Takai T., Fcgamma receptor IIB-deficient mice develop Goodpasture's syndrome upon immunization with type IV collagen: a novel murine model for autoimmune glomerular basement membrane disease., J. Exp. Med. (2000) 191(5), 899-906
[Непатентный документ 15] Li F., Ravetch J.V., Inhibitory Fey receptor engagement drives adjuvant and anti-tumor activities of agonistic CD40 antibodies., Science (2011) 333 (6045), 1030-1034
[Непатентный документ 16] Wilson N.S., Yang B., Yang A., Loeser S., Marsters S., Lawrence D., Li Y., Pitti R., Totpal K., Yee S., Ross S., Vernes J.M., Lu Y., Adams C., Offringa R., Kelley B., Hymowitz S., Daniel D., Meng G., Ashkenazi A., An Fсy receptor-dependent mechanism drives antibody-mediated target-receptor signaling in cancer cells., Cancer Cell (2011) 19(1), 101-113
[Непатентный документ 17] Moore G.L., Chen H., Karki S., Lazar G.A., Engineered Fc variant antibodies with enhanced ability to recruit complement and mediate effector functions., Mol. Immunol.(2008) 45, 3926-3933
[Непатентный документ 18] Li F., Ravetch J.V., Apoptotic and antitumor activity of death receptor antibodies require inhibitory Fсy receptor engagement., Proc. Natl. Acad. Sci. USA. (2012) 109(27) 10966-10971
[Непатентный документ 19] Scappaticci F.A., Skillings J.R., Holden S.N., Gerber H.P., Miller K., Kabbinavar F., Bergsland E., Ngai J., Holmgren E., Wang J., Hurwitz H., Arterial thromboembolic events in patients with metastatic carcinoma treated with chemotherapy and bevacizumab., J. Natl. Cancer Inst. (2007) 99(16), 1232-1239
[Непатентный документ 20] Boumpas D.T., Furie R., Manzi S., Illei G.G., Wallace D.J., Balow J.E., Vaishnaw A., A short course of BG9588 (anti-CD40 ligand antibody) improves serologic activity and decreases hematuria in patients with proliferative lupus glomerulonephritis., Arthritis. Rheum. (2003) 48(3), 719-727
[Непатентный документ 21] Mackay M., Stanevsky A., Wang T., Aranow C., Li M., Koenig S., Ravetch J.V., Diamond B., Selective dysregulation of the FcgammaIIB receptor on memory B cells in SLE., J. Exp. Med. (2006) 203(9), 2157-2164
[Непатентный документ 22] Meyer T., Robles-Carrillo L., Robson T., Langer F., Desai H., Davila M., Amaya M., Francis J.L., Amirkhosravi A., Bevacizumab immune complexes activate platelets and induce thrombosis in FCGR2A transgenic mice., J. Thromb. Haemost. (2009) 7(1), 171-181
[Непатентный документ 23] Robles-Carrillo L., Meyer T., Hatfield M., Desai H., Davila M., Langer F., Amaya M., Garber E., Francis J.L., Hsu Y.M., Amirkhosravi A., Anti-CD40L immune complexes potently activate platelets in vitro and cause thrombosis in FCGR2A transgenic mice., J. Immunol. (2010) 185(3), 1577-1583
[Непатентный документ 24] Duffau P., Seneschal J., Nicco C., Richez C., Lazaro E., Douchet I., Bordes C., Viallard J.F., Goulvestre C., Pellegrin J.L., Weil B., Moreau J.F., Batteux F., Blanco P., Platelet CD154 potentiates interferon-alpha secretion by plasmacytoid dendritic cells in systemic lupus erythematosus., Sci. Transl. Med. (2010) 2(47), 47-63
[Непатентный документ 25] Desai D.D., Harbers S.O., Flores M., Colonna L., Downie M.P., Bergtold A., Jung S., Clynes R., Fc gamma receptor IIB on dendritic cells enforces peripheral tolerance by inhibiting effector T cell responses., J. Immunol. (2007) 178(10), 6217-6226
[Непатентный документ 26] Richards J.O., Karki S., Lazar G.A., Chen H., Dang W., Desjarlais J.R., Optimization of antibody binding to FcgammaRIIa enhances macrophage phagocytosis of tumor cells, Mol. Cancer Ther. (2008) 7(8) 2517-2527
Сущность изобретения
[Проблемы, решаемые с помощью изобретения]
Настоящее изобретение было осуществлено ввиду описанных выше обстоятельств. Как упоминалось выше, не было известно, что активность связывания с активирующими и/или ингибирующими Fcγ-рецепторами антител, нацеленными на растворимые антигены, обладает эффектом на кинетику в плазме антител или антигенов, связываемых антителами, в организмах, в которые вводили антитела. Более конкретно, задачей настоящего изобретения является подавление увеличения концентрации в плазме антигена, связанного антигенсвязывающей молекулой, путем введения антигенсвязывающей молекулы, которая обладает активностью связывания с патогенным антигеном, присутствующим в растворимой форме в плазме, а также обладает желаемой активностью связывания с активирующими и/или ингибирующими Fcγ-рецепторами. Другой задачей настоящего изобретения является оптимизация связывающей активности с активирующими и/или ингибирующими Fcγ-рецепторами антигенсвязывающих молекул против вызывающих заболевание антигенов, присутствующих в плазме в растворимой форме, и, тем самым, оптимизация подавления увеличения концентрации в плазме антигенов, связываемых антигенсвязывающими молекулами.
[Способы решения проблем]
В частности, настоящее изобретение относится к антигенсвязывающим молекулам, содержащим (i) антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов, (ii) FcγR-связывающий домен, обладающий селективной активностью связывания FcγRIIb, и (iii) FcRn-связывающий домен, обладающий активностью связывания FcRn в условиях диапазона кислых значений pH, и к способам снижения концентрации антигена в плазме по сравнению с концентрацией антигена в плазме до введения антигенсвязывающей молекулы, которые включают стадию введения молекулы. Более того, настоящее изобретение относится к средствам для снижения концентрации антигена в плазме, которые содержат антигенсвязывающую молекулу, содержащую (i) антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов, (ii) FcγR-связывающий домен, обладающий активностью селективного связывания FcγRIIb, и (iii) FcRn-связывающий домен, обладающий активностью связывания FcRn в условиях диапазона кислых значений pH. Настоящее изобретение также относится к фармацевтическим композициям, которые содержат антигенсвязывающую молекулу, содержащую (i) антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов, (ii) FcγR-связывающий домен, обладающий активностью селективного связывания FcγRIIb, и (iii) FcRn-связывающий домен, обладающий активностью связывания FcRn в условиях диапазона кислых значений pH. Настоящее изобретение также относится к применениям антигенсвязывающей молекулы для снижения концентрации антигена в плазме, где молекула содержит (i) антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов; (ii) FcγR-связывающий домен, обладающий активностью селективного связывания FcγRIIb, и (iii) FcRn-связывающий домен, обладающий активностью связывания FcRn в условиях диапазона кислых значений pH. В дополнение к вышеуказанному, настоящее изобретение относится к способам получения и/или к способам скрининга антигенсвязывающих молекул. В частности, представленное ниже, хотя и не предназначено для ограничения объема изобретения, предоставлено в качестве неограничивающего варианта осуществления:
[1] применение антигенсвязывающей молекулы для элиминации антигена из плазмы, где антигенсвязывающая молекула содержит антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов, и Fc-область, в которой аминокислота в положении 238 представляет собой Asp и аминокислота в положении 271 представляет собой Gly, как указано с помощью нумерации EU;
[2] применение согласно [1], где Fc-область имеет аминокислотную замену по меньшей мере в одном или более из положений, выбранных из группы, состоящей из 233, 234, 237, 264, 265, 266, 267, 268, 269, 272, 274, 296, 326, 327, 330, 331, 332, 333, 355, 356, 358, 396, 409 и 419, как указано с помощью нумерации EU;
[3] применение согласно [2], где аминокислоты Fc-области включают любую одну или более из следующих аминокислот, указанных с помощью нумерации EU:
Asp в положении аминокислоты 233;
Tyr в положении аминокислоты 234;
Asp в положении аминокислоты 237;
Ile в положении аминокислоты 264;
Glu в положении аминокислоты 265;
любой из Phe, Met и Leu в положении аминокислоты 266;
любой из Ala, Glu, Gly и Gln в положении аминокислоты 267;
любой из Asp, Glu и Gln в положении аминокислоты 268;
Asp в положении аминокислоты 269;
любой из Asp, Phe, Ile, Met, Asn, Pro и Gln в положении аминокислоты 272;
Gln в положении аминокислоты 274;
Asp или Phe в положении аминокислоты 296;
Ala или Asp в положении аминокислоты 326;
Gly в положении аминокислоты 327;
Lys или Arg в положении аминокислоты 330;
Ser в положении аминокислоты 331;
Thr в положении аминокислоты 332;
любой из Thr, Lys и Arg в положении аминокислоты 333;
Gln в положении аминокислоты 355;
Glu в положении аминокислоты 356;
Met в положении аминокислоты 358;
любой из Asp, Glu, Phe, Ile, Lys, Leu, Met, Gln, Arg и Tyr в положении аминокислоты 396;
Arg в положении аминокислоты 409; и
Glu в положении аминокислоты 419;
[4] применение согласно любому из [1]-[3], где антигенсвязывающий домен представляет собой антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов кальция;
[5] применение согласно [4], где антигенсвязывающий домен представляет собой антигенсвязывающий домен, антигенсвязывающая активность которого варьирует так, что антигенсвязывающая активность в условиях низкой концентрации ионов кальция является более низкой, чем антигенсвязывающая активность в условиях высокой концентрации ионов кальция;
[6] применение согласно любому из [1]-[3], где антигенсвязывающий домен представляет собой антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий pH;
[7] применение согласно [6], где антигенсвязывающий домен представляет собой антигенсвязывающий домен, антигенсвязывающая активность которого варьирует так, что антигенсвязывающая активность в условиях диапазона кислых значений pH является более низкой, чем антигенсвязывающая активность в условиях диапазона нейтральных значений pH;
[8] применение согласно любому из [1]-[7], где антигенсвязывающий домен представляет собой вариабельную область антитела;
[9] применение согласно любому из [1]-[8], где Fc-область представляет собой Fc-область, в которой аминокислота в положении 238 представляет собой Asp и аминокислота в положении 271 представляет собой Gly, как указано с помощью нумерации EU, в Fc-области, включенной в любую из SEQ ID NO: 14, 15, 16 или 17;
[10] применение согласно любому из [1]-[8], где активность связывания с FcRn Fc-области в условиях диапазона кислых значений pH усилена по сравнению с активностью связывания с FcRn Fc-области, включенной в любую из SEQ ID NO: 14, 15, 16 или 17;
[11] применение согласно [10], где Fc-область с усиленным связыванием представляет собой Fc-область, обладающую аминокислотной заменой по меньшей мере в одном или более положениях, выбранных из группы, состоящей из 244, 245, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 260, 262, 265, 270, 272, 279, 283, 285, 286, 288, 293, 303, 305, 307, 308, 309, 311, 312, 314, 316, 317, 318, 332, 339, 340, 341, 343, 356, 360, 362, 375, 376, 377, 378, 380, 382, 385, 386, 387, 388, 389, 400, 413, 415, 423, 424, 427, 428, 430, 431, 433, 434, 435, 436, 438, 439, 440, 442 и 447, как указано с помощью нумерации EU, в аминокислотной последовательности Fc-области, включенной в любую из SEQ ID NO: 14, 15, 16 или 17;
[12] применение согласно [11], где Fc-область с усиленным связыванием содержит по меньшей мере одну или более аминокислот, выбранных из группы, состоящей из:
Leu в положении аминокислоты 244;
Arg в положении аминокислоты 245;
Pro в положении аминокислоты 249;
Gln или Glu в положении аминокислоты 250;
любой из Arg, Asp, Glu и Leu в положении аминокислоты 251;
любой из Phe, Ser, Thr и Tyr в положении аминокислоты 252;
Ser или Thr в положении аминокислоты 254;
любой из Arg, Gly, Ile и Leu в положении аминокислоты 255;
любой из Ala, Arg, Asn, Asp, Gln, Glu, Pro и Thr в положении аминокислоты 256;
любой из Ala, Ile, Met, Asn, Ser и Val в положении аминокислоты 257;
Asp в положении аминокислоты 258;
Ser в положении аминокислоты 260;
Leu в положении аминокислоты 262;
Lys в положении аминокислоты 270;
Leu или Arg в положении аминокислоты 272;
любой из Ala, Asp, Gly, His, Met, Asn, Gln, Arg, Ser, Thr, Trp и Tyr в положении аминокислоты 279;
любой из Ala, Asp, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr, Trp и Tyr в положении аминокислоты 283;
Asn в положении аминокислоты 285;
Phe в положении аминокислоты 286;
Asn или Pro в положении аминокислоты 288;
Val в положении аминокислоты 293;
любой из Ala, Glu, Gln и Met в положении аминокислоты 307;
любой из Ile, Pro и Thr в положении аминокислоты 308;
Pro в положении аминокислоты 309;
любой из Ala, Glu, Ile, Lys, Leu, Met, Ser, Val и Trp в положении аминокислоты 311;
любой из Ala, Asp и Pro в положении аминокислоты 312;
Ala или Leu в положении аминокислоты 314;
Lys в положении аминокислоты 316;
Pro в положении аминокислоты 317;
Asn или Thr в положении аминокислоты 318;
любой из Phe, His, Lys, Leu, Met, Arg, Ser и Trp в положении аминокислоты 332;
любой из Asn, Thr и Trp в положении аминокислоты 339;
Pro в положении аминокислоты 341;
любой из Glu, His, Lys, Gln, Arg, Thr или Tyr в положении аминокислоты 343;
Arg в положении аминокислоты 375;
любой из Gly, Ile, Met, Pro, Thr и Val в положении аминокислоты 376;
Lys в положении аминокислоты 377;
любой из Asp, Asn и Val в положении аминокислоты 378;
любой из Ala, Asn, Ser и Thr в положении аминокислоты 380;
любой из Phe, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr, Val, Trp и Tyr в положении аминокислоты 382;
любой из Ala, Arg, Asp, Gly, His, Lys, Ser и Thr в положении аминокислоты 385;
любой из Arg, Asp, Ile, Lys, Met, Pro, Ser и Thr в положении аминокислоты 386;
любой из Ala, Arg, His, Pro, Ser и Thr в положении аминокислоты 387;
любой из Asn, Pro и Ser в положении аминокислоты 389;
Asn в положении аминокислоты 423;
Asn в положении аминокислоты 427;
любой из Leu, Met, Phe, Ser и Thr в положении аминокислоты 428;
любой из Ala, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr, Val и Tyr в положении аминокислоты 430;
His или Asn в положении аминокислоты 431;
любой из Arg, Gln, His, Ile, Lys, Pro и Ser в положении аминокислоты 433;
любой из Ala, Gly, His, Phe, Ser, Trp и Tyr в положении аминокислоты 434;
любой из Arg, Asn, His, Ile, Leu, Lys, Met и Thr в положении аминокислоты 436;
любой из Lys, Leu, Thr и Trp в положении аминокислоты 438;
Lys в положении аминокислоты 440; и
Lys в положении аминокислоты 442,
как указано с помощью нумерации EU, в аминокислотной последовательности Fc-области, включенной в любую из SEQ ID NO: 14, 15, 16 или 17;
[13] применение согласно любому из [1]-[12], где антигенсвязывающая молекула представляет собой антитело;
[14] фармацевтическая композиция, содержащая антигенсвязывающую молекулу, которая содержит антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов, и Fc-область, в которой аминокислота в положении 238 представляет собой Asp и аминокислота в положении 271 представляет собой Gly, как указано с помощью нумерации EU;
[15] фармацевтическая композиция согласно [14], где Fc-область имеет аминокислотную замену по меньшей мере в одном или более положениях, выбранных из группы, состоящей из 233, 234, 237, 264, 265, 266, 267, 268, 269, 272, 274, 326, 327, 330, 331, 332, 333, 355, 356, 358, 396, 409 и 419, как указано с помощью нумерации EU;
[16] фармацевтическая композиция согласно [15], где аминокислоты Fc-области включают любую одну или более из следующих аминокислот, указанных с помощью нумерации EU:
Asp в положении аминокислоты 233;
Tyr в положении аминокислоты 234;
Asp в положении аминокислоты 237;
Ile в положении аминокислоты 264;
Glu в положении аминокислоты 265;
любой из Phe, Met и Leu в положении аминокислоты 266;
любой из Ala, Glu, Gly и Gln в положении аминокислоты 267;
любой из Asp, Glu и Gln в положении аминокислоты 268;
Asp в положении аминокислоты 269;
любой из Asp, Phe, Ile, Met, Asn, Pro и Gln в положении аминокислоты 272;
Gln в положении аминокислоты 274;
Asp или Phe в положении аминокислоты 296;
Ala или Asp в положении аминокислоты 326;
Gly в положении аминокислоты 327;
Lys или Arg в положении аминокислоты 330;
Ser в положении аминокислоты 331;
Thr в положении аминокислоты 332;
любой из Thr, Lys и Arg в положении аминокислоты 333;
Gln в положении аминокислоты 355;
Glu в положении аминокислоты 356;
Met в положении аминокислоты 358;
любой из Asp, Glu, Phe, Ile, Lys, Leu, Met, Gln, Arg и Tyr в положении аминокислоты 396;
Arg в положении аминокислоты 409; и
Glu в положении аминокислоты 419;
[17] способ получения антигенсвязывающей молекулы, включающий стадии (a)-(e), ниже:
(a) получение антигенсвязывающего домена, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов;
(b) получение гена, кодирующего антигенсвязывающий домен, выбранный на стадии (a);
(c) функциональное связывание гена, полученного на стадии (b), с геном, кодирующим Fc-область, в которой аминокислота в положении 238 представляет собой Asp и аминокислота в положении 271 представляет собой Gly, как указано с помощью нумерации EU;
(d) культивирование клеток-хозяев, содержащих ген, функционально связанный на стадии (c); и
(e) выделение антигенсвязывающей молекулы из культурального раствора, полученного на стадии (d);
[18] способ получения согласно [17], где Fc-область имеет аминокислотную замену по меньшей мере в одном или более положениях, выбранных из группы, состоящей из 233, 234, 237, 264, 265, 266, 267, 268, 269, 272, 274, 296, 326, 327, 330, 331, 332, 333, 355, 356, 358, 396, 409 и 419, как указано с помощью нумерации EU;
[19] способ получения согласно [18], где аминокислоты Fc-области включают любую одну или более из следующих аминокислот, указанных с помощью нумерации EU:
Asp в положении аминокислоты 233;
Tyr в положении аминокислоты 234;
Asp в положении аминокислоты 237;
Ile в положении аминокислоты 264;
Glu в положении аминокислоты 265;
любой из Phe, Met и Leu в положении аминокислоты 266;
любой из Ala, Glu, Gly и Gln в положении аминокислоты 267;
любой из Asp, Glu и Gln в положении аминокислоты 268;
Asp в положении аминокислоты 269;
любой из Asp, Phe, Ile, Met, Asn, Pro и Gln в положении аминокислоты 272;
Gln в положении аминокислоты 274;
Asp или Phe в положении аминокислоты 296;
Ala или Asp в положении аминокислоты 326;
Gly в положении аминокислоты 327;
Lys или Arg в положении аминокислоты 330;
Ser в положении аминокислоты 331;
Thr в положении аминокислоты 332;
любой из Thr, Lys и Arg в положении аминокислоты 333;
Gln в положении аминокислоты 355;
Met в положении аминокислоты 356;
Met в положении аминокислоты 358;
любой из Asp, Glu, Phe, Ile, Lys, Leu, Met, Gln, Arg и Tyr в положении аминокислоты 396;
Arg в положении аминокислоты 409; и
Glu в положении аминокислоты 419;
[20] способ получения фармацевтической композиции, содержащей антигенсвязывающую молекулу, который включает стадии:
(a) получение антигенсвязывающего домена, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов;
(b) получение гена, кодирующего антигенсвязывающий домен, выбранный на стадии (a);
(с) функциональное связывание гена, полученного на стадии (b), с геном, кодирующим Fc-область, в которой аминокислота в положении 238 (нумерация EU) представляет собой Asp и аминокислота в положении 271 (нумерация EU) представляет собой Gly;
(d) культивирование клеток-хозяев, содержащих ген, функционально связанный на стадии (c); и
(e) выделение антигенсвязывающей молекулы из культурального раствора, полученного на стадии (d);
[21] способ получения согласно [20], где Fc-область имеет аминокислотную замену по меньшей мере в одном или более положениях, выбранных из группы, состоящей из положений 233, 234, 237, 264, 265, 266, 267, 268, 269, 272, 274, 296, 326, 327, 330, 331, 332, 333, 355, 356, 358, 396, 409 и 419 (нумерация EU);
[22] способ получения [21], где аминокислоты в Fc-области включают любую одну или более из следующих аминокислот, указанных с помощью нумерации EU:
Asp в положении аминокислоты 233;
Tyr в положении аминокислоты 234;
Asp в положении аминокислоты 237;
Ile в положении аминокислоты 264;
Glu в положении аминокислоты 265;
любой из Phe, Met и Leu в положении аминокислоты 266;
любой из Ala, Glu, Gly и Gln в положении аминокислоты 267;
любой из Asp, Glu и Gln в положении аминокислоты 268;
Asp в положении аминокислоты 269;
любой из Asp, Phe, Ile, Met, Asn, Pro и Gln в положении аминокислоты 272;
Gln в положении аминокислоты 274;
Asp или Phe в положении аминокислоты 296;
Ala или Asp в положении аминокислоты 326;
Gly в положении аминокислоты 327;
Lys или Arg в положении аминокислоты 330;
Ser в положении аминокислоты 331;
Thr в положении аминокислоты 332;
любой из Thr, Lys и Arg в положении аминокислоты 333;
Gln в положении аминокислоты 355;
Glu в положении аминокислоты 356;
Met в положении аминокислоты 358;
любой из Asp, Glu, Phe, Ile, Lys, Leu, Met, Gln, Arg и Tyr в положении аминокислоты 396;
Arg в положении аминокислоты 409; и
Glu в положении аминокислоты 419;
[23] способ элиминации антигена из плазмы, который включает введение эффективного количества антигенсвязывающей молекулы, содержащей антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов, и Fc-область, в которой аминокислота в положении 238 представляет собой Asp и аминокислота в положении 271 представляет собой Gly, как указано с помощью нумерации EU;
[24] способ согласно [23], где Fc-область обладает аминокислотной заменой по меньшей мере в одном или более положениях, выбранных из группы, состоящей из 233, 234, 237, 264, 265, 266, 267, 268, 269, 272, 274, 296, 326, 327, 330, 331, 332, 333, 355, 356, 358, 396, 409 и 419, как указано с помощью нумерации EU;
[25] способ согласно [24], где аминокислоты Fc-области включают любую одну или более из следующих аминокислот, указанных с помощью нумерации EU:
Asp в положении аминокислоты 233;
Tyr в положении аминокислоты 234;
Asp в положении аминокислоты 237;
Ile в положении аминокислоты 264;
Glu в положении аминокислоты 265;
любой из Phe, Met и Leu в положении аминокислоты 266;
любой из Ala, Glu, Gly и Gln в положении аминокислоты 267;
любой из Asp, Glu и Gln в положении аминокислоты 268;
Asp в положении аминокислоты 269;
любой из Asp, Phe, Ile, Met, Asn, Pro и Gln в положении аминокислоты 272;
Gln в положении аминокислоты 274;
Asp или Phe в положении аминокислоты 296;
Ala или Asp в положении аминокислоты 326;
Gly в положении аминокислоты 327;
Lys или Arg в положении аминокислоты 330;
Ser в положении аминокислоты 331;
Thr в положении аминокислоты 332;
любой из Thr, Lys и Arg в положении аминокислоты 333;
Gln в положении аминокислоты 355;
Glu в положении аминокислоты 356;
Met в положении аминокислоты 358;
любой из Asp, Glu, Phe, Ile, Lys, Leu, Met, Gln, Arg и Tyr в положении аминокислоты 396;
Arg в положении аминокислоты 409; и
Glu в положении аминокислоты 419;
[26] способ согласно любому из [23]-[25], где антигенсвязывающий домен представляет собой антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов кальция;
[27] способ согласно [26], где антигенсвязывающий домен представляет собой антигенсвязывающий домен, антигенсвязывающая активность которого варьирует так, что антигенсвязывающая активность в условиях низкой концентрации ионов кальция является более низкой, чем антигенсвязывающая активность в условиях высокой концентрации ионов кальция;
[28] способ согласно любому из [23]-[25], где антигенсвязывающий домен представляет собой антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий pH;
[29] способ согласно [28], где антигенсвязывающий домен представляет собой антигенсвязывающий домен, антигенсвязывающая активность которого варьирует так, что антигенсвязывающая активность в условиях диапазона кислых значений pH является более низкой, чем антигенсвязывающая активность в условиях диапазона нейтральных значений pH;
[30] способ согласно любому из [23]-[29], где антигенсвязывающий домен представляет собой вариабельную область антитела;
[31] способ согласно любому из [23]-[30], где упомянутая выше Fc-область представляет собой Fc-область, содержащуюся в любой из SEQ ID NO: 14, 15, 16 или 17, в которой аминокислота в положении 238 представляет собой Asp и аминокислота в положении 271 представляет собой Gly, как указано с помощью нумерации EU;
[32] способ согласно любому из [23]-[30], где активность связывания с FcRn Fc-области в условиях диапазона кислых значений pH усилена по сравнению с активностью связывания с FcRn Fc-области, содержащейся в любой из SEQ ID NO: 14, 15, 16 или 17;
[33] способ согласно [32], где Fc-область с усиленным связыванием представляет собой Fc-область, обладающую аминокислотной заменой по меньшей мере в одном или более положениях, выбранных из группы, состоящей из положений 244, 245, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 260, 262, 265, 270, 272, 279, 283, 285, 286, 288, 293, 303, 305, 307, 308, 309, 311, 312, 314, 316, 317, 318, 332, 339, 340, 341, 343, 356, 360, 362, 375, 376, 377, 378, 380, 382, 385, 386, 387, 388, 389, 400, 413, 415, 423, 424, 427, 428, 430, 431, 433, 434, 435, 436, 438, 439, 440, 442 и 447, как указано с помощью нумерации EU, в аминокислотной последовательности Fc-области, содержащейся в любой из SEQ ID NO: 14, 15, 16 или 17;
[34] способ согласно [33], где Fc-область с усиленным связыванием содержит по меньшей мере одну или более аминокислот, выбранных из группы, состоящей из:
Leu в положении аминокислоты 244;
Arg в положении аминокислоты 245;
Pro в положении аминокислоты 249;
Gln или Glu в положении аминокислоты 250;
любой из Arg, Asp, Glu и Leu в положении аминокислоты 251;
любой из Phe, Ser, Thr и Tyr в положении аминокислоты 252;
Ser или Thr в положении аминокислоты 254;
любой из Arg, Gly, Ile и Leu в положении аминокислоты 255;
любой из Ala, Arg, Asn, Asp, Gln, Glu, Pro и Thr в положении аминокислоты 256;
любой из Ala, Ile, Met, Asn, Ser и Val в положении аминокислоты 257;
Asp в положении аминокислоты 258;
Ser в положении аминокислоты 260;
Leu в положении аминокислоты 262;
Lys в положении аминокислоты 270;
Leu или Arg в положении аминокислоты 272;
любой из Ala, Asp, Gly, His, Met, Asn, Gln, Arg, Ser, Thr, Trp и Tyr в положении аминокислоты 279;
любой из Ala, Asp, Phe, Gly, His, He, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr, Trp и Tyr в положении аминокислоты 283;
Asn в положении аминокислоты 285;
Phe в положении аминокислоты 286;
Asn или Pro в положении аминокислоты 288;
Val в положении аминокислоты 293;
любой из Ala, Glu, Gln и Met в положении аминокислоты 307;
любой из Ile, Pro и Thr в положении аминокислоты 308;
Pro в положении аминокислоты 309;
любой из Ala, Glu, Ile, Lys, Leu, Met, Ser, Val и Trp в положении аминокислоты 311;
любой из Ala, Asp и Pro в положении аминокислоты 312;
Ala или Leu в положении аминокислоты 314;
Lys в положении аминокислоты 316;
Pro в положении аминокислоты 317;
Asn или Thr в положении аминокислоты 318;
любой из Phe, His, Lys, Leu, Met, Arg, Ser и Trp в положении аминокислоты 332;
любой из Asn, Thr и Trp в положении аминокислоты 339;
Pro в положении аминокислоты 341;
любой из Glu, His, Lys, Gln, Arg, Thr и Tyr в положении аминокислоты 343;
Arg в положении аминокислоты 375;
любой из Gly, Ile, Met, Pro, Thr и Val в положении аминокислоты 376;
Lys в положении аминокислоты 377;
любой из Asp, Asn или Val в положении аминокислоты 378;
любой из Ala, Asn, Ser и Thr в положении аминокислоты 380;
любой из Phe, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr, Val, Trp и Tyr в положении аминокислоты 382;
любой из Ala, Arg, Asp, Gly, His, Lys, Ser и Thr в положении аминокислоты 385;
любой из Arg, Asp, Ile, Lys, Met, Pro, Ser и Thr в положении аминокислоты 386;
любой из Ala, Arg, His, Pro, Ser и Thr в положении аминокислоты 387;
любой из Asn, Pro и Ser в положении аминокислоты 389;
Asn в положении аминокислоты 423;
Asn в положении аминокислоты 427;
любой из Leu, Met, Phe, Ser и Thr в положении аминокислоты 428;
любой из Ala, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr, Val и Tyr в положении аминокислоты 430;
His или Asn в положении аминокислоты 431;
любой из Arg, Gln, His, Ile, Lys, Pro и Ser в положении аминокислоты 433;
любой из Ala, Gly, His, Phe, Ser, Trp и Tyr в положении аминокислоты 434;
любой из Arg, Asn, His, Ile, Leu, Lys, Met и Thr в положении аминокислоты 436;
любой из Lys, Leu, Thr и Trp в положении аминокислоты 438;
Lys в положении аминокислоты 440; и
Lys в положении аминокислоты 442,
как указано с помощью нумерации EU, в аминокислотной последовательности Fc-области, содержащейся в любой из SEQ ID NO: 14, 15, 16 или 17; и
[35] способ согласно любому из [23]-[34], где антигенсвязывающая молекула представляет собой антитело.
В рамках настоящего изобретения следующие выражения используют синонимично: "применение антигенсвязывающей молекулы для элиминации антигена из плазмы, где антигенсвязывающая молекула содержит антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов, и Fc-область, в которой аминокислота в положении 238 представляет собой Asp и аминокислота в положении 271 представляет собой Gly, как указано с помощью нумерации EU"; "способ лечения заболевания, вызываемого антигеном, который включает введение антигенсвязывающей молекулы, содержащей антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов, и Fc-область, в которой аминокислота в положении 238 представляет собой Asp и аминокислота в положении 271 представляет собой Gly, как указано с помощью нумерации EU"; "фармацевтическая композиция, содержащая антигенсвязывающую молекулу, которая содержит антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов, и Fc-область, в которой аминокислота в положении 238 представляет собой Asp и аминокислота в положении 271 представляет собой Gly, как указано с помощью нумерации EU"; "применение антигенсвязывающей молекулы для получения фармацевтической композиции, где антигенсвязывающая молекула содержит антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов, и Fc-область, в которой аминокислота в положении 238 представляет собой Asp и аминокислота в положении 271 представляет собой Gly, как указано с помощью нумерации EU"; и "способ получения фармацевтической композиции, который включает использование антигенсвязывающей молекулы, содержащей антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов, и Fc-область, в которой аминокислота в положении 238 представляет собой Asp и аминокислота в положении 271 представляет собой Gly, как указано с помощью нумерации EU".
Краткое описание чертежей
На фиг. 1 представлен неограниченный механизм действия для элиминации растворимого антигена из плазмы посредством введения антитела, которое связывается с антигеном зависимым от концентрации ионов образом и связывание которого с Fcγ-рецептором усилено при нейтральных значениях pH по сравнению с существующими нейтрализующими антителами.
На фиг. 2 представлена концентрация рецептора IL-6 человека с течением времени в плазме трансгенных мышей с FcRn человека, которым вводили Fv4-IgG1, которое связывается с рецептором IL-6 человека pH-зависимым образом, или H54/L28-IgG1.
На фиг. 3 представлена концентрация рецептора IL-6 человека в плазме трансгенных мышей с FcRn человека, которым вводили Fv4-IgG1, которое связывается с рецептором IL-6 человека pH-зависимым образом, Fv4-IgG1-F760, которое представляет собой вариант Fv4-IgG1, который лишен связывания FcγR мыши, Fv4-IgG1-F1022, которое представляет собой вариант Fv4-IgG1 с усиленным связыванием FcγR мыши, или Fv4-IgG1-Fuc, которое представляет собой антитело Fv4-IgG1 с низким содержанием фукозы.
На фиг. 4 представлена концентрация рецептора IL-6 человека в плазме трансгенных мышей с FcRn человека, которым вводили Fv4-IgG1, или антигенсвязывающие молекулы, содержащие в качестве тяжелой цепи Fv4-IgG1-F1022 или Fv4-IgG1-F1093, которое является вариантом Fv4-IgG1-F1022 с повышенным связыванием FcRn в диапазоне кислых значений pH.
На фиг. 5 представлена концентрация с течением времени введенных антигенсвязывающих молекул в плазме трансгенных мышей с FcRn человека, которым вводили Fv4-IgG1, или антигенсвязывающие молекулы, содержащие в качестве тяжелой цепи Fv4-IgG1-F1022 или Fv4-IgG1-F1093, которое представляет собой вариант Fv4-IgG1-F1022 с повышенным связыванием FcRn в диапазоне кислых значений pH.
На фиг. 6 представлена концентрация рецептора IL-6 человека в плазме трансгенных мышей с FcRn человека, которым вводили Fv4-IgG1, Fv4-IgG1-F1087, которое является вариантом Fv4-IgG1 с усиленным связыванием FcγR мыши (в частности, усиленным связыванием мыши FcγRIIb и связыванием FcγRIII мыши), и Fv4-IgG1-F1182, которое представляет собой вариант Fv4-IgG1 с усиленным связыванием FcγR (в частности, усиленным связыванием FcγRI и связыванием FcγRIV).
На фиг. 7 представлена концентрация с течением времени введенных антигенсвязывающих молекул в плазме трансгенных мышей с FcRn человека, которым вводили Fv4-IgG1, Fv4-IgG1-F1087 и Fv4-IgG1-F1180 и Fv4-IgG1-F1412, которые представляют собой варианты Fv4-IgG1-F1087 с повышенным связыванием FcRn в диапазоне кислых значений pH.
На фиг. 8 представлена концентрация с течением времени введенных антигенсвязывающих молекул в плазме трансгенных мышей с FcRn человека, которым вводили Fv4-IgG1, Fv4-IgG1-F1182 и Fv4-IgG1-F1181, которое является вариантом Fv4-IgG1-F1182 с повышенным связыванием FcRn в диапазоне кислых значений pH.
На фиг. 9 представлена концентрация рецептора IL-6 человека в плазме трансгенных мышей с FcRn человека, которым вводили Fv4-IgG1, Fv4-IgG1-F1087 и Fv4-IgG1-F1180 и Fv4-IgG1-F1412, которые являются вариантами Fv4-IgG1-F1087 с повышенным связыванием FcRn в диапазоне кислых значений pH.
На фиг. 10 представлена концентрация рецептора IL-6 человека в плазме трансгенных мышей с FcRn человека, которым вводили Fv4-IgG1, Fv4-IgG1-F1182 и Fv4-IgG1-F1181, которое является вариантом Fv4-IgG1-F1182 с повышенным связыванием FcRn, в диапазоне кислых значений pH.
На фиг. 11 представлена концентрация рецептора IL-6 человека в плазме нормальных мышей, которым вводили Fv4-mIgG1, Fv4-mIgG1-mF44, которое является вариантом Fv4-mIgG1 с усиленным связыванием FcγRIIb мыши и связыванием FcγRIII мыши, и Fv4-mIgG1-mF46, которое является вариантом Fv4-mIgG1 с дополнительно усиленным связыванием FcγRIIb мыши и связыванием FcγRIII мыши.
На фиг. 12 представлена концентрация рецептора IL-6 человека в плазме мышей с дефицитом FcγRIII, которым вводили Fv4-mIgG1, Fv4-mIgG1-mF44, которое является вариантом Fv4-mIgG1 с усиленным связыванием FcγRIIb мыши и связыванием FcγRIII мыши, и Fv4-mIgG1-mF46, которое является вариантом Fv4-mIgG1 с дополнительно усиленным связыванием FcγRIIb мыши и связыванием FcγRIII мыши.
На фиг. 13 представлена концентрация рецептора IL-6 человека в плазме мышей с дефицитом γ-цепи Fc-рецептора, которым вводили Fv4-mIgG1: Fv4-mIgG1-mF44, которое представляет собой вариант Fv4-mIgG1 с усиленным связыванием FcγRIIb мыши и связыванием FcγRIII мыши, и Fv4-mIgG1-mF46, которое является вариантом Fv4-mIgG1 с далее усиленным связыванием FcγRIIb мыши и связыванием FcγRIII мыши.
На фиг. 14 представлена концентрация рецептора IL-6 человека в плазме мышей с дефицитом FcγRIIb, которым вводили Fv4-mIgG1: Fv4-mIgG1-mF44, которое является вариантом Fv4-mIgG1 с усиленным связыванием FcγRIIb мыши и связыванием FcγRIII мыши, и Fv4-mIgG1-mF46, которое является вариантом Fv4-mIgG1 с дополнительно усиленным связыванием FcγRIIb мыши и связыванием FcγRIII мыши.
На фиг. 15 представлен результат оценки способности к агрегации тромбоцитов иммунокомплекса омализумаб-G1d-v3/IgE с помощью анализа агрегации тромбоцитов с использованием тромбоцитов, происходящих из доноров с аллотипом FcγRIIa (R/H).
На фиг. 16 представлен результат оценки способности к агрегации тромбоцитов иммунокомплекса омализумаб-G1d-v3/IgE с помощью анализа агрегации тромбоцитов с использованием тромбоцитов, происходящих из доноров с аллотипом FcγRIIa (H/H).
На фиг. 17 представлен результат оценки экспрессии CD62p на поверхности мембраны промытых тромбоцитов. Закрашенная черным цветом область на графике указывает на результат стимуляции посредством ADP после реакции с PBS. Область, которая не закрашена на графике, указывает на результат стимуляции посредством ADP после реакции с иммунокомплексом.
На фиг. 18 представлен результат оценки экспрессии активного интегрина на поверхности мембраны промытых тромбоцитов. Закрашенная черным цветом область на графике указывает на результат стимуляции посредством ADP после реакции с PBS. Область, которая не закрашена на графике, указывает на результат стимуляции посредством ADP после реакции с иммунокомплексом.
На фиг. 19 представлен график, на котором на горизонтальной оси показана относительная величина активности связывания FcγRIIb для каждого варианта PD, а на вертикальной оси показана относительная величина активности связывания FcγRIIa типа R для каждого варианта PD. Значение величины связывания каждого варианта PD с каждым FcγR делили на значение величины связывания IL6R-F652/IL6R-L, которое представляет собой контрольное антитело до внесения изменения (IL6R-F652, соответствующая SEQ ID NO: 61, представляет собой тяжелую цепь антитела, содержащую измененную Fc с заменой Pro в положении 238 (нумерация EU) на Asp), с каждым FcγR; а затем полученную величину умножали на 100 и использовали в качестве относительной величины активности связывания для каждого варианта PD с каждым FcγR. На графике F652 на фигуре показана величина для IL6R-F652/IL6R-L.
На фиг. 20 показан график, на котором на вертикальной оси показана относительная величина активности связывания FcγRIIb для вариантов, полученных путем внесения каждого изменения в GpH7-B3 (SEQ ID NO: 63)/GpL16-k0, которое не имеет изменения P238D, и на горизонтальной оси показана относительная величина активности связывания FcγRIIb для вариантов, полученных путем внесения каждого изменения в IL6R-F652 (SEQ ID NO: 61)/IL6R-L, имеющего изменение P238D. Значение величины связывания FcγRIIb каждого варианта делили на значение величины связывания FcγRIIb предварительно измененного антитела; а затем полученную величину умножали на 100 и использовали в качестве величины относительной активности связывания. В этом случае область A содержит изменения, которые проявляют эффект усиления связывания FcγRIIb в обоих случаях, когда изменение вносят в GpH7-B3/GpL16-k0, которое не имеет P238D, и когда изменение вносят в IL6R-F652/IL6R-L, которое имеет P238D. Область B содержит изменения, которые проявляют эффект усиления связывания FcγRIIb при внесении в GpH7-B3/GpL16-k0, которое не имеет P238D, но не проявляют эффекта усиления связывания FcγRIIb при внесении в IL6R-F652/IL6R-L, которое имеет P238D.
На фиг. 21 показана кристаллическая структура комплекса Fc(P238D)/внеклеточная область FcγRIIb.
На фиг. 22 представлено изображение наложения кристаллической структуры комплекса Fc(P238D)/внеклеточная область FcγRIIb и модельной структуры комплекса Fc(WT)/внеклеточная область FcγRIIb, в отношении внеклеточной области FcγRIIb и CH2-домена A Fc путем аппроксимации методом наименьших квадратов на основании расстояний между парами атомов Cα.
На фиг. 23 показано сравнение детальной структуры в области P238D после наложения кристаллической структуры комплекса Fc(P238D)/внеклеточная область FcγRIIb и модельной структуры комплекса Fc(WT)/внеклеточная область FcγRIIb, в отношении только CH2-домена A Fc или только CH2-домена B Fc путем аппроксимации методом наименьших квадратов на основании расстояний между парами атомов Cα.
На фиг. 24 показано, что водородная связь может находиться между основной цепью Gly в положении 237 (указанном согласно нумерации EU) в CH2-домене A Fc и Tyr в положении 160 в FcγRIIb в кристаллической структуре комплекса Fc(P238D)/внеклеточная область FcγRIIb.
На фиг. 25 показано, что между Asp в положении 270 (указанном согласно нумерации EU) в CH2-домене B Fc и Arg в положении 131 FcγRIIb может быть выявлено электростатическое взаимодействие в кристаллической структуре комплекса внеклеточной области Fc(P238D)/FcγRIIb.
На фиг. 26 представлен график, на котором на горизонтальной оси показана относительная величина активности связывания FcγRIIb для каждого варианта 2B, и на вертикальной оси показана относительная величина активности связывания FcγRIIa типа R для каждого варианта 2B. Значение величины связывания каждого варианта 2B с каждым FcγR делили на значение величины связывания контрольного антитела перед изменением (измененная Fc с заменой Pro в положении 238 (указанном согласно нумерации EU) на Asp) для каждого FcγR; а затем полученную величину умножали на 100, и использовали в качестве величины относительной активности связывания каждого варианта 2B в отношении каждого FcγR.
На фиг. 27 показаны Glu в положении 233 (указанном согласно нумерации EU) в цепи A Fc и окружающие остатки во внеклеточной области FcγRIIb в кристаллической структуре комплекса Fc(P238D)/внеклеточная область FcγRIIb.
На фиг. 28 показаны Ala в положении 330 (указанном согласно нумерации EU) в цепи A Fc и окружающие остатки во внеклеточной области FcγRIIb в кристаллической структуре комплекса Fc(P238D)/внеклеточная область FcγRIIb.
На фиг. 29 показаны структуры Pro в положении 271 (указанном согласно нумерации EU) цепи B Fc после наложения кристаллических структур комплекса Fc(P238D)/внеклеточная область FcγRIIb и комплекса Fc(WT)/внеклеточная область FcγRIIIa путем аппроксимации методом наименьших квадратов на основе расстояний между парами атомов Cα, в отношении B-цепи Fc.
На фиг. 30 представлено изображение комплекса Fc (P208)/внеклеточная область FcγRIIb, определенное посредством рентгеноструктурного анализа. Для каждого из доменов CH2 и CH3 в Fc-области домены слева обозначены как домен A и домены справа обозначены как домен B.
На фиг. 31 представлено сравнение после наложения структур комплекса Fc (P208)/внеклеточная область FcγRIIb и комплекса Fc (WT)/внеклеточная область FcγRIIa (код PDB: 3RY6), определенных с помощью рентгеноструктурного анализа, в отношении CH2-домена A Fc-области посредством аппроксимации методом наименьших квадратов на основе расстояний между парами атомов Cα. На этой диаграмме структура, изображенная с помощью жирной линии, демонстрирует комплекс Fc (P208)/внеклеточная область FcγRIIb, в то время как структура, изображенная тонкой линией, указывает на структуру Fc (WT)/внеклеточная область FcγRIIa. Только CH2-домен A Fc-области изображен для комплекса Fc (WT)/внеклеточная область FcγRIIa.
На фиг. 32 представлена рентгеновская кристаллическая структура комплекса Fc (P208)/внеклеточная область FcγRIIb, детальная структура в области Asp в положении 237 (нумерация EU) в CH2-домене A Fc-области, который образует водородную связь с Tyr в положении 160 в FcγRIIb в структуре основной цепи.
На фиг. 33 представлена рентгеновская кристаллическая структура комплекса Fc (P208)/внеклеточная область FcγRIIb, структура аминокислотных остатков в области Asp в положении 237 (нумерация EU) в CH2-домене A Fc-области, который образует водородную связь с Tyr в положении 160 в FcγRIIb в структуре основной цепи.
На фиг. 34 представлено сравнение в области петли в положениях 266-271 (нумерация EU) после наложения рентгеновских кристаллических структур комплекса Fc (P238D)/внеклеточный домен FcγRIIb, представленного в примере 10, и комплекса Fc (P208)/внеклеточный домен FcγRIIb в отношении CH2-домена B Fc-области посредством аппроксимации методом наименьших квадратов на основе расстояний между парами атомов Cα. По сравнению с Fc (P238D), Fc (P208) имеет изменение H268D в положении 268 (нумерация EU) и изменение P271G в положении 271 (нумерация EU) в петле.
На фиг. 35 представлена диаграмма, на которой показана структура в области Ser239 в CH2-домене B Fc-области в рентгеновской кристаллической структуре комплекса Fc (P208)/внеклеточная область FcγRIIb, вместе с электронной плотностью с коэффициентом 2Fo-Fc, определенной с помощью рентгеноструктурного анализа.
На фиг. 36 представлено сравнение после наложения трехмерных структур комплекса Fc (P208)/внеклеточная область FcγRIIaR и комплекса Fc (P208)/внеклеточная область FcγRIIb, определенных с помощью рентгеноструктурного анализа посредством аппроксимации методом наименьших квадратов на основе расстояний между парами атомов Cα.
На фиг. 37 представлено сравнение в области Asp в положении 237 (нумерация EU) в CH2-домене A Fc-области между рентгеновскими кристаллическими структурами комплекса Fc (P208)/внеклеточная область FcγRIIaR и комплекса Fc (P208)/внеклеточная область FcγRIIb, вместе с электронной плотностью с коэффициентом 2Fo-Fc, определенной с помощью рентгеноструктурного анализа.
На фиг. 38 представлено сравнение в области Asp в положении 237 (нумерация EU) в CH2-домене B Fc-области между рентгеновскими кристаллическими структурами комплекса Fc (P208)/внеклеточная область FcγRIIaR и комплекса Fc (P208)/внеклеточная область FcγRIIb, вместе с электронной плотностью с коэффициентом 2Fo-Fc, определенной с помощью рентгеноструктурного анализа.
На фиг. 39 представлено сравнение между последовательностями константной области G1d и G4d. На диаграмме аминокислоты, заключенные в жирную рамку, указывают на положения с отличающимися аминокислотными остатками между G1d и G4d.
На фиг. 40 представлено изменение концентрации в плазме антитела GA2-IgG1 и GA2-F1087 у нормальных мышей.
На фиг. 41 представлено изменение концентрации в плазме hIgA у нормальных мышей, которым вводили GA2-IgG1 и GA2-F1087.
На фиг. 42 представлено изменение концентрации в плазме антител 278-IgG1 и 278-F1087 у нормальных мышей.
На фиг. 43 представлено изменение концентрации в плазме hIgE (Asp6) у мышей C57BL/6J, которым вводили 278-IgG1 и 278-F1087.
На фиг. 44 представлена концентрация с течением времени антитела мыши против рецептора IL-6 человека в плазме нормальных мышей, которым вводили Fv4-mIgG1 и Fv4-mIgG1-MB367, которое является вариантом Fv4-mIgGl с усиленным связыванием FcγRIIb мыши.
На фиг. 45 представлена концентрация растворимого рецептора IL-6 человека с течением времени в плазме нормальных мышей, которым вводили Fv4-mIgG1 и Fv4-mIgG1-MB367, которое является вариантом Fv4-mIgG1 с усиленным связыванием FcγRIIb мыши.
[Способы осуществления изобретения]
Ниже предоставлены определения и подробное описание, чтобы облегчить понимание настоящего изобретения, проиллюстрированного в настоящем описании.
Аминокислоты
В рамках настоящего изобретения аминокислоты описаны с помощью однобуквенного или трехбуквенного кодов или обоих из них, например, Ala/A, Leu/L, Arg/R, Lys/K, Asn/N, Met/M, Asp/D, Phe/F, Cys/C, Pro/P, Gln/Q, Ser/S, Glu/E, Thr/T, Gly/G, Trp/W, His/H, Tyr/Y, Ile/I или Val/V.
Изменение аминокислот
Для изменений аминокислот в аминокислотной последовательности антигенсвязывающей молекулы, можно соответствующим образом использовать известные способы, такие как способы сайт-направленного мутагенеза (Kunkel et al. (Proc. Natl. Acad. Sci. USA (1985) 82, 488-492)) и перекрывающаяся ПЦР. Вставки, делеции и/или замены аминокислот вносят соответствующим образом с помощью этих известных способов. Замена аминокислотных остатков означает замену аминокислотного остатка другим аминокислотным остатком для цели изменения аспектов, таких как следующие:
(a) структура основной цепи полипептида в области спиральной структуры или области структуры слоя;
(b) заряд или гидрофобность заданного участка; или
(c) длина боковой цепи.
Аминокислотные остатки подразделяют на следующие группы, исходя из свойств боковых цепей, включенных в их структуры:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu и Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn и Gln;
(3) кислые: Asp и Glu;
(4) основные: His, Lys и Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly и Pro; и
(6) ароматические: Trp, Tyr и Phe.
Замену между аминокислотными остатками в каждой из этих групп называют консервативной заменой. С другой стороны, замену между аминокислотными остатками из различных групп аминокислот называют неконсервативной заменой. Замены в рамках настоящего изобретения могут представлять собой консервативные замены или неконсервативные замены или комбинацию консервативных и неконсервативных замен. Более того, в качестве способов изменения аминокислот для замены на ненативные аминокислоты можно использовать множество известных способов (Annu. Rev. Biophys. Biomol. Struct. (2006) 35, 225-249; и Proc. Natl. Acad. Sci. U.S.A. (2003) 100(11), 6353-6357). Например, можно использовать бесклеточную систему трансляции (Clover Direct (Protein Express)), содержащую тРНК, которая имеет ненативную аминокислоту, связанную с комплементарной амбер-супрессорной тРНК кодона UAG (амбер-кодон), который является одним из стоп-кодонов.
Более того, в качестве обозначения аминокислотного изменения можно использовать обозначение, в котором используются однобуквенные коды аминокислот для аминокислоты до изменения и аминокислоты после изменения, перед и после номера, указывающего на конкретное положение, соответственно. Например, изменение P238D, которое используют при замене аминокислоты Fc-области, включенной в константную область антитела, обозначает замену Pro в положении 238 (в соответствии с нумерацией EU) на Asp. Иными словами, номер указывает на положение аминокислоты в соответствии с нумерацией EU, однобуквенный код аминокислоты, находящийся перед номером, указывает на аминокислоту до замены, и однобуквенный код аминокислоты, находящийся после номера, указывает на аминокислоту после замены.
И/или
Как используют в рамках изобретения, термин "и/или" означает комбинацию терминов до и после выражения "и/или" и включает каждую комбинацию, где "и" и "или" пригодным образом комбинируются. В частности, например, выражение "аминокислоты в положениях 326, 328 и/или 428 являются замещенными" включает следующие варианты изменений аминокислот:
аминокислота(ы) в (a) положении 326, (b) положении 328, (c) положении 428, (d) положениях 326 и 328, (e) положениях 326 и 428, (f) положениях 328 и 428 и (g) положениях 326, 328 и 428.
Антигены
В рамках настоящего изобретения "антигены" конкретно не ограничены по их структуре при условии, что они содержат эпитопы, с которыми связываются антигенсвязывающие домены. Иными словами, антигены могут представлять собой неорганические или органические вещества. Антигены включают, например, представленные ниже молекулы: 17-IA, 4-1BB, 4Dc, 6-кето-PGF1a, 8-изо-PGF2a, 8-оксо-dG, аденозиновый рецептор A1, A33, ACE, ACE-2, активин, активин A, активин AB, активин B, активин C, активин RIA, активин RIA ALK-2, активин RIB ALK-4, активин RIIA, активин RIIB, ADAM, ADAM10, ADAM12, ADAM15, ADAM17/TACE, ADAM8, ADAM9, ADAMTS, ADAMTS4, ADAMTS5, адрессин, aFGF, ALCAM, ALK, ALK-1, ALK-7, альфа-1-антитрипсин, антагонист альфа-V/бета-1, ANG, Ang, APAF-1, APE, APJ, APP, APRIL, AR, ARC, ART, артемин, анти-Id, ASPARTIC, предсердный натрийуретический пептид, интегрин av/b3, Ax1, b2M, B7-1, B7-2, B7-H, B-лимфоцитарный стимулирующий фактор (BlyS), BACE, BACE-1, Bad, BAFF, BAFF-R, Bag-1, BAK, Bax, BCA-1, BCAM, Bсl, BCMA, BDNF, b-ECGF, bFGF, BID, Bik, BIM, BLC, BL-CAM, BLK, BMP, BMP-2 BMP-2a, BMP-3 остеогенин, BMP-4 BMP-2b, BMP-5, BMP-6 Vgr-1, BMP-7 (OP-1), BMP-8 (BMP-8a, OP-2), BMPR, BMPR-IA (ALK-3), BMPR-IB (ALK-6), BRK-2, RPK-1, BMPR-II (BRK-3), BMP, b-NGF, BOK, бомбезин, костный нейротрофический фактор, BPDE, BPDE-DNA, BTC, фактор комплемента 3 (C3), C3a, C4, C5, C5a, C10, CA125, CAD-8, кальцитонин, cAMP, карциноэмбриональный антиген (CEA), ассоциированный со злокачественной опухолью, катепсин A, катепсин B, катепсин C/DPPI, катепсин D, катепсин E, катепсин H, катепсин L, катепсин O, катепсин S, катепсин V, катепсин X/Z/P, CBL, CCI, CCK2, CCL, CCL1, CCL11, CCL12, CCL13, CCL14, CCL15, CCL16, CCL17, CCL18, CCL19, CCL2, CCL20, CCL21, CCL22, CCL23, CCL24, CCL25, CCL26, CCL27, CCL28, CCL3, CCL4, CCL5, CCL6, CCL7, CCL8, CCL9/10, CCR, CCR1, CCR10, CCR10, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CD1, CD2, CD3, CD3E, CD4, CD5, CD6, CD7, CD8, CD10, CD11a, CD11b, CD11c, CD13, CD14, CD15, CD16, CD18, CD19, CD20, CD21, CD22, CD23, CD25, CD27L, CD28, CD29, CD30, CD30L, CD32, CD33 (белок p67), CD34, CD38, CD40, CD40L, CD44, CD45, CD46, CD49a, CD52, CD54, CD55, CD56, CD61, CD64, CD66e, CD74, CD80 (B7-1), CD89, CD95, CD123, CD137, CD138, CD140a, CD146, CD147, CD148, CD152, CD164, CEACAM5, CFTR, cGMP, CINC, токсин Botulinum, токсин Clostridium perfringens, CKb8-1, CLC, CMV, CMV UL, CNTF, CNTN-1, COX, C-Ret, CRG-2, CT-1, CTACK, CTGF, CTLA-4, CX3CL1, CX3CR1, CXCL, CXCL1, CXCL2, CXCL3, CXCL4, CXCL5, CXCL6, CXCL7, CXCL8, CXCL9, CXCL10, CXCL11, CXCL12, CXCL13, CXCL14, CXCL15, CXCL16, CXCR, CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, CXCR6, цитокератиновый ассоциированный с опухолью антиген, DAN, DCC, DcR3, DC-SIGN, регулирующий фактор комплемента (фактор, ускоряющий распад), дез-(1-3)-IGF-I (IGF-1 головного мозга), Dhh, дигоксин, ДНКM-1, ДНКаза, Dpp, DPPIV/CD26, Dtk, ECAD, EDA, EDA-A1, EDA-A2, EDAR, EGF, EGFR (ErbB-1), EMA, EMMPRIN, ENA, рецептор эндотелина, энкефалиназа, eNOS, Eot, эотаксин 1, EpCAM, эфрин B2/EphB4, EPO, ERCC, E-селектин, ET-1, фактор IIa, фактор VII, фактор VIIIc, фактор IX, белок активации фибробластов (FAP), Fas, FcR1, FEN-1, ферритин, FGF, FGF-19, FGF-2, FGF3, FGF-8, FGFR, FGFR-3, фибрин, FL, FLIP, Flt-3, Flt-4, фолликулостимулирующий гормон, фракталкин, FZD1, FZD2, FZD3, FZD4, FZD5, FZD6, FZD7, FZD8, FZD9, FZD10, G250, Gas6, GCP-2, GCSF, GD2, GD3, GDF, GDF-1, GDF-3 (Vgr-2), GDF-5 (BMP-14, CDMP-1), GDF-6 (BMP-13, CDMP-2), GDF-7 (BMP-12, CDMP-3), GDF-8 (миостатин), GDF-9, GDF-15 (MIC-1), GDNF, GDNF, GFAP, GFRa-1, GFR-альфа1, GFR-альфа2, GFR-альфа3, GITR, глюкагон, Glut4, гликопротеин IIb/IIIa (GPIIb/IIIa), GM-CSF, gp130, gp72, GRO, рилизинг-фактор гормона роста, гаптен (NP-cap или NIP-cap), HB-EGF, HCC, гликопротеин оболочки gB HCMV, гликопротеин оболочки gH HCMV, UL HCMV, гемопоэтический фактор роста (HGF), HepB gp120, гепараназа, Her2, Her2/neu (ErbB-2), Her3 (ErbB-3), Her4 (ErbB-4), гликопротеин gB вируса простого герпеса (HSV), гликопротеин gD HSV, HGFA, высокомолекулярный ассоциированный с меланомой антиген (HMW-MAA), gp120 HIV, петля V3 gp 120 IIIB HIV, HLA, HLA-DR, HM1.24, HMFG PEM, HRG, Hrk, сердечный миозин человека, цитомегаловирус человека (HCMV), гормон роста человека (HGH), HVEM, 1-309, IAP, ICAM, ICAM-1, ICAM-3, ICE, ICOS, IFNg, Ig, рецептор IgA, IgE, IGF, IGF-связывающий белок, IGF-1R, IGFBP, IGF-I, IGF-II, IL, IL-1, IL-1R, IL-2, IL-2R, IL-4, IL-4R, IL-5, IL-5R, IL-6, IL-6R, IL-8, IL-9, IL-10, IL-12, IL-13, IL-15, IL-18, IL-18R, IL-23, интерферон (INF)-альфа, INF-бета, INF-гамма, ингибин, iNOS, A-цепь инсулина, B-цепь инсулина, инсулиноподобный фактор роста 1, интегрин альфа-2, интегрин альфа-3, интегрин альфа-4, интегрин альфа4/бета1, интегрин альфа4/бета7, интегрин альфа5 (альфа V), интегрин альфа5/бета1, интегрин альфа5/бета3, интегрин альфа6, интегрин бета1, интегрин бета2, интерферон-гамма, IP-10, I-TAC, JE, калликреин 2, калликреин 5, калликреин 6, калликреин 11, калликреин 12, калликреин 14, калликреин 15, калликреин L1, калликреин L2, калликреин L3, калликреин L4, KC, KDR, фактор роста кератиноцитов (KGF), ламинин 5, LAMP, LAP, LAP (TGF-1), латентный TGF-1, латентный TGF-1 bpl, LBP, LDGF, LECT2, lefty, антиген Lewis-Y, ассоциированный с Lewis-Y антиген, LFA-1, LFA-3, Lfo, LIF, LIGHT, липопротеин, LIX, LKN, Lptn, L-селектин, LT-a, LT-b, LTB4, LTBP-1, белок поверхности легких, лютеинизирующий гормон, рецептор лимфотоксина-бета, Mac-1, MAdCAM, MAG, MAP2, MARC, MCAM, MCAM, MCK-2, MCP, M-CSF, MDC, Mer, металлопротеазы, рецептор MGDF, MGMT, MHC (HLA-DR), MIF, MIG, MIP, MIP-1-альфа, MK, MMAC1, MMP, MMP-1, MMP-10, MMP-11, MMP-12, MMP-13, MMP-14, MMP-15, MMP-2, MMP-24, MMP-3, MMP-7, MMP-8, MMP-9, MPIF, Mpo, MSK, MSP, муцин (Muc1), MUC18, мюллерово ингибиторное вещество, Mug, MuSK, NAIP, NAP, NCAD, адгерин N-C, NCA90, NCAM, NCAM, неприлизин, нейротрофин-3, -4 или -6, нейротурин, фактор роста нервов (NGF), NGFR, NGF-бета, nNOS, NO, NOS, Npn, NRG-3, NT, NTN, OB, OGG1, OPG, OPN, OSM, OX40L, OX40R, p150, p95, PADPr, паратиреоидный гормон, PARC, PARP, PBR, PBSF, PCAD, P-кадгерин, PCNA, PDGF, PDGF, PDK-1, PECAM, PEM, PF4, PGE, PGF, PGI2, PGJ2, PIN, PLA2, плацентарная щелочная фосфатаза (PLAP), P1GF, PLP, PP14, проинсулин, прорелаксин, белок C, PS, PSA, PSCA, простат-специфический мембранный антиген (PSMA), PTEN, PTHrp, Ptk, PTN, R51, RANK, RANKL, RANTES, RANTES, A-цепь релаксина, B-цепь релаксина, ренин, респираторно-синцитиальный вирус (RSV) F, RSV Fgp, Ret, ревматоидный фактор, RLIP76, RPA2, RSK, S100, SCF/KL, SDF-1, SERINE, сывороточный альбумин, sFRP-3, Shh, SIGIRR, SK-1, SLAM, SLPI, SMAC, SMDF, SMOH, SOD, SPARC, Stat, STEAP, STEAP-II, TACE, TACI, TAG-72 (ассоциированный с опухолью гликопротеин-72), TARC, TCA-3, T-клеточный рецептор (например, T-клеточный рецептор альфа/бета), TdT, TECK, TEM1, TEM5, TEM7, TEM8, TERT, PLAP-подобная щелочная фосфатаза семенников, TfR, TGF, TGF-альфа, TGF-бета, панспецифический TGF-бета, TGF-бета RI (ALK-5), TGF-бета RII, TGF-бета RIIb, TGF-бета RIII, TGF-бета 1, TGF-бета 2, TGF-бета 3, TGF-бета 4, TGF-бета 5, тромбин, Ck-1 тимуса, тиреотропный гормон, Tie, TIMP, TIQ, тканевой фактор, TMEFF2, Tmpo, TMPRSS2, TNF, TNF-альфа, TNF-альфа-бета, TNF-бета 2, TNFc, TNF-RI, TNF-RII, TNFRSF10A (TRAIL R1 Apo-2, DR4), TNFRSF10B (TRAIL R2 DR5, KILLER, TRICK-2A, TRICK-B), TNFRSF10C (TRAIL R3 DcR1, LIT, TRID), TNFRSF10D (TRAIL R4 DcR2, TRUNDD), TNFRSF11A (RANK ODF R, TRANCE R), TNFRSF11B (OPG OCIF, TR1), TNFRSF12 (TWEAK R FN14), TNFRSF13B (TACI), TNFRSF13C (BAFF R), TNFRSF14 (HVEM ATAR, HveA, LIGHT R, TR2), TNFRSF16 (NGFR p75NTR), TNFRSF17 (BCMA), TNFRSF18 (GITR AITR), TNFRSF19 (TROY TAJ, TRADE), TNFRSF19L (RELT), TNFRSF1A (TNF RI CD 120a, p55-60), TNFRSF1B (TNF RII CD 120b, p75-80), TNFRSF26 (TNFRH3), TNFRSF3 (LTbR TNF RIII, TNFC R), TNFRSF4 (0X40 ACT35, TXGP1 R), TNFRSF5 (CD40 p50), TNFRSF6 (Fas Apo-1, APT1, CD95), TNFRSF6B (DcR3 M68, TR6), TNFRSF7 (CD27), TNFRSF8 (CD30), TNFRSF9 (4-1BB CD137, ILA), TNFRSF21 (DR6), TNFRSF22 (DcTRAIL R2 TNFRH2), TNFRST23 (DcTRAIL Rl TNFRH1), TNFRSF25 (DR3 Apo-3, LARD, TR-3, TRAMP, WSL-1), TNFSF10 (лиганд Apo-2 TRAIL, TL2), TNFSF11 (лиганд ODF TRANCE/RANK, лиганд OPG), TNFSF12 (лиганд Apo-3 TWEAK, лиганд DR3), TNFSF13 (APRIL TALL2), TNFSF13B (BAFF BLYS, TALL1, THANK, TNFSF20), TNFSF14 (лиганд HVEM LIGHT, LTg), TNFSF15 (TL1A/VEGI), TNFSF18 (лиганд AITR лиганда GITR, TL6), TNFSF1A (TNF-a коннектин, DIF, TNFSF2), TNFSF1B (TNF-b LTa, TNFSF1), TNFSF3 (LTb TNFC, p33), TNFSF4 (лиганд gp34 OX40, TXGP1), TNFSF5 (лиганд CD154 CD40, gp39, HIGM1, IMD3, TRAP), TNFSF6 (лиганд Apo-1 Fas-лиганда, лиганд APT1), TNFSF7 (лиганд CD70 CD27), TNFSF8 (лиганд CD153 CD30), TNFSF9 (лиганд CD137 лиганда 4-1BB), TP-1, t-PA, Tpo, TRAIL, TRAIL R, TRAIL-R1, TRAIL-R2, TRANCE, рецептор трансферрина, TRF, Trk, TROP-2, TSG, TSLP, ассоциированный с опухолью fynbuty CA125, ассоциированный с опухолью антиген, экспрессирующий ассоциированные с Lewis-Y углеводы, TWEAK, TXB2, Ung, uPAR, uPAR-1, урокиназа, VCAM, VCAM-1, VECAD, VE-кадгерин, VE-кадгерин-2, VEFGR-1 (flt-1), VEGF, VEGFR, VEGFR-3 (flt-4), VEGI, VIM, вирусный антиген, VLA, VLA-1, VLA-4, интегрин VNR, фактор Виллебранда, WIF-1, WNT1, WNT2, WNT2B/13, WNT3, WNT3A, WNT4, WNT5A, WNT5B, WNT6, WNT7A, WNT7B, WNT8A, WNT8B, WNT9A, WNT9A, WNT9B, WNT10A, WNT10B, WNT11, WNT16, XCL1, XCL2, XCR1, XCR1, XEDAR, XIAP, XPD, HMGB1, IgA, Αβ, CD81, CD97, CD98, DDR1, DKK1, EREG, Hsp90, IL-17/IL-17R, IL-20/IL-20R, окисленный LDL, PCSK9, прекалликреин, RON, TMEM16F, SOD1, хромогранин A, хромогранин B, tau, VAP1, высокомолекулярный кининоген, IL-31, IL-31R, Nav1.1, Nav1.2, Nav1.3, Nav1.4, Nav1.5, Nav1.6, Nav1.7, Nav1.8, Nav1.9, EPCR, C1, C1q, C1r, C1s, C2, C2a, C2b, C3, C3a, C3b, C4, C4a, C4b, C5, C5a, C5b, C6, C7, C8, C9, фактор B, фактор D, фактор H, пропердин, склеростин, фибринoген, фибрин, протромбин, тромбин, тканевой фактор, фактор V, фактор Va, фактор VII, фактор VIIa, фактор VIII, фактор VIIIa, фактор IX, фактор IXa, фактор X, фактор Xa, фактор XI, фактор XIa, фактор XII, фактор XIIa, фактор XIII, фактор XIIIa, TFPI, антитромбин III, EPCR, тромбомодулин, TAPI, tPA, плазминоген, плазмин, PAI-1, PAI-2, GPC3, синдекан-1, синдекан-2, синдекан-3, синдекан-4, LPA и S1P; и рецепторы для гормонов и факторов роста.
Хотя рецепторы приведены в качестве примеров упомянутых выше антигенов, когда эти рецепторы существуют в растворимых формах в биологических жидкостях, таких как плазма, они могут образовывать комплексы с антигенсвязывающими молекулами по настоящему изобретению. Таким образом, при условии, что упомянутые выше рецепторы существуют в их растворимых формах в биологических жидкостях, таких как плазма, их можно использовать в качестве антигенов, которые могут образовывать комплексы по настоящему изобретению путем связывания с антигенсвязывающей молекулой по настоящему изобретению. Примером неограничивающего варианта осуществления такого растворимого рецептора является растворимый IL-6R, который представляет собой белок, состоящий из аминокислот в положениях 1-357 в полипептидной последовательности IL-6R SEQ ID NO: 1, как описано в Mullberg et al. (J. Immunol. (1994) 152(10), 4958-4968).
Растворимые антигены приведены в качестве примеров упомянутых выше антигенов, и растворы, в которых антигены существуют, не ограничены. Растворимые антигены могут существовать в биологических жидкостях, или, более конкретно, во всех жидкостях, заполняющих пространство между тканями и клетками или сосудами в организмах. В неограничивающем варианте осуществления антигены, с которыми связываются антигенсвязывающие молекулы по настоящему изобретению, могут присутствовать во внеклеточных жидкостях. В позвоночных внеклеточная жидкость является общим термином для плазмы, интерстициальной жидкости, лимфы, плотной соединительной ткани, цереброспинальной жидкости, спинномозговой жидкости, жидкости пунктата, синовиальной жидкости или подобных компонентов в кости или хряще, альвеолярной жидкости (жидкость бронхоальвеолярного лаважа), перитонеальной жидкости, плевральной жидкости, перикардиальной жидкости, жидкости кисты, водянистой влаги (внутриглазная жидкость) или подобных трансцеллюлярных жидкостей (различные жидкости в полостях желез и жидкости в полости пищеварительного тракта или жидкости других полостей организма, продуцируемые в результате активного транспорта/секреторной активности клеток).
Эпитоп
"Эпитоп" означает антигенную детерминанту в антигене и относится к антигенному центру, с которым связывается антигенсвязывающий домен антигенсвязывающей молекулы, описанной в настоящем описании. Таким образом, например, эпитоп может быть определен в соответствии с его структурой. Альтернативно? эпитоп может быть определен в соответствии с антигенсвязывающей активностью антигенсвязывающей молекулы, которая распознает эпитоп. Когда антиген представляет собой пептид или полипептид, эпитоп может быть указан с помощью аминокислотных остатков, образующих эпитоп. Альтернативно, когда эпитоп представляет собой цепь сахаров, эпитоп может быть указан с помощью его определенной структуры цепи сахаров.
Линейный эпитоп представляет собой эпитоп, который содержит эпитоп, в котором распознается его первичная аминокислотная последовательность. Такой линейный эпитоп, как правило, содержит по меньшей мере три и наиболее часто по меньшей мере пять, например, приблизительно от 8 до 10 или 6-20 аминокислот в его конкретной последовательности.
В противоположность линейному эпитопу, "конформационный эпитоп" представляет собой эпитоп, в котором первичная аминокислотная последовательность, содержащая эпитоп, не является единственной детерминантой распознаваемого эпитопа (например, первичная аминокислотная последовательность конформационного эпитопа не обязательно распознается определяющим эпитоп антителом). Конформационные эпитопы могут содержать большее количество аминокислот по сравнению с линейными эпитопами. Антитело, распознающее конформационный эпитоп, распознает трехмерную структуру пептида или белка. Например, когда молекула белка сворачивается и формирует трехмерную структуру, аминокислоты и/или основные цепи полипептида, которые образуют конформационный эпитоп, располагаются рядом друг с другом, и эпитоп становится распознаваемым для антитела. Способы определения конформаций эпитопов включают, например, рентгеновскую кристаллографию, двумерный ядерный магнитный резонанс, сайт-специфическое спиновое мечение и электронный парамагнитный резонанс, но они не ограничиваются ими. См., например, Epitope Mapping Protocols in Methods in Molecular Biology (1996), Vol. 66, Morris (ed.).
Активность связывания
Примеры способа оценки связывания эпитопа исследуемой антигенсвязывающей молекулой, содержащей антигенсвязывающий домен для IL-6R, описаны ниже. В соответствии с примерами ниже, также можно соответствующим образом проводить способы оценки связывания эпитопа исследуемой антигенсвязывающей молекулой, содержащей антигенсвязывающий домен, с антигеном, отличным от IL-6R.
Например, то, что исследуемая антигенсвязывающая молекула, содержащая антигенсвязывающий домен для IL-6R, распознает линейный эпитоп в молекуле IL-6R, можно подтвердить, например, как описано ниже. Для указанной выше цели синтезируют линейный пептид, содержащий аминокислотную последовательность, образующую внеклеточный домен IL-6R. Пептид можно синтезировать химически или его можно получать способами генетической инженерии с использованием области, кодирующей аминокислотную последовательность, соответствующую внеклеточному домену в кДНК IL-6R, соответствующей SEQ ID NO: 2. Затем исследуемую антигенсвязывающую молекулу, содержащую антигенсвязывающий домен для IL-6R, оценивают в отношении ее активности связывания с линейным пептидом, содержащим аминокислотную последовательность, образующую внеклеточный домен. Например, иммобилизованный линейный пептид можно использовать в качестве антигена в ELISA для оценки активности связывания антигенсвязывающей молекулы с пептидом. Альтернативно, активность связывания с линейным пептидом можно оценивать, исходя из уровня, на котором линейный пептид ингибирует связывание антигенсвязывающей молекулы с клетками, экспрессирующими IL-6R. Эти исследования могут продемонстрировать активность связывания антигенсвязывающей молекулы с линейным пептидом.
Наличие распознавания исследуемой антигенсвязывающей молекулой, содержащей антигенсвязывающий домен для IL-6R, конформационного эпитопа можно оценивать следующим образом. Для указанной выше цели получают экспрессирующие IL-6R клетки. Наличие распознавания исследуемой антигенсвязывающей молекулой, содержащей антигенсвязывающий домен IL-6R, конформационного эпитопа, можно определять, когда она прочно связывается с экспрессирующими IL-6R клетками при контакте, но по существу не связывается с иммобилизованным линейным пептидом, содержащим аминокислотную последовательность, образующую внеклеточный домен IL-6R. В рамках настоящего изобретения "по существу не связывает" означает, что активность связывания составляет 80% или менее, как правило, 50% или менее, предпочтительно 30% или менее, и особенно предпочтительно 15% или менее по сравнению с активностью связывания с клетками, экспрессрующими IL-6R человека.
Способы оценки активности связывания исследуемой антигенсвязывающей молекулы, содержащей антигенсвязывающий домен для IL-6R, с экспрессирующими IL-6R клетками, включают, например, способы, описанные в Antibodies: A Laboratory Manual (Ed Harlow, David Lane, Cold Spring Harbor Laboratory (1988) 359-420). В частности, оценку можно проводить на основе принципа ELISA или активированной флуоресценцией сортировки клеток (FACS) с использованием в качестве антигена экспрессирующих IL-6R клеток.
В формате ELISA активность связывания исследуемой антигенсвязывающей молекулы, содержащей антигенсвязывающий домен для IL-6R, с экспрессирующими IL-6R клетками можно оценивать количественно путем сравнения уровней сигнала, генерируемого ферментативной реакцией. В частности, исследуемый комплекс полипептидов добавляют в планшет для ELISA, на котором иммобилизованы экспрессирующие IL-6R клетки. Затем антигенсвязывающую молекулу, связанную с клетками, выявляют с использованием меченного ферментом антитела, которое распознает исследуемую антигенсвязывающую молекулу. Альтернативно, когда используют FACS, приготавливают серии разведений исследуемой антигенсвязывающей молекулы, и можно определять титр связывания антитела с экспрессирующими IL-6R клетками для сравнения активности связывания исследуемой антигенсвязывающей молекулы с экспрессирующими IL-6R клетками.
Связывание исследуемой антигенсвязывающей молекулы с антигеном, экспрессируемым на поверхности клеток, суспендированных в буфере или сходных с ним, можно выявлять с использованием проточного цитометра. Известные проточные цитометры включают, например, следующие устройства:
FACSCanto™ II
FACSAria™
FACSArray™
FACSVantage™ SE
FACSCalibur™ (все являются торговыми названиями BD Biosciences)
EPICS ALTRA HyPerSort
Cytomics FC 500
EPICS XL-MCL ADC EPICS XL ADC
Cell Lab Quanta/Cell Lab Quanta SC (все являются торговыми названиями Beckman Coulter).
Предпочтительные способы оценки активности связывания исследуемой антигенсвязывающей молекулы, содержащей антигенсвязывающий домен для IL-6R, с антигеном включают, например, следующий способ. Сначала экспрессирующие IL-6R клетки подвергают реакции с исследуемой антигенсвязывающей молекулой, а затем их окрашивают меченным FITC вторичным антителом, которое распознает антигенсвязывающую молекулу. Исследуемую антигенсвязывающую молекулу надлежащим образом разбавляют подходящим буфером с получением молекулы с желаемой концентрацией. Например, молекулу можно использовать в концентрации в диапазоне от 10 мкг/мл до 10 нг/мл. Затем определяют интенсивность флуоресценции и количество клеток с использованием FACSCalibur (BD). Интенсивность флуоресценции, полученную с помощью анализа с использованием программного обеспечения CELL QUEST (BD), т.е. среднее геометрическое значение, отражает количество антитела, связанного с клетками. Следовательно, активность связывания исследуемой антигенсвязывающей молекулы, которую отражает количество связанной исследуемой антигенсвязывающей молекулы, можно определять путем определения геометрического среднего значения.
То, обладает ли исследуемая антигенсвязывающая молекула, содержащая антигенсвязывающий домен для IL-6R, общим эпитопом с другой антигенсвязывающей молекулой, можно оценивать на основе конкуренции между двумя молекулами за один и тот же эпитоп. Конкуренцию между антигенсвязывающими молекулами можно выявлять с помощью анализа перекрестного блокирования и т.п. Например, предпочтительным анализом перекрестного блокирования является конкурентный анализ ELISA.
В частности, в анализе перекрестного блокирования белок IL-6R, иммобилизованный на лунках микропланшета для титрования, предварительно инкубируют в присутствии или в отсутствие являющейся кандидатом конкурентной антигенсвязывающей молекулы, а затем к ним добавляют антигенсвязывающую молекулу. Количество исследуемой антигенсвязывающей молекулы, связавшейся с белком IL-6R в лунках, непрямо коррелирует со связывающей способностью являющейся кандидатом конкурентной антигенсвязывающей молекулы, которая конкурирует за связывание с тем же эпитопом. Следовательно, чем более высокой является аффинность конкурентной антигенсвязывающей молекулы к тому же эпитопу, тем более низкой является активность связывания исследуемой антигенсвязывающей молекулы с покрытыми белком IL-6R лунками.
Количество исследуемой антигенсвязывающей молекулы, связавшейся с лунками через IL-6R, можно без труда определить путем предварительного мечения антигенсвязывающей молекулы. Например, меченную биотином антигенсвязывающую молекулу определяют с использованием конъюгата авидин/пероксидаза и соответствующего субстрата. В частности, анализ перекрестного блокирования, в котором используются ферментные метки, такие пероксидаза, называют "конкурентным анализом ELISA". Антигенсвязывающую молекулу также можно метить другими агентами для мечения, которые обеспечивают выявление или измерение. В частности, известны радиоактивные метки, флуоресцентные метки и т.п.
Когда являющаяся кандидатом конкурентная антигенсвязывающая молекула может блокировать связывание исследуемой антигенсвязывающей молекулы, содержащей антигенсвязывающий домен для IL-6R, по меньшей мере на 20%, предпочтительно по меньшей мере на 20-50% и более предпочтительно по меньшей мере на 50% по сравнению с активностью связывания в контрольном эксперименте, проведенном в отсутствие конкурентного комплекса антигенсвязывающей молекулы, то определяют, что исследуемая антигенсвязывающая молекула по существу связывается с тем же эпитопом, с которым связывается конкурентная антигенсвязывающая молекула, или конкурирует за связывание с тем же эпитопом.
Когда структура эпитопа, с которым связывается исследуемая антигенсвязывающая молекула, содержащая антигенсвязывающий домен для IL-6R, уже идентифицирована, тогда то, имеют ли исследуемые и контрольные антигенсвязывающие молекулы общий эпитоп, можно оценивать путем сравнения активности связывания двух антигенсвязывающих молекул с пептидом, полученным путем внесения аминокислотных мутаций в пептид, формирующий эпитоп.
Для измерения указанной выше активности связывания, например, активность связывания исследуемых и контрольных антигенсвязывающих молекул в отношении линейного пептида, в который внесена мутация, сравнивают в описанном выше формате ELISA. Помимо способов ELISA, активность связывания с мутантным пептидом, связанным с колонкой, можно определять путем пропускания исследуемых и контрольных антигенсвязывающих молекул через колонку, а затем количественного определения антигенсвязывающей молекулы, элюированной в элюирующем растворе. Способы адсорбции мутантного пептида на колонку, например, в форме слитого пептида с GST, известны.
Альтернативно, когда идентифицированный эпитоп представляет собой конформационный эпитоп, тогда то, обладают ли исследуемые и контрольные антигенсвязывающие молекулы общим эпитопом, можно оценивать следующим способом. Сначала получают экспрессирующие IL-6R клетки и клетки, экспрессирующие IL-6R с мутацией, внесенной в эпитоп. Исследуемые и контрольные антигенсвязывающие молекулы добавляют в суспензию клеток, полученную суспендированием этих клеток в соответствующем буфере, таком как PBS. Затем клеточные суспензии надлежащим образом промывают буфером, и к ним добавляют меченное FITC антитело, которое распознает исследуемые и контрольные антигенсвязывающие молекулы. Интенсивность флуоресценции и количество клеток, окрашенных меченым антителом, определяют с использованием FACSCalibur (BD). Исследуемые и контрольные антигенсвязывающие молекулы надлежащим образом разбавляют с использованием подходящего буфера и используют в желаемых концентрациях. Например, их можно использовать в концентрации в диапазоне от 10 мкг/мл до 10 нг/мл. Интенсивность флуоресценции, определенная с помощью анализа с использованием программного обеспечения CELL QUEST (BD), т.е. геометрическое среднее значение, отражает количество меченого антитела, связавшегося с клетками. Следовательно, активность связывания исследуемых и контрольных антигенсвязывающих молекул, которую отражает количество связавшегося меченого антитела, можно определять путем измерения геометрического среднего значения.
В описанном выше способе, то, что антигенсвязывающая молекула "по существу не связывается с клетками, экспрессирующими мутантный IL-6R", можно оценивать, например, следующим способом. Сначала исследуемые и контрольные антигенсвязывающие молекулы, связанные с клетками, экспрессирующими мутантный IL-6R, окрашивают меченым антителом. Затем определяют интенсивность флуоресценции клеток. Когда используют FACSCalibur для выявления флуоресценции проточной цитометрией, определенную интенсивность флуоресцении можно анализировать с использованием программного обеспечения CELL QUEST. Из геометрических средних значений в присутствии и в отсутствие комплекса полипептидов можно вычислять сравнительное значение (ΔGeo-Mean) по следующей формуле для определения соотношения увеличения интенсивности флуоресценции в результате связывания антигенсвязывающей молекулой.
ΔGeo-Mean=Geo-Mean (в присутствии комплекса полипептидов)/Geo-Mean (в отсутствие комплекса полипептидов)
Геометрическое среднее сравнительное значение (значение ΔGeo-Mean для мутантной молекулы IL-6R), определенное с помощью описанного выше анализа, которое отражает количество исследуемой антигенсвязывающей молекулы, связавшейся с клетками, экспрессирующими мутантный IL-6R, сравнивают со сравнительным значением ΔGeo-Mean, которое отражает количество исследуемой антигенсвязывающей молекулы, связавшейся с экспрессирующими IL-6R клетками. В этом случае особенно предпочтительно, чтобы концентрации исследуемой антигенсвязывающей молекулы, используемой для определения сравнительных значений ΔGeo-Mean для экспрессирующих IL-6R клеток и клеток, экспрессирующих мутантный IL-6R, были скорректированы так, чтобы они были равными или по существу равными. В качестве контрольной антигенсвязывающей молекулы используют антигенсвязывающую молекулу, для которой подтверждено, что она распознает эпитоп в IL-6R.
Если сравнительное значение ΔGeo-Mean исследуемой антигенсвязывающей молекулы для клеток, экспрессирующих мутантный IL-6R, меньше, чем сравнительное значение ΔGeo-Mean исследуемой антигенсвязывающей молекулы для экспрессирующих IL-6R клеток по меньшей мере на 80%, предпочтительно на 50%, более предпочтительно на 30% и особенно предпочтительно на 15%, тогда исследуемая антигенсвязывающая молекула "по существу не связывается с клетками, экспрессирующими мутантный IL-6R". Формула для определения значения Geo-Mean (геометрического среднего значения) описана в руководстве пользователя программного обеспечения CELL QUEST (BD biosciences). Если сравнение показывает, что сравнительные величины по существу эквивалентны, то может быть определено, что эпитоп для исследуемой и контрольной антигенсвязывающих молекул является одним и тем же.
Антигенсвязывающий домен
В рамках настоящего изобретения "антигенсвязывающий домен" может представлять собой любую структуру при условии, что она связывается с представляющим интерес антигеном. Такие домены предпочтительно включают, например:
вариабельные области тяжелых цепей и легких цепей антител;
модуль приблизительно из 35 аминокислот, называемый A-доменом, который содержится в мембранном белке клеток авимере in vivo (WO 2004/044011, WO 2005/040229);
аднектин, содержащий домен 10Fn3, который связывается с белковой частью фибронектина - гликопротеина, экспрессирующегося на клеточной мембране (WO 2002/032925);
аффитело, которое состоит из трехспирального пучка из 58-аминокислот на основе каркаса связывающего IgG домена белка A (WO 1995/001937);
смоделированные белки анкиринового повтора (DARPin), которые представляют собой область, экспонированную на молекулярной поверхности анкириновых повторов (AR), имеющих структуру, в которой субъединица, состоящая из поворота, содержащего 33 аминокислотных остатка, две антипараллельных спирали и петли многократно сложены в стопку (WO 2002/020565);
антикалины и т.п., которые представляют собой домены, состоящие из четырех петель, которые поддерживают одну сторону структуры бочки, состоящей из восьми расположенных по кругу антипараллельных нитей, которые являются высоко консервативными среди молекул липокалина, таких как ассоциированный с желатиназой липокалин нейтрофилов (NGAL) (WO 2003/029462); и
вогнутая область, образованная структурой параллельных слоев внутри структуры в форме подковы, образованной уложенными в стопку повторами модуля лейцин-богатого повтора (LRR) вариабельного рецептора лимфоцитов (VLR), который не имеет иммуноглобулиновой структуры и используется в системе приобретенного иммунитета у бесчелюстных позвоночных, таких как минога и миксина (WO 2008/016854). Предпочтительные антигенсвязывающие домены по настоящему изобретению включают, например, антигенсвязывающие домены, имеющие вариабельные области тяжелых цепей и легких цепей антител. Предпочтительные примеры антигенсвязывающих доменов включают "одноцепочечный Fv (scFv)", "одноцепочечное антитело", "Fv", "одноцепочечный Fv 2 (scFv2)", "Fab" и "F(ab')2".
Антигенсвязывающие домены антигенсвязывающих молекул по настоящему изобретению могут связываться с идентичным эпитопом. Такой эпитоп может присутствовать, например, в белке, содержащем аминокислотную последовательность SEQ ID NO: 1. Альтернативно, каждый из антигенсвязывающих доменов антигенсвязывающих молекул по настоящему изобретению может связываться с отличающимся эпитопом. В рамках настоящего изобретения, отличающийся эпитоп может присутствовать, например, в белке, содержащем аминокислотную последовательность SEQ ID NO: 1.
Специфичный
Что касается связывания антигенсвязывающих молекул, предусматриваемых настоящим изобретением, с антигеном, термин "специфичный" означает, что одна из молекул, которая специфически связывается, по существу не связывается с молекулами, отличными от ее одной или множества молекулы(молекул)-партнера по связыванию. В рамках настоящего изобретения, "по существу не связывает" относится к наличию 80% или менее, как правило, 50% или менее, предпочтительно 30% или менее и особенно предпочтительно 15% или менее активности связывания с молекулами, отличными от молекул-партнеров по связыванию, по сравнению с активностью связывания с молекулой(ами)-партнером, как описано в упомянутом выше разделе об активности связывания. Более того, "специфичный" также используют, когда антигенсвязывающий домен является специфичным к конкретному эпитопу среди множества эпитопов в антигене. Когда эпитоп, связываемый антигенсвязывающим доменом, содержится в нескольких различных антигенах, антигенсвязывающие молекулы, содержащие антигенсвязывающий домен, могут связываться с различными антигенами, которые имеют этот эпитоп.
Нейтрализующая активность
В неограничивающем варианте осуществления настоящего изобретения предусматривается фармацевтическая композиция, содержащая в качестве активного ингредиента антигенсвязывающую молекулу, обладающую антигеннейтрализующей активностью, где антигенсвязывающая молекула содержит (i) антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов, (ii) FcγR-связывающий домен, обладающий активностью селективного связывания FcγRIIb, и (iii) FcRn-связывающий домен, обладающий активностью связывания FcRn в условиях диапазона кислых значений pH. Главным образом, нейтрализующая активность относится к активности ингибирования биологической активности лиганда, такого как вирусы и токсины, обладающие биологической активностью в отношении клеток. Таким образом, вещества, обладающие нейтрализующей активностью, относятся к веществам, которые связываются с лигандом или рецептором, с которым связывается лиганд, и ингибируют связывание между лигандом и рецептором. Рецепторы, связывание которых с лигандом блокировано вследствие нейтрализующей активности, не способны проявлять биологическую активность через этот рецептор. Когда антигенсвязывающая молекула представляет собой антитело, такое антитело, обладающее нейтрализующей активностью, обычно называют нейтрализующим антителом. Нейтрализующую активность исследуемого вещества можно измерять путем сравнения биологической активности в присутствии лиганда между ситуациями, когда исследуемое вещество присутствует и отсутствует.
Например, основные возможные лиганды для рецептора IL-6 предпочтительно включают IL-6, как показано в SEQ ID NO: 3. Рецептор IL-6, который представляет собой мембранный белок типа I, N-конец которого образует внеклеточный домен, образует гетеротетрамер с рецептором gp130, который индуцируется к димеризации посредством IL-6 (Heinrich et al. (Biochem. J. (1998) 334, 297-314)). Образование гетеротетрамера активирует Jak, которая ассоциирована с рецептором gp130. Jak претерпевает аутофосфорилирование и фосфорилирует рецептор. Участок фосфорилирования рецептора и Jak служит в качестве участка связывания для содержащих SH2 молекул, принадлежащих семейству Stat, таких как Stat3; MAP-киназа; PI3/Akt; и другие содержащие SH2 белки и адаптеры. Далее, Stat, связанный с рецептором gp130, фосфорилируется посредством Jak. Фосфорилированный Stat димеризуется и перемещается в ядро, и регулирует транскрипцию генов-мишеней. Jak или Stat также могут быть вовлечены в каскады передачи сигнала через рецепторы других классов. Нарушенную регуляцию каскадов передачи сигнала IL-6 наблюдают при воспалительных и патологических состояниях аутоиммунных заболеваний и злокачественных опухолей, таких как рак предстательной железы и множественная миелома. Stat3, который может действовать в качестве онкогена, конститутивно активируется во многих злокачественных опухолях. При раке предстательной железы и множественной миеломе существует перекрестная связь между каскадом передачи сигнала через рецептор IL-6 и каскадом передачи сигнала через представителей семейства рецептора эпителиального фактора роста (EGFR) (Ishikawa et al. (J. Clin. Exp. Hematopathol. (2006) 46(2), 55-66)).
Такие внутриклеточные каскады передачи сигнала различаются для каждого типа клеток; таким образом, соответствующие молекулы-мишени можно определять для каждой представляющей интерес клетки-мишени, и они не ограничиваются упомянутыми выше факторами. Активность нейтрализации можно оценивать путем измерения активации передачи сигнала in vivo. Более того, активацию передачи сигнала in vivo можно выявлять с использованием в качестве показателя действия индукции транскрипции гена-мишени, который находится ниже каскада передачи сигнала in vivo. Изменение активности транскрипции гена-мишени можно выявлять по принципу репортерных анализов. В частности, репортерный ген, такой как зеленый флуоресцентный белок (GFP) или люцифераза, помещают ниже промоторной области или фактора транскрипции гена-мишени, его репортерную активность измеряют, и, тем самым, можно измерять изменение активности транскрипции в качестве активности репортера. Можно соответствующим образом использовать коммерчески доступные наборы для измерения активации передачи сигнала in vivo (например, Mercury Pathway Profiling Luciferase System (Clontech)).
Более того, для способов измерения активности нейтрализации рецепторов/лигандов семейства рецепторов EGF и т.п., которая обычно воздействует на каскады передачи сигнала, которые действуют в направлении стимуляции пролиферации клеток, активность нейтрализации антигенсвязывающих молекул можно оценивать путем измерения активности пролиферации клеток-мишеней. Например, когда пролиферация клеток стимулируется факторами роста семейства EGF, такими как HB-EGF, ингибиторный эффект на пролиферацию таких клеток, основанный на нейтрализующей активности антитела против HB-EGF, можно пригодным образом оценивать или измерять следующими способами: для оценки или измерения активности ингибирования пролиферации клеток in vitro используют способ измерения включения [3H]-меченного тимидина, добавленного в среду, жизнеспособными клетками в качестве показателя способности к репликации ДНК. В качестве более удобных способов используют способ исключения красителя, в котором измеряют способность клеток исключать краситель, такой как трипановый синий, из клетки под микроскопом, и способ с MTT. В последнем из этих способов используется способность живых клеток преобразовывать MTT (бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия), который представляет собой соль тетразолия, в синий продукт формазан. Более конкретно, исследуемое антитело добавляют вместе с лигандом в культуральный раствор исследуемых клеток, и после определенного периода времени в культуральный раствор добавляют MTT, и его оставляют стоять в течение некоторого периода времени для включения MTT в клетку. В результате, MTT, который представляет собой желтое соединение, преобразуется в синее соединение под действием сукцинатдегидрогеназы в митохондриях клеток. После растворения этого синего продукта для окрашивания, его поглощение измеряют и используют в качестве показателя количества живых клеток. В дополнение к MTT, также являются коммерчески доступными реагенты, такие как MTS, XTT, WST-1 и WST-8 (Nacalai Tesque и т.п.), и их можно пригодным образом использовать. Для измерения активности связывающее антитело, которое представляет собой антитело того же изотипа, что и антитело против HB-EGF, но не обладает активностью ингибирования пролиферации клеток, можно использовать в качестве контрольного антитела аналогично тому, как и антитело против HB-EGF, и активность можно определять, когда антитело против HB-EGF демонстрирует более высокую активность ингибирования пролиферации клеток, чем контрольное антитело.
Клетки, которые предпочтительно можно использовать для оценки активности, включают, например, клетки, пролиферация которых стимулируется посредством HB-EGF, такие как клеточная линия рака яичника RMG-1 и клетки мыши Ba/F3, трансформированные вектором для экспрессии гена, кодирующего hEGFR/mG-CSFR, который представляет собой слитый белок, в котором внеклеточный домен EGFR человека слит в рамке считывания с внутриклеточным доменом рецептора G-CSF мыши. Таким образом, специалисты в данной области могут соответствующим образом выбрать клетки для применения для оценки активности и использовать их для измерения активности пролиферации клеток, как упоминалось выше.
Антитело
В рамках настоящего изобретения "антитело" относится к природному иммуноглобулину или иммуноглобулину, полученному частичным или полным синтезом. Антитела можно выделять из природных источников, таких как природная плазма и сыворотка, или из культуральных супернатантов продуцирующих антитела гибридом. Альтернативно, антитела можно частично или полностью синтезировать с использованием способов, таких как генетическая рекомбинация. Предпочтительные антитела включают, например, антитела изотипа иммуноглобулинов или принадлежащего ему подкласса. Известные иммуноглобулины человека включают антитела следующих девяти классов (изотипов): IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgD, IgE и IgM. Из этих изотипов антитела по настоящему изобретению включают IgG1, IgG2, IgG3 и IgG4. Ряд аллотипических последовательностей константных областей IgG1 человека, IgG2 человека, IgG3 человека и IgG4 человека вследствие генетического полиморфизма описан в "Sequences of proteins of immunological interest", NIH Publication No.91-3242. Любую из таких последовательностей можно использовать в рамках настоящего изобретения. В частности, для последовательности IgG1 человека, аминокислотная последовательность положений 356-358, как указано с помощью нумерации EU, может быть либо DEL, либо EEM. Несколько аллотипических последовательностей вследствие генетических полиморфизмов описаны в "Sequences of proteins of immunological interest", NIH Publication No. 91-3242 для константной области Igκ (каппа) человека и константной области Igλ (лямбда) человека, и любую из этих последовательностей можно использовать в рамках настоящего изобретения.
Способы получения антитела с желаемой активностью связывания известны специалистам в данной области. Ниже приведен пример, в котором описан способ получения антитела, которое связывается с IL-6R (антитело против IL-6R). Антитела, которые связываются с антигеном, отличным от IL-6R, также можно получать в соответствии с примером, описанным ниже.
Антитела против IL-6R можно получать в качестве поликлональных или моноклональных антител с использованием известных способов. Продуцируемые антитела против IL-6R предпочтительно представляют собой моноклональные антитела, происходящие из млекопитающих. Такие происходящие из млекопитающих моноклональные антитела включают антитела, продуцируемые гибридомами или клетками-хозяевами, трансформированными экспрессирующим вектором, несущим ген антитела, способами генетической инженерии. Моноклональные антитела по настоящему изобретению включают "гуманизированные антитела" или "химерные антитела".
Продуцирующие моноклональные антитела гибридомы можно получать с использованием известных способов, например, как описано ниже. В частности, млекопитающих иммунизируют общепринятыми способами иммунизации с использованием белка IL-6R в качестве сенсибилизирующего антигена. Полученные иммунные клетки подвергают слиянию с известными родительскими клетками общепринятыми способами слияния клеток. Затем гибридомы, продуцирующие антитело против IL-6R, можно отбирать путем скрининга продуцирующих моноклональное антитело клеток с использованием общепринятых способов скрининга.
В частности, моноклональные антитела получают так, как описано ниже. Сначала можно экспрессировать ген IL-6R, нуклеотидная последовательность которого представлена в SEQ ID NO: 2, для получения белка IL-6R, представленного в SEQ ID NO: 1, который будет использован в качестве сенсибилизирующего антигена для получения антитела. Для этого последовательность гена, кодирующего IL-6R, встраивают в известный экспрессирующий вектор, и подходящие клетки-хозяева трансформируют этим вектором. Желаемый белок IL-6R человека очищают из клеток-хозяев или их культуральных супернатантов известными способами. Для получения растворимого IL-6R из культуральных супернатантов, например, белок, состоящий из аминокислот в положениях 1-357 в полипептидной последовательности IL-6R SEQ ID NO: 1, такой как описан в Mullberg et al. (J. Immunol. (1994) 152(10), 4958-4968), экспрессируют в качестве растворимого IL-6R вместо белка IL-6R SEQ ID NO: 1. Также в качестве сенсибилизирующего антигена можно использовать очищенный нативный белок IL-6R.
Очищенный белок IL-6R можно использовать в качестве сенсибилизирующего антигена для иммунизации млекопитающих. Также в качестве сенсибилизирующего антигена можно использовать неполный пептид IL-6R. В этом случае неполный пептид можно получать путем химического синтеза на основе аминокислотной последовательности IL-6R человека, или путем встраивания неполного гена IL-6R в экспрессирующий вектор для экспрессии. Альтернативно, неполный пептид можно получать путем деградации белка IL-6R протеазой. Длина и область неполного пептида IL-6R не ограничены конкретными вариантами осуществления. Предпочтительная область может быть произвольным образом выбрана из аминокислотной последовательности в положениях аминокислот 20-357 аминокислотной последовательности SEQ ID NO: 1. Количество аминокислот, образующих пептид, подлежащий применению в качестве сенсибилизирующего антигена, предпочтительно составляет по меньшей мере пять или более, шесть или более или семь или более. Более конкретно, в качестве сенсибилизирующего антигена можно использовать пептид из 8-50 остатков, более предпочтительно из 10-30 остатков.
Альтернативно, для сенсибилизирующего антигена можно использовать слитый белок, полученный путем слияния желаемого неполного полипептида или пептида белка IL-6R с отличающимся полипептидом. Например, предпочтительно в качестве сенсибилизирующих антигенов используют Fc-фрагменты антител и пептидные метки. Векторы для экспрессии таких слитых белков можно конструировать путем слияния в рамке считывания генов, кодирующих два или более желаемых полипептидных фрагментов, и встраивания слитого гена в экспрессирующий вектор, как описано выше. Способы получения слитых белков описаны в Molecular Cloning 2nd ed. (Sambrook, J. et al., Molecular Cloning 2nd ed., 9.47-9.58 (1989) Cold Spring Harbor Lab. Press). Способы получения IL-6R для применения в качестве сенсибилизирующего антигена и способы иммунизации с использованием IL-6R конкретно описаны в WO 2003/000883, WO 2004/022754, WO 2006/006693 и т.п.
Отсутствует конкретное ограничение на млекопитающих, подлежащих иммунизации сенсибилизирующим антигеном. Однако предпочтительно выбирать млекопитающих, учитывая их совместимость с родительскими клетками, используемыми для слияния клеток. Как правило, предпочтительно используют грызунов, таких как мыши, крысы и хомячки, кроликов и обезьян.
Указанных выше животных иммунизируют сенсибилизирующим антигеном известными способами. Как правило, выполняемые способы иммунизации включают, например, внутрибрюшинную или подкожную инъекцию сенсибилизирующего антигена млекопитающим. В частности, сенсибилизирующий антиген соответствующим образом разбавляют PBS (фосфатно-солевой буфер), физиологическим солевым раствором или сходными с ними. Если желательно, общепринятый адъювант, такой как полный адъювант Фрейнда, смешивают с антигеном, и смесь эмульгируют. Затем сенсибилизирующий антиген вводят млекопитающим несколько раз с интервалами 4-21 суток. При иммунизации сенсибилизирующим антигеном можно использовать подходящие носители. В частности, когда в качестве сенсибилизирующего антигена используют низкомолекулярный неполный пептид, иногда желательно связывать сенсибилизирующий антигенный пептид с белком-носителем, таким как альбумин или гемоцианин лимфы улитки, для иммунизации.
Альтернативно, гибридомы, продуцирующие желаемое антитело, можно получать с использованием способов иммунизации ДНК, как описано ниже. Иммунизация ДНК представляет собой способ иммунизации, который обеспечивает стимуляцию иммунной системы путем экспрессии сенсибилизирующего антигена у животного, иммунизированного в результате введения векторной ДНК, сконструированной для обеспечения экспрессии гена, кодирующего антигенный белок, у животного. По сравнению с общепринятыми способами иммунизации, в которых белковый антиген вводят животным, подлежащим иммунизации, иммунизация ДНК является лучшей в том, что:
- может быть обеспечена стимуляция иммунной системы при сохранении структуры мембранного белка, такого как IL-6R; и
- отсутствует необходимость в очистке антигена для иммунизации.
Для получения моноклонального антитела по настоящему изобретению с использованием иммунизации ДНК, сначала ДНК, экспрессирующую белок IL-6R, вводят животному, подлежащему иммунизации. ДНК, кодирующую IL-6R, можно синтезировать известными способами, такими как ПЦР. Полученную ДНК встраивают в соответствующий экспрессирующий вектор, а затем его вводят животному, подлежащему иммунизации. Предпочтительно используемые экспрессирующие векторы включают, например, коммерчески доступные экспрессирующие векторы, такие как pcDNA3.1. Векторы можно вводить в организм с использованием общепринятых способов. Например, иммунизацию ДНК проводят с использованием генной пушки для введения покрытых экспрессирующим вектором частиц золота в клетки организма животного, подлежащего иммунизации. Антитела, которые распознают IL-6R. также можно получать способами, описанными в WO 2003/104453.
После иммунизации млекопитающего, как описано выше, подтверждают увеличение титра связывающего IL-6R антитела в сыворотке. Затем иммунные клетки собирают от млекопитающего, а затем подвергают слиянию клеток. В частности, предпочтительно в качестве иммунных клеток используют спленоциты.
В качестве клетки, подлежащей слиянию с упомянутыми выше иммунными клетками, используют клетки миеломы млекопитающих. Клетки миеломы предпочтительно содержат подходящий селективный маркер для скрининга. Селективный маркер придает клеткам характеристики для их выживания (или гибели) в конкретных условиях культивирования. В качестве селективных маркеров известны дефицит гипоксантин-гуанин-фосфорибозилтрансферазы (далее сокращенно обозначаемый как дефицит HGPRT) и дефицит тимидинкиназы (далее сокращенно обозначаемый как дефицит TK). Клетки с дефицитом HGPRT или TK обладают чувствительностью к гипоксантину-аминоптерину-тимидину (далее сокращенно обозначаемой чувствительностью HAT). Чувствительные к HAT клетки не могут синтезировать ДНК в селективной среде HAT и, таким образом, погибают. Однако, когда клетки слиты с нормальными клетками, они могут продолжать синтезировать ДНК с использованием пути спасения нормальных клеток, и, таким образом, они могут расти в селективной среде HAT.
Селекцию клеток с дефицитом HGPRT и TK можно проводить в среде, содержащей 6-тиогуанин, 8-азагуанин (далее сокращенно обозначаемый как 8AG) или 5'-бромдезоксиуридин, соответственно. Нормальные клетки погибают, поскольку они включают аналоги пиримидина в их ДНК. Между тем, клетки, которые являются дефицитными по этим ферментам, могут выживать в селективной среде, поскольку они не могут включать эти аналоги пиримидина. Кроме того, селективный маркер, называемый устойчивостью к G418, обеспечиваемый геном устойчивости к неомицину, обеспечивает устойчивость к 2-дезоксистрептаминовым антибиотикам (аналоги гентамицина). Известны различные типы миеломных клеток, которые пригодны для слияния клеток.
Например, предпочтительно можно использовать миеломные клетки, включающие следующие клетки:
P3(P3x63Ag8.653) (J. Immunol. (1979) 123(4), 1548-1550);
P3x63Ag8U.1 (Current Topics in Microbiology and Immunology (1978) 81, 1-7);
NS-1 (C. Eur. J. Immunol. (1976) 6(7), 511-519);
MPC-11 (Cell (1976) 8(3), 405-415);
SP2/0 (Nature (1978) 276(5685), 269-270);
FO (J. Immunol. Methods (1980) 35(1-2), 1-21);
S194/5.XX0.BU.1 (J. Exp. Med. (1978) 148(1), 313-323);
R210 (Nature (1979) 277(5692), 131-133), и т.д.
Слияние клеток между иммуноцитами и клетками миеломы по существу проводят с использованием известных способов, например, способа Kohler and Milstein et al. (Methods Enzymol. (1981) 73:3-46).
Более конкретно, слияние клеток можно проводить, например, в общепринятой культуральной среде в присутствии агента, обеспечивающего слияние клеток. Агенты, обеспечивающие слияние клеток, включают, например, полиэтиленгликоль (PEG) и вирус Сендай (HVJ). Если необходимо, также можно добавлять вспомогательное вещество, такое как диметилсульфоксид, для повышения эффективности слияния.
Соотношение иммунных клеток и клеток миеломы можно определять самостоятельно, предпочтительно, например, оно составляет одну клетку миеломы на каждые от одного до десяти иммуноцитов. Культуральные среды, используемые для слияния клеток, включают, например, среды, которые пригодны для выращивания клеточных линий, такие как среда RPMI1640 и среда MEM, и другие общепринятые культуральные среды, используемые для этого типа клеточной культуры. Кроме того, предпочтительно в культуральную среду можно добавлять сывороточные добавки, такие как эмбриональная телячья сыворотка (FCS).
Для слияния клеток заданные количества указанных выше иммунных клеток и миеломных клеток смешивают в описанной выше культуральной среде. Затем добавляют раствор PEG (например, средняя молекулярная масса составляет приблизительно от 1000 до 6000), предварительно нагретый до приблизительно 37°C, в концентрации, как правило, от 30% до 60% (масс./об.). Затем эту смесь осторожно перемешивают для получения желаемых слитых клеток (гибридом). Затем к клеткам постепенно добавляют подходящую культуральную среду, упомянутую выше, и смесь многократно центрифугируют для удаления супернатанта. Таким образом, можно удалить агенты слияния клеток и т.п., которые являются неблагоприятными для роста гибридомы.
Селекцию полученных таким образом гибридом можно проводить путем культивирования с использованием общепринятой селективной среды, например, среды HAT (культуральная среда, содержащая гипоксантин, аминоптерин и тимидин). Клетки, отличные от желаемых гибридом (неслитые клетки), можно уничтожать путем продолжения культивирования в описанной выше среде HAT в течение достаточного периода времени (как правило, период составляет от нескольких суток до нескольких недель). Затем гибридомы, продуцирующие желаемое антитело, подвергают скринингу и клонируют по отдельности общепринятыми способами лимитирующих разведений.
Селекцию полученных таким образом гибридом можно проводить с использованием селективной среды на основе селективного маркера, которым обладает миелома, используемая для слияния клеток. Например, селекцию клеток с дефицитом HGPRT или TK можно проводить путем культивирования с использованием среды HAT (культуральная среда, содержащая гипоксантин, аминоптерин и тимидин). В частности, когда для слияния клеток используют чувствительные к HAT миеломные клетки, клетки, успешно слитые с нормальными клетками, могут селективно пролиферировать в среде HAT. Клетки, отличные от желаемых гибридом (неслитые клетки), можно уничтожать путем продолжения культивирования в описанной выше среде HAT в течение достаточного периода времени. В частности, селекцию желаемых гибридом можно проводить путем культивирования, как правило, в течение от нескольких суток до нескольких недель. Затем гибридомы, продуцирующие желаемое антитело, подвергают скринингу и по отдельности клонируют общепринятыми способами лимитирующих разведений.
Желаемые антитела можно предпочтительно отбирать и по отдельности клонировать способами скрининга на основе известной реакции антиген/антитело. Например, связывающее IL-6R моноклональное антитело может связываться с IL-6R, экспрессированным на поверхности клетки. Такое моноклональное антитело можно подвергать скринингу с помощью активированной флуоресценцией сортировки клеток (FACS). FACS представляет собой систему, которая оценивает связывание антитела с клеточной поверхностью путем анализа клеток, контактирующих с флуоресцентным антителом, с использованием лазерного луча и измерения флуоресценции, испускаемой индивидуальными клетками.
Для скрининга гибридом, которые продуцируют моноклональные антитело по настоящему изобретению, с помощью FACS, сначала получают экспрессирующие IL-6R клетки. Клетки, предпочтительно используемые для скрининга, представляют собой клетки млекопитающих, в которых IL-6R экспрессируется неестественным образом. В качестве контроля можно проводить селективное выявление активности антитела, которое связывается с IL-6R клеточной поверхности, с использованием в качестве клеток-хозяев нетрансформированных клеток млекопитающих. В частности, гибридомы, продуцирующие моноклональное антитело против IL-6R, можно выделять путем селекции гибридом, которые продуцируют антитело, которое связывается с клетками, в которых экспрессируется IL-6R неестественным образом, но не с клетками-хозяевами.
Альтернативно, активность связывания антитела с иммобилизованными экспрессирующими IL-6R клетками можно оценивать на основе принципа ELISA. Например, экспрессирующие IL-6R клетки иммобилизуют на лунках планшета для ELISA. Культуральные супернатанты гибридом контактируют с иммобилизованными клетками в лунках и выявляют антитела, которые связываются с иммобилизованными клетками. Когда моноклональные антитела происходят из мыши, антитела, связанные с клетками, можно выявлять с использованием антитела против иммуноглобулина мыши. Селекцию гибридом, продуцирующих желаемое антитело, обладающее антигенсвязывающей способностью, проводят с помощью описанного выше скрининга, и их можно клонировать способом лимитирующих разведений и т.п.
Продуцирующие моноклональное антитело гибридомы, полученные таким образом, можно пассировать в общепринятой культуральной среде и хранить в жидком азоте в течение длительного периода времени.
Описанные выше гибридомы культивируют общепринятым способом, и желаемые моноклональные антитела можно получать из культуральных супернатантов. Альтернативно, гибридомы вводят совместимым млекопитающим и выращивают в них, и моноклональные антитела получают из асцитной жидкости. Первый из этих способов пригоден для получения антител с высокой чистотой.
Предпочтительно, также можно использовать антитела, кодируемые генами антител, которые клонированы из антителопродуцирующих клеток, таких как описанные выше гибридомы. Клонированный ген антитела встраивают в подходящий вектор, и его вводят в клетку-хозяина для экспрессии антитела, кодируемого геном. Способы выделения генов антител, встраивания генов в векторы и трансформации клеток-хозяев уже разработаны, например, Vandamme et al. (Eur. J. Biochem. (1990) 192(3), 767-775). Способы продуцирования рекомбинантных антител также известны, как описано ниже.
Например, кДНК, кодирующую вариабельную область (V-область) антитела против IL-6R, получают из клеток гибридомы, экспрессирующих антитело против IL-6R. Для этой цели сначала из гибридом экстрагируют тотальную РНК. Способы, используемые для экстракции мРНК из клеток, включают, например:
- способ ультрацентрифугирования с гуанидином (Biochemistry (1979) 18(24), 5294-5299), и
- способ AGPC (Anal. Biochem. (1987) 162(1), 156-159)
Экстрагированные мРНК можно очищать с использованием набора для очистки мРНК mRNA Purification Kit(GE Healthcare Bioscience) и т.п. Альтернативно, также коммерчески доступны наборы для экстракции тотальной мРНК непосредственно из клеток, такие как набор для очистки мРНК QuickPrep mRNA Purification Kit (GE Healthcare Bioscience). мРНК можно получать из гибридом с использованием таких наборов. кДНК, кодирующие V-область антитела, можно синтезировать из полученных мРНК с использованием обратной транскриптазы. кДНК можно синтезировать с использованием набора для синтеза первой цепи кДНК с обратной транскриптазой AMV Reverse Transcriptase First-strand cDNA Synthesis Kit (Seikagaku Co.) и т.п. Более того, для синтеза и амплификации кДНК можно соответствующим образом использовать набор для амплификации кДНК SMART RACE cDNA Amplification Kit (Clontech) и способ 5’-RACE на основе ПЦР (Proc. Natl. Acad. Sci. USA (1988) 85(23), 8998-9002; Nucleic Acids Res. (1989) 17(8), 2919-2932). В таком способе синтеза кДНК на оба конца кДНК можно вносить подходящие участки для ферментов рестрикции, описанные ниже.
Представляющий интерес фрагмент кДНК очищают из полученного продукта ПЦР, а затем его лигируют в векторную ДНК. Таким образом, конструируют рекомбинантный вектор и вводят в E. coli и т.п. После селекции колоний из образующих колонии E. coli можно получать желаемый рекомбинантный вектор. Затем исследуют, имеет ли рекомбинантный вектор представляющую интерес нуклеотидную последовательность кДНК, известным способом, таким как способ с терминацией цепи дидезоксинуклеотидами.
Способ 5'-RACE, в котором используются праймеры для амплификации гена вариабельной области, удобно использовать для выделения гена, кодирующего вариабельную область. Сначала конструируют библиотеку кДНК 5'-RACE с помощью синтеза кДНК с использованием РНК, экстрагированных из клеток гибридом в качестве матрицы. Для синтеза библиотеки кДНК 5'-RACE соответствующим образом используют коммерчески доступный набор, такой как набор для амплификации кДНК SMART RACE cDNA Amplification Kit.
Ген антитела амплифицируют способом ПЦР с использованием полученной библиотеки кДНК 5'-RACE в качестве матрицы. Праймеры для амплификации гена антитела мыши можно конструировать на основе известных последовательностей генов антител. Нуклеотидные последовательности праймеров варьируют, в зависимости от подкласса иммуноглобулинов. Таким образом, предпочтительно, чтобы подкласс был определен заранее с использованием коммерчески доступного набора, такого как набор для изотипирования моноклональных антител мыши Iso Strip Mouse Monoclonal Antibody Isotyping Kit (Roche Diagnostics).
В частности, например, праймеры, которые обеспечивают амплификацию генов, кодирующих тяжелые цепи γ1, γ2a, γ2b и γ3 и легкие цепи κ и λ, используют для выделения генов, кодирующих IgG мыши. Как правило, для амплификации гена вариабельной области IgG используют праймер, который гибридизуется с областью константной области вблизи вариабельной области, в качестве 3'-праймера. Между тем, в качестве 5'-праймера используют праймер, прилагаемый к набору для конструирования библиотеки кДНК 5'-RACE.
Продукты ПЦР, амплифицированные таким образом, используют для переформировывания иммуноглобулинов, состоящих из комбинации тяжелых и легких цепей. Селекцию желаемого антитела можно проводить с использованием активности связывания IL-6R переформированного иммуноглобулина в качестве индикатора. Например, когда задачей является выделение антитела против IL-6R, более предпочтительно, чтобы связывание антитела с IL-6R было специфическим. Скрининг связывающего IL-6R антитела можно проводить, например, с помощью следующих стадий:
(1) контактирование экспрессирующей IL-6R клетки с антителом, содержащим V-область, кодируемую кДНК, выделенной из гибридомы;
(2) выявление связывания антитела с экспрессирующей IL-6R клеткой; и
(3) селекция антитела, которое связывается с экспрессирующей IL-6R клеткой.
Способы выявления связывания антитела с экспрессирующими IL-6R клетками известны. В частности, связывание антитела с экспрессирующими IL-6R клетками можно выявлять с помощью описанных выше способов, таких как FACS. Для оценки активности связывания антитела соответствующим образом используют иммобилизованные образцы экспрессирующих IL-6R клеток.
Предпочтительные способы скрининга антител, в которых в качестве индикатора используется активность связывания, также включают способы пэннинга с использованием фаговых векторов. Способы скрининга с использованием фаговых векторов являются преимущественными, когда гены антител выделяют из библиотек подклассов тяжелых цепей и легких цепей из популяции клеток, экспрессирующей поликлональное антитело. Гены, кодирующие вариабельные области тяжелых цепей и легких цепей, можно связывать соответствующей линкерной последовательностью с получением одноцепочечного Fv (scFv). Фаги, представляющие scFv на их поверхности, можно получать встраиванием гена, кодирующего scFv, в фаговый вектор. Фаги контактируют с представляющим интерес антигеном. Затем ДНК, кодирующую scFv, обладающие представляющей интерес активностью связывания, можно выделять путем сбора фагов, связанных с антигеном. Этот процесс можно повторять при необходимости для увеличения содержания scFv, обладающих представляющий интерес активностью связывания.
После выделения кДНК, кодирующей V-область представляющего интерес антитела против IL-6R, кДНК расщепляют ферментами рестрикции, которые распознают участки рестрикции, встроенные на обоих концах кДНК. Предпочтительные ферменты рестрикции распознают и расщепляют нуклеотидную последовательность, которая встречается в нуклеотидной последовательности гена антитела с низкой частотой. Более того, предпочтительно в представляющий интерес вектор вводят участок рестрикции для фермента, который образует липкий конец, для встраивания одной копии расщепленного фрагмента в правильной ориентации. Кодирующую кДНК V-область антитела против IL-6R расщепляют, как описано выше, и ее встраивают в соответствующий экспрессирующий вектор для конструирования экспрессирующего вектора для антитела. В этом случае, если ген, кодирующий константную область антитела (C-область), и ген, кодирующий описанную выше V-область, слить в рамке считывания, то получится химерное антитело. В рамках настоящего изобретения "химерное антитело" означает, что происхождение константной области отличается от вариабельной области. Таким образом, в дополнение к гетерохимерным антителам мыши/человека, химерные антитела по настоящему изобретению включают аллохимерные антитела человека/человека. Экспрессирующий вектор для химерного антитела можно конструировать путем встраивания гена V-области в экспрессирующий вектор, который уже имеет константную область. В частности, например, последовательность, распознаваемая первым ферментом рестрикции, который расщепляет выше гена V-области, можно соответствующим образом помещать на 5’-конец экспрессирующего вектора, содержащего ДНК, кодирующую желаемую константную область антитела. Экспрессирующий вектор для химерного антитела конструируют путем слияния в рамке считывания двух генов, расщепленных одной и той же комбинацией ферментов рестрикции.
Для получения моноклонального антитела против IL-6R, гены антител встраивают в экспрессирующий вектор так, чтобы гены экспрессировались под контролем регулирующей экспрессию области. Регулирующая экспрессию область для экспрессии антитела включает, например, энхансеры и промоторы. Более того, на N-конец можно присоединять подходящую сигнальную последовательность, так чтобы экспрессируемое антитело секретировалось наружу клеток. В примерах, описанных ниже, в качестве сигнальной последовательности используют пептид, имеющий аминокислотную последовательность MGWSCIILFLVATATGVHS (SEQ ID NO: 4). Между тем, можно присоединять другие подходящие сигнальные последовательности. Экспрессированный полипептид расщепляется на С-конце описанной выше последовательности, и полученный полипептид секретируется из клеток в качестве зрелого полипептида. Затем подходящие клетки-хозяева трансформируют экспрессирующим вектором и получают рекомбинантные клетки, экспрессирующие ДНК, кодирующую антитело IL-6R.
ДНК, кодирующие тяжелую цепь (H-цепь) и легкую цепь (L-цепь) антитела, по отдельности встраивают в различные экспрессирующие векторы для экспрессии гена антитела. Молекулу антитела, имеющую H- и L-цепи, можно экспрессировать путем котрансфекции одной и той же клетки-хозяина векторами, в которые соответственно встроены гены H-цепи и L-цепи. Альтернативно, клетки-хозяева можно трансформировать одним экспрессирующим вектором, в который встроены ДНК, кодирующие H- и L-цепи (см. WO 1994/011523).
Существуют различные известные комбинации клетка-хозяин/экспрессирующий вектор для получения антител путем введения выделенных генов антител в соответствующих хозяев. Все из этих экспрессирующих систем пригодны для выделения антигенсвязывающих доменов по настоящему изобретению. Подходящие эукариотические клетки, используемые в качестве клеток-хозяев, включают клетки животных, клетки растений и клетки грибов. В частности, клетки животных включают, например, следующие клетки:
(1) клетки млекопитающих: CHO (линия клеток яичника китайского хомяка), COS (линия клеток почки обезьяны), миелома (Sp2/0, NS0 и т.п.), BHK (клеточная линия почки детенышей хомячка), Hela, Vero, HEK293 (линия клеток почки эмбриона человека с расщепленной аденовирусной ДНК (Ad)5), Freestyle293, клетки PER.C6 (линия клеток сетчатки эмбриона человека, трансформированных генами E1A и E1B аденовируса 5 типа (Ad5)), и т.п. (Current Protocols in Protein Science (май 2001 года, раздел 5.9, таблица 5.9.1));
(2) клетки земноводных: ооциты Xenopus и т.п.; и
(3) клетки насекомых: sf9, sf21, Tn5 и т.п.
Кроме того, в качестве клетки растений известна экспрессирующая система для генов антител с использованием клеток, происходящих из рода Nicotiana, таких как Nicotiana tabacum. Для трансформации клеток растений можно соответствующим образом использовать культивированные клетки каллуса.
Более того, в качестве клеток грибов можно использовать следующие клетки:
- дрожжи: род Saccharomyces, как, например, Saccharomyces serevisiae, и род Pichia, как, например, Pichia pastoris; и
- нитчатые грибы: род Aspergillus, как, например, Aspergillus niger.
Более того, также известны экспрессирующие системы для генов антител, в которых используются прокариотические клетки. Например, при использовании бактериальных клеток в рамках настоящего изобретения, можно подходящим образом использовать клетки E. coli, клетки Bacillus subtilis и т.п. Экспрессирующие векторы, несущие представляющие интерес гены антитела, вводят в клетки путем трансфекции. Трансфицированные клетки культивируют in vitro, и из культуры трансформированных клеток можно получать желаемое антитело.
В дополнение к описанным выше клеткам-хозяевам, также для получения рекомбинантного антитела можно использовать трансгенных животных. Следовательно, антитело можно получать из животного, которому введен ген, кодирующий представляющее интерес антитело. Например, ген антитела можно конструировать в качестве слитого гена путем встраивания в рамке считывания в ген, который кодирует белок, специфически продуцируемый в молоке. В качестве белка, секретируемого в молоке, можно использовать, например, β-казеин козы или т.п. Фрагменты ДНК, содержащие слитый ген, в который встроен ген антитела, инъецируют в эмбрион козы, а затем этот эмбрион имплантируют самке козы. Желаемые антитела можно получать в качестве белка, слитого с белком молока, из молока, продуцируемого трансгенной козой, родившейся от козы, являющейся реципиентом эмбриона (или ее потомства). Кроме того, для увеличения объема молока, содержащего желаемое антитело, продуцируемого трансгенной козой, трансгенной козе при необходимости можно вводить гормоны (Ebert, K. M. et al., Bio/Technology (1994) 12 (7), 699-702).
Когда антигенсвязывающую молекулу, описанную в настоящем описании, вводят человеку, антигенсвязывающий домен, происходящий из генетически рекомбинантного антитела, которое является искусственно модифицированным для снижения гетерологической антигенности против человека и т.п., можно соответствующим образом использовать в качестве антигенсвязывающего домена антигенсвязывающей молекулы. Такие генетически рекомбинантные антитела включают, например, гуманизированные антитела. Эти модифицированные антитела получают соответствующим образом известными способами.
Вариабельная область антитела, используемая для получения антигенсвязывающего домена антигенсвязывающей молекулы, описанной в настоящем описании, как правило, образована тремя определяющими комплементарность областями (CDR) которые разделены четырьмя каркасными областями (FR). CDR представляет собой область, которая по существу определяет специфичность связывания антитела. Аминокислотные последовательности CDR являются в высокой степени разнообразными. С другой стороны, образующие FR аминокислотные последовательности часто обладают высокой идентичностью, даже среди антител с отличающейся специфичностью связывания. Таким образом, как правило, специфичность связывания определенного антитела можно вносить в другое антитело путем пересадки CDR.
Гуманизированное антитело также называют переформированным антителом человека. В частности, известны гуманизированные антитела, полученные пересадкой CDR антитела не являющегося человеком животного, такого как антитело мыши, в антитело человека и т.п. Также известны стандартные способы генной инженерии для получения гуманизированных антител. В частности, например, в качестве способа пересадки CDR антитела мыши в FR человека известна перекрывающаяся ПЦР с удлинением. В перекрывающейся ПЦР с удлинением нуклеотидную последовательность, кодирующую CDR антитела мыши, подлежащую пересадке, добавляют к праймерам для синтеза FR антитела человека. Праймеры получают для каждой из четырех FR. Является общепризнанным, что при пересадке CDR мыши в FR человека, выбор FR человека, который имеет высокую идентичность FR мыши, является преимущественным для сохранения функции CDR. Таким образом, как правило, предпочтительно использовать FR человека, содержащую аминокислотную последовательность, которая обладает высокой идентичностью с аминокислотной последовательностью FR, соседней с CDR мыши, подлежащей пересадке.
Нуклеотидные последовательности, подлежащие лигированию, конструируют так, чтобы они были соединены друг с другом в рамке считывания. FR человека синтезируют по отдельности с использованием соответствующих праймеров. В результате получают продукты, в которых ДНК, кодирующая CDR мыши, связана с индивидуальными ДНК, кодирующими FR. Нуклеотидные последовательности, кодирующие CDR мыши, каждого продукта конструируют так, чтобы они перекрывались друг с другом. Затем проводят синтез комплементарной цепи для гибридизации перекрывающихся областей CDR продуктов, синтезированных с использованием гена антитела человека в качестве матрицы. С помощью этой реакции FR человека лигируют через последовательности CDR мыши.
Полноразмерный ген V-области, в котором в конечном итоге лигированы три CDR и четыре FR, амплифицируют с использованием праймеров, которые гибридизуются с его 5'- или 3'-концом, в которые добавлены подходящие последовательности, распознаваемые ферментом рестрикции. Экспрессирующий вектор для гуманизированного антитела можно получать путем встраивания ДНК, полученной, как описано выше, и ДНК, которая кодирует C-область антитела человека, в экспрессирующий вектор, так чтобы они лигировались в рамке считывания. После трансфекции рекомбинантным вектором хозяина для получения рекомбинантных клеток, рекомбинантные клетки культивируют, и ДНК, кодирующую гуманизированное антитело, экспрессируют с получением гуманизированного антитела в клеточной культуре (см., публикацию патента Европы № EP 239400 и международную публикацию патента № WO 1996/002576).
Путем качественного или количественного определения и оценки антигенсвязывающей активности гуманизированного антитела, полученного, как описано выше, можно пригодным образом отобрать FR антитела человека, которые позволяют CDR образовывать подходящий антигенсвязывающий центр при лигировании через CDR. Аминокислотные остатки в FR можно заменять при необходимости, так чтобы CDR переформированного антитела человека образовывали соответствующий антигенсвязывающий центр. Например, мутации аминокислотной последовательности можно вносить в FR с использованием способа ПЦР, который используется для пересадки CDR мыши в FR человека. Более конкретно, в праймеры, которые гибридизуются с FR, можно вносить частичные мутации нуклеотидной последовательности. Мутации нуклеотидной последовательности вносятся в FR, синтезированные с использованием таких праймеров. Мутантные последовательности FR, имеющие желаемые характеристики, можно отбирать путем измерения и оценки активности мутанта антитела с замененной аминокислотой в отношении связывания с антигеном с помощью упомянутого выше способа (Cancer Res. (1993) 53:851-856).
Альтернативно, желаемые антитела человека можно получать путем иммунизации трансгенных животных, имеющих полный набор генов антител человека (см. WO 1993/012227; WO 1992/003918; WO 1994/002602; WO 1994/025585; WO 1996/034096; WO 1996/033735) путем иммунизации ДНК.
Более того, также известны способы получения антител человека путем пэннинга с использованием библиотек антител человека. Например, V-область антитела человека экспрессируют в качестве одноцепочечного антитела (scFv) на поверхности фага способом фагового дисплея. Можно отбирать фаги, экспрессирующие scFv, которые связываются с антигеном. Последовательность ДНК, кодирующую V-область антитела человека, которая связывается с антигеном, можно определять путем анализа генов выбранных фагов. Определяют последовательность ДНК scFv, которая связывается с антигеном. Получают экспрессирующий вектор путем слияния последовательности V-области в рамке считывания с последовательностью C-области желаемого антитела человека, и встраивания ее в соответствующий экспрессирующий вектор. Экспрессирующий вектор вводят в клетки, пригодные для экспрессии, такие как клетки, описанные выше. Антитело человека можно получать путем экспрессии гена, кодирующего антитело человека, в клетках. Эти способы уже известны (см. WO 1992/001047; WO 1992/020791; WO 1993/006213; WO 1993/011236; WO 1993/019172; WO 1995/001438; WO 1995/015388).
В дополнение к способам, описанным выше, для выделения генов антител можно соответствующим образом использовать способы клонирования B-клеток (идентификация каждой кодирующей антитело последовательности, ее клонирование и выделение; использование при конструировании экспрессирующего вектора для получения каждого антитела (IgG1, IgG2, IgG3 или IgG4, в частности); и т.п.), как описано, например Bernasconi et al. (Science (2002) 298:2199-2202) или в WO 2008/081008.
Система нумерации EU и система нумерации Kabat
В соответствии со способами, используемыми в рамках настоящего изобретения, положения аминокислот, приписываемые CDR и FR антитела, указаны в соответствии с нумерацией по Kabat (Sequences of Proteins of Immunological Interest (National Institute of Health, Bethesda, Md., 1987 и 1991)). В рамках настоящего изобретения, когда антигенсвязывающая молекула представляет собой антитело или антигенсвязывающий фрагмент, аминокислоты вариабельной области указаны в соответствии с нумерацией по системе Kabat, в то время как аминокислоты константной области указаны в соответствии с системой нумерации EU на основе положений аминокислот по Kabat.
Условия концентрации ионов
Условия концентрации ионов металлов
В одном варианте осуществления настоящего изобретения концентрация ионов относится к концентрации ионов металлов. "Ионы металлов" относятся к ионам элементов группы I, за исключением водорода, таких как щелочные металлы и элементы группы меди, ионам элементов группы II, таких как щелочноземельные металлы и элементы группы цинка, ионам элементов группы III, за исключением бора, ионам элементов группы IV, за исключением углерода и кремния, ионам элементов группы VIII, таких как элементы группы железа и элементы группы платины, ионам элементов, принадлежащих подгруппе A групп V, VI и VII, и элементов металлов, таких как сурьма, висмут и полоний. Атомы металлов обладают свойством высвобождения валентных электронов так, что они становятся катионами. Это называют тенденцией к ионизации. Металлы с высокой тенденцией к ионизации считаются химически активными.
В рамках настоящего изобретения предпочтительные ионы металлов включают, например, ион кальция. Ион кальция вовлечен в модулирование множества биологических явлений, включая сокращение мышц, таких как скелетные, гладкие и сердечная мышцы; активацию движения, фагоцитоза и т.п. лейкоцитов; активацию изменения формы, секреции и т.п. тромбоцитов; активацию лимфоцитов; активацию тучных клеток, включая секрецию гистамина; клеточные ответы, опосредуемые рецептором катехоламина α или рецептором ацетилхолина; экзоцитоз; высвобождение веществ-передатчиков из окончаний нейронов; и поток аксоплазмы в нейронах. Известные внутриклеточные рецепторы ионов кальция включают тропонин C, кальмодулин, парвальбумин и легкую цепь миозина, которые имеют несколько участков связывания ионов кальция и, как полагают, имеют общее происхождение с точки зрения молекулярной эволюции. Также существует множество известных кальций-связывающих мотивов. Такие хорошо известные мотивы включают, например, домены кадгерина, EF-hand кальмодулина, C2-домен протеинкиназы C, Gla-домен белка фактора свертывания крови IX, лектины C-типа рецептора асиалогликопротеинов и манноза-связывающего рецептора, A-домены рецепторов LDL, аннексин, домен тромбоспондина 3 типа и EGF-подобные домены.
В рамках настоящего изобретения, когда ион металла представляет собой ион кальция, условия концентрации ионов кальция включают условия низкой концентрации ионов кальция и условия высокой концентрации ионов кальция. "Антигенсвязывающая активность антигенсвязывающего домена, содержащегося в антигенсвязывающей молекуле по настоящему изобретению, варьирует в зависимости от условий концентрации ионов кальция" означает, что антигенсвязывающая активность антигенсвязывающего домена, содержащегося в антигенсвязывающей молекуле, варьирует вследствие отличий в условиях между низкими и высокими концентрациями ионов кальция. Например, антигенсвязывающая активность антигенсвязывающего домена может быть более высокой в условиях высокой концентрации ионов кальция, чем в условиях низкой концентрации ионов кальция. Альтернативно, антигенсвязывающая активность антигенсвязывающего домена может быть, например, более высокой в условиях низкой концентрации ионов кальция, чем в условиях высокой концентрации ионов кальция.
В рамках настоящего изобретения высокая концентрация ионов кальция, в частности, не ограничена конкретной величиной; однако концентрация предпочтительно может быть выбрана из величин в пределах от 100 мкМ до 10 мМ. В другом варианте осуществления концентрация может быть выбрана из величин в пределах от 200 мкМ до 5 мМ. В альтернативном варианте осуществления концентрация может быть выбрана из величин в пределах от 400 мкМ до 3 мМ. В другом варианте осуществления концентрация может быть выбрана из величин в пределах от 200 мкМ до 2 мМ. Более того, концентрация может быть выбрана из величин в пределах от 400 мкМ до 1 мМ. В частности, предпочтительной является концентрация, выбранная из величин в пределах от 500 мкМ до 2,5 мМ, которая является близкой к концентрации ионов кальция в плазме (крови) in vivo.
В рамках настоящего изобретения низкая концентрация ионов кальция, в частности, не ограничена конкретной величиной; однако концентрация предпочтительно может быть выбрана из величин в пределах от 0,1 мкМ до 30 мкМ. В другом варианте осуществления концентрация может быть выбрана из величин в пределах от 0,2 мкМ до 20 мкМ. В другом варианте осуществления концентрация может быть выбрана из величин в пределах от 0,5 мкМ до 10 мкМ. В альтернативном варианте осуществления концентрация может быть выбрана из величин в пределах от 1 мкМ до 5 мкМ. Более того, концентрация может быть выбрана из величин в пределах от 2 мкМ до 4 мкМ. В частности, предпочтительной является концентрация, выбранная из величин в пределах от 1 мкМ до 5 мкМ, которая является близкой к концентрации ионизированного кальция в ранних эндосомах in vivo.
В рамках настоящего изобретения "антигенсвязывающая активность является более низкой в условиях низкой концентрации ионов кальция, чем в условиях высокой концентрации ионов кальция" означает, что антигенсвязывающая активность антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен по настоящему изобретению, является более слабой при концентрации ионов кальция, выбранной из величин в пределах от 0,1 мкМ до 30 мкМ, чем при концентрации ионов кальция, выбранной из величин в пределах от 100 мкМ до 10 мМ. Предпочтительно, это означает, что антигенсвязывающая активность антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен по настоящему изобретению, является более слабой при концентрации ионов кальция, выбранной из величин в пределах от 0,5 мкМ до 10 мкМ, чем при концентрации ионов кальция, выбранной из величин в пределах от 200 мкМ до 5 мМ. Особенно предпочтительно, это означает, что антигенсвязывающая активность при концентрации ионов кальция в ранней эндосоме in vivo является более слабой, чем при концентрации ионов кальция в плазме in vivo; и, в частности, это означает, что антигенсвязывающая активность антигенсвязывающей молекулы является более слабой при концентрации ионов кальция, выбранной из величин в пределах от 1 мкМ до 5 мкМ, чем при концентрации ионов кальция, выбранной из величин в пределах от 500 мкМ до 2,5 мМ.
То, изменяется ли антигенсвязывающая активность антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен, в зависимости от концентрации ионов металлов, можно определять, например, с использованием известных способов измерения, таких как способы, описанные в разделе "Активность связывания" выше. Например, для подтверждения того, что антигенсвязывающая активность антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен, становится более высокой в условиях высокой концентрации ионов кальция, чем в условиях низкой концентрации ионов кальция, сравнивают антигенсвязывающую активность антигенсвязывающей молекулы или домена в условиях низкой и высокой концентрации ионов кальция.
В рамках настоящего изобретения выражение "антигенсвязывающая активность является более низкой в условиях низкой концентрации ионов кальция, чем в условиях высокой концентрации ионов кальция" также может быть сформулировано как "антигенсвязывающая активность антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен, является более высокой в условиях высокой концентрации ионов кальция, чем в условиях низкой концентрации ионов кальция". В настоящем описании "антигенсвязывающая активность является более низкой в условиях низкой концентрации ионов кальция, чем в условиях высокой концентрации ионов кальция" иногда представлено как "антигенсвязывающая активность является более слабой в условиях низкой концентрации ионов кальция, чем в условиях высокой концентрации ионов кальция". Также "антигенсвязывающая активность в условиях низкой концентрации ионов кальция снижена так, чтобы она была ниже, чем антигенсвязывающая активность в условиях высокой концентрации ионов кальция" может быть сформулировано как "антигенсвязывающую активность в условиях низкой концентрации ионов кальция ослабили по сравнению с антигенсвязывающей активностью в условиях высокой концентрации ионов кальция".
При определении антигенсвязывающей активности, условия, отличные от концентрации ионов кальция, могут быть соответствующим образом выбраны специалистами в данной области, и они конкретно не ограничены. Например, активность можно определять при 37°C в буфере HEPES. Например, для определения можно использовать Biacore (GE Healthcare) и т.п. Когда антиген представляет собой растворимый антиген, антигенсвязывающую активность антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен, можно оценивать путем пропускания антигена в качестве анализируемого соединения над чипом, на котором иммобилизованы антигенсвязывающий домен или антигенсвязывающая молекула, содержащая домен. Когда антиген представляет собой антиген мембраны, активность связывания антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен, с антигеном мембраны можно оценивать путем пропускания антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен, в качестве анализируемого соединения над чипом, на котором иммобилизован антиген.
При условии, что антигенсвязывающая активность антигенсвязывающей молекулы по настоящему изобретению является более слабой в условиях низкой концентрации ионов кальция, чем в условиях высокой концентрации ионов кальция, соотношение антигенсвязывающей активности между условиями низкой и высокой концентрации ионов кальция конкретно не ограничено. Однако соотношение KD (константа диссоциации) антигенсвязывающей молекулы в отношении антигена в условиях низкой концентрации ионов кальция и KD в условиях высокой концентрации ионов кальция, т.е. величина KD (3 мкМ Ca)/KD (2 мМ Ca), предпочтительно равна 2 или более, более предпочтительно 10 или более и еще более предпочтительно 40 или более. Верхний предел величины KD (3 мкМ Ca)/KD (2 мМ Ca) конкретно не ограничен, и он может представлять собой любую величину, такую как 400, 1000 или 10000, при условии, что молекулу можно получить способами, известными специалистам в данной области.
Когда антиген представляет собой растворимый антиген, для отображения антигенсвязывающей активности можно использовать KD (константа диссоциации). Между тем, когда антиген представляет собой антиген мембраны, для отображения активности можно использовать кажущуюся KD (кажущаяся константа диссоциации). KD (константа диссоциации) и кажущуюся KD (кажущаяся константа диссоциации) можно определять способами, известными специалистам в данной области, например, с использованием Biacore (GE healthcare), графика Скэтчарда или проточного цитометра.
Альтернативно, например, также в качестве показателя для отображения соотношения антигенсвязывающей активности антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен, по настоящему изобретению в условиях низкой и высокой концентраций кальция предпочтительно можно использовать константу скорости диссоциации (kd). Когда константу скорости диссоциации (kd) используют вместо константы диссоциации (KD) в качестве показателя для отображения соотношения активностей связывания, соотношение констант скорости диссоциации (kd) в условиях низкой и высокой концентраций кальция, т.е. величина kd (условия низкой концентрации кальция)/kd (условия высокой концентрации кальция), предпочтительно равна 2 или более, более предпочтительно 5 или более, еще более предпочтительно 10 или более, и еще более предпочтительно 30 или более. Верхний предел величины Kd (условия низкой концентрации кальция)/kd (условия высокой концентрации кальция) конкретно не ограничен, и он может представлять собой любую величину, такую как 50, 100 или 200, при условии, что можно получить молекулу способами, известными специалистам в данной области.
Когда антиген представляет собой растворимый антиген, для отображения антигенсвязывающей активности можно использовать kd (константа скорости диссоциации). Между тем, когда антиген представляет собой антиген мембраны, для отображения антигенсвязывающей активности можно использовать кажущуюся kd (кажущуюся константу скорости диссоциации). kd (константа скорости диссоциации) и кажущуюся kd (кажущаяся константа скорости диссоциации) можно определять способами, известными специалистам в данной области, например, с использованием Biacore (GE healthcare) или проточного цитометра. В рамках настоящего изобретения, когда антигенсвязывающую активность антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен, определяют при различных концентрациях ионов кальция, предпочтительно использовать одни и те же условия, за исключением концентраций кальция.
Способы, описанные в WO 2012/073992 (например, абзацы 0200-0213) и т.п., могут быть предоставлены в качестве примеров способа скрининга антигенсвязывающей молекулы или антигенсвязывающего домена, антигенсвязывающая активность которых в условиях низкой концентрации ионов кальция является более низкой, чем в условиях высокой концентрации ионов кальция, которые являются вариантом осуществления, предусматриваемым в рамках настоящего изобретения.
Библиотеки
В одном варианте осуществления антигенсвязывающий домен или антигенсвязывающую молекулу по настоящему изобретению можно получать из библиотеки, которая в основном состоит из множества антигенсвязывающих молекул, последовательности которых отличаются друг от друга и антигенсвязывающие домены которых имеют по меньшей мере один аминокислотный остаток, который изменяет антигенсвязывающую активность антигенсвязывающих молекул в зависимости от концентрации ионов. Концентрации ионов предпочтительно включают, например, концентрацию ионов металлов и концентрацию ионов водорода.
В рамках настоящего изобретения "библиотека" относится к множеству антигенсвязывающих молекул или множеству слитых полипептидов, содержащих антигенсвязывающие молекулы, или нуклеиновых кислот или полинуклеотидов, кодирующих их последовательности. Последовательности множества антигенсвязывающих молекул или множества слитых полипептидов, содержащих антигенсвязывающие молекулы, в библиотеке не идентичны, а отличаются друг от друга.
В рамках настоящего изобретения выражение "последовательности отличаются друг от друга" в выражении "множество антигенсвязывающих молекул, последовательности которых отличаются друг от друга" означает, что последовательности антигенсвязывающих молекул в библиотеке отличаются друг от друга. В частности, в библиотеке количество последовательностей, отличающихся друг от друга, отражает количество независимых клонов с различными последовательностями, и также может называться "размером библиотеки". Размер библиотеки для обычной библиотеки фагового дисплея находится в диапазоне от 106 до 1012. Размер библиотеки может быть увеличен вплоть до 1014 с использованием известных способов, таких как рибосомный дисплей. Однако истинное количество фаговых частиц, используемых в селекции способом пэннинга фаговой библиотеки, как правило, в 10-10000 раз превышает размер библиотеки. Эту избыточную множественность также называют "количеством эквивалентов библиотеки", и она означает, что существует от 10 до 10000 индивидуальных клонов, которые обладают одной и той же аминокислотной последовательностью. Таким образом, в рамках настоящего изобретения выражение "последовательности отличаются друг от друга" означает, что последовательности независимых антигенсвязывающих молекул в библиотеке, исключая эквиваленты библиотеки, отличаются друг от друга. Более конкретно, указанное выше означает, что существует от 106 до 1014 антигенсвязывающих молекул, последовательности которых отличаются друг от друга, предпочтительно от 107 до 1012 молекул, более предпочтительно от 108 до 1011, и особенно предпочтительно от 108 до 1010, последовательности которых отличаются друг от друга.
В рамках настоящего изобретения выражение "множество" в выражении "библиотека в основном состоит из множества антигенсвязывающих молекул" в случае, например, антигенсвязывающих молекул, слитых полипептидов, полинуклеотидных молекул, векторов или вирусов по настоящему изобретению, главным образом, относится к группе из двух или более типов вещества. Например, когда два или более вещества отличаются друг от друга конкретной характеристикой, это означает, что существует два или более типов вещества. Такие примеры могут включать, например, мутантные аминокислоты, наблюдаемые в конкретных аминокислотных положениях аминокислотной последовательности. Например, когда существует две или более антигенсвязывающих молекул по настоящему изобретению, последовательности которых являются по существу одинаковыми или предпочтительно одинаковыми, за исключением нестрогих остатков или за исключением конкретных мутантных аминокислот в гипервариабельных положениях, экспонированных на поверхности, существует множество антигенсвязывающих молекул по настоящему изобретению. В другом примере, когда существует две или более полинуклеотидных молекул, последовательности которых являются по существу одинаковыми или предпочтительно одинаковыми, за исключением нуклеотидов, кодирующих нестрогие остатки, или нуклеотидов, кодирующих мутантные аминокислоты гипервариабельных положений, экспонированных на поверхности, существует множество полинуклеотидных молекул по настоящему изобретению.
Кроме того, в рамках настоящего изобретения выражение "в основном состоит из" в выражении "библиотека в основном состоит из множества антигенсвязывающих молекул" отражает количество антигенсвязывающих молекул, антигенсвязывающая активность которых варьирует, в зависимости от концентрации ионов, среди независимых клонов с отличающимися последовательностями в библиотеке. Особенно предпочтительно, чтобы в библиотеке существовало по меньшей мере 104 антигенсвязывающих молекул, имеющих такую активность связывания. Более предпочтительно, антигенсвязывающие домены по настоящему изобретению можно получать из библиотеки, содержащей по меньшей мере 105 антигенсвязывающих молекул, обладающих такой активностью связывания. Еще более предпочтительно, антигенсвязывающие домены по настоящему изобретению можно получать из библиотеки, содержащей по меньшей мере 106 антигенсвязывающих молекул, обладающих такой активностью связывания. Особенно предпочтительно, антигенсвязывающие домены по настоящему изобретению можно получать из библиотеки, содержащей по меньшей мере 107 антигенсвязывающих молекул, обладающих такой активностью связывания. Еще более предпочтительно, антигенсвязывающие домены по настоящему изобретению можно получать из библиотеки, содержащей по меньшей мере 108 антигенсвязывающих молекул, обладающих такой активностью связывания. Альтернативно, это также предпочтительно может быть выражено как соотношение количества антигенсвязывающих молекул, антигенсвязывающая активность которых варьирует, в зависимости от концентрации ионов, и количества независимых клонов, имеющих различные последовательности, в библиотеке. В частности, антигенсвязывающие домены по настоящему изобретению можно получать из библиотеки, в которой антигенсвязывающие молекулы, имеющие такую активность связывания, составляют от 0,1% до 80%, предпочтительно от 0,5% до 60%, более предпочтительно от 1% до 40%, еще более предпочтительно от 2% до 20%, и особенно предпочтительно от 4% до 10% независимых клонов с отличающимися последовательностями в библиотеке. В случае слитых полипептидов, полинуклеотидных молекул или векторов, могут быть возможными сходные выражения, в которых используются количества молекул или отношение к общему количеству молекул. В случае вирусов, также могут быть возможными сходные выражения, в которых используется количество вирионов или отношение к общему количеству вирионов.
Аминокислоты, которые изменяют антигенсвязывающую активность антигенсвязывающих доменов в зависимости от концентрации ионов кальция
Антигенсвязывающие домены или антигенсвязывающие молекулы по настоящему изобретению, подлежащие скринингу описанными выше способами скрининга, можно получать любым путем. Например, когда ион металла представляет собой ион кальция, можно использовать заранее существующие антигенсвязывающие домены или антигенсвязывающие молекулы, заранее существующие библиотеки (фаговая библиотека и т.д.), антитела или библиотеки, полученные из гибридом, полученных путем иммунизации животных или из B-клеток иммунизированных животных, антитела или библиотеки, полученные внесением аминокислот, способных хелатировать кальций (например, аспарагиновая кислота и глутаминовая кислота), или неприродных аминокислотных мутаций в описанные выше антитела или библиотеки (хелатирующие кальций аминокислоты (такие как аспарагиновая кислота и глутаминовая кислота), библиотеки с увеличенным содержанием неприродных аминокислот, библиотеки, полученные путем внесения хелатирующих кальций аминокислот (таких как аспарагиновая кислота и глутаминовая кислота) или неприродных аминокислотных мутаций в конкретные положения, и т.п.
Примеры аминокислот, которые изменяют антигенсвязывающую активность антигенсвязывающих молекул в зависимости от концентрации ионов кальция, как описано выше, могут представлять собой любые типы аминокислот, при условии, что аминокислоты формируют кальций-связывающий мотив. Кальций-связывающие мотивы хорошо известны специалистам в данной области и подробно описаны (например, Springer et al. (Cell (2000) 102, 275-277); Kawasaki and Kretsinger (Protein Prof. (1995) 2, 305-490); Moncrief et al. (J. Mol. Evol. (1990) 30, 522-562); Chauvaux et al. (Biochem. J. (1990) 265, 261-265); Bairoch and Cox (FEBS Lett. (1990) 269, 454-456); Davis (New Biol. (1990) 2, 410-419); Schaefer et al. (Genomics (1995) 25, 638-643); Economou et al. (EMBO J. (1990) 9, 349-354); Wurzburg et al. (Structure. (2006) 14, 6, 1049-1058)). В частности, любые известные кальций-связывающие мотивы, включая лектины C-типа, такие как ASGPR, CD23, MBR и DC-SIGN, могут быть включены в антигенсвязывающие молекулы по настоящему изобретению. Предпочтительные примеры таких предпочтительных кальций-связывающих мотивов также включают, в дополнение к кальций-связывающим мотивам, описанным выше, например, кальций-связывающий мотив в антигенсвязывающем домене SEQ ID NO: 5.
Более того, в качестве аминокислот, которые изменяют антигенсвязывающую активность антигенсвязывающих доменов, включенных в антигенсвязывающие молекулы по настоящему изобретению, в зависимости от условий концентрации ионов кальция, например, предпочтительно можно использовать аминокислоты, имеющие активность хелатирования металлов. Примеры таких хелатирующих металлы аминокислот включают, например, серин (Ser(S)), треонин (Thr(T)), аспарагин (Asn(N)), глутамин (Gln(Q)), аспарагиновую кислоту (Asp(D)) и глутаминовую кислоту (Glu(E)).
Положения в антигенсвязывающих доменах, в которых содержатся описанные выше аминокислоты, конкретно не ограничены конкретными положениями, и они могут представлять собой любые положения в вариабельной области тяжелой цепи или вариабельной области легкой цепи, которые образуют антигенсвязывающий домен, при условии, что они изменяют антигенсвязывающую активность антигенсвязывающих молекул в зависимости от концентраций ионов кальция. В неограничивающем варианте осуществления антигенсвязывающие домены по настоящему изобретению можно получать из библиотеки, в основном состоящей из антигенсвязывающих молекул, последовательности которых отличаются друг от друга и антигенсвязывающие домены тяжелых цепей которых содержат аминокислоты, которые изменяют антигенсвязывающую активность антигенсвязывающих молекул в зависимости от концентраций ионов кальция. В другом неограничивающем варианте осуществления антигенсвязывающие домены по настоящему изобретению можно получать из библиотеки, в основном состоящей из антигенсвязывающих молекул, последовательности которых отличаются друг от друга и CDR3-домены тяжелой цепи которых содержат упомянутые выше аминокислоты. В другом варианте осуществления антигенсвязывающие домены по настоящему изобретению можно получать из библиотеки, в основном состоящей из антигенсвязывающих молекул, последовательности которых отличаются друг от друга и CDR3-домены тяжелых цепей которых содержат упомянутые выше аминокислоты в положениях 95, 96, 100a и/или 101, как указано в соответствии с системой нумерации Kabat.
Между тем, в неограничивающем варианте осуществления настоящего изобретения антигенсвязывающие домены по настоящему изобретению можно получать из библиотеки, в основном состоящей из антигенсвязывающих молекул, последовательности которых отличаются друг от друга и антигенсвязывающие домены легкой цепи которых содержат аминокислоты, которые изменяют антигенсвязывающую активность антигенсвязывающих молекул в зависимости от концентраций ионов кальция. В другом неограничивающем варианте осуществления антигенсвязывающие домены по настоящему изобретению можно получать из библиотеки, в основном состоящей из антигенсвязывающих молекул, последовательности которых отличаются друг от друга и CDR1-домены легкой цепи которых содержат упомянутые выше аминокислоты. В другом варианте осуществления антигенсвязывающие домены по настоящему изобретению можно получать из библиотеки, в основном состоящей из антигенсвязывающих молекул, последовательности которых отличаются друг от друга и CDR1-домены легкой цепи которых содержат упомянутые выше аминокислоты в положениях 30, 31 и/или 32, как указано в соответствии с системной нумерации Kabat.
В другом неограничивающем варианте осуществления антигенсвязывающие домены по настоящему изобретению можно получать из библиотеки, в основном состоящей из антигенсвязывающих молекул, последовательности которых отличаются друг от друга и CDR2-домены легкой цепи которых содержат упомянутые выше аминокислотные остатки. В другом неограничивающем варианте осуществления настоящее изобретение относится к библиотекам, в основном состоящим из антигенсвязывающих молекул, последовательности которых отличаются друг от друга и CDR2-домены легкой цепи которых содержат упомянутые выше аминокислотные остатки в положении 50, как указано в соответствии с системой нумерации Kabat.
В другом варианте осуществления настоящего изобретения антигенсвязывающие домены по настоящему изобретению можно получать из библиотеки, в основном состоящей из антигенсвязывающих молекул, последовательности которых отличаются друг от друга и CDR3-домены легкой цепи которых содержат упомянутые выше аминокислотные остатки. В альтернативном варианте осуществления антигенсвязывающие домены по настоящему изобретению можно получать из библиотеки, в основном состоящей из антигенсвязывающих молекул, последовательности которых отличаются друг от друга и CDR3-домены легкой цепи которых содержат упомянутые выше аминокислотные остатки в положении 92, как указано в соответствии с системной нумерации Kabat.
Более того, в различных вариантах осуществления настоящего изобретения антигенсвязывающие домены по настоящему изобретению можно получать из библиотеки, в основном состоящей из антигенсвязывающих молекул, последовательности которых отличаются друг от друга и в которых две или три CDR, выбранных из описанных выше CDR1, CDR2 и CDR3 легкой цепи, содержат упомянутые выше аминокислотные остатки. Более того, антигенсвязывающие домены по настоящему изобретению можно получать из библиотеки, в основном состоящей из антигенсвязывающих молекул, последовательности которых отличаются друг от друга и легкие цепи которых содержат упомянутые выше аминокислотные остатки в любом одном или нескольких из положений 30, 31, 32, 50 и/или 92, как указано в соответствии с системной нумерации Kabat.
В особенно предпочтительном варианте осуществления каркасные последовательности вариабельной области легкой цепи и/или тяжелой цепи антигенсвязывающей молекулы предпочтительно содержат каркасные последовательности человека эмбрионального типа. Таким образом, в одном варианте осуществления настоящего изобретения, когда каркасные последовательности представляют собой полностью человеческие последовательности, ожидается, что при введении такой антигенсвязывающей молекулы по настоящему изобретению человеку (например, для лечения заболеваний), она индуцирует небольшой иммуногенный ответ или не индуцирует иммуногенного ответа. В указанном выше контексте выражение "содержащий последовательность эмбрионального типа" в рамках настоящего изобретения означает, что часть каркасных последовательностей по настоящему изобретению идентична части любых каркасных последовательностей человека эмбрионального типа. Например, когда последовательность FR2 тяжелой цепи антигенсвязывающей молекулы по настоящему изобретению представляет собой комбинацию последовательностей FR2 тяжелой цепи различных каркасных последовательностей человека эмбрионального типа, такая молекула также представляет собой антигенсвязывающую молекулу по настоящему изобретению, "содержащую последовательность эмбрионального типа".
Предпочтительные примеры каркасных областей включают, например, последовательности полностью человеческих каркасных областей человека, известные в настоящее время, которые включены в web-сайт V-Base (http://vbase.mrc-cpe.cam.ac.uk/) или другие. Эти последовательности каркасных областей можно соответствующим образом использовать в качестве последовательности эмбрионального типа, содержащейся в антигенсвязывающей молекуле по настоящему изобретению. Последовательности эмбрионального типа могут быть подразделены на категории в соответствии с их сходством (Tomlinson et al. (J. Mol. Biol. (1992) 227, 776-798); Williams and Winter (Eur. J. Immunol. (1993) 23, 1456-1461); Cox et al. (Nat. Genetics (1994) 7, 162-168)). Соответствующие последовательности эмбрионального типа могут быть выбраны из Vκ, которые подразделяются на семь подгрупп; Vγ, которые подразделяются на десять подгрупп; и VH, которые подразделяются на семь подгрупп.
Полностью человеческие последовательности VH предпочтительно включают, но не ограничиваются ими, например, последовательности VH:
подгруппы VH1 (например, VH1-2, VH1-3, VH1-8, VH1-18, VH1-24, VH1-45, VH1-46, VH1-58 и VH1-69);
подгруппы VH2 (например, VH2-5, VH2-26 и VH2-70);
подгруппы VH3 (VH3-7, VH3-9, VH3-11, VH3-13, VH3-15, VH3-16, VH3-20, VH3-21, VH3-23, VH3-30, VH3-33, VH3-35, VH3-38, VH3-43, VH3-48, VH3-49, VH3-53, VH3-64, VH3-66, VH3-72, VH3-73 и VH3-74);
подгруппы VH4 (VH4-4, VH4-28, VH4-31, VH4-34, VH4-39, VH4-59 и VH4-61);
подгруппы VH5 (VH5-51);
подгруппы VH6 (VH6-1); и
подгруппы VH7 (VH7-4 и VH7-81).
Они также описаны в известных документах (Matsuda et al. (J. Exp. Med. (1998) 188, 1973-1975)) и т.п., и, таким образом, специалисты в данной области могут соответствующим образом моделировать антигенсвязывающие молекулы по настоящему изобретению, исходя из информации об этих последовательностях. Также предпочтительно использовать другие полностью человеческие каркасные области или каркасные субобласти.
Полностью человеческие последовательности Vk предпочтительно включают, но не ограничиваются ими, например:
A20, A30, L1, L4, L5, L8, L9, L11, L12, L14, L15, L18, L19, L22, L23, L24, O2, O4, O8, O12, O14 и O18, выделенные в подгруппу Vk1;
A1, A2, A3, A5, A7, A17, A18, A19, A23, O1 и O11, выделенные в подгруппу Vk2;
A11, A27, L2, L6, L10, L16, L20 и L25, выделенные в подгруппу Vk3;
B3, выделенная в подгруппу Vk4;
B2 (также обозначаемая как Vk5-2), выделенная в подгруппу Vk5; и
A10, A14 и A26, выделенные в подгруппу Vk6.
(Kawasaki et al. (Eur. J. Immunol. (2001) 31, 1017-1028); Schable and Zachau (Biol. Chem. Hoppe Seyler (1993) 374, 1001-1022); Brensing-Kuppers et al. (Gene (1997) 191, 173-181)).
Полностью человеческие последовательности Vλ предпочтительно включают, но не ограничиваются ими, например:
V1-2, V1-3, V1-4, V1-5, V1-7, V1-9, V1-11, V1-13, V1-16, V1-17, V1-18, V1-19, V1-20 и V1-22, выделенные в подгруппу VL1;
V2-1, V2-6, V2-7, V2-8, V2-11, V2-13, V2-14, V2-15, V2-17 и V2-19, выделенные в подгруппу VL1;
V3-2, V3-3 и V3-4, выделенные в подгруппу VL3;
V4-1, V4-2, V4-3, V4-4 и V4-6, выделенные в подгруппу VL4; и
V5-1, V5-2, V5-4 и V5-6, выделенные в подгруппу VL5 (Kawasaki et al. (Genome Res. (1997) 7, 250-261)).
Обычно эти каркасные последовательности отличаются друг от друга одним или несколькими аминокислотными остатками. Эти каркасные последовательности можно использовать в комбинации с "по меньшей мере одним аминокислотным остатком, который изменяет антигенсвязывающую активность антигенсвязывающей молекулы в зависимости от условий концентрации ионов" по настоящему изобретению. Другие примеры полностью человеческих каркасных областей, используемых в комбинации с "по меньшей мере одним аминокислотным остатком, который изменяет антигенсвязывающую активность антигенсвязывающей молекулы в зависимости от условий концентрации ионов" по настоящему изобретению включают, но не ограничиваются ими, например, KOL, NEWM, REI, EU, TUR, TEI, LAY и POM (например, Kabat et al. (1991), выше, Wu et al. (J. Exp. Med. (1970) 132, 211-250)).
Без связи с конкретной теорией полагают, что одна из причин для того, чтобы ожидать, что использование последовательностей эмбрионального типа предотвратит неблагоприятные иммунные ответы у большинства индивидуумов, состоит в следующем. В результате процесса созревания аффинности в ходе нормальных иммунных ответов, часто в вариабельных областях иммуноглобулинов происходят соматические мутации. Такие мутации чаще всего происходят в областях CDR, последовательности которых являются гипервариабельными, но также затрагивают остатки каркасных областей. Такие мутации каркасной области не существуют в генах эмбрионального типа, но также с меньшей вероятностью будут иммуногенными у пациентов. С другой стороны, в нормальной человеческой популяции присутствует большинство каркасных последовательностей, экспрессируемых с генов эмбрионального типа. В результате иммунной толерантности ожидается, что эти каркасные области эмбрионального типа будут иметь низкую иммуногенность у пациентов или не иметь иммуногенности у пациентов. Для максимизации возможности иммунной толерантности можно выбирать гены, кодирующие вариабельную область, из группы часто встречающихся функциональных генов эмбрионального типа.
Для получения антигенсвязывающих молекул по настоящему изобретению, в которых описанные выше последовательности вариабельной области, последовательности вариабельной области тяжелой или легкой цепи, последовательности CDR или каркасные последовательности содержат аминокислоты, которые изменяют антигенсвязывающую активность антигенсвязывающих молекул в зависимости от условий концентрации ионов кальция, можно соответствующим образом использовать известные способы, такие как сайт-направленный мутагенез (Kunkel et al. (Proc. Natl. Acad. Sci. USA (1985) 82, 488-492)) и перекрывающаяся ПЦР.
Например, библиотеку, которая содержит множество антигенсвязывающих молекул по настоящему изобретению, последовательности которых отличаются друг от друга, можно конструировать путем комбинирования вариабельных областей тяжелой цепи, полученных в качестве рандомизированной библиотеки последовательностей вариабельной области, где вариабельную область легкой цепи выбирают в качестве каркасной последовательности, первоначально содержащей по меньшей мере один аминокислотный остаток, который изменяет антигенсвязывающую активность антигенсвязывающей молекулы в зависимости от условий концентрации ионов кальция. В качестве неограничивающего примера, когда концентрация ионов представляет собой концентрацию ионов кальция, такие предпочтительные библиотеки включают, например, библиотеки, сконструированные посредством комбинирования последовательности вариабельной области легкой цепи SEQ ID NO: 5 (Vk5-2) и вариабельной области тяжелой цепи, полученными в качестве рандомизированной библиотеки последовательностей вариабельной области.
Альтернативно, последовательность вариабельной области легкой цепи, выбранную в качестве каркасной области, первоначально содержащей по меньшей мере один аминокислотный остаток, который изменяет антигенсвязывающую активность антигенсвязывающего домена или антигенсвязывающей молекулы, как упоминалось выше, можно конструировать так, чтобы она содержала различные аминокислотные остатки, отличные от упомянутых выше аминокислотных остатков. В настоящем описании такие остатки называют нестрогими остатками. Количество и положение нестрогих остатков конкретно не ограничено, при условии, что антигенсвязывающая активность антигенсвязывающего домена или антигенсвязывающей молекулы по настоящему изобретению варьирует в зависимости от концентраций ионов. В частности, последовательности CDR и/или последовательности FR тяжелой цепи и/или легкой цепи могут содержать один или несколько нестрогих остатков. Например, когда концентрация ионов представляет собой концентрацию ионов кальция, неограничивающие примеры нестрогих остатков, подлежащих внесению в последовательность вариабельной области легкой цепи SEQ ID NO: 5 (Vk5-2), включают аминокислотные остатки, приведенные в таблицах 1 или 2.

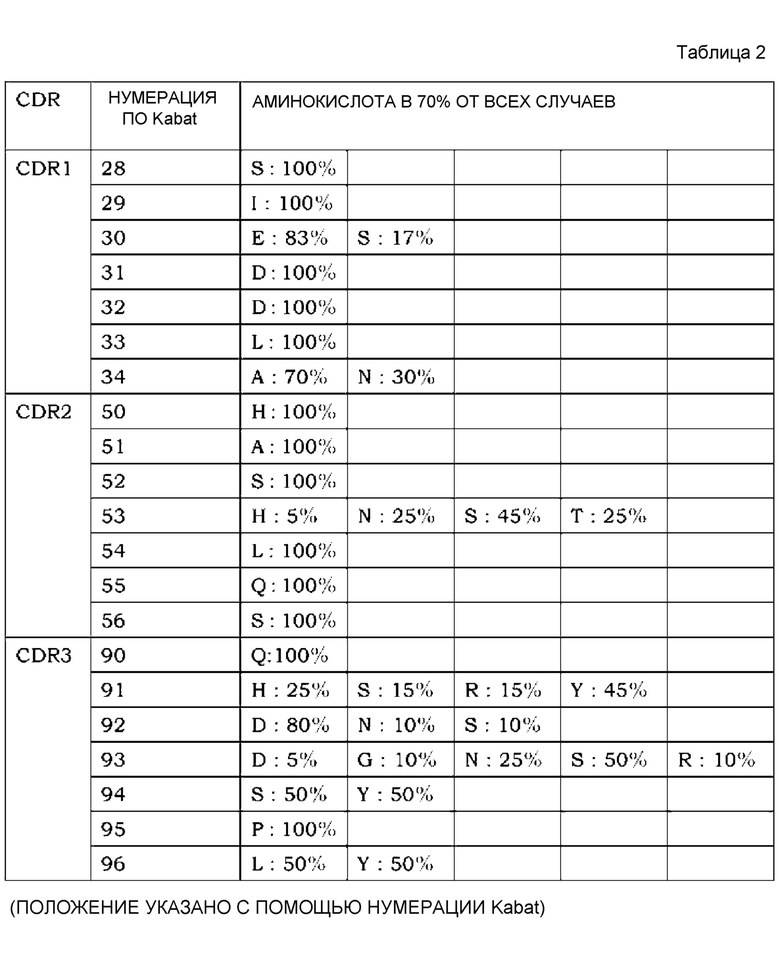
В настоящем описании нестрогие остатки относятся к варьированию аминокислотных остатков, имеющемуся в гипервариабельных положениях, в которых присутствует несколько различных аминокислот, в вариабельных областях легкой цепи и тяжелой цепи, когда сравнивают аминокислотные последовательности известных и/или нативных антител или антигенсвязывающих доменов. Гипервариабельные положения, как правило, расположены в областях CDR. В одном варианте осуществления для определения гипервариабельных положений в известных и/или нативных антителах пригодны данные, предоставленные Kabat, Sequences of Proteins of Immunological Interest (National Institute of Health Bethesda Md.) (1987 и 1991). Более того, в базах данных в Интернете (http://vbase.mrc-cpe.cam.ac.uk/, http://www.bioinf.org.uk/abs/index.html) предоставлены собранные последовательности многих легких цепей и тяжелых цепей человека и их положения. Информация о последовательностях и положениях пригодна для определения гипервариабельных положений в рамках настоящего изобретения. В соответствии с настоящим изобретением, когда определенное положение аминокислоты имеет предпочтительно от приблизительно 2 до приблизительно 20 возможных вариантов аминокислотных остатков, предпочтительно от приблизительно 3 до приблизительно 19, предпочтительно от приблизительно 4 до приблизительно 18, предпочтительно от 5 до 17, предпочтительно от 6 до 16, предпочтительно от 7 до 15, предпочтительно от 8 до 14, предпочтительно от 9 до 13 и предпочтительно от 10 до 12 возможных вариантов аминокислотных остатков, это положение является гипервариабельным. В некоторых вариантах осуществления определенное положение аминокислоты может иметь предпочтительно по меньшей мере приблизительно 2, предпочтительно по меньшей мере приблизительно 4, предпочтительно по меньшей мере приблизительно 6, предпочтительно по меньшей мере приблизительно 8, предпочтительно приблизительно 10 и предпочтительно приблизительно 12 вариантов аминокислотных остатков.
Альтернативно, библиотеку, содержащую множество антигенсвязывающих молекул по настоящему изобретению, последовательности которых отличаются друг от друга, можно конструировать путем комбинирования вариабельных областей тяжелой цепи, полученных в качестве рандомизированной библиотеки последовательностей вариабельной области, с вариабельными областями легкой цепи, в которые внесен по меньшей мере один аминокислотный остаток, который изменяет антигенсвязывающую активность антигенсвязывающих молекул в зависимости от концентраций ионов, как упоминалось выше. Когда концентрация ионов представляет собой концентрацию ионов кальция, неограничивающие примеры таких библиотек предпочтительно включают, например, библиотеки, в которых вариабельные области тяжелой цепи, полученные в качестве рандомизированной библиотеки последовательностей вариабельной области, комбинируют с последовательностями вариабельной области легкой цепи, в которых конкретный остаток(и) в последовательности эмбрионального типа, такой как SEQ ID NO: 6 (Vk1), SEQ ID NO: 7 (Vk2), SEQ ID NO: 8 (Vk3) или SEQ ID NO: 9 (Vk4), заменен по меньшей мере одним аминокислотным остатком, который изменяет антигенсвязывающую активность антигенсвязывающей молекулы в зависимости от концентрации ионов кальция. Неограничивающие примеры таких аминокислотных остатков включают аминокислотные остатки в CDR1 легкой цепи. Более того, неограничивающие примеры таких аминокислотных остатков включают аминокислотные остатки в CDR2 легкой цепи. Кроме того, неограничивающие примеры таких аминокислотных остатков также включают аминокислотные остатки в CDR3 легкой цепи.
Неограничивающие примеры таких аминокислотных остатков, содержащихся в CDR1 легкой цепи, включают остатки в положениях 30, 31 и/или 32 в CDR1 вариабельной области легкой цепи, как указано согласно нумерации EU. Более того, неограничивающие примеры таких аминокислотных остатков, содержащихся в CDR2 легкой цепи, включают аминокислотный остаток в положении 50 в CDR2 вариабельной области легкой цепи, как указано согласно нумерации Kabat. Более того, неограничивающие примеры таких аминокислотных остатков, содержащихся в CDR3 легкой цепи, включают аминокислотный остаток в положении 92 в CDR3 вариабельной области легкой цепи, как указано согласно нумерации Kabat. Эти аминокислотные остатки могут содержаться отдельно или в комбинации, при условии, что они образуют кальций-связывающий мотив, и/или при условии, что антигенсвязывающая активность антигенсвязывающей молекулы варьирует в зависимости от концентрации ионов кальция. Между тем, поскольку известны тропонин C, кальмодулин, парвальбумин и легкая цепь миозина, которые обладают несколькими участками связывания ионов кальция и, как полагают, имеют общее происхождение с точки зрения молекулярной эволюции, можно конструировать CDR1, CDR2 и/или CDR3 легкой цепи так, чтобы они имели их связывающие мотивы. Например, можно использовать домены кадгерина, EF-hand кальмодулина, C2-домен протеинкиназы C, Gla-домен белка фактора свертывания крови IX, лектины C-типа рецептора асиалогликопротеинов и манноза-связывающего рецептора, A-домены рецепторов LDL, аннексин, домен тромбоспондина 3 типа, и EGF-подобные домены соответствующим образом для описанных выше целей.
Когда вариабельные области тяжелой цепи, полученные в качестве рандомизированной библиотеки последовательностей вариабельной области, и вариабельные области легкой цепи, в которые внесен по меньшей мере один аминокислотный остаток, который изменяет антигенсвязывающую активность антигенсвязывающей молекулы в зависимости от условий концентрации ионов, комбинируют, как описано выше, последовательности вариабельных областей легкой цепи можно конструировать так, чтобы они содержали нестрогие остатки аналогично тому, как описано выше. Количество и положение таких нестрогих остатков конкретно не ограничивается конкретными вариантами осуществления, при условии, что антигенсвязывающая активность антигенсвязывающих молекул по настоящему изобретению варьирует в зависимости от условий концентрации ионов. В частности, последовательности CDR и/или последовательности FR тяжелой цепи и/или легкой цепи могут содержать один или несколько нестрогих остатков. Когда концентрация ионов представляет собой концентрацию ионов кальция, неограничивающие примеры нестрогих остатков, вносимых в последовательность вариабельной области легкой цепи, включают аминокислотные остатки, приведенные в таблицах 1 и 2.
Предпочтительные вариабельные области тяжелой цепи, подлежащие комбинированию, включают, например, рандомизированные библиотеки вариабельной области. Для получения рандомизированной библиотеки вариабельной области известные способы комбинируют соответствующим образом. В неограничивающем варианте осуществления настоящего изобретения в качестве рандомизированной библиотеки вариабельной области предпочтительно можно использовать иммунную библиотеку, сконструированную на основе генов антител, происходящих из лимфоцитов животных, иммунизированных конкретным антигеном, пациентов с инфекциями, индивидуумов с повышенным титром антител в крови в результате вакцинации, пациентов со злокачественной опухолью или пациентов с аутоиммунным заболеванием.
В другом неограничивающем варианте осуществления настоящего изобретения, в качестве рандомизированной библиотеки вариабельной области также предпочтительно можно использовать синтетическую библиотеку, полученную путем замены последовательностей CDR V-генов в геномной ДНК или функциональных реконструированных V-генов набором синтетических олигонуклеотидов, содержащих последовательности, кодирующие наборы кодонов соответствующей длины. В этом случае, поскольку в последовательности CDR3 тяжелой цепи наблюдают разнообразие, также можно заменять только последовательность CDR3. Критерием возникновения разнообразия аминокислот в вариабельной области антигенсвязывающей молекулы является то, что разнообразие возникает у аминокислотных остатков в экспонированных на поверхности положениях антигенсвязывающей молекулы. Экспонированное на поверхности положение относится к положению, которое считается способным экспонироваться на поверхности и/или контактировать с антигеном, исходя из структуры, группы структур и/или смоделированной структуры антигенсвязывающей молекулы. Как правило, такие положения представляют собой CDR. Предпочтительно, экспонированные на поверхности положения определяют с использованием координат из трехмерной модели антигенсвязывающей молекулы с использованием компьютерной программы, такой как программа InsightII (Accelrys). Экспонированные на поверхности положения можно определять с использованием алгоритмов, известных в данной области (например, Lee and Richards (J. Mol. Biol. (1971) 55, 379-400); Connolly (J. Appl. Cryst. (1983) 16, 548-558)). Определение экспонированных на поверхности положений можно проводить с использованием программного обеспечения, пригодного для моделирования белка, и информации о трехмерной структуре, полученной для антитела. Программное обеспечение, которое можно использовать для этих целей, предпочтительно включает программное обеспечение SYBYL Biopolymer Module (Tripos Associates). Главным образом или предпочтительно, когда алгоритм требует введения пользователем параметра размера, "размер" образца, который используют в вычислении, устанавливают как радиус, равный приблизительно 1,4 ангстрем или менее. Более того, способы определения экспонированных на поверхности областей и участков с использованием программного обеспечения для персональных компьютеров описаны Pacios (Comput. Chem. (1994) 18(4), 377-386; J. Mol. Model. (1995) 1, 46-53).
В другом неограничивающем варианте осуществления настоящего изобретения в качестве рандомизированной библиотеки вариабельной области также особенно предпочтительно можно использовать наивную библиотеку, которая сконструирована из генов антител, происходящих из лимфоцитов здоровых индивидуумов, и набор генов которой состоит из наивных последовательностей, которые представляют собой последовательности антител без предпочтений (Gejima et al. (Human Antibodies (2002) 11, 121-129); Cardoso et al. (Scand. J. Immunol. (2000) 51, 337-344)). В настоящем описании аминокислотная последовательность, содержащая наивную последовательность, относится к аминокислотной последовательности, полученной из такой наивной библиотеки.
В одном варианте осуществления настоящего изобретения антигенсвязывающий домен по настоящему изобретению можно получать из библиотеки, содержащей множество антигенсвязывающих молекул по настоящему изобретению, последовательности которых отличаются друг от друга, полученных путем комбинирования вариабельных областей легкой цепи, сконструированных в качестве рандомизированной библиотеки вариабельной области, где вариабельная область тяжелой цепи выбрана в качестве каркасной последовательности, которая первоначально содержит "по меньшей мере один аминокислотный остаток, который изменяет антигенсвязывающую активность антигенсвязывающей молекулы в зависимости от условий концентрации ионов". Когда концентрация ионов представляет собой концентрацию ионов кальция, неограничивающие примеры таких библиотек предпочтительно включают библиотеки, сконструированные путем комбинирования вариабельных областей легкой цепи, сконструированных в качестве рандомизированной библиотеки вариабельной области с последовательностью вариабельной области тяжелой цепи SEQ ID NO: 10 (6RL#9-IgG1) или SEQ ID NO: 11 (6KC4-1#85-IgG1). Альтернативно, такую библиотеку можно конструировать путем выбора соответствующих вариабельных областей легкой цепи из вариабельных областей легкой цепи, которые имеют последовательности эмбрионального типа, вместо вариабельных областей легкой цепи, сконструированных в качестве рандомизированной библиотеки последовательностей вариабельной области. Такие предпочтительные библиотеки включают, например, библиотеки, в которых последовательность вариабельной области тяжелой цепи SEQ ID NO: 10 (6RL#9-IgG1) или SEQ ID NO: 11 (6KC4-1#85-IgG1) комбинируют с вариабельными областями легкой цепи, имеющими последовательность эмбрионального типа.
Альтернативно, последовательность вариабельной области тяжелой цепи, выбранную в качестве каркасной последовательности, которая первоначально содержит "по меньшей мере один аминокислотный остаток, который изменяет антигенсвязывающую активность антигенсвязывающей молекулы в зависимости от условий концентрации ионов", как упоминалось выше, можно конструировать так, чтобы она содержала нестрогие остатки. Количество и положение нестрогих остатков конкретно не ограничено, при условии, что антигенсвязывающая активность антигенсвязывающей молекулы по настоящему изобретению варьирует в зависимости от условий концентрации ионов. В частности, последовательности CDR и/или FR тяжелой цепи и/или легкой цепи могут содержать один или несколько нестрогих остатков. Когда концентрация ионов представляет собой концентрацию ионов кальция, неограничивающие примеры нестрогих остатков, вносимых в последовательность вариабельной области тяжелой цепи SEQ ID NO: 10 (6RL#9-IgG1), включают все аминокислотные остатки CDR1 и CDR2 тяжелой цепи и аминокислотные остатки CDR3 тяжелой цепи, за исключением остатков в положении(ях) 95, 96 и/или 100a. Альтернативно, неограничивающие примеры нестрогих остатков, вносимых в последовательность вариабельной области тяжелой цепи SEQ ID NO: 11 (6KC4-1#85-IgG1), включают все аминокислотные остатки CDR1 и CDR2 тяжелой цепи и аминокислотные остатки CDR3 тяжелой цепи, за исключением остатков в положении(ях) аминокислоты 95 и/или 101.
Альтернативно, библиотеку, содержащую множество антигенсвязывающих молекул, последовательности которых отличаются друг от друга, можно конструировать путем комбинирования вариабельных областей легкой цепи, сконструированных в качестве рандомизированной библиотеки последовательностей вариабельной области, или вариабельных областей легкой цепи, имеющих последовательности эмбрионального типа, с вариабельными областями тяжелой цепи, в которые внесен "по меньшей мере один аминокислотный остаток, который изменяет антигенсвязывающую активность антигенсвязывающей молекулы в зависимости от условий концентрации ионов". Когда концентрация ионов представляет собой концентрацию ионов кальция, неограничивающие примеры таких библиотек предпочтительно включают библиотеки, в которых вариабельные области легкой цепи, сконструированные в качестве рандомизированной библиотеки последовательностей вариабельной области, или вариабельные области легкой цепи, имеющие последовательности эмбрионального типа, комбинируют с последовательностью вариабельной области тяжелой цепи, в которой конкретный остаток (остатки) заменен по меньшей мере одним аминокислотным остатком, который изменяет антигенсвязывающую активность антигенсвязывающей молекулы в зависимости от условий концентрации ионов кальция. Неограничивающие примеры таких аминокислотных остатков включают аминокислотные остатки CDR1 тяжелой цепи. Следующие неограничивающие примеры таких аминокислотных остатков включают аминокислотные остатки CDR2 тяжелой цепи. Кроме того, неограничивающие примеры таких аминокислотных остатков также включают аминокислотные остатки CDR3 тяжелой цепи. Неограничивающие примеры таких аминокислотных остатков CDR3 тяжелой цепи включают аминокислоту(ы) в положении(ях) 95, 96, 100a и/или 101 в CDR3 вариабельной области тяжелой цепи, как указано согласно нумерации Kabat. Более того, эти аминокислотные остатки могут содержаться отдельно или в комбинации, при условии, что они образуют кальций-связывающий мотив и/или антигенсвязывающая активность антигенсвязывающей молекулы варьирует в зависимости от условий концентрации ионов кальция.
Когда вариабельные области легкой цепи, сконструированные в качестве рандомизированной библиотеки последовательностей вариабельной области, или вариабельные области легкой цепи, имеющие последовательность эмбрионального типа, комбинируют с вариабельной областью тяжелой цепи, в которую внесен по меньшей мере один аминокислотный остаток, который изменяет антигенсвязывающую активность антигенсвязывающей молекулы в зависимости от условий концентрации ионов, как упоминалось выше, последовательность вариабельной области тяжелой цепи также можно конструировать так, чтобы она содержала нестрогие остатки, аналогично тому, как описано выше. Количество и положение нестрогих остатков конкретно не ограничено, при условии, что антигенсвязывающая активность антигенсвязывающей молекулы по настоящему изобретению варьирует в зависимости от условий концентрации ионов. В частности, последовательности CDR и/или FR тяжелой цепи могут содержать один или несколько нестрогих остатков. Более того, рандомизированные библиотеки вариабельной области можно предпочтительно использовать в качестве аминокислотных последовательностей CDR1, CDR2 и/или CDR3 вариабельной области тяжелой цепи, отличных от аминокислотных остатков, которые изменяют антигенсвязывающую активность антигенсвязывающей молекулы. Когда в качестве вариабельных областей легкой цепи используют последовательности эмбрионального типа, неограничивающие примеры таких последовательностей включают последовательности SEQ ID NO: 6 (Vk1), SEQ ID NO: 7 (Vk2), SEQ ID NO: 8 (Vk3) и SEQ ID NO: 9 (Vk4).
Предпочтительно можно использовать любую из описанных выше аминокислот, которые изменяют антигенсвязывающую активность антигенсвязывающей молекулы в зависимости от условий концентрации ионов кальция, при условии, что они образуют кальций-связывающий мотив. В частности, такие аминокислоты включают электронодонорные аминокислоты. Предпочтительные примеры таких электронодонорных аминокислот включают серин, треонин, аспарагин, глутаминовую кислоту, аспарагиновую кислоту и глутаминовую кислоту.
Условия концентраций ионов водорода
В одном варианте осуществления настоящего изобретения условия концентрации ионов относятся к условиям концентрации ионов водорода или условиям pH. В рамках настоящего изобретения концентрация протона, т.е. ядра атома водорода, используется в качестве синонима водородного показателя (pH). Когда активность ионов водорода в водном растворе отображают как aH+, pH определяется как -log10aH+. Когда ионная сила водного раствора является низкой (например, ниже 10-3), aH+ практически равна ионной силе водорода. Например, ионное произведение воды при 25°C и 1 атмосфере составляет Kw=aH+aOH=10-14, и, таким образом, в чистой воде aH+=aOH=10-7. В этом случае pH=7 является нейтральным; водный раствор, pH которого ниже 7, является кислым, или pH которого больше 7, является щелочным.
В рамках настоящего изобретения, когда условия pH используют в качестве условий концентрации ионов, условия pH включают условия высокой концентрации ионов водорода или низких значений pH, т.е. условия диапазона кислых значений pH, и условия низких концентраций ионов водорода или условия высоких значений pH, т.е. условия диапазона нейтральных значений pH. "Активность связывания антигена антигенсвязывающего домена, содержащегося в антигенсвязывающей молекуле по настоящему изобретению, варьирует в зависимости от условий pH" означает, что антигенсвязывающая активность антигенсвязывающего домена, содержащегося в антигенсвязывающей молекуле, варьирует вследствие различий в условиях высокой концентрации ионов водорода или низких значений pH (диапазон кислых значений pH) и низкой концентрации ионов водорода или высоких значений pH (диапазон нейтральных значений pH). Это включает, например, случай, когда антигенсвязывающая активность антигенсвязывающей молекулы является более высокой в условиях диапазона нейтральных значений pH, чем в условиях диапазона кислых значений pH, и случай, когда антигенсвязывающая активность антигенсвязывающей молекулы является более высокой в условиях диапазона кислых значений pH, чем в условиях диапазона нейтральных значений pH.
В настоящем описании диапазон нейтральных значений pH не ограничивается конкретной величиной и предпочтительно выбран из диапазона от pH 6,7 до pH 10,0. В другом варианте осуществления значение pH может быть выбрано из диапазона от pH 6,7 до pH 9,5. В другом варианте осуществления значение pH может быть выбрано из диапазона от pH 7,0 до pH 9,0. В другом варианте осуществления значение pH может быть выбрано из диапазона от pH 7,0 до pH 8,0. Особенно предпочтительное значение pH включает pH 7,4, которое является близким к pH плазмы (крови) in vivo.
В настоящем описании диапазон кислых значений pH не ограничивается конкретной величиной и предпочтительно выбран из диапазона от pH 4,0 до pH 6,5. В другом варианте осуществления значение pH может быть выбрано из диапазона от pH 4,5 до pH 6,5. В другом варианте осуществления значение pH может быть выбрано из диапазона от pH 5,0 до pH 6,5. В другом варианте осуществления pH может быть выбрано из диапазона от pH 5,5 до pH 6,5. Особенно предпочтительное значение pH включает pH 5,8, что является близким к концентрации ионизированного кальция в ранней эндосоме in vivo.
В рамках настоящего изобретения "антигенсвязывающая активность в условиях высокой концентрации ионов водорода или низком значении pH (диапазон кислых значений pH) является более низкой, чем в условиях низкой концентрации ионов водорода или высоком значении pH (диапазон нейтральных значений pH)" означает, что антигенсвязывающая активность антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен, по настоящему изобретению при значении pH, выбранном из диапазона от pH 4,0 до pH 6,5, является более слабой, чем при значении pH, выбранном из диапазона от pH 6,7 до pH 10,0; предпочтительно это означает, что антигенсвязывающая активность антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен, при значении pH, выбранном из диапазона от pH 4,5 до pH 6,5, является более слабой, чем при pH, выбранном из диапазона от pH 6,7 до pH 9,5; более предпочтительно это означает, что антигенсвязывающая активность антигенсвязывающей молекулы при значении pH, выбранном из диапазона от pH 5,0 до pH 6,5, является более слабой, чем при значении pH, выбранном из диапазона от pH 7,0 до pH 9,0; еще более предпочтительно это означает, что антигенсвязывающая активность антигенсвязывающей молекулы при значении pH, выбранном из диапазона от pH 5,5 до pH 6,5 является более слабой, чем при значении pH, выбранном из диапазона от pH 7,0 до pH 8,0; особенно предпочтительно это означает, что антигенсвязывающая активность при значении pH в ранней эндосоме in vivo является более слабой, чем антигенсвязывающая активность при значении pH в плазме in vivo; и, конкретно, это означает, что антигенсвязывающая активность антигенсвязывающей молекулы при pH 5,8 является более слабой, чем антигенсвязывающая активность при pH 7,4.
Определение того, изменяется ли антигенсвязывающая активность антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен, в зависимости от условий pH можно проводить, например, с использованием известных способов измерения, таких как способы, описанные в разделе "Активность связывания" выше. Например, активность связывания измеряют в различных условиях pH с использованием способов измерения, описанных выше. Например, антигенсвязывающую активность антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен, сравнивают в условиях диапазона кислых значений pH и диапазона нейтральных значений pH, чтобы подтвердить, что активность связывания домена или молекулы изменяется так, что она является более высокой в условиях диапазона нейтральных значений pH, чем в условиях диапазона кислых значений pH.
Более того, в рамках настоящего изобретения выражение "антигенсвязывающая активность в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, является более низкой, чем в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH" также может быть выражено как "антигенсвязывающая активность антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен, в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH, является более высокой чем в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH". В рамках настоящего изобретения "антигенсвязывающая активность в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, является более низкой, чем в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH" может быть описана как "антигенсвязывающая активность в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазоне кислых значений pH, является более слабой, чем антигенсвязывающая способность в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH". Альтернативно, "антигенсвязывающая активность в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, снижена так, чтобы она более низкой, чем в условиях низкой концентрации ионов водорода или высоком значении pH, т.е. в условиях диапазона нейтральных значений pH" может быть описана как "антигенсвязывающая активность в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, снижена так, чтобы она была слабее, чем антигенсвязывающая способность в условиях низкой концентрации ионов водорода или в условиях высоких значений pH, т.е. в условиях диапазона нейтральных значений pH".
Условия, отличные от концентрации ионов водорода или pH для измерения и антигенсвязывающей активности, могут быть соответствующим образом выбраны специалистами в данной области и они конкретно не ограничены. Измерение можно проводить, например, при 37°C с использованием буфера HEPES. Измерение можно проводить, например, с использованием Biacore (GE Healthcare). Когда антиген представляет собой растворимый антиген, антигенсвязывающую активность антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен, можно определять путем оценки активности связывания с растворимым антигеном путем пропускания антигена в качестве анализируемого соединения над чипом, на котором иммобилизованы антигенсвязывающий домен или антигенсвязывающая молекула, содержащая домен. Когда антиген представляет собой антиген мембраны, активность связывания с антигеном мембраны можно оценивать путем пропускания антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен, в качестве анализируемого соединения над чипом, на который иммобилизован антиген.
При условии, что антигенсвязывающая активность антигенсвязывающей молекулы по настоящему изобретению в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, является более слабой, чем в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH, соотношение антигенсвязывающей активности между антигенсвязывающей активностью в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, и в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH, конкретно не ограничено, и величина KD (pH 5,8)/KD (pH 7,4), которая представляет собой соотношение константы диссоциации (KD) для антигена в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, и KD в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH, предпочтительно составляет 2 или более; более предпочтительно величина KD (pH 5,8)/KD (pH 7,4) составляет 10 или более; и еще более предпочтительно величина KD (pH 5,8)/KD (pH 7,4) составляет 40 или более. Верхний предел величины KD (pH 5,8)/KD (pH 7,4) конкретно не ограничен, и он может представлять собой любую величину, такую как 400, 1000 или 10000, при условии, что молекулу можно получать способами, известными специалистам в данной области.
Альтернативно, например, константу скорости диссоциации (kd) можно соответствующим образом использовать в качестве показателя, указывающего на соотношение антигенсвязывающей активности антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен, по настоящему изобретению между активностью в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, и в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH. Когда kd (константа скорости диссоциации) используют в качестве показателя, указывающего на соотношение активностей связывания вместо KD (константа диссоциации), величина kd (в диапазоне кислых значений pH)/kd (в диапазоне нейтральных значений pH), которая представляет собой соотношение kd (константа скорости диссоциации) в отношении антигена в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений, pH и kd (константа скорости диссоциации) в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH, предпочтительно составляет 2 или более, более предпочтительно 5 или более, еще более предпочтительно 10 или более и еще более предпочтительно 30 или более. Верхний предел величины kd (в диапазоне кислых значений pH)/kd (в диапазоне нейтральных значений pH) конкретно не ограничен, и он может представлять собой любую величину, такую как 50, 100 или 200, при условии, что молекулу можно получать способами, известными специалистам в данной области.
Когда антиген представляет собой растворимый антиген, в качестве величины антигенсвязывающей активности можно использовать константу скорости диссоциации (kd), и когда антиген представляет собой антиген мембраны, можно использовать кажущуюся константу скорости диссоциации (kd). Константу скорости диссоциации (kd) и кажущуюся константу скорости диссоциации (kd) можно определять способами, известными специалистам в данной области, и можно использовать Biacore (GE healthcare), проточный цитометр и т.п. В рамках настоящего изобретения, когда антигенсвязывающую активность антигенсвязывающего домена или антигенсвязывающей молекулы, содержащей домен, измеряют при различных концентрациях ионов водорода, т.е. pH, условия, отличные от концентрации ионов водорода, т.е. pH, предпочтительно являются одинаковыми.
Например, антигенсвязывающий домен или антигенсвязывающую молекулу, антигенсвязывающая активность которых в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, является более низкой, чем в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH, которые являются одним из вариантов осуществления, предусматриваемых настоящим изобретением, можно получать путем скрининга антигенсвязывающих доменов или антигенсвязывающих молекул, включающего следующие стадии (a)-(c):
(a) получение значения антигенсвязывающей активности антигенсвязывающего домена или антигенсвязывающей молекулы в условиях диапазона кислых значений pH;
(b) получение значения антигенсвязывающей активности антигенсвязывающего домена или антигенсвязывающей молекулы в условиях диапазона нейтральных значений pH; и
(c) выбор антигенсвязывающего домена или антигенсвязывающей молекулы, антигенсвязывающая активность которых в условиях диапазона кислых значений pH является более низкой, чем в условиях диапазона нейтральных значений pH.
Альтернативно, антигенсвязывающий домен или антигенсвязывающую молекулу, антигенсвязывающая активность которых в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, является более низкой, чем в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH, которые являются одним из вариантов осуществления, предусматриваемых настоящим изобретением, можно получать путем скрининга антигенсвязывающих доменов или антигенсвязывающим молекул, или их библиотеки, включающего следующие стадии (a)-(c):
(a) контактирование антигенсвязывающего домена, или антигенсвязывающей молекулы, или их библиотеки в условиях диапазона нейтральных значений pH с антигеном;
(b) помещение антигенсвязывающего домена или антигенсвязывающей молекулы, связавшихся с антигеном на стадии (a), в условия диапазона кислых значений pH; и
(c) выделение антигенсвязывающего домена или антигенсвязывающей молекулы, диссоциировавших на стадии (b).
Антигенсвязывающий домен или антигенсвязывающая молекула, антигенсвязывающая активность которых в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, является более низкой, чем в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH, которые являются другим вариантом осуществления, предусматриваемым настоящим изобретением, можно получать путем скрининга антигенсвязывающих доменов, или антигенсвязывающих молекул, или их библиотеки, включающего следующие стадии (a)-(d):
(a) контактирование в условиях диапазона кислых значений pH антигена с библиотекой антигенсвязывающих доменов или антигенсвязывающих молекул;
(b) отбор антигенсвязывающего домена или антигенсвязывающей молекулы, которые не связываются с антигеном на стадии (a);
(c) позволение антигенсвязывающему домену или антигенсвязывающей молекуле, отобранным на стадии (b), связываться с антигеном в условиях диапазона нейтральных значений pH; и
(d) выделение антигенсвязывающего домена или антигенсвязывающей молекулы, связавшихся с антигеном на стадии (c).
Антигенсвязывающий домен или антигенсвязывающую молекулу, антигенсвязывающая активность которых в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, является более низкой, чем в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH, которые являются другим вариантом осуществления, предусматриваемым настоящим изобретением, можно получать способом скрининга, включающим следующие стадии (a)-(c):
(a) контактирование в условиях диапазона нейтральных значений pH библиотеки антигенсвязывающих доменов или антигенсвязывающих молекул с колонкой, на которой иммобилизован антиген;
(b) элюирование в условиях диапазона кислых значений pH из колонки антигенсвязывающего домена или антигенсвязывающей молекулы, связавшихся с колонкой на стадии (a); и
(c) выделение антигенсвязывающего домена или антигенсвязывающей молекулы, элюированных на стадии (b).
Антигенсвязывающий домен или антигенсвязывающую молекулу, антигенсвязывающая активность которых в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, является более низкой, чем в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH, которые являются другим вариантом осуществления, предусматриваемым настоящим изобретением, можно получать способом скрининга, включающим следующие стадии (a)-(d):
(a) позволение в условиях диапазона кислых значений pH библиотеке антигенсвязывающих доменов или антигенсвязывающих молекул проходить через колонку, на которую иммобилизован антиген;
(b) сбор антигенсвязывающего домена или антигенсвязывающей молекулы, элюированных без связывания с колонкой на стадии (a);
(c) позволение антигенсвязывающему домену или антигенсвязывающей молекуле, собранным на стадии (b), связываться с антигеном в условиях диапазона нейтральных значений pH; и
(d) выделение антигенсвязывающего домена или антигенсвязывающей молекулы, связавшихся с антигеном на стадии (c).
Антигенсвязывающий домен или антигенсвязывающую молекулу, антигенсвязывающая активность которых в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, является более низкой, чем в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH, которые являются другим вариантом осуществления, предусматриваемым настоящим изобретением, можно получать способом скрининга, включающим следующие стадии (a)-(d):
(a) контактирование антигена с библиотекой антигенсвязывающих доменов или антигенсвязывающих молекул в условиях диапазона нейтральных значений pH;
(b) получение антигенсвязывающего домена или антигенсвязывающей молекулы, связавшихся с антигеном на стадии (a);
(c) помещение антигенсвязывающего домена или антигенсвязывающей молекулы, полученных на стадии (b), в условия диапазона кислых значений pH; и
(d) выделение антигенсвязывающего домена или антигенсвязывающей молекулы, антигенсвязывающая активность которых на стадии (c) является более слабой, чем у стандарта, выбранного на стадии (b).
Описанные выше стадии можно повторять два или более раз. Таким образом, настоящее изобретение относится к антигенсвязывающим доменам и антигенсвязывающим молекулам, антигенсвязывающая активность которых в условиях диапазона кислых значений pH является более низкой, чем в условиях диапазона нейтральных значений pH, которые получают способом скрининга, который дополнительно включает стадии повторения стадий (a)-(c) или (a)-(d) в описанных выше способах скрининга. Количество повторений стадий (a)-(c) или (a)-(d) конкретно не ограничено; однако обычно количество составляет 10 или менее.
В способах скрининга по настоящему изобретению антигенсвязывающая активность антигенсвязывающего домена или антигенсвязывающей молекулы в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в диапазоне кислых значений pH, конкретно не ограничена, при условии, что она представляет собой антигенсвязывающую активность при pH от 4,0 до 6,5, и включает антигенсвязывающую активность при pH от 4,5 до 6,6 в качестве предпочтительных значений pH. Антигенсвязывающая активность также включает антигенсвязывающую активность при pH от 5,0 до 6,5, и антигенсвязывающую активность при pH от 5,5 до 6,5 в качестве других предпочтительных значений pH. Антигенсвязывающая активность также включает антигенсвязывающую активность при pH в ранней эндосоме in vivo в качестве более предпочтительного значения pH, и, в частности, антигенсвязывающую активность при pH 5,8. Между тем, антигенсвязывающая активность антигенсвязывающего домена или антигенсвязывающей молекулы в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в диапазоне нейтральных значений pH, конкретно не ограничена, при условии, что она представляет собой антигенсвязывающую активность при pH от 6,7 до 10, и включает антигенсвязывающую активность при pH от 6,7 до 9,5 в качестве предпочтительных значений pH. Антигенсвязывающая активность также включает антигенсвязывающую активность при pH от 7,0 до 9,5 и антигенсвязывающую активность при pH от 7,0 до 8,0 в качестве других предпочтительных значений pH. Антигенсвязывающая активность также включает антигенсвязывающую активность при pH плазмы in vivo в качестве более предпочтительных значений pH, и, в частности, антигенсвязывающую активность при pH 7,4.
Антигенсвязывающую активность антигенсвязывающего домена или антигенсвязывающей молекулы можно измерять способами, известными специалистам в данной области. Специалисты в данной области могут соответствующим образом определить условия, отличные от концентрации ионизированного кальция. Антигенсвязывающую активность антигенсвязывающего домена или антигенсвязывающей молекулы можно оценивать, основываясь на константе диссоциации (KD), кажущейся константе диссоциации (KD), константе скорости диссоциации (kd), кажущейся константе скорости диссоциации (kd) и т.п. Их можно определять способами, известными специалистам в данной области, например, с использованием Biacore (GE healthcare), графика Скэтчарда или FACS.
В рамках настоящего изобретения стадия отбора антигенсвязывающего домена или антигенсвязывающей молекулы, антигенсвязывающая активность которых в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH, является более высокой, чем в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, является синонимичной стадии отбора антигенсвязывающего домена или антигенсвязывающей молекулы, антигенсвязывающая активность которых в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, является более низкой, чем в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH.
При условии, что антигенсвязывающая активность в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH, является более высокой, чем в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, отличие между антигенсвязывающей активностью в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH, и антигенсвязывающей активностью в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, конкретно не ограничено; однако антигенсвязывающая активность в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH, предпочтительно в два или более раз, более предпочтительно в 10 или более раз и еще более предпочтительно в 40 или более раз превышает антигенсвязывающую активность в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH.
Аминокислоты, которые изменяют антигенсвязывающую активность антигенсвязывающего домена в зависимости от условий концентрации ионов водорода
Антигенсвязывающий домен или антигенсвязывающую молекулу по настоящему изобретению, подлежащие скринингу описанными выше способами скрининга, можно получать любым способом. Например, можно использовать общепринятые антигенсвязывающие молекулы, общепринятые библиотеки (фаговая библиотека и т.д.), антитела или библиотеки, полученные из B-клеток иммунизированных животных или из гибридом, полученных путем иммунизации животных, антитела или библиотеки (библиотеки с увеличенным содержанием аминокислот с pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродных аминокислот, библиотеки, в которые внесены аминокислоты с pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродные аминокислотные мутации в конкретных положениях и т.д.), полученные путем внесения аминокислот с pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродных аминокислотных мутаций в описанные выше антитела или библиотеки.
Способы получения антигенсвязывающего домена или антигенсвязывающей молекулы, антигенсвязывающая активность которых в условиях низкой концентрации ионов водорода или в условиях высокого значения pH, т.е. в условиях диапазона нейтральных значений pH, является более высокой, чем в условиях высокой концентрации ионов водорода или в условиях низкого значения pH, т.е. в условиях диапазона кислых значений pH, из антигенсвязывающих доменов или антигенсвязывающих молекул, полученных из гибридом, полученных иммунизацией животных или из B-клеток иммунизированных животных, предпочтительно включают, например, антигенсвязывающую молекулу или антигенсвязывающую молекулу, в которых по меньшей мере одна из аминокислот антигенсвязывающего домена или антигенсвязывающей молекулы заменена аминокислотой с pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или мутацией на неприродную аминокислоту, или антигенсвязывающий домен или антигенсвязывающую молекулу, в которые встроена аминокислота с pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродная аминокислота, такая как описана в WO 2009/125825.
Участки внесения мутаций на аминокислоты с pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродные аминокислоты конкретно не ограничены, и они могут представлять собой любое положение, при условии, что антигенсвязывающая активность в диапазоне кислых значений pH становится более слабой, чем в диапазоне нейтральных значений pH (величина KD (в диапазоне кислых значений pH)/KD (в диапазоне нейтральных значений pH) или kd (в диапазоне кислых значений pH)/kd (в диапазоне нейтральных значений pH) увеличивается) по сравнению с величиной до замены или вставки. Например, когда антигенсвязывающая молекула представляет собой антитело, являются пригодными вариабельная область и CDR антитела. Специалисты в данной области могут соответствующим образом определить количество аминокислот, подлежащих замене, или количество аминокислот с pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродных аминокислот, подлежащих встраиванию. Можно осуществить замену на одну аминокислоту, имеющую pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота), или одну неприродную аминокислоту; можно осуществить встраивание одной аминокислоты, имеющей pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота), или одной неприродной аминокислоты; можно осуществить замену на две или более аминокислот, имеющих pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или на две или более неприродных аминокислоты; и можно осуществить встраивание двух или более аминокислот, имеющих pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или двух или более неприродных аминокислот. Альтернативно, другие аминокислоты можно параллельно удалять, добавлять, встраивать и/или заменять, помимо замены на аминокислоты, имеющие pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродные аминокислоты, или встраивания аминокислот, имеющих pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродных аминокислот. Замену на или встраивание аминокислот с pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродных аминокислот можно проводить случайным образом способами, такими как сканирование гистидином, в которых аланин в способе сканирования аланином, известном специалистам в данной области, заменяют на гистидин. Антигенсвязывающие молекулы, проявляющие более высокую величину KD (в диапазоне кислых значений pH)/KD (в диапазоне нейтральных значений pH) или kd (в диапазоне кислых значений pH)/kd (в диапазоне нейтральных значений pH) по сравнению с величиной до внесения мутации, можно выбирать из антигенсвязывающих доменов или антител, в которые внесены случайные инсерции или мутации с заменой на аминокислоты с pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродные аминокислоты.
Предпочтительные примеры антигенсвязывающих молекул, содержащих мутацию на аминокислоты с pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродные аминокислоты, как описано выше, и антигенсвязывающая активность которых в диапазоне кислых значений pH является более низкой, чем в диапазоне нейтральных значений pH, включают антигенсвязывающие молекулы, антигенсвязывающая активность которых в диапазоне нейтральных значений pH после мутации на аминокислоты с pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродные аминокислоты сравнима с антигенсвязывающей активностью до мутации на аминокислоты с pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродные аминокислоты. В рамках настоящего изобретения "антигенсвязывающая молекула после мутации на аминокислоты, имеющие pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота), или неприродные аминокислоты имеет антигенсвязывающую активность, сравнимую с антигенсвязывающей активностью до мутации на аминокислоты, имеющие pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродные аминокислоты" означает, что, при принятии антигенсвязывающей активности антигенсвязывающей молекулы до мутации на аминокислоты, имеющие pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота), или неприродные аминокислоты, как 100%, антигенсвязывающая активность антигенсвязывающей молекулы после мутации на аминокислоты, имеющие pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота), или неприродные аминокислоты составляет по меньшей мере 10% или более, предпочтительно 50% или более, более предпочтительно 80% или более и еще более предпочтительно 90% или более. Антигенсвязывающая активность после мутации на аминокислоты с pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродные аминокислоты при pH 7,4 может быть более высокой, чем до мутации на аминокислоты с pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродные аминокислоты при pH 7,4. Если антигенсвязывающая активность антигенсвязывающей молекулы снижается вследствие встраивания или замены на аминокислоты с pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродные аминокислоты, антигенсвязывающую активность можно сделать сравнимой с антигенсвязывающей активностью до встраивания или замены на аминокислоты с pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродные аминокислоты, путем внесения замены, делеции, вставки и/или инсерции одной или более аминокислот антигенсвязывающей молекулы. Настоящее изобретение также включает антигенсвязывающие молекулы, активность связывания которых скорректирована так, чтобы она была сравнимой, путем замены, делеции, вставки и/или инсерции одной или более аминокислот после замены на или вставки аминокислоты с pKa боковой цепи 4,0-8,0 (например, гистидин и глутаминовая кислота) или неприродной аминокислоты.
В одном варианте осуществления настоящего изобретения библиотеку, содержащую множество антигенсвязывающих доменов или антигенсвязывающих молекул по настоящему изобретению, последовательности которых отличаются друг от друга, также можно конструировать путем комбинирования вариабельных областей тяжелой цепи, полученных в качестве рандомизированной библиотеки последовательностей вариабельной области, с вариабельными областями легкой цепи, в которые внесен "по меньшей мере один аминокислотный остаток, который изменяет антигенсвязывающую активность антигенсвязывающего домена или антигенсвязывающей молекулы в зависимости от условий концентрации ионов водорода".
Такие аминокислотные остатки включают, но не ограничиваются ими, например, аминокислотные остатки, содержащиеся в CDR1 легкой цепи. Аминокислотные остатки также включают, но не ограничиваются ими, например, аминокислотные остатки, содержащиеся в CDR2 легкой цепи. Аминокислотные остатки также включают, но не ограничиваются ими, например, аминокислотные остатки, содержащиеся в CDR3 легкой цепи.
Описанные выше аминокислотные остатки, содержащиеся в CDR1 легкой цепи, включают, но не ограничиваются ими, например, аминокислотные остаток(и) в положении(ях) 24, 27, 28, 31, 32 и/или 34 согласно нумерации Kabat в CDR1 вариабельной области легкой цепи. Между тем, аминокислотные остатки, содержащиеся в CDR2 легкой цепи, включают, но не ограничиваются ими, например, аминокислотные остаток(и) в положении(ях) 50, 51, 52, 53, 54, 55 и/или 56 согласно нумерации Kabat в CDR2 вариабельной области легкой цепи. Более того, аминокислотные остатки в CDR3 легкой цепи включают, но не ограничиваются ими, например, аминокислотные остаток(и) в положении(ях) 89, 90, 91, 92, 93, 94 и/или 95A согласно нумерации Kabat в CDR3 вариабельной области легкой цепи. Более того, аминокислотные остатки могут содержаться отдельно или они могут содержаться в комбинации из двух или более аминокислот, при условии, что они позволяют изменять антигенсвязывающую активность антигенсвязывающей молекулы в зависимости от условий концентрации ионов водорода.
Даже когда вариабельную область тяжелой цепи, полученную в качестве рандомизированной библиотеки последовательностей вариабельной области, комбинируют с описанной выше вариабельной областью легкой цепи, в которую внесен "по меньшей мере один аминокислотный остаток, который изменяет антигенсвязывающую активность антигенсвязывающего домена или антигенсвязывающей молекулы в зависимости от условий концентрации ионов водорода", ее можно конструировать так, чтобы нестрогие остатки содержались в последовательности вариабельной области легкой цепи аналогично тому, как описано выше. Количество и положение нестрогих остатков конкретно не ограничено конкретным вариантом осуществления, при условии, что антигенсвязывающая активность антигенсвязывающего домена или антигенсвязывающей молекулы по настоящему изобретению изменяется в зависимости от условий концентрации ионов водорода. В частности, последовательности CDR и/или FR тяжелой цепи и/или легкой цепи могут содержать один или несколько нестрогих остатков. Например, нестрогие остатки, подлежащие внесению в последовательности вариабельных областей легкой цепи, включают, но не ограничиваются ими, например, аминокислотные остатки, приведенные в таблице 3 и 4. Между тем, аминокислотные последовательности вариабельных областей легкой цепи, отличные от нестрогих остатков, и аминокислотные остатки, которые изменяют антигенсвязывающую активность антигенсвязывающей молекулы в зависимости от условий концентрации ионов водорода, соответственно включают, но не ограничиваются ими, последовательности эмбрионального типа, такие как Vk1 (SEQ ID NO: 6), Vk2 (SEQ ID NO: 7), Vk3 (SEQ ID NO: 8) и Vk4 (SEQ ID NO: 9).
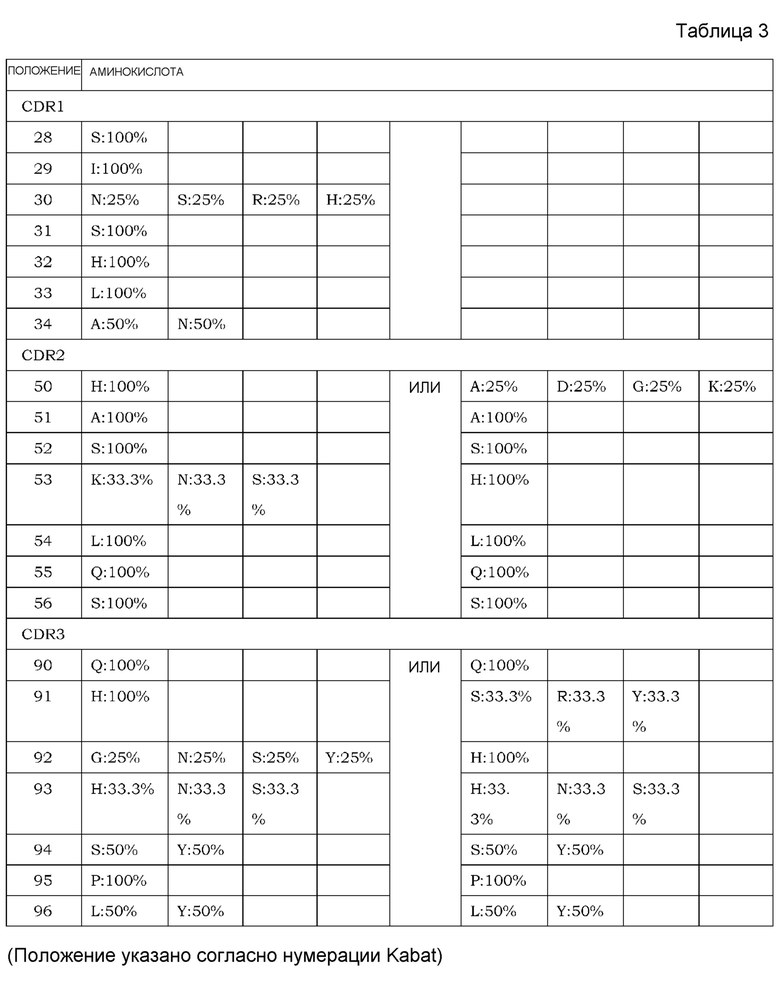
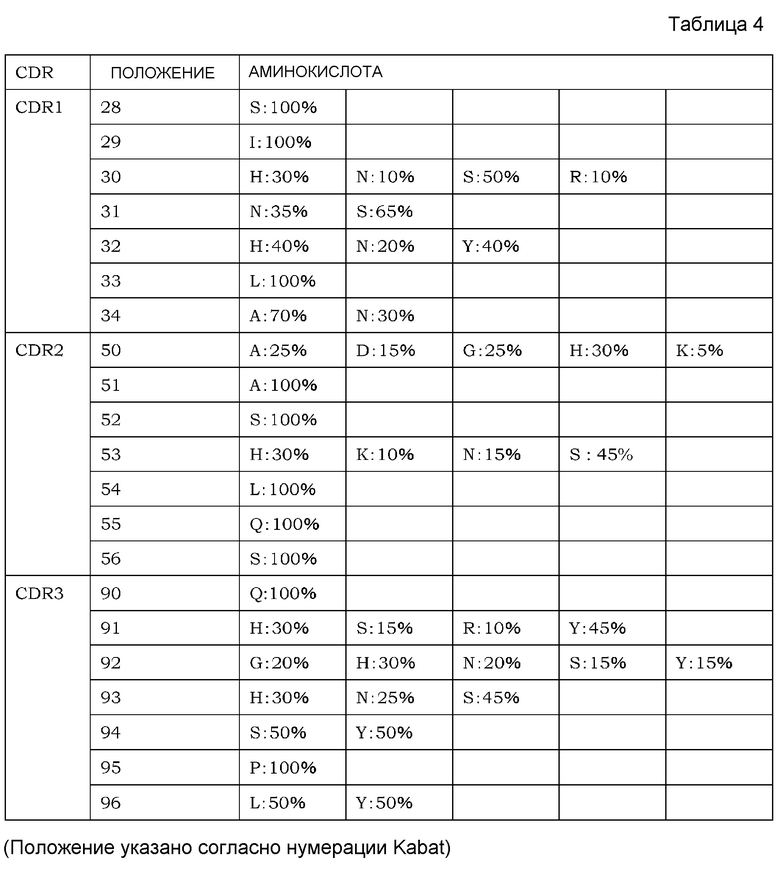
Любой аминокислотный остаток можно соответствующим образом использовать в качестве описанных выше аминокислотных остатков, которые изменяют антигенсвязывающую активность антигенсвязывающего домена или антигенсвязывающей молекулы в зависимости от условий концентрации ионов водорода. В частности, такие аминокислотные остатки включают аминокислоты с pKa боковой цепи 4,0-8,0. Такие электроноотдающие аминокислоты предпочтительно включают, например, встречающиеся в природе аминокислоты, такие как гистидин и глутаминовая кислота, а также неприродные аминокислоты, такие как аналоги гистидина (US 2009/0035836), m-NO2-Tyr (pKa 7,45), 3.5-Br2-Tyr (pKa 7,21) и 3,5-I2-Tyr (pKa 7,38) (Bioorg. Med. Chem. (2003) 11(17), 3761-3768). Особенно предпочтительные аминокислотные остатки включают, например, аминокислоты с pKa боковой цепи 6,0-7,0. Такие электроноотдающие аминокислотные остатки предпочтительно включают, например, гистидин.
Предпочтительная вариабельная область тяжелой цепи, которую используют в комбинации, включает, например, рандомизированные библиотеки вариабельной области. Известные способы соответствующим образом комбинируют в качестве способа получения рандомизированной библиотеки вариабельной области. В неограничивающем варианте осуществления настоящего изобретения, в качестве рандомизированной библиотеки вариабельной области можно использовать иммунную библиотеку, сконструированную на основе генов антител, происходящих из животных, иммунизированных конкретными антигенами, пациентов с инфекцией или индивидуумов с повышенным титром антител в крови в результате вакцинации, пациентов со злокачественной опухолью или лимфоцитов от пациентов с иммунными заболеваниями.
В другом неограничивающем варианте осуществления настоящего изобретения, аналогично тому, как описано выше, в качестве рандомизированной библиотеки вариабельной области также пригодным образом можно использовать синтетическую библиотеку, полученную путем замены последовательностей CDR V-генов в геномной ДНК или функциональных реконструированных V-генов набором синтетических олигонуклеотидов, содержащих последовательности, кодирующие наборы кодонов соответствующей длины. В этом случае, поскольку в последовательности CDR3 тяжелой цепи наблюдают разнообразие, также можно заменять только последовательность CDR3. Основанием для получения вариантов аминокислот в вариабельной области антигенсвязывающей молекулы является получение вариантов аминокислотных остатков экспонированных на поверхности положений антигенсвязывающей молекулы. Экспонированное на поверхности положение относится к положению, которое считается способным экспонироваться на поверхности и/или контактировать с антигеном, исходя из структуры, группы структур и/или смоделированной структуры антигенсвязывающей молекулы, и, как правило, такие положения представляют собой CDR. Предпочтительно, экспонированные на поверхности положения определяют с использованием координат из трехмерной модели антигенсвязывающей молекулы с использованием компьютерной программы, такой как программа InsightII (Accelrys). Экспонированные на поверхности положения можно определять с использованием алгоритмов, известных в данной области (например, Lee and Richards (J. Mol. Biol. (1971) 55, 379-400); Connolly (J. Appl. Cryst. (1983) 16, 548-558)). Определение экспонированных на поверхности положений можно проводить на основе информации о трехмерной структуре с использованием программного обеспечения, пригодного для моделирования белка. Программное обеспечение, которое можно использовать для этих целей, предпочтительно включает программное обеспечение SYBYL Biopolymer Module (Tripos Associates). Когда алгоритм требует введения пользователем параметра размера, "размер" образца, который используют в вычислении, устанавливают как радиус, приблизительно равный 1,4 ангстрем или менее. Более того, способы определения экспонированных на поверхности областей и участков с использованием программного обеспечения для персонального компьютера описаны Pacios (Comput. Chem. (1994) 18(4), 377-386; J. Mol. Model. (1995) 1, 46-53).
В другом неограничивающем варианте осуществления настоящего изобретения в качестве рандомизированной библиотеки вариабельной области также особенно пригодным является использование наивной библиотеки, которая сконструирована из генов антител, происходящих из лимфоцитов здоровых индивидуумов, и набор генов которой состоит из наивных последовательностей, которые представляют собой последовательности антител без предпочтений (Gejima et al. (Human Antibodies (2002) 11, 121-129); Cardoso et al. (Scand. J. Immunol. (2000) 51, 337-344)).
FcRn
В отличие от Fcγ-рецептора, принадлежащего семейству иммуноглобулинов, FcRn человека структурно сходен с полипептидами главного комплекса гистосовместимости (MHC) класса I, проявляя 22%-29% идентичность последовательности с молекулами MHC класса I (Ghetie el al., Immunol. Today (1997) 18(12):592-598). FcRn экспрессируется в качестве гетеродимера, состоящего из растворимой β- или легкой цепи (β2-микроглобулин) в комплексе с трансмембранной α- или тяжелой цепью. Подобно MHC, α-цепь FcRn содержит три внеклеточных домена (α1, α2 и α3), и ее короткий цитоплазматический домен заякоривает белок на клеточной поверхности. α1- и α2-домены взаимодействуют с FcRn-связывающим доменом Fc-области антитела (Raghavan et al., Immunity (1994) 1:303-315).
FcRn экспрессируется в материнской плаценте и желточном мешке млекопитающих, и он вовлечен в перенос IgG от матери к плоду. Кроме того, в тонком кишечнике новорожденных грызунов, где FcRn экспрессируется, FcRn вовлечен в перенос материнских IgG через эпителий щеточной каемки из проглоченного молозива или молока. FcRn экспрессируется во множестве других тканей и системах эндотелиальных клеток различных видов. FcRn также экспрессируется у взрослого человека в эндотелии, кровеносных сосудах мышц и синусоидных капиллярах печени. Полагают, что FcRn участвует в поддержании концентрации IgG в плазме путем опосредования рециклирования IgG в сыворотку при связывании с IgG. Как правило, связывание FcRn с молекулами IgG строго зависит от pH. Оптимальное связывание наблюдают при кислом диапазоне pH ниже 7,0.
FcRn человека, предшественником которого является полипептид, имеющий сигнальную последовательность SEQ ID NO: 12 (полипептид с сигнальной последовательностью представлен в SEQ ID NO: 13), образует комплекс с β2-микроглобулином человека in vivo. Растворимый FcRn человека в комплексе с β2-микроглобулином получают с использованием общепринятых способов рекомбинантной экспрессии. FcRn-связывающий домен по настоящему изобретению можно оценивать в отношении его активности связывания с таким растворимым FcRn человека в комплексе с β2-микроглобулином. В рамках настоящего изобретения, если нет иных указаний, FcRn человека относится к форме, способной связываться с FcRn-связывающим доменом по настоящему изобретению. Примеры включают комплекс между FcRn человека и β2-микроглобулином человека.
Активность связывания FcRn-связывающего домена или антигенсвязывающей молекулы, содержащей домен, с FcRn, в частности, FcRn человека
Активность связывания FcRn-связывающего домена, содержащегося в антигенсвязывающей молекуле, предусматриваемой в рамках настоящего изобретения, с FcRn, в частности FcRn человека, можно измерять способами, известными специалистам в данной области, как описано в разделе "Активность связывания" выше. Специалисты в данной области могут соответствующим образом определить условия, отличные от pH. Активность связывания антигенсвязывающего домена или антигенсвязываюещй молекулы, содержащей домен, с FcRn человека можно оценивать, основываясь на константе диссоциации (KD), кажущейся константе диссоциации (KD), константе скорости диссоциации (kd), кажущейся константе скорости диссоциации (kd) и т.п. Их можно измерять способами, известными специалистам в данной области. Например, можно использовать Biacore (GE healthcare), график Скэтчарда или проточный цитометр.
Когда измеряют активность связывания с FcRn человека FcRn-связывающего домена или антигенсвязывающей молекулы, содержащей домен, по настоящему изобретению, условия, отличные от pH, конкретно не ограничены, и их могут соответствующим образом выбирать специалисты в данной области. Измерения можно проводить, например, в условиях 37°C с использованием буфера MES, как описано в WO 2009/125825. Альтернативно, активность связывания с FcRn человека FcRn-связывающего домена или антигенсвязывающей молекулы по настоящему изобретению можно измерять способами, известными специалистам в данной области, и ее можно измерять с использованием, например, Biacore (GE Healthcare) и т.п. Активность FcRn-связывающего домена или антигенсвязывающей молекулы, содержащей домен, по настоящему изобретению в отношении связывания с FcRn человека можно оценивать путем пропускания в качестве анализируемого соединения FcRn человека, FcRn-связывающего домена или антигенсвязывающей молекулы, содержащей домен, по настоящему изобретению, над чипом, на котором иммобилизован FcRn-связывающий домен, антигенсвязывающая молекула, содержащая домен, или FcRn человека.
В рамках настоящего изобретения диапазон кислых значений pH, указываемый в качестве условий для наличия активности связывания между FcRn и антигенсвязывающей молекулой по настоящему изобретению и FcRn-связывающим доменом в молекуле, как правило, относится к pH 4,0-pH 6,5. Предпочтительно он относится к pH 5,5-pH 6,5 и особенно предпочтительно он относится к pH 5,8-pH 6,0, что является близким к pH в ранней эндосоме in vivo. Диапазон нейтральных значений pH, указываемый в качестве условий для наличия активности связывания между FcRn и антигенсвязывающей молекулой по настоящему изобретению или FcRn-связывающим доменом, включенным в такую молекулу, как правило, относится к pH от 6,7 до 10,0. Диапазон нейтральных значений pH предпочтительно представляет собой диапазон, указываемый с помощью любой величиной pH от pH 7,0 до pH 8,0, и предпочтительно он выбран из pH 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9 и 8,0, и особенно предпочтительно pH 7,4, что близко к значению pH плазмы (крови) in vivo. Когда оценка аффинности связывания между FcRn человека и FcRn-связывающим доменом человека или антигенсвязывающей молекулой, содержащей этот домен при pH 7,4, затруднена вследствие низкой аффинности связывания, вместо pH 7,4 можно использовать pH 7,0. В качестве температуры, подлежащей применению в условиях анализа, аффинность связывания между FcRn человека и FcRn-связывающим доменом человека или антигенсвязывающей молекулой, содержащей домен, можно оценивать при любой температуре от 10°C до 50°C. Предпочтительно, температуру от 15°C до 40°C используют для определения аффинности связывания между FcRn человека и FcRn-связывающим доменом или антигенсвязывающей молекулой, содержащей домен. Более предпочтительно, также для определения аффинности связывания между FcRn человека и FcRn-связывающим доменом или антигенсвязывающей молекулой, содержащей домен, в равной степени можно использовать любую температуру от 20°C до 35°C, такую как любая из 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 и 35°C. Неограничивающим примером варианта осуществления настоящего изобретения является температура 25°C.
FcRn-связывающий домен
Антигенсвязывающие молекулы по настоящему изобретению имеют FcRn-связывающий домен, обладающий активностью связывания с FcRn в условиях диапазона кислых значений pH. FcRn-связывающий домен конкретно не ограничен при условии, что антигенсвязывающие молекулы обладают FcRn-связывающей активностью в условиях диапазона кислых значений pH, и он может представлять собой домен, который обладает активностью прямого или непрямого связывания с FcRn. Предпочтительные примеры такого FcRn-связывающего домена включают Fc-область IgG-иммуноглобулина, альбумина, домена 3 альбумина, антитела против FcRn, описанного в Christianson et al. (mAbs (2012) 4(2), 208-216), пептида против FcRn, описанного в WO 2007/098420, каркасной молекулы против FcRn и т.п., которые обладают активностью прямого связывания с FcRn, или молекулы, которые связываются с IgG или альбумином и т.п., которые обладают активностью непрямого связывания с FcRn. Если домен уже обладает активностью связывания FcRn в диапазоне кислых значений pH, его предпочтительно можно использовать как есть. Если домен не обладает или обладает слабой активностью связывания FcRn в диапазоне кислых значений pH, аминокислоты, составляющие FcRn-связывающий домен в антигенсвязывающей молекуле, можно изменять так, чтобы сообщать активность связывания FcRn. Альтернативно аминокислоты можно изменять в домене, уже обладающем активностью связывания FcRn в диапазоне кислых значений pH, для увеличения активности связывания FcRn в диапазоне кислых значений pH. Для изменения аминокислот FcRn-связывающего домена, представляющее интерес изменение можно идентифицировать путем сравнения активности связывания FcRn в диапазоне кислых значений pH до и после изменения аминокислот.
Fc-область
Fc-область содержит аминокислотную последовательность, происходящую из константной области тяжелой цепи антитела. Fc-область представляет собой часть константной области тяжелой цепи антитела, начинающуюся с N-конца шарнирной области, которая соответствует участку расщепления папаином по аминокислоте около положения 216 в соответствии с системой нумерации EU, и она содержит шарнирную область, домены CH2 и CH3. Хотя Fc-область можно получать из IgG1 человека, она не ограничивается конкретным подклассом IgG. Примеры такого неограничивающего варианта осуществления Fc-области включают Fc-области IgG1 человека (SEQ ID NO: 14), IgG2 (SEQ ID NO: 15), IgG3 (SEQ ID NO: 16) или IgG4 (SEQ ID NO: 17).
FcRn-связывающий домен, обладающий активностью связывания с FcRn в условиях диапазона кислых значений pH
Как описано выше, в неограничивающем варианте осуществления настоящего изобретения Fc-область IgG-иммуноглобулина человека используют в качестве FcRn-связывающего домена, обладающего активностью связывания с FcRn в условиях диапазона кислых значений pH. Fc-область, первоначально обладающую активностью связывания FcRn в условиях диапазона кислых значений pH, можно использовать как есть для этого домена, и примеры таких Fc-областей включают Fc-области IgG человека (IgG1, IgG2, IgG3 или IgG4 и их варианты). Когда Fc-область обладает слабой или не обладает активностью связывания FcRn в условиях диапазона кислых значений pH, Fc-области, обладающие желаемой активностью связывания FcRn, можно получать путем изменения аминокислот Fc-области. Альтернативно, Fc-области, обладающие желаемой или усиленной активностью связывания FcRn в условиях диапазона кислых значений pH, можно пригодным образом получать путем изменения аминокислот в Fc-области. Аминокислотные изменения Fc-области, которые приводят к такой желаемой активности связывания, можно определять путем сравнения активности связывания FcRn в условиях диапазона кислых значений pH до и после изменения аминокислот. Например, такие аминокислотные изменения можно определять способами, описанными в упомянутом выше разделе "Активность связывания FcRn-связывающего домена или антигенсвязывающей молекулы, содержащей домен, с FcRn, в частности, FcRn человека".
Изменения Fc-области, которые усиливают активность связывания FcRn в условиях диапазона кислых значений pH, представлены ниже в качестве примеров неограничивающего варианта осуществления таких изменений. Предпочтительные Fc-области (исходные Fc-области) иммуноглобулина IgG-типа для изменения включают, например, Fc-области IgG человека (IgG1, IgG2, IgG3 и IgG4 и их варианты). Происхождение исходных Fc-областей не ограничено, и их можно получать из организмов человека или любых организмов, не являющихся человеком. Такие организмы предпочтительно включают мышей, крыс, морских свинок, хомячков, песчанок, кошек, кроликов, собак, коз, овец, животных семейства бычьих, лошадей, верблюдов и организмы, выбранные из не являющихся человеком приматов. В другом варианте осуществления исходные Fc-области также можно получать из яванских макаков, мартышек, макаков-резус, шимпанзе или людей. Исходные Fc-области можно получать предпочтительно из IgG1 человека; однако они не ограничиваются каким-либо конкретным подклассом IgG. Это означает, что Fc-область, соответствующую IgG1 человека (SEQ ID NO: 14), IgG2 (SEQ ID NO: 15), IgG3 (SEQ ID NO: 16) или IgG4 (SEQ ID NO: 17), можно использовать соответствующим образом в качестве исходной Fc-области, и в рамках настоящего изобретения это также означает, что Fc-область произвольного класса или подкласса IgG, происходящую из любых организмов, описанных выше, предпочтительно можно использовать в качестве исходной Fc-области. Примеры встречающихся в природе вариантов IgG или модифицированных форм описаны в опубликованных документах (Curr. Opin. Biotechnol. (2009) 20(6):685-91; Curr. Opin. Immunol. (2008) 20(4), 460-470; Protein Eng. Des. Sel. (2010) 23(4):195-202; WO 2009/086320; WO 2008/092117; WO 2007/041635; и WO 2006/105338); однако они не ограничиваются примерами.
Примеры изменений включают изменения с одной или несколькими мутациями, например, мутациями путем замены различными аминокислотными остатками аминокислот исходных Fc-областей, путем встраивания одного или нескольких аминокислотных остатков в исходные Fc-области, или путем делеции одной или нескольких аминокислот из исходной Fc-области. Предпочтительно, аминокислотные последовательности измененных Fc-областей содержат по меньшей мере часть аминокислотной последовательности ненативной Fc-области. Такие варианты обязательно обладают идентичностью или сходством последовательности менее 100% с их исходной Fc-областью. В предпочтительном варианте осуществления варианты обладают идентичностью или сходством аминокислотной последовательности от приблизительно 75% до менее чем 100%, более предпочтительно от приблизительно 80% до менее чем 100%, еще более предпочтительно от приблизительно 85% до менее чем 100%, еще более предпочтительно от приблизительно 90% до менее чем 100%, и наиболее предпочтительно от приблизительно 95% до менее чем 100% с аминокислотной последовательностью их исходной Fc-области. В неограничивающем варианте осуществления настоящего изобретения по меньшей мере одна аминокислота отличается между модифицированной Fc-областью по настоящему изобретению и ее исходной Fc-областью. Аминокислотное отличие между модифицированной Fc-областью по настоящему изобретению и ее исходной Fc-областью также может быть предпочтительно определено на основе аминокислотных отличий в описанных выше конкретных положениях аминокислот в соответствии с нумерацией EU.
При условии, что Fc-область обладает активностью связывания FcRn в условиях диапазона кислых значений pH или может увеличивать активность связывания FcRn человека в условиях диапазона кислых значений pH, аминокислоты в любом положении можно модифицировать в другие аминокислоты. Когда антигенсвязывающая молекула по настоящему изобретению содержит Fc-область IgG1 человека в качестве FcRn-связывающего домена, предпочтительно, чтобы полученная Fc-область содержала модификацию, которая приводит к эффекту усиления связывания FcRn в условиях диапазона кислых значений pH по сравнению с активностью связывания исходной Fc-области IgG1 человека. Аминокислоты, которые позволяют такую модификацию, включают, например, аминокислоту(ы) в положении(ях) 252, 254, 256, 309, 311, 315, 433 и/или 434 в соответствии с нумерацией EU, и их комбинации с аминокислотой(ами) в положении(ях) 253, 310, 435 и/или 426, как описано в WO 1997/034631. Подходящие примеры включают аминокислоту(ы) в положении(ях) 238, 252, 253, 254, 255, 256, 265, 272, 286, 288, 303, 305, 307, 309, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 386, 388, 400, 413, 415, 424, 433, 434, 435, 436, 439 и/или 447, как указано с помощью нумерации EU, как описано в WO 2000/042072. Аналогично, подходящие примеры аминокислот, которые позволяют такую модификацию, включают, аминокислоту(ы) в положении(ях) 251, 252, 254, 255, 256, 308, 309, 311, 312, 385, 386, 387, 389, 428, 433, 434 и/или 436 в соответствии с нумерацией EU, как описано в WO 2002/060919. Более того, аминокислоты, которые позволяют такую модификацию, включают, например, аминокислоту(ы) в положении(ях) 250, 314 и 428 в соответствии с нумерацией EU, как описано в WO 2004/092219. Кроме того, подходящие примеры аминокислоты, которые позволяют такую модификацию, включают аминокислоту(ы) в положении(ях) 238, 244, 245, 249, 252, 256, 257, 258, 260, 262, 270, 272, 279, 283, 285, 286, 288, 293, 307, 311, 312, 316, 317, 318, 332, 339, 341, 343, 375, 376, 377, 378, 380, 382, 423, 427, 430, 431, 434, 436, 438, 440 и/или 442, как описано в WO 2006/020114. Более того, подходящие примеры аминокислот, которые позволяют такую модификацию, включают аминокислоту(ы) в положении(ях) 251, 252, 307, 308, 378, 428, 430, 434 и/или 436 в соответствии с нумерацией EU, как описано в WO 2010/045193. Модификация этих аминокислот усиливает связывание с FcRn Fc-области иммуноглобулина IgG-типа в условиях диапазона кислых значений pH.
Когда Fc-область IgGй человека содержится в качестве FcRn-связывающего домена, неограничивающий вариант осуществления модификации, которая приводит к эффекту усиления связывания FcRn в условиях диапазона кислых значений pH по сравнению с активностью связывания исходной Fc-области IgG1 человека, включает по меньшей мере одну или несколько модификаций аминокислот, выбранных из группы, состоящей из:
Arg или Leu вместо аминокислоты в положении 251;
Phe, Ser, Thr или Tyr вместо аминокислоты в положении 252;
Ser или Thr вместо аминокислоты в положении 254;
Arg, Gly, Ile или Leu вместо аминокислоты в положении 255;
Ala, Arg, Asn, Asp, Gln, Glu или Thr вместо аминокислоты в положении 256;
Ile или Thr вместо аминокислоты в положении 308;
Pro вместо аминокислоты в положении 309;
Glu, Leu или Ser вместо аминокислоты в положении 311;
Ala или Asp вместо аминокислоты в положении 312;
Ala или Leu вместо аминокислоты в положении 314;
Ala, Arg, Asp, Gly, His, Lys, Ser или Thr вместо аминокислоты в положении 385;
Arg, Asp, Ile, Lys, Met, Pro, Ser или Thr вместо аминокислоты в положении 386;
Ala, Arg, His, Pro, Ser или Thr вместо аминокислоты в положении 387;
Asn, Pro или Ser вместо аминокислоты в положении 389;
Leu, Met, Phe, Ser или Thr вместо аминокислоты в положении 428;
Arg, Gln, His, Ile, Lys, Pro или Ser вместо аминокислоты в положении 433;
His, Phe или Tyr вместо аминокислоты в положении 434; и
Arg, Asn, His, Lys, Met или Thr вместо аминокислоты в положении 436, как указано с помощью нумерации EU. Между тем, количество аминокислот, подлежащих модификации, конкретно не ограничено; и аминокислоту можно модифицировать только в одном участке, или аминокислоты можно модифицировать в двух или более участках.
Когда в качестве FcRn-связывающего домена содержится Fc-область IgG1 человека, неограничивающий вариант осуществления модификации, которая приводит к эффекту усиления связывания FcRn в условиях диапазона кислых значений pH по сравнению с активностью связывания исходной Fc-области IgG1 человека, может представлять собой модификации, включающие Ile вместо аминокислоты в положении 308, Pro вместо аминокислоты в положении 309, и/или Glu вместо аминокислоты в положении 311 в соответствии с нумерацией EU. Другой неограничивающий вариант осуществления этой модификации может включать Thr вместо аминокислоты в положении 308, Pro вместо аминокислоты в положении 309, Leu вместо аминокислоты в положении 311, Ala вместо аминокислоты в положении 312, и/или Ala вместо аминокислоты в положении 314. Более того, другой неограничивающий вариант осуществления этой модификации может включать Ile или Thr вместо аминокислоты в положении 308, Pro вместо аминокислоты в положении 309, Glu, Leu или Ser вместо аминокислоты в положении 311, Ala вместо аминокислоты в положении 312, и/или Ala или Leu вместо аминокислоты в положении 314. Другой неограничивающий вариант осуществления этой модификации может включать Thr вместо аминокислоты в положении 308, Pro вместо аминокислоты в положении 309, Ser вместо аминокислоты в положении 311, Asp вместо аминокислоты в положении 312, и/или Leu вместо аминокислоты в положении 314.
Когда в качестве FcRn-связывающего домена содержится Fc-область IgG1 человека, неограничивающий вариант осуществления модификации, которая приводит к эффекту усиления связывания FcRn в условиях диапазона кислых значений pH по сравнению с активностью связывания исходной Fc-области IgG1 человека, может представлять собой модификации, включающие Leu вместо аминокислоты в положении 251, Tyr вместо аминокислоты в положении 252, Ser или Thr вместо аминокислоты в положении 254, Arg вместо аминокислоты в положении 255, и/или Glu вместо аминокислоты в положении 256 в соответствии с нумерацией EU.
Когда в качестве FcRn-связывающего домена содержится Fc-область IgG1 человека, неограничивающий вариант осуществления модификации, которая приводит к эффекту усиления связывания FcRn в условиях диапазона кислых значений pH по сравнению с активностью связывания исходной Fc-области IgG1 человека, может представлять собой модификации, включающие Leu, Met, Phe, Ser или Thr вместо аминокислоты в положении 428, Arg, Gln, His, Ile, Lys, Pro или Ser вместо аминокислоты в положении 433, His, Phe или Tyr вместо аминокислоты в положении 434, и/или Arg, Asn, His, Lys, Met или Thr вместо аминокислоты в положении 436 в соответствии с нумерацией EU. Другой неограничивающий вариант осуществления этой модификации может включать His или Met вместо аминокислоты в положении 428 и/или His или Met вместо аминокислоты в положении 434.
Когда в качестве FcRn-связывающего домена содержится Fc-область IgG1 человека, неограничивающий вариант осуществления модификации, которая приводит к эффекту усиления связывания FcRn в условиях диапазона кислых значений pH по сравнению с активностью связывания исходной Fc-области IgG1 человека, может представлять собой модификации, включающие Arg вместо аминокислоты в положении 385, Thr вместо аминокислоты в положении 386, Arg вместо аминокислоты в положении 387 и/или Pro вместо аминокислоты в положении 389 в соответствии с нумерацией EU. Другой неограничивающий вариант осуществления этой модификации может включать Asp вместо аминокислоты в положении 385, Pro вместо аминокислоты в положении 386 и/или Ser вместо аминокислоты в положении 389.
Более того, когда в качестве FcRn-связывающего домена содержится Fc-область IgG1 человека, неограничивающий вариант осуществления модификации, которая приводит к эффекту усиления связывания FcRn в условиях диапазона кислых значений pH по сравнению с активностью связывания исходной Fc-области IgG1 человека, включает по меньшей мере одну или несколько аминокислотных модификаций, выбранных из группы, состоящей из:
Gln или Glu вместо аминокислоты в положении 250; и
Leu или Phe вместо аминокислоты в положении 428 в соответствии с нумерацией EU. Количество аминокислот, подлежащих модификации, конкретно не ограничено; и аминокислоту можно модифицировать только в одном участке, или аминокислоты можно модифицировать в двух участках.
Когда в качестве FcRn-связывающего домена содержится Fc-область IgG1 человека, неограничивающий вариант осуществления модификации, которая приводит к эффекту усиления связывания FcRn в условиях диапазона кислых значений pH по сравнению с активностью связывания исходной Fc-области IgG1 человека, может представлять собой модификации, включающие Gln вместо аминокислоты в положении 250 и/или Leu или Phe вместо аминокислоты в положении 428 в соответствии с нумерацией EU. Другой неограничивающий вариант осуществления этой модификации может включать Glu вместо аминокислоты в положении 250 и/или Leu или Phe вместо аминокислоты в положении 428.
Когда в качестве FcRn-связывающего домена содержится Fc-область IgG1 человека, неограничивающий вариант осуществления модификации, которая приводит к эффекту усиления связывания FcRn в условиях диапазона кислых значений pH по сравнению с активностью связывания исходной Fc-области IgG1 человека, включает по меньшей мере две или более аминокислотных модификаций, выбранных из группы, состоящей из:
Asp или Glu вместо аминокислоты в положении 251;
Tyr вместо аминокислоты в положении 252;
Gln вместо аминокислоты в положении 307;
Pro вместо аминокислоты в положении 308;
Val вместо аминокислоты в положении 378;
Ala вместо аминокислоты в положении 380;
Leu вместо аминокислоты в положении 428;
Ala или Lys вместо аминокислоты в положении 430;
Ala, His, Ser или Tyr вместо аминокислоты в положении 434; и
Ile вместо аминокислоты в положении 436, как указано с помощью нумерации EU. Количество аминокислот, подлежащих модификации, конкретно не ограничено; и аминокислоту можно модифицировать только в двух участках, или аминокислоту можно модифицировать в трех или более участках.
Когда в качестве FcRn-связывающего домена содержится Fc-область IgG1 человека, неограничивающий вариант осуществления модификации, которая приводит к эффекту усиления связывания FcRn в условиях диапазона кислых значений pH по сравнению с активностью связывания исходной Fc-области IgG1 человека, может представлять собой модификации, включающие Gln вместо аминокислоты в положении 307 и Ala или Ser вместо аминокислоты в положении 434 в соответствии с нумерацией EU. Другой неограничивающий вариант осуществления этой модификации может включать Pro вместо аминокислоты в положении 308 и Ala вместо аминокислоты в положении 434. Более того, другой неограничивающий вариант осуществления этой модификации может включать Tyr вместо аминокислоты в положении 252 и Ala вместо аминокислоты в положении 434. Другой неограничивающий вариант осуществления этой модификации может включать Val вместо аминокислоты в положении 378 и Ala вместо аминокислоты в положении 434. Другой неограничивающий вариант осуществления этой модификации может включать Leu вместо аминокислоты в положении 428 и Ala вместо аминокислоты в положении 434. Другой неограничивающий вариант осуществления этой модификации может включать Ala вместо аминокислоты в положении 434 и Ile вместо аминокислоты в положении 436. Более того, другой неограничивающий вариант осуществления этой модификации может включать Pro вместо аминокислоты в положении 308 и Tyr вместо аминокислоты в положении 434. Кроме того, другой неограничивающий вариант осуществления этой модификации может включать Gln вместо аминокислоты в положении 307 и Ile вместо аминокислоты в положении 436.
Когда в качестве FcRn-связывающего домена содержится Fc-область IgG1 человека, неограничивающий вариант осуществления модификации, которая приводит к эффекту усиления связывания FcRn в условиях диапазона кислых значений pH по сравнению с активностью связывания исходной Fc-области IgG1 человека, может представлять собой модификации, включающие любой из Gln вместо аминокислоты в положении 307, Ala вместо аминокислоты в положении 380 и Ser вместо аминокислоты в положении 434 в соответствии с нумерацией EU. Другой неограничивающий вариант осуществления этой модификации может включать Gln вместо аминокислоты в положении 307, Ala вместо аминокислоты в положении 380 и Ala вместо аминокислоты в положении 434. Более того, другой неограничивающий вариант осуществления этой модификации может включать Tyr вместо аминокислоты в положении 252, Pro вместо аминокислоты в положении 308 и Tyr вместо аминокислоты в положении 434. Другой неограничивающий вариант осуществления этой модификации может включать Asp вместо аминокислоты в положении 251, Gln вместо аминокислоты в положении 307 и His вместо аминокислоты в положении 434.
Когда в качестве FcRn-связывающего домена содержится Fc-область IgG1 человека, неограничивающий вариант осуществления модификации, которая приводит к эффекту усиления связывания FcRn в условиях диапазона кислых значений pH по сравнению с активностью связывания исходной Fc-области IgG1 человека, включает модификацию по меньшей мере двух или более аминокислот, выбранных из группы, состоящей из:
Leu вместо аминокислоты в положении 238;
Leu вместо аминокислоты в положении 244;
Arg вместо аминокислоты в положении 245;
Pro вместо аминокислоты в положении 249;
Tyr вместо аминокислоты в положении 252;
Pro вместо аминокислоты в положении 256;
Ala, Ile, Met, Asn, Ser или Val вместо аминокислоты в положении 257;
Asp вместо аминокислоты в положении 258;
Ser вместо аминокислоты в положении 260;
Leu вместо аминокислоты в положении 262;
Lys вместо аминокислоты в положении 270;
Leu или Arg вместо аминокислоты в положении 272;
Ala, Asp, Gly, His, Met, Asn, Gln, Arg, Ser, Thr, Trp или Tyr вместо аминокислоты в положении 279;
Ala, Asp, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr, Trp или Tyr вместо аминокислоты в положении 283;
Asn вместо аминокислоты в положении 285;
Phe вместо аминокислоты в положении 286;
Asn или Pro вместо аминокислоты в положении 288;
Val вместо аминокислоты в положении 293;
Ala, Glu или Met вместо аминокислоты в положении 307;
Ala, Ile, Lys, Leu, Met, Val или Trp вместо аминокислоты в положении 311;
Pro вместо аминокислоты в положении 312;
Lys вместо аминокислоты в положении 316;
Pro вместо аминокислоты в положении 317;
Asn или Thr вместо аминокислоты в положении 318;
Phe, His, Lys, Leu, Met, Arg, Ser или Trp вместо аминокислоты в положении 332;
Asn, Thr или Trp вместо аминокислоты в положении 339;
Pro вместо аминокислоты в положении 341;
Glu, His, Lys, Gln, Arg, Thr или Tyr вместо аминокислоты в положении 343;
Arg вместо аминокислоты в положении 375;
Gly, Ile, Met, Pro, Thr или Val вместо аминокислоты в положении 376;
Lys вместо аминокислоты в положении 377;
Asp или Asn вместо аминокислоты в положении 378;
Asn, Ser или Thr вместо аминокислоты в положении 380;
Phe, His, He, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr, Val, Trp или Tyr вместо аминокислоты в положении 382;
Asn вместо аминокислоты в положении 423;
Asn вместо аминокислоты в положении 427;
Ala, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr, Val или Tyr вместо аминокислоты в положении 430;
His или Asn вместо аминокислоты в положении 431;
Phe, Gly, His, Trp или Tyr вместо аминокислоты в положении 434;
Ile, Leu или Thr вместо аминокислоты в положении 436;
Lys, Leu, Thr или Trp вместо аминокислоты в положении 438;
Lys вместо аминокислоты в положении 440; и
Lys вместо аминокислоты в положении 442 в соответствии с нумерацией EU. Количество аминокислот, подлежащих модификации, конкретно не ограничено, и может быть модифицирована аминокислота только в двух участках, и может быть модифицирована аминокислота в трех или более участках.
Когда в качестве FcRn-связывающего домена содержится Fc-область IgG1 человека, неограничивающий вариант осуществления модификации, которая приводит к эффекту усиления связывания FcRn в условиях диапазона кислых значений pH по сравнению с активностью связывания исходной Fc-области IgG1 человека, может представлять собой модификации, включающие Ile вместо аминокислоты в положении 257 и Ile вместо аминокислоты в положении 311 в соответствии с нумерацией EU. Другой неограничивающий вариант осуществления этой модификации может включать Ile вместо аминокислоты в положении 257 и His вместо аминокислоты в положении 434. Другой неограничивающий вариант осуществления этой модификации может включать Val вместо аминокислоты в положении 376 и His вместо аминокислоты в положении 434.
Fcγ-рецептор
Fcγ-рецептор (FcγR) относится к рецептору, способному связываться с Fc-областью моноклональных антител IgG1, IgG2, IgG3 или IgG4, и включает всех представителей, принадлежащих семейству белков, по существу кодируемых геном Fcγ-рецептора. У человека это семейство включает FcγRI (CD64), включая изоформы FcγRIa, FcγRIb и FcγRIc; FcγRII (CD32), включая изоформы FcγRIIa (включая аллотип H131 и R131), FcγRIIb (включая FcγRIIb-1 и FcγRIIb-2) и FcγRIIc; и FcγRIII (CD16), включая изоформу FcγRIIIa (включая аллотип V158 и F158) и FcγRIIIb (включая аллотип FcγRIIIb-NA1 и FcγRIIIb-NA2); а также неидентифицированные FcγR человека, изоформы FcγR и их аллотипы. Однако Fcγ-рецептор не ограничивается этими примерами. Не ограничиваясь этим, FcγR включает FcγR человека, мыши, крысы, кролика и обезьяны. FcγR может происходить из любых организмов. FcγR мыши включает, но не ограничивается ими, FcγRI (CD64), FcγRII (CD32), FcγRIII (CD16) и FcγRIII-2 (FcγRIV, CD16-2), а также неидентифицированные FcγR мыши, изоформы FcγR и их аллотипы. Такие предпочтительные Fcγ-рецепторы включают, например, FcγRI (CD64), FcγRIIa (CD32), FcγRIIb (CD32), FcγRIIIa (CD16) и/или FcγRIIIb (CD16) человека. Полинуклеотидная последовательность и аминокислотная последовательность FcγRI представлены в SEQ ID NO: 18 (NM_000566.3) и 19 (NP_000557.1), соответственно; полинуклеотидная последовательность и аминокислотная последовательность FcγRIIa представлены в SEQ ID NO: 20 (BC020823.1) и 21 (AAH20823.1), соответственно; полинуклеотидная последовательность и аминокислотная последовательность FcγIIb представлены в SEQ ID NO: 22 (BC146678.1) и 23 (AAI46679.1), соответственно; полинуклеотидная последовательность и аминокислотная последовательность FcγRIIIa представлены в SEQ ID NO: 24 (BC033678.1) и 25 (AAH33678.1), соответственно; и полинуклеотидная последовательность и аминокислотная последовательность FcγRIIIb представлены в SEQ ID NO: 26 (BC128562.1) и 27 (AAI28563.1), соответственно (номер доступа RefSeq представлен в каждом случае в скобках). То, обладает ли Fcγ-рецептор активностью связывания с Fc-областью моноклонального антитела IgG1, IgG2, IgG3 или IgG4, можно оценивать с помощью скрининга ALPHA (анализ усиленной за счет эффекта близости люминесценции), способа BIACORE на основе поверхностного плазмонного резонанса (SPR) и других (Proc. Natl. Acad. Sci. USA (2006) 103(11), 4005-4010), в дополнение к описанным выше форматам FACS и ELISA.
В FcγRI (CD64), включая FcγRIa, FcγRIb и FcγRIc, и FcγRIII (CD16), включающий изоформы FcγRIIIa (включая аллотипы V158 и F158) и FcγRIIIb (включая аллотипы FcγRIIIb-NA1 и FcγRIIIb-NA2), α-цепь, которая связывается с Fc-частью IgG, ассоциирована с общей γ-цепью, имеющей ITAM, ответственный за передачу внутриклеточного активирующего сигнала. Между тем, цитоплазматический домен FcγRII (CD32), включая изоформы FcγRIIa (включая аллотипы H131 и R131) и FcγRIIc, содержит ITAM. Эти рецепторы экспрессируются на многих клетках, таких как макрофаги, тучные клетки и антигенпредставляющие клетки. Активирующий сигнал, передаваемый при связывании этих рецепторов с Fc-частью IgG, приводит к усилению фагоцитарной активности макрофагов, продукции воспалительных цитокинов, дегрануляции тучных клеток и усилению функции антигенпредставляющих клеток. Fcγ-рецепторы, обладающие способностью передавать активирующий сигнал, как описано выше, также называют активирующими Fcγ-рецепторами.
Между тем, внутрицитоплазматический домен FcγRIIb (включая FcγRIIb-1 и FcγRIIb-2) содержит ITIM, ответственный за передачу ингибиторных сигналов. Связывание между FcγRIIb и B-клеточным рецептором (BCR) на B-клетках подавляет активирующий сигнал от BCR, что приводит к подавлению продукции антитела через BCR. Связывание FcγRIII и FcγRIIb на макрофагах подавляет фагоцитарную активность и продукцию воспалительных цитокинов. Fcγ-рецепторы, обладающие способностью передавать ингибирующий сигнал, как описано выше, также называют ингибиторным Fcγ-рецептором.
Активность связывания с Fcγ-рецептором
Активность связывания FcγR-связывающего домена, который включен в антигенсвязывающую молекулу по настоящему изобретению, с любым из Fcγ-рецепторов человека, FcγRI, FcγRIIa, FcγRIIb, FcγRIIIa и/или FcγRIIIb, может быть подтверждена с помощью описанного выше формата FACS и ELISA, а также скрининга ALPHA (анализ усиленной за счет эффекта близости люминесценции), способа BIACORE, который основан на явлении поверхностного плазмонного резонанса (SPR), и т.п. (Proc. Natl. Acad. Sci. USA (2006) 103(11), 4005-4010).
Скрининг ALPHA проводят с помощью технологии ALPHA на основе принципа, описанного ниже, где используется два типа гранул: донорные и акцепторные гранулы. Люминесцентный сигнал выявляется, только когда молекулы, связанные с донорными гранулами, биологически взаимодействуют с молекулами, связанными с акцепторными гранулами, и эти два типа гранул находятся вблизи друг друга. Возбуждаемый лазерным пучком фотосенсибилизатор в донорных гранулах преобразует кислород вокруг гранулы в возбужденный синглетный кислород. Когда синглетный кислород распространяется среди донорных гранул и достигает акцепторных гранул, расположенных близко, в акцепторных гранулах индуцируется хемилюминесцентная реакция. Это в конечном итоге приводит к испусканию света. Когда молекулы, связанные с донорными гранулами, не взаимодействуют с молекулами, связанными с акцепторными гранулами, синглетный кислород, продуцируемый донорными гранулами, не достигает акцепторных гранул и хемилюминесцентная реакция не происходит.
Например, меченную биотином антигенсвязывающую молекулу, содержащую FcγR-связывающий домен, иммобилизуют на донорных гранулах, и Fcγ-рецептор, меченный глутатион-S-трансферазой (GST), иммобилизуют на акцепторных гранулах. В отсутствие антигенсвязывающей молекулы, содержащей конкурирующий вариант FcγR-связывающего домена, Fcγ-рецептор взаимодействует с антигенсвязывающей молекулой, содержащей FcγR-связывающий домен дикого типа, что приводит к индукции сигнала в области 520-620 нм. Антигенсвязывающая молекула, имеющая немеченый вариант FcγR-связывающего домена, конкурирует с антигенсвязывающей молекулой, содержащей нативный FcγR-связывающий домен, для взаимодействия с Fcγ-рецептором. Относительную аффинность связывания можно определять путем количественного определения снижения флуоресценции в результате конкуренции. Способы биотинилирования антигенсвязывающих молекул, таких как антитела, с использованием сульфо-NHS-биотина и т.п., известны. Соответствующие способы добавления GST-метки к Fcγ-рецептору включают способы, которые вовлекают слияние полипептидов, кодирующих Fcγ и GST в рамке считывания, экспрессию слитого гена с использованием клеток, в которые введен вектор, с которым ген функционально связан, а затем очистку с использованием колонки с глутатионом. Индуцированный сигнал предпочтительно можно анализировать, например, путем аппроксимации его к односторонней модели конкуренции на основе нелинейного регрессионного анализа с использованием программного обеспечения, такого как GRAPHPAD PRISM (GraphPad, San Diego).
Одно из веществ при наблюдении их взаимодействия иммобилизуют в качестве лиганда на тонкую золотую пленку на сенсорном чипе. Когда свет падает на заднюю поверхность сенсорного чипа, так чтобы общее отражение происходило на поверхности контакта между тонкой золотой пленкой и стеклом, интенсивность отраженного света частично снижается в определенной области (сигнал SPR). Другое из веществ при выявлении взаимодействия инжектируют в качестве анализируемого соединения на поверхность сенсорного чипа. Когда анализируемое соединение связывается с лигандом, масса иммобилизованной молекулы лиганда возрастает. Это изменяет индекс рефракции растворителя на поверхности сенсорного чипа. Изменение индекса рефракции вызывает сдвиг положения сигнала SPR (с другой стороны, диссоциация вызывает сдвиг сигнала обратно в исходное положение). В системе Biacore величину сдвига, упомянутую выше (т.е. изменение массы на поверхности сенсорного чипа), наносят на график по вертикальной оси, и, таким образом, изменение массы с течением времени показывают в качестве данных измерения (сенсограмма). Параметры кинетики (константа скорости ассоциации (ka) и константа скорости диссоциации (kd)) определяют из кривых сенсограммы, и аффинность (KD) определяют из соотношения этих двух констант. В способе BIACORE предпочтительно используют анализ ингибирования. Примеры такого анализа ингибирования описаны в Proc. Natl. Acad. Sci USA (2006) 103(11):4005-4010. Активность связывания FcγR-связывающего домена, включенного в антигенсвязывающую молекулу по настоящему изобретению, с любым из Fcγ-рецепторов человека: FcγRI, FcγRIIa, FcγRIIb, FcγRIIIa и/или FcγRIIIb, можно определять, исходя из величины связывания и величины KD для каждого из Fcγ-рецепторов человека, вычисленных с использованием системы Biacore в соответствии с примерами, описанными выше. В этом случае величина связывания различных FcγR с полипептидами также отражается величинами, полученными путем определения разности величин RU на сенсограммах, которые изменились до и после взаимодействия различных FcγR в качестве анализируемого соединения с каждым полипептидом, и деления их на разность величин RU на сенсограммах, которые изменились до и после иммобилизации полипептидов на сенсорных чипах.
В качестве условий pH для измерения активности связывания Fcγ-рецептора FcγR-связывающего домена, включенного в антигенсвязывающую молекулу по настоящему изобретению или антигенсвязывающую молекулу, содержащую домен, можно пригодным образом использовать условия диапазона кислых значений pH или условия диапазона нейтральных значений pH. Диапазон нейтральных значений pH в качестве условий для измерения активности связывания с Fcγ-рецептором FcγR-связывающего домена по настоящему изобретению или антигенсвязывающей молекулы, содержащей домен, как правило, относится к диапазону от pH 6,7 до pH 10,0. Предпочтительно, он представляет собой диапазон, указываемый произвольными величинами pH от pH 7,0 до pH8,0; и предпочтительно он выбран из pH 7,0, pH 7,1, pH 7,2, pH 7,3, pH 7,4, pH 7,5, pH 7,6, pH 7,7, pH 7,8, pH 7,9 и pH 8,0; и особенно предпочтительно он представляет собой значение pH 7,4, которое является близким к pH плазмы (крови) in vivo. В рамках настоящего изобретения диапазон кислых значений pH в качестве условий наличия активности связывания связывающего Fcγ-рецептор домена, содержащегося в антигенсвязывающей молекуле по настоящему изобретению, и Fcγ-рецептора, как правило, указывают как с pH 4,0 по pH 6,5. Предпочтительно, его указывают как с pH 5,5 по pH 6,5 и особенно предпочтительно его указывают как с pH 5,8 по pH 6,0, что является близким к значению pH в ранней эндосоме in vivo. Что касается температуры, используемой в качестве условий измерения, аффинность связывания между связывающим Fcγ-рецептор доменом и Fcγ-рецептором человека можно оценивать при любой температуре от 10°C до 50°C. Предпочтительно, для определения аффинности связывания между связывающим Fcγ-рецептор доменом или антигенсвязывающей молекулы, содержащей домен, и Fcγ-рецептором используют температуру от 15°C до 40°C. Более предпочтительно, для определения аффинности связывания между связывающим Fcγ-рецептор доменом и Fcγ-рецептором можно сходным образом использовать любую температуру от 20°C до 35°C, такую как любая из 20°C, 21°C, 22°C, 23°C, 24°C, 25°C, 26°C, 27°C, 28°C, 29°C, 30°C, 31°C, 32°C, 33°C, 34°C и 35°C. Температура 25°C является неограничивающим примером в одном варианте осуществления настоящего изобретения.
FcγR-связывающий домен
Антигенсвязывающая молекула по настоящему изобретению содержит антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов, FcRn-связывающий домен, обладающий активностью связывания FcRn в условиях диапазона кислых значений pH, и связывающий Fcγ-рецептор домен, обладающий селективной активностью связывания с Fcγ-рецептором (далее также обозначаемый как селективный FcγR-связывающий домен). Предпочтительные примеры FcγR-связывающего домена включают Fc-области иммуноглобулинов IgG-типа, FcγR-связывающие домены иммуноглобулинов IgG-типа, антитела против FcγR и каркасные молекулы против FcγR. В качестве домена фактически можно пригодным образом использовать домен, первоначально обладающий активностью связывания FcγR. Когда домен обладает слабой или не обладает активностью связывания FcγR, активность связывания FcγR можно сообщать путем изменения аминокислот, образующих FcγR-связывающий домен в антигенсвязывающей молекуле. Альтернативно, активность связывания FcγR можно увеличивать путем изменения аминокислот в домене, первоначально обладающих активностью связывания FcγR. Изменения аминокислоты FcγR-связывающего домена, которые приводят к такой желаемой активности связывания, можно выявлять путем сравнения активности связывания FcγR до и после изменения аминокислоты. Неограничивающим вариантом осуществления таких FcγR-связывающих доменов является, например, FcγR-связывающий домен, включенный в Fc-область IgG1 человека (SEQ ID NO: 14), IgG2 человека (SEQ ID NO: 15), IgG3 человека (SEQ ID NO: 16) или IgG4 человека (SEQ ID NO: 17). Например, когда Fc-область IgG-антитела используют в качестве FcRn-связывающего домена, обладающего активностью связывания FcRn в условиях диапазона кислых значений pH, в качестве FcγR-связывающего домена можно использовать FcγR-связывающий домен, включенный в Fc-область.
FcγR-связывающий домен, обладающий активностью селективного связывания с Fcγ-рецептором
То, обладает ли FcγR-связывающий домен по настоящему изобретению активностью селективного связывания, может быть подтверждено посредством сравнения активности связывания с соответствующими Fcγ-рецепторами, определенной способом, описанным в представленном выше разделе об активности связывания Fcγ-рецепторов. FcγR-связывающий домен с более высокой активностью связывания с ингибиторными Fcγ-рецепторами, чем с активирующими Fcγ-рецепторами, можно использовать в качестве селективного FcγR-связывающего домена, включенного в антигенсвязывающую молекулу, предусматриваемую в рамках настоящего изобретения. В одном неограничивающем варианте FcγR-связывающий домен с более высокой активностью связывания с FcγRIIb (включая FcγRIIb-1 и FcγRIIb-2), чем с активирующим Fcγ-рецептором, выбранным из группы, состоящей из FcγRI (CD64), включая FcγRIa, FcγRIb, FcγRIc, FcγRIII (CD16), включая изоформы FcγRIIIa (включая аллотипы V158 и F158) и FcγRIIIb (включая аллотипы FcγRIIIb-NA1 и FcγRIIIb-NA2), и FcγRII (CD32), включая изоформы FcγRIIa и FcγRIIc (включая аллотипы H131 и R131), можно использовать в качестве селективного FcγR-связывающего домена, включенного в антигенсвязывающую молекулу, предусматриваемую в рамках настоящего изобретения. Более того, в неограничивающем варианте осуществления настоящего изобретения FcγR-связывающий домен с более высокой активностью связывания с FcγRIIb-1 и/или FcγRIIb-2, чем с FcγRIa, FcγRIb и FcγRIc, FcγRIIIa, включая аллотип V158, FcγRIIIa, включая аллотип F158, FcγRIIIb, включая аллотип FcγRIIIb-NA1, FcγRIIIb, включая аллотип FcγRIIIb-NA2, FcγRIIa, включая аллотип H131, FcγRIIa, включая аллотип R131, и/или FcγRIIc, можно использовать в качестве селективного FcγR-связывающего домена, включенного в антигенсвязывающую молекулу, предусматриваемую в рамках настоящего изобретения. То, обладает ли FcγR-связывающий домен, подлежащий исследованию, селективной активностью связывания с Fcγ-рецепторами, можно определять посредством сравнения величины (соотношения), полученной делением величин KD FcγR-связывающего домена в отношении FcγRIa, FcγRIb, FcγRIc, FcγRIIIa, включая аллотип V158, FcγRIIIa, включая аллотип F158, FcγRIIIb, включая аллотип FcγRIIIb-NA1, FcγRIIIb, включая аллотип FcγRIIIb-NA2, FcγRIIa, включая аллотип H131, FcγRIIa, включая аллотип R131, и/или FcγRIIc, на величины KD для FcγRIIb-1 и/или FcγRIIb-2, где величины KD определяют способом, описанным в упомянутом выше разделе об активности связывания с Fcγ-рецепторами, или, более конкретно, посредством сравнения показателей селективности FcγR, представленных в уравнении 1.
[Уравнение 1]
Показатель селективности FcγR = величина KD для активирующего FcγR/величина KD для ингибиторного FcγR
В уравнении 1, упомянутом выше, "активирующий FcγR" относится к FcγRIa, FcγRIb, FcγRIc, FcγRIIIa, включая аллотип V158, FcγRIIIa, включая аллотип F158, FcγRIIIb, включая аллотип FcγRIIIb-NA1, FcγRIIIb, включая аллотип FcγRIIIb-NA2, FcγRIIa, включая аллотип H131, FcγRIIa, включая аллотип R131, и/или FcγRIIc, и ингибиторный FcγR относится к FcγRIIb-1 и/или FcγRIIb-2. Хотя активирующий FcγR и ингибиторный FcγR, используемые для измерений величины KD, могут быть выбраны из любой комбинации, в неограничивающем варианте осуществления можно использовать величину (соотношение), полученную делением величины KD для FcγRIIa, включая аллотип H131, на величину KD для FcγRIIb-1 и/или FcγRIIb-2.
Например, показатели селективности FcγR имеют величины 1,2 или более, 1,3 или более, 1,4 или более, 1,5 или более, 1,6 или более, 1,7 или более, 1,8 или более, 1,9 или более, 2 или более, 3 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 15 или более, 20 или более, 25 или более, 30 или более, 35 или более, 40 или более, 45 или более, 50 или более, 55 или более, 60 или более, 65 или более, 70 или более, 75 или более, 80 или более, 85 или более, 90 или более, 95 или более, 100 или более, 110 или более, 120 или более, 130 или более, 140 или более, 150 или более, 160 или более, 170 или более, 180 или более, 190 или более, 200 или более, 210 или более, 220 или более, 230 или более, 240 или более, 250 или более, 260 или более, 270 или более, 280 или более, 290 или более, 300 или более, 310 или более, 320 или более, 330 или более, 340 или более, 350 или более, 360 или более, 370 или более, 380 или более, 390 или более, 400 или более, 410 или более, 420 или более, 430 или более, 440 или более, 450 или более, 460 или более, 470 или более, 480 или более, 490 или более, 500 или более, 520 или более, 540 или более, 560 или более, 580 или более, 600 или более, 620 или более, 640 или более, 660 или более, 680 или более, 700 или более, 720 или более, 740 или более, 760 или более, 780 или более, 800 или более, 820 или более, 840 или более, 860 или более, 880 или более, 900 или более, 920 или более, 940 или более, 960 или более, 980 или более, 1000 или более, 1500 или более, 2000 или более, 2500 или более, 3000 или более, 3500 или более, 4000 или более, 4500 или более, 5000 или более, 5500 или более, 6000 или более, 6500 или более, 7000 или более, 7500 или более, 8000 или более, 8500 или более, 9000 или более, 9500 или более, 10000 или более или 100000 или более.
Неограничивающий вариант осуществления селективного FcγR-связывающего домена в антигенсвязывающей молекуле по настоящему изобретению включает, например, Fc-области, полученные посредством модификации FcγR-связывающего домена, включенного в Fc-область, представленную в качестве IgG1 человека (SEQ ID NO: 14), IgG2 человека (SEQ ID NO: 15), IgG3 человека (SEQ ID NO: 16) или IgG4 человека (SEQ ID NO: 17). Пример способа получения модифицированных Fc-областей включает способ, описанный в упомянутом выше разделе об аминокислотных изменениях. Примеры таких измененных Fc-областей включают Fc-область, в которой аминокислота в положении 238 (нумерация EU) представляет собой Asp, или Fc-область, в которой аминокислота в положении 328 (нумерация EU) представляет собой Glu в IgG человека (IgG1, IgG2, IgG3 или IgG4). Fc-область, в которой аминокислота в положении 238 (нумерация EU) представляет собой Asp, или Fc-область, в которой аминокислота в положении 328 (нумерация EU) представляет собой Glu в IgG человека (IgG1, IgG2, IgG3 или IgG4), и антигенсвязывающие молекулы, содержащие такую Fc-область, демонстрируют более высокую активность связывания с FcγRIIb-1 и/или FcγRIIb-2, чем с FcγRIa, FcγRIb, FcγRIc, FcγRIIIa, включая аллотип V158, FcγRIIIa, включая аллотип F158, FcγRIIIb, включая аллотип FcγRIIIb-NA1, FcγRIIIb, включая аллотип FcγRIIIb-NA2, FcγRIIa, включая аллотип H131, FcγRIIa, включая аллотип R131, и/или FcγRIIc.
Fc-области, содержащие селективный FcγR-связывающий домен, которые включены в антигенсвязывающие молекулы по настоящему изобретению, и антигенсвязывающие молекулы, содержащие такую Fc-область, также могут представлять собой Fc-области и антигенсвязывающие молекулы, содержащие такую Fc-область, которая сохраняет или демонстрирует сниженную активность связывания с активирующим FcγR (FcγRIa, FcγRIb, FcγRIc, FcγRIIIa, включая аллотип V158, FcγRIIIa, включая аллотип F158, FcγRIIIb, включая аллотип FcγRIIIb-NA1, FcγRIIIb, включая аллотип FcγRIIIb-NA2, FcγRIIa, включая аллотип H131, FcγRIIa, включая аллотип R131, и/или FcγRIIc) по сравнению с Fc-областью, представленной в качестве IgG1 человека (SEQ ID NO: 14), IgG2 человека (SEQ ID NO: 15), IgG3 человека (SEQ ID NO: 16) или IgG4 человека (SEQ ID NO: 17) (далее обозначаемой как Fc-область дикого типа), и антигенсвязывающей молекулы, содержащей такую Fc-область дикого типа.
По сравнению с Fc-областью дикого типа и антигенсвязывающей молекулой, содержащей Fc-область дикого типа, степень упомянутого выше уменьшения активности связывания с активирующим FcγR Fc-области, содержащей селективный FcγR-связывающий домен, включенный в антигенсвязывающую молекулу по настоящему изобретению, и антигенсвязывающей молекулы, содержащей такую Fc-область, составляет, например, 99% или менее, 98% или менее, 97% или менее, 96% или менее, 95% или менее, 94% или менее, 93% или менее, 92% или менее, 91% или менее, 90% или менее, 88% или менее, 86% или менее, 84% или менее, 82% или менее, 80% или менее, 78% или менее, 76% или менее, 74% или менее, 72% или менее, 70% или менее, 68% или менее, 66% или менее, 64% или менее, 62% или менее, 60% или менее, 58% или менее, 56% или менее, 54% или менее, 52% или менее, 50% или менее, 45% или менее, 40% или менее, 35% или менее, 30% или менее, 25% или менее, 20% или менее, 15% или менее, 10% или менее, 5% или менее, 4% или менее, 3% или менее, 2% или менее, 1% или менее, 0,5% или менее, 0,4% или менее, 0,3% или менее, 0,2% или менее, 0,1% или менее, 0,05% или менее, 0,01% или менее или 0,005% или менее.
Fc-области, содержащие селективный FcγR-связывающий домен, и антигенсвязывающие молекулы, содержащие такую Fc-область, которые включены в антигенсвязывающие молекулы по настоящему изобретению, также могут представлять собой Fc-области и антигенсвязывающие молекулы, содержащие такую Fc-область, которые демонстрируют усиленную активность связывания с ингибиторным FcγR (FcγRIIb-1 и/или FcγRIIb-2) по сравнению с Fc-областью, представленной в качестве IgG1 человека (SEQ ID NO: 14), IgG2 человека (SEQ ID NO: 15), IgG3 человека (SEQ ID NO: 16) или IgG4 человека (SEQ ID NO: 17) (далее обозначаемой как Fc-область дикого типа), и антигенсвязывающую молекулу, содержащую такую Fc-область дикого типа.
По сравнению с Fc-областью дикого типа и антигенсвязывающей молекулой, содержащей Fc-область дикого типа, степень упомянутого выше усиления активности связывания с ингибиторным FcγR Fc-области, содержащей селективный FcγR-связывающий домен, включенный в антигенсвязывающую молекулу по настоящему изобретению, и антигенсвязывающей молекулы, содержащей такую Fc-область, составляет, например, 101% или более, 102% или более, 103% или более, 104% или более, 105% или более, 106% или более, 107% или более, 108% или более, 109% или более, 110% или более, 112% или более, 114% или более, 116% или более, 118% или более, 120% или более, 122% или более, 124% или более, 126% или более, 128% или более, 130% или более, 132% или более, 134% или более, 136% или более, 138% или более, 140% или более, 142% или более, 144% или более, 146% или более, 148% или более, 150% или более, 155% или более, 160% или более, 165% или более, 170% или более, 175% или более, 180% или более, 185% или более, 190% или более, 195% или более, превышает в 2 раза или более, в 3 раза или более, в 4 раза или более, в 5 раз или более, в 6 раз или более, в 7 раз или более, в 8 раз или более, в 9 раз или более, в 10 раз или более, в 20 раз или более, в 30 раз или более, в 40 раз или более, в 50 раз или более, в 60 раз или более, в 70 раз или более, в 80 раз или более, в 90 раз или более, в 100 раз или более, в 200 раз или более, в 300 раз или более, в 400 раз или более, в 500 раз или более, в 600 раз или более, в 700 раз или более, в 800 раз или более, в 900 раз или более, в 1000 раз или более, в 10000 раз или более или в 100000 раз или более.
Более того, Fc-область, содержащая селективный FcγR-связывающий домен, включенный в антигенсвязывающую молекулу по настоящему изобретению, и антигенсвязывающая молекула, содержащая такую Fc-область, могут представлять собой Fc-область и антигенсвязывающую молекулу, содержащую такую Fc-область, которая сохраняет или демонстрирует сниженную активность связывания с активирующим FcγR (FcγRIa, FcγRIb, FcγRIc, FcγRIIIa, включая аллотип V158, FcγRIIIa, включая аллотип F158, FcγRIIIb включая аллотип FcγRIIIb-NA1, FcγRIIIb включая аллотип FcγRIIIb-NA2, FcγRIIa включая аллотип H131, FcγRIIa включая аллотип R131, и/или FcγRIIc) по сравнению с Fc-областью, присутствующей в качестве IgG1 человека (SEQ ID NO: 14), IgG2 человека (SEQ ID NO: 15), IgG3 человека (SEQ ID NO: 16) или IgG4 человека (SEQ ID NO: 17) (далее обозначаемой как Fc-область дикого типа), и антигенсвязывающей молекулой, содержащей такую Fc-область дикого типа; и демонстрирует усиленную активность связывания с ингибиторным FcγR (FcγRIIb-1 и/или FcγRIIb-2) по сравнению с Fc-областью, присутствующей в качестве IgG1 человека (SEQ ID NO: 14), IgG2 человека (SEQ ID NO: 15), IgG3 человека (SEQ ID NO: 16) или IgG4 человека (SEQ ID NO: 17) (далее обозначаемой как Fc-область дикого типа), и антигенсвязывающей молекулой, содержащей такую Fc-область дикого типа.
Более того, Fc-область, содержащая селективный FcγR-связывающий домен, включенный в антигенсвязывающую молекулу по настоящему изобретению, и антигенсвязывающая молекула, содержащая такую Fc-область, могут представлять собой Fc-область и антигенсвязывающую молекулу, содержащую такую Fc-область с более высокой степенью усиления активности связывания с ингибиторным Fcγ-рецептором (FcγRIIb-1 и/или FcγRIIb-2), чем с активирующим Fcγ-рецептором (FcγRIa, FcγRIb, FcγRIc, FcγRIIIa включая аллотип V158, FcγRIIIa включая аллотип F158, FcγRIIIb включая аллотип FcγRIIIb-NA1, FcγRIIIb включая аллотип FcγRIIIb-NA2, FcγRIIa включая аллотип H131, FcγRIIa включая аллотип R131), по сравнению с Fc-областью, присутствующей в качестве IgG1 человека (SEQ ID NO: 14), IgG2 человека (SEQ ID NO: 15), IgG3 человека (SEQ ID NO: 16) или IgG4 человека (SEQ ID NO: 17) (далее обозначаемой как Fc-область дикого типа), и антигенсвязывающей молекулой, содержащей такую Fc-область дикого типа.
В рамках настоящего изобретения по меньшей мере одно другое изменение Fc-области можно добавлять к Fc-области, в которой аминокислота в положении 238 (нумерация EU) представляет собой Asp, и Fc-области, в которой аминокислота в положении 328 (нумерация EU) представляет собой Glu, согласно вариантам осуществления и т.п., описанным в упомянутом выше разделе об аминокислотных изменениях. В дополнение к этим изменениям также можно добавлять дополнительные изменения. Дополнительные изменения можно выбирать из любых замен, делеций и модификаций аминокислот и их комбинаций. Например, можно добавлять изменения, которые усиливают активность связывания с FcγRIIb при сохранении или снижении активности связывания с FcγRIIa (H-тип) и FcγRIIa (R-тип). Добавление таких изменений повышает селективность связывания с FcγRIIb относительно FcγRIIa.
Среди них, изменения, которые повышают селективность в отношении FcγRIIb относительно FcγRIIa (R-тип), являются благоприятными, и изменения, которые повышают селективность связывания с FcγRIIb относительно FcγRIIa (H-тип), являются более благоприятными. Примеры предпочтительных аминокислотных замен для таких изменений включают: изменение посредством замены Gly в положении 237 (нумерация EU) на Trp; изменение посредством замены Gly в положении 237 (нумерация EU) на Phe; изменение посредством замены Pro в положении 238 (нумерация EU) на Phe; изменение посредством замены Asn в положении 325 (нумерация EU) на Met; изменение посредством замены Ser в положении 267 (нумерация EU) на Ile; изменение посредством замены Leu в положении 328 (нумерация EU) на Asp; изменение посредством замены Ser в положении 267 (нумерация EU) на Val; изменение посредством замены Leu в положении 328 (нумерация EU) на Trp; изменение посредством замены Ser в положении 267 (нумерация EU) на Gln; изменение посредством замены Ser в положении 267 (нумерация EU) на Met; изменение посредством замены Gly в положении 236 (нумерация EU) на Asp; изменение посредством замены Ala в положении 327 (нумерация EU) на Asn; изменение посредством замены Asn в положении 325 (нумерация EU) на Ser; изменение посредством замены Leu в положении 235 (нумерация EU) на Tyr; изменение посредством замены Val в положении 266 (нумерация EU) на Met; изменение посредством замены Leu в положении 328 (нумерация EU) на Tyr; изменение посредством замены Leu в положении 235 (нумерация EU) на Trp; изменение посредством замены Leu в положении 235 (нумерация EU) на Phe; изменение посредством замены Ser в положении 239 (нумерация EU) на Gly; изменение посредством замены Ala в положении 327 (нумерация EU) на Glu; изменение посредством замены Ala в положении 327 (нумерация EU) на Gly; изменение посредством замены Pro в положении 238 (нумерация EU) на Leu; изменение посредством замены Ser в положении 239 (нумерация EU) на Leu; изменение посредством замены Leu в положении 328 (нумерация EU) на Thr; изменение посредством замены Leu в положении 328 (нумерация EU) на Ser; изменение посредством замены Leu в положении 328 (нумерация EU) на Met; изменение посредством замены Pro в положении 331 (нумерация EU) на Trp; изменение посредством замены Pro в положении 331 (нумерация EU) на Tyr; изменение посредством замены Pro в положении 331 (нумерация EU) на Phe; изменение посредством замены Ala в положении 327 (нумерация EU) на Asp; изменение посредством замены Leu в положении 328 (нумерация EU) на Phe; изменение посредством замены Pro в положении 271 (нумерация EU) на Leu; изменение посредством замены Ser в положении 267 (нумерация EU) на Glu; изменение посредством замены Leu в положении 328 (нумерация EU) на Ala; изменение посредством замены Leu в положении 328 (нумерация EU) на Ile; изменение посредством замены Leu в положении 328 (нумерация EU) на Gln; изменение посредством замены Leu в положении 328 (нумерация EU) на Val; изменение посредством замены Lys в положении 326 (нумерация EU) на Trp; изменение посредством замены Lys в положении 334 (нумерация EU) на Arg; изменение посредством замены His в положении 268 (нумерация EU) на Gly; изменение посредством замены His в положении 268 (нумерация EU) на Asn; изменение посредством замены Ser в положении 324 (нумерация EU) на Val; изменение посредством замены Val в положении 266 (нумерация EU) на Leu; изменение посредством замены Pro в положении 271 (нумерация EU) на Gly; изменение посредством замены Ile в положении 332 (нумерация EU) на Phe; изменение посредством замены Ser в положении 324 (нумерация EU) на Ile; изменение посредством замены Glu в положении 333 (нумерация EU) на Pro; изменение посредством замены Tyr в положении 300 (нумерация EU) на Asp; изменение посредством замены Ser в положении 337 (нумерация EU) на Asp; изменение посредством замены Tyr в положении 300 (нумерация EU) на Gln; изменение посредством замены Thr в положении 335 (нумерация EU) на Asp; изменение посредством замены Ser в положении 239 (нумерация EU) на Asn; изменение посредством замены Lys в положении 326 (нумерация EU) на Leu; изменение посредством замены Lys в положении 326 (нумерация EU) на Ile; изменение посредством замены Ser в положении 239 (нумерация EU) на Glu; изменение посредством замены Lys в положении 326 (нумерация EU) на Phe; изменение посредством замены Lys в положении 326 (нумерация EU) на Val; изменение посредством замены Lys в положении 326 (нумерация EU) на Tyr; изменение посредством замены Ser в положении 267 (нумерация EU) на Asp; изменение посредством замены Lys в положении 326 (нумерация EU) на Pro; изменение посредством замены Lys в положении 326 (нумерация EU) на His; изменение посредством замены Lys в положении 334 (нумерация EU) на Ala; изменение посредством замены Lys в положении 334 (нумерация EU) на Trp; изменение посредством замены His в положении 268 (нумерация EU) на Gln; изменение посредством замены Lys в положении 326 (нумерация EU) на Gln; изменение посредством замены Lys в положении 326 (нумерация EU) на Glu; изменение посредством замены Lys в положении 326 (нумерация EU) на Met; изменение посредством замены Val в положении 266 (нумерация EU) на Ile; изменение посредством замены Lys в положении 334 (нумерация EU) на Glu; изменение посредством замены Tyr в положении 300 (нумерация EU) на Glu; изменение посредством замены Lys в положении 334 (нумерация EU) на Met; изменение посредством замены Lys в положении 334 (нумерация EU) на Val; изменение посредством замены Lys в положении 334 (нумерация EU) на Thr; изменение посредством замены Lys в положении 334 (нумерация EU) на Ser; изменение посредством замены Lys в положении 334 (нумерация EU) на His; изменение посредством замены Lys в положении 334 (нумерация EU) на Phe; изменение посредством замены Lys в положении 334 (нумерация EU) на Gln; изменение посредством замены Lys в положении 334 (нумерация EU) на Pro; изменение посредством замены Lys в положении 334 (нумерация EU) на Tyr; изменение посредством замены Lys в положении 334 (нумерация EU) на Ile; изменение посредством замены Gln в положении 295 (нумерация EU) на Leu; изменение посредством замены Lys в положении 334 (нумерация EU) на Leu; изменение посредством замены Lys в положении 334 (нумерация EU) на Asn; изменение посредством замены His в положении 268 (нумерация EU) на Ala; изменение посредством замены Ser в положении 239 (нумерация EU) на Asp; изменение посредством замены Ser в положении 267 (нумерация EU) на Ala; изменение посредством замены Leu в положении 234 (нумерация EU) на Trp; изменение посредством замены Leu в положении 234 (нумерация EU) на Tyr; изменение посредством замены Gly в положении 237 (нумерация EU) на Ala; изменение посредством замены Gly в положении 237 (нумерация EU) на Asp; изменение посредством замены Gly в положении 237 (нумерация EU) на Glu; изменение посредством замены Gly в положении 237 (нумерация EU) на Leu; изменение посредством замены Gly в положении 237 (нумерация EU) на Met; изменение посредством замены Gly в положении 237 (нумерация EU) на Tyr; изменение посредством замены Ala в положении 330 (нумерация EU) на Lys; изменение посредством замены Ala в положении 330 (нумерация EU) на Arg; изменение посредством замены Glu в положении 233 (нумерация EU) на Asp; изменение посредством замены His в положении 268 (нумерация EU) на Asp; изменение посредством замены His в положении 268 (нумерация EU) на Glu; изменение посредством замены Lys в положении 326 (нумерация EU) на Asp; изменение посредством замены Lys в положении 326 (нумерация EU) на Ser; изменение посредством замены Lys в положении 326 (нумерация EU) на Thr; изменение посредством замены Val в положении 323 (нумерация EU) на Ile; изменение посредством замены Val в положении 323 (нумерация EU) на Leu; изменение посредством замены Val в положении 323 (нумерация EU) на Met; изменение посредством замены Tyr в положении 296 (нумерация EU) на Asp; изменение посредством замены Lys в положении 326 (нумерация EU) на Ala; изменение посредством замены Lys в положении 326 (нумерация EU) на Asn; и изменение посредством замены Ala в положении 330 (нумерация EU) на Met.
Благоприятными аминокислотными заменами среди этих изменений являются, например, изменение посредством замены Gly в положении 237 (нумерация EU) на Trp; изменение посредством замены Gly в положении 237 (нумерация EU) на Phe; изменение посредством замены Ser в положении 267 (нумерация EU) на Val; изменение посредством замены Ser в положении 267 (нумерация EU) на Gln; изменение посредством замены His в положении 268 (нумерация EU) на Asn; изменение посредством замены Pro в положении 271 (нумерация EU) на Gly; изменение посредством замены Lys в положении 326 (нумерация EU) на Leu; изменение посредством замены Lys в положении 326 (нумерация EU) на Gln; изменение посредством замены Lys в положении 326 (нумерация EU) на Glu; изменение посредством замены Lys в положении 326 (нумерация EU) на Met; изменение посредством замены Ser в положении 239 (нумерация EU) на Asp; изменение посредством замены Ser в положении 267 (нумерация EU) на Ala; изменение посредством замены Leu в положении 234 (нумерация EU) на Trp; изменение посредством замены Leu в положении 234 (нумерация EU) на Tyr; изменение посредством замены Gly в положении 237 (нумерация EU) на Ala; изменение посредством замены Gly в положении 237 (нумерация EU) на Asp; изменение посредством замены Gly в положении 237 (нумерация EU) на Glu; изменение посредством замены Gly в положении 237 (нумерация EU) на Leu; изменение посредством замены Gly в положении 237 (нумерация EU) на Met; изменение посредством замены Gly в положении 237 (нумерация EU) на Tyr; изменение посредством замены Ala в положении 330 (нумерация EU) на Lys; изменение посредством замены Ala в положении 330 (нумерация EU) на Arg; изменение посредством замены Glu в положении 233 (нумерация EU) на Asp; изменение посредством замены His в положении 268 (нумерация EU) на Asp; изменение посредством замены His в положении 268 (нумерация EU) на Glu; изменение посредством замены Lys в положении 326 (нумерация EU) на Asp; изменение посредством замены Lys в положении 326 (нумерация EU) на Ser; изменение посредством замены Lys в положении 326 (нумерация EU) на Thr; изменение посредством замены Val в положении 323 (нумерация EU) на Ile; изменение посредством замены Val в положении 323 (нумерация EU) на Leu; изменение посредством замены Val в положении 323 (нумерация EU) на Met; изменение посредством замены Tyr в положении 296 (нумерация EU) на Asp; изменение посредством замены Lys в положении 326 (нумерация EU) на Ala; изменение посредством замены Lys в положении 326 (нумерация EU) на Asn; и изменение посредством замены Ala в положении 330 (нумерация EU) на Met.
Упомянутое выше изменение может представлять собой изменение в одном положении, или можно комбинировать изменения в двух или более положениях. Подходящие примеры таких изменений представляют собой изменения, описанные в таблицах 13-14, таблицах 16-23 и таблицах 25-27.
Fc-область, полученная путем изменения FcγR-связывающего домена, включенного в Fc-область, представленную в качестве IgG1 (SEQ ID NO: 14), IgG2 (SEQ ID NO: 15), IgG3 (SEQ ID NO: 16) или IgG4 (SEQ ID NO: 17) человека, может быть приведена в качестве примера другого неограничивающего варианта осуществления селективного FcγR-связывающего домена, включенного в антигенсвязывающие молекулы по настоящему изобретению. Способ получения модифицированных Fc-областей представляет собой, например, способ, описанный в упомянутом выше разделе об аминокислотных изменениях. Примеры таких измененных Fc-областей включают Fc-область, в которой аминокислота в положении 238 (нумерация EU) представляет собой Asp и аминокислота в положении в положении 271 (нумерация EU) представляет собой Gly в IgG человека (IgG1, IgG2, IgG3 или IgG4). Fc-область, в которой аминокислота в положении 238 (нумерация EU) представляет собой Asp и аминокислота в положении в положении 271 (нумерация EU) представляет собой Gly в IgG человека (IgG1, IgG2, IgG3 или IgG4), и антигенсвязывающие молекулы, содержащие такую Fc-область, демонстрируют более высокую активность связывания с FcγRIIb-1 и/или FcγRIIb-2, чем с FcγRIa, FcγRIb, FcγRIc, FcγRIIIa. включая аллотип V158, FcγRIIIa, включая аллотип F158, FcγRIIIb, включая аллотип FcγRIIIb-NA1, FcγRIIIb включая аллотип FcγRIIIb-NA2, FcγRIIa включая аллотип H131, FcγRIIa включая аллотип R131, и/или FcγRIIc.
В рамках настоящего изобретения по меньшей мере одно другое изменение Fc-области можно добавлять к Fc-области, в которой аминокислота в положении 238 (нумерация EU) представляет собой Asp и аминокислота в положении 271 (нумерация EU) представляет собой Gly, посредством вариантов осуществления и т.п., описанных в упомянутом выше разделе об аминокислотных изменениях. В дополнение к этим изменениям также можно добавлять дополнительные изменения. Дополнительные изменения могут быть выбраны из любых из замен, делеций и модификаций аминокислот и их комбинаций. Например, можно добавлять изменения, которые сохраняют или снижают активность связывания с активирующими Fcγ-рецепторами (FcγRIa, FcγRIb, FcγRIc, FcγRIIIa, включая аллотип V158, FcγRIIIa, включая аллотип F158, FcγRIIIb, включая аллотип FcγRIIIb-NA1, FcγRIIIb, включая аллотип FcγRIIIb-NA2, FcγRIIa, включая аллотип H131, FcγRIIa, включая аллотип R131). Можно добавлять изменения, которые усиливают активность связывания с ингибиторными Fcγ-рецепторами (FcγRIIb-1 и/или FcγRIIb-2) при сохранении или снижении активности связывания с FcγRIIa (H-тип) и FcγRIIa (R-тип). Более того, также можно добавлять изменения, где степень усиления активности связывания с ингибиторными Fcγ-рецепторами (FcγRIIb-1 и/или FcγRIIb-2) является более высокой, чем степень усиления активности связывания с активирующими Fcγ-рецепторами (FcγRIa, FcγRIb, FcγRIc, FcγRIIIa, включая аллотип V158, FcγRIIIa, включая аллотип F158, FcγRIIIb, включая аллотип FcγRIIIb-NA1, FcγRIIIb, включая аллотип FcγRIIIb-NA2, FcγRIIa, включая аллотип H131, FcγRIIa, включая аллотип R131). Добавление таких изменений повышает селективность связывания с FcγRIIb относительно FcγRIIa.
Пример неограничивающего варианта осуществления измененной Fc-области, содержащей селективный FcγR-связывающий домен, включает измененную Fc-область, в которой по меньшей мере одна или несколько аминокислот, выбранных из группы, состоящей из аминокислот в положениях 233, 234, 237, 264, 265, 266, 267, 268, 269, 272, 274, 296, 326, 327, 330, 331, 332, 333, 355, 356, 358, 396, 409 и 419 (нумерация EU), заменены в Fc-области, в которой аминокислота в положении 238 (нумерация EU) представляет собой Asp и аминокислота в положении 271 (нумерация EU) представляет собой Gly в IgG человека (IgG1, IgG2, IgG3 или IgG4).
Кроме того, примером неограничивающего варианта осуществления измененной Fc-области, содержащей селективный FcγR-связывающий домен, является измененная Fc-область, содержащая любой один или несколько из
Asp в положении аминокислоты 233,
Tyr в положении аминокислоты 234,
Asp в положении аминокислоты 237,
Ile в положении аминокислоты 264,
Glu в положении аминокислоты 265,
любой из Phe, Met и Leu в положении аминокислоты 266,
любой из Ala, Glu, Gly и Gln в положении аминокислоты 267,
любой из Asp, Glu и Gln в положении аминокислоты 268,
Asp в положении аминокислоты 269,
любой из Asp, Phe, Ile, Met, Asn, Pro и Gln в положении аминокислоты 272,
Gln в положении 274,
Asp или Phe в положении аминокислоты 296,
Ala или Asp в положении аминокислоты 326,
Gly в положении аминокислоты 327,
Lys или Arg в положении аминокислоты 330,
Ser в положении аминокислоты 331,
Thr в положении аминокислоты 332,
любой из Thr, Lys и Arg в положении аминокислоты 333,
Gln в положении аминокислоты 355,
Glu в положении аминокислоты 356,
Met в положении аминокислоты 358,
любой из Asp, Glu, Phe, Ile, Lys, Leu, Met, Gln, Arg и Tyr в положении аминокислоты 396,
Arg в положении аминокислоты 409,
Glu в положении аминокислоты 419,
показанные с помощью нумерации EU, в Fc-области, в которой аминокислота в положении 238 представляет собой Asp и аминокислота в положении 271 (нумерация EU) представляет собой Gly в IgG человека (IgG1, IgG2, IgG3 или IgG4).
Примеры неограничивающего варианта осуществления Fc-области, которая дополнительно содержит по меньшей мере одно дополнительное изменение Fc-области, и дополнительно содержит дополнительные изменения, упомянутые выше, включают Fc-области, представленные в таблицах с 5-1 по 5-7.
(Таблица 5-2 является продолжением таблицы 5-1)
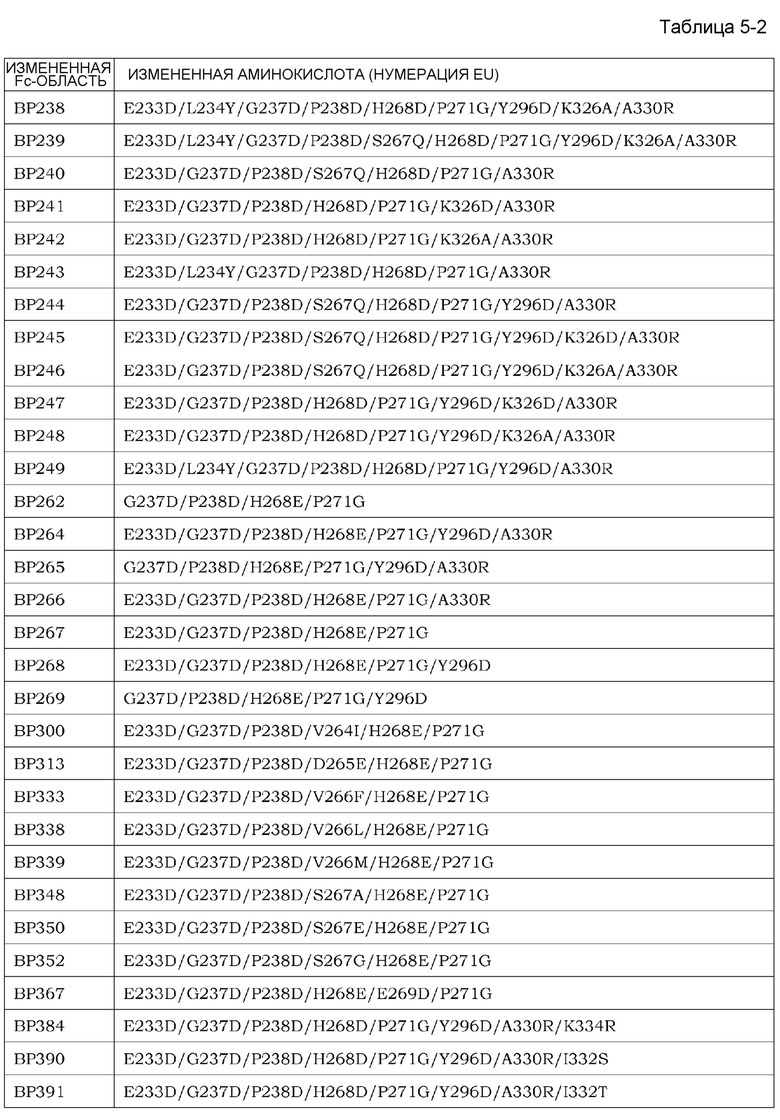
(Таблица 5-3 является продолжением таблицы 5-2)
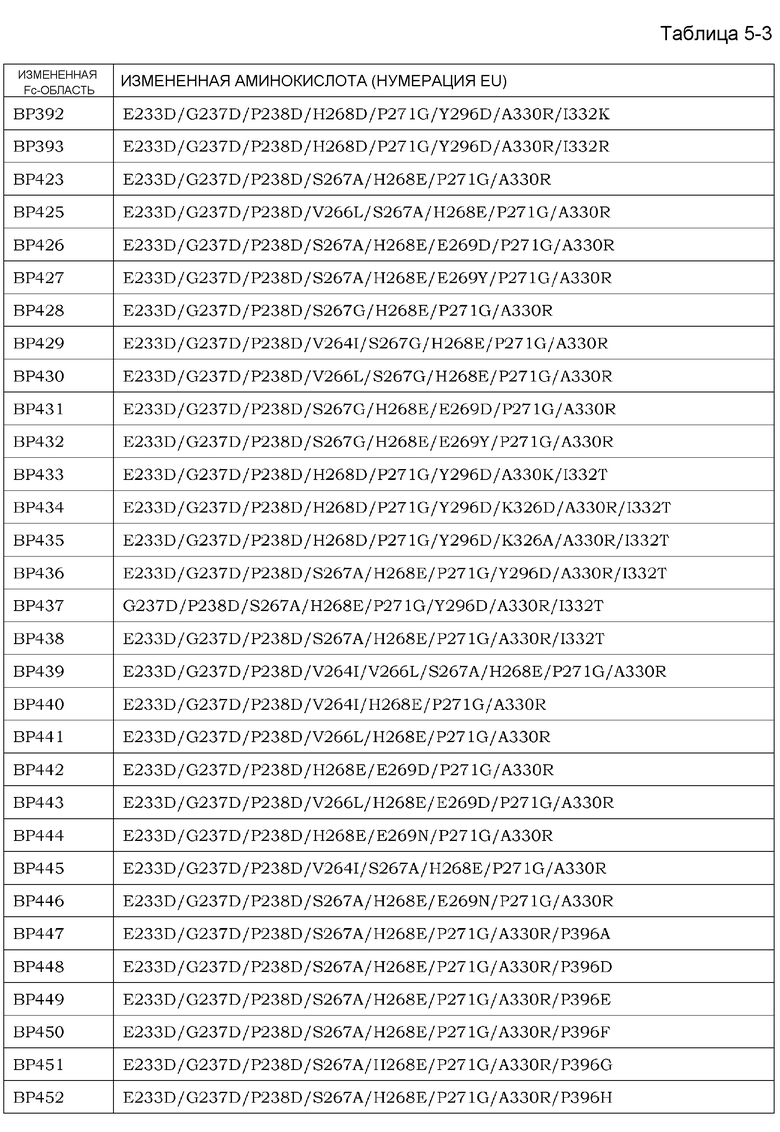
(Таблица 5-4 является продолжением таблицы 5-3)
(Таблица 5-5 является продолжением таблицы 5-4)
(Таблица 5-6 является продолжением таблицы 5-5)
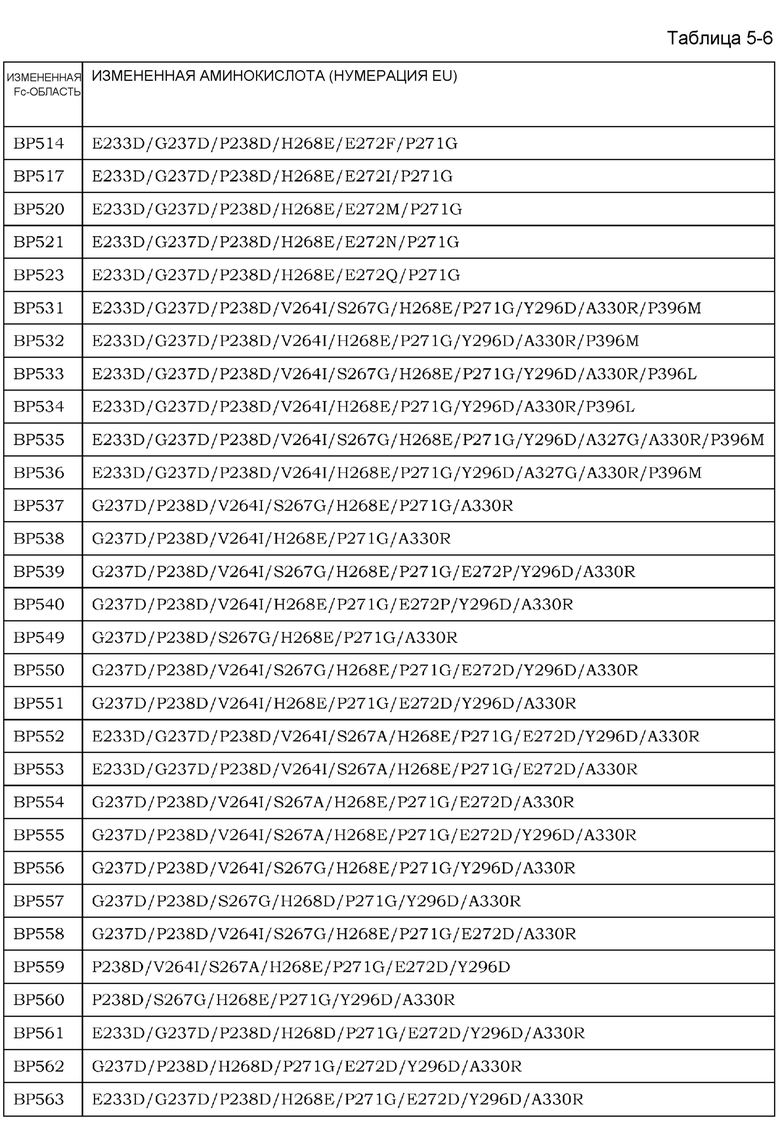
(Таблица 5-7 является продолжением таблицы 5-6)

Антигенсвязывающая молекула
В рамках настоящего изобретения термин "антигенсвязывающая молекула" используют в наиболее широком значении для обозначения молекулы, содержащей антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов, FcRn-связывающий домен, обладающий активностью связывания FcRn в условиях диапазона кислых значений pH, и связывающий Fcγ-рецептор домен, обладающий активностью селективного связывания с Fcγ-рецептором (селективный FcγR-связывающий домен). В частности, антигенсвязывающие молекулы включают различные типы молекул, при условии, что они проявляют антигенсвязывающую активность. Примерами молекул, в которых антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов, FcRn-связывающий домен, обладающий активностью связывания FcRn в условиях диапазона кислых значений pH, и связывающий Fcγ-рецептор домен, обладающий активностью селективного связывания с Fcγ-рецептором (селективный FcγR-связывающий домен), связаны вместе, являются антитела. Антитела могут включать единичные моноклональные антитела (включая антитела-агонисты и антитела-антагонисты), антитела человека, гуманизированные антитела, химерные антитела и т.п. Альтернативно, при использовании в качестве фрагментов антител, они предпочтительно включают антигенсвязывающие домены и антигенсвязывающие фрагменты (например, Fab, F(ab')2, scFv и Fv). Каркасные молекулы, где трехмерные структуры, такие как уже известная стабильная белковая структура α/β-бочонок, используются в качестве каркаса (основы) и только некоторые части структур преобразованы в библиотеки для конструирования антигенсвязывающих доменов, также включены в антигенсвязывающие молекулы по настоящему изобретению.
Антигенсвязывающая молекула по настоящему изобретению может содержать по меньшей мере некоторые части Fc-области, которые опосредуют связывание с FcRn и Fcγ-рецептором и/или рецептором комплемента. В неограничивающем варианте осуществления антигенсвязывающая молекула включает, например, антитела и слитые белки Fc. Слитый белок относится к химерному полипептиду, содержащему полипептид, имеющий первую аминокислотную последовательность, который связан с полипептидом, имеющим вторую аминокислотную последовательность, которые не связаны в природе. Например, слитый белок может содержать аминокислотную последовательность по меньшей мере части Fc-области (например, часть Fc-области, ответственная за связывание с FcRn, часть Fc-области, ответственная за связывание с Fcγ-рецептором, или часть Fc-области, ответственная за связывание с рецептором комплемента) и не являющегося иммуноглобулином полипептида, содержащего, например, аминокислотную последовательность лиганд-связывающего домена рецептора или рецептор-связывающего домена лиганда. Аминокислотные последовательности могут находиться в отдельных белках, которые переносят вместе в слитый белок, или, как правило, они могут находиться в одном белке, но они включены в слитый полипептид в новом порядке. Слитые белки можно получать, например, посредством химического синтеза или способами генетической рекомбинации для экспрессии полинуклеотида, кодирующего области пептидов в желаемом порядке.
Соответствующие домены по настоящему изобретению, такие как антигенсвязывающий домен, FcRn-связывающий домен, обладающий активностью связывания FcRn в условиях диапазона кислых значений pH, и связывающий Fcγ-рецептор домен, обладающий активностью селективного связывания с Fcγ-рецептором (селективный FcγR-связывающий домен), могут быть связаны вместе через линкеры или прямо через полипептидные связи. Линкеры включают произвольные пептидные линкеры, которые можно вносить способами генетической инженерии, синтетические линкеры и линкеры, описанные, например, в Protein Engineering (1996) 9(3), 299-305. Однако пептидные линкеры являются предпочтительными в рамках настоящего изобретения. Длина пептидных линкеров конкретно не ограничена, и ее могут надлежащим образом выбирать специалисты в данной области в зависимости от назначения. Длина предпочтительно составляет пять аминокислот или более (без конкретных ограничений, верхний предел обычно составляет 30 аминокислот или менее, предпочтительно 20 аминокислот или менее) и особенно предпочтительно 15 аминокислот.
Например, такие пептидные линкеры предпочтительно включают:
Ser
Gly·Ser
Gly·Gly·Ser
Ser·Gly·Gly
Gly·Gly·Gly·Ser (SEQ ID NO: 28)
Ser·Gly·Gly·Gly (SEQ ID NO: 29)
Gly·Gly·Gly·Gly·Ser (SEQ ID NO: 30)
Ser·Gly·Gly·Gly·Gly (SEQ ID NO: 31)
Gly·Gly·Gly·Gly·Gly·Ser (SEQ ID NO: 32)
Ser·Gly·Gly·Gly·Gly·Gly (SEQ ID NO: 33)
Gly·Gly·Gly·Gly·Gly·Gly·Ser (SEQ ID NO: 34)
Ser·Gly·Gly·Gly·Gly·Gly·Gly (SEQ ID NO: 35)
(Gly·Gly·Gly·Gly·Ser (SEQ ID NO: 30))n
(Ser·Gly·Gly·Gly·Gly (SEQ ID NO: 31))n,
где n представляет собой целое число, равное 1 или более. Длину или последовательности пептидных линкеров могут соответствующим образом выбирать специалисты в данной области, в зависимости от назначения.
Обычно для сшивания пептидов используют синтетические линкеры (химические сшивающие агенты), и например:
N-гидроксисукцинимид (NHS),
дисукцинимидилсуберат (DSS),
бис(сульфосукцинимидил)суберат (BS3),
дитиобис(сукцинимидилпропионат) (DSP),
дитиобис(сульфосукцинимидилпропионат) (DTSSP),
этиленгликоль бис(сукцинимидилсукцинат) (EGS),
этиленгликоль бис(сульфосукцинимидилсукцинат) (сульфо-EGS),
дисукцинимидилтартрат (DST), дисульфосукцинимидилтартрат (сульфо-DST),
бис[2-(сукцинимидоксикарбонилокси)этил]сульфон (BSOCOES)
и бис[2-(сульфосукцинимидоксикарбонилокси)этил]сульфон (сульфо-BSOCOES). Эти сшивающие агенты являются коммерчески доступными.
Когда используют множество линкеров для связывания соответствующих доменов, все они могут быть одного типа, или они могут быть различных типов.
В дополнение к линкерам, проиллюстрированным выше, также можно соответствующим образом использовать линкеры с пептидными метками, такими как His-метка, HA-метка, myc-метка и FLAG-метка. Более того, также можно соответствующим образом использовать образование водородных связей, образование дисульфидных связей, образование ковалентных связей, ионное взаимодействие и свойства связывания друг с другом в результате их комбинации. Например, можно использовать аффинность между CH1 и CL антитела, и также можно использовать Fc-области, происходящие из описанных выше биспецифических антител для гетероассоциации Fc-областей. Более того, также можно соответствующим образом использовать дисульфидные связи, образующиеся между доменами.
Для связывания соответствующих доменов пептидной связью, полинуклеотиды, кодирующие домены, связывают вместе в рамке считывания. Известные способы связывания полинуклеотидов в рамке считывания включают способы, такие как лигирование фрагментов рестрикции, ПЦР со слиянием и перекрывающаяся ПЦР. Такие способы можно соответствующим образом использовать отдельно или в комбинации для конструирования антигенсвязывающих молекул по настоящему изобретению. В рамках настоящего изобретения термины "связанный" и "слитый" или "связывание" и "слияние" используют взаимозаменяемо. Эти термины означают, что два или более элементов или компонентов, таких как полипептиды, слиты вместе с образованием единой структуры любыми способами, включая описанные выше способы химического связывания и способы рекомбинации. Когда два или более доменов, элементов или компонентов представляют собой полипептиды, связывание в рамке считывания означает связывание двух или более элементов рамок считывания с образованием более длинной непрерывной рамки считывания при сохранении правильных рамок считывания полипептидов. Когда две молекулы Fab используют в качестве антигенсвязывающего домена, в качестве предпочтительной антигенсвязывающей молекулы по настоящему изобретению можно использовать антитело, которое представляет собой антигенсвязывающую молекулу по настоящему изобретению, где антигенсвязывающий домен связан в рамке считывания через пептидную связь без линкера с FcRn-связывающим доменом, обладающим активностью связывания FcRn в условиях диапазона кислых значений pH, и связывающим Fcγ-рецептор доменом, обладающим активностью селективного связывания с Fcγ-рецептором (селективный FcγR-связывающий домен). Примеры множества неограничивающих вариантов осуществления антигенсвязывающей молекулы по настоящему изобретению, включающей структуру антитела, представлены ниже:
(1) антитело, которое содержит F(ab')2, содержащую две вариабельные области и обладающую антигенсвязывающей активностью, которая варьирует в зависимости от условий концентрации ионов, и Fc-область, обладающую активностью связывания FcRn в условиях диапазона кислых значений pH и активностью селективного связывания с Fcγ-рецептором;
(2) антитело, которое содержит F(ab')2, где одна из вариабельных областей, образующих F(ab')2, обладает антигенсвязывающей активностью, которая варьирует в зависимости от условий концентрации ионов, а другая вариабельная область обладает активностью селективного связывания с Fcγ-рецептором, и Fc-область, обладающую активностью связывания FcRn в условиях диапазона кислых значений pH; и
(3) антитело, которое содержит F(ab')2, где одна из вариабельных областей, образующих F(ab')2, обладает антигенсвязывающей активностью, которая варьирует в зависимости от условий концентрации ионов, и другая вариабельная область обладает активностью связывания FcRn в условиях диапазона кислых значений pH, и Fc-область, обладающую активностью селективного связывания с Fcγ-рецептором.
Когда антитело содержит упомянутую выше структуру (3), вариабельную область, обладающую активностью связывания FcRn, которая варьирует в зависимости от условий pH, можно использовать предпочтительно в качестве вариабельной области, обладающей активностью связывания FcRn в условиях диапазона кислых значений pH. Без связи с конкретной теорией, если используют вариабельную область, активность связывания с FcRn которой варьирует в зависимости от условий pH, и если вариабельная область не обладает активностью связывания FcRn в условиях диапазона нейтральных значений pH, антитело освобождается от FcRn на поверхности клетки, когда антитело, связанное с FcRn в кислой эндосоме, транспортируется на клеточную поверхность и может без труда рециклировать в плазму.
Биспецифические антитела и способы их получения
Способы получения биспецифических антител можно использовать в качестве варианта осуществления способа получения антител, содержащих структуры (2) и (3), упомянутые выше. Биспецифические антитела представляют собой антитела, содержащие два типа вариабельных областей, которые специфично связываются с различными эпитопами. Биспецифические антитела IgG-типа могут секретироваться гибридной гибридомой (квадромой), полученной путем слияния двух типов гибридом, которые продуцируют IgG-антитела (Milstein et al., Nature (1983) 305, 537-540).
Когда биспецифическое антитело получают с использованием способов рекомбинации, таких как способы, описанные в представленном выше разделе об антителах, можно использовать способ, в котором гены, кодирующие тяжелые цепи, содержащие два типа представляющих интерес вариабельных областей, вводят в клетки для коэкспрессии их. Однако, даже если рассматривать только комбинацию тяжелых цепей, такой способ коэкспрессии приведет к смеси (i) комбинации пары тяжелых цепей, в которой одна из тяжелых цепей содержит вариабельную область, которая связывается с первым эпитопом, и другая тяжелая цепь содержит вариабельную область, которая связывается со вторым эпитопом, (ii) комбинации пары тяжелых цепей, которая включает только тяжелые цепи, содержащие вариабельную область, которая связывается с первым эпитопом, и (iii) комбинации пары тяжелых цепей, которая включает только тяжелые цепи, содержащие вариабельную область, которая связывается со вторым эпитопом, которые присутствуют в молярном соотношении 2:1:1. Трудно очищать антигенсвязывающие молекулы, содержащие желаемую комбинацию тяжелых цепей, из смеси трех типов комбинаций тяжелых цепей.
При получении биспецифических антител с использованием способов рекомбинации, таких как описано выше, биспецифические антитела, содержащие комбинацию гетерогенных тяжелых цепей, можно предпочтительно секретировать путем изменения домена CH3, который является компонентом тяжелой цепи, с использованием соответствующих аминокислотных замен. В частности, это является способом усиления образования гетерогенных тяжелых цепей и ингибирования образования гомогенных тяжелых цепей путем замены боковой цепи аминокислоты в одном домене CH3 тяжелой цепи линкером с более объемной боковой цепью (выступ (что означает "выпуклая часть")), одновременно заменяя боковую цепь в домене CH3 другой тяжелой цепи боковой цепью меньшего размера (углубление (что означает "полость")), так чтобы "выступ" помещался в "полости" (WO 1996/027011, Ridgway et al. (Protein Engineering (1996) 9, 617-621), Merchant et al. (Nat. Biotech. (1998) 16, 677-681)).
Более того, известные способы получения биспецифических антител включают способы, в которых для связывания тяжелых цепей используются средства, регулирующие ассоциацию полипептидов или ассоциацию с образованием гетеромерных мультимеров, состоящих из полипептидов. В частности, для получения биспецифических антител можно использовать способы регуляции ассоциации тяжелых цепей путем изменения аминокислотных остатков, образующих поверхность контакта между тяжелыми цепями, так чтобы образовывалось две тяжелых цепи с различными последовательностями, при одновременном ингибировании ассоциации тяжелых цепей, обладающих идентичными последовательностями (WO 2006/106905). Такие способы можно использовать для получения биспецифических антител.
В неограничивающем варианте осуществления настоящего изобретения два полипептида, составляющих Fc-область, происходящую из биспецифического антитела, описанного выше, можно пригодным образом использовать в качестве Fc-области, содержащейся в антигенсвязывающей молекуле. Более конкретно, можно пригодным образом использовать два полипептида, составляющих Fc-область, в которых в аминокислотной последовательности одного из полипептидов аминокислота в положении 349, как указано с помощью нумерации EU, представляет собой Cys и аминокислота в положении 366 представляет собой Trp, и в аминокислотной последовательности другого из полипептидов аминокислота в положении 356, как указано с помощью нумерации EU, представляет собой Cys, аминокислота в положении 366 представляет собой Ser, аминокислота в положении 368 представляет собой Ala, и аминокислота в положении 407 представляет собой Val.
В другом неограничивающем варианте осуществления настоящего изобретения два полипептида, составляющих Fc-область, в которых в аминокислотной последовательности одного из полипептидов аминокислота в положении 409 в соответствии с нумерацией EU представляет собой Asp, и в аминокислотной последовательности другого из полипептидов аминокислота в положении 399 в соответствии с нумерацией EU представляет собой Lys, можно пригодным образом использовать в качестве Fc-области. В указанном выше варианте осуществления, аминокислота в положении 409 может представлять собой Glu вместо Asp, и аминокислота в положении 399 может представлять собой Arg вместо Lys. Более того, в дополнение к аминокислоте Lys в положении 399, Asp можно пригодным образом добавлять в качестве аминокислоты в положении 360 или Asp можно пригодным образом добавлять в качестве аминокислоты в положении 392.
В другом неограничивающем варианте осуществления настоящего изобретения два полипептида, составляющих Fc-область, в которых в аминокислотной последовательности одного из полипептидов аминокислота в положении 370 в соответствии с нумерацией EU представляет собой Glu, и в аминокислотной последовательности другого из полипептидов аминокислота в положении 357 в соответствии с нумерацией EU представляет собой Lys, можно пригодным образом использовать в качестве Fc-области.
В другом неограничивающем варианте осуществления настоящего изобретения два полипептида, составляющих Fc-область, в которых в аминокислотной последовательности одного из полипептидов аминокислота в положении 439 в соответствии с нумерацией EU представляет собой Glu, и в аминокислотной последовательности другого из полипептидов аминокислота в положении 356 в соответствии с нумерацией EU представляет собой Lys, можно пригодным образом использовать в качестве Fc-области.
В другом неограничивающем варианте осуществления настоящего изобретения любой из вариантов осуществления, указанных ниже, в которых вышеуказанное объединено, можно пригодным образом использовать в качестве Fc-области:
(i) два полипептида, составляющих Fc-область, в которых в аминокислотной последовательности одного из полипептидов аминокислота в положении 409 в соответствии с нумерацией EU представляет собой Asp и аминокислота в положении 370 представляет собой Glu, и в аминокислотной последовательности другого из полипептидов аминокислота в положении 399 в соответствии с нумерацией EU представляет собой Lys и аминокислота в положении 357 представляет собой Lys (в этом варианте осуществления аминокислота в положении 370 в соответствии с нумерацией EU может представлять собой Asp вместо Glu, и аминокислота Asp в положении 392 в соответствии с нумерацией EU может быть использована вместо аминокислоты Glu в положении 370 в соответствии с нумерацией EU);
(ii) два полипептида, составляющих Fc-область, в которых в аминокислотной последовательности одного из полипептидов аминокислота в положении 409 в соответствии с нумерацией EU представляет собой Asp и аминокислота в положении 439 представляет собой Glu, и в аминокислотной последовательности другого из полипептидов аминокислота в положении 399 в соответствии с нумерацией EU представляет собой Lys и аминокислота в положении 356 представляет собой Lys (в этом варианте осуществления аминокислота Asp в положении 360 в соответствии с нумерацией EU, аминокислота Asp в положении 392 в соответствии с нумерацией EU, или аминокислота Asp в положении 439 в соответствии с нумерацией EU могут быть использованы вместо аминокислоты Glu в положении 439 в соответствии с нумерацией EU);
(iii) два полипептида, составляющих Fc-область, в которых в аминокислотной последовательности одного из полипептидов аминокислота в положении 370 в соответствии с нумерацией EU представляет собой Glu и аминокислота в положении 439 представляет собой Glu, и в аминокислотной последовательности других полипептидов аминокислота в положении 357 в соответствии с нумерацией EU представляет собой Lys и аминокислота в положении 356 представляет собой Lys; и
два полипептида, составляющих Fc-область, в которых в аминокислотной последовательности одного из полипептидов аминокислота в положении 409 в соответствии с нумерацией EU представляет собой Asp, аминокислота в положении 370 представляет собой Glu, и аминокислота в положении 439 представляет собой Glu, и в аминокислотной последовательности другого из полипептидов аминокислота в положении 399 в соответствии с нумерацией EU представляет собой Lys, аминокислота в положении 357 представляет собой Lys, и аминокислота в положении 356 представляет собой Lys (в этом варианте осуществления аминокислота в положении 370 в соответствии с нумерацией EU может не быть заменена на Glu, и более того, когда аминокислота в положении 370 не заменена на Glu, аминокислота в положении 439 может представлять собой Asp вместо Glu, или аминокислота Asp в положении 392 может быть использована вместо аминокислоты Glu в положении 439).
Кроме того, в другом неограничивающем варианте осуществления настоящего изобретения, два полипептида, составляющих Fc-область, в которых в аминокислотной последовательности одного из полипептидов аминокислота в положении 356 в соответствии с нумерацией EU представляет собой Lys, и в аминокислотной последовательности другого из полипептидов аминокислота в положении 435 в соответствии с нумерацией EU представляет собой Arg и аминокислота в положении 439 представляет собой Glu, также можно пригодным образом использовать.
В другом неограничивающем варианте осуществления настоящего изобретения также можно пригодным образом использовать два полипептида, составляющих Fc-область, в которых в аминокислотной последовательности одного из полипептидов аминокислота в положении 356 в соответствии с нумерацией EU представляет собой Lys и аминокислота в положении 357 представляет собой Lys, и в аминокислотной последовательности другого из полипептидов аминокислота в положении 370 в соответствии с нумерацией EU представляет собой Glu, аминокислота в положении 435 представляет собой Arg, и аминокислота в положении 439 представляет собой Glu.
Более того, в дополнение к упомянутому выше способу ассоциации гетерологичных тяжелых цепей также для получения антигенсвязывающих молекул, предусматриваемых в рамках настоящего изобретения, можно использовать упомянутый выше способ ассоциации гетерологичных тяжелых цепей, технологию CrossMab, которая известна как технология ассоциации гетерологичных тяжелых цепей, в которой легкую цепь, образующую вариабельную область, которая связывается с первым эпитопом, и легкую цепь, образующую вариабельную область, которая связывается со вторым эпитопом, соответственно ассоциируют с тяжелой цепью, образующей вариабельную область, которая связывается с первым эпитопом, и тяжелой цепью, образующей вариабельную область, которая связывается со вторым эпитопом (Scaefer et al. (Proc. Natl. Acad. Sci. U.S.A. (2011) 108, 11187-11192)).
Улучшение фармакокинетики
В рамках настоящего изобретения "способность элиминировать антигены из плазмы" относится к способности элиминировать из плазмы антигены, которые присутствуют в плазме, когда антигенсвязывающие молекулы вводят in vivo или когда антигенсвязывающие молекулы секретируются in vivo. Таким образом, в рамках настоящего изобретения "способность антигенсвязывающих молекул элиминировать антигены из плазмы увеличивается" означает, что, когда вводят антигенсвязывающие молекулы, скорость элиминации антигена из плазмы увеличивается по сравнению с тем, когда вводят антигенсвязывающую молекулу, содержащую антигенсвязывающий домен, антигенсвязывающая активность которого не варьирует в зависимости от концентраций ионов, антигенсвязывающую молекулу, содержащую FcRn-связывающий домен без активности связывания FcRn в условиях диапазона кислых значений pH, или антигенсвязывающую молекулу, содержащую связывающий Fcγ-рецептор домен без активности селективного связывания с Fcγ-рецептором. Определение того, увеличивается ли способность антигенсвязывающей молекулы элиминировать антигены из плазмы, можно проводить, например, путем введения растворимых антигенов и антигенсвязывающей молекулы in vivo, а затем измерения концентрации в плазме растворимого антигена после введения. Когда концентрация растворимых антигенов в плазме снижается после введения растворимых антигенов и антигенсвязывающих молекул, содержащих антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов, FcRn-связывающий домен, обладающий активностью связывания FcRn в условиях диапазона кислых значений pH, и связывающий Fcγ-рецептор домен, обладающий активностью селективного связывания с Fcγ-рецептором (селективный FcγR-связывающий домен), считают, что способность антигенсвязывающих молекул элиминировать антигены в плазме увеличивается. Растворимый антиген может представлять собой антиген, который связывается с антигенсвязывающей молекулой, или антиген, который не связывается с антигенсвязывающей молекулой в плазме, и его концентрация может быть определена как "концентрация в плазме антигена, связанного с антигенсвязывающей молекулой" или как "концентрация в плазме антигена, не связанного с антигенсвязывающей молекулой", соответственно (последняя является синонимом "концентрации свободного антигена в плазме"). "Общая концентрация антигена в плазме" означает сумму концентраций антигенов, связанных с антигенсвязывающими молекулами, и не связанных антигенов или "концентраций свободного антигена в плазме", которая представляет собой концентрацию антигенов, не связанных с антигенсвязывающими молекулами, или "концентрации свободного антигена в плазме", которая представляет собой концентрацию антигена, не связанного с антигенсвязывающей молекулой. Таким образом, концентрацию растворимого антигена можно определять как "концентрацию общего антигена в плазме". Различные способы измерения "общей концентрации антигена в плазме" или "концентрации свободного антигена в плазме" хорошо известны в данной области, как описано в настоящем описании далее.
В настоящем описании "усиление фармакокинетики", "улучшение фармакокинетики" и "превосходящая фармакокинетика" можно переформулировать как "усиление удержания в плазме (крови)", "улучшение удержания в плазме (крови)", "превосходящее удержание в плазме (крови)" и "пролонгированное удержание в плазме (крови)". Эти термины являются синонимами.
В настоящем описании "улучшение фармакокинетики" означает не только пролонгирование периода времени до элиминации из плазмы (например, пока антигенсвязывающая молекула не деградирует внутреклеточно и т.п. и может вернуться в плазму) после введения антигенсвязывающей молекулы человеку или не являющимся человеком животным, таким как мыши, крысы, обезьяны, кролики и собаки, но также пролонгирование удержания в плазме антигенсвязывающих молекул в форме, которая обеспечивает связывание антигена (например, в свободной от антигена форме антигенсвязывающей молекулы) в ходе периода введения до элиминации вследствие деградации. IgG человека, имеющий нативную Fc-область, может связываться с FcRn из не являющихся человеком животных. Например, мышь можно предпочтительно использовать для введения в целях подтверждения свойства антигенсвязывающей молекулы по изобретению, поскольку IgG человека, имеющий нативную Fc-область, может связываться с FcRn мыши прочнее, чем с FcRn человека (Int Immunol. (2001) 13(12):1551-1559). В качестве другого примера для подтверждения свойства антигенсвязывающей молекулы по изобретению, описанной далее, можно использовать мышь, в которой ее нативные гены FcRn разрушены и которая содержит трансген гена FcRn человека, подлежащий экспрессии (Methods Mol Biol. 2010; 602:93-104). В частности, "улучшение фармакокинетики" также включает пролонгирование периода времени до элиминации вследствие деградации антигенсвязывающей молекулы, не связанной с антигенами (свободная от антигена форма антигенсвязывающей молекулы). Антигенсвязывающая молекула в плазме не может связываться с новым антигеном, если антигенсвязывающая молекула уже связана с антигеном. Таким образом, чем более длительным является период времени, когда антигенсвязывающая молекула не связана с антигеном, тем более длительным является период времени, когда она может связываться с новым антигеном (более высокая вероятность связывания с другим антигеном). Это обеспечивает уменьшение периода времени, когда антиген свободен от антигенсвязывающей молекулы in vivo, и продление периода времени, когда антиген связан с антигенсвязывающей молекулой. Концентрация в плазме свободной от антигена формы антигенсвязывающей молекулы может увеличиваться и период времени, когда антиген связан с антигенсвязывающей молекулой, может продлеваться путем ускорения элиминации антигена из плазмы посредством введения антигенсвязывающей молекулы. В частности, в настоящем описании "улучшение фармакокинетики антигенсвязывающей молекулы" включает улучшение фармакокинетического параметра свободной от антигена формы антигенсвязывающей молекулы (любое из продления времени полужизни в плазме, продления среднего времени удержания в плазме и снижения клиренса из плазмы), продление периода времени, когда антиген связан с антигенсвязывающей молекулой, после введения антигенсвязывающей молекулы, и ускорение опосредуемой антигенсвязывающей молекулой элиминации из плазмы. Улучшение фармакокинетики антигенсвязывающей молекулы можно оценивать путем определения любого из параметров: время полужизни в плазме, среднее время удержания в плазме и клиренс из плазмы, для антигенсвязывающей молекулы или ее свободной от антигена формы ("Pharmacokinetics: Enshu-niyoru Rikai (Understanding through practice)" Nanzando). Например, концентрацию в плазме антигенсвязывающей молекулы или ее свободной от антигена формы определяют после введения антигенсвязывающей молекулы мышам, крысам, обезьянам, кроликам, собакам или человеку. Затем определяют каждый параметр. Когда время полужизни в плазме или среднее время удержания в плазме пролонгируются, можно считать, что фармакокинетика антигенсвязывающей молекулы в плазме повышается. Параметры можно определять способами, известными специалистам в данной области. Параметры можно оценивать соответствующим образом, например, с помощью некомпартментного анализа с использованием программного обеспечения для фармакокинетического анализа WinNonlin (Pharsight) в соответствии с инструкцией по применению. Концентрацию в плазме свободной от антигена антигенсвязывающей молекулы можно определять способами, известными специалистам в данной области, например, с использованием способа анализа, описанного в Clin Pharmacol. 2008 Apr; 48(4):406-417.
В рамках настоящего изобретения "улучшение фармакокинетики" также включает пролонгирование периода, когда антиген связан с антигенсвязывающей молекулой, после введения антигенсвязывающей молекулы. Оценку того, пролонгируется ли период, когда антиген связан с антигенсвязывающей молекулой после введения антигенсвязывающей молекулы, можно проводить путем определения концентрации в плазме свободного антигена. Заключение о пролонгировании можно делать, исходя из определенной концентрации в плазме свободного антигена или периода времени, требуемого для увеличения соотношения концентрации свободного антигена и общей концентрации антигена.
Концентрацию в плазме свободного антигена, не связанного с антигенсвязывающей молекулой, или соотношение концентрации свободного антигена и концентрации общего антигена можно определять способами, известными специалистам в данной области, например, способом, использованным в Pharm Res. 2006 Jan; 23(1):95-103. Альтернативно, когда антиген проявляет конкретную функцию in vivo, определение того, связан ли антиген с антигенсвязывающей молекулой, которая нейтрализует функцию антигена (антагонистическая молекула), можно проводить путем исследования того, нейтрализуется ли функция антигена. Оценку того, нейтрализуется ли функция антигена, можно проводить путем анализа маркера in vivo, который отражает функцию антигена. Оценку того, связан ли антиген с антигенсвязывающей молекулой, которая активирует функцию антигена (молекула-агонист), можно проводить путем анализа маркера in vivo, который отражает функцию антигена.
Определение концентрации в плазме свободного антигена и соотношения количества свободного антигена в плазме и количества общего антигена в плазме, анализ маркеров in vivo и сходные способы определения конкретно не ограничены; однако анализы предпочтительно проводят после того, как проходит определенный период времени после введения антигенсвязывающей молекулы. В рамках настоящего изобретения период после введения антигенсвязывающей молекулы конкретно не ограничен; специалисты в данной области могут определить соответствующий период, в зависимости от свойств и т.п. вводимой антигенсвязывающей молекулы. Такие периоды включают, например, одни сутки после введения антигенсвязывающей молекулы, трое суток после введения антигенсвязывающей молекулы, семь суток после введения антигенсвязывающей молекулы, 14 суток после введения антигенсвязывающей молекулы и 28 суток после введения антигенсвязывающей молекулы. В настоящем описании понятие "концентрация антигена в плазме" включает как "общую концентрацию антигена в плазме", которая представляет собой сумму концентрации антигена, связанного и не связанного антигенсвязывающей молекулой, так и "концентрацию свободного антигена в плазме", которая представляет собой концентрацию антигена, не связанного антигенсвязывающей молекулой.
Путем введения, в качестве антигенсвязывающей молекулы, антигенсвязывающей молекулы по настоящему изобретению общую концентрацию антигена в плазме можно снижать в 2 раза, в 5 раз, в 10 раз, в 20 раз, в 50 раз, в 100 раз, в 200 раз, в 500 раз, в 1000 раз или даже больше по сравнению с введением антигенсвязывающей молекулы, содержащей антигенсвязывающий домен, антигенсвязывающая активность которого не зависит от концентрации ионов, или антигенсвязывающей молекулы, содержащей Fc-область со сниженной активностью связывания FcγR, или по сравнению с тем, когда молекулу с антигенсвязывающим доменом по настоящему изобретению не вводят.
Молярное соотношение антиген/антигенсвязывающая молекула можно вычислять, как показано ниже;
величина A: Молярная концентрация антигена в каждый момент времени
величина B: Молярная концентрация антигенсвязывающей молекулы в каждый момент времени
величина C: Молярная концентрация антигена на молярную концентрацию антигенсвязывающей молекулы (молярное соотношение антиген/антигенсвязывающая молекула) в каждый момент времени
C=A/B.
Меньшая величина C указывает на более высокую эффективность элиминации антигена на антигенсвязывающую молекулу, в то время как более высокая величина C указывает на более низкую эффективность элиминации антигена на антигенсвязывающую молекулу.
Молярное соотношение антиген/антигенсвязывающая молекула можно вычислять, как описано выше.
Молярное соотношение антиген/антигенсвязывающая молекула можно снижать путем введения антигенсвязывающей молекулы по настоящему изобретению в 2 раз, в 5 раз, в 10 раз, в 20 раз, в 50 раз, в 100 раз, в 200 раз, в 500 раз, в 1000 раз или даже выше по сравнению с введением, в качестве антигенсвязывающей молекулы, антигенсвязывающей молекулы, содержащей антигенсвязывающий домен, антигенсвязывающая активность которого не варьирует в зависимости от концентраций ионов, антигенсвязывающей молекулы, содержащей FcRn-связывающий домен без активности связывания FcRn в условиях диапазона кислых значений pH, или антигенсвязывающей молекулы, содержащей связывающий Fcγ-рецептор домен без активности селективного связывания Fcγ-рецептора.
В рамках настоящего изобретения в качестве эталонной антигенсвязывающей молекулы, подлежащей сравнению с антигенсвязывающими молекулами по настоящему изобретению, используют антигенсвязывающую молекулу, содержащую антигенсвязывающий домен, антигенсвязывающая активность которого не варьирует в зависимости от концентраций ионов, антигенсвязывающую молекулу, содержащую FcRn-связывающий домен без активности связывания FcRn в условиях диапазона кислых значений pH, или антигенсвязывающую молекулу, содержащую связывающий Fcγ-рецептор домен без активности селективного связывания Fcγ-рецептора.
При оценке эффекта FcRn-связывающего домена, обладающего активностью связывания FcRn в условиях диапазона кислых значений pH, снижение общей концентрации антигена в плазме или молярное соотношение антиген/антитело можно оценивать либо с помощью модели совместной инъекции антигена и антитела, либо с помощью модели инфузии антигена в стационарном состоянии с использованием линии мышей 32 или линии мышей 276 с трансгенным FcRn человека (Jackson Laboratories, Methods Mol. Biol. (2010) 602, 93-104), когда антигенсвязывающая молекула не реагирует перекрестно с антигеном-аналогом мыши. Когда антигенсвязывающая молекула перекрестно реагирует с аналогом мыши, его можно оценивать просто путем инъекции антигенсвязывающей молекулы линии мышей 32 или линии мышей 276 с трансгенным FcRn человека (Jackson Laboratories). В модели совместной инъекции мыши вводят смесь антигенсвязывающей молекулы и антигена. В модели инфузии антигена в стационарном состоянии инфузионный насос, содержащий раствор антигена, имплантируют мыши для достижения постоянной концентрации антигена в плазме, а затем мыши инъецируют антигенсвязывающую молекулу. Исследуемую антигенсвязывающую молекулу вводят в той же дозировке. Общую концентрацию антигена в плазме, концентрацию свободного антигена в плазме и концентрацию антигенсвязывающей молекулы в плазме измеряют в соответствующий момент времени с использованием способа, известного специалистам в данной области.
Для оценки эффектов связывающего Fcγ-рецептор домена, обладающего активностью селективного связывания с Fcγ-рецепторами, когда антигенсвязывающая молекула не реагирует перекрестно с антигеном-аналогом мыши, общую концентрацию антигена в плазме или снижение молярного соотношения антиген/антитело можно оценивать либо с помощью модели одновременной инъекции антигена и антитела, либо с помощью модели инъекции антигена в стационарном состоянии с использованием традиционно используемых мышей C57BL/6J (Charles River Japan). Когда антигенсвязывающая молекула перекрестно реагирует с аналогом мыши, антигенсвязывающую молекулу можно просто инъецировать традиционно используемым мышам C57BL/6J (Charles River Japan) для проведения оценки.
В модели совместной инъекции смесь антигенсвязывающей молекулы и антигена вводят мышам. В модели инфузии антигена в стационарном состоянии, инфузионный насос, заполненный раствором антигена, имплантируют мышам для достижения постоянной концентрации антигена в плазме, а затем антигенсвязывающую молекулу инъецируют мышам. Исследуемые антигенсвязывающие молекулы вводят в той же дозировке. Общую концентрацию антигена в плазме, концентрацию свободного антигена в плазме и концентрацию антигенсвязывающей молекулы в плазме измеряют в соответствующие моменты времени с использованием способов, известных специалистам в данной области.
Общую концентрацию антигена в плазме или концентрацию свободного антигена в плазме и молярное соотношение антиген/антигенсвязывающая молекула можно измерять через 2, 4, 7, 14, 28, 56 или 84 суток после введения для оценки долговременного эффекта настоящего изобретения. Иными словами, долговременную концентрацию антигена в плазме определяют путем измерения общей концентрации антигена в плазме или концентрации свободного антигена в плазме и молярного соотношения антиген/антигенсвязывающая молекула через 2, 4, 7, 14, 28, 56 или 84 суток после введения антигенсвязывающей молекулы для оценки свойств антигенсвязывающей молекулы по настоящему изобретению. Определение того, обеспечивает ли антигенсвязывающая молекула, описанная в настоящем описании, снижение концентрации антигена в плазме или молярного соотношения антиген/антигенсвязывающая молекула, можно проводить путем оценки снижения в один или несколько моментов времени, описанных выше.
Общую концентрацию антигена или концентрацию свободного антигена в плазме и молярное соотношение антиген/антигенсвязывающая молекула можно измерять через 15 минут, 1, 2, 4, 8, 12 или 24 часа после введения, для оценки кратковременного эффекта настоящего изобретения. Иными словами, кратковременную концентрацию антигена в плазме определяют путем измерения общей концентрации антигена или концентрации свободного антигена в плазме и молярного соотношения антиген/антигенсвязывающая молекула через 15 минут, 1, 2, 4, 8, 12 или 24 часа после введения антигенсвязывающей молекулы для оценки свойства антигенсвязывающей молекулы по настоящему изобретению.
Путь введения антигенсвязывающей молекулы по настоящему изобретению можно выбирать из внутрикожной, внутривенной, проводимой внутрь стекловидного тела, подкожной, внутрибрюшинной, парентеральной и внутримышечной инъекции.
В рамках настоящего изобретения предпочтительным является улучшение фармакокинетики антигенсвязывающей молекулы у человека. Когда время удержания в плазме трудно определить, его можно прогнозировать на основе времени удержания в плазме у мышей (например, нормальные мыши, экспрессирующие антиген человека трансгенные мыши, экспрессирующие FcRn человека трансгенные мыши) или у обезьян (например, яванские макаки).
"Улучшение фармакокинетики и пролонгированное время удержания в плазме антигенсвязывающей молекулы" в рамках настоящего изобретения означает улучшение любого фармакокинетического параметра (любой из пролонгирования времени полужизни в плазме, пролонгирования среднего времени удержания в плазме, уменьшения клиренса из плазмы и биодоступности) после введения антигенсвязывающей молекулы in vivo, или увеличение концентрации антигенсвязывающей молекулы в плазме в соответствующий момент времени после введения. Его можно определять путем измерения любого параметра, такого как время полужизни в плазме, среднее время удержания в плазме, клиренс из плазмы и биодоступность антигенсвязывающей молекулы (Pharmacokinetics: Enshu-niyoru Rikai (Understanding through practice), (Nanzando)). Например, когда антигенсвязывающую молекулу вводят мышам (нормальные мыши и мыши с трансгенным FcRn человека), крысам, обезьянам, кроликам, собакам, людям и т.д., и концентрацию антигенсвязывающей молекулы в плазме определяют и вычисляют каждый из параметров, фармакокинетику антигенсвязывающей молекулы можно считать улучшенной, когда время полужизни в плазме или среднее время удержания в плазме являются увеличенными. Эти параметры можно определять способами, известными специалистам в данной области. Например, параметры можно соответствующим образом оценивать с помощью некомпартментного анализа с использованием программного обеспечения для анализа фармакокинетики WinNonlin (Pharsight) в соответствии с прилагаемыми инструкциями.
У мышей было идентифицировано четыре типа FcγR: FcγRI, FcγRIIb, FcγRIII и FcγRIV. У человека также в качестве соответствующих FcγR были идентифицированы FcγRI, FcγRIIa, FcγRIIb, FcγRIIIa, FcγRIIIa и FcγRIIIb. FcγRIIb, который считается только ингибиторным типом среди этих FcγR, является консервативным как у человека, так и у мышей. Другие FcγR, за исключением FcγRIIIb, передают сигналы активации через иммунорецепторный тирозиновый активирующий мотив (ITAM), в то время как FcγRIIb передает ингибиторные сигналы через иммунорецепторный тирозиновый ингибиторный мотив (ITIM), присутствующий внутри клеток (Nat. Rev. Immunol. (2008) 8, 34-47).
FcγRIIb1 и FcγRIIb2 описаны в качестве вариантов по сплайсингу FcγRIIb. Как у человека, так и у мышей, FcγRIIb1 имеет более длинный внутриклеточный домен, чем FcγRIIb2. Было подтверждено, что FcγRIIb1 экспрессируется в B-клетках, и было подтверждено, что FcγRIIb2 экспрессируется в макрофагах, тучных клетках, дендритных клетках, базофилах, нейтрофилах и эозинофилах (J. Clin. Immunol. (2005) 25(1), 1-18).
До настоящего времени было описано, что у человека дисфункция и сниженная экспрессия FcγRIIb коррелирует с возникновением аутоиммунных заболеваний. Например, было описано, что у некоторых пациентов с SLE связывание активаторов транскрипции ослаблено вследствие полиморфизма в области промотора экспрессии FcγRIIb, что приводит к сниженной экспрессии FcγRIIb (Hum. Genet. (2005) 117, 220-227; J. Immunol. (2004) 172, 7192-7199; и J. Immunol. (2004) 172, 7186-7191). Более того, среди пациентов с SLE описано два типа аллотипов, где аминокислота в положении 233 представляет собой Ile или Thr в FcγRIIb. Это положение находится в трансмембранной области FcγRIIb, и, согласно сообщениям, FcγRIIb менее вероятно существует в липидном рафте, когда аминокислота в положении 233 представляет собой Thr по сравнению с тем, когда аминокислота представляет собой Ile, и в результате, функция передачи сигнала FcγRIIb снижается (Nat. Med. (2005) 11, 1056-1058; Hum. Mol. Genet., (2005) 14, 2881-2892). Равным образом у мышей, сообщалось, что у мышей с нокаутом, полученных путем нарушения гена FcγRIIb у мышей C57BL/6, присутствуют SLE-подобные симптомы, такие как продукция аутоантител и гломерулонефрит (Immunity 13 (2000) 277-285; J. Exp. Med. (2002) 195, 1167-1174). Более того, до настоящего времени был описан сниженный уровень экспрессии FcγRIIb и т.п. у мышей, которых считают моделями с естественным возникновением SLE (Immunogenetics (2000) 51, 429-435; Int. Immunol. (1999) 11, 1685-1691; Curr. Biol. (2000) 10, 227-230; J. Immunol. (2002) 169, 4340-4346). Из этих сообщений считается, что FcγRIIb регулирует гуморальный иммунитет у мышей, как и у человека.
Когда антитело, содержащее Fc по настоящему изобретению, элиминирует антигены через FcγRIIb, считается, что функция эндоцитоза FcγRIIb вносит наиболее важный вклад среди функций FcγRIIb. Как описано выше, FcγRIIb1 и FcγRIIb2 существуют в качестве вариантов по сплайсингу FcγRIIb, однако описано, что последний в основном вовлечен в эндоцитоз иммунокомплекса антитела и антигена (J. Immunol. (1994), 152, 574-585; Science (1992) 256, 1808-1812; Cell (1989) 58, 317-327). До настоящего времени сообщалось, что FcγRIIb2 мыши включен в покрытое клатрином углубление и подвергается эндоцитозу (Cell (1989) 58, 317-327). Более того, сообщалось, что дилейциновый мотив является необходимым для опосредуемого FcγRIIb2 эндоцитоза, и дилейциновый мотив является консервативным, как у человека, так и у мышей (EMBO J. (1994) 13 (13), 2963-2969). Исходя из этого, FcγRIIb2 может обладать активностью эндоцитоза у человека, как и у мышей.
С другой стороны, в отличие от FcγRIIb2, сообщалось, что FcγRIIb1 не вызывает эндоцитоза. FcγRIIb1 обладает встроенной последовательностью в его внутриклеточном домене, который не встречается в FcγRIIb2. Считается, что эта последовательность ингибирует захват FcγRIIb1 в покрытое клатрином углубление и в результате ингибируется эндоцитоз (J. Cell. Biol. (1992) 116, 875-888; J. Cell. Biol. (1989) 109, 3291-3302). Равным образом у человека FcγRIIb1 обладает последовательностью вставки в участке, сходном с участком FcγRIIb2, как и у мышей; таким образом, предположительно, отличие в способности к эндоцитозу между FcγRIIb1 и FcγRIIb2 обеспечивается сходным механизмом. Более того, сообщалось, что как у человека, так и у мышей приблизительно 40% иммунокомплексов на поверхности клеток захватываются в клетку в течение 20 минут (Mol. Immunol. (2011) 49, 329-337; Science (1992) 256, 1808-1812). Таким образом, равным образом у человека FcγRIIb2 предположительно захватывает иммунокомплексы в клетки на уровнях, сходных с мышами.
Поскольку FcγRIIb является единственным, который имеет ITIM внутри клетки, как у человека, так и у мышей, среди семейства FcγR и распределение экспрессирующих клеток является одинаковым, предположительно, их функция в иммунном контроле является сходной. Более того, учитывая тот факт, что иммунокомплексы захватывается в клетки на сходных уровнях у человека и у мышей, эффекты антител в отношении элиминации антигена, опосредуемые FcγRIIb, у человека могут быть предсказуемыми с использованием мышей. Антигенсвязывающие молекулы mF44 и mF46 обладают свойствами связывания с растворимыми антигенами pH-зависимым образом и обладают усиленной аффинностью в отношении FcγRIIb и FcγRIII мыши по сравнению с mIgG1, который является антигенсвязывающей молекулой, обладающей свойством связывания растворимого антигена pH-зависимым образом. Действительно, в примере 5 показано, что выведение антигена возрастало, когда mF44 или mF46 вводили нормальным мышам по сравнению с тем, когда вводили mIgG1.
Более того, в описанном ниже примере 6 сходный эксперимент проводили с использованием мышей с дефицитом γ-цепи Fc-рецептора. Сообщалось, что FcγR, отличные от FcγRIIb, экспрессируются только в совместном присутствии гамма-цепи у мышей. Таким образом, только FcγRIIb экспрессируется у мышей с дефицитом γ-цепи Fc-рецептора. Введение mF44 или mF46, которые являются антигенсвязывающими молекулами, обладающими свойством связывания с растворимыми антигенами pH-зависимым образом, мышам с дефицитом γ-цепи Fc-рецептора позволяет оценку эффектов ускорения элиминации антигена, когда связывание FcγRIIb селективно усиливалось. Из результатов примера 6, когда mF44 или mF46 (которые являются антигенсвязывающими молекулами, обладающими свойством связывания растворимых антигенов pH-зависимым образом) вводили мышам с дефицитом γ-цепи Fc-рецептора, было показано, что выведение антигена было увеличено по сравнению с тем, когда мышам вводили mIgG1 (который является антигенсвязывающей молекулой, обладающей свойством связывания с растворимыми антигенами pH-зависимым образом). Более того, результаты примера 6 демонстрируют, что при введении мышам с дефицитом γ-цепи Fc-рецептора mF44 или mF46 вызывают сходную степень элиминации антигена по сравнению с нормальными мышами.
В примере 6 проводили сходный эксперимент с использованием мышей с дефицитом FcγRIII. Поскольку mIgG1, mF44 и mF46 связываются только с FcγRIIb и FcγRIII среди mFcγR, введение антител мышам с дефицитом FcγRIII позволяет оценку эффектов ускорения элиминации антигена, когда связывание FcγRIIb селективно усилено. Результаты примера 6 указывают на то, что, когда mF44 или mF46 вводили мышам с FcγRIII, выведение антигена увеличивалось по сравнению с тем выведением антигена у мышей, когда им вводили mIgG1. Более того, результаты примера 6 показали, что при введении мышам с дефицитом FcγRIII mF44 и mF46 обеспечивают сходные степени элиминации антигена по сравнению с тем, когда их вводили мышам с дефицитом γ-цепи Fc-рецептора и при введении нормальным мышам.
Эти результаты показали, что элиминация антигена может быть ускорена посредством усиления селективного связывания с FcγRIIb отдельно без усиления связывания с активными FcγR.
В дополнение к сообщенным документам, рассмотренным до настоящего времени, на основе упомянутых выше результатов оценки с использованием мышей, считается, что захват иммунокомплексов в клетки через FcγRIIb происходит in vivo у человека, как и у мышей, и в результате антитела, которые обладают Fc с селективно усиленным связыванием с FcγRIIb человека, могут ускорять элиминацию его антигенов. Более того, как рассмотрено выше, поскольку считается, что захват иммунокомплексов в клетки через FcγRIIb происходит при сходных скоростях у мышей и человека, эффекты ускорения элиминации антигена по сравнению с эффектами антител, имеющих Fc с усиленной аффинностью в отношении FcγRIIb мыши, могут быть достигнуты in vivo у человека с использованием Fc, в которой аффинность в отношении FcγRIIb человека усилена до сходной степени.
Как описано в WO 2009/125825, Fv4-IgG1 представляет собой антитело, которое является результатом сообщения гуманизированному антителу против рецептора IL-6 H54/L28-IgG1 активности связывания с антигеном pH-зависимым образом, т.е. изменения вариабельной области так, чтобы сообщить ей свойство связывания с антигеном при pH 7,4 и диссоциации от антигена при pH 5,8. В WO 2009/125825 показано, что элиминация растворимого рецептора IL-6 человека значительно ускорена у мышей, которым совместно вводили IgG1 Fv4 и растворимый рецептор IL-6 человека в качестве антигена, по сравнению с мышами, которым вводили совместно H54/L28-IgG1 и антиген. В этом случае, тяжелая цепь H54-IgG1 и легкая цепь L28-CK, включенные в H54/L28-IgG1, представлены в SEQ ID NO: 36 и SEQ ID NO: 37, соответственно; и тяжелая цепь VH3-IgG1 и легкая цепь VL3-CK, включенные в Fv4-IgG1, представлены в SEQ ID NO: 38 и SEQ ID NO: 39, соответственно.
Растворимый рецептор IL-6 человека, связанный с антителом H54/L28-IgG1, которое связывается с растворимым рецептором IL-6 человека, рециклирует в плазму вместе с антителом через FcRn. Между тем, антитело Fv4-IgG1, которое связывается с растворимым рецептором IL-6 человека pH-зависимым образом, диссоциирует от растворимого рецептора IL-6 человека, который связался с антителом в кислых условиях в эндосоме. Поскольку диссоциированный растворимый рецептор IL-6 человека деградируется в лизосоме, элиминация растворимого рецептора IL-6 человека может быть значительно ускорена, и антитело Fv4-IgG1, которое связывается с растворимым рецептором IL-6 человека pH-зависимым образом, рециклирует в плазму после связывания с FcRn в эндосоме. Поскольку рециклированное антитело может вновь связываться с растворимым рецептором IL-6 человека, связывание с антигеном (растворимый рецептор IL-6 человека) и рециклирование в плазму через FcRn повторяется. В результате одна молекула антитела может многократно связываться с растворимым рецептором IL-6 человека множество раз (фиг. 1).
С другой стороны, как описано в рамках настоящего изобретения, было обнаружено, что концентрация в плазме растворимого антигена может быть значительно снижена посредством введения антигенсвязывающей молекулы с усиленной активностью связывания FcγR связывающего Fcγ-рецептор домена, включенного в антигенсвязывающую молекулу, которая содержит антигенсвязывающий домен, антигенсвязывающая активность которого изменяется в зависимости от условий концентрации ионов, такой как pH, FcRn-связывающий домен, обладающий активностью связывания FcRn в условиях диапазона кислых значений pH, и связывающий Fcγ-рецептор домен.
Не ограничиваясь конкретной теорией, неожиданное снижение концентрации растворимого антигена в плазме, наблюдаемое при введении антигенсвязывающей молекулы с усиленным связыванием с FcγR, которая содержит антигенсвязывающий домен, антигенсвязывающая активность которого изменяется в зависимости от условий концентрации ионов, таких как pH, и FcRn-связывающий домен, обладающий активностью связывания FcRn в условиях диапазона кислых значений pH, может быть объяснено следующим образом.
Как описано выше, антигенсвязывающая молекула, такая как Fv4-IgG1, содержащая антигенсвязывающий домен, антигенсвязывающая активность которого изменяется в зависимости от условий концентрации ионов, может быть способна неоднократно связываться с антигеном множество раз, однако эффект диссоциации растворимого антигена в эндосоме в отношении ускорения элиминации антигена из плазмы может зависеть от скорости захвата комплекса антигена и антигенсвязывающей молекулы в эндосому. Антигенсвязывающие молекулы с усиленной активностью связывания с различными FcγR, которые содержат антигенсвязывающий домен, в котором антигенсвязывающая активность изменяется в зависимости от условий концентрации ионов, активно захватываются в клетки посредством связывания с различными FcγR, экспрессируемыми на клеточной мембране, и могут вновь циркулировать в плазме посредством рециклирования через связывание между FcRn и FcRn-связывающим доменом в молекуле, обладающей активностью связывания с FcRn, в условиях диапазона кислых значений pH. Более конкретно, поскольку упомянутые выше антигенсвязывающие молекулы, которые образовали комплексы с растворимыми антигенами в плазме, активно захватываются в клетки через FcγR, экспрессируемые на клеточной мембране, эффект ускорения элиминации растворимых антигенов в плазме может быть более выраженным, чем у антигенсвязывающих молекул, активность связывания которых с различными FcγR не усилена.
FcγR-связывающая активность антител, которые связываются с мембранными антигенами, играет важную роль в цитотоксической активности антител. Таким образом, когда цитотоксическая активность необходима для антитела, подлежащего применению в качестве фармацевтического средства, используют IgG1-изотип человека, который обладает высокой активностью связывания FcγR, и широко используют способ усиления активности связывания FcγR антител для усиления цитотоксической активности антитела. С другой стороны, роль FcγR-связывающей активности антител, которые связываются с растворимыми антигенами и которые используют в качестве фармацевтических средств, не известна, и отличия в физиологических эффектах на организмы, которым вводили IgG1 человека с высокой активностью связывания FcγR и IgG2 человека и IgG4 человека с низкой активностью связывания FcγR, вследствие их отличий в активности связывания FcγR, до настоящего времени полностью не исследовались. Как описано ниже в разделе "Примеры", было в действительности подтверждено, что в плазме индивидуумов, которым вводили антитела, активность связывания которых с FcγR была утрачена, не было влияния на изменения концентрации растворимого антигена. С другой стороны, в рамках настоящего изобретения было обнаружено, что концентрация растворимых антигенов в плазме значительно снижена у индивидуумов, которым вводили антигенсвязывающие молекулы, обладающие усиленной активностью связывания FcγR и содержащие антигенсвязывающий домен, активность связывания которого с растворимыми антигенами изменяется в зависимости от условий концентрации ионов. Более конкретно, посредством комбинирования FcRn-связывающего домена, обладающего активностью связывания FcRn в условиях диапазона кислых значений pH и антигенсвязывающим доменом, связывание которого с растворимыми антигенами изменяется в зависимости от условий концентрации ионов, которые представляют собой домены, включенные в антигенсвязывающие молекулы, нацеленные на растворимые антигены, впервые было выявлено преимущество усиления связывания с FcγR.
Способ элиминации антигенов из плазмы ex vivo
Пример неограничивающего варианта осуществления применения антигенсвязывающей молекулы для способа элиминации антигенов из плазмы, который предусматривается настоящим изобретением, включает применение антигенсвязывающей молекулы для так называемого способа элиминации антигенов из плазмы ex vivo, который включает контактирование антигенсвязывающей молекулы по настоящему изобретению с плазмой, выделенной от индивидуумов, чтобы позволить образование иммунокомплексов, и позволение иммунокомплексам контактировать с клетками, экспрессирующими Fcγ-рецепторы и FcRn. Скорость элиминации антигенов плазмы может быть увеличена посредством замены/комбинирования способа введения антигенсвязывающих молекул in vivo с так называемым способом ex vivo, где плазму, содержащую антигенсвязывающие молекулы и антигены, которые связываются с антигенсвязывающими молекулами, временно извлекают из живого организма, а затем контактируют с клетками, экспрессирующими Fcγ-рецепторы и FcRn, и плазму, содержащую внеклеточно рециклированные (или также называемые ресекретированными или рециркулированными) антигенсвязывающие молекулы без связанного антигена после определенного периода времени, возвращают в живой организм.
Более того, пример неограничивающего варианта осуществления применения антигенсвязывающей молекулы для способа элиминации антигенов из плазмы, который предусматривается в рамках настоящего изобретения, включает применение антигенсвязывающей молекулы для так называемого способа элиминации антигенов из плазмы ex vivo, который включает контактирование иммунокомплексов, присутствующих в плазме, выделенной от индивидуумов, которым вводили антигенсвязывающие молекулы по настоящему изобретению, с клетками, экспрессирующими FcRn и Fcγ-рецепторы.
Подтверждение того, элиминируются ли антигены из плазмы, можно проводить, например, посредством оценки того, увеличивается ли скорость элиминации из плазмы антигенов, по сравнению с тем, когда вместо антигенсвязывающей молекулы по настоящему изобретению в качестве контроля используют антигенсвязывающую молекулу, содержащую антигенсвязывающий домен, антигенсвязывающая активность которого не варьирует в зависимости от концентраций ионов, антигенсвязывающую молекулу, содержащую FcRn-связывающий домен, без активности связывания FcRn в условиях диапазона кислых значений pH, или антигенсвязывающую молекулу, содержащую связывающий Fсγ-рецептор домен без активности селективного связывания с Fсγ-рецептором.
Способы получения антигенсвязывающих молекул
Настоящее изобретение относится к способу получения антигенсвязывающей молекулы, обладающей функцией элиминации антигенов из плазмы, где способ включает стадии (a)-(e), ниже:
(a) получение антигенсвязывающего домена, антигенсвязывающая активность которого варьирует в зависимости от условий концентрации ионов;
(b) получение гена, кодирующего антигенсвязывающий домен, выбранный на стадии (a);
(c) функциональное связывание гена, полученного на стадии (b), с геном, кодирующим FcRn-связывающий домен, обладающий активностью связывания FcRn в условиях диапазона кислых значений pH, и связывающий Fcγ-рецептор домен, обладающий активностью селективного связываания с Fcγ-рецептором;
(d) культивирование клеток-хозяев, содержащих ген, функционально связанный на стадии (c); и
(e) выделение антигенсвязывающей молекулы из культурального раствора, полученного на стадии (d).
В неограничивающем варианте осуществления настоящего изобретения после выделения полинуклеотида, кодирующего антигенсвязывающий домен, активность связывания которого изменяется в зависимости от условий, выбранных, как описано выше, полинуклеотид встраивают в соответствующий экспрессирующий вектор. Например, когда антигенсвязывающий домен представляет собой вариабельную область антитела, после получения кДНК, кодирующей вариабельную область, кДНК расщепляют ферментами рестрикции, которые распознают участки, встроенные на двух концах кДНК. Предпочтительно, ферменты рестрикции распознают и расщепляют нуклеотидную последовательность, которая появляется с низкой частотой в нуклеотидной последовательности, составляющей ген антигенсвязывающей молекулы. Более того, предпочтительно встраивают участки ферментов рестрикции, которые обеспечивают липкие концы, для встраивания одной копии расщепленного фрагмента в вектор в правильной ориентации. кДНК, кодирующую вариабельную область антигенсвязывающей молекулы, расщепленной, как описано выше, встраивают в соответствующий экспрессирующий вектор с получением экспрессирующего вектора для антигенсвязывающей молекулы по настоящему изобретению.
Полинуклеотид, кодирующий антигенсвязывающий домен, полученный, как описано выше, функционально связывают с геном, кодирующим FcRn-связывающий домен, обладающий активностью связывания FcRn в условиях диапазона кислых значений pH, и связывающий Fcγ-рецептор домен, обладающий активностью селективного связывания с Fcγ-рецептором, которые описаны в разделах "FcRn-связывающий домен, обладающий активностью связывания FcRn в условиях диапазона кислых значений pH" и "связывающий Fcγ-рецептор домен, обладающий активностью селективного связывания с Fcγ-рецептором", соответственно. При связывании гены можно прямо связывать в рамке считывания, или полинуклеотиды, кодирующие каждый домен, можно связывать в рамке считывания через линкеры. В дополнение к каждому из упомянутых выше доменов, они могут быть функционально связаны с геном, кодирующим FcγR-связывающий домен, описанный в упомянутом выше разделе "FcγR-связывающий домен".
Когда антитело используют в качестве антигенсвязывающей молекулы по настоящему изобретению, полинуклеотид, кодирующий Fc-область антитела, можно соответствующим образом использовать в качестве упомянутого выше "FcRn-связывающего домена, обладающего активностью связывания FcRn в условиях диапазона кислых значений pH и связывающего Fcγ-рецептор домена, обладающего активностью селективного связывания с Fcγ-рецептором". Также можно использовать Fc-области, в которых "активность связывания FcRn в условиях диапазона кислых значений pH" и "активность селективного связывания с Fcγ-рецептором" соответствующим образом модифицированы посредством модификации полинуклеотидов. Примеры неограничивающих вариантов осуществления таких модификаций представлены в упомянутых выше разделах "FcRn-связывающий домен, обладающий активностью связывания FcRn в условиях диапазона кислых значений pH" и "связывающий Fcγ-рецептор домен, обладающий активностью селективного связывания с Fcγ-рецептором", соответственно.
Для получения представляющей интерес антигенсвязывающей молекулы полинуклеотид, кодирующий антигенсвязывающую молекулу, встраивают в экспрессирующий вектор так, чтобы он был функционально связан с регуляторной последовательностью. Регуляторные последовательности включают, например, энхансеры и промоторы. Более того, соответствующую сигнальную последовательность можно связывать с N-концом так, чтобы экспрессируемая антигенсвязывающая молекула секретировалась наружу клеток. В качестве сигнальной последовательности используют, например, пептид, обладающий аминокислотной последовательностью MGWSCIILFLVATATGVHS (SEQ ID NO: 4); однако также можно связывать другие подходящие сигнальные последовательности. Экспрессируемый полипептид расщепляется на C-конце описанной выше последовательности, и отщепленный полипептид секретируется в качестве зрелого полипептида наружу клеток. Затем соответствующие клетки трансформируют этим экспрессирующим вектором так, чтобы можно было получить рекомбинантные клетки, экспрессирующие полинуклеотид, кодирующий представляющую интерес антигенсвязывающую молекулу. Антигенсвязывающие молекулы по настоящему изобретению можно получать из рекомбинантных клеток с помощью способов, описанных выше в разделе об антителах.
Для нуклеиновой кислоты термин "функционально связанный" означает, что нуклеиновая кислота имеет функциональную взаимосвязь с другой последовательностью нуклеиновой кислоты. Например, ДНК, кодирующая препоследовательность или секреторную лидерную последовательность, функционально связана с ДНК, кодирующей определенный полипептид, если он экспрессируется в качестве белка-предшественника, который участвует в секреции полипептида. Промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию кодирующей последовательности. Участок связывания рибосом функционально связан с кодирующей последовательностью, если он расположен так, чтобы способствовать трансляции. Обычно выражение "функционально связанный" означает, что связанные последовательности ДНК являются смежными и, в случае секреторного лидера, оно означает, что связанные последовательности ДНК являются смежными и находятся в рамке считывания. Однако энхансеры не должны быть смежными. Связывание осуществляют посредством лигирования в подходящих участках рестрикции. Если такие участки не существуют, используют синтетические олигонуклеотидные адаптеры или линкеры в соответствии с общепринятой практикой. Более того, связанные нуклеиновые кислоты можно получать с помощью упомянутой выше технологии перекрывающейся ПЦР.
В неограничивающем варианте осуществления настоящего изобретения после выделения полинуклеотида, кодирующего описанную выше антигенсвязывающую молекулу, антигенсвязывающая активность которой варьирует в зависимости от выбранных условий, вариант полинуклеотида встраивают в подходящий экспрессирующий вектор. Такие варианты предпочтительно включают варианты, полученные гуманизацией на основе полинуклеотидной последовательности, кодирующей антигенсвязывающую молекулу по настоящему изобретению, полученную путем скрининга в качестве рандомизированной библиотеки вариабельных областей, синтетической библиотеки или иммунной библиотеки, сконструированной на основе последовательностей, происходящих из не являющихся человеком животных. Те же способы, которые описаны выше для получения описанных выше гуманизированных антител, можно использовать в качестве способа получения гуманизированных вариантов антител.
В другом варианте осуществления такие варианты предпочтительно включают варианты, полученные путем внесения изменения, которое повышает аффинность к антигену (созревание аффинности) антигенсвязывающей молекулы по настоящему изобретению, в выделенную полинуклеотидную последовательность для молекулы, полученной путем скрининга с использованием синтетической библиотеки или наивной библиотеки в качестве рандомизированной библиотеки вариабельных областей. Такие варианты можно получать широко известными способами созревания аффинности, включающими мутагенез CDR (Yang et al. (J. Mol. Biol. (1995) 254, 392-403)), шаффлинг цепей (Marks et al. (Bio/Technology (1992) 10, 779-783)), применение мутантных штаммов E. coli (Low et al. (J. Mol. Biol. (1996) 250, 359-368)), шаффлинг ДНК (Patten et al. (Curr. Opin. Biotechnol. (1997) 8, 724-733)), фаговый дисплей (Thompson et al. (J. Mol. Biol. (1996) 256, 77-88)) и половую ПЦР (Clameri et al. (Nature (1998) 391, 288-291)).
В одном из вариантов осуществления настоящего изобретения, полинуклеотиды, кодирующие антигенсвязывающие молекулы, которые имеют тяжелую цепь, где полинуклеотид, кодирующий Fc-область, модифицированную так, чтобы она имела аминокислотную мутацию, как описано выше, связывают в рамке считывания с полинуклеотидом, кодирующим описанный выше антигенсвязывающий домен, активность связывания которого варьирует в зависимости от выбранных условий.
Настоящее изобретение относится к способам получения антигенсвязывающих молекул, включающим сбор антигенсвязывающих молекул из культуральной среды клеток, в которые введены векторы, в которых полинуклеотид, кодирующий Fc-область, функционально связан в рамке считывания с полинуклеотидом, кодирующим антигенсвязывающий домен, активность связывания которого варьирует в зависимости от условий концентрации ионов. Более того, настоящее изобретение также относится к способам получения антигенсвязывающих молекул, включающим сбор антигенсвязывающих молекул из культуральной среды клеток, в которые введены векторы, сконструированные путем функционального связывания полинуклеотида, кодирующего антигенсвязывающий домен, активность связывания которого варьирует в зависимости от условий концентрации ионов, с полинуклеотидом, кодирующим Fc-область, которая заранее функционально связана с вектором.
В "способах получения антигенсвязывающих молекул" по настоящему изобретению можно использовать известные способы в качестве способов оценки элиминации антигена из плазмы антигенсвязывающими молекулами. Антигенсвязывающую молекулу по настоящему изобретению вводят каждой группе не являющихся человеком животных, таких как мыши, в соответствующем возрасте в месяцах. Как описано ниже в разделе "фармацевтическая композиция", антигенсвязывающую молекулу можно системно или местно вводить путем внутривенной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции, подкожной инъекции, внутричерепной инъекции и т.п., в качестве композиций в дозированной форме для инъекций, трансназального введения, транспульмонарного введения или трансдермального введения.
Для измерения концентраций можно использовать спектроскопические способы, такие как анализы с использованием ядерного магнитного резонанса (NMR) или масс-спектрометрии (MS), включающие SELDI(-TOF), MALDI(-TOF), 1D-анализ на основе геля, 2D-анализ на основе геля, жидкостную хроматографию (например, высокоэффективную жидкостную хроматографию (ВЭЖХ) или жидкостную хроматографию низкого давления (LPLC)), тонкослойную хроматографию, и способы на основе LC-MS. Примеры соответствующих способов LCMS включают ICAT (зарегистрированный торговый знак) (Applied Biosystems) и iTRAQ (зарегистрированный торговый знак) (Applied Biosystems). Также в соответствующих случаях можно использовать способ определения фрагментов антител, которые получены дальнейшим расщеплением антигена-мишени соответствующим ферментом. Более того, концентрацию антигена можно измерять с помощью прямого или непрямого способа обнаружения. Более конкретно, антиген можно выявлять прямо или непрямо посредством взаимодействия с лигандом или лигандами, такими как ферменты, связываемые рецепторы или транспортные белки, антитела, пептиды, аптамеры или олигонуклеотиды, или любые синтетические химические рецепторы или соединения, которые могут специфично связываться с антигеном. Лиганд можно модифицировать поддающейся обнаружению меткой, такой как люминесцентная метка, флуоресцентная метка или радиоактивная метка и/или аффинная метка. В качестве примера может быть приведен иммунологический способ.
Предпочтительный способ измерения может представлять собой, например, иммунологический способ, в котором используется антитело, которое связывается с эпитопом, присутствующим в антигене. Примеры такого иммунологического способа включают иммуноферментный анализ (ELISA, EIA), флуоресцентный иммуноанализ (FIA), радиоиммунный анализ (RIA), люминесцентный иммуноанализ (LIA), технологию фермент-антитело, технологию флуоресцентных антител, способ иммунохроматографии, иммунотурбодиметрию, латексную турбидиметрию и способ измерения с агглютинацией латекса. Более того, измерение в этих иммунологических способах можно проводить вручную или с использованием устройства, такого как анализатор. Иммунологический способ в рамках настоящего изобретения можно осуществлять в соответствии с известным способом, таким как сэндвич-способ. Например, первому антителу, иммобилизованному на носителе, позволяют реагировать одновременно или последовательно с биологическим образцом и вторым антителом, модифицированным веществом для мечения. Упомянутая выше реакция приводит к образованию комплекса, содержащего первое антитело, иммобилизованное на носителе, антиген и второе антитело, модифицированное веществом для мечения, и количественное определение вещества для мечения, связанного со вторым антителом, включенным в этот комплекс, позволяет измерение количества (концентрации) антигена, включенного в биологический образец.
Например, в случае иммуноферментного анализа предпочтительно используют микропланшет, на котором иммобилизовано первое антитело, серийно разбавленные биологические образцы, вторичное антитело, модифицированное ферментом, таким как HRP, промывочный буфер, и раствор, содержащий субстрат, с которым реагирует фермент, такой как HRP. В неограничивающем варианте осуществления измерения субстрату позволяют реагировать в оптимальных условиях с ферментом, который модифицирует вторичное антитело, и количество продукта фермента реакции можно определять оптическим способом. В случае флуоресцентного иммуноанализа предпочтительно используют оптический волновод, на котором иммобилизовано первое антитело, серийно разбавленные биологические образцы, вторичное антитело, модифицированное флуоресцентным веществом, и промывочный буфер. В неограничивающем варианте осуществления измерения, измеряют интенсивность флуоресценции, испускаемой флуоресцентным веществом посредством облучения возбуждающим светом флуоресцентного вещества, модифицирующего вторичное антитело.
Более того, в случае радиоиммунного анализа измеряют величину радиоактивного излучения, испускаемого радиоактивным веществом. В случае люминесцентного иммуноанализа измеряют величину люминесценции, испускаемой люминесцентной реакционной системой. Более того, в случае иммунотурбидиметрии, латексной турбидиметрии, способа измерения с агглютинацией латекса и т.п., измеряют проходящий свет или рассеянный свет способом по конечной точке или способом скоростей. Когда иммунохроматографические измерения проводят с помощью визуального исследования, цвет меченого вещества, который появляется на тест-полоске, определяют с помощью визуального исследования. Вместо такого измерения с помощью визуального исследования, при необходимости можно использовать устройство, такое как анализатор.
Фармацевтическая композиция
Настоящее изобретение относится к фармацевтическим композициям, содержащим антигенсвязывающие молекулы по настоящему изобретению, антигенсвязывающим молекулам, полученным способами изменения по настоящему изобретению, или антигенсвязывающим молекулам, полученным способами получения по настоящему изобретению. Антигенсвязывающие молекулы по настоящему изобретению или антигенсвязывающие молекулы, полученные способами получения по настоящему изобретению, пригодны в качестве фармацевтических композиций, поскольку они при введении обладают мощным эффектом снижения концентрации антигена в плазме по сравнению с типичными антигенсвязывающими молекулами, и проявляют улучшенный иммунный ответ in vivo, фармакокинетику и т.п. у животных, которым вводят молекулы. Фармацевтические композиции по настоящему изобретению могут содержать фармацевтически приемлемые носители.
В рамках настоящего изобретения фармацевтические композиции, как правило, относятся к средствам для лечения или профилактики или исследования/диагностики заболеваний.
Фармацевтические композиции по настоящему изобретению могут быть составлены способами, известными специалистам в данной области. Например, их можно использовать парентерально в форме инъекций стерильных растворов или суспензий, включающих воду или другую фармацевтически приемлемую жидкость. Например, такие композиции могут быть составлены путем смешения в форме единичной дозы, требуемой повсеместно одобренной практикой производства лекарственных средств, путем комбинирования надлежащим образом с фармакологически приемлемыми носителями или средами, в частности, со стерильной водой, физиологическим раствором, растительным маслом, эмульгатором, суспензией, поверхностно-активным веществом, стабилизатором, вкусовой добавкой, эксципиентом, носителем, консервантом, связующим веществом и т.п. В таких составах количество активного ингредиента корректируют так, чтобы получить соответствующее количество в заданном диапазоне.
Стерильные композиции для инъекций могут быть составлены с использованием носителей, таких как дистиллированная вода для инъекций, в соответствии со стандартной практикой составления.
Водные растворы для инъекций включают, например, физиологический солевой раствор и изотонические растворы, содержащие декстрозу или другие адъюванты (например, D-сорбит, D-маннозу, D-маннит и хлорид натрия). Также их можно использовать в комбинации с соответствующими солюбилизаторами, например, спиртами (этанол и т.п.), полиспиртами (пропиленгликоль, полиэтиленгликоль и т.п.), неионными поверхностно-активными веществами (полисорбат 80(TM), HCO-50 и т.п.).
Масла включают кунжутное масло и соевые масла. В комбинации с солюбилизаторами можно использовать бензилбензоат и/или бензиловый спирт. Также можно комбинировать буферы (например, фосфатный буфер и натрий-ацетатный буфер), успокаивающие средства (например, прокаина гидрохлорид), стабилизаторы (например, бензиловый спирт и фенол) и/или антиоксиданты. Полученными инъекционными препаратами заполняют подходящие ампулы.
Фармацевтические композиции по настоящему изобретению предпочтительно вводят парентерально. Например, вводят композиции в дозированной форме для инъекций, трансназального введения, введения через легкие или чрескожного введения. Например, их можно вводить системно или локально путем внутривенной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции, подкожной инъекции и т.п.
Способы введения можно надлежащим образом выбирать, учитывая возраст и симптомы пациента. Доза фармацевтической композиции, содержащей антигенсвязывающую молекулу, может составлять, например, от 0,0001 до 1000 мг/кг для каждого введения. Альтернативно, доза может составлять, например, от 0,001 до 100000 мг на пациента. Однако настоящее изобретение не ограничивается числовыми величинами, описанными выше. Дозы и способы введения варьируют, в зависимости от массы тела пациента, возраста, симптомов и т.п. Специалисты в данной области могут установить подходящие дозы и способы введения, учитывая факторы, описанные выше.
Более того, настоящее изобретение относится к наборам для применения в способах по настоящему изобретению, которые содержат по меньшей мере одну антигенсвязывающую молекулу по настоящему изобретению. В дополнение к вышеуказанному, в наборы могут быть упакованы фармацевтически приемлемые носители, среды, эксплуатационная документация, в которой описано использование способа и т.п.
Более того, настоящее изобретение относится к фармацевтическим средствам для элиминации из плазмы комплексов, содержащих два или более антигенсвязывающих элементов и две или более антигенсвязывающих молекул, присутствующих в плазме, которые содержат в качестве активного ингредиента антигенсвязывающие молекулы по настоящему изобретению или антигенсвязывающие молекулы, полученные способом получения по настоящему изобретению.
Настоящее изобретение относится к способам лечения заболевания, которые включают введение индивидуумам (пациентам, людям и т.д.) антигенсвязывающих молекул по настоящему изобретению или антигенсвязывающих молекул, полученных способами получения по настоящему изобретению. Неограничивающий пример заболевания включает злокачественную опухоль и воспалительные заболевания.
Настоящее изобретение также относится к применению антигенсвязывающих молекул по настоящему изобретению или антигенсвязывающих молекул, полученных способами получения по настоящему изобретению, для изготовления фармацевтического средства для элиминации из плазмы комплексов, содержащих два или более антигенных связывающих элементов и две или более антигенсвязывающих молекул, присутствующих в плазме.
Кроме того, настоящее изобретение относится к применению антигенсвязывающих молекул по настоящему изобретению или антигенсвязывающим молекулам, полученным способами получения по настоящему изобретению, для элиминации из плазмы комплексов, содержащих два или более антигенных связывающих элементов и две или более антигенсвязывающих молекул, присутствующих в плазме.
Кроме того, настоящее изобретение относится к антигенсвязывающим молекулам по настоящему изобретению и антигенсвязывающим молекулам, полученным способами получения по настоящему изобретению, для применения в способах по настоящему изобретению.
Аминокислоты, содержащиеся в аминокислотных последовательностях по настоящему изобретению, могут быть посттрансляционно модифицированными (например, модификация N-концевого глутамина в пироглутаминовую кислоту путем пироглутамилирования хорошо известна специалистам в данной области). Естественно, такие посттрансляционно модифицированные аминокислоты включены в аминокислотные последовательности по настоящему изобретению.
Все цитированные в описании документы уровня техники включены в настоящее описание в качестве ссылок. Ниже настоящее изобретение конкретно описано с помощью примеров, однако его не следует считать ограниченным ими.
[Примеры]
[Пример 1] Получение антигенсвязывающих молекул, активность связывания FcγR мыши которых в условиях диапазона нейтральных значений pH является более высокой, чем активность связывания нативной Fc-области IgG человека
(1-1) Антитела с pH-зависимым связыванием рецептора IL-6 человека
H54/L28-IgG1, которое содержит H54-IgG1 (SEQ ID NO: 36) и L28-CK (SEQ ID NO: 37), описанное в WO2009/125825, представляет собой гуманизированное антитело против рецептора IL-6. Между тем, Fv4-IgG1, которое содержит VH3-IgG1 (SEQ ID NO: 38) и VL3-CK (SEQ ID NO: 39), представляет собой гуманизированное антитело против рецептора IL-6, которое получили путем сообщения H54/L28-IgG1 свойства связывания с растворимым рецептором IL-6 человека pH-зависимым образом (который связывается при pH 7,4 и диссоциирует при pH 5,8). Исследование на мышах in vivo, описанное в WO 2009/125825, продемонстрировало, что в группе, в которой вводили смесь Fv4-IgG1 и растворимого рецептора IL-6 человека в качестве антигена, элиминация растворимого рецептора IL-6 человека из плазмы была значительно ускорена по сравнению с группой, в которой вводили смесь H54/L28-IgG1 и растворимого рецептора IL-6 человека в качестве антигена.
Растворимый рецептор IL-6 человека, связанный с H54/L28-IgG1, который представляет собой антитело, которое связывается с растворимым рецептором IL-6 человека, вместе с другим антителом рециклирует в плазму посредством FcRn. Между тем, Fv4-IgG1, которое представляет собой антитело, которое связывается с растворимым рецептором IL-6 человека pH-зависимым образом, диссоциирует от растворимого рецептора IL-6 человека в кислых условиях в эндосоме. Диссоциировавший растворимый рецептор IL-6 человека деградируется в лизосомах, и, таким образом, это обеспечивает значительное ускорение элиминации растворимого рецептора IL-6 человека. Более того, после связывания с FcRn в эндосоме, Fv4-IgG1, которое представляет собой антитело, которое связывается с растворимым рецептором IL-6 человека pH-зависимым образом, рециклирует в плазму. Поскольку рециклированное антитело может вновь связываться с растворимым рецептором IL-6 человека, антитело многократно связывается с антигеном (растворимый рецептор IL-6 человека) и рециклирует посредством FcRn в плазму. Полагают, что в результате единичная молекула антитела может повторно связываться несколько раз с растворимым рецептором IL-6 человека (фиг. 1).
(1-2) Получение антитела против рецептора IL-6 человека с усиленным связыванием FcγR мыши и антитела против рецептора IL-6 без связывания FcγR мыши
VH3-IgG1-F1022 (SEQ ID NO: 40), антигенсвязывающую молекулу с усиленным связыванием FcγR мыши, получали путем замены Lys на Asp в положении 326 (нумерация EU) и Leu на Tyr в положении 328 (нумерация EU) в VH3-IgG1. Fv4-IgG1-F1022, содержащее VH3-IgG1-F1022 в качестве тяжелой цепи и VL3-CK в качестве легкой цепи, получали с использованием способа, описанного в справочном примере 1.
Между тем, VH3-IgG1-F760 (SEQ ID NO: 41), антигенсвязывающую молекулу без связывания FcγR мыши, получали путем замены Leu на Arg в положении 235 и Ser на Lys в положении 239 (нумерация EU) в VH3-IgG1. Fv4-IgG1-F760, содержащее VH3-IgG1-F760 в качестве тяжелой цепи и VL3-CK в качестве легкой цепи, получали с использованием способа, описанного в справочном примере 1.
(1-3) Оценка связывания FcγR мыши
VH3/L(WT)-IgG1, VH3/L(WT)-IgG1-F1022 и VH3/L(WT)-IgG1-F760, которые содержал VH3-IgG1, VH3-IgG1-F1022 и VH3-IgG1-F760 в качестве тяжелой цепи и L(WT)-CK (SEQ ID NO: 42) в качестве легкой цепи, получали с использованием способа, описанного в справочном примере 1. Эти антитела подвергали кинетическому анализу в отношении их связывания FcγR мыши, как описано ниже.
(1-4) Кинетический анализ связывания FcγR мыши
Проводили кинетический анализ связывания антител с FcγRI, FcγRIIb, FcγRIII и FcγRIV мыши (далее обозначаемыми как FcγR мыши) (R & D systems, SinoBiological, или полученные способом, описанным в справочном примере 2) с использованием Biacore T100 и T200 (GE Healthcare). Соответствующее количество белка L (ACTIGEN или Bio Vision) иммобилизовывали на сенсорный чип CM4 (GE Healthcare) способом присоединения аминов, и представляющие интерес антитела улавливали на него. Затем инжектировали разбавленные растворы FcγR мыши и подвижный буфер в качестве пустого образца и FcγR мыши позволяли взаимодействовать с антителами, уловленными на сенсорный чип. Использованный подвижный буфер представлял собой 20 ммоль/л ACES, 150 ммоль/л NaCl, 0,05% (масс./об.) Tween20, pH 7,4. Этот буфер также использовали для разбавления FcγR мыши. Сенсорный чип регенерировали с использованием 10 ммоль/л глицин-HCl, pH 1,5. Все измерения проводили при 25°C. Константу скорости связывания ka (1/Мс) и константу скорости диссоциации kd (1/с), которые являются параметрами кинетики, вычисляли из сенсограмм, полученных посредством измерения. На основе этих величин вычисляли KD (M) каждого антитела в отношении FcγR человека. Каждый параметр вычисляли с использованием программного обеспечения Biacore T100 или T200 Evaluation Software (GE Healthcare).
Посредством измерения был получен результат, представленный в таблице 6. Было продемонстрировано, что VH3/L (WT)-IgG1-F1022 обладает увеличенной активностью связывания с mFcγRI, mFcγRIIb и mFcγRIII по сравнению с VH3/L (WT)-IgG1. Что касается VH3/L (WT)-IgG1-F760, связывание с различными FcγR мыши не поддавалось обнаружению, что демонстрирует, что VH3/L (WT)-IgG1-F760 лишено активности связывания с различными FcγR мыши. В таблице VH3/L (WT)-IgG1, VH3/L (WT)-IgG1-F1022 и VH3/L (WT)-IgG1-F760 представлены в качестве IgG1, F1022 и F760, соответственно.
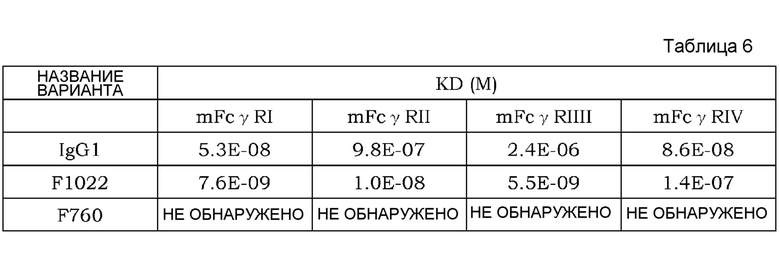
(1-5) Получение антител с низким содержанием фукозы
Известные способы увеличения активности связывания FcγR антител включают способы преобразования цепей сахаров, связанных с антителом, в цепи сахаров с низким содержанием фукозы (J. Biol. Chem. (2003) 278, 3466-3473), в дополнение к способам внесения изменения аминокислот в Fc-область антитела. Fv4-IgG1 с низким содержанием фукозы (далее сокращенно обозначаемое как Fv4-IgG1-Fuc) приобретали посредством экспрессии Fv4-IgG1 с использованием клеток CHO с дефицитом гена переносчика фукозы (WO 2006/067913) в качестве клеток-хозяев в соответствии со способом, описанным в справочном примере 4. Сообщалось, что, среди mFcγR (Fcγ-рецепторы мыши), антитела с низким содержанием фукозы обладают селективно увеличенной активностью связывания FcγRIV (Science, 2005, 310 (5753) 1510-1512).
[Пример 2] Эффект элиминации антигенов из плазмы посредством антигенсвязывающих молекул, активность связывания с FcγR которых является более высокой, чем активность связывания нативной Fc-области IgG человека
(2-1) Эффект H54/L28-IgG1 и Fv4-IgG1 в отношении элиминации антигенов из плазмы
H54/L28-IgG1, которое представляет собой антитело против рецептора IL-6 человека, и Fv4-IgG1, обладающее свойством связывания с рецептором IL-6 человека pH-зависимым образом, получали способом, описанным в справочном примере 1. Исследования инфузии in vivo проводили с использованием полученных H54/L28-IgG1 и Fv4-IgG1 способом, описанным ниже.
(2-1-1) Инфузионные исследования in vivo с использованием трансгенных мышей с FcRn человека
Модель на животных, в которой концентрация растворимого рецептора IL-6 человека поддерживается постоянной в плазме, создавали посредством имплантации инфузионного насоса (MINI-OSMOTIC PUMP MODEL2004, alzet), содержащего растворимый рецептор IL-6 человека, под кожу спины трансгенных мышей с FcRn человека (B6.mFcRn-/-.hFcRn Tg линия 32 +/+ мышь, Jackson Laboratories, Methods Mol Biol. (2010) 602, 93-104). В модели на животных оценивали динамику in vivo после введения антитела против рецептора IL-6 человека. Для подавления продукции нейтрализующих антител против растворимого рецептора IL-6 человека, моноклональное антитело против CD4 мыши (полученное известным способом) вводили один раз в количестве 20 мг/кг в хвостовую вену. Затем в область спины мышей имплантировали инфузионный насос, содержащий 92,8 мкг/мл растворимого рецептора IL-6 человека. Через трое суток после имплантации инфузионного насоса вводили антитело против рецептора IL-6 человека один раз в сутки в дозе 1 мг/кг в хвостовую вену. Взятие крови от мышей проводили через 15 минут, семь часов, одни сутки, двое суток, четверо суток и семь суток после введения антитела против рецептора IL-6 человека. Сразу после этого собранную кровь центрифугировали при 15000 об./мин и 4°C в течение 15 минут с получением плазмы. Выделенную плазму хранили в морозильной камере, установленной на -20°C или ниже, до применения.
(2-1-2) Определение концентрации растворимого рецептора IL-6 человека hsIL-6R в плазме способом электрохемилюминесценции
Концентрации растворимого рецептора IL-6 человека hsIL-6R в плазме мыши определяли способом электролюминесценции. Образцы для кривой стандарта растворимого рецептора IL-6 человека hsIL-6R, полученные в концентрации 2000, 1000, 500, 250, 125, 62,5 и 31,25 пг/мл и образцы для анализа плазмы мыши, разбавленные в 50 раз или более, смешивали с моноклональным антителом против IL-6R человека (R&D), биотинилированным антителом против IL-6R человека (R&D), тоцилизумабом, рутенированным посредством SULFO-TAG NHS Ester (Meso Scale Discovery). Смеси инкубировали при 37°C в течение ночи. Тоцилизумаб приготавливали в конечной концентрации 333 мкг/мл. Затем реакционные смеси разделяли на аликвоты в планшете со стрептавидином MA400 PR (Meso Scale Discovery). Раствор, подвергаемый реакции при комнатной температуре в течение одного часа, смывали, а затем распределяли аликвотами буфер для считывания T (x4) (Meso Scale Discovery). Сразу после этого проводили измерение с использованием устройства для считывания SECTOR PR 400 Reader (Meso Scale Discovery). Концентрацию рецептора IL-6 человека hsIL-6R определяли на основе ответа по стандартной кривой с использованием аналитического программного обеспечения SOFTmax PRO (Molecular Devices).
Мониторинг концентрации рецептора IL-6 человека с течением времени представлен на фиг. 2. По сравнению с H54/L28-IgG1, Fv4-IgG1, которое связывается с рецептором IL-6 человека pH-зависимым образом, могло снизить концентрацию рецептора IL-6 человека, но не могло снизить ее ниже исходного уровня без введения антитела. Следовательно, введенное антитело, которое связывается с антигеном pH-зависимым образом, не могло снижать концентрацию антигена ниже уровня до введения антитела.
(2-2) Эффект элиминации антигена из плазмы посредством антитела с увеличенной или сниженной активностью связывания FcγR
То, влияет ли на концентрацию рецептора IL-6 человека с течением времени увеличение или снижение активности Fv4-IgG1, которое представляет собой антитело с pH-зависимым связыванием рецептора IL-6 человека, в отношении связывания FcγR, оценивали способом, описанным ниже. С использованием Fv4-IgG1, Fv4-IgG1-F760, Fv4-IgG1-F1022 и Fv4-IgG1-Fuc, полученных, как описано в примере 1, проводили испытания с инфузией in vivo способом, описанным ниже.
(2-2-1) Испытания с инфузией in vivo с использованием трансгенных мышей с FcRn человека
Модель на животных, в которой концентрация растворимого рецептора IL-6 человека поддерживается постоянной в плазме, создавали посредством имплантации инфузионного насоса (MINI-OSMOTIC PUMP MODEL2004, alzet), содержащего растворимый рецептор IL-6 человека, под кожу спины трансгенных мышей с FcRn человека (B6.mFcRn-/-.hFcRn Tg линия 32 +/+ мышь, Jackson Laboratories, Methods Mol Biol. (2010) 602, 93-104). В модели на животных антитело против рецептора IL-6 человека вводили одновременно с Sanglopor (CSL Behring), который представляет собой препарат иммуноглобулинов, для оценки динамики in vivo растворимого рецептора IL-6 человека после введения антитела. Для подавления продукции нейтрализующих антител против растворимого рецептора IL-6 человека, моноклональное антитело против CD4 мыши (полученное известным способом) вводили один раз в количестве 20 мг/кг в хвостовую вену. Затем в область спины мышей имплантировали инфузионный насос, содержащий 92,8 мкг/мл растворимого рецептора IL-6 человека. Через трое суток после имплантации инфузионного насоса вводили антитело против рецептора IL-6 человека и Sanglopor один раз в дозе 1 мг/кг и 1000 мг/кг, соответственно, в хвостовую вену. Взятие крови от мышей проводили через 15 минут, семь часов, одни сутки, двое суток, четверо суток, семь суток, 14 суток и 21 сутки после введения антитела против рецептора IL-6 человека. Взятие крови от мышей проводили через 15 минут, семь часов, одни сутки, двое суток, трое суток, семь суток, 14 суток и 21 сутки после введения антитела против рецептора IL-6 человека. Сразу после этого собранную кровь центрифугировали при 15000 об./мин и 4°C в течение 15 минут с получением плазмы. Выделенную плазму хранили в морозильной камере, установленной на -20°C или ниже, до применения.
(2-2-2) Определение концентрации растворимого рецептора IL-6 человека (hsIL-6R) в плазме способом электрохемилюминесценции
Концентрации растворимого рецептора IL-6 человека hsIL-6R в плазме мыши определяли способом электролюминесценции, как описано в (2-1-2).
Результат представлен на фиг. 3. Было продемонстрировано, что концентрация рецептора IL-6 человека в плазме мыши с течением времени, которым вводили Fv4-IgG1-F760, в котором устранено связывание Fv4-IgG1 с FcγR мыши, является сравнимой с концентрацией у мышей, которым вводили Fv4-IgG1. Цитотоксическая активность в отношении мембранного антигена зависит от связывания FcγR, и такая цитотоксическая активность утрачивается при устранении связывания FcγR. С другой стороны, даже при введении антитела, в котором устранено связывание FcγR мыши, против рецептора IL-6 человека, который представляет собой растворимый антиген, отсутствовал эффект на концентрацию рецептора IL-6 человека в плазме с течением времени у мышей, которым проводили введение. Таким образом, можно было предположить, что связывание антитела против растворимого антигена с FcγR не вносило вклад в концентрацию антигена с течением времени в плазме мышей, которым вводили антитело.
Однако неожиданно концентрация рецептора IL-6 человека в плазме мышей, которым вводили Fv4-IgG1-F1022 с усиленным связыванием FcγR мыши, была значительно снижена по сравнению с концентрацией рецептора IL-6 человека в плазме мышей, которым вводили Fv4-IgG1. Что касается степени снижения, было подтверждено, что концентрация снизилась ниже исходной концентрации рецептора IL-6 человека без введения антитела. В частности, концентрация рецептора IL-6 человека в плазме мышей, которым вводили Fv4-IgG1-F1022, была снижена до приблизительно 1/100 через трое суток после введения по сравнению со случаем введения Fv4-IgG1. Эти данные демонстрируют, что, посредством введения мышам антитела, которое связывается с рецептором IL-6 человека pH-зависимым образом и связывание с FcγR которого усилено, концентрация рецептора IL-6 человека в плазме мышей может быть снижена, и, что касается степени снижения, концентрация антигена в плазме может быть снижена ниже уровня до введения антитела.
Более того, было продемонстрировано, что, по сравнению с мышами, которым вводили Fv4-IgG1, концентрация рецептора IL-6 человека в плазме была снижена у мышей с Fv4-IgG1-Fuc, которое имеет цепь сахаров с низким содержанием фукозы и обладает увеличенной активностью связывания FcγR IV мыши. В частности, концентрация рецептора IL-6 человека в плазме мышей, которым вводили Fv4-IgG1-Fuc, была снижена приблизительно до 1/2 через семь суток после введения по сравнению со случаем введения Fv4-IgG1. Указанные выше данные демонстрируют, что, посредством введения мышам pH-зависимой антигенсвязывающей молекулы, которая связывается с рецептором IL-6 человека pH-зависимым образом и связывание с FcγR которой усилено, концентрация растворимого антигена в плазме мышей может быть снижена. В этом случае способы усиления связывания FcγR конкретно не ограничиваются внесением аминокислотных изменений. Было продемонстрировано, что такое усиление может быть достигнуто, например, с использованием Fc-области IgG человека, с которой связана цепь сахаров с низким содержанием фукозы в положении 297 (нумерация EU); однако эффект Fv4-IgG1-Fuc в отношении снижения концентрации антигена был меньше, чем у Fv4-F1022. На основе этого результата полагали, что среди нескольких FcγR (FcγRI, II, III и IV для мыши), mFcγIV, с которым усилено связывание у Fv4-IgG1-Fuc, не вносит большого вклада в снижение концентрации антигена в качестве FcγR.
Таким образом, было выявлено, что, посредством введения индивидууму антитела, которое связывается с растворимым антигеном pH-зависимым образом и связывание которого с FcγR усилено, концентрация растворимого антигена в плазме индивидуума может быть значительно снижена.
Без связи с конкретной теорией, неожиданное снижение концентрации растворимого антигена в плазме, которое наблюдали при введении антигенсвязывающей молекулы, которая содержит антигенсвязывающий домен, связывание которого с FcγR усилено и антигенсвязывающая активность которого изменяется в зависимости от условий концентрации ионов, таких как pH, и FcRn-связывающий домен, который обладает активностью связывания FcRn в условиях диапазона кислых значений pH, может быть объяснено следующим образом.
IgG-антитела, которые неспецифически включаются в клетки, возвращаются на клеточную поверхность посредством связывания с FcRn в кислых условиях в эндосоме, а затем диссоциируют от FcRn в нейтральных условиях в плазме. В таком случае, когда антитело, которое нейтрализует функцию растворимого антигена посредством связывания с антигеном, вводят мышам, у которых концентрация растворимого антигена сохраняется постоянной в плазме, растворимый антиген в плазме образует комплекс с введенным антителом. Полагают, что растворимый антиген, включенный в клетки, оставаясь в качестве комплекса, рециклирует, в состоянии, связанном с антителом, в плазму вместе с антителом, поскольку Fc-область антитела связывается с FcRn в кислых условиях в эндосоме.
Между тем, когда антитело против растворимого антигена представляет собой антитело, которое связывается с антигеном pH-зависимым образом (т.е. антитело, которое диссоциирует от растворимого антигена в кислых условиях в эндосоме), растворимый антиген, который неспецифически включается в клетки, оставаясь в качестве комплекса с антителом, диссоциирует от антитела в эндосоме и деградируется в лизосоме клетки; таким образом, растворимый антиген не рециклирует в плазму. Следовательно, полагают, что Fv4-IgG1, включенное в качестве комплекса с растворимым антигеном в клетки, может диссоциировать от растворимого антигена в эндосоме и, таким образом, ускорять элиминацию растворимого антигена.
Как описано выше, полагают, что антигенсвязывающие молекулы, такие как Fv4-IgG1, которые содержат антигенсвязывающий домен, антигенсвязывающая активность которого изменяется в зависимости от концентрации ионов, способны связываться с антигенами многократно несколько раз. Полагают, что эффект ускорения элиминации растворимых антигенов из плазмы посредством диссоциации их в эндосоме зависит от скорости включения комплекса антиген/антигенсвязывающая молекула в эндосому. Антигенсвязывающая молекула, которая содержит антигенсвязывающий домен, активность связывания которого с различными FcγR увеличена, и антигенсвязывающая активность которых изменяется, в зависимости от условий концентрации ионов, активно включается в клетки посредством связывания с различными FcγR, экспрессируемыми на клеточной мембране, и может перемещаться обратно в плазму посредством рециклирования через связывание между FcRn и FcRn-связывающим доменом, содержащимся в молекуле, которая обладает активностью связывания FcRn в условиях диапазона кислых значений pH. Следовательно, полагают, что, поскольку указанная выше антигенсвязывающая молекула, которая образует комплекс с растворимым антигеном в плазме, активно включается в клетки через FcγR, экспрессируемый на клеточной мембране, ее эффект ускорения элиминации растворимого антигена из плазмы более выражен, чем у антигенсвязывающих молекул, активность связывания которых с различными FcγR не была увеличена.
Активность связывания с FcγR антитела, которое связывается с мембранным антигеном, играет важную роль в цитотоксической активности антитела. Таким образом, когда необходимо, чтобы антитело, используемое в качестве фармацевтического средства, обладало цитотоксической активностью, используют изотип IgG1 человека с высокой активностью связывания FcγR. Кроме того, способы усиления цитотоксической активности таких антител посредством увеличения активности связывания антител с FcγR широко используются в данной области.
Между тем, роль активности связывания с FcγR антител, которые связываются с растворимыми антигенами и которые используют в качестве фармацевтических средств, не была известна в данной области. Отсутствовала достаточная оценка того, какое отличие в эффекте на живой организм, в который вводили антитела, обеспечивается отличием в активности связывания с FcγR между IgG1 человека с высокой активностью связывания FcγR и IgG2 человека и IgG4 человека с низкой активностью связывания FcγR. Фактически, в настоящем примере было продемонстрировано, что отсутствовало влияние на концентрацию растворимого антигена в плазме с течением времени у индивидуумов, которым вводили антитело, которое лишено активности связывания FcγR. Между тем в рамках настоящего изобретения было выявлено, что концентрация растворимого антигена была значительно снижена в плазме индивидуумов, которым вводили антигенсвязывающую молекулу, активность связывания FcγR которой была увеличена и которая содержит антигенсвязывающий домен, антигенсвязывающая активность которого изменяется в зависимости от условий концентрации ионов. В частности, можно сказать, что авторы настоящего изобретения впервые выявили пользу усиления связывания FcγR посредством комбинирования FcRn-связывающего домена, который обладает активностью связывания FcRn в условиях диапазона кислых значений pH с антигенсвязывающим доменом, связывание которого с растворимым антигеном изменяется в зависимости от условий концентрации ионов, содержащимся в антигенсвязывающей молекуле, нацеленной на растворимый антиген.
[Пример 3] Эффект элиминации антигенов из плазмы антигенсвязывающими молекулами, активность связывания FcγR которых превышает активность нативной Fc-области IgG человека и активность связывания FcRn человека которых увеличена в условиях диапазона кислых значений pH
(3-1) Получение антигенсвязывающих молекул, активность связывания с FcγR которых превышает активность связывания нативной Fc-области IgG человека и активность связывания которых с FcRn человека увеличивается в условиях диапазона кислых значений pH
Описанным способом увеличения удержания IgG-антитела в плазме является повышение связывания FcRn в условиях диапазона кислых значений pH. Полагают, что, когда связывание FcRn в условиях диапазона кислых значений pH увеличивается посредством внесения аминокислотной замены в Fc-область IgG-антитела, это увеличивает эффективность рециклирования из эндосомы в плазму, что приводит к увеличению времени удержания в плазме IgG-антитела.
Существует множество сообщений об изменениях аминокислот для увеличения времени удержания в плазме посредством увеличения активности связывания FcRn человека в условиях диапазона кислых значений pH. Такие изменения включают, например:
способ замены Met на Leu в положении 428 и Asn на Ser в положении 434 (нумерация EU) в IgG-антителе (Nat. Biotechnol, (2010) 28, 157-159); способ замены Asn на Ala в положении 434 (Drug. Metab. Dispos. (2010) 38(4), 600-605); способ замены Met на Tyr в положении 252, Ser на Thr в положении 254 и Thr на Glu в положении 256 (J. Biol. Chem. (2006) 281, 23514-23524); способ замены Thr на Gln в положении 250 и Met на Leu в положении 428 (J. Immunol. (2006) 176(1) 346-356); способ замены Asn на His в положении 434 (Clin. Pharm. & Ther. (2011) 89(2) 283-290); и WO 2010/106180; WO 2010/045193; WO 2009/058492; WO 2008/022152; WO 2006/050166, WO 2006/053301, WO 2006/031370; WO 2005/123780; WO 2005/047327; WO 2005/037867; WO 2004/035752 и WO 2002/060919.
VH3-IgG1-F1093 (SEQ ID NO: 43) с заменой Met на Leu в положении 428 и Asn на Ser в положении 434 (нумерация EU) в VH3-IgG1-F1022 получали для улучшения фармакодинамики Fv4-IgG1-F1022, для которого было продемонстрировано, что оно при введении вызывает эффект значительного снижения концентрации растворимого антигена в плазме, как описано в примере 2. Fv4-IgG1-F1093, содержащее VH3-IgG1-F1093 в качестве тяжелой цепи и VL3-CK в качестве легкой цепи, конструировали с использованием способа, описанного в справочном примере 1.
(3-2) Эффект элиминации антигенов из плазмы посредством антигенсвязывающих молекул, активность связывания которых с FcγR является более высокой, чем у нативной Fc-области IgG человека и активность связывания которых с FcRn человека увеличена в условиях диапазона кислых значений pH
Испытание с инфузией in vivo проводили для Fv4-IgG1-F1093 тем же способом, как описано в примере (2-1-1), с использованием трансгенных мышей с FcRn человека, у которых концентрация растворимого рецептора IL-6 человека сохраняется постоянной в плазме. Концентрации растворимого рецептора IL-6 человека в плазме у мышей определяли способом, описанным в примере (2-1-2). Результат представлен на фиг.4.
(3-2-1) Определение концентрации антитела против рецептора IL-6 человека в плазме способом ELISA
Концентрации антитела против рецептора IL-6 человека в плазме мыши определяли с помощью ELISA. Сначала F(ab')2-фрагмент антитела против IgG человека (специфичный к γ цепи) (SIGMA) распределяли аликвотами в планшеты Nunc-Immuno Plate, MaxiSoup (Nalge nunc International). Планшету позволяли стоять в течение ночи при 4°C с получением планшетов, на которые иммобилизовано антитело против IgG человека. Получали образцы стандарта для кривой, содержащие антитело против рецептора IL-6 человека (концентрация в плазме: 0,8, 0,4, 0,2, 0,1, 0,05, 0,025 и 0,0125 мкг/мл) и образцы плазмы мыши для анализа, разбавленные в 100 раз или более. 100 мкл каждого образца для стандартной кривой и образца для анализа комбинировали с 200 мкл растворимого рецептора IL-6 человека в концентрации 20 нг/мл. Полученным смесям позволяли стоять при комнатной температуре в течение одного часа и распределяли аликвотами в каждую лунку планшета с иммобилизованным антителом IgG человека. Планшету позволяли стоять при комнатной температуре в течение другого часа. Затем биотинилированное антитело против IL-6R человека (R&D) подвергали реакции с ним при комнатной температуре в течение одного часа. Затем стрептавидин-PolyHRP80 (Stereospecific Detection Technologies) подвергали реакции с ним при комнатной температуре в течение одного часа. Хромогенную реакцию реакционного раствора проводили с использованием в качестве субстрата TMB One Component HRP Microwell Substrate (BioFX Laboratories). После завершения реакции с 1Н серной кислотой (Showa Chemical) измеряли поглощение при 450 нм реакционного раствора в каждой лунке с помощью устройства для считывания микропланшетов. Концентрации антител в плазме мыши определяли на основе поглощения стандартной кривой с использованием программного обеспечения для анализа SOFTmax PRO (Molecular Devices).
Результат представлен на фиг. 5.
(3-3) Улучшение фармакодинамики посредством увеличения активности связывания FcRn в условиях диапазона кислых значений pH
Как показано на фиг. 5, в группе, в которой вводили Fv4-IgG1-F1022, полученное усилением активности связывания Fv4-IgG1 с FcγR в условиях диапазона нейтральных значений pH, было продемонстрировано, что удержание в плазме введенного антитела является сниженным по сравнению с группой, в которой вводили Fv4-IgG1. Между тем, в группе, в которой вводили Fv4-IgG1-F1093, вследствие усиления активности связывания Fv4-IgG1-F1022 с FcRn человека в условиях диапазона кислых значений pH, было продемонстрировано, что удержание в плазме введенного антитела было значительно увеличено по сравнению с группой, в которой вводили Fv4-IgG1-F1022.
Более того, как показано на фиг.4, концентрация растворимого рецептора IL-6 человека в плазме с течением времени в группе введения Fv4-IgG1-F1022 была эквивалентной концентрации в группе введения Fv4-IgG1-F1093, вплоть до трех суток после введения антитела. На третьи сутки после введения по сравнению с группой введения Fv4-IgG1 концентрации растворимого рецептора IL-6 человека в плазме снижались вплоть до приблизительно 100 раз в группах введения как Fv4-IgG1-F1022, так и Fv4-IgG1-F1093. Однако на седьмые сутки после введения антитела наблюдали, что концентрация растворимого рецептора IL-6 человека в плазме повышена в группе введения Fv4-IgG1-F1022 по сравнению с третьими сутками после введения. С другой стороны, в группе введения Fv4-IgG1-F1093 не наблюдали увеличения концентрации в плазме растворимого рецептора IL-6 человека, что демонстрирует, что эффект снижения концентрации растворимого рецептора IL-6 человека был длительным в этой группе введения.
В частности, Fv4-IgG1-F1093, при введении, снижало концентрацию растворимого рецептора IL-6 человека в плазме у индивидуума после введения вплоть до приблизительно 1/100 по сравнению с Fv4-IgG1, и кроме того оно сохраняло это состояние в течение длительного периода времени. Таким образом, было продемонстрировано, что Fv4-IgG1-F1093 является превосходной антигенсвязывающей молекулой. Без связи с конкретной теорией, явление, наблюдаемое в этом случае, может быть объяснено следующим образом. Полагают, что Fv4-IgG1-F1022, в котором активность связывания Fv4-IgG1 с FcγR увеличена в условиях диапазона нейтральных значений pH, включается в большом количестве, в основном, в клетки, экспрессирующие FcγR на клеточной мембране. Включенное антитело переносится в эндосому и, посредством связывания с FcRn в эндосоме, антитело рециклирует в плазму. Полагают, что, когда активность связывания антитела с FcRn не является достаточно высокой в условиях кислых значений pH в эндосоме, антитело, включенное в эндосому, неспособно в достаточной степени рециклировать. В частности, возможной причиной сниженного удержания в плазме Fv4-IgG1-F1022 относительно Fv4-IgG1 является то, что активность связывания FcRn в условиях диапазона кислых значений pH является недостаточной для достаточного рециклирования включенного в эндосому антитела в плазму посредством связывания FcRn, и антитело, которое не рециклировало, деградировалось в лизосоме.
С другой стороны, полагают, что как и в случае Fv4-IgG1-F1022, Fv4-IgG1-F1093, полученное посредством усиления активности связывания Fv4-IgG1-F1022 с FcRn человека в условиях диапазона кислых значений pH, включается в большом количестве в основном в клетки, экспрессирующие FcγR на клеточной мембране. Антитело, включенное и перенесенное в эндосому, рециклирует в плазму посредством связывания с FcRn в эндосоме. Поскольку его активность связывания FcRn человека в условиях диапазона кислых значений pH усилена, полагают, что Fv4-IgG1-F1093 обладает достаточной активностью связывания FcRn в эндосоме. Таким образом, после включения в клетки большая часть Fv4-IgG1-F1093 рециклирует в плазму. Таким образом, можно было предположить, что удержание в плазме Fv4-IgG1-F1093 было увеличено у индивидуумов, которым проводили его введение, по сравнению с Fv4-IgG1-F1022.
С другой стороны, известно, что удержание в плазме обычных антител улучшается, когда повышена их активность связывания с FcRn в условиях диапазона кислых значений pH. Однако полагают, что, когда время удержания в плазме антитела увеличено, время удержания в плазме связанных с антителом антигенов также увеличено, и это приводит к увеличению концентрации антигена в плазме. В действительности, как описано в WO 2010/088444, антитело 18E, в которое внесено изменение YTE в антитело 18, которое представляет собой антитело IgG1 человека против IL-6, для увеличения активности связывания FcRn в условиях диапазона кислых значений pH, продемонстрировало увеличенное время удержания в плазме яванских макаков, и в то же время концентрация антигена IL-6 также была увеличена в плазме.
Однако неожиданно, при введении Fv4-IgG1-F1093, в которое внесено изменение, сходное с YTE, для увеличения активности связывания FcRn в условиях диапазона кислых значений pH в Fv4-F1022, которое связывается с антигеном pH-зависимым образом и имеет увеличенную активность связывания FcγR, время удержания антитела в плазме значительно увеличивалось у индивидуумов, которым проводили его введение, без увеличения концентрации растворимого рецептора IL-6 человека, который представляет собой антиген. Вместо этого, на седьмые сутки после введения антитела концентрация растворимого рецептора IL-6 человека оставалась низкой у индивидуумов, которым вводили Fv4-IgG1-F1093, по сравнению с индивидуумами, которым вводили Fv4-F1022.
Без связи с конкретной теорией, явление, наблюдаемое в этом случае, может быть объяснено следующим образом. При введении в живой организм антитело без pH-зависимого связывания антигена неспецифически включается в клетки. Антигены, которые остаются связанными с антителом, рециклируют в плазму в той же степени, как и антитело. Между тем, для антитела с увеличенной активностью связывания FcRn в условиях диапазона кислых значений pH, степень рециклирования в плазму у живого организма, которому вводили антитело, является более высокой, чем степень рециклирования антитела без увеличенной активности связывания FcRn, и это приводит к увеличенной степени рециклирования антител, связавшихся с антигеном в плазме живого организма. Таким образом, полагают, что вследствие увеличенного удержания в плазме антитела, введенного в живой организм, концентрация в плазме антигена, с которым связывается антитело, также увеличивается в живом организме.
Между тем, при введении в живой организм антитело, которое связывается с антигеном pH-зависимым образом и которое имеет увеличенную активность связывания FcγR, главным образом, включается в клетки, экспрессирующие FcγR на клеточной мембране, и это снижает удержание в плазме. Более того, после включения в клетки, в связанном с антителом состоянии антиген диссоциирует от антитела в эндосоме, а затем деградируется в лизосоме, что приводит к снижению концентрации антигена в плазме в живом организме. Когда активность связывания FcRn увеличивается в условиях диапазона кислых значений pH, время удержания антитела в плазме, даже если и снижается вследствие увеличенной активности связывания FcγR, увеличивается посредством увеличения скорости рециклирования посредством FcRn. В этом случае, поскольку полагают, что антиген, связанный с антителом, которое связывается с антигеном pH-зависимым образом, диссоциирует от антитела в эндосоме и прямо деградируется в лизосоме, концентрация антигена увеличивается в плазме. Более того, полагают, что увеличенное удержание в плазме антитела, введенного в живой организм, обеспечивает эффект длительной элиминации антитела и поддержание концентрации антигена низкой в течение более длительного периода времени.
Описанные выше данные демонстрируют, что время удержания в плазме введенного антитела увеличивается в живом организме, которому вводят антитело, где активность связывания FcRn человека в условиях диапазона кислых значений pH усилена в антигенсвязывающей молекуле, активность связывания FcγR которой является более высокой, чем у нативной Fc-области IgG человека. Более того, было выявлено, что в этом случае время удержания антитела в плазме увеличивается без ухудшения эффекта элиминации антигена.
[Пример 4] Дальнейшая оценка эффекта антигенсвязывающих молекул в отношении элиминации антигенов из плазмы, активность связывания которых с FcγR является более высокой, чем у нативной Fc-области IgG человека, и активность связывания у которых с FcRn человека увеличена в условиях диапазона кислых значений pH
(4-1) Эффект антитела, у которого усилена активность связывания FcγR, в отношении элиминации антигена
Как описано в примере 2, концентрация антигена в плазме была значительно снижена в группе, в которой вводили Fv4-IgG1-F1022 с усиленным связыванием FcγR мыши. Между тем, как показано в примере 3, сниженное время удержания в плазме, наблюдаемое в группе ведения Fv4-IgG1-F1022, значительно увеличивалось посредством увеличения активности связывания Fv4-IgG1-F1022 с FcRn человека в условиях диапазона кислых значений pH. Далее, дополнительно оценивали, как описано ниже, эффект элиминации растворимых антигенов из плазмы посредством усиленного связывания FcγR мыши и эффект увеличения времени удержания в плазме антитела посредством усиления активности связывания FcRn человека в условиях диапазона кислых значений pH.
(4-2) Получение антитела против рецептора IL-6 человека с усиленным связыванием FcγR мыши
VH3-IgG1-F1087 (SEQ ID NO: 44), полученное путем замены Lys на Asp в положении 326 (нумерация EU) в VH3-IgG1, и VH3-IgG1-F1182 (SEQ ID NO: 45), полученное путем замены Ser на Asp в положении 239 и Ile на Glu в положении 332 (нумерация EU) в VH3-IgG1, получали в качестве антигенсвязывающих молекул с усиленным связыванием FcγR мыши. Fv4-IgG1-F1087, которое содержит VH3-IgG1-F1087 в качестве тяжелой цепи и VL3-CK в качестве легкой цепи, и Fv4-IgG1-F1182, которое содержит VH3-IgG1-F1182 в качестве тяжелой цепи и VL3-CK в качестве легкой цепи, получали с использованием способа, описанного в справочном примере 1.
(4-3) Оценка активности связывания FcγR мыши
VH3/L (WT)-IgG1-F1087 и VH3/L (WT)-IgG1-F1182, которые содержат VH3-IgG1-F1087 и VH3-IgG1-F1182 в качестве тяжелой цепи, соответственно, и L (WT)-CK (SEQ ID NO: 42) в качестве легкой цепи, получали способом, описанным в справочном примере 1. Эти антитела, и VH3/L (WT)-IgG1-F1022 и VH3/L (WT)-IgG1, оценивали в отношении их активности связывания FcγR мыши способом, описанным в справочном примере 2. Результат представлен в таблице 7. Кроме того, соотношение увеличения активности связывания FcγR каждого варианта относительно IgG1 до изменения представлено в таблице 8. В таблице VH3/L (WT)-IgG1, VH3/L (WT)-IgG1-F1022, VH3/L (WT)-IgG1-F1087 и VH3/L (WT)-IgG1-F1182 представлены в качестве IgG1, F1022, F1087 и F1182, соответственно.
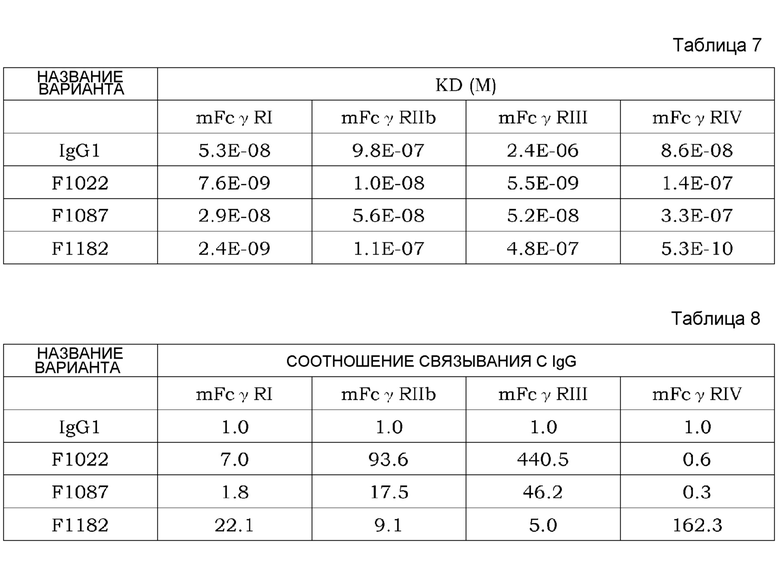
Как показано в таблице 8, было продемонстрировано, что F1087 и F1022 имели увеличенную активность связывания с FcγRI мыши, FcγRIIb мыши и FcγRIII мыши по сравнению с IgG1, в то время как их активность связывания FcγRIV мыши не была увеличена. Что касается активности связывания F1087 с FcγRI мыши, FcγRIIb мыши, FcγRIII мыши и FcγRIV мыши, было выявлено, что степень ее повышения является меньшей, чем у F1022. Между тем, было показано, что активность связывания F1182 с FcγRI мыши и FcγRIV мыши была значительно увеличена, в то время как степень увеличения его активности связывания с FcγRIIb и FcγRIII была меньшей, чем у F1022 и F1087. Как упоминалось выше, эти три типа вариантов продемонстрировали усиленное связывание с некоторыми FcγR мыши; однако было показано, что активность связывания с FcγR селективно увеличивается и степень увеличения варьирует в зависимости от варианта.
(4-4) Эффект Fv4-IgG1-F1087 и Fv4-IgG1-F1182 на элиминацию антигенов из плазмы
С помощью того же способа, который описан в примере 2, испытания с инфузией in vivo с использованием трансгенных мышей с FcRn человека проводили для определения концентраций растворимого рецептора IL-6 в плазме мышей. Результат представлен на фиг. 6.
В обеих группах, в которых вводили in vivo Fv4-IgG1-F1087 и Fv4-IgG1-F1182, которые обладают увеличенной активностью связывания FcγR мыши по сравнению с Fv4-IgG1, концентрация в плазме in vivo растворимого рецептора IL-6 человека могла быть снижена по сравнению с группой, в которой вводили Fv4-IgG1. Эффект снижения концентрации в плазме растворимого рецептора IL-6 человека был высоким, особенно в группе, в которой вводили Fv4-IgG1-F1087, которое обладает усиленным связыванием с FcγRII мыши и FcγRIII мыши. Между тем, эффект введения F1182 на снижение концентрации в плазме растворимого рецептора IL-6 человека был небольшим в группе, в которой вводили in vivo F1182, которое обладает значительно увеличенной активностью связывания с FcγRI мыши и FcγRIV мыши (а также увеличенное в несколько раз связывание с FcγRII мыши и FcγRIII мыши). Исходя из этих результатов, было предположено, что FcγR мыши, которые вносят значительно больший вклад в эффект эффективного снижения концентрации антигена в плазме у мышей, которым вводили антитело с pH-зависимым связыванием антигена, представляют собой FcγRII мыши и/или FcγRIII мыши. В частности, полагают, что концентрация антигена в плазме может быть более эффективно снижена in vivo посредством введения в живой организм антитела с pH-зависимым связыванием антигена с усиленным связыванием с FcγRII мыши и/или FcγRIII мыши.
(4-5) Получение антигенсвязывающих молекул, активность связывания которых с FcγR является более высокой, чем активность связывания нативной Fc-области IgG человека, и которые обладают увеличенной активностью связывания FcRn человека в условиях диапазона кислых значений pH
Как описано в примере 3, по сравнению с трансгенными мышами с FcRn человека, которым вводили Fv4-IgG1-F1022, удержание в плазме антитела значительно увеличивалось у трансгенных мышей с FcRn человека, которым вводили Fv4-IgG1-F1093, полученное увеличением активности связывания с FcRn человека в условиях диапазона кислых значений pH у Fv4-IgG1-F1022, активность связывания которого с FcγR мыши увеличена. То, наблюдается ли этот эффект также у трансгенных мышей с FcRn человека, которым вводили Fv4-IgG1-F1087 и Fv4-IgG1-F1182, и то, наблюдается ли этот же эффект у мышей, которым вводили варианты, активность связывания которых с FcRn человека увеличена в условиях диапазона кислых значений pH посредством добавления изменения, отличающегося от изменения, оцененного в примере 3, оценивали следующим образом.
VH3-IgG1-F1180 (SEQ ID NO: 46) и VH3-IgG1-F1181 (SEQ ID NO: 47) получали путем замены Met на Leu в положении 428 и Asn на Ser в положении 434 (нумерация EU) в тяжелых цепях VH3-IgG1-F1087 и VH3-IgG1-F1182, для увеличения активности связывания Fv4-IgG1-F1087 и Fv4-IgG1-F1182 с FcRn человека в условиях диапазона кислых значений pH. Более того, получали VH3-IgG1-F1412 (SEQ ID NO: 127) путем замены Asn на Ala в положении 434 (нумерация EU) в тяжелой цепи VH3-IgG1-F1087, для увеличения активности связывания Fv4-IgG1-F1087 с FcRn человека в условиях диапазона кислых значений pH. Fv4-IgG1-F1180, Fv4-IgG1-F1181 и Fv4-IgG1-F1412, которые содержат описанные выше тяжелые цепи и VL3-CK в качестве легкой цепи, получали с использованием способа, описанного в справочном примере 1.
(4-6) Улучшение фармакодинамики антител путем увеличения активности связывания FcRn человека в условиях диапазона кислых значений pH
Испытания с инфузией in vivo проводили путем введения Fv4-IgG1-F1180, Fv4-IgG1-F1181 и Fv4-IgG1-F1412 трансгенным мышам с FcRn человека в соответствии с тем же способом, который описан в примере 2, для определения концентрации растворимого рецептора IL-6 в плазме мышей. Результаты в отношении концентраций растворимого рецептора IL-6 в плазме в группах мышей, которым вводили Fv4-IgG1-F1087, Fv4-IgG1-F1180, Fv4-IgG1-F1412 и Fv4-IgG1, представлены на фиг. 9. Результаты в отношении концентраций растворимого рецептора IL-6 в плазме в группах мышей, в которых вводили Fv4-IgG1-F1182, Fv4-IgG1-F1181 и Fv4-IgG1, представлены на фиг. 10. Между тем, концентрации антитела в плазме в группах мышей измеряли способом, описанным в примере 3. Результаты в отношении концентраций антител в плазме в группах мышей Fv4-IgG1-F1087, Fv4-IgG1-F1180, Fv4-IgG1-F1412 и Fv4-IgG1 представлены на фиг.7; и результаты в отношении концентраций антител в плазме в группах Fv4-IgG1-F1182, Fv4-IgG1-F1181 и Fv4-IgG1 представлены на фиг. 8.
Было подтверждено, что по сравнению с группой мышей, в которой вводили Fv4-IgG1-F1182, время удержания антител в плазме увеличивалось в группе мышей, которым вводили Fv4-IgG1-F1181, что приводит к увеличению активности связывания Fv4-IgG1-F1182 с FcRn человека в диапазоне кислых значений pH. Между тем, концентрация растворимого рецептора IL-6 в плазме в группах мышей, которым вводили Fv4-IgG1-F1181, была сравнимой с группой мышей, которым вводили Fv4-IgG1-F1182. По сравнению с группами мышей, которым вводили Fv4-IgG1, концентрация растворимого рецептора IL-6 в плазме была снижена в обеих группах.
С другой стороны, по сравнению с группой мышей, в которой вводили Fv4-IgG1-F1087, время удержания в плазме антител было увеличено в обеих группах мышей, в которых вводили Fv4-IgG1-F1180 и Fv4-IgG1-F1412, полученных увеличением активности связывания Fv4-IgG1-F1087 с FcRn человека в диапазоне кислых значений pH, и, неожиданно, время удержания в плазме увеличивалось вплоть до уровня, сравнимого с уровнем в группах мышей, в которых вводили Fv4-IgG1. Более того, продолжительность эффекта снижения концентрации растворимого рецептора IL-6 в плазме увеличивалась посредством увеличения времени удержания антитела в плазме в группах введенных мышей. В частности, в группах введенных мышей концентрации растворимого рецептора IL-6 в плазме через 14 суток и 21 сутки после введения Fv4-IgG1-F1180 и Fv4-IgG1-F1412 были значительно снижены по сравнению с концентрациями через 14 суток и 21 сутки после введения Fv4-IgG1-F1087.
Ввиду вышесказанного, что касается групп мышей, которым вводили четыре иллюстративных антитела Fv4-IgG1-F1093, Fv4-IgG1-F1181, Fv4-IgG1-F1180 и Fv4-IgG1-F1412, было продемонстрировано, что время удержания в плазме может быть увеличено в живом организме, в который вводили антитело, где активность связывания с FcRn человека в условиях диапазона кислых значений pH усилена у антигенсвязывающей молекулы, активность связывания которой с FcγR является более высокой, чем активность связывания у нативной Fc-области IgG человека. Также было продемонстрировано, что в живом организме, в который вводили антигенсвязывающую молекулу, время удержания в плазме увеличивается без ухудшения эффекта элиминации антигенов из живого организма и, вернее, эффект элиминации антигена может быть длительным.
Было продемонстрировано, что изменение для усиления активности связывания FcRn человека в условиях диапазона кислых значений pH можно было проводить способом, который осуществляет замену Asn на Ala в положении 434 (нумерация EU), в дополнение к способу, который осуществляет замену Met на Leu в положении 428 (нумерация EU) и Asn на Ser в положении 434 (нумерация EU). Таким образом, изменения, используемые для усиления активности связывания FcRn человека в условиях диапазона кислых значений pH, конкретно не ограничены, и можно использовать способ, который осуществляет замену Met на Leu в положении 428 (нумерация EU) и Asn на Ser в положении 434 (нумерация EU) в IgG-антителе (Nat. Biotechnol. (2010) 28, 157-159), способ, который осуществляет замену Asn на Ala в положении 434 (нумерация EU) в IgG-антителе (Drug Metab. Dispos. (2010) 38(4), 600-605), способ, который осуществляет замену Met на Tyr в положении 252 (нумерация EU), Ser на Thr в положении 254 (нумерация EU) и Thr на Glu в положении 256 (нумерация EU) в IgG-антителе (J. Biol. Chem. (2006) 281, 23514-23524), способ, который осуществляет замену Thr на Gln в положении 250 (нумерация EU) и Met на Leu в положении 428 (нумерация EU) в IgG-антителе (J. Immunol. (2006) 176(1), 346-356), способ, который осуществляет замену Asn на His в положении 434 (нумерация EU) в IgG-антителе (Clin. Pharmcol. Ther. (2011) 89(2), 283-290), а также изменения, описанные в WO 2010/106180, WO 2010/045193, WO 2009/058492, WO 2008/022152, WO 2006/050166, WO 2006/053301, WO 2006/031370, WO 2005/123780, WO 2005/047327, WO 2005/037867, WO 2004/035752, WO 2002/060919 и т.п.
(4-7) Получение антигенсвязывающих молекул с увеличенной активностью связывания с FcRn человека в условиях диапазона кислых значений pH и сниженным связыванием с ревматоидным фактором
В последние годы сообщалось, что молекула антитела, полученная путем замены Asn на His в положении 434 (нумерация EU) в гуманизированном антителе против CD4 для увеличения времени удержания в плазме посредством увеличения его активности связывания с FcRn человека в условиях диапазона кислых значений pH, связывается с ревматоидным фактором (RF) (Clin. Pharmacol. Ther. (2011) 89(2), 283-290). Это антитело обладает Fc-областью IgG1 человека и заменой Asn на His в положении 434 (нумерация EU) в участке связывания FcRn. Было продемонстрировано, что ревматоидный фактор распознает и связывается с областью с заменой.
Как показано в (4-6), различные изменения описывали как изменения для усиления активности связывания FcRn человека в условиях диапазона кислых значений pH, и внесение этих изменений в участок связывания FcRn в Fc-области может усилить его аффинность к ревматоидному фактору, который распознает этот участок.
Однако антигенсвязывающие молекулы, которые обладают увеличенной активностью связывания FcRn человека в условиях диапазона кислых значений pH, но не обладают связыванием с ревматоидным фактором, можно получать путем внесения в участок Fc-области изменения, которое снижает активность связывания ревматоидного фактора отдельно без снижения активности связывания FcRn в условиях диапазона кислых значений pH.
Такие изменения, используемые для снижения активности связывания ревматоидного фактора, включают изменения в положениях 248-257, 305-314, 342-352, 380-386, 388, 414-421, 423, 425-437, 439 и 441-444 (нумерация EU), предпочтительно в положениях 387, 422, 424, 426, 433, 436, 438 и 440 (нумерация EU) и особенно предпочтительно изменение, которое заменяет Val на Glu или Ser в положении 422, изменение, которое заменяет Ser на Arg в положении 424, изменение, которое заменяет His на Asp в положении 433, изменение, которое заменяет Tyr на Thr в положении 436, изменение, которое заменяет Gln на Arg или Lys в положении 438, и изменение, которое заменяет Ser на Glu или Asp в положении 440 (нумерация EU). Эти изменения можно использовать отдельно или в комбинации.
Альтернативно возможно вносить последовательности гликозилирования N-типа для снижения активности связывания ревматоидного фактора. В частности, известные последовательности гликозилирования N-типа включают Asn-Xxx-Ser/Thr (Xxx представляет собой произвольную аминокислоту, отличную от Pro). Эта последовательность может быть встроена в Fc-область для добавления цепи сахаров N-типа, и связывание с RF может ингибироваться из-за пространственного препятствования цепью сахаров N-типа. Изменения, используемые для добавления цепи сахаров N-типа, предпочтительно включают изменение, которое заменяет Lys на Asn в положении 248, изменение, которое заменяет Ser на Asn в положении 424, изменение, которое заменяет Tyr на Asn в положении 436 и Gln на Thr в положении 438, и изменение, которое заменяет Qln на Asn в положении 438, в соответствии с нумерацией EU, особенно предпочтительно изменение, которое заменяет Ser на Asn в положении 424 (нумерация EU).
[Пример 5] Эффекты элиминации антигенов из плазмы для антигенсвязывающих молекул, активность связывания с FcγR которых является более высокой, чем у Fc-области нативного IgG мыши
(5-1) Эффект элиминации антигена для антител мыши с усиленной активностью связывания FcγR
Как описано в примерах 1-4, было продемонстрировано, что элиминация растворимого рецептора IL-6 человека из плазмы мыши ускоряется в группах трансгенных мышей с FcRn человека, которым вводили антигенсвязывающие молекулы, полученные увеличением активности связывания FcγR мыши у антигенсвязывающих молекул, которые обладают Fc-областью антител человека и свойством связывания с рецептором IL-6 человека pH-зависимым образом. То, достигался ли этот эффект у нормальных мышей, имеющих FcRn мыши, которым вводили антигенсвязывающие молекулы, которые обладают Fc-областью антител мыши и свойством связывания с рецептором IL-6 человека pH-зависимым образом, оценивали у нормальных мышей, имеющих FcRn мыши, следующим образом.
(5-2) Получение антител мыши с увеличенной активностью связывания FcγR
Для антитела IgG1 мыши, обладающего свойством связывания с рецептором IL-6 человека pH-зависимым образом, тяжелую цепь VH3-mIgG1 (SEQ ID NO: 49) и легкую цепь VL3-mk1 (SEQ ID NO: 50) конструировали с использованием способа, описанного в справочном примере 1. Между тем, для увеличения активности связывания VH3-mIgG1 с FcγR мыши, получали VH3-mIgG1-mF44 (SEQ ID NO: 51) посредством замены Ala на Asp в положении 327 (нумерация EU). Аналогично, VH3-mIgG1-mF46 (SEQ ID NO: 52) получали путем замены Ser на Asp в положении 239 и Ala на Asp в положении 327, в соответствии с нумерацией EU, в VH3-mIgG1. Fv4-mIgG1, Fv4-mIgG1-mF44 и Fv4-mIgG1-mF46, которые содержат VH3-mIgG1, VH3-mIgG1-mF44 и VH3-mIgG1-mF46, соответственно, в качестве тяжелой цепи и VL3-mk1 в качестве легкой цепи, получали с использованием способа, описанного в справочном примере 1.
(5-3) Оценка активности связывания FcγR мыши
VH3/L (WT)-mIgG1, VH3/L (WT)-mIgG1-mF44 и VH3/L (WT)-mIgG1-mF46, которые содержат VH3-mIgG1, VH3-mIgG1-mF44 и VH3-mIgG1-mF46, соответственно, в качестве тяжелой цепи и L (WT)-CK (SEQ ID NO: 42) в качестве легкой цепи получали способом, описанным в справочном примере 1. Эти антитела оценивали в отношении их активности связывания FcγR мыши способом, описанным в справочном примере 2. Результат представлен в таблице 9. Кроме того, соотношение увеличения активности каждого варианта в отношении связывания FcγR мыши относительно mIgG1 до изменения представлено в таблице 10. В таблице VH3/L (WT)-mIgG1, VH3/L (WT)-mIgG1-mF44 и VH3/L (WT)-mIgG1-mF46 представлены в качестве mIgG1, mF44 и mF46, соответственно.

Результат оценки примера 4, демонстрирующего, что VH3/L (WT)-mIgG1, обладающее Fc-областью нативного IgG1-антитела мыши, связывается только с FcγRIIb мыши и FcγRIII мыши, но не с FcγRI мыши и FcγRIV мыши, указывает на то, что FcγR мыши, важный для снижения концентрации антигена, представляют собой FcγRII мыши и/или FcγRIII мыши. Было продемонстрировано, что VH3/L (WT)-mIgG-mF44 и VH3/L (WT)-mIgG1-mF46, в которые введено изменение, которое предположительно увеличивает активность связывания VH3/L (WT)-mIgG1 с FcγR, имеет увеличенную активность связывания как с FcγRIIb мыши, так и с FcγRIII мыши.
(5-4) Оценка эффекта в отношении снижения концентрации растворимого рецептора IL-6 в плазме нормальных мышей
Эффект элиминации растворимого рецептора IL-6 из плазмы нормальных мышей, которым вводили антитело против рецептора IL-6 человека Fv4-mIgG1, Fv4-mIgG1-mF44 или Fv4-mIgG1mF46, оценивали следующим образом.
Модель на животных, в которой концентрация растворимого рецептора IL-6 человека поддерживается постоянной в плазме, создавали посредством имплантации инфузионного насоса (MINI-OSMOTIC PUMP MODEL2004, alzet), содержащего растворимый рецептор IL-6 человека, под кожу спины нормальных мышей (мышь C57BL/6J, Charles River Japan). В модели на животных оценивали динамику in vivo после введения антитела против рецептора IL-6 человека. Для подавления продукции антител против растворимого рецептора IL-6 человека, моноклональное антитело против CD4 мыши вводили один раз в количестве 20 мг/кг в хвостовую вену. Затем в область спины мышей имплантировали инфузионный насос, содержащий 92,8 мкг/мл растворимого рецептора IL-6 человека. Через трое суток после имплантации инфузионного насоса вводили антитело против рецептора IL-6 человека один раз в сутки 1 мг/кг в хвостовую вену. Взятие крови от мышей проводили через 15 минут, семь часов, одни сутки, двое суток, четверо суток, семь суток, 14 суток (или 15 суток) и 21 сутки (или 22 суток) после введения антитела против рецептора IL-6 человека. Сразу после этого собранную кровь центрифугировали при 15000 об./мин и 4°C в течение 15 минут с получением плазмы. Выделенную плазму хранили в морозильной камере, установленной на -20°C или ниже, до применения.
Концентрации растворимого рецептора IL-6 человека в плазме определяли способом, описанным в (2-1-2). Результат представлен на фиг.11.
Неожиданно было продемонстрировано, что у мышей, которым вводили mF44 и mF46, в которые внесено изменение для увеличения активности связывания mIgG1 (нативный IgG1 мыши) с FcγRIIb мыши и FcγRIII мыши, концентрация рецептора IL-6 с плазме была значительно снижена по сравнению с мышами, которым вводили mIgG1. В частности, даже на 21 сутки после введения mF44, концентрация рецептора IL-6 в плазме в группе введения mF44 была снижена приблизительно в 6 раз по сравнению с концентрацией рецептора IL-6 в плазме в группе без введения антитела и приблизительно в 10 раз по сравнению с группой введения mIgG1. С другой стороны, на седьмые сутки после введения mF46, концентрация в плазме рецептора IL-6 в группе введения mF46 была значительно снижена приблизительно в 30 раз по сравнению с концентрацией в плазме рецептора IL-6 в группе без введения антитела и приблизительно в 50 раз по сравнению с группой введения mIgG1.
Указанные выше данные демонстрируют, что элиминация растворимого рецептора IL-6 из плазмы также ускорялась у мышей, которым вводили антитела, где активность связывания с FcγR мыши у антигенсвязывающей молекулы, обладающей Fc-областями IgG1-антитела мыши, увеличивается, как и в случае антител, где активность связывания FcγR мыши у антигенсвязывающей молекулы, обладающей Fc-областью IgG1-антитела человека, увеличивается. Без связи с конкретной теорией, описанное выше наблюдаемое явление может быть объяснено следующим образом.
При введении мышам антитела, которые связываются с растворимым антигеном pH-зависимым образом и обладают увеличенной активностью связывания FcγR, активно включаются в основном в клетки, экспрессирующие FcγR на клеточной мембране. Включенные антитела диссоциируют от растворимого антигена в условиях кислых значений pH в эндосоме, а затем рециклируют в плазму через FcRn. Таким образом, фактором, который обеспечивает эффект элиминации из плазмы растворимого антигена у такого антитела, является уровень активности связывания FcγR у антитела. В частности, поскольку активность связывания FcγR является более высокой, включение в экспрессирующие FcγR клетки происходит более активно, и это делает элиминацию растворимых антигенов из плазмы более быстрой. Более того, при условии, что активность связывания FcγR увеличена, эффект может быть оценен аналогичным образом независимо от того, происходит ли Fc-область, содержащаяся в антителе, из IgG1 человека или мыши. В частности, оценку можно осуществлять для Fc-области любого вида животного, такого как любой из IgG1 человека, IgG2 человека, IgG3 человека, IgG4 человека, IgG1 мыши, IgG2a мыши, IgG2b мыши, IgG3 мыши, IgG крысы, IgG обезьяны и IgG крысы, при условии, что активность связывания с FcγR у видов животных, подлежащих введению, увеличивается.
[Пример 6] Эффект элиминации антигена антителами с активностью связывания, увеличенной селективным в отношении FcγRIIb образом
(6-1) Эффект в отношении элиминации антигена у антител, в которых активность связывания FcγRIIb селективно увеличена
Мыши с дефицитом FcγRIII (мышь B6.129P2-FcgrFcγR3tm1Sjv/J, Jackson Laboratories) экспрессируют FcγRI мыши, FcγRIIb мыши и FcγRIV мыши, но не FcγRIII мыши. Между тем, мыши с дефицитом γ-цепи Fc-рецептора (Fcer1g mouse, Taconic, Cell (1994) 76, 519-529) экспрессируют только FcγRIIb мыши, но не FcγRI мыши, FcγRIII мыши и FcγRIV мыши.
Как описано в примере 5, было продемонстрировано, что mF44 и mF46 с увеличенной активностью связывания нативного IgG1 с FcγR мыши демонстрируют селективное усиление связывания с FcγRIIb мыши и FcγRIII мыши. Было предположено, что с использованием селективно увеличенной активности связывания антител, условия, в которых вводят антитело с селективно усиленным связыванием FcγRIIb мыши, могут быть имитированы путем введения mF44 и mF46 мышам с дефицитом FcγRIII или мышам с дефицитом γ-цепи Fc-рецептора, которые не экспрессируют FcγRIII мыши.
(6-2) Оценка эффекта элиминации антигена путем селективного усиления связывания с FcγRIIb мыши с использованием мышей с дефицитом FcγRIII
Эффект элиминации растворимого рецептора IL-6 из плазмы у мышей с дефицитом FcγRIII, которым вводили антитело против рецептора IL-6 человека Fv4-mIgG1, Fv4-mIgG1-mF44 или Fv4-mIgG1-mF46, оценивали тем же способом, который описан в примере 5. Концентрации растворимого рецептора IL-6 человека в плазме у мышей определяли способом, описанным в примере (2-1-2). Результат представлен на фиг.12.
Неожиданно, было продемонстрировано, что концентрации рецептора IL-6 в плазме у мышей с дефицитом FcγRIII, которым вводили mF44 и mF46, которые имитируют условия, в которых активность связывания mIgG1 (нативный IgG1 мыши) с FcγRIIb мыши селективно увеличена, были значительно снижены по сравнению с концентрацией рецептора IL-6 в плазме у мышей, которым вводили mIgG1. В частности, концентрация рецептора IL-6 в плазме в группе введения mF44 была снижена приблизительно в три раза по сравнению с группой введения mIgG1 и увеличение концентрации накопленного антигена вследствие введения антитела подавлялось. Между тем, на третьи сутки после введения концентрация IL-6 в плазме в группе введения mF46 была значительно снижена приблизительно в шесть раз по сравнению с концентрацией рецептора IL-6 в плазме у группы без введения антитела и приблизительно в 25 раз превышала концентрацию рецептора IL-6 в плазме в группе введения mIgG1. Этот результат показывает, что, поскольку активность связывания FcγRIIb мыши у антитела против рецептора IL-6 человека, которое связывается с антигеном pH-зависимым образом, является более высокой, концентрация рецептора IL-6 может быть в большей степени снижена у мышей, которым вводили антитело.
(6-3) Оценка эффекта элиминации антигена посредством селектвного усиления связывания FcγRIIb мыши с использованием мышей с дефицитом γ-цепи Fc-рецептора
Эффект элиминации растворимого рецептора IL-6 из плазмы у мышей с дефицитом γ-цепи Fc-рецептора, которым вводили антитело против рецептора IL-6 человека Fv4-mIgG1, Fv4-mIgG1-mF44 или Fv4-mIgG1mF46, оценивали тем же способом, который описан в примере 5. Концентрации растворимого рецептора IL-6 человека в плазме мышей определяли способом, описанным в примере (2-1-2). Результат представлен на фиг. 13.
Как и в случае, где mF44 и mF46 вводили мышам с дефицитом FcγRIII, было продемонстрировано, что концентрация рецептора IL-6 в плазме у мышей с дефицитом γ-цепи Fc-рецептора, которым вводили mF44 и mF46, которые имитируют условия селективного увеличения активности связывания mIgG1 с FcγRIIb мыши (нативный IgG1 мыши), была значительно снижена по сравнению с концентрацией рецептора IL-6 в плазме у мышей с дефицитом γ-цепи Fc-рецептора, которым вводили mIgG1. В частности, концентрация рецептора IL-6 в плазме в группе введения mF44 была снижена приблизительно в три раза по сравнению с группой введения mIgG1, и увеличение концентрации накопленного антигена вследствие введения антитела подавлялось. Между тем, на третьи сутки после введения концентрация рецептора IL-6 в плазме в группе введения mF46 была значительно снижена приблизительно в пять раз по сравнению с группой без введения антитела и приблизительно в 15 раз по сравнению с группой введения mIgG1.
Результаты, описанные в примерах (6-2) и (6-3), демонстрируют, что концентрация растворимого антигена в плазме значительно снижается в группе, в которой вводили антитело, которое связывается с растворимым антигеном pH-зависимым образом и обладает селективно увеличенной активностью связывания FcγRIIb мыши.
[Пример 7] Эффект антител в отношении элиминации антигена с селективным усилением связывания с FcγRIII
(7-1) Эффект элиминации антигена для антител с селективно усиленным связыванием FcγRIII
Мыши с дефицитом FcγRIIb (мышь Fcgr2b (FcγRII), Taconic) (Nature (1996) 379 (6563), 346-349) экспрессируют FcγRI мыши, FcγRIII мыши и FcγRIV мыши, но не FcγRIIb мыши. Как описано в примере 5, было продемонстрировано, что mF44 и mF46, полученные посредством увеличения активности связывания нативного IgG1 мыши с FcγR, демонстрируют селективно усиленное связывание с FcγRIIb мыши и FcγRIII мыши. Было предположено, что, исходя из применения антител с селективно увеличенной активностью связывания, условия введения антитела с селективно усиленным связыванием с FcγRIII мыши можно имитировать путем введения mF44 или mF46 мышам с дефицитом FcγRIIb, которые не экспрессируют FcγRIIb мыши.
Как описано в примере 6, концентрация растворимого антигена была снижена в плазме у мышей с дефицитом FcγRIII, которые имитируют состояние введения антитела с селективно увеличенной активностью связывания FcγRIIb мыши. Между тем, то, снижается ли концентрация растворимого антигена в плазме мышей с дефицитом FcγRIIb, которые имитируют условия введения антитела с селективно увеличенной активностью связывания FcγRIII мыши, оценивали с помощью исследования, описанного ниже.
(7-2) Оценка эффекта элиминации антигена посредством селективного усиления связывания FcγRIII мыши с использованием мышей с дефицитом FcγRIIb
Эффект элиминации растворимого рецептора IL-6 из мышей с дефицитом FcγRIIb в плазме, которым вводили антитело против рецептора IL-6 человека Fv4-mIgG1, Fv4-mIgG1-mF44 или Fv4-mIgG1mF46, оценивали тем же способом, который описан в примере 5. Концентрации растворимого рецептора IL-6 человека в плазме определяли способом, описанным в примере (2-1-2). Результат представлен на фиг. 14.
Неожиданно, в группах, в которых вводили mF44 и mF46, которые имитируют селективное увеличение активности связывания mIgG1 (нативный IgG1 мыши) с FcγRIII мыши, концентрация рецептора IL-6 в плазме снижалась, однако снижение не было подтверждено по сравнению с тем, что показано в примере 6.
Без связи с конкретной теорией, исходя из результатов, описанных в примерах 5, 6 и 7, возможно следующее обсуждение. Было выявлено, что элиминация растворимого рецептора IL-6 из плазмы значительно ускорена у нормальных мышей, экспрессирующих как FcγRIIb мыши, так и FcγRIII мыши, которым вводили mF44 и mF46 с селективно увеличенной активностью связывания mIgG1 (нативный IgG1 мыши) с FcγRIIb мыши и FcγRIII мыши. Более того, было выявлено, что, когда mF44 и mF46 вводили мышам, которые экспрессируют FcγRIIb мыши, но не FcγRIII мыши (т.е., мышам с дефицитом FcγRIII и мышам с дефицитом γ-цепи Fc-рецептора), элиминация растворимого рецептора IL-6 из плазмы у мышей также значительно ускорялась. Между тем, когда mF44 и mF46 вводили мышам, которые экспрессируют FcγRIII мыши, но не FcγRIIb мыши (т.е. мышам с дефицитом FcγRII), элиминация растворимого рецептора IL-6 из плазмы не ускорялась у мышей в значительной степени.
Из указанных выше данных, полагали, что антитела mF44 и mF46, в которых активность связывания mIgG1 (нативный IgG1 мыши) с FcγRIIb мыши и FcγRIII мыши увеличена, включаются в экспрессирующие FcγR клетки в основном посредством FcγRIIb мыши, и, таким образом, растворимый антиген в плазме, который связывается с антителами, элиминируется. Между тем, полагают, что опосредуемое FcγRIII включение комплексов антитело/антиген в экспрессирующие FcγR клетки не вносит значительного вклада в элиминацию растворимого антигена из плазмы.
Более того, как показано в примере 4, концентрация растворимого рецептора IL-6 в плазме была значительно снижена у мышей, которым вводили Fv4-IgG1-F1087, обладающее увеличенной активностью связывания, в частности, с FcγRIIb мыши и FcγRIII мыши. Между тем, эффект элиминации растворимого рецептора IL-6 из плазмы мышей, которым вводили Fv4-IgG1-F1182 с увеличенной активностью связывания с FcγRI мыши и FcγRIV мыши, в частности, был меньшим, чем у Fv4-IgG1-F1087.
Более того, как показано в примере 2, у мышей, которым вводили Fv4-IgG1-Fuc, активность связывания которого с FcγRIV мыши значительно увеличена вследствие наличия цепи сахаров с низким содержанием фукозы (Science (2005) 310 (5753) 1510-1512), концентрация в плазме растворимого рецептора IL-6 была снижена по сравнению с концентрацией растворимого рецептора IL-6 у мышей, которым вводили Fv4-IgG1; однако эффект снижения был приблизительно в два раза меньшим. Таким образом, полагают, что опосредуемое FcγRIV мыши включение антител в экспрессирующие FcγR клетки не вносит значительный вклад в элиминацию растворимых антигенов из плазмы.
Ввиду вышесказанного, было продемонстрировано, что из нескольких FcγR мыши, FcγRIIb мыши играет основную роль во включении антитела в экспрессирующие FcγR клетки у мышей. Таким образом, можно предположить, что мутации, вносимые в FcγR-связывающий домен мыши, особенно предпочтительно включают, но не ограничиваются ими, мутации, которые усиливают связывание с FcγRIIb мыши.
Описанные выше данные демонстрируют, что у мышей более предпочтительно активность связывания антител, подлежащих введению, с FcγRIIb мыши, увеличена для ускорения элиминации растворимых антигенов из плазмы живого организма посредством введения антигенсвязывающих молекул, которые связываются с растворимыми антигенами pH-зависимым образом и обладают увеличенной активностью связывания FcγR. В частности, при введении в живой организм, антигенсвязывающие молекулы, которые связываются с растворимыми антигенами pH-зависимым образом и обладают увеличенной активностью с FcγRIIb мыши, могут ускорять элиминацию растворимых антигенов из плазмы и эффективно снижать концентрацию растворимых антигенов в плазме и, таким образом, было выявлено, что антигенсвязывающие молекулы демонстрируют очень эффективное действие.
[Пример 8] Оценка способности антител, содержащих Fc-область, в которую внесено известное изменение, которое усиливает связывание FcγRIIb, к агрегации тромбоцитов
(8-1) Получение антител, содержащих Fc-область, в которую внесено известное изменение, которое усиливает связывание FcγRIIb
Как описано в примере 7, антигены можно эффективно элиминировать из плазмы живого организма посредством введения антител с селективно увеличенной активностью связывания FcγRIIb в живой организм. Более того, полагают, что введение антител, содержащих Fc-область с селективно увеличенной активностью связывания FcγRIIb, является предпочтительным с точки зрения безопасности и побочных эффектов в живом организме, в который вводили такие антитела.
Однако в mF44 и mF46 усилено как связывание FcγRIIb мыши, так и связывание FcγRIII мыши, и, таким образом, усиление связывания не является селективным в отношении FcγRIIb мыши. Поскольку гомология между FcγRIIb мыши и FcγRIII мыши является высокой, было бы трудным найти изменение, которое усиливает селективное связывание с FcγRIIb, различающее их. Более того, отсутствуют предшествующие сообщения о Fc-областях с селективно усиленным связыванием FcγRIIb мыши. Также известно, что гомология между FcγRIIb человека и FcγRIIa человека (два аллотипа, 131Arg и 131His) является высокой. Более того, отсутствуют сообщения о Fc-областях, которые содержат изменение, которое усиливает селективное связывание с FcγRIIb человека, различающее их (Seung et al., (Mol. Immunol. (2008) 45, 3926-3933); Greenwood et al., (Eur. J. Immunol. (1993) 23(5), 1098-1104)). Более того, было описано, что антитела с усиленным связыванием FcγRIIa обладают увеличенной активностью агрегации тромбоцитов, и они могут увеличивать риск развития тромбоза при введении в организмы (Meyer et al. (J. Thromb. Haemost. (2009), 7(1), 171-181) и Robles-Carrillo et al. (J. Immunol. (2010), 185(3), 1577-1583)). Таким образом, обладают ли антитела с усиленным связыванием FcγRIIa увеличенной активностью агрегации тромбоцитов оценивали следующим образом.
(8-2) Оценка активности связывания FcγR человека у антител, содержащих Fc-область, в которую внесено известное изменение, которое усиливает связывание FcγRIIb
Антитела, содержащие Fc-область, в которую внесено известное изменение, которое усиливает связывание FcγRIIb человека, анализировали в отношении их аффинности в отношении FcγRIa человека, FcγRIIa R-типа и H-типа, FcγRIIb и FcγRIIIa по следующей методике. H-цепь конструировали так, чтобы она имела в качестве вариабельной области H-цепи антитела вариабельную область антитела IL6R-H (SEQ ID NO: 53) против рецептора интерлейкина 6 человека, который описан в WO 2009/125825 и, в качестве константной области H-цепи антитела, IL6R-G1d (SEQ ID NO: 54), которая имеет G1d, полученный удалением C-концевого Gly и Lys из IgG1 человека. Затем IL6R-G1d-v3 (SEQ ID NO: 55) конструировали посредством изменения Fc-области IL6R-G1d посредством замены Ser на Glu в положении 267 (нумерация EU) и Leu на Phe в положении 328 (нумерация EU), как описано в Seung et al., (Mol. Immunol. (2008) 45, 3926-3933). IL6R-L (SEQ ID NO: 56), которая представляет собой L-цепь антитела против рецептора интерлейкина 6 человека, использовали в качестве L-цепи обычного антитела и экспрессировали в комбинации с соответствующими H-цепями в соответствии со способом, описанным в справочном примере 1, и полученные антитела очищали. Далее, антитела, содержащие IL6R-G1d и IL6R-G1d-v3 в качестве тяжелой цепи, обозначают как IgG1 и IgG1-v3, соответственно.
Затем взаимодействие между FcγR и описанными выше антителами кинетически анализировали с использованием Biacore T100 (GE Healthcare). Анализ взаимодействия проводили при 25°C с использованием HBS-EP+ (GE Healthcare) в качестве подвижного буфера. Использованный чип представлял собой сенсорный чип CM5 Series S (GE Healthcare), на который иммобилизован белок A способом присоединения аминов. Каждому FcγR, разбавленному подвижным буфером, позволяли взаимодействовать с представляющими интерес антителами, уловленными на чипе, для измерения связывания антител с каждым FcγR. После измерения 10 мМ глицин-HCl (pH 1,5) подвергали реакции с чипом для смывания уловленных антител, чтобы повторно использовать регенерированный чип. Сенсограмму, полученную в результате измерения, анализировали с использованием модели связывания Ленгмюра 1:1 с помощью программного обеспечения Biacore Evaluation Software и вычисляли константу скорости связывания ka (л/моль/с) и константу скорости диссоциации kd (1/с), и из этих величин вычисляли константу диссоциации KD (моль/л). Величины KD IgG1 и IgG1-v3 в отношении каждого FcγR (величины KD каждого антитела в отношении каждого FcγR) представлены в таблице 11, в то время как относительные величины KD IgG1-v3, которые получены путем деления KD IgG1 в отношении каждого FcγR на KD IgG1-v3 в отношении каждого FcγR, представлены в таблице 12.
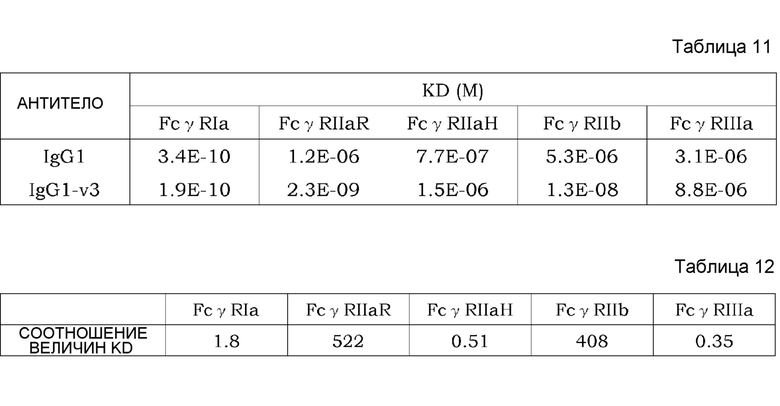
Эти результаты подтвердили, что, по сравнению с антителом, содержащим Fc-область IgG1, антитело, содержащее измененную Fc-область, в которой Ser в положении 267 заменен на Glu и Leu в положении 328 заменен на Phe, как указано с помощью нумерации EU, в Fc-области IgG1 (Mol. Immunol. (2008) 45, 3926-3933), имеет в 408 раз увеличенную аффинность в отношении FcγRIIb, и в то время как аффинность в отношении FcγRIIa H-типа была снижена до 0,51 раза, аффинность в отношении FcγRIIa R-типа была увеличена в 522 раза.
(8-3) Оценка способности агрегировать тромбоциты
Далее оценку того, изменяет ли увеличенная/сниженная аффинность в отношении FcγRIIa антитела, содержащего Fc-область с заменой Ser на Glu в положении 267 и Leu на Phe в положении 328 (нумерация EU) в Fc-области IgG1, способность тромбоцитов к агрегации, проводили с использованием тромбоцитов, полученных от доноров с FcγRIIa типа H или типа R. Антитело, содержащее в качестве легкой цепи омализумаб_VL-CK (SEQ ID NO: 58) и омализумаб_VH-G1d (SEQ ID NO: 57), которые содержат вариабельную область тяжелой цепи антитела hIgG1 (константная область IgG1 человека), которое связывается с IgE, и константную область тяжелой цепи G1d, конструировали с использованием способа, описанного в справочном примере 1. Более того, омализумаб_VH-G1d-v3 (SEQ ID NO: 59) конструировали путем замены Ser на Glu в положении 267 и Leu на Phe в положении 328 (нумерация EU) в омализумаб_VH-G1d. Омализумаб-G1d-v3, которое содержит омализумаб_VH-G1d-v3 в качестве тяжелой цепи и омализумаб_VL-CK в качестве легкой цепи, получали с использованием способа, описанного в справочном примере 2. Это антитело оценивали в отношении способности к агрегации тромбоцитов.
Агрегацию тромбоцитов анализировали с использованием агрегометра тромбоцитов HEMA TRACER 712 (LMS Co.). Сначала приблизительно 50 мл цельной крови собирали в фиксированном количестве в 4,5-мл вакуумированные пробирки для сбора крови, содержащие 0,5 мл 3,8% цитрата натрия, и их центрифугировали при 200×g в течение 15 минут. Полученный супернатант собирали и использовали в качестве обогащенной тромбоцитами плазмы (PRP). После того, как PRP промывали буфером A (137 мМ NaCl, 2,7 мМ KCl, 12 мМ NaHCO3, 0,42 мМ NaH2PO4, 2 мМ MgCl2, 5 мМ HEPES, 5,55 мМ декстроза, 1,5 Е/мл апиразы, 0,35% BSA), буфер заменяли буфером B (137 мМ NaCl, 2,7 мМ KCl, 12 мМ NaHCO3, 0,42 мМ NaH2PO4, 2 мМ MgCl2, 5 мМ HEPES, 5,55 мМ декстроза, 2 мМ CaCl2, 0,35% BSA). Это обеспечивало промытые тромбоциты при плотности приблизительно 300000/мкл. 156 мкл промытых тромбоцитов разделяли на аликвоты в кюветы для анализа, содержащие мешалку, в агрегометре для тромбоцитов. Тромбоциты перемешивали при 1000 об./мин мешалкой в кюветах, поддерживаемых при 37,0°C, в агрегометре для тромбоцитов. 44 мкл иммунного комплекса омализумаб-G1d-v3 и IgE в молярном соотношении 1:1, приготовленного в конечных концентрациях 600 мкг/мл и 686 мкг/мл, соответственно, добавляли в кюветы. Тромбоциты подвергали реакции с иммунным комплексом в течение пяти минут. Затем при концентрации, которая не позволяет вторичную агрегацию тромбоцитов, к реакционной смеси добавляли аденозиндифосфат (ADP, SIGMA) для исследования того, усилилась ли агрегация.
Результат агрегации тромбоцитов для каждого донора с полиморфной формой FcγRIIa (H/H или R/H), полученной в анализе выше, представлен на фиг. 15 и 16, соответственно. Из результата на фиг. 15 показано, что агрегация тромбоцитов усиливалась, когда иммунный комплекс добавляют к тромбоцитам донора с полиморфной формой FcγRIIa (R/H). Между тем, как показано на фиг. 16, агрегация тромбоцитов не усиливалась, когда иммунный комплекс добавляли к тромбоцитам донора с полиморфной формой FcγRIIa (H/H).
Далее активацию тромбоцитов оценивали с использованием маркеров активации. Активацию тромбоцитов можно измерять на основе увеличенной экспрессии маркера активации, такого как CD62p (p-селектин), или активного интегрина на поверхности мембраны тромбоцитов. 2,3 мкл иммунного комплекса добавляли к 7,7 мкл промытых тромбоцитов, приготовленных способом, описанным выше. После реакции в течение пяти минут при комнатной температуре, активацию индуцировали добавлением ADP в конечной концентрации 30 мкМ и оценивали, усиливает ли иммунный комплекс зависимую от ADP активацию. Образец, в который был добавлен буфер (pH 7,4) (Gibco), вместо иммунного комплекса, использовали в качестве отрицательного контроля. Окрашивание проводили посредством добавления в каждый образец после реакции PE-меченного антитела против CD62 (BECTON DICKINSON), PerCP-меченного антитела против CD61 и FITC-меченного антитела PAC-1 (BD bioscience). Интенсивность флуоресценции каждым красителем измеряли с использованием проточного цитометра (FACS CantoII, BD bioscience).
Результат экспрессии CD62p, полученный указанным выше способом, представлен на фиг. 17. Результат активированной экспрессии интегринов представлен на фиг. 18. Использованные промытые тромбоциты получали от здорового индивидуума с полиморфной формой FcγRIIa R/H. Как CD62p, так и активный интегрин, экспрессированные на поверхности мембраны тромбоцитов, которые индуцируются посредством стимуляции ADP, усиливались в присутствии иммунного комплекса.
Представленные выше результаты демонстрируют, что антитело, обладающее Fc-областью, в которую внесено известное изменение, которое усиливает связывание FcγRIIb человека, которое представляет собой замену Ser на Glu в положении 267 и Leu на Phe в положении 328 (нумерация EU) в Fc-области IgG1, ускоряет агрегацию тромбоцитов, в которых аллотип FcγRIIa является таким, что аминокислота в положении 131 представляет собой R, по сравнению с тромбоцитами, в которых аллотип FcγRIIa является таким, что аминокислота в положении 131 представляет собой H. Таким образом, было предположено, что риск развития тромбоза вследствие агрегации тромбоцитов может быть увеличен, когда антитело, содержащее Fc-область, в которую внесено известное изменение, которое усиливает связывание с известным FcγRIIb человека, вводят человеку, имеющему FcγRIIa R-типа. Было показано, что антигенсвязывающие молекулы, содержащие Fc-область по настоящему изобретению, которая усиливает связывание FcγRIIb более селективно, не только увеличивает время удержания антигена в плазме, но также, возможно, решает указанные выше проблемы. Таким образом, применимость антигенсвязывающих молекул по настоящему изобретению является очевидной.
[Пример 9] Детальный анализ связывания FcγRIIb для вариантов, в которые внесено изменение в шарнирной области в дополнение к изменению P238D
В Fc, полученной путем замены Pro в положении 238 (нумерация EU) на Asp во встречающемся в природе IgG1 человека, ожидаемый комбинаторный эффект не мог быть достигнут даже путем комбинирования его с другим изменением, для которого предсказано, что оно далее повышает связывание FcγRIIb, исходя из анализа встречающихся в природе антител. Таким образом, чтобы найти варианты, которые далее усиливают связывание FcγRIIb, вносили всесторонние изменения в измененную Fc, полученную путем замены Pro в положении 238 (нумерация EU) на Asp. IL6R-F11 (SEQ ID NO: 60) получали путем внесения изменения в виде замены Met в положении 252 (нумерация EU) на Tyr и изменения путем замены Asn в положении 434 (нумерация EU) на Tyr в IL6R-G1d (SEQ ID NO: 54), которую использовали в качестве H-цепи антитела. Более того, IL6R-F652 (SEQ ID NO: 61) получали путем внесения изменения путем замены Pro в положении 238 (нумерация EU) на Asp в IL6R-F11. Экспрессирующие плазмиды, содержащие последовательность H-цепи антитела, получали для каждой из последовательностей H-цепи антитела, полученных путем замены области вблизи остатка в положении 238 (нумерация EU) (положения с 234 по 237, и 239 (нумерация EU)) в IL6R-F652, в каждом случае на 18 аминокислот, за исключением исходных аминокислот и цистеина. Для всех антител в качестве L-цепи антитела использовали IL6R-L (SEQ ID NO: 56). Эти варианты экспрессировали и очищали способом по справочному примеру 1. Эти варианты Fc названы вариантами PD. Взаимодействия каждого варианта PD с FcγRIIa типа R и FcγRIIb детально оценивали способом справочного примера 2.
График, на котором показаны результаты анализа взаимодействия с соответствующими FcγR, строили в соответствии со следующим способом. Величина, полученная делением значения величины связывания каждого варианта PD с каждым FcγR на значение величины связывания FcγR предварительно измененного антитела, которое использовали в качестве контроля (IL6R-F652/IL6R-L, который имеет изменение в виде замены Pro в положении 238 (нумерация EU) на Asp, а затем умножения результата на 100, показана в качестве относительной величины активности связывания каждого варианта PD с каждым FcγR. На горизонтальной оси показаны относительные величины активности связывания FcγRIIb для каждого варианта PD, и на вертикальной оси показаны относительные величины активности связывания FcγRIIa типа R для каждого варианта PD (фиг. 19).
В результате было выявлено, что связывание FcγRIIb в случае одиннадцати типов изменений усиливалось по сравнению с антителом до внесения изменений, и они обладают эффектами сохранения или усиления связывания FcγRIIa типа R. Активность этих одиннадцати вариантов в отношении связывания FcγRIIb и FcγRIIa типа R обобщенно представлена в таблице 13. В таблице номера ID последовательностей относится к номерам H-цепей вариантов, и изменение относится к изменению, внесенному в IL6R-F11 (SEQ ID NO: 60).
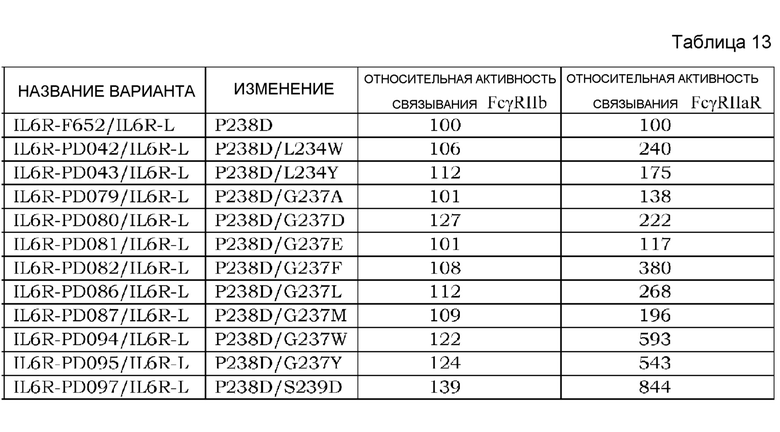
На фиг. 20 показаны относительные величины для активности связывания FcγRIIb, полученной путем дальнейшего внесения указанных выше одиннадцати изменений в вариант, имеющий изменение P238D, и относительные величины для активности связывания FcγRIIb варианта, полученного путем внесения этих изменений в Fc, который не содержит P238D. Эти одиннадцать изменений усиливали связывание FcγRIIb по сравнению с тем, что было до внесения, когда их дополнительно вносили в вариант P238D. Напротив, наблюдали эффект снижения связывания FcγRIIb для восьми из этих изменений, за исключением G237F, G237W и S239D, когда их вносили в вариант, который не содержит P238D (данные не представлены).
Эти результаты показали, что, исходя из эффектов внесения изменений во встречающийся в природе IgG1, трудно предсказать эффекты комбинирования и внесения тех же изменений в вариант, содержащий изменение P238D. Иными словами, невозможно выявить эти восемь изменений, идентифицированных в этот раз, без этого исследования, в котором указанные изменения комбинируют и вносят в вариант, содержащий изменение P238D.
Результаты измерения величин KD вариантов, указанных в таблице 13 для FcγRIa, FcγRIIaR, FcγRIIaH, FcγRIIb и FcγRIIIaV способом справочного примера 2, обобщенно представлены в таблице 14. В таблице изменение относится к изменению, внесенному в IL6R-F11 (SEQ ID NO: 60). Матрица, использованная для получения IL6R-F11, IL6R-G1d/IL6R-L, обозначена звездочкой (*). Более того, KD(IIaR)/KD(IIb) и KD(IIaH)/KD(IIb) в таблице, соответственно, показывают величину, полученную путем деления величины KD каждого варианта для FcγRIIaR на величину KD каждого варианта для FcγRIIb, и величину, полученную делением величины KD каждого варианта для FcγRIIaH на величину KD каждого варианта для FcγRIIb. KD(IIb) исходного полипептида/KD(IIb) варианта относится к величине, полученной путем деления величины KD исходного полипептида в отношении FcγRIIb на величину KD каждого варианта для FcγRIIb. Кроме того, в таблице 14 показаны величины KD для более сильной активности связывания FcγRIIaR и FcγRIIaH каждого варианта/величины KD для более сильной активности связывания FcγRIIaR и FcγRIIaH исходного полипептида. В этом случае исходный полипептид относится к варианту, который имеет IL6R-F11 (SEQ ID NO: 60) в качестве H-цепи. Было определено, что, вследствие слабого связывания FcγR с IgG, его было невозможно точно проанализировать с помощью анализа кинетики, и, таким образом, закрашенные серым цветом ячейки в таблице 14 показывают величины, вычисленные с использованием уравнения 2 справочного примера 2.
[Уравнение 2]
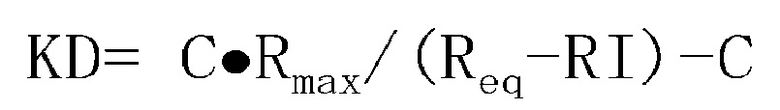
В таблице 14 показано, что у всех вариантов аффинность связывания с FcγRIIb повышалась по сравнению с IL6R-F11, и диапазон улучшения составлял от 1,9 раза до 5,0 раз. Соотношение величина KD каждого варианта в отношении FcγRIIaR/величина KD каждого варианта в отношении FcγRIIb и соотношение величина KD каждого варианта в отношении FcγRIIaH/величина KD каждого варианта в отношении FcγRIIb соответствует активности связывания FcγRIIb относительно активности связывания FcγRIIaR и активности связывания FcγRIIaH, соответственно. Следовательно, эти величины показывают степень селективности связывания каждого варианта в отношении FcγRIIb, и более высокая величина указывает на более высокую селективность связывания в отношении FcγRIIb. Для исходного полипептида IL6R-F11/IL6R-L, соотношение величина KD для FcγRIIaR/величина KD для FcγRIIb и соотношение величина KD для FcγRIIaH/величина KD для FcγRIIb в обоих случаях равно 0,7, и, соответственно, все варианты, представленные в таблице 14, продемонстрировали увеличение селективности связывания в отношении FcγRIIb по сравнению с исходным полипептидом. Когда отношение величина KD для более сильной из активностей связывания FcγRIIaR и FcγRIIaH варианта/величина KD для более сильной из активностей связывания FcγRIIaR и FcγRIIaH исходного полипептида равно 1 или более, это означает, что более сильная из активностей связывания FcγRIIaR и FcγRIIaH варианта имеет эквивалентное или сниженное связывание по сравнению со связыванием при более сильной из активностей связывания FcγRIIaR и FcγRIIaH исходного полипептида. Поскольку эта величина составляла от 0,7 до 5,0 для вариантов, полученных на этот раз, можно сказать, что связывание при более сильной из активностей связывания FcγRIIaR и FcγRIIaH вариантов, полученных на этот раз, было практически таким же или сниженным по сравнению с исходным полипептидом. Эти результаты показали, что, по сравнению с исходным полипептидом, варианты, полученные в этом случае, имеют сохраненную или сниженную активность связывания с FcγRIIa типа R и типа H и усиленную активность связывания с FcγRIIb и, таким образом, обладают увеличенной селективностью в отношении FcγRIIb. Более того, по сравнению с IL6R-F11, все варианты имели более низкую аффинность в отношении FcγRIa и FcγRIIIaV.
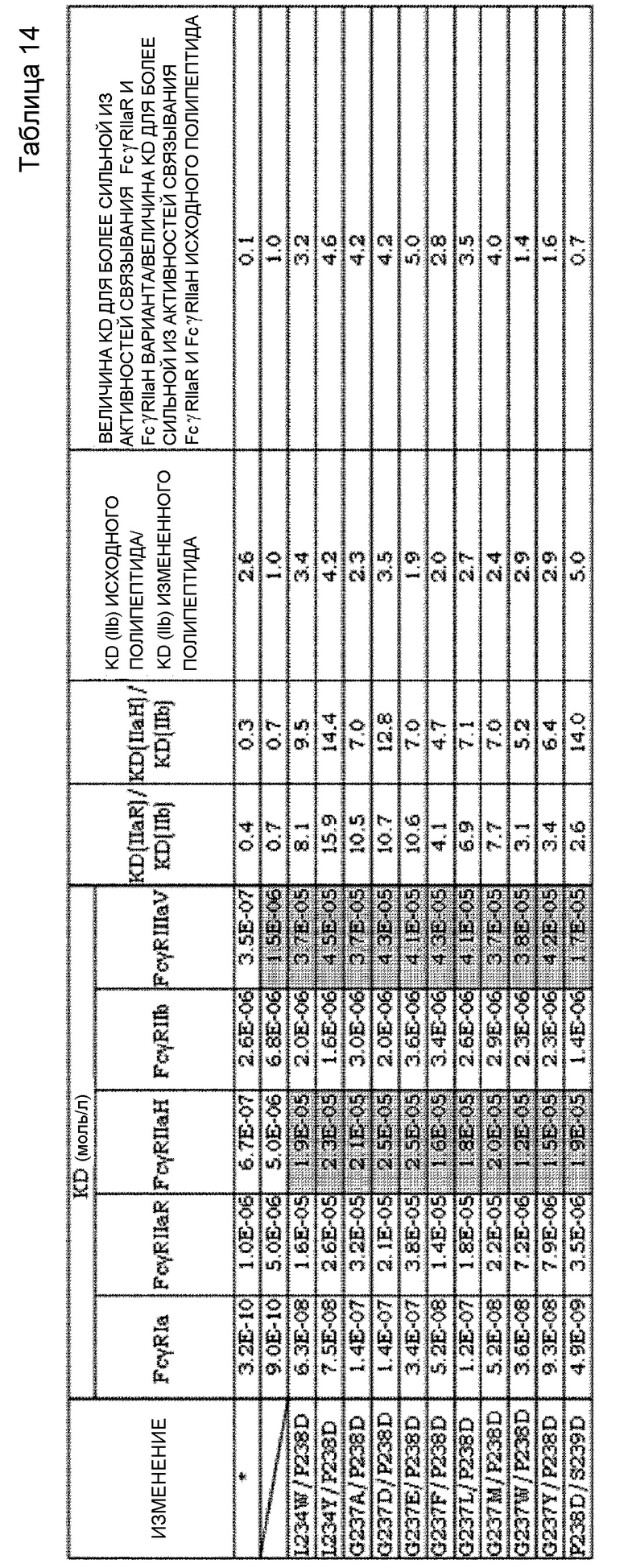
[Пример 10] Рентгеноструктурный анализ комплекса, образованного между Fc, содержащей P238D, и внеклеточной областью FcγRIIb
Как показано ранее в примере 9, даже несмотря на то, что вносят изменение, для которого из анализа встречающихся в природе IgG1-антител предсказано, что оно повышает активность связывания FcγRIIb или селективность к FcγRIIb, в Fc, содержащую P238D, было выявлено, что активность связывания FcγRIIb снижается, и причиной для этого может быть то, что структура на поверхности взаимодействия между Fc и FcγRIIb изменяется вследствие внесения P238D. Таким образом, для установления причины этого явления определяли трехмерную структуру комплекса, образованного между Fc IgG1, содержащей мутацию P238D (далее, обозначаемой как Fc(P238D)), и внеклеточной областью FcγRIIb с помощью рентгеноструктурного анализа, и ее сравнивали с трехмерной структурой комплекса, образованного между Fc встречающегося в природе IgG1 (далее обозначаемой как Fc(WT)) и внеклеточной областью FcγRIIb, и сравнивали способы связывания. Было сделано множество сообщений о трехмерной структуре комплекса, образованного между Fc и внеклеточной областью FcγR; и были проанализированы трехмерные структуры комплекса Fc(WT)/внеклеточная область FcγRIIIb (Nature, 2000, 400:267-273; J. Biol. Chem. 2011, 276:16469-16477), комплекса Fc(WT)/внеклеточная область FcγRIIIa (Proc. Natl. Acad. Sci. USA, 2011, 108:12669-126674) и комплекса Fc(WT)/внеклеточная область FcγRIIa (J. Immunol. 2011, 187:3208-3217). Хотя трехмерная структура комплекса Fc(WT)/внеклеточная область FcγRIIb не была проанализирована, FcγRIIa, трехмерная структура которого в комплексе с Fc(WT) уже известна, и FcγRIIb совпадают на 93% по аминокислотной последовательности их внеклеточной области и имеют очень высокую гомологию. Таким образом, трехмерная структура комплекса Fc(WT)/внеклеточная область FcγRIIb была предсказана путем моделирования с использованием кристаллической структуры комплекса Fc(WT)/внеклеточная область FcγRIIa.
Трехмерная структура комплекса Fc(P238D)/внеклеточная область FcγRIIb была определена с помощью рентгеноструктурного анализа при разрешении 2,6 Å. Структура, полученная в результате этого анализа, представлена на фиг.21. Внеклеточная область FcγRIIb связывается между двумя CH2-доменами Fc, и это было аналогично трехмерным структурам комплексов, образованных между Fc(WT) и соответствующей внеклеточной областью FcγRIIIa, FcγRIIIb или FcγRIIa, проанализированных до настоящего времени. Далее для детального сравнения кристаллическую структуру комплекса Fc(P238D)/внеклеточная область FcγRIIb и структуру комплекса Fc(WT)/внеклеточная область FcγRIIb накладывали друг на друга с помощью аппроксимации методом наименьших квадратов на основе расстояний между парами атомов Cα в отношении внеклеточной области FcγRIIb и CH2-домена A Fc (фиг. 22). В этом случае степень перекрывания между CH2-доменами B Fc не была удовлетворительной, и в этой части были выявлены конформационные различия. Более того, с использованием кристаллической структуры комплекса Fc(P238D)/внеклеточная область FcγRIIb и модельной структуры комплекса Fc(WT)/внеклеточная область FcγRIIb, отбирали пары атомов, которые имеют расстояние 3,7 Å или менее между отобранной внеклеточной областью FcγRIIb и CH2-доменом B Fc для сравнения в отношении межатомного взаимодействия между FcγRIIb и CH2-доменом B в Fc(WT) с межатомным взаимодействием между FcγRIIb и CH2-доменом B Fc(P238D). Как показано в таблице 15, межатомные взаимодействия между CH2-доменом B Fc и FcγRIIb в Fc(P238D) и Fc(WT) не совпадали.
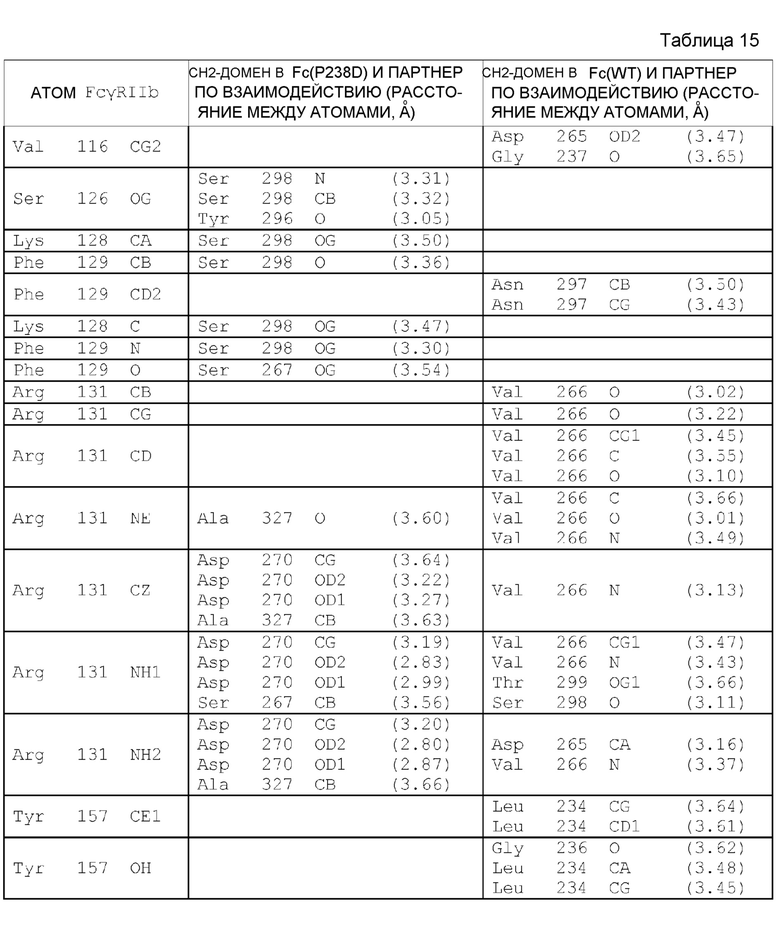
Более того, детальные структуры в области P238D сравнивали путем наложения рентгеновской кристаллической структуры комплекса Fc (P238D)/внеклеточная область FcγRIIb на модельную структуру комплекса Fc (WT)/внеклеточная область FcγRIIb с использованием метода наименьших квадратов на основе атомного расстояния Cα между CH2-доменами A и B Fc отдельно. Поскольку положение аминокислотного остатка в положении 238 (нумерация EU), т.е. положение мутагенеза Fc (P238D), изменено относительно Fc (WT), было выявлено, что структура петли в области аминокислотного остатка в положении 238 после шарнирной области отличается между Fc (P238D) и Fc (WT) (фиг.23). Pro в положении 238 (нумерация EU) первоначально расположен внутри Fc (WT), образуя гидрофобную сердцевину с остатками в области положения 238. Однако, если Pro в положении 238 (нумерация EU) изменен на высоко гидрофильный и заряженный Asp, присутствие измененного остатка Asp в гидрофобной сердцевине является энергетически преимущественным с точки зрения десольватации. Таким образом, в Fc(P238D) для устранения этой энергетически невыгодной ситуации, аминокислотный остаток в положении 238 (нумерация EU) изменяет его ориентацию в сторону растворителя, и это может вызвать это изменение в структуре петли вблизи аминокислотного остатка в положении 238. Более того, поскольку эта петля расположена недалеко от шарнирной области, сшитой связью S-S, ее структурное изменение не будет ограничено локальным изменением, и повлияет на относительное расположение CH2-домена A и домена B Fc. В результате, было предположено, что изменяются межатомные взаимодействия между FcγRIIb и CH2-доменом B Fc. Таким образом, предсказанные эффекты нельзя было наблюдать, когда изменения, которые повышают селективность и активность связывания с FcγRIIb во встречающемся в природе IgG, комбинировали с Fc, содержащим изменение P238D.
Более того, в результате структурных изменений вследствие внесения P238D в CH2-домен A Fc, была выявлена водородная связь между основной цепью Gly в положении 237 (нумерация EU), которое является соседним с мутантным P238D и Tyr в положении 160 в FcγRIIb (фиг.24). Остаток в FcγRIIa, который соответствует этому Tyr160, представляет собой Phe; и когда происходит связывание с FcγRIIa, эта водородная связь не образуется. Учитывая, что аминокислота в положении 160 представляет собой одно из небольшого количества отличий между FcγRIIa и FcγRIIb на границе взаимодействия с Fc, и присутствие этой водородной связи, которая является специфичной к FcγRIIb, предположительно привело к повышению активности связывания FcγRIIb и снижению активности связывания FcγRIIa в Fc(P238D) и повышению его селективности. Более того, в CH2-домене B Fc наблюдают электростатическое взаимодействие между Asp в положении 270 (нумерация EU) и Arg в положении 131 в FcγRIIb (фиг. 25). В FcγRIIa типа H, который является одним из аллотипов FcγRIIa, остаток, соответствующий Arg в положении 131 FcγRIIb, представляет собой His, и, таким образом, он не может образовывать это электростатическое взаимодействие. Это может объяснить, почему активность связывания Fc(P238D) снижается в FcγRIIa типа H по сравнению с FcγRIIa типа R. Наблюдения, сделанные на основе таких результатов рентгеноструктурного анализа, показали, что изменение структуры петли вблизи P238D вследствие внесения P238D и сопутствующего изменения в относительном расположении доменов вызывает формирование новых взаимодействий, которые не встречаются при связывании встречающегося в природе IgG и FcγR, и это могло привести к селективному профилю связывания вариантов P238D в отношении FcγRIIb.
[Экспрессия и очистка Fc(P238D)]
Fc, содержащую изменение P238D, получали следующим образом. Сначала Cys в положении 220 (нумерация EU) hIL6R-IgG1-v1 (SEQ ID NO: 62) заменяли на Ser. Затем генетическую последовательность Fc(P238D) от Glu в положении 236 (нумерация EU) до ее C-конца клонировали способом ПЦР. С использованием этой клонированной генетической последовательности проводили продуцирование экспрессирующих векторов и экспрессию и очистку Fc(P238D) в соответствии со способом справочного примера 1. Cys в положении 220 (нумерация EU) образует дисульфидную связь с Cys L-цепи в общем IgG1. L-цепь не коэкспрессируется, когда получают Fc отдельно, и, таким образом, остаток Cys заменяли на Ser, чтобы избежать образования ненужных дисульфидных связей.
[Экспрессия и очистка внеклеточной области FcγRIIb]
Внеклеточную область FcγRIIb получали в соответствии со способом справочного примера 2.
[Очитка комплекса Fc(P238D)/внеклеточная область FcγRIIb]
К 2 мг образца внеклеточной области FcγRIIb, полученного для применения в кристаллизации, добавляли 0,29 мг Endo F1 (Protein Science (1996) 5:2617-2622), экспрессированного и очищенного из Escherichia coli, в качестве слитого белка глутатион-S-трансферазы. Смеси позволяли стоять при комнатной температуре в течение трех суток в 0,1 M буфере Bis-Tris при 6,5, и N-связанную цепь сахаров отщепляли, за исключением N-ацетилглюкозамина прямо связанного с Asn внеклеточной области FcγRIIb. Далее образец внеклеточной области FcγRIIb, подвергнутый обработке для отщепления цепи сахаров, который концентрировали путем ультрафильтрации с 5000 MWCO, очищали гель-фильтрацией (Superdex200 10/300) с использованием колонки, уравновешенной в 20 мМ HEPS при pH 7,5, содержавшем 0,05 M NaCl. Более того, к полученной после отщепления углевода фракции внеклеточной области FcγRIIb добавляли Fc(P238D), так чтобы внеклеточная область FcγRIIb в молярном соотношении присутствовала в небольшом избытке. Смесь, концентрированную путем ультрафильтрации с 10000 MWCO, очищали гель-фильтрацией (Superdex200 10/300) с использованием колонки, уравновешенной в 20 мМ HEPS при pH 7,5, содержащем 0,05 M NaCl. Таким образом, получали образец комплекса Fc(P238D)/внеклеточная область FcγRIIb.
[Кристаллизация комплекса Fc(P238D)/внеклеточная область FcγRIIb]
С использованием образца комплекса Fc(P238D)/внеклеточная область FcγRIIb, который концентрировали до приблизительно 10 мг/мл путем ультрафильтрации с 10000 MWCO, проводили кристаллизацию комплекса способом паровой диффузии с сидячей каплей. Для кристаллизации использовали Hydra II Plus One (MATRIX); и в качестве резервуарного раствора, содержавшего 100 мМ Bis-Tris pH 6,5, 17% PEG3350, 0,2 M ацетат аммония и 2,7% (масс./об.) D-галактозу, кристаллизационную каплю получали путем смешения соотношения резервуарный раствор:образец для кристаллизации = 0,2 мкл:0,2 мкл. Емкость закрывали, и кристаллу позволяли стоять при 20°C, и таким образом получали плоские кристаллы.
[Измерение данных рентгенодифракции в кристалле комплекса Fc(P238D)/внеклеточная область FcγRIIb]
Один из полученных монокристаллов комплекса Fc(P238D)/внеклеточная область FcγRIIb погружали в раствор 100 мМ Bis-Tris pH 6,5, 20% PEG3350, ацетат аммония, 2,7% (масс./об.) D-галактоза, 22,5% (об./об.) этиленгликоль. Монокристалл вылавливали из раствора с использованием булавки с прикрепленной тонкой нейлоновой петлей и замораживали в жидком азоте. Затем данные рентгенодифракции кристалла измеряли на оборудовании с магнитотормозном излучением Photon Factory BL-1A in High Energy Accelerator Research Organization. В ходе измерения кристалл постоянно помещали в поток азота при -178°C для поддержания в замороженном состоянии, и было получено всего 225 рентгенограмм с использованием детектора Quantum 270 CCD (ADSC), подсоединенного к линии пучка, с вращением кристалла 0,8° за один раз. Определение параметров ячейки, индексирование дифракционных пятен и обработку дифракционных данных из полученных рентгенограмм проводили с использованием программы Xia2 (CCP4 Software Suite), XDS Package (Walfgang Kabsch) и Scala (CCP4 Software Suite); и, наконец, получали данные об интенсивности дифракции кристалла при разрешении вплоть до 2,46 Å. Кристалл относится к пространственной группе P21 и имеет следующие параметры ячейки; a=48,85 Å, b=76,01 Å, c=115,09 Å, a=90°, β=100,70°, α=90°.
[Рентгеноструктурный анализ комплекса Fc(P238D)/внеклеточная область FcγRIIb]
Кристаллическую структуру комплекса Fc(P238D)/внеклеточная область FcγRIIb определяли способом молекулярного замещения с использованием программы Phaser (CCP4 Software Suite). Из размера полученной кристаллической решетки и молекулярной массы комплекса Fc(P238D)/внеклеточная область FcγRIIb было предсказано, что количество комплексов в асимметричном элементе равно единице. Из структурных координат кода PDB: 3SGJ, который представляет собой кристаллическую структуру комплекса Fc(WT)/внеклеточная область FcγRIIIa, участки аминокислотных остатков A-цепи в положениях 239-340 и B-цепи в положениях 239-340 брали в качестве отдельных координат, и они были приняты, соответственно, в качестве моделей для поиска CH2-доменов Fc. Участки аминокислотных остатков A-цепи в положениях 341-444 и B-цепи в положениях 341-443 брали в качестве единого набора координат из тех же структурных координат кода PDB: 3SGJ; и они были приняты в качестве модели для поиска CH3-доменов Fc. Наконец, из структурных координат кода PDB: 2FCB, что соответствует кристаллической структуре внеклеточной области FcγRIIb, участки аминокислотных остатков A-цепи в положениях 6-178 выбирали, и они были приняты в качестве модели для поиска внеклеточной области FcγRIIb. Ориентацию и положение каждой поисковой модели в кристаллической решетке определяли в порядке CH3-домен Fc, внеклеточная область FcγRIIb и CH2-домен Fc, исходя из функции вращения и функции трансляции, с получением первоначальной модели кристаллической структуры комплекса Fc(P238D)/внеклеточная область FcγRIIb. Когда на полученной первоначальной модели проводили уточнение жесткого тела, которое осуществляет движение двух CH2-доменов Fc, двух CH3-доменов Fc и внеклеточной области FcγRIIb, кристаллографический фактор достоверности, R-величина, становилась равной 40,4%, и свободная R-величина становилась равной 41,9% для данных интенсивности дифракции от 25 Å до 3,0 Å в этот момент времени. Более того, уточнение структуры с использованием программы Refmac5 (CCP4 Software Suite), и пересмотр модели для выявления карт электронной плотности, коэффициент которых имеет 2Fo-Fc или Fo-Fc, которые вычисляют, исходя из экспериментально определенного структурного фактора Fo, вычисленного структурного фактора Fc и вычисленной фазы с использованием модели, проводили с помощью программы Coot (Paul Emsley). Уточнение модели проводили путем повторения этих стадий. Наконец, в результате включения молекул воды в модель на основе карт электронной плотности, в которых используются 2Fo-Fc или Fo-Fc в качестве коэффициента, и последующего уточнения, кристаллографический фактор достоверности, R-величина, и свободная R-величина модели, содержащей 4846 не являющихся водородом атомами, становились равными 23,7% и 27,6% для 24291 данных интенсивности дифракции при разрешении от 25 Å до 2,6 Å, соответственно.
[Получение модельной структуры комплекса Fc(WT)/внеклеточная область FcγRIIb]
Исходя из структурных координат кода PDB: 3RY6, что соответствует кристаллической структуре комплекса Fc(WT)/внеклеточная область FcγRIIa, функцию Build Mutants программы Discovery Studio 3.1 (Accelrys) использовали для внесения мутаций, чтобы они соответствовали аминокислотной последовательности FcγRIIb, в FcγRIIa в этих структурных координатах. В этом случае уровень оптимизации был установлен на высокий, радиус отсечения был установлен на 4,5, получали пять моделей, и модель с наилучшей энергетической оценкой среди них устанавливали в качестве модельной структуры для комплекса Fc(WT)/внеклеточная область FcγRIIb.
[Пример 11] Анализ связывания FcγR вариантами Fc, в которых участки изменения были определены на основе кристаллических структур.
Исходя из результатов рентгеноструктурного анализа комплекса, образованного между Fc(P238D) и внеклеточной областью FcγRIIb, полученной в примере 10, конструировали варианты путем внесения комплексных изменений в участки измененной Fc, имеющей замену Pro в положении 238 (нумерация EU) на Asp, которые, как было предсказано, повлияют на взаимодействие с FcγRIIb (остатки положений 233, 240, 241, 263, 265, 266, 267, 268, 271, 273, 295, 296, 298, 300, 323, 325, 326, 327, 328, 330, 332 и 334 (нумерация EU)), и исследовали, можно ли получить комбинации изменений, которые далее усиливают связывание FcγRIIb, в дополнение к изменению P238D.
IL6R-B3 (SEQ ID NO: 63) получали путем внесения в IL6R-G1d (SEQ ID NO: 54), изменения, полученного путем замены Lys в положении 439 (нумерация EU) на Glu. Далее, получали IL6R-BF648 путем внесения в IL6R-B3 замены, полученной путем замены Pro в положении 238 (нумерация EU) на Asp. IL6R-L (SEQ ID NO: 56) использовали в качестве общей L-цепи антитела. Эти экспрессированные варианты антител очищали в соответствии со способом справочного примера 1. Связывание каждого из этих вариантов антител с каждым из FcγR (FcγRIa, FcγRIIa типа H, FcγRIIa типа R, FcγRIIb и FcγRIIIa типа V) детально оценивали способом справочного примера 2.
В соответствии со следующим способом строили график, чтобы показать результаты анализа взаимодействий с соответствующими FcγR. Значение величины связывания каждого варианта с каждым FcγR делили на величину связывания предварительно измененного контрольного антитела (IL6R-BF648/IL6R-L, изменение путем замены Pro в положении 238 (нумерация EU) на Asp) с каждым FcγR, а затем полученную величину умножали на 100, и она показана в качестве величины относительной активности связывания каждого варианта с каждым FcγR. На горизонтальной оси показана величина относительной активности связывания каждого варианта с FcγRIIb, и на вертикальной оси показана величина относительной активности связывания каждого варианта с FcγRIIa типа R (фиг. 26).
Как показано на фиг. 26, результаты показывают, что из всех изменений, как было выявлено, 24 типа изменений сохраняют или усиливают связывание FcγRIIb по сравнению с предварительно измененным антителом. Связывание этих вариантов с каждым из FcγR представлено в таблице 16. В таблице изменение относится к изменению, внесенному в IL6R-B3 (SEQ ID NO: 63). Матрица, использованная для получения IL6R-B3, IL6R-G1d/IL6R-L, обозначена звездочкой (*).
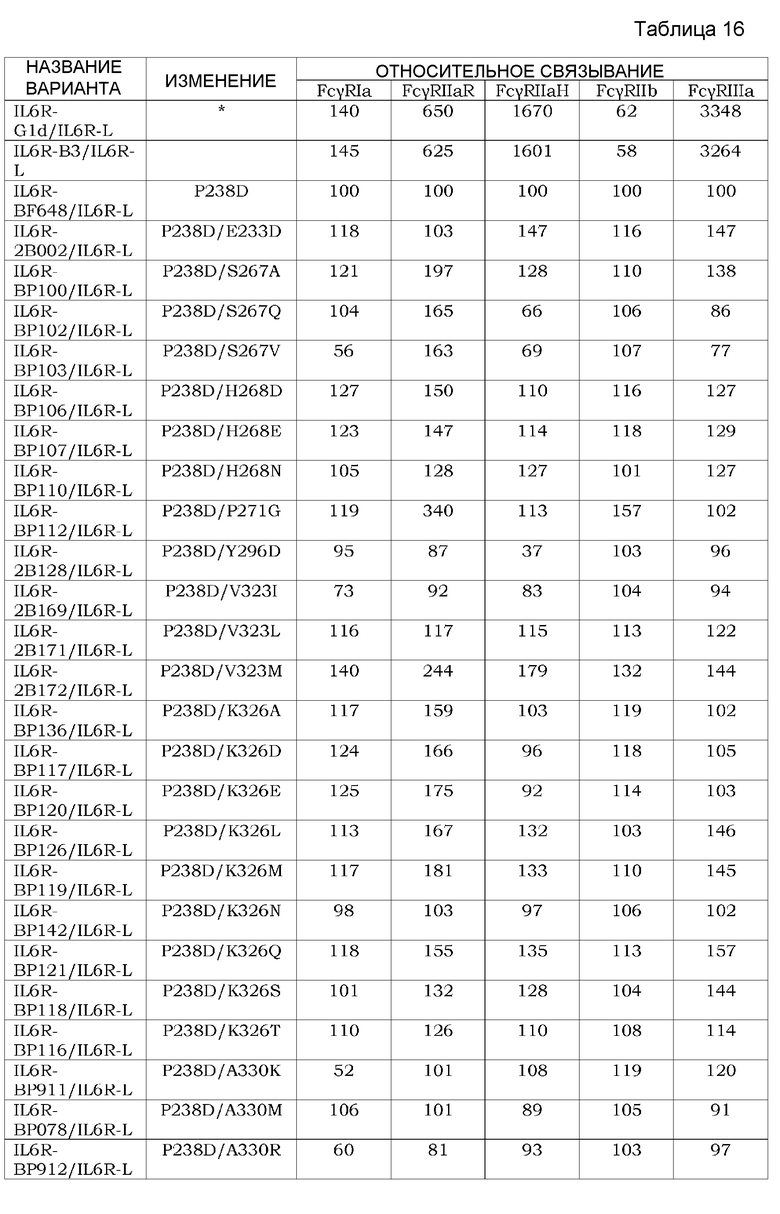
Результаты измерения величин KD вариантов, представленных в таблице 16 в отношении FcγRIa, FcγRIIaR, FcγRIIaH, FcγRIIb и FcγRIIIa типа V с помощью способа справочного примера 2, обобщенно представлены в таблице 17. В таблице изменение относится к изменению, внесенному в IL6R-B3 (SEQ ID NO: 63). Матрица, использованная для получения IL6R-B3, IL6R-G1d/IL6R-L, обозначена звездочкой (*). Более того, KD(IIaR)/KD(IIb) и KD(IIaH)/KD(IIb) в таблице, соответственно, соответствуют величине, полученной путем деления величины KD каждого варианта для FcγRIIaR на величину KD каждого варианта для FcγRIIb, и величине, полученной делением величины KD каждого варианта для FcγRIIaH на величину KD каждого варианта для FcγRIIb. KD(IIb) исходного полипептида/KD(IIb) измененного полипептида относится к величине, полученной делением величины KD исходного полипептида в отношении FcγRIIb на величину KD каждого варианта для FcγRIIb. Кроме того, величина KD для более сильной из активностей связывания FcγRIIaR и FcγRIIaH каждого варианта/величина KD для более сильной из активностей связывания FcγRIIaR и FcγRIIaH исходного полипептида представлена в таблице 17. Здесь исходный полипептид относится к варианту, который имеет IL6R-B3 (SEQ ID NO: 63) в качестве H-цепи. Было определено, что, вследствие слабого связывания FcγR с IgG, его было невозможно точно проанализировать с помощью анализа кинетики, и, таким образом, закрашенные серым цветом ячейки в таблице 17 показывают величины, вычисленные с использованием уравнения 2 справочного примера 2.
[Уравнение 2]
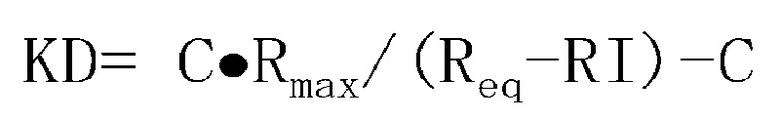
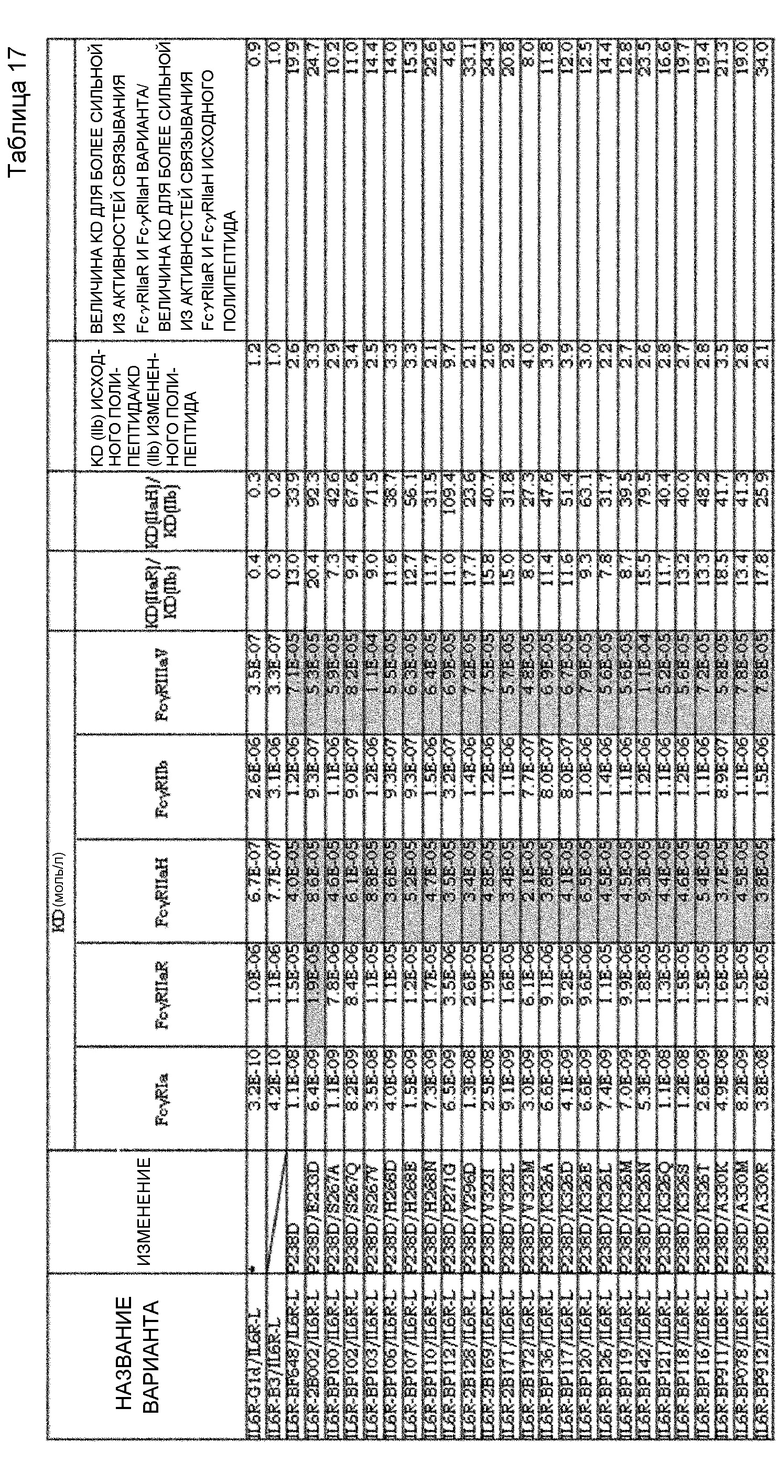
В таблице 17 показано, что, по сравнению с IL6R-B3, все варианты показали улучшение аффинности в отношении FcγRIIb, и диапазон улучшения составлял от 2,1 раза до 9,7 раз. Соотношение величина KD каждого варианта для FcγRIIaR/величина KD каждого варианта для FcγRIIb и соотношение величина KD каждого варианта для FcγRIIaH/величина KD каждого варианта для FcγRIIb соответствует активности связывания FcγRIIb относительно активности связывания FcγRIIaR и активности связывания FcγRIIaH, соответственно. Следовательно, эти величины показывают степень селективности связывания каждого варианта с FcγRIIb, и более высокая величина указывает на более высокую селективность связывания с FcγRIIb. Поскольку соотношение величина KD для FcγRIIaR/величина KD для FcγRIIb и соотношение величина KD для FcγRIIaH/величина KD для FcγRIIb в исходном полипептиде IL6R-B3/IL6R-L составляло 0,3 и 0,2, соответственно, все варианты в таблице 17 показали улучшение селективности связывания с FcγRIIb по сравнению с исходным полипептидом. Когда соотношение величина KD для более сильной из активностей связывания FcγRIIaR и FcγRIIaH варианта/величина KD для более сильной из активностей связывания FcγRIIaR и FcγRIIaH исходного полипептида равно 1 или более, это означает, что более сильная из активностей связывания FcγRIIaR и FcγRIIaH варианта имеет эквивалентное или сниженное связывание по сравнению со связыванием при более сильной из активностей связывания FcγRIIaR и FcγRIIaH исходного полипептида. Поскольку эта величина составляла от 4,6 до 34,0 для вариантов, полученных на этот раз, можно сказать, что по сравнению с исходным полипептидом варианты, полученные на этот раз, имели сниженное связывание при более сильной из активностей связывания FcγRIIaR и FcγRIIaH. Эти результаты показали, что, по сравнению с исходным полипептидом, варианты, полученные на этот раз, имеют сохраненную или сниженную активность связывания FcγRIIa типа R и типа H, усиленную активность связывания FcγRIIb и увеличенную селективность в отношении FcγRIIb. Более того, по сравнению с IL6R-B3, все варианты имели более низкую аффинность к FcγRIa и FcγRIIIaV.
Что касается перспективных вариантов среди полученных комбинированных вариантов, факторы, обеспечивающие их эффекты, исследовали с использованием кристаллической структуры. На фиг. 27 показана кристаллическая структура комплекса Fc(P238D)/внеклеточная область FcγRIIb. На этой фигуре H-цепь, расположенная слева, представляет собой A-цепь Fc, и H-цепь, расположенная справа, представляет собой B-цепь Fc. Здесь можно видеть, что участок в положении 233 (нумерация EU) в A-цепи Fc, расположен вблизи Lys в положении 113 FcγRIIb. Однако в этой кристаллической структуре боковая цепь E233 находится в состоянии в значительной степени высокой подвижности, и ее электронная плотность четко не выявляется. Таким образом, изменение, полученное путем замены Glu в положении 233 (нумерация EU) на Asp, приводит к снижению степени свободы боковой цепи, поскольку боковая цепь становится на один атом углерода короче. В результате, может быть снижена потеря энтропии при формировании взаимодействия с Lys в положении 113 FcγRIIb, и, следовательно, предположительно, это приводит к повышению свободной энергии связывания.
Аналогично, на фиг. 28 показано окружение вблизи участка в положении 330 (нумерация EU) в структуре комплекса Fc(P238D)/внеклеточная область FcγRIIb. На этой фигуре показано, что окружение участка в положении 330 (нумерация EU) A-цепи Fc в Fc (P238D) представляет собой гидрофильное окружение, состоящее из Ser в положении 85, Glu в положении 86, Lys в положении 163 и т.п. FcγRIIb. Таким образом, изменение, полученное путем замены Ala в положении 330 (нумерация EU) на Lys или Arg, предположительно приводит к упрочнению взаимодействия с Ser в положении 85 или Glu в положении 86 в FcγRIIb.
На фиг. 29 представлены структуры Pro в положении 271 (нумерация EU) B-цепи Fc после наложения друг на друга кристаллической структуры комплекса Fc(P238D)/внеклеточная область FcγRIIb и комплекса Fc(WT)/внеклеточная область FcγRIIIa путем аппроксимации с помощью метода наименьших квадратов на основе расстояний между парами атомов Cα в отношении B-цепи Fc. Эти две структуры хорошо соответствуют, но имеют различные трехмерные структуры Pro в положении 271 (нумерация EU). Когда также учитывают слабую электронную плотность в этой области в кристаллической структуре комплекса Fc(P238D)/внеклеточная область FcγRIIb, предполагается, что существует возможность того, что Pro в положении 271 (нумерация EU) в Fc(P238D)/FcγRIIb вызывает большое напряжение в структуре, таким образом, нарушая равновесие структуры петли для достижения оптимальной структуры. Таким образом, изменение, полученное путем замены Pro в положении 271 (нумерация EU) на Gly, обеспечивает подвижность этой структуры петли и предположительно приводит к усилению связывания путем снижения энергетического барьера, когда позволяют образоваться оптимальной структуре в ходе взаимодействия с FcγRIIb.
[Пример 12] Исследование комбинаторного эффекта изменений, которые усиливают связывание FcγRIIb, при комбинировании с P238D
Из изменений, полученных согласно примерам 9 и 11, изменения, которые усиливали связывание FcγRIIb или сохраняли связывание FcγRIIb и продемонстрировали эффекты подавления связывания с другими FcγR, комбинировали друг с другом, и их эффект исследовали.
Особенно удачные изменения, выбранные из таблиц 13 и 17, вносили в H-цепь антитела IL6R-BF648 аналогично способу примера 11. IL6R-L использовали в качестве L-цепи, экспрессированные антитела очищали в соответствии со способом справочного примера 1. Связывание с каждым из FcγR (FcγRIa, FcγRIIa H-типа, FcγRIIa R-типа, FcγRIIb и FcγRIIIa V-типа) детально оценивали способом справочного примера 2.
В соответствии со следующим способом, относительную активность связывания вычисляли для результатов анализа взаимодействий с соответствующими FcγR. Значение величины связывания каждого варианта с каждым FcγR делили на значение величины связывания предварительно измененного контрольного антитела (IL6R-BF648/IL6R-L) с заменами Pro в положении 238 (нумерация EU) на Asp с каждым FcγR и умножали на 100; а затем эту величину представляли в качестве относительной активности связывания каждого варианта с каждым FcγR (таблица 18). В таблице изменение относится к изменению, внесенному в IL6R-B3 (SEQ ID NO: 63). Матрица, использованная для получения IL6R-B3, IL6R-G1d/IL6R-L, обозначена звездочкой (*).
Таблица 18-2 является продолжением таблицы 18-1.
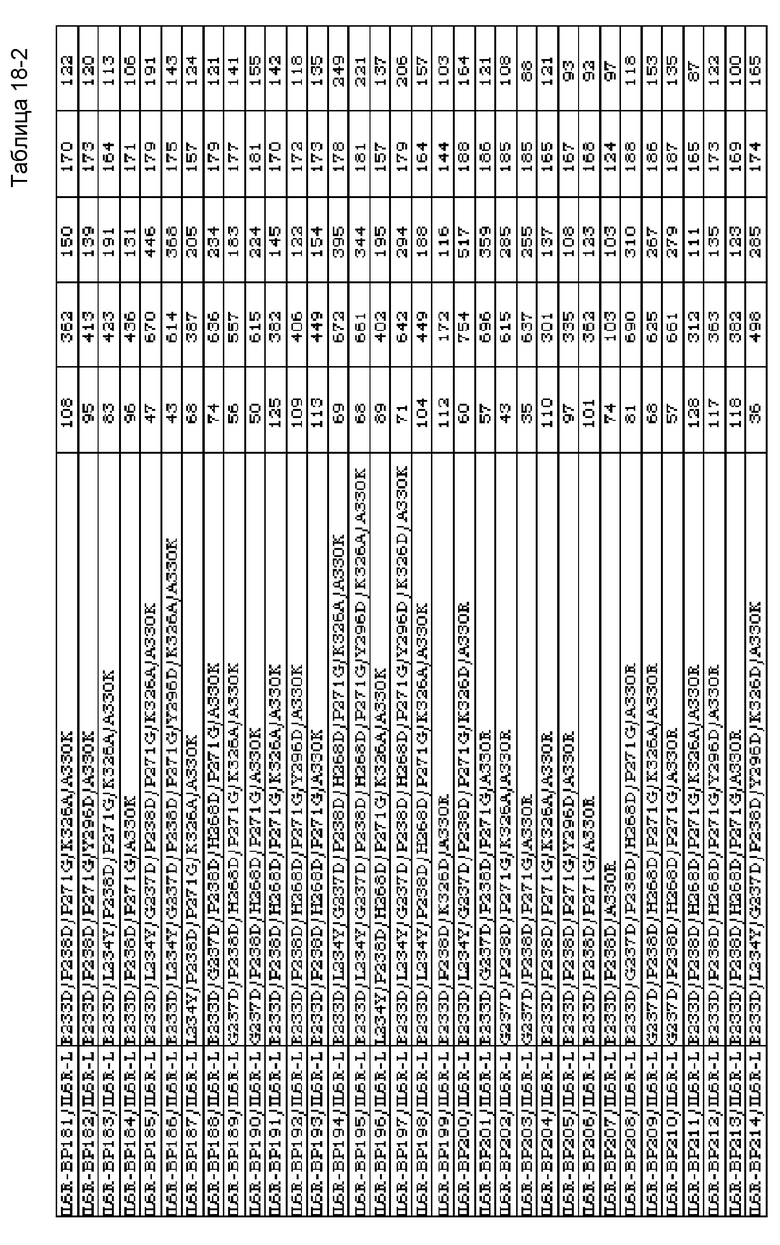
Результаты измерения величин KD вариантов, представленных в таблице 18, для FcγRIa, FcγRIIaR, FcγRIIaH, FcγRIIb и FcγRIIIa типа V способом справочного примера 2 обобщенно представлены в таблицах 19-1 и 19-2. В таблице изменение относится к изменению, внесенному в IL6R-B3 (SEQ ID NO: 63). Матрица, использованная для получения IL6R-B3, IL6R-G1d/IL6R-L, обозначена звездочкой (*). Более того, KD(IIaR)/KD(IIb) и KD(IIaH)/KD(IIb) в таблице, соответственно, соответствуют величине, полученной путем деления величины KD каждого варианта для FcγRIIaR на величину KD варианта для FcγRIIb, и величине, полученной путем деления величины KD варианта для FcγRIIaH на величину KD каждого варианта для FcγRIIb. KD(IIb) исходного полипептида/KD(IIb) измененного полипептида относится к величине, полученной путем деления величины KD исходного полипептида в отношении FcγRIIb на величину KD каждого варианта для FcγRIIb. Кроме того, в таблицах 19-1 и 19-2 представлено соотношение величина KD для более сильной из активностей связывания FcγRIIaR и FcγRIIaH каждого варианта/величина KD для более сильной из активностей связывания FcγRIIaR и FcγRIIaH исходного полипептида. Здесь, исходный полипептид относится к варианту, который имеет IL6R-B3 (SEQ ID NO: 63) в качестве H-цепи. Было определено, что вследствие слабого связывания FcγR с IgG, его было невозможно точно проанализировать путем анализа кинетики, и, таким образом, величины в закрашенных серым цветом ячейках в таблицах 19-1 и 19-2 показывают величины, вычисленные с использованием уравнения 2 справочного примера 2.
[Уравнение 2]
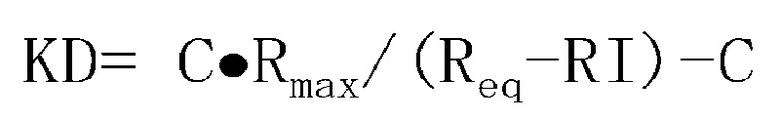
В таблицах 19-1 и 19-2 показано, что по сравнению с IL6R-B3 все варианты продемонстрировали увеличение аффинности к FcγRIIb и диапазон улучшения составлял от 3,0 раз до 99,0 раз. Соотношение величина KD каждого варианта в отношении FcγRIIaR/величина KD каждого варианта в отношении FcγRIIb и соотношение величина KD каждого варианта в отношении FcγRIIaH/величина KD каждого варианта в отношении FcγRIIb соответствует активности связывания FcγRIIb относительно активности связывания FcγRIIaR и активности связывания FcγRIIaH, соответственно. Следовательно, эти величины показывают степень селективности связывания каждого варианта с FcγRIIb, и более высокая величина указывает на более высокую селективность связывания с FcγRIIb. Поскольку соотношение величина KD в отношении FcγRIIaR/величина KD в отношении FcγRIIb и соотношение величина KD в отношении FcγRIIaH/величина KD для в отношении FcγRIIb исходного полипептида IL6R-B3/IL6R-L составляло 0,3 и 0,2, соответственно, все варианты в таблицах 19-1 и 19-2 показали увеличение селективности связывания с FcγRIIb по сравнению с исходным полипептидом. Когда соотношение величина KD для более сильной из активностей связывания FcγRIIaR и FcγRIIaH варианта/величина KD для более сильной из активностей связывания исходного полипептида равно 1 или более, это означает, что более сильная из активностей связывания FcγRIIaR и FcγRIIaH варианта имеет эквивалентное или сниженное связывание по сравнению со связыванием при более сильной из активностей связывания FcγRIIaR и FcγRIIaH исходного полипептида. Поскольку эта величина составляла от 0,7 до 29,9 для вариантов, полученных на этот раз, можно сказать, что связывание при более сильной из активностей связывания вариантов FcνRIIaR и FcγRIIaH, полученных на этот раз, практически эквивалентно или снижено по сравнению с исходным полипептидом. Эти результаты показали, что по сравнению с исходным полипептидом варианты, полученные на этот раз, имеют сохраненную или сниженную активность связывания FcγRIIa типа R и типа H, усиленную активность связывания FcγRIIb и увеличенную селективность в отношении FcγRIIb. Более того, по сравнению с IL6R-B3 все варианты имели более низкую аффинность в отношении FcγRIa и FcγRIIIaV.
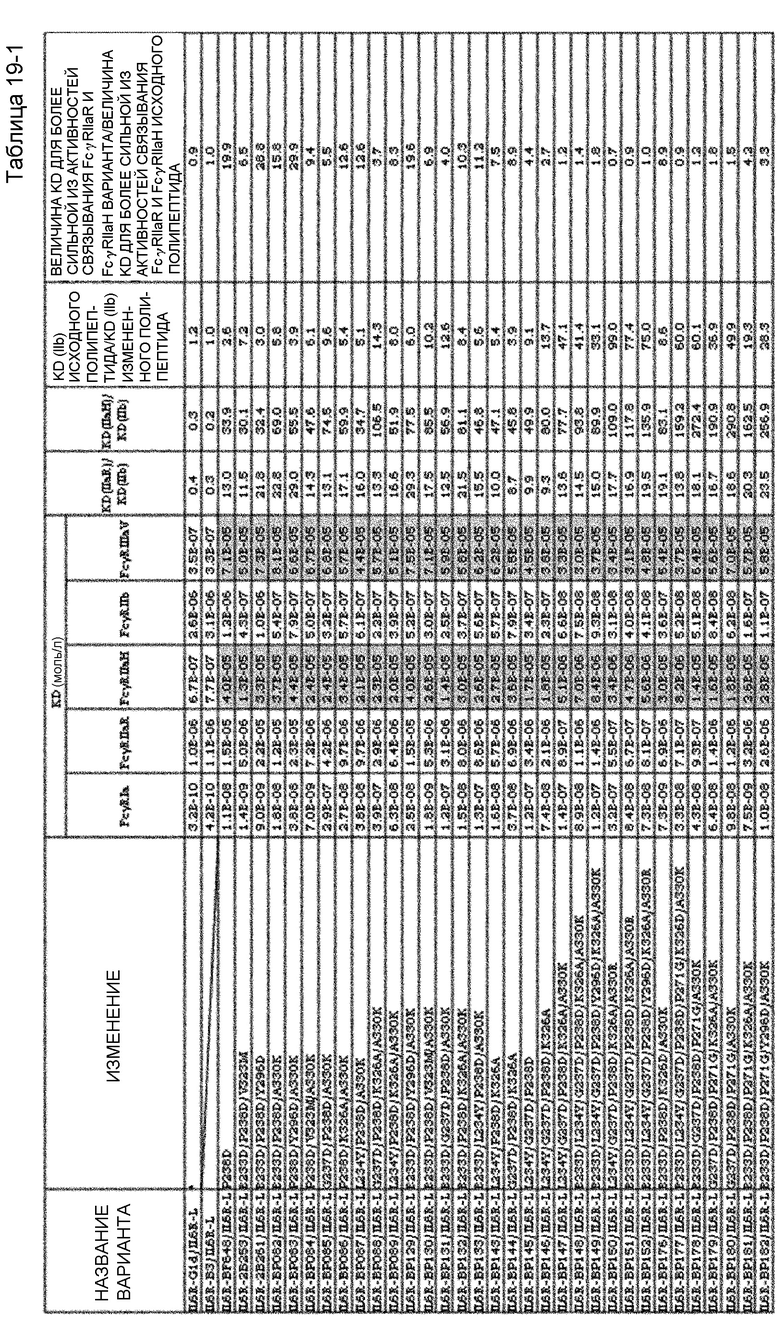
Таблица 19-2 является продолжением таблицы 19-1.

[Пример 13] Получение вариантов с усиленным связыванием FcγRIIb
Как показано в примере 8, при усилении связывания FcγRIIb предпочтительно, чтобы связывание FcγRIIb усиливалось при максимальном подавлении связывания с другими активирующими FcγR. Таким образом, авторы настоящего изобретения дополнительно получили варианты с усиленным связыванием FcγRIIb или увеличенной селективностью в отношении FcγRIIb посредством комбинирования изменений, которые усиливают связывание FcγRIIb, или повышения селективности в отношении FcγRIIb. В частности, изменения, описанные в примерах 9, 11 и 12, для которых было выявлено, что они являются эффективными при комбинировании с изменением P238D, комбинировали друг с другом, на основе изменения P238D, которое продемонстрировало превосходный эффект усиления связывания FcγRIIb и повышения селективности к FcγRIIb.
Варианты получали путем комбинирования Fc-областей IL6R-G1d (SEQ ID NO: 54) и IL6R-B3 (SEQ ID NO: 63) с изменениями E233D, L234Y, G237D, S267Q, H268D, P271G, Y296D, K326D, K326A, A330R и A330K, описанными в примерах 9, 11 и 12, которые, как было выявлено, являются эффективными при комбинировании с изменением P238D. С использованием IL6R-L (SEQ ID NO: 56) в качестве L-цепи антитела, антитела, содержащие описанные выше варианты в тяжелой цепи, экспрессировали и очищали в соответствии со способом, описанным в справочном примере 1. Полученные варианты, соответственно, оценивали в отношении связывания с каждым FcγR (FcγRIa, FcγRIIaH, FcγRIIaR, FcγRIIb или FcγRIIIaV) способом, описанным в справочном примере 2.
KD каждого варианта в отношении каждого FcγR представлена в таблице 20. "Изменение" относится к изменению, внесенному в IL6R-B3 (SEQ ID NO: 63). IL6R-B3/IL6R-L, которое используют в качестве матрицы для получения каждого варианта, указано звездочкой (*). "KD (IIaR)/KD (IIb)" в таблице демонстрирует величину, полученную делением KD каждого варианта в отношении FcγRIIaR на KD каждого варианта в отношении FcγRIIb. Чем больше величина, тем более высокой является селективность в отношении FcγRIIb. "KD (IIb) исходного полипептида/KD (IIb) измененного полипептида" демонстрирует величину, полученную делением величины KD IL6R-B3/IL6R-L в отношении FcγRIIb на величину KD каждого варианта в отношении FcγRIIb. Между тем, KD (IIaR) исходного полипептида/KD (IIaR) измененного полипептида демонстрирует величину, полученную делением величины KD IL6R-B3/IL6R-L в отношении FcγRIIaR на величину KD каждого варианта в отношении FcγRIIaR. В таблице 20 величина в закрашенных серым цветом ячейках указывает на то, что было сделано заключение, что связывание FcγR с IgG является слишком слабым для анализа посредством анализа кинетики и, таким образом, его вычисляли с использованием:
[Уравнение 2]
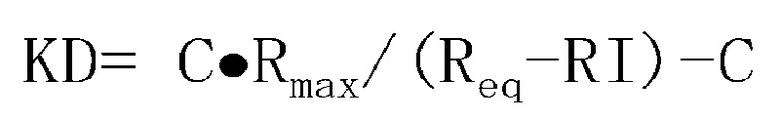 ,
,
которое описано в справочном примере 2.

Принимая связывание IL6R-B3/IL6R-L, полученного внесением изменения K439E в IL6R-G1d/IL6R-L, содержащего последовательность нативного IgG1 человека с каждым FcγR, за 1, связывание IL6R-G1d/IL6R-L с FcγRIa составляло 1,3 раза; связывание IL6R-G1d/IL6R-L с FcγRIIaR составляло 1,1 раза; связывание IL6R-G1d/IL6R-L с FcγRIIaH составляло 1,1 раза, связывание IL6R-G1d/IL6R-L с FcγRIIb составляло 1,2 раза и связывание IL6R-G1d/IL6R-L с FcγRIIIaV составляло 0,9 раз. Таким образом, для любого данного типа FcγR, связывание IL6R-B3/IL6R-L с FcγR было сравнимым со связыванием IL6R-G1d/IL6R-L с FcγR. Таким образом, сравнение связывания каждого варианта с каждым FcγR с IL6R-B3/IL6R-L перед внесением изменения предположительно эквивалентно сравнению связывания каждого варианта с каждым FcγR со связыванием IL6R-G1d/IL6R-L, содержащего последовательность нативного IgG1 человека, с каждым FcγR. По этой причине в представленных ниже примерах активность связывания каждого варианта с каждым FcγR будут сравнивать с активностью связывания IL6R-B3/IL6R-L с каждым FcγR перед внесением изменения. В таблице 20 показано, что все варианты обладают увеличенной активностью связывания FcγRIIb по сравнению с IL6R-B3 перед внесением изменения. Активность связывания IL6R-BF648/IL6R-L, которая была наиболее низкой, была увеличена в 2,6 раза, в то время как активность связывания IL6R-BP230/IL6R-L, которая является наиболее высокой, была увеличена в 147,6 раз. Что касается величины KD (IIaR)/KD (IIb), которая соответствует селективности, величина для IL6R-BP234/IL6R-L, которая была наиболее низкой, составляла 10,0, в то время как величина для IL6R-BP231/IL6R-L, которая была наиболее высокой, составляла 32,2. По сравнению с 0,3 для IL6R-B3/IL6R-L перед внесением изменения, эти величины подразумевают, что все варианты обладают увеличенной селективностью. Все варианты продемонстрировали более низкую активность связывания с FcγRIa, FcγRIIaH и FcγRIIIaV, чем у IL6R-B3/IL6R-L, перед внесением изменения.
[Пример 14] Рентгеноструктурный анализ комплексов внеклеточной области FcγRIIb или внеклеточной области FcγRIIaR и Fc-области с усиленным связыванием FcγRIIb
Как показано в примере 13, связывание с FcγRIIb варианта IL6R-BP230/IL6R-L, активность связывания которого с FcγRIIb была в наибольшей степени усилена, было усилено приблизительно в 150 раз по сравнению с IL6R-B3/IL6R-L перед внесением изменения, в то время как его связывание с FcγRIIaR подавлялось приблизительно в 1,9 раза. Таким образом, IL6R-BP230/IL6R-L является превосходным, как в отношении связывания FcγRIIb, так и селективности. Однако авторы настоящего изобретения искали возможность создать более предпочтительные варианты с еще более усиленным связыванием FcγRIIb при подавлении связывания FcγRIIaR настолько, насколько это возможно.
Как показано на фиг. 25, описанной в примере 10, в Fc-области с изменением P238D, Asp в положении 270 (нумерация EU) в его CH2-домене B образует прочное электростатическое взаимодействие с Arg в положении 131 в FcγRIIb. Этот аминокислотный остаток в положении 131 представляет собой His в FcγRIIIa и FcγRIIaH, в то время как он представляет собой Arg в FcγRIIaR, как и в FcγRIIb. Таким образом, отсутствует отличие между FcγRIIaR и FcγRIIb с точки зрения взаимодействия аминокислотного остатка в положении 131 с Asp в положении 270 (нумерация EU) в CH2-домене B. Это предположительно является основным фактором низкой селективности между связыванием Fc-области с FcγRIIb и с FcγRIIaR.
С другой стороны, внеклеточные области FcγRIIa и FcγRIIb на 93% идентичны по аминокислотной последовательности, и, таким образом, они обладают очень высокой гомологией. Исходя из структурного анализа кристаллов комплекса Fc-области нативного IgG1 (далее сокращенно обозначаемого как Fc (WT)) и внеклеточной области FcγRIIaR (J. Imunol. (2011) 187, 3208-3217), было выявлено различие поверхности контакта между FcγRIIaR и FcγRIIb в их взаимодействии, составляющее только три аминокислоты (Gln127, Leu132, Phe160). Таким образом, авторы настоящего изобретения предположили, что крайне трудно увеличить селективность Fc-области между связыванием FcγRIIb и связыванием FcγRIIaR.
В этом контексте авторы настоящего изобретения предположили, что для дальнейшего усиления активности связывания Fc-области с FcγRIIb и для повышения селективности Fc-областей между связыванием с FcγRIIb и FcγRIIaR, было важно установить тонкие различия между взаимодействием Fc-область-FcγRIIb и взаимодействием Fc-область-FcγRIIaR посредством анализа не только трехмерной структуры комплекса Fc-области с усиленным связыванием FcγRIIb и внеклеточной областью FcγRIIb, но также с трехмерной структурой комплекса Fc-области с усиленным связыванием FcγRIIb и внеклеточной областью FcγRIIaR. Сначала авторы настоящего изобретения проанализировали рентгеновскую кристаллическую структуру комплекса внеклеточной области FcγRIIb или FcγRIIaR и Fc (P208), полученной устранением изменения K439E из Fc-области IL6R-BP208/IL6R-L, полученной, как описано в примере 12, которая была вариантом, используемым в качестве основы для получения IL6R-BP230/IL6R-L.
(14-1) Рентгеноструктурный анализ комплекса Fc (P208) и внеклеточной области FcγRIIb
[Экспрессия и очистка Fc (P208)]
Fc (P208) получали, как описано ниже. Сначала IL6R-P208 получали путем замены Glu на Lys в положении 439 (нумерация EU) в IL6R-BP208, как и в случае последовательности нативного IgG1 человека. Затем клонировали последовательность гена Fc (P208), который клонировали способом ПЦР, от Glu в положении 216 (нумерация EU) до C-конца с использованием в качестве матрицы ДНК, кодирующей вариант с заменой Cys на Ser в положении 220 (нумерация EU). Конструирование экспрессирующего вектора, экспрессию и очистку осуществляли в соответствии со способом, описанным в справочном примере 1. Между тем, Cys в положении 220 (нумерация EU) в обычном IgG1 образует дисульфидную связь с Cys в L-цепи. При получении Fc-области отдельно, L-цепь не коэкспрессируется. Таким образом, Cys в положении 220 заменяли на Ser, чтобы избежать ненужного образования дисульфидной связи.
[Экспрессия и очистка внеклеточной области FcγRIIb]
Внеклеточную область FcγRIIb получали в соответствии со способом, описанным в справочном примере 2.
[Очистка комплекса Fc (P208)/внеклеточная область FcγRIIb]
К 0,15 мг очищенного продукта Endo F1 (Protein Science (1996) 5, 2617-2622), экспрессированного в E. coli в качестве слитого белка с глутатион-S-трансферазой, добавляли 1,5 мг образца для кристаллизации внеклеточной области FcγRIIb. Этому образу в 0,1 M буфере Bis-Tris (pH 6,5) позволяли стоять при комнатной температуре в течение трех суток для отщепления цепи сахаров N-типа, за исключением N-ацетилглюкозамина, прямо связанного с Asn в образце внеклеточной области FcγRIIb. Затем образец внеклеточной области FcγRIIb, подвергнутый обработке для расщепления цепи сахаров, концентрировали с помощью фильтра для ультрафильтрации 5000MWCO и очищали хроматографией с колонкой для гель-фильтрации (Superdex200 10/300), уравновешенной с помощью 20 мМ HEPES (pH7,5)/0,1 M NaCl. Более того, к очищенной фракции внеклеточной области FcγRIIb после отщепления от нее цепей сахаров добавляли Fc (P208) так, чтобы молярное соотношение внеклеточной области FcγRIIb присутствовало в небольшом избытке. Смесь, концентрированную путем ультрафильтрации с 10000 MWCO, очищали хроматографией с колонкой для гель-фильтрации (Superdex200 10/300), уравновешенной 25 мМ HEPES (pH 7,5)/0,1 M NaCl. Очищенную фракцию, полученную, как описано выше, использовали в качестве образца комплекса Fc (P208)/внеклеточная область FcγRIIb при последующей оценке.
[Кристаллизация комплекса Fc (P208)/внеклеточная область FcγRIIb]
Образец комплекса Fc (P208)/внеклеточная область FcγRIIb, концентрированный приблизительно до 10 мг/мл с помощью фильтра для ультрафильтрации 10000MWCO, кристаллизовали с использованием способа висячей капли посредством диффузии в парах в комбинации со способом внесения затравки. Для кристаллизации использовали планшет VDXm (Hampton Research). С использованием резервуарного раствора 0,1 M Bis-Tris (pH 6,5)/19% (масс./об.) PEG3350/0,2 M двухосновный фосфат калия, получали кристаллизационные капли в соотношении смешения резервуарный раствор:образец для кристаллизации = 0,85 мкл:0,85 мкл. Кристаллы комплекса, полученного в сходных условиях, дробили с помощью Seed Bead (Hampton Research) для получения раствора с затравочными кристаллами. К кристаллизационным каплям добавляли 0,15 мкл разбавленного раствора, полученного из затравочного раствора, и позволяли стоять при 20°C в закрытых резервуарных лунках. Это обеспечило плоские кристаллы.
[Измерение данных рентгенодифракции для кристалла комплекса Fc (P208)/внеклеточная область FcγRIIb]
Один кристалл комплекса Fc (P208)/внеклеточная область FcγRIIb, полученный, как описано выше, погружали в раствор 0,1 M Bis-Tris (pH 6,5)/24% (масс./об.) PEG3350/0,2 M двухосновный фосфат калия/20% (об./об.) этиленгликоль. Затем один кристалл вылавливали из раствора с использованием булавки с прикрепленной к ней нейлоновой петлей и замораживали в жидком азоте. Данные рентгенодифракции монокристалла получали с помощью Spring-8 BL32XU. В процессе измерения кристалл был постоянно помещен в поток азота при -178°C для сохранения в замороженном состоянии. Было получено всего 300 рентгенодифракционных изображений монокристалла с использованием детектора CCD MX-225HE (RAYONIX), подсоединенного к линии пучка с вращением монокристалла на 0,6° за раз. На основе полученных дифракционных изображений, определения константы решетки, индексирования дифракционных пятен, данных о дифракции проводили обработку с использованием программы Xia2 (J. Appl. Cryst. (2010) 43, 186-190), XDS Package (Acta Cryst. (2010) D66, 125-132) и Scala (Acta Cryst. (2006) D62, 72-82). Наконец, получали данные об интенсивности монокристалла при разрешении вплоть до 2,81 Å. Кристалл принадлежит к пространственной группе C2221 с константой решетки a=156,69 Å, b=260,17 Å, c=56,85 Å, α=90°, β=90° и γ=90°.
[Рентгеноструктурный анализ комплекса Fc (P208)/внеклеточная область FcγRIIb]
Структуру комплекса Fc (P208)/внеклеточная область FcγRIIb определяли способом молекулярного замещения с использованием программы Phaser (J. Appl. Cryst. (2007) 40, 658-674). Количество комплексов в асимметричном элементе оценивали, исходя из размера полученной кристаллической решетки и молекулярной массы комплекса Fc (P208)/внеклеточная область FcγRIIb. Участки из аминокислотных остатков в положениях 239-340 A-цепи и в положениях 239-340 B-цепи, которые были взяты в качестве отдельной координаты из структурной координаты кода PDB: 3SGJ для кристаллической структуры комплекса Fc (WT)/внеклеточная область FcγRIIIa, использовали, соответственно, в качестве моделей для поиска CH2-домена Fc-области. Аналогично, участки из аминокислотных остатков в положениях 341-444 A-цепи и в положениях 341-443 B-цепи, которые были взяты в качестве единичной координаты из структурной координаты кода PDB: 3SGJ, использовали в качестве модели для поиска CH3-домена Fc-области. Наконец, участки из аминокислотных остатков в положениях 6-178 A-цепи, которые были взяты из структурной координаты кода PDB: 2FCB для кристаллической структуры внеклеточной области FcγRIIb, использовали в качестве модели для поиска Fc (P208). Авторы настоящего изобретения предприняли попытку определить ориентации и положения соответствующих моделей для поиска CH3-домена Fc-области, внеклеточной области FcγRIIb и CH2-домена Fc-области в кристаллических решетках на основе функции вращения и функции сдвига, но не смогли определить положение одного из CH2-доменов. Затем, ссылаясь на кристаллическую структуру комплекса Fc (WT)/внеклеточная область FcγRIIIa, положение последнего CH2-домена A было определено, исходя из карты электронной плотности, которую вычисляли на основе фазы, определенной для остальных трех частей. Таким образом, авторы настоящего изобретения получили исходную модель кристаллической структуры комплекса Fc (P208)/внеклеточная область FcγRIIb. Величина кристаллографического фактора достоверности R структурной модели для данных интенсивности дифракции при от 25 до 3,0 Å составляла 42,6%, и величина свободного R составляла 43,7% после детализации жесткого каркаса полученной первоначальной структурной модели, в которой перемещаются два CH2-домена и два CH3-домена Fc-области и внеклеточная область FcγRIIb. Затем уточнения структурной модели достигали посредством повторения детализации структуры с использованием программы REFMAC5 (Acta Cryst. (2011) D67, 355-367) с последующей проверкой структурной модели, проведенной с использованием программы Coot (Acta Cryst. (2010) D66, 486-501) с помощью карт электронной плотности, где вычисляли коэффициенты 2Fo-Fc и Fo-Fc с использованием экспериментально определенного структурного фактора Fo, структурного фактора Fc, вычисленного в соответствии со структурной моделью, и фаз, вычисленных в соответствии со структурной моделью. Наконец, в результате включения молекул воды в модель на основе карт электронной плотности, в которой используются 2Fo-Fc или Fo-Fc в качестве коэффициентов и после детализации кристаллографический фактор надежности, величины R и величина свободного R в модели, содержащей 4786 неводородных атомов, составили 24,5% и 28,2% для 27259 данных интенсивности дифракции при разрешении от 25 Å до 2,81 Å, соответственно.
Трехмерную структуру комплекса Fc (P208)/внеклеточная область FcγRIIb определяли при разрешении 2,81 Å посредством анализа структуры. Структура, полученная с помощью этого анализа, представлена на фиг.30. Было выявлено, что внеклеточная область FcγRIIb связана между двумя CH2-доменами Fc-области, что напоминает трехмерные структуры ранее анализированных комплексов Fc (WT), которые представляют собой Fc нативного IgG и каждую из внеклеточных областей FcγRIIIa (Proc. Natl. Acad. Sci. USA (2011) 108, 12669-126674), FcγRIIIb (Nature (2000) 400, 267-273; J. Biol. Chem. (2011) 276, 16469-16477) и FcγRIIa (J. Immunol. (2011) 187(6), 3208-3217).
Тщательное наблюдение за комплексом Fc (P208)/внеклеточная область FcγRIIb выявило изменение в структуре петли в положениях 233-239 (нумерация EU) после шарнирной области в CH2-домене A Fc-области вследствие влияния внесенных изменений G237D и P238D по сравнению с комплексом Fc (WT)/внеклеточная область FcγRIIaR (фиг.31). Это привело к тому, что главная цепь Asp в положении 237 (нумерация EU) в Fc (P208) образовывала прочную водородную связь с боковой цепью Tyr в положении 160 в FcγRIIb (фиг.32). Как в FcγRIIaH, так и в FcγRIIaR аминокислотный остаток в положении 160 представляет собой Phe, который не способен образовывать такую водородную связь. Это указывает на то, что описанная выше водородная связь вносит важный вклад в усиление связывания FcγRIIb и приобретение селективности связывания Fc (P208) с FcγRIIa, т.е. повышение активности связывания Fc (P208)с FcγRIIb и уменьшение активности связывания Fc (P208)с FcγRIIa.
С другой стороны, боковая цепь Asp в положении 237 (нумерация EU) в Fc (P208) не формирует ни особенно значительного взаимодействия при связывании FcγRIIb, ни взаимодействия с другими остатками в Fc-области. Ile в положении 332, Glu в положении 333 и Lys в положении 334 (нумерация EU) в Fc-области расположены вблизи Asp в положении 237 (нумерация EU) (фиг. 33). Когда аминокислотные остатки в этих положениях заменены гидрофильными остатками для формирования взаимодействия с боковой цепью Asp в положении 237 (нумерация EU) в Fc (P208) и структура петли может быть стабилизирована посредством взаимодействия, это может приводить к снижению потери энергии энтропии вследствие образования водородных связей между Fc-областью и Tyr в положении 160 в FcγRIIb и, тем самым, к увеличению свободной энергии связывания, т.е. увеличению активности связывания.
При сравнении рентгеновской кристаллической структуры комплекса Fc (P238D) с изменением P238D и внеклеточной области FcγRIIb, описанного в примере 10, с рентгеновской кристаллической структурой комплекса Fc (P208) и внеклеточной области FcγRIIb, наблюдают изменения в пяти участках Fc (P208) по сравнению с Fc (P238D), и большинство изменений наблюдают только на уровне боковой цепи. Между тем, позиционное отклонение на уровне основной цепи вследствие изменения Pro на Gly в положении 271 (нумерация EU) также наблюдают в CH2-домене B Fc-области и, кроме того, существует структурное изменение в петле в положениях 266-270 (нумерация EU) (фиг. 34). Как описано в примере 11, предполагается, что, когда Asp в положении 270 (нумерация EU) в Fc (P238D) образует прочное электростатическое взаимодействие с Arg в положении 131 в FcγRIIb, взаимодействие может индуцировать стереохимическое напряжение в Pro в положении 271 (нумерация EU). Эксперимент, описанный в настоящем описании, указывает на то, что структурное изменение, наблюдаемое при изменении на Gly для аминокислоты в положении 271 (нумерация EU), предположительно, является результатом устранения структурного искажения, сосредоточенного у Pro, перед изменением и устранение приводит к увеличению свободной энергии для связывания FcγRIIb, т.е. увеличению активности связывания.
Более того, было продемонстрировано, что, вследствие изменения в структуре петли в положениях 266-271 (нумерация EU), Arg в положении 292 (нумерация EU) претерпевает структурное изменение между двумя состояниями. В этом случае было предположено, что электростатическое взаимодействие (фиг. 34), образованное между Arg в положении 292 (нумерация EU) и Asp в положении 268 (нумерация EU), который является измененным остатком в Fc (P208), может приводить к стабилизации структуры петли. Поскольку электростатическое взаимодействие между Asp в положении 270 (нумерация EU) в петле и Arg в положении 131 в FcγRIIb по большей части вносит вклад в активность связывания Fc (P208) с FcγRIIb, вероятно, стабилизация структуры петли в конформации связывания снизит потерю энергии энтропии при связывании. Таким образом, ожидается, что изменение приведет к увеличению свободной энергии связывания, т.е. увеличению активности связывания.
Более того, исходя из результата структурного анализа, исследовали возможность изменения для увеличения активности. Было обнаружено, что Ser в положении 239 (нумерация EU) является кандидатом для участка внесения изменения. Как показано на фиг. 35, Ser в положении 239 (нумерация EU) в CH2-домене B присутствует в положении, к которому наиболее естественным образом в структуре обращен Lys в положении 117 в FcγRIIb. Однако, поскольку электронной плотности не наблюдали для Lys в положении 117 в FcγRIIb с помощью анализа, описанного выше, Lys не имеет уточненной структуры. В этой ситуации Lys117, вероятно, имеет только ограниченный эффект на взаимодействие с Fc (P208). Когда Ser в положении 239 (нумерация EU) в CH2-домене B замещен отрицательно заряженным Asp или Glu, ожидается, что такое изменение вызовет электростатическое взаимодействие с положительно заряженным Lys в положении 117 в FcγRIIb, что, тем самым, приводит к повышению активности связывания FcγRIIb.
С другой стороны, наблюдение структуры Ser в положении 239 (нумерация EU) в CH2-домене A показало, что, вследствие образование водородной связи с главной цепью Gly в положении 236 (нумерация EU), боковая цепь этого Ser стабилизировала структуру петли в положениях 233-239, включая Asp в положении 237 (нумерация EU), который образует водородную связь с боковой цепью Tyr в положении 160 в FcγRIIb после шарнирной области (фиг. 32). Стабилизация структуры петли в конформации связывания может снизить потерю энергии энтропии при связывании и привести к увеличению свободной энергии связывания, т.е. увеличению активности связывания. Между тем, когда Ser в положении 239 (нумерация EU) в CH2-домене A заменен на Asp или Glu, структура петли может стать нестабильной вследствие потери водородной связи с главной цепью Gly в положении 236 (нумерация EU). Кроме того, изменение может приводить к электростатическому отталкиванию от Asp в положении 265 (нумерация EU), находящемуся рядом, что приведет к дальнейшей дестабилизации структуры петли. Энергия дестабилизации соответствует потере свободной энергии для связывания FcγRIIb, что может приводить к снижению активности связывания.
(14-2) Рентгеноструктурный анализ комплекса Fc (P208) и внеклеточной области FcγRIIaR
[Экспрессия и очистка внеклеточной области FcγRIIaR]
Внеклеточную область FcγRIIaR получали в соответствии со способом, описанном в справочном примере 2.
[Очистка комплекса Fc (P208)/внеклеточная область FcγRIIaR]
К 1,5 мг очищенного образца внеклеточной области FcγRIIaR добавляли 0,15 мг очищенного продукта Endo F1 (Protein Science (1996) 5, 2617-2622), экспрессированного в E. coli в качестве слитого белка с S-трансферазой, 20 мкл 5 Е/мл Endo F2 (QA-bio) и 20 мкл 5 Е/мл Endo F3 (QA-bio). После инкубации в течение 9 суток при комнатной температуре в 0,1 M Na-ацетатном буфере (pH 4,5), к образцу далее добавляли 0,07 мг описанного выше Endo F1, 7,5 мкл описанного выше Endo F2 и 7,5 мкл описанного выше Endo F3, и инкубировали в течение трех суток для отщепления цепи сахаров N-типа, за исключением N-ацетилглюкозамина, прямо связанного с Asn в образце внеклеточной области FcγRIIaR. Затем образец внеклеточной области FcγRIIaR, концентрированный с помощью фильтра для ультрафильтрации 10000MWCO и подвергнутый описанной выше обработке для отщепления цепи сахаров, очищали хроматографией с колонкой для гель-фильтрации (Superdex200 10/300), уравновешенной 25 мМ HEPES (pH 7)/0,1 M NaCl. Далее, к очищенной фракции внеклеточной области FcγRIIaR после отщепления от нее цепей сахаров добавляли Fc (P208) так, чтобы молярное соотношение внеклеточной области FcγRIIb присутствовало в небольшом избытке. Смесь, концентрированную путем ультрафильтрации с 10000MWCO, очищали хроматографией с колонкой для гель-фильтрации (Superdex200 10/300), уравновешенной 25 мМ HEPES (pH 7)/0,1 M NaCl. Очищенную фракцию, полученную, как описано выше, использовали в качестве образца комплекса Fc (P208)/внеклеточная область FcγRIIaR при последующей оценке.
[Кристаллизация комплекса Fc (P208)/внеклеточная область FcγRIIaR]
Образец комплекса Fc (P208)/внеклеточная область FcγRIIaR, концентрированный приблизительно до 10 мг/мл с помощью фильтра для ультрафильтрации 10000MWCO, кристаллизовали с использованием способа висячей капли посредством диффузии в парах. С использованием резервуарного раствора 0,1 M Bis-Tris (pH 7,5)/26%(масс./об.) PEG3350/0,2 M сульфат аммония, получали кристаллизационные капли в соотношении смешения резервуарный раствор:образец для кристаллизации = 0,8 мкл:1,0 мкл. Капли плотно закрывали и позволяли им стоять при 20°C. Это обеспечило плоские кристаллы.
[Измерение данных рентгенодифракции для кристалла комплекса Fc (P208)/внеклеточная область FcγRIIaR]
Один кристалл комплекса Fc (P208)/внеклеточная область FcγRIIaR, полученный, как описано выше, погружали в раствор 0,1 M Bis-Tris (pH 7,5)/27,5% (масс./об.) PEG3350/0,2 M сульфат аммония/20% (об./об.) глицерин. Затем один кристалл вылавливали из раствора с использованием булавки с прикрепленной к ней нейлоновой петлей и замораживали в жидком азоте. Данные рентгенодифракции монокристалла получали на Photon Factory BL-17A института синхротронного излучения в High Energy Accelerator Research Organization. В процессе измерения кристалл был постоянно помещен в поток азота при -178°C для сохранения в замороженном состоянии. Было получено всего 225 рентгенодифракционных изображений монокристалла с использованием детектора CCD Quantum 315r (ADSC), оборудованного линией пучка с вращением монокристалла на 0,6° за раз. На основе полученных дифракционных изображений, определения константы решетки, индексирования дифракционных пятен и данных о дифракции проводили обработку с использованием программы Xia2 (J. Appl. Cryst. (2010) 43, 186-190), XDS Package (Acta Cryst. (2010) D66, 125-132) и Scala (Acta Cryst. (2006) D62, 72-82). Наконец, получали данные об интенсивности монокристалла при разрешении вплоть до 2,87 Å. Кристалл принадлежит к пространственной группе C2221 с константой решетки a=154,31 Å, b=257,61 Å, c=56,19 Å, α=90°, β=90° и γ=90°.
[Рентгеноструктурный анализ комплекса Fc (P208)/внеклеточная область FcγRIIaR]
Структуру комплекса Fc (P208)/внеклеточная область FcγRIIaR определяли способом молекулярного замещения с использованием программы Phaser (J. Appl. Cryst. (2007) 40, 658-674). Количество комплексов в асимметричном элементе оценивали, исходя из размера полученной кристаллической решетки и молекулярной массы комплекса Fc (P208)/внеклеточная область FcγRIIaR. С использованием, в качестве модели для поиска, кристаллографической структуры комплекса Fc (P208)/внеклеточная область FcγRIIb, полученного, как описано в примере (14-1), ориентацию и положение комплекса Fc (P208)/внеклеточная область FcγRIIaR в кристаллической решетке определяли на основе функции вращения и функции сдвига. Величина кристаллографического фактора достоверности R структурной модели для данных интенсивности дифракции при от 25 до 3,0 Å составляла 38,4%, и величина свободного R составляла 30,0% после детализации жесткого каркаса первоначальной структурной модели, в которой перемещаются два CH2-домена и два CH3-домена Fc-области и внеклеточная область FcγRIIb. Затем уточнения структурной модели достигали посредством повторения детализации структуры с использованием программы REFMAC5 (Acta Cryst. (2011) D67, 355-367) с последующей проверкой структурной модели, проведенной с использованием программы Coot (Acta Cryst. (2010) D66, 486-501) с помощью карт электронной плотности, где вычисляли коэффициенты 2Fo-Fc и Fo-Fc с использованием экспериментально определенного структурного фактора Fo, структурного фактора Fc, вычисленного в соответствии со структурной моделью, и фаз, вычисленных в соответствии со структурной моделью. Наконец, в результате включения молекул воды в модель на основе карт электронной плотности, в которой используются 2Fo-Fc или Fo-Fc в качестве коэффициентов, и после детализации кристаллографический фактор надежности, величины R и величина свободного R в модели, содержащей 4758 неводородных атомов, составили 26,3% и 38,0% для 24838 данных интенсивности дифракции при разрешении от 25 Å до 2,87 Å, соответственно.
Трехмерную структуру комплекса Fc (P208)/внеклеточная область FcγRIIaR определяли при разрешении 2,87 Å посредством анализа структуры. Сравнение кристаллической структуры между комплексом Fc (P208)/внеклеточная область FcγRIIaR и комплексом Fc (P208)/внеклеточная область FcγRIIb, описанным в примере (14-1), практически не выявило отличий на уровне общей структуры (фиг.36), что отражает очень высокую идентичность аминокислот между двумя Fcγ-рецепторами.
Однако точное наблюдение структур на уровне электронной плотности обнаружило некоторые различия, которые могут приводить к увеличению селективности между связыванием Fc-области с FcγRIIb и с FcγRIIaR. Аминокислотный остаток в положении 160 в FcγRIIaR представляет собой не Tyr, а Phe. Как показано на фиг.37, ожидается, что водородная связь между аминокислотным остатком в положении 237 основной цепи (нумерация EU) в CH2-домене A Fc-области и Tyr в положении 160 в FcγRIIb, хотя и образовывалась при связывании между FcγRIIb и Fc-областью с изменением P238D, не будет образовываться при связывании между FcγRIIaR и Fc-областью с изменением P238D. Отсутствие образования водородной связи может быть основным фактором повышения селективности между связыванием Fc-области, в которую внесено изменение P238D с FcγRIIb и с FcγRIIaR. Дальнейшее сравнение на уровне электронной плотности показало, что в комплексе Fc-область/FcγRIIb электронная плотность отчетливо наблюдалась для боковых цепей Leu в положениях 235 (нумерация EU) и 234 (нумерация EU), в то время как электронная плотность боковых цепей была неясной в комплексе Fc-область/FcγRIIaR. Это указывает на то, что петля вблизи положения 237 (нумерация EU) является гибкой вследствие сниженного взаимодействия FcγRIIaR в этом положении. Между тем, структурное сравнение CH2-домена B Fc-области (фиг. 38) в той же области выявило, что в комплексе Fc-области и FcγRIIb наблюдали электронную плотность вплоть до Asp в положении 237 (нумерация EU), в то время как в структуре комплекса Fc-область и FcγRIIaR электронную плотность наблюдали вплоть до трех остатков перед Asp в положении 237 (нумерация EU), т.е. вплоть до приблизительно Leu в положении 234 (нумерация EU), что указывает на то, что связывание FcγRIIaR формирует взаимодействие на протяжении большей области по сравнению со связыванием FcγRIIb. Описанное выше связывание указывает на вероятность того, что в CH2-домене A Fc-области область в положениях от 234 до 238 (нумерация EU) вносит большой вклад в связывание между Fc-областью и FcγRIIb, в то время как в CH2-домене B Fc-области в положениях от 234 до 238 (нумерация EU) вносит большой вклад в связывание между Fc-областью и FcγRIIaR.
[Пример 15] Fc-варианты, для которых участки изменения были определены на основе кристаллической структуры
Как описано в примере 14, было предположено, что Asp в положении 268 (нумерация EU) электростатически взаимодействует с Arg в положении 292 (нумерация EU) (фиг. 34) в результате локального структурного изменения вследствие внесения изменения P271G в домен B варианта с усиленным связыванием FcγRIIb (P208). Существует вероятность того, что структура петли в положениях 266-271 (нумерация EU) стабилизируется при формировании взаимодействия, что приводит к усилению связывания FcγRIIb. Таким образом, авторы настоящего изобретения оценивали, можно ли усилить связывание FcγRIIb варианта посредством дополнительной стабилизации его структуры петли вследствие усиления электростатического взаимодействия посредством замены Asp на Glu в положении 268 (нумерация EU) в варианте. С другой стороны, как показано на фиг.33, Tyr в положении 160 (нумерация EU) FcγRIIb взаимодействует с Asp основной цепи в положении 237 (нумерация EU) в домене A P208. Между тем, боковая цепь Asp в положении 237 (нумерация EU) расположена близко к Ile в положении 332, Glu в положении 333 и Lys в положении 334 (нумерация EU) в молекуле без формирования какого-либо особенно значимого взаимодействия. Таким образом, авторы настоящего изобретения также оценивали, может ли взаимодействие с Tyr в положении 160 в FcγRIIb быть усилено посредством стабилизации структуры петли в положениях 266-271 (нумерация EU) вследствие увеличенного взаимодействия с боковой цепью Asp в положении 237 (нумерация EU) посредством замены гидрофильных аминокислотных остатков в положениях, описанных выше.
Варианты IL6R-BP230/IL6R-L, полученные, как описано в примере 13, получали путем внесения каждого из изменений H268E, I332T, I332S, I332E, I332K, E333K, E333R, E333S, E333T, K334S, K334T и K334E. IL6R-L (SEQ ID NO: 56) использовали в качестве L-цепи антитела. Антитела, содержащие легкую цепь IL6R-L и описанные выше варианты тяжелой цепи, экспрессировали и очищали способом, описанным в справочном примере 1. Очищенные антитела оценивали в отношении их связывания с каждым FcγR (FcγRIa, FcγRIIaH, FcγRIIaR, FcγRIIb или FcγRIIIaV) способом, описанным в справочном примере 2.
KD каждого варианта в отношении FcγR представлена в таблице 21. В таблице "изменение" относится к изменению IL6R-BP3 (SEQ ID NO: 63). IL6R-B3/IL6R-L, которое использовали в качестве матрицы для получения IL6R-BP230, указано звездочкой (*). KD (IIb) исходного полипептида/KD (IIb) измененного полипептида в таблице показывает величину, полученную делением величины KD IL6R-B3/IL6R-L в отношении FcγRIIb на величину KD каждого варианта в отношении FcγRIIb. Между тем, KD (IIaR) исходного полипептида/KD (IIaR) измененного полипептида показывает величину, полученную делением величины KD IL6R-B3/IL6R-L в отношении FcγR IIaR на величину KD каждого варианта в отношении FcγR IIaR. KD (IIaR)/KD (IIb) показывает величину, полученную делением KD каждого варианта в отношении FcγRIIaR на KD варианта в отношении FcγRIIb. Чем большей является величина, тем более высокой является селективность в отношении FcγRIIb. В таблице 21 число в закрашенных серым цветом ячейках указывает на то, что было сделано заключение, что связывание FcγR в IgG было слишком слабым для корректного анализа с помощью кинетического анализа и, таким образом, было вычислено с использованием:
[Уравнение 2]
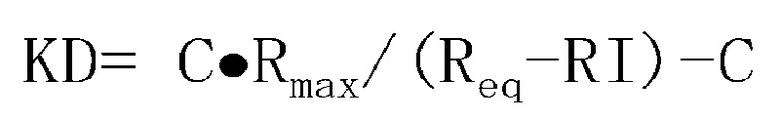 ,
,
которое описано в справочном примере 2.
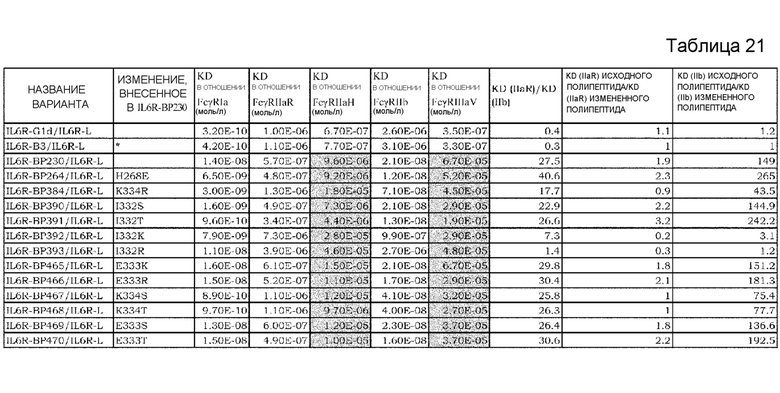
Как активность связывания FcγRIIb, так и селективность в отношении FcγRIIb у IL6R-BP264/IL6R-L, IL6R-BP465/IL6R-L, IL6R-BP466/IL6R-L и IL6R-BP470, полученных внесением изменений H268E, E333K, E333R и E333T, соответственно, в IL6R-BP230/IL6R-L, были увеличенными по сравнению с IL6R-BP230/IL6R-L. Селективность в отношении FcγRIIb у IL6R-BP391/IL6R-L, в которое внесено изменение I332T, была снижена, в то время как его активность связывания FcγRIIb была увеличена по сравнению с IL6R-BP230/IL6R-L.
[Пример 16] Исчерпывающее внесение изменений в аминокислотные остатки в области положения 271 (нумерация EU)
При структурном сравнении между Fc (P208) и FcγRIIb и Fc (P238D)/FcγRIIb, наиболее значительное отличие выявлено в структуре в области положения 271 (нумерация EU) в CH2-домене B Fc-области (фиг. 33). Как описано в примере 11, было предположено, что, когда в Fc (P238D) Asp в положении 270 (нумерация EU) формирует прочное электростатическое взаимодействие с Arg в положении 131 в FcγRIIb, взаимодействие может индуцировать стереохимическое напряжение у Pro в положении 271 (нумерация EU). В структуре Fc (P208)/FcγRIIb, вследствие замены Pro на Gly в положении 271 (нумерация EU), происходило позиционное отклонение на уровне основной цепи, устраняющее структурное искажение, что приводило к значительному структурному изменению в области положения 271. Существует вероятность того, что дополнительная стабилизация структуры, измененной в области положения 271, далее снизит потерю энергии энтропии, вызываемую связыванием, при формировании электростатического взаимодействия с Arg в положении 131 в FcγRIIb. Таким образом, проводили поиск изменений, которые усиливают связывание Fc-области с FcγRIIb или увеличивают ее селективность в отношении FcγRIIb посредством исчерпывающего внесения изменений в аминокислотные остатки в области положения 271 (нумерация EU).
IL6R-BP267 конструировали в качестве матрицы для исчерпывающего внесения изменений путем внесения изменений E233D, G237D, P238D, H268E и P271G в IL6R-B3 (SEQ ID NO: 63). IL6R-L (SEQ ID NO: 56) использовали в качестве L-цепи антитела. Антитела, содержащие легкую цепь IL6R-L и описанные выше варианты тяжелой цепи, экспрессировали и очищали в соответствии со способом, описанным в справочном примере 1. Очищенные антитела оценивали в отношении связывания с каждым FcγR (FcγRIa, FcγRIIaH, FcγRIIaR, FcγRIIb или FcγRIIIaV) способом, описанным в справочном примере 2. Аминокислоты в положениях 264, 265, 266, 267, 269 и 272 (нумерация EU) в IL6R-BP267 заменяли на каждую из 18 типов аминокислот, за исключением Cys и аминокислоты до замены. IL6R-L (SEQ ID NO: 56) использовали в качестве L-цепи антитела. Антитела, содержащие легкую цепь IL6R-L и описанные выше варианты тяжелой цепи, экспрессировали и очищали в соответствии со способом, описанным в справочном примере 1. Очищенные антитела оценивали в отношении их связывания с каждым FcγR (FcγRIa, FcγRIIaH, FcγRIIaR, FcγRIIb или FcγRIIIaV) способом, описанным в справочном примере 2. Варианты, связывание которых с FcγRIIb было усилено или селективность которых в отношении FcγRIIb была увеличена по сравнению со связыванием FcγRIIb или селективностью в отношении FcγIIb у IL6R-BP267/IL6R-L до внесения изменений, представлены в таблице 22.

Величина KD каждого варианта в отношении каждого FcγR представлена в таблице 22. В таблице "изменение" относится к изменению, внесенному в IL6R-BP3, которое использовали в качестве матрицы. IL6R-B3/IL6R-L, которое использовали в качестве матрицы для получения IL6R-BP267, обозначено звездочкой (*). В таблице KD (IIb) исходного полипептида/KD (IIb) измененного полипептида показывает величину, полученную делением величины KD IL6R-B3/IL6R-L в отношении FcγRIIb, на величину KD каждого варианта в отношении FcγRIIb. Между тем, KD (IIaR) исходного полипептида/KD (IIaR) измененного полипептида показывает величину, полученную делением KD IL6R-B3/IL6R-L в отношении FcγRIIaR на KD каждого варианта в отношении FcγR IIaR. KD (IIaR)/KD (IIb) показывает величину, полученную делением величины KD каждого варианта в отношении FcγRIIaR на величину KD варианта в отношении FcγRIIb. Чем большей является величина, тем более высокой является селективность в отношении FcγRIIb. В таблице 22 число в закрашенных серым цветом ячейках указывает на то, что было сделано заключение, что связывание FcγR в IgG было слишком слабым для корректного анализа с помощью кинетического анализа и, таким образом, было вычислено с использованием:
[Уравнение 2]
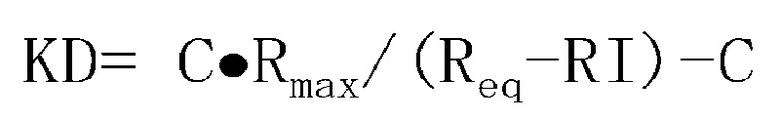 ,
,
которое описано в справочном примере 2.
Активность связывания всех вариантов, представленных в таблице 22, с FcγRIa, FcγRIIaH и FcγRIIIaV была сравнимой или сниженной по сравнению с активностью связывания IL6R-B3/IL6R-L. Между тем, активность связывания с FcγRIIb вариантов вследствие внесения изменений S267A, V264I, E269D, S267E, V266F, S267G и V266M, соответственно, в IL6R-BP267/IL6R-L была увеличена по сравнению с активностью связывания IL6R-BP267/IL6R-L перед внесением изменения. Между тем, величины KD (IIaR)/KD (IIb) вариантов вследствие внесения изменений S267A, S267G, E272M, E272Q, D265E, E272D, E272N, Y266L, E272I и E272F, соответственно, в IL6R-BP267/IL6R-L были увеличены по сравнению с величинами для IL6R-BP267/IL6R-L перед внесением изменения. Это демонстрирует, что изменения S267A, S267G, E272M, E272Q, D265E, E272D, E272N, V266L, E272I и E272F обеспечивают эффект повышения селективности FcγRIIb.
[Пример 17] Усиление связывания FcγRIIb посредством внесения изменений в область CH3
Сообщалось, что изменение посредством замены Pro на Leu в положении 396 (нумерация EU) усиливает связывание FcγRIIb (Cancer Res. (2007) 67, 8882-8890). Аминокислота в положении 396 (нумерация EU) присутствует в положении, которое не прямо вовлечено во взаимодействие с FcγR. Однако можно предположить, что аминокислота обладает эффектом на взаимодействие с FcγR посредством изменения структуры антитела. Таким образом, авторы настоящего изобретения оценивали, усиливается ли связывание Fc-области с FcγRIIb или увеличивается ли ее селективность в отношении FcγRIIb посредством исчерпывающего внесения аминокислотных изменений в положении 396 (нумерация EU) в Fc-области.
При исчерпывающем внесении изменений IL6R-BP423 конструировали в качестве матрицы путем внесения изменений E233D, G237D, P238D, S267A, H268E, P271G и A330R в IL6R-B3 (SEQ ID NO: 63). Конструировали варианты, в которых аминокислоту в положении 396 (нумерация EU) в IL6R-BP423 заменяли каждым из 18 типов аминокислот, за исключением цистеина и аминокислоты до внесения замены. IL6R-L (SEQ ID NO: 56) использовали в качестве L-цепи антитела. Антитела, содержащие легкую цепь IL6R-L и описанные выше варианты тяжелой цепи, экспрессировали и очищали способом, описанным в справочном примере 1. Очищенные антитела оценивали в отношении их связывания с каждым FcγR (FcγRIa, FcγRIIaH, FcγRIIaR, FcγRIIb или FcγRIIIaV) способом, описанным в справочном примере 2. Связывание полученных вариантов с каждым FcγR представлено в таблице 23.

В таблице "изменение, внесенное в IL6R-BP423," относится к изменению, внесенному в IL6R-BP423, которое использовали в качестве матрицы. IL6R-B3/IL6R-L, которое использовали в качестве матрицы для получения IL6R-BP423, обозначено звездочкой (*). В таблице KD (IIb) исходного полипептида/KD (IIb) измененного полипептида показывает величину, полученную делением величины KD IL6R-B3/IL6R-L в отношении FcγRIIb на величину KD каждого варианта в отношении FcγRIIb. Между тем, KD (IIaR) исходного полипептида/KD (IIaR) измененного полипептида показывает величину, полученную делением KD IL6R-B3/IL6R-L в отношении FcγRIIaR на KD каждого варианта в отношении FcγR IIaR. KD (IIaR)/KD (IIb) показывает величину, полученную делением величины KD каждого варианта в отношении FcγRIIaR на величину KD варианта в отношении FcγRIIb. Чем большей является величина, тем более высокой является селективность в отношении FcγRIIb. В таблице 23 число в закрашенных серым цветом ячейках указывает на то, что было сделано заключение, что связывание FcγR в IgG было слишком слабым для корректного анализа с помощью кинетического анализа и, таким образом, было вычислено с использованием:
[Уравнение 2]
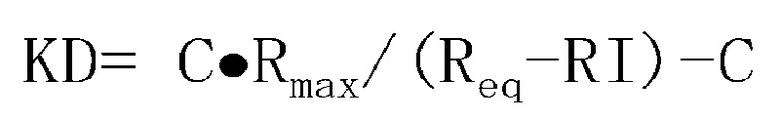 ,
,
которое описано в справочном примере 2.
Результат, представленный в таблице 23, демонстрирует, что: активность связывания FcγRIIb у
IL6R-BP456/IL6R-L, полученного внесением изменения P396M в IL6R-BP423/IL6R-L,
IL6R-BP455/IL6R-L, полученного внесением изменения P396L в IL6R-BP423/IL6R-L,
IL6R-BP464/IL6R-L, полученного внесением изменения P396Y в IL6R-BP423/IL6R-L,
IL6R-BP450/IL6R-L, полученного внесением изменения P396F в IL6R-BP423/IL6R-L,
IL6R-BP448/IL6R-L, полученного внесением изменения P396D в IL6R-BP423/IL6R-L,
IL6R-BP458/IL6R-L, полученного внесением изменения P396Q в IL6R-BP423/IL6R-L,
IL6R-BP453/IL6R-L, полученного внесением изменения P396I в IL6R-BP423/IL6R-L,
IL6R-BP449/IL6R-L, полученного внесением изменения P396E в IL6R-BP423/IL6R-L,
IL6R-BP454/IL6R-L, полученного внесением изменения P396K в IL6R-BP423/IL6R-L, и
IL6R-BP459/IL6R-L, полученного внесением изменения P396R в IL6R-BP423/IL6R-L, во всех случаях была увеличена по сравнению с IL6R-BP423/IL6R-L перед внесением изменений. Между тем, величина KD (IIaR)/KD (IIb) для IL6R-BP456/IL6R-L, полученного внесением изменения P396M в IL6R-BP423/IL6R-L, была более высокой по сравнению с IL6R-BP423/IL6R-L до внесения изменения, что демонстрирует увеличенную селективность в отношении FcγRIIb. Как видно из таблицы 23, активность связывания полученных вариантов с FcγRIa, FcγRIIaH и FcγRIIIaV во всех случаях была более низкой, чем у IL6R-B3/IL6R-L, который представлял собой исходный полипептид.
[Пример 18] Получение вариантов с усиленным связыванием FcγRIIb с использованием последовательностей подклассов
Профиль связывания FcγR варьирует в зависимости от подкласса IgG человека. Авторы настоящего изобретения оценивали, можно ли использовать активность связывания каждого FcγR между IgG1 и IgG4 для увеличения активности связывания FcγRIIb и/или повышения селективности. Сначала IgG1 и IgG4 анализировали в отношении их активности связывания с каждым FcγR. IL6R-G4d (SEQ ID NO: 64), содержащий G4d, конструировали в качестве H-цепи антитела. G4d представляет собой Fc-область, которая лишена C-концевого Gly и Lys и содержит замену Ser на Pro в положении 228 (нумерация EU) в IgG4 человека. IL6R-L (SEQ ID NO: 56) использовали в качестве L-цепи антитела. Антитела, содержащие легкую цепь IL6R-L и IL6R-G1d/IL6R-L или IL6R-G4d/IL6R-L, экспрессировали и очищали в соответствии со способом, описанным в справочном примере 1. Очищенные антитела оценивали в отношении их связывания с каждым FcγR (FcγRIa, FcγRIIaH, FcγRIIaR, FcγRIIb или FcγRIIIaV) способом, описанным в справочном примере 2. Связывание полученных вариантов с каждым FcγR обобщенно представлено в таблице 24.
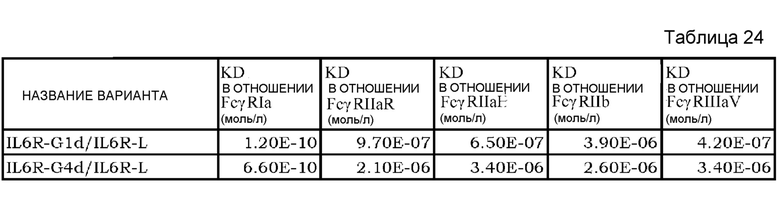
Было продемонстрировано, что связывание IL6R-G4d/IL6R-L с FcγRIIb было в 1,5 раза более сильным, чем у IL6R-G1d/IL6R-L, в то время как связывание IL6R-G4d/IL6R-L с FcγRIIaR было в 2,2 раза более слабым, чем у IL6R-G1d/IL6R-L. Между тем, активность связывания IL6R-G4d/IL6R-L с FcγRIa, FcγRIIaH и FcγRIIIaV более низкая, чем у IL6R-G1d/IL6R-L. Результат, описанный выше, показал, что IL6R-G4d имело предпочтительные характеристики по сравнению с IL6R-G1d с точки зрения как активности связывания FcγRIIb, так и селективности.
На фиг. 39 представлено выравнивание для сравнения последовательностей CH1 G1d и G4d вплоть до C-конца (положения с 118 по 445 (нумерация EU)). На фиг. 39 аминокислотные остатки, которые отличаются между G1d и G4d, закрашены черным. Авторы настоящего изобретения оценивали, может ли связывание FcγRIIb быть далее увеличено и/или может ли селективность в отношении FcγRIIb далее повышена путем выбора, из указанных выше отличающихся аминокислот, некоторых частей, которые, как предсказано, вовлечены во взаимодействие с FcγR, и пересадки по меньшей мере одного аминокислотного остатка или более из последовательности G4d, который сообщает свойство, предпочтительное с точки зрения как активности связывания, так и селективности в отношении FcγRIIb, варианту с усиленным связыванием FcγRIIb.
В частности, авторы настоящего изобретения получили:
IL6R-BP473, полученное внесением изменения A327G в IL6R-BP230;
IL6R-BP472, полученное внесением изменения A330S в IL6R-BP230;
IL6R-BP471, полученное внесением изменения P331S в IL6R-BP230;
IL6R-BP474, полученное внесением изменения A330S и P331S в IL6R-BP230;
IL6R-BP475, полученное внесением изменения A327G и A330S в IL6R-BP230;
IL6R-BP476, полученное внесением изменения A327G, A330S и P331S в IL6R-BP230; и
IL6R-BP477, полученное внесением изменения A327G и P331S в IL6R-BP230. Более того, для конструирования IL6R-BP478, аминокислоты от Ala в положении 118 до Thr в положении 225 (нумерация EU) в IL6R-BP230 заменяли на аминокислоты в последовательности G4d от Ala в положении 118 до Pro в положении 222 (нумерация EU). IL6R-L (SEQ ID NO: 56) использовали в качестве L-цепи антитела. Антитела, содержащие легкую цепь IL6R-L и варианты тяжелой цепи, описанные выше, очищали в соответствии со способом, описанным в справочном примере 1. Очищенные антитела оценивали в отношении их активности связывания с каждым FcγR (FcγRIa, FcγRIIaH, FcγRIIaR, FcγRIIb или FcγRIIIaV) способом, описанным в справочном примере 2.
Величина KD каждого варианта в отношении каждого FcγR представлена в таблице 25. KD (IIb) исходного полипептида/KD (IIb) измененного полипептида в таблице показывает величину, полученную делением величины KD IL6R-B3/IL6R-L в отношении FcγRIIb на величину KD каждого варианта в отношении FcγRIIb. В таблице "изменение, внесенное в IL6R-BP230" относится к изменению, внесенному в IL6R-BP230. IL6R-B3/IL6R-L, использованное в качестве матрицы для получения IL6R-BP230, обозначено *1. Между тем, IL6R-BP478, в котором последовательность G4d от Ala в положении 118 вплоть до Pro в положении 222 (нумерация EU) заменена сегментом от Ala в положении 118 вплоть Thr в положении 225 (нумерация EU) в IL6R-BP230, обозначена *2. KD (IIaR) исходного полипептида/KD (IIaR) измененного полипептида показывает величину, полученную делением величины KD IL6R-B3/IL6R-L в отношении FcγR IIaR на величину KD варианта в отношении FcγR IIaR. KD (IIaR)/KD (IIb) показывает величину, полученную делением KD каждого варианта в отношении FcγRIIaR, на KD варианта в отношении FcγRIIb. Чем большей является величина, тем более высокой является селективность в отношении FcγRIIb. В таблице 25 число в закрашенных серым цветом ячейках указывает на то, что было сделано заключение, что связывание FcγR в IgG было слишком слабым для корректного анализа с помощью кинетического анализа и, таким образом, было вычислено с использованием:
[Уравнение 2]
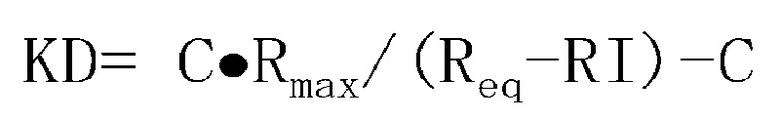 ,
,
которое описано в справочном примере 2.

Среди вариантов, представленных в таблице 25, IL6R-BP473/IL6R-L, в который было внесено изменение A327G, продемонстрировал связывание FcγRIIb, увеличенное в 1,2 раза по сравнению с IL6R-BP230/IL6R-L. IL6R-BP478/IL6R-L, полученный путем замены аминокислот с Ala в положении 118 на Thr в положении 225 (нумерация EU) IL6R-BP230 с заменой аминокислот с Ala в положении 118 на Pro в положении 222 (нумерация EU) в последовательности G4d, обладает в 1,1 раза увеличенное связывание с FcγRIIb относительно IL6R-BP230/IL6R-L, и связывание IL6R-BP478/IL6R-L с FcγRIIaR снижено до 0,9 раза относительно IL6R-BP230/IL6R-L. Активность связывания всех вариантов с FcγRIa, FcγRIIaH и FcγRIIIaV была более низкой, чем у исходного полипептида IL6R-B3/IL6R-L.
В исследовании, проведенном до настоящего времени, было показано, что внесение изменения A327G, которое заменяет аминокислоту в последовательности IgG4 человека в положении 327 (нумерация EU) варианта IL6R-BP230/IL6R-L, усиливает активность связывания FcγRIIb. Следующее исследование проводили для аминокислот, которые не совпадают между последовательностями IgG4 и IgG1, и аминокислот, отличных от аминокислоты в положении 327 (нумерация EU). В частности, варианты получали путем внесения следующих изменений в IL6R-BP230, который использовали в качестве H-цепи антитела: K274Q вносили для получения IL6R-BP541; Y296F вносили для получения IL6R-BP542; H268Q вносили для получения IL6R-BP543; R355Q вносили для получения IL6R-BP544; D356E вносили для получения IL6R-BP545; L358M вносили для получения IL6R-BP546; K409R вносили для получения IL6R-BP547; и Q419E вносили для получения IL6R-BP548, как указано с помощью нумерации EU, соответственно. Между тем, IL6R-L использовали в качестве общей L-цепи антител. Антитела, которые содержат указанный выше вариант тяжелой цепи и легкую цепь IL6R-L, очищали способами, описанными в справочном примере 1. Очищенные антитела оценивали в отношении их связывания с каждым FcγR (FcγRIa, FcγRIIaH, FcγRIIaR, FcγRIIb или FcγRIIIaV) способом согласно справочному примеру 2.
KD каждого варианта в отношении каждого FcγR представлена в таблице 26. В таблице "KD (IIb) исходного полипептида/KD (IIb) измененного полипептида" соответствует величине, полученной делением величины KD IL6R-B3/IL6R-L в отношении FcγRIIb на величину KD каждого варианта в отношении FcγRIIb. В таблице "изменение IL6R-BP230" относится к изменению, внесенному в IL6R-BP230. IL6R-B3/IL6R-L, использованный в качестве матрицы для получения IL6R-BP230, обозначен как *1. "KD (IIaR) исходного полипептида/KD (IIaR) измененного полипептида" соответствует величине, полученной делением величины KD IL6R-B3/IL6R-L в отношении FcγRIIaR на величину KD того же варианта в отношении FcγRIIaR. KD (IIaR)/KD (IIb) соответствуют величине, полученной делением KD каждого варианта в отношении FcγRIIaR на KD того же варианта в отношении FcγRIIb. Чем большей является величина, тем более высокой является селективность в отношении FcγRIIb. В таблице 26 число в ячейке, закрашенной серым цветом, указывает на то, что связывание FcγR с IgG было слабым, и было определено, что анализ не может быть корректно проведен посредством кинетического анализа и, таким образом, было вычислено с использованием:
[Уравнение 2]
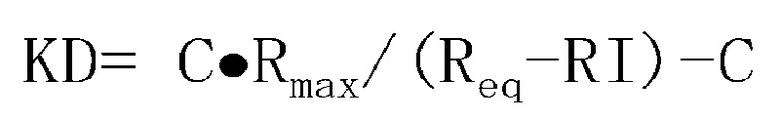 ,
,
которое описано в справочном примере 2.
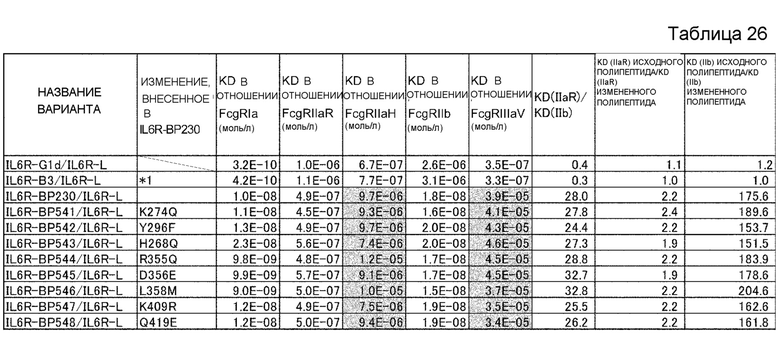
Как показано в таблице 26, IL6R-BP541/IL6R-L, полученное внесением K274Q (в каждом случае в соответствии с нумерацией EU) в IL6R-BP230/IL6R-L, IL6R-BP544/IL6R-L, полученное внесением R355Q в IL6R-BP230/IL6R-L, IL6R-BP545/IL6R-L, полученное внесением D356E в IL6R-BP230/IL6R-L, и IL6R-BP546/IL6R-L, полученное внесением L358M в IL6R-BP230/IL6R-L, продемонстрировало усиленное связывание FcγRIIb по сравнению с IL6R-BP230/IL6R-L до внесения изменения. Среди них было показано, что IL6R-BP544/IL6R-L, полученное внесением R355Q (в каждом случае в соответствии с нумерацией EU) в IL6R-BP230/IL6R-L, IL6R-BP545/IL6R-L, полученное внесением D356E в IL6R-BP230/IL6R-L, и IL6R-BP546/IL6R-L, полученное внесением L358M в IL6R-BP230/IL6R-L, имеют увеличенную величину KD(IIaR)/KD(IIb) и повышенную селективность в отношении FcγRIIb, по сравнению с IL6R-BP230/IL6R-L до внесения изменений.
[Пример 19] Оценка комбинаций изменений, которые усиливают связывание с FcγRIIb или повышают селективность в отношении FcγRIIb
Проводили оценку дополнительных комбинаций изменений, которые были выявлены путем оценки, описанной выше, для улучшения связывания FcγRIIb или селективности в отношении FcγRIIb. В частности, изменения, которые оценили как эффективные с точки зрения усиления связывания FcγRIIb и/или повышения селективности в отношении FcγRIIb, вносили в комбинации в IL6R-B3 (SEQ ID NO: 63). Более того, вносили известные изменения S267E и L328F, которые усиливают связывание FcγRIIb (Seung et al., (Mol. Immunol. (2008) 45, 3926-3933)) в IL6R-B3 с получением IL6R-BP253 в качестве контроля для сравнения. IL6R-L (SEQ ID NO: 56) использовали в качестве L-цепи антитела. Антитела, содержащие легкую цепь IL6R-L и описанные выше варианты тяжелой цепи, экспрессировали и очищали в соответствии со способом, описанным в справочном примере 1. Очищенные антитела оценивали в отношении их связывания с каждым FcγR (FcγRIa, FcγRIIaH, FcγRIIaR, FcγRIIb или FcγRIIIaV) способом, описанным в справочном примере 2.
KD каждого варианта в отношении каждого FcγR представлена в таблице 27. В таблице "изменение" относится к изменению, внесенному в IL6R-B3 (SEQ ID NO: 144). IL6R-B3/IL6R-L, которое использовали в качестве матрицы для получения каждого варианта, обозначено звездочкой (*). KD (IIb) исходного полипептида/KD (IIb) измененного полипептида демонстрирует величину, полученную делением величины KD для IL6R-B3/IL6R-L в отношении FcγRIIb на величину KD для каждого варианта в отношении FcγRIIb. Между тем, KD (IIaR) исходного полипептида/KD (IIaR) измененного полипептида демонстрирует величину, полученную делением величины KD для IL6R-B3/IL6R-L в отношении FcγR IIaR на KD варианта в отношении FcγRIIaR. KD (IIaR)/KD (IIb) показывает величину, полученную делением KD каждого варианта в отношении FcγRIIaR на KD варианта в отношении FcγRIIb. Чем большей является величина, тем более высокой является селективность в отношении FcγRIIb по сравнению с FcγRIIaR. Между тем, KD (IIaH)/KD (IIb) показывает величину, полученную делением KD каждого варианта в отношении FcγRIIaH на KD варианта в отношении FcγRIIb. Чем большей является величина, тем более высокой является селективность в отношении FcγRIIb по сравнению с FcγRIIaH. В таблице 27 число в закрашенных серым цветом ячейках указывает на то, что было сделано заключение, что связывание FcγR в IgG было слишком слабым для корректного анализа с помощью кинетического анализа и, таким образом, было вычислено с использованием:
[Уравнение 2]
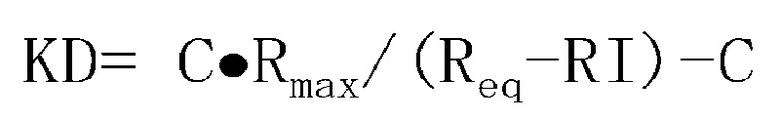 ,
,
которое описано в справочном примере 2.


Среди вариантов, представленных в таблице 27, IL6R-BP253/IL6R-L, в который были внесены известные изменения, которые усиливают связывание FcγRIIb, проявляло активность связывания FcγRIIb и FcγRIIaR, увеличенную в 277 раз и 529 раз относительно IL6R-B3/IL6R-L до внесения изменений, соответственно. Более того, активность связывания FcγRIa IL6R-BP253/IL6R-L также была более высокой, чем у IL6R-B3/IL6R-L. Между тем, связывание FcγRIIaH и связывание FcγRIIIaV у IL6R-BP253/IL6R-L было снижено по сравнению с IL6R-B3/IL6R-L. Среди других вариантов IL6R-BP436/IL6R-L и IL6R-BP438/IL6R-L продемонстрировало связывание FcγRIa, немного усиленное по сравнению с IL6R-B3/IL6R-L до внесения изменений. Все другие варианты продемонстрировали сниженное связывание FcγRIa. Кроме того, все варианты проявляли сниженное связывание FcγRIIaH и связывание FcγRIIIaV по сравнению с IL6R-B3/IL6R-L.
Что касается IL6R-BP489/IL6R-L, IL6R-BP487/IL6R-L, IL6R-BP499/IL6R-L, IL6R-BP498/IL6R-L, IL6R-BP503/IL6R-L, IL6R-BP488/IL6R-L, IL6R-BP490/IL6R-L, IL6R-BP445/IL6R-L, IL6R-BP552/IL6R-L, IL6R-BP507/IL6R-L, IL6R-BP536/IL6R-L, IL6R-BP534/IL6R-L, IL6R-491/IL6R-L, IL6R-BP553/IL6R-L, IL6R-BP532/IL6R-L, IL6R-BP506/IL6R-L, IL6R-BP511/IL6R-L, IL6R-BP502/IL6R-L, IL6R-BP531/IL6R-L, IL6R-BP510/IL6R-L, IL6R-BP535/IL6R-L, IL6R-BP497/IL6R-L, IL6R-BP533/IL6R-L, IL6R-BP555/IL6R-L, IL6R-BP554/IL6R-L, IL6R-BP436/IL6R-L, IL6R-BP423/IL6R-L, IL6R-BP440/IL6R-L, IL6R-BP538/IL6R-L, IL6R-BP429/IL6R-L, IL6R-BP438/IL6R-L, IL6R-BP565/IL6R-L, IL6R-BP540/IL6R-L, IL6R-BP426/IL6R-L, IL6R-BP437/IL6R-L, IL6R-BP439/IL6R-L, IL6R-BP551/IL6R-L, IL6R-BP494/IL6R-L, IL6R-BP537/IL6R-L, IL6R-BP550/IL6R-L, IL6R-BP556/IL6R-L, IL6R-BP539/IL6R-L, IL6R-BP558/IL6R-L, IL6R-BP425/IL6R-L и IL6R-BP495/IL6R-L, их связывание FcγRIIb было более высоким, чем у IL6R-BP253/IL6R-L, в которое было внесено известное изменение, которое усиливает связывание FcγRIIb. Из указанного выше, усиление связывания FcγRIIb находится в диапазоне от 321 раз (наиболее низкое) до 3100 раз (наиболее высокое), по сравнению со связыванием IL6R-B3/IL6R-L (которое определено как 1), от IL6R-BP495/IL6R-L до IL6R-BP489/IL6R-L, соответственно. Таким образом, можно сказать, что эти варианты являются лучшими в отношении как уровня, так и селективности усиления активности связывания FcγRIIb по сравнению с уровнем техники.
Сравнение вариантов, полученных с помощью этого исследования с существующим вариантом IL6R-BP253/IL6R-L, обладающим усиленным связыванием FcγRIIb, продемонстрировало, что величина KD (IIaR)/KD (IIb) равна 16,1 для IL6R-BP479/IL6R-L, который продемонстрировал наиболее низкую величину, и равна 64,4 для IL6R-BP567/IL6R-L, который продемонстрировал наиболее высокую величину, и величины для всех вариантов превышали 0,2 для IL6R-BP253/IL6R-L. Более того, величина KD (IIaH)/KD (IIb) равна 107,7 для IL6R-BP480/IL6R-L, который продемонстрировал наиболее низкую величину, и равна 8362 для IL6R-BP426/IL6R-L, который продемонстрировал наиболее высокую величину, и величины для всех вариантов превышали 107,1 для IL6R-BP253/IL6R-L. Из этих результатов, было показано, что все варианты, представленные в таблице 27, являются вариантами с увеличенной селективностью в отношении FcγRIIb по сравнению с известным вариантом, в который внесено изменение(я) для усиления связывания FcγRIIb. В частности, все из IL6R-BP559/IL6R-L, IL6R-BP493/IL6R-L, IL6R-P557/IL6R-L, IL6R-BP492/IL6R-L и IL6R-BP500/IL6R-L обладают сохраненным связыванием FcγRIIaR на уровне не более чем в 1,5 раза выше относительно IL6R-B3/IL6R-L, и в то же время активностью связывания FcγRIIb, усиленной в 100 раз; таким образом, ожидалось, что эти варианты продемонстрируют эффекты, обеспечиваемые усиленным связыванием с FcγRIIb, одновременно избегая побочных эффектов, вызываемых усиленным связыванием с FcγRIIaR. Таким образом, эти варианты можно считать обладающими лучшими свойствами, с точки зрения как активности связывания, так и селективности, в отношении FcγRIIb по сравнению с антителами, получаемыми с помощью существующих способов.
Без связи с конкретное теорией, варианты IL6R-BP568/IL6R-L и IL6R-BP492/IL6R-L, которые обладают консервативной последовательностью Tregitope, обладающие более высокой способностью индуцировать Treg (De Groot et al. (Blood (2008) 112, 3303-3311)) и, таким образом, считающиеся обладающими высокой активностью индукции Treg относительно вариантов, имеющих Y296D: IL6R-BP567/IL6R-L и IL6R-BP493/IL6R-L, могут быть более эффективными. Что касается активности связывания и селективности этих вариантов в отношении FcγRIIb, сравнение с нативным типом демонстрирует, что связывание FcγRIIaR в 1,6 раза превышает и связывание FcγRIIb в 211 раз превышает связывание с ними нативного типа IL6R-BP568/IL6R-L, и связывание FcγRIIaR в 1,2 раза превышает и связывание FcγRIIb в 131 раз превышает связывание с ними нативного типа IL6R-BP492/IL6R-L, и было выявлено, что эти варианты обладают высокой активностью связывания и селективностью в отношении FcγRIIb.
[Пример 20] Получение антител, которые связываются с IgA человека зависимым от кальция образом
(20-1) Получение IgA человека (hIgA)
Примеры 2-4 демонстрируют, что молекулы, которые обладают усиленным связыванием FcγR мыши и которые связываются pH-зависимым образом с рецептором IL-6 человека в качестве антигена, могут значительно снизить концентрацию антигена в плазме. Затем проводили дополнительное испытание с использованием антител к IgA человека в качестве антигена, для оценки наличия сходного эффекта элиминации растворимых антигенов из плазмы в живом организме, в который вводили антитела, которые обладают усиленным связыванием FcγR мыши и которые связываются pH-зависимым образом с антигенами, отличными от рецептора IL-6 человека. Антиген, IgA человека (далее также обозначаемый как hIgA) (его вариабельная область происходит из антитела против IL6R человека) получали с использованием следующего рекомбинантного способа. hIgA экспрессировали путем культивирования клеток-хозяев, содержащих рекомбинантные векторы, содержащие H (WT)-IgA1 (SEQ ID NO: 65) и L (WT)-CK (SEQ ID NO: 42), и очищали способом, известным специалистам в данной области, с использованием ионообменной хроматографии и гель-фильтрационной хроматографии.
(20-2) Экспрессия и очистка антитела, которое связывается с hIgA
GA2-IgG1 (тяжелая цепь, SEQ ID NO: 66; легкая цепь, SEQ ID NO: 67) представляет собой антитело, которое связывается с hIgA. Последовательность ДНК, кодирующую GA2-IgG1 (тяжелая цепь, SEQ ID NO: 66; легкая цепь, SEQ ID NO: 67), встраивали в экспрессирующие плазмиды клеток животных способом, известным специалистам в данной области. Антитело экспрессировали и очищали способом, описанным ниже. Клетки, происходящие из клеток почки эмбриона человека FreeStyle 293-F (Invitrogen), суспендировали в среде для экспрессии FreeStyle 293 Expression Medium (Invitrogen). Суспензию клеток высевали при плотности клеток 1,33×106 клеток/мл в 3 мл в каждую лунку 6-луночного планшета. Затем полученную плазмиду вводили в клетки способом липофекции. Клетки культивировали в инкубаторе с CO2 (37°C, 8% CO2, 90 об./мин) в течение 4 суток. Из полученного культурального супернатанта антитела очищали с использованием rProtein A Sepharose™ Fast Flow (Amersham Biosciences) способом, известным специалистам в данной области. Поглощение (длина волны: 280 нм) раствора очищенного антитела измеряли с использованием спектрофотометра. Концентрацию антитела определяли с использованием коэффициента экстинкции, вычисленного из измеренной величины способом PACE (Protein Science (1995) 4, 2411-2423).
(20-3) Оценка выделенного антитела в отношении его зависимой от кальция способности связывания hIgA
Антитело, выделенное, как описано в примере (20-2), оценивали в отношении его активности связывания hIgA (константа диссоциации, KD (M)) с использованием Biacore T200 (GE Healthcare). Активность связывания измеряли с использованием в качестве подвижного буфера 0,05% tween20, 20 ммоль/л ACES, 150 ммоль/л NaCl (pH 7,4 или pH 5,8), содержащего 3 мкМ или 1,2 мМ CaCl2. Соответствующее количество рекомбинантного белка A/G (Thermo Scientific) иммобилизовывали на сенсорном чипе CM5 (GE Healthcare) способом присоединения аминов, и антителу позволяли связываться с ним. Затем соответствующую концентрацию hIgA (описанный в (A1-1)) инжектировали в качестве анализируемого соединения и позволяли ему взаимодействовать с антителом на сенсорном чипе. Измерения проводили при 37°C. После измерения 10 ммоль/л глицин-HCl (pH 1,5) инжектировали для регенерации сенсорного чипа. Из результата измерения константу диссоциации KD (M) вычисляли посредством анализа аппроксимации кривой и анализа равновесия с использованием программного обеспечения Biacore T200 Evaluation Software (GE Healthcare). Результат представлен в таблице 28. GA2-IgG1 прочно связывалось с hIgA при концентрации Ca2+ 1,2 мМ и слабо связывалось с hIgA при концентрации Ca2+ 3 мкМ. Между тем, при концентрации Ca2+ 1,2 мМ, GA2-IgG1 прочно связывалось с IgA человека при pH 7,4 и слабо связывалось с IgA человека при pH 5,8. В целом, было продемонстрировано, что GA2-IgG1 связывается с IgA человека зависимым от pH- и кальция образом.
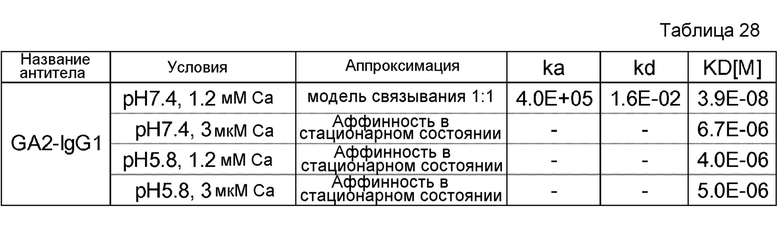
[Пример 21] Получение вариантов антител, которые связываются с hIgA зависимым от кальция образом
Далее, для дальнейшего ускорения элиминации антигена (hIgA) из плазмы, получали GA2-F1087 (тяжелая цепь, SEQ ID NO: 68) путем замены Leu на Tyr в положении 328 (нумерация EU) в GA2-IgG1 для усиления связывания с FcγR мыши GA2-IgG1, которое связывается с hIgA зависимым от кальция образом. Последовательность ДНК, кодирующую GA2-F1087 (тяжелая цепь, SEQ ID NO: 68; легкая цепь, SEQ ID NO: 67), встраивали в экспрессирующую плазмиду животных способом, известным специалистам в данной области. Варианты антител экспрессировали описанным выше способом с использованием плазмиды. Концентрации вариантов измеряли после очистки. Антитела, содержащие описанную выше модификацию, проявляли значительно увеличенное связывание FcγR мыши, как показано в примере (4-3).
[Пример 22] Оценка эффекта на время удержания антигена в плазме у нормальных мышей, которым вводили антитела с Ca-зависимым связыванием hIgA
(22-1) Испытания in vivo с использованием нормальных мышей
hIgA (IgA человека, полученный, как описано в примере (20-1)) вводили отдельно или в комбинации с антителом против hIgA антитела нормальным мышам (мышь C57BL/6J, Charles River Japan). После введения оценивали динамику in vivo hIgA и антител против hIgA. Раствор hIgA (80 мкг/мл) или смешанный раствор hIgA и антитела против hIgA вводили один раз в дозе 10 мл/кг в хвостовую вену. Используемые антитела против hIgA представляли собой GA2-IgG1 и GA2-F1087, описанные выше.
Во всех смешанных растворах концентрация hIgA составляла 80 мкг/мл, и концентрация антитела против hIgA составляла 2,69 мг/мл. В этом эксперименте антитела против hIgA присутствовали в существенном избытке относительно hIgA, и, таким образом, полагали, что основная часть hIgA связывалась с антителами. В группе, в которой вводили GA-hIgG1, взятие крови от мышей проводили через пять минут, семь часов, одни сутки, двое суток, трое суток и семь суток после введения. Между тем, в группе, в которой вводили GA-F1087, взятие крови от мышей проводили через пять минут, 30 минут, один час, два часа, одни сутки, трое суток и семь суток после введения. Собранную кровь сразу центрифугировали при 12000 об./мин и 4°C в течение 15 минут для выделения плазмы. Выделенную плазму хранили в морозильной камере при -20°C или ниже до применения.
(22-2) Определение концентрации антитела против hIgA в плазме у нормальных мышей способом ELISA
Концентрации антитела против hIgA в плазме мыши измеряли способом ELISA. Сначала, для получения планшета с иммобилизованным на нем антителом против IgG человека, антитело против F(ab')2-фрагмента IgG (специфичное к γ-цепи) (SIGMA) распределяли аликвотами в каждую лунку планшета Nunc-Immuno Plate, MaxiSorp (Nalge nunc International), и планшету позволяли стоять при 4°C в течение ночи. Образцы для калибровочной кривой антитела против hIgA, полученные в качестве стандартных разведений для концентраций в плазме (0,5, 0,25, 0,125, 0,0625, 0,03125, 0,01563 и 0,007813 мкг/мл), и образцы плазмы мыши для анализа, разбавленные в 100 раз или более, распределяли аликвотами в упомянутый выше планшет с иммобилизованным на нем антителом против IgG. После инкубации планшета в течение одного часа при 25°C, в каждую лунку планшета распределяли аликвотами конъюгат антитела козы против IgG человека (специфичное к γ-цепи) с биотином (BIOT) (Southern Biotechnology Associates Inc.). Затем планшет инкубировали при 25°C в течение одного часа. Затем в каждую лунку планшета распределяли аликвотами стрептавидин-PolyHRP80 (Stereospecific Detection Technologies). Затем планшет инкубировали при 25°C в течение одного часа. Хромогенную реакцию проводили с использованием в качестве субстрата TMB One Component HRP Microwell Substrate (BioFX Laboratories). После завершения реакции 1Н серной кислотой (Showa Chemical), измеряли поглощение реакционного раствора в каждой лунке при 450 нм в устройстве для считывания микропланшетов. Концентрации антитела против hIgA в плазме мыши определяли на основе стандартной кривой поглощения с использованием программного обеспечения для анализа SOFTmax PRO (Molecular Devices). Концентрации антител GA2-IgG1 и GA2-F1087 с течением времени в плазме нормальных мышей после внутривенного введения, которые измеряли способом, описанным выше, представлены на фиг.40. Результаты демонстрируют, что в отношении клона GA2-IgG1, который имеет pH-зависимую мощную активность связывания hIgA, концентрация в плазме антитела не снижалась значительно, даже если связывание FcγR усиливалось.
(22-3) Определение концентрации hIgA в плазме способом ELISA
Концентрации hIgA в плазме мыши измеряли способом ELISA. Сначала для получения планшета с иммобилизованным антителом против IgA человека, козы против IgA человека (BETHYL) распределяли аликвотами в каждую лунку планшета Nunc-Immuno Plate, MaxiSorp (Nalge nunc International), и планшету позволяли стоять при 4°C в течение ночи. Образцы hIgA для калибровочной кривой получали в качестве стандартных растворов для концентрации в плазме (0,4, 0,2, 0,1, 0,05, 0,025, 0,0125 и 0,00625 мкг/мл) и использовали. 100 мкл каждого из образцов для калибровочной кривой и образцы плазмы мыши для анализа, разбавленные в 100 раз или более, комбинировали с 200 мкл 500 нг/мл hsL6R. Их смешивали и инкубировали при комнатной температуре в течение одного часа. Затем 100 мкл смесей распределяли аликвотами в планшет с иммобилизованным антителом против IgA человека. Планшету позволяли стоять при комнатной температуре в течение одного часа. Далее биотинилированное антитело против IL-6 R человека (R&D) распределяли аликвотами в каждую лунку планшета. После инкубации в течение одного часа при комнатной температуре, стрептавидин-PolyHRP80 (Stereospecific Detection Technologies) распределяли аликвотами в каждую лунку планшета. Планшет инкубировали при комнатной температуре в течение одного часа. Хромогенную реакцию проводили с использованием в качестве субстрата TMB One Component HRP Microwell Substrate (BioFX Laboratories). После завершения реакции с 1Н серной кислотой (Showa Chemical), измеряли поглощение реакционного раствора в каждой лунке при 450 нм с помощью устройства для считывания микропланшетов. Концентрации в плазме мыши определяли, исходя из поглощения стандартной кривой, с использованием программного обеспечения для анализа SOFTmax PRO (Molecular Devices). Концентрация в hIgA в плазме у нормальных мышей с течением времени после внутривенного введения, которую измеряли описанным выше способом, представлена на фиг. 41.
Результат показал, что у мышей, которым вводили hIgA в комбинации с GA2-IgG1, обладающий Ca-зависимой активностью связывания hIgA, увеличенной в 100 раз или более, элиминация hIgA была ускорена по сравнению с введением hIgA отдельно. Между тем, в плазме мышей, которым вводили GA2-F1087 с усиленным связыванием с hIgA и FcγR, концентрация hIgA была снижена ниже поддающегося измерению диапазона (0,006 мкг/мл или более) через одни сутки после введения, и, таким образом, элиминация hIgA была значительно ускорена по сравнению с плазмой мышей, которым вводили GA-IgG1. Данные, описанные в примерах 2-7 выше, демонстрируют увеличенный эффект элиминации антигена у антител с усиленным связыванием FcγR у мышей, которым вводили IL6R и антитело против IL6R. Аналогично, также было продемонстрировано достижение сходного эффекта у мышей, которым вводили антиген hIgA и антитело против hIgA. Из результатов, полученных на данный момент в примерах, элиминация антигена в этом случае также может опосредоваться FcγRIIb.
[Пример 23] Получение pH-зависимого антитела против IgE
(23-1) Получение антитела против IgE человека
Для получения pH-зависимого антитела против IgE человека, IgE человека (тяжелая цепь, SEQ ID NO: 69; легкая цепь, SEQ ID NO: 70) (его вариабельная область происходит из антитела против глипикана 3 человека) экспрессировали в качестве антигена с использованием FreeStyle293 (Life Technologies). Экспрессированный IgE человека получали и очищали общим способом хроматографии, известным специалистам в данной области. Антитело, которое связывается с IgE человека pH-зависимым образом, выбрали из множества выделенных антител. Вариабельные области выбранного антитела против IgE подвергали слиянию с константной областью тяжелой цепи IgG1 человека и константной областью легкой цепи IgG1 человека, и полученный ген антитела встраивали в вектор. С использованием вектора рекомбинантное антитело против IgE человека экспрессировали и очищали. Полученное антитело было названо клоном 278 (далее обозначаемым как 278-IgG1; тяжелая цепь, SEQ ID NO: 71, легкая цепь, SEQ ID NO: 72).
(23-2) Оценка антитела против IgE человека в отношении активности связывания IgE и pH-зависимой активности связывания
Антитела, способные диссоциировать от антигенов в эндосоме, можно получать таким образом, чтобы они связывались с антигенами не только pH-зависимым образом, но также и Ca-зависимым образом. Таким образом, 278-IgG1 и контрольное IgG1-антитело человека Xolair (омализумаб, Novartis) без способности к pH/Ca-зависимому связыванию IgE оценивали в отношении способности к pH-зависимому связыванию и способности к pH/Ca-зависимому связыванию IgE человека (hIgE). В частности, 278-IgG1 и Xolair оценивали в отношении их активности связывания hIgE (константа диссоциации, KD (M)) с использованием Biacore T200 (GE Healthcare). Измерения проводили с использованием следующих трех типов подвижных буферов:
1,2 ммоль/л CaCl2, 0,05% tween20, 20 ммоль/л ACES, 150 ммоль/л NaCl, pH 7,4,
1,2 ммоль/л CaCl2, 0,05% tween20, 20 ммоль/л ACES, 150 ммоль/л NaCl, pH 5,8,
3 мкмоль/л CaCl2, 0,05% tween20, 20 ммоль/л ACES, 150 ммоль/л NaCl, pH 5,8.
Соответствующее количество пептида (далее обозначаемого как "биотинилированный пептид GPC3"), полученное путем присоединения биотина к C-концевому Lys химически синтезированной последовательности, происходящей из белка глипикана 3 человека (SEQ ID NO: 73), наносили на сенсорный чип SA (GE Healthcare) и иммобилизовали на сенсорном чипе SA на основе аффинности биотин/стрептавидин. Соответствующую концентрацию IgE человека инжектировали и улавливали с помощью биотинилированного пептида GPC3 для иммобилизации IgE человека на чип. Соответствующую концентрацию 278-IgG1 инжектировали в качестве анализируемого соединения и позволяли ей взаимодействовать с IgE человека на сенсорном чипе. Затем 10 ммоль/л глицин-HCl (pH 1,5) инжектировали для регенерации сенсорного чипа. Весь анализ взаимодействия проводили при 37°C. С использованием программного обеспечения Biacore T200 Evaluation Software (GE Healthcare) результаты анализа анализировали посредством аппроксимации кривой для определения константы скорости связывания ka (1/Мс) и константы скорости диссоциации kd (1/c). Из указанных выше констант вычисляли константу диссоциации KD (M). Затем pH-зависимое связывание оценивали посредством вычисления соотношения KD каждого антитела между условиями pH 5,8/1,2 мМ Ca и pH 7,4/1,2 мМ Ca. pH/Ca-зависимое связывание оценивали путем вычисления соотношения KD для каждого антитела между условиями pH 5,8/3 мкМ Ca и pH 7,4/1,2 мМ Ca. Результаты представлены в таблице 29.

[Пример 24] Получение варианта антитела, который связывается с IgE человека pH-зависимым образом
Далее, для дальнейшего ускорения элиминации антигена (IgE человека) из плазмы, последовательность ДНК, кодирующую 278-F1087 (тяжелая цепь, SEQ ID NO: 74; легкая цепь, SEQ ID NO: 72) с заменой Leu на Tyr в положении 328 (нумерация EU) в 278-IgG1, встраивали в экспрессирующую плазмиду животных способом, известным специалистам в данной области, для усиления связывания FcγR мыши 278-IgG1, которое связывается с IgE человека pH-зависимым образом. Варианты антител экспрессировали упомянутым выше способом с использованием клеток животных, в которые вводили плазмиду. После очистки определяли концентрации вариантов антител.
[Пример 25] Оценка 278-IgG1 in vivo
(25-1) Получение IgE человека (hIgE (Asp6)) для оценки in vivo
hIgE (Asp6) (его вариабельная область происходит из антитела против глипикана 3), которое представляет собой IgE человека для оценки in vivo, состоящее из тяжелой цепи (SEQ ID NO: 75) и легкой цепи (SEQ ID NO: 70), получали тем же способом, который описан в примере (23-1). hIgE (Asp6) представляет собой молекулу, в которой аспарагин заменен аспарагиновой кислотой в шести участках N-гликозилирования в IgE человека, так что на зависимые от времени изменения в концентрации IgE человека в качестве антигена не влияет гетерогенность N-связанных цепей сахаров IgE человека.
(25-2) Оценка эффекта ускорения элиминации IgE человека из плазмы нормальных мышей, которым вводили клон 278
Как описано в примерах 2-4 и 22, было продемонстрировано, что концентрация антигена была значительно снижена в плазме мышей, которым вводили молекулы, которые связываются pH-зависимым образом с рецептором IL-6 человека или IgA человека в качестве антигена, и связывание которых с FcγR мыши было усилено. Дополнительное испытание проводили с использованием антител к IgE человека в качестве антигена для оценки того, достигается ли сходный эффект элиминации растворимых антигенов из плазмы живого организма, в который вводили антитела с усиленным связыванием FcγR мыши, которые связываются pH-зависимым образом с антигенами, отличными от рецептора IL-6 человека и IgA человека, когда связывание с FcγR усилено.
hIgE (Asp6) и антитела против IgE человека оценивали в отношении их динамики in vivo после введения hIgE (Asp6) отдельно или hIgE (Asp6) в комбинации с антителами против hIgE (278-IgG1 и 278-F1087) мышам C57BL/6J (Charles river Japan). hIgE (Asp6) (20 мкг/мл) или смесь hIgE (Asp6) и антитело против IgE вводили один раз в количестве 10 мл/кг в хвостовую вену (как описано в таблице 30, все антитела получали в одной и той же концентрации). В этом случае каждое антитело присутствовало в значительном избытке относительно hIgE (Asp6), и, таким образом, как полагали, практически весь hIgE (Asp6) был связан с антителом. В группе, в которой вводили клон 278 (278-IgG1), взятие крови от мышей проводили через пять минут, два часа, семь часов, одни сутки, двое суток, четверо суток, пять суток, семь суток, 14 суток и 21 сутки после введения. В группе, в которой вводили 278-F1087, взятие крови от мышей проводили через пять минут, 30 минут, один час, два часа, одни сутки, трое суток, семь суток, 14 суток и 21 сутки после введения. Собранную кровь сразу центрифугировали при 15000 об./мин и 4°C в течение 5 минут для выделения плазмы. Выделенную плазму хранили в морозильной камере при -20°C или ниже до применения.
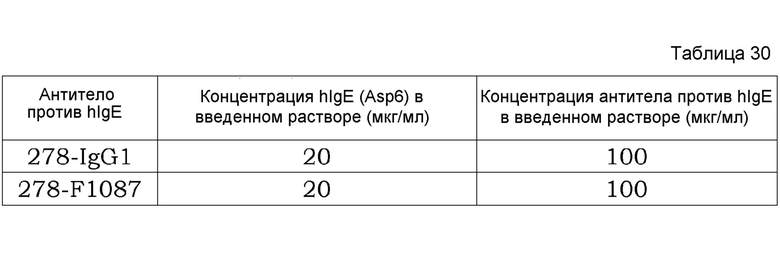
(25-3) Определение концентрации антитела против IgE человека у нормальных мышей
Концентрации антитела против hIgE в плазме мыши измеряли способом ELISA. Образцы для стандартной кривой получали для концентраций в плазме 0,4, 0,2, 0,1, 0,05, 0,025, 0,0125 и 0,00625 мкг/мл. Чтобы обеспечить однородность иммунного комплекса между hIgE (Asp6) и антителом против hIgE, hIgE (Asp6) добавляли в концентрации 1 мкг/мл к образцам стандартной кривой и образцам плазмы мыши для анализа. Образцам группы введения 278-hIgG1 и образцам для соответствующей стандартной кривой позволяли стоять при комнатной температуре в течение 30 минут. Между тем, образцы группы введения 278-F1087 и образцы для соответствующей стандартной кривой перемешивали при 37°C в течение ночи. После инкубации или перемешивания образцы для стандартной кривой и образцы плазмы мыши для анализа распределяли аликвотами в Immunoplate (Nunc-Immuno Plate, MaxiSorp (Nalge nunc International)), на котором было иммобилизовано антитело против легкой цепи каппа человека (Bethyl Laboratories), и им позволяли стоять/перемешиваться при комнатной температуре в течение двух часов (образцы группы введения 278-F1087 и образцы для стандартной кривой 278-F1087) или позволяли стоять при 4°C в течение ночи (образцы группы введения 278-hIgG1 и образцы для стандартной кривой 278-hIgG1). Затем каждый из вторичного антитела кролика против IgG человека (Fc), конъюгированного с биотином (Pierce Biotechnology), и стрептавидин-PolyHRP80 (Stereospecific Detection Technologies) подвергали реакции последовательно в течение одного часа. Хромогенную реакцию проводили с использованием в качестве субстрата TMB One Component HRP Microwell Substrate (BioFX Laboratories). После завершения реакции 1Н серной кислотой (Showa Chemical), концентрации в плазме мыши определяли на основе развития окраски способом измерения поглощения при 450 нм на устройстве для считывания микропланшетов. Концентрации в плазме мыши определяли на основе поглощения стандартной кривой с использованием программного обеспечения для анализа SOFTmax PRO (Molecular Devices). Концентрации антитела в плазме с течением времени после внутривенного введения, которые определяли описанным выше способом, представлены на фиг.42. Этот результат демонстрирует, что у мышей, которым вводили варианты, полученные усилением связывания 278-IgG1 с FcγR с pH-зависимой мощной активностью связывания IgE человека, концентрация антитела в плазме у мышей не была значительно снижена по сравнению с 278-IgG1.
(25-4) Определение концентрации hIgE (Asp6) в плазме у нормальных мышей
Концентрации hIgE (Asp6) в плазме мыши измеряли способом ELISA. Образцы для стандартной кривой получали для концентраций в плазме 192, 96, 48, 24, 12, 6 и 3 нг/мл. Чтобы обеспечить однородность иммунного комплекса между hIgE (Asp6) и антителом против hIgE, в группе, в которой вводили 278-hIgG1, добавляли Xolair (Novartis) в концентрации 10 мкг/мл к образцам для стандартной кривой и образцам плазмы мыши для анализа, и смесям позволяли стоять при комнатной температуре в течение 30 минут. В группе, в которой вводили 278-F1087, 278-F1022 (тяжелая цепь, SEQ ID NO: 76; легкая цепь, SEQ ID NO: 72; полученное аналогично примеру 24) или 278-F760 (тяжелая цепь, SEQ ID NO: 77; легкая цепь, SEQ ID NO: 72; полученное согласно примеру А5) добавляли в концентрации 20 мкг/мл, и смеси перемешивали при 37°C в течение 60 часов. Образцы плазмы мыши для анализа распределяли аликвотами в Immunoplate (MABTECH), на который было иммобилизовано антитело против IgE, или Immunoplate (Nunc F96 MicroWell Plate (Nalge nunc International)), на который было иммобилизовано антитело против IgE человека (клон 107, MABTECH), и им позволяли стоять и перемешиваться при комнатной температуре в течение двух часов или позволяли стоять при 4°C у течение ночи. Затем каждый из корового белка GPC3 человека (SEQ ID NO: 78), антитела против GPC3 (полученное в собственной лаборатории), биотинилированного NHS-PEG4-биотином (Thermo Fisher Scientific), и стрептавидин-PolyHRP80 (Stereospecific Detection Technologies) подвергали реакции последовательно в течение одного часа. Хромогенную реакцию проводили с использованием в качестве субстрата TMB One Component HRP Microwell Substrate (BioFX Laboratories). После завершения реакции 1Н серной кислотой (Showa Chemical), концентрации в плазме мыши определяли на основе развития окраски способом измерения поглощения при 450 нм на устройстве для считывания микропланшетов. Альтернативно, хромогенную реакцию проводили с использованием в качестве субстрата хемилюминесцентного субстрата SuperSignal(r) ELISA Pico Chemiluminesrent Substrate (Thermo Fisher Scientific), и концентрации в плазме определяли способом измерения интенсивности люминесценции с помощью устройства для считывания микропланшетов. Концентрации в плазме мыши определяли на основе поглощения или интенсивности люминесценции стандартной кривой с использованием программного обеспечения для анализа SOFTmax PRO (Molecular Devices). Концентрации hIgE (Asp6) в плазме с течением времени после внутривенного введения, которые определяли описанным выше способом, представлены на фиг. 43.
Что касается элиминации IgE человека отдельно, результат демонстрирует, что у мышей, которым вводили IgE человека в комбинации с 278-IgG1, обладающим pH-зависимой мощной активностью связывания, элиминация IgE человека ускорялась по сравнению с введением IgE человека отдельно. Более того, у мышей, которым вводили IgE человека в комбинации с 278-F1087, полученным усилением связывания 278-IgG1 c FcγR, было продемонстрировано, что элиминация IgE человека является значительно ускоренной по сравнению с мышами, которым вводили IgE человека отдельно или IgE человека в комбинации с 278-IgG1. Следовательно, было показано, что элиминация антигена была ускорена не только у мышей, которым вводили упомянутое выше антитело против IL6R и антитело против IgA с усиленным связыванием FcγR, но также и у мышей, которым вводили антитело против IgE с усиленным связыванием FcγR. Из результатов, полученных на данный момент в примерах, элиминация антигена в этом случае также может опосредоваться FcγRIIb.
[Пример 26] Эффекты элиминации антигенов из плазмы для антигенсвязывающих молекул с активностью связывания FcγRIIb, превышающей активность связывания FcγRIIb у Fc-области нативного IgG мыши
(26-1) Эффект элиминации антигена для антител мыши с селективно усиленной активностью связывания FcγRIIb
В примерах 5-7 исследовали группу нормальных мышей, которым вводили антигенсвязывающую молекулу, полученную путем усиления активности связывания FcγR мыши у антигенсвязывающей молекулы, обладающей Fc-областью антитела мыши и обладающей свойствами pH-зависимого связывания рецептора IL-6 человека, и группу мышей с дефицитом γ-цепи Fc-рецептора, и группу мышей с дефицитом FcγRIII, которая имитирует состояние, когда вводят антитело с селективно усиленной активностью связывания FcγRIIb мыши. Из этих результатов, было показано, что антигенсвязывающие молекулы, проявляющие pH-зависимое связывание с растворимыми антигенами и обладающие селективно усиленной активностью связывания FcγRIIb, способны эффективно элиминировать растворимые антигены из плазмы при введении in vivo. Исследование того, наблюдается ли этот эффект у нормальных мышей при введении антигенсвязывающей молекулы, содержащей Fc-область мыши с селективно усиленной активностью связывания FcγRIIb мыши и обладающей свойствами pH-зависимого связывания рецептора IL-6 человека, проводили, как указано ниже.
(26-2) Получение антител мыши с селективно усиленной активностью связывания FcγRIIb
VH3-mIgG1 (SEQ ID NO: 49) и VL3-mk1 (SEQ ID NO: 50) получали в качестве тяжелой цепи и легкой цепи, соответственно, IgG1-антитела мыши, обладающего свойствами pH-зависимого связывания с рецептором IL-6 человека, с использованием способа справочного примера 1. Более того, для усиления активности связывания VH3-mIgG1 с FcγRIIb мыши, вносили замены Thr на Glu в положении 230, Val на Ala в положении 231, Pro на Asn в положении 232, Ser на Glu в положении 238 и Ser на Asp в положении 239, как указано с помощью нумерации EU, с получением VH3-mIgG1-MB367 (SEQ ID NO: 79). Fv4-mIgG1 или Fv4-mIgG1-MB367, содержащие VL3-mk1 в качестве легкой цепи и VH3-mIgG1 или VH3-mIgG1-MB367, соответственно, в качестве тяжелой цепи, экспрессировали и очищали с использованием способа справочного примера 1.
(26-3) Подтверждение активности связывания FcγR мыши
VH3/L(WT)-mIgG1 или VH3/L(WT)-mIgG1-MB367, содержащие L(WT)-CK (SEQ ID NO: 42) в качестве легкой цепи и VH3-mIgG1 или VH3-mIgG1-MB367, соответственно, в качестве тяжелой цепи экспрессировали и очищали с использованием способа справочного примера 1. Активность связывания этих антител с FcγR мыши оценивали способом справочного примера 2, и результаты представлены в таблице 31. Более того, то, насколько активность связывания с FcγR мыши усилена у каждого варианта по сравнению с mIgG1 до изменения, представлена в таблице 32.
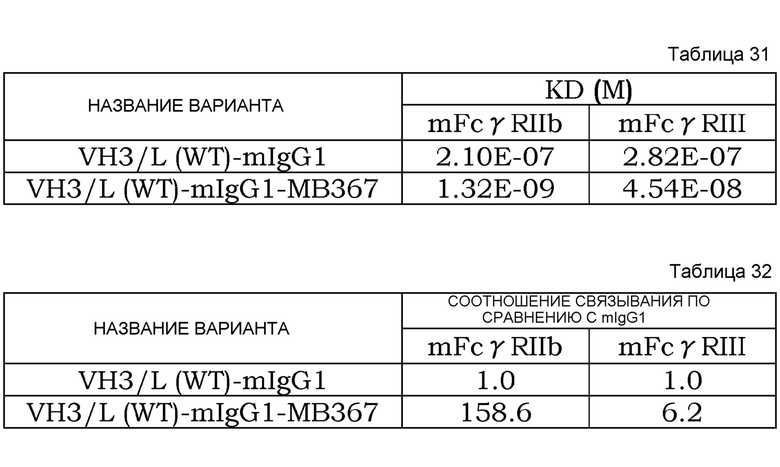
В соответствии с результатами, представленными в таблице 32, VH3/L(WT)-mIgG1-MB367, полученный путем внесения пяти упомянутых выше изменений в VH3/L(WT)-mIgG1, имел активность связывания FcγRIIb мыши, которая была усилена приблизительно в 160 раз, и активность связывания FcγRIII мыши, которая была усилена в 6,2 раза по сравнению с активностью связывания до изменения. Иными словами, VH3/L(WT)-mIgG1-MB367 продемонстрировало селективную и усиленную активность связывания FcγRIIb мыши.
(26-4) Подтверждение эффектов снижения концентрации растворимого рецептора IL-6 человека в плазме с использованием нормальных мышей
Эффекты элиминации растворимого рецептора IL-6 человека из плазмы нормальных мышей, которым вводили Fv4-mIgG1 или Fv4-mIgG1-MB367 в качестве антитела против рецептора IL-6 человека, исследовали, как описано ниже.
(26-4-1) Исследование in vivo с использованием нормальных мышей
Нормальным мышам (мышь C57BL/6J; Charles River Japan) совместно вводили растворимый рецептор IL-6 человека и антитело мыши против рецептора IL-6 человека, а затем оценивали в отношении их динамики in vivo. Смешанный раствор растворимого рецептора IL-6 человека и антитела мыши против рецептора IL-6 человека вводили один раз в дозе 10 мл/кг в хвостовую вену. В этом случае растворимый рецептор IL-6 человека и антитело мыши против рецептора IL-6 человека вводили в дозе 50 мкг/кг и 1 мг/кг, соответственно. В качестве антитела мыши против рецептора IL-6 человека использовали упомянутые выше Fv4-mIgGl или Fv4-mIgG1-MB367. Взятие крови от мышей проводили через 5 минут, 7 часов, 1 сутки, 2 суток, 3 суток, 7 суток, 14 суток, 21 сутки и 28 суток после введения антитела мыши против рецептора IL-6 человека. Собранные образцы крови сразу центрифугировали при 4°C и 15000 об./мин в течение 15 минут для получения плазмы. Отделенную плазму хранили в морозильной камере при -20°C или ниже до измерения.
(26-4-2) Определение с помощью ELISA концентрации антитела мыши против рецептора IL-6 человека в плазме
Концентрацию антитела против рецептора IL-6 человека в плазме мыши определяли с помощью ELISA. Сначала растворимый рецептор IL-6 человека распределяли аликвотами в планшет Nunc-Immuno Plate, MaxiSoup (Nalge nunc International) и позволяли ему стоять в течение ночи при 4°C с получением планшетов с иммобилизованным на них растворимым рецептором против IL-6 человека. Образцы для калибровочной кривой, содержащий антитело мыши против рецептора IL-6 человека, приготавливали при концентрациях в плазме 2,50, 1,25, 0,625, 0,313, 0,156, 0,078 и 0,039 мкг/мл, и приготавливали образцы плазмы мыши для анализа, разбавленные в 100 раз. 100 мкл этих образцов для калибровочной кривой и образцов плазмы для анализа распределяли аликвотами в каждую лунку планшета с иммобилизованным растворимым рецептором IL-6 человека, и проводили перемешивание при комнатной температуре в течение двух часов. Затем проводили реакцию развития окраски, которой позволяли протекать при комнатной температуре в течение двух часов с антителом против IgG мыши с пероксидазой (SIGMA), с использованием в качестве субстрата TMB One Component HRP Microwell Substrate (BioFX Laboratories). После остановки реакции путем добавления 1Н серной кислоты (Showa Chemical) измеряли поглощение реакционного раствора в каждой лунке при 450 нм с помощью устройства для считывания микропланшетов. Концентрацию антитела в плазме мыши вычисляли на основе данных поглощения из калибровочной кривой с использованием аналитического программного обеспечения SOFTmax PRO (Molecular Devices). Результаты представлены на фиг. 44.
(26-4-3) Определение концентрации растворимого рецептора IL-6 человека способом электрохемилюминесценции
Концентрацию shIL-6R в плазме мыши определяли способом электрохемилюминесценции. Образец для калибровочной кривой shIL-6R приготавливали при концентрациях в плазме 12,5, 6,25, 3,13, 1,56, 0,781, 0,391 и 0,195 нг/мл. Образцы плазмы мыши для анализа приготавливали путем разбавления в 50 раз или выше. Моноклональное антитело против IL-6R человека (R&D), меченное рутением с использованием SULFO-TAG NHS Ester (Meso Scale Discovery), биотинилированное антитело против IL-6R человека (R&D) и раствор тоцилизумаба (Chugai Pharmaceutical Co. Ltd.) смешивали и позволяли реагировать в течение ночи при 37°C. Затем планшет Streptavidin Gold Multi-ARRAY Plate (Meso Scale Discovery) блокировали с помощью раствора PBS-Tween, содержавшего 0,5% BSA (масс./об.) при 5°C в течение ночи, и в планшет распределяли смешанный раствор аликвотами. После дополнительного проведения реакции в планшете в течение двух часов при комнатной температуре планшет промывали. Затем буфер для считывания T (x2) (Meso Scale Discovery) распределяли аликвотами в планшет и сразу проводили измерения с использованием SECTOR Imager 2400 (Meso Scale Discovery). Концентрации shIL-6R вычисляли на основе ответа из калибровочной кривой с использованием аналитического программного обеспечения SOFTmax PRO (Molecular Devices). Результаты представлены на фиг.45.
Как показано на фиг. 44, в группе, в которой вводили Fv4-mIgG1-MB367, обладающий селективно усиленной активностью связывания FcγRIIb мыши, в то время как изменение с течением времени концентрации антитела в плазме было эквивалентно изменению в группе, в которой вводили Fv4-mIgG1, не наблюдали снижения времени удержания антитела в плазме вследствие усиления активности связывания FcγRIIb мыши. Между тем, как показано на фиг. 45, в группе, в которой вводили Fv4-mIgG1-MB367, обладающий селективно усиленной активностью связывания FcγRIIb мыши, концентрация растворимого рецептора IL-6 в плазме была значительно снижена по сравнению с группой, в которой вводили Fv4-mIgG1.
Вышеуказанное показало, что при введении in vivo антигенсвязывающая молекула, которая связывается с растворимым антигеном pH-зависимым образом и обладает селективно усиленной активностью связывания FcγRIIb, также может эффективно элиминировать растворимые антигены из плазмы нормальных мышей. Не ограничиваясь конкретной теорией, наблюдаемые явления могут быть объяснены следующим образом.
Когда антитело, которое связывается с растворимым антигеном pH-зависимым образом и обладает усиленной активностью связывания FcγRIIb, вводят мыши, антитело активно захватывается в основном клетками, экспрессирующими FcγRIIb на их клеточной мембране. Интернализованное антитело диссоциирует от растворимого антитела в условиях кислых значений pH в эндосоме, а затем рециклирует в плазму через FcRn. Таким образом, один из элементов, который обеспечивает эффект элиминации растворимых антигенов из плазмы благодаря такому антителу, может включать интенсивность активности связывания антитела с FcγRIIb. Иными словами, более интенсивная активность связывания с FcγRIIb приводит к более активной интернализации в экспрессирующие FcγRIIb клетки, и растворимые антигены в плазме могут быстро элиминироваться. Более того, такие эффекты можно подтверждать аналогичным образом, независимо от того, происходит ли Fc-область, включенная в антитело, из IgG1 человека или из IgG1 мыши, при условии, что активность связывания FcγRIIb усиливается. Более конкретно, подтверждение можно проводить с использованием Fc-области любого вида животных, такой как из IgG1 человека, IgG2 человека, IgG3 человека, IgG4 человека, IgG1 мыши, IgG2a мыши, IgG2b мыши, IgG3 мыши, IgG крысы, IgG обезьяны или IgG кролика, при условии, что активность связывания с FcγRIIb усиливается у видов животных, которым ее вводят.
[Справочный пример 1] Конструирование экспрессирующих векторов для антител и экспрессия и очистка антител
Синтез полноразмерных генов, кодирующих нуклеотидные последовательности H-цепи и L-цепи вариабельных областей антител, проводили с помощью способов получения, известных специалистам в данной области, с использованием ПЦР со сборкой и т.п. Внесение аминокислотных замен проводили способами, известными специалистам в данной области, с использованием ПЦР и т.п. Полученный фрагмент плазмиды встраивали в экспрессирующий вектор клеток животных, и получали экспрессирующий вектор H-цепи и экспрессирующий вектор L-цепи. Нуклеотидную последовательность полученного экспрессирующего вектора определяли способами, известными специалистам в данной области. Полученные плазмиды временно встраивали в клеточную линию HEK293H, происходящую из клеток рака почки эмбриона человека, (Invitrogen) или в клетки FreeStyle293 (Invitrogen) для экспрессии антител. Полученный культуральный супернатант собирали, а затем пропускали через 0,22-мкм фильтр MILLEX(R)-GV (Millipore) или через 0,45-мкм фильтр MILLEX(R)-GV (Millipore) для получения культурального супернатанта. Антитела очищали из полученного культурального супернатанта способами, известными специалистам в данной области, с использованием rProtein A Sepharose Fast Flow (GE Healthcare) или Protein G Sepharose 4 Fast Flow (GE Healthcare). Для концентрирования очищенных антител, их поглощение при 280 нм измеряли с использованием спектрофотометра. На основе полученной величины, коэффициент экстинкции, вычисленный способами, такими как PACE, использовали для вычисления концентрации антитела (Protein Science 1995; 4:2411-2423).
[Справочный пример 2] Способ получения FcγR и способ анализа взаимодействия между измененным антителом и FcγR
Внеклеточные домены FcγR получали следующим способом. Сначала ген внеклеточного домена FcγR синтезировали способом, хорошо известным специалистам в данной области. В то же время получали последовательность каждого FcγR на основе информации, зарегистрированной в NCBI. В частности, FcγRI получали на основе последовательности с номером доступа NCBI № NM_000566 (версия № NM_000566.3), FcγRIIa получали на основе последовательности с номером доступа NCBI № NM_001136219 (версия № NM_001136219.1), FcγRIIb получали на основе последовательности с номером доступа NCBI № NM_004001 (версия № NM_004001.3), FcγRIIIa получали на основе последовательности с номером доступа NCBI № NM_001127593 (версия № NM_001127593.1), и FcγRIIIb получали на основе последовательности с номером доступа NCBI № NM_000570 (версия № NM 000570.3), и к C-концу присоединяли His-метку. Более того, известно о существовании полиморфизма для FcγRIIa, FcγRIIIa и FcγRIIIb, и полиморфные участки получали, основываясь на Warmerdam et al. (J. Exp. Med., 1990, 172:19-25) для FcγRIIa; Wu et al. (J. Clin. Invest., 1997, 100(5):1059-1070) для FcγRIIIa; и Ory et al. (J. Clin. Invest., 1989, 84, 1688-1691) для FcγRIIIb.
Полученные фрагменты генов встраивали в экспрессирующий вектор клеток животных и получали экспрессирующие векторы. Полученные экспрессирующие векторы временно встраивали в клетки, происходящие из клеточной линии рака почки эмбриона человека, FreeStyle293 (Invitrogen) для экспрессии представляющих интерес белков. Что касается FcγRIIb, использованного для кристаллографического анализа, представляющий интерес белок экспрессировали в присутствии кифунезина в конечной концентрации 10 мкг/мл, так чтобы цепь сахаров, присоединенная к FcγRIIb, представляла собой тип цепи сахаров с высоким содержанием маннозы. Клетки культивировали, и после сбора полученного культурального супернатанта, его пропускали через 0,22-мкм фильтр с получением культурального супернатанта. В принципе, полученные культуральные супернатанты очищали с помощью следующих четырех стадий. Проведенные стадии представляли собой катионообменную колоночную хроматографию (SP Sepharose FF) на стадии 1, аффинную колоночную хроматографию (HisTrap HP) для His-метки на стадии 2, гель-фильтрационную колоночную хроматографию (Superdex200) на стадии 3 и асептическую хроматографию на стадии 4. Однако для FcγRI проводили анионообменную колоночную хроматографию с использованием Q sepharose FF в качестве стадии 1. Очищенные белки подвергали измерению поглощения при 280 нм с использованием спектрофотометра; и на основе полученных значений вычисляли концентрации очищенных белков с использованием коэффициента поглощения, вычисленного с использованием способов, таких как PACE (Protein Science 1995; 4:2411-2423).
Анализ взаимодействия между каждым измененным антителом и Fcγ-рецептором, полученным, как описано выше, проводили с использованием Biacore T100 (GE Healthcare), Biacore T200 (GE Healthcare), Biacore A100 и Biacore 4000. HBS-EP+ (GE Healthcare) использовали в качестве подвижного буфера, и температура измерения была установлена на 25°C. Использовали чипы, полученные путем иммобилизации антигенного пептида, белка A (Thermo Scientific), белка A/G (Thermo Scientific) и белка L (ACTIGEN или Bio Vision) способом присоединения аминов, на сенсорном чипе CM5 Series S (GE Healthcare) или сенсорном чипе CM4 Series S (GE Healthcare), или альтернативно чипы, полученные путем позволения предварительно биотинилированным антигенным пептидам взаимодействовать и иммобилизовываться на сенсорном чипе SA Series S (сертифицированный) (GE Healthcare).
После улавливания представляющих интерес антител на этих сенсорных чипах, Fcγ-рецептору, разбавленному с помощью подвижного буфера, позволяли реагировать, и измеряли величины связывания антител, и антитела сравнивали. Однако, поскольку количество связанного Fcγ-рецептора зависит от количества уловленных антител, количество связанного Fcγ-рецептора делили на количество каждого уловленного антитела с получением величин с поправкой, и эти величины сравнивали. Более того, антитела, уловленные на чипах, промывали с помощью реакции с 10 мМ глицин-HCl, pH 1,5, и чипы регенерировали и использовали повторно.
Анализы кинетики для вычисления величин KD каждого измененного антитела в отношении FcγR проводили с помощью следующего способа. Сначала представляющие интерес антитела улавливали на упомянутых выше сенсорных чипах, и Fcγ-рецептору, разбавленному подвижным буфером, позволяли взаимодействовать. Программное обеспечение Biacore Evaluation Software использовали для глобальной аппроксимации измеренных результатов к полученной сенсограмме с использованием модели связывания Ленгмюра 1:1, и вычисляли константу скорости ассоциации ka (л/моль/с) и константу скорости диссоциации kd (1/с); и из этих величин вычисляли константы диссоциации KD (моль/л).
Когда взаимодействие между каждым из измененных антител и FcγR было слабым и с помощью упомянутого выше кинетического анализа определяли, что корректный анализ невозможен, KD для таких взаимодействий вычисляли с использованием следующего уравнения модели связывания 1:1, описанного в Biacore T100 Software Handbook BR1006-48 Edition AE.
Поведение взаимодействующих молекул в соответствии с моделью связывания 1:1 на Biacore может быть описано с помощью уравнения 3, представленного ниже.
[Уравнение 3]

Req: зависимость уровней связывания в стационарном состоянии от концентрации анализируемого соединения
C: концентрация
RI: совокупный вклад индекса рефракции в образец
Rmax: способность связывания поверхности с анализируемым соединением
После преобразования этого уравнения KD может быть выражена с помощью уравнения 2, представленного ниже.
[Уравнение 2]

KD можно вычислять путем подстановки величин Rmax, RI и C в это уравнение. Величины RI и C можно определять из сенсограммы для результатов измерения и условий измерения. Rmax вычисляли в соответствии со следующим способом. В качестве цели для сравнения, для антител, которые обладали достаточно сильным взаимодействием при оценке одновременно в одном и том же раунде измерения, величину Rmax получали путем глобальной аппроксимации с использованием модели связывания Ленгмюра 1:1, а затем ее делили на количество сравниваемого антитела, уловленного на сенсорном чипе, и умножали на уловленное количество измененного антитела, подлежащего оценке.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CHUGAI SEIYAKU KABUSHIKI KAISHA
<120> Антигенсвязывающая молекула для ускорения исчезновения
антигена через FcγRIIB
<130> C102Y1PY1P
<150> PCT/JP2012/054624
<151> 2012-02-24
<150> JP 2012-185866
<151> 2012-08-24
<150> PCT/JP2012/075092
<151> 2012-09-28
<160> 81
<170> PatentIn version 3.5
<210> 1
<211> 468
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Met Leu Ala Val Gly Cys Ala Leu Leu Ala Ala Leu Leu Ala Ala Pro
1 5 10 15
Gly Ala Ala Leu Ala Pro Arg Arg Cys Pro Ala Gln Glu Val Ala Arg
20 25 30
Gly Val Leu Thr Ser Leu Pro Gly Asp Ser Val Thr Leu Thr Cys Pro
35 40 45
Gly Val Glu Pro Glu Asp Asn Ala Thr Val His Trp Val Leu Arg Lys
50 55 60
Pro Ala Ala Gly Ser His Pro Ser Arg Trp Ala Gly Met Gly Arg Arg
65 70 75 80
Leu Leu Leu Arg Ser Val Gln Leu His Asp Ser Gly Asn Tyr Ser Cys
85 90 95
Tyr Arg Ala Gly Arg Pro Ala Gly Thr Val His Leu Leu Val Asp Val
100 105 110
Pro Pro Glu Glu Pro Gln Leu Ser Cys Phe Arg Lys Ser Pro Leu Ser
115 120 125
Asn Val Val Cys Glu Trp Gly Pro Arg Ser Thr Pro Ser Leu Thr Thr
130 135 140
Lys Ala Val Leu Leu Val Arg Lys Phe Gln Asn Ser Pro Ala Glu Asp
145 150 155 160
Phe Gln Glu Pro Cys Gln Tyr Ser Gln Glu Ser Gln Lys Phe Ser Cys
165 170 175
Gln Leu Ala Val Pro Glu Gly Asp Ser Ser Phe Tyr Ile Val Ser Met
180 185 190
Cys Val Ala Ser Ser Val Gly Ser Lys Phe Ser Lys Thr Gln Thr Phe
195 200 205
Gln Gly Cys Gly Ile Leu Gln Pro Asp Pro Pro Ala Asn Ile Thr Val
210 215 220
Thr Ala Val Ala Arg Asn Pro Arg Trp Leu Ser Val Thr Trp Gln Asp
225 230 235 240
Pro His Ser Trp Asn Ser Ser Phe Tyr Arg Leu Arg Phe Glu Leu Arg
245 250 255
Tyr Arg Ala Glu Arg Ser Lys Thr Phe Thr Thr Trp Met Val Lys Asp
260 265 270
Leu Gln His His Cys Val Ile His Asp Ala Trp Ser Gly Leu Arg His
275 280 285
Val Val Gln Leu Arg Ala Gln Glu Glu Phe Gly Gln Gly Glu Trp Ser
290 295 300
Glu Trp Ser Pro Glu Ala Met Gly Thr Pro Trp Thr Glu Ser Arg Ser
305 310 315 320
Pro Pro Ala Glu Asn Glu Val Ser Thr Pro Met Gln Ala Leu Thr Thr
325 330 335
Asn Lys Asp Asp Asp Asn Ile Leu Phe Arg Asp Ser Ala Asn Ala Thr
340 345 350
Ser Leu Pro Val Gln Asp Ser Ser Ser Val Pro Leu Pro Thr Phe Leu
355 360 365
Val Ala Gly Gly Ser Leu Ala Phe Gly Thr Leu Leu Cys Ile Ala Ile
370 375 380
Val Leu Arg Phe Lys Lys Thr Trp Lys Leu Arg Ala Leu Lys Glu Gly
385 390 395 400
Lys Thr Ser Met His Pro Pro Tyr Ser Leu Gly Gln Leu Val Pro Glu
405 410 415
Arg Pro Arg Pro Thr Pro Val Leu Val Pro Leu Ile Ser Pro Pro Val
420 425 430
Ser Pro Ser Ser Leu Gly Ser Asp Asn Thr Ser Ser His Asn Arg Pro
435 440 445
Asp Ala Arg Asp Pro Arg Ser Pro Tyr Asp Ile Ser Asn Thr Asp Tyr
450 455 460
Phe Phe Pro Arg
465
<210> 2
<211> 1407
<212> ДНК
<213> Homo sapiens
<400> 2
atgctggccg tcggctgcgc gctgctggct gccctgctgg ccgcgccggg agcggcgctg 60
gccccaaggc gctgccctgc gcaggaggtg gcgagaggcg tgctgaccag tctgccagga 120
gacagcgtga ctctgacctg cccgggggta gagccggaag acaatgccac tgttcactgg 180
gtgctcagga agccggctgc aggctcccac cccagcagat gggctggcat gggaaggagg 240
ctgctgctga ggtcggtgca gctccacgac tctggaaact attcatgcta ccgggccggc 300
cgcccagctg ggactgtgca cttgctggtg gatgttcccc ccgaggagcc ccagctctcc 360
tgcttccgga agagccccct cagcaatgtt gtttgtgagt ggggtcctcg gagcacccca 420
tccctgacga caaaggctgt gctcttggtg aggaagtttc agaacagtcc ggccgaagac 480
ttccaggagc cgtgccagta ttcccaggag tcccagaagt tctcctgcca gttagcagtc 540
ccggagggag acagctcttt ctacatagtg tccatgtgcg tcgccagtag tgtcgggagc 600
aagttcagca aaactcaaac ctttcagggt tgtggaatct tgcagcctga tccgcctgcc 660
aacatcacag tcactgccgt ggccagaaac ccccgctggc tcagtgtcac ctggcaagac 720
ccccactcct ggaactcatc tttctacaga ctacggtttg agctcagata tcgggctgaa 780
cggtcaaaga cattcacaac atggatggtc aaggacctcc agcatcactg tgtcatccac 840
gacgcctgga gcggcctgag gcacgtggtg cagcttcgtg cccaggagga gttcgggcaa 900
ggcgagtgga gcgagtggag cccggaggcc atgggcacgc cttggacaga atccaggagt 960
cctccagctg agaacgaggt gtccaccccc atgcaggcac ttactactaa taaagacgat 1020
gataatattc tcttcagaga ttctgcaaat gcgacaagcc tcccagtgca agattcttct 1080
tcagtaccac tgcccacatt cctggttgct ggagggagcc tggccttcgg aacgctcctc 1140
tgcattgcca ttgttctgag gttcaagaag acgtggaagc tgcgggctct gaaggaaggc 1200
aagacaagca tgcatccgcc gtactctttg gggcagctgg tcccggagag gcctcgaccc 1260
accccagtgc ttgttcctct catctcccca ccggtgtccc ccagcagcct ggggtctgac 1320
aatacctcga gccacaaccg accagatgcc agggacccac ggagccctta tgacatcagc 1380
aatacagact acttcttccc cagatag 1407
<210> 3
<211> 107
<212> БЕЛОК
<213> Homo sapiens
<400> 3
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 4
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 4
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser
<210> 5
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 5
Glu Thr Thr Leu Thr Gln Ser Pro Ala Phe Met Ser Ala Thr Pro Gly
1 5 10 15
Asp Lys Val Asn Ile Ser Cys Lys Ala Ser Gln Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Glu Ala Ala Ile Phe Ile Ile
35 40 45
Gln Glu Ala Thr Thr Leu Val Pro Gly Ile Ser Pro Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Ile Glu Ser
65 70 75 80
Glu Asp Ala Ala Tyr Tyr Phe Cys Leu Gln His Asp Asn Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 6
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 7
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 7
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Asp Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu Arg Asn Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Gln
100 105 110
<210> 8
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 8
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 9
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 9
Asp Ile Val Met Thr Gln Ser Pro Glu Ser Leu Val Leu Ser Leu Gly
1 5 10 15
Gly Thr Ala Thr Ile Asn Cys Arg Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Thr Leu Leu Phe Ser Trp Ala Ser Ile Arg Asp Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Ala Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr
65 70 75 80
Ile Ser Asp Leu Gln Ala Glu Asp Ala Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Arg Ala Pro Ser Phe Gly Gln Gly Thr Lys Leu Gln Ile Lys
100 105 110
<210> 10
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 10
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Asp Pro Gly Gly Gly Glu Tyr Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 11
<211> 126
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 11
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Glu Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Ala Pro Tyr Tyr Tyr Asp Ser Ser Gly Tyr Thr Asp Ala
100 105 110
Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120 125
<210> 12
<211> 365
<212> БЕЛОК
<213> Homo sapiens
<400> 12
Met Gly Val Pro Arg Pro Gln Pro Trp Ala Leu Gly Leu Leu Leu Phe
1 5 10 15
Leu Leu Pro Gly Ser Leu Gly Ala Glu Ser His Leu Ser Leu Leu Tyr
20 25 30
His Leu Thr Ala Val Ser Ser Pro Ala Pro Gly Thr Pro Ala Phe Trp
35 40 45
Val Ser Gly Trp Leu Gly Pro Gln Gln Tyr Leu Ser Tyr Asn Ser Leu
50 55 60
Arg Gly Glu Ala Glu Pro Cys Gly Ala Trp Val Trp Glu Asn Gln Val
65 70 75 80
Ser Trp Tyr Trp Glu Lys Glu Thr Thr Asp Leu Arg Ile Lys Glu Lys
85 90 95
Leu Phe Leu Glu Ala Phe Lys Ala Leu Gly Gly Lys Gly Pro Tyr Thr
100 105 110
Leu Gln Gly Leu Leu Gly Cys Glu Leu Gly Pro Asp Asn Thr Ser Val
115 120 125
Pro Thr Ala Lys Phe Ala Leu Asn Gly Glu Glu Phe Met Asn Phe Asp
130 135 140
Leu Lys Gln Gly Thr Trp Gly Gly Asp Trp Pro Glu Ala Leu Ala Ile
145 150 155 160
Ser Gln Arg Trp Gln Gln Gln Asp Lys Ala Ala Asn Lys Glu Leu Thr
165 170 175
Phe Leu Leu Phe Ser Cys Pro His Arg Leu Arg Glu His Leu Glu Arg
180 185 190
Gly Arg Gly Asn Leu Glu Trp Lys Glu Pro Pro Ser Met Arg Leu Lys
195 200 205
Ala Arg Pro Ser Ser Pro Gly Phe Ser Val Leu Thr Cys Ser Ala Phe
210 215 220
Ser Phe Tyr Pro Pro Glu Leu Gln Leu Arg Phe Leu Arg Asn Gly Leu
225 230 235 240
Ala Ala Gly Thr Gly Gln Gly Asp Phe Gly Pro Asn Ser Asp Gly Ser
245 250 255
Phe His Ala Ser Ser Ser Leu Thr Val Lys Ser Gly Asp Glu His His
260 265 270
Tyr Cys Cys Ile Val Gln His Ala Gly Leu Ala Gln Pro Leu Arg Val
275 280 285
Glu Leu Glu Ser Pro Ala Lys Ser Ser Val Leu Val Val Gly Ile Val
290 295 300
Ile Gly Val Leu Leu Leu Thr Ala Ala Ala Val Gly Gly Ala Leu Leu
305 310 315 320
Trp Arg Arg Met Arg Ser Gly Leu Pro Ala Pro Trp Ile Ser Leu Arg
325 330 335
Gly Asp Asp Thr Gly Val Leu Leu Pro Thr Pro Gly Glu Ala Gln Asp
340 345 350
Ala Asp Leu Lys Asp Val Asn Val Ile Pro Ala Thr Ala
355 360 365
<210> 13
<211> 119
<212> БЕЛОК
<213> Homo sapiens
<400> 13
Met Ser Arg Ser Val Ala Leu Ala Val Leu Ala Leu Leu Ser Leu Ser
1 5 10 15
Gly Leu Glu Ala Ile Gln Arg Thr Pro Lys Ile Gln Val Tyr Ser Arg
20 25 30
His Pro Ala Glu Asn Gly Lys Ser Asn Phe Leu Asn Cys Tyr Val Ser
35 40 45
Gly Phe His Pro Ser Asp Ile Glu Val Asp Leu Leu Lys Asn Gly Glu
50 55 60
Arg Ile Glu Lys Val Glu His Ser Asp Leu Ser Phe Ser Lys Asp Trp
65 70 75 80
Ser Phe Tyr Leu Leu Tyr Tyr Thr Glu Phe Thr Pro Thr Glu Lys Asp
85 90 95
Glu Tyr Ala Cys Arg Val Asn His Val Thr Leu Ser Gln Pro Lys Ile
100 105 110
Val Lys Trp Asp Arg Asp Met
115
<210> 14
<211> 330
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 14
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 15
<211> 326
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 15
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro
100 105 110
Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
165 170 175
Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
195 200 205
Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Pro Gly Lys
325
<210> 16
<211> 377
<212> БЕЛОК
<213> Homo sapiens
<400> 16
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Leu Lys Thr Pro Leu Gly Asp Thr Thr His Thr Cys Pro
100 105 110
Arg Cys Pro Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg
115 120 125
Cys Pro Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys
130 135 140
Pro Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys Pro
145 150 155 160
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
165 170 175
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
180 185 190
Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Lys Trp Tyr
195 200 205
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
210 215 220
Gln Tyr Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Leu His
225 230 235 240
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
245 250 255
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln
260 265 270
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
275 280 285
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
290 295 300
Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly Gln Pro Glu Asn Asn
305 310 315 320
Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu
325 330 335
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Ile
340 345 350
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn Arg Phe Thr Gln
355 360 365
Lys Ser Leu Ser Leu Ser Pro Gly Lys
370 375
<210> 17
<211> 327
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 17
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 18
<211> 1125
<212> ДНК
<213> Homo sapiens
<400> 18
atgtggttct tgacaactct gctcctttgg gttccagttg atgggcaagt ggacaccaca 60
aaggcagtga tcactttgca gcctccatgg gtcagcgtgt tccaagagga aaccgtaacc 120
ttgcactgtg aggtgctcca tctgcctggg agcagctcta cacagtggtt tctcaatggc 180
acagccactc agacctcgac ccccagctac agaatcacct ctgccagtgt caatgacagt 240
ggtgaataca ggtgccagag aggtctctca gggcgaagtg accccataca gctggaaatc 300
cacagaggct ggctactact gcaggtctcc agcagagtct tcacggaagg agaacctctg 360
gccttgaggt gtcatgcgtg gaaggataag ctggtgtaca atgtgcttta ctatcgaaat 420
ggcaaagcct ttaagttttt ccactggaat tctaacctca ccattctgaa aaccaacata 480
agtcacaatg gcacctacca ttgctcaggc atgggaaagc atcgctacac atcagcagga 540
atatctgtca ctgtgaaaga gctatttcca gctccagtgc tgaatgcatc tgtgacatcc 600
ccactcctgg aggggaatct ggtcaccctg agctgtgaaa caaagttgct cttgcagagg 660
cctggtttgc agctttactt ctccttctac atgggcagca agaccctgcg aggcaggaac 720
acatcctctg aataccaaat actaactgct agaagagaag actctgggtt atactggtgc 780
gaggctgcca cagaggatgg aaatgtcctt aagcgcagcc ctgagttgga gcttcaagtg 840
cttggcctcc agttaccaac tcctgtctgg tttcatgtcc ttttctatct ggcagtggga 900
ataatgtttt tagtgaacac tgttctctgg gtgacaatac gtaaagaact gaaaagaaag 960
aaaaagtggg atttagaaat ctctttggat tctggtcatg agaagaaggt aatttccagc 1020
cttcaagaag acagacattt agaagaagag ctgaaatgtc aggaacaaaa agaagaacag 1080
ctgcaggaag gggtgcaccg gaaggagccc cagggggcca cgtag 1125
<210> 19
<211> 374
<212> БЕЛОК
<213> Homo sapiens
<400> 19
Met Trp Phe Leu Thr Thr Leu Leu Leu Trp Val Pro Val Asp Gly Gln
1 5 10 15
Val Asp Thr Thr Lys Ala Val Ile Thr Leu Gln Pro Pro Trp Val Ser
20 25 30
Val Phe Gln Glu Glu Thr Val Thr Leu His Cys Glu Val Leu His Leu
35 40 45
Pro Gly Ser Ser Ser Thr Gln Trp Phe Leu Asn Gly Thr Ala Thr Gln
50 55 60
Thr Ser Thr Pro Ser Tyr Arg Ile Thr Ser Ala Ser Val Asn Asp Ser
65 70 75 80
Gly Glu Tyr Arg Cys Gln Arg Gly Leu Ser Gly Arg Ser Asp Pro Ile
85 90 95
Gln Leu Glu Ile His Arg Gly Trp Leu Leu Leu Gln Val Ser Ser Arg
100 105 110
Val Phe Thr Glu Gly Glu Pro Leu Ala Leu Arg Cys His Ala Trp Lys
115 120 125
Asp Lys Leu Val Tyr Asn Val Leu Tyr Tyr Arg Asn Gly Lys Ala Phe
130 135 140
Lys Phe Phe His Trp Asn Ser Asn Leu Thr Ile Leu Lys Thr Asn Ile
145 150 155 160
Ser His Asn Gly Thr Tyr His Cys Ser Gly Met Gly Lys His Arg Tyr
165 170 175
Thr Ser Ala Gly Ile Ser Val Thr Val Lys Glu Leu Phe Pro Ala Pro
180 185 190
Val Leu Asn Ala Ser Val Thr Ser Pro Leu Leu Glu Gly Asn Leu Val
195 200 205
Thr Leu Ser Cys Glu Thr Lys Leu Leu Leu Gln Arg Pro Gly Leu Gln
210 215 220
Leu Tyr Phe Ser Phe Tyr Met Gly Ser Lys Thr Leu Arg Gly Arg Asn
225 230 235 240
Thr Ser Ser Glu Tyr Gln Ile Leu Thr Ala Arg Arg Glu Asp Ser Gly
245 250 255
Leu Tyr Trp Cys Glu Ala Ala Thr Glu Asp Gly Asn Val Leu Lys Arg
260 265 270
Ser Pro Glu Leu Glu Leu Gln Val Leu Gly Leu Gln Leu Pro Thr Pro
275 280 285
Val Trp Phe His Val Leu Phe Tyr Leu Ala Val Gly Ile Met Phe Leu
290 295 300
Val Asn Thr Val Leu Trp Val Thr Ile Arg Lys Glu Leu Lys Arg Lys
305 310 315 320
Lys Lys Trp Asp Leu Glu Ile Ser Leu Asp Ser Gly His Glu Lys Lys
325 330 335
Val Ile Ser Ser Leu Gln Glu Asp Arg His Leu Glu Glu Glu Leu Lys
340 345 350
Cys Gln Glu Gln Lys Glu Glu Gln Leu Gln Glu Gly Val His Arg Lys
355 360 365
Glu Pro Gln Gly Ala Thr
370
<210> 20
<211> 951
<212> ДНК
<213> Homo sapiens
<400> 20
atgactatgg agacccaaat gtctcagaat gtatgtccca gaaacctgtg gctgcttcaa 60
ccattgacag ttttgctgct gctggcttct gcagacagtc aagctgctcc cccaaaggct 120
gtgctgaaac ttgagccccc gtggatcaac gtgctccagg aggactctgt gactctgaca 180
tgccaggggg ctcgcagccc tgagagcgac tccattcagt ggttccacaa tgggaatctc 240
attcccaccc acacgcagcc cagctacagg ttcaaggcca acaacaatga cagcggggag 300
tacacgtgcc agactggcca gaccagcctc agcgaccctg tgcatctgac tgtgctttcc 360
gaatggctgg tgctccagac ccctcacctg gagttccagg agggagaaac catcatgctg 420
aggtgccaca gctggaagga caagcctctg gtcaaggtca cattcttcca gaatggaaaa 480
tcccagaaat tctcccattt ggatcccacc ttctccatcc cacaagcaaa ccacagtcac 540
agtggtgatt accactgcac aggaaacata ggctacacgc tgttctcatc caagcctgtg 600
accatcactg tccaagtgcc cagcatgggc agctcttcac caatgggggt cattgtggct 660
gtggtcattg cgactgctgt agcagccatt gttgctgctg tagtggcctt gatctactgc 720
aggaaaaagc ggatttcagc caattccact gatcctgtga aggctgccca atttgagcca 780
cctggacgtc aaatgattgc catcagaaag agacaacttg aagaaaccaa caatgactat 840
gaaacagctg acggcggcta catgactctg aaccccaggg cacctactga cgatgataaa 900
aacatctacc tgactcttcc tcccaacgac catgtcaaca gtaataacta a 951
<210> 21
<211> 316
<212> БЕЛОК
<213> Homo sapiens
<400> 21
Met Thr Met Glu Thr Gln Met Ser Gln Asn Val Cys Pro Arg Asn Leu
1 5 10 15
Trp Leu Leu Gln Pro Leu Thr Val Leu Leu Leu Leu Ala Ser Ala Asp
20 25 30
Ser Gln Ala Ala Pro Pro Lys Ala Val Leu Lys Leu Glu Pro Pro Trp
35 40 45
Ile Asn Val Leu Gln Glu Asp Ser Val Thr Leu Thr Cys Gln Gly Ala
50 55 60
Arg Ser Pro Glu Ser Asp Ser Ile Gln Trp Phe His Asn Gly Asn Leu
65 70 75 80
Ile Pro Thr His Thr Gln Pro Ser Tyr Arg Phe Lys Ala Asn Asn Asn
85 90 95
Asp Ser Gly Glu Tyr Thr Cys Gln Thr Gly Gln Thr Ser Leu Ser Asp
100 105 110
Pro Val His Leu Thr Val Leu Ser Glu Trp Leu Val Leu Gln Thr Pro
115 120 125
His Leu Glu Phe Gln Glu Gly Glu Thr Ile Met Leu Arg Cys His Ser
130 135 140
Trp Lys Asp Lys Pro Leu Val Lys Val Thr Phe Phe Gln Asn Gly Lys
145 150 155 160
Ser Gln Lys Phe Ser His Leu Asp Pro Thr Phe Ser Ile Pro Gln Ala
165 170 175
Asn His Ser His Ser Gly Asp Tyr His Cys Thr Gly Asn Ile Gly Tyr
180 185 190
Thr Leu Phe Ser Ser Lys Pro Val Thr Ile Thr Val Gln Val Pro Ser
195 200 205
Met Gly Ser Ser Ser Pro Met Gly Val Ile Val Ala Val Val Ile Ala
210 215 220
Thr Ala Val Ala Ala Ile Val Ala Ala Val Val Ala Leu Ile Tyr Cys
225 230 235 240
Arg Lys Lys Arg Ile Ser Ala Asn Ser Thr Asp Pro Val Lys Ala Ala
245 250 255
Gln Phe Glu Pro Pro Gly Arg Gln Met Ile Ala Ile Arg Lys Arg Gln
260 265 270
Leu Glu Glu Thr Asn Asn Asp Tyr Glu Thr Ala Asp Gly Gly Tyr Met
275 280 285
Thr Leu Asn Pro Arg Ala Pro Thr Asp Asp Asp Lys Asn Ile Tyr Leu
290 295 300
Thr Leu Pro Pro Asn Asp His Val Asn Ser Asn Asn
305 310 315
<210> 22
<211> 876
<212> ДНК
<213> Homo sapiens
<400> 22
atgggaatcc tgtcattctt acctgtcctt gccactgaga gtgactgggc tgactgcaag 60
tccccccagc cttggggtca tatgcttctg tggacagctg tgctattcct ggctcctgtt 120
gctgggacac ctgcagctcc cccaaaggct gtgctgaaac tcgagcccca gtggatcaac 180
gtgctccagg aggactctgt gactctgaca tgccggggga ctcacagccc tgagagcgac 240
tccattcagt ggttccacaa tgggaatctc attcccaccc acacgcagcc cagctacagg 300
ttcaaggcca acaacaatga cagcggggag tacacgtgcc agactggcca gaccagcctc 360
agcgaccctg tgcatctgac tgtgctttct gagtggctgg tgctccagac ccctcacctg 420
gagttccagg agggagaaac catcgtgctg aggtgccaca gctggaagga caagcctctg 480
gtcaaggtca cattcttcca gaatggaaaa tccaagaaat tttcccgttc ggatcccaac 540
ttctccatcc cacaagcaaa ccacagtcac agtggtgatt accactgcac aggaaacata 600
ggctacacgc tgtactcatc caagcctgtg accatcactg tccaagctcc cagctcttca 660
ccgatgggga tcattgtggc tgtggtcact gggattgctg tagcggccat tgttgctgct 720
gtagtggcct tgatctactg caggaaaaag cggatttcag ccaatcccac taatcctgat 780
gaggctgaca aagttggggc tgagaacaca atcacctatt cacttctcat gcacccggat 840
gctctggaag agcctgatga ccagaaccgt atttag 876
<210> 23
<211> 291
<212> БЕЛОК
<213> Homo sapiens
<400> 23
Met Gly Ile Leu Ser Phe Leu Pro Val Leu Ala Thr Glu Ser Asp Trp
1 5 10 15
Ala Asp Cys Lys Ser Pro Gln Pro Trp Gly His Met Leu Leu Trp Thr
20 25 30
Ala Val Leu Phe Leu Ala Pro Val Ala Gly Thr Pro Ala Ala Pro Pro
35 40 45
Lys Ala Val Leu Lys Leu Glu Pro Gln Trp Ile Asn Val Leu Gln Glu
50 55 60
Asp Ser Val Thr Leu Thr Cys Arg Gly Thr His Ser Pro Glu Ser Asp
65 70 75 80
Ser Ile Gln Trp Phe His Asn Gly Asn Leu Ile Pro Thr His Thr Gln
85 90 95
Pro Ser Tyr Arg Phe Lys Ala Asn Asn Asn Asp Ser Gly Glu Tyr Thr
100 105 110
Cys Gln Thr Gly Gln Thr Ser Leu Ser Asp Pro Val His Leu Thr Val
115 120 125
Leu Ser Glu Trp Leu Val Leu Gln Thr Pro His Leu Glu Phe Gln Glu
130 135 140
Gly Glu Thr Ile Val Leu Arg Cys His Ser Trp Lys Asp Lys Pro Leu
145 150 155 160
Val Lys Val Thr Phe Phe Gln Asn Gly Lys Ser Lys Lys Phe Ser Arg
165 170 175
Ser Asp Pro Asn Phe Ser Ile Pro Gln Ala Asn His Ser His Ser Gly
180 185 190
Asp Tyr His Cys Thr Gly Asn Ile Gly Tyr Thr Leu Tyr Ser Ser Lys
195 200 205
Pro Val Thr Ile Thr Val Gln Ala Pro Ser Ser Ser Pro Met Gly Ile
210 215 220
Ile Val Ala Val Val Thr Gly Ile Ala Val Ala Ala Ile Val Ala Ala
225 230 235 240
Val Val Ala Leu Ile Tyr Cys Arg Lys Lys Arg Ile Ser Ala Asn Pro
245 250 255
Thr Asn Pro Asp Glu Ala Asp Lys Val Gly Ala Glu Asn Thr Ile Thr
260 265 270
Tyr Ser Leu Leu Met His Pro Asp Ala Leu Glu Glu Pro Asp Asp Gln
275 280 285
Asn Arg Ile
290
<210> 24
<211> 765
<212> ДНК
<213> Homo sapiens
<400> 24
atgtggcagc tgctcctccc aactgctctg ctacttctag tttcagctgg catgcggact 60
gaagatctcc caaaggctgt ggtgttcctg gagcctcaat ggtacagggt gctcgagaag 120
gacagtgtga ctctgaagtg ccagggagcc tactcccctg aggacaattc cacacagtgg 180
tttcacaatg agagcctcat ctcaagccag gcctcgagct acttcattga cgctgccaca 240
gttgacgaca gtggagagta caggtgccag acaaacctct ccaccctcag tgacccggtg 300
cagctagaag tccatatcgg ctggctgttg ctccaggccc ctcggtgggt gttcaaggag 360
gaagacccta ttcacctgag gtgtcacagc tggaagaaca ctgctctgca taaggtcaca 420
tatttacaga atggcaaagg caggaagtat tttcatcata attctgactt ctacattcca 480
aaagccacac tcaaagacag cggctcctac ttctgcaggg ggcttgttgg gagtaaaaat 540
gtgtcttcag agactgtgaa catcaccatc actcaaggtt tgtcagtgtc aaccatctca 600
tcattctttc cacctgggta ccaagtctct ttctgcttgg tgatggtact cctttttgca 660
gtggacacag gactatattt ctctgtgaag acaaacattc gaagctcaac aagagactgg 720
aaggaccata aatttaaatg gagaaaggac cctcaagaca aatga 765
<210> 25
<211> 254
<212> БЕЛОК
<213> Homo sapiens
<400> 25
Met Trp Gln Leu Leu Leu Pro Thr Ala Leu Leu Leu Leu Val Ser Ala
1 5 10 15
Gly Met Arg Thr Glu Asp Leu Pro Lys Ala Val Val Phe Leu Glu Pro
20 25 30
Gln Trp Tyr Arg Val Leu Glu Lys Asp Ser Val Thr Leu Lys Cys Gln
35 40 45
Gly Ala Tyr Ser Pro Glu Asp Asn Ser Thr Gln Trp Phe His Asn Glu
50 55 60
Ser Leu Ile Ser Ser Gln Ala Ser Ser Tyr Phe Ile Asp Ala Ala Thr
65 70 75 80
Val Asp Asp Ser Gly Glu Tyr Arg Cys Gln Thr Asn Leu Ser Thr Leu
85 90 95
Ser Asp Pro Val Gln Leu Glu Val His Ile Gly Trp Leu Leu Leu Gln
100 105 110
Ala Pro Arg Trp Val Phe Lys Glu Glu Asp Pro Ile His Leu Arg Cys
115 120 125
His Ser Trp Lys Asn Thr Ala Leu His Lys Val Thr Tyr Leu Gln Asn
130 135 140
Gly Lys Gly Arg Lys Tyr Phe His His Asn Ser Asp Phe Tyr Ile Pro
145 150 155 160
Lys Ala Thr Leu Lys Asp Ser Gly Ser Tyr Phe Cys Arg Gly Leu Val
165 170 175
Gly Ser Lys Asn Val Ser Ser Glu Thr Val Asn Ile Thr Ile Thr Gln
180 185 190
Gly Leu Ser Val Ser Thr Ile Ser Ser Phe Phe Pro Pro Gly Tyr Gln
195 200 205
Val Ser Phe Cys Leu Val Met Val Leu Leu Phe Ala Val Asp Thr Gly
210 215 220
Leu Tyr Phe Ser Val Lys Thr Asn Ile Arg Ser Ser Thr Arg Asp Trp
225 230 235 240
Lys Asp His Lys Phe Lys Trp Arg Lys Asp Pro Gln Asp Lys
245 250
<210> 26
<211> 702
<212> ДНК
<213> Homo sapiens
<400> 26
atgtggcagc tgctcctccc aactgctctg ctacttctag tttcagctgg catgcggact 60
gaagatctcc caaaggctgt ggtgttcctg gagcctcaat ggtacagcgt gcttgagaag 120
gacagtgtga ctctgaagtg ccagggagcc tactcccctg aggacaattc cacacagtgg 180
tttcacaatg agagcctcat ctcaagccag gcctcgagct acttcattga cgctgccaca 240
gtcaacgaca gtggagagta caggtgccag acaaacctct ccaccctcag tgacccggtg 300
cagctagaag tccatatcgg ctggctgttg ctccaggccc ctcggtgggt gttcaaggag 360
gaagacccta ttcacctgag gtgtcacagc tggaagaaca ctgctctgca taaggtcaca 420
tatttacaga atggcaaaga caggaagtat tttcatcata attctgactt ccacattcca 480
aaagccacac tcaaagatag cggctcctac ttctgcaggg ggcttgttgg gagtaaaaat 540
gtgtcttcag agactgtgaa catcaccatc actcaaggtt tggcagtgtc aaccatctca 600
tcattctctc cacctgggta ccaagtctct ttctgcttgg tgatggtact cctttttgca 660
gtggacacag gactatattt ctctgtgaag acaaacattt ga 702
<210> 27
<211> 233
<212> БЕЛОК
<213> Homo sapiens
<400> 27
Met Trp Gln Leu Leu Leu Pro Thr Ala Leu Leu Leu Leu Val Ser Ala
1 5 10 15
Gly Met Arg Thr Glu Asp Leu Pro Lys Ala Val Val Phe Leu Glu Pro
20 25 30
Gln Trp Tyr Ser Val Leu Glu Lys Asp Ser Val Thr Leu Lys Cys Gln
35 40 45
Gly Ala Tyr Ser Pro Glu Asp Asn Ser Thr Gln Trp Phe His Asn Glu
50 55 60
Ser Leu Ile Ser Ser Gln Ala Ser Ser Tyr Phe Ile Asp Ala Ala Thr
65 70 75 80
Val Asn Asp Ser Gly Glu Tyr Arg Cys Gln Thr Asn Leu Ser Thr Leu
85 90 95
Ser Asp Pro Val Gln Leu Glu Val His Ile Gly Trp Leu Leu Leu Gln
100 105 110
Ala Pro Arg Trp Val Phe Lys Glu Glu Asp Pro Ile His Leu Arg Cys
115 120 125
His Ser Trp Lys Asn Thr Ala Leu His Lys Val Thr Tyr Leu Gln Asn
130 135 140
Gly Lys Asp Arg Lys Tyr Phe His His Asn Ser Asp Phe His Ile Pro
145 150 155 160
Lys Ala Thr Leu Lys Asp Ser Gly Ser Tyr Phe Cys Arg Gly Leu Val
165 170 175
Gly Ser Lys Asn Val Ser Ser Glu Thr Val Asn Ile Thr Ile Thr Gln
180 185 190
Gly Leu Ala Val Ser Thr Ile Ser Ser Phe Ser Pro Pro Gly Tyr Gln
195 200 205
Val Ser Phe Cys Leu Val Met Val Leu Leu Phe Ala Val Asp Thr Gly
210 215 220
Leu Tyr Phe Ser Val Lys Thr Asn Ile
225 230
<210> 28
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 28
Gly Gly Gly Ser
1
<210> 29
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 29
Ser Gly Gly Gly
1
<210> 30
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 30
Gly Gly Gly Gly Ser
1 5
<210> 31
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 31
Ser Gly Gly Gly Gly
1 5
<210> 32
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 32
Gly Gly Gly Gly Gly Ser
1 5
<210> 33
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 33
Ser Gly Gly Gly Gly Gly
1 5
<210> 34
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 34
Gly Gly Gly Gly Gly Gly Ser
1 5
<210> 35
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 35
Ser Gly Gly Gly Gly Gly Gly
1 5
<210> 36
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 36
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 37
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 37
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Ser Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Glu Leu Leu Ile
35 40 45
Tyr Tyr Gly Ser Glu Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Ser Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Glu Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 38
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 38
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 39
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 39
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Ser Val Thr Ile Thr Cys Gln Ala Ser Thr Asp Ile Ser Ser His
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Glu Leu Leu Ile
35 40 45
Tyr Tyr Gly Ser His Leu Leu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gly Gln Gly Asn Arg Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Glu Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 40
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 40
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Asp Ala Tyr Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 41
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 41
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Arg Gly Gly Pro
225 230 235 240
Lys Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 42
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 42
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 43
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 43
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Asp Ala Tyr Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Leu His Glu
420 425 430
Ala Leu His Ser His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 44
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 44
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Tyr Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 45
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 45
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Asp Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Glu Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 46
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 46
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Tyr Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Leu His Glu
420 425 430
Ala Leu His Ser His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 47
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 47
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Asp Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Glu Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Leu His Glu
420 425 430
Ala Leu His Ser His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 48
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 48
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Tyr Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Ala His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 49
<211> 443
<212> БЕЛОК
<213> Mus musculus
<400> 49
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 50
<211> 214
<212> БЕЛОК
<213> Mus musculus
<400> 50
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Ser Val Thr Ile Thr Cys Gln Ala Ser Thr Asp Ile Ser Ser His
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Glu Leu Leu Ile
35 40 45
Tyr Tyr Gly Ser His Leu Leu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gly Gln Gly Asn Arg Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Glu Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly
115 120 125
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
130 135 140
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
145 150 155 160
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
165 170 175
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
180 185 190
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
195 200 205
Phe Asn Arg Asn Glu Cys
210
<210> 51
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 51
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Asp Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 52
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 52
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Asp Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Asp Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 53
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 53
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 54
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 54
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 55
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 55
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Glu His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Phe Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 56
<211> 214
<212> БЕЛОК
<213> Homo sapiens
<400> 56
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 57
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 57
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Ser Trp Asn Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Val Ala Ser Ile Thr Tyr Asp Gly Ser Thr Asn Tyr Asn Pro Ser Val
50 55 60
Lys Gly Arg Ile Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr Phe Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ser His Tyr Phe Gly His Trp His Phe Ala Val Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro
<210> 58
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 58
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser Tyr Met Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Tyr Leu Glu Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser His
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 59
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 59
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Ser Trp Asn Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Val Ala Ser Ile Thr Tyr Asp Gly Ser Thr Asn Tyr Asn Pro Ser Val
50 55 60
Lys Gly Arg Ile Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr Phe Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ser His Tyr Phe Gly His Trp His Phe Ala Val Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Glu His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Phe Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro
<210> 60
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 60
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Tyr Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Tyr His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 61
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 61
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Asp
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Tyr Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Tyr His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 62
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 62
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Asp
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 63
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 63
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440 445
<210> 64
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 64
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val
260 265 270
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440
<210> 65
<211> 464
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 65
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Pro Thr Ser Pro Lys Val Phe
115 120 125
Pro Leu Ser Leu Cys Ser Thr Gln Pro Asp Gly Asn Val Val Ile Ala
130 135 140
Cys Leu Val Gln Gly Phe Phe Pro Gln Glu Pro Leu Ser Val Thr Trp
145 150 155 160
Ser Glu Ser Gly Gln Gly Val Thr Ala Arg Asn Phe Pro Pro Ser Gln
165 170 175
Asp Ala Ser Gly Asp Leu Tyr Thr Thr Ser Ser Gln Leu Thr Leu Pro
180 185 190
Ala Thr Gln Cys Leu Ala Gly Lys Ser Val Thr Cys His Val Lys His
195 200 205
Tyr Thr Asn Pro Ser Gln Asp Val Thr Val Pro Cys Pro Val Pro Ser
210 215 220
Thr Pro Pro Thr Pro Ser Pro Ser Thr Pro Pro Thr Pro Ser Pro Ser
225 230 235 240
Cys Cys His Pro Arg Leu Ser Leu His Arg Pro Ala Leu Glu Asp Leu
245 250 255
Leu Leu Gly Ser Glu Ala Asn Leu Thr Cys Thr Leu Thr Gly Leu Arg
260 265 270
Asp Ala Ser Gly Val Thr Phe Thr Trp Thr Pro Ser Ser Gly Lys Ser
275 280 285
Ala Val Gln Gly Pro Pro Glu Arg Asp Leu Cys Gly Cys Tyr Ser Val
290 295 300
Ser Ser Val Leu Pro Gly Cys Ala Glu Pro Trp Asn His Gly Lys Thr
305 310 315 320
Phe Thr Cys Thr Ala Ala Tyr Pro Glu Ser Lys Thr Pro Leu Thr Ala
325 330 335
Thr Leu Ser Lys Ser Gly Asn Thr Phe Arg Pro Glu Val His Leu Leu
340 345 350
Pro Pro Pro Ser Glu Glu Leu Ala Leu Asn Glu Leu Val Thr Leu Thr
355 360 365
Cys Leu Ala Arg Gly Phe Ser Pro Lys Asp Val Leu Val Arg Trp Leu
370 375 380
Gln Gly Ser Gln Glu Leu Pro Arg Glu Lys Tyr Leu Thr Trp Ala Ser
385 390 395 400
Arg Gln Glu Pro Ser Gln Gly Thr Thr Thr Phe Ala Val Thr Ser Ile
405 410 415
Leu Arg Val Ala Ala Glu Asp Trp Lys Lys Gly Asp Thr Phe Ser Cys
420 425 430
Met Val Gly His Glu Ala Leu Pro Leu Ala Phe Thr Gln Lys Thr Ile
435 440 445
Asp Arg Leu Ala Gly Lys Glu Gln Lys Leu Ile Ser Glu Glu Asp Leu
450 455 460
<210> 66
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 66
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Pro Arg Trp Glu Thr Ala Ile Ser Ser Asp Ala Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro
450
<210> 67
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 67
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Asp Asp
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Glu Ala Ser Asn Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Ser Ser Ser Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 68
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 68
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Pro Arg Trp Glu Thr Ala Ile Ser Ser Asp Ala Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Tyr Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro
450
<210> 69
<211> 543
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 69
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Leu Asp Pro Lys Thr Gly Asp Thr Ala Tyr Ser Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Phe Tyr Ser Tyr Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Gln Ser Pro Ser Val Phe Pro Leu Thr Arg
115 120 125
Cys Cys Lys Asn Ile Pro Ser Asn Ala Thr Ser Val Thr Leu Gly Cys
130 135 140
Leu Ala Thr Gly Tyr Phe Pro Glu Pro Val Met Val Thr Trp Asp Thr
145 150 155 160
Gly Ser Leu Asn Gly Thr Thr Met Thr Leu Pro Ala Thr Thr Leu Thr
165 170 175
Leu Ser Gly His Tyr Ala Thr Ile Ser Leu Leu Thr Val Ser Gly Ala
180 185 190
Trp Ala Lys Gln Met Phe Thr Cys Arg Val Ala His Thr Pro Ser Ser
195 200 205
Thr Asp Trp Val Asp Asn Lys Thr Phe Ser Val Cys Ser Arg Asp Phe
210 215 220
Thr Pro Pro Thr Val Lys Ile Leu Gln Ser Ser Cys Asp Gly Gly Gly
225 230 235 240
His Phe Pro Pro Thr Ile Gln Leu Leu Cys Leu Val Ser Gly Tyr Thr
245 250 255
Pro Gly Thr Ile Asn Ile Thr Trp Leu Glu Asp Gly Gln Val Met Asp
260 265 270
Val Asp Leu Ser Thr Ala Ser Thr Thr Gln Glu Gly Glu Leu Ala Ser
275 280 285
Thr Gln Ser Glu Leu Thr Leu Ser Gln Lys His Trp Leu Ser Asp Arg
290 295 300
Thr Tyr Thr Cys Gln Val Thr Tyr Gln Gly His Thr Phe Glu Asp Ser
305 310 315 320
Thr Lys Lys Cys Ala Asp Ser Asn Pro Arg Gly Val Ser Ala Tyr Leu
325 330 335
Ser Arg Pro Ser Pro Phe Asp Leu Phe Ile Arg Lys Ser Pro Thr Ile
340 345 350
Thr Cys Leu Val Val Asp Leu Ala Pro Ser Lys Gly Thr Val Asn Leu
355 360 365
Thr Trp Ser Arg Ala Ser Gly Lys Pro Val Asn His Ser Thr Arg Lys
370 375 380
Glu Glu Lys Gln Arg Asn Gly Thr Leu Thr Val Thr Ser Thr Leu Pro
385 390 395 400
Val Gly Thr Arg Asp Trp Ile Glu Gly Glu Thr Tyr Gln Cys Arg Val
405 410 415
Thr His Pro His Leu Pro Arg Ala Leu Met Arg Ser Thr Thr Lys Thr
420 425 430
Ser Gly Pro Arg Ala Ala Pro Glu Val Tyr Ala Phe Ala Thr Pro Glu
435 440 445
Trp Pro Gly Ser Arg Asp Lys Arg Thr Leu Ala Cys Leu Ile Gln Asn
450 455 460
Phe Met Pro Glu Asp Ile Ser Val Gln Trp Leu His Asn Glu Val Gln
465 470 475 480
Leu Pro Asp Ala Arg His Ser Thr Thr Gln Pro Arg Lys Thr Lys Gly
485 490 495
Ser Gly Phe Phe Val Phe Ser Arg Leu Glu Val Thr Arg Ala Glu Trp
500 505 510
Glu Gln Lys Asp Glu Phe Ile Cys Arg Ala Val His Glu Ala Ala Ser
515 520 525
Pro Ser Gln Thr Val Gln Arg Ala Val Ser Val Asn Pro Gly Lys
530 535 540
<210> 70
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 70
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Arg Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Asn
85 90 95
Thr His Val Pro Pro Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 71
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 71
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Leu Ser Ser Tyr His
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Val Ile Asn Ser Ala Gly Asn Thr Tyr Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Thr Val Ser Lys Thr Ser Thr Thr Val Asp Leu Asn Leu Thr
65 70 75 80
Ser Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg Tyr Val
85 90 95
Phe Ser Ser Gly Ser His Asp Ile Trp Gly Pro Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440
<210> 72
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 72
Ala Tyr Asp Met Thr Gln Thr Pro Ala Ser Val Glu Val Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Ser Ile Gly Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Glu Leu Ile
35 40 45
Tyr Gly Thr Ser Thr Leu Glu Ser Gly Val Pro Ser Arg Phe Ile Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Gly Val Glu Cys
65 70 75 80
Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Ser Glu Asp Asn
85 90 95
Ile Asp Asn Ala Phe Gly Gly Gly Thr Glu Val Val Val Lys Arg Thr
100 105 110
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
115 120 125
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
130 135 140
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
145 150 155 160
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
165 170 175
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
180 185 190
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
195 200 205
Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 73
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 73
Val Asp Asp Ala Pro Gly Asn Ser Gln Gln Ala Thr Pro Lys Asp Asn
1 5 10 15
Glu Ile Ser Thr Phe His Asn Leu Gly Asn Val His Ser Pro Leu Lys
20 25 30
<210> 74
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 74
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Leu Ser Ser Tyr His
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Val Ile Asn Ser Ala Gly Asn Thr Tyr Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Thr Val Ser Lys Thr Ser Thr Thr Val Asp Leu Asn Leu Thr
65 70 75 80
Ser Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg Tyr Val
85 90 95
Phe Ser Ser Gly Ser His Asp Ile Trp Gly Pro Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Ala Tyr Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440
<210> 75
<211> 543
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 75
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Leu Asp Pro Lys Thr Gly Asp Thr Ala Tyr Ser Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Phe Tyr Ser Tyr Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Gln Ser Pro Ser Val Phe Pro Leu Thr Arg
115 120 125
Cys Cys Lys Asn Ile Pro Ser Asp Ala Thr Ser Val Thr Leu Gly Cys
130 135 140
Leu Ala Thr Gly Tyr Phe Pro Glu Pro Val Met Val Thr Trp Asp Thr
145 150 155 160
Gly Ser Leu Asp Gly Thr Thr Met Thr Leu Pro Ala Thr Thr Leu Thr
165 170 175
Leu Ser Gly His Tyr Ala Thr Ile Ser Leu Leu Thr Val Ser Gly Ala
180 185 190
Trp Ala Lys Gln Met Phe Thr Cys Arg Val Ala His Thr Pro Ser Ser
195 200 205
Thr Asp Trp Val Asp Asp Lys Thr Phe Ser Val Cys Ser Arg Asp Phe
210 215 220
Thr Pro Pro Thr Val Lys Ile Leu Gln Ser Ser Cys Asp Gly Gly Gly
225 230 235 240
His Phe Pro Pro Thr Ile Gln Leu Leu Cys Leu Val Ser Gly Tyr Thr
245 250 255
Pro Gly Thr Ile Asp Ile Thr Trp Leu Glu Asp Gly Gln Val Met Asp
260 265 270
Val Asp Leu Ser Thr Ala Ser Thr Thr Gln Glu Gly Glu Leu Ala Ser
275 280 285
Thr Gln Ser Glu Leu Thr Leu Ser Gln Lys His Trp Leu Ser Asp Arg
290 295 300
Thr Tyr Thr Cys Gln Val Thr Tyr Gln Gly His Thr Phe Glu Asp Ser
305 310 315 320
Thr Lys Lys Cys Ala Asp Ser Asn Pro Arg Gly Val Ser Ala Tyr Leu
325 330 335
Ser Arg Pro Ser Pro Phe Asp Leu Phe Ile Arg Lys Ser Pro Thr Ile
340 345 350
Thr Cys Leu Val Val Asp Leu Ala Pro Ser Lys Gly Thr Val Asp Leu
355 360 365
Thr Trp Ser Arg Ala Ser Gly Lys Pro Val Asp His Ser Thr Arg Lys
370 375 380
Glu Glu Lys Gln Arg Asn Gly Thr Leu Thr Val Thr Ser Thr Leu Pro
385 390 395 400
Val Gly Thr Arg Asp Trp Ile Glu Gly Glu Thr Tyr Gln Cys Arg Val
405 410 415
Thr His Pro His Leu Pro Arg Ala Leu Met Arg Ser Thr Thr Lys Thr
420 425 430
Ser Gly Pro Arg Ala Ala Pro Glu Val Tyr Ala Phe Ala Thr Pro Glu
435 440 445
Trp Pro Gly Ser Arg Asp Lys Arg Thr Leu Ala Cys Leu Ile Gln Asn
450 455 460
Phe Met Pro Glu Asp Ile Ser Val Gln Trp Leu His Asn Glu Val Gln
465 470 475 480
Leu Pro Asp Ala Arg His Ser Thr Thr Gln Pro Arg Lys Thr Lys Gly
485 490 495
Ser Gly Phe Phe Val Phe Ser Arg Leu Glu Val Thr Arg Ala Glu Trp
500 505 510
Glu Gln Lys Asp Glu Phe Ile Cys Arg Ala Val His Glu Ala Ala Ser
515 520 525
Pro Ser Gln Thr Val Gln Arg Ala Val Ser Val Asn Pro Gly Lys
530 535 540
<210> 76
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 76
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Leu Ser Ser Tyr His
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Val Ile Asn Ser Ala Gly Asn Thr Tyr Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Thr Val Ser Lys Thr Ser Thr Thr Val Asp Leu Asn Leu Thr
65 70 75 80
Ser Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg Tyr Val
85 90 95
Phe Ser Ser Gly Ser His Asp Ile Trp Gly Pro Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Asp Ala Tyr Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440
<210> 77
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 77
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Leu Ser Ser Tyr His
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Val Ile Asn Ser Ala Gly Asn Thr Tyr Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Thr Val Ser Lys Thr Ser Thr Thr Val Asp Leu Asn Leu Thr
65 70 75 80
Ser Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg Tyr Val
85 90 95
Phe Ser Ser Gly Ser His Asp Ile Trp Gly Pro Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Leu Arg Gly Gly Pro Lys Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440
<210> 78
<211> 545
<212> БЕЛОК
<213> Homo sapiens
<400> 78
Gln Pro Pro Pro Pro Pro Pro Asp Ala Thr Cys His Gln Val Arg Ser
1 5 10 15
Phe Phe Gln Arg Leu Gln Pro Gly Leu Lys Trp Val Pro Glu Thr Pro
20 25 30
Val Pro Gly Ser Asp Leu Gln Val Cys Leu Pro Lys Gly Pro Thr Cys
35 40 45
Cys Ser Arg Lys Met Glu Glu Lys Tyr Gln Leu Thr Ala Arg Leu Asn
50 55 60
Met Glu Gln Leu Leu Gln Ser Ala Ser Met Glu Leu Lys Phe Leu Ile
65 70 75 80
Ile Gln Asn Ala Ala Val Phe Gln Glu Ala Phe Glu Ile Val Val Arg
85 90 95
His Ala Lys Asn Tyr Thr Asn Ala Met Phe Lys Asn Asn Tyr Pro Ser
100 105 110
Leu Thr Pro Gln Ala Phe Glu Phe Val Gly Glu Phe Phe Thr Asp Val
115 120 125
Ser Leu Tyr Ile Leu Gly Ser Asp Ile Asn Val Asp Asp Met Val Asn
130 135 140
Glu Leu Phe Asp Ser Leu Phe Pro Val Ile Tyr Thr Gln Leu Met Asn
145 150 155 160
Pro Gly Leu Pro Asp Ser Ala Leu Asp Ile Asn Glu Cys Leu Arg Gly
165 170 175
Ala Arg Arg Asp Leu Lys Val Phe Gly Asn Phe Pro Lys Leu Ile Met
180 185 190
Thr Gln Val Ser Lys Ser Leu Gln Val Thr Arg Ile Phe Leu Gln Ala
195 200 205
Leu Asn Leu Gly Ile Glu Val Ile Asn Thr Thr Asp His Leu Lys Phe
210 215 220
Ser Lys Asp Cys Gly Arg Met Leu Thr Arg Met Trp Tyr Cys Ser Tyr
225 230 235 240
Cys Gln Gly Leu Met Met Val Lys Pro Cys Gly Gly Tyr Cys Asn Val
245 250 255
Val Met Gln Gly Cys Met Ala Gly Val Val Glu Ile Asp Lys Tyr Trp
260 265 270
Arg Glu Tyr Ile Leu Ser Leu Glu Glu Leu Val Asn Gly Met Tyr Arg
275 280 285
Ile Tyr Asp Met Glu Asn Val Leu Leu Gly Leu Phe Ser Thr Ile His
290 295 300
Asp Ser Ile Gln Tyr Val Gln Lys Asn Ala Gly Lys Leu Thr Thr Thr
305 310 315 320
Ile Gly Lys Leu Cys Ala His Ser Gln Gln Arg Gln Tyr Arg Ser Ala
325 330 335
Tyr Tyr Pro Glu Asp Leu Phe Ile Asp Lys Lys Val Leu Lys Val Ala
340 345 350
His Val Glu His Glu Glu Thr Leu Ser Ser Arg Arg Arg Glu Leu Ile
355 360 365
Gln Lys Leu Lys Ser Phe Ile Ser Phe Tyr Ser Ala Leu Pro Gly Tyr
370 375 380
Ile Cys Ser His Ser Pro Val Ala Glu Asn Asp Thr Leu Cys Trp Asn
385 390 395 400
Gly Gln Glu Leu Val Glu Arg Tyr Ser Gln Lys Ala Ala Arg Asn Gly
405 410 415
Met Lys Asn Gln Phe Asn Leu His Glu Leu Lys Met Lys Gly Pro Glu
420 425 430
Pro Val Val Ser Gln Ile Ile Asp Lys Leu Lys His Ile Asn Gln Leu
435 440 445
Leu Arg Thr Met Ser Met Pro Lys Gly Arg Val Leu Asp Lys Asn Leu
450 455 460
Asp Glu Glu Gly Phe Glu Ala Gly Asp Cys Gly Asp Asp Glu Asp Glu
465 470 475 480
Cys Ile Gly Gly Ala Gly Asp Gly Met Ile Lys Val Lys Asn Gln Leu
485 490 495
Arg Phe Leu Ala Glu Leu Ala Tyr Asp Leu Asp Val Asp Asp Ala Pro
500 505 510
Gly Asn Ser Gln Gln Ala Thr Pro Lys Asp Asn Glu Ile Ser Thr Phe
515 520 525
His Asn Leu Gly Asn Val His Ser Pro Leu Lys His His His His His
530 535 540
His
545
<210> 79
<211> 433
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 79
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Glu Ala Asn Glu Val Glu Asp Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr
<210> 80
<211> 328
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 80
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro
325
<210> 81
<211> 325
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 81
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu
325
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА ДЛЯ УСКОРЕНИЯ ИСЧЕЗНОВЕНИЯ АНТИГЕНА ЧЕРЕЗ FcγRIIB | 2013 |
|
RU2812226C1 |
| ВАРИАНТЫ FcγRIIB-СПЕЦИФИЧЕСКОЙ Fc-ОБЛАСТИ | 2013 |
|
RU2729831C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВАРИАНТОВ FcyRIIB-СПЕЦИФИЧЕСКОЙ Fc-ОБЛАСТИ | 2013 |
|
RU2820161C1 |
| ВАРИАНТ Fc-ОБЛАСТИ | 2014 |
|
RU2757124C2 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА ДЛЯ УСКОРЕНИЯ ЭЛИМИНАЦИИ АНТИГЕНОВ | 2012 |
|
RU2772771C1 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА, ИНДУЦИРУЮЩАЯ ИММУННЫЙ ОТВЕТ НА АНТИГЕН-МИШЕНЬ | 2012 |
|
RU2722829C2 |
| СОДЕРЖАЩИЙ ЛЕКАРСТВЕННОЕ СРЕДСТВО ПЕРЕНОСЧИК В КЛЕТКУ ДЛЯ ФОРМИРОВАНИЯ ИММУННОГО КОМПЛЕКСА | 2012 |
|
RU2739792C1 |
| ВАРИАНТ ПОЛИПЕПТИДА, КОТОРЫЙ ИМЕЕТ СОХРАНЕННУЮ ИЛИ СНИЖЕННУЮ АКТИВНОСТЬ СВЯЗЫВАНИЯ С FcγRIIa, СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2749357C2 |
| СПЕЦИФИЧНАЯ К ТКАНИ-МИШЕНИ АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА | 2013 |
|
RU2743463C2 |
| АНТИ-CD137 АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2829536C2 |

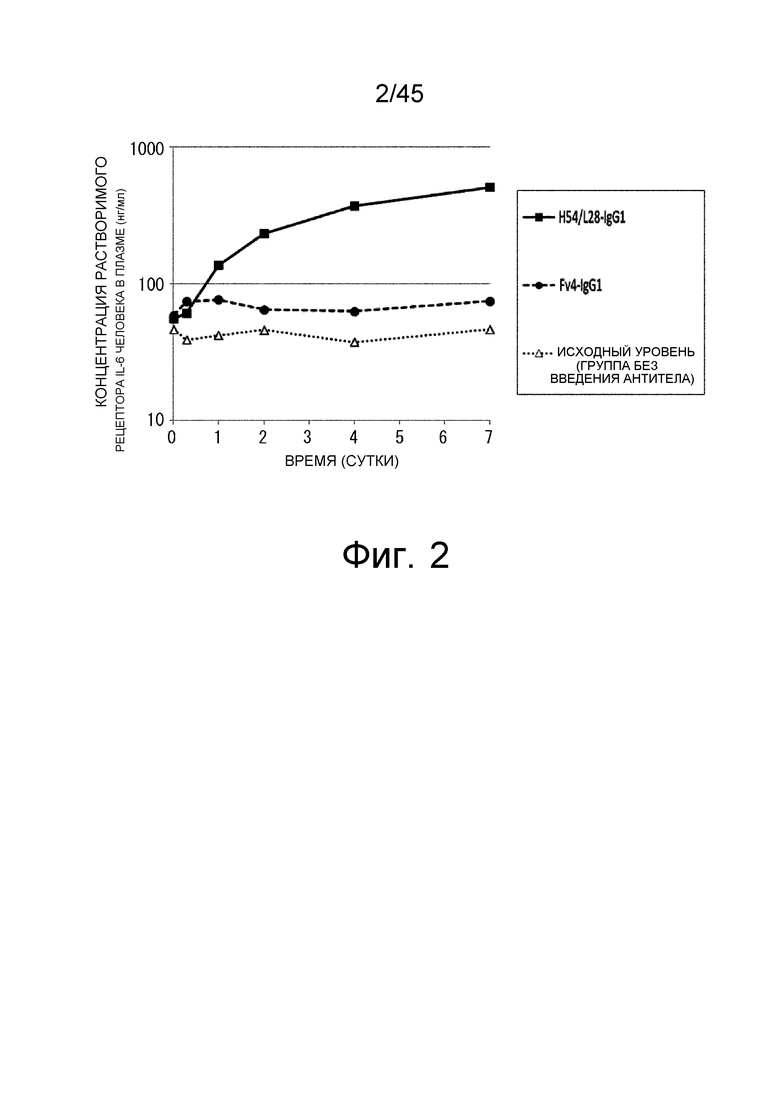
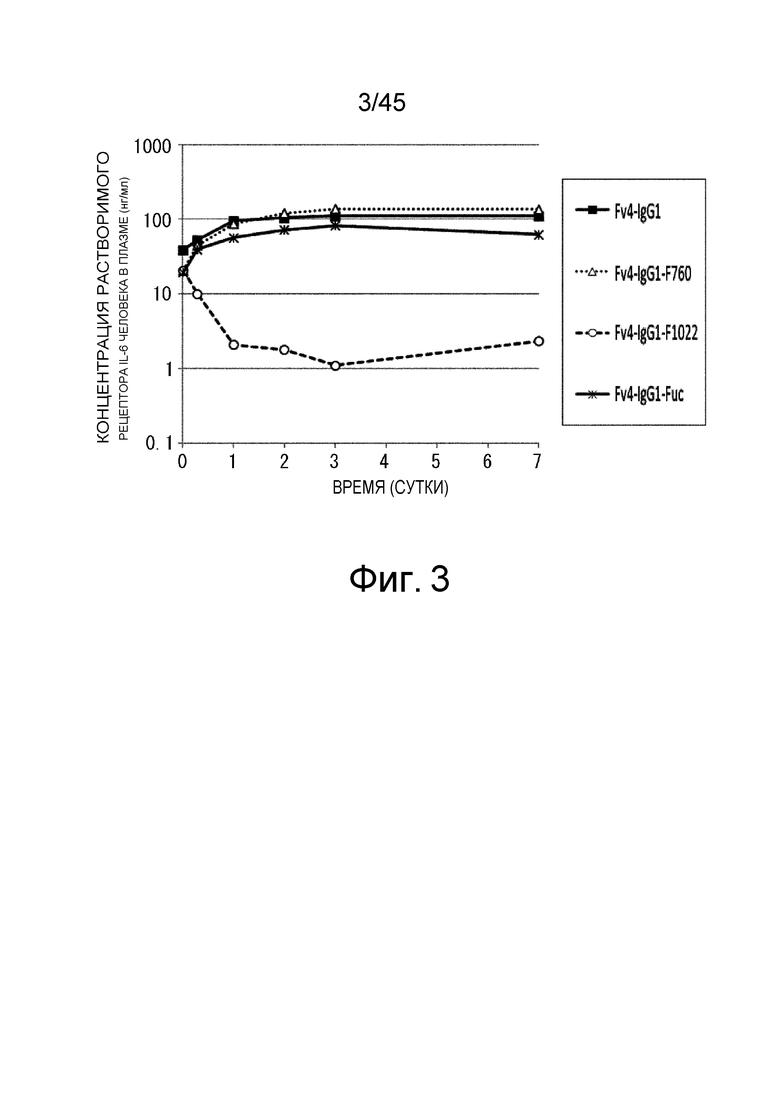

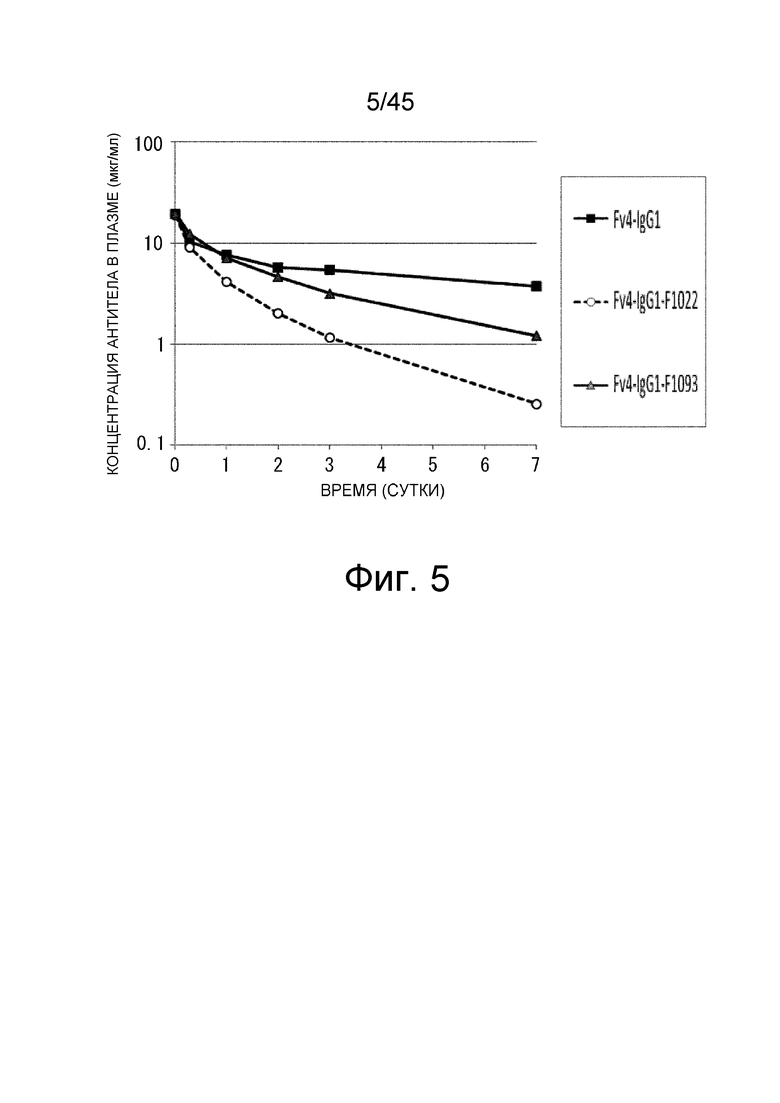
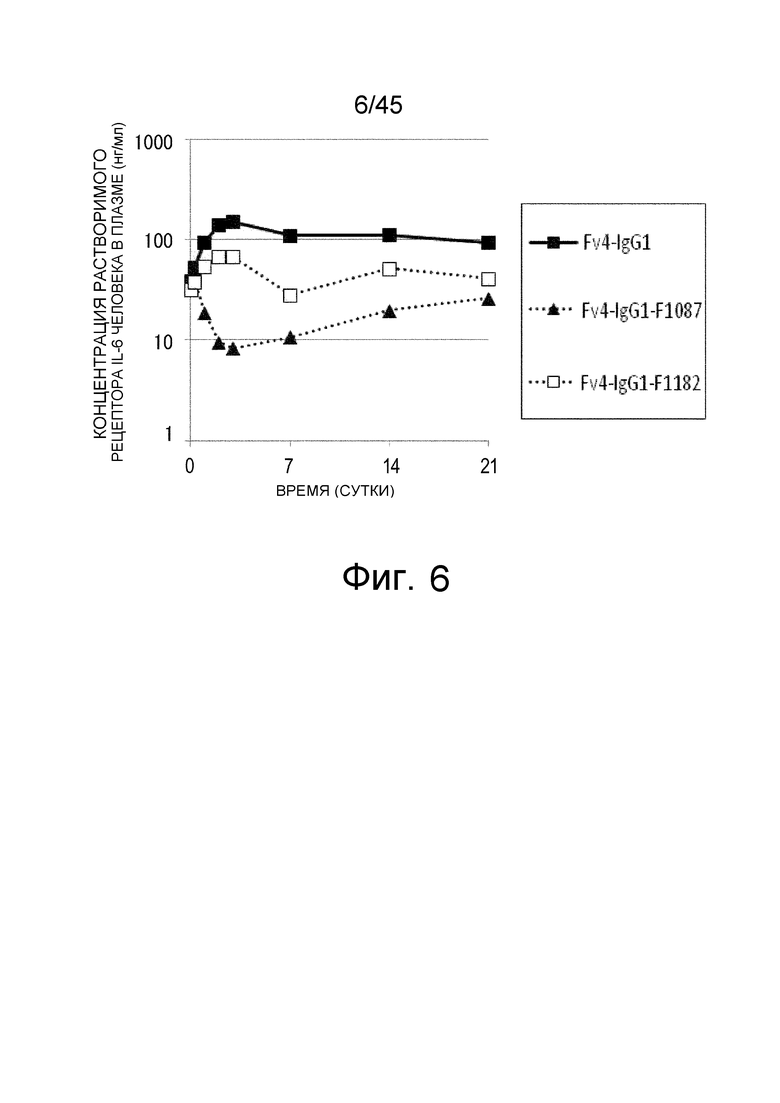
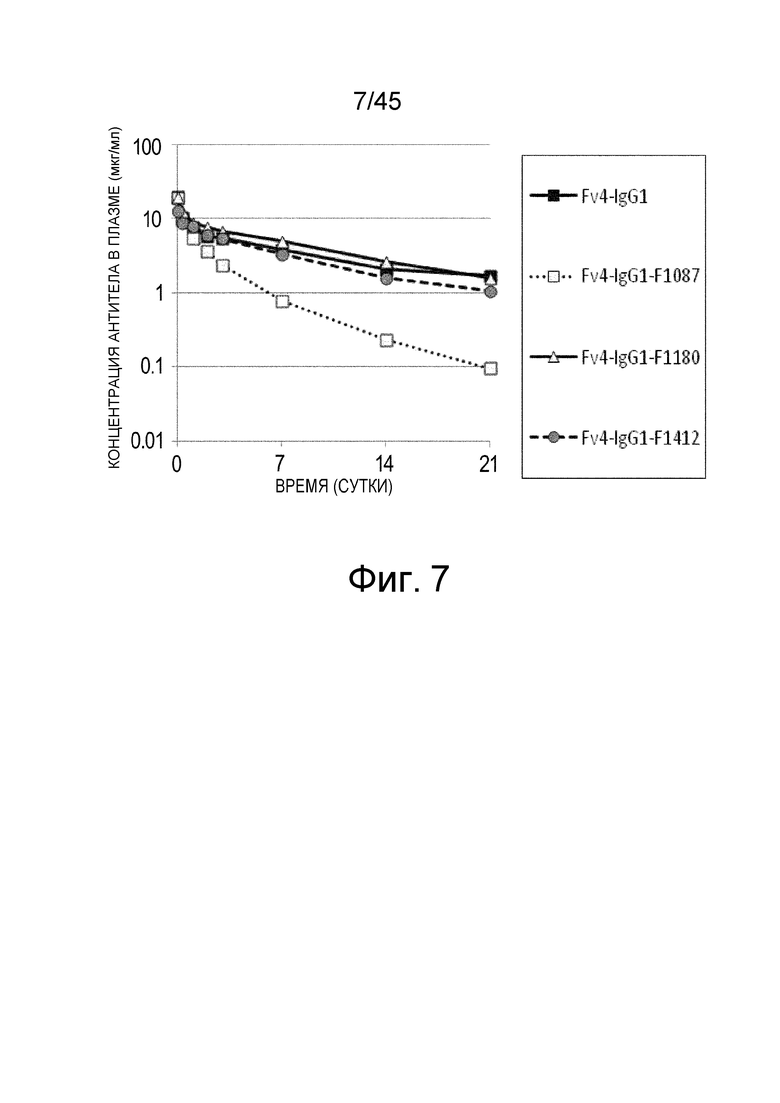


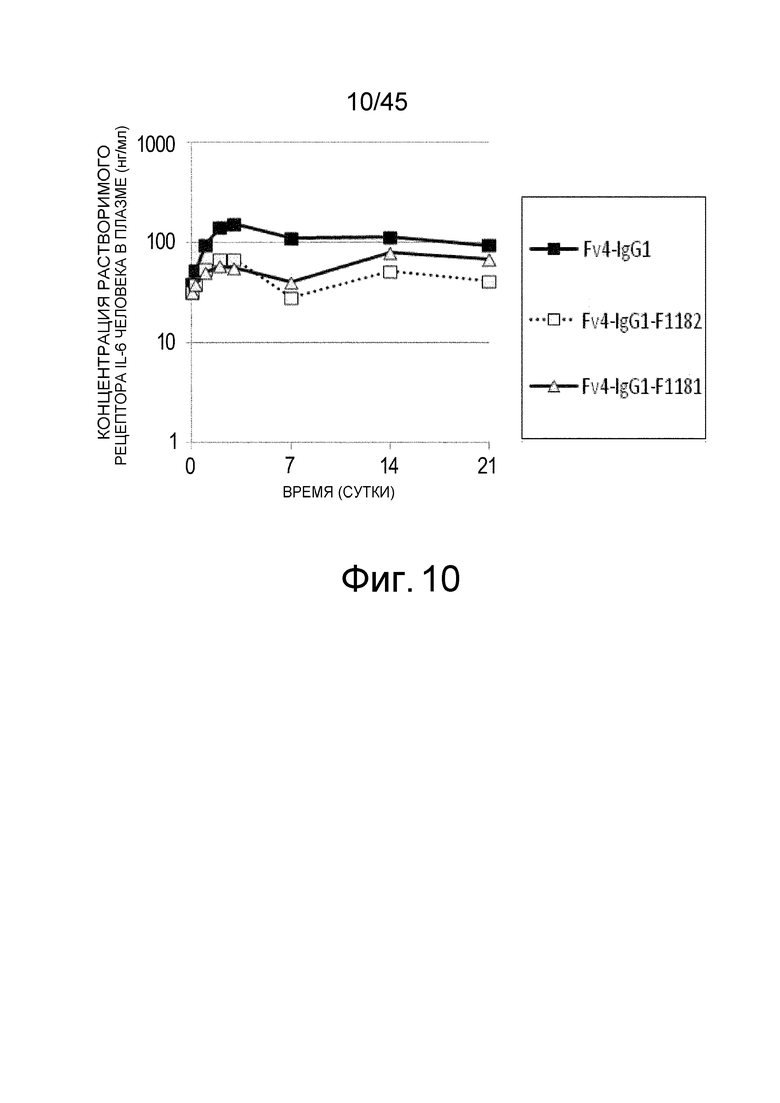
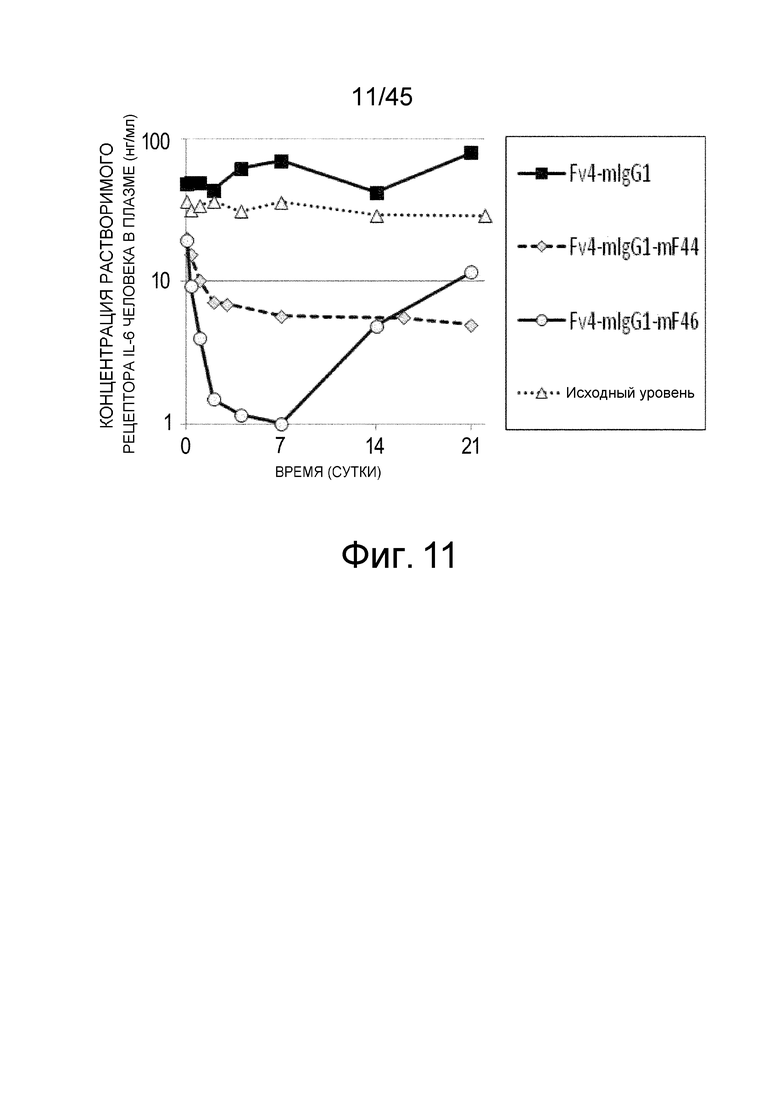
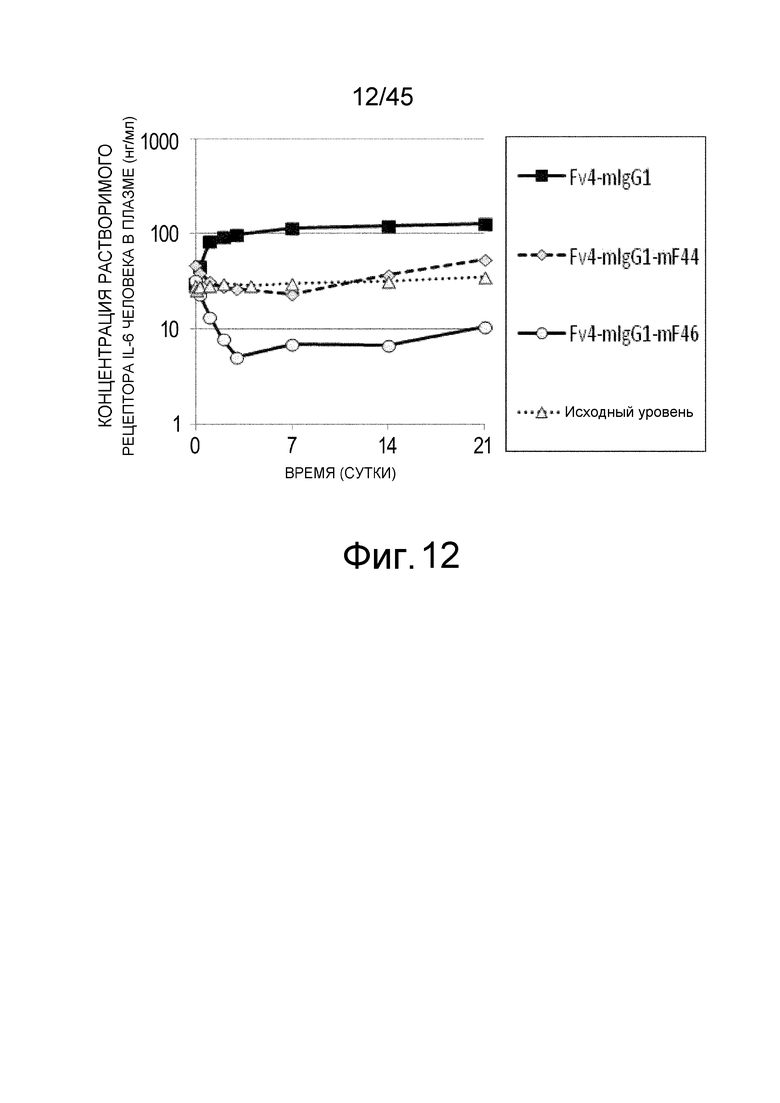
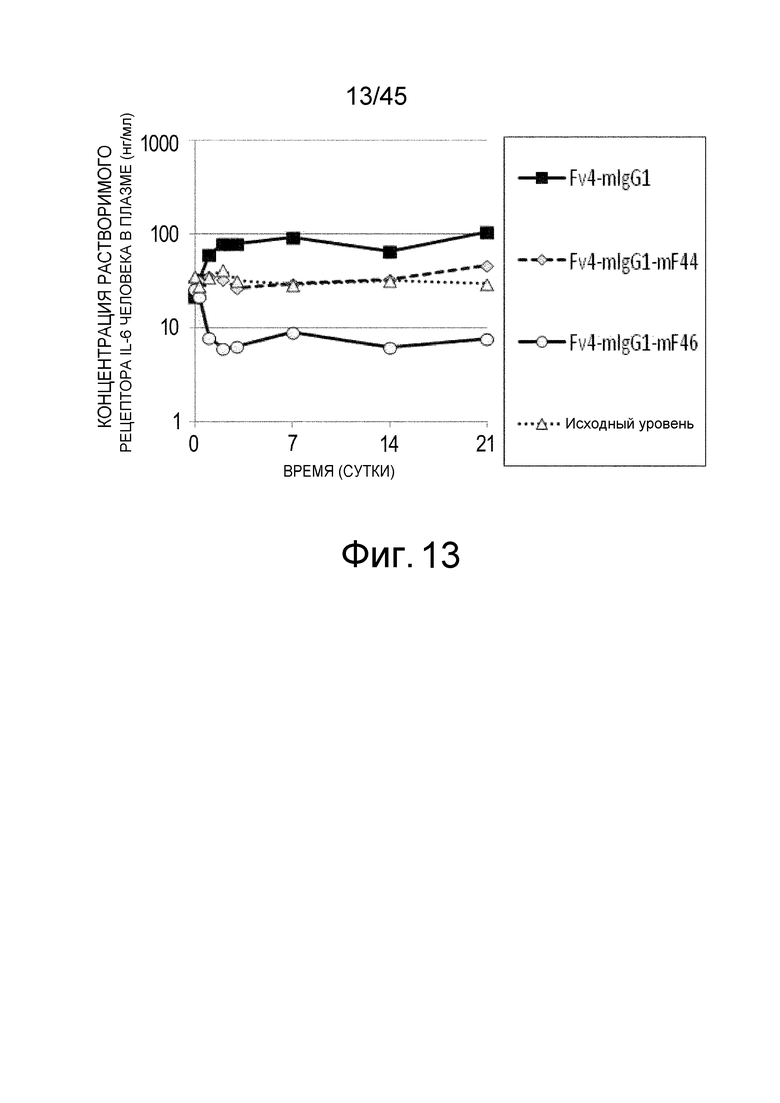
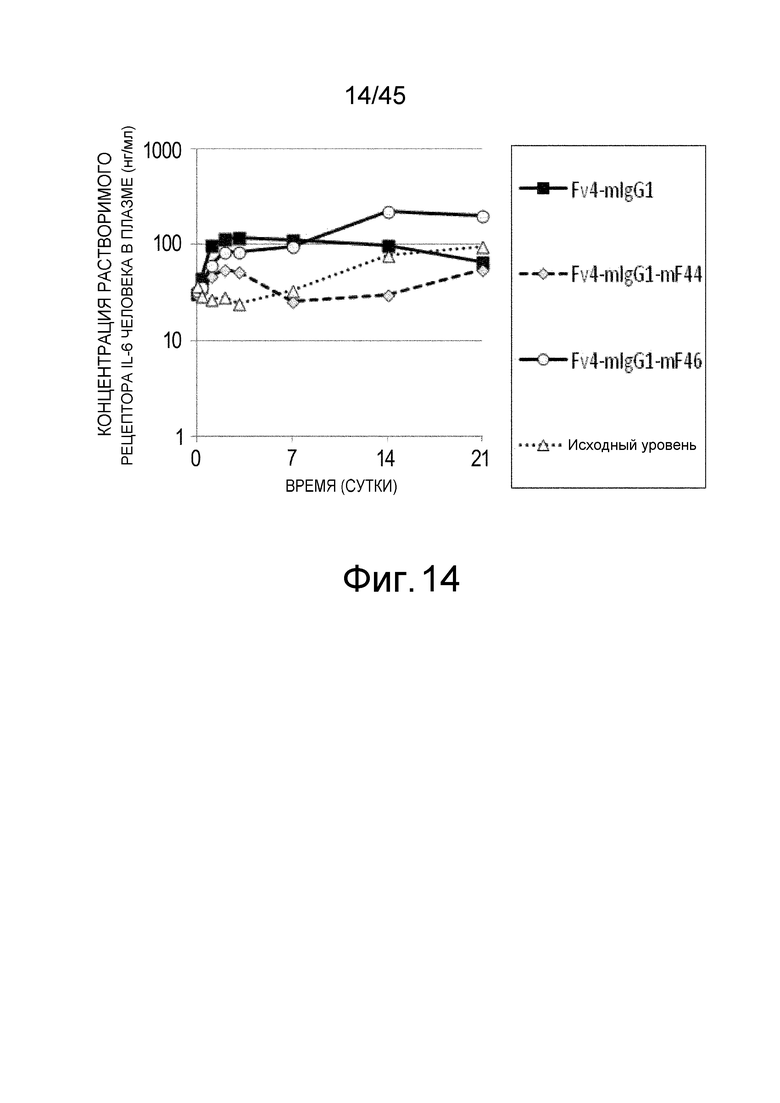
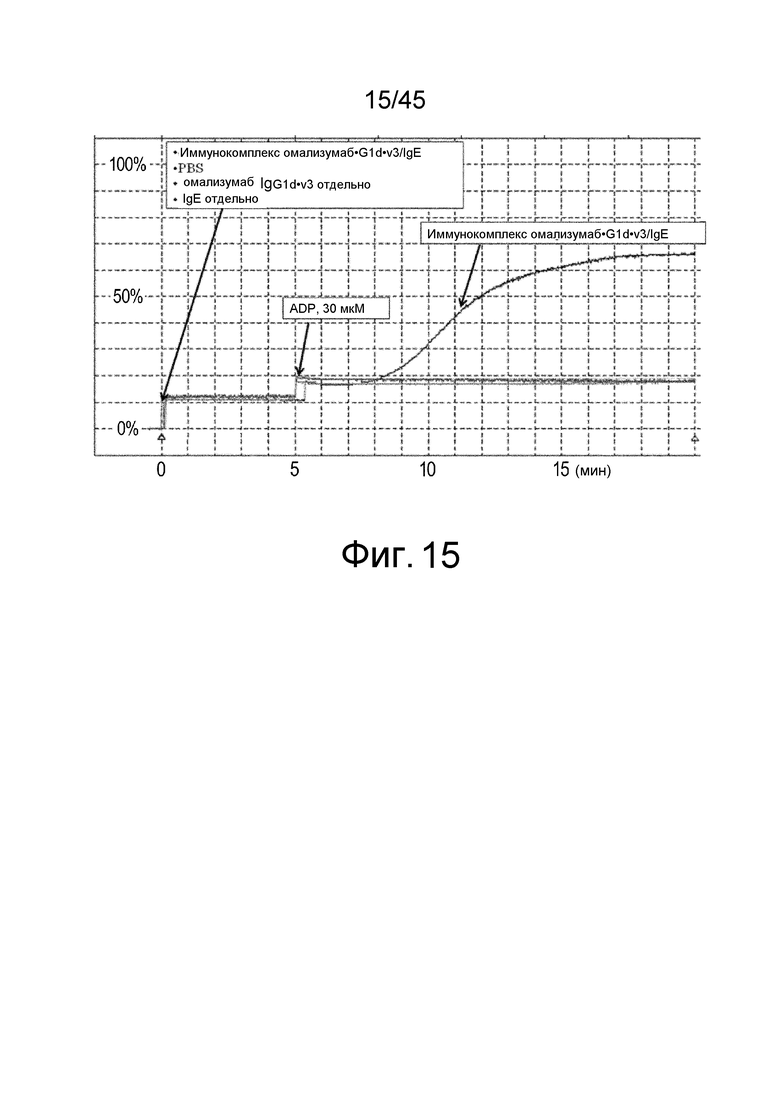
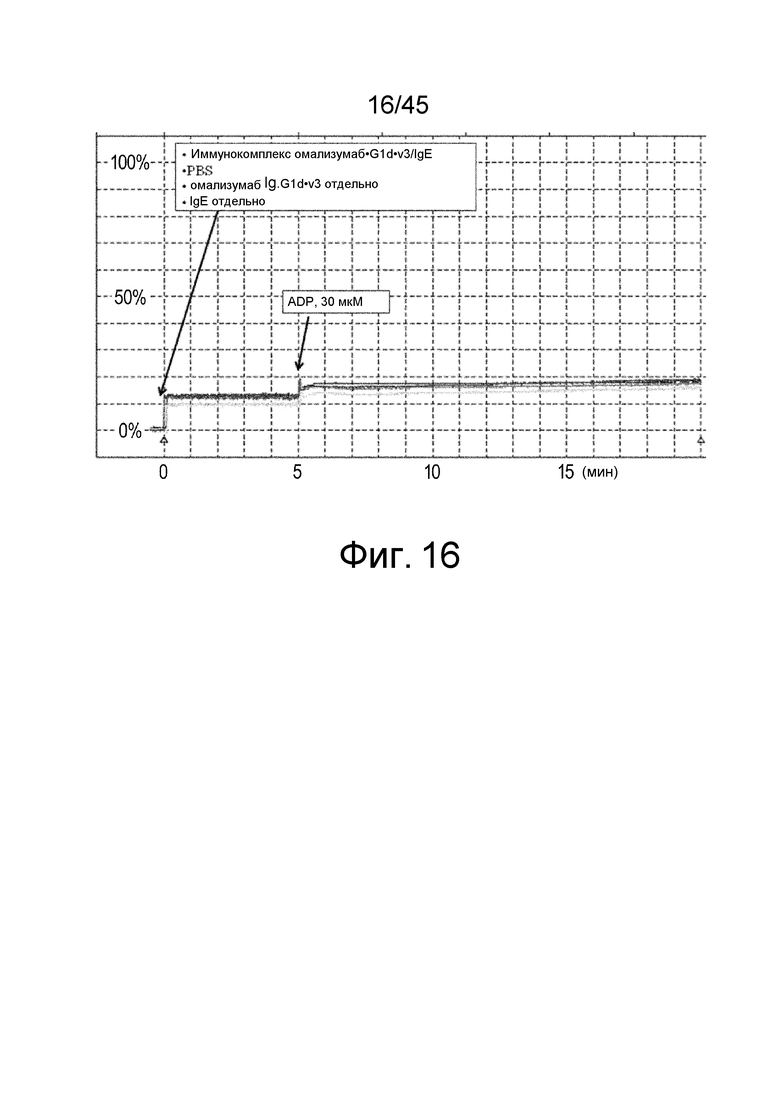
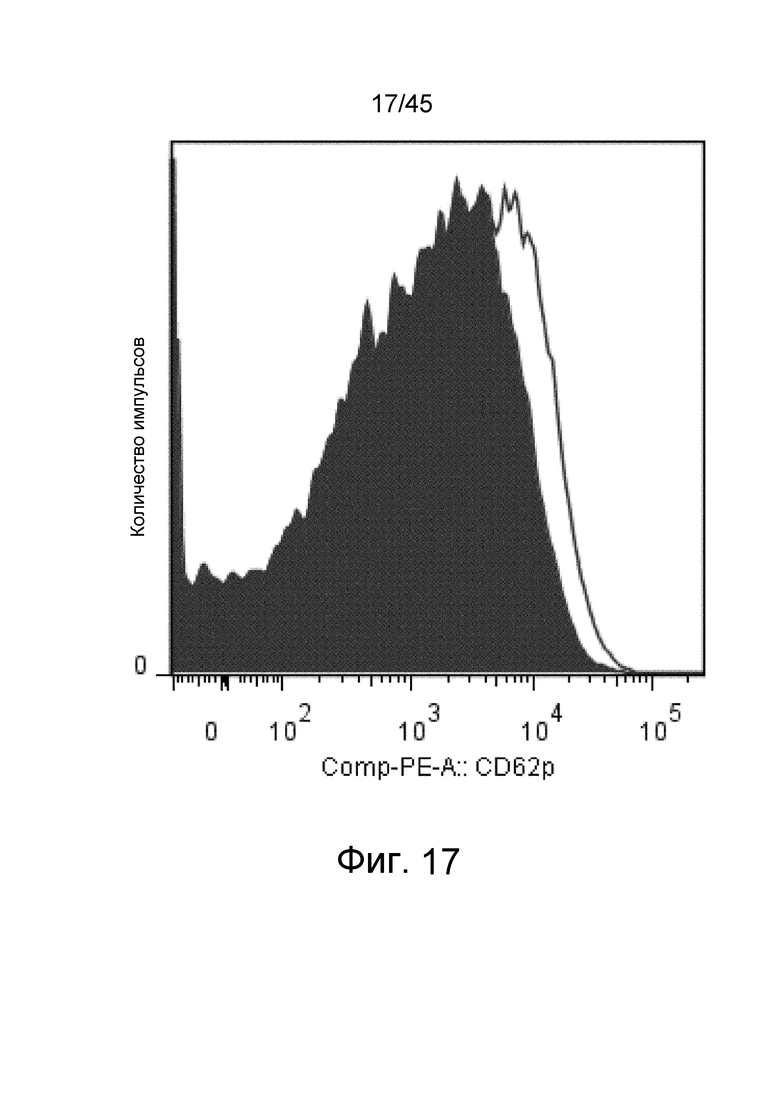
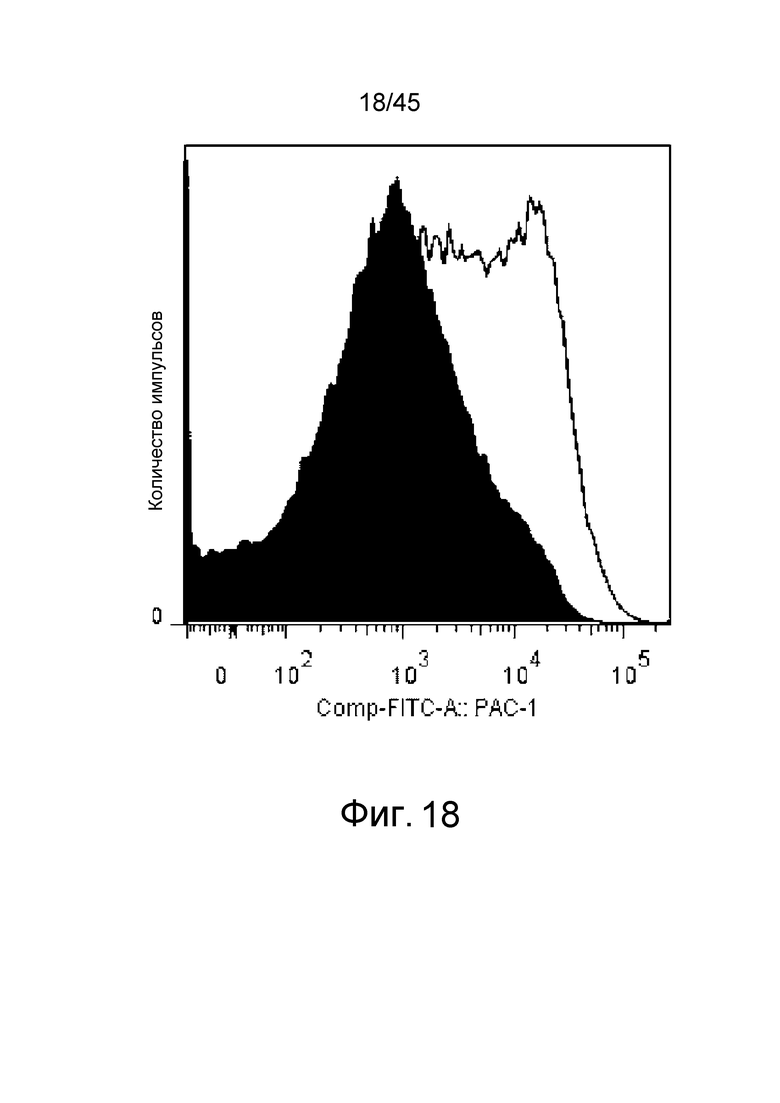
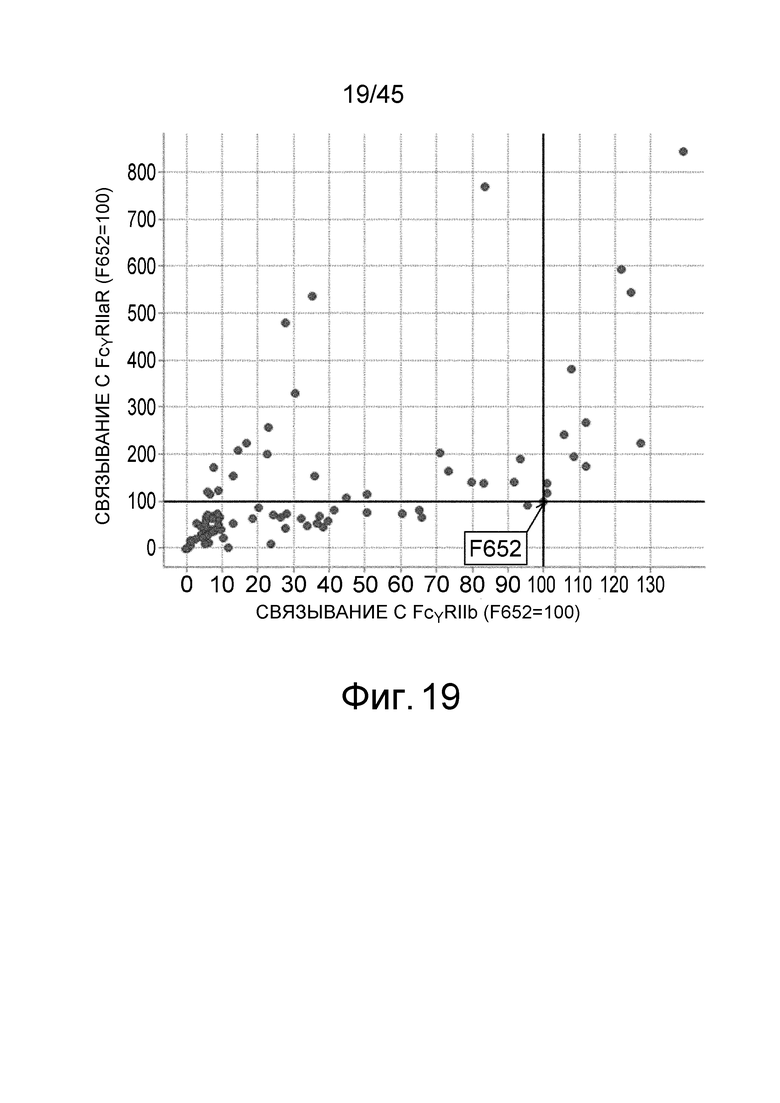
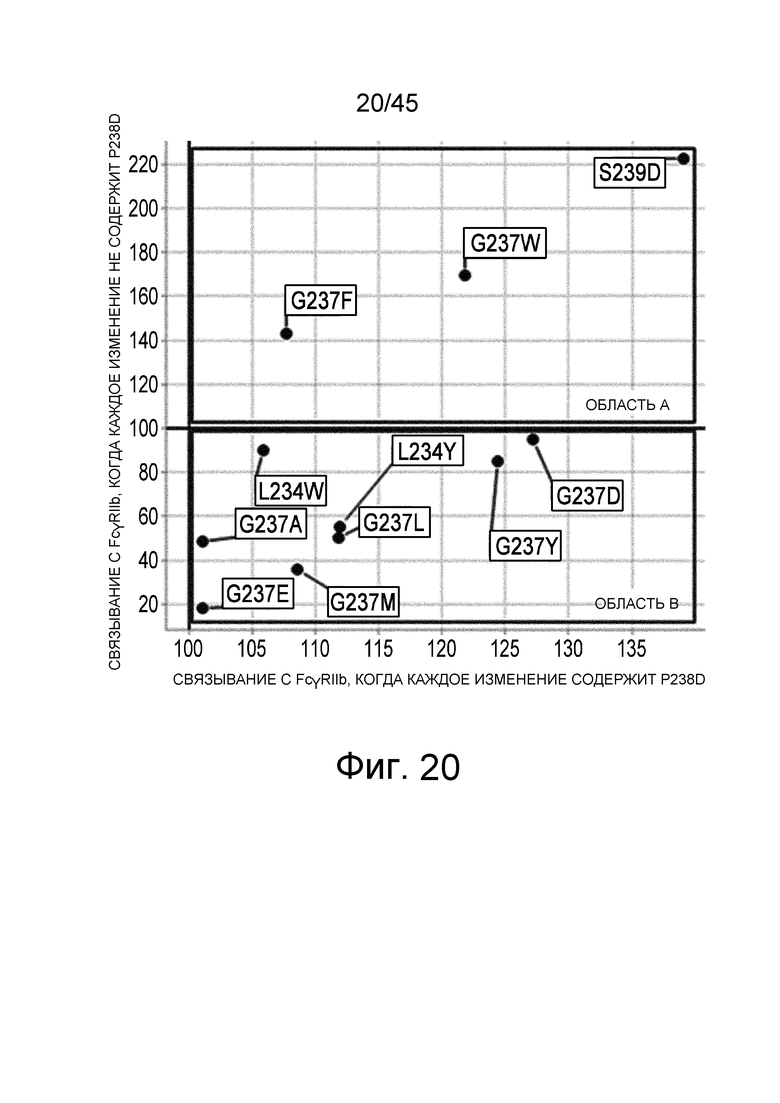




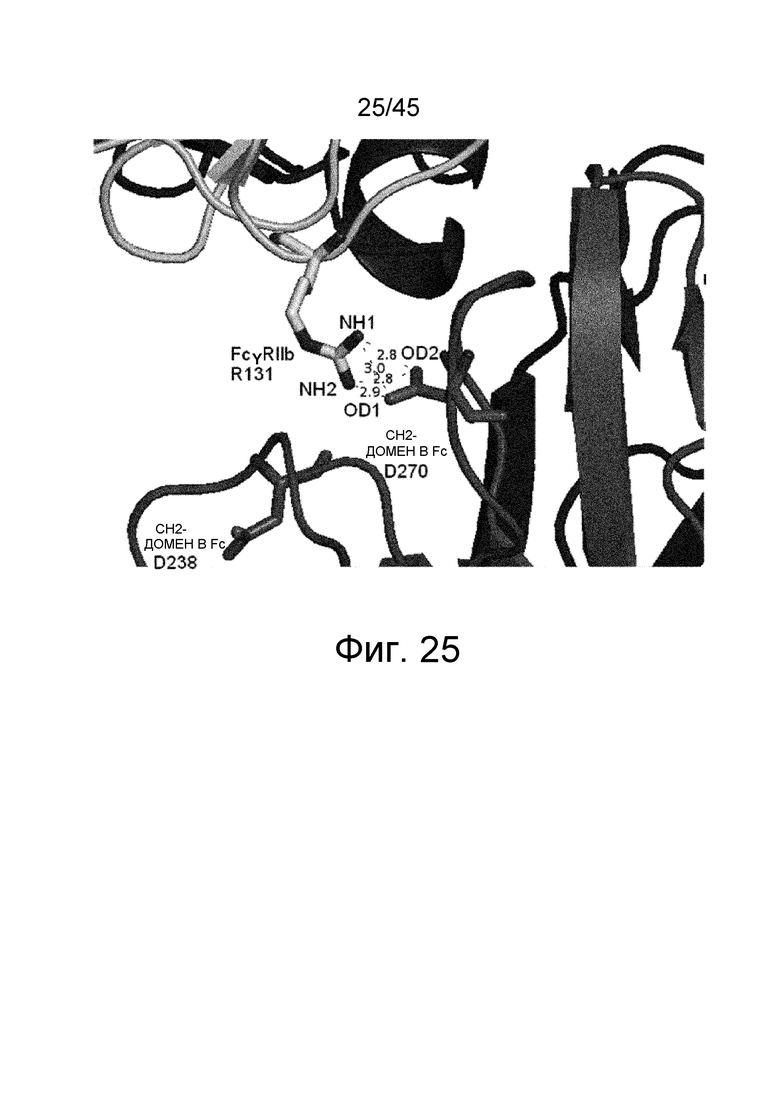
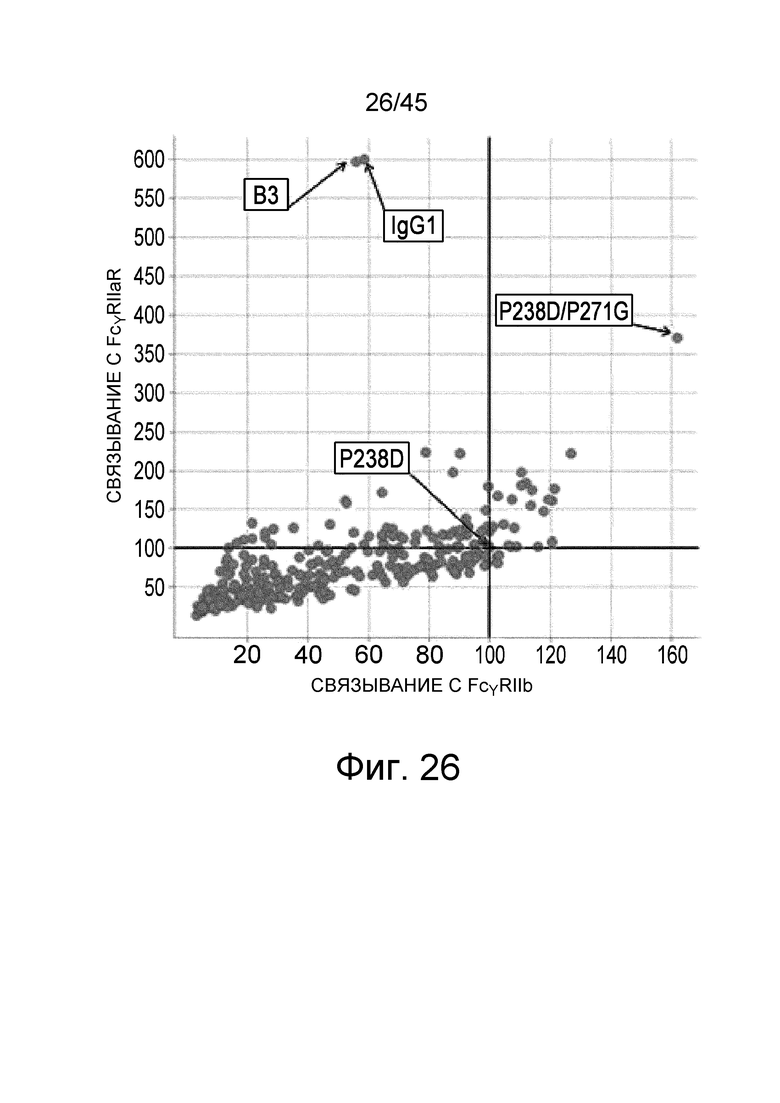
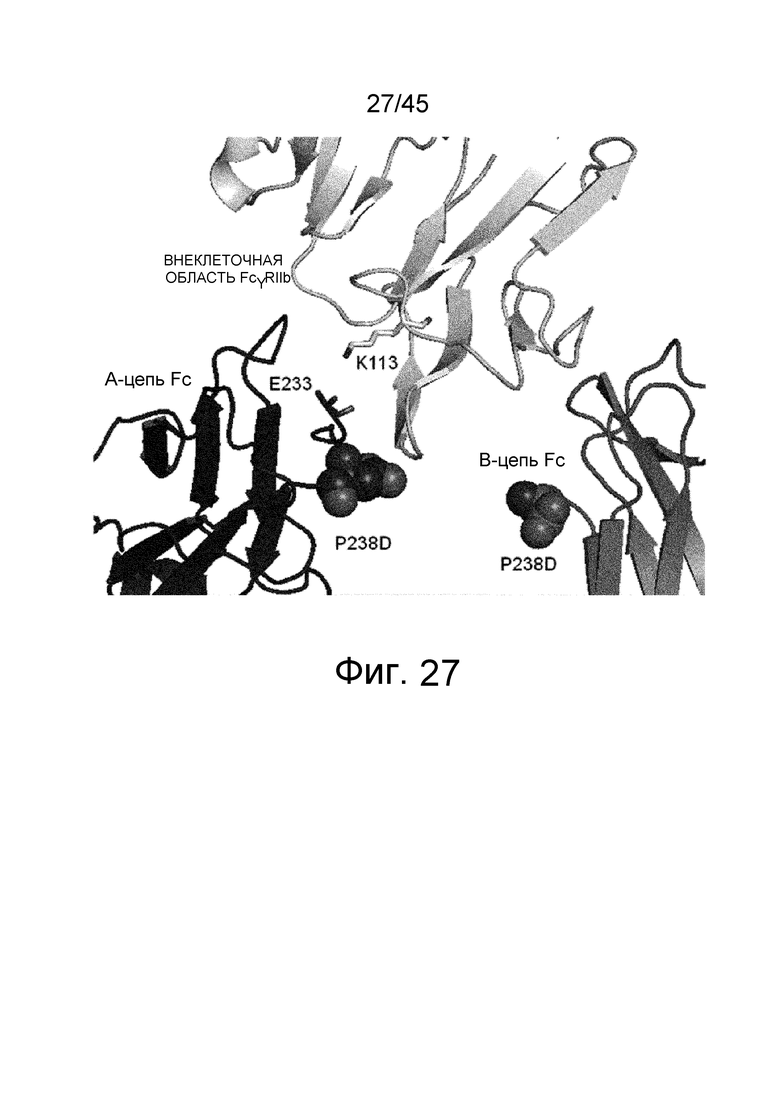
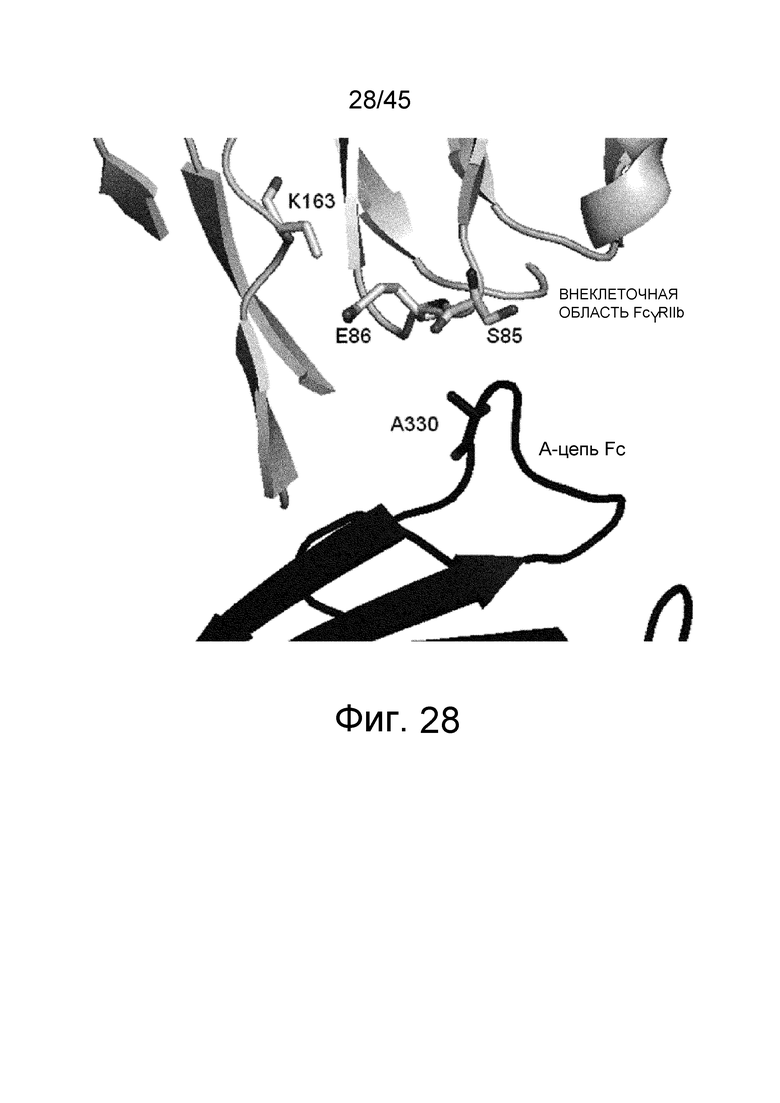
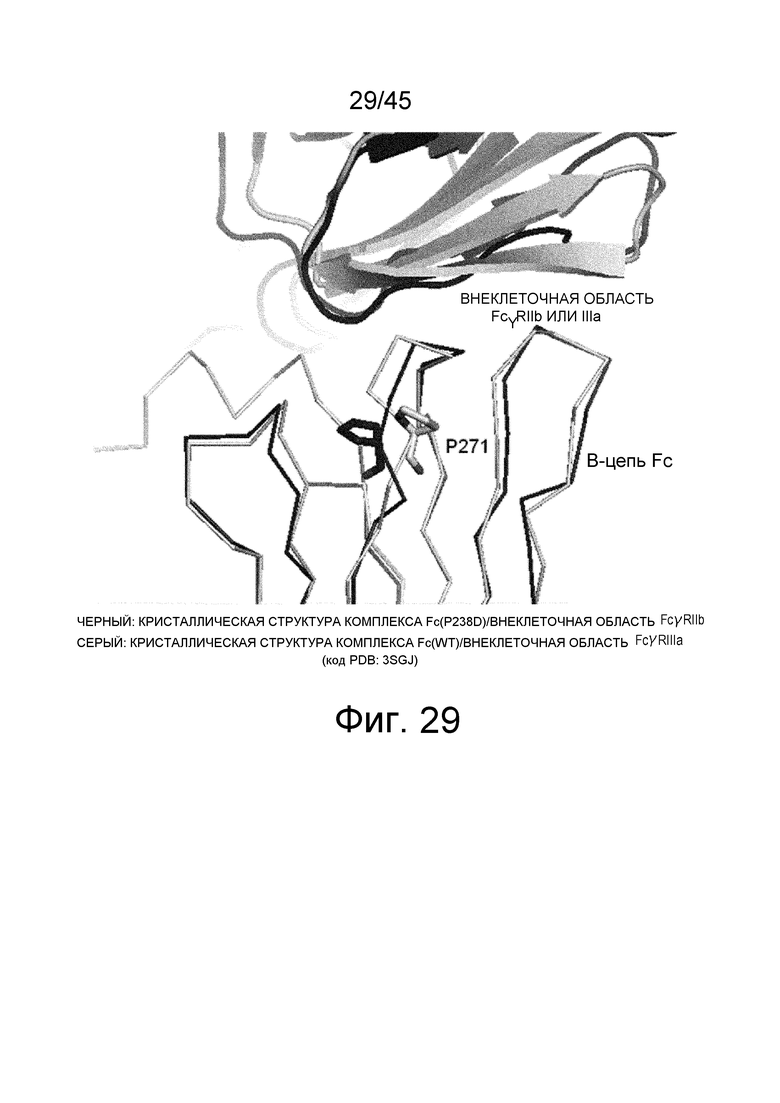
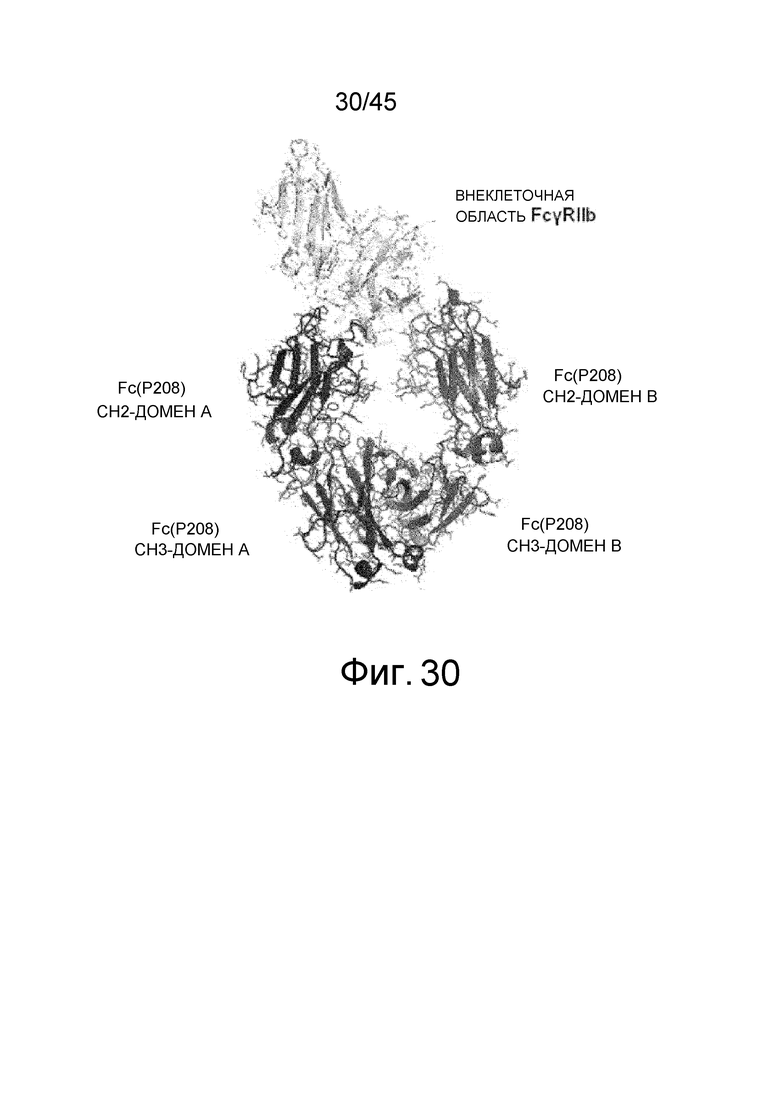
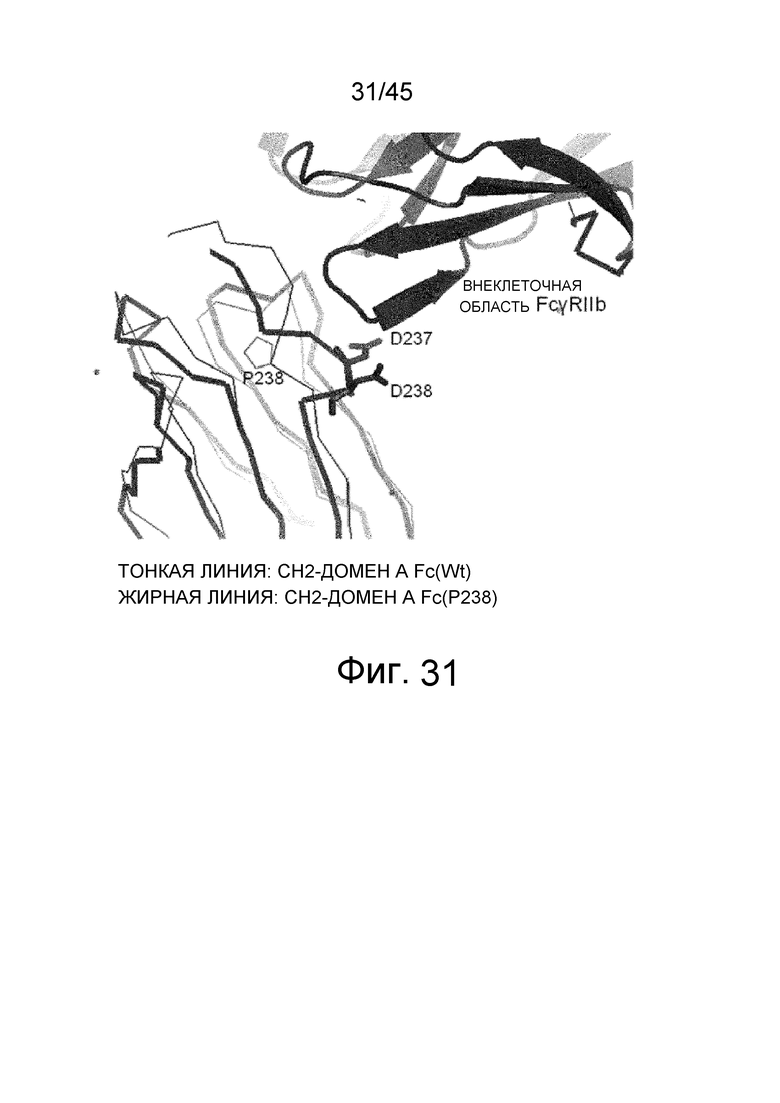

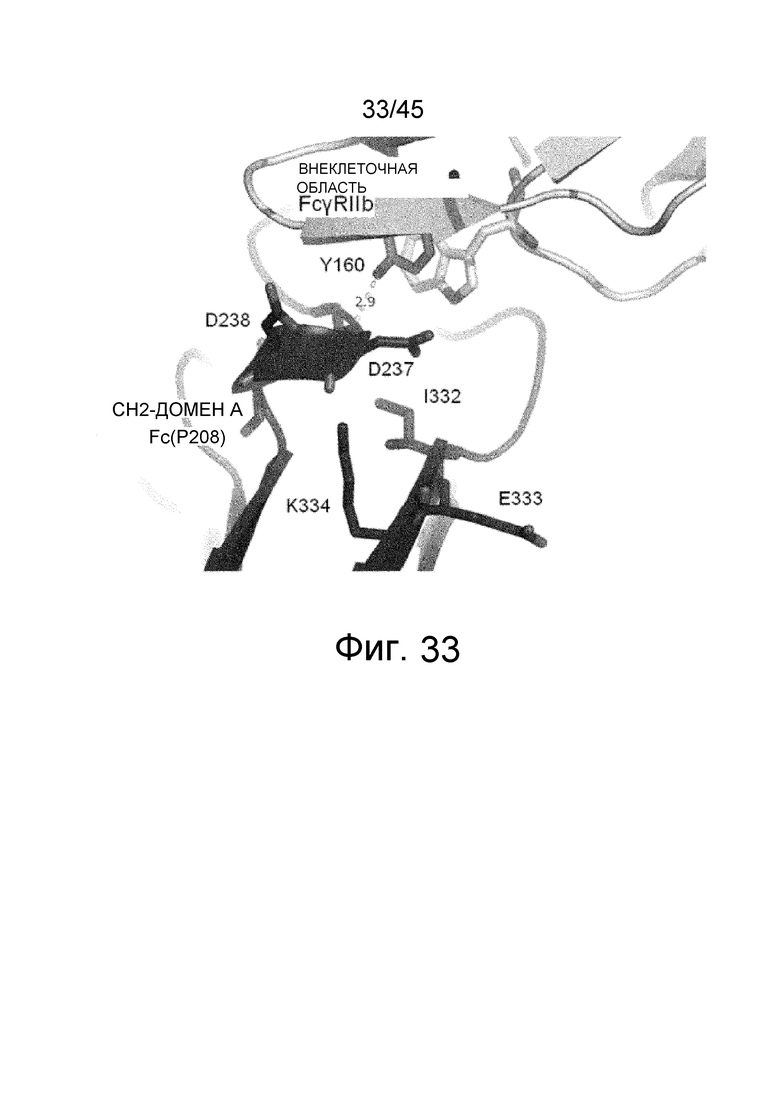

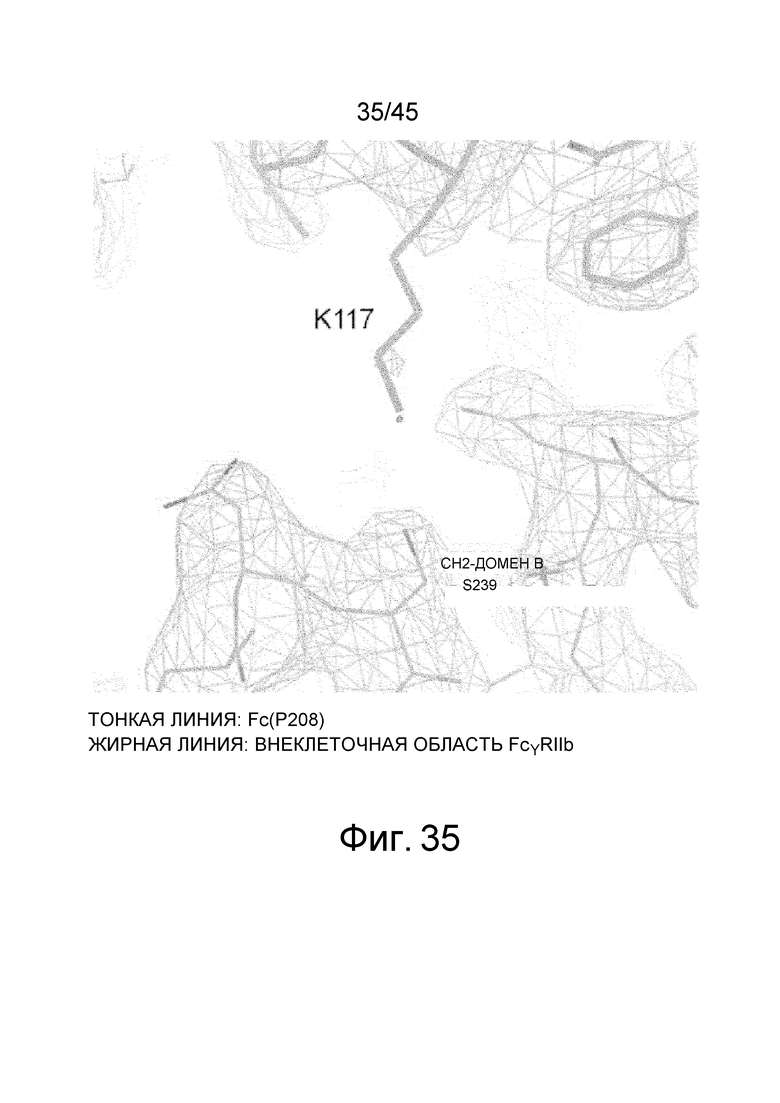

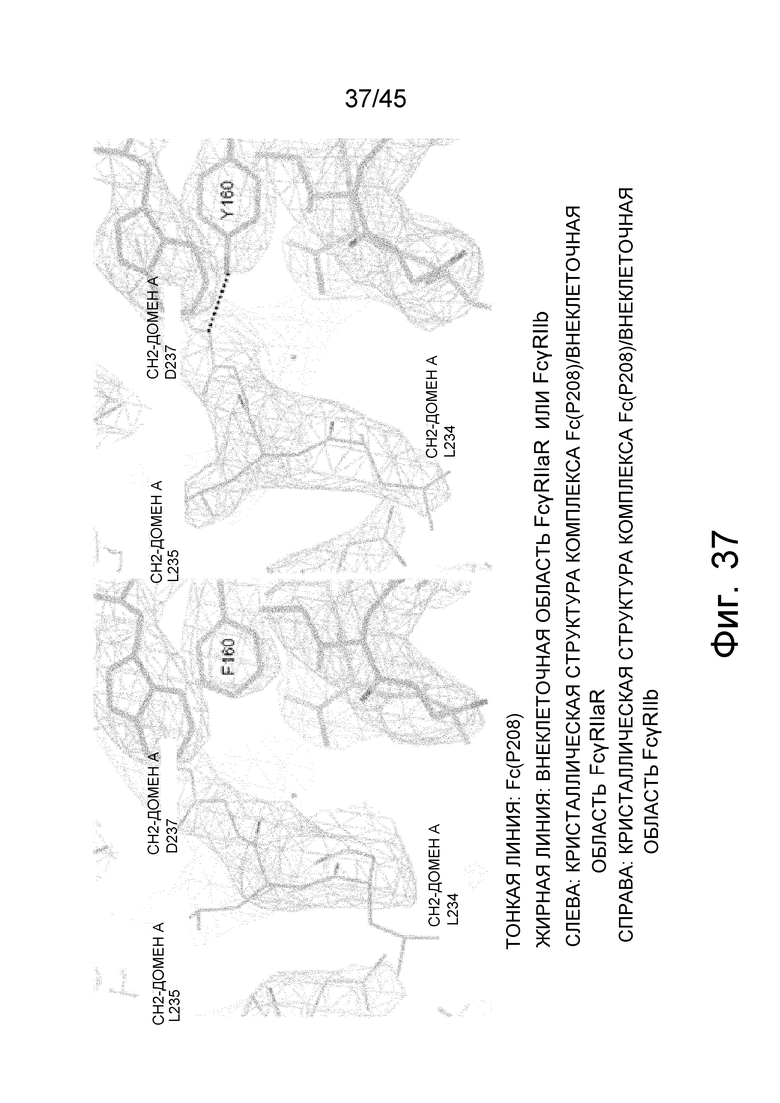

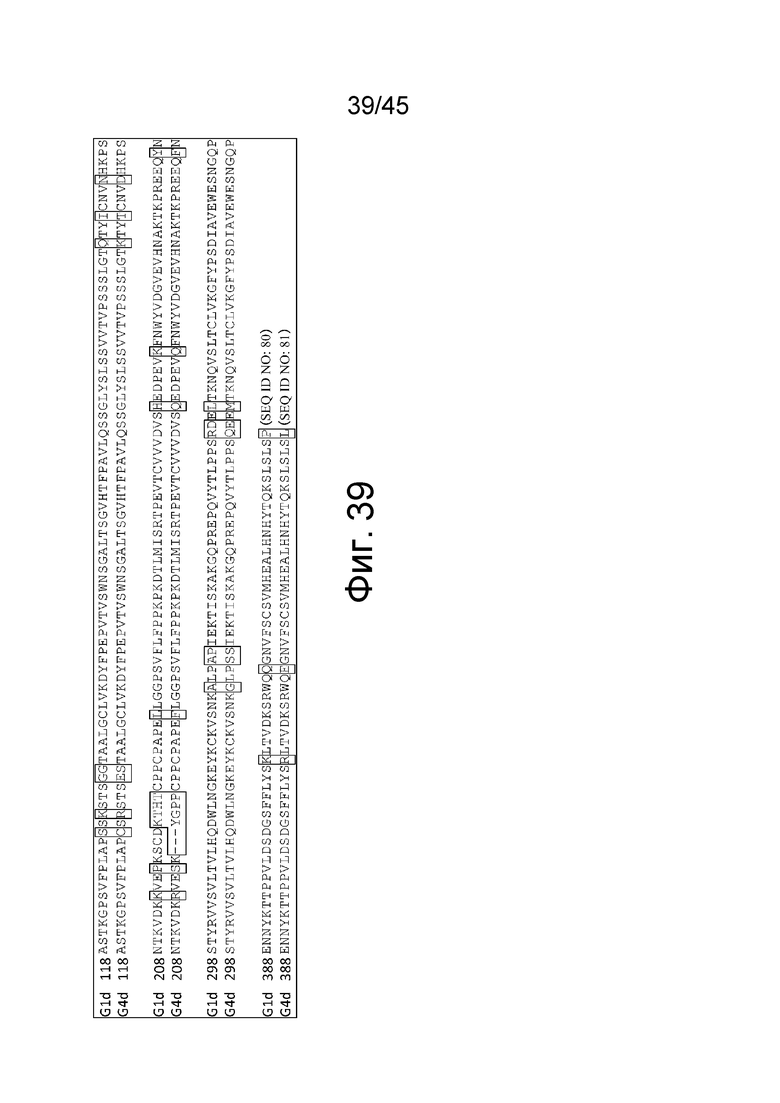
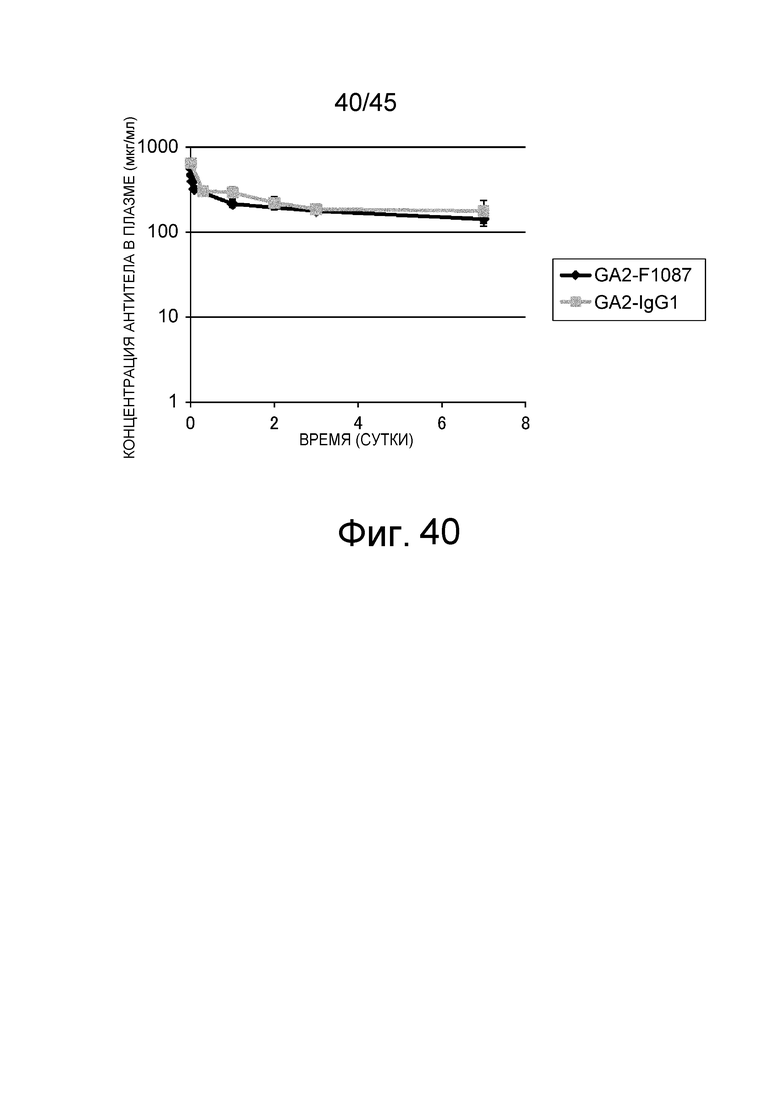
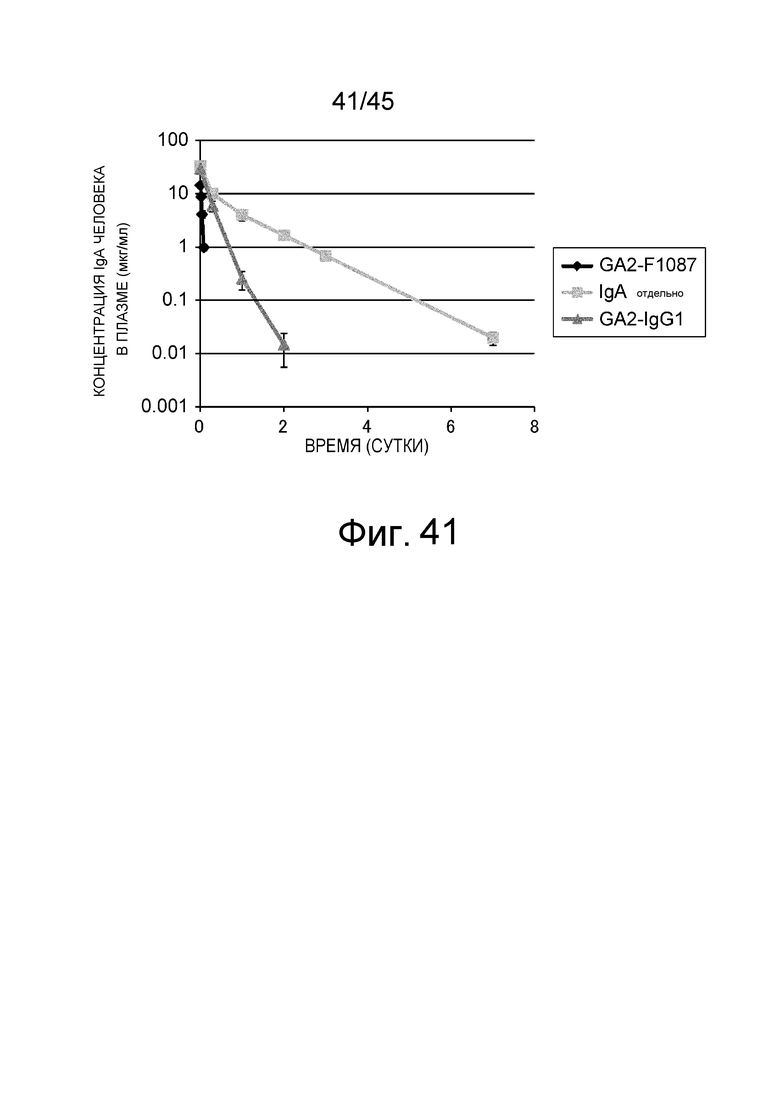
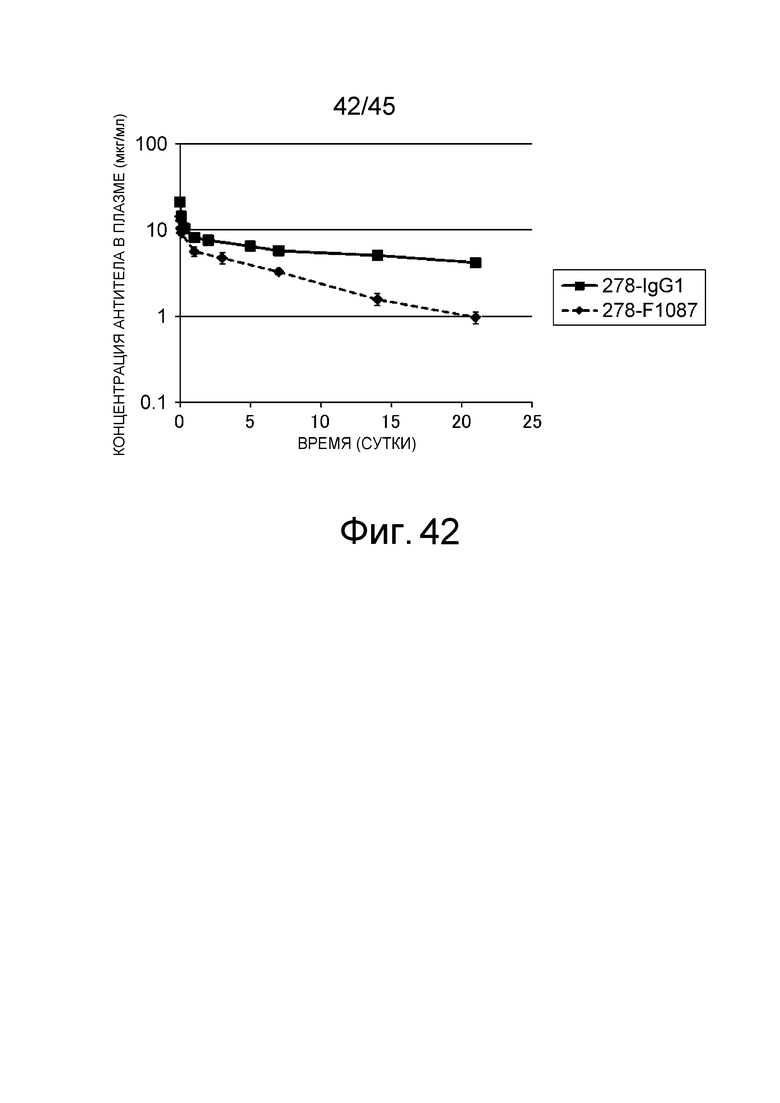
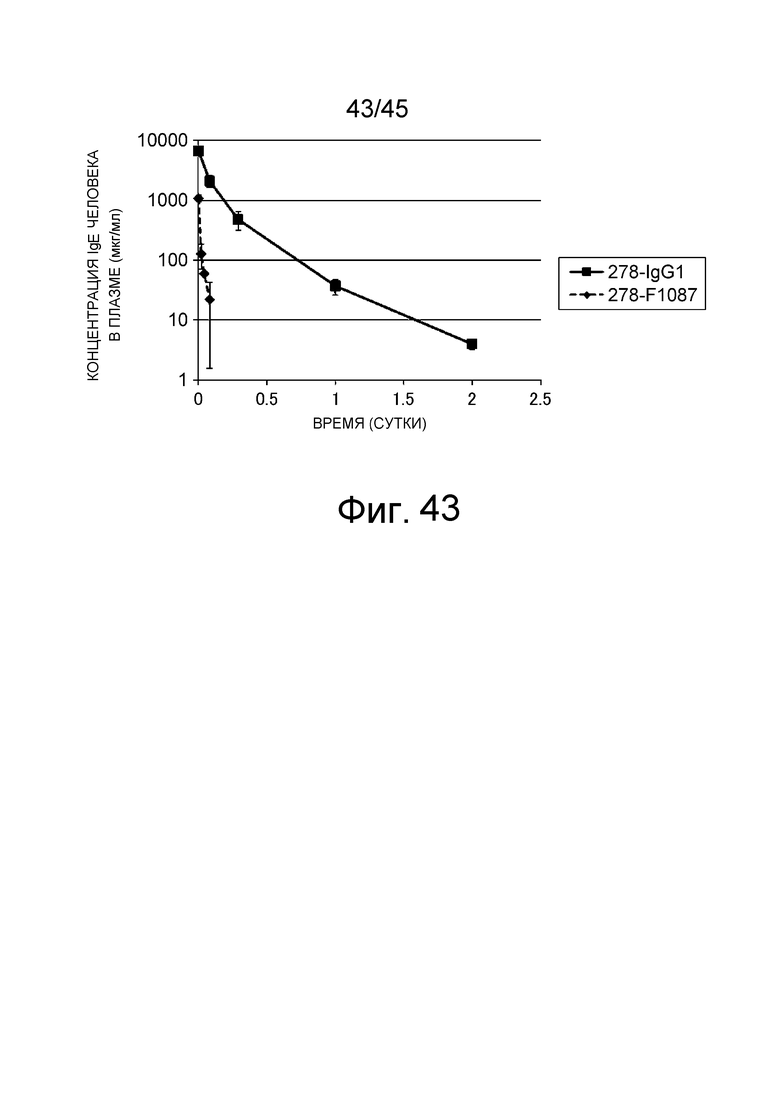

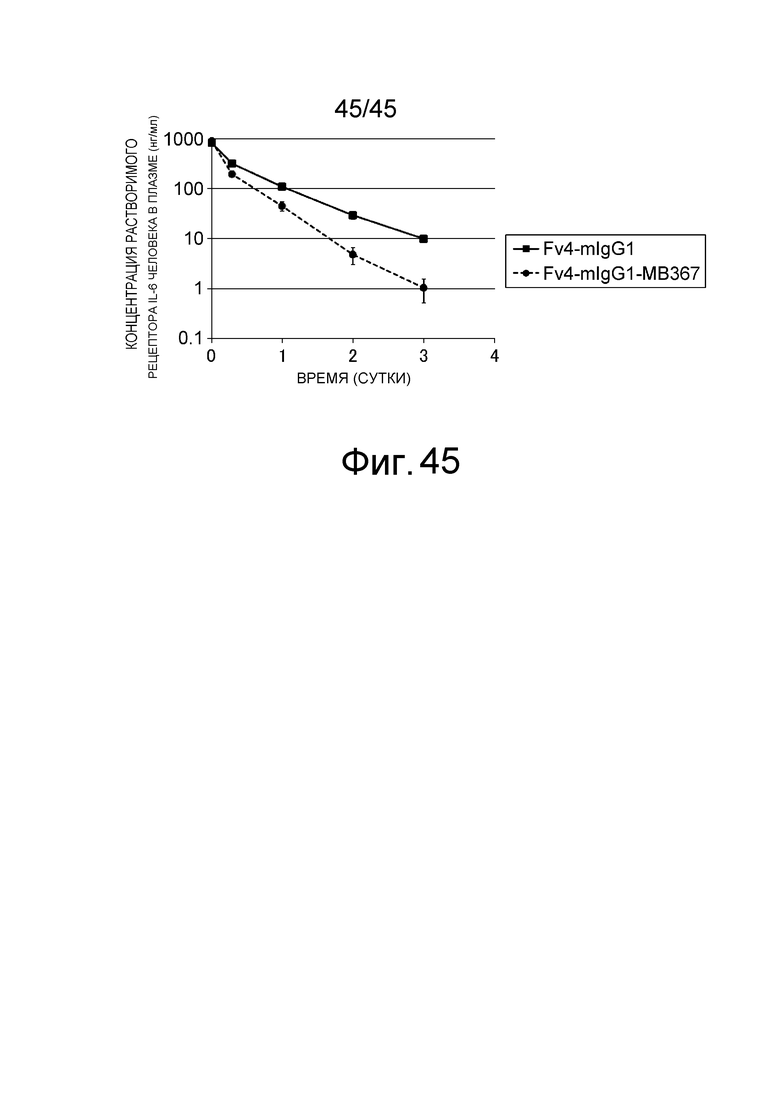
Настоящее изобретение относится к иммунологии. Предложены: антигенсвязывающая молекула, способ ее получения и применение антигенсвязывающей молекулы для элиминации антигена из плазмы. Антигенсвязывающая молекула содержит антигенсвязывающий домен, антигенсвязывающая активность которого варьирует в зависимости от pH, и Fc-область человеческого IgG1, содержащую Asp в положении 238 и Gly в положении 271, что обеспечивает усиленное связывание с FcγRIIb. 3 н. и 8 з.п. ф-лы, 45 ил., 32 табл., 26 пр.
1. Антигенсвязывающая молекула для удаления растворимого антигена из плазмы, которая содержит антигенсвязывающий домен, который представляет собой вариабельную область антитела, специфически связывающуюся с указанным антигеном, и Fc-область человеческого IgG1, содержащую Asp в положении 238 и Gly в положении 271, как указано с помощью нумерации EU, где антигенсвязывающая активность антигенсвязывающего домена, которая изменяется в зависимости от концентрации ионов, определена следующим подпунктом (а):
(а) величина KD (pH 5.8)/KD (pH 7.4), которая представляет собой отношение KD антигена в кислом диапазоне pH к KD в нейтральном диапазоне pH, равна 2 или более.
2. Антигенсвязывающая молекула по п. 1, где Fc-область содержит аминокислотную замену по меньшей мере в одном или более положениях, выбранных из группы, состоящей из 233, 234, 237, 264, 265, 266, 267, 268, 269, 272, 274, 296, 326, 327, 330, 331, 332, 333, 355, 356, 358, 396, 409 и 419, как указано с помощью нумерации EU.
3. Антигенсвязывающая молекула по п. 2, где аминокислоты Fc-области включают любую одну или более из следующих аминокислот, указанных с помощью нумерации EU:
Asp в положении аминокислоты 233;
Tyr в положении аминокислоты 234;
Asp в положении аминокислоты 237;
Ile в положении аминокислоты 264;
Glu в положении аминокислоты 265;
любую из Phe, Met и Leu в положении аминокислоты 266;
любую из Ala, Glu, Gly и Gln в положении аминокислоты 267;
любую из Asp, Glu и Gln в положении аминокислоты 268;
Asp в положении аминокислоты 269;
любую из Asp, Phe, Ile, Met, Asn, Pro, и Gln в положении аминокислоты 272;
Gln в положении аминокислоты 274;
Asp или Phe в положении аминокислоты 296;
Ala или Asp в положении аминокислоты 326;
Gly в положении аминокислоты 327;
Lys или Arg в положении аминокислоты 330;
Ser в положении аминокислоты 331;
Thr в положении аминокислоты 332;
любую из Thr, Lys и Arg в положении аминокислоты 333;
Gln в положении аминокислоты 355;
Glu в положении аминокислоты 356;
Met в положении аминокислоты 358;
любую из Asp, Glu, Phe, Ile, Lys, Leu, Met, Gln, Arg и Tyr в положении аминокислоты 396;
Arg в положении аминокислоты 409; и
Glu в положении аминокислоты 419.
4. Антигенсвязывающая молекула по любому из пп. 1-3, где активность связывания с FcRn Fc-области в условиях диапазона кислых значений pH усилена по сравнению с активностью связывания с FcRn Fc-области, включенной в любую из SEQ ID NO: 14, 15, 16 или 17.
5. Антигенсвязывающая молекула по п. 4, где Fc-область с усиленным связыванием представляет собой Fc-область, обладающую аминокислотной заменой по меньшей мере в одном или более положениях, выбранных из группы, состоящей из 244, 245, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 260, 262, 265, 270, 272, 279, 283, 285, 286, 288, 293, 303, 305, 307, 308, 309, 311, 312, 314, 316, 317, 318, 332, 339, 340, 341, 343, 356, 360, 362, 375, 376, 377, 378, 380, 382, 385, 386, 387, 388, 389, 400, 413, 415, 423, 424, 427, 428, 430, 431, 433, 434, 435, 436, 438, 439, 440, 442 и 447, как указано с помощью нумерации EU, в аминокислотной последовательности Fc-области, включенной в любую из SEQ ID NO: 14, 15, 16 или 17.
6. Антигенсвязывающая молекула по п. 5, где Fc-область с усиленным связыванием содержит по меньшей мере одну или более аминокислот, выбранных из группы, состоящей из:
Leu в положении аминокислоты 244;
Arg в положении аминокислоты 245;
Pro в положении аминокислоты 249;
Gln или Glu в положении аминокислоты 250;
любую из Arg, Asp, Glu и Leu в положении аминокислоты 251;
любую из Phe, Ser, Thr и Tyr в положении аминокислоты 252;
Ser или Thr в положении аминокислоты 254;
любую из Arg, Gly, Ile и Leu в положении аминокислоты 255;
любую из Ala, Arg, Asn, Asp, Gln, Glu, Pro и Thr в положении аминокислоты 256;
любую из Ala, Ile, Met, Asn, Ser и Val в положении аминокислоты 257;
Asp в положении аминокислоты 258;
Ser в положении аминокислоты 260;
Leu в положении аминокислоты 262;
Lys в положении аминокислоты 270;
Leu или Arg в положении аминокислоты 272;
любую из Ala, Asp, Gly, His, Met, Asn, Gln, Arg, Ser, Thr, Trp и Tyr в положении аминокислоты 279;
любую из Ala, Asp, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr, Trp и Tyr в положении аминокислоты 283;
Asn в положении аминокислоты 285;
Phe в положении аминокислоты 286;
Asn или Pro в положении аминокислоты 288;
Val в положении аминокислоты 293;
любую из Ala, Glu, Gln и Met в положении аминокислоты 307;
любую из Ile, Pro и Thr в положении аминокислоты 308;
Pro в положении аминокислоты 309;
любую из Ala, Glu, Ile, Lys, Leu, Met, Ser, Val и Trp в положении аминокислоты 311;
любую из Ala, Asp и Pro в положении аминокислоты 312;
Ala или Leu в положении аминокислоты 314;
Lys в положении аминокислоты 316;
Pro в положении аминокислоты 317;
Asn или Thr в положении аминокислоты 318;
любую из Phe, His, Lys, Leu, Met, Arg, Ser и Trp в положении аминокислоты 332;
любую из Asn, Thr и Trp в положении аминокислоты 339;
Pro в положении аминокислоты 341;
любую из Glu, His, Lys, Gln, Arg, Thr и Tyr в положении аминокислоты 343;
Arg в положении аминокислоты 375;
любую из Gly, Ile, Met, Pro, Thr и Val в положении аминокислоты 376;
Lys в положении аминокислоты 377;
любую из Asp, Asn и Val в положении аминокислоты 378;
любую из Ala, Asn, Ser и Thr в положении аминокислоты 380;
любую из Phe, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr, Val, Trp и Tyr в положении аминокислоты 382;
любую из Ala, Arg, Asp, Gly, His, Lys, Ser и Thr в положении аминокислоты 385;
любую из Arg, Asp, Ile, Lys, Met, Pro, Ser и Thr в положении аминокислоты 386;
любую из Ala, Arg, His, Pro, Ser и Thr в положении аминокислоты 387;
любую из Asn, Pro и Ser в положении аминокислоты 389;
Asn в положении аминокислоты 423;
Asn в положении аминокислоты 427;
любую из Leu, Met, Phe, Ser и Thr в положении аминокислоты 428;
любую из Ala, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr, Val и Tyr в положении аминокислоты 430;
His или Asn в положении аминокислоты 431;
любую из Arg, Gln, His, Ile, Lys, Pro и Ser в положении аминокислоты 433;
любую из Ala, Gly, His, Phe, Ser, Trp и Tyr в положении аминокислоты 434;
любую из Arg, Asn, His, Ile, Leu, Lys, Met и Thr в положении аминокислоты 436;
любую из Lys, Leu, Thr и Trp в положении аминокислоты 438;
Lys в положении аминокислоты 440; и
Lys в положении аминокислоты 442,
как указано с помощью нумерации EU, в аминокислотной последовательности Fc-области, включенной в любую из SEQ ID NO: 14, 15, 16 или 17.
7. Антигенсвязывающая молекула по любому из пп. 1-6, где антигенсвязывающая молекула представляет собой антитело.
8. Способ получения антигенсвязывающей молекулы по любому из пп. 1-7, включающий стадии (а)-(е), представленные ниже:
(a) получение антигенсвязывающего домена, который представляет собой вариабельную область антитела, специфически связывающуюся с указанным антигеном, где антигенсвязывающая активность антигенсвязывающего домена, которая изменяется в зависимости от концентрации ионов, определена следующим подпунктом (i):
(i) величина KD (pH 5.8)/KD (pH 7.4), которая представляет собой отношение KD антигена в кислом диапазоне pH к KD в нейтральном диапазоне pH, равна 2 или более;
(b) получение гена, кодирующего антигенсвязывающий домен, выбранный на стадии (а);
(c) функциональное связывание гена, полученного на стадии (Ь), с геном, кодирующим Fc-область человеческого IgGl, содержащую Asp в положении 238 и Gly в положении 271, как указано с помощью нумерации EU;
(d) культивирование клеток-хозяев, содержащих ген, функционально связанный на стадии (с); и
(e) выделение антигенсвязывающей молекулы из культурального раствора, полученного на стадии (d).
9. Способ получения по п. 8, где Fc-область имеет аминокислотную замену по меньшей мере в одном или более положениях, выбранных из группы, состоящей из 233, 234, 237, 264, 265, 266, 267, 268, 269, 272, 274, 296, 326, 327, 330, 331, 332, 333, 355, 356, 358, 396, 409 и 419, как указано с помощью нумерации EU.
10. Способ получения по п. 9, где аминокислоты Fc-области включают любую одну или более из следующих аминокислот, указанных с помощью нумерации EU:
Asp в положении аминокислоты 233;
Tyr в положении аминокислоты 234;
Asp в положении аминокислоты 237;
Ile в положении аминокислоты 264;
Glu в положении аминокислоты 265;
любую из Phe, Met и Leu в положении аминокислоты 266;
любую из Ala, Glu, Gly и Gln в положении аминокислоты 267;
любую из Asp, Glu и Gln в положении аминокислоты 268;
Asp в положении аминокислоты 269;
любую из Asp, Phe, Ile, Met, Asn, Pro и Gln в положении аминокислоты 272;
Gln в положении аминокислоты 274;
Asp или Phe в положении аминокислоты 296;
Ala или Asp в положении аминокислоты 326;
Gly в положении аминокислоты 327;
Lys или Arg в положении аминокислоты 330;
Ser в положении аминокислоты 331;
Thr в положении аминокислоты 332;
любую из Thr, Lys и Arg в положении аминокислоты 333;
Gln в положении аминокислоты 355;
Glu в положении аминокислоты 356;
Met в положении аминокислоты 358;
любую из Asp, Glu, Phe, Ile, Lys, Leu, Met, Gln, Arg и Tyr в положении аминокислоты 396;
Arg в положении аминокислоты 409; и
Glu в положении аминокислоты 419.
11. Применение антигенсвязывающей молекулы по любому из пп. 1-7 для элиминации антигена из плазмы.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| ROBERTO REVERBERI, LORENZO REVERBERI, "Factors affecting the antigen-antibody reaction", Blood Transfusion, 2007, 5(4): 227-240 | |||
| МАЙОНЕЗ ВЫСОКОКАЛОРИЙНЫЙ | 2009 |
|
RU2409990C1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| IGAWA TOMOYUKI et al | |||
| "Antibody recycling by engineered pH-dependent antigen binding improves the duration of antigen | |||
Авторы
Даты
2020-11-16—Публикация
2013-02-22—Подача