Изобретение относится к области биотехнологии и медицины, а конкретно, к получению новых аптамеров, узнающих EGFR и EGFR vIII и содержащих химически модифицированные нуклеотиды с производным пирена, которые могут использоваться для узнавания рекомбинантных белков рецептора эпидермального фактора роста (EGFR) и его мутантной формы (EGFR vIII).
Аптамеры (от латинского Aptus - «соответствовать» и греческого Meros - «единица повтора») - короткие синтетические фрагменты нуклеиновых кислот (олигонуклеотиды) со сложной пространственной структурой, которая определяет их уникальные свойства избирательно связываться (как ключ с замком) с любой мишенью: будь то химическое вещество (изотоп, лекарство, токсин и проч.), полимеры (ферменты, рецепторы, факторы роста, регуляторные и структурные белки, иммуноглобулины и проч.), супрамолекулярные комплексы (например, вирусы), целые клетки (болезнетворные бактерии, злокачественные и другие дефектные клетки).
Разрабатываемые нами аптамеры к EGFR, в частности объект патентирования - модифицированные ДНК аптамеры GR200-Pyr-03 и GR200-Pyr-05, связываются с внеклеточным доменом белка.
Важные преимущества аптамеров по сравнению с препаратами белковой и пептидной природы - низкая иммуногенность и возможность при развитии осложнений (например, кровотечений) блокировать их активность специфическими антидотами на основе олигонуклеотидов, комплементарных лекарственному аптамеру. Кроме того, возможность химического синтеза аптамеров позволяет добиваться высокой степени чистоты препарата, воспроизводимости партий и масштабируемости производства.
В патенте US 9316647 B2 (приоритет от 30.12.2011 года) описан аптамер к свободному EGFR, включающий следующую последовательность XGANNGNNYGANNCNN (SEQ ID NO: 55). Недостатком данного аптамера может оказаться существенное количество модификаций, которые могут отразиться на стабильности структуры в целом. Кроме того, нет данных о сродстве аптамера к мутантным формам EGFR.
В еще одном патенте US 9125930 B2 (приоритет от 12.10.2010 года) описывается аптамер к EGFR, включающий следующую последовательность 5'GCCUUAGUAACGUGCUUUGAUGUCGAUUCGACAGGAGGC 3' (SEQ ID NO: 1). Недостатком является то, что данный аптамер является РНК аптамером, что сопряжено с определенными трудностями, молекулы РНК легко деградируют под воздействием разнообразных факторов, таких, как РНКазы, высокая температура, щелочная среда и т.д., что в конечном итоге может существенно сказаться на эффективности препарата.
Ближайшим аналогом изобретения является аптамер GR20, характеризующийся нуклеотидной последовательностью общей формулы 5'-ACGCACCATTTGTTTAATATGTTTTTTAATTCCCCTTGTGGTGTGT-3'.
Задачей настоящего изобретения является создание высокоэффективных лигандов к EGFR, содержащих химически модифицированные производным пирена нуклеотиды, на основе ДНК-аптамера. Для последующего практического применения длина аптамера не должна превышать 50 нуклеотидов, что значительно снижает стоимость и повышает выход при синтезе.
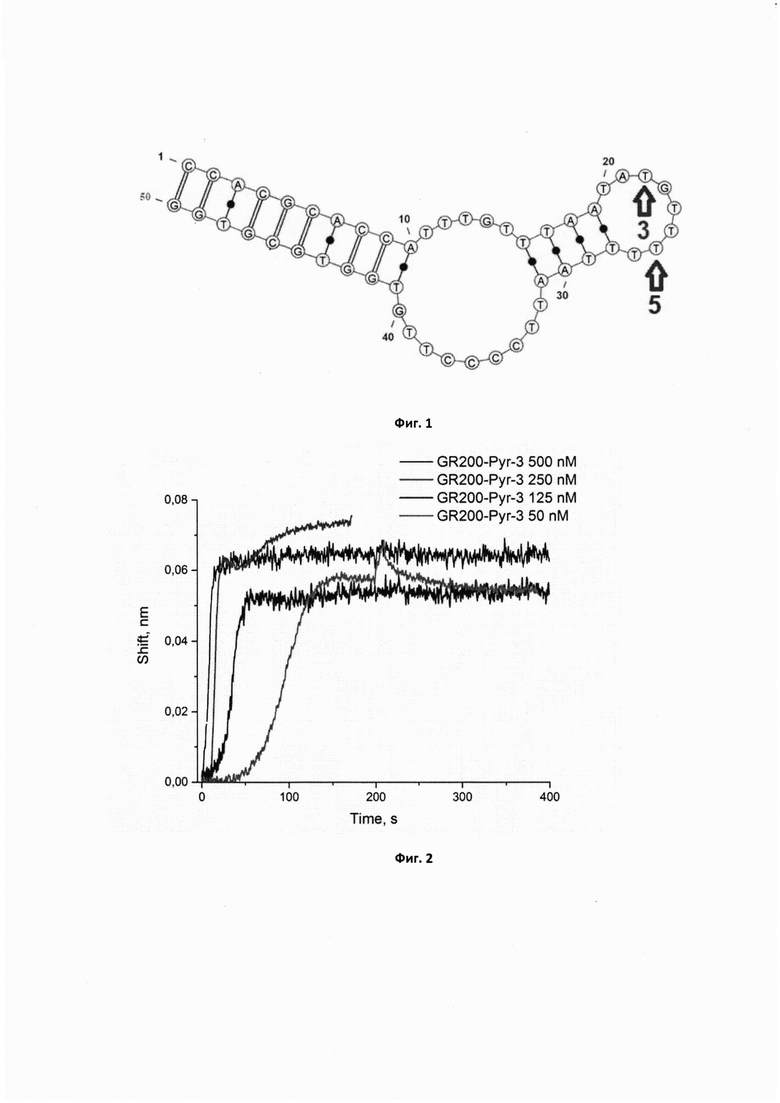
Решение указанной задачи заключается в том, что разработанный ранее в нашей лаборатории аптамерный ДНК олигонуклеотид, характеризующийся нуклеотидной последовательностью общей формулы 5'-CGACGC ACCATTTGTTTAATATGTTTTTTAATTCCCCTTGTGGTGCGTCG-3' (GR200) был химически модифицирован по нуклеотидам в 22 и 26 положениях, заменой одного из тиминов на 5-(1-(пропиламид 4-пиренбутановой кислоты)-4-триазолил)дезоксирибоуридин, как указано на фигуре 1.
Модифицированные ДНК-аптамеры GR200-Pyr-03 и GR200-Pyr-05 узнают внеклеточный домен EGFR с аффинностью в 7,5 раз выше, чем у исходного аптамера GR200, а также связываются с мутантной версией белка EGFR vIII с аффинностью соответственно в 5 раз и в 1,8 раза выше, чем у исходного аптамера GR200. Химическая модификация аптамера GR200 производным пирена привела к улучшению взаимодействия с обоими белками, при этом длина олигонуклеотидов не превышает 50 нуклеотидов.
Описание чертежей
Фигура 1. Предполагаемая вторичная структура исходного аптамера GR200, предсказанная программой Mfold, с указанием положения модифицированных нуклеотидов.
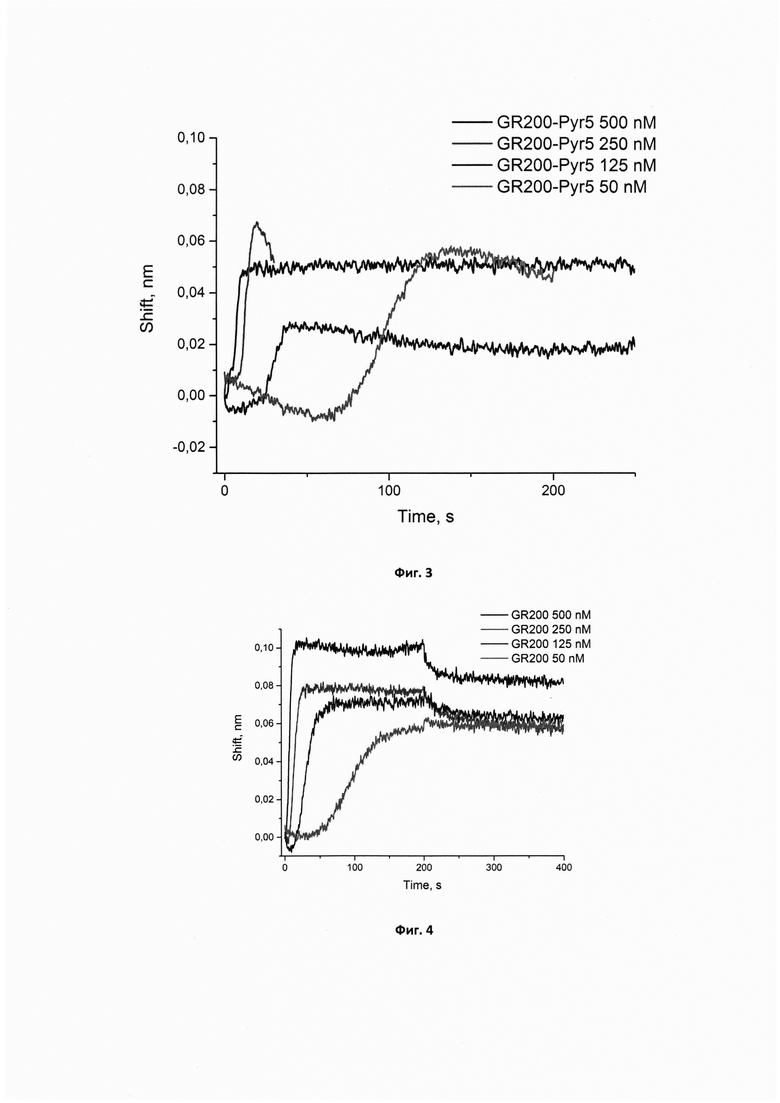
Фигура 2. Сенсограммы связывания нового модифицированного аптамера GR200-Pyr-03 в концентрациях 50, 125, 250, 500 нМ с иммобилизованным рекомбинантным белком EGFR. Сигнал от связывания аптамера с референсным белком (антителом С225) в аналогичных концентрациях вычтен из сенсограмм.
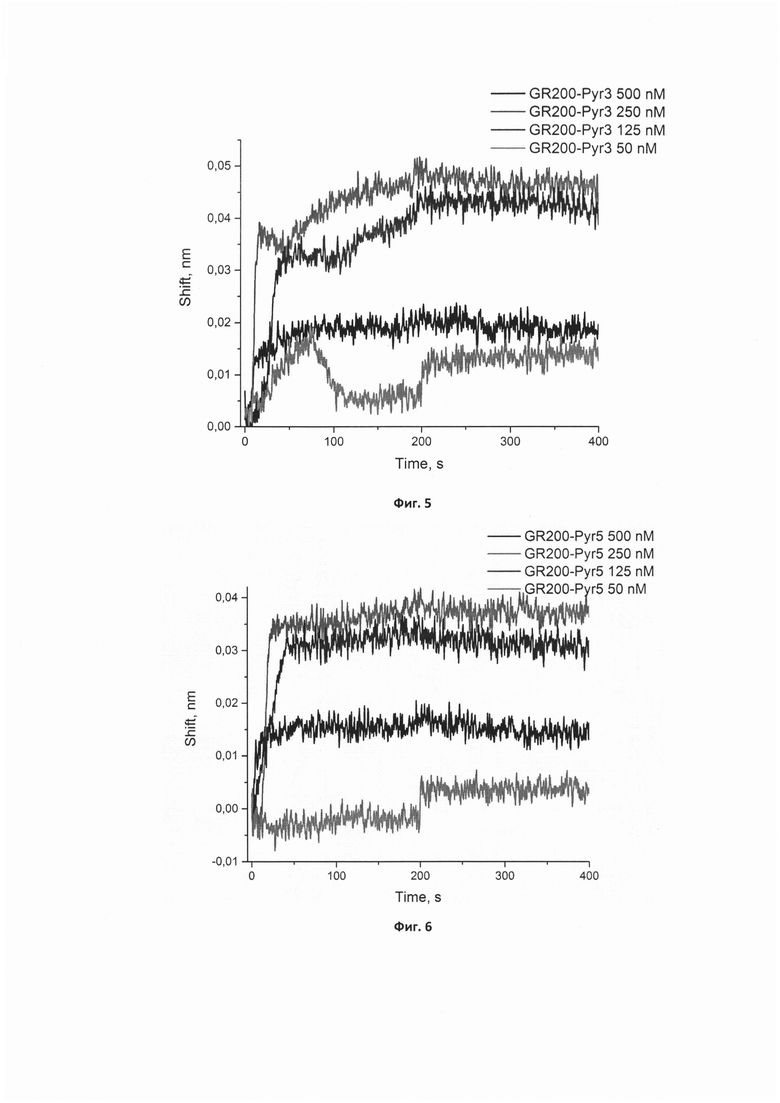
Фигура 3. Сенсограммы связывания нового модифицированного аптамера GR200-Pyr-05 в концентрациях 50, 125, 250, 500 нМ с иммобилизованным рекомбинантным белком EGFR.
Сигнал от связывания аптамера с референсным белком (антителом С225) в аналогичных концентрациях вычтен из сенсограмм.
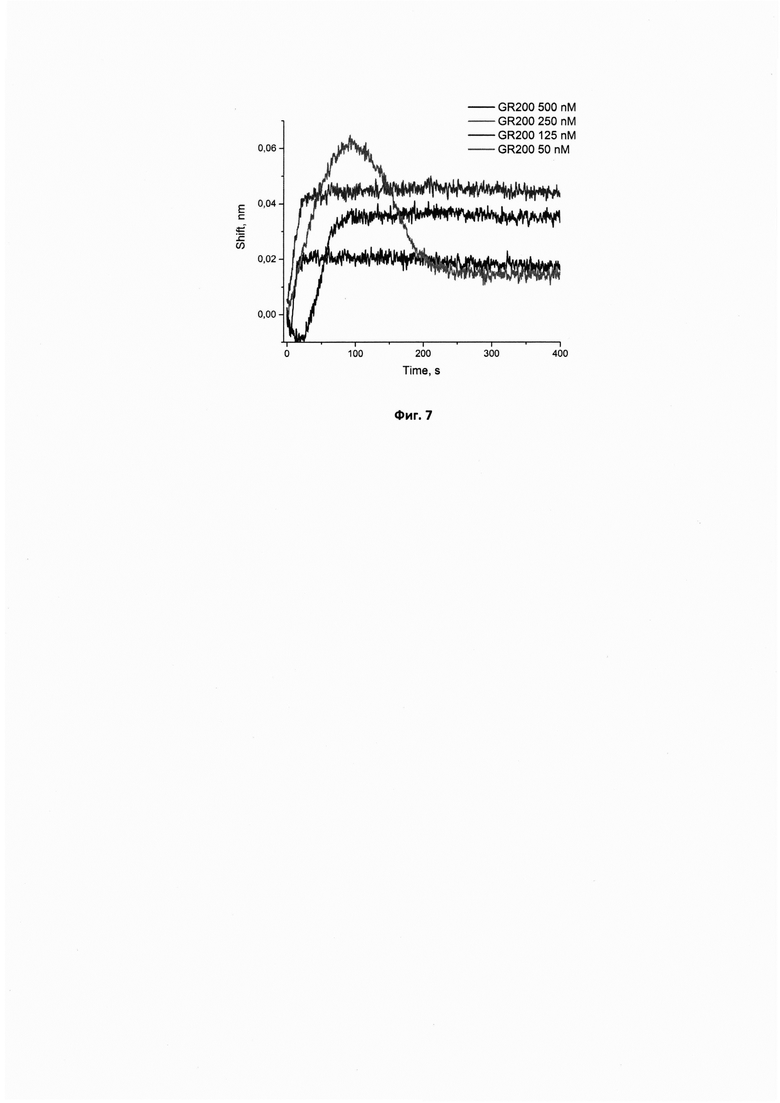
Фигура 4. Сенсограммы связывания исходного аптамера GR200 в концентрациях 50, 125, 250, 500 нМ с иммобилизованным рекомбинантным белком EGFR. Сигнал от связывания аптамера с референсным белком (антителом С225) в аналогичных концентрациях вычтен из сенсограмм.
Фигура 5. Сенсограммы связывания нового модифицированного аптамера GR200-Pyr-03 в концентрациях 50, 125, 250, 500 нМ с иммобилизованной мутантной формой рецептора эпидермального фактора роста EGFR vIII. Сигнал от связывания аптамера с референсным белком (антителом С225) в аналогичных концентрациях вычтен из сенсограмм. Фигура 6. Сенсограммы связывания нового модифицированного аптамера GR200-Pyr-05 в концентрациях 50, 125, 250, 500 нМ с иммобилизованной мутантной формой рецептора эпидермального фактора роста EGFR vIII. Сигнал от связывания аптамера с референсным белком (антителом С225) в аналогичных концентрациях вычтен из сенсограмм. Фигура 7. Сенсограммы связывания исходного аптамера GR200 в концентрациях 50, 125, 250, 500 нМ с иммобилизованной мутантной формой рецептора эпидермального фактора роста EGFR vIII. Сигнал от связывания аптамера с референсным белком (антителом С225) в аналогичных концентрациях вычтен из сенсограмм.
Нижеследующие примеры приведены в целях раскрытия характеристик настоящего изобретения и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения.
Пример 1. Синтез олигонуклеотидов, содержащих модифицированный нуклеотид
Для синтеза олигонуклеотидов использовались стандартные фосфорамидиты и колоночные реакторы типа MerMade column с CPG-носителем (диаметр пор 1000А, нагрузка 1 мкмоль) производства компании LGC Genomics Ltd. (Великобритания). Для фосфорамидита цитидина использовалась ацетильная защита. Фосфорамидит с функциональной группой для проведения клик-химии (5'-диметокситиритл-5-этинил-dU 3'-[(2-цианоэтил)-(N,N-диизопро-пил)]-фосфорамидит) был заказан в компании Baseclick GmbH (Германия). Используемые в олигонуклеотидном синтезе растворы деблока (3% дихлоруксусной кислоты в толуоле), активатора (0,25 М 4,5-дицианимидазол в безводном ацетонитриле), кэппирующие растворы (20% N-метилимидазол в ацетонитриле и смесь 20% уксусного ангидрида с 30% лутидином в ацетонитриле), оксилитель (раствор 0,005 М йода в смеси пиридин/вода в соотношении 9:1) и раствор 20% диэтиламина в ацетонитриле получены от emp Biotech GmbH (Германия). Безводный ацетонитрил (максимальное содержание воды 0,003%) получен от Biosolve BV (Нидерланды).
Азиды для проведения реакций клик-химии (бензилазид, 6-азидогексановая кислота и пиреназид) поставлялись компаниями Baseclick GmbH (Германия) и Sigma-Aldrich, Inc. (США). Вспомогательные реагенты сульфат меди(II) и L-аскорбиновая кислота получены от компании Acros Organics (Thermo Fisher Scientific, Бельгия), трис(3-гидроксипропилтриазолилметил)амин (лиганд ТНРТА) получены от Sigma-Aldrich, Inc. (США). Остальные использованные в работе реактивы были фармакопейного качества и поставлялись компаниями Sigma-Aldrich, Inc. (США), Acros Organics (Thermo Fisher Scientific, Бельгия) и AppliChem GmbH (Германия).
Синтез олигонуклеотидов производился химически на твердой фазе с использованием фосфорамидитной химии. Процесс синтеза заданных последовательностей выполнялся на синтезаторе MerMade 48 (Bioautomation, США) по стандартной программе прибора. Рабочая концентрация растворов фосфорамидитов в безводном ацетонитриле составляла 0,067 М. Приготовленные растворы фосфорамидитов перед синтезом сушились над предварительно активированными молекулярными ситами  Конденсация амидитов (в том числе и модифицированного) с наращиваемым олигонуклеотидным звеном проводилась в течение 60 секунд. После завершения синтеза колонки с продуктом обрабатывались 20% раствором диэтиламина в ацетонитриле в течение 3 минут для удаления цианоэтильных групп, способных образовывать нежелательные примеси с целевым продуктом в процессе депротекции продукта.
Конденсация амидитов (в том числе и модифицированного) с наращиваемым олигонуклеотидным звеном проводилась в течение 60 секунд. После завершения синтеза колонки с продуктом обрабатывались 20% раствором диэтиламина в ацетонитриле в течение 3 минут для удаления цианоэтильных групп, способных образовывать нежелательные примеси с целевым продуктом в процессе депротекции продукта.
Депротекция проводилась путем инкубации колонок в 30% водном растворе аммиака при комнатной температуре в течение 17 часов. Данный метод был выбран для минимизации гидратации этинильной группы и образования производного метил кетона, блокирующего проведение реакции клик-химии. После завершения процедуры депротекции растворы с колонками выдерживались в течение 1 часа при -35°С, после чего промывались трехкратно 200 мкл 80%-ого водного раствора этанола. Собранные после промывки колонок растворы олигонуклеотидов концентрировались в течение 3 часов на роторном испарителе Concentrator Plus (Eppendorf AG, Германия) при 30°С.
Далее аберрантные продукты синтеза удалялись от целевой полнозвенной последовательности с помощью жидкостной хроматографии. Разделение проводилось на анионообменной колонне Resource Q 1 mL (GE Healthcare Life Sciences, США) в хроматографической системе  purifier UPC 100 (GE Healthcare Life Sciences, США), использовалась буферная система, содержащая 10 мМ Tris*HCl и 50 мМ NaClO4 (рН 7.8). Элюирование олигонуклеотидов с колонны осуществлялось в градиентном режиме путем добавления буферного раствора В (10 мМ Tris*HCl, 500 мМ NaClO4 (рН 7.8)): 0-70% буферного раствора В за 30 объемов колонны при скорости потока 3 мл/мин. Собранные при помощи коллектора фракций растворы целевых олигонуклеотидов подвергались обессоливанию/ концентрированию посредством 4-х циклов центрифугирования на ультрафильтрационных ячейках Amicon Ultra-15, cut off limits 30 кДа (Merck KGaA, США). Общее содержание олигонуклеотида в образцах оценивалось спектрофотометрически по прямому поглощению растворов света с длиной волны 260 нм. Оценка содержания целевого олигонуклеотида в растворах с депротекции и во фракциях с хроматографической очистки производилась методом обращено-фазовой ВЭЖХ (хроматографическая система Agilent series 1200, Agilent Tech., США) на колонне XTerra MS С18 Column (Waters Corp., США) в буферной системе 100 мМ ТЕАА/ацетонитрил.
purifier UPC 100 (GE Healthcare Life Sciences, США), использовалась буферная система, содержащая 10 мМ Tris*HCl и 50 мМ NaClO4 (рН 7.8). Элюирование олигонуклеотидов с колонны осуществлялось в градиентном режиме путем добавления буферного раствора В (10 мМ Tris*HCl, 500 мМ NaClO4 (рН 7.8)): 0-70% буферного раствора В за 30 объемов колонны при скорости потока 3 мл/мин. Собранные при помощи коллектора фракций растворы целевых олигонуклеотидов подвергались обессоливанию/ концентрированию посредством 4-х циклов центрифугирования на ультрафильтрационных ячейках Amicon Ultra-15, cut off limits 30 кДа (Merck KGaA, США). Общее содержание олигонуклеотида в образцах оценивалось спектрофотометрически по прямому поглощению растворов света с длиной волны 260 нм. Оценка содержания целевого олигонуклеотида в растворах с депротекции и во фракциях с хроматографической очистки производилась методом обращено-фазовой ВЭЖХ (хроматографическая система Agilent series 1200, Agilent Tech., США) на колонне XTerra MS С18 Column (Waters Corp., США) в буферной системе 100 мМ ТЕАА/ацетонитрил.
Реакция клик-химии олигонуклеотидов с этинильной группой и выбранных азидов осуществлялась в присутствии ионов меди (I). Реакции проводились в смеси фосфатного буфера и ДМСО в соотношении 5,5:4,5, содержащей 50 мкМ (порядка 14 нмоль) олигонуклеотида с этинильной группой и пятикратным избытком азида. Катализ реакции осуществлялся с помощью смеси 100 мкМ раствора сульфата меди(II) и 50-и кратного избытка аскорбата натрия в присутствии 5-и кратного (по отношению к сульфату меди) избытка стабилизирующего лиганда ТНРТА. Растворы компонентов перед смешиванием трехкратно дегазировались аргоном при перемешивании. Реакция проводилась в течение 2 часов при 40°С. По завершении инкубации реакционная смесь разбавлялась деионизированной водой и концентрировалась на ультрафильтрационных ячейках Amicon Ultra-15. Оценка содержания целевого олигонуклеотида в реакционной смеси производилась методом обращено-фазовой ВЭЖХ. Полученные смеси содержали от 31 до 67% целевого конъюгата.
Методики по исследованию связывания аптамеров с белками методом биослойной интерферометрии
Связывание исходного и стабилизированного аптамеров с рекомбинантным внеклеточным доменом белка человека EGFR (R&D Systems) и с рекомбинантным внеклеточным фрагментом мутантной формы белка EGFR vIII (R&D Systems) изучали методом биослойной интерферометрии. Метод биослойной интерферометрии основан на сдвиге длины волны максимума интенсивности интерференции (нм) при изменении во времени толщины сорбированного на поверхности биосенсора слоя биомолекул, полученные кривые называются сенсограммами. Из сенсограмм, полученных для разной концентрации компонентов комплекса, вычисляют кажущуюся константу диссоциации кКд - главную характеристику аффинности комплекса. Поскольку лишь специфическая сорбция позволяет определить параметры комплексообразования, данный метод требует иммобилизации одного из компонентов комплекса на поверхности биосенсора. В настоящем исследовании на поверхность сенсоров с карбоксильными группами иммобилизовали белки за концевые аминогруппы лизина. Все исследования методом биослойной интерферометрии проводили на приборе Octet RED96 (ForteBio Pall, USA) при температуре 25°С.
Иммобилизация белков проводилась методом сочетания свободных аминогрупп белка (например, е-аминогрупп остатков лизина) и карбоксильных групп на поверхности биосенсора AR2G. Биосенсоры активировали свежеприготовленной активирующей смесью 40 мМ гидрохлорида 3-(3-диметиламинопропил)-1-этилкарбодиимида и 10 мМ сульфо-N-гидроксисукцинимида. Затем на активированную поверхность биосенсоров иммобилизовали белки EGFR, EGFR vIII или С225, разведенные в 40 мМ натрий-калий-фосфатном буфере рН 6,43 до концентраций 1 мкг/мл, 1 мкг/мл или 5 мкг/мл соответственно. Оба белка иммобилизовали на разные биосенсоры до выхода сигнала на плато. Затем проводили деактивацию несвязавшихся карбоксильных групп биосенсора при помощи 1 М гидрохлорида этаноламина рН 8,5. Сигнал стабилизировали, отмывая нековалентно связавшиеся молекулы белка при помощи опускания сенсора в 5 мМ Трис-HCl буфер рН 7,0 с добавлением 140 мМ хлорида натрия и 10 мМ хлорида калия. В этом же буфере преформировали 2 мкМ раствор аптамера. Для количественного определения кажущейся константы диссоциации кКд связывание с белком проводили для растворов аптамера в концентрациях 50, 125, 250, 500 нМ. Стадия ассоциации длилась 200 с, стадия диссоциации - 300 с. Для регенерации белка после стадии взаимодействия с аптамером использовали раствор 1 М гидрохлорида этаноламина рН 8,5. В качестве референса использовали сенсоры с иммобилизованным моноклональным антителом к EGFR С225 (Merck). Первичная обработка данных, полученных на приборе, включала в себя вычитание сигнала от взаимодействия аптамера с антителом С225. Во всех случаях сигнал от взаимодействия аптамера с отрицательным контролем С225 был значительно ниже сигнала от взаимодействия с EGFR или EGFR vIII.
Каждую сенсограмму обрабатывали вручную при помощи программного обеспечения Origin (OriginLab Corporation) с целью получения данных по кинетике образования комплекса. Комплекс (АБ) аптамера (А) и белка (Б) образуется по следующей реакции:
A+Б↔АБ,
причем константа скорости прямой реакции (ассоциации) - ka, а константа скорости обратной реакции (диссоциации комплекса) kd. Из изменения сигнала на стадии ассоциации можно получить обе эти константы, а из стадии диссоциации - только константу скорости диссоциации [1]. Из соотношения величин этих констант скоростей вычислили равновесную кажущуюся константу диссоциации кКд по уравнению:
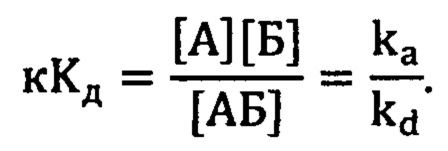
Пример 2. Исследование связывания с рецептором эпидермального фактора роста EGFR.
Сенсограммы, полученные методом биослойной интерферометрии для вычисления кажущейся константы диссоциации комплекса нового модифицированного аптамера GR200-Pyr-03 с белком рецептором эпидермального фактора роста EGFR, иммобилизованным на поверхности биосенсора, приведены на фигуре 2.
Сенсограммы, полученные методом биослойной интерферометрии для вычисления кажущейся константы диссоциации комплекса нового модифицированного аптамера GR200-Pyr-05 с белком рецептором эпидермального фактора роста EGFR, иммобилизованным на поверхности биосенсора, приведены на фигуре 3.
Сенсограммы, полученные методом биослойной интерферометрии по аналогичной методике для вычисления кажущейся константы диссоциации комплекса исходного аптамера GR200 с белком рецептором эпидермального фактора роста EGFR, иммобилизованным на поверхности биосенсора, приведены на фигуре 4.
Вычисленные кажущиеся константы диссоциации кКд для комплексов новых модифицированных ДНК-аптамеров GR200-Pyr-03 и GR200-Pyr-05 с иммобилизованным EGFR составляют 0,12±0,02 нМ, что в 7,5 раз ниже константы кКд, полученной для комплекса с исходным аптамером GR200 (0,9±0,2 нМ) и свидетельствует о высокой аффинности новых модифицированных аптамеров к белку EGFR.
Пример 3. Исследование связывания с мутантной формой рецептора эпидермального фактора роста EGFR vIII.
Сенсограммы, полученные методом биослойной интерферометрии для вычисления кажущейся константы диссоциации комплекса нового модифицированного аптамера GR200-Pyr-03 с мутантной формой рецептора эпидермального фактора роста EGFR vIII, иммобилизованной на поверхности биосенсора, приведены на фигуре 5.
Сенсограммы, полученные методом биослойной интерферометрии для вычисления кажущейся константы диссоциации комплекса нового модифицированного аптамера GR200-Pyr-05 с мутантной формой рецептора эпидермального фактора роста EGFR vIII, иммобилизованной на поверхности биосенсора, приведены на фигуре 6.
Сенсограммы, полученные методом биослойной интерферометрии по аналогичной методике для вычисления кажущейся константы диссоциации комплекса исходного аптамера GR200 с мутантной формой рецептора эпидермального фактора роста EGFR vIII, иммобилизованной на поверхности биосенсора, приведены на фигуре 7.
Вычисленная кажущаяся константа диссоциации кКд для комплекса аптамера GR200-Pyr-03 с иммобилизованным EGFR vIII составляет 0,12±0,02 нМ, а для комплекса аптамера GR200-Pyr-05 с иммобилизованным EGFR vIII равна 0,34±0,06 нМ, что соответственно в 5 раз и в 1,8 раза ниже константы кКд, известной для комплекса с исходным аптамером GR200 (0,60±0,09 нМ). Химическая модификация аптамера GR200 производным пирена привела к улучшению взаимодействия с EGFR vIII.
Специалистам в данной области будет понятно, что в описанные выше варианты осуществления можно вносить многочисленные изменения и/или модификации без отклонения от широкого общего объема настоящего изобретения. Таким образом, представленные варианты осуществления следует считать во всех аспектах иллюстративными, но не ограничивающими.
Список литературы
 D.J., Brighamburke, М., Soneson, K.K., Hensley, P., & Brooks, I. (1993). Determination of Rate and Equilibrium Binding Constants for Macromolecular Interactions Using Surface Plasmon Resonance: Use of Nonlinear Least Squares Analysis Methods. Analytical Biochemistry, 212(2), 457-468.
D.J., Brighamburke, М., Soneson, K.K., Hensley, P., & Brooks, I. (1993). Determination of Rate and Equilibrium Binding Constants for Macromolecular Interactions Using Surface Plasmon Resonance: Use of Nonlinear Least Squares Analysis Methods. Analytical Biochemistry, 212(2), 457-468.
--->
<110> Общество с ограниченной ответственностью «АПТО-ФАРМ»
<120>Модифицированные 50-звенные ДНК-аптамеры, связывающие внеклеточный домен EGFR
<140> 2019134988
<141> 31.10.2019
<160>
<210>
<211>50
<212>ДНК
<213>
<400>CGACGCACCATTTGТTTAATAXGTTTTTTAATTCCCCTTGTGGTGCGTCG
X – 5-(1-(пропиламид 4-пиренбутановой кислоты)-4-триазолил)дезоксирибоуридин
<110> Общество с ограниченной ответственностью «АПТО-ФАРМ»
<120>Модифицированные 50-звенные ДНК-аптамеры, связывающие внеклеточный домен EGFR
<140> 2019134988
<141> 31.10.2019
<160>
<210>
<211>50
<212>ДНК
<213>
<400>CGACGCACCATTTGТTTAATATGTTXTTTAATTCCCCTTGTGGTGCGTCG
X – 5-(1-(пропиламид 4-пиренбутановой кислоты)-4-триазолил)дезоксирибоуридин
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Модифицированные ДНК-аптамеры, связывающие внеклеточный домен EGFR | 2019 |
|
RU2723398C1 |
| ДНК-аптамер GR200, узнающий внеклеточный домен EGFR | 2019 |
|
RU2729382C1 |
| ДНК-аптамер, связывающий внеклеточный домен EGFR | 2018 |
|
RU2700097C1 |
| ДНК-АПТАМЕР, ОБЛАДАЮЩИЙ ВЫСОКИМ СРОДСТВОМ К БЕЛКУ ИНТЕРЛЕЙКИН-6 | 2023 |
|
RU2814541C2 |
| ДНК-АПТАМЕРЫ, ВЗАИМОДЕЙСТВУЮЩИЕ С ПРОТРОМБИНОМ | 2018 |
|
RU2703799C1 |
| СОЕДИНЕНИЯ НУКЛЕИНОВОЙ КИСЛОТЫ ДЛЯ СВЯЗЫВАНИЯ РОСТОВОГО ФАКТОРА ДИФФЕРЕНЦИРОВКИ 11 | 2015 |
|
RU2708170C2 |
| СПОСОБ СПЕЦИФИЧЕСКОГО ОТБОРА ВЫСОКОАФФИННЫХ МОЛЕКУЛ ДНК (ДНК-АПТАМЕРОВ) К РЕКОМБИНАНТНОМУ БЕЛКУ-МИШЕНИ | 2012 |
|
RU2513700C1 |
| УСОВЕРШЕНСТВОВАННЫЕ ПРОТЕОМНЫЕ МУЛЬТИПЛЕКСНЫЕ АНАЛИЗЫ | 2019 |
|
RU2792385C2 |
| Способ оценки сродства олигонуклеотида | 2018 |
|
RU2700584C1 |
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК-АПТАМЕРОВ, СВЯЗЫВАЮЩАЯ ШИГА-ТОКСИН ТИПА 2 | 2014 |
|
RU2566552C1 |
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая аптамерный модифицированный ДНК олигонуклеотид, специфически связывающийся с рецептором эпидермального фактора роста (EGFR) (варианты), аптамерный модифицированный ДНК олигонуклеотид, специфически связывающийся с мутантной формой рецептора эпидермального фактора роста (EGFR vIII) (варианты), способ узнавания рецептора эпидермального фактора роста (EGFR) и способ узнавания мутантной формы рецептора эпидермального фактора роста (EGFR vIII). В одном из вариантов реализации аптамерный модифицированный ДНК олигонуклеотид характеризуется нуклеотидной последовательностью общей формулы
5'-CGACGCACCATTTGTTTAATAXGTTTTTT AATTCCCCTTGTGGTGCGTCG-3',
где X - 5-(1-(пропиламид 4-пиренбутановой кислоты)-4-триазолил)дезоксирибоуридин.
Изобретение расширяет арсенал средств, специфически связывающихся с рецептором эпидермального фактора роста (EGFR) и его мутантной формой (EGFR vIII). 6 н.п. ф-лы, 3 пр., 7 ил.
1. Аптамерный модифицированный ДНК олигонуклеотид, специфически связывающийся с рецептором эпидермального фактора роста (EGFR) и характеризующийся нуклеотидной последовательностью общей формулы
5'-CGACGCACCATTTGTTTAATAXGTTTTTTAATTCCCCTTGTGGTGCGTCG-3',
где X - 5-(1-(пропиламид 4-пиренбутановой кислоты)-4-триазолил)дезоксирибоуридин.
2. Аптамерный модифицированный ДНК олигонуклеотид, специфически связывающийся с рецептором эпидермального фактора роста (EGFR) и характеризующийся нуклеотидной последовательностью общей формулы
5'-CGACGCACCATTTGTTTAATATGTTXTTTAATTCCCCTTGTGGTGCGTCG-3',
где Х - 5-(1-(пропиламид 4-пиренбутановой кислоты)-4-триазолил)дезоксирибоуридин.
3. Аптамерный модифицированный ДНК олигонуклеотид, специфически связывающийся с мутантной формой рецептора эпидермального фактора роста (EGFR vIII) и характеризующийся нуклеотидной последовательностью общей формулы
5'-CGACGCACCATTTGTTTAATAXGTTTTTTAATTCCCCTTGTGGTGCGTCG-3',
где X - 5-(1-(пропиламид 4-пиренбутановой кислоты)-4-триазолил)дезоксирибоуридин.
4. Аптамерный модифицированный ДНК олигонуклеотид, специфически связывающийся с мутантной формой рецептора эпидермального фактора роста (EGFR vIII) и характеризующийся нуклеотидной последовательностью общей формулы
5'-CGACGCACCATTTGTTTAATATGTTXTTTAATTCCCCTTGTGGTGCGTCG-3',
где X - 5-(1-(пропиламид 4-пиренбутановой кислоты)-4-триазолил)дезоксирибоуридин.
5. Способ узнавания рецептора эпидермального фактора роста (EGFR), включающий в себя использование аптамерных модифицированных ДНК олигонуклеотидов по любому из пп. 1-2.
6. Способ узнавания мутантной формы рецептора эпидермального фактора роста (EGFR vIII), включающий в себя использование аптамерных модифицированных ДНК олигонуклеотидов по любому из пп. 3-4.
| ДНК-аптамер, связывающий внеклеточный домен EGFR | 2018 |
|
RU2700097C1 |
| WO 2013102096 A1 04.07.2013 | |||
| US 9316647 B2 19.04.2016 | |||
| XIDONG WU, et al | |||
| "Cell-SELEX Aptamer for Highly Specific Radionuclide Molecular Imaging of Glioblastoma In Vivo", Plos One, 2014, V | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2020-11-20—Публикация
2019-10-31—Подача