ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[001] Данная заявка заявляет приоритет по предварительной заявке США № 62/083592, поданной 24 ноября 2014 года, и по предварительной заявке США № 62/113864, поданной 9 февраля 2015 года, каждая из которых включена в данный документ посредством ссылки в полном объеме и для любых целей.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[002] Настоящая заявка подается вместе с Перечнем последовательностей в электронном формате. Перечень последовательностей предоставляется в виде файла под названием "2015-11-23_01137-0011-00PCT_ST25.txt", созданного 23 ноября 2015 года, размер которого составляет 122816 байт. Информация в электронном формате Перечня последовательностей включена в данный документ посредством ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
[003] Настоящее изобретение в целом относится к области нуклеиновых кислот и, более конкретно, к аптамерам, способным связываться с белком - ростовым фактором дифференцировки 11 (GDF11); композициям, содержащим аптамер связывания GDF11 с белком GDF11; а также к способам их получения и применения.
УРОВЕНЬ ТЕХНИКИ
[004] Ростовой фактор дифференцировки 11 (GDF11) или костный морфогенетический белок 11 (BMP-11) относятся к суперсемейству трансформирующего ростового фактора бета, которое регулирует формирование переднезаднего паттерна во время развития посредством регуляции экспрессии генов Hox. Было показано, что GDF11 играет некоторую роль в регуляции пролиферации кардиомиоцитов, органогенезе почек, развитии поджелудочной железы, выступает в качестве негативного регулятора нейрогенеза и хондрогенеза.
[005] GDF11 является близкородственным миостатину (GDF8), который представляет собой негативный регулятор мышечного роста. Подобно GDF11, миостатин участвует в регуляции пролиферации кардиомиоцитов. Сходство между GDF11 и миостатином подразумевает вероятность того, что одни и те же регуляторные механизмы используются для регуляции размера ткани как во время мышечного развития, так и во время развития нервной системы. Механистически, действия GDF11, скорее всего, регулируются с помощью WFIKKN2, крупного внеклеточного мультидоменного белка, состоящего из фоллистатина, иммуноглобулина, ингибитора протеазы и доменов NTR. WFIKKN2 имеет высокую аффинность к GDF11 и ранее было установлено, что он ингибирует биологическую активность миостатина.
[006] Как GDF11, так и GDF8 (миостатин) играют важную роль в процессе развития, а также в регуляции клеточного роста и дифференцировке во взрослых тканях. Способность локализовать и/или измерять эти два белка важна для дальнейшего понимания и различения их вклада в развитие и взрослые ткани (например, сердечная и скелетная мышца). Тем не менее, из-за их гомологии трудно различить присутствие и/или уровни этих белков с помощью существующих связывающих белок реагентов (например, антител). Таким образом, существует потребность в связывающих белок реагентах, которые способны различать белки GDF11 и GDF8. Настоящее изобретение отвечает этим потребностям, обеспечивая аптамеры, обладающие специфичностью связывания с белком GDF11.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[007] Настоящее изобретение описывает аптамеры, способные связываться с белком - ростовым фактором дифференцировки 11 (GDF11). В некоторых вариантах реализации изобретения предлагаются аптамеры, которые связывают GDF11 с равновесной константой связывания (Kd), составляющей менее 100 нМ. В другом аспекте Kd составляет от около 0,1 нМ до около 100 нМ (или от около 0,1 нМ до около 50 нМ или от около 0,1 нМ до около 10 нМ, или от около 0,5 нМ до около 10 нМ, или от около 0,5 нМ до около 5 нМ).
[008] В некоторых вариантах реализации изобретения предлагается аптамер, который связывает GDF11 с аффинностью, составляющей менее 10 нМ. В некоторых вариантах реализации изобретения аптамер связывает GDF11 с аффинностью, составляющей менее 10 нМ, и в тех же условиях данный аптамер связывает GDF8 с аффинностью, которая по меньшей мере в 10 раз слабее, чем аффинность к GDF11. В некоторых вариантах реализации изобретения аптамер не связывает GDF8. В некоторых вариантах реализации изобретения аптамер связывает GDF8 с аффинностью, которая по меньшей мере в 20 раз слабее или по меньшей мере в 30 раз слабее, или по меньшей мере в 50 раз слабее, чем аффинность к GDF11. В некоторых вариантах реализации изобретения аптамер связывает GDF8 с аффинностью, составляющей более 50 нМ или более 100 нМ, или более 150 нМ, или более 200 нМ, или более 250 нМ, или более 300 нМ. В некоторых вариантах реализации изобретения аптамер связывает GDF11 с аффинностью, составляющей менее 8 нМ или менее 7 нМ, или менее 6 нМ, или менее 5 нМ, или менее 4 нМ, или менее 3 нМ, или менее 2 нМ, или менее 1 нМ. В некоторых вариантах реализации изобретения аффинность определяется с помощью анализа связывания, включающего полианионный ингибитор. В некоторых вариантах реализации изобретения полианионный ингибитор выбран из декстрансульфата, гепарина, Z-блока, поли-dI/dC, озвученной ультразвуком или деградированной в результате гидродинамического сдвига ДНК из молок лососевых, ДНК из тимуса теленка и дНТФ. В некоторых вариантах реализации изобретения аптамер содержит последовательность 5'-RWnMCnCPPGMmMPPPAnACnMCmRWnPPGnPASnGC-3' (SEQ ID №: 110) или 5'-RWnMCnCPPGMmMPPPAnACnMCmRWnPPGnPASnGS-3' (SEQ ID №: 151), где:
каждый P независимо, и в каждом случае, представляет собой C-5-модифицированный пиримидин;
R представляет собой A или G;
каждый W независимо, и в каждом случае, представляет собой A, T или U;
каждый M независимо, и в каждом случае, представляет собой A или C;
каждый S независимо, и в каждом случае, представляет собой G или C;
каждый n независимо, и в каждом случае, равен 0 или 1; и
каждый m независимо, и в каждом случае, равен 0 или 1.
[009] В некоторых вариантах реализации изобретения предлагается аптамер, который связывает GDF11, при этом данный аптамер содержит последовательность 5'-RWnMCnCPPGMmMPPPAnACnMCmRWnPPGnPASnGC-3' (SEQ ID №: 110) или 5'-RWnMCnCPPGMmMPPPAnACnMCmRWnPPGnPASnGS-3' (SEQ ID №: 151), где:
каждый P независимо, и в каждом случае, представляет собой C-5-модифицированный пиримидин;
R представляет собой A или G;
каждый W независимо, и в каждом случае, представляет собой A, T или U;
каждый M независимо, и в каждом случае, представляет собой A или C;
каждый S независимо, и в каждом случае, представляет собой G или C;
каждый n независимо, и в каждом случае, равен 0 или 1; и
каждый m независимо, и в каждом случае, равен 0 или 1.
[010] В некоторых вариантах реализации изобретения аптамер, который связывает GDF11, содержит последовательность, выбранную из:
(а) 5'-RWnACnCPPGMmMPPPAnACnMCmRWnPPGnPASnGC-3' (SEQ ID №: 111);
(б) 5'-RWnACnCPPGMmMPPPAnACnMCmRWnPPGnPASnGS-3' (SEQ ID №: 152);
(в) 5'-RWnMCnCPPGMmMPPPAnACnMCmGWnPPGnPASnGC-3' (SEQ ID №: 112);
(г) 5'-RWnMCnCPPGMmMPPPAnACnMCmGWnPPGnPASnGS-3' (SEQ ID №: 153);
(д) 5'-RMCPPGMmMPPPAnACnMCmRWnPPPASnGC-3' (SEQ ID №: 113); и
(е) RMCPPGMmMPPPAnACnMCmRWnPPPASnGS-3' (SEQ ID №: 154).
В некоторых вариантах реализации приведенных выше последовательностей, если R представляет собой G, первый W может представлять собой A и при этом, если R представляет собой A, первый W может представлять собой C. В некоторых вариантах реализации изобретения по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5 или по меньшей мере 6 n равны 0. В некоторых вариантах реализации изобретения каждый n равен 0. В некоторых вариантах реализации изобретения по меньшей мере 1, по меньшей мере 2, по меньшей мере 3 n равны 1. В некоторых вариантах реализации изобретения по меньшей мере один m равен 0. В некоторых вариантах реализации изобретения по меньшей мере один m равен 1.
[011] В некоторых вариантах реализации изобретения аптамер, который связывает GDF11, содержит последовательность 5'-CPPGMPPP-3' (SEQ ID №: 114), где каждый P независимо, и в каждом случае, представляет собой C-5-модифицированный пиримидин и, где M представляет собой C или A. В некоторых вариантах реализации изобретения аптамер, который связывает GDF11, содержит последовательность 5'-PPPAGC-3' (SEQ ID №: 115) или 5'-PPPAGG-3' (SEQ ID №: 155), где каждый P независимо, и в каждом случае, представляет собой C-5-модифицированный пиримидин. В некоторых вариантах реализации изобретения аптамер, который связывает GDF11, содержит последовательность 5'-CPPGMPPPNxPPPAGC-3' (SEQ ID №: 116) или 5'-CPPGMPPPNxPPPAGG-3' (SEQ ID №: 160), где каждый P независимо, и в каждом случае, представляет собой C-5-модифицированный пиримидин, где x равен 2, 3, 4 или 5, где M представляет собой C или A и где каждый N независимо, и в каждом случае, выбран из А, С, G, T и U. В некоторых вариантах реализации изобретения x равен 3 или 4. В некоторых вариантах реализации изобретения Nx содержит последовательность 5'-AAG-3' или 5'-ACG-3', или 5'-AGG-3'.
[012] В некоторых вариантах реализации изобретения аптамер, который связывает GDF11, содержит последовательность 5'-NNCPPGRPPPAMGPPPAGS-3' (SEQ ID №: 141), где каждый P независимо, и в каждом случае, представляет собой C-5-модифицированный пиримидин, R представляет собой A или G; каждый N независимо, и в каждом случае, представляет собой A, G или C; M представляет собой A или C; и S представляет собой G или C.
[013] В некоторых вариантах реализации изобретения каждый Р независимо, и в каждом случае, выбран из:
5-(N-бензилкарбоксиамид)-2'-дезоксиуридина (BndU),
5-(N-бензилкарбоксиамид)-2'-O-метилуридина,
5-(N-бензилкарбоксиамид)-2'-фторуридина,
5-(N-фенэтилкарбоксиамид)-2'-дезоксиуридина (PEdU),
5-(N-тиофенилметилкарбоксиамид)-2'-дезоксиуридина (ThdU),
5-(N-изобутилкарбоксиамид)-2'-дезоксиуридина (iBudU),
5-(N-тирозилкарбоксиамид)-2'-дезоксиуридина (TyrdU),
5-(N-3,4-метилендиоксибензилкарбоксиамид)-2'-дезоксиуридина (MBndU),
5-(N-4-фторбензилкарбоксиамид)-2'-дезоксиуридина (FBndU),
5-(N-3-фенилпропилкарбоксиамид)-2'-дезоксиуридина (PPdU),
5-(N-имидизолилэтилкарбоксиамид)-2'-дезоксиуридина (ImdU),
5-(N-изобутилкарбоксиамид)-2'-O-метилуридина,
5-(N-изобутилкарбоксиамид)-2'-фторуридина,
5-(N-триптаминокарбоксиамид)-2'-дезоксиуридина (TrpdU),
5-(N-R-треонинилкарбоксиамид)-2'-дезоксиуридина (ThrdU),
5-(N-триптаминокарбоксиамид)-2'-O-метилуридина,
5-(N-триптаминокарбоксиамид)-2'-фторуридина,
5-(N-[1-(3-триметиламмоний)пропил]карбоксиамид)-2'-дезоксиуридинхлорида,
5-(N-нафтилметилкарбоксиамид)-2'-дезоксиуридина (NapdU),
5-(N-нафтилметилкарбоксиамид)-2'-O-метилуридина,
5-(N-нафтилметилкарбоксиамид)-2'-фторуридина,
5-(N-[1-(2,3-дигидроксипропил)]карбоксиамид)-2'-дезоксиуридина),
5-(N-2-нафтилметилкарбоксиамид)-2'-дезоксиуридина (2NapdU),
5-(N-2-нафтилметилкарбоксиамид)-2'-O-метилуридина,
5-(N-2-нафтилметилкарбоксиамид)-2'-фторуридина,
5-(N-1-нафтилэтилкарбоксиамид)-2'-дезоксиуридина (NEdU),
5-(N-1-нафтилэтилкарбоксиамид)-2'-O-метилуридина,
5-(N-1-нафтилэтилкарбоксиамид)-2'-фторуридина,
5-(N-2-нафтилэтилкарбоксиамид)-2'-дезоксиуридина (2NEdU),
5-(N-2-нафтилэтилкарбоксиамид)-2'-O-метилуридина,
5-(N-2-нафтилэтилкарбоксиамид)-2'-фторуридина,
5-(N-3-бензофуранилэтилкарбоксиамид)-2'-дезоксиуридина (BFdU),
5-(N-3-бензофуранилэтилкарбоксиамид)-2'-O-метилуридина,
5-(N-3-бензофуранилэтилкарбоксиамид)-2'-фторуридина,
5-(N-3-бензотиофенилэтилкарбоксиамид)-2'-дезоксиуридина (BTdU),
5-(N-3-бензотиофенилэтилкарбоксиамид)-2'-O-метилуридина и
5-(N-3-бензотиофенилэтилкарбоксиамид)-2'-фторуридина.
[014] В некоторых вариантах реализации изобретения каждый Р независимо, и в каждом случае, выбран из:
5-(N-1-нафтилметилкарбоксиамид)-2'-дезоксиуридина (NapdU),
5-(N-1-нафтилметилкарбоксиамид)-2'-O-метилуридина,
5-(N-1-нафтилметилкарбоксиамид)-2'-фторуридина,
5-(N-2-нафтилметилкарбоксиамид)-2'-дезоксиуридина (2NapdU),
5-(N-2-нафтилметилкарбоксиамид)-2'-O-метилуридина,
5-(N-2-нафтилметилкарбоксиамид)-2'-фторуридина,
5-(N-1-нафтилэтилкарбоксиамид)-2'-дезоксиуридина (NEdU),
5-(N-1-нафтилэтилкарбоксиамид)-2'-O-метилуридина,
5-(N-1-нафтилэтилкарбоксиамид)-2'-фторуридина,
5-(N-2-нафтилэтилкарбоксиамид)-2'-дезоксиуридина (2NEdU),
5-(N-2-нафтилэтилкарбоксиамид)-2'-O-метилуридина,
5-(N-2-нафтилэтилкарбоксиамид)-2'-фторуридина,
5-(N-3-бензофуранилэтилкарбоксиамид)-2'-дезоксиуридина (BFdU),
5-(N-3-бензофуранилэтилкарбоксиамид)-2'-O-метилуридина,
5-(N-3-бензофуранилэтилкарбоксиамид)-2'-фторуридина,
5-(N-3-бензотиофенилэтилкарбоксиамид)-2'-дезоксиуридина (BTdU),
5-(N-3-бензотиофенилэтилкарбоксиамид)-2'-O-метилуридина и
5-(N-3-бензотиофенилэтилкарбоксиамид)-2'-фторуридина.
В некоторых вариантах реализации изобретения каждый из по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5 или по меньшей мере 6 P независимо выбран из 5-(N-нафтилметилкарбоксиамид)-2'-дезоксиуридина (NapdU), 5-(N-2-нафтилметилкарбоксиамид)-2'-O-метилуридина и 5-(N-2-нафтилметилкарбоксиамид)-2'-фторуридина.
[015] В некоторых вариантах реализации изобретения аптамер содержит последовательность, выбранную из SEQ ID №: 12, 13, 15-109 и 117-140. В некоторых вариантах реализации изобретения аптамер содержит последовательность, выбранную из SEQ ID №: 12, 15, 26, 105-109 и 142-150.
[016] В любом из описанных в данном документе вариантов реализации аптамер может состоять из 18-200 нуклеотидов или 18-150 нуклеотидов, или 18-100 нуклеотидов, или 18-75 нуклеотидов, или 18-50 нуклеотидов, или 20-150 нуклеотидов, или 20-100 нуклеотидов, или 20-75 нуклеотидов, или 20-50 нуклеотидов, при этом каждый нуклеотид может, независимо, представлять собой модифицированный или немодифицированный нуклеотид. В любом из описанных в данном документе вариантов реализации аптамер может содержать детектируемую метку.
[017] В некоторых вариантах реализации изобретения GDF11 представляет собой GDF11 человека и GDF8 представляет собой GDF8 человека. В некоторых вариантах реализации изобретения GDF11 представляет собой зрелый GDF11 человека, содержащий последовательность SEQ ID №: 118, и GDF8 представляет собой зрелый GDF8 человека, содержащий последовательность SEQ ID №: 119.
[018] В некоторых вариантах реализации изобретения предлагается способ детектирования GDF11 в образце, включающий приведение в контакт белков из образца с аптамером, описанным в данном документе. В некоторых вариантах реализации изобретения аптамер связывает GDF8 с аффинностью, которая по меньшей мере в 10 раз слабее, чем аффинность к GDF11. В некоторых вариантах реализации изобретения аптамер не связывает GDF8.
[019] В некоторых вариантах реализации изобретения предлагается способ определения того, содержит ли образец GDF11, включающий приведение в контакт белков из образца с аптамером, описанным в данном документе. В некоторых вариантах реализации изобретения образец содержит GDF8. В некоторых вариантах реализации изобретения способ включает приведение в контакт образца с аптамером в жестких условиях. В некоторых вариантах реализации изобретения жесткие условия включают полианионный ингибитор. В некоторых вариантах реализации изобретения полианионный ингибитор выбран из декстрансульфата, гепарина, Z-блока, поли-dI/dC, озвученной ультразвуком или деградированной в результате гидродинамического сдвига ДНК из молок лососевых, ДНК из тимуса теленка и дНТФ.
[020] В некоторых вариантах реализации изобретения образец представляет собой образец, взятый у человека. В некоторых вариантах реализации изобретения образец выбран из образца крови, сыворотки, плазмы, слюны, мочи и ткани. В некоторых вариантах реализации изобретения образец ткани выбран из ткани сердечной мышцы, ткани скелетных мышц, ткани поджелудочной железы, хрящевой ткани и нервной ткани.
[021] В некоторых вариантах реализации изобретения белки отделяли по меньшей мере от одного другого компонента образца. В некоторых вариантах реализации изобретения белки не отделяли от других компонентов образца.
[022] В некоторых вариантах реализации изобретения предлагаются композиции, содержащие аптамер, описанный в данном документе, и белки из образца. В некоторых вариантах реализации изобретения образец содержит GDF8. В некоторых вариантах реализации изобретения композиция содержит полианионный ингибитор. В некоторых вариантах реализации изобретения полианионный ингибитор выбран из декстрансульфата, гепарина, Z-блока, поли-dI/dC, озвученной ультразвуком или деградированной в результате гидродинамического сдвига ДНК из молок лососевых, ДНК из тимуса теленка и дНТФ. В некоторых вариантах реализации изобретения образец представляет собой образец, взятый у человека. В некоторых вариантах реализации изобретения образец выбран из образца крови, сыворотки, плазмы, слюны, мочи и ткани. В некоторых вариантах реализации изобретения образец ткани выбран из ткани сердечной мышцы, ткани скелетных мышц, ткани поджелудочной железы, хрящевой ткани и нервной ткани. В некоторых вариантах реализации изобретения белки отделяли по меньшей мере от одного другого компонента образца. В некоторых вариантах реализации изобретения белки не отделяли от других компонентов образца.
[023] В другом аспекте аптамер составляет по меньшей мере 25 нуклеотидов в длину. В другом аспекте аптамер составляет по меньшей мере 30 нуклеотидов в длину. В другом аспекте аптамер составляет по меньшей мере 40 нуклеотидов в длину. В другом аспекте аптамер составляет от около 40 до около 100 нуклеотидов в длину (или от 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 нуклеотидов в длину).
[024] Настоящее изобретение дополнительно относится к композиции, содержащей аптамер и белок GDF11, при этом аптамер и белок GDF11 связаны нековалентной связью.
[025] Указанные выше и другие цели, признаки и преимущества данного изобретения станут более очевидными из последующего подробного описания, которое идет со ссылкой на прилагаемые графические материалы.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[026] На Фиг. 1 проиллюстрировано сравнение аффинностей связывания аптамерного клона 12060-28_3 для белка GDF11 человека и белка миостатина (GDF8) человека в присутствии или в отсутствие полианионного ингибитора (Z-блок). Ось x показывает концентрации для соответствующих белков, а ось y показывает процент связанного с белком аптамера (1,0-100%).
[027] На Фиг. 2 проиллюстрировано сравнение аффинностей связывания аптамера 12058-6_3 для белка GDF11 человека и белка миостатина (GDF8) человека в присутствии или в отсутствие полианионного ингибитора (Z-блок). Ось x показывает концентрации для соответствующих белков, а ось y показывает процент связанного с белком клона аптамера (1,0-100%).
[028] На Фиг. 3 проиллюстрирован анализ усечения аптамерного клона 12060-28_3 (50-мерная последовательность) и аффинность связывания каждой последовательности для GDF11.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Термины и способы
[029] Хотя данное изобретение будет описано в сочетании с некоторыми типичными вариантами реализации, следует понимать, что данное изобретение определено формулой изобретения и не ограничено этими вариантами реализации.
[030] Специалисту в данной области техники будет понятно, что многие способы и материалы, аналогичные или эквивалентные тем, которые описаны в данном документе, могут применяться при практическом осуществлении настоящего изобретения. Настоящее изобретение никаким образом не ограничено описанными способами и материалами.
[031] Если не указано иное, используемые в данном документе технические и научные термины имеют такое значение, которое обычно под ними подразумевается специалистом в области техники, к которой относится данное изобретение. Определения распространенных терминов в молекулярной биологии можно найти в публикациях Benjamin Lewin, Genes V, под издательством Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, под издательством Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); и Robert A. Meyers (ed.), Molecular Biology and Biotechnology: a Comprehensive Desk Reference, под издательством VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8). Хотя для практической реализации данного изобретения можно применять любые способы, устройства и материалы, аналогичные или эквивалентные тем, которые описаны в данном документе, в данном документе описаны некоторые способы, устройства и материалы.
[032] Все публикации, опубликованные патентные документы и заявки на патенты, цитируемые в данном документе, включены в данный документ посредством ссылки в той же степени, как если бы каждая отдельная публикация, опубликованный патентный документ или патентная заявка были бы специально и отдельно указаны как включенные посредством ссылки.
[033] При использовании в данной заявке и прилагаемой формуле изобретения, формы единственного числа включают множественное число, если из контекста явно не следует иное, и могут использоваться взаимозаменяемо со словосочетаниями "по меньшей мере один" и "один или более". Таким образом, указание на "аптамер" включает смеси аптамеров, указание на "зонд" включает смеси зондов и тому подобное.
[034] При использовании по тексту данного документа, термины "состоит", "состоящий", "включает", "включающий", "содержит", "содержащий" и любые их варианты подразумевают включение без каких-либо ограничений, т. е. процесс, способ, изделие, характеризуемое способом его получения, или композиция вещества, которая состоит, включает или содержит элемент или перечень элементов, могут включать другие элементы, не указанные явным образом.
[035] Кроме того, следует понимать, что все размеры оснований или размеры аминокислот, а также все значения молекулярного веса или молекулярной массы, приведенные для нуклеиновых кислот или полипептидов, являются приблизительными и приведены с целью описания.
[036] Чтобы облегчить рассмотрение различных вариантов реализации изобретения, предоставляются следующие пояснения к конкретным терминам:
[037] Аптамер: При использовании по тексту данного документа, термин "аптамер" относится к нуклеиновой кислоте, которая обладает специфической аффинностью связывания с молекулой-мишенью. Признается, что аффинные взаимодействия являются вопросом степени; тем не менее, в данном контексте "специфическая аффинность связывания" аптамера с его мишенью означает, что аптамер, как правило, связывается со своей мишенью с гораздо более высокой степенью аффинности, чем он связывается с другими компонентами в образце для испытаний. "Аптамер" представляет собой набор копий одного типа или вида молекулы нуклеиновой кислоты, которая имеет конкретную нуклеотидную последовательность. Аптамер может содержать любое подходящее количество нуклеотидов, в том числе любое количество химически модифицированных нуклеотидов. Термин "аптамеры" относится к более чем одному такому набору молекул. Разные аптамеры могут иметь одинаковое или разное количество нуклеотидов. Аптамеры могут представлять собой ДНК или РНК, или химически модифицированные нуклеиновые кислоты, и могут быть одноцепочечными, двухцепочечными или содержать двухцепочечные области, и могут включать более высокоупорядоченные структуры. Аптамер может также представлять собой фотоаптамер, где в аптамер включена фотореактивная или реакционноспособная функциональная группа, чтобы позволять ему ковалентно связываться с его соответствующей мишенью. Любой из описанных в данном документе аптамерных способов может включать использование двух или более аптамеров, которые специфически связывают одну и ту же молекулу-мишень. Как дополнительно описано ниже, аптамер может содержать метку. Если аптамер содержит метку, необязательно все копии данного аптамера должны иметь такую же метку. Более того, если разные аптамеры содержат метку, эти разные аптамеры могут иметь либо одинаковую метку, либо разную метку.
[038] Аптамер можно идентифицировать любым известным способом, в том числе способом SELEX. После идентификации аптамер можно получить или синтезировать в соответствии с любым известным методом, включая методы химического синтеза и методы ферментативного синтеза.
[039] Аптамер GDF11: Аптамер GDF11, при использовании по тексту данного документа, относится к аптамеру, который способен связываться со зрелым белком GDF11. Неограничивающий типовой зрелый белок GDF11 человека показан ниже (аминокислоты 299-407 UniProtKB/Swiss-Prot: O95390.1):
L GLDCDEHSSE SRCCRYPLTV DFEAFGWDWI IAPKRYKANY CSGQCEYMFM QKYPHTHLVQ QANPRGSAGP CCTPTKMSPI NMLYFNDKQQ IIYGKIPGMV VDRCGCS (SEQ ID №: 118).
В некоторых вариантах реализации изобретения аптамер GDF11 связывает GDF8 с аффинностью, которая по меньшей мере в 10 раз слабее, чем аффинность к GDF11. В некоторых вариантах реализации изобретения аптамер GDF11 не связывает GDF8. Неограничивающий типовой зрелый белок GDF8 человека показан ниже (аминокислоты 267-375 UniProtKB/Swiss-Prot: O14793.1):
FGL DCDEHSTESR CCRYPLTVDF EAFGWDWIIA PKRYKANYCS GECEFVFLQK YPHTHLVHQA NPRGSAGPCC TPTKMSPINM LYFNGKEQII YGKIPAMVVD RCGCS (SEQ ID №: 119).
[040] Ингибировать: Термин "ингибировать", при использовании по тексту данного документа, означает предотвращать или снижать экспрессию пептида или полипептида до такой степени, чтобы пептид или полипептид более не обладал измеримой активностью или биологической активностью; или снижать стабильность и/или снижать или предотвращать активность пептида или полипептида до такой степени, чтобы пептид или полипептид более не обладал измеримой активностью или биологической активностью. Как описано в данном документе, белок, который может ингибироваться, представляет собой GDF11.
[041] Нуклеиновая кислота: При использовании по тексту данного документа, термины "нуклеиновая кислота", "олигонуклеотид" и "полинуклеотид" используются взаимозаменяемо для обозначения полимера нуклеотидов и включают ДНК, РНК, гибриды ДНК/РНК и модификации этих видов нуклеиновых кислот, олигонуклеотидов и полинуклеотидов, при этом сюда входит присоединение различных элементов или фрагментов к нуклеотидным единицам в любом положении. Термины "полинуклеотид", "олигонуклеотид" и "нуклеиновая кислота" включают двух- или одноцепочечные молекулы, а также трехспиральные молекулы. Нуклеиновая кислота, олигонуклеотид и полинуклеотид являются более широкими терминами, чем термин аптамер, и поэтому термины нуклеиновая кислота, олигонуклеотид и полинуклеотид включают полимеры нуклеотидов, которые являются аптамерами, но термины нуклеиновая кислота, олигонуклеотид и полинуклеотид не ограничиваются аптамерами.
[042] Модифицированный: При использовании по тексту данного документа, термины "модифицировать", "модифицированный", "модификация" и любые их варианты, используемые в отношении олигонуклеотида, означают, что по меньшей мере одно из четырех составляющих нуклеотидных оснований (т.е. A, G, T/U и C) олигонуклеотида является аналогом или сложным эфиром природного нуклеотида. В некоторых вариантах реализации изобретения модифицированный нуклеотид придает олигонуклеотиду устойчивость к действию нуклеаз. В некоторых вариантах реализации изобретения модифицированные нуклеотиды приводят к преимущественно гидрофобным взаимодействиям аптамеров с белками-мишенями, что приводит к высокой эффективности связывания и стабильным комплексам сокристаллов. Примером модифицированного нуклеотида является пиримидин с замещением в положении C-5. Модификации могут включать модификации остова, метилирование, необычные комбинации спаривания оснований, такие как изомерные основания изоцитидина и изогуанидина, и тому подобное. Модификации также могут включать модификации 3-' и 5'-концов, такие как кэпирование. Другие модификации могут включать замещение одного или более природных нуклеотидов аналогом, межнуклеотидные модификации, такие как, например, модификации незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т. д.) и модификации заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т. д.), модификации интеркаляторами (например, акридином, псораленом и т. д.), модификации, содержащие хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы и т. д.), модификации, содержащие алкилирующие средства, модификации модифицированными связями (например, альфа-аномерные нуклеиновые кислоты и т. д.). Кроме того, любая из гидроксильных групп, обычно присутствующих в сахаре нуклеотида, может быть замещена, например, фосфонатной группой или фосфатной группой, защищена стандартными защитными группами; или активирована с образованием дополнительных связей с другими нуклеотидами или с твердой подложкой. 5'- и 3'-концевые ОН-группы могут быть фосфорилированы или замещены аминами, фрагментами органических кэпирующих групп, содержащими от около 1 до около 20 атомов углерода, полимерами полиэтиленгликоля (ПЭГ), в некоторых вариантах реализации изобретения, составляющими от около 10 до около 80 кДа, полимерами ПЭГ, в некоторых вариантах реализации изобретения, составляющими от около 20 до около 60 кДа, или другими гидрофильными или гидрофобными биологическими или синтетическими полимерами. В одном варианте реализации изобретения модификациями являются модификации в положении C-5 пиримидинов. Эти модификации могут быть получены посредством амидной связи непосредственно в положении С-5 или другими типами связей.
[043] Полинуклеотиды также могут содержать аналогичные формы рибозных или дезоксирибозных сахаров, как правило, известные в данной области техники, в том числе 2'-O-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидрибозу, карбоциклические аналоги сахаров, α-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и нуклеозидные аналоги с удаленными азотистыми основаниями, такие как метилрибозид. Как отмечено выше, одна или более фосфодиэфирных связей могут быть замещены альтернативными связывающими группами. Эти альтернативные связывающие группы включают варианты реализации, в которых фосфат замещен P(O)S ("тиоатом"), P(S)S ("дитиоатом"), (O)NR2 ("амидатом"), P(O)R, P(O)OR', CO или CH2 ("формацеталем"), где каждый заместитель R или R' независимо представляет собой Н или замещенный или незамещенный алкил (1-20 С), необязательно содержащий эфирную (-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралкил. Необязательно, чтобы все связи в полинуклеотиде были идентичными. Замещение аналогичных форм сахаров, пуринов и пиримидинов может быть целесообразным при создании конечного продукта, как и альтернативные структуры остова, такие как, например, остов полиамида.
[044] Нуклеаза: При использовании по тексту данного документа, термин "нуклеаза" относится к ферменту, способному расщеплять фосфодиэфирную связь между нуклеотидными субъединицами олигонуклеотида. При использовании по тексту данного документа, термин "эндонуклеаза" относится к ферменту, который расщепляет фосфодиэфирную связь (связи) во внутреннем по отношению к олигонуклеотиду участке. При использовании по тексту данного документа, термин "экзонуклеаза" относится к ферменту, который расщепляет фосфодиэфирную связь (связи), связывающую концевые нуклеотиды олигонуклеотида. Биологические жидкости, как правило, содержат смесь как эндонуклеаз, так и экзонуклеаз.
[045] При использовании по тексту данного документа, термин "устойчивый к действию нуклеаз" и "устойчивость к действию нуклеаз" относится к сниженной способности олигонуклеотида служить в качестве субстрата для эндо- или экзонуклеазы, т. е. при контактировании с таким ферментом олигонуклеотид либо не деградирует, либо деградирует медленнее, чем олигонуклеотид, состоящий из немодифицированных нуклеотидов.
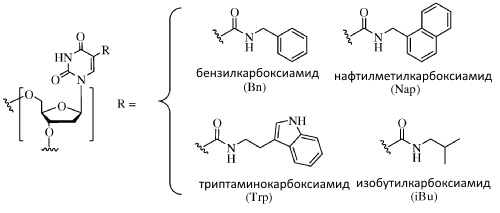
[046] C-5-модифицированный пиримидин: При использовании по тексту данного документа, термин "C-5-модифицированный пиримидин" относится к пиримидину с модификацией в положении C-5, включая, без ограничения ими, те фрагменты, которые проиллюстрированы в данном документе. Примеры C-5-модифицированного пиримидина включают примеры, описанные в патентах США № 5719273 и № 5945527. Примеры C-5-модификации включают замещение дезоксиуридина в положении C-5 заместителем, независимо выбранным из: бензилкарбоксиамида (в альтернативном варианте бензиламинокарбонила) (Bn), нафтилметилкарбоксиамида (в альтернативном варианте нафтилметиламинокарбонила) (Nap), триптаминокарбоксиамида (в альтернативном варианте триптаминокарбонила) (Trp), фенэтилкарбоксиамида (в альтернативном варианте фенэтиламинокарбонила) (Pe), тиофенилметилкарбоксиамида (в альтернативном варианте тиофенилметиламинокарбонила) (Th) и изобутилкарбоксиамида (в альтернативном варианте изобутиламинокарбонила) (iBu), как проиллюстрировано непосредственно ниже.
[047] Химические модификации C-5-модифицированного пиримидина также можно комбинировать, по отдельности или в любой комбинации, с модификациями сахаров в 2'-положении, модификациями в экзоциклических аминах, а также замещением 4-тиуридина и тому подобным.
[048] Типичные C-5-модифицированные пиримидины включают: 5-(N-бензилкарбоксиамид)-2'-дезоксиуридин (BndU), 5-(N-бензилкарбоксиамид)-2'-O-метилуридин, 5-(N-бензилкарбоксиамид)-2'-фторуридин, 5-(N-изобутилкарбоксиамид))-2'-дезоксиуридин (iBudU), 5-(N-изобутилкарбоксиамид)-2'-O-метилуридин, 5-(N-фенэтилкарбоксиамид)-2'-дезоксиуридин (PedU), 5-(N-тиофенилметилкарбоксиамид)-2-дезоксиуридин (ThdU), 5-(N-изобутилкарбоксиамид)-2'-фторуридин, 5-(N-триптаминокарбоксиамид)-2'-дезоксиуридин (TrpdU), 5-(N-триптаминокарбоксиамид)-2'-O-метилуридин, 5-(N-триптаминокарбоксиамид)-2'-фторуридин, 5-(N-[1-(3-триметиламмоний)пропил]карбоксиамид)-2'-дезоксиуридинхлорид, 5-(N-нафтилметилкарбоксиамид)-2'-дезоксиуридин (NapdU), 5-(N-нафтилметилкарбоксиамид)-2'-O-метилуридин, 5-(N-нафтилметилкарбоксиамид)-2'-фторуридин или 5-(N-[1-(2,3-дигидроксипропил)]карбоксиамид)-2'-дезоксиуридин).
[049] Нуклеотиды могут быть модифицированы либо до, либо после синтеза олигонуклеотида. Последовательность нуклеотидов в олигонуклеотиде может быть прервана одним или более ненуклеотидными компонентами. Модифицированный олигонуклеотид может быть дополнительно модифицирован после полимеризации, и, в частности, например, посредством конъюгации с любым подходящим компонентом для мечения.
[050] При использовании по тексту данного документа, термин "по меньшей мере один пиримидин", если речь идет о модификациях нуклеиновой кислоты, относится к одному, нескольким или всем пиримидинам в нуклеиновой кислоте, указывая на то, что любой или все случаи любого или всех C, T или U в нуклеиновой кислоте могут быть модифицированы или не модифицированы.
[051] Модулировать: Термин "модулировать", при использовании по тексту данного документа, означает изменять уровень экспрессии пептида, белка или полипептида посредством увеличения или уменьшения уровня их экспрессии относительно эталонного уровня экспрессии и/или изменять стабильность и/или активность пептида, белка или полипептида посредством увеличения или уменьшения уровня их стабильности и/или активности относительно эталонного уровня стабильности и/или активности.
[052] Фармацевтически приемлемый: Термин "фармацевтически приемлемый", при использовании по тексту данного документа, означает одобренный органами государственного регулирования федерального правительства или правительства штата или входящий в список Фармакопеи США или других общепризнанных фармакопей для использования на животных и, более конкретно, на людях.
[053] Фармацевтически приемлемая соль: Фармацевтически приемлемая соль или соль соединения (например, аптамера), при использовании по тексту данного документа, относится к продукту, который содержит ионную связь и, как правило, получают посредством взаимодействия соединения либо с кислотой, либо с основанием, пригодным для введения индивидууму. Фармацевтически приемлемая соль может включать, без ограничения ими, кислотно-аддитивные соли, в том числе гидрохлориды, гидробромиды, фосфаты, сульфаты, кислые сернокислые соли, алкилсульфонаты, арилсульфонаты, арилалкилсульфонаты, ацетаты, бензоаты, цитраты, малеаты, фумараты, сукцинаты, лактаты и тартраты; катионы щелочных металлов, таких как Li, Na, K, соли щелочноземельных металлов, таких как Mg или Ca, или соли органических аминов.
[054] Фармацевтическая композиция: Термин "фармацевтическая композиция", при использовании по тексту данного документа, относится к препарату, содержащему аптамер GDF11 в форме, подходящей для введения индивидууму. Фармацевтическую композицию, как правило, готовят таким образом, чтобы она была совместима с предполагаемым способом введения. Примеры способов введения включают, без ограничения ими, пероральное и парентеральное, например, внутривенное, внутрикожное, подкожное, ингаляционное, местное, чрескожное, чресслизистое и ректальное введение.
[055] SELEX: Термины "SELEX" и "способ SELEX" взаимозаменяемо используются в данном документе, как правило, для обозначения комбинации (1) отбора аптамеров, которые подходящим образом взаимодействуют с молекулой-мишенью, например, с высокой степенью аффинности связываются с белком, с (2) амплификацией этих выбранных нуклеиновых кислот. Способ SELEX может использоваться для идентификации аптамеров с высокой аффинностью к конкретной мишени или биомаркеру.
[056] Идентичность последовательностей: Термин "идентичность последовательностей", при использовании по тексту данного документа, в контексте двух или более последовательностей нуклеиновых кислот является функцией от количества идентичных нуклеотидных положений, общих для сравниваемых последовательностей (т.е. % идентичности=количество идентичных положений/общее количество положений × 100), с учетом количества гэпов и длины каждого гэпа, которые необходимо ввести для оптимизации выравнивания двух или более последовательностей. Сравнение последовательностей и определение процента идентичности между двумя или более последовательностями может быть выполнено с помощью математического алгоритма, такого как программы BLAST и Gapped BLAST с их параметрами по умолчанию (например, Altschul et al., J. Mol. Biol. 215:403, 1990; см. также BLASTN на www.ncbi.nlm.nih.gov/BLAST). При сравнении последовательностей, как правило, одна последовательность выполняет функцию эталонной последовательности, с которой сравниваются исследуемые последовательности. При использовании алгоритма сравнения последовательностей в компьютер вводят исследуемую и эталонную последовательности, в случае необходимости задают координаты подпоследовательностей и задают программные параметры алгоритма последовательности. Затем на основании заданных программных параметров алгоритм сравнения последовательностей рассчитывает процент идентичности последовательностей для исследуемой последовательности (последовательностей) относительно эталонной последовательности. Оптимальное выравнивание последовательностей для сравнения может быть выполнено, например, с помощью алгоритма локальной гомологии согласно Смита и Ватермана, Adv. Appl. Math., 2:482, 1981, с помощью алгоритма гомологичного выравнивания согласно Нидлмана и Вунша, J. Mol. Biol., 48:443, 1970, посредством поиска методом подобия согласно Пирсону и Липмана, Proc. Nat'l. Acad. Sci. USA 85:2444, 1988, посредством компьютеризированной реализации этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics, Genetics Computer Group, 575 Science Dr., Мэдисон, штат Висконсин) или посредством визуального изучения (см. в основном Ausubel, F. M. et al., Current Protocols in Molecular Biology, под изд. Greene Publishing Assoc. и Wiley-Interscience (1987)). При использовании по тексту данного документа, при описании процента идентичности нуклеиновой кислоты, такой как аптамер GDF11, последовательность которого по меньшей мере, например, на около 95% идентична относительно эталонной нуклеотидной последовательности, подразумевается, что нуклеотидная последовательность является идентичной относительно эталонной последовательности, за исключением того, что данная нуклеотидная последовательность может содержать до пяти точечных мутаций на каждые 100 нуклеотидов эталонной нуклеотидной последовательности. Иными словами, чтобы получить необходимую нуклеотидную последовательность, последовательность которой по меньшей мере на 95% идентична относительно эталонной нуклеотидной последовательности, до 5% нуклеотидов в эталонной последовательности могут быть удалены или замещены другим нуклеотидом, или некоторое количество нуклеотидов, составляющее до 5% от общего количества нуклеотидов в эталонной последовательности, может быть вставлено в эталонную последовательность (в данном документе такая модификация называется инсерцией). Эти мутации эталонной последовательности для получения необходимой последовательности могут встречаться в 5'- или 3'-концевых положениях эталонной нуклеотидной последовательности или в любом месте между этими концевыми положениями, будучи вставленными либо отдельно среди нуклеотидов в эталонной последовательности, либо в одной или более смежных группах в пределах эталонной последовательности.
[057] SOMAмер: Термин "SOMAмер", при использовании по тексту данного документа, относится к аптамеру, обладающему улучшенными характеристиками скорости диссоциации. В альтернативном варианте SOMAмеры называются как модифицированные аптамеры с низкой скоростью диссоциации, и могут выбираться с помощью улучшенных способов SELEX, описанных в опубликованной заявке на патент США № 20090004667, под названием "Method for Generating Aptamers with Improved Off-Rates", которая включена посредством ссылки в полном объеме. В некоторых вариантах реализации изобретения аптамер с низкой скоростью диссоциации (в том числе аптамеры, содержащие по меньшей мере один нуклеотид с гидрофобной модификацией) имеет скорость диссоциации (t½), составляющую ≥ 2 минут, ≥ 4 минут, ≥ 5 минут, ≥ 8 минут, ≥ 10 минут, ≥ 15 минут, ≥ 30 минут, ≥ 60 минут, ≥ 90 минут, ≥ 120 минут, ≥ 150 минут, ≥ 180 минут, ≥ 210 минут или ≥ 240 минут.
[058] Молекула-мишень: Термины "мишень", "молекула-мишень" и "анализируемое вещество" взаимозаменяемо используются в данном документе для обозначения любой представляющей интерес молекулы, которая может присутствовать в образце. Данный термин включает любое незначительное изменение конкретной молекулы, такое как, в случае белка, например, незначительное изменение в аминокислотной последовательности, образование дисульфидной связи, гликозилирование, липидизация, ацетилирование, фосфорилирование или любая другая манипуляция или модификация, такая как конъюгация с компонентом для мечения, которая, по сути, не изменяет идентичность молекулы. Термин "молекула-мишень", "мишень" или "анализируемое вещество" относится к набору копий одного типа или вида молекулы или многомолекулярной структуры. Термины "молекулы-мишени", "мишени" и "анализируемые вещества" относятся более чем к одному типу или виду молекулы или многомолекулярной структуры. Типовые молекулы-мишени включают белки, полипептиды, нуклеиновые кислоты, углеводы, липиды, полисахариды, гликопротеины, гормоны, рецепторы, антигены, антитела, аффитела, миметики антител, вирусы, патогенные микроорганизмы, токсичные вещества, субстраты, метаболиты, аналоги переходного состояния, кофакторы, ингибиторы, лекарственные средства, красители, питательные вещества, факторы роста, клетки, ткани и любой фрагмент или часть любого из указанного выше. В некоторых вариантах реализации изобретения молекула-мишень представляет собой белок, и в этом случае молекула-мишень может называться " белком-мишенью".
[059] Полианионный ингибитор: Полианионный ингибитор представляет собой молекулу-ингибитор, которая содержит или имитирует полианионный фосфатный остов молекулы нуклеиновой кислоты. В некоторых вариантах реализации изобретения полианионный ингибитор включен в реакцию связывания с аптамером для повышения жесткости условий связывания. Неограничивающие типовые полианионные ингибиторы включают декстрансульфат, гепарин, Z-блок, поли-dI/dC, озвученную ультразвуком или деградированную в результате гидродинамического сдвига ДНК из молок лососевых, ДНК из тимуса теленка, дНТФ и тому подобное.
[060] Z-блок: Z-блок, при использовании по тексту данного документа, представляет собой одноцепочечный олигонуклеотид последовательности 5'-(AC-BndU-BndU)7-AC-3', где BndU обозначает бензилзамещенный дезоксиуридиновый остаток. Z-блок может быть синтезирован с использованием обычной фосфорамидитной химии.
[061] Следует понимать, что приведенные в данном документе диапазоны подразумевают все значения в пределах данного диапазона. Например, следует понимать, что диапазон от 1 до 50 включает любое число, комбинацию чисел или поддиапазон от 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50 (а также их доли, если из контекста явно не следует иное). Следует понимать, что любой диапазон концентраций, процентный диапазон, диапазон коэффициентов или диапазон целых чисел включает значение любого целого числа в пределах приведенного диапазона, и при необходимости, его дробных частей (таких как одна десятая и одна сотая целого числа), если не указано иное. Кроме того, следует понимать, что любой диапазон чисел, приведенный в данном документе, относящийся к любому физическому признаку, такому как полимерные субъединицы, размер или толщина, включает любое целое число в пределах приведенного диапазона, если не указано иное. При использовании по тексту данного документа, термин "около" или "состоящий, по сути, из" означает ± 20% от указанного диапазона, значения или структуры, если не указано иное. При использовании по тексту данного документа, термины "включать" и "содержать" являются неограничивающими и используются в качестве синонимов. Следует понимать, что используемые в данном документе формы терминов в единственном числе относятся к "одному или более" перечисленным компонентам. Следует понимать, что использование альтернативы (например, "или") означает либо одну, либо обе, либо любую комбинацию из этих альтернатив.
II. Обзор
А. Белки - ростовой фактор дифференцировки 11 (GDF11) и миостатин (GDF8)
[062] Нативные зрелые формы GDF11 и миостатина являются гомодимерами и на около 90% идентичными при выравнивании последовательностей, имея 98 из 109 совпадающих аминокислотных остатков. См. выравнивание аминокислотных последовательностей для GDF11 (ID белка 095390, аминокислоты 1-407, SEQ ID №: 4) и миостатина (ID белка 014793, аминокислоты 1-375, SEQ ID №: 5), с обозначением зрелой формы серой полосой. Выравнивание аминокислотных последовательностей GDF11 и препропептидов миостатина показано ниже. Зрелые части белков выделены серой полосой.

[063] Считается, что GDF11 и GDF8 имеют общее происхождение и общий регуляторный механизм, но все же отличаются в отношении их тканевой специфичности (преимущественно сердечной и мышечной, соответственно).
[064] Зрелый GDF11 на 100% идентичен у человека и мыши и на 99% идентичен у крысы. Выравнивание аминокислотных последовательностей (зрелого) белка GDF11 человека, мыши и крысы показано ниже. ID белка GDF11 человека - O95390; типовой зрелый GDF11 человека показан ниже; SEQ ID №: 6). ID белка GDF11 мыши - Q9Z1W4; типовой зрелый GDF8 мыши показан ниже; SEQ ID №: 7). ID белка GDF11 крысы - Q9Z217; типовой зрелый GDF8 крысы показан ниже; SEQ ID №: 8).

[065] Миостатин (GDF8) на 100% идентичен у человека, мыши и крысы. Выравнивание аминокислотных последовательностей (зрелого) белка миостатина человека, мыши и крысы показано ниже. ID белка миостатина GDF8 человека - O14793; типовой зрелый GDF8 человека показан ниже; SEQ ID №: 9). ID белка GDF8 мыши - O08689; типовой зрелый GDF8 мыши показан ниже; SEQ ID №: 10). ID белка GDF11 крысы - O35312; типовой зрелый GDF8 крысы показан ниже; SEQ ID №: 11).

Б. SELEX
[066] SELEX, как правило, включает получение кандидатной смеси нуклеиновых кислот, связывание кандидатной смеси с необходимой молекулой-мишенью с образованием аффинного комплекса, отделение аффинных комплексов от несвязанных кандидатных нуклеиновых кислот, отделение и выделение нуклеиновой кислоты из аффинного комплекса, очистка нуклеиновой кислоты и идентификация конкретной последовательности аптамера. Данный способ может включать несколько циклов для дополнительного улучшения аффинности выбранного аптамера. Данный способ может включать этапы амплификации на одной или более стадиях способа. См., например, патент США № 5475096 под названием "Nucleic Acid Ligands". Способ SELEX можно использовать для создания аптамера, который ковалентно связывает свою мишень, а также аптамера, который нековалентно связывает свою мишень. См., например, патент США № 5705337 под названием "Systematic Evolution of Nucleic Acid Ligands by Exponential Enrichment: Chemi-SELEX".
[067] Способ SELEX можно использовать для идентификации высокоаффинных аптамеров, содержащих модифицированные нуклеотиды, которые придают аптамеру улучшенные характеристики, такие как, например, улучшенная стабильность in vivo или улучшенные характеристики доставки. Примеры таких модификаций включают химические замещения в положениях рибозы и/или фосфата, и или оснований. Идентифицированные способом SELEX аптамеры, содержащие модифицированные нуклеотиды, описаны в патенте США № 5660985 под названием "High Affinity Nucleic Acid Ligands Containing Modified Nucleotides", в котором описаны олигонуклеотиды, содержащие производные нуклеотидов, химически модифицированные в 5'- и 2'-положениях пиримидинов. В патенте США № 5580737, см. выше, описаны высокоспецифичные аптамеры, содержащие один или более нуклеотидов, модифицированных по 2'-амино (2'-NH2), 2'-фтор (2'-F) и/или 2'-O-метил (2'-OMe). См. также публикацию заявки на патент США № 20090098549 под названием "SELEX and PHOTOSELEX", в которой описаны библиотеки нуклеиновых кислот, обладающих расширенными физическими и химическими свойствами, и их использование в SELEX и photoSELEX.
[068] SELEX также можно использовать для идентификации аптамеров, обладающих необходимыми характеристиками скорости диссоциации. См. публикацию заявки на патент США № 20090004667 под названием "Method for Generating Aptamers with Improved Off-Rates", в которой описаны улучшенные способы SELEX для создания аптамеров, которые могут связываться с молекулами-мишенями. Как упоминалось выше, эти аптамеры с низкой скоростью диссоциации известны как "SOMAмеры". Описываются способы получения аптамеров или SOMAмеров, а также фотоаптамеры или SOMAмеры, обладающие более низкими скоростями диссоциации, из их соответствующих молекул-мишеней. Данные способы включают приведение кандидатной смеси в контакт с молекулой-мишенью с обеспечением возможности образования комплексов нуклеиновая кислота-мишень и осуществление способа увеличения низкой скорости диссоциации, при этом комплексы нуклеиновая кислота-мишень с высокими скоростями диссоциации будут диссоциировать и не улучшатся, тогда как комплексы с низкими скоростями диссоциации останутся неизменными. Кроме того, данные способы включают использование модифицированных нуклеотидов при получении смесей кандидатных нуклеиновых кислот для создания аптамеров или SOMAмеров с улучшенными характеристиками скорости диссоциации.
[069] В варианте этого анализа используют аптамеры, которые содержат фотореактивные функциональные группы, позволяющие аптамерам ковалентно связывать или "фотосшивать" их молекулы-мишени. См., например, патент США № 6544776 под названием "Nucleic Acid Ligand Diagnostic Biochip". Эти фотореактивные аптамеры также называются фотоаптамерами. См., например, патент США № 5763177, патент США № 6001577 и патент США № 6291184, каждый из которых носит название "Systematic Evolution of Nucleic Acid Ligands by Exponential Enrichment: Photoselection of Nucleic Acid Ligands and Solution SELEX"; см. также, например, патент США № 6458539 под названием "Photoselection of Nucleic Acid Ligands". После того, как микрочип приводят в контакт с образцом, и фотоаптамеры получили возможность связываться с их молекулами-мишенями, фотоаптамеры фотоактивируют, а твердую подложку промывают с удалением любых неспецифически связанных молекул. Могут использоваться жесткие условия промывки, так как молекулы-мишени, которые связаны с фотоаптамерами, как правило, не удаляются из-за ковалентных связей, созданных фотоактивированной функциональной группой (группами) на фотоаптамерах.
[070] В обоих из этих аналитических форматов аптамеры или SOMAмеры иммобилизуют на твердой подложке до приведения в контакт с образцом. Тем не менее, в определенных обстоятельствах иммобилизация аптамеров или SOMAмеров до приведения в контакт с образцом может не обеспечивать оптимальный анализ. Например, предварительная иммобилизация аптамеров или SOMAмеров может приводить к неэффективному смешиванию аптамеров или SOMAмеров с молекулами-мишенями на поверхности твердой подложки, предположительно приводя к продолжительному времени реакции и, следовательно, к увеличению периодов инкубации для обеспечения эффективного связывания аптамеров или SOMAмеров с их молекулами-мишенями. Кроме того, при использовании в анализе фотоаптамеров или фотоSOMAмеров и в зависимости от материала, используемого в качестве твердой подложки, твердая подложка может иметь тенденцию к рассеиванию или поглощению света, используемого для образования ковалентных связей между фотоаптамерами или фотоSOMAмерами и их молекулами-мишенями. Кроме того, в зависимости от используемого способа, детектирование молекул-мишеней, связанных с их аптамерами или фотоSOMAмерами, может иметь склонность к неточности, поскольку поверхность твердой подложки может также подвергаться воздействию и находиться под влиянием любых используемых средств для мечения. Наконец, иммобилизация аптамеров или SOMAмеров на твердой подложке, как правило, включает этап подготовки аптамеров или SOMAмеров (т.е. иммобилизацию) до воздействия аптамеров или SOMAмеров на образец, и этот этап подготовки может оказывать воздействие на активность или функциональность данных аптамеров или SOMAмеров.
[071] Также были описаны анализы SOMAмеров (см. публикацию заявки на патент США № 20090042206 под названием "Multiplexed Analyses of Test Samples"), которые позволяют SOMAмерам иммобилизовать свою мишень в растворе, а затем применять этапы разделения, которые предназначены для удаления конкретных компонентов смеси SOMAмер-мишень до детектирования. Описанные методы анализа SOMAмеров обеспечивают возможность детектирования и определения количества ненуклеиново-кислотной мишени (например, белка-мишени) в образце для испытаний посредством осуществления детектирования и определения количества нуклеиновой кислоты (т.е. SOMAмера). Описанные методы позволяют создание суррогата нуклеиновой кислоты (т.е. SOMAмера) для детектирования и определения количества ненуклеиново-кислотной мишени, таким образом, обеспечивая возможность применения широкого спектра технологий нуклеиновых кислот, в том числе амплификации, к более широкому спектру необходимых мишеней, в том числе к белкам-мишеням.
[072] Варианты реализации способа SELEX, в котором мишенью является пептид, описаны в патенте США № 6376190 под названием "Modified SELEX Processes Without Purified Protein". В данном случае мишенью является белок GDF11.
В. Химически модифицированные аптамеры
[073] Аптамеры могут содержать модифицированные нуклеотиды, которые улучшают их свойства и характеристики. Неограничивающие примеры таких улучшений включают устойчивость in vivo, устойчивость к деградации, аффинность связывания со своей мишенью и/или улучшенные характеристики доставки.
[074] Примеры таких модификаций включают химические замещения в положениях рибозы и/или фосфата, и или оснований нуклеотида. Идентифицированные способом SELEX аптамеры, содержащие модифицированные нуклеотиды, описаны в патенте США № 5660985 под названием "High Affinity Nucleic Acid Ligands Containing Modified Nucleotides", в котором описаны олигонуклеотиды, содержащие производные нуклеотидов, химически модифицированные в 5'- и 2'-положениях пиримидинов. В патенте США № 5580737, см. выше, описаны высокоспецифичные аптамеры, содержащие один или более нуклеотидов, модифицированных по 2'-амино (2'-NH2), 2'-фтор (2'-F) и/или 2'-O-метил (2'-OMe). См. также публикацию заявки на патент США № 20090098549 под названием "SELEX and PHOTOSELEX", в которой описаны библиотеки нуклеиновых кислот, обладающих расширенными физическими и химическими свойствами, и их использование в SELEX и photoSELEX.
[075] Конкретные примеры C-5-модификации включают замещение дезоксиуридина в положении C-5 заместителем, независимо выбранным из: бензилкарбоксиамида (в альтернативном варианте бензиламинокарбонила) (Bn), нафтилметилкарбоксиамида (в альтернативном варианте нафтилметиламинокарбонила) (Nap), триптаминокарбоксиамида (в альтернативном варианте триптаминокарбонила) (Trp) и изобутилкарбоксиамида (в альтернативном варианте изобутиламинокарбонила) (iBu), как проиллюстрировано непосредственно ниже.
[076] Химические модификации C-5-модифицированного пиримидина также можно комбинировать, по отдельности или в любой комбинации, с модификациями сахаров в 2'-положении, модификациями в экзоциклических аминах, а также замещением 4-тиуридина и тому подобным.
[077] Типичные C-5-модифицированные пиримидины включают: 5-(N-бензилкарбоксиамид)-2'-дезоксиуридин (BndU), 5-(N-бензилкарбоксиамид)-2'-O-метилуридин, 5-(N-бензилкарбоксиамид)-2'-фторуридин, 5-(N-изобутилкарбоксиамид)-2'-дезоксиуридин (iBudU), 5-(N-изобутилкарбоксиамид)-2'-O-метилуридин, 5-(N-изобутилкарбоксиамид)-2'-фторуридин, 5-(N-триптаминокарбоксиамид)-2'-дезоксиуридин (TrpdU), 5-(N-триптаминокарбоксиамид)-2'-O-метилуридин, 5-(N-триптаминокарбоксиамид)-2'-фторуридин, 5-(N-[1-(3-триметиламмоний)пропил]карбоксиамид)-2'-дезоксиуридинхлорид, 5-(N-нафтилметилкарбоксиамид)-2'-дезоксиуридин (NapdU), 5-(N-нафтилметилкарбоксиамид)-2'-O-метилуридин, 5-(N-нафтилметилкарбоксиамид)-2'-фторуридин или 5-(N-[1-(2,3-дигидроксипропил)]карбоксиамид)-2'-дезоксиуридин).
[078] Модификация нуклеотидной структуры, если таковая имеет место, может быть осуществлена до или после сборки полинуклеотида. Последовательность нуклеотидов может быть прервана ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, например, посредством конъюгации с компонентом для мечения.
[079] Дополнительные неограничивающие примеры модифицированных нуклеотидов (например, C-5-модифицированного пиримидина), которые могут быть включены в нуклеотидные последовательности по данному изобретению, включают следующие:
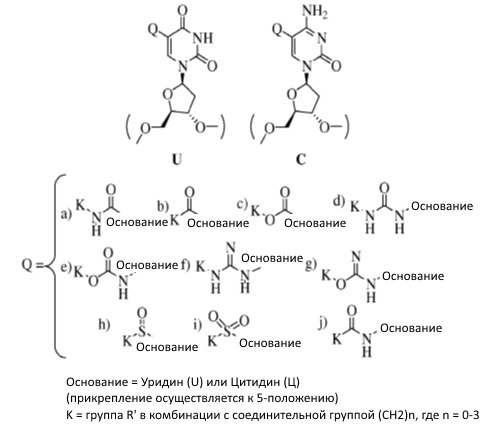
R' определяется следующим образом:
И, R'', R''' и R'''' определяются следующим образом:
где
R"" выбран из группы, состоящей из разветвленного или неразветвленного низшего алкила (C1-C20); галогена (F, Cl, Br, I); нитрила (CN); бороновой кислоты (BO2H2); карбоновой кислоты (COOH); сложного эфира карбоновой кислоты (COOR"); первичного амида (CONH2); вторичного амида (CONHR"); третичного амида (CONR"R"); сульфонамида (SO2NH2); N-алкилсульфонамида (SONHR").
где
R", R"' независимо выбраны из группы, состоящей из разветвленного или неразветвленного низшего алкила (C1-C20); фенила (C6H5); R""-замещенного фенильного кольца (R""C6H4); где R"" является таким, как определено выше; карбоновой кислоты (COOH); сложного эфира карбоновой кислоты (COOR"'"); где R"'" представляет собой разветвленный или неразветвленный низший алкил (C1-C20); и циклоалкила; где R"=R"'=(CH2)n; где n=2-10.
[080] Другие C-5-модифицированные пиримидиновые нуклеотиды включают следующие:
[081] В некоторых вариантах реализации изобретения модифицированный нуклеотид придает аптамеру устойчивость к действию нуклеаз. Примером модифицированного нуклеотида является пиримидин с замещением в положении C-5. Модификации могут включать модификации остова, метилирование, необычные комбинации спаривания оснований, такие как изомерные основания изоцитидина и изогуанидина, и тому подобное. Модификации также могут включать модификации 3-' и 5'-концов, такие как кэпирование. Другие модификации могут включать замещение одного или более природных нуклеотидов аналогом, межнуклеотидные модификации, такие как, например, модификации незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т. д.) и модификации заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т. д.), модификации интеркаляторами (например, акридином, псораленом и т. д.), модификации, содержащие хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы и т. д.), модификации, содержащие алкилирующие средства, модификации модифицированными связями (например, альфа-аномерные нуклеиновые кислоты и т. д.). Кроме того, любая из гидроксильных групп, обычно присутствующих в сахаре нуклеотида, может быть замещена, например, фосфонатной группой или фосфатной группой, защищена стандартными защитными группами; или активирована с образованием дополнительных связей с другими нуклеотидами или с твердой подложкой. 5'- и 3'-концевые ОН-группы могут быть фосфорилированы или замещены аминами, фрагментами органических кэппирующих групп, содержащими от около 1 до около 20 атомов углерода, полимерами полиэтиленгликоля (ПЭГ), составляющими от около 10 до около 80 кДа в одном варианте реализации изобретения, полимерами ПЭГ, составляющими от около 20 до около 60 кДа в другом варианте реализации изобретения, или другими гидрофильными или гидрофобными биологическими или синтетическими полимерами. В одном варианте реализации изобретения модификациями являются модификации в положении C-5 пиримидинов. Эти модификации могут быть получены посредством амидной связи непосредственно в положении С-5 или другими типами связей.
[082] Аптамеры также могут содержать аналогичные формы рибозных или дезоксирибозных сахаров, как правило, известные в данной области техники, в том числе 2'-O-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидрибозу, карбоциклические аналоги сахаров, α-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и нуклеозидные аналоги с удаленными азотистыми основаниями, такие как метилрибозид. Как отмечено выше, одна или более фосфодиэфирных связей могут быть замещены альтернативными связывающими группами. Эти альтернативные связывающие группы включают варианты реализации, в которых фосфат замещен P(O)S ("тиоатом"), P(S)S ("дитиоатом"), (O)NR2 ("амидатом"), P(O)R, P(O)OR', CO или CH2 ("формацеталем"), где каждый заместитель R или R' независимо представляет собой Н или замещенный или незамещенный алкил (1-20 С), необязательно содержащий эфирную (-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралкил. Необязательно, чтобы все связи в аптамере были идентичными. Замещение аналогичных форм сахаров, пуринов и пиримидинов может быть целесообразным при создании конечного продукта, как и альтернативные структуры остова, такие как, например, остов полиамида.
[083] Конкретные примеры C-5-модифицированных пиримидинов, которые могут быть включены или встроены в аптамер, включают, без ограничения ими, приведенные в данном документе структуры. Несмотря на то, что соглашение об именовании, используемое для структуры, предполагает, что X представляет собой -H (т.е. ДНК), они также включают структуры, где Х может представлять собой -OH (РНК) или другие заместители, описанные в данном документе (например, -OCH3; -O-аллил; -F, -OEt; -OPr, -NH2; -азидо или -OCH2CH2OCH3), R' может представлять собой -H; -OAc; -OBz; -OCH2CH2OCH3 и -OSiMe2tBu, а R" может представлять собой -H; ДМТ и трифосфат (-P(O)(OH)-O-P(O)(OH)-O-P(O)(OH)2), а также их соли.
[084] Типовая структура NapdU (5-[N-(1-нафтилметил)карбоксамид]-2'-дезоксиуридина):
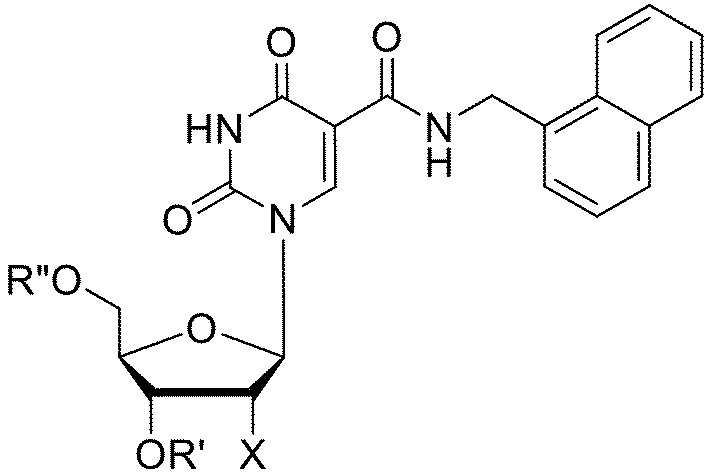
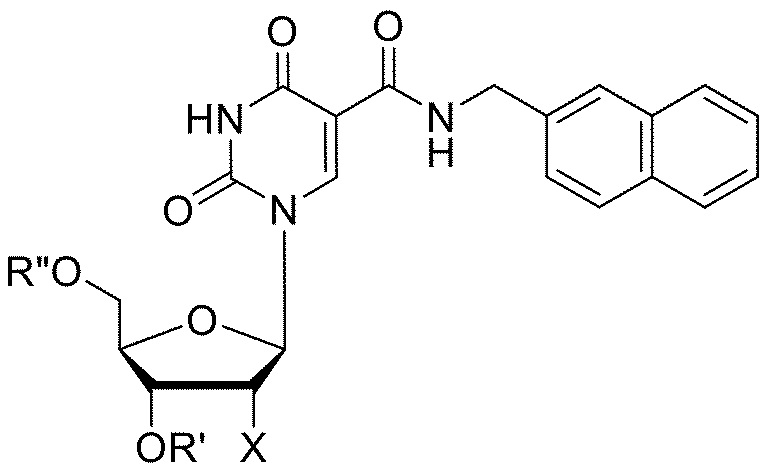
[085] Типовая структура 2NapdU (5-[N-(2-нафтилметил)карбоксамид]-2'-дезоксиуридина):
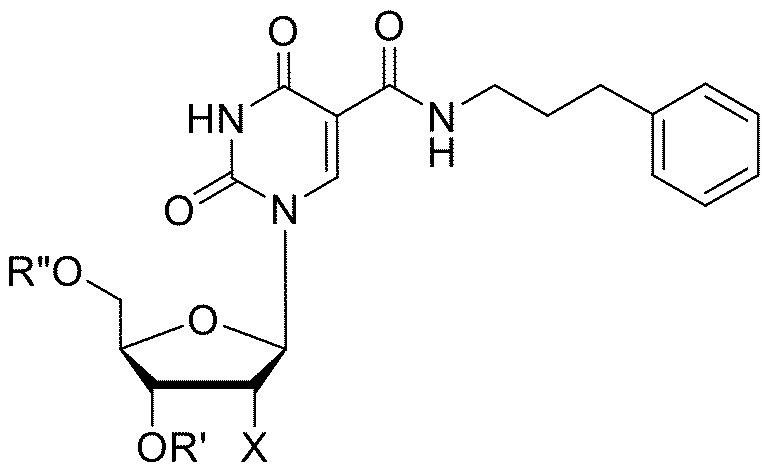
[086] Типовая структура PPdU (5-[N-(фенил-3-пропил)карбоксамид]-2'-дезоксиуридина):
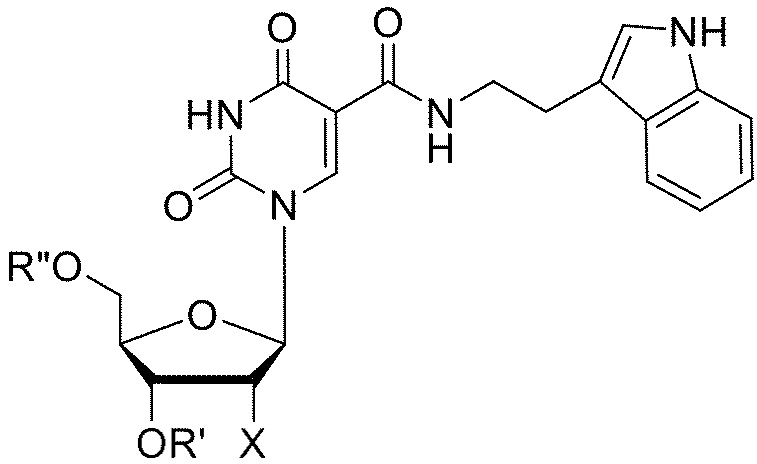
[087] Типовая структура TrpdU (5-[N-(3-индол-2-этил)карбоксамид]-2'-дезоксиуридина):
[088] Типовая структура 2NEdU 5-[N-(2-нафтил-2-этил)карбоксамид]-2'-дезоксиуридина):
[089] Следующие примеры приведены для иллюстрации некоторых конкретных признаков и/или вариантов реализации. Эти примеры не следует толковать как ограничивающие данное изобретение конкретными описанными признаками или вариантами реализации.
Г. Типовые аптамеры GDF11
[090] В данном документе предлагаются аптамеры, которые связывают GDF11. В некоторых вариантах реализации изобретения аптамер связывает GDF11 с аффинностью, составляющей менее 10 нМ. В некоторых таких вариантах реализации изобретения аптамер связывает GDF8 с аффинностью, которая по меньшей мере в 10 раз слабее, чем аффинность к GDF11, при измерении обеих аффинностей в одинаковых условиях связывания. В некоторых вариантах реализации изобретения аптамер связывает GDF11 с аффинностью, находящейся в пределах от 0,5 нМ до 10 нМ, и связывает GDF8 с аффинностью, составляющей более 50 нМ, или более 100 нМ, или более 150 нМ, или более 200 нМ, или более 300 нМ. В некоторых вариантах реализации изобретения аптамер не связывает GDF8 при тех же условиях, при которых данный аптамер связывает GDF11 с аффинностью, составляющей менее 10 нМ. В некоторых вариантах реализации изобретения аптамер связывает GDF11 с аффинностью, составляющей менее 8 нМ или менее 7 нМ, или менее 6 нМ, или менее 5 нМ, или менее 4 нМ, или менее 3 нМ, или менее 2 нМ, или менее 1 нМ; или находящейся в пределах от 0,1 нМ до 10 нМ, от 0,1 нМ до 8 нМ или от 0,1 нМ до 5 нМ.
[091] В некоторых вариантах реализации изобретения аффинность определяют с помощью метода, описанного в данном документе. В некоторых вариантах реализации изобретения аффинность определяют в присутствии полианионного ингибитора. В данном документе описаны неограничивающие типовые полианионные ингибиторы. В некоторых вариантах реализации изобретения аффинность определяют в присутствии Z-блока.
В некоторых вариантах реализации изобретения аптамер, который связывает GDF11, содержит последовательность:
5'-RWnMCnCPPGMmMPPPAnACnMCmRWnPPGnPASnGC-3' (SEQ ID №: 110), где:
каждый P независимо, и в каждом случае, представляет собой C-5-модифицированный пиримидин;
R представляет собой A или G;
каждый W независимо, и в каждом случае, представляет собой A, T или U;
каждый M независимо, и в каждом случае, представляет собой A или C;
S представляет собой G или C;
каждый n независимо, и в каждом случае, равен 0 или 1; и
каждый m независимо, и в каждом случае, равен 0 или 1.
[092] В некоторых вариантах реализации изобретения аптамер, который связывает GDF11, содержит последовательность, выбранную из:
(а) 5'-RWnACnCPPGMmMPPPAnACnMCmRWnPPGnPASnGC-3' (SEQ ID №: 111);
(б) 5'-RWnMCnCPPGMmMPPPAnACnMCmGWnPPGnPASnGC-3' (SEQ ID №: 112); и
(в) 5'-RMCPPGMmMPPPAnACnMCmRWnPPPASnGC-3' (SEQ ID №: 113);
где R, W, P, M, S, n и m являются такими, как указано выше.
[093] В некоторых вариантах реализации изобретения, если R представляет собой G, первый W представляет собой A; или, если R представляет собой A, первый W представляет собой C. В некоторых вариантах реализации изобретения по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5 или по меньшей мере 6 n равны 0. В некоторых вариантах реализации изобретения каждый n равен 0. В некоторых вариантах реализации изобретения по меньшей мере 1, по меньшей мере 2, по меньшей мере 3 n равны 1. В некоторых вариантах реализации изобретения по меньшей мере 1 m равен 1. В некоторых вариантах реализации изобретения по меньшей мере 1 m равен 0.
[094] В некоторых вариантах реализации изобретения предлагается аптамер GDF11, при этом данный аптамер содержит последовательность 5'-CPPGMPPP-3' (SEQ ID №: 114), где каждый P независимо, и в каждом случае, представляет собой C-5-модифицированный пиримидин и где M представляет собой C или A. В некоторых вариантах реализации изобретения предлагается аптамер GDF11, при этом данный аптамер содержит последовательность 5'-PPPAGC-3' (SEQ ID №: 115), где каждый P независимо, и в каждом случае, представляет собой C-5-модифицированный пиримидин. В некоторых вариантах реализации изобретения аптамер содержит последовательность 5'-CPPGMPPPNxPPPAGC-3' (SEQ ID №: 116), где каждый P независимо, и в каждом случае, представляет собой C-5-модифицированный пиримидин, где x равен 2, 3, 4 или 5, где M представляет собой C или A и где каждый N независимо, и в каждом случае, выбран из А, С, G, T и U. В некоторых таких вариантах реализации изобретения x равен 3 или 4. В некоторых вариантах реализации изобретения Nx содержит последовательность 5'-AAG-3' или 5'-ACG-3', или 5'-AGG-3'.
[095] В некоторых вариантах реализации изобретения аптамер, который связывает GDF11, содержит последовательность 5'-NNCPPGRPPPAMGPPPAGS-3' (SEQ ID №: 141), где каждый P независимо, и в каждом случае, представляет собой C-5-модифицированный пиримидин, R представляет собой A или G; каждый N независимо, и в каждом случае, представляет собой A, G или C; M представляет собой A или C; и S представляет собой G или C.
[096] В любом из описанных в данном документе вариантов реализации изобретения каждый Р независимо выбран из C-5-модифицированных пиримидинов, описанных в данном документе. В некоторых вариантах реализации изобретения каждый Р выбран из:
5-(N-1-нафтилметилкарбоксиамид)-2'-дезоксиуридина (NapdU),
5-(N-1-нафтилметилкарбоксиамид)-2'-O-метилуридина,
5-(N-1-нафтилметилкарбоксиамид)-2'-фторуридина,
5-(N-2-нафтилметилкарбоксиамид)-2'-дезоксиуридина (2NapdU),
5-(N-2-нафтилметилкарбоксиамид)-2'-O-метилуридина,
5-(N-2-нафтилметилкарбоксиамид)-2'-фторуридина,
5-(N-1-нафтилэтилкарбоксиамид)-2'-дезоксиуридина (NEdU),
5-(N-1-нафтилэтилкарбоксиамид)-2'-O-метилуридина,
5-(N-1-нафтилэтилкарбоксиамид)-2'-фторуридина,
5-(N-2-нафтилэтилкарбоксиамид)-2'-дезоксиуридина (2NEdU),
5-(N-2-нафтилэтилкарбоксиамид)-2'-O-метилуридина,
5-(N-2-нафтилэтилкарбоксиамид)-2'-фторуридина,
5-(N-3-бензофуранилэтилкарбоксиамид)-2'-дезоксиуридина (BFdU),
5-(N-3-бензофуранилэтилкарбоксиамид)-2'-O-метилуридина,
5-(N-3-бензофуранилэтилкарбоксиамид)-2'-фторуридина,
5-(N-3-бензотиофенилэтилкарбоксиамид)-2'-дезоксиуридина (BTdU),
5-(N-3-бензотиофенилэтилкарбоксиамид)-2'-O-метилуридина и
5-(N-3-бензотиофенилэтилкарбоксиамид)-2'-фторуридина.
В некоторых вариантах реализации изобретения каждый из по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5 или по меньшей мере 6 P независимо выбран из 5-(N-нафтилметилкарбоксиамид)-2'-дезоксиуридина (NapdU), 5-(N-2-нафтилметилкарбоксиамид)-2'-O-метилуридина и 5-(N-2-нафтилметилкарбоксиамид)-2'-фторуридина.
[097] В некоторых вариантах реализации изобретения аптамер GDF11 содержит последовательность, выбранную из SEQ ID №: 12, 13, 15-109 и 117-140. В некоторых вариантах реализации изобретения аптамер GDF11 содержит последовательность, выбранную из SEQ ID №: 12, 15, 26, 105-109 и 142-150.
[098] В некоторых вариантах реализации изобретения аптамер GDF11 может содержать до около 100 нуклеотидов, до около 95 нуклеотидов, до около 90 нуклеотидов, до около 85 нуклеотидов, до около 80 нуклеотидов, до около 75 нуклеотидов, до около 70 нуклеотидов, до около 65 нуклеотидов, до около 60 нуклеотидов, до около 55 нуклеотидов, до около 50 нуклеотидов, до около 45 нуклеотидов, до около 40 нуклеотидов, до около 35 нуклеотидов, до около 30 нуклеотидов, до около 25 нуклеотидов и до около 20 нуклеотидов.
[099] В другом аспекте данного изобретения аптамер GDF11 может быть по меньшей мере на около 95% идентичным, по меньшей мере на около 90% идентичным, по меньшей мере на около 85% идентичным, по меньшей мере на около 80% идентичным или по меньшей мере на около 75% идентичным относительно любой из SEQ ID №: 1 или 2. В другом варианте реализации изобретения аптамер GDF11 содержит последовательность из любой из SEQ ID №: 1 или 2, а также их фрагменты. В связанном с этим аспекте их фрагменты составляют от около 25 до 49 нуклеотидов в длину (или от около 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49 нуклеотидов в длину).
[0100] В другом аспекте данного изобретения аптамер GDF11 имеет константу диссоциации (Kd) для GDF11, составляющую около 10 нМ или менее. В другом типовом варианте реализации изобретения аптамер GDF11 имеет константу диссоциации (Kd) для белка GDF11, составляющую около 15 нМ или менее. В еще одном типовом варианте реализации изобретения аптамер GDF11 имеет константу диссоциации (Kd) для белка GDF11, составляющую около 20 нМ или менее. В еще одном типовом варианте реализации изобретения аптамер GDF11 имеет константу диссоциации (Kd) для белка GDF11, составляющую около 25 нМ или менее. В еще одном типовом варианте реализации изобретения аптамер GDF11 имеет константу диссоциации (Kd) для белка GDF11, составляющую около 30 нМ или менее. В еще одном типовом варианте реализации изобретения аптамер GDF11 имеет константу диссоциации (Kd) для белка GDF11, составляющую около 35 нМ или менее. В еще одном типовом варианте реализации изобретения аптамер GDF11 имеет константу диссоциации (Kd) для белка GDF11, составляющую около 40 нМ или менее. В еще одном типовом варианте реализации изобретения аптамер GDF11 имеет константу диссоциации (Kd) для белка GDF11, составляющую около 45 нМ или менее. В еще одном типовом варианте реализации изобретения аптамер GDF11 имеет константу диссоциации (Kd) для белка GDF11, составляющую около 50 нМ или менее. В еще одном типовом варианте реализации изобретения аптамер GDF11 имеет константу диссоциации (Kd) для белка GDF11, находящуюся в диапазоне около 3-10 нМ (или 3, 4, 5, 6, 7, 8, 9 или 10 нМ). Подходящую константу диссоциации можно определить с помощью анализа связывания, используя многоточечное титрование и подгоняя уравнение y=(макс. -мин.) (белок)/(Kd+белок)+мин., как описано в данном документе. В других вариантах реализации изобретения аптамер GDF11 представляет собой аптамер, Kd которого составляет не более чем Kd аптамера, содержащего последовательность SEQ ID №: 12.
[0101] В некоторых вариантах реализации изобретения аптамер содержит детектируемую метку.
Способы детектирования GDF11
[0102] В некоторых вариантах реализации изобретения предлагаются способы детектирования GDF11 в образце, включающие приведение в контакт образца с аптамером, описанным в данном документе. В некоторых вариантах реализации изобретения предлагаются способы детектирования или определения количества GDF11 в присутствии GDF8, включающие приведение в контакт образца, предположительно содержащего как GDF11, так и GDF8, с аптамером, описанным в данном документе. В некоторых вариантах реализации изобретения предлагаются способы различения GDF11 от GDF8 в образце, включающие приведение в контакт образца с аптамером, описанным в данном документе. В некоторых вариантах реализации изобретения способ включает приведение образца в контакт с аптамером GDF11, описанным в данном документе, в присутствии полианионного ингибитора.
[0103] Детектирование и/или определение количества GDF11, связанного аптамером GDF11, может быть осуществлено с помощью способов в данной области техники и/или способов, описанных в данном документе. В некоторых вариантах реализации изобретения аптамер GDF11 содержит детектируемую метку. В некоторых вариантах реализации изобретения аптамер GDF11 связан с твердой подложкой или содержит элемент пары связывания, который может быть иммобилизован на твердой подложке (например, биотинилированный аптамер может быть связан с твердой подложкой, содержащей стрептавидин).
Наборы, содержащие композиции аптамера GDF11
[0104] В настоящем изобретении предлагаются наборы, содержащие любой из описанных в данном документе аптамеров GDF11. Такие наборы могут содержать, например, (1) по меньшей мере один аптамер GDF11; и (2) по меньшей мере один фармацевтически приемлемый носитель, такой как растворитель или раствор. Дополнительные компоненты набора могут необязательно включать, например: (1) любое из фармацевтически приемлемых вспомогательных веществ, установленных в данном документе, таких как стабилизаторы, буферы и т.д., (2) по меньшей мере один контейнер, виалу или подобное устройство для хранения и/или смешивания компонентов набора; и (3) устройство доставки.
ПРИМЕРЫ
Пример 1: Отбор и идентификация аптамеров, обладающих специфичностью к связыванию GDF11
[0105] В этом примере представлен типичный способ отбора и получения аптамеров, связывающих зрелый белок GDF11.
[0106] Предыдущие попытки отбора аптамеров, обладающих специфичностью к GDF11, были проблематичными. Сравнение аффинности связывания белка для GDF11 и миостатина (GDF8) нескольких аптамеров, отобранных с помощью способа SELEX, показано в Таблице 1 ниже.
Таблица 1.
[0107] Как показано в Таблице 1, аптамеры, выбранные для связывания GDF11, как правило, также обладают аффинностью к миостатину. Также в Таблице 1 показан коэффициент аффинности связывания для GDF11 к миостатину для каждого аптамера. Данные коэффициенты варьируются от менее одного (1) (т.е. аптамер обладал более высокой аффинностью к миостатину по сравнению с GDF11) до коэффициентов, составляющих от около 1,6 до около 6,3 (т.е. аптамер обладал более высокой аффинностью к GDF11 по сравнению с миостатином). Тем не менее, эти различия в аффинностях являются недостаточными для того, чтобы отличить GDF11 от миостатина в анализе связывания белка. В результате, наличие и/или уровни GDF11 и GDF8 нельзя различить. В свете трудностей в идентификации аптамера GDF11, которая может отличать GDF11 от миостатина, в способ SELEX включали стратегию контротбора.
Отбор аптамеров с помощью способа увеличения низкой скорости диссоциации
[0108] SELEX в случае GDF11 выполняли с помощью описанных в данном документе способов SELEX. Кроме того, применяли модификации протокола, включающие два разных вида контротбора для отбора аптамеров GDF11, которые не связывают миостатин или обладают более высокой аффинностью к GDF11, чем миостатин: пассивный контротбор и активный контротбор.
[0109] Пассивный контротбор проводили с нежелательной мишенью (миостатином) в немеченом виде посредством добавления ее к PCB (буферу белка-конкурента, содержащему протромбин, казеин и альбумин) во время отбора, удаляя последовательности, которые не имеют предпочтения к GDF11 по сравнению с миостатином. Соотношение миостатина к GDF11 составляло 1:1 в первом цикле (по 100 пмоль каждого), 2:1 во втором цикле (20 пмоль миостатина и 10 пмоль GDF11) и увеличивалось в последующих циклах SELEX, поскольку концентрация мишени GDF11 уменьшалась (20 пмоль миостатина и 0,3 пмоль GDF11 или около 67:1).
[0110] Активный контротбор проводили с использованием биотинилированного миостатина, иммобилизованного на гранулах стрептавидина (SA). Перед каждым циклом SELEX, библиотеку инкубировали с гранулами для контротбора в течение 10 мин при встряхивании при 37 °С. Затем супернатант восстанавливали и переносили в выборку с GDF11, оставляя последовательности, которые связывают миостатин после гранул. В первом цикле использовали 100 пмоль миостатина для контротбора 1000 пмоль библиотеки, в каждом последующем цикле использовали 20 пмоль миостатина для контротбора около 20-50 пмоль библиотеки.
Получение кандидатной смеси
[0111] Кандидатную смесь частично рандомизированных олигонуклеотидов оцДНК готовили посредством полимеразного удлинения праймера ДНК, ренатурированного до биотинилированной матрицы оцДНК (показано в Таблице 2 ниже). Кандидатная смесь содержала 40-нуклеотидную рандомизированную кассету, содержащую дАТФ, дГТФ, дЦТФ и 5-(N-нафтилметилкарбоксиамид)-2'-дезоксиуридинтрифосфат (NapdUTP).
Таблица 2. Последовательности матрицы и праймеров
B'=биотин
[0112] Пять миллилитров 50% суспензии Streptavidin Plus UltraLink Resin (PIERCE) промывали один раз с использованием 2,5 мл 20 мМ NaOH, дважды с использованием 2,5 мл SB18T0.05 (40 мМ ГЭПЭС (4-(2-гидроксиэтил)пиперазин-1-этансульфоновой кислоты), доведенного до рН 7,5 с использованием NaOH, 102 мМ NaCl, 5 мМ KCl, 5 мМ MgCl2 и 0,05% Твин-20) и дважды с использованием 2,5 мл 16 мМ NaCl. Восемьдесят наномолей матрицы 1 (SEQ ID №: 1), содержащей два биотиновых остатка (обозначенных в последовательности как B') и 40 рандомизированных положений (обозначенных в последовательности как N40), добавляли к промытым гранулам UltraLink SA и вращали при 37 °С в течение 2,5 часов. Затем гранулы трижды промывали с использованием 16 мМ NaCl. Между каждой промывкой гранулы извлекали центрифугированием. Гранулы, уже содержащие иммобилизованную матрицу, суспендировали в 3,75 мл реакционного буфера для удлинения (содержащего 80 нмоль праймера (SEQ ID №: 2), 1X буфера SQ20 (120 мМ Трис-HCl, рН 7,8, 10 мМ KCl, 7 мМ MgSO4, 6 мМ (NH4)2SO4, 0,001% БСА и 0,1% Triton X-100), 470 единиц ДНК-полимеразы KOD XL (EMD MILLIPORE) и 1 мМ каждого из дАТФ, дЦТФ, дГТФ и NapdUTP. Гранулы оставляли инкубироваться с вращением при 68 °С в течение 2 часов. Затем гранулы промывали один раз с использованием SB18T0.01 (SB18, как указано выше, но с 0,01% Твин-20) и дважды с использованием 16 мМ NaCl. Библиотеку аптамеров элюировали из гранул с использованием 2,5 мл 40 мМ NaOH. Элюированную библиотеку немедленно нейтрализовали с использованием 50 мкл нейтрализатора (700 мМ HCl, 180 мМ ГЭПЭС, 0,45% Твин-20). Элюирование повторяли еще два раза и объединяли элюаты. Библиотеку концентрировали с использованием фильтра AMICON Ultracel YM-10 до около 0,4 мл и определяли концентрацию библиотеки с помощью спектроскопии поглощения ультрафиолетового излучения.
Мечение GDF11 человека биотином
[0113] Немеченый рекомбинантный белок GDF11 человека, очищенный в гомодимерной форме после сверхэкспрессии в E.coli (Peprotech, каталожный номер 120-11), биотинилировали посредством ковалентного присоединения NHS-PEO4-биотина (PIERCE, EZ-Link NHS-PEG4-биотин) к остаткам, содержащим первичные амины. Белок (1600 пмоль в 80 мкл) смешивали с 4-кратным молярным избытком NHS-PEG4-биотина и оставляли реакционную смесь инкубироваться при 20 °С в течение 1 часа. По окончании реакции непрореагировавший NHS-PEG4-биотин удаляли с помощью центрифужной колонки для обессоливания Zeba™ (PIERCE), в которой буфер заменяли на SB18T0.05.
Мечение миостатина человека биотином
[0114] Немеченый рекомбинантный белок миостатин человека, очищенный в гомодимерной форме после сверхэкспрессии в E.coli (Peprotech, каталожный номер 120-00), биотинилировали, как описано выше.
Иммобилизация миостатина
[0115] Парамагнитные гранулы MYONE-SA (MYONE SA, Invitrogen, называемые далее по тексту в данном документе гранулами SA) готовили посредством промывки гранул один раз с использованием 14 мл 20 мМ NaOH и дважды с использованием 14 мл SB18T0.05. Наконец, гранулы SA суспендировали при концентрации 10 мг/мл в SB18T0.05 и хранили при 4°C до использования. Меченый биотином белок миостатин (500 пмоль) иммобилизовали во всех циклах SELEX. Этого достигали посредством смешивания гранул SA (5 мг) с меченым биотином миостатином (500 пмоль) в течение 30 мин при встряхивании, с последующей трехкратной промывкой с использованием SB18T0.05. Гранулы SA-миостатина ресуспендировали в 0,5 мл SB18T0.05 (10 мг/мл гранул с 1 мкМ прикрепленного миостатина) и хранили при 4°C до использования.
Отбор аптамеров с помощью способа увеличения низкой скорости диссоциации
[0116] Всего было завершено 11 циклов способа SELEX с отбором по аффинности и низкой скорости диссоциации. Перед каждым циклом проводили контротбор для уменьшения фона и снижения вероятности получения аптамеров с неспецифическим связыванием с белком. Кроме того, для принудительного отбора аптамеров GDF11, которые не связывают близкородственный, на 90% идентичный белок миостатин, применяли разные виды контротбора. Контротбор осуществляли следующим образом.
[0117] В цикле 1 100 мкл кандидатной смеси ДНК, содержащей около 1 нмоль ДНК в SB18T0.05, нагревали при 95°C в течение 5 минут, а затем охлаждали до 70°C в течение 5 минут, затем до 48°C в течение 5 минут, а затем на 5 минут переносили в 37°C блок. Затем образец объединяли с 10 мкл смеси белка-конкурента и 1 мг (100 мкл) гранул для контротбора и инкубировали при 37 °С в течение 10 минут при перемешивании. Гранулы удаляли разделением в магнитном поле. Смесь белка-конкурента и гранулы для контротбора были составлены следующим образом. В стандартном SELEX использовали 10 мкл стандартной смеси белка-конкурента (0,1% ЧСА, 10 мкМ казеина и 10 мкМ протромбина в SB18T0.05) и 1 мг (100 мкл) гранул SA. В SELEX с пассивным контротбором использовали 10 мкл модифицированной смеси белка-конкурента (0,1% ЧСА, 10 мкМ казеина, 10 мкМ протромбина и 10 мкМ немеченого миостатина в SB18T0.05) и 1 мг (100 мкл) гранул SA. В SELEX с активным контротбором использовали 10 мкл стандартной смеси белка-конкурента (0,1% ЧСА, 10 мкМ казеина и 10 мкМ протромбина в SB18T0.05) и 1 мг (100 мкл) гранул SA-миостатина (гранулы SA с 1 мкМ прикрепленного миостатина).
[0118] В циклах 2-11 68 мкл аликвоту кандидатной смеси ДНК, полученной в предыдущем цикле (68% вкДНК, полученной в предыдущем цикле), смешивали с 13 мкл 5x SB18T0.05. Образец нагревали до 95°C в течение 3 минут и охлаждали до 37 °С со скоростью 0,1 °C/секунду. Затем образец объединяли с 9 мкл смеси белка-конкурента (0,1% ЧСА, 10 мкМ казеина и 10 мкМ протромбина в SB18T0.05) и 0,1 мг (10 мкл) гранул SA и инкубировали при 37°C в течение 10 минут при перемешивании (стандартный SELEX). Как и в первом цикле, смесь белка-конкурента дополняли 10 мкМ немеченого миостатина (SELEX с пассивным контротбором) и использовали гранулы SA-миостатина (гранулы SA с 1 мкМ прикрепленного миостатина) вместо гранул SA (SELEX с активным контротбором). Гранулы удаляли разделением в магнитном поле.
[0119] После первого контротбора белок-мишень предварительно иммобилизовали на гранулах SA для цикла 1 способа отбора. Для достижения этого, 0,5 мг гранул SA смешивали с 50 пмоль меченого биотином белка-мишени (гомодимера GDF11) и инкубировали при встряхивании в течение 30 минут при 37 °C. Несвязанную мишень удаляли посредством двукратной промывки гранул с использованием SB18T0.05. Полученную при контротборе кандидатную смесь ДНК (100 мкл) добавляли к гранулам и инкубировали при 37 °С в течение 60 минут при перемешивании. В первом цикле не использовали способ увеличения низкой скорости диссоциации, и просто промывали гранулы 5 раз по 2 мин каждый с использованием 100 мкл SB18T0.05. После промывок связанный аптамер элюировали из гранул посредством добавления 45 мкл 8 мМ NaOH и инкубации при 37 °С в течение 5 минут при перемешивании. Аптамерсодержащий элюат (40 мкл) переносили в новую пробирку после разделения гранул в магнитном поле. Элюирование повторяли еще раз с использованием 45 мкл 8 мМ NaOH и инкубировали при 37 °С в течение 5 минут при перемешивании. Элюаты объединяли (80 мкл), и нейтрализовали раствор посредством добавления 20 мкл 32 мМ HCl и 2 мкл Трис-HCl, pH 7,5.
[0120] В циклах 2-11 отбор осуществляли с использованием кандидатной смеси ДНК и белка-мишени, как описано ниже, в то время как параллельно осуществляли идентичный отбор с использованием кандидатной смеси ДНК, но без белка-мишени. Сравнение значений Ct, полученных из ПЦР для образца с белком-мишенью (сигнал S) и образца без белка-мишени (фон B), использовали в качестве руководства для уменьшения концентрации мишени в следующем цикле. Если значение дельта Ct было больше 4, но меньше 8, в следующем цикле содержание белка-мишени уменьшали в три раза. Если значение дельта Ct было больше 8, в следующем цикле содержание мишени уменьшали в 10 раз.
[0121] В соответствии с этой схемой после циклов стандартного SELEX концентрация GDF11 была уменьшена в 3 раза (циклы 5-6), в 10 раз (циклы 7-8), в 30 раз (циклы 9-10) и в 100 раз (цикл 11). Для отбора посредством пассивного контротбора концентрация мишени была уменьшена в 3 раза (циклы 5-6), в 10 раз (циклы 7-10) и в 30 раз (цикл 11 Для отбора посредством активного контротбора концентрация мишени была уменьшена в 3 раза (циклы 5-6), в 10 раз (цикл 7), в 30 раз (циклы 8-10) и в 100 раз (цикл 11). "RX", где X является числом, представляет собой номер цикла в SELEX (например, R3 обозначает цикл 3 в SELEX).
[0122] В цикле 2 меченый белок-мишень (5 пмоль гомодимера GDF11 в 10 мкл) смешивали с 40 мкл полученной при контротборе кандидатной смеси ДНК и инкубировали при 37 °С в течение 15 минут. Способ увеличения низкой скорости диссоциации начинали с добавления 50 мкл 10 мМ декстрансульфата с последующим немедленным добавлением 0,1 мг гранул SA. Эту смесь оставляли инкубироваться в течение 15 минут при 37 °С при перемешивании. Затем гранулы промывали 5 раз с использованием 100 мкл SB18T0.05. Аптамерную цепь элюировали из гранул посредством добавления 105 мкл элюирующего буфера перхлората натрия (1,8 М NaClO4, 40 мМ PIPES, pH 6,8, 1 мМ ЭДТА, 0,05% Triton Х-100) и инкубировали при 37 °С в течение 10 минут при перемешивании. Гранулы удаляли посредством разделения в магнитном поле и переносили 100 мкл элюата аптамера в новую пробирку, содержащую гранулы с иммобилизованным праймером (25 мкл 2,5 мг/мл гранул SA с 12,5 пмоль прикрепленного праймера 2 (SEQ ID №: 2)) и оставляли инкубироваться в течение 30 минут при 50°C при перемешивании. Затем гранулы промывали трижды с использованием 100 мкл SB18T0.05. Аптамерную цепь элюировали из гранул посредством добавления 85 мкл 40 мМ NaOH и нейтрализовали элюат (80 мкл) с использованием 20 мкл 160 мМ HCl и 2 мкл 500 мМ Трис-HCl, pH 7,5.
[0123] Отбор в циклах 3-11 осуществляли, как описано для цикла 2, за исключением того, что за 15 минут (циклы 3-4), 30 минут (цикл 5), 45 минут (цикл 6), 60 минут (цикл 7), 75 минут (цикл 8) или 90 минут (циклы 9-11) до добавления гранул добавляли декстрансульфат. Разделение осуществляли с использованием 0,1 мг Neutravidin Coated Sera-Mag SpeedBeads (Fisher Scientific, каталожный № 09-981-155, или называемых далее по тексту в данном документе гранулами NA, циклы 3, 5, 7, 9, 11) или 0,1 мг гранул SA (циклы 4, 6, 8, 10).
[0124] Пулы, полученные после 11 циклов SELEX, показали хорошую активность с обеспечением эПЦР и секвенирования на платформе Ion Torrent (Таблица 3). Из каждого пула было получено 384 последовательности для сравнительного анализа последовательностей с последующими анализами связывания основных кандидатов.
Таблица 3. Данные об аффинности для пулов аптамеров GDF11, полученных с использованием стандартного SELEX, а также с использованием пассивного или активного контротбора с миостатином.
Амплификация и очистка аптамера
[0125] Отобранную из каждого цикла аптамерную ДНК амплифицировали и проводили количественное определение с помощью кПЦР. 48 мкл ДНК добавляли к 12 мкл смеси для кПЦР (10X ДНК-полимеразного буфера KOD, Novagen № 71157, разбавляли до 5X, 25 мМ MgCl2, 10 мкМ прямого праймера для ПЦР (праймер 1, SEQ ID №: 2), 10 мкМ биотинилированного обратного праймера для ПЦР (праймер 2, SEQ ID №: 3), 5X SYBR Green I, 0,075 Ед/мкл ДНК-полимеразы KOD XL и 1 мМ каждого из дАТФ, дЦТФ, дГТФ и дТТФ) и подвергали термоциклированию в приборе для кПЦР BIO-RAD MyIQ со следующим протоколом: 1 цикл из 96°C в течение 15 секунд, 55°C в течение 10 секунд и 68°C в течение 30 минут; а затем 30 циклов из 96 °С в течение 15 секунд, 68 °С в течение 1 минуты. Количественное определение проводили с использованием программного обеспечения, и сравнивали количество копий отобранной ДНК, с белком-мишенью и без него, для определения соотношений сигнал/фон.
[0126] После амплификации продукт ПЦР иммобилизовали на гранулах SA через биотинилированную антисмысловую цепь. 1,25 мл гранул SA (10 мг/мл) промывали один раз с использованием 14 мл 20 мМ NaOH, дважды с использованием 14 мл SB18T0.05, ресуспендировали в 1,25 мл 3 М NaCl+0,05% Твин и хранили при 4 °С. 25 мкл гранул SA (10 мг/мл в 3 М NaCl) добавляли к 50 мкл двухцепочечных продуктов кПЦР и инкубировали при 25 °С в течение 5 минут при перемешивании. "Смысловую" цепь элюировали из гранул посредством добавления 100 мкл 40 мМ NaOH и инкубировали при 37 °С в течение 5 минут при перемешивании. Элюированную цепь исключали и дважды промывали гранулы с использованием SB18T и один раз с использованием 16 мМ NaCl.
[0127] Смысловую цепь аптамера, содержащую NapdUTP, получали посредством удлинения праймера из иммобилизованной антисмысловой цепи. Гранулы суспендировали в 40 мкл реакционной смеси для удлинения праймера (1X буфера для удлинения праймера (120 мМ Трис-HCl, pH 7,8, 10 мМ KCl, 7 мМ MgSO4, 6 мМ (NH4)2SO4, 0,1% TRITON X-100 и 0,001% бычьего сывороточного альбумина), 2,5 мкМ прямого праймера (праймер 1, SEQ ID №: 2), 0,5 мМ каждого из дАТФ, дЦТФ, дГТФ и NapdUTP, а также 0,015 Ед/мкл ДНК-полимеразы KOD XL) и инкубировали при 68°C в течение 60 минут при перемешивании. Гранулы промывали 3 раза с использованием SB18T0.05 и элюировали цепь аптамера из гранул посредством добавления 45 мкл 40 мМ NaOH, и инкубировали при 37 °С в течение 5 минут при перемешивании. 40 мкл элюата аптамера переносили в новую пробирку после разделения в магнитном поле и повторяли элюирование еще раз с использованием 45 мкл 40 мМ NaOH, и инкубировали при 37 °С в течение 5 минут при перемешивании. Элюаты объединяли (80 мкл) и нейтрализовали раствор с использованием 20 мкл 160 мМ HCl, и буферизовали с использованием 10 мкл 0,1 М ГЭПЭС, pH 7,5.
Выбор обратной связи и жесткости условий
[0128] Концентрация соответствующего белка-мишени на этапе отбора снижалась с каждым циклом в соответствии с сигналом кПЦР (Δ Ct), исходя из приведенного ниже правила:
Если Δ Ct < 4, [P](i+1)=[P](i)
Если 4 ≤ Δ Ct < 8, [P](i+1)=[P](i)/3,2
Если Δ Ct ≥ 8, [P](i+1)=[P](i)/10
Где [P]=концентрация белка, а i=номер текущего цикла.
[0129] После каждого цикла отбора определяли состояние конвергенции обогащенной смеси ДНК. 10 мкл двухцепочечного продукта кПЦР разводили до 200 мкл с использованием 4 мМ MgCl2, содержащего 1X SYBR Green I. Образцы анализировали на конвергенцию с помощью анализа C0t, который измеряет время гибридизации сложных смесей двухцепочечных олигонуклеотидов. Образцы подвергали термоциклированию по следующему протоколу: 3 цикла из 98 °С в течение 1 минуты, 85 °С в течение 1 минуты; 2 цикла из 98 °С в течение 1 минуты, затем 85 °С в течение 30 минут. В течение 30 минут при 85 °С измеряли флуоресцентные изображения с интервалом в 5 секунд. Интенсивность флуоресценции строили в зависимости от логарифма времени и с каждым циклом SELEX наблюдали повышенную скорость гибридизации, что указывало на конвергенцию последовательностей.
Секвенирование обогащенного пула и идентификация аптамеров
[0130] После 11 циклов SELEX конвергированный пул секвенировали. Подготовку последовательности выполняли следующим образом. Пул амплифицировали с помощью ПЦР с использованием специфичных для библиотеки SELEX праймеров, содержащих последовательность с уникальным штрих-кодом/индексом (уникальный идентификатор последовательности для каждого пула). Количество отдельных продуктов ПЦР определяли с помощью анализа с использованием реагентов для дцДНК Quant-iT™ PicoGreen® (LIFE TECHNOLOGIES), объединяли в эквимолярных концентрациях и концентрировали/заменяли буфер с помощью центрифужного фильтровального устройства AMICON Ultra-0.5 (MILLIPORE). Затем смесь очищали посредством электрофореза в полиакриламидном геле (ПААГ) в присутствии ДСН и концентрировали элюат с помощью центрифужного фильтровального устройства Amicon Ultra-0.5, и визуализировали с помощью ПААГ-электрофореза для подтверждения размера, чистоты и выхода конечной смеси. Образец предоставляли в SeqWright Genomic Services (GE HEALTHCARE, Хьюстон, штат Техас) для секвенирования Ion Torrent PGM. Из пула последовательностей, содержащего более 40 000 последовательностей, 384 случайным образом отбирали и анализировали на предмет конвергенции с использованием заказного программного обеспечения, которое определяет порядковый номер/число копий последовательностей и идентифицирует общие паттерны конвергенции с помощью алгоритма локального выравнивания. Для дальнейшей характеристики выбирали последовательности с наибольшей представленностью/числом копий в пуле и по меньшей мере одну последовательность из каждого паттерна конвергенции. Следует отметить, что прочтения этой последовательности из пулов аптамеров SELEX, у которых был "низкий" показатель качества последовательности (т.е. показатель качества Phred, составлявший 20 или ниже), исключали из секвенирования и идентификации мотивов.
Идентификация аптамеров посредством функционального анализа и вычитательного секвенирования
[0131] Конвергентный паттерн 1 первоначально идентифицировали из последовательностей 12060-28_3 (SEQ ID №: 12) и 12060-16_3 (SEQ ID №: 13) с помощью сравнительных анализов связывания с GDF11 и миостатином (см. Пример 2). Буква "P" в последовательности обозначает NapdU.
ID аптамера 12060-28_3:
5'-ccctgCGCCPPCGGACPPGCPPPAAGPPPAGCCGCPPGCPCACAPcacaa-3' (SEQ ID №: 12)
ID аптамера 12060-16_3:
5'-ccctgPGAGACPPGAPPPACGPPPAGCPGCPAACAPGGGGAACCAcacaa-3' (SEQ ID №: 13)
[0132] Параллельно, конвергентный паттерн 1 идентифицировали in silico с помощью сравнительного и вычитательного секвенирования последовательностей из пулов, полученных различными вариантами SELEX. Они включали 768 последовательностей из пула 12058 (стандартный SELEX GDF11), 384 последовательности из пула 12060 (SELEX GDF11 с пассивным контротбором), 384 последовательности из пула 12061 (SELEX GDF11 с активным контротбором) и 384 последовательности из пула 12059 (стандартный SELEX миостатина). Анализ и выравнивание всех последовательностей в этих объединенных пулах использовали для исключения из числа приоритетных последовательностей с общими паттернами, присутствующими во всех пулах, что свидетельствует о неселективном связывании GDF11 и миостатина (см. Таблицу 4). Конвергентный паттерн 1 был высоко обогащенным в пуле 12060 из SELEX GDF11 с пассивным контротбором (15%) и имел более низкую представленность в пуле 12058 из стандартного SELEX GDF11 (3%), и отсутствовал в пуле 12059 из стандартного SELEX миостатина, что свидетельствует о специфичности GDF11.
Таблица 4.
(GDF11, стандартный SELEX)
(GDF11, пассивный контротбор)
(GDF11, активный контротбор)
(миостатин, стандартный SELEX)
Пример 2: Сэндвич SELEX для аптамеров, которые связывают GDF11
[0133] Сэндвич-анализ SELEX использовали для идентификации дополнительных специфичных к GDF11 аптамеров с использованием 2NEdU-содержащего аптамера, который связывает GDF11. Сэндвич SELEX описан в WO 2015/048084. Вкратце, SELEX выполняют с использованием комплекса мишень-аптамер (т.е. GDF11 в комплексе с 2NEdU-содержащим аптамером). Было установлено, что некоторые из аптамеров, идентифицированных в пуле NapdU, подвергнутом скринингу с использованием сэндвич SELEX, подобны аптамеру 12060-28. Эти клоны обсуждаются ниже.
Пример 3: Равновесная константа связывания (Kd) для аптамеров к белку GDF11 по сравнению с миостатином
[0134] В этом примере представлены аффинности связывания белка (Kd) для аптамера-GDF11 и аптамера-белка миостатина, а также идентификация аптамеров, которые связывают GDF11 более предпочтительно, чем миостатин.
[0135] Несколько клонов аптамеров, отобранных с помощью способа SELEX с контротбором и с помощью способа сэндвич SELEX, описанных в данном документе, дополнительно характеризовали и отбирали для предпочтительного связывания с GDF11, а не миостатином (см. Таблицу 5). Анализ связывания проводили в отсутствие и в присутствии 1 мкМ Z-блока (случайная олигонуклеотидная последовательность) в качестве неспецифического конкурента. Аптамер, содержащий BndU в качестве C-5-модифицированного пиримидина (BndU-аптамер GDF11), который предварительно отбирали с помощью SELEX без этапов контротбора и использовали в качестве контроля для связывания как GDF11, так и миостатина. Предыдущие эксперименты по связыванию BndU-аптамера GDF11 показали, что он, как правило, является неселективным для GDF11 и миостатина.
Таблица 5. Сравнение аффинности связывания аптамеров: GDF11 и миостатина
[0136] Аптамерный пул 12060 (аптамеры NapdU), который получали с помощью SELEX с пассивным контротбором, содержал несколько нуклеотидных последовательностей с аффинностью и различной степенью селективности в отношении к GDF11 (см. коэффициент Kd, где большее число указывает на большую специфичность к GDF11 по сравнению с миостатином). В частности, аптамерные клоны 12060-16_3 (NapdU) показали около 50-кратную дифференциальную Kd для GDF11 по сравнению с миостатином (т.е. Kd, составляющую 6,52 нМ, по сравнению с >320 нМ) при испытании в присутствии 1 мкМ Z-блока, а 12060-28_3 (NapdU), который составлял 9% от 12060 аптамерного пула нуклеотидных последовательностей, показал около 100-кратную дифференциальную Kd для GDF11 по сравнению с миостатином (т.е. Kd, составляющую 1,74 нМ, по сравнению с >320 нМ) при испытании в присутствии 1 мкМ Z-блока (см. Фиг. 1). Аптамерный пул 16139 (NapdU), который получали с помощью сэндвич SELEX, также содержал несколько нуклеотидных последовательностей с высокой аффинностью и специфичностью к GDF11.
[0137] Остальные клоны аптамеров из Таблицы 5 показали аффинность к GDF11 с рядом аффинности к миостатину. Например, в аптамерном пуле 12058 (NapdU) из стандартного SELEX преобладала последовательность 12058-6 (17%). Этот аптамерный клон имел Kd, составляющую 0,09 нМ для GDF11, а также имел Kd, составляющую 0,12 нМ для миостатина (Фиг. 2).
Пример 4: Пост-SELEX усечение и анализ аптамера 12060-28 для GDF11
[0138] В этом примере представлены пост-SELEX аффинности связывания GDF11 для усеченных последовательностей аптамера 12060-28_3 и определение минимальной длины коровой последовательности, которая способна связываться с GDF11.
[0139] Усечения аптамера 12060-28 (NapdU) показали, что 20-мерная последовательность 5'-GACPPGCPPPAAGPPPAGCC-3' (аптамер 12060-28_37; SEQ ID №: 156) способна связывать GDF11. Тем не менее, активность 21-мерной последовательности 5'-GGACPPGCPPPAAGPPPAGCC-3' (аптамерный клон 12060-28_36; SEQ ID №: 157) показала относительно лучшее связывание с GDF11 (Kd составила 4,43E-10) (см. Фиг. 3). Это согласуется с консервативным мотивом CPPGCPPPANGPPPAGC (SEQ ID №: 105), присутствующим в семействе активных клонов, относящихся к 12060-28, т.е. оказалось, что связыванию подлежали только остатки NapdU в положениях 12-24 40-мерной центральной области (последовательности мотива).
Пример 5: Конкретные последовательности аптамеров GDF11
[0140] В этом примере представлено выравнивание последовательностей основного селективного аптамерного связующего GDF11 (12060-28_3) с другими последовательностями аптамеров, которые были выбраны с помощью способа SELEX. Это привело к идентификации последовательности мотива в нескольких последовательностях в пуле последовательностей, выбранных с помощью SELEX. Кроме того, для выбранных последовательностей также предоставляются данные об аффинности. Выравнивание последовательностей (50-мер) и аффинности связывания см. в Таблице 6. В Таблице 7 представлены дополнительные последовательности из аптамерных пулов 12060 и 12058, а также их выравнивание. В Таблице 7 показаны последовательности с пятью (5) удаленными нуклеотидами на каждом из 5'- и 3'-концов последовательности (40-мер). В обеих Таблицах 6 и 7 представлена основа для мотива "коровой последовательности", общего у последовательностей. Эта последовательность может представлять собой GACPPGAPPPACGPPPAGC (SEQ ID №: 106); GACPPGAPPPAAGPPPAGC (SEQ ID №: 107); GACPPGCPPPAAGPPPAGC (SEQ ID №: 108); GACPPGCPPPACGPPPAGC (SEQ ID №: 109); GCCPPGAPPPACGPPPAGC (SEQ ID №: 142); CACPPGAPPPACGPPPAGG (SEQ ID №: 143); GACPPGGPPPACGPPPAGC (SEQ ID №: 144); GCCPPGCPPPACGPPPAGC (SEQ ID №: 145); GCAPPGAPPPACGPPPAGC (SEQ ID №: 146); GGCPPGCPPPACGPPPAGA (SEQ ID №: 147); CGCPPGAPPPAAGPPPAGG (SEQ ID №: 148); AACPPGAPPPAAGPPPAGG (SEQ ID №: 149); или GACPPGAPPPAGGPPPAGC (SEQ ID №: 150); где в каждом случае P представляет собой NapdU. В некоторых вариантах реализации изобретения консервативный мотив представляет собой NNCPPGRPPPAMGPPPAGS (SEQ ID №: 141), где в каждом случае P представляет собой NapdU, R представляет собой A или G; каждый N независимо, и в каждом случае, представляет собой A, G или C; M представляет собой A или C; и S представляет собой G или C. Было установлено, что последовательность 12060-209_3 в Таблице 6, которая содержит цитозин вместо одного из консервативных NapdU в 12060-28, не связывает GDF11.
Таблица 6. Выравнивание последовательностей и аффинность для GDF11-специфичного аптамера 12060-28 (Napd U обозначен "Р" в последовательностях) и родственных клонов. Аффинность определяли методами связывания на фильтрах в присутствии 0,1 мкМ Z-блока. Последовательности показаны полноразмерными (50-мер). "x" последовательности мотива может представлять собой нуклеотид А или С.
(P представляет собой NapdU)
Таблица 7. Выравнивание последовательностей для 12060-28 (Napd U обозначен "Р" в последовательностях), а также дополнительных родственных клонов. Последовательности показаны усеченными (40-мер). "x" последовательности мотива может представлять собой нуклеотид А или С.
(P представляет собой NapdU)
Пример 6: Последовательности аптамеров GDF11
[0141] В этом примере представлены результаты BLAST-анализа пула аптамеров SELEX с использованием последовательности основного селективного аптамерного связующего GDF11 (12060-28_3). Этот анализ был менее строгим, чем выравнивание, выполненное в Примере 5, и привел к идентификации дополнительных последовательностей аптамеров, которые также содержали общий или коровый мотив. Выравнивание последовательностей см. в Таблице 8.
[0142] Из выравнивания последовательностей в Таблице 8 можно получить несколько мотивов последовательностей, где каждый мотив сохраняет перекрытие мотивом (или общей последовательностью), идентифицированным из выравнивания аптамерной последовательности 102060-28_3 в Примерах 3 и 4.
[0143] Первый мотив может быть определен следующим образом:
5'-RWnMCnCPPGMmMPPPAnACnMCmRWnPPGnPASnGC-3' (SEQ ID №: 110), где каждый P независимо, и в каждом случае, представляет собой C-5-модифицированный пиримидин; R представляет собой A или G; каждый W независимо, и в каждом случае, представляет собой A, T или U; каждый M независимо, и в каждом случае, представляет собой A или C; S представляет собой G или C; каждый n независимо, и в каждом случае, равен 0 или 1; и каждый m независимо, и в каждом случае, равен 0 или 1.
[0144] Второй мотив может быть определен следующим образом:
5'-RWnACnCPPGMmMPPPAnACnMCmRWnPPGnPASnGC-3' (SEQ ID №: 111). Третий мотив может быть следующим: 5'-RWnMCnCPPGMmMPPPAnACnMCmGWnPPGnPASnGC-3' (SEQ ID №: 112). Четвертый мотив может быть следующим: 5'-RMCPPGMmMPPPAnACnMCmRWnPPPASnGC-3' (SEQ ID №: 113). В каждом из второго, третьего и четвертого мотивов каждый P независимо, и в каждом случае, представляет собой C-5-модифицированный пиримидин; R представляет собой A или G; каждый W независимо, и в каждом случае, представляет собой A, T или U; каждый M независимо, и в каждом случае, представляет собой A или C; S представляет собой G или C; каждый n независимо, и в каждом случае, равен 0 или 1; и каждый m независимо, и в каждом случае, равен 0 или 1.
[0145] Первый мотив может быть определен следующим образом:
5'-RWnMCnCPPGMmMPPPAnACnMCmRWnPPGnPASnGS-3' (SEQ ID №: 151), где каждый P независимо, и в каждом случае, представляет собой C-5-модифицированный пиримидин; R представляет собой A или G; каждый W независимо, и в каждом случае, представляет собой A, T или U; каждый M независимо, и в каждом случае, представляет собой A или C; каждый S независимо, и в каждом случае, представляет собой G или C; каждый n независимо, и в каждом случае, равен 0 или 1; и каждый m независимо, и в каждом случае, равен 0 или 1.
[0146] Второй мотив может быть определен следующим образом:
5'-RWnACnCPPGMmMPPPAnACnMCmRWnPPGnPASnGS-3' (SEQ ID №: 152). Третий мотив может быть следующим: 5'-RWnMCnCPPGMmMPPPAnACnMCmGWnPPGnPASnGS-3' (SEQ ID №: 153). Четвертый мотив может быть следующим: 5'-RMCPPGMmMPPPAnACnMCmRWnPPPASnGS-3' (SEQ ID №: 154). В каждом из второго, третьего и четвертого мотивов каждый P независимо, и в каждом случае, представляет собой C-5-модифицированный пиримидин; R представляет собой A или G; каждый W независимо, и в каждом случае, представляет собой A, T или U; каждый M независимо, и в каждом случае, представляет собой A или C; каждый S независимо, и в каждом случае, представляет собой G или C; каждый n независимо, и в каждом случае, равен 0 или 1; и каждый m независимо, и в каждом случае, равен 0 или 1.
Таблица 8. Выравнивание нуклеотидных последовательностей аптамеров с помощью аптамерного связующего GDF11 12060-28 (SEQ ID №: 27)
(P представляет собой NapdU)
| название | год | авторы | номер документа |
|---|---|---|---|
| ОЛИГОНУКЛЕОТИДЫ, СОДЕРЖАЩИЕ МОДИФИЦИРОВАННЫЕ НУКЛЕОЗИДЫ | 2017 |
|
RU2763470C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ЛЕГОЧНОЙ ГИПЕРТЕНЗИИ | 2017 |
|
RU2748278C2 |
| ЦИТИДИН-5-КАРБОКСАМИД МОДИФИЦИРОВАННЫЕ НУКЛЕОТИДНЫЕ КОМПОЗИЦИИ И СПОСОБЫ, ОТНОСЯЩИЕСЯ К НИМ | 2014 |
|
RU2732402C2 |
| АНТИТЕЛА ПРОТИВ GDF8 ЧЕЛОВЕКА | 2011 |
|
RU2710156C2 |
| АПТАМЕРЫ НА ОСНОВЕ ДНК ДЛЯ КАТЕПСИНА G ЧЕЛОВЕКА | 2004 |
|
RU2360000C2 |
| АНТИТЕЛА ПРОТИВ GDF8 ЧЕЛОВЕКА | 2011 |
|
RU2567805C2 |
| СВЯЗЫВАЮЩИЕ КОМПЛЕМЕНТ АПТАМЕРЫ И СРЕДСТВА ПРОТИВ С5, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ ГЛАЗНЫХ НАРУШЕНИЙ | 2007 |
|
RU2477137C2 |
| УСОВЕРШЕНСТВОВАННЫЕ ПРОТЕОМНЫЕ МУЛЬТИПЛЕКСНЫЕ АНАЛИЗЫ | 2019 |
|
RU2792385C2 |
| АПТАМЕР ПРОТИВ МИДКИНА И ЕГО ПРИМЕНЕНИЕ | 2007 |
|
RU2460794C2 |
| АПТАМЕРНЫЕ ТЕРАПЕВТИЧЕСКИЕ СРЕДСТВА, ПРИМЕНИМЫЕ ДЛЯ ЛЕЧЕНИЯ СВЯЗАННЫХ С КОМПЛЕМЕНТОМ РАССТРОЙСТВ | 2006 |
|
RU2406507C2 |




























































































































Изобретение относится к области биотехнологии. Описана группа изобретений, включающая аптамер, связывающий GDF11, способ детектирования GDF11 в образце, включающий приведение в контакт белков из образца с вышеуказанным аптамером, и композиция для определения GDF11, включающая вышеуказанный аптамер и белки из образца. В одном из вариантов реализации аптамер содержит последовательность 5'-RWnMCnCPPGMmMPPPAnACnMCmRWnPPGnPASnGC-3' (SEQ ID NO: 110) или 5'-RWnMCnCPPGMmMPPPAnACnMCmRWnPPGnPASnGS-3' (SEQ ID NO: 151) и связывает GDF11 с аффинностью, составляющей менее 10 нМ. Изобретение расширяет арсенал средств, связывающих с GDF11. 3 н. и 50 з.п. ф-лы, 3 ил., 8 табл., 6 пр.
1. Аптамер, который связывает GDF11, при этом указанный аптамер содержит последовательность 5'-RWnMCnCPPGMmMPPPAnACnMCmRWnPPGnPASnGC-3' (SEQ ID NO: 110) или 5'-RWnMCnCPPGMmMPPPAnACnMCmRWnPPGnPASnGS-3' (SEQ ID NO: 151), где:
каждый P независимо и в каждом случае представляет собой
5-(N-бензилкарбоксиамид)-2'-дезоксиуридин (BndU),
5-(N-бензилкарбоксиамид)-2'-O-метилуридин,
5-(N-бензилкарбоксиамид)-2'-фторуридин,
5-(N-фенэтилкарбоксиамид)-2'-дезоксиуридин (PEdU),
5-(N-тиофенилметилкарбоксиамид)-2'-дезоксиуридин (ThdU),
5-(N-изобутилкарбоксиамид)-2'-дезоксиуридин (iBudU),
5-(N-тирозилкарбоксиамид)-2'-дезоксиуридин (TyrdU),
5-(N-3,4-метилендиоксибензилкарбоксиамид)-2'-дезоксиуридин (MBndU),
5-(N-4-фторбензилкарбоксиамид)-2'-дезоксиуридин (FBndU),
5-(N-3-фенилпропилкарбоксиамид)-2'-дезоксиуридин (PPdU),
5-(N-имидизолилэтилкарбоксиамид)-2'-дезоксиуридин (ImdU),
5-(N-изобутилкарбоксиамид)-2'-O-метилуридин,
5-(N-изобутилкарбоксиамид)-2'-фторуридин,
5-(N-триптаминокарбоксиамид)-2'-дезоксиуридин (TrpdU),
5-(N-R-треонинилкарбоксиамид)-2'-дезоксиуридин (ThrdU),
5-(N-триптаминокарбоксиамид)-2'-O-метилуридин,
5-(N-триптаминокарбоксиамид)-2'-фторуридин,
5-(N-[1-(3-триметиламмоний)пропил]карбоксиамид)-2'-дезоксиуридинхлорид,
5-(N-нафтилметилкарбоксиамид)-2'-дезоксиуридин (NapdU),
5-(N-нафтилметилкарбоксиамид)-2'-O-метилуридин,
5-(N-нафтилметилкарбоксиамид)-2'-фторуридин,
5-(N-[1-(2,3-дигидроксипропил)]карбоксиамид)-2'-дезоксиуридин,
5-(N-2-нафтилметилкарбоксиамид)-2'-дезоксиуридин (2NapdU),
5-(N-2-нафтилметилкарбоксиамид)-2'-O-метилуридин,
5-(N-2-нафтилметилкарбоксиамид)-2'-фторуридин,
5-(N-1-нафтилэтилкарбоксиамид)-2'-дезоксиуридин (NEdU),
5-(N-1-нафтилэтилкарбоксиамид)-2'-O-метилуридин,
5-(N-1-нафтилэтилкарбоксиамид)-2'-фторуридин,
5-(N-2-нафтилэтилкарбоксиамид)-2'-дезоксиуридин (2NEdU),
5-(N-2-нафтилэтилкарбоксиамид)-2'-O-метилуридин,
5-(N-2-нафтилэтилкарбоксиамид)-2'-фторуридин,
5-(N-3-бензофуранилэтилкарбоксиамид)-2'-дезоксиуридин (BFdU),
5-(N-3-бензофуранилэтилкарбоксиамид)-2'-O-метилуридин,
5-(N-3-бензофуранилэтилкарбоксиамид)-2'-фторуридин,
5-(N-3-бензотиофенилэтилкарбоксиамид)-2'-дезоксиуридин (BTdU),
5-(N-3-бензотиофенилэтилкарбоксиамид)-2'-O-метилуридин, или
5-(N-3-бензотиофенилэтилкарбоксиамид)-2'-фторуридин;
R представляет собой A или G;
каждый W независимо и в каждом случае представляет собой A, T или U;
каждый M независимо и в каждом случае представляет собой A или C;
каждый S независимо и в каждом случае представляет собой G или C;
каждый n независимо и в каждом случае равен 0 или 1; и
каждый m независимо и в каждом случае равен 0 или 1.
2. Аптамер по п. 1, отличающийся тем, что указанный аптамер содержит последовательность, выбранную из:
(а) 5'-RWnACnCPPGMmMPPPAnACnMCmRWnPPGnPASnGC-3' (SEQ ID NO: 111);
(б) 5'-RWnACnCPPGMmMPPPAnACnMCmRWnPPGnPASnGS-3' (SEQ ID NO: 152);
(в) 5'-RWnMCnCPPGMmMPPPAnACnMCmGWnPPGnPASnGC-3' (SEQ ID NO: 112);
(г) 5'-RWnMCnCPPGMmMPPPAnACnMCmGWnPPGnPASnGS-3' (SEQ ID NO: 153);
(д) 5'-RMCPPGMmMPPPAnACnMCmRWnPPPASnGC-3' (SEQ ID NO: 113); и
(е) RMCPPGMmMPPPAnACnMCmRWnPPPASnGS-3' (SEQ ID NO: 154).
3. Аптамер по п. 1 или 2, при этом, если R представляет собой G, первый W представляет собой A и при этом, если R представляет собой A, первый W представляет собой C.
4. Аптамер по любому из пп. 1-3, отличающийся тем, что по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5 или по меньшей мере 6 n равны 0.
5. Аптамер по любому из пп. 1-3, отличающийся тем, что каждый n равен 0.
6. Аптамер по любому из пп. 1-3, отличающийся тем, что по меньшей мере 1, по меньшей мере 2, по меньшей мере 3 n равны 1.
7. Аптамер по любому из пп. 1-6, отличающийся тем, что по меньшей мере 1 m равен 0.
8. Аптамер по любому из пп. 1-6, отличающийся тем, что по меньшей мере 1 m равен 1.
9. Аптамер по любому из предшествующих пунктов, отличающийся тем, что указанный аптамер содержит последовательность 5'-CPPGMPPP-3' (SEQ ID NO: 114).
10. Аптамер по любому из предшествующих пунктов, отличающийся тем, что указанный аптамер содержит последовательность 5'-PPPAGC-3'(SEQ ID NO: 115) или 5'-PPPAGG-3' (SEQ ID NO: 155).
11. Аптамер по п. 1, отличающийся тем, что указанный аптамер содержит последовательность 5'-CPPGMPPPNxPPPAGC-3' (SEQ ID NO: 160) или 5'-CPPGMPPPNxPPPAGG-3' (SEQ ID NO: 116), где x равен 2, 3, 4 или 5, где M представляет собой C или A и где каждый N независимо и в каждом случае выбран из А, С, G, T и U.
12. Аптамер по п. 11, отличающийся тем, что х равен 3 или 4.
13. Аптамер по п. 11 или 12, отличающийся тем, что Nx содержит последовательность 5'-AAG-3', или 5'-ACG-3', или 5'-AGG-3'.
14. Аптамер по любому из предшествующих пунктов, отличающийся тем, что указанный аптамер содержит последовательность 5'-NNCPPGRPPPAMGPPPAGS-3' (SEQ ID NO: 141), где каждый N независимо и в каждом случае представляет собой A, G или C.
15. Аптамер по любому из пп. 1-14, отличающийся тем, что каждый Р независимо и в каждом случае выбран из:
5-(N-1-нафтилметилкарбоксиамид)-2'-дезоксиуридина (NapdU),
5-(N-1-нафтилметилкарбоксиамид)-2'-O-метилуридина,
5-(N-1-нафтилметилкарбоксиамид)-2'-фторуридина,
5-(N-2-нафтилметилкарбоксиамид)-2'-дезоксиуридина (2NapdU),
5-(N-2-нафтилметилкарбоксиамид)-2'-O-метилуридина,
5-(N-2-нафтилметилкарбоксиамид)-2'-фторуридина,
5-(N-1-нафтилэтилкарбоксиамид)-2'-дезоксиуридина (NEdU),
5-(N-1-нафтилэтилкарбоксиамид)-2'-O-метилуридина,
5-(N-1-нафтилэтилкарбоксиамид)-2'-фторуридина,
5-(N-2-нафтилэтилкарбоксиамид)-2'-дезоксиуридина (2NEdU),
5-(N-2-нафтилэтилкарбоксиамид)-2'-O-метилуридина,
5-(N-2-нафтилэтилкарбоксиамид)-2'-фторуридина,
5-(N-3-бензофуранилэтилкарбоксиамид)-2'-дезоксиуридина (BFdU),
5-(N-3-бензофуранилэтилкарбоксиамид)-2'-O-метилуридина,
5-(N-3-бензофуранилэтилкарбоксиамид)-2'-фторуридина,
5-(N-3-бензотиофенилэтилкарбоксиамид)-2'-дезоксиуридина (BTdU),
5-(N-3-бензотиофенилэтилкарбоксиамид)-2'-O-метилуридина, и
5-(N-3-бензотиофенилэтилкарбоксиамид)-2'-фторуридина.
16. Аптамер по любому из пп. 1-15, отличающийся тем, что каждый из по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5 или по меньшей мере 6 P независимо выбран из 5-(N-нафтилметилкарбоксиамид)-2'-дезоксиуридина (NapdU), 5-(N-2-нафтилметилкарбоксиамид)-2'-O-метилуридина и 5-(N-2-нафтилметилкарбоксиамид)-2'-фторуридина.
17. Аптамер по любому из пп. 1-14, отличающийся тем, что каждый Р независимо выбран из 5-(N-нафтилметилкарбоксиамид)-2'-дезоксиуридина (NapdU), 5-(N-2-нафтилметилкарбоксиамид)-2'-O-метилуридина и 5-(N-2-нафтилметилкарбоксиамид)-2'-фторуридина.
18. Аптамер по любому из предшествующих пунктов, отличающийся тем, что указанный аптамер содержит последовательность, выбранную из SEQ ID NO: 12, 13, 15-109 и 117-140.
19. Аптамер по любому из пп. 1-17, отличающийся тем, что указанный аптамер содержит последовательность, выбранную из SEQ ID NO: 12, 15, 26, 105-109 и 142-150.
20. Аптамер по любому из предшествующих пунктов, отличающийся тем, что указанный аптамер состоит из 18-200 нуклеотидов, или 18-150 нуклеотидов, или 18-100 нуклеотидов, или 18-75 нуклеотидов, или 18-50 нуклеотидов, или 20-150 нуклеотидов, или 20-100 нуклеотидов, или 20-75 нуклеотидов, или 20-50 нуклеотидов.
21. Аптамер по любому из предшествующих пунктов, отличающийся тем, что указанный аптамер содержит детектируемую метку.
22. Аптамер по любому из предшествующих пунктов, который связывает GDF11 с аффинностью, составляющей менее 10 нМ, при этом в аналогичных условиях указанный аптамер связывает GDF8 с аффинностью, которая по меньшей мере в 10 раз слабее, чем аффинность к GDF11, или не связывает GDF8.
23. Аптамер по п. 22, отличающийся тем, что указанный аптамер связывает GDF8 с аффинностью, которая по меньшей мере в 20 раз слабее, или по меньшей мере в 30 раз слабее, или по меньшей мере в 50 раз слабее, чем аффинность к GDF11.
24. Аптамер по п. 22 или 23, отличающийся тем, что указанный аптамер связывает GDF8 с аффинностью, составляющей более 50 нМ, или более 100 нМ, или более 150 нМ, или более 200 нМ, или более 250 нМ, или более 300 нМ.
25. Аптамер по любому из пп. 22-24, отличающийся тем, что указанный аптамер связывает GDF11 с аффинностью, составляющей менее 8 нМ, или менее 7 нМ, или менее 6 нМ, или менее 5 нМ, или менее 4 нМ, или менее 3 нМ, или менее 2 нМ, или менее 1 нМ.
26. Аптамер по п. 22, отличающийся тем, что указанный аптамер не связывает GDF8.
27. Аптамер по любому из пп. 22-26, отличающийся тем, что аффинность определяется с помощью анализа связывания, включающего полианионный ингибитор.
28. Аптамер по п. 27, отличающийся тем, что данный полианионный ингибитор выбран из декстрансульфата, гепарина, Z-блока, поли-dI/dC, разрушенной ультразвуком или деградированной в результате гидродинамического сдвига ДНК из молок лососевых, ДНК из тимуса теленка и дНТФ.
29. Аптамер по любому из пп. 1-28, где GDF11 представляет собой GDF11 человека.
30. Аптамер по любому из пп. 22-28, отличающийся тем, что GDF11 представляет собой GDF11 человека и GDF8 представляет собой GDF8 человека.
31. Аптамер по п. 29, отличающийся тем, что GDF11 представляет собой зрелый GDF11 человека, содержащий последовательность SEQ ID NO: 118.
32. Аптамер по п. 30, отличающийся тем, что GDF11 представляет собой зрелый GDF11 человека, содержащий последовательность SEQ ID NO: 118, и GDF8 представляет собой зрелый GDF8 человека, содержащий последовательность SEQ ID NO: 119.
33. Способ детектирования GDF11 в образце, включающий приведение в контакт белков из образца с аптамером по любому из пп. 1-32.
34. Способ по п. 33, отличающийся тем, что аптамер связывает GDF8 с аффинностью, которая по меньшей мере в 10 раз слабее, чем аффинность к GDF11, или не связывает GDF8.
35. Способ определения того, содержит ли образец GDF11, включающий приведение в контакт белков из образца с аптамером по любому из пп. 1-32.
36. Способ по п. 35, отличающийся тем, что образец содержит GDF8.
37. Способ по любому из пп. 33-36, отличающийся тем, что указанный способ включает приведение в контакт образца с аптамером в жестких условиях.
38. Способ по п. 37, отличающийся тем, что указанные жесткие условия включают полианионный ингибитор.
39. Способ по п. 38, отличающийся тем, что данный полианионный ингибитор выбран из декстрансульфата, гепарина, Z-блока, поли-dI/dC, разрушенной ультразвуком или деградированной в результате гидродинамического сдвига ДНК из молок лососевых, ДНК из тимуса теленка и дНТФ.
40. Способ по любому из пп. 33-39, отличающийся тем, что образец представляет собой образец, взятый у человека.
41. Способ по п. 40, отличающийся тем, что образец выбран из образца крови, сыворотки, плазмы, слюны, мочи и ткани.
42. Способ по п. 41, отличающийся тем, что образец ткани выбран из ткани сердечной мышцы, ткани скелетных мышц, ткани поджелудочной железы, хрящевой ткани и нервной ткани.
43. Способ по любому из пп. 33-42, отличающийся тем, что белки отделяли по меньшей мере от одного другого компонента образца.
44. Способ по любому из пп. 33-42, отличающийся тем, что белки не отделяли от других компонентов образца.
45. Композиция для детектирования GDF11, содержащая аптамер по любому из пп. 1-32 и белки из образца.
46. Композиция по п. 45, отличающаяся тем, что образец содержит GDF8.
47. Композиция по п. 45 или 46, содержащая полианионный ингибитор.
48. Композиция по п. 47, отличающаяся тем, что данный полианионный ингибитор выбран из декстрансульфата, гепарина, Z-блока, поли-dI/dC, разрушенной ультразвуком или деградированной в результате гидродинамического сдвига ДНК из молок лососевых, ДНК из тимуса теленка и дНТФ.
49. Композиция по любому из пп. 45-48, отличающаяся тем, что образец представляет собой образец, взятый у человека.
50. Композиция по п. 49, отличающаяся тем, что образец выбран из образца крови, сыворотки, плазмы, слюны, мочи и ткани.
51. Композиция по п. 50, отличающаяся тем, что образец ткани выбран из ткани сердечной мышцы, ткани скелетных мышц, ткани поджелудочной железы, хрящевой ткани и нервной ткани.
52. Композиция по любому из пп. 45-51, отличающаяся тем, что белки отделяли по меньшей мере от одного другого компонента образца.
53. Композиция по любому из пп. 45-51, отличающаяся тем, что белки не отделяли от других компонентов образца.
| WO 1999006559 A1, 11.02.1999 | |||
| WO 2014066486 A2, 01.05.2014 | |||
| АНТИТЕЛА К GDF8 И ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2447084C2 |
| АНТИТЕЛА ПРОТИВ GDF8 ЧЕЛОВЕКА | 2011 |
|
RU2567805C2 |
Авторы
Даты
2019-12-04—Публикация
2015-11-23—Подача