Изобретение относится к области биотехнологии и используется для диагностики возбудителя сосудистого бактериоза крестоцветных в пробах растительных тканей.
Известен способ определения степени инфицированности семян бобовых культур фитопатогенными бактериями рода Pseudomonas SYRINGAE (патент RU №2492611, МПК А01С 1/00, опубл. 20.09.2013, бюл. №26), включающий помещение семян на увлажненную фильтровальную бумагу, экспозицию семян в термостате при температуре 28-32°С, анализ степени их инфицированности, отличающийся тем, что предварительно осуществляют замачивание семян в течение 30-70 мин в стерильной дистиллированной воде, затем производят кратковременное погружение семян в течение 10-15 с в раствор фунгицида без бактерицидных свойств, а экспозицию семян в термостате проводят в течение 2-4 суток.
Недостатком данного способа является его трудоемкость, низкая точность и длительность проведения анализа.
Известен способ диагностики биоматериалов на наличие в них агробактерий (патент RU №2458142, МПК C12Q 1/68. C12R 1/00, опубл. 10.08.2012, бюл. №22), заключающийся в выделении из биоматериала ДНК и проведении на ней полимеразной цепной реакции в режиме реального времени зондами, меченными флуоресцентными красителями и гасителями флуоресценции, отличающийся тем, что после выделения из образцов ДНК в концентрации 0,1-100 нг/мкл на основе ее составляют две реакционные смеси, одна из которых содержит праймеры 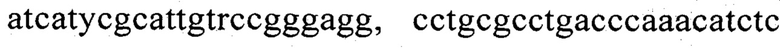 и зонд
и зонд 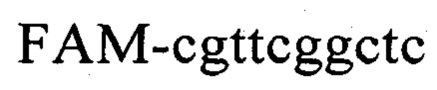
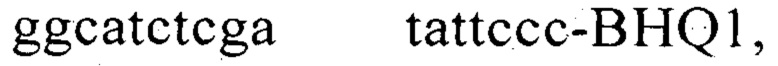 а вторая содержит праймеры
а вторая содержит праймеры 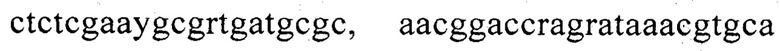 и зонд
и зонд 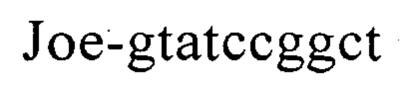
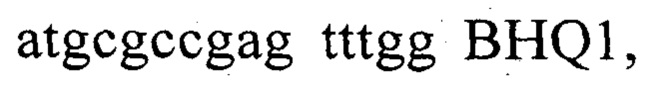 праймеры в составе реакционных смесей имеют концентрацию 0,2-2 mM, а зонды 0,1-1 mM, реакционные смеси содержат буфер для полимеразы, катионы Mg 2+ в концентрации 0,1-0,3 mM, нуклеотиды в концентрации 2-10 мкМ, термостабильную полимеразу 0,1-0,3 ед. активности на микролитр смеси, полимеразную цепную реакцию проводят в режиме реального времени с температурой отжига праймеров 55-62°С при 30-45 циклах, при этом осуществляют непрерывный контроль флуоресценции и по экспоненциальному ее нарастанию в одной или обеих реакционных смесях диагностируют наличие в образцах агробактерий, причем в качестве термостабильной полимеразы с активностью 0,1-0,3 ед. на микролитр смеси берут Taq, в качестве термостабильной полимеразы с активностью 0,1-0,3 ед. на микролитр смеси берут Pfu, в качестве термостабильной полимеразы с активностью 0,1-0,3 ед. на микролитр смеси берут Vent, в качестве термостабильной полимеразы с активностью 0,1-0,3 ед. на микролитр смеси берут Tth.
праймеры в составе реакционных смесей имеют концентрацию 0,2-2 mM, а зонды 0,1-1 mM, реакционные смеси содержат буфер для полимеразы, катионы Mg 2+ в концентрации 0,1-0,3 mM, нуклеотиды в концентрации 2-10 мкМ, термостабильную полимеразу 0,1-0,3 ед. активности на микролитр смеси, полимеразную цепную реакцию проводят в режиме реального времени с температурой отжига праймеров 55-62°С при 30-45 циклах, при этом осуществляют непрерывный контроль флуоресценции и по экспоненциальному ее нарастанию в одной или обеих реакционных смесях диагностируют наличие в образцах агробактерий, причем в качестве термостабильной полимеразы с активностью 0,1-0,3 ед. на микролитр смеси берут Taq, в качестве термостабильной полимеразы с активностью 0,1-0,3 ед. на микролитр смеси берут Pfu, в качестве термостабильной полимеразы с активностью 0,1-0,3 ед. на микролитр смеси берут Vent, в качестве термостабильной полимеразы с активностью 0,1-0,3 ед. на микролитр смеси берут Tth.
Недостатком способа является необходимость синтеза специфических праймеров, высокая стоимость используемых реактивов и аппаратуры, длительность и сложность проведения анализа, высокая вероятность ложных ответов.
Известен способ выявления обсемененности объектов внешней среды грамотрицательными бактериями рода pseudomonas и acinetobacter (патент RU 2372406 МПК C12Q 1/68, опубл. 10.11.2009, бюл. №31), путем исследования смывов, отличающийся тем, что смывы фильтруют через бактериальные фильтры с диаметром пор 0,22 мкм, на которых концентрируются бактерии, содержащиеся в минимальных количествах, и/или покоящиеся формы, с последующим ПЦР-анализом элюированной тотальной ДНК с использованием родо- и видоспецифичных праймеров к данным бактериям.
Недостатком способа является длительный и трудоемкий процесс пробоподготовки. Также ему присущи недостатки описанного выше способа.
Наиболее близким является способ, описанный в работе Е.С. Мазурина, Ф.С. Джалилова, А.Н. Игнатова и Ю.А. Варицева, Диагностика зараженности семян капусты сосудистым бактериозом методом ИФА (Доклады ТСХА. - 2009. - Вып. 281. - с. 24-26). Согласно этому способу, анализ проводится по методу ИФА в варианте двойного сэндвича антител (KAS-ELISA) с применением кроличьих гипериммунных сывороток, полученных к клеткам возбудителя, и количественным учетом результатов посредством измерения оптической плотности продукта ИФА.
Способ отличается чувствительностью и точностью, простотой проведения пробоподготовки и непосредственно анализа, минимальными требованиями к количеству используемого оборудования, доступностью расходных материалов.
Недостатком прототипа является использование фотометрического метода учета результатов анализа. Данный метод может давать искажения, вызванные изменением прозрачности продукта реакции со временем, и требует проведения повторного анализа для воспроизведения результата. Также это требует наличия специализированного оборудования, что сказывается на стоимости выполнения процедуры анализа.
Технической задачей изобретения является проведение анализа возбудителя сосудистого бактериоза крестоцветных в препаратах растительных тканей методом дот-иммуноанализа (ДИА).
Поставленная задача решается способом диагностики сосудистого бактериоза крестоцветных методом ДИА, выполняемым на твердом носителе с использованием специфической гипериммунной кроличьей сыворотки, содержащей антитела к выявляемому возбудителю, и визуальным учетом результатов анализа.
Отличием от прототипа является то, что при получении сыворотки в качестве адъюванта используется химическая полиэлектролитная субстанция, состоящая из 0,05% раствора полиазолидинаммония, модифицированного гидрат-ионами галогенов, в физиологическом растворе, анализ выполняется в варианте ДИА на нитроцеллюлозной мембране, проводится с препаратами растительных тканей или смывов с исследуемых поверхностей, с сывороткой, взятой в разведении 1:100.
Техническим результатом является, простота учета результатов выявления возбудителя в исследуемых образцах и упрощение используемого для этого оборудования
Простота учета результатов ДИА в сравнении с ИФА заключается в отсутствии необходимости использования для данной процедуры субстрата, стоп-раствора и считывающего результат прибора. Субстрат и стоп-раствор вносятся в лунки планшета для ИФА после завершения инкубации конъюгата. Приготовление и внесение в планшет данных растворов увеличивают трудоемкость и требуют постоянного внимания со стороны сотрудника, проводящего учет результатов ИФА.
Простота используемого для ДИА оборудования обусловлена отсутствием в методике проведения анализа требований к наличию такого оборудования, как планшетный спектрофотометр, промывающее устройство, термостатируемый шейкер и многоканальный дозатор. Однако данное оборудование необходимо для проведения ИФА. Таким образом, ДИА как метод диагностики может быть использован в слабо оснащенных оборудованием лабораториях.
Предложенный способ осуществляется следующим образом. Сначала получают антиген клеточной стенки Xanthomonas campestris. Для этого замороженную микробную массу суспензируют в физиологическом растворе и подвергают ультразвуковой обработке. Дезинтегрированную клеточную массу отделяют от цитоплазмы и периплазмы центрифугированием. Полученный осадок обрабатывается 10% раствором додецилсульфата натрия в течение суток при непрерывном перемешивании, после чего подвергается диализу в проточной воде в течение трех суток. Полученный препарат концентрируется сушкой в токе воздуха. Далее необходимо получить специфическую гипериммунную сыворотку. Для этого готовится смесь антигена с адъювантом в соотношении 1:1 и вводится кроликам в объеме 1 мл. Адъювантом выступает химическая полиэлектролитная субстанция, состоящая из 0,05% раствора полиазолидинаммония, модифицированного гидрат-ионами галогенов, в физиологическом растворе. Иммунизация проводится семикратно, с интервалом в 2 недели (Кузнецов М.А., Щербаков А.А. и др., «Получение специфических антител к клеточным мембранам Xanthomonas campestris», Аграрный научный журнал, №6, 2016, стр. 46 - 49). Далее производится подготовка исследуемой пробы. Для этого подвергаемые анализу образцы растительных тканей стерильно измельчают в 1 мл физиологического раствора. После этого, готовится разведение пробы в физиологическом растворе в отношении 1:100. Затем ставится реакция ДИА. Для этого необходимо приготовить маркерный раствор конъюгата коллоидного золота с белком А стафилококка по методу Г. Френса Controlled Nucleation for the Regulation of the Particle Size in Monodisperse Gold Suspension (Nature Phys. Sci. - 1973. - Vol. 241. - №1. - P. 20-22). Анализ проводится на нитроцеллюлозной мембране «Миллипор» типа НА с размером пор 0,45 мкм. Учет результатов проводится визуально.
Для пояснения практической реализации способа ниже приводятся соответствующие примеры.
Пример 1
5 г замороженной микробной массы X. campesrtis суспендируют в 40 мл стерильного физиологического раствора. Затем взвесь помещают на ледяную баню и охлаждают до +1…+3°С. Затем проводят дезинтегрирование клеточных мембран ультразвуком частоты 22 кГц в течение 8 циклов по 60 сек. Между циклами для охлаждения взвеси делается перерыв по 90 сек. Затем проводят центрифугирование полученной массы 15 мин при 5000 об/мин для отделения неразрушенных клеток. Надосадочную жидкость центрифугируют 20 мин при 18000 об/мин для получения препарата клеточных стенок.
1 г полученной массы разводят в 10 мл 2% раствора SDS и выдерживают 20 ч при 18°С и непрерывном перемешивании. Неэкстрагируемые примеси удаляются из раствора центрифугированием при 18000 об/мин в течение 20 мин. Удаление SDS из раствора производится при помощи диализа в проточной воде в течение трех суток.
Полученный препарат сушится в токе воздуха на ледяной бане и сохраняется замораживанием.
Пример 2
Для получения специфической гипериммунной кроличьей сыворотки к антигену клеточной стенки возбудителя готовится смесь антигена с адъювантом в соотношении 1:1 и вводится кроликам в объеме 1 мл. Адъювантом выступает химическая полиэлектролитная субстанция, состоящая из 0,05% раствора полиазолидинаммония, модифицированного гидрат-ионами галогенов, в физиологическом растворе. Иммунизация проводится семикратно, с интервалом в 2 недели.
Пример 3
Для приготовления препарата у исследуемых растений берется проба зеленой массы в количестве 1 г. Образцы измельчаются с добавкой 10 мл физиологического раствора в стерильных условиях. Полученный экстракт отделяется от растительной массы центрифугированием при 2500 об/мин в течение 10 мин. Для постановки реакции экстракт разводится физиологическим раствором в 100 раз.
Пример 4
ДИА пробы, полученной в примере 3, выполняется на нитроцеллюлозной мембране фирмы «Миллипор» типа НА с размером пор 0,45 мкм, на поверхность которой наносится по 2 мкл десятикратных разведений исследуемых препаратов. Мембрану подсушивают на воздухе, помещают в 3%-й р-р БСА, после чего проводят отмывку в 0,05%-м р-ре Твин 20 и трехкратно ополаскивают деионизированной водой. Затем подложка помещается в специфическую гипериммунную сыворотку, полученную по 2, и инкубируется 30 мин на шейкере при комнатной температуре. Поле этого проводится отмывка мембраны в р-ре Твин 20 и двукратное ополаскивание деионизированной водой. Отмытая мембрана помещается в раствор конъюгата коллоидного золота с белком А и выдерживается до появления окраски. Учет результатов проводится визуально по появлению на мембране красных пятен.
На фигуре показаны результаты цветного окрашивания, получаемого при взаимодействии диагностической сыворотки с исследуемыми образцами. Цифрами отмечены препараты: 1 - культуры клеток X. campestris В-610, 2 - тканей здоровых растений, 3 - тканей зараженных растений.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДИАГНОСТИКУМ И ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ АНТИРАБИЧЕСКИХ СЫВОРОТОК И ПРЕПАРАТА ГЕТЕРОЛОГИЧНОГО АНТИРАБИЧЕСКОГО ИММУНОГЛОБУЛИНА IN VITRO МЕТОДОМ ДОТ-ИММУНОАНАЛИЗА | 2008 |
|
RU2360252C1 |
| Экспресс-тест на токсокароз и способы изготовления компонентов для его проведения | 2023 |
|
RU2834042C2 |
| СПОСОБ ПОДГОТОВКИ КОМПОНЕНТОВ ДЛЯ ПРОВЕДЕНИЯ ЭКСПРЕСС-ТЕСТА НА ТОКСОПЛАЗМОЗ ЖИВОТНЫХ И ЭКСПРЕСС-ТЕСТ НА ТОКСОПЛАЗМОЗ | 2018 |
|
RU2704973C1 |
| КОМПЛЕКСНАЯ ГЕНО- И ИММУНОДИАГНОСТИЧЕСКАЯ ТЕСТ-СИСТЕМА ДЛЯ ИДЕНТИФИКАЦИИ ХОЛЕРНЫХ ВИБРИОНОВ О1 И О139 СЕРОГРУПП И ОЦЕНКИ ИХ ВИРУЛЕНТНОСТИ | 2009 |
|
RU2404257C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ БРУЦЕЛЛЕЗА КРУПНОГО РОГАТОГО СКОТА И СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2005 |
|
RU2300107C2 |
| Штамм гибридных культивируемых клеток MUS мUSсULUS L., используемый для получения моноклональных антител к легким цепям иммуноглобулинов кролика | 1990 |
|
SU1778184A1 |
| Способ экспресс-диагностики нодулярного дерматита КРС | 2016 |
|
RU2648773C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПСЕВДОТУБЕРКУЛЕЗНОГО АНТИГЕННОГО ПОЛИМЕРНОГО ДИАГНОСТИКУМА | 2010 |
|
RU2430376C1 |
| ШТАММ ВИРУСА ЭФЕМЕРНОЙ ЛИХОРАДКИ КРУПНОГО РОГАТОГО СКОТА EPHEMEROVIRUS BOVINUM ДЛЯ ИЗГОТОВЛЕНИЯ БИОПРЕПАРАТОВ ДЛЯ ДИАГНОСТИКИ ЭФЕМЕРНОЙ ЛИХОРАДКИ КРУПНОГО РОГАТОГО СКОТА | 2011 |
|
RU2461391C1 |
| Способ иммуноферментной диагностики иерсиниозов | 1990 |
|
SU1767435A1 |

Изобретение относится к области биотехнологии и используется для диагностики возбудителя сосудистого бактериоза крестоцветных в пробах растительных тканей. Способ диагностики сосудистого бактериоза крестоцветных методом ДИА, выполняемый на твердом носителе с использованием специфической гипериммунной кроличьей сыворотки, содержащей антитела к выявляемому возбудителю и количественным учетом результатов анализа, при этом при получении сыворотки в качестве адъюванта используется химическая полиэлектролитная субстанция, состоящая из 0,05% раствора полиазолидинаммония, модифицированного гидрат-ионами галогенов, в физиологическом растворе, анализ выполняется в варианте дот-иммуноанализа на нитроцеллюлозной мембране, проводится с препаратами растительных тканей или смывов с исследуемых поверхностей, с сывороткой, взятой в разведении 1:100 и визуальным учетом результатов анализа. Изобретение обеспечивает простоту учета результатов выявления возбудителя в исследуемых образцах и упрощение используемого для этого оборудования. 4 пр., 1 ил.
Способ диагностики сосудистого бактериоза крестоцветных методом ДИА, выполняемый на твердом носителе с использованием специфической гипериммунной кроличьей сыворотки, содержащей антитела к выявляемому возбудителю и количественным учетом результатов анализа, отличающийся тем, что при получении сыворотки в качестве адъюванта используется химическая полиэлектролитная субстанция, состоящая из 0,05% раствора полиазолидинаммония, модифицированного гидрат-ионами галогенов, в физиологическом растворе, анализ выполняется в варианте дот-иммуноанализа на нитроцеллюлозной мембране, проводится с препаратами растительных тканей или смывов с исследуемых поверхностей, с сывороткой, взятой в разведении 1:100 и визуальным учетом результатов анализа.
| Е.А | |||
| Музурин "МЕТОДЫ ДИАГНОСТИКИ ВОЗБУДИТЕЛЯ СОСУДИСТОГО БАКТЕРИОЗА КАПУСТЫ И МЕРЫ ЗАЩИТЫ", автореферат, Москва 2009, с.23 | |||
| БЕЗЫНСТРУМЕНТАЛЬНЫЙ СПОСОБ ДИАГНОСТИКИ ПСЕВДОТУБЕРКУЛЕЗА | 2011 |
|
RU2464573C1 |
| СПОСОБ ОТБОРА РАСТЕНИЙ КАПУСТЫ, УСТОЙЧИВЫХ К СЛИЗИСТОМУ БАКТЕРИОЗУ | 1995 |
|
RU2083090C1 |
| Машина для уборки кукурузы | 1931 |
|
SU25794A1 |
Авторы
Даты
2020-11-20—Публикация
2019-03-25—Подача