Настоящее изобретение относится к конкретным бициклическим производным сульфонамидов, их фармацевтически приемлемым солям присоединения, их гидратам и/или их сольватам, а также их применению в качестве обратного агониста связанного с ретиноидами орфанного рецептора гамма RORγt.
Изобретение также относится к фармацевтической композиции, содержащей такие соединения, а также к ее применению для лечения местным и/или пероральным путем воспалительных заболеваний, опосредованных рецепторами RORγt, в частности акне, атопического дерматита и/или псориаза.
Ядерные рецепторы составляют большое семейство (называемое суперсемейством) факторов транскрипции, которые соответствуют белкам, способным активироваться лигандом, прикрепляться к конкретным последовательностям ДНК и регулировать транскрипцию генов-мишеней. Таким образом, эти рецепторы находят применение в регуляции большого числа биологических функций, таких как рост, развитие, размножение, дифференцировка и метаболизм у большинства живых организмов.
Первые представители этого суперсемейства, которые были идентифицированы и описаны в научной литературе, представляют собой ядерные рецепторы стероидных гормонов, такие как глюкокортикоидные рецепторы и эстрогеновые рецепторам. В число представителей этого суперсемейства также входят большая часть рецепторов, для которых не было идентифицировано ни одного лиганда. Такие ядерные рецепторы называют "орфанными рецепторами".
Относящиеся к ретиноидам орфанные рецепторы, таким образом, составляют подсемейство ядерных рецепторов. Это подсемейство состоит из трех представителей, каждый из которых характеризуется своим собственным профилем экспрессии: ROR альфа (обозначаемый RORα), ROR бета (обозначаемый RORβ) и ROR гамма (обозначаемый RORγ). Две изоформы орфанных рецепторов RORγ уже идентифицировали, а именно RORγ1, которые экспрессируются в определенном типе тканей, таких как тимус, почки, мышцы и печени, и RORγ2 (также называемый как RORγt), который экспрессируется только в клетках иммунной системы.
В частности, рецептор RORγt играет важную роль в регуляции клеточной дифференцировки лимфоцитов Th17, которые соответствуют лимфоцитам T-хелперам, функция которых заключается в обеспечении защиты организма по отношению к большому числу внеклеточных патогенных агентов, таких как бактерии и грибковые инфекции.
Тем не мене, продемонстрировали, что лимфоциты Th17 также участвуют в большом разнообразии воспалительных заболеваний, таких как акне, и аутоиммунных заболеваний, таких как псориаз, ревматоидный артрит, а также рассеянный склероз (Peck A, Mellins ED. Precarious balance; Th17 cells in host defense. Infect Immun. 2010 Jan; 78(1):32-8; Suarez-Farinas: J. Allergy Clin. Immunol. 2014; J. Invest. Dermatol. 2008, 128(11), 2625).
Это объясняется тем, что лимфоциты Th17 продуцируют множество цитокинов, обладающих различными характеристиками, такие как интерлейкин 17A (IL-17A), интерлейкин 17F (IL-17F), интерлейкин 26 (IL-26), интерлейкин 21 (IL-21), интерлейкин 22 (IL-22) и TNFα, в том числе их развитие, их выживаемость и их пролиферация зависит от интерлейкина 23 (IL-23). Эти цитокины способны активировать различные типы эффекторных клеток, таких как кератиноциты, что приводит к их гиперпролиферации и к дополнительной продукции провоспалительных цитокинов, химокинов и антимикробных пептидов, которые в свою очередь рекрутируют и активируют другие клетки иммунной системы в воспаленной коже, что может приводить к увеличению воспалительного ответа.
Таким образом, активация лимфоцитов Th17 обеспечивает рекрутинг цитокинов, в частности интерлейкина 17 (IL17), и других типов провоспалительных клеток, что приведет к опосредованию воспалительных заболеваний, таких как акне и/или аутоиммунных заболеваний, таких как псориаз.
Проводимые на мышах эксперименты показали, что понижение уровня экспрессии рецептора RORγt приводит к понижению активности лимфоцитов Th17, что позволяет, таким образом, значительно понижать экспрессию интерлейкина 17 (IL-17) (Ivanov II, McKenzie BS, Zhou L, Tadokoro CE, Lepelley A, Lafaille JJ, Cua DJ, Littman DR: Cell 2006, 126, 1121-1133) и проводить эффективное лечение воспалительных заболеваний и аутоиммунных заболеваний, опосредованных такими цитокинами, в частности таких, для которых детектируют значительное процентное содержание интерлейкина 17 (IL-17).
Для этой цели в патентной заявке WO 2013/160418 описаны соединения сульфонамидов, используемые в качестве обратных агонистов рецептора RORγt, для возможности лечения воспалительных заболеваний и аутоиммунных заболеваний. Таким же образом другие соединения также были разработаны в качестве обратных агонистов рецептора RORγt, такие как описываемые в патентных заявках WO 2014/090712, WO 2014/008214, WO2013/169588, WO2013/160419, WO2013/1002027, WO2013/092939, WO2013/092941, WO2013/085890 и WO2012/100732.
Таким образом, существует действительная необходимость в разработке новых соединений в качестве обратных агонистов рецептора RORγt для возможности эффективного лечения заболеваний, опосредованных таким рецептором, в частности воспалительных заболеваний, таких как акне и/или аутоиммунные заболевания, таких как псориаз или атопический дерматит.
Этой цели удается достичь благодаря разработке конкретных бициклических производных сульфонамидов, таких как описанные ниже, которые позволяют модулировать активность рецептора RORγt и, таким образом, эффективно лечить воспалительные заболевания и аутоиммунные заболевания определенных патологий.
Таким образом, настоящее изобретение в частности относится к соединению или соединениям формулы (I), их фармацевтически приемлемым солям присоединения, их гидратам и/или их сольватам:
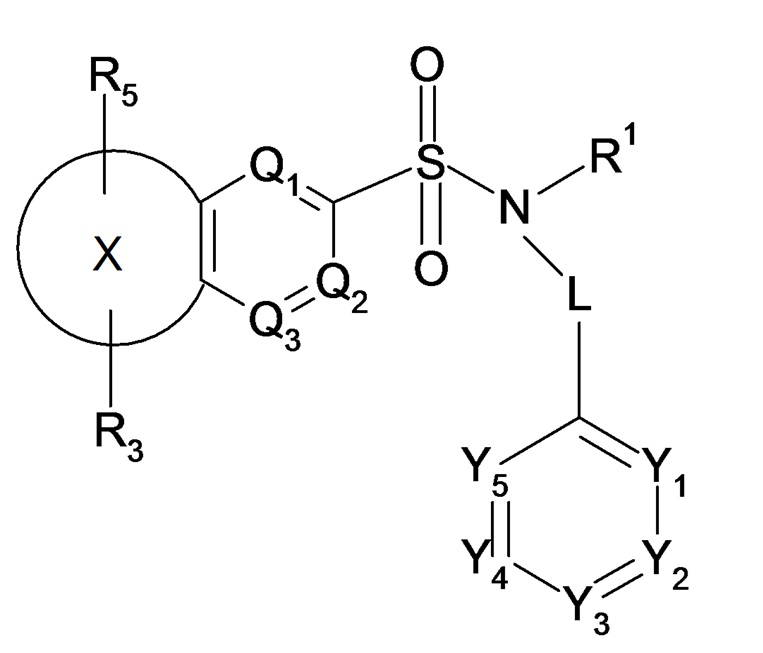
(I)
где в формуле (I):
- L представляет собой простую связь или метиленовую группу CH2,
- X представляет собой следующий ниже циклический радикал:
- один или два элемента Y1, Y2, Y3, Y4 и Y5 представляют собой атом азота и другие элементы, соответствующие группе -CR2, или каждый из элементов Y1, Y2, Y3, Y4 и Y5 соответствует группе -CR2,
- один или два элемента Q1, Q2 и Q3 соответствуют атому азота и другому или другим элементам, соответствующим группе -CR2a, или каждый из элементов Q1, Q2 и Q3 соответствует группе -CR2a,
- R1 представляет собой линейный или разветвленный C3-C5алкильный радикал, C3-C5циклоалкильный радикал, линейный или разветвленный C2-C5алкенильный радикал, C3-C5алкил(C1)циклоалкильный радикал, C4-C5гетероциклоалкильный радикал, C4-C6алкил(C1)гетероциклоалкильный радикал,
- R2 представляет собой атом водорода или атом галогена, линейный или разветвленный C1-C5алкильный радикал, линейный или разветвленный C2-C4алкенильный радикал, C1-C4алкоксирадикал, цианогруппу -CN, радикал -C(=O)R'2, где R'2 означает C1-C3алкоксирадикал, радикал -CF3; где указанные алкильные, алкенильные радикалы и алкоксирадикал могут являться замещенными одним или несколькими атомами галогена;
- R2a представляет собой атом водорода или атом галогена, линейный или разветвленный C1-C5алкильный радикал, линейный или разветвленный C2-C4алкенильный радикал, C1-C4алкоксирадикал, группу -CN, гидроксигруппу -OH, группу -CH(R3a)OH, карбоксильную группу -COOH, карбамоильную группу -CONR2cR2d, амидогруппу -NR2cCOR2d, группу -SO2R2c, группу -SOR2c, группу -S(=O)(=NH-R2c), где указанные алкильные, алкенильные радикалы и алкоксирадикал могут являться замещенными одним или несколькими атомами галогена,
- R2c и R2d, которые могут быть идентичными или различными, представляют собой атом водорода или линейный или разветвленный C1-C5алкильный радикал;
- R3a представляет собой атом водорода или линейный или разветвленный C1-C5алкильный радикал;
- R3 представляет собой атом водорода, группу (CHR6)n-(Z)o-(CHR'6)p-R7, группу CH=R7 или группу -C=CH-R7,
- n, o и p, которые могут быть идентичными или различными, представляют собой ноль или натуральное число в диапазоне от 1 до 3,
- Z представляет собой двухвалентную группу, выбранную из метиленовой группы -CH2-, аминогруппы -NH- и атома кислорода - O-,
- R6 и R'6, которые могут быть идентичными или различными, представляют собой атом водорода, метильную группу -CH3, группу -OH, гидроксиалкильную группу C1, функциональную карбоксильную группу -COOH,
- R7 представляет собой:
- атом водорода или атом галогена,
- группу COOR'7, где R'7 означает алкил(C1)гетероцикл(C6),
- некатионный гетероциклический радикал, необязательно замещенный одним или несколькими атомами галогена, одной или несколькими линейными или разветвленными C1-C3алкильными группами, одной или несколькими группами -OH, одной или несколькими функциональными карбонильными группами, одной или несколькими линейными или разветвленными C1-C4гидроксиалкильными группами, одной или несколькими аминогруппами, одной или несколькими группами -C(=O)R7a, одной или несколькими группами S(=O)2R7a;, где R7a представляет собой линейный или разветвленный C1-C3алкильный радикал, линейный или разветвленный C1-C3алкоксирадикал или аминорадикал N(R8a)(R8b),
- некатионный C3-C6циклоалкильный радикал, необязательно замещенный одним или несколькими алкильными радикалами C1, одним или несколькими атомами галогена, цианогруппой -CN или одной или несколькими группами -COR9; R9 означает линейный или разветвленный C1-C3алкоксирадикал или гидроксигруппу,
- некатионный ароматический или гетероароматический радикал, необязательно замещенный одним или несколькими атомами галогена, одной или несколькими линейными или разветвленными C1-C3алкильными группами, необязательно замещенными одним или несколькими атомами галогена, одной или несколькими C1-C3алкоксигруппами, одной или несколькими аминогруппами -NR11R12, одной или несколькими группами -COR11, одной или несколькими группами -COOR11, одной или несколькими амидогруппами -CONR11R12, одной или несколькими группами -SOR11, одной или несколькими группами -SO2R11, одной или несколькими группами -NHCOR11, одной или несколькими группами -NHCOOR11, одной или несколькими группами -SO2NR11R12 или одной или несколькими группами -CN;, где R11 и R12, которые могут быть идентичными или различными, представляют собой атом водорода, гидроксирадикал -OH, линейный или разветвленный C1-C3алкильный радикал, необязательно замещенный одним или несколькими атомами галогена,
- если R3 представляют собой группу -CH=R7 или группу -C=CH-R7, то R7 не является атомом водорода, атомом галогена или группой COOR'7,
- R5 представляет собой атом водорода или атом галогена, линейный или разветвленный C1-C3алкильный радикал, необязательно замещенный одним или несколькими атомами галогена; аминорадикал -NH2, радикал CH2R'7a,где R'7a означает алкоксирадикал C1, гидроксигруппу -OH, группу -CH2COOH, группу -CH(R5b)OH, аминогруппу -NH2, карбоксильную группу -COOH, группу -CN, функциональную тиоксогруппу,
- R5b представляет собой атом водорода; линейный или разветвленный C1-C3алкильный радикал, необязательно замещенный одной или несколькими карбоксильными функциональными группами; циклопропильный радикал,
- R8a и R8b, которые могут быть идентичными или различными, означают атом водорода, линейный или разветвленный C1-C3алкильный радикал или циклопропильный радикал.
Соединение или соединения по изобретению, таким образом, соответствуют бициклическим производным сульфонамидов, таким образом, соединению или соединениям сульфонамидов, содержащих в своей структуре по меньшей мере два цикла, которые являются сопряженными друг с другом.
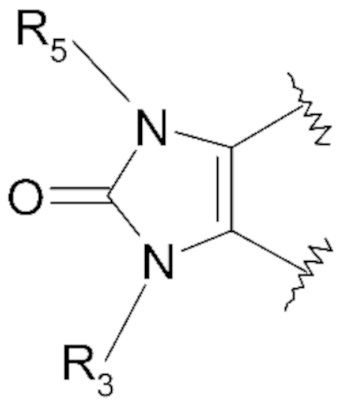
В соответствии с определением формулы (I) внутрициклическая связь между циклическим радикалом X, таким как представлено выше, и ароматическим ядром, содержащем элементы Q1-Q3, представляет собой двойную связь. Таким образом, двойная связь является общей для циклического радикала X и ароматическим ядром, содержащим элементы Q1-Q3. Внутрициклическая двойная связь может изменять положение в ароматическом ядре, содержащем элементы Q1-Q3.
Соединения по изобретению позволяют модулировать, т.е. ингибировать активность рецептора RORγt.
Настоящее изобретение также относится к соединению или соединениям, таким как определено выше, в качестве лекарственного средства и косметического средства.
Другой целью изобретения является соединение или соединения, такие как определено выше, для применения в лечении заболеваний, опосредованных рецептором RORγt, в частности воспалительных заболеваний и/или аутоиммунных заболеваний, опосредованных рецептором RORγt.
Кроме того, изобретение также относится к фармацевтической композиции, содержащей в фармацевтически приемлемой среде одно или несколько соединений формулы (I), такой как определено выше, их фармацевтически приемлемым солям присоединения, их гидратам и/или их сольватам.
Настоящее изобретение также относится к фармацевтической композиции, такой как описанной выше, для применения в лечении заболеваний, опосредованных рецептором RORγt, в частности воспалительных заболеваний и/или аутоиммунных заболеваний.
Также изобретение относится к способу лечения заболеваний, опосредованных рецептором RORγt, включающему введение в частности местным или пероральным путем терапевтически эффективного количества одного или нескольких соединений, таких как указано выше, пациенту.
Другие объекты и характеристики, аспекты и преимущества изобретения станут еще более очевидны при прочтении описания и примеров, которые следуют ниже.
По одному из вариантов осуществления в формуле (I) L представляет собой простую связь.
По другому варианту осуществления в формуле (I) L представляет собой метиленовую группу -CH2.
Предпочтительно в формуле (I) L представляет собой простую связь.
Предпочтительно R3 отличается от атома галогена, и R5 представляет собой атом водорода или линейный или разветвленный C1-C3алкильный радикал, необязательно замещенный одним или несколькими атомами галогена.
По одному из вариантов осуществления R3 представляет собой атом водорода, группу (CHR6)n-(Z)o-(CHR'6)p-R7, и R5 представляет собой атом водорода или линейный или разветвленный C1-C3алкильный радикал, необязательно замещенный одним или несколькими атомами галогена.
По одному из вариантов осуществления в формуле (I) R3 представляет собой атом водорода.
По одному из вариантов осуществления в формуле (I) R3 представляет собой группу (CHR6)n-(Z)o-(CHR'6)p-R7.
По одному из вариантов осуществления в формуле (I) индексы n, o, и p, которые могут быть идентичными или различными, означают ноль.
По одному из вариантов осуществления в формуле (I) индексы n, o, и p, которые могут быть идентичными или различными, означают натуральное число в диапазоне от 1 до 3.
По одному из вариантов осуществления в формуле (I) индексы n и p означают ноль, и индекс o равен 1.
По одному из вариантов осуществления в формуле (I) Z представляет собой метиленовую группу -CH2.
По одному из вариантов осуществления в формуле (I) Z представляет собой двухвалентную группу -O-.
По одному из вариантов осуществления в формуле (I) Z представляет собой двухвалентную группу -NH-.
По одному из вариантов осуществления в формуле (I) R3 представляет собой группу Z-R7, где Z имеет описанное выше значение.
В конкретном варианте осуществления, в формуле (I) R3 представляет собой группу -CH2-R7.
В конкретном варианте осуществления, в формуле (I) R3 представляет собой группу -O-R7.
В конкретном варианте осуществления, в формуле (I) R3 представляет собой группу -NH-R7.
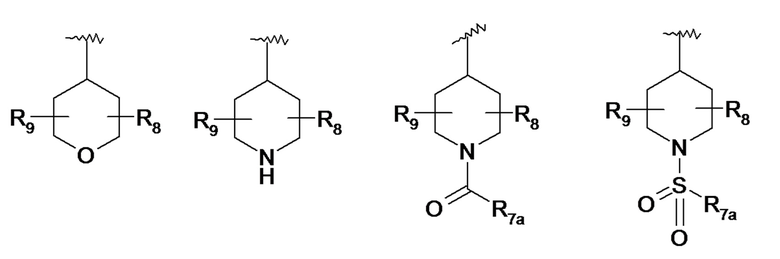
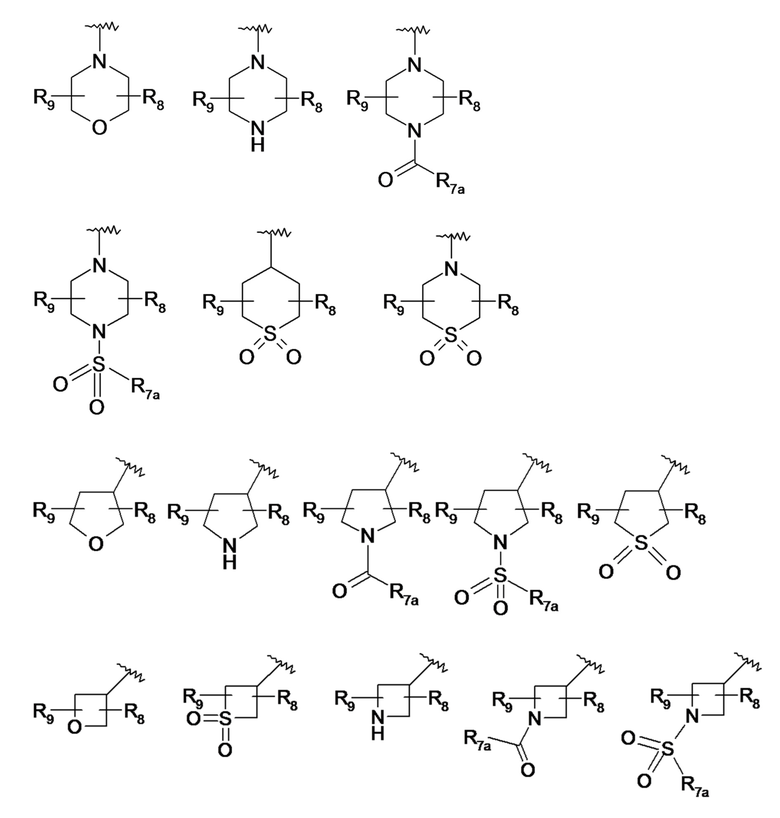
По одному из вариантов осуществления в формуле (I) R7 представляет собой гетероциклический радикал, выбранный из следующих ниже гетероциклов:
где:
- R7a представляет собой линейный или разветвленный C1-C3алкильный радикал, линейный или разветвленный C1-C3алкоксирадикал или аминорадикал N(R8a)(R8b),
- R8a и R8b, которые могут быть идентичными или различными, означают атом водорода, линейный или разветвленный C1-C3алкильный радикал или циклопропильный радикал,
- R8 и R9, которые могут быть идентичными или различными, представляют собой атом водорода, линейный или разветвленный C1-C3алкильный радикал, гидроксигруппу -OH, функциональную карбонильную группу =O, радикал гидроксиалкил C1 (-CH2OH), аминогруппу NH2,
- R8 и R9 могут образовывать совместно с атомами углерода, к которым они присоединены, карбоциклический цикл, содержащий от 5 до 7 звеньев.
По одному из вариантов осуществления в формуле (I) R7 представляет собой ароматический или гетероароматический радикал, выбранный из:
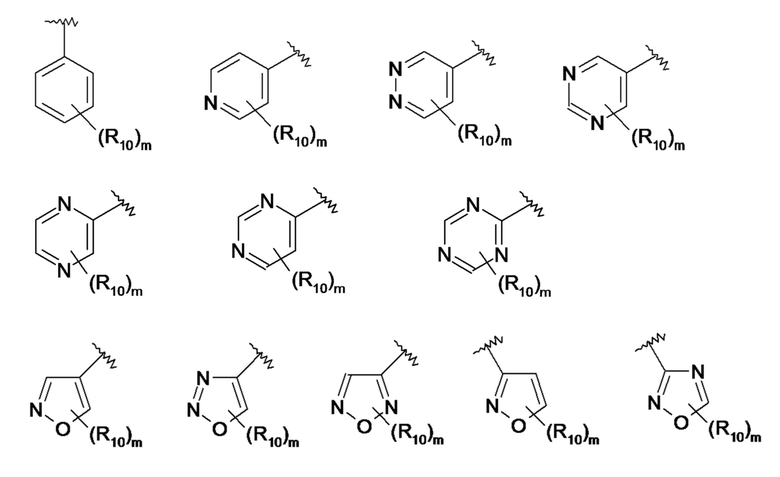
где:
- R10 представляет собой атом водорода или атом галогена, линейную или разветвленную C1-C3алкильную группу, необязательно замещенную одним или несколькими атомами галогена; C1-C3алкоксигруппу, аминогруппу -NR11R12, группу -COR11, группу -COOR11, амидогруппу -CONR11R12, группу -SOR11, группу -SO2R11, группу -NHCOR11, группу -NHCOOR11, группу -SO2NR11R12 или группу -CN;, где R11 и R12, которые могут быть идентичными или различными, представляют собой атом водорода или линейный или разветвленный C1-C3алкильный радикал, необязательно замещенный одним или несколькими атомами галогена,
- m означает ноль или натуральное число в диапазоне от 1 до 3.
Предпочтительно R7 представляет собой ароматический или гетероароматический радикал, такой как определено выше, необязательно замещенный одной или несколькими метильными группами -CH3, одной или несколькими метоксигруппами -OCH3, одной или несколькими гидроксигруппами -OH, одной или несколькими аминогруппами -NH2, одной или несколькими группами -CH2OH, одной или несколькими цианогруппами -CN, одним или несколькими атомами галогена или одной или несколькими функциональными карбонильными группами.
По одному из вариантов осуществления индекс m равен нолю.
По одному из вариантов осуществления индекс m означает натуральное число в диапазоне от 1 до 3.
Предпочтительно индекс m равен 1.
По одному из вариантов осуществления в формуле (I) каждый из элементов Y1, Y2, Y3, Y4 и Y5 соответствует группе -CR2, где R2 имеет такое же значение, как описанное выше значение.
По одному из вариантов осуществления в формуле (I) каждый из элементов Y1, Y2, Y3, Y4 и Y5 соответствует группе -CR2, где R2 представляет собой атом водорода.
По одному из вариантов осуществления в формуле (I) каждый из элементов Y1, Y2, Y3, Y4 и Y5 соответствует группе -CR2, где R2 представляет собой линейный или разветвленный C1-C5алкильный радикал.
По одному из вариантов осуществления в формуле (I) каждый из элементов Q1, Q2 и Q3 представляет собой группу -CR2a, где R2a имеет такое же значение, как описанное выше значение.
По одному из вариантов осуществления в формуле (I) каждый из элементов Q1, Q2 и Q3 представляет собой группу -CR2a, где R2a представляет собой атом водорода.
По одному из вариантов осуществления в формуле (I) Q1 и Q2 представляют собой группу -CR2a, где R2a представляет собой атом водорода, и Q3 представляет собой группу -CR2a, где R2a представляет собой линейный или разветвленный C1-C5алкильный радикал.
По одному из вариантов осуществления в формуле (I) R1 представляет собой линейный или разветвленный C3-C5алкильный радикал, предпочтительно разветвленный C3-C5алкильный радикал, более предпочтительно разветвленный C4.
По одному из вариантов осуществления в формуле (I) R1 представляет собой C3-C5циклоалкильный радикал, предпочтительно циклопропильный.
По одному из вариантов осуществления в формуле (I) R1 представляет собой линейный или разветвленный C2-C5алкенильный радикал.
По одному из вариантов осуществления в формуле (I) R1 представляет собой CH2-C3-C5циклоалкильный радикал.
По одному из вариантов осуществления в формуле (I) R1 представляет собой C4-C5гетероциклоалкильный радикал.
По одному из вариантов осуществления в формуле (I) R1 представляет собой CH2-C4-C6гетероциклоалкильный радикал, в частности CH2-C4-C5гетероциклоалкильный радикал.
Предпочтительно R1 представляет собой линейный или разветвленный C3-C5алкильный радикал или CH2-C4-C5гетероциклоалкильный радикал.
По одному из вариантов осуществления R5 представляет собой атом водорода.
Предпочтительно соединение или соединения формулы (I) выбирают из соединения или соединений формулы (IV), их солей присоединения фармацевтически приемлемых, их гидратов и/или их сольватов:
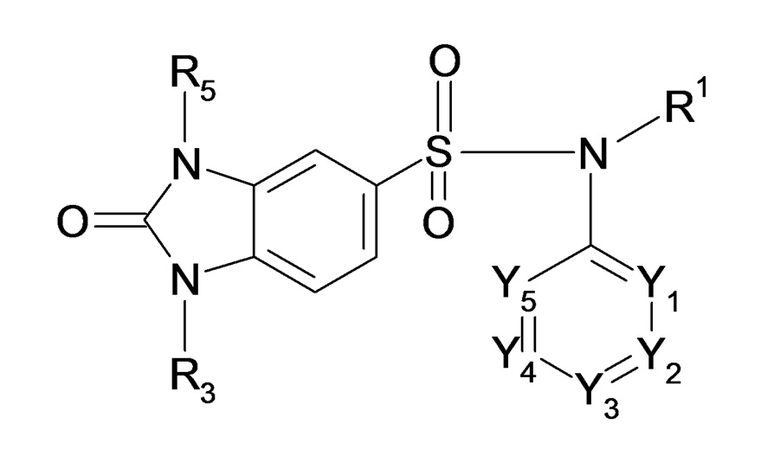
(IV)
где в формуле (IV) R1, R3, R5 и Y1-Y5 имеют такие же значения, что и в описанной выше формуле (I).
Предпочтительно R1 представляет собой линейный или разветвленный C3-C5алкильный радикал или C3-C5циклоалкильный радикал. Более предпочтительно R1 представляет собой линейный или разветвленный C3-C5алкильный радикал, в частности разветвленный.
Предпочтительно Y1-Y2 и Y4-Y5 соответствуют группе -CR2, где R2 означает атом водорода, и Y3 соответствует группе -CR2, где R2 означает линейный или разветвленный C1-C5алкильный радикал, предпочтительно C2.
Предпочтительно Y1 и Y3, которые могут быть идентичными или различными, соответствуют группе -CR2, где R2 означает атом водорода или линейный или разветвленный C1-C5алкильный радикал, предпочтительно C2.
Предпочтительно Y1 и Y3 являются идентичными и соответствуют группе -CR2, где R2 означает атом водорода или линейный или разветвленный C1-C5алкильный радикал, предпочтительно C2.
Предпочтительно R5 представляет собой атом водорода.
Предпочтительно R3 представляет собой группу (CHR6)n-(Z)o-(CHR'6)p-R7, где индексы n, p, o, R6, R'6 и R7 имеют указанные выше значения, и предпочтительно R7 выбран из гетероциклических радикалов и ароматических радикалов или гетероароматических радикалов, описанных выше.
Более предпочтительно R3 представляет собой группу CH2-R7.
По одному из вариантов осуществления R1 представляет собой линейный или разветвленный C3-C5алкильный радикал, R5 представляет собой атом водорода, и R3 представляет собой группу (CHR6)n-(Z)o-(CHR'6)p-R7, где индексы n, p, o, R6, R'6 и R7 имеют указанные выше значения.
Соединения формулы (I) могут находиться в форме фармацевтически приемлемых солей. Примеры иллюстративных фармацевтически приемлемых солей описаны у Berge et al., 1977, "Sels pharmaceutiquement acceptables", J. Pharm. Sci., Vol. 66, pp. 1-19.
В частности, когда соединения формулы по изобретению находятся в виде солей, то электронейтральность указанных соединений обеспечивается внешним катионным противоионом Y, который может быть органическим или минеральным.
Y можно выбирать из соответствующих неорганических катионов, таких как ионы щелочных металлов, в частности Na+, K+, ионы щелочно-земельных металлов, в частности Ca2+, Mg2+, а также других катионов, таких как ион алюминия Al3+.
Y можно выбирать из соответствующих органических катионов, таких как ион аммония NH4+, замещенные ионы аммония, такие как NH3R+, NHR2+, NR4+, где R представляет собой C1-C4алкильный радикал.
В частности, замещенные ионы аммония представляют собой ионы аммония, выбираемые из производных этиламина, диэтиламина, дициклогексиламина, триэтиламина, бутиламина, этилендиамина, этаноламина, диэтаноламина, пиперазина, бензиламина, фенилбензиламина, холина, меглюмина и трометамина, аминокислот, таких как лизин и аргинин.
Примером иона четвертичного аммония может являться ион N+ (CH3)4.
Соединение или соединения по изобретению могут находиться в виде сольватов.
В контексте настоящего изобретения термин "сольват" означает комплекс растворенного вещества (т.е. соединения по изобретению или соли указанного соединения) и растворителя.
Если растворитель представляет собой воду, то сольват можно легко рассматривать как гидрат, например, полугидрат, моногидрат, дигидрат, тригидрат и т.д.
Например, сольваты и/или гидраты можно получать непосредственно в конце процесса синтеза, где целевое соединение выделяют в виде гидрата, например, моногидрата или полугидрата, или в виде сольвата растворитель реакционной смеси и/или растворителя для очищения.
Если не указано иное, любая ссылка на соединение по изобретению также включает сольват или гидрат соответствующего соединения.
Характерные способы получения и идентификации гидратов и сольватов хорошо известны специалисту в данной области, см., например, стр. 202-209 KJ Guillory, "Generation of Polymorphs, Hydrates, Solvates, and Amorphous Solids" в Polymorphism in Pharmaceutical Solids, edition. Harry G. Britain, Vol. 95, Marcel Dekker, Inc., New York, 1999.
Гидраты и сольваты можно выделять и характеризовать способами, известными в данной области, такими как термогравиметрический анализ (TGA), масс-спектроскопия TGA, инфракрасная спектроскопия TGA, порошковая рентгеновская дифракция, титрование по Карлу Фишеру, рентгеновская дифракция высокого разрешения и аналогичным.
Предпочтительно соединение или соединения формулы (I) выбирают из соединений, таких как описанные ниже в таблицах, а также их фармацевтически приемлемых солей присоединений, их гидратов и/или их сольватов.
Таблица 1
соединение 1
соединение 2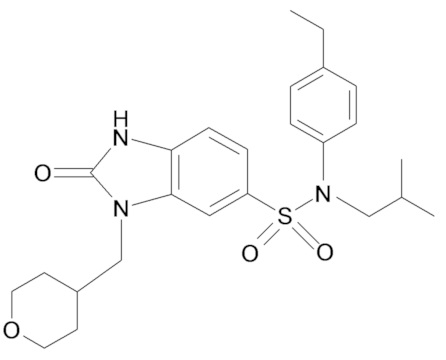
соединение 3
Таблица 2
соединение 4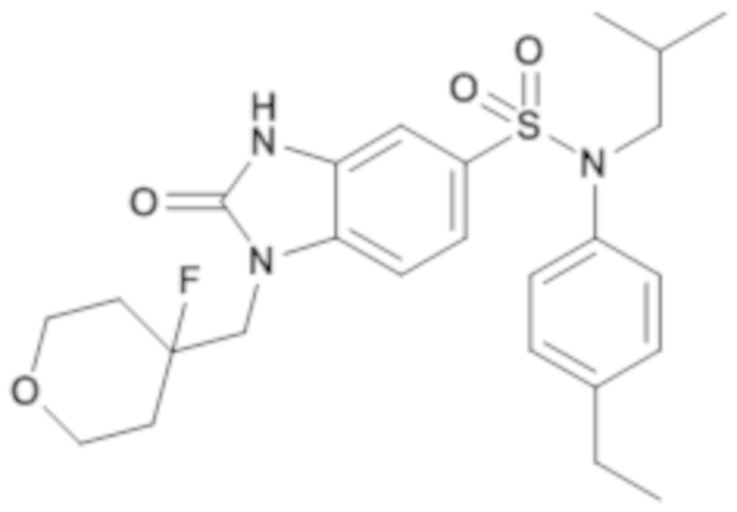
соединение 5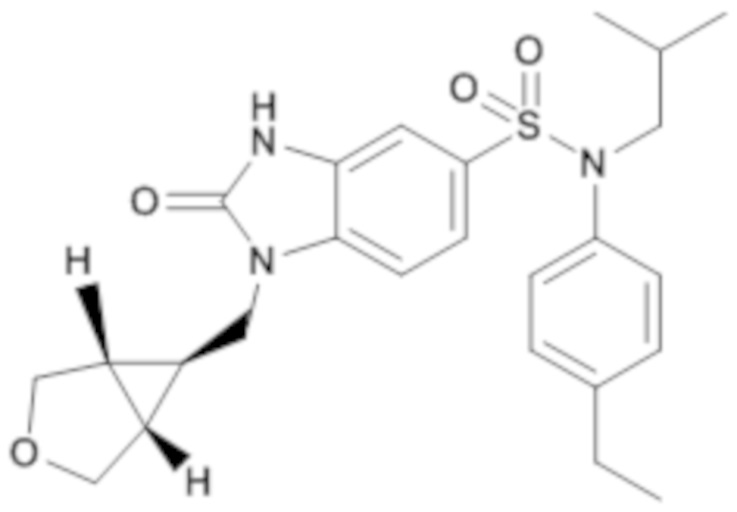
соединение 6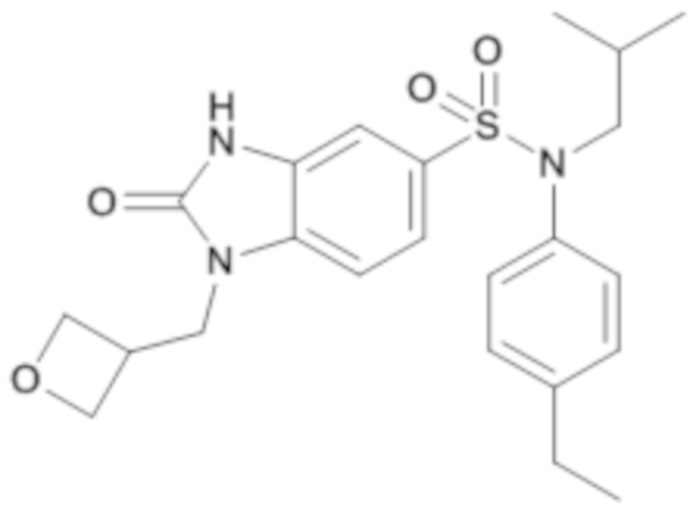
соединение 7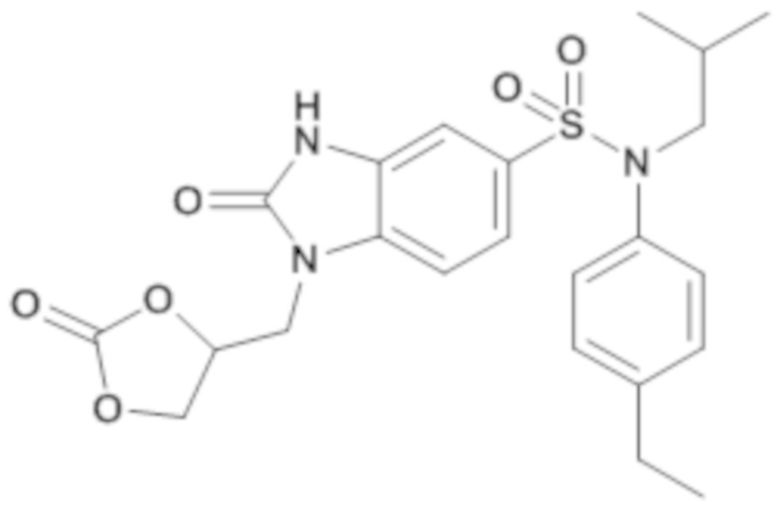
соединение 8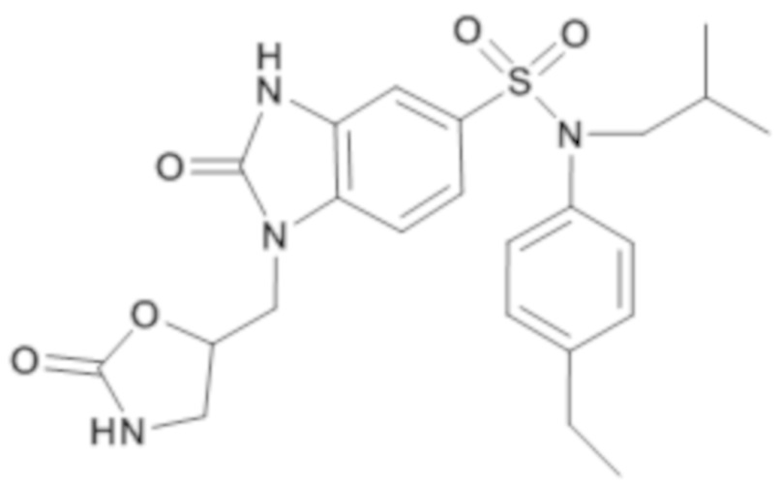
соединение 9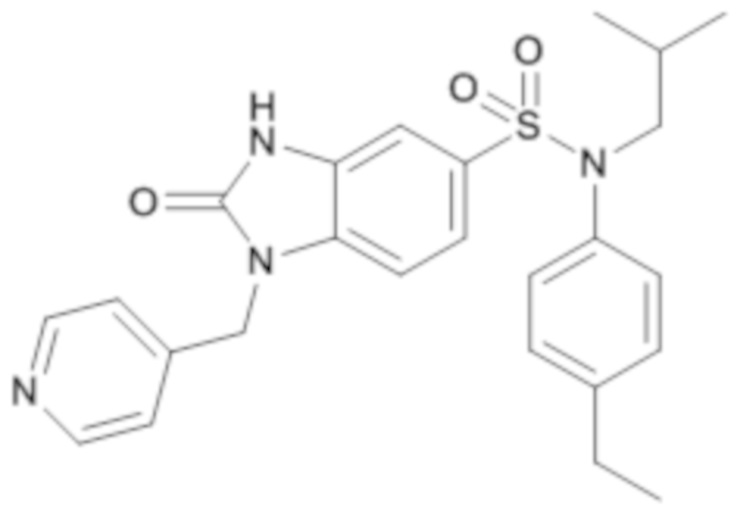
соединение 11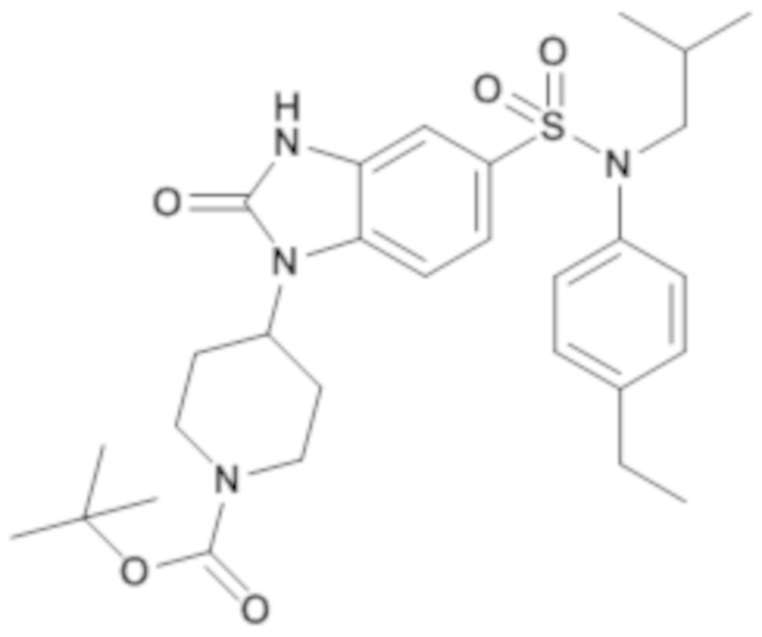
соединение 12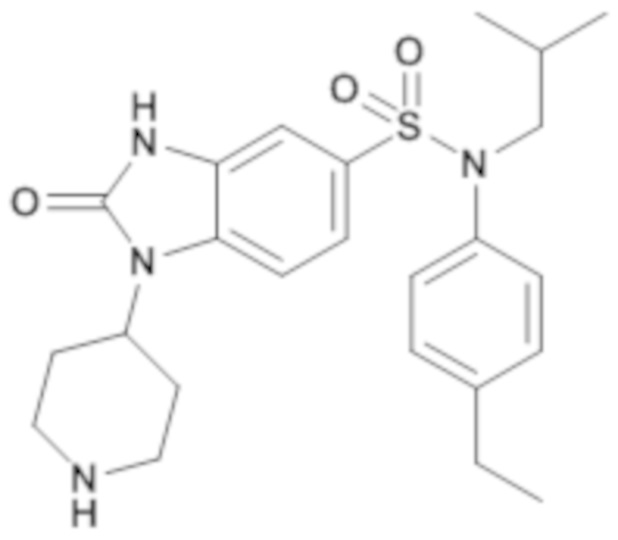
соединение 14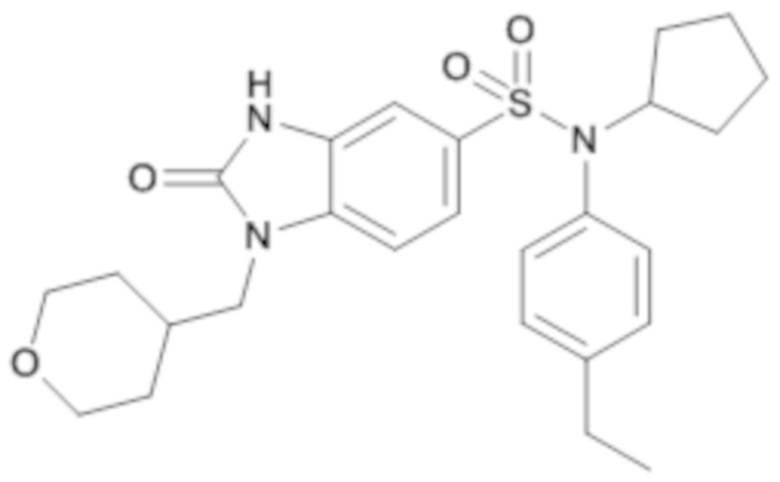
соединение 15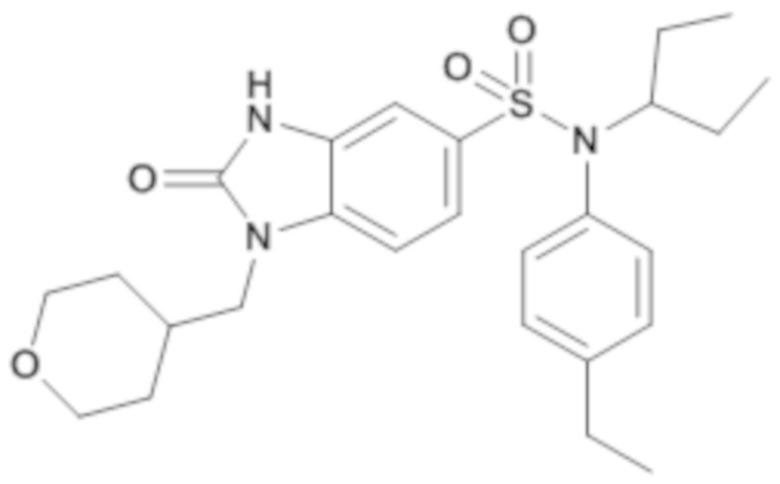
соединение 16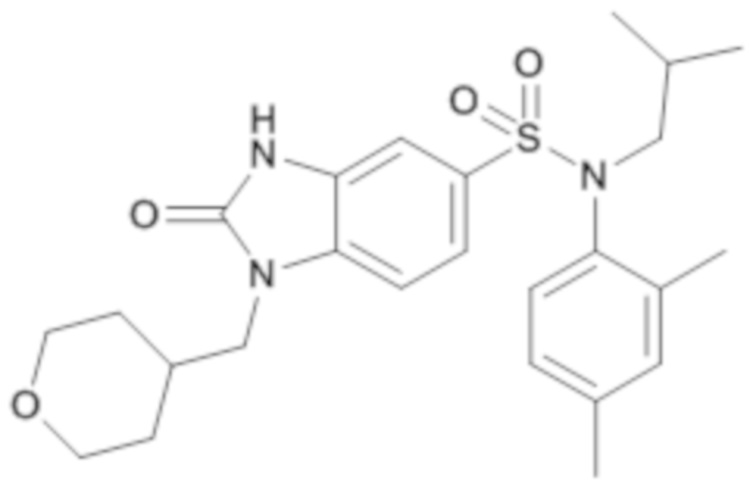
соединение 17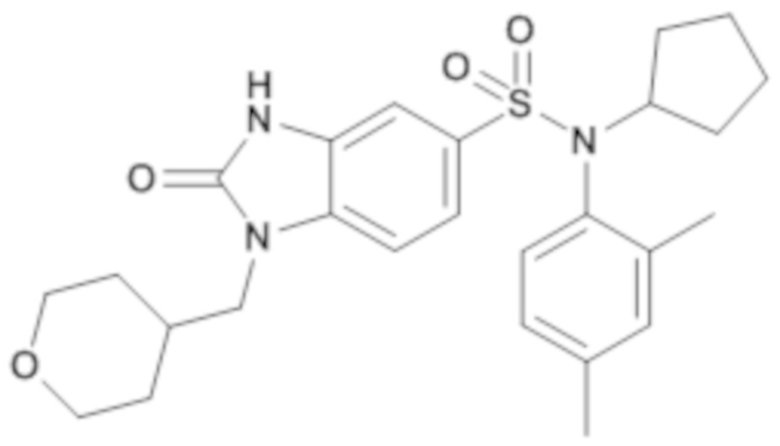
соединение 18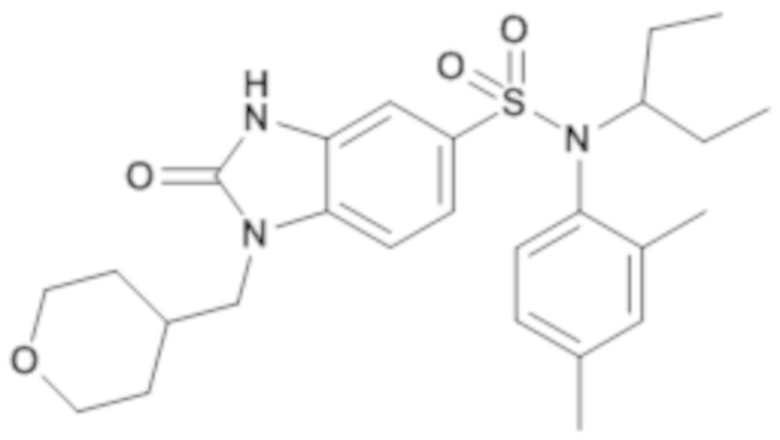
соединение 19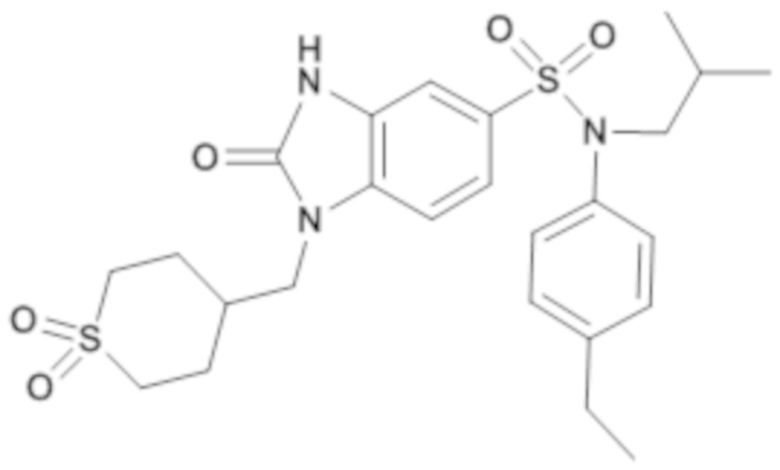
соединение 20
соединение 21
соединение 22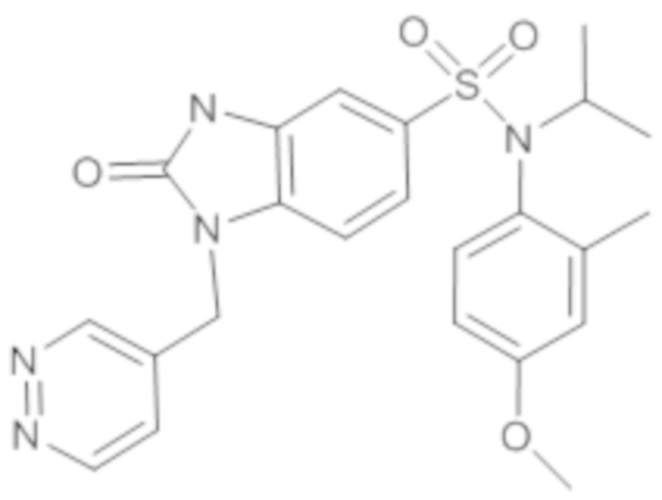
соединение 23
ND: не определено; A: IC50 <100 нМ; B: IC50=100 нМ-1 мкМ; C: IC50>1 мкМ.
В описанных выше таблицах средние ингибирующие концентрации IC50 для соединений, принадлежащих формуле (I) по изобретению, приведены в соответствии со следующими ниже моделями.
Трансактивация GAL4-RORγ
Модель трансактивации RORγ была разработана на основании линии клеток HG5LN, которая является стабильной линией клеток HeLa, стабильно экспрессирующей репортерный ген люциферазу под контролем пентамера области распознавания GAL4 дрожжей и промотора β-глобина. Линию клеток HG5LN стабильно трансфицировали ДНК-связывающим доменом (DBD) GAL4, соединенным с лиганд-связывающим доменом (LBD) ROR гамма. Молекулы, ингибирующие конститутивную активность ROR гамма, снижают экспрессию люциферазы, обуславливая, таким образом, снижение испускаемой люминесценции.
Клетки засевают в 384-луночные планшеты (5000 клеток в 45 мкл/лунку среды для культивирования, содержащей 10% эмбриональной телячьей сыворотки) и инкубируют в течение 4 часов при 37°C, 5% CO2. Затем в каждую лунку добавляют 5 мкл тестируемых молекул (соединения, описанные в таблицах, описанных выше) и инкубируют планшет в течение 18 часов при температуре 37°C в 5% CO2. В каждую лунку добавляют 20 мкл субстрата люциферазы (Promega) и регистрируют испускаемую люминесценцию микропланшетным спектрофотометром.
Единицы люминесценции ("RLU") нормализуют на положительные контроли ("POS", содержащие насыщенную концентрацию бензолсульфонамида, N-(2,2,2-трифторэтил)-N-[4-[2,2,2-трифтор-1-гидрокси-1-(трифторметил)этил]фенила]) и отрицательные контроли ("NEG", содержащие DMSO): % ингибирования=((RLU-NEG)×100)/(POS-NEG). IC50 рассчитывают на основании логистической модели с 4 параметрами с помощью программного обеспечения XLFit (IDBS).
Секреция IL-17A
Эта модель позволяет измерять действие ингибиторов на секрецию IL-17A CD4+ клетками. Клетки представляют собой замороженные (STEMCELL, №70026), выделенные CD4+ клетки периферической крови человека и активированные антителами против CD3 и против CD28. Количество секретируемого IL-17A измеряют способом TR-FRET (набор HTRF® Human Interleukin 17A (Cisbio, №64H17PEC)).
Клетки быстро размораживают, ресуспендируют в среде для культивирования (RPMI, инактивированной 10% SVF), дополненной растворимыми антителами против CD28, и высевают (100000 клеток/лунка) в 96-луночные планшеты, предварительно покрытые антителами против CD3. Затем клетки обрабатывали рядом тестируемых ингибиторов (от 1000 нМ до 0,05 нМ, 0,1% DMSO). После 4 суток инкубации измеряют сигнал HTRF посредством микропланшетного спектрофотометра (λ возбуждения=337 нМ, λ испускания=620/665 нМ). Получаемые отношения (665/620) нормализуют на положительный контроль (клетки, активированные антителами против CD3 и против CD28, 0,1% DMSO). IC50 рассчитывают на основании логистической модели с 4 параметрами с помощью программного обеспечения XLFit (IDBS).
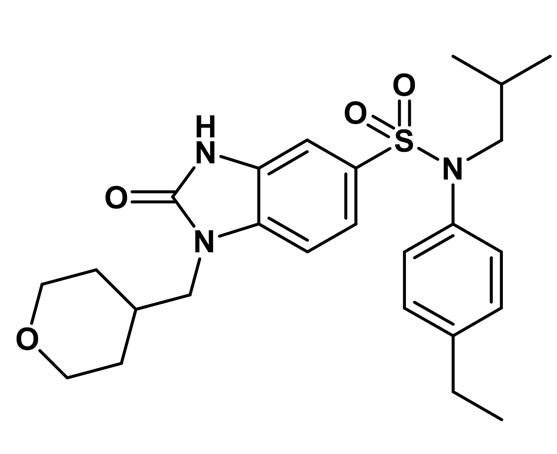
Предпочтительно соединения формулы (I) по изобретению выбирают из следующих ниже соединений.
Таблица 3
соединение 2
соединение 4
соединение 5
соединение 6
соединение 7
соединение 8
соединение 10
соединение 15
соединение 16
соединение 17
соединение 18
соединение 19
Таким образом, соединения 2, 4-8, 10 и 15-19 являются предпочтительными.
Изобретение также относится соединению или соединениям, таким как описано выше, в качестве лекарственного средства и косметического средства.
Предпочтительно изобретение также относится соединению или соединениям, таким как описано выше, в качестве лекарственного средства.
Это объясняется тем, что, соединения по изобретению обладают представляющими интерес фармакологическими свойствами, т.к. указанные соединения модулируют, т.е. ингибируют активность рецептора RORγt.
Таким образом, эти свойства делают соединение или соединения формулы (I), такие как описано выше, пригодными для применения в качестве лекарственного средства для лечения заболеваний, опосредованных рецептором RORγt.
Предпочтительно соединение или соединения по изобретению используют для лечения воспалительных заболеваний и/или аутоиммунных заболеваний, опосредованных рецептором RORγt.
Более предпочтительно соединение или соединения по изобретению, предпочтительно соединения, выбранные из соединений, отвечающих формулам (I), используют в лечении акне, псориаза и/или атопического дерматита.
По другому варианту осуществления соединения по изобретению применяют для косметического лечения кожи.
Как указано выше, настоящее изобретение также относится к фармацевтической композиции, содержащей в фармацевтически приемлемой среде одно или несколько соединений формулы (I), таких как определено выше, их фармацевтически приемлемые соли присоединения, их гидраты и/или их сольваты.
Более предпочтительно фармацевтическая композиция содержит одно или несколько соединений формулы (I), выбираемые из соединений (1)-(20), как определено выше.
Еще более предпочтительно фармацевтическая композиция содержит одно или несколько соединений формулы (Ia) или (Ib), выбираемых из соединений 2, 4-8, 10 и 15-19.
Введение фармацевтической композиции по изобретению, такой как указано выше, можно проводить пероральным или местным путем.
Предпочтительно фармацевтическую композицию формулируют в виде, подходящем для применения местным путем.
Для перорального пути композиция может находиться в виде таблеток, желатиновых капсул, драже, сиропов, суспензий, растворов, порошков, гранул, эмульсий, суспензий микросфер или наносфер, или липидных везикул, или полимеров, обеспечиваю контролируемое высвобождение.
Для местного нанесения фармацевтическая композиция по изобретению более конкретно предназначена для обработки кожи и слизистых оболочек и может находиться в жидкой, пастообразной или твердой форме, и более конкретно в виде мазей, кремов, молочка, помады, порошков, пропитанных тампонов, синтетических моющих средств, растворов, гелей, спреев, муссов, суспензий, палочек, шампуней или основ для мытья. Она также может находиться в виде суспензий микросфер или наносфер, или липидных везикул, или полимеров, или полимерных пластырей, или гелеобразующих средств, обеспечивающих контролируемое высвобождение.
Фармацевтическую композицию применяют для лечения воспалительных заболеваний и/или аутоиммунных заболеваний, опосредованных рецептором RORγt.
Более предпочтительно фармацевтическую композицию применяют для лечения акне и/или псориаза.
Изобретение также относится к способу лечения заболеваний, опосредованных рецептором RORγt, включающему введение, в частности, местным или пероральным путем терапевтически эффективного количества фармацевтической композиции, такой как определено выше, пациенту.
Предпочтительно фармацевтическую композицию наносят местным путем.
Предпочтительно изобретение относится к соединению или соединениям формулы (I) для их применения в лечении акне.
Альтернативно, изобретение также относится к соединению или соединениям формулы (I) для их применения в лечении псориаза.
Альтернативно, соединение или соединения формулы (I) по изобретению применяют для косметического лечения кожи.
Изобретение также относится к фармацевтической композиции, такой как определено выше, для применения в лечении воспалительных нарушений и/или аутоиммунных заболеваний, опосредованных рецептором RORγt, в частности акне и/или псориаза.
Следующие ниже примеры служат для иллюстрации изобретения без какого-либо ограничения.
ПРИМЕРЫ
Стандартный способ LCMS для анализа продуктов является таким, как указано ниже следующим: стандартная колонка BEH C18 (150×2,1 мм, 1,8 мкм) растворитель вода/ацетонитрил 0,1% муравьиная кислота.
Очистки препаративной ВЭЖХ проводили на колонке C18 с элюентом: 85% ацетонитрил в воде/0,1% муравьиной кислоты.
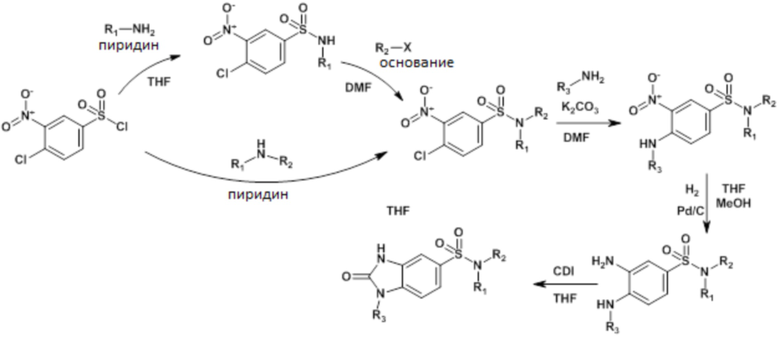
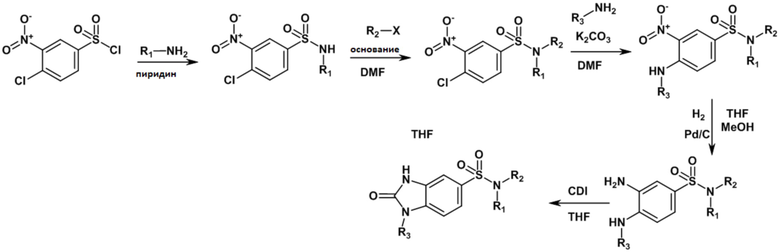
Часть I: Синтез бициклических сульфонамидов по схеме реакции 1
Схема реакции 1
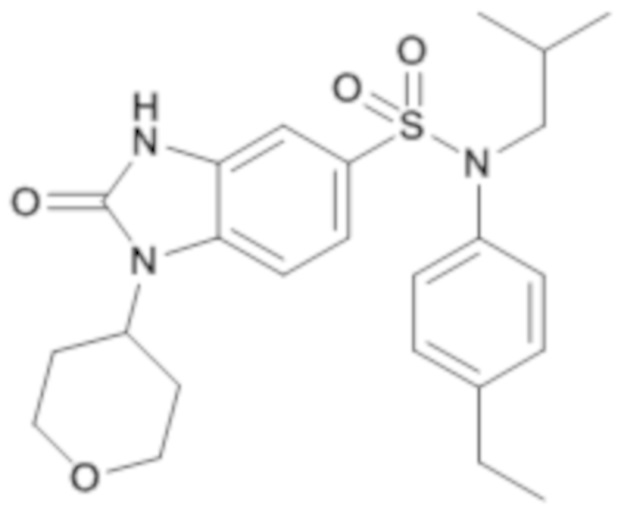
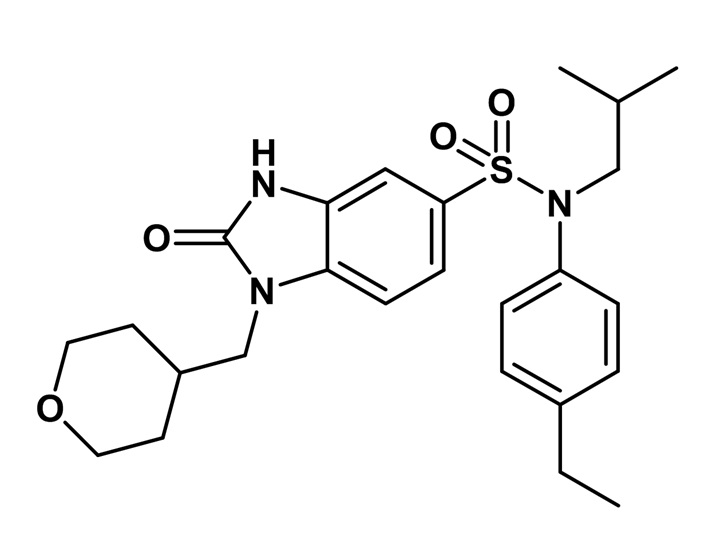
Пример 1: Синтез (4-этилфенил)изобутиламида 2-оксо-1-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты
Соединение 2
1. Синтез промежуточного соединения 1.1
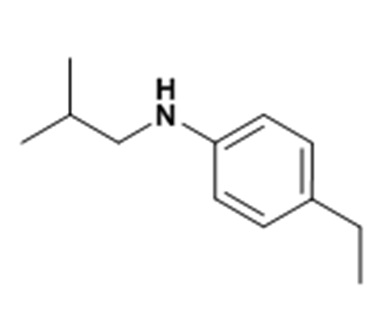
(4-этилфенил)изобутиламин
К 4-этиланилину (9,48 мл; 0,08 моль) добавляют изобутиральдегид (6,33 мл; 0,07 моль.) в тетрагидрофуране (100 мл). Смесь перемешивают 2 часа при температуре окружающей среды. Затем добавляют триацетоксиборгидрат натрия (22,04 г; 0,10 моль). Смесь перемешивают в течение ночи при температуре окружающей среды, добавляют воду (100 мл) и экстрагируют этилацетатом (2×100 мл). Органические фазы объединяют, промывают солевым раствором (100 мл), сушат (Na2SO4) и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/дихлорметаном от 0 до 50% дихлорметана). (4-этилфенил)изобутиламин получают в виде оранжевого масла с соответствующим 1H ЯМР.
MS: [M+H]=179
2. Синтез промежуточного соединения 1.1
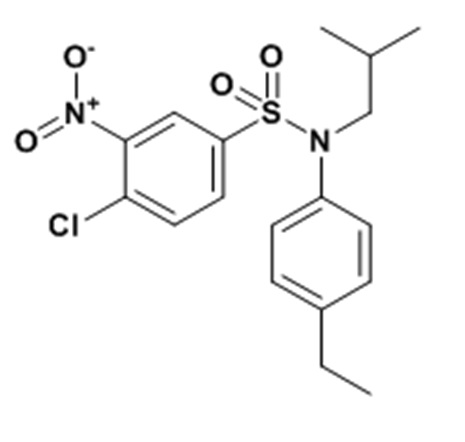
4-хлор-N-(4-этилфенил)-N-изобутил-3-нитробензолсульфонамид
К раствору (4-этилфенил)изобутиламина (0,68 г; 3,83 ммоль) в тетрагидрофуране (15 мл) добавляют пиридин (1,85 мл; 22,96 ммоль) и 4-хлор-3-нитробензолсульфонилхлорид (1,0 г; 3,83 ммоль).
Смесь перемешивают в течение 3 часов, гидролизуют и экстрагируют этилацетатом. Органическую фазу сушат над ангидридом Na2SO4, фильтруют и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 20% этилацетата). 4-хлор-N-(4-этилфенил)-N-изобутил-3-нитробензолсульфонамид (1,42 г; 93%) получают в виде желтого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=397
3. Синтез промежуточного соединения 1.3
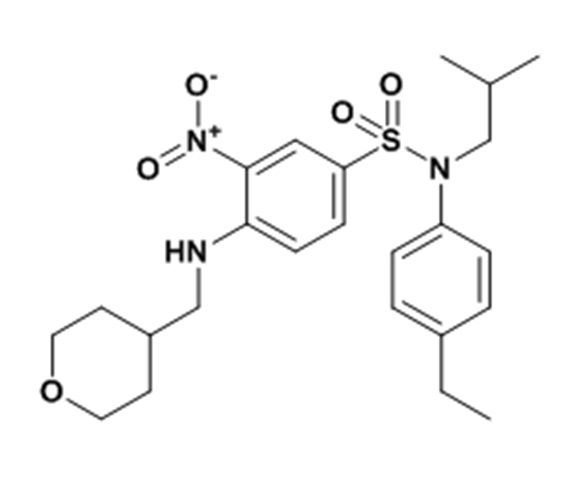
N-(4-этилфенил)-N-изобутил-3-нитро-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид
Смесь 4-хлор-N-(4-этилфенил)-N-изобутил-3-нитробензолсульфонамида (0,98 г; 2,47 ммоль), 4-аминометилтетрагидропирана (0,30 г; 2,59 ммоль) и карбоната калия (0,50 г; 3,62 ммоль) в N,N-диметилформамиде (5 мл) перемешивают 4 часа при 60°C, гидролизуют и экстрагируют этилацетатом. Органическую фазу сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 10 до 50% этилацетата). N-(4-этилфенил)-N-изобутил-3-нитро-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид (0,99 г; 84%) получают в виде желтого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=476
4. Синтез промежуточного соединения 1.4
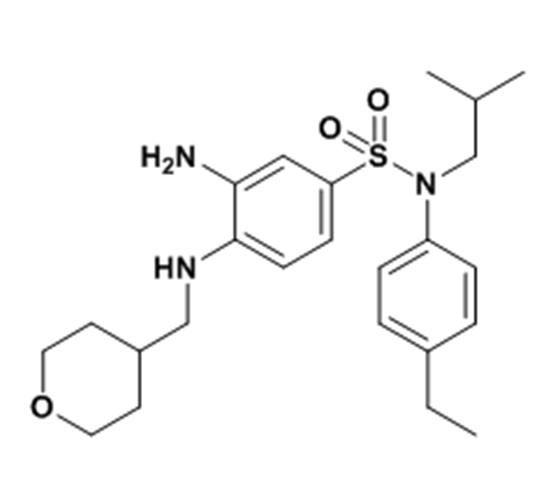
3-амино-N-(4-этилфенил)-N-изобутил-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид
К суспензии N-(4-этилфенил)-N-изобутил-3-нитро-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамида (19,82 г; 32,50 ммоль) в тетрагидрофуране (120 мл) и метаноле (120 мл) добавляют Pd/C 10% (50% H2O) (3,46 г; 1,63 ммоль).
Реакционную среду перемешивают в течение ночи в атмосфере водорода, фильтруют через целит, который промывают несколько раз смесью DCM/тетрагидрофурана/MeOH.
Фильтрат концентрируют, ресуспендируют в пентане и фильтруют. Получаемое твердое вещество снова промывают пентаном, затем одни раз смесью пентана и немного простого этилового эфира. 3-амино-N-(4-этилфенил)-N-изобутил-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид (11,77 г; 81%) получают в виде бежевого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=446
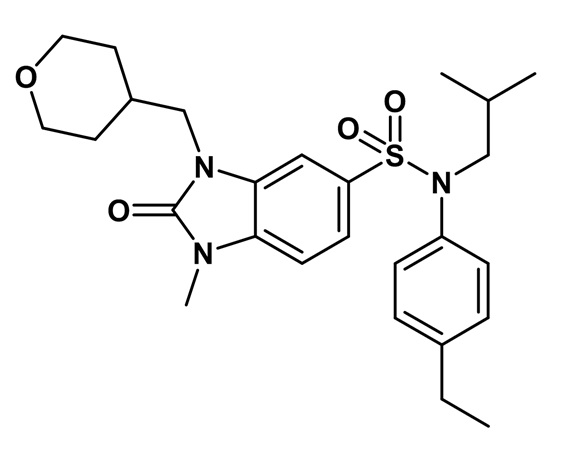
5. Синтез соединения 2 по изобретению
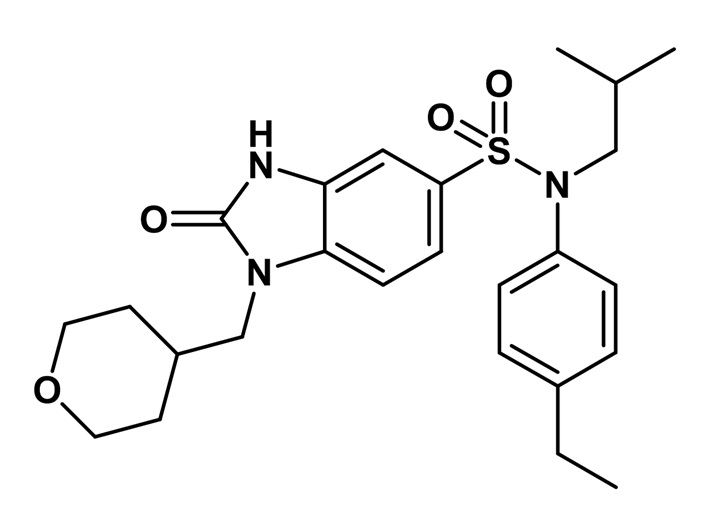
3-амино-N-(4-этилфенил)-N-изобутил-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид (1,00 г; 2,24 ммоль) растворяют в тетрагидрофуране (10 мл) перед добавлением N,N'-карбонилдиимидазола (1,09 г; 6,72 ммоль). Реакционную среду перемешивают в течение двух часов при температуре окружающей среды, гидролизуют и экстрагируют этилацетатом. Органические фазы объединяют, промывают насыщенным раствором (NaHCO3) и водой, затем сушат (MgSO4), фильтруют и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют дихлорметаном/метанолом от 0 до 8% метанола). (4-этилфенил)изобутиламид 2-оксо-1-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (785 мг; 74%) получают в виде твердого беловатого кристаллического вещества после повторной кристаллизации в смеси ацетона/воды.
1H ЯМР (DMSO-d6) δ: 0,83 (д, J=6,5 Гц, 6H), 1,17 (т, J=7,6 Гц, 3H), 1,28 (кд, J=12,2, 4,4 Гц, 2H), 1,39 (п, J=6,7 Гц, 1H), 1,47 (д, J=12,2 Гц, 2H), 2,00 (д, J=12,5 Гц, 1H), 2,59 (к, J=7,6 Гц, 2H), 3,21 (д, J=11,3 Гц, 2H), 3,26 (д, J=6,6 Гц, 2H), 3,72 (д, J=7,2 Гц, 2H), 3,82 (дд, J=12,2, 3,8 Гц, 2H), 6,96 (д, J=8,0 Гц, 2H), 7,00 (с, 1H), 7,17 (д, J=7,9 Гц, 2H), 7,20 (д, J=8,3 Гц, 1H), 7,33 (д, J=8,3 Гц, 1H), 11,16 (с, 1H)
MS: [M+H]=472
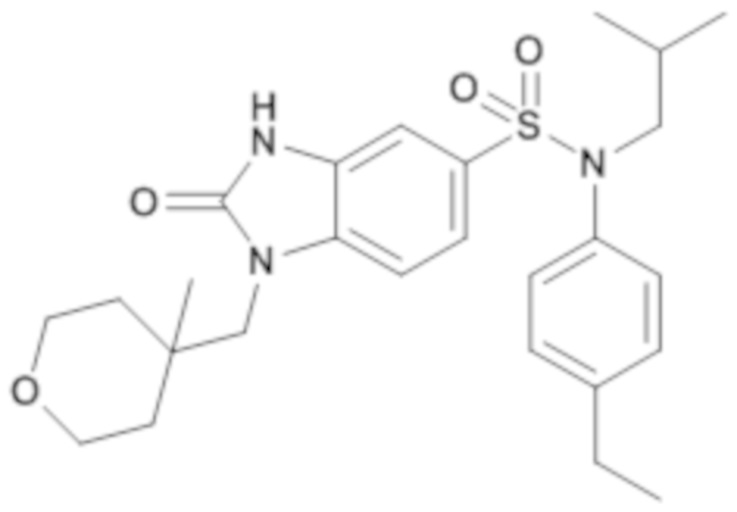
Пример 2: Синтез (4-этилфенил)изобутиламида 1-(4-метил-тетрагидропиран-4-илметил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты

Соединение 4
1. Синтез промежуточного соединения 2.1
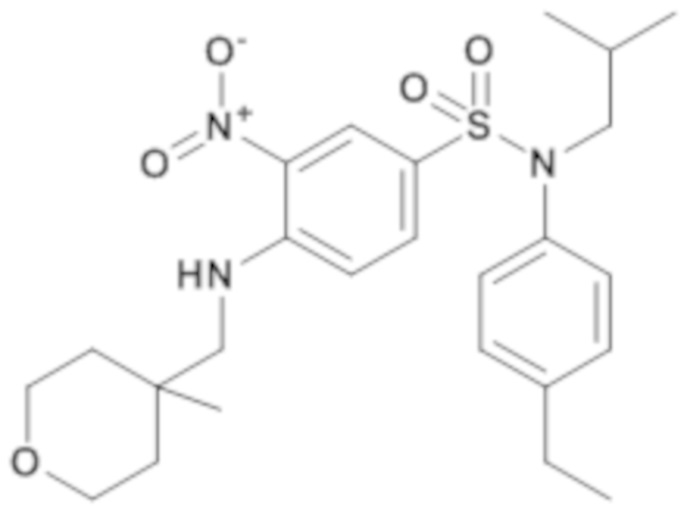
N-(4-этилфенил)-N-изобутил-4-[(4-метил-тетрагидропиран-4-илметил)амино]-3-нитробензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.3, получают N-(4-этилфенил)-N-изобутил-4-[(4-метилтетрагидропиран-4-илметил)амино]-3-нитробензолсульфонамид (100 мг; 27%) в виде желтого масла с соответствующим 1H ЯМР.
MS: [M+H] =490
2. Синтез промежуточного соединения 2.2
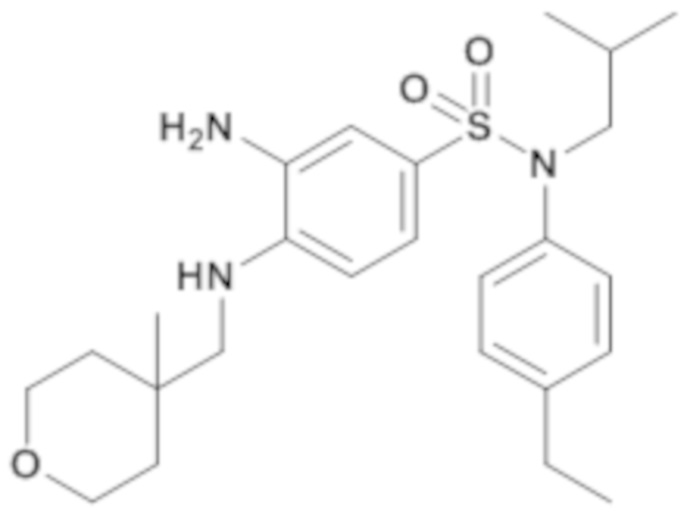
3-амино-N-(4-этилфенил)-N-изобутил-4-[(4-метилтетрагидропиран-4-илметил)амино]бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.4, получают 3-амино-N-(4-этилфенил)-N-изобутил-4-[(4-метилтетрагидропиран-4-илметил)амино]бензолсульфонамид (80 мг; 85%) в виде коричневого масла с соответствующим 1H ЯМР.
MS: [M+H]=460
3. Синтез соединения 4 (соединения 269) по изобретению
Способом, аналогичным способу, описанному в примере 1 получают (4-этилфенил)изобутиламид 1-(4-метилтетрагидропиран-4-илметил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (40 мг; 43%) в виде бежевого твердого вещества
1H ЯМР (DMSO-d6) δ: 0,84 (д, J=6,7 Гц, 6H), 1,03 (с, 3H), 1,18 (т, J=7,6 Гц, 3H), 1,27 (д, J=13,7 Гц, 2H), 1,40 (п, J=6,8 Гц, 1H), 1,59 (с, 1H), 1,59 (дд, J=23,5, 4,4 Гц, 1H), 2,53-2,66 (м, 3H), 3,27 (д, J=7,3 Гц, 2H), 3,51 (т, J=9,8 Гц, 2H), 3,64-3,74 (м, 4H), 6,93-7,04 (м, 3H), 7,14-7,24 (м, 3H), 7,35 (д, J=8,4 Гц, 1H), 11,21 (с, 1H).
MS: [M+H]=486
Пример 3: Синтез (4-этилфенил)изобутиламида 1-(4-фтортетрагидропиран-4-илметил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты

Соединение 5
1. Синтез промежуточного соединения 3.1
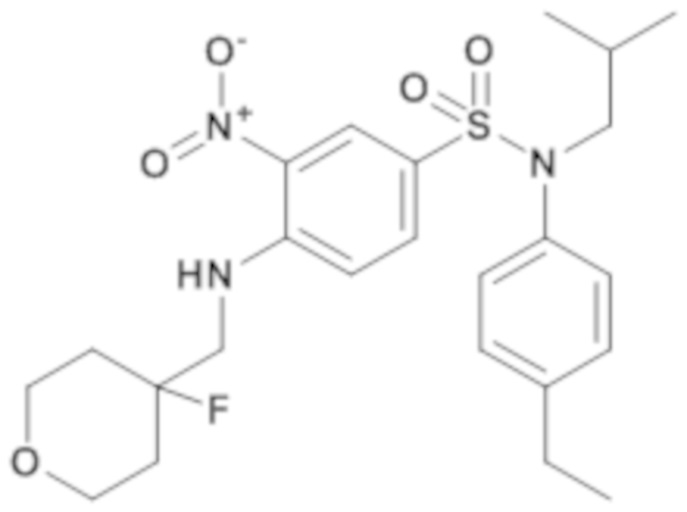
N-(4-этилфенил)-4-[(4-фтортетрагидропиран-4-илметил)амино]-N-изобутил-3-нитробензолсульфонамид
Смесь 4-хлор-N-(4-этилфенил)-N-(1-этилпропил)-3-нитробензолсульфонамида (200 мг; 0,50 ммоль), N,N-диметилформамида (2,00 мл), карбоната калия (77 мг; 0,55 ммоль) и (4-фтороксан-4-ил)метанамина (70,46 мг; 0,53 ммоль) перемешивают в течение 2 часов при температуре 40°C, разбавляют этилацетатом. Органическую фазу промывают насыщенным раствором NH4Cl и водой, сушат (MgSO4), фильтруют и концентрируют досуха. N-(4-этилфенил)-4-[(4-фтортетрагидропиран-4-илметил)амино]-N-изобутил-3-нитробензолсульфонамид (205 мг; 82%) получают в виде светлого масла с соответствующим 1H ЯМР.
MS: [M+H] =494
2. Синтез промежуточного соединения 3.2
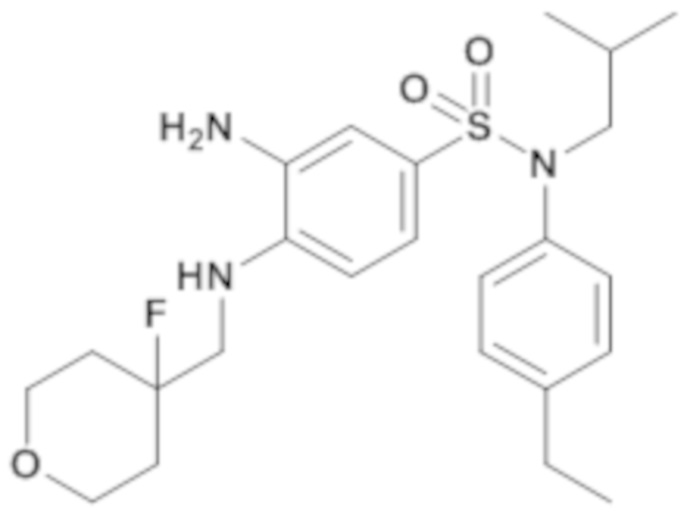
3-амино-N-(4-этилфенил)-4-[(4-фтортетрагидропиран-4-илметил)амино]-N-изобутил-бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.4, получают 3-амино-N-(4-этилфенил)-4-[(4-фтортетрагидропиран-4-илметил)амино]-N-изобутил-бензолсульфонамид (190 мг; 99%) в виде бесцветного масла с соответствующим 1H ЯМР.
MS: [M+H]=465
3. Синтез соединения 5 по изобретению

Способом, аналогичным способу, описанному в примере 1 получают (4-этилфенил)изобутиламид 1-(4-фтортетрагидропиран-4-илметил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (80 мг; 40%) в виде белого кристаллического твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,84 (д, J=6,7 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,40 (п, J=6,8 Гц, 2H), 1,69 (т, J=12,4 Гц, 2H), 1,74-1,94 (м, 1H), 2,61 (к, J=7,6 Гц, 2H), 3,27 (д, J=7,3 Гц, 2H), 3,52 (т, J=10,7 Гц, 2H), 3,76 (д, J=11,7 Гц, 2H), 4,08 (д, J=22,1 Гц, 2H), 6,97-7,00 (м, 2H), 7,02 (д, J=1,7 Гц, 1H), 7,18 (д, J=8,3 Гц, 2H), 7,26 (тд, J=8,2, 1,7 Гц, 2H), 11,25 (с, 1H).
MS: [M+H]=490
Пример 4: Синтез (4-этилфенил)изобутиламида 1-[(1R,5S,6S)-1-(3-оксабицикло[3.1.0]гекс-6-ил)метил]-2-оксо-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты

Соединение 6
1. Синтез промежуточного соединения 4.1
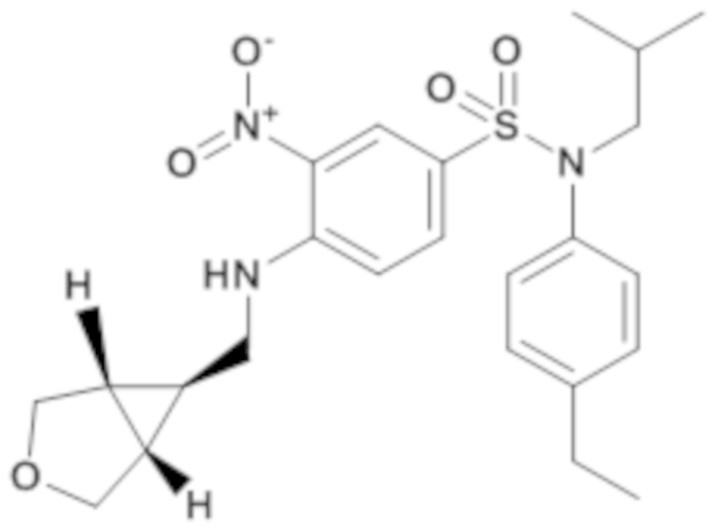
N-(4-этилфенил)-N-изобутил-3-нитро-4-{[(1R,5S,6S)-1-(3-оксабицикло[3.1.0]гекс-6-ил)метил]амино}бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.3, получают N-(4-этилфенил)-N-изобутил-3-нитро-4-{[(1R,5S,6S)-1-(3-оксабицикло[3.1.0]гекс-6-ил)метил]амино}бензолсульфонамид (238 мг; 100%) в виде желтого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H] =474
2. Синтез промежуточного соединения 4.2
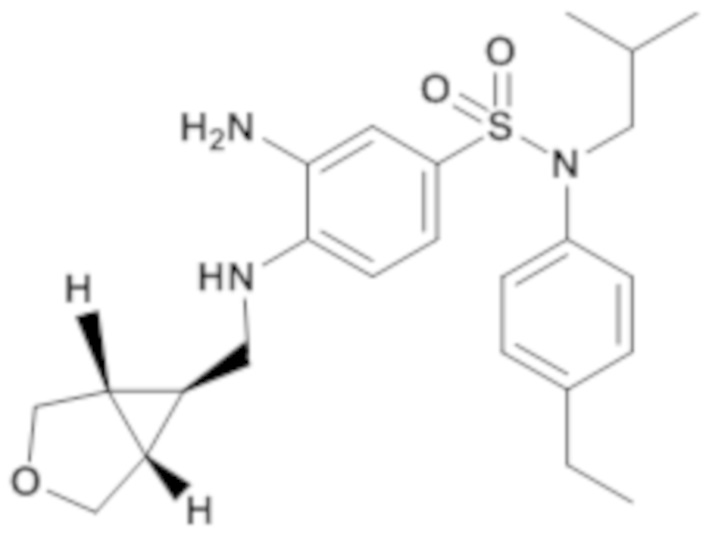
3-амино-N-(4-этилфенил)-N-изобутил-4-{[(1R,5S,6S)-1-(3-оксабицикло[3.1.0]гекс-6-ил)метил]амино}бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.4, получают 3-амино-N-(4-этилфенил)-N-изобутил-4-{[(1R,5S,6S)-1-(3-оксабицикло[3.1.0]гекс-6-ил)метил]амино}бензолсульфонамид (206 мг; 94%) в виде коричневого масла с соответствующим 1H ЯМР.
MS: [M+H]=444
3. Синтез соединения 6 по изобретению

Способом, аналогичным способу, описанному в примере 1, получают (4-этилфенил)изобутиламид 1-[(1R,5S,6S)-1-(3-оксабицикло[3.1.0]гекс-6-ил)метил]-2-оксо-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (56 мг; 25%) в форме беловатого твердого кристаллического вещества.
1H ЯМР (DMSO-d6) δ: 0,84 (д, J=6,7 Гц, 6H), 1,06 (дт, J=7,1, 3,6 Гц, 1H), 1,18 (т, J=7,6 Гц, 3H), 1,40 (дт, J=13,6, 6,7 Гц, 1H), 1,75 (т, J=2,6 Гц, 2H), 2,60 (к, J=7,6 Гц, 2H), 3,25-3,30 (м, 2H), 3,53 (д, J=8,3 Гц, 2H), 3,68 (д, J=8,4 Гц, 2H), 3,79 (д, J=7,1 Гц, 2H), 6,97 (д, J=8,3 Гц, 2H), 7,02 (д, J=1,8 Гц, 1H), 7,18 (д, J=8,3 Гц, 2H), 7,23 (дд, J=8,3, 1,8 Гц, 1H), 7,37 (д, J=8,3 Гц, 1H), 11,14 (с, 1H).
MS: [M+H]=470
Пример 5: Синтез (4-этилфенил)изобутиламид 1-оксетан-3-илметил-2-оксо-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты

Соединение 7
1. Синтез промежуточного соединения 5.1
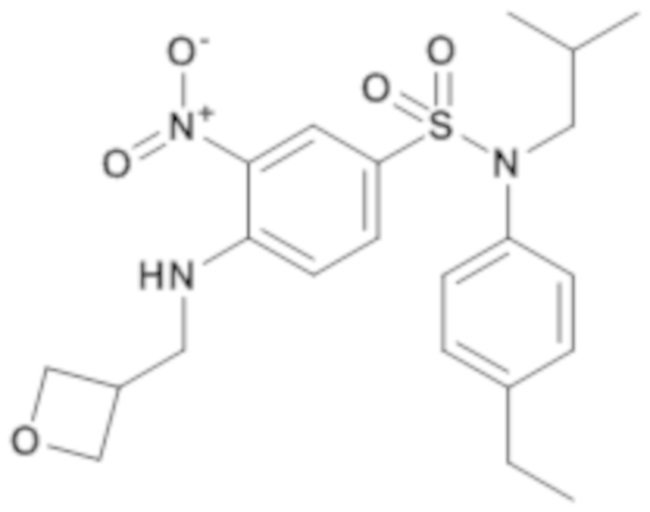
N-(4-этилфенил)-N-изобутил-3-нитро-4-[(оксетан-3-илметил)амино]бензолсульфонамид
Смесь 4-хлор-N-(4-этилфенил)-N-изобутил-3-нитробензолсульфонамида (500 мг; 1,26 ммоль), 1-метил-2-пирролидон (5 мл), карбоната цезия (1,03 г; 3,15 ммоль) и метилоксетан-3-аммонийгидрохлорида (187 мг; 1,51 ммоль) перемешивают в течение 2 часов при температуре окружающей среды, разбавляют этилацетатом (20 мл).
Органическую фазу промывают насыщенным раствором NH4Cl (20 мл), насыщенным раствором NaHCO3 (20 мл) и водой (20 мл), сушат (MgSO4), фильтруют и концентрируют досуха.
N-(4-этилфенил)-N-изобутил-3-нитро-4-[(оксетан-3-илметил)амино]бензолсульфонамид (520 мг; 92%) получают в виде желтого масла с соответствующим 1H ЯМР.
MS: [M+H] =450
2. Синтез промежуточного соединения 5.2
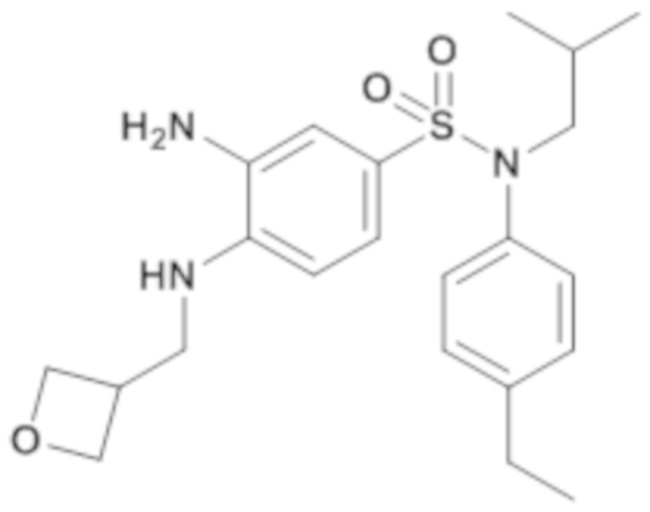
3-амино-N-(4-этилфенил)-N-изобутил-4-[(оксетан-3-илметил)амино]бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.4, получают 3-амино-N-(4-этилфенил)-N-изобутил-4-[(оксетан-3-илметил)амино]бензолсульфонамид (90 мг; 19%) в виде масла с соответствующим 1H ЯМР.
MS: [M+H]=419
3. Синтез соединения 7 по изобретению

Способом, аналогичным способу, описанному для примера 1, получают (4-этилфенил)изобутиламид 1-оксетан-3-илметил-2-оксо-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (50 мг; 52%) в форме бежевого твердого вещества
1H ЯМР (DMSO-d6) δ: 0,84 (д, J=6,7 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,40 гепт, J=6,7 Гц, 1H), 2,60 (к, J=7,6 Гц, 2H), 3,26 (д, J=7,3 Гц, 2H), 4,15 (д, J=7,2 Гц, 2H), 4,42 (т, J=6,1 Гц, 2H), 4,63 (т, J=7,0 Гц, 2H), 6,92-7,05 (м, 3H), 7,18 (д, J=7,9 Гц, 2H), 7,23 (д, J=8,3 Гц, 1H), 7,37 (д, J=8,3 Гц, 1H).
MS: [M+H]=444
Пример 6: Синтез (4-этилфенил)изобутиламида 2-оксо-1-(2-оксо-[1,3]-диоксолан-4-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты

Соединение 8
1. Синтез промежуточного соединения 6.1
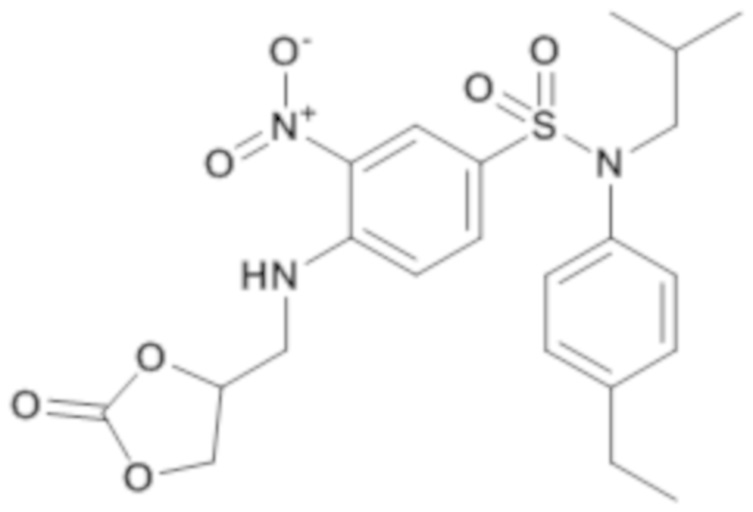
N-(4-этилфенил)-N-изобутил-3-нитро-4-[(2-оксо-[1,3]диоксолан-4-илметил)амино]бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.3, получают N-(4-этилфенил)-N-изобутил-3-нитро-4-[(2-оксо-[1,3]-диоксолан-4-илметил)амино]бензолсульфонамид (300 мг; 100%) в виде коричневого масла с соответствующим 1H ЯМР.
MS: [M+H] =478
2. Синтез промежуточного соединения 6.2
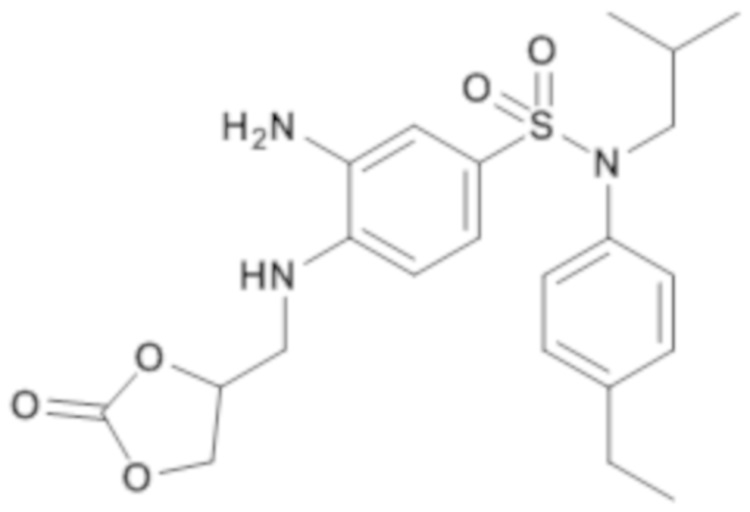
3-амино-N-(4-этилфенил)-N-изобутил-4-[(2-оксо-[1,3]-диоксолан-4-илметил)амино]бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.4, получают 3-амино-N-(4-этилфенил)-N-изобутил-4-[(2-оксо-[1,3]-диоксолан-4-илметил)амино]бензолсульфонамид (286 мг; 100%) в виде бледно-желтого масла с соответствующим 1H ЯМР.
MS: [M+H]=448
3. Синтез соединения 8 по изобретению

Способом, аналогичным способу, описанному для примера 1, получают (4-этилфенил)изобутиламид 2-оксо-1-(2-оксо-[1,3]-диоксолан-4-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (80 мг; 26%) в форме твердого беловатого кристаллического вещества.
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,6, 1,3 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,40 (дт, J=13,5, 6,7 Гц, 1H), 2,60 (к, J=7,6 Гц, 2H), 3,27 (д, J=7,3 Гц, 2H), 4,19 (дд, J=15,2, 3,5 Гц, 1H), 4,30 (дд, J=15,2, 6,9 Гц, 1H), 4,37 (дд, J=8,6, 6,2 Гц, 1H), 4,64 (т, J=8,4 Гц, 1H), 5,10-5,19 (м, 1H), 6,93-6,99 (м, 2H), 7,02 (д, J=1,7 Гц, 1H), 7,15-7,22 (м, 2H), 7,27 (дд, J=8,4, 1,8 Гц, 1H), 7,40 (д, J=8,4 Гц, 1H), 11,29 (с, 1H).
MS: [M+H]=474
Пример 7: Синтез (4-этилфенил)изобутиламид 2-оксо-1-(2-оксооксазолидин-5-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты
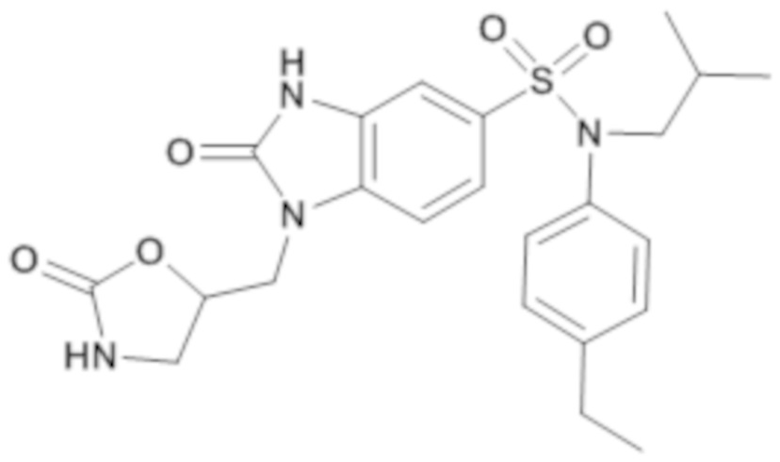
Соединение 9
1. Синтез промежуточного соединения 7.1
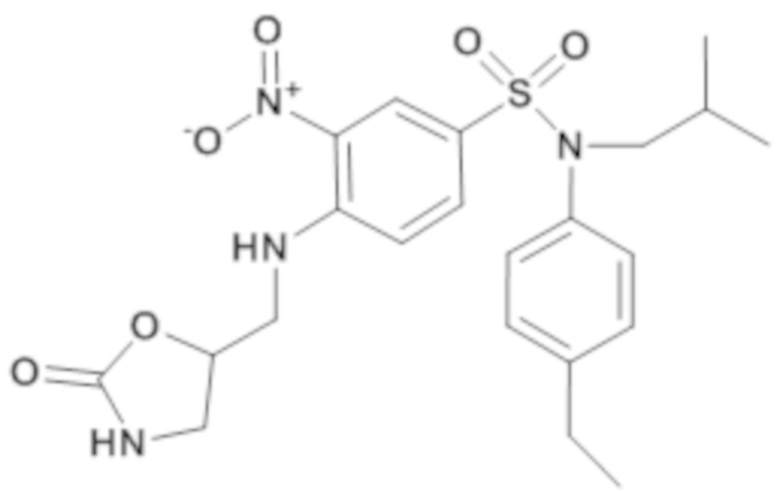
N-(4-этилфенил)-N-изобутил-3-нитро-4-[(2-оксооксазолидин-5-илметил)амино]бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.3, получают N-(4-этилфенил)-N-изобутил-3-нитро-4-[(2-оксооксазолидин-5-илметил)амино]бензолсульфонамид (240 мг; 100%) в виде желтого масла с соответствующим 1H ЯМР.
MS: [M+H] =477
2. Синтез промежуточного соединения 7.2
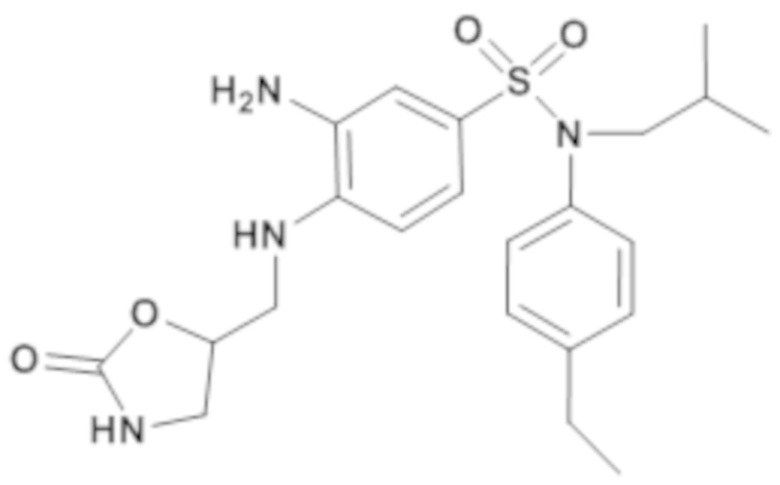
3-амино-N-(4-этилфенил)-N-изобутил-4-[(2-оксооксазолидин-5-илметил)амино]бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.4, получают 3-амино-N-(4-этилфенил)-N-изобутил-4-[(2-оксооксазолидин-5-илметил)амино]бензолсульфонамид (200 мг; 71%) в виде коричневого масла с соответствующим 1H ЯМР.
MS: [M+H]=447
3. Синтез соединения 9 по изобретению

Способом, аналогичным способу, описанному в примере 1, получают (4-этилфенил)изобутиламид 2-оксо-1-(2-оксооксазолидин-5-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (37 мг; 18%) в форме белого кристаллического твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,7, 1,3 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,34-1,47 (м, 1H), 2,61 (к, J=7,7 Гц, 2H), 3,27 (д, J=7,3 Гц, 2H), 3,36 (д, J=10,4 Гц, 2H), 3,61 (т, J=8,9 Гц, 1H), 4,07 (дд, J=14,9, 3,9 Гц, 1H), 4,16 (дд, J=15,0, 6,9 Гц, 1H), 6,92-7,00 (м, 2H), 7,01 (д, J=1,8 Гц, 1H), 7,19 (д, J=8,3 Гц, 2H), 7,26 (дд, J=8,3, 1,8 Гц, 1H), 7,37 (д, J=8,3 Гц, 1H), 7,56 (с, 1H), 11,25 (с, 1H).
MS: [M+H]=473
Пример 8: Синтез (4-этилфенил)изобутиламид 2-оксо-1-(2-оксотетрагидрофуран-3-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты
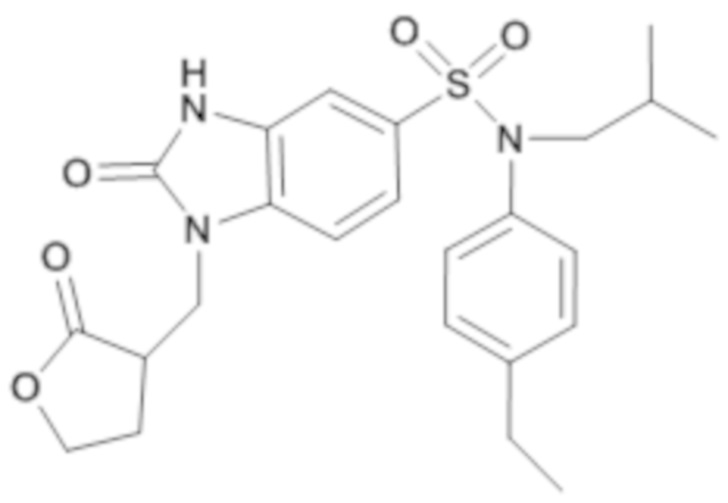
1. Синтез промежуточного соединения 8.1
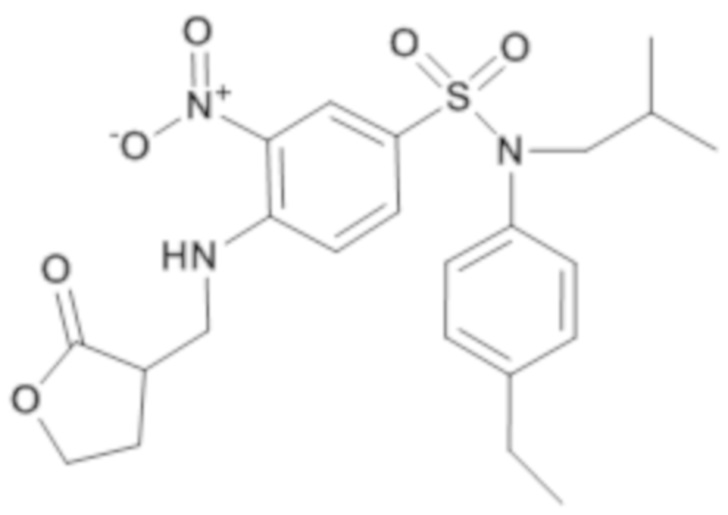
N-(4-этилфенил)-N-изобутил-3-нитро-4-[(2-оксотетрагидрофуран-3-илметил)амино]бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.3, получают N-(4-этилфенил)-N-изобутил-3-нитро-4-[(2-оксотетрагидрофуран-3-илметил)амино]бензолсульфонамид (290 мг; 97%) в виде коричневого масла с соответствующим 1H ЯМР.
MS: [M+H] =476
2. Синтез промежуточного соединения 8.2

3-амино-N-(4-этилфенил)-N-изобутил-4-[(2-оксотетрагидрофуран-3-илметил)амино]бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.4, получают 3-амино-N-(4-этилфенил)-N-изобутил-4-[(2-оксотетрагидрофуран-3-илметил)амино]бензолсульфонамид (260 мг; 96%) в виде серого масла с соответствующим 1H ЯМР.
MS: [M+H]=446
3. Синтез (4-этилфенил)изобутиламида 2-оксо-1-(2-оксотетрагидрофуран-3-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты

Способом, аналогичным способу, описанному в примере 1, получают (4-этилфенил)изобутиламид 2-оксо-1-(2-оксотетрагидрофуран-3-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (145 мг; 52%) в форме беловатого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,84 (д, J=6,6 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,38 (тт, J=11,8, 5,8 Гц, 1H), 2,02-2,17 (м, 1H), 2,23 (дтт, J=9,2, 6,7, 3,3 Гц, 1H), 2,60 (к, J=7,6 Гц, 2H), 3,20 (ддт, J=10,4, 8,6, 4,2 Гц, 1H), 3,27 (д, J=7,3 Гц, 2H), 4,07 (дд, J=14,5, 8,3 Гц, 1H), 4,12-4,20 (м, 2H), 4,33 (тд, J=8,5, 2,8 Гц, 1H), 6,93-7,00 (м, 2H), 7,01 (д, J=1,7 Гц, 1H), 7,14-7,22 (м, 2H), 7,26 (дд, J=8,3, 1,8 Гц, 1H), 7,37 (д, J=8,3 Гц, 1H), 11,23 (с, 1H).
MS: [M+H]=472
Пример 9: Синтез (4-этилфенил)изобутиламида 2-оксо-1-пиридин-4-илметил-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты

Соединение 10
1. Синтез промежуточного соединения 9.1
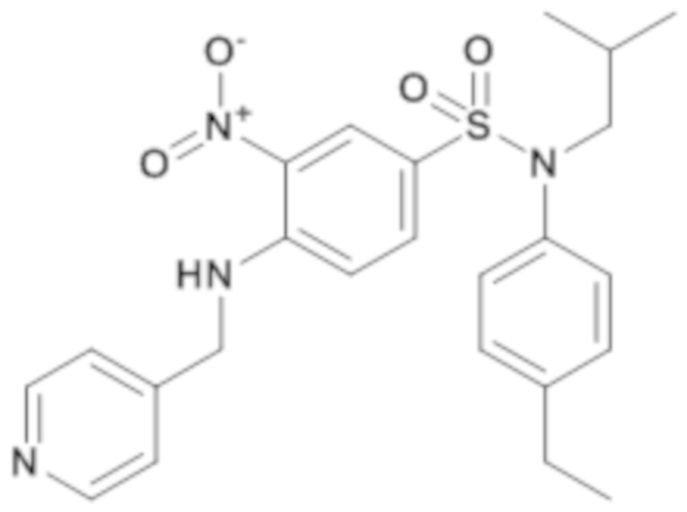
N-(4-этилфенил)-N-изобутил-3-нитро-4-[(пиридин-4-илметил)амино]бензолсульфонамид
Смесь 4-хлор-N-(4-этилфенил)-N-изобутил-3-нитробензолсульфонамида (500 мг; 1,26 ммоль), тетрагидрофурана (10 мл), карбоната цезия (516 мг; 1,89 ммоль) и 4-пиколиламина (409 мг; 3,78 ммоль) перемешивают в течение 5 часов при температуре 60°C, разбавляют этилацетатом (20 мл).
Органическую фазу промывают насыщенным раствором NH4Cl (20 мл), насыщенным раствором NaHCO3 (20 мл) и водой (20 мл), сушат (MgSO4), фильтруют и концентрируют досуха.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 100% этилацетата). N-(4-этилфенил)-N-изобутил-3-нитро-4-[(пиридин-4-илметил)амино]бензолсульфонамид (520 мг; 92%) получают в виде желтого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H] =469
2. Синтез промежуточного соединения 9.2
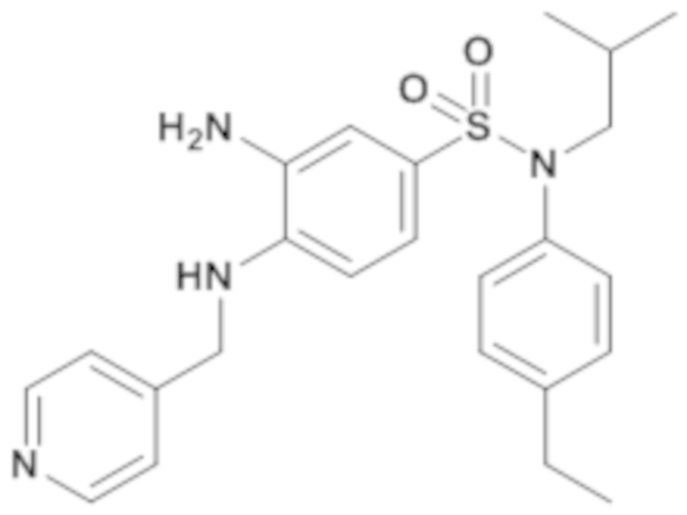
3-амино-N-(4-этилфенил)-N-изобутил-4-[(пиридин-4-илметил)амино]бензолсульфонамид
К дегазированному в аргоне раствору N-(4-этилфенил)-N-изобутил-3-нитро-4-[(пиридин-4-илметил)амино]бензолсульфонамиду (150 мг; 0,32 ммоль) в метаноле (5 мл) добавляют оксид платины (IV) (7,27 мг; 0,03 ммоль). Реакционную среду помещают в водород при давлении 1 атмосфера и перемешивают в течение 1 часа, фильтруют через целит и концентрируют досуха.
3-амино-N-(4-этилфенил)-N-изобутил-4-[(оксетан-3-илметил)амино]бензолсульфонамид (140 мг; 100%) получают в виде масла с соответствующим 1H ЯМР.
MS: [M-H]=437
3. Синтез соединения 10 (соединение 275) по изобретению

Способом, аналогичным способу, описанному для примера 1, (4-этилфенил)изобутиламид получают 2-оксо-1-пиридин-4-илметил-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (70 мг; 44%) в форме белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,83 (д, J=6,6 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 2,55-2,64 (м, 3H), 3,26 (д, J=7,3 Гц, 2H), 5,12 (с, 2H), 6,91-6,99 (м, 2H), 7,06 (д, J=1,4 Гц, 1H), 7,14-7,19 (м, 2H), 7,20-7,23 (м, 2H), 7,25-7,28 (м, 2H), 8,51-8,56 (м, 2H), 11,36 (с, 1H).
MS: [M-H]=463
Пример 10: Синтез (4-этилфенил)изобутиламида 2-оксо-1-(тетрагидропиран-4-ил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты

Соединение 11
1. Синтез промежуточного соединения 10.1
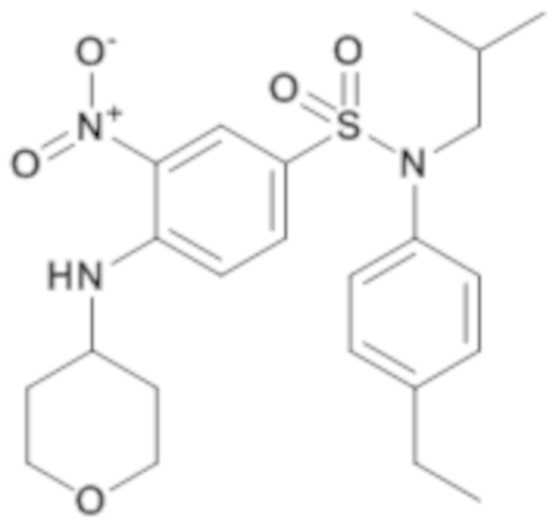
N-(4-этилфенил)-N-изобутил-3-нитро-4-(тетрагидропиран-4-иламино)бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.3, получают N-(4-этилфенил)-N-изобутил-3-нитро-4-(тетрагидропиран-4-иламино)бензолсульфонамид (215 мг; 92%) в виде желтого масла с соответствующим 1H ЯМР.
MS: [M+H] =462
2. Синтез промежуточного соединения 10.2
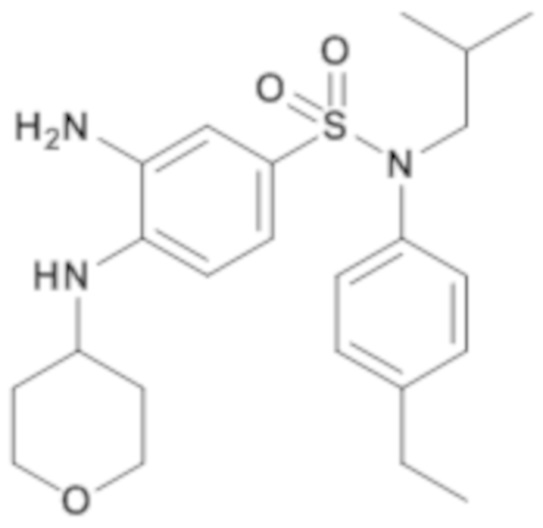
3-амино-N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-иламино)бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.4, получают 3-амино-N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-иламино)бензолсульфонамид (195 мг; 97%) в виде коричневого масла с соответствующим 1H ЯМР.
MS: [M+H]=432
3. Синтез соединения 11 по изобретению

Способом, аналогичным способу, описанному в примере 1, получают (4-этилфенил)изобутиламид 2-оксо-1-(тетрагидропиран-4-ил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (37 мг; 18%) в форме твердого беловатого кристаллического вещества.
1H ЯМР (DMSO-d6) δ: 0,84 (д, J=6,6 Гц, 6H), 1,19 (т, J=7,6 Гц, 3H), 1,39 (dq, J=13,4, 6,7 Гц, 1H), 1,67 (д, J=11,5 Гц, 2H), 2,30-2,45 (м, 2H), 2,61 (к, J=7,6 Гц, 2H), 3,26 (д, J=7,3 Гц, 2H), 3,48 (дд, J=12,6, 10,6 Гц, 2H), 3,94-4,05 (м, 2H), 4,40-4,52 (м, 1H), 6,99 (д, J=8,4 Гц, 2H), 7,02 (д, J=1,8 Гц, 1H), 7,15-7,23 (м, 2H), 7,22 (дд, J=8,4, 1,8 Гц, 1H), 7,45 (д, J=8,5 Гц, 1H), 11,16 (с, 1H).
MS: [M+H]=458
Пример 11: Синтез трет-бутил-4-{5-[(4-этилфенил)изобутилсульфамоил]-2-оксо-2,3-дигидробензоимидазол-1-ил}пиперидин-1-карбоксилата

Соединение 12
1. Синтез промежуточного соединения 11.1
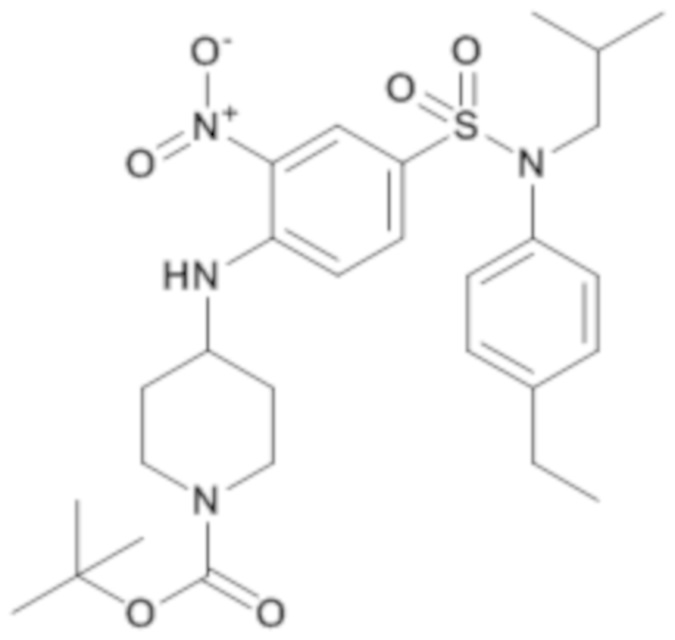
трет-бутил-4-{4-[(4-этилфенил)изобутилсульфамоил]-2-нитрофениламино}пиперидин-1-карбоксилат
Способом, аналогичным способу, описанному для промежуточного соединения 1.3, получают трет-бутил-4-{4-[(4-этилфенил)изобутилсульфамоил]-2-нитрофениламино}пиперидин-1-карбоксилат (353 мг; 100%) в виде коричневого масла с соответствующим 1H ЯМР.
MS: [M+H]=461
2. Синтез промежуточного соединения 11.2
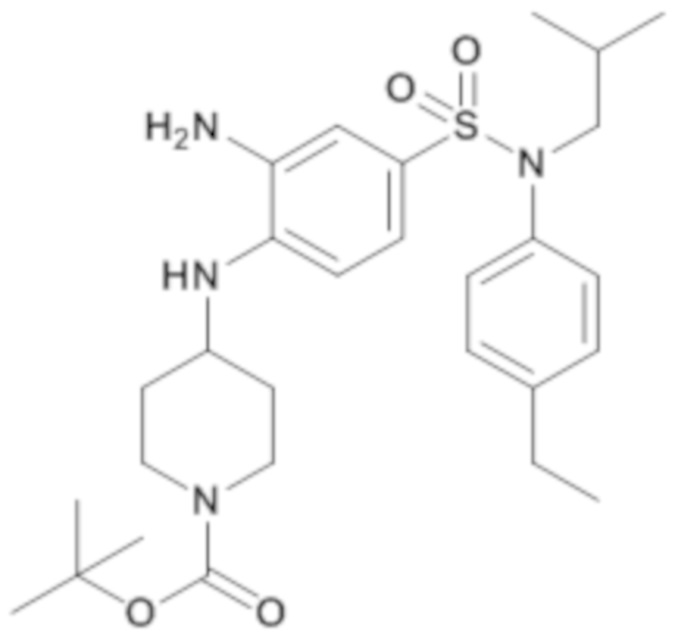
трет-бутил-4-{2-амино-4-[(4-этилфенил)изобутилсульфамоил]фениламино}пиперидин-1-карбоксилат
Способом, аналогичным способу, описанному для промежуточного соединения 1.4, получают трет-бутиловый эфир 4-{2-амино-4-[(4-этилфенил)изобутилсульфамоил]фениламино}пиперидин-1-карбоновой кислоты (340 мг; 100%) в виде коричневого масла с соответствующим 1H ЯМР.
MS: [M+H]=531
3. Синтез соединения 12 по изобретению

Способом, аналогичным способу, описанному в примере 1, получают трет-бутиловый эфир 4-{5-[(4-этилфенил)изобутилсульфамоил]-2-оксо-2,3-дигидробензоимидазол-1-ил}пиперидин-1-карбоновой кислоты (80 мг; 22%) в форме бежевого кристаллического твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,84 (д, J=6,6 Гц, 6H), 1,19 (т, J=7,6 Гц, 3H), 1,39 (дд, J=13,6, 6,9 Гц, 1H), 1,44 (с, 9H), 1,72 (д, J=12,4 Гц, 2H), 2,13-2,27 (м, 2H), 2,61 (к, J=7,6 Гц, 2H), 2,88 (с, 2H), 3,25 (д, J=7,4 Гц, 2H), 4,11 (с, 2H), 4,39 (т, J=12,4 Гц, 1H), 6,98 (д, J=8,4 Гц, 2H), 7,02 (д, J=1,9 Гц, 1H), 7,17-7,22 (м, 3H), 7,40 (д, J=8,5 Гц, 1H), 11,18 (с, 1H).
MS: [M+H]=557
Пример 12: Синтез (4-этилфенил)изобутиламида 2-оксо-1-пиперидин-4-ил-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты

Соединение 13
Смесь трет-бутилового эфира 4-{5-[(4-этилфенил)изобутилсульфамоил]-2-оксо-2,3-дигидробензоимидазол-1-ил}пиперидин-1-карбоновой кислоты (85,0 мг; 0,15 ммоль) в дихлорметане (2 мл) и трифторуксусной кислоте (175,4 мкл; 2,29 ммоль) перемешивают в течение ночи при температуре окружающей среды, затем реакционную среду концентрируют в вакууме. (4-этилфенил)изобутиламид 2-оксо-1-пиперидин-4-ил-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (80 мг; 26%) получают в виде твердого беловатого кристаллического вещества
1H ЯМР (DMSO-d6) δ: 0,85 (д, J=6,7 Гц, 6H), 1,14-1,23 (м, 3H), 1,41 (п, J=6,8 Гц, 1H), 1,92 (д, J=13,3 Гц, 2H), 2,61 (к, J=7,6 Гц, 2H), 3,10 (д, J=12,4 Гц, 2H), 3,26 (д, J=7,3 Гц, 2H), 3,45 (д, J=12,5 Гц, 2H), 4,57 (т, J=12,1 Гц, 1H), 6,95-7,03 (м, 2H), 7,06 (д, J=1,7 Гц, 1H), 7,16-7,23 (м, 2H), 7,26 (дд, J=8,4, 1,8 Гц, 1H), 7,42 (д, J=8,4 Гц, 1H), 8,59 (д, J=11,0 Гц, 1H), 11,24 (с, 1H).
MS: [M+H]=457
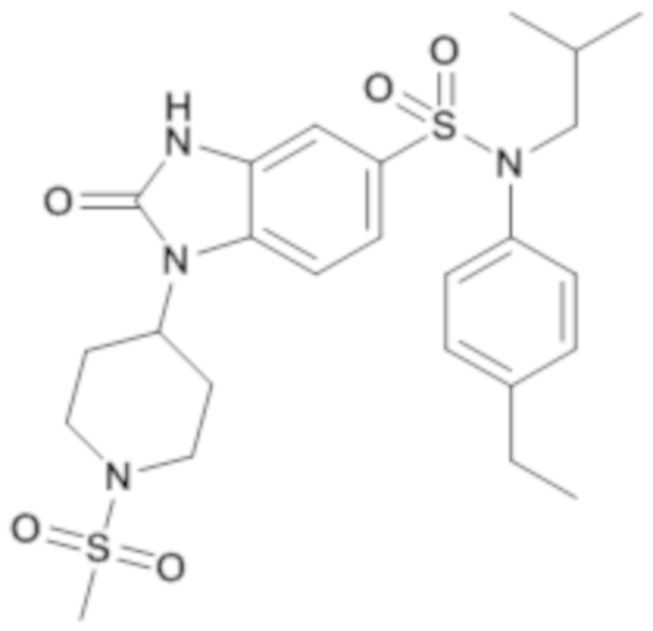
Пример 13: Синтез (4-этилфенил)изобутиламида 1-(1-метансульфонилпиперидин-4-ил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты

Соединение 14
К раствору(4-этилфенил)изобутиламида 2-оксо-1-пиперидин-4-ил-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (60,00 мг; 0,13 ммоль) в дихлорметане (0,50 мл) добавляют метансульфонилхлорид (15,26 мкл; 0,20 ммоль) и триэтиламин (27,32 мкл; 0,20 ммоль). Реакционную среду гидролизуют, разбавляют в дихлорметане и экстрагируют. Органические фазы промывают водой, сушат (MgSO4) и концентрируют в вакууме.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрилом в воде/0,1% муравьиной кислоты).
После повторной кристаллизации в смеси ацетона/воды получают (4-этилфенил)изобутиламид 1-(1-метансульфонил-пиперидин-4-ил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (10,00 мг; 14,11%) в виде твердого беловатого кристаллического вещества.
1H 1H ЯМР (DMSO-d6) δ: 0,84 (д, J=6,5 Гц, 6H), 1,19 (т, J=7,6 Гц, 3H), 1,40 (дт, J=13,7, 7,0 Гц, 1H), 1,84 (д, J=12,2 Гц, 2H), 2,39 (дд, J=12,5, 4,0 Гц, 2H), 2,61 (к, J=7,6 Гц, 2H), 2,91 (д, J=12,6 Гц, 2H), 2,95 (с, 3H), 3,26 (д, J=7,3 Гц, 2H), 3,74 (д, J=11,8 Гц, 2H), 4,29-4,46 (м, 1H), 6,96-7,04 (м, 3H), 7,21 (дд, J=12,4, 8,5 Гц, 3H), 7,42 (д, J=8,4 Гц, 1H), 11,20 (с, 1H).
MS: [M+H]=535
Способом, аналогичным способу для промежуточного соединения 1.1, соответствующему восстановительному аминированию между 1 эквивалентом альдегида и 1,15 эквивалентами анилина в тетрагидрофуране в присутствии 1,5 эквивалентов триацетоксиборгидрида натрия, получают анилины из таблицы, указанной ниже.
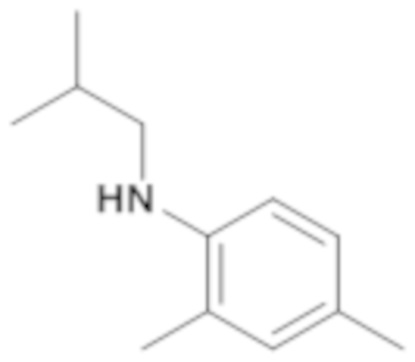
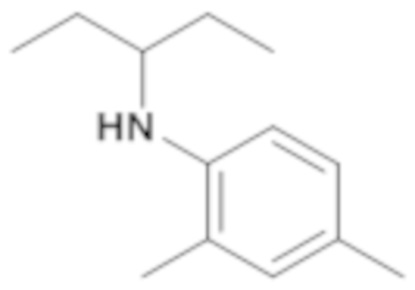
Пример 14: (4-этилфенил)циклопентиламид 2-оксо-1-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты

Соединение 15
1. Синтез промежуточного соединения 14.2
4-хлор-N-(4-этилфенил)-N-циклопентил-3-нитробензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.2, применяемому к промежуточному соединению 14.1, получают 4-хлор-N-циклопентил-N-(4-этилфенил)-3-нитробензолсульфонамид (440 мг; 28%) в виде беловатого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H] =409
2. Синтез промежуточного соединения 14.3
N-(4-этилфенил)-N-циклопентил-3-нитро-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.3, получают N-(4-этилфенил)-N-циклопентил-3-нитро-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид (480 мг; 91%) в виде оранжевого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H] =488
3. Синтез промежуточного соединения 14.4
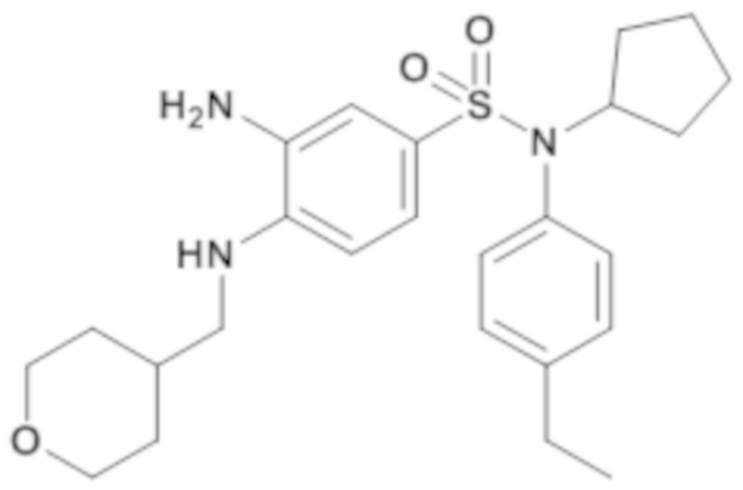
3-амино-N-(4-этилфенил)-N-циклопентил-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.4, получают 3-амино-N-(4-этилфенил)-N-циклопентил-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид (420 мг; 97%) в виде бежевого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=458
4. Синтез соединения 15 (соединение 280) по изобретению

Способом, аналогичным способу, описанному в примере 1, получают (4-этилфенил)циклопентиламид 2-оксо-1-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (262 мг; 59%) в виде белого кристаллического твердого вещества после повторной кристаллизации в смеси ацетона/воды.
1H ЯМР (DMSO-d6) δ: 1,19 (т, J=7,6 Гц, 3H), 1,32 (tdd, J=12,9, 7,2, 4,5 Гц, 3H), 1,41 (дд, J=7,6, 4,7 Гц, 1H), 1,49 (д, J=11,8 Гц, 1H), 1,73 (дд, J=11,5, 6,5 Гц, 2H), 2,03 (ддд, J=11,3, 7,6, 4,0 Гц, 1H), 2,62 (к, J=7,6 Гц, 2H), 3,24 (тд, J=11,6, 2,1 Гц, 2H), 3,74 (д, J=7,2 Гц, 2H), 3,80-3,87 (м, 2H), 4,43 (тт, J=9,3, 7,3 Гц, 1H), 6,88-6,91 (м, 2H), 7,19-7,21 (м, 2H), 7,21 (д, J=1,9 Гц, 1H), 7,35-7,43 (м, 2H), 11,19 (с, 1H).
MS: [M+H]=484
Пример 15: Синтез (4-этилфенил)(1-этилпропил)амид 2-оксо-1-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты

Соединение 16
1. Синтез промежуточного соединения 15.2
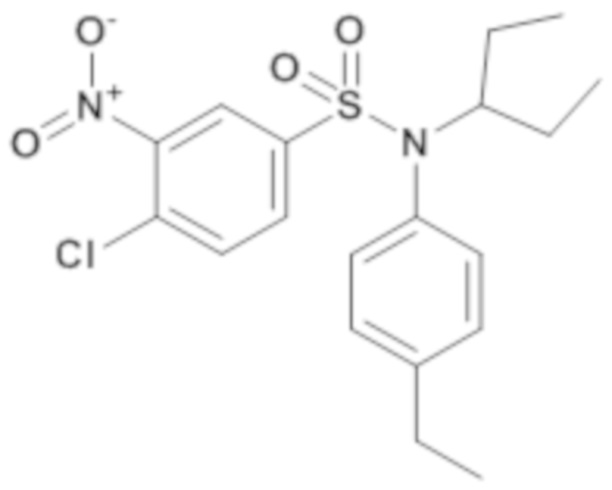
4-хлор-N-(4-этилфенил)-N-(1-этилпропил)-3-нитробензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.2, применяемому к промежуточному соединению 15.1, получают 4-хлор-N-(4-этилфенил)-N-(1-этилпропил)-3-нитробензолсульфонамид (900 мг; 88%) в виде оранжевого масла с соответствующим 1H ЯМР.
MS: [M+H]=411
2. Синтез промежуточного соединения 15.3
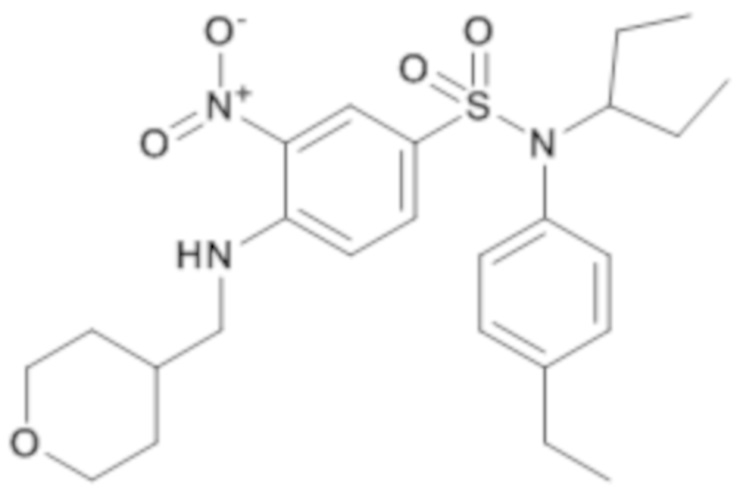
N-(4-этилфенил)-N-(1-этилпропил)-3-нитро-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.3, получают N-(4-этилфенил)-N-(1-этилпропил)-3-нитро-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид (1,07 г; 100%) в виде янтарного масла с соответствующим 1H ЯМР.
MS: [M+H]=490
3. Синтез промежуточного соединения 15.4
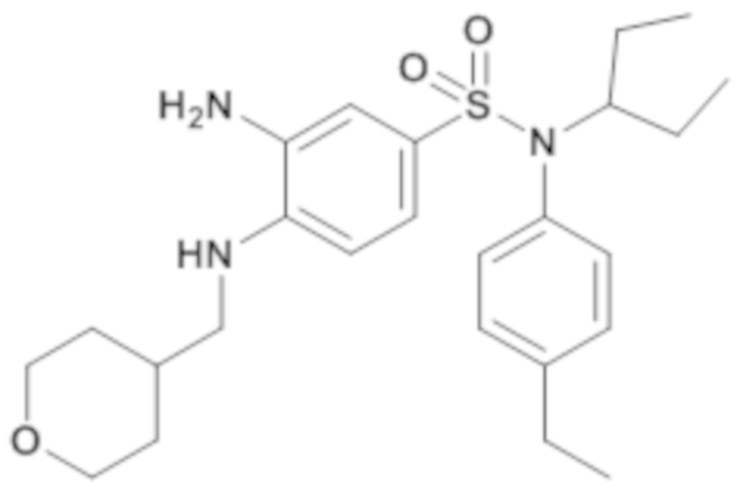
3-амино-N-(4-этилфенил)-N-(1-этилпропил)-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид
По аналогии со способом, описанным для промежуточного соединения 1.3, получают 3-амино-N-(4-этилфенил)-N-(1-этилпропил)-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид (910 мг; 83%) в виде янтарного масла с соответствующим 1H ЯМР.
MS: [M+H]=460
4. Синтез соединения 16 по изобретению

Способом, аналогичным способу, описанному в примере 1, получают (4-этилфенил)(1-этилпропил)амид 2-оксо-1-(тетрагидропиран-4-ил-метил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (120 мг; 12%) в виде белого кристаллического твердого вещества после повторной кристаллизации в смеси ацетона/воды.
1H ЯМР (DMSO-d6) δ: 0,87 (т, J=7,3 Гц, 6H), 1,08-1,16 (м, 2H), 1,19 (т, J=7,6 Гц, 3H), 1,29 (дддд, J=14,4, 12,7, 7,1, 4,9 Гц, 4H), 1,43-1,51 (м, 2H), 2,02 (ддт, J=11,5, 7,8, 3,8 Гц, 1H), 2,62 (к, J=7,6 Гц, 2H), 3,23 (тд, J=11,6, 2,1 Гц, 2H), 3,74 (д, J=7,2 Гц, 2H), 3,79-3,86 (м, 2H), 3,88 (ддд, J=8,1, 5,7, 2,5 Гц, 1H), 6,88-6,92 (м, 2H), 7,16 (д, J=1,2 Гц, 1H), 7,19-7,24 (м, 2H), 7,35 (д, J=1,1 Гц, 2H), 11,19 (с, 1H).
MS: [M+H]=486
Пример 16: Синтез (2,4-диметилфенил)изобутиламида 2-оксо-1-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты

Соединение 17
1. Синтез промежуточного соединения 16.2
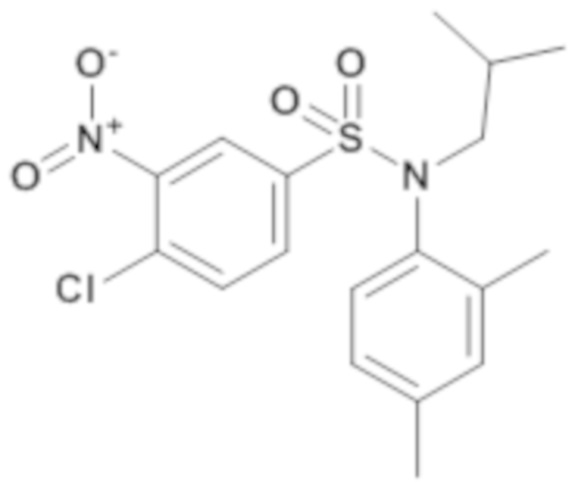
4-хлор-N-(2,4-диметилфенил)-N-изобутил-3-нитробензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.2, применяемому к промежуточному соединению 16.1, получают 4-хлор-N-(2,4-диметилфенил)-N-изобутил-3-нитробензолсульфонамид (665 мг; 88%) в виде коричневого масла с соответствующим 1H ЯМР.
MS: [M-H]=396
2. Синтез промежуточного соединения 16.3
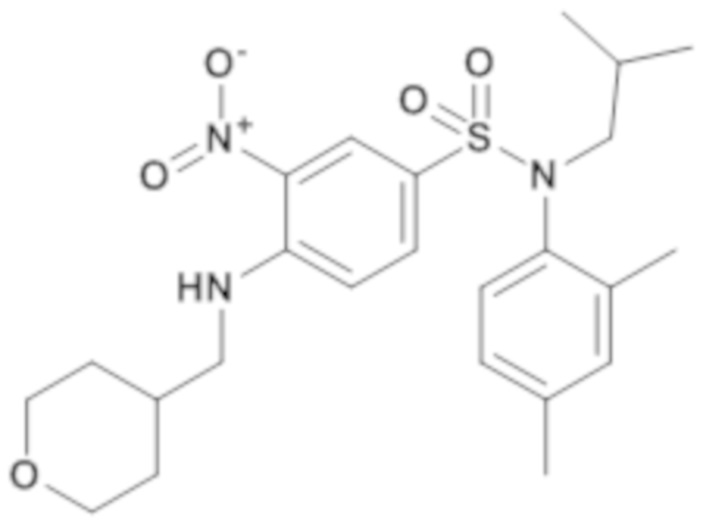
N-(2,4-диметилфенил)-N-изобутил-3-нитро-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.3, получают N-(2,4-диметилфенил)-N-изобутил-3-нитро-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид (740 мг; 93%) в виде коричневого масла с соответствующим 1H ЯМР.
MS: [M+H]=476
3. Синтез промежуточного соединения 16.4
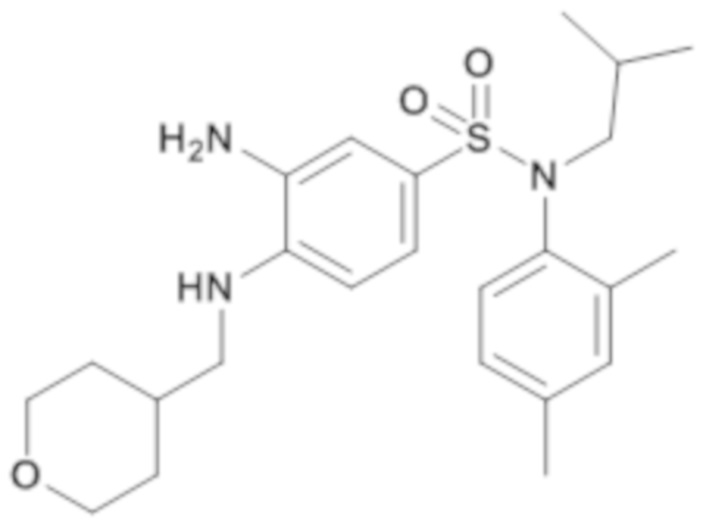
3-амино-N-(2,4-диметилфенил)-N-изобутил-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид
По аналогии со способом, описанным для промежуточного соединения 1.4, получают 3-амино-N-(2,4-диметилфенил)-N-изобутил-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид (693 г; 100%) в виде янтарного масла с соответствующим 1H ЯМР.
MS: [M+H]=446
4. Синтез соединения 17 по изобретению

Способом, аналогичным способу, описанному в примере 1, получают (2,4-диметилфенил)изобутиламид 2-оксо-1-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (273 мг; 37%) в виде белого кристаллического твердого вещества после повторной кристаллизации в смеси ацетона/воды.
1H ЯМР (DMSO-d6) δ: 0,75 (д, J=6,6 Гц, 3H), 0,94 (д, J=6,5 Гц, 3H), 1,30 (кд, J=12,1, 4,4 Гц, 2H), 1,40 (дтд, J=9,0, 6,8, 4,8 Гц, 1H), 1,48 (дд, J=13,6, 3,5 Гц, 2H), 2,03 (dtq, J=11,2, 7,4, 3,9 Гц, 1H), 2,25 (д, J=3,5 Гц, 6H), 3,04 (дд, J=13,0, 4,6 Гц, 1H), 3,19-3,29 (м, 2H), 3,36 (дд, J=13,0, 9,0 Гц, 1H), 3,75 (д, J=7,2 Гц, 2H), 3,83 (dq, J=11,6, 1,9 Гц, 2H), 6,52 (д, J=8,1 Гц, 1H), 6,90 (дд, J=8,1, 2,1 Гц, 1H), 7,09 (дд, J=11,3, 1,9 Гц, 2H), 7,29 (дд, J=8,3, 1,8 Гц, 1H), 7,38 (д, J=8,3 Гц, 1H), 11,21 (с, 1H).
MS: [M+H]=472
Пример 17: Синтез циклопентил-(2,4-диметилфенил)амида 2-оксо-1-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты

Соединение 18
1. Синтез промежуточного соединения 17.1
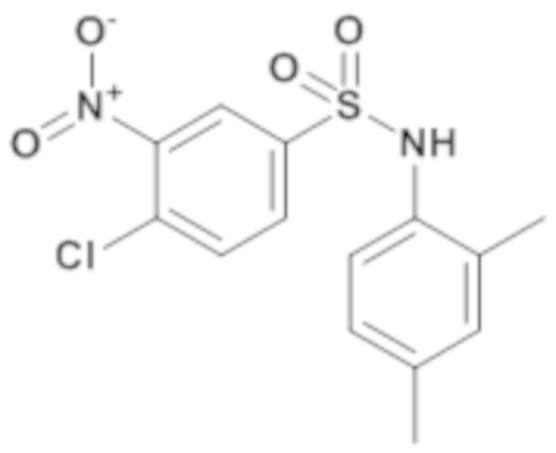
4-хлор-N-(2,4-диметилфенил)-3-нитробензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.2, получают 4-хлор-N-(2,4-диметилфенил)-3-нитробензолсульфонамид (180 мг; 28%) в виде коричневого масла с соответствующим 1H ЯМР.
MS: [M-H]=339
2. Синтез промежуточного соединения 17.2
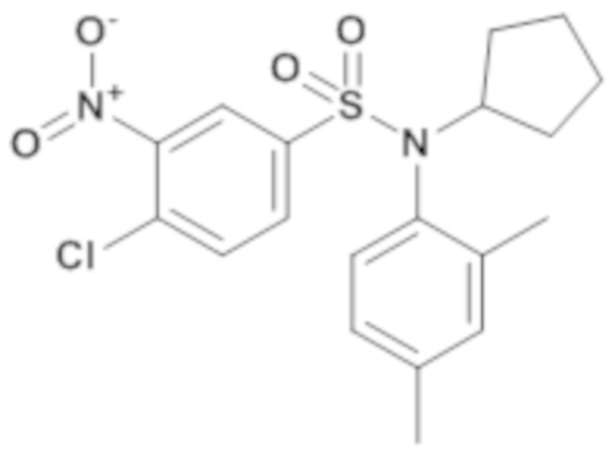
4-хлор-N-циклопентил-N-(2,4-диметилфенил)-3-нитробензолсульфонамид
Смесь 4-хлор-N-(2,4-диметилфенил)-3-нитробензолсульфонамида (180 мг; 0,53 ммоль), карбоната цезия (258 мг; 0,79 ммоль), йодциклопентана (90 мкл; 0,79 ммоль) в 1-метил-2-пирролидоне (5 мл) перемешивают в течение ночи при температуре 80°C, гидролизуют, разбавляют и экстрагируют ацетатом. Органические фазы объединяют, промывают водой, сушат (MgSO4), фильтруют и концентрируют в вакууме.
4-хлор-N-циклопентил-N-(2,4-диметилфенил)-3-нитробензолсульфонамид (216 мг; 100%) получают в виде коричневого масла с соответствующим 1H ЯМР.
3. Синтез промежуточного соединения 17.3
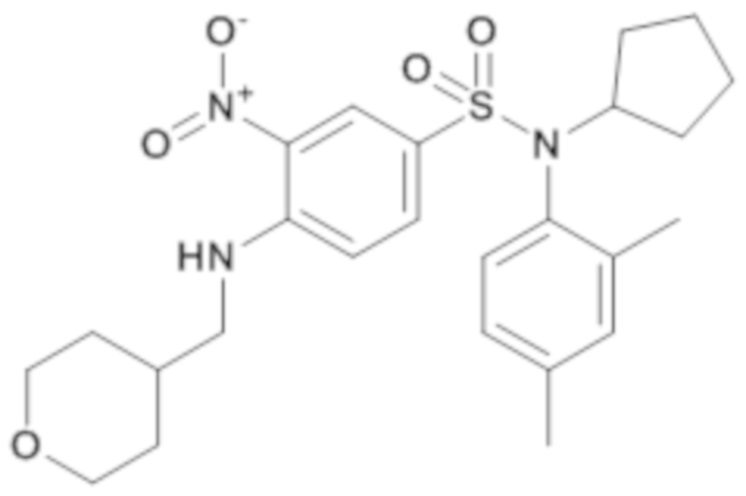
N-циклопентил-N-(2,4-диметилфенил)-3-нитро-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.3, N-циклопентил-N-(2,4-диметилфенил)-3-нитро-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид (105 мг; 35%) получают в виде желтого масла с соответствующим 1H ЯМР.
MS: [M+H]=488
4. Синтез промежуточного соединения 17.4
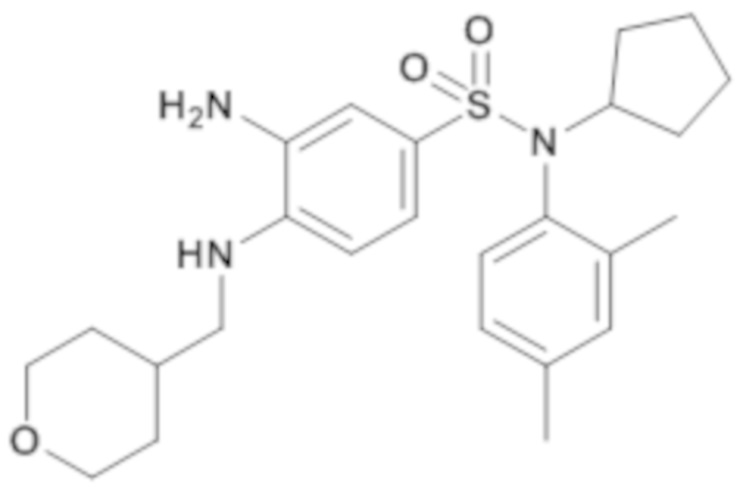
3-амино-N-циклопентил-N-(2,4-диметилфенил)-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид
По аналогии со способом, описанным для промежуточного соединения 1.4, получают 3-амино-N-циклопентил-N-(2,4-диметилфенил)-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид (94 г; 100%) в виде зеленоватого масла с соответствующим 1H ЯМР.
MS: [M+H]=458
5. Синтез соединения 18 по изобретению
Способом, аналогичным способу, описанному в примере 1, получают циклопентил-(2,4-диметилфенил)амид 2-оксо-1-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (10 мг; 8%) в виде коричневого масла.
1H ЯМР (CDCl3-d) δ: 1,24 (д, J=11,7 Гц, 4H), 1,43 (дд, J=13,9, 7,6 Гц, 8H), 1,95-2,05 (м, 1H), 2,31 (с, 6H), 3,32-3,41 (м, 2H), 3,79 (д, J=7,2 Гц, 2H), 3,99 (дд, J=11,6, 4,1 Гц, 2H), 4,48 (ддд, J=10,1, 7,1, 3,0 Гц, 1H), 6,57 (д, J=8,0 Гц, 1H), 6,86 (д, J=8,2 Гц, 1H), 7,03 (д, J=8,4 Гц, 1H), 7,11 (д, J=2,1 Гц, 1H), 7,44 (д, J=1,7 Гц, 1H), 7,54 (дд, J=8,3, 1,7 Гц, 1H), 8,60 (с, 1H).
MS: [M+H]=484
Пример 18: Синтез (2,4-диметилфенил)(1-этилпропил)амида 2-оксо-1-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты

Соединение 19
1. Синтез промежуточного соединения 18.2
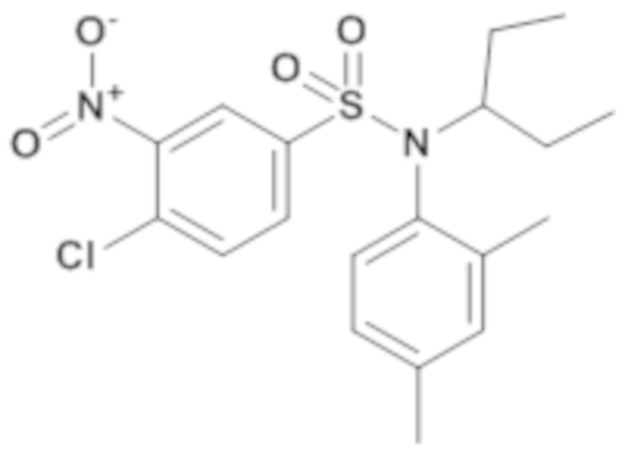
4-хлор-N-(2,4-диметилфенил)-N-(1-этилпропил)-3-нитробензолсульфонамид
Смесь 4-хлор-N-(2,4-диметилфенил)-3-нитробензолсульфонамида (480 мг; 1,41 ммоль), карбоната цезия (1,38 мг; 4,23 ммоль) и 3-бромпентана (520 мкл; 4,23 ммоль) в 1-метил-2-пирролидоне (5 мл) перемешивают в течение ночи при температуре 80°C, гидролизуют и экстрагируют этилацетатом. Органические фазы объединяют, промывают водой, сушат (MgSO4), фильтруют и концентрируют. 4-хлор-N-(2,4-диметилфенил)-N-(1-этилпропил)-3-нитробензолсульфонамид (580 мг; 100%) получают в виде коричневого масла с соответствующим 1H ЯМР.
MS: [M+H]=411
2. Синтез промежуточного соединения 18.3
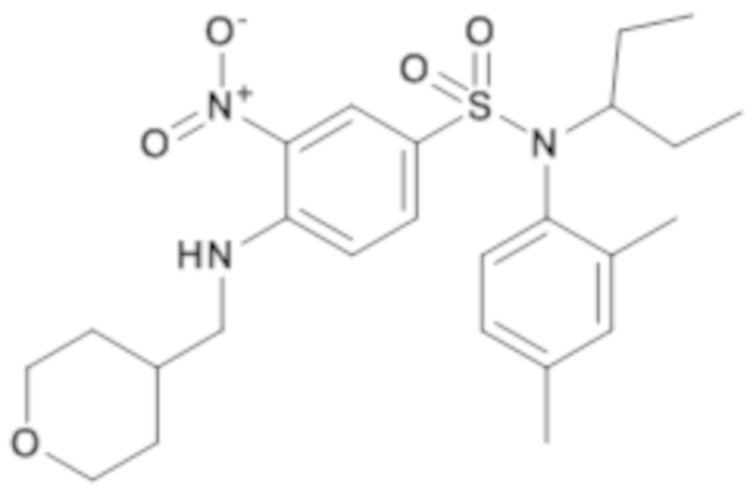
N-(2,4-диметилфенил)-N-(1-этилпропил)-3-нитро-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.3, получают N-(2,4-диметилфенил)-N-(1-этилпропил)-3-нитро-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид (450 мг; 41%) в виде коричневого масла с соответствующим 1H ЯМР.
MS: [M+H]=490
3. Синтез промежуточного соединения 18.4
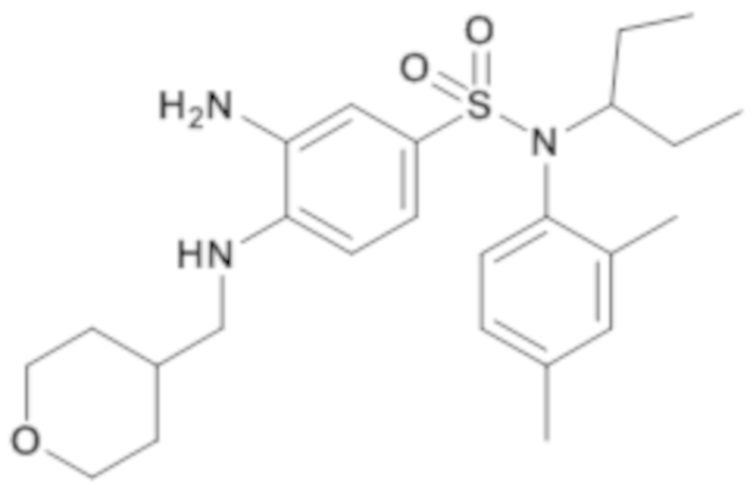
3-амино-N-(2,4-диметилфенил)-N-(1-этилпропил)-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид
По аналогии со способом, описанным для промежуточного соединения 1.4, получают 3-амино-N-(2,4-диметилфенил)-N-(1-этилпропил)-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид (420 мг; 100%) в виде янтарного масла с соответствующим 1H ЯМР.
MS: [M+H]=460
4. Синтез соединения 19 по изобретению

Способом, аналогичным способу, описанному в примере 1, получают (2,4-диметилфенил)-(1-этилпропил)амид 2-оксо-1-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (92 мг; 19%) в виде твердого беловатого кристаллического вещества после повторной кристаллизации в смеси ацетона/воды.
1H ЯМР (DMSO-d6) δ: 0,67 (т, J=7,3 Гц, 3H), 0,95 (т, J=7,3 Гц, 3H), 1,08-1,21 (м, 2H), 1,30 (ттд, J=14,6, 7,1, 3,9 Гц, 4H), 1,46 (д, J=13,3 Гц, 3H), 2,03 (ддд, J=11,4, 7,3, 3,8 Гц, 1H), 2,09 (с, 0H), 2,24 (с, 3H), 2,28 (с, 3H), 3,23 (тд, J=11,6, 2,2 Гц, 2H), 3,75 (д, J=7,3 Гц, 2H), 3,79-3,87 (м, 2H), 6,65 (д, J=8,1 Гц, 1H), 6,94 (дд, J=8,1, 2,2 Гц, 1H), 7,12-7,19 (м, 2H), 7,38 (д, J=1,6 Гц, 2H), 11,21 (с, 1H).
MS: [M+H]=486
Пример 19: Синтез (4-этилфенил)изобутиламид 1-(1,1-диоксо-гексагидро-1λ6-тиопиран-4-илметил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты
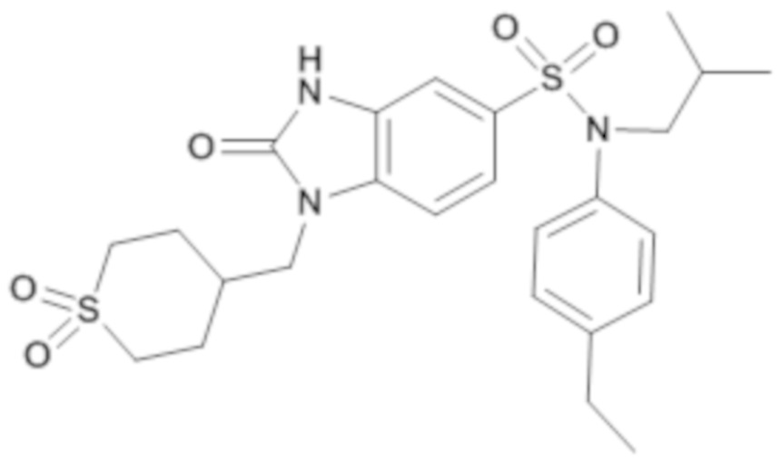
Соединение 20
1. Синтез промежуточного соединения 19.1
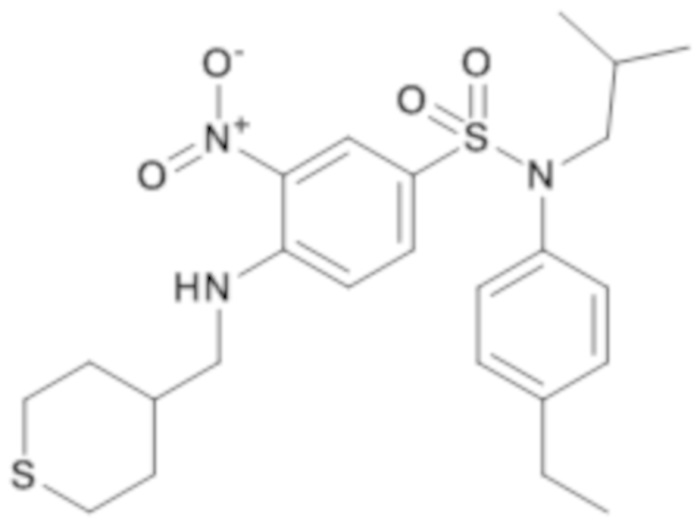
N-(4-этилфенил)-N-изобутил-3-нитро-4-[(тетрагидро-тиопиран-4-илметил)амино]бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 1.3, получают N-(4-этилфенил)-N-изобутил-3-нитро-4-[(тетрагидро-тиопиран-4-илметил)амино]бензолсульфонамид (600 мг; 97%) в виде коричневого масла с соответствующим 1H ЯМР.
MS: [M+H]=492
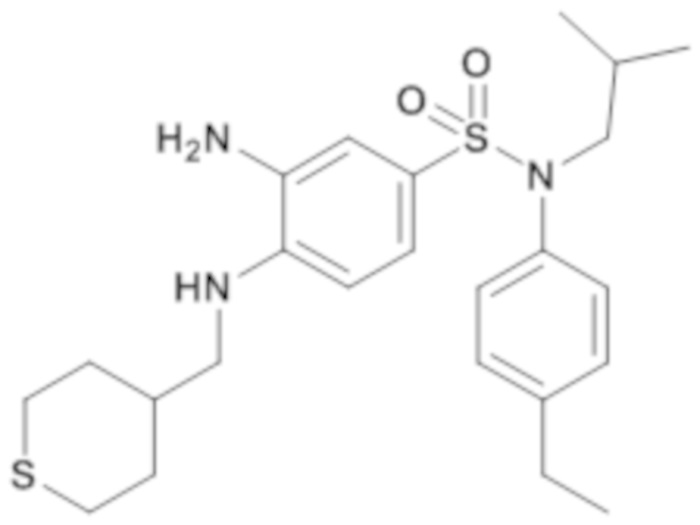
3-амино-N-(4-этилфенил)-N-изобутил-4-[(тетрагидро-тиопиран-4-илметил)амино]бензолсульфонамид
По аналогии со способом, описанным для промежуточного соединения 1.4, получают 3-амино-N-(4-этилфенил)-N-изобутил-4-[(тетрагидротиопиран-4-илметил)амино]бензолсульфонамид (543 мг; 96%) в виде янтарного масла с соответствующим 1H ЯМР.
MS: [M+H]=462
2. Синтез соединения 20 по изобретению

Способом, аналогичным способу, описанному в примере 1, получают (4-этилфенил)изобутиламид 1-(1,1-диоксо-гексагидро-λ6-тиопиран-4-илметил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (140 мг; 40%) в виде твердого беловатого кристаллического вещества после повторной кристаллизации в смеси ацетона/воды.
1H ЯМР (DMSO-d6) δ: 0,84 (д, J=6,6 Гц, 6H), 1,14-1,23 (м, 3H), 1,40 (дт, J=13,5, 6,8 Гц, 1H), 1,73 (к, J=12,4 Гц, 2H), 1,95 (д, J=13,8 Гц, 2H), 2,07-2,18 m, 1H), 2,61 (к, J=7,6 Гц, 2H), 3,00-3,17 (м, 4H), 3,27 (д, J=7,3 Гц, 2H), 3,80 (д, J=7,2 Гц, 2H), 6,97 (д, J=8,3 Гц, 2H), 7,02 (д, J=1,8 Гц, 1H), 7,14-7,22 (м, 2H), 7,24 (дд, J=8,4, 1,8 Гц, 1H), 7,39 (д, J=8,3 Гц, 1H), 11,17 (с, 1H).
MS: [M+H]=520
Часть II: Синтез бициклических сульфонамидов по схеме реакции 2
Схема реакции 2
Пример 21: Синтез (4,6-диметилпиридин-3-ил)изобутиламида 1-оксетан-3-илметил-2-оксо-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты

1. Синтез промежуточного соединения 21.1
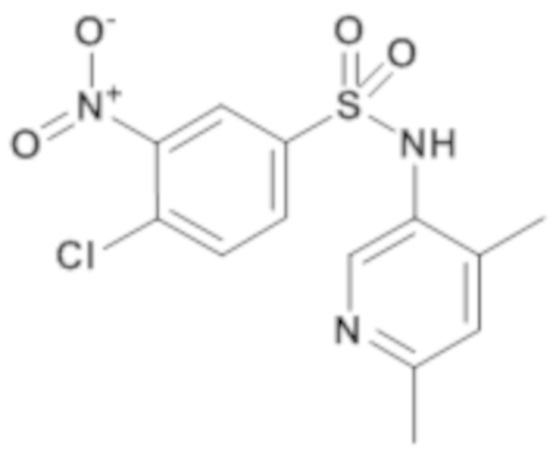
4-хлор-N-(4,6-диметилпиридин-3-ил)-3-нитробензолсульфонамид
4-хлор-3-нитробензолсульфонилхлорид (500 мг; 1,91 ммоль) добавляют к 4,6-диметилпиридин-3-иламину (487 мг; 3,83 ммоль), триэтиламину (53 мкл; 0,38 ммоль) и пиридину (5,2 мл). Реакционную среду перемешивают в течение 10 минут при температуре окружающей среды, гидролизуют насыщенным раствором NH4Cl и экстрагируют этилацетатом. Органическую фазу концентрируют, затем выпаривают совместно с толуолом.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрилом в воде/0,1% муравьиной кислоты).
4-хлор-N-(4,6-диметилпиридин-3-ил)-3-нитробензолсульфонамид (303мг; 46%) получают в виде твердого вещества кремового цвета с соответствующим 1H ЯМР.
MS: [M-H]=340
2. Синтез промежуточного соединения 21.2
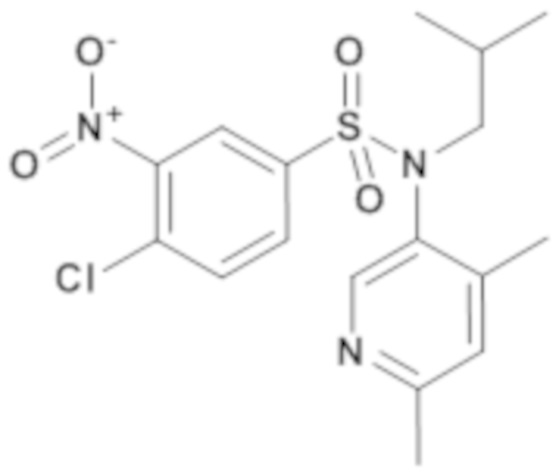
4-хлор-N-(4,6-диметилпиридин-3-ил)-N-изобутил-3-нитробензолсульфонамид
Гидрид натрия 60% (32 мг; 0,80 ммоль) добавляют к 4-хлор-N-(4,6-диметилпиридин-3-ил)-3-нитробензолсульфонамиду (248 мг; 0,73 ммоль) и 1-йод-2-метилпропану (125 мкл; 1,09 ммоль) в растворе в N,N-диметилформамиде (6,6 мл). Реакционную среду перемешивают в течение 8 часов при температуре 80°C, гидролизуют и экстрагируют этилацетатом. Органические фазы объединяют, промывают солевым раствором и сушат (MgSO4). Растворители выпаривают.
Неочищенный продукт очищают хроматографией на силикагеле (гептан/этилацетат от 20 до 60%). 4-хлор-N-(4,6-диметилпиридин-3-ил)-N-изобутил-3-нитробензолсульфонамид (140 мг; 48%) получают в виде белого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=398
3. Синтез промежуточного соединения 21.3
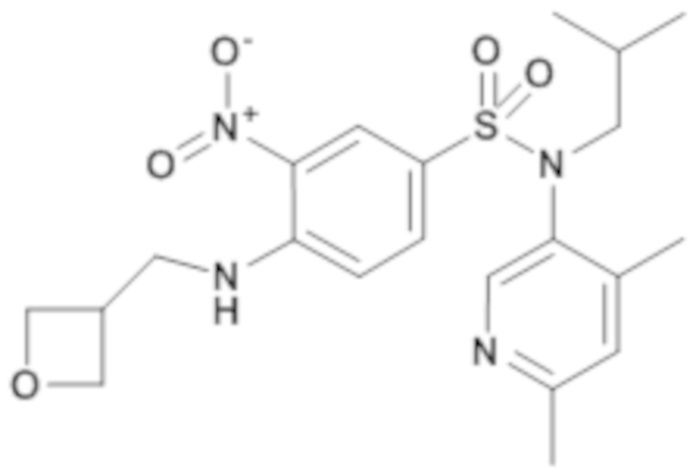
N-(4,6-диметилпиридин-3-ил)-N-изобутил-3-нитро-4-[(оксетан-3-илметил)амино]бензолсульфонамид
К раствору 4-хлор-N-(4,6-диметилпиридин-3-ил)-N-изобутил-3-нитробензолсульфонамида (139 мг; 0,35 ммоль) в N,N-диметилформамиде (1,4 мл) добавляют карбонат калия (72 мг; 0,52 ммоль), затем оксетан-3-илметиламин (31,96 мг; 0,37 ммоль). Реакционную среду перемешивают в течение 16 часов при температуре окружающей среды, гидролизуют и экстрагируют этилацетатом. Органические фазы промывают солевым раствором, сушат над ангидридом сульфата магния, фильтруют и концентрируют. Неочищенный продукт очищают хроматографией на силикагеле (гептан/этилацетат от 20 до 60%, затем 50% этилацетата). N-(4,6-диметилпиридин-3-ил)-N-изобутил-3-нитро-4-[(оксетан-3-илметил)амино]бензолсульфонамид (123 мг; 78%) получают в виде желтого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=449
4. Синтез промежуточного соединения 21.4
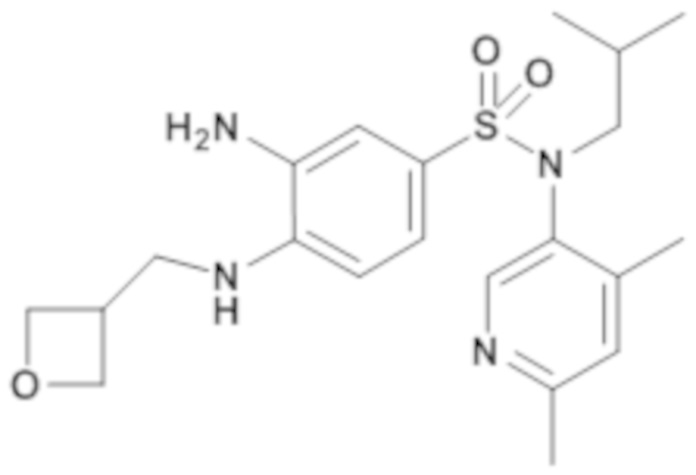
3-амино-N-(4,6-диметилпиридин-3-ил)-N-изобутил-4-[(оксетан-3-илметил)амино]бензолсульфонамид
N-(4,6-диметилпиридин-3-ил)-N-изобутил-3-нитро-4-[(оксетан-3-илметил)амино]бензолсульфонамид (120 мг; 0,27 ммоль) растворяют в тетрагидрофуране (1,2 мл). Дегазируют реакционную среду, затем добавляют 10% палладиум на активированном угле, стабилизированном 50% воды (57 мг; 0,03 ммоль). Реакционную среду помещают в атмосферу водорода и перемешивают в течение 4 часов при температуре окружающей среды. Реакционную среду фильтруют через целит. Фильтрат концентрируют в вакууме.
3-амино-N-(4,6-диметилпиридин-3-ил)-N-изобутил-4-[(оксетан-3-илметил)амино]бензолсульфонамид (112 мг; 100%) получают в виде серой пленки с соответствующим 1H ЯМР.
MS: [M+H]=419
5. Синтез (4,6-диметилпиридин-3-ил)изобутиламида 1-оксетан-3-илметил-2-оксо-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты
К раствору 3-амино-N-(4,6-диметилпиридин-3-ил)-N-изобутил-4-[(оксетан-3-илметил)амино]бензолсульфонамида (110 мг; 0,26 ммоль) в тетрагидрофуране (1,1 мл) добавляют N,N'-карбонилдиимидазол (128 мг; 0,79 ммоль). Реакционную среду перемешивают в течение 17 часов при температуре 60°C, гидролизуют водой и экстрагируют этилацетатом.
Органическую фазу осаждают, промывают водой, сушат (MgSO4), фильтруют и концентрируют.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрилом в воде/0,1% муравьиной кислоты). (4,6-диметилпиридин-3-ил)изобутиламид 1-оксетан-3-илметил-2-оксо-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (73 мг; 61%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,77 (д, J=6,7 Гц, 3H), 0,93 (д, J=6,5 Гц, 3H), 1,40 (т, J=7,1 Гц, 1H), 2,22 (с, 3H), 2,41 (с, 3H), 3,18 (дд, J=13,1, 5,0 Гц, 1H), 3,31-3,46 (м, 1H), 4,16 (д, J=7,1 Гц, 2H), 4,41 (т, J=6,1 Гц, 2H), 4,63 (дд, J=7,8, 6,1 Гц, 2H), 7,09 (д, J=1,7 Гц, 1H), 7,20 (с, 1H), 7,30 (дд, J=8,3, 1,7 Гц, 1H), 7,41 (д, J=8,3 Гц, 1H), 7,69 (с, 1H), 11,27 (с, 1H).
MS: [M-H]=445
Пример 22: Синтез изопропил-(4-метокси-2-метилфенил)амида 2-оксо-1-пиридазин-4-илметил-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты

1. Синтез промежуточного соединения 22.1
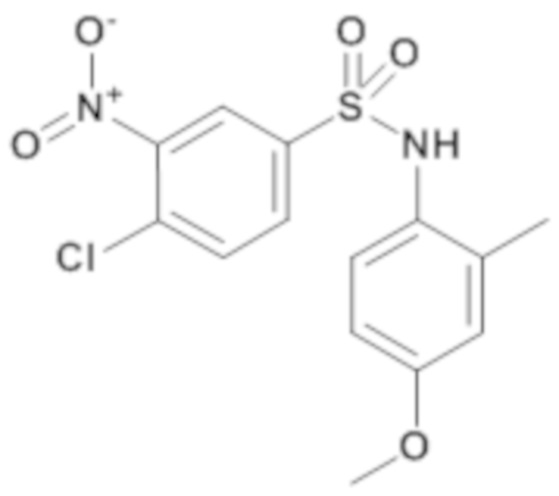
4-хлор-N-(4-метокси-2-метилфенил)-3-нитробензолсульфонамид
4-хлор-3-нитробензолсульфонилхлорид (300 мг; 1,15 ммоль) добавляют к смеси 4-метокси-2-метиланилина (157,5 мг; 1,15 ммоль) и пиридина (1,50 мл; 18,6 ммоль). Реакционную среду перемешивают в течение 3 часов при температуре 45°C, гидролизуют водой и разбавляют этилацетатом. Органическую фазу экстрагируют, промывают водой, сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрилом в воде/0,1% муравьиной кислоты).
4-хлор-N-(4-метокси-2-метилфенил)-3-нитробензолсульфонамид (264 мг; 64%) получают в виде пурпурного твердого вещества с соответствующим 1H ЯМР.
MS: [M-H]=355
2. Синтез промежуточного соединения 22.2
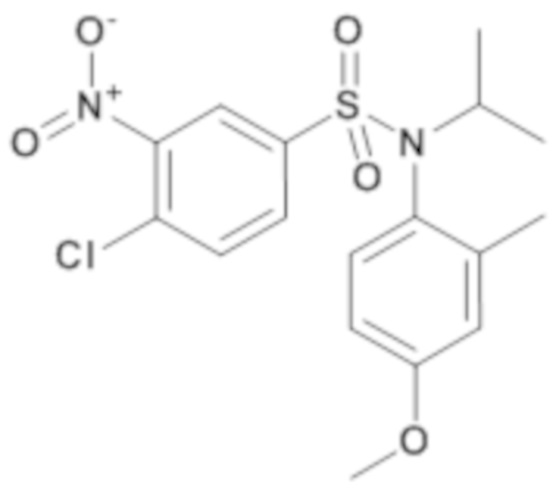
4-хлор-N-изопропил-N-(4-метокси-2-метилфенил)-3-нитробензолсульфонамид
При температуре 0°C гидрид натрия 60% (26 мг; 0,65 ммоль) добавляют к 4-хлор-N-(4-метокси-2-метилфенил)-3-нитробензолсульфонамидк (210; 0,59 ммоль) и 2-йодпропану (90 мкл; 0,88 ммоль) в растворе в N,N-диметилформамиде (5,5 мл). Реакционную среду перемешивают в течение 18 часов при температуре 30°C, гидролизуют и экстрагируют этилацетатом. Органические фазы объединяют, промывают насыщенным раствором хлорида натрия и сушат (MgSO4). Растворители выпаривают.
Неочищенный продукт очищают хроматографией на силикагеле (гептан/этилацетат от 5 до 20% этилацетата). 4-хлор-N-изопропил-N-(4-метокси-2-метилфенил)-3-нитробензолсульфонамид (183 мг; 78%) получают в виде бесцветной кашицы, которая кристаллизуется в белое твердое вещество с соответствующим 1H ЯМР.
MS: [M+H]=399
3. Синтез промежуточного соединения 22.3
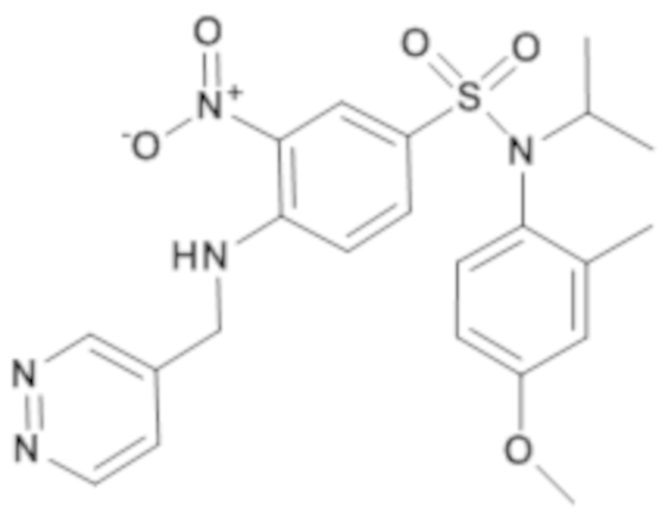
N-Изопропил-N-(4-метокси-2-метилфенил)-3-нитро-4-[(пиридазин-4-илметил)амино]бензолсульфонамид
К раствору 4-хлор-N-изопропил-N-(4-метокси-2-метилфенил)-3-нитробензолсульфонамид (167 мг; 0,42 ммоль) в N,N-диметилформамиде (1,7 мл) добавляют N,N-диизопропилэтиламин (300 мкл; 1,75 ммоль), затем пиридазин-4-илметиламмонийдигидрохлорид (80 мг; 0,44 ммоль).
Реакционную среду перемешивают в течение 30 часов при температуре окружающей среды, гидролизуют водой, затем этилацетатом и добавляют солевой раствор. Органическую фазу экстрагируют, промывают водой и солевым раствором, сушат (MgSO4), фильтруют и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле, элюируют гептаном/этилацетатом от 30 до 100% этилацетата. N-изопропил-N-(4-метокси-2-метилфенил)-3-нитро-4-[(пиридазин-4-илметил)амино]бензолсульфонамид (100 мг, 51%) получают в виде желтой пленки с соответствующим 1H ЯМР.
MS: [M+H]=472
4. Синтез промежуточного соединения 22.4
3-амино-N-(4,6-диметилпиридин-3-ил)-N-изобутил-4-[(оксетан-3-илметил)амино]бензолсульфонамид
Способом, аналогичным способу, описанному для промежуточного соединения 21.4, получают 3-амино-N-изопропил-N-(4-метокси-2-метилфенил)-4-[(пиридазин-4-илметил)амино]бензолсульфонамид (94 мг; 100%) в виде темного масла с соответствующим 1H ЯМР.
MS: [M+H]=442
5. Синтез изопропил-(4-метокси-2-метилфенил)амида 2-оксо-1-пиридазин-4-илметил-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты
Способом, аналогичным способу, описанному в примере 21, получают изопропил-(4-метокси-2-метилфенил)амид 2-оксо-1-пиридазин-4-илметил-2,3-дигидро-1H-бензоимидазол-5-сульфоновой кислоты (23 мг; 23%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,85 (д, J=6,7 Гц, 3H), 0,97 (д, J=6,6 Гц, 3H), 2,24 (с, 3H), 3,76 (с, 3H), 4,32-4,54 (м, 1H), 5,21 (с, 2H), 6,47-6,80 (м, 2H), 6,91 (д, J=2,9 Гц, 1H), 7,16-7,57 (м, 4H), 9,04-9,35 (м, 2H), 11,44 (с, 1H).
MS: [M-H]=468
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ БЕНЗОЛСУЛЬФОНАМИДОВ В КАЧЕСТВЕ ОБРАТНЫХ АГОНИСТОВ СВЯЗАННОГО С РЕТИНОИДАМИ ROR ОРФАННОГО РЕЦЕПТОРА ГАММА (Т) | 2015 |
|
RU2724331C2 |
| СИНТЕЗ ЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ ПИРАЗОЛИН КАРБОКСАМИДИНА | 2011 |
|
RU2550694C2 |
| ПРОИЗВОДНЫЕ 5-АМИНО-2-(1-ГИДРОКСИЭТИЛ)ТЕТРАГИДРОПИРАНА | 2009 |
|
RU2525541C2 |
| СУЛЬФОНАМИДНЫЕ ПЕРИ-ЗАМЕЩЕННЫЕ БИЦИКЛЫ ДЛЯ ЛЕЧЕНИЯ ОККЛЮЗИОННОГО ПОРАЖЕНИЯ АРТЕРИЙ | 2005 |
|
RU2403240C2 |
| ПИРИМИДИНАМИДНЫЕ СОЕДИНЕНИЯ КАК ИНГИБИТОРЫ PGDS | 2006 |
|
RU2420519C2 |
| ЦИКЛОАЛКИЛНИТРИЛПИРАЗОЛОПИРИДОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ЯНУС-КИНАЗЫ | 2014 |
|
RU2655380C2 |
| 2,6-ЗАМЕЩЕННЫЕ-4-МОНОЗАМЕЩЕННЫЙ АМИНО-ПИРИМИДИНЫ КАК АНТАГОНИСТЫ РЕЦЕПТОРА ПРОСТАГЛАНДИНА D2 | 2005 |
|
RU2417990C2 |
| КАРБОКСАМИДНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КАЛЬПАИНА | 2010 |
|
RU2540856C2 |
| ПРОИЗВОДНЫЕ 2-ГИДРОКСИЭТИЛ-1Н-ХИНОЛИН-2-ОНА И ИХ АЗАИЗОСТЕРИЧЕСКИЕ АНАЛОГИ С АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2540862C2 |
| ПРОИЗВОДНЫЕ ИНДОЛА И ИНДАЗОЛА, ОБЛАДАЮЩИЕ КОНСЕРВИРУЮЩИМ ДЕЙСТВИЕМ ПО ОТНОШЕНИЮ К КЛЕТКАМ, ТКАНЯМ И ОРГАНАМ | 2009 |
|
RU2460525C2 |
Изобретение относится к производным бензимидазолсульфонамидов формулы (I), их фармацевтически приемлемым солям присоединения, их гидратам и/или их сольватам, где L представляет собой простую связь; X представляет собой следующий циклический радикал: 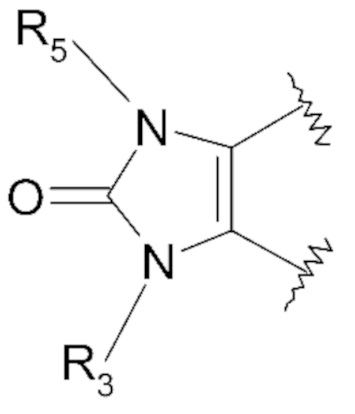 ; один из элементов Y1, Y2, Y3, Y4 и Y5 соответствует атому азота, а другие элементы соответствуют группе -CR2, или каждый из элементов Y1, Y2, Y3, Y4 и Y5 соответствует группе -CR2; каждый из элементов Q1, Q2 и Q3 соответствует группе -CR2a; R1 представляет собой линейный или разветвленный C3-C5алкильный радикал или C3-C5циклоалкильный радикал; R2 представляет собой атом водорода, линейный или разветвленный C1-C5алкильный радикал или C1-C4алкоксирадикал; R2a представляет собой атом водорода; R3 представляет собой атом водорода или группу (CHR6)n-(Z)o-(CHR'6)p-R7; n, o и p, которые могут быть идентичными или различными, представляют собой ноль или 1; Z представляет собой метиленовую группу -CH2-; R6 и R'6 представляют собой атом водорода; R7 представляет собой некатионный гетероциклоалкильный радикал, выбранный из тетрагидропирана, оксабицикло[3.1.0]гексила, оксетана, 2-оксо[1,3]диоксолана, 2-оксазолидинона, пиперидина и 1,1-диоксо-тетрагидро-2H-тиопирана, необязательно замещенный одним атомом галогена, одной линейной или разветвленной C1-C3алкильной группой, одной группой S(=O)2R7a; где R7a представляет собой линейный или разветвленный C1-C3алкильный радикал; или R7 представляет собой некатионный незамещенный гетероароматический радикал, выбранный из пиридина или пиридазина; R5 представляет собой атом водорода или линейный или разветвленный C1-C3алкильный радикал. Также изобретение относится к фармацевтической композиции на основе соединения формулы (I). Технический результат: получены новые производные бензимидазолсульфонамидов, полезные в качестве обратимых агонистов связанного с ретиноидами орфанного рецептора гамма (RORγt), в частности полезны для лечения акне, псориаза, и/или атопического дерматита. 2 н. и 9 з.п. ф-лы, 3 табл., 22 пр.
; один из элементов Y1, Y2, Y3, Y4 и Y5 соответствует атому азота, а другие элементы соответствуют группе -CR2, или каждый из элементов Y1, Y2, Y3, Y4 и Y5 соответствует группе -CR2; каждый из элементов Q1, Q2 и Q3 соответствует группе -CR2a; R1 представляет собой линейный или разветвленный C3-C5алкильный радикал или C3-C5циклоалкильный радикал; R2 представляет собой атом водорода, линейный или разветвленный C1-C5алкильный радикал или C1-C4алкоксирадикал; R2a представляет собой атом водорода; R3 представляет собой атом водорода или группу (CHR6)n-(Z)o-(CHR'6)p-R7; n, o и p, которые могут быть идентичными или различными, представляют собой ноль или 1; Z представляет собой метиленовую группу -CH2-; R6 и R'6 представляют собой атом водорода; R7 представляет собой некатионный гетероциклоалкильный радикал, выбранный из тетрагидропирана, оксабицикло[3.1.0]гексила, оксетана, 2-оксо[1,3]диоксолана, 2-оксазолидинона, пиперидина и 1,1-диоксо-тетрагидро-2H-тиопирана, необязательно замещенный одним атомом галогена, одной линейной или разветвленной C1-C3алкильной группой, одной группой S(=O)2R7a; где R7a представляет собой линейный или разветвленный C1-C3алкильный радикал; или R7 представляет собой некатионный незамещенный гетероароматический радикал, выбранный из пиридина или пиридазина; R5 представляет собой атом водорода или линейный или разветвленный C1-C3алкильный радикал. Также изобретение относится к фармацевтической композиции на основе соединения формулы (I). Технический результат: получены новые производные бензимидазолсульфонамидов, полезные в качестве обратимых агонистов связанного с ретиноидами орфанного рецептора гамма (RORγt), в частности полезны для лечения акне, псориаза, и/или атопического дерматита. 2 н. и 9 з.п. ф-лы, 3 табл., 22 пр.
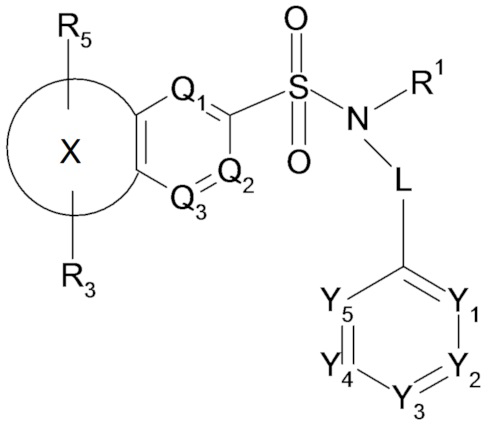
1. Соединение формулы (I), его фармацевтически приемлемые соли присоединения, его гидраты и/или его сольваты:
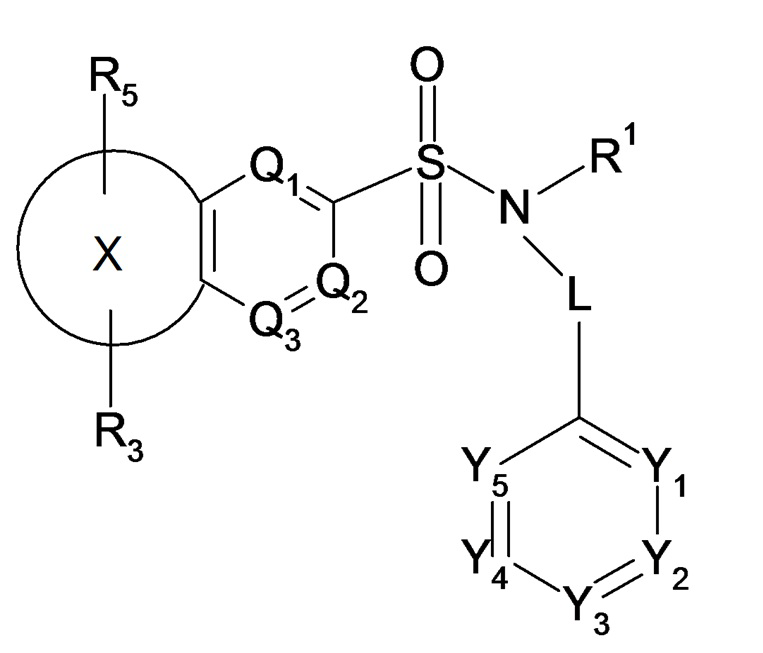
(I)
где в формуле (I):
- L представляет собой простую связь,
- X представляет собой следующий циклический радикал:
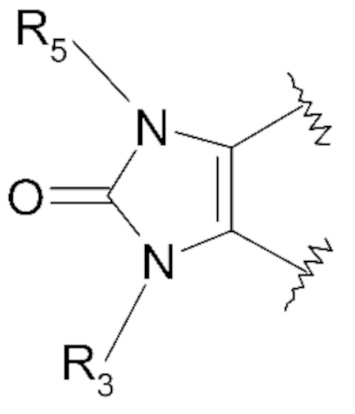
- один из элементов Y1, Y2, Y3, Y4 и Y5 соответствует атому азота, а другие элементы соответствуют группе -CR2, или каждый из элементов Y1, Y2, Y3, Y4 и Y5 соответствует группе -CR2,
- каждый из элементов Q1, Q2 и Q3 соответствует группе -CR2a,
- R1 представляет собой линейный или разветвленный C3-C5алкильный радикал или C3-C5циклоалкильный радикал,
- R2 представляет собой атом водорода, линейный или разветвленный C1-C5алкильный радикал или C1-C4алкоксирадикал;
- R2a представляет собой атом водорода;
- R3 представляет собой атом водорода или группу (CHR6)n-(Z)o-(CHR'6)p-R7,
- n, o и p, которые могут быть идентичными или различными, представляют собой ноль или 1,
- Z представляет собой метиленовую группу -CH2-,
- R6 и R'6 представляют собой атом водорода,
- R7 представляет собой:
- некатионный гетероциклоалкильный радикал, выбранный из тетрагидропирана, оксабицикло[3.1.0]гексила, оксетана, 2-оксо[1,3]диоксолана, 2-оксазолидинона, пиперидина и 1,1-диоксо-тетрагидро-2H-тиопирана, необязательно замещенный:
• одним атомом галогена,
• одной линейной или разветвленной C1-C3алкильной группой,
• одной группой S(=O)2R7a; где R7a представляет собой линейный или разветвленный C1-C3алкильный радикал,
- некатионный незамещенный гетероароматический радикал, выбранный из пиридина или пиридазина;
- R5 представляет собой атом водорода или линейный или разветвленный C1-C3алкильный радикал.
2. Соединение формулы (I) по п. 1, отличающееся тем, что R7 представляет собой гетероциклический радикал, выбранный из следующих гетероциклов:
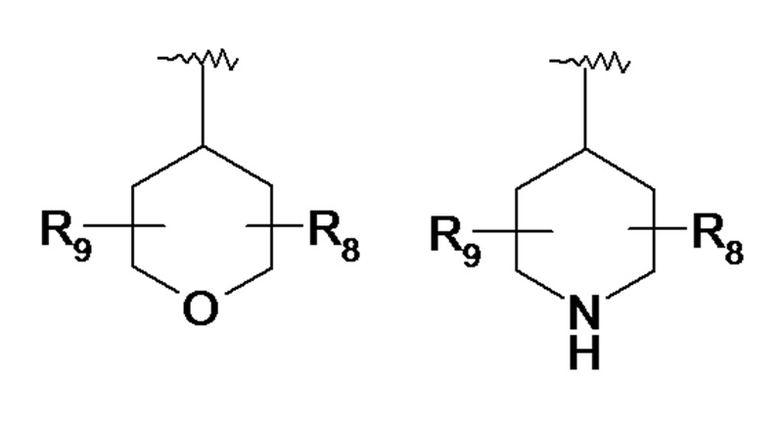
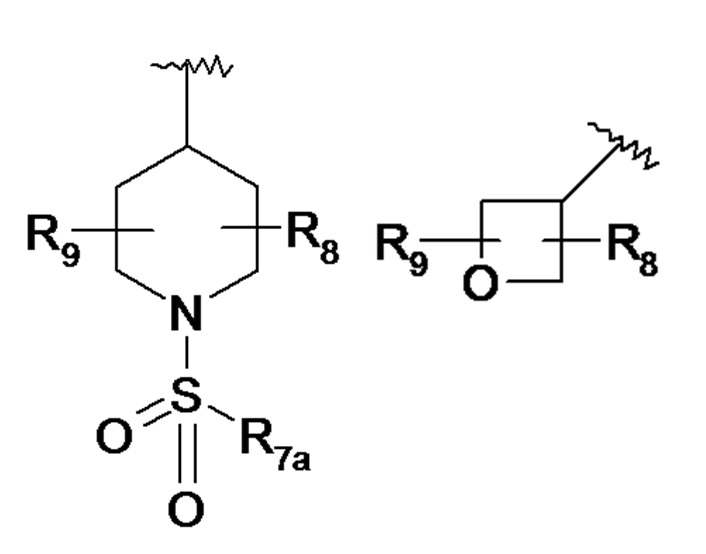
где:
- R8 и R9, которые могут быть идентичными или различными, представляют собой атом водорода или линейный или разветвленный C1-C3алкильный радикал.
3. Соединение формулы (I) по п. 1, отличающееся тем, что R7 представляет собой ароматический или гетероароматический радикал, выбранный из:
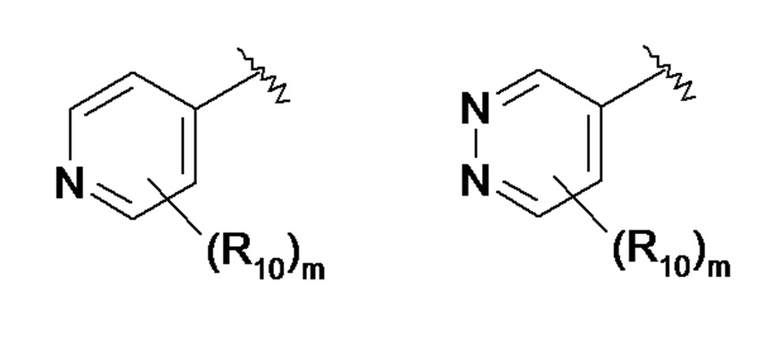
где:
- R10 представляет собой атом водорода, и
m означает ноль или натуральное число в диапазоне от 1 до 3.
4. Соединение формулы (I) по п. 1, отличающееся тем, что оно выбрано из соединения или соединений формулы (IV), а также его фармацевтически приемлемых солей присоединения, его гидратов и/или его сольватов:
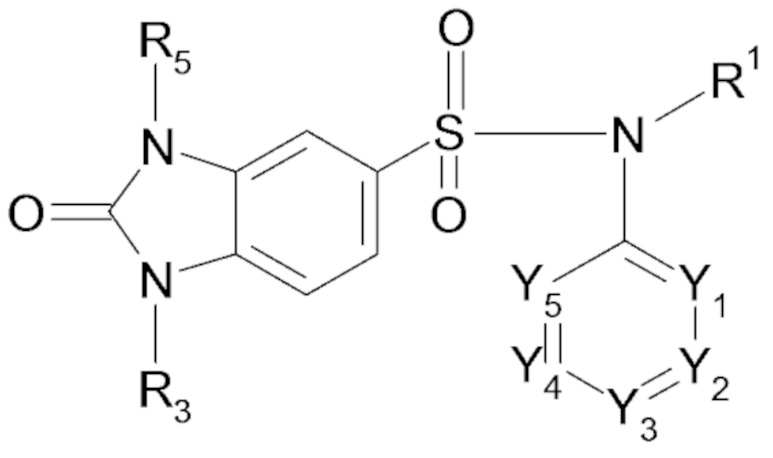
(IV)
где в формуле (IV) R1, R3, R5 и Y1-Y5 имеют такие же значения, что и в формуле (I), такой, как определено в п. 1.
5. Соединение формулы (I) по п. 1, отличающееся тем, что R5 представляет собой атом водорода.
6. Соединение формулы (I) по п. 1, отличающееся тем, что оно выбрано из следующих соединений:
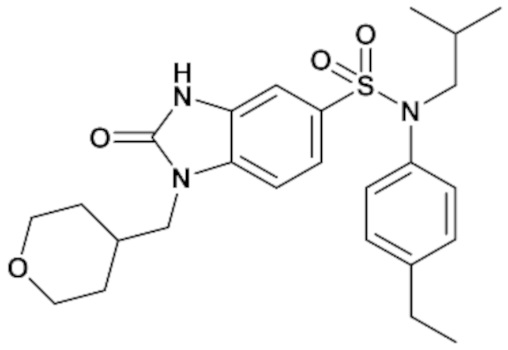
соединение 2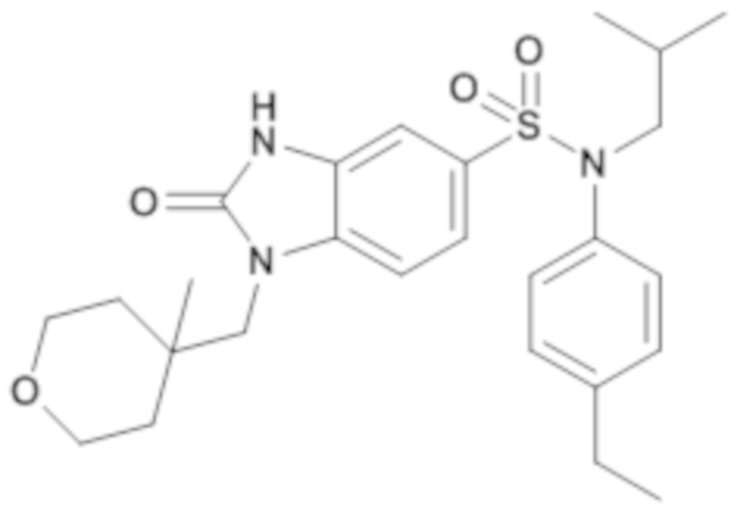
соединение 4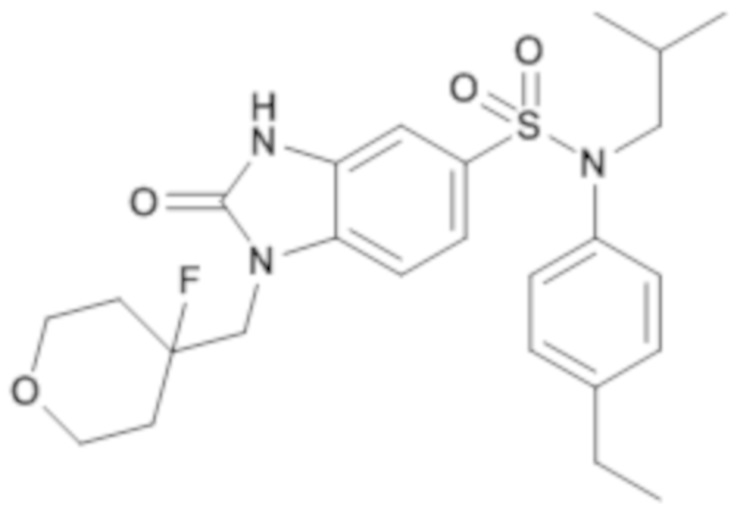
соединение 5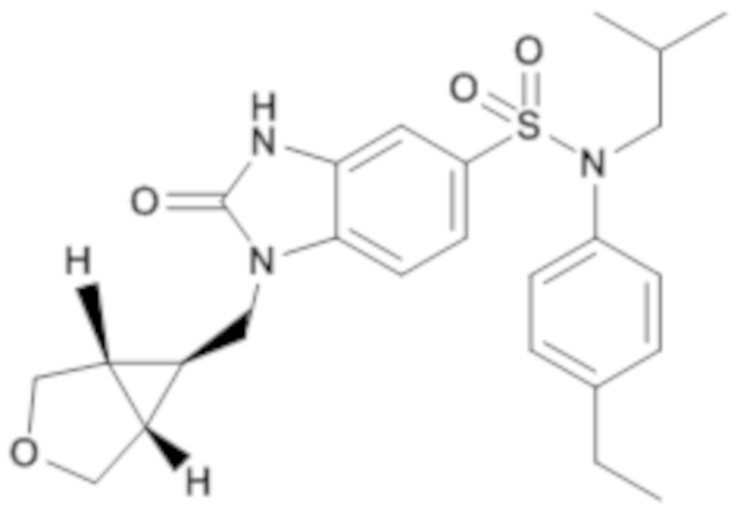
соединение 6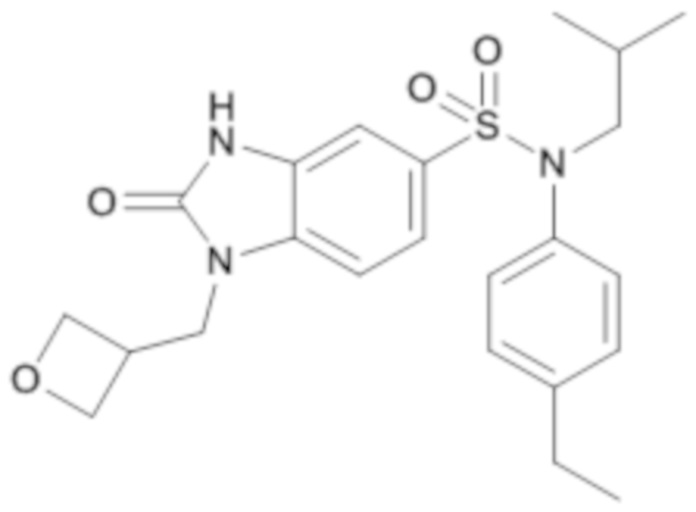
соединение 7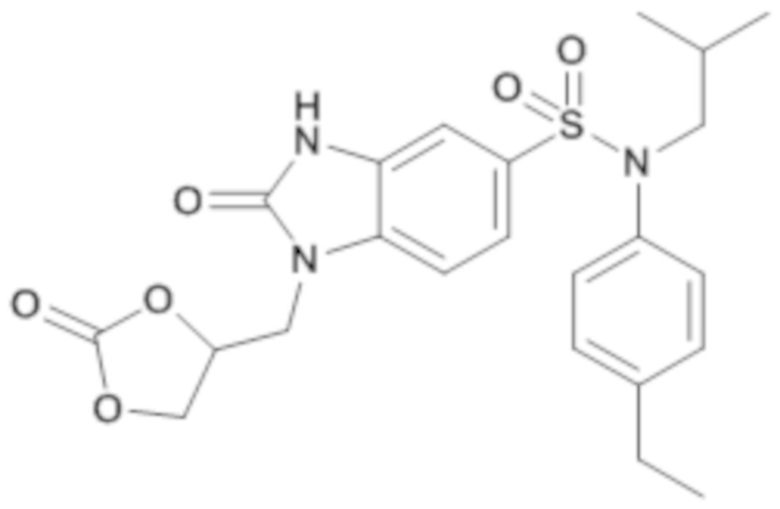
соединение 8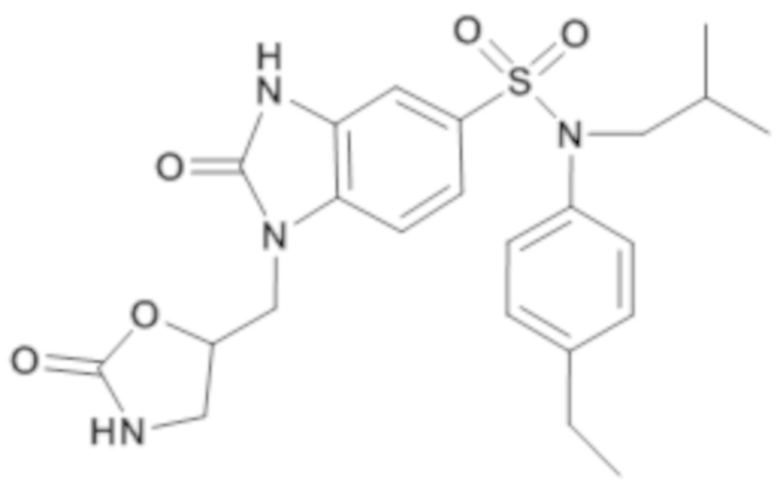
соединение 9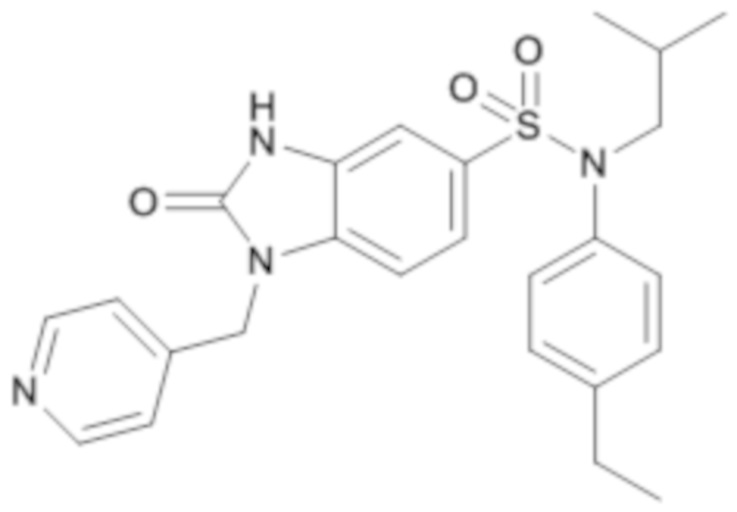
соединение 10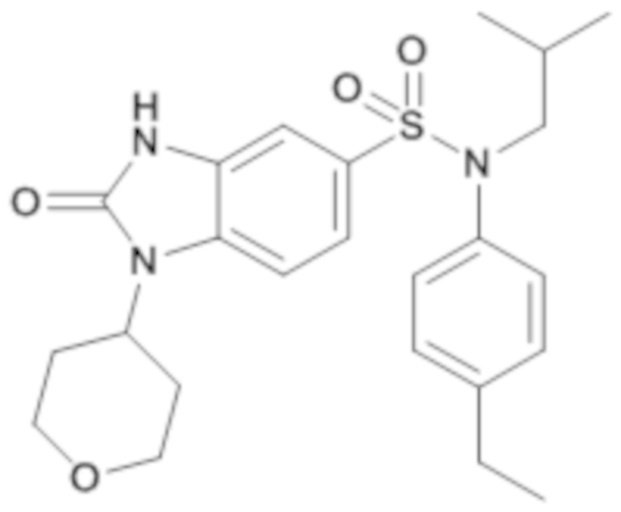
соединение 11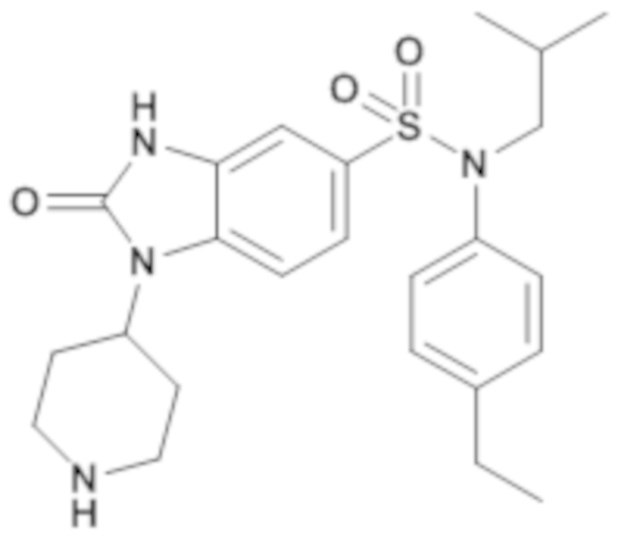
соединение 13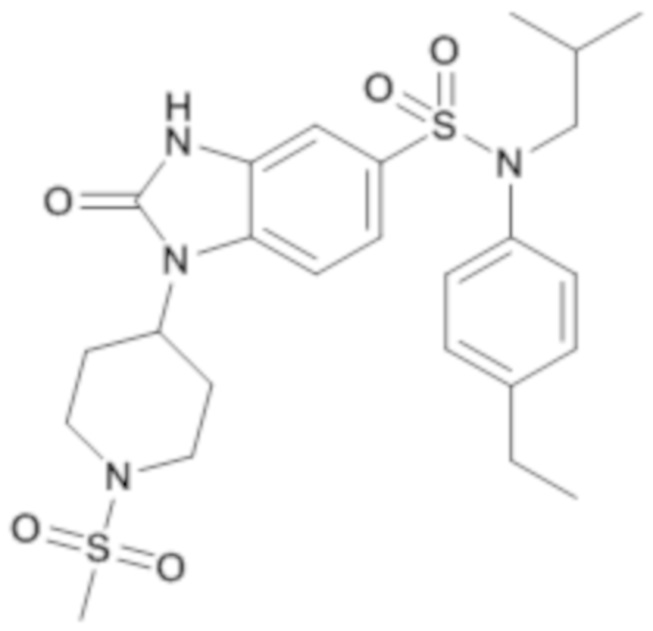
соединение 14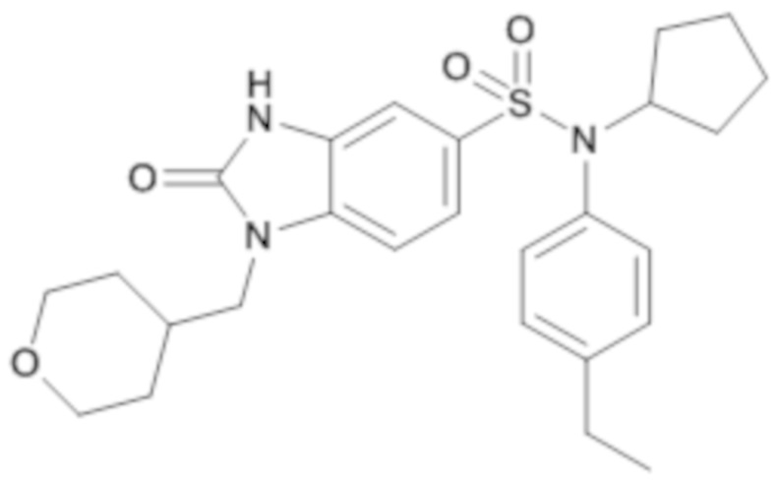
соединение 15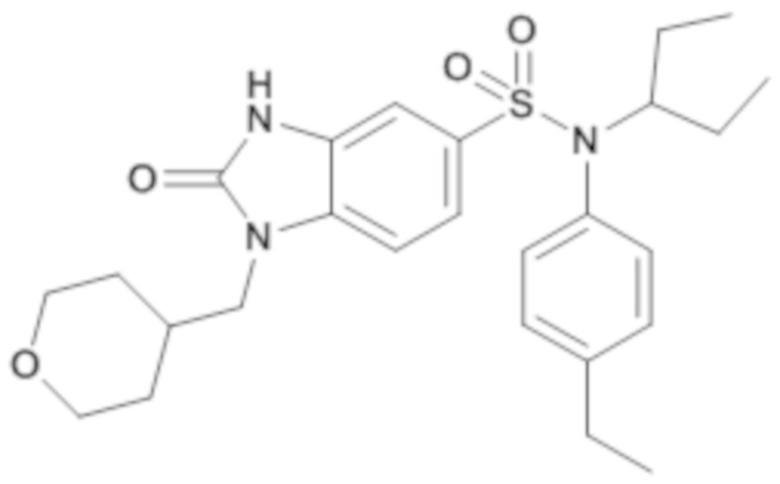
соединение 16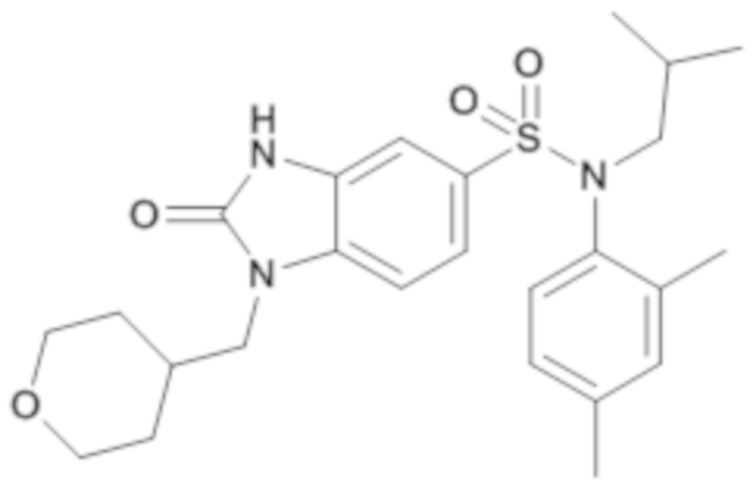
соединение 17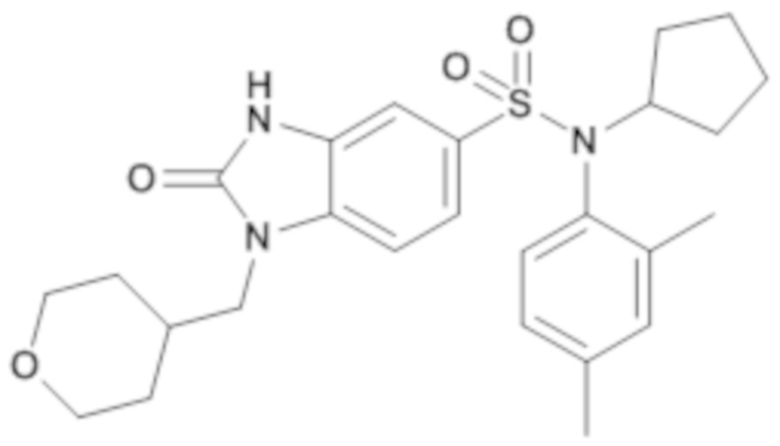
соединение 18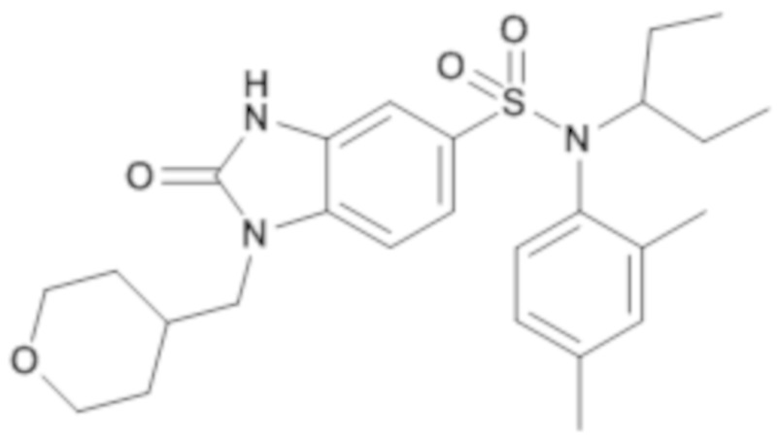
соединение 19
соединение 22
соединение 23
7. Соединение по любому из предшествующих пунктов в качестве лекарственного средства для лечения акне, атопического дерматита и/или псориаза.
8. Соединение по любому из пп. 1-6 для применения в лечении акне.
9. Соединение по любому из пп. 1-6 для применения в лечении псориаза.
10. Фармацевтическая композиция, обладающая способностью ингибировать активность рецептора RORγt, содержащая терапевтически эффективное количество соединения по любому из пп. 1-6 и фармацевтически приемлемую среду.
11. Фармацевтическая композиция, как определено в п. 10, для применения в лечении акне, атопического дерматита и/или псориаза.
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| БЕНЗИМИДАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2005 |
|
RU2374234C2 |
Авторы
Даты
2020-12-17—Публикация
2015-12-18—Подача