Настоящее изобретение относится к конкретным производным сульфонамидов, их фармацевтически приемлемым солям присоединения, их гидратам и/или их сольватам, а также их использованию в качестве обратного агониста связанного с ретиноидами орфанного рецептора гамма RORγt.
Изобретение также относится к фармацевтической композиции, содержащей такие соединения, а также к ее применению для лечения топическим и/или пероральным путем воспалительных заболеваний, опосредованных рецепторами RORγt, в частности акне, атопического дерматита и/или псориаза.
Ядерные рецепторы составляют большое семейство (называемое суперсемейством) факторов транскрипции, которые соответствуют белкам, способным активироваться лигандом, прикрепляться к конкретным последовательностям ДНК и регулировать транскрипцию генов-мишеней. Таким образом, эти рецепторы находят применение в регуляции большого числа биологических функций, таких как рост, развитие, размножение, дифференцировка и метаболизм у большинства живых организмов.
Первые представители этого суперсемейства, которые были идентифицированы и описаны в научной литературе, представляют собой ядерные рецепторы стероидных гормонов, такие как рецепторы к глюкокортикоидам и эстрогеновым рецепторам. В число представителей этого суперсемейства также входят большая часть рецепторов, для которых не было идентифицировано ни одного лиганда. Такие ядерные рецепторы называют "орфанными рецепторами".
Орфанные рецепторы, связанные с ретиноидами (на английском языке retinoid-related orphan receptors), таким образом, составляют подсемейство ядерных рецепторов. Это подсемейство состоит из трех представителей, каждый из которых характеризуется своим собственным профилем экспрессии: ROR альфа (обозначаемый RORα), ROR бета (обозначаемый RORβ) и ROR гамма (обозначаемый RORγ). Две изоформы орфанных рецепторов RORγ уже идентифицировали, а именно RORγ1, которые экспрессируются в определенном типе тканей, таких как тимус, почки, мышцы и печени, и RORγ2 (также называемый как RORγt), который экспрессируется только в клетках иммунной системы.
В частности, рецептор RORγt играет важную роль в регуляции клеточной дифференцировки лимфоцитов Th17, которые соответствуют лимфоцитам T-хелперам, функция которых заключается в обеспечении защиты организма по отношению к большому числу внеклеточных патогенных агентов, таких как бактерии и грибковые инфекции.
Тем не менее, было продемонстрировано, что лимфоциты Th17 также участвуют в большом разнообразии воспалительных заболеваний, таких как акне, и аутоиммунных заболеваний, таких как псориаз, ревматоидный артрит, а также рассеянный склероз (Peck A, Mellins ED. Precarious balance; Th17 cells in host defense. Infect Immun. 2010 Jan; 78(1):32-8; Suarez-Farinas: J. Allergy Clin. Immunol. 2014; J. Invest. Dermatol. 2008, 128(11), 2625).
Это объясняется тем, что лимфоциты Th17 продуцируют множество цитокинов, обладающих различными характеристиками, такие как интерлейкин 17A (IL-17A), интерлейкин 17F (IL-17F), интерлейкин 26 (IL-26), интерлейкин 21 (IL-21), интерлейкин 22 (IL-22) и TNFα, в том числе их развитие, их выживаемость и их пролиферация зависит от интерлейкина 23 (IL-23). Эти цитокины способны активировать различные типы эффекторных клеток, таких как кератиноциты, что приводит к их гиперпролиферации и к дополнительной продукции провоспалительных цитокинов, химокинов и антимикробных пептидов, которые в свою очередь рекрутируют и активируют другие клетки иммунной системы в воспаленной коже, что может приводить к увеличению воспалительного ответа.
Таким образом, активация лимфоцитов Th17 обеспечивает рекрутинг цитокинов, в частности интерлейкина 17 (IL17), и других типов провоспалительных клеток, что приведет к опосредованию воспалительных заболеваний, таких как акне и/или аутоиммунных заболеваний, таких как псориаз.
Проводимые на мышах эксперименты показали, что понижение уровня экспрессии рецептора RORγt приводит к понижению активности лимфоцитов Th17, что позволяет, таким образом, значительно понижать экспрессию интерлейкина 17 (IL-17) (Ivanov II, McKenzie BS, Zhou L, Tadokoro CE, Lepelley A, Lafaille JJ, Cua DJ, Littman DR: Cell 2006, 126, 1121-1133) и проводить эффективное лечение воспалительных заболеваний и аутоиммунных заболеваний, опосредованных такими цитокинами, в частности таких, для которых детектируют значительное процентное содержание интерлейкина 17 (IL-17).
Для этой цели в патентной заявке WO 2013/160418 описаны соединения сульфонамидов в качестве обратных агонистов рецептора RORγt для возможности лечить воспалительные заболевания и аутоиммунные заболевания. Таким же образом другие соединения также были разработаны в качестве обратных агонистов рецептора RORγt, такие как описываемые в патентных заявках WO 2014/090712, WO 2014/008214, WO2013/169588, WO2013/160419, WO2013/1002027, WO2013/092939, WO2013/092941, WO2013/085890 и WO2012/ 100732.
Таким образом, существует действительная необходимость в разработке новых соединений в качестве обратных агонистов рецептора RORγt для возможности эффективного лечения заболеваний, опосредованных таким рецептором, в частности воспалительных заболеваний, таких как акне и/или аутоиммунные заболевания, таких как псориаз и атопический дерматит.
Этой цели удается достичь благодаря разработке конкретных производных сульфонамидов, таких как описанные ниже, которые позволяют модулировать активность рецептора RORγt и, таким образом, эффективно лечить воспалительные заболевания и аутоиммунные заболевания определенных патологий.
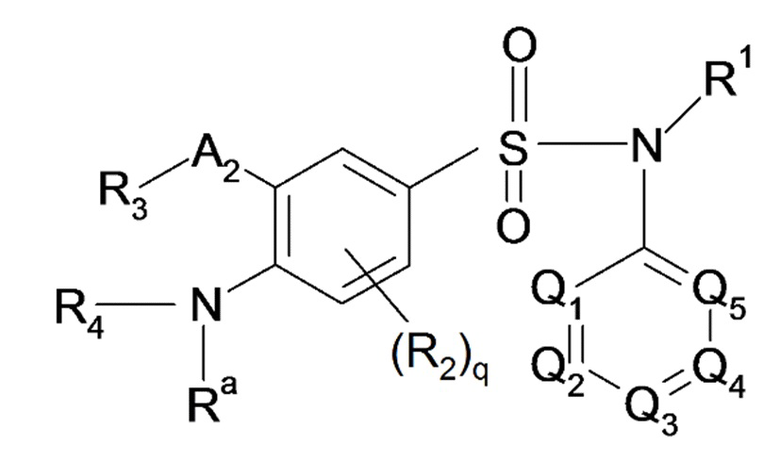
Таким образом, настоящее изобретение в частности относится к соединению или соединениям формулы (I), их фармацевтически приемлемым солям присоединения, их гидратам и/или их сольватам:
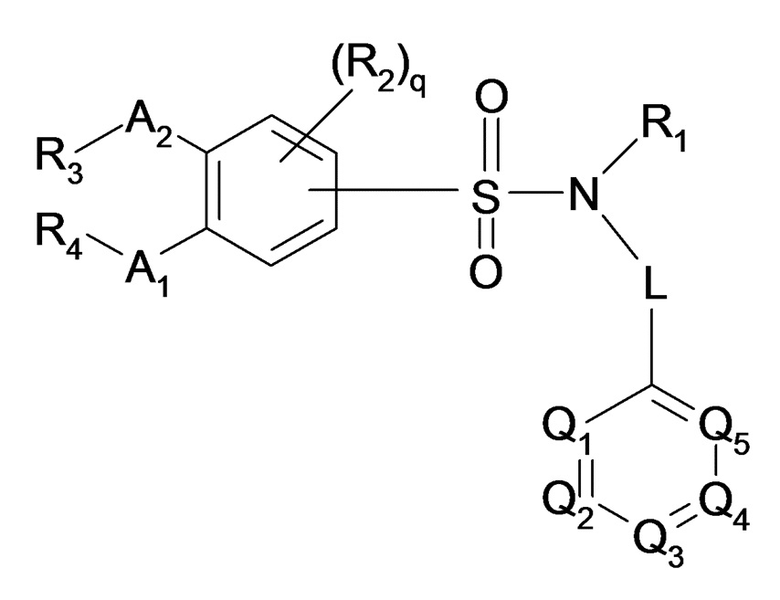
(I)
Формула (I), где:
- q равно нулю или натуральному числу от 1 до 3,
- L представляют собой простую связь или метильную группу CH2,
- R1 представляет собой прямой или разветвленный C3-C5алкильный радикал, C3-C5циклоалкильный радикал, прямой или разветвленный C2-C5алкенильный радикал, C3-C5алкил(C1)циклоалкильный радикал, C4-C5гетероциклоалкильный радикал, C4-C5алкил(C1)гетероциклоалкильный радикал,
- R2 представляет собой атом водорода или атом галогена, прямой или разветвленный C1-C5алкильный радикал, прямой или разветвленный C2-C4алкенильный радикал, C1-C4алкокси радикал, цианогруппу -CN; алкильные, алкенильные и алкокси радикалы, которые могут быть замещенными один или несколькими атомами галогена,
- R3 представляет собой атом водорода, C1-C3алкильный радикал или аминорадикал -NH2,
- R4 представляет собой атом водорода, группу (CHR5)n-(Z)o-(CHR'5)p-R6,
- n, o и p,, одинаковые или разные, означают ноль или натуральное число в диапазоне от 1 до 3,
- Z представляет собой двухвалентную группу, выбранную из -CH2-, -NH- и -O-,
- R5 и R'5,, одинаковые или разные, представляют собой атом водорода, метильный радикал -CH3, гидроксирадикал -OH, гидроксиалкильный радикал C1, карбоксильный радикал -COOH,
- R6 представляет собой:
- атом водорода или атом галогена,
- гетероциклоалкильный радикал необязательно замещенный одним или несколькими атомами галогена, одной или несколькими прямыми или разветвленными C1-C3алкильными группами, одной или несколькими группами -OH, одной или несколькими функциональными карбонильными группами =O, одной или несколькими прямыми или разветвленными C1-C4гидроксиалкильными группами, пирролидиновым циклом с одной или несколькими аминогруппами, одной или несколькими группами -C(=O)R7, одной или несколькими группами S(=O)2R7; R7 представляет собой прямой или разветвленный C1-C3алкильный радикал, гидрокси радикал -OH, прямой или разветвленный C1-C4алкоксирадикал или аминорадикал N(R7a)(R7b); где R7a и R7b, одинаковые или разные, означают атом водорода, прямой или разветвленный C1-C3алкильный радикал или циклопропильный радикал,
- C3-C6циклоалкильный радикал, необязательно замещенный одной или несколькими группами -OH,
- ароматический или гетероароматический радикал, необязательно замещенный одним или несколькими атомами галогена, одной или несколькими прямой или разветвленный C1-C3алкильными группами, необязательно замещенными одним или несколькими атомами галогена, одной или несколькими C1-C3алкоксигруппами, одной или несколькими аминогруппами -NR11R12, одной или несколькими группами -COR11, функциональной карбонильной группой (=O), одной или несколькими группами -OR11, одной или несколькими C1-C4гидроксиалкильными группами, одной или несколькими группами -COOR11, одной или несколькими амидогруппами -CONR11R12, одной или несколькими группами -SOR11, одной или несколькими группами -SO2R11, одной или несколькими группами -NHCOR11, одной или несколькими группами -NHCOOR11, одной или несколькими группами -SO2NR11R12 или одной или несколькими группами -CN; R11 и R12, одинаковые или разные, представляют собой атом водорода или прямой или разветвленный C1-C3алкильный радикал, необязательно замещенный одним или несколькими атомами галогена;
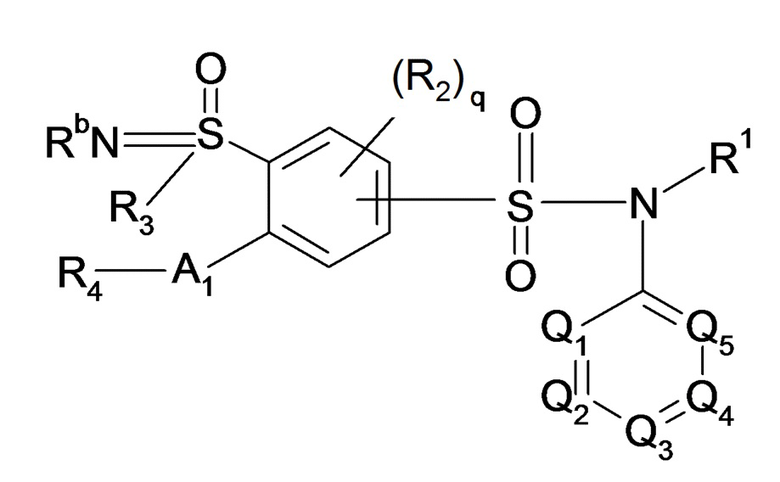
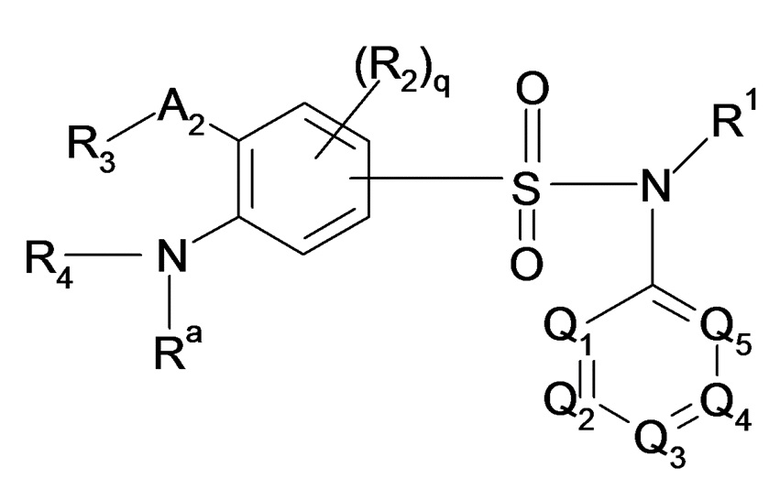
- A1 представляет собой двухвалентную группу, выбранную из -NRa-, -O-, -S-, -SO-, -SO2-, -SO(=NH)-, -CH2-, -C=C-, -CH(Ra)-;
- A2 представляет собой простую связь или двухвалентную группу, выбранную из -S-, -SO-, -SO2-, -SO(=N-Rb)-, -CH(OH)-, -C(=O)O-;
при условии, что:
- если A1 представляет собой одну из двухвалентных групп, выбранных из: -NRa-, -O-, -CH2-, -C=C- или -CH(Ra), то A2 не содержится в двухвалентной группе -CH(OH)- и -C(=O)O-, и R3 не является атомом водорода, аминорадикалом -NH2 или C1-C3алкильным радикалом,
- если A2 представляет собой простую связь, и R3 представляет собой атом водорода, то A1 представляет собой одну из двухвалентных групп, выбранных из: -SO- и -SO(=NH)-,
- Ra представляет собой атом водорода, прямой или разветвленный C1-C3алкильный радикал, ацетильный радикал -C(=O)CH3,
- Rb представляет собой атом водорода, прямой или разветвленный C1-C3алкильный радикал, циклопропильную группу,
- Q1, Q2, Q3, Q4 и Q5, одинаковые или разные, представляют собой атом азота или группу -CR'2,
- если A2 представляет собой двухвалентную группу, выбранную из -S-, -SO, -SO2-, -SO(=N-Rb)-, то Ra и R3 могут образовывать совместно с атомами углерода, к которому они присоединены, гетероциклоалкильную группу, которая необязательно может быть замещена одной или несколькими функциональными карбонильными группами, одним или несколькими радикалами C1-C3алкильными,
- если A1 представляет собой -NRa-, то Ra и R4 могут образовывать совместно с атомом азота, к которому они присоединены, C2-C10гетероциклоалкильную группу, содержащую необязательно от одного до трех гетероатомов, выбранных из атома серы, атом азота и атома кислорода; где указанная гетероциклоалкильная группа является необязательно замещенной по меньшей мере радикалом R14,
- R14 представляет собой прямой или разветвленный C1-C3алкильный радикал, прямой или разветвленный C1-C3алкоксирадикал, атом галогена, гидроксигруппу -OH, цианогруппу -CN, группу -CONR15R16, группу -SO2R15, группу -COR15 или аминогруппу -NR15R16; R15 и R16, одинаковые или разные, представляют собой атом водорода или прямой или разветвленный C1-C3алкильный радикал.
Другими словами, в соответствии с формулой (I):
- если A1 представляет собой одну из следующих ниже двухвалентных групп: -NRa-, -O-, -CH2-, -C=C- или -CH(Ra), то A2 не является простой связью или двухвалентной группой: -CH(OH)- или -C(=O)O-,
- если A2-R3 представляет собой атом водорода, то A1 представляет собой одну из двухвалентных групп: -SO- или -SO(=NH).
Соединения по изобретению соответствуют производным сульфонамидов и предпочтительно к содержащим серу производным сульфонамидов, которые содержат в своей структуре по меньшей мере сульфонамидную группу SO2-N и по меньшей мере один атом серы.
Соединения по изобретению позволяют модулировать, т.е. ингибировать активность рецептора RORγt.
Настоящее изобретение также относится к соединению или соединениям, таким как определено выше, в качестве лекарственного средства и косметического средства.
Другим объектом изобретения является соединение или соединения, такие как определено выше, для применения в лечении заболеваний, опосредованных рецептором RORγt, в частности воспалительных заболеваний и/или аутоиммунных заболеваний, опосредованных рецептором RORγt.
Кроме того, изобретение также относится к фармацевтической композиции, содержащей в фармацевтически приемлемой среде одно или несколько соединений формулы (I), такой как определено выше, их фармацевтически приемлемым солям присоединения, их гидратам и/или их сольватам.
Настоящее изобретение также относится к фармацевтической композиции, такой как описанной выше, для применения в лечении заболеваний, опосредованных рецептором RORγt, в частности, воспалительных заболеваний и/или аутоиммунных заболеваний.
Также изобретение относится к способу лечения заболеваний, опосредованных рецептором RORγt, включающему введение, в частности, топическим или пероральным путем, терапевтически эффективного количества одного или нескольких соединений, таких как указано выше, пациенту.
Другие объекты и характеристики, аспекты и преимущества изобретения станут еще более очевидны при прочтении описания и примеров, которые следуют ниже.
Предпочтительно соединение или соединения формулы (I) представляет собой содержащие серу сульфонамиды.
Предпочтительно соединение или соединения формулы (I) по изобретению выбирают из соединения или соединений формул (Ia) и/или (Ib):
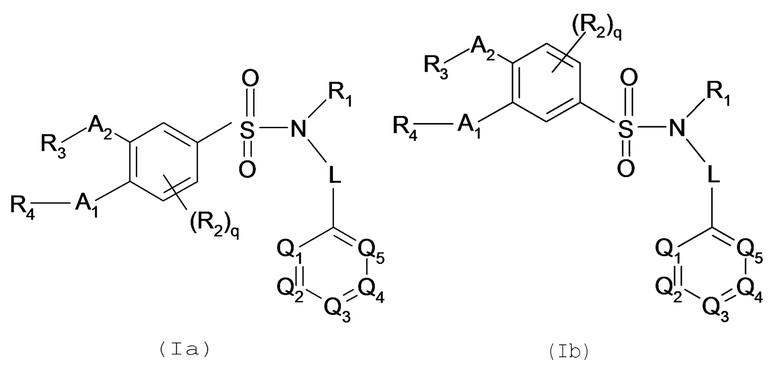
Формулы (Ia) и (Ib), где R1, R2, R'2, R3, R4, R5, R'5, R6, R7, R7a, R7b, R11, R12, R14, R15, R16, Ra, Rb, Z, Q1, Q2, Q3, Q4, Q5, A1, A2, L и индексы q, n, o и p имеют такие же значения, что и в формуле (I), описанной ранее.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) L представляет собой простую связь.
По другому варианту осуществления в формулах (I), (Ia) и (Ib), L представляет собой метильную группу -CH2.
Предпочтительно в формулах (I), (Ia) и (Ib), L представляет собой простую связь.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) R1 представляет собой прямой или разветвленный C3-C5алкильный радикал, в частности разветвленный C4.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) R1 представляет собой C3-C5циклоалкильный радикал.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) R1 представляет собой прямой или разветвленный C2-C5алкенильный радикал.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) R1 представляет собой алкил(C1)C3-C5циклоалкильный радикал.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) R1 представляет собой C4-C5гетероциклоалкильный радикал.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) R1 представляет собой алкил(C1)C4-C5гетероциклоалкильный радикал.
Предпочтительно R1 представляет собой прямой или разветвленный C3-C5алкильный радикал, в частности разветвленный, и Еще более предпочтительно разветвленный C4.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) R3 представляет собой атом водорода.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) R3 представляет собой прямой или разветвленный C1-C3алкильный радикал, в частности C1.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) Q1, Q2, Q3, Q4 и Q5, одинаковые или разные, представляют собой группу -CR'2, где R'2 может представлять собой атом водорода или прямой или разветвленный C1-C5алкильный радикал.
Предпочтительно в формулах (I), (Ia) и (Ib) Q3 представляет собой группу -CR'2, где R'2 представляет собой прямой или разветвленный C1-C5алкильный радикал, в частности C2.
Предпочтительно Q1, Q2, Q4 и Q5, одинаковые или разные, представляют собой группу -CR'2, где R'2 представляет собой атом водорода.
В соответствии с предпочтительным вариантом осуществления Q3 представляет собой группу -CR'2, где R'2 представляет собой прямой или разветвленный C1-C5алкильный радикал, в частности C2, и Q1, Q2, Q4 и Q5, одинаковые или разные, представляют собой группу -CR'2, где R'2 представляет собой атом водорода.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) индекс q равен нулю.
Предпочтительно в формулах (I), (Ia) и (Ib) A2 представляет собой двухвалентную группу, выбранную из -SO-, -SO2- и -SO(=N-Rb)-.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) A2 представляет собой двухвалентную группу -SO-.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) A2 представляет собой двухвалентную группу -SO2-.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) A2 представляет собой двухвалентную группу -SO(=N-Rb)-.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) A2 представляет собой двухвалентную группу -CH(OH)-.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) A2 представляет собой простую связь.
Предпочтительно в формулах (I), (Ia) и (Ib) A2 представляет собой двухвалентную группу -SO(=N-Rb)-, где Rb представляет собой атом водорода.
Предпочтительно в формулах (I), (Ia) и (Ib) A1 представляет собой двухвалентную группу, выбранную из групп -NRa- и -CH(Ra)-.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) A1 представляет собой двухвалентную группу -NRa-.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) A1 представляет собой двухвалентную группу -O-.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) A1 представляет собой двухвалентную группу -SO-.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) A1 представляет собой двухвалентную группу -S-.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) A1 представляет собой двухвалентную группу -SO2-.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) A1 представляет собой двухвалентную группу - SO(=NH)-.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) A1 представляет собой двухвалентную группу -CH2-.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) A1 представляет собой двухвалентную группу -C=C-.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) A1 представляет собой двухвалентную группу -CH(Ra)-.
Предпочтительно в формулах (I), (Ia) и (Ib) A1 представляет собой двухвалентную группу -O-, -S- и -SO- и еще более предпочтительно двухвалентную группу -O-.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) индексы n, o, и p, одинаковые или разные, означают ноль
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) индексы n, o, и p,, одинаковые или разные, означают натуральное число в диапазоне от 1 до3.
По одному из вариантов осуществления индексы n и o означают 1, и индекс p означает ноль.
По одному из вариантов осуществления индексы n и p означают ноль, и индекс o равен 1.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) Z представляет собой метильную группу -CH2-.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) Z представляет собой двухвалентную группу -O-.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) Z представляет собой двухвалентную группу -NH-.
Предпочтительно R4 является отличным от атома водорода.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) R4 представляет собой группу Z-R6, где Z имеет ранее описанное значение.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) R4 представляет собой группу -CH2-R6.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) R4 представляет собой группу -O-R6.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) R4 представляет собой группу -NH-R6.
Таким образом, в формулах (I), (Ia) и (Ib) R4 выбран из групп -CH2-R6, -O-R6 или -NH-R6.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib) R6 представляет собой гетероциклическую, моноциклическую, бициклическую или бициклическую спирогруппу.
По одному из вариантов осуществления R6 представляет собой гетероциклоалкильный радикал, предпочтительно выбранный из:
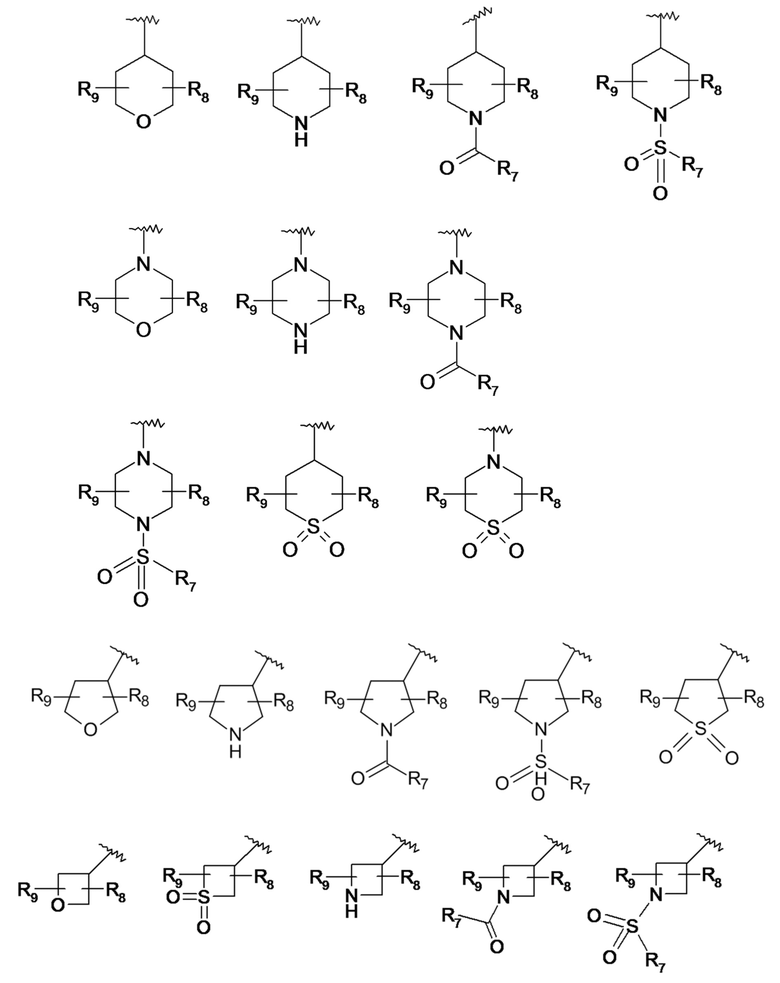
где:
- R7 представляет собой прямой или разветвленный C1-C3алкильный радикал, радикал гидрокси -OH, C1-C3алкоксирадикал или аминорадикал N(R7a)(R7b),
- R7a и R7b, одинаковые или разные, означают атом водорода, прямой или разветвленный C1-C3алкильный радикал или циклопропильный радикал,
- R8 и R9, одинаковые или разные, представляют собой атом водорода, прямой или разветвленный C1-C3алкильный радикал, гидроксигруппа -OH, карбонильную группу, гидроксиалкильный радикал C1 (CH2OH), аминогруппу -NH2,
- R8 и R9 могут образовывать совместно с атомами углерода, с которыми они связаны карбоксильным циклом, состоящим из 5-7 звеньев.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib), R6 представляет собой ароматический или гетероароматический радикал, предпочтительно выбранный из:
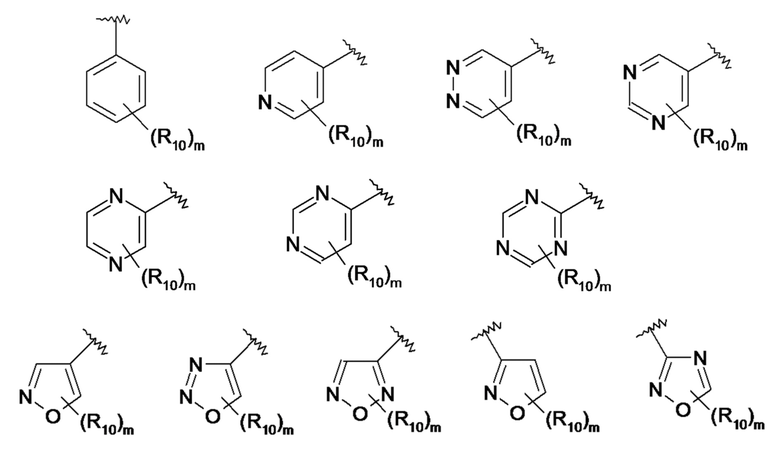
где:
- R10 представляет собой атом водорода или атом галогена; прямой или разветвленный C1-C3алкильный радикал, необязательно замещенный одним или несколькими атомами галогена; функциональную карбонильную группу (=O), группу OR11, C1-C4гидроксиалкильную группу, аминогруппу -NR11R12, группу -COR11, группу -COOR11, амидогруппу -CONR11R12, группу -SOR11, группу -SO2R11, группу -NHCOR11, группу -NHCOOR11, группу -SO2NR11R12 или цианогруппу -CN,
- R11 и R12, одинаковые или разные, представляют собой атом водорода или прямой или разветвленный C1-C3алкильный радикал необязательно, замещенный одним или несколькими атомами галогена,
- m означает ноль или натуральное число от 1 до 3.
Предпочтительно R6 представляет собой ароматический или гетероароматический радикал, такой как определено выше, необязательно замещенный одной или несколькими метильными группами -CH3, одной или несколькими метоксигруппами -OCH3, одной или несколькими гидроксигруппами -OH, одной или несколькими аминогруппами -NH2, одной или несколькими группами -CH2OH, одной или несколькими цианогруппами -CN, одним или несколькими атомами галогена, одной или несколькими функциональными карбонильными группами.
По одному из вариантов осуществления R6 представляет собой атом водорода.
По одному из вариантов осуществления R6 представляет собой C3-C6циклоалкильный радикал.
По одному из вариантов осуществления R8 и R9 представляют собой атом водорода.
По одному из вариантов осуществления R8 и R9 представляют собой прямой или разветвленный C1-C3алкильный радикал.
По одному из вариантов осуществления в формулах (I), (Ia) и (Ib), если A2 представляет собой двухвалентную группу, выбранную из -SO, -SO2-, -SO(=N-Rb)-, то A1 представляет собой двухвалентную группу, выбранную из групп -NRa- и -CH(Ra)-, и Ra и R3 образуют совместно с атомами углерода, к которым они присоединены, гетероциклоалкильную группу, содержащую 5 или 6 звеньев, необязательно замещенных одной или несколькими функциональными карбонильными группами, одним или несколькими атомами галогена или одним или несколькими C1-C2алкильными радикалами.
В соответствии с этим вариантом осуществления Ra и R3 образуют совместно с атомами углерода, к которым они присоединены, незамещенную гетероциклоалкильную группу, содержащую 5 или 6 звеньев.
В соответствии с этим вариантом осуществления A2 предпочтительно представляет собой -SO2-.
В соответствии с этим вариантом осуществления A2 предпочтительно представляет собой -SO-.
В соответствии с этим вариантом осуществления A2 предпочтительно представляет собой SO(=N-Rb)-, где Rb предпочтительно представляет собой атом водорода или прямой или разветвленный C1-C3алкильный радикал.
По другому варианту осуществления в формулах (I), (Ia) и (Ib), если A2 представляет собой двухвалентную группу, выбранную из -SO, -SO2-, -SO(=N-Rb)-, то A1 представляет собой двухвалентную группу, выбранную из двухвалентных групп -NRa-, -O-, -CH2-, -C=C- или -CH(Ra).
В соответствии с этим вариантом осуществления Ra и R3 не образуют совместно с атомами углерода, к которым они присоединены, гетероциклоалкильную группу, содержащую 5 или 6 звеньев.
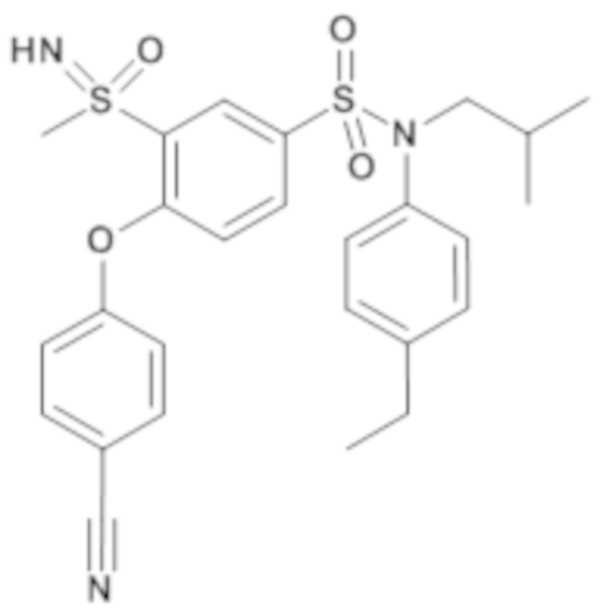
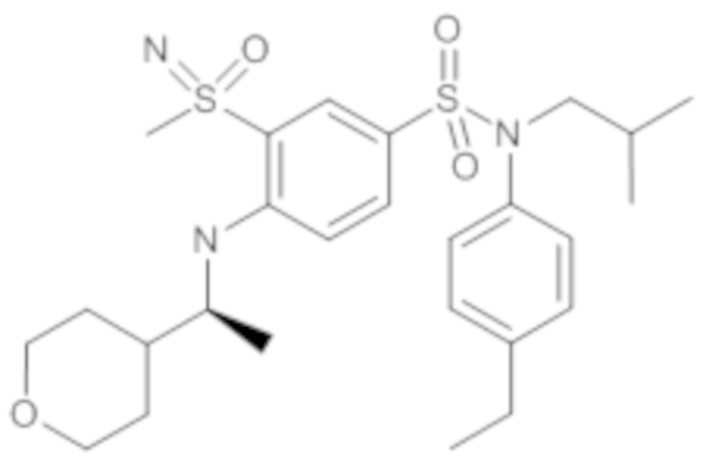
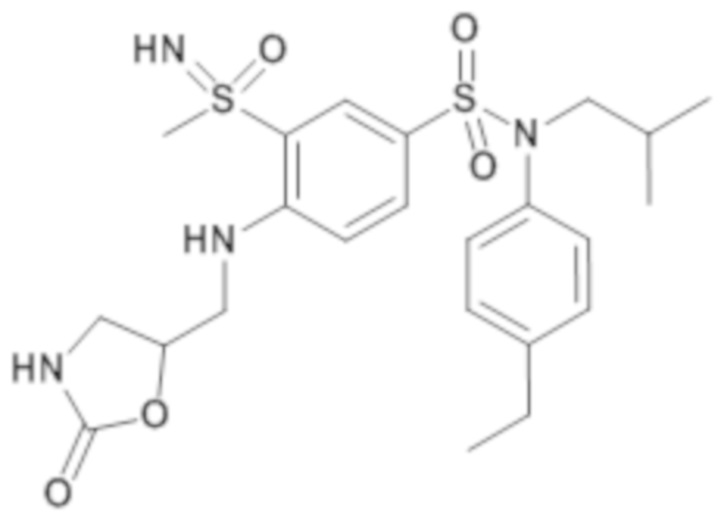
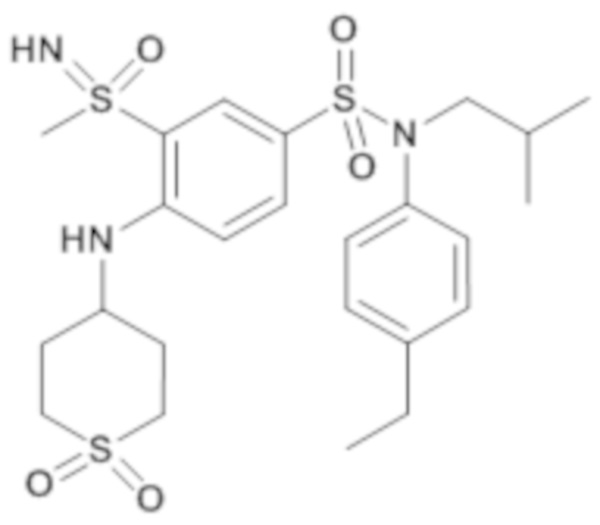
По одному из вариантов осуществления, если A1 представляет собой -NRa-, то Ra и R4 образуют совместно с атомом азота, к которому они присоединены, C2-C10гетероциклоалкильную группу, содержащую необязательно от одного до трех гетероатомов, выбранных из атома серы, атома азота и атома кислорода; где казанная гетероциклоалкильная группа является необязательно замещенной по меньшей мере одним радикалом R14, таким как определено в формуле (I), описанной выше.
В частности, C2-C10гетероциклоалкильная группа может являться моноциклической, бициклической или бициклической спиро.
Предпочтительно гетероциклоалкильная группа является необязательно замещенной одним, двумя или тремя радикалами R14, такими как определено выше.
Предпочтительно соединение или соединения по изобретению вбирают из соединений формулы (II), а также их фармацевтически приемлемых солей присоединения, их гидратов и/или их сольватов:
(II)
Формула (II), где:
- R3 представляет собой C1-C3алкильный радикал,
- R1, R2, R'2, R3, R4, R5, R'5, R6, R7, R7a, R7b, R8, R9, R10, R11, R12, Ra, Rb, Z, Q1, Q2, Q3, Q4, Q5, A1 и индексы q, m, n, o и p имеют такие же значения, как указанные выше значения.
Предпочтительно Rb представляет собой атом водорода или алкильный радикал C1.
Предпочтительно Rb представляет собой атом водорода.
Предпочтительно R3 представляет собой алкильный радикал C1.
Предпочтительно R1 представляет собой разветвленный алкильный радикал C3.
Предпочтительно R4 представляет собой группу (CHR5)n-(Z)o-(CHR'5)p-R6, где R6 предпочтительно соответствует ароматическому или гетероароматическому радикалу, циклоалкильному радикалу или гетероциклическому радикалу, такому как указано выше в формуле формуле (I) или такому как указано выше.
Предпочтительно Q1-Q2 и Q4-Q5 соответствует группе -CR2, где R2 означает атом водорода, и Q3 соответствует группе -CR2, где R2 означает прямой или разветвленный C1-C5алкильный радикал, предпочтительно C2.
Предпочтительно Q1 и Q3, одинаковые или разные, соответствуют группе -CR'2, где R'2 означает атом водорода или прямой или разветвленный C1-C5алкильный радикал, предпочтительно C2.
По одному из вариантов осуществления предпочтительно R1 представляет собой прямой или разветвленный C3-C5алкильный радикал, и Rb представляет собой атом водорода.
Предпочтительно соединение или соединения по изобретению вбирают из соединений формулы (III), а также их фармацевтически приемлемых солей присоединения, их гидратов и/или их сольватов:
(III)
Формула (III), где:
- R1, R2, R'2, R3, Rb, Q1, Q2, Q3, Q4, Q5, A2 и индекс q имеют такие же значения, как в формуле (I), описанной выше,
- Ra и R4 образуют совместно с атомом азота, к которому они присоединены C2-C10гетероциклоалкильную группу, содержащую необязательно от одного до трех гетероатомов, выбранных из атома серы, атома азота и атома кислорода; где указанная гетероциклоалкильная группа является необязательно замещенной по меньшей мере одним радикалом R14,
- R14 представляет собой прямой или разветвленный C1-C3алкильный радикал, прямой или разветвленный C1-C3алкоксирадикал, атом галогена, гидроксигруппу -OH, цианогруппу -CN, группу -CONR15R16, группу -SO2R15, группу -COR15 или аминогруппу -NR15R16; R15 и R16, одинаковые или разные, представляют собой атом водорода или прямой или разветвленный C1-C3алкильный радикал.
В частности, C2-C10гетероциклоалкильная группа может являться моноциклической, бициклической или бициклической спиро.
Соединения формулы (I), (II), (III), (Ia) и (Ib) могут находиться в виде фармацевтически приемлемых солей. Примеры фармацевтически приемлемых солей описаны у Bergeet al., 1977, "Sels pharmaceutiquement acceptables", J. Pharm. Sci., Vol. 66, pp. 1-19.
В частности, когда соединения формулы по изобретению находятся в виде солей, то электронейтральность указанных соединений обеспечивается внешним катионным противоионом Y, который может быть органическим или минеральным.
Y можно выбирать из соответствующих неорганических катионов, таких как ионы щелочных металлов, в частности Na+, K+, ионы щелочно-земельных металлов, в частности Ca2+, Mg2+, а также других катионов, таких как ион алюминия Al3+.
Y можно выбирать из соответствующих органических катионов, таких как ион аммония NH4+, замещенные ионы аммония, такие как NH3R+, NHR2+, NR4+, где R представляет собой C1-C4алкильный радикал.
В частности, замещенные ионы аммония представляют собой ионы аммония, выбираемые из производных этиламина, диэтиламина, дициклогексиламина, триэтиламина, бутиламина, этилендиамина, этаноламина, диэтаноламина, пиперазина, бензиламина, фенилбензиламина, холина, меглюмина и трометамина, аминокислот, таких как лизин и аргинин.
Примером иона четвертичного аммония может являться ион N+ (CH3)4.
Соединение или соединения по изобретению могут находиться в виде сольватов.
В контексте настоящего изобретения термин "сольват" означает комплекс растворенного вещества (т.е. соединения по изобретению или соли указанного соединения) и растворителя.
Если растворитель представляет собой воду, то сольват можно легко рассматривать как гидрат, например, полугидрат, моногидрат, дигидрат, тригидрат и т.д.
Например, сольваты и/или гидраты можно получать непосредственно в конце процесса синтеза, где целевое соединение выделяют в виде гидрата, например, моногидрата или полугидрата, или в виде сольвата растворитель реакционной смеси и/или растворителя для очищения.
Если не указано иное, любая ссылка на соединение по изобретению также включает сольват или гидрат соответствующего соединения.
Характерные способы получения и идентификации гидратов и сольватов хорошо известны специалисту в данной области, см., например, стр. 202-209 KJ Guillory, "Generation of Polymorphs, Hydrates, Solvates, and Amorphous Solids" в Polymorphism in Pharmaceutical Solids, edition. Harry G. Britain, Vol. 95, Marcel Dekker, Inc., New York, 1999.
Гидраты и сольваты можно выделять и характеризовать способами, известными в данной области, такими как термогравиметрический анализ (TGA), масс-спектроскопия TGA, инфракрасная спектроскопия TGA, порошковая рентгеновская дифракция, титрование по Карлу Фишеру, рентгеновская дифракция высокого разрешения и аналогичным.
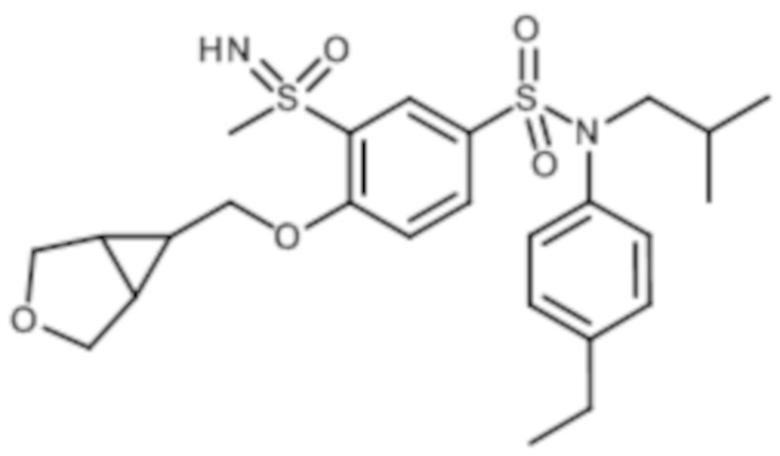
Предпочтительно соединение или соединения формулы (I) выбирают из следующих ниже соединений, таких как описанные ниже в таблицах, а также их фармацевтически приемлемых солей присоединений, их гидратов и/или их сольватов.
Таблица 1.
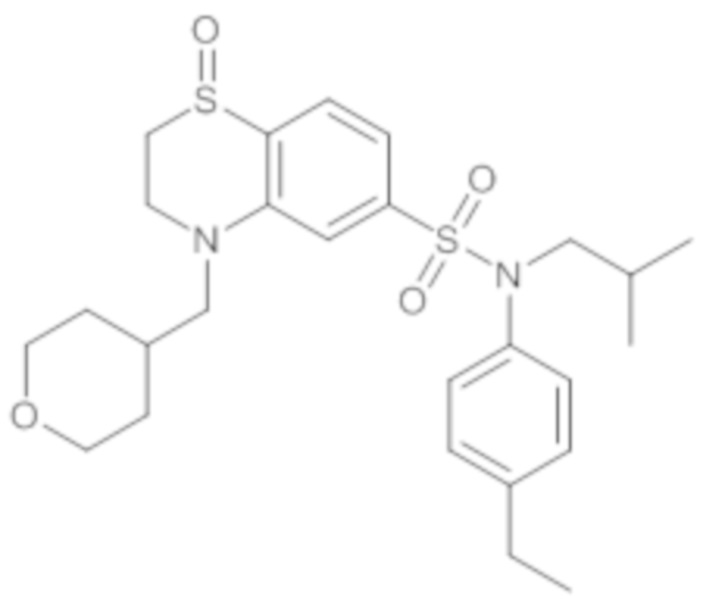
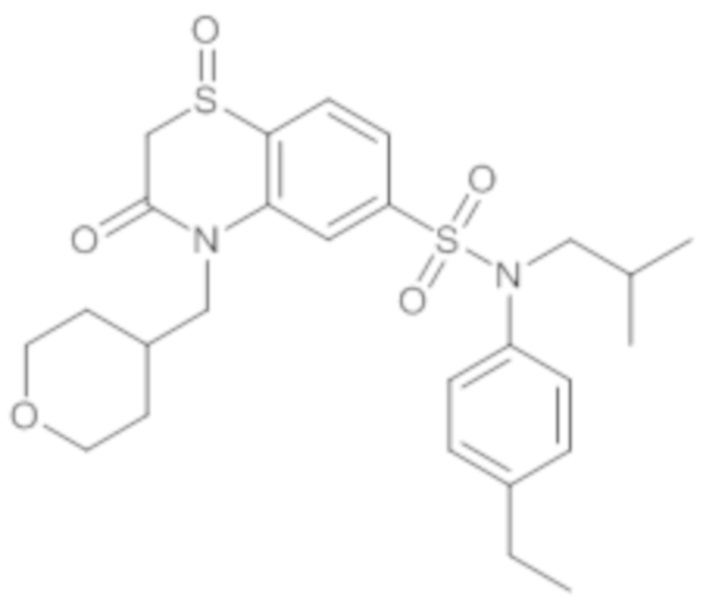
4-бензо-[1,4]триазин-6-сульфоновой кислоты соединение 4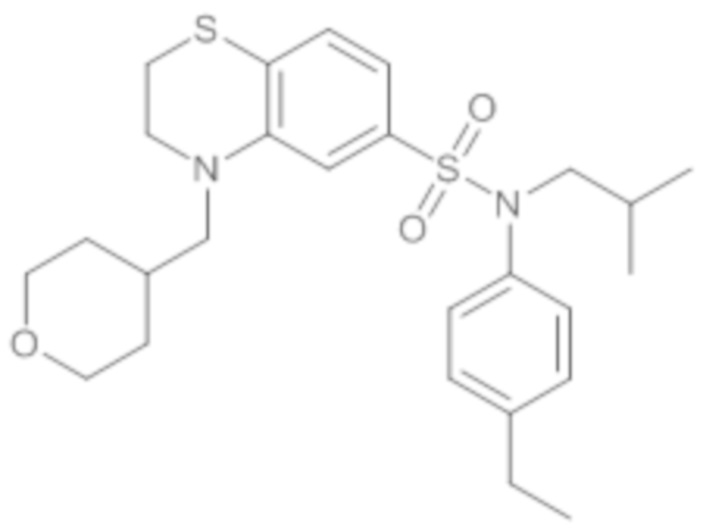
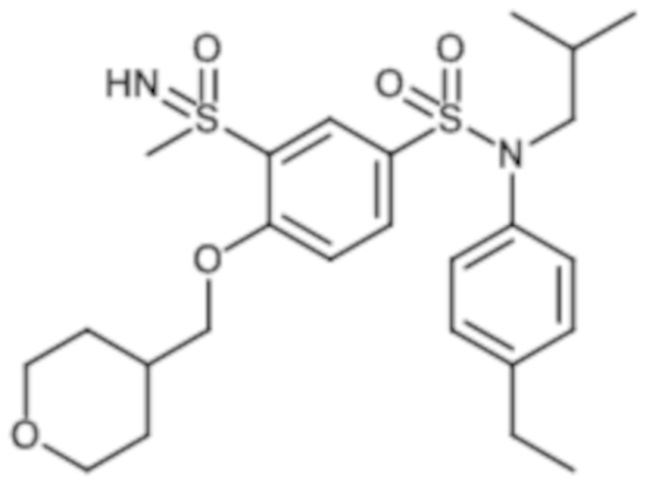
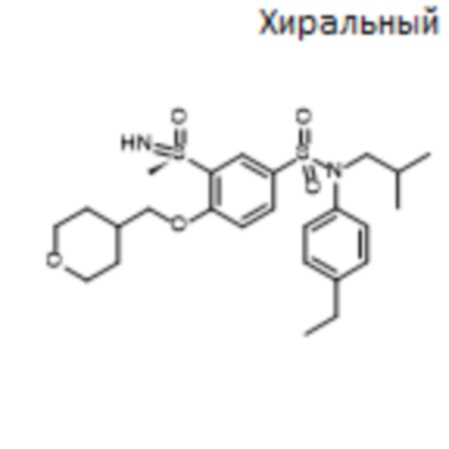
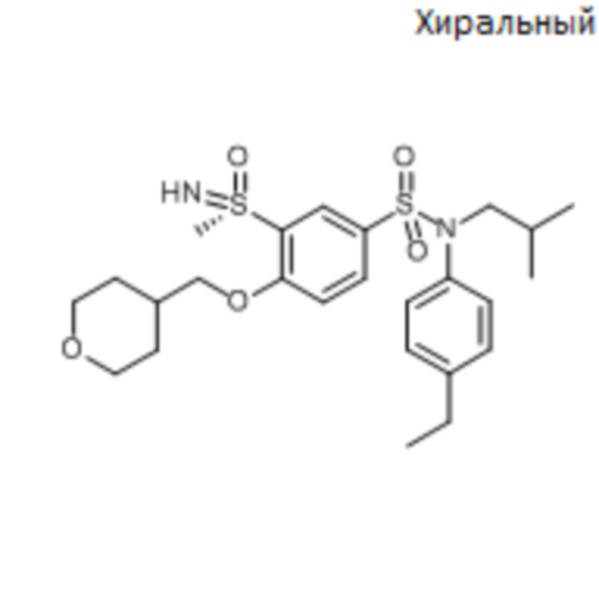
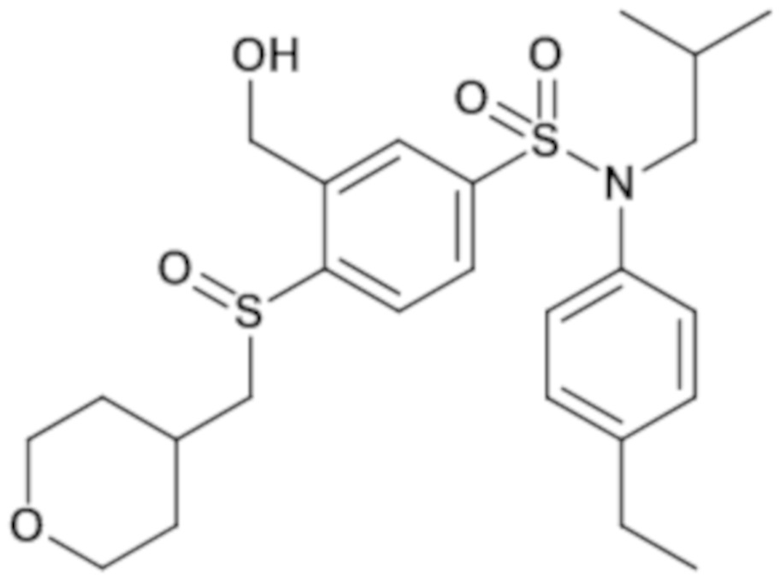
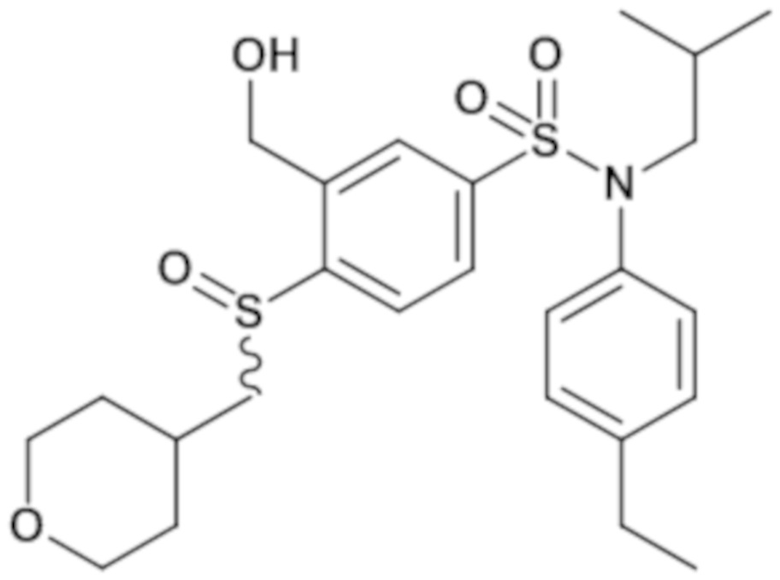

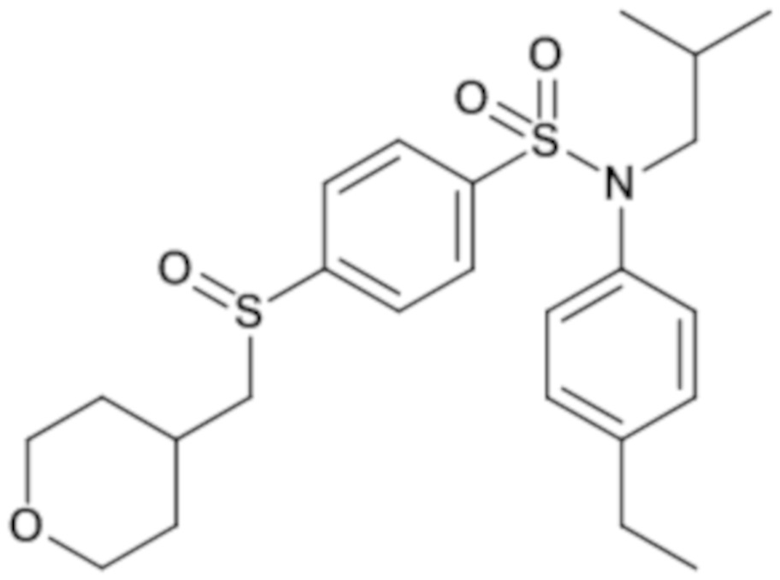


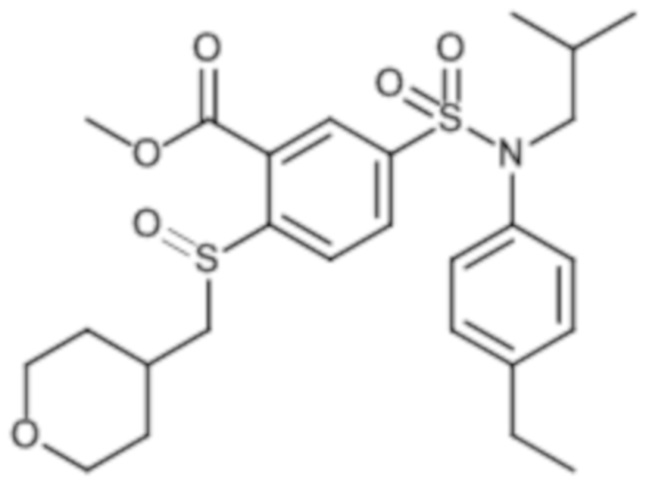
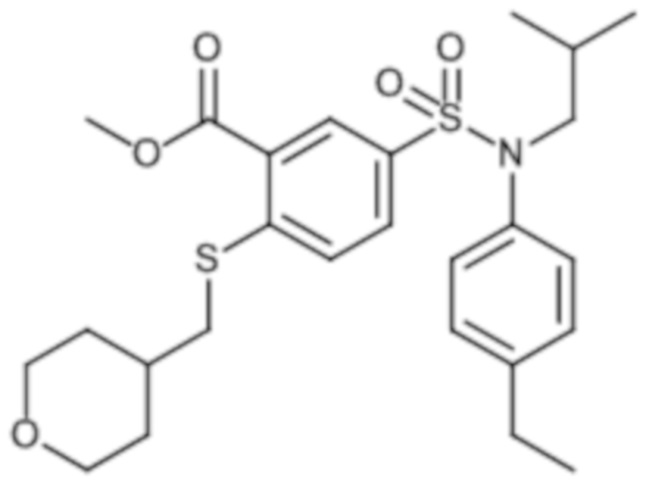
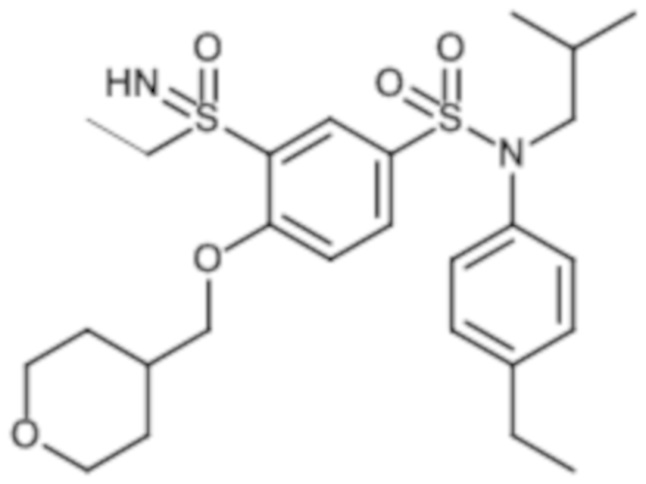
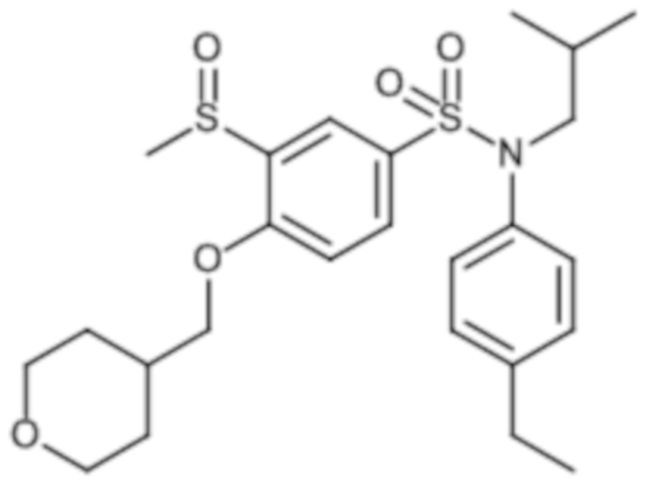
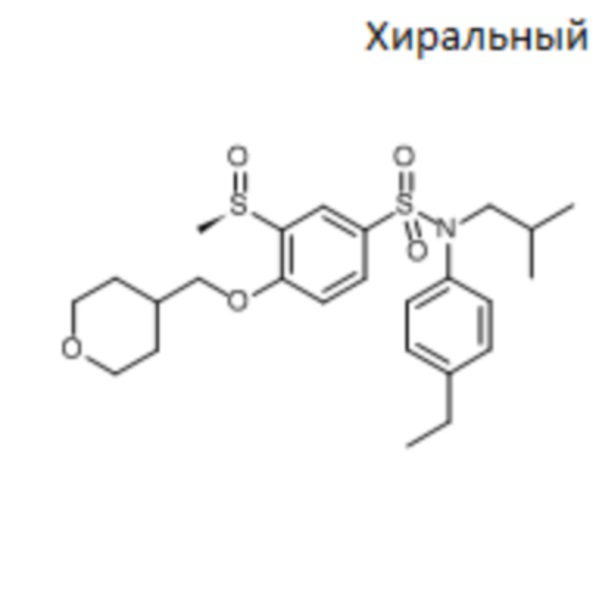
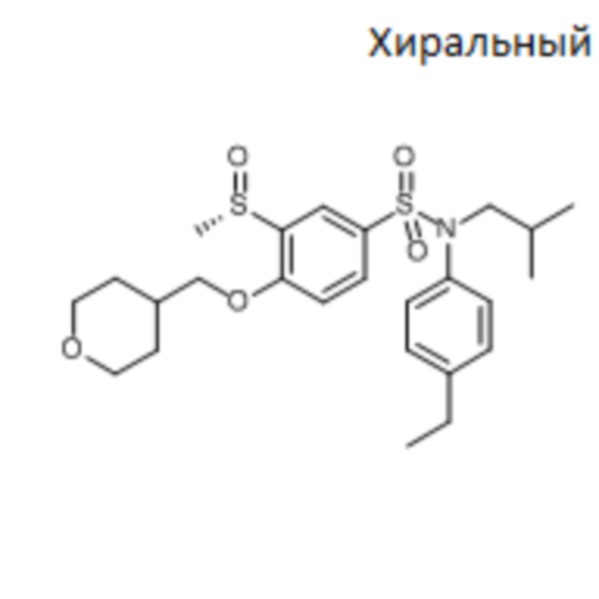
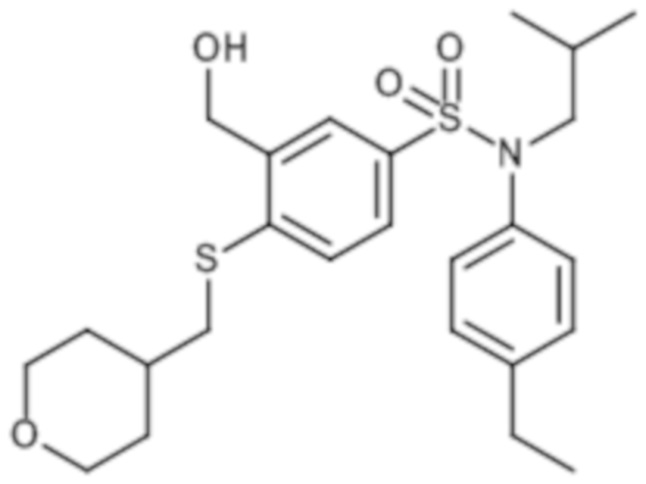
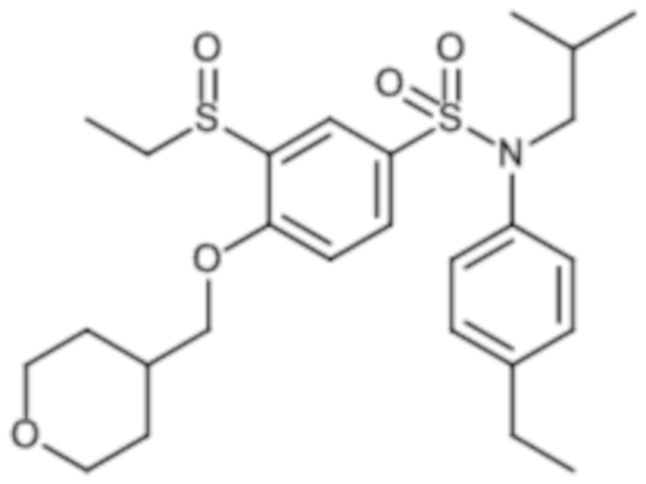
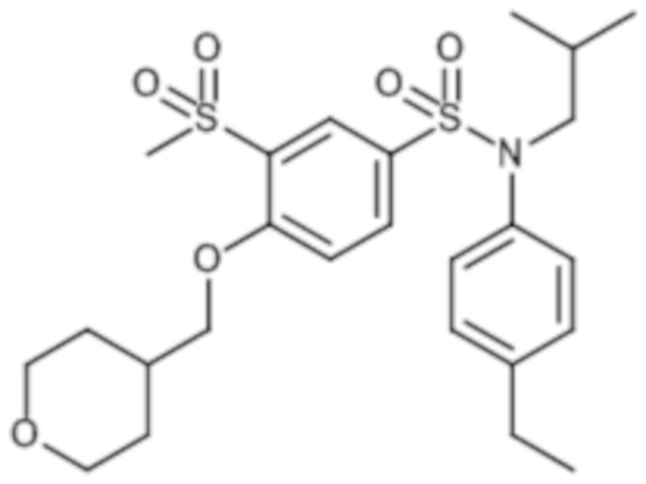
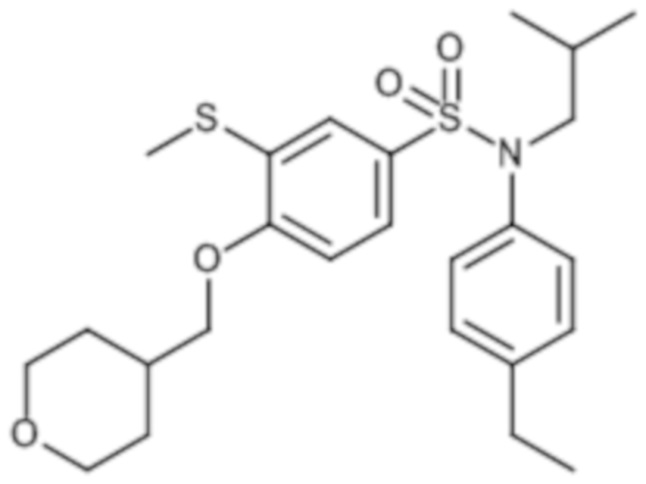
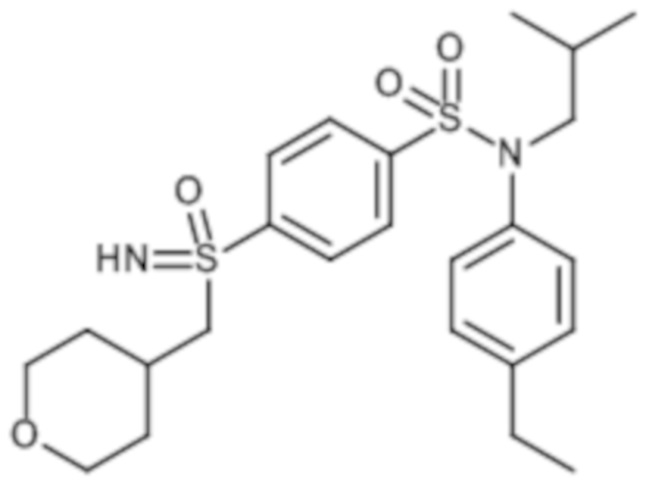
Таблица 2
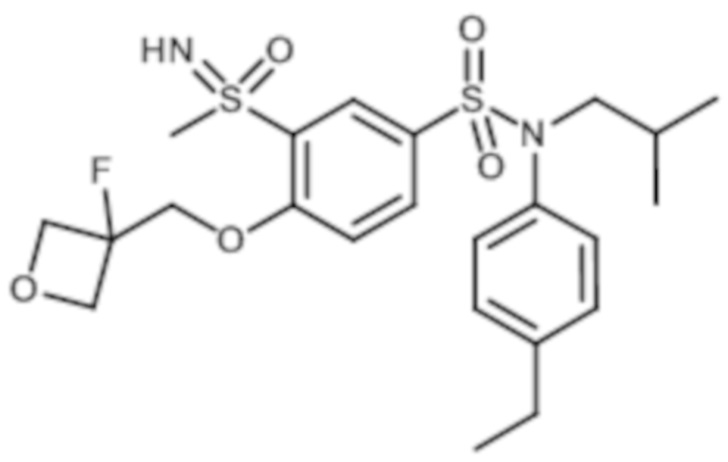
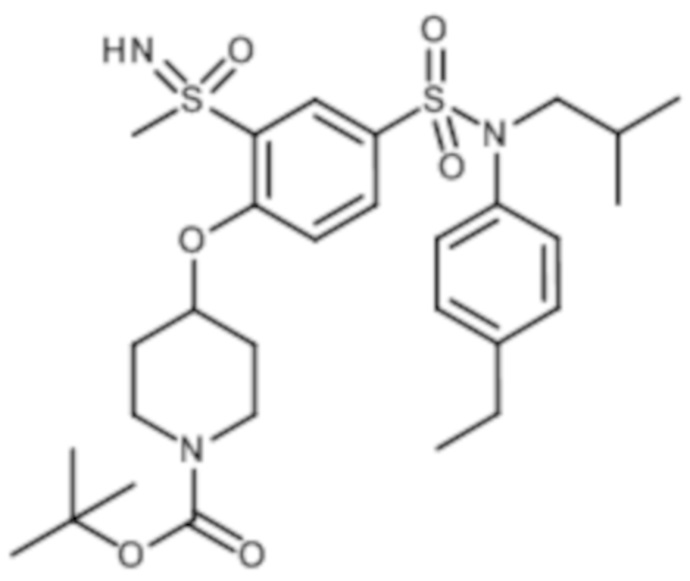
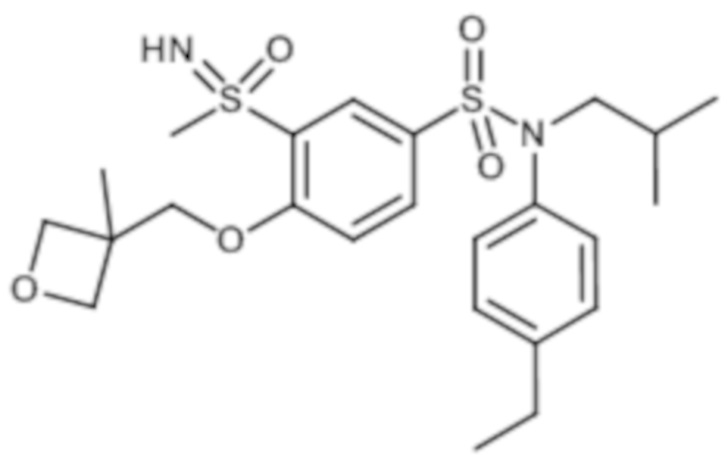
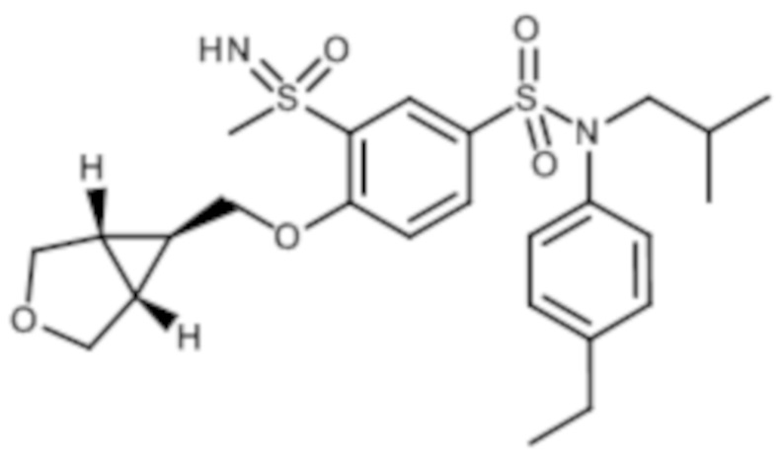
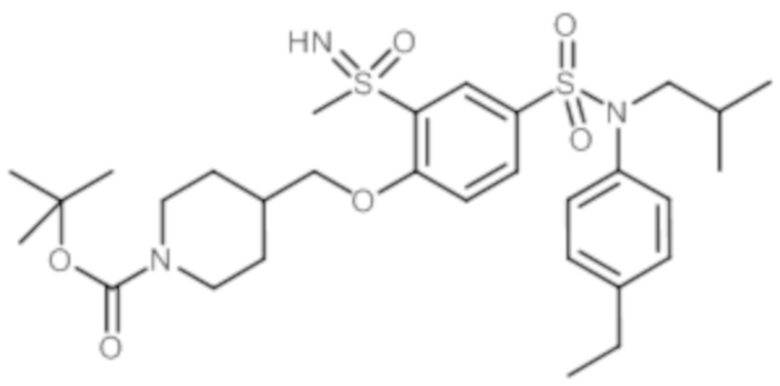
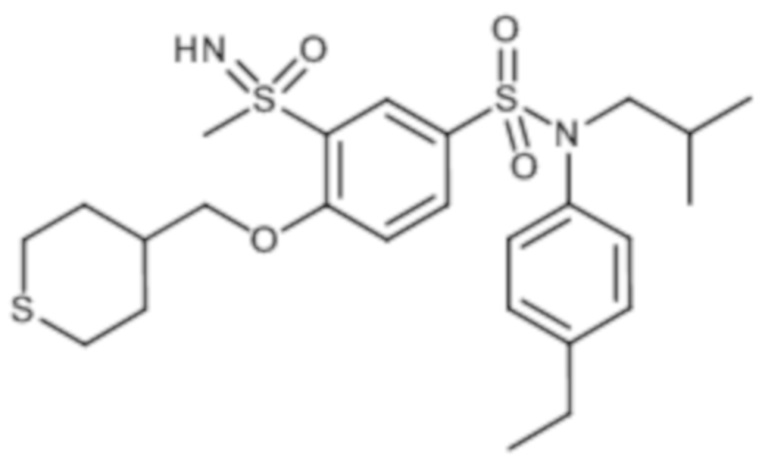
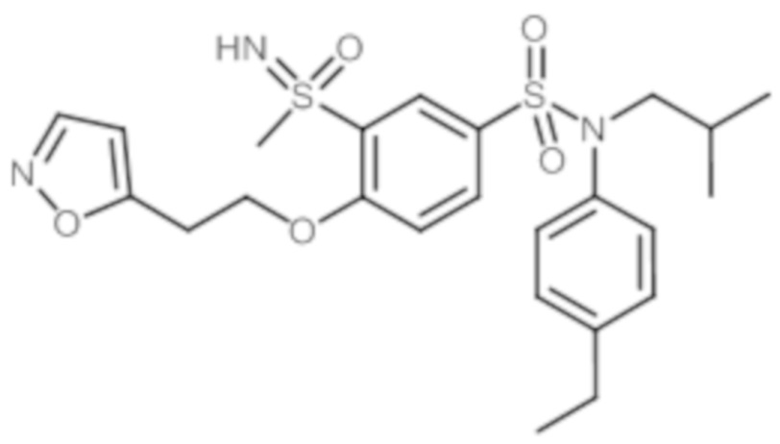
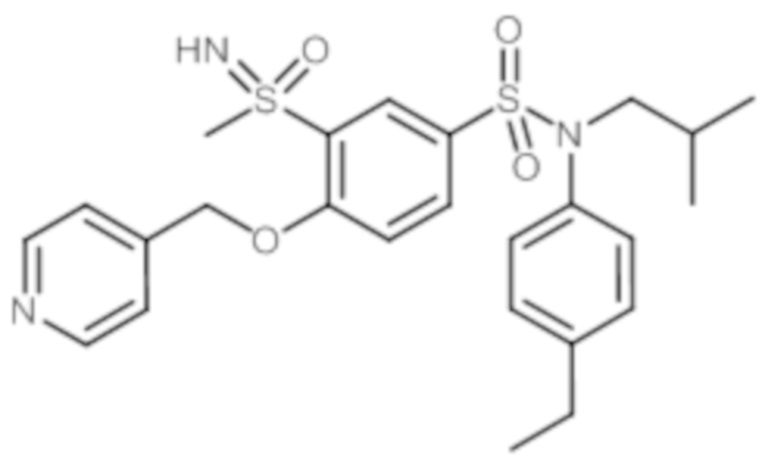
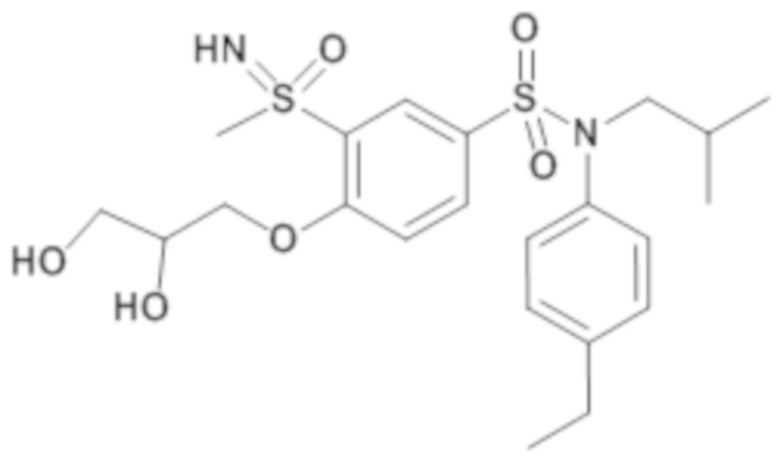
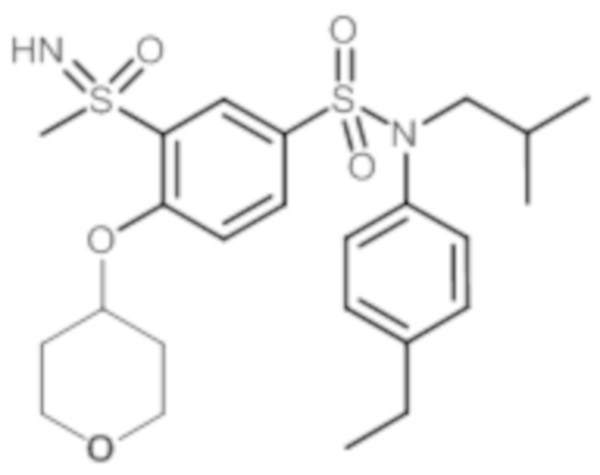
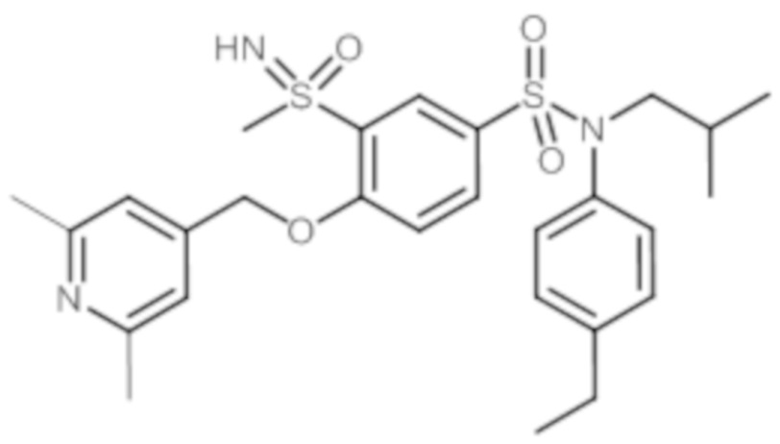
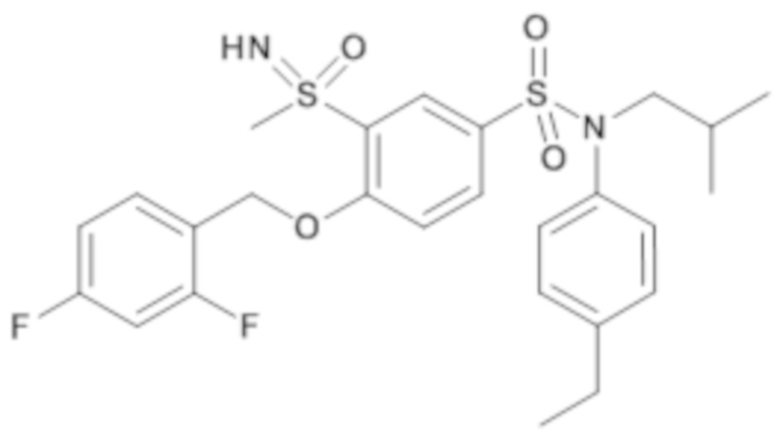
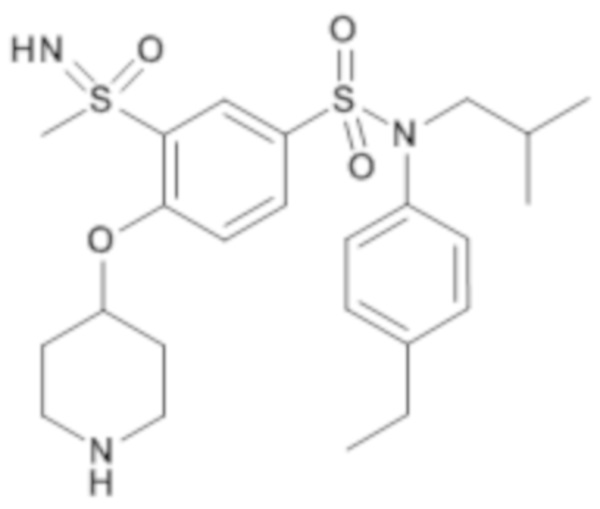
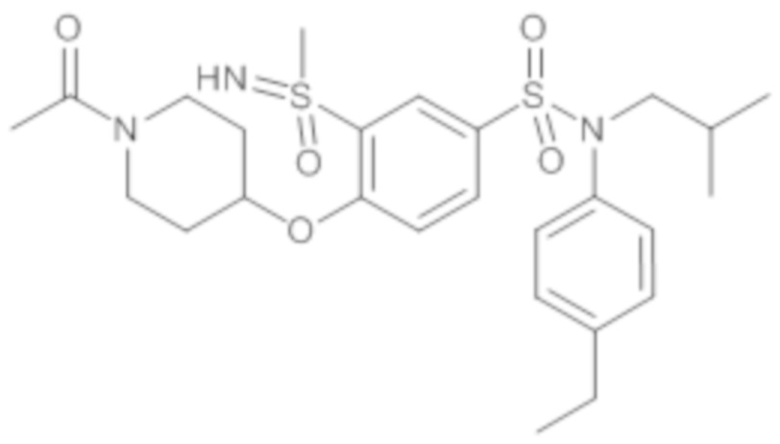
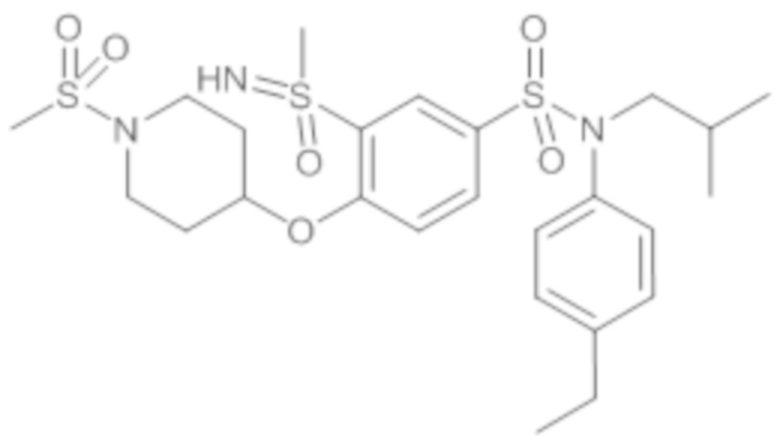
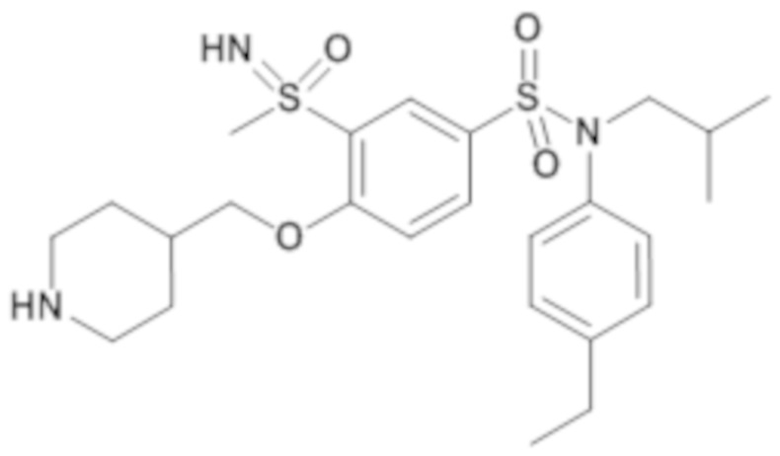
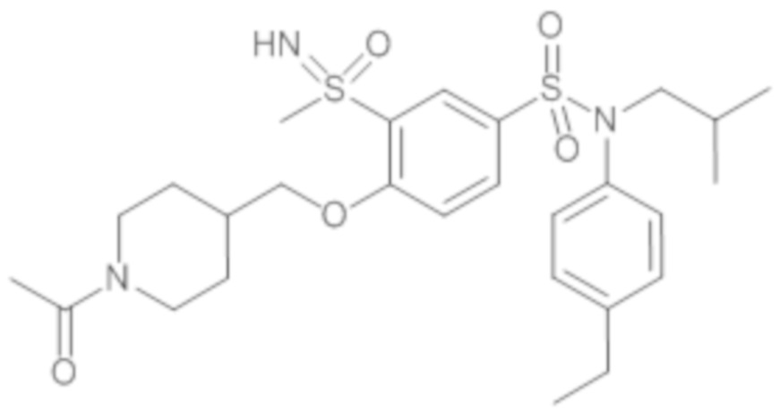
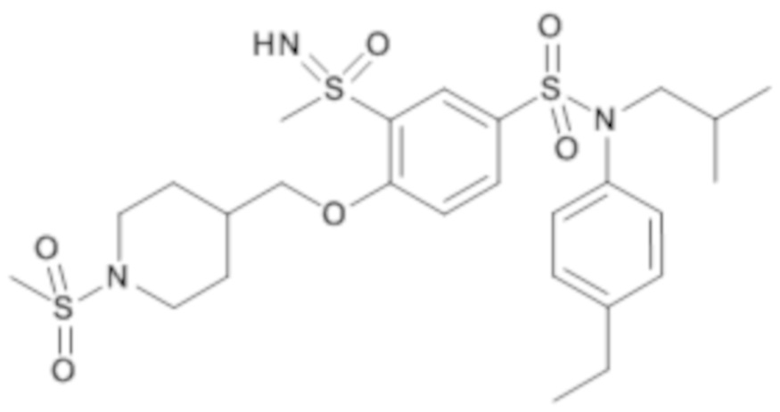
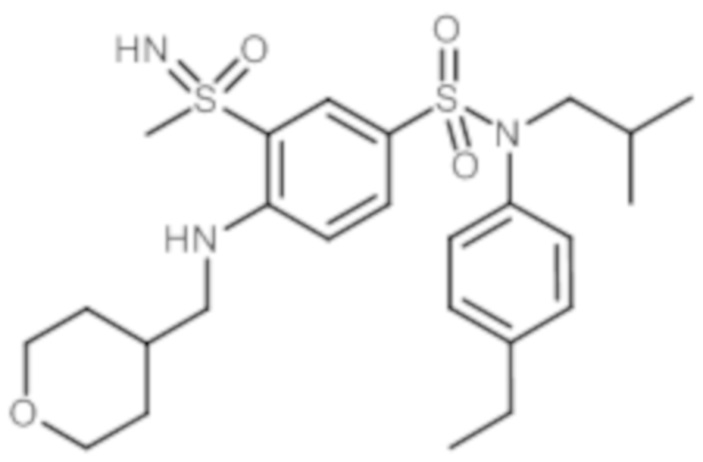
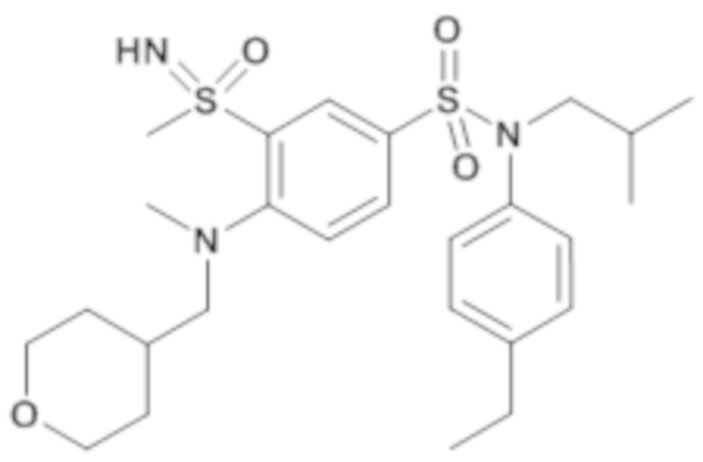
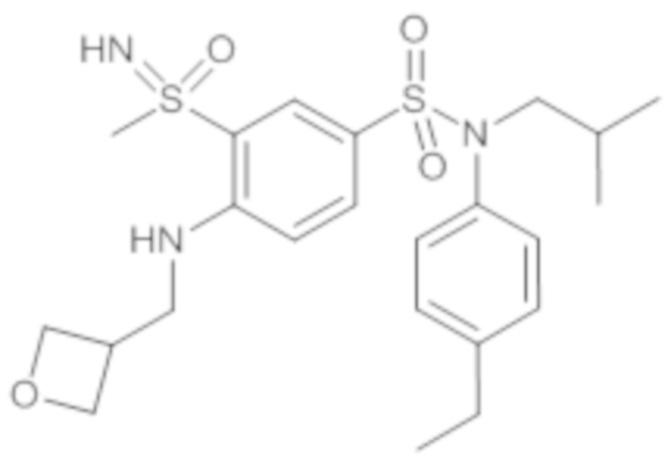
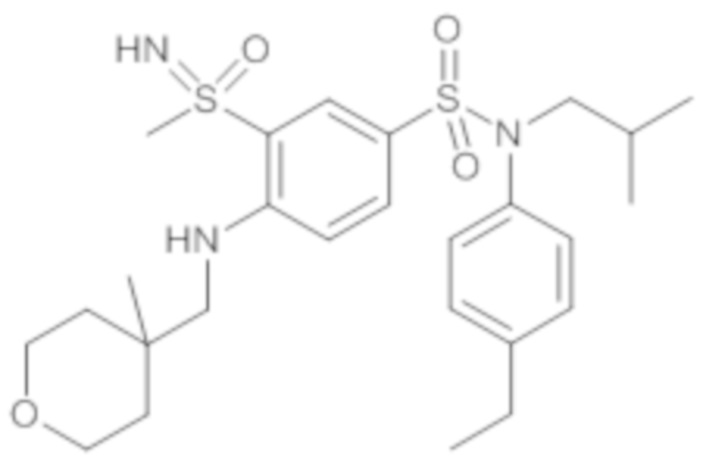
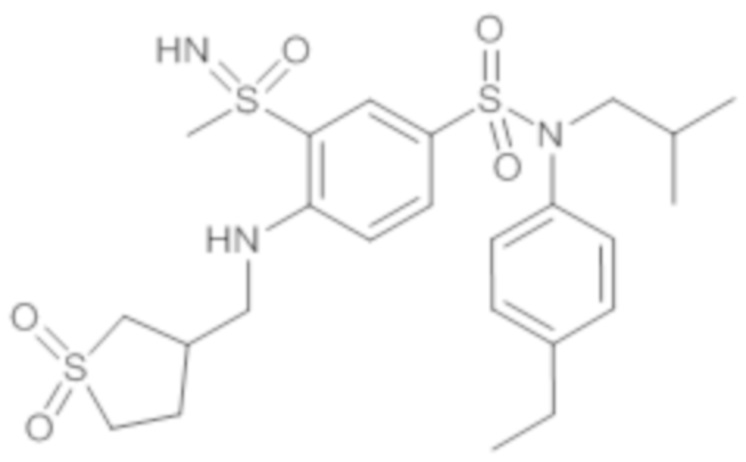
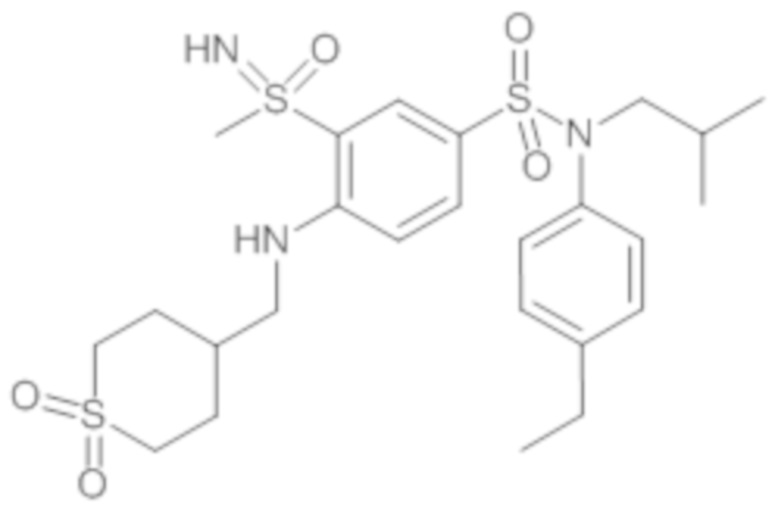
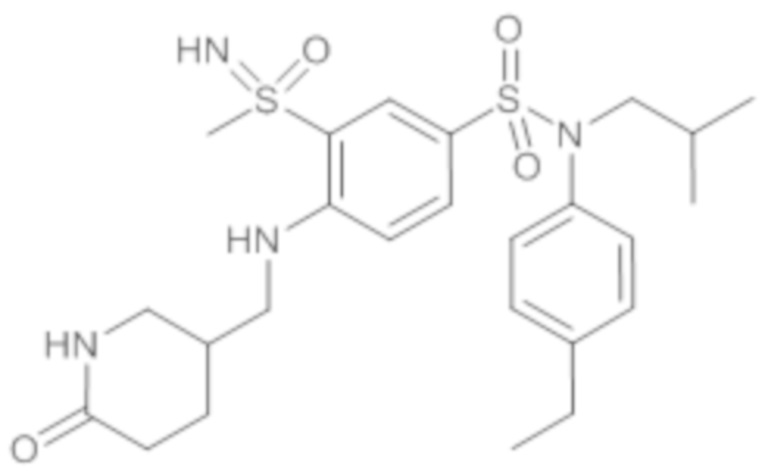
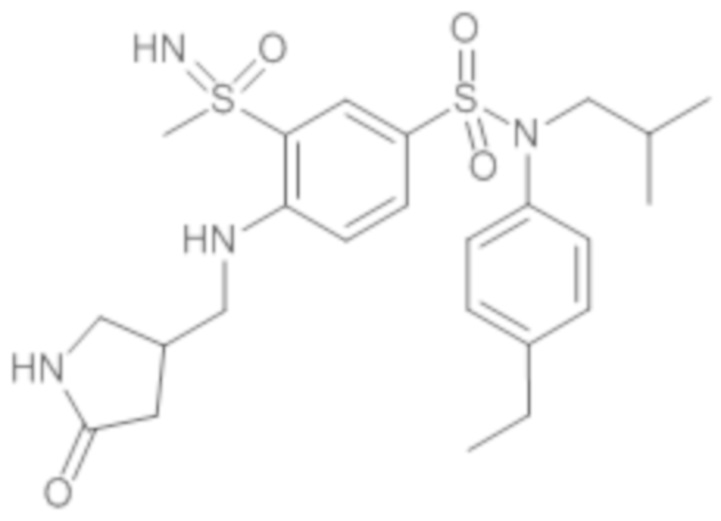
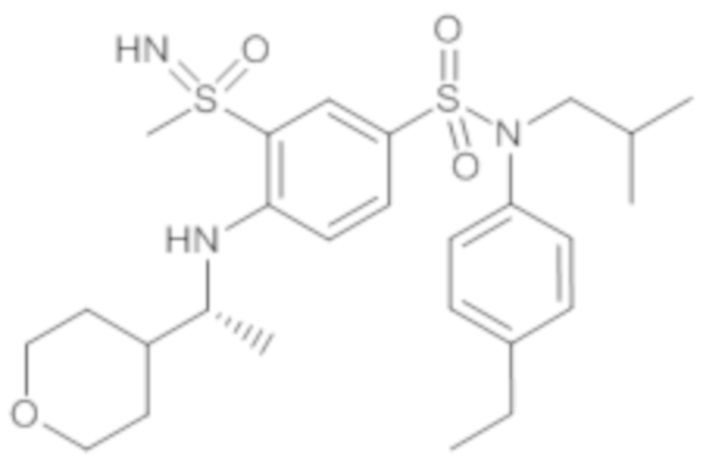
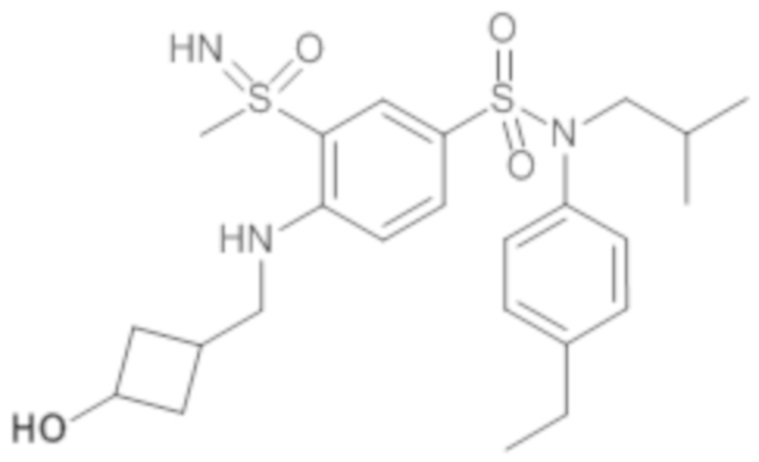
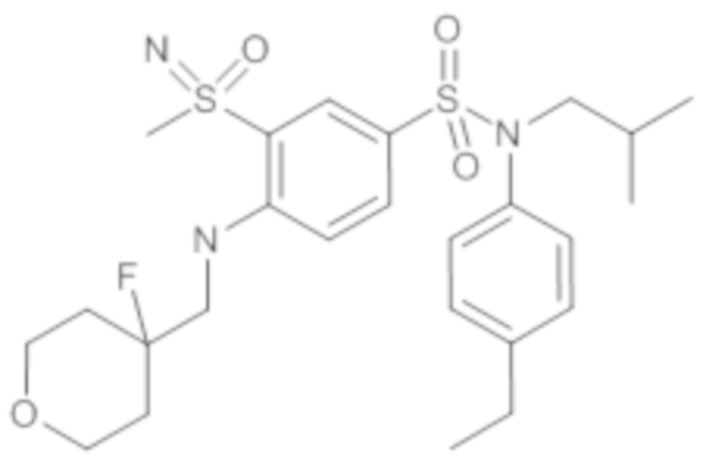
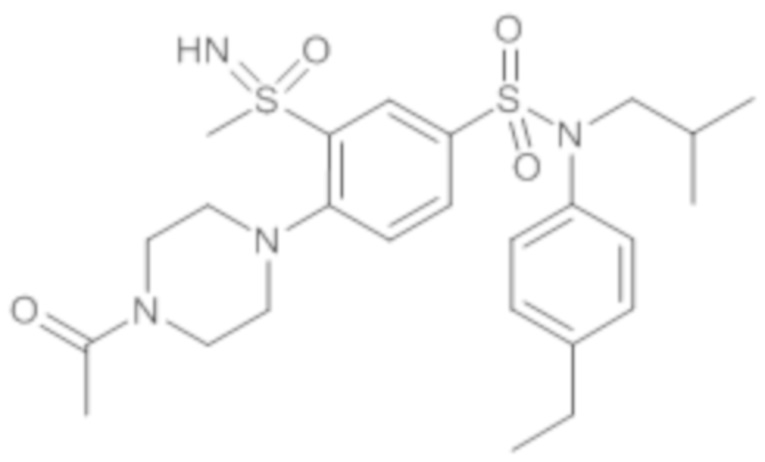
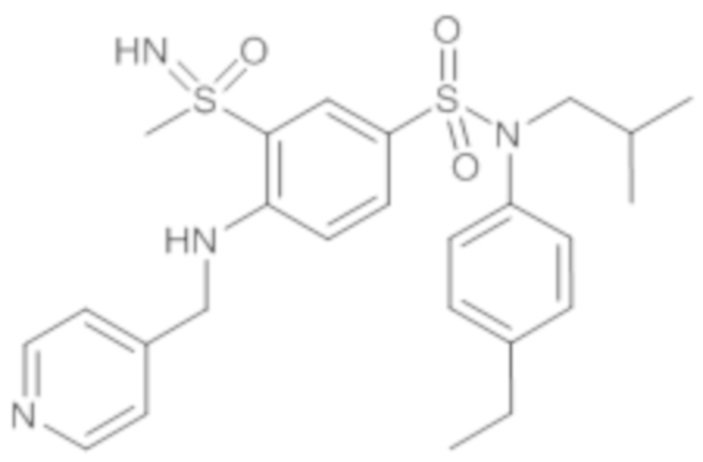
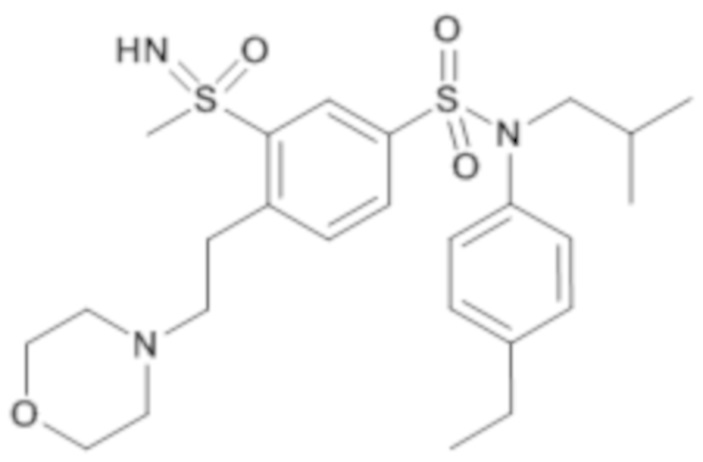
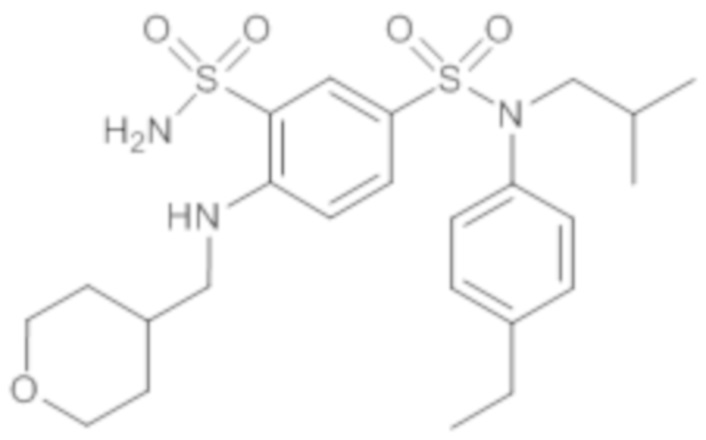
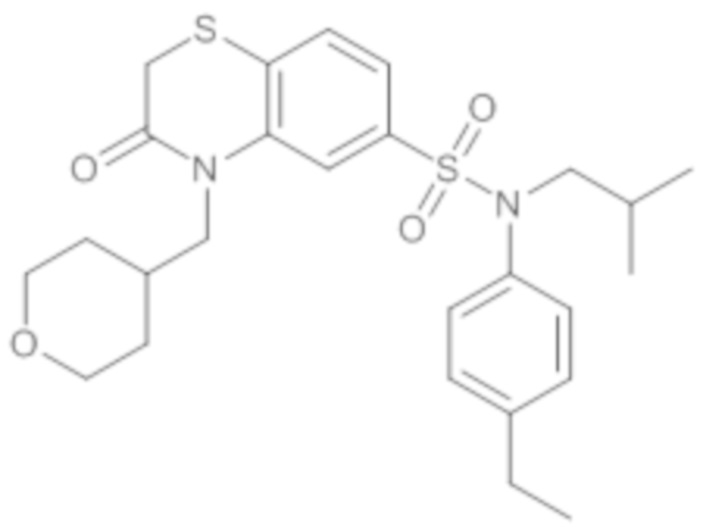

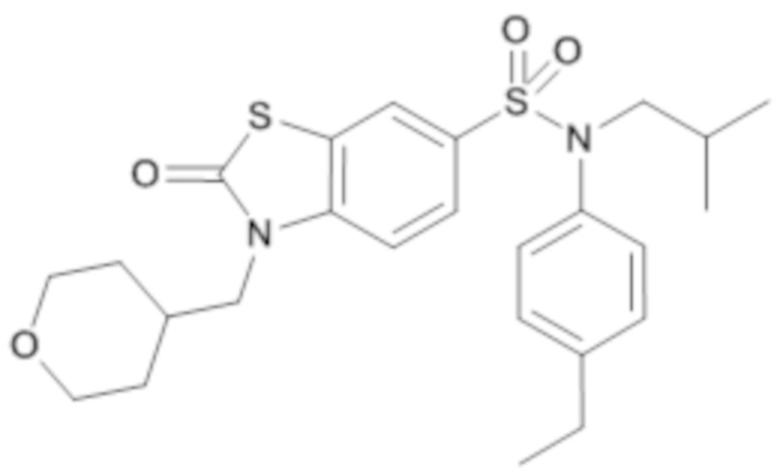
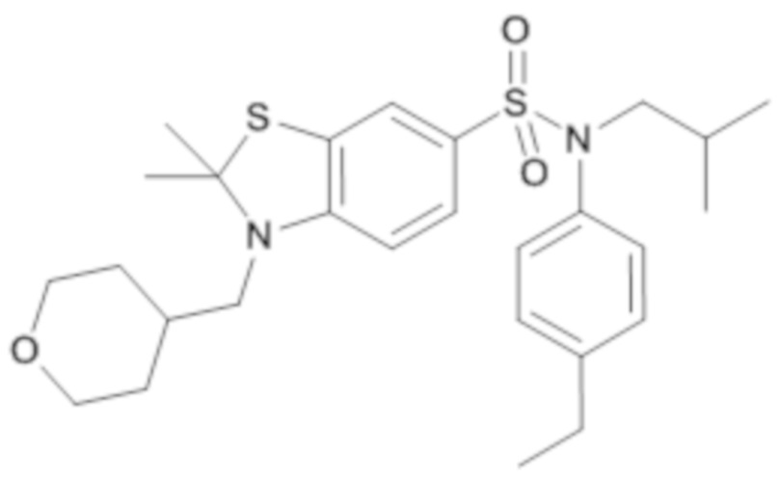
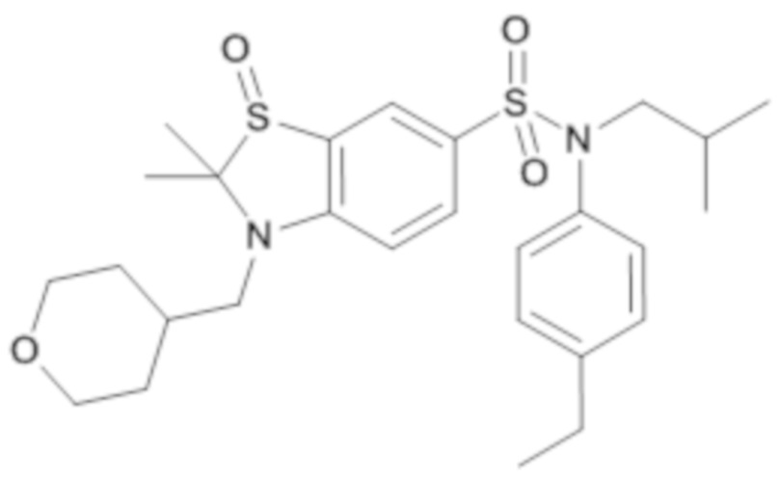
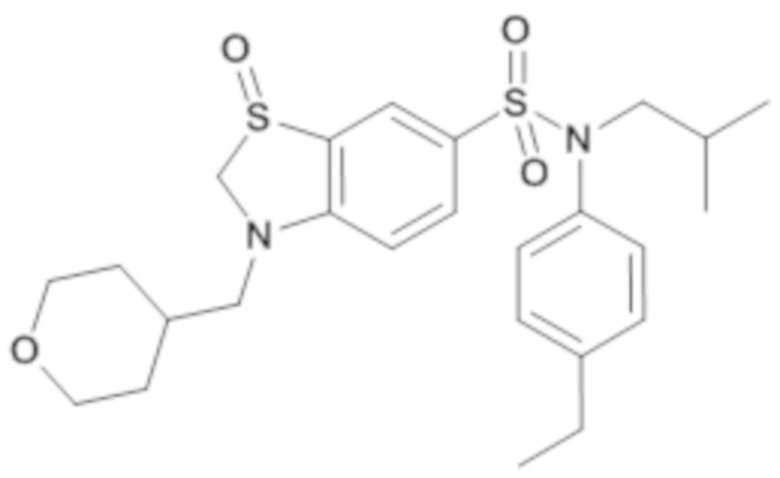
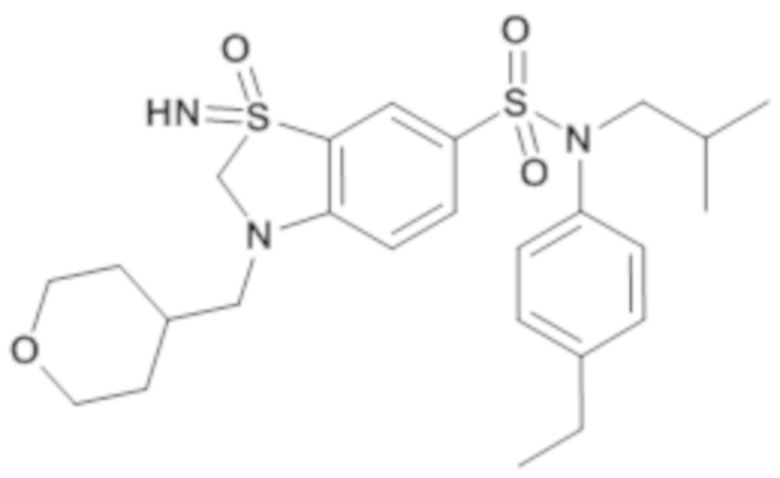
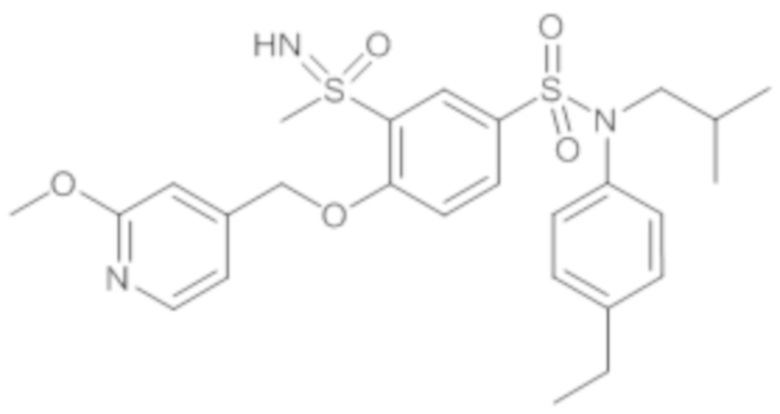
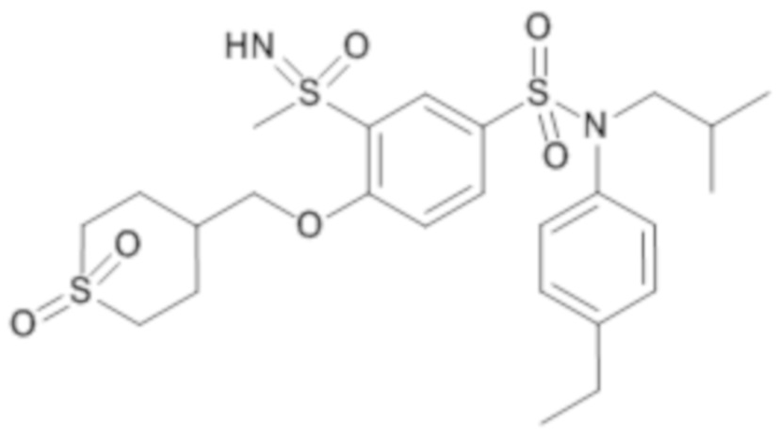
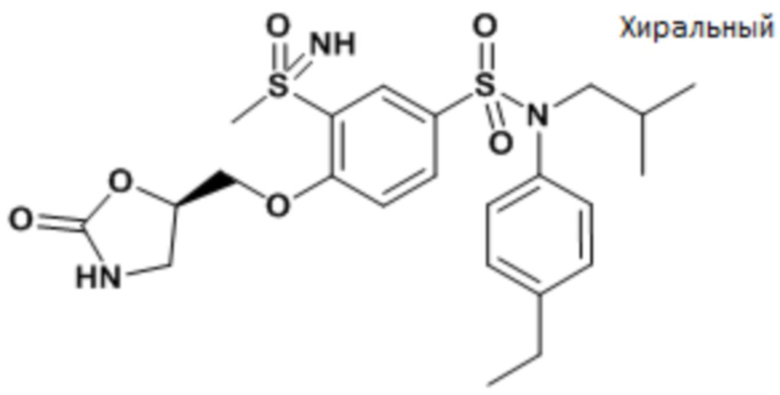
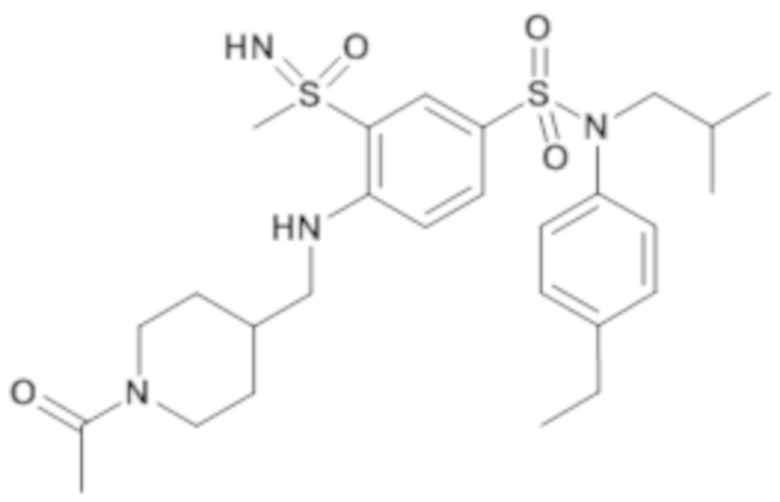
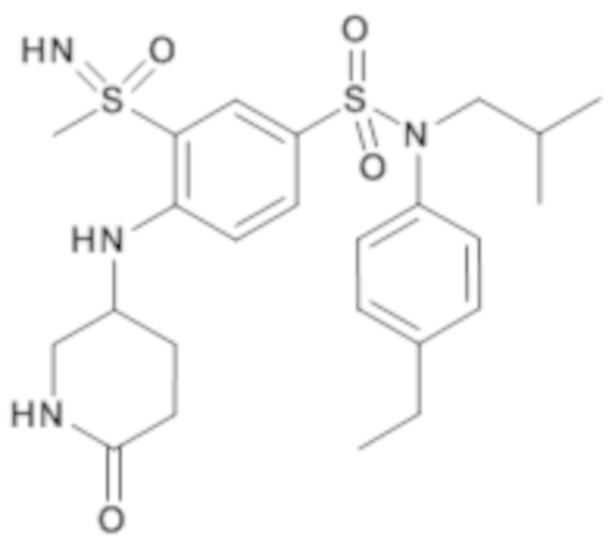
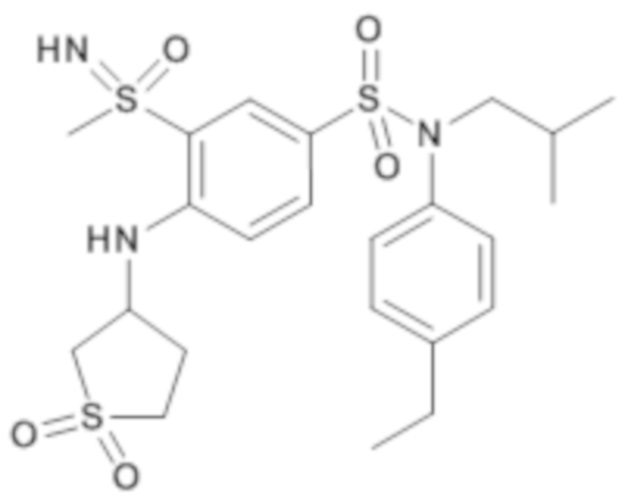
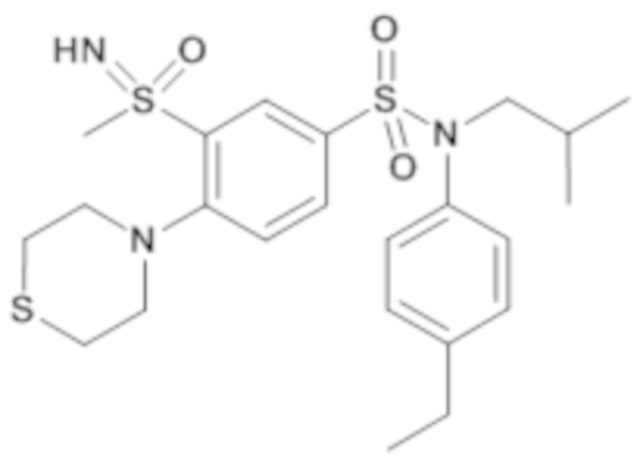
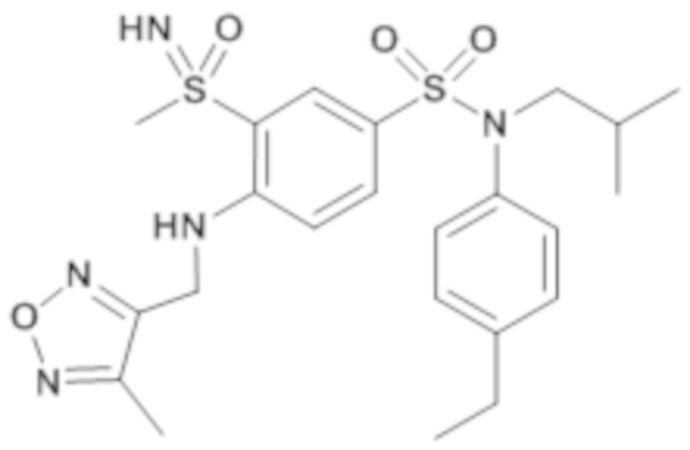
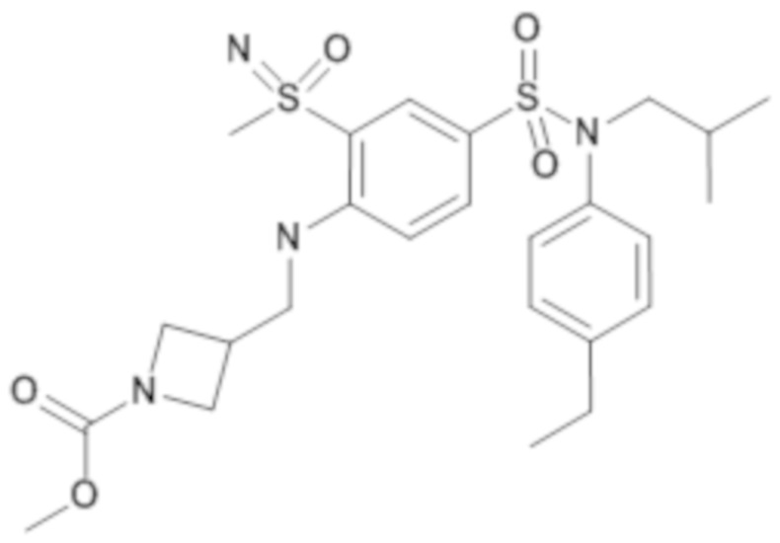
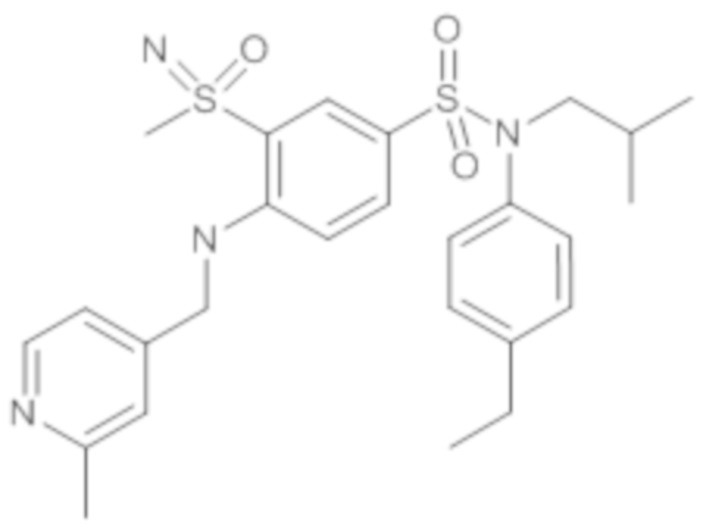
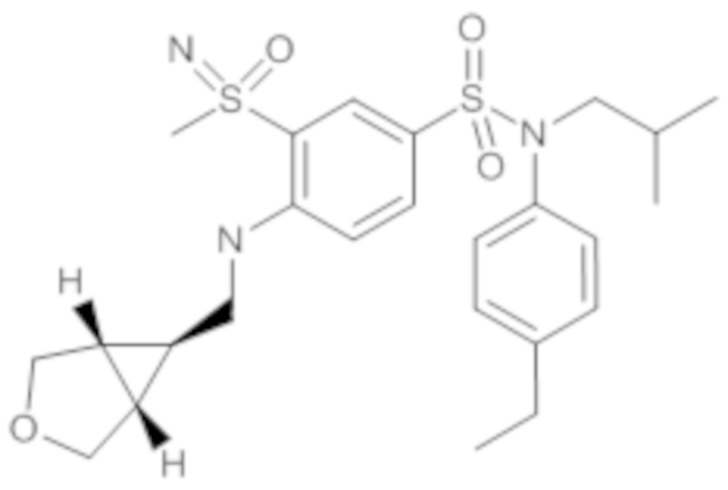
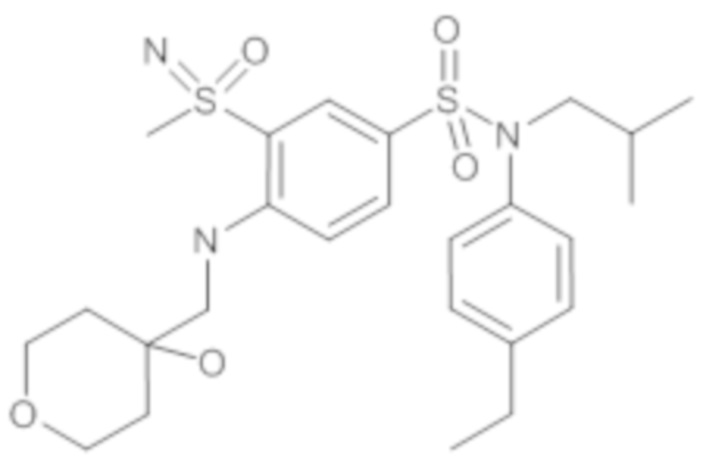
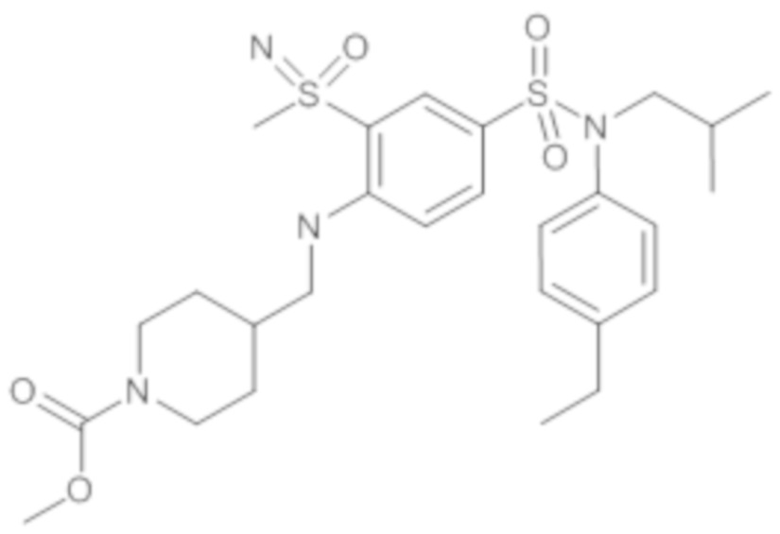
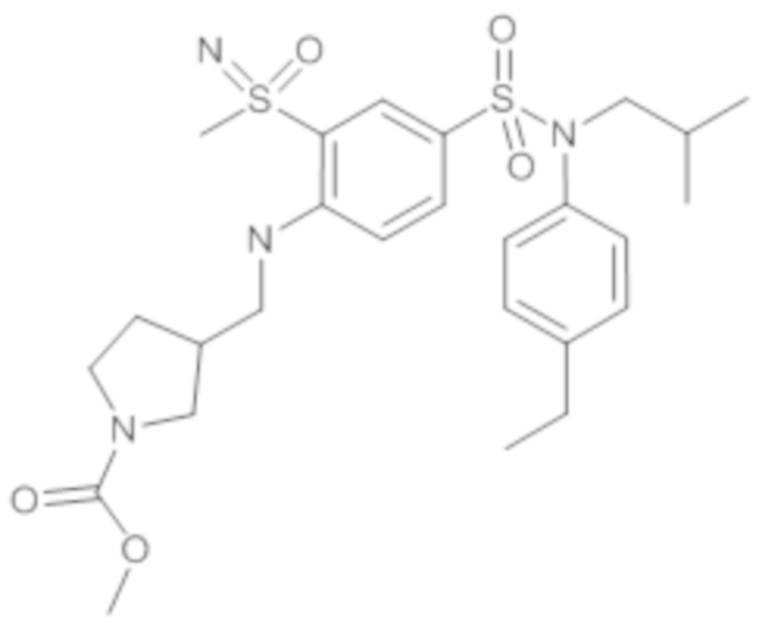
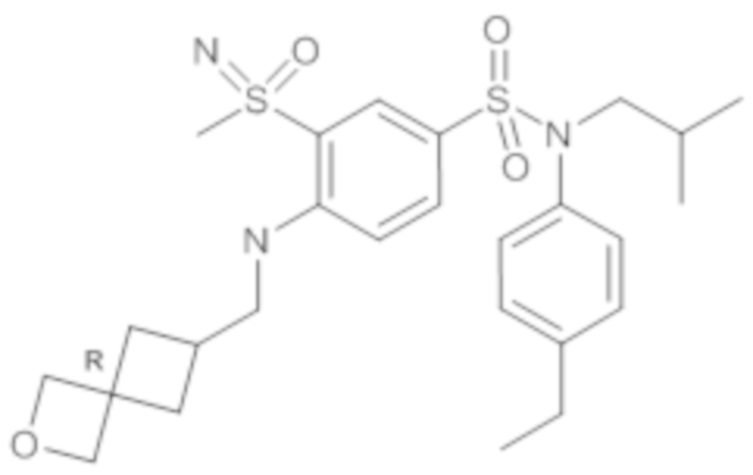
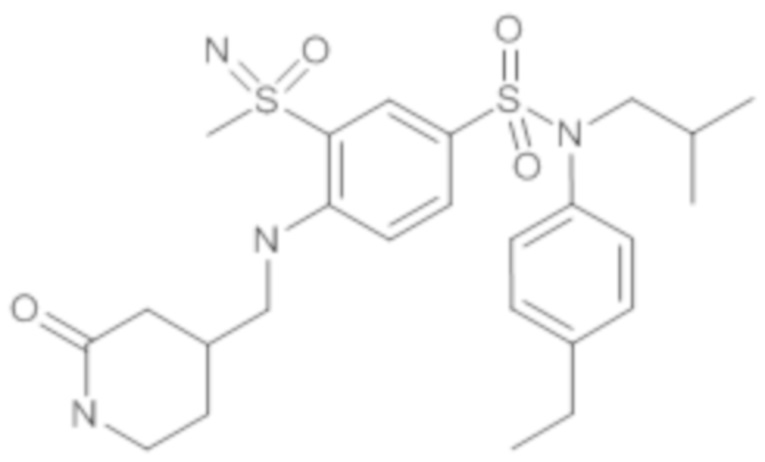
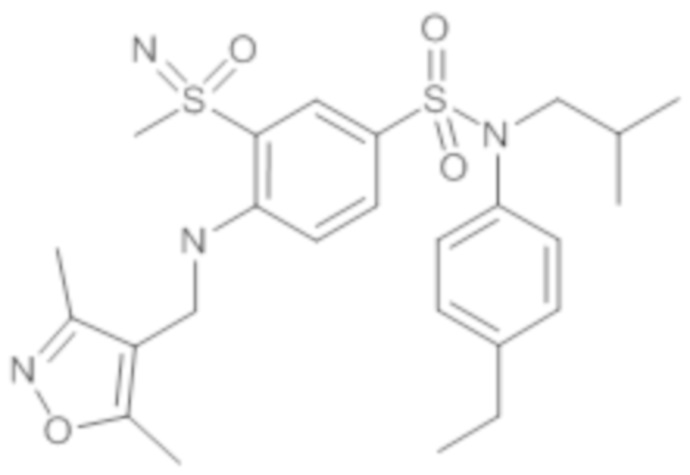
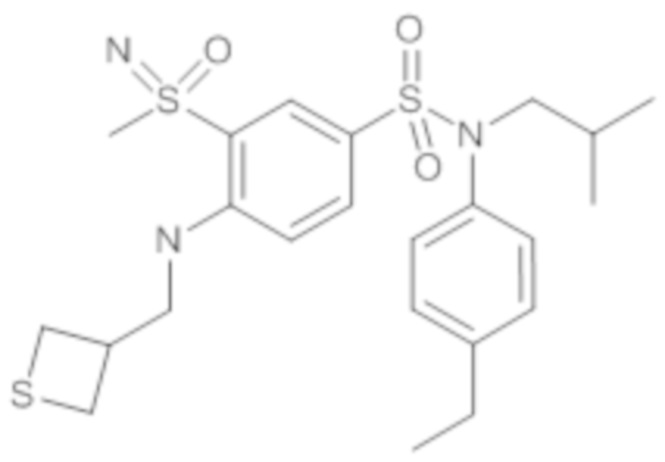
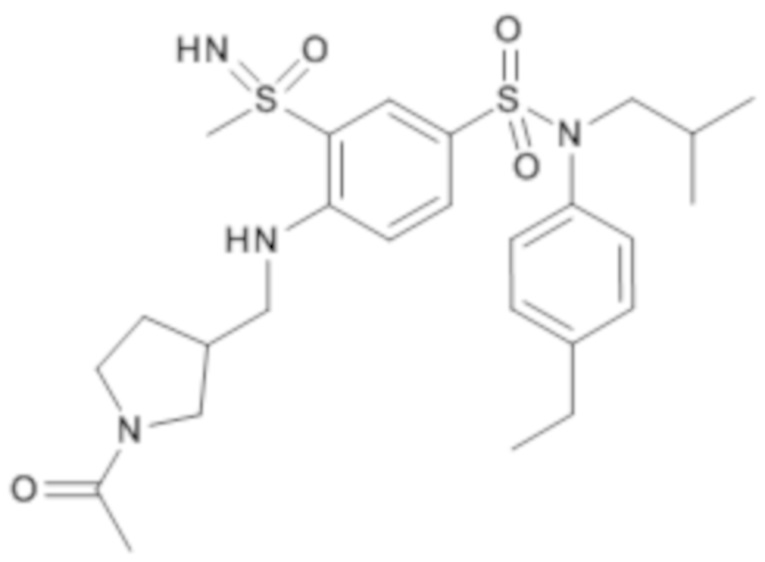
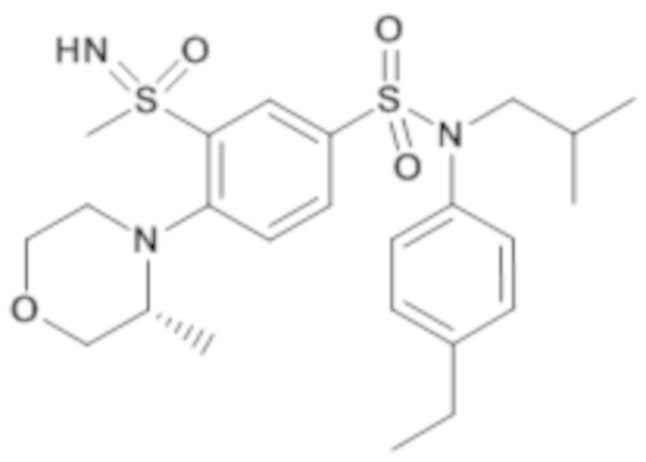
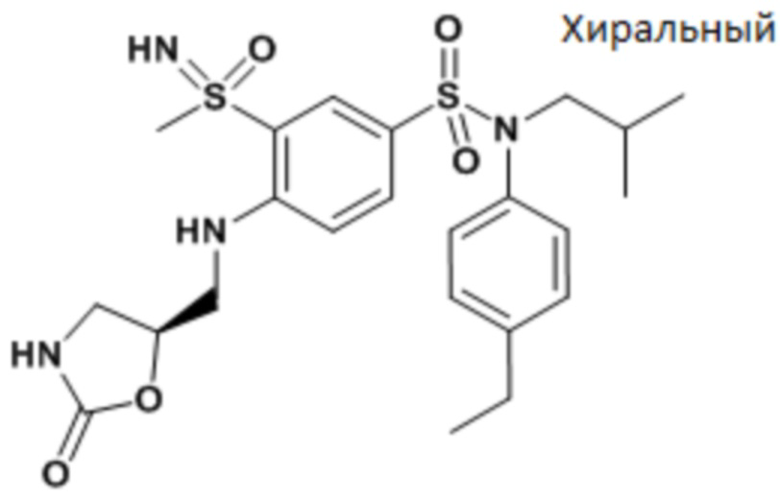
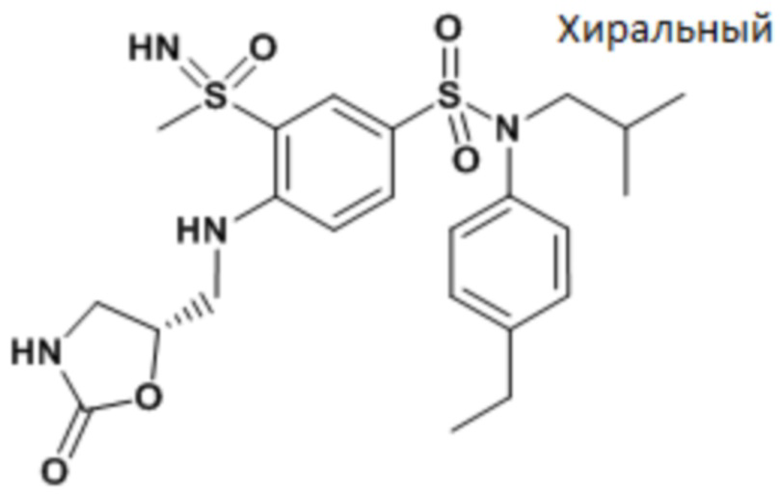
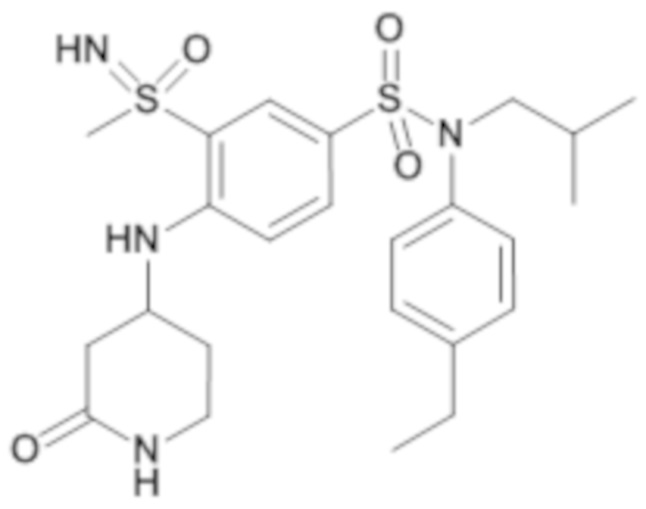
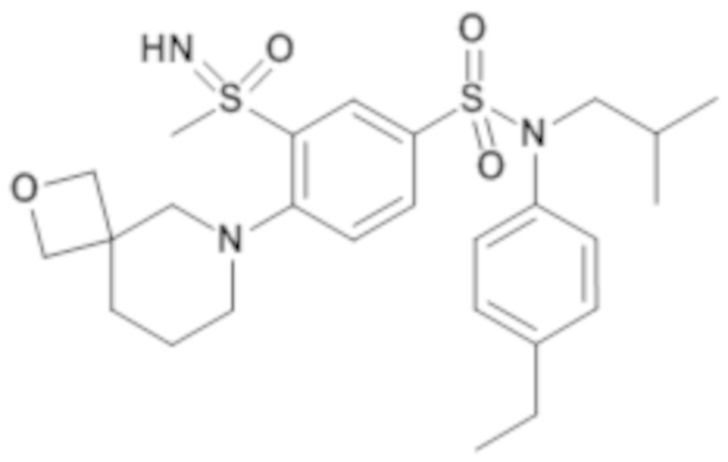
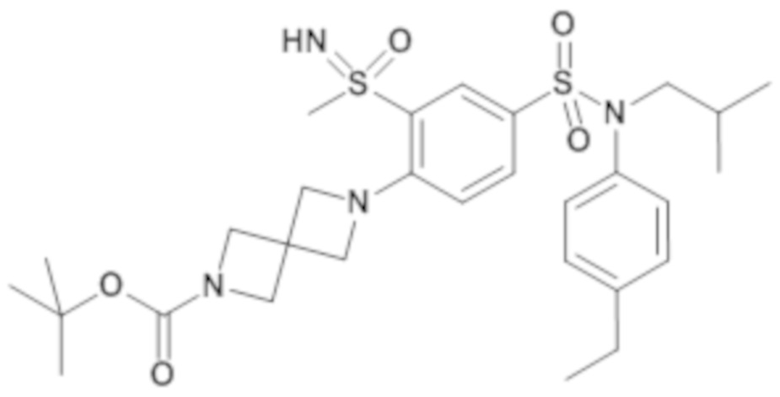

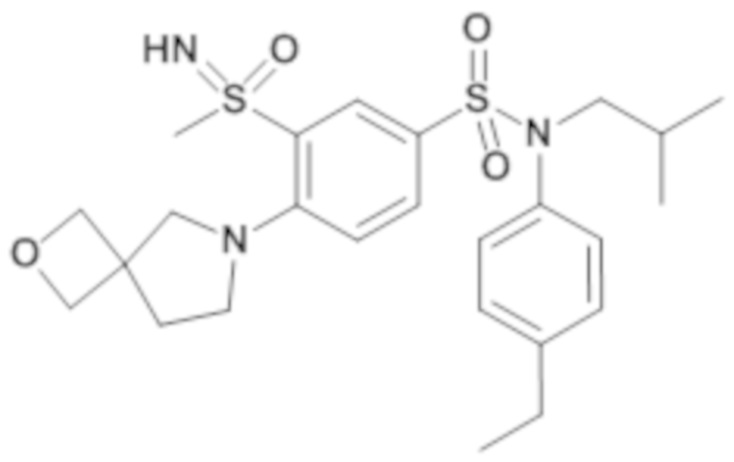
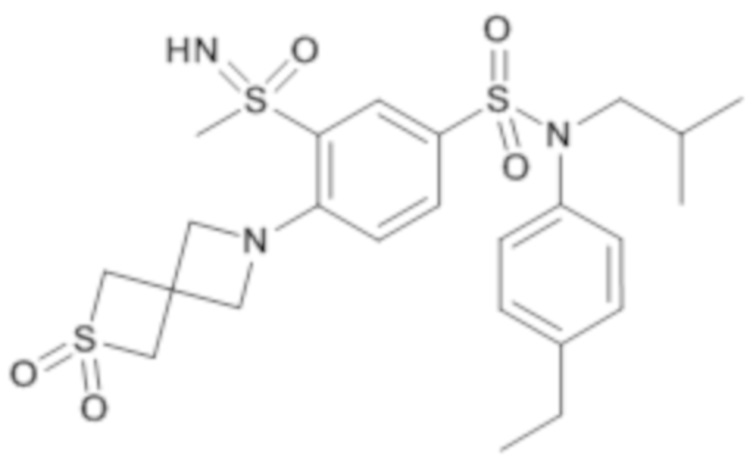
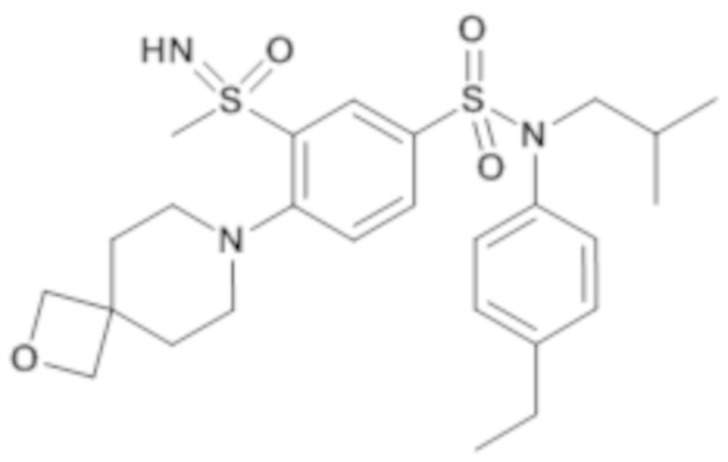
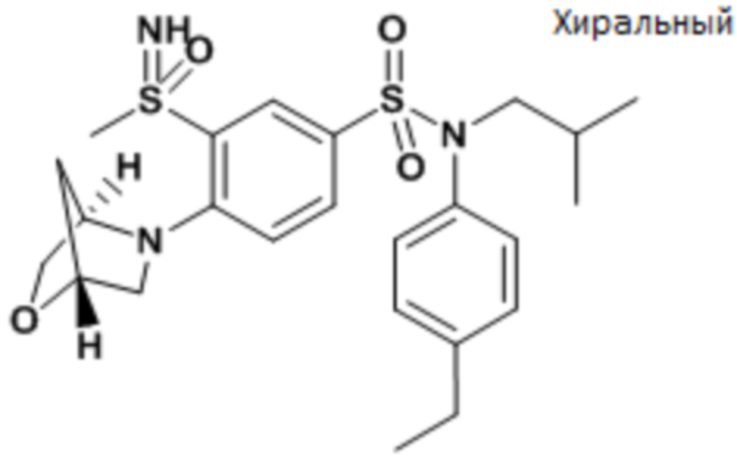
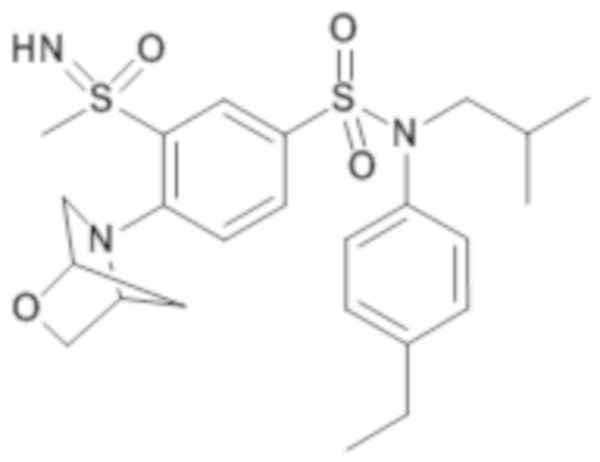
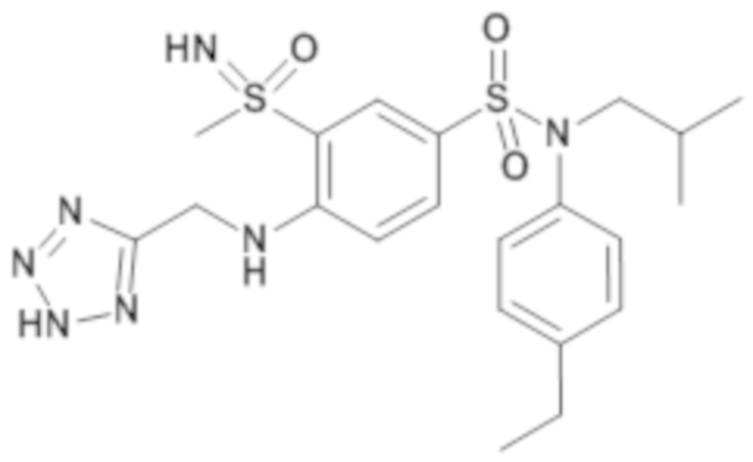
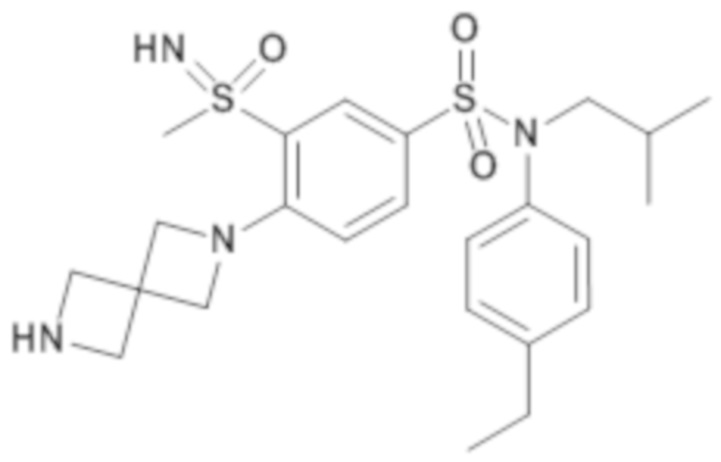
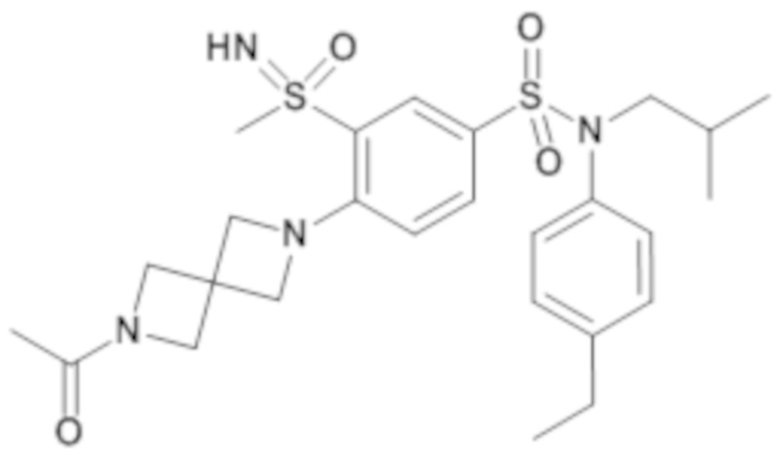
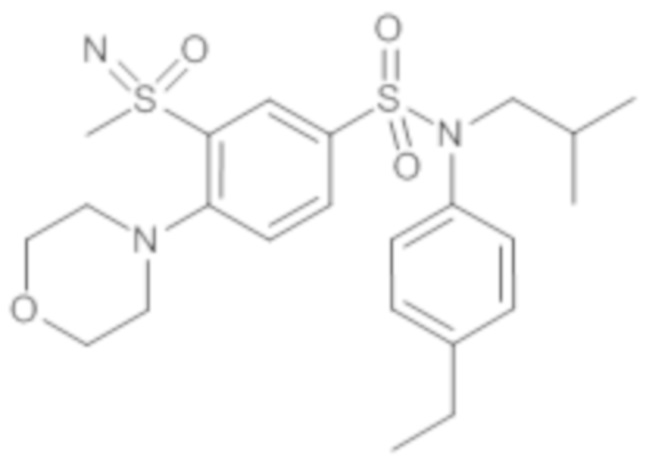
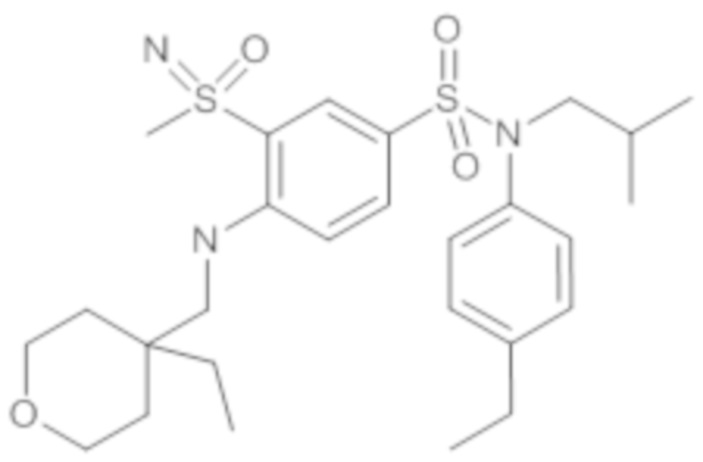
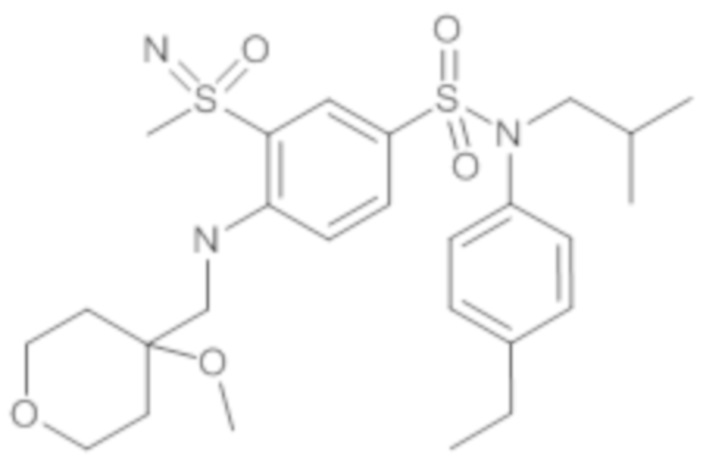
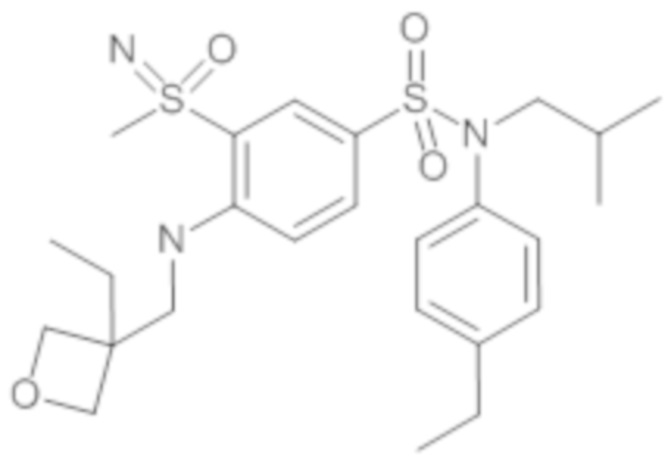
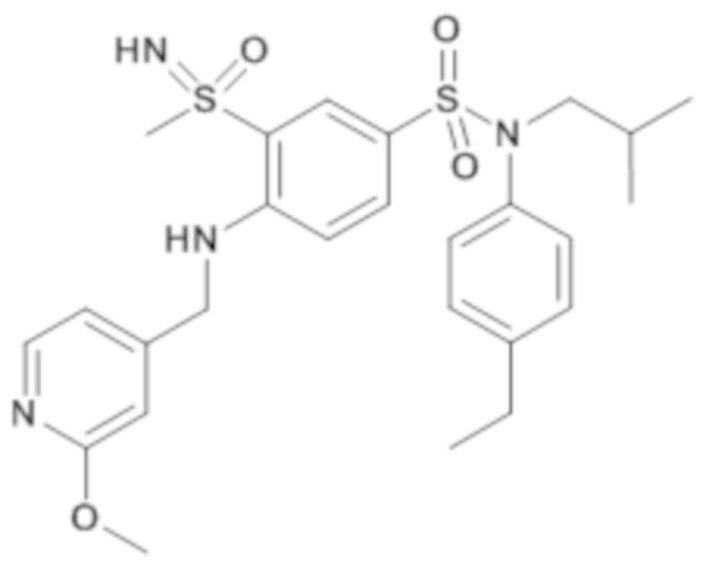
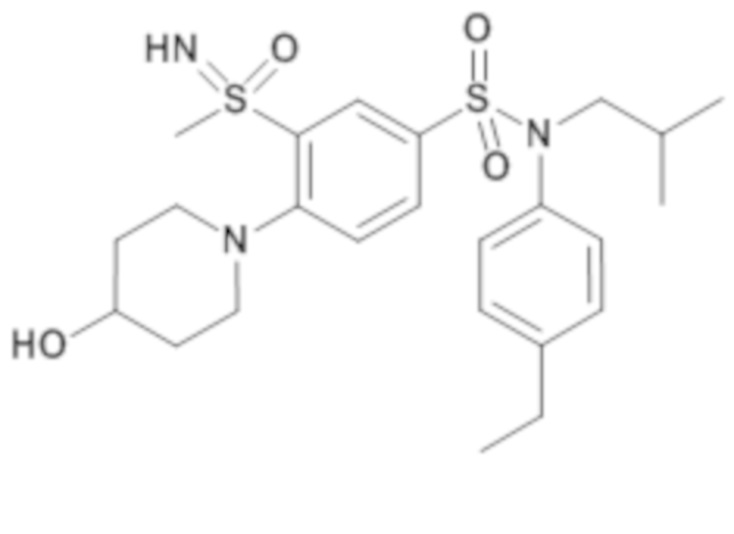
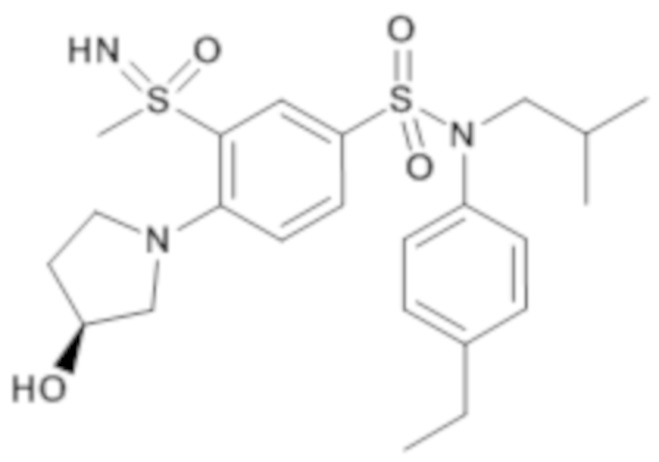
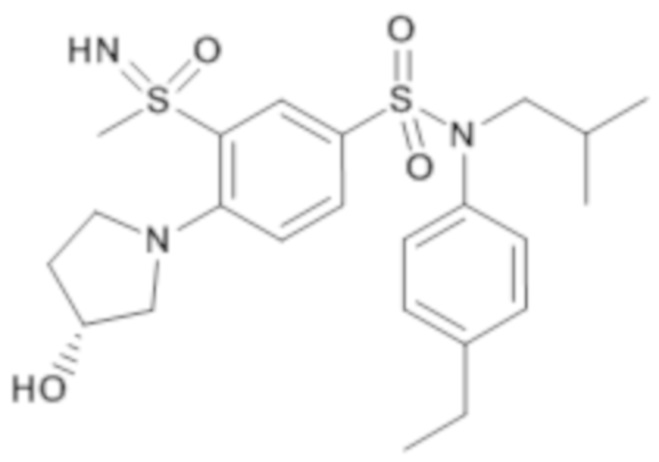
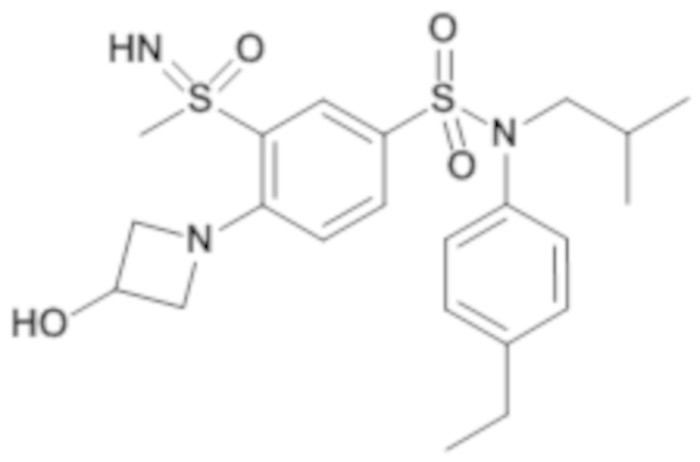
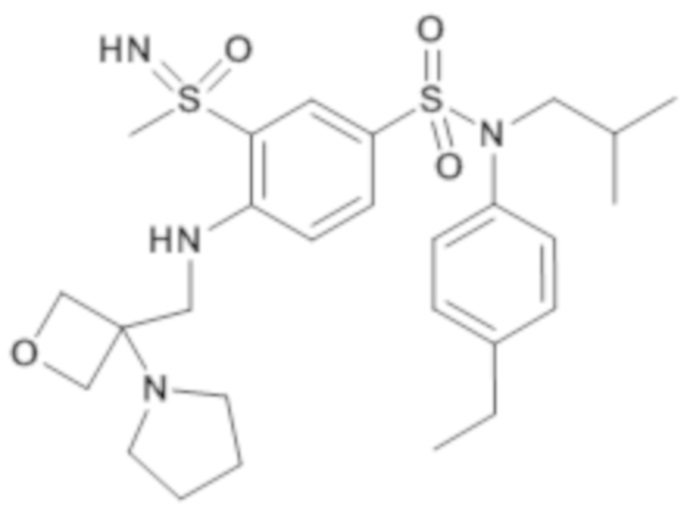
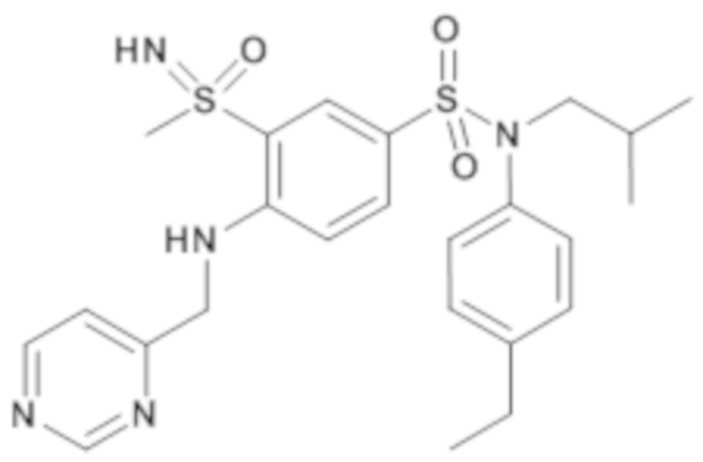
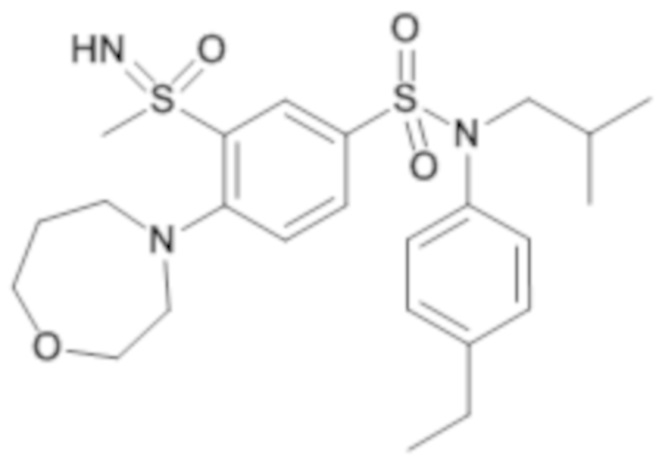
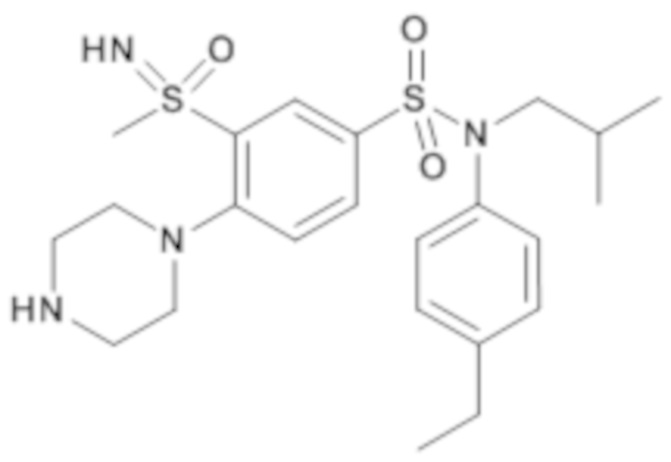
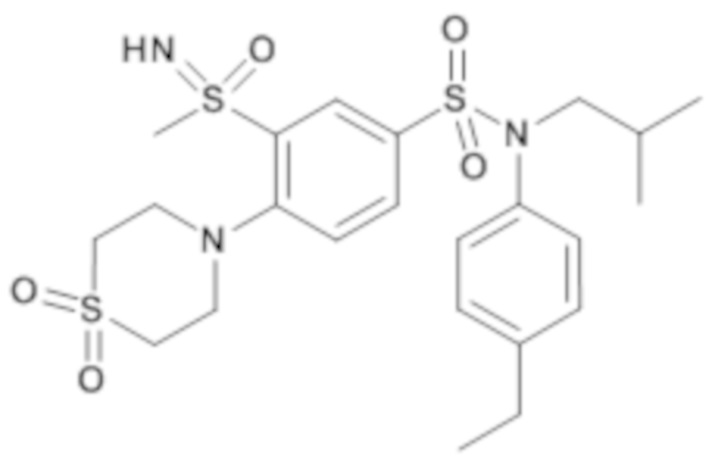
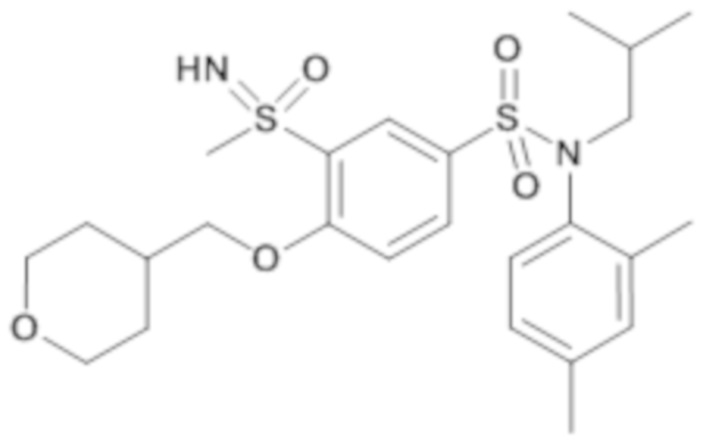
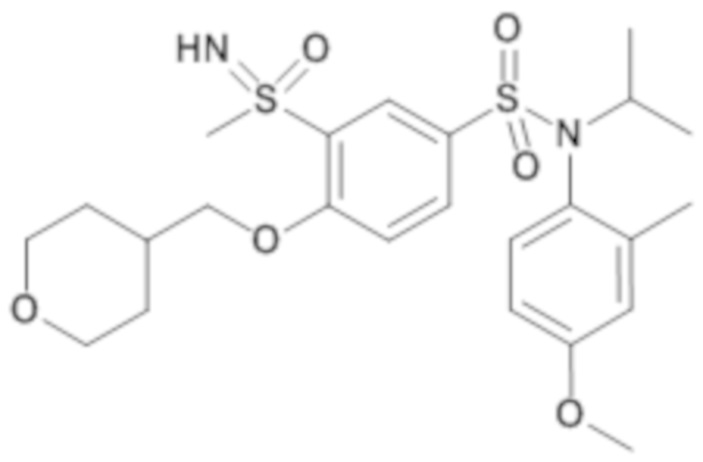
ND: не определено; A: IC50<100 нМ.; B: IC50=100нМ-1кмМ; C: IC50>1мкМ
В описанных выше таблицах средние ингибирующие концентрации IC50 для соединений, принадлежащих формуле (I) по изобретению, приведены в соответствии со следующими ниже моделями.
Трансактивация GAL4-RORγ
Модель трансактивации RORγ была разработана на основании линии клеток HG5LN, которая является стабильной линией клеток HeLa, стабильно экспрессирующей репортерный ген люциферазу под контролем пентамера области распознавания GAL4 дрожжей и промотора β-глобина. Линию клеток HG5LN стабильно трансфицировали DNA-binding domain (DBD) (или ДНК-связывающим доменом) GAL4, слитым с лиганд-связывающим доменом (LBD) ROR гамма. Молекулы, ингибирующие конститутивную активность ROR гамма, снижают экспрессию люциферазы, обуславливая, таким образом, снижение испускаемой люминесценции.
Клетки засевают в 384-луночные планшеты (5000 клеток в 45 мкл/лунку среды для культивирования, содержащей 10% эмбриональной телячьей сыворотки) и инкубируют в течение 4 часов при 37°C, 5% CO2. Затем в каждую лунку добавляют 5 мкл тестируемых молекул (соединения, описанные в таблицах, описанных выше) и инкубируют планшет в течение 18 часов при температуре 37°C в 5% CO2. В каждую лунку добавляют 20 мкл субстрата люциферазы (Promega) и регистрируют испускаемую люминесценцию микропланшетным спектрофотометром.
Единицы люминесценции ("RLU") нормализуют на положительный контроли ("POS", содержащие насыщенную концентрацию бензолсульфонамида, N-(2,2,2-трифторэтил)-N-[4-[2,2,2-трифтор-1-гидрокси-1-(трифторметил)этил]фенила]) и отрицательные контроли ("NEG", содержащие DMSO): % ингибирования=((RLU-NEG)*100)/(POS-NEG). IC50 рассчитывают на основании логистической модели с 4 параметрами с помощью программного обеспечения XLFit (IDBS).
Секреция IL-17A
Эта модель позволяет измерять действие ингибиторов на секрецию IL-17A CD4+ клетками. Клетки представляют собой замороженные (STEMCELL, № 70026), выделенные CD4+ клетки периферической крови человека и активированные антителами против CD3 и против CD28. Количество секретируемого IL-17A измеряют способом TR-FRET (набор HTRF® Human Interleukin 17A (Cisbio, №64H17PEC)).
Клетки быстро размораживают, ресуспендируют в среде для культивирования (RPMI, инактивированной 10% SVF), дополненной растворимыми антителами против CD28, и высевают (100000 клеток/лунка) в 96-луночные планшеты, предварительно покрытые антителами против CD3. Затем клетки обрабатывали рядом тестируемых ингибиторов (от 1000 нМ до 0,05 нМ, 0,1% DMSO). После 4 суток инкубации измеряют сигнал HTRF посредством микропланшетного спектрофотометра (λ возбуждения=337 нМ, λ испускания=620/665 нМ). Получаемые отношения (665/620) нормализуют на положительный контроль (клетки, активированные антителами против CD3 и против CD28, 0,1% DMSO). IC50 рассчитывают на основании логистической модели с 4 параметрами с помощью программного обеспечения XLFit (IDBS).
В таблице ниже, средние ингибирующие концентрации IC50 для соединений, принадлежащих формуле (I) по изобретению, приведены в соответствии с тестом hERG.
Тест hERG позволяет исследовать ген, который кодирует белок, необходимый для функционирования калиевых каналов ткани сердца. Для прогнозирования блокады in vitro hERG (human Ether-a-go-go Related) используют способ пэтч-клемп на клетках CHO-K1 (клетках, трансфицированных геном hERG, и который обеспечивает активность ионов K+ на мембранах).
Сначала применяли внеклеточный раствор (контрольный). Клетки (клетки яичников китайского хомяка, экспрессирующие ген Ether-a-go-go Related Gene человека) стабилизируют внеклеточным раствором в течение 5 минут. Клетки инкубируют в течение 5 минут с молекулами от самой низкой до самой высокой концентрация в конечном 0,6% DMSO.
Способ расчета ингибирования для каждой концентрации: % ингибирования=100×(величина следового потока инкубируемой молекулы - величина следового потока контрольного носителя). Результат выражают в виде IC50 на мкМ.
Результаты приведены для следующих ниже соединений:
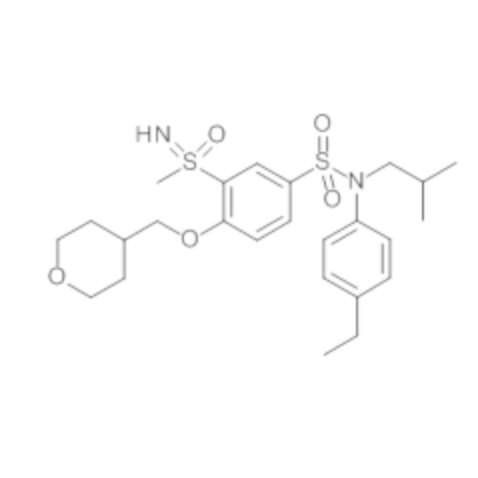

энантиомер A
энантиомер B
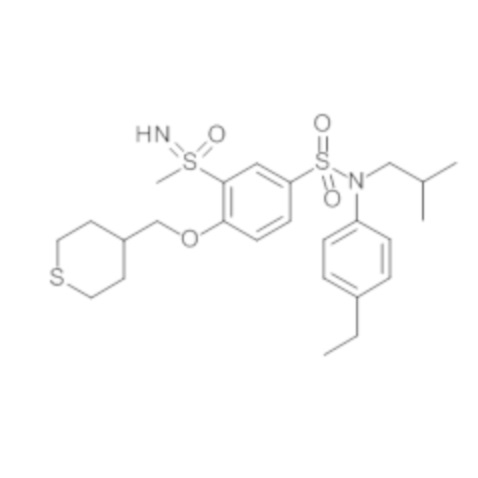

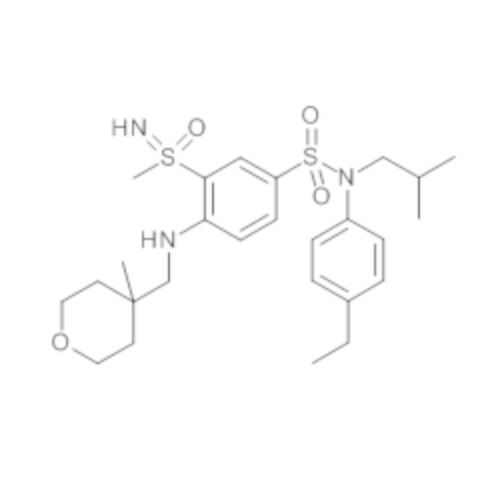
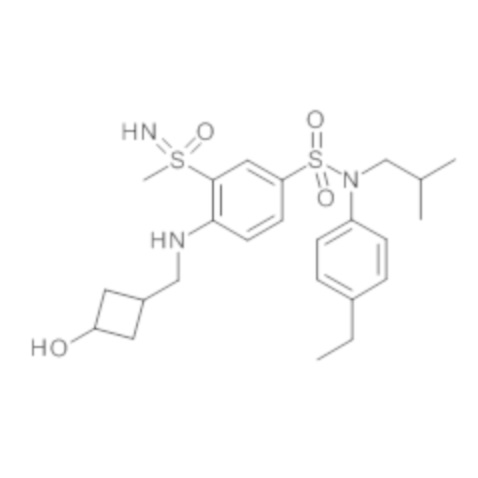
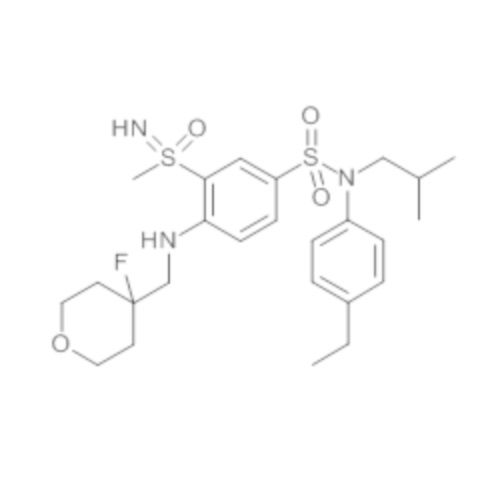
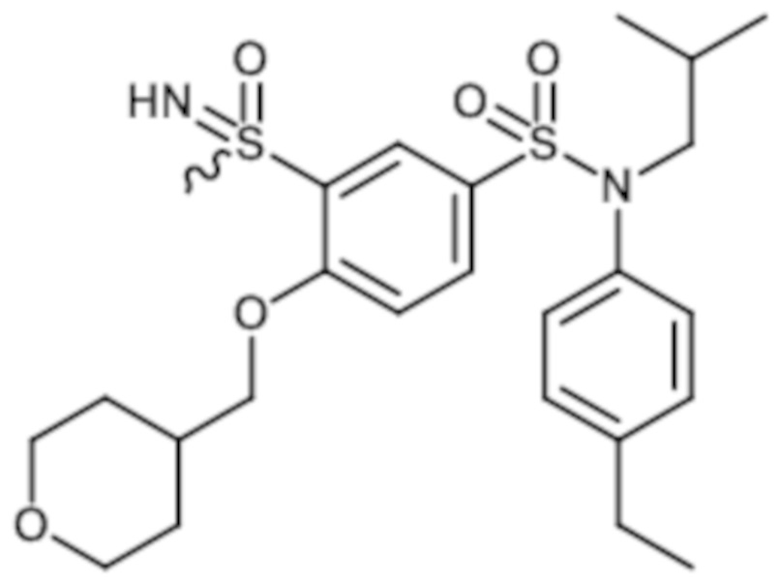
Предпочтительно соединения формулы (I) по изобретению выбирают из следующих ниже соединений:

энантиомер A
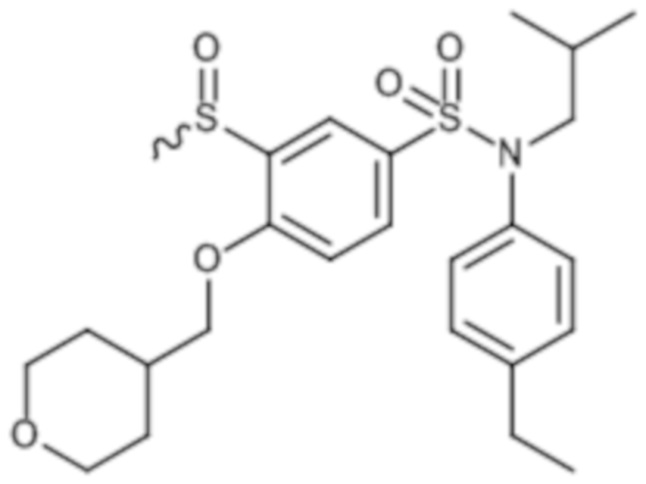
Энантиомер A



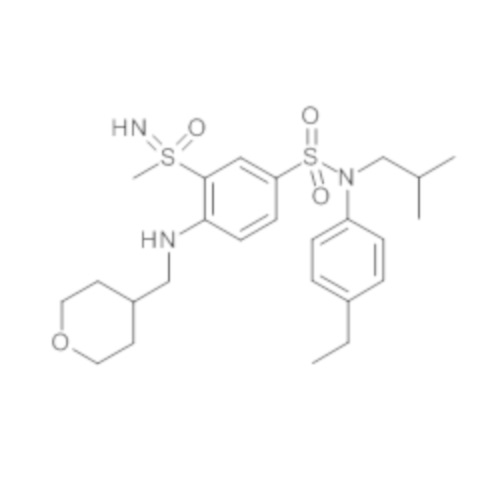




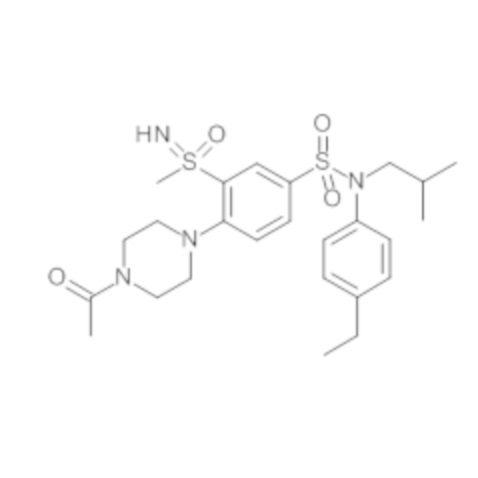
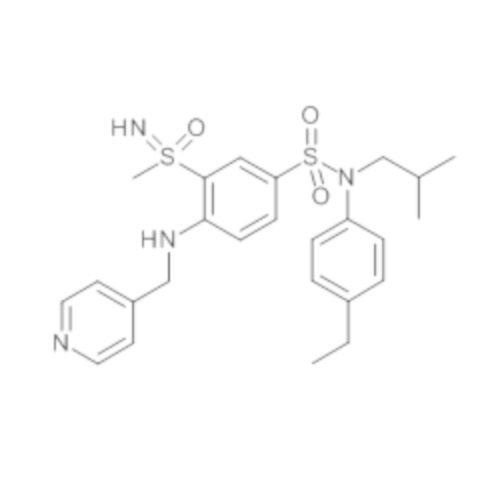
Соединение или соединения, предпочтительные по изобретению, обеспечивают преимущество, которое заключается в том, что они обладают большой биологической активностью, в частности средней ингибирующей концентрацией IC50, которая составляет менее 100 нМ в соответствии с тестом трансактивации GAL-4 RORγ, таким как описано выше.
Кроме того, соединение или соединения, предпочтительные по изобретению, обеспечивают преимущество, которое заключается в том, что они обладают слабой токсичностью.
Изобретение также относится соединению или соединениям, таким как описано выше, в качестве лекарственного средства и косметического средства.
Предпочтительно изобретение также относится соединению или соединениям, таким как описано выше, в качестве лекарственного средства.
Это объясняется тем, что, соединения по изобретению обладают представляющими интерес фармакологическими свойствами, т.к. указанные соединения модулируют, т.е. ингибируют активность рецептора RORγt.
Таким образом, эти свойства делают соединение или соединения формулы (I), такие как описано выше, пригодными для применения в качестве лекарственного средства в лечении заболеваний, опосредованных рецептором RORγt.
Предпочтительно соединение или соединения по изобретению используют для лечения воспалительных заболеваний и/или аутоиммунных заболеваний, опосредованных рецептором RORγt.
Более предпочтительно соединение или соединения по изобретению используют для лечения акне, псориаза и/или атопического дерматита.
По одному из вариантов осуществления соединения (1)-(76) используют для лечения акне, псориаза и/или атопического дерматита.
Предпочтительно соединения (7), (8), (18), (19), (26), (30), (31), (35), (37), (52), (53), (55), (61), (62), (63) и (64) используют для лечения акне, псориаза и/или атопического дерматита.
По другому варианту осуществления, соединения используют для косметического лечения кожи.
Как указано выше, настоящее изобретение также относится к фармацевтической композиции, содержащей в фармацевтически приемлемой среде одно или несколько соединений формулы (I), таких как определено выше, их фармацевтически приемлемые соли присоединения, их гидраты и/или их сольваты.
Предпочтительно фармацевтическая композиция содержит одно или несколько соединений формулы (Ia) и/или (Ib), таких как определен выше, их фармацевтически приемлемые соли присоединения, их гидраты и/или их сольваты.
Более предпочтительно фармацевтическая композиция содержит одно или несколько соединений формулы (Ia) или (Ib), выбираемые из соединений (1)-(143), как определено выше.
Еще более предпочтительно фармацевтическая композиция содержит одно или несколько соединений формулы (Ia) или (Ib), выбираемых из соединений (7), (8), (18), (19) и (26), (30), (31), (35), (37), (52), (53), (55), (61), (62), (63) и (64).
Введение фармацевтической композиции по изобретению можно проводить пероральным или топическим путем.
Предпочтительно фармацевтическая композиция составляют в форме, подходящей для нанесения топическим путем.
Для перорального пути композиция может находиться в виде таблеток, желатиновых капсул, драже, сиропов, суспензий, растворов, порошков, гранул, эмульсий, суспензий микросфер или наносфер, или липидных везикул, или полимеров, обеспечиваю контролируемое высвобождение.
Для топического нанесения фармацевтическая композиция по изобретению более конкретно предназначена для обработки кожи и слизистых оболочек и может находиться в жидкой, пастообразной или твердой форме, и более конкретно в виде мазей, кремов, молочка, помады, порошков, пропитанных тампонов, синтетических моющих средств, растворов, гелей, спреев, муссов, суспензий, палочек, шампуней или основ для мытья. Она также может находиться в виде суспензий микросфер или наносфер, или липидных везикул, или полимеров, или полимерных пластырей, или гелеобразующих средств, обеспечивающих контролируемое высвобождение.
Фармацевтическую композицию используют для лечения воспалительных заболеваний и/или аутоиммунных заболеваний, опосредованных рецептором RORγt.
Более предпочтительно фармацевтическую композицию используют для лечения акне, псориаза или атопического дерматита.
Изобретение также относится к способу лечения заболеваний, опосредованных рецептором RORγt, включающему введение, в частности, топическим или пероральным путем терапевтически эффективного количества фармацевтической композиции, такой как определено выше, пациенту.
Предпочтительно фармацевтическую композицию наносят топическим путем.
По одному из вариантов осуществления, настоящее изобретение также относится к соединению или соединениям формулы (II), а также его или их фармацевтически приемлемым солям присоединения, их гидратам и/или их сольватам:
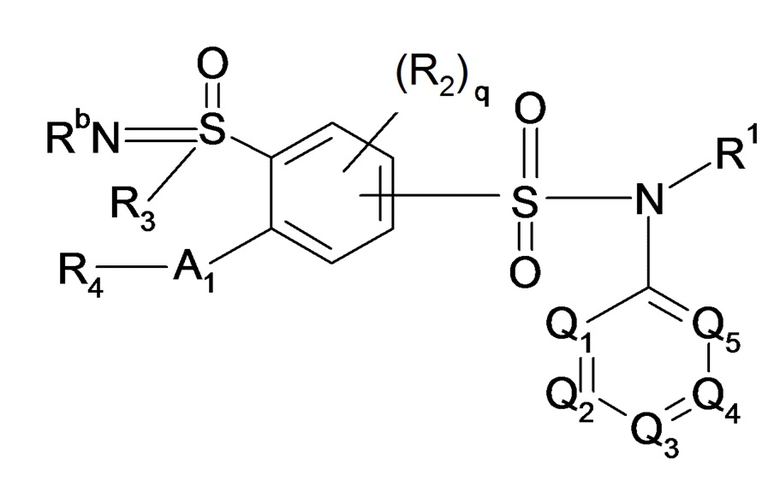
(II)
Формула (II), где:
- R3 представляет собой C1-C3алкильный радикал,
- R1, R2, R'2, R4, R5, R'5, R6, R7, R7a, R7b, R8, R9, R10, R11, R12, Ra, Rb, Z, Q1, Q2, Q3, Q4, Q5, A1 и индексы q, n, m, o и p имеют такие же значения, как в формуле (I), описанной выше.
Предпочтительно Rb представляет собой атом водорода или алкильный радикал C1.
Предпочтительно Rb представляет собой атом водорода.
Предпочтительно R3 представляет собой алкильный радикал C1.
Предпочтительно R1 представляет собой прямой или разветвленный C3-C5алкильный радикал.
Предпочтительно R4 представляет собой группу (CHR5)n-(Z)o-(CHR'5)p-R6, R6 предпочтительно соответствует ароматическому или гетероароматическому радикалу, циклоалкильному радикалу или гетероциклическому радикалу, такому как указано выше в формуле (I) или такому как указано выше.
Предпочтительно Q1-Q2 и Q4-Q5 соответствует группе -CR'2, R2 означает атом водорода, и Q3 соответствует группе -CR'2, где R'2 означает прямой или разветвленный C1-C5алкильный радикал, предпочтительно C2.
Предпочтительно Q1 и Q3, одинаковые или разные, соответствует группе -CR'2, где R'2 означает атом водорода или прямой или разветвленный C1-C5алкильный радикал, предпочтительно C2.
Предпочтительно индекс q равен нулю.
В частности, когда группа A1 представляет собой двухвалентную группу -NRa, то Ra и R4 не образуют совместно с атомом азота, к которому они присоединены, C2-C10гетероциклоалкильную группу, такую как определено в формуле (I), описанной выше.
По одному из вариантов осуществления предпочтительно R1 представляет собой прямой или разветвленный C3-C5алкильный радикал, и Rb представляет собой атом водорода.
Предпочтительно соединение или соединения формулы (II) выбирают из соединения или соединений формулы (IIa) и (IIb), которые следуют ниже:
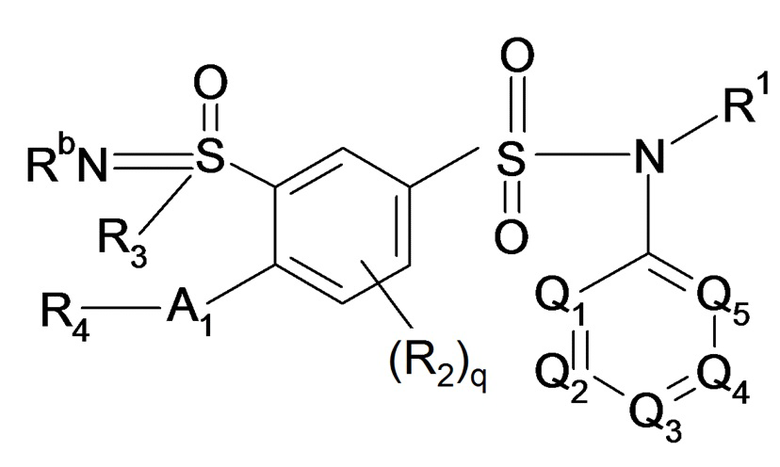
(IIa)
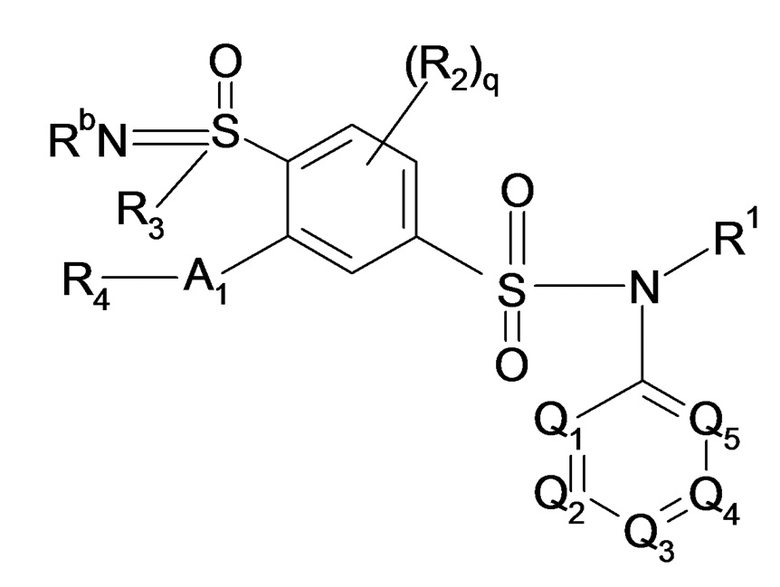
(IIb)
Формулы (IIa) и (IIb), где R1, R2, R'2, R3, R4, R5, R'5, R6, R7, R7a, R7b, R8, R9, R10, R11, R12, Ra, Rb, Z, Q1, Q2, Q3, Q4, Q5, A1 и индексы q, m, n, o и p имеют такие же значения, что и в формуле (II), описанной выше.
Предпочтительно соединение или соединения формулы (III) выбирают из соединения или соединений формулы (IIa).
В соответствии с этим вариантом осуществления изобретение также относится к соединению или соединениям формул (II), предпочтительно формул (IIa) и (IIb), в качестве лекарственного средства и косметического средства.
Предпочтительно изобретение относится к соединению или соединениям формул (II) в качестве лекарственного средства и косметического средства.
Предпочтительно изобретение относится к соединению или соединениям формулы (IIa) в качестве лекарственного средства и косметического средства, в частности в качестве лекарственного средства.
В частности, изобретение относится к соединению или соединениям формул (II), предпочтительно формулы (IIa), в качестве лекарственного средства в лечении заболеваний, опосредованных рецептором RORγt, предпочтительно лечении воспалительных заболеваний и/или аутоиммунных заболеваний, опосредованных рецептором RORγt.
Более предпочтительно соединение или соединения формул (II) по изобретению, предпочтительно формулы (IIa), используют для лечения акне, псориаза и/или атопического дерматита.
В соответствии с этим вариантом осуществления настоящее изобретение также относится к фармацевтической композиции, содержащей в фармацевтически приемлемой среде одно или несколько соединений формулы (II), такой как определено выше, их фармацевтически приемлемые соли присоединения, их гидраты и/или их сольваты.
Фармацевтическую композицию используют для лечения воспалительных заболеваний и/или аутоиммунных заболеваний, опосредованных рецептором RORγt, предпочтительно для лечения акне, псориаз или атопический дерматит.
Изобретение также относится к способу лечения заболеваний, опосредованных рецептором RORγt, включающему введение, в частности, топическим или пероральным путем терапевтически эффективного количества фармацевтической композиции, такой как определено выше, пациенту, в частности топическим путем.
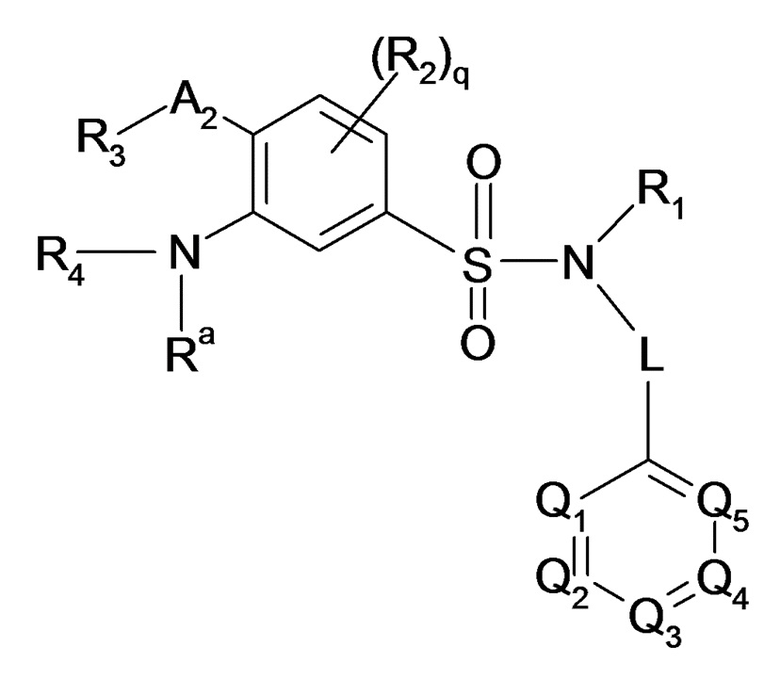
Согласно другому варианту осуществления настоящее изобретение также относится к соединению или соединениям формулы (III), а также его или их фармацевтически приемлемым солям присоединения, их гидратам и/или их сольватам:
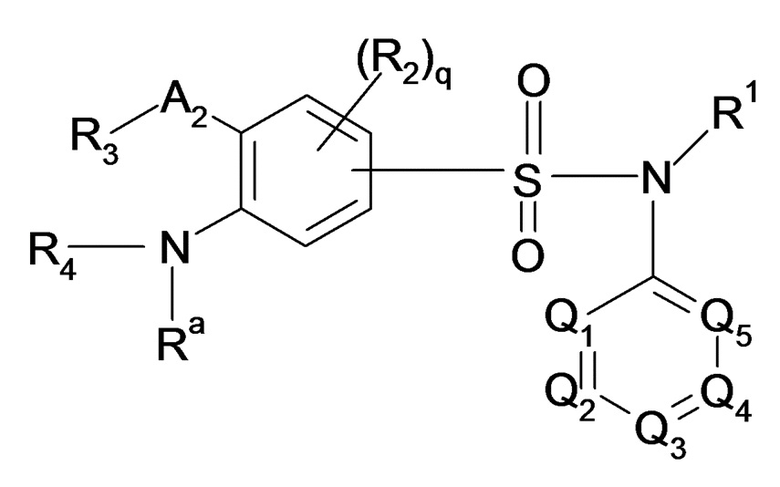
(III)
Формула (III), где:
- Ra и R4 образуют совместно с атомом азота, к которому они присоединены C2-C10гетероциклоалкильную группу, содержащую необязательно от одного до трех гетероатомов, выбранных из атома серы, атома азота и атома кислорода; где указанная гетероциклоалкильная группа является необязательно замещенной по меньшей мере одним радикалом R14,
- R14 представляет собой прямой или разветвленный C1-C3алкильный радикал, прямой или разветвленный C1-C3алкоксирадикал, атом галогена, гидроксигруппу -OH, цианогруппу -CN, группу -CONR15R16, группу -SO2R15, группу -COR15 или аминогруппу -NR15R16; R15 и R16, одинаковые или разные, представляют собой атом водорода или прямой или разветвленный C1-C3алкильный радикал,
- R1, R2, R'2, R3, Rb, Q1, Q2, Q3, Q4, Q5, A2 и индекс q имеют такие же значения, что и в формуле (I), описанной выше.
Таким образом, A2 не является двухвалентной группой -CH(OH)- и -C(=O)O-.
Другими словами, в формуле (III) A2 представляет собой двухвалентную группу, выбранную из следующих ниже групп -S-, -SO-, SO2-, -SO(=N-Rb)-.
Предпочтительно A2 представляет собой двухвалентную группу -SO(=N-Rb)-.
В частности, Ra и R4 образуют совместно с атомом азота, к которому они присоединены, моноциклическую, бициклическую или бициклическую спиро C2-C10гетероциклоалкильную группу, такую как определено выше.
Предпочтительно Ra и R4 образуют совместно с атомом азота, к которому они присоединены, моноциклическую или бициклическую спиро C2-C10гетероциклоалкильную группу, в частности моноциклическую.
Предпочтительно Ra и R4 образуют совместно с атомом азота, к которому они присоединены, C2-C10гетероциклоалкильную группу, где указанная гетероциклоалкильная группа является необязательно замещенной по меньшей мере одним радикалом R14, таким как определено выше.
Предпочтительно гетероциклоалкильная группа является необязательно замещенной одним, двумя или тремя радикалами R14, такими как определено выше.
В частности, гетероциклоалкильная группа является замещенной радикалом R14.
Предпочтительно Q1-Q2 и Q4-Q5 соответствует группе -CR2, где R2 означает атом водорода, и Q3 соответствует группе -CR'2, где R'2 означает прямой или разветвленный C1-C5алкильный радикал, предпочтительно C2.
Предпочтительно Q1 и Q3, одинаковые или разные, соответствуют группе -CR'2, где R'2 означает атом водорода или прямой или разветвленный C1-C5алкильный радикал, предпочтительно C2.
Предпочтительно индекс q равен нулю.
В конкретном случае A2 представляет собой двухвалентную группу, выбранную из -S-, -SO-, SO2-.
Предпочтительно соединение или соединения формулы (III) выбирают из соединения или соединений формулы (IIIa) и (IIIb), которые следуют ниже:
(IIIa)
(IIIb)
Формулы (IIIa) и (IIIb), где R1, R2, R'2, R3, R4, Ra, Rb, Q1, Q2, Q3, Q4, Q5, A2, и индекс q имеют такие же значения, что и в формуле (III), описанной выше.
Предпочтительно соединение или соединения формулы (III) выбирают из соединения или соединений формулы (IIIa).
Предпочтительно изобретение относится к соединению или соединениям формул (III), предпочтительно формул (IIIa) и (IIIb) в качестве лекарственного средства и косметического средства.
Предпочтительно изобретение относится к соединению или соединениям формулы (IIIa) в качестве лекарственного средства и косметического средства, в частности в качестве лекарственного средства.
В частности, изобретение относится к соединению или соединениям формул (III), предпочтительно формулы (IIIa), в качестве лекарственного средства в лечении заболеваний, опосредованных рецептором RORγt, предпочтительно лечении воспалительных заболеваний и/или аутоиммунных заболеваний, опосредованных рецептором RORγt.
Более предпочтительно соединение или соединения формул (III), предпочтительно формулы (IIIa) по изобретению используют для лечения акне, псориаза и/или атопического дерматита.
В соответствии с этим вариантом осуществления настоящее изобретение также относится к фармацевтической композиции, содержащей в фармацевтически приемлемой среде одно или несколько соединений формулы (III), такой как определено выше, их фармацевтически приемлемые соли присоединения, их гидраты и/или их сольваты.
Фармацевтическую композицию используют для лечения воспалительных заболеваний и/или аутоиммунных заболеваний, опосредованных рецептором RORγt, предпочтительно для лечения акне, псориаза или атопического дерматита.
Изобретение также относится к способу лечения заболеваний, опосредованных рецептором RORγt, включающему введение, в частности топическим или пероральным путем терапевтически эффективного количества фармацевтической композиции, такой как определено выше, пациенту, в частности топическим путем.
Следующие ниже примеры служат для иллюстрации изобретения без какого-либо ограничения.
Примеры
Стандартный способ LCMS для анализа продуктов является таким, как указано ниже следующим: стандартная колонка BEH C18 (150×2,1 мм, 1,8 мкм) растворитель вода/ацетонитрил 0,1% муравьиная кислота.
Очистки препаративной ВЭЖХ проводили на колонке C18 с элюентом: 85% ацетонитрила в воде/0,1% муравьиной кислоты.
Устройство, используемое для хроматографии, представляет собой устройство Pic Solution 10-20, колонку Chiraltechnologie Ic 25×5 микрон, (элюэнтная фаза: CO2 сверхкритический/метанол, скорость потока 4 мл/минуту).
Стандартный способ LCMS для анализа продуктов является, таким как указано ниже: колонка BEH C18 150×2,1 мм 1,8 мкм растворитель вода/ацетонитрил 0,1% муравьиная кислота.
Очистки препаративной ВЭЖХ проводили на колонке C18 с элюентом: 85% ацетонитрила в воде/0,1% муравьиной кислоты.
Часть I: Синтез содержащих серу сульфонамидов по схеме реакции 1
Схема реакции 1
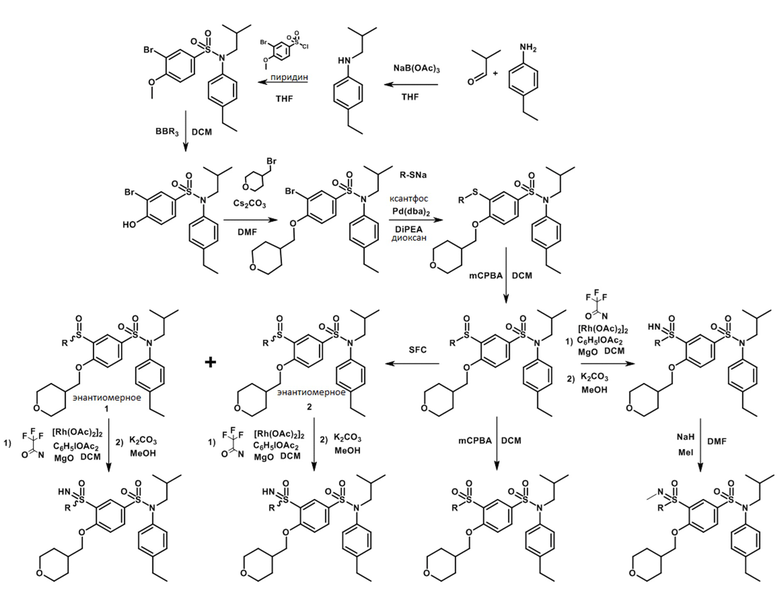
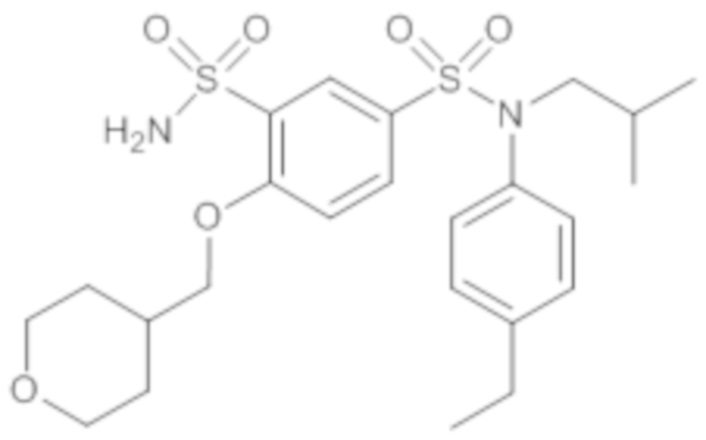
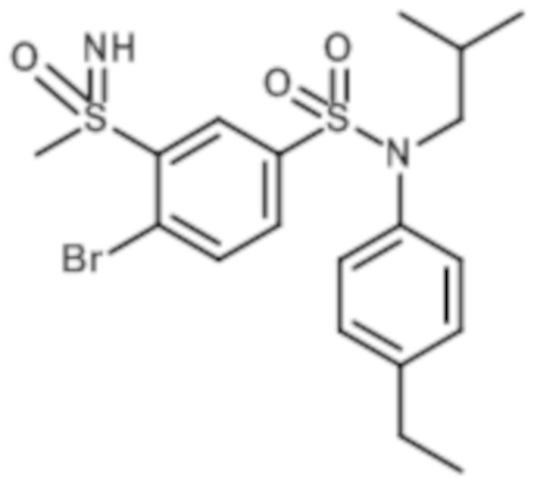
Пример 1: Синтез N-(4-этилфенил)-N-изобутил-3-метилсульфанил-4-(тетрагидропиран-4-илметокси)бензолсульфонамида

Соединение 25
1. Синтез промежуточного соединения 1.1
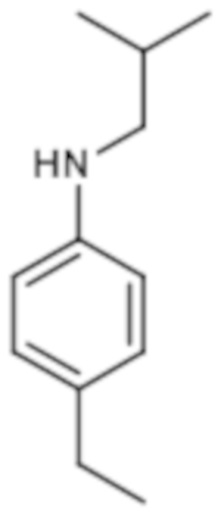
(4-этилфенил)изобутиламин
К 4-этиланилину (9,48 мл; 0,08 моль) добавляют изобутиралдегид (6,33 мл; 0,07 моль) в тетрагидрофуране (100 мл). Смесь перемешивают 2 часа при температуре окружающей среды. Затем добавляют триацетоксиборогидрид натрия (22,04 г; 0,10 моль). Смесь перемешивают в течение ночи при температуре окружающей среды, добавляют воду (100 мл) и экстрагируют этилацетатом (2×100 мл).
Органические фазы разделяют, промывают солевым раствором (100 мл), сушат (Na2SO4) и концентрируют. Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/дихлорметаном от 0 до 50% дихлорметана). (4-этилфенил)изобутиламин получают в виде оранжевого масла с соответствующим 1H ЯМР.
MS: [M+H]=179
2. Синтез промежуточного соединения 1.2
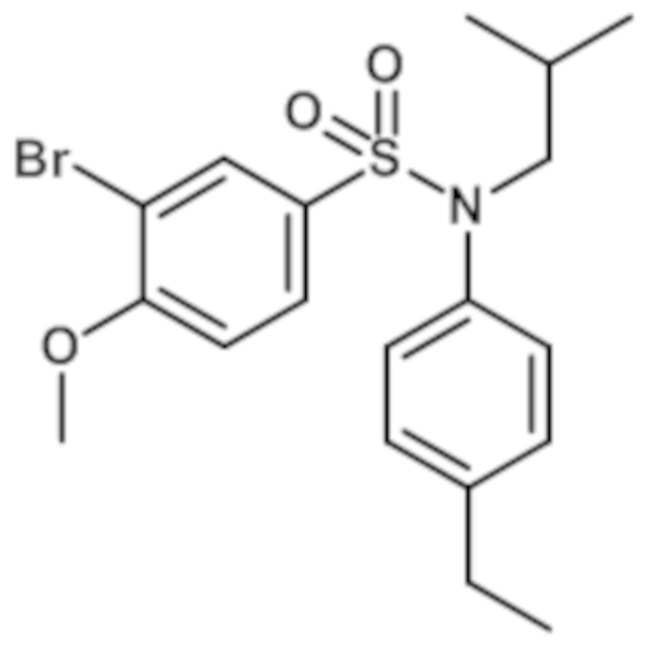
N-(4-этилфенил)-N-изобутил-4-метоксибензолсульфонамид
3-бром-4-метоксибензолсульфонилхлорид (3,22 г; 11,28 ммоль) добавляют к (4-этилфенил)изобутиламину (2.00 г; 11,28 ммоль) и пиридину (5.5 мл; 67.69 ммоль) в растворе в тетрагидрофуране (40 мл). Реакционную среду перемешивают в течение 4 часов при температуре окружающей среды, гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, промывают насыщенным раствором NH4Cl, затем солевым раствором, сушат (Na2SO4) и концентрируют. Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 20% этилацетата). N-(4-этилфенил)-N-изобутил-4-метоксибензолсульфонамид (1,63 г; 34%) получают в виде бледно-желтого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=426
3. Синтез промежуточного соединения 1.3
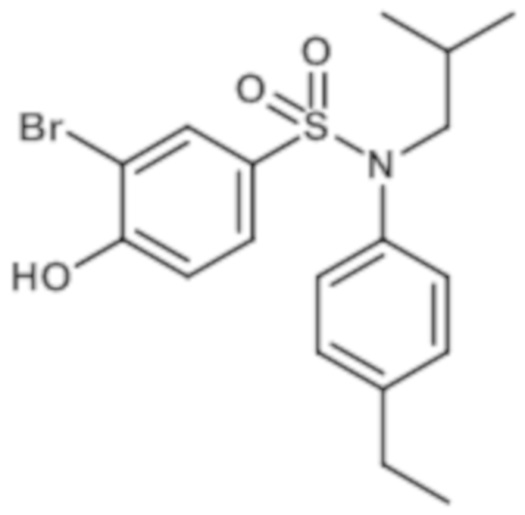
3-бром-N-(4-этилфенил)-4-гидрокси-N-изобутилбензолсульфонамид
Трибромид бора 1M в дихлорметане (5,6 мл; 5,63 ммоль) медленно добавляют при температуре 0°C к 3-бром-N-(4-этилфенил)-N-изобутил-4-метоксибензолсульфонамиду (1,60 г; 3.75 ммоль) в растворе в дихлорметане (32 мл). Реакционную среду оставляют медленно уравновешиваться с температурой окружающей среды, перемешивают в течение 16 часов и гидролизуют при температуре 0°C, затем экстрагируют дихлорметаном. Органические фазы разделяют, промывают солевым раствором, сушат (Na2SO4) и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 30% этилацетата). 3-бром-N-(4-этилфенил)-4-гидрокси-N-изобутилбензолсульфонамид (1,41 г; 91%) получают в виде бежевого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=414
4. Синтез промежуточного соединения 1.4
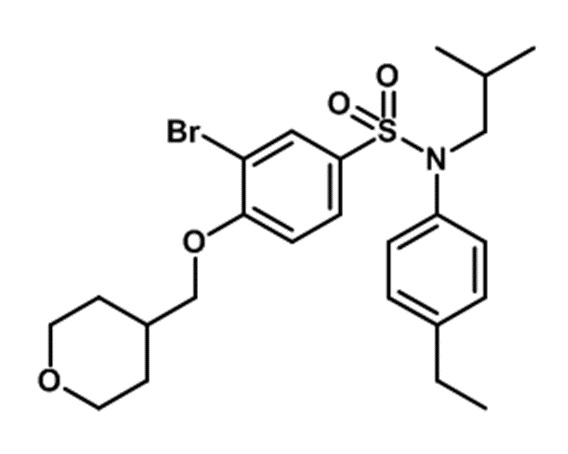
N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметокси)бензолсульфонамид
4-(бромметил)тетрагидропиран (261 мг; 1,46 ммоль) и карбонат цезия (790 мг; 2.43 ммоль) добавляют к 3-бром-N-(4-этилфенил)-4-гидрокси-N-изобутилбензолсульфонамид (500 мг; 1,21 ммоль) в растворе в N,N-диметилформамиде (10 мл). Реакционную среду перемешивают в течение 2 часов при температуре 80°C, гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором и сушат (Na2SO4), и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют: гептан/этилацетат 0 до 30% этилацетата). N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметокси)бензолсульфонамид (598 мг; 97%) получают в виде белого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=512
Пример 1: Синтез соединения 25 по изобретению

Бис(дибензилиденцетон)паладий (0) (216 мг; 0,38 ммоль) в течение 15 минут добавляют к раствор, дегазированному в аргоне, 3-бром-N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметокси)бензолсульфонамида (480 мг; 0,94 ммоль), N,N-диизопропилэтиламина (490 мкл; 2,82 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (45 мг; 0,08 ммоль) и метантиолата натрия (264 мг; 3.76 ммоль) в 1,4-диоксане (5 мл). Реакционную среду перемешивают в течение 3 часов при температуре 110°C, гидролизуют, экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором, сушат (Na2SO4) и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 30% этилацетата). N-(4-этилфенил)-N-изобутил-3-метилсульфанил-4-(тетрагидропиран-4-илметокси)бензолсульфонамид (335 мг; 71%): получают в виде бледно-желтого твердого вещества.
1H ЯМР (400 МГц, хлороформ-d) δ 7,41 (дд, J=8,4, 2,1 Гц, 1H), 7,19-7,11 (м, 2H), 7,08 (д, J=2,2 Гц, 1H), 7,04-6,95 (м, 2H), 6,83 (д, J=8,5 Гц, 1H), 4,07 (дт, J=11,5, 2,8 Гц, 2H), 3,95 (д, J=6,4 Гц, 2H), 3,49 (тд, J=11,9, 2,1 Гц, 2H), 3,27 (д, J=7,3 Гц, 2H), 2,66 (к, J=7,6 Гц, 2H), 2,24-2,10 (м, 1H), 1,87-1,74 (м, 2H), 1,59 (с, 11H), 1,25 (т, J=7,6 Гц, 4H), 0,93 (д, J=6,7 Гц, 7H).
MS: [M+H]=478
Пример 2: Синтез N-(4-этилфенил)-N-изобутил-3-метансульфонил-4-(тетрагидропиран-4-илметокси)бензолсульфонамида

Соединение 27
К раствору N-(4-этилфенил)-N-изобутил-3-метилсульфанил-4-(тетрагидропиран-4-илметокси)бензолсульфонамида (0,40 г; 0,84 ммоль) в дихлорметане (8 мл) при 0°C по частям добавляют 3-хлорпероксибензойную кислоту (0,17 г; 0,75 ммоль). Реакционную среду перемешивают 45 минут, гидролизуют 10% водным раствором Na2S2O3 и экстрагируют дихлорметаном. Промывают органическую фазу 1н. водным раствором гидроксида натрия, затем сушат (Na2SO4), фильтруют и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 50 до 100% этилацетата). N-(4-этилфенил)-N-изобутил-3-метансульфонил-4-(тетрагидропиран-4-илметокси)бензолсульфонамид (0,24 г; 58%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,85 (т, J=6,9 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,28-1,48 (м, 3H), 1,65 (тдд, J=11,5, 4,0, 2,1 Гц, 2H), 2,61 (к, J=7,6 Гц, 2H), 2,74 (с, 3H), 3,21-3,40 (м, 5H), 3,90 (ддд, J=11,5, 4,9, 2,1 Гц, 2H), 4,00-4,15 (м, 2H), 6,94-7,02 (м, 2H), 7,15-7,23 (м, 2H), 7,33-7,35 (м, 1H) 7,64-7,73 (м, 2H).
MS: [M+H]=494
Соединение 27: (550 мг; 1,11 ммоль) подвергают хроматографии хиральной SFC для разделения 2 энантиомеров (соединения 19 и соединения 20) ниже.
Сверхкритические условия 10 МПа, 70°C; колонка CHIRALPAK IC 250×4,6 мм 5 мк]
Пример 3: N-(4-этилфенил)-N-изобутил-3-метансульфонил-4-(тетрагидропиран-4-илметокси)бензолсульфонамид (соединение 19) - энантиомер A соединения 27
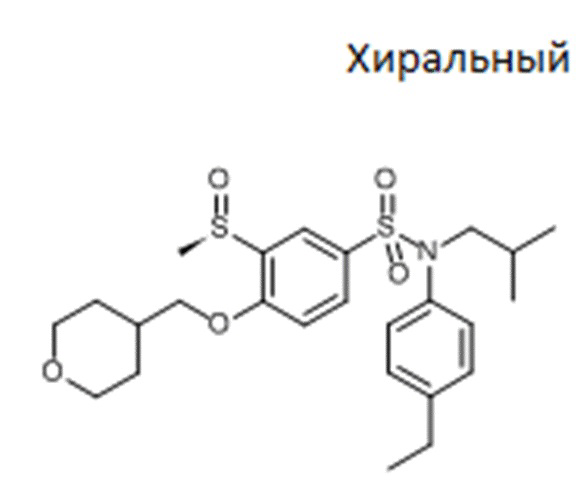
(311 мг; 56%) в виде белого твердого вещества
1H ЯМР (Хлороформ-d) δ: 0,86-0,96 (м, 6H), 1,23 (т, J=7,6 Гц, 3H), 1,40-1,65 (м, 7H), 1,65-1,87 (м, 2H), 2,11 (с, 1H), 2,63 (к, J=7,6 Гц, 2H), 2,77 (с, 2H), 3,22-3,34 (м, 1H), 3,36-3,45 (м, 1H), 3,48 (дд, J=11,9, 2,2 Гц, 1H), 3,89-4,09 (м, 4H), 6,88 (д, J=8,6 Гц, 1H), 6,94-7,01 (м, 2H), 7,09-7,16 (м, 2H), 7,57 (дд, J=8,6, 2,4 Гц, 1H), 8,16 (д, J=2,3 Гц, 1H).
Время удержания (хиральная SFC) 6,0 минут
Пример 4: N-(4-этилфенил)-N-изобутил-3-метансульфонил-4-(тетрагидропиран-4-илметокси)бензолсульфонамид (соединение 20) - энантиомер B соединения 27

(240 мг; 44%) в виде белого твердого вещества
1H ЯМР (Хлороформ-d) δ: 0,91 (дд, J=13,3, 6,7 Гц, 6H), 1,23 (т, J=7,6 Гц, 4H), 1,39-1,64 (м, 7H), 1,66-1,79 (м, 2H), 2,02-2,20 (м, 1H), 2,63 (к, J=7,7 Гц, 2H), 2,77 (с, 3H), 3,27 (дд, J=12,9, 6,8 Гц, 1H), 3,36-3,52 (м, 3H), 3,87-4,10 (м, 4H), 6,88 (д, J=8,6 Гц, 1H), 6,94-7,02 (м, 2H), 7,09-7,16 (м, 2H), 7,57 (дд, J=8,6, 2,3 Гц, 1H), 8,16 (д, J=2,3 Гц, 1H).
Время удержания (хиральная SFC) 9,9 минут
Пример 5: Синтез N-(4-этилфенил)-N-изобутил-3-метансульфоксимин-4-(тетрагидропиран-4-илметокси)бензолсульфонамида

Соединение 26
К раствору предварительно дегазированному аргоном N-(4-этилфенил)-N-изобутил-3-метансульфонил-4-(тетрагидропиран-4-илметокси)бензолсульфонамида (0,23 г; 0,47 ммоль) в дихлорметане (8 мл) добавляют 2,2,2-трифторацетамид (0,13 г; 1,16 ммоль), оксида магния (0,09 г; 2,33 ммоль), димер ацетата родия (II) (31 мг; 0,07 ммоль) и йодбензолдиацетат (0.29 г; 0.89 ммоль). Реакционную среду перемешивают в течение 4 часов 30 минут, фильтруют через целит и концентрируют.
Остаток растворяют в метаноле (8 мл) и добавляют карбонат калия (0,32 г; 2.33 ммоль). Реакционную среду перемешивают в течение 30 минут, гидролизуют и экстрагируют этилацетатом. Органические фазы объединяют, сушат (Na2SO4), фильтруют и концентрируют.
Неочищенный продукт очищают препаративной ВЭЖХ. N-(4-этилфенил)-N-изобутил-3-метансульфоксимин-4-(тетрагидропиран-4-илметокси)бензолсульфонамид (0,08 г; 34%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,84 (д, J=4,5 Гц, 3H), 0,86 (д, J=4,4 Гц, 3H), 1,18 (т, J=7,6 Гц, 3H), 1,27-1,58 (м, 3H), 1,66-1,83 (м, 2H), 2,02-2,21 (м, 1H), 2,61 (к, J=7,6 Гц, 2H), 3,19 (д, J=1,2 Гц, 3H), 3,24-3,39 (м, 4H), 3,83-3,96 (м, 2H), 4,11 (дд, J=6,2, 2,5 Гц, 2H), 4,41 (д, J=1,5 Гц, 1H), 7,01 (д, J=8,3 Гц, 2H), 7,21 (д, J=8,4 Гц, 2H), 7,39 (д, J=8,8 Гц, 1H), 7,67 (дд, J=8,8, 2,4 Гц, 1H), 8,00 (д, J=2,4 Гц, 1H).
MS: [M+H]=509
Для получения соединений 7 и 8 (энантиомеров соединения 26) применяли способ обработки, аналогичный способу, применяемому для соединения 26 для получения соединений 19 и 20.
Пример 6: N-(4-этилфенил)-N-изобутил-3-(метансульфонил)-4-(тетрагидропиран-4-илметокси)бензолсульфоксимин (соединение 7)-энантиомер A соединения 26

Соединение 7
Тот же способ обработки, что и для примера 3 на примере 4 (213 мг; 0.43 ммоль). N-(4-этилфенил)-N-изобутил-3-((S)метансульфонил)-4-(тетрагидропиран-4-илметокси)бензолсульфоксимин (20 мг; 9%) получают в виде бежевого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=509
Пример 7: N-(4-этилфенил)-N-изобутил-3-(метансульфонил)-4-(тетрагидропиран-4-илметокси)бензолсульфоксимин (соединение 8)-энантиомер B соединения 26

Соединение 8
Тот же способ обработки, что и для примера 3 на примере 5 (132 мг; 0.27 ммоль). N-(4-этилфенил)-N-изобутил-3-((R)метансульфонил)-4-(тетрагидропиран-4-илметокси)бензолсульфоксимин (11 мг; 9%) получают в виде нечисто белого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=509
Пример 8: Синтез N-(4-этилфенил)-N-изобутил-3-метансульфонил-4-(тетрагидропиран-4-илметокси)бензол-N-метил-сульфоксимина

Соединение 2
Гидрид натрия 60% (9.2 мг; 0.23 ммоль) добавляют небольшими частями к раствору при 0°C N-(4-этилфенил)-N-изобутил-3-метансульфонил-4-(тетрагидропиран-4-илметокси)бензолсульфоксимина (90 мг; 0,18 ммоль) в N,N-диметилформамида (1,8 мл). Реакционную среду перемешивают в течение 20 минут при температуре 0°C, затем добавляют по каплям йодметан (22 мкл; 0,35 ммоль). Реакционную среду перемешивают в течение 20 часов при температуре окружающей среды, гидролизуют и экстрагируют этилацетатом.
Органические фазы разделяют, промывают солевым раствором и сушат (Na2SO4), и концентрируют, и неочищенный продукт подвергают хроматографии на силикагеле (элюируют дихлорметаном/метанолом от 0 до 5% метанола).
N-(4-этилфенил)-N-изобутил-3-метансульфонил-4-(тетрагидропиран-4-илметокси)бензол-N-метил-сульфоксимин (59,3 мг; 64%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,85 (т, J=7,1 Гц, 6H), 1,17 (т, J=7,6 Гц, 3H), 1,30-1,51 (м, 3H), 1,62-1,71 (м, 1H), 1,80 (ддд, J=13,0, 4,1, 2,0 Гц, 1H), 2,08 (с, 1H), 2,34 (с, 3H), 2,59 (к, J=7,6 Гц, 2H), 3,20 (с, 3H), 3,22-3,41 (м, 8H), 3,90 (ддд, J=11,5, 4,6, 1,9 Гц, 2H), 4,04 (дд, J=9,5, 6,7 Гц, 1H), 4,17 (дд, J=9,3, 5,6 Гц, 1H), 6,93-7,00 (м, 2H), 7,14-7,21 (м, 2H), 7,45 (д, J=8,8 Гц, 1H), 7,74 (д, J=2,4 Гц, 1H), 7,86 (дд, J=8,8, 2,5 Гц, 1H).
MS: [M+H]=523
Пример 9: Синтез N-(4-этилфенил)-N-изобутил-3-метансульфонил-4-(тетрагидропиран-4-илметокси)бензолсульфонамида

Соединение 24
3-хлорпербензойную кислоту (188 мг; 0.84 ммоль) по частям добавляют при 0°C к N-(4-этилфенил)-N-изобутил-3-метилсульфанил-4-(тетрагидропиран-4-илметокси)бензолсульфонамиду (200 мг; 0,42 ммоль) в растворе дихлорметана (2 мл). Реакционную среду перемешивают 72 часа, гидролизуют, экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором, сушат (Na2SO4) и концентрируют. Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 50% этилацетата). N-(4-этилфенил)-N-изобутил-3-метансульфонил-4-(тетрагидропиран-4-илметокси)бензолсульфонамид (150 мг; 71%) получают в виде белого твердого вещества.
1H ЯМР (400 МГц, DMSO-d6) δ 7,86-7,77 (м, 2H), 7,48 (д, J=8,7 Гц, 1H), 7,24-7,17 (м, 2H), 7,05-6,96 (м, 2H), 4,16 (д, J=6,2 Гц, 2H), 3,95-3,86 (м, 2H), 3,32-3,25 (м, 6H), 2,61 (к, J=7,6 Гц, 2H), 2,16-2,09 (м, 1H), 1,77-1,68 (м, 2H), 1,49-1,34 (м, 3H), 1,18 (т, J=7,6 Гц, 3H), 0,85 (д, J=6,6 Гц, 6H).
MS: [M+H]=510
Пример 10: Синтез этансульфонил-N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметокси)бензолсульфонамида

Соединение 22
1. Синтез промежуточного соединения 10.1
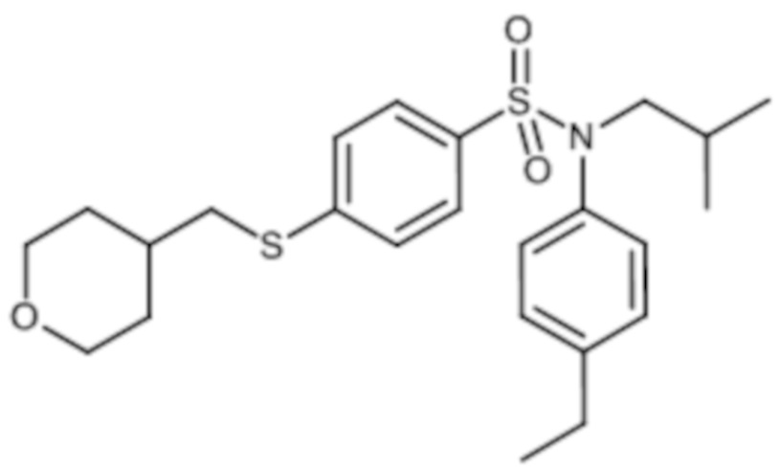
N-(4-этилфенил)-3-этилсульфанил-N-изобутил-4-(тетрагидропиран-4-илметокси)бензолсульфонамид
Бис(дибензилиденцетон)палладий (0) (225 мг; 0,39 ммоль) добавляют к дегазированной 15 минут аргоном смеси 3-бром-N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметокси)бензолсульфонамида (500 мг; 0,98 ммоль), N,N-диизопропилэтиламина (510 мкл; 2,94 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (45 мг; 0,08 ммоль) этантиолата натрия (91 мг; 1,08 ммоль) в растворе в 1,4-диоксане (5 мл). Реакционную среду перемешивают 1 час при 110°C, гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором, сушат (Na2SO4) и концентрируют. Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: от 56% до 62% ацетонитрила в воде/0,1% муравьиной кислоты). N-(4-этилфенил)-3-этилсульфанил-N-изобутил-4-(тетрагидропиран-4-илметокси)бензолсульфонамид (271 мг; 42%) получают в виде белого твердого вещества после растирания в гептане с соответствующим 1H ЯМР.
MS: [M+H]=492
2. Синтез соединения 22 по изобретению

3-хлорпербензойную кислоту (59 мг; 0,26 ммоль) по частям добавляют при температуре 0°C к N-(4-этилфенил)-3-этилсульфанил-N-изобутил-4-(тетрагидропиран-4-илметокси)бензолсульфонамиду (260 мг; 0,53 ммоль) в растворе в дихлорметане (5 мл). Реакционную среду перемешивают в течение 1 часа при температуре окружающей среды, гидролизуют 10% водным раствором Na2S2O3, затем экстрагируют дихлорметаном. Органические фазы разделяют, промывают 0,1н. водным раствором гидроксида натрия, солевым раствором, сушат (Na2SO4) и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 100% этилацетата). 3-этансульфонил-N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметокси)бензолсульфонамид (125 мг; 47%) получают в виде белого твердого вещества.
1H ЯМР (Хлороформ-d) δ: 0,84 (дд, J=13,3, 6,7 Гц, 6H), 1,10 (т, J=7,4 Гц, 3H), 1,15 (т, J=7,6 Гц, 3H), 1,33-1,55 (м, 2H), 1,58-1,72 (м, 2H), 1,94-2,12 (м, 1H), 2,56 (к, J=7,6 Гц, 2H), 2,73 (дк, J=13,4, 7,4 Гц, 1H), 2,99 (дк, J=13,5, 7,4 Гц, 1H), 3,21 (дд, J=12,8, 6,8 Гц, 1H), 3,28-3,45 (м, 3H), 3,84 (дд, J=9,0, 6,3 Гц, 1H), 3,91 (дд, J=9,0, 6,4 Гц, 1H), 3,98 (ддд, J=11,6, 4,6, 1,8 Гц, 2H), 6,81 (д, J=8,7 Гц, 1H), 6,86-6,93 (м, 2H), 7,01-7,08 (м, 2H), 7,50 (дд, J=8,6, 2,4 Гц, 1H), 8,02 (д, J=2,4 Гц, 1H).
MS: [M+H]=508
Пример 11: Синтез N-(4-этилфенил)-N-изобутил-3-этансульфоксимин-4-(тетрагидропиран-4-илметокси)бензолсульфонамида

Соединение 18
К предварительно дегазированному аргоном раствору 3-этансульфонил-N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметокси)бензолсульфонамида (110 мг; 0,22 ммоль) в дихлорметане (8 мл) добавляют 2,2,2-трифторацетамида (61 мг; 0,54 ммоль), оксида магния (44 мг; 1,08 ммоль), ацетата родия (II) (14 мг; 0,03 ммоль) и йодбензолдиацетата (133 мг; 0,41 ммоль). Реакционную среду перемешивают 16 часов при температуре окружающей среды, фильтруют через целит и концентрируют. Получаемый остаток разбавляют в метаноле (8 мл) и добавляют карбонат калия (150 мг; 1,08 ммоль). Реакционную среду перемешивают в течение 30 минут, гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором, сушат (Na2SO4) и концентрируют.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: от 56% до 62% ацетонитрила в воде/0,1% муравьиной кислоты). N-(4-этилфенил)-N-изобутил-3-этансульфоксимин-4-(тетрагидропиран-4-илметокси)бензолсульфонамид (23 мг; 20%) получают в виде не чисто белого твердого вещества.
1H ЯМР (Хлороформ-d) δ: 0,93 (дд, J=8,4, 6,6 Гц, 6H), 1,25 (к, J=7,4 Гц, 7H), 1,46-1,69 (м, 6H), 1,86 (ддк, J=11,1, 4,5, 2,2 Гц, 2H), 2,14-2,30 (м, 1H), 2,67 (к, J=7,6 Гц, 2H), 2,75 (с, 1H), 3,28 (дд, J=12,8, 7,0 Гц, 1H), 3,31-3,45 (м, 3H), 3,49 (тд, J=11,9, 2,2 Гц, 2H), 4,00-4,12 (м, 4H), 6,96-7,01 (м, 2H), 7,04 (д, J=8,8 Гц, 1H), 7,13-7,20 (м, 2H), 7,73 (дд, J=8,7, 2,4 Гц, 1H), 8,12 (д, J=2,4 Гц, 1H).
MS: [M+H]=523
Часть II: Синтез содержащих серу сульфонамидов по схеме реакции 2
Схема реакции 2:
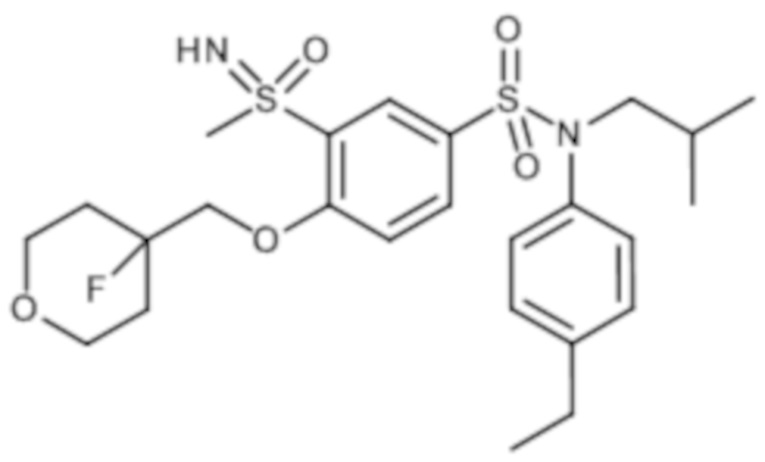
Пример 12: Синтез N-(4-этилфенил)-4-((4-фтортетрагидро-2H-пиран-4-ил)метокси)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамида

Соединение 30
1. Синтез промежуточного соединения 12.1
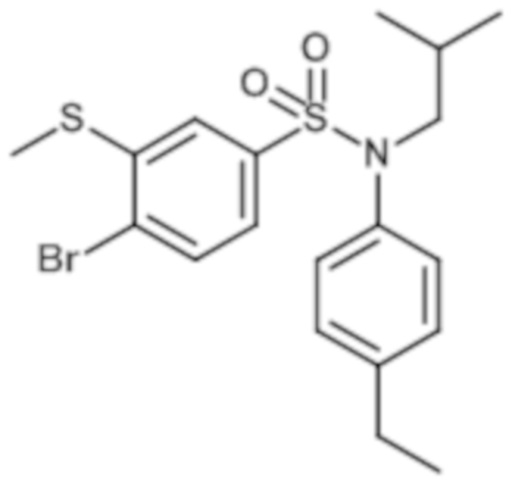
4-бром-N-(4-этилфенил)-N-изобутил-3-метилсульфанилбензолсульфонамид
4-бром-3-(метилтио)бензол-1-сульфонилхлорид (19,63 г; 61,83 ммоль) в растворе в тетрагидрофуране (95мл) добавляют к (4-этилфенил)изобутиламинк (10,96 г; 61,83 ммоль) и пиридину (30 мл; 371 ммоль) в растворе в тетрагидрофуране (370мл). Реакционную среду перемешивают в течение 16 часов при температуре окружающей среды, затем гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, промывают насыщенным раствором хлорида аммония, затем солевым раствором, сушат (Na2SO4) и концентрируют. Неочищенный продукт ресуспендируют в гептане и сушат.
4-бром-N-(4-этилфенил)-N-изобутил-3-метилсульфанилбензолсульфонамид (21,31 г; 78%) получают в виде бледно-желтого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=444
2. Синтез промежуточного соединения 12.2
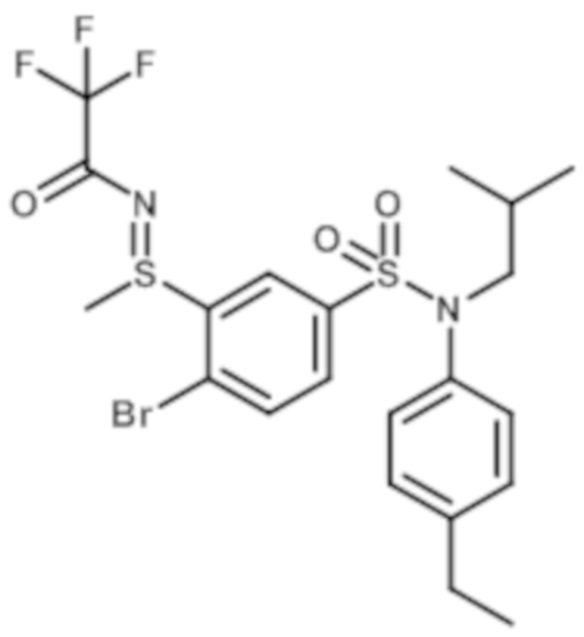
(E)-N-((2-бром-5-(N-(4-этилфенил)-N-изобутилсульфамоил)фенил)(метил)-λ4-сульфанилиден)-2,2,2-трифторацетамид
4-бром-N-(4-этилфенил)-N-изобутил-3-метилсульфанилбензолсульфонамид (5.00 г; 11,30 ммоль) и 2,2,2-трифторацетамид (1,92 г; 16,95 ммоль) в растворе в тетрагидрофуране (10мл) медленно добавляют к гидриду натрия 60% (0,41 г; 10,17 ммоль) в виде суспензии в тетрагидрофуране (10мл) при 0-5°C, затем добавляют 1,3-дибром-5,5-диметилгидантоин (4,85 г; 16,95 ммоль) в растворе в тетрагидрофуране (25мл) при температуре 0-5°C. Среду перемешивают в течение 1 часа при температуре окружающей среды. Реакционную среду гидролизуют 10% раствором лимонной кислоты, затем экстрагируют этилацетатом.
Органические фазы разделяют, промывают 25% раствором сульфита натрия, затем солевым раствором, сушат (Na2SO4) и концентрируют. Остаток ресуспендируют в простом эфире и сушат. (E)-N-((2-бром-5-(N-(4-этилфенил)-N-изобутилсульфамоил)фенил)(метил)-λ4-сульфанилиден)-2,2,2-трифторацетамид (4,76 г; 76%) получают в виде белого порошка с соответствующим 1H ЯМР.
MS: [M+H]=554
3. Синтез промежуточного соединения 12.3
2-бром-N-(4-этилфенил)-N-изобутил-3-(S-этилсульфонимидоил)бензолсульфонамид
Карбонат калия (2,79 г; 20,16 ммоль) добавляют к (E)-N-((2-бром-5-(N-(4-этилфенил)-N-изобутилсульфамоил)фенил)(метил)-λ4-сульфанилиден)-2,2,2-трифторацетамиду (3,72 г; 6,72 ммоль) в растворе в метаноле (35 мл), затем медленно добавляли 3-хлорпероксибензойную кислоту (2,26 г; 10,08 ммоль) при температуре 0°C. Реакционную среду перемешивают в течение 16 часов при температуре окружающей среды.
Реакционную среду гидролизуют, затем экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором, сушат (Na2SO4) и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 80% этилацетата). 4-бром-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамид (1,51 г, 47%) получают в виде белого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=474
4. Синтез соединения 30 по изобретению

Гидрид натрия 60% (9 мг; 0,22 ммоль) медленно добавляют к (4-фтортетрагидропиран-4-ил)метанолу (28,33 мг; 0,21 ммоль) в растворе в N,N-диметилформамиде (0,5 мл), затем 4-бром-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамиду (50 мг; 0,11 ммоль).
Реакционную среду перемешивают в течение 2 часов при температуре окружающей среды. Реакционную среду гидролизуют на холоду, затем экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором, сушат (Na2SO4) и концентрируют.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). N-(4-этилфенил)-4-((4-фтортетрагидро-2H-пиран-4-ил)метокси)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамид (46 мг; 82%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,86 (дд, J=6,7, 4,6 Гц, 6H), 1,19 (т, J=7,6 Гц, 3H), 1,36-1,51 (м, 1H), 1,76-2,05 (м, 4H), 2,61 (к, J=7,6 Гц, 2H), 3,19 (д, J=1,0 Гц, 3H), 3,22-3,32 (м, 2H), 3,63 (тд, J=11,2, 3,0 Гц, 2H), 3,80 (дт, J=11,2, 2,8 Гц, 2H), 4,34-4,48 (м, 3H), 6,97-7,04 (м, 2H), 7,17-7,24 (м, 2H), 7,39 (д, J=8,8 Гц, 1H), 7,70 (дд, J=8,7, 2,4 Гц, 1H), 8,01 (д, J=2,4 Гц, 1H).
MS: [M+H]=527
Аналогичным способом, описанным для примера 12, получают:

Соединение 31
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,7, 4,3 Гц, 6H), 1,12-1,23 (м, 4H), 1,43 (дт, J=13,6, 6,9 Гц, 1H), 1,79-1,86 (м, 2H), 2,61 (к, J=7,6 Гц, 2H), 3,23 (с, 3H), 3,25-3,36 (м, 2H), 3,61 (дт, J=8,3, 1,4 Гц, 2H), 3,78 (д, J=8,4 Гц, 2H), 4,21 (дд, J=6,9, 1,9 Гц, 2H), 4,41 (д, J=1,5 Гц, 1H), 6,96-7,03 (м, 2H), 7,17-7,24 (м, 2H), 7,34 (д, J=8,8 Гц, 1H), 7,65 (дд, J=8,7, 2,4 Гц, 1H), 8,00 (д, J=2,5 Гц, 1H).
MS: [M+H]=507
Соединение 32
1H ЯМР (DMSO-d6) δ: 0,86 (дд, J=6,6, 4,3 Гц, 6H), 1,19 (т, J=7,6 Гц, 3H), 1,38-1,50 (м, 1H), 2,61 (к, J=7,6 Гц, 2H), 3,16 (д, J=1,2 Гц, 3H), 3,22-3,41 (м, 2H), 4,46 (д, J=1,5 Гц, 1H), 4,63-4,86 (м, 6H), 6,97-7,05 (м, 2H), 7,21 (д, J=8,3 Гц, 2H), 7,74 (дд, J=8,7, 2,4 Гц, 1H), 8,00 (д, J=2,4 Гц, 1H).
MS: [M+H]=499
Соединение 33
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,6, 3,5 Гц, 6H), 1,19 (т, J=7,6 Гц, 3H), 1,42 (с, 11H), 1,70-1,80 (м, 2H), 1,90 (т, J=10,4 Гц, 2H), 2,61 (к, J=7,5 Гц, 2H), 3,19 (с, 3H), 3,24-3,31 (м, 2H), 3,38-3,48 (м, 2H), 3,48-3,61 (м, 2H), 4,42 (д, J=1,4 Гц, 1H), 4,97-5,05 (м, 1H), 6,98-7,05 (м, 2H), 7,17-7,25 (м, 2H), 7,45 (д, J=9,0 Гц, 1H), 7,64 (дд, J=8,7, 2,4 Гц, 1H), 8,01 (д, J=2,3 Гц, 1H).
MS: [M+H]=594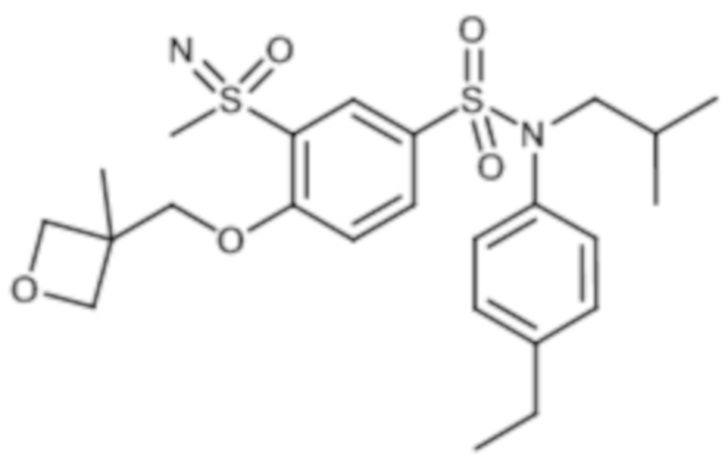
Соединение 34
1H ЯМР (DMSO-d6) δ: 0,86 (дд, J=6,6, 4,1 Гц, 6H), 1,19 (т, J=7,6 Гц, 3H), 1,42 (с, 4H), 2,56-2,67 (м, 2H), 3,21 (д, J=1,2 Гц, 3H), 3,24-3,32 (м, 2H), 4,30 (д, J=3,3 Гц, 2H), 4,36 (д, J=6,0 Гц, 2H), 4,42 (д, J=1,4 Гц, 1H), 4,62 (дд, J=5,9, 3,0 Гц, 2H), 6,98-7,05 (м, 2H), 7,18-7,25 (м, 2H), 7,43 (д, J=8,8 Гц, 1H), 7,70 (дд, J=8,7, 2,5 Гц, 1H), 8,02 (д, J=2,4 Гц, 1H).
MS: [M+H]=495
Соединение 35
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,7, 4,3 Гц, 6H), 1,18 (т, J=7,6 Гц, 4H), 1,35-1,51 (м, 1H), 1,79-1,86 (м, 2H), 2,61 (к, J=7,6 Гц, 2H), 3,23 (д, J=1,2 Гц, 3H), 3,25-3,31 (м, 2H), 3,61 (дт, J=8,4, 1,3 Гц, 2H), 3,78 (д, J=8,3 Гц, 2H), 4,21 (дд, J=7,0, 1,9 Гц, 2H), 4,41 (д, J=1,4 Гц, 1H), 6,96-7,03 (м, 2H), 7,17-7,24 (м, 2H), 7,34 (д, J=8,8 Гц, 1H), 7,65 (дд, J=8,7, 2,4 Гц, 1H), 8,00 (д, J=2,5 Гц, 1H).
MS: [M+H]=507
Соединение 36
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,6, 4,4 Гц, 6H), 1,14-1,31 (м, 5H), 1,41 (с, 10H), 1,82 (с, 2H), 2,04 (с, 1H), 2,53-2,66 (м, 3H), 2,77 (с, 2H), 3,17 (д, J=1,2 Гц, 3H), 3,21-3,31 (м, 2H), 3,99 (д, J=12,8 Гц, 2H), 4,08-4,15 (м, 2H), 4,41 (д, J=1,5 Гц, 1H), 6,97-7,04 (м, 2H), 7,17-7,24 (м, 2H), 7,37 (д, J=8,8 Гц, 1H), 7,67 (дд, J=8,7, 2,5 Гц, 1H), 8,00 (д, J=2,4 Гц, 1H).
MS: [M+H]=608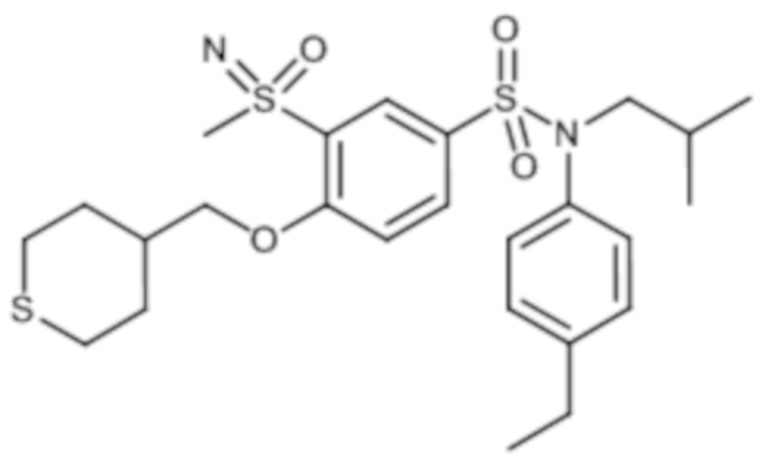
Соединение 37
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,6, 4,5 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,35-1,57 (м, 3H), 1,82-2,01 (м, 1H), 2,11-2,20 (м, 2H), 2,52-2,76 (м, 7H), 3,19 (д, J=1,2 Гц, 3H), 3,32 (с, 8H), 4,05-4,12 (м, 2H), 4,40 (д, J=1,5 Гц, 1H), 6,97-7,04 (м, 2H), 7,17-7,24 (м, 2H), 7,37 (д, J=8,9 Гц, 1H), 7,67 (дд, J=8,8, 2,5 Гц, 1H), 8,00 (д, J=2,4 Гц, 1H).
MS: [M+H]=525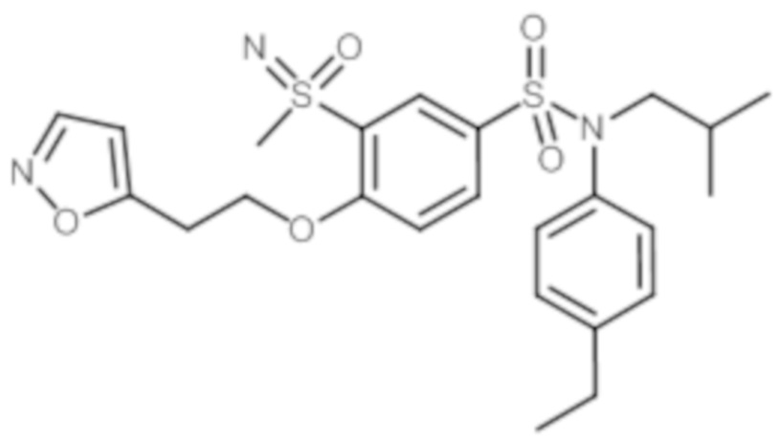 Соединение 38
Соединение 38
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=11,0, 6,7 Гц, 6H), 1,17 (т, J=7,6 Гц, 3H), 1,43 (т, J=7,2 Гц, 1H), 2,29-2,38 (м, 2H), 2,60 (д, J=7,6 Гц, 2H), 3,22-3,39 (м, 4H), 3,54 (д, J=2,5 Гц, 3H), 4,64 (с, 1H), 6,83 (с, 1H), 6,94-7,04 (м, 2H), 7,22 (д, J=8,4 Гц, 4H), 7,64 (д, J=2,3 Гц, 1H), 7,82 (дд, J=8,9, 2,4 Гц, 1H).
MS: [M+H]=506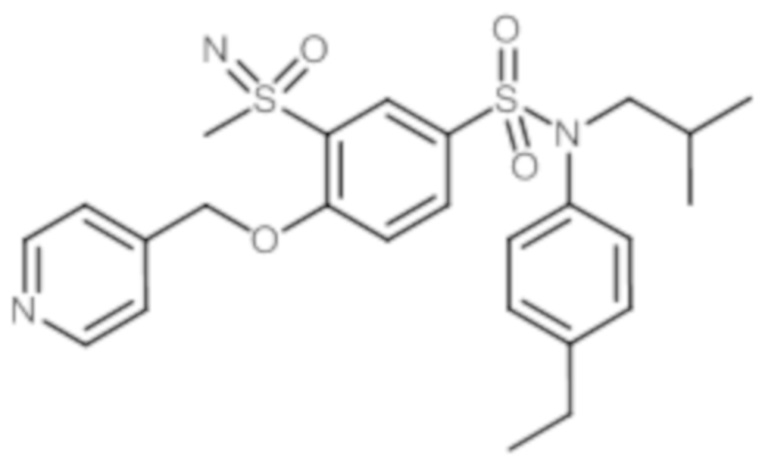
Соединение 39
1H ЯМР (DMSO-d6) δ: 0,86 (дд, J=6,7, 4,3 Гц, 7H), 1,19 (т, J=7,6 Гц, 3H), 1,36-1,51 (м, 1H), 2,61 (к, J=7,6 Гц, 2H), 3,15 (д, J=1,2 Гц, 3H), 3,24-3,32 (м, 2H), 4,51 (д, J=1,5 Гц, 1H), 5,47 (д, J=2,5 Гц, 2H), 6,97-7,04 (м, 2H), 7,17-7,24 (м, 2H), 7,44-7,54 (м, 2H), 7,73 (дд, J=8,7, 2,5 Гц, 1H), 8,00 (дт, J=7,9, 2,0 Гц, 1H), 8,03 (д, J=2,4 Гц, 1H), 8,59 (дд, J=4,8, 1,6 Гц, 1H), 8,79 (д, J=2,5 Гц, 1H).
MS: [M+H]=502
Соединение 40
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,6, 3,5 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,37-1,49 (м, 1H), 2,61 (к, J=7,6 Гц, 2H), 3,24 (т, J=1,4 Гц, 3H), 3,25-3,31 (м, 2H), 3,53 (т, J=5,8 Гц, 2H), 3,89 (дд, J=10,2, 5,1 Гц, 1H), 4,11-4,34 (м, 2H), 4,41 (дд, J=8,9, 1,4 Гц, 1H), 4,74 (дт, J=7,7, 5,7 Гц, 1H), 5,08 (д, J=4,9 Гц, 1H), 6,97-7,04 (м, 2H), 7,17-7,24 (м, 2H), 7,39 (дд, J=8,9, 2,1 Гц, 1H), 7,64-7,73 (м, 1H), 7,95-8,00 (м, 1H).
MS: [M+H]=485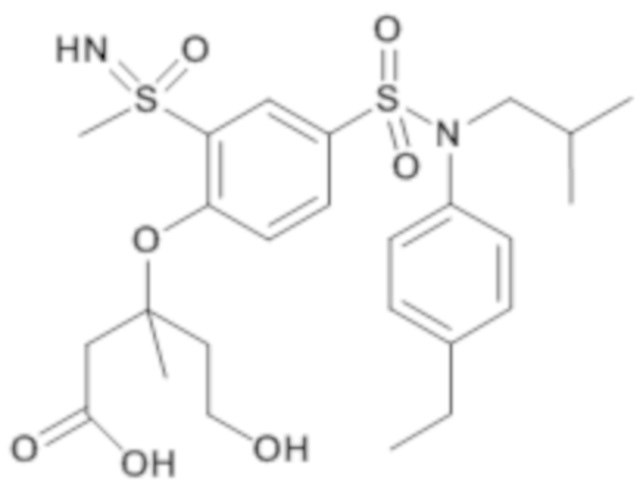
Соединение 41
1H ЯМР (DMSO-d6) δ: 0,85 (т, J=5,4 Гц, 7H), 1,17 (т, J=7,6 Гц, 5H), 1,36-1,48 (м, 1H), 2,60 (к, J=7,5 Гц, 2H), 3,14 (д, J=4,9 Гц, 3H), 3,20-3,29 (м, 2H), 4,39-4,71 (м, 5H), 5,26 (с, 1H), 6,99 (д, J=7,2 Гц, 2H), 7,20 (д, J=8,0 Гц, 2H), 7,40 (дт, J=8,5, 4,3 Гц, 1H), 7,65-7,76 (м, 1H), 7,99 (дд, J=14,4, 2,4 Гц, 1H).
MS: [M+H]=541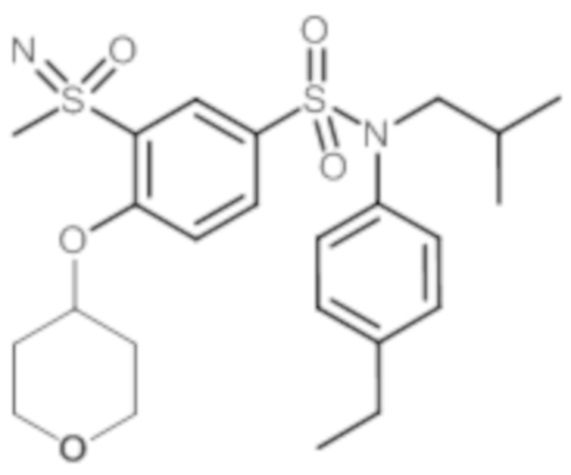
Соединение 42
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,6, 3,8 Гц, 6H), 1,19 (т, J=7,6 Гц, 3H), 1,36-1,51 (м, 1H), 1,68-1,81 (м, 2H), 1,97-2,07 (м, 2H), 2,61 (к, J=7,6 Гц, 2H), 3,21 (д, J=1,2 Гц, 3H), 3,32 (м,2H, 3,50-3,61 (м, 2H), 3,87-3,92 (м, 2H), 4,41 (д, J=1,5 Гц, 1H), 5,00 (дт, J=7,3, 3,6 Гц, 1H), 6,98-7,05 (м, 2H), 7,17-7,24 (м, 2H), 7,46 (д, J=8,9 Гц, 1H), 7,63 (дд, J=8,8, 2,4 Гц, 1H), 8,02 (д, J=2,5 Гц, 1H).
MS: [M+H]=495
Соединение 43
MS: [M+H]=530
Соединение 44
1H ЯМР (DMSO-d6) δ: 0,84 (д, J=6,4 Гц, 7H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (дт, J=13,7, 6,8 Гц, 1H), 1,74 (дд, J=14,3, 7,3 Гц, 1H), 1,88 (дт, J=14,3, 6,9 Гц, 1H), 2,30-2,41 (м, 2H), 2,61 (к, J=7,6 Гц, 2H), 3,01 (д, J=5,9 Гц, 3H), 3,25 (д, J=7,3 Гц, 3H), 3,50 (с, 2H), 3,68 (с, 1H), 4,67 (д, J=23,1 Гц, 1H), 4,95 (д, J=17,8 Гц, 1H), 7,01 (д, J=8,1 Гц, 3H), 7,20 (д, J=8,0 Гц, 2H), 7,47 (дд, J=8,8, 2,9 Гц, 1H), 7,67-7,81 (м, 2H), 12,12 (с, 1H).
MS: [M+H]=526
Соединение 77
1H ЯМР (DMSO-d6) δ: 0.89 (ддд, J=10.8, 6.5, 3.9 Гц, 6H), 1,23 (т, J=7.6 Гц,3H), 1,42-1,54 (м, 1H), 2.66 (к, J=7.7 Гц, 2H), 3.25 (с, 3H), 3.28-3.35 (м, 2H), 3.92 (с, 3H), 4.61 (с, 1H), 5.50 (с, 2H), 7.05 (д, J=8.1 Гц, 3H), 7.25 (д, J=8,0 Гц, 2H), 7.46 (д, J=8.9 Гц, 1H), 7.57-7.73 (м, 2H), 7.76 (дд, J=8.9, 2.4 Гц, 1H), 8,09 (д, J=2.6 Гц, 1H), 8.26 (д, J=5.3 Гц, 1H).
MS: [M+H]=532
Соединение 78
1H ЯМР (DMSO-d6) δ: 0.85 (дд, J=6.6, 4,7 Гц, 6H), 1,18 (т, J=7.6 Гц, 3H), 1,36-1,50 (м, 1H), 1,88 (т, J=12,8 Гц, 2H), 2.15-2.30 (м, 3H), 2.61 (к, J=7.6 Гц, 2H), 3.07-3.18 (м, 2H), 3.19 (д, J=1,2 Гц, 3H), 3.20-3.32 (м, 4H), 4.18 (дт, J=6.0, 3.6 Гц, 2H), 4.44 (д, J=1,5 Гц, 1H), 6.97-7.04 (м, 2H), 7.17-7.24 (м, 2H), 7.38 (д, J=8.7 Гц, 1H), 7.68 (дд, J=8.8, 2.4 Гц, 1H), 8,01 (д, J=2.4 Гц, 1H).
MS: [M+H]=557
Соединение 79
1H ЯМР (DMSO-d6) δ: 0,81-0,89 (м, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,35-1,50 (м, 1H), 2,61 (к, J=7,6 Гц, 2H), 3,18 (дд, J=4,2, 1,2 Гц, 3H), 3,22-3,32 (м, 2H), 3,59 (дт, J=32,3, 8,2 Гц, 2H), 4,30-4,45 (м, 2H), 4,46-4,57 (м, 1H), 5,01 (дт, J=4,8, 2,3 Гц, 1H), 6,96-7,04 (м, 2H), 7,17-7,24 (м, 2H), 7,42 (дд, J=8,8, 2,2 Гц, 1H), 7,65-7,75 (м, 2H), 8,00 (дд, J=10,9, 2,4 Гц, 1H).
MS: [M+H]=510
Пример 30: Синтез соединения 4-((2,4-дифторбензил)окси)-N-(4-этилфенил)-N-изобутил-3-(S-метил-сульфонимидоил)бензолсульфонамида

Соединение 45
4-бром-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамид (50,0 мг; 0,11 ммоль) добавляют к смеси, содержащей 2,4-дифторбензиловый спирт (30,5 мг; 0.21 ммоль) и карбонат цезия (103,2 мг; 0,32 ммоль) в растворе в N,N-диметилформамиде (0,50 мл) после 20 минут перемешивания. Реакционную среду перемешивают в течение 20 часов при температуре 80°C, гидролизуют на холоду, затем экстрагируют этилацетатом. Органические фазы разделяют, промывают насыщенным раствором хлорида натрия, сушат (сульфат натрия) и концентрируют досуха.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). 4-((2,4-дифтор-бензил)окси)-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамид (9,4 мг; 16%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,86 (дд, J=6,8, 4,4 Гц, 6H), 1,19 (т, J=7,6 Гц, 3H), 1,33-1,53 (м, 1H), 2,62 (т, J=7,6 Гц, 2H), 3,12 (с, 3H), 4,47 (с, 1H), 5,42 (с, 2H), 7,01 (д, J=8,1 Гц, 2H), 7,21 (д, J=8,0 Гц, 3H), 7,38 (т, J=9,2 Гц, 1H), 7,55 (д, J=8,8 Гц, 1H), 7,72 (дд, J=8,7, 2,5 Гц, 1H), 7,80 (к, J=8,2 Гц, 1H), 8,03 (д, J=2,5 Гц, 1H).
MS: [M+H]=537
Пример 31: Синтез соединения 4-(4-цианофенокси)-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамидв

Соединение 80
Гидрид натрия 60% (6,3 мг; 0,16 ммоль) добавляют к (1,1-диоксогексагидро-1λ6-тиопиран-4-ил)метанол-4-цианофенолу (13,8 мг; 0,12 ммоль), находящемуся в растворе в N,N-диметилформамиде (1,0 мл). Реакционную среду перемешивают в течение 20 минут перед добавлением 4-бром-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамида (50,0 мг; 0,11 ммоль).
Реакционную среду перемешивают в течение 1 часа при температуре окружающей среды в течение, затем в течение 16 часов при температуре 80°C. Реакционную среду гидролизуют добавлением воды на холоду, затем экстрагируют этилацетатом. Органические фазы разделяют, затем промывают солевым раствором, сушат (Na2SO4) и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле, элюируют гептаном/этилацетатом от 0 до 100% этилацетата. 4-(4-цианофенокси)-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамид (14,5 мг; 24%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,87 (дд, J=6,6, 3,9 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,21-1,31 (м, 2H), 1,39-1,51 (м, 1H), 2,57-2,66 (м, 2H), 3,26 (с, 3H), 3,33-3,39 (м, 2H), 4,66 (д, J=1,5 Гц, 1H), 7,00-7,07 (м, 2H), 7,20-7,31 (м, 3H), 7,30-7,38 (м, 2H), 7,72 (дд, J=8,6, 2,4 Гц, 1H), 7,93-8,00 (м, 2H), 8,09 (д, J=2,4 Гц, 1H).
MS: [M+H]=512
Часть III: Синтез содержащих серу сульфонамидов по схеме реакции 3
Схема реакции 3:
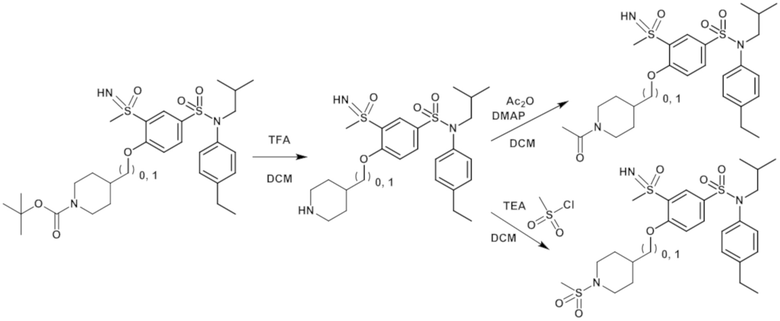
Пример 32: Синтез N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-(пиперидин-4-илметокси)бензолсульфонамида

Соединение 46
Трифторуксусную кислоту (0,2 мл; 2,61 ммоль) добавляют к трет-бутил-4-(4-(N-(4-этилфенил)-N-изобутилсульфамоил)-2-(S-метилсульфонимидоил)фенокси)пиперидин-1-карбоксилату (40,0 мг; 0,07 ммоль) в растворе в дихлорметане (1,6 мл). Реакционную среду перемешивают в течение 1 часа при температуре окружающей среды, концентрируют, разбавляют дихлорметаном, промывают насыщенным раствором гидрокарбоната натрия, затем насыщенным раствором хлорида натрия и сушат (Na2SO4). Выпаривают растворители.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-(пиперидин-4-илокси)бензолсульфонамид (32,1 мг; 97%) получают в виде белого порошка.
Смесь конформеров: 1H ЯМР (DMSO-d6) δ: 0,86 (дд, J=6,6, 1,5 Гц, 6H), 1,20 (т, J=7,6 Гц, 3H), 1,46-1,61 (м, 1H), 1,77-1,96 (м, 2H), 1,96-2,15 (м, 2H), 2,57-2,68 (м, 2H), 2,77-2,96 (м, 2H), 3,20 (с, 3H), 3,28-3,38 (м, 2H), 3,98-4,21 (м, 1H), 4,75-5,03 (м, 1H), 6,98-7,06 (м, 2H), 7,16-7,23 (м, 2H), 7,41 (д, J=8,8 Гц, 1H), 7,64-7,72 (м, 1H), 8,05 (д, J=2,5 Гц, 1H).
MS: [M+H]=494
Пример 33: Синтез 4-((1-ацетилпиперидин-4-ил)окси)-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамида
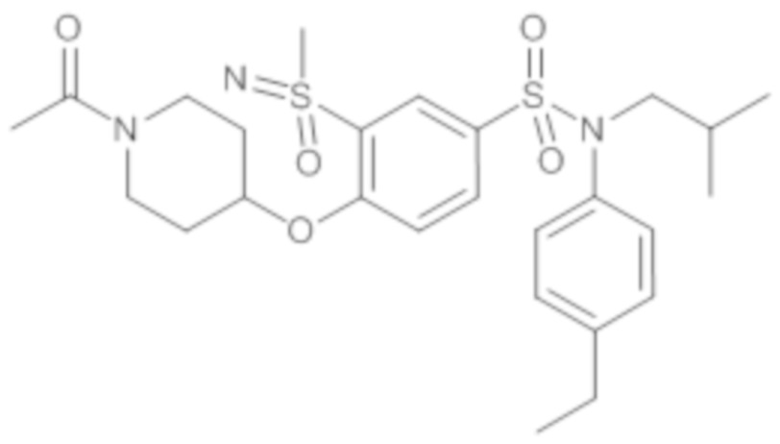
Соединение 47
К раствору N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-(пиперидин-4-илокси)бензолсульфонамида (65,0 мг; 0,13 ммоль) в дихлорметане (2 мл), охлажденному до температуры -10°C, добавляют 4-диметиламинопиридин (1,6 мг; 0,01 ммоль) и уксусный ангидрид (11,2 мкл; 0,12 ммоль).
Реакционную среду перемешивают в течение 2 часов при температуре окружающей среды. Реакционную среду гидролизуют добавлением насыщенного раствора гидрокарбоната натрия, затем экстрагируют этилацетатом. Органические фазы разделяют, промывают насыщенным раствором хлорида натрия, сушат (Na2SO4 и концентрируют досуха.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). 4-((1-ацетилпиперидин-4-ил)окси)-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамид (34,8 мг; 49%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,86 (дд, J=6,6, 2,3 Гц, 6H), 1,19 (т, 3H), 1,36-1,51 (м, 1H), 1,89-2,07 (м, 5H), 2,61 (к, J=7,6 Гц, 2H), 2,87 (с, 3H), 3,20 (д, J=1,2 Гц, 3H), 3,23-3,31 (м, 5H), 4,47 (д, J=1,5 Гц, 1H), 5,06 (т, J=4,1 Гц, 1H), 6,98-7,05 (м, 2H), 7,18-7,25 (м, 2H), 7,47 (д, J=9,0 Гц, 1H), 7,67 (дд, J=8,7, 2,4 Гц, 1H), 8,00 (д, J=2,4 Гц, 1H).
MS: [M+H]=536
Пример 34: Синтез N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-((1-(метилсульфонил)пиперидин-4-ил)окси)бензолсульфонамида
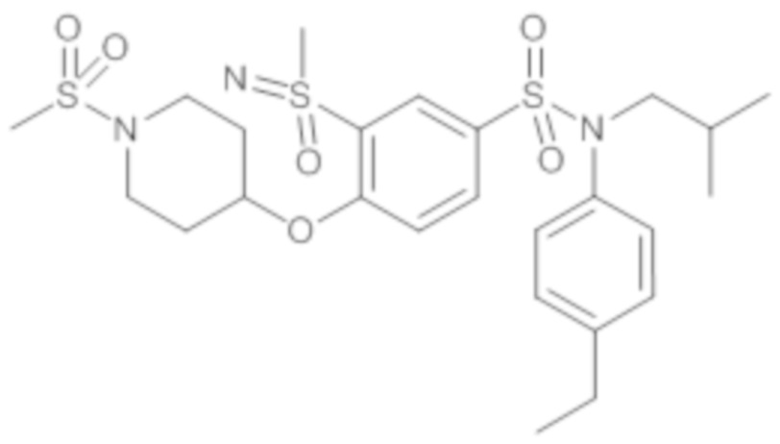
Соединение 48
К раствору N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-(пиперидин-4-илметокси)бензолсульфонамида (65,0 мг; 0,13 ммоль) в дихлорметане (1,3 мл) добавляют триэтиламин (18,3 мкл; 0,13 ммоль) и метансульфонилхлорид (10,2 мкл; 0,13 ммоль).
Реакционную среду перемешивают в течение 2 часов при температуре окружающей среды, гидролизуют добавлением насыщенного раствора гидрокарбонат натрия и экстрагируют этилацетатом. Органические фазы разделяют, промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют досуха.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-((1-(метилсульфонил)пиперидин-4-ил)окси)бензолсульфонамид (24,8 мг; 32%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,86 (дд, J=6,7, 3,4 Гц, 6H), 1,19 (т, J=7,6 Гц, 3H), 1,36-1,51 (м, 1H), 1,81-1,88 (м, 2H), 1,99 (д, J=9,4 Гц, 1H), 2,03 (с, 3H), 2,61 (к, J=7,6 Гц, 2H), 3,19 (д, J=1,2 Гц, 3H), 3,22-3,31 (м, 2H), 3,43-3,52 (м, 1H), 3,53-3,74 (м, 3H), 4,42 (дд, J=3,3, 1,5 Гц, 1H), 5,02-5,09 (м, 1H), 6,98-7,06 (м, 2H), 7,17-7,25 (м, 2H), 7,47 (д, J=8,9 Гц, 1H), 7,65 (дд, J=8,8, 2,4 Гц, 1H), 8,02 (д, J=2,4 Гц, 1H)).
MS: [M+H]=572
Пример 35: Синтез N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-(пиперидин-4-илметокси)бензолсульфонамида

Соединение 49
Способом, аналогичным способу, описанному для примера 31, получают N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-(пиперидин-4-илметокси)бензолсульфонамид (68.2 мг; 100%) в виде белого порошка.
1H ЯМР (DMSO-d6) δ: 0,77 (дд, J=6,6, 4,4 Гц, 6H), 1,11 (т, J=7,6 Гц, 3H), 1,14-1,24 (м, 2H), 1,24-1,43 (м, 1H), 1,70 (д, J=13,3 Гц, 2H), 1,82-1,89 (м, 1H), 2,45-2,51 (м, 2H), 2,51-2,58 (м, 2H), 2,93 (дт, J=12,1, 3,3 Гц, 2H), 3,11 (с, 3H), 3,18 (дд, J=13,0, 7,1 Гц, 3H), 3,99 (дд, J=6,3, 2,3 Гц, 2H), 4,32 (с, 1H), 6,93 (д, J=8,4 Гц, 2H), 7,13 (д, J=8,4 Гц, 2H), 7,30 (д, J=8,8 Гц, 1H), 7,58 (дд, J=8,8, 2,5 Гц, 1H), 7,92 (д, J=2,4 Гц, 1H).
MS: [M+H]=508
Пример 36: Синтез 4-((1-ацетилпиперидин-4-ил)метокси)-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамида
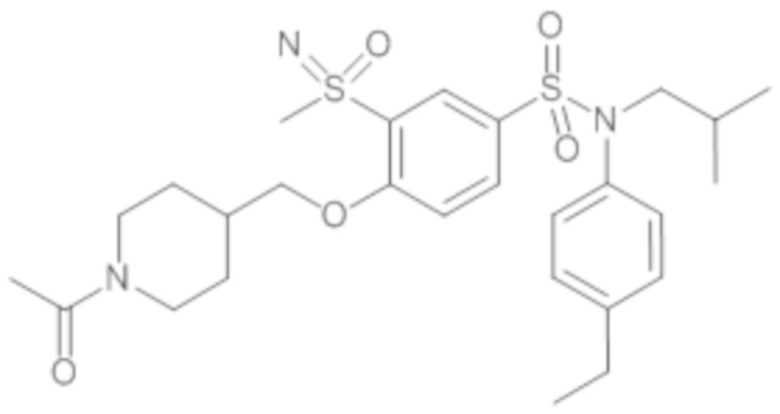
Соединение 50
Способом, аналогичным способу, описанному для примера 32, получают 4-((1-ацетилпиперидин-4-ил)метокси)-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамид (6,5 мг; 10%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,7, 4,2 Гц, 6H), 1,08-1,23 (м, 5H), 1,22-1,35 (м, 2H), 1,43 (дт, J=13,4, 6,8 Гц, 1H), 1,88 (д, J=26,7 Гц, 2H), 2,01 (с, 3H), 2,09-2,14 (м, 1H), 2,61 (к, J=7,6 Гц, 3H), 3,08 (т, J=12,8 Гц, 1H), 3,18 (с, 3H), 3,22-3,30 (м, 2H), 3,87 (д, J=13,6 Гц, 1H), 4,11 (к, J=4,4 Гц, 2H), 4,42 (д, J=11,5 Гц, 2H), 7,01 (д, J=7,9 Гц, 2H), 7,21 (д, J=8,2 Гц, 2H), 7,38 (д, J=8,8 Гц, 1H), 7,67 (дд, J=8,8, 2,4 Гц, 1H), 8,00 (д, J=2,4 Гц, 1H).
MS: [M+H]=550
Пример 37: Синтез N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-((1-(метилсульфонилпиперидин-4-ил)метокси)бензолсульфонамида

Соединение 51
Способом, аналогичным способу, описанному для примера 33, получают N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-((1-(метилсульфонил)пиперидин-4-ил)метокси)бензолсульфонамид (17,2 мг; 25%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,7, 4,3 Гц, 6H), 1,19 (т, J=7,6 Гц, 3H), 1,37-1,51 (м, 3H), 1,89-2,04 (м, 3H), 2,61 (к, J=7,7 Гц, 2H), 2,72-2,83 (м, 2H), 2,88 (с, 3H), 3,18 (с, 3H), 3,28 (д, J=7,8 Гц, 2H), 3,62 (д, J=11,5 Гц, 2H), 4,09-4,20 (м, 2H), 4,42 (с, 1H), 7,01 (д, J=8,0 Гц, 2H), 7,21 (д, J=8,1 Гц, 2H), 7,39 (д, J=8,8 Гц, 1H), 7,68 (дд, J=8,7, 2,5 Гц, 1H), 8,00 (д, J=2,5 Гц, 1H).
MS: [M+H]=586
Пример 38: Синтез N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамида
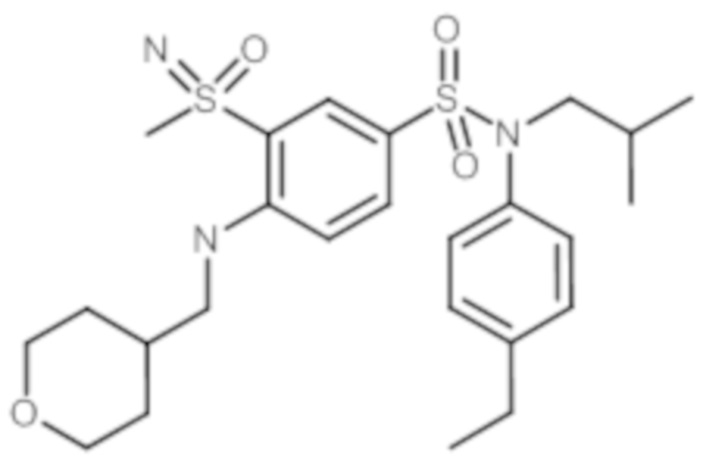
Соединение 52
Смесь 4-бром-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамида (15,0 мг; 0,03 ммоль) и 4-аминометилтетрагидропирана (7,5 мкл; 0,06 ммоль) перемешивают в течение ночи при температуре окружающей среды.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-[(тетрагидропиран-4-илметил)амино]бензолсульфонамид (9,0 мг; 56%) получают в виде белого твердого вещества.
1H ЯМР(DMSO-d6, 400 МГц): δ (млн.д.) 0,84 (дд, J=6,7, 2,6 Гц, 6H), 1,18 (т, J=7,7 Гц, 3H), 1,28 (дд, J=14,5, 10,3 Гц, 2H), 1,37-1,46 (м,1H), 1,66 (д, J=13,3 Гц, 2H), 1,87 (с, 1H), 2,61 (к, J=7,4 Гц, 2H), 3,01 (с, 3H), 3,17 (к, J=6,8, 6,4 Гц, 2H), 3,24 (дд, J=7,4, 3,3 Гц, 2H), 3,89 (дд, J=11,6, 4,0 Гц, 2H), 4,74 (с, 1H), 6,95 (д, J=8,9 Гц, 1H), 7,00 (д, J=7,9 Гц, 2H), 7,20 (д, J=8,1 Гц, 2H), 7,50 (д, J=9,0 Гц, 1H), 7,70 (д, J=2,3 Гц, 1H), 7,84 (т, J=5,5 Гц, 1H).
MS: [M+H]=508
Пример 39: Синтез N-(4-этилфенил)-N-изобутил-4-(метил((тетрагидро-2H-пиран-4-ил)метил)амино)-3-(S-метилсульфонимидоил)бензолсульфонамида

Соединение 53
Раствор 4-бром-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамида (15,0 мг; 0,03 ммоль) в N,N-диметилформамиде (0,20 мл) перемешивают в течение ночи при температуре 50°C.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). N-(4-этилфенил)-N-изобутил-4-(метил((тетрагидро-2H-пиран-4-ил)метил)амино)-3-(S-метилсульфонимидоил)бензолсульфонамид (9,0 мг; 49%) получают в виде бесцветной сухой пленки.
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,6, 3,2 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,44 (дт, J=13,7, 6,8 Гц, 1H), 1,58 (д, J=13,4 Гц, 2H), 1,93 (с, 1H), 2,61 (к, J=7,6 Гц, 2H), 2,82 (с, 3H), 2,93-3,10 (м, 2H), 3,26 (д, J=1,3 Гц, 3H), 3,28-3,30 (м, 2H), 3,80-3,87 (м, 2H), 4,50 (д, J=1,5 Гц, 1H), 7,00 (д, J=8,4 Гц, 2H), 7,20 (д, J=8,3 Гц, 2H), 7,56 (д, J=8,6 Гц, 1H), 7,61 (дд, J=8,6, 2,2 Гц, 1H), 8,13 (д, J=2,3 Гц, 1H).
MS: [M+H]=522
Пример 40: Синтез N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-((оксетан-3-илметил)амино-бензолсульфонамида
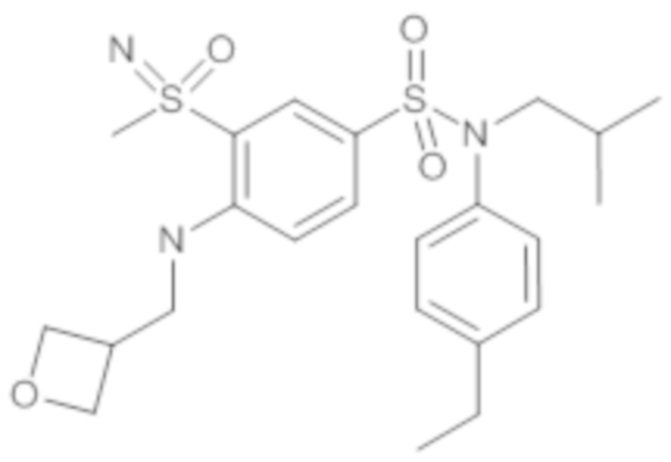
Соединение 54
К 4-бром-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамиду (50,00 мг; 0,11 ммоль) в растворе в N,N-диметилформамиде (250 мкл) добавляют гидорохлорид 3-аминометилоксетана (33 мг; 0,26 ммоль) и триэтиламин (51 мкл; 0,37 ммоль). Реакционную среду перемешивают в течение ночи при 50°C.
Неочищенный продукт очищают непосредственно препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-((оксетан-3-илметил)амино)бензолсульфонамид (14,0 мг; 26%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,7, 2,2 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,35-1,50 (м, 1H), 2,61 (к, J=7,7 Гц, 2H), 3,00 (с, 3H), 3,25 (д, J=6,9 Гц, 2H), 3,58 (дт, J=14,5, 7,1 Гц, 2H), 4,35 (тд, J=6,0, 2,8 Гц, 2H), 4,70 (тд, J=6,4, 3,3 Гц, 3H), 6,99 (дд, J=8,5, 5,0 Гц, 3H), 7,20 (д, J=7,8 Гц, 2H), 7,51 (дд, J=8,8, 2,5 Гц, 1H), 7,71 (д, J=2,5 Гц, 1H), 7,82 (т, J=5,5 Гц, 1H).
MS: [M+H]=480
Способом, аналогичным способу, описанному для примера 40, получают:

Соединение 55
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,7, 3,3 Гц, 6H), 1,09 (с, 3H), 1,18 (т, J=7,6 Гц, 3H), 1,31-1,38 (м, 2H), 1,38-1,47 (м, 1H), 1,54 (ддт, J=14,2, 9,8, 5,0 Гц, 2H), 2,61 (к, J=7,7 Гц, 2H), 3,01 (с, 3H), 3,07-3,21 (м, 2H), 3,24 (p, J=5,6 Гц, 2H), 3,51-3,60 (м, 2H), 3,68 (дт, J=11,8, 4,4 Гц, 2H), 4,84 (с, 1H), 7,00 (д, J=8,1 Гц, 3H), 7,20 (д, J=7,9 Гц, 2H), 7,49 (дд, J=8,9, 2,4 Гц, 1H), 7,69 (д, J=2,5 Гц, 1H), 7,98 (т, J=5,1 Гц, 1H).
MS: [M+H]=522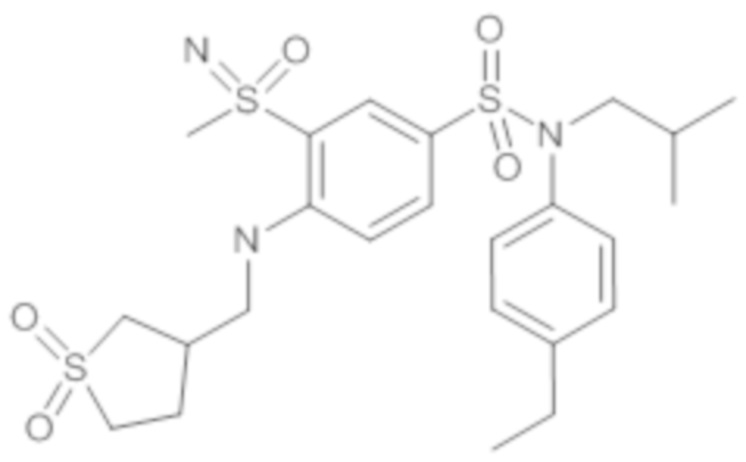
Соединение 56
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,6, 2,7 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,38-1,50 (м, 1H), 1,89 (д, J=22,1 Гц, 1H), 2,61 (к, J=7,6 Гц, 2H), 2,90 (т, J=12,1 Гц, 1H), 3,03 (д, J=1,5 Гц, 3H), 3,25 (дд, J=7,5, 3,9 Гц, 2H), 3,44 (т, J=6,3 Гц, 2H), 4,73 (д, J=6,3 Гц, 1H), 7,01 (дд, J=8,6, 5,9 Гц, 3H), 7,20 (д, J=8,3 Гц, 2H), 7,49 (дд, J=8,9, 2,4 Гц, 1H), 7,72 (д, J=2,3 Гц, 1H), 7,85 (с, 1H).
MS: [M+H]=542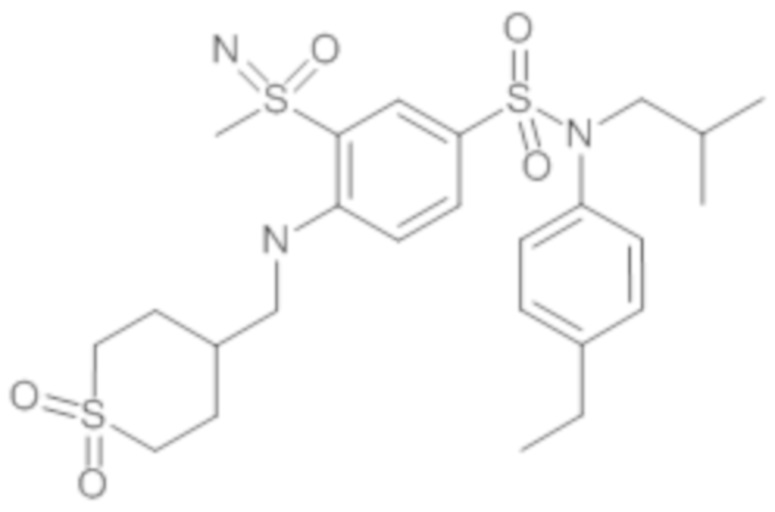
Соединение 57
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,7, 2,2 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (дт, J=13,5, 6,8 Гц, 1H), 1,71 (к, J=12,2 Гц, 2H), 1,91-1,98 (м, 1H), 2,06-2,14 (м, 2H), 2,61 (к, J=7,6 Гц, 2H), 3,02 (с, 3H), 3,10 (дд, J=28,9, 13,4 Гц, 2H), 3,23-3,28 (м, 4H), 4,74 (д, J=1,1 Гц, 1H), 6,97-7,02 (м, 3H), 7,20 (д, J=8,3 Гц, 2H), 7,50 (дд, J=8,9, 2,4 Гц, 1H), 7,71 (д, J=2,3 Гц, 1H), 7,84 (т, J=5,8 Гц, 1H).
MS: [M+H]=556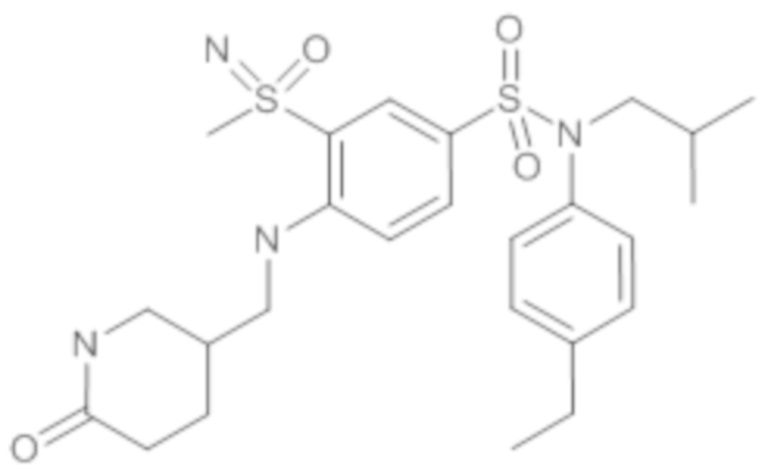
Соединение 58
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,6, 2,5 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (дт, J=13,6, 6,8 Гц, 1H), 1,47-1,59 (м, 1H), 1,83-1,93 (м, 1H), 2,02-2,11 (м, 1H), 2,16-2,25 (м, 2H), 2,60 (к, J=7,7 Гц, 2H), 2,90-2,98 (м, 1H), 3,02 (с, 3H), 3,23-3,29 (м, 3H), 4,75 (с, 1H), 6,97-7,04 (м, 3H), 7,17-7,23 (м, 2H), 7,44-7,53 (м, 2H), 7,71 (дд, J=2,3, 1,1 Гц, 1H), 7,83 (с, 1H).
MS: [M+H]=521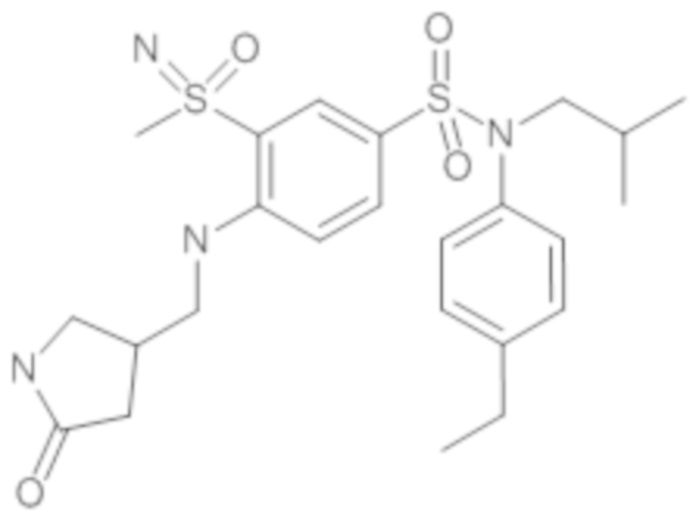
Соединение 59
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,6, 2,7 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (дт, J=13,5, 6,8 Гц, 1H), 2,00 (ддд, J=16,6, 6,8, 3,6 Гц, 1H), 2,29 (д, J=8,8 Гц, 1H), 2,60 (к, J=7,7 Гц, 2H), 2,68-2,78 (м, 1H), 3,02 (с, 3H), 3,24 (дд, J=7,3, 3,6 Гц, 2H), 3,33-3,44 (м, 2H), 4,74 (с, 1H), 6,97 (с, 1H), 7,00 (д, J=8,1 Гц, 2H), 7,16-7,23 (м, 2H), 7,50 (дд, J=8,9, 2,4 Гц, 1H), 7,59 (с, 1H), 7,71 (д, J=2,3 Гц, 1H), 7,83 (д, J=5,0 Гц, 1H).
MS: [M+H]=507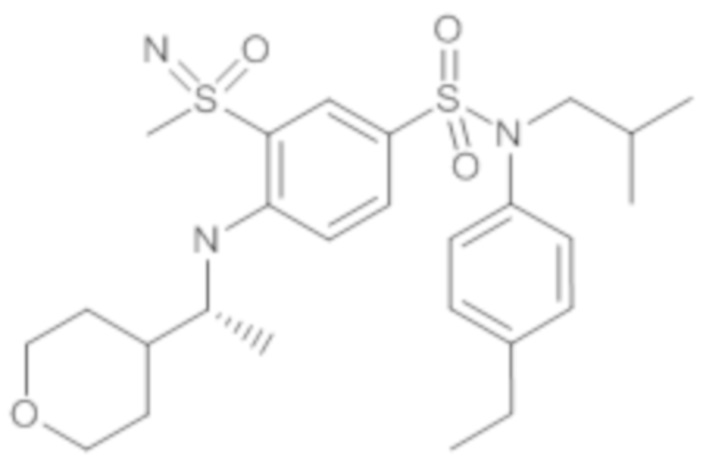
Соединение 60
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,7, 3,0 Гц, 6H), 1,10-1,23 (м, 6H), 1,26-1,40 (м, 1H), 1,42 (p, J=7,0 Гц, 2H), 1,57 (д, J=13,1 Гц, 2H), 1,62-1,79 (м, 1H), 2,61 (к, J=7,6 Гц, 2H), 2,99 (дд, J=4,0, 1,0 Гц, 3H), 3,19-3,30 (м, 4H), 3,56-3,69 (м, 1H), 3,84-3,95 (м, 2H), 4,78 (д, J=4,6 Гц, 1H), 6,94-7,02 (м, 1H), 7,01 (д, J=8,4 Гц, 2H), 7,16-7,25 (м, 2H), 7,43-7,53 (м, 1H), 7,70 (т, J=2,0 Гц, 1H), 7,80-7,90 (м, 1H).
MS: [M+H]=522
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,7, 3,0 Гц, 6H), 1,10-1,23 (м, 6H), 1,24-1,48 (м, 2H), 1,57 (д, J=13,0 Гц, 1H), 1,62-1,77 (м, 3H), 2,61 (к, J=7,6 Гц, 2H), 2,99 (дд, J=4,0, 1,0 Гц, 3H), 3,21-3,30 (м, 4H), 3,60 (д, J=20,4 Гц, 1H), 3,84-3,97 (м, 2H), 4,75-4,82 (м, 1H), 6,94-7,01 (м, 1H), 7,01 (д, J=8,4 Гц, 2H), 7,16-7,24 (м, 2H), 7,43-7,52 (м, 1H), 7,67-7,73 (м, 1H), 7,80-7,88 (м, 1H).
MS: [M+H]=522
Соединение 82
1H ЯМР (DMSO-d6) δ: 0,81-0,87 (м, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (p, J=6,6 Гц, 1H), 2,60 (к, J=7,6 Гц, 2H), 3,02 (т, J=1,1 Гц, 3H), 3,22-3,28 (м, 3H), 3,60 (ддт, J=11,1, 6,9, 3,9 Гц, 2H), 4,55 (с, 1H), 4,73 (д, J=11,6 Гц, 1H), 4,82 (с, 1H), 6,94-7,04 (м, 2H), 7,06 (д, J=8,9 Гц, 1H), 7,20 (д, J=8,2 Гц, 2H), 7,51 (дт, J=8,9, 2,1 Гц, 1H), 7,60 (с, 1H), 7,72 (дд, J=3,4, 2,3 Гц, 1H), 7,86-8,01 (м, 1H).
MS: [M+H]=509
Соединение 83
1H ЯМР (Хлороформ-d) δ: 0,90 (дд, J=9,1, 6,6 Гц, 6H), 1,25 (д, J=8,2 Гц, 4H), 2,31 (с, 2H), 2,44 (с, 2H), 2,58-2,66 (м, 2H), 3,04 (с, 3H), 3,07-3,23 (м, 4H), 3,24-3,37 (м, 2H), 3,75 (с, 1H), 6,67 (д, J=8,9 Гц, 1H), 7,00 (д, J=8,3 Гц, 2H), 7,14 (д, J=8,0 Гц, 2H), 7,58 (дд, J=8,8, 2,2 Гц, 1H), 8,03 (д, J=2,2 Гц, 1H).
MS: [M+H]=542
Соединение 84
1H ЯМР (Хлороформ-d) δ: 0,92 (дд, J=8,9, 6,7 Гц, 6H), 1,22-1,28 (м, 4H), 1,59 (гепрт, J=6,8 Гц, 1H), 1,90 (дддд, J=26,2, 18,2, 8,2, 4,9 Гц, 4H), 2,12 (с, 3H), 2,65 (к, J=7,8 Гц, 2H), 3,04 (с, 3H), 3,09-3,17 (м, 4H), 3,24 (дд, J=12,8, 6,9 Гц, 1H), 3,34 (дд, J=12,7, 7,7 Гц, 1H), 3,89 (дд, J=13,2, 3,5 Гц, 1H), 4,66-4,76 (м, 1H), 6,68 (д, J=9,0 Гц, 1H), 7,01 (д, J=8,0 Гц, 2H), 7,15 (д, J=8,0 Гц, 2H), 7,55 (дд, J=8,8, 2,0 Гц, 1H), 7,65 (к, J=4,4, 3,9 Гц, 1H), 7,99 (д, J=2,2 Гц, 1H).
MS: [M+H]=549
Соединение 85
1H ЯМР (Хлороформ-d) δ: 0,90 (дд, J=9,2, 6,6 Гц, 6H), 1,19-1,27 (м, 5H), 1,58 (гепрт, J=7,0 Гц, 1H), 2,55 (с, 2H), 2,64 (д, J=7,9 Гц, 2H), 3,03 (с, 3H), 3,29 (ддд, J=39,3, 12,4, 6,9 Гц, 3H), 3,67 (с, 1H), 3,87-3,99 (м, 1H), 6,02 (с, 1H), 6,74 (д, J=8,4 Гц, 1H), 7,00 (д, J=7,6 Гц, 2H), 7,14 (д, J=7,6 Гц, 2H), 7,56 (д, J=7,6 Гц, 1H), 7,92 (с, 1H), 8,02 (д, J=5,8 Гц, 1H).
MS: [M+H]=507
Соединение 86
1H ЯМР (DMSO-d6) δ: 0,84 (ддд, J=6,6, 2,3, 1,0 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (дт, J=13,6, 6,7 Гц, 1H), 2,12-2,24 (м, 1H), 2,61 (к, J=7,5 Гц, 2H), 3,04 (д, J=2,6 Гц, 3H), 3,07-3,21 (м, 1H), 3,23-3,27 (м, 2H), 3,65 (ддд, J=20,2, 13,3, 7,0 Гц, 1H), 4,44-4,56 (м, 1H), 4,74 (с, 1H), 4,80 (с, 1H), 7,00 (д, J=8,3 Гц, 2H), 7,20 (д, J=8,4 Гц, 2H), 7,54 (дт, J=8,3, 1,4 Гц, 1H), 7,73 (дд, J=4,0, 2,3 Гц, 1H), 7,98 (д, J=7,1 Гц, 1H), 8,12 (д, J=6,6 Гц, 1H).
MS: [M+H]=528
Соединение 87
1H ЯМР (DMSO-d6) δ: 0,84 (ддд, J=6,6, 2,3, 1,0 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (дт, J=13,6, 6,7 Гц, 1H), 2,12-2,24 (м, 1H), 2,61 (к, J=7,5 Гц, 2H), 3,04 (д, J=2,6 Гц, 3H), 3,07-3,21 (м, 1H), 3,23-3,27 (м, 2H), 3,65 (ддд, J=20,2, 13,3, 7,0 Гц, 1H), 4,44-4,56 (м, 1H), 4,74 (с, 1H), 4,80 (с, 1H), 7,00 (д, J=8,3 Гц, 2H), 7,20 (д, J=8,4 Гц, 2H), 7,54 (дт, J=8,3, 1,4 Гц, 1H), 7,73 (дд, J=4,0, 2,3 Гц, 1H), 7,98 (д, J=7,1 Гц, 1H), 8,12 (д, J=6,6 Гц, 1H).
MS: [M+H]=528
Соединение 88
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,6, 3,5 Гц, 6H), 1,13-1,23 (м, 3H), 1,43 (дт, J=13,6, 6,8 Гц, 1H), 2,61 (к, J=7,6 Гц, 2H), 2,80 (дт, J=6,8, 3,6 Гц, 4H), 3,25 (к, J=5,9, 5,3 Гц, 4H), 3,31 (с, 3H), 4,53-4,57 (м, 1H), 6,97-7,05 (м, 2H), 7,17-7,26 (м, 2H), 7,63 (д, J=8,4 Гц, 1H), 7,71 (дд, J=8,4, 2,3 Гц, 1H), 8,12 (д, J=2,3 Гц, 1H).
MS: [M+H]=496
Пример 55: Синтез N-(4-этилфенил)-4-(((3-гидроксициклобутил)метил)амино)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамида
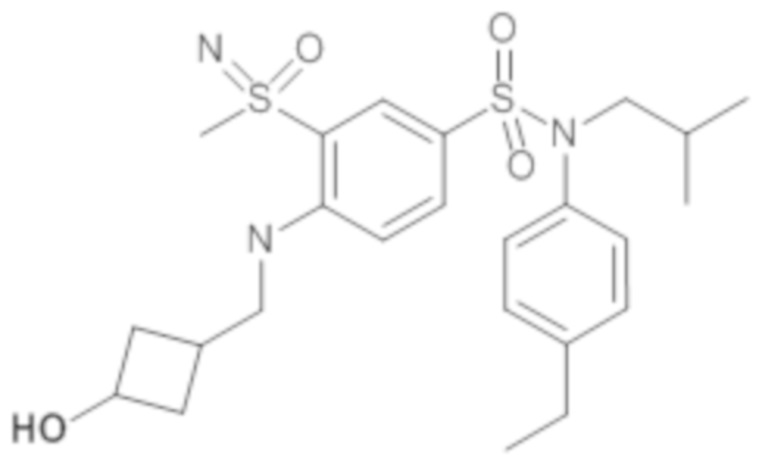
Соединение 61
К 4-бром-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамиду (50,00 мг; 0,11 ммоль) в растворе в N,N-диметилформамиде (150 мкл) добавляют гидрохлорид 3-аминометилциклобутанола (36,33 мг; 0,26 ммоль) и карбонат цезия (120,43 мг; 0,37 ммоль).
Реакционную среду перемешивают в течение выходных дней при температуре 50°C.
Неочищенный продукт очищают непосредственно препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). N-(4-этилфенил)-4-(((3-гидроксициклобутил)метил)амино)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамид (20,0 мг; 38%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,7, 2,4 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (дт, J=13,5, 6,7 Гц, 1H), 1,56 (к, J=8,7 Гц, 1H), 1,94-2,07 (м, 2H), 2,27-2,36 (м, 2H), 2,60 (к, J=7,6 Гц, 2H), 2,99 (с, 3H), 3,24 (дд, J=7,3, 3,5 Гц, 2H), 3,98 (дт, J=14,2, 7,4 Гц, 1H), 4,70 (д, J=1,3 Гц, 1H), 5,03 (т, J=3,1 Гц, 1H), 6,91 (т, J=8,6 Гц, 1H), 6,99 (дд, J=8,4, 1,6 Гц, 2H), 7,17-7,23 (м, 2H), 7,50 (дт, J=8,8, 2,9 Гц, 1H), 7,69 (д, J=2,3 Гц, 1H).
MS: [M+H]=494
Способом, аналогичным способу, описанному для примера 55, получают:

Соединение 62
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,7, 2,4 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (дт, J=13,6, 6,8 Гц, 1H), 1,81 (tq, J=19,3, 9,1 Гц, 4H), 2,09 (с, 1H), 2,60 (к, J=7,6 Гц, 2H), 3,02 (д, J=0,9 Гц, 3H), 3,25 (дд, J=7,3, 3,1 Гц, 2H), 3,51-3,63 (м, 4H), 3,74-3,82 (м, 2H), 4,76-4,83 (м, 1H), 7,00 (д, J=8,3 Гц, 2H), 7,06 (д, J=8,9 Гц, 1H), 7,17-7,22 (м, 2H), 7,50 (дд, J=8,9, 2,3 Гц, 1H), 7,72 (д, J=2,3 Гц, 1H), 8,01 (т, J=5,8 Гц, 1H).
MS: [M+H]=526
Соединение 89
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,7, 2,3 Гц, 6H), 1,11-1,23 (м, 3H), 1,42 (дт, J=13,6, 6,7 Гц, 1H), 2,55-2,66 (м, 2H), 2,99 (с, 3H), 3,25 (ддд, J=17,8, 9,7, 4,2 Гц, 4H), 3,51 (к, J=6,5 Гц, 1H), 3,56 (с, 3H), 3,67 (дт, J=12,1, 6,8 Гц, 2H), 4,00 (p, J=8,0 Гц, 2H), 4,69 (с, 1H), 6,95-7,05 (м, 3H), 7,16-7,24 (м, 2H), 7,50 (дд, J=8,9, 2,3 Гц, 1H), 7,71 (д, J=2,4 Гц, 1H), 7,81 (т, J=5,5 Гц, 1H).
MS: [M+H]=537
Соединение 90
1H ЯМР (DMSO-d6) δ: 0,83 (дд, J=6,6, 2,0 Гц, 6H), 1,17 (т, J=7,6 Гц, 3H), 1,41 (дт, J=13,6, 6,9 Гц, 1H), 2,45 (с, 3H), 2,59 (к, J=7,7 Гц, 2H), 3,10 (д, J=1,0 Гц, 3H), 3,24 (дд, J=7,4, 2,7 Гц, 2H), 4,58 (д, J=6,1 Гц, 2H), 4,79 (с, 1H), 6,74 (д, J=8,9 Гц, 1H), 6,95-7,00 (м, 2H), 7,13-7,23 (м, 4H), 7,45 (дд, J=8,8, 2,3 Гц, 1H), 7,76 (д, J=2,3 Гц, 1H), 8,19 (т, J=6,0 Гц, 1H), 8,40 (д, J=5,3 Гц, 1H).
MS: [M+H]=515
Соединение 91
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,7, 2,1 Гц, 6H), 1,00 (дт, J=7,0, 3,6 Гц, 1H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (дт, J=13,6, 6,8 Гц, 1H), 1,69 (гепрт, J=3,5 Гц, 2H), 2,56-2,66 (м, 2H), 3,02 (д, J=0,9 Гц, 3H), 3,25 (дд, J=7,4, 2,5 Гц, 2H), 3,58 (дд, J=8,2, 2,5 Гц, 2H), 3,74 (дд, J=8,3, 1,7 Гц, 2H), 4,71 (д, J=1,3 Гц, 1H), 6,91 (д, J=9,0 Гц, 1H), 6,95-7,01 (м, 2H), 7,15-7,25 (м, 2H), 7,50 (дд, J=8,8, 2,3 Гц, 1H), 7,70 (д, J=2,3 Гц, 1H), 7,77 (т, J=5,1 Гц, 1H).
MS: [M+H]=506
Соединение 92
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,7, 1,9 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (дт, J=13,6, 6,8 Гц, 1H), 1,51 (д, J=13,3 Гц, 2H), 1,62 (дт, J=15,5, 8,6 Гц, 2H), 2,61 (к, J=7,6 Гц, 2H), 3,02 (д, J=0,8 Гц, 3H), 3,20-3,30 (м, 2H), 3,59-3,70 (м, 2H), 4,69 (д, J=1,1 Гц, 1H), 4,80 (с, 1H), 6,93-7,03 (м, 3H), 7,16-7,23 (м, 2H), 7,48 (дд, J=8,9, 2,4 Гц, 1H), 7,72 (д, J=2,3 Гц, 1H), 7,88 (т, J=5,1 Гц, 1H).
MS: [M+H]=524
Соединение 93
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,7, 2,5 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,41 (дк, J=13,8, 6,9 Гц, 1H), 1,73 (д, J=13,3 Гц, 4H), 1,76-1,88 (м, 1H), 2,60 (к, J=7,6 Гц, 2H), 3,01 (д, J=1,0 Гц, 3H), 3,13-3,20 (м, 2H), 3,24 (дд, J=7,2, 3,3 Гц, 2H), 3,59 (с, 3H), 3,93-4,10 (м, 4H), 4,74 (д, J=1,3 Гц, 1H), 6,95 (д, J=8,9 Гц, 1H), 6,97-7,02 (м, 2H), 7,17-7,23 (м, 2H), 7,50 (дд, J=8,9, 2,4 Гц, 1H), 7,70 (д, J=2,3 Гц, 1H), 7,83 (т, J=5,4 Гц, 1H).
MS: [M+H]=565
Соединение 94
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,6, 2,5 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,41 (дт, J=13,5, 6,8 Гц, 1H), 1,58-1,76 (м, 1H), 1,93-2,08 (м, 2H), 2,60 (к, J=7,6 Гц, 2H), 3,02 (с, 3H), 3,07 (тд, J=8,5, 7,9, 3,9 Гц, 1H), 3,24 (дд, J=7,3, 3,2 Гц, 4H), 3,43 (тд, J=9,6, 8,2, 4,3 Гц, 1H), 3,50 (ддд, J=10,2, 7,3, 2,3 Гц, 1H), 3,58 (с, 3H), 4,75 (с, 1H), 6,96-7,03 (м, 3H), 7,17-7,23 (м, 2H), 7,50 (ддд, J=8,9, 2,3, 1,2 Гц, 1H), 7,70 (д, J=2,2 Гц, 1H), 7,83 (с, 1H).
MS: [M+H]=551
Соединение 95
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,6, 2,4 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,40 (дк, J=13,7, 6,9 Гц, 1H), 1,96 (ддд, J=10,0, 5,7, 2,0 Гц, 2H), 2,28-2,46 (м, 3H), 2,60 (к, J=7,6 Гц, 2H), 2,99 (д, J=0,9 Гц, 3H), 3,22 (dtd, J=14,0, 7,6, 7,0, 5,1 Гц, 4H), 4,49 (с, 2H), 4,59 (с, 2H), 4,71 (д, J=1,1 Гц, 1H), 6,89 (д, J=9,0 Гц, 1H), 6,97-7,02 (м, 2H), 7,17-7,21 (м, 2H), 7,49 (дд, J=8,9, 2,3 Гц, 1H), 7,69 (д, J=2,3 Гц, 1H).
MS: [M+H]=520
Соединение 96
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,6, 2,7 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (дк, J=13,9, 7,0 Гц, 2H), 1,86 (д, J=13,6 Гц, 1H), 1,96 (ддд, J=16,8, 10,8, 3,4 Гц, 1H), 2,10-2,32 (м, 2H), 2,60 (к, J=7,6 Гц, 2H), 3,02 (с, 3H), 3,13 (тд, J=12,4, 11,2, 6,5 Гц, 2H), 3,14-3,30 (м, 4H), 4,77 (с, 1H), 6,96-7,03 (м, 2H), 7,16-7,24 (м, 2H), 7,47-7,55 (м, 1H), 7,54-7,66 (м, 1H), 7,70 (дд, J=2,4, 1,4 Гц, 1H), 7,86 (д, J=5,9 Гц, 1H).
MS: [M+H]=521
Соединение 97
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,7, 2,2 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,41 (дк, J=13,7, 6,9 Гц, 1H), 2,23 (с, 3H), 2,42 (с, 3H), 2,61 (к, J=7,6 Гц, 2H), 3,00 (с, 3H), 3,26 (дд, J=7,3, 2,9 Гц, 2H), 4,28 (т, J=5,3 Гц, 2H), 4,75 (с, 1H), 6,95 (д, J=8,8 Гц, 1H), 6,99 (д, J=8,2 Гц, 2H), 7,20 (д, J=8,1 Гц, 2H), 7,59 (дд, J=8,7, 2,4 Гц, 1H), 7,72 (д, J=2,3 Гц, 1H), 7,80 (т, J=5,1 Гц, 1H).
MS: [M+H]=519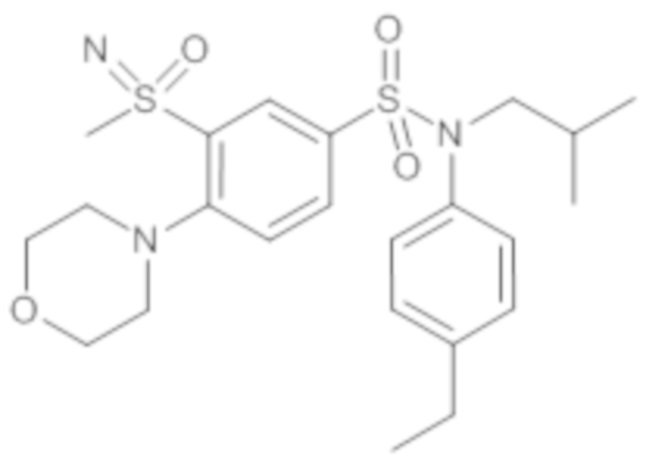
Соединение 123
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,7, 2,8 Гц, 6H), 1,01-1,10 (м, 2H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (дт, J=13,7, 6,8 Гц, 1H), 1,53 (тд, J=18,2, 15,7, 6,5 Гц, 2H), 1,73-1,90 (м, 4H), 2,60 (к, J=7,5 Гц, 2H), 3,00 (с, 3H), 3,08 (д, J=6,8 Гц, 2H), 3,24 (дд, J=7,5, 3,6 Гц, 2H), 4,53 (д, J=4,5 Гц, 1H), 4,74 (с, 1H), 6,91 (д, J=9,0 Гц, 1H), 7,00 (д, J=8,1 Гц, 2H), 7,20 (д, J=8,1 Гц, 2H), 7,49 (дд, J=8,8, 2,5 Гц, 1H), 7,69 (д, J=2,2 Гц, 1H), 7,81 (т, J=5,4 Гц, 1H).
MS: [M+H]=522
Соединение 99
1H ЯМР (Хлороформ-d) δ: 0,93 (дд, J=9,2, 6,8 Гц, 6H), 1,26 (т, J=7,6 Гц, 3H), 1,62 (дк, J=13,6, 7,0 Гц, 1H), 2,67 (к, J=7,6 Гц, 2H), 3,04 (дд, J=9,4, 6,0 Гц, 2H), 3,11 (с, 3H), 3,26 (дд, J=12,9, 7,0 Гц, 1H), 3,32-3,44 (м, 2H), 3,49 (д, J=7,0 Гц, 2H), 3,57 (h, J=6,8, 6,4 Гц, 1H), 6,74 (д, J=9,0 Гц, 1H), 7,02 (д, J=8,1 Гц, 2H), 7,17 (д, J=7,9 Гц, 2H), 7,58 (дд, J=8,8, 2,3 Гц, 1H), 8,03 (д, J=2,2 Гц, 1H).
MS: [M+H]=496
Соединение 100
1H ЯМР (Хлороформ-d) δ: 0,89 (дд, J=8,8, 6,6 Гц, 6H), 1,23 (т, J=7,9 Гц, 3H), 1,57 (гепрт, J=6,8 Гц, 1H), 1,65-1,90 (м, 1H), 2,06 (д, J=2,9 Гц, 3H), 2,21-2,24 (м, 2H), 2,63 (к, J=7,7 Гц, 2H), 3,03 (д, J=4,6 Гц, 3H), 3,27 (dtd, J=20,1, 12,9, 7,5 Гц, 5H), 3,47 (дт, J=19,3, 9,3 Гц, 1H), 3,55-3,83 (м, 2H), 6,60-6,72 (м, 1H), 6,98 (д, J=7,8 Гц, 2H), 7,13 (д, J=7,8 Гц, 2H), 7,54 (д, J=8,3 Гц, 1H), 7,69 (с, 1H), 7,98 (дд, J=4,5, 2,1 Гц, 1H).
MS: [M+H]=535
1H ЯМР (DMSO-d6) δ: 0,77 (дд, J=6,3, 2,6 Гц, 3H), 0,82-0,88 (м, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,44 (дт, J=13,7, 6,8 Гц, 1H), 2,61 (ддт, J=8,7, 6,3, 3,4 Гц, 2H), 3,40 (дд, J=17,2, 1,2 Гц, 3H), 3,44-3,50 (м, 1H), 3,68 (ддд, J=11,1, 8,0, 3,0 Гц, 1H), 3,78 (ддт, J=7,9, 5,2, 2,8 Гц, 1H), 3,87 (дд, J=10,9, 2,4 Гц, 1H), 4,47 (д, J=1,5 Гц, 1H), 4,62 (д, J=1,5 Гц, 1H), 6,92-7,05 (м, 2H), 7,19 (дд, J=8,4, 2,2 Гц, 2H), 7,68 (д, J=1,3 Гц, 1H), 7,70-7,72 (м, 1H), 8,09 (д, J=1,9 Гц, 1H), 8,25 (т, J=1,3 Гц, 1H).
MS: [M+H]=494
1H ЯМР (Хлороформ-d) δ: 0,90 (дд, J=9,3, 6,7 Гц, 6H), 1,23 (т, J=7,6 Гц, 3H), 1,59 (дк, J=13,8, 6,8 Гц, 1H), 2,64 (к, J=7,6 Гц, 2H), 3,06 (д, J=2,6 Гц, 3H), 3,24 (ддд, J=12,8, 7,0, 2,1 Гц, 1H), 3,34 (ддд, J=12,9, 7,8, 3,3 Гц, 1H), 3,44 (ддд, J=8,6, 5,9, 2,4 Гц, 1H), 3,53-3,68 (м, 1H), 3,82 (т, J=8,7 Гц, 1H), 4,93 (qd, J=6,0, 3,9 Гц, 1H), 5,07 (с, 1H), 6,75 (дд, J=8,8, 3,0 Гц, 1H), 6,94-7,03 (м, 2H), 7,13-7,19 (м, 2H), 7,57 (дт, J=8,8, 2,4 Гц, 1H), 8,01 (дд, J=5,5, 2,2 Гц, 1H).
MS: [M+H]=509 Соединение 106
Соединение 106
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,6, 1,9 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (дд, J=13,7, 7,0 Гц, 1H), 1,52 (тд, J=17,8, 15,2, 7,1 Гц, 2H), 1,94-2,09 (м, 2H), 2,60 (к, J=7,6 Гц, 2H), 3,01 (с, 3H), 3,24 (д, J=7,4 Гц, 2H), 3,37-3,46 (м, 2H), 3,78 (д, J=11,5 Гц, 2H), 4,69 (с, 1H), 6,99 (д, J=8,2 Гц, 3H), 7,20 (д, J=8,4 Гц, 2H), 7,47 (дд, J=8,9, 2,4 Гц, 1H), 7,70 (д, J=2,3 Гц, 1H), 7,85 (с, 1H).
MS: [M+H]=509
Соединение 107
1H ЯМР (Хлороформ-d) δ: 0,90 (д, J=7,3 Гц, 6H), 1,17-1,27 (м, 3H), 1,45-1,68 (м, 2H), 2,57-2,68 (м, 2H), 3,01-3,4 (м, 2H), 3,19-3,40 (м, 2H), 3,48-3,52 (м, 1H), 3,99 (с, 1H), 6,03 (д, J=40,9 Гц, 1H), 6,72 (с, 1H), 7,00 (д, J=7,3 Гц, 2H), 7,15 (д, J=7,3 Гц, 2H), 7,57 (с, 1H), 8,00 (с, 1H).
MS: [M+H]=508
Соединение 109
1H ЯМР (DMSO-d6) δ: 0,86 (дд, J=6,7, 4,1 Гц, 6H), 1,19 (т, J=7,6 Гц, 3H), 1,44 (дт, J=13,6, 6,8 Гц, 1H), 1,63 (к, J=5,6 Гц, 2H), 1,83 (с, 2H), 2,61 (к, J=7,6 Гц, 2H), 2,92 (д, J=17,9 Гц, 2H), 3,17 (с, 2H), 3,27 (д, J=1,2 Гц, 3H), 3,33 (с, 2H), 4,29 (д, J=5,6 Гц, 2H), 4,42-4,62 (м, 3H), 6,97-7,05 (м, 2H), 7,18-7,25 (м, 2H), 7,64-7,75 (м, 2H), 8,15 (д, J=2,0 Гц, 1H).
MS: [M+H]=520
Соединение 110
1H ЯМР (DMSO-d6) δ: 0,83 (дд, J=6,6, 3,4 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,39 (с, 9H), 2,60 (к, J=7,6 Гц, 2H), 3,12 (д, J=1,5 Гц, 3H), 3,23 (дд, J=7,3, 5,1 Гц, 2H), 4,05 (с, 4H), 4,20 (д, J=1,7 Гц, 1H), 4,43 (с, 4H), 6,59 (д, J=8,9 Гц, 1H), 6,94-7,01 (м, 2H), 7,15-7,23 (м, 2H), 7,42 (дд, J=8,8, 2,4 Гц, 1H), 7,94 (д, J=2,3 Гц, 1H).
MS: [M+H]=591
Соединение 111
1H ЯМР (DMSO-d6) δ: 0,83 (дд, J=6,4, 3,3 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,33-1,47 (м, 1H), 2,60 (к, J=7,6 Гц, 2H), 3,12 (с, 3H), 3,24 (h, J=6,7, 5,8 Гц, 3H), 4,20 (с, 1H), 4,48 (с, 4H), 4,73 (с, 4H), 6,61 (д, J=8,8 Гц, 1H), 6,98 (д, J=7,9 Гц, 2H), 7,19 (д, J=8,2 Гц, 2H), 7,42 (дд, J=8,8, 2,3 Гц, 1H), 7,93 (д, J=2,4 Гц, 1H).
MS: [M+H]=493
Соединение 112
1H ЯМР (DMSO-d6) δ: 0,90 (дд, J=6,8, 3,4 Гц, 6H), 1,23 (т, J=7,6 Гц, 3H), 1,41-1,55 (м, 1H), 2,00 (д, J=5,7 Гц, 4H), 2,66 (к, J=7,6 Гц, 2H), 2,89-3,09 (м, 4H), 3,36 (с, 3H), 4,43 (с, 4H), 4,57 (с, 1H), 7,04 (д, J=8,0 Гц, 2H), 7,25 (д, J=8,1 Гц, 2H), 7,62 (д, J=8,4 Гц, 1H), 7,72 (дд, J=8,3, 2,3 Гц, 1H), 8,18 (д, J=2,3 Гц, 1H).
MS: [M+H]=407
Соединение 113
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,8, 3,4 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,34-1,49 (м, 1H), 2,60 (к, J=7,6 Гц, 2H), 3,13 (с, 3H), 3,25 (дд, J=7,4, 5,1 Гц, 2H), 4,28 (с, 1H), 4,52 (д, J=4,5 Гц, 8H), 6,66 (д, J=8,9 Гц, 1H), 6,98 (д, J=8,1 Гц, 2H), 7,19 (д, J=8,0 Гц, 2H), 7,45 (дд, J=8,8, 2,3 Гц, 1H), 7,96 (д, J=2,3 Гц, 1H).
MS: [M+H]=540
Соединение 114
1H ЯМР (DMSO-d6) δ: 0,84 (д, J=6,7 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,35-1,50 (м, 1H), 2,16-2,30 (м, 2H), 2,61 (к, J=7,5 Гц, 2H), 3,21 (с, 3H), 3,28 (д, J=7,3 Гц, 2H), 3,42-3,62 (м, 2H), 3,68-3,83 (м, 2H), 4,21 (с, 1H), 4,54 (дд, J=6,0, 3,6 Гц, 2H), 4,60 (дд, J=14,2, 5,9 Гц, 2H), 7,01 (д, J=7,9 Гц, 2H), 7,19 (дд, J=8,5, 4,5 Гц, 3H), 7,49 (дд, J=8,8, 2,4 Гц, 1H), 8,05 (д, J=2,4 Гц, 1H).
MS: [M+H]=520
Соединение 115
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,7, 1,5 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,36-1,48 (м, 1H), 1,82-1,97 (м, 2H), 2,53-2,66 (м, 3H), 3,18 (дд, J=7,4, 1,3 Гц, 3H), 3,28 (дд, J=7,3, 1,7 Гц, 2H), 3,35-3,48 (м, 1H), 3,77 (тд, J=7,6, 1,7 Гц, 1H), 3,81-3,97 (м, 2H), 4,11 (д, J=1,7 Гц, 0,5H), 4,46 (д, J=1,5 Гц, 0,5H), 4,60-4,84 (м, 2H), 6,97-7,05 (м, 2H), 7,14-7,27 (м, 3H), 7,44 (ддд, J=8,4, 5,7, 2,4 Гц, 1H), 8,07 (дд, J=14,5, 2,4 Гц, 1H).
MS: [M+H]=493
Соединение 117
1H ЯМР (DMSO-d6) δ: 0,83 (дт, J=5,7, 2,8 Гц, 6H), 1,16 (тд, J=7,6, 2,7 Гц, 3H), 1,20-1,31 (м, 1H), 1,34-1,49 (м, 1H), 1,87-1,99 (м, 2H), 2,59 (к, J=7,6 Гц, 2H), 3,17-3,26 (м, 4H), 3,34 (с, 3H), 3,67-3,88 (м, 3H), 4,49 (с, 1H), 6,95-7,01 (м, 2H), 7,15-7,22 (м, 2H), 7,58-7,68 (м, 2H), 8,10 (д, J=2,2 Гц, 1H).
MS: [M+H]=493
Соединение 118
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,7, 1,4 Гц, 7H), 1,18 (т, J=7,6 Гц, 3H), 1,34-1,47 (м, 1H), 2,60 (к, J=7,6 Гц, 2H), 3,08 (с, 3H), 3,25 (д, J=7,4 Гц, 4H), 4,86 (д, J=5,7 Гц, 2H), 6,92-7,03 (м, 3H), 7,15-7,23 (м, 2H), 7,53 (дд, J=8,8, 2,3 Гц, 1H), 7,74 (д, J=2,3 Гц, 1H), 8,20 (т, J=5,7 Гц, 1H).
MS: [M+H]=494
Пример 89: Синтез N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-(2,6-диазаспиро[3.3]гептан-2-ил)бензолсульфонамид

Соединение 121
Трифторуксусную кислоту (0,28 мл; 3.59 ммоль) добавляют к трет-бутил-6-(4-(N-(4-этилфенил)-N-изобутилсульфамоил)-2-(S-метилсульфонимидоил)фенил)-2,6-диазаспиро[3.3]гептан-2-карбоксилату (55,0 мг; 0,09 ммоль) в растворе в дихлорметане (2,75 мл). Реакционную среду перемешивают в течение 4 часов при температуре окружающей среды, концентрируют в вакууме, разбавляют этилацетатом, промывают насыщенным раствором гидрокарбонат натрия, затем насыщенным раствором хлорида натрия, сушат (Na2SO4) и концентрируют. Остаток ресуспендируют в простом эфире и сушат.
N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-(2,6-диазаспиро[3.3]гептан-2-ил)бензолсульфонамид (44,9 мг; 880%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,83 (дд, J=6,6, 3,3 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,25 (с, 1H), 1,34-1,47 (м, 1H), 2,60 (к, J=7,6 Гц, 2H), 3,12 (д, J=1,8 Гц, 3H), 3,23 (дд, J=7,2, 4,7 Гц, 2H), 3,79 (с, 2H), 4,21 (д, J=7,3 Гц, 1H), 4,37 (с, 1H), 4,40 (с, 2H), 6,61 (дд, J=9,1, 3,7 Гц, 1H), 6,94-7,01 (м, 2H), 7,15-7,23 (м, 2H), 7,41 (дд, J=8,8, 2,3 Гц, 1H), 7,93 (дд, J=4,7, 2,3 Гц, 1H).
MS: [M+H]=492
Пример 90: Синтез 4-(6-ацетил-2,6-диазаспиро[3.3]гептан-2-ил)-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамида

Соединение 122
К раствору (4-этилфенил)изобутиламида 4-оксо-1-пиперидин-4-ил-1,2,3,4-тетрагидро-хинолин-6-сульфоновой кислоты (29,0 мг; 0,06 ммоль) в дихлорметане (1,45 мл), охлажденному до -10°C, добавляют 4-диметиламинопиридин (0,72 мг; 0,01 ммоль) и уксусный ангидрид (5,6 мкл; 0,06 ммоль). Реакционную среду перемешивают 30 минут при температуре окружающей среды. Реакционную среду гидролизуют насыщенным раствором гидрокарбонат натрия затем экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором, сушат (Na2SO4) и концентрируют.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). 4-(6-ацетил-2,6-диазаспиро[3.3]гептан-2-ил)-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамид (23,10 мг; 73%): получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,8, 3,4 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,34-1,47 (м, 1H), 1,76 (с, 3H), 2,60 (к, J=7,6 Гц, 2H), 3,12 (с, 3H), 3,16-3,28 (м, 2H), 4,03 (с, 2H), 4,21 (с, 1H), 4,31 (с, 2H), 4,45 (с, 4H), 6,61 (д, J=8,9 Гц, 1H), 6,98 (д, J=8,0 Гц, 2H), 7,19 (д, J=8,0 Гц, 2H), 7,43 (дд, J=8,8, 2,3 Гц, 1H), 7,94 (д, J=2,3 Гц, 1H).
MS: [M+H]=533
Пример 91: Синтез 4-(4-ацетилпиперазин-1-ил)-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамида
Соединение 63
Смесь 4-бром-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамида (50,0 мг; 0,11 ммоль) и 1-пиперазин-1-ил-этанона (67,68 мг; 0,53 ммоль) перемешивают в течение выходных дней при 50°C.
Неочищенный продукт очищают непосредственно препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). 4-(4-ацетилпиперазин-1-ил)-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамид (20,0 мг; 36%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,7, 3,5 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,44 (дт, J=13,7, 6,9 Гц, 1H), 2,61 (к, J=7,6 Гц, 2H), 3,04 (дк, J=23,9, 5,3 Гц, 4H), 3,34 (д, J=1,2 Гц, 3H), 3,61 (д, J=5,4 Гц, 4H), 4,57 (д, J=1,4 Гц, 1H), 6,97-7,05 (м, 2H), 7,17-7,25 (м, 2H), 7,62 (д, J=8,4 Гц, 1H), 7,71 (дд, J=8,4, 2,3 Гц, 1H), 8,14 (д, J=2,3 Гц, 1H).
MS: [M+H]=521
Пример 92: Синтез N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-()пиперидин-4-илметил)амино)бензолсульфонамида
Соединение 64
Смесь 4-бром-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамида (50,0 мг; 0,11 ммоль) и 4-пиколинамина (53,62 мкл; 0,53 ммоль) перемешивают в течение выходных дней при 50°C.
Неочищенный продукт очищают непосредственно препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-()пиперидин-4-илметил)амино)бензолсульфонамид (26,0 мг; 49%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,83 (д, J=6,7 Гц, 6H), 1,17 (т, J=7,6 Гц, 3H), 1,41 (гепрт, J=6,7 Гц, 1H), 2,59 (к, J=7,5 Гц, 2H), 3,11 (с, 3H), 3,23 (дд, J=7,3, 2,5 Гц, 2H), 4,64 (д, J=5,9 Гц, 2H), 4,79 (с, 1H), 6,75 (д, J=8,8 Гц, 1H), 6,97 (д, J=7,9 Гц, 2H), 7,18 (д, J=8,0 Гц, 2H), 7,36 (д, J=5,1 Гц, 2H), 7,44 (дд, J=9,1, 2,4 Гц, 1H), 7,76 (д, J=2,4 Гц, 1H), 8,21 (т, J=6,0 Гц, 1H), 8,54 (д, J=5,2 Гц, 2H).
MS: [M+H]=501
Способом, аналогичным способу, описанному для примера 92, получают:

Соединение 124
1H ЯМР (DMSO-d6) δ: 0,81 (т, J=7,6 Гц, 3H), 0,84 (дд, J=6,7, 3,4 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,38-1,57 (м, 7H), 2,61 (к, J=7,6 Гц, 2H), 3,00 (д, J=0,8 Гц, 3H), 3,10-3,21 (м, 2H), 3,21-3,28 (м, 2H), 3,61 (к, J=6,2 Гц, 4H), 4,85 (с, 1H), 6,99-7,04 (м, 3H), 7,16-7,24 (м, 2H), 7,51 (дд, J=8,9, 2,3 Гц, 1H), 7,69 (д, J=2,3 Гц, 1H), 7,92 (т, J=4,9 Гц, 1H).
MS: [M+H]=536
Соединение 125
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,6, 2,6 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (дт, J=13,7, 6,9 Гц, 1H), 1,61 (ддд, J=14,2, 9,0, 4,2 Гц, 2H), 1,75 (т, J=10,6 Гц, 2H), 2,61 (к, J=7,6 Гц, 2H), 3,00 (д, J=0,9 Гц, 3H), 3,13 (с, 3H), 3,19-3,32 (м, 4H), 3,57 (ддд, J=11,1, 8,5, 2,5 Гц, 2H), 3,62-3,70 (м, 2H), 4,74 (д, J=1,1 Гц, 1H), 6,96 (д, J=9,0 Гц, 1H), 6,99-7,04 (м, 2H), 7,16-7,22 (м, 2H), 7,51 (дд, J=8,8, 2,3 Гц, 1H), 7,71 (д, J=2,2 Гц, 1H), 7,81 (т, J=4,7 Гц, 1H).
Соединение 126
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,6, 3,0 Гц, 6H), 0,91 (т, J=7,4 Гц, 3H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (дт, J=13,7, 6,8 Гц, 1H), 1,70-1,81 (м, 2H), 2,61 (к, J=7,6 Гц, 2H), 3,01 (д, J=0,9 Гц, 3H), 3,21-3,30 (м, 2H), 3,37-3,56 (м, 2H), 4,36 (д, J=1,3 Гц, 2H), 4,38 (д, J=5,0 Гц, 2H), 4,80 (с, 1H), 6,97-7,04 (м, 2H), 7,05 (д, J=9,0 Гц, 1H), 7,16-7,25 (м, 2H), 7,53 (дд, J=8,8, 2,3 Гц, 1H), 7,71 (д, J=2,4 Гц, 1H), 7,98 (т, J=5,1 Гц, 1H).
MS: [M+H]=508
Соединение 127
1H ЯМР (DMSO-d6) δ: 0,83 (дд, J=6,6, 1,9 Гц, 6H), 1,17 (т, J=7,6 Гц, 3H), 1,42 (дк, J=13,6, 6,7 Гц, 1H), 2,54-2,64 (м, 2H), 3,09 (д, J=0,9 Гц, 3H), 3,24 (дд, J=7,3, 2,6 Гц, 2H), 3,84 (с, 3H), 4,58 (д, J=6,0 Гц, 2H), 4,79 (с, 1H), 6,73-6,77 (м, 2H), 6,95-6,99 (м, 3H), 7,15-7,20 (м, 2H), 7,44 (дд, J=8,8, 2,4 Гц, 1H), 7,76 (д, J=2,3 Гц, 1H), 8,13 (дд, J=5,3, 0,7 Гц, 1H), 8,17 (т, J=6,1 Гц, 1H).
MS: [M+H]=531
Соединение 128
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,7, 3,3 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,43 (дт, J=13,4, 6,6 Гц, 1H), 1,60 (т, J=9,5 Гц, 2H), 1,82-1,91 (м, 2H), 2,61 (к, J=7,6 Гц, 2H), 2,84 (к, J=9,2 Гц, 2H), 3,18-3,30 (м, 4H), 3,66 (с, 1H), 4,52 (д, J=1,5 Гц, 1H), 4,71 (д, J=4,3 Гц, 1H), 6,95-7,04 (м, 2H), 7,17-7,24 (м, 2H), 7,59 (д, J=8,4 Гц, 1H), 7,67 (дд, J=8,4, 2,3 Гц, 1H), 8,12 (д, J=2,3 Гц, 1H).
MS: [M+H]=494
Соединение 129
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,6, 1,5 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (дт, J=13,6, 6,8 Гц, 1H), 1,86 (д, J=9,6 Гц, 1H), 2,01 (ддд, J=14,4, 10,7, 4,8 Гц, 1H), 2,60 (к, J=7,6 Гц, 2H), 3,21 (дд, J=12,9, 1,3 Гц, 3H), 3,27-3,29 (м, 2H), 3,67 (к, J=8,2 Гц, 1H), 3,73-3,85 (м, 1H), 3,91 (дд, J=10,8, 4,5 Гц, 1H), 4,01 (д, J=1,8 Гц, 1H), 4,28 (д, J=1,5 Гц, 1H), 4,39 (с, 1H), 5,01 (дд, J=19,6, 3,4 Гц, 1H), 7,01 (д, J=8,4 Гц, 1H), 7,12 (дд, J=12,6, 8,9 Гц, 1H), 7,20 (д, J=8,4 Гц, 2H), 7,43 (дд, J=8,9, 2,4 Гц, 1H), 8,05 (д, J=2,4 Гц, 1H).
MS: [M+H]=480
Соединение 130
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,6, 1,5 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (дт, J=13,6, 6,8 Гц, 1H), 1,86 (д, J=9,6 Гц, 1H), 2,01 (ддд, J=14,4, 10,7, 4,8 Гц, 1H), 2,60 (к, J=7,6 Гц, 2H), 3,21 (дд, J=12,9, 1,3 Гц, 3H), 3,27-3,29 (м, 2H), 3,67 (к, J=8,2 Гц, 1H), 3,73-3,85 (м, 1H), 3,91 (дд, J=10,8, 4,5 Гц, 1H), 4,01 (д, J=1,8 Гц, 1H), 4,28 (д, J=1,5 Гц, 1H), 4,39 (с, 1H), 5,01 (дд, J=19,6, 3,4 Гц, 1H), 7,01 (д, J=8,4 Гц, 1H), 7,12 (дд, J=12,6, 8,9 Гц, 1H), 7,20 (д, J=8,4 Гц, 2H), 7,43 (дд, J=8,9, 2,4 Гц, 1H), 8,05 (д, J=2,4 Гц, 1H).
MS: [M+H]=480
Соединение 131
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,6, 3,1 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,41 (дт, J=14,1, 7,0 Гц, 1H), 2,60 (к, J=7,7 Гц, 2H), 3,11 (д, J=1,3 Гц, 3H), 3,24 (дд, J=7,3, 4,5 Гц, 2H), 4,02 (дд, J=10,5, 5,7 Гц, 2H), 4,20 (д, J=1,5 Гц, 1H), 4,50 (с, 2H), 5,71 (с, 1H), 6,63 (д, J=8,9 Гц, 1H), 6,99 (д, J=8,4 Гц, 2H), 7,16-7,25 (м, 2H), 7,40 (дд, J=8,8, 2,3 Гц, 1H), 7,94 (д, J=2,4 Гц, 1H).
MS: [M+H]=466
Соединение 132
1H ЯМР (DMSO-d6) δ: 0,84 (дд, J=6,6, 2,0 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,42 (p, J=6,9 Гц, 1H), 1,76 (д, J=6,2 Гц, 4H), 2,61 (к, J=7,6 Гц, 2H), 2,73 (к, J=5,9 Гц, 4H), 2,96 (д, J=0,9 Гц, 3H), 3,25 (дд, J=7,4, 1,6 Гц, 2H), 3,55-3,72 (м, 2H), 4,29 (дд, J=8,5, 6,6 Гц, 2H), 4,59 (с, 1H), 4,78 (д, J=6,7 Гц, 2H), 6,97-7,02 (м, 3H), 7,17-7,23 (м, 2H), 7,53 (дд, J=8,8, 2,4 Гц, 1H), 7,72 (д, J=2,3 Гц, 1H), 7,85 (т, J=4,2 Гц, 1H).
MS: [M+H]=549
Пример 103: Синтез N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-((пиримидин-4-илметил)амино)бензолсульфонамида

Соединение 133
4-бром-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамид (50,0 мг; 0,11 ммоль) и 4-(аминометил)пиримидин (34.6 мг; 0,32 ммоль) вносят в пробирку для микроволновой обработки. Реакционную среду перемешивают в течение 30 минут при 100°C под воздействием микроволнового излучения.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-((пиримидин-4-илметил)амино)бензолсульфонамид 001 (15,0 мг; 28%) получают в виде бежевого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,83 (дд, J=6,6, 1,5 Гц, 6H), 1,17 (т, J=7,6 Гц, 3H), 1,41 (дт, J=13,7, 6,8 Гц, 1H), 2,60 (к, J=7,6 Гц, 2H), 3,11 (д, J=1,0 Гц, 3H), 3,24 (дд, J=7,4, 1,4 Гц, 2H), 4,72 (дд, J=5,7, 1,9 Гц, 2H), 4,75-4,79 (м, 1H), 6,81 (д, J=8,9 Гц, 1H), 6,93-7,01 (м, 2H), 7,15-7,23 (м, 2H), 7,47 (дд, J=8,8, 2,3 Гц, 1H), 7,50 (дд, J=5,2, 1,4 Гц, 1H), 7,77 (д, J=2,3 Гц, 1H), 8,35 (т, J=5,9 Гц, 1H), 8,77 (д, J=5,2 Гц, 1H), 9,17 (д, J=1,4 Гц, 1H).
MS: [M+H]=502
Пример 107: Синтез N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-(1,4-оксазепан-4-ил)бензолсульфонамида
К 1,4-оксазепану (16.0 мг; 0,16 ммоль) и N,N-диизопропилэтиламину (0,11 мл; 0,63 ммоль) в растворе в диметилсульфоксиде (2 мл) добавляют 4-бром-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамид (50,0 мг; 0,11 ммоль).
Реакционную среду нагревают при температуре 150°C в течение 20 минут под воздействием микроволнового излучения. Реакционную среду гидролизуют 1н. раствором соляной кислоты и разбавляют, затем экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором, сушат (Na2SO4) и концентрируют в вакууме.
Неочищенный продукт очищают непосредственно препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-(1,4-оксазепан-4-ил)бензолсульфонамид (23,8 мг; 46%) получают в виде белого твердого вещества.
1H ЯМР (Метанол-d4) δ: 0,93 (д, J=6,7 Гц, 6H), 1,25 (т, J=7,6 Гц, 3H), 1,49-1,64 (м, 1H), 2,09 (p, J=6,0 Гц, 2H), 2,67 (к, J=7,6 Гц, 2H), 3,39 (д, J=7,3 Гц, 2H), 3,48 (с, 3H), 3,90 (дд, J=6,2, 3,5 Гц, 2H), 3,95 (т, J=6,1 Гц, 2H), 6,98-7,05 (м, 2H), 7,17-7,24 (м, 2H), 7,66 (д, J=8,4 Гц, 1H), 7,74 (дд, J=8,4, 2,3 Гц, 1H), 8,23 (д, J=2,2 Гц, 1H).
MS: [M+H]=494

Соединение 137
1H ЯМР (Метанол-d4) δ: 0,93 (д, J=6,7 Гц, 6H), 1,25 (т, J=7,6 Гц, 3H), 1,49-1,64 (м, 1H), 2,09 (p, J=6,0 Гц, 2H), 2,67 (к, J=7,6 Гц, 2H), 3,39 (д, J=7,3 Гц, 2H), 3,48 (с, 3H), 3,90 (дд, J=6,2, 3,5 Гц, 2H), 3,95 (т, J=6,1 Гц, 2H), 6,98-7,05 (м, 2H), 7,17-7,24 (м, 2H), 7,66 (д, J=8,4 Гц, 1H), 7,74 (дд, J=8,4, 2,3 Гц, 1H), 8,23 (д, J=2,2 Гц, 1H).
MS: [M+H]=494
Пример 110: Синтез N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-(пиперазин-1-ил)бензолсульфонамида

Соединение 140
К раствору 4-бром-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамида (50,00 мг; 0,11 ммоль) в N,N-диметилформамиде (200мкл) добавляют пиперазин (18,2 мг; 0,21 ммоль). Реакционную среду перемешивают в течение ночи при 60°C. Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,2% карбоната аммония). N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-(пиперазин-1-ил)бензолсульфонамид (30,0 мг; 53%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,6, 3,5 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,43 (дт, J=13,8, 6,9 Гц, 1H), 2,61 (к, J=7,6 Гц, 2H), 2,87 (т, J=4,7 Гц, 4H), 2,99 (д, J=5,0 Гц, 4H), 3,35 (с, 3H), 4,53 (с, 1H), 6,97-7,04 (м, 2H), 7,21 (д, J=8,4 Гц, 2H), 7,59 (д, J=8,5 Гц, 1H), 7,69 (дд, J=8,4, 2,3 Гц, 1H), 8,14 (д, J=2,3 Гц, 1H).
MS: [M+H] 479
Пример 111: Синтез N-(4-этилфенил)-4-(((3-гидроксициклобутил)метил)амино)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамида

Соединение 141
3-хлорпероксибензойную кислоту (24,4 мг; 0,11 ммоль) добавляют при 0°C к N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-тиоморфолинобензолсульфонамиду (27,0 мг; 0,05 ммоль) в растворе в дихлорметане (250 мкл). Реакционную среду перемешивают 5 часов при температуре окружающей среды, гидролизуют 1н. раствором гидроксида натрия и экстрагируют дихлорметаном. Органические фазы разделяют, промывают водой, сушат (MgSO4) и концентрируют в вакууме.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). 4-(1,1-диоксидотиоморфолино)-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамид (8,0 мг; 28%) получают в виде не чисто белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,86 (д, J=6,6 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,43 (дт, J=13,5, 6,8 Гц, 1H), 2,61 (к, J=7,6 Гц, 2H), 3,31 (д, J=7,8 Гц, 2H), 3,35-3,40 (м, 7H), 3,49 (дд, J=6,8, 3,4 Гц, 4H), 6,94-7,05 (м, 2H), 7,17-7,25 (м, 2H), 7,83-7,91 (м, 3H).
MS: [M+H] 529
Часть III: Синтез содержащих серу сульфонамидов по схеме реакции 3
Схема реакции 3
Пример 112: Синтез N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-(2-морфолиноэтил)бензолсульфонамида

Соединение 65
1. Синтез промежуточного соединения 112.1
N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-бензолсульфонамид
К раствору 4-бром-N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамида (100,0 мг; 0,21 ммоль) в 1,4-диоксане (1,2 мл) добавляют карбонат цезия (206,45 мг; 0,63 ммоль) трет-бутил-N-(2-оксиранилметил)карбамат (101,66 мг; 0,42 ммоль) и воду (0,40 мл). Перед добавлением бис(три-тер-бутилфосфин)палладий (0) (10,79 мг; 0,02 ммоль; 0,10 экв.) реакционную среду подвергают дегазации в аргоне в течение 10 минут. Реакционную среду перемешивают 2 часа при 90°C, фильтруют через целит с промыванием этилацетатом. Промывают органическую фазу насыщенным раствором гидрокарбонат натрия, затем водой, сушат (MgSO4), фильтруют и концентрируют досуха. Неочищенный продукт очищают хроматографией на силикагеле (элюируют гептаном/этилацетатом от 0 до 100% этилацетата). N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-винилбензолсульфонамид (70,0 мг; 79%) получают в виде бесцветного масла с соответствующим 1H ЯМР.
MS: [M+H]=422
2. Синтез соединения N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-(2-морфолиноэтил)бензолсульфонамида
Смесь N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-винилбензолсульфонамид (70,0 мг; 0,17 ммоль; 1,00 экв.) и морфолина (1,0 мл; 11,59 ммоль) перемешивают 30 минут при температуре окружающей среды.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). N-(4-этилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-(2-морфолиноэтил)бензолсульфонамид (25,00 мг; 29.59%) получают в виде порошка охрового цвета.
1H ЯМР (DMSO-d6) δ: 1,10 (д, J=6,5 Гц, 6H), 1,43 (т, J=7,6 Гц, 3H), 1,69 (дт, J=13,4, 6,8 Гц, 1H), 2,71 (д, J=5,4 Гц, 2H), 2,83-2,90 (м, 2H), 3,36 (с, 8H), 3,84 (т, J=4,5 Гц, 3H), 4,79 (с, 1H), 7,24 (д, J=8,0 Гц, 2H), 7,45 (д, J=8,0 Гц, 2H), 7,95 (с, 2H), 8,32 (с, 1H).
MS: [M+H]=508
Часть IV: Синтез содержащих серу сульфонамидов по схеме реакции 4
Схема реакции 4
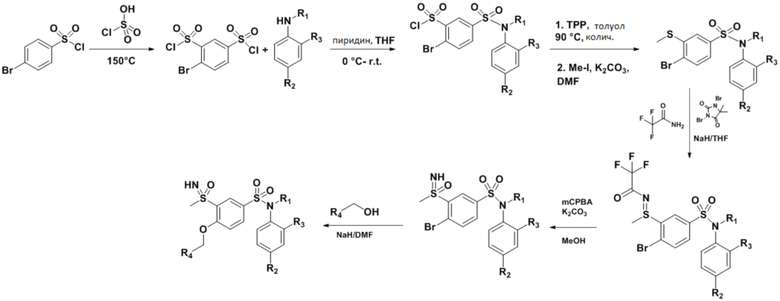
Пример 113: Синтез N-(2,4-диметилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-((тетрагидро-2H-пиран-4-ил)метокси)бензолсульфонамида

Соединение 142
1. Синтез промежуточного соединения 113.1
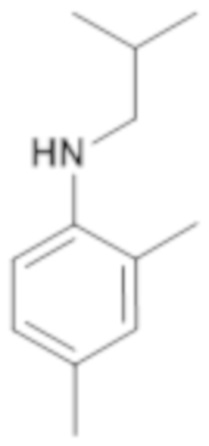
(2,4-диметилфенил)изобутиламин
Раствор 2,4-диметиланилинв (30 мл; 0,24 моль) и изобутиралдегида (20 мл; 0,22 моль) тетрагидрофуране (320 мл) перемешивают 30 минут при температуре окружающей среды, затем по частям добавляют триацетоксиборогидрид натрия (70 г; 0,33 моль). Реакционную среду перемешивают в течение 3 часов при температуре окружающей среды, гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, промывают насыщенным раствором хлорида натрия и сушат (MgSO4).
Выпаривают растворители. Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 10% этилацетата).
(2,4-диметилфенил)изобутиламин (29,9 г; 77%) получают в виде желтого масла с соответствующим ЯМР.
MS: [M+H]=177
2. Синтез промежуточного соединения 113.2
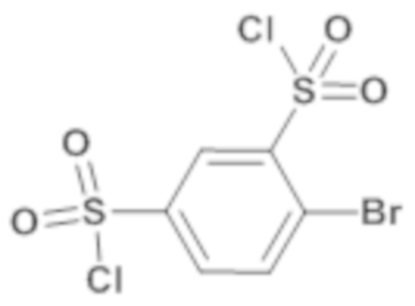
4-бромбензол-1,3-дисульфонилдихлорид
Смесь 4-бромбензолсульфонилхлорида (50 г; 0,20 моль) и хлорсульфоновой кислоты (260 мл; 3,91 моль) перемешивают 6 часов при 150°C. Реакционную среду аккуратно медленно выливают в смесь воды и льда и экстрагируют дихлорметаном. Органические фазы разделяют, сушат (MgSO4), фильтруют и концентрируют. 4-бромбензол-1,3-дисульфонилдихлорид (54 г; 78%) получают в виде сероватого порошка с соответствующим ЯМР.
MS: [M+H]=177
3. Синтез промежуточного соединения 113.3
2-бром-5-[(2,4-диметилфенил)изобутилсульфамоил]бензолсульфонилхлорид
4-бромбензол-1,3-дисульфонилдихлорид (1,0 г; 2,82 ммоль) в растворе в тетрагидрофуране (5 мл) добавляют к (2,4-диметилфенил)изобутиламину (0,50 г; 2,82 ммоль) и пиридину (1,4 мл; 17.0 ммоль) в растворе в тетрагидрофуране (20 мл). Реакционную среду перемешивают в течение 16 часов при температуре окружающей среды. Реакционную среду гидролизуют, затем экстрагируют этилацетатом. Органические фазы разделяют, промывают 1M водным раствором соляной кислоты, затем насыщенным раствором хлорида натрия, сушат (Na2SO4) и концентрируют.
2-бром-5-[(2,4-диметилфенил)изобутилсульфамоил]бензолсульфонилхлорид (1,23 г; 88%) получают в виде желтого масла с соответствующим ЯМР.
4. Синтез промежуточного соединения 113.4
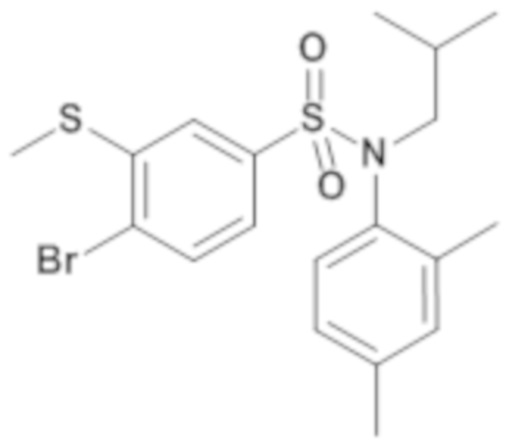
4-бром-N-(4-этилфенил)-N-изобутил-3-метилсульфанилбензолсульфонамид
2-бром-5-[(2,4-диметилфенил)изобутилсульфамоил]бензолсульфонилхлорид (1,67 г; 3,37 ммоль) в растворе в толуоле (8 мл) медленно добавляют к трифенилфосфину (2,66 г; 10,12 ммоль) в виде суспензии в толуоле (17 мл). Реакционную среду перемешивают в течение 4 часов при 90°C. Реакционную среду концентрируют в вакууме и растворяют в N,N-диметилформамиде (14,5 мл) без очисти, затем добавляют карбонат калия (0,51 г; 3,72 ммоль) и йодметан (0,32 мл; 5,08 ммоль). Реакционную среду перемешивают в течение 20 минут при температуре окружающей среды, гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, промывают насыщенным раствором хлорида натрия и сушат (Na2SO4).
Выпаривают растворители. Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 10% этилацетата).
4-бром-N-(4-этилфенил)-N-изобутил-3-метилсульфанилбензолсульфонамид (775,30 мг; 52%) получают в виде белого твердого вещества с соответствующим ЯМР
MS: [M-H]=441
5. Синтез промежуточного соединения 113.5
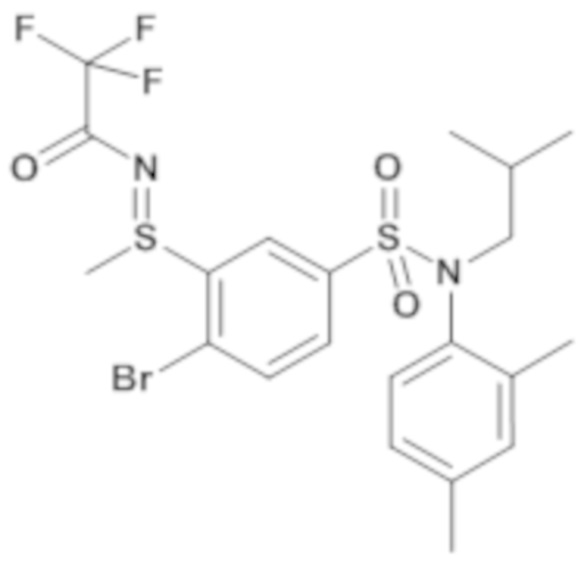
(E)-N-((2-бром-5-(N-(2,4-диметилфенил)-N-изобутилсульфамоил)фенил)(метил)-λ4-сульфанилиден)-2,2,2-трифторацетамид
4-бром-N-(2,4-диметилфенил)-N-изобутил-3-метилсульфанилбензолсульфонамид (755,0 мг; 1,71 ммоль) и 2,2,2-трифторацетамид (289,34 мг; 2,56 ммоль) в растворе в тетрагидрофуране (1,51 мл) медленно добавляют к гидриду натрия 60% (61,43 мг; 1,54 ммоль) в виде суспензии в тетрагидрофуране (3,78 мл) при 0-5°C. Затем добавляют 1,3-дибром-5,5-диметилгидантоин (732 мг; 2,56 ммоль) в растворе в тетрагидрофуране (1,5 мл).
Среду перемешивают в течение 1 часа при температуре окружающей среды, гидролизуют добавлением 10% раствора лимонной кислоты, затем экстрагируют этилацетатом. Органические фазы разделяют, затем промывают 25% раствором сульфита натрия, затем 2 раза насыщенным раствором хлорида натрия и сушат (Na2SO4). Выпаривают растворители.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 50% этилацетата). (E)-N-((2-бром-5-(N-(2,4-диметилфенил)-N-изобутилсульфамоил)фенил)(метил)-l4-сульфанилиден)-2,2,2-трифторацетамид (233,0 мг; 25%) получают в виде белого порошка с соответствующим ЯМР
MS: [M-H]=552
6. Синтез промежуточного соединения 113.6
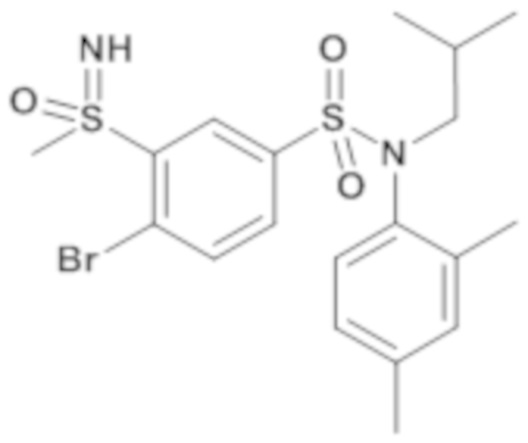
4-бром-N-(2,4-диметилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамид
Карбонат калия (172,30 мг; 1,25 ммоль) добавляют к (E)-N-((2-бром-5-(N-(4-этилфенил)-N-изобутилсульфамоил)фенил)(метил)-l4-сульфанилиден)-2,2,2-трифторацетамиду (230,0 мг; 0,42 ммоль) в растворе в метаноле (2,3 мл), затем медленно добавляют 3-хлорпероксибензойную кислоту (139,7 мг; 0.62 ммоль) при 0°C. Реакционную среду перемешивают в течение 3 суток при температуре окружающей среды. Реакционную среду гидролизуют, затем экстрагируют этилацетатом. Органические фазы разделяют, промывают насыщенным раствором хлорида натрия и сушат (Na2SO4). Выпаривают растворители.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 80% этилацетата). 4-бром-N-(2,4-диметилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамид (70,8 мг; 36%) получают в виде белого твердого вещества с соответствующим ЯМР.
MS: [M+H]=475
7. Синтез N-(2,4-диметилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-((тетрагидро-2H-пиран-4-ил)метокси)бензолсульфонамида

Гидрид натрия 60% (8,74 мг; 0,22 ммоль) медленно добавляют при температуре 0°C к (тетрагидропиран-4-ил)метанолу (18,62 мг; 0,16 ммоль) в растворе в N,N-диметилформамиде (1,38 мл), затем 4-бром-N-(2,4-диметилфенил)-N-изобутил-3-(S-метилсульфонимидоил)бензолсульфонамид (69,0 мг; 0,15 ммоль). Реакционную среду перемешивают в течение 2 часов при температуре окружающей среды, затем 1 час при 80°C. Реакционную среду гидролизуют на холоду, затем экстрагируют этилацетатом. Органические фазы разделяют, промывают насыщенным раствором хлорида натрия и сушат (Na2SO4). Выпаривают растворители.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). N-(2,4-диметилфенил)-N-изобутил-3-(S-метилсульфонимидоил)-4-((тетрагидро-2H-пиран-4-ил)метокси)бензолсульфонамид (44,81 мг; 59,54%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,76 (дд, J=6,8, 3,2 Гц, 3H), 0,82-0,91 (м, 1H), 0,95 (т, J=6,7 Гц, 3H), 1,25 (к, J=3,6, 2,6 Гц, 1H), 1,40 (p, J=4,2 Гц, 2H), 1,43 (с, 1H), 1,75 (д, J=7,5 Гц, 1H), 2,23-2,32 (м, 6H), 3,06 (ддд, J=21,2, 13,1, 4,6 Гц, 1H), 3,20 (дд, J=2,7, 1,2 Гц, 3H), 3,35-3,44 (м, 2H), 3,87-3,95 (м, 2H), 4,12 (дд, J=6,3, 3,6 Гц, 2H), 4,45 (дд, J=50,6, 1,5 Гц, 1H), 6,58 (дд, J=16,3, 8,1 Гц, 1H), 6,94 (дд, J=8,1, 2,0 Гц, 1H), 7,13 (с, 1H), 7,41 (д, J=8,9 Гц, 1H), 7,74 (тд, J=8,6, 2,5 Гц, 1H), 8,05 (дд, J=4,9, 2,4 Гц, 1H).
MS: [M+H]=509
Часть V: Синтез содержащих серу сульфонамидов по схеме реакции 5
Схема реакции 5
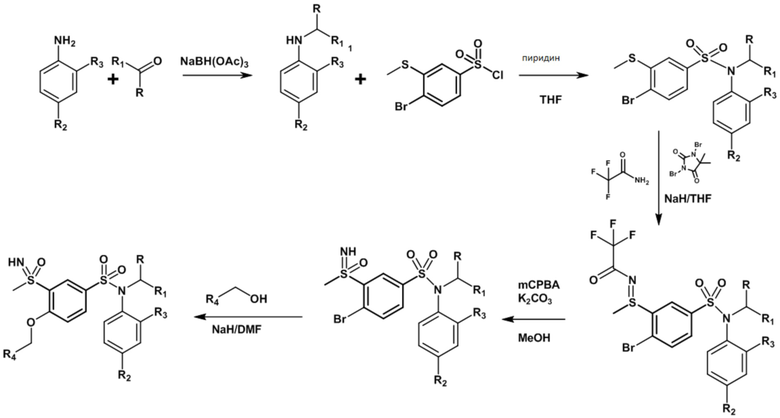
Пример 114: Синтез N-изопропил-N-(4-метокси-2-метилфенил)-3-(S-метилсульфонимидоил)-4-((тетрагидро-2H-пиран-4-ил)метокси)бензолсульфонамида

Соединение 143
1. Синтез промежуточного соединения 114.1
Изопропил-(4-метокси-2-метилфенил)амин
Триацетоксиборогидрид натрия (4,63 г; 21,9 ммоль) добавляют к раствору 4-метокси-2-метиланилина (2,0 г; 14,6 ммоль) в ацетоне (20мл). Реакционную среду нагревают в течение 10 минут при температуре 70°C под воздействием микроволнового излучения. Реакционную среду выливают на лед и экстрагируют дихлорметаном. Органические фазы разделяют, промывают насыщенным раствором хлорида натрия, сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 15% этилацетата). Изопропил-(4-метокси-2-метилфенил)амин (1,43 г; 55%) получают в виде желтого масла с соответствующим ЯМР.
MS: [M+H]=180
2. Синтез промежуточного соединения 114.2
4-бром-N-изопропил-N-(4-метокси-2-метилфенил)-3-метилсульфанилбензолсульфонамид
4-бром-3-(метилтио)бензол-1-сульфонилхлорид (500 мг; 1,57 ммоль) добавляют к изопропил(4-метокси-2-метилфенил)амину (290 мг; 1,62 ммоль) и пиридину (2,4 мл). Реакционную среду нагревают в течение 20 минут при температуре 100°C под воздействием микроволнового излучения, гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, затем промывают 1н. раствором соляной кислоты затем насыщенным раствором хлорида натрия и сушат (MgSO4). Выпаривают растворители.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 40% этилацетата). 4-бром-N-изопропил-N-(4-метокси-2-метилфенил)-3-метилсульфанилбензолсульфонамид (570 мг; 81%) получают в виде желтого масла с соответствующим ЯМР
MS: [M+H]=444
3. Синтез промежуточного соединения 114.3
(E)-N-((2-бром-5-(N-изопропил-N-(4-метокси-2-метилфенил)сульфамоил)фенил)-(метил)-λ4-сульфанилиден)-2,2,2-трифторацетамид
4-бром-N-изопропил-N-(4-метокси-2-метилфенил)-3-метилсульфанилбензолсульфонамид (565 мг; 1,27 ммоль) и 2,2,2-трифторацетамид (215,6 мг; 1,91 ммоль) в растворе в тетрагидрофуране (1,1 мл) медленно добавляют к гидриду натрия 60% (45,8 мг; 1,14 ммоль) в виде суспензии в тетрагидрофуране (2,8 мл) при 0-5°C, затем раствор 1,3-дибром-5,5-диметилгидантоина (545,3 мг; 1,91 ммоль) тетрагидрофуран (1,13 мл). Среду перемешивают в течение 2 часов при температуре окружающей среды, гидролизуют добавлением 10% раствора лимонной кислоты, затем экстрагируют этилацетатом. Органические фазы разделяют, промывают 25% раствором сульфита натрия, затем 2 раза насыщенным раствором хлорида натрия и сушат (Na2SO4). Выпаривают растворители.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 60% этилацетата). (E)-N-((2-бром-5-(N-изопропил-N-(4-метокси-2-метилфенил)сульфамоил)фенил)(метил)-l4-сульфанилиден)-2,2,2-трифторацетамид (706 мг; 100%) получают в виде бесцветного масла с соответствующим ЯМР
MS: [M-H]=557
4. Синтез промежуточного соединения 114.4
4-бром-N-изопропил-N-(4-метокси-2-метилфенил)-3-(S-метилсульфонимидоил)бензолсульфонамид
Карбонат калия (549 мг; 3,97 ммоль) добавляют к (E)-N-((2-бром-5-(N-изопропил-N-(4-метокси-2-метилфенил)сульфамоил)фенил)(метил)-l4-сульфанилиден)-2,2,2-трифторацетамиду (735 мг; 1,32 ммоль) в растворе в метаноле (7,4 мл), затем медленно добавляют 3-хлорпероксибензойную кислоту (445 мг; 1,98 ммоль) при 0°C,. Реакционную среду перемешивают в течение 2 часов при температуре окружающей среды, гидролизуют затем экстрагируют этилацетатом. Органические фазы разделяют, промывают насыщенным раствором хлорида натрия и сушат (MgSO4). Выпаривают растворители.
Неочищенный продукт подвергают хроматографии на силикагеле (гептан/этилацетат от 40 до 80% этилацетата). 4-бром-N-изопропил-N-(4-метокси-2-метилфенил)-3-(S-метилсульфонимидоил)бензолсульфонамид (211,6 мг; 34%) получают в виде белого твердого вещества с соответствующим ЯМР
MS: [M+H]=477
5. Синтез соединения N-изопропил-N-(4-метокси-2-метилфенил)-3-(S-метилсульфонимидоил)-4-((тетрагидро-2H-пиран-4-ил)метокси)бензолсульфонамида
Гидрид натрия 60% (12,6 мг; 0,32 ммоль) медленно добавляют при 0°C к (тетрагидропиран-4-ил)метанолу (26,8 мг; 0,23 ммоль) в растворе N,N-диметилформамида (2 мл), затем добавляют 4-бром-N-изопропил-N-(4-метокси-2-метилфенил)-3-(S-метилсульфонимидоил)бензолсульфонамид (100 мг; 0,21 ммоль). Реакционную среду перемешивают в течение одного часа при температуре окружающей среды и 90 минут при температуре 60°C, затем гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, затем промывают насыщенным раствором хлорида натрия и сушат (Na2SO4). Выпаривают растворители.
Продукт подвергают хроматографии на силикагеле (элюируют дихлорметаном/метанолом от 0 до 10% метанола).
N-изопропил-N-(4-метокси-2-метилфенил)-3-(S-метилсульфонимидоил)-4-((тетрагидро-2H-пиран-4-ил)метокси)бензолсульфонамид (76,2 мг; 71%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,79-0,93 (м, 4H), 0,98 (дд, J=6,8, 2,1 Гц, 3H), 1,26 (дд, J=10,8, 4,6 Гц, 2H), 1,41 (тдд, J=12,3, 7,6, 4,4 Гц, 2H), 1,75 (т, J=11,7 Гц, 2H), 2,10 (д, J=8,7 Гц, 1H), 2,25 (д, J=8,3 Гц, 3H), 3,19 (д, J=1,2 Гц, 3H), 3,33-3,43 (м, 2H), 3,82-3,99 (м, 2H), 4,02-4,19 (м, 2H), 4,34-4,55 (м, 2H), 6,57-6,76 (м, 2H), 6,92 (т, J=2,2 Гц, 1H), 7,41 (дд, J=8,8, 2,9 Гц, 1H), 7,84 (дд, J=8,7, 2,4 Гц, 1H), 8,14 (т, J=2,7 Гц, 1H).
MS: [M+H]=511
Часть VI: Синтез содержащих серу сульфонамидов по схеме реакции 6
Схема реакции 6
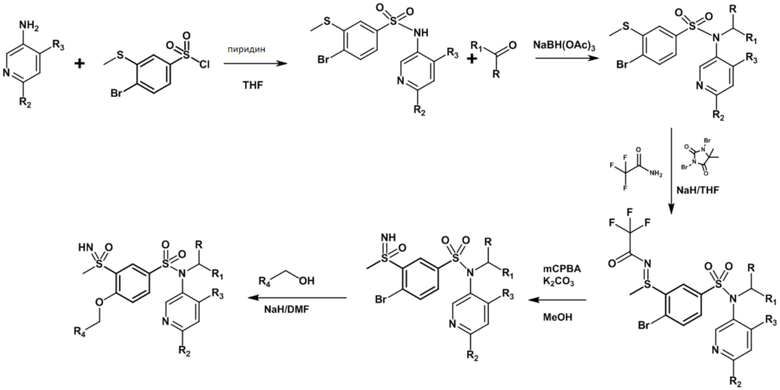
Пример 116: Синтез N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметилсульфанил)бензолсульфонамида

Соединение 68
1. Синтез промежуточного соединения 116.1
N-(4-этилфенил)-4-фтор-N-изобутилбензолсульфонамид
4-фтор-бензолсульфонилхлорид (2,78 г; 14,27 ммоль) добавляют к (4-этилфенил)изобутиламину (2,3 г; 12,28 ммоль) и диизопропиламину (5,5 мл; 67,69 ммоль) в растворе в дихлорметане (25 мл). Реакционную среду перемешивают в течение 16 часов при температуре окружающей среды, гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, промывают насыщенным раствором хлорида аммония, солевым раствором, сушат (Na2SO4) и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 10% этилацетата). N-(4-этилфенил)-4-фтор-N-изобутилбензолсульфонамид (2,09 г; 48%) получают в виде желто-оранжевого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=336
2. Синтез промежуточного соединения 116.2

Бис[4-[(4-этилфенил)изобутилсульфамоил]-тиобензол]-дисульфид
Смесь N-(4-этилфенил)-4-фтор-N-изобутилбензолсульфонамида (1,0 г; 2,98 ммоль) и гидросульфида натрия (2,1 г; 37,26 ммоль) в 1-метил-2-пирролидиноне (4 мл) перемешивают 2 часа при 80°C, затем 16 часов при температуре окружающей среды. Реакционную среду разбавляют этилацетатом и подкисляют добавлением концентрированной HCl, затем экстрагируют. Органические фазы разделяют, промывают водой, сушат (MgSO4), фильтруют, концентрируют досуха. Получаемый бис[4-[(4-этилфенил)изобутилсульфамоил]тиобензол]дисульфид (1,04 г; 50%) непосредственно используют в следующей реакции.
MS: [M+H]=698
3. Синтез N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметилсульфанил)бензолсульфонамида
К раствору бис[4-[(4-этилфенил)изобутилсульфамоил]тиобензол]дисульфида (1,03 г; 1,48 ммоль) в N,N-диметилформамиде (15 мл) добавляют карбонат калия (0,41 г; 2,96 ммоль). Реакционную среду перемешивают в течение 5 минут перед добавлением 4-(бромметил)тетрагидропирана (0,53 г; 2,96 ммоль), затем формальдегидсульфоксилата натрия (0,60 г; 4,44 ммоль) и воды (20 мкл; 1,10 ммоль). Реакционную среду перемешивают 1 час при температуре окружающей среды, гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт подвергают хроматографии на силикагеле, элюируют гептан этилацетатом от 5 до 30% этилацетата). N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметилсульфанил)бензолсульфонамид (1,10 г; 83%) получают в виде твердого вещества.
1H ЯМР (400 МГц, DMSO-d6) δ 7,55-7,34 (м, 4H), 7,23-7,15 (м, 2H), 7,02-6,93 (м, 2H), 3,90-3,81 (м, 2H), 3,30-3,21 (м, 3H), 3,02 (д, J=6,6 Гц, 2H), 2,60 (к, J=7,6 Гц, 2H), 1,79-1,68 (м, 2H), 1,48-1,36 (м, 1H), 1,36-1,22 (м, 1H), 1,18 (т, J=7,6 Гц, 3H), 0,84 (д, J=6,7 Гц, 6H).
MS: [M+H]=448
Пример 117: Синтез N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметансульфонил)бензолсульфонамида

Соединение 29
К раствору N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметилсульфанил)бензолсульфонамида (787 мг; 1,76 ммоль) в дихлорметане (20 мл) при 0°C по частям добавляют 3-хлорпербензойную кислоту (414 мг; 1,85 ммоль).
Реакционную среду перемешивают в течение 3 часов 30. При 0°C добавляют по каплям 13 мл 1н. водного раствора гидроксида натрия, затем 13 мл воды. Реакционную среду экстрагируют дихлорметаном. Органические фазы промывают водным раствором тиосульфата натрия, сушат над сульфатом магния, фильтруют и концентрируют. Получаемое масло осаждают дихлорметаном и гептаном. Твердое вещество фильтруют, промывают гептаном и сушат. N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметансульфонил)бензолсульфонамид (755 мг; 88%) получают в виде белого твердого вещества.
1H ЯМР (400 МГц, DMSO-d6) δ 0,86 (д, J=6,6 Гц, 7H), 1,18 (т, J=7,6 Гц, 3H), 1,51-1,24 (м, 3H), 1,55 (д, J=13,3 Гц, 1H), 1,83 (д, J=13,0 Гц, 1H), 2,16-1,98 (м, 1H), 2,60 (к, J=7,6 Гц, 2H), 2,81 (дд, J=13,1, 5,0 Гц, 1H), 2,93 (дд, J=13,2, 8,6 Гц, 1H), 3,38-3,28 (м, 4H), 3,95-3,70 (м, 2H), 7,08-6,85 (м, 2H), 7,27-7,14 (м, 2H), 7,80-7,66 (м, 2H), 7,95-7,81 (м, 2H).
MS: [M+H]=464
Соединение N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметансульфонил)бензолсульфонамид (450 мг; 1,11 ммоль) подвергают хроматографии хиральной SFC для разделения 2 энантиомеров (соединения 13 и соединения 14), как описано ниже:
[Сверхкритические условия 10 МПа, 70°C; колонка CHIRALPAK IC 250×4,6 мм 5 мк элюируют CO2/этанол: 30% этанола]
Пример 118: N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметансульфонил)бензолсульфонамид (соединение 13) - энантиомер A соединения 29
(150 мг; 22%) в виде кристаллического белого вещества
1H ЯМР (400 МГц, DMSO-d6) δ 7,91-7,84 (м, 2H), 7,76-7,69 (м, 2H), 7,20 (д, J=8,4 Гц, 2H), 6,98 (д, J=8,3 Гц, 2H), 3,84 (дд, J=22,1, 12,3 Гц, 2H), 3,45-3,17 (м, 4H), 2,93 (дд, J=13,2, 8,6 Гц, 1H), 2,81 (дд, J=13,1, 5,0 Гц, 1H), 2,66-2,48 (м, 2H), 2,08 (дддд, J=19,9, 12,3, 8,7, 4,1 Гц, 1H), 1,89-1,79 (м, 1H), 1,60-1,25 (м, 4H), 1,18 (т, J=7,6 Гц, 3H), 0,86 (д, J=6,7 Гц, 6H).
Время удержания (хиральная SFC) 6,92 минуты.
Пример 119: N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметансульфонил)бензолсульфонамид (соединение 14) - энантиомер B соединения 29
(120 мг; 18%) в виде белого твердого вещества
1H ЯМР (400 МГц, DMSO-d6) δ 7,92-7,80 (м, 2H), 7,80-7,64 (м, 2H), 7,28-7,11 (м, 2H), 7,04-6,92 (м, 2H), 3,85 (ддд, J=21,3, 10,9, 4,2 Гц, 2H), 3,47-3,18 (м, 4H), 2,93 (дд, J=13,2, 8,6 Гц, 1H), 2,81 (дд, J=13,1, 5,0 Гц, 1H), 2,61 (к, J=7,6 Гц, 2H), 2,08 (dtt, J=19,8, 8,2, 4,1 Гц, 1H), 1,94-1,72 (м, 1H), 1,64-1,24 (м, 4H), 1,18 (т, J=7,6 Гц, 3H), 0,86 (д, J=6,7 Гц, 6H).
Время удержания (хиральная SFC) 9,31 минут
Пример 120: Синтез N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметансульфоксиминил)бензолсульфонамида

Соединение 28
К предварительно дегазированному аргоном раствору N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметансульфонил)бензолсульфонамида (199 мг; 0,43 ммоль) в дихлорметане (7 мл), добавляют 2,2,2- трифторацетамид (121 мг; 1,07 ммоль), оксид магния (87 мг; 2,15 ммоль), димер ацетата родия (II) (28 мг; 0,06 ммоль) и йодбензолдиацетат (263 мг; 0,82 ммоль). Реакционную среду перемешивают при температуре окружающей среды в течение 20 часов, фильтруют через целит и концентрируют. Получаемый остаток разбавляют в метаноле (7 мл) и добавляют карбонат калия (297 мг; 2,15 ммоль).
Реакционную среду перемешивают в течение 30 минут при температуре окружающей среды, гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором, сушат (Na2SO4) и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом 10/90). N-(4-этилфенил)-N-изобутил-4-(тетрагидропиран-4-илметансульфоксиминил)бензолсульфонамид (87 мг; 41%) получают в виде твердого вещества кремового цвета.
1H ЯМР (400 МГц, DMSO-d6) δ 0,86 (дд, J=6,8, 1,9 Гц, 6H), 1,35-1,06 (м, 5H), 1,44 (дт, J=13,5, 6,9 Гц, 1H), 1,77-1,50 (м, 2H), 2,06 (т, J=9,2 Гц, 1H), 2,61 (д, J=7,6 Гц, 2H), 3,29-3,16 (м, 3H), 3,37 (д, J=7,2 Гц, 2H), 3,76 (дт, J=11,7, 3,1 Гц, 2H), 4,55 (с, 1H), 7,07-6,84 (м, 2H), 7,19 (дд, J=8,6, 2,0 Гц, 2H), 7,89-7,62 (м, 2H), 8,09 (дд, J=8,4, 2,0 Гц, 2H).
MS: [M+H]=479
Часть VII: Синтез содержащих серу сульфонамидов по схеме реакции 7
Схема реакции 7
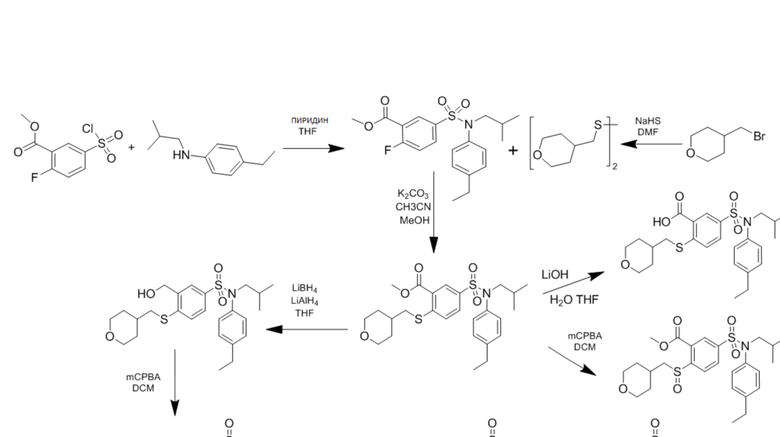
Пример 121: Синтез 5-[(4-этилфенил)изобутилсульфамоил]-2-(тетрагидропиран-4-илметилсульфанил)метилбензоата

Соединение 17
1. Синтез промежуточного соединения 121.1
5-[(4-этилфенил)изобутилсульфамоил]-2-фторметилбензоат
5-хлорсульфонил-2-фторметилбензоат (720 мг; 2,85 ммоль) добавляют к (4-этилфенил)изобутиламину (0,95 г; 4,27 ммоль) и пиридину (1,38 мл; 0,02 моль; 6,00 экв.) в растворе в тетрагидрофуране (16 мл). Реакционную среду перемешивают при температуре окружающей среды в течение 16 часов, гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором, сушат (Na2SO4) и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептан этилацетатом 5 à 20% этилацетата). 5-[(4-этилфенил)изобутилсульфамоил]-2-фторметилбензоат (800 мг; 71%) получают в виде бежевого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=394
2. Синтез промежуточного соединения 121.2
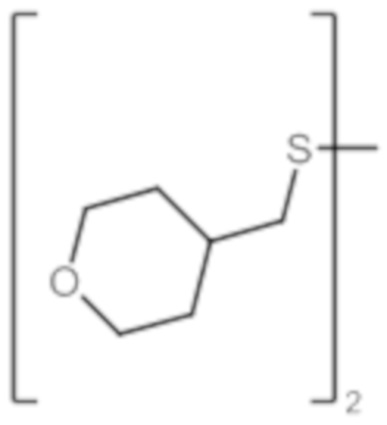
Бис[-(тетрагидропиран-4-ил)метанбисульфид
Смесь 4-(бромметил)тетрагидропирана (1,0 г; 5,58 ммоль) и гидросульфида натрия (0,44 г; 7,82 ммоль) в диметилформамиде (4 мл) перемешивают при температуре окружающей среды в течение 2 часов. Реакционную среду разбавляют простым эфиром и подкисляют добавлением концентрированной HCl, затем экстрагируют. Органические фазы разделяют, промывают водой, сушат над сульфатом магния, фильтруют, концентрируют досуха. Бис[-(тетрагидропиран-4-ил)метанбисульфид (565.00 мг; 77%), получаемый в виде светлого масла, непосредственно используют в следующей реакции.
MS: [M+H]=263
3. Синтез 5-[(4-этилфенил)изобутилсульфамоил]-2-(тетрагидропиран-4-илметилсульфанил)метилбензоата

К 5-[(4-этилфенил)изобутилсульфамоил]-2-фторметилбензоату (200 мг; 0,51 ммоль) и бис(тетрагидропиран-4-ил)метанбисульфиду (133,39 мг; 0,51 ммоль; 1,00 экв.) в ацетонитриле (2 мл) добавляют карбонат калия (81мг; 0,59 ммоль). Реакционную среду перемешивают при температуре окружающей среды в течение 16 часов, гидролизуют и экстрагируют этилацетатом. Органические фазы объединяют, промывают солевым раствором, сушат и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле, элюируют гептан этилацетатом: от 5 до 20% этилацетата. 5-[(4-этилфенил)изобутилсульфамоил]-2-(тетрагидропиран-4-илметилсульфанил)метилбензоат (214 мг; 83%) получают в виде белого твердого вещества.
1H ЯМР (400 МГц, DMSO-d6) δ 0,85 (д, J=6,6 Гц, 7H), 1,18 (т, J=7,6 Гц, 3H), 1,37 (dtd, J=36,3, 12,9, 12,1, 7,3 Гц, 3H), 1,91-1,70 (м, 4H), 2,61 (к, J=7,6 Гц, 2H), 2,98 (д, J=6,7 Гц, 2H), 3,35-3,24 (м, 4H), 3,91-3,80 (м, 5H), 7,05-6,98 (м, 2H), 7,23-7,17 (м, 2H), 7,66-7,59 (м, 2H), 7,89 (д, J=1,9 Гц, 1H).
MS: [M+H]=506
Пример 122: Синтез 5-[(4-этилфенил)изобутилсульфамоил]-2-(тетрагидропиран-4-илметансульфонил)метилбензоата

Соединение 16
К раствору 5-[(4-этилфенил)изобутилсульфамоил]-2-(тетрагидропиран-4-илметилсульфанил)метилбензоата (150мг; 0,30 ммоль) в дихлорметане (5 мл) при температуре 0°C добавляют 3-перхлорбензойную кислоту (70 мг; 0,31 ммоль). Реакционную среду перемешивают в течение 2 часов. При 0°C по каплям добавляют 1н. водный раствор гидроксида натрия и воду, затем экстрагируют реакционную среду дихлорметаном.
Органические фазы промывают водным раствором тиосульфата натрия, сушат над сульфатом магния, фильтруют и выпаривают.
Неочищенный продукт подвергают хроматографии на силикагеле, (элюируют гептаном/этилацетатом, от 10 до 30% этила). 5-[(4-этилфенил)изобутилсульфамоил]-2-(тетрагидропиран-4-илметансульфонил)метилбензоат (140 мг; 90%) получают в виде белого твердого вещества.
1H ЯМР (400 МГц, DMSO-d6) δ 0,86 (дд, J=6,7, 4,0 Гц, 6H), 1,19 (т, J=7,6 Гц, 3H), 1,67-1,23 (м, 3H), 1,97 (дд, J=16,3, 5,1 Гц, 1H), 2,66-2,55 (м, 3H), 2,22 (с, 1H), 3,09 (дд, J=12,8, 9,7 Гц, 1H), 3,44-3,31 (м, 4H), 3,89 (с, 5H), 7,07-6,97 (м, 2H), 7,22 (д, J=8,3 Гц, 2H), 8,02 (д, J=1,9 Гц, 1H), 8,08 (дд, J=8,3, 2,0 Гц, 1H), 8,30 (д, J=8,3 Гц, 1H).
MS: [M+H]=522
Пример 123: Синтез 5-[(4-этилфенил)изобутилсульфамоил]-2-(тетрагидропиран-4-илметилсульфанил)бензойной кислоты
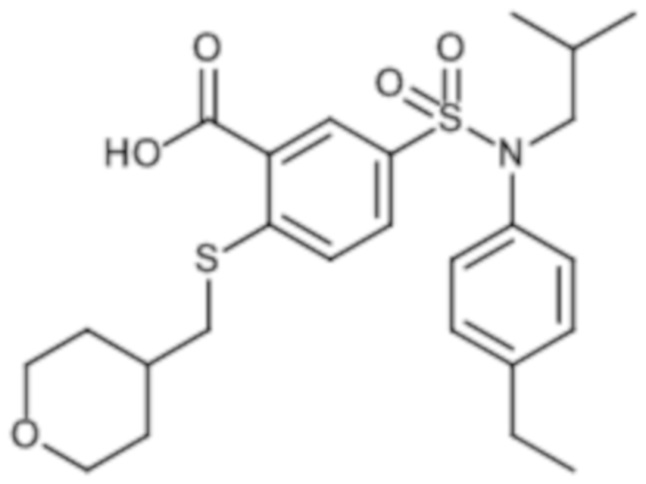
Соединение 23
Смесь 5-[(4-этилфенил)изобутилсульфамоил]-2-(тетрагидропиран-4-илметилсульфанил)тетрагидропиран-4-ил-метилбензоата (277 мг; 0,47 ммоль) и гидроксида лития (0,70 мл; 1,00 M; 0,70 ммоль) в тетрагидрофуране (6,93 мл) перемешивают при температуре 60°C в течение 24 часов. Реакционную среду гидролизуют 1н. водным раствором гидроксида натрия, экстрагируют этилацетатом. Органические фазы объединяют, промывают 1н. водным раствором гидроксида натрия.
Водные фазы объединяют, подкисляют HCl и экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором, сушат над сульфатом магния, фильтруют и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле, элюируют гептаном/этилацетатом +1% AcOH, от 10 до 50% этилацетата. 5-[(4-этилфенил)изобутилсульфамоил]-2-(тетрагидропиран-4-илметилсульфанил)бензойную кислоту (87,00 мг; 36%) получают в виде твердого вещества после кристаллизации в смеси метанол, дихлорметан.
1H ЯМР (400 МГц,DMSO-d6) δ 0,85 (д, J =6,6 Гц, 6H), 1,18 (т,J=7,6 Гц, 3H), 1,50-1,24 (м, 3H), 1,89-1,67 (м, 3H), 2,66-2,55 (м,2H), 2,94 (д, J=6,6Гц, 2H), 3,30 (д, J =7,1 Гц, 3H), 4,03 -3,71 (м, 2H), 7,04-6,97 (м, 2H), 7,25-7,16 (м, 2H), 7,59 (с,2H), 8,10-7,74 (м, 1H), 13,46 (с, 1H).
MS: [M+H]=492
Пример 124: Синтез N-(4-этилфенил)-3-гидроксиметил-N-изобутил-4-(тетрагидропиран-4-илметил-сульфанил)бензолсульфонамида

Соединение 21
К 5-[(4-этилфенил)изобутилсульфамоил]-2-(тетрагидропиран-4-илметил-сульфанил)метилбензоата (113 мг; 0,22 ммоль) в тетрагидрофуране (3 мл) добавляют боргидрид лития (9 мг; 0,40 ммоль). Реакционную среду перемешивают при температуре окружающей среды в течение 16 часов, гидролизуют 5% лимонной кислотой в течение 1 часа, экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором, сушат над сульфатом магния, фильтруют и выпаривают.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом 80/20). N-(4-этилфенил)-3-гидроксиметил-N-изобутил-4-(тетрагидропиран-4-илметилсульфанил)бензолсульфонамид (106 мг, 96%) получают в виде белого твердого вещества.
1H ЯМР (Хлороформ-d) δ: 0,84 (д, J=6,7 Гц, 6H), 1,16 (т, J=7,6 Гц, 3H), 1,35 (qd, J=13,1, 12,4, 3,6 Гц, 2H), 1,50 (гепрт, J=6,7 Гц, 1H), 1,73 (д, J=12,3 Гц, 1H), 2,51-2,62 (м, 2H), 2,64 (д, J=1,7 Гц, 2H), 2,87 (д, J=6,5 Гц, 2H), 3,22 (д, J=7,4 Гц, 2H), 3,31 (тд, J=11,8, 1,9 Гц, 2H), 3,92 (ддд, J=12,5, 4,6, 1,5 Гц, 2H), 4,65 (с, 2H), 6,87-6,94 (м, 2H), 7,06 (д, J=8,3 Гц, 2H), 7,19 (д, J=8,2 Гц, 1H), 7,33 (дд, J=8,3, 2,2 Гц, 1H), 7,56 (д, J=2,1 Гц, 1H).
MS: [M+H]=478
Пример 125: Синтез N-(4-этилфенил)-3-гидроксиметил-N-изобутил-4-(тетрагидропиран-4-илметан-сульфонил)бензолсульфонамида

Соединение 15
К раствору N-(4-этилфенил)-3-гидроксиметил-N-изобутил-4-(тетрагидропиран-4-илметил-сульфанил)бензолсульфонамида (614,00 мг; 1,29 ммоль) в дихлорметане (20,00 мл) добавляют 3-хлорпероксибензойную кислоту (302,47 мг; 1,35 ммоль). Реакционную среду перемешивают при температуре окружающей среды в течение 4 часов. При температуре 0°C реакционную среду добавляют к воде и экстрагируют этилацетатом. Органические фазы промывают солевым раствором, сушат над сульфатом магния, фильтруют и выпаривают.
Неочищенный продукт подвергают хроматографии на силикагеле, элюируют гептаном/этилацетатом от 50 до 100% этилацетата). N-(4-этилфенил)-3-гидроксиметил-N-изобутил-4-(тетрагидропиран-4-илметансульфонил)бензолсульфонамид (455 мг, 71%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ 0,84 (д, J=6,7 Гц, 6H), 1,16 (т, J=7,6 Гц, 3H), 1,19-1,50 (м, 3H), 1,47-1,63 (м, 1H), 1,86 (ддд, J=13,1, 3,9, 2,1 Гц, 1H), 2,12 (дк, J=15,5, 5,7, 4,0 Гц, 2H), 2,55-2,69 (м, 3H), 2,94 (дд, J=13,2, 9,4 Гц, 1H), 3,33 (д, J=3,1 Гц, 3H), 3,74-3,95 (м, 2H), 4,60 (дд, J=5,3, 3,3 Гц, 2H), 5,65 (дд, J=5,9, 4,8 Гц, 1H), 6,86- 7,07 (м, 2H), 7,10-7,30 (м, 2H), 7,57-7,76 (м, 2H), 8,01 (д, J=8,1 Гц, 1H).
MS: [M+H]=494
Соединение 15 (377 мг; 0,76 ммоль) подвергают хроматографии хиральной SFC для разделения 2 энантиомеров, как указано ниже.
[Сверхкритические условия 10 МПа, 70°C; колонка CHIRALPAK IC 250×4,6 мм 5 мк элюируют CO2/метанолом: 45% метанола]
Пример 126: N-(4-этилфенил)-3-гидроксиметил-N-изобутил-4-(тетрагидропиран-4-илметан-сульфонил)бензолсульфонамид (соединение 11) - энантиомер A соединения 15
(146 мг; 39%) в виде белого твердого вещества
1H ЯМР (400 МГц, DMSO-d6) δ 8,01 (д, J=8,1 Гц, 1H), 7,76-7,57 (м, 2H), 7,30-7,10 (м, 2H), 7,07-6,86 (м, 2H), 5,65 (дд, J=5,9, 4,8 Гц, 1H), 4,60 (дд, J=5,3, 3,3 Гц, 2H), 3,95-3,74 (м, 1H), 3,33 (д, J=3,1 Гц, 2H), 2,94 (дд, J=13,2, 9,4 Гц, 1H), 2,69-2,55 (м, 2H), 2,12 (дк, J=15,5, 5,7, 4,0 Гц, 1H), 1,86 (ддд, J=13,1, 3,9, 2,1 Гц, 1H), 1,63-1,47 (м, 1H), 1,50-1,19 (м, 2H), 1,16 (т, J=7,6 Гц, 3H), 0,84 (д, J=6,7 Гц, 6H).
Время удержания (хиральная SFC) 2,49 минут
Пример 127: N-(4-этилфенил)-3-гидроксиметил-N-изобутил-4-(тетрагидропиран-4-илметан-сульфонил)бензолсульфонамид (соединение 12)- энантиомер B соединения 15 (134 мг; 36%) в виде белого твердого вещества
1H ЯМР (400 МГц, DMSO-d6) δ 8,01 (д, J=8,1 Гц, 1H), 7,76-7,57 (м, 2H), 7,30-7,10 (м, 2H), 7,07-6,86 (м, 2H), 5,65 (дд, J=5,9, 4,8 Гц, 1H), 4,60 (дд, J=5,3, 3,3 Гц, 2H), 3,95-3,74 (м, 1H), 3,33 (д, J=3,1 Гц, 2H), 2,94 (дд, J=13,2, 9,4 Гц, 1H), 2,69-2,55 (м, 2H), 2,12 (дк, J=15,5, 5,7, 4,0 Гц, 1H), 1,86 (ддд, J=13,1, 3,9, 2,1 Гц, 1H), 1,63-1,47 (м, 1H), 1,50-1,19 (м, 2H), 1,16 (т, J=7,6 Гц, 3H), 0,84 (д, J=6,7 Гц, 6H).
Время удержания (хиральная SFC) 2,92 минуты
Часть VIII: Синтез содержащих серу сульфонамидов по схеме реакции 8
Схема реакции 8
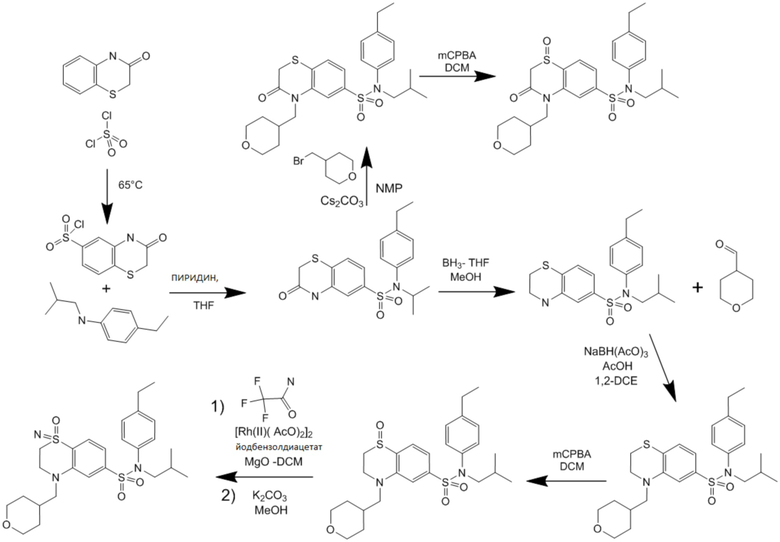
Пример 128: Синтез (4-этилфенил)изобутиламида 3-оксо-3,4-дигидро-2H-бензо[1,4]триазин-6-сульфоновой кислоты

Соединение 10
1. Синтез промежуточного соединения 128.1
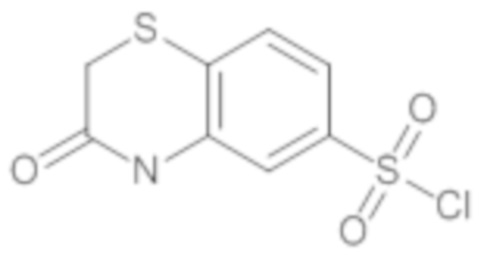
3-оксо-3,4-дигидро-2H-бензо-[1,4]триазин-6-сульфонилхлорид
4H-бензо[1,4]тиазин-3-он (4,0 г; 24.21 ммоль) медленно добавляют к хлорсульфоновой кислоте (6,5 мл; 96,84 ммоль), охлажденной до 10°C. Температуру поддерживают выше 20°C. Реакционную среду перемешивают при температуре окружающей среды в течение 1 часа, затем нагревают при температуре 65°C, медленно переливают на лед, затем экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором, сушат над сульфатом натрия и концентрируют. Остаток ресуспендируют в простом эфире и сушат.
3-оксо-3,4-дигидро-2H-бензо-[1,4]триазин-6-сульфонилхлорид (4,88 г; 76%) получают в виде порошка охрового цвета.
MS: [M+H]=262
2. Синтез соединения 10 по изобретению

3-оксо-3,4-дигидро-2H-бензо-[1,4]триазин-6-сульфонилхлорид (3,27 г; 12,41 ммоль) добавляют к (4-этилфенил)изобутиламину: (2 г; 11,28 ммоль) и пиридину (40 мл; 495,56 ммоль) в растворе в тетрагидрофуране (5,4 мл). Реакционную среду перемешивают при температуре окружающей среды в течение 2 часов, гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, промывают 1н. раствором соляной кислоты, солевым раствором, сушат над сульфатом натрия и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 50% этилацетата). (4-этилфенил)изобутиламид 3-оксо-3,4-дигидро-2H-бензо-[1,4]триазин-6-сульфоновой кислоты (2,53 г; 55%) получают в виде желтого твердого вещества.
1H ЯМР (Хлороформ-d) δ: 0,93 (д, J=6,7 Гц, 7H), 1,25 (тд, J=7,6, 4,3 Гц, 4H), 1,53-1,67 (м, 2H), 2,67 (к, J=7,6 Гц, 2H), 3,32 (д, J=7,4 Гц, 2H), 3,50 (с, 2H), 6,94-7,04 (м, 2H), 7,07 (д, J=1,9 Гц, 1H), 7,12-7,20 (м, 2H), 7,22 (дд, J=8,2, 1,8 Гц, 1H), 7,41 (д, J=8,2 Гц, 1H), 8,28 (с, 1H).
MS: [M+H]=405
Пример 129: Синтез (4-этилфенил)изобутиламида 3,4-дигидро-2H-бензо[1,4]триазин-6-сульфоновой кислоты

Соединение 9
(4-этилфенил))изобутиламид 3-оксо-3,4-дигидро-2H-бензо-[1,4]триазин-6-сульфоновой кислоты (500 мг; 1,28 ммоль) растворяют в комплексе 1M тетрагидрофуранборана с 5 ммоль NaBH4 (35 мл). Реакционную среду нагревают с обратным холодильником в течение 30 минут, затем охлаждают до температуры 0°C и медленно вливают в метанол (35 мл).
Концентрируют растворители и остаток подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 40% этилацетата).
(4-этилфенил))изобутиламид 3,4-дигидро-2H-бензо[1,4]триазин-6-сульфоновой кислоты (437 мг; 86%) получают в виде белого кристаллического твердого вещества после повторной кристаллизации в смеси этилацетата/гептана.
1H ЯМР (DMSO-d6) δ: 0,82 (д, J=6,7 Гц, 6H), 1,17 (т, J=7,6 Гц, 3H), 1,31-1,47 (м, 1H), 2,59 (к, J=7,6 Гц, 2H), 2,97-3,05 (м, 2H), 3,25 (д, J=7,3 Гц, 2H), 3,48 (дт, J=7,0, 3,0 Гц, 2H), 6,48-6,56 (м, 2H), 6,75 (д, J=2,0 Гц, 1H), 6,95-7,04 (м, 3H), 7,14-7,21 (м, 2H).
MS: [M+H]=391
Пример 130: Синтез (4-этилфенил)изобутиламида 4-(тетрагидропиран-4-илметил)-3,4-дигидро-2H-бензо-[1,4]триазин-6-сульфоновой кислоты

Соединение 6
Триацетоксиборогидрид натрия (33 мг; 0,15 ммоль) добавляют при температуре 0°C к(4-этилфенил))изобутиламиду 3,4-дигидро-2H-бензо[1,4]триазин-6-сульфоновой кислоты (20 мг; 0,05 ммоль), 4-формилтетрагидропирану (29 мг; 0,26 ммоль) и уксусной кислоте (0,15 мкл) в растворе в 1,2-дихлорэтане. Реакционную среду перемешивают при температуре окружающей среды в течение 24 часов, добавляют к воде и экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором, сушат над сульфатом натрия и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 50% этилацетата). (4-этилфенил)изобутиламид 4-(тетрагидропиран-4-илметил)-3,4-дигидро-2H-бензо-[1,4]триазин-6-сульфоновой кислоты (15 мг; 59%) получают в виде твердого вещества бежевого цвета.
1H ЯМР (DMSO-d6) δ: 0,84 (д, J=6,6 Гц, 7H), 1,06-1,27 (м, 6H), 1,40-1,48 (м, 3H), 1,68-1,79 (м, 1H), 2,55-2,66 (м, 2H), 3,01 (д, J=6,9 Гц, 2H), 3,08 (т, J=4,8 Гц, 2H), 3,19 (т, J=11,5 Гц, 2H), 3,26 (д, J=7,3 Гц, 2H), 3,62 (т, J=4,8 Гц, 2H), 3,82 (дд, J=11,0, 4,2 Гц, 2H), 6,54 (с, 1H), 6,71 (д, J=7,9 Гц, 1H), 7,02 (д, J=8,0 Гц, 2H), 7,13 (д, J=8,1 Гц, 1H), 7,21 (д, J=7,9 Гц, 2H).
MS: [M+H]=489
Пример 131: Синтез (4-этилфенил)изобутиламида 1-оксо-4-(тетрагидропиран-4-илметил)-1,2,3,4-тетрагидро-1λ4-бензо[1,4]триазин-7-сульфоновой кислоты

Соединение 3
3-хлорпербензойную кислоту (124 мг; 0,55 ммоль) при температуре 0°C добавляют к (4-этилфенил)изобутиламиду 4-(тетрагидропиран-4-илметил)-3,4-дигидро-2H-бензо[1,4]триазин-7-сульфоновой кислоты (300 мг; 0,61 ммоль) в растворе дихлорметана (6 мл). Реакционную среду перемешивают при температуре окружающей среды в течение 30 минут, гидролизуют 10% водным раствором Na2S2O3 и экстрагируют au дихлорметан. Органические фазы разделяют, промывают 0,1н. водным раствором гидроксида натрия, солевым раствором, сушат над сульфатом натрия и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют дихлорметан/метанол от 0 до 10% метанола). (4-этилфенил)изобутиламид 1-оксо-4-(тетрагидропиран-4-илметил)-1,2,3,4-тетрагидро-1λ4-бензо[1,4]триазин-7-сульфоновой кислоты (274 мг; 88%) получают в виде белого твердого вещества кристаллизацией в смеси вода/ацетон.
1H ЯМР (DMSO-d6) δ: 0.85 (дд, J=6.6, 1,3 Гц, 6H), 1,12-1,28 (м, 5H), 1,44 (дт, J=12,8, 9.6 Гц, 3H), 1,71-1,88 (м, 1H), 2.61 (к, J=7.6 Гц, 2H), 2,85 (тд, J=13.6, 3.4 Гц, 1H), 3.09-3.36 (м, 12H), 3.64 (дт, J=14.0, 3.8 Гц, 1H), 3.78-3.90 (м, 3H), 6.81 (д, J=7.3 Гц, 2H), 7.01-7.08 (м, 2H), 7.19-7.26 (м, 2H), 7.70 (д, J=8.2 Гц, 1H).
MS: [M+H]=505
Пример 132: Синтез (4-этилфенил)изобутиламида 1-Имино-1-оксо-4-(тетрагидропиран-4-илметил)-1,2,3,4-тетрагидро-1λ6-бензо-[1,4]триазин-6-сульфоновой кислоты
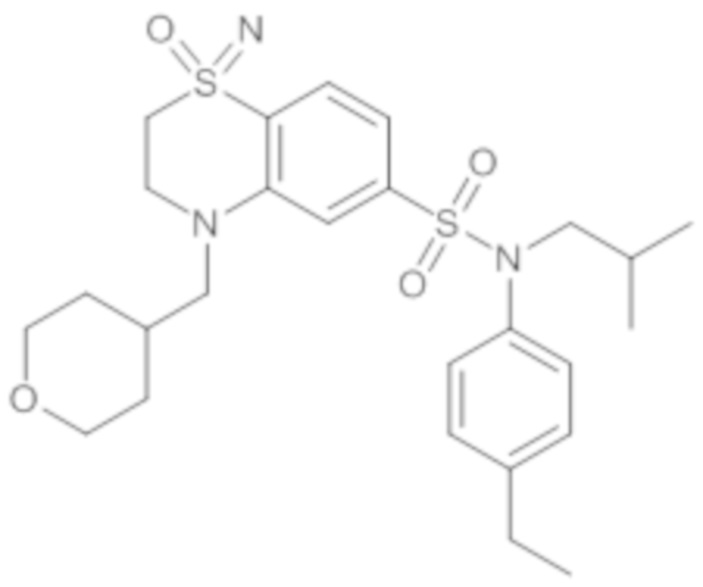
Соединение 1
К предварительно дегазированному аргоном раствору (4-этилфенил)изобутиламида 1-оксо-4-(тетрагидропиран-4-илметил)-1,2,3,4-тетрагидро-1λ4-бензо[1,4]триазин-6-сульфоновой кислоты (195,00 мг; 0,39 ммоль) в дихлорметане (10 мл) добавляют 2,2,2-трифторацетамид (109 мг; 0,97 ммоль), ацетат родия (II) (26 мг; 0,06 ммоль), оксида магния (78 мг; 1,93 ммоль) и йодбензолдиацетат (249 мг; 0,77 ммоль). Реакционную среду перемешивают при температуре окружающей среды в течение 16 часов, фильтруют через целит и концентрируют. Получаемый остаток разбавляют в метаноле (10 мл) и добавляют карбонат калия (267 мг; 1,93 ммоль).
Реакционную среду перемешивают в течение 30 минут, затем гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором и сушат над сульфатом натрия. Выпаривают растворители. Неочищенный продукт подвергают хроматографии на силикагеле (элюируют дихлорметаном/метанол от 0 до 5% метанола).
(4-этилфенил)изобутиламид 1-имино-1-оксо-4-(тетрагидропиран-4-илметил)-1,2,3,4-тетрагидро-1λ6-бензо[1,4]триазин-6-сульфоновой кислоты (44,50 мг; 21,97%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,86 (т, J=4,9 Гц, 8H), 1,09-1,33 (м, 9H), 1,36-1,49 (м, 3H), 1,75 (qd, J=8,6, 7,9, 4,2 Гц, 1H), 2,61 (к, J=7,6 Гц, 2H), 3,17 (дд, J=15,8, 9,0 Гц, 4H), 3,34-3,46 (м, 3H), 3,85 (ддд, J=23,1, 9,5, 4,1 Гц, 4H), 4,74 (с, 1H), 6,68 (с, 1H), 6,88 (д, J=8,1 Гц, 1H), 7,05 (д, J=8,2 Гц, 2H), 7,23 (д, J=7,9 Гц, 2H), 7,84 (д, J=8,1 Гц, 1H).
MS: [M+H]=519
Пример 133: Синтез (4-этилфенил)изобутиламида 3-оксо-4-(тетрагидропиран-4-илметил)-3,4-дигидро-2H-бензо[1,4]триазин-7-сульфоновой кислоты

Соединение 70
4-(бромметил)тетрагидропиран (18 мг; 0,10 ммоль) добавляют к (4-этилфенил)изобутиламиду 3-оксо-3,4-дигидро-2H-бензо[1,4]триазин-7-сульфоновой кислоты (20 мг; 0,05 ммоль) и карбонату цезия (24 мг; 0,07 ммоль) в растворе в 1-метил-2-пирролидоне (0,4 мл).
Реакционную среду нагревают до 80°C в течение 24 часов, гидролизуют, затем экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором и сушат над сульфатом натрия.
Выпаривают растворители и неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 50% этилацетата).
(4-этилфенил)изобутиламид 3-оксо-4-(тетрагидропиран-4-илметил)-3,4-дигидро-2H-бензо[1,4]триазин-7-сульфоновой кислоты (10,4 мг; 40%) получают в виде бежевого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,85 (д, J=6,8 Гц, 7H), 1,17 (т, J=7,6 Гц, 3H), 1,25 (д, J=6,5 Гц, 2H), 1,37-1,67 (м, 10H), 1,68-1,77 (м, 5H), 2,44 (дт, J=11,1, 4,0 Гц, 10H), 2,60 (к, J=7,6 Гц, 2H), 3,17 (с, 1H), 3,33-3,38 (м, 5H), 3,80 (дт, J=11,3, 3,7 Гц, 7H), 3,92 (с, 1H), 7,02 (д, J=7,8 Гц, 2H), 7,18 (дд, J=18,5, 8,4 Гц, 3H), 7,42 (д, J=8,4 Гц, 1H), 7,60 (д, J=2,1 Гц, 1H), 12,17 (с, 2H).
MS: [M+H]=503
Пример 134: Синтез (4-этилфенил)изобутиламида 1,3-диоксо-4-(тетрагидропиран-4-илметил)-1,2,3,4-тетрагидро-1λ4-бензо-[1,4]триазин-6-сульфоновой кислоты

Соединение 4
3-хлорпербензойную кислоту (161 мг; 0,72 ммоль) добавляют при 0°C к (4-этилфенил)изобутиламиду 3-оксо-4-(тетрагидропиран-4-илметил)-3,4-дигидро-2H-бензо[1,4]триазин-6-сульфоновой кислоте (400 мг; 0,80 ммоль) в растворе в дихлорметане (8 мл).
Реакционную среду перемешивают при температуре окружающей среды в течение 1 часа, гидролизуют 10% водным раствором Na2S2O3 и экстрагируют дихлорметаном. Органические фазы разделяют, промывают 0,1н. водным раствором гидроксида натрия, затем солевым раствором и сушат над сульфатом натрия. Растворители концентрируют и неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 80% этилацетата). (4-этилфенил)изобутиламид 1,3-диоксо-4-(тетрагидропиран-4-илметил)-1,2,3,4-тетрагидро-1λ4-бензо[1,4]триазин-6-сульфоновой кислоты (358 мг; 87%) получают в виде белого твердого вещества
1H ЯМР (DMSO-d6) δ: 0,87 (д, J=6,6 Гц, 6H), 1,01-1,23 (м, 5H), 1,37-1,53 (м, 3H), 1,62-1,83 (м, 1H), 2,62 (к, J=7,6 Гц, 2H), 3,05-3,22 (м, 2H), 3,33-3,49 (м, 2H), 3,72-3,89 (м, 3H), 4,04 (дд, J=14,8, 8,5 Гц, 1H), 4,29-4,39 (м, 2H), 7,01-7,08 (м, 2H), 7,21-7,28 (м, 2H), 7,43 (дд, J=7,8, 1,5 Гц, 1H), 7,50 (д, J=1,6 Гц, 1H), 8,08 (д, J=7,8 Гц, 1H).
MS: [M+H]=519
Часть IX: Синтез содержащих серу сульфонамидов по схеме реакции 9
Схема реакции 9
Пример 135: Синтез (4-этилфенил)изобутиламида 1-оксо-4-(тетрагидропиран-4-илметил)-1,2,3,4-тетрагидро-1λ4-бензо-[1,4]триазин-7-сульфоновой кислоты

Соединение 71
1. Синтез промежуточного соединения 135.1
3-бром-N-(4-этилфенил)-N-изобутил-4-метоксибензолсульфонамид
3-фтор-4-нитробензолсульфонилхлорид (5,57 г; 22,56 ммоль) добавляют к раствор (4-этилфенил)изобутиламина (4,0 г; 22,56 ммоль) и пиридина (11 мл; 135,37 ммоль) в тетрагидрофуране (80 мл). Реакционную среду перемешивают в течение 16 часов при температуре окружающей среды, гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, промывают насыщенным раствором NH4Cl, солевым раствором, сушат (Na2SO4) и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 10% этилацетата). 3-бром-N-(4-этилфенил)-N-изобутил-4-метоксибензолсульфонамид (7,02 г; 82%) получают в виде белого твердого хлопьевидного вещества с соответствующим 1H ЯМР.
MS: [M+H]=381
2. Синтез промежуточного соединения 135.2
{5-[(4-этилфенил)изобутилсульфамоил]-2-нитрофенилсульфанил}этилацетaт
Этилтиогликолят (0,86 мл; 7,89 ммоль) медленно добавляют к раствору N-(4-этилфенил)-3-фтор-N-изобутил-4-нитробензолсульфонамида (3,0 г; 7,89 ммоль) и триэтиламина (1,31 мл; 9,46 ммоль) в дихлорметане (75 мл). Реакционную среду перемешивают в течение 16 часов при температуре окружающей среды.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептан/этилацетатом от 0 до 30% этилацетата).
{5-[(4-этилфенил)изобутилсульфамоил]-2-нитрофенилсульфанил}этилацетат (3,49 г; 92%) получают в виде ярко-желтого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=481,
3. Синтез промежуточного соединения 135.3
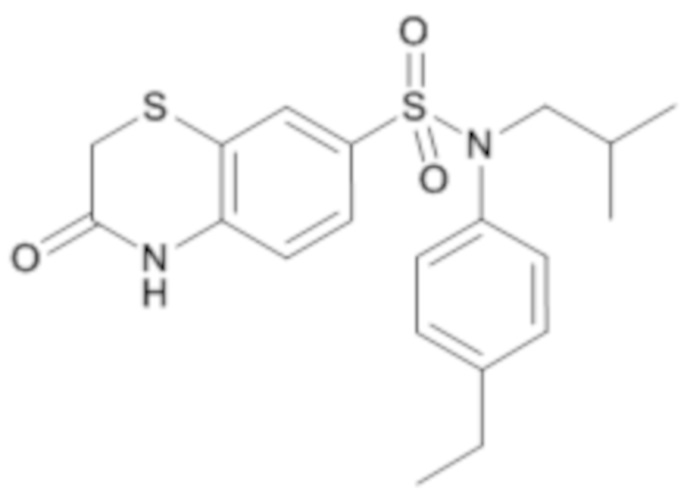
4-этилфенил)изобутиламид 3-оксо-3,4-дигидро-2H-бензо[1,4]триазин-7-сульфоновой кислоты
Железный порошок (1,16 г; 20,81 ммоль) добавляют к раствору {5-[(4-этилфенил)изобутилсульфамоил]-2-нитрофенилсульфанил}этилацетата (2,00 г; 4,16 ммоль) в этаноле (20 мл) и уксусной кислоте (5 мл).
Реакционную среду перемешивают в течение 2 часов при температуре 80°C, приводят к температуре окружающей среды, разбавляют этилацетатом, затем фильтруют через целит. Фильтрат промывают насыщенным раствором NaHCO3, затем солевым раствором, сушат (Na2SO4), концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 40% этилацетата). (4-этилфенил)изобутиламид 3-оксо-3,4-дигидро-2H-бензо[1,4]триазин-7-сульфоновой кислоты (0,98 г; 58%) получают в виде белого порошка с соответствующим 1H ЯМР.
MS: [M+H]=405
4. Синтез промежуточного соединения 135.4
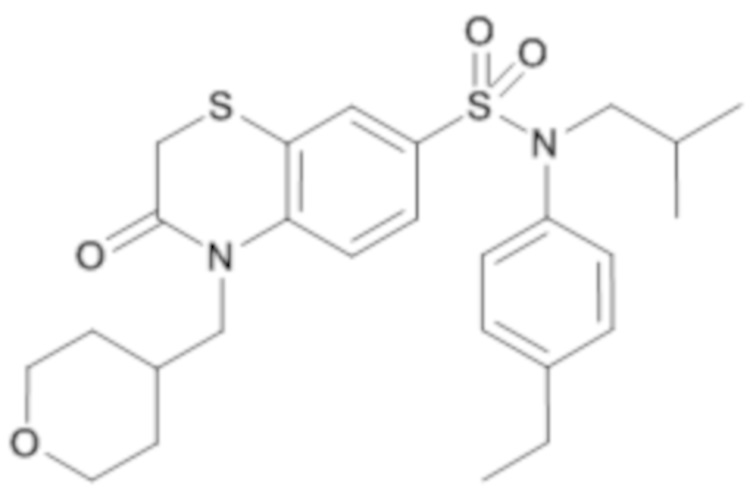
(4-этилфенил)изобутиламид 3-оксо-4-(тетрагидропиран-4-илметил)-3,4-дигидро-2H-бензо-[1,4]триазин-7-сульфоновой кислоты
4-(бромметил)тетрагидропиран (797 мг; 4,45 ммоль) добавляют к смеси(4-этилфенил)изобутиламида 3-оксо-3,4-дигидро-2H-бензо[1,4]триазин-7-сульфоновой кислоты (900 мг; 2,22 ммоль) и карбоната цезия (1,09 г; 3.,34 ммоль) в 1-метил-2-пирролидоне (20 мл).
Реакционную среду перемешивают в течение 4 часов при температуре 110°C, гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором, сушат (Na2SO4), концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 60% этилацетата). (4-этилфенил)изобутиламид 3-оксо-4-(тетрагидропиран-4-илметил)-3,4-дигидро-2H-бензо-[1,4]триазин-7-сульфоновой кислоты (1,11 г; 99%) получают в виде белого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=503
5. Синтез промежуточного соединения 135.5
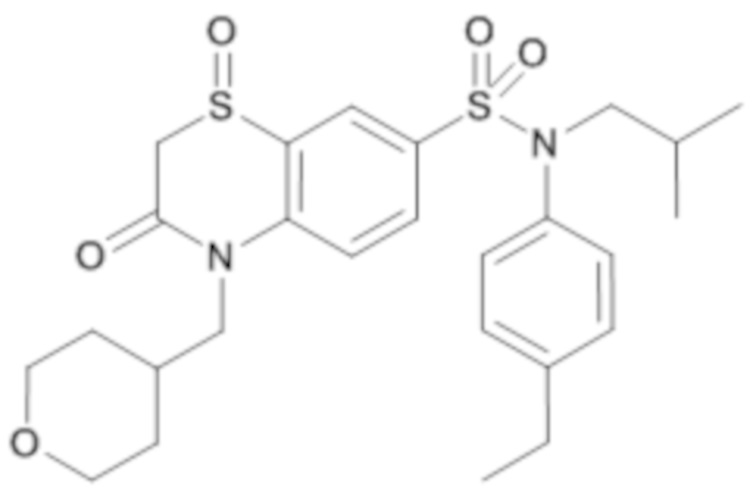
(4-этилфенил)изобутиламид 1,3-диоксо-4-(тетрагидропиран-4-илметил)-1,2,3,4-тетрагидро-1λ4-бензо-[1,4]триазин-7-сульфоновой кислоты
3-хлорпероксибензойную кислоту (223 мг; 0,99 ммоль) добавляют при температуре 0°C к (4-этилфенил)изобутиламиду 3-оксо-4-(тетрагидропиран-4-илметил)-3,4-дигидро-2H-бензо-[1,4-]триазин-7-сульфоновой кислоты: (500 мг; 0,99 ммоль) в растворе в дихлорметане (10 мл). Реакционную среду перемешивают в течение 30 минут при температуре окружающей среды, гидролизуют 10% водным раствором Na2S2O3 и экстрагируют дихлорметан. Органические фазы разделяют, затем промывают 0,1н. водным раствором гидроксида натрия, затем солевым раствором, сушат (Na2SO4), концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 80% этилацетата). (4-этилфенил)изобутиламид 1,3-диоксо-4-(тетрагидропиран-4-илметил)-1,2,3,4-тетрагидро-1λ4-бензо[1,4]триазин-7-сульфоновой кислоты (310 мг; 60%) получают в виде кристаллического белого порошка после кристаллизации в смеси этанол-гептан.
MS: [M+H]=519
6. Синтез промежуточного соединения 135.6
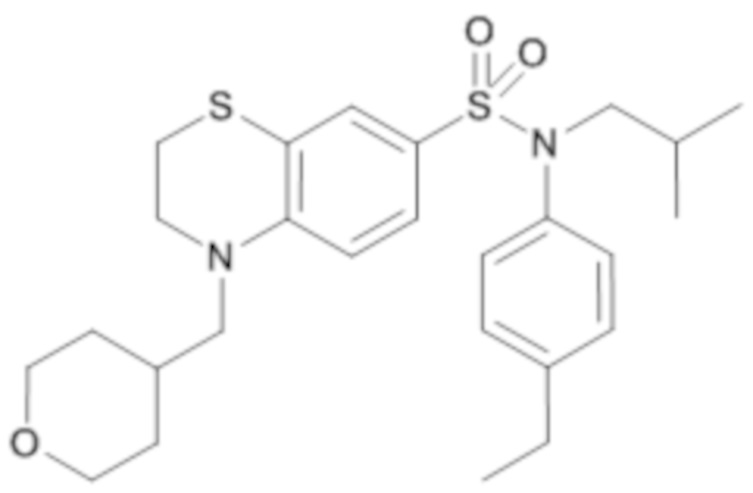
(4-этилфенил)изобутиламид 4-(тетрагидропиран-4-илметил)-3,4-дигидро-2H-бензо[1,4]триазин-7-сульфоновой кислоты
(4-этилфенил)изобутиламид 3-оксо-4-(тетрагидропиран-4-илметил)-3,4-дигидро-2H-бензо[1,4]триазин-7-сульфоновой кислоты (500 мг; 0,99 ммоль) добавляют к 1M раствору комплекса, стабилизированного бораном/тетрагидрофураном в тетрагидрофуране (35 мл). Реакционную среду перемешивают с обратным холодильником, охлаждают и переливают при 0°C в метанол (35 мл). Концентрируют растворители.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 50% этилацетата). (4-этилфенил)изобутиламид 4-(тетрагидропиран-4-илметил)-3,4-дигидро-2H-бензо[1,4]триазин-7-сульфоновой кислоты (466 мг; 95%) получают в виде кристаллического белого твердого вещества после повторной кристаллизации в простом эфире с соответствующим 1H ЯМР.
MS: [M+H]=489
7. Синтез соединения 71 по изобретению

3-хлорпероксибензойную кислоту (175,4 мг; 0,78 ммоль) добавляют при температуре 0°C к (4-этилфенил)изобутиламиду 4-(тетрагидропиран-4-илметил)-3,4-дигидро-2H-бензо[1,4]триазин-7-сульфоновой кислоты (425, мг; 0,87 ммоль) в растворе в дихлорметане (8,5 мл). Реакционную среду перемешивают в течение 15 минут при температуре окружающей среды, гидролизуют 10% водным раствором Na2S2O3, затем экстрагируют дихлорметаном. Органические фазы разделяют, промывают 0,1н. водным раствором гидроксида натрия, затем солевым раствором, сушат (Na2SO4), концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 100% этилацетата, затем дихлорметаном/метанолом от 0 до 10% метанола). (4-этилфенил)изобутиламид 1-оксо-4-(тетрагидропиран-4-илметил)-1,2,3,4-тетрагидро-1λ4-бензо-[1,4]триазин-7-сульфоновой кислоты (379 мг; 86%) получают в виде белого кристаллического порошка после кристаллизации в смеси простой эфир/гептан.
1H ЯМР (DMSO-d6) δ: 0,84 (д, J=6,7 Гц, 6H), 1,19 (т, J=7,6 Гц, 3H), 1,35 (дддд, J=34,9, 26,9, 14,1, 8,5 Гц, 3H), 1,53-1,61 (м, 2H), 2,02 (ддд, J=11,6, 7,6, 3,7 Гц, 1H), 2,61 (к, J=7,6 Гц, 2H), 2,87 (тд, J=13,7, 3,4 Гц, 1H), 3,14 (ддд, J=13,9, 4,1, 2,3 Гц, 1H), 3,20-3,33 (м, 8H), 3,42-3,50 (м, 2H), 3,69 (дт, J=14,1, 3,7 Гц, 1H), 3,82-3,98 (м, 3H), 6,97-7,04 (м, 2H), 7,09 (д, J=9,1 Гц, 1H), 7,16-7,23 (м, 2H), 7,35 (дд, J=9,1, 2,3 Гц, 1H), 7,54 (д, J=2,3 Гц, 1H).
MS: [M+H]=505
Пример 136: Синтез (4-этилфенил)изобутиламид 1-имино-1-оксо-4-(тетрагидропиран-4-илметил)-1,2,3,4-тетрагидро-1λ6-бензо[1,4]триазин-7-сульфоновой кислоты
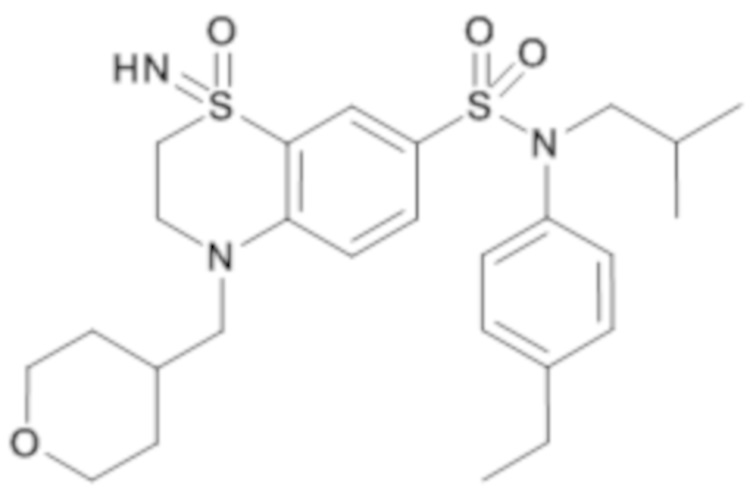
К предварительно дегазированному аргоном раствору (4-этилфенил)изобутиламида 1-оксо-4-(тетрагидропиран-4-илметил)-1,2,3,4-тетрагидро-1λ4-бензо[1,4]триазин-7-сульфоновой кислоты (330 мг; 0,65 ммоль) в дихлорметане (16,5 мл) добавляют 2,2,2-трифторацетамид (185 мг; 1,63 ммоль), димер ацетата родия (II) (44 мг; 0,10 ммоль), оксида магния (132 мг; 3.27 ммоль) и йодбензолдиацетат (421 мг; 1,31 ммоль).
Реакционную среду перемешивают в течение 16 часов при температуре окружающей среды, фильтруют через целит и концентрируют. Остаток разбавляют в метаноле (16.50 мл) и карбонате калия (452 мг; 3.27 ммоль) добавляют. Реакционную среду перемешивают в течение 30 минут, гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, промывают солевым раствором, сушат (Na2SO4), концентрируют.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты).
(4-этилфенил)изобутиламид 1-имино-1-оксо-4-(тетрагидропиран-4-илметил)-1,2,3,4-тетрагидро-1λ6-бензо[1,4]триазин-7-сульфоновой кислоты (44,5 мг; 13%) получают в виде кристаллического порошка кремового цвета после повторной кристаллизации в смеси гептан/дихлорметан.
1H ЯМР (DMSO-d6) δ: 0,73-0,94 (м, 7H), 1,19 (т, J=7,6 Гц, 3H), 1,22-1,36 (м, 4H), 1,42 (дт, J=13,6, 6,8 Гц, 1H), 1,58 (д, J=13,1 Гц, 2H), 1,85-2,10 (м, 1H), 2,61 (к, J=7,6 Гц, 2H), 3,20-3,32 (м, 4H), 3,34-3,51 (м, 3H), 3,86 (дд, J=11,4, 4,0 Гц, 2H), 3,94 (p, J=3,7 Гц, 2H), 4,68 (с, 1H), 7,00 (дд, J=15,4, 8,7 Гц, 3H), 7,20 (д, J=8,1 Гц, 2H), 7,27 (дд, J=9,2, 2,4 Гц, 1H), 7,86 (д, J=2,4 Гц, 1H).
MS: [M+H]=520
Часть X: Синтез содержащих серу сульфонамидов по схеме реакции 10
Схема реакции 10
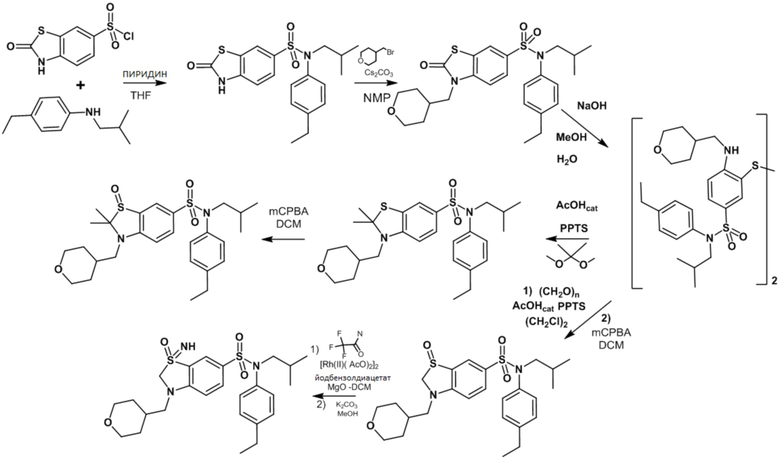
Пример 137: Синтез (4-этилфенил)изобутиламида 3-оксо-4-(тетрагидропиран-4-илметил)-3,4-дигидро-2H-бензо-[1,4]триазин-7-сульфоновой кислоты

Соединение 72
1. Синтез промежуточного соединения 137.1
(4-этилфенил)изобутиламид 2-оксо-2,3-дигидро-бензотиазол-6-сульфоновой кислоты
2-оксо-2,3-дигидро-бензотиазол-6-сульфонилхлорид (2,97 г; 11,28 ммоль) добавляют к (4-этилфенил)изобутиламину (2,00 г; 11,28 ммоль) и пиридину (5,5 мл; 67,69 ммоль) в растворе в тетрагидрофуране (40 мл). Реакционную среду перемешивают в течение 16 часов при температуре окружающей среды, гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, затем промывают насыщенным раствором NH4Cl, солевым раствором, сушат (MgSO4) и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептаном/этилацетатом от 0 до 10% этилацетата). (4-этилфенил)изобутиламид 2-оксо-2,3-дигидро-бензотиазол-6-сульфоновой кислоты (2,67 г; 61%) получают в виде хлопьевидного белого твердого вещества с соответствующим 1H ЯМР.
MS: [M+H]=391
2. Синтез соединения 72 по изобретению

4-(бромметил)тетрагидропиран (2,25 г; 12,55 ммоль) добавляют к (4-этилфенил)изобутиламиду 2-оксо-2,3-дигидро-бензотиазол-6-сульфоновой кислоты: (2,45 г; 6,27 ммоль) и карбонату цезия (3,07 г; 9,41 ммоль) в растворе в 1-метил-2-пирролидоне (50 мл). Реакционную среду перемешивают в течение 4 часов при 90°C, гидролизуют и экстрагируют этилацетатом. Органические фазы разделяют, затем промывают солевым раствором и сушат (Na2SO4), и концентрируют.
Неочищенный продукт подвергают хроматографии на силикагеле (элюируют гептан/этилацетатом от 0 до 60% этилацетата). (4-этилфенил)изобутил 3-оксо-4-(тетрагидропиран-4-илметил)-3,4-дигидро-2H-бензо[1,4]триазин-7-сульфоновую кислоту (2,19 г; 72%) получают в виде кристаллического белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,85 (д, J=6,6 Гц, 7H), 1,13-1,22 (м, 4H), 1,24-1,55 (м, 6H), 2,03 (ддт, J=10,8, 6,9, 3,4 Гц, 1H), 2,50-2,66 (м, 3H), 3,23 (тд, J=11,6, 2,1 Гц, 2H), 3,34 (с, 1H), 3,83 (ддд, J=11,3, 4,4, 1,9 Гц, 2H), 3,90 (д, J=7,3 Гц, 2H), 6,96-7,04 (м, 2H), 7,14-7,22 (м, 2H), 7,42 (дд, J=8,6, 1,9 Гц, 1H), 7,57 (с, 1H), 8,05 (д, J=1,9 Гц, 1H).
MS: [M+H]=489
Пример 138: Синтез (4-этилфенил)изобутиламида 2,2-диметил-3-(тетрагидропиран-4-илметил)-2,3-дигидро-бензотиазол-6-сульфоновой кислоты

Соединение 73
1. Синтез промежуточного соединения 138.1
3,3'-дисульфандиил-бис-(N-(4-этилфенил)-N-изобутил-4-(((тетрагидро-2H-пиран-4-ил)метил)амино)бензолсульфонамид
Смесь(4-этилфенил)изобутиламида 2-оксо-3-(тетрагидропиран-4-илметил)-2,3-дигидро-бензотиазол-6-сульфоновой кислоты (500 мг; 1,02 ммоль) и гидроксида натрия (410 мг; 10,23 ммоль) в метаноле (6 мл) и воде (100 мкл) перемешивают в течение 16 часов при температуре 80°. Реакционную среду разбавляют 20 мл этилацетата.
Промывают органическую фазу 20 мл насыщенного раствора NH4Cl, 20 мл насыщенного раствора NaHCO3 и 20 мл воды, сушат (MgSO4), фильтруют и концентрируют досуха. 3,3'-дисульфандиил-бис-(N-(4-этилфенил)-N-изобутил-4-(((тетрагидро-2H-пиран-4-ил)метил)амино)бензолсульфонамид) (500 мг; 53%) получают в виде желтого масла с соответствующим 1H ЯМР.
MS: [M+H]=923
2. Синтез соединения 73 по изобретению

(4-этилфенил)изобутиламид 2,2-диметил-3-(тетрагидропиран-4-илметил)-2,3-дигидро-бензотиазол-6-сульфоновой кислоты
К 3,3'-дисульфандиил-бис-(N-(4-этилфенил)-N-изобутил-4-(((тетрагидро-2H-пиран-4-ил)метил)амино)бензолсульфонамиду) (300 мг; 0,32 ммоль) добавляют 2,2-диметоксипропан (1,0 мл; 8,35 ммоль) и пара-толуолсульфонaт пиридина (245 мг; 0,97 ммоль). Реакционную среду перемешивают в течение 16 часов при температуре 80°C. Затем добавляют 3 капли уксусной кислоты и перемешивают реакционную среду в течение 2 часов при 80°C.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). (4-этилфенил)изобутиламид 2,2-диметил-3-(тетрагидропиран-4-илметил)-2,3-дигидро-бензотиазол-6-сульфоновой кислоты (70 мг; 40%) получают в виде светло-желтого масла.
1H ЯМР (DMSO-d6) δ: 0,83 (д, J=6,7 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,21-1,33 (м, 2H), 1,31-1,47 (м, 1H), 1,63 (с, 8H), 1,80 (с, 1H), 2,60 (к, J=7,6 Гц, 2H), 3,08 (д, J=7,2 Гц, 2H), 3,22-3,30 (м, 4H), 3,87 (дд, J=11,5, 3,8 Гц, 2H), 6,47 (д, J=8,4 Гц, 1H), 6,99-7,03 (м, 2H), 7,07 (дк, J=8,3, 2,1 Гц, 1H), 7,12 (д, J=2,0 Гц, 1H), 7,16-7,21 (м, 2H).
MS: [M+H]=503
Пример 139: Синтез (4-этилфенил)изобутиламида 2,2-диметил-1-оксо-3-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-1λ4-бензотиазол-6-сульфоновой кислоты

Соединение 74
К раствору (4-этилфенил)изобутиламида 2,2-диметил-3-(тетрагидропиран-4-илметил)-2,3-дигидро-бензотиазол-6-сульфоновой кислоты (70 мг; 0,14 ммоль) в дихлорметане (2 мл) добавляют 3-хлорпероксибензойную кислоту (30 мг; 0,15 ммоль). Реакционную среду перемешивают 45 минут при температуре окружающей среды, разбавляют дихлорметаном (10 мл) и водой (5 мл) и экстрагируют.
Органические фазы разделяют, сушат (MgSO4), фильтруют и концентрируют.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). (4-этилфенил)изобутиламид 2,2-диметил-1-оксо-3-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-1λ4-бензотиазол-6-сульфоновую кислоту (20мг; 28%) получают в виде бледно-желтого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,85 (д, J=6,7 Гц, 6H), 1,19 (дд, J=15,7, 8,1 Гц, 6H), 1,25-1,49 (м, 3H), 1,56 (д, J=12,1 Гц, 2H), 1,64 (с, 3H), 1,90 (с, 1H), 2,60 (к, J=7,6 Гц, 2H), 3,18-3,28 (м, 2H), 3,87 (дт, J=10,6, 4,9 Гц, 2H), 7,00 (т, J=8,9 Гц, 3H), 7,19 (д, J=8,1 Гц, 2H), 7,46 (дд, J=8,5, 2,1 Гц, 1H), 8,00 (д, J=2,0 Гц, 1H).
MS: [M+H]=519
Пример 140: Синтез соединения (4-этилфенил)изобутиламида 1-оксо-3-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-1λ4-бензотиазол-6-сульфоновой кислоты
Соединение 75
К 3,3'-дисульфан-диил-бис(N-(4-этилфенил)-N-изобутил-4-(((тетрагидро-2H-пиран-4-ил)метил)амино)бензолсульфонамиду) (200 мг; 0.22 ммоль) добавляют параформальдегид (473 мг; 1,08 ммоль), пара-толуолсульфонaт пиридина (163 мг; 0,65 ммоль) и 1,2-дихлорэтан (3 мл).
Реакционную среду перемешивают в течение 16 часов при 80°C, фильтруют, разбавляют дихлорметаном, сушат (MgSO4) и фильтруют. К фильтрату добавляют 3-хлорпероксибензойную кислоту (107 мг; 0,48 ммоль). Реакционную среду перемешивают в течение 30 минут при температуре окружающей среды, разбавляют дихлорметаном (20 мл) и водой (10 мл) и экстрагируют. Промывают органическую фазу раствором сульфита натрия (20 мл), водой (20 мл), сушат (MgSO4), фильтруют и концентрируют.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). (4-этилфенил)изобутиламид 1-оксо-3-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-1λ4-бензотиазол-6-сульфоновую кислоту (70 мг; 66%) получают в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,85 (дд, J=6,7, 3,5 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,22-1,34 (м, 2H), 1,42 (дт, J=13,6, 6,9 Гц, 1H), 1,55 (т, J=13,0 Гц, 2H), 1,87-2,09 (м, 1H), 2,61 (к, J=7,5 Гц, 2H), 3,27 (ддт, J=12,1, 9,7, 6,3 Гц, 4H), 3,40 (дд, J=14,5, 7,4 Гц, 1H), 3,54 (дд, J=14,5, 7,2 Гц, 1H), 3,81-3,89 (м, 2H), 4,49 (д, J=13,6 Гц, 1H), 4,76 (д, J=13,6 Гц, 1H), 6,95-7,04 (м, 2H), 7,11 (д, J=9,0 Гц, 1H), 7,19 (д, J=8,3 Гц, 2H), 7,43 (дд, J=8,8, 2,0 Гц, 1H), 8,02 (д, J=2,0 Гц, 1H),MS: [M+H]=491.
Пример 141: Синтез (4-этилфенил)изобутиламида 1-имино-1-оксо-3-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-1λ6-бензотиазол-6-сульфоновой кислоты

Соединение 76
К предварительно дегазированному аргоном раствору (4-этилфенил)изобутиламида 1-оксо-3-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-1λ4-бензотиазол-6-сульфоновой кислоты (70 мг; 0,14 ммоль) в дихлорметане (2 мл) добавляют 2,2,2-трифторацетамид (40,3 мг; 0,36 ммоль), димер ацетата родия (II) (9,5 мг; 0,02 ммоль), оксида магния (30 мг; 0,71 ммоль) и йодбензолацетат (92 мг; 0,29 ммоль). Реакционную среду перемешивают 3 суток при температуре окружающей среды, фильтруют через целит и концентрируют досуха. Остаток ресуспендируют в метаноле (1 мл), к которому добавляют карбонате калия (100 мг; 0,71 моль). Реакционную среду перемешивают в течение 1 часа, разбавляют этилацетатом (20мл) и экстрагируют.
Промывают органическую фазу насыщенным раствором (NH4Cl, 20 мл), насыщенным раствором (NaHCO3, 20 мл) и водой (20 мл, сушат (MgSO4), фильтруют и концентрируют.
Неочищенный продукт очищают препаративной ВЭЖХ (колонка C18, элюируют: ацетонитрил в воде/0,1% муравьиной кислоты). (4-этилфенил)изобутиламид 1-имино-1-оксо-3-(тетрагидропиран-4-илметил)-2,3-дигидро-1H-1λ6-бензотиазол-6-сульфоновую кислоту (25 мг; 33,34%) получают в виде бежевого твердого вещества.
1H ЯМР (DMSO-d6) δ: 0,84 (д, J=6,4 Гц, 6H), 1,18 (т, J=7,6 Гц, 3H), 1,29 (ддд, J=18,9, 11,8, 7,0 Гц, 2H), 1,42 (p, J=6,9 Гц, 1H), 1,48-1,65 (м, 2H), 1,93 (д, J=11,7 Гц, 1H), 2,61 (к, J=7,5 Гц, 2H), 3,25 (м, 4H), 3,46 (т, J=7,0 Гц, 2H), 3,86 (д, J=9,7 Гц, 2H), 4,49 (т, J=4,3 Гц, 2H), 7,01 (д, J=8,0 Гц, 2H), 7,08-7,24 (м, 4H), 7,37 (дд, J=9,4, 2,3 Гц, 1H), 7,50 (д, J=2,4 Гц, 1H), 8,23 (д, J=4,9 Гц, 1H).
MS: [M+H]=506
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛСУЛЬФОНАМИДОВ В КАЧЕСТВЕ ОБРАТНЫХ АГОНИСТОВ СВЯЗАННОГО С РЕТИНОИДАМИ ОРФАННОГО РЕЦЕПТОРА ГАММА ROR GAMMA (Т) | 2015 |
|
RU2738843C2 |
| ТИАЗОЛИЛФЕНИЛБЕНЗОЛСУЛЬФОНАМИДОПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ | 2012 |
|
RU2606497C2 |
| ПРОИЗВОДНОЕ СУЛЬФОНАМИДА И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2014 |
|
RU2667520C9 |
| НОВОЕ ПРОИЗВОДНОЕ ПУРИНИЛПИРИДИНИЛАМИНО-2,4-ДИФТОРФЕНИЛСУЛЬФОНАМИДА, ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ RAF-КИНАЗЫ, СОДЕРЖАЩАЯ ДАННОЕ СОЕДИНЕНИЕ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2011 |
|
RU2550038C2 |
| ТРИАЗОЛОПИРИДИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ ДЛЯ ЛЕЧЕНИЯ КОЖНЫХ ЗАБОЛЕВАНИЙ | 2009 |
|
RU2544011C2 |
| НОВОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2814103C1 |
| ЦИКЛОАЛКАНОВОЕ ПРОИЗВОДНОЕ | 2013 |
|
RU2635354C2 |
| ПРОИЗВОДНЫЕ СПИРОКЕТАЛЕЙ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА ПРОТИВ ДИАБЕТА | 2006 |
|
RU2416617C2 |
| ИНГИБИТОРЫ ТРАНСГЛУТАМИНАЗЫ 2 (TG2) | 2019 |
|
RU2781370C2 |
| ПРОИЗВОДНЫЕ 5-АМИДИНО-2-ГИДРОКСИБЕНЗОЛСУЛЬФОНАМИДА, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ИХ ПОЛУЧЕНИЯ | 2001 |
|
RU2273633C9 |
Изобретение относится к конкретным производным сульфонамидов формулы (II)
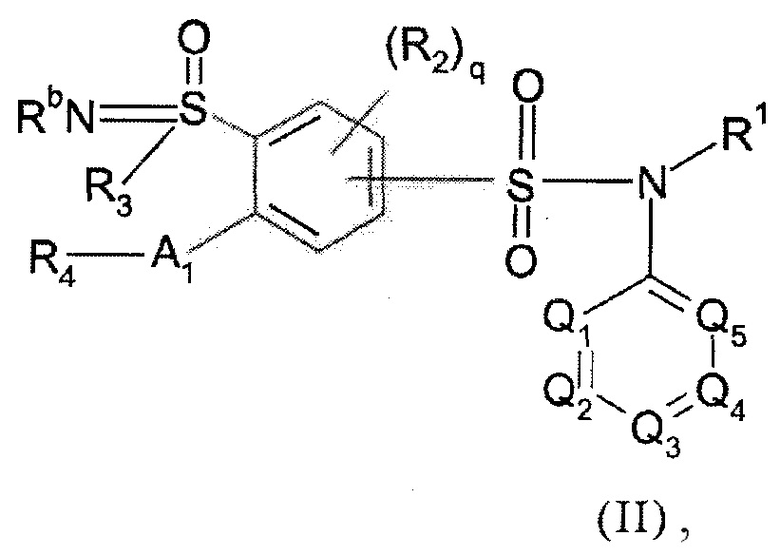
их фармацевтически приемлемым солям, а также к их применению в качестве обратного агониста, связанного с ретиноидами орфанного рецептора гамма RORγt. Изобретение также относится к фармацевтической композиции, содержащей такие соединения, а также ее применению для лечения топическим и/или пероральным путем воспалительных заболеваний, опосредованных рецепторами RORγt, в частности акне, псориаза и/или атопического дерматита. 3 н. и 3 з.п. ф-лы, 2 табл., 141 пр.
1. Соединение формулы (II), а также его фармацевтически приемлемые соли присоединения, гидраты и/или сольваты:
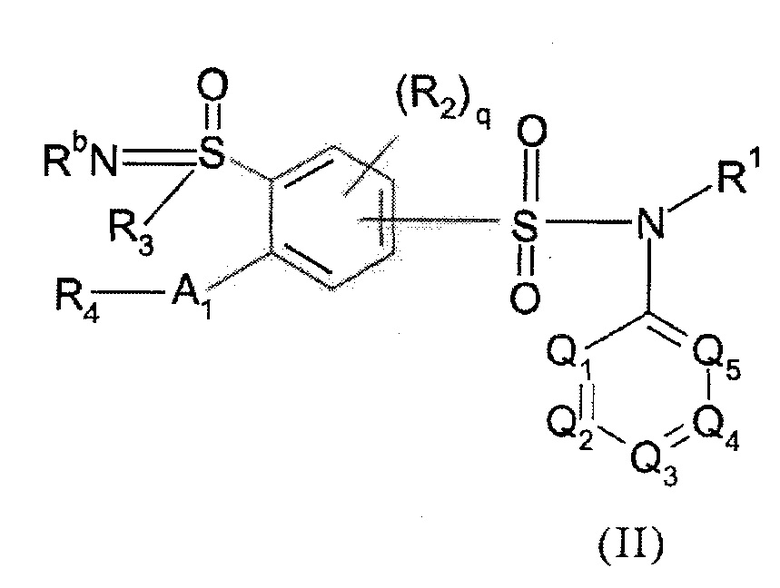
формула (II), в которой:
- q означает ноль или натуральное число от 1 до 3,
- L означает простую связь или метиленовую группу CH2,
- R1 означает линейный или разветвленный C3-C5алкильный радикал, C3-C5циклоалкильный радикал, линейный или разветвленный C2-C5алкенильный радикал, радикал (C1)алкил-C3-C5циклоалкил, C4-C5гетероциклоалкильный радикал, радикал (C1)алкил-C4-C5гетероциклоалкил,
- R2 означает атом водорода или атом галогена, линейный или разветвленный C1-C5алкильный радикал, линейный или разветвленный C2-C4алкенильный радикал, C1-C4алкоксирадикал, цианогруппу -CN; причем алкильный, алкенильный и алкокси-радикалы могут быть замещены одним или несколькими атомами галогена,
- R3 означает C1-C3алкильный радикал,
- R4 означает атом водорода, группу (CHR5)n-(Z)o-(CHR'5)p-R6,
- n, o и p, одинаковые или разные, означают ноль или натуральное число от 1 до 3,
- Z означает двухвалентную группу, выбранную из -CH2-, -NH- и -O-,
- R5 и R'5, одинаковые или разные, означают атом водорода, метильный радикал -CH3, гидроксирадикал -OH, гидроксиалкильный радикал C1, карбоксильный радикал -COOH,
- R6 представляет собой:
атом водорода или атом галогена,
гетероциклоалкильный радикал, возможно замещенный одним или несколькими атомами галогена, одной или несколькими линейными или разветвленными C1-C3алкильными группами, одной или несколькими группами -OH, одной или несколькими карбонильными группами =O, одной или несколькими линейными или разветвленными C1-C4гидроксиалкильными группами, пирролидиновым циклом, одной или несколькими аминогруппами, одной или несколькими группами -C(=O)R7, одной или несколькими группами S(=O)2R7, где R7 представляет собой линейный или разветвленный C1-C3алкильный радикал, гидроксирадикал -OH, линейный или разветвленный C1-C4алкоксирадикал или радикал амино N(R7a)(R7b), где R7a и R7b, одинаковые или разные, означают атом водорода, линейный или разветвленный C1-C3алкильный радикал или циклопропильный радикал,
C3-C6циклоалкильный радикал, возможно замещенный одной или несколькими группами -OH,
ароматический или гетероароматический радикал, возможно замещенный одним или несколькими атомами галогена, одной или несколькими линейными или разветвленными C1-C3алкильными группами, возможно замещенными одним или несколькими атомами галогена, одной или несколькими C1-C3алкоксигруппами, одной или несколькими аминогруппами -NR11R12, одной или несколькими группами -COR11, карбонильной группой (=O), одной или несколькими группами -OR11, одной или несколькими C1-C4гидроксиалкильными группами, одной или несколькими группами -COOR11, одной или несколькими амидогруппами -CONR11R12, одной или несколькими группами -SOR11, одной или несколькими группами -SO2R11, одной или несколькими группами -NHCOR11, одной или несколькими группами -NHCOOR11, одной или несколькими группами -SO2NR11R12 или одной или несколькими группами -CN; причем R11 и R12, одинаковые или разные, означают атом водорода или линейный или разветвленный C1-C3алкильный радикал, возможно замещенный одним или несколькими атомами галогена;
- A1 означает двухвалентную группу, выбранную из -NRa-, -O-, -S-, -SO-, -SO2-, -SO(=NH)-, -CH2-, -C=C-, -CH(Ra)-;
- Ra означает атом водорода, линейный или разветвленный C1-C3алкильный радикал, ацетильный радикал -C(=O)CH3,
- Rb означает атом водорода, линейный или разветвленный C1-C3алкильный радикал, циклопропильную группу,
- Q1, Q2, Q3, Q4 и Q5, одинаковые или разные, представляют собой атом азота или группу -CR'2,
- когда A1 представляет собой -NRa-, тогда Ra и R4 могут вместе с атомом азота, с которым они связаны, образовать гетероциклоалкильную группу C2-C10, возможно содержащую от одного до трех гетероатомов, выбранных из атома серы, атома азота и атома кислорода, причем указанная гетероциклоалкильная группа возможно замещена по меньшей мере одним радикалом R14,
- R14 означает линейный или разветвленный C1-C3алкильный радикал, линейный или разветвленный C1-C3алкоксирадикал, атом галогена, гидроксигруппу -OH, цианогруппу -CN, группу -CONR15R16, группу -SO2R15, группу -COR15 или аминогруппу -NR15R16, где R15 и R16, одинаковые или разные, означают атом водорода или линейный или разветвленный C1-C3алкильный радикал;
причем соединение формулы (II) выбрано из следующих соединений:
Соединение 1
Соединение 2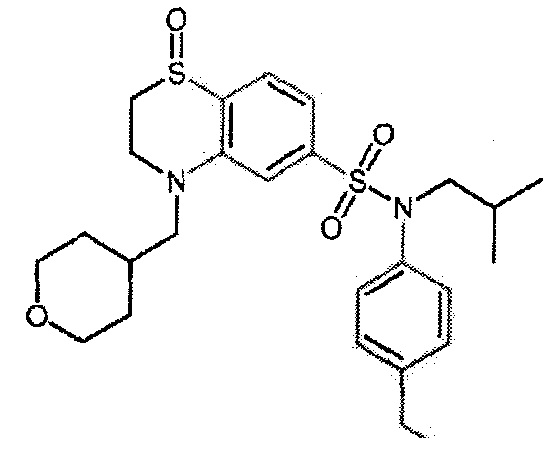
Соединение 3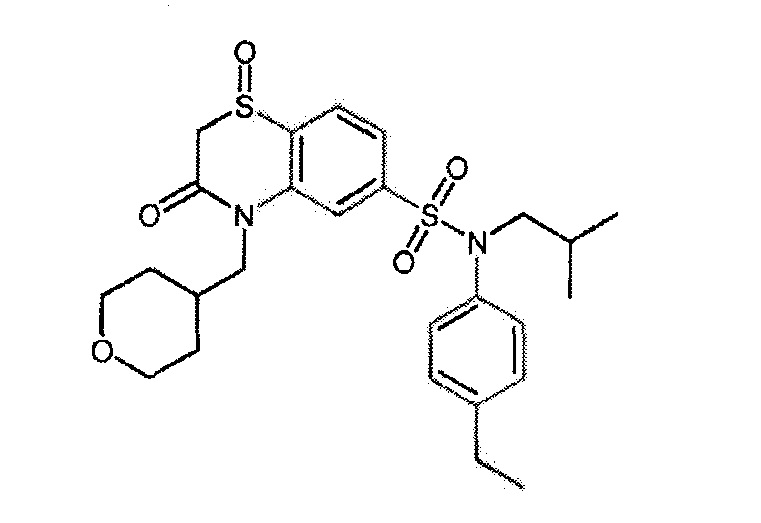
Соединение 4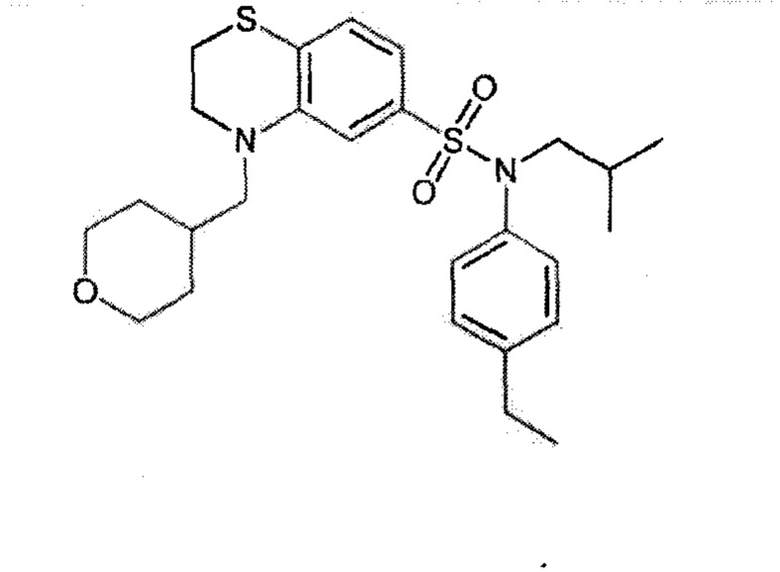
Соединение 6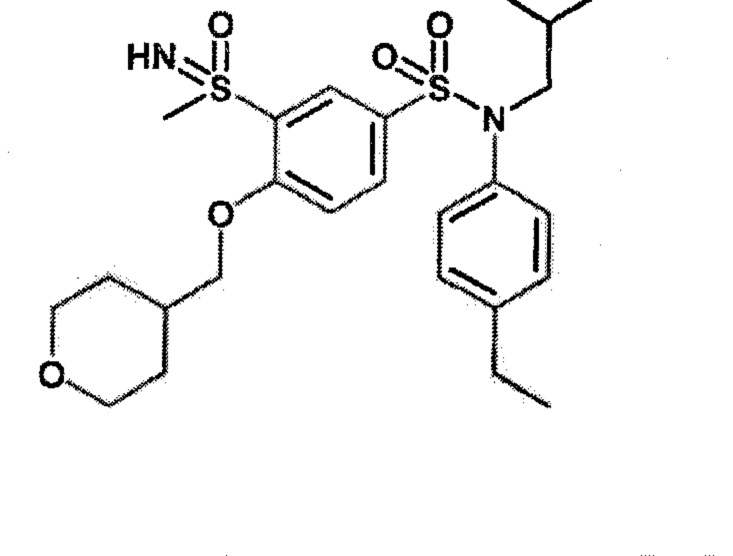
Соединение 26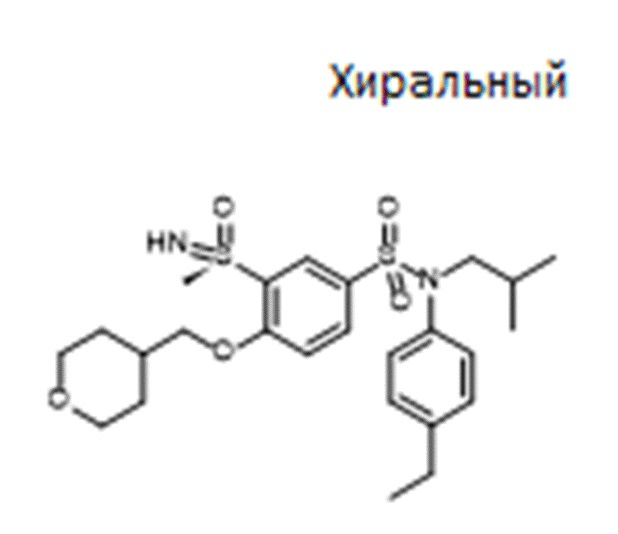
Соединение 7
(энантиомер A)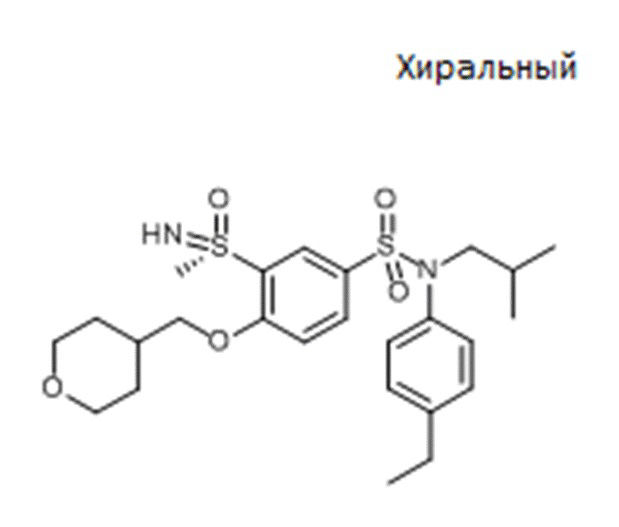
Соединение 8
(энантиомер B)
Соединение 9
Соединение 10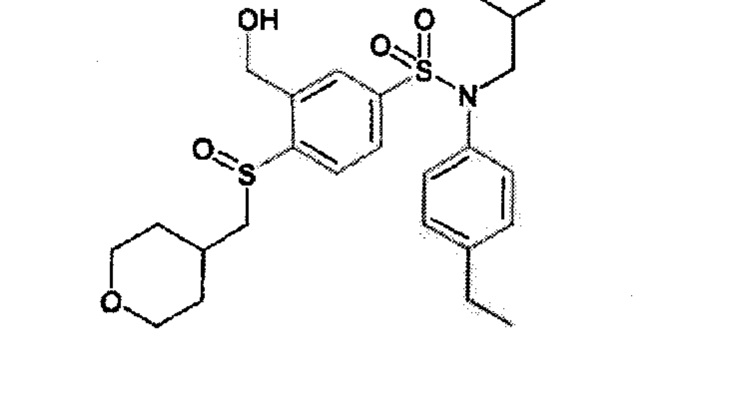
Соединение 15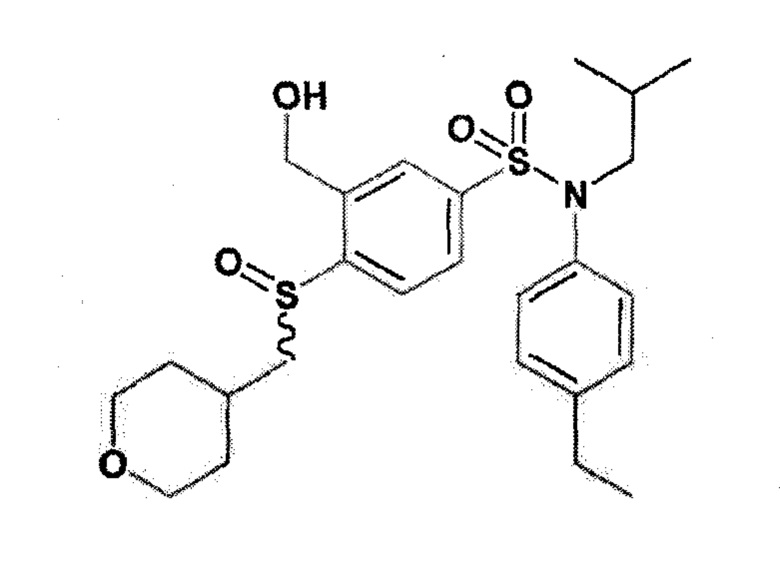
Соединение 11
Энантиомер A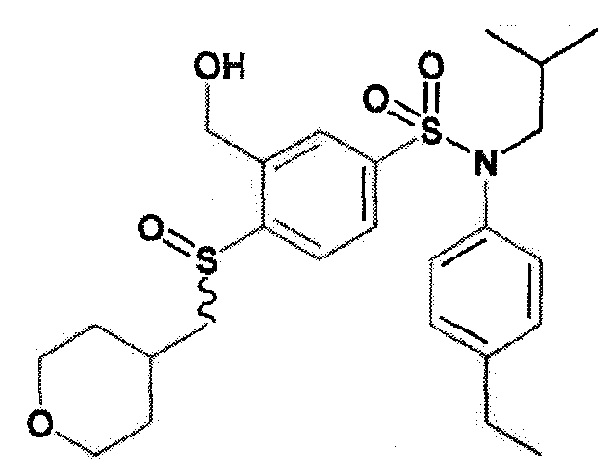
Соединение 12
Энантиомер B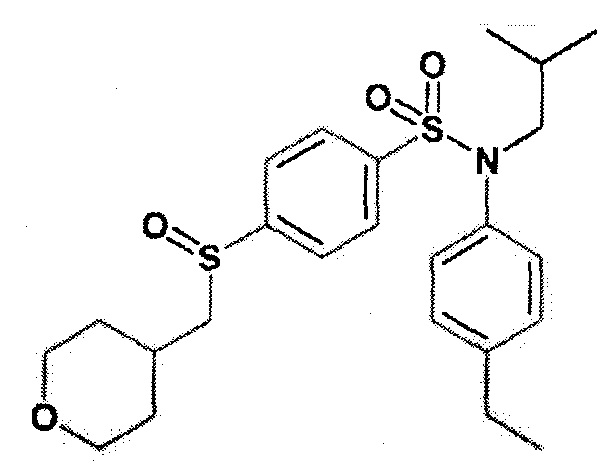
Соединение 29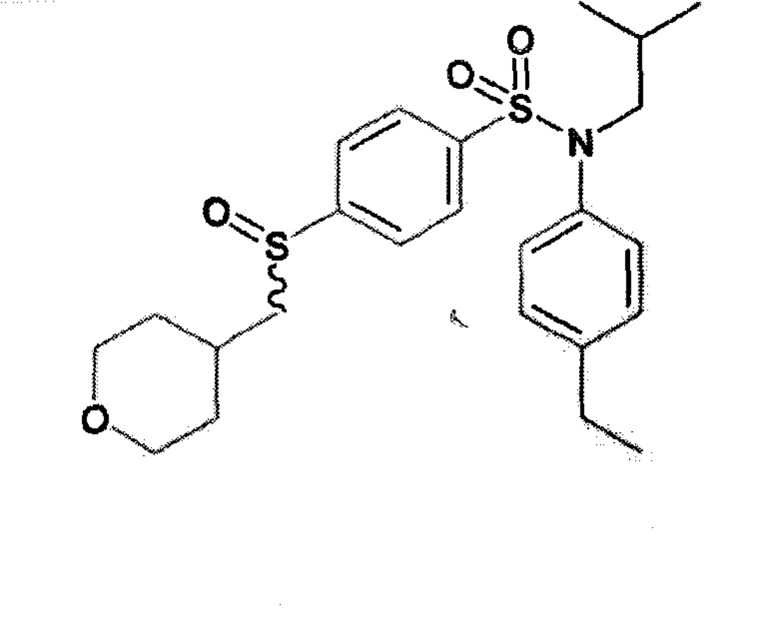
Соединение 13
Энантиомер A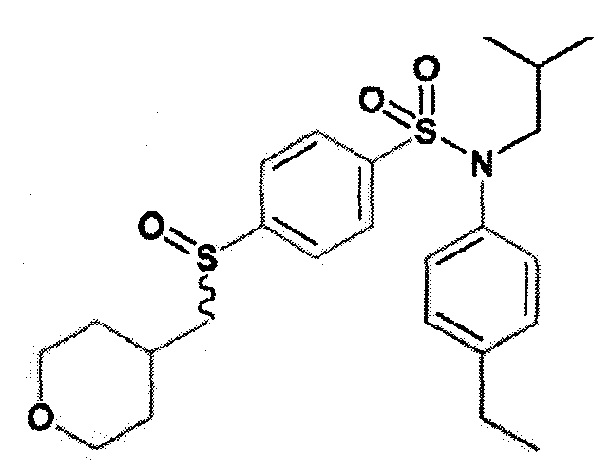
Соединение 14
Энантиомер B
Соединение 16
Соединение 17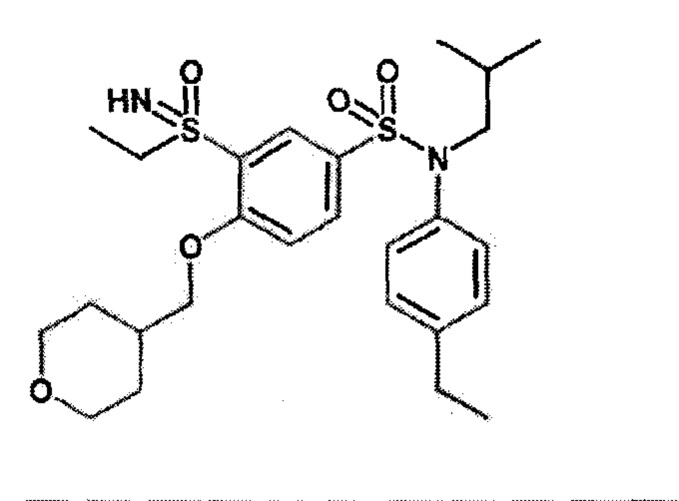
Соединение 18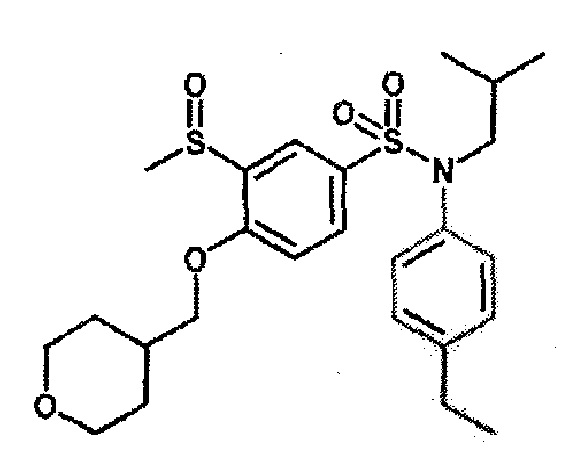
Соединение 27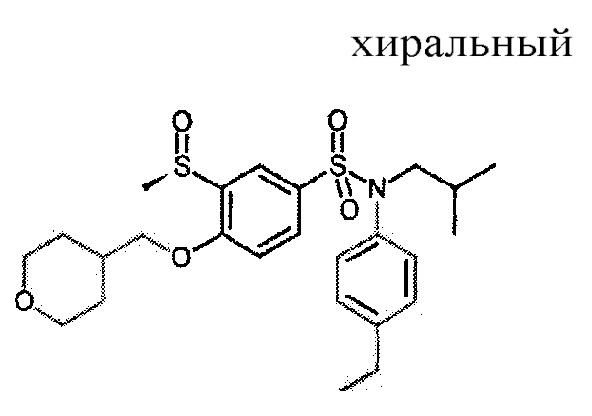
Соединение 19
Энантиомер A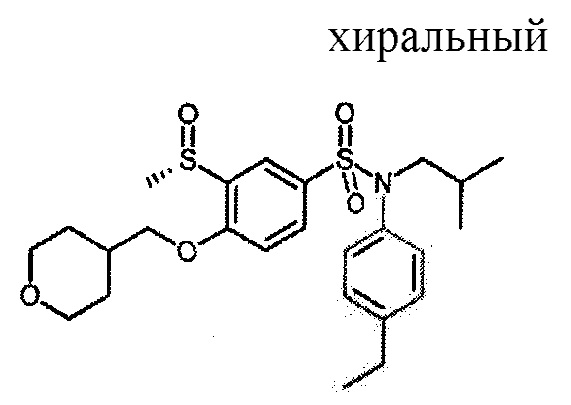
Соединение 20
Энантиомер B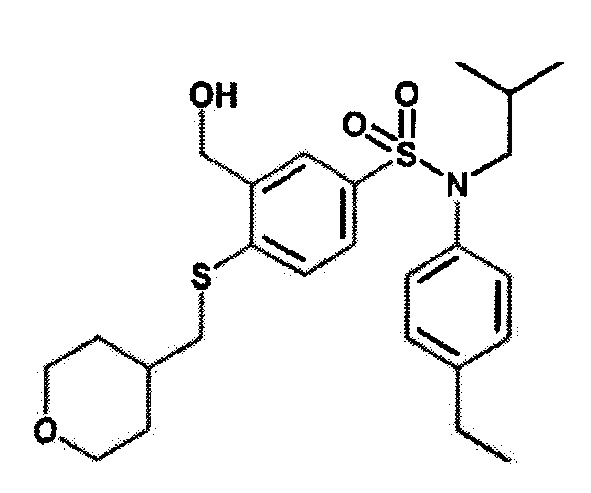
Соединение 21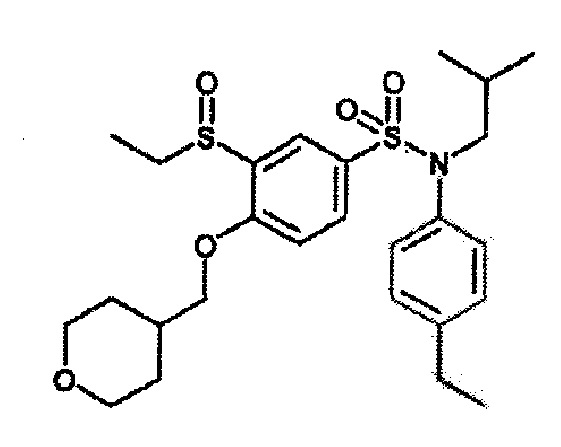
Соединение 22
Соединение 23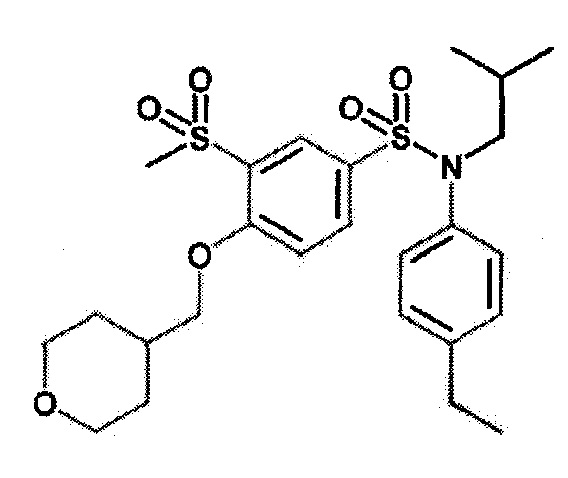
Соединение 24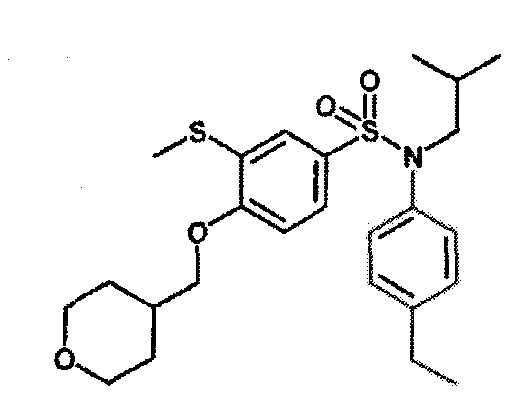
Соединение 25
Соединение 28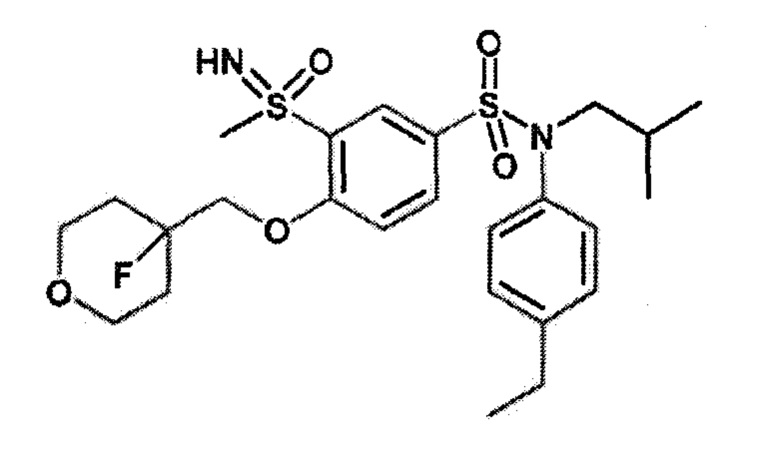
Соединение 30
Соединение 31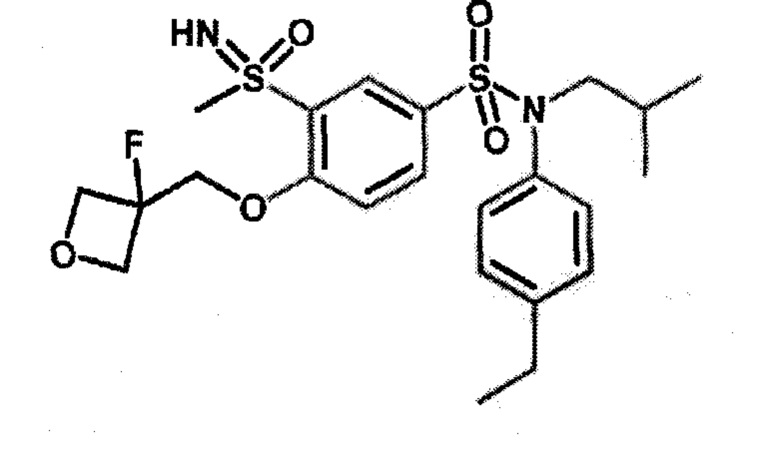
Соединение 32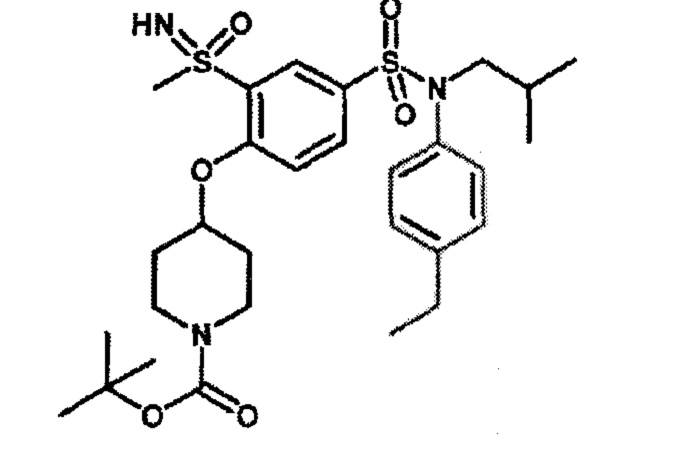
Соединение 33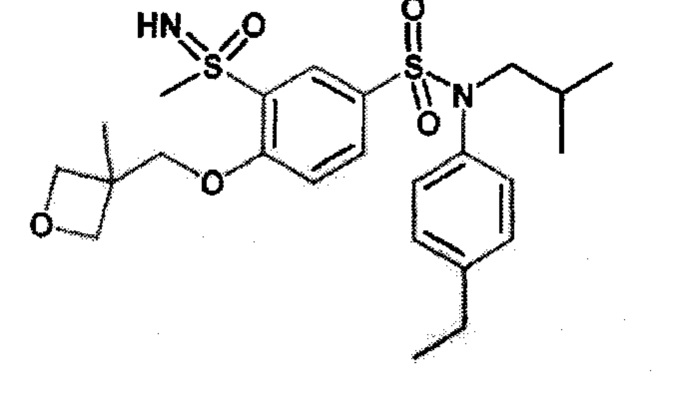
Соединение 34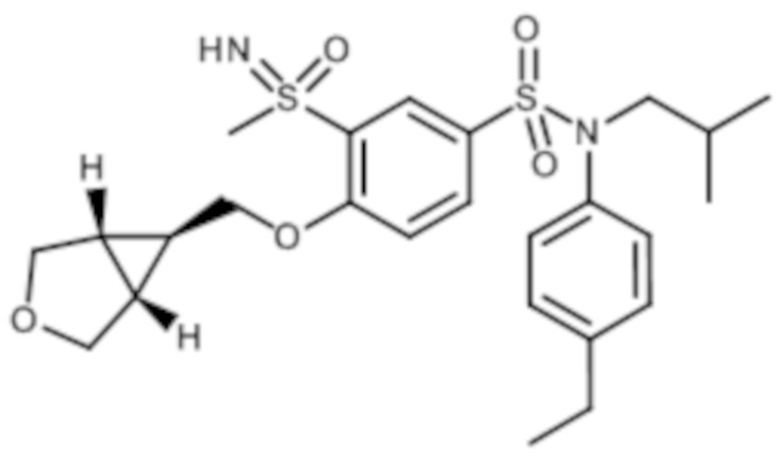
Соединение 35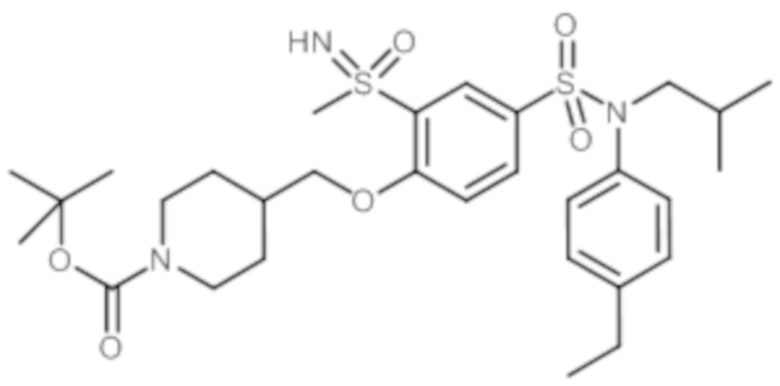
Соединение 36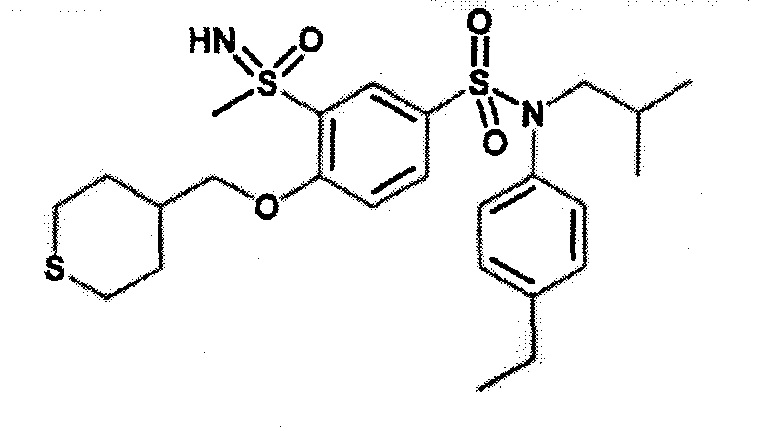
Соединение 37
Соединение 38
Соединение 39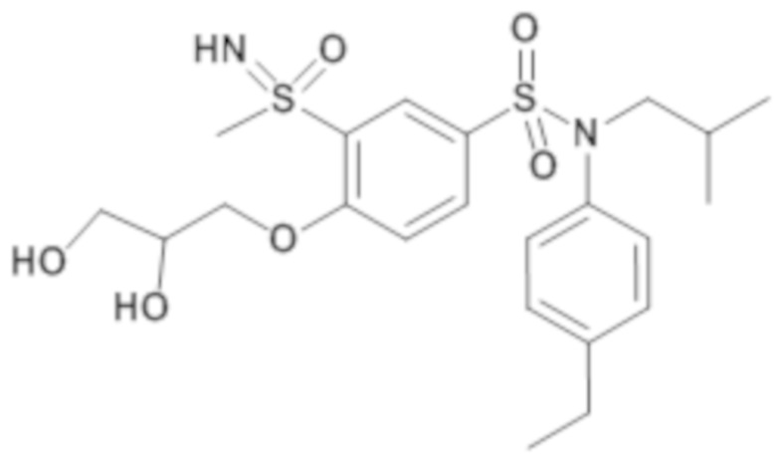
Соединение 40
Соединение 41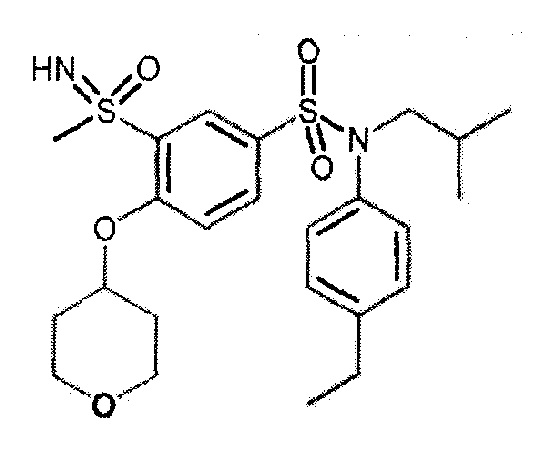
Соединение 42
Соединение 43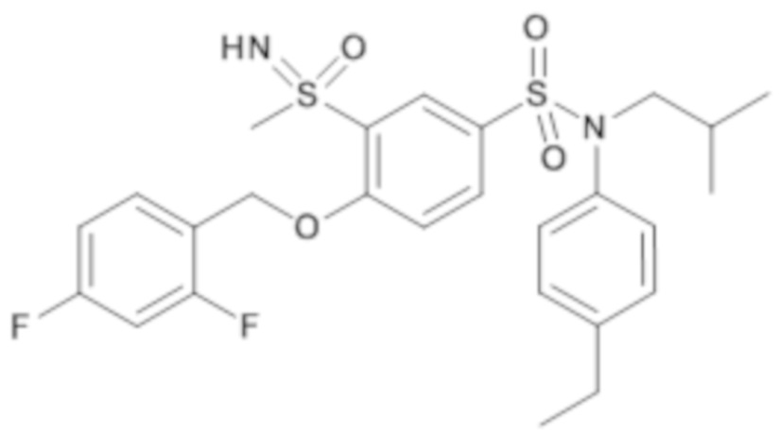
Соединение 45
Соединение 46
Соединение 47
Соединение 48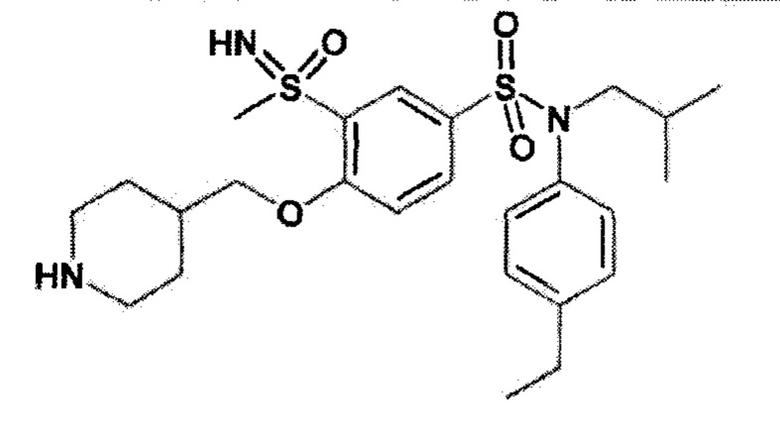
Соединение 49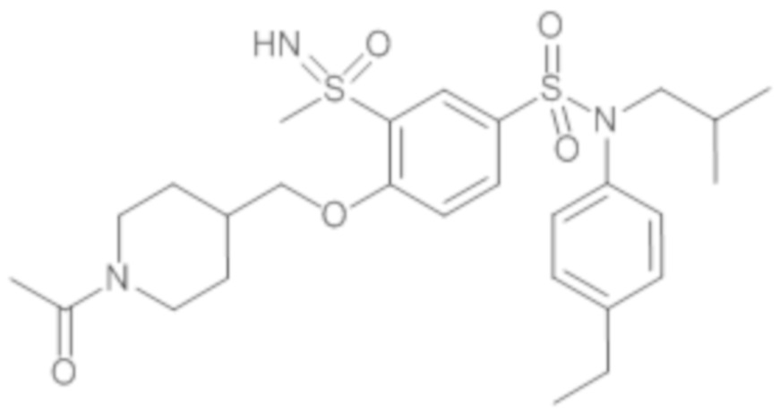
Соединение 50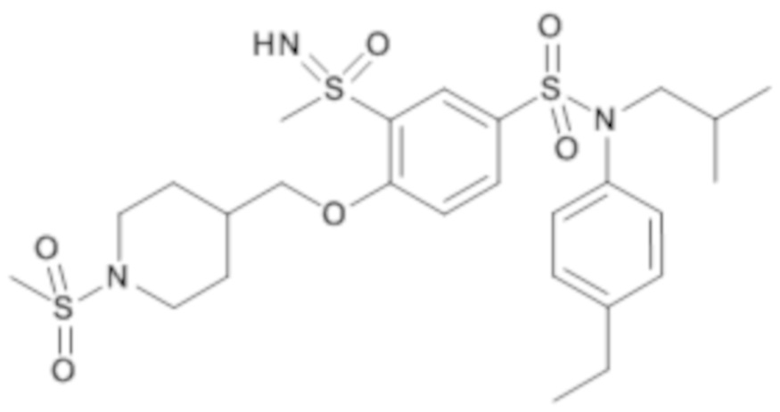
Соединение 51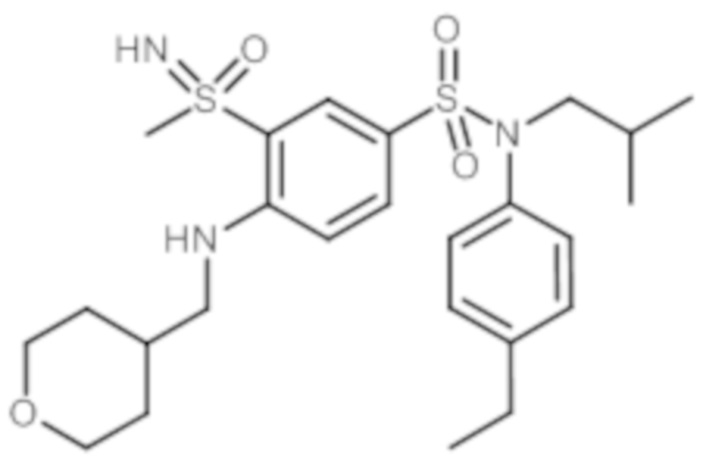
Соединение 52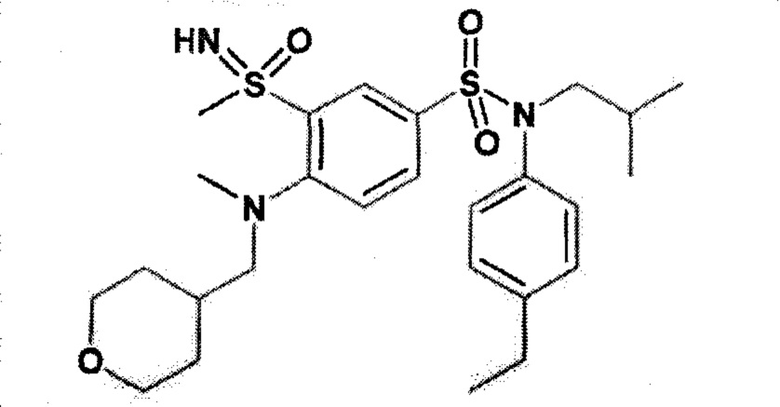
Соединение 53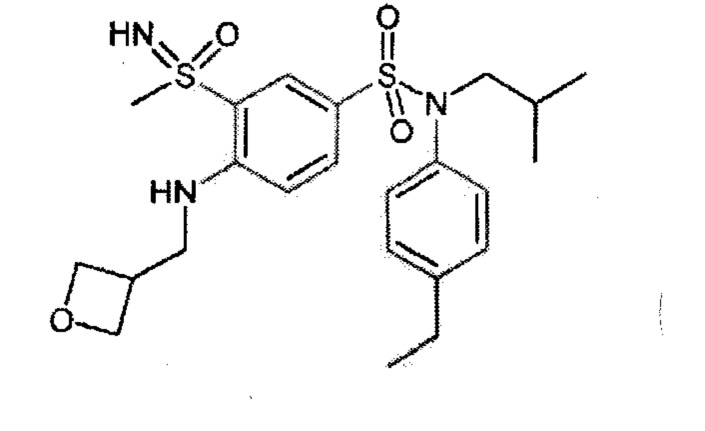
Соединение 54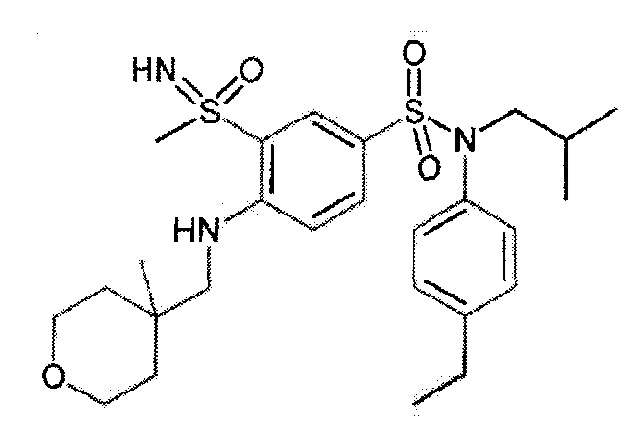
Соединение 55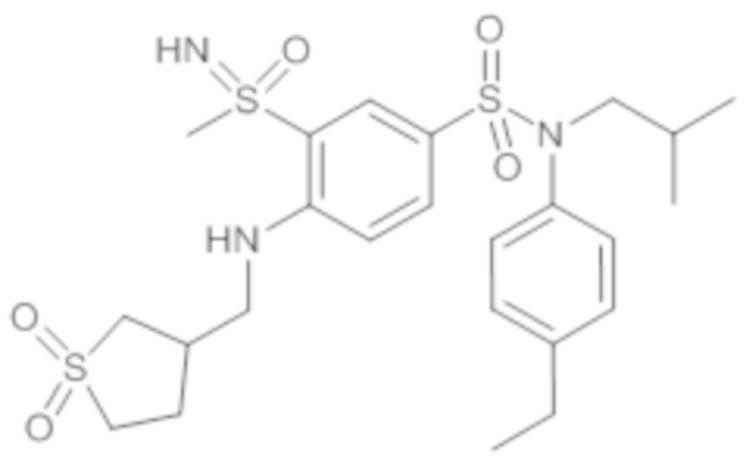
Соединение 56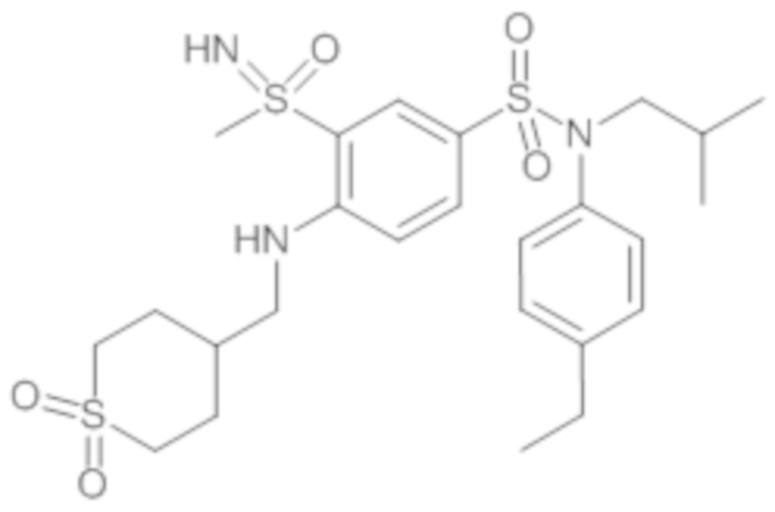
Соединение 57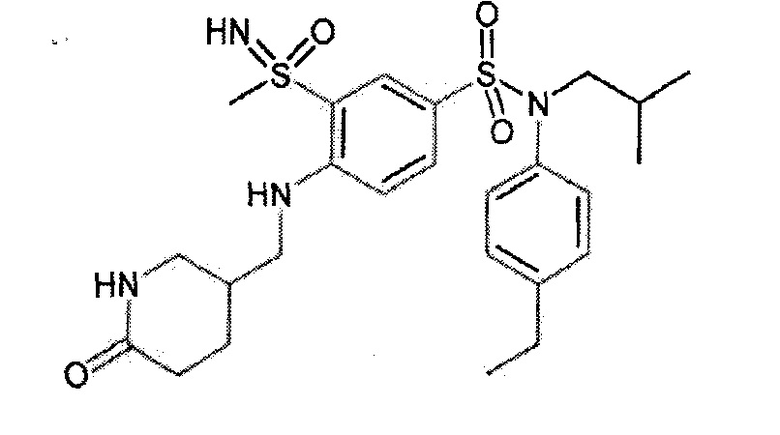
Соединение 58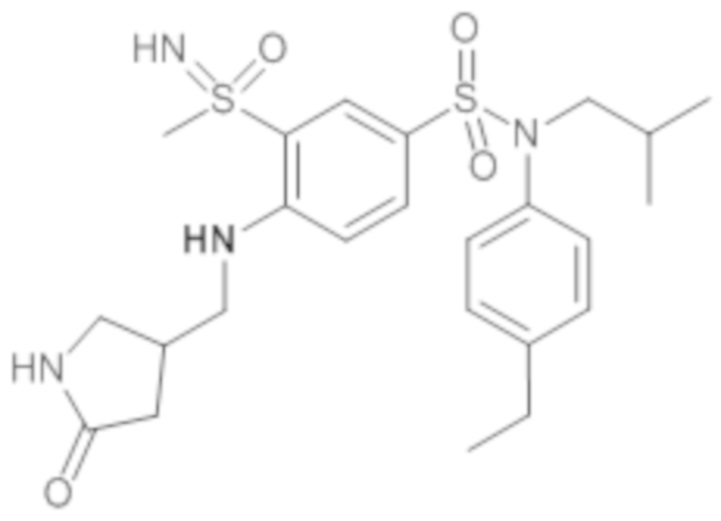
Соединение 59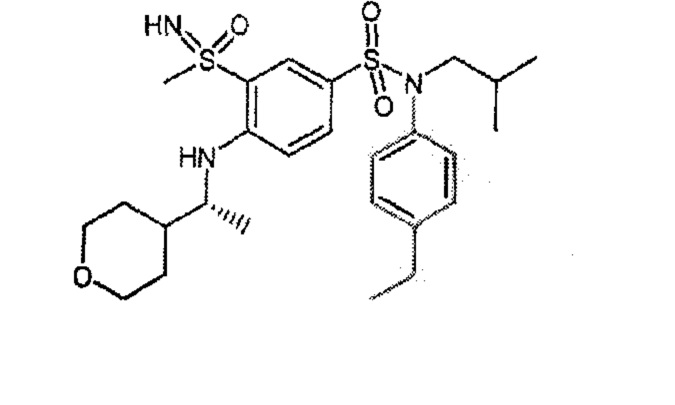
Соединение 60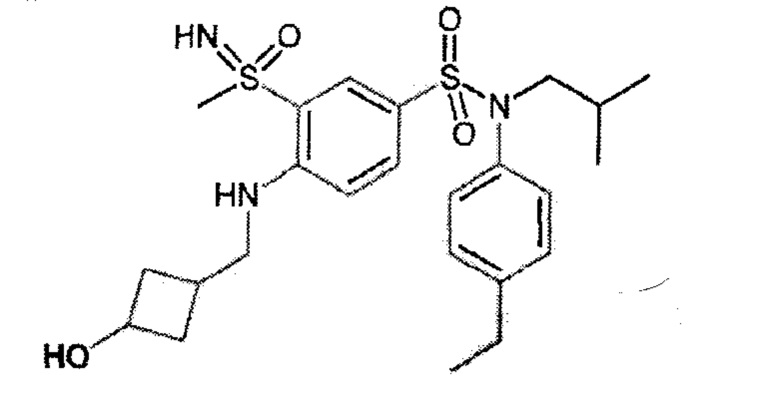
Соединение 61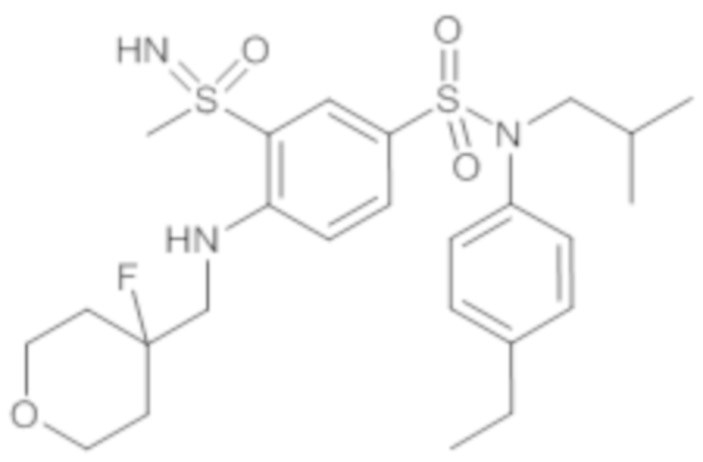
Соединение 62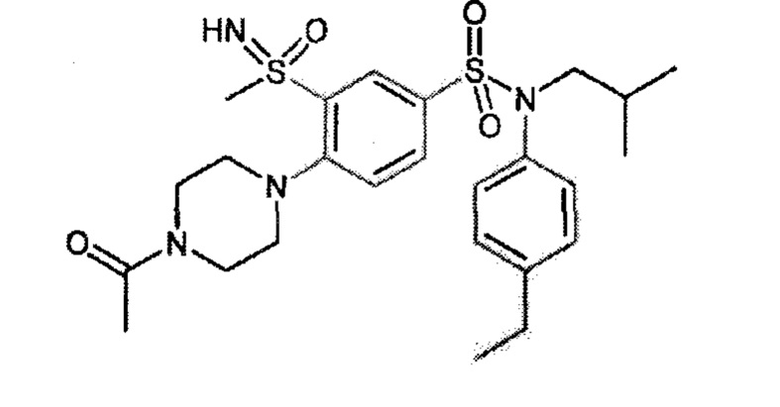
Соединение 63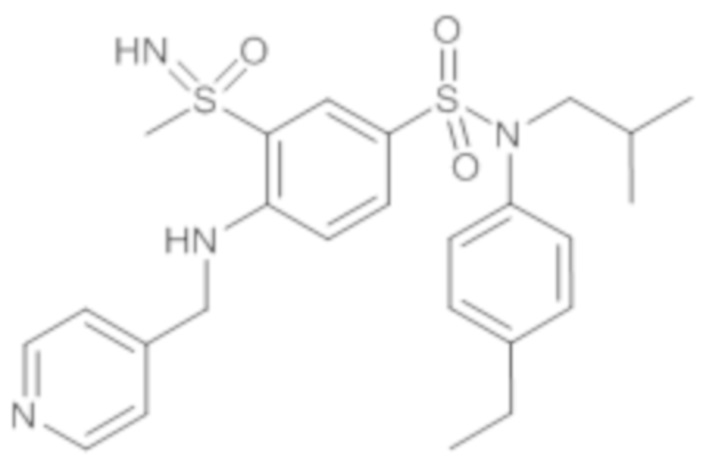
Соединение 64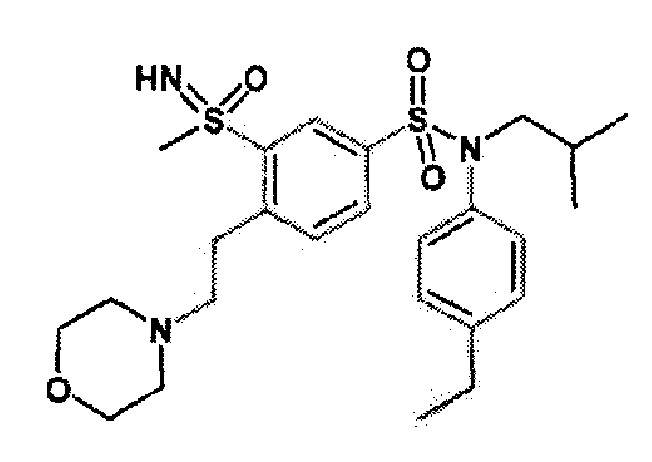
Соединение 65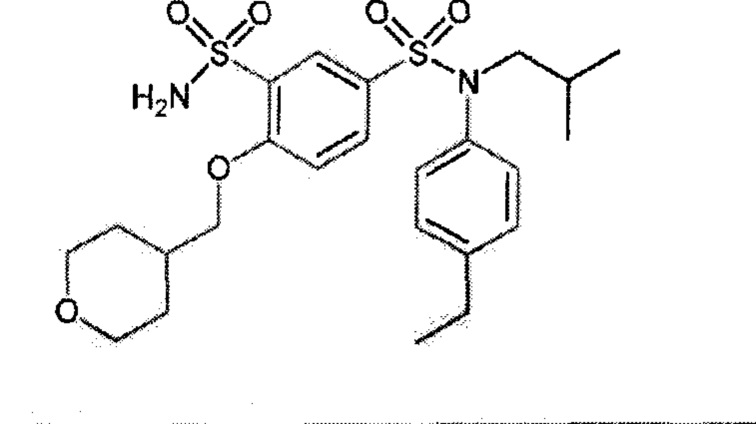
Соединение 66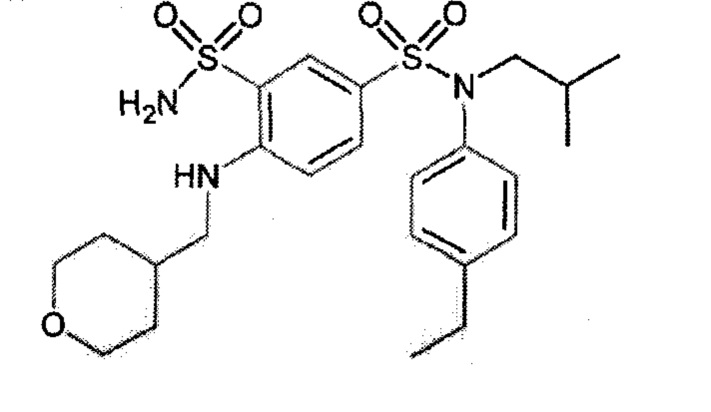
Соединение 67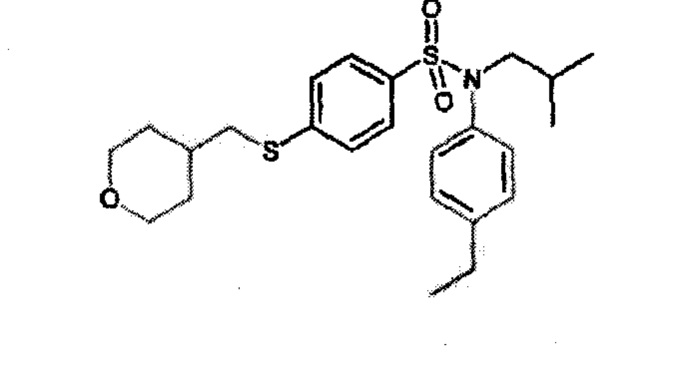
Соединение 68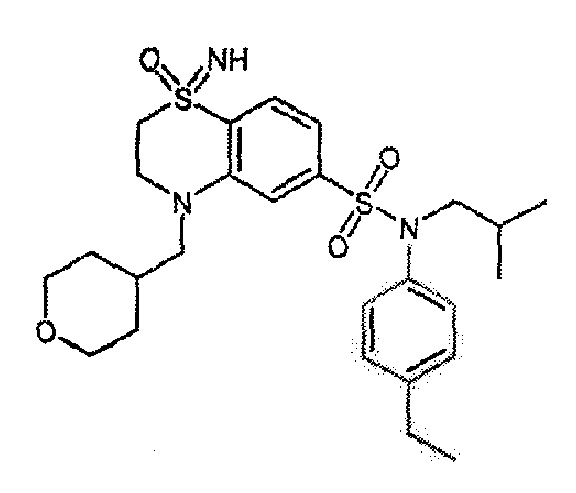
Соединение 69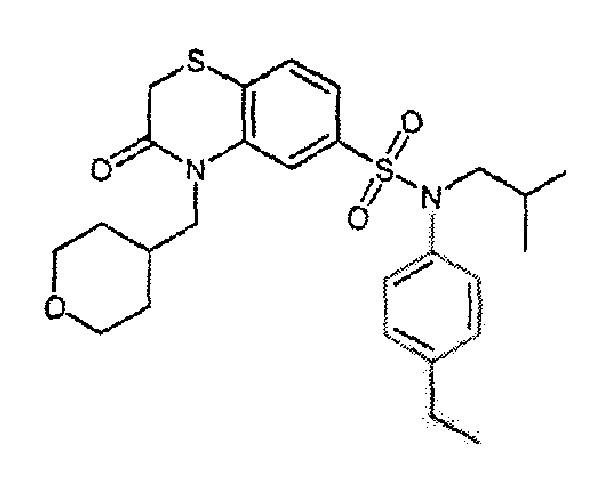
Соединение 70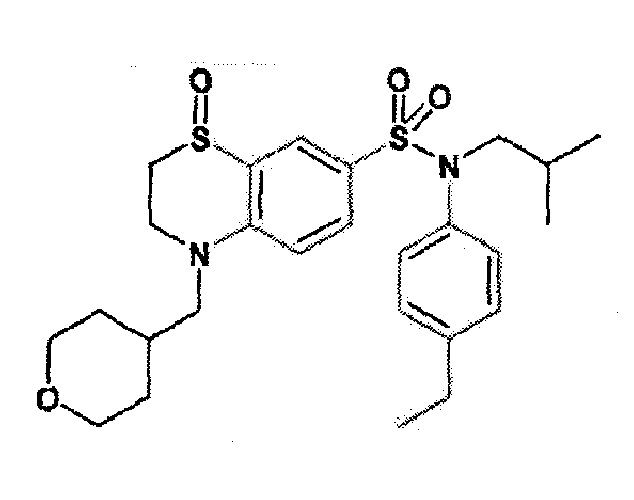
Соединение 71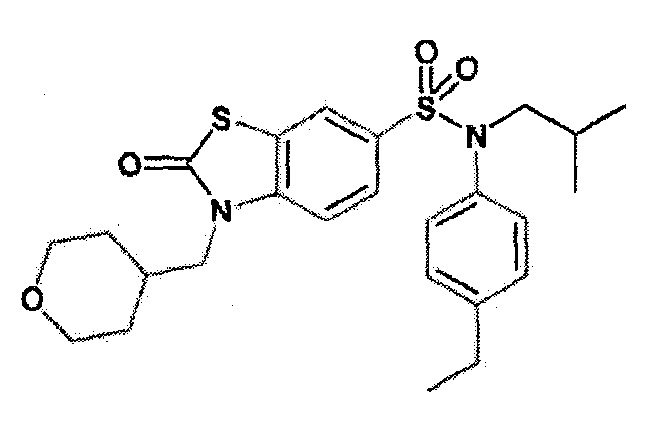
Соединение 72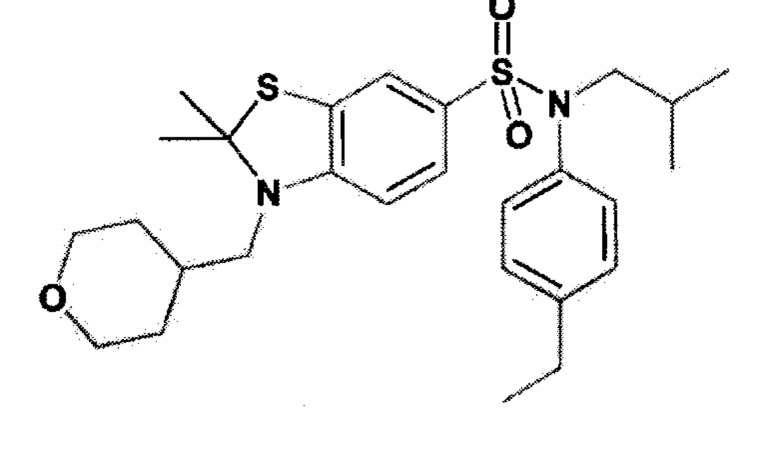
Соединение 73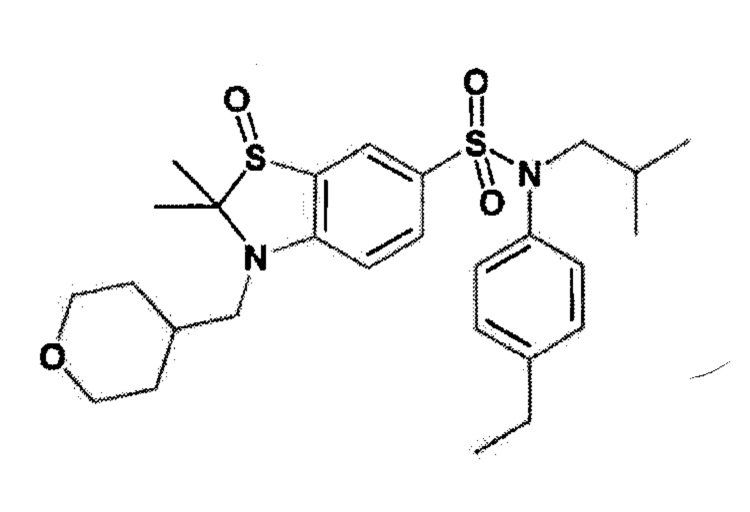
Соединение 74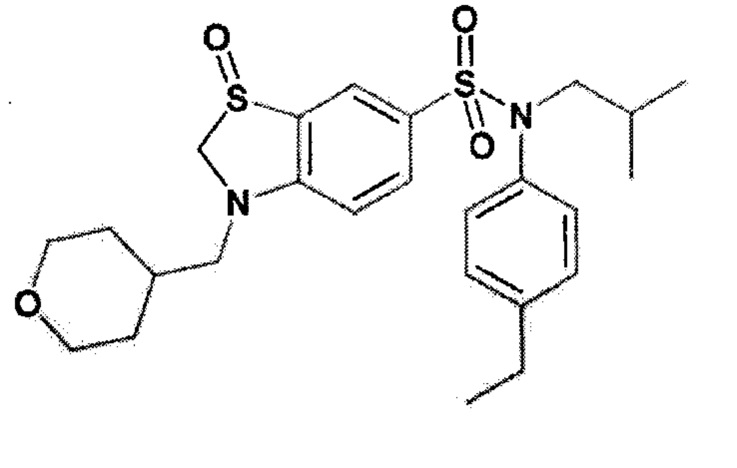
Соединение 75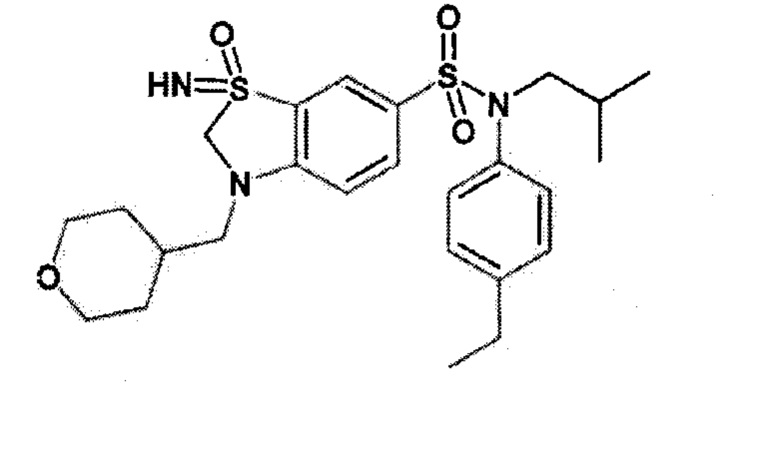
Соединение 76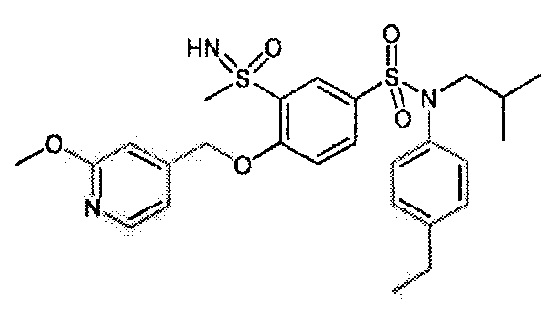
Соединение 77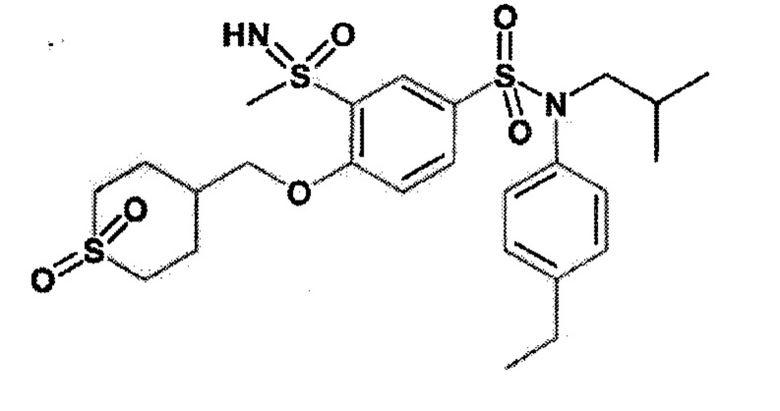
Соединение 78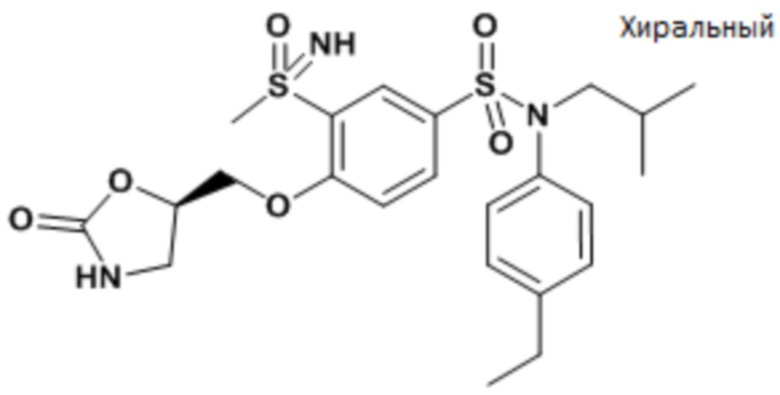
Соединение 79
Соединение 80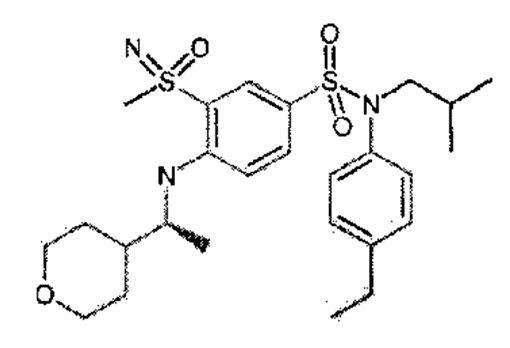
Соединение 81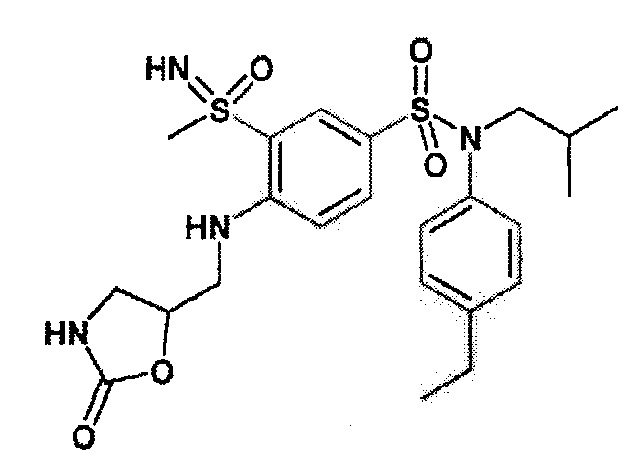
Соединение 82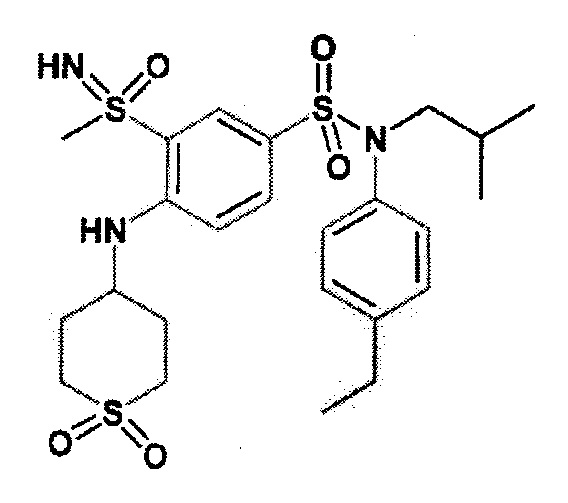
Соединение 83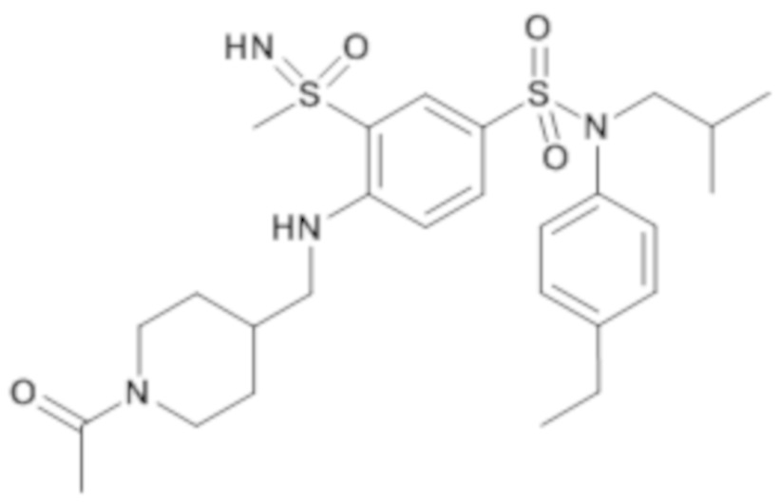
Соединение 84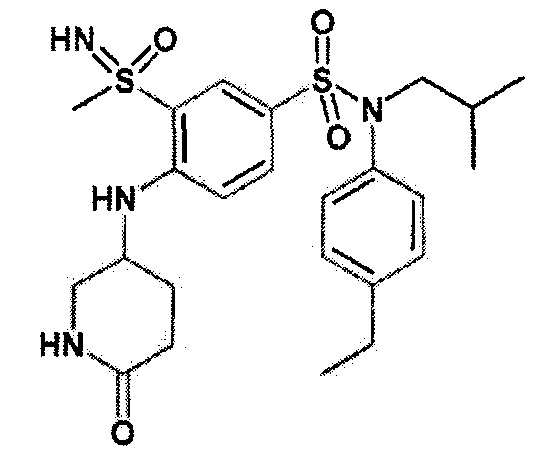
Соединение 85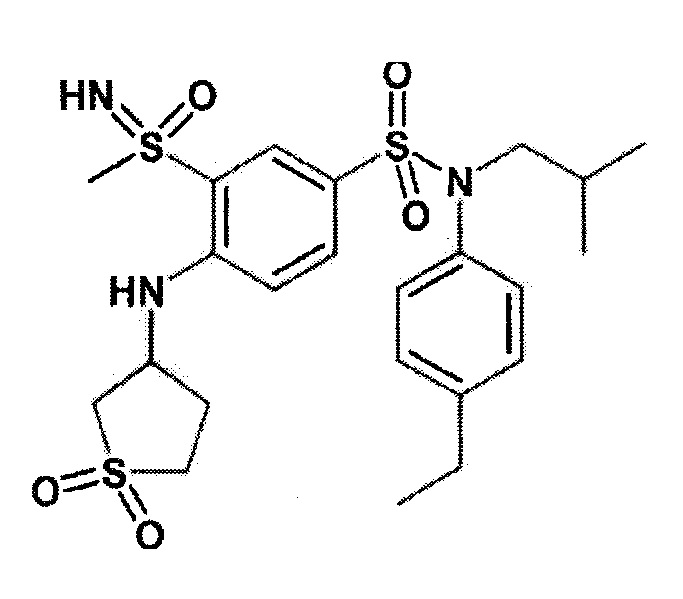
Соединение 86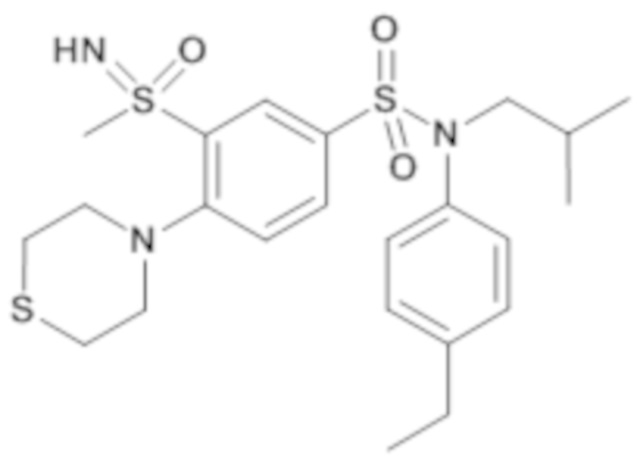
Соединение 87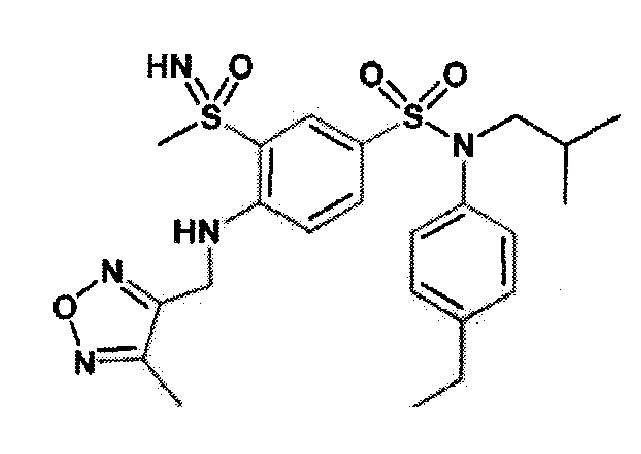
Соединение 88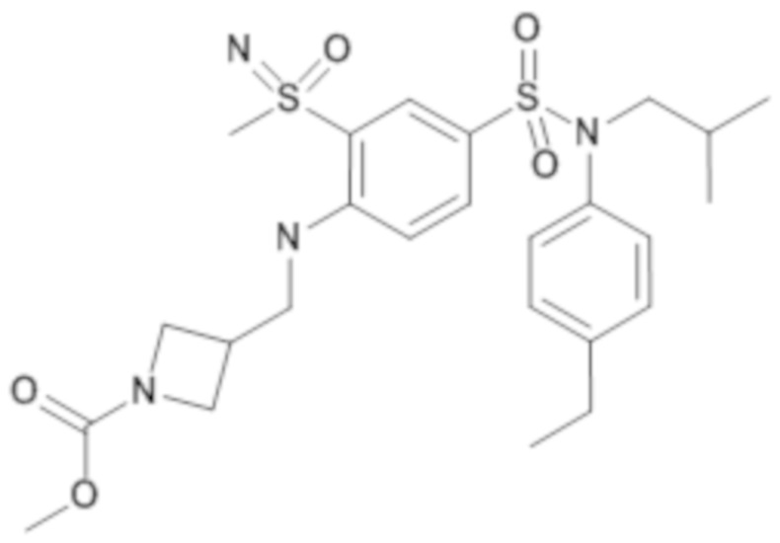
Соединение 89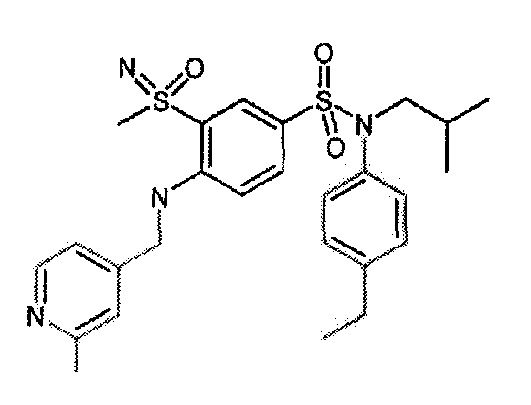
Соединение 90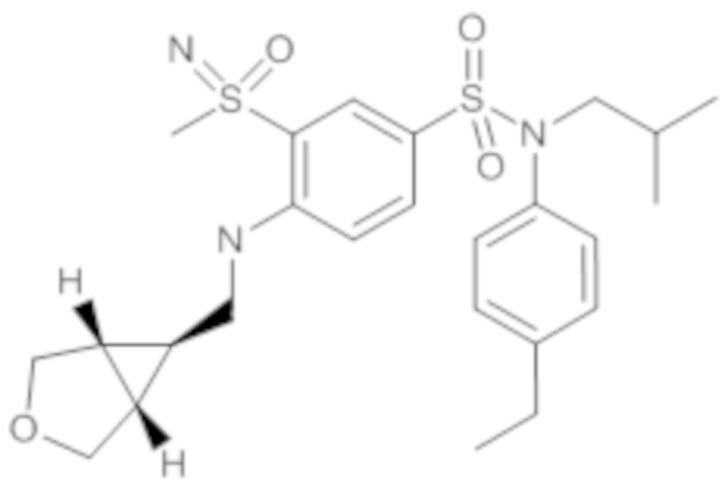
Соединение 91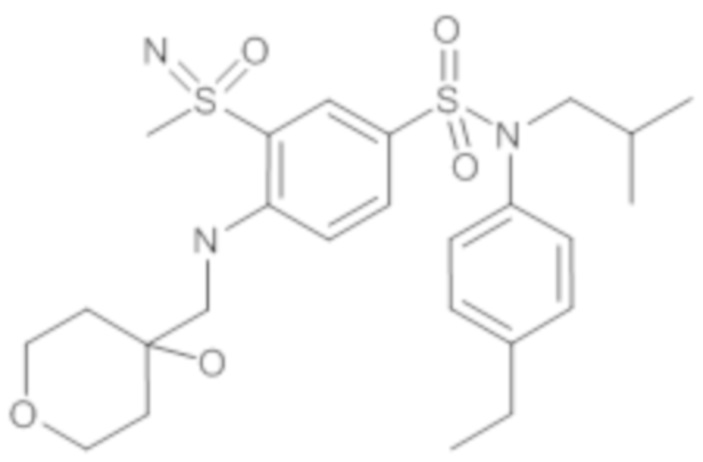
Соединение 92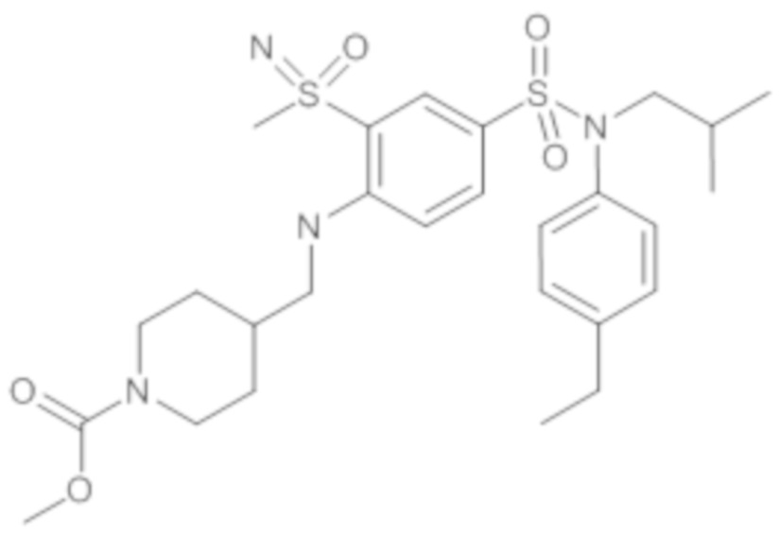
Соединение 93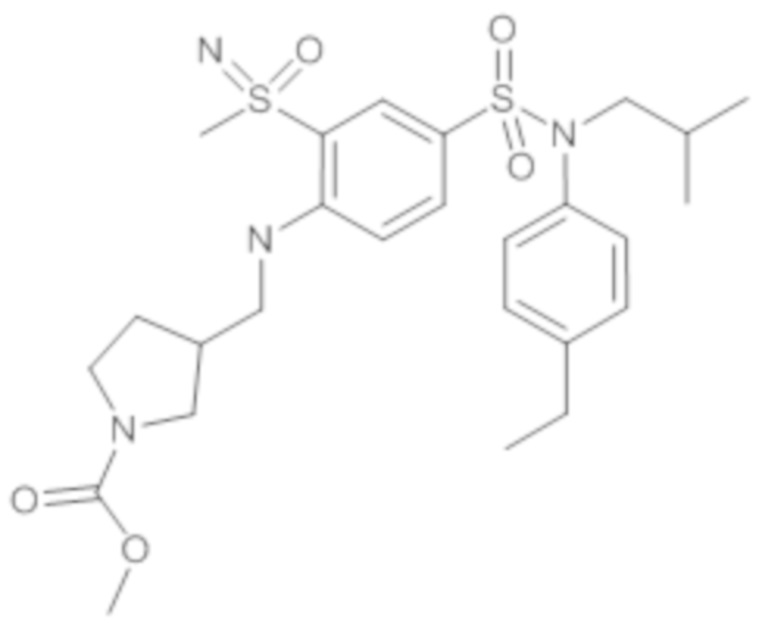
Соединение 94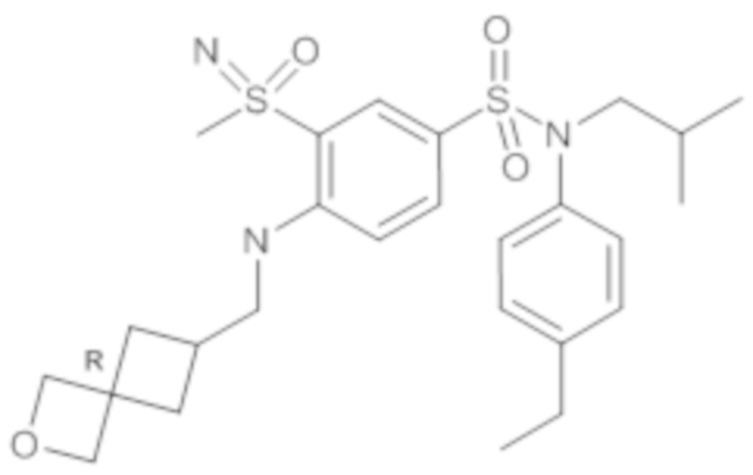
Соединение 95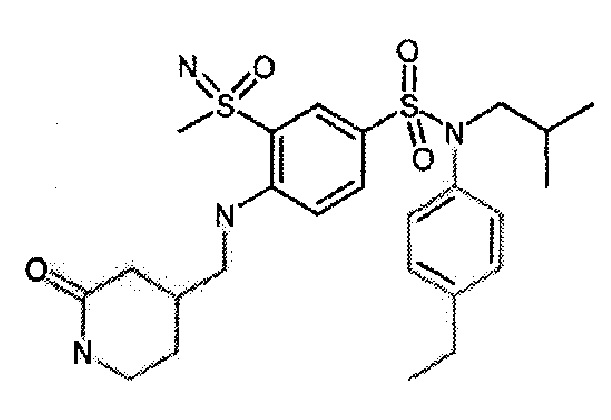
Соединение 96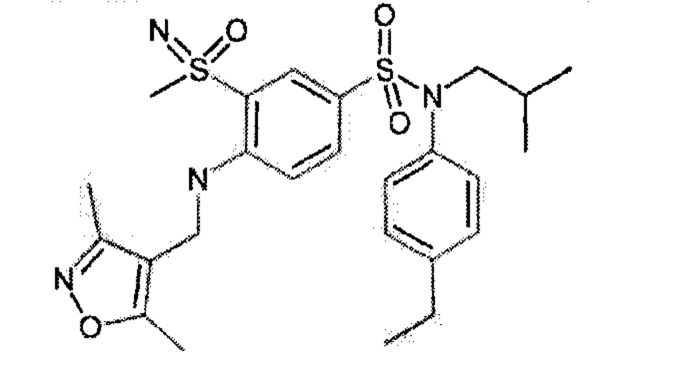
Соединение 97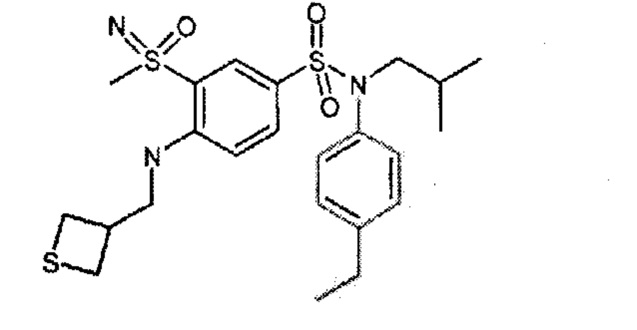
Соединение 99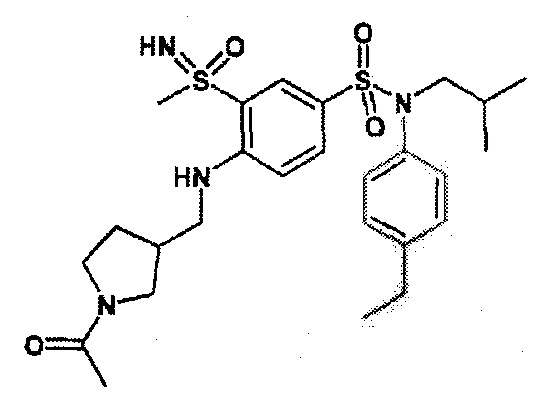
Соединение 100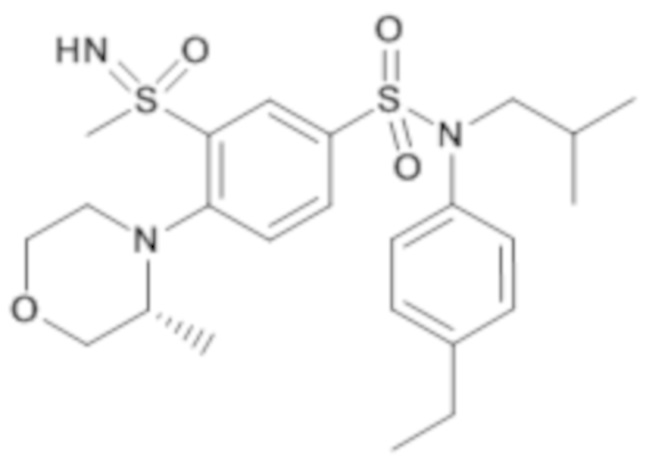
Соединение 103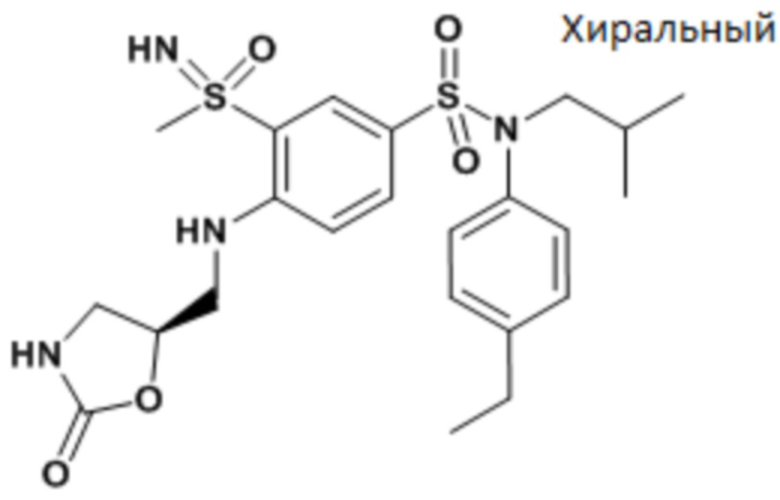
Соединение 105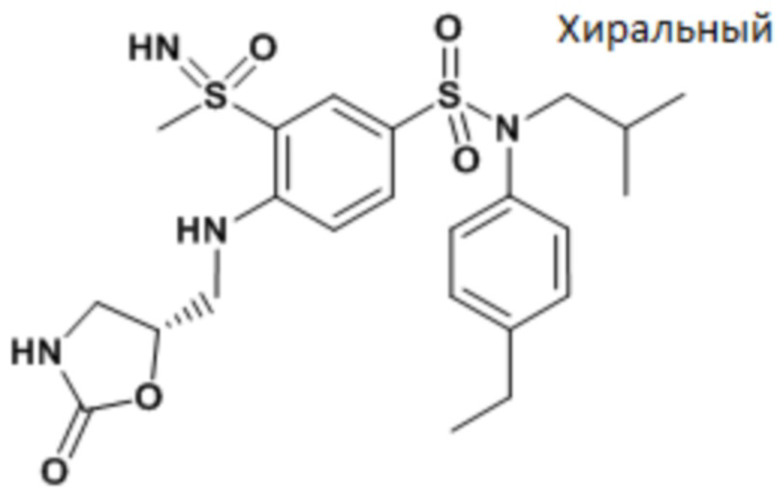
Соединение 106
Соединение 107
Соединение 109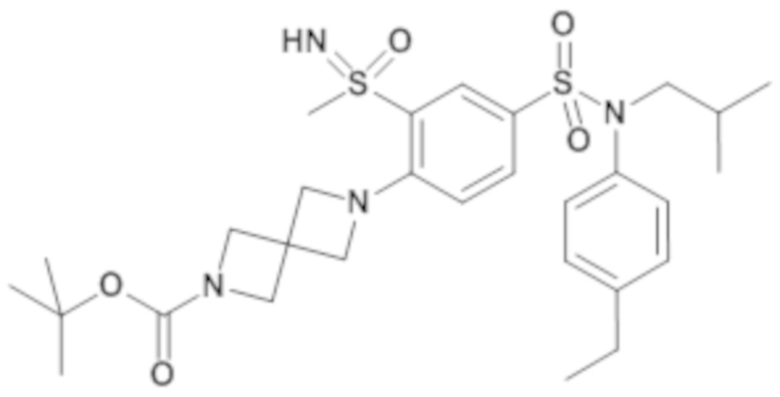
Соединение 110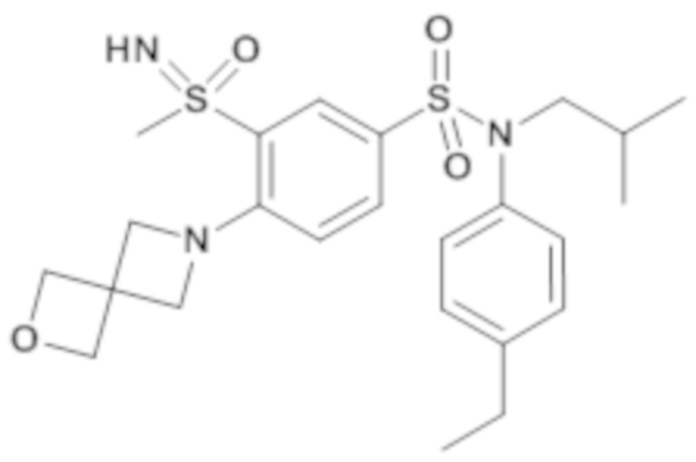
Соединение 111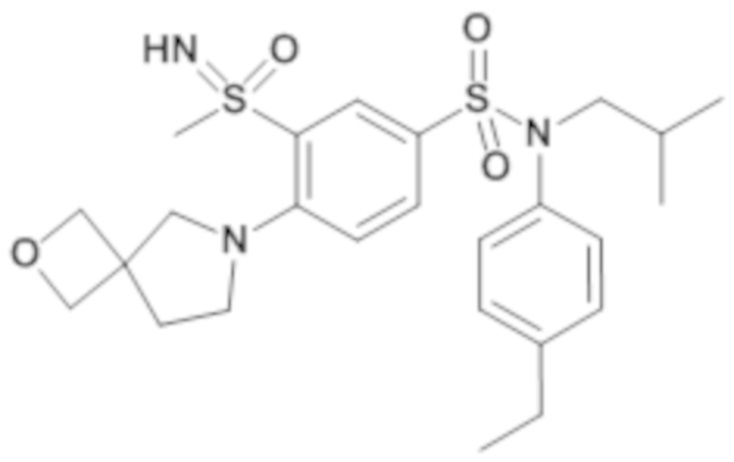
Соединение 112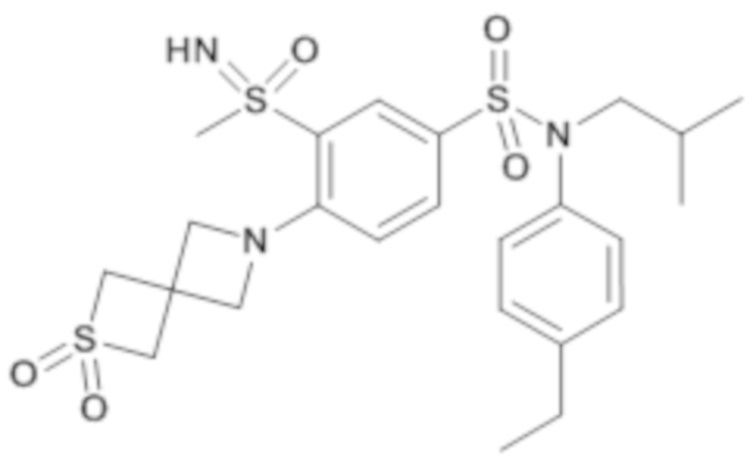
Соединение 113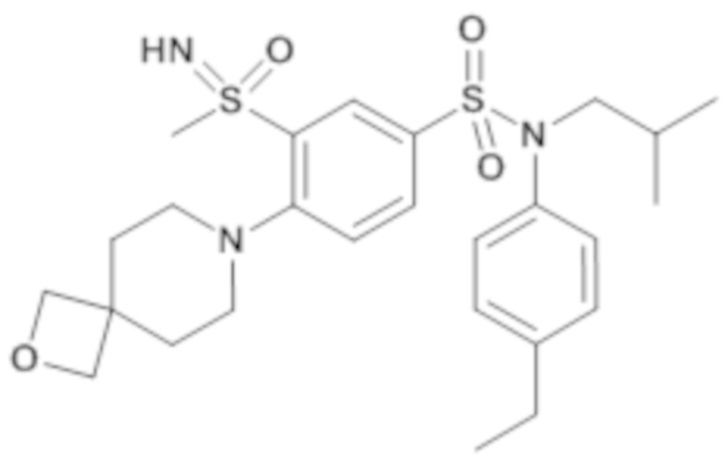
Соединение 114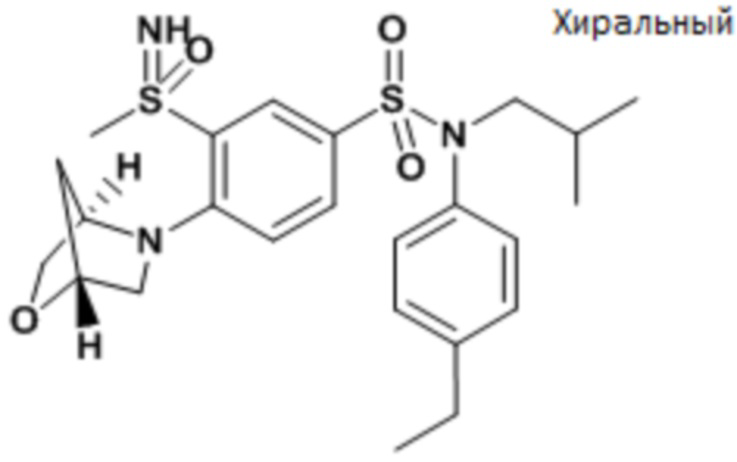
Соединение 115
Соединение 117
Соединение 118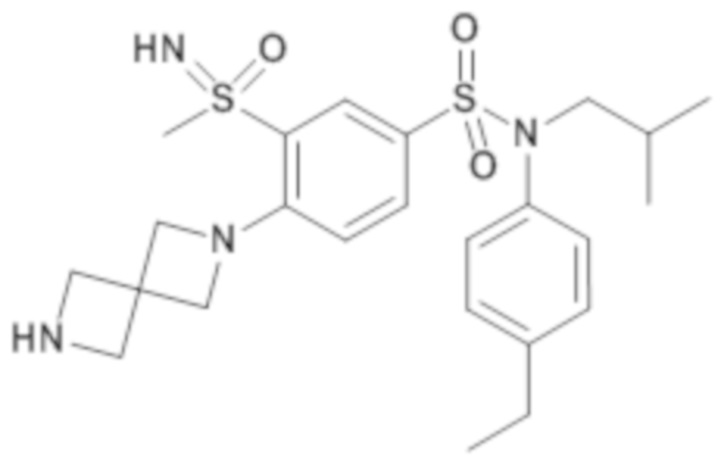
Соединение 121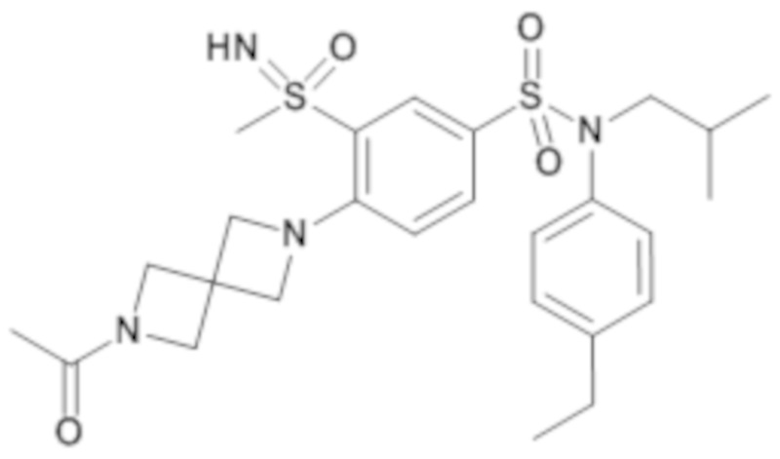
Соединение 122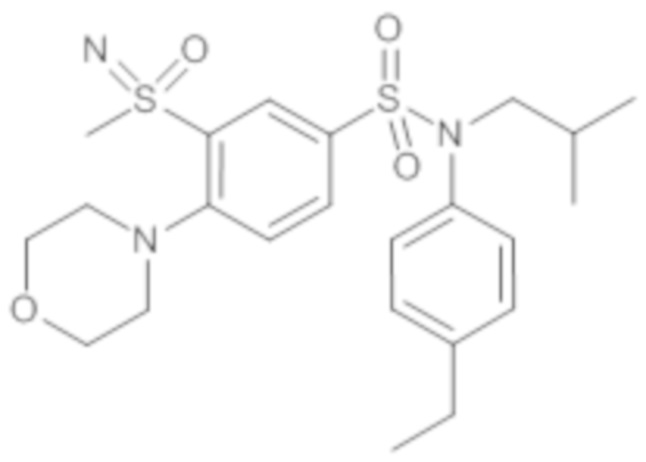
Соединение 123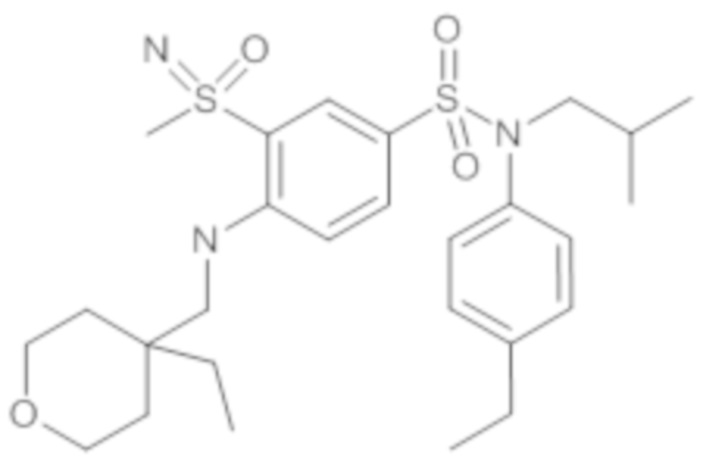
Соединение 124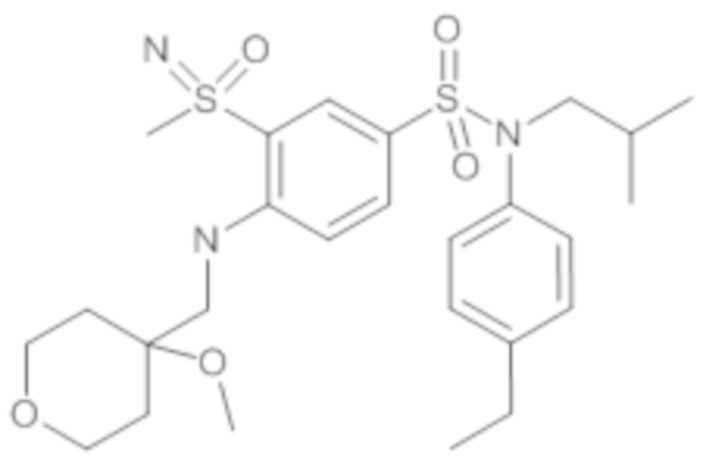
Соединение 125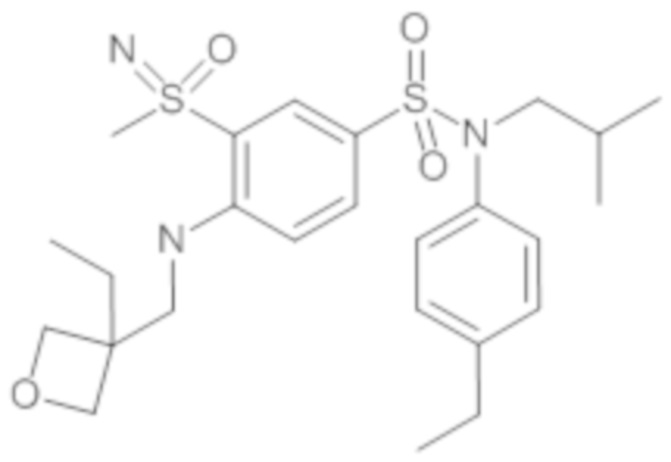
Соединение 126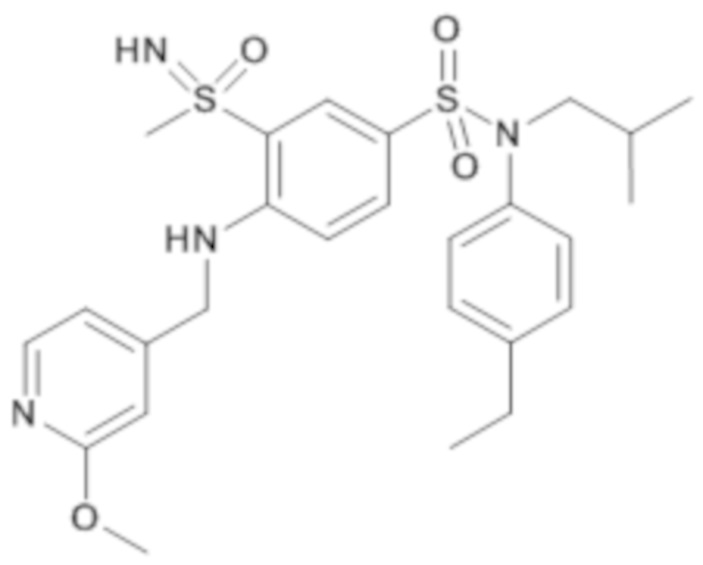
Соединение 127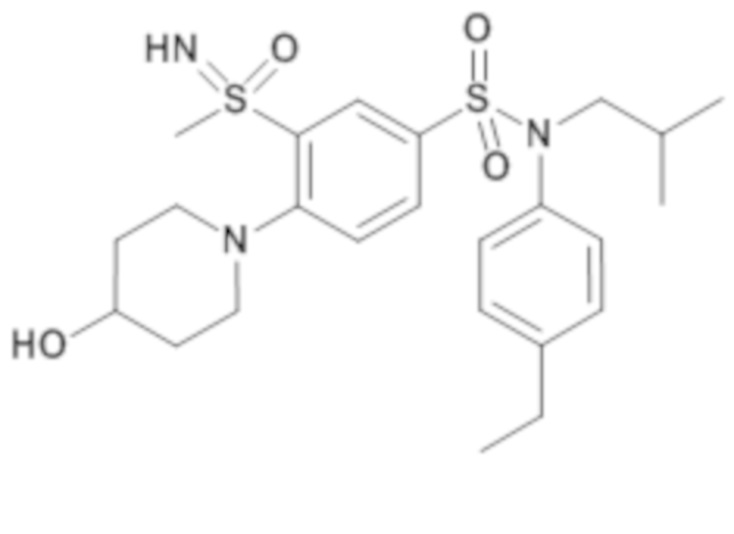
Соединение 128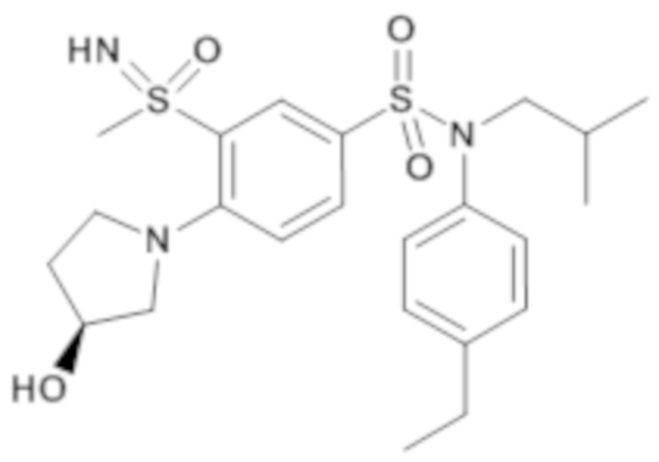
Соединение 129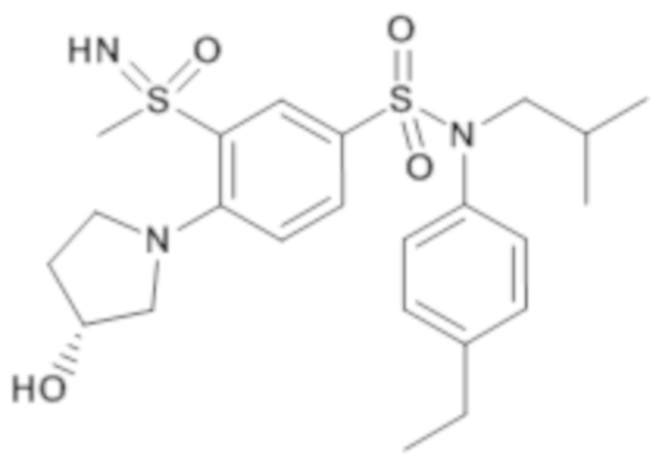
Соединение 130
Соединение 131
Соединение 132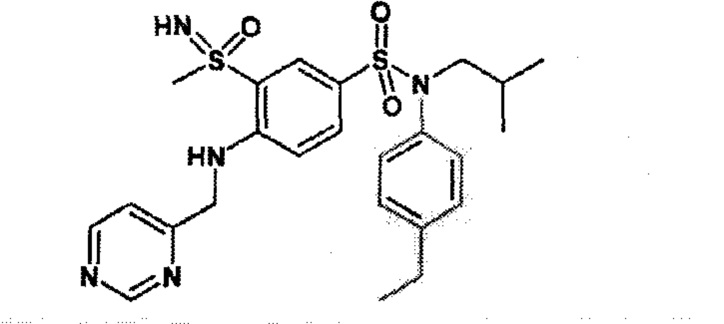
Соединение 133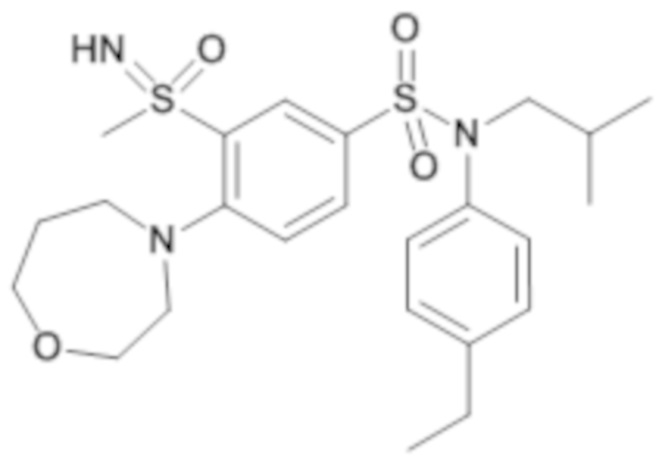
Соединение 137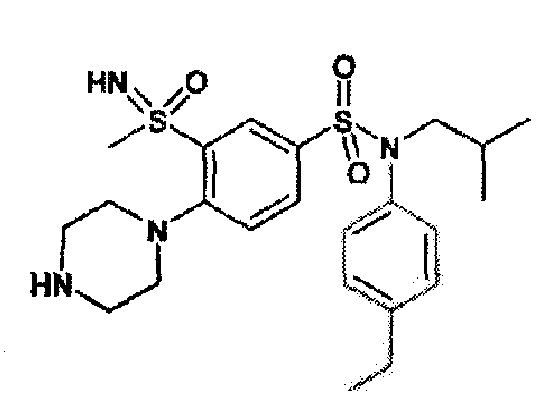
Соединение 140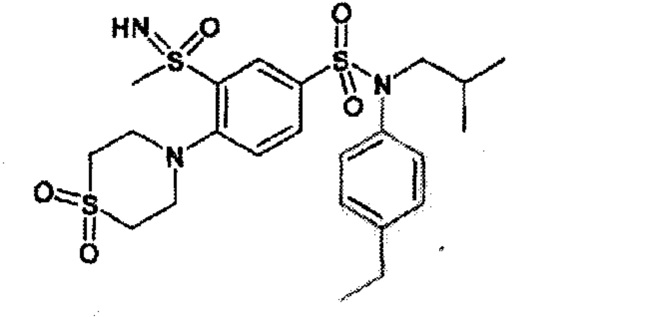
Соединение 141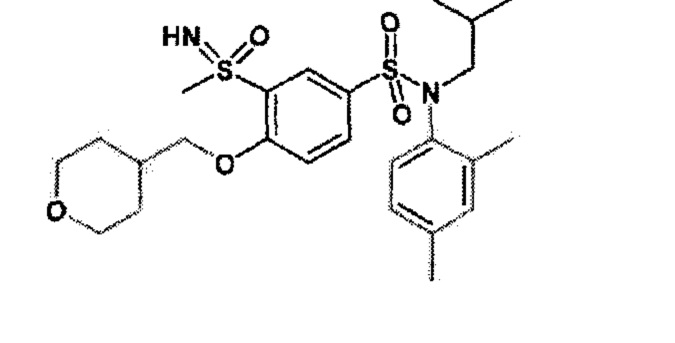
Соединение 142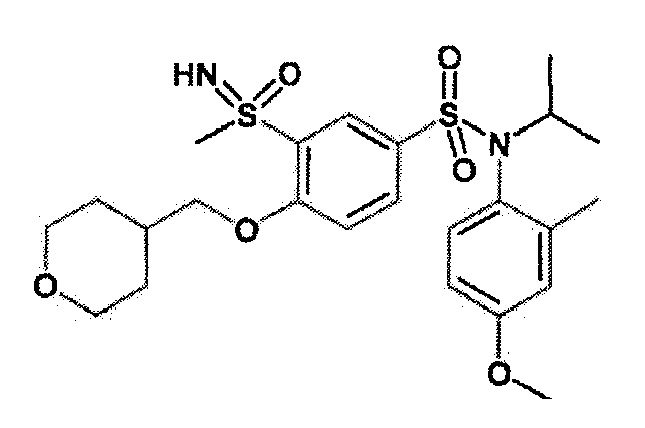
Соединение 143
2. Соединение по п. 1, отличающееся тем, что оно выбрано из следующих соединений:

Соединение 29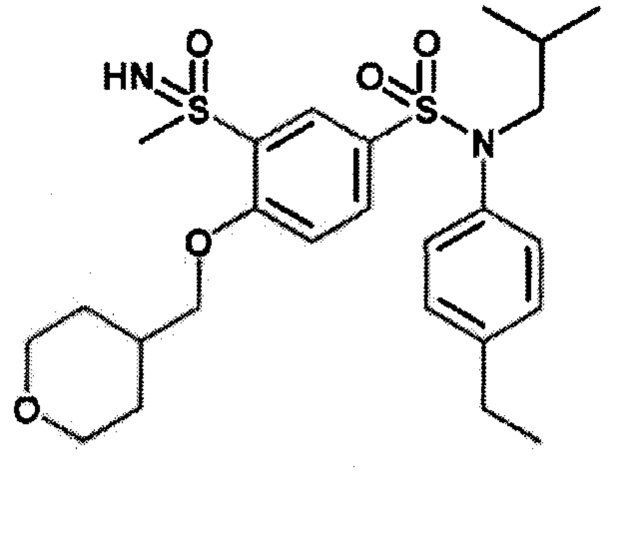
Соединение 26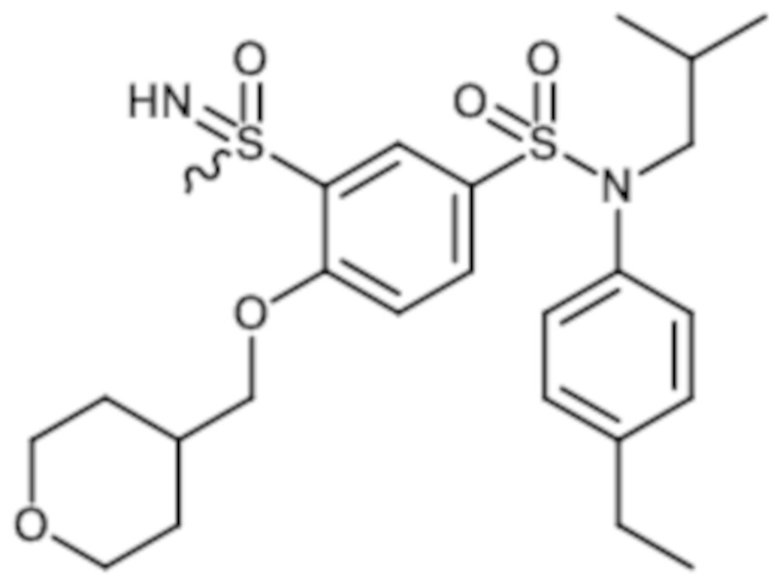
энантиомер A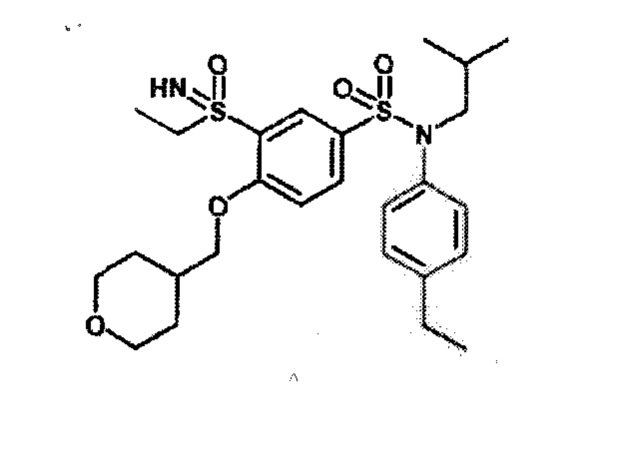
Соединение 18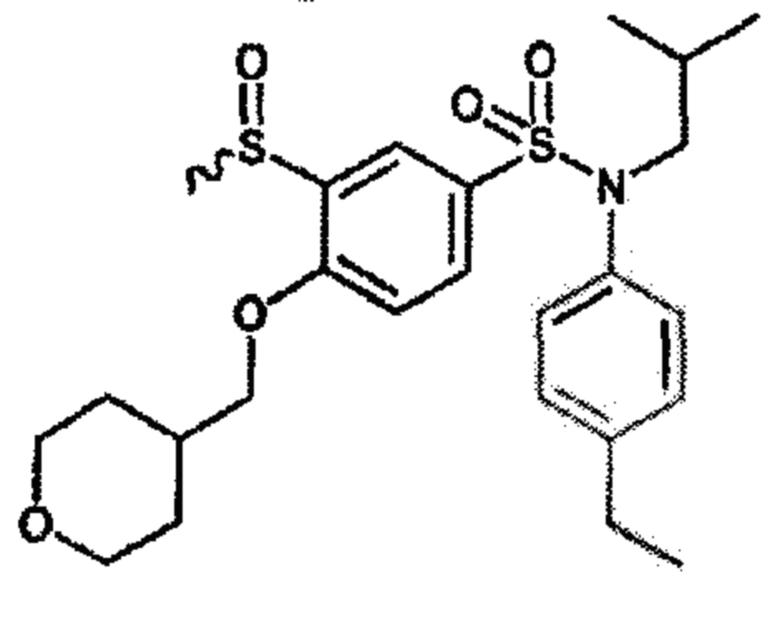
Соединение 19
Энантиомер A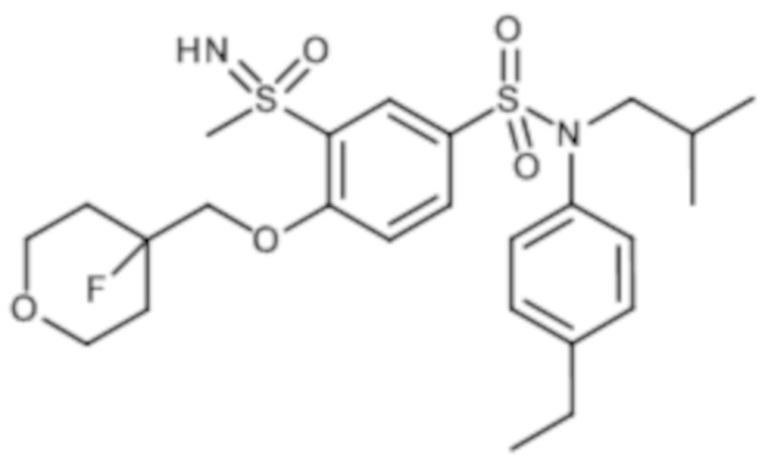
Соединение 30
Соединение 31
Соединение 35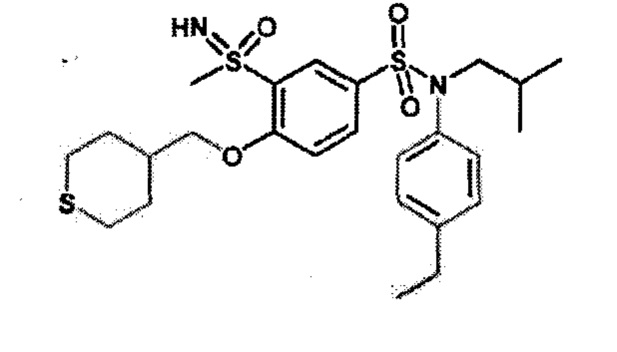
Соединение 37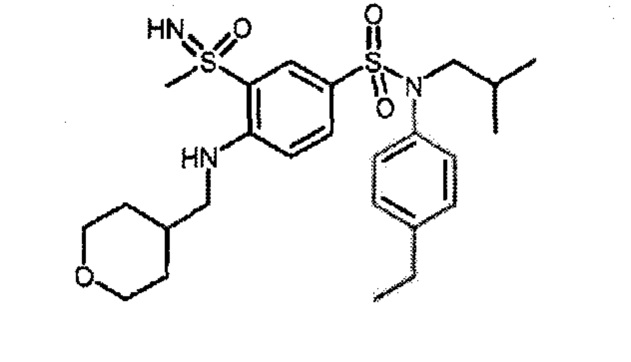
Соединение 52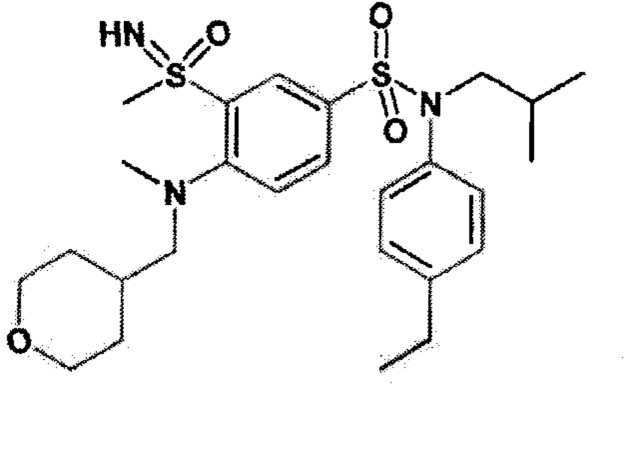
Соединение 53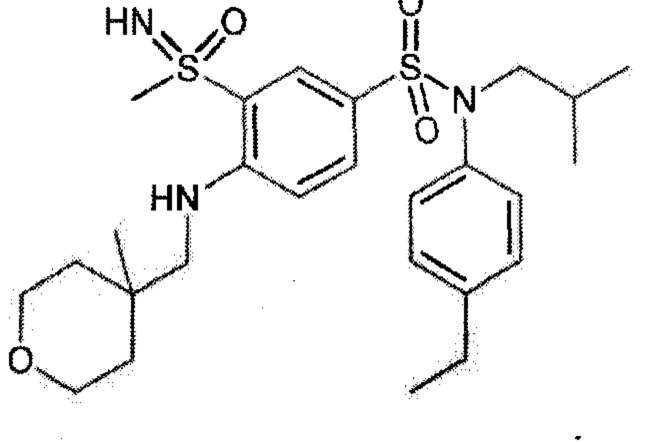
Соединение 55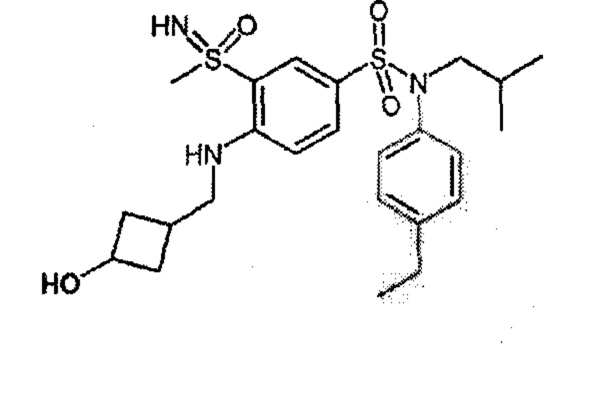
Соединение 61
Соединение 62
Соединение 63
Соединение 64
3. Соединение по любому из пп. 1 или 2 в качестве лекарственного средства для применения в лечении воспалительных заболеваний и/или аутоиммунных заболеваний, опосредованных рецептором RORγt.
4. Соединение для применения по п. 3, отличающееся его применением для лечения акне.
5. Соединение для применения по п. 3, отличающееся его применением для лечения псориаза.
6. Фармацевтическая композиция для применения в лечении воспалительных заболеваний и/или аутоиммунных заболеваний, опосредованных рецептором RORγt, в частности акне, атопического дерматита и/или псориаза, содержащая одно или несколько соединений, определенных в любом из пп. 1 или 2.
| WO 2014090712 A1, 19.06.2014 | |||
| WO 2013160418 A1, 31.10.2013 | |||
| N-ЗАМЕЩЕННЫЕ БЕНЗОЛСУЛЬФОНАМИДЫ | 2004 |
|
RU2364587C2 |
| WO 1996036595 A1 21.11.1996 | |||
| Zhang, Y., Xue, X., Jin, X., Song, Y., Li, J., Luo, X | |||
| Xu, Y | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2020-06-23—Публикация
2015-12-18—Подача