Область техники, к которой относится изобретение
Настоящее изобретение относится к способам оценки чистоты клеточного препарата, в частности препарата мезенхимальных стволовых клеток. В частности, настоящее изобретение относится к факторам роста в качестве биомаркера чистоты препарата мезенхимальных стволовых клеток.
Предшествующий уровень техники.
Применение методов лечения на основе стволовых клеток для заживления и восстановления различных тканей и органов обеспечивает альтернативные решения для лечения ряда заболеваний. Мезенхимальные стволовые клетки (МСК) представляют собой стромальные клетки с адгезией к пластмассе, характеризующиеся своей способностью к дифференцировке в мезенхимальные ткани, такие как кости, хрящ и жир. За счет этих свойств МСК представляются идеальной популяцией стволовых клеток для практической регенеративной медицины. Одним из самых богатых источников МСК является жировая ткань, и стволовые клетки, полученные из жировой ткани (СКЖТ), широко исследуются в целях разработки новых методов лечения в области регенеративной медицины (таких как, например, заживление ран, регенерация костей/хрящей, болезнь Крона).
Продукты клеточной терапии должны изготавливаться в соответствии с рекомендациями по эффективной производственной практике, которые требуют анализа чистоты готовых клеточных продуктов. Однако распространенными загрязнителями клеток, могут являться фибробласты, которые влияют на чистоту препаратов мезенхимальных стволовых клеток. В настоящее время чистота клеток продуктов клеточной терапии по-прежнему не характеризуются с точки зрения отсутствия фибробластов. Действительно, существующими установленными критериями определения характеристик мезенхимальных стволовых клеток, включая СКЖТ, являются: (i) адгезия к пластмассе для распластывания и пролиферации клеток; (ii) профиль поверхностных маркеров (CD44+, CD45-, CD73+, CD90+, CD105+); и (iii) способность к дифференцировке в адипогенном, остеогенном и хондрогенном направлениях. Однако в соответствии с этими критериями мезенхимальные стволовые клетки и фибробласты рассматриваются в настоящее время как подсемейство без какой-либо способности к дифференцировке (Hematti, Cytotherapy, 2012; 14: 516-521). Фибробласты являются клетками, повсеместно присутствующими в различных тканях (кожной, жировой, мышечной ткани). Они также обладают способностью адгезии к пластмассе, экспрессируют поверхностный маркер сходного с МСК фенотипа и обладают способностью к дифференцировке в мезенхимальном направлении при культивировании в специфических средах.
Немногие исследования посвящены тому, как отличать фибробласты от других клеток. У Pilling и др. описана идентификация маркеров, которые различают моноциты периферической крови человека, тканевые макрофаги, фиброциты и фибробласты (PLoS One., 2009, 4(10): е7475). Однако в это исследование не включены мезенхимальные стволовые клетки. Кроме того, у Goodpaster и др. описано, что фибробласты могут идентифицироваться антителом ТЕ-7, которое специфически распознает растущие и неактивные фибробласты в зафиксированных в формалине и залитых парафином образцах ткани (Journal of Histochemistry & Cytochemistry. 2008, 56(4):347-358). Тем не менее, антитело ТЕ-7 не испытывалось на мезенхимальных стволовых клетках.
Соответственно, в настоящее время не существует количественного и объективного метода, позволяющего отличать МСК от фибробластов. Фибробласты, однако, сопутствуют раковым клеткам на всех стадиях развития рака. Таким образом, продукт клеточной терапии, содержащий фибробласты, является потенциально канцерогенным. Следовательно, существует потребность в средствах оценки чистоты препарата МСК с точки зрения загрязнения фибробластами, в частности, в контексте получения продуктов клеточной терапии.
Авторами изобретения неожиданно продемонстрирована возможность различать мезенхимальные стволовые клетки и фибробласты по их способности секретировать такие факторы, как фактор стромальных клеток 1 альфа (ФСК-1α) и фактор роста сосудистого эндотелия (ФРСЭ).
Следовательно, настоящее изобретение относится к способу определения присутствия фибробластов в препарате мезенхимальных стволовых клеток, например, в содержащей клетки композиции и количественного определения чистоты такого препарата.
Краткое изложение сущности изобретения
Настоящее изобретение относится к способу in vitro определения, оценки и/или контроля чистоты клеточного препарата, содержащего мезенхимальные стволовые клетки (МСК), который включает измерение уровня экспрессии упомянутым клеточным препаратом, по меньшей мере, одного фактора роста, которым является ФСК-1α и/или ФРСЭ.
В одном из вариантов осуществления способ согласно изобретению дополнительно включает сравнение измеренного уровня экспрессии с контрольным уровнем экспрессии.
В одном из вариантов осуществления мезенхимальные стволовые клетки клеточного препарата согласно изобретению выделены из тканей, выбранных из группы, включающей жировую ткань, костный мозг, пуповинную кровь, околоплодные воды, вартонов студень, плаценту, периферическую кровь, фаллопиевую трубу, роговичную строму, легкие, мышцы и плодную печень. В одном из частных вариантов осуществления мезенхимальными стволовыми клетками являются стволовые клетки жировой ткани (СКЖТ).
В одном из вариантов осуществления уровень экспрессии клеточным препаратом согласно изобретению, по меньшей мере, одного фактора роста оценивают на уровне белков, предпочтительно путем обнаружения и/или определения количества, по меньшей мере, одного фактора роста, секретируемого в супернатанте клеточной культуры. В одном из частных вариантов осуществления уровень экспрессии оценивают на уровне РНК, предпочтительно методами ПЦР в реальном времени, количественной ПЦР в реальном времени, нозерн-блоттинга и/или гибридизации.
В одном из вариантов осуществления изобретения клеточный препарат является преимущественно чистым, когда уровень экспрессии ФСК-1α составляет не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл.
В другом варианте осуществления изобретения клеточный препарат является преимущественно чистым, когда уровень экспрессии ФСК-1α составляет не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл; и/или уровень экспрессии ФРСЭ составляет, по меньшей мере, 200 пг/мл в культуральной среде, предпочтительно, по меньшей мере, 250, 260, 270, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289 или 290 пг/мл; при этом клеточный препарат культивируют в условиях гипоксии, предпочтительно при содержании О2 около 0,1% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л до измерения уровня экспрессии.
В другом варианте осуществления изобретения клеточный препарат является преимущественно чистым, когда уровень экспрессии ФСК-1α составляет не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл; и/или уровень экспрессии ФРСЭ составляет, по меньшей мере, 90 пг/мл в культуральной среде, предпочтительно, по меньшей мере, 95, 100, 105, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119 или 120 мкг/мл, при этом клеточный препарат культивируют при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л до измерения уровня экспрессии.
В одном из вариантов осуществления способ согласно изобретению предназначен для оценки качества или чистоты клеточного препарата, содержащего мезенхимальные стволовые клетки (МСК), при этом содержащий МСК клеточный препарат предназначен для применения в качестве продукта клеточной терапии на основе МСК в регенеративной медицине.
Настоящее изобретение также относится к применению фактора роста, предпочтительно ФСК-1α и/или ФРСЭ как биомаркера качества клеточного препарата, содержащего мезенхимальные стволовые клетки (МСК), в частности, содержащего МСК клеточного препарата для применения в качестве продукта клеточной терапии на основе МСК в регенеративной медицине.
Другой задачей изобретения является создание популяции клеток, идентифицированной описанным выше способом in vitro.
Настоящее изобретение также относится к преимущественно чистой популяции мезенхимальных стволовых клеток, предпочтительно к популяции стволовых клеток жировой ткани.
Настоящее изобретение также относится к набору для реализации описанного выше способа in vitro, при этом набор содержит средство определения или измерения уровня экспрессии, по меньшей мере, одного фактора роста и необязательно дополнительно содержит контроль для сравнения уровня экспрессии, по меньшей мере, одного фактора роста.
Определения
В настоящем изобретении следующие термины имеют следующие значения:
"Чистота клеточного препарата" означает обогащение представляющих интерес клеток из гетерогенной популяции (также называемой смешанной популяцией). В одном из вариантов осуществления клетками согласно изобретению являются мезенхимальные стволовые клетки, предпочтительно мезенхимальные стволовые клетки жировой ткани. В одном из вариантов осуществления чистота согласно изобретению выражается в процентах мезенхимальных стволовых клеток, предпочтительно мезенхимальных стволовых клеток жировой ткани из смешанной популяции, включающей клетки других типов, предпочтительно фибробласты.
"Мезенхимальные стволовые клетки" или МСК являются мультипотентными стволовыми клетками, способными к дифференцировке в клетки разнообразных типов, включая остеоциты, хондроциты, адипоциты, миелоидные стромальные клетки, последовательности миогенных или нейрогенных клеточных поколений. Мезенхимальные стволовые клетки могут выделяться из тканей, включающих без ограничения жировую ткань, костный мозг, ткань пуповины, околоплодные воды, вартонов студень, плаценту, периферическую кровь, фаллопиевую трубу, роговичную строму, легкие, мышцы, кожу, кости, дентин, предменструальную жидкость, крайнюю плоть, плодную печень и т.п.
"Жировая ткань" означает любую жировую ткань. Жировой тканью может являться коричневая, желтая или белая жировая ткань. Жировой тканью предпочтительно является подкожная белая жировая ткань. Жировая ткань включает адипоциты и строму. Жировую ткань содержится во всем теле животного. Например, у млекопитающих жировая ткань может присутствовать в сальнике, костном мозге, подкожном пространстве, скоплениях жировой ткани (например, лопаточных или инфрапателлярных скоплениях жировой ткани) и окружать большинство органов. Клетки, выделенные из жировой ткани, могут представлять собой первичную клеточную культуру или линию клеток-предшественников. Источником жировой ткани может являться любой организм, имеющий жировую ткань.
"Клетка, выделенная из жировой ткани" означает клетку, которая происходит из жировой ткани. В частности, "мезенхимальные стволовые клетки жировой ткани" (СКЖТ) означают стромальные клетки, которые происходят из жировой ткани и которые могут служить предшественниками клеток разнообразных типов, таких как без ограничения адипоциты, остеоциты, хондроциты.
"Фактор роста" означает любое вещество, участвующее в регуляции пролиферации или дифференцировки клеток.
"Тканевые уровни содержания кислорода" означают уровни содержания кислорода от около 3% до около 6%, предпочтительно около 5%.
"Гипоксическая среда" означает уровни содержания кислорода от около 0% до около 1%, предпочтительно около 0,1%.
"Условия нормогликемии" означают концентрацию глюкозы от около 0,5 г/л до около 1,5 г/л, предпочтительно около 1 г/л.
"Условия гипергликемии" означают концентрацию глюкозы от около 2 г/л до около 10 г/л, предпочтительно от около 3 г/л до около 6 г/л, более предпочтительно около 4,5 г/л.
"Около" перед какой-либо величиной означает отклонения плюс-минус 10% от указанной величины.
"Пассирование", также известное как субкультивирование или деление клеток, означает перенос небольшого числа клеток в новый сосуд, когда клетки находятся или почти находятся в условиях конфлюэнтности, чтобы продлить жизнь и/или увеличить число клеток в культуре. В одном из вариантов осуществления нулевым пассажем (Р0) является состояние, в котором клетки были первоначально помещены в культуру.
"Мезенхимальная стволовая клетка позднего пассажа" означает клетку с меньшей иммуногенностью, чем у клетки более раннего пассажа. Иммуногенность мезенхимальной стволовой клетки соответствует числу пассажей. Клетку предпочтительно пассируют, по меньшей мере, четыре раза, более предпочтительно, по меньшей мере, шесть раз, наиболее предпочтительно, по меньшей мере, восемь раз.
Подробное описание изобретения
Настоящее изобретение относится к способу, предпочтительно способу in vitro определения, оценки и/или контроля чистоты клеточного препарата, содержащего мезенхимальные стволовые клетки (МСК), например, содержащей МСК композиции клеток, который включает определение или измерение уровня экспрессии клеточным препаратом, по меньшей мере, одного фактора роста. В одном из вариантов осуществления МСК представляют собой мезенхимальные стволовые клетки, полученные из жировой ткани (СКЖТ).
В одном из вариантов осуществления способ согласно изобретению предназначен для определения присутствия фибробластов в клеточном препарате, содержащем мезенхимальные стволовые клетки. Таким образом, согласно этому варианту осуществления способ согласно изобретению может соответствовать способу контроля качества с целью проверки, например, чистоты содержащего МСК клеточного препарата с точки зрения загрязнения фибробластами. Эти МСК могут, например, использоваться в продукте клеточной терапии на основе МСК.
В одном из вариантов осуществления способ согласно изобретению предназначен для количественной оценки чистоты клеточного препарата, содержащего мезенхимальные стволовые клетки. В одном из вариантов осуществления клеточным препаратом является гетерогенный препарат, содержащий мезенхимальные стволовые клетки и клетки других типов. В одном из частных вариантов осуществления изобретения клеточный препарат содержит мезенхимальные стволовые клетки и фибробласты.
В одном из вариантов осуществления способ согласно изобретению предназначен для количественного определения процента мезенхимальных стволовых клеток из гетерогенной популяции, содержащей мезенхимальные стволовые клетки и клетки других типов, предпочтительно фибробласты.
Заявитель продемонстрировал, что с нарастанием загрязнения МСК фибробластами уровень экспрессии факторов роста имеет тенденцию к повышению или снижению. Следовательно, в настоящем изобретении продемонстрирована способность различать МСК и фибробласты на основании экспрессии их специфических факторов роста. В частности, различение может быть основано на экспрессии их факторов роста в специфических условиях оксигенации и/или гликемии.
Соответственно, в одном из вариантов осуществления способ согласно изобретению предназначен для определения, оценки и/или контроля чистоты содержащего МСК клеточного препарата с точки зрения загрязнения фибробластами на основании экспрессии их специфических факторов роста.
Примеры факторов роста включают без ограничения адипоцитокины, ангиопоэтины, ангиопоэтин-подобные белки и их рецепторы, хемокины и их рецепторы, общие рецепторы бета-цепи, общие рецепторы гамма-цепи, фактор роста эпидермиса (ФРЭ), фактор роста фибробластов (ФРФ), белки семейства "hedgehog", инсулиноподобный фактор роста (ИФР), интерфероны, интерлейкины и рецепторы, фактор роста тромбоцитов (ФРТ), трансформирующий фактор роста (ТФР), фактор некроза опухоли (ФНО), ФРСЭ, фактор стромальных клеток 1 (ФСК-1)и Wnt.
В одном из вариантов осуществления способ согласно изобретению включает измерение уровня экспрессии ФСК-1 (также известного как хемокин 12 с С-Х-С мотивом (CXCL12), фактор роста пре-В-клеток (PBSF), SCYB12 или TLSF) и/или ФРСЭ. ФСК-1 предпочтительно находится в форме ФСК-1α.
В одном из вариантов осуществления способ согласно изобретению включает измерение уровня экспрессии ФСК-1α. В другом варианте осуществления способ согласно изобретению включает измерение уровня экспрессии ФРСЭ. В другом варианте осуществления способ согласно изобретению включает измерение уровня экспрессии ФСК-1α и ФРСЭ.
В одном из вариантов осуществления выделяют МСК из тканей, выбранных из группы, включающей жировую ткань, костный мозг, пуповинную кровь, вартонов студень (такой как, например, вартонов студень, находящийся внутри пуповины), плаценту, периферическую кровь, фаллопиевой трубу, роговичную строму, легкие, мышцы, кожу, кости, дентин, плодную печень и т.п. В одном из частных вариантов осуществления выделяют МСК из жировой ткани. В одном из предпочтительных вариантов осуществления МСК представляют собой стволовые клетки жировой ткани (СКЖТ).
В одном из вариантов осуществления выделяют МСК из тканей любых теплокровных животных, предпочтительно из тканей человека. В одном из частных вариантов осуществления МСК представляют собой СКЖТ человека.
В одном из вариантов осуществления клетками являются культивируемые клетки, предпочтительно линии клеток и/или производные первичных клеток, т.е. клеток, выделенных непосредственно из ткани. В одном из вариантов осуществления извлекают из взятого у индивидуума образца, полученного, например, путем биопсии. Стадия взятия образца у индивидуума предпочтительно не является частью способа согласно настоящему изобретению.
Выделение мезенхимальных стволовых клеток может осуществляться любым приемлемым способом, известным специалисту в данной области техники. Примеры способов выделения МСК включают без ограничения расщепление коллагеназой, трипсинизацию или культивирование в искусственной среде.
В одном из частных вариантов осуществления выделяют мезенхимальные стволовые клетки из жировой ткани путем расщепления ткани, например, коллагеназой.
В одном из вариантов осуществления изобретения после выделения культивируют популяцию МСК в любой известной специалистам культуральной среде, способной поддерживать рост клеток. В настоящем изобретении такая культуральная среда называется "пролиферативной средой" или "средой для выращивания". Примеры среды для выращивания включают без ограничения среды MEM, DMEM, IMDM, RPMI 1640, FGM or FGM-2, 199/109, HamF10/HamF12 или 5A McCoy, предпочтительно DMEM или RPMI.
В одном из вариантов осуществления культуральная среда также может содержать любые дополнительные факторы, известные специалисту в данной области, которые могут быть использованы в клеточной культуре. Примеры дополнительных факторов включают без ограничения ФБС; глицин; аминокислоты, такие как глутамин, аспарагин, глутаминовая кислота, аспарагиновая кислота, серии, пролин или аланин, предпочтительно аминокислоты, имеющие L-конфигурацию; и антибиотики, такие как стрептомицин или пенициллин.
В одном из частных вариантов осуществления культивируют клеточный препарат, содержащий МСК, в DMEM, дополненной фетальной бычьей сывороткой, глутамином, предпочтительно L-глутамином и антибиотиками, такими как пенициллин, стрептомицин и амфотерицин В.
В одном из вариантов осуществления клеточный препарат, содержащий МСК, может быть загрязнен клетками других типов, такими как, например, фибробласты. В одном из частных вариантов осуществления клеточный препарат, содержащий МСК, загрязнен фибробластами.
В одном из вариантов осуществления культивируют клеточный препарат, содержащий МСК, в среде для выращивания вплоть, по меньшей мере, до 2-го пассажа, предпочтительно, по меньшей мере, до 3-го пассажа, более предпочтительно, по меньшей мере, до 4-го пассажа. Используемый термин "культивированный вплоть, по меньшей мере, до 4-го пассажа" означает, что клеточный препарат отделяют и переносят в новый сосуд, по меньшей мере, 4 раза. В одном из вариантов осуществления мезенхимальные стволовые клетки клеточного препарата представляют собой мезенхимальные стволовые клетки позднего пассажа.
С целью пассирования клетки могут отделяться одним из нескольких способов, известных специалистам в данной области техники, включая обработку трипсином, чтобы разрушить белки, отвечающие за адгезию с поверхностью, хелатирование ионов натрия с помощью ЭДТК, которая нарушает некоторые механизмы адгезии белка, или механические методы, такие как повторное промывание или использование скребка для клеток. Отделенные клетки затем повторно суспендируют в свежей среде.
В одном из вариантов осуществления культивируют клеточный препарат, содержащий МСК, в течение, по меньшей мере, 24 часов, предпочтительно, по меньшей мере, 36, 48, 60 или 72 часов. В другом варианте осуществления культивируют клеточный препарат, содержащий МСК, в течение, по меньшей мере, 1 дня, предпочтительно, по меньшей мере, 2, 3, 4, 5, 6 или 7 дней. В другом варианте осуществления культивируют клеточный препарат, содержащий МСК, в течение, по меньшей мере, 10, 15, 20, 25, 30, 35 или 40 дней.
В одном из вариантов осуществления культивируют клеточный препарат, содержащий МСК, в стандартных условиях культивирования. Используемый термин "стандартные условия культивирования" означает температуре около 37°С и кислородный потенциал около 21% и около 5%.
В одном из вариантов осуществления стадия культивирования клеточного препарата, содержащего МСК, не является частью способа согласно настоящему изобретению.
В одном из вариантов осуществления изменяют условия культивирования клеточного препарата, содержащего МСК, до измерения уровня экспрессии, по меньшей мере, одного фактора роста.
Используемый термин "до измерения уровня экспрессии, по меньшей мере, одного фактора роста" означает, что после последнего пассажа и до измерения уровня экспрессии, по меньшей мере, одного фактора роста проходит, по меньшей мере, 6 часов, предпочтительно, по меньшей мере, 9, 12, 15, 18 или 24 часа.
В одном из вариантов осуществления культивируют клеточный препарат, содержащий МСК, при кислородном потенциале не более 21%, предпочтительно, не более 15%, более предпочтительно, не более 10% до измерения уровня экспрессии, по меньшей мере, одного фактора роста. В одном из частных вариантов осуществления культивируют клеточный препарат, содержащий МСК, при содержании О2 от около 3% до около 6%, предпочтительно около 5%, что соответствует тканевому кислородному потенциалу, до измерения уровня экспрессии, по меньшей мере, одного фактора роста. В другом варианте осуществления культивируют клеточный препарат, содержащий МСК, при содержании О2 от около 0% до около 1%, предпочтительно около 0,1%, что соответствует условиям гипоксии, до измерения уровня экспрессии, по меньшей мере, одного фактора роста.
В другом варианте осуществления культивируют клеточный препарат, содержащий МСК, в среде, содержащей от около 0,1 до около 10 г/л глюкозы, предпочтительно от около 0,5 до около 6 г/л глюкозы, более предпочтительно от около 1 до около 4,5 г/л глюкозы, до измерения уровня экспрессии, по меньшей мере, одного фактора роста.
В одном из вариантов осуществления культивируют клеточный препарат, содержащий МСК, в среде с низкой концентрацией глюкозы, соответствующей нормальным уровням содержания сахара в крови in vivo, т.е. в среде, содержащей от около 0,5 до около 1,5 г/л глюкозы, предпочтительно около 1 г/л глюкозы до измерения уровня экспрессии, по меньшей мере, одного фактора роста. В другом варианте осуществления культивируют клеточный препарат, содержащий МСК, в среде, содержащей с высокой концентрацией глюкозы, соответствующей условиям гипергликемии, т.е. в среде, содержащей от 2 до 10 г/л глюкозы, предпочтительно от около 3 до около 6 г/л глюкозы, более предпочтительно около 4,5 г/л глюкозы, до измерения уровня экспрессии, по меньшей мере, одного фактора роста.
В одном из вариантов осуществления культивируют клеточный препарат, содержащий МСК, при содержании О2 около 21% и концентрации глюкозы около 1 г/л глюкозы до измерения уровня экспрессии, по меньшей мере, одного фактора роста. В другом варианте осуществления культивируют клеточный препарат, содержащий МСК, при содержании О2 около 21% и концентрации глюкозы около 4,5 г/л до измерения уровня экспрессии, по меньшей мере, одного фактора роста. В другом варианте осуществления культивируют клеточный препарат, содержащий МСК, при содержании О2 около 5% и концентрации глюкозы около 1 г/ до измерения уровня экспрессии, по меньшей мере, одного фактора роста. В другом варианте осуществления культивируют клеточный препарат, содержащий МСК, при содержании О2 около 5% и концентрации глюкозы около 4,5 г/л глюкозы до измерения уровня экспрессии, по меньшей мере, одного фактора роста. В другом варианте осуществления культивируют клеточный препарат, содержащий МСК, при содержании О2 около 0,1% и концентрации глюкозы около 1 г/л до измерения уровня экспрессии, по меньшей мере, одного фактора роста. В другом варианте осуществления культивируют клеточный препарат, содержащий МСК, при содержании О2 около 0,1% и концентрации глюкозы около 4,5 г/л до измерения уровня экспрессии, по меньшей мере, одного фактора роста.
Согласно другому варианту осуществления условия культивирования клеточного препарата, содержащие МСК, всегда одинаковы на всех стадиях способа согласно изобретению.
В одном из вариантов осуществления изобретения способ включает следующие стадии:
а) культивирования клеточного препарата, содержащего мезенхимальные стволовые клетки,
б) необязательно изменения условий культивирования и
в) количественного определения уровня экспрессии, по меньшей мере, одного фактора роста, предпочтительно ФСК- 1α и/или ФРСЭ.
В одном из предпочтительных вариантов осуществления способ оценки чистоты клеточного препарата, содержащего мезенхимальные стволовые клетки, предпочтительно стволовые клетки жировой ткани, включает следующие стадии:
а) культивирования клеточного препарата, содержащего мезенхимальные стволовые клетки, предпочтительно стволовые клетки жировой ткани,
б) необязательно изменения условий культивирования, предпочтительно кислородного потенциала и
в) количественного определения уровня экспрессии ФСК-1α и/или ФРСЭ.
В одном из частных вариантов осуществления способ оценки чистоты клеточного препарата, содержащего мезенхимальные стволовые клетки, предпочтительно стволовые клетки жировой ткани, включает следующие стадии:
а) культивирования клеточного препарата, содержащего мезенхимальные стволовые клетки, предпочтительно стволовые клетки жировой ткани,
б) необязательно изменения условий культивирования, предпочтительно кислородного потенциала и
в) количественного определения уровня экспрессии ФСК-1α.
В одном из частных вариантов осуществления способ оценки чистоты клеточного препарата, содержащего мезенхимальные стволовые клетки, предпочтительно стволовые клетки жировой ткани, включает следующие стадии:
а) культивирования клеточного препарата, содержащего мезенхимальные стволовые клетки, предпочтительно стволовые клетки жировой ткани,
б) необязательно изменения условий культивирования, предпочтительно кислородного потенциала, и
в) количественного определения уровней экспрессии ФСК-1α и ФРСЭ.
Используемый термин "экспрессия" может в качестве альтернативы означать транскрипцию фактора роста (т.е. экспрессию РНК) или трансляцию (т.е. экспрессию белка) фактора роста или присутствие фактора роста в супернатанте культивируемых клеток (т.е. секрецию фактора роста).
Способы определения уровня экспрессии хорошо известны специалистам в данной области и включают без ограничения определение транскриптома (в одном из вариантов осуществления, в котором экспрессия означает транскрипцию фактора роста) или протеома (в одном из вариантов осуществления, в котором экспрессия означает трансляцию или секрецию фактора роста) клетки.
В одном из вариантов осуществления изобретения оценивают экспрессию фактора роста на уровне РНК. Способы оценки уровня транскрипции фактора роста хорошо известны из техники. Примеры таких способов включают без ограничения ПЦР в реальном времени, количественную ПЦР в реальном времени, нозерн-блоттинг, методы гибридизации, такие как, например, использование биочипов, и их сочетание, включая без ограничения гибридизацию ампликонов, полученных путем ПЦР в реальном времени, секвенирования, такого как, например, секвенирование ДНК следующего поколения (NGS) или RNA-seq (также известное как полнотранскриптомное секвенирование методом дробовика, от английского - Whole Transcriptome Shotgun Sequencing) и т.п.
В другом варианте осуществления изобретения оценивают экспрессию фактора роста на уровне белка. Способы определения уровня белка в образце хорошо известны из техники. Примеры таких способов включают без ограничения иммуногистохимию, мультиплексные методы (Luminex), вестерн-блоттинг, иммуносорбентный анализ с ферментной меткой (ELISA), ELISA сэндвич-типа, иммуносорбентный анализ с флуоресцентной меткой (FLISA), иммуноферментный анализ (EIA) радиоиммуноанализ (RIA), проточную цитометрию (FACS) и т.п. Уровень белка в факторе роста предпочтительно определяют методом иммуносорбентного анализа с ферментной меткой (ELISA).
В одном из вариантов осуществления изобретения определение уровня экспрессии фактора роста конкретно соответствует обнаружению и определению количества упомянутого фактора роста, секретируемого в супернатанте клеточной культуры. В одном из частных вариантов осуществления способ согласно изобретению включает определение уровня экспрессии ФСК-1α и/или ФРСЭ в супернатанте клеточной культуры клеточного препарата, содержащего МСК.
В одном из вариантов осуществления стадия определения уровня экспрессии, по меньшей мере, одного фактора роста выполняется, когда МСК, содержащиеся в клеточном препарате, имеют плотность, приводящую к конфлюэнтности около 80%, предпочтительно около 85, 90, 95, 99 или 100%.
По смыслу изобретения клеточный препарат, содержащий МСК, является преимущественно чистым, когда он содержит менее 25% фибробластов, предпочтительно менее 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12 или 11% фибробластов. В одном из вариантов осуществления клеточный препарат, содержащий МСК, является преимущественно чистым, когда он содержит менее 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1% фибробластов.
В соответствии с одним из вариантов осуществления клеточный препарат, содержащий МСК, является преимущественно чистым, когда уровень экспрессии ФСК-1α у клеточного препарата, содержащего МСК, составляет не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл.
В одном из вариантов осуществления клеточный препарат, содержащий МСК, является преимущественно чистым, когда уровень экспрессии ФСК-1α у содержащего МСК клеточного препарата, культивируемого при содержании О2 около 21%, составляет не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 мкг/мл.
В другом варианте осуществления изобретения клеточный препарат, содержащий МСК, является преимущественно чистым, когда уровень экспрессии ФСК-1α у содержащего МСК клеточного препарата, культивируемого при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5%, составляет не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл.
В другом варианте осуществления клеточный препарат, содержащий МСК, является преимущественно чистым, когда уровень экспрессии ФСК-1α у содержащего МСК клеточного препарата, культивируемого в условиях гипоксии, предпочтительно при содержании О2 около 0,1%, составляет не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл.
В одном из вариантов осуществления клеточный препарат, содержащий МСК, является преимущественно чистым, когда уровень экспрессии ФСК-1α у содержащего МСК клеточного препарата, культивируемого при низкой концентрации глюкозы, предпочтительно около 1 г/л, составляет не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл.
В другом варианте осуществления изобретения клеточный препарат, содержащий МСК, является преимущественно чистым, когда уровень экспрессии ФСК-1α у содержащего МСК клеточного препарата, культивируемого при высокой концентрации глюкозы, предпочтительно около 4,5 г/л, составляет не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 3, 2 или 1 пг/мл.
В одном из вариантов осуществления клеточный препарат, содержащий МСК, является преимущественно чистым, когда уровень экспрессии ФСК-1α у содержащего МСК клеточного препарата, культивируемого при содержании О2 около 21% и при низкой концентрации глюкозы, предпочтительно около 1 г/л, составляет не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 4, 3, 2 или 1 пг/мл.
В другом варианте осуществления изобретения клеточный препарат, содержащий МСК, является преимущественно чистым, когда уровень экспрессии ФСК-1α у содержащего МСК клеточного препарата, культивируемого при содержании О2 около 21% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л, составляет не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл.
В другом варианте осуществления изобретения клеточный препарат, содержащий МСК, является преимущественно чистым, когда уровень экспрессии ФСК-1А у содержащего МСК клеточного препарата, культивируемого при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при низкой концентрации глюкозы, предпочтительно около 1 г/л, составляет не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл.
В другом варианте осуществления клеточный препарат, содержащий МСК, является преимущественно чистым, когда уровень экспрессии ФСК-1α у содержащего МСК клеточного препарата, культивируемого при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л, составляет не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл.
В другом варианте осуществления клеточный препарат, содержащий МСК, является преимущественно чистым, когда уровень экспрессии ФСК-1α у содержащего МСК клеточного препарата, культивируемого в условиях гипоксии, предпочтительно при содержании О2 около 0,1% и при низкой концентрации глюкозы, предпочтительно около 1 г/л, составляет не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5,4, 3, 2 или 1 пг/мл.
В другом варианте осуществления изобретения клеточный препарат, содержащий МСК, является преимущественно чистым, когда уровень экспрессии ФСК-1α у содержащего МСК клеточного препарата, культивируемого в условиях гипоксии, предпочтительно при содержании О2 около 0,1% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л, составляет не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл.
В одном из вариантов осуществления, клеточный препарат, содержащий МСК, является преимущественно чистым, когда уровень экспрессии ФРСЭ у содержащего МСК клеточного препарата, культивируемого в условиях гипоксии, предпочтительно при содержании O2 около 0,1% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л, составляет, по меньшей мере, 200 пг/мл, предпочтительно, по меньшей мере, 250, 260, 270, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289 или 290 пг/мл.
В другом варианте осуществления клеточный препарат, содержащий МСК, является преимущественно чистым, когда уровень экспрессии ФРСЭ у содержащего МСК клеточного препарата, культивируемого при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л, составляет, по меньшей мере, 90 пг/мл, предпочтительно, по меньшей мере, 95, 100, 105, 110, 111, 112, 113, 114, 115, 116, 117, 188, 119 или 120 пг/мл.
В другом варианте осуществления изобретения клеточный препарат, содержащий МСК, является преимущественно чистым, когда уровень экспрессии ФРСЭ у содержащего МСК клеточного препарата, культивируемого при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при низкой концентрации глюкозы, предпочтительно около 1 г/л, составляет, по меньшей мере, 160 пг/мл, предпочтительно, по меньшей мере, 161, 162, 163, 164, 165, 166, 167, 168 или 169 пг/мл, более предпочтительно, по меньшей мере, 170 пг/мл.
В одном из вариантов осуществления клеточный препарат, содержащий МСК, является преимущественно чистым, когда содержащий МСК клеточный препарат, культивируемый в условиях гипоксии, предпочтительно при содержании О2 около 0,1% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л, имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл; и уровень экспрессии ФРСЭ, по меньшей мере, 200 пг/мл, предпочтительно, по меньшей мере, 250, 260, 270, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289 или 290 пг/мл.
В другом варианте осуществления клеточный препарат, содержащий МСК, является преимущественно чистым, когда содержащий МСК клеточный препарат, культивируемый при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л, имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл; и уровень экспрессии ФРСЭ, по меньшей мере, 90 пг/мл, предпочтительно, по меньшей мере, 95, 100, 105, 110, 111, 112, 113, 114, 115, 116, 117, 188, 119 или 120 пг/мл.
В другом варианте осуществления клеточный препарат, содержащий МСК, является преимущественно чистым, когда содержащий МСК клеточный препарат, культивируемый при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при низкой концентрации глюкозы, предпочтительно около 1 г/л, имеет уровень экспрессии ФСК-1α не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл; и уровень экспрессии ФРСЭ, по меньшей мере, 160 пг/мл, предпочтительно, по меньшей мере, 161, 162, 163, 164, 165, 166, 167, 168 или 169 пг/мл, более предпочтительно, по меньшей мере, 170 пг/мл.
В одном из вариантов осуществления изобретения способ включает следующие стадии:
а) культивирования клеточного препарата, содержащего мезенхимальные стволовые клетки,
б) необязательно изменения условий культивирования и
в) количественного определения секреции, по меньшей мере, одного фактора роста в супернатанте клеточной культуры, предпочтительно ФСК-1α и/или ФРСЭ.
В одном из предпочтительных вариантов осуществления способ оценки чистоты клеточного препарата, содержащего мезенхимальные стволовые клетки, предпочтительно стволовые клетки жировой ткани, включает следующие стадии:
а) культивирования клеточного препарата, содержащего мезенхимальные стволовые клетки, предпочтительно стволовые клетки жировой ткани,
б) необязательно изменения условий культивирования, предпочтительно кислородного потенциала и
в) количественного определения секреции ФСК-1α и/или ФРСЭ в супернатанте клеточной культуры.
В одном из частных вариантов осуществления способ оценки чистоты клеточного препарата, содержащего мезенхимальные стволовые клетки, предпочтительно стволовые клетки жировой ткани, включает следующие стадии:
а) культивирования клеточного препарата, содержащего мезенхимальные стволовые клетки, предпочтительно стволовые клетки жировой ткани,
б) необязательно изменения условий культивирования, предпочтительно кислородного потенциала, и
в) количественного определения секреции ФСК-1α в супернатанте клеточной культуры.
В одном из частных вариантов осуществления способ оценки чистоты клеточного препарата, содержащего мезенхимальные стволовые клетки, предпочтительно стволовые клетки жировой ткани, включает следующие стадии:
а) культивирования клеточного препарата, содержащего мезенхимальные стволовые клетки, предпочтительно стволовые клетки жировой ткани,
б) необязательно изменения условий культивирования, предпочтительно кислородного потенциала и
в) количественного определения секреции ФСК-1α и ФРСЭ в супернатанте клеточной культуры.
В одном из вариантов осуществления способ согласно изобретению дополнительно включает стадию сравнения измеренного уровня экспрессии с контрольным уровнем.
Используемый термин "контроль" в широком смысле охватывает любой применимый контрольный уровень экспрессии, который может использоваться в качестве основы для сравнения с измеренным уровнем экспрессии.
В одном из вариантов осуществления контролем является собой чистый препарат фибробластов. Используемый термин "чистый препарат фибробластов", например, композиция, содержащая фибробласты, означает препарат, который, как известно, не содержит клетки любых других типов помимо фибробластов. В одном из вариантов осуществления чистый препарат фибробластов культивируют в тех же условиях, что и клеточный препарат, содержащий МСК.
В одном из вариантов осуществления клеточный препарат, содержащий МСК, является преимущественно чистым, когда он имеет значительно более низкий уровень экспрессии ФСК-1α, чем у препарата чистых фибробластов. Используемый термин "значительно более низкий" означает, по меньшей мере, в 1,5 раза более низкий, предпочтительно, по меньшей мере, в 2, 3 или 4 раза более низкий, более предпочтительно, по меньшей мере, в 5, 6, 7 или 8 раз более низкий.
В другом варианте осуществления изобретения клеточный препарат, содержащий МСК, является преимущественно чистым, когда он имеет значительно более высокий уровень экспрессии ФРСЭ, чем чистый препарат фибробластов. Используемый термин "значительно более высокий" означает, по меньшей мере, в 1,5 раза более высокий, предпочтительно, по меньшей мере, в 2 раза более высокий, более предпочтительно, по меньшей мере, в 2,1, 2,2, 2,3, 2,4 или 2,5 более высокий.
В другом варианте осуществления клеточный препарат, содержащий МСК, является преимущественно чистым, когда он имеет значительно более низкий уровень экспрессии ФСК-1α, чем чистый препарат фибробластов, и значительно более высокий уровень экспрессии ФРСЭ, чем чистый препарат фибробластов.
В другом варианте контрольным образцом является чистый препарат мезенхимальных стволовых клеток. Используемый термин "чистый препарат мезенхимальных стволовых клеток", например, композиция, содержащая мезенхимальные стволовые клетки, означает препарат, который, как известно, не содержит фибробластов. В одном из вариантов осуществления чистый препарат мезенхимальных стволовых клеток культивируют в тех же условиях, что и тестируемый клеточный препарат, содержащий МСК.
В одном из вариантов осуществления клеточный препарат, содержащий МСК, является преимущественно чистым, когда он имеет уровень экспрессии ФСК-1α, по меньшей мере, 80%, предпочтительно, по меньшей мере, 85%, более предпочтительно, по меньшей мере, 90%, 95%, 96% 97%, 98%, 99% или 100% уровня экспрессии ФСК-1α у чистого препарата МСК.
В одном из частных вариантов осуществления клеточный препарат, содержащий МСК, является полностью чистым, то есть без какого-либо загрязнения фибробластами, когда уровень экспрессии ФСК-1α у препарата, содержащего МСК, и у чистого препарата МСК являются одинаковыми.
В другом варианте осуществления клеточный препарат, содержащий МСК, является преимущественно чистым, когда уровень экспрессии ФРСЭ у клеточного препарата, содержащего МСК, составляет, по меньшей мере, 80%, предпочтительно, по меньшей мере, 85%, более предпочтительно, по меньшей мере, 90%, 95%, 96%, 97%, 98%, 99% или 100% уровня экспрессии ФРСЭ у чистого препарата МСК.
В одном из частных вариантов осуществления клеточный препарат, содержащий МСК, является полностью чистым, то есть без какого-либо загрязнения фибробластами, когда уровень экспрессии ФРСЭ у клеточного препарата, содержащего МСК, и у чистого препарата МСК являются одинаковыми.
В другом варианте осуществления изобретения клеточный препарат, содержащий МСК, является преимущественно чистым, когда уровень экспрессии ФСК-1α у клеточного препарата, содержащего МСК, составляет, по меньшей мере, 80%, предпочтительно, по меньшей мере, 85%, более предпочтительно, по меньшей мере, 90%, 95%, 96% 97%, 98%, 99% или 100% уровня экспрессии ФСК-1α у чистого препарата МСК, и когда уровень экспрессии ФРСЭ у клеточного препарата, содержащего МСК, составляет, по меньшей мере, 80%, предпочтительно, по меньшей мере, 85%, более предпочтительно на не менее 90%, 95%, 96%, 97%, 98%, 99% или 100% уровня экспрессии ФРСЭ у чистого препарата МСК.
В одном из вариантов осуществления изобретения способ включает следующие стадии:
а) культивирования клеточного препарата, содержащего мезенхимальные стволовые клетки,
б) необязательно изменения условий культивирования,
в) количественного определения уровня экспрессии, по меньшей мере, одного фактора роста, предпочтительно ФСК-1α и/или ФРСЭ, и
г) сравнения уровня экспрессии, измеренной на стадии (в), с контрольным уровнем экспрессии.
В одном из предпочтительных вариантов осуществления способ оценки чистоты клеточного препарата, содержащего мезенхимальные стволовые клетки, предпочтительно стволовые клетки жировой ткани, включает следующие стадии:
а) культивирования клеточного препарата, содержащего мезенхимальные стволовые клетки, предпочтительно стволовые клетки жировой ткани,
б) необязательно изменения условий культивирования, предпочтительно кислородного потенциала,
в) количественного определения уровня экспрессии ФСК-1α и/или ФРСЭ и
г) сравнения уровня экспрессии, измеренного на стадии (в), с уровнями экспрессии ФСК-1α и/или ФРСЭ у контрольной популяции клеток, культивируемых в тех же условиях, что и МСК.
В одном из частных вариантов осуществления способ оценки чистоты клеточного препарата, содержащего мезенхимальные стволовые клетки, предпочтительно стволовые клетки жировой ткани, включает следующие стадии:
а) культивирования клеточного препарата, содержащего мезенхимальные стволовые клетки, предпочтительно стволовые клетки жировой ткани,
б) необязательно изменения условий культивирования, предпочтительно кислородного потенциала,
в) количественного определения уровня экспрессии ФСК-1α и ФРСЭ и
г) сравнение уровня экспрессии, измеренного на стадии (в), с уровнями экспрессии ФСК-1α и ФРСЭ у контрольной популяции клеток, культивируемых в тех же условиях, что и МСК.
Изобретение также относится к популяции клеток, идентифицированной описанным выше способом согласно изобретению.
В одном из вариантов осуществления оценивают чистоту идентифицированной таким способом популяции клеток с точки зрения загрязнения фибробластами.
В одном из вариантов осуществления идентифицированная таким способом клеточная популяция является преимущественно чистой, т.е. содержит менее 25% фибробластов, предпочтительно менее 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12 или 11% фибробластов. В одном из вариантов осуществления изобретения идентифицированный таким способом клеточный препарат, содержит менее 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1% фибробластов.
В одном из вариантов осуществления идентифицированная клеточная популяция имеет уровень экспрессии ФСК-1α не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл.
В одном из вариантов осуществления идентифицированная таким способом клеточная популяция имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл, когда клеточный препарат, содержащий МСК, культивируют при содержании О2 около 21%.
Согласно другому варианту идентифицированная таким способом клеточная популяция имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл, когда клеточный препарат, содержащий МСК, культивируют при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5%.
Согласно другому варианту идентифицированная таким способом клеточная популяция имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл, когда клеточный препарат, содержащий МСК, культивируют в условиях гипоксии, предпочтительно при содержании О2 около 0,1%.
В одном из вариантов осуществления идентифицированная таким способом клеточная популяция имеет уровень экспрессии ФСК-1α не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл, когда клеточный препарат, содержащий МСК, культивируют при низкой концентрации глюкозы, предпочтительно около 1 г/л.
Согласно другому варианту идентифицированная таким способом клеточная популяция имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 10 пг/мл, когда клеточный препарат, содержащий МСК, культивируют при высокой концентрации глюкозы, предпочтительно около 4,5 г/л.
В одном из вариантов осуществления идентифицированная таким способом клеточная популяция имеет уровень экспрессии ФСК-1α не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл, когда клеточный препарат, содержащий МСК, культивируют при содержании О2 около 21% и при низкой концентрации глюкозы, предпочтительно около 1 г/л.
В другом варианте осуществления идентифицированная таким способом клеточная популяция имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл, когда клеточный препарат, содержащий МСК, культивируют при содержании О2 около 21% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л.
В одном из вариантов осуществления идентифицированная таким способом клеточная популяция имеет уровень экспрессии ФСК-1α не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл, когда клеточный препарат, содержащий МСК, культивируют при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при низкой концентрации глюкозы, предпочтительно около 1 г/л.
В другом варианте осуществления идентифицированная таким способом клеточная популяция имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл, когда клеточный препарат, содержащий МСК, культивируют при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л.
В одном из вариантов осуществления идентифицированная таким способом клеточная популяция имеет уровень экспрессии ФСК-1α не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл, когда клеточный препарат, содержащий МСК, культивируют в условиях гипоксии, предпочтительно при содержании О2 около 0,1% и при низкой концентрации глюкозы, предпочтительно около 1 г/л.
В другом варианте осуществления идентифицированная таким способом клеточная популяция имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл, когда клеточный препарат, содержащий МСК, культивируют в условиях гипоксии, предпочтительно при содержании О2 около 0,1% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л.
В одном из вариантов осуществления идентифицированная таким способом клеточная популяция имеет уровень экспрессии ФРСЭ, по меньшей мере, 200 пг/мл, предпочтительно, по меньшей мере, 250, 260, 270, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289 или 290 пг/мл, когда клеточный препарат, содержащий МСК, культивируют в условиях гипоксии, предпочтительно при содержании О2 около 0,1% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л.
В другом варианте осуществления идентифицированная таким способом клеточная популяция имеет уровень экспрессии ФРСЭ, по меньшей мере, 90 пг/мл, предпочтительно, по меньшей мере, 95, 100, 105, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119 или 120 мкг/мл, когда клеточный препарат, содержащий МСК, культивируют при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л.
Согласно другому варианту идентифицированная таким способом клеточная популяция имеет уровень экспрессии ФРСЭ, по меньшей мере, 160 пг/мл, предпочтительно, по меньшей мере, 161, 162, 163, 164, 165, 166, 167, 168 или 169 пг/мл, более предпочтительно, по меньшей мере, 170 пг/мл, когда клеточный препарат, содержащий МСК, культивируют при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при низкой концентрации глюкозы, предпочтительно около 1 г/л.
В одном из вариантов осуществления идентифицированная таким способом клеточная имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл и уровень экспрессии ФРСЭ, по меньшей мере, 200 пг/мл, предпочтительно, по меньшей мере, 250, 206, 270, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289 или 290 пг/мл, когда клеточный препарат, содержащий МСК, культивируют в условиях гипоксии, предпочтительно при содержании О2 около 0,1% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л.
В другом варианте осуществления идентифицированная таким способом клеточная популяция имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25,20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл; и уровень экспрессии ФРСЭ, по меньшей мере, 90 пг/мл, предпочтительно, по меньшей мере, 95, 100, 105, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119 или 120 мкг/мл, когда клеточный препарат, содержащий МСК, культивируют при содержании О2 5% и высокой концентрации глюкозы, предпочтительно около 4,5 г/л.
В другом варианте осуществления идентифицированный таким способом клеточный препарат имеет уровень экспрессии ФСК-1α не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл и уровень экспрессии ФРСЭ, по меньшей мере, 160 пг/мл, предпочтительно, по меньшей мере, 161, 162, 163, 164, 165, 166, 167, 168 или 169 пг/мл, более предпочтительно, по меньшей мере, 170 пг/мл, когда клеточный препарат, содержащий МСК, культивируют при содержании О2 5% и при низкой концентрации глюкозы, предпочтительно около 1 г/л глюкозы.
Другой задачей изобретения является получение преимущественно чистой популяции мезенхимальных стволовых клеток, предпочтительно популяции стволовых клеток жировой ткани.
В одном из вариантов осуществления преимущественно чистая клеточная популяция согласно изобретению содержит менее 25% фибробластов, предпочтительно менее 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12 или 11% фибробластов. В одном из вариантов осуществления клеточный препарат согласно изобретению содержит менее 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1% фибробластов.
В одном из вариантов осуществления преимущественно чистая клеточная популяция согласно изобретению имеет уровень экспрессии ФСК-1α не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл.
В одном из вариантов осуществления преимущественно чистая клеточная популяция согласно изобретению имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл при культивировании при содержании О2 около 21%.
Согласно другому варианту осуществления преимущественно чистая клеточная популяция согласно изобретению имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл при культивировании при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5%.
Согласно другому варианту осуществления преимущественно чистая клеточная популяция согласно изобретению имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл при культивировании в условиях гипоксии, предпочтительно при содержании О2 около 0,1%.
В одном из вариантов осуществления преимущественно чистая клеточная популяция согласно изобретению имеет уровень экспрессии ФСК-1α не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл при культивировании при низкой концентрации глюкозы, предпочтительно около 1 г/л.
Согласно другому варианту осуществления преимущественно чистая клеточная популяция согласно изобретению имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл при культивировании при высокой концентрации глюкозы, предпочтительно около 4,5 г/л.
В одном из вариантов осуществления преимущественно чистая клеточная популяция согласно изобретению имеет уровень экспрессии ФСК-1α не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл при культивировании при содержании О2 около 21% и при низкой концентрации глюкозы, предпочтительно около 1 г/л.
В другом варианте осуществления преимущественно чистая клеточная популяция согласно изобретению имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл при культивировании при содержании О2 около 21% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л.
В одном из вариантов осуществления преимущественно чистая клеточная популяция согласно изобретению имеет уровень экспрессии ФСК-1α не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл при культивировании при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при низкой концентрации глюкозы, предпочтительно около 1 г/л.
В другом варианте осуществления преимущественно чистая клеточная популяция согласно изобретению имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл при культивировании при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л.
В одном из вариантов осуществления преимущественно чистая клеточная популяция согласно изобретению имеет уровень экспрессии ФСК-1α не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл при культивировании в условиях гипоксии, предпочтительно при содержании О2 около 0,1%, и при низкой концентрации глюкозы, предпочтительно около 1 г/л.
В другом варианте осуществления преимущественно чистая клеточная популяция согласно изобретению имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл при культивировании в условиях гипоксии, предпочтительно при содержании О2 около 0,1% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л.
В одном из вариантов осуществления преимущественно чистая клеточная популяция согласно изобретению имеет уровень экспрессии ФРСЭ, по меньшей мере, 200 пг/мл, предпочтительно, по меньшей мере, 250, 260, 270, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289 или 290 пг/мл при культивировании в условиях гипоксии, предпочтительно при содержании О2 около 0,1% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л.
Согласно другому варианту осуществления преимущественно чистая клеточная популяция согласно изобретению имеет уровень экспрессии ФРСЭ, по меньшей мере, из 90 пг/мл, предпочтительно, по меньшей мере, 95, 100, 105, 110, 111,112, 113, 114, 115, 116, 117, 118, 119 или 120 пг/мл при культивировании при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л.
Согласно другому варианту осуществления преимущественно чистая клеточная популяция согласно изобретению имеет уровень экспрессии ФРСЭ, по меньшей мере, 160 пг/мл, предпочтительно, по меньшей мере, 161, 162, 163, 164, 165, 166, 167, 168 или 169 пг/мл, более предпочтительно, по меньшей мере, 170 пг/мл при культивировании при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при низкой концентрации глюкозы, предпочтительно около 1 г/л.
В одном из вариантов осуществления преимущественно чистая клеточная популяция по настоящему изобретению имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл; и уровень экспрессии ФРСЭ, по меньшей мере, 200 пг/мл, предпочтительно, по меньшей мере, 250, 206, 270, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289 или 290 пг/мл при культивировании в условиях гипоксии, предпочтительно при содержании О2 около 0,1% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л.
В другом варианте осуществления преимущественно чистая клеточная популяция согласно настоящему изобретению имеет уровень экспрессии ФСК-1α не более 50 пг/мл, предпочтительно не более 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл и уровень экспрессии ФРСЭ, по меньшей мере, 90 пг/мл, предпочтительно, по меньшей мере, 95, 100, 105, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119 или 120 пг/мл при культивировании при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при высокой концентрации глюкозы, предпочтительно при около 4,5 г/л.
В другом варианте осуществления преимущественно чистая клеточная популяция согласно изобретению имеет уровень экспрессии ФСК-1α не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл и уровень экспрессии ФРСЭ, по меньшей мере, 160 пг/мл, предпочтительно, по меньшей мере, 161, 162, 163, 164, 165, 166, 167, 168 или 169 пг/мл, более предпочтительно, по меньшей мере, 170 пг/мл при культивировании при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при низкой концентрации глюкозы, предпочтительно около 1 г/л.
Другой задачей изобретения является создание набора для реализации способа согласно изобретению, содержащего средство определения или измерения уровня экспрессии, по меньшей мере, одного фактора роста препарата мезенхимальных стволовых клеток (МСК), предпочтительно ФСК-1α и/или ФРСЭ.
В одном из вариантов осуществления оценивают уровень экспрессии, по меньшей мере, одного фактора роста на уровне белка, при этом набор согласно изобретению может содержать средство обнаружения, по меньшей мере, одного фактора роста, предпочтительно ФСК-1α и/или ФРСЭ. В одном из вариантов осуществления средством обнаружения, по меньшей мере, одного фактора роста является антитело, специфичное в отношении упомянутого, по меньшей мере, одного фактора роста, предпочтительно ФСК-1α и/или ФРСЭ. В одном из вариантов осуществления набор согласно изобретению может также содержать средство определения уровня экспрессии, по меньшей мере, одного нормализующего белка.
В другом варианте осуществления оценивают уровень экспрессии, по меньшей мере, одного фактора роста на уровне РНК, при этом набор согласно изобретению может содержать средство экстракции суммарной РНК, средство обратной транскрипции суммарной РНК и средство количественной оценки экспрессии, по меньшей мере, одного фактора роста, предпочтительно ФРСЭ и/или ФСК-1α у РНК. В одном из вариантов осуществления средством количественной оценки экспрессии, по меньшей мере, одного фактора роста, предпочтительно ФСК-1α и/или ФРСЭ у РНК являются праймеры ПЦР или количественной ПЦР, специфичные в отношении упомянутого фактора роста, предпочтительно ФСК-1α и/или ФРСЭ. В одном из вариантов осуществления набор также содержит реагенты для проведения количественной ПЦР (такие как, например, буферы, фермент и т.п.). В одном из вариантов осуществления набор согласно изобретению может также содержать средство определения уровня экспрессии, по меньшей мере, одного гена нормализации на уровне РНК.
В одном из вариантов осуществления набор согласно изобретению дополнительно содержит контроль для сравнения измеренного уровня экспрессии, по меньшей мере, одного фактора роста.
В одном из вариантов осуществления набор согласно изобретению дополнительно содержит чистый препарат фибробластов. В другом варианте осуществления набор согласно изобретению дополнительно содержит чистый препарат МСК.
В одном из вариантов осуществления набор согласно изобретению содержит супернатант чистого препарата фибробластов. В другом варианте осуществления набор согласно изобретению содержит супернатант чистого препарата МСК. В другом варианте осуществления набор согласно изобретению имеет определенный диапазон разведений супернатанта чистого препарата МСК и супернатанта чистого препарата фибробластов. Одним из примеров диапазона разведений является без ограничения 100/0, 75/25, 50/50, 25/75, 0/100.
Настоящее изобретение также относится к фактору роста, предпочтительно ФСК-1α и/или ФРСЭ как биомаркера качества или чистоты содержащего МСК клеточного препарата, в частности содержащего МСК клеточного препарата для применения в качестве продукта клеточной терапии на основе МСК в регенеративной медицине.
В одном из частных вариантов осуществления изобретение относится к фактору роста, предпочтительно ФСК-1α и/или ФРСЭ как биомаркеру качества или чистоты препарата СКЖТ.
Краткое описание чертежей
На Фиг. 1 изображена фотография, иллюстрирующая СКЖТ и КФ в пролиферативной среде (А) и в среде остеогенной дифференцировки (В).
На Фиг. 2 показан график, иллюстрирующий пролиферацию клеток СКЖТ и КФ в соответствии с числом пассажей.
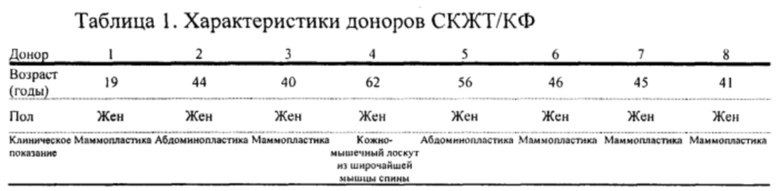
На Фиг. 3 показана гистограмма, иллюстрирующая выживаемость клеток СКЖТ и КФ в пролиферативной среде без FBS при содержании О2 0,1% или 5%.
На Фиг. 4 показан набор гистограмм, иллюстрирующих секрецию фактора роста кератиноцитов (ФРК) (А), основного фактора роста фибробластов (оФРФ) (В), ИФР-1 (С) и фактора роста гепатоцитов (ФРГ) (D) при пяти различных разведениях СКЖТ/КФ в пролиферативной среде при концентрации глюкозы 4,5 г/л и содержании О2 0,1% или 5%.
На Фиг. 5 показан набор гистограмм, иллюстрирующих секрецию ФРСЭ (А) и ФСК-1α (В) при 5 различных разведениях СКЖТ/КФ в пролиферативной среде при концентрации глюкозы 4,5 г/л и содержании О2 0,1%.
На Фиг. 6 показан набор гистограмм, иллюстрирующих секрецию ФРСЭ (А) и ФСК-1α (В) при 5 различных разведениях СКЖТ/КФ в пролиферативной среде при концентрации глюкозы 4,5 г/л и содержании О2 5%.
На Фиг. 7 показана гистограмма, иллюстрирующая секрецию ФСК-1α при 5 различных разведениях СКЖТ/КФ в пролиферативной среде при концентрации глюкозы 4,5 г/л и содержании О2 21%.
На Фиг. 8 показан набор гистограмм, иллюстрирующих секрецию ФРСЭ (А) и ФСК-1α (В) при 5 различных разведениях СКЖТ/КФ в пролиферативной среде при концентрации глюкозы 1 г/л и содержании О2 0,1%.
На Фиг. 9 показан набор гистограмм, иллюстрирующих секрецию ФРСЭ (А) и ФСК-1α (В) при 5 различных разведениях СКЖТ/КФ в пролиферативной среде при концентрации глюкозы 1 г/л и содержании О2 5%.
На Фиг. 10 показана гистограмма, иллюстрирующая секрецию ФСК-1α при 5 различных разведениях СКЖТ/КФ в пролиферативной среде при концентрации глюкозы 1 г/л и содержании О2 21%.
Примеры
Настоящее изобретение дополнительно проиллюстрировано следующими примерами.
Пример 1.
Материалы и методы
Это исследование проводилось в соответствии с рекомендациями Министерства здравоохранения Бельгии. Все процедуры закупок тканей и клинического исследования (В40320108280) были одобрены Комитетом по этике медицинского факультета Католического университета Лувена. Все материалы были получены от компаний Lonza (Вервье, Швейцария), Sigma-Aldrich (Сент-Луис, штат Миссури, США) или Invitrogen (Карлсбад, штат Калифорния, США), если не указано иное.
Выделение и культивирование СКЖТ и КФ
Осуществили комбинированный сбор жировых (в среднем: 7,4 г) и кожных (в среднем 1,5 см2) тканей у 8 пациентов (Таблица 1), подвергающихся рекомендуемой пластической хирургии, после информированного согласия и серологического скрининга, путем липоаспирации методом Коулмана и биопсии кожи, соответственно. Выдержали образцы жировой ткани и кожи в стерильных условиях в течение максимум 60 минут при 4°С перед выделением стволовых клеток жировой ткани (СКЖТ) и кожных фибробластов (КФ).
Расщепили жировую ткань коллагеназой (1/2 в отношении веса к объему) на водяной бане при 37°С в течение 60 минут. Инактивировали коллагеназу в модифицированной по способу Дульбекко среде Игла (DMEM), дополненной 10% фетальной бычьей сывороткой. Центрифугировали собранную ткань со скоростью 1500 об/мин в течение 10 минут при комнатной температуре. Суспендировали капли осадка в пролиферативной среде, состоящей из DMEM, дополненной 10%) фетальной бычьей сывороткой, L-глутамином (2 мМ) и антибиотиками (100 ед/мл пенициллина, 100 мкг/мл стрептомицина и 1 мкл/мл амфотерицина В), и отфильтровали через сито с размером ячеек 500 мкм. Затем высеяли собранную суспензию в колбы размером 25 см2 с пролиферативной средой.
Выделили КФ путем экстрагирования из лишенных эпидермиса биопсий кожи, измельчили на фрагменты 2 мм × 2 мм и поместили в пластмассовую лунку. Добавили небольшой объем пролиферативной среды во избежание отсоединения от поверхности пластмассы.
После 24-х часовой инкубации при 37°С и содержании СО2 5% заменили пролиферативную среду. Этот первичный пассаж исходных клеток называется нулевым пассажем. Извлекли куски кожи из чашки для культивирования, когда на поверхности пластмассы, окружавшей фрагменты ткани, были видны сцепленные клетки. Сохраняли клетки в пролиферативной среде (которую заменяли 2 раза в неделю) вплоть до 4-го пассажа после последовательных трипсинизаций. Культивировали клетки от 3 доноров вплоть до 15-го пассажа с целью изучения профиля пролиферации в стандартных условиях культивирования (37°С, 21% О2, 5% СО2, 4,5 г/л глюкозы).
Характеристика профилей мембранных маркеров
В 4-м пассаже определили характеристики стандартных маркеров клеточной поверхности для СКЖТ и КФ (CD44, CD45, CD73, CD90, CD 105, stro-1, CD106, CD146, CD166, CD19, CD31, CD11b, CD79α, CD13, HLA-DR, CD14, CD34) [Dominici и др., Cytotherapy. 2006; 8 (4): 315-331; Bourin и др. Cytotherapy. 2013; 15: 641-648] путем клеточной сортировки с возбуждением флуоресценции (FACScan, BD Biosciences, Сан-Хосе, штат Калифорния).
Окрасили СКЖТ насыщающими количествами моноклональных антител: к Stro-1, к CD90, к CD106, к CD105, к CD146, к CD166, к CD44, к CD19, к CD45 (Human Mesenchymal Stem Cell panel, R&D System, Миннеаполис, штат Миннесота, США), к CD44 (окрашенных РЕ моноклональных мышиных антител к CD44 человека, BD Bioscience, Франклин-Лейкс, штат Нью-Джерси, США), к CD73 (окрашенных FITC моноклональных мышиных антител к CD73 человека, BD Bioscience), к CD31 (окрашенных FITC моноклональных мышиных антител к CD31 человека, Abсam, Кембридж, Великобритания), к CD11b (окрашенных FITC моноклональных мышиных антител к CD11b человека, Abсam, Кембридж, Великобритания), к CD79a (окрашенных РЕ моноклональных мышиных антител к CD79α человека, Abсam, Кембридж, Великобритания), к CD13 (окрашенных FITC моноклональных мышиных антител к человека, Abсam, Кембридж, Великобритания), к HLA-DR (окрашенных FITC моноклональных мышиных антител к HLA-DR человека, Abсam, Кембридж, Великобритания), к CD14 (окрашенных FITC моноклональных мышиных антител к CD14 человека, Abсam, Кембридж, Великобритания), к CD34 (окрашенных РЕ моноклональных мышиных антител к CD34 человека, Abсam, Кембридж, Великобритания). Проанализировали, по меньшей мере, 10000 отобранных событий методом проточной цитометрии с помощью программного обеспечения CellquestPro. Результаты отображены как средняя интенсивность флуоресценции (MFI) в процентах клеток с положительной реакцией (порог: 95% изотипа).
Способность к дифференцировке.
Испытали 4-й пассаж СКЖТ и КФ в определенных средах, чтобы оценить способность к дифференцировке в остеогенном направлении. Оценили дифференцировку по окрашиванию ализариновым красным после культивирования клеток в течение 3 недель в среде для специфической дифференцировки (пролиферативной среде, дополненной дексаметазоном (1 мкМ), аскорбатом натрия (50 мкг/мл) и дигидрофосфатом натрия (36 мг/мл) [Qu и др., In Vitro Cell Dev Biol Anim. 2007; 43:95-100]. Подтвердили остеогенную дифференцировку окрашиванием фосфата кальция ализариновым красным после фиксации в формалине. Кроме того, для подтверждения костного фенотипа провели иммуногистохимическое исследование на остеокальцин.
Влияние кислородного потенциала и фетальной бычьей сыворотки (ФБС) на пролиферацию клеток: анализ EdU
Испытали способность клеток к пролиферации методом измерения прямого синтеза ДНК путем включения 5-этинил-2'-дезоксиуридина с использованием набора для проточного цитометрического анализа Click-iT® EdU Alexa Fluor® 488 (Life Technology, Уолтем, штат Массачусетс, США). Высеяли СКЖТ (n=3) и КФ (n=3) в чашки для культивирования размером 21,5 см2 с плотностью 5000 клеток/ см2 и культивировали в течение 24 часов в 10% ФБС при содержании О2 21%. Затем прекратили пролиферацию клеток, заменив пролиферативную среду такой же средой ФБС в течение 24 часов. Наконец, поместили клетки на 48 часов в специфические условия с содержанием О2 0,1%, 5% и 21% и добавили пролиферативную среду, дополненную 1% ФБС или 5% ФБС и EdU (5-этинил-2'-дезоксиуридином, нуклеозидным аналогом тимидина, включенным в ДНК при активном синтезе ДНК). После проявления с помощью Alexa Fluor® 488 подсчитали клетки с положительной реакцией методом проточной цитометрии (FACScan, BD Biosciences, Сан-Хосе, штат Калифорния).
Профиль секреции факторов роста
Подсчитали клетки (3-го пассажа) после трипсинизации и получили 5 последовательных разведений: 100% СКЖТ + 0% КФ; 75% СКЖТ + 25% КФ; 50% СКЖТ + 50% КФ; 25% СКЖТ + 75% КФ; и 0% СКЖТ + 100% КФ, которые трижды высеяли на 12-луночные культуральные планшеты при плотности клеток, приводящей к конфлюэнтности от около 80% до 95%, для инкубации в гипоксических камерах (Modular Incubator Chamber MIC-101, Billups-Rothenberg, Дель-Мар, штат Калифорния, США) с содержанием О2 0,1% и 5%, что соответствует среде с высокой степенью гипоксии и тканевому кислородному потенциалу, соответственно. Подвергли клетки (в каждом разведении и при каждом кислородном потенциале) воздействию нормогликемической (1 г/л) или гипергликемической (4,5 г/л) пролиферативной среды. После инкубации в течение 24 часов в этих контролируемых условиях по отдельности собрали супернатанты клеточных культур и хранили при -20°С для дальнейшего определения количества факторов роста (ФРСЭ, ФРГ, ИФР-1, ФСК-1α и основного ФРФ) методом иммуноферментного анализа с ферментной меткой с помощью комплекта Quantikine ELISA, R&D System, Миннеаполис, штат Миннесота, США). Оценили жизнеспособность клеток сразу после гипоксического стресса путем анализа с помощью раствора 3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразолия (MTS; Promega, Лейден, Нидерланды). Осуществили испытания на гипоксический/гликемический стресс и определение количества факторов роста трижды и дважды, соответственно. Результаты представлены в пикограммах на миллиметр.
Статистический анализ
Для оценки нормального распределения значений использовали одновыборочный критерий Колмогорова и графики КК. Проверили статистически значимые различия между группами (с нормальным распределением) парным t-критерием и односторонним дисперсионным анализом с поправкой Бонферрони. Осуществили статистические испытания с помощью программного обеспечения PASW 18 (SPSS, IBM, Нью-Йорк, штат Нью-Йорк, США); значение р<0,05 считалось значимым.
Результаты
Профили поверхностных маркеров не позволяют различать две популяции клеток (Таблица 2).


СКЖТ и КФ имели положительную реакцию (>90 клеток) на маркеры мезенхимальных клеток (CD13, CD44, CD73, CD90, CD105, CD166) и отрицательную реакцию на маркеры эндотелиальных клеток (CD31), маркеры стромальных клеток, полученных из костного мозга (CD106, Stro-1, CD146), маркеры гемопоэтической дифференцировки (CD14, CD45, CD1b, CD34) и HLA-DR, CD79a и CD19. После культивирования в специфических средах дифференцировки (фиг. 13) была продемонстрирована способность к дифференцировке как СКЖТ, так и КФ окрашиванием ализариновым красным и путем иммуногистохимического исследования на остеокальцин.
СКЖТ и КФ имели сходные профили пролиферации до 15-го пассажа (NS на фиг. 14).
Жизнеспособность СКЖТ и КФ существенно не изменилась после 24 часов культивирования при содержании О2 0,1% и 5% без ФБС (Фиг. 15). При содержании О2 5% КФ снизалась по сравнению с СКЖТ (выживаемость СКЖТ 87,04%, р<0,05).
Изучение секреции ФРГ, ИФР-1, оФРФ и ФРК (при содержании O2 0,1% и 5% и концентрации глюкозы 4,5 г/л) из последовательных разведений СКЖТ и КФ не продемонстрировало какой-либо значимой кривой (Фиг. 4).
Однако в случае ФРСЭ и ФСК-1α наблюдались линейные регрессии после того, как СКЖТ были "загрязнены" КФ. Действительно, уровень секреции ФСК-1α снижается с увеличением доли СКЖТ. Этот результат обнаружен в условиях различного кислородного потенциала (21%, 5% или 0,1%) или концентрации глюкозы (1 г/л или 4,5 г/л) (Фиг. 5-10). Кроме того, в условиях культивирования при высокой концентрации глюкозы и содержании О2 0,1% и 5% уровень секреции ФРСЭ повышается с увеличением доли СКЖТ (Фиг. 5А и 6А). Такие же измерения в условиях низкой концентрации глюкозы продемонстрировали значительные линейные регрессии секреции ФРСЭ при содержании O2 5% (Фиг. 8А).
Инвертировали отношения, поскольку более высокие уровни высвобождения ФСК-1α и ФРСЭ КФ с более высокими скоростями достигались у СКЖТ, что позволяло измерять долю клеток (чистоту СКЖТ).
| название | год | авторы | номер документа |
|---|---|---|---|
| АДГЕЗИВНЫЕ КЛЕТКИ ЖИРОВОЙ ТКАНИ ИЛИ ПЛАЦЕНТЫ И ИХ ИСПОЛЬЗОВАНИЕ В ЛЕЧЕБНЫХ ЦЕЛЯХ | 2008 |
|
RU2709780C2 |
| КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИЧЕСКОГО ИЛИ ТЕРАПЕВТИЧЕСКОГО ЛЕЧЕНИЯ СОСТОЯНИЙ, СВЯЗАННЫХ С ИЗМЕНЕНИЕМ КОЛИЧЕСТВА ВОЛОС | 2018 |
|
RU2716159C2 |
| Способ лечения обморожений с использованием мезенхимальных стволовых клеток, выделенных из красного костного мозга | 2020 |
|
RU2748539C1 |
| Способ получения и ведения мезенхимальных стволовых клеток из костного материала млекопитающих | 2023 |
|
RU2821926C1 |
| МЕЗЕНХИМАЛЬНЫЕ СТРОМАЛЬНЫЕ КЛЕТКИ И СПОСОБЫ ПОЛУЧЕНИЯ МЕЗЕНХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК ИЗ ПУПОВИНЫ | 2018 |
|
RU2793467C2 |
| МАТЕРИАЛ СТВОЛОВЫХ КЛЕТОК И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2785588C2 |
| КОМПОЗИЦИИ СТВОЛОВЫХ КЛЕТОК И СПОСОБЫ ПОЛУЧЕНИЯ СТВОЛОВЫХ КЛЕТОК ДЛЯ ПРИМЕНЕНИЯ В ТЕРАПИИ | 2015 |
|
RU2714236C2 |
| СПОСОБ ПОЛУЧЕНИЯ СЕКРЕТОМА МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК, СОДЕРЖАЩЕГО ФРАКЦИЮ ЭКЗОСОМ | 2023 |
|
RU2827355C1 |
| СПОСОБ ПОВЫШЕНИЯ АНГИОГЕННОЙ АКТИВНОСТИ СТРОМАЛЬНЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ | 2011 |
|
RU2531502C2 |
| КОСМЕТИЧЕСКОЕ СРЕДСТВО НА ОСНОВЕ ПРОДУКТОВ СЕКРЕЦИИ МЕЗЕНХИМНЫХ СТВОЛОВЫХ/СТРОМАЛЬНЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ ЧЕЛОВЕКА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2016 |
|
RU2620342C1 |

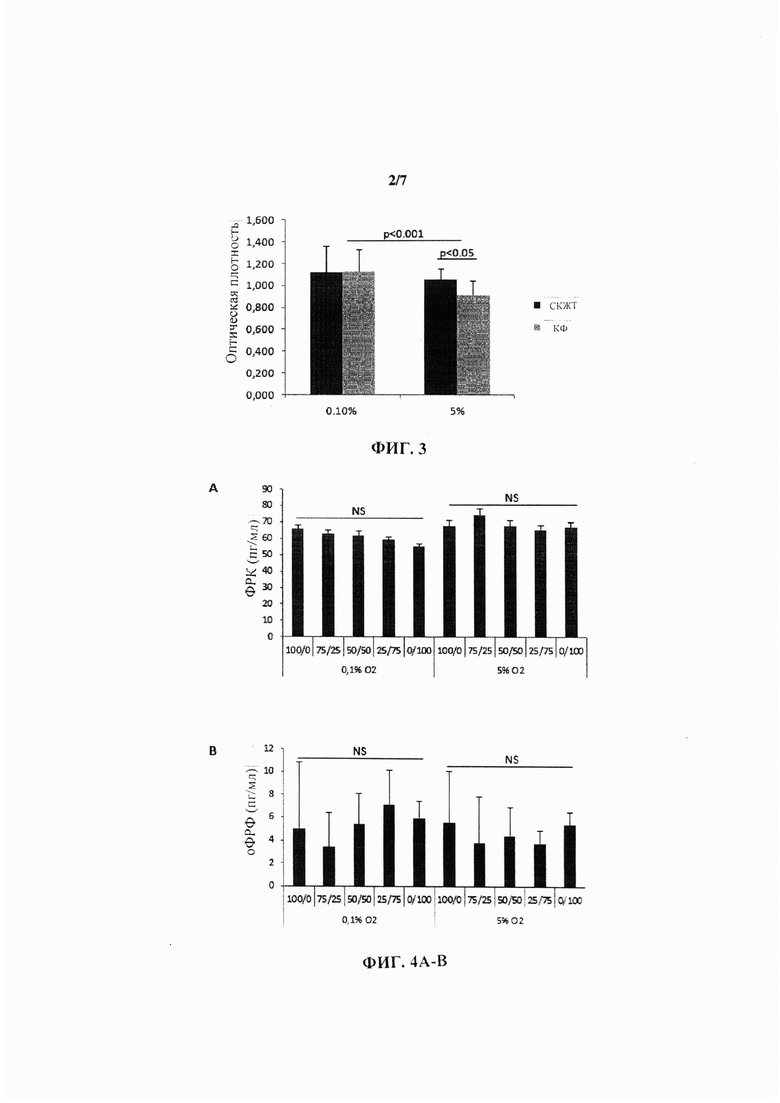
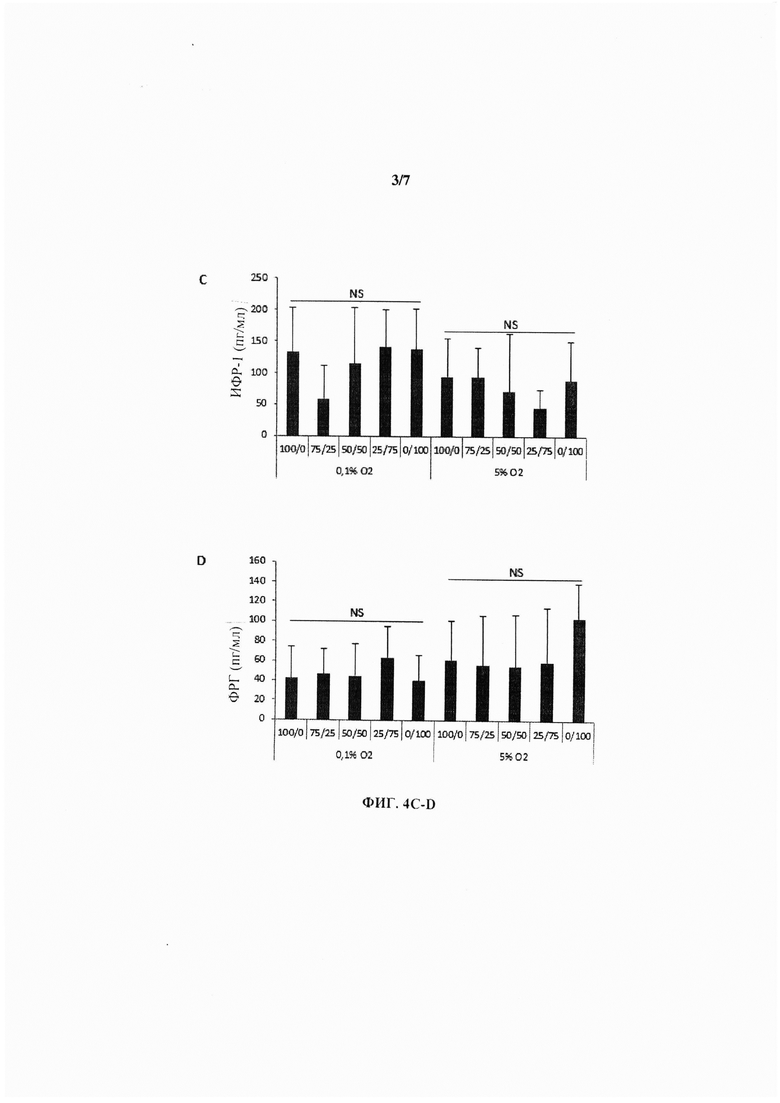
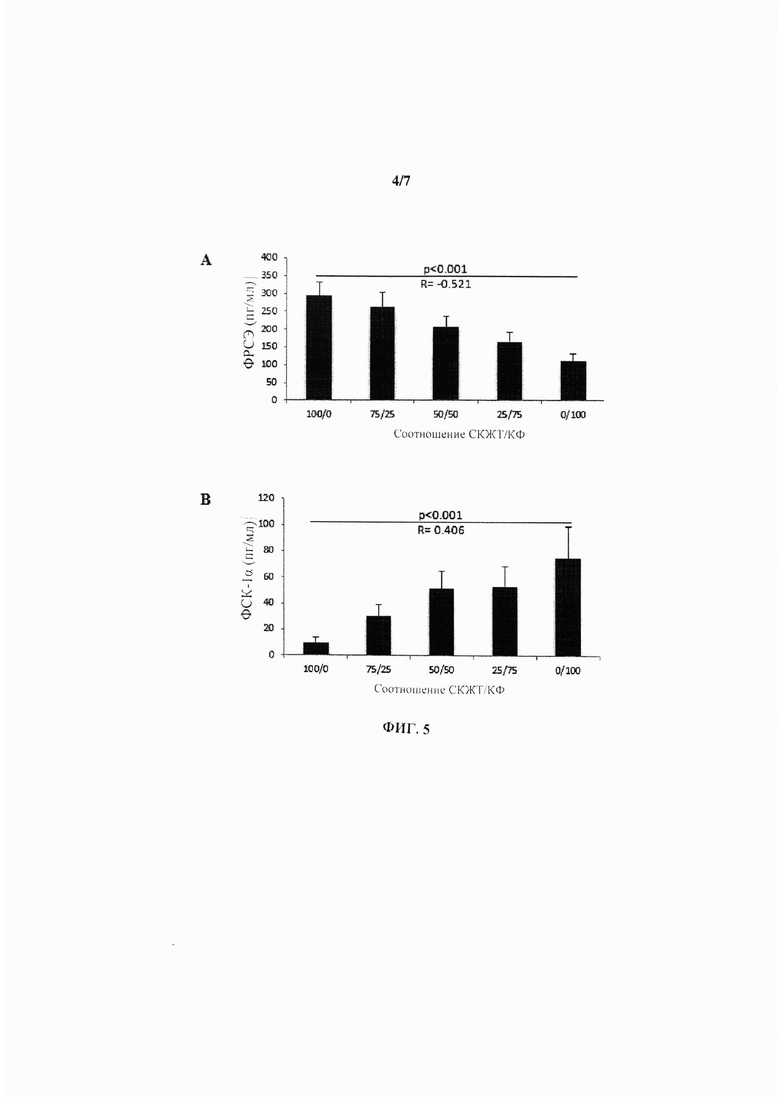
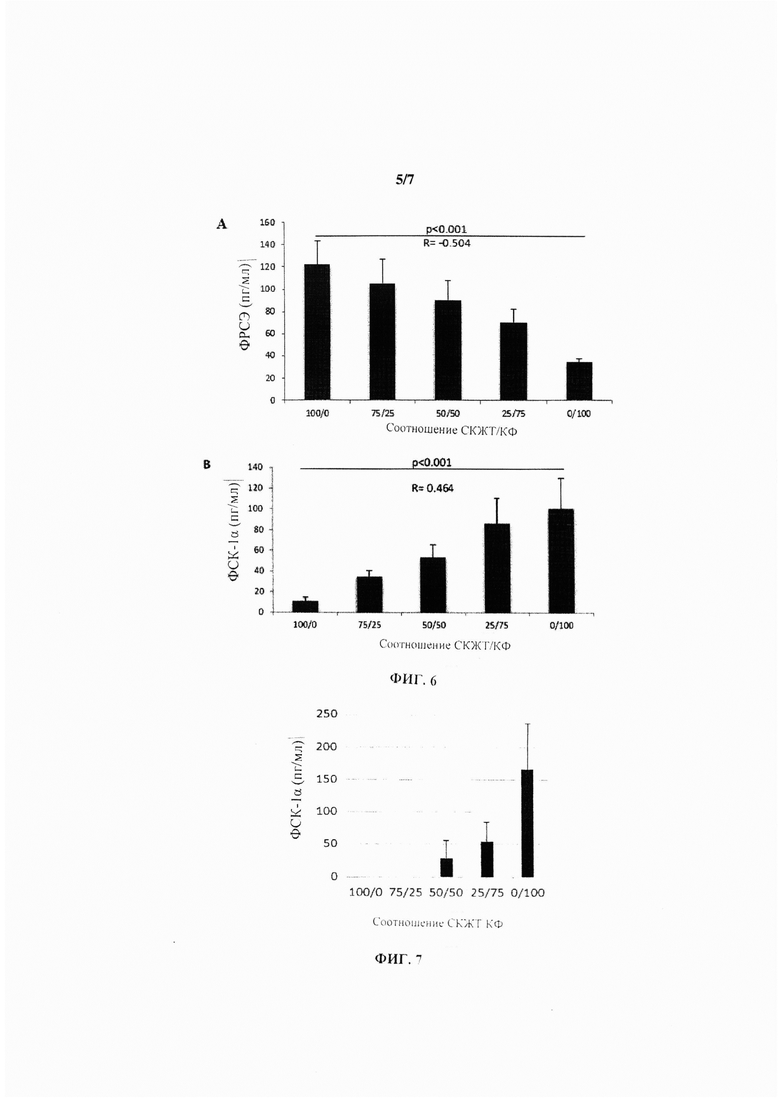
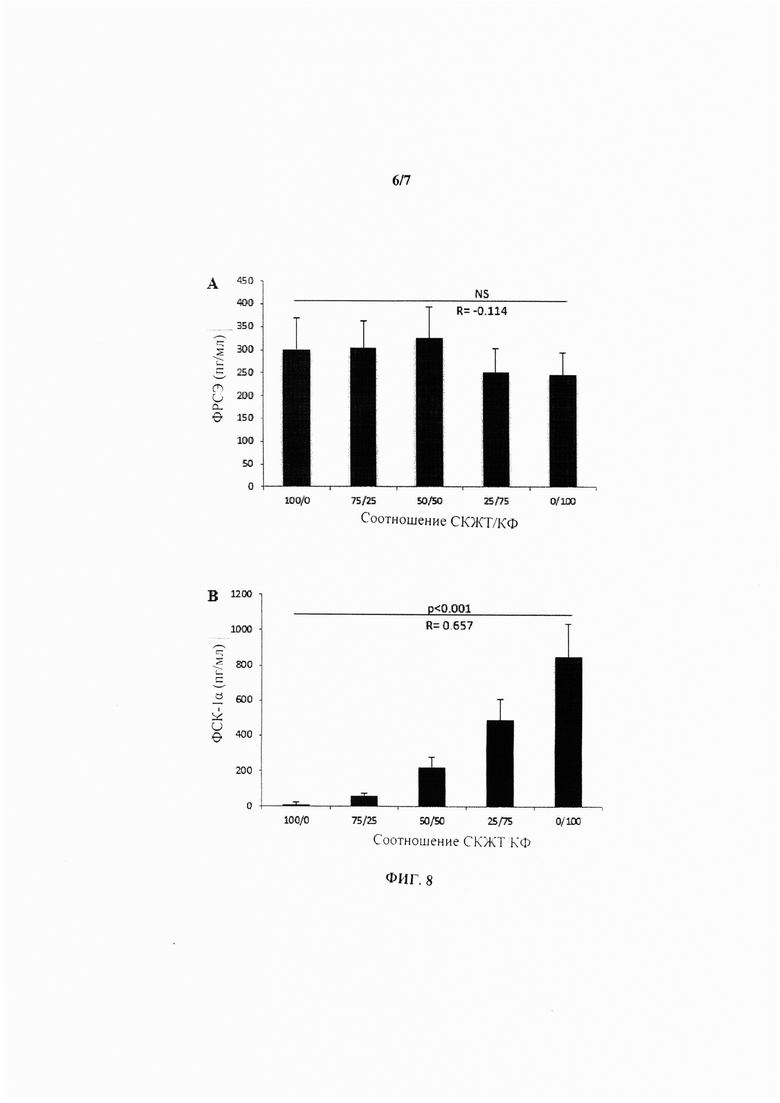
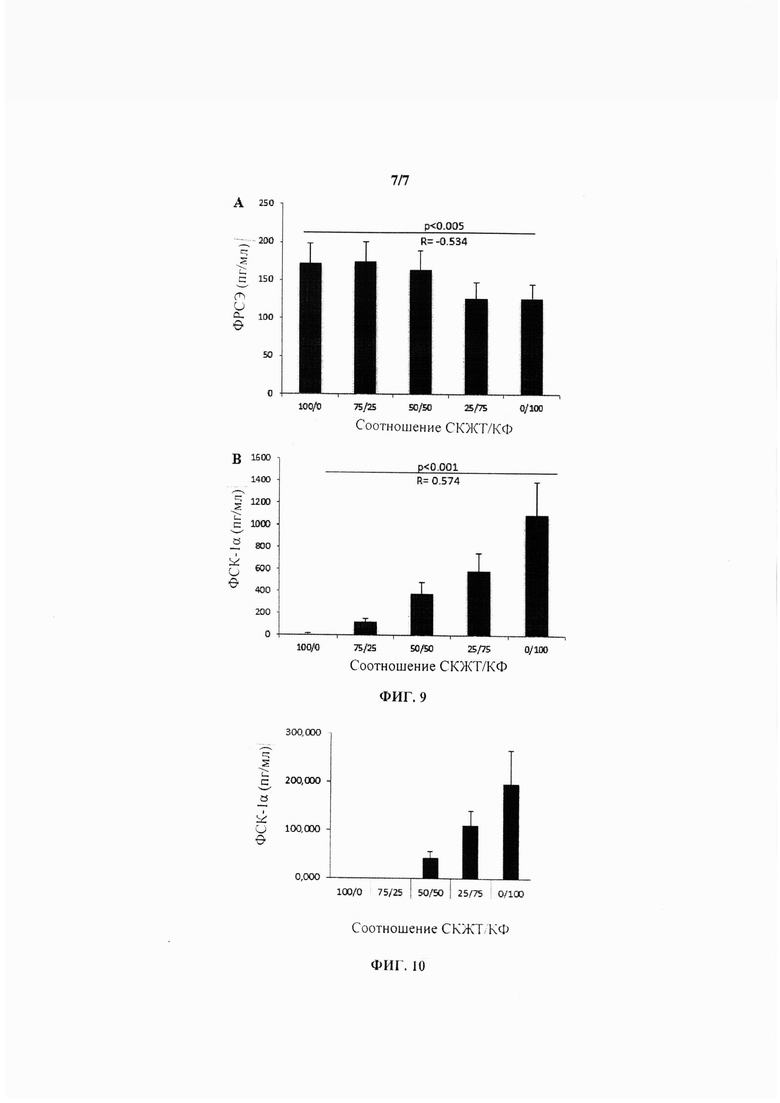
Изобретение относится к области биотехнологии, а именно к in vitro определению и мониторингу чистоты клеточного препарата, содержащего мезенхимальные стволовые клетки (МСК), а также к набору для in vitro определения и мониторинга чистоты клеточного препарата, содержащего МСК. Способ включает измерение уровня экспрессии упомянутым клеточным препаратом по меньшей мере одного фактора роста, которым является ФСК-1α и/или ФРСЭ, и затем включает сравнение измеренного уровня экспрессии с контрольным уровнем экспрессии. Изобретение позволяет расширить арсенал технических средств. 3 н. и 9 з.п. ф-лы, 10 ил., 2 табл., 1 пр.
1. Способ in vitro определения и мониторинга чистоты клеточного препарата, содержащего мезенхимальные стволовые клетки (МСК), который включает измерение уровня экспрессии упомянутым клеточным препаратом по меньшей мере одного фактора роста, которым является ФСК-1α и/или ФРСЭ, и затем включает сравнение измеренного уровня экспресии с контрольным уровнем экспрессии.
2. Способ по п. 1, в котором мезенхимальные стволовые клетки выделены из тканей, выбранных из группы, включающей жировую ткань, костный мозг, пуповинную кровь, околоплодные воды, вартонов студень, плаценту, периферическую кровь, фаллопиевую трубу, роговичную строму, легкие, мышцы и плодную печень.
3. Способ по п. 1 или 2, в котором мезенхимальными стволовыми клетками являются стволовые клетки жировой ткани (СКЖТ).
4. Способ по любому из пп. 1-3, в котором оценивают уровень экспрессии на уровне белка, предпочтительно путем обнаружения и/или количественного определения упомянутого по меньшей мере одного фактора роста, секретируемого в супернатанте клеточной культуры.
5. Способ по любому из пп. 1-4, в котором оценивают уровень экспрессии на уровне РНК, предпочтительно методами ПЦР в реальном времени, количественной ПЦР в реальном времени, нозерн-блоттинга и/или гибридизации.
6. Способ по любому из пп. 1-5, в котором клеточный препарат является преимущественно чистым, когда уровень экспрессии ФСК-1α составляет не более 100 пг/мл, предпочтительно не более 50,40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5,4, 3, 2 или 1 пг/мл.
7. Способ по любому из пп. 1-6, в котором клеточный препарат является преимущественно чистым, когда уровень экспрессии ФСК-1α составляет не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл и/или уровень экспрессии ФРСЭ в клеточной культуральной среде составляет по меньшей мере 200 пг/мл, предпочтительно по меньшей мере50, 260, 270, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289 или 290 пг/мл; при этом культивируют клеточный препарат в условиях гипоксии, предпочтительно при содержании О2 около 0,1% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л глюкозы до измерения уровня экспрессии.
8. Способ по любому из пп. 1-6, в котором клеточный препарат является преимущественно чистым, когда уровень экспрессии ФСК-1α составляет не более 100 пг/мл, предпочтительно не более 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пг/мл; и/или уровень экспрессии ФРСЭ в клеточной культуральной среде составляет по меньшей мере 90 пг/мл, предпочтительно по меньшей мере 95, 100, 105, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119 или 120 мкг/мл, при этом культивируют клеточный препарат при тканевом кислородном потенциале, предпочтительно при содержании О2 около 5% и при высокой концентрации глюкозы, предпочтительно около 4,5 г/л до измерения уровня экспрессии.
9. Способ по любому из пп. 1-8, предназначенный для оценки качества или чистоты клеточного препарата, содержащего мезенхимальные стволовые клетки (МСК), при этом содержащий МСК клеточный препарат предназначен для применения в качестве продукта клеточной терапии на основе МСК в регенеративной медицине.
10. Применение фактора роста, предпочтительно ФСК-1α и/или ФРСЭ, в качестве биомаркера качества клеточного препарата, содержащего мезенхимальные стволовые клетки (МСК).
11. Применение фактора роста по п. 10, где указанный клеточный препарат используют в качестве продукта клеточной терапии на основе МСК в регенеративной медицине.
12. Набор для осуществления способа in vitro по любому из пп. 1-9, содержащий средство определения или измерения уровня экспрессии по меньшей мере одного фактора роста, необязательно дополнительно содержащий контроль для сравнения уровня экспрессии упомянутого по меньшей мере одного фактора роста.
| KERSTI J., et al | |||
| "RNA-Seq Analysis Reveals Different Dynamics of Differentiation of Human Dermis- and Adipose-Derived Stromal Stem Cells", PLoS One | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| ВЕЧКАНОВ Е.М., и др | |||
| Основы клеточной инженерии: Учебное пособие | |||
| - Ростов-на-Дону, 2012 | |||
| НОВОХАТСКТИЙ А.С., и др | |||
| "Проблема контаминации клетками и новые подходы к контролю | |||
Авторы
Даты
2020-12-21—Публикация
2016-05-09—Подача