Область техники
Настоящее изобретение относится к новому пептиду, обладающему улучшенной активностью в отношении рецептора глюкагонподобного пептида-1 и рецептора глюкагона, более высокой по сравнению с нативным оксинтомодулином, а также к композиции для предупреждения или лечения ожирения, содержащей такой пептид в качестве активного ингредиента.
Предшествующий уровень техники
В настоящее время экономический рост и изменения в образе жизни приводят к изменениям в привычках питания. Главные причины набора избыточного веса и степени ожирения у современных людей заключаются в потреблении высококалорийной пищи, такой как фастфуд, и в отсутствии физической нагрузки. По оценкам Всемирной Организации Здравоохранения (ВОЗ) более 1 миллиарда людей имеют избыточный вес, и по меньшей мере 300 миллионов из них имеют клинически установленный диагноз ожирение. В частности, 250000 людей в год умирают в Европе, и более 2,5 миллионов людей в год во всем мире умирают по причине избыточного веса (World Health Organization, Global Strategy on Diet, Physical Activity and Health, 2004).
Избыточный вес и ожирение повышают кровяное давление и уровни холестерина, вызывая или осложняя различные заболевания, такие как сердечно-сосудистое заболевание, диабет и артрит, и, кроме того, являются основной причиной увеличения частоты возникновения атеросклероза, гипертензии, гиперлипидемии или сердечно-сосудистого заболевания у детей или подростков, а также у взрослых.
Ожирение представляет собой тяжелое состояние, которое повсеместно вызывает различные заболевания. Предполагается, что его следует преодолевать индивидуальными усилиями, и также полагают, что у пациентов с ожирением отсутствует самоконтроль. Однако, ожирение трудно поддается лечению, так как ожирение представляет собой сложное расстройство, затрагивающее регуляцию аппетита и энергетический обмен. Что касается лечения ожирения, наряду с усилиями самих пациентов с ожирением, лечение следует направлять на аномальные эффекты, ассоциированные с регуляцией аппетита и энергетическим метаболизмом. Много попыток было предпринято для разработки лекарственных средств, способных лечить эти аномальные эффекты. В результате этих попыток были разработаны такие лекарственные средства, как римонабант (Sanofi-Aventis), сибутрамин (Abbott), контрав (Takeda) и орлистат (Roche), однако они имеют недостатки в виде серьезных побочных эффектов или очень слабых эффектов против ожирения. Например, сообщалось, что римонабант (Sanofi-Aventis) проявляет побочный эффект в виде расстройства центральной нервной системы, сибутрамин (Abbott) и контрав (Takeda) проявляют сердечно-сосудистые побочные эффекты, а орлистат (Roche) дает только 4 кг потери веса при приеме в течение 1 года. К сожалению, нет терапевтических агентов для лечения ожирения, которые могут быть безопасно предписаны пациентам с ожирением.
Много исследований было проведено для разработки терапевтических агентов для лечения ожирения, которые не имеют проблем традиционных лекарственных средств против ожирения. В настоящее время много внимания привлечено к производным глюкагона. Глюкагон продуцируется поджелудочной железой, когда уровень глюкозы в крови падает в результате действия других лекарств или заболеваний, гормональных или ферментативных недостаточностей. Глюкагон стимулирует распад гликогена в печени и способствует высвобождению глюкозы для повышения уровней глюкозы в крови до нормального диапазона. В дополнение к эффекту повышения уровня глюкозы в крови глюкагон подавляет аппетит и активирует гормон-чувствительную липазу (HSL) адипоцитов для облегчения липолиза, тем самым проявляя эффекты против ожирения. Одно из производных глюкагона, глюкагонподобный пептид-1 (GLP-1), находится в разработке в качестве терапевтического агента для лечения гипергликемии у пациентов с диабетом, и его функция заключается в стимуляции синтеза и секреции инсулина, в ингибировании секреции глюкагона, в замедлении опорожнения желудка, в усилении утилизации глюкозы и в ингибировании приема пищи. Эксендин-4 выделен из яда ящерицы, который имеет приблизительно 50% аминокислотной гомологии с GLP-1, и также сообщалось, что он активирует рецептор GLP-1, тем самым ослабляя гипергликемию у пациентов с диабетом. Однако, лекарственные средства против ожирения, включающие GLP-1, как сообщалось, имеют побочные эффекты, такие как рвота и тошнота.
В качестве альтернативы GLP-1, таким образом, много внимания было сконцентрировано на оксинтомодулине, пептиде, имеющем происхождение от предшественника глюкагона, преглюкагона, который связывается с рецепторами двух пептидов: GLP-1 и глюкагона. Оксинтомодулин представляет собой сильнодействующее средство для лечения ожирения, так как он подавляет потребление пищи подобно GLP-1, способствует насыщению и обладает липолитической активностью подобно глюкагону.
Основываясь на двойной функции пептида оксинтомодулина, его активно изучали в качестве лекарственного средства для лечения ожирения. Например, в патенте Кореи No. 925017 раскрыта фармацевтическая композиция, включающая оксинтомодулин в качестве активного ингредиента для лечения избыточного веса у человека, которую вводят пероральным, парентеральным, мукозальным, ректальным, подкожным или трансдермальным путем. Однако, сообщалось, что это лекарственное средство против ожирения, включающее оксинтомодулин, обладает коротким периодом полувыведения in vivo и слабой терапевтической эффективностью, даже несмотря на введение в высокой дозе три раза в сутки. Так, много попыток было предпринято для увеличения периода полувыведения in vivo или улучшения терапевтического эффекта оксинтомодулина в отношении ожирения путем его модификации.
Например, двойной агонист оксинтомодулин (Merck) получен путем замены L-серина на D-серин по положению 2 оксинтомодулина для повышения устойчивости к дипептидилпептидазе-IV (DPP-IV) и путем присоединения холестериновой группировки по С-концу для увеличения в то же время периода полувыведения из крови. ZP2929 (Zealand) получен путем замены L-серина на D-серин по положению 2 для повышения устойчивости к DPP-IV, замены аргинина на аланин по положению 17 для повышения устойчивости к протеазе, замены метионина на лизин по положению 27 для усиления оксидативной стабильности и замены глутамина на аспарагиновую кислоту и аланин по положениям 20 и 24 и аспарагина на серии по положению 28 для усиления стабильности к дезамидированию. Однако, даже несмотря на то что период полувыведения этого двойного агониста оксинтомодулина (Merck) был увеличен, проявляя период полувыведения примерно на 8-12 минут дольше по сравнению с нативным оксинтомодулином, он все еще имеет очень короткий период полувыведения in vivo, составляющий 1,7 часа, и его доза введения также является настолько высокой как несколько мг/кг. К сожалению, оксинтомодулин и его производные имеют недостатки ежедневного введения в высокой дозе из-за короткого периода полувыведения и низкой эффективности. Описание
Техническая задача
Соответственно, авторы настоящего изобретения разработали производное оксинтомодулина, получаемое путем модификации аминокислотной последовательности нативного оксинтомодулина с целью усиления его терапевтических эффектов в отношении ожирения и снижения дозы его введения. В результате они обнаружили, что производное оксинтомодулина проявляет улучшенные активности в отношении рецептора глюкагона и рецептора GLP-1 по сравнению с нативным оксинтомодулином, тем самым осуществляя настоящее изобретение.
Техническое решение
Задача настоящего изобретения состоит в том, чтобы предложить новый пептид, проявляющий улучшенные терапевтические эффекты в отношении ожирения.
Задача настоящего изобретения также состоит в том, чтобы предложить композицию для предупреждения или лечения ожирения, содержащую такой пептид.
Задача настоящего изобретения также состоит в том, чтобы предложить способ предупреждения или лечения ожирения путем введения субъекту данного пептида или данной композиции.
Задача настоящего изобретения также состоит в том, чтобы предложить применение пептида в изготовлении лекарственных средств для предупреждения или лечения ожирения.
Благоприятные эффекты
В противоположность нативному оксинтомодулину, новый пептид по настоящему изобретению сокращает потребление пищи, подавляет опорожнение желудка и способствует липолизу без проявления побочных эффектов, а также демонстрирует улучшенные рецептор-активирующие эффекты. Поэтому он может быть широко использован в безопасном и эффективном лечении ожирения.
Краткое описание графических материалов
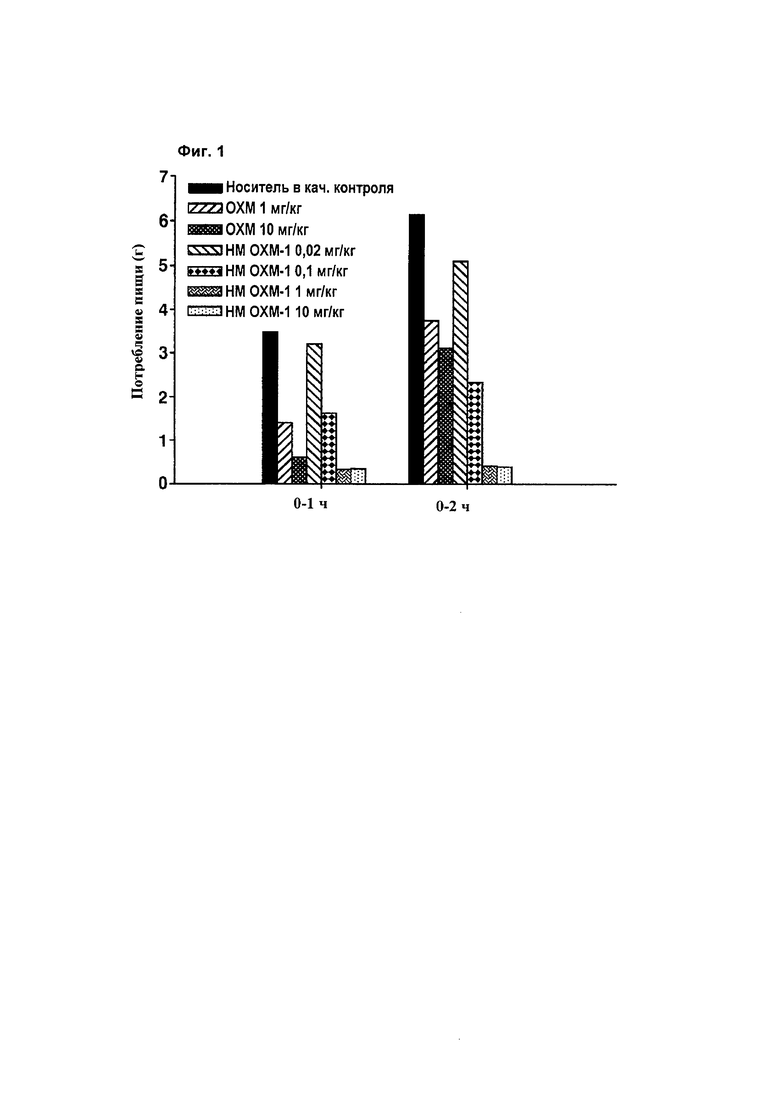
На Фиг. 1 представлен график, показывающий изменения в потреблении пищи в зависимости от дозы введения оксинтомодулина или производного оксинтомодулина.
Наилучший путь осуществления изобретения
В одном аспекте для достижения указанных выше задач в настоящем изобретении предложен новый пептид, включающий аминокислотную последовательность следующей формулы 1:
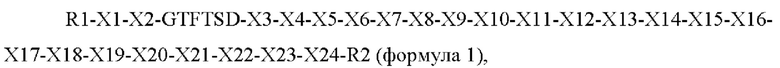
где R1 представляет собой гистидин, дезамино-гистидил, диметил-гистидил (N-диметил-гистидил), бета-гидроксиимидазопропионил, 4-имидазо ацетил, бета-карбоксиимидазопропионил или тирозин;
X1 представляет собой Aib(аминоизомасляную кислоту), d-аланин, глицин, Sar(N-метилглицин), серии или d-серин;
Х2 представляет собой глутаминовую кислоту или глутамин;
Х3 представляет собой лейцин или тирозин;
Х4 представляет собой серии или аланин;
Х5 представляет собой лизин или аргинин;
Х6 представляет собой глутамин или тирозин;
Х7 представляет собой лейцин или метионин;
Х8 представляет собой аспарагиновую кислоту или глутаминовую кислоту;
Х9 представляет собой глутаминовую кислоту, серии, альфа-метил-глутаминовую кислоту или делетирован;
Х10 представляет собой глутамин, глутаминовую кислоту, лизин, аргинин, серии или делетирован;
X11 представляет собой аланин, аргинин, валин или делетирован;
Х12 представляет собой аланин, аргинин, серии, валин или делетирован;
Х13 представляет собой лизин, глутамин, аргинин, альфа-метил-глутаминовую кислоту или делетирован;
Х14 представляет собой аспарагиновую кислоту, глутаминовую кислоту, лейцин или делетирован;
X15 представляет собой фенилаланин или делетирован;
Х16 представляет собой изолейцин, валин или делетирован;
Х17 представляет собой аланин, цистеин, глутаминовую кислоту, лизин, глутамин, альфа-метил-глутаминовую кислоту или делетирован;
X18 представляет собой триптофан или делетирован;
Х19 представляет собой аланин, изолейцин, лейцин, серии, валин или делетирован;
Х20 представляет собой аланин, лизин, метионин, глутамин, аргинин или делетирован;
Х21 представляет собой аспарагин или делетирован;
Х22 представляет собой аланин, глицин, треонин или делетирован;
Х23 представляет собой цистеин, лизин или делетирован;
Х24 представляет собой пептид, имеющий от 2 до 10 аминокислот, состоящих из комбинаций аланина, глицина и серина, или делетирован; и
R2 представляет собой 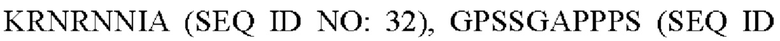
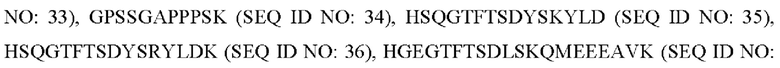
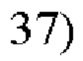 или делетирован (за исключением случая, когда аминокислотная последовательность формулы 1 идентична SEQ ID NO: 1).
или делетирован (за исключением случая, когда аминокислотная последовательность формулы 1 идентична SEQ ID NO: 1).
Термин «пептид», как он использован здесь, означает соединение из двух или более α-аминокислот, связанных пептидной связью. В отношении объектов по настоящему изобретению, этот термин означает пептид, который активирует как рецептор GLP-1, так и рецептор глюкагона для проявления эффектов против ожирения. Пептид по настоящему изобретению включает пептиды, производные пептидов или миметики пептидов, которые получают путем добавления, делеции или замены аминокислот оксинтомодулина таким образом, чтобы активировать оба рецептора GLP-1 и глюкагона на высоком уровне по сравнению с нативным оксинтомодулином.
Аминокислоты, упомянутые здесь, имеют следующие сокращения согласно правилам номенклатуры IUPAC-IUB:


В настоящем изобретении пептид охватывает любой пептид, который получают путем замен, вставок, делеций или посттрансляционных модификаций (например, метилирования, ацилирования, убиквитинилирования, внутримолекулярного ковалентного связывания) в аминокислотной последовательности оксинтомодулина 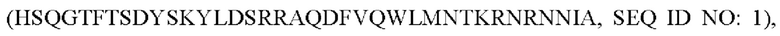 так чтобы одновременно активировать рецепторы глюкагона и GLP-1. Что касается замены или добавления аминокислот, могут быть использованы любые из 20 аминокислот, обычно обнаруживаемых в человеческих белках, а также атипичные или неприродные аминокислоты. Коммерческие источники атипичных аминокислот включают Sigma-Aldrich, ChemPep Inc. и Genzyme Pharmaceuticals. Пептиды, включающие эти аминокислоты и атипичные пептидные последовательности, могут быть синтезированы и приобретены у коммерческих поставщиков, например American Peptide Company или Bachem (USA) или Anygen (Korea).
так чтобы одновременно активировать рецепторы глюкагона и GLP-1. Что касается замены или добавления аминокислот, могут быть использованы любые из 20 аминокислот, обычно обнаруживаемых в человеческих белках, а также атипичные или неприродные аминокислоты. Коммерческие источники атипичных аминокислот включают Sigma-Aldrich, ChemPep Inc. и Genzyme Pharmaceuticals. Пептиды, включающие эти аминокислоты и атипичные пептидные последовательности, могут быть синтезированы и приобретены у коммерческих поставщиков, например American Peptide Company или Bachem (USA) или Anygen (Korea).
С целью усиления активности оксинтомодулина дикого типа в отношении рецептора глюкагона и рецептора GLP-1, пептид по настоящему изобретению может быть замещен 4-имидазоацетилом, где альфа-углерод гистидина по положению 1 аминокислотной последовательности, представленной в SEQ ID NO: 1, делетирован, дезамино-гистидилом, где N-концевая аминогруппа делетирована, диметил-гистидилом (N-диметил-гистидилом), где N-концевая аминогруппа модифицирована с помощью двух метальных групп, бета-гидрокси-имидазопропионилом, где N-концевая аминогруппа замещена гидроксильной группой, или бета-карбоксиимидазопропионилом, где N-концевая аминогруппа замещена карбоксильной группой. В дополнение, область, связывающая рецептор GLP-1, может быть заменена на аминокислоты, которые усиливают гидрофобные и ионные связи или их комбинации. Часть последовательности оксинтомодулина может быть заменена на аминокислотную последовательность GLP-1 или эксендина-4 для усиления активности в отношении рецептора GLP-1.
Кроме того, часть последовательности оксинтомодулина может быть заменена на последовательность, стабилизирующую альфа-спираль. Предпочтительно, аминокислоты по положениям 10, 14, 16, 20, 24 и 28 аминокислотной последовательности формулы 1 могут быть заменены на аминокислоты или производные аминокислот, состоящие из Tyr(4-Me), Phe, Phe(4-Me), Phe(4-Cl), Phe(4-CN), Phe(4-NO2), Phe(4-NH2), Phg, Pal, Nal, Ala(2-тиенил) и А1а(бензотиенил), которые, как известно, стабилизируют альфа-спираль, и не имеется ограничений в отношении типа и количества подлежащих вставке аминокислот или производных аминокислот, стабилизирующих альфа-спираль. Предпочтительно, аминокислоты по положениям 10 и 14, 12 и 16, 16 и 20, 20 и 24, и 24 и 28 могут быть также заменены на глутаминовую кислоту или лизин, соответственно таким образом чтобы образовать кольца, и не имеется ограничения в отношении количества колец, подлежащих вставке. Наиболее предпочтительно, пептид может представлять собой пептид, имеющий аминокислотную последовательность, выбранную из нижеследующих формул со 2 по 6.
В одном конкретном воплощении пептид по настоящему изобретению представляет собой производное оксинтомодулина, включающее аминокислотную последовательность следующей формулы 2, где аминокислотная последовательность оксинтомодулина заменена на аминокислотную последовательность эксендина или GLP-1:
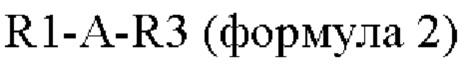
В другом конкретном воплощении пептид по настоящему изобретению представляет собой производное оксинтомодулина, включающее аминокислотную последовательность следующей формулы 3, которую получают путем связывания части аминокислотной последовательности оксинтомодулина и части аминокислотной последовательности эксендина или GLP-1 через подходящий аминокислотный линкер:
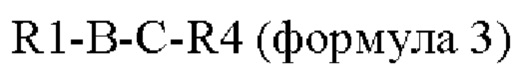
В еще одном конкретном воплощении пептид по настоящему изобретению представляет собой производное оксинтомодулина, включающее аминокислотную последовательность следующей формулы 4, где часть аминокислотной последовательности оксинтомодулина заменена на аминокислоту, способную усиливать аффинность связывания с рецептором GLP-1, например, Leu в положении 26, который связывается с рецептором GLP-1 путем гидрофобного взаимодействия, замещен гидрофобным остатком, Ile или Val:
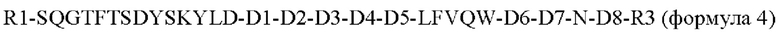
В еще одном конкретном воплощении пептид по настоящему изобретению представляет собой производное оксинтомодулина, включающее следующую формулу 5, где часть аминокислотной последовательности делетирована, добавлена или заменена на другую аминокислоту с целью усиления активностей нативного оксинтомодулина в отношении рецептора GLP-1 и рецептора глюкагона:
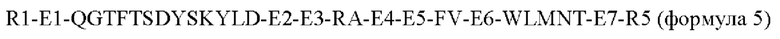
В формулах со 2 по 5, R1 является таким же, как в описании формулы 1; А выбран из группы, состоящей из 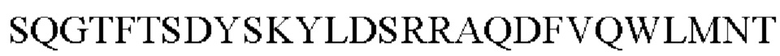

В выбран из группы, состоящей из 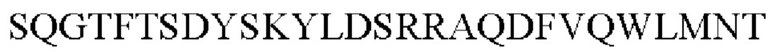

С представляет собой пептид, имеющий 2-10 аминокислот, состоящих из комбинаций аланина, глицина и серина;
D1 представляет собой серии, глутаминовую кислоту или аргинин;
D2 представляет собой аргинин, глутаминовую кислоту или серии;
D3 представляет собой аргинин, аланин или валин;
D4 представляет собой аргинин, валин или серии;
D5 представляет собой глутамин, аргинин или лизин;
D6 представляет собой изолейцин, валин или серии;
D7 представляет собой метионин, аргинин или глутамин;
D8 представляет собой треонин, глицин или аланин;
Е1 представляет собой серии, Aib, Sar, d-аланин или d-серин;
Е2 представляет собой серии или глутаминовую кислоту;
ЕЗ представляет собой аргинин или лизин;
Е4 представляет собой глутамин или лизин;
Е5 представляет собой аспарагиновую кислоту или глутаминовую кислоту;
Е6 представляет собой глутамин, цистеин или лизин;
Е7 представляет собой цистеин, лизин или делетирован;
R3 представляет собой 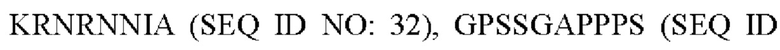
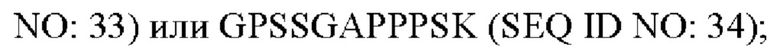
R4 представляет собой 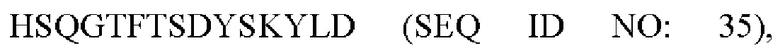
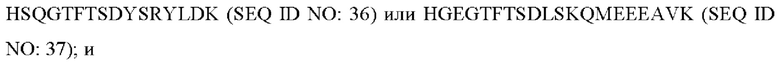
R5 представляет собой 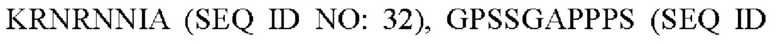
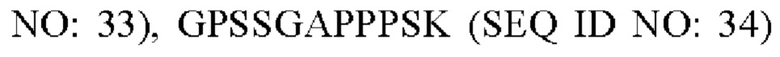 или делетирован (за исключением случая, когда аминокислотные последовательности формул 2-5 идентичны SEQ ID NO: 1).
или делетирован (за исключением случая, когда аминокислотные последовательности формул 2-5 идентичны SEQ ID NO: 1).
Предпочтительно новый пептид по настоящему изобретению может представлять собой пептид следующей формулы 6:
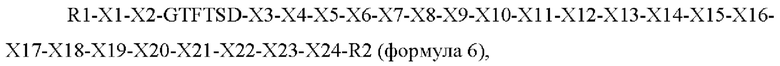
где R1 представляет собой гистидин, дезамино-гистидил, 4-имидазоацетил или тирозин;
X1 представляет собой Aib(аминоизомасляную кислоту), глицин или серии;
Х2 представляет собой глутаминовую кислоту или глутамин;
Х3 представляет собой лейцин или тирозин;
Х4 представляет собой серии или аланин;
Х5 представляет собой лизин или аргинин;
Х6 представляет собой глутамин или тирозин;
Х7 представляет собой лейцин или метионин;
Х8 представляет собой аспарагиновую кислоту или глутаминовую кислоту;
Х9 представляет собой глутаминовую кислоту, альфа-метил-глутаминовую кислоту или делетирован;
Х10 представляет собой глутамин, глутаминовую кислоту, лизин, аргинин или делетирован;
X11 представляет собой аланин, аргинин или делетирован;
Х12 представляет собой аланин, валин или делетирован;
Х13 представляет собой лизин, глутамин, аргинин, альфа-метил-глутаминовую кислоту или делетирован;
Х14 представляет собой аспарагиновую кислоту, глутаминовую кислоту, лейцин или делетирован;
X15 представляет собой фенилаланин или делетирован;
Х16 представляет собой изолейцин, валин или делетирован;
Х17 представляет собой аланин, цистеин, глутаминовую кислоту, глутамин, альфа-метил-глутаминовую кислоту или делетирован;
X18 представляет собой триптофан или делетирован;
Х19 представляет собой аланин, изолейцин, лейцин, валин или делетирован;
Х20 представляет собой аланин, лизин, метионин, аргинин или делетирован;
Х21 представляет собой аспарагин или делетирован;
Х22 представляет собой треонин или делетирован;
Х23 представляет собой цистеин, лизин или делетирован;
Х24 представляет собой пептид, имеющий 2-10 аминокислот, состоящих из глицина, или делетирован; и
R2 представляет собой 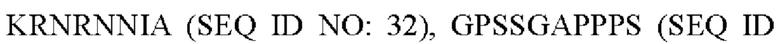
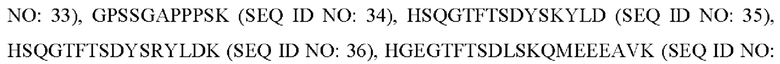
 или делетирован (за исключением случая, когда аминокислотная последовательность формулы 6 идентична SEQ ID NO: 1).
или делетирован (за исключением случая, когда аминокислотная последовательность формулы 6 идентична SEQ ID NO: 1).
Более предпочтительно пептид по настоящему изобретению может быть выбран из группы, состоящей из пептидов SEQ ID NO: с 1 по 31. Еще более предпочтительно пептид по настоящему изобретению может представлять собой производное оксинтомодулина, описанное в Таблице 1 Примера 2-1.
Оксинтомодулин обладает активностями двух пептидов, GLP-1 и глюкагона. GLP-1 снижает уровень глюкозы в крови, снижает потребление пищи и подавляет опорожнение желудка, а глюкагон повышает уровень глюкозы в крови, способствует липолизу и снижает массу тела посредством увеличения энергетического метаболизма. Разные биологические эффекты двух пептидов могут вызывать нежелательные эффекты типа повышения уровня глюкозы в крови, если глюкагон проявляет более доминирующий эффект по сравнению с GLP-1, или вызывая тошноту и рвоту, если GLP-1 проявляет более доминирующий эффект по сравнению с глюкагоном. Таким образом, производные оксинтомодулина по настоящему изобретению не только предназначены для повышения этих активностей, например, аминокислоты по положению 1 и 11 оксинтомодулина, которые подавляют активность глюкагона, могут быть модифицированы, для того чтобы сбалансировать соотношения активностей глюкагона и GLP-1.
Авторы настоящего изобретения осуществили in vitro эксперименты для того, чтобы продемонстрировать, что пептид по настоящему изобретению проявляет улучшенные активности в отношении рецептора GLP-1 и рецептора глюкагона по сравнению с оксинтомодулином. Так, подтверждено, что пептид по настоящему изобретению активирует рецептор GLP-1 и рецептор глюкагона с проявлением улучшенных терапевтических эффектов в отношении ожирения по сравнению с традиционным оксинтомодулином. Кроме того, были исследованы его ингибирующие эффекты в отношении потребления пищи in vivo, и он показывает улучшенные ингибирующие эффекты в отношении приема пищи по сравнению с традиционным оксинтомодулином (Фиг. 1).
Специалистам в данной области техники понятно, что когда производные оксинтомодулина по настоящему изобретению модифицированы с использованием типичных методик, включая модификацию полимерами, такими как полиэтиленгликолевые (ПЭГ) и сахарные цепи, или слиянием с альбумином, трансферрином, жирной кислотой и иммуноглобулином, с целью улучшения терапевтических эффектов производных оксинтомодулина, они будут проявлять превосходные терапевтические эффекты по сравнению с нативным оксинтомодулином. Таким образом, модифицированные производные оксинтомодулина также включены в объем настоящего изобретения.
В другом аспекте настоящего изобретения предложен полинуклеотид, кодирующий данный пептид.
Термин "гомология", как он использован здесь в отношении полинуклеотида, указывает на сходство последовательностей между аминокислотными последовательностями дикого типа или нуклеотидными последовательностями дикого типа и включает последовательность гена, которая на 75% или выше, предпочтительно на 85% или выше, более предпочтительно на 90% или выше и даже еще более предпочтительно на 95% или выше идентична полинуклеотидной последовательности, кодирующей данный пептид. Оценка гомологии может быть осуществлена невооруженным глазом или с использованием коммерчески доступных программ. Используя коммерчески доступную компьютерную программу, гомология между двумя или более последовательностями может быть выражена в виде процента (%), и может быть оценена гомология (%) между соседними последовательностями. Полинуклеотид, кодирующий пептид, встраивают в вектор и экспрессируют таким образом, чтобы получить большое количество пептида.
В еще одном аспекте настоящего изобретения предложена фармацевтическая композиция для предупреждения или лечения ожирения, содержащая данный пептид.
Термин "предупреждение", как он использован здесь, означает все действия, путем осуществления которых ожирение сдерживается или замедляется при введении пептида или композиции, и термин "лечение" означает все действия, путем осуществления которых симптомы ожирения направляются в сторону улучшения состояния или модифицируются при введении пептида или композиции.
Термин "введение", как он использован здесь, означает введение количества заранее определенного вещества пациенту определенным подходящим методом. Композиция по настоящему изобретению может быть введена посредством любого общепринятого пути, пока она способна достичь желаемой ткани, например, без ограничения, внутрибрюшинным, внутривенным, внутримышечным, подкожным, внутридермальным, пероральным, местным, интраназальным, внутрилегочным или внутриректальным введением. Однако, поскольку пептиды перевариваются при пероральном введении, активные ингредиенты композиции для перорального введения должны быть покрыты или изготовлены в виде препарата для защиты против разложения в желудке.
Термин "ожирение", как он использован здесь, подразумевает накопление избыточного количества жировой ткани в организме, и индекс массы тела (масса тела (кг), разделенная на рост (м) в квадрате) выше 25 считается ожирением. Ожирение обычно вызывается нарушением энергетического баланса, когда количество принимаемой пищи превышает количество энергии, расходуемое в течение длительного периода времени. Ожирение представляет собой метаболическое расстройство, которое влияет на весь организм и повышает риск диабета, гиперлипидемии, сексуальной дисфункции, артрита и сердечно-сосудистых заболеваний, и в некоторых случаях ассоциировано с возникновением рака.
Фармацевтическая композиция по настоящему изобретению может дополнительно включать фармацевтически приемлемый носитель, эксципиент или разбавитель. Термин "фармацевтически приемлемый", как он использован здесь, означает, что композиция достаточна для достижения терапевтических эффектов без неблагоприятных побочных эффектов и может быть легко определена в зависимости от типа заболеваний, возраста пациента, массы тела, состояния здоровья, пола и лекарственной чувствительности, пути введения, способа введения, частоты введения, продолжительности лечения, лекарственных средств, используемых в комбинации или сочетании с композицией по данному изобретению, и других факторов, известных в медицине.
Фармацевтическая композиция, включающая производное по настоящему изобретению, может дополнительно включать фармацевтически приемлемый носитель. Для перорального введения носитель может включать, без ограничения, связывающий агент, смазывающий агент, разрыхлитель, эксципиент, солюбилизатор, диспергирующий агент, стабилизатор, суспендирующий агент, краситель и корригент.Для инъекционных препаратов носитель может включать буферный агент, консервант, анальгетик, солюбилизатор, изотонический агент и стабилизатор. Для препаратов для местного введения носитель может включать основу, эксципиент, смазывающий агент и консервант.
Композиция по настоящему изобретению может быть изготовлена в большом разнообразии лекарственных форм в комбинации с вышеупомянутыми фармацевтически приемлемыми носителями. Например, для перорального введения фармацевтическая композиция может быть изготовлена в виде таблеток, троше, капсул, эликсиров, суспензий, сиропов или или облаток. Для инъецируемых препаратов фармацевтическая композиция может быть изготовлена в виде ампулы в индивидуальной лекарственной форме или многодозовом контейнере. Фармацевтическая композиция также может быть изготовлена в виде растворов, суспензий, таблеток, пилюлей, капсул и препаратов длительного действия.
С другой стороны, примеры носителя, эксципиента и разбавителя, подходящего для фармацевтических композиций, включают лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритрит, мальтит, крахмал, аравийскую камедь, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния и минеральные масла. В дополнение, фармацевтические композиции могут дополнительно включать наполнители, агенты против коагуляции, смазывающие агенты, увлажнители, корригенты и антисептики.
Кроме того, фармацевтическая композиция по настоящему изобретению может иметь любую форму, выбранную из группы, состоящей из таблеток, пилюль, порошков, гранул, капсул, суспензий, жидкостей для приема внутрь, эмульсий, сиропов, стерильных водных растворов, неводных растворителей, лиофилизированных препаратов и суппозиториев.
Кроме того, композиция может быть изготовлена в виде индивидуальной лекарственной формы, подходящей для организма пациента, и предпочтительно изготовлена в виде препарата, полезного для пептидных лекарственных средств, в соответствии с типичным способом в фармацевтической области, так чтобы вводить пероральным или парентеральным путем, таким как через кожу, внутривенным, внутримышечным, внутриартериальным путем, интрамедуллярно,
интравентрикулярно, легочным, транс дер мал ьным, подкожным, внутрибрюшинным, интраназальным, внутрикишечным, местным, сублингвальным, вагинальным или ректальным введением, но не ограничиваясь ими.
Пептид может быть использован путем смешивания с рядом фармацевтически приемлемых носителей, таких как физиологический раствор или органические растворители. С целью повышения стабильности или всасываемости могут быть использованы углеводы, такие как глюкоза, сахароза или декстраны, антиоксиданты, такие как аскорбиновая кислота или глутатион, хелатирующие агенты, низкомолекулярные белки или другие стабилизаторы.
Дозу и частоту введения фармацевтической композиции по настоящему изобретению определяют по типу активного ингредиента, вместе с разными факторами, такими как заболевание, подлежащее лечению, пути введения, возраст, пол и масса тела пациента, а также тяжесть заболевания.
Суммарная эффективная доза композиции по настоящему изобретению может быть введена пациенту в однократной дозе или может быть введена в течение длительного периода времени в нескольких дозах в соответствии с протоколом многократного введения. В фармацевтической композиции по настоящему изобретению содержание активного ингредиента может варьировать в зависимости от тяжести заболевания. Предпочтительно суммарная суточная доза пептида по настоящему изобретению может составлять приблизительно от 0,0001 мкг до 500 мг на 1 кг массы тела пациента. Однако, эффективная доза пептида определяется различными факторами, включая возраст пациента, массу тела, состояние здоровья, пол, тяжесть заболевания, тип питания и скорость выведения, в дополнение к пути и частоте введения фармацевтической композиции. В свете этого, специалисты в данной области техники могут легко определить эффективную дозу, подходящую для конкретного использования фармацевтической композиции по настоящему изобретению. Фармацевтическая композиция по настоящему изобретению конкретно не ограничена препаратом, а также путем и способом введения, пока она проявляет эффекты настоящего изобретения.
Фармацевтическая композиция по настоящему изобретению проявляет улучшенные in vivo продолжительность эффекта и титр, тем самым значительно снижая количество и частоту ее введения.
Кроме того, фармацевтическая композиция может быть введена отдельно или в комбинации либо сочетании с другими фармацевтическими препаратами, проявляющими профилактические или терапевтические эффекты в отношении ожирения. Фармацевтические препараты, проявляющие профилактические или терапевтические эффекты в отношении ожирения, конкретно не ограничены и могут включать агонист рецептора GLP-1, агонист рецептора лептина, ингибитор DPP-IV, антагонист рецептора Y5, антагонист рецептора меланин-концентрирующего гормона (МСН), агонист рецептора Y2/3, агонист меланокортиновых рецепторов 3/4 (МС3/4), ингибитор желудочной/панкреатической липазы, агонист серотониновых рецепторов 2 с типа (5НТ2с), агонист рецептора β3А, агонист рецептора амилина, антагонист грелина и/или антагонист рецептора грелина.
В еще одном аспекте настоящего изобретения предложен способ предупреждения или лечения ожирения, включающий стадию введения субъекту пептида или фармацевтической композиции, включающей его.
В настоящем изобретении термин "субъект" относится к тем, кто подозревается в наличии ожирения, что означает млекопитающих, включая человека, мышь и сельскохозяйственных животных, имеющих ожирение или имеющих возможность развития ожирения. Однако, без ограничения включен любой субъект, предназначенный для лечения пептидом или фармацевтической композицией по настоящему изобретению. Фармацевтическую композицию, включающую пептид по настоящему изобретению, вводят субъекту, подверженному ожирению, тем самым эффективно излечивая данного субъекта. Ожирение является таким, как описано выше.
Терапевтический способ по настоящему изобретению может включать стадию введения композиции, включающей пептид в фармацевтически эффективном количестве. Суммарная суточная доза должна определяться через подходящее медицинское руководство лечащим врачом, и ее вводят один или несколько раз. В отношении задач настоящего изобретения, уровень конкретной терапевтически эффективной дозы для любого конкретного пациента может варьировать в зависимости от различных факторов, хорошо известных в медицинской области, включая вид и степень ответа, которые следует достигнуть, конкретных композиций в зависимости от того используют ли с ними или нет другие агенты, возраст пациента, масса тела, состояние здоровья, пол и тип питания, и путь введения, скорость выведения композиции, период времени терапии, другие лекарственные средства, используемые в комбинации или сочетании с композицией по данному изобретению, и подобные факторы, хорошо известные в медицинской области.
В еще одном аспекте настоящего изобретения предложено применение пептида или фармацевтической композиции, включающей его, в изготовлении лекарственных средств для предупреждения или лечения ожирения.
Способ осуществления
Далее настоящее изобретение будет описано более подробно со ссылкой на следующие Примеры. Однако, эти Примеры приведены только с иллюстративной целью, и изобретение не предназначено быть ограниченным этими Примерами.
Пример 1. Получение in vitro активированной клеточной линии
Пример 1-1: Получение клеточной линии, демонстрирующей цАМФ-ответ на GLP-1
Полимеразную цепную реакцию (PCR) осуществляли с использованием области, соответствующей открытой рамке считывания (ORF) в кДНК (OriGene Technologies, Inc. USA) гена человеческого рецептора GLP-1 в качестве матрицы и следующих прямого и обратного праймера, каждый из которых включает сайты рестрикции HindIII и EcoRI с получением PCR-продукта.
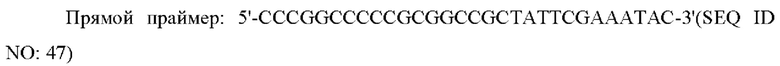
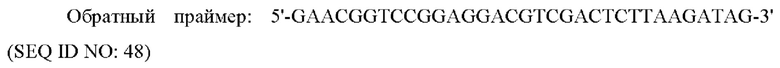
Этот PCR-продукт клонировали в известный вектор экспрессии в животной клетке x0GC/dhfr (дигидрофолатредуктаза) с получением рекомбинантного вектора x0GC/GLP1R.
СНО DG44 клеточную линию, культивированную в среде DMEM/F12 (модифицированная Дульбекко среда Игла с питательной смесью Хэма F12) (10% FBS (фетальная телячья сыворотка)), транс фицировали рекомбинантным вектором x0GC/GLPIR с использованием липофектамина (hwitrogen, USA) и культивировали в селекционной среде, содержащей 1 мг/мл G418 и 10 им метотрексат. Из нее отбирали клеточные линии, происходящие из единичных клонов, используя метод предельных разведений, и из них окончательно отбирали клеточную линию, демонстрирующую лучший цАМФ-ответ на GLP-1 зависимым от концентрации образом.
Пример 1-2: Получение клеточной линии, демонстрирующей цАМФ-ответ на глюкагон
PCR осуществляли с использованием области, соответствующей ORF в кДНК (OriGene Technologies, Inc. USA) гена человеческого рецептора глюкагона в качестве матрицы и следующих прямого и обратного праймеров, каждый из которых включает сайты рестрикции EcoRI and XhoI с получением PCR-продукта.
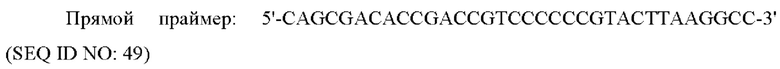
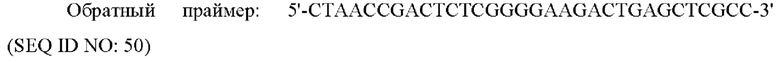
Этот PCR-продукт клонировали в известный вектор экспрессии в животной клетке x0GC/dhfr с получением рекомбинантного вектора x0GC/GCGR.
СНО DG44 клеточную линию, культивированную в среде DMEM/F12 (10% FBS), трансфицировали рекомбинантным вектором xOGC/GCGR с использованием липофектамина и культивировали в селекционной среде, содержащей 1 мг/мл G418 и 10 нм метотрексат. Из нее отбирали клеточные линии, происходящие из единичных клонов, используя метод предельных разведений, и из них окончательно отбирали клеточную линию, демонстрирующую лучший цАМФ-ответ на глюкагон зависимым от концентрации образомм.
Пример 2. Тест на in vitro активность производных оксинтомодулина
Пример 2-1: Синтез производных оксинтомодулина
Для измерения in vitro активностей производных оксинтомодулина синтезировали производные оксинтомодулина со следующими аминокислотными последовательностями (Таблица 1).

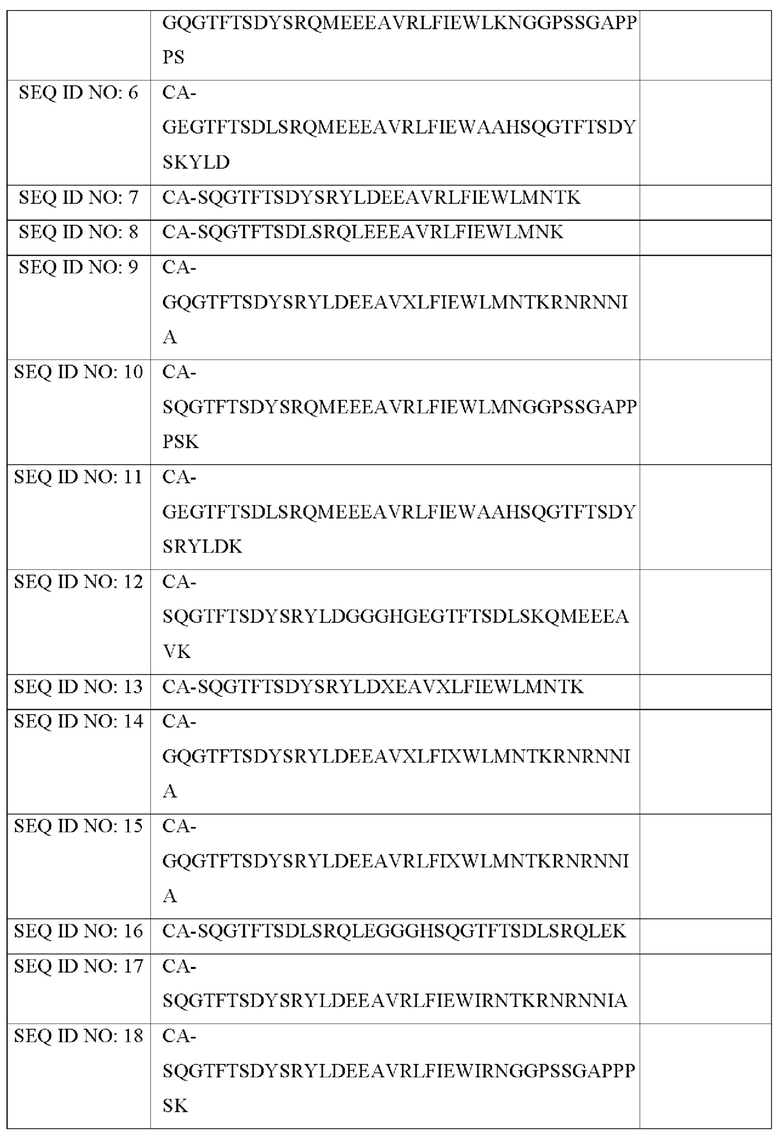
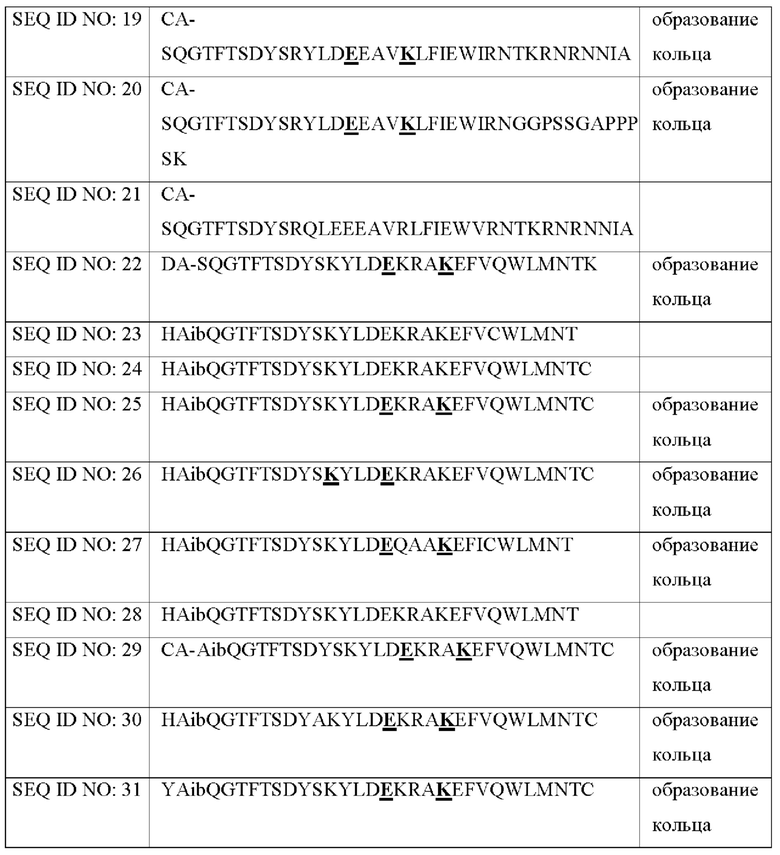
В Таблице 1 аминокислоты, выделенные жирным шрифтом и подчеркиванием в каждой из последовательностей SEQ ID NOs: 19, 20, 22, 25, 26, 27, 29, 30 и 31, взятые вместе образуют кольцо, и аминокислоты, обозначенные X, означают неприродную аминокислоту, альфа-метил-глутаминовую кислоту. Кроме того, СА представляет собой 4-имидазоацетил, и DA представляет собой дезамино-гистидил.
Пример 2-2: Тест на in vitro активность производных оксинтомодулина
Для измерения эффективности производных оксинтомодулина против ожирения, синтезированных в Примере 2-1, измеряли клеточную активность in vitro с использованием клеточных линий, полученных в Примерах 1-1 и 1-2.
Использовали клеточные линии, которые были получены путем транс фицирования СНО (яичники китайского хомячка) для экспрессии гена человеческого рецептора GLP-1 и гена рецептора глюкагона, соответственно. Таким образом, они подходят для измерения активностей GLP-1 и глюкагона. Таким образом, активность каждого производного оксинтомодулина измеряли с использованием каждой трансформированной клеточной линии.
Конкретно, каждую клеточную линию субкультивировали дважды или трижды в неделю и распределяли аликвотами в каждую лунку 96-луночного планшета с плотностью 1×105, а затем культивировали в течение 24 часов.
Культивированные клетки промывали буфером KRB (бикарбонатный буфер Кребса-Рингера) и суспендировали в 40 мл буфера KRB, содержащего 1 мМ IBMX (изобутилметилксантин), и оставляли при комнатной температуре в течение 5 минут.Оксинтомодулин (SEQ ID NO: 1) и производные оксинтомодулина (представленные последовательностями SEQ ID NO: 2-6, 8, 10-13, 17, 18, 23-25, 27-30 и 31) разбавляли от 1000 нМ до 0,02 нМ 5-кратным серийным разведением и каждые их 40 мл добавляли к клеткам и культивировали при 37°С в течение 1 часа в С02 инкубаторе. Затем 20 мл буфера для клеточного лизиса добавляли для лизиса клеток, и в клеточных лизатах измеряли концентрации цАМФ с использованием набора для анализа цАМФ (Molecular Device, USA). На их основе рассчитывали значения ЕС50 и сравнивали друг с другом. Значения ЕС50 показаны в следующей Таблице 2.
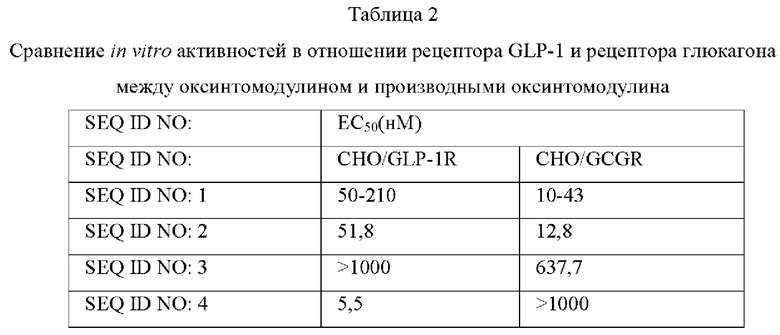
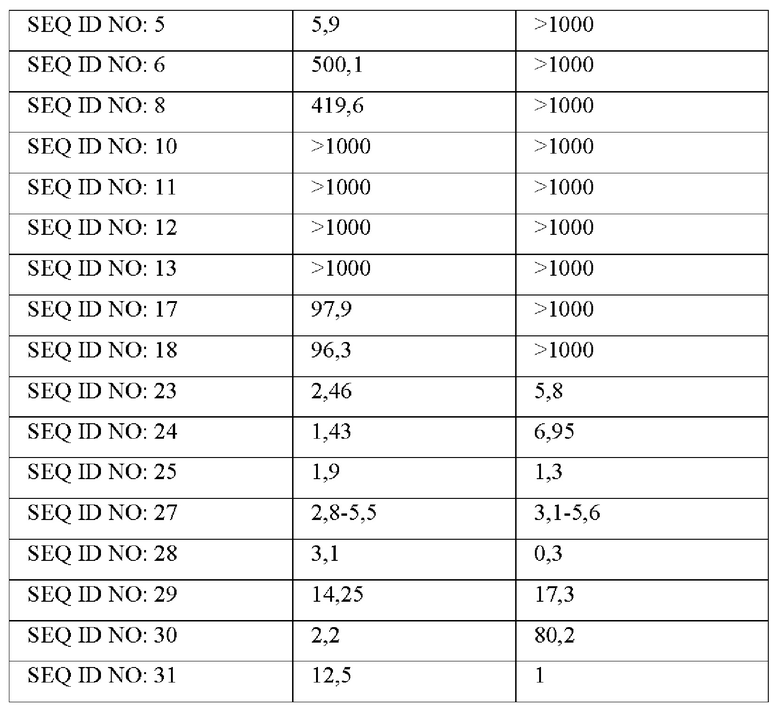
Как показано в Таблице 2, выявлены производные оксинтомодулина, проявляющие превосходные in vitro активности и отличные соотношения активностей в отношении рецептора GLP-1 и рецептора глюкагона по сравнению с нативным оксинтомодулином SEQ ID NO: 1.
Известно, что оксинтомодулин активирует как рецептор GLP-1, так и рецептор глюкагона с подавлением аппетита, облегчением липолиза и стимулированием насыщения, тем самым проявляя эффекты против ожирения. Производные оксинтомодулина по настоящему изобретению показывают более высокие активности in vitro в отношении как рецептора GLP-1, так и рецептора глюкагона по сравнению с оксинтомодулином дикого типа, и поэтому могут быть использованы в качестве терапевтического агента для лечения ожирения с более высокой эффективностью по сравнению с известным оксинтомодулином.
Пример 3. Тест на in vivo активность производных оксинтомодулина
С целью измерения in vivo терапевтической активности производных оксинтомодулина изучали изменения в потреблении пищи при введении производных оксинтомодулина у мышей линии ob/ob с использованием нативного оксинтомодулина в качестве контроля.
Конкретно, диабетические мыши с ожирением ob/ob, обычно используемые для тестирования эффективности терапевтических агентов против ожирения и диабета, голодали в течение 16 часов, затем им вводили 1 или 10 мг/кг оксинтомодулина либо 0,02, 0,1, 1 или 10 мг/кг производного оксинтомодулина с SEQ ID NO: 2. Затем, в течение 2 часов проверяли потребление пищи (Фиг. 1). На Фиг. 1 представлен график, показывающий изменения в потреблении пищи в зависимости от дозы введения оксинтомодулина или производного оксинтомодулина. Как показано на Фиг. 1, введение 1 мг/кг производного оксинтомодулина проявляло намного более сильное подавляющее действие в отношении потребления пищи, чем введение 10 мг/кг о ксинто мо дулина.
Взятые в целом производные оксинтомодулина по настоящему изобретению проявляют намного более сильные эффекты против ожирения, чем оксинтомодулин дикого типа, несмотря на то что вводится в более низкой дозе, указывая на улучшение проблем, связанных с оксинтомодулином дикого типа, который показывает более слабые эффекты против ожирения и должен быть введен в более высокой дозе три раза в сутки.
--->
УТОЧНЕННЫЙ ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ХАНМИ САЙЕНС КO., ЛТД.
<120> Новые производные оксинтомодулина и содержащая их фармацевтическая
композиция для лечения ожирения
<130> OPA12062
<150> KR 10-2011-0056472
<151> 2011-06-10
<160> 50
<170> KopatentIn 2.0
<210> 1
<211> 37
<212> ПРТ
<213> Homo sapiens
<220>
<223> оксинтомодулин
<400> 1
His Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Ser
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr Lys Arg Asn
20 25 30
Arg Asn Asn Ile Ala
35
<210> 2
<211> 37
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<400> 2
Хаа Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Met Asn Thr Lys Arg Asn
20 25 30
Arg Asn Asn Ile Ala
35
<210> 3
<211> 39
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<400> 3
Xaa Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Ala Trp Leu Lys Asn Thr Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Ser
35
<210> 4
<211> 39
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<400> 4
Xaa Gly Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Tyr Leu Glu Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Ser
35
<210> 5
<211> 39
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<400> 5
Xaa Gly Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Gln Met Glu Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Ser
35
<210> 6
<211> 42
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<400> 6
Xaa Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Arg Gln Met Glu Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Ala Ala His Ser Gln Gly Thr
20 25 30
Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp
35 40
<210> 7
<211> 30
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<400> 7
Xaa Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Tyr Leu Asp Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Met Asn Thr Lys
20 25 30
<210> 8
<211> 29
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<400> 8
Xaa Ser Gln Gly Thr Phe Thr Ser Asp Leu Ser Arg Gln Leu Glu Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Met Asn Lys
20 25
<210> 9
<211> 37
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<220>
<221> ВАРИАНТ
<222> (20)
<223> Xaa представляет собой альфа-метил-глутаминовую кислоту
<400> 9
Xaa Gly Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Tyr Leu Asp Glu
1 5 10 15
Glu Ala Val Xaa Leu Phe Ile Glu Trp Leu Met Asn Thr Lys Arg Asn
20 25 30
Arg Asn Asn Ile Ala
35
<210> 10
<211> 40
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<400> 10
Xaa Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Gln Met Glu Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Met Asn Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Ser Lys
35 40
<210> 11
<211> 43
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<400> 11
Xaa Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Arg Gln Met Glu Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Ala Ala His Ser Gln Gly Thr
20 25 30
Phe Thr Ser Asp Tyr Ser Arg Tyr Leu Asp Lys
35 40
<210> 12
<211> 38
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<400> 12
Xaa Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Tyr Leu Asp Gly
1 5 10 15
Gly Gly His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met
20 25 30
Glu Glu Glu Ala Val Lys
35
<210> 13
<211> 30
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<220>
<221> ВАРИАНТ
<222> (16)
<223> Xaa представляет собой альфа-метил-глутаминовую кислоту
<220>
<221> ВАРИАНТ
<222> (20)
<223> Xaa представляет собой альфа-метил-глутаминовую кислоту
<400> 13
Xaa Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Tyr Leu Asp Xaa
1 5 10 15
Glu Ala Val Xaa Leu Phe Ile Glu Trp Leu Met Asn Thr Lys
20 25 30
<210> 14
<211> 37
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<220>
<221> ВАРИАНТ
<222> (20)
<223> Xaa представляет собой альфа-метил-глутаминовую кислоту
<220>
<221> ВАРИАНТ
<222> (24)
<223> Xaa представляет собой альфа-метил-глутаминовую кислоту
<400> 14
Xaa Gly Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Tyr Leu Asp Glu
1 5 10 15
Glu Ala Val Xaa Leu Phe Ile Xaa Trp Leu Met Asn Thr Lys Arg Asn
20 25 30
Arg Asn Asn Ile Ala
35
<210> 15
<211> 37
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<220>
<221> ВАРИАНТ
<222> (24)
<223> Xaa представляет собой альфа-метил-глутаминовую кислоту
<400> 15
Xaa Gly Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Tyr Leu Asp Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Xaa Trp Leu Met Asn Thr Lys Arg Asn
20 25 30
Arg Asn Asn Ile Ala
35
<210> 16
<211> 34
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<400> 16
Xaa Ser Gln Gly Thr Phe Thr Ser Asp Leu Ser Arg Gln Leu Glu Gly
1 5 10 15
Gly Gly His Ser Gln Gly Thr Phe Thr Ser Asp Leu Ser Arg Gln Leu
20 25 30
Glu Lys
<210> 17
<211> 37
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<400> 17
Xaa Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Tyr Leu Asp Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Ile Arg Asn Thr Lys Arg Asn
20 25 30
Arg Asn Asn Ile Ala
35
<210> 18
<211> 40
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<400> 18
Xaa Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Tyr Leu Asp Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Ile Arg Asn Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Ser Lys
35 40
<210> 19
<211> 37
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<220>
<221> ВАРИАНТ
<222> (16),(20)
<223> аминокислоты в положении 16 и положении 20 образуют кольцо
<400> 19
Xaa Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Tyr Leu Asp Glu
1 5 10 15
Glu Ala Val Lys Leu Phe Ile Glu Trp Ile Arg Asn Thr Lys Arg Asn
20 25 30
Arg Asn Asn Ile Ala
35
<210> 20
<211> 40
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<220>
<221> ВАРИАНТ
<222> (16),(20)
<223> аминокислоты в положении 16 и положении 20 образуют кольцо
<400> 20
Xaa Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Tyr Leu Asp Glu
1 5 10 15
Glu Ala Val Lys Leu Phe Ile Glu Trp Ile Arg Asn Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Ser Lys
35 40
<210> 21
<211> 37
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<400> 21
Xaa Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Gln Leu Glu Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Val Arg Asn Thr Lys Arg Asn
20 25 30
Arg Asn Asn Ile Ala
35
<210> 22
<211> 30
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой дезамино-гистидил
<220>
<221> ВАРИАНТ
<222> (16),(20)
<223> аминокислоты в положении 16 и положении 20 образуют кольцо
<400> 22
Xaa Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu
1 5 10 15
Lys Arg Ala Lys Glu Phe Val Gln Trp Leu Met Asn Thr Lys
20 25 30
<210> 23
<211> 29
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (2)
<223> Xaa представляет собой аминоизомасляную кислоту
<400> 23
His Xaa Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu
1 5 10 15
Lys Arg Ala Lys Glu Phe Val Cys Trp Leu Met Asn Thr
20 25
<210> 24
<211> 30
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (2)
<223> Xaa представляет собой аминоизомасляную кислоту
<400> 24
His Xaa Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu
1 5 10 15
Lys Arg Ala Lys Glu Phe Val Gln Trp Leu Met Asn Thr Cys
20 25 30
<210> 25
<211> 30
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (2)
<223> Xaa представляет собой аминоизомасляную кислоту
<220>
<221> ВАРИАНТ
<222> (16),(20)
<223> аминокислоты в положении 16 и положении 20 образуют кольцо
<400> 25
His Xaa Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu
1 5 10 15
Lys Arg Ala Lys Glu Phe Val Gln Trp Leu Met Asn Thr Cys
20 25 30
<210> 26
<211> 30
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (2)
<223> Xaa представляет собой аминоизомасляную кислоту
<220>
<221> ВАРИАНТ
<222> (12),(16)
<223> аминокислоты в положении 12 и положении 16 образуют кольцо
<400> 26
His Xaa Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu
1 5 10 15
Lys Arg Ala Lys Glu Phe Val Gln Trp Leu Met Asn Thr Cys
20 25 30
<210> 27
<211> 29
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (2)
<223> Xaa представляет собой аминоизомасляную кислоту
<220>
<221> ВАРИАНТ
<222> (16),(20)
<223> аминокислоты в положении 16 и положении 20 образуют кольцо
<400> 27
His Xaa Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Cys Trp Leu Met Asn Thr
20 25
<210> 28
<211> 29
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (2)
<223> Xaa представляет собой аминоизомасляную кислоту
<400> 28
His Xaa Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu
1 5 10 15
Lys Arg Ala Lys Glu Phe Val Gln Trp Leu Met Asn Thr
20 25
<210> 29
<211> 30
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (1)
<223> Xaa представляет собой 4-имидазоацетил
<220>
<221> ВАРИАНТ
<222> (2)
<223> Xaa представляет собой аминоизомасляную кислоту
<220>
<221> ВАРИАНТ
<222> (16),(20)
<223> аминокислоты в положении 16 и положении 20 образуют кольцо
<400> 29
Xaa Xaa Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu
1 5 10 15
Lys Arg Ala Lys Glu Phe Val Gln Trp Leu Met Asn Thr Cys
20 25 30
<210> 30
<211> 30
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (2)
<223> Xaa представляет собой аминоизомасляную кислоту
<220>
<221> ВАРИАНТ
<222> (16),(20)
<223> аминокислоты в положении 16 и положении 20 образуют кольцо
<400> 30
His Xaa Gln Gly Thr Phe Thr Ser Asp Tyr Ala Lys Tyr Leu Asp Glu
1 5 10 15
Lys Arg Ala Lys Glu Phe Val Gln Trp Leu Met Asn Thr Cys
20 25 30
<210> 31
<211> 30
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> производное оксинтомодулина
<220>
<221> ВАРИАНТ
<222> (2)
<223> Xaa представляет собой аминоизомасляную кислоту
<220>
<221> ВАРИАНТ
<222> (16),(20)
<223> аминокислоты в положении 16 и положении 20 образуют кольцо
<400> 31
Tyr Xaa Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu
1 5 10 15
Lys Arg Ala Lys Glu Phe Val Gln Trp Leu Met Asn Thr Cys
20 25 30
<210> 32
<211> 8
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> группа R2
<400> 32
Lys Arg Asn Arg Asn Asn Ile Ala
1 5
<210> 33
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> группа R2
<400> 33
Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser
1 5 10
<210> 34
<211> 11
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> группа R2
<400> 34
Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser Lys
1 5 10
<210> 35
<211> 15
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> группа R2
<400> 35
His Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp
1 5 10 15
<210> 36
<211> 16
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> группа R2
<400> 36
His Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Tyr Leu Asp Lys
1 5 10 15
<210> 37
<211> 20
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> группа R2
<400> 37
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu
1 5 10 15
Glu Ala Val Lys
20
<210> 38
<211> 28
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> группа A или B
<400> 38
Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Ser Arg
1 5 10 15
Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr
20 25
<210> 39
<211> 28
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> группа A или B
<400> 39
Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu Glu
1 5 10 15
Ala Val Arg Leu Phe Ile Glu Trp Leu Met Asn Thr
20 25
<210> 40
<211> 28
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> группа A или B
<400> 40
Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu Arg
1 5 10 15
Arg Ala Gln Asp Phe Val Ala Trp Leu Lys Asn Thr
20 25
<210> 41
<211> 28
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> группа A или B
<400> 41
Gly Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Tyr Leu Glu Glu Glu
1 5 10 15
Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly
20 25
<210> 42
<211> 28
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> группа A или B
<400> 42
Gly Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Gln Met Glu Glu Glu
1 5 10 15
Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly
20 25
<210> 43
<211> 26
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> группа A или B
<400> 43
Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Arg Gln Met Glu Glu Glu
1 5 10 15
Ala Val Arg Leu Phe Ile Glu Trp Ala Ala
20 25
<210> 44
<211> 28
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> группа A или B
<400> 44
Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Gln Met Glu Glu Glu
1 5 10 15
Ala Val Arg Leu Phe Ile Glu Trp Leu Met Asn Gly
20 25
<210> 45
<211> 24
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> группа B
<400> 45
Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Arg Gln Met Glu Glu Glu
1 5 10 15
Ala Val Arg Leu Phe Ile Glu Trp
20
<210> 46
<211> 14
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> группа B
<400> 46
Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Arg Tyr Leu Asp
1 5 10
<210> 47
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 47
cccggccccc gcggccgcta ttcgaaatac 30
<210> 48
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 48
gaacggtccg gaggacgtcg actcttaaga tag 33
<210> 49
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 49
cagcgacacc gaccgtcccc ccgtacttaa ggcc 34
<210> 50
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 50
ctaaccgact ctcggggaag actgagctcg cc 32
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Конъюгат, содержащий оксинтомодулин и фрагмент иммуноглобулина, и его применение | 2012 |
|
RU2733544C2 |
| Композиция для лечения гиперлипидемии, содержащая производное оксинтомодулина | 2013 |
|
RU2768853C1 |
| ПЕПТИДНЫЙ АНАЛОГ АЦИЛИРОВАННОГО ОКСИНТОМОДУЛИНА | 2018 |
|
RU2752787C1 |
| ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ КОНЪЮГАТА ТРОЙНОГО АГОНИСТА ДЛИТЕЛЬНОГО ДЕЙСТВИЯ, ОБЛАДАЮЩЕГО АКТИВНОСТЯМИ В ОТНОШЕНИИ ВСЕХ ИЗ РЕЦЕПТОРОВ ГЛЮКАГОНА /GLP-1/GIP, ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ ЛЕГКОГО | 2020 |
|
RU2829342C1 |
| Терапевтическое применение глюкагона и включающей его комбинации | 2019 |
|
RU2838895C2 |
| ДВОЙНОЙ АГОНИСТ РЕЦЕПТОРОВ ГЛЮКАГОНОПОДОБНОГО ПЕПТИДА-1 И ГЛЮКАГОНА ДЛИТЕЛЬНОГО ДЕЙСТВИЯ | 2021 |
|
RU2799327C1 |
| Жидкая композиция | 2021 |
|
RU2838973C1 |
| МУЛЬТИРЕЦЕПТОРНЫЙ АГОНИСТ И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2816492C2 |
| БИСПЕЦИФИЧЕСКИЙ БЕЛОК | 2019 |
|
RU2784486C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ПОЛИПЕПТИД | 2019 |
|
RU2777095C1 |
Настоящее изобретение относится к области биотехнологии, конкретно к получению пептидов, способных к активации рецептора глюкагонподобного рецептора-1 (GLP-1) и рецептора глюкагона, и может быть использовано в медицине для предупреждения или лечения ожирения. Изобретение обеспечивает получение пептида, обладающего более высокой активностью в отношении рецепторов GLP-1 и глюкагона по сравнению с нативным оксинтомодулином при пониженных побочных эффектах. 6 н. и 2 з.п. ф-лы, 1 ил., 2 табл., 3 пр.
1. Пептид, способный к активации рецептора глюкагонподобного рецептора-1 (GLP-1) и рецептора глюкагона, содержащий аминокислотную последовательность SEQ ID NO: 2, 23, 27 или 29-31.
2. Пептид по п. 1, где пара аминокислот по положениям 16 и 20 аминокислотной последовательности указанного пептида образует кольцо.
3. Фармацевтическая композиция для предупреждения или лечения ожирения, содержащая фармацевтически эффективное количество пептида по п. 1 или 2 в качестве активного ингредиента и фармацевтически приемлемый носитель.
4. Способ предупреждения или лечения ожирения, включающий введение субъекту фармацевтической композиции по п. 3 в комбинации либо в сочетании с другими фармацевтическими препаратами, проявляющими профилактические или терапевтические эффекты в отношении ожирения.
5. Способ по п. 4, где фармацевтический препарат, проявляющий профилактические или терапевтические эффекты в отношении ожирения, выбран из группы, состоящей из агониста рецептора GLP-1, агониста рецептора лептина, ингибитора дипептидилпептидазы-IV (DPP-IV), антагониста рецептора Y5, антагониста рецептора меланин-концентрирующего гормона (МСН), агониста рецептора Y2/3, агониста меланокортиновых рецепторов 3/4 (МС3/4), ингибитора желудочной/панкреатической липазы, агониста серотонинового рецептора 2 с типа (5НТ2с), агониста рецептора β3А, агониста рецептора амилина, антагониста грелина и антагониста рецептора грелина.
6. Способ предупреждения или лечения ожирения, включающий стадию введения субъекту пептида по п. 1 или 2 или композиции по п. 3.
7. Применение пептида по п. 1 или 2 или композиции по п. 3 в изготовлении лекарственных средств для предупреждения или лечения ожирения.
8. Применение пептида по п. 1 или 2 или композиции по п. 3 для предупреждения или лечения ожирения.
| US 2010190701 A1, 29.07.2010 | |||
| DAY J.W | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Chem | |||
| Biol., 2009, v.5, n.10, p.749-757 | |||
| WO 2010096052 A1, 26.08.2010 | |||
| WO 2006134340 A2, 21.12.2006 | |||
| WO 2007100535 A2, 07.09.2007 | |||
| ШЛАНГОВЫЙ ЗАТВОР | 2005 |
|
RU2300037C2 |
| ПРИМЕНЕНИЕ ОКСИНТОМОДУЛИНА, СПОСОБ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ИЗБЫТОЧНОЙ МАССЫ ТЕЛА | 2002 |
|
RU2351359C2 |
| EA 200701704 A1, 28.02.2008 | |||
| WO 2005087797 A1 | |||
Авторы
Даты
2020-12-21—Публикация
2012-06-07—Подача