Область техники, к которой относится изобретение
Настоящее изобретение относится к ацилированным аналогам пептида оксинтомодулина с улучшенной фармакокинетической активностью двойного агониста рецепторов ГПП-1 и глюкагона, а также к включающей их фармацевтической композиции, для профилактики или лечения ожирения и избыточной массы тела или, сопровождающего их инсулиннезависимого диабета.
Предшествующий уровень техники
Метаболические заболевания, или метаболический синдром обычно вызываются нарушениями метаболизма глюкозы, жиров, белков и др. Термин обычно относится к различным заболеваниям, вызванным нарушениями метаболизма глюкозы и жиров, включая рак, диабет, расстройства костного метаболизма, стеатоз печени, ожирение и сердечно-сосудистые заболевания. Согласно отчету Национальной образовательной программы по холестерину (NCEP) США за 2001 год и публикациям Международной диабетической федерации (IDF) за 2012 год, для диагностики метаболического синдрома необходимо наличие трех или более из следующих пяти факторов: (1) абдоминальное ожирение, на которое указывает окружность талии 102 см (NCEP) или 94 см (IDF) для мужчин и 88 см (NCEP) или 80 см (IDF) для женщин; (2) гипертриглицеридемия, на которую указывает уровень триглицеридов 150 мг/дл или выше; (3) уровень холестерина ЛПВП 40 мг/дл или ниже (у мужчин) или 50 мг/дл или ниже (у женщин); (4) гипертензия, на которую указывает артериальное давление 130/85 мм рт.ст. или выше; (5) уровень глюкозы натощак 110 мг/дл или выше.
По данным Всемирной организации здравоохранения (ВОЗ), с 1980 по 2014 год распространенность ожирения в мире увеличилась более чем вдвое. В 2014 году 39% взрослых в возрасте 18 лет и старше (38% мужчин и 40% женщин) имели избыточную массу тела, и 13% (11% мужчин, 15% женщин) страдали ожирением. Первопричиной ожирения и избыточной массы тела является энергетический дисбаланс между потреблением и расходом калорий, причинами которого являются диета с высоким содержанием жиров и высокой энергетической плотностью и снижение физической активности в связи с характером современного труда и образа жизни, изменением режимов передвижения и ростом урбанизации.
Распространенность сахарного диабета (или диабета), являющегося одним из заболеваний, связанных с ожирением, также быстро растет; 4,7% взрослых в возрасте 18 лет и старше страдали диабетом в 1980 по сравнению с 8,5% в 2015. Распространенность диабета повышается быстрее в странах со средним и низким уровнем дохода и является одной из основных причин слепоты, почечной недостаточности, остановки сердца и инсульта.
Глюкагон - это гормон, вырабатываемый альфа-клетками поджелудочной железы. Он повышает концентрацию глюкозы, стимулируя глюконеогенез и способствуя расщеплению гликогена, хранящегося в печени. Когда запасы гликогена в печени истощаются, глюкагон стимулирует печень и почки к синтезу новой глюкозы. Также известно, что он влияет на подавление аппетита и расщепление запасов триглицеридов на жирные кислоты, вызывая усиление метаболизма и тем самым влияя на потерю массы тела (Diabetes.co.uk. the global diabetes community, Anim Sci J. 2016;87(9):1090-1098).
Глюкагоноподобный пептид-1 (ГПП-1), производное глюкагона, представляет собой пептидный гормон, снижающий уровень глюкозы в крови. ГПП-1 секретируется L-клетками в тонком кишечнике после приема пищи и имеет очень короткий период полувыведения, менее 2 минут. Сообщается, что глюкоза увеличивает секрецию ГПП-1, который индуцирует секрецию инсулина бета-клетками поджелудочной железы, в конечном итоге контролируя уровень глюкозы в крови и улучшая функцию бета-клеток. ГПП-1 также подавляет секрецию глюкагона, ингибирует опорожнение желудка и снижает потребление пищи (Physiol Rev. 2007;87(4):1409-1439).
Лираглутид компании Novo Nordisk представляет собой производное человеческого ГПП-1, которое было разработано для лечения диабета 2 типа и ожирения, и предназначено для инъекций один раз в день. Лираглутид является агонистом рецептора ГПП-1 длительного действия, который связывается с тем же рецептором, что и эндогенный ГПП-1, стимулирующий секрецию инсулина, тем самым модулируя уровень глюкозы в крови, снижая аппетит, подавляя увеличение массы тела и снижая уровень триглицеридов. Он продавался в США и Европе под названиями «Виктоза» для лечения диабета 2 типа и «Саксенда» для лечения ожирения (Expert Rev Cardiovasc Ther. 2015;13(7):753-767). Эксенатид, ликсисенатид, альбиглутид, дулаглутид и семаглутид также были разработаны в качестве противодиабетических препаратов. Однако сообщалось о побочных эффектах этих агонистов рецептора ГПП-1, таких как тошнота, рвота и снижение аппетита, головная боль и запор, а также вздутие живота (Korean J Med. 2014;87(1):9-13).
Оксинтомодулин представляет собой пептид, полученный из проглюкагона, предшественника глюкагона, и является пептидом из 37 аминокислот, включающим полную 29-аминокислотную последовательность глюкагона. Известно, что оксинтомодулин является двойным агонистом, который может связываться как с рецепторами ГПП-1, так и с рецепторами глюкагона. В неклинических исследованиях сообщалось, что оксинтомодулин приводит к снижению потребления пищи, потере массы тела, увеличению расхода энергии и улучшению метаболизма глюкозы (Diabetes. 2009;58(10):2258-2266). В клинических исследованиях оксинтомодулин продемонстрировал снижение массы тела в среднем на 2,3 кг при подкожном введении в течение 4 недель, 3 раза в день у пациентов с избыточной массой тела и ожирением (Diabetes. 2005; 54: 2390-2395), а также показал значительный эффект в отношении секреции инсулина и снижения уровня глюкозы в крови по сравнению с плацебо (Diabetes. 2013; 62 (Suppl. 1): A48); в другом клиническом исследовании было показано, что постоянное применение оксинтомодулина снижает потребление энергии без побочных эффектов, таких как рвота или стимуляция аппетита (J Clin Endocrinol Metab. 2003; 88:4696-4701). Эффективность оксинтомодулина в контроле гликемии, снижении потребления пищи и стимуляции чувства сытости вызвала интерес в связи с его потенциалом в качестве нового метода лечения ожирения и контроля гликемии (Molecular metabolism. 2014; 3: 241-251).
Однако, поскольку оксинтомодулин, как и ГПП-1, может расщепляться дипептидилпептидазой-IV (ДПП-IV), он нестабилен in vivo и имеет очень короткий период полувыведения in vivo (J Biol Chem. 2003; 278: 22418- 22423).
Таким образом, имеются сообщения об исследованиях производных оксинтомодулина, устойчивых к ДПП-IV, которые могут избирательно связываться с рецепторами ГПП-1 и глюкагона сбалансированным образом, чтобы поддерживать фармакологическое и терапевтическое действие оксинтомодулина в течение длительного периода времени и преодолевать побочные эффекты каждого гормонального пептида (Diabetes. 2009; 58(10):2258-2266), и несколько компаний, включая Merck, Zealand, Medimmune и Hanmi Pharmaceutical, занимаются разработкой потенциальных соединений.
Корейская патентная заявка № 2017-0103798 и Корейская патентная заявка № 2018-0095717 раскрывают ацилированные аналоги пептида оксинтомодулина, обладающие двойным действием на рецепторы ГПП-1 и глюкагона. Среди ацилированных аналогов пептида оксинтомодулина, описанных в вышеупомянутом предшествующем уровне техники, Соединение 3 обладает превосходной эффективностью (EC50 <10 пМ) в отношении рецепторов ГПП-1 и глюкагона по сравнению с эндогенным гормоном оксинтомодулином, чрезвычайно высокой активностью в отношении рецепторов ГПП-1 и глюкагона и проявляет лучший эффект потери массы тела, по сравнению с лираглутидом, контрольным соединением, в 1-недельной оценке потери массы тела in vivo у мышей.
В процессе разработки вышеуказанного Соединения 3 для коммерческого использования авторы настоящего изобретения провели фармакокинетические исследования на мышах и обнаружили, что период полувыведения соединения составляет 3,3 часа, что аналогично периоду полувыведения MEDI0382 компании Medimmune, составляющему 4,0 часа (таблица 6, фиг. 1). MEDI0382 в настоящее время проходит клинические испытания в форме инъекции один раз в день. Соединение 3 может быть представлено в виде препарата для инъекций один раз в день, учитывая, что его период полувыведения сопоставим с периодом полувыведения MEDI0382. Однако препараты двойного агониста рецепторов ГПП-1 и глюкагона, предназначенные для приема один раз в сутки, имеют недостатки, требующие ежедневного введения путем инъекции.
Таким образом, авторы настоящего изобретения признали необходимость разработки ацилированного аналога пептида оксинтомодулина длительного действия, который можно применять в виде инъекции один раз в неделю для повышения удобства за счет увеличения периода полувыведения in vivo при сохранении эффективности лекарственного средства.
В попытках разработать пролонгированный двойной агонист рецепторов ГПП-1 и глюкагона, отвечающий вышеуказанным требованиям, авторы настоящего изобретения усовершенствовали Соединение 3, аналог ацилированного пептида оксинтомодулина, раскрытый в Корейской патентной заявке № 2018-0095717, для разработки ацилированного аналога пептида оксинтомодулина длительного действия, который обладает двойным агонизмом в отношении рецепторов ГПП-1/глюкагона и длительным периодом полувыведения in vivo за счет улучшения метаболической стабильности и, таким образом, может быть введен один раз в неделю в виде инъекции, что составляет предмет настоящего изобретения.
Подробное описание изобретения
Техническая проблема, решаемая изобретением
Задачей настоящего изобретения является создание ацилированного аналога пептида оксинтомодулина, обладающего двойным агонизмом в отношении рецепторов ГПП-1 и глюкагона с увеличенным периодом полувыведения in vivo. Другой задачей настоящего изобретения является разработка фармацевтической композиции для профилактики или лечения состояния, вызванного или характеризующегося ожирением и избыточной массой тела, или инсулиннезависимого сахарного диабета, сопровождающегося ожирением или избыточной массой тела, включающей ацилированный аналог пептида оксинтомодулина. Другой задачей является создание инъекционного препарата, содержащего ацилированный аналог пептида оксинтомодулина в качестве активного ингредиента, который можно вводить один раз в неделю.
Техническое решение
В качестве решения вышеупомянутой проблемы настоящее изобретение предлагает новый ацилированный аналог пептида оксинтомодулина, имеющий следующую химическую формулу I:
Химическая формула I
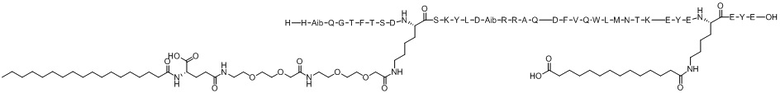
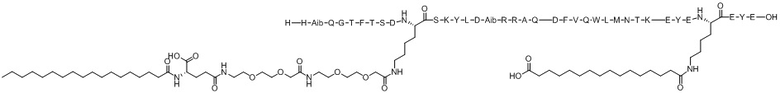
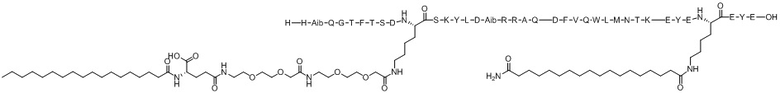
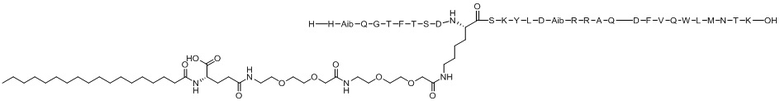
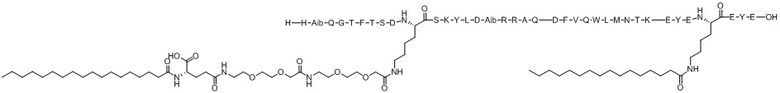
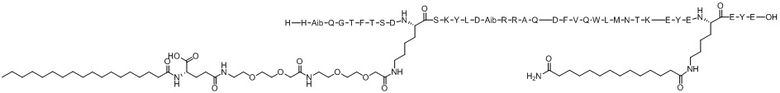
His-Aib-Gln-Gly-Thr-Phe-Thr-Ser-Asp-X1-Ser-Lys-Tyr-Leu-Asp-Aib-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-Lys-Glu-Tyr-Glu-X2-Glu-Tyr-Glu (SEQ ID NO.14)
В приведенной выше формуле
X1 представляет собой функционализированный Lys с [(2-(2-(2-аминоэтокси)этокси)ацетоил)2]-[гамма-глутамил]-[октадеканоилом], конъюгированным с его боковой цепью;
X2 представляет собой функционализированный Lys с липофильным липидом, или спейсером-липофильным липидом, или полимерным фрагментом-спейсером-липофильным липидом, или спейсером-полимерным фрагментом-спейсером-липофильным липидом, конъюгированным с его боковой цепью;
липофильный липид имеет следующую структурную формулу (1) или (2):
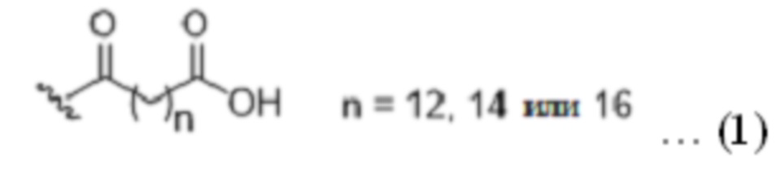
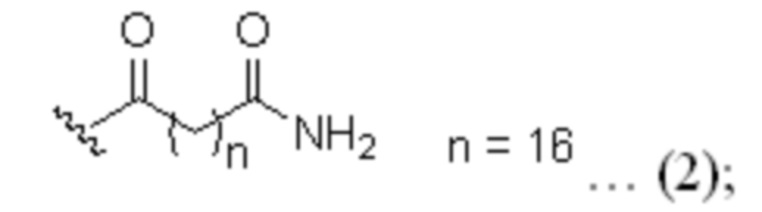
полимерный фрагмент представляет собой 1-3 (один или два, или три) 2-(2-(2-аминоэтокси)этокси)ацетоила; и
спейсер представляет собой r-Glu или Lys.
В настоящем изобретении для обозначения аминокислот используются следующие трехбуквенные и/или однобуквенные сокращения:
Ala (A), Lys (K), Asn (N), Asp (D), Cys (C), His (H), Ile (I), Met (M), Ser (S), Val (V), Gly (G), Leu (L), Pro (P), Thr (T), Phe (F), Arg (R), Tyr (Y), Trp (W), Glu (E), Gln (Q), Aib (аминоизомасляная кислота).
Используемый в настоящей заявке термин «оксинтомодулин» относится к пептиду, полученному из преглюкагона, предшественника глюкагона, а оксинтомодулин дикого типа имеет аминокислотную последовательность HSQGTFTSDYSKYLDSRRAQDFVQWLMNTKRNRNNIA (SEQ ID NO: 1).
В липофильном липиде, который является одним из компонентов X2, ацильная группа на липидном конце может быть присоединена к аминогруппе в боковой цепи Lys или в спейсере посредством амидной связи и содержит насыщенную углеводородную цепь C14-C18, если концевой углерод углеводородной цепи представляет собой карбоновую кислоту, или насыщенную углеводородную цепь C18, если концевой углерод углеводородной цепи находится в форме аминокарбоновой кислоты.
Спейсер представляет собой r-Glu или Lys, а аминогруппа аминокислотного остатка Lys или α-аминогруппа r-Glu может быть ковалентно связана с липофильным липидом или полимерным фрагментом.
Хотя настоящее изобретение не следует рассматривать как ограниченное в интерпретации конкретной теорией, считается, что ацилирование X1 вышеупомянутой Химической формулы I стабилизирует альфа-спиральную структуру пептида, повышая его фармакологическую эффективность или селективность на рецепторе ГПП-1 и/или рецепторе глюкагона (ACS Chem Biol. 2016; 11:324-328), и считается, что семь аминокислотных концевых остатков, включая X2 (EYEX2EYE), связываются с альбумином в кровотоке, тем самым предотвращая реакцию соединения по настоящему изобретению в качестве субстрата с различным деградирующими такой субстрат ферментами в кровотоке, таким образом улучшая период полувыведения соединения in vivo (Nat. Commun. 2017; 8:16092).
Варианты осуществления пептида химической формулы I представляют собой соединение 1 (SEQ ID NO: 2), соединение 2 (SEQ ID NO: 3), соединение 3 (SEQ ID NO: 4), соединение 4 (SEQ ID NO: 5), соединение 5 (SEQ ID NO: 6), соединение 6 (SEQ ID NO: 7) и соединение 7 (SEQ ID NO: 8).
Ацилированный аналог пептида оксинтомодулина по настоящему изобретению может быть представлен в виде кислотно-аддитивной соли любой аминогруппы, присутствующей в его структуре, карбоксилатной соли любой карбоксигруппы, или его щелочно-аддитивной соли.
Кроме того, настоящее изобретение относится к фармацевтической композиции для профилактики и лечения ожирения и избыточной массы тела, или инсулиннезависимого сахарного диабета, сопровождающегося ожирением или избыточной массой тела, включающей вышеуказанный ацилированный аналог пептида оксинтомодулина в качестве активного ингредиента и фармацевтически приемлемый эксципиент.
Используемый в настоящей заявке термин «профилактика» относится к любому действию, которое подавляет или замедляет начало целевого заболевания. Термин «лечение» относится к любому действию, которое смягчает, улучшает или облегчает симптомы развивающегося состояния или заболевания.
Поскольку ацилированный аналог пептида оксинтомодулина по настоящему изобретению является двойным агонистом рецептора глюкагона и рецептора ГПП-1, он проявляет как эффекты ГПП-1 в отношении потребления пищи, так и эффекты глюкагона в отношении метаболизма жиров и расхода энергии. Таким образом, фармацевтическая композиция для профилактики и лечения ожирения и избыточной массы тела, включающая ацилированный аналог пептида оксинтомодулина по настоящему изобретению, может оказывать благоприятное с медицинской точки зрения воздействие на контроль массы тела за счет комбинированного эффекта удаления чрезмерно накопленного жира и уменьшения потребления пищи.
Кроме того, фармацевтическая композиция, содержащая ацилированный аналог пептида оксинтомодулина по настоящему изобретению, может быть использована для профилактики или лечения сахарного диабета, сопровождающего ожирение или избыточную массу тела, путем снижения уровня глюкозы в крови. В частности, ее можно использовать для лечения диабета 2 типа, то есть инсулиннезависимого сахарного диабета, сопровождающего ожирение. Хотя не предполагается ограничение объема интерпретации конкретной теорией, фармацевтическая композиция, содержащая ацилированный аналог пептида оксинтомодулина по настоящему изобретению, представляет собой производное глюкагона и обладает высокой активностью в отношении рецептора ГПП-1, который снижает уровень глюкозы в крови и, таким образом, полезна для гликемического контроля.
Таким образом, фармацевтическую композицию, содержащую ацилированный аналог пептида оксинтомодулина по настоящему изобретению, можно вводить либо отдельно, либо в комбинации с другими родственными агентами как часть прямого или косвенного лечения любого состояния, вызванного или характеризующегося избыточной массой тела, включая лечение и профилактику ожирения, патологического ожирения, предоперационного патологического ожирения, воспаления, связанного с ожирением, заболевания желчного пузыря, связанного с ожирением, апноэ во сне, вызванного ожирением, и диабета, сопровождающегося ожирением. Кроме того, фармацевтическую композицию, содержащую ацилированный аналог пептида оксинтомодулина по настоящему изобретению, можно вводить отдельно или в комбинации с другими родственными агентами для предотвращения состояний, которые могут возникать в результате повышения массы тела, или могут быть связаны с влиянием массы тела, таких как метаболический синдром, гипертензия, вызывающая атеросклероз дислипидемия, атеросклероз, артериосклероз, ишемическая болезнь сердца или инсульт.
Кроме того, настоящее изобретение относится к инъекционному составу, содержащему ацилированный аналог пептида оксинтомодулина в качестве активного ингредиента, который можно вводить один раз в неделю.
Состав для инъекций, содержащий ацилированный аналог пептида оксинтомодулина по настоящему изобретению, можно использовать в сочетании с буферами, консервантами, анальгетиками, солюбилизаторами, изотоническими агентами, стабилизаторами и т.п.; и он может быть приготовлен в ампулах с единичной дозировкой или в многодозовых лекарственных формах.
Ацилированный аналог пептида оксинтомодулина по настоящему изобретению демонстрирует улучшенную фармакокинетику (время полувыведения in vivo), по сравнению с ацилированным аналогом пептида оксинтомодулина, описанным в Корейской патентной заявке № 2018-0095717. Улучшенный период полувыведения in vivo в настоящем изобретении позволяет повысить удобство использования аналога пептида длительного действия, представляющее собой инъекцию один раз в неделю, которая преодолевает недостатки ежедневной инъекции.
Далее, термин, «введение», используемый в настоящей заявке, включает введение пациенту вещества для терапевтического применения подходящим способом, и фармацевтическая композиция, содержащая ацилированный аналог пептида оксинтомодулина по настоящему изобретению, может быть введена различными путями и в различных формах при условии, что может быть достигнута необходимая эффективность за счет того, что лекарство достигает ткани-мишени. То есть помимо интраперитонеального, внутривенного и внутримышечного введения возможные пути введения также включают подкожное введение, интрадермальное введение, пероральное введение, местное введение, интраназальное введение, внутрилегочное введение и ректальное введение, хотя состав и способ введения особо не ограничиваются.
Фармацевтическая композиция, содержащая ацилированный аналог пептида оксинтомодулина по настоящему изобретению, может содержать фармацевтически приемлемый носитель, включая, без ограничения указанными, связующие вещества, любриканты, дезинтегранты, эксципиенты, солюбилизаторы, диспергаторы, стабилизаторы, суспендирующие агенты, красители, ароматизаторы и т.д. для перорального введения; и различные основы, эксципиенты, любриканты, консерванты и т.д. для местного применения. Примеры носителей, эксципиентов и разбавителей включают лактозу, декстрозу, сахарозу, сорбитол, маннитол, ксилитол, эритритол, мальтитол, крахмал, аравийскую камедь, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния или минеральное масло.
Фармацевтическую композицию, содержащую ацилированный аналог пептида оксинтомодулина по настоящему изобретению, можно приготовить различными способами путем смешивания с указанным выше носителем в дополнение к составу для инъекций. Например, в случае перорального приема она может быть приготовлена в виде таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток и т.д., а также в виде растворов, суспензий, таблеток, пилюль, капсул, препаратов для пролонгированного высвобождения и т.д.
Диапазон доз, согласно настоящему изобретению, варьирует в зависимости от таких факторов, как масса тела пациента, возраст, пол, состояние здоровья, диета, скорость экскреции и тяжесть состояния. Для взрослого пациента подходящая доза может составлять от 0,001 до 500 мг/кг в сутки.
Преимущества изобретения
Настоящее изобретение относится к ацилированному аналогу пептида оксинтомодулина длительного действия, обладающему активностью в отношении рецепторов как ГПП-1, так и глюкагона, и имеющему увеличенный период полувыведения in vivo. В частности, ацилированные аналоги пептида оксинтомодулина в соответствии с настоящим изобретением имеют существенно улучшенное время полувыведения in vivo по сравнению не только с оксинтомодулином дикого типа, но и с обычными ацилированными аналогами пептида оксинтомодулина (Корейская патентная заявка № 10-2018-0095717, ацилированный аналог пептида оксинтомодулина).
Следовательно, настоящее изобретение, включающее ацилированный аналог пептида оксинтомодулина длительного действия с увеличенным периодом полувыведения in vivo, который можно вводить один раз в неделю, преодолевает недостаток существующих составов, требующих ежедневных инъекций, тем самым повышая удобство применения. Кроме того, его можно с пользой применять в первую очередь для профилактики или лечения состояний, вызванных или характеризующихся ожирением или избыточной массой тела, а также для профилактики или лечения инсулиннезависимого сахарного диабета, сопровождающего ожирение или избыточную массу тела.
Краткое описание чертежей
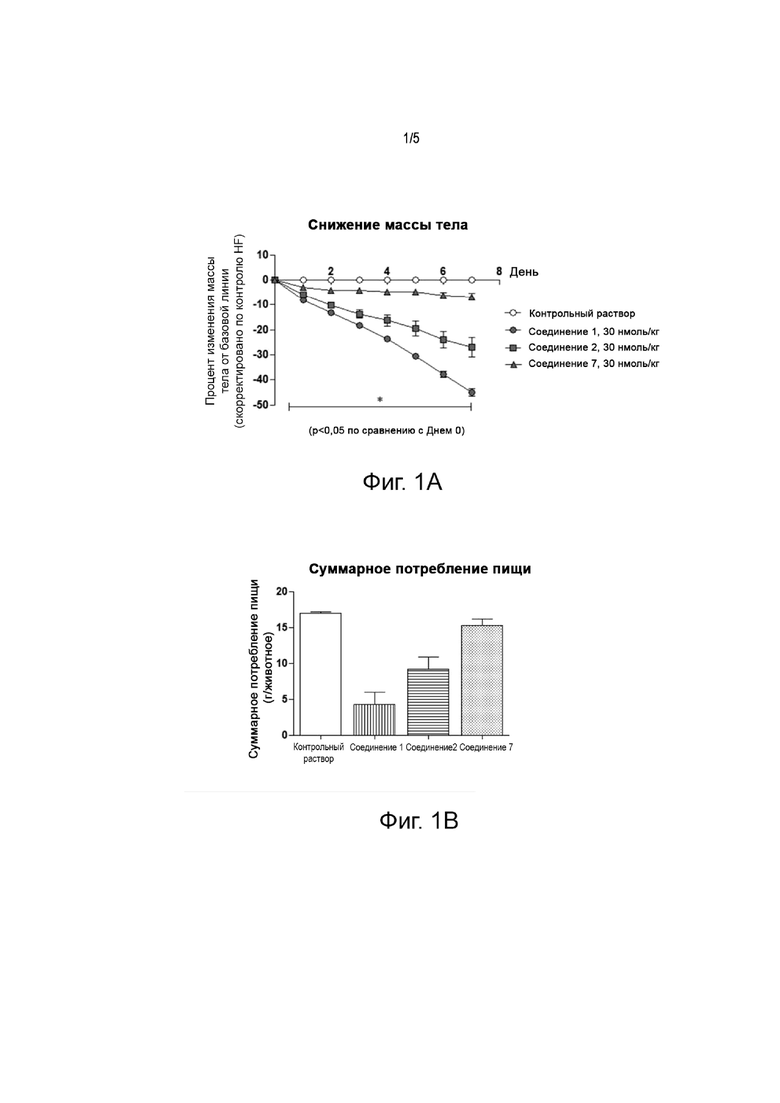
Фиг. 1 представляет собой график, показывающий результаты оценки эффективности снижения массы тела у мышей после одной недели повторных инъекций соединения 1, соединения 2 или соединения 7, соответственно, которые представляют собой ацилированные аналоги пептида оксинтомодулина по настоящему изобретению. На фиг. 1А представлен результат снижения массы тела, а на фиг. 1В - график, показывающий результат суммарного потребления корма.
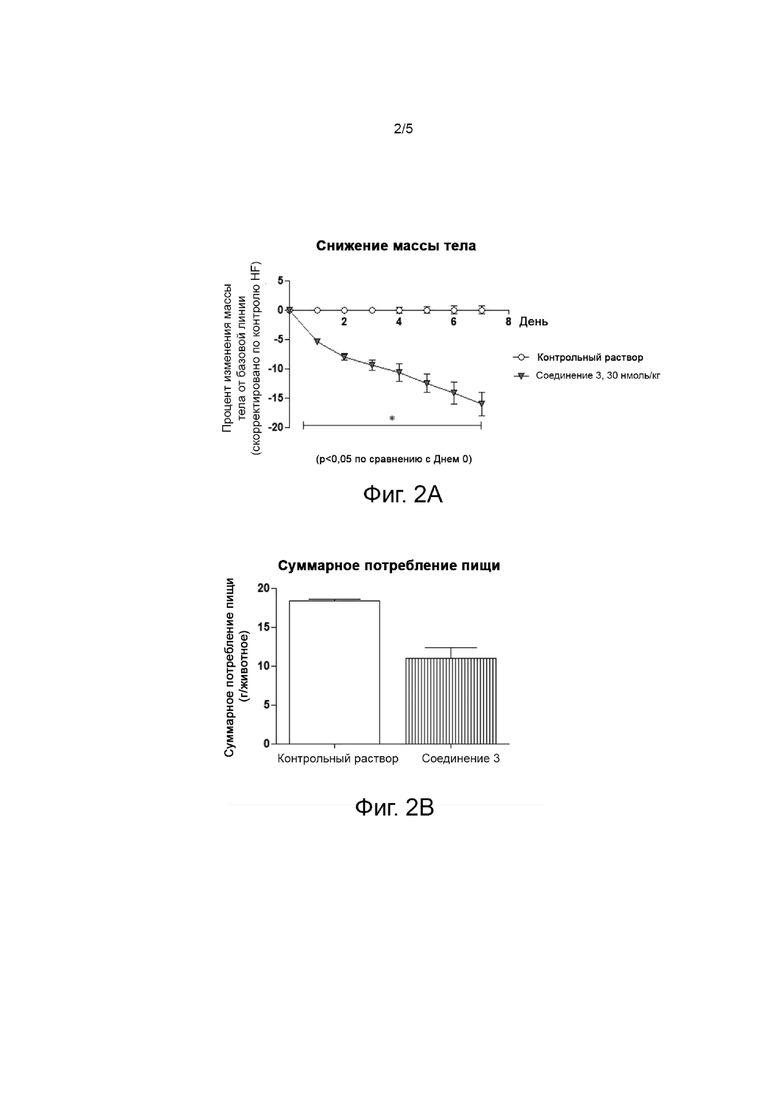
Фиг. 2 представляет собой график, показывающий результаты оценки эффективности лекарственного средства для снижения массы тела у мышей после одной недели повторного введения Соединения 3, которое представляет собой ацилированный аналог пептида оксинтомодулина по настоящему изобретению. На фиг. 2А показаны результаты снижения массы тела, а на фиг. 2В представлен график, показывающий результаты суммарного потребления корма.
Фиг. 3 представляет собой график, показывающий результаты оценки эффективности снижения массы тела у мышей после одной недели повторного введения Соединения 4, Соединения 5 или Соединения 6, соответственно, которые представляют собой ацилированные аналоги пептида оксинтомодулина по настоящему изобретению. На фиг. 3А показаны результаты снижения массы тела, а на фиг. 3В представлен график, показывающий результаты суммарного потребления корма.
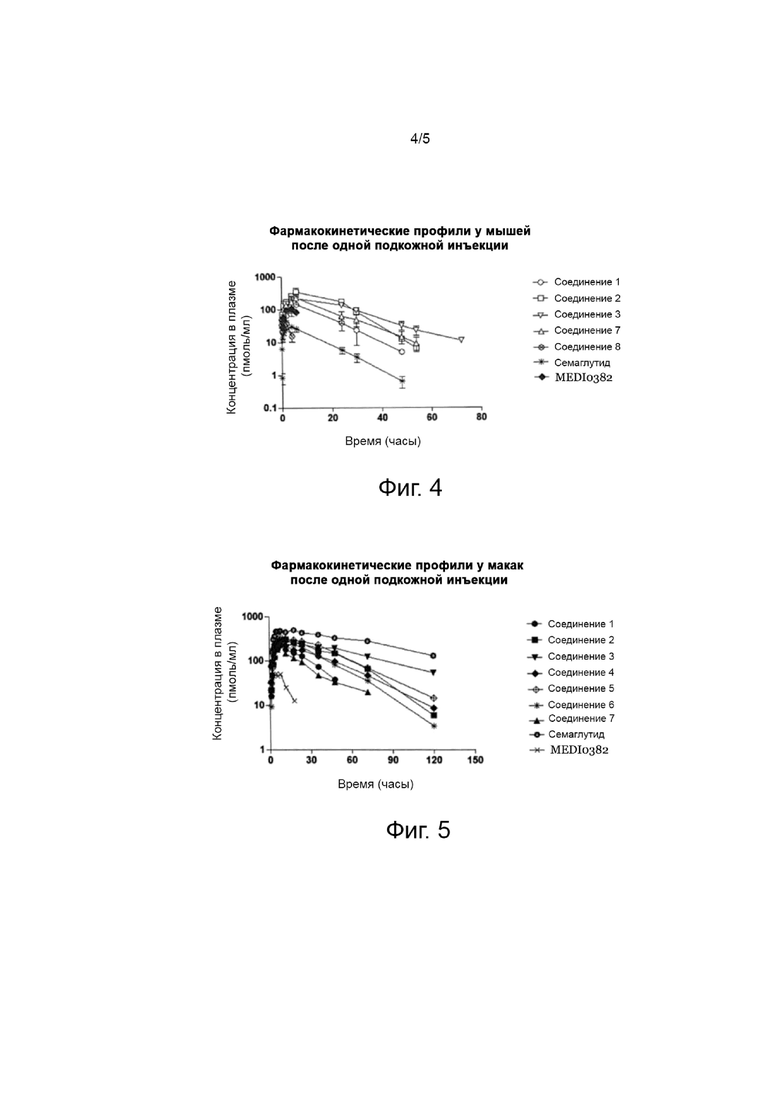
Фиг. 4 представляет собой график, показывающий фармакокинетические результаты после однократного введения мышам ацилированного аналога пептида оксинтомодулина по настоящему изобретению.
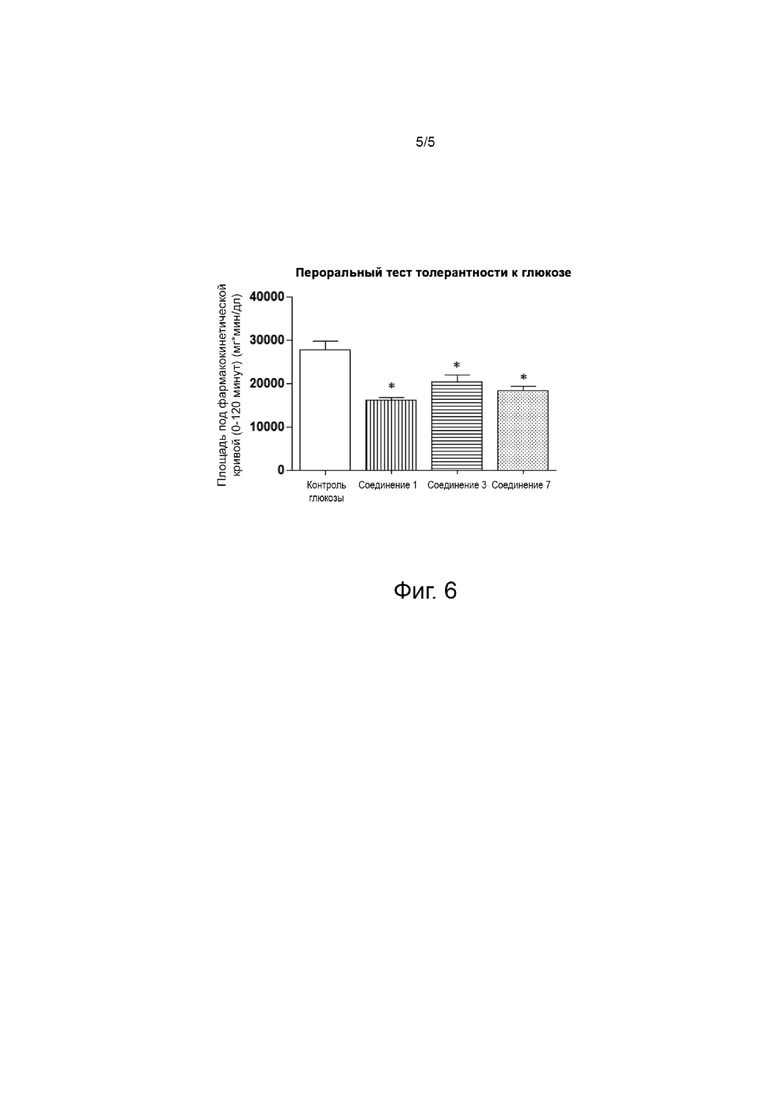
Фиг. 5 представляет собой график, показывающий фармакокинетические результаты после однократного введения обезьянам ацилированного аналога пептида оксинтомодулина по настоящему изобретению.
Фиг. 6 представляет собой график, показывающий результаты анализа улучшения толерантности к глюкозе у мышей при применении ацилированного аналога пептида оксинтомодулина по настоящему изобретению.
Описание вариантов осуществления изобретения
Настоящее изобретение далее подробно описано со ссылкой на следующие примеры и экспериментальные примеры. Эти примеры приведены только в иллюстративных целях, чтобы помочь специалисту в данной области техники понять изобретение, и их никоим образом не следует рассматривать как ограничивающие объем настоящего изобретения.
Пример 1. Синтез ацилированных аналогов пептида оксинтомодулина по настоящему изобретению
Пептиды и канонические пептидные последовательности, содержащие некоторые аминокислоты по настоящему изобретению, могут быть синтезированы или приобретены у коммерческих производителей пептидов, таких как American Peptide Company или Bachem в США, или Anygen в Корее.
Ацилированный аналог пептида оксинтомодулина по настоящему изобретению синтезировали с использованием модели Symphony X (масштаб синтеза: 0,1 ммоль) компании Protein Technologies, Inc. Структуры от соединения 1 (SEQ ID NO: 2) до Соединения 7 (SEQ ID NO: 8), которые представляют собой ацилированные аналоги пептида оксинтомодулина, синтезированные в соответствии с настоящим изобретением, показаны в таблицах 1 и 2. Конкретный процесс синтеза выглядит следующим образом:
Смесь Fmoc-AA-OH (1 ммоль), HBTU (1 ммоль), NMM (н-метилморфолина) (2 ммоль) и ДМФА (7 мл) помещали в смолу, из которой был удален Fmoc, и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор сливали и дважды промывали 7 мл ДМФА (N,N-диметилформамида). Реакцию расщепления Fmoc проводили дважды в течение 5 минут при комнатной температуре с 20% раствором пиперидина в ДМФА (5 мл), и раствор промывали 6 раз ДМФА (7 мл). Этот процесс повторяли с использованием автоматического синтезатора для соединения аминокислот.
Для синтеза боковых цепей Lys осуществляли связывание с использованием Fmoc-K(dde)-OH или Fmoc-K(Alloc)-OH и последнее связывание His с использованием Boc-His(trt)-OH. Синтез функционализированных боковых цепей Lys осуществляли с использованием 2% гидралазинового раствора или тетракис(трифенилфосфин)палладия для удаления защищенных dde или Alloc, а затем проводили связывание необходимых групп боковых цепей (PEG2, rE, K, C14-18 двухосновные кислоты и др.).
К 0,1 ммоль полученной выше пептидной смолы добавляли 8 мл раствора Реагента К (трифторуксусной кислоты, воды, тиоанизола, 1,2-этандиола (87,5; 5,0; 5,0; 2,5)) после охлаждения до 5-10°С, объединяли фильтрат со 100 мл диэтилового эфира для кристаллизации. Твердый отфильтрованный неочищенный пептид очищали препаративной ВЭЖХ с получением целевого соединения.
Спектрометр Shimadzu Axima Assurance MALDI-TOF использовали для анализа молекулярной массы с α-циано-4-гидроксикоричной кислотой (CHCA) в качестве матрицы.
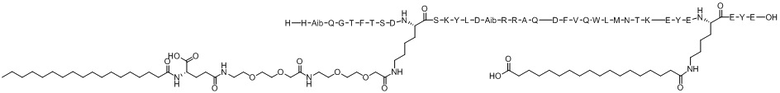
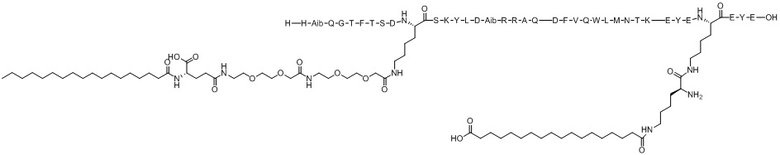
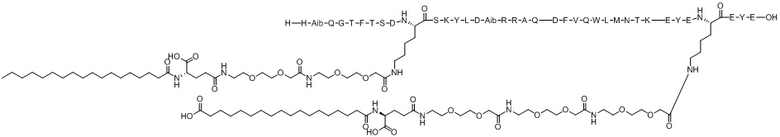
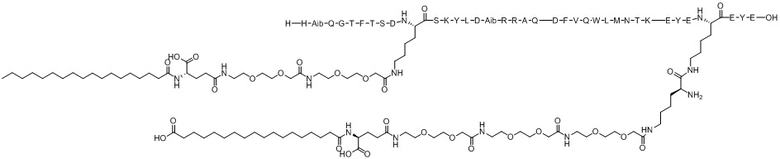
(оригиналь-ный)
Сравнительный пример 1. Синтез ацилированных аналогов пептида оксинтомодулина
Для сравнения с соединением по настоящему изобретению ацилированный аналог пептида оксинтомодулина, имеющий структурное сходство, был синтезирован способом из Примера 1. Следующее соединение 8 из сравнительного примера описан в Корейской патентной заявке № 2018-0095717 как соединение 3 и представляет собой пептидный аналог, который не имеет 7 аминокислот (EYEX2EYE) на С-конце. Соединение 9 из сравнительного примера является пептидным аналогом, представляющим собой соединение 8 из сравнительного примера с добавленным лигандом, упомянутым в литературе (ACS Chem Biol. 2016; 11:324-328). Соединение 10 из сравнительного примера и соединение 11 из сравнительного примера представляют собой пептидные аналоги, имеющие аминокарбоксильную группу на конце углеродной цепи C14 и C16, соответственно, в качестве липофильного липида в X2. Соединение 12 из сравнительного примера представляет собой пептидный аналог, в котором С16 связан с полимерным фрагментом в качестве липофильного липида в X2. Структуры соединения 8 из сравнительного примера и соединения 12 из сравнительного примера показаны в таблицах 3 и 4.
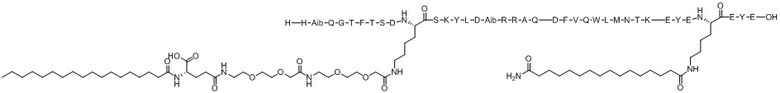
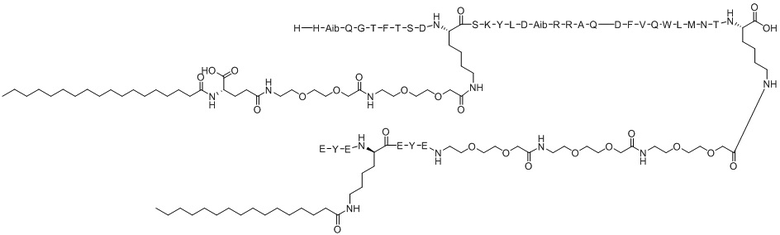
Экспериментальный пример 1. Анализ активации рецепторов ГПП-1 и глюкагона
Человеческие рецепторы ГПП-1 или глюкагона были временно сверхэкспрессированы в клетках, так что ацилированный аналог пептида оксинтомодулина по настоящему изобретению мог активировать рецепторы, что приводило к повышению уровня циклического аденозинмонофосфата (цАМФ), который последовательно активирует элементы ответа на циклический аденозинмонофосфат (CRE). Затем результирующую повышенную активность люциферазы оценивали для анализа влияния на активацию каждого рецептора.
В качестве положительного контроля для соответствующей оценки использовали эндогенный лиганд ГПП-1 или глюкагон. Упомянутые выше ацилированные аналоги пептида оксинтомодулина из сравнительных примеров 8-12 были синтезированы и использованы в качестве сравнительных примеров.
Вектор экспрессии человеческого ГПП-1 или глюкагона («OriGene») транзиторно трансфицировали в клетки яичника китайского хомячка (CHO-K1) с плазмидными ДНК, которые могут индуцировать экспрессию люциферазы светлячка или люциферазы Renilla, с использованием реагента Lipofectamine Plus (Invitrogen). Через 3 часа после трансфекции среду заменяли на альфа-минимальную необходимую среду (α-MEM), содержащую 10% эмбриональной телячьей сыворотки (ЭТС). На следующий день среду заменяли на α-MEM, содержащую ацилированный аналог пептида оксинтомодулина по настоящему изобретению и 0,1% бычьего сывороточного альбумина (БСА). Через 6 часов добавляли реагент для двойного анализа люциферазы (Promega) в том же количестве, что и среду, в которую были погружены клетки, и последовательно измеряли активность люциферазы светлячка и люциферазы Renilla. Значения активности люциферазы светлячка корректировали относительно активности люциферазы Renilla, чтобы получить эффективность трансфекции.
Для измерения эффективности активации рецептора был проведен тест с несколькими концентрациями ацилированного аналога пептида оксинтомодулина по настоящему изобретению, чтобы получить относительную активацию (%) максимального влияния аналога либо на ГПП-1, либо на глюкагон, и концентрацию, указывающую на 50% активацию (EC50) рассчитывали с использованием нелинейного регрессионного анализа. Полученные значения показаны в таблице 5.
активация
(% против ГПП-1)
активация
(% против
глюкагона)
* A: EC50<100 пМ; B: 100 пМ ≤EC50<1000 пМ; C: EC50≥1000 пМ
Экспериментальные результаты показывают, что соединения ацилированных аналогов пептида оксинтомодулина по настоящему изобретению проявляют двойной агонизм в отношении рецепторов ГПП-1 и глюкагона, подобно оксинтомодулину дикого типа, и проявляют достаточную активность, сравнимую с эндогенными гормонами ГПП-1 и глюкагоном, с точки зрения максимальной эффективности.
Экспериментальный пример 2. Оценка эффективности снижения массы тела при повторных инъекциях аналога пептида оксинтомодулина по настоящему изобретению в течение 1 недели
Этот эксперимент был проведен для подтверждения эффективности снижения массы тела для ацилированного аналога пептида оксинтомодулина по настоящему изобретению. Самцов лабораторных мышей (мышь C57BL/6) кормили пищей с высоким содержанием жиров. Мышей с ожирением, вызванным диетой с высоким содержанием жиров, перед началом эксперимента разделили на группы по массе тела. Соединение 1, Соединение 2 и Соединение 7, которые являются примерами согласно настоящему изобретению, получали каждое в стерильной дистиллированной воде для инъекций, содержащей 0,1% Cremophor EL, до дозировки 30 нмоль/кг. Соединения вводили подкожно один раз в день в течение 7 дней, как описано в таблице 6. Массу тела и потребление пищи измеряли один раз в день в одно и то же время каждый день, чтобы оценить эффективность снижения массы тела ацилированных аналогов оксинтомодулина по сравнению с исходной массой тела. Результаты показаны на фиг. 1А и 1В.
Таблица 6. Оценка эффективности снижения массы тела путем многократного введения в течение 1 недели ацилированного пептида оксинтомодулина по настоящему изобретению

По результатам эксперимента значительные изменения массы тела -44,9%, -26,9% и -6,8% от исходной массы тела наблюдались для Соединения 1, Соединения 2 и Соединения 7, соответственно, которые представляют собой ацилированные аналоги пептида оксинтомодулина по настоящему изобретению; а суммарное потребление корма снизилось на 75%, 46% и 10%, соответственно, по сравнению с группой, получавшей контрольный раствор.
Экспериментальный пример 3. Оценка эффективности потери массы тела при повторной инъекции аналога пептида оксинтомодулина по настоящему изобретению в течение 1 недели
Этот эксперимент был проведен для подтверждения эффективности снижения массы тела для ацилированного аналога пептида оксинтомодулина по настоящему изобретению. Самцов лабораторных мышей (мышь C57BL/6) кормили пищей с высоким содержанием жиров. Мышей с ожирением, вызванным диетой с высоким содержанием жиров, перед началом эксперимента разделили на группы по массе тела. Соединение 3, которое представляет собой ацилированный аналог пептида оксинтомодулина согласно варианту осуществления настоящего изобретения, готовили в стерильной дистиллированной воде для инъекций, содержащей 0,1% Cremophor EL, до дозы 30 нмоль/кг. Его вводили подкожно один раз в день в течение 7 дней, как описано в таблице 9. Живую массу и потребление корма измеряли один раз в день в одно и то же время каждый день, чтобы оценить эффективность снижения живой массы с течением времени по сравнению с исходной живой массой, а результаты показаны на фиг. 2А и 2В.
По результатам эксперимента наблюдалось значительное изменение массы тела группы, которой вводили соединение 3, которое представляет собой ацилированный аналог пептида оксинтомодулина по настоящему изобретению, на -16,1% по сравнению с исходным значением, а также суммарное потребление корма было снижено на 40% по сравнению с группой, получавшей контрольный раствор.
Экспериментальный пример 4. Оценка эффективности снижения массы тела при многократном введении в течение 1 недели аналога пептида оксинтомодулина по настоящему изобретению
Этот эксперимент был проведен для подтверждения эффективности снижения массы тела при применении ацилированного аналога пептида оксинтомодулина по настоящему изобретению. Самцов лабораторных мышей (мышь C57BL/6) кормили пищей с высоким содержанием жиров. Мышей с ожирением, вызванным диетой с высоким содержанием жиров, перед началом эксперимента разделили на группы по массе тела. Соединение 4, Соединение 5 или Соединение 6, которые представляют собой ацилированные аналоги пептида оксинтомодулина согласно варианту осуществления настоящего изобретения, готовили в стерильной дистиллированной воде для инъекций, содержащей 0,1% Cremophor EL, до дозы 30 нмоль/кг. Его вводили подкожно один раз в день в течение 7 дней, как описано в таблице 8. Массу тела и потребление корма измеряли один раз в день в одно и то же время каждый день, чтобы оценить эффективность снижения массы тела для ацилированных аналогов пептида оксинтомодулина с течением времени, по сравнению с исходной массой тела, и результаты показаны на фиг. 3А и 3В.
Таблица 8. Оценка эффективности снижения массы тела при многократном введении в течение 1 недели ацилированного пептида оксинтомодулина по настоящему изобретению

По результатам эксперимента значительные изменения массы тела на -24,3%, -30,3% и -26,9% от исходной массы тела наблюдались для соединения 4, соединения 5 и соединения 6, соответственно, которые представляют собой ацилированные аналоги пептида оксинтомодулина по настоящему изобретению, а суммарное потребление корма снизилось на 67%, 83% и 75%, соответственно, по сравнению с группой, получавшей контрольный раствор.
Экспериментальный пример 5. Оценка фармакокинетического профиля однократной дозы у мышей
Мышей ICR использовали для оценки фармакокинетики ацилированных аналогов пептида оксинтомодулина по настоящему изобретению. Соединение 1, соединение 2, соединение 3 или соединение 7, которое представляет собой ацилированный аналог пептида оксинтомодулина, полученный в соответствии с настоящим изобретением, готовили в стерильной дистиллированной воде для инъекций, содержащей 0,1% Cremophore EL, до дозы 30 нмоль/кг, и вводили мышам ICR подкожно; затем в назначенное время после введения собирали кровь и рассчитывали фармакокинетические показатели посредством анализа концентрации лекарственного средства в плазме, и результаты показаны в таблице 9 и на фиг. 4.
(время полувыведения при подкожном введении)*
* А: менее 6 часов; В: 6 часов или более.
Как видно из таблицы 9 и фиг. 4, экспериментальные результаты показали, что четыре ацилированных аналога пептида оксинтомодулина (соединение 1, соединение 2, соединение 3, соединение 7) в соответствии с примерами настоящего изобретения демонстрируют более длительный период полувыведения более чем 6 часов по сравнению с соединением 8 из сравнительного примера (заявка на патент Кореи № 2018-0095717, соединение 3) и MEDI0382 из сравнительного примера. Можно видеть, что улучшенная химическая стабильность благодаря введению нового альбуминового лиганда приводит к значительному увеличению периода полувыведения по сравнению с одним ацилированным аналогом пептида оксинтомодулина, соединением 8 из сравнительного примера.
Кроме того, период полувыведения соединения 8 из сравнительного примера был аналогичен периоду полувыведения соединения из сравнительного примера MEDI0382, разрабатываемого в качестве препарата для инъекции один раз в день, что указывает на то, что соединение 8 из сравнительного примера также может быть приготовлено только в виде препарата для ежедневного введения. С другой стороны, четыре ацилированных аналога пептида оксинтомодулина в соответствии с вариантами осуществления настоящего изобретения показали улучшенный фармакокинетический период полувыведения по сравнению с соединением 8 из сравнительного примера, и показали период полувыведения, подобный семаглутиду, разработанному для инъекции один раз в неделю, что указывает на то, что ацилированный аналог пептида оксинтомодулина по настоящему изобретению может быть приготовлен в качестве лекарственного средства длительного действия в составе для приема один раз в неделю.
Экспериментальный пример 6. Оценка фармакокинетического профиля при введении однократной дозы у макак
Яванских макак использовали для оценки фармакокинетики ацилированных аналогов пептида оксинтомодулина по настоящему изобретению. Соединение 1, соединение 2, соединение 3, соединение 4, соединение 5, соединение 6 или соединение 7, которое представляет собой ацилированный аналог пептида оксинтомодулина, полученный по настоящему изобретению, готовили в стерильной дистиллированной воде для инъекций, содержащей 0,1% Cremophore EL, в дозе 100 нмоль/кг, и вводили яванским макакам однократно подкожно; затем в назначенное время после введения собирали кровь и рассчитывали фармакокинетические показатели посредством анализа концентрации лекарственного средства в плазме. Результаты представлены в таблице 10 и на фиг. 5.
* А: менее 6 часов; В: от 6 часов до менее 12 часов; С: от 12 часов до менее 18 часов; D: от 18 часов до менее 24 часов; Е: 24 часа или более.
Как видно из таблицы 10 и фиг. 5, экспериментальные результаты показывают, что семь ацилированных пептидных аналогов оксинтомодулина (соединения 1-7) в соответствии с примерами настоящего изобретения демонстрируют более длительный период полувыведения, составляющий 12 часов или более, по сравнению с четырьмя соединениями из сравнительных примеров и MEDI0382 из сравнительного примера (находятся на стадии разработки для инъекции один раз в день), что указывает на то, что период полувыведения был значительно улучшен за счет повышения химической стабильности путем введения нового лиганда альбумина. В частности, соединение 3 и соединение 7 демонстрируют период полувыведения, сходный с периодом полувыведения семаглутида, который был разработан в виде препарата для инъекции один раз в неделю, с фармакокинетическим периодом полувыведения у макак более 24 часов, что указывает на то, что эти соединения могут быть приготовлены в качестве препарата длительного действия для введения один раз в неделю.
Соединение 9 из сравнительного примера представляет собой соединение 8 из сравнительного примера (заявка на патент Кореи № 2018-0095717, соединение 3), за исключением альбуминового лиганда, описанного в литературе (Nat. Commun. 2017; 8:16092), и имеет период полувыведения менее 12 часов, что позволяет предположить, что пептидные аналоги длительного действия могут быть разработаны не только со встраиванием такого альбуминового лиганда.
Соединение 10 из сравнительного примера, соединение 11 из сравнительного примера и соединение 7, содержащие липофильный липид в концевой форме аминокарбоксильной группы на боковой цепи Lys в положении 34 основной цепи пептидного аналога, имеют длину углеродной цепи C14, C16 и С18, соответственно. Соединение 7 имело период полувыведения 24 часа или более, тогда как соединение 10 из сравнительного примера и соединение 11 из сравнительного примера показали менее 12 часов, что указывает, что если липофильный липид заканчивается аминокарбоксильной группой, он имеет длительный период полувыведения только тогда, когда длина углеродной цепи составляет C18.
Соединение 1, соединение 2 и соединение 3, каждое из которых имеет липофильный липид в концевой форме карбоксильной группы на боковой цепи Lys в положении 34 каркасной цепи пептидного аналога, имеют длину углеродной цепи C14, C16 и C18, соответственно. Все эти вещества показали период полувыведения более 12 часов, и в частности, соединение 3 показало период полувыведения более 24 часов. Для обеспечения длительного периода полувыведения предпочтительно иметь заместитель карбоксильной группы на конце липофильного липида, и чем длиннее углеродная цепь, тем лучше эффект.
Соединения 4, 5 и 6, в которых липофильный липид связан с боковой цепью Lys в положении 34 каркасной цепи пептидного аналога с помощью комбинации спейсера и полимерного фрагмента, имеют более длительный период полувыведения от 12 часов до менее 24 часов по сравнению со сравнительными примерами. С другой стороны, сравнительный пример 12 продемонстрировал более короткий период полувыведения менее 12 часов, несмотря на то что липофильный липид связан с полимерным фрагментом, что свидетельствует о том, что эффект в отношении периода полувыведения для конца липофильного липида больше, чем эффект полимерного фрагмента.
Экспериментальный пример 7. Тестирование эффекта улучшения толерантности к глюкозе у мышей
В этом эксперименте эффект улучшения толерантности к глюкозе у самцов лабораторных мышей (мыши ICR) для ацилированных аналогов пептида оксинтомодулина по настоящему изобретению оценивали по улучшению гликемического контроля после приема пищи. Лабораторных мышей не кормили за сутки до эксперимента. Затем готовили соединение 2, или 3, или 7 по настоящему изобретению в стерильной дистиллированной воде для инъекций, содержащей 0,1% Cremophor EL, и вводили подкожно за 6 часов до нагрузки глюкозой. Раствор глюкозы вводили перорально через 6 часов после инъекции аналога пептида оксинтомодулина. Глюкозу в цельной крови измеряли взятием пробы из хвостовой вены непосредственно перед введением лекарственного средства и глюкозы и в течение 2 часов после нагрузки глюкозой в назначенное время. По результатам получали площадь под кривой (AUC) изменения уровня глюкозы в крови в зависимости от времени для расчета отношения AUC глюкозы в крови для ацилированного аналога пептида оксинтомодулина и контрольного раствора в процентах. Результаты показаны на фиг. 6.
Как видно на фиг. 6, соединение 2, соединение 3 или соединение 7, которые представляют собой ацилированные аналоги пептида оксинтомодулина по настоящему изобретению, показали значительное снижение AUC глюкозы в крови на 42,1%; 26,7% и 33,9%, соответственно, по сравнению с группой контроля глюкозы, 30 нмоль/кг. В дополнение к уменьшению периода полувыведения за счет химической стабильности, ацилированные аналоги пептида оксинтомодулина по настоящему изобретению эффективны для улучшения уровня глюкозы в крови и снижения массы тела за счет действия на рецепторы ГПГ-1 и глюкагона.
--->
<110> DONG-A ST CO., LTD.
<120> Long-acting dual agonists of GLP-1/glucagon receptors
<130> WR20003DAP
<160> 14
<170> KoPatentIn 3.0
<210> 1
<211> 37
<212> PRT
<213> Homo sapiens
<400> 1
His Ser Gln Gly Thr Phe Thr Ser Asp Lys Ser Lys Tyr Leu Asp Ser
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr Lys Arg Asn
20 25 30
Arg Asn Asn Ile Ala
35
<210> 2
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> oxyntomodulin analogue
<220>
<221> MOD_RES
<222> (2)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (10)
<223> Xaa=modified Lys;
Lys([(2-(2-(2-aminoethoxy)ethoxy)acetoyl)2]-[gammaglutamyl]-[
oct
adecanoyl])
<220>
<221> MOD_RES
<222> (16)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (34)
<223> Xaa=modified Lys; Lys(13-carboxy-1-oxotridecyl)
<400> 2
His Xaa Gln Gly Thr Phe Thr Ser Asp Xaa Ser Lys Tyr Leu Asp Xaa
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr Lys Glu Tyr
20 25 30
Glu Xaa Glu Tyr Glu
35
<210> 3
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> oxyntomodulin analogue
<220>
<221> MOD_RES
<222> (2)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (10)
<223> Xaa=modified Lys;
Lys([(2-(2-(2-aminoethoxy)ethoxy)acetoyl)2]-[gammaglutamyl]-[
octa
decanoyl])
<220>
<221> MOD_RES
<222> (16)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (34)
<223> Xaa=modified Lys; Lys(15-carboxy-1-oxopentadecyl)
<400> 3
His Xaa Gln Gly Thr Phe Thr Ser Asp Xaa Ser Lys Tyr Leu Asp Xaa
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr Lys Glu Tyr
20 25 30
Glu Xaa Glu Tyr Glu
35
<210> 4
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> oxyntomodulin analogue
<220>
<221> MOD_RES
<222> (2)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (10)
<223> Xaa=modified Lys;
Lys([(2-(2-(2-aminoethoxy)ethoxy)acetoyl)2]-[gammaglutamyl]-[
octa
decanoyl])
<220>
<221> MOD_RES
<222> (16)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (34)
<223> Xaa=modified Lys; Lys(17-carboxy-1-oxoheptadecyl)
<400> 4
His Xaa Gln Gly Thr Phe Thr Ser Asp Xaa Ser Lys Tyr Leu Asp Xaa
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr Lys Glu Tyr
20 25 30
Glu Xaa Glu Tyr Glu
35
<210> 5
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> oxyntomodulin analogue
<220>
<221> MOD_RES
<222> (2)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (10)
<223> Xaa=modified Lys;
Lys([(2-(2-(2-aminoethoxy)ethoxy)acetoyl)2]-[gammaglutamyl]-[
octa
decanoyl])
<220>
<221> MOD_RES
<222> (16)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (34)
<223> Xaa=modified Lys; Lys([lysyl]-[17-carboxy-1-oxoheptadecyl])
<400> 5
His Xaa Gln Gly Thr Phe Thr Ser Asp Xaa Ser Lys Tyr Leu Asp Xaa
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr Lys Glu Tyr
20 25 30
Glu Xaa Glu Tyr Glu
35
<210> 6
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> oxyntomodulin analogue
<220>
<221> MOD_RES
<222> (2)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (10)
<223> Xaa=modified Lys;
Lys([(2-(2-(2-aminoethoxy)ethoxy)acetoyl)2]-[gammaglutamyl]-[
octa
decanoyl])
<220>
<221> MOD_RES
<222> (16)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (34)
<223> Xaa=modified Lys;
Lys([(2-(2-(2-aminoethoxy)ethoxy)acetoyl)3]-[gammaglutamyl]-[
17-c
arboxy-1-oxoheptadecyl])
<400> 6
His Xaa Gln Gly Thr Phe Thr Ser Asp Xaa Ser Lys Tyr Leu Asp Xaa
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr Lys Glu Tyr
20 25 30
Glu Xaa Glu Tyr Glu
35
<210> 7
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> oxyntomodulin analogue
<220>
<221> MOD_RES
<222> (2)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (10)
<223> Xaa=modified Lys;
Lys([(2-(2-(2-aminoethoxy)ethoxy)acetoyl)2]-[gammaglutamyl]-[
octa
decanoyl])
<220>
<221> MOD_RES
<222> (16)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (34)
<223> Xaa=modified Lys;
Lys([lysyl]-[(2-(2-(2-aminoethoxy)ethoxy)acetoyl)3]-[gammaglu
tamy
l]-[17-carboxy-1-oxoheptadecyl])
<400> 7
His Xaa Gln Gly Thr Phe Thr Ser Asp Xaa Ser Lys Tyr Leu Asp Xaa
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr Lys Glu Tyr
20 25 30
Glu Xaa Glu Tyr Glu
35
<210> 8
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> oxyntomodulin analogue
<220>
<221> MOD_RES
<222> (2)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (10)
<223> Xaa=modified Lys;
Lys([(2-(2-(2-aminoethoxy)ethoxy)acetoyl)2]-[gammaglutamyl]-[
octa
decanoyl])
<220>
<221> MOD_RES
<222> (16)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (34)
<223> Xaa=modified Lys; Lys(17-aminocarboxy-1-oxoheptadecyl)
<400> 8
His Xaa Gln Gly Thr Phe Thr Ser Asp Xaa Ser Lys Tyr Leu Asp Xaa
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr Lys Glu Tyr
20 25 30
Glu Xaa Glu Tyr Glu
35
<210> 9
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> oxyntomodulin analogue
<220>
<221> MOD_RES
<222> (2)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (10)
<223> Xaa=modified Lys;
Lys([(2-(2-(2-aminoethoxy)ethoxy)acetoyl)2]-[gammaglutamyl]-[
octa
decanoyl])
<220>
<221> MOD_RES
<222> (16)
<223> Xaa=aminoisobutyric acid
<400> 9
His Xaa Gln Gly Thr Phe Thr Ser Asp Xaa Ser Lys Tyr Leu Asp Xaa
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr Lys
20 25 30
<210> 10
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> oxyntomodulin analogue
<220>
<221> MOD_RES
<222> (2)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (10)
<223> Xaa=modified Lys;
Lys([(2-(2-(2-aminoethoxy)ethoxy)acetoyl)2]-[gammaglutamyl]-[
octa
decanoyl])
<220>
<221> MOD_RES
<222> (16)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (34)
<223> Xaa=modified Lys; Lys(hexadecanoyl)
<400> 10
His Xaa Gln Gly Thr Phe Thr Ser Asp Xaa Ser Lys Tyr Leu Asp Xaa
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr Lys Glu Tyr
20 25 30
Glu Xaa Glu Tyr Glu
35
<210> 11
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> oxyntomodulin analogue
<220>
<221> MOD_RES
<222> (2)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (10)
<223> Xaa=modified Lys;
Lys([(2-(2-(2-aminoethoxy)ethoxy)acetoyl)2]-[gammaglutamyl]-[
octa
decanoyl])
<220>
<221> MOD_RES
<222> (16)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (34)
<223> Xaa=modified Lys; Lys(13-aminocarboxy-1-oxotridecyl)
<400> 11
His Xaa Gln Gly Thr Phe Thr Ser Asp Xaa Ser Lys Tyr Leu Asp Xaa
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr Lys Glu Tyr
20 25 30
Glu Xaa Glu Tyr Glu
35
<210> 12
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> oxyntomodulin analogue
<220>
<221> MOD_RES
<222> (2)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (10)
<223> Xaa=modified Lys;
Lys([(2-(2-(2-aminoethoxy)ethoxy)acetoyl)2]-[gammaglutamyl]-[
octa
decanoyl])
<220>
<221> MOD_RES
<222> (16)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (34)
<223> Xaa=modified Lys; Lys(15-aminocarboxy-1-oxopentadecyl)
<400> 12
His Xaa Gln Gly Thr Phe Thr Ser Asp Xaa Ser Lys Tyr Leu Asp Xaa
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr Lys Glu Tyr
20 25 30
Glu Xaa Glu Tyr Glu
35
<210> 13
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> oxyntomodulin analogue
<220>
<221> MOD_RES
<222> (2)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (10)
<223> Xaa=modified Lys;
Lys([(2-(2-(2-aminoethoxy)ethoxy)acetoyl)2]-[gammaglutamyl]-[
octa
decanoyl])
<220>
<221> MOD_RES
<222> (16)
<223> Xaa=aminoisobutyric acid
<220>
<221> MOD_RES
<222> (34)
<223> Xaa=modified Lys;
Lys([(2-(2-(2-aminoethoxy)ethoxy)acetoyl)3]-[hexadecanoyl])
<400> 13
His Xaa Gln Gly Thr Phe Thr Ser Asp Xaa Ser Lys Tyr Leu Asp Xaa
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr Lys Glu Tyr
20 25 30
Glu Xaa Glu Tyr Glu
35
<210> 14
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> oxyntomodulin analogue
<220>
<221> MOD_RES
<222> (2)
<223> Xaa=aminoisobutyric acid
<220>
<221> VARIANT
<222> (10)
<223> Xaa=modified Lys;
Lys([(2-(2-(2-aminoethoxy)ethoxy)acetoyl)2]-[gammaglutamyl]-[
octa
decanoyl])
<220>
<221> MOD_RES
<222> (16)
<223> Xaa=aminoisobutyric acid
<220>
<221> VARIANT
<222> (34)
<223> Xaa=modified Lys
<400> 14
His Xaa Gln Gly Thr Phe Thr Ser Asp Xaa Ser Lys Tyr Leu Asp Xaa
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr Lys Glu Tyr
20 25 30
Glu Xaa Glu Tyr Glu
35
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИДНЫЙ АНАЛОГ АЦИЛИРОВАННОГО ОКСИНТОМОДУЛИНА | 2018 |
|
RU2752787C1 |
| Новые производные оксинтомодулина и содержащая их фармацевтическая композиция для лечения ожирения | 2012 |
|
RU2739209C2 |
| Фармацевтическая композиция, содержащая инсулин и глюкагон | 2019 |
|
RU2823246C2 |
| Композиция для лечения гиперлипидемии, содержащая производное оксинтомодулина | 2013 |
|
RU2768853C1 |
| Терапевтическое применение глюкагона и включающей его комбинации | 2019 |
|
RU2838895C2 |
| КОАГОНИСТЫ РЕЦЕПТОРОВ ГЛЮКАГОНА И GLP-1 ДЛИТЕЛЬНОГО ДЕЙСТВИЯ | 2018 |
|
RU2779314C2 |
| СОЕДИНЕНИЯ-АГОНИСТЫ GIP И СПОСОБЫ | 2015 |
|
RU2716985C2 |
| Жидкая композиция | 2021 |
|
RU2838973C1 |
| Конъюгат, содержащий оксинтомодулин и фрагмент иммуноглобулина, и его применение | 2012 |
|
RU2733544C2 |
| УЛУЧШЕННЫЕ ПЕПТИДНЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ NASH И ДРУГИХ РАССТРОЙСТВ | 2019 |
|
RU2790209C2 |

Изобретение относится к новому ацилированному аналогу пептида оксинтомодулина длительного действия, обладающему двойным агонизмом в отношении рецепторов ГПП-1 и глюкагона (двойным агонизмом GLP-1-R/глюкагон-R), и к содержащей его фармацевтической композиции для профилактики и лечения ожирения и избыточной массы тела или инсулиннезависимого сахарного диабета, сопровождающегося ожирением и избыточной массой тела. Ацилированный аналог пептида оксинтомодулина по настоящему изобретению обладает двойным агонизмом в отношении рецепторов ГПП-1/глюкагона и имеет превосходно увеличенный период полувыведения in vivo, а содержащая его фармацевтическая композиция применима для лечения метаболических заболеваний, таких как ожирение и диабет. 3 н. и 5 з.п. ф-лы, 6 ил., 10 табл., 12 пр.
1. Ацилированный аналог пептида оксинтомодулина следующей химической формулы I:
His-Aib-Gln-Gly-Thr-Phe-Thr-Ser-Asp-X1-Ser-Lys-Tyr-Leu-Asp-Aib-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-Lys-Glu-Tyr-Glu-X2-Glu-Tyr-Glu (SEQ ID NO.14),
где X1 представляет собой функционализированный Lys с [(2-(2-(2-аминоэтокси)этокси)ацетоил)2]-[гаммаглутамил]-[октадеканоилом], конъюгированным с его боковой цепью;
X2 представляет собой функционализированный Lys с липофильным липидом, или спейсером-липофильным липидом, или полимерным фрагментом-спейсером-липофильным липидом, или спейсером-полимерным фрагментом-спейсером-липофильным липидом, конъюгированным с его боковой цепью;
липофильный липид имеет следующую структурную формулу (1) или (2):
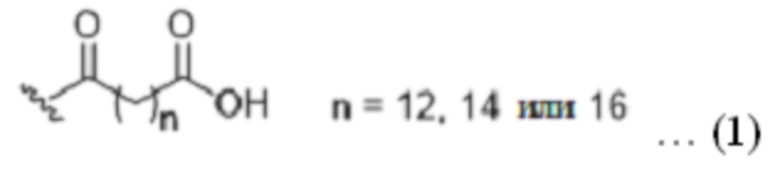
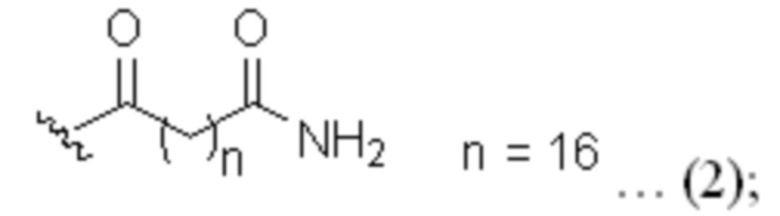
полимерный фрагмент представляет собой 1-3 (один, или два, или три) 2-(2-(2-аминоэтокси)этокси)ацетоила и
спейсер представляет собой r-Glu или Lys.
2. Ацилированный аналог пептида оксинтомодулина по п. 1, где спейсер представляет собой Lys, а аминогруппа аминокислотного остатка спейсера Lys ковалентно связана с липофильным липидом или полимерным фрагментом.
3. Ацилированный аналог пептида оксинтомодулина по п. 1, где спейсер представляет собой r-Glu, а α-аминогруппа спейсера r-Glu ковалентно связана с липофильным липидом или полимерным фрагментом.
4. Ацилированный аналог пептида оксинтомодулина по п. 1, который представляет собой соединение 1 (SEQ ID NO: 2), Соединение 2 (SEQ ID NO: 3), соединение 3 (SEQ ID NO: 4), соединение 4 (SEQ ID NO: 5), соединение 5 (SEQ ID NO: 6), соединение 6 (SEQ ID NO: 7) или соединение 7 (SEQ ID NO: 8).
5. Фармацевтическая композиция для профилактики или лечения состояния, характеризующегося или вызванного ожирением или избыточной массой тела, содержащая аналог пептида оксинтомодулина химической формулы I по п.1 в качестве активного ингредиента и фармацевтически приемлемый вспомогательный эксципиент.
6. Фармацевтическая композиция по п. 5, которую применяют в форме препарата для инъекций.
7. Фармацевтическая композиция для лечения или профилактики инсулиннезависимого сахарного диабета, сопровождающегося ожирением или избыточной массой тела, содержащая аналог пептида оксинтомодулина химической формулы I по п.1 в качестве активного ингредиента и включающая фармацевтически приемлемый вспомогательный эксципиент.
8. Фармацевтическая композиция по п. 7, которую применяют в форме препарата для инъекций.
| WO 2019035672 A1, 21.02.2019 | |||
| WO 2011006497 A1, 20.01.2011 | |||
| Способ борьбы с туманами и тучами | 1929 |
|
SU22820A1 |
| Niu Xianli et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
Авторы
Даты
2023-07-04—Публикация
2021-04-15—Подача