[ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ]
[0001] Настоящее изобретение относится к поликлональным антителам против пресепсина, применимым для измерения пресепсина в образцах.
[Предшествующий уровень техники]
[0002] CD14 является известным гликопротеином, экспрессируемым на мембранной поверхности моноцитов, который функционирует в качестве рецептора LPS (липополисахарида). Существуют 2 формы молекул CD14. Одна представляет собой мембраносвязанную форму CD14 (mCD14), экспрессируемую на поверхности клеток. Еще одна другая форма является растворимым CD14 (sCD14). sCD14, которые имеют молекулярную массу равную приблизительно 55 кДа и приблизительно 49 кДа (далее в данном документе, именуемую как ʺвысокомолекулярный sCD14ʺ) являются известными в данной области, и сообщается, что эти sCD14 показывают высокий уровень в крови пациента при многих заболеваниях, таких как сепсис, синдром приобретенного иммунодефицита (AIDS), острый респираторный дистресс-синдром (ARDS) и системная красная волчанка (SLE). По этой причине, эти высокомолекулярные sCD14 не считают специфичными маркерами для заболевания. См. Непатентные Документы 1 и 2.
[0003] В то же время, сообщалось, что существует новый молекулярный вид sCD14, sCD14-ST (растворимый антигенный подтип CD14, также именуемый как пресепсин), концентрация в крови которого характерным образом увеличивается у пациентов с сепсисом.
[0004] sCD14-ST (пресепсин) характеризуется миграцией в область молекулярной массы 13 ± 2 кДа при SDS-PAGE в невосстанавливающих условиях для всех sCD14, и он содержит N-концевую область из CD14. sCD14-ST (пресепсин) имеет аминокислотную последовательность, в которой С-концевая область в значительной степени удалена в сравнении с аминокислотными последовательностями высокомолекулярного sCD14, и в отличие от высокомолекулярного sCD14, sCD14-ST (пресепсин) не имеет активности связывания с LPS. В дополнение, пресепсин показывает иммуногенность, отличающуюся от иммуногенности высокомолекулярного sCD14, и, следовательно, молекулы могут различаться при использовании антител. Концентрация пресепсина в крови специфически увеличивается у пациентов с сепсисом (см. Патентный Документ 1). Более того, сообщается, что концентрация пресепсина в крови показывает более высокий уровень у пациентов с сепсисом в сравнении с пациентами с синдромом системной воспалительной реакции (SIRS), который трудно отличить от сепсиса. Таким образом, пресепсин считается специфичным диагностическим маркером сепсиса (см. Непатентный Документ 3).
[0005] Были раскрыты кроличьи поликлональные антитела (антитело S68) и крысиные моноклональные антитела (F1146-17-2), которые специфически распознавали пресепсин (см. Патентные Документы 1 и 2).
[0006] В настоящее время, систему измерения с использованием кроличьих поликлональных антител в качестве антител, специфичных к пресепсину, практически применяют при измерении пресепсина, и наборы для измерения представлены на рынке в Европе и Японии (PATHFAST™ Presepsin, Mitsubishi Chemical Medience Corporation).
[0007] Кроличьи поликлональные антитела распознают различные антигены и обладают сильной аффинностью к антигену в сравнении с антителами, полученными из грызунов, таких как мыши. С другой стороны, значительная индивидуальная изменчивость кроликов создает трудности для стабильного получения антител, и полагают, что они имеют более высокий разброс характеристик от партии к партии.
[ДОКУМЕНТЫ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ]
[Патентный Документ]
[0008]
Патентный Документ 1: WO2005/108429
Патентный Документ 2: WO 2004/044005
[Непатентный Документ]
[0009]
Непатентный Документ 1: Hayashi et al., Infection and Immunity,67:417-420, 1999
Непатентный Документ 2: Lawn et al., Clinical&Experimental Immunology,120:483-487,2000
Непатентный Документ3: Yaegashi et al., Journal of Infection and Chemotherapy, 11:234-238, 2005
[СУЩНОСТЬ ИЗОБРЕТЕНИЯ]
[Проблема, решаемая изобретением]
[0010] Пресепсин общепринято измеряют, используя поликлональные антитела против пресепсина (антитела S68), полученные из кроликов. Однако было установлено, что когда образцы измеряют посредством построения ELISA с антителами S68, существует относительно высокий разброс измеренных значений среди различных партий антител.
[0011] Проблема настоящего изобретения состоит в том, чтобы предоставить поликлональные антитела против пресепсина, которые имеют меньший разброс измеренных значений среди партий антител в сравнении с антителами S68, и, таким образом, подходят для измерения пресепсина.
[0012] Одна другая проблема настоящего изобретения состоит в том, чтобы предоставить высокоспецифичные антитела, которые специфически связываются с пресепсином и вызывают меньше перекрестных реакций с высокомолекулярным sCD14 в крови человека.
[0013] Еще одна другая проблема настоящего изобретения состоит в том, чтобы предоставить поликлональные антитела против пресепсина, имеющие более высокую реактивность с пресепсином, чем антитела S68.
[0014] Цель настоящего изобретения состоит в том, чтобы предоставить поликлональные антитела против пресепсина, которые могут решить по меньшей мере одну из вышеуказанных проблем.
[СРЕДСТВО РЕШЕНИЯ ПРОБЛЕМЫ]
[0015] Общепринятые поликлональные кроличьи антитела против пресепсина (антитела S68) получают посредством очистки, используя аффинную колонку с иммобилизованным пептидом S68 для очистки поликлональных антител, полученных при иммунизации кроликов пептидом S68 (SEQ ID NO: 2). Автор настоящего изобретения установил, что поликлональные антитела с высокой реактивностью получали посредством переключения аффинной колонки для очистки с аффинной колонки с иммобилизованным пептидом S68 на аффинную колонку с иммобилизованным пептидом P03 (SEQ ID NO: 1). Пептид P03 имеет последовательность, содержащую часть пептида S68.
[0016] Автор настоящего изобретения подтвердил специфичность поликлональных антител, полученных посредством очистки с использованием пептида P03, анализом конкурентного ингибирования пептидов. Автор изобретения установил, что поликлональные антитела против пресепсина, которые специфически связываются с пептидом P03 (далее в данном документе также именуемые как ʺP03-специфичные поликлональные антителаʺ) имеют свойства, позволяющие обеспечить меньший разброс измеренных значений от партии к партии антител, чем в случае антител S68, и вызывать меньше перекрестных реакций с высокомолекулярным растворимым CD14 (далее в данном документе также именуемым как ʺвысокомолекулярный sCD14 в кровиʺ) в крови человека, что делает их подходящими для измерения пресепсина, и, следовательно, автор изобретения завершил создание настоящего изобретения.
[0017] Конкретно, по отношению к разбросу измеренных значений от партии к партии, применяли 3 партии P03-специфичных поликлональных антител и 3 партии антител S68, и с их помощью измеряли концентрацию пресепсина. Также измеряли концентрацию пресепсина в множестве образцов (при известной концентрации пресепсина). Затем между полученными измеренными значениями и известной концентрацией проводили корреляционный анализ, и коэффициент вариации (CV) углов наклона линий регрессии оценивали в Примерах. CV (10,6%) для аналитической системы P03-специфичных поликлональных антител был ниже, чем коэффициент вариации для антител S68 (20%), подтверждая примерами, что аналитическая система с использованием P03-специфичных поликлональных антител имеет низкий разброс измеренных значений от партии к партии.
[0018] Относительно перекрестной реакции с высокомолекулярным sCD14 в крови, было подтверждено примерами, что перекрестная реакция с высокомолекулярным sCD14 в крови находилась ниже предела обнаружения в аналитической системе ELISA с использованием P03-специфичных поликлональных антител.
[0019] Специфичную очистку поликлональных антител во время их процесса получения обычно проводят с использованием введенных антигенов (пептида S68 в настоящем изобретении), и, в целом, не предусмотрено, что существует пептид, который является более подходящим для специфичной очистки, отличающийся от вводимого антигена. Удивительно, что антитела, которые являются более подходящими для измерения пресепсина, чем антитела S68, теперь получают посредством специфичной очистки, используя пептид P03, имеющий последовательность, содержащую часть пептида S68.
[0020] Таким образом, настоящее изобретение описано ниже.
[1] Поликлональные антитела против пресепсина, где антитела специфически связываются с пептидом, состоящим из аминокислотной последовательности SEQ ID NO: 1.
[2] Поликлональные антитела против пресепсина, где процентное содержание поликлональных антител против пресепсина, специфически связывающихся с пептидом, состоящим из аминокислотной последовательности SEQ ID NO: 1, является более высоким, чем процентное содержание в антителах S68, поликлональных антител против пресепсина, специфически связывающихся с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 1.
[2-1] Поликлональные антитела против пресепсина, где процентное содержание поликлональных антител против пресепсина специфически связывающихся с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 1, в поликлональных антителах против пресепсина, составляет 40% или более.
[3] Антитела по любому одному из [1]-[2-1],
где связывание между антителами и пресепсином конкурентно ингибируется на 30% или более в системе конкурентных реакций, в которой пептид, состоящий из аминокислотной последовательности SEQ ID NO: 1, подвергают конкурентной реакции таким образом, что связывание между антителами и пресепсином ингибируется, и,
где связывание между антителами и пресепсином конкурентно ингибируется на менее чем 30% в системе конкурентных реакций, в которой пептид, содержащий аминокислотную последовательность SEQ ID NO: 9 подвергают конкурентной реакции таким образом, что связывание между антителами и пресепсином ингибируется.
[3-1] Антитела по любому одному из [1]-[3], где антитела имеют одну или несколько характеристик, выбранных из следующих (A)-(C):
(A) в системе конкурентных реакций с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 6 таким образом, чтобы ингибировать связывание между антителами и пресепсином, связывание между антителами и пресепсином конкурентно ингибируется на менее чем 30%;
(B) в системе конкурентных реакций с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 7 таким образом, чтобы ингибировать связывание между антителами и пресепсином, связывание между антителами и пресепсином конкурентно ингибируется на менее чем 30%; и
(C) в системе конкурентных реакций с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 8 таким образом, чтобы ингибировать связывание между антителами и пресепсином, связывание между антителами и пресепсином конкурентно ингибируется на менее чем 30%.
[4] Антитела по любому одному из [1]-[3-1], где, когда антитела применяют в аналитической системе ELISA, система анализа ELISA имеет более низкую частоту протекания перекрестной реакции с высокомолекулярным растворимым CD14 в крови человека, чем система анализа ELISA с использованием антител S68.
[5] Антитела по любому одному из [1]-[4], где, когда антитела применяют в аналитической системе ELISA для измерения концентрации пресепсина в образцах, (при известной концентрации пресепсина), содержащих пресепсин, чтобы провести корреляционный анализ измеренных значений и известной концентрации, коэффициент вариации (CV) углов наклона линий регрессии составляет 15% или менее.
[6] Антитела по любому одному из [1]-[5], где антитела связываются с пресепсином с аффиностью (KD), меньшей чем 10-7.
[7] Антитела по любому одному из [1]-[6], где антитела получают посредством очистки поликлональных антител, полученных из млекопитающего, не являющегося человеком, иммунизированного пептидом, в качестве иммуногена, включающим аминокислотные остатки от положения 1 до положения 9 аминокислотной последовательности SEQ ID NO: 2 и включающим 9 или более последовательных аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 2.
[8] Антитела по любому одному из [1]-[6], полученные посредством подвергания поликлональных антител обработке, чтобы увеличить долю антител, специфически связывающихся с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 1, где поликлональные антитела получают из млекопитающего, не являющегося человеком, иммунизированного пептидом, в качестве иммуногена, включающим аминокислотные остатки от положения 1 до положения 9 аминокислотной последовательности SEQ ID NO: 2, и включающего 9 или более последовательных аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 2.
[9] Поликлональные антитела против пресепсина, полученные посредством очистки с использованием колонки, на которой иммобилизуют пептид, содержащий аминокислотную последовательность SEQ ID NO: 1, поликлональные антитела получают из млекопитающего, не являющегося человеком, иммунизированного с использованием, в качестве иммуногена, пептида, включающего аминокислотные остатки от положений 1 до 9 аминокислотной последовательности SEQ ID NO: 2, и включающего 9 или более последовательных аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 2.
[10] Антитела согласно [9], дополнительно подвергаемые обработке, которая удаляет антитела, связывающиеся с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 8.
[11] Антитела согласно [9], дополнительно подвергаемые обработке, которая снижает активность связывания антител, связывающихся с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 8.
[11-1] Антитела по любому одному из [9]-[11], где связывание между антителами и пресепсином конкурентно ингибируется на 30% или более в системе конкурентных реакций с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 1, таким образом, чтобы ингибировать связывание между антителами и пресепсином, и связывание между антителами и пресепсином конкурентно ингибируется на 30% или менее в системе конкурентных реакций с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 9, таким образом, чтобы ингибировать связывание между антителами и пресепсином.
[11-2] Антитела по любому одному из [9]-[11-1], где, когда антитела применяют в аналитической системе ELISA, система анализа ELISA имеет более низкую частоту протекания перекрестной реакции с высокомолекулярным растворимым CD14 в крови человека, чем система анализа ELISA с использованием Антитела S68.
[11-3] Антитела по любому одному из [9]-[11-2], где, когда антитела применяют в аналитической системе ELISA для измерения концентрации пресепсина в образцах (при известной концентрации пресепсина), содержащих пресепсин, чтобы провести корреляционный анализ измеренных значений и известной концентрации, коэффициент вариации (CV) углов наклона линий регрессии составляет 15% или менее.
[11-4] Антитела по любому одному из [9]-[11-3], связывающиеся с пресепсином с аффиностью (KD), меньшей чем 10-7.
[12] Способ получения поликлональных антител против пресепсина, включающий по меньшей мере следующие стадии; стадию получения поликлональных антител из млекопитающего, не являющегося человеком, иммунизированного с использованием пептида, в качестве иммуногена, включающего аминокислотные остатки от положения 1 до положения 9 аминокислотной последовательности SEQ ID NO: 2, и включающего 9 или более последовательных аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 2; и стадию очистки полученных антител с использованием колонки, на которой иммобилизуют пептид, содержащий аминокислотную последовательность SEQ ID NO: 1.
[13] Способ получения поликлональных антител против пресепсина согласно [12], дополнительно включающий стадию удаления антител, связывающихся с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 8.
[14] Способ измерения пресепсина, включающий по меньшей мере стадию предоставления антител по любому одному из [1]-[11-4] в образец, содержащий пресепсин.
[15] Набор для измерения пресепсина, содержащий по меньшей мере антитела по любому одному из [1]-[11-4].
[16] Набор для обнаружения сепсиса или набор, способствующий обнаружению или диагностике сепсиса, содержащий по меньшей мере антитела по любому одному из [1]-[11-4].
[Эффект изобретения]
[0021] Настоящее изобретение предоставляет поликлональные антитела против пресепсина, имеющие превосходную реактивность с пресепсином и являющиеся подходящими для измерения пресепсина в образцах. Соответственно, является возможным повысить качество и точность измерения пресепсина.
[0022] В одном предпочтительном варианте осуществления, антитела настоящего изобретения имеют меньший разброс измеренных значений от партии к партии антител во время измерения пресепсина, с использованием антител, и, следовательно, является возможным стабильно обеспечить антитела, имеющие постоянное качество, и превосходные по практичности для пригодности для измерения пресепсина.
[0023] Обычно важно, чтобы при измерении образцов с использованием антител (в частности, для диагностических лекарственных средств), углы наклона линий регрессии, как показано в Примере 5, попадали в пределы определенного интервала даже в ряду различных партий антител. В одном предпочтительном варианте осуществления, антитела настоящего изобретения имеют CV углов наклона линий регрессии, равный около 10%, и, таким образом, углы наклона линий регрессии имеют тенденцию попадать в пределы стандартного интервала даже в ряду различных партий антител.
[0024] В одном дополнительном предпочтительном варианте осуществления, антитела настоящего изобретения специфически связываются с пресепсином в сэндвич-системе ELISA и вызывают меньшую перекрестную реакцию с высокомолекулярным sCD14 в крови человека в сравнении с антителами S68, и, таким образом, обеспечивают измерение с высокой специфичностью.
[КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ]
[0025]
[Фиг. 1]
Фиг. 1 показывает линию регрессии для P03-специфичных поликлональных антител (P03-A), полученных в Примере 5.
[Фиг. 2]
Фиг. 2 показывает линию регрессии для P03-специфичных поликлональных антител (P03-B), полученных в Примере 5.
[Фиг. 3]
Фиг. 3 показывает линию регрессии для P03-специфичных поликлональных антител (P03-C), полученных в Примере 5.
[ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ДЛЯ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ]
[0026] Далее в данном документе, настоящее изобретение будет описано более подробно. Следующие варианты осуществления являются примерами, чтобы описать настоящее изобретение, и не предназначены для ограничения настоящего изобретения вариантами осуществления. Следует понимать, что способы и композиции, описанные в данном документе, не ограничиваются конкретными описанными вариантами осуществления, и могут варьировать как таковые.
[0027] 1. Антитела настоящего изобретения
Настоящее изобретение предоставляет следующие поликлональные антитела против пресепсина (далее в настоящем описании именуемые как ʺантитела настоящего изобретенияʺ):
(1) поликлональные антитела против пресепсина (P03-специфичные поликлональные антитела), специфически связывающиеся с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 1; или
(2) поликлональные антитела против пресепсина, в которых процентное содержание поликлональных антител против пресепсина (P03-специфичных поликлональных антител), специфически связывающихся с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 1, является более высоким, чем процентное содержание поликлональных антител против пресепсина (P03-специфичных поликлональных антител), специфически связывающихся с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 1, в антителах S68.
[0028] ʺПресепсинʺ также именуют как sCD14-ST (подтип антигенного растворимого CD14). Как описано выше, существуют две формы CD14, которые представляют собой мембраносвязанный CD14 (mCD14) и растворимый CD14 (sCD14), и в крови существует множество растворимых CD14, имеющих различные молекулярные массы. Пресепсин является фрагментом растворимого CD14 и представляет собой вещество, имеющее характеристики, показанные в 1)-3) ниже:
1) он имеет молекулярную массу 13±2 кДа в соответствии с SDS-PAGE при невосстанавливающих условиях;
2) он имеет аминокислотную последовательность от положения 1 до положения 11 аминокислотной последовательности (непроцессированной аминокислотной последовательности человеческого растворимого CD14) SEQ ID NO: 3 по N-концу; и
3) он специфически связывается с антителом, полученным при использовании пептида (пептида S68), состоящего из 16 аминокислотных остатков (соответствующих аминокислотной последовательности от положений 53 до 68 в аминокислотной последовательности SEQ ID NO: 3), описанной в SEQ ID NO: 2 для антигена.
[0029] В настоящем изобретении, пресепсин означает человеческий пресепсин, если конкретно не иллюстрируется иначе. Например, пресепсин является стандартным пресепсином (rsCD14-ST, раскрытым в Примере 16 из WO2005/108429). Альтернативно, применяют вещество, имеющее активность связывания, как у пресепсина, и частично модифицированное, исходя из пресепсина.
[0030] Как описано в данном документе, ʺполиклональные антитела против пресепсинаʺ означают поликлональные антитела, которые иммунологически распознают пресепсин, и/или поликлональные антитела, которые имеют нормальную реакцию антиген-антитело с пресепсином. Реакцию антиген-антитело можно подтвердить методами агглютинации, сэндвич-методами, методами непосредственно на твердой фазе, конкурентными методами и т.д. Выражая связывание между антителами и субъектом, распознаваемым антителами, в виде аффинности, равновесная константа диссоциации (KD), как правило, составляет менее 10-7 M.
[0031] Как описано в данном документе, ʺпептид, содержащий аминокислотную последовательность SEQ ID NO: 1ʺ означает пептид P03. Как применяют в данном документе, ʺпептид P03ʺ означает пептид, содержащий аминокислотную последовательность, соответствующую участку от положения 52 до положения 61 человеческого непроцессированного растворимого CD14 (SEQ ID NO: 3).
[0032] Термин ʺспецифически связывающиеся с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 1ʺ означает, что антитела специфически связываются с аминокислотной последовательностью SEQ ID NO: 1 (пептид P03), но не связываются с другими пептидами в аминокислотной последовательности пресепсина. Иначе говоря, антитела специфически распознают эпитоп в аминокислотной последовательности пептида P03, но не распознают другие пептиды. Более подробно, например, согласно описанию в Примере 3 в настоящем изобретении, термин может быть представлен так, что, когда проводят анализ конкурентного ингибирования пептида (предпочтительно используя поглощение), конкурентное ингибирование связывания между антителами настоящего изобретения и пресепсином составляет 30% или более при добавлении пептида P03 и менее чем 30% при добавлении других пептидов.
Как описано в данном документе, ʺдругие пептидыʺ представляют собой, например, пептид, содержащий аминокислотную последовательность SEQ ID NO: 6 (пептид P01), пептид, содержащий аминокислотную последовательность SEQ ID NO: 7 (пептид P02), пептид, содержащий аминокислотную последовательность SEQ ID NO: 8 (пептид P04), пептид, содержащий аминокислотную последовательность SEQ ID NO: 9 (пептид P05), пептид, содержащий аминокислотную последовательность SEQ ID NO: 10 (пептид P06), пептид, содержащий аминокислотную последовательность SEQ ID NO: 11 (пептид P07), и пептид, содержащий аминокислотную последовательность SEQ ID NO: 12 (пептид P08). ʺСпецифическое связывание с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 1ʺ включает специфическое связывание с пептидом P03, иммобилизованным на колонке. ʺПептид P03, иммобилизованный на колонкеʺ может включать пептид P03, имеющий цистеин, связанный по N- или C-концу, и, следовательно, связанный с колонкой через цистеин.
[0033] В данном описании аминокислотная последовательность SEQ ID NO: 6 (пептид P01) соответствует аминокислотной последовательности от положения 46 до положения 55 аминокислотной последовательности SEQ ID NO: 3. Аминокислотная последовательность SEQ ID NO: 7 (пептид P02) соответствует аминокислотной последовательности от положения 49 до положения 58 аминокислотной последовательности SEQ ID NO: 3. Аминокислотная последовательность SEQ ID NO: 8 (пептид P04) соответствует аминокислотной последовательности от положения 55 до положения 64 аминокислотной последовательности SEQ ID NO: 3. Аминокислотная последовательность SEQ ID NO: 9 (пептид P05) соответствует аминокислотной последовательности от положения 58 до положения 67 аминокислотной последовательности SEQ ID NO: 3. Аминокислотная последовательность SEQ ID NO: 10 (пептид P06) соответствует аминокислотной последовательности от положения 61 до положения 70 аминокислотной последовательности SEQ ID NO: 3. Аминокислотная последовательность SEQ ID NO: 11 (пептид P07) соответствует аминокислотной последовательности от положения 64 до положения 73 аминокислотной последовательности SEQ ID NO: 3. Аминокислотная последовательность SEQ ID NO: 12 (пептид P08) соответствует аминокислотной последовательности от положения 67 до положения 76 аминокислотной последовательности SEQ ID NO: 3.
[0034] Как описано в данном документе, ʺболее высокое процентное содержание, в поликлональных антителах против пресепсина, поликлональных антител против пресепсина, специфически связывающихся с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 1, чем процентное содержание, в антителах S68, поликлональных антител против пресепсина, специфически связывающихся с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 1ʺ означает, что доля P03-специфичных поликлональных антителах в поликлональных антителах против пресепсина является более высокой, чем доля P03-специфичных поликлональных антител в антителах S68. Такие антитела имеют более высокое процентное содержание доли P03-специфичных поликлональных антител, имеющих предпочтительные свойства, чем свойства антител S68, и, таким образом, проявляют превосходящие способности в сравнении с антителами S68.
[0035] Такие антитела могут быть получены из, например, поликлональных антител, полученных из млекопитающего, не являющегося человеком, иммунизированного с использованием пептида, в качестве иммуногена, включающего аминокислотные остатки от положения 1 до положения 9 аминокислотной последовательности SEQ ID NO: 2, и включающего 9 или более последовательных аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 2 посредством обработки, чтобы увеличить долю антител, специфически связывающихся с пептидом (пептидом P03), содержащим аминокислотную последовательность SEQ ID NO: 1. Подробности описаны далее в данном документе.
[0036] ʺАнтитела S68ʺ означают поликлональные антитела против пептида S68, полученные посредством очистки поликлональных антител, полученных из млекопитающего, не являющегося человеком, иммунизированного с использованием пептида S68 в качестве иммуногена, с использованием колонки с иммобилизованным пептидом S68. ʺПептид S68ʺ означает пептид, состоящий из аминокислотной последовательности SEQ ID NO: 2 (аминокислотной последовательности от положения 53 до положения 68 в аминокислотной последовательности SEQ ID NO: 3). Подробный способ получения антител S68 раскрыт в Примере 1 из WO2004/044005 и описан в Примере 1 ниже в данном документе.
[0037] Расчет процентного содержания специфичных к P03 поликлональных антител в поликлональных антителах против пресепсина и антителах S68 может быть сделан, например, как описано в Примере 1 и Примере 6, посредством очистки поликлональных антител против пресепсина или антител S68 (A), и затем получения P03-специфичных поликлональных антител (B), а затем измерения количество белка для (A) и (B), и определения отношения (B) относительно (A), но конкретно не ограничивается. Количество белка измеряют посредством применения, например, метода, описанного в Примере 1-3.
[0038] Значения процентного содержания доли P03-специфичных поликлональных антител в поликлональных антителах против пресепсина и в антителах S68 предпочтительно сравнивают следующим образом: значения процентного содержания рассчитывают для более чем одной партии соответствующих поликлональных антител против пресепсина и антител S68, и усредненные значения процентного содержания сравнивают. 3 партии или более являются предпочтительными, несмотря на то, что ими не ограничиваются.
[0039] Некоторые предпочтительные варианты осуществления настоящего изобретения представляют собой поликлональные антитела против пресепсина, имеющие высокое процентное содержание поликлональных антител против пресепсина (P03-специфичных поликлональных антител), специфически связывающихся с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 1 в поликлональных антителах против пресепсина.
[0040] Фраза ʺимеющие высокое процентное содержание доли P03-специфичных поликлональных антител в поликлональных антителах против пресепсинаʺ означает, что доля P03-специфичных поликлональных антител в поликлональных антителах против пресепсина составляет предпочтительно 40% или более, более предпочтительно 50% или более, даже более предпочтительно 60% или более и особенно предпочтительно 70% или более. Процентное содержание доли P03-специфичных поликлональных антител в поликлональных антителах может быть рассчитано, как описано выше.
[0041] В варианте осуществления, антитела, включенные в поликлональные антитела против пресепсина, представляют собой P03-специфичные поликлональные антитела, и в дополнение (1) поликлональные антитела против пресепсина, которые распознают пептид P03 и распознают другие пептиды, и (2) поликлональные антитела против пресепсина, которые не распознают пептид P03, но распознают другие пептиды. ʺДругие пептидыʺ представляют собой, например, пептид P01, пептид Р02, пептид Р04, пептид Р05, пептид Р06, пептид Р07 и пептид Р08.
[0042] Такие антитела могут быть получены посредством, например, подвергания поликлональных антител, полученных из млекопитающего, не являющегося человеком, иммунизированного с использованием пептида, в качестве иммуногена, включающего аминокислотные остатки от положения 1 до положения 9 аминокислотной последовательности SEQ ID NO: 2, и включающего 9 или более последовательных аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 2, обработке, чтобы увеличить долю антител, специфически связывающихся с пептидом (пептидом P03), содержащим аминокислотную последовательность SEQ ID NO: 1. Подробности описаны далее в данном документе.
[0043] Как применяют в данном документе, термин ʺантителоʺ означает ʺантитело или его антигенсвязывающий фрагментʺ, если конкретно не иллюстрируется иначе. Термин ʺантигенсвязывающий фрагментʺ означает фрагмент, имеющий по существу такое же антигенсвязывающее свойство, как исходное антитело, в частичном фрагменте антитело. Примеры антигенсвязывающего фрагмента включают Fab, Fab', F(ab')2 и т.п.
[0044] Антитела настоящего изобретения получают из млекопитающих, не являющихся человеком. Антитела настоящего изобретения получают из млекопитающих, не являющихся человеком, например, кроликов, коз, лошадей, овец, свиней, крыс, мышей и т.п. Вследствие простоты получения антител, млекопитающим является предпочтительно кролик, коза и т.п., и, более предпочтительно, кролик.
[0045] Антитела настоящего изобретения имеют превосходную реактивность с пресепсином и являются подходящими для измерения пресепсина в образцах. Реактивность антител настоящего изобретения с пресепсином можно оценить посредством сэндвич-системы ELISA, построенной с использованием антител настоящего изобретения. Сэндвич-система ELISA предпочтительно является системой, в которой используются (a) антитела настоящего изобретения и (b) антитело F1106-13-3 или антитело F1031-8-3 (раскрытые в Примере 3 из WO2004/044005). Более подробно, согласно описанию в Примере 2, реактивность антитела настоящего изобретения с пресепсином можно оценить по поглощению, когда антитела настоящего изобретения, иммобилизованные на твердой фазе, взаимодействуют с пресепсином. Как описано в Примере 2, отношение (отношение S/N) поглощения антител, которые взаимодействуют с 500 пг/мл пресепсина относительно поглощения, полученного, когда обеспечивают взаимодействие антител с 0 пг/мл пресепсина, которое считают как 1, может использоваться для оценки реактивности с пресепсином. Отношение S/N антител настоящего изобретения составляет предпочтительно 36 или более, более предпочтительно 40 или более и даже более предпочтительно 45 или более. Отношение S/N антител настоящего изобретения является более высоким, чем отношение антител S68, и предпочтительно в 1,2 раза или более, более предпочтительно в 2 раза или более и даже более предпочтительно в 2-3 раза выше, чем отношение для антител S68.
[0046] Антитела настоящего изобретения специфически связываются с пресепсином и предпочтительно имеют лучшую аффинность к пресепсину, чем имеют антитела S68. Антитела настоящего изобретения предпочтительно имеют аффинность к пресепсину (равновесную константу диссоциации, KD) менее 10-7M и более предпочтительно менее 10-8M. Равновесная константа диссоциации антител настоящего изобретения с пресепсином находится, например, в интервале от 10-7M до 10-13M. Аффинность (равновесную константу диссоциации, KD) можно измерить, с использованием, например, BIAcore (GE Healthcare).
[0047] Предпочтительно, антитела настоящего изобретения могут характеризоваться конкурентным ингибированием, равным 30% или более для связывания между антителами и пресепсином в соответствии с системой реакции (предпочтительно с использованием поглощения), в которой пептид P03 применяют для конкурентной реакции, чтобы ингибировать связывание между антителами и пресепсином, и
конкурентным ингибированием, равным 30% или менее для связывания между антителами и пресепсином (предпочтительно с использованием поглощения), при котором применяют пептид P05 для конкурентной реакции, чтобы ингибировать связывание между антителами и пресепсином. Предпочтительно, система реакции представляет собой сэндвич-ELISA. Более предпочтительно, система реакции является сэндвич-ELISA, в которой применяют (a) антитела настоящего изобретения и (b) антитела F1106-13-3 или антитела F1031-8-3 (раскрытые в Примере 3 из WO2004/044005). Более подробно, реакцию конкурентного ингибирования можно оценить методом, описанным в Примере 3.
[0048] Более предпочтительно, антитела настоящего изобретения могут характеризоваться конкурентным ингибированием, менее 30% при использовании пептида P01, пептида Р06, пептида Р07 и пептида Р08. Даже более предпочтительно, антитела настоящего изобретения могут характеризоваться конкурентным ингибированием на менее чем 30% при использовании по меньшей мере одного пептида, выбранного из пептида Р02 и пептида Р04. Наиболее предпочтительно, антитела настоящего изобретения могут характеризоваться конкурентным ингибированием на менее чем 30% при использовании пептида Р02 и пептида Р04.
[0049] Предпочтительно, антитела настоящего изобретения специфически связываются с пресепсином и имеют низкую частоту протекания перекрестной реакции с растворимым CD14, с молекулярной массой около 55 кДа и около 49 кДа (далее в данном документе также именуемыми как ʺвысокомолекулярный sCD14 в кровиʺ), которые являются основными растворимыми CD14 в крови человека. Пресепсин имеет молекулярную массу, отличающуюся от высокомолекулярного sCD14, и имеет более короткую аминокислотную последовательность, чем высокомолекулярный sCD14. По причинам, описанным выше, пресепсин имеет структуру, отличающуюся от структуры высокомолекулярного sCD14 в крови, и антитела имеют различные реактивности с молекулами, таким образом, считают, что антитела настоящего изобретения более сильно связываются с пресепсином.
[0050] Перекрестную реакцию можно оценить посредством построения сэндвич-системы ELISA с использованием антител настоящего изобретения. Сэндвич-система ELISA более предпочтительно является системой, в которой применяют (a) антитела настоящего изобретения и (b) антитело F1106-13-3 или антитело F1031-8-3 (раскрытые в Примере 3 из WO2004/044005). Более подробно, перекрестную реакцию можно оценить методом, описанным в Примере 4. Согласно Примеру 4, перекрестную реакцию с антителами настоящего изобретения можно оценить по поглощению, когда антитела настоящего изобретения, иммобилизованные на твердой фазе, взаимодействуют с высокомолекулярным sCD14 в сыворотке.
[0051] Что касается высокомолекулярного sCD14, то может применяться человеческий непроцессированный растворимый CD14, содержащий аминокислотную последовательность, описанную в SEQ ID NO: 3 или он может быть получен посредством адсорбции на аффинной колонке с использованием антител 3C10 из биологической жидкости здоровых людей, например (см. Пример 23 в WO2005/108429). Образцы, содержащие высокомолекулярный sCD14 в крови, могут быть получены, например, посредством использования сыворотки здорового человека и человеческой сыворотки с поглощенным CD14 (сыворотки, содержащей пониженное количество высокомолекулярного sCD14 в крови). Человеческая сыворотка с поглощенным CD14 может быть получена согласно описанию в Примере 4, посредством, например, нанесения сыворотки здорового человека на аффинную колонку с иммобилизованными антителами против CD14.
[0052] Перекрестная реакция может быть рассчитана, например, согласно следующему уравнению.
Перекрестная реакция (%)=(Концентрация, определенная посредством нанесения поглощения образца, содержащего высокомолекулярный sCD14 в крови, измеренная с использованием антител, на стандартную кривую для пресепсина/Концентрация высокомолекулярного sCD14, применяемая для измерения)×100.
[0053] Перекрестная реакция антител настоящего изобретения с высокомолекулярным sCD14, определенная согласно вышеприведенному уравнению, предпочтительно находится на уровне или ниже предела обнаружения.
[0054] Предпочтительно, система анализа ELISA с использованием антител настоящего изобретения может иметь более низкую частоту протекания перекрестной реакци (имеет более низкую перекрестную реакцию (%)) с высокомолекулярным sCD14 в крови, чем система анализа ELISA с использованием антител S68. При сравнении частоты протекания перекрестной реакции, предпочтительно сравнивать средние значения для перекрестной реакции для более чем одной партии (например, для 3 партий или более) антител.
[0055] Антитела настоящего изобретения отличаются тем, что когда антитела применяют для измерения пресепсина человеческой сыворотки, разброс измеренных значений в ряду различий от партии к партии антител является более низким в сравнении с антителами S68, и антитела имеют высокую однородность от партии к партии антител. Концентрация пресепсина в человеческой сыворотке может быть измерена, чтобы оценить разброс измеренных значений от партии к партии посредством построения сэндвич-системы ELISA с использованием антител настоящего изобретения. Сэндвич-система ELISA более предпочтительно является системой, в которой применяют (a) антитела настоящего изобретения и (b) антитело F1106-13-3 или антитело F1031-8-3 (раскрытые в Примере 3 из WO2004/044005).
[0056] Более подробно, разброс измеренных значений от партии к партии можно оценить, согласно методу, описанному в Примере 5. Согласно описанию в Примере 5, антитела настоящего изобретения (например, применяют 3 партии) иммобилизуют на твердой фазе, измеряют концентрацию пресепсина из более чем одного образца (при известной концентрации пресепсина), и проводят корреляционный анализ с полученными измеренными значениями и известной концентрацией для определения линии регрессии, и можно определить коэффициент вариации (CV) углов наклона линий регрессии. CV определенных углов наклона может применяться для оценки разброса измеренных значений от партии к партии антител. CV угла наклона антител согласно предпочтительному варианту осуществления настоящего изобретения составляет предпочтительно 15% или менее, более предпочтительно 13% или менее и особенно предпочтительно 11% или менее. В одном другом предпочтительном варианте осуществления, CV углов наклона антител настоящего изобретения является более низким, чем CV углов наклона для антител S68, и различие угла наклона составляет предпочтительно 3% или более, более предпочтительно 5% или более и даже более предпочтительно 8% или более. Для измерения стандартных образцов с известной концентрацией пресепсина предпочтительно применять набор для измерения пресепсина с использованием антител S68 (такой как PATHFAST™ Presepsin, Mitsubishi Chemical Medience Corporation).
[0057] Что касается антител настоящего изобретения, то, когда выстраивают систему измерения и пресепсин измеряют в более чем одном образце (при известной концентрации пресепсина), предпочтительно, чтобы антитела имели хорошую корреляцию между измеренными значениями и известными концентрациями. Наличие хорошей корреляции означает коэффициент корреляции, равный предпочтительно 0,9 или более и более предпочтительно 0,95 или более.
[0058] В некоторых вариантах осуществления настоящего изобретения, антитела настоящего изобретения очищают.
Антитела настоящего изобретения могут быть получены посредством, например, очистки поликлональных антител, полученных из млекопитающего, не являющегося человеком, иммунизированного с использованием пептида (например, пептида S68), в качестве иммуногена, включающего аминокислотные остатки от положения 1 до положения 9 аминокислотной последовательности SEQ ID NO: 2, и включающего 9 или более последовательных аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 2.
[0059] Альтернативно, антитела настоящего изобретения могут быть получены посредством подвергания поликлональных антител обработке, чтобы увеличить долю антител, специфически связывающихся с пептидом (пептидом P03), содержащим аминокислотную последовательность SEQ ID NO: 1, поликлональных антител, получаемых из кролика, иммунизированного с использованием пептида (например, пептида S68), в качестве иммуногена, включающего аминокислотные остатки от положения 1 до положения 9 аминокислотной последовательности SEQ ID NO: 2, и включающего 9 или более последовательных аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 2.
[0060] Конкретный способ получения антител настоящего изобретения описан ниже в данном документе.
[0061] 2. Способ получения антител настоящего изобретения
Настоящее изобретение предоставляет способ получения поликлональных антител против пресепсина, включающий стадию: получения поликлональных антител из млекопитающего, не являющегося человеком, иммунизированного с использованием пептида, в качестве иммуногена, включающего аминокислотные остатки от положения 1 до положения 9 аминокислотной последовательности SEQ ID NO: 2, и включающего 9 или более последовательных аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 2; и стадию очистки полученных антител с использованием колонки с иммобилизованным пептидом (пептидом P03), содержащим аминокислотную последовательность SEQ ID NO: 1.
[0062] При получении антител настоящего изобретения, пептид, применяемый в качестве иммуногена, включает аминокислотные остатки от положения 1 до положения 9 аминокислотной последовательности SEQ ID NO: 2 и включает 9 или более последовательных аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 2. Термин ʺ9 или более последовательных аминокислотных остатковʺ означает предпочтительно 10 или более последовательных, более предпочтительно 12 или более, последовательных, особенно предпочтительно 16 последовательных аминокислотных остатков. В дополнение, пептид, применяемый в качестве антигена, не ограничивается, с учетом других частей аминокислотной последовательности, поскольку пептид включает 9 или более последовательных аминокислот в аминокислотных остатках, указанных в SEQ ID NO: 2, но предпочтительно, чтобы пептид имел аминокислотную последовательность, которая вся является производной из аминокислотной последовательности SEQ ID NO: 2. Цистеин может быть вставлен по N- или C-концу (предпочтительно N-концу) пептида, чтобы обеспечить связывание носителя, описанного ниже в данном документе, через SH-группу. Пептид, применяемый в качестве иммуногена, особенно предпочтительно является пептидом (пептидом S68), состоящим из 16 последовательных аминокислотных остатков (а именно, всех аминокислотных остатков) в аминокислотной последовательности SEQ ID NO: 2, и может иметь цистеин, вставленный по его N- или C-концу (предпочтительно N-концу).
[0063] Способ получения пептида, применяемого в качестве иммуногена, может являться способом с использованием обычно применяемого пептидного синтезатора (пептидного синтезатора 433A, Perkin Elmer Japan Co., Ltd.) и т.п., способом генной рекомбинации (Division of Cancer Research, Institute of Medical Science, University of Tokyo Ed., Shin Saibo Kogaku Jikken Protcol (New Protocols of Cellular Engineering Experiments), Shujunsha Co., Ltd.) и т.п.
[0064] Например, пептид, включающий 9 или более последовательных аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 2, может быть синтезирован на пептидном синтезаторе 433A посредством Fmoc-метода, и после снятия защитных групп с использованием ТФУ и отщепления от смолы, пептид может быть очищен посредством использования колонки C18 для ВЭЖХ (Capcell-pak, Shiseido Company, Limited), и может быть получен желательный пептид.
[0065] Когда антигеном является белок, белок может применяться в качестве иммуногена непосредственно. Однако когда пептид включает от 8 до 30 аминокислотных остатков или менее, пептид, как правило, может не обладать иммуногенностью вследствие низкой молекулярной массы. В этом случае, пептид может быть связан с носителем или пептид может применяться для получения MAP-пептида посредством способа множественного антигенного пептида (MAP), чтобы придать молекулярную массу, которая проявляет иммуногенность, чтобы получить, таким образом, иммуноген.
[0066] Что касается носителя, связанного с пептидом, описанным выше, то им может быть белок-носитель или полимер. Белок-носитель, который может применяться, представляет собой гетерогенный белок, такой как альбумин бычьей сыворотки, гемоцианин лимфы улитки (KLH), тиреоглобулин и овальбумин. Эти белки-носители могут быть связаны с пептидом посредством использования функциональной группы боковой цепи в аминокислоте пептида или белка-носителя, или могут быть связаны посредством введения малеимидной группы, N-гидроксисукцинимидной (NHS) группы или альдегидной группы. В этом случае, аминокислота (например, цистеин), функциональная группа которой может использоваться, может быть связана с пептидом. Полимер может представлять собой сахариды, такие как маннан или хитозан и т.п. или поливинилпирролидон (PVA). Эти полимеры могут быть связаны с пептидом посредством адсорбции или химического связывания, как описано выше.
[0067] В некоторых вариантах осуществления настоящего изобретения, иммуноген представляет собой пептид S68, связанный с KLH (пептид S68-KLH) через цистеин, вставленный по N-концу.
[0068] Посредством применения иммуногена, полученного, как указано выше, поликлональные антитела, направленные на иммуноген, могут быть получены в соответствии с хорошо известным методом (например, см. Men-eki Jikken Sosaho (Immunological Experimental Procedures), Japanese Society for Immunology Ed., published by Japanese Society for Immunology).
[0069] Млекопитающее, не являющееся человеком, иммунизируют с использованием иммуногена, полученного, как указано выше. Например, млекопитающее, не являющееся человеком, иммунизируют с использованием от 20 до 1000 мкг иммуногена, смешанного с адъювантом, таким как неполный адъювант Фрейнда, адъювант RIBI, ALUM или т.п. Млекопитающее, не являющееся человеком, предпочтительно является кроликом, козой, лошадью, овцой, свиньей, крысой, мышью и т.п., среди которых кролик или коза являются предпочтительными, и кролик является более предпочтительным. Иммунизация может быть выполнена посредством внутримышечного введения, внутрикожного введения, подкожного введения, внутрибрюшинного введения, введения в лимфатические узлы и т.п. Бустер-иммунизация может быть выполнена посредством аналогичного введения иммуногена, смешанного с адъювантом, таким как неполный адъювант Фрейнда, адъювант RIBI, ALUM или т.п., или посредством прямого введения иммуногена внутривенно с интервалом от 1 до 4 недель после первоначального введения.
[0070] Поликлональные антитела, направленные на иммуноген, могут быть собраны из крови или жидкости брюшной полости, предпочтительно из крови млекопитающего, не являющегося человеком, иммунизированного согласно приведенному выше методу. Кровь собирают из иммунизированного млекопитающего, не являющегося человеком, в соответствии с обычным методом забора крови, таким как из сонной артерии, вены предсердия, сердца, ножной вены и т.п. Из собранной крови антисыворотка может быть отделена центрифугированием или т.п. Для получения поликлональных антител, предпочтительно использовать антисыворотку, полученную из индивидуальных иммунизированных млекопитающих, не являющихся человеком, имеющим титр антител. Титр антител в антисыворотке может быть измерен посредством, например, обеспечения проведения реакции меченого пептида P03 с антисывороткой и затем измерения активности метки, связанной с пептидом P03, или обеспечения проведения реакции пептида P03, иммобилизованного на планшете, с антисывороткой и обнаружения количества антител, связанных с пептидом P03 с использованием меченого вторичного антитела. Антисыворотку затем подвергают осаждению γ-глобулиновой фракции высаливанием, при котором добавляют сульфат аммония, сульфат натрия или т.п., и диализу в соответствующем буфере, и поликлональные антитела, направленные на иммуноген (например, очищенные поликлональные антитела фракции IgG) затем могут быть получены посредством использования аффинной матрицы, которая может специфически очищать γ-глобулины, такой как Белок A и Белок G.
[0071] Полученные таким образом поликлональные антитела могут содержать, в дополнение к P03-специфичным поликлональным антителам, поликлональные антитела против пресепсина, отличающиеся от P03-специфичных поликлональных антител. В настоящем изобретении, полученные таким образом поликлональные антитела подвергают обработке, которая увеличивает долю антител, специфически связывающихся с пептидом P03. Обработка может включать, например, очистку.
[0072] Чтобы очистить поликлональные антитела против пресепсина, связывающиеся с пептидом P03 (именуемые как ʺP03-очищенные поликлональные антителаʺ) из полученных поликлональных антител, очистку проводят, используя аффинную матрицу. Более подробно, аффинная матрица представляет собой колонку, на которой иммобилизуют пептид P03. Поскольку пептид P03 связывается с колонкой через SH-группу, цистеин может быть связан по N- или C-концу. Аминокислотная последовательность пептида P03, имеющего цистеин, связанный по его N-концу, и аминокислотная последовательность пептида P03, имеющего цистеин, связанный по его С-концу, указаны в SEQ ID NO: 4 и SEQ ID NO: 5, соответственно. Предпочтительно, колонка с иммобилизованным пептидом Р03 является колонкой, с которой связаны как пептид P03, имеющий цистеин, связанный по его N-концу, и пептид P03, имеющий цистеин, связанный по его С-концу. P03-очищенные поликлональные антитела могут быть получены посредством очистки очищенной фракции IgG, полученной как указано выше, на такой колонке.
[0073] P03-очищенные поликлональные антитела представляют собой антитела, полученные посредством очистки с использованием пептида P03, как описано выше, и связыванием с пептидом P03, и процентное содержание доли P03-специфичных поликлональных антител в P03-очищенных поликлональных антителах является более высоким, чем процентное содержание доли P03-специфичных поликлональных антител в антителах S68. Следовательно, P03-очищенные поликлональные антитела могут проявлять превосходные свойства, будучи полученными из P03-специфичных поликлональных антител в сравнении с антителами S68.
[0074] При необходимости, специфичность полученных антител может подтверждаться выполнением анализа конкурентного ингибирования с использованием пептидов согласно описанию в Примере 3 и, в соответствии с его результатом, антитела могут быть подвергнуты следующей обработке.
[0075] Например, полученные P03-очищенные поликлональные антитела могут содержать, в дополнение к P03-специфичным поликлональным антителам, поликлональные антитела, связывающиеся с по меньшей мере одним пептидом, выбранным из пептида P02 и пептида P04, например, пептидом P02 или пептидом P04.
[0076] В некоторых вариантах осуществления настоящего изобретения полученные P03-очищенные поликлональные антитела могут дополнительно подвергаться обработке, которая удаляет антитела, связывающиеся с пептидом Р04, или предпочтительно антитела, связывающиеся с пептидом Р02 и пептидом Р04. Примеры обработки, которая удаляет антитела, связывающиеся с пептидами, включают очистку с использованием аффинной матрицы. Более подробно, например, когда антитело содержит антитела, связывающиеся с пептидом Р04, для аффинной матрицы применяют колонку с иммобилизованным пептидом Р04. Поскольку пептид Р04 связывается с колонкой через SH-группу, цистеин может быть связан по N- или C-концу. Предпочтительно, колонка с иммобилизованным пептидом Р04 является колонкой, с которой связаны как пептид Р04, имеющий цистеин, связанный по его N-концу, так и пептид Р04, имеющий цистеин, связанный по его С-концу. Посредством выполнения очистки с использованием такой колонки, антитела, связывающиеся с пептидом P04, могут быть удалены из P03-очищенных поликлональных антител. Когда антитела также содержат антитела, связывающиеся с пептидом Р02, колонку с иммобилизованным пептидом Р02 можно применять для очистки аналогично способу, описанному выше. Соответственно, поликлональные антитела против пресепсина, специфически связывающиеся с пептидом P03 (именуемые как ʺP03-специфичные поликлональные антителаʺ) могут быть получены из P03-очищенных поликлональных антител.
[0077] В других вариантах осуществления настоящего изобретения полученные P03-очищенные поликлональные антитела могут дополнительно подвергаться обработке, которая снижает активность связывания антител, связывающихся с пептидом Р04, или предпочтительно обработке, которая снижает активность связывания антител, связывающихся с пептидом P02, и антител, связывающихся с пептидом Р04. Примеры обработки, которая снижает активность связывания антител, связывающихся с пептидом Р04, включают обработку, при которой пептид P04 добавляют к P03-очищенным поликлональным антителам, чтобы обеспечить реакцию антиген-антитело, и активность связывания антител, связывающихся с пептидом Р04, блокируется. Обработка, которая снижает активность связывания антител, связывающихся с пептидом Р02, может также выполняться аналогично способу, описанному выше. Соответственно, активность связывания антител, связывающихся с пептидом Р04, или предпочтительно, активность связывания антител, связывающихся с пептидом Р02, и антител, связывающихся с пептидом Р04 в P03-очищенных поликлональных антителах, может снижаться.
[0078] Антигенсвязывающий фрагмент может быть получен из полученных таким образом поликлональных антител согласно хорошо известному способу.
[0079] В ряду антигенсвязывающих фрагментов, Fab указывает на фрагмент антител, имеющий антигенсвязывающую активность, в котором около половины H-цепи с N-концевой стороны и полная L-цепь связаны через дисульфидную связь. Fab может быть получен посредством, например, обработки поликлональных IgG антител протеазой папаином для фрагментации антител и очистки, при необходимости, в соответствии с хорошо известным способом.
[0080] F(ab')2 представляет собой Fab, связанный с использованием дисульфидной связи шарнирной области. F(ab')2 может быть получен посредством обработки поликлональных IgG антител протеазой пепсином для фрагментации антител и очистки, при необходимости, в соответствии с хорошо известным способом.
[0081] Fab' представляет собой фрагмент антитела, имеющий антигенсвязывающую активность, полученный посредством расщепления дисульфидной связи шарнирной области F(ab')2. Fab' может быть получен посредством, например, обработки F(ab')2 восстанавливающим реагентом дитиотреитолом для расщепления дисульфидной связи шарнирной области и очистки, при необходимости, в соответствии с хорошо известным способом.
[0082] 3. Способ измерения пресепсина
Настоящее изобретение предоставляет способ (именуемый как ʺспособ измерения настоящего изобретенияʺ) для иммунологического измерения пресепсина посредством антител настоящего изобретения, где способ включает стадию предоставления антител настоящего изобретения в образец, содержащий пресепсин. Как применяют в данном документе, термин ʺизмерениеʺ может применяться взаимозаменяемо с такими терминами как ʺобнаружениеʺ, ʺколичественное определениеʺ, ʺанализʺ и т.п., и его применяют для включения значений количественных и качественных определений. Измерение пресепсина предпочтительно выполняют in vitro.
[0083] Поскольку пресепсин является известным маркером для обнаружения сепсиса, способ может рассматриваться как способ обнаружения сепсиса, включающий стадию предоставления антител настоящего изобретения в образец, содержащий пресепсин.
[0084] А именно, способ может рассматриваться как способ обнаружения сепсиса или способ, способствующий обнаружению или диагностике сепсиса, способ, включающий 1) стадию измерения концентрации пресепсина в образце от субъекта посредством использования антител настоящего изобретения, и 2) стадию сравнения концентрации пресепсина, полученной в 1), с пороговым значением, чтобы заключить является или нет концентрация более высокой чем пороговое значение. Пороговое значение составляет от 314 до 600 пг/мл, предпочтительно от 400 до 580 пг/мл, более предпочтительно от 450 до 550 пг/мл и даже более предпочтительно 500 пг/мл.
[0085] В настоящем изобретении, ʺобнаружение заболеванияʺ можно понимать, как ʺспособствовать обнаружению заболеванияʺ или ʺспособствовать диагностике заболеванияʺ.
[0086] Антитела могут также применяться для обнаружения или оценки по меньшей мере одного заболевания, выбранного из таких задач, как установление различия между сепсисом и синдромом системной воспалительной реакции (SIRS), оценка риска тяжести сепсиса, прогноз развития сепсиса (предсказание смертности), оценка степени тяжести сепсиса, обнаружение инфекции области хирургического вмешательства, обнаружение синдрома диссеминированной внутрисосудистой коагуляции (DIC), обнаружение инфекционной DIC, обнаружение болезни сердца, обнаружение респираторной инфекции, ассоциированной с бактериальной инфекцией, обнаружение воспалительного заболевания кишечника (болезни Крона, язвенного колита), обнаружение фебрильной нейтропении (FN), обнаружение гемофагоцитарного синдрома (HPS) и оценка функции фагоцитов.
[0087] Термин ʺинфекция области хирургического вмешательстваʺ, как применяют в данном документе, означает инфекционные заболевания, которые вызываются после хирургического вмешательства, и включает все инфекции, обусловленные операцией и адъювантными терапиями, необходимыми для нее. Инфекция области хирургического вмешательства включает все заболевания, диагностируемые как инфекция области хирургического вмешательства, на основании Руководства по предупреждению инфекции области хирургического вмешательства, 1999 (CDC).
Заболевание сердца, например, включает острый коронарный синдром (ACS), острую сердечную недостаточность, острую декомпенсированную сердечную недостаточность (ADHF), хроническую сердечную недостаточность, заболевание коронарной артерии, стенокардию, инфаркт миокарда, ишемический инсульт, внутримозговое кровоизлияние и преходящее ишемическое нарушение.
[0088] Респираторная инфекция, ассоциированная с бактериальной инфекцией, может представлять собой инфекцию нижних дыхательных путей или пневмонию. Инфекция нижних дыхательных путей включает острую инфекцию нижних дыхательных путей и хроническую инфекцию нижних дыхательных путей. Острая инфекция нижних дыхательных путей включает острый трахеит, острый бронхит и острый бронхиолит, и большинство из них происходят вследствие распространения вирусной инфекции из верхних дыхательных путей в более низкие дыхательные пути и при некоторых из этих заболеваний затем имеет место вторичная инфекция, вызванная бактериями. Если наблюдались признаки бактериальной вторичной инфекции, может применяться введение антибиотиков. Хроническая инфекция нижних дыхательных путей является патологическим состоянием, при котором устойчивая бактериальная инфекция устанавливается в нижних дыхательных путях, имеющих органические нарушения вследствие бронхоэктаза или хронического обструктивного заболевания легких, и включает устойчивую инфекцию и острый приступ. Заболевания, вызывающие органические нарушения нижних дыхательных путей, включают бронхоэктаз, хроническое обструктивное заболевание легких, хронический бронхит, диффузный панбронхиолит, абсолютный туберкулез легких, пневмокониоз, нетуберкулезную микобактериальную инфекцию, аллергический бронхолегочный аспергиллез, фиброз легких, хроническую бронхиальную астму и т.п. Как в случае устойчивой инфекции, так и острых приступов заболеваний, применяют введение антибиотиков. Пневмония включает внебольничную пневмонию и внутрибольничную пневмонию. Предпочтительно, пневмония представляет собой внебольничнаю пневмонию.
[0089] Оценка функции фагоцитов включает (a) измерение фагоцитарной активности нейтрофилов, гранулоцитов и/или лейкоцитов, (b) оценку иммунной функции посредством измерения фагоцитарной активности нейтрофилов, гранулоцитов и/или лейкоцитов, (c) оценку качества имплантируемых клеток при трансплантации аутологичных клеток или трансплантации аллогенных клеток, (d) обнаружение заболевания, ассоциированного с фагоцитозом посредством фагоцитов и т.п. Примеры заболевания, ассоциированного с фагоцитозом посредством фагоцитов, включают аутоиммунные заболевания, ревматоидный артрит, воспаление молочных желез, подагру, гломерулонефрит, язвенный колит, средиземноморскую лихорадку, отит среднего уха, ринит, пневмонию, туберкулез, цистит, инфекцию в амниотической жидкости и пиоспермию. Образец, применяемый при обнаружении заболевания, ассоциированного с фагоцитозом фагоцитов, представляет собой биологическую жидкость, такую как тканевую жидкость, лимфу, синовиальную жидкость, молоко, спинномозговую жидкость, гной, слюну, слезную жидкость, слизь, отделяемое из носа, мокроту, мочу, жидкость брюшной полости, амниотическую жидкость и семенную жидкость, а также промывные жидкости, полученные после промывки носовой полости, бронхов, легкого, кожи, брюшной полости, различных органов, суставов, костей и т.п.
[0090] Примеры метода иммунологического измерения пресепсина посредством применения антител настоящего изобретения включают иммуноферментный анализ ((далее в данном документе также именуемый как EIA или ELISA), хемилюминесцентный иммуноферментный анализ (CLEIA), хемилюминесцентный иммунологический анализ (CLIA), метод флуоресцентных антител (FAT), флуоресцентный иммуноферментный анализ (FEIA), электрохемилюминесцентный иммунологический анализ (ECLIA), радиоиммунологический анализ (RIA), иммунохроматографию, метод агглютинации, конкурентный анализ и т.п., но ими не ограничены. В настоящем изобретении, могут применяться либо прямой метод или косвенный метод. Также может применяться метод сенсибилизации, при котором обнаружение выполняют после образования комплексов биотин-авидин (стрептавидин).
[0091] EIA является одним из иммунологических анализов с использованием меченых ферментом антител и включает прямой метод и косвенный метод. Его предпочтительные примеры включают сэндвич-ELISA (ферментный иммуносорбентный анализ).
[0092] Сэндвич-ELISA представляет собой метод, при котором измерение проводят, используя два или более антител с различными участками распознавания антигена и посредством образования комплексов антитело-антиген-антитело с антигеном для обнаружения, расположенным между двумя видами антител, и одно антитело предварительно иммобилизуют на твердой фазе.
[0093] Хемилюминесцентный иммуноферментный анализ (CLEIA) представляет собой метод, при котором антиген в образце взаимодействует с антителами, иммобилизованными на магнитных частицах или шариках, с последующей реакцией с антителом, меченым ферментом, промывкой (B/F разделением), ферментативной реакцией при добавлении хемилюминесцентного субстрата и измерением интенсивности люминесценции.
[0094] Например, антиген в образце может реагировать с антителом, конъюгированным с биотином в жидкой фазе, антитело может улавливаться магнитными частицами, связанными со стрептавидином, и реакция меченого ферментом антитела может обеспечиваться после промывки (B/F разделения), с последующей аналогичной обработкой, как описано выше.
[0095] Когда в качестве фермента для мечения применяют щелочную фосфатазу (ALP), предпочтительно, чтобы применяемый хемилюминесцентный субстрат представлял собой CDP-Star™, AMPPD™ или CSPD™. Когда меченым ферментом является HRP, в качестве хемилюминесцентного субстрата предпочтительно применяют люминол.
[0096] Как правило, утверждают, что чувствительность обнаружения является более высокой в следующем порядке: хемилюминесценция > флуоресценция > поглощение (окрашивание), и метод измерения может быть выбран в соответствии с желательной чувствительностью.
[0097] Хемилюминесцентный иммунологический анализ (CLIA) является методом, при котором антиген в образце реагирует с антителами, иммобилизованными на магнитных частицах или т.п., с последующей реакцией с антителами, мечеными хемилюминесцентным веществом, промывкой (B/F разделением) и измерением интенсивности люминесценции. В качестве вещества для мечения применяют акридиний или т.п.
[0098] Флуоресцентный иммуноферментный анализ (FEIA) является методом, при котором антиген в образце взаимодействует с иммобилизованными антителами, с последующей реакцией с антителом, меченым ферментом, промывкой (B/F разделением), ферментативной реакцией при добавлении флуоресцентного субстрата и измерением интенсивности флуоресценции. В качестве фермента для мечения применяют HRP, ALP или т.п. Предпочтительно, чтобы Amplex™ Red или т.п. применяли в качестве флуоресцентного субстрата, когда ферментом для мечения является HRP, и 4-MUP (4-метилумбеллифенилфосфат), AttoPhos™ или т.п. применяют в качестве флуоресцентного субстрата, когда ферментом для мечения является ALP.
[0099] Электролюминесцентный иммунологический анализ (ECLIA) представляет собой метод, при котором обеспечивают взаимодействие антигена в образце, антител, иммобилизованных на магнитных частицах, и антител, меченных электролюминесцентным веществом, с последующей промывкой (B/F разделением) и измерением интенсивности электрической энергии люминесценции. Рутений или т.п. применяют в качестве вещества для мечения. Когда Ru(bpy)3 или т.п. применяют в качестве вещества для мечения, возбуждение люминесценции повторяется вследствие окисления, основанного на зарядке электрода и реакции восстановления под действием трипропиламина (TPA) или т.п.
[0100] Радиоиммунологический анализ ((RIA) является методом измерения с использованием вещества, меченного радиоактивным изотопом. Например, после реакции антигена в образце и антител, иммобилизованных на шариках или т.п., обеспечивают взаимодействие с антителами, меченными радиоактивным изотопом (125I или т.п.), и доза 125I может быть измерена после промывки (B/F разделения).
[0101] Иммунохроматография представляет собой иммунологический анализ, основанный на капиллярном действии вещества, подлежащего обнаружению, мигрирующего на тестовой полоске при растворении реагента. Она является методом, при котором иммунокомплекс образуется из трех веществ, то есть, антигена в образце, меченого антитела на тест-полоске и антитела захвата, и наблюдают окраску меченого продукта. В качестве метки для антитела применяют коллоидное золото, ферменты, флуоресцентные вещества или т.п. Когда применяют антитело, меченное ферментом, субстрат для фермента наносят на тест-полоску для проявления цвета.
[0102] Проточный метод является методом, при котором на нерастворимом носителе, которым является мембрана, антиген, подлежащий обнаружению, вместе с раствором в образце образует комплекс антитело-антиген-антитело. Со временем, вещество, которое не иммобилизовано на мембране перпендикулярно проходит через мембрану от поверхности к обратной поверхности мембраны, и его удаляют.
[0103] Метод агглютинации является методом, при котором антиген в образце взаимодействует с антителом в реагенте, и наблюдают его агглютинацию. Метод включает метод без использования твердой фазы, метод агглютинации частиц (PA), при котором искусственно полученные частицы применяют в качестве твердой фазы, и метод PA, включающий латексную агглютинацию (LA), при котором применяют латексные частицы.
[0104] При конкурентном анализе, например, антитела связывают с твердой фазой, и они одновременно взаимодействуют с образцом для тестирования и определенным количеством меченого антигена, и таким образом количество антигена в образце может быть измерено, исходя из количества связанного меченого продукта.
[0105] Антитела настоящего изобретения предпочтительно применяют для приведенных выше методов измерения.
[0106] Образец, применяемый для измерения пресепсина, конкретно не ограничивают, но предпочтительно он является водным образцом. Его примеры включают биологические жидкости, такие как кровь (цельную кровь, плазму крови, сыворотку крови, и т.д.), мочу, тканевую жидкость, лимфу, синовиальную жидкость, молоко, спинномозговую жидкость, гной, слюну, слезную жидкость, слизь, отделяемое из носа, мокроту, жидкость брюшной полости, амниотическую жидкость и семенную жидкость, а также промывные жидкости, полученные после промывки носовой полости, бронхов, легкого, кожи, брюшной полости, различных органов, суставов, костей и т.п., супернатанты клеточных культур, элюенты с колонки, элюенты и т.п. Эти образцы могут применяться для измерения либо непосредственно или после разбавления или экстракции с использованием различных буферов, с последующим концентрированием.
[0107] Кроме того, в случае использования цельной крови в качестве образца, образец цельной крови будет проанализирован в интервале 72 часов, 48 часов, 24 часов, 12 часов, 6 часов или 4 часов после сбора образца цельной крови. Сбор образца цельной крови может проводиться с использованием пробирки для сбора крови с EDTA или пробирки для сбора крови с гепарином. Предпочтительно, образец цельной крови анализируют в пределах 6 часов после ее сбора в пробирку для сбора крови с EDTA или в пределах 4 часов после ее сбора в пробирку для сбора крови с гепарином.
[0108] 4. Набор для измерения sCD14-ST
Настоящее изобретение предоставляет набор (именуемый как ʺизмерительный набор настоящего изобретенияʺ) для измерения пресепсина, содержащий антитела настоящего изобретения в качестве главного компонента.
[0109] Измерительный набор настоящего изобретения предпочтительно включает вспомогательный реагент для измерения пресепсина. Примеры вспомогательного реагента включают первичное антитело, вторичное антитело, меченое антитело, фермент для мечения, вещество для введения метки, такое как коллоидное золото, хромогенный субстрат, флуоресцентный субстрат (такой как Amplex™ Red, AttoPhos™ и 4-MUP), хемилюминесцентный субстрат (такой как люминол, CDP-Star™, AMPPD™ и CSPD™), специфически связывающее вещество, такое как биотин-стрептавидин, в растворимом носителе, блокирующий агент, разбавитель, промывочный раствор, стандартное вещество и т.п. без ограничения.
[0110] Измерительные наборы настоящего изобретения соответствующим образом комбинируют и применяют согласно способу измерения пресепсина.
[0111] Первичное антитело предпочтительно является антителом, связывающимся с пресепсином и, более предпочтительно, антителом, распознающим эпитоп, отличающийся от эпитопа, распознаваемого антителами настоящего изобретения. Его примеры включают антитело F1106-13-3 и антитело F1031-8-3, описанные в Примере 3 из WO2004/044005.
[0112] Оба из антитела настоящего изобретения и первичного антитела могут быть мечеными. Когда ни антитело настоящего изобретения или первичное антитело не является меченым, набор может также содержать меченое вторичное антитело.
[0113] Примеры нерастворимого носителя включают магнитные частицы, шарики, стекло, целлюлозу, нитроцеллюлозу, пористые синтетические полимеры, стеклянные волокна, полиакриламид, найлон, полистирол, поливинилхлорид, полипропилен, пластмассовые планшеты, латексные частицы, нетканые изделия, фильтровальную бумагу и т.п.
[0114] Меткой для антитела могут предпочтительно быть ферменты, такие как пероксидаза (HRP), щелочная фосфатаза (ALP) и β-галактозидаза, коллоидное золото и т.п. без ограничения.
[0115] Например, когда применяют HRP, хромогенный субстрат может представлять собой 3,3',5,5'-тетраметилбензидин (TMB), о-фенилендиамин (OPD) или т.п. Когда применяют ALP, хромогенный субстрат может представлять собой п-нитрофенилфосфат (pNPP) или т.п. Примеры хромогенного субстрата, когда применяют β-галактозидазу, включают o-нитрофенил-β-D-галактопиранозид (ONPD) и т.п.
[0116] Например, измерительный набор для сэндвич-ELISA может содержать антитела настоящего изобретения и первичное антитело (одно из двух антител может быть меченым с использованием фермента), хромогенный субстрат, разбавитель, стандартное вещество и т.п. Когда ни антитело настоящего изобретения или первичное антитело не является меченым, набор может также содержать меченое вторичное антитело.
[0117] Измерительный набор для хемилюминесцентного иммуноферментного анализа (CLEIA) может содержать, например, антитела, иммобилизованные на магнитных частицах или т.п., антитело, меченное ферментом, хемилюминесцентный субстрат, разбавитель, промывочный раствор и т.п.
[0118] Измерительный набор для флуоресцентного иммуноферментного анализа (FEIA) может содержать, например, антитела, иммобилизованные на магнитных частицах или т.п., антитело, меченное ферментом, флуоресцентный субстрат, разбавитель, промывочный раствор и т.п.
[0119] Измерительный набор для электролюминесцентного иммунологического анализа (ECLIA) может содержать, например, биотинилированное антитело, Ru(bpy)3-меченое антитело, покрытые стрептавидином магнитные частицы, трипропиламин и т.п.
[0120] Измерительный набор для иммунохроматографии представляет собой тест-полоску, включающую слой добавления образца, слой реагента, слой обнаружения и слой абсорбента, которые предоставлены таким образом, что жидкий образец, добавленный в слой добавления тестируемого образца перемещается через слои в указанном выше порядке. Например, слой реагента может быть импрегнирован меченым вторым антителом, а нерастворимый носитель, связанный с первым антителом может быть предоставлен в слое обнаружения.
[0121] Тест-полоска может иллюстрироваться на примере тест-полоски, содержащей пористый носитель и т.п. Примеры пористого носителя включают нитроцеллюлозу, целлюлозу, поизводные целлюлозы, найлон, найлоновые волокна, стеклянные волокна, пористые синтетические полимеры и т.п. Слой абсорбента может быть представлен абсорбирующими полимерами, такими как губка, изготовленная с использованием водопоглощающих материалов, целлюлозных фильтров, фильтровальной бумаги и т.п.
[0122] Поскольку сообщается, что пациенты с сепсисом имеют характерную увеличенную концентрацию пресепсина в крови, набор для измерения пресепсина настоящего изобретения может представлять собой набор для обнаружения сепсиса или набор, способствующий обнаружению или дигностике сепсиса.
[0123] Измерительный набор настоящего изобретения может применяться в качестве диагностического средства для сепсиса или вспомогательного средства для диагностики сепсиса. Когда набор для измерения пресепсина применяют с целью обнаружения сепсиса или т.п., определяют, что субъект имеет вероятность сепсиса, когда концентрация пресепсина в образце от субъекта, измеренная с использованием антител настоящего изобретения, является более высокой, чем пороговое значение, и, таким образом, это способствует обнаружению или диагностированию. Пороговое значение составляет от 314 до 600 пг/мл, предпочтительно от 400 до 580 пг/мл, более предпочтительно от 450 до 550 пг/мл и дополнительно более предпочтительно 500 пг/мл.
[0124] В дополнение, набор для измерения пресепсина может применяться для обнаружения или оценки, например, по меньшей мере одного заболевания, выбранного из таких задач, как установление различия между сепсисом и синдромом системной воспалительной реакции (SIRS), оценка риска тяжести сепсиса, прогноз развития сепсиса (предсказание смертности), оценка степени тяжести сепсиса, обнаружение инфекции области хирургического вмешательства, обнаружение синдрома диссеминированной внутрисосудистой коагуляции (DIC), обнаружение инфекционной DIC, обнаружение болезни сердца, обнаружение респираторной инфекции, ассоциированной с бактериальной инфекцией, обнаружение воспалительного заболевания кишечника (болезни Крона, язвенного колита), обнаружение фебрильной нейтропении (FN), обнаружение гемофагоцитарного синдрома (HPS) и оценка функции фагоцитов. Набор для измерения пресепсина может являться набором для обнаружения или оценки по меньшей мере одного из заболеваний, описанных выше.
[0125] 5. Способ лечения пациентов с сепсисом
Настоящее изобретение предоставляет способ лечения пациента с сепсисом, включающий лечение сепсиса у субъекта, которому проводили способ, способствующий обнаружению сепсиса посредством использования антител настоящего изобретения.
[0126] Способ, способствующий обнаружению сепсиса, представляет собой способ, описанный выше. Лечение сепсиса включает, например, введение антибактериальных средств или стероидов, вазопрессоров, инфузионную терапию, введение кислорода, контроль искусственного дыхания, непрерывную гемодиафильтрацию, плазмаферез и т.п., но конкретно не органичено.
[0127] 6. Способ скрининга тестируемых лекарственных средств (или терапевтических лекарственных средств)
Настоящее изобретение предоставляет способ скрининга тестируемого лекарственного средства (или терапевтического лекарственного средства), включающий стадию определения концентрации пресепсина в образце от субъекта, которому вводят тестируемое лекарственное средство (или терапевтическое лекарственное средство), с использованием антител настоящего изобретения или измерительного набора настоящего изобретения. Заболевание, на которое нацелено тестируемое лекарственное средство, конкретно не ограничивается, поскольку оно является заболеванием, при котором концентрация пресепсина в образце от субъекта увеличивается. Предпочтительно, концентрацию пресепсина в образце от субъекта сравнивают до и после введения тестируемого лекарственного средства, чтобы определить снижается или не снижается концентрация пресепсина после введения тестируемого лекарственного средства по сравнению с концентрацией пресепсина до введения. Альтернативно определяют, снижается или не снижается концентрация пресепсина в образце от субъекта после введения тестируемого лекарственного средства в сравнении с уровнем пресепсина у нормального человека.
[0128] В одном варианте осуществления, способ скрининга тестируемого лекарственного средства включает следующую стадию:
1) стадию определения концентрации пресепсина в образце от субъекта, которому вводят тестируемое лекарственное средство.
[0129] 7. Способ скрининга поликлональных антител против пресепсина
Настоящее изобретение предоставляет способ скрининга антител для получения поликлональных антител против пресепсина, применимых для измерения пресепсина в образце, способ, который включает по меньшей мере следующие стадии:
[0130] 1) стадию получение кандидатных поликлональных антител против пресепсина; и
2) стадию построения системы измерения пресепсина с кандидатными антителами и отбор антител в системе реакции для конкурентной реакции пептида (пептида P03), содержащего аминокислотную последовательность SEQ ID NO: 1, таким образом, чтобы ингибировать связывание между антителами и пресепсином, причем выбранные антитела конкурентно ингибируют связывание антител и пресепсина на 30% или более, и
в системе реакции для обеспечения конкурентной реакции пептида (пептида P05), содержащего аминокислотную последовательность SEQ ID NO: 9 таким образом, чтобы ингибировать связывание между антителами и пресепсином, причем выбранные антитела конкурентно ингибируют связывание антител и пресепсина на менее чем 30%.
[0131] Анализ конкурентного ингибирования может быть выполнен согласно описанию в Примере 3.
[0132] Предпочтительно, способ может дополнительно включать стадию отбора антител, имеющих конкурентное ингибирование посредством пептида P01, пептида Р02, пептида Р04, пептида Р06, пептида Р07 и/или пептида Р08, менее 30%. Пептиды могут быть выбраны соответствующим образом.
[0133] Все ссылки, опубликованные патентные заявки, опубликованные патенты, выданные по заявкам, и другие патентные ссылки, цитируемые в данном описании, включены в него посредством ссылки.
Настоящее изобретение более конкретно описано далее в данном документе посредством Примеров. Не следует понимать, что настоящее изобретение ограничивается Примерами.
ПРИМЕРЫ
[0134] Пример 1: Получение поликлональных антител, специфически очищенных с использованием пептида S68 или пептида P03
Кроличьи поликлональные антитела против пептида S68, полученные посредством иммунизации кроликов иммуногеном пептидом S68, специфически очищали, используя аффинные колонки, на которых были иммобилизованы пептид P03 (SEQ ID NO: 1) и пептид S68 (SEQ ID NO: 2), соответственно.
[0135] 1-1: Получение кроличьих поликлональных антител против пептида S68
Согласно методу, раскрытому в Примере 1 из WO2004/044005, кроликов иммунизировали иммуногеном пептидом S68-KLH. Затем в соответствии с общепринятым методом получали антисыворотку, и 3 партии очищенных фракций IgG (A, B и C) получали осаждением сульфатом аммония и очисткой на Белке A (Prosep-A, Millipore Corporation).
[0136] 1-2: Получение аффинной колонки с иммобилизованным пептидом Р03 и аффинной колонки с иммобилизованным пептидом S68
Согласно руководству, 3,0 мл контактного геля SulfoLink Coupling Gel (ThermoFisher Scientific) заполняли колонку, которую затем промывали 6 колоночными объемами 50 мМ Tris, 5 мМ EDTA (pH8,5). Нижнюю часть колонки закрывали крышкой. Пептид S68 (2,5 мг), имеющий цистеин, связанный по N-концу, и пептид P03 (3,0 мг, смесь равных количеств SEQ ID NO: 4 и 5), имеющий цистеин, связанный по N- или C-концу, растворяли соответственно в 50 мМ Tris, 5 мМ EDTA(pH8,5) при 1мг/мл.
[0137] Пептид P03, имеющий цистеин, связанный по N-концу (SEQ ID NO: 4:CKRVDADADPR).
Пептид P03, имеющий цистеин, связанный по С-концу (SEQ ID NO: 5:KRVDADADPRC).
[0138] Полученные растворы пептидов добавляли к гелю каждой колонки, и верхнюю часть каждой колонки закупоривали. Колонки смешивали посредством перевертывания при комнатной температуре в течение 15 минут и инкубировали при комнатной температуре в течение 30 минут. Крышки с верхних и нижних частей колонок удаляли, и реакционные растворы собирали посредством естественного стекания. Гель промывали 3 объемами геля 50 мМ Tris, 5 мМ EDTA (pH8,5) с последующим блокированием непрореагировавших активных групп раствором, содержащим 50 мМ цистеина. После реакции, гель промывали 16 объемами геля 1M NaCl и 16 объемами геля фосфатного буфера (PBS, pH 7,4). Гель хранили в холодильнике после добавления раствора 1M NaCl/PBS.
[0139] 1-3:Получение специфически очищенных антител
Гель с иммобилизованным пептидом S68 и гель с иммобилизованным пептидом P03, полученные в 1-2 соответственно вводили посредством инъекции в 1 мл колонки, которые затем промывали PBS и уравновешивали. 3 партии очищенных фракций IgG (50 мг каждая), полученные в 1-1, наносили на две различные аффинные колонки с иммобилизованными пептидами при скорости потока, равной 0,5 мл/мин, и неадсорбированную фракцию промывали PBS. Затем колонки элюировали 0,1M Глицин-HCl буфером (pH 2,5) и пиковые фракции собирали. Полученные элюированные фракции нейтрализовали, концентрировали и затем диализировали против PBS (pH 7,4). Чистоту полученных антител подтверждали на SDS-PAGE, и наблюдали одиночную полосу приблизительно рядом с 150 кДа. Концентрацию белка измеряли с использованием DC Protein Assay (Bio-Rad Laboratories, Inc.). Результаты измерений концентраций белка в полученных антителах показаны в Таблице 1. S68-A, S68-B и S68-C указывают на антитела, полученные посредством специфичной очистки на аффинной колонке с иммобилизованным пептидом S68, а P03-A, P03-B и P03-C указывают на антитела, полученные посредством очистки на аффинной колонке с иммобилизованным пептидом Р03.
[0140] Таблица 1
[Таблица 1]
[0141] Пример 2: Оценка реактивности с пресепсином
Используя шесть различных специфически очищенных антител, полученных в Примере 1, были подготовлены сэндвич-системы ELISA, и измеряли стандартный пресепсиновый продукт (rsCD14-ST, раскрытый в Примере 16 WO2005/108429), и реактивность этих антител оценивали. (Далее в данном документе, антитела, полученные посредством специфичной очистки на аффинной колонке с иммобилизованным пептидом P03, именуются как ʺP03-очищенные поликлональные антителаʺ, а антитела, полученные посредством специфичной очистки на аффинной колонке с иммобилизованным пептидом S68, именуются как ʺантитела S68ʺ.)
[0142] 2-1: Получение планшетов с иммобилизованными антителами
Шесть антител, полученных в Примере 1, разбавляли соответственно в PBS (pH 7,4) до 5 мкг/мл и распределяли в иммунопланшеты (MAXISORP, C8 планшет, Nunc). Планшеты герметично закрывали и инкубировали при 4°C в течение ночи. На следующий день планшеты промывали пять раз холодным PBS (pH 7,4), и в них добавляли 200 мл блокирующего раствора для получения планшетов, на которых были иммобилизованы соответствующие антитела.
[0143] 2-2: Сравнение реактивности специфически очищенных антител посредством сэндвич-ELISA
Стандартный продукт пресепсина разбавляли до 500 пг/мл в разбавителе для образцов (D-PBS (pH 7,4) содержащем 0,1% BSA). В каждый планшет, полученный в 2-1, добавляли 50 мкл на лунку разбавителя для образцов (соответствующего 0 пг/мл стандартного продукта пресепсина) или 500 пг/мл стандартного продукта пресепсина, и протекание реакции обеспечивали на шейкере (TAITEC bioShakerM-BR-022UP) при 500 об/мин и 25°C в течение 1 часа. После завершения реакции, планшеты промывали пять раз физраствором, содержащим 0,05% Tween 20 на устройстве для промывки планшетов (Biotec MW-96AR, Nunc-ImmunoWash) с последующим добавлением 50 мкл на лунку раствора меченого пероксидазой антитела F1106-13-3 (раскрытого в Примере 3 из WO2004/044005), разбавленного в разбавителе для меченых антител до 0,125 мкг/мл. После проведения реакции при 25°C и 500 об/мин в течение 2 часов, планшеты аналогично промывали пять раз, в каждую лунку добавляли и раствор тетраметилбензидина (TMB, BioFx) и обеспечивали протекание реакции при комнатной температуре в течение 20 минут. В каждую лунку, добавляли 50 мкл раствора 1M серной кислоты для прекращения реакции, и поглощение измеряли при 450 нм/650 нм на спектрофотометре для планшетов (CORONA ELECTRIC MTP-300). Поглощение антител, когда добавляли 0 пг/мл или 500 пг/мл стандартного продукта пресепсина, показано в Таблице 2.
[0144] В результате, отношение S/N (Поглощение при добавлении 500 пг/мл стандартного продукта пресепсина/Поглощение для 0 пг/мл стандартного продукта пресепсина), определенное на основании поглощения, составляло от 44 до 57 для P03-очищенных поликлональных антител, и в то же время от 17 до 35 для антител S68. Было установлено, что S/N отношение для P03-очищенных поликлональных антитела было приблизительно в 2-3 раза выше, чем это отношение для антител S68. В результате было установлено, что, даже если антитела получали из одних и тех же поликлональных антител, очистка с использованием аффинной колонки с иммобилизованным пептидом Р03 позволяет получить антитела, имеющие более высокую реактивность с пресепсином, чем при очистке на колонке с иммобилизованным пептидом S68.
[0145] Таблица 2
[Таблица 2]
[0146] Пример 3: Оценка специфичности: реакция конкурентного ингибирования пептида
Чтобы оценить специфичность шести различных антител, полученных в Примере 1, применяли сэндвич-ELISA, полученный в Примере 2, и частичные пептиды, производные от пептида S68 (по 10 аминокислот каждый, см. Таблицу 3) добавляли в реакционную смесь соответствующих антител с пресепсином для проведения анализа конкурентного ингибирования.
[0147] 3-1: Получение пептидов
Синтезировали восемь пептидов с использованием пептида P01, содержащего 10 аминокислот, включающего 3 N-концевые аминокислоты пептида S68, и другие пептиды, содержащие 3 аминокислоты, сдвинутые в них к C-концевой стороне (Таблица 3). Синтезированные пептиды разбавляли в PBS (pH7,4) до 20 мг/мл для получения ингибирующих пептидов.
[0148] Таблица 3
[Таблица 3]
[0149] 3-2: Оценка специфичности
Стандартный продукт пресепсина разбавляли в PBS(pH 7,4) для получения стандартного продукта с 400 пг/мл. В качестве контроля применяли PBS(pH 7,4) без пептида. Согласно способу, описанному в Примере 2, 25 мкл ингибирующего пептида, полученного в 3-1, и 25 мкл стандартного продукта пресепсина добавляли в планшеты, полученные с соответствующими специфически очищенными антителами и обеспечивали взаимодействие при 25°C и 500 об/мин в течение 1 часа. После промывки планшетов, добавляли меченые антитела и обеспечивали взаимодействие аналогичным образом. Исходя из полученного поглощения, делали вывод, что пептид, имеющий поглощение, сниженное на 30% или более в сравнении с поглощением контроля, имеет активность связывания.
[0150] В результате, антитела S68 содержали антитела, взаимодействующие с пептидами от P01 до Р05, в то время как 2 партии P03-очищенных поликлональных антител содержали антитела, взаимодействующие с пептидом P03 и пептидом Р04 и 1 партия P03-очищенных поликлональных антител содержала антитела, взаимодействующие с пептидом Р02, пептидом P03 и пептидом Р04. Результаты показаны в Таблице 4.
[0151] Таблица 4
[Таблица 4]
Остаточная реактивность (%)
-: Выше 70%, +: на уровне или ниже 70%
[0152] Пример 4: Сравнение перекрестной реакции с высокомолекулярным sCD14 в крови
Шесть антител, полученных в Примере 1, измеряли на предмет перекрестной реакции с высокомолекулярным sCD14 в крови посредством сэндвич-ELISA. Исходя из результатов в Примере 3, было установлено, что P03-очищенные поликлональные антитела содержали антитела, связывающиеся с пептидом P03 и пептидом Р04. Таким образом, при ELISA с использованием P03-очищенных поликлональных антител, конечную концентрацию 20 мкг/мл пептида Р04 добавляли к разбавителям высокомолекулярного sCD14 в крови и стандартного продукта пресепсина, чтобы блокировать активность связывания антител, связывающихся с пептидом Р04, таким образом, оценивая антитела (P03-специфичные поликлональные антитела), специфически связывающиеся с пептидом P03.
[0153] 4-1: Получение кровяного высокомолекулярного sCD14
Высокомолекулярный sCD14 в крови получали следующим образом. Сыворотку здорового человека наносили на колонку, на которой были иммобилизованы антитела против CD14 (F1024-1-3: раскрытые в Примере 2 из WO01/072993), и CD14 абсорбировали для получения абсорбированного человеческой сыворотки с CD14. Абсорбированную человеческую сыворотку с CD14 и сыворотку здорового человека измеряли для определения концентрации высокомолекулярного sCD14 в крови с использованием набора ELISA для CD14 (R&D Systems, Inc., #DC140). Сыворотка здорового человека имела концентрацию высокомолекулярного sCD14 в крови, равную 1603 нг/мл, а человеческая сыворотка с абсорбированным CD14 имела 21 нг/мл. Сыворотки смешивали для получения ряда разведений высокомолекулярного sCD14.
[0154] 4-2: Измерение перекрестной реакции
Ряд разведений кровяного высокомолекулярного sCD14 (от 21 до 1603 нг/мл) получали, разбавляли в 20 раз в разбавителе, и поглощение измеряли посредством ELISA с использованием соответствующих антител согласно способу, описанному в Примере 2. Стандартные продукты пресепсина (от 0 до 500 пг/мл) также измеряли, и на основании полученного поглощения получали стандартную кривую для пресепсина. Поглощение образца, содержащего высокомолекулярный sCD14 в крови (1603 нг/мл) измеряли посредством ELISA с использованием антител, наносили на стандартную кривую для пресепсина, и определяли концентрацию, соответствующую поглощению. Перекрестную реакцию рассчитывали посредством деления полученной концентрации на концентрацию (так как измерение проводили после 20-кратного разбавления, применяли 80 нг/мл) высокомолекулярного sCD14 в крови, применяемого для измерения.
[0155] Перекрестная реакция (%)=(Концентрация, определенная посредством нанесения поглощения образца, содержащего высокомолекулярный sCD14 в крови, измеренный посредством антител, на стандартную кривую для пресепсина/Концентрация высокомолекулярного sCD14 в крови, применяемая для измерения)×100(%)
[0156] Результаты показаны в Таблице 5.
В результате было установлено, что в аналитической системе ELISA с использованием P03-специфичных поликлональных антител, перекрестная реакция с высокомолекулярным sCD14 в крови находилась на уровне или ниже предела обнаружения, и P03-специфичные поликлональные антитела имели редкую перекрестную реакцию с высокомолекулярным sCD14 в крови. Исходя из результатов, было продемонстрировано, что ELISA, полученный с использованием P03-специфичных поликлональных антител, обеспечивает измерение пресепсина с более высокой точностью, чем ELISA с использованием антител S68.
[0157] Таблица 5 (ND: на уровне или ниже предела обнаружения)
[Таблица 5]
[0158] Пример 5: Измерение образцов от пациентов с сепсисом, имеющих известную концентрацию.
Используя ELISA, полученный с использованием шести различных антител, полученных в Примере 1, измеряли 22 образца от пациентов с сепсисом, имеющих известную концентрацию, и проводили корреляционный анализ. Пресепсин в образцах, имеющих известную концентрацию, измеряли с использованием набора для измерения пресепсина с использованием антител S68. Согласно Примеру 4, конечную концентрацию 20 мкг/мл пептида P04 добавляли к разбавителям стандартного продукта пресепсина и образцам от пациентов, чтобы блокировать антитела, связывающиеся с пептидом P04 в P03-очищенных поликлональных антителах, оценивая, таким образом, P03-специфичные поликлональные антитела.
[0159] 5-1: Измерение образцов от пациентов с сепсисом посредством сэндвич-ELISA
Используя сэндвич-ELISA, описанный в Примере 2, измеряли стандартные продукты пресепсина (от 0 до 500 пг/мл, 8 точек с n=2 каждая) и образцы от пациента с сепсисом, разбавленные в 20 раз в разбавителе (n=2). Стандартную кривую получали по результатам значений поглощения стандартных продуктов пресепсина, используя SoftMax Pro (Molecular Devices, Llc.), и концентрацию каждого образца рассчитывали. Измеренные значения, имеющие коэффициент вариации (CV), равный 30% или более, были исключены из анализа.
[0160] 5-2: Корреляционный анализ результатов измерений
Используя измеренные значения, полученные в 5-1, и известные концентрации, корреляционный анализ проводили на Excel 2007 для определения линий регрессии. Линии регрессии, полученные для P03-специфичных поликлональных антител (3 партии) показаны на Фиг. 1-3. Результаты регрессионного анализа показаны в Таблице 6.
[0161] В результате, коэффициент вариации (CV) углов наклона линий регрессии для 3 партий антител S68 составлял 20%, в то время как CV для 3 партий P03-специфичных поликлональных антител составлял 10,6%. При использовании P03-специфичных поликлональных антител, полагают, что набор для измерения пресепсина может быть стабильно получен с меньшим разбросом измеренных значений для различий от партии к партии антител.
[0162] Таблица 6
[Таблица 6]
[0163] Пример 6: Получение P03-специфичных поликлональных антител
На основании результатов Примера 3, было установлено, что антитела, полученные с использованием аффинной колонки с иммобилизованным пептидом Р03, содержали антитела, связывающиеся с пептидом P03 и пептидом Р04. Таким образом, посредством удаления антител, связывающихся с пептидом Р04, из полученных антител, получают поликлональные антитела против пресепсина, специфически связывающиеся с пептидом P03. Следующий способ может применяться, когда удаляют антитела, связывающиеся с другими пептидами.
[0164] 6-1: Способ использования аффинной колонки с иммобилизованным пептидом Р04
Согласно методу, описанному в Примере 1, аффинную колонку с иммобилизованным пептидом Р04 получают с использованием пептида P04. Согласно Примеру 1-3, фракцию IgG, полученную в Примере 1-1 наносят на аффинную колонку с иммобилизованным пептидом Р04. Антитела, связывающиеся с пептидом Р04, удаляют посредством пропускания через аффинную колонку с иммобилизованным пептидом Р04. Полученную неадсорбированную фракцию очищают с использованием аффинной колонки с иммобилизованным пептидом Р03 согласно методу, описанному в Примере 1, получая, таким образом, P03-специфичные поликлональные антитела.
[0165] 6-2: Способ добавления пептида P04
После добавления пептида P04 к фракции IgG, полученной в Примере 1-1, проводили очистку с использованием аффинной колонки с иммобилизованным пептидом. Посредством этого процесса антитела, связывающиеся с пептидом Р04, могут быть удалены для очистки, с получением, таким образом, P03-специфичных поликлональных антител.
[СВОБОДНЫЙ ТЕКСТ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ]
[0166]
[SEQ ID NO:1] Аминокислотная последовательность пептида P03.
[SEQ ID NO:2] Аминокислотная последовательность пептида S68.
[SEQ ID NO:3] Аминокислотная последовательность человеческого непроцессированного растворимого CD14.
[SEQ ID NO:4] Аминокислотная последовательность пептида P03, имеющего цистеин, связанный по N-концу.
[SEQ ID NO:5] Аминокислотная последовательность пептида P03, имеющего цистеин, связанный по С-концу.
[SEQ ID NO:6] Аминокислотная последовательность пептида P01.
[SEQ ID NO:7] Аминокислотная последовательность пептида P02.
[SEQ ID NO:8] Аминокислотная последовательность пептида P04.
[SEQ ID NO:9] Аминокислотная последовательность пептида P05.
[SEQ ID NO:10] Аминокислотная последовательность пептида P06.
[SEQ ID NO:11] Аминокислотная последовательность пептида P07.
[SEQ ID NO:12] Аминокислотная последовательность пептида P08.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Mochida Pharmaceutical Co., Ltd.
<120> Специфически очищенные антитела против пресепсина
<130> G1414WO
<160> 12
<170> PatentIn version 3.5
<210> 1
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 1
Lys Arg Val Asp Ala Asp Ala Asp Pro Arg
1 5 10
<210> 2
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 2
Arg Val Asp Ala Asp Ala Asp Pro Arg Gln Tyr Ala Asp Thr Val Lys
1 5 10 15
<210> 3
<211> 356
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 3
Thr Thr Pro Glu Pro Cys Glu Leu Asp Asp Glu Asp Phe Arg Cys Val
1 5 10 15
Cys Asn Phe Ser Glu Pro Gln Pro Asp Trp Ser Glu Ala Phe Gln Cys
20 25 30
Val Ser Ala Val Glu Val Glu Ile His Ala Gly Gly Leu Asn Leu Glu
35 40 45
Pro Phe Leu Lys Arg Val Asp Ala Asp Ala Asp Pro Arg Gln Tyr Ala
50 55 60
Asp Thr Val Lys Ala Leu Arg Val Arg Arg Leu Thr Val Gly Ala Ala
65 70 75 80
Gln Val Pro Ala Gln Leu Leu Val Gly Ala Leu Arg Val Leu Ala Tyr
85 90 95
Ser Arg Leu Lys Glu Leu Thr Leu Glu Asp Leu Lys Ile Thr Gly Thr
100 105 110
Met Pro Pro Leu Pro Leu Glu Ala Thr Gly Leu Ala Leu Ser Ser Leu
115 120 125
Arg Leu Arg Asn Val Ser Trp Ala Thr Gly Arg Ser Trp Leu Ala Glu
130 135 140
Leu Gln Gln Trp Leu Lys Pro Gly Leu Lys Val Leu Ser Ile Ala Gln
145 150 155 160
Ala His Ser Pro Ala Phe Ser Cys Glu Gln Val Arg Ala Phe Pro Ala
165 170 175
Leu Thr Ser Leu Asp Leu Ser Asp Asn Pro Gly Leu Gly Glu Arg Gly
180 185 190
Leu Met Ala Ala Leu Cys Pro His Lys Phe Pro Ala Ile Gln Asn Leu
195 200 205
Ala Leu Arg Asn Thr Gly Ile Glu Thr Pro Thr Gly Val Cys Ala Ala
210 215 220
Leu Ala Ala Ala Gly Val Gln Pro His Ser Leu Asp Leu Ser His Asn
225 230 235 240
Ser Leu Arg Ala Thr Val Asn Pro Ser Ala Pro Arg Cys Met Trp Ser
245 250 255
Ser Ala Leu Asn Ser Leu Asn Leu Ser Phe Ala Gly Leu Glu Gln Val
260 265 270
Pro Lys Gly Leu Pro Ala Lys Leu Arg Val Leu Asp Leu Ser Cys Asn
275 280 285
Arg Leu Asn Arg Ala Pro Gln Pro Asp Glu Leu Pro Glu Val Asp Asn
290 295 300
Leu Thr Leu Asp Gly Asn Pro Phe Leu Val Pro Gly Thr Ala Leu Pro
305 310 315 320
His Glu Gly Ser Met Asn Ser Gly Val Val Pro Ala Cys Ala Arg Ser
325 330 335
Thr Leu Ser Val Gly Val Ser Gly Thr Leu Val Leu Leu Gln Gly Ala
340 345 350
Arg Gly Phe Ala
355
<210> 4
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 4
Cys Lys Arg Val Asp Ala Asp Ala Asp Pro Arg
1 5 10
<210> 5
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 5
Lys Arg Val Asp Ala Asp Ala Asp Pro Arg Cys
1 5 10
<210> 6
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 6
Asn Leu Glu Pro Phe Leu Lys Arg Val Asp
1 5 10
<210> 7
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 7
Pro Phe Leu Lys Arg Val Asp Ala Asp Ala
1 5 10
<210> 8
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 8
Asp Ala Asp Ala Asp Pro Arg Gln Tyr Ala
1 5 10
<210> 9
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 9
Ala Asp Pro Arg Gln Tyr Ala Asp Thr Val
1 5 10
<210> 10
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 10
Arg Gln Tyr Ala Asp Thr Val Lys Ala Leu
1 5 10
<210> 11
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 11
Ala Asp Thr Val Lys Ala Leu Arg Val Arg
1 5 10
<210> 12
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 12
Val Lys Ala Leu Arg Val Arg Arg Leu Thr
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ АНТИТЕЛО ПРОТИВ ПРЕСЕПСИНА | 2015 |
|
RU2710439C2 |
| ГИСТОНЫ И/ИЛИ PROADM В КАЧЕСТВЕ МАРКЕРОВ, СВИДЕТЕЛЬСТВУЮЩИХ ОБ ОРГАННОЙ ДИСФУНКЦИИ | 2017 |
|
RU2764766C2 |
| АНТИТЕЛА К ПОВЕРХНОСТНЫМ ДЕТЕРМИНАНТАМ S. AUREUS | 2013 |
|
RU2808018C2 |
| АНТИТЕЛА К ПОВЕРХНОСТНЫМ ДЕТЕРМИНАНТАМ S. AUREUS | 2013 |
|
RU2698131C2 |
| АНТИТЕЛО ПРОТИВ ЗЛОКАЧЕСТВЕННОЙ КЛЕТКИ, ПРОТИВОРАКОВОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБ ТЕСТИРОВАНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2015 |
|
RU2753512C2 |
| МОНИТОРИНГ ТЕРАПИИ ПРИ ЛЕЧЕНИИ СВЯЗЫВАЮЩИМ ВЕЩЕСТВОМ ПРОТИВ АДРЕНОМЕДУЛЛИНА (ADM) | 2018 |
|
RU2776811C2 |
| СПЕЦИФИЧНЫЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2020 |
|
RU2825837C2 |
| DPP3 ДЛЯ ОСУЩЕСТВЛЕНИЯ, МОНИТОРИНГА И СТРАТИФИКАЦИИ ТЕРАПИИ NT-ADM АНТИТЕЛАМИ У ПАЦИЕНТОВ С ШОКОМ | 2021 |
|
RU2838370C1 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К BTN2, И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2821703C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К ГИПЕРФОСФОРИЛИРОВАННОМУ ТАУ-БЕЛКУ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2727911C2 |
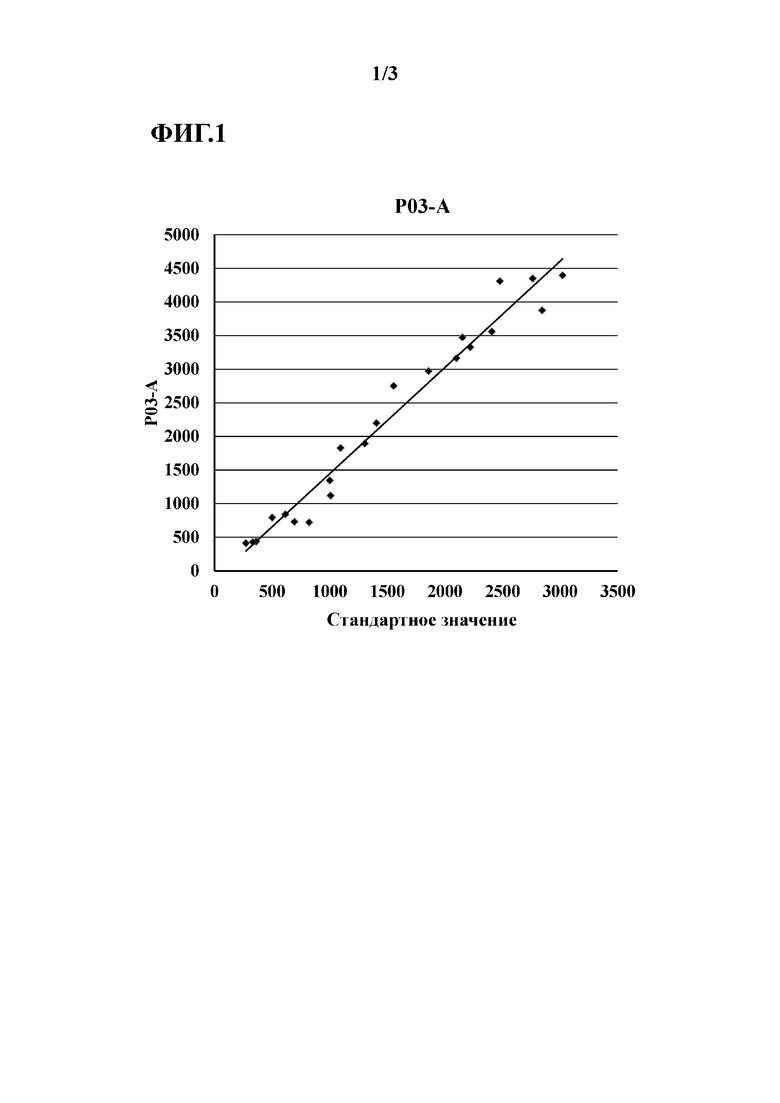
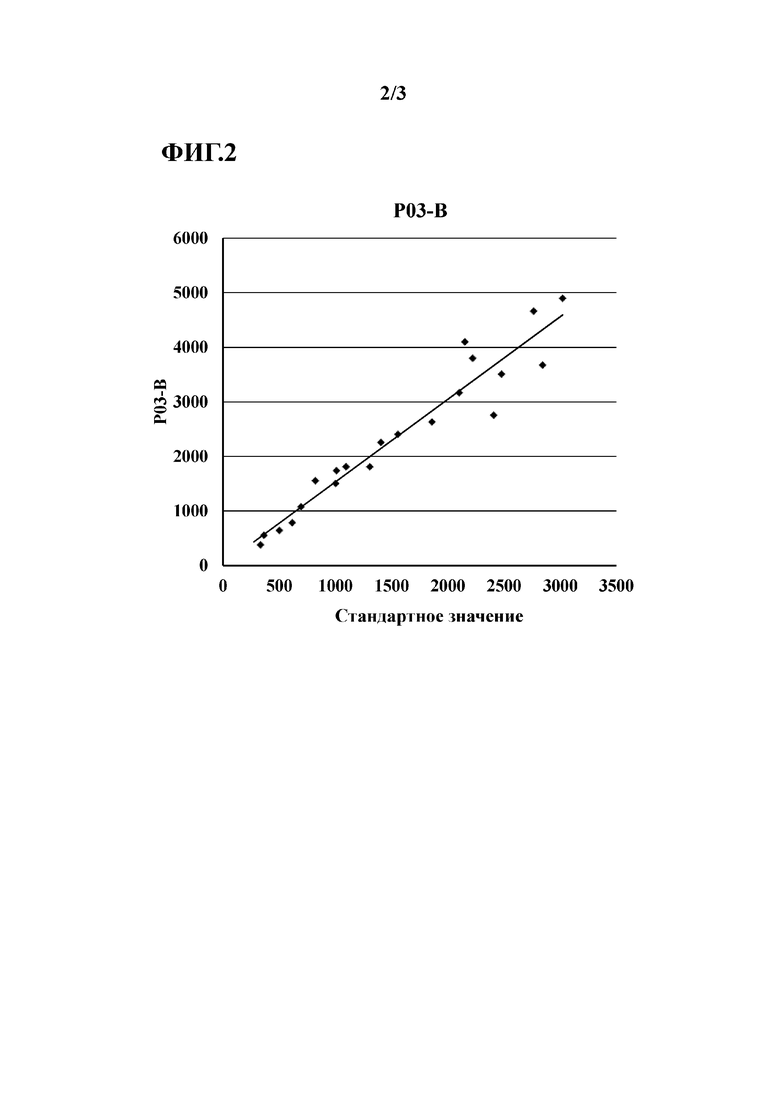

Настоящее изобретение относится к области иммунологии. Предложены способ получения поликлональных антител против пресепсина, композиция антител для обнаружения сепсиса или способствующая обнаружению или диагностике сепсиса. Кроме того, рассмотрена композиция антител для измерения пресепсина, способ измерения пресепсина, набор для измерения пресепсина, а также набор для обнаружения сепсиса или набор, способствующий обнаружению или диагностике сепсиса. Данное изобретение может найти дальнейшее применение в диагностике сепсиса. 6 н. и 2 з.п. ф-лы, 3 ил., 6 табл., 6 пр.
1. Способ получения поликлональных антител против пресепсина, включающий по меньшей мере следующие стадии: стадию получения поликлональных антител из млекопитающего, не являющегося человеком, иммунизированного с использованием пептида, в качестве иммуногена, включающего аминокислотные остатки от положения 1 до положения 9 аминокислотной последовательности SEQ ID NO: 2 и включающего 9 или более последовательных аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 2; и стадию очистки полученных антител с использованием колонки, на которой иммобилизуют пептид, состоящий из аминокислотной последовательности SEQ ID NO: 1.
2. Способ получения поликлональных антител против пресепсина по п. 1, дополнительно включающий стадию удаления антител, связывающихся с пептидом, состоящим из аминокислотной последовательности SEQ ID NO: 8.
3. Способ получения поликлональных антител против пресепсина по п. 1, дополнительно включающий стадию снижения активности связывания антител, связывающихся с пептидом, состоящим из аминокислотной последовательности SEQ ID NO: 8.
4. Композиция антител для обнаружения сепсиса или способствующая обнаружению или диагностике сепсиса, содержащая поликлональные антитела против пресепсина, полученные способом по любому из пп. 1-3.
5. Композиция антител для измерения пресепсина, содержащая поликлональные антитела против пресепсина, полученные способом по любому из пп. 1-3.
6. Способ измерения пресепсина, включающий по меньшей мере стадию подвергания композиции антител по п. 5 воздействию образца, содержащего пресепсин.
7. Набор для измерения пресепсина, содержащий по меньшей мере композицию антител по п. 5 и вспомогательный реагент для измерения пресепсина.
8. Набор для обнаружения сепсиса или набор, способствующий обнаружению или диагностике сепсиса, содержащий по меньшей мере композицию антител по п. 4 и вспомогательный реагент для измерения пресепсина.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| OKAMURA Y, YOKOI H | |||
| Паровоз для отопления неспекающейся каменноугольной мелочью | 1916 |
|
SU14A1 |
| Способ применения поваренной соли в нагревательной закалочной ванне при высоких температурах | 1923 |
|
SU412A1 |
| Способ определения содержания жира в семенах подсолнечника | 1924 |
|
SU2157A1 |
| ВЕЛЬКОВ В.В | |||
| "Пресепсин - новый высокоэффективный биомаркер сепсиса", Педиатрия, 2013, Том 92, Номер 4, стр | |||
| Сепаратор-центрофуга с периодическим выпуском продуктов | 1922 |
|
SU128A1 |
Авторы
Даты
2020-12-28—Публикация
2015-08-25—Подача