Настоящее изобретение относится к специфичным связывающим молекулам, связывающим HLA-A*02-рестриктированный пептид GLSPTVWLSV (SEQ ID NO: 1), полученный из белка оболочки ВГВ. Указанные специфичные связывающие молекулы могут содержать альфа- и/или бета-вариабельные домены TCR. Кроме того, указанные специфичные связывающие молекулы могут содержать неприродные мутации в альфа- и/или бета-вариабельных доменах по сравнению с нативным TCR. Специфичные связывающие молекулы и/или альфа- и/или бета-вариабельные домены согласно настоящему изобретению в особенности подходят для применения в качестве новых иммунотерапевтических реагентов для лечения инфекционного или злокачественного заболевания.
Уровень техники
По оценкам, во всем мире 257 миллионов человек инфицированы ВГВ, что составляет 3,5% от общей численности населения. Распространенность этого заболевания наиболее высока в определенных Всемирной организацией здравоохранения Западно-Тихоокеанском регионе и Африканском регионе, где инфицировано ~6% взрослых. Острая инфекция ВГВ может разрешиться выздоровлением или перерасти в хроническую инфекцию, однако вероятность того, что инфекция станет хронической, зависит от возраста человека. Хроническая инфекция развивается у 80-90% младенцев в возрасте < 1 года, 30-50% у детей в возрасте < 6 лет и у < 5% взрослых. Хронический гепатит В - гетерогенное и устойчивое к лечению заболевание с плохим прогнозом, приводящее к циррозу (рубцеванию печени) или раку у 20-30% инфицированных взрослых. Эффективная и безопасная вакцина для профилактики инфекции ВГВ существует с 1980-х годов. Однако многие лица, живущие с ВГВ, родились до внедрения вакцины против ВГВ и осуществления планов ранней вакцинации; по оценкам Всемирной организации здравоохранения, 65 миллионов взрослых с хронической инфекцией могут быть женщинами детородного возраста, подверженными риску передачи инфекции младенцам. Ожидается, что, в отличие от туберкулеза и ВИЧ, смертность от данного вируса будет увеличиваться из-за осложнений, связанных с циррозом и гепатоцеллюлярной карциномой (ГЦК), особенно у лиц, которым не поставлен диагноз.
Устранение инфекции ВГВ связано с устойчивым вирусологическим контролем за счет эффекторных T-клеток, хотя считается, что прогрессирование до хронической инфекции обусловлено отсутствием Т-клеточных реакций, характеризующихся достаточной эффективностью и широкой специфичностью против вируса. При хронической инфекции ВГВ-специфичные Т-клетки, как правило, обладают истощенным фенотипом, характеризующимся плохой цитотоксической активностью и нарушением продукции цитокинов, что мешает устранению вирусов (Ye et al., Cell Death Dis. 2015 Mar; 6(3): e1694; Park et al., Gastroenterology. 2016 Mar;150(3):684-695.e5). Современное лечение хронического ВГВ включает лечение противовирусными средствами для перорального применения, например, тенофовиром или энтекавиром; однако хотя противовирусные средства подавляют репликацию вируса, что может помочь замедлить прогрессирование постоянного и фатального повреждения печени, они не устраняют вирус, и во избежание риска обострений их необходимо принимать неопределенно долго. Кроме того, длительное применение противовирусных средств ассоциировано с резистентностью вируса и токсичностью. Поэтому существует необходимость в новых способах лечения хронической инфекции ВГВ, которые могут преодолеть ограничения современных методов лечения, восстановить Т-клеточный ответ на клетки, инфицированные вирусом, и обеспечить функциональное излечение.
Т-клеточные рецепторы (TCR) в естественных условиях экспрессируют CD4+ и CD8+ Т-клетки. TCR предназначены для распознавания коротких пептидных антигенов, отображаемых на поверхности антигенпрезентирующих клеток в комплексе с молекулами главного комплекса гистосовместимости (MHC) (у человека молекулы MHC также известны как антигены лейкоцитов человека, или HLA) (Davis et al., Annu Rev Immunol. 1998;16:523-44). CD8+ Т-клетки, которые также называют цитотоксическими Т-клетками, несут TCR, специфично распознающие пептиды, связанные с молекулами MHC I класса. CD8+ Т-клетки обычно отвечают за обнаружение и опосредованное разрушение больных клеток, включая раковые и инфицированные вирусами клетки.
Пептид GLSPTVWLSV (SEQ ID NO: 1) соответствует аминокислотам 348-357 полноразмерного белка оболочки ВГВ и презентируется на поверхности инфицированных клеток в комплексе с HLA-A*02. Сообщалось о Т-клетках, которые распознают этот комплекс "пептид-HLA" (Webster et al., J Virol. 2004 Jun; 78(11): 5707-5719). Пептид GLSPTVWLSV демонстрирует высокий уровень консервативности последовательности у ВГВ всех генотипов, характеризуясь лишь незначительной вариабельностью по положению 10 (природный вариант GLSPTVWLSA (SEQ ID NO: 17) присутствует в ~78% последовательностей в генотипе A). Таким образом, комплекс GLSPTVWLSV-HLA-A*02 является идеальной мишенью для иммунотерапевтического вмешательства на основе TCR для лечения хронического заболевания.
Описание изобретения
В первом аспекте настоящего изобретения предложена специфичная связывающая молекула, обладающая свойством связываться с GLSPTVWLSV (SEQ ID NO: 1) в комплексе с HLA-A*02 и/или GLSPTVWLSA (SEQ ID No: 17) в комплексе с HLA-A*02 и содержащая вариабельный домен альфа-цепи TCR и/или вариабельный домен бета-цепи TCR, каждый из которых содержит FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, где FR представляет собой каркасную область, а CDR представляет собой область, определяющую комплементарность, причем
(а) CDR альфа-цепи содержат следующие последовательности:
CDR1 - DRGSQS (SEQ ID NO: 18)
CDR2 - IYSNGD (SEQ ID NO: 19)
CDR3 - CAVRNYNTDKLIF (SEQ ID NO: 20)
необязательно с одной или несколькими мутациями в них,
и/или
(b) CDR бета-цепи содержат следующие последовательности:
CDR1 - MNHEY (SEQ ID NO: 21)
CDR2 - SVGAGI (SEQ ID NO: 22)
CDR3 - CASSYATGGTGELFF (SEQ ID NO: 23)
необязательно с одной или несколькими мутациями в них.
В настоящем изобретении впервые предложены специфичные связывающие молекулы, содержащие CDR и вариабельные домены, связывающиеся с комплексом GLSPTVWLSV-HLA. Специфичные связывающие молекулы или их связывающие фрагменты могут содержать вариабельные домены TCR, которые могут соответствовать доменам нативного TCR, или, более предпочтительно, указанные вариабельные домены TCR можно сконструировать. Нативные вариабельные домены TCR также можно называть доменами дикого типа, природными, исходными, немутированными доменами или доменами остова. Специфичные связывающие молекулы или связывающие фрагменты можно применять для получения молекул с идеальными терапевтическими свойствами, например, повышенным физиологическим сродством к мишени, длительным периодом полураспада комплекса, образуемого в результате связывания, высокой специфичностью по отношению к мишени и хорошей стабильностью. Настоящее изобретение также включает биспецифичные или бифункциональные или гибридные молекулы, содержащие специфичные связывающие молекулы или их связывающие фрагменты и фрагмент, перенаправляющий Т-клетки. Такие молекулы могут опосредовать мощный и специфичный ответ против клеток, инфицированных ВГВ, за счет перенаправления и активации неистощенных Т-клеток, не специфичных против ВГВ. Кроме того, использование специфичных связывающих молекул с повышенной физиологической аффинностью облегчает распознавание и устранение клеток с низкими уровнями комплекса пептид-HLA, инфицированных вирусом. В качестве альтернативы, специфичные связывающие молекулы или связывающие фрагменты можно включать в сконструированные Т-клетки для адоптивной терапии.
Последовательности домена TCR, определенные в настоящем документе, описаны со ссылкой на номенклатуру IMGT, которая широко известна и доступна специалистам в области TCR. Например, см.: LeFranc and LeFranc, (2001). “T cell Receptor Factsbook”, Academic Press; Lefranc, (2011), Cold Spring Harb Protoc 2011(6): 595-603; Lefranc, (2001), Curr Protoc Immunol Appendix 1: Appendix 10O; и Lefranc, (2003), Leukemia 17(1): 260-266. Вкратце, αβ TCR состоят из двух цепей, связанных дисульфидными связями. Обычно считается, что каждая цепь (альфа и бета) содержит два домена, а именно вариабельный и константный домен. Короткая соединительная область связывает вариабельный и константный домены и обычно считается частью вариабельной области альфа-цепи. Кроме того, бета-цепь обычно содержит короткую дополнительную область рядом с соединительной областью, которая также обычно считается частью вариабельной области бета-цепи. Вариабельный домен каждой цепи занимает N-концевой положение и включает три области, определяющие комплементарность (CDR), встроенные в каркасную последовательность (FR). Эти CDR содержат сайты распознавания для связывания комплекса «пептид-МНС«пептид-МНС«пептид-МНС«пептид-ГКГС. Существует несколько генов, кодирующих вариабельные области альфа-цепи (Vα), и несколько генов, кодирующих вариабельные области бета-цепи (Vβ), которые различаются своим каркасом, последовательностями CDR1 и CDR2 и частично определенной последовательностью CDR3. Гены Vα и Vβ, согласно номенклатуре IMGT, обозначают префиксом TRAV и TRBV, соответственно (Folch and Lefranc, (2000), Exp Clin Immunogenet 17(1):42-54; Scaviner and Lefranc, (2000), Exp Clin Immunogenet 17(2):83-96; LeFranc and LeFranc, (2001), “T cell Receptor Factsbook”, Academic Press). Кроме того, существует несколько соединительных генов или J-генов, обозначаемых как TRAJ или TRBJ для альфа- и бета-цепей, соответственно, и, в случае бета-цепи, существует дополнительный ген или D-ген, обозначаемый как TRBD (Folch and Lefranc, (2000), Exp Clin Immunogenet 17(2):107-114; Scaviner and Lefranc, (2000), Exp Clin Immunogenet 17(2):97-106; LeFranc and LeFranc, (2001), “T cell Receptor Factsbook”, Academic Press). Огромное разнообразие цепей Т-клеточного рецептора является результатом комбинаторной реаранжировки между различными V-, J- и D-генами, включающими аллельные варианты, а также разнообразия вариантов их соединения (Arstila, et al., (1999), Science 286(5441): 958-961; Robins et al., (2009), Blood 114(19): 4099-4107.) Константные, или С-области альфа и бета-цепей TCR обозначают как TRAC и TRBC, соответственно (Lefranc, (2001), Curr Protocol Immunol Appendix 1: Appendix 10).
В специфичной связывающей молекуле согласно первому аспекту каркасные области вариабельного домена альфа-цепи могут содержать следующие каркасные последовательности:
FR1 - аминокислоты 1-26 SEQ ID NO: 2
FR2 - аминокислоты 33-49 SEQ ID NO: 2
FR3 - аминокислоты 56-88 SEQ ID NO: 2
FR4 - аминокислоты 102-111 SEQ ID NO: 2
или соответствующие последовательности, характеризующиеся по меньшей мере 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентичности по отношению к указанным последовательностям, и/или
каркасные области вариабельного домена бета-цепи могут содержать следующие последовательности:
FR1 - аминокислоты 1-26 SEQ ID NO: 3
FR2 - аминокислоты 32-48 SEQ ID NO: 3
FR3 - аминокислоты 55-90 SEQ ID NO: 3
FR4 - аминокислоты 106-114 SEQ ID NO: 3
или соответствующие последовательности, характеризующиеся по меньшей мере 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентичности по отношению к указанным последовательностям.
Пептид GLSPTVWLSA (SEQ ID No: 17) представляет собой встречающийся в природе вариант GLSPTVWLSV, который является вариантом, представленным в подгруппе пациентов. Специфичная связывающая молекула с двойным профилем связывания может быть предпочтительной при применении специфичных связывающих молекул согласно настоящему изобретению при лечении, поскольку она обеспечивает охват тех пациентов, у которых от природы присутствует указанный вариант пептида. Таким образом, можно охватить расширенную популяцию пациентов. Таким образом, в настоящем документе предложены специфичные связывающие молекулы, связывающиеся с комплексом GLSPTVWLSV (SEQ ID NO: 1) HLA-A*02 и с комплексом GLSPTVWLSA (SEQ ID No: 17) HLA-A*02.
В настоящем документе термин «специфичная связывающая молекула» относится к молекуле, способной связываться с антигеном-мишенью. Такие молекулы могут принимать ряд различных форматов, обсуждаемых в настоящем документе. Кроме того, предусмотрены фрагменты специфичных связывающих молекул согласно настоящему изобретению. Фрагмент относится к части специфичной связывающей молекулы, сохраняющей способность к связыванию с антигеном-мишенью.
Термин «мутации» включает замены, инсерции и делеции. Мутации нативной (также называемой исходной, природной, немутированной молекулой дикого типа или молекулой остова) специфичной связывающей молекулы могут включать мутации, повышающие аффинность связывания (kD и/или период полураспада комплекса, образуемого в результате связывания) специфичной связывающей молекулы с комплексом GLSPTVWLSV-HLA-A*02 и/или с комплексом GLSPTVWLSA-HLA-A*02.
Каркасные области FR1, FR2 и FR3 альфа-цепи могут содержать аминокислотные последовательности, соответствующие цепи TRAV12-2*02, и/или каркасные области FR1, FR2 и FR3 бета-цепи могут содержать аминокислотные последовательности, соответствующие последовательностям цепи TRBV6-5*01.
Область FR4 может содержать соединяющую область альфа- и бета-вариабельных цепей (TRAJ и TRBJ, соответственно). Область TRAJ может содержать аминокислотные последовательности, соответствующие последовательностям TRAJ34. Область TRBJ может содержать аминокислотные последовательности, соответствующие последовательностям TRBJ2-2.
В вариабельной области альфа-цепи TCR может быть по меньшей мере одна мутация. В CDR альфа-цепи может быть одна, две, три, четыре, пять или более мутаций. Одна или более из указанных мутаций могут быть выбраны из следующих мутаций, со ссылкой на нумерацию SEQ ID NO: 2:
Таким образом, в приведенной выше таблице могут присутствовать всевозможные мутации, необязательно в комбинации с другими мутациями.
CDR альфа-цепи могут содержать одну из следующих групп мутаций (со ссылкой на нумерацию SEQ ID NO: 2):
CDR1, CDR2 и CDR3 альфа-цепи могут быть выбраны из:
В предпочтительной альфа-цепи CDR1 представляет собой DRGSQS, CDR2 представляет собой IYSNGD, а CDR3 представляет собой CAARNYKTDLLIF. В еще одной предпочтительной альфа-цепи CDR1 представляет собой DRGSQS, CDR2 представляет собой IYSDGD, а CDR3 представляет собой CAARNYKTDLLIF.
В вариабельной области бета-цепи TCR может быть по меньшей мере одна мутация. В CDR бета-цепи может быть одна, две, три, четыре или пять или более мутаций. Одна или более из указанных мутаций могут быть выбраны из следующих мутаций, со ссылкой на нумерацию SEQ ID NO: 3:
Таким образом, в приведенной выше таблице могут присутствовать любые или все мутации, необязательно в комбинации с другими мутациями.
CDR бета-цепи могут содержать одну из следующих групп мутаций (со ссылкой на нумерацию SEQ ID NO: 3):
CDR1, CDR2 и CDR3 бета-цепи могут быть выбраны из:
В предпочтительной бета-цепи CDR1 представляет собой MSHGY, CDR2 представляет собой SVGAGI, а CDR3 представляет собой CASSYATGGTGDLFF. В еще одной предпочтительной бета-цепи CDR1 представляет собой LNHGY, CDR2 представляет собой SVGAGI, а CDR3 представляет собой CASSYATGGTGVLFF.
В еще одной предпочтительной бета-цепи CDR1 представляет собой MNHEY, CDR2 представляет собой SVGAGI, а CDR3 представляет собой CASSYATGGTGLLFF.
В еще одной предпочтительной бета-цепи CDR1 представляет собой MNHEY, CDR2 представляет собой SLGAGI, а CDR3 представляет собой CASSYATGGTGDLFF.
В еще одной предпочтительной бета-цепи CDR1 представляет собой LSHGY, CDR2 представляет собой SVGAGI, а CDR3 представляет собой CASSYATGGTGDLFF.
Предпочтительные варианты сопряжения альфа- и бета CDR TCR показаны ниже в таблице:
Особенно предпочтительный вариант сопряжения представляет собой комбинацию 6. Еще один особенно предпочтительный вариант сопряжения представляет собой комбинацию 2.
Мутация(и) в CDR предпочтительно улучшают аффинность связывания специфичной связывающей молекулы с комплексом GLSPTVWLSV-HLA-A*02 и/или комплексом GLSPTVWLSA-HLA-A*02, однако могут, в качестве дополнения или альтернативы, обеспечивать другие преимущества, например, улучшенную стабильность в выделенной форме и улучшенную специфичность. Мутации в одном или более положениях могут, в качестве дополнения или альтернативы, влиять на взаимодействие смежного положения с родственным комплексом pMHC, например, обеспечивая более благоприятный угол для взаимодействия. Мутации могут включать мутации, способные количественно снижать неспецифичное связывание, т.е. снижать связывание с альтернативными антигенами по сравнению с GLSPTVWLSV-HLA-A*02 и/или GLSPTVWLSA-HLA-A*02. Мутации могут включать мутации, повышающие эффективность фолдинга и/или производства. Некоторые мутации могут вносить вклад в каждую из этих характеристик; другие могут способствовать, например, аффинности, но не специфичности, или специфичности, но не аффинности, и т. д.
Как правило, для получения специфичных связывающих молекул с аффинностью к антигену-мишени на уровне пМ необходимо в общей сложности по меньшей мере 5, по меньшей мере 10, по меньшей мере 15 или более мутаций CDR. Для получения специфичных связывающих молекул с аффинностью к антигену-мишени на уровне пМ может потребоваться в общей сложности по меньшей мере 5, по меньшей мере 10 или по меньшей мере 15 мутаций CDR. Специфичные связывающие молекулы с аффинностью к антигену-мишени на уровне пМ в особенности подходят для применения в качестве растворимых терапевтических средств. Специфичные связывающие молекулы для применения в вариантах адоптивной терапии могут обладать более низкой аффинностью к антигену-мишени и, таким образом, содержать меньшее количеством мутаций CDR, например, в общей сложности до 1, до 2, до 5 или более мутаций CDR. Специфичные связывающие молекулы для применения в вариантах адоптивной терапии могут обладать более низкой аффинностью к антигену-мишени и, таким образом, содержать меньшее количество мутаций CDR, например, в общей сложности 0 мутаций или до 1, до 2 или до 5 мутаций CDR. В некоторых случаях нативная (также называемая немутированной) специфичная связывающая молекула может обладать достаточно высокой аффинностью к антигену-мишени без необходимости внесения мутации. Отмечено, что специфичные связывающие молекулы согласно настоящему изобретению в нативной форме обладают высокой аффинностью, особенно по сравнению со связывающими молекулами, связывающими раковые пептиды в комплексе с HLA. Безотносительно к теоретическим представлениям, авторы настоящего изобретения считают, что указанное повышенную аффинность может быть обусловлено тем, что пептид GLSPTVWLSV происходит из вирусного источника, т.е. не из организма, продуцирующего указанные молекулы.
В качестве дополнения или альтернативы, мутации можно осуществлять в каркасных областях за пределами CDR; такие мутации могут улучшать связывание и/или специфичность и/или стабильность и/или выход очищенной растворимой формы специфичной связывающей молекулы. Например, специфичная связывающая молекула согласно настоящему изобретению может, в качестве дополнения или альтернативы, содержать вариабельный домен альфа-цепи, причем вариабельная область альфа-цепи FR2 содержит мутацию замены S на G в положении 43 согласно нумерации SEQ ID NO: 2. Обнаружено, что эти мутации повышают выход. Кроме того, обнаружено, что мутация замены Q на A в положении 1 альфа-цепи согласно нумерации SEQ ID NO: 2 улучшает эффективность отщепления N-концевого метионина во время продукции в E. coli. Неэффективное отщепление может быть вредным для терапевтического средства, поскольку оно может привести к получению гетерогенного белкового продукта, и/или присутствие начального метионина может быть иммуногенным для людей.
Вариабельный домен α-цепи специфичной связывающей молекулы согласно настоящему изобретению предпочтительно может содержать соответствующие каркасные аминокислотные последовательности, характеризующиеся по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью по отношению к каркасным аминокислотным остаткам 1-26, 33-49, 56-88, 102-111 SEQ ID NO: 2. Вариабельный домен бета-цепи специфичной связывающей молекулы согласно настоящему изобретению может содержать соответствующие каркасные аминокислотные последовательности, характеризующиеся по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью по отношению к каркасным аминокислотным остаткам 1-26, 32-48, 55-90, 106-114 SEQ ID NO: 3. В качестве альтернативы, указанная процентная идентичность может распространяться на все каркасные последовательности при их рассмотрении как целого.
Вариабельный домен альфа-цепи может содержать любую из аминокислотных последовательностей SEQ ID NO: 4-6 (показанных на фигуре 2), а вариабельный домен бета-цепи может содержать любую из аминокислотных последовательностей SEQ ID NO: 7-11 (показанных на фигуре 3).
Например, специфичная связывающая молекула может содержать следующие пары альфа- и бета-цепей.
Предпочтительным вариантом сопряжения цепей TCR является SEQ ID NO: 6 и SEQ ID NO: 8. Предпочтительным вариантом сопряжения цепей TCR является SEQ ID NO: 4 и SEQ ID NO: 8.
В рамки настоящего изобретения входят не влияющие на фенотип варианты любой специфичной связывающей молекулы согласно настоящему изобретению, описанные в настоящем документе. В настоящем документе следует понимать, что термин «варианты, не влияющие на фенотип» относится к специфичной связывающей молекуле с вариабельным доменом TCR, включающим одно или более из дополнительных аминокислотных изменений, включая замены, инсерции и делеции, в дополнение к вышеизложенным изменениям, причем фенотип указанной специфичной связывающей молекулы аналогичен фенотипу соответствующей специфичной связывающей молекулы без указанного(ых) изменения(й). Для целей настоящей заявки фенотип специфичной связывающей молекулы включает аффинность связывания (KD и/или период полураспада комплекса, образуемого в результате связывания) и специфичность. Фенотип растворимой специфичной связывающей молекулы, ассоциированной с иммунным эффектором, предпочтительно включает эффективность иммунной активации и выход очистки в дополнение к аффинности и специфичности связывания. Вариант, не влияющий на фенотип, может обладать KD и/или периодом полураспада комплекса, образуемого в результате связывания, по отношению к комплексу GLSPTVWLSV-HLA-A*02 и/или комплексу GLSPTVWLSA-HLA-A*02, находящимся в пределах 50% или, более предпочтительно, в пределах 30%, 25% или 20% KD и/или периода полураспада комплекса, образуемого в результате связывания соответствующей специфичной связывающей молекулы без указанного(ых) изменения(й), измеренного в идентичных условиях (например, при 25°C и/или на одном и том же ППР-чипе). Подходящие условия дополнительно представлены в примере 3. Как известно специалистам в данной области техники, можно получить специфичные связывающие молекулы, включающие изменения в вариабельных доменах, сопоставимые с изменениями, подробно описанными выше, без изменения аффинности взаимодействия с комплексом GLSPTVWLSV-HLA-A*02 и/или комплексом GLSPTVWLSA-HLA-A*02 и/или других функциональных характеристик. В частности, такие молчащие мутации можно включать во фрагменты последовательности, заведомо не участвующие непосредственно в связывании антигена (например, каркасные области и/или фрагменты CDR, не контактирующие с антигеном). Такие варианты включены в рамки настоящего изобретения.
Варианты, не влияющие на фенотип, могут содержать одну или более консервативных замен и/или одну или более приемлемых замен. Под приемлемыми заменами подразумеваются замены, которые не подпадают под определение консервативных согласно описанию ниже, но, тем не менее, фенотипически не проявляются. Специалисту в данной области техники известно, что различные аминокислоты обладают аналогичными свойствами и, соответственно, являются «консервативными». Одна или более таких аминокислот белка, полипептида или пептида часто могут быть заменены одной или несколькими другими такими аминокислотами без устранения желаемой активности этого белка, полипептида или пептида.
Таким образом, часто аминокислоты глицин, аланин, валин, лейцин и изолейцин могут быть взаимно заменены (аминокислоты, имеющие алифатические боковые цепи). Для этих возможных замен предпочтительно использование глицина и аланина для взаимных замен (поскольку они имеют относительно короткие боковые цепи), а также валина, лейцина и изолейцина (поскольку они имеют более крупные алифатические боковые цепи, которые являются гидрофобными). Другие аминокислоты, которые часто могут быть взаимно заменены, включают: фенилаланин, тирозин и триптофан (аминокислоты, имеющие ароматические боковые цепи); лизин, аргинин и гистидин (аминокислоты, имеющие основные боковые цепи); аспартат и глутамат (аминокислоты, имеющие кислые боковые цепи); аспарагин и глутамин (аминокислоты, имеющие амидные боковые цепи); и цистеин и метионин (аминокислоты, имеющие серосодержащие боковые цепи). Подразумевается, что замены аминокислот в пределах объема настоящего изобретения могут быть осуществлены с использованием встречающихся или не встречающихся в природе аминокислот. Например, настоящим изобретением предусмотрено, что метильная группа на аланине может быть заменена этильной группой и/или что в остов пептида могут быть внесены незначительные изменения. Независимо от использования природных или синтетических аминокислот, предпочтительно присутствие только L-аминокислот.
Замены такого характера часто называют «консервативными» или «полуконсервативными» заменами аминокислот. Таким образом, настоящее изобретение охватывает применение специфичной связывающей молекулы, содержащей любую из аминокислотных последовательностей, описанных выше, включающую одну или более консервативную замену и/или одну или более приемлемую замену, так что аминокислотная последовательность указанной специфичной связывающей молекулы характеризуется по меньшей мере 90% идентичностью, например, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичностью по отношению к специфичной связывающей молекуле, содержащей аминокислоты 1-111 SEQ ID NO: 2, 4-6 и/или аминокислоты 1-114 SEQ ID NO: 3, 7-11.
«Идентичность», как известно в данной области техники, представляет собой взаимосвязь между двумя или более полипептидными последовательностями или двумя или более полинуклеотидными последовательностями, определенную путем сравнения указанных последовательностей. В данной области техники идентичность также означает степень родства последовательностей, полипептидных или полинуклеотидных, в зависимости от обстоятельств, определяемую на основании совпадения строк таких последовательностей. Хотя существует ряд способов измерения идентичности двух полипептидных или двух полинуклеотидных последовательностей, способы, обычно используемые для определения идентичности, кодифицированы в виде компьютерных программ. Предпочтительные компьютерные программы для определения идентичности двух последовательностей включают, не ограничиваясь перечисленным, программный пакет GCG (Devereux, et al., Nucleic Acids Research, 12, 387 (1984)), BLASTP, BLASTN и FASTA (Atschul et al., J. Molec. Biol. 215, 403 (1990)).
Для сравнения аминокислотных последовательностей можно использовать программу, такую как программа CLUSTAL. Эта программа сравнивает аминокислотные последовательности и находит оптимальное выравнивание, вставляя пробелы в любую из последовательностей по мере необходимости. Можно рассчитать идентичность или сходство аминокислот (идентичность плюс сохранение типа аминокислоты) для оптимального выравнивания. Такая программа, как BLASTx, выравнивает самый длинный отрезок сходных последовательностей и присваивает значение соответствию. Таким образом, можно получить сравнение с несколькими найденными областями сходства, каждая из которых имеет отличающуюся оценку. Оба типа анализа идентичности предусмотрены настоящим изобретением.
Процент идентичности двух аминокислотных последовательностей или двух последовательностей нуклеиновых кислот определяют путем выравнивания указанных последовательностей с целью оптимального сравнения (например, в первую последовательность могут быть введены пропуски для наилучшего выравнивания с последовательностью) и сравнения остатков аминокислот или нуклеотидов в соответствующих положениях. «Наилучшее выравнивание» представляет собой выравнивание двух последовательностей, которое приводит к самому высокому проценту идентичности. Процентную идентичность определяют по количеству идентичных аминокислотных остатков или нуклеотидов в сравниваемых последовательностях (т.е. % идентичность = количество идентичных положений/общее количество положений x 100).
Определение процентной идентичности двух последовательностей можно выполнить с использованием математического алгоритма, известного специалистам в данной области техники. Примером математического алгоритма для сравнения двух последовательностей является алгоритм Карлина-Альтшула (Karlin and Altschul (1990) Proc. Natl. Acad. Sci. USA 87:2264-2268), модифицированный согласно Karlin and Altschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-5877. Программы BLASTn и BLASTp (Altschul, et al. (1990) J.Mol. Biol. 215:403-410) включают такой алгоритм. Определение процента идентичности двух нуклеотидных последовательностей может быть выполнено с помощью программы BLASTn. Определение процента идентичности двух последовательностей белка может быть выполнено с помощью программы BLASTp. Чтобы получить выравнивания с пропусками в целях сравнения, можно использовать Gapped BLAST согласно описанию в Altschul et al. (1997) Nucleic Acids Res. 25:3389-3402. В качестве альтернативы можно использовать PSI-Blast для выполнения итерационного поиска, который обнаруживает отдаленные взаимосвязи между молекулами (там же). При использовании программ BLAST, Gapped BLAST и PSI-BLAST можно использовать установленные по умолчанию параметры соответствующих программ (например, BLASTn и BLASTp). Подробнее см. на http://www.ncbi.nlm.nih.gov. Общие параметры по умолчанию могут включать, например, размер слова = 3, ожидаемый порог = 10. Могут быть выбраны параметры для автоматического подстраивания под короткие входные последовательности. Еще одним примером математического алгоритма, используемого для сравнения последовательностей, является алгоритм Майерса и Миллера, CABIOS (1989). Программа ALIGN (версии 2.0), которая является частью пакета программного обеспечения для выравнивания последовательностей CGC, включает такой алгоритм. Другие алгоритмы для анализа последовательностей, известные в данной области техники, включают ADVANCE и ADAM, которые описаны в источнике:Torellis and Robotti (1994) Comput. Appl. Biosci., 10:3-5; и FASTA, описанный в источнике: Pearson and Lipman (1988) Proc. Natl. Acad. Sci. 85:2444-8. В FASTA ktup - это опция управления, которая задает чувствительность и скорость поиска. Для оценки процента идентичности согласно настоящему изобретению в качестве метода сравнения используют BLASTp с параметрами по умолчанию. Кроме того, при получении нецелого значения указанной процентной идентичности для аминокислот (т.е. последовательность из 25 аминокислот, на 90% идентичная другой последовательности, дает значение «22,5», полученное значение округляют в меньшую сторону до ближайшего целого числа, соответственно, до «22»). Соответственно, в представленном примере последовательность с 22 совпадающими аминокислотами из 25 аминокислот находится в пределах 90% идентичности последовательности.
Как очевидно для специалистов в данной области техники, можно укорачивать или удлинять последовательности на С-конце и/или N-конце специфичной связывающей молекулы на 1, 2, 3, 4, 5 или более остатков, по существу не влияя на функциональные характеристики указанной специфичной связывающей молекулы. Последовательности на С-конце и/или N-конце специфичной связывающей молекулы можно укоротить или удлинить на 1, 2, 3, 4 или 5 остатков. Настоящее изобретение охватывает все подобные варианты.
Мутации, включая консервативные и приемлемые замены, инсерции и делеции, можно внедрять в последовательности, полученные с применением любого подходящего способа, включая способы на основе полимеразной цепной реакции (ПЦР), клонирования с использованием эндонуклеаз рестрикции или процедур безлигазного клонирования (LIC), но не ограничиваясь ими. Эти способы подробно описаны во многих стандартных пособиях по молекулярной биологии. Для получения дополнительной информации о полимеразной цепной реакции (ПЦР) и клонировании с использованием рестрикционных эндонуклеаз см. руководство: Sambrook & Russell, (2001) Molecular Cloning - A Laboratory Manual (3rd Ed.) CSHL Press. Дополнительную информацию о процедурах безлигазного клонирования (LIC) можно найти в Rashtchian, (1995) Curr Opin Biotechnol 6(1): 30-6. Последовательности TCR, предложенные в настоящем изобретении, можно получить с помощью твердофазного синтеза или любого другого подходящего способа, известного в данной области техники.
Специфичные связывающие молекулы согласно настоящему изобретению обладают свойством связывать комплекс GLSPTVWLSV-HLA-A*02 и/или комплекс GLSPTVWLSA-HLA-A*02. Специфичные связывающие молекулы согласно настоящему изобретению демонстрируют высокую степень специфичности к комплексу GLSPTVWLSV-HLA-A*02 и/или к комплексу GLSPTVWLSA-HLA-A*02 и, таким образом, особенно подходят для терапевтического применения. Специфичность в контексте специфичных связывающих молекул согласно настоящему изобретению относится к их способности распознавать клетки-мишени с HLA-A*02, которые являются антиген-положительными, при минимальной способности распознавать клетки-мишени с HLA-A*02, которые являются антиген-отрицательными. В некоторых случаях специфичные связывающие молекулы согласно настоящему изобретению могут связывать комплекс пептида-мишени (GLSPTVWLSV или варианта GLSPTVWLSA) с конкретными подтипами HLA-A*02, включая HLA-A*0201, HLA-A*0206 или HLA-A*0207, но не ограничиваясь ими.
Специфичность можно измерять in vitro, например, посредством клеточных анализов, например, описанных в примере 6. Для проверки специфичности специфичные связывающие молекулы могут находиться в растворимой форме, ассоциированной с иммунным эффектором, и/или могут экспрессироваться на поверхности клеток, например, Т-клеток. Специфичность можно определять путем измерения уровня активации Т-клеток в присутствии антиген-положительных и антиген-отрицательных клеток-мишеней. Минимальное распознавание антиген-отрицательных клеток-мишеней определяют как уровень активации Т-клеток менее 20%, предпочтительно менее 10%, предпочтительно менее 5% и более предпочтительно менее 1% от уровня, полученного в присутствии антиген-положительных клеток-мишеней, при измерении в тех же условиях и при терапевтически значимой концентрации TCR. Для растворимых TCR, ассоциированных с иммунным эффектором, можно задать терапевтически значимую концентрацию как концентрацию TCR 10-9 M или ниже, и/или концентрацию, 100-кратно, предпочтительно 1000-кратно превышающую соответствующее значение EC50. Для растворимых специфичных связывающих молекул, ассоциированных с иммунным эффектором, концентрации, необходимые для активации Т-клеток против антиген-положительных клеток по сравнению с антиген-отрицательными клетками, предпочтительно различаются по меньшей мере в 100 раз. Антиген-положительные клетки можно получать путем обработки пептидом с использованием подходящей концентрации пептида для получения уровня презентации антигена, сопоставимого с раковыми клетками или инфицированными клетками (например, 10-9 M пептида, как описано в Bossi et al., (2013) Oncoimmunol. 1;2 (11) :e26840), либо они могут презентировать указанный пептид естественным образом. Как антиген-положительные, так и антиген-отрицательные клетки предпочтительно представляют собой клетки человека. Антиген-положительные клетки предпочтительно представляют собой раковые клетки человека со встроенным геномом ВГВ или клетки, инфицированные ВГВ. Антиген-отрицательные клетки предпочтительно включают клетки, полученные из здоровых тканей человека.
Специфичность может, в качестве дополнения или альтернативы, относиться к способности специфичной связывающей молекулы связываться с комплексом GLSPTVWLSV (SEQ ID NO: 1) HLA-A*02 и/или комплексом GLSPTVWLSA-HLA-A*02, а не с панелью альтернативных комплексов пептид-HLA. Это можно, например, определить с помощью способа Biacore из примера 3. Указанная панель может содержать по меньшей мере 5 и предпочтительно по меньшей мере 10 альтернативных комплексов пептид-HLA-A*02. Все альтернативные пептиды могут характеризоваться низким уровнем идентичности последовательности по отношению к SEQ ID NO: 1 и могут презентироваться в природных условиях. Альтернативные пептиды предпочтительно получают из белков, экспрессируемых в здоровых тканях человека. Связывание специфичной связывающей молекулы с комплексом GLSPTVWLSV-HLA-A*02 и/или комплексом GLSPTVWLSA-HLA-A*02 может быть по меньшей мере в 2 раза более сильным, чем с другими презентируемыми в природных условиях комплексами пептид-HLA, более предпочтительно по меньшей мере в 10 раз или по меньшей мере в 50 раз или по меньшей мере в 100 раз более сильным, еще более предпочтительно по меньшей мере в 400 раз более сильным. Альтернативные HLA не включают другие природные варианты пептида GLSPTVWLSV, например, последовательности GLSPIVWLSV и GLSPTVWLLV).
Альтернативным или дополнительным подходом для определения специфичности специфичной связывающей молекулы может быть выявление пептид-распознающего мотива специфичной связывающей молекулы с использованием последовательного мутагенеза пептида-мишени, например, посредством сканирования аланином. Остатки, которые составляют фрагмент связывающего мотива, являются остатками, не допускающими замены. Недопустимые замены можно определить как положения в составе пептида, для которых аффинность связывания специфичной связывающей молекулы понижено по меньшей мере на 50% или предпочтительно по меньшей мере на 80% относительно аффинности связывания с немутированным пептидом. Такой подход дополнительно описан в Cameron et al., (2013), Sci Transl Med. 2013 Aug 7; 5 (197): 197ra103 и WO2014096803 в отношении TCR, хотя следует принимать во внимание, что такие способы также можно применять к специфичным связывающим молекулам согласно настоящему изобретению. Специфичностьспецифичной связывающей молекулы в этом случае можно определить путем выявления пептидов, содержащих альтернативный мотив, в частности, пептидов, содержащих альтернативный мотив, в протеоме человека, и проверки этих пептидов на предмет связывания со специфичной связывающей молекулой. Связывание специфичной связывающей молекулы с одним или более альтернативными пептидами может указывать на отсутствие специфичности. В этом случае может потребоваться дальнейшая проверка специфичности специфичной связывающей молекулы с помощью клеточных анализов. Низкая переносимость замен (на аланин) в центральной части пептида указывает на то, что TCR обладает высокой специфичностью и, следовательно, представляет низкий риск перекрестной реакции с альтернативными пептидами.
Специфичные связывающие молекулы согласно настоящему изобретению могут характеризоваться идеальным профилем безопасности для применения в качестве терапевтических реагентов. В этом случае специфичная связывающая молекула может находиться в растворимой форме и предпочтительно может быть присоединена к иммунному эффектору. Подходящие иммунные эффекторы включают цитокины, например, ИЛ-2 и ИФН-γ; их суперантигены и мутанты; хемокины, например, ИЛ-8, тромбоцитарный фактор 4, белок, стимулирующий рост меланомы; антитела, включая их фрагменты, производные и варианты, связывающиеся с антигенами на иммунных клетках, например, Т-клетках или NK-клетках (например, антитело против CD3, антитело против CD28 или антитело против CD16); и активаторы комплемента, но не ограничиваются ими. Идеальный профиль безопасности означает, что в дополнение к демонстрации хорошей специфичности, специфичные связывающие молекулы согласно настоящему изобретению могут пройти дальнейшие доклинические тесты безопасности. Примеры таких тестов включают анализы цельной крови, подтверждающие минимальное высвобождение цитокинов в присутствии цельной крови и, таким образом, низкий риск возникновения потенциального синдрома высвобождения цитокинов in vivo, и тесты на аллореактивность, подтверждающие низкий потенциал распознавания альтернативных типов HLA.
Специфичные связывающие молекулы согласно настоящему изобретению могут поддаваться высокоэффективной очистке, особенно специфичные связывающие молекулы в растворимом формате. Выход можно определить на основании количества материала с правильным фолдингом, полученного в конце процесса очистки, относительно исходного объема культуры. Высокий выход, как правило, означает более 1 мг/л, или более 2 мг/л, или более предпочтительно более 3 мг/л, или более 4 мг/л, или более 5 мг/л, или более высокий выход.
Специфичные связывающие молекулы согласно настоящему изобретению предпочтительно характеризуются KD по отношению к комплексу GLSPTVWLSV-HLA-A*02 и/или комплексу GLSPTVWLSA- HLA-A*02, превышающей (т.е. более эффективной) аналогичный параметр нативного TCR (также называемого немутированным TCR или TCR остова), например, в диапазоне от 1 пМ до 1 мкМ. В одном аспекте специфичные связывающие молекулы согласно настоящему изобретению характеризуются KD по отношению к указанному комплексу от приблизительно (т.е. +/- 10%) 1 пМ до приблизительно 400 нМ, от приблизительно 1 пМ до приблизительно 1000 пМ, от приблизительно 1 пМ до приблизительно 500 пМ, от приблизительно 1 пМ до приблизительно 100 пМ. Указанная специфичная связывающая молекула может, в качестве дополнения или альтернативы, характеризоваться периодом полураспада (T½) комплекса, образуемого в результате связывания, по отношению к указанному комплексу в диапазоне от приблизительно 1 минуты до приблизительно 60 часов, от приблизительно 20 минут до приблизительно 50 часов, или от приблизительно 2 часов до приблизительно 35 часов, или от приблизительно 4 часов до приблизительно 20 часов. Специфичные связывающие молекулы согласно настоящему изобретению предпочтительно характеризуются KD по отношению к комплексу GLSPTVWLSV-HLA-A*02 и/или комплексу GLSPTVWLSA-HLA-A*02 от приблизительно 1 пМ до приблизительно 100 пМ и/или периодом полураспада комплекса, образуемого в результате связывания, от приблизительно 4 ч до приблизительно 20 ч. Такая высокая аффинность является предпочтительной для специфичных связывающих молекул в растворимом формате, ассоциированных с терапевтическими агентами и/или детектируемыми метками.
В еще одном аспекте специфичная связывающая молекула согласно настоящему изобретению может характеризоваться KD по отношению к указанному комплексу от приблизительно 50 нМ до приблизительно 200 мкМ или от приблизительно 100 нМ до приблизительно 2 мкМ и/или периодом полураспада комплекса, образуемого в результате связывания, по отношению к указанному комплексу от приблизительно 3 с до приблизительно 12 мин. Такие специфичные связывающие молекулы могут быть предпочтительными для применения в адоптивной терапии.
Способы определения аффинности связывания (обратно пропорционального константе равновесия KD) и периода полураспада комплекса, образуемого в результате связывания (выраженного как T½), известны специалистам в данной области техники. В предпочтительном варианте реализации аффинностьсвязывания и период полураспада комплекса, образуемого в результате связывания, определяют при помощи поверхностного плазмонного резонанса (ППР) или интерферометрии в биологическом слое (BLI), например, при помощи прибора BIAcore или прибора Octet, соответственно. Предпочтительный способ представлен в примере 3. Следует принимать во внимание, что удвоение аффинности специфичной связывающей молекулы приводит к уменьшению KD в два раза. T½ рассчитывают как ln2, разделенный на константу диссоциации (koff). Таким образом, удвоение T½ приводит к уменьшению koff в два раза. Значения KD и koff для TCR обычно измеряют для растворимых форм TCR, то есть для форм, укороченных путем удаления остатков цитоплазматического и трансмембранного доменов. Чтобы учесть различия между независимыми измерениями, в частности, для взаимодействий со временем диссоциации более 20 часов, аффинность связывания и/или период полураспада комплекса, образуемого в результате связывания заданной специфичной связывающей молекулы, можно измерить несколько раз, например, 3 или более раз, используя один и тот же протокол анализа и усредняя полученные результаты. Для сравнения данных связывания между двумя образцами (т.е. двумя различными специфичными связывающими молекулами и или двумя составами одной и той же специфичной связывающей молекулы) предпочтительно выполнять измерения при одних и тех же условиях анализа (например, температуре), например, как описано в примере 3.
Некоторые предпочтительные специфичные связывающие молекулы согласно настоящему изобретению характеризуются аффинностью связывания и/или периодом полураспада комплекса, образуемого в результате связывания, в отношении комплекса GLSPTVWLSV-HLA-A*02 и/или комплекса GLSPTVWLSA-HLA-A*02, существенно превышающими аналогичные параметры нативного TCR. Повышение аффинности связывания нативного TCR часто снижает специфичность TCR по отношению к лиганду «пептид-MHC«пептид-MHC«пептид-MHC«пептид-ГКГС, и это продемонстрировано в статье Zhao et al., (2007) J.Immunol, 179:9, 5845-5854. Однако такие TCR согласно настоящему изобретению остаются специфичными по отношению к комплексу GLSPTVWLSV-HLA-A*02 и/или комплексу GLSPTVWLSA-HLA-A*02, несмотря на свое существенно более высокую аффинность связывания по сравнению с нативным TCR.
Некоторые предпочтительные специфичные связывающие молекулы способны генерировать высокоэффективный Т-клеточный ответ in vitro на антиген-положительные клетки, в частности, клетки, презентирующие низкие уровни антигена (т.е. порядка 5-100). Такие специфичные связывающие молекулы могут находиться в растворимой форме, связанной с иммунным эффектором, например, антителом против CD3. Измеряемый Т-клеточный ответ может представлять собой высвобождение маркеров активации Т-клеток, например, интерферона γ или гранзима B, или уничтожение клеток-мишеней, или другую меру активации Т-клеток, например, пролиферацию Т-клеток. Высокоэффективный ответ предпочтительно представляет собой ответ со значением EC50 в пМ-диапазоне, наиболее предпочтительно 100 пМ или ниже.
Специфичные связывающие молекулы согласно настоящему изобретению могут содержать вариабельные домены TCR, которые могут являться гетеродимерами αβ. В некоторых случаях специфичные связывающие молекулы согласно настоящему изобретению могут содержать вариабельные домены TCR, которые могут являться гетеродимерами γδ. В других случаях специфичные связывающие молекулы согласно настоящему изобретению могут содержать вариабельные домены TCR, которые могут представлять собой гомодимеры αα или β (или гомодимеры γγ или δδ). Альфа-бета гетеродимерные специфичные связывающие молекулы согласно настоящему изобретению могут содержать последовательность константного домена альфа-цепи TRAC и/или последовательность константного домена бета-цепи TRBC1 или TRBC2. Константные домены могут быть полноразмерными, что означает присутствие внеклеточных, трансмембранных и цитоплазматических доменов, или могут быть представлены в растворимом формате (т.е. не содержать трансмембранных или цитоплазматических доменов). Один или оба константных домена могут содержать мутации, замены или делеции по сравнению с природными последовательностями TRAC и/или TRBC1/2. Термины TRAC и TRBC1/2 также охватывают природные полиморфные варианты, например, замену N на K в положении 4 TRAC (Bragado et al International immunology. 1994 Feb;6(2):223-30).
Для растворимых специфичных связывающих молекул согласно настоящему изобретению последовательности константных доменов альфа- и бета-цепей могут быть модифицированы путем укорачивания или замены с удалением нативной дисульфидной связи между Cys4 экзона 2 TRAC и Cys2 экзона 2 TRBC1 или TRBC2. Последовательность(и) константных доменов альфа- и/или бета-цепей может(могут) содержать внедренную дисульфидную связь между остатками соответствующих константных доменов, как описано, например, в WO 03/020763. В предпочтительном варианте реализации альфа и бета-константные домены могут быть модифицированы замещением остатков цистеина в положении Thr 48 TRAC и положении Ser 57 TRBC1 или TRBC2, причем указанные остатки цистеина образуют дисульфидную связь между альфа и бета константными доменами TCR. TRBC1 или TRBC2 могут дополнительно содержать мутацию цистеина на аланин в положении 75 константного домена и мутацию аспарагина на аспарагиновую кислоту в положении 89 константного домена. Один или оба внеклеточных константных домена, присутствующих в гетеродимере αβ согласно настоящему изобретению, могут быть укорочены на С-конце или С-концах, например, до 15, или до 10, или до 8 или менее аминокислот. Один или оба внеклеточных константных домена, присутствующих в гетеродимере αβ согласно настоящему изобретению, могут быть укорочены на С-конце или С-концах, например, до 15, или до 10, или до 8 аминокислот. С-конец внеклеточного константного домена альфа-цепи может быть укорочен на 8 аминокислот. Растворимые специфичные связывающие молекулыпредпочтительно связаны с терапевтическими агентами и/или детектируемыми метками.
Константные домены αβ-гетеродимерного TCR могут быть полноразмерными и содержать как трансмембранные, так и цитоплазматические домены. Такие TCR могут содержать дисульфидную связь, соответствующую той, которая встречается в природе, между соответствующими константными доменами альфа и бета. Дополнительно или в качестве альтернативы, между внеклеточными константными доменами может присутствовать не встречающаяся в природе дисульфидная связь. Указанные не встречающиеся в природе дисульфидные связи более подробно описаны в WO03020763 и WO06000830. Не встречающаяся в природе дисульфидная связь может находиться между положением Thr 48 TRAC и положением Ser 57 TRBC1 или TRBC2. Один или оба константных домена могут содержать одну или более мутаций в виде замен или делеций относительно природных последовательностей TRAC и/или TRBC1/2. TCR с полноразмерными константными доменами предпочтительны для использования в адоптивной терапии.
В качестве альтернативы, вместо полноразмерных или укороченных константных доменов константные домены TCR могут отсутствовать. Соответственно, специфичная связывающая молекула согласно настоящему изобретению может состоять из вариабельных доменов альфа- и бета-цепей TCR, необязательно с дополнительными доменами, описанными в настоящем документе. Дополнительные домены включают иммунные эффекторные домены (например, домены антител), домены Fc или альбумин-связывающие домены, но не ограничиваются ими.
Специфичные связывающие молекулы согласно настоящему изобретению могут выть представлены в одноцепочечном формате. Одноцепочечные форматы включают αβ-полипептиды TCR типов Vα-L-Vβ, Vβ-L-Vα, Vα-Cα-L-Vβ, Vα-L-Vβ-Cβ или Vα-Cα-L-Vβ-Cβ, где Vα и Vβ представляют собой α- и β-вариабельные области TCR, соответственно, Cα и Cβ представляют собой α- и β-константные области TCR, соответственно, а L представляет собой линкерную последовательность (Weidanz et al., (1998) J Immunol Methods. Dec 1;221(1-2):59-76; Epel et al., (2002), Cancer Immunol Immunother. Nov;51(10):565-73; WO 2004/033685; WO9918129), но не ограничиваются ими. Линкерные последовательности обычно являются гибкими, поскольку состоят в основном из таких аминокислот, как глицин, аланин и серин, которые не содержат объемных боковых цепей, способных ограничивать гибкость. В альтернативных вариантах могут быть предпочтительными линкеры с большей жесткостью. Пригодные для применения или оптимальные длины линкерных последовательностей могут быть легко определены. Часто длина линкерной последовательности составляет менее 12, например, менее 10, или от 2 до 10 аминокислот. Длина линкера может составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 аминокислот. Примеры подходящих линкеров, которые можно использовать в составе мультидоменных связывающих молекул согласно настоящему изобретению, включают: GGGGS (SEQ ID No: 33), GGGSG (SEQ ID No: 34), GGSGG (SEQ ID No: 35), GSGGG (SEQ ID No: 36), GSGGGP (SEQ ID No: 37), GGEPS (SEQ ID No: 38), GGEGGGP (SEQ ID No: 39) и GGEGGGSEGGGS (SEQ ID No: 40) (описанные в WO2010/133828) и GGGSGGGG (SEQ ID NO: 41), но не ограничиваются ими. Дополнительные линкеры могут включать последовательности, содержащие одну или более из следующих последовательностей мотивов: GGGS, GGGGS, TVLRT, TVSSAS и TVLSSAS. Один или оба константных домена (при их наличии) могут быть полноразмерными или укороченными и/или содержать вышеописанные мутации. Одноцепочечные TCR предпочтительно являются растворимыми. В некоторых вариантах реализации одноцепочечные TCR согласно настоящему изобретению могут содержать внедренную дисульфидную связь между остатками соответствующих константных доменов, как описано в WO 2004/033685. Одноцепочечные TCR подробнее описаны в источниках WO2004/033685; WO98/39482; WO01/62908; Weidanz et al. (1998) J Immunol Methods 221(1-2): 59-76; Hoo et al. (1992) Proc Natl Acad Sci U S A 89(10): 4759-4763; Schodin (1996) Mol Immunol 33(9): 819-829).
Настоящее изобретение также включает частицы, отображающие специфичные связывающие молекулы согласно настоящему изобретению, и включение указанных частиц в библиотеку частиц. Такие частицы включают фаг, дрожжевые клетки, рибосомы или клетки млекопитающих, но не ограничиваются ими. Способ получения таких частиц и библиотек известен в данной области техники (например, см. WO2004/044004; WO01/48145, Chervin et al. (2008) J. Immuno. Methods 339.2: 175-184).
Растворимые специфичные связывающие молекулы согласно настоящему изобретению пригодны для доставки детектируемых меток или терапевтических агентов в антиген-презентирующие клетки и ткани, содержащие антиген-презентирующие клетки. Поэтому они могут быть ассоциированы (ковалентно или иным образом) с детектируемой меткой (для диагностических целей, где специфичная связывающая молекула используется для обнаружения присутствия клеток, презентирующих родственный антиген); и/или терапевтическим агентом; и/или фрагментом, модифицирующим фармакокинетические (ФК) параметры.
Примеры фрагментов, модифицирующих ФК параметры, включают полиэтиленгликоль (ПЭГ) (Dozier et al., (2015) Int J Mol Sci. Oct 28;16(10):25831-64 и Jevsevar et al., (2010) Biotechnol J.Jan;5(1):113-28), модификацию остатками пролина, аланина и серина (PAS) (Schlapschy et al., (2013) Protein Eng Des Sel. Aug;26(8):489-501), альбумин и альбумин-связывающие домены (Dennis et al., (2002) J Biol Chem. Sep 20;277(38):35035-43) и/или неструктурированные полипептиды (Schellenberger et al., (2009) Nat Biotechnol. Dec;27(12):1186-90), но не ограничиваются ими. Дополнительные фрагменты, модифицирующие ФК параметры, включают Fc-фрагменты антител. Фрагменты, модифицирующие ФК параметры, могут служить для увеличения периода полувыведения in vivo.
При применении Fc-домена иммуноглобулина это может быть любая Fc-область антитела. Fc-область - это хвостовая область антитела, взаимодействующая с Fc-рецепторами клеточной поверхности и некоторыми белками системы комплемента. Fc-область обычно содержит две полипептидные цепи, содержащие два или три константных домена тяжелой цепи (называемых CH2, CH3 и CH4), и шарнирную область. Две цепи связаны дисульфидными связями в шарнирной области. Fc-домены из подклассов иммуноглобулинов IgG1, IgG2 и IgG4 связываются с и подвергаются FcRn-опосредованной рециркуляции, обеспечивая длительный период полужизни в кровотоке (3-4 недели). Взаимодействие IgG с FcRn локализовано в Fc-области, охватывающей фрагменты доменов CH2 и CH3.Fc-иммуноглобулин для применения в настоящем изобретении предпочтительно включает Fc-домены IgG1 или IgG4, но не ограничивается ими. Fc-домен предпочтительно происходит от последовательностей человека. Fc-область может также предпочтительно включать KiH-мутации, облегчающие димеризацию, а также мутации для предотвращения взаимодействия с активирующими рецепторами, т.е. функционально неактивные молекулы. Fc-домен иммуноглобулина можно объединить с C- или N-концом других доменов (т.е. с вариабельными доменами и/или константными доменами и/или иммунным эффектором TCR) в любом подходящем порядке или конфигурации. Fc-иммуноглобулин можно объединить с другими доменами (например, вариабельными доменами и/или константными доменами и/или иммунным эффектором TCR) через линкер. Линкерные последовательности обычно являются гибкими, поскольку состоят в основном из таких аминокислот, как глицин, аланин и серин, которые не содержат объемных боковых цепей, способных ограничивать гибкость. В альтернативных вариантах могут быть предпочтительными линкеры с большей жесткостью. Пригодные для применения или оптимальные длины линкерных последовательностей могут быть легко определены. Часто длина линкерной последовательности составляет менее 12, например, менее 10, или от 2 до 10 аминокислот. Длина линкера может составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 аминокислот. Примеры подходящих линкеров, которые можно использовать в составе мультидоменных связывающих молекул согласно настоящему изобретению, включают: GGGGS (SEQ ID No: 33), GGGSG (SEQ ID No: 34), GGSGG (SEQ ID No: 35), GSGGG (SEQ ID No: 36), GSGGGP (SEQ ID No: 37), GGEPS (SEQ ID No: 38), GGEGGGP (SEQ ID No: 39) и GGEGGGSEGGGS (SEQ ID No: 40) (описанные в WO2010/133828) и GGGSGGGG (SEQ ID NO: 41), но не ограничиваются ими. Дополнительные линкеры могут включать последовательности, содержащие одну или более из следующих последовательностей мотивов: GGGS, GGGGS, TVLRT, TVSSAS и TVLSSAS. При объединении Fc-иммуноглобулина с TCR его можно присоединить к альфа - или к бета-цепями, с использованием линкера или без него. Кроме того, отдельные цепи Fc можно объединить с отдельными цепями TCR.
Fc-область предпочтительно может происходить от иммуноглобулина подкласса IgG1 или IgG4. Эти две цепи могут содержать константные домены СН2 и СН3 и, целиком или полностью, шарнирную область. Шарнирная область может по существу или частично соответствовать шарнирной области IgG1, IgG2, IgG3 или IgG4. Шарнир может содержать всю или часть основной шарнирной области и всю или часть нижней шарнирной области. Предпочтительно, чтобы шарнирная область содержала по меньшей мере одну дисульфидную связь, связывающую две цепи.
Область Fc может содержать мутации относительно последовательности дикого типа. Мутации включают в себя замены, вставки и делеции. Такие мутации могут быть введены с целью введения желательных терапевтических свойств. Например, чтобы облегчить гетеродимеризацию, мутации выступы-во-впадины (knobs into holes, KiH) могут быть встроены в домен CH3. В этом случае одна цепь спроектирована так, чтобы содержать громоздкий выступающий остаток (то есть выступ), такой как Y, а другая цепь спроектирована так, чтобы содержать дополнительный карман (то есть впадину). Подходящие положения для мутаций KiH известны в данной области техники. В качестве дополнения или альтернативны, можно внедрять мутации, устраняющие или снижающие эффективность связывания с Fcy-рецепторами и/или увеличивающие эффективность связывания с FcRn, и/или предотвращающие обмен плечами Fab, или удаляющие сайты протеаз.
Фрагмент, модифицирующий ФК параметры, также может представлять собой альбумин-связывающий домен, который также может увеличивать период полувыведения. Как известно в данной области техники, альбумин характеризуется длительным периодом полувыведения из кровотока, составляющим 19 суток, отчасти из-за его размера, превышающего порог выведения почками, а также из-за его специфичного взаимодействия и рециклинга через FcRn. Связывание с альбумином - это известная стратегия для улучшения периода полувыведения терапевтической молекулы из кровотока in vivo. Альбумин можно присоединять нековалентно, посредством специфичного альбумин-связывающего домена, или ковалентно, путем конъюгирования или прямого объединения генов. Примеры терапевтических молекул, в которых применяли присоединение к альбумину для улучшения периода полувыведения, приведены в Sleep et al., Biochim Biophys Acta.2013 Dec;1830(12):5526-34.
Альбумин-связывающий домен может представлять собой любой фрагмент, способный связываться с альбумином, включая любой известный альбумин-связывающий фрагмент. Альбумин-связывающие домены можно выбрать из эндогенных или экзогенных лигандов, низкомолекулярных органических соединений, жирных кислот, пептидов и белков, специфично связывающих альбумин. Примеры предпочтительных алтбумин-связывающих доменов включают короткие пептиды, например, описанные в Dennis et al., J Biol Chem. 2002 Sep 20;277(38):35035-43 (например, пептид QRLMEDICLPRWGCLWEDDF); белки, сконструированные с целью связывания альбумина, например, антитела, фрагменты антител и антитело-подобные каркасы, например, Albudab® (O'Connor-Semmes et al., Clin Pharmacol Ther. 2014 Dec;96(6):704-12), предоставляемый на коммерческой основе GSK, и Nanobody® (Van Roy et al., Arthritis Res Ther. 2015 May 20;17:135), предоставляемый на коммерческой основе Ablynx; а также природные белки на основе альбумин-связывающих доменов, например, G-белок стрептококков (Stork et al., Eng Des Sel. 2007 Nov;20(11):569-76), например, Albumod®, предоставляемый на коммерческой основе Affibody.
Альбумин предпочтительно представляет собой альбумин сыворотки человека (HSA). Аффинность альбумин-связывающего домена к альбумину человека может находиться в диапазоне от пикомоль до микромоль. Учитывая чрезвычайно высокую концентрацию альбумина в сыворотке крови человека (35-50 мг/мл, приблизительно 0,6 мМ), подсчитано, что практически все альбумин-связывающие домены связывают альбумин in vivo.
Альбумин-связывающий фрагмент можно присоединять к C или N концу других доменов (т.е. к вариабельным доменам и/или константным доменам и/или иммунному эффектору TCR) в любом порядке или конфигурации. Альбумин-связывающий фрагмент можно присоединять к другим доменам (например, вариабельным доменам и/или константным доменам и/или иммунным эффектором TCR) через линкер. Линкерные последовательности обычно являются гибкими, поскольку состоят в основном из таких аминокислот, как глицин, аланин и серин, которые не содержат объемных боковых цепей, способных ограничивать гибкость. В альтернативных вариантах могут быть предпочтительными линкеры с большей жесткостью. Пригодные для применения или оптимальные длины линкерных последовательностей могут быть легко определены. Часто длина линкерной последовательности составляет менее 12, например, менее 10, или от 2 до 10 аминокислот. Длина линкера может составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 аминокислот. Примеры подходящих линкеров, которые можно использовать в мультидоменных связывающих молекулах согласно настоящему изобретению, включают: GGGGS (SEQ ID No: 36), GGGSG (SEQ ID No: 37), GGSGG (SEQ ID No: 38), GSGGG (SEQ ID No: 39), GSGGGP (SEQ ID No: 40), GGEPS (SEQ ID No: 41), GGEGGGP (SEQ ID No: 42) и GGEGGGSEGGGS (SEQ ID No: 43) (описанные в WO2010/133828) и GGGSGGGG (SEQ ID NO: 44), но не ограничиваются ими. Дополнительные линкеры могут включать последовательности, содержащие одну или более из следующих последовательностей мотивов: GGGS, GGGGS, TVLRT, TVSSAS и TVLSSAS. Если альбумин-связывающий фрагмент присоединен TCR, он может быть присоединен к альфа- или бета-цепям с использованием линкера или без него.
Детектируемые метки для диагностических целей включают, например, флуоресцентные метки, радиоактивные метки, ферменты, нуклеотидные зонды и контрастные реагенты.
Для некоторых целей специфичные связывающие молекулы согласно настоящему изобретению можно агрегировать в комплекс, содержащий несколько специфичных связывающих молекул, с образованием комплекса поливалентных специфичных связывающих молекул. Существует ряд белков человека, содержащих домен мультимеризации, который можно использовать для получени комплексов поливалентных специфичных связывающих молекул. Например, домен тетрамеризации p53, использованный для получения тетрамеров фрагментов антитела scFv, которые демонстрировали повышенное время нахождения в сыворотке и значительно сниженную скорость диссоциации по сравнению с мономерным фрагментом scFv (Willuda et al. (2001) J. Biol. Chem. 276 (17) 14385-14392). Гемоглобин также содержит домен тетрамеризации, который можно использовать в таких целях. Поливалентный комплекс специфичной связывающей молекулы комплекс согласно настоящему изобретению может обладать повышенной связывающей способностью по отношению к указанному комплексу по сравнению с немультимерным нативным (также называемым исходным, природным, немутированным, гетеродимером дикого типа или гетеродимером остова) гетеродимером Т-клеточного рецептора согласно настоящему изобретению. Таким образом, настоящее изобретение также включает поливалентные комплексы специфичных связывающих молекул согласно настоящему изобретению. Такие поливалентные комплексы специфичных связывающих молекул согласно настоящему изобретению особенно пригодны для отслеживания или адресного воздействия на клетки, презентирующие конкретные антигены in vitro или in vivo, а также пригодны в качестве промежуточных продуктов для получения дополнительных поливалентных комплексов специфичных связывающих молекул, применяемых в таких целях.
Терапевтические агенты, которые можно ассоциировать со специфичными связывающими молекулами согласно изобретению, включают иммуномодуляторы и эффекторы, радиоактивные соединения, ферменты (например, перфорин) или химиотерапевтические агенты (например, цисплатин). Для гарантии проявления токсических эффектов в нужном месте токсин может находиться внутри липосомы, присоединенной к специфичной связывающей молекуле, что обеспечивает медленное высвобождение соединения. Это предотвращает повреждающие эффекты при транспорте в организме и обеспечивает максимальный эффект токсина после связывания специфичной связывающей молекулы с соответствующими антиген-презентирующими клетками.
Примеры подходящих терапевтических агентов включают:
• Низкомолекулярные цитотоксические агенты, т.е. соединения, обладающие способностью убивать клетки млекопитающих, имеющие молекулярную массу менее 700 дальтон. Такие соединения могут также содержать токсичные металлы, способные оказывать цитотоксическое действие. Кроме того, следует понимать, что эти низкомолекулярные цитотоксические агенты также включают пролекарства, т.е. соединения, распадающиеся или преобразующиеся в физиологических условиях с высвобождением цитотоксических агентов. Примеры таких агентов включают цисплатин, производные майтансина, рахелмицин, калихеамицин, доцетаксел, этопозид, гемцитабин, ифосфамид, иринотекан, мелфалан, митоксантрон, порфимер натрия фотофрин II, темозоломид, топотекан, триметрексат 20arbour20ate, ауристатин E, винкристин и доксорубицин;
• пептидные цитотоксины, т.е. белки или их фрагменты, обладающие способностью уничтожать клетки млекопитающих. Например, рицин, дифтерийный токсин, псевдомонадный бактериальный экзотоксин A, ДНКаза и РНКаза;
• Радионуклиды, т.е. нестабильные изотопы элементов, которые распадаются при одновременном излучении одной или нескольких α- или β-частиц или γ-лучей. Например, йод-131, рений-186, индий-111, иттрий-90, висмут-210 и висмут-213, актиний-225 и астатин-213; хелатирующие агенты могут быть использованы для облегчения ассоциации этих радионуклидов с высокоаффинными TCR или их мультимерами;
• Иммуностимуляторы, т.е. иммунные эффекторные молекулы, которые стимулируют иммунный ответ. Например, цитокины, такие как ИЛ-2 и ИФН-γ;
• Суперантигены и их мутантные формы;
• Слитые TCR-HLA, например, слияние с комплексом пептид-HLA, где пептид происходит из обычного патогена человека, такого как вирус Эпштейна-Барр (ВЭБ);
• Хемокины, такие как ИЛ-8, тромбоцитарный фактор 4, стимулирующий рост меланомы белок и т.д.;
• Антитела или их фрагменты, включая антитела против Т-клеточных или NK-клеточных детерминант (например, анти-CD3, анти-CD28 или анти-CD16);
• Альтернативные белковые скаффолды с антитело-подобными характеристиками связывания;
• Активаторы комплемента;
• ксеногенные белковые домены, аллогенные белковые домены, вирусные/бактериальные белковые домены, вирусные/бактериальные пептиды.
В одном предпочтительном варианте реализации предложена растворимая специфичная связывающая молекула согласно настоящему изобретению, ассоциированная (как правило, путем присоединения к N- или C-концу альфа- и/или бета-цепи в любой подходящей конфигурации) с иммунным эффектором. Особенно предпочтительным иммунным эффектором является антитело против CD3 или функциональный фрагмент или вариант указанного антитела против CD3. В настоящем документе термин «антитело» охватывает такие фрагменты и варианты. Примеры антител против CD3 включают OKT3, UCHT-1, BMA-031 и 12F6, но не ограничиваются ими. Фрагменты и варианты/аналоги антител, пригодные для применения в композициях и способах, описанных в настоящем документе, включают миниантитела, Fab-фрагменты, F(ab')2 -фрагменты, dsFv- и scFv-фрагменты, нанотела (Nanobodies™) (эти конструкты, продаваемые Ablynx (Бельгия), содержат синтетический одиночный вариабельный домен тяжелой цепи иммуноглобулина, полученный из антитела верблюдовых (например, верблюда или ламы)) и доменные антитела (Domantis (Бельгия), содержащие подвергнутый созреванию аффинности одиночный вариабельный домен тяжелой цепи иммуноглобулина или вариабельный домен легкой цепи иммуноглобулина) или альтернативные белковые каркасные структуры, проявляющие характеристики связывания, подобные антителу, например, аффитела (Affibody (Швеция), содержащие каркас сконструированного белка A) или антикалины (Pieris (Германия), содержащие сконструированные антикалины), и т.д.
В еще одном предпочтительном формате специфичной связывающей молекулы вариабельные домены TCR и иммунные эффекторные домены могут чередоваться на отдельных полипептидных цепях, что приводит к димеризации. Такие форматы описаны в WO2019012138. Коротко, первая полипептидная цепь может содержать (от N до C-конца) первый вариабельный домен антитела, за которым следует вариабельный домен TCR, а затем необязательно Fc-домен. Вторая цепь может содержать (от N до C-конца) вариабельный домен TCR, за которым следует второй вариабельный домен антитела, за которым необязательно следует FC-домен. При наличии линкеров соответствующей длины, цепи димеризуются в мультиспецифичную молекулу, необязательно содержащую Fc-домен. Молекулы, в которых домены расположены на различных цепях таким образом, также могут быть названы диателами, которые также рассматриваются в данном изобретении. Дополнительные цепи и домены могут быть добавлены для формирования, например, триател.
Соответственно, в настоящей заявке также предложена полипептидная молекула с двойной специфичностью, выбранная из группы молекул, содержащих первую полипептидную цепь и вторую полипептидную цепь, причем: первая полипептидная цепь содержит первую область связывания вариабельного домена (VD1 ) антитела, специфично связывающегося с антигеном клеточной поверхности иммунной эффекторной клетки человека, и
первую область связывания вариабельного домена (VR1) TCR, специфично связывающегося с MHC-ассоциированным пептидным эпитопом, и
первый линкер (LINK1 ), соединяющий указанные домены;
вторая полипептидная цепь содержит вторую область связывания вариабельного домена (VR2) TCR, специфично связывающегося с MHC-ассоциированным пептидным эпитопом, и
вторую область связывания вариабельного домена (VD2) антитела, специфично связывающегося с антигеном клеточной поверхности иммунной эффекторной клетки человека, и
второй линкер (LINK2), соединяющий указанные домены;
причем указанная первая связывающая область (VD1 ) и указанная вторая связывающая область (VD2) ассоциируют с образованием первого сайта связывания (VD1 )(VD2), который связывает антиген клеточной поверхности иммунной эффекторной клетки человека;
указанная первая связывающая область (VR1 ) и указанная вторая связывающая область (VR2) ассоциируют с образованием второго сайта связывания (VR1 )(VR2), который связывает указанный MHC-ассоциированный пептидный эпитоп;
причем указанные две полипептидные цепи объединены с шарнирными доменами IgG человека и/или Fс-доменами IgG человека или их димеризующими фрагментами; и
указанные две полипептидные цепи соединены ковалентными и/или нековалентными связями между указанными шарнирными доменами и/или Fc-доменами; и
указанная полипептидная молекула с двойной специфичностью способна одновременно связывать указанную молекулу клеточной поверхности и указанный MHC-ассоциированный пептидный эпитоп, а также полипептидные молекулы с двойной специфичностью, причем порядок областей связывания в двух полипептидных цепях выбран из VD1 -VR1 и VR2- VD2 или VD1 - VR2 и VR1 -VD2, или VD2- VR1 и VR2- VD1 или VD2- VR2 и VR1 -VD1, и домены связаны посредством LINK1 либо LINK2, причем MHC-ассоциированный пептидный эпитоп представляет собой GLSPTVWLSV или GLSPTVWLSA, а MHC представляет собой HLA-A*02.
Связь специфичной связывающей молекулы и антитела против CD3 можно осуществить посредством ковалентного или нековалентного присоединения. Ковалентное присоединение может быть прямым или непрямым, через линкерную последовательность. Линкерные последовательности обычно являются гибкими, поскольку состоят в основном из таких аминокислот, как глицин, аланин и серин, которые не содержат объемных боковых цепей, способных ограничивать гибкость. В альтернативных вариантах могут быть предпочтительными линкеры с большей жесткостью. Пригодные для применения или оптимальные длины линкерных последовательностей могут быть легко определены. Часто длина линкерной последовательности составляет менее 12, например, менее 10, или от 2 до 10 аминокислот. Примеры подходящих линкеров, которые можно использовать в специфичных связывающих молекулах согласно настоящему изобретению, включают: GGGGS (SEQ ID No: 33), GGGSG (SEQ ID No: 34), GGSGG (SEQ ID No: 35), GSGGG (SEQ ID No: 36), GSGGGP (SEQ ID No: 37), GGEPS (SEQ ID No: 38), GGEGGGP (SEQ ID No: 39) и GGEGGGSEGGGS (SEQ ID No: 40) (описанные в WO2010/133828) и GGGSGGGG (SEQ ID NO: 41), но не ограничиваются ими. Дополнительные линкеры могут включать последовательности, содержащие одну или более из следующих последовательностей мотивов: GGGS, GGGGS, TVLRT, TVSSAS и TVLSSAS.
Конкретные варианты реализации гибридных конструктов специфичная связывающая молекула - антитело против CD3 согласно настоящему изобретению включают пары альфа- и бета-цепей, где альфа-цепь состоит из вариабельного домена TCR, содержащего аминокислотную последовательность SEQ ID NO: 4-6, и/или бета-цепь состоит из вариабельного домена TCR, содержащего аминокислотную последовательность SEQ ID NO: 7-11. Указанные альфа- и бета-цепи могут дополнительно содержать константную область, содержащую ненативную дисульфидную связь. Константный домен альфа-цепи может быть укорочен на восемь аминокислот. N- или C-конец альфа- и/или бета-цепи можно объединить с фрагментом scFv-антитела против CD3 через линкер, выбранный из SEQ ID NO: 33-41. Некоторые предпочтительные варианты реализации таких гибридных конструктов специфичная связывающая молекула - антитело против CD3 представлены на фигуре 4 ниже:
Рамки настоящего изобретения также включают функциональные варианты указанных гибридных конструктов TCR - антитело против CD3. Указанные функциональные варианты предпочтительно характеризуются по меньшей мере 90% идентичностью, например, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичностью по отношению к эталонной последовательностью, но, тем не менее, являются функционально эквивалентными.
В дополнительном аспекте настоящего изобретения предложена нуклеиновая кислота, кодирующая специфичную связывающую молекулу или гибрид специфичная связывающая молекула - антитело против CD3 согласно настоящему изобретению. В некоторых вариантах реализации указанная нуклеиновая кислота представляет собой кДНК. В некоторых вариантах реализации нуклеиновой кислотой может быть мРНК. В некоторых вариантах реализации настоящего изобретения предложена нуклеиновая кислота, содержащая последовательность, кодирующую вариабельный домен α-цепи TCR согласно настоящему изобретению. В некоторых вариантах реализации настоящего изобретения предложена нуклеиновая кислота, содержащая последовательность, кодирующую вариабельный домен β-цепи специфичной связывающей молекулы согласно настоящему изобретению. Нуклеиновая кислота может иметь неприродное происхождение и/или быть очищенной и/или сконструированной. Последовательность указанной нуклеиновой кислоты можно подвергнуть оптимизации кодонов в соответствии с применяемой системой экспрессии. Как известно специалистам в данной области техники, системы экспрессии могут включать бактериальные клетки, например, E. coli, или дрожжевые клетки, или клетки млекопитающих, или клетки насекомых, или могут представлять собой бесклеточные системы экспрессии.
В еще одном аспекте настоящего изобретения предложен вектор, содержащий нуклеиновую кислоту согласно настоящему изобретению. Указанный вектор предпочтительно является вектором экспрессии TCR. Подходящие векторы экспрессии TCR включают, например, гамма-ретровирусные векторы или, более предпочтительно, лентивирусные векторы. Дополнительную информацию можно найти в статье Zhang 2012 и ссылках, приведенных в ней (Zhang et al,. Adv Drug Deliv Rev. 2012 Jun 1; 64(8): 756-762).
В настоящем изобретении также предложена клетка, содержащая вектор согласно настоящему изобретению, предпочтительно вектор экспрессии TCR. К подходящим клеткам относятся клетки млекопитающих, предпочтительно иммунные клетки, еще более предпочтительно Т-клетки. Вектор может содержать нуклеиновую кислоту согласно настоящему изобретению, кодирующую одну открытую рамку считывания, или две отдельные открытые рамки считывания, кодирующие альфа-цепь и бета-цепь, соответственно. В еще одном аспекте предложена клетка, содержащая первый экспрессирующий вектор, содержащий нуклеиновую кислоту, кодирующую альфа-цепь специфичной связывающей молекулы согласно настоящему изобретению, и второй экспрессирующий вектор, содержащий нуклеиновую кислоту, кодирующую бета-цепь специфичной связывающей молекулы согласно настоящему изобретению. Такие клетки особенно пригодны для применения при адоптивной терапии. Клетки согласно настоящему изобретению могут быть выделенными и/или рекомбинантными и/или не встречаться в природе и/или быть сконструированными.
Поскольку специфичные связывающие молекулы согласно настоящему изобретению можно применять при адоптивной терапии, настоящее изобретение включает не встречающуюся в природе и/или очищенную и/или сконструированную клетку, особенно Т-клетку, представляющую собой специфичную связывающую молекулу согласно настоящему изобретению. Кроме того, в настоящем изобретении предложена расширенная популяция Т-клеток, презентирующих специфичную связывающую молекулу согласно настоящему изобретению. Существует ряд способов, подходящих для трансфекции Т-клеток нуклеиновой кислотой (например, ДНК, кДНК или РНК), кодирующей специфичные связывающие молекулы согласно настоящему изобретению (см., например, Robbins et al., (2008) J Immunol. 180: 6116-6131). Т-клетки, экспрессирующие специфичные связывающие молекулы согласно настоящему изобретению, пригодны для применения при лечении рака или хронической вирусной инфекции на основе адоптивной терапии. Как известно специалистам в данной области техники, существует ряд подходящих способов, с помощью которых возможно выполнение адоптивной терапии (см., например, Rosenberg et al., (2008) Nat Rev Cancer 8(4): 299-308).
Как хорошо известно в данной области техники, белки (в том числе TCR) могут подвергаться посттрансляционным модификациям. Одной из таких модификаций является гликозилирование, которое включает ковалентное присоединение олигосахаридных фрагментов к определенным аминокислотам в полипептиде или цепи TCR. Например, остатки аспарагина или остатки серина/треонина являются хорошо известными сайтами присоединения олигосахаридов. Статус гликозилирования конкретного белка зависит от ряда факторов, включая последовательность белка, конформацию белка и доступность определенных ферментов. Кроме того, статус гликозилирования (т.е. тип олигосахарида, ковалентная связь и общее количество присоединений) может влиять на функцию белка. Поэтому при получении рекомбинантных белков часто желательно контролировать гликозилирование. Контролируемое гликозилирование применялось для улучшения терапевтических средств на основе антител. (Jefferis et al., (2009) Nat Rev Drug Discov Mar;8(3):226-34.). Гликозилирование растворимых TCR согласно настоящему изобретению можно контролировать, например, с помощью применения конкретных линий клеточных (включая линии клеток млекопитающих, например, клетки яичника китайского хомяка (CHO) или эмбриональные клетки почки человека (HEK), но не ограничиваясь ими), или путем химической модификации. Такие модификации могут быть предпочтительными, поскольку гликозилирование может улучшать фармакокинетику, снижать иммуногенность и более точно имитировать природный белок человека (Sinclair and Elliott, (2005) Pharm Sci.Aug; 94(8):1626-35).
Для введения пациентам специфичные связывающие молекулы согласно настоящему изобретению (предпочтительно ассоциированные с детектируемой меткой или терапевтическим агентом или экспрессируемые на трансфицированной Т-клетке), гибриды специфичная связывающая молекула - антитело против CD3, нуклеиновые кислоты, экспрессирующие векторы или клетки согласно настоящему изобретению можно представить в составе стерильной фармацевтической композиции вместе с одним или более фармацевтически приемлемыми носителями или вспомогательными веществами. Эта фармацевтическая композиция может быть находиться в любой подходящей форме (в зависимости от желательного способа введения пациенту). Она может быть предоставлена в единичной лекарственной форме, как правило, предоставляется в герметичном контейнере и может быть предоставлена как часть набора. Такой набор обычно (хотя и не обязательно) включает инструкции по применению. Он может включать множество указанных стандартных лекарственных форм.
Фармацевтическую композицию можно адаптировать для введения любым подходящим путем, например, парентеральным (включая подкожный, внутримышечный, интратекальный или внутривенный), энтеральным (включая пероральный или ректальный), ингаляционным или интраназальным путем. Такие композиции можно получить любым способом, известным в области фармацевтики, например, путем смешивания действующего вещества с носителем(ями) или вспомогательным(и) веществом(ами) в стерильных условиях.
Дозировки веществ согласно настоящему изобретению могут варьировать в широких пределах в зависимости от заболевания или расстройства, подлежащего лечению, возраста и состояния индивида, подлежащего лечению, и т.д. подходящий диапазон доз для гибридных молекул специфичная связывающая молекула - антитело против CD3 может составлять от 25 нг/кг до 50 мкг/кг или от 1 мкг до 1 г. В конечном счете подходящие дозировки для применения определяет врач.
Специфичные связывающие молекулы, гибридные молекулы специфичная связывающая молекула - антитело против CD3, фармацевтические композиции, векторы, нуклеиновые кислоты и клетки согласно настоящему изобретению можно представить по существу в чистой форме, например, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% чистой форме.
Кроме того, в настоящем изобретении предложены:
• Специфичная связывающая молекула, гибридная молекула специфичная связывающая молекула - антитело против CD3, нуклеиновая кислота, фармацевтическая композиция или клетка согласно настоящему изобретению для применения в медицине, предпочтительно для применения в способе лечения хронического ВГВ или гепатоцеллюлярной карциномы (ГКЦ) в результате хронической инфекции ВГВ;
• применение специфичной связывающей молекулы, гибридной молекулы специфичная связывающая молекула - антитело против CD3, нуклеиновой кислоты, фармацевтической композиции или клетки согласно настоящему изобретению при получении медикамента для лечения хронического ВГВ или гепатоцеллюлярной карциномы (ГКЦ) в результате хронической инфекции ВГВ;
• способ лечения рака или опухоли у пациента, включающий введение пациенту специфичной связывающей молекулы, гибридной молекулы специфичная связывающая молекула - антитело против CD3, нуклеиновой кислоты, фармацевтической композиции или клетки согласно настоящему изобретению;
• состав для инъекций для введения субъекту-человеку, содержащий специфичную связывающую молекулу, гибридную молекулу специфичная связывающая молекула - антитело против CD3, нуклеиновую кислоту, фармацевтическую композицию или клетку согласно настоящему изобретению.
Специфичную связывающую молекулу, гибридную молекулу специфичная связывающая молекула - антитело против CD3, нуклеиновую кислоту, фармацевтическую композицию или клетку согласно настоящему изобретению можно вводить путем инъекции, например, внутривенной, подкожной или прямой внутриопухолевой инъекции. У субъекта-человека может быть подтип HLA-A*02. Если предполагается лечение опухоли, опухоль может быть солидной или гематологической опухолью.
Способ лечения может дополнительно включать введение одного или более дополнительных противовирусных и/или противоопухолевых агентов по отдельности, в комбинации или последовательно.
Предпочтительными признаками каждого аспекта изобретения являются те же признаки, что и для всех других аспектов, с соответствующими изменениями. Упомянутые в настоящем документе документы предшествующего уровня техники включены в него посредством ссылки в максимальной возможной степени, разрешенной законом.
Описание чертежей
На фигуре 1 представлена аминокислотная последовательность внеклеточных областей растворимого варианта остова альфа- и бета-цепей TCR.
На фигуре 2 представлены примеры аминокислотных последовательностей мутированных вариабельных областей альфа-цепи TCR.
На фигуре 3 показан пример последовательности аминокислот мутированных вариабельных областей бета-цепи TCR.
На фигуре 4 представлены аминокислотные последовательности гибридов TCR-антитело против CD3, содержащие определенные мутированные вариабельные домены TCR, представленные на фигурах 2 и 3.
На фигуре 5 представлены сравнительные данные связывания растворимого TCR дикого типа с аланин-замещенными пептидами.
На фигуре 6 представлены клеточные данные, демонстрирующие эффективность и специфичность гибридных молекул TCR-антитело против CD3, содержащих мутированные вариабельные домены TCR, представленные на фигурах 2 и 3.
На фигуре 7 представлены клеточные данные, демонстрирующие уничтожение антиген-положительных клеток гибридными молекулами TCR-антитело против CD3, содержащими мутированные вариабельные домены TCR, представленные на фигурах 2 и 3.
На фигуре 8 представлены клеточные данные, дополнительно демонстрирующие специфичность гибридных молекул TCR-антитело против CD3, содержащих мутированные вариабельные домены TCR, представленные на фигурах 2 и 3.
На фигуре 9 представлены клеточные данные, демонстрирующие, что гибридные молекулы TCR-антитело против CD3, содержащие мутированные вариабельные домены TCR, представленные на фигурах 2 и 3, опосредуют снижение процента инфицированных клеток.
Настоящее изобретение дополнительно описано в следующих неограничивающих примерах.
Примеры
Пример 1 - Экспрессия, рефолдинг и очистка TCR дикого типа в растворимом формате
Способ
Последовательности ДНК, кодирующие внеклеточные области альфа- и бета-цепей растворимого TCR (соответствующие аминокислотным последовательностям на фигуре 1), клонировали отдельно в экспрессирующие плазмиды на основе pGMT7 с использованием стандартных способов (описанных в Sambrook, et al. Molecular cloning. Vol. 2. (1989) New York: Cold Spring harbour laboratory press). Экспрессирующие плазмиды трансформировали отдельно в штамм E. coli Rosetta (BL21pLysS). Для экспрессии клетки выращивали в среде для автоматической индукции с добавлением 1% глицерина (+ 100 мкг/мл ампициллина и 34 мкг/мл хлорамфеникола) при 230 об/мин и 37C в течение 2 часов, после чего температуру снижали до 30C в течение ночи. Затем клетки собирали центрифугированием. Клеточный осадок лизировали с помощью реагента для экстракции белков BugBuster (Merck Millipore) в соответствии с инструкциями производителя. Гранулы телец включений извлекали центрифугированием. Гранулы дважды промывали в буфере с тритоном (50 мМ трис-HCI рН 8,1, 0,5% тритон-X100, 100 мМ NaCl, 10 мМ Na-ЭДТА) и, наконец, ресуспендировали в буфере без детергента (50 мМ трис-HCl рН 8,1, 100 мМ NaCl, 10 мМ Na-ЭДТА). Выход белка тел включения количественно определяли путем солюбилизации с 6 M гуанидин-HCl и измерения ОП280. Затем рассчитывали концентрацию белка с использованием коэффициента экстинкции. Чистоту тел включения измеряли путем солюбилизации с 8 М мочевины и загрузки ~2 мкг для электрофореза в 4-20% ДСН-ПААГ в восстанавливающих условиях. Затем выполняли оценку или расчет чистоты с использованием программного обеспечения для денситометрии (Chemidoc, Biorad). Тела включения хранили при температуре +4 °C для кратковременного хранения и при температуре -20 °C или -70 °C для длительного хранения.
Для рефолдинга растворимого TCR тела включения, содержащие α- и β-цепь, сначала смешивали и разбавляли буфером для солюбилизации/денатурации (6 М гидрохлорид гуанидина, 50 мМ трис-HCl рН 8,1, 100 мМ NaCl, 10 мМ ЭДТА, 20 мМ ДТТ) с последующим инкубированием в течение 30 мин при 37 °С. Затем инициировали рефолдинг путем дальнейшего разбавления в буфере для рефолдинга (100 мМ трис рН 8,1, 800 или 400 мМ L-аргинина HCL, 2 мМ ЭДТА, 4 М мочевины, 6,5 мМ гидрохлорида цистеамина и 1,9 мМ дигидрохлорида цистамина) и хорошо перемешивали раствор. Смесь после рефолдинга диализировали против 10 л H2O на 1 л продуктов рефолдинга в течение 18-20 часов при 5 °C ± 3 °C. По истечении этого времени диализный буфер дважды заменяли на 10 мМ трис pH 8,1 (10 л) и продолжали диализ еще в течение 15 часов. Затем смесь для рефолдинга фильтровали через 0,45-мкм целлюлозные фильтры.
Очистку растворимых TCR инициировали путем нанесения диализированного продукта рефолдинга на анионообменную колонку POROS® 50HQ и элюирования связанного белка с градиентом 0-500 мМ NaCl в 20 мМ трис рН 8,1 в 6 объемах колонки с применением Akta® Pure (GE Healthcare). Пиковые фракции TCR идентифицировали с помощью электрофореза в ДСН-ПААГ, а затем объединяли и концентрировали. Затем концентрированный образец наносили на колонку для гель-фильтрации Superdex® 200 Increase 10/300 GL (GE Healthcare), предварительно уравновешенную в PBS-буфере по Дульбекко. Пиковые фракции TCR объединяли и концентрировали, и рассчитывали конечный выход очищенного материала.
Пример 2 - экспрессия, рефолдинг и очистка гибридных молекул растворимый TCR-антитело против CD3
Способ
Получение гибридных молекул растворимый TCR-антитело против CD3 выполняли, как описано в примере 1, за исключением того, что бета-цепь TCR объединяли через линкер с одноцепочечным антителом против CD3. Кроме того, концентрация окислительно-восстановительных реагентов на стадии рефолдинга составляла 1 мМ дигидрохлорида цистамина, 10 мМ гидрохлорида цистеамина). Наконец, после анионообменной стадии добавляли катионообменную стадию. В этом случае пиковые фракции, полученные с анионообменной колонки, разбавляли в 20 раз 40 мМ MES и наносили на катионообменную колонку POROS® 50HS. Связанный белок элюировали градиентом 0-500 мМ NaCl в 40 мМ MES. Пиковые фракции объединяли и доводили до 200 мМ трис рН 8,1, затем концентрировали и наносили непосредственно на матрицу для гель-фильтрации, как описано в примере 1.
Пример 3 - исследование характеристик связывания
Анализ связывания очищенных растворимых TCR и гибридных молекул с комплексом пептид-HLA выполняли с помощью поверхностного плазмонного резонанса с использованием приборов BIAcore 8K, BIAcore 3000 или BIAcore T200. Биотинилированные молекулы HLA-A*02 I класса подвергали рефолдингу с пептидом, представляющим интерес, и очищали с использованием способов, известных специалистам в данной области техники (O'Callaghan et al. (1999). Anal Biochem 266(1): 9-15; Garboczi, et al. (1992). Proc Natl Acad Sci USA 89(8): 3429-3433). Все измерения выполняли при 25 °С в буфере PBS по Дульбекко с добавлением 0,005% P20.
Способ BIAcore
Биотинилированные мономеры пептид-HLA иммобилизовали на сенсорных чипах CM-5 со связанным стрептавидином или Biotin CAPture. Равновесные константы связывания определяли с использованием последовательных разведений растворимого TCR или гибридных молекул, вводимых при постоянной скорости потока 10-30 μл/мин через проточную ячейку с иммобилизованным комплексом пептид-HLA-A*02 в количестве ~500 единиц ответа (ЕО). Равновесные ответы нормировали для каждой концентрации TCR путем вычитания ответа буфера-наполнителя в контрольной проточной ячейке, не содержащей пептида-HLA. Значение KD получали путем нелинейной аппроксимации с использованием программного обеспечения Prism и изотермы связывания Ленгмюра, связывание = C*Max/(C + KD), где «связывание» представляет собой равновесное связывание, выраженное в ЕО, при введенной концентрации TCR C, а Max представляет собой максимальное связывание.
Для взаимодействий с высокой аффинностью параметры связывания определяли с помощью одноциклового кинетического анализа. Пять различных концентраций растворимого TCR или гибридного белка вводили через проточную ячейку с иммобилизованным комплексом пептид-HLA в количестве ~50 - 200 ЕО при скорости потока 50-60 мкл/мин. Как правило, 60-200 мкл растворимого TCR или гибридной молекулы вводили в максимальной концентрации от 2 до 100 нМ с последующими 2-кратными разведениями для четырех других инъекций. Минимальную концентрацию вводили первой. Для измерения фазы диссоциации вводили буфер до осуществления ≥ 10% диссоциации, что, как правило, происходило через 1-3 часа. Кинетические параметры рассчитывали с использованием программного обеспечения производителя. Фазу диссоциации аппроксимировали уравнением однократного экспоненциального снижения, позволяющим рассчитать период полураспада. Равновесную константу KD рассчитывали из koff/kon.
Пример 4 - исследование характеристик связывания растворимого TCR дикого типа
Растворимый TCR дикого типа, содержащий аминокислотные последовательности, показанные на фигуре 1, получали в соответствии со способами, описанными в примере 1. Выход очищенного белка составлял 9,1 мг/л. Параметры связывания рассчитывали на основе равновесных констант связывания в соответствии с примером 3.Получали комплексы pHLA, содержащие либо родственный пептид, известный вариант вирусного пептида, либо неспецифичные пептиды.
Результаты
Растворимый TCR дикого типа связывался с комплексом родственный пептид GLSPTVWLSV-HLA-A*02 с KD 1,44 мкМ +/- 0,076 мкМ (Bmax = 303; R2 = 0,997). Тот же TCR связывался с вариантом пептида GLSPTVWLSA-HLA-A*02 с KD 1,23 мкМ +/- 0,07 мкМ (Bmax = 152; R2 = 0,996). Эти данные указывают на то, что растворимый TCR дикого типа можно применять для адресного воздействия как на природный, так и на вариантный пептид.
Специфичность растворимого TCR дикого типа оценивали по сравнению с панелью из 24 природных комплексов неспецифичный пептид-HLA-A*02. Неспецифичные pHLA разделили на три группы и загружали в одну из трех проточных ячеек. Растворимый TCR дикого типа вводили в концентрациях 68,3 и 6,8 мкМ во все проточные ячейки. Ни в одной из концентраций не обнаружено значимого связывания, указывающего на то, что растворимый TCR дикого типа является специфичным по отношению к комплексу HLA-A*02.
Дополнительную оценку специфичности выполнили с использованием панели пептидов, в которой каждый остаток пептида GLSPTVWLSV последовательно заменяли на аланин. Определяли относительное связывание с каждым из аланин-замещенных пептидов, полученные данные представлены на фигуре 5. Замены на аланин в центральной части пептида приводили к потере связывания TCR. Низкая устойчивость к заменам в центральной части пептида указывает на то, что TCR обладал высокой специфичностью и, следовательно, характеризовался низким риском перекрестной реакционной способности с альтернативными пептидами.
Пример 5 - исследование характеристик связывания мутировавших растворимых TCR, объединенных с антителом против CD3
Мутированные аминокислотные последовательности вариабельного домена альфа- и бета-цепей TCR, представленные на фигурах 2 и 3, соответственно (SEQ ID NO: 4-11), использовали для получения гибридных молекул TCR-антитело против CD3. Получение выполняли в соответствии с примером 2.На фигуре 4 представлены полные аминокислотные последовательности четырех из этих гибридных молекул TCR-антитело против CD3, указанных ниже. Выход каждой из этих четырех гибридных молекул показан в скобках
• a19b03 (6,02 мг/л)
• a13b03 (4,13 мг/л)
• a01b03 (3,78) мг/л)
• a13b09 (3,46 мг/л)
Связывание с комплексом пептид-HLA-A*02 определяли в соответствии с примером 3.
Результаты
Данные, представленные ниже в таблице, демонстрируют, что гибридные молекулы, содержащие указанные последовательности вариабельных доменов TCR, распознавали комплекс GLSPTVWLSV-HLA-A*02 с повышенной физиологической аффинностью связывания и периодом полураспада.
Пример 6 - исследование характеристик активности и специфичности мутировавших растворимых TCR, объединенных с антителом против CD3
Активация Т-клеток
Гибридные молекулы, содержащие последовательности вариабельного домена TCR, показанные на фигурах 2 и 3, оценивали на предмет способности опосредовать мощную и специфичную активацию CD3+ Т-клеток против клеток, представляющих комплекс GLSPTVWLSV-HLA-A*02. Высвобождение интерферона-γ (ИФН-γ) использовали в качестве сигнала об активации Т-клеток.
Способ
Анализы проводили с применением набора для анализа на ИФН-γ человека ELISPOT (BD Biosciences) в соответствии с инструкциями производителя. Вкратце, клетки-мишени получали с плотностью 1x106/мл в среде для анализа (RPMI 1640, содержащей 10% инактивированной нагреванием FBS и 1% пенициллин-стрептомицин-L-глутамин) и высевали по 50000 клеток на лунку в объеме 50 мкл. Мононуклеарные клетки периферической крови (МПК), выделенные из свежей донорской крови, использовали в качестве эффекторных клеток и высевали в количестве 50000 клеток на лунку в объеме 50 мкл (точное количество клеток, используемых для каждого эксперимента, зависело от донора и могло корректироваться для получения ответа в подходящем диапазоне для анализа). Гибридные молекулы титровали с получением конечных концентраций 10 нМ, 1 нМ, 0,1 нМ, 0,01 нМ, 0,001 нМ и 0,0001 нМ (охватывающих предполагаемый клинически значимый диапазон) и добавляли в лунку в объеме 50 мкл.
Планшеты подготавливали в соответствии с инструкциями производителя. Клетки-мишени, эффекторные клетки и гибридные молекулы добавляли в соответствующие лунки и доводили до конечного объема 200 мкл средой для анализа. Все реакции выполняли в трех повторностях. Кроме того, получали контрольные лунки без гибридных молекул. Затем планшеты инкубировали в течение ночи (37°C/5% CO2). На следующий день планшеты трижды промывали буфером для промывки (пакет с 1 x PBS, содержащим 0,05% твин-20, разведенный в деионизированной воде). Затем в каждую лунку добавляли первичное антитело для детекции в объеме 50 мкл. Планшеты инкубировали при комнатной температуре в течение 2 часов перед повторным трехкратным промыванием. Вторичную детекцию проводили путем добавления 50 мкл разбавленного конъюгата стрептавидин-HRP в каждую лунку и инкубирования при комнатной температуре в течение 1 часа, после чего повторяли этап промывания. Не более чем за 15 минут до использования добавляли одну каплю (20 мкл) хромогена AEC на каждый 1 мл субстрата AEC, перемешивали и добавляли по 50 мкл в каждую лунку. Регулярно отслеживали проявление пятен и промывали планшеты водопроводной водой для прекращения реакции проявления. Затем планшеты оставляли для просушивания при комнатной температуре по меньшей мере на 2 часа перед подсчетом пятен с использованием анализатора CTL с программным обеспечением Immunospot (Cellular Technology Limited).
В этом примере в качестве клеток-мишеней использовали следующие линии клеток:
• PLC/PRF/5 (антиген-положительные)
PLC/PRF/5 представляет собой линию клеток гепатоцеллюлярной карциномы человека со встроенным геномом ВГВ. Эти клетки естественным образом презентируют пептид GLSPTVWLSV (согласно определению с помощью масс-спектрометрии).
• HepG2 (антиген-отрицательные)
HepG2 представляет собой линию клеток человека, полученную из гепатоцеллюлярной карциномы печени
Клетки обеих линий трансдуцировали генами, кодирующими комплекс HLA-A*02 β2M
Результаты
Каждая из протестированных гибридных молекул демонстрировала мощную активацию Т-клеток в присутствии антиген-положительных клеток. Значения Ec50 рассчитывали на основании данных, они приведены ниже в таблице. Гибридные молекулы не демонстрировали распознавания антиген-отрицательных HLA-A*02-положительных клеток. На фигуре 6 показаны типичные данные для четырех гибридных молекул, перечисленных ниже в таблице (обратите внимание, что показанное значение получено с использованием различных эффекторных доноров (т.е. не одного донора, который являлся бы общим для всех).
Эти данные демонстрируют, что гибридные молекулы, содержащие мутированные последовательности вариабельных доменов TCR согласно настоящему изобретению, могут опосредовать мощную (Ec50 в диапазоне низких пМ значений) и специфичную активацию Т-клеток против антиген-положительных клеток.
Уничтожение клеток-мишеней
Способность гибридных молекул, содержащих мутированные последовательности TCR, опосредовать эффективное опосредованное Т-клетками уничтожение антиген-положительных опухолевых клеток исследовали с использованием платформы IncuCyte (Essen BioScience). Этот анализ позволял обнаруживать высвобождение каспазы 3/7, маркера апоптоза, с помощью микроскопии в режиме реального времени.
Способ
Анализы выполняли с использованием набора для анализа апоптоза с каспазой 3/7 CellPlayer в 96-луночном формате (Essen BioScience, № в каталоге 4440) в соответствии с протоколом производителя. Вкратце, клетки PLC/PRF/5 окрашивали CellTracker DeepRed перед высеванием для обеспечения возможности 2-цветного анализа, а затем высевали в количестве 10000 клеток на лунку и инкубировали в течение ночи для адгезии клеток. Гибридные молекулы получали в различных концентрациях и добавляли по 25 мкл каждой концентрации в соответствующую лунку таким образом, чтобы конечные концентрации составляли от 100 фМ до 10 нМ. Эффекторные клетки использовали при соотношении эффекторных клеток и клеток-мишеней 10:1 (100000 клеток на лунку). Кроме того, вместе с образцами, содержащими либо только эффекторные клетки, либо только клетки-мишени, получали контрольный образец, не содержащий гибридов. Реагент для анализа NucView получали в концентрации 30 мкМ, добавляли в объеме 25 мкл в каждую лунку, и доводили конечный объем до 150 мкл (с получением конечной концентрации 1,25 мкМ). Планшет помещали в прибор IncuCyte и получали изображения каждые 3 часа (1 изображение на лунку) в течение 5 дней. Количество апоптозных клеток на каждом изображении определяли и записывали как количество апоптозных клеток на мм2. Анализы выполняли в трех повторностях.
Результаты
Данные, представленные на фигуре 7, демонстрируют уничтожение антиген-положительных клеток в реальном времени в присутствии гибридных молекул, содержащих мутированные последовательности вариабельной цепи TCR, указанные на каждом графике (для ясности показаны только три концентрации). В каждом случае уничтожение клеток-мишеней наблюдали при концентрациях 100 пМ или ниже. В отсутствие гибридных молекул уничтожения не наблюдали.
Скрининг безопасности в отношении нормальной ткани с высоким риском
Для дополнительной демонстрации специфичности гибридных молекул, содержащих мутированные последовательности TCR, выполнили дополнительное тестирование с использованием методики ELISPOT, описанной выше, и панели нормальных клеток, полученных из здоровых тканей человека, в качестве мишеней.
В первом эксперименте гибриды TCR- антитело против CD3, содержащие мутированные вариабельные домены TCR a19b03, тестировали при трех различных концентрациях (2 нм, 1 нМ и 0,1 нМ). Две партии клеток из каждой нормальной ткани использовали в качестве мишеней, а эффекторные Т-клетки получали от 3 различных доноров. Контрольные измерения выполняли с использованием образца, не содержащего гибридных молекул, и образца, в котором нормальные клетки заменяли на PLC/PRF/5 (антиген-положительные) клетки при единственной концентрации гибридной молекулы (1 нМ).
Во втором эксперименте использовали четыре различных гибрида TCR-антитело против CD3, содержащие следующие мутированные цепи (a01b03, a01b02, a01b04, a01b05). Использовали те же три концентрации гибридной молекулы (2 нм, 1 нМ и 0,1 нМ). В качестве мишеней использовали одну партию клеток из каждой нормальной ткани, а эффекторные Т-клетки получали от одного донора. Контрольные измерения выполняли с использованием образца, не содержащего гибридных молекул, и образца, в котором нормальные клетки обрабатывали 10 мкМ пептида (антиген-положительные клетки) и гибридной молекулой в единственной концентрации 0,1 нМ.
Результаты
В обоих экспериментах наблюдали активацию Т-клеток против нормальных клеток на уровне, аналогичном фону (т.е. образцу, не содержащему гибридных молекул).
На фигуре 8а показаны данные первого эксперимента для одной партии нормальных клеток из двух разных тканей и для трех различных доноров (меченый донор 1-3). На фигуре 8b показаны данные второго эксперимента для двух различных тканей. Пунктирной линией на каждом графике показан уровень фона.
Эти данные показывают, что гибридные молекулы, содержащие вариабельные домены TCR, показанные на фигурах 2 и 3, не демонстрировали существенной перекрестной реакционной способности против панели клеток, полученных из нормальных тканей.
Описанные гибриды TCR-антитело против CD3 обладали свойствами, которые делали их особенно подходящими для терапевтического применения.
Пример 7 - мощная активация Т-клеток против клеток, инфицированных ВГВ, с помощью растворимых TCR, объединенных с антителом против CD3
Для демонстрации способности гибридов TCR-антитело против CD3 согласно настоящему изобретению перенаправлять активность Т-клеток на клетки, инфицированные ВГВ, создали модель инфекции ВГВ.
Вкратце, положительную линию клеток HLA-A*02:01 гепатоцеллюлярной карциномы (ГЦК) HepG2 трансфицировали рецептором NTCP. Затем клетки инфицировали 200 MOI ВГВ генотипа D (1x108 геномных копий партии 03072018, ImQuest BioSciences). Затем инфицированные клетки совместно культивировали с общими Т-клетками, полученными из донорской крови, в присутствии или в отсутствие гибрида TCR-антитело против CD3. Процент оставшихся инфицированных клеток количественно определяли с использованием PrimeFlow (Invitrogen) для обнаружения РНК поверхностного антигена гепатита B (HBsAg).
В этом примере применяли гибриды TCR-антитело против CD3, содержащие a19b03 и a01b03. Кроме того, в качестве отрицательного контроля использовали гибрид TCR-антитело против CD3, специфичный по отношению к альтернативному пептиду, не имеющему отношения к ВГВ.
Способ
На 7 день инфекции супернатант удаляли из лунок, содержащих инфицированные клетки HepG2-NTCP, а затем для совместного культивирования вносили общие Т-клетки с гибридом TCR-антитело против CD3 или без него. Эффекторные Т-клетки добавляли в соотношении 10:1 в соответствии с исходным количеством HepG2-NTCP, посеянного для инфекции, а гибрид TCR-антитело против CD3 добавляли в конечной концентрации 1 нМ либо 0,1 нМ. Клетки культивировали в течение 5 дней. В конце совместного культивирования инфицированные клетки удаляли из культуральных планшетов с помощью трипсина и окрашивали поверхность на предмет CD45, а также фиксируемым красителем для определения жизнеспособности (eFluor 780). После этого клетки фиксировали и пермеабилизировали для окрашивания РНК поверхностного антигена гепатита B (HBsAg) с использованием набора зондов PrimeFlow VF1-6000704. Окрашивание гена домашнего хозяйства RPL13A использовали в качестве положительного контроля процедуры окрашивания (набор зондов VA4-13187). Окрашенные клетки регистрировали на проточном цитометре MACSQuant X и анализировали с помощью FlowJov10 с целью количественного определения процента клеток, экспрессирующих HBsAg.
Результаты
На фигуре 9 показано, что гибриды TCR-антитело против CD3 a19b03 и a01b03 приводили к приблизительно 60% снижению процента инфицированных клеток при концентрации гибрида 1 нМ. Эффект является титруемым, причем изменение концентрации на 0,1 нМ приводит к его 34% снижению.
Эти данные показывают, что гибридные молекулы, содержащие вариабельные домены TCR, показанные на фигурах 2 и 3, могли эффективно удалять инфицированные клетки.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Immunocore Limited
<120> Специфичные связывающие молекулы
<130> P123152WO
<160> 41
<170> PatentIn версия 3.5
<210> 1
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Gly Leu Ser Pro Thr Val Trp Leu Ser Val
1 5 10
<210> 2
<211> 197
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность остова внеклеточной области
альфа-цепи
<400> 2
Ala Lys Glu Val Glu Gln Asn Ser Gly Pro Leu Ser Val Pro Glu Gly
1 5 10 15
Ala Ile Ala Ser Leu Asn Cys Thr Tyr Ser Asp Arg Gly Ser Gln Ser
20 25 30
Phe Phe Trp Tyr Arg Gln Tyr Ser Gly Lys Ser Pro Glu Leu Ile Met
35 40 45
Ser Ile Tyr Ser Asn Gly Asp Lys Glu Asp Gly Arg Phe Thr Ala Gln
50 55 60
Leu Asn Lys Ala Ser Gln Tyr Val Ser Leu Leu Ile Arg Asp Ser Gln
65 70 75 80
Pro Ser Asp Ser Ala Thr Tyr Leu Cys Ala Val Arg Asn Tyr Asn Thr
85 90 95
Asp Lys Leu Ile Phe Gly Thr Gly Thr Arg Leu Gln Val Phe Pro Asn
100 105 110
Ile Gln Asn Pro Asp Pro Ala Val Tyr Gln Leu Arg Asp Ser Lys Ser
115 120 125
Ser Asp Lys Ser Val Cys Leu Phe Thr Asp Phe Asp Ser Gln Thr Asn
130 135 140
Val Ser Gln Ser Lys Asp Ser Asp Val Tyr Ile Thr Asp Lys Cys Val
145 150 155 160
Leu Asp Met Arg Ser Met Asp Phe Lys Ser Asn Ser Ala Val Ala Trp
165 170 175
Ser Asn Lys Ser Asp Phe Ala Cys Ala Asn Ala Phe Asn Asn Ser Ile
180 185 190
Ile Pro Glu Asp Thr
195
<210> 3
<211> 244
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность остова внеклеточной области
бета-цепи
<400> 3
Asn Ala Gly Val Thr Gln Thr Pro Lys Phe Gln Val Leu Lys Thr Gly
1 5 10 15
Gln Ser Met Thr Leu Gln Cys Ala Gln Asp Met Asn His Glu Tyr Met
20 25 30
Ser Trp Tyr Arg Gln Asp Pro Gly Met Gly Leu Arg Leu Ile His Tyr
35 40 45
Ser Val Gly Ala Gly Ile Thr Asp Gln Gly Glu Val Pro Asn Gly Tyr
50 55 60
Asn Val Ser Arg Ser Thr Thr Glu Asp Phe Pro Leu Arg Leu Leu Ser
65 70 75 80
Ala Ala Pro Ser Gln Thr Ser Val Tyr Phe Cys Ala Ser Ser Tyr Ala
85 90 95
Thr Gly Gly Thr Gly Glu Leu Phe Phe Gly Glu Gly Ser Arg Leu Thr
100 105 110
Val Leu Glu Asp Leu Lys Asn Val Phe Pro Pro Glu Val Ala Val Phe
115 120 125
Glu Pro Ser Glu Ala Glu Ile Ser His Thr Gln Lys Ala Thr Leu Val
130 135 140
Cys Leu Ala Thr Gly Phe Tyr Pro Asp His Val Glu Leu Ser Trp Trp
145 150 155 160
Val Asn Gly Lys Glu Val His Ser Gly Val Cys Thr Asp Pro Gln Pro
165 170 175
Leu Lys Glu Gln Pro Ala Leu Asn Asp Ser Arg Tyr Ala Leu Ser Ser
180 185 190
Arg Leu Arg Val Ser Ala Thr Phe Trp Gln Asp Pro Arg Asn His Phe
195 200 205
Arg Cys Gln Val Gln Phe Tyr Gly Leu Ser Glu Asn Asp Glu Trp Thr
210 215 220
Gln Asp Arg Ala Lys Pro Val Thr Gln Ile Val Ser Ala Glu Ala Trp
225 230 235 240
Gly Arg Ala Asp
<210> 4
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная вариабельная область альфа-цепи (a01)
<400> 4
Ala Lys Glu Val Glu Gln Asn Ser Gly Pro Leu Ser Val Pro Glu Gly
1 5 10 15
Ala Ile Ala Ser Leu Asn Cys Thr Tyr Ser Asp Arg Gly Ser Gln Ser
20 25 30
Phe Phe Trp Tyr Arg Gln Tyr Ser Gly Lys Ser Pro Glu Leu Ile Met
35 40 45
Ser Ile Tyr Ser Asn Gly Asp Lys Glu Asp Gly Arg Phe Thr Ala Gln
50 55 60
Leu Asn Lys Ala Ser Gln Tyr Val Ser Leu Leu Ile Arg Asp Ser Gln
65 70 75 80
Pro Ser Asp Ser Ala Thr Tyr Leu Cys Ala Ala Arg Asn Tyr Lys Thr
85 90 95
Asp Leu Leu Ile Phe Gly Thr Gly Thr Arg Leu Gln Val Phe Pro
100 105 110
<210> 5
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная вариабельная область альфа-цепи (a13)
<400> 5
Ala Lys Glu Val Glu Gln Asn Ser Gly Pro Leu Ser Val Pro Glu Gly
1 5 10 15
Ala Ile Ala Ser Leu Asn Cys Thr Tyr Ser Asp Arg Gly Ser Gln Ser
20 25 30
Phe Phe Trp Tyr Arg Gln Tyr Ser Gly Lys Ser Pro Glu Leu Ile Met
35 40 45
Ser Ile Tyr Ser Asp Gly Asp Lys Glu Asp Gly Arg Phe Thr Ala Gln
50 55 60
Leu Asn Lys Ala Ser Gln Tyr Val Ser Leu Leu Ile Arg Asp Ser Gln
65 70 75 80
Pro Ser Asp Ser Ala Thr Tyr Leu Cys Ala Ala Arg Asn Tyr Lys Thr
85 90 95
Asp Leu Leu Ile Phe Gly Thr Gly Thr Arg Leu Gln Val Phe Pro
100 105 110
<210> 6
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная вариабельная область альфа-цепи (a19)
<400> 6
Ala Lys Glu Val Glu Gln Asn Ser Gly Pro Leu Ser Val Pro Glu Gly
1 5 10 15
Ala Ile Ala Ser Leu Asn Cys Thr Tyr Ser Asp Arg Gly Ser Gln Ser
20 25 30
Phe Phe Trp Tyr Arg Gln Tyr Ser Gly Lys Gly Pro Glu Leu Ile Met
35 40 45
Ser Ile Tyr Ser Asp Gly Asp Lys Glu Asp Gly Arg Phe Thr Ala Gln
50 55 60
Leu Asn Lys Ala Ser Gln Tyr Val Ser Leu Leu Ile Arg Asp Ser Gln
65 70 75 80
Pro Ser Asp Ser Ala Thr Tyr Leu Cys Ala Ala Arg Asn Tyr Lys Thr
85 90 95
Asp Leu Leu Ile Phe Gly Thr Gly Thr Arg Leu Gln Val Phe Pro
100 105 110
<210> 7
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная вариабельная область бета-цепи (b02)
<400> 7
Asn Ala Gly Val Thr Gln Thr Pro Lys Phe Gln Val Leu Lys Thr Gly
1 5 10 15
Gln Ser Met Thr Leu Gln Cys Ala Gln Asp Leu Asn His Gly Tyr Met
20 25 30
Ser Trp Tyr Arg Gln Asp Pro Gly Met Gly Leu Arg Leu Ile His Tyr
35 40 45
Ser Val Gly Ala Gly Ile Thr Asp Gln Gly Glu Val Pro Asn Gly Tyr
50 55 60
Asn Val Ser Arg Ser Thr Thr Glu Asp Phe Pro Leu Arg Leu Leu Ser
65 70 75 80
Ala Ala Pro Ser Gln Thr Ser Val Tyr Phe Cys Ala Ser Ser Tyr Ala
85 90 95
Thr Gly Gly Thr Gly Val Leu Phe Phe Gly Glu Gly Ser Arg Leu Thr
100 105 110
Val Leu
<210> 8
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная вариабельная область бета-цепи (b03)
<400> 8
Asn Ala Gly Val Thr Gln Thr Pro Lys Phe Gln Val Leu Lys Thr Gly
1 5 10 15
Gln Ser Met Thr Leu Gln Cys Ala Gln Asp Met Ser His Gly Tyr Met
20 25 30
Ser Trp Tyr Arg Gln Asp Pro Gly Met Gly Leu Arg Leu Ile His Tyr
35 40 45
Ser Val Gly Ala Gly Ile Thr Asp Gln Gly Glu Val Pro Asn Gly Tyr
50 55 60
Asn Val Ser Arg Ser Thr Thr Glu Asp Phe Pro Leu Arg Leu Leu Ser
65 70 75 80
Ala Ala Pro Ser Gln Thr Ser Val Tyr Phe Cys Ala Ser Ser Tyr Ala
85 90 95
Thr Gly Gly Thr Gly Asp Leu Phe Phe Gly Glu Gly Ser Arg Leu Thr
100 105 110
Val Leu
<210> 9
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная вариабельная область бета-цепи (b04)
<400> 9
Asn Ala Gly Val Thr Gln Thr Pro Lys Phe Gln Val Leu Lys Thr Gly
1 5 10 15
Gln Ser Met Thr Leu Gln Cys Ala Gln Asp Met Asn His Glu Tyr Met
20 25 30
Ser Trp Tyr Arg Gln Asp Pro Gly Met Gly Leu Arg Leu Ile His Tyr
35 40 45
Ser Val Gly Ala Gly Ile Thr Asp Gln Gly Glu Val Pro Asn Gly Tyr
50 55 60
Asn Val Ser Arg Ser Thr Thr Glu Asp Phe Pro Leu Arg Leu Leu Ser
65 70 75 80
Ala Ala Pro Ser Gln Thr Ser Val Tyr Phe Cys Ala Ser Ser Tyr Ala
85 90 95
Thr Gly Gly Thr Gly Leu Leu Phe Phe Gly Glu Gly Ser Arg Leu Thr
100 105 110
Val Leu
<210> 10
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная вариабельная область бета-цепи (b05)
<400> 10
Asn Ala Gly Val Thr Gln Thr Pro Lys Phe Gln Val Leu Lys Thr Gly
1 5 10 15
Gln Ser Met Thr Leu Gln Cys Ala Gln Asp Met Asn His Glu Tyr Met
20 25 30
Ser Trp Tyr Arg Gln Asp Pro Gly Met Gly Leu Arg Leu Ile His Tyr
35 40 45
Ser Leu Gly Ala Gly Ile Thr Asp Gln Gly Glu Val Pro Asn Gly Tyr
50 55 60
Asn Val Ser Arg Ser Thr Thr Glu Asp Phe Pro Leu Arg Leu Leu Ser
65 70 75 80
Ala Ala Pro Ser Gln Thr Ser Val Tyr Phe Cys Ala Ser Ser Tyr Ala
85 90 95
Thr Gly Gly Thr Gly Asp Leu Phe Phe Gly Glu Gly Ser Arg Leu Thr
100 105 110
Val Leu
<210> 11
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутантная вариабельная область бета-цепи (b09)
<400> 11
Asn Ala Gly Val Thr Gln Thr Pro Lys Phe Gln Val Leu Lys Thr Gly
1 5 10 15
Gln Ser Met Thr Leu Gln Cys Ala Gln Asp Leu Ser His Gly Tyr Met
20 25 30
Ser Trp Tyr Arg Gln Asp Pro Gly Met Gly Leu Arg Leu Ile His Tyr
35 40 45
Ser Val Gly Ala Gly Ile Thr Asp Gln Gly Glu Val Pro Asn Gly Tyr
50 55 60
Asn Val Ser Arg Ser Thr Thr Glu Asp Phe Pro Leu Arg Leu Leu Ser
65 70 75 80
Ala Ala Pro Ser Gln Thr Ser Val Tyr Phe Cys Ala Ser Ser Tyr Ala
85 90 95
Thr Gly Gly Thr Gly Asp Leu Phe Phe Gly Glu Gly Ser Arg Leu Thr
100 105 110
Val Leu
<210> 12
<211> 197
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> альфа-цепь (a19)
<400> 12
Ala Lys Glu Val Glu Gln Asn Ser Gly Pro Leu Ser Val Pro Glu Gly
1 5 10 15
Ala Ile Ala Ser Leu Asn Cys Thr Tyr Ser Asp Arg Gly Ser Gln Ser
20 25 30
Phe Phe Trp Tyr Arg Gln Tyr Ser Gly Lys Gly Pro Glu Leu Ile Met
35 40 45
Ser Ile Tyr Ser Asp Gly Asp Lys Glu Asp Gly Arg Phe Thr Ala Gln
50 55 60
Leu Asn Lys Ala Ser Gln Tyr Val Ser Leu Leu Ile Arg Asp Ser Gln
65 70 75 80
Pro Ser Asp Ser Ala Thr Tyr Leu Cys Ala Ala Arg Asn Tyr Lys Thr
85 90 95
Asp Leu Leu Ile Phe Gly Thr Gly Thr Arg Leu Gln Val Phe Pro Asn
100 105 110
Ile Gln Asn Pro Asp Pro Ala Val Tyr Gln Leu Arg Asp Ser Lys Ser
115 120 125
Ser Asp Lys Ser Val Cys Leu Phe Thr Asp Phe Asp Ser Gln Thr Asn
130 135 140
Val Ser Gln Ser Lys Asp Ser Asp Val Tyr Ile Thr Asp Lys Cys Val
145 150 155 160
Leu Asp Met Arg Ser Met Asp Phe Lys Ser Asn Ser Ala Val Ala Trp
165 170 175
Ser Asn Lys Ser Asp Phe Ala Cys Ala Asn Ala Phe Asn Asn Ser Ile
180 185 190
Ile Pro Glu Asp Thr
195
<210> 13
<211> 502
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> бета-цепь (b03)
<400> 13
Ala Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Arg Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Ser Phe
145 150 155 160
Thr Gly Tyr Thr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
165 170 175
Glu Trp Val Ala Leu Ile Asn Pro Tyr Lys Gly Val Ser Thr Tyr Asn
180 185 190
Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ser Lys Asn
195 200 205
Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Arg Ser Gly Tyr Tyr Gly Asp Ser Asp Trp Tyr Phe
225 230 235 240
Asp Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
245 250 255
Gly Ser Asn Ala Gly Val Thr Gln Thr Pro Lys Phe Gln Val Leu Lys
260 265 270
Thr Gly Gln Ser Met Thr Leu Gln Cys Ala Gln Asp Met Ser His Gly
275 280 285
Tyr Met Ser Trp Tyr Arg Gln Asp Pro Gly Met Gly Leu Arg Leu Ile
290 295 300
His Tyr Ser Val Gly Ala Gly Ile Thr Asp Gln Gly Glu Val Pro Asn
305 310 315 320
Gly Tyr Asn Val Ser Arg Ser Thr Thr Glu Asp Phe Pro Leu Arg Leu
325 330 335
Leu Ser Ala Ala Pro Ser Gln Thr Ser Val Tyr Phe Cys Ala Ser Ser
340 345 350
Tyr Ala Thr Gly Gly Thr Gly Asp Leu Phe Phe Gly Glu Gly Ser Arg
355 360 365
Leu Thr Val Leu Glu Asp Leu Lys Asn Val Phe Pro Pro Glu Val Ala
370 375 380
Val Phe Glu Pro Ser Glu Ala Glu Ile Ser His Thr Gln Lys Ala Thr
385 390 395 400
Leu Val Cys Leu Ala Thr Gly Phe Tyr Pro Asp His Val Glu Leu Ser
405 410 415
Trp Trp Val Asn Gly Lys Glu Val His Ser Gly Val Cys Thr Asp Pro
420 425 430
Gln Pro Leu Lys Glu Gln Pro Ala Leu Asn Asp Ser Arg Tyr Ala Leu
435 440 445
Ser Ser Arg Leu Arg Val Ser Ala Thr Phe Trp Gln Asp Pro Arg Asn
450 455 460
His Phe Arg Cys Gln Val Gln Phe Tyr Gly Leu Ser Glu Asn Asp Glu
465 470 475 480
Trp Thr Gln Asp Arg Ala Lys Pro Val Thr Gln Ile Val Ser Ala Glu
485 490 495
Ala Trp Gly Arg Ala Asp
500
<210> 14
<211> 197
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> альфа-цепь (a13)
<400> 14
Ala Lys Glu Val Glu Gln Asn Ser Gly Pro Leu Ser Val Pro Glu Gly
1 5 10 15
Ala Ile Ala Ser Leu Asn Cys Thr Tyr Ser Asp Arg Gly Ser Gln Ser
20 25 30
Phe Phe Trp Tyr Arg Gln Tyr Ser Gly Lys Ser Pro Glu Leu Ile Met
35 40 45
Ser Ile Tyr Ser Asp Gly Asp Lys Glu Asp Gly Arg Phe Thr Ala Gln
50 55 60
Leu Asn Lys Ala Ser Gln Tyr Val Ser Leu Leu Ile Arg Asp Ser Gln
65 70 75 80
Pro Ser Asp Ser Ala Thr Tyr Leu Cys Ala Ala Arg Asn Tyr Lys Thr
85 90 95
Asp Leu Leu Ile Phe Gly Thr Gly Thr Arg Leu Gln Val Phe Pro Asn
100 105 110
Ile Gln Asn Pro Asp Pro Ala Val Tyr Gln Leu Arg Asp Ser Lys Ser
115 120 125
Ser Asp Lys Ser Val Cys Leu Phe Thr Asp Phe Asp Ser Gln Thr Asn
130 135 140
Val Ser Gln Ser Lys Asp Ser Asp Val Tyr Ile Thr Asp Lys Cys Val
145 150 155 160
Leu Asp Met Arg Ser Met Asp Phe Lys Ser Asn Ser Ala Val Ala Trp
165 170 175
Ser Asn Lys Ser Asp Phe Ala Cys Ala Asn Ala Phe Asn Asn Ser Ile
180 185 190
Ile Pro Glu Asp Thr
195
<210> 15
<211> 197
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> альфа-цепь (a01)
<400> 15
Ala Lys Glu Val Glu Gln Asn Ser Gly Pro Leu Ser Val Pro Glu Gly
1 5 10 15
Ala Ile Ala Ser Leu Asn Cys Thr Tyr Ser Asp Arg Gly Ser Gln Ser
20 25 30
Phe Phe Trp Tyr Arg Gln Tyr Ser Gly Lys Ser Pro Glu Leu Ile Met
35 40 45
Ser Ile Tyr Ser Asn Gly Asp Lys Glu Asp Gly Arg Phe Thr Ala Gln
50 55 60
Leu Asn Lys Ala Ser Gln Tyr Val Ser Leu Leu Ile Arg Asp Ser Gln
65 70 75 80
Pro Ser Asp Ser Ala Thr Tyr Leu Cys Ala Ala Arg Asn Tyr Lys Thr
85 90 95
Asp Leu Leu Ile Phe Gly Thr Gly Thr Arg Leu Gln Val Phe Pro Asn
100 105 110
Ile Gln Asn Pro Asp Pro Ala Val Tyr Gln Leu Arg Asp Ser Lys Ser
115 120 125
Ser Asp Lys Ser Val Cys Leu Phe Thr Asp Phe Asp Ser Gln Thr Asn
130 135 140
Val Ser Gln Ser Lys Asp Ser Asp Val Tyr Ile Thr Asp Lys Cys Val
145 150 155 160
Leu Asp Met Arg Ser Met Asp Phe Lys Ser Asn Ser Ala Val Ala Trp
165 170 175
Ser Asn Lys Ser Asp Phe Ala Cys Ala Asn Ala Phe Asn Asn Ser Ile
180 185 190
Ile Pro Glu Asp Thr
195
<210> 16
<211> 502
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> бета-цепь (b09)
<400> 16
Ala Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Arg Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Ser Phe
145 150 155 160
Thr Gly Tyr Thr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
165 170 175
Glu Trp Val Ala Leu Ile Asn Pro Tyr Lys Gly Val Ser Thr Tyr Asn
180 185 190
Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ser Lys Asn
195 200 205
Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Arg Ser Gly Tyr Tyr Gly Asp Ser Asp Trp Tyr Phe
225 230 235 240
Asp Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
245 250 255
Gly Ser Asn Ala Gly Val Thr Gln Thr Pro Lys Phe Gln Val Leu Lys
260 265 270
Thr Gly Gln Ser Met Thr Leu Gln Cys Ala Gln Asp Leu Ser His Gly
275 280 285
Tyr Met Ser Trp Tyr Arg Gln Asp Pro Gly Met Gly Leu Arg Leu Ile
290 295 300
His Tyr Ser Val Gly Ala Gly Ile Thr Asp Gln Gly Glu Val Pro Asn
305 310 315 320
Gly Tyr Asn Val Ser Arg Ser Thr Thr Glu Asp Phe Pro Leu Arg Leu
325 330 335
Leu Ser Ala Ala Pro Ser Gln Thr Ser Val Tyr Phe Cys Ala Ser Ser
340 345 350
Tyr Ala Thr Gly Gly Thr Gly Asp Leu Phe Phe Gly Glu Gly Ser Arg
355 360 365
Leu Thr Val Leu Glu Asp Leu Lys Asn Val Phe Pro Pro Glu Val Ala
370 375 380
Val Phe Glu Pro Ser Glu Ala Glu Ile Ser His Thr Gln Lys Ala Thr
385 390 395 400
Leu Val Cys Leu Ala Thr Gly Phe Tyr Pro Asp His Val Glu Leu Ser
405 410 415
Trp Trp Val Asn Gly Lys Glu Val His Ser Gly Val Cys Thr Asp Pro
420 425 430
Gln Pro Leu Lys Glu Gln Pro Ala Leu Asn Asp Ser Arg Tyr Ala Leu
435 440 445
Ser Ser Arg Leu Arg Val Ser Ala Thr Phe Trp Gln Asp Pro Arg Asn
450 455 460
His Phe Arg Cys Gln Val Gln Phe Tyr Gly Leu Ser Glu Asn Asp Glu
465 470 475 480
Trp Thr Gln Asp Arg Ala Lys Pro Val Thr Gln Ile Val Ser Ala Glu
485 490 495
Ala Trp Gly Arg Ala Asp
500
<210> 17
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<400> 17
Gly Leu Ser Pro Thr Val Trp Leu Ser Ala
1 5 10
<210> 18
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR1 альфа-цепи
<400> 18
Asp Arg Gly Ser Gln Ser
1 5
<210> 19
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR2 альфа-цепи
<400> 19
Ile Tyr Ser Asn Gly Asp
1 5
<210> 20
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR3 альфа-цепи
<400> 20
Cys Ala Val Arg Asn Tyr Asn Thr Asp Lys Leu Ile Phe
1 5 10
<210> 21
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR1 бета-цепи
<400> 21
Met Asn His Glu Tyr
1 5
<210> 22
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR2 бета-цепи
<400> 22
Ser Val Gly Ala Gly Ile
1 5
<210> 23
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR3 бета-цепи
<400> 23
Cys Ala Ser Ser Tyr Ala Thr Gly Gly Thr Gly Glu Leu Phe Phe
1 5 10 15
<210> 24
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR2 альфа-цепи
<400> 24
Ile Tyr Ser Asp Gly Asp
1 5
<210> 25
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR3 альфа-цепи
<400> 25
Cys Ala Ala Arg Asn Tyr Lys Thr Asp Leu Leu Ile Phe
1 5 10
<210> 26
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR1 бета-цепи
<400> 26
Leu Asn His Gly Tyr
1 5
<210> 27
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR1 бета-цепи
<400> 27
Met Ser His Gly Tyr
1 5
<210> 28
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR1 бета-цепи
<400> 28
Leu Ser His Gly Tyr
1 5
<210> 29
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR2 бета-цепи
<400> 29
Ser Leu Gly Ala Gly Ile
1 5
<210> 30
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR3 бета-цепи
<400> 30
Cys Ala Ser Ser Tyr Ala Thr Gly Gly Thr Gly Val Leu Phe Phe
1 5 10 15
<210> 31
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR3 бета-цепи
<400> 31
Cys Ala Ser Ser Tyr Ala Thr Gly Gly Thr Gly Asp Leu Phe Phe
1 5 10 15
<210> 32
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR3 бета-цепи
<400> 32
Cys Ala Ser Ser Tyr Ala Thr Gly Gly Thr Gly Leu Leu Phe Phe
1 5 10 15
<210> 33
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкер
<400> 33
Gly Gly Gly Gly Ser
1 5
<210> 34
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкер
<400> 34
Gly Gly Gly Ser Gly
1 5
<210> 35
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкер
<400> 35
Gly Gly Ser Gly Gly
1 5
<210> 36
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкер
<400> 36
Gly Ser Gly Gly Gly
1 5
<210> 37
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкер
<400> 37
Gly Ser Gly Gly Gly Pro
1 5
<210> 38
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкер
<400> 38
Gly Gly Glu Pro Ser
1 5
<210> 39
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкер
<400> 39
Gly Gly Glu Gly Gly Gly Pro
1 5
<210> 40
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкер
<400> 40
Gly Gly Glu Gly Gly Gly Ser Glu Gly Gly Gly Ser
1 5 10
<210> 41
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкер
<400> 41
Gly Gly Gly Ser Gly Gly Gly Gly
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Т-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ | 2017 |
|
RU2775623C2 |
| Т-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ, СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ КОМПЛЕКСА ОПУХОЛЕВЫЙ АНТИГЕН NY-ESO-1/HLA-A*02 | 2016 |
|
RU2775394C2 |
| Т-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ | 2018 |
|
RU2762255C2 |
| T-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ, РАСПОЗНАЮЩИЕ МУТАЦИЮ R175H ИЛИ Y220C В P53 | 2020 |
|
RU2830061C2 |
| ВЫСОКОАФФИННЫЙ Т-КЛЕТОЧНЫЙ РЕЦЕПТОР ДЛЯ РАСПОЗНАВАНИЯ АНТИГЕНА AFP | 2019 |
|
RU2836365C2 |
| КОНСТРУКТЫ Т-КЛЕТОЧНОГО РЕЦЕПТОРА И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2785954C2 |
| УЛУЧШЕННЫЙ СИНТЕТИЧЕСКИЙ Т-КЛЕТОЧНЫЙ РЕЦЕПТОР И АНТИГЕННЫЙ РЕЦЕПТОР | 2021 |
|
RU2820497C1 |
| HPV-СПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2018 |
|
RU2804664C2 |
| АНТИГЕНСВЯЗЫВАЮЩИЕ ДОМЕНЫ ПРОТИВ TRBC1 | 2018 |
|
RU2791327C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) С АНТИГЕНСВЯЗЫВАЮЩИМИ ДОМЕНАМИ К КОНСТАНТНОЙ ОБЛАСТИ β Т-КЛЕТОЧНОГО РЕЦЕПТОРА | 2015 |
|
RU2830064C2 |





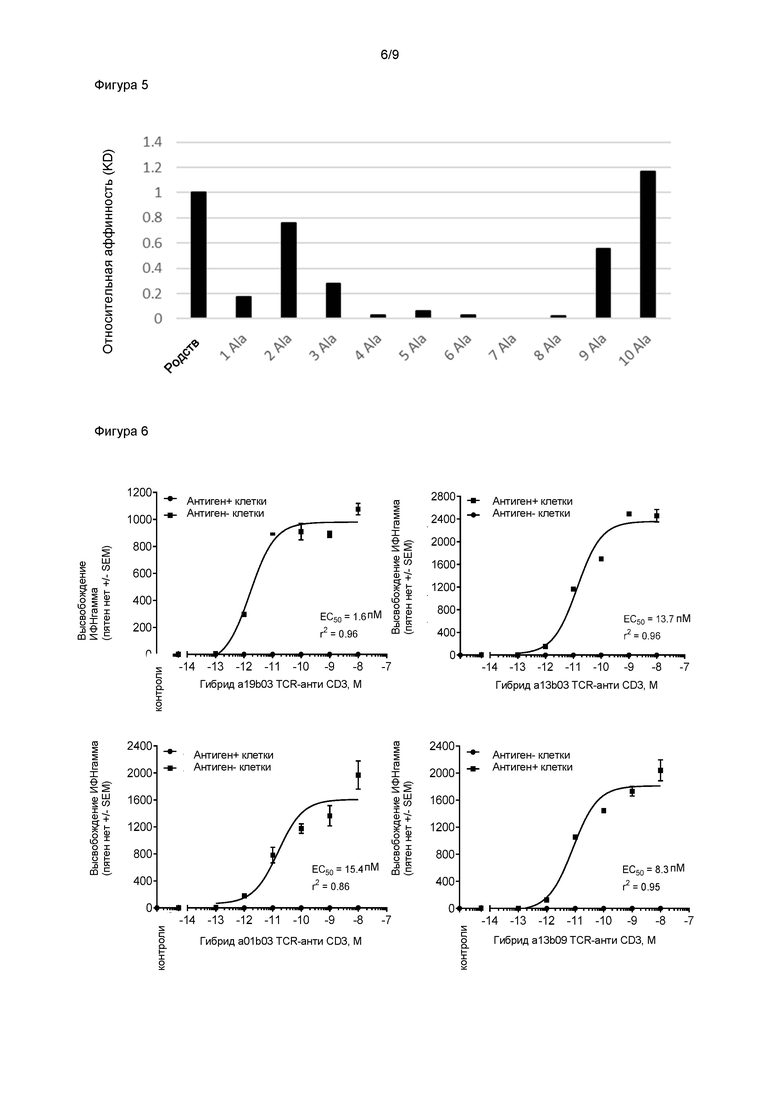
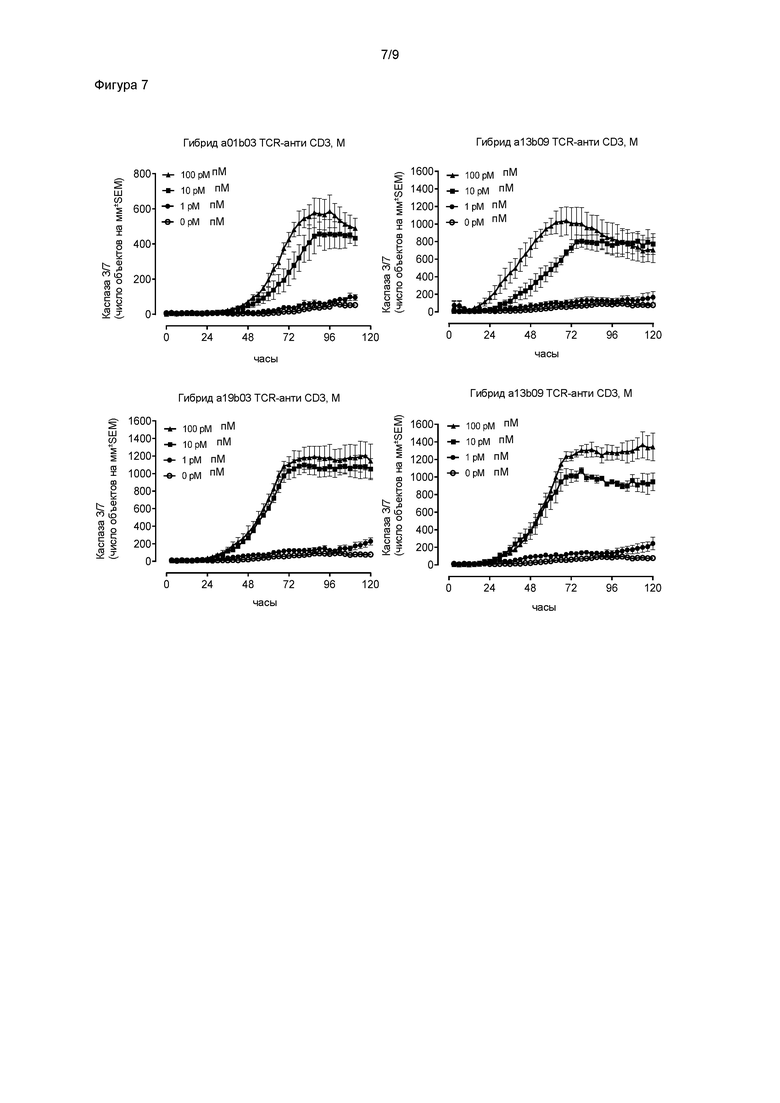
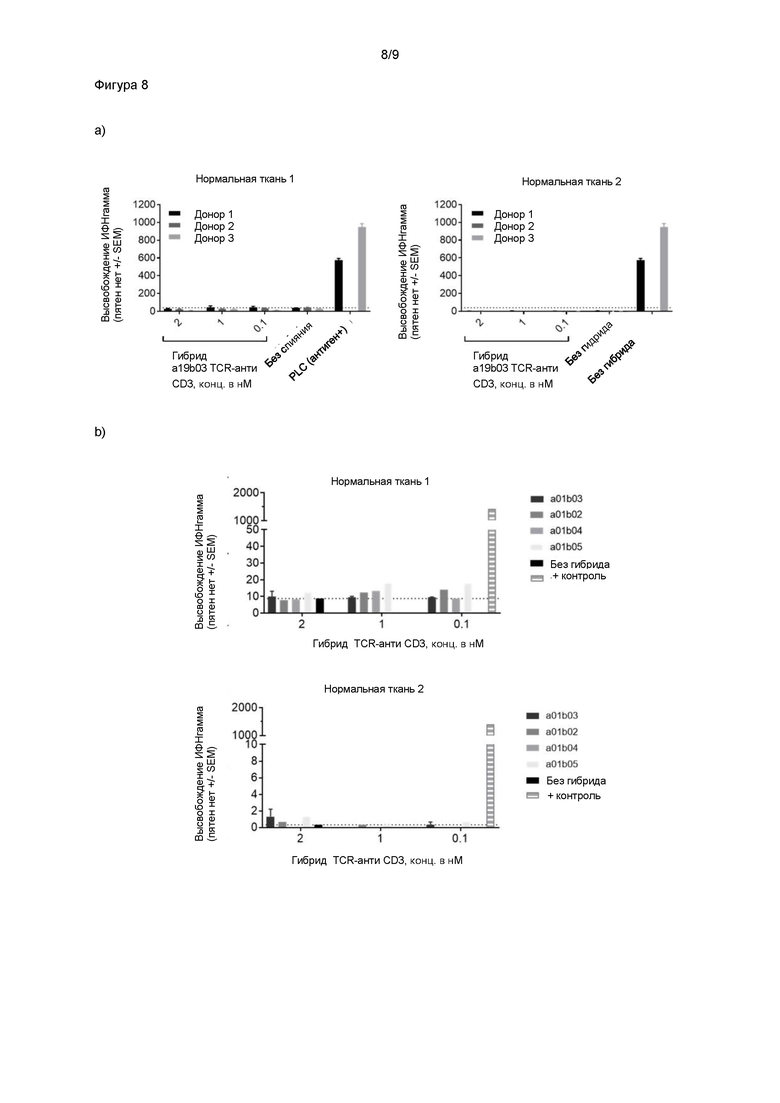
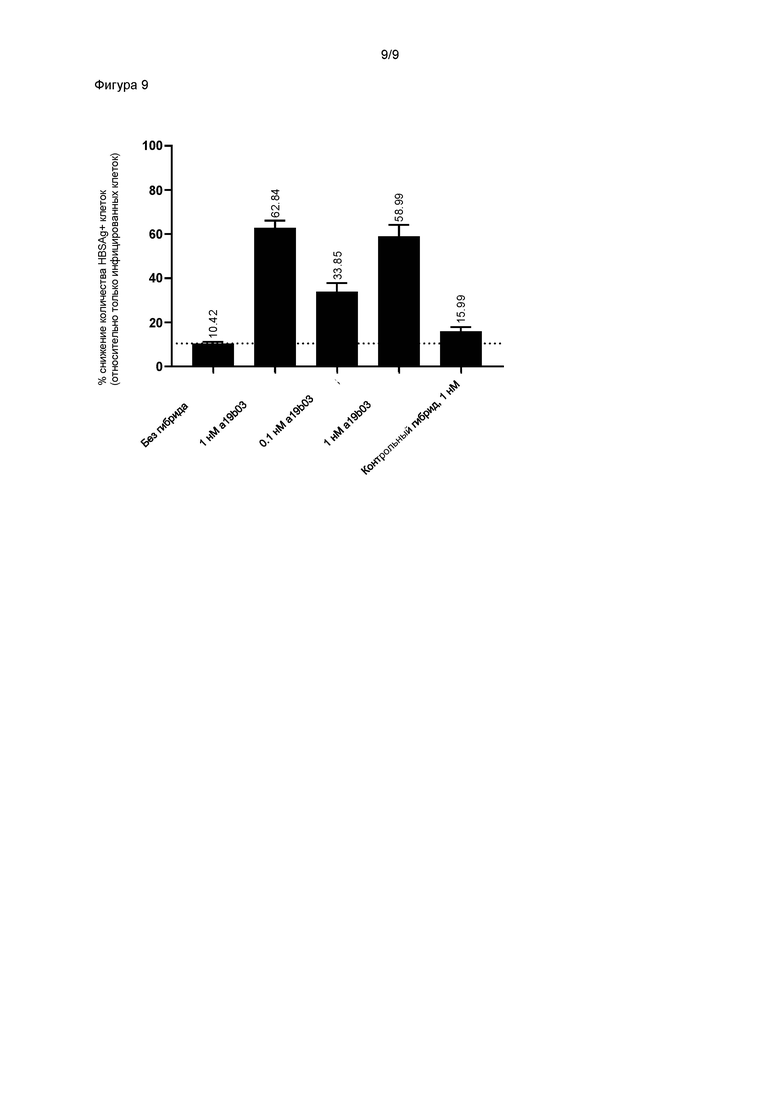
Изобретение относится к области биотехнологии, в частности к cпецифичной связывающей молекуле, обладающей свойством связываться с комплексом (GLSPTVWLSV и/или GLSPTVWLSA)-HLA-A*02, а также к гибридной молекуле и композиции, ее содержащим. Также раскрыты нуклеиновая кислота, кодирующая вышеуказанную молекулу или гибридную молекулу, а также вектор, клетка, ее содержащие. Изобретение эффективно для лечения хронической инфекции ВГВ у субъекта. 12 н. и 15 з.п. ф-лы, 9 ил., 7 пр.
1. Специфичная связывающая молекула, обладающая свойством связываться с комплексом (GLSPTVWLSV и/или GLSPTVWLSA)-HLA-A*02 и содержащая вариабельный домен альфа-цепи TCR и вариабельный домен бета-цепи TCR, каждый из которых содержит FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, где FR представляет собой каркасную область, а CDR представляет собой область, определяющую комплементарность, причем указанная специфическая связывающая молекула имеет одну из следующих комбинаций CDR альфа-цепи и бета-цепи:
a) последовательности CDR1, CDR2 и CDR3 альфа-цепи DRGSQS (SEQ ID NO: 18), IYSNGD (SEQ ID NO: 19) и CAARNYKTDLLIF (SEQ ID NO: 25), соответственно, и последовательности CDR1, CDR2 и CDR3 бета-цепи LNHGY (SEQ ID NO: 26), SVGAGI (SEQ ID NO: 22) и CASSYATGGTGVLFF (SEQ ID NO: 30), соответственно;
b) последовательности CDR1, CDR2 и CDR3 альфа-цепи DRGSQS (SEQ ID NO: 18), IYSNGD (SEQ ID NO: 19) и CAARNYKTDLLIF (SEQ ID NO: 25), соответственно, и последовательности CDR1, CDR2 и CDR3 бета-цепи MSHGY (SEQ ID NO: 27), SVGAGI (SEQ ID NO: 22) и CASSYATGGTGDLFF (SEQ ID NO: 31), соответственно;
c) последовательности CDR1, CDR2 и CDR3 альфа-цепи DRGSQS (SEQ ID NO: 18), IYSNGD (SEQ ID NO: 19) и CAARNYKTDLLIF (SEQ ID NO: 25), соответственно, и последовательности CDR1, CDR2 и CDR3 бета-цепи MNHEY (SEQ ID NO: 21), SVGAGI (SEQ ID NO: 22) и CASSYATGGTGLLFF (SEQ ID NO: 32), соответственно;
d) последовательности CDR1, CDR2 и CDR3 альфа-цепи DRGSQS (SEQ ID NO: 18), IYSNGD (SEQ ID NO: 19) и CAARNYKTDLLIF (SEQ ID NO: 25), соответственно, и последовательности CDR1, CDR2 и CDR3 бета-цепи MNHEY (SEQ ID NO: 21), SLGAGI (SEQ ID NO: 29) и CASSYATGGTGDLFF (SEQ ID NO: 31), соответственно;
e) последовательности CDR1, CDR2 и CDR3 альфа-цепи DRGSQS (SEQ ID NO: 18), IYSNGD (SEQ ID NO: 19) и CAARNYKTDLLIF (SEQ ID NO: 25), соответственно, и последовательности CDR1, CDR2 и CDR3 бета-цепи LSHGY (SEQ ID NO: 28), SVGAGI (SEQ ID NO: 22) и CASSYATGGTGDLFF (SEQ ID NO: 31), соответственно;
f) последовательности CDR1, CDR2 и CDR3 альфа-цепи DRGSQS (SEQ ID NO: 18), IYSDGD (SEQ ID NO: 24) и CAARNYKTDLLIF (SEQ ID NO: 25), соответственно, и последовательности CDR1, CDR2 и CDR3 бета-цепи MSHGY (SEQ ID NO: 27), SVGAGI (SEQ ID NO: 22) и CASSYATGGTGDLFF (SEQ ID NO: 31), соответственно; или
g) последовательности CDR1, CDR2 и CDR3 альфа-цепи DRGSQS (SEQ ID NO: 18), IYSDGD (SEQ ID NO: 24) и CAARNYKTDLLIF (SEQ ID NO: 25), соответственно, и последовательности CDR1, CDR2 и CDR3 бета-цепи LSHGY (SEQ ID NO: 28), SVGAGI (SEQ ID NO: 22) и CASSYATGGTGDLFF (SEQ ID NO: 31), соответственно.
2. Специфичная связывающая молекула по п. 1, характеризующаяся тем, что каркасные области вариабельного домена альфа-цепи содержат следующие последовательности:
FR1 – аминокислоты 1-26 SEQ ID NO: 2,
FR2 – аминокислоты 33-49 SEQ ID NO: 2,
FR3 – аминокислоты 56-88 SEQ ID NO: 2,
FR4 – аминокислоты 102-111 SEQ ID NO: 2
или соответствующие последовательности, характеризующиеся по меньшей мере 90% идентичностью с указанными последовательностями, и/или
каркасные области вариабельного домена бета-цепи содержат следующие последовательности:
FR1 – аминокислоты 1-26 SEQ ID NO: 3,
FR2 – аминокислоты 32-48 SEQ ID NO: 3,
FR3 – аминокислоты 55-90 SEQ ID NO: 3,
FR4 – аминокислоты 106-114 SEQ ID NO: 3
или соответствующие последовательности, характеризующиеся по меньшей мере 90% идентичностью с указанными последовательностями.
3. Специфичная связывающая молекула по п. 1 или 2, характеризующаяся тем, что вариабельный домен альфа-цепи и вариабельный домен бета-цепи выбраны из аминокислотных последовательностей:
a) последовательности вариабельного домена альфа-цепи, представленной в SEQ ID NO: 4, и последовательности вариабельного домена бета-цепи, представленной в SEQ ID NO: 7;
b) последовательности вариабельного домена альфа-цепи, представленной в SEQ ID NO: 4, и последовательности вариабельного домена бета-цепи, представленной в SEQ ID NO: 8;
c) последовательности вариабельного домена альфа-цепи, представленной в SEQ ID NO: 4, и последовательности вариабельного домена бета-цепи, представленной в SEQ ID NO: 9;
d) последовательности вариабельного домена альфа-цепи, представленной в SEQ ID NO: 4, и последовательности вариабельного домена бета-цепи, представленной в SEQ ID NO: 10;
e) последовательности вариабельного домена альфа-цепи, представленной в SEQ ID NO: 4, и последовательности вариабельного домена бета-цепи, представленной в SEQ ID NO: 11;
f) последовательности вариабельного домена альфа-цепи, представленной в SEQ ID NO: 5, и последовательности вариабельного домена бета-цепи, представленной в SEQ ID NO: 8;
g) последовательности вариабельного домена альфа-цепи, представленной в SEQ ID NO: 5, и последовательности вариабельного домена бета-цепи, представленной в SEQ ID NO: 11; или
h) последовательности вариабельного домена альфа-цепи, представленной в SEQ ID NO: 6, и последовательности вариабельного домена бета-цепи, представленной в SEQ ID NO: 8.
4. Специфичная связывающая молекула по любому из предыдущих пунктов, представляющая собой альфа-бета-гетеродимер, содержащий последовательность константного домена альфа-цепи TRAC и последовательность константного домена бета-цепи TRBC1 или TRBC2.
5. Специфичная связывающая молекула по п. 4, характеризующаяся тем, что последовательности константных доменов альфа- и бета-цепей модифицированы путем укорачивания или замены с удалением нативной дисульфидной связи между Cys4 экзона 2 TRAC и Cys2 экзона 2 TRBC1 или TRBC2.
6. Специфичная связывающая молекула по п. 4 или 5, характеризующаяся тем, что последовательность(и) константного домена альфа- и/или бета-цепи модифицирована(ы) путем замены Thr 48 в TRAC и Ser 57 в TRBC1 или TRBC2 на остатки цистеина, причем указанные остатки цистеина образуют ненативную дисульфидную связь между константными доменами альфа- и бета-цепи TCR.
7. Специфичная связывающая молекула по любому из предыдущих пунктов, представляющая собой одноцепочечный формат типа Vα-L-Vβ, Vβ-L-Vα, Vα-Cα-L-Vβ, Vα-L-Vβ-Cβ, причем Vα и Vβ представляют собой вариабельные области α- и β-цепей TCR, соответственно, Cα и Cβ представляют собой константные области α- и β-цепей TCR, соответственно, а L представляет собой линкерную последовательность.
8. Специфичная связывающая молекула по любому из предыдущих пунктов, связанная с детектируемой меткой, терапевтическим агентом или фрагментом, модифицирующим фармакокинетические (ФК) параметры.
9. Специфичная связывающая молекула по п. 8, характеризующаяся тем, что антитело против CD3 ковалентно связано с C- или N-концом альфа- или бета-цепи TCR, необязательно через линкерную последовательность.
10. Специфичная связывающая молекула по п. 9, характеризующаяся тем, что линкерная последовательность выбрана из группы, состоящей из GGGGS (SEQ ID NO: 33), GGGSG (SEQ ID NO: 34), GGSGG (SEQ ID NO: 35), GSGGG (SEQ ID NO: 36), GSGGGP (SEQ ID NO: 37), GGEPS (SEQ ID NO: 38), GGEGGGP (SEQ ID NO: 39), GGEGGGSEGGGS (SEQ ID NO: 40) и GGGSGGGG (SEQ ID NO:41).
11. Гибридная молекула, обладающая свойством связываться с комплексом (GLSPTVWLSV и/или GLSPTVWLSA)-HLA-A*02 и с CD3, где указанная гибридная молекула содержит специфическую связывающую молекулу по п. 3 и антитело против CD3, причем антитело против CD3 ковалентно связано с N-концом или C-концом бета-цепи TCR через линкерную последовательность, выбранную из SEQ ID NO: 33-41.
12. Гибридная молекула по п. 11, содержащая
аминокислотную последовательность альфа-цепи, выбранную из SEQ ID NO: 12, 14 и 15, или аминокислотную последовательность альфа-цепи, характеризующуюся по меньшей мере 90% идентичностью, например по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичностью с аминокислотными последовательностями, выбранным из SEQ ID NO: 12, 14 и 15,
и аминокислотную последовательность бета-цепи, выбранную из SEQ ID NO: 13 и 16, или аминокислотную последовательность бета-цепи, характеризующуюся по меньшей мере 90% идентичностью, например по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичностью с аминокислотными последовательностями, выбранным из SEQ ID NO: 13 и 16.
13. Гибридная молекула по п. 12, содержащая
(a) аминокислотную последовательность альфа-цепи, соответствующую SEQ ID NO: 12, и аминокислотную последовательность бета-цепи, соответствующую SEQ ID NO: 13;
(b) аминокислотную последовательность альфа-цепи, соответствующую SEQ ID NO: 14, и аминокислотную последовательность бета-цепи, соответствующую SEQ ID NO: 13;
(c) аминокислотную последовательность альфа-цепи, соответствующую SEQ ID NO: 15, и аминокислотную последовательность бета-цепи, соответствующую SEQ ID NO: 13; или
(d) аминокислотную последовательность альфа-цепи, соответствующую SEQ ID NO: 14, и аминокислотную последовательность бета-цепи, соответствующую SEQ ID NO: 16.
14. Нуклеиновая кислота, кодирующая специфическую связывающую молекулу по любому из пп. 1-10.
15. Экспрессирующий вектор, содержащий нуклеиновую кислоту по п. 14.
16. Клетка, экспрессирующая специфическую связывающую молекулу по любому из пп. 1-10, где указанная клетка несет
(a) экспрессирующий вектор по п. 15, кодирующий альфа- и бета-вариабельные цепи TCR по любому из пп. 1-10, в одной открытой рамке считывания или в двух отдельных открытых рамках считывания; или
(b) первый экспрессирующий вектор, содержащий нуклеиновую кислоту, кодирующую альфа-вариабельную цепь TCR по любому из пп. 1-10, и второй экспрессирующий вектор, содержащий нуклеиновую кислоту, кодирующую бета-вариабельную цепь TCR по любому из пп. 1-10.
17. Клетка по п. 16, где клетка представляет собой T-клетку.
18. Нуклеиновая кислота, кодирующая гибридную молекулу по любому из пп. 11-13.
19. Экспрессирующий вектор, содержащий нуклеиновую кислоту по п. 18.
20. Клетка, экспрессирующая гибридную молекулу по любому из пп. 11-13, где указанная клетка несет
(a) экспрессирующий вектор по п. 19, кодирующий альфа- и бета-вариабельные цепи TCR по любому из пп. 11-13, в одной открытой рамке считывания или в двух отдельных открытых рамках считывания; или
(b) первый экспрессирующий вектор, содержащий нуклеиновую кислоту, кодирующую альфа-вариабельную цепь TCR по любому из пп. 11 и 13, второй экспрессирующий вектор, содержащий нуклеиновую кислоту, кодирующую бета-вариабельную цепь TCR по любому из пп. 11-13.
21. Клетка по п. 20, где клетка представляет собой T-клетку.
22. Фармацевтическая композиция для лечения хронической инфекции ВГВ у субъекта, содержащая специфичную связывающую молекулу по любому из пп. 1-10, или гибридную молекулу по любому из пп. 11-13, или клетку по пп. 16, 17, 20 или 21 вместе с одним или более фармацевтически приемлемыми носителями или вспомогательными веществами.
23. Специфичная связывающая молекула по любому из пп. 1-10, или гибридная молекула по любому из пп. 11-13, или нуклеиновая кислота по п. 14 или 18, фармацевтическая композиция по п. 22 или клетка по пп. 16, 17, 20 или 21 для применения в медицине, предпочтительно у субъекта-человека с хронической инфекцией ВГВ.
24. Специфичная связывающая молекула по любому из пп. 1-10 или гибридная молекула по любому из пп. 11-13 или нуклеиновая кислота по п. 14 или 18, фармацевтическая композиция по п. 22 или клетка по пп. 16, 17, 20 или 21 для применения в способе лечения хронической инфекции ВГВ или рака или опухоли, возникшей в результате хронической инфекции ВГВ, предпочтительно у субъекта-человека.
25. Способ лечения хронической инфекции ВГВ у субъекта-человека, включающий введение указанному субъекту, нуждающемуся в этом, фармацевтически эффективной дозы фармацевтической композиции по п. 22.
26. Способ получения специфичной связывающей молекулы по любому из пп. 1-10, включающий a) поддержание клетки по п. 16 или 17 в оптимальных условиях для экспрессии цепей специфичной связывающей молекулы и b) выделение цепей специфичной связывающей молекулы.
27. Способ получения гибридной молекулы по любому из пп. 11-13, включающий a) поддержание клетки по п. 20 или 21 в оптимальных условиях для экспрессии цепей гибридной связывающей молекулы и b) выделение цепей гибридной связывающей молекулы.
| WO 2011062562 A1, 26.05.2011 | |||
| WO 2017158367 A1, 21.09.2017 | |||
| ANTONIO BERTOLETTI et al | |||
| T cell receptor-therapy in HBV-related hepatocellularcarcinoma, Oncoimmunology, 2015 Jun; 4(6): e1008354 | |||
| WO 2016174652 A1, 11.03.2016 | |||
| СПОСОБ НЕЙТРАЛИЗАЦИИ ВИРУСА ГЕПАТИТА С, ПОЛНОСТЬЮ ЧЕЛОВЕЧЕСКОЕ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ПРОТИВ ВИРУСА ГЕПАТИТА С (ВАРИАНТЫ), КОМПОЗИЦИЯ ПОЛНОСТЬЮ ЧЕЛОВЕЧЕСКИХ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ПРОТИВ ВИРУСА ГЕПАТИТА С И ГИБРИДНАЯ МЫШЬ/ЧЕЛОВЕК КЛЕТОЧНАЯ ЛИНИЯ - ПРОДУЦЕНТ ПОЛНОСТЬЮ ЧЕЛОВЕЧЕСКИХ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ПРОТИВ ВИРУСА ГЕПАТИТА С (ВАРИАНТЫ) | 2013 |
|
RU2539770C1 |
Авторы
Даты
2024-09-02—Публикация
2020-03-27—Подача