ОБЛАСТЬ ТЕХНИКИ.
Объект изобретения относится к органической химии, а именно к способу получения индивидуальных соединений класса пиразолов, которые могут быть использованы в качестве исходных продуктов в синтезе новых гетероциклических систем и в фармакологии.
УРОВЕНЬ ТЕХНИКИ.
Пиразолы и их производные являются одними из наиболее популярных гетероциклических систем, проявляющих разнообразную биологическую активность, вследствие чего они представляют особый интерес для фармацевтической и агрохимической отраслей [Fustero S., Sánchez-Roselló M., Barrio P., Simón-Fuentes A. From 2000 to mid-2010: A fruitful decade for the synthesis of pyrazoles // Chem. Rev. 2011, 111, 6984-7034; Giornal F., Pazenok S., Rodefeld L., Lui N., Vors J.-P., Leroux F.R. Synthesis of diversely fluorinated pyrazoles as novel active agrochemical ingredients // J. Fluor. Chem. 2013, 152, 2-11]. Особое внимание уделяется синтезу поли(пер)фторалкилзамещенных пиразолов, поскольку фторалкильные группы зачастую улучшают мембранную проницаемость, биодоступность и повышают метаболическую стабильность соединений [Böhm H.-J., Banner D., Bendels S., Kansy M., Kuhn B., Müller K., Obst-Sander U., Stahl M. Fluorine in medicinal chemistry // ChemBioChem 2004, 5, 637–643; O'Hagan D. Fluorine in health care: Organofluorine containing blockbuster drugs // J. Fluor. Chem. 2010, 131, 1071-1081; Wang J., Sánchez-Roselló M., Aceña J.L., Pozo C., Sorochinsky A.E., Fustero S., Soloshonok V.A., Liu H. Fluorine in pharmaceutical industry: fluorine-containing drugs introduced to the market in the last decade (2001–2011) // Chem. Rev. 2014, 114, 2432–2506]. При этом дальнейшая функционализация пиразолов, в том числе за счет введения модифицированного ацильного фрагмента в боковой заместитель, расширяет возможности в поиске биологически активных соединений на их основе [Bazhin D.N., Kudyakova Y.S., Onoprienko A.Y., Slepukhin P.A., Burgart Y.V., Saloutin V.I. Synthesis and tuberculostatic activity of functionalized pyrazoles derived from (trifluoromethyl)pyrazole containing a hydrazone group // Chem. Heterocycl. Comp. 2017, 53, 1324–1329; Bazhin D.N., Kudyakova Y.S., Slepukhin P.A., Burgart Y.V., Malysheva Na.N., Kozitsina A.N., Ivanova A.V., Bogomyakov A.S., Saloutin V.I. Dinuclear copper(II) complex with novel N,N’,N”,O-tetradentate Schiff base ligand containing trifluoromethylpyrazole and hydrazone moieties // Mendeleev Commun. 2018, 28, 202-204].
Одним из наиболее используемых методов в построении пиразольного кольца, в том числе содержащим фторсодержащие заместители, является конденсация 1,3-диэлектрофильных соединений (таких как 1,3-дикарбонильные соединения, α,β-непредельные прекурсоры и т.д.) с гидразином либо замещенными гидразинами [Fustero S., Sánchez-Roselló M., Barrio P., Simón-Fuentes A. From 2000 to mid-2010: a fruitful decade for the synthesis of pyrazoles // Chem. Rev. 2011, 111, 6984-7034; Sloop J.C., Holder C., Henary M. Selective incorporation of fluorine in pyrazoles // Eur. J. Org. Chem. 2015, 3405-3422].
Однако для получения ацилзамещенных (перфторалкил)/(полифторалкил)пиразолов был предложен подход с использованием реакции циклоприсоединения in situ генерируемых диазосоединений с замещенными ацетиленами. 1-[5-(Трифторметил)-1Н-пиразол-3-ил]этанон был получен циклоприсоединением ацетилацетилена к CF3-диазометану при катализе дорогостоящим оксидом серебра(I) [Li F., Nie J., Sun L., Zheng Y., Ma J.- A. Silver-mediated cycloaddition of alkynes with CF3CHN2: highly regioselective synthesis of 3-trifluoromethylpyrazoles // Angew. Chem. Int. Ed., 2013, 52, 6255-6258]. Высокий выход ацилпиразолов достигался при добавлении 4 эквивалентов гидрохлорида 2,2,2-трифторэтиламина, 5 эквивалентов нитрита натрия к 1 эквиваленту замещенного ацетилена.
Позже для получения 3-ацил-5-полифторалкилпиразолов предложен однореакторный подход с использованием (полифторалкил)метиламингидрохлоридов с нитритом натрия и ацилацетиленами, с промежуточным генерированием (полифторалкил)диазометанов in situ под действием нитрозирующего реагента [HCF2-пиразолы: Mykhailiuk P.K. In situ generation of difluoromethyl diazomethane for [3+2] cycloadditions with alkynes // Angew. Chem. Int. Ed. 2015, 54, 6558-6561; CF3-пиразолы: Slobodyanyuk E.Y., Artamonov O.S., Shishkin O.V., Mykhailiuk P.K. One-pot synthesis of CF3-substituted pyrazolines/pyrazoles from electron-deficient alkenes/alkynes and CF3CHN2 generated in situ: optimized synthesis of tris(trifluoromethyl)pyrazole // Eur. J. Org. Chem. 2014, 2487-2495; C2F5-пиразолы: Mykhailiuk P.K. Three-component synthesis of C2F5-substituted pyrazoles from C2F5CH2NH2·HCl, NaNO2 and electron-deficient alkynes // Beilstein J. Org. Chem. 2015, 11, 16–24; HCF2CF2-пиразолы: Mykhailiuk P.K. Three-component synthesis of fluorinated pyrazoles from fluoroalkylamines, NaNO2 and electron-deficient alkynes // Org. Biomol. Chem. 2015, 13, 3438-3445; i-C3F7-пиразолы: Mykhailiuk P.K. Heptafluoroisopropyl diazomethane (i-C3F7CHN2): in situ generation and synthesis of pyrazoles // Org. Biomol. Chem. 2017, 15, 7296-7301]. Недостатком данного подхода является использование малодоступных ацилацетиленов и избытка (полифторалкил)метиламингидрохлоридов (2-3 эквивалента).
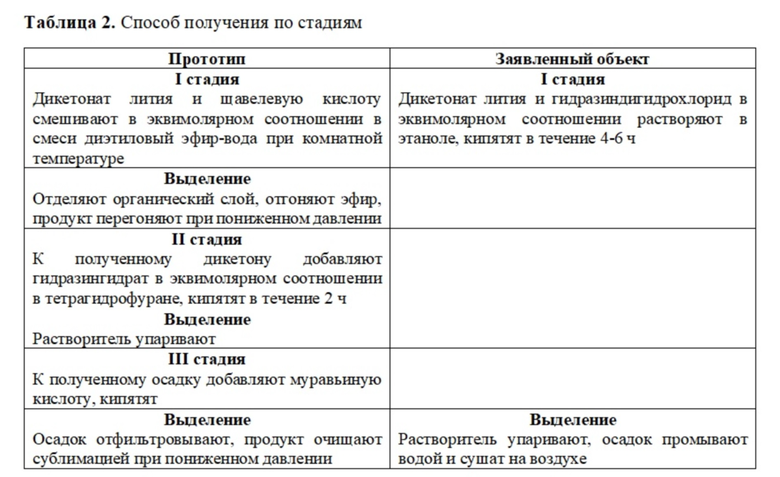
Известен способ синтеза 1-[5-(перфторэтил)-1H-пиразол-3-ил]этанона Ib (Схема 1) [Kudyakova Y.S., Onoprienko A.Y., Slepukhin P.A., Burgart Y.V., Saloutin V.I., Bazhin D.N. Fluorine-containing furan-3(2Н)-ones in reactions with binucleophiles: CF3 vs C2F5 // Chem. Heterocycl. Comp. 2019, 55, 517–522]. По этому методу дикетонат лития IIb обрабатывали водным раствором щавелевой кислоты с образованием фуранона III, который при дальнейшем взаимодействии с гидразингидратом в метаноле давал фуран IV, кипячением которого в 20%-ной соляной кислоте получен пиразол Ib. Суммарный выход продукта в трехстадийном процессе составил 43%.
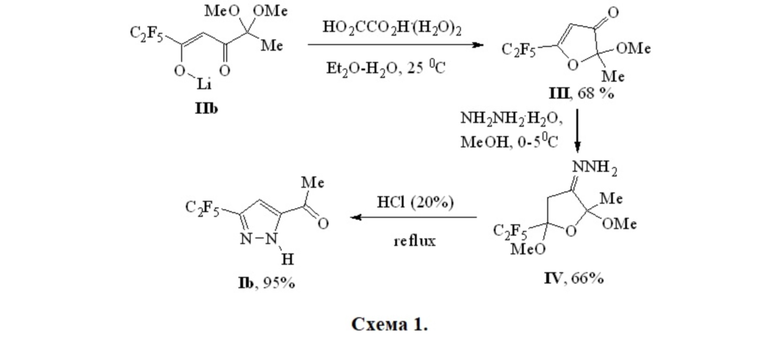
К недостаткам указанного способа получения пиразола IIb следует отнести трудоемкость трехстадийного процесса, сопровождающегося выделением всех промежуточных соединений, что приводит к низкому общему выходу целевого пиразола Ib. Кроме того, этот метод не является универсальным, поскольку CF3-пиразол Ia таким образом синтезировать не удалось.
Наиболее близким к нашему изобретению является способ получения 1-[5-(трифторметил)-1H-пиразол-3-ил]этанона (Ia) из CF3-дикетоната лития IIIa, включающий несколько стадий синтеза [Bazhin D.N., Chizhov D.L., Röschenthaler G.-V., Kudyakova Y.S., Burgart Y.V., Slepukhin P.A., Saloutin V.I., Charushin V.N. A concise approach to CF3-containing furan-3-ones, (bis)pyrazoles from novel fluorinated building blocks based on 2,3-butanedione // Tetrahedron Lett. 2014, 55, 5714-5717] согласно общей Cхеме 2 (прототип), в котором дикетонат лития IIIa обрабатывали раствором щавелевой кислоты, далее промежуточный дикетон V кипятили с гидразингидратом в тетрагидрофуране в течение 2 ч, после чего растворитель упаривали, добавляли муравьиную кислоту и кипятили. Затем к раствору добавляли воды, осадок возгоняли при пониженном давлении. Суммарный выход пиразола Ia в результате трехстадийного процесса составил 72%.
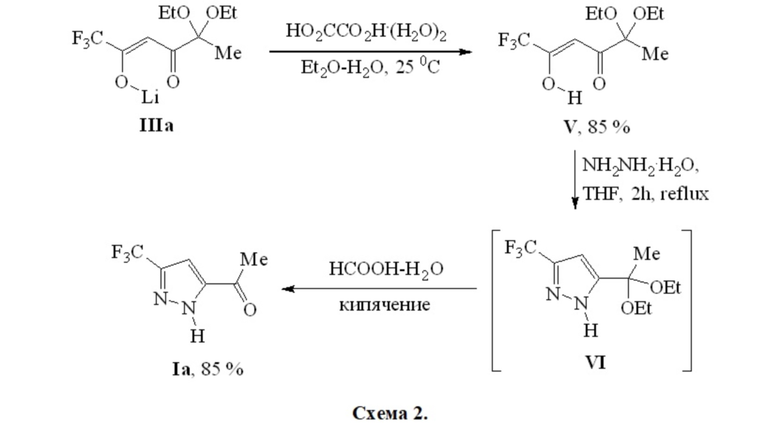
К недостаткам указанного способа получения пиразола Ia
1) трудоемкость трехстадийного процесса;
2) необходимость выделения и очистки промежуточных соединений;
3) дополнительная операция, связанная с необходимостью очистки продукта, заключающаяся в возгонке твердого остатка при пониженном давлении.
Задачей настоящего изобретения является разработка простого способа, позволяющего получить 1-[5-(перфторалкил)-1Н-пиразол-3-ил]этаноны I с высоким суммарным выходом.
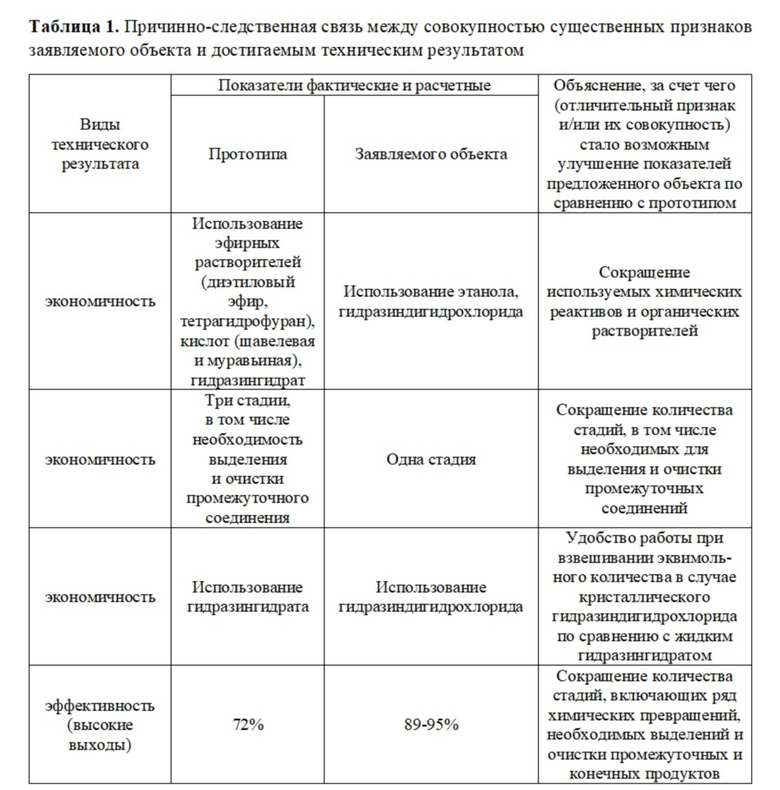
В соответствии с этой задачей предлагается способ получения пиразолов общей формулы I, заключающийся в одностадийном синтезе из дикетонатов II или III и гидразин дигидрохлорида в среде этанола (Схема 3). Заявленный способ осуществляют следующим образом: смесь в эквимолярных количествах дикетоната лития II и гидразиндигидрохлорида в этаноле кипятят при 75-78°С в течение 4-6 ч. После чего реакционную смесь охлаждают до комнатной температуры, добавляют воды, осадок отфильтровывают. Структуры соединений подтверждены спектральными методами исследования (ЯМР и ИК спектроскопии), чистота продуктов согласуется с данными элементного анализа, масс-спектрометрии, газожидкостной хроматографии. Замена дикетоната лития II на III в указанном способе не влияет на выход пиразолов. Соединения Ia,b имеют схожие температуры плавления с заявленными в литературных источниках. Соединения Ic,d получены и охарактеризованы впервые.

Преимуществом представленного способа получения пиразолов I является
1) получение пиразолов в одну стадию;
2) повышение экологичности процесса за счет снижения количества используемых химических реагентов в сравнении с прототипом;
3) повышение выходов соединений.
Соединения II и III являются легкодоступными реагентами, полученными согласно способу [Bazhin D.N., Chizhov D.L., Röschenthaler G.-V., Kudyakova Y.S., Burgart Y.V., Slepukhin P.A., Saloutin V.I., Charushin V.N. A concise approach to CF3-containing furan-3-ones, (bis)pyrazoles from novel fluorinated building blocks based on 2,3-butanedione // Tetrahedron Lett. 2014, 55, 5714-5717; Бажин Д.Н., Кудякова Ю.С., Бургарт Я.В., Салоутин В.И. Внутримолекулярная циклизация литий 4,4-диметокси-1-(перфторалкил)-3-оксопент-1-ен-1-олятов под действием эфирата трехфтористого бора // Известия РАН, Серия химич. 2018, 67, 497-499].
Анализ целевых соединений проводят с использованием ЯМР-спектроскопии (Спектры ЯМР 1H, 19F регистрировались на спектрометрах Bruker DRX-400 (400 МГц) Bruker AVANCEIII-500 (500 МГц), внутренние стандарты ТМС и C6F6), газовой хроматографии/масс-спектрометрии (газовый хроматограф-масс-спектрометр Agilent GC 7890А MS 5975С Inert XL EI/CI с квадрупольным масс-спектрометрическим детектором) и элементного анализа на автоматическом анализаторе Perkin-Elmer РЕ-2400.
Изобретение иллюстрируется следующими примерами.
Пример 1.
К раствору 1.235 г (5 ммоль) дикетоната IIa в 15 мл 95%-ного этанола добавляли 0.524 г (5 ммоль) гидразин дигидрохлорида кипятили 3 часа, растворитель упаривали, остаток промывали водой. Выход соединения Ia составил 0.84 г (95 %).
Белый порошок, т.пл. 103-104°C.
Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.: 2.54 (3Н, c, Me), 7.51 (1H, c), 14.63 (1H, c, NH).
Спектр ЯМР 19F (376 МГц, ДМСО-d6/C6F6), δ, м.д.: 102.03 (3F, с, CF3).
Элементный анализ для C6H5F3N2O (178.11).
Найдено (%): С, 40.39; H 2.78; N 15.64.
Вычислено (%): С, 40.46; H, 2.83; N, 15.73.
Данные ГХ-МС: время удерживания 10.70 мин. Масс-спектр: 178.1 [M+].
Пример 2.
К раствору 1.42 г (5 ммоль) дикетоната IIb в 15 мл 95%-ного этанола добавляли 0.524 г (5 ммоль) гидразин дигидрохлорида, кипятили 3 часа, растворитель упаривали, остаток промывали водой. Выход соединения Ib составил 1.03 г (90 %).
Белый порошок, т.пл. 86-87°C.
Спектр ЯМР 1H (500 МГц, ДМСО-d6), δ, м.д.: 2.55 (3Н, c, Me), 7.54 (1H, c), 14.73 (1H, c, NH).
Спектр ЯМР 19F (470 МГц, ДМСО-d6/C6F6), δ, м.д.: 51.6 (2F, м, CF2), 78.9 (3F, м, CF3).
Элементный анализ для C7H5F5N2O (228.12).
Найдено (%): С, 36.73; H, 2.13; N, 12.21.
Вычислено (%): С, 36.86; H, 2.21; N, 12.28.
Данные ГХ-МС: время удерживания 11.08 мин. Масс-спектр: 228.1 [M+].
Пример 3.
К раствору 1.67 г дикетоната IIc (5 ммоль) в 15 мл 95%-ного этанола добавляли 0.524 г гидразин дигидрохлорида (5 ммоль), кипятили 3 часа, растворитель упаривали, остаток промывали водой. Выход соединения Ic составил 1.28 г (92 %).
Белый порошок, т.пл. 71-72°C.
Спектр ЯМР 1H (500 МГц, ДМСО-d6), δ, м.д.: 2.55 (3Н, c, Me), 7.52 (1H, c), 14.63 (1H, c, NH).
Спектр ЯМР 19F (470 МГц, ДМСО-d6/C6F6), δ, м.д.: 36.0 (2F, c, CF2), 53.5 (2F, м, CF2), 82.9 (3F, м, CF3).
Элементный анализ для C8H5F7N2O (278.13).
Найдено (%): С, 34.49; H, 1.77; N, 9.98.
Вычислено (%): С, 34.55; H, 1.81; N, 10.07.
Данные ГХ-МС: время удерживания 11.67 мин. Масс-спектр: 278.1 [M+].
Пример 4.
К раствору 1.92 г дикетоната IId (5 ммоль) в 15 мл 95%-ного этанола добавляли 0.524 г гидразин дигидрохлорида (5 ммоль), кипятили 3 часа, растворитель упаривали, остаток промывали водой. Выход соединения Id составил 1.51 г (92 %).
Белый порошок, т.пл. 73-74°C.
Спектр ЯМР 1H (500 МГц, ДМСО-d6), δ, м.д.: 2.55 (3Н, c, Me), 7.54 (1H, c), 14.73 (1H, c, NH).
Спектр ЯМР 19F (470 МГц, ДМСО-d6/C6F6), δ, м.д.: 37.05 (2F, м, CF2), 39.9 (2F, м, CF2), 44.5 (2F, м, CF2), 82.1 (3F, м, CF3).
Элементный анализ для C9H5F9N2O (328.13).
Найдено (%): С, 32.88; H, 1.48; N, 8.45.
Вычислено (%): С, 32.94; H, 1.54; N, 8.54.
Данные ГХ-МС: время удерживания 12.39 мин. Масс-спектр: 328.1 [M+].
Пример 5.
К раствору 1.31 г дикетоната IIIa (5 ммоль) в 15 мл 95%-ного этанола добавляли 0.524 г гидразин дигидрохлорида (5 ммоль), кипятили 3 часа, растворитель упаривали, остаток промывали водой. Выход соединения Ia составил 0.82 г (92 %).
Пример 6.
К раствору 1.56 г (5 ммоль) дикетоната IIIb в 15 мл 95%-ного этанола добавляли 0.524 г (5 ммоль) гидразин дигидрохлорида, кипятили 3 часа, растворитель упаривали, остаток промывали водой. Выход соединения Ib составил 1.07 г (94 %).
Пример 7.
К раствору 1.81 г дикетоната IIIc (5 ммоль) в 15 мл 95%-ного этанола добавляли 0.524 г гидразин дигидрохлорида (5 ммоль), кипятили 3 часа, растворитель упаривали, остаток промывали водой. Выход соединения Ic составил 1.27 г (91 %).
Пример 8.
К раствору 2.06 г дикетоната IIId (5 ммоль) в 15 мл 95%-ного этанола добавляли 0.524 г гидразин дигидрохлорида (5 ммоль), кипятили 3 часа, растворитель упаривали, остаток промывали водой. Выход соединения Id составил 1.48 г (90 %).
| название | год | авторы | номер документа |
|---|---|---|---|
| ФТОРСОДЕРЖАЩИЕ ПИРАЗОЛИЛТИОСЕМИКАРБАЗОНЫ С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2021 |
|
RU2772460C1 |
| ФТОРСОДЕРЖАЩИЕ 1,3-ДИКЕТОНЫ С ГИДРАЗОНОБЕНЗОЙНЫМ ЗАМЕСТИТЕЛЕМ В КАЧЕСТВЕ АНТИФРИКЦИОННЫХ ПРИСАДОК К ПЛАСТИЧНЫМ СМАЗКАМ | 2022 |
|
RU2796025C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ФЕНИЛ-3-(ТРИФТОРМЕТИЛ)-1Н-ПИРАЗОЛ-4-АМИНА | 2017 |
|
RU2642924C1 |
| 4-(4-Метоксифенилдиазенил)-3,5-диметил-1-(4-нитрофенил)-1H-пиразол с антимикотической активностью в отношении штаммов патогенных грибов - дерматофитов | 2021 |
|
RU2772381C1 |
| 3-БУТИЛ-5-ОКСИ-5-ПЕРФТОРОКТИЛ-4,5-ДИГИДРО-1H-ПИРАЗОЛ-1-КАРБОТИОАМИД В КАЧЕСТВЕ СТАНДАРТНОГО ОБРАЗЦА СОСТАВА ДЛЯ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ФТОРА И СЕРЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2603634C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРАЛКИЛСОДЕРЖАЩИХ ТРИБУТИЛСТАННАНОВ | 2023 |
|
RU2807921C1 |
| Способ получения 4'-(трифторметил)-2,2':6',2''-терпиридина | 2020 |
|
RU2723682C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(1-АДАМАНТИЛ)-3,4-ДИНИТРО-5-(ТИО-R)-1Н-ПИРАЗОЛОВ | 2013 |
|
RU2533711C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(1-АДАМАНТИЛ)-3,4-ДИНИТРО-5(N-НИТРОПИРАЗОЛИЛ)-1H-ПИРАЗОЛОВ | 2013 |
|
RU2532268C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-АМИНОЗАМЕЩЕННЫХ 1-(1-АДАМАНТИЛ)-3,4-ДИНИТРО-1Н-ПИРАЗОЛОВ | 2013 |
|
RU2533557C1 |
Изобретение относится к способу получения производных пиразола формулы I, в которой RF обозначают перфторалкильную группу, а именно CF3 (a), C2F5 (b), C3F7 (c), C4F9 (d). Способ заключается в том, что 4,4-диалкокси-1-(перфторалкил)пентан-1,3-дионаты лития, где алкокси-заместитель равен метокси- или этокси-группе, нагревают при температуре 75-78°С с эквимолярным количеством гидразиндигидрохлорида в этаноле в течение 4-6 часов. Технический результат - одностадийный способ получения 1-[5-(перфторалкил)-1Н-пиразол-3-ил]этанонов, с высоким выходом. 2 табл., 8 пр.
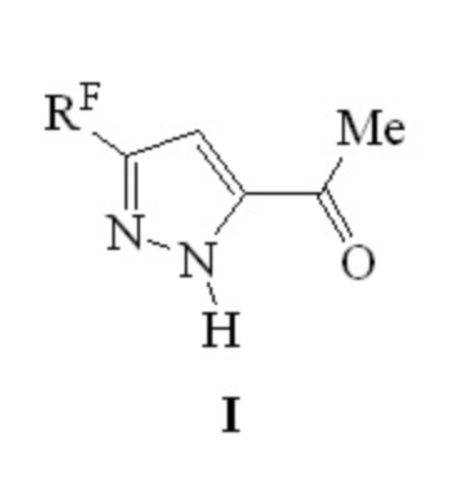
Способ получения производных пиразола формулы I,
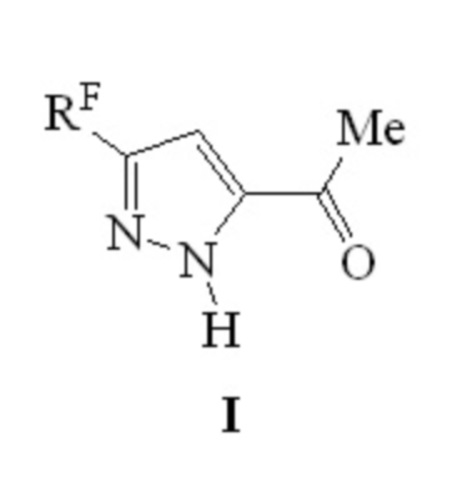
в которой RF обозначают перфторалкильную группу, а именно CF3 (a), C2F5 (b), C3F7 (c), C4F9 (d), отличающийся тем, что 4,4-диалкокси-1-(перфторалкил)пентан-1,3-дионаты лития, где алкокси-заместитель равен метокси- или этокси-группе, нагревают при температуре 75-78°С с эквимолярным количеством гидразиндигидрохлорида в этаноле в течение 4-6 часов.
| Denis N.Bazhin, Dmitry L.Chizhov D.L., et al.: "A concise approach to CF3-containing furan-3-ones, (bis)pyrazoles from novel fluorinated building blocks based on 2,3-butanedione", Tetrahedron Letters, 2014, vol.55, p.5714-5717 | |||
| Yulia S.Kudyakova, Aleksandra Ya.Onoprienko et al.: "Fluorine-containing furan-3(2H)-ones in reactions with |
Авторы
Даты
2021-01-26—Публикация
2020-04-30—Подача