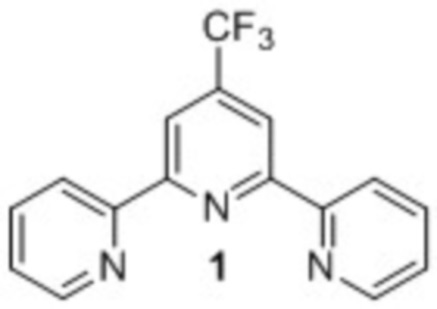
Изобретение относится к области органической химии, в частности к способу получения 4'-(трифторметил)-2,2':6',2''-терпиридина (1) (далее – терпиридин 1) – эффективного лиганда в катализируемых никелем реакциях кросс-сочетания по Негиши [A. Joshi-Pangu, M. Ganesh, M. R. Biscoe Nickel-Catalyzed Negishi Cross-Coupling Reactions of Secondary Alkylzinc Halides and Aryl Iodides. Org. Lett., 2011. Vol. 13, No. 5, p. 1218 – 1221. doi:10.1021/ol200098d].
В литературе представлено 3 наиболее важных подхода к формированию 2,2':6',2''-терпиридиновой системы: метод, Крёнке, конденсация Поттса, реакция кросс-сочетания с использованием методики Стилле.
Известен способ получения 2,2':6',2''–терпиридинов – метод Крёнке, состоящий из следующих стадий: альдольно-кротоновая конденсация между 2-ацетилпиридином и альдегидом с образованием енона, присоединение по Михаэлю второй молекулы 2-ацетилпиридина, замещение одного из атомов кислорода в образовавшемся 1,5-дикетоне на азотсодержащую группировку и последующих циклизации и окислительной ароматизации. Процесс осуществляют по схеме 1.
Схема 1.
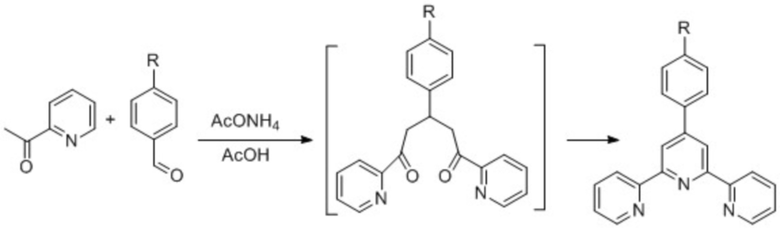
В литературе представлены различные синтетические модификации метода Крёнке, сохраняющие описанный выше подход к созданию терпиридинового фрагмента [F. Krohnke. The specific synthesis of pyridines and oligopyridines. Synthesis. 1976, p. 1-24; M.W. Cooke, P. Tremblay, G.S. Hanan Carboxy-derived (tpy) Ru2+2 complexes as sub-units in supramolecular architectures: The solubilized ligand 4'-(4-carboxyphenyl)-4,4''-di-(tert-butyl)tpy and its homoleptic Ru(II) complex. Inorg. Chim. Acta. 2008. V. 361, p. 2259-2269; Р.Б. Ромашкина, А.Г. Мажуга, Е.К. Белоглазкина, Д.А. Пичугина, М.С. Аскерка, А.А. Моисеева, Р.Д. Рахимов, Н.В. Зык. Серосодержащие производные терпиридина: синтез, координационные свойства, адсорбция на поверхности золота. Изв. АН, сер. хим. 2012. Т. 61, с. 2244 – 2260].
Примеров получения 4'-фторалкилсодержащих 2,2':6',2''–терпиридинов (в том числе терпиридина 1) методом Крёнке в литературе нет. Это связано с тем, что фторалкилсодержащие альдегиды являются труднодоступными соединениями, склонными к гидратации и полимеризации; трифторацетальдегид, необходимый для синтеза терпиридина 1, при комнатной температуре является газом (Т. кип. = -19oC), работа с которым требует специальных синтетических приемов.
Также известен способ получения 2,2':6',2''-терпиридинов – конденсация Поттса [Y.-W. u Zhong, C.-J. Yao, H.-J. Nie. Electropolymerized films of vinyl-substituted polypyridine complexes: Synthesis, characterization, and applications. Coord. Chem. Rev. 2013. V. 257, p. 1357–1372; K.T. Potts. б, б'-Oligopyridines: A source of new materials. Bull. Soc. Chim. Belg. 1990. V. 99, p. 741-768; J.-P. Sauvage, M. Ward. A bis(terpyridine)ruthenium(II) catenate. Inorg. Chem. 1991. V. 30, p. 3869-3874].
Способ состоит из следующих стадий: енолят 2-ацетилпиридина или его производного реагирует с сероуглеродом в присутствии метил иодида. Образовавшийся дитиоацеталь α-оксокетона при взаимодействии с одним эквивалентом калиевого енолята 2-ацетилпиридина дает непредельный 1,5–дикетон. Далее непредельный 1,5–дикетон при кипячении в уксусной кислоте с ацетатом аммония циклизуется в 4'-метилтио-2,2':6',2''-терпиридин, после чего происходит замена метилтиогруппы или обессеривание. Процесс осуществляется по схеме 2.
Схема 2
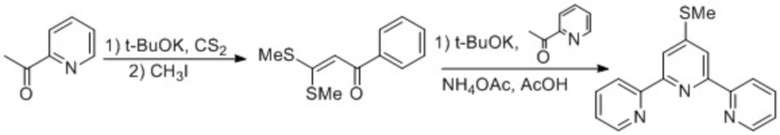
Примеров получения 4'-фторалкилсодержащих 2,2':6',2''–терпиридинов (в том числе терпиридина 1) конденсацией Поттса в литературе нет.
В качестве ближайшего аналога (прототипа) выбран единственный способ получения терпиридина 1 реакцией кросс-сочетания 2,6-дихлор-4-трифторметилпиридина и 2-пиридил-трибутилстаннана в присутствии тетракис(трифенилфосфин)палладия в толуоле. [Reza-Ali Fallahpour, Markus Neuburger and Magareta Zehnder New J. Chem. 1999, p. 53-61]. Процесс осуществляют по схеме 3.
Схема 3
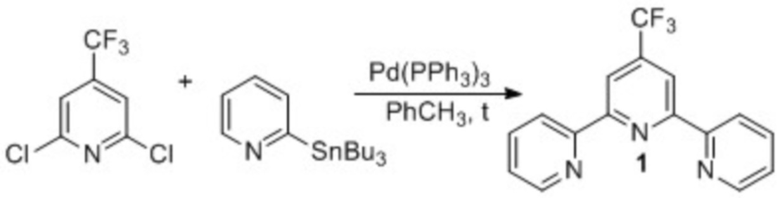
В осушенную пламенем колбу добавляют 120 мг (0,56 ммоль) 2,6-дихлор-4-трифторметилпиридина, 511 мг (1.39 ммоль) 2-пиридил-трибутил станнана, 10 мл толуола. Колбу трижды вакуумируют и заполняют сухим аргоном. Далее в реакционную массу добавляют тетракис(трифенилфосфин)палладий (под аргоном) и кипятят 20 часов. Мониторинг реакции осуществляют при помощи спектроскопии ЯМР 1H. По окончании реакции реакционную массу обрабатывают насыщенным раствором NH4Cl (~5 мл), трижды экстрагируют EtOAc. Объединенные органические экстракты промывают раствором NaCl и сушат над Na2SO4. Очищают колоночной хроматографией (элюент – смесь CH2Cl2 и MeOH, 20:1). Выход 30%.
К недостаткам ближайшего аналога (прототипа) следует отнести:
1. Использование труднодоступных, токсичных реагентов: 2-пиридил-трибутил станнана, 2,6-дихлор-4-трифторметилпиридина.
2. Использование в качестве катализатора дорогостоящего тетракис(трифенилфосфин)палладия. Он неустойчив на воздухе (кислород воздуха окисляет палладиевый катализатор, провоцирует гомо-сочетание оловоорганического соединения, снижая выход и затрудняя выделение и очистку целевого продукта), поэтому процесс проводят в атмосфере аргона с использованием тщательно осушенных посуды (открытое пламя газовой горелки), реагентов и растворителей.
3. Трудоёмкость процесса из-за сложного аппаратурного оформления процесса и необходимости подготовительных операций.
4. Использование для мониторинга хода реакции дорогостоящего трудоемкого метода спектроскопии ЯМР 1Н.
Задачей изобретения является разработка простого способа получения терпиридина 1 с использованием доступных, дешевых, стабильных реагентов.
Поставленная задача решается использованием способа получения терпиридина 1 взаимодействием литий (Z)-1,1,1-трифтор-4-оксо-4-(2-пиридинил)-2-бутен-2-олата (далее – дикетоната 2) с ацетатом аммония в диглиме. Процесс осуществляется по схеме 4.
Схема 4
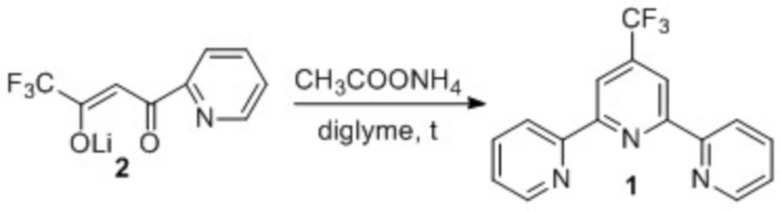
Сущность предложенного способа заключается в следующем. Предлагают новый подход к формированию 2,2':6',2''-терпиридиновой системы – использование реакции дикетоната 2 с ацетатом аммония в диглиме.
Дикетонат 2 доступен, устойчив при хранении, удобен в обращении, не токсичен. Дикетонат 2 получают конденсацией этилового эфира трифторуксусной кислоты с 2-ацетилпиридином под действием гидрида лития с выходом 92%, в синтезах используют в виде технического продукта без дополнительной очистки. [П. А. Слепухин, Н. С. Болтачева, В. И. Филякова, В. Н. Чарушин. Синтез и строение 3-(трифторметил)-1,3-дикетонатов лития, содержащих 2-, 3- или 4-пиридинильные заместители. Изв. Ан, сер. хим. 2019, № 6, с. 1213-1218]. Ацетат аммония – товарный продукт.
Способ получения включает одну химическую стадию – взаимодействие дикетоната 2 с ацетатом аммония в диглиме. (Схема 4).
Способ осуществляют следующим образом. В круглодонную колбу, снабженную обратным холодильником, помещают дикетонат 2, диглим, ацетат аммония (двукратный мольный избыток) и кипятят 10 часов. Установлено, что десяти часов достаточно для завершения реакции; уменьшение времени реакции приводит к снижению выхода терпиридина 2, увеличение времени реакции приводит к образованию побочных продуктов реакции – изомерных терпиридинов. По окончании реакции реакционную массу выливают в воду, экстрагируют хлористым метиленом. Выделяют путем хроматографического разделения на силикагеле при элюировании хлористым метиленом, поскольку чистого хлористого метилена достаточно для селективного отделения целевого продукта. Добавление каких-либо дополнительных компонентов в элюент приведет к его необоснованному расходу.
Состав и структуру терпиридина 1 устанавливают при помощи данных хромато-масс-спектрометрии (ГХ-МС), элементного анализа, ИК и ЯМР (1H, 19F) - спектроскопии.
Изобретение позволяет:
1. Исключить из процесса труднодоступные и токсичные реагенты 2,6-дихлор-4-трифторметилпиридин, 2-пиридил-трибутил станнан, заменив их доступными, нетоксичными, удобными в обращении реагентами – дикетонатом 2 и ацетатом аммония.
2. Исключить из процесса труднодоступный, дорогостоящий, не устойчивый на воздухе катализатор: тетракис(трифенилфосфин)палладий, что существенно упрощает аппаратурное оформление, снижает трудоемкость процесса.
3. Сократить время реакции с 20-ти до 10-ти часов.
4. Упростить контроль за ходом реакции за счет использования метода ТСХ.
Возможность осуществления заявляемого изобретения показана следующим примером.
Пример 1. Получение 4'-(трифторметил)-2,2':6',2''-терпиридина 1.
К раствору 1.2 г (0.0054 моль) дикетоната 2 в 4 мл диглима добавляют 0.83 г (0.01 моль) ацетата аммония и кипятят 10 часов. Реакционную массу выливают в воду, экстрагируют хлористым метиленом. Хлористый метилен упаривают, остаток хроматографируют на колонке (элюент – хлористый метилен). Получают 0.28 г (35%) белого порошка. Т. пл. = 144-145°С. Найдено, %: С 63.77; Н 3.38; N 13.96; F 18.95. Брутто-формула: C16H10F3N3. Вычислено, %: С 63.79; Н 3.46; N 13.95; F 18.92. ИК спектр (dra), н/см–1: 1587, 1568, 1468, 1448, 1404, 1374, 1265, 1168, 1124, 1091, 1070, 994, 895, 839, 792, 717, 663, 621. Спектр ЯМР 1H (500 MHz, CDCl3) д м. д.: 8.77 м (2H), 8.74 с (2H), 8.66 д (J = 8.3 Гц, 2H), 7.92 т. д (J = 7.8, 1.5 Гц, 2H), 7.42 м (2H). Спектр ЯМР 19F (470.5 МГц, CDCl3, C6F6 – внутренний стандарт), д (м. д.): 97.12 с (CF3). ГХ-МС: фуд = 22,91. Масс-спектр, m/z (Iотн, %): 301 (100) [M]+; 273 (24); 232 (18) [M- CF3]+; 223 (16) [M-Py2]+; 203 (8) [M-Py2-HF]+; 151 (10); 128 (8); 78 (28) [Py2]+; 51 (10).
| название | год | авторы | номер документа |
|---|---|---|---|
| 5-ФЕНИЛ-5""-п-ТОЛИЛ-2,2":6",2""-ТЕРПИРИДИН - ХЕМОСЕНСОР ДЛЯ ФЛУОРЕСЦЕНТНОГО ОПРЕДЕЛЕНИЯ КАТИОНОВ Zn В ВОДНЫХ И ПИЩЕВЫХ ОБРАЗЦАХ | 2021 |
|
RU2773238C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРАЛКИЛСОДЕРЖАЩИХ ТРИБУТИЛСТАННАНОВ | 2023 |
|
RU2807921C1 |
| 4-ГИДРОКСИПИРАН-2-ОНЫ, ЦИКЛООКТИЛ-ИЛИ БЕНЗОПИРАН-2-ОНЫ, 4-ГИДРОКСИ-2Н-ПИРАН-2-ОНЫ И 4-ГИДРОКСИ-ЦИКЛООКТАПИРАН-2-ОНЫ | 1995 |
|
RU2139284C1 |
| РАДИОАКТИВНЫЙ ИММУНОРЕАГЕНТ НАПРАВЛЕННОГО ДЕЙСТВИЯ, КОМПОЗИЦИЯ ДЛЯ ПОЛУЧЕНИЯ ИЗОБРАЖЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ В ОРГАНИЗМЕ, СПОСОБ ПОЛУЧЕНИЯ ИЗОБРАЖЕНИЯ И КОМПЛЕКСООБРАЗУЮЩИЙ АГЕНТ | 1992 |
|
RU2122431C1 |
| ТРИАЗОЛО[4,3-А][1,4]-БЕНЗОДИАЗЕПИНЫ И ТИЕНО[3,2-F]-[1,2,4]-ТРИАЗОЛО[4,3-А] [1,4]ДИАЗЕПИНЫ, В СЛУЧАЕ НАЛИЧИЯ ПО МЕНЬШЕЙ МЕРЕ ОДНОГО АСИММЕТРИЧЕСКОГО ЦЕНТРА ИХ ЭНАНТИОМЕРЫ, РАЦЕМАТЫ И ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ ПРИСОЕДИНЕНИЯ КИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИНГИБИРУЮЩАЯ ФАКТОР АКТИВАЦИИ ТРОМБОЦИТОВ. | 1992 |
|
RU2094436C1 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ БЛОКАДЫ РЕЦЕПТОРОВ НЕЙРОКИНИНА-1 У МЛЕКОПИТАЮЩИХ, СПОСОБ ДЛЯ БЛОКАДЫ РЕЦЕПТОРОВ НЕЙРОКИНИНА-1 У МЛЕКОПИТАЮЩИХ | 1993 |
|
RU2140914C1 |
| СПОСОБ РЕГИСТРАЦИИ РЕЗУЛЬТАТА РЕАКЦИИ ПОЛИМЕРИЗАЦИИ ДНК И УСТРОЙСТВО ДЛЯ ЕГО РЕАЛИЗАЦИИ | 2019 |
|
RU2724507C1 |
| РЕЗЕРВУАРНОЕ ВЫЧИСЛИТЕЛЬНОЕ УСТРОЙСТВО НА ОСНОВЕ МЕТАЛЛОРГАНИЧЕСКОГО КАРКАСНОГО ПОЛИМЕРА И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2022 |
|
RU2796048C1 |
| ПРОИЗВОДНЫЕ ПИРИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ИНСЕКТИЦИДНАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2083562C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТЕТРАЗАМЕЩЕННЫХ 4-ДИАЗО-5,5-ДИАЛКИЛ-2,2-ДИАРИЛДИГИДРОФУРАН-3(2Н)-ОНОВ | 2014 |
|
RU2562247C1 |
Изобретение касается нового способа получения 4'-(трифторметил)-2,2':6',2''-терпиридина 1
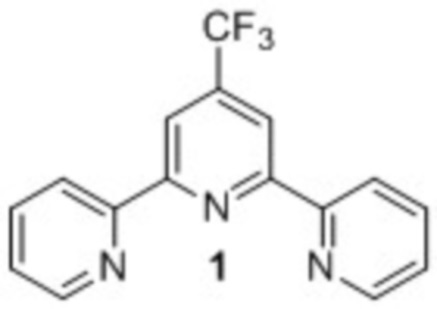
эффективного лиганда в катализируемых никелем реакциях кросс-сочетания по Негиши путем взаимодействия литий (Z)-1,1,1-трифтор-4-оксо-4-(2-пиридинил)-2-бутен-2-олата с двукратным мольным избытком ацетата аммония в диглиме с последующим выливанием в воду, экстракцией хлористым метиленом, упариванием хлористого метилена, выделением конечного продукта путем хроматографического разделения на силикагеле при элюировании хлористым метиленом. Способ позволяет исключить труднодоступные и токсичные реагенты, дорогостоящий, не устойчивый на воздухе катализатор, упростить аппаратурное оформление процесса, снизить трудоемкость процесса, сократить время реакции с 20-ти до 10-ти часов, упростить контроль за ходом реакции за счет использования метода ТСХ. 1 пр.
Способ получения 4'-(трифторметил)-2,2':6',2''-терпиридина 1,
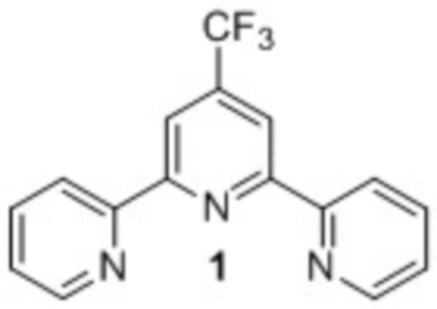
заключающийся в том, что смесь литий (Z)-1,1,1-трифтор-4-оксо-4-(2-пиридинил)-2-бутен-2-олата с двукратным мольным избытком ацетата аммония в диглиме кипятят 10 часов, реакционную массу выливают в воду, экстрагируют хлористым метиленом, хлористый метилен упаривают, целевой продукт выделяют путем хроматографического разделения на силикагеле при элюировании хлористым метиленом.
| F | |||
| Krohnke | |||
| The specific synthesis of pyridines and oligopyridines | |||
| Synthesis | |||
| Планшайба для точной расточки лекал и выработок | 1922 |
|
SU1976A1 |
| Reza-Ali Fallahpour, Markus Neuburger and Magareta Zehnder New J | |||
| Chem | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
Авторы
Даты
2020-06-17—Публикация
2020-02-03—Подача