Изобретение относится к области биотехнологии, касается ассоциированной вакцины, которая может быть использована для специфической профилактики болезней кроликов, индуцируемых вирусами вирусной геморрагической болезнью 1 и 2 типов, миксоматозом и бактериями пастереллеза.
Кролиководство - отрасль животноводства, производящая такую ценную продукцию, как диетическое мясо, шкурка и мех. Среди вирусных болезней кроликов, являющихся в настоящее время актуальными и вызывающими большие экономические потери, следует выделить миксоматоз, пастереллез и вирусную геморрагическую болезнь кроликов.
Миксоматоз - острое высококонтагиозное вирусное заболевание кроликов, характеризующееся воспалением слизистых оболочек, серозным или серозно-гнойным конъюнктивитом, образованием студенистых отеков (миксом) в области головы и других частях тела животного. Заболевание вызывает ДНК-содержащий вирус, относящийся к семейству Poxviridae, роду Leporipoxvirus [1, 2].
Пастереллез - острое высококонтагиозное инфекционное заболевание кроликов, характеризующееся различными клиническими признаками: ринит, конъюнктивит, отит, абсцессы, бронхопневмония. Острое течение заболевания чаще всего вызывают различные серовары P. multocida, относящиеся к серогруппе А, хроническую форму болезни вызывают серогруппы А и D в ассоциации. Представители вида P. multocida разделяются на 5 капсульных серогрупп (А, В, D, Е и F) и 16 серовариантов по соматическому антигену. У кроликов заболевание вызывают пастереллы серогрупп А, В и D по капсульному антигену [3, 4].
Вирусная геморрагическая болезнь кроликов (ВГБК) - острое высококонтагиозное вирусное заболевание кроликов, характеризующееся явлениями геморрагического диатеза в различных органах, преимущественно в печени, легких и почках. Заболевание вызывает РНК-содержащий вирус, относящийся к семейству Caliciviridae, роду Lagovirus. Заболевание протекает преимущественно без клинических признаков, может наблюдаться угнетение животных, снижение аппетита. При ВГБК возникает геморрагическое воспаление практически всех органов и отмечается высокая смертность животных [5].
Миксоматоз, пастереллез и вирусная геморрагическая болезнь кроликов наносят значительный экономический ущерб кролиководству в виде падежа, введения карантинных мер, резкого падения производительности, снижения качества получаемой продукции, уменьшения прироста поголовья.
В острой форме миксоматоз у кроликов протекает стремительно и заканчивается 95-100%-ным летальным исходом [6, 7]. В связи с этим кролиководческие хозяйства при возникновении миксоматоза несут огромный экономический ущерб в виде массовой гибели животных, введения карантинных мер и резкого падения производительности. По данным МЭБ за последние три года вспышку миксоматоза регистрировали в Кировской области (2018 г.).
Также в последнее время серьезной проблемой для кролиководства стала вирусная геморрагическая болезнь кроликов - высококонтагиозная, остропротекающая инфекция, сопровождающаяся явлениями геморрагического диатеза в различных органах, особенно в печени и легких [8, 9, 10, 11].
Оба заболевания своему распространению по континентам обязаны человеку и исторически взаимосвязаны, так как их возбудители последовательно культивировались фермерами Австралии с целью сокращения численности популяции кроликов, являющихся экологической проблемой местного сельского хозяйства [9, 12, 13, 14, 15].
Распространение заболеваемости ВГБК очень велико. По информации МЭБ вспышки ВГБК за последние три года наблюдали в Швеции (2017), Финляндии (2017-2019), Казахстане (2017), Израиле (2017-2018), США (2018-2019), Новой Зеландии (2018), Канаде (2018-2019), Норвегии (2019), Ирландии (2019). На 2019 г. по ВГБК неблагополучны такие страны, как Новая Зеландия, Дания, Канада, Норвегия, США и Финляндия. В России за последние три года вспышки ВГБК регистрировали в Забайкальском крае (2017), Московской области (2018), Тверской области (2018), Красноярском крае (2019) [2, 8].
Миксоматоз и вирусная геморрагическая болезнь кроликов приносят большой экономический ущерб кролиководству - летальность в среднем составляет 70-90% от всего поголовья [6, 7, 16, 17]. Основные пути заражения - алиментарный и респираторный. Источниками заражения являются больные, переболевшие и павшие кролики. В качестве факторов передачи служат контаминированные возбудителем корма, объекты окружающей среды, включая почву, воду, поверхности помещений, оборудования, транспортных и технических средств, человек [6, 8, 18, 19].
Большое опасение вызывает появление нового серотипа ВГБК. Данный серотип отличается от предыдущего тем, что к нему восприимчив и молодняк менее 2-недельного возраста. Еще одной особенностью возбудителя является то, что он преодолевает видовой барьер и поражает не только кроликов, но и зайцев некоторых видов.
Вакцины, в состав которых входят RHDV и RHDVa, не защищают кроликов от RHDV2. Сначала он был зарегистрирован во Франции в 2010 году, а позже в Австралии (2015 г.), Канаде (2016) [2]. В 2018 году данный серотип был выявлен в Тверской и Московской области Российской Федерации, а зарегистрированных вакцин против данного серотипа на территории нашей страны в настоящий момент нет. Поэтому разработка вакцины против ВГБК 2 является актуальнейшей задачей.
Пастереллез - опасное инфекционное заболевание кроликов, которое наряду с вирусной геморрагической болезнью кроликов и миксоматозом наносит огромный экономический ущерб кролиководческим хозяйствам. Хотя нарушение дыхания (от ринита до пневмонии) является распространенным проявлением пастереллеза у кроликов, оно также может проявляться различными клиническими признаками, такими как генитальные инфекции, абсцессы, отит и сепсис, или может происходить в скрытой форме без проявления каких-либо признаков. Смертность составляет от 15 до 75%. Экономический ущерб при пастереллезе складывается из гибели животных, ухудшения качества мяса и шкурок, плохого развития молодняка [3, 4].
В России по данным МЭБ пастереллез был зарегистрирован в следующих регионах: Республика Марий Эл (2015), Красноярский край (2018), Орловская область (2019).
Для предотвращения вспышек миксоматоза и ВГБК существуют моновакцины и ассоциированные вакцины. В РФ зарегистрированы вакцины против миксоматоза и ВГБК как отечественных производителей (ФГБНУ ФИЦВиМ, ОАО «Покровский завод биопрепаратов», ООО «Торговый дом «БиАгро») так и зарубежных («Merial», Франция; «Laboratorios Hipra, S.A.», Испания; «Intervet International B.V.», Нидерланды). Официально зарегистрированных вакцин против пастереллеза кроликов в РФ нет. Кролиководы вынуждены применять вакцины против пастереллеза КРС, жвачных животных, свиней.
Ассоциированной вакцины против миксоматоза, пастереллеза и ВГБК 1 и 2 типов в РФ не зарегистрировано, несмотря на то, что данные болезни являются для кроликов особо опасными, высококонтагиозными инфекциямии, наносящими большой экономический ущерб, приводя к гибели большое число поголовья.
На данный момент разработка новых препаратов для искоренения миксоматоза, пастереллеза и вирусной геморрагической болезни кроликов является одной из важнейших задач вакцинопрофилактики [6, 8, 11, 14, 18].
Эффективность предупреждения указанных заболеваний во всем мире связывают главным образом с применением инактивированных моно- и бивалентных вакцин. При этом вакцинопрофилактика до последнего времени остается единственным фундаментально проработанным методическим приемом для эффективного противостояния инфекционным болезням при выращивании кроликов.
Однако каждый тип вакцин, используемых для специфической профилактики вышеуказанных заболеваний кроликов, имеет преимущества и недостатки.
Применение инактивированных моновалентных вакцин ограничено необходимостью одновременной вакцинации против нескольких инфекций в короткий промежуток времени. Кроме того, многократное повторение индивидуального способа вакцинации сказывается на затратах труда, растягивает сроки образования иммунитета у кроликов, способствует возникновению стрессовых явлений и осложнений.
Указанные недостатки частично устранены разработкой и применением в кролиководстве ассоциированных инактивированных вакцин, имеющих в составе разнообразное количественное и качественное соотношение антигенов.
Известен способ подготовки и инактивации вакцины против пастереллеза кроликов [UA 27906 (U) от 16.04.2007 г.]. Способ получения вакцины, включает культивирование эпизоотических штаммов рода Pasteurella для накопления бактериальной массы, приготовление корпускулярного инактивированного антигена, добавление адъюванта и определение уровня защиты препарата. Инактивацию штамма рода Pasteurella осуществляют 0,5% водным раствором перекиси водорода в течение 12 часов [20, 26].
Известна прополисная бивалентная вакцина против геморрагической болезни кроликов и пастереллеза инактивированная и способ ее получения [патент CN 105169380, от 15.09.2015 г.]. Данная вакцина содержит тканевую суспензию вируса геморрагической болезни кроликов и жидкий антиген штамма Pasteurella multocida, инактивированные прополисом. Вакцина имеет 100% показатель иммунной защиты кроликов против геморрагического заболевания и 90% показатель иммунной защиты против пастереллеза, длительный период хранения [21].
Известна вакцина ассоциированная против стрептококкоза и вирусной геморрагической болезни кроликов [патент RU 2429879 от 12.04.2010 г.]. Данная вакцина предназначена для профилактики инфекционных заболеваний у кроликов, в частности стрептококкоза и вирусной геморрагической болезни, содержит суспензию клеток чистой культуры возбудителя стрептококкоза Str. pneumoniae и суспензию печени кроликов с вирусом вирусной геморрагической болезни кроликов, выделенных из местного эпизоотического очага, инактивированы формалином, на гидроокись алюминии [22].
Известна вакцина, ассоциированная против колибактериоза, стрептококкоза и вирусной геморрагической болезни кроликов [патент RU 2443775 от 29.06.2010 г.]. Вакцина в качестве антигенов содержит суспензию клеток чистой культуры возбудителя колибактериоза E.coli, стрептококкоза Str. pneumoniae и вируса геморрагической болезни кроликов, полученных путем отбора пораженных органов от павших кроликов из местного эпизоотического очага [23].
Известна трехвалентная вакцина для кроликов [патент CN 101708332 от 30.11.2009 г.]. Вакцина изготовлена, главным образом из вирусной суспензии вируса геморрагической болезни кролика, из бактериальной массы штаммов Pasturella multocida типа А и Clostridium perfringens, является инактивированной и имеет объемное соотношение 1:1:2 [24].
По данным патентной и научно-технической литературы не обнаружена аналогичная совокупность признаков, в части компонентов, что позволяет судить об изобретательском уровне заявленного технического решения.
Что касается критерия «промышленная применимость», то компоненты, входящие в состав вакцин, известны и широко применяются в ветеринарной практике при изготовлении вакцин: ассоциированная вакцина против миксоматоза и вирусной геморрагической болезни кроликов (СТО 00495549-0044-2007); ассоциированная вакцина против сальмонеллеза, пастереллеза и энтерококковой инфекции поросят ТУ 10.09-62-90, утверждено 01.08.90 г., вакцина против геморрагической болезни кроликов тканевая инактивированная гидроокись алюминиевая СТО 00495549-0005-2006; представлены все необходимые сведения о микроорганизмах. Однако для кроликов некоторые вакцины не применяются, или содержат в своем составе отличные от предлагаемого изобретения компоненты.
Общим существенным недостатком известных ассоциированных вакцин, является их недостаточно высокая эффективность вследствие несоответствия антигенного профиля используемых в составе вакцины специфических антигенов эпизоотической обстановке.
Таким образом, при всем многообразии и достаточно широком спектре предлагаемых вакцин против болезней кроликов нет ни одного препарата, в состав которого входили бы вирусные антигены (ВГБК, миксоматоз) и бактериальный антиген (пастереллез), при этом антигены ВГБК и пастереллеза - инактивированы, а антиген миксоматоза, представляет собой аттенуированный вирусный материал. Впервые используется сорбированный инактивированный компонент вакцины в качестве разбавителя сухого компонента живого вируса, тем самым снижается уровень разбавления вирусных компонентов.
Известно также, что при изготовлении ассоциированных вакцин с валентностью выше трех происходит значительное взаимное разведение содержащихся в них антигенных компонентов. В результате происходит снижение их концентрации в прививном объеме препарата. При этом возможность повышения концентрации вирусов при помощи культивирования ограничена. В связи с этим одним из наиболее важных технологических показателей является их оптимальное соотношения в прививном объеме вакцины, что обеспечивало бы формирование напряженного иммунитета у кроликов. Немаловажным в производстве инактивированных вакцин является выбор адъюванта, который обеспечивал бы стабильность вакцины, индукцию и персистенцию высоких титров антител у привитых кроликов при отсутствии побочных эффектов в местах своего введения, а также удобство применения вакцины в производственных условиях.
В ассоциированной вакцине компоненты против вируса геморрагической болезни кроликов и пастереллеза являются инактивированными. Для снижения реактогенности вакцины и полноценной инактивации вируса, необходимо провести его очистку от клеточного детрита. Для очистки вирусов от балластных белков существуют физические, физико-химические и химические методы [25]. В предлагаемом изобретении представлен метод очистки, при котором происходит наименьшая потеря антигена и который максимально очищает его от клеточного детрита, при изготовлении данной вакцины использовали хлороформ.
В моновакцинах против вирусной геморрагической болезни кроликов для инактивации вируса используют формальдегид. Недостатком при использовании формальдегида для инактивации вирусов является часто наблюдаемые «хвосты» инфекционного вируса, образование поперечных связей в вирусных белках, существенное снижение антигенной активности. В данном изобретении для инактивации вирусного материала был использован аминоэтилэтиленимин (АЭЭИ). Преимуществом его использования является минимальное повреждение структуры антигена во время инактивации, надежность и продолжительность протекания реакции, а также воздействие только на генетический материал вируса. Инактивация вируса происходит за счет депуренизации и последующей деполимеризации нуклеиновых кислот [25].
Однако формальдегид (выпускаемый в виде водного 36-40% раствора), используют для инактивации бактериальных антигенов. Для бактериальных штаммов этот инактивант имеет относительно невысокую токсичность и себестоимость, прост в применении и обеспечивает надежную сохранность иммунобиологических препаратов.
При изготовлении предлагаемой вакцины для инактивации вируссодержащей суспензии использовали АЭЭИ в конечной концентрации для ВГБК1 - 0,3%, для ВГБК2 - 1,0%, для инактивации бактерий штамма Pasteurella multocida использовали формальдегид в конечной концентрации 0,1%.
Поэтому проблема получения высокоэффективной ассоциированной вакцины против основных возбудителей заболеваний кроликов остается актуальной и является основным направлением исследований по созданию искомого препарата.
Задача, на решение которой направлено настоящее изобретение, заключается в получении вакцины ассоциированной, содержащей в своем составе инактивированные вирусные и бактериальный агенты и живой аттенуированный вирусный агент, создающей эффективную защиту кроликов от заражения возбудителями миксоматоза, пастереллеза и вирусной геморрагической болезни кроликов 1 и 2 типов. Основным показателем эффективности применения препарата является защита кроликов от миксоматоза, пастереллеза и вирусной геморрагической болезни кроликов 1 и 2 типов - современных эпизоотических штаммов, а также создание защиты от перекрестного заражения кроликов вирусом геморрагической болезни 1 и 2 типов.
Технический результат от использования предлагаемого изобретения заключается в расширении арсенала высокоиммуногенных, безвредных и ареактогенных ассоциированных вакцин против возбудителей инфекционных болезней кроликов, циркулирующих на территории Российской Федерации.
Указанный технический результат достигнут созданием ассоциированной вакцины против миксоматоза, пастереллеза и вирусной геморрагической болезни кроликов 1 и 2 типов, охарактеризованной следующей совокупностью признаков.
Согласно изобретению предлагаемая вакцина содержит в качестве активного вещества смесь из аттенуированного антигенного материала из штамма «Миксо/ВНИИЗЖ-18» вируса миксоматоза кроликов; из инактивированного очищенного антигенного материала из штамма «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов 1 типа; из инактивированного очищенного антигенного материала из штамма «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов 2 типа; из инактивированного очищенного антигенного материала из штамма №1231 Pasteurella multocida, взятых в эффективных количествах, обеспечивающих протективную иммунную активность в организме животного после введении ему целевого препарата. В качестве целевой добавки предлагаемая вакцина содержит в качестве адъюванта гидроокись алюминия (производство «ВНИИЗЖ») и стабилизирующую среду.
В предлагаемой вакцине активное вещество и целевая добавка объединены в соотношении: для жидкого компонента, об. %: 50,0÷50,0; для сухого компонента - активное вещество и целевая добавка объединены в соотношении, об. %: 91,8÷8,8: жидкий компонент и сухой компонент смешиваются в соотношении 1:1.
Предлагаемое изобретение включает следующую совокупность существенных признаков, обеспечивающих получение технического результата во всех случаях, на которые спрашивается правовая охрана:
1. Вакцина, ассоциированная против миксоматоза, пастереллеза и вирусной геморрагической болезни кроликов 1 и 2 типов.
2. Активное вещество в виде смеси из лиофильно высушенного живого аттенуированного антигенного материала из штамма «Миксо/ВНИИЗЖ-18» вируса миксоматоза кроликов, сем. Poxviridae, подсемейства Chordopoxvirinae,, рода Leporipoxvirus, коллекция ФГБУ «ВНИИЗЖ» под регистрационным номером: №120 - деп/19-10 - КШМ ФГБУ «ВНИИЗЖ»; из инактивированного очищенного антигенного материала из штамма «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов сем. Caliciviridae, рода Lagovirus, виду Rabbit hemorrhagic disease virus 1 типа, коллекция ФГБУ «ВНИИЗЖ» под регистрационным номером: №305 - деп/20-93 - ГКШМ ФГБУ «ВНИИЗЖ»; из инактивированного очищенного антигенного материала из штамма «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов, сем. Caliciviridae, рода Lagovirus, виду Rabbit hemorrhagic disease virus 2 типа, коллекция ФГБУ «ВНИИЗЖ» под регистрационным номером: №306 - деп/20-94 - ГКШМ ФГБУ «ВНИИЗЖ»; из инактивированного очищенного антигенного материала из штамма №1231 Pasteurella multocida, сем. Pasteurellaceae, рода Pasteurella, типа А, коллекция ФГБУ «ВНИИЗЖ» под регистрационным номером: №307 - деп/20-95 - ГКШМ ФГБУ «ВНИИЗЖ»
3. Целевые добавки
Существенные отличительные признаки предлагаемой вакцины заключаются в том, что в качестве активного вещества она содержит смесь из инактивированных очищенных антигенных материалов из штаммов «ВГБК1/ВНИИЗЖ» и «ВГБК2/ВНИИЗЖ» вируса ВГБК и штамма №1231 Pasteurella multocida, и аттенуированного лиофилизированного вирусного материала из штамма «Миксо/ВНИИЗЖ-18» вируса миксоматоза кроликов, в эффективном количестве.
Предлагаемое изобретение характеризуется также другими отличительными признаками, выражающими конкретные формы выполнения или особые условия его использования:
1. Антигенный материал из штамма «Миксо/ВНИИЗЖ-18» вируса миксоматоза кроликов, полученный предпочтительно в перевиваемой культуре клеток RK-13/91, в эффективном количестве.
2. Антигенный материал из штамма «Миксо/ВНИИЗЖ-18» вируса миксоматоза кроликов, полученный предпочтительно в перевиваемой культуре клеток RK-13/91, представляющий собой аттенуированную лиофилизированную вирусную суспензию с инфекционной активностью не менее 6,5±0,25 lg ТЦД50/см3 и инфекционной активностью на кроликах - не менее 3,0±0,25 lg ИД50/см3 количестве 91,8 об. %.
3. Инактивированный и очищенный антигенный материал из штамма «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов 1 типа, полученный предпочтительно из 10%-ной печеночной суспензии кролика, зараженного штаммом «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов 1 типа, представляющий собой вирусную суспензию в эффективном количестве.
4. Инактивированный и очищенный антигенный материал из штамма «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов 1 типа, полученный предпочтительно из 10%-ной печеночной суспензии кролика, зараженного штаммом «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов 1 типа, представляющий собой вирусную суспензию с инфекционной активностью на кроликах не менее 4,0±0,25 lg ЛД50/см3, количестве 12,5 об. %.
5. Инактивированный и очищенный антигенный материал из штамма «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов 2 типа, полученный предпочтительно из 10%-ной печеночной суспензии кролика, зараженного штаммом «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов 2 типа, представляющий собой суспензию в эффективном количестве.
6. Инактивированный и очищенный антигенный материал из штамма «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов 2 типа, полученный предпочтительно из 10%-ной печеночной суспензии кролика, зараженного штаммом «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов 2 типа, представляющий собой вирусную суспензию с инфекционной активностью на кроликах не менее 5,25±0,25 lg ЛД50/см3, в количестве 12,5 об. %.
7. Инактивированный и очищенный антигенный материал из штамма №1231 Pasteurella multocida типа А, полученный предпочтительно путем глубинного культивирования на лабораторном биореакторе АК-210, в жидкой питательной среде приготовленной на основе триптического гидролизата мяса по Хоттингеру с концентрацией аминного азота 250-300 мг %, с добавлением в качестве источника V-фактора роста 2%-ного дрожжевого экстракта, в эффективном количестве.
8. Инактивированный и очищенный антигенный материал из штамма №1231 Pasteurella multocida типа А, полученный путем глубинного культивирования на лабораторном биореакторе АК-210, в жидкой питательной среде приготовленной на основе триптического гидролизата мяса по Хоттингеру с концентрацией аминного азота 250-300 мг %, с добавлением в качестве источника V-фактора роста 2%-ного дрожжевого экстракта, представляющий собой бактериальную суспензию с инфекционной активностью на кроликах 3,0±0,25 ЛД50/см3, в количестве 25,0 об. %.
9. Из целевых добавок вакцина содержит гидроокись алюминия.
10. 3%-ный гель гидроокиси алюминия.
11. Вакцина содержит 3%-ный гель гидроокиси алюминия в количестве не менее 50,0 об. %.
12. Дополнительно из целевых добавок вакцина содержит стабилизирующую среду.
13. Стабилизирующая среда состоит из: гидролизат лактальбумина (ГЛА) - 4%, сахарозы - 4%, желатозы - 0,8%.
14. Вакцина содержит стабилизирующую среду: гидролизат лактальбумина (ГЛА) - 4%, сахарозы - 4%, желатозы - 0,8%, в количестве 8,8 об. %.
15. Смесь из инактивированных и очищенных антигенных материалов из штамма «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов 1 типа, из штамма «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов 2 типа, из штамма №1231 Pasteurella multocida типа А; лиофилизированного аттенуированного антигенного материала из штамма «Миксо/ВНИИЗЖ-18» вируса миксоматоза кроликов и целевые добавки: стабилизирующую среду и адъювант гидроокись алюминия в количестве, об. %:
Сухой компонент:
Жидкий компонент:
В результате проведенных исследований авторы определили важнейшие технологические показатели, позволившие создать препарат, в котором отсутствует конкуренция между антигенами, входящими в состав предлагаемой вакцины, а его иммуногенные свойства были сравнимы с таковыми после применения монопрепаратов. Высокий иммунологический эффект в отношении специфических антигенов, входящих в состав вакцины, был достигнут путем получения вирусных и бактериального компонентов в составе вакцины, обладающих безвредностью, иммуногенностью и антигенной активностью, а так же вариант оптимального их соотношения в составе вакцины, обеспечивающих выработку защитного уровня антител, т.е. создание напряженного иммунитета к заболеваниям у кроликов.
Предлагаемая вакцина обладает высокой иммуногенной активностью и обеспечивает надежную защиту против вируса миксоматоза и вирусной геморрагической болезни кроликов 1 и 2 типов; против изолятов пастереллеза, циркулирующих на территории Российской Федерации.
Дополнительный технический результат от использования предлагаемого изобретения достигается за счет того, что для инактивации вируссодержащих материалов используют аминоэтилэтиленимин (АЭЭИ), что позволяет значительно снизить трудо- и энергозатраты на изготовление вакцины и повысить качество антигенных материалов.
Дополнительный технический результат от использования предлагаемого изобретения достигается за счет того, что представленные активные вещества (жидкого и сухого компонентов), перед использованием готового препарата смешиваются в соотношении 1:1, обеспечивающем антигенную и иммуногенную активность целевого продукта.
Сущность изобретения отражена на графических материалах:
Фиг. 1 - Дендрограмма, отражает филогенетическое взаимоотношения штаммов вируса миксоматоза «Миксо/ВНИИЗЖ-18» с эпизоотическими и вакцинными штаммами вируса миксоматоза. Дендрограмма основана на сравнении полных нуклеотидных последовательностях гена m071L.
Фиг. 2 - Дендрограмма, отражает филогенетическое взаимоотношения штаммов вируса геморрагической болезни кроликов «ВГБК1/ВНИИЗЖ» с эпизоотическими и вакцинными штаммами вируса ВГБК. Дендрограмма основана на сравнении полных нуклеотидных последовательностях гена VP60.
Фиг. 3 - Дендрограмма, отражает филогенетическое взаимоотношения штаммов вируса геморрагической болезни кроликов «ВГБК2/ВНИИЗЖ» с эпизоотическими и вакцинными штаммами вируса ВГБК. Дендрограмма основана на сравнении полных нуклеотидных последовательностях гена VP60.
Исходный вирус для получения штамма вируса миксоматоза кроликов получен из института экспериментальной зоопрофилактики (Италия), как классический вариант миксоматоза кроликов, который был выделен в Северной Италии «Мухо№278». Путем последовательных пассажей в культуре клеток почки кролика RK-13/91 из штамма «Мухо№278» был получен культуральный вирус «Миксо/ВНИИЗЖ-18» миксоматоза кроликов.
Штамм «Миксо/ВНИИЗЖ-18» вируса миксоматоза кроликов депонирован в Коллекции штаммов микроорганизмов ФГБУ «ВНИИЗЖ» под регистрационным номером: №120 - деп /19-10 - КШМ ФГБУ «ВНИИЗЖ».
Штамм «Миксо/ВНИИЗЖ-18» вируса миксоматоза кроликов характеризуется следующими признаками и свойствами.
Морфологические признаки
Штамм «Миксо/ВНИИЗЖ-18» относится к семейству Poxviridae, подсемейству Chordopoxvirinae, роду Leporipoxvirus, виду Myxoma virus: форма вириона кирпичевидная, размер ~ 280 нм. Вирион состоит из нуклеоида, имеющего форму двояковогнутого диска и содержащего ДНК. По обе стороны от нуклеоида расположены овальные структуры - боковые тела. Липопротеидная оболочка вируса покрыта беспорядочно расположенными ворсинками с трубчатым строением. Геном представлен двуспиральной нитчатой не фрагментированной ДНК, длиной приблизительно от 147,6 т.п.н. до 161,8 т.п.н.
Антигенные свойства
По своим антигенным свойствам штамм «Миксо/ВНИИЗЖ-18» вируса миксоматоза кроликов имеет 3 антигена: L и S (часто в комплексе LS) и нуклеопротеидный NP. Антигены L и S являются неинфекционными, располагаются на поверхности вириона, обладают преципитирующей и комплементсвязывающей активностью, L - термолабилен. Антиген NP - структурный белок нуклеокапсида, характерный для всех представителей семейства Poxviridae. Вирус стабильно нейтрализуется гомологичной антисывороткой, у переболевших кроликов в сыворотке крови образуются антитела, выявляемые в иммуноферментном анализе (ИФА) При иммунизации кроликов вакциной индуцирует образование специфических антител, выявляемых в ИФА.
Методом нуклеотидного секвенирования определена первичная структура гена вируса миксоматоза штамма «Миксо/ВНИИЗЖ-18» и выведена первичная структура белка. Сравнительный анализ нуклеотидных последовательностей показал, что штамм «Миксо/ВНИИЗЖ-18» вируса миксоматоза не отличается от изолятов и штаммов, выделенных в Европе, со значением bootstrap в пределе от 70 до 100% (Фиг. 1).
На территории Российской Федерации циркулируют штаммы и изоляты возбудителя миксоматоза, имеющие практически 100% гомологию с европейскими штаммами по участку гена m071L, кодирующему основной оболочечный протеин вируса.
Таким образом, филогенетический анализ показал, что штамм «Миксо/ВНИИЗЖ-18» принадлежит к генетической линии представителей ВМК, в соответствии с данными GenBank.
Гено- и хемотаксономические характеристики
Штамм «Миксо/ВНИИЗЖ-18» является двухспиральным ДНК-содержащим вирусом, покрытым оболочкой. Липопротеидная оболочка представляет собой ворсинки с трубчатым строением. В своем составе вирус имеет белки (88% массы вириона), ДНК (5% массы вириона), липиды (4% массы вириона), углеводы (3% массы вириона).
Штамм «Миксо/ВНИИЗЖ-18» проявляет генетическую стабильность.
Биотехнологические характеристики
Штамм «Миксо/ВНИИЗЖ-18» вируса миксоматоза кроликов культивируется в перевиваемых клеточных линиях: почки кролика (RK-13/91), вызывая цитопатическое действие (ЦПД), и в течение 48-96 часов инкубирования накапливается в титрах от 6,5 до 7,0 lg ЦПД50/см3. Результаты адаптации вируса ВМК штамма «Миксо/ВНИИЗЖ-18» к культуре клеток RK-13/91 представлены в таблице 1.
Цитоморфологические изменения при культивировании штамма «Миксо/ВНИИЗЖ-18» ВМК имеют специфические параметры, которые позволяют в достаточной степени объективно устанавливать его ЦПД.
Штамм «Миксо/ВНИИЗЖ-18» является стабильным и сохраняет свои свойства на протяжении 10 пассажей (срок наблюдения).
Устойчивость к внешним факторам
Вирус миксоматоза чувствителен к действию трипсина, полностью инактивируется эфиром, устойчив к высушиванию. Прогревание вируса в течение часа при температуре 56°С вызывает его инактивацию. При минусовых температурах вирус сохраняет инфекционность до 6 месяцев.
В трупах животных, погибших от миксоматоза, сохраняется до 7 дней, в высушенных шкурках - до 10 месяцев, в почве - до 2 лет. Вирус миксоматоза в шкурках кролика пресно-сухой консервации инактивируется при температуре 19-23°С через 159 дней; при температуре 4-6°С - через 570 дней, а при 0-3°С через 720 дней.
Надежными дезинфектантами в отношении вируса миксоматоза являются растворы формальдегида и едкой щелочи.
Дополнительные признаки и свойства
Реактогенность - реактогенными свойствами не обладает.
Патогенность - патогенен для кроликов любой породы и возраста.
Вирулентность - вирулентен для естественно-восприимчивых животных при контактном заражении, трансмиссивным путем и механическим через контаминированные вирусом миксоматоза корма, инвентарь, животных, птиц и людей.
Стабильность - сохраняет исходные биологические свойства при пассировании в течение 10 пассажей (срок наблюдения) в перевиваемых культурах клеток почек кролика (RK-13/91).
Свободен от контаминации бактериями, микоплазмами и посторонними вирусами.
Для получения антигенного материала их штамма «Миксо/ВНИИЗЖ-18» вируса миксоматоза кроликов в качестве чувствительной биологической системы используют преимущественно монослойную перевиваемую культуру клеток почки кролика RK-13/91 (КК ПК RK-13/91), выращенную в 1,5 дм3 матрасах.
Для сохранения инфекционной активности в процессе сушки к вируссодержащему материалу добавляют стабилизатор или стабилизирующую среду, обеспечивающую максимальное сохранение биологической активности штамма «Миксо/ВНИИЗЖ-18» вируса миксоматоза кроликов. В качестве стабилизатора используют среду следующего состава: гидролизат лактальбумина (ГЛА) - 4,0%, желатоза - 0,8%, сахароза - 4,0%. Лиофилизацию проводят в лиофильной установке, предварительно смешивают живой аттенуированный антигенный материал и стабилизирующую среду в количественном соотношении 0,9:0,1; готовый препарат расфасовывают во флаконы, охлаждают до минус 45°С в морозильной камере. Затем замороженный материал в кассетах быстро переносят (не более 2-3 мин) из морозильной камеры в сублимационную камеру, которую герметично закрывают и включают вакуум-насос. Величина вакуума в аппарате от 4 Па до 7 Па. Исходная температура полок с высушиваемым материалом от минус 50°С до минус 55°С. Конечная температура полок аппарата в процессе высушивания от 30°С до 40°С. Градиент повышения температуры полок от исходного до конечного значения варьирует от 10 до 15% в сек. Конечная температура высушиваемого материала от 20°С до 23°С. Досушивание материала при указанной температуре проводится от 4 до 6 час.
Для изготовления предлагаемой вакцины используют лиофильно высушенный живой материал из штамма «Миксо/ВНИИЗЖ-18» вируса миксоматоза кроликов, полученный в культуру клеток RK-13/91 с инфекционной активностью не менее 6,5±0,25 lg ТЦД50/см3, в количестве не менее 91,8 об. %.
Вирусный штамм, послуживший источником для получения производственного штамма «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов (1 тип), выделен путем освежения и масштабирования штамма «RHDVaPv97» ВГБК 1 типа, полученного из института экспериментальной зоопрофилактики (Италия), в организме восприимчивых животных (кроликов).
Штамм «ВГБК1/ВНИИЗЖ» вируса ВГБК 1 типа депонирован в коллекции штаммов микроорганизмов ФГБУ «ВНИИЗЖ» под регистрационным номером: №305 - деп / 20-93 ГКШМ ФГБУ «ВНИИЗЖ».
Штамм «ВГБК1/ВНИИЗЖ» имеет генетические и феногенетические особенности. Культивируется на естественно восприимчивых животных -кроликах in vivo, при этом обладает инфекционной, антигенной и иммуногенной активностью в нативном виде и сохраняет высокую антигенную и иммунногенную активность после инактивации.
Морфологические признаки
Штамм «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов относится к порядку Picornavirales, классу Pisoniviricetes, семейству Caliciviridae, роду Lagovirus, виду Rabbit hemorrhagic disease virus. Вирус кубической симметрии, имеет форму икосаэдра, диаметром ~ 30 нм, имеет чашеобразные углубления. Геном представлен одноцепочечной положительной линейной несегментированной РНК, длиной приблизительно около 7,5-8,5 т.п.н.
Антигенные свойства
По антигенным свойствам штамм «ВГБК1/ВНИИЗЖ» относится к 1 типу.
Вирус стабильно нейтрализуется гомологичной антисывороткой.
Вирус реагирует с антителами переболевших или иммунизированных животных в реакции ИФА. При вакцинации естественно-восприимчивых животных инактивированный вирус индуцирует образование вирусспецифических антител на защитном уровне, который способствует образованию иммунитета от данного заболевания (значения протективного уровня антител зависят от применяемого диагностического набора).
Генотаксономическая характеристика
При генетической идентификации образца штамма «ВГБК1/ВНИИЗЖ» методом ПЦР и нуклеотидного секвенирования установлена его принадлежность к ВГБК 1 типа (Фиг. 2), т.е. первому типу генетической группы G6, и полное соответствие по нуклеотидным последовательностям гена VP60 заявленному штамму в соответствии с базой данных GenBank.
Биотехнологические характеристики
Штамм «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов культивируется в организме восприимчивых животных (кроликах). Вирусный материал получают путем заражения животных 10%-ной печеночной суспензии, полученной из печени павшего от «ВГБК1/ВНИИЗЖ» кролика. Штамм «ВГБК1/ВНИИЗЖ», освеженный в течение 2-х последовательных пассажей на кроликах вызывает летальность в период от 24 до 72 часов при прямом и контактном заражении с проявлением характерных для ВГБК клинических и патологоанатомических признаков.
Штамм «ВГБК1/ВНИИЗЖ» является стабильным и сохраняет свои исходные характеристики при пассировании на указанных восприимчивых животных на протяжении 5 последовательных пассажей (срок наблюдения).
Физические свойства Вирус устойчив к обработке эфиром, хлороформом, рН 3,0 и к температуре 50°С в течение 60 мин. Он сохраняется в суспензии инфицированной печени при минус 40°С в течение 1 года, минус 20°С - 3 года, минус 50°С - 5 лет без снижения вирулентности; инактивируется 0,1%-ным формальдегидом при 40°С в течение суток. Дополнительные признаки и свойства
Антигенная активность - обладает антигенностью в составе инактивированной вакцины и препарата для гипериммунизации доноров диагностических сывороток.
Реактогенность - реактогенными свойствами не обладает.
Стабильность - сохраняет исходные биологические (антигенные) свойства при пассировании на кроликах в течение 10 серийных пассажей (срок наблюдения).
Патогенность - патогенен для кроликов любой породы. Патогенен для кроликов старше 1,5-месячного возраста.
Вирулентность - выражена.
Контагиозность - выражена.
Инфекционная активность штамма при титровании на кроликах живой массой 2,5-3,0 кг составила не менее 4,0±0,25 lg ЛД50/см3.
Контаминация бактериями, грибами и микоплазмами отсутствует. Высевы суспензии образца штамма «ВГБК1/ВНИИЗЖ» вируса на соответствующие питательные среды без проростов в течение всего срока наблюдения.
Для получения антигенного материала из штамма «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов 1 типа в качестве биологической системы используют преимущественно 10%-ную печеночную суспензию, полученную из печени кролика, зараженного штаммом «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов 1 типа. Полученный вируссодержащий материал очищают от балластных примесей центрифугированием или другим известным способом.
Для инактивации штамма «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов 1 типа используют аминоэтилэтиленимин (АЭЭИ), который добавляют в очищенную вируссодержащую суспензию до концентрации 0,3%. Инактивацию вируса проводят при температуре 37°С в течение 72 часов при значении рН 7,6-7,8 с периодическим перемешиванием суспензии (каждые 5-6 часов по 3-5 минут). По окончании инактивации АЭЭИ нейтрализуют внесением в антигенный материал тиосульфата натрия. Для этого в охлажденную суспензию антигена добавляют 2 М раствора тиосульфата натрия из расчета 10% к объему использованного АЭЭИ.
Для изготовления сорбированной - жидкой части ассоциированной вакцины используют инактивированный очищенный антигенный материал из штамма «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов 1 типа, полученного из 10%-ной печеночной суспензии больного кролика, зараженного штаммом «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов 1 типа, с инфекционной активностью на кроликах не менее 4,0±0,25 lg ЛД50/см3, в количестве 12,5 об. %
Вирусный штамм, послуживший источником для получения производственного штамма «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов (2 тип), выделен путем освежения и масштабирования штамма «RHDV2Ch14» вируса геморрагической болезни кроликов 2 типа, полученного из института экспериментальной зоопрофилактики (Италия), в организме восприимчивых животных (кроликов).
Штамм «ВГБК2/ВНИИЗЖ» вируса ВГБК 2 типа депонирован в коллекции штаммов микроорганизмов ФГБУ «ВНИИЗЖ» под регистрационным номером: №306 - деп / 20-94 ГКШМ ФГБУ «ВНИИЗЖ».
Штамм «ВГБК2/ВНИИЗЖ» культивируется только на естественно восприимчивых животных - кроликах in vivo, при этом обладает инфекционной, антигенной и иммуногенной активностью в нативном виде и сохраняет высокую антигенную и иммунногенную активность после инактивации.
Морфологические признаки
Штамм «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов относится к порядку Picornavirales, классу Pisoniviricetes, семейству Caliciviridae, роду Lagovirus, виду Rabbit hemorrhagic disease virus. Обладает морфологическими признаками, характерными для вируса геморрагической болезни кроликов: вирус кубической симметрии, имеет форму икосаэдра, диаметром ~ 30 нм, имеет чашеобразные углубления. Геном представлен одноцепочечной положительной линейной несегментированной РНК, длиной приблизительно около 7,5-8,5 т.п.н. Антигенные свойства
Основным протективным антигеном вируса является Vp 60, при инъецировании которым у кролика формируется иммунитет.
По своим антигенным свойствам штамм «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов принадлежит к геногруппе RHDV2 (тип 2).
Вирус стабильно нейтрализуется гомологичной антисывороткой.
При вакцинации естественно-восприимчивых животных вирусный антиген индуцирует образование специфических антител, выявляемых в ИФА.
Таким образом, представленный штамм «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов позволяет обеспечить защиту от заражения изолятами серотипа RHDV2.
Гено- и хемотаксономические характеристики
Штамм «ВГБК2/ВНИИЗЖ» относится к серотипу RHDV2.
Возбудитель является РНК-содержащим вирусом со средним молекулярной массой 2,1 кД. Геном представлен одноцепочечной положительной линейной несегментированной РНК, длиной приблизительно около 7,5-8,5 т.п.н. Вирион представляет собой лишенный суперкапсидной оболочки сферический нуклеокапсид икосаэдрической симметрии, диаметром ~ 30 нм. На поверхности вирионов различают 32 чашеобразных углубления.
В капсидах вируса 4 вирионных белка - VP1, VP2, VP3, VP4. VP1 - основной капсидный белок, на долю которого приходится 54,7% массы капсидных белков, VP2 - минорный структурный белок. Синтезирован белок VP60 - уникальный компонент капсида ВГБК.
Филогенетическое родство штамма «ВГБК2/ВНИИЗЖ» изучено в ГЩР посредством сравнения со штаммами и изолятами, представленными в международной базе GenBank NCBI при помощи программы MEGA 6.0. Штамм «ВГБК2/ВНИИЗЖ» относится к серотипу RHDV2 и имеет близкое родство с изолятами 13-71 France, Е13-37 France, CBVal16, Zar2014-8 и Ssl1 Italy (Фиг. 3).
Биотехнологические характеристики
Штамм «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов 2 типа культивируется только на естественно восприимчивых животных -кроликах in vivo. Кроликов заражали 10% тканевой суспензией, приготовленной из печени зараженных кроликов, в дозе 4,0-5,0 lg ЛД50/см3.
Биологическая активность при титровании вируса каждого пассажа на естественно восприимчивых животных - кроликах, в течение 48-144 часов титр вируса достигает высоких значений от 4,0±0,25 до 5,0±0,25 lg ЛД50/см3. Штамм «ВГБК2/ВНИИЗЖ» является стабильным и сохраняет свои исходные характеристики при пассировании на указанных восприимчивых животных на протяжении 5 последовательных пассажей (срок наблюдения).
Устойчивость к внешним факторам
Штамм «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов устойчив к обработке эфиром, хлороформом, рН 3,0 и к температуре 50°С в течение 60 минут. В суспензии инфицированной печени сохраняется при 4°С в течение 1 года, минус 20°С - 3 года, минус 50°С - 5 лет без снижения вирулентности.
Чувствителен к формалину и глутаровому альдегиду. Инактивируется 0,1% формальдегидом или теотропином в течение суток. Дополнительные признаки и свойства Реактогенность - реактогенными свойствами не обладает.
Патогенность - патогенен для кроликов любой породы. Патогенен для кроликов 1-месячного возраста.
Вирулентность - высоковирулентен для естественно восприимчивых животных - кроликов, при контактном заражении.
Стабильность - сохраняет исходные биологические свойства при пассировании в чувствительных биологических системах в течение 10 пассажей (срок наблюдения) на кроликах.
Для получения антигенного материала из штамма «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов 2 типа используют преимущественно 10%-ную печеночную суспензию, полученную из печени кролика, зараженного штаммом «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов 2 типа. Полученный вируссодержащий материал освобождают от клеточного детрита и других балластных примесей низкоскоростным центрифугированием или любым другим известным способом.
Для инактивации штамма «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов 2 типа используют аминоэтилэтиленимин (АЭЭИ), который добавляют в очищенную вируссодержащую суспензию до концентрации 1,0%. Инактивацию вируса проводят при температуре 37°С в течение 24 часов при значении рН 7,6-7,8 с периодическим перемешиванием суспензии (каждые 5-6 часов по 3-5 минут). По окончании инактивации АЭЭИ нейтрализуют внесением в антигенный материал тиосульфата натрия. Для этого в охлажденную суспензию антигена добавляют 2 М раствора тиосульфата натрия из расчета 10% к объему использованного АЭЭИ.
Для изготовления сорбированной - жидкой части ассоциированной вакцины используют авирулентный очищенный антигенный материал из штамма «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов 2 типа, полученного из 10%-ной печеночной суспензии павшего кролика, зараженного штаммом «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов 2 типа, с инфекционной активностью на кроликах не менее 5,25±lg ЛД50/см3, в количестве 12,5 об. %.
Исходя из полученных данных анализа морфологических, биотехнологических, антигенных и дополнительных характеристик, можно утверждать, что штаммы «ВГБК1/ВНИИЗЖ» и «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов обладают высокой стабильностью при репродукции in vivo на кроликах, характеризуются высокими показателями титра инфекционной активности, штамм «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов позволяет обеспечить защиту от заражения изолятами и штаммами подтипа RHDVa/G6, а штамм «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов позволяет обеспечить защиту от заражения изолятами серотипа RHDV2.
Вирусный изолят, послуживший источником для получения производственного штамма бактерий №1231 Pasteurella multocida типа А выделен от поросенка и получен из Всероссийской государственной коллекции штаммов микроорганизмов, используемых в ветеринарии и животноводстве, ФГБУ «ВГНКИ».
Штамм №1231 Pasteurella multocida типа А депонирован в ФГБУ «ВНИИЗЖ» под регистрационным номером: №307 - деп / 20-95 ГКШМ ФГБУ «ВНИИЗЖ».
Штамм №1231 P. multocida пастереллеза кроликов характеризуется следующими признаками и свойствами.
Морфологические признаки
P. multocida штамм №1231 пастереллеза кроликов относится к семейству Pasteurellaceae, роду Pasteurella, виду Pasteurella multocida. Имеет форму коротких, овальных палочек размером 0,3-1,0 х 1-2 мкм, в культуре наряду с типичной формой встречаются мелкие коккообразные клетки, располагающиеся одиночно, парами и цепочками. В свежевыделенных культурах обнаруживают капсулу, которая не является продолжением клеточной культуры и ее утрата не вызывает существенных изменений в жизнедеятельности бактерий. При длительном культивировании капсула исчезает.Окрашивается по Граму - грамотрицательно. Не спорообразующий факультативный анаэроб.
Антигенная структура
У штаммов P. multocida в РИГА с эритроцитами барана идентифицируют 5 типов капсульных антигенов А, В, D, Е и F, которые являются полисахаридами. По капсульному антигену P. multocida штамм №1231 относится к серогруппе А.
Кулътуралъные свойства
Оптимальными температура для роста пастерелл являются 36-38°С и слабощелочная среда.
На МПА в течение суток вырастают мелкие (1-3 мм), похожие на капельки росы, полупрозрачные, сероватые, слегка выпуклые, гладкие колонии с ровными краями, имеют голубоватый оттенок. С увеличением колонии приобретают беловатую окраску, по форме напоминают пуговицу с приподнятым центром и периферическим валиком. Со временем колонии сливаются между собой, образуя на поверхности среды сплошную, тонкую и нежную пленку.
На кровяном агаре P. multocida растут так же, как на МПА, но значительно пышнее. На агаре Мак-Конки P. multocida не растет. На полужидком мясо-пептонном агаре рост происходит вдоль линии укола петлей, вначале в виде отдельных колоний, а затем образуется беловатый стержень без отростков. На поверхности желатиновых сред бактерия растет так же, как на агаровых средах, желатин не разжижает.
На МПБ рост сопровождается равномерным помутнением среды в первые сутки после посева. При встряхивании пробирки образуются «муаровые волны». На бульоне по Хоттингера растет в виде равномерного помутнения с небольшим осадком, который при встряхивании поднимается в виде «косички».
На 1,5% агаре на основе гидролизата по Хоттингеру образует полупрозрачные колонии, правильной округлой формы с ровными краями, с гладкой, выпуклой, блестящей поверхностью, слизистой консистенции, диаметром от 3,0 до 5,0 мм. В последующих пассажах может наблюдаться диссоциация и появление наряду с колониями S-формы шероховатых колоний R-формы.
Биохимические свойства
Штамм P. multocida №1231 не обладает желатиназой, лизин- и аргининдекарбоксилазой. Восстанавливает нитраты в нитриты. Дает положительную реакцию на каталазу, щелочную фосфатазу, и на оксидазу. Уреазу не синтезирует. Образует индол. Имеет орнитидиндекарбоксилазу. Ферментирует глюкозу, сахарозу, маннит с образованием кислоты без газа. Не ферментирует лактозу, мальтозу.
Биотехнологические характеристики
Наиболее подходящим методом получения бактериальной массы является глубинное культивирование. Данным методом штамм P. multocida культивируют на аппаратах АК-210 в жидкой питательной среде приготовленной на основе триптического гидролизата мяса по Хоттингеру. Температура питательной среды в биореакторе во время культивирования бактерий поддерживалась на постоянном уровне 37,0±0,2°С. Исходная среда перед внесением расплодочного материала характеризуется следующими физико-химическими показателями: рН - 7,5 ед., еН -+90 мВ, pO2 - 100%.
Биологическая активность при титровании возбудителя каждого пассажа на естественно восприимчивых животных - кроликах, в течение 24-48 часов титр вируса достигает значения 3 ЛД50 (60 КОЕ). Пастерелла сохраняет исходные характеристики при пассировании на указанных восприимчивых животных на протяжении 7 последовательных пассажей (срок наблюдения).
Гено- и хемотаксономические характеристики
По капсульному антигену P. multocida «1231» относится к серогруппе А.
Геном пастерелл сосредоточен в циркулярной хромосоме размером 2,257 млн. пар оснований. Он включает свыше 2000 кодируемых зон, 6 рРНК оперона и 57 тРНК при среднем размере одного гена - 997 пар оснований. Свыше 100 генов (5% генома) связаны с вирулентностью пастерелл.
Выявлено 50 генов (2,5% генома), продукты которых связаны с обменом железа. Обнаружены гены, отвечающие за образование капсулы, устойчивость пастерелл к лекарственным препаратам, хемотаксис бактерий.
Устойчивость к внешним факторам
В замороженных трупах штамм P. multocida сохраняется до 1 года. Высокая температура, напротив, вызывает быструю гибель возбудителя: 45-55°С за 45 мин, 58-62°С за 15-20 мин, 70-90°С за 5-10 мин.
Штамм P. multocida сохраняет жизнеспособность в условиях воздействия прямых солнечных лучей при температуре 15-20°С на протяжении 2 мес. В сухих субстратах, особенно при ограниченном доступе воздуха, погибает за 2-3 дня. В гниющих трупах возбудитель сохраняется 1-3 мес, а в навозе до 14 дней. В поверхностных слоях почвы и на траве пастереллы в зависимости от влажности, затененности и температуры сохраняют жизнеспособность от 5 дней до 4 мес, в воде - от 4 мес до 1 года, во льду - до 3-х недель. В жидких питательных средах под вазелиновым маслом или в запаянных пипетках P. multocida выживают в течение 5-12 мес. При хранении замороженных жидких культур хорошим криопротектором является 15% глицерин.
Надежными средствами дезинфекции при комнатной температуре являются 3% раствор NaOH (3 ч), 0,34% раствор формальдегида (1 ч), 3% водная эмульсия креолина (2 ч), растворы с концентрацией хлора 1:30000-1:40000 (1-2 ч), раствор сулемы 1:5000 и 5% раствор фенола (1 мин), 3% крезол и 1% раствор известкового молока (10 мин).
P. multocida чувствительна к ампициллину, байтрилу, неомицину, пенициллину, тетрациклину, хлорамфениколу, цефалоспоринам.
Дополнительные признаки и свойства
Реактогенность - реактогенными свойствами не обладает.
Патогенность - патогенен для кроликов и белых мышей. Титр ЛД50/см3 при подкожном заражении белых мышей (16-18 г.) составляет 25 КОЕ/см3.
Вирулентность - вирулентен для кроликов и белых мышей; передача возбудителя происходит аэрогенным и алиментарным путем, вертикальным путем, через поврежденный покров или слизистые оболочки.
Стабильность - сохраняет исходные биологические свойства при пассировании в питательных средах в течение 7 пассажей (срок наблюдения).
Свободен от контаминации микоплазмами и посторонними вирусами.
Исходя из полученных данных анализа морфологических, биотехнологических, антигенных и дополнительных характеристик, можно утверждать, что P. multocida штамм №1231 обладает высокой стабильностью при репродукции в бульоне Хоттингера, характеризуется высокими показателями титра инфекционной активности и обеспечивает защиту от пастереллеза кроликов типа А.
Для получения антигенного материала из штамма №1231 P. multocida типа А в качестве чувствительной биологической системы используют преимущественно жидкую питательную среду приготовленную на основе триптического гидролизата мяса по Хоттингеру с концентрацией аминного азота 250-300 мг %, с добавлением в качестве источника V-фактора роста 2%-ного дрожжевого экстракта. От среды освобождаются с использование проточного центрифугирования при 4000 об/мин. Полученную бактериальную суспензию ресуспендируют фосфатно-буферным раствором до первоначального объема, инактивируют 0,1% формальдегида (в виде водного 36-40%) раствора) при температуре 37°С и постоянном перемешивании (60 об/мин).
Для изготовления сорбированной формы предлагаемой вакцины используют инактивированный очищенный антигенный материал из штамма №1231 P. multocida типа А, полученного путем глубинного культивирования в биореакторе АК-210, с инфекционной активностью на кроликах 3,0±0,25 ЛД50/см3, в количестве не менее 25,0 об. %.
Получена ассоциированная вакцина для профилактической иммунизации кроликов против миксоматоза, пастереллеза и вирусной геморрагической болезни кроликов 1 и 2 типов.
Сущность предлагаемого изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
Пример 1. Приготовление предлагаемой вакцины
Для приготовления ассоциированной вакцины против миксоматоза, пастереллеза и вирусной геморрагической болезни кроликов 1 и 2 типа использовали штаммы вирусов и бактерий: штамм «Миксо/ВНИИЗЖ-18», штамм «ВГБК1/ВНИИЗЖ», штамм «ВГБК2/ВНИИЗЖ» и штамм №1231 P. multocida типа А.
Технологический процесс состоит из следующих технологических этапов:
получение вирусных суспензий из штаммов «Миксо/ВНИИЗЖ-18», штамм «ВГБК1/ВНИИЗЖ», штамм «ВГБК2/ВНИИЗЖ» и бактериальной суспензии штамма №1231 P. multocida;
определение активности каждой суспензии;
лиофилизация вирусного материала из аттенуированного штамма «Миксо/ВНИИЗЖ-18» отдельно;
инактивация вирус- и бактериосодержащих жидкостей штаммов «ВГБК1/ВНИИЗЖ», «ВГБК2/ВНИИЗЖ» и №1231 P. multocida отдельно;
объединение полученных инактивированных суспензий вирусов и бактерий;
добавления адьюванта к смеси инактивированных вирусов и бактерии;
расфасовка готового продукта - лиофилизированный аттенуированный антиген штамма «Миксо/ВНИИЗЖ-18» отдельно от смешанных объединенных инактивированных сорбированных компонентов.
Посевной материал, используемый для изготовления вакцины, получали в перевиваемой культуре клеток, питательной среде и на естественно восприимчивых животных (кроликах).
Для изготовления вакцины ассоциированной против миксоматоза, пастереллеза, вирусной геморрагической болезни кроликов 1 и 2 типов использовали культуральный аттенуированный вирус штамма «Миксо/ВНИИЗЖ-18», выращенный в 1,5 дм матрасах; 10%-ную печеночную суспензию содержащую вирус «ВГБК1/ВНИИЗЖ» ВГБК 1 типа; 10%-ную печеночную суспензию содержащую вирус «ВГБК2/ВНИИЗЖ» ВГБК 2 типа, бактериальную суспензию штамма №1231 P. multocida, выращенную в биореакторе АК-210.
Предлагаемая вакцина имеет оптимальный компонентный состав, об. %:
- Сухой компонент:
1. Антигенный материал из штамма «Миксо/ВНИИЗЖ-18» вируса миксоматоза кроликов, репродуцированный в перевиваемой культуре клеток RK-13/91, с инфекционной активностью не менее 6,5±0,25 lg ТЦД50/см3 в количестве 91,8 об. %.
2. Стабилизирующая среда, в количестве 8,8 об. %.
- Жидкий компонент:
3. Антигенный материал из штамма «ВГБК 1/ВНИИЗЖ» вируса геморрагической болезни кроликов 1 типа, полученный из 10%-ной печеночной суспензии кролика, зараженного штаммом «ВГБК 1/ВНИИЗЖ» вируса геморрагической болезни кроликов 1 типа, с инфекционной активностью на кроликах не менее 4,0±0,25 lg ЛД50/см3, в количестве 12,5 об. %.
4. Антигенный материал из штамма «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов 2 типа, полученный из 10%-ной печеночной суспензии кролика, зараженного штаммом «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов 2 типа, с инфекционной активностью на кроликах не менее 5,25±0,25 lg ЛД50/см3 в количестве 12,5 об. %.
5. Антигенный материал из штамма №1231 Pasteurella multocida типа А, полученный путем глубинного культивирования на лабораторном биореакторе АК-210, в жидкой питательной среде приготовленной на основе триптического гидролизата мяса по Хоттингеру с концентрацией аминного азота 250-300 мг %, с добавлением в качестве источника V-фактора роста 2%-ного дрожжевого экстракта, с инфекционной активностью на кроликах 3,0±0,25 ЛД50/см3, в количестве 25,0 об. %.
6. Адьювант 3%-ный гель гидроокиси алюминия в количестве не менее 50,0 об. %.
Содержимое антигенных материалов в предлагаемой вакцине в указанных выше концентрациях является их эффективным количеством в препарате, обеспечивающим достижение технического результата от использования изобретения.
Полученная вакцина представляет собой:
- лиофилизированная сухая однородная масса светло- или темно-бежевого цвета;
- жидкость бежево-коричневого цвета с осадком. При встряхивании легко разбивается в гомогенную взвесь.
Сосуды, в которых отмечали ЦПД вируса миксоматоза кроликов с поражением 70-80% клеточного монослоя исследования на стерильность. Отобранные сосуды (V=1,5 дм3) с культурой клеток RK-13/91 содержащей вирус штамма «Миксо/ВНИИЗЖ-18», прошедшие контроль на отсутствие контаминации, однократно замораживали и оттаивали при комнатной температуре, при этом клетки вируссодержащей суспензии дезагрегировали, и далее встряхивали суспензию подтаявшего монослоя. Матрасы горизонтально шуттелировали троекратно в течение двух часов. Вируссодержащую культуральную суспензию из всех сосудов объединяли, общую пробу повторно высевали на бактериальные среды для исключения контаминации микробами, грибами и микоплазмами, после чего отбирали пробы для определения инфекционной активности.
Содержимое сосудов, с 10%-ной вируссодержащей суспензией из гомогената печени кролика, содержащих штаммы «ВГБК 1/ВНИИЗЖ» и «ВГБК2/ВНИИЗЖ» сливали в отдельные емкости и охлаждали при температуре 2-8°С, освобождаясь от клеточного детрита известным способом, использовали хлороформ и низкоскоростное центрифугирование. Освобожденная от детрита суспензия должна иметь вид полупрозрачной жидкости от светло-коричневого до темно-коричневого с красноватым оттенком цвета.
Содержимое реактора АК-210, при глубинном культивировании штамма №1231 Pasteurella multocida типа А, в течение всего времени культивирования проверяли на стерильность и рост бактериальной массы. При концентрации бактериальных клеток не менее 10 млрд м.к./см за « 5, 6 часа, содержимое реактора стерильно сливали в стерильные бутили, для охлаждения до 2-8°С. Методом проточного центрифугирования проводили освобождение от питательной среды. Полученный осадок бактериальных клеток ресуспендировали в фосфатно-солевом буферном растворе с рН 7,4-7,6. до первоначального объема и перекачивали в сосуд для инактивации. Концентрацию бактерий в суспензии определяли визуально с помощью стандарта мутности.
Затем из емкостей отбирали пробы для контроля вирусного сырья.
Серия вируса штамма «Миксо/ВНИИЗЖ-18» миксоматоза кроликов должна иметь инфекционную активность не менее 5,0 lg ТЦД50/см3.
Серия вируса штамма «ВГБК1/ВНИИЗЖ» ВГБК 1 типа должна иметь антигенную активность не ниже минимального положительного значения - 0,300 по оптической плотности;
Серия вируса штамма «ВГБК2/ВНИИЗЖ» ВГБК 2 типа должна иметь антигенную активность не ниже минимального положительного значения 0,300 по оптической плотности;
Производственная серия штамма №1231 Pasteurella multocida типа А должна иметь антигенную активность ≥1:200 в ИФА.
Лиофилизацию вирусной суспензии штамма «Миксо/ВНИИЗЖ-18» миксоматоза кроликов с добавлением стабилизирующей среды 8,8 об. %, расфасованной во флаконы, осуществляли при помощи лиофильной установки. Вирусную суспензию с стабилизатором охлаждали в морозильной камере до минус 45°С. Затем замороженный материал в кассетах размещали в сублимационной камере, которую герметично закрывали и включали вакуум-насос. Величина вакуума в аппарате составляла от 4 Па до 7 Па. Исходная температура полок с высушиваемым материалом находилась в пределах от минус 50°С до минус 55°С. Конечная температура полок аппарата в процессе высушивания от 30°С до 40°С. Градиент повышения температуры полок от исходного до конечного значения варьировал от 10 до 15% в сек. Конечная температура высушиваемого материала составляла от 20°С до 23°С. Досушивание материала при указанной температуре проводили от 4 до 6 час.
Инактивацию вирусного сырья осуществляли добавлением аминэтилэтиленимином (АЭЭИ): вносимого в вирусную суспензию штамма «ВГБК1/ВНИИЗЖ» ВГБК 1 типа 0,3% концентрации при экспозиции 72 ч и температуре инактивации 37°С; а для штамма «ВГБК2/ВНИИЗЖ» ВГБК 2 типа вводили 1% концентрации при экспозиции 24 ч и температуре 37°С. Инактивацию проводили с периодическим перемешиванием (каждые 5-6 часов по 3-5 мин.)
Инактивацию бактериальной суспензии штамма №1231 P. multocida осуществляли добавлением 0,1% формальдегида при температуре 37°С и постоянном перемешивании (60 об/мин).
По окончании инактивации антигенный материал каждого штамма охлаждали до температуры 2-8°С и отбирали пробы для определения рН, стерильности и полноты инактивации.
Для нейтрализации АЭЭИ в вирусную суспензию антигенного материала добавляли тиосульфат натрия из расчета 10% к объему использованного АЭЭИ.
Полученный антигенный материал штамма «ВГБК1/ВНИИЗЖ», штамма «ВГБК2/ВНИИЗЖ», штамма №1231 P. multocida использовали для изготовления сорбированной формы вакцины против миксоматоза, пастереллеза, вирусной геморрагической болезни кроликов 1 и 2 типов.
Для этого антигенный материал тщательно смешивают с 3%-ным гелем гидроокиси алюминия в количественном соотношении 12,5:12,5:25,0:50,0, соответственно.
Вакцину контролировали на стабильность, стерильность и антигенную активность.
Стерильность вакцины определяют в соответствии с ГОСТ 28085-89 «Препараты биологические. Методы биологического контроля стерильности». Сущность метода заключается в определении отсутствия роста бактериальной и грибной микрофлоры в посевах из образцов вакцины на питательные среды.
Контроль лиофилизированной части проводили на остаточную влажность после лиофилизации, контроль биологической активности в культуре клеток, отсутствие контаминации штамма другими вирусами общепринятыми методами. Содержимое флаконов в виде восстановленной суспензии высевали на следующие среды: МПА (мясо-пептонный агар), МПБ (мясо-пептонный бульон), МППБ (мясо-пептонный печеночный бульон), агар Сабуро (жидкий) и тиогликолевую среду. Для исключения контаминации микоплазмами делали высевы на среду Каган жидкую с 0,3% агара и среду Каган полутвердую с 1,3% агара, проводят 3 пересева с интервалом 4-7 дней. В посевах не наблюдали роста бактериальной, грибной микрофлоры и микоплазм в установленные периоды наблюдений.
Для определения остаточной влажности проводили в соответствии с ГОСТ 24061-89 «Препараты биологические сухие. Метод определения влажности». Для проведения испытания использовали 3 флакона со штаммом «Миксо/ВНИИЗЖ-18» ВМК. Пробу биопрепарата, растолченную до порошкообразного состояния, ровным слоем вносили в предварительно взвешенную бюксу. Бюксы с пробами и крышками взвешивали и помещали в открытом состоянии в сушильный шкаф. Началом досушивания считали время достижения температуры 105°С, которое продолжается 1 ч. После окончания досушивания бюксы накрывали крышками и переносили в эксикатор для достижения комнатной температуры, после чего взвешивали с точностью до четвертого знака после запятой. Вычисление влажности каждой из проб проводили с точностью до второго десятичного знака. За окончательный результат принимали значение среднего арифметического трех параллельных определений. Массовая доля влаги в образце штамма «Миксо/ВНИИЗЖ-18» ВМК составила 3,9%, что соответствует требованиям НД.
Контроль биологической активности проводили в перевиваемой культуре клеток RK-13/91 путем определения титра биологической активности штамма «Миксо/ВНИИЗЖ-18». Сущность титрования основана на определении цитопатогенного действия (ЦПД) вируса, которое проявлялось в образовании без слияния в единый синцитий многочисленных симпластов, содержащих 20 и более ядер. Ядра в клетках были плотно упакованы, а ядрышки хорошо контрастны, что свидетельствовало об их функциональной активности. Титром вируса считали наивысшее его разведение, вызывающее ЦПД в 50% культуры клеток.
Испытания на биологическую активность штамма «Миксо/ВНИИЗЖ-18» ВМК проводили по общепринятой методике титрования с использованием последовательных 10-кратных разведений исследуемого образца. С этой целью готовили его разведения с 10-1 до 10-8 на смеси сред ПСС + Игла (2:1) с 2% сыворотки крови КРС. Для титрования штамма «Миксо/ВНИИЗЖ-18» ВМК использовали 1-2 суточный монослой культуры клеток RK-13/91, выращенный в пенициллиновых флаконах. Титр вируса определяли по методу Кербера в модификации Ашмарина. Титр биологической/инфекционной активности штамма «Миксо/ВНИИЗЖ-18» ВМК, после лиофилизации составил 6,5±0,25 lg ТЦД50/см3.
Лиофильно высушенную часть вакцины (сухой компонент), содержащей аттенуированный вирус штамма «Миксо/ВНИИЗЖ-18» ВМК, контролировали на безвредность и авирулентность на естественно восприимчивых животных (кроликах) по ГОСТ 31926. Образец штамма «Миксо/ВНИИЗЖ-18» вводили в повышенной дозе не иммунным по миксоматозу кроликам. Содержимое трех флаконов растворяли в физиологическом растворе до первоначального объема перед лиофилизацией и объединяли. Из смеси готовили разведение вируссодержащего материала, содержащего 3,0 lg ИД50/см3 ВМК. Препарат вводили трем кроликам (Ц, 10-1 и 10-2) внутримышечно в область бедра по 1,0 см и внутрикожно по 0,25 см в четыре точки (по две слева и справа) в бесшерстный участок кожи спины и боков, для чего выстригали шерсть на боках животных левой и правой полосой перпендикулярной позвоночнику. Оценку общего состояния животных и проявлений клинических признаков миксоматоза осуществляли в течение 28 суток. Лиофилизированный препарат из штамма «Миксо/ВНИИЗЖ-18» ВМК является безвредным, т.к. в течение срока наблюдения все кролики остались живыми и клинически здоровыми.
Жидкую часть вакцины контролировали на полноту инактивации (авирулентность), безвредность и фасовали в стерильные флаконы.
Полноту инактивации препарата определяют общеизвестным способом, аналогично определению безвредности.
Безвредность вакцин, определяли на кроликах двухмесячного возраста, массой не менее 2,5 кг, в количестве 4 голов кроликов из расчета две головы на образец вакцины и два контрольных животных (не вакцинированных). Жидкую часть вакцины предлагаемого изобретения вводили внутримышечно в область бедра в объеме 3 см3, что в 3 раза превышает рекомендуемый прививной объем. Клиническое наблюдение за животными проводили в течение 10 суток. По результатам проверки безвредности животные оставались живыми в течение всего срока наблюдения. Известно, что местные и общие реакции, зависящие от токсического действия вакцины, наиболее выражены после первого введения препарата, в то время как аллергические свойства проявляются при повторной вакцинации.
Реактогенность сорбированной жидкой части вакцины изучали на кроликах двухмесячного возраста, массой не менее 2,5 кг, используя три головы на испытуемый препарат. Наблюдение за животными в течение 10 дней после введения второй дозы вакцины не выявило каких-либо отклонений со стороны общего состояния организма животных, что говорит о безвредности и ареактогенности жидкой части вакцины.
Жидкий компонент вакцины должен быть стерильным, авирулентным и безвредным.
Безвредность и ареактогенность ассоциированной вакцины против ВМК, пастереллеза, ВГБК1 и ВГБК2 проверяли на кроликах старше месячного возраста массой свыше 1 кг, не вакцинированные от ВМК, пастереллеза, ВГБК1 и ВГБК2. Содержимое пяти флаконов с сухим компонентом объединяли с содержимым пяти флаконов с жидким компонентом вакцины, перемешивали, получали среднюю пробу и вводили трем кроликам внутримышечно по 3,0 см3 (3-кратная прививная доза). За животными наблюдали в течение 10 суток. В течение всего срока наблюдения все животные остались живы, отклонений от физиологической нормы в состоянии кроликов не наблюдали. В месте введения вакцины изменений некротического характера зарегистрировано не было. Отсутствие падежа кроликов после вакцинации дополнительно свидетельствовало об отсутствии остаточной вирулентности компонентов вакцины.
Пример 2. Применение предлагаемой ассоциированной вакцины для иммунизации кроликов
Предлагаемая вакцина состоит из 2 компонентов:
- сухой компонент - лиофилизат для приготовления суспензии для инъекций (изготовлена из перевиваемой культуры клеток почки кролика RK-13/91, инфицированной аттенуированным вирусом миксоматоза кроликов штамм «Миксо/ВНИИЗЖ-18», с добавлением стабилизирующих компонентов (% по сухому веществу): гидролизата лактальбумина (4%), сахарозы (4%) и желатозы (0,8%));
- жидкий компонент - смесь антигенов, полученных из суспензии печени кроликов, инфицированных вирусом геморрагической болезни кроликов 1 типа штамм «ВГБК1/ВНИИЗЖ» и 2 типа штамм «ВГБК2/ВНИИЗЖ», инактивированных аминоэтилэтиленимином (АЭЭИ) и клеток бактерий Pasteurella multocida типа А штамм №1231, инактивированных формальдегидом, с добавлением в качестве адьюванта 3%-ного геля гидроокиси алюминия.
По внешнему виду сухой компонент представляет собой однородную пористую массу светло- или темно-бежевого цвета, полностью растворяющуюся в жидком компоненте вакцины в течение 2-3 минут без образования хлопьев. Жидкий компонент представляет собой жидкость бежево-коричневого цвета с осадком, легко разбивающимся при встряхивании в гомогенную взвесь.
Во флакон с сухим компонентом вакцины, содержащий 5 прививных доз вакцины, соблюдая правила асептики, при помощи шприца вносили 5,0 см3 жидкого компонента и тщательно встряхивали.
Вакцину вводили кроликам внутримышечно в дозе 1,0 см3 в область средней трети бедра с соблюдением правил асептики.
Вакцина вызывает формирование иммунного ответа к миксоматозу, пастереллезу и вирусной геморрагической болезни кроликов через 10-14 суток после однократного применения, продолжительностью около 12 месяцев против миксоматоза и вирусной геморрагической болезни кроликов 1 и 2 типов и не менее 6 месяцев против пастереллеза.
Пример 3. Эффективность вакцинации предлагаемой вакциной Эффективность вакцины ассоциированной против миксоматоза, пастереллеза и вирусной геморрагической болезни кроликов 1 и 2 типа, изготовленной так, как описано в примере 2, представлена в таблице 2.
Испытание иммуногенной активности полученного препарата провели на 73 кроликах от 4-5-недельного возраста до 2-месячного возраста не вакцинированных от миксоматоза, ВГБК и пастереллеза, а 8 кроликов оставили не вакцинированными в качестве контроля. Отбор проб для получения сывороток крови осуществляли до вакцинации, через 14 и 21 сут после ее проведения. Сыворотки крови исследовали методом ИФА на наличие антител к вирусам ВМК, ВГБК и пастереллезу. Результаты исследований титров антител по каждому компоненту вакцины приведены в таблице 2.
Данные таблицы 2 свидетельствуют о том, что титры антител против ВМК, ВГБК и пастереллеза кроликов через 14 сут значительно увеличились по сравнению с исходными показателями, превышали требуемые минимальные титры ко всем антигенным компонентам вакцины, и сохранялись на высоком уровне к 21 сут наблюдения. Титры антител ко всем антигенным компонентам в контрольной группе оставались примерно на одном уровне в течение всего срока наблюдения.
Данные свидетельствует о том, что полученная вакцина обладает высокой антигенной активностью и вызывает у кроликов формирование высоких титров антител к вирусу миксоматоза кроликов «Миксо/ВНИИЗЖ-18», причем прирост титров антител был постоянным в течение всего срока наблюдений и достигал максимального значения 1: 295 через 21 сут после вакцинации.
Данные свидетельствует о том, что ассоциированная вакцина индуцирует у привитых кроликов образование высоких уровней антител к вирусам «ВГБК1/ВНИИЗЖ» и «ВГБК2/ВНИИЗЖ». Максимальный уровень титров антител наблюдали у кроликов через 21 сут после вакцинации и составил 0,429; 0,478 (по оптической плотности), соответственно.
Данные свидетельствует о том, что полученный препарат обладает высокой антигенной активностью по антигенному компоненту P. multocida штамм №1231 типа А и вызывает у кроликов формирование титра антител на уровне 1:325 через 21 сут после вакцинации.
Через 21 сут после вакцинации во всех группах после диагностического убоя производили осмотр места введения предлагаемой вакцины, результатом которого явилось отсутствие или незначительное количество в них остатков вакцины, воспалительных изменений или участков некроза.
Таким образом, вакцина ассоциированная против миксоматоза, пастереллеза и вирусной геморрагической болезни кроликов 1 и 2 типа обладает высокой иммуногенной и антигенной активностью в отношении всех 4 антигенных компонентов и безвредна для кроликов.
Пример 3. Определение антигенной активности вируса миксоматоза
Готовили среднюю пробу вакцины, содержимое пяти флаконов с сухим компонентом объединяли с содержимым пяти флаконов с жидким компонентом вакцины, перемешивали, получали среднюю пробу и вводили пяти кроликам по 1,0 см (одна прививная доза) внутримышечно в область бедра. Контрольную группу из двух кроликов оставляли не привитыми и содержали отдельно. За животными вели клиническое наблюдение в течение 21 суток, после чего отбирали индивидуальные пробы крови для определения титров сывороточных антител методом ИФА. Пробы сывороток от вакцинированных и не иммунных (контрольных) групп кроликов исследовали методом ИФА.
Вакцину считаются антигенно активной, если через 21 сутки после вакцинации не менее чем у 80% привитых кроликов титр антител составляет не ниже 1:190 в ИФА.
Пример 4. Определение антигенной активности штамма №1231 Pasterurella multocida типа А
Объединенную пробу вакцины, приготовленную как в примере 3, вводили внутримышечно в область внутренней стороны правого бедра 5 кроликам однократно по 1,0 см3 (одна прививная доза). Перед вакцинацией и через 21 сутки после вакцинации у животных из ушной вены отбирали по 2-3 см3 крови, выдерживали при температуре (37,0±0,5)°С, отделяли сыворотку крови и исследовали на наличие антител.
Вакцина является антигенной, титр специфических антител в ИФА к P. multocida у кроликов через 21 сутки после вакцинации был не менее 1:200.
Пример 5. Определение иммуногенной активности вируса штаммов «ВГБК1/ВНИИЗЖ» и «ВГБК2/ВНИИЗЖ»
Пробой вакцины, полученной по примеру 3, вакцинировали восемь кроликов внутримышечно в область внутренней стороны бедра по 1,0 см3 (одна прививная доза). Контрольную группу из шести кроликов оставляли не вакцинированными и содержали отдельно. Через 7 суток после иммунизации всех вакцинированных и контрольных кроликов заражали внутримышечно в область бедра по 1,0 см3 в дозе по 3 lg ЛД50/см3 контрольными вирусами «ВГБК1/ВНИИЗЖ» и «ВГБК2/ВНИИЗЖ» (по 4 вакцинированных и 3 контрольных кролика каждым вирусом). За животными вели наблюдение в течение 10 суток.
Все вакцинированные кролики остались живыми (100% защита). В контрольной группе заболело и погибло два из трех животных.
Пример 6. Контроль иммуногенности предлагаемой вакцины по компоненту ВГБК1 и ВГБК2
Проводили на кроликах от 4-5-недельного возраста до 2-месячного возраста, не вакцинированных от миксоматоза и ВГБК, используя различные ассоциированные вакцины: ВГБК1+ВГБК2+ВМК; ВГБК1+ВГБК2+Р.m. и ВГБК1+ВГБК2+ВМК+Р.m. (предлагаемое изобретение).
Использовали 38 кроликов. Животных содержали в изоляторах с автономным поением и кормлением. Взаимная контаминация штаммами «ВГБК1/ВНИИЗЖ» и «ВГБК2/ВНИИЗЖ» была исключена. При заражении животным внутримышечно вводили 1,0 см3 вируссодержащей суспензии и вели ежедневное наблюдение за их физиологическим состоянием в течение 7 дней. Образцы вакцин готовили следующим образом:
-ассоциированная вакцина против ВГБК1+ВГБК2+ВМК.
Лиофилизированную часть вакцины против ВМК (2 см3) растворяли в 5 см3 инактивированной вакциной против ВГБК1+ВГБК2, содержащей по 2,5 см3 штаммы «ВГБК1/ВНИИЗЖ» и «ВГБК2/ВНИИЗЖ». Вакцину вводили внутримышечно по 1,0 см3;
- ассоциированная вакцина против ВГБК1+ВГБК2+Р.m. Готовили инактивированную вакцину, содержащую в своем составе 1,25 см3 штамма «ВГБК1/ВНИИЗЖ»; 1,25 см3 штамма «ВГБК2/ВНИИЗЖ»; 2,5 см3 штамма №1231 P.multocida типа А. Вакцину вводили внутримышечно по 1,0 см3; ВГБК1+ВГБК2+Р.m.+ВМК (предлагаемое изобретение).
Лиофилизированную сухую вакцину против ВМК (2 см3) растворяли в 5 см3 инактивированной жидкой вакцины, содержащую штаммы «ВГБК1/ВНИИЗЖ» и «ВГБК2/ВНИИЗЖ» и штамма №1231 P.multocida типа А. Вакцину вводили внутримышечно по 1,0 см3.
Для проверки иммуногенности ассоциированной вакцины по компоненту ВГБК1 и ВГБК2 было сформировано 5 групп. Трем группам животных (по 10 голов) вводили ассоциированные вакцины с различным компонентным составом, две группы (по 4 головы) использовали в качестве контроля. На 14 сутки после вакцинации животным всех групп, включая контрольную, были инъецированы штаммы «ВГБК 1/ВНИИЗЖ» и «ВГБК2/ВНИИЗЖ» в дозе по 3,0 lg ЛД50/см3 на голову, внутримышечно, по 1,0 см3. Результаты исследований представлены в таблице 3.
Из данных таблицы 3 видно, что падеж животных регистрировали только в контрольных группах. В опытных группах все животные остались живы. Отклонений в физиологическом состоянии отмечено не было.
Таким образом, был сделан вывод о том, что образцы ассоциированных вакцин, содержащие в своем составе компонент - ВГБК1 и ВГБК2, защищают иммунизированных кроликов при прямом контрольном заражении на 100% от гомологичных штаммов ВГБК, т.е. вакцина (предлагаемое изобретение) по данному компоненту является иммуногенной.
Пример 6. Контроль иммуногенности предлагаемой вакцины по компоненту P. multocida
Для проверки иммуногенности ассоциированной вакцины (предлагаемое изобретение) по компоненту P. multocida было сформировано четыре группы. Трем группам животных (по 10 голов) вводили ассоциированные вакцины с различным компонентным составом, одну группу (10 голов) использовали в качестве контроля. Схема изготовления образцов вакцин была аналогична со схемой, представленной в предыдущем опыте. На 14 сутки после вакцинации животным всех групп, включая контрольную, был введен штамм №1231 Р. multocida типа А с дозой заражения 3,0 ЛД50/см3 на 1 гол. Результаты исследований представлены в таблице 4. Из данных таблицы видно, что в группе кроликов, вакцинированных ассоциированной вакциной, в состав которой не входил компонент P.multocida, наблюдали 100% падеж животных, в то время как в группе, иммунизированной вакциной с бактериальным компонентом (предлагаемое изобретение), сохранность животных составляла 100%.
Выявлено, что образцы ассоциированных вакцин, содержащие в своем составе компонент - P. multocida, защищают иммунизированных кроликов при прямом контрольном заражении в дозе по 3,0 lg ЛД50/см3 на 100% от гомологичного штамма P. multocida, т.е. вакцина по данному компоненту является иммуногенной и обеспечивает образование защитного уровня антител.
Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента РФ на изобретение «Ассоциированная вакцина против миксоматоза, пастереллеза и вирусной геморрагической болезни кроликов 1 и 2 типов»:
1. Jaglic Z. Host response in rabbits to infection with Pasteurella multocida serogroup F strains originating from fowl cholera // Z. Jaglic, E. Jeklova, H. Christensen [et al.] / Canadian journal of veterinary research. - Vol. 75. - №3. - 2011. - p.200-208.
2. vetugolok.ru: https://vetugolok.ru/gryzuny/krolik/miksomatoz.html (дата обращения: 14.05.18).
3. Шевченко, А.А. Диагностика пастереллеза: учебное пособие / А.А. Шевченко, О.Ю. Черных, Л.В. Шевченко [и др.]. - Краснодар: КубГАУ. - 2013.- 12 с.
4. Инфекционная патология животных: Т. 3 / Под ред. А.Я. Самуйленко. - М.:РАСХН. - Т. 3. - 2009. - 881 с.
5. Вирусная геморрагическая болезнь кроликов // Вестник ветеринарии. 2018, №1(84). - с. 41-45.
6. Наташкина, М.Ю., Середа, А.Д., Юрков, С.Г., Жестерев, В.И., Колосова, М.В., Сидоров, С.И., Луницын, А.В., Смыслова, Н.Ю. Сублиния клеток ПК-13/2-03 для изготовления вакцины против миксоматоза кроликов / М.Ю. Наташкина, А.Д. Середа, С.Г. Юрков, В.И. Жестерев, М.В. Колосова, С.И. Сидоров, А.В. Луницын, Н.Ю. Смыслова // Ветеринария, 2005. - №3. - С.26.
7. Моргунов, Ю.П. Генодиагностика и профилактика вирусной геморрагической болезни и миксоматоза кроликов / Ю.П. Моргунов, И.П. Синдрякова, С.Ю. Моргунов, С.Г. Юрков, Д.В. Колбасов // Кролиководство и звероводство, 2014. - №2. - С. 29-32.
8. Куникова, Е.Д. Эпизоотологическая опасность вирусной геморрагической болезни кроликов и перспективы ее специфической профилактики (обзор) / Е.Д. Куликова, Н.В. Мороз, Л.В. Малахова // БИО. - 2019. - №5. - с. 12-16
9. Шевченко, А.А. Вирусная геморрагическая болезнь кроликов: профилактика и лечение / А.А. Шевченко, Л.В. Шевченко, Д.Ю. Зеркалев, Т.В. Левченко, О.Ю. Черных // Ветеринария Кубани. - №5. - 2014. - с. 11-13.
10. Шевченко, А.А. Вирусная геморрагическая болезнь кроликов / А.А. Шевченко, Л.В. Шевченко, Д.Ю. Зеркалев, В.Н. Шевкопляс, О.Ю. Черных // Ветеринария Кубани. - №2. - 2011. - с. 3-6.
11. Lany P., Rosenbergova K., Zendulkova D. Rabbit haemorrghagic disease: new types of virus on our territory? // Vedecky vybor veterinarni. 2017. p. 23. URL: https://zenodo.org/record/1478485#.XHzdd8AzaUk (дата обращения: 04.03.2019).
12. Моргунов, Ю.П. Стратегия вакцинации кроликов против миксоматоза и ПЦР-диагностика / Ю.П. Моргунов, С.Ю. Моргунов, А.В. Луницин, В.И. Уласов // Ветеринария, 2014. - №2. - С. 22-24.
13. Способ изготовления инактивированной вакцины против вирусной геморрагической болезни кроликов // Патент №2039570. 1995 / А.А. Шевченко, И.Ф. Вишняков, М.А. Дымин [и др.].
14. Rabbit Haemorrghagic Disease. Technical Disease Cart // Information on aquatic and terrestrial animal diseases: OIE - World Organisation for Animal Health. 2019. URL: http://www.oie.int/fileadmin/Home/eng/Animal Health in the_World/docs/pdf/Disease_cards/RHD.pdf (дата обращения: 11.03.2019).
15. Шевченко, А.А. Болезни кроликов / А.А. Шевченко, Л.А. Шевченко, А.М. Литвинов. - М.: «АКВАРИУМ БУК», 2002. - с. 48-50.
16. Музалевская, А. В. Патоморфология вирусной геморрагической болезни кроликов: автореф. дис.… канд. вет. наук. - Саратов, 2008. - 21 с.
17. Власов Н.А. Физико-химические свойства и антигенная структура вируса геморрагической болезни кроликов 03.00.06. Вирусология. Автореферат диссертации на соискание ученой степени доктора биологических наук, Покров, 1998 г. - 46 с.
18. Вакцина против вирусной геморрагической болезни кроликов // Патент №2229895. 2004 / А.А. Шевченко, Л.В. Шевченко, И.Д. Гнездилов [и др.].
19. Жестерев В.И., М.А. Дымин, Н.К. Крюкова, С.Г. Юрков, В.А. Мищанин / Изучение культуральных свойств вируса геморрагической болезни кроликов // Пробл. инфекц. патологии с.-х. ж-х: тез. докл., посвящ. 100-летию откр. вируса ящура, 27-31 окт., Владимир, 1997 / - С. 177.
20. Патент UA 27906 (U) от 16.04.2007 г.
21. Патент CN 105169380, от 15.09.2015 г.
22. Патент №2429879 от 12.04.2010 г.
23. Патент №2443775 от 29.06.2010 г.
24. Патент CN 101708332 от 30.11.2009 г.
25. Сергеев, В.А. Вирусы и вирусные вакцины / В.А. Сергеев, Е.А. Непоклонов, Т.И. Алипер. - М.: Библионика, 2007. - с. 206-223.
26. Шевченко, А.А. Болезни кроликов / А.А. Шевченко, Л.А. Шевченко, A.M. Литвинов. - М.: «Аквариум». - 2002. - 224 с.


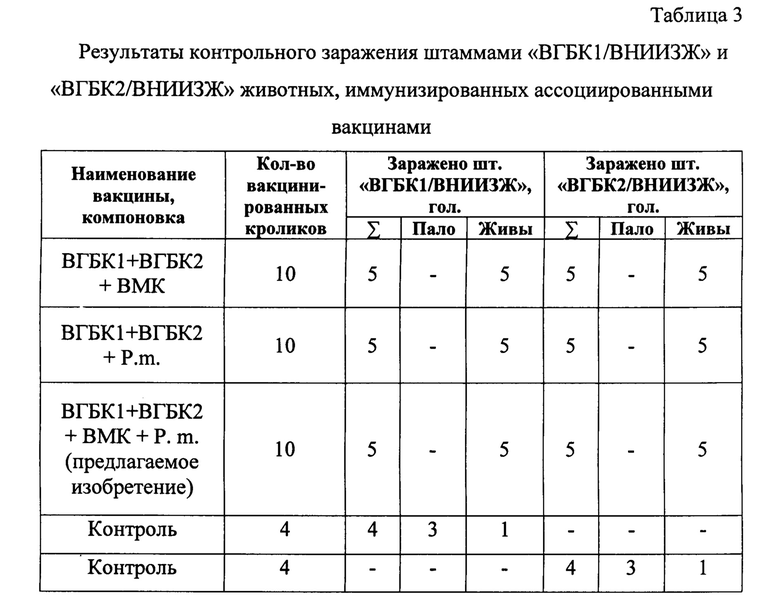

| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм бактерии Pasteurella multocida "РМ - В" для изготовления биопрепаратов для специфической профилактики пастереллеза (геморрагической септицемии) крупного рогатого скота, вызванного пастереллой серогруппы В | 2023 |
|
RU2818959C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ АССОЦИИРОВАННОЙ ПРОТИВ СТРЕПТОКОККОЗА И ВИРУСНОЙ ГЕМОРРАГИЧЕСКОЙ БОЛЕЗНИ КРОЛИКОВ | 2010 |
|
RU2429880C1 |
| Штамм "Шевченко-2014" вируса геморрагической болезни кроликов для изготовления вакцинных, диагностических и лечебных препаратов | 2015 |
|
RU2631925C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ, АССОЦИИРОВАННОЙ ПРОТИВ КОЛИБАКТЕРИОЗА, СТРЕПТОКОККОЗА И ВИРУСНОЙ ГЕМОРРАГИЧЕСКОЙ БОЛЕЗНИ КРОЛИКОВ | 2010 |
|
RU2443774C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ АССОЦИИРОВАННОЙ ПРОТИВ САЛЬМОНЕЛЛЕЗА, ЭШЕРИХИОЗА И ВИРУСНОЙ ГЕМОРРАГИЧЕСКОЙ БОЛЕЗНИ КРОЛИКОВ | 2012 |
|
RU2496518C1 |
| ВАКЦИНА ПРОТИВ МАНХЕЙМИОЗА, БИБЕРШТЕЙНИОЗА И ПАСТЕРЕЛЛЁЗА КРУПНОГО И МЕЛКОГО РОГАТОГО СКОТА АССОЦИИРОВАННАЯ ИНАКТИВИРОВАННАЯ, СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2020 |
|
RU2744744C1 |
| ВАКЦИНА ИНАКТИВИРОВАННАЯ КОМБИНИРОВАННАЯ ПРОТИВ ИНФЕКЦИОННОГО РИНОТРАХЕИТА, ПАРАГРИППА-3, РЕСПИРАТОРНО-СИНЦИТИАЛЬНОЙ БОЛЕЗНИ, ВИРУСНОЙ ДИАРЕИ И ПАСТЕРЕЛЛЕЗА КРУПНОГО РОГАТОГО СКОТА | 2009 |
|
RU2403061C1 |
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО АТРОФИЧЕСКОГО РИНИТА И ПАСТЕРЕЛЛЕЗА СВИНЕЙ ИНАКТИВИРОВАННАЯ, СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2021 |
|
RU2763991C1 |
| ПОЛИВАЛЕНТНАЯ ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ РИЕМЕРЕЛЛЁЗА, ПАСТЕРЕЛЛЁЗА И САЛЬМОНЕЛЛЁЗА ИНДЕЕК, УТОК И ГУСЕЙ, СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2020 |
|
RU2750865C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ, АССОЦИИРОВАННОЙ ПРОТИВ ПСЕВДОМОНОЗА И ВИРУСНОЙ ГЕМОРРАГИЧЕСКОЙ БОЛЕЗНИ КРОЛИКОВ | 2013 |
|
RU2553557C2 |
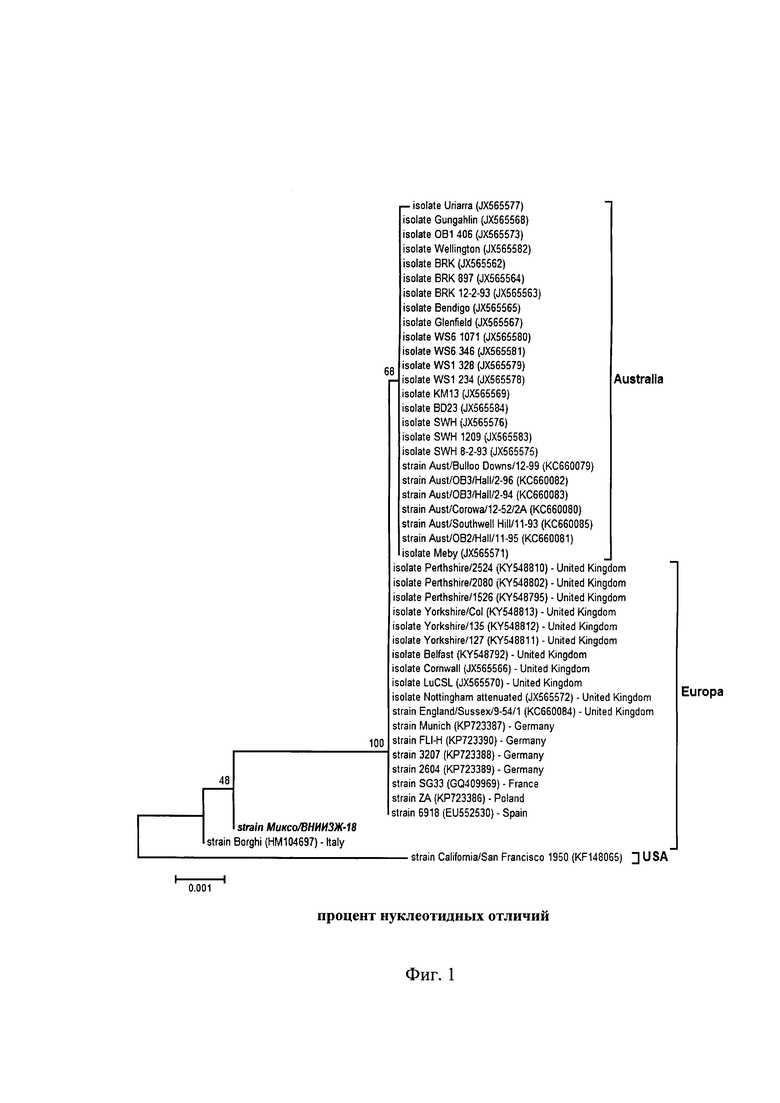
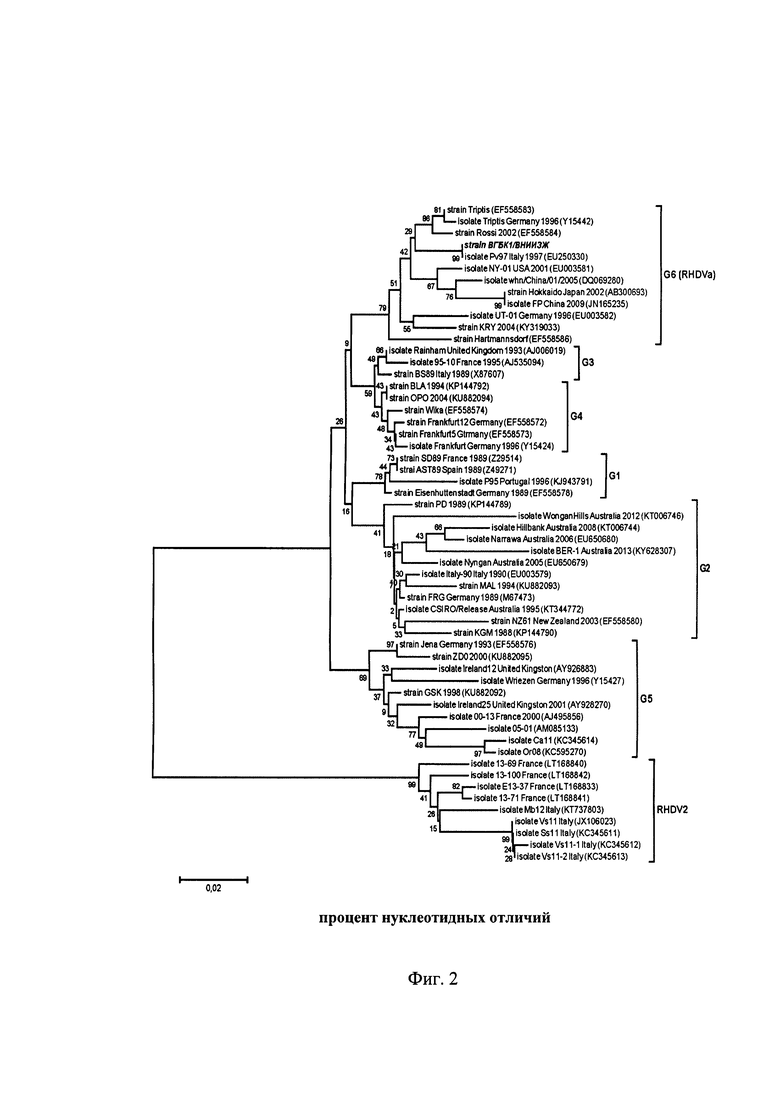

Изобретение относится к биотехнологии. Предложена вакцина, ассоциированная против миксоматоза, пастереллеза и вирусной геморрагической болезни кроликов, содержащая в качестве активного вещества два компонента: жидкий компонент - смесь из инактивированного антигенного материала из штамма №1231 Pasteurella multocida, депонированного под регистрационным номером: №307-деп/20-95 ПОИМ ФГБУ «ВНИИЗЖ»; из инактивированных и очищенных антигенных материалов штамма «ВГБК1/ВНИИЗЖ» типа 1, депонированного под регистрационным номером: №305-деп/20-93-ГКШМ ФГБУ «ВНИИЗЖ», и из штамма «ВГБК 2/ВНИИЗЖ», депонированного под регистрационным номером: №306-деп/20-94-ГКШМ ФГБУ «ВНИИЗЖ»; и сухой компонент-лиофилизированный аттенуированный очищенный антигенный материал из штамма «Миксо/ВНИИЗЖ-18», депонированного под регистрационным номером: №120 - деп/19-10-КШМ ФГБУ «ВНИИЗЖ»; и целевые добавки: 3%-ный гель гидроокиси алюминия и стабилизирующая среда, взятых в объемном соотношении 1,0:0,5:0,5:0,9:2,0:0,1, соответственно, и в количествах, обеспечивающих протективную иммунногенную активность каждого антигена в организме кроликов. Изобретение обеспечивает расширение арсенала высокоиммуногенных, безвредных и ареактогенных ассоциированных вакцин против возбудителей инфекционных болезней кроликов, циркулирующих на территории Российской Федерации. 7 з.п. ф-лы, 4 табл., 6 пр., 3 ил.
1. Вакцина ассоциированная против миксоматоза, пастереллеза и вирусной геморрагической болезни кроликов, содержащая активное вещество и целевую добавку, отличающаяся тем, что в качестве активного вещества она содержит два компонента: жидкий компонент - смесь из инактивированного антигенного материала из штамма №1231 Pasteurella multocida, сем. Pasteurellaceae, рода Pasteurella, депонированного в коллекции штаммов микроорганизмов ФГБУ «ВНИИЗЖ» под регистрационным номером №307 - деп / 20-95 ПОИМ ФГБУ «ВНИИЗЖ»; из инактивированного и очищенного антигенного материала из штамма «ВГБК1/ВНИИЗЖ» вирусной геморрагической болезни кроликов, сем. Caliciviridae, рода Lagovirus, типа 1, депонированного в коллекции штаммов микроорганизмов ФГБУ «ВНИИЗЖ» под регистрационным номером №305 - деп / 20-93 - ГКШМ ФГБУ «ВНИИЗЖ»; из инактивированного и очищенного антигенного материала из штамма «ВГБК 2/ВНИИЗЖ» вирусной геморрагической болезни кроликов, сем. Caliciviridae, рода Lagovirus, типа 2, депонированного в коллекции штаммов микроорганизмов ФГБУ «ВНИИЗЖ» под регистрационным номером №306 - деп / 20-94 - ГКШМ ФГБУ «ВНИИЗЖ»; и сухой компонент - лиофилизированный аттенуированный очищенный антигенный материала из штамма «Миксо/ВНИИЗЖ-18» вируса миксоматоза кроликов, семейства Poxviridae, рода Leporipoxvirus, депонированного в коллекции штаммов микроорганизмов ФГБУ «ВНИИЗЖ» под регистрационным номером №120 - деп / 19-10 - КШМ ФГБУ «ВНИИЗЖ»; и целевые добавки: 3%-ный гель гидроокиси алюминия и стабилизирующая среда, взятых в объемном соотношении 1,0:0,5:0,5:0,9:2,0:0,1, соответственно и в количествах, обеспечивающих протективную иммунногенную активность каждого антигена в организме кроликов после введения им целевого препарата.
2. Вакцина по п. 1, отличающаяся тем, что она содержит инактивированный и очищенный антигенный материал из штамма «ВГБК1/ВНИИЗЖ» вирусной геморрагической болезни кроликов, сем. Caliciviridae, рода Lagovirus, типа 1, полученный предпочтительно из 10%-ной печеночной суспензии кролика, зараженного штаммом «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов 1 типа, представляющий собой вирусную суспензию в количестве 12,5 об.%.
3. Вакцина по п. 1, отличающаяся тем, что она содержит инактивированный и очищенный антигенный материал из штамма «ВГБК2/ВНИИЗЖ» вирусной геморрагической болезни кроликов, сем. Caliciviridae, рода Lagovirus, типа 2, полученный предпочтительно из 10%-ной печеночной суспензии кролика, зараженного штаммом «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов 2 типа, представляющий собой вирусную суспензию в количестве 12,5 об.%.
4. Вакцина по п. 1, отличающаяся тем, что она содержит инактивированный и очищенный антигенный материал из штамма №1231 Pasteurella multocida типа А, полученный путем глубинного культивирования на лабораторном биореакторе АК-210, в жидкой питательной среде, приготовленной на основе триптического гидролизата мяса по Хоттингеру с концентрацией аминного азота 250-300 мг %, с добавлением в качестве источника V-фактора роста 2%-ного дрожжевого экстракта, представляющий собой бактериальную суспензию с инфекционной активностью на кроликах 3,0±0,25 ЛД50/см3, в количестве 25,0 об.%.
5. Вакцина по п. 1, отличающаяся тем, что в качестве адъюванта она содержит 3%-ный гель гидроокиси алюминия в количестве не менее 50 об.%.
6. Вакцина по п. 1, отличающаяся тем, что она содержит сухой аттенуированный антигенный материал из штамма «Миксо/ВНИИЗЖ-18» вируса миксоматоза кроликов, полученный предпочтительно в перевиваемой культуре клеток RK-13/91, представляющий собой аттенуированную лиофилизированную вирусную суспензию с инфекционной активностью не менее 6,5±0,25 lg ТЦД50/см3 и инфекционной активностью на кроликах не менее 3,0±0,25 lg ИД50/см3, в количестве 91,8 об.%.
7. Вакцина по п. 1, отличающаяся тем, что она содержит стабилизирующую среду из: гидролизат лактальбумина (ГЛА) - 4%, сахарозы - 4%, желатозы - 0,8%, в количестве 8,8 об.%.
8. Вакцина по любому из пп. 1-7, отличающаяся тем, что она содержит смесь из инактивированных и очищенных антигенных материалов из штамма «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов 1 типа, полученный предпочтительно из 10%-ной печеночной суспензии кролика, зараженного штаммом «ВГБК1/ВНИИЗЖ» вируса геморрагической болезни кроликов 1 типа, с инфекционной активностью не менее 4,0±0,25 ЛД50/см3; из штамма «ВГБК2/ВНИИЗЖ» вируса геморрагической болезни кроликов 2 типа, с инфекционной активностью не менее 5,25±0,25 ЛД50/см3; из штамма №1231 Pasteurella multocida типа А, с инфекционной активностью не менее 3,0±0,25 ЛД50/см3; лиофилизированного антигенного материала из аттенуированного штамма «Миксо/ВНИИЗЖ-18» вируса миксоматоза кроликов, с инфекционной активностью не менее 6,5±0,25 lg ТЦД50/см3 и целевые добавки: стабилизирующую среду и масляный адъювант в количестве, об.%:
Сухой компонент:
Жидкий компонент:
| RU 2064304 C1, 27.07.1996 | |||
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ ПАСТЕРЕЛЛЕЗА И ВИРУСНОЙ ГЕМОРРАГИЧЕСКОЙ БОЛЕЗНИ КРОЛИКОВ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1994 |
|
RU2071662C1 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ ПСЕВДОМОНОЗА И ВИРУСНОЙ ГЕМОРРАГИЧЕСКОЙ БОЛЕЗНИ КРОЛИКОВ | 2013 |
|
RU2531054C1 |
| CN 0108904796 A, 30.11.2018. | |||
Авторы
Даты
2021-01-28—Публикация
2020-06-15—Подача