ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение основывается на открытии того, что состояние кэпирования остатков цистеина на антителах может быть модифицировано в живых клетках. Таким образом, изобретение касается способа получения антитела в клетках млекопитающих, в котором сконструированные непарные остатки цистеина посттрансляционно модифицированы и блокированы конкретными химическими структурами, при этом кэпированные антитела являются хорошо подходящими для дальнейших сайт-специфичных стадий конъюгации с образованием конъюгатов антитело - лекарственное средство (ADC) илм конъюгатов белок - лекарственное средство. Изобретение, кроме того, касается ADC, полученных с использованием данных кэпированных антител, в частности ADC, образованных путем селективного восстановления цистеиновых остатков кэпированных антител, что позволяет избежать восстановления межцепочечных дисульфидов и, таким образом, исключает необходимость в стадии (повторного) окисления перед конъюгацией. Изобретение, кроме того, касается новых кэпированных нитробензоатом антител, которые позволяют селективное восстановление три(3-сульфонатофенил)фосфином (TSPP) или соответствующими агентами для непосредственной конъюгации, и, следовательно, исключает обработку стадий межцепочечного дисульфидного восстановления - повторного окисления. Изобретение, кроме того, касается конструирования новых Cys-кэпирований, состоящих из химических ручек, таких как альдегидные/азидные/алкиновые биортогональные группы, которые разрешают дополнительную химическую конъюгацию лекарственного средства. Изобретение, кроме того, касается некэпированных антител, продуцируемых клетками в среде с низким уровнем цистеина, цистина и и глутатиона, и ADC, полученных путем непосредственной конъюгации с данными некэпированными антителами.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
ADC появились в качестве перспективного класса целевых терапевтических средств со значительным потенциалом для улучшения клинической эффективности и переносимости терапии антителом или традиционной химиотерапии. Клинически полезные ADC способны к антиген-специфической доставке сильнодействующих цитотоксических лекарственных средств в опухолевые клетки. Моноклональный антительный фрагмент ADC может специфически распознавать клеточные поверхностные антигены, которые значительно более повышены в опухолевых клетках, чем в здоровых клетках, что, таким образом, уменьшает неспецифический захват и увеличивает специфическое обновление конъюгированных лекарственных средств опухолевыми клетками. Недавние клинические данные привели к коммерциализации двух одобренных FDA продуктов ADC, которые включают брентуксимаба ведотин: конъюгат анти-CD30 моноклонального антитела, и Ado-трастузумаб эмтанзин: конъюгат анти-HER2 моноклонального антитела. Третий представленный на рынке ADC представляет собой гемтузумаб озогамицин, конъюгат анти-CD33 моноклонального антитела, коммерчески доступен в Японии.
Подход, посредством которого лекарственные средства присоединяются к антителу (то есть, конъюгируются), является важным аспектом разработки ADC. Все три коммерческие ADC продукты, на которые ссылаются, используют общепринятый неспецифический способ конъюгации. Брентуксимаб ведотин получают путем модификации тиолов боковой цепи нативного цистеина в дисульфидах, подверженных воздействию растворителей, тогда как ado-трастузумаб эмтанзин и гемтузумаб озогамицин получают путем модификации аминов боковой цепи поверхностного лизина. Данные неспецифические способы конъюгация в результате приводят к гетерогенным смесям ADC.
В целях улучшения терапевтического индекса и фармакокинетики ADC, в последнее время были разработаны сайт-специфичные ADC на основе цистеина для того, чтобы получать более однородные лекарственные продукты с большим контролем над сайтами присоединения лекарственного средства. Непарные остатки цистеина уже давно введены в белки для сайт-специфичного введения метки и конъюгации лекарственного средства. Смотрите: Lyons et al., Protein Eng. 3, 703-708 (1990); Zheng et al., Biochemistry, 30, 9125-9132 (1991); Stimmel, et al., J. Biol. Chem. 275, 30445-30450 (2000); Junutula et al., Nat. Biotechnol., 26, 925-932 (2008); Voynov et al., Bioconjug. Chem. 21, 385-392 (2010); and Shen et al., Nat. Biotechnol., 30, 184-189 (2012). Данные сконструированные остатки цистеина обычно располагаются на поверхности белка, и не изменяют структуру и функцию белка. Недавно было показано, что сайт-специфичные ADC на основе цистеина обладают улучшенным терапевтическим индексом и сниженной токсичностью по сравнению с общепринятыми Cys конъюгатами и Lys конъюгатами. Смотрите: Junutula et al., Nat. Biotechnol., 26, 925-932 (2008); Junutula et al., Clin. Cancer Res. 16, 4769-47788 (2010); Shen et al., Nat. Biotechnol., 30, 184-189 (2012); and Kung et al., Blood 122, 1455-1463 (2013).
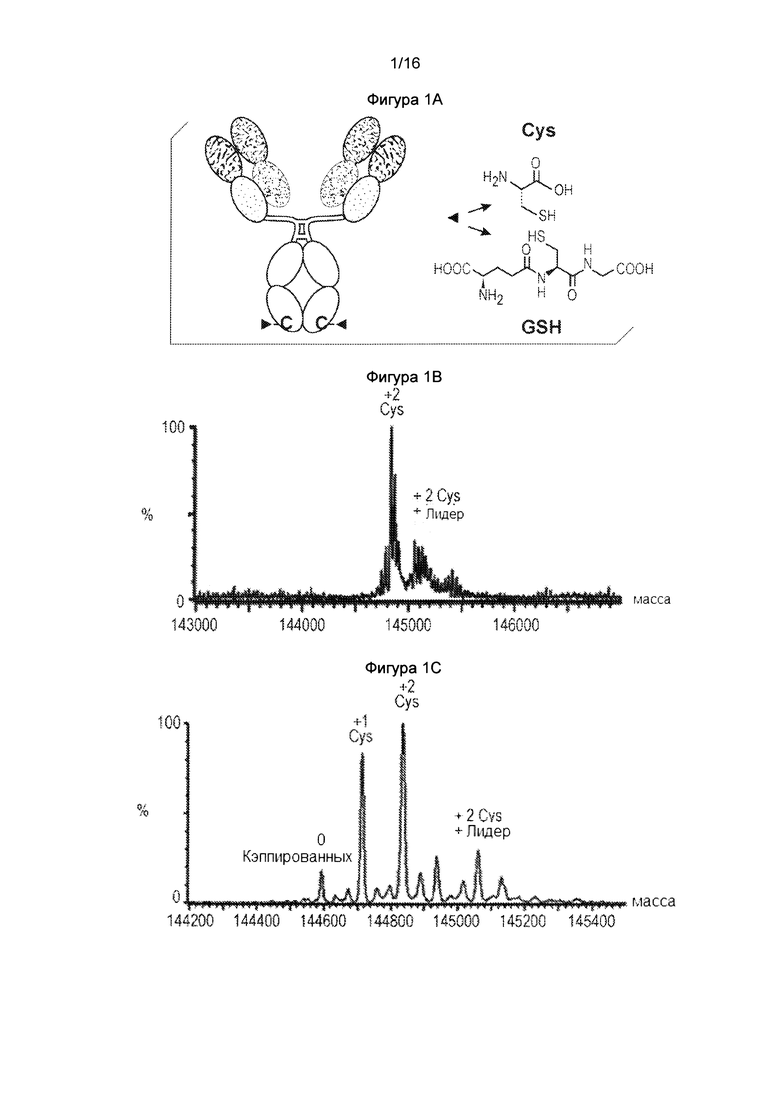
Однако, сайт-специфичные ADC на основе цистеина, вводят сложности в процесс конъюгации лекарственного средства. При продуцировании в клетках млекопитающих, тиольная(ые) группа(ы) непарных цистеиновых остатков цистеинового мутантного антитела, как было обнаружено, образует(ют) дисульфиды с другими цистеинами (цистеинилирование) или и глутатион (глутатионилирование) (Junutula, Raab et al. 2008, Chen, Nguyen et al. 2009). Данные посттрансляционные модификации называются цистеиновым кэпированием или Cys-кэпированием. Данное цистеиновое кэпирование создает тиол-связанные блокирующие группы, которые предотвращают или ингибируют конъюгацию, и, таким образом, перед конъюгацией лекарственного средства тиольная группа должна быть регенерирована за счет стадии частичного восстановления с использованием восстанавливающих агентов. Поскольку данная обработка также восстановливает межцепочечные дисульфиды антитела (также известные как "спаренные" цистеины) такие восстановленные межцепочечные дисульфиды антитела затем должны быть преобразованы. Это осуществляется в процессе повторного окисления, включая диализирование восстанавливающих агентов, цистеина или глутатиона, и обработку окислительными реагентами. Данное восстановление и повторное окисление потенциально вносит дисульфидную перетасовку (также называемое дисульфидным запутыванием, смотрите пунктирный овал ниже для иллюстрации) и накручивание антитела. Накрученное антитело может неблагоприятно влиять на сгибание белка и качество белка, и также вызывать проблемы, такие как ухудшеннная ФК (фармакокинетика) для полученных в результате ADC. Данное явление показано ниже:
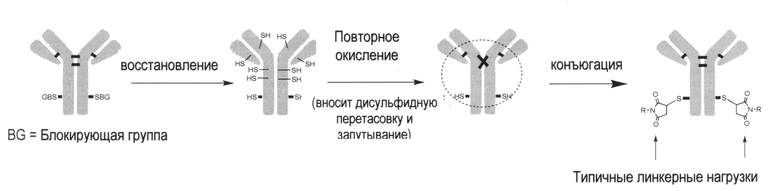
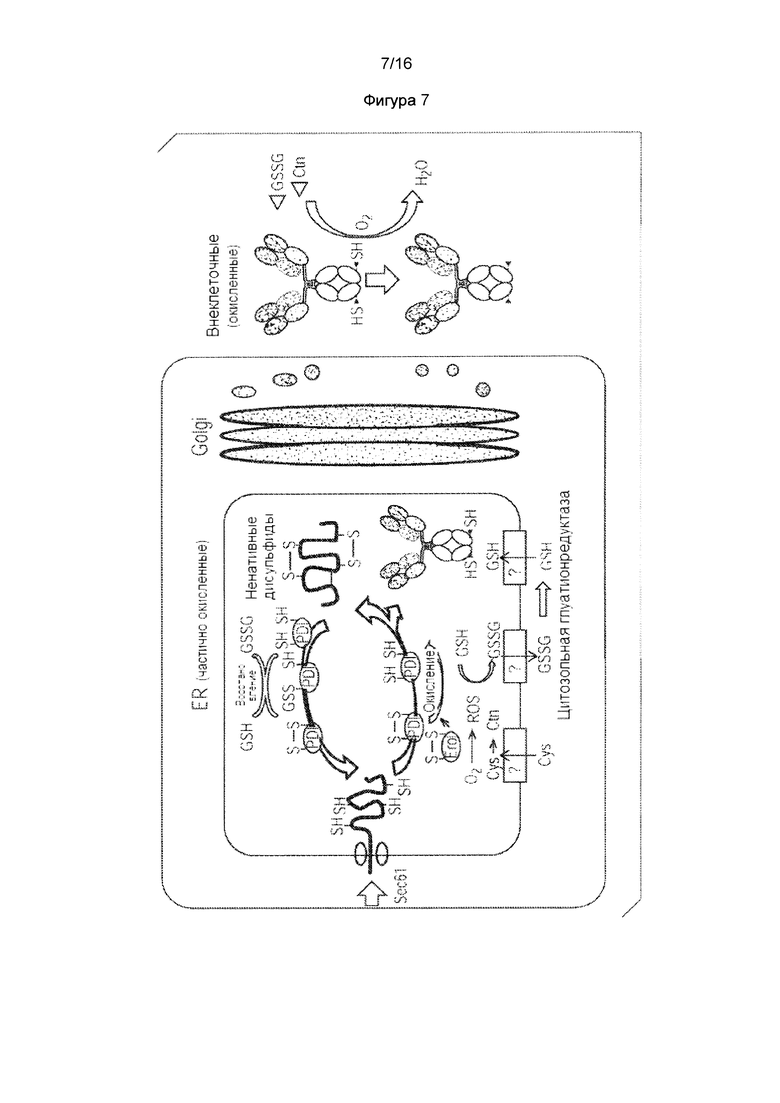
Обозначенный механизм для данного "естественного" цистеинилирующего и глутатионилирующего кэпирований является неясным. Поскольку обе модификации включают образование дисульфидной связи, уже давно предполагается, что данные модификации могут происходить в просвете эндоплазматического ретикулума (ER), где осуществляется образование дисульфидной связи. Хорошо известно, что просвет ER является более окисленным, чем цитозоль (Hwang, Sinskey et al. 1992), из-за высококонсервативного молекулярного пути окисления (Frand, Cuozzo et al., 2000, Sevier and Kaiser, 2006). Флавинсодержащий мембранный белок Ero1 (Frand and Kaiser 1998, Pollard, Travers et al., 1998) использует окислительную способность кислорода для введения дисульфидных связей внутри себя, затем переносит дисульфидную связь на протеин-дисульфидную изомеразу (PDI), которая может передавать ее на внеклеточные белки (Tu, Ho-Schleyer et al., 2000). Альтернативные независящие от Ero1 пути окисления, такие как суперсемейство квиесцинсульфидрилоксидазы /Erv/ и эпоксидредуктаза витамина К, также способствуют образованию дисульфидных связей в клетках млекопитающих (Margittai and Banhegyi 2010, Sevier 2010). GSH присутствует в просвете ER благодаря либо транспортеру (Hwang, Sinskey et al. 1992, Banhegyi, Lusini et al. 1999), либо порам (Le Gall, Neuhof et al. 2004) в мембране. Cys также предположительно присутствует благодаря транспортной активности (Hwang, Sinskey et al. 1992). Поэтому окислительный просвет ER плюс присутствие GSH и Cys сделали просвет ER приемлемым местом для глутатионилирования или цистеинилирования. Однако, нет никаких убедительных доказательств в поддержке данной гипотезы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение касается способа получения антитела в клетках млекопитающих, в котором сконструированные непарные остатков цистеина посттрансляционно модифицированы и копированы конкретными химическими структурами, причем копированные антитела являются хорошо подходящие для дальнейших сайт-специфичных стадий конъюгации с образованием конъюгатов антитело - лекарственное средство (ADC). Изобретение, кроме того, касается ADC, полученных с использованием данных кэпированных антител, в частности ADC, образованных путем селективного восстановления цистеиновых остатков кэпированных антител, что позволяет избежать восстановления межцепочечных дисульфидов и, таким образом, исключает необходимость в стадии (повторного) окисления перед конъюгацией. Изобретение, кроме того, касается новых кэпированных нитробензоатом антител, в частности антител, кэпированных 5-тио-2-нитробензойной кислотой (TNB), при этом тип кэпированных антител позволяет селективное восстановление три(3-сульфонатофенил)фосфином (TSPP), или соответствующими, или аналогично действующими восстанавливающими агентами для непосредственной конъюгации, и, следовательно, исключает обработки стадий межцепочечного дисульфидного восстановления - повторного окисления. Изобретение также касается конструирования новых цистеиновых кэпирований, состоящих из химических ручек, таких как альдегидные/азидные/алкиновые биортогональные группы, которые допускают дополнительную химическую конъюгацию лекарственного средства.
Оптимизирующая культуральная среда позволяет генерировать цистеин-мутантное антитело с различными состояниями кэпирования, включая цистеинилированные, глутатионилированные, некэпированные или копированные нитробензоатом антитела. Новые кэпированные нитробензоатом антитела, в частности, позволяют селективное восстановление с использованием TSPP, с последующей непосредственной конъюгацией, исключая необходимость использования жестких обработок на стадиях межцепочечного дисульфидного восстановления/повторного окисления. Ключевые характеристики процесса конъюгации, как представлено в некоторых вариантах осуществления представленного изобретения, показаны на следующей схеме:
где антитело, которое обычно может быть кэпировано цистеином (цистеинилированные), и, таким образом, конъюгировано с использованием описанных выше стадий восстановления и окисления, является копированным вместо TNB. TNB кэпирование удаляют, и одновременно осуществляется конъюгация посредством селективного восстановления (например, с использованием TSPP), как показано здесь:
Поскольку повторное окисление предотвращается, раскрытый процесс позволяет антителу поддерживать свое первоначальное складывание и оставаться интактным. Поэтому, представленное изобретение, таким образом, представляет собой новый способ, который кардинально улучшает и упрощает процесс конъюгации лекарственного средства для сайт-специфичных ADC на основе цистеина.
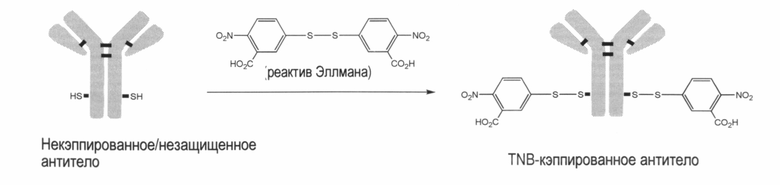
Таким образом, в некоторых вариантах осуществления изобретения цистеиновые мутантные антитела являются кэпированными нитротиобензоатом, когда к среде добавляют дитионитробензоат.В данном варианте осуществления реагент Эллмана, также известный как 5,5'-дитиобис-(2-нитробензойная кислота) и DTNB, действует при добавлении тионитробензоата (TNB) к антителу, которое экспрессируется клеточной линией, например, СНО клеточной линией. Это происходит с последующей очисткой антитела, и может продуцировать большинство видов белка с тионитробензоатным кэпированием. Смотрите пример изобретения 1.
В другом варианте осуществления изобретения TNB кэпирование антител не уменьшает термическую стабильность, например, как измерено с использованием ДСК, таким образом, что цистеинилированное, некэпированное и TNB-кэпированное антитело вели себя почти одинаково. Смотрите пример изобретения 2.
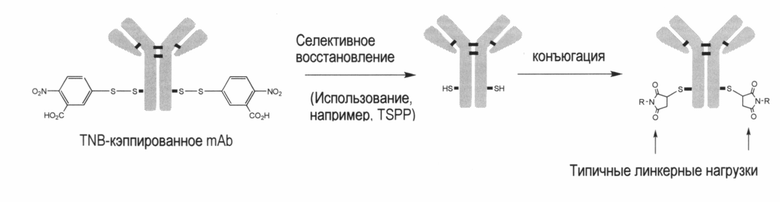
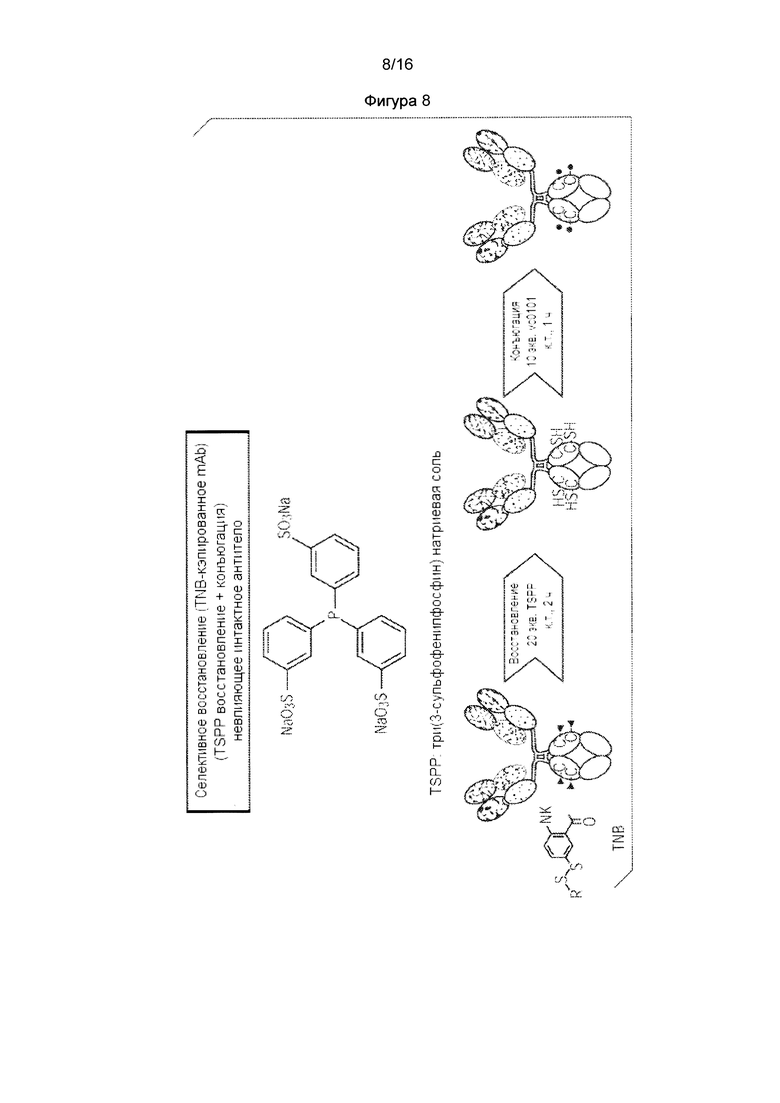
В еще другом варианте осуществления изобретения TNB-кэпированное антитело селективно восстанавливают с использованием TSPP. В данном варианте осуществления, свободные тиольные группы, образующиеся в этом процессе, позволяют непосредственную конъюгацию лекарственного средства без стадий межцепочечного восстановления и повторного окисления, что, в свою очередь, ускоряет процесс манипулирования in vitro. Смотрите пример 3.
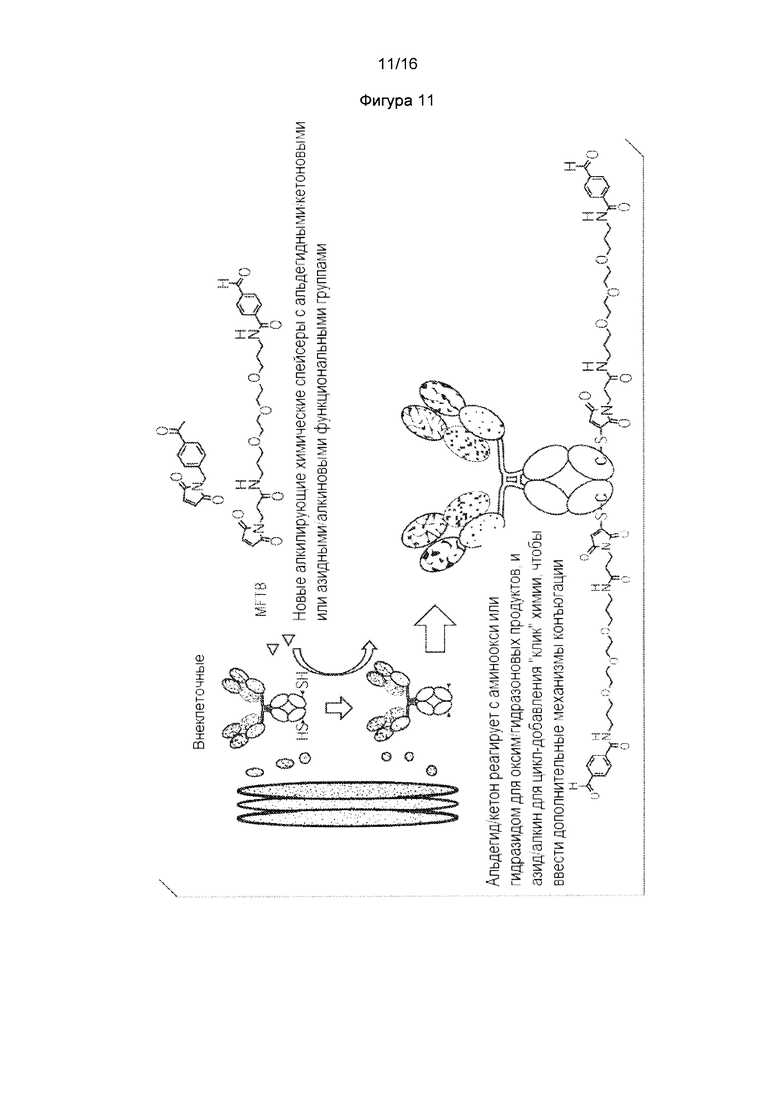
Как отмечается в данном документе, другой вариант осуществления изобретения включает образование сконструированных цистеиновых копирований, содержащих химические "ручки", отличные от TNB или аналогичных лабильных фрагментов, полезных для дополнительных типов химической конъюгации лекарственного средства. Данные ручки присоединяются к антителу путем добавления новых алкилирующих химических спейсеров в культуральную среду. Алкилирующие химические спейсеры содержат химических ручки, такие как альдегиды, кетоны, азиды и алкины. В случае кетонов и альдегидов, данные химические ручки могут взаимодействовать с аминоокси нуклеофилами или гидразидом для дополнительной химической конъюгации, образуя оксимные/гидразоновые продукты. В случае азидов и алкинов, данные химические ручки могут допускать конъюгацию с циклоприсоединением. Дополнительные алкилирующие химические спейсеры включает функциональный домен биотина, который позволяет специфическое жесткое нековалентное взаимодействие между стрепавидином и биотином. Смотрите пример 4, в котором обсуждается химическая ручка малеимидотриокса-4-формилбензамид (MTFB), дибензоциклооктил-полиэтилен малеимид (ОВСО-ПЭГ4-Малеимид), и Малеимид-ПЭГ2-биотин (МРВ).
Таким образом, мы дополнительно продемонстрировали, что засчет добавления алкилирующих химических спейсеров в культуральную среду, могут быть сконструированы новые Cys-кэпирования, состоящие из химических ручек, таких как альдегидная группа. Данные новые кэпирования могут обеспечить химические ручки для дополнительной химической конъюгации лекарственного средства, отчасти, как изображенно на данной схеме:

где:
R - алкил, арил, гетероарил, азид, алкин, альдегид, кетон, цитотоксические нагрузки (ауристатины, калихимицины, майтанзиноиды, сплицеостатины, димеры CPI/CTI, и т.д.).
Следующий вариант осуществления включает генерирование полностью некэпированного цистеинового мутантного антитела через транзиентную или СНО стабильную экспрессию HEK293 в культуральных средах, имеющих нулевые или низкие уровни цистеина, цистина и глутатиона. Смотрите примеры 5 и 6.
В данной заявке, раскрытие или обсуждение культуральных сред, имеющих нулевые или низкие уровни цистеина, цистина и глутатиона, относятся к средам, которые содержат: 0-5 мМ цистеина, предпочтительно 0-1 мМ цистеина и наиболее предпочтительно 0.2 мМ цистеина; и 0-5 мМ глутатиона, предпочтительно 0-1 мМ глутатиона и наиболее предпочтительно 0.2 мМ глутатион. Среды с данными характерными уровнями компоненто коммерчески доступны или могут быть легко получены из коммерчески доступных сред с использованием общепринятых технологий. Иногда данные среды, имеющие нулевой или низкий уровень цистеина, цистина и глутатиона, относятся к «тройным свободным» средам или «тройным низким» средам.
Как используется в данном документе, термин "алкил" сам по себе или как часть другого термина касается насыщенного углеводорода с неразветвленной или разветвленной цепью, имеющего указанное количество атомов углерода (например, "С1-С6" алкил касается алкильной группы, имеющей от 1 до 6 атомов углерода). Алкильные группы, как правило, содержат от 1 до 20 атомов углерода, предпочтительно от 1 до 6 атомов углерода, и более предпочтительно от 1 до 4 атомов углерода. Когда количество атомов углерода не указано, алкильная группа имеет от 1 до 8, или от 1 до 6, атомов углерода. Типичные С1-С8 алкилы с неразветвленной цепью включают, но не ограничиваются этим, метил, этил, н-пропил, н-бутил, н-пентил, н-гексил, н-гептил и н-октил; в то время как разветвленные С1-С8 алкилы включают, но не ограничиваются этим, -изопропил, -втор-бутил, -изобутил, -трет-бутил, -изопентил, и -2-метилбутил, ненасыщенные С2-С8 алкилы включают, но не ограничиваются этим, винил, аллил, 1-бутенил, 2-бутенил, изобутенил, 1-пентенил, 2-пентенил, 3-метил-1-бутенил, 2- метил-2-бутенил, 2,3-диметил-2-бутенил, 1-гексил, 2-гексил, 3-гексил, ацетиленил, пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинил и 3-метил-1-бутинил. Ссылка на "алкил" в данном документе касается незамещенных и замещенных фрагментов, как описано выше.
Как используется в данном документе, термин "арил" сам по себе или как часть другого термина, означает замещенный или незамещенный одновалентный карбоциклический ароматический углеводородный радикал из 5-20, предпочтительно 5-14 или 6-14, атомов углерода, полученный путем удаления одного атома водорода от одного атома углерода исходной ароматической кольцевой системы. Типичные арильные группы включают, но не ограничиваются этим, радикалы, полученные из бензола, замещенного бензола, нафталина, антрацена, бифенила и тому подобного.
"Гетероарил" касается одновалентной замещенной или незамещенной ароматической моноциклической, бициклической или трициклической кольцевой системы, имеющей от 2 до 10, от 2 до 14 или от 2 до 20 атомов углерода, предпочтительно от 3 до 8 атомов углерода (также называемыми как кольцевые члены) и от одного до четырех гетероатомных кольцевых членов, независимо выбранных из N, О, Р или S, и полученной путем удаления одного атома водорода от кольцевого атома исходной кольцевой системы. Один или несколько атомов N, С или S в гетероциклиле могут быть окисленными. Гетероарилы могут представлять собой моноциклические, бициклические или трициклические кольцевые системы. Типичные гетероарилы включают, но не ограничиваются этим, триазолил, тетразолил, оксадиазолил, пиридил, фурил, бензофуранил, тиофенил, бензотиофенил, хинолинил, пирролил, индолил, оксазолил, бензоксазолил, имидазолил, бензимидазолил, тиазолил, бензотиазолил, изоксазолил, пиразолил, изотиазолил, пиридазинил, пиримидинил, пиразинил, триазинил, циннолинил, фталазинил, хиназолинил, пиримидил, азепинил, оксепинил и хиноксалинил. Гетероарилы являются необязательно замещенными.
Как используется в данном документе термин "предварительно определенный" касается химического компонента, который выбран практикующим специалистом согласно изобретению, в отличие от химического компонента, который, как оказывается, присутствует. Таким образом, "предварительно определенный фрагмент кэпирования" представляет собой фрагмент кэпирования, который был выбран практикующим специалистом согласно изобретению для размещения на (то есть, ковалентного связывания с) остатке цистеина(ов) антитела. Предварительно определенный фрагмент кэпирования, как правило, представляет собой компонент, выбранный для добавления в культуральную среду, который в результате приводит к присутствию конкретного и желаемого кэпа на антителе. Предварительно определенный фрагмент кэпирования не встречается в культуральной среде общего назначения.
Следующий вариант осуществления включает непосредственное конъюгирование полезной нагрузки или препарата линкер - полезная нагрузка с некэпированным цистеиновым мутантным антителом.
Примечательно, что получение полностью некэпированного подверженного действию растворителя непарного Cys в антителе в клетках млекопитающих является необычным, поскольку только очень низкий процент свободных остатков цистеина был ранее обнаружен в рекомбинантных антителах IgG1, IgG2 и IgG4 (Zhang and Czupryn 2002). Канонические Cys остатки для нормального IgG предположительно являются дисульфидно связанными. Низкий уровень свободного Cys, вероятно, обусловлен двумя источниками: одним из источников является деградация межцепочечных дисульфидных связей между тяжелыми цепями или между тяжелой цепью и легкой цепью. Cys остатки, образующие межцепочечные дисульфидные святи, являются восприимчивыми к восстановлению (Liu and May 2012), поскольку они очень подвержены действию растворителя. В основных условиях дисульфидные связи могут разрушаться на дегидроаланин и персульфид, которые могут вернуться к Cys (Florence 1980). Другим источником является неполное образование внутрицепочечных дисульфидных связей во время биосинтеза. Внутрицепочечный Cys и дисульфидные связи зарыты в пределах антипараллельных структур р-листа и не подвержены действию растворителя. Известно, что неканоническая зародышевая линия Cys, которая отсутствует в антителе согласно данному исследованию, существует в вариабельной области антитела. Ее частота в зародышевой линии человека относительно редка: от 6% до 10% (Ehrenmann, Kaas et al., 2010, Buchanan, Clementel et al., 2013). Несколько отчетов (Kroon, Baldwin-Ferro et al. 1992, Johnson, Oliver et al. 1997, Gadgil, Bondarenko et al. 2006, Banks, Gadgil et al. 2008, Buchanan, Clementel et al. 2013) показывают, что данные неканонические Cys оказывают незначительное влияние на стабильность и агрегацию белка. Некоторые из данных неанонических Cys, как обнаружено, подвержены действию растворителя и цистеинилированы (Banks, Gadgil et al. 2008, Buchanan, Clementel et al. 2013). В соответствии с результатами данного исследования цистеинилирование этих неанонических Cys, вероятно, происходит вне клеток млекопитающих.
По всей видимости, чувствительность тиола зависит не только от внешних факторов, таких как окислительная среда, но и от внутренних факторов, таких как доступность растворителей и локальная окружающая Cys среда. Расположение Cys в области Fab, Fc, тяжелой цепи или легкой цепи не является фактором, влияющим на модификацию цистеинилирования (Banks, Gadgil et al. 2008, Junutula, Raab et al. 2008, Chen, Nguyen et al. 2009, Buchanan, Clementel et al. 2013). Биологические последствия цистеинилирования или глутатионилирования являются неясными. Ряд белков, таких как тирозинфосфатазы и молекулярные шапероны, содержат чувствительный к восстановлению-окислению Cys (Georgiou 2002, Barford 2004). Для антитела, удаление цистеинилирования из неканонического Cys не влияет на вторичную структуру белка, но, по всей видимости, улучшает третичную или четвертичную структуру белка, путем уменьшения агрегации и увеличения температуры плавления (Banks, Gadgil et al. 2008). Для Fc Cys в этом исследовании, цистеинилирование не оказывает влияния на всю структурную стабильность белка.
Новый открытый клеточный механизм: Cys-кэпирование непарного поверхностного цистеина, вероятно, встречается вне клеток млекопитающих. На основе данных этого исследования предлагается гипотетическая модель для модификаций Cys-кэпирования (Фигура 7). Полипептиды тяжелых и легких цепей антитела транслоцируются в просвет ER через комплекс Sec61 (Schwartz and Blobel 2003). Нативные дисульфидные связи образуются посредством семейства белков PDI с мощностью окисления от путей Его1 или других окислительных источников. Неправильные дисульфидные связи восстанавливаются GSH, который образуется из цитозольной глутатионредуктазы (Chakravarthi, Jessop et al. 2006) и импортируется посредством мембранного транспортера (Hwang, Sinskey et al. 1992, Banhegyi, Lusini et al. 1999, Le Gall, Neuhof et al. 2004). Полностью собранное Cys мутантное антитело остается некэпированным и в конечном итоге секретируется в культуральную среду. Ctn и GSH в культуральной среде образуют дисульфидную связь со свободным Cys антитела посредством дисульфидного обмена с последующим окислением растворенного кислорода в среде.
Тот факт, что полностью некэпированный Cys может быть сгенерирован в клетках млекопитающих, мог бы выявить некоторые интересные физиологические окислительно-восстановительные состояния о просвете ER. Во-первых, просвет ER является значительно менее окислениям, чем внеклеточное пространство. Это согласуется с представлением о том, что надлежащее образование дисульфидов требует как окислительных, так и восстановительных реакций в просвете ER. Нативные и ненативные дисульфиды транзиентно образуются и восстанавливаются для того, чтобы достичь правильную конформацию. Высказывалось предположение, что точное равновесие между реакциями окисления и восстановления в ER является важным для того, чтобы данные ковалентные связи оставались динамическими до завершения сгибания белка. Либо избыточное окисление ER, стабилизирующее ненативные связи, либо восстановление ER, препятствующее образованию дисульфидов, может вызвать стрессовые реакции ER (Margittai and Sitia 2011). Его1 и другие окислительные пути способствуют окислительной способности для образования дисульфидов (Frand, Cuozzo et al. 2000, Sevier and Kaiser 2006, Margittai and Banhegyi 2010, Sevier 2010), что делает просвет ER более окисленным, чем цитозоль (Hwang, Sinskey et al. 1992). В то же время восстановленная форма GSH, вырабатываемая цитозольной GSH-редуктазой, может быть импортирована в просвет ER для обеспечения способности к восстановлению (Jessop and Bulleid 2004, Chakravarthi, Jessop et al. 2006, Gomez, Vinson et al. 2010). Дрожжевые клетки могут выживать без GSH-синтезирующего пути, предполагая, что просвет ER дрожжей является более окисленным, чем ER млекопитающего. Поскольку дрожжи являются уникальным клеточным организмом, возможно, что для осуществления менее сложных клеточных функций, чем для клеток млекопитающих, требуется меньшее количество и более простые внеклеточные белки с дисульфидными связями. Кроме того, менее окисленный ER дополнительно подтверждается обнаружением того, что PDI может восстанавливать неправильно свернутые белки в ER для ретро-транслокации для деградации (Kopito and Sitia 2000), развертывать цепочку токсина холер А1 для цитозольного транспорта (Tsai, Rodighiero et al. 2001), и служить в качестве редуктазы при экспортировании на клеточную поверхность (Yoshimori, Semba et al. 1990, Jordan and Gibbins 2006).
Второе раскрытие о просвете ER заключается в том, что свободные GSH или Cys в просвете ER, и свободный Cys остаток белка, являются плохими субстратами PDI для образования вместе дисульфидной связи. Образование дисульфидной связи внеклеточных белков катализируется членами семейства PDI и оксидоредуктазы, дисульфидная связь которых переносится из Его1. Поскольку не происходит образование никакой дисульфидной связи между GSH/Cys и сконструированным Cys антитела в ER, они не являются субстратом оксидоредуктаз, даже когда GSH может восстанавливать окисленный PDI (Chakravarthi, Jessop et al. 2006). Сообщалось, что значительная часть ER-расположенных GSH, как было обнаружено, находятся в смешанном дисульфиде с белком ER (Bass, Ruddock et al. 2004). Возможно, что белки ER, образующие смешанные дисульфиды с GSH, представляют собой PDI и другие оксидоредуктазы. Следует отметить, что помимо цистеинилирования и глутатионилирования, третий тип кэпирования был идентифицирован как дополнительная легкая цепь, образующая дисульфидную связь со сконструированным Cys (Gomez, Vinson et al. 2010). Местом проведения данной модификации, вероятно, является просвет ER, поскольку обнаружено образование тройной легкой цепи, влияющее на внутриклеточное продуцирование GSH и соотношение между LC и НС в мРНК.
Давно неизвестно, почему процент кэпирования варьируется от портии к партии (Banks, Gadgil et al. 2008, Junutula, Raab et al. 2008, Chen, Nguyen et al. 2009, Gomez, Vinson et al. 2010, Buchanan, Clementel et al. 2013). Наши данные показывают, что это связано с недостаточностью Cys/Ctn в среде, которая может находиться под влиянием роста клеток и состава среды. Интересно отметить, что глутатионилированные материалы не были обнаружены в транзиентной культуре HEK293 или кратковременной культуре стабильного СНО. Это согласуется с тем, что концентрация GSH в типичной культуральной среде млекопитающих является очень низкой. С другой стороны, цитозоль содержит приблизительно 2-10 мМ GSH (Meister and Anderson 1983). Глутатионилированные материалы могут быть обнаружены в стабильных СНО 12-дневных культуральных материалах (неопубликованные данные), что указывает на то, что источник GSH, вероятно, происходит от клеточного лизиса. Действительно, сообщалось, что концентрация GSH в культуральной среде постепенно увеличивалась вместе с более длительными днями культивирования и может доходить до приблизительно в 10-раз более высокой вплоть до 200 мкМ (Gomez, Vinson et al. 2010). В этом исследовании добавление избытка GSH или Ctn в культуру может продуцировать полностью глутатионилированное или цистеинилированное Cys мутантное антитело. Ранее сообщалось, что глутатионилирование очищенных видов Cys антитела может быть эффективно удалено и заменено цистеинилированием in vitro с использованием Cys/Ctn окислительно-восстановительной пары (Chen, Nguyen et al. 2009). Об удалении цистеинилатона с GSH и образование глутатионилирования in vitro пока не сообщается.
В некоторых вариантах осуществления изобретения предусмотренным является способ связывания предварительно определенного фрагмента кэпирования с одним или несколькими непарными остатками цистеина на антителе, причем указанный способ включает стадию: роста клеточной линии, экспрессирующей антитело в культуральной среде, содержащей указанный предварительно определенный фрагмент кэпирования, или предшественник указанного предварительно определенного фрагмента кэпирования, причем указанная клеточная линия экспрессирует указанное антитело, и причем указанный предварительно определенный фрагмент кэпирования присоединен посредством ковалентной связи к, по меньшей мере, одному из указанных непарных остатков цистеина на указанном экспрессированном антителе. Фрагмент кэпирования может быть выбран из группы, состоящей из 5-тио-2-нитробензойной кислоты (TNB), 2-меркаптопиридина, дитиодипиридина (DTDP), 4-тиобензойной кислоты, 2-тиобензойной кислоты, 4-тиобензолсульфоновой кислоты, 2-тиобензолсульфоновой кислоты, метилсульфоната (Ms), п-толуолсульфоната (Ts) и трифторметансульфоната (Tf), но возможны и другие фрагменты кэпирования.
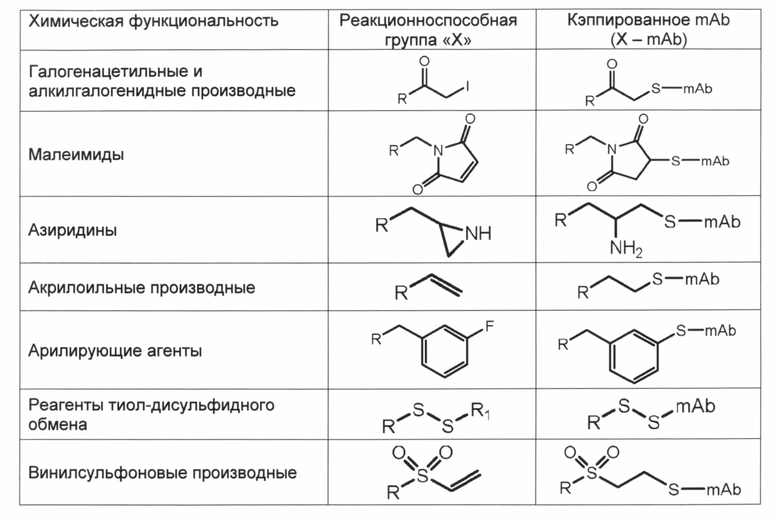
Такие другие фрагменты кэпирования включают так называемые химические ручки фрагментов кэпирования, как отмечалось выше, такие как малеимидотриокса-4-формилбензамид (MTFB) и, в более общем случае, связанные азиды и алкины (которые дополнительно облегчают клик-химию), связанные альдегиды и кетоны (которые дополнительно облегчают оксимную химию), связанные галогенацетилы (которые облегчают тиольную и аминную химию), и связанные малеимиды (которые дополнительно облегчают тиольную химию). Добавление, связывающее химические вещества, может быть выполнено, как описано в данном документе, а также в соответствии с известными способами.
Изобретение также предусматривает способ получения конъюгата антитело -лекарственное средство (ADC) или конъюгат белка, включающий стадии: (а) получения кэпированного антитела в клеточной культуре, причем один или несколько непарных остатков цистеина на указанном антителе являются ковалентно связанными посредством связей серы с одним или несколькими предварительно определенными фрагментами кэпирования; (b) подвергание действию указанного кэпированного антитела восстанавливающего агента, способного удалить указанные фрагменты кэпирования с указанного антитела без восстановления межцепочечных связей серы антитела; и (с) без введения окислительного агента, конъюгирование одной или нескольких восстановленных связей серы на указанном антителе с полезной нагрузкой через связывающий фрагмент. Указанный выше способ получения ADC может быть осуществлен там, где фрагмент кэпирования выбирают из группы, состоящей из 5-тио-2-нитробензойной кислоты (TNB), 2-меркаптопиридина и дитиодипиридина (DTDP). Кэпирование с 5-тио-2-нитробензойной кислотой (TNB) представляет особый интерес.
Такое кэпирование, как правило, происходит с последующим селективным восстановлением в непарных остатках цистеина.
Полезная нагрузка, используемая в указанном выше способе, чаще всего представляет собой ауристатин, сплайсостатин, калихеамицин или димер, содержащий один или несколько мономеров CBI, CPI и CTI. В случае, когда полезная нагрузка представляет собой ауристатин, она может быть выбрана из (2-метилаланил-N-[(3R,4S,5S)-3-метокси-1-{(2S)-2-[(1R,2R)-1-метокси-2-метил-3-оксо-3-{[(1S)-2-фенил-1-(1,3-тиазол-2-ил)этил]амино}пропил]пирролидин-1-ил}-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамида); (2-метилаланил-N-[(3R,4S,5S)-1-{(2S)-2-[(1R,2R)-3-{[(1S)-1-карбокси-2-фенилэтил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-3-метокси-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамида); (2-метил-L-пролил-N-[3R,4S,5S)-3-метокси-1-{(2S)-2-[(1R,2R)-1-метокси-3-{[(2S)-1-метокси-1-оксо-3-фенилпропан-2-ил]амино}-2-метил-3-оксопропил]пирролидин-1-ил}-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамида, соли трифторуксусной кислоты); (2-метилаланил-N-[(3R,4S,5S)-3-метокси-1-{(2S)-2-[(1R,2R)-1-метокси-3-{[(2S)-1-метокси-1-оксо-3-фенилпропан-2-ил]амино}-2-метил-3-оксопропил]пирролидин-1-ил}-5-метил-1-оксогептан-4-ил]-N-метил-1-валинамида); (2-метилаланил-N-[(3R,4S,5S)-1-{(2S)-2-[(1R,2R)-3-{[(1S,2R)-1-гидрокси-1-фенилпропан-2-ил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-3-метокси-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамида); (2-метил-L-пролил-N-[(3R,4S,5S)-1-{(2S)-2-[(1R,2R)-3-{[(1S)-1-карбокси-2-фенилэтил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-3-метокси-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамида, соли трифторуксусной кислоты); монометилдоластатина 10; (N-метилвалин-валин-долаизолейцин-долапроин-норэфидрина); и (N-метилвалин-валин-долаизолейцин-долапроин-фенилаланина).
Линкер, используемым в указанном(ых) выше способе(ах) часто представляет собой тс или mcvcPABC, но многие другие линкеры находятся в пределах объема изобретения, включая те, которые описаны, например, в WO15/110935. Как используется в данном документе, "РАВС" касается п-аминобензилоксикарбонила и его производных фрагментов, например, структуры:
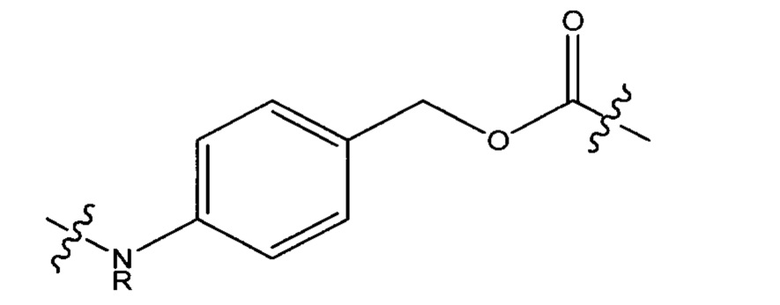
или ее варианты. "VC" или "vc" касается пептида валин-цитруллин. "МС" или "mc" касается:
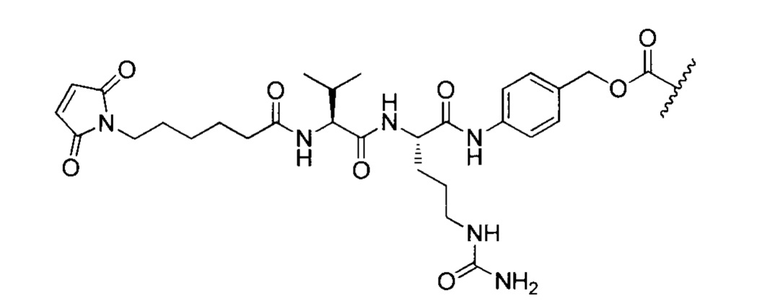
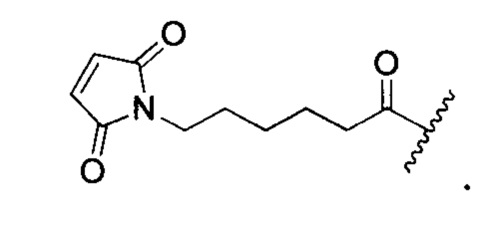 Как используется в данном документе, "mcvcPABC" касается линкера:
Как используется в данном документе, "mcvcPABC" касается линкера:
В некоторых вариантах осуществления, восстанавливающий агент, используемый в указанном выше способе, как правило, имеет формулу:
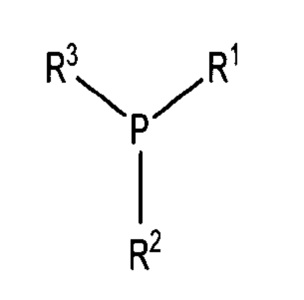
или R4-S-H, где каждый из R1, R2, R3 и R4 независимо выбирают из группы, состоящей из (С1-С6)алкила, (С5-С7)арила и (С5-С7)гетероарила, где каждый из R1, R2, R3 и R4 независимо необязательно замещен одним или несколькими заместителями, выбранными из SO3Na, СООН, ОН, ОМе, NO2 и NH2.
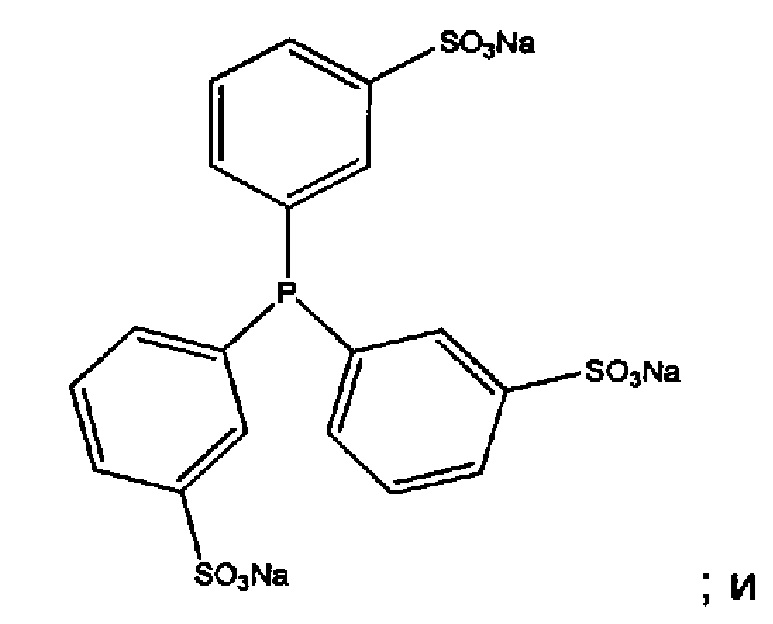
Часто восстанавливающий агент представляет собой три(3-сульфофенил)фосфин (TSPP):
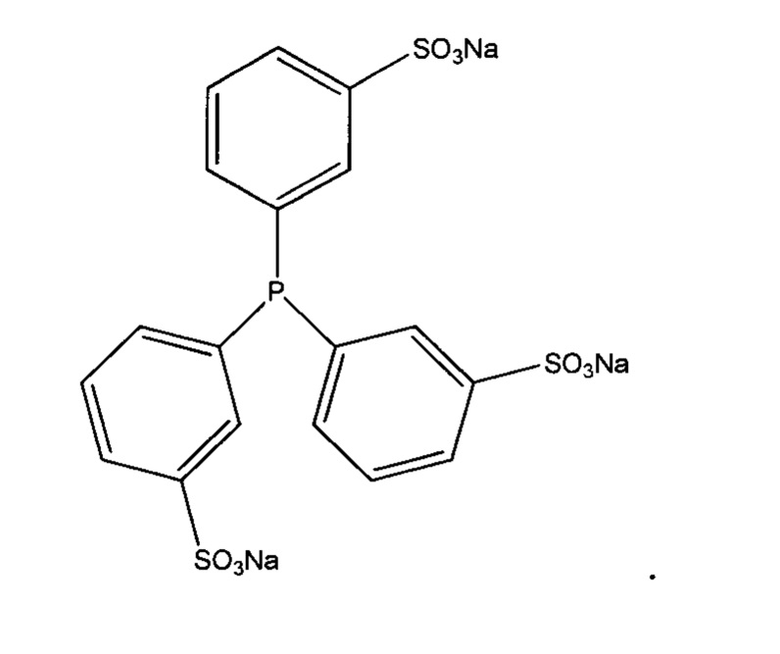
Варианты осуществления изобретения включают те, в которых фрагмент кэпирования TNB присоединен к антителу с использованием ди-TNB, также известного как реагент Эллмана:
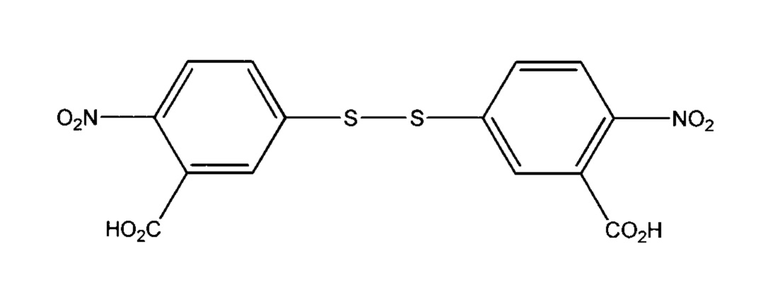
для получения кэпированного антитела в клеточной культуре.
Кроме того, варианты осуществления изобретения включают способ получения антитела, содержащего один или несколько некэпированных непарных цистеинов. Некэпированные непарные цистеины определяются как остатки цистеина с открытыми тиольными боковыми цепями. Данные свободные тиольные группы не являются образующими какие-либо ковалентные или нековалентные связи с какими-либо другими химическими веществами, таким образом, они являются реакционноспособными к химической конъюгации. Диаграмма некэпированных остатков цистеина в антителе является следующей:
Данный способ включает стадии: (а) роста клетки, экспресирующей антитело, в культуральной среде с низким цистеином, низким цистином и низким глутатионом, и (b) сбора экспрессированного некэпированного антитела. В данном способе, культуральная среда, как правило, содержит меньше, чем 5 мМ, меньше, чем 1 мМ или меньше, чем 0,2 мМ цистеина, меньше, чем 5 мМ, меньше, чем 1 мМ или меньше, чем 0,2 мМ цистина или меньше, чем 5 мМ, меньше, чем 1 мМ или меньше, чем 0,2 мМ глутатиона. Кроме того, в данном способе, клеточная линия может быть выбранна из группы, состоящей из СНО, HEK293 и NSO, но, конечно, другие клеточные линии находятся в пределах объема изобретения.
Дополнительно, варианты осуществления изобретения включают те, в которых существует способ получения конъюгата лекарственного средства с антителом (ADC) или белкового конъюгата, причем указанный способ включает стадии: (а) роста клетки, экспресирующей антитело в культуральной среде с низким цистеином, низким цистином и низким глутатионом, (b) сбора экспрессированного антитела, содержащего один или несколько некэпированных непарных цистеинов, и (с) конъюгирования линкер-полезная нагрузка с указанным собранным антителом.
Аналогичным образом, изобретение включает способы получения конъюгата лекарственного средства с антителом (ADC) или белкового конъюгата, включающие стадию конъюгирования линкер-полезной нагрузки с выделенным антителом, содержащим один или несколько некэпированных, непарных цистеинов.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1. Фигура 1А: Схематическая диаграмма цистеинилирования и глутатионилирования антитела со сконструированной мутацией Cys поверхности в области Fc. Фигура 1 В: Масс-спектральный график цистеинового мутантного антитела, экспрессированного в стабильных клетках CHO-DUKX. Фигура 1С.Масс-спектральный график цистеинового мутантного антитела, экспрессированного в транзиентной экспрессии HEK293.
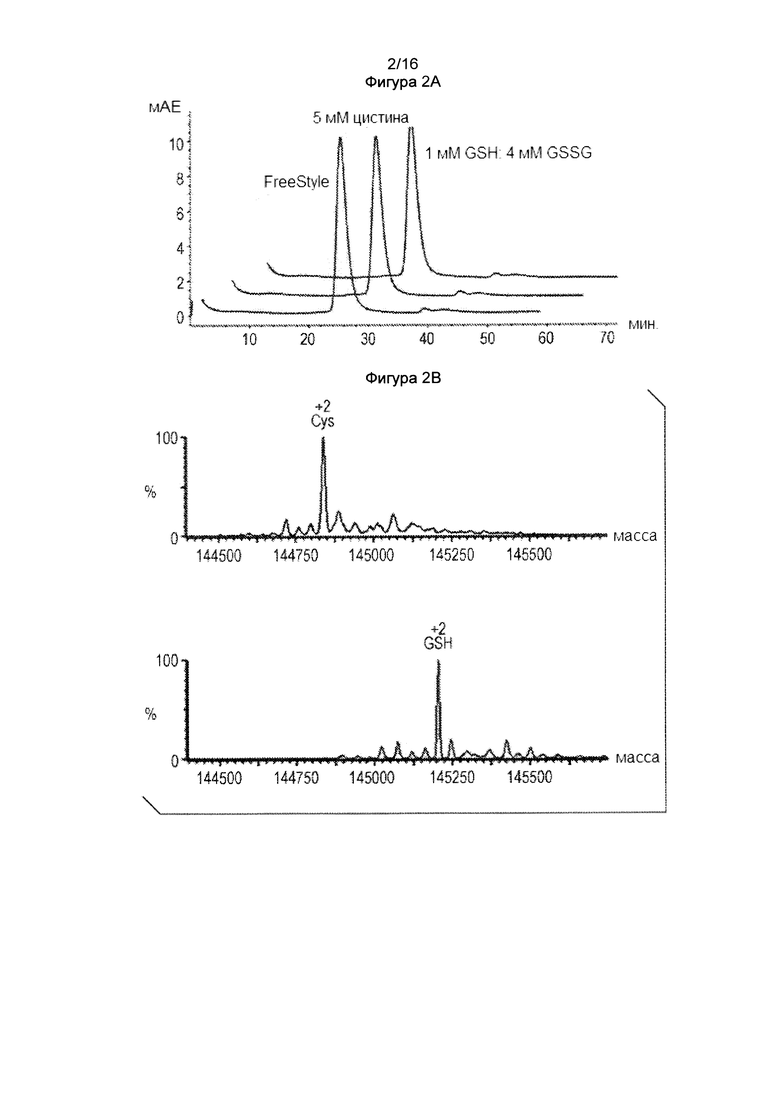
Фигура 2. Избыточный GSH или цистин, добавленный в культуральную среду, в результате приводит к получению полностью глутатионилированных или цистеинилированных видов. Фигура 2А: SEC анализ Cys мутантного антитела транзиентно экспрессированного в HEK293 клетках с избытком цистина или глутатиона. Фигура 2В. Масс-спектральный анализ цистеиновых мутантных антител, показанных на фигуре 2А.
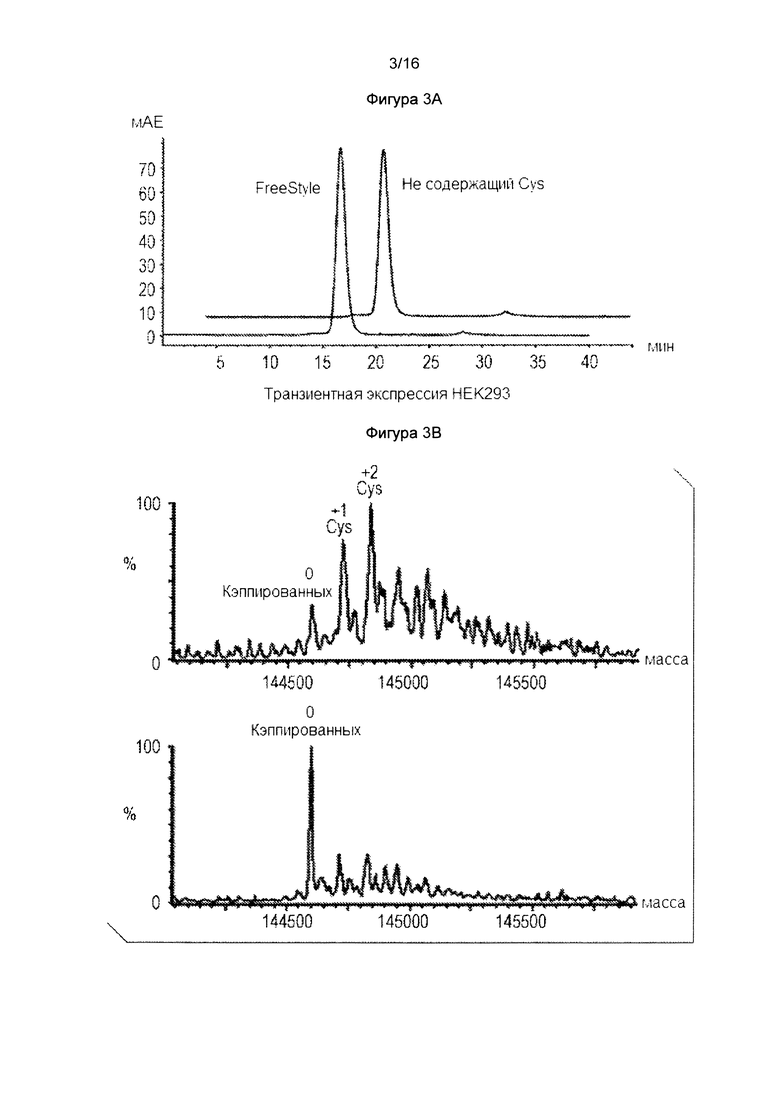
Фигура 3. Полностью некэпированное цистеиновое мутантное антитело генерируется засчет транзиентной экспрессии HEK293 в среде с низким цистеином, цистином и глутатионом ("тройной низкоуровневой" среде). Фигура 3А: SEC анализ цистеинового мутантного антитела транзиентно экспрессированного в клетках HEK293 в тройной низкоуровневой среде. Фигура 3В: Масс-спектральный анализ цистеинового мутантного антитела, как показано на фигуре 3А.
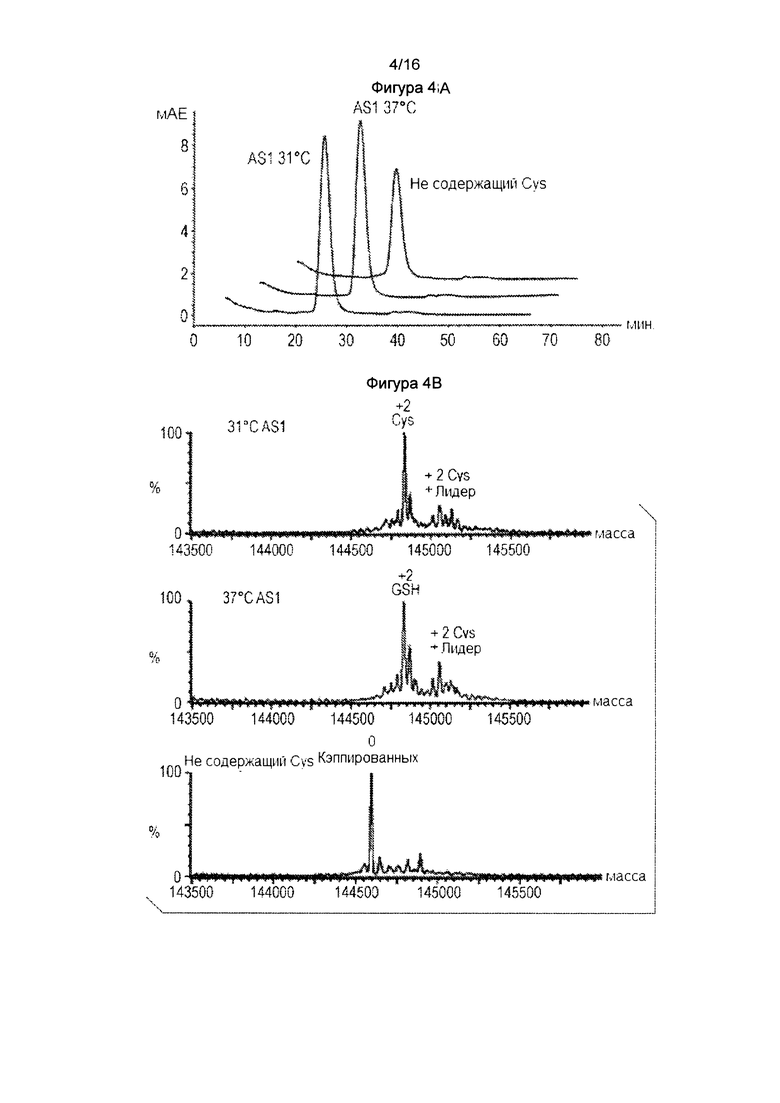
Фигура 4. Полностью некэпированное цистеиновое мутантное антитело генерируется стабильной экспрессией СНО в тройной низкоуровневой (низкий цистеин, низкий цистин и низкий глутатион) среде. Фигура 4А: SEC анализ цистеинового мутантного антитела, экспрессированного в стабильных CHO-DUKX в тройной низкоуровневой среде. Фигура 4В: Масс-спектральный анализ цистеинового мутантного антитела, как показано на фигуре 4А.
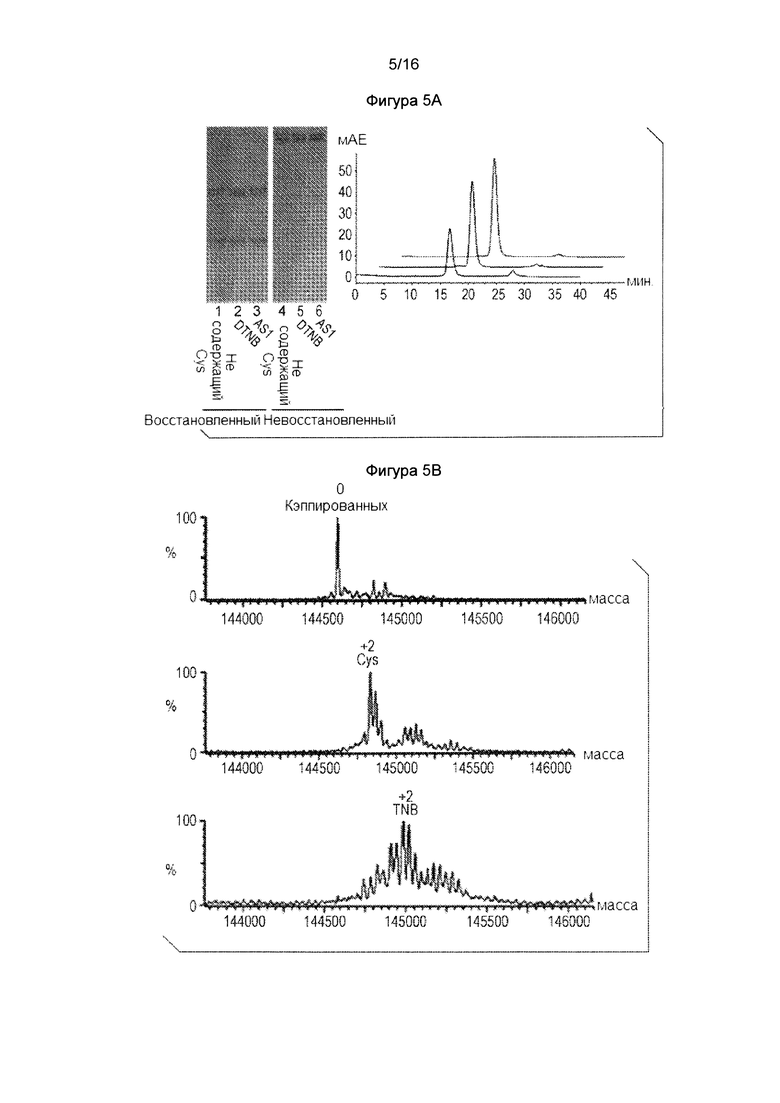
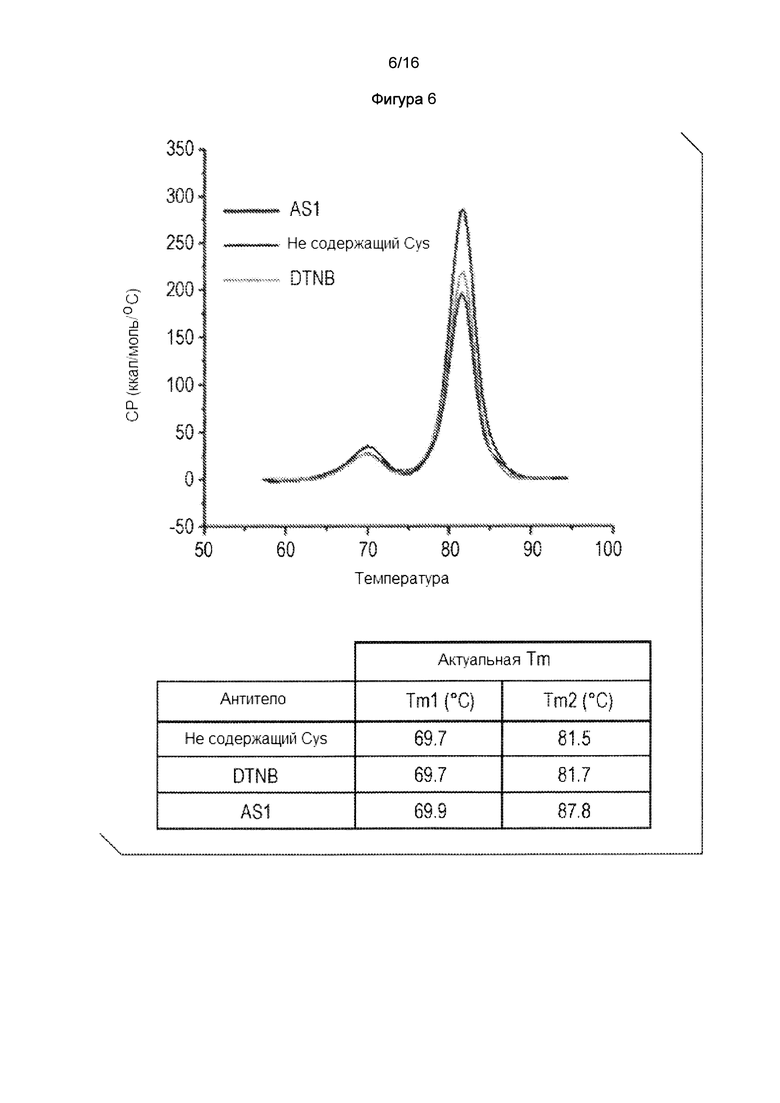
Фигура 5. Цистеиновое мутантное антитело является дополнительно кэпированным нитротиобензоатом (TNB), когда дитионитробензоат (DTNB, также называется как реагент Эллмана) добавляют к среде. Фигура 5А: SDS-PAGE анализ и SEC анализ цистеинового мутантного антитела, экспрессированного в стабильном CHO-DUKX в CD-СНО среде (Thermo-Fischer) (в данном документе, CD-CHO среда касается либо коммерчески доступных CD-CHO сред, либо эквивалентных проприетарных составов сред) CD-CHO плюс 0,5 мМ DTNB, и тройной низкоуровневой среде. Фигура 5В: Масс-спектральный анализ Cys мутантного антитела, как показано на фигуре 5А. Фигура 6. Термограмма ДСК сравнения температуры плавления цистеиновых мутантных антител, которые являются цистеинилированными, некэпированноми и кэпированными нитробензоатом, и сопутствующими данными.
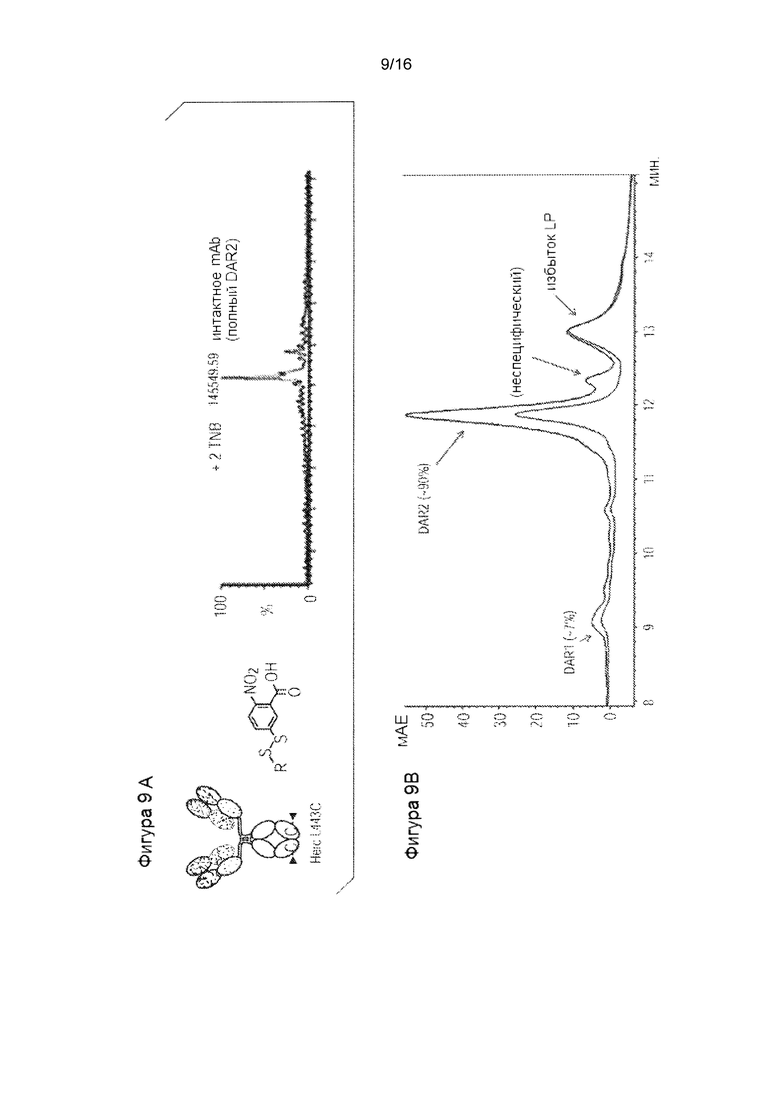
Фигура 7. Понятный вероятный механизм модификаций цистеинилирования и глутатионилирования в цистеиновом мутантном антителе в клетках млекопитающих. Фигура 8. Селективное восстановление TSPP и непосредственная конъюгация исключает межцепочечное дисульфидное восстановление/повторное окисление. Фигура 9. TNB-кэпированное антитело продуцирует 90% DAR2 ADC с TSPP восстановлением/конъюгацией. Фигура 9А. Масс-спектральный анализ цистеинового мутантного антитела, расщепленного PNGase F для интактного антитела L443C. Фигура 9В. Селективное восстановление TSPP и последующая непосредственная конъюгация полезной нагрузки с линкером mcvcPABC0101.
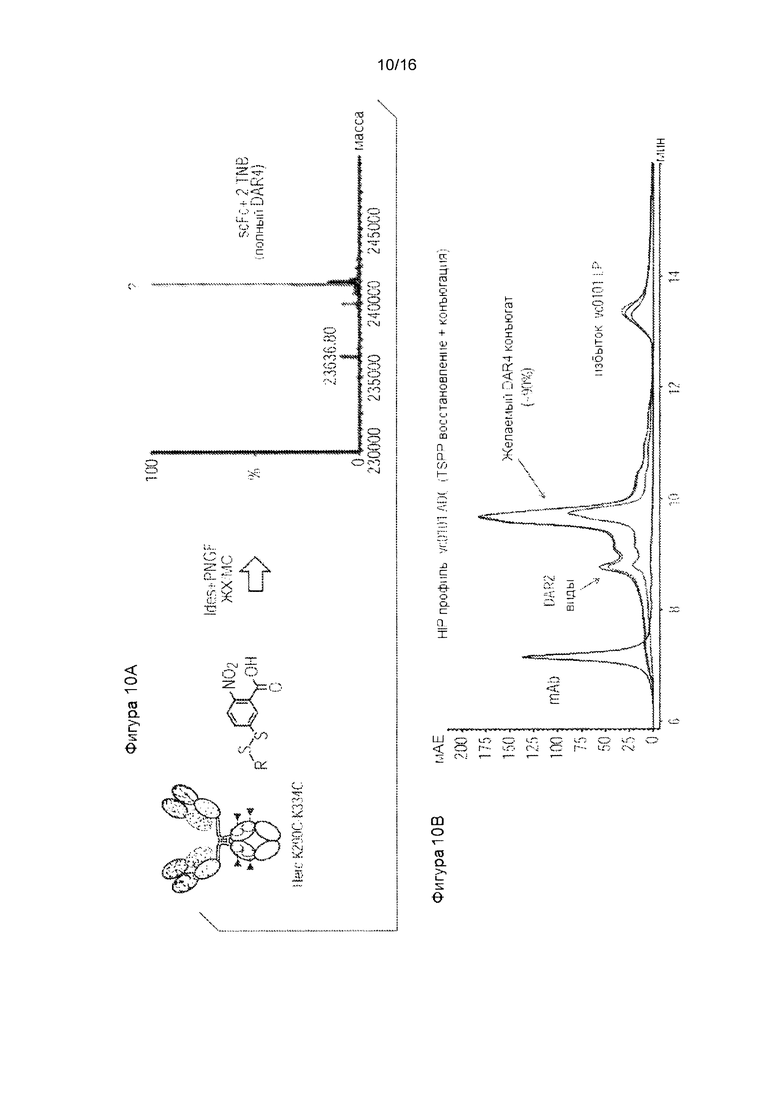
Фигура 10. TNB-Кэпированное Herc-K290C/K334C продуцирует 90% DAR4 ADC с TSPP восстановлением/конъюгацией. Фигура 10А. Масс-спектральный анализ цистеинового мутантного антитела, расщепленного PNGase F и IdeS для Fc области К290С/К334С.ФигураЮВ. Селективное восстановление TSPP и последующая непосредственная конъюгация полезной нагрузки с линкером mcvcPABC0101.
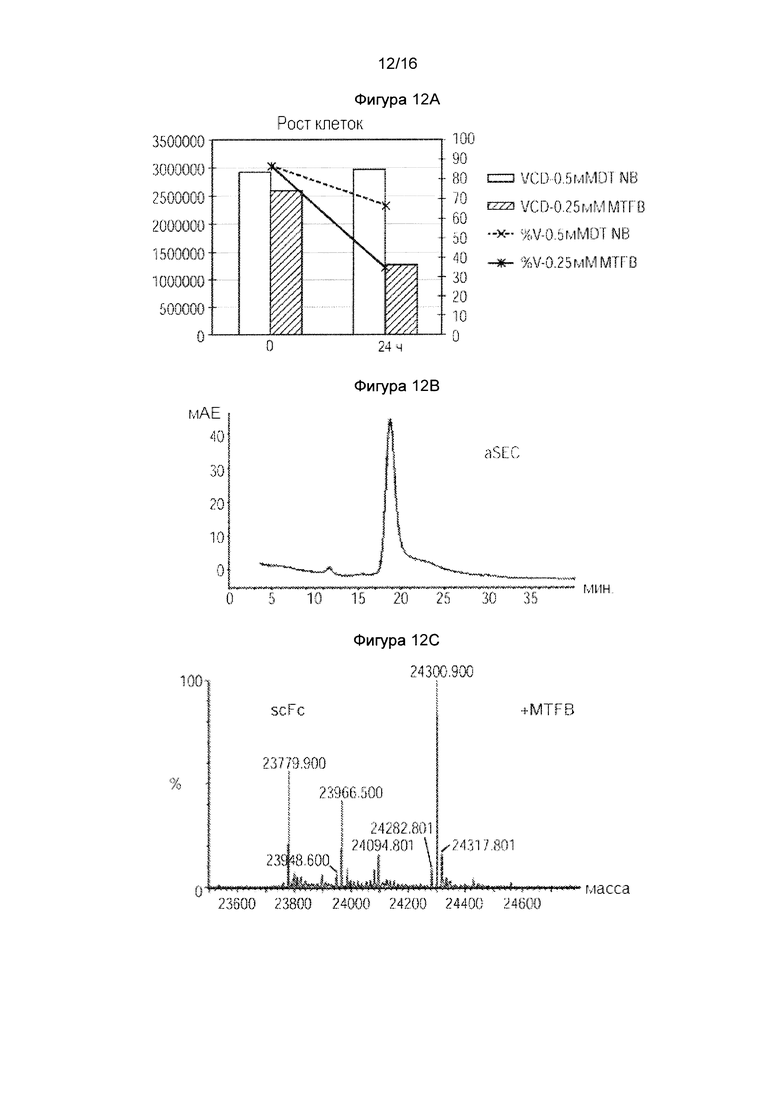
Фигура 11. Получение новых цистеин-кэпированных химических спейсеров с новыми химическими ручками, отличными от реакционноспособных тиолов. Фигура 12. Получение MFTB-кэпированного НАВ08 L443C в стабильных клетках СНО. Фигура 12А. Подсчет клеток и жизнеспособность клеток стабильных клеток СНО в присутствии MFTB или DTNB в тройной низкоуровневой среде. Фигура 12В. SEC анализ цистеинового мутантного антитела, экспрессированного в стабильных клетках СНО в тройной низкоуровневой среде с MFTB. Фигура 12С. Масс-спектральный анализ цистеинового мутантного антитела, расщепленного PNGase F для интактного антитела L443C.
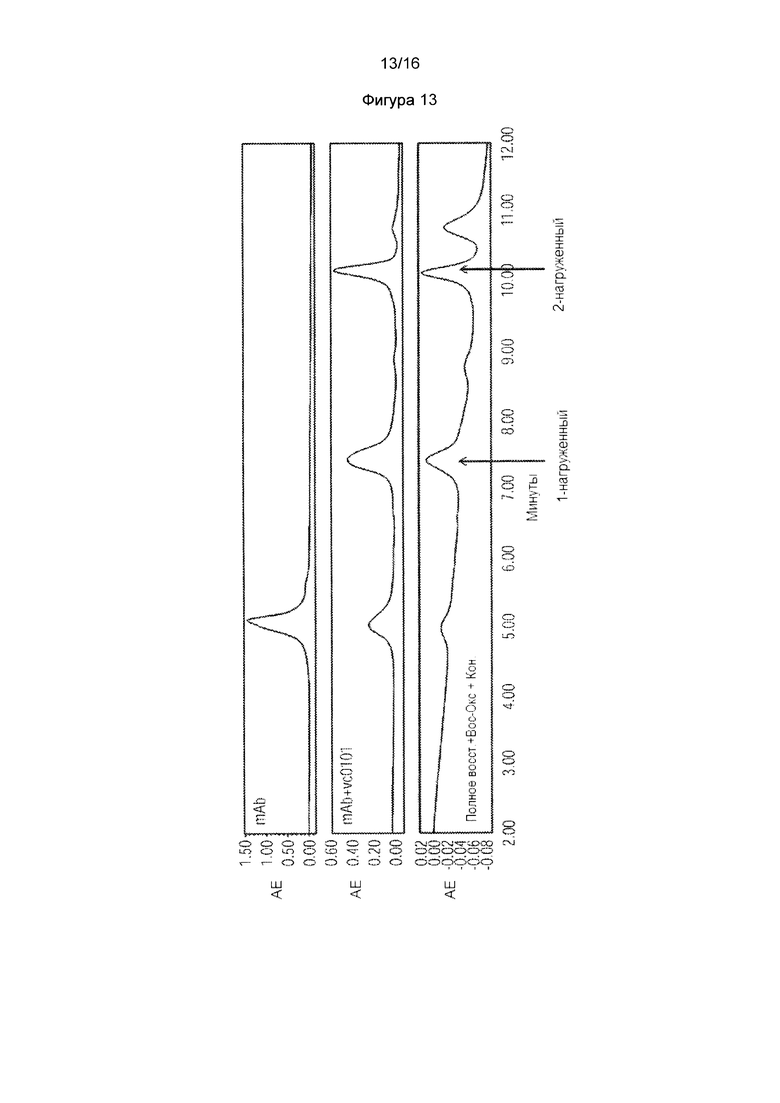
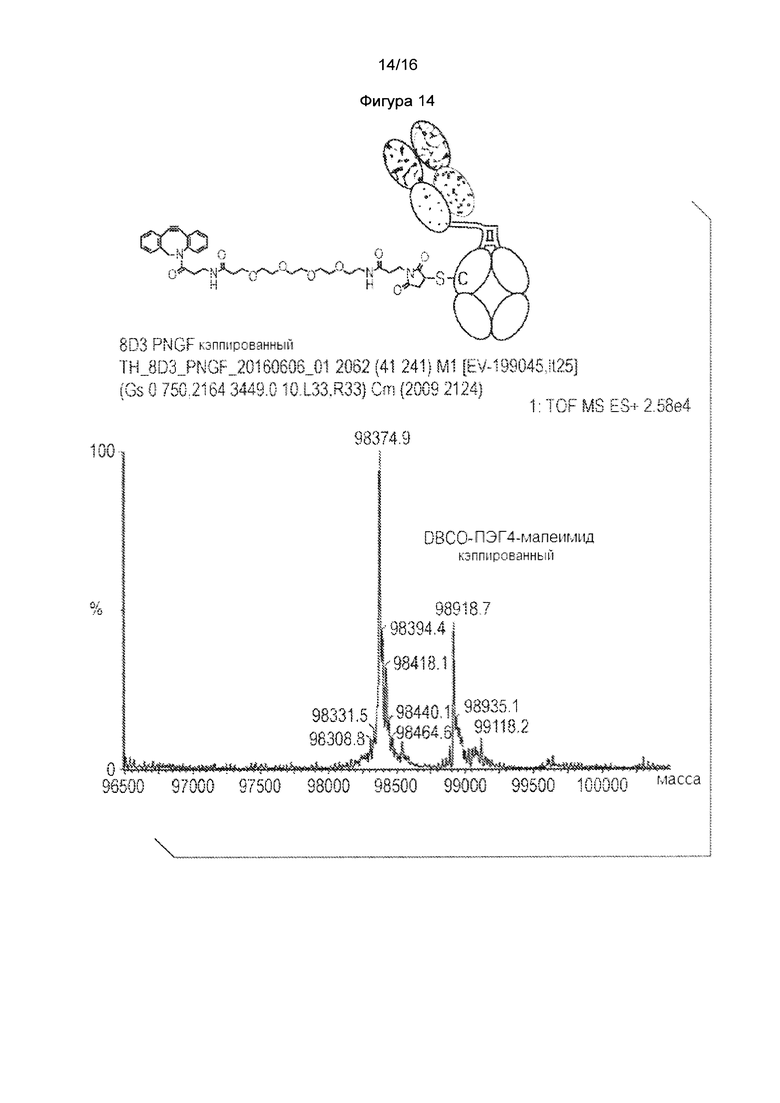
Фигура 13. HIC профиль, показывающий непосредственную конъюгацию некэпированного антитела с mcvcPABC0101. Для сравнения показаны HIC профили антитела и ADC, синтезированного согласно общепринятому протоколу (общее восстановление с последующим повторным окислением и конъюгацией). Фигура 14. Получение ОВСО-ПЭГ4-малеимид-кэпированного K290C одноплечевого антитела 8D3 в транзиентных клетках НЕК293. Масс-спектральный анализ цистеинового мутантного антитела, расщепленного PNGase F для интактной молекулы K290C одноплечевого антитела 8D3.
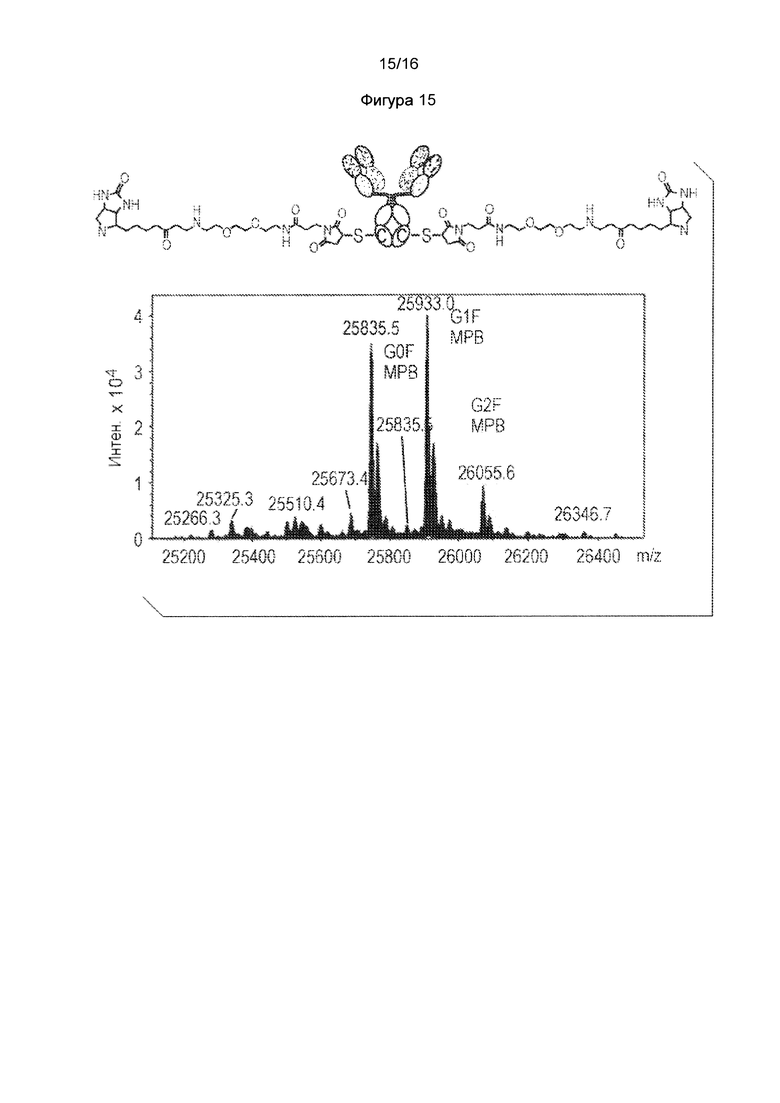
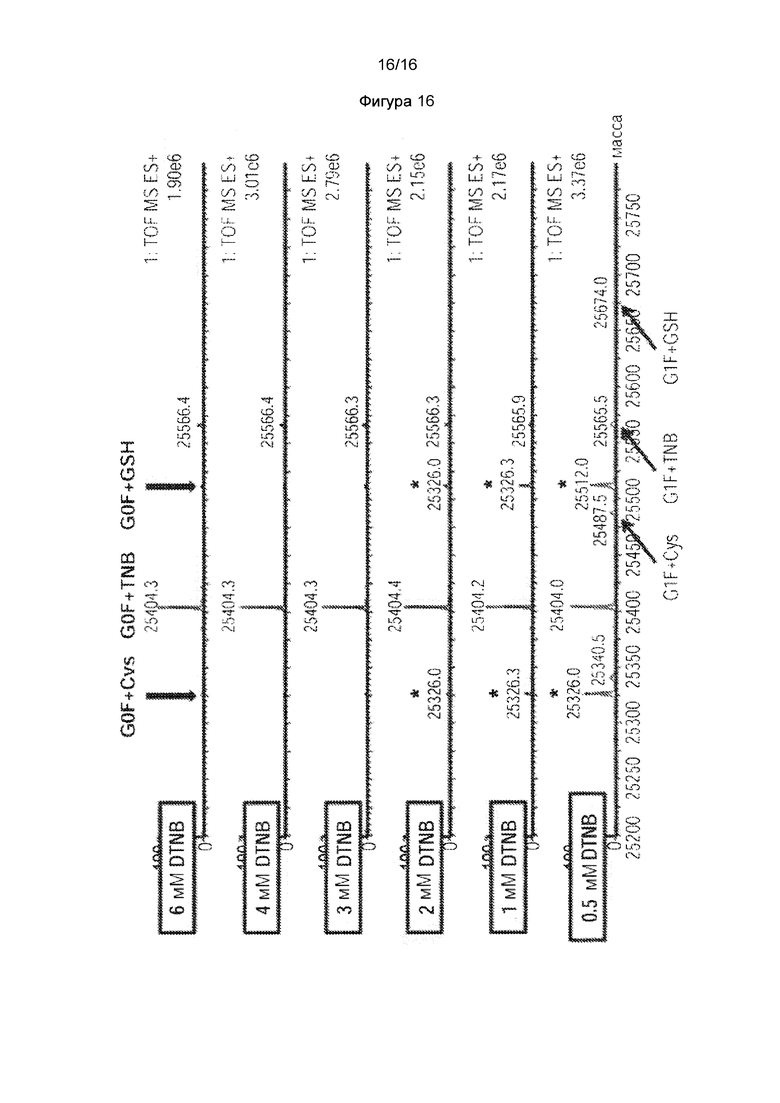
Фигура 15. Получение малеимид-ПЭГ2-биотин-кэпированного НАВ08 L443C в стабильных клетках СНО. Масс-спектральный анализ интактного антитела НАВ08 L443C. Фигура 16. Кэпированное нитротиобензоатом Cys-мутантное K290C антитело эффективно генерируется HEK293F транзиентной экспрессионной системой в нормальной среде, содержащей цистеин, когда титруют добавление DTNB к клеточной культуре. Масс-спектральный анализ цистеинового мутантного антитела, расщепленного ферментом Ides для Fc части цистеинового мутантного антитела K290C.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Общие процедуры
Разработка клеточной культуры, трансфекций и клеточных линий: Линии клеток млекопитающих выращивали и поддерживали в увлажненном инкубаторе с 5% или 7% CO2 при 37°С. Клетки СНО и клетки HEK293F [American Type Culture Collection (АТСС), Manassas, VA] культивировали в среде для экспрессии Freestyle™ 293 (Invitrogen, Grand Island, NY). Крупномасштабный транзиентный HEK293 трансфекционный процесс, как описано в (Zhong, Kieras et al., J. Biol. Chem. 288(2): 1490-1419 (2013)), использовали для получения антитела. Для стабильной трансфекций, СНО-DUKX клетки выращивали в альфа модификации минимальной эссенциальной среды Игла (Sigma-Aldrich, М0644), где альфа среды дополнены аденозином (10 мг/л), дезоксиаденозином (10 мг/л) и тимидином (10 мг/л). Клетки CHO-DUKX трансфицировали ДНК, кодирующими белок цистеинового мутантного рекомбинантного антитела и подвергали селекции с использованием 100 нМ метотрексата и 1 мг/мл G418. Стабильным пулам было разрешено проводить селекцию в течение 3 недель, и затем высевали в концентрации 2е5 клеток/мл в суспензию, не содержащую сыворотки при 37°С. Стабильные клетки CHO-DUKX поддерживали в альфа-среде, дополненной 100 нМ метотрексата и 1 мг/мл G418. Во время получения, клетки высевали в среду CD-CHO и кондиционированную среду собирали в конце получения и просветляли центрифугированием перед очисткой. Тройная свободная среда представляет собой альфа модификацию минимальной эссенциальной среды Игла (Sigma-Aldrich), аналогичную среде клеточной культуры млекопитающих, которая не содержит GSH, Cys, и Ctn. Эта среда содержит инсулин в качестве фактора роста и полимер (поливиниловый спирт) в качестве защитного средства сдвига.
Очистка белка: Смолу rmpProtein A (GE Healthcare, Piscataway, NJ) предварительно уравновешивали 50 мМ Трис (три(гидроксиметил)аминометана), 150 мМ NaCl, рН 7,5 (TBS) в течение ночи при 4°С. Смолу фильтровали с использованием фильтра 0,2 PES и упаковывали в колонку, где ее промывали 2 CV (объемами колонки) TBS, 5 CV CaCl2, рН 7,5, 3 CV 10 мМ Трис, 10 мМ NaCl, рН 7,5 перед тем, как элюировали белок с использованием 100% стадии 150 мМ глицина, 40 мМ NaCl, рН 3,5. Белок титровали до рН 3,5 с использованием 2М глицина, рН 7,2 перед тем, как регулировали рН до 7,0 с использованием 2М HEPES, рН 8,0. Белок подвергали диализу в PBS (137 мМ NaCl, 2,7 мМ KCl, 8,1 мМ Na2HPO4, 2,7 мМ KH2PO4, рН 7,2) перед тем, как концентрировали и загружали в колонку Superdex 200, уравновешенную PBS, рН 7,2. Пиковые фракции объединяли, подвергали диализу в 20 мМ гистидина, 8,5% сахарозы, рН 5,8, и затем концентрировали до 10 мг/мл с использованием центрифужного устройства MWCO 50 кДа.
Дегликозилирование N-связанных гликанов: Образцы антител дегликозилировали путем добавления PNGase F (NE BioLabs, Ipswich, MA). Образцы подкисляли путем разбавления 1:1 0,05% ТФУ (Sigma-Aldrich, St Louis, МО), с последующим анализом жидкостной хроматографии - масс-спектрометрии.
Жидкостная хроматография - масс-спектрометрия: Анализ жидкостной хроматографии - масс-спектрометрии (ЖХ-МС) проводили с использованием масс-спектрометра Waters Xevo Q-TOF G2 (Waters, Milford, MA), связанного с капиллярной ВЭЖХ Agilent (Santa Clara, CA) 1200. Дегликозилированные образцы разделяли на колонке Waters ВЕН300 С4, 1,7 мкм, (1,0×50 мм), поддерживаемой при 80°С со скоростью потока 65 мкл/мин. Подвижная фаза А представляла собой воду с 0,05% ТФУ, и подвижная фаза В представляла собой ацетонитрил с 0,05% ТФУ. Белки элюируют из колонки с использованием градиента: от 2% до 20% В на 0,5 мин, от 20% до 40% В на 6 мин, и от 40% до 100% В на 4 мин. Масс-спектрометр запускался только в положительном МС режиме сканирования от 800 до 3500 m/z, и данные были получены с использованием программного обеспечения MassLynx (Waters) 4.1. Сигнал TOF-MS, соответствующий антителу, суммировали и деконволюлировали с использованием программы MaxEnt1 (Waters). Цистеин, GSH, TNB или MTFB (малеимидотриокса-4-формилбензамид) кэпированные виды определяли по массовому сдвигу (Cys: 119,004 Да, GSH: 305,068 Да, TNB: 198,175, MTFB: 503,54 Да).
Дифференциальная сканирующая калориметрия (ДСК): Термические стабильности для белка Cys мутантного антитела анализировали с использованием капиллярной системы ДСК MicroCal's, VP-ДСК (Northampton, MA). Образцы белка в концентрации 0,002 мМ в гистидин-сахарозном препарате нагревали от 10 до 110°С со скоростью сканирования 100°С в час. Полученная в результате теплоемкость была исходной, скорректированной путем вычитания из пустого сканирования гистидин/сахарозного препарата и оснащенной функцией переходов не-2 состояния с использованием программного обеспечения Origin 7.0 от MicroCal (OriginLab Corporation, Northampton, MA).
Справочные примеры
Справочные примеры, рассмотренные ниже, в общем и целом описывают существующий уровень техники указывают на особенности уровня техники, которые улучшены в соответствии с изобретением, описанным в примерах изобретения.
Справочный пример 1: Обнаружение некэпированных остатков цистеина в цистеиновых мутантных антителах, полученных транзиентной экспрессией HEK293: Исследовали модельное антитело НАВ08 с поверхностным лейцином, модифицированным цистеином в области СН3 (Фигура 1А). Данный мутант был полностью цистеилирован при стабильном экспрессировании в клетках CHO-DUKX (смотрите представленные данные масс-спектроскопии, показанные на фигуре 1В Также был обнаружен очень небольшой процент глютионированных видов. Когда мы экспрессировали данный мутант путем транзиентного трансфицирования в клетки HEK293, мы неожиданно обнаружили, что детектированными были приблизительно 10% полностью некэпированного Cys мутантного антитела плюс 30% отдельных некэпированных материалов. Обнаружение некэпированного Cys антитела было согласующимся, в то время как процент варьировался от партии к партии. Типичные данные масс-спектров показаны на фигуре 1С. Очень мало глутатионилированные виды было обнаружено в транзиентных материалах HEK293. Белковые материалы из транзиентного HEK293 и стабильного СНО оба содержали небольшое количество белковых видов с альтернативным расщеплением лидерной последовательности.
Справочный пример 2: Избыток глутатиона или цистина в культуральной среде в результате приводит к получению полностью глутатионилированных или цистеинилированных видов: Как продемонстрировано в справочном примере 1, цистеиновые мутантные антитела, продуцируемые стабильными клетками СНО, были полностью кэпированы цистеинилированием. Для того, чтобы определить, обнаружены ли некэпированные виды в HEK293 материалам было свойственно недостаточное присутствие цистеина и цистина в среде для экспрессии Freestyle™ 293, избыточное количество данных молекул добавляли в культуральную среду. Поэтому транзиентное продуцирование HEK293 проводили в среде с избыточным количеством цистеина или глутатиона. Клетки HEK293 трансфицировали в среде FreeStyle, которая, как было установлено, содержит приблизительно 1 мМ цистина. После того, как проводили трансфекцию через 24 часа, осуществляли обмен среды засчет повторного суспендирования трансфицированных клеток либо в свежей среде, либо в среде, содержащей либо дополнительный 5 мМ Ctn, либо 5 мМ GSH (восстановленный: окисленный = 1:4). Через 96 ч измеряли жизнеспособность клеток, собирали кондиционированную среду и очищали антитело. Оба условия культивирования имели почти идентичную жизнеспособность роста клеток (> 80%), уровень экспрессии белка (~30 мг/л), профиль элюирования proA и картину миграции белка в SDS-PAGE. Фигура 2А показывает данные данные аналитической эксклюзионной колонки (SEC), которая показывает почти идентичную хроматографию с агрегацией белка меньше, чем 1%. Образцы белка анализировали в масс-спектре для измерения их состояния кэпирования, как показано на фигуре 2В. В отличие от контрольных образцов, среды для экспрессии FreeStyleTM 293 содержали некэпированные, 1-кэпированные и 2 кэпированные гетерогенные кэпированные виды, как показано на фигуре 1С. Образец белка из культуральной среды с дополнительными 5 мМ Ctn был полностью цистеинилированным-кэпированным, и образец белка из культуральной среды с дополнительным GSH был полностью глутатионилированным-кэпированным. Таким образом, путем добавления в культуральную среду достаточного количества цистеина или глутатиона было получено полностью цистеинилированное или глутатионилированное цистеиновое мутантное антитело.
Справочные примеры, приведенные выше, и примеры изобретения, представленные ниже демонстрируют, что цистеиновое кэпирование происходит вне, а не внутри, клеток млекопитающих. Это означает, что кэпирование цистеина другими реагентами может быть получено, если данные реагенты добавляют непосредственно в среду во время культивирования клеток. Новые кэпированное материалы, могли бы потенциально обеспечить преимущества для процессов конъюгации лекарственного средства.
Примеры
Следующий пример иллюстрирует важные признаки изобретения.
Пример 1: Цистеиновые мутантные антитела являются кэпированными нитротиобензоатом, когда дитионитробензоат добавляют к среде: реагент Эллмана, 5,5'-дитиобис-(2-нитробензойная кислота) (DTNB) был исследован в качестве агента кэпирования при добавлении тионитробензоата (TNB). (DTNB обычно используется для анализа содержания свободного тиола в белках. Данный реагент не может разрушить дисульфидную связь, но может взаимодействовать со свободным Cys. Он использовался для обработки частично восстановленных материалов антител для того, чтобы генерировать четыре свободных Cys для конъюгации лекарственного средства.) Клеточная линия СНО, которая стабильно экспрессирует цистеиновое мутантное антитело, выращивали до 4×10е6/мл в CD-CHO среде, затем меняли на свежую среду CD-CHO, свежую среду CD-CHO с 0,5 мМ DTNB или тройную низкоуровневую среду в качестве контроля. Клетки культивировали в этих условиях в течение 72 часов, измеряли жизнеспособность клеток и собирали кондиционированную среду. Клеточная жизнеспособность стабильных клеток СНО в среде с DTNB снижалась до 40%, что, возможно, указывало на то, что DTNB был токсичен для клеток СНО. Цвет DTNB клеточной культуры переходил в желтый, указывая на то, что в культуре присутствовал свободный тионитробензоат, и происходило алкилирование клеточного поверхностного белка. Экспрессия белка в среде, содержащей DTNB, была также в 5 раз ниже, чем в CD-СНО. Очистка антитела из колонки ProA и миграция белка в SDS-PAGE из всех трех материалов условий культивирования были приблизительно одинаковыми, как показано на фигуре 5А. Все три образца в анализе SEC показывают виды мономеров с очень небольшой агрегацией. Как показано в таблице 1, все три формы кэпирования могут быть сконцентрированы до приблизительно 10 мг/мл с меньшей, чем приблизительно 2% агрегацией, и белки были стабильными после обработки замораживанием-оттаиванием.


Как показано на фигуре 5В, данные масс-спектров показывают, что полученная контрольная среда CD-CHO полностью цистеинилирована (увеличение массы 238 Да), и что тройная низкоуровневая среда генерировала полностью некэпированные материалы. DTNB среда продуцировала большинство (> 70%) видов белка с тионитробензоатным кэпированием увеличение массы ~396 Да). Небольшой процент полностью цистеинилированных видов также присутствовал в количестве приблизительно 1 мМ, в среде присутствовал цистин. DTNB, таким образом, был более эффективен для цистеинового кэпирования, чем цистин. Поскольку DTNB представляет собой заряженную молекулу и является не проницаемой через мембрану, данный результат обеспечивает дополнительные свидетельства, показывающие, что цистеиновое кэпирование происходит вне клетки.
Пример 2: TNB кэпирование антител не уменьшает термическую стабильность: Последствия TNB кэпирования исследовали для того, чтобы определить дестабилизируют ли структурные изменения, индуцированные таким кэпированием, антитело. ДСК использовали для отслеживания термической стабильности антитела с цистеинилированием, без кэпирования, или с кэпированием тиобензоатом. Как показано на фигуре 6, цистеинилированное, некэпированное, и TNB-кэпированное антитело ведут себя почти идентично, с Tm1 при более 69°С. В отличие от цистеинилирования в Fab-области (Banks, Gadgil et al., 2008,) которая, как известно, в результате приводит к снижению температуры плавления на 6°С по сравнению с некэпированными материалами, цистеинилирование и нитробензоат-кэпирование в непарных Cys в области СН3 не появляются, что влияет на структурную стабильность антитела. Это согласуется с наблюдением, что антитело с некэпированным Cys может быть концентрировано до 10 мг/мл с небольшой агрегацией белка и противоречит предположению, что реакционноспособный тиол вызывает олигомеризацию белка.
Пример 3: Селективное восстановление TNB-кэпированного антитела TSPP: Цистеиновое мутантное антитело, кэпированное TNB, селективно восстанавливаются TSPP (Фигура 8). Полученные свободные тиольные группы позволяют непосредственную конъюгацию лекарственного средства без межцепочечного восстановления и стадий повторного окисления, что ускоряет процесс манипулирования in vitro. Кроме того, как показано на фигуре 9А, герцептин L443C, полностью кэпированный TNB (2 кэпирования на антитело, или DAR2) получали и анализировали с использованием масс-спектрометрии. Антитело DAR2, кэпированное TNB, непосредственно конъюгировали после обработки TSPP с эффективностью 90%, как было проанализировано с использованием HIC (Фигура 9В). Аналогичным образом, герцептин K290CK334C, полностью кэпированный TNB в форме 4 кэпирований на антитело (DAR4), получали и анализировали с использованием масс-спектрометрии после IDES и PNGase F расщепления (Фигура 10А), и непосредственно конъюгировали после обработки TSPP с эффективностью 90% (Фигура 10В).
В качестве дополнительного примера в данном документе обсуждается TNB-кэпирование и конъюгация (K290C/K334C). Протокол TNB-кэпированной конъюгации для цистеиновой мутантной конъюгации состоит из двух стадий, приводящих к сырому конъюгату: селективное восстановление и конъюгация. На первой стадии выполняется селективное восстановление мутантных цистеинов, (но не межцепочечных дисульфидов) для достижения удаления защитной(ых) группы()из мутантных цистеиновых остатков. Как правило, это делается с использованием избытка (~10 эквивалентов) восстанавливающего агента, такого как три(3-сульфофенилфосфин) (TSPP) при 25°С в течение 2 часов. В конкретном случае: до 1 мг (6,9 нмоль; 7,6 мг/мл в PBS; 131,58 мкл) K290C/K334C антитела в 0,5 мл пробирке Эппендорфа добавляли 39,2 мкг TSPP (10 эквивалентов; 69,05 нмоль; 50 мМ в воде; 1,38 мкл). Реакционную смесь инкубировали при 25°С, 2 часа.
На второй стадии незащищенные мутантные цистеины конъюгируют с линкерной полезной нагрузкой. Как правило, в реакцию добавляют избыток (~10 эквивалентов) линкерной полезной нагрузки, и реакцию проводят при 25°С в течение 1 часа для получения сырого конъюгата. Таким образом, в конкретном примере: к реакционной смеси со стадии 1, указанной выше, добавляли 92,6 мкг mcvcPABC0101 линкер-полезной нагрузки (10 эквивалентов, 69,05 нмоль; 10 мМ в диметилсульфоксиде; 6,9 мкл). Реакционную смесь инкубировали при 25°С 1 ч. Анализ хроматографии гидрофобного взаимодействия (HIC) использовали для анализа реакционной смеси.
Пример 4: Дополнительные сконструированные цистеиновые кэпирования с химическими ручками для химической конъюгации дополнительного лекарственного средства: Другое применение изобретения заключается в том, чтобы конструировать новые кэпирования (то есть, кроме TNB) путем добавления новых алкилирующих химических спейсеров в культуральную среду. Как показано на фигуре 11, данные алкилирующие химические спейсеры содержат химические ручки, такие как альдегидные или азидные функциональные группы, которые допускают дополнительную химическую конъюгацию лекарственного средства. В случае кетона/альдегида, они могут взаимодействовать с аминооксинуклеофилами или гидразидом для дополнительной химической конъюгации, образуя оксим/гидразоновые продукты.
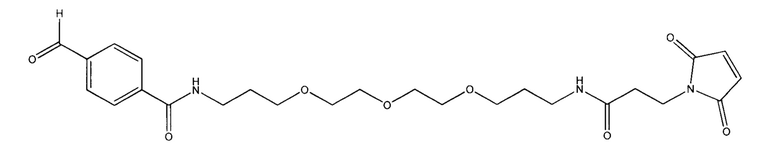
Малеимидотриокса-4-формилбензамид (MTFB) представляет собой малеимид с линкером ПЭГЗ и 4-формилбензамидом (Solulink Inc. San Diego, CA). Как показано ниже, MTFB представляет собой алкилирующий химический спейсер с альдегидной группой:
Как показано на фигуре 12А, клетки CHO-DUKX, стабильно экспрессирующие антитело HAB08L443C выращивали в среде CD-CHO до приблизительно 2,5е6 клетках/мл при 37°С, затем меняли на тройную низкоуровневую среду (нулевую или с низким уровнем Cys-, Ctn- и GSH). 19,8 мМ MTFB, розчиненний в ДМСО, добавляли к 50 мл клеточной культуры при конечной концентрации 0,25 мМ в течение 24 часов. Измеряли жизнеспособность клеток и собирали кондиционированную среду. По сравнению с контролируемой культурой с 0,5 мМ DTNB, жизнеспособность клеток и количество клеток в состоянии с MTFB были значительно ниже. Антитело HAB08L443C в таком состоянии затем очищали колонкой 1 мл ProA (Фигура 12 В). Такое антитело подвергали исследованию 2-части ЖХ/МС, сначала расщепляли PNGF для удаления Fc-гликанов и IDES для разделения Fab2 из scFc, содержащего 443 Cys. Как показано на фигуре 12С, получили виды MTFB-кэпированное НАВ08 L443C антитела.
Альдегидная группа антитела, MTFB-кэпированное антитело реагирует с гидразинами или аминоксисодержащими полезными нагрузками, такими как аминоокси-ПЭГ3-С2-амид-ММАО. 10 мкМ антитела и полезной нагрузки инкубируют в присутствии 100 мМ анилина, свеже приготовленного в 0,3 М Na фосфат (рН 7,0). Реакция протекает при комнатной температуре в течение 24 часов для образования гидразоновых или оксимовых продуктов. Конечное конъюгированное антитело очищают, с использованием колонки HIC.
Алкилирующие химические спейсеры, содержащие химическиех ручки, такие как алкиновые или азидные функциональные группы, позволяют конъюгацию циклоприсоединения. Как показано ниже, дибензоциклооктил-полиэтилен-малеимид (DBCO-ПЭГ4-малеимид) представляет собой малеимид с ПЭГ4 линкером и дибензоциклооктилом (Click Chemistry Tools, Scottsdale, AZ). Азидо-ПЭГ3-малеимид представляет собой малеимид с ПЭГ3 линкером и азидо-доменом (Click Chemistry Tools, Scottsdale, AZ).
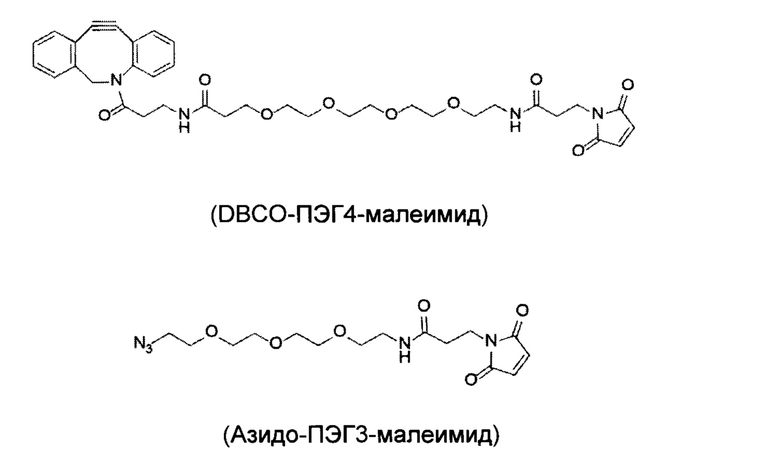
Для того, чтобы продемонстрировать, что получали новое Cys-кэпирование с ОВСО-ПЭГ4-малеимидом, HEK293F клетки транзиентно трансфецировали с одноплечевым антителом 8D3K290C в 2 л среды Freestyle при плотности клеток 2.0е6 клетках/мл при 37°С. Через 24 часа после трансфекций, HEK293F клеткам затем меняли на тройную низкоуровневую среду (нулевую или с низким уровнем Cys-, Ctn- и GSH) в течение дополнительных 96 часов при 37°С. Кондиционированную среду собирали, фильтровали и инкубировали с конечной концентрацией 0,14 мМ DBCO-ПЭГ4-малеимид с исходной концентрацией 29,6 мМ, растворенной в ДМСО в течение дополнительных 24 часов при 37°С. Одноплечевое антитело 8D3K290C из такой кондиционированной среды затем очищали с использованием колонки 5 мл -ProA. Такое антитело подвергали исследованию ЖХ/МС, сначала расщепляли PNGase F для того, чтобы удалить Fc-гликаны. Как показано на фигуре 14, получали виды DBCO-ПЭГ4-малеимид-кэпированного 8D3K290C антитела. Аналогичным образом, также получали азид-ПЭГ3-малеимид-кэпированное 8D3K290C.
Для реакции конъюгации с циклоприсоединением 10 мкМ азидо-ПЭГ3-малеимид-кэпированного антитела в буфере PBS инкубируют с 100 мкМ дибензоциклооктил-полиэтиленгликолем (DBCO-PEG)-MMAF (ACME Bioscience; Palo Alto, CA) при комнатной температуре в течение 16 ч. Не содержащая соединений меди клик-реакцию конъюгации прекращают добавлением 1 мМ азида натрия. Конъюгированное антитело может быть очищено колонкой HIC.
Дополнительные новые примеры Cys-кэпирования включают алкилирующие химические спейсеры с функциональным доменом биотином. Данное Cys-кэпирование с биотином позволяет специфическое нековалентное взаимодействие между стрепавидином и биотином для визуализации клеток и мечения белков. Как видно ниже, малеимид-ПЭГ2-биотин (МРВ) представляет собой малеимид с линкером ПЭГ2 и биотиновым доменом.
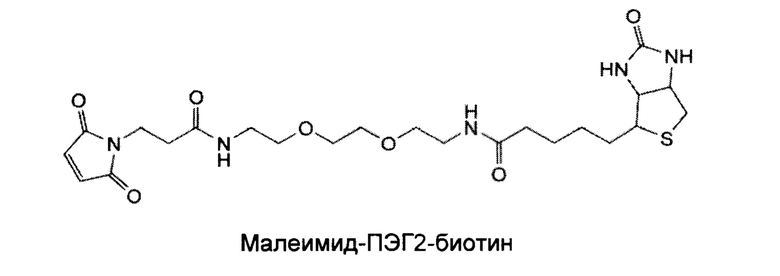
Клетки CHO-DUKX стабильно экспрессирующие антитело HAB08L443C выращивали в среде CD-CHO до приблизительно 2,5е6 клеток/мл при 37°С, затем меняли на тройную низкоуровневую среду (нулевую или с низким уровнем Cys-, Ctn- и GSH). 20 мМ малеимид-ПЭГ2-биотина добавляли до 50 мл клеточной культуры при конечной концентрации 0,2 мМ в течение 48 часов. МРВ-обработка не влияла на жизнеспособность клеток и количество клеток. Антитело HAB08L443C при таком условии культивирования затем очищали на колонке 1 мл-РгоА и подвергали исследованию 2-части ЖХ/МС, расщепляли как PNGase F для удаления Fc-гликанов, так и IDES для отделения Fab2 от scFc, содержащего 443 Cys. Как показано на фигуре 15, были получены МРВ - кэпированные виды НАВ08 L443C антитела.
Пример 5: Получение полностью некэпированного цистеинового мутантного антитела за счет транзиентной экспрессия HEK293 в среде с нулевым или низким уровнем цистеина, цистина и глутатиона: Обнаружение того, что добавление избытка цистеина или глутатиона в культуральные среды влияет на условия кэпирования цистеиновых мутантных антител, указывает на кэпирование цистеина, которое происходит за пределами клетки. Для того, чтобы дополнительно это исследовать, была создана среда, в которой отсутствовали цистеин, цистин и глутатион (так называемая "тройная низкоуровневая" среда). Не ограничиваясь определенной теорией, было заподозрено, что если цистеинилирование и глутатионилирование произошли внутри клетки (как это часто предполагалось), фактически цистеинилированное или глутатионилированное антитело все же должно быть обнаружено в антителах, генерированных с использованием тройной низкоуровневой среды, поскольку просвет ER имеет достаточный уровень цистеина, цистина и глутатиона (способные синтезироваться из других компонентов среды, таких как серии и метионин). И наоборот, если цистеинилирование и глутатионилирование происходили вне клетки, цистеиновое мутантное антитело должно быть полностью некэпированным при получении в тройной низкоуровневой среде, поскольку в среде отсутствует какой-либо доступный источник кэпирование. HEK293 клетки в обычной среде Freestyle™ 293 для экспрессии трансфицировали и затем повторно суспендировали в или свежей среде для экспрессии Freestyle™ 293 (контроль), или тройной низкоуровневой среде. Трансфекция была завершена за 24 часа. Через 96 часов измеряли жизнеспособность клеток, и собирали кондиционированную среду. Для тройной низкоуровневой среды, жизнеспособность клеток культуры составляла 50%, в то время как жизнеспособность клеток составляла 80% в среде для экспрессии Freestyle™ 293. (Это наблюдение жизнеспособности не является неожиданным. Несмотря на то, что Cys является заменимой аминокислотой, клеткам все же потребуется время, чтобы адаптироваться к изменениям отсутствия прямого питания Cys). Экспрессия белка в тройной низкоуровневой среде была в 5 раз ниже, чем в обычной среде, так как синтез белка, вероятно, замедлился из-за отсутствия немедленного поступления цистеина. Очистка антител из колонки ProA и миграция белка в SDS-PAGE были приблизительно идентичными (данные не показаны). Фигура 3А показывает данные SEC, которые показывают приблизительно идентичную хроматографию с агрегацией белка меньше, чем 1%. Затем образцы белка анализировали в масс-спектре для измерения их состояния кэпирования. Как показано на фигуре 3В, в то время как обычная среда давала аналогичную гетерогенную смесь кэпирования, интересно, что тройная низкоуровневая среда продуцировала только полностью некэпированные виды - цистеинилированные типы не присутствовали. Эти данные свидетельствуют о том, что в клетках HEK293, кэпирование цистеинилирования по-видимому, происходит вне клеток.
Пример 6: Получение полностью некэпированных цистеиновых мутантных антител посредством стабильной экспрессии СНО в среде с нулевым или низким уровнем цистеина, цистина и глутатиона: Для того, чтобы исключить возможность того, что наблюдения примера 5 были специфичными для линии клеток или были связаны с транзиентной экспрессией, эксперимент повторяли с использованием стабильной линии CHO-DUKX. Линию клеток CHO-DUKX, которая стабильно экспрессирует цистеиновое мутантное антитело выращивали в среде CD-CHO 4×10е6/мл, затем среду этих клеток меняли или на среду CD-CHO (контроль), или на тройную низкоуровневую среду. Еще одним контролем является свежая среда CD-CHO культивирования при 31°С вместо 37°С. Через 72 часа, измеряли жизнеспособность клеток и собирали кондиционированную среду. Для клеток, выращенных в тройной низкоуровневой среде, жизнеспособность клеток стабильных клеток СНО составляла 60%. Жизнеспособность клеток для клеток, выращенных в среде CD-CHO, составляла больше, чем 95%. Экспрессия белка в тройной низкоуровневой среде была приблизительно в 5 раз ниже, чем в среде CD-CHO, вероятно, из-за отсутствия цистеина в среде. Очистка антител из колонки ProA и миграция белка в SDS-PAGE с обеих сред были приблизительно идентичными (данные не показаны). Фигура 4А показывает аналогичные данные SEC с очень малой агрегацией. Образцы белка анализировали по масс-спектру для измерения кэпирования. Как показано на фигуре 4В, для среды CD-CHO, цистеиновое мутантное антитело было полностью цистеинилированным или при 37°С, или 31°С, что указывает на то, что температуры культивирования не влияли на состояние кэпирования. В тройной низкоуровневой среде стабильные клетки СНО продуцировали полностью некэпированный цистеиновый мутантный белок. Таким образом, в клетках СНО кэпирование цистеинилирования, по-видимому, происходит вне клеток. Эти данные подтверждают, что получение полностью некэпированных цистеиновых мутантных антител в тройной низкоуровневой среде не является специфичной для клеточного типа.
Пример 7: Непосредственная конъюгация некэпированных цистеиновых мутантных антител: К 0,5 мг (3,45 нмоль; 10,19 мг/мл; 49,07 мкл) IL13Ra2 L443C некэпированного mAb из примера 6 в 20 мМ гистидиновом буфере с рН 5,8 добавляли 32,0 мкг mcvcPABC0101 линкер-полезной нагрузки (10 эквивалентов, 34,52 нмоль; 10 мМ в диметилсульфоксиде; 1,7 мкл). Реакционную смесь инкубировали при 25°С, 1 ч. Хроматографический анализ гидрофобного взаимодействия (HIC) использовали для анализа реакционной смеси. Смотрите фигуру 13, которая сравнивает хроматограммы HIC для примера 7 ADC с соответствующим неконъюгированным антителом и соответствующим ADC, полученным согласно общепринятым способам.
Пример 8: Кэпированное нитротиобензоатом Cys-мутантное K290C антитело эффективно получено с использованием системы транзиентной экспрессии HEK293F в содержащей цистеин нормальной среде Freestyle™, когда титруют добавление DTNB к клеточной культуре: Для того, чтобы определить может ли быть получено кэпирование нитротиобензоатом в нормальной клеточной культуральной среде во время транзиентной экспрессии HEK293F, различные концентрации растворов DTNB добавляли к культуре HEK293F после трансфекций ДНК. Короче говоря, клетки HEK293F выращивали в приблизительно 1,0е6/мл в среде Freestyle™, 1 мг ДНК (0,5 мг тяжелой цепи ДНК и 0,5 мг легкой цепи ДНК Cys-мутантного K290C антитела) смешивали с 3,5 мг трансфекционного агента в течение 20 минутного инкубирования при комнатной температуре. Смесь инокулировали 1 л клеток HEK293F и трансфицированные клетки культивировали при 37°С. Через 16 часов после трансфекций, конечная концентрация DTNB при 0,5 мМ, или 1 мМ, или 2 мМ, или 3 мМ, или 4 мМ, или 6 мМ была инокулирована из стоковой концентрации 40 мМ в аликвоты 50 мл-клеточной культуре из 1 л трансфицированной клеточной культуры. Такое культивирование клеток продолжалось в течение дополнительных 5 дней. Кондиционированные среды собирали и фильтровали, и подвергали очистке на колонке 1 мл-ProA. Белковые элюирования подвергали диализу против буфера PBS и концентрировали с использованием центрикона.
Как показано на фигуре 16,, данные масс-спектров показывают, что с увеличением концентрации DTNB, белковые виды с кэпированием тионитробензоатом (увеличение массы -396 Да) были значительно улучшены. При концентрации большей чем 3 мМ DTNB, почти все виды белка были тиокэпированными нитробензоатом. Этот результат указывает на то, что кэпирование тионитробензоатом может быть получено во время транзиентной экспрессии HEK293F в нормальной культуральной среде с цистеином, и что поколение кэпирования тионитробензоатом, по-видимому, намного эффективнее, чем кэпирование цистеинилирования.
Настоящее изобретение относится к созданию терапевтических средств. Предложен способ получения конъюгата лекарственного средства с антителом (ADC), включающий стадии получения кэпированного антитела в клеточной культуре, где фрагменты кэпирования выбирают из 5-тио-2-нитробензойной кислоты (TNB), 2-меркаптопиридина и дитиодипиридина (DTDP); подвергание кэпированного антитела действию восстанавливающего агента, представляющего собой три(3-сульфофенил)фосфин (TSPP); и без введения окислительного агента конъюгирование восстановленных связей серы на антителе с полезной нагрузкой посредством связывающего фрагмента, где указанная полезная нагрузка представляет собой ауристатин, сплайсостатин или калихеамицин. Конъюгаты, полученные таким образом, обладают повышенной эффективностью и могут быть использованы в терапии. 5 з.п. ф-лы, 16 ил., 1 табл., 8 пр.
1. Способ получения конъюгата лекарственного средства с антителом (ADC), включающий стадии:
(a) получения кэпированного антитела в клеточной культуре, причем один или несколько непарных остатков цистеина на указанном антителе являются ковалентно связанными посредством связей серы с одним или несколькими предварительно определенными фрагментами кэпирования, где указанные предварительно определенные фрагменты кэпирования выбирают из группы, состоящей из 5-тио-2-нитробензойной кислоты (TNB), 2-меркаптопиридина и дитиодипиридина (DTDP);
(b) подвергание указанного кэпированного антитела действию восстанавливающего агента, способного удалить указанный фрагмент кэпирования из указанного антитела без восстановления межцепочечных связей серы антитела, где указанный восстанавливающий агент представляет собой три(3-сульфофенил)фосфин (TSPP):
(с) без введения окислительного агента, конъюгирование одного или нескольких восстановленных связей серы на указанном антителе с полезной нагрузкой посредством связывающего фрагмента, где указанная полезная нагрузка представляет собой ауристатин, сплайсостатин или калихеамицин.
2. Способ по п. 1, в котором указанный предварительно определенный фрагмент кэпирования представляет собой 5-тио-2-нитробензойную кислоту (TNB).
3. Способ по п. 1, в котором указанное восстановление происходит, главным образом, в непарных остатках цистеина.
4. Способ по п. 1, в котором указанном ауристатин выбирают из (2-метилаланил-N- [(3R,4S,5S)-3-метокси-1-{(2S)-2-[(1R,2R)-1-метокси-2-метил-3-оксо-3-{[(1S)-2-фенил-1-(1,3- тиазол-2-ил)этил]амино}пропил]пирролидин-1-ил}-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамида); (2-метилаланил-N-[(3R,4S,5S)-1-{(2S)-2-[(1R,2R)-3-{[(1S)-1-карбокси-2- фенилэтил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-3-метокси-5-метил- 1-оксогептан-4-ил]-N-метил-L-валинамида); (2-метил-L-пропил-N-[(3R,4S,5S)-3-метокси-1- {(2S)-2-[(1R,2R)-1-метокси-3-{[(2S)-1-метокси-1-оксо-3-фенилпропан-2-ил]амино}-2-метил-3-оксопропил]пирролидин-1-ил}-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамида, соли трифторуксусной кислоты); (2-метилаланил-N-[(3R,4S,5S)-3-метокси-1-{(2S)-2-[(1R,2R)-1- метокси-3-{[(2S)-1-метокси-1-оксо-3-фенилпропан-2-ил]амино}-2-метил-3-оксопропил]пирролидин-1-ил}-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамида); (2- метилаланил-N-[(3R,4S,5S)-1-{(2S)-2-[(1R,2R)-3-{[(1S,2R)-1-гидрокси-1-фенилпропан-2-ил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-3-метокси-5-метил-1-оксогептан-4-ил]-N-метил-1-валинамида); (2-метил-L-пролил-N-[3R,4S,5S)-1-{(2S)-2-[(1R,2R)-3-{[(1S)-1-карбокси-2-фенилэтил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-3-метокси-5-метил-1-оксогептан-4-ил]-N-метил-1-валинамида, соли трифторуксусной кислоты); монометилдоластатина 10; (N-метилвалин-валин-долаизолейцин-долапроин-норэфидрина) и (N-метилвалин-валин-долаизолейцин-долапроин-фенилаланина).
5. Способ по п. 1, в котором указанная клеточная культура содержит предшественник фрагмента кэпирования, и в котором указанный предшественник указанного фрагмента кэпирования представляет собой реагент Эллмана.
6. Способ по п. 1, в котором указанный связывающий фрагмент представляет собой mc или mcvcPABC.
| WO 00/42175 A1, 20.07.2000 | |||
| US 5241078 A, 31.08.1993 | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| BOUTUREIRA O., BERNARDES G.JL | |||
| "Advances in chemical protein modification." Chemical reviews, 2015 (February 20), 115(5): 2174-2195 | |||
| TREXLER‐SCHMIDT M | |||
| et al | |||
| "Identification and prevention of antibody disulfide bond reduction during cell culture manufacturing." | |||
Авторы
Даты
2021-02-04—Публикация
2016-08-09—Подача