ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к фармацевтически активным борсодержащим соединениям, которые ингибируют фосфодиэстеразу 4 (PDE4), фармацевтическим композициям, содержащим эти соединения, и применению для лечения или профилактики заболеваний, состояний или расстройств, облегчаемых ингибированием PDE4.
УРОВЕНЬ ТЕХНИКИ
Воспаление является основным компонентом множества заболеваний, и индивидуумы с такими заболеваниями часто демонстрируют высокие уровни воспалительных регуляторов, которые включают, но не ограничены ими, следующие цитокины IL-1α,IL-1β, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL-12, IL-13, IL-17, IL-18, IL-23, IL-31, IL-33, TNF-α, IFN-α, IFN-β и IFN-γ. Неограничивающий список болезненных состояний, которые напрямую связаны с воспалительными цитокинами, включает: атопический дерматит, при котором воспалительные цитокины вызывают воспаление; псориаз, при котором воспалительные цитокины вызывают дерматит; артрит, при котором воспалительные цитокины могут привести к поражению синовиальной оболочки и разрушению суставного хряща и кости; фиброз, при котором воспалительные цитокины могут атаковать травмированную ткань; волчанку, при которой воспалительные цитокины могут усугублять отложение и повреждение иммунного комплекса; аллергию, при которой воспалительные цитокины могут вызывать воспаление, выработку IgE и застой; фибромиалгию, при которой у пациентов повышены воспалительные цитокины; и хирургические осложнения, при которых воспалительные цитокины могут препятствовать заживлению.
Другие заболевания, связанные с хроническим воспалением, включают: рак; сердечный приступ, при котором хроническое воспаление способствует коронарному атеросклерозу; Болезнь Альцгеймера, при которой хроническое воспаление отрицательно влияет на клетки мозга; застойная сердечная недостаточность, при которой хроническое воспаление вызывает истощение сердечной мышцы; инсульт, при котором хроническое воспаление способствует тромбоэмболическим явлениям; и стеноз аортального клапана, при котором хроническое воспаление повреждает клапаны сердца. С воспалением также связаны артериосклероз, остеопороз, болезнь Паркинсона, бактериальная инфекция, вирусная инфекция, воспалительное заболевание кишечника, включая болезнь Крона и язвенный колит, а также рассеянный склероз (типичное аутоиммунное воспалительное заболевание). Современные способы, доступные для лечения таких воспалительных заболеваний, могут быть неудовлетворительными из-за недостаточной эффективности и/или побочных эффектов, связанных с лекарственными средствами. Следовательно, существует потребность в новых терапевтических способах, которые модулируют воспалительный процесс, связанный с заболеваниями, состояниями и расстройствами, описанными в настоящем документе.
В частности, атопический дерматит (AD) представляет собой воспалительное заболевание кожи, которое обычно проявляется в раннем детстве, но может появиться в подростковом или взрослом возрасте и следует за хроническим или рецидивирующим/трудноподдающимся лечению прогрессированием заболевания. У пациентов с AD наблюдается кожный зуд и предрасположенность к кожным вторичным бактериальным, вирусным и грибковым инфекциям. Пациенты с AD могут также демонстрировать нарушение барьерной функции, что приводит к активации кератиноцитов и других иммунных клеток. Ряд воспалительных цитокинов участвует в симптомах, характерных для AD, включая, помимо прочего, IL-1 IL-2, IL-3, IL-4, IL-5, IL-6, IL-12, IL-13, IL-17, IL-18, IL-22, IL-23, IL-31, IL-33, IL-36 и TNF-α. Воспалительные цитокины способствуют продуцированию различных хемоаттрактантов или хемокинов, которые поддерживают привлечение лейкоцитов в место заболевания. Хемокины, которые вносят вклад в воспаление у пациентов с AD, включают, но не ограничены ими, CCL1, CCL2, CCL3, CCL4, CCL5, CCL11, CCL13, CCL17, CCL18, CCL20, CCL22, CCL26 и CCL27.
Существуют ограниченные терапевтические возможности для лечения AD. Местное применение противовоспалительных стероидов используют при лечении AD, особенно в случае обострения болезни. Стероиды подавляют активацию и пролиферацию воспалительных клеток, а также кератиноцитов и фибробластов. Однако стероиды могут вызывать неблагоприятные местные побочные эффекты, которые включают, помимо прочего, атрофию кожи, телеангиэктазию (аномальное расширение капиллярных сосудов), нарушение эпидермального барьера, стрии, розацеа, угри, гипертрихоз, гипопигментацию, замедленное заживление ран и изменения в эластичности кожи. Смягчающие средства, включая вазелин и увлажняющие средства, отпускаемые без рецепта, используют для сокращения использования местных стероидов. Местное применение мевалоновой кислоты и никотинамида используют для улучшения проницаемости эпидермального барьера за счет продуцирования холестерина и церамида. Местные ингибиторы кальциневрина (TCI), такие как такролимус и пимекролимус, используют для лечения AD. Циклоспорин A (CyA) используют в качестве иммунодепрессанта для ингибирования кальциневринфосфатазы, что приводит к снижению уровней IL-2 и ингибированию пролиферации Т-клеток.
Системное лечение включает гуманизированные моноклональные антитела, такие как Омализумаб, Эфализумаб и Этанерцепт, Дупилумаб, которые нацелены на сывороточные IgE, LFA-1, TNF-α и IL-4, соответственно [Rahman, Inf. & All. 2011, 10, 486]. Дополнительные экземы, кожные и болезненные состояния включают дерматит рук, контактный дерматит, аллергический контактный дерматит, раздражающий контактный дерматит, нейродермит, периоральный дерматит, застойный дерматит, дисгидротическую экзему, ксерозный дерматит, нуммалярный дерматит, себорейный дерматит, дерматит век, дерматомиозиты, красный плоский лишай, склероатрофический лишай, очаговую алопецию, витилиго, розацеа, буллезный эпидермолиз, волосяной кератоз, себорейную экзему, пузырчатку, вульвовагинит, акне, хроническую спонтанную крапивницу, хроническую идиопатическую крапивницу, хроническую физическую крапивницу, синдром Фогта-Коянаги-Харада, невус/невусы Саттона, поствоспалительную гипопигментацию, сенильную лейкодерму, химическую/лекарственную лейкодерму, кожную красную волчанку, дискоидную волчанку, ладонно-подошвенный пустулез, пемфигоид, синдром Свита и гнойный гидраденит [Eyerich and Eyerich, J. Eur. Ac. Derm. Ven., 32, 692 (2018)].
Псориаз представляет собой иммуноопосредованное хроническое заболевание кожи, которое существует в нескольких различных формах, включая пятнистый псориаз, пустулезный псориаз, псориаз ногтей, псориаз складок, каплевидный псориаз, псориазный артрит, эритродермический псориаз и обратный псориаз. Пятнистый псориаз (psoriasis vulgaris) является наиболее частой формой псориаза и обычно проявляется в виде бляшек выступающей красной кожи, покрытых шелушащимися белыми наростами. Пустулезный псориаз проявляется в виде выпуклостей, заполненных неинфекционным гноем (пустул). Кожа под пустулами и вокруг них красная и болезненная. Пустулезный псориаз может быть локализованным, обычно на руках и ногах, или генерализованным с обширными пятнами на любой части тела. Псориаз ногтей вызывает множество изменений внешнего вида ногтей пальцев рук и ног. Эти изменения включают обесцвечивание под ногтевой пластиной, изъязвление ногтей, линии на ногтях, утолщение кожи под ногтем, а также ослабление (онихолизис) и крошение ногтя. Псориаз складок (обратный псориаз) проявляется в виде гладких воспаленных участков кожи. Это происходит в складках кожи, особенно вокруг гениталий (между бедром и пахом), в подмышечных впадинах, под избыточным весом живота (паннус) и под грудью (в складках под молочными железами). Он усугубляется трением и потом, а также подвержен грибковым инфекциям. Каплевидный псориаз характеризуется многочисленными небольшими пятнами овальной формы. Эти пятна псориаза появляются на больших участках тела, таких как туловище, конечности и кожа головы. Псориатический артрит включает воспаление суставов и соединительной ткани. Псориатический артрит может поражать любой сустав, но чаще всего встречается в суставах пальцев рук и ног. Псориатический артрит может привести к отеку пальцев рук и ног, известному как дактилит. Псориатический артрит также может поражать бедра, колени и позвоночник (спондилит). Эритродермический псориаз включает широко распространенное воспаление и шелушение кожи на большей части поверхности тела. Он может сопровождаться сильным зудом, отеком и болью. Он часто является результатом обострения нестабильного пятнистого псориаза, особенно после резкого прекращения системного лечения. Современные способы лечения псориаза включают местное лечение, фототерапию и системные применения. Лечение либо нежелательно с косметической точки зрения, либо неудобно для длительного использования, либо имеет ограниченную эффективность.
Воспалительное заболевание кишечника (IBD) описывает группу кишечных расстройств, которые включают воспаление пищеварительного тракта, включая язвенный колит и болезнь Крона. Язвенный колит (UC) вызывает периодические и хронические воспаления и язвы в слизистой оболочке толстого кишечника (толстой кишки). Болезнь Крона (CD) характеризуется воспалением слизистой оболочки желудочно-кишечного тракта и может проникать в родственные ткани. Пациенты с IBD могут демонстрировать диарею, боль в животе, утомляемость и потерю веса, и эти состояния могут быть тяжелыми и изнурительными. Поскольку симптомы варьируются в зависимости от уровня и продолжительности воспаления, средство, которое модулирует указанное воспаление, может быть полезно при лечении IBD.
Фосфодиэстеразы (PDE) представляют собой семейство ферментов, которые катализируют гидролиз различных циклических нуклеозидмонофосфатов, включая циклический аденозинмонофосфат (cAMP) и циклический гуанозинмонофосфат (cGMP). PDE регулируют уровень циклических нуклеотидов в клетках и поддерживают гомеостаз циклических нуклеотидов путем гидролиза таких циклических мононуклеотидов, вызывающего прекращение их роли мессенджера. Ферменты PDE могут быть сгруппированы в семейства в соответствии с их специфичностью к гидролизу cAMP и/или cGMP, их чувствительностью к регуляции кальцием и кальмодулином и их селективным ингибированием различными соединениями.
Подсемейство фермента PDE4 состоит из четырех генов, которые продуцируют 4 изоформы фермента PDE4, обозначенные PDE4A, PDE4B, PDE4C и PDE4D [Wang et al., Biochem. Biophys. Res. Comm., 234, 320 (1997)]. Кроме того, были идентифицированы различные варианты сплайсинга каждой изоформы PDE4. Изоферменты PDE4 специфически инактивируют cAMP, катализируя его гидролиз до аденозин-5'-монофосфата (AMP). Регулирование активности cAMP играет важную роль во многих биологических процессах, включая воспаление.
Соединения по настоящему изобретению ингибируют фосфодиэстеразы, включая PDE4, и модулируют уровни воспалительных цитокинов и, следовательно, полезны при лечении воспалительных заболеваний, таких как атопический дерматит, экзема, псориаз, артрит, астма, фиброз, волчанка, аллергия, фибромиалгия, заживление ран, язвенный колит, болезнь Крона, воспалительное заболевание кишечника и воспаление в результате хирургических осложнений.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении представлены соединения формулы (I), которые ингибируют PDE4 и применяются для лечения или профилактики расстройств, облегчаемых ингибированием PDE4 у человека,
X-Y-Z
Формула (I)
или их фармацевтически приемлемая соль, где
X является фенилом, пиридином, пиримидином, пиразином, пиридазином или триазином, где каждый необязательно замещен 1, 2, 3, 4 или 5 заместителями, которые независимо являются дейтерием, (C2-C6)алкенилом, (C2-C6)алкенилокси, (C2-C6)алкенилтио, (C1-C6)алкокси, (C1-C6)алкокси-d1-13, (C1-C6)алкокси(C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонилом, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C1-C6)алкилкарбонилом, (C1-C6)алкилтио, (C2-C6)алкинилом, (C2-C6)алкинилокси, (C2-C6)алкинилтио, арилом, арил(C1-C6)алкокси, арил(C1-C6)алкилом, арил(C1-C6)алкилтио, арилокси, арилтио, карбокси, карбокси(C1-C6)алкокси, карбокси(C1-C6)алкилом, циано, (C3-C8)циклоалкилом, (C3-C8)циклоалкил(C1-C6)алкокси, (C3-C8)циклоалкил(C1-C6)алкилом, (C3-C8)циклоалкил(C1-C6)алкилтио, (C3-C8)циклоалкилокси, (C3-C8)циклоалкилтио, галоген, гало(C1-C6)алкокси, гало(C1-C6)алкилом, гало(C1-C6)алкилтио, (5-6-членным)гетероарилом, (5-6-членный)гетероарил(C1-C6)алкокси, (5-6-членный)гетероарил(C1-C6)алкилом, (5-6-членный)гетероарил(C1-C6)алкилтио, (5-6-членным)гетероарилокси, (5-6-членным)гетероарилтио, (4-7-членным)гетероциклом, содержащим, по меньшей мере, один гетероатом, независимо выбранный из группы, состоящей из O, N и S, (4-7-членный)гетероцикл(C1-C6)алкокси, (4-7-членный)гетероцикл(C1-C6)алкилом, (4-7-членный)гетероцикл(C1-C6)алкилтио, (4-7-членным)гетероциклокси, (4-7-членным)гетероциклтио, гидрокси, гидрокси(C1-C6)алкокси, гидрокси(C1-C6)алкилом, меркапто, нитро, тио(C1-C6)алкилом, -NRARB, NRARB(C1-C6)алкокси, NRARB(C1-C6)алкилом или (NRARB)карбонилом; RA и RB независимо являются водородом, (C1-C6)алкилом или (C1-C6)алкилкарбонилом; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, триазином, фураном, тиофеном, пирролом, оксазолом, тиазолом, имидазолом, изоксазолом, изотиазолом, пиразолом, оксадиазолом, тиадиазолом или триазолом, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются дейтерием, (C1-C6)алкокси, (C1-C6)алкокси-d1-13, (C1-C6)алкокси(C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C3)алкил-d1-7, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C1-C6)алкилкарбонилом, (C1-C6)алкилтио, карбокси, карбокси(C1-C6)алкокси, карбокси(C1-C6)алкилом, циано, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, гидрокси, гидрокси(C1-C6)алкокси, гидрокси(C1-C6)алкилом, меркапто, нитро, -NRCRD, NRCRD(C1-C6)алкокси, NRCRD(C1-C6)алкилом или (NRCRD)карбонилом; RC и RD независимо являются водородом, (C1-C6)алкилом или (C1-C6)алкилкарбонилом; Z является
 ,
,

 ,
,
где B является бором; R10 в каждом случае независимо является H, дейтерием, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C1-C6)алкилтио(C1-C6)алкилом, гидрокси(C1-C6)алкилом или тио(C1-C6)алкилом; R11 в каждом случае независимо является дейтерием, (C1-C3)алкилом или (C1-C3)алкил-d1-7; R12 независимо является H, (C1-C6)алкилом или гидрокси(C1-C6)алкилом; m равно 0, 1, 2 или 3; n равно 0, 1, 2, 3 или 4; р равно 0, 1, 2, 3, 4 или 5; q равно 0, 1, 2, 3, 4, 5 или 6; и r равно 0, 1, 2, 3, 4, 5, 6 или 7.
В другом варианте осуществления, в настоящем изобретении представлена фармацевтическая композиция, содержащая соединение формулы (I) и, по меньшей мере, один фармацевтически приемлемый эксципиент, разбавитель или носитель.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики воспалительных заболеваний у млекопитающих, в частности, человека, включающий введение млекопитающему или человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики воспалительных заболеваний у млекопитающих, в частности, человека, включающий местное введение млекопитающему или человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли.
В другом аспекте, в настоящем изобретении представлено применение соединений формулы (I) в производстве лекарственного средства для лечения воспалительных заболеваний у млекопитающих, в частности, человека.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 представлена рентгеновская структура (изображение ORTEP) кристаллического (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (пример 3).
На фигуре 2 представлена рентгеновская структура (изображение ORTEP) кристаллического (R) 4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (пример 4).
На фигуре 3 представлена рентгеновская структура (изображение ORTEP) кристаллического (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (пример 5).
На фигуре 4 представлена рентгеновская структура (изображение ORTEP) кристаллического (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ола (пример 19).
На фигуре 5 представлен анализ порошковой рентгеновской дифракции кристаллического (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (пример 3).
На фигуре 6 представлен анализ порошковой рентгеновской дифракции кристаллического (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (пример 4).
На фигуре 7 представлен анализ порошковой рентгеновской дифракции кристаллического (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (пример 5).
На фигуре 8 представлен анализ порошковой рентгеновской дифракции кристаллического (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (пример 10).
На фигуре 9 представлен анализ порошковой рентгеновской дифракции кристаллического (R)-4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ола (пример 19).
На фигуре 10 представлен анализ порошковой рентгеновской дифракции кристаллической (4-метокси-3-пропоксифенил)бороновой кислоты.
На фигуре 11 представлен анализ порошковой рентгеновской дифракции кристаллического 3-бром-5-(4-метокси-3-пропоксифенил)пиридина.
На фигуре 12 представлен анализ порошковой рентгеновской дифракции кристаллического 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I)
X-Y-Z
формула (I)
или их фармацевтически приемлемая соль, где X является фенилом, пиридином или пиримидином, где каждый необязательно замещен 1, 2, 3, 4 или 5 заместителями, которые независимо являются дейтерием, (C2-C6)алкенилом, (C2-C6)алкенилокси, (C2-C6)алкенилтио, (C1-C6)алкокси, (C1-C6)алкокси-d1-13, (C1-C6)алкокси(C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонилом, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C1-C6)алкилкарбонилом, (C1-C6)алкилтио, (C2-C6)алкинилом, (C2-C6)алкинилокси, (C2-C6)алкинилтио, арилом, арил(C1-C6)алкокси, арил(C1-C6)алкилом, арил(C1-C6)алкилтио, арилокси, арилтио, карбокси, карбокси(C1-C6)алкокси, карбокси(C1-C6)алкилом, циано, (C3-C8)циклоалкилом, (C3-C8)циклоалкил(C1-C6)алкокси, (C3-C8)циклоалкил(C1-C6)алкилом, (C3-C8)циклоалкил(C1-C6)алкилтио, (C3-C8)циклоалкилокси, (C3-C8)циклоалкилтио, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, гало(C1-C6)алкилтио, (5-6-членным)гетероарилом, (5-6-членный)гетероарил(C1-C6)алкокси, (5-6-членный)гетероарил(C1-C6)алкилом, (5-6-членный)гетероарил(C1-C6)алкилтио, (5-6-членным)гетероарилокси, (5-6-членным)гетероарилтио, (4-7-членным)гетероциклом, содержащим, по меньшей мере, один гетероатом, независимо выбранный из группы, состоящей из O, N и S, (4-7-членный)гетероцикл(C1-C6)алкокси, (4-7-членный)гетероцикл(C1-C6)алкилом, (4-7-членный)гетероцикл(C1-C6)алкилтио, (4-7-членным)гетероциклокси, (4-7-членным)гетероциклтио, гидрокси, гидрокси(C1-C6)алкокси, гидрокси(C1-C6)алкилом, меркапто, нитро, тио(C1-C6)алкилом, -NRARB, NRARB(C1-C6)алкокси, NRARB(C1-C6)алкилом или (NRARB)карбонилом; RA и RB независимо являются водородом, (C1-C6)алкилом или (C1-C6)алкилкарбонилом; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразолом или тиадиазолом, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются дейтерием, (C1-C6)алкокси, (C1-C6)алкокси-d1-13, (C1-C6)алкокси(C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C3)алкил-d1-7, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C1-C6)алкилкарбонилом, (C1-C6)алкилтио, карбокси, карбокси(C1-C6)алкокси, карбокси(C1-C6)алкилом, циано, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, гидрокси, гидрокси(C1-C6)алкокси, гидрокси(C1-C6)алкилом, меркапто, нитро, -NRCRD, NRCRD(C1-C6)алкокси, NRCRD(C1-C6)алкилом или (NRCRD)карбонилом; RC и RD независимо являются водородом, (C1-C6)алкилом или (C1-C6)алкилкарбонилом; Z такой, как определен в разделе «Сущность изобретения» в настоящем документе; R10 в каждом случае является H, дейтерием, (C1-C6)алкилом, (C1-C6)алкил-d1-13 или гидрокси(C1-C6)алкилом; R11 в каждом случае является дейтерием, метилом или метил-d3; R12 независимо является H, (C1-C6)алкилом или гидрокси(C1-C6)алкилом; m равно 0, 1, 2 или 3; n равно 0 или 1; р равно 0, 1, 2, 3, 4 или 5; q равно 0, 1, 2 или 3; и r равно 0, 1, 2, 3, 4, 5, 6 или 7.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является фенилом, пиридином или пиримидином, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются(C1-C6)алкокси, (C1-C6)алкилом, (C1-C6)алкилтио, циано, (C3-C8)циклоалкилокси, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, (4-7-членным)гетероциклокси или гидрокси(C1-C6)алкокси; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразолом или тиадиазолом, где каждый необязательно замещен 1 заместителем, который является (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z является  или
или  , где B является бором;
, где B является бором;
R10 в каждом случае является H, метилом или гидроксиметилом; m равно 1; и p равно 1.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является фенилом, пиридином или пиримидином, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются(C1-C6)алкокси, (C1-C6)алкилом, (C1-C6)алкилтио, циано, (C3-C8)циклоалкилокси, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, (3-7-членным)гетероциклокси или гидрокси(C1-C6)алкокси; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразолом или тиадиазолом, где каждый необязательно замещен 1 заместителем, который является (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z является  , где B является бором.
, где B является бором.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является фенилом, пиридином или пиримидином, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются (C1-C6)алкокси, (C1-C6)алкилом, (C1-C6)алкилтио, циано, (C3-C8)циклоалкилокси, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, (4-7-членным)гетероциклокси или гидрокси(C1-C6)алкокси; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразолом или тиадиазолом, где каждый необязательно замещен 1 заместителем, который является (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z является 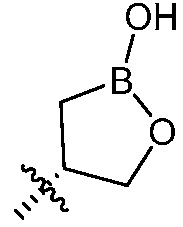 , где B является бором.
, где B является бором.
В другом варианте осуществления, в настоящем изобретении представлен соединения формулы (I) или их фармацевтически приемлемая соль, где X является фенилом, пиридином или пиримидином, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются (C1-C6)алкокси, (C1-C6)алкилом, (C1-C6)алкилтио, циано, (C3-C8)циклоалкилокси, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, (4-7-членным)гетероциклокси или гидрокси(C1-C6)алкокси; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразолом или тиадиазолом, где каждый необязательно замещен 1 заместителем, который является (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z является 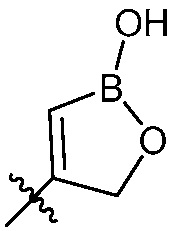 , где B является бором.
, где B является бором.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является фенилом, пиридин или пиримидин, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются (C1-C6)алкокси, (C1-C6)алкилом, (C1-C6)алкилтио, циано, (C3-C8)циклоалкилокси, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, (4-7-членным)гетероциклокси или гидрокси(C1-C6)алкокси; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразолом или тиадиазолом, где каждый необязательно замещен 1 заместителем, который является (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z является  или
или  , где B является бором;
, где B является бором;
R10 в каждом случае является H, метилом или гидроксиметилом; p равно 1; и r равно 1.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является фенилом, пиридин или пиримидин, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются (C1-C6)алкокси, (C1-C6)алкилом, (C1-C6)алкилтио, циано, (C3-C8)циклоалкилокси, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, (4-7-членным)гетероциклокси или гидрокси(C1-C6)алкокси; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразолом или тиадиазолом, где каждый необязательно замещен 1 заместителем, который является (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z является  или
или  , где B является бором; R10 в каждом случае является H, метилом или гидроксиметилом; R12 в каждом случае независимо является H, (C1-C6)алкилом или гидрокси(C1-C6)алкилом.
, где B является бором; R10 в каждом случае является H, метилом или гидроксиметилом; R12 в каждом случае независимо является H, (C1-C6)алкилом или гидрокси(C1-C6)алкилом.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является фенилом, пиридин или пиримидин, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются (C1-C6)алкокси, (C1-C6)алкилом, (C1-C6)алкилтио, циано, (C3-C8)циклоалкилокси, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, (4-7-членным)гетероциклокси или гидрокси(C1-C6)алкокси; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразолом или тиадиазолом, где каждый необязательно замещен 1 заместителем, который является (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z является  , где B является бором; R12 в каждом случае независимо является H, (C1-C6)алкилом или гидрокси(C1-C6)алкилом.
, где B является бором; R12 в каждом случае независимо является H, (C1-C6)алкилом или гидрокси(C1-C6)алкилом.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является фенилом, пиридином или пиримидином, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются (C1-C6)алкокси, (C1-C6)алкилом, (C1-C6)алкилтио, циано, (C3-C8)циклоалкилокси, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, (4-7-членным)гетероциклокси или гидрокси(C1-C6)алкокси; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразолом или тиадиазолом, где каждый необязательно замещен 1 заместителем, который является (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z является  , где B является бором; R12 в каждом случае независимо является H, (C1-C6)алкилом или гидрокси(C1-C6)алкилом.
, где B является бором; R12 в каждом случае независимо является H, (C1-C6)алкилом или гидрокси(C1-C6)алкилом.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является фенилом, пиридином или пиримидином, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются (C1-C6)алкокси, (C1-C6)алкилом, (C1-C6)алкилтио, циано, (C3-C8)циклоалкилокси, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, (4-7-членным)гетероциклокси или гидрокси(C1-C6)алкокси; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразолом или тиадиазолом, где каждый необязательно замещен 1 заместителем, который является (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z является 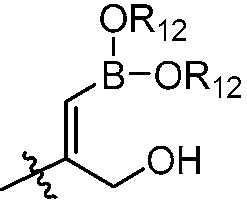 , где B является бором; и R12 в каждом случае независимо является H, (C1-C6)алкилом или гидрокси(C1-C6)алкилом.
, где B является бором; и R12 в каждом случае независимо является H, (C1-C6)алкилом или гидрокси(C1-C6)алкилом.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является фенилом, пиридином или пиримидином, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются (C1-C6)алкокси, (C1-C6)алкилом, (C1-C6)алкилтио, циано, (C3-C8)циклоалкилокси, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, (4-7-членным)гетероциклокси или гидрокси(C1-C6)алкокси; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразолом или тиадиазолом, где каждый необязательно замещен 1 заместителем, который является (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z является  , где B является бором; R10 в каждом случае является H, метилом или гидроксиметилом; R11 в каждом случае независимо является (C1-C3)алкилом; и n равно 0, 1, 2, 3 или 4.
, где B является бором; R10 в каждом случае является H, метилом или гидроксиметилом; R11 в каждом случае независимо является (C1-C3)алкилом; и n равно 0, 1, 2, 3 или 4.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является фенилом, пиридином или пиримидином, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются (C1-C6)алкокси, (C1-C6)алкилом, (C1-C6)алкилтио, циано, (C3-C8)циклоалкилокси, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, (4-7-членным)гетероциклокси или гидрокси(C1-C6)алкокси; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразолом или тиадиазолом, где каждый необязательно замещен 1 заместителем, который является (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z является 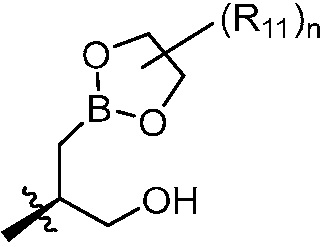 , где B является бором; R11 является метилом; и n равно 0 или 1.
, где B является бором; R11 является метилом; и n равно 0 или 1.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является фенилом, пиридином или пиримидином, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются (C1-C6)алкокси, (C1-C6)алкилом, (C1-C6)алкилтио, циано, (C3-C8)циклоалкилокси, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, (4-7-членным)гетероциклокси или гидрокси(C1-C6)алкокси; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразолом или тиадиазолом, где каждый необязательно замещен 1 заместителем, который является (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z является 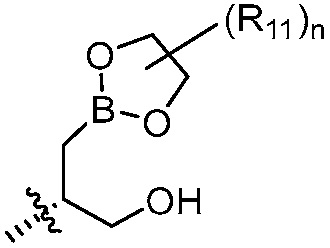 , где B является бором; R11 является метилом; и n равно 0 или 1.
, где B является бором; R11 является метилом; и n равно 0 или 1.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является фенилом, пиридином или пиримидином, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются (C1-C6)алкокси, (C1-C6)алкилом, (C1-C6)алкилтио, циано, (C3-C8)циклоалкилокси, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, (4-7-членным)гетероциклокси или гидрокси(C1-C6)алкокси; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразолом или тиадиазолом, где каждый необязательно замещен 1 заместителем, который является (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z является  , где B является бором; R11 является метилом; и n равно 0 или 1.
, где B является бором; R11 является метилом; и n равно 0 или 1.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является фенилом, пиридином или пиримидином, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются (C1-C6)алкокси, (C1-C6)алкилом, (C1-C6)алкилтио, циано, (C3-C8)циклоалкилокси, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, (4-7-членным)гетероциклокси или гидрокси(C1-C6)алкокси; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразол или тиадиазолом, где каждый необязательно замещен 1 заместителем, который является (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z является 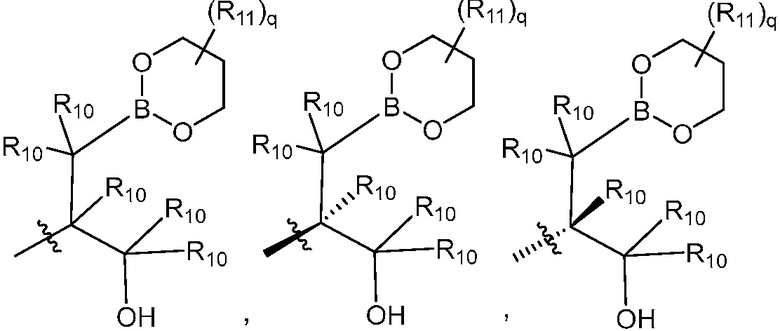 или
или  , где B является бором; R10 в каждом случае является H, метилом или гидроксиметилом; R11 в каждом случае независимо является (C1-C3)алкилом; и q равно 0, 1, 2, 3, 4, 5 или 6.
, где B является бором; R10 в каждом случае является H, метилом или гидроксиметилом; R11 в каждом случае независимо является (C1-C3)алкилом; и q равно 0, 1, 2, 3, 4, 5 или 6.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является фенилом, пиридином или пиримидином, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются (C1-C6)алкокси, (C1-C6)алкилом, (C1-C6)алкилтио, циано, (C3-C8)циклоалкилокси, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, (4-7-членным)гетероциклокси или гидрокси(C1-C6)алкокси; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразолом или тиадиазолом, где каждый необязательно замещен 1 заместителем, который является (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z является  , где B является бором; R11 в каждом случае является метилом; и q равно 0, 1, 2 или 3.
, где B является бором; R11 в каждом случае является метилом; и q равно 0, 1, 2 или 3.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является фенилом, пиридином или пиримидином, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются (C1-C6)алкокси, (C1-C6)алкилом, (C1-C6)алкилтио, циано, (C3-C8)циклоалкилокси, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, (4-7-членным)гетероциклокси или гидрокси(C1-C6)алкокси; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразолом или тиадиазолом, где каждый необязательно замещен 1 заместителем, который является (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z является  , где B является бором; R11 в каждом случае является метилом; и q равно 0, 1, 2 или 3.
, где B является бором; R11 в каждом случае является метилом; и q равно 0, 1, 2 или 3.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является фенилом, пиридином или пиримидином, где каждый необязательно замещен 1, 2 или 3 заместителями, которые независимо являются (C1-C6)алкокси, (C1-C6)алкилом, (C1-C6)алкилтио, циано, (C3-C8)циклоалкилокси, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, (4-7-членным)гетероциклокси или гидрокси(C1-C6)алкокси; Y является фенилом, пиридином, пиримидином, пиразином, пиридазином, тиазолом, пиразолом или тиадиазолом, где каждый необязательно замещен 1 заместителем, который является (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкил; Z является  , где B является бором; R11 в каждом случае является метилом; и q равно 0, 1, 2 или 3.
, где B является бором; R11 в каждом случае является метилом; и q равно 0, 1, 2 или 3.
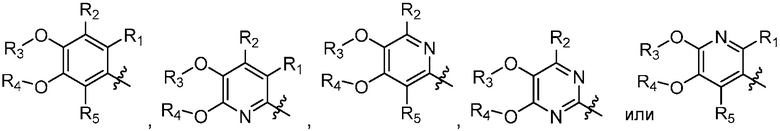
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является

 ; A1 и A2 независимо являются O или S; R1, R2 и R5 независимо являются H, дейтерием, циано, галогеном или гало(C1-C6)алкилом; R3 и R4 независимо являются H, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; Y является
; A1 и A2 независимо являются O или S; R1, R2 и R5 независимо являются H, дейтерием, циано, галогеном или гало(C1-C6)алкилом; R3 и R4 независимо являются H, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; Y является


 ;
;
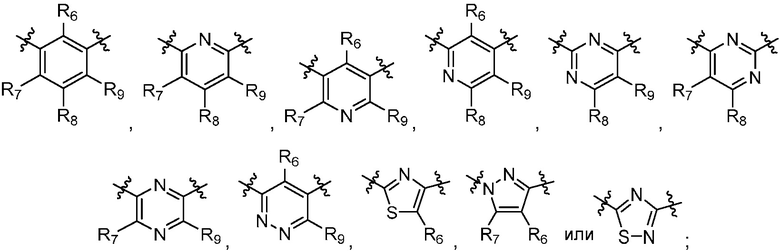
R6, R7, R8 и R9 независимо являются H, дейтерием, (C1-C6)алкокси, (C1-C6)алкокси-d1-13,(C1-C6)алкокси(C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C3)алкил-d1-7, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C1-C6)алкилкарбонилом, (C1-C6)алкилтио, карбокси, карбокси(C1-C6)алкокси, карбокси(C1-C6)алкилом, циано, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, гидрокси, гидрокси(C1-C6)алкокси, гидрокси(C1-C6)алкилом, меркапто, нитро, -NRCRD, NRCRD(C1-C6)алкокси, NRCRD(C1-C6)алкилом или (NRCRD)карбонилом; RC и RD независимо являются водородом, (C1-C6)алкилом или (C1-C6)алкилкарбонилом; Z такой, как определен в разделе «Сущность изобретения» в настоящем документе; R10 в каждом случае независимо является H, дейтерием, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C1-C6)алкилтио(C1-C6)алкилом, гидрокси(C1-C6)алкилом или тио(C1-C6)алкилом; R11 в каждом случае независимо является (C1-C3)алкилом или (C1-C3)алкил-d1-7; R12 независимо является H, (C1-C6)алкилом или гидрокси(C1-C6)алкилом; m равно 0, 1, 2 или 3; n равно 0, 1, 2, 3 или 4; р равно 0, 1, 2, 3, 4 или 5; q равно 0, 1, 2, 3, 4, 5 или 6; и r равно 0, 1, 2, 3, 4, 5, 6 или 7.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является  ,
,  или
или  ; R1, R2 и R5 независимо являются H, циано, галогеном или гало(C1-C6)алкилом; R3 и R4 независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; Y является
; R1, R2 и R5 независимо являются H, циано, галогеном или гало(C1-C6)алкилом; R3 и R4 независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; Y является

R6, R7, R8 и R9 независимо являются H, (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z такой, как определен в разделе «Сущность изобретения» в настоящем документе; R10 в каждом случае независимо является H, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкилом, (C1-C6)алкилтио(C1-C6)алкилом, гидрокси(C1-C6)алкилом или тио(C1-C6)алкилом; R11 в каждом случае независимо является (C1-C3)алкилом; R12 независимо является H, (C1-C6)алкилом или гидрокси(C1-C6)алкилом; m равно 0, 1, 2 или 3; n равно 0, 1, 2, 3 или 4; р равно 0, 1, 2, 3, 4 или 5; q равно 0, 1, 2, 3, 4, 5 или 6; и r равно 0, 1, 2, 3, 4, 5, 6 или 7.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является
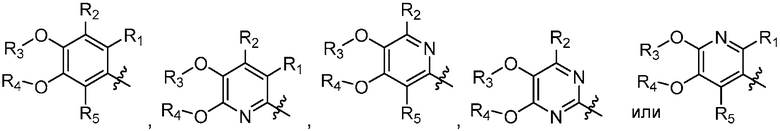 ;
;
R1, R2 и R5 независимо являются H, циано, галогеном или гало(C1-C6)алкилом; R3 и R4 независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; Y является
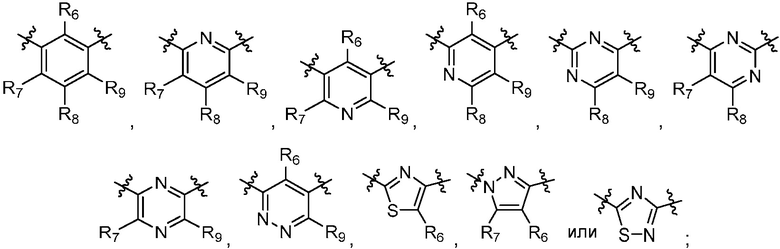
R6, R7, R8 и R9 независимо являются H, (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; Z является  или
или 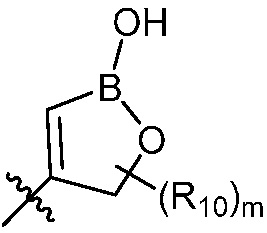 , где B является бором; R10 в каждом случае независимо является H, (C1-C6)алкилом или гидрокси(C1-C6)алкилом; m равно 0, 1, 2 или 3; и р равно 0, 1, 2, 3, 4 или 5.
, где B является бором; R10 в каждом случае независимо является H, (C1-C6)алкилом или гидрокси(C1-C6)алкилом; m равно 0, 1, 2 или 3; и р равно 0, 1, 2, 3, 4 или 5.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является
 ;
;
R1, R2 и R5 независимо являются H, циано, галогеном или гало(C1-C6)алкилом; R3 и R4 независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; Y является
R6, R7, R8 и R9 независимо являются H, (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; и Z является  , где B является бором.
, где B является бором.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является
 ;
;
R1, R2 и R5 независимо являются H, циано, галогеном или гало(C1-C6)алкилом; R3 и R4 независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; Y является

R6, R7, R8 и R9 независимо являются H, (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; и Z является 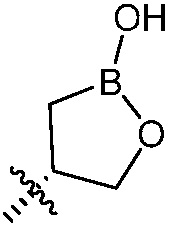 , где B является бором.
, где B является бором.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (I) или их фармацевтически приемлемая соль, где X является
 ;
;
R1, R2 и R5 независимо являются H, циано, галогеном или гало(C1-C6)алкилом; R3 и R4 независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; Y является

R6, R7, R8 и R9 независимо являются H, (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; и Z является 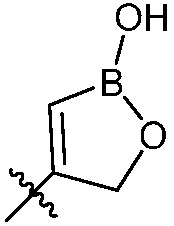 , где B является бором.
, где B является бором.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IA)
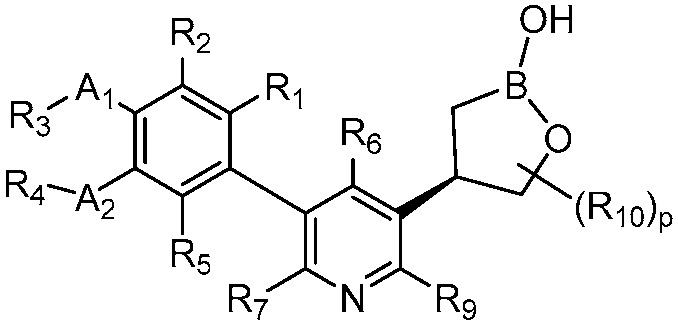
формула (IA)
или их фармацевтически приемлемая соль, где B является бором; A1 и A2 независимо являются O или S; R1, R2 и R5 независимо являются H, дейтерием, (C2-C6)алкенилом, (C2-C6)алкенилокси, (C2-C6)алкенилтио, (C1-C6)алкокси, (C1-C6)алкокси-d1-13, (C1-C6)алкокси(C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонилом, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C1-C6)алкилкарбонилом, (C1-C6)алкилтио, (C2-C6)алкинилом, (C2-C6)алкинилокси, (C2-C6)алкинилтио, арилом, арил(C1-C6)алкокси, арил(C1-C6)алкилом, арил(C1-C6)алкилтио, арилокси, арилтио, карбокси, карбокси(C1-C6)алкокси, карбокси(C1-C6)алкилом, циано, (C3-C8)циклоалкилом, (C3-C8)циклоалкил(C1-C6)алкокси, (C3-C8)циклоалкил(C1-C6)алкилом, (C3-C8)циклоалкил(C1-C6)алкилтио, (C3-C8)циклоалкилокси, (C3-C8)циклоалкилтио, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, гало(C1-C6)алкилтио, (5-6-членным)гетероарилом, (5-6-членный)гетероарил(C1-C6)алкокси, (5-6-членный)гетероарил(C1-C6)алкилом, (5-6-членный)гетероарил(C1-C6)алкилтио, (5-6-членным)гетероарилокси, (5-6-членным)гетероарилтио, (4-7-членным)гетероциклом, содержащим, по меньшей мере, один гетероатом, независимо выбранный из группы, состоящей из O, N и S, (4-7-членный)гетероцикл(C1-C6)алкокси, (4-7-членным)гетероцикл(C1-C6)алкилом, (4-7-членный)гетероцикл(C1-C6)алкилтио, (4-7-членным)гетероциклокси, (4-7-членным)гетероциклтио, гидрокси, гидрокси(C1-C6)алкокси, гидрокси(C1-C6)алкилом, меркапто, нитро, тио(C1-C6)алкилом, -NRARB, NRARB(C1-C6)алкокси, NRARB(C1-C6)алкил или (NRARB)карбонилом; RA и RB независимо являются водородом, (C1-C6)алкилом или (C1-C6)алкилкарбонилом; R3 и R4 независимо являются H, дейтерием, (C1-C3)алкилом, (C1-C3)алкил-d1-7, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; R6, R7 и R9 независимо являются, H, дейтерием, (C1-C6)алкокси, (C1-C6)алкокси-d1-13, (C1-C6)алкокси(C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C3)алкил-d1-7, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C1-C6)алкилкарбонилом, (C1-C6)алкилтио, карбокси, карбокси(C1-C6)алкокси, карбокси(C1-C6)алкилом, циано, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, гидрокси, гидрокси(C1-C6)алкокси, гидрокси(C1-C6)алкилом, меркапто, нитро, -NRCRD, NRCRD(C1-C6)алкокси, NRCRD(C1-C6)алкил или (NRCRD)карбонил; RC и RD независимо являются водородом, (C1-C6)алкилом или (C1-C6)алкилкарбонилом; R10 в каждом случае независимо является дейтерием, (C1-C6)алкокси(C1-C6)алкилом, (C1-C3)алкилом, (C1-C3)алкил-d1-7, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C1-C6)алкилтио(C1-C6)алкилом, гидрокси(C1-C6)алкилом или тио(C1-C6)алкилом; и р равно 0, 1, 2, 3, 4 или 5.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IA) или их фармацевтически приемлемая соль, где B является бором; A1 и A2 являются O; R1, R2 и R5 независимо являются H, циано, галогеном или гало(C1-C6)алкилом; R3 и R4 независимо являются(C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; R6, R7 и R9 независимо являются, H, (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкил; R10 является (C1-C3)алкилом, (C1-C6)алкилом или гидрокси(C1-C6)алкилом; и р равно 0 или 1.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IA) или их фармацевтически приемлемая соль, где B является бором; A1 и A2 являются O; R1, R2 и R5 являются H; R3 и R4 независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; R6, R7 и R9 независимо являются H или (C1-C3)алкилом; R10 является метилом; и р равно 0, 1 или 2.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IA) или их фармацевтически приемлемая соль, где B является бором; A1 и A2 являются О; R1, R2 и R5 являются Н; R3 и R4 независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; R6, R7 и R9 независимо являются H или (C1-C3)алкилом; и р равно 0.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IA) или их фармацевтически приемлемая соль, где B является бором; A1 и A2 являются О; R1, R2 и R5 являются Н; R3 и R4 независимо являются (C1-C3)алкилом; R6, R7 и R9 независимо являются H или (C1-C3)алкилом; и р равно 0.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IA) или их фармацевтически приемлемая соль, где B является бором; A1 и A2 являются О; R1, R2 и R5 являются Н; R3 и R4 независимо являются (C1-C3)алкилом; R6, R7 и R9 являются Н; и р равно 0.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IB)

формула (IB)
или их фармацевтически приемлемая соль, где B является бором; A1 и A2 независимо являются O или S; R1, R2 и R5 независимо являются H, дейтерием, (C2-C6)алкенилом, (C2-C6)алкенилокси, (C2-C6)алкенилтио, (C1-C6)алкокси, (C1-C6)алкокси-d1-13, (C1-C6)алкокси(C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонилом, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C1-C6)алкилкарбонилом, (C1-C6)алкилтио, (C2-C6)алкинилом, (C2-C6)алкинилокси, (C2-C6)алкинилтио, арилом, арил(C1-C6)алкокси, арил(C1-C6)алкилом, арил(C1-C6)алкилтио, арилокси, арилтио, карбокси, карбокси(C1-C6)алкокси, карбокси(C1-C6)алкилом, циано, (C3-C8)циклоалкилом, (C3-C8)циклоалкил(C1-C6)алкокси, (C3-C8)циклоалкил(C1-C6)алкилом, (C3-C8)циклоалкил(C1-C6)алкилтио, (C3-C8)циклоалкилокси, (C3-C8)циклоалкилтио, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, гало(C1-C6)алкилтио, (5-6-членным)гетероарилом, (5-6-членный)гетероарил(C1-C6)алкокси, (5-6-членный)гетероарил(C1-C6)алкилом, (5-6-членный)гетероарил(C1-C6)алкилтио, (5-6-членным)гетероарилокси, (5-6-членным)гетероарилтио, (4-7-членным)гетероциклом, содержащим, по меньшей мере, один гетероатом, независимо выбранный из группы, состоящей из O, N и S, (4-7-членный)гетероцикл(C1-C6)алкокси, (4-7-членный)гетероцикл(C1-C6)алкилом, (4-7-членный)гетероцикл(C1-C6)алкилтио, (4-7-членным)гетероциклокси, (4-7-членным)гетероциклтио, гидрокси, гидрокси(C1-C6)алкокси, гидрокси(C1-C6)алкилом, меркапто, нитро, тио(C1-C6)алкилом, -NRARB, NRARB(C1-C6)алкокси, NRARB(C1-C6)алкилом или (NRARB)карбонилом; RA и RB независимо являются водородом, (C1-C6)алкилом или (C1-C6)алкилкарбонилом; R3 и R4 независимо являются H, дейтерием, (C1-C3)алкилом, (C1-C3)алкил-d1-7, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; R6, R7 и R9 независимо являются, H, дейтерием, (C1-C6)алкокси, (C1-C6)алкокси-d1-13, (C1-C6)алкокси(C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C6)алкилом, (C1-C6)алкилкарбонилом, (C1-C6)алкилтио, карбокси, карбокси(C1-C6)алкокси, карбокси(C1-C6)алкилом, циано, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, гидрокси, гидрокси(C1-C6)алкокси, гидрокси(C1-C6)алкилом, меркапто, нитро, -NRCRD, NRCRD(C1-C6)алкокси, NRCRD(C1-C6)алкилом или (NRCRD)карбонилом; RC и RD независимо являются водородом, (C1-C6)алкилом или (C1-C6)алкилкарбонилом; R10 в каждом случае независимо является дейтерием, (C1-C6)алкокси(C1-C6)алкилом, (C1-C3)алкилом, (C1-C3)алкил-d1-7, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C1-C6)алкилтио(C1-C6)алкилом, гидрокси(C1-C6)алкилом или тио(C1-C6)алкилом; и р равно 0, 1, 2, 3, 4 или 5.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IB) или их фармацевтически приемлемая соль, где B является бором; A1 и A2 являются О; R1, R2 и R5 независимо являются H, циано, галогеном или гало(C1-C6)алкилом; R3 и R4 независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; R6, R7 и R9 независимо являются, H, (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; R10 является (C1-C3)алкилом, (C1-C6)алкилом или гидрокси(C1-C6)алкилом; и р равно 0 или 1.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IB) или их фармацевтически приемлемая соль, где B является бором; A1 и A2 являются О; R1, R2 и R5 являются Н; R3 и R4 независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; R6, R7 и R9 независимо являются H или (C1-C3)алкилом; R10 является метилом; и р равно 0, 1 или 2.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IB) или их фармацевтически приемлемая соль, где B является бором; A1 и A2 являются О; R1, R2 и R5 являются Н; R3 и R4 независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; R6, R7 и R9 независимо являются H или (C1-C3)алкилом; и р равно 0.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IB) или их фармацевтически приемлемая соль, где B является бором; A1 и A2 являются О; R1, R2 и R5 являются Н; R3 и R4 независимо являются (C1-C3)алкилом; R6, R7 и R9 независимо являются H или (C1-C3)алкилом; и р равно 0.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IB) или их фармацевтически приемлемая соль, где B является бором; A1 и A2 являются О; R1, R2 и R5 являются Н; R3 и R4 независимо являются (C1-C3)алкилом; R6, R7 и R9 являются Н; и р равно 0.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IC)

формула (IC)
или их фармацевтически приемлемая соль, где B является бором; A1 и A2 независимо являются O или S; R1, R2 и R5 независимо являются H, дейтерием, (C2-C6)алкенилом, (C2-C6)алкенилокси, (C2-C6)алкенилтио, (C1-C6)алкокси, (C1-C6)алкокси-d1-13, (C1-C6)алкокси(C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонилом, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C1-C6)алкилкарбонилом, (C1-C6)алкилтио, (C2-C6)алкинилом, (C2-C6)алкинилокси, (C2-C6)алкинилтио, арилом, арил(C1-C6)алкокси, арил(C1-C6)алкилом, арил(C1-C6)алкилтио, арилокси, арилтио, карбокси, карбокси(C1-C6)алкокси, карбокси(C1-C6)алкилом, циано, (C3-C8)циклоалкилом, (C3-C8)циклоалкил(C1-C6)алкокси, (C3-C8)циклоалкил(C1-C6)алкилом, (C3-C8)циклоалкил(C1-C6)алкилтио, (C3-C8)циклоалкилокси, (C3-C8)циклоалкилтио, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, гало(C1-C6)алкилтио, (5-6-членным)гетероарилом, (5-6-членный)гетероарил(C1-C6)алкокси, (5-6-членный)гетероарил(C1-C6)алкилом, (5-6-членный)гетероарил(C1-C6)алкилтио, (5-6-членным)гетероарилокси, (5-6-членным)гетероарилтио, (4-7-членным)гетероциклом, содержащим, по меньшей мере, один гетероатом, независимо выбранный из группы, состоящей из O, N и S, (4-7-членный)гетероцикл(C1-C6)алкокси, (4-7-членный)гетероцикл(C1-C6)алкилом, (4-7-членный)гетероцикл(C1-C6)алкилтио, (4-7-членным)гетероциклокси, (4-7-членным)гетероциклтио, гидрокси, гидрокси(C1-C6)алкокси, гидрокси(C1-C6)алкилом, меркапто, нитро, тио(C1-C6)алкилом, -NRARB, NRARB(C1-C6)алкокси, NRARB(C1-C6)алкил или (NRARB)карбонил; RA и RB независимо являются водородом, (C1-C6)алкилом или (C1-C6)алкилкарбонилом; R3 и R4 независимо являются H, дейтерием, (C1-C3)алкилом, (C1-C3)алкил-d1-7, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C3-C8)циклоалкилом, гало(C1-C6)алкил или гидрокси(C1-C6)алкил; R6, R7 и R9 независимо являются, H, дейтерием, (C1-C6)алкокси, (C1-C6)алкокси-d1-13, (C1-C6)алкокси(C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C3)алкилом, (C1-C3)алкил-d1-7, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C1-C6)алкилкарбонилом, (C1-C6)алкилтио, карбокси, карбокси(C1-C6)алкокси, карбокси(C1-C6)алкилом, циано, галогеном, гало(C1-C6)алкокси, гало(C1-C6)алкилом, гидрокси, гидрокси(C1-C6)алкокси, гидрокси(C1-C6)алкилом, меркапто, нитро, -NRCRD, NRCRD(C1-C6)алкокси, NRCRD(C1-C6)алкил или (NRCRD)карбонил; RC и RD независимо являются водородом, (C1-C6)алкилом или (C1-C6)алкилкарбонилом; R10 в каждом случае независимо является дейтерием, (C1-C6)алкокси(C1-C6)алкилом, (C1-C3)алкилом, (C1-C3)алкил-d1-7, (C1-C6)алкилом, (C1-C6)алкил-d1-13, (C1-C6)алкилтио(C1-C6)алкилом, гидрокси(C1-C6)алкилом или тио(C1-C6)алкилом; и р равно 0, 1, 2, 3, 4 или 5.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IC) или их фармацевтически приемлемая соль, где B является бором; A1 и A2 являются О; R1, R2 и R5 независимо являются H, циано, галогеном или гало(C1-C6)алкилом; R3 и R4 независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; R6, R7 и R9 независимо являются, H, (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкилом, (C1-C6)алкоксикарбонил(C1-C6)алкилом, (C1-C6)алкилом, карбокси(C1-C6)алкилом, галогеном, гало(C1-C6)алкилом, гидрокси(C1-C6)алкокси или гидрокси(C1-C6)алкилом; R10 является (C1-C3)алкилом, (C1-C6)алкилом или гидрокси(C1-C6)алкилом; и р равно 0 или 1.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IC) или их фармацевтически приемлемая соль, где B является бором; A1 и A2 являются О; R1, R2 и R5 являются Н; R3 и R4 независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; R6, R7 и R9 независимо являются H или (C1-C3)алкилом; R10 является метилом; и р равно 0, 1 или 2.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IC) или их фармацевтически приемлемая соль, где B является бором; A1 и A2 являются О; R1, R2 и R5 являются Н; R3 и R4 независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; R6, R7 и R9 независимо являются H или (C1-C3)алкилом; и р равно 0.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IC) или их фармацевтически приемлемая соль, где B является бором; A1 и A2 являются О; R1, R2 и R5 являются Н; R3 и R4 независимо являются (C1-C3)алкилом; R6, R7 и R9 независимо являются H или (C1-C3)алкилом; и р равно 0.
В другом варианте осуществления, в настоящем изобретении представлены соединения формулы (IC) или их фармацевтически приемлемая соль, где B является бором; A1 и A2 являются О; R1, R2 и R5 являются Н; R3 и R4 независимо являются (C1-C3)алкилом; R6, R7 и R9 являются Н; и р равно 0.
В другом варианте осуществления, в настоящем изобретении представлены следующие соединения:
(R) 4-(5-(3,4-диметоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3,4-диметоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-изопропокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-изопропокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-циклопропокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-циклопропокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-(2-гидроксиэтокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-(2-гидроксиэтокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-(3-гидроксипропокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-(3-гидроксипропокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-этокси-5-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-этокси-5-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-хлор-5-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-хлор-5-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(5-этокси-2-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(5-этокси-2-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(2-хлор-5-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(2-хлор-5-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(3-фтор-5-метокси-6-пропокси[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол; (S) 4-(3-фтор-5-метокси-6-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(4-(дифторметокси)-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(4-(дифторметокси)-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(6'-метокси-5'-пропокси-[3,3'-бипиридин]-5-ил)-1,2-оксаборолан-2-ол; (S) 4-(6'-метокси-5'-пропокси-[3,3'-бипиридин]-5-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-этокси-4-метоксифенил)-4-метилпиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-этокси-4-метоксифенил)-4-метилпиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(2-(4-метокси-3-пропоксифенил)-6-метилпиримидин-4-ил)-1,2-оксаборолан-2-ол; (S) 4-(2-(4-метокси-3-пропоксифенил)-6-метилпиримидин-4-ил)-1,2-оксаборолан-2-ол; (R) 4-(2-(4-метокси-3-пропоксифенил)-6-(трифторметил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (S) 4-(2-(4-метокси-3-пропоксифенил)-6-(трифторметил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (R) 4-(6-(3-этокси-4-метоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-(3-этокси-4-метоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ол; 4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборол-2(5H)-ол; (R) 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборинан-2-ол; (S) 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборинан-2-ол; (R) 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-3-метил-1,2-оксаборолан-2-ол; (S) 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-3-метил-1,2-оксаборолан-2-ол; 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-3-метил-1,2-оксаборол-2(5H)-ол; (R) 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-4-метил-1,2-оксаборолан-2-ол; (S) 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-4-метил-1,2-оксаборолан-2-ол; (R) 4-(6-(4-метокси-3-пропоксифенил)пиридазин-4-ил)-5-метил-1,2-оксаборолан-2-ол; (S) 4-(6-(4-метокси-3-пропоксифенил)пиридазин-4-ил)-5-метил-1,2-оксаборолан-2-ол; (R) 4-(гидроксиметил)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(гидроксиметил)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-(2-фторэтокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-(2-фторэтокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(3'-(3-фторпропокси)-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(3'-(3-фторпропокси)-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 3'-(2-гидрокси-1,2-оксаборолан-4-ил)-4-метокси-3-пропокси-[1,1'-бифенил]-2-карбонитрил; (S) 3'-(2-гидрокси-1,2-оксаборолан-4-ил)-4-метокси-3-пропокси-[1,1'-бифенил]-2-карбонитрил; (R) 3'-(2-гидрокси-2,5-дигидро-1,2-оксаборол-4-ил)-4-метокси-3-пропокси-[1,1'-бифенил]-2-карбонитрил; (S) 3'-(2-гидрокси-2,5-дигидро-1,2-оксаборол-4-ил)-4-метокси-3-пропокси-[1,1'-бифенил]-2-карбонитрил; (R) 4-(5-(2-фтор-4-метокси-5-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(2-фтор-4-метокси-5-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(6-(гидроксиметил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-(гидроксиметил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (R) 4-(2-(3-этокси-4-метоксифенил)тиазол-4-ил)-1,2-оксаборолан-2-ол; (S) 4-(2-(3-этокси-4-метоксифенил)тиазол-4-ил)-1,2-оксаборолан-2-ол; (2R)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-3-(4,4,6-триметил-1,3,2-диоксаборинан-2-ил)пропан-1-ол; (2S)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-3-(4,4,6-триметил-1,3,2-диоксаборинан-2-ил)пропан-1-ол; (R) 4-(5-метокси-6-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол: (S) 4-(5-метокси-6-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол; (R) 4-(3'-(2-фторэтокси)-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(3'-(2-фторэтокси)-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(4-(гидроксиметил)-6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(4-(гидроксиметил)-6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (R) 4-(6-(3-(циклопентилокси)-4-метоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-(3-(циклопентилокси)-4-метоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(4-метокси-3-(тиетан-3-илокси)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(4-метокси-3-(тиетан-3-илокси)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(5-этокси-4-метокси-2-метилфенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(5-этокси-4-метокси-2-метилфенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-этокси-4-метоксифенил)-1,2,4-тиадиазол-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-этокси-4-метоксифенил)-1,2,4-тиадиазол-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-этокси-2-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-этокси-2-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(3'-изопропокси-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(3'-изопропокси-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(3'-этокси-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(3'-этокси-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(4-метокси-3-((тетрагидротиофен-3-ил)окси)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(4-метокси-3-((тетрагидротиофен-3-ил)окси)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(2-фтор-4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(2-фтор-4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R)-4-(6-((S)-1-гидроксиэтил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (R)-4-(6-((R)-1-гидроксиэтил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (S)-4-(6-((S)-1-гидроксиэтил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (S)-4-(6-((R)-1-гидроксиэтил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол (R) 4-(5-(4-метокси-3-пропоксифенил)-4-метилпиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(4-метокси-3-пропоксифенил)-4-метилпиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 6-(6-(2-гидрокси-1,2-оксаборолан-4-ил)пиридин-2-ил)-3-метокси-2-пропоксибензонитрил; (S) 6-(6-(2-гидрокси-1,2-оксаборолан-4-ил)пиридин-2-ил)-3-метокси-2-пропоксибензонитрил; (R) 4-(4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(2-(5-этокси-2-фтор-4-метоксифенил)тиазол-4-ил)-1,2-оксаборолан-2-ол; (S) 4-(2-(5-этокси-2-фтор-4-метоксифенил)тиазол-4-ил)-1,2-оксаборолан-2-ол; (R) 4-(3-(4-(циклопентилокси)-5-метоксипиримидин-2-ил)фенил)-1,2-оксаборолан-2-ол; (S) 4-(3-(4-(циклопентилокси)-5-метоксипиримидин-2-ил)фенил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-этокси-4-метокси-2-(трифторметил)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-этокси-4-метокси-2-(трифторметил)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3,4-диэтоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3,4-диэтоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-(циклопентилокси)-4-(метилтио)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-(циклопентилокси)-4-(метилтио)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(2-(4-метокси-3-пропоксифенил)-6-(метоксиметил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (S) 4-(2-(4-метокси-3-пропоксифенил)-6-(метоксиметил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(4-этокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(4-этокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(2-фтор-3,4-диметоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(2-фтор-3,4-диметоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(4'-метокси-3'-(пентилокси)-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(4'-метокси-3'-(пентилокси)-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(4-(метилтио)-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(4-(метилтио)-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(6-(4-метокси-3-пропоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-(4-метокси-3-пропоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ол; (R) 4-(2'-фтор-4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(2'-фтор-4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 3'-(2-гидрокси-1,2-оксаборолан-4-ил)-4,5-диметокси-[1,1'-бифенил]-3-карбонитрил; (S) 3'-(2-гидрокси-1,2-оксаборолан-4-ил)-4,5-диметокси-[1,1'-бифенил]-3-карбонитрил; (R) 3-этокси-5-(5-(2-гидрокси-1,2-оксаборолан-4-ил)пиридин-3-ил)-2-метоксибензонитрил; (S) 3-этокси-5-(5-(2-гидрокси-1,2-оксаборолан-4-ил)пиридин-3-ил)-2-метоксибензонитрил; 4-(3-(6-этокси-5-метоксипиридин-2-ил)фенил)-1,2-оксаборол-2(5H)-ол; (R) 4-(3-(6-этокси-5-метоксипиридин-2-ил)фенил)-1,2-оксаборолан-2-ол; (S) 4-(3-(6-этокси-5-метоксипиридин-2-ил)фенил)-1,2-оксаборолан-2-ол; (R) 4-(3-(4,5-диметоксипиримидин-2-ил)фенил)-1,2-оксаборолан-2-ол; (S) 4-(3-(4,5-диметоксипиримидин-2-ил)фенил)-1,2-оксаборолан-2-ол; (R) 4-(6-(3-(циклопентилокси)-4-метоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-(3-(циклопентилокси)-4-метоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ол; (R) 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; 4-(3'-(циклопентилокси)-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборол-2(5H)-ол; (R) 4-(3'-(циклопентилокси)-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(3'-(циклопентилокси)-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол (R) 4-(6-(3-(циклопентилокси)-4-метоксифенил)-5-фторпиридин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-(3-(циклопентилокси)-4-метоксифенил)-5-фторпиридин-2-ил)-1,2-оксаборолан-2-ол; (R) 4-(2-(3-(циклопентилокси)-4-метоксифенил)-6-метоксипиримидин-4-ил)-1,2-оксаборолан-2-ол; (S) 4-(2-(3-(циклопентилокси)-4-метоксифенил)-6-метоксипиримидин-4-ил)-1,2-оксаборолан-2-ол; (R) этил 2-(6-(2-гидрокси-1,2-оксаборолан-4-ил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)ацетат; (S) этил 2-(6-(2-гидрокси-1,2-оксаборолан-4-ил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)ацетат; (R) 2-(6-(2-гидрокси-1,2-оксаборолан-4-ил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)уксусная кислота; (S) 2-(6-(2-гидрокси-1,2-оксаборолан-4-ил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)уксусная кислота; (R) 4-(5-фтор-6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-фтор-6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (R) 4-(6-(4-метокси-3-пропоксифенил)пиридазин-4-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-(4-метокси-3-пропоксифенил)пиридазин-4-ил)-1,2-оксаборолан-2-ол; (R) 4-(4-(дифторметил)-5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(4-(дифторметил)-5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(5-этокси-2-фтор-4-метоксифенил)-4-метилпиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(5-этокси-2-фтор-4-метоксифенил)-4-метилпиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-этокси-4-(метилтио)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-этокси-4-(метилтио)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(4-метокси-3-пропоксифенил)-1,2,4-тиадиазол-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(4-метокси-3-пропоксифенил)-1,2,4-тиадиазол-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-(циклопентилокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-(циклопентилокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(2'-фтор-4',5'-диметокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(2'-фтор-4',5'-диметокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 2-этокси-6-(6-(2-гидрокси-1,2-оксаборолан-4-ил)пиридин-2-ил)-3-метоксибензонитрил; (S) 2-этокси-6-(6-(2-гидрокси-1,2-оксаборолан-4-ил)пиридин-2-ил)-3-метоксибензонитрил; (R) 4-(3-(5,6-диметоксипиридин-2-ил)фенил)-1,2-оксаборолан-2-ол; (S) 4-(3-(5,6-диметоксипиридин-2-ил)фенил)-1,2-оксаборолан-2-ол; (R) 6-(5-(2-гидрокси-1,2-оксаборолан-4-ил)пиридин-3-ил)-2,3-диметоксибензонитрил; (S) 6-(5-(2-гидрокси-1,2-оксаборолан-4-ил)пиридин-3-ил)-2,3-диметоксибензонитрил; (R) 4-(2-(2-фтор-4-метокси-5-пропоксифенил)-6-(гидроксиметил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (S) 4-(2-(2-фтор-4-метокси-5-пропоксифенил)-6-(гидроксиметил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; 4-(3-(5-метокси-6-пропоксипиридин-2-ил)фенил)-1,2-оксаборол-2(5H)-ол; (R) 4-(3-(5-метокси-6-пропоксипиридин-2-ил)фенил)-1,2-оксаборолан-2-ол; (S) 4-(3-(5-метокси-6-пропоксипиридин-2-ил)фенил)-1,2-оксаборолан-2-ол; (R) 4-(3',4',5-триметокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(3',4',5-триметокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(6-(4-метокси-3-пропоксифенил)-4-метилпиридин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-(4-метокси-3-пропоксифенил)-4-метилпиридин-2-ил)-1,2-оксаборолан-2-ол; (R) 4-(2-(3,4-диметоксифенил)тиазол-4-ил)-1,2-оксаборолан-2-ол; (S) 4-(2-(3,4-диметоксифенил)тиазол-4-ил)-1,2-оксаборолан-2-ол; (R) 4-(3-(5,6-диметоксипиридин-3-ил)фенил)-1,2-оксаборолан-2-ол; (S) 4-(3-(5,6-диметоксипиридин-3-ил)фенил)-1,2-оксаборолан-2-ол; (R) 4-(6-(2-фтор-3,4-диметоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-(2-фтор-3,4-диметоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-этокси-2,6-дифтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-этокси-2,6-дифтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(3'-(циклопропилметокси)-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(3'-(циклопропилметокси)-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(3'-этокси-2'-фтор-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(3'-этокси-2'-фтор-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(2,4-диметокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(2,4-диметокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(4-метокси-3-((тетрагидро-2H-тиопиран-4-ил)окси)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(4-метокси-3-((тетрагидро-2H-тиопиран-4-ил)окси)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-этокси-4-метоксифенил)-6-этилпиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-этокси-4-метоксифенил)-6-этилпиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(3'-этокси-4'-(метилтио)-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(3'-этокси-4'-(метилтио)-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-хлор-5-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-хлор-5-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(3-(4,5-диметоксипиридин-2-ил)фенил)-1,2-оксаборолан-2-ол; (S) 4-(3-(4,5-диметоксипиридин-2-ил)фенил)-1,2-оксаборолан-2-ол; (R) 4-(4-(3-(циклопентилокси)-4-метоксифенил)-6-метоксипиримидин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(4-(3-(циклопентилокси)-4-метоксифенил)-6-метоксипиримидин-2-ил)-1,2-оксаборолан-2-ол; (R) 3'-(2-гидрокси-1,2-оксаборолан-4-ил)-3,4-диметокси-[1,1'-бифенил]-2-карбонитрил; (S) 3'-(2-гидрокси-1,2-оксаборолан-4-ил)-3,4-диметокси-[1,1'-бифенил]-2-карбонитрил; (R) 4-(5-метокси-4-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-метокси-4-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол; (R) 4-(2-(гидроксиметил)-6-(4-метокси-3-пропоксифенил)пиридин-4-ил)-1,2-оксаборолан-2-ол; (S) 4-(2-(гидроксиметил)-6-(4-метокси-3-пропоксифенил)пиридин-4-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-циклопропокси-4-метоксифенил)-1,2,4-тиадиазол-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-циклопропокси-4-метоксифенил)-1,2,4-тиадиазол-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(4'-этокси-3'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(4'-этокси-3'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(3'-изобутокси-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(3'-изобутокси-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(3'-циклобутокси-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол: (S) 4-(3'-циклобутокси-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(2-(3-этокси-4-метоксифенил)-6-метоксипиримидин-4-ил)-1,2-оксаборолан-2-ол; (S) 4-(2-(3-этокси-4-метоксифенил)-6-метоксипиримидин-4-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(4-этокси-3-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(4-этокси-3-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 3-этокси-3'-(2-гидрокси-1,2-оксаборолан-4-ил)-4-метокси-[1,1'-бифенил]-2-карбонитрил; (S) 3-этокси-3'-(2-гидрокси-1,2-оксаборолан-4-ил)-4-метокси-[1,1'-бифенил]-2-карбонитрил; (R) 4-(6-(2-гидроксиэтокси)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-(2-гидроксиэтокси)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (R) 4-(6-(3,4-диметоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-(3,4-диметоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (R) 4-(4-(гидроксиметил)-6-(4-метокси-3-пропоксифенил)пиримидин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(4-(гидроксиметил)-6-(4-метокси-3-пропоксифенил)пиримидин-2-ил)-1,2-оксаборолан-2-ол; (R) 4-(6-(3-этокси-2-фтор-4-метоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-(3-этокси-2-фтор-4-метоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (R) 4-(1-(4-метокси-3-пропоксифенил)-1H-пиразол-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(1-(4-метокси-3-пропоксифенил)-1H-пиразол-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-метокси-4-(метилтио)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-метокси-4-(метилтио)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(6-(3-этокси-4-(метилтио)фенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-(3-этокси-4-(метилтио)фенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(3-этокси-4-метоксифенил)-4,6-диметилпиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(3-этокси-4-метоксифенил)-4,6-диметилпиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(3'-метокси-4'-(метилтио)-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(3'-метокси-4'-(метилтио)-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(3',4'-диметокси-5-метил-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(3',4'-диметокси-5-метил-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(2'-фтор-3',4'-диметокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(2'-фтор-3',4'-диметокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(2-(3-(циклопентилокси)-4-метоксифенил)пиридин-4-ил)-1,2-оксаборолан-2-ол; (S) 4-(2-(3-(циклопентилокси)-4-метоксифенил)пиридин-4-ил)-1,2-оксаборолан-2-ол; (R) 4-(2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (S) 4-(2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (R) 4-(6-(2-фтор-4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-(2-фтор-4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (R) 4-(6-(2-фтор-4-метокси-3-пропоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-(2-фтор-4-метокси-3-пропоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-(4-этокси-2-фтор-3-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-(4-этокси-2-фтор-3-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(6'-метокси-2-метил-5'-пропокси-[3,3'-бипиридин]-5-ил)-1,2-оксаборолан-2-ол; (S) 4-(6'-метокси-2-метил-5'-пропокси-[3,3'-бипиридин]-5-ил)-1,2-оксаборолан-2-ол; (R) 4-(6-(3-этокси-4-метоксифенил)-4-(трифторметил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-(3-этокси-4-метоксифенил)-4-(трифторметил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (R) 4-(6-этокси-2-(3-этокси-4-метоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-этокси-2-(3-этокси-4-метоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (R) 4-(6-метокси-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (S) 4-(6-метокси-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол; (R) 2-(циклопентилокси)-6-(6-(2-гидрокси-1,2-оксаборолан-4-ил)пиридин-2-ил)-3-метоксибензонитрил; (S) 2-(циклопентилокси)-6-(6-(2-гидрокси-1,2-оксаборолан-4-ил)пиридин-2-ил)-3-метоксибензонитрил; 4-(2-(3,4-диметоксифенил)пиридин-4-ил)-1,2-оксаборол-2(5H)-ол; 4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборол-2(5H)-ол; (R) 4-(3-фтор-6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (S) 4-(3-фтор-6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; (R) 4-(5-метокси-2'-метил-6-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол; (S) 4-(5-метокси-2'-метил-6-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол; (R) 4-(3',4'-диметокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (S) 4-(3',4'-диметокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол; (R) 4-(6-(3-этокси-4-метоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; и (S) 4-(6-(3-этокси-4-метоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол; или их фармацевтически приемлемая соль.
В другом варианте осуществления, в настоящем изобретении представлена фармацевтическая композиция, содержащая соединение формулы (I), формулы (IA), формулы (IB) или формула (IC) или их фармацевтически приемлемая соль и, по меньшей мере, один фармацевтически приемлемый эксципиент, разбавитель или носитель.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики воспалительного заболевания у человека, включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I), формулы (IA), формулы (IB) или формулы (IC) или их фармацевтически приемлемой соли.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики воспалительного заболевания у человека, включающий местное введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I), формулы (IA), формулы (IB) или формулы (IC) или их фармацевтически приемлемой соли, в форме трансдермального пластыря, мази, лосьона, крема или геля.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека, включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I), формулы (IA), формулы (IB) или формулы (IC) или их фармацевтически приемлемой соли.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека, включающий местное введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I), формулы (IA), формулы (IB) или формулы (IC) или их фармацевтически приемлемой соли, в форме трансдермального пластыря, мази, лосьона, крема или геля.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека, включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I), формулы (IA), формулы (IB) или формулы (IC) или их фармацевтически приемлемой соли.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека, включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I), формулы (IA), формулы (IB) или формулы (IC) или их фармацевтически приемлемой соли, в форме трансдермального пластыря, мази, лосьона, крема или геля.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики воспалительного заболевания кишечника, язвенного колита или болезни Крона у человека, включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I), формулы (IA), формулы (IB) или формулы (IC) или их фармацевтически приемлемой соли.
В другом варианте осуществления, в настоящем изобретении представлено применение соединения формулы (I), формулы (IA), формулы (IB) или формулы (IC) или их фармацевтически приемлемой соли, в производстве лекарственного средства для лечения воспалительного заболевания у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение соединения формулы (I), формулы (IA), формулы (IB) или формулы (IC) или их фармацевтически приемлемой соли, в производстве лекарственного средства для лечения атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение соединения формулы (I), формулы (IA), формулы (IB) или формулы (IC) или их фармацевтически приемлемой соли, в производстве лекарственного средства для лечения артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение соединения формулы (I), формулы (IA), формулы (IB) или формулы (IC) или их фармацевтически приемлемой соли, в производстве лекарственного средства для лечения воспалительного заболевания кишечника, язвенного колита или болезни Крона у человека.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 10,5 ± 0,2, 18,3 ± 0,2 и 24,9 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 10,5 ± 0,2, 12,3 ± 0,2, 13,5 ± 0,2, 15,8 ± 0,2, 16,0 ± 0,2, 18,3 ± 0,2 и 24,9 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 10,5 ± 0,2, 12,3 ± 0,2, 13,5 ± 0,2, 15,8 ± 0,2, 16,0 ± 0,2, 18,3 ± 0,2, 21,5 ± 0,2, 22,9 ± 0,2, 24,4 ± 0,2, 24,9 ± 0,2, 25,4 ± 0,2, 26,5 ± 0,2, 27,8 ± 0,2 и 30,2 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую 3-10 пиков дифракции, перечисленных в таблице 5.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции, перечисленные в таблице 5.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, изображенную на фигуре 5.
В другом варианте осуществления, в настоящем изобретении представлена фармацевтическая композиция, содержащая кристаллический (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол и, по меньшей мере, один фармацевтически приемлемый эксципиент, разбавитель или носитель.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики воспалительного заболевания у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека включающий местное введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в форме трансдермального пластыря, мази, лосьона, крема или геля.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека включающий местное введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол в форме трансдермального пластыря, мази, лосьона, крема или геля.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики воспалительного заболевания кишечника, язвенного колита или болезни Крона у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в производстве лекарственного средства для лечения воспалительного заболевания у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол в производстве лекарственного средства для лечения атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в производстве лекарственного средства для лечения артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в производстве лекарственного средства для лечения воспалительного заболевания кишечника, язвенного колита или болезни Крона у человека.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 11,0 ± 0,2, 22,9 ± 0,2 и 25,1 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 11,0 ± 0,2, 11,4 ± 0,2, 18,8 ± 0,2, 22,9 ± 0,2, 25,1 ± 0,2 и 26,4 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 11,0 ± 0,2, 11,4 ± 0,2, 13,2 ± 0,2, 15,1 ± 0,2, 18,8 ± 0,2, 21,3 ± 0,2, 22,9 ± 0,2, 25,1 ± 0,2 и 26,4 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 11,0 ± 0,2, 11,4 ± 0,2, 13,2 ± 0,2, 14,5 ± 0,2, 15,1 ± 0,2, 15,6 ± 0,2, 15,9 ± 0,2, 17,7 ± 0,2,18,8 ± 0,2, 19,4 ± 0,2, 19,7 ± 0,2, 20,5 ± 0,2, 21,3 ± 0,2 и 22,9 ± 0,2, градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 11,0 ± 0,2, 11,4 ± 0,2, 13,2 ± 0,2, 14,5 ± 0,2, 15,1 ± 0,2, 15,6 ± 0,2, 15,9 ± 0,2, 17,7 ± 0,2,18,8 ± 0,2, 19,4 ± 0,2, 19,7 ± 0,2, 20,5 ± 0,2, 21,3 ± 0,2, 22,9 ± 0,2, 25,1 ± 0,2, 25,9 ± 0,2, 26,4 ± 0,2, 27,5 ± 0,2 и 28,4 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую 3-10 пиков дифракции, перечисленных в таблице 6.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции, перечисленные в таблице 6.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, изображенную на фигуре 6.
В другом варианте осуществления, в настоящем изобретении представлена фармацевтическая композиция, содержащая кристаллический (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол и, по меньшей мере, один фармацевтически приемлемый эксципиент, разбавитель или носитель.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики воспалительного заболевания у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека включающий местное введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в форме трансдермального пластыря, мази, лосьона, крема или геля.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека включающий местное введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в форме трансдермального пластыря, мази, лосьона, крема или геля.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики воспалительного заболевания кишечника, язвенного колита или болезни Крона у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол в производстве лекарственного средства для лечения воспалительного заболевания у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в производстве лекарственного средства для лечения атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в производстве лекарственного средства для лечения артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в производстве лекарственного средства для лечения воспалительного заболевания кишечника, язвенного колита или болезни Крона у человека.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 18,7 ± 0,2, 22,8 ± 0,2 и 25,0 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 11,0 ± 0,2, 11,4 ± 0,2, 13,2 ± 0,2, 18,7 ± 0,2, 22,8 ± 0,2 и 25,0 ± 0,2, градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 11,0 ± 0,2, 11,4 ± 0,2, 13,2 ± 0,2, 14,5 ± 0,2, 15,1 ± 0,2, 15,6 ± 0,2, 18,7 ± 0,2, 22,8 ± 0,2 и 25,0 ± 0,2, градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 11,0 ± 0,2, 11,4 ± 0,2, 13,2 ± 0,2, 14,5 ± 0,2, 15,1 ± 0,2, 15,6 ± 0,2, 18,7 ± 0,2, 19,7 ± 0,2, 21,2 ± 0,2, 22,8 ± 0,2, 25,0 ± 0,2 и 26,4 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 11,0 ± 0,2, 11,4 ± 0,2, 13,2 ± 0,2, 14,5 ± 0,2, 15,1 ± 0,2, 15,6 ± 0,2, 18,7 ± 0,2, 19,4 ± 0,2, 19,7 ± 0,2, 20,5 ± 0,2, 21,2 ± 0,2, 22,8 ± 0,2, 25,0 ± 0,2, 26,4 ± 0,2, 27,4 ± 0,2 и 28,3 ± 0,2, градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую 3-10 пиков дифракции, перечисленных в таблице 7.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции, перечисленные в таблице 7.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, изображенную на фигуре 7.
В другом варианте осуществления, в настоящем изобретении представлена фармацевтическая композиция, содержащая кристаллический (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол и, по меньшей мере, один фармацевтически приемлемый эксципиент, разбавитель или носитель.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики воспалительного заболевания у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека включающий местное введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в форме трансдермального пластыря, мази, лосьона, крема или геля.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека включающий местное введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в форме трансдермального пластыря, мази, лосьона, крема или геля.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики воспалительного заболевания кишечника, язвенного колита или болезни Крона у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в производстве лекарственного средства для лечения воспалительного заболевания у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического(S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в производстве лекарственного средства для лечения атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в производстве лекарственного средства для лечения артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в производстве лекарственного средства для лечения воспалительного заболевания кишечника, язвенного колита или болезни Крона у человека.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 12,8 ± 0,2, 20,4 ± 0,2 и 25,7 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 12,8 ± 0,2, 17,9 ± 0,2, 20,4 ± 0,2, 22,9 ± 0,2, 23,1 ± 0,2 и 25,7 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 8,9 ± 0,2, 12,0 ± 0,2, 12,3 ± 0,2,12,8 ± 0,2, 17,8 ± 0,2, 20,4 ± 0,2, 22,9 ± 0,2, 23,1 ± 0,2 и 25,7 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 8,9 ± 0,2, 12,0 ± 0,2, 12,3 ± 0,2,12,8 ± 0,2, 13,9 ± 0,2, 14,2 ± 0,2, 17,6 ± 0,2, 17,8 ± 0,2, 19,2 ± 0,2, 19,4 ± 0,2, 19,6 ± 0,2 и 20,4 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 8,9 ± 0,2, 12,0 ± 0,2, 12,3 ± 0,2,12,8 ± 0,2, 13,9 ± 0,2, 14,2 ± 0,2, 17,6 ± 0,2, 17,8 ± 0,2, 19,2 ± 0,2, 19,4 ± 0,2, 19,6 ± 0,2, 20,4 ± 0,2, 21,4 ± 0,2, 22,0 ± 0,2, 22,3 ± 0,2, 22,9 ± 0,2, 23,1 ± 0,2 и 25,7 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую 3-10 пиков дифракции, перечисленных в таблице 8.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции, перечисленные в таблице 8.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, изображенную на фигуре 8.
В другом варианте осуществления, в настоящем изобретении представлена фармацевтическая композиция, содержащая кристаллический (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол и, по меньшей мере, один фармацевтически приемлемый эксципиент, разбавитель или носитель.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики воспалительного заболевания у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека включающий местное введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в форме трансдермального пластыря, мази, лосьона, крема или геля.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека включающий местное введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в форме трансдермального пластыря, мази, лосьона, крема или геля.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики воспалительного заболевания кишечника, язвенного колита или болезни Крона у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в производстве лекарственного средства для лечения воспалительного заболевания у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в производстве лекарственного средства для лечения атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в производстве лекарственного средства для лечения артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола в производстве лекарственного средства для лечения воспалительного заболевания кишечника, язвенного колита или болезни Крона у человека.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 21,1 ± 0,2, 22,7 ± 0,2 и 23,8 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 10,9 ± 0,2, 11,3 ± 0,2, 19,3 ± 0,2, 21,1 ± 0,2, 22,7 ± 0,2, 23,8 ± 0,2 и 30,4 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 10,9 ± 0,2, 11,3 ± 0,2, 17,0 ± 0,2, 17,3 ± 0,2, 19,3 ± 0,2, 21,1 ± 0,2, 22,7 ± 0,2, 23,8 ± 0,2 и 30,4 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 10,9 ± 0,2, 11,3 ± 0,2, 17,0 ± 0,2, 17,3 ± 0,2, 19,0 ± 0,2, 19,3 ± 0,2, 21,1 ± 0,2, 22,7 ± 0,2, 23,8 ± 0,2, 25,4 ± 0,2, 26,5 ± 0,2 и 30,4 ± 0,2 градусов два тэта.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую 3-10 пиков дифракции, перечисленных в таблице 9.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, содержащую пики дифракции, перечисленные в таблице 9.
В другом варианте осуществления, в настоящем изобретении представлен кристаллический (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол, имеющий порошковую рентгеновскую дифрактограмму, изображенную на фигуре 9.
В другом варианте осуществления, в настоящем изобретении представлена фармацевтическая композиция, содержащая кристаллический (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол и, по меньшей мере, один фармацевтически приемлемый эксципиент, разбавитель или носитель.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики воспалительного заболевания у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека включающий местное введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ола в форме трансдермального пластыря, мази, лосьона, крема или геля.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека включающий местное введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ола в форме трансдермального пластыря, мази, лосьона, крема или геля.
В другом варианте осуществления, в настоящем изобретении представлен способ лечения или профилактики воспалительного заболевания кишечника, язвенного колита или болезни Крона у человека включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллического (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ола.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол в производстве лекарственного средства для лечения воспалительного заболевания у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического(R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол в производстве лекарственного средства для лечения атопического дерматита, дерматита рук, контактного дерматита, аллергического контактного дерматита, раздражающего контактного дерматита, нейродермита, периорального дерматита, застойного дерматита, дисгидротической экземы, ксерозного дерматита, нуммалярного дерматита, себорейного дерматита, дерматита век, пеленочного дерматита, дерматомиозита, красного плоского лишая, склероатрофического лишая, очаговой алопеции, витилиго, розацеа, буллезного эпидермолиза, волосяного кератоза, себорейной экземы, пузырчатки, вульвовагинита, угрей, хронической спонтанной крапивницы, хронической идиопатической крапивницы, хронической физической крапивницы, синдрома Фогта-Коянаги-Харада, невуса/невусов Саттона, поствоспалительной гипопигментации, сенильной лейкодермии, химической/лекарственной лейкодермии, кожной красной волчанки, дискоидной волчанки, ладонно-подошвенного пустулеза, пемфигоида, синдрома Свита, гнойного гидраденита, псориаза, пятнистого псориаза, пустулезного псориаза, псориаза ногтей, псориаза складок, каплевидного псориаза, псориатического артрита, эритродермического псориаза или обратного псориаза у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол в производстве лекарственного средства для лечения артрита, астмы, фиброза, волчанки, аллергии, фибромиалгии, заживления ран или воспаления после хирургических осложнений у человека.
В другом варианте осуществления, в настоящем изобретении представлено применение кристаллического (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол в производстве лекарственного средства для лечения воспалительного заболевания кишечника, язвенного колита или болезни Крона у человека.
В другом варианте осуществления, в настоящем изобретении представлены фармацевтические комбинации для местного введения, содержащие соединение формулы (I), формулы (IA), формулы (IB) или формулы (IC) или их фармацевтически приемлемую соль в комбинации с другим фармацевтическим агентом для лечения заболеваний, состояний и/или расстройств, описанных в настоящем документе. Подходящие фармацевтические агенты, которые можно использовать в комбинации с соединениями по настоящему изобретению для местного введения, включают, но не ограничиваются ими: второе соединение формулы (I), формулы (IA), формулы (IB) или формулы (IC); ингибитор изофермента PDE4, включая, но не ограничиваясь ими,, кризаборол, ампремиласт, рофлумиласт, ролипрам и пикламиласт; кортикостероид, включая, но не ограничиваясь ими, флуоцинонид, дезоксиметазон, мометазон, триамцинолон, бетаметазон, алклометазон, дезонид, гидрокортизон и мапракорат; ингибитор кальциневрина, включая, но не ограничиваясь ими, такролимус, пимекролимус и циклоспорин; ингибитор JAK, включая, но не ограничиваясь ими, тофацитиниб, ATI-502, SNA-152, SHR-0302, JTE052, BMS-986165, филготиниб, барицитиниб, упадацитиниб, руксолитиниб, пецитиниб, PF-04965842, PF-06651600, PF-06700841 и PF06826647; агонист арилуглеводородного рецептора, включая, но не ограничиваясь ими, тапинароф; ингибитор IRAK4, включая, но не ограничиваясь ими, PF-06650833; нестероидные противовоспалительные средства, включая, но не ограничивая ими, WBI-1001 и MRX-6; аналог витамина D, такой как кальципотриен; производные ретиноевой кислоты, включая, но не ограничиваясь ими, алитретиноин; селективный агонист Х рецептора печени (LXR), включая, но не ограничиваясь ими, VTP-38543; антагонисты рецептора H4, включая, но не ограничивая ими, ZPL-389; антагонисты рецептора NKI, включая, но не ограничиваясь ими, Апрепитант и Традипитант; антагонисты рецептора CRTH2, включая, но не ограничиваясь ими, февипипрант и OC-459; ингибиторы химазы, включая, но не ограничиваясь ими, SUN 13834; ингибиторы GATA-3, включая, но не ограничиваясь ими, SB-011 и GR-MD-02; и обратные агонисты ROR, включая, но не ограничиваясь ими, VTP-43742, ARN6039, TAK-828 и JTE-451; иммуномодуляторы, такие как PF-06763809 и ингибиторы SYK, BTK и ITK, включая, но не ограничиваясь ими, R-348, цердулатиниб, ибрутиниб, энтосплетиниб, тирабрутиниб и JTE-051.
В другом варианте осуществления, в настоящем изобретении представлены фармацевтические комбинации для перорального введения, содержащие соединение формулы (I), формулы (IA), формулы (IB) или формулы (IC) или их фармацевтически приемлемую соль в комбинации с другим фармацевтическим агентом для лечения заболеваний, состояний и/или расстройств, описанных в настоящем документе. Подходящие фармацевтические агенты, которые можно использовать в комбинации с соединениями по настоящему изобретению для перорального введения, включают, но не ограничиваются ими: пероральные производные ретиноевой кислоты, включая, но не ограничиваясь ими, алитретиноин; пероральные селективные агонисты X рецептора печени (LXR), включая, но не ограничиваясь ими, VTP-38543; пероральные антагонисты рецептора H4, включая, но не ограничиваясь ими, ZPL-389; пероральные антагонисты рецепторов NKI, включая, но не ограничиваясь ими, Апрепитант и Традипитант; пероральные антагонисты рецептора CRTH2, включая, но не ограничиваясь ими, февипипрант и OC-459; оральные ингибиторы химазы, включая, но не ограничиваясь ими, SUN 13834; пероральные ингибиторы GATA-3, включая, но не ограничиваясь ими, SB-011; пероральные обратные агонисты ROR, включая, но не ограничивая ими, VTP-43742, ARN6039, TAK-828 и JTE-451; пероральные ингибиторы JAK, включая, но не ограничиваясь ими, барицитиниб, цердулатиниб, децернотиниб, дельгоцитиниб, федратиниб, филготиниб, гандотиниб, ильгинатиниб, итацитиниб, лестауртиниб, момелотиниб, оклацитиниб, пакритиниб, пефицитиниб, руксолитиниб, тофацитиниб, упадациниб, ASN-002, AT9283, ATI-501, ATI-502, AZD1480, AZD4205, BMS-911543, BMS-986165, INCB-52793, INCB-54707, PF-04965842, PF-06263276, PF-06651600, PF-06700841, PF-06826647, SHR-0302, SNA-125 или TD-1473; иммуномодуляторы и ингибиторы SYK, BTK и ITK, включая, но не ограничиваясь ими, фостаматиниб, ибрутиниб, мастиниб, мивавотиниб, энтосплетиниб, спербрутиниб, тирабрутиниб, фенебрутиниб, TOP-1288, R-348, цердулатиниб, SKI-O-703, TAS-05567, CG-806, R-343, CG-103065, PRT-2607, GSK-143, VRT-750018, UR-67767, PRN-1008, BMS-935177, PRN-473, ABBV-105, AS-550, M-7583, WXFL-10230486, LOU-064, AEG-42766, HCI-1401, KBP-7536, ARQ-531, GNE-4997 и GNE-9822; и пероральные ингибиторы IRAK4 включая, но не ограничиваясь ими, PF-06650833 и BAY-1830839.
В другом варианте осуществления, в настоящем изобретении представлены фармацевтические комбинации для введения инъекцией, содержащие соединение формулы (I), формулы (IA), формулы (IB) или формулы (IC) или их фармацевтически приемлемую соль в комбинации с другим фармацевтическим агентом для лечения заболеваний, состояний и/или расстройств, описанных в настоящем документе. Подходящие фармацевтические агенты, которые можно использовать в комбинации с соединениями по настоящему изобретению для введения инъекцией включают, но не ограничиваются ими: ингибиторы TNFα, включая, но не ограничиваясь ими, инфликсимаб, адалимумаб, голимумаб, цертолизумаб пегол; инъекционные анти-IL4, IL-12, IL-17, IL-22, IL-23, IL-31, IL-33, IgE препараты, такие как дупилумаб, лебрикизумаб, немолизумаб, тралокинумаб, этанерцепт, адалимумаб, инфликсимаб, устекинумаб, секукинумаб, омазумилаб и CIM-331.
Комбинированная терапия включает введение двух или более терапевтических агентов одновременно или последовательно. Агенты можно вводить в любом порядке. Альтернативно, несколько терапевтических агентов можно объединить в единую композицию, которую можно вводить пациенту. Например, одна фармацевтическая композиция может содержать соединение или его фармацевтически приемлемую соль, сложный эфир или пролекарство в соответствии с формулами (I), (IA), (IB) и (IC), другой терапевтический агент или фармацевтически приемлемую соль, сложный эфир или его пролекарство и, по меньшей мере, один фармацевтически приемлемый наполнитель или носитель.
При использовании в вышеуказанных или других вариантах лечения, терапевтически эффективное количество одного из соединений по настоящему изобретению можно использовать в чистой форме или, если такие формы существуют, в форме фармацевтически приемлемой соли, сложного эфира, амида или пролекарства. Альтернативно, соединение можно вводить в виде фармацевтической композиции, содержащей соединение, представляющее интерес, в комбинации с одним или несколькими фармацевтически приемлемыми носителями. Фраза «терапевтически эффективное количество» соединения по настоящему изобретению означает достаточное количество соединения для лечения заболеваний, состояний или расстройств, указанных в настоящем документе, при разумном соотношении польза/риск, применимом к любому медицинскому лечению. Конкретный терапевтически эффективный уровень дозы для любого конкретного пациента будет зависеть от множества факторов, включая заболевание, которое лечат, и тяжесть расстройства; активность конкретного используемого соединения; конкретную используемую композицию; возраст, массу тела, общее состояние здоровья, пол и диету пациента; время введения, способ введения и скорость выведения конкретного применяемого соединения; продолжительность лечения; лекарственные средства, применяемые в комбинации или одновременно с конкретным используемым соединением; и подобные факторы, хорошо известные в медицине.
Фармацевтические композиции или составы
В другом варианте осуществления, в настоящем изобретении представлены фармацевтические композиции или составы, содержащие терапевтически эффективное количество соединения по настоящему изобретению и фармацевтически приемлемый эксципиент, разбавитель или носитель. Фармацевтические композиции или составы по настоящему изобретению могут вводиться человеку и другим млекопитающим местно, перорально, парентерально, интрацистерально, интравагинально, внутрибрюшинно, буккально, в виде перорального спрея, в виде назального спрея, ректально в виде суппозитория или в форме липосом.
Типовую фармацевтическую композицию или состав получают смешиванием соединения по настоящему изобретению и носителя, разбавителя или эксципиента. Подходящие носители, разбавители и эксципиенты включают материалы, такие как углеводы, воски, водорастворимые и/или набухающие полимеры, гидрофильные или гидрофобные материалы, желатин, масла, растворители, вода и подобные. Конкретный используемый носитель, разбавитель или эксципиент будет зависеть от средств и цели, для которых применяется соединение по настоящему изобретению. Подходящие водные растворители включают воду, этанол, пропиленгликоль, полиэтиленгликоли (например, PEG400, PEG300) и т.д. и их смеси. Составы могут также включать один или несколько буферов, стабилизаторов, поверхностно-активных веществ, смачивающих агентов, смазывающих агентов, эмульгаторов, суспендирующих агентов, консервантов, антиоксидантов, кроющих агентов, глидантов, технологических добавок, красителей, подсластителей, отдушек, ароматизаторов и других известных добавок для обеспечения элегантного внешнего вида лекарственного средства (т.е. соединения по настоящему изобретению или его фармацевтической композиции) или помощи в производстве фармацевтического продукта (т.е. для использования при приготовлении лекарственного средства).
Составы могут быть приготовлены с использованием обычных процедур растворения и смешивания. Например, нерасфасованное лекарственное вещество (т.е. соединение по настоящему изобретению или стабилизированную форму соединения (например, комплекс с производным циклодекстрина или другим известным комплексообразующим агентом)) растворяют в подходящем растворителе в присутствии одного или нескольких вспомогательных веществ, описанные выше. Скорость растворения плохорастворимых в воде соединений может быть увеличена за счет использования высушенных распылением дисперсий, таких как те, которые описаны в Takeuchi, H., et al. in “Enhancement of the dissolution rate of a poorly water-soluble drug (tolbutamide) by a spray-drying solvent deposition method и disintegrants” J. Pharm. Pharmacol., 39, 769-773 (1987); и EP0901786 B1 (US2002/009494), включенном в настоящий документ в качестве ссылки. Соединение по настоящему изобретению обычно составляют в виде фармацевтических дозированных форм для обеспечения легко контролируемой дозировки лекарственного средства и для получения пациентом элегантного и легко обрабатываемого продукта.
Фармацевтическая композиция или состав для применения может быть упакован различными способами в зависимости от метода, используемого для введения лекарственного средства. Обычно изделие для распространения включает контейнер, который содержит фармацевтический состав в соответствующей форме. Подходящие контейнеры включают такие материалы, как бутылки (пластиковые и стеклянные), саше, ампулы, пластиковые пакеты, металлические цилиндры и подобные. Контейнер может также включать в себя защищенную от взлома сборку для предотвращения несанкционированного доступа к содержимому упаковки. Кроме того, на контейнер нанесена этикетка, которая описывает содержимое контейнера. Этикетка может также включать соответствующие предупреждения.
Термин «фармацевтически приемлемый носитель» относится к среде носителя, которая обеспечивает подходящую доставку эффективного количества активного агента, как определено в настоящем документе, не влияет на эффективность биологической активности активного агента, и которая в достаточной степени не токсична для хозяина или пациента. Типовые носители включают воду, масла, как растительные, так и минеральные, основы для кремов, основы для лосьонов, основы для мазей и подобные. Эти основы включают суспендирующие агенты, загустители, усилители проникновения и подобные. Дополнительную информацию относительно носителей можно найти в Remington: The Science и Practice of Pharmacy, 21st Ed., Lippincott, Williams & Wilkins (2005), который включен в настоящий документ в качестве ссылки. Другими примерами материалов, которые могут служить фармацевтически приемлемыми носителями, являются сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; эксципиенты, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; сложные эфиры, такие как этилолеат и этил лаурат; агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический солевой раствор; раствор Рингера; этиловый спирт и фосфатные буферные растворы, а также другие нетоксичные совместимые смазывающие агенты, такие как лаурилсульфат натрия и стеарат магния, а также красители, антиадгезионные агенты, покрывающие вещества, подсластители, ароматизаторы и отдушки, консерванты и антиоксиданты также могут присутствовать в композиции, по мнению составителя.
Термин «фармацевтически приемлемый носитель для местного применения» относится к фармацевтически приемлемым носителям, как описано в настоящем документе выше, подходящим для местного применения. Неактивная жидкость или кремовый носитель, способный суспендировать или растворять активный агент(ы) и обладающий свойствами нетоксичности и невызывающий воспаление при нанесении на кожу, ноготь, волосы, коготь или копыто, является примером фармацевтически приемлемого носителя для местного применения. Этот термин специально предназначен для охвата материалов носителя, одобренных для использования в косметике для местного применения.
Термин «местное введение» относится к нанесению фармацевтического агента на внешнюю поверхность кожи, ногтя, волос, когтя или копыта, так что агент проходит через внешнюю поверхность кожи, ногтя, волос, когтя или копыта и попадает в низлежащие ткани. Местное введение включает нанесение композиции на неповрежденную кожу, ноготь, волосы, коготь или копыто или на сломанную, необработанную или открытую рану кожи, ногтя, волос, когтя или копыта. Местное введение фармацевтического агента может привести к ограниченному распределению агента на коже и окружающих тканях или, когда агент удаляется из области лечения кровотоком, может привести к системному распределению агента.
Дозированные формы для местного или трансдермального введения соединения по настоящему изобретению включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, ингалянты или пластыри. Активный компонент смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами, которые могут потребоваться. Летучие соединения могут потребовать смешивания со специальными препаратообразующими агентами или специальными упаковочными материалами, чтобы гарантировать правильную дозировку. Кроме того, соединения по настоящему изобретению, которые имеют плохую проницаемость для кожи человека, могут потребовать одного или нескольких усилителей проницаемости, тогда как для соединений, быстро всасывающихся через кожу, может потребоваться состав с замедляющими абсорбцию агентами или барьерами.
Мази, пасты, кремы, лосьоны, гели, порошки и растворы для местного применения могут содержать, помимо активного соединения по настоящему изобретению, фармацевтически приемлемые эксципиенты, такие как животные и растительные жиры, масла, воски, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевая кислота, тальк, оксид цинка, консерванты, антиоксиданты, ароматизаторы, эмульгаторы, красители, инертные наполнители, агенты, не вызывающие раздражения, вещества, повышающие клейкость, отдушки, замутнители, антиоксиданты, гелеобразующие агенты, стабилизаторы, поверхностно-активные вещества, смягчающие вещества, красители, консерванты, буферные агенты, усилители проницаемости или их смеси. Эксципиенты для местного применения не должны влиять на эффективность биологической активности активного агента и не быть вредными для эпителиальных клеток или их функции.
Термины «усилитель проницаемости» или «усилитель проникновения» относятся к увеличению проницаемости кожи, ногтей, волос, когтей или копыт для лекарственного средства, чтобы увеличить скорость, с которой лекарство проникает через кожу, ноготь, волосы, коготь или копыто. Усиление проницаемости, достигаемое за счет использования таких усилителей, можно наблюдать, например, через измерение скорости диффузии лекарственного средства через кожу, ноготь, волосы, коготь или копыто животного или человека с использованием аппарата диффузионных клеток. Диффузионная клетка описывается у Merritt et al. Diffusion Apparatus for Skin Penetration, J of Controlled Release, 1 (1984) pp. 161-162. Термин «усилитель проницаемости» или «усилитель проникновения» означает агент или смесь агентов, которые, по отдельности или в комбинации, действуют, увеличивая проницаемость кожи, ногтей, волос или копыт для лекарственного средства.
Термин «трансдермальная доставка» относится к диффузии агента через барьер кожи, ногтя, волос, когтей или копыта в результате местного введения или другого применения композиции. Роговой слой действует как барьер, и немногие фармацевтические агенты способны проникать через неповрежденную кожу. Напротив, эпидермис и дерма проницаемы для многих растворенных веществ, и поэтому всасывание лекарств легче происходит через кожу, ноготь, волосы, коготь или копыто, которые истираются или иным образом лишаются рогового слоя, обнажая эпидермис. Трансдермальная доставка включает инъекцию или другую доставку через любую часть кожи, ногтя, волос, когтя или копыта или слизистой оболочки и абсорбцию или проникновение через оставшуюся часть. Абсорбция через неповрежденную кожу, ноготь, волосы, коготь или копыто может быть усилена помещением активного агента в соответствующий фармацевтически приемлемый носитель перед нанесением на кожу, ноготь, волосы, коготь или копыто. Пассивное местное введение может состоять из нанесения активного агента непосредственно на обрабатываемый участок в сочетании со смягчающими средствами или усилителями проникновения. В настоящем документе, трансдермальная доставка включает доставку путем проникновения через или через покровы, то есть кожу, ноготь, волосы, коготь или копыто.
Порошки и спреи могут содержать, помимо соединений по настоящему изобретению, лактозу, тальк, кремниевую кислоту, гидроксид алюминия, силикаты кальция и порошок полиамида или смеси этих веществ. Спреи могут дополнительно содержать обычные пропелленты, такие как хлорфторуглеводороды.
Твердые дозированные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных формах активное соединение смешано, по меньшей мере, с одним инертным фармацевтически приемлемым носителем, таким как цитрат натрия или фосфат кальция, и/или а) наполнителями или разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и салициловая кислота; b) связующими агентами, такими как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидинон, сахароза и аравийская камедь; с) увлажнителями, такими как глицерин; d) разрыхлителями, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия; e) агентами, замедляющими растворение, такими как парафин; f) ускорителями абсорбции, такими как соединения четвертичного аммония; g) смачивающими агентами, такими как цетиловый спирт и моностеарат глицерина; h) абсорбентами, такими как каолин и бентонитовая глина; и i) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль, дозированная форма может также содержать буферные агенты.
Твердые композиции подобного типа также могут использоваться в качестве наполнителей в мягких и твердых желатиновых капсулах с использованием лактозы или молочного сахара, а также высокомолекулярных полиэтиленгликолей и подобных.
Твердые дозированные формы таблеток, драже, капсул, пилюль и гранул могут быть приготовлены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области составления фармацевтических препаратов. Они могут необязательно содержать замутняющие агенты и также могут быть композицией, из которой они высвобождают активный ингредиент(ы) только или предпочтительно в определенной части кишечного тракта замедленным образом. Примеры заливающих композиций, которые можно использовать, включают полимерные вещества и воски.
Жидкие дозированные формы для перорального введения включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям, жидкие дозированные формы могут содержать инертные разбавители, обычно используемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное, зародышевое, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана, и их смеси.
Помимо инертных разбавителей, пероральные композиции могут также включать адъюванты, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подсластители, ароматизаторы и отдушки.
Термин «парентерально», используемый в настоящем документе, относится к способам введения, которые включают внутривенную, внутримышечную, внутрибрюшинную, внутригрудинную, подкожную, внутрисуставную инъекцию и инфузию. Фармацевтические композиции по настоящему изобретению для парентеральной инъекции включают фармацевтически приемлемые стерильные водные или не водные растворы, дисперсии, суспензии или эмульсии и стерильные порошки для восстановления в стерильные растворы или дисперсии для инъекций. Примеры подходящих водных и не водных носителей, разбавителей, растворителей или носителей включают воду, этанол, полиолы (пропиленгликоль, полиэтиленгликоль, глицерин и подобные), их подходящие смеси, растительные масла (такие как оливковое масло) и органические сложные эфиры для инъекций, такие как этилолеат. Надлежащая текучесть может поддерживаться, например, при использовании покрытия, такого как лецитин, при поддержании требуемого размера частиц в случае дисперсий и при использовании поверхностно-активных веществ.
Формы депо для инъекций получают формированием микроинкапсулированных матриц лекарственного средства в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от отношения лекарственного средства к полимеру и природы конкретного используемого полимера можно контролировать скорость высвобождения лекарственного средства. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Инъекционные формы депо также получают улавливанием лекарственного средства липосомами или микроэмульсиями, которые совместимы с тканями организма.
Составы для инъекций могут быть простерилизованы, например, фильтрацией через фильтр, задерживающий бактерии, или включением стерилизующих агентов в форме стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или другой стерильной среде для инъекций непосредственно перед применением.
Препараты для инъекций, например стерильные водные или масляные суспензии для инъекций, могут быть составлены с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильным препаратом для инъекций также может быть стерильный раствор, суспензия или эмульсия для инъекций в нетоксичном, парентерально приемлемом разбавителе или растворителе, таком как раствор в 1,3-бутандиоле. Приемлемые носители и растворители, которые можно использовать, включают воду, раствор Рингера, U.S.P. и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно используются в качестве растворителя или суспендирующей среды. Для этой цели может быть использовано любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, при приготовлении инъекционных препаратов используются жирные кислоты, такие как олеиновая кислота.
Фармацевтические композиции или составы для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые могут быть приготовлены путем смешивания соединений по настоящему изобретению с подходящими не раздражающими носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при температуре окружающей среды, но жидкими при температуре тела и, следовательно, плавятся в прямой кишке или влагалище и высвобождают активное соединение.
Соединения по настоящему изобретению также можно вводить в форме липосом. Липосомы обычно получены из фосфолипидов или других жировых веществ и образованы моно- или многослойными гидратированными жидкими кристаллами, которые диспергированы в водной среде. Можно использовать любой нетоксичный, физиологически приемлемый и метаболизируемый жир, способный образовывать липосомы. Настоящие композиции в форме липосом могут содержать, помимо соединений настоящего изобретения, стабилизаторы, консерванты и подобные. Предпочтительными жирами являются природные и синтетические фосфолипиды и фосфатидилхолины (лецитины), используемые отдельно или вместе. Способы образования липосом известны в данной области. См., например, Prescott, Ed., Methods in Cell Biology, Volume XIV, Academic Press, New York, N. Y., (1976), стр. 33 и далее.
Фармацевтические композиции или составы по настоящему изобретению могут также содержать адъюванты, такие как консерванты, смачивающие агенты, эмульгирующие агенты и диспергирующие агенты. Предотвращение действия микроорганизмов может быть обеспечено различными антибактериальными и противогрибковыми агентами, например парабенами, хлорбутанолом, фенолом, сорбиновой кислотой и подобными. Также может быть желательно включить изотонические агенты, например, сахара, хлорид натрия и подобные. Пролонгированная абсорбция инъекционной фармацевтической формы может быть обеспечена использованием агентов, замедляющих абсорбцию, например, моностеарата алюминия и желатина.
Фармацевтические композиции или составы по изобретению могут быть суспензиями. Суспензии, в дополнение к активным соединениям, могут содержать суспендирующие агенты, такими как, например, этоксилированные изостеариловые спирты, полиоксиэтилен сорбитол и сложные эфиры сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар, трагакант и их смеси.
Фармацевтические композиции также включают сольваты и гидраты соединений по настоящему изобретению. Термин «сольват» относится к молекулярному комплексу соединения, представленного формулами (I), (IA), (IB) и (IC), включая его фармацевтически приемлемые соли, с одной или несколькими молекулами растворителя. Такие молекулы растворителя, которые обычно используются в фармацевтике, как известно, безвредны для реципиента, например вода, этанол, этиленгликоль, (S)-пропиленгликоль, (R)-пропиленгликоль и подобные. «Гидрат» относится к комплексу, в котором молекулой растворителя является вода. Сольваты и/или гидраты предпочтительно существуют в кристаллической форме. Другие растворители могут применяться в качестве промежуточных сольватов при приготовлении более желательных сольватов. Промежуточные растворители включают, но не ограничиваются ими, метанол, метил-трет-бутиловый эфир, этилацетат, метилацетат, 1,4-бутиндиол и подобные.
Фактические уровни дозировки активных ингредиентов в фармацевтических композициях настоящего изобретения могут варьироваться для получения количества активного соединения(й), которое эффективно для достижения желаемого терапевтического ответа для конкретного пациента, композиций и способа введения. Выбранный уровень дозировки будет зависеть от активности конкретного соединения, пути введения, тяжести состояния, подлежащего лечению, состояния и предшествующей истории болезни пациента, подвергаемого лечению. Однако в компетенции специалиста в данной области техники начинать дозирование соединения с уровней ниже, чем требуется, для достижения желаемого терапевтического эффекта, и постепенно увеличивать дозировку до тех пор, пока желаемый эффект не будет достигнут.
Общая суточная доза соединений по изобретению, вводимая человеку или низшему животному, может варьироваться от примерно 0,000001 до примерно 10 мг/кг/сутки. Для целей перорального введения, более предпочтительные дозы могут быть в диапазоне от примерно 0,001 до примерно 1 мг/кг/сутки. Для местного введения, более предпочтительные дозы могут быть в диапазоне от 0,00001 мг/кг/сутки до примерно 5 мг/кг/сутки. При желании, эффективная суточная доза может быть поделена на множество доз для целей введения, например, от двух до четырех отдельных доз в сутки.
Определения
В контексте данного описания и прилагаемой формулы изобретения, следующие термины имеют следующие значения:
Термин «(C2-C6)алкенил» в настоящем документе означает прямую или разветвленную углеводородную цепь, содержащую от 2 до 6 атомов углерода и содержащую, по меньшей мере, одну двойную связь углерод-углерод. Типовые примеры (C2-C6)алкенила включают, но не ограничены ими, этенил, 2-пропенил, 2-метил-2-пропенил, 3-бутенил, 4-пентенил и 5-гексенил.
Термин «(C2-C6)алкенилокси» в настоящем документе означает (C2-C6)алкенильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через атом кислорода.
Термин «(C2-C6)алкенилтио» в настоящем документе означает (C2-C6)алкенильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через атом серы.
Термин «(C1-C6)алкокси» в настоящем документе означает (C1-C6)алкильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через атом кислорода. Типовые примеры (C1-C6)алкокси включают, но не ограничены ими, метокси, этокси, пропокси, 2-пропокси, бутокси, трет-бутокси, пентилокси и гексилокси.
Термин «(C1-C6)алкокси-d1-13» в настоящем документе означает (C1-C6)алкил-d1-13 группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через атом кислорода. Типовые примеры (C1-C6)алкокси-d1-13 включают, но не ограничены ими, метокси-d3, этокси-d5, пропокси-d7, 2-пропокси-d7, бутокси-d9, трет-бутокси-d9, пентилокси-d11 и гексилокси-d13.
Термин «(C1-C6)алкокси(C1-C6)алкокси» в настоящем документе означает (C1-C6)алкокси группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через другую (C1-C6)алкокси группу, как определено в настоящем документе. Типовые примеры (C1-C6)алкокси(C1-C6)алкокси включают, но не ограничены ими, трет-бутоксиметокси, 2-этоксиэтокси, 2-метоксиэтокси и метоксиметокси.
Термин «(C1-C6)алкокси(C1-C6)алкил» в настоящем документе означает (C1-C6)алкокси группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через (C1-C6)алкильную группу, как определено в настоящем документе. Типовые примеры (C1-C6)алкокси(C1-C6)алкил включают, но не ограничены ими, трет-бутоксиметил, 2-этоксиэтил, 2-метоксиэтил и метоксиметил.
Термин «(C1-C6)алкоксикарбонил» в настоящем документе означает (C1-C6)алкокси группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через карбонильную группу, как определено в настоящем документе. Типовые примеры (C1-C6)алкоксикарбонил включают, но не ограничены ими, метоксикарбонил, этоксикарбонил и трет-бутоксикарбонил.
Термин «(C1-C3)алкил» в настоящем документе означает прямой или разветвленный углеводород, содержащий от 1 до 3 атомов углерода. Типовые примеры (C1-C3)алкила включают метил, этил, н-пропил и изопропил.
Термин «(C1-C3)алкил-d1-7» в настоящем документе означает прямой или разветвленный углеводород, содержащий от 1 до 3 атомов углерода, где от одного до семь атомов водорода заменены дейтерием (2H или D). Типовые примеры (C1-C3)алкил-d1-7 включают метил-d3, этил-d5, этил-2,2,2-d3, пропил-d7 и 2-пропил-d7.
Термин «(C1-C6)алкил» в настоящем документе означает прямой или разветвленный углеводород, содержащий от 1 до 6 атомов углерода. Типовые примеры (C1-C6)алкила включают, но не ограничены ими, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил и н-гексил.
Термин «(C1-C6)алкил-d1-13» в настоящем документе означает прямой или разветвленный углеводород, содержащий от 1 до 6 атомов углерода, где от одного до тринадцати атомов водорода замещены дейтерием (2H или D). Типовые примеры (C1-C6)алкил-d1-13 включают, но не ограничены ими, метил-d3, этил-d5, этил-2,2,2-d3, пропил-d7, 2-пропил-d7, бутил-d9, трет-бутил-d9, пентил-d11 и гексил-d13.
Термин «(C1-C6)алкилкарбонил» в настоящем документе означает (C1-C6)алкильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через карбонильную группу, как определено в настоящем документе. Типовые примеры (C1-C6)алкилкарбонила включают, но не ограничены ими, ацетил, 1-оксопропил, 2,2-диметил-1-оксопропил, 1-оксобутил и 1-оксопентил.
Термин «(C1-C6)алкилтио» в настоящем документе означает (C1-C6)алкильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через атом серы. Типовые примеры (C1-C6)алкилтио включают, но не ограничены ими, метилтио, этилтио, трет-бутилтио и гексилтио.
Термин «(C1-C6)алкилтио(C1-C6)алкил» в настоящем документе означает (C1-C6)алкилтио группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через (C1-C6)алкильную группу, как определено в настоящем документе. Типовые примеры (C1-C6)алкилтио(C1-C6)алкила включают, но не ограничены ими, метилтиометил и 2-(этилтио)этил.
Термин «(C2-C6)алкинил» в настоящем документе означает прямую или разветвленную углеводородную группу, содержащую от 2 до 6 атомов углерода и содержащую, по меньшей мере, одну тройную связь углерод-углерод. Типовые примеры (C2-C6)алкинила включают, но не ограничены ими, ацетиленил, 1-пропинил, 2-пропинил, 3-бутинил, 2-пентинил и 1-бутинил.
Термин «(C2-C6)алкинилокси» в настоящем документе означает (C2-C6)алкинильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через атом кислорода.
Термин «(C2-C6)алкинилтио» в настоящем документе означает (C2-C6)алкинильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через атом серы.
Термин «арил» в настоящем документе означает фенильную или нафтильную группу.
Термин «арил(C1-C6)алкокси» в настоящем документе означает арильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через (C1-C6)алкокси группу, как определено в настоящем документе.
Термин «арил(C1-C6)алкил» в настоящем документе означает арильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через (C1-C6)алкильную группу, как определено в настоящем документе. Типовые примеры арил(C1-C6)алкила включают, но не ограничены ими, бензил, 2-фенилэтил, 3-фенилпропил и 2-нафт-2-илэтил.
Термин «арил(C1-C6)алкилтио» в настоящем документе означает арил(C1-C6)алкильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через атом серы, как определено в настоящем документе. Типовые примеры арил(C1-C6)алкилтио включают, но не ограничены ими, бензилтио, фенилэтилтио, 3-фенилпропилтио и 2-нафт-2-илэтилтио.
Термин «арилокси» в настоящем документе означает арильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через атом кислорода. Типовые примеры арилокси включают, но не ограничены ими, фенокси и нафталенилокси.
Термин «арилтио» в настоящем документе означает арильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через атом серы. Типовые примеры арилтио включают, но не ограничены ими, фенилтио и нафталенилтио.
Термин «карбонил» в настоящем документе означает -C(O)- группу.
Термин «карбокси» в настоящем документе означает -C(O)OH группу.
Термин «карбокси(C1-C6)алкокси» в настоящем документе означает карбоксигруппу, как определено в настоящем документе, присоединенную к основной молекулярной группе через (C1-C6)алкоксигруппу, как определено в настоящем документе.
Термин «карбокси(C1-C6)алкил» в настоящем документе означает карбоксигруппу, как определено в настоящем документе, присоединенную к основной молекулярной группе через (C1-C6)алкильную группу, как определено в настоящем документе.
Термин «циано» в настоящем документе означает -CN группу.
Термин «(C3-C8)циклоалкил» в настоящем документе означает насыщенную циклическую углеводородную группу, содержащую от 3 до 8 атомов углерода, примеры (C3-C8)циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил.
Термин «(C3-C8)циклоалкил(C1-C6)алкокси» в настоящем документе означает (C3-C8)циклоалкильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через (C1-C6)алкоксигруппу, как определено в настоящем документе.
Термин «(C3-C8)циклоалкил(C1-C6)алкил» в настоящем документе означает (C3-C6)циклоалкильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через (C1-C6)алкильную группу, как определено в настоящем документе. Типовые примеры (C3-C8)циклоалкил(C1-C6)алкила включают, но не ограничены ими, циклопропилметил, 2-циклобутилэтил, циклопентилметил, циклогексилметил и 4-циклогептилбутил.
Термин «(C3-C8)циклоалкил(C1-C6)алкилтио» в настоящем документе означает (C3-C8)циклоалкил(C1-C6)алкильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через атом серы.
Термин «(C3-C8)циклоалкилокси» в настоящем документе означает (C3-C8)циклоалкильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через атом кислорода, как определено в настоящем документе. Типовые примеры (C3-C8)циклоалкилокси включают, но не ограничены ими, циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси, циклогептилокси и циклооктилокси.
Термин «(C3-C8)циклоалкилтио» в настоящем документе означает (C3-C8)циклоалкильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через атом серы, как определено в настоящем документе. Типовые примеры (C3-C8)циклоалкилтио включают, но не ограничены ими, циклопропилтио, циклобутилтио, циклопентилтио, циклогексилтио, циклогептилтио и циклооктилтио.
Термин «формил» в настоящем документе означает -C(O)H группу.
Термин «гало» или «галоген» в настоящем документе означает -Cl, -Br, -I или -F.
Термин «гало(C1-C6)алкокси» в настоящем документе означает, по меньшей мере, один галоген, как определено в настоящем документе, присоединенный к основной молекулярной группе через (C1-C6)алкоксигруппу, как определено в настоящем документе. Типовые примеры гало(C1-C6)алкокси включают, но не ограничены ими, хлорметокси, 2-фторэтокси, трифторметокси и пентафторэтокси.
Термин «гало(C1-C6)алкил» в настоящем документе означает, по меньшей мере, один галоген, как определено в настоящем документе, присоединенный к основной молекулярной группе через (C1-C6)алкильную группу, как определено в настоящем документе. Типовые примеры гало(C1-C6)алкила включают, но не ограничены ими, хлорметил, 2-фторэтил, трифторметил, пентафторэтил и 2-хлор-3-фторпентил.
Термин «гало(C1-C6)алкилтио» в настоящем документе означает гало(C1-C6)алкильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через атом серы. Типовые примеры гало(C1-C6)алкилтио включают, но не ограничены ими, трифторметилтио.
Термин «(5-6-членный)гетероарил» в настоящем документе означает 5 или 6-членный моноциклический гетероарил. 5-членное кольцо состоит из двух двойных связей и одной, двух, трех или четырех атомов азота и/или, необязательно, одного атома кислорода или серы. 6-членное кольцо состоит из трех двойных связей и одной, двух, трех или четырех атомов азота. 5- или 6-членный гетероарил соединен с исходной молекулой через любой атом углерода или любой атом азота, содержащийся в гетероариле. Типовые примеры моноциклического гетероарила включают, но не ограничены ими, фурил, имидазолил, изоксазолил, изотиазолил, оксадиазолил, оксазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, пиразолил, пирролил, тетразолил, тиадиазолил, тиазолил, тиенил, триазолил и триазинил.
Термин «(5-6-членный)гетероарил(C1-C6)алкокси» в настоящем документе означает (5-6-членный)гетероарил, как определено в настоящем документе, присоединенный к основной молекулярной группе через (C1-C6)алкоксигруппу, как определено в настоящем документе. Типовые примеры гетероарил(C1-C6)алкокси включают, но не ограничены ими, фур-3-илметокси, 1H-имидазол-2-илметокси, 1H-имидазол-4-илметокси, 1-(пиридин-4-ил)этокси, пиридин-3-илметокси, 6-хлорпиридин-3-илметокси, пиридин-4-илметокси, (6-(трифторметил)пиридин-3-ил)метокси, (6-(циано)пиридин-3-ил)метокси, (2-(циано)пиридин-4-ил)метокси, (5-(циано)пиридин-2-ил)метокси, (2-(хлор)пиридин-4-ил)метокси, пиримидин-5-илметокси, 2- (пиримидин-2-ил)пропокси, тиен-2-илметокси и тиен-3-илметокси.
Термин «(5-6-членный)гетероарил(C1-C6)алкил» в настоящем документе означает (5-6-членный)гетероарил, как определено в настоящем документе, присоединенный к основной молекулярной группе через (C1-C6)алкильную группу, как определено в настоящем документе. Типовые примеры гетероарил(C1-C6)алкила включают, но не ограничены ими, фур-3-илметил, 1H-имидазол-2-илметил, 1H-имидазол-4-илметил, 1-(пиридин-4-ил)этил, пиридин-3-илметил, 6-хлорпиридин-3-илметил, пиридин-4-илметил, (6-(трифторметил)пиридин-3-ил)метил, (6-(циано)пиридин-3-ил)метил, (2-(циано)пиридин-4-ил)метил, (5-(циано)пиридин-2-ил)метил, (2-(хлор)пиридин-4-ил)метил, пиримидин-5-илметил, 2-(пиримидин-2-ил)пропил, тиен-2-илметил и тиен-3-илметил.
Термин «(5-6-членный)гетероарил(C1-C6)алкилтио» в настоящем документе означает (5-6-членный)гетероарил(C1-C6)алкильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через атом серы. Типовые примеры гетероарил(C1-C6)алкилтио включают, но не ограничены ими, фур-3-илметилтио, 1H-имидазол-2-илметилтио, 1H-имидазол-4-илметилтио, пиридин-3-илметилтио, 6-хлорпиридин-3-илметилтио, пиридин-4-илметилтио, (6-(трифторметил)пиридин-3-ил)метилтио, (6-(циано)пиридин-3-ил)метилтио, (2-(циано)пиридин-4-ил)метилтио, (5-(циано)пиридин-2-ил)метилтио, (2-(хлор)пиридин-4-ил)метилтио, пиримидин-5-илметилтио, 2-(пиримидин-2-ил)пропилтио, тиен-2-илметилтио и тиен-3-илметилтио.
Термин «(5-6-членный)гетероарилокси» в настоящем документе означает (5-6-членный)гетероарил, как определено в настоящем документе, присоединенный к основной молекулярной группе через атом кислорода. Типовые примеры гетероарилокси включают, но не ограничены ими, фур-3-илокси, 1H-имидазол-2-илокси, 1H-имидазол-4-илокси, пиридин-3-илокси, 6-хлорпиридин-3-илокси, пиридин-4-илокси, (6-(трифторметил)пиридин-3-ил)окси, (6-(циано)пиридин-3-ил)окси, (2-(циано)пиридин-4-ил)окси, (5-(циано)пиридин-2-ил)окси, (2-(хлор)пиридин-4-ил)окси, пиримидин-5-илокси, пиримидин-2-илокси, тиен-2-илокси и тиен-3-илокси.
Термин «(5-6-членный)гетероарилтио» в настоящем документе означает (5-6-членным)гетероарил, как определено в настоящем документе, присоединенный к основной молекулярной группе через атом серы. Типовые примеры гетероарилтио включают, но не ограничены ими, пиридин-3-илтио и хинолин-3-илтио.
Термин «(4-7-членный)гетероцикл» или «гетероциклический» в настоящем документе означает 4, 5, 6 или 7-членное кольцо, содержащее, по меньшей мере, один гетероатом, независимо выбранный из группы, состоящей из O, N и S. 4-членное кольцо содержит 1 гетероатом, выбранный из группы, состоящей из O, N и S. 5-членное кольцо содержит ноль или одну двойную связь и один, два или три гетероатома, выбранных из группы, состоящей из O, N и S. 6- или 7-членное кольцо содержит ноль, одну или две двойные связи и один, два или три гетероатома, выбранных из группы, состоящей из O, N и S. Гетероцикл соединен с исходной молекулярной группой через любой атом углерода или любой атом азота, содержащийся в гетероцикле. Типовые примеры гетероцикла включают, но не ограничены ими, азетидинил, азепанил, азиридинил, диазепанил, 1,3-диоксанил, 1,3-диоксоланил, 1,3-дитиоиланил, 1,3-дитианил, имидазолинил, имидазолидинил, изотиазолинил, изотиазолидинил, изоксазолинил, изоксазолидинил, морфолинил, оксадиазолинил, оксадиазолидинил, оксазолинил, оксазолидинил, пиперазинил, пиперидинил, пиранил, пиразолинил, пиразолидинил, пирролинил, пирролидинил, тетрагидрофуранил, тетрагидротиенил, тиадиазолинил, тиадиазолидинил, тиазолинил, тиазолидинил, тиоморфолинил, 1,1-диоксидотиоморфолинил (тиоморфолин сульфон), тиопиранил и тритианил.
Термин «(4-7-членный)гетероцикл(C1-C6)алкокси» в настоящем документе означает (4-7-членный)гетероцикл, как определено в настоящем документе, присоединенный к основной молекулярной группе через (C1-C6)алкоксигруппу, как определено в настоящем документе.
Термин «(4-7-членный)гетероцикл(C1-C6)алкил» в настоящем документе означает (4-7-членный)гетероцикл, как определено в настоящем документе, присоединенный к основной молекулярной группе через (C1-C6)алкильную группу, как определено в настоящем документе.
Термин «(4-7-членный)гетероцикл(C1-C6)алкилтио» в настоящем документе означает (4-7-членный)гетероцикл(C1-C6)алкильную группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через атом серы.
Термин «(4-7-членный)гетероциклокси» в настоящем документе означает (4-7-членный)гетероцикл, как определено в настоящем документе, присоединенный к основной молекулярной группе через атом кислорода. Типовые примеры гетероарилокси включают, но не ограничены ими, пиридин-3-илокси и пиримидин-2-илокси.
Термин «(4-7-членный)гетероциклтио» в настоящем документе означает (4-7-членный)гетероцикл, как определено в настоящем документе, присоединенный к основной молекулярной группе через атом серы. Типовые примеры гетероарилтио включают, но не ограничены ими, пиридин-3-илтио и пиримидин-2-илтио.
Термин «гидрокси» в настоящем документе означает -OH группу.
Термин «гидрокси(C1-C6)алкокси» в настоящем документе означает, по меньшей мере, одну гидрокси группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через (C1-C6)алкоксигруппу, как определено в настоящем документе. Типовые примеры гидрокси(C1-C6)алкокси включают, но не ограничены ими, гидроксиметокси, 2-гидроксиэтокси, 3-гидроксипропокси, 2,3-дигидроксипентокси и 2-этил-4-гидроксигептокси.
Термин «гидрокси(C1-C6)алкил» в настоящем документе означает, по меньшей мере, одну гидроксигруппу, как определено в настоящем документе, присоединенную к основной молекулярной группе через (C1-C6)алкильную группу, как определено в настоящем документе. Типовые примеры гидрокси(C1-C6)алкила включают, но не ограничены ими, гидроксиметил, 2-гидроксиэтил, 3-гидроксипропил, 2,3-дигидроксипентил и 2-этил-4-гидроксигептил.
Термин «меркапто» в настоящем документе означает -SH группу.
Термин «нитро» в настоящем документе означает -NO2 группу.
Термин «тио(C1-C6)алкил» в настоящем документе означает атом серы, присоединенный к основной молекулярной группе через (C1-C6)алкильную группу, как определено в настоящем документе. Типовые примеры тио(C1-C6)алкила включают, но не ограничены ими, тиометил, 2-тиоэтил, 3-тиопропил и 4-тиобутил.
Термин «-NRARB» в настоящем документе означает две группы, RA и RB присоединенные к основной молекулярной группе через атом азота. RA и RB каждый независимо является водородом, (C1-C6)алкилом или (C1-C6)алкилкарбонилом. Типовые примеры -NRARB включают, но не ограничены ими, амино, метиламино, диметиламино, ацетиламино и ацетилметиламино.
Термин «NRARB(C1-C6)алкокси» в настоящем документе означает NRARB группу, присоединенную к исходной молекулярной группе через (C1-C6)алкоксигруппу.
Термин «NRARB(C1-C6)алкил» в настоящем документе означает NRARB группу, присоединенную к исходной молекулярной группе через (C1-C6)алкильную группу.
Термин «(NRARB)карбонил» в настоящем документе означает NRARB группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через карбонильную группу, как определено в настоящем документе. Типовые примеры (NRARB)карбонила включают, но не ограничены ими, аминокарбонил, (метиламино)карбонил, (диметиламино)карбонил и (этилметиламино)карбонил.
Термин «-NRCRD» в настоящем документе означает две группы, RC и RD, присоединенные к основной молекулярной группе через атом азота. RC и RD каждый независимо является водородом, (C1-C6)алкилом или (C1-C6)алкилкарбонилом. Типовые примеры -NRCRD включают, но не ограничены ими, амино, метиламино, диметиламино, ацетиламино и ацетилметиламино.
Термин «NRCRD(C1-C6)алкокси» в настоящем документе означает NRCRD группу, присоединенную к основной молекулярной группе через (C1-C6)алкоксигруппу.
Термин «NRCRD(C1-C6)алкил» в настоящем документе означает NRCRD группу, присоединенную к основной молекулярной группе через (C1-C6)алкильную группу.
Термин «(NRCRD)карбонил» в настоящем документе означает NRCRD группу, как определено в настоящем документе, присоединенную к основной молекулярной группе через карбонильную группу, как определено в настоящем документе.
Соединения по настоящему изобретению могут образовывать координативные связи бор-кислород после воздействия воды, спиртов (ROH, r является алкилом) и диолов (ROH, r является гидроксиалкилом), как показано на схеме А.
Схема A

Если атом бора ковалентно связан с атомом кислорода и координативно связан со вторым атомом кислорода, координативная связь и ковалентная связь могут взаимно превращаться или образовывать резонансный гибрид, представленный структурами (1), (2), (3) и (4) на Схеме A. Соединения настоящего изобретения после воздействия воды, спиртов и диолов могут существовать в виде нейтральных соединений, представленных соединениями (1)-(4), или в виде отрицательно заряженных соединений, изображенных соединениями (5) и (6), где R1, R2, R3, R4, R5, R6, R7, R9, R10 и p такие, как определены в разделе «Сущность изобретения» в настоящем документе. В дополнение к кислороду, бор может образовывать координативные связи с серой и азотом. Следует понимать, что настоящее изобретение охватывает соединения формулы (I), формулы (IA), формулы (IB) и формулы (IC), которые образуют координативные связи с кислородом, серой и азотом, включая, но не ограничиваясь ими, соединения (7)-(12). Подходящие противоионы включают, но не ограничены ими, литий, натрий, калий, аммоний, тетраметиламмоний, тетраэтиламмоний, метиламмоний, диметиламмоний, триметиламмоний, триэтиламмоний, диэтиламмоний, этиламмоний, кальций, магний и алюминий.
Соединения по настоящему изобретению могут образовывать кислород-связанные димеры после воздействия воды. Типовые димеры настоящего изобретения показаны на схеме B где R1, R2, R3, R4, R5, R6, R7, R9, R10 и p такие, как определены в разделе «Сущность изобретения» в настоящем документе.
Схема B

Следует понимать, что настоящее изобретение охватывает кислород-связанные димеры формулы (I), формулы (IA), формулы (IB) и формулы (IC), включая, но не ограничиваясь ими, бис((R)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)дибороновую кислоту и бис((S)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)дибороновую кислоту.
Соединения по настоящему изобретению также могут формировать ациклические и циклические тримеры при обработке водой. Типовые ациклические и циклические тримеры настоящего изобретения показаны на схеме C, где R1, R2, R3, R4, R5, R6, R7, R9, R10 и p такие, как определены в разделе «Сущность изобретения» в настоящем документе.
Схема C


Следует понимать, что настоящее изобретение охватывает ациклические и циклические тримеры формулы (I), формулы (IA), формулы (IB) и формулы (IC), включая, но не ограничивая ими, ациклические тримеры (13) и (14), показанные на схеме C, и циклические тримеры (2R,2'R,2''R)-3,3',3''-(1,3,5,2,4,6-триоксатриборинан-2,4,6-триил)трис(2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропан-1-ол) и (2S,2'S,2''S)-3,3',3''-(1,3,5,2,4,6- триоксатриборинан -2,4,6-триил)трис(2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропан-1-ол).
Настоящее изобретение охватывает ангидриды формулы (I), формулы (IA), формулы (IB) и формулы (IC), образованные в условиях дегидратации. Типовые ангидриды настоящего изобретения показаны на схеме D, где R1, R2, R3, R4, R5, R6, R7, R9, R10 и p такие, как определены в разделе «Сущность изобретения» в настоящем документе.
Схема D

Следует понимать, что настоящее изобретение охватывает ангидриды формулы (I), формулы (IA), формулы (IB) и формулы (IC), включая, но не ограничиваясь ими, 5,5'-((4S,4'S)-оксибис(1,2-оксаборолан-2,4-диил))бис(3-(4-метокси-3-пропоксифенил)пиридин) и 5,5'-((4R,4'R)-оксибис(1,2-оксаборолан-2,4-диил))бис(3-(4-метокси-3-пропоксифенил)пиридин).
Соединения по настоящему изобретению могут образовывать поли- или многовалентные соединения, собранные из одного соединения или из более чем одного соединения по настоящему изобретению. Полимерные конструкции могут быть «гомополимерными», состоящими из одинаковых или родственных конструкций, или «гетерополимерными», состоящими из множества различных конструкций.
Настоящее изобретение охватывает соединения, которые могут быть составлены с эксципиентами, так что один или несколько эксципиентов взаимодействуют с соединением по настоящему изобретению, давая одно-, поли- или многовалентные соединения, включая, например, такие соединения, как сложные эфиры, димеры, тримеры, тетрамеры и высшие гомологи. Например, соединения формулы (I), формулы (IA), формулы (IB) и формулы (IC) могут образовывать сложные эфиры бора с пропиленгликолем или гексиленгликолем в соответствующих условиях. Типовые эфиры настоящего изобретения показаны на схеме E, где R1, R2, R3, R4, R5, R6, R7, R9, R10 и p такие, как определены в разделе «Сущность изобретения» в настоящем документе.
Схема E


Следует понимать, что настоящее изобретение охватывает сложные эфиры бора формулы (I), формулы (IA), формулы (IB) и формулы (IC), включая, но не ограничиваясь ими, 1-гидроксипропан-2-ил гидро-((R)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, (S)-1-гидроксипропан-2-ил гидро-((R)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, (R)-1-гидроксипропан-2-ил гидро-((R)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, 2-гидроксипропил гидро-((R)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, (S)-2-гидроксипропил гидро-((R)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, (R)-2-гидроксипропил гидро-((R)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, 4-гидрокси-2-метилпентан-2-ил гидро-((R)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, (S)-4-гидрокси-2-метилпентан-2-ил гидро-((R)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, (R)-4-гидрокси-2-метилпентан-2-ил гидро-((R)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, 4-гидрокси-4-метилпентан-2-ил гидро-((R)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, (S)-4-гидрокси-4-метилпентан-2-ил гидро-((R)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, (R)-4-гидрокси-4-метилпентан-2-ил гидро-((R)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, 1-гидроксипропан-2-ил гидро-((S)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, (S)-1-гидроксипропан-2-ил гидро-((S)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, (R)-1-гидроксипропан-2-ил гидро-((S)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, 2-гидроксипропил гидро-((S)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, (S)-2-гидроксипропил гидро-((S)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, (R)-2-гидроксипропил гидро-((S)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, 4-гидрокси-2-метилпентан-2-ил гидро-((S)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, (S)-4-гидрокси-2-метилпентан-2-ил гидро-((S)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, (R)-4-гидрокси-2-метилпентан-2-ил гидро-((S)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, 4-гидрокси-4-метилпентан-2-ил гидро-((S)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат, (S)-4-гидрокси-4-метилпентан-2-ил гидро-((S)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат и (R)-4-гидрокси-4-метилпентан-2-ил гидро-((S)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)боронат.
Настоящее изобретение также охватывает циклические сложные эфиры, образованные взаимодействием формулы (I), формулы (IA), формулы (IB) и формулы (IC) с некоторыми диолами, которые включают, но не ограничены ими, пропиленгликоль и гексиленгликоль. Типичные циклические эфиры показаны на схеме F, где R1, R2, R3, R4, R5, R6, R7, R9, R10 и p такие, как определены в разделе «Сущность изобретения» в настоящем документе.
Схема F

Следует понимать, что настоящее изобретение охватывает циклические сложные эфиры бора формулы (I), формулы (IA), формулы (IB) и формулы (IC), включая, но не ограничиваясь ими, (2R)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-3-(4-метил-1,3,2-диоксаборолан-2-ил)пропан-1-ол, (R)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-3-((S)-4-метил-1,3,2-диоксаборолан-2-ил)пропан-1-ол, (R)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-3-((R)-4-метил-1,3,2-диоксаборолан-2-ил)пропан-1-ол, (2R)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-3-(4,4,6-триметил-1,3,2-диоксаборинан-2-ил)пропан-1-ол, (R)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-3-((S)-4,4,6-триметил-1,3,2-диоксаборинан-2-ил)пропан-1-ол, (R)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-3-((R)-4,4,6-триметил-1,3,2-диоксаборинан-2-ил)пропан-1-ол, (2S)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-3-(4-метил-1,3,2-диоксаборолан-2-ил)пропан-1-ол, (S)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-3-((S)-4-метил-1,3,2-диоксаборолан-2-ил)пропан-1-ол, (S)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-3-((R)-4-метил-1,3,2-диоксаборолан-2-ил)пропан-1-ол, (2S)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-3-(4,4,6-триметил-1,3,2-диоксаборинан-2-ил)пропан-1-ол, (S)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-3-((S)-4,4,6-триметил-1,3,2-диоксаборинан-2-ил)пропан-1-ол и (S)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-3-((R)-4,4,6-триметил-1,3,2-диоксаборинан-2-ил)пропан-1-ол.
Соли, сложные эфиры, ангидриды, димеры и тримеры, представленные на схемах A-F, представляют собой пролекарства, которые могут гидролизоваться до исходных соединений в водных условиях, которые включают условия in vivo, реформирующие оксабороловое кольцо.
Соединения по настоящему изобретению можно использовать в форме фармацевтически приемлемых солей, полученных из неорганических или органических кислот. Под «фармацевтически приемлемой солью» подразумевают те соли, которые в рамках обоснованного медицинского заключения подходят для использования в контакте с тканями людей и животных без чрезмерной токсичности, раздражения, аллергической реакции и подобных и которые соизмеримы с разумным соотношением польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области. Например, S. M. Berge et al. подробно описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 1977, 66:1-19, в настоящем документе, включенном в качестве ссылки. Соли могут быть получены in situ во время окончательного выделения и очистки соединения по настоящему изобретению или отдельно путем взаимодействия свободного основания (основного азота) с подходящей органической или неорганической кислотой. Типичные кислотно-аддитивные соли включают, но не ограничены ими ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат (изетионат), лактат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, фосфат, глутамат, бикарбонат, п-толуолсульфонат и ундеканоат. Также основные азотсодержащие группы могут быть кватернизованы такими агентами, как низшие алкилгалогениды, такие как метил-, этил-, пропил- и бутилхлориды, -бромиды и -иодиды; диалкилсульфаты, такие как диметил-, диэтил-, дибутил- и диамилсульфаты; галогениды с длинной цепью, такие как децил-, лаурил-, миристил- и стеарилхлориды, -бромиды и -йодиды; арилалкилгалогениды, такие как бензил- и фенэтилбромиды и другие. Таким образом, получают растворимые или диспергируемые в воде или масле продукты. Примеры кислот, которые могут применяться для образования фармацевтически приемлемых кислотно-аддитивных солей, включают такие неорганические кислоты, как хлористоводородная кислота, бромистоводородная кислота, серная кислота и фосфорная кислота, и такие органические кислоты, как щавелевая кислота, малеиновая кислота, янтарная кислота и лимонная кислота.
Соединения по настоящему изобретению могут существовать в виде стереоизомеров, где присутствуют асимметрические или хиральные центры. Эти стереоизомеры являются «R» или «S» в зависимости от конфигурации заместителей вокруг хирального атома углерода. Термины «R» и «S», применяемые в настоящем документе, являются конфигурациями, как определено в IUPAC 1974 Recommendations for Section E, Fundamental Stereochemistry, Pure Appl. Chem., 1976, 45: 13-30. В частности, стереохимия в точке присоединения Y и Z, как показано в формулах (I), (IA) и (IB), может независимо быть либо (R), либо (S), если специально не указано иное. Энантиомеры настоящего изобретения, обозначенные (R), (S) или *, по существу не содержат другой энантиомер. «По существу не содержит» означает, что энантиомерный избыток составляет более примерно 90%, предпочтительно, более примерно 95% и более предпочтительно, более примерно 99%. В контексте энантиомерного избытка термин «примерно» означает ±1,0%. Символ * обозначает хиральный атом углерода либо в (R), либо в (S) стереохимии в зависимости от конфигурации заместителей вокруг хирального атома углерода. Настоящее изобретение рассматривает различные стереоизомеры и их смеси, которые конкретно включены в объем этого изобретения. Стереоизомеры включают энантиомеры и смеси энантиомеров. Индивидуальные стереоизомеры соединений настоящего изобретения могут быть получены синтетически из коммерчески доступных исходных материалов, которые содержат асимметричные или хиральные центры, или путем приготовления рацемических смесей с последующим разделением, хорошо известным специалистам в данной области техники. Эти способы разделения включают, но не ограничены ими, (1) присоединение хирального вспомогательного вещества к смеси энантиомеров, разделение полученной смеси диастереомеров перекристаллизацией или хроматографией и выделение оптически чистого продукта из вспомогательного вещества или (2) прямое разделение смеси оптических энантиомеров на хиральных хроматографических колонках.
Соединения по настоящему изобретению, не обозначенные (R), (S) или *, могут существовать в виде рацематов (т.е. 50% (R) и 50% (S)) или в виде смеси двух энантиомеров, где один энантиомер находится в избытке. Например, энантиомерные смеси могут включать (R) энантиомер в 51% и (S) энантиомер в 49% или наоборот, или любую комбинацию (R) и (S), отличную от рацемической смеси 50% (R) и 50% (S). Настоящее изобретение включает рацематы и энантиомерные смеси соединений по настоящему изобретению.
Соединения по настоящему изобретению могут существовать в различных стабильных конформационных формах, которые могут быть разделены. Торсионная асимметрия из-за ограниченного вращения вокруг асимметричной одинарной связи, например, из-за пространственных препятствий или деформации кольца, может допускать разделение различных конформеров. Соединения по настоящему изобретению дополнительно включают каждый конформационный изомер соединения формулы (I), (IA), (IB) и (IC) и их смеси.
Таутомеры могут существовать в соединениях по настоящему изобретению, и конкретно включены в объем настоящего изобретения. Термин «таутомер» в настоящем документе означает сдвиг протона от одного атома молекулы к другому атому той же самой молекулы, где два или более структурно различных соединения находятся в равновесии друг с другом. Соединения по настоящему изобретению могут существовать в виде таутомеров. Настоящее изобретение рассматривает таутомеры из-за сдвигов протонов от одного атома к другому атому одной и той же молекулы с образованием двух или более различных соединений, находящихся в равновесии друг с другом.
Соединения по настоящему изобретению могут быть выделены и использованы per se или в форме их фармацевтически приемлемых солей. В соответствии с настоящим изобретением, соединения с несколькими основными атомами азота могут образовывать соли с различным числом эквивалентов («экв.») кислоты. Практикующим специалистам будет понятно, что все такие соли входят в объем настоящего изобретения.
Соединения по настоящему изобретению могут существовать в более чем одной кристаллической форме. Полиморфы соединений формулы (I), (IA), (IB) и (IC) и их солей (включая сольваты и гидраты) составляют часть настоящего изобретения и могут быть получены кристаллизацией соединения настоящего изобретения в различных условиях. Например, используя разные растворители или разные смеси растворителей для перекристаллизации; кристаллизации при разных температурах; различные режимы охлаждения, от очень быстрого до очень медленного охлаждения во время кристаллизации. Полиморфы также могут быть получены нагреванием или плавлением соединения настоящего изобретения с последующим постепенным или быстрым охлаждением. Присутствие полиморфов может быть определено с помощью спектроскопии ядерного магнитного резонанса (ЯМР) с твердотельным датчиком, инфракрасной (ИК) спектроскопии, дифференциальной сканирующей калориметрии, порошковой рентгеновской дифракции или других подобных методов.
Это изобретение также включает меченые изотопами соединения, которые идентичны соединениям, описанным формулами (I), (IA), (IB) и (IC), но из-за того факта, что один или несколько атомов заменены атомом, имеющим атомную массу или массовое число, отличающиеся от атомной массы или массового числа, обычно встречающегося в природе. Примеры изотопов, которые могут быть включены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, серы, хлора, йода и фтора, такие как 2H, 3H, 13C, 14C, 15N, 18O, 17O, 35S, 36Cl, 125I, 129I, 18F и 19F, соответственно. Определенные меченые изотопами соединения настоящего изобретения, например, в которые включены радиоактивные изотопы, такие как 3H и 14C, применяют в анализа распределения лекарственного средства и/или субстрата в ткани. Тритированные (т.е., 3H) и углерод-14 (т.е., 14C), изотопы особенно предпочтительны благодаря простоте их получения и определяемости. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий (т.е., 2H), может дать определенные терапевтические преимущества, возникающие в результате большей метаболической стабильности, например, увеличенный период полувыведения in vivo или уменьшенные требования к дозировке, и, следовательно, может быть предпочтительным в некоторых обстоятельствах. Меченые изотопами соединения по настоящему изобретению, как правило, можно получить, выполняя процедуры, описанные на схемах и/или в примерах ниже, путем замены легко доступным изотопно меченным реагентом реагента, не меченого изотопами.
В частности, настоящее изобретение включает дейтерированные соединения формулы (I), (IA), (IB) и (IC). Любой из атомов водорода, содержащихся в соединениях по настоящему изобретению, можно заменить на дейтерий. Типовые примеры дейтерированных соединений настоящего изобретения включают, но не ограничены ими, соединения, перечисленные ниже, где D является дейтерием.
 .
.
Все патенты, заявки на патенты и ссылки на литературу, цитируемые в описании, полностью включены в настоящий документ в качестве ссылки.
Соединения по настоящему изобретению были поименованы Chemdraw Professional версии 15,0 или 16,0 или им были даны наименования, которые, по-видимому, соответствовали номенклатуре Chemdraw.
Настоящее изобретение включает соединения формул (I), (IA), (IB) и (IC), полученные с помощью процессов синтеза или метаболических процессов. Получение соединений изобретения с помощью метаболических процессов включает процессы, происходящие в организме человека или животного (in vivo), или процессы, происходящие in vitro.
Настоящее изобретение также рассматривает фармацевтически активные метаболиты, образованные путем биотрансформации in vivo соединений формул (I), (IA), (IB) и (IC). Термин фармацевтически активный метаболит, используемый в настоящем документе, относится к соединению, образованному in vivo биотрансформацией соединений формулы (I), (IA), (IB) и (IC). Подробное обсуждение биотрансформации представлено в (Goodman and Gilman’s, The Pharmacological Basis of Therapeutics, seventh edition, MacMillan Publishing Company, New York, NY, (1985)).
Соединения по настоящему изобретению могут быть синтезированы способами синтеза, которые включают процессы, аналогичные тем, которые хорошо известны в области химии, особенно в свете описания, содержащегося в настоящем документе. Исходные материалы обычно доступны из коммерческих источников или могут быть легко получены с использованием способов, хорошо известных специалистам в данной области техники (например, получены способами, обычно описанными в Louis F. Fieser and Mary Fieser, Reagents for Organic Synthesis, v. 1-19, Wiley, New York (1967-1999 ed.) или Beilsteins Handbuch der organischen Chemie, 4, Aufl. ed. Springer-Verlag, Berlin, включая приложения (также доступные через онлайн базу данных Beilstein)).
В иллюстративных целях схемы реакций, изображенные ниже, обеспечивают возможные пути синтеза соединений по настоящему изобретению, а также промежуточных соединений для получения соединений настоящего изобретения. Более подробное описание отдельных стадий реакции представлено в разделе «Примеры» ниже. Специалисты в данной области поймут, что для синтеза соединений по изобретению можно использовать другие пути синтеза. Хотя конкретные исходные материалы и реагенты изображены на схемах и обсуждаются ниже, другие исходные материалы и реагенты могут быть заменены, чтобы обеспечить множество производных и/или условий реакции. Кроме того, многие соединения, полученные описанными ниже способами, могут быть дополнительно модифицированы в свете этого раскрытия с использованием общепринятой химии, хорошо известной специалистам в данной области.
При получении соединений по настоящему изобретению может потребоваться защита удаленных функциональных групп, таких как карбоновые кислоты, амины и/или гидроксигруппы промежуточных соединений. Потребность в такой защите будет варьироваться в зависимости от характера удаленной функциональности и условий способов получения. Подходящие аминозащитные группы (NH-PG) включают ацетил, трифторацетил, трет-бутоксикарбонил (BOC), бензилоксикарбонил (Cbz) и 9-флуоренилметиленоксикарбонил (Fmoc). Аналогично, «гидрокси-защитная группа» относится к заместителю гидроксигруппы, который блокирует или защищает функциональную гидроксигруппу. Подходящие гидрокси-защитные группы (O-PG) включают, например, аллил, ацетил, силил, бензил, пара-метоксибензил, тритил и подобные. Защитные группы карбоновой кислоты включают алкиловые эфиры, такие как метил, этил, пропил и трет-бутил. Необходимость в такой защите легко определяется специалистом в данной области техники. Общее описание защитных групп и их использования см. T. W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991.
Реакции проводят в растворителе, подходящем для используемых реагентов и материалов и подходящем для осуществляемых превращений. Специалистам в области органического синтеза будет понятно, что функциональность, присутствующая в молекуле, должна соответствовать предлагаемым превращениям. Иногда это потребует решения изменить порядок стадий синтеза или выбрать одну конкретную схему процесса по сравнению с другой, чтобы получить желаемое соединение по настоящему изобретению.
Также будет понятно, что еще одним важным фактором при планировании любого пути синтеза в этой области является разумный выбор защитной группы, используемой для защиты реакционноспособных функциональных групп, присутствующих в соединениях, описанных в настоящем изобретении. Авторитетным документом, описывающим множество альтернатив для обученного практикующего специалиста, является Greene and Wuts (Protective Groups In Organic Synthesis, Wiley and Sons, 1999). Подходящие защитные группы включают, но не ограничены ими, защитные группы трет-бутоксикарбонил (BOC), триметилсилилэтансульфонамид (SES), бензилоксикарбонил (CBZ) и бензил (Bn). Защитная группа BOC может быть удалена обработкой кислотой, такой как трифторуксусная кислота или концентрированная хлористоводородная кислота, и защитная группа SES может быть удалена с помощью фторида, такой как фторид цезия или фторид тетрабутиламмония. Защитные группы CBZ и Bn могут быть удалены каталитическим гидрированием. Дополнительные подходящие защитные группы для гидрокси заместителей включают, но не ограничены ими, защитные группы трет-бутилдиметилсилил (TBDMS), тетрагидропиранил (THP) или изопропил (i-Pr). Защитные группы TBDMS и THP могут быть удалены обработкой кислотой, такой как уксусная кислота или хлористоводородная кислота, в то время как защитная группа i-Pr может быть удалена трихлоридом алюминия.
Выделение и очистка соединений и промежуточных соединений, описанных в настоящем документе, при желании может быть осуществлена с помощью любой подходящей процедуры разделения или очистки, такой как, например, фильтрация, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, толстослойная хроматография, препаративная жидкостная хроматография низкого, среднего или высокого давления или комбинация этих процедур. Конкретные иллюстрации подходящих процедур разделения и выделения можно найти в приведенных ниже примерах в настоящем документе. Однако также могут быть использованы другие эквивалентные процедуры разделения или выделения.
Соединения по изобретению могут быть получены любым способом, известным в данной области техники, для получения соединений аналогичной структуры. В частности, соединения по настоящему изобретению могут быть получены с помощью процедур, описанных со ссылкой на схемы, которые следуют ниже, или с помощью конкретных способов, описанных в примерах, или с помощью способов, аналогичных любому из них.
Квалифицированный специалист поймет, что экспериментальные условия, изложенные в следующих схемах, иллюстрируют подходящие условия для осуществления показанных превращений и что может быть необходимо или желательно изменить точные условия, используемые для получения соединений формулы (I), (IA), (IB) и (IC). Также будет понятно, что может быть необходимо или желательно выполнить преобразования в порядке, отличном от того, который описан в схемах, или изменить одно или несколько превращений, чтобы получить желаемое соединение по изобретению.
Производные формул (I), (IA), (IB) и (IC) могут быть получены с помощью процедур, описанных в общих способах, представленных ниже, или путем их обычных модификаций. Настоящее изобретение также включает один или несколько из этих способов получения производных формул (I), (IA), (IB) и (IC) в дополнение к любым новым промежуточным соединениям, используемым в настоящем документе. Специалист в данной области техники поймет, что следующие реакции можно нагревать термически или под воздействием микроволнового излучения.
Приведенные ниже пути, включая указанные в примерах и примерах получения, иллюстрируют способы синтеза соединений формул (I), (IA), (IB) и (IC). Специалист в данной области техники поймет, что соединения по изобретению и промежуточные соединения к ним могут быть получены способами, отличными от тех, которые конкретно описаны в настоящем документе, например, путем адаптации способов, описанных в настоящем документе, например, способами, известными в данной области техники. Подходящими руководствами по синтезу, взаимопревращениям функциональных групп, использованию защитных групп и т. д. являются, например: «Comprehensive Organic Transformations» by RC Larock, VCH Publishers Inc. (1989); Advanced Organic Chemistry» by J. March, Wiley Interscience (1985); «Designing Organic Synthesis» by S Warren, Wiley Interscience (1978); «Organic Synthesis - The Disconnection Approach» by S Warren, Wiley Interscience (1982); «Guidebook to Organic Synthesis» by RK Mackie и DM Smith, Longman (1982); «Protective Groups in Organic Synthesis» by TW Greene и PGM Wuts, John Wiley and Sons, Inc. (1999); и «Protecting Groups» by PJ Kocienski, Georg Thieme Verlag (1994); и любые обновленные версии указанных стандартных работ.
Кроме того, специалист в данной области техники поймет, что на любой стадии синтеза соединений по изобретению может быть необходимо или желательно защитить одну или несколько чувствительных групп, чтобы предотвратить нежелательные побочные реакции. В частности, может быть необходимо или желательно защитить группы спирта, амино или карбоновой кислоты. Защитные группы, используемые при получении соединений по изобретению, могут применяться обычным способом. См., например, описанные в 'Greene’s Protective Groups in Organic Synthesis' by Theodora W Greene and Peter GM Wuts, fifth edition, (John Wiley и Sons, 2014), включенный в настоящий документ в качестве ссылки, где также описаны способы удаления таких групп.
В общих способах синтеза, приведенных ниже, если не указано иное, заместители имеют значения, указанные выше со ссылкой на соединения формулы (I) выше. Если даны соотношения растворителей, они даны по объему, если не указано иное.
Соединения по изобретению могут быть получены любым способом, известным в данной области техники, для получения соединений аналогичной структуры. В частности, соединения по настоящему изобретению могут быть получены с помощью процедур, описанных со ссылкой на схемы, которые следуют ниже, или с помощью конкретных способов, описанных в примерах, или с помощью способов, аналогичных любому из них.
Специалист в данной области техники поймет, что экспериментальные условия, изложенные в следующих схемах, иллюстрируют подходящие условия для осуществления показанных превращений, и что может быть необходимо или желательно изменить точные условия, используемые для получения соединений формулы (I).
Согласно первому способу, соединения формулы (1D) (где R1, R2, R3, R4, R5, R6, R7, R9, R10 и p такие, как определены в разделе «Сущность изобретения» в настоящем документе и v=0, 1, 2, 3, 4, 5) могут быть получены из соединения формулы (II) и (III) как показано на схеме 1.
Схема 1

На схеме 1, соединения формулы (II), где R14 является подходящей защитной группой (предпочтительно, TBS), превращают в соединение формулы (III), где R15 является бороновой кислотой (предпочтительно) или 4,4,5,5-тетраметил-1,3,2-диоксабороланом (Bpin) обработкой подходящим гидроборирующим источником, таким как катехолборан или бис(пинаколато)дибор, в присутствии подходящего катализатора (бис(1,5-циклооктадиен)ди-µ-метоксидииридия(I) или димера (1,5-циклооктадиен)(метокси)иридия(I)) и лиганда (этиленбис(дифенилфосфина), в подходящем растворителе, таким как ДХЭ или ТГФ, при подходящей температуре (15°C - 70°C). Специалист в данной области техники также знает, что альтернативные методы гидроборирования алкенов достижимы с использованием альтернативных реагентов, растворителей и температур. Соединение формулы (III) превращают в соединение формулы (1D) в водных кислых условиях, обрабатывая подходящей кислотой (уксусной или хлористоводородной) при подходящей температуре. Специалисту в данной области техники хорошо понятно, что соединение формулы (III) получают и выделяют, как описано выше, или получают in situ без выделения в стратегии последовательной реакции, дающей соединение (1D). В случае, когда соединения формулы (III) и (1D) приводят к присутствию хирального центра, специалисту в данной области техники хорошо понятно, что отдельные энантиомеры могут быть получены с использованием подходящего способа разделения, такого как ЖХВД или СЖХ-хроматография, чтобы получить оба (+) и (-) энантиомера соединения формулы (III) и (1D). Специалисту в данной области техники хорошо понятно, что индивидуальный энантиомер соединения формулы (III) и (1D) получают и выделяют, как описано выше, или выделяют с использованием альтернативной методики разделения, такой как ЖХВД или СЖХ, с использованием подходящей хиральной неподвижной фазы, элюируемой подходящей подвижной фазой, которая определена как необходимая для выделения требуемых энантиомеров.
Согласно второму способу, соединения формулы (1E) или (1F) могут быть получены из формулы (II) как показано на схеме 2.
Схема 2

На схеме 2, соединения формулы (1E) или (1F) могут быть получены по методике, изображенной на схеме 1, с применением подходящих хиральных лигандов, таких как (S, S)-[2-(4'-и-пропилоксазолин-2-ил)ферроцинил]дифенилфосфин или (R, R)-[2-(4'-и-пропилоксазолин-2-ил)ферроцинил]дифенилфосфин, с получением хирального соединения формулы (IV). Специалист в данной области техники знает, что в стратегиях хирального гидроборирования можно использовать альтернативные хиральные лиганды, катализаторы, источники бора, комбинации растворителей и температур. Специалисту в данной области техники хорошо понятно, что соединение формулы (IV) может быть получено и выделено, как описано выше, или получено in situ без выделения в последовательной реакции, дающей соединение формулы (1E) или (1F). Специалист в данной области техники также знает, что соединения формулы (1E) или (1F) могут быть дополнительно обогащены с помощью методов кристаллизации или хиральной хроматографии (ЖХВД или СЖХ) с использованием подходящей хиральной стационарной фазы, элюируя подходящей подвижной фазой, которая определена как необходимая для выделения требуемых энантиомеров.
Согласно третьему способу, соединения формулы (1G) могут быть получены из формулы (II) как показано на схеме 3.
Схема 3

На схеме 3, соединения формулы (II) превращают в соединения формулы (V) обработкой галогенирующим агентом, таким как трибромид пиридиния, в подходящем растворителе, таком как ДХМ, при подходящей температуре, такой как 0°C. Специалист в данной области техники также знает, что альтернативные способы специфического введения подходящей галогеновой группы, такой как Br, проводят с применением альтернативных реагентов, растворителей и температур. Соединения формулы (VI) могут быть синтезированы этим способом или реакцией соединения формулы (V) с применением DBU с подходящим растворителем, таким как ДХМ, при подходящей температуре, такой как 25°C. Соединения формулы (VI) могут быть превращены в соединения формулы (VII) (где R15=Bpin) с применением условий борилирования Мияура. Типовые условия получения сложного эфира бороната включают Pd(dppf)Cl2∙ДХМ и ацетат калия с биспинаколатобором в 1,4-диоксане при подходящей температуре, такой как 55°C. Соединение формулы (VII) может быть превращено в соединение формулы (1G) в водных кислых условиях, обрабатывая подходящей кислотой (уксусной или хлористоводородной) при подходящей температуре.
Соединения формулы (II) могут быть получены из соединений формул (VIII), (IX), (X) и (XI) как показано на схеме 4.
Схема 4

На схеме 4, соединения формулы (X), где R17 является хлором, бромом или йодом, могут быть получены из соединений формулы (VIII) и (IX) с применением подходящей реакции металлорганического кросс-сочетания, такой как реакция кросс-сочетания Сузуки, которое предшествует, при необходимости, получение бороновой кислоты или сложного эфира. Типовые условия кросс-сочетания Сузуки включают палладиевый катализатор, содержащий подходящие фосфиновые лиганды, в присутствии неорганического основания, в водном диоксане или метаноле, при повышенных температурах, либо термически, либо при микроволновом облучении. Предпочтительные условия включают Pd(OAc)2, Pd(dppf)Cl2 или Pd(PPh3)4 с карбонатом натрия, цезия или калия, в водном диоксане или метаноле при температуре от комнатной температуры до 120°C. Специалист в данной области техники знает, что могут применяться реакции металлорганического кросс-сочетания, включающие альтернативные комбинации металлов, катализаторов, лигандов, оснований, растворителей и температур. Типовые условия получения сложного боронового эфира включают Pd(dppf)Cl2 и ацетат калия с биспинаколатодибором с соединением формулы (VIII), где R16=хлор, бром или йод, в диоксане при кипении с обратным холодильником. Соединения формулы (VIII) также могут быть получены коммерчески или синтезированы специалистом в данной области техники согласно литературе или по аналогии со способами, описанными в настоящем документе.
Соединения формулы (II) могут быть получены из соединений формулы (X) и (XI), (где R18=бороновая кислота или Bpin) реакцией металлорганического кросс-сочетания, аналогичной тем, которые описаны выше. Специалист в данной области техники знает, что также могут применяться альтернативные стратегии реакции металлорганического кросс-сочетания, включающие альтернативные сочетания металлов, катализаторов, лигандов, оснований, растворителей и температур. Предпочтительные условия Сузуки включают Pd(dppf)Cl2 с карбонатом калия и ацетатом калия в диоксане от комнатной температуры до 120°C.
Альтернативно, соединения формулы (II) могут быть получены из соединений формул (VIII), (IX), (XI) и (XII), в обратной последовательности к той, которая указана на схеме 4, показанной на схеме 5.
Схема 5

Соединения формулы (XII) могут быть получены из соединений формулы (XI) (где R18=бороновая кислота или пинакол) и (IX) (где R17 является хлором, бромом или йодом) с применением реакции металлорганического кросс-сочетания, как описано на схеме 4. Предпочтительные условия включают Pd(dppf)Cl2 с карбонатом калия в водном диоксане при температуре от комнатной температуры до 120°C. Соединения формулы (XI) могут быть синтезированы специалистами в данной области техники согласно литературе или по аналогии со способами, описанными в настоящем документе. Соединения формулы (XII) могут быть превращены в соединения формулы (II) с применением способа, подобного тому, который описан ранее на схеме 4, реакции кросс-сочетания Сузуки, которой может предшествовать, при необходимости, получение бороновой кислоты или сложного эфира. Специалист в данной области техники знает, что также могут применяться альтернативные стратегии реакции металлорганического кросс-сочетания, включающие альтернативные сочетания металлов, катализаторов, лигандов, оснований, растворителей и температур.
Согласно шестому способу, соединения формулы (1H) могут быть получены из формулы (XIII) и (XIV) как показано на схеме 6.
Схема 6
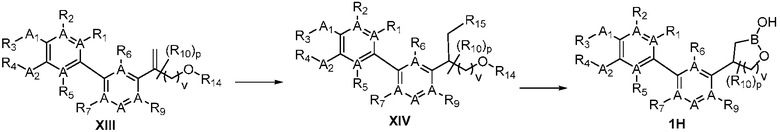
Соединения формулы (1H), где A является углеродом или азотом, могут быть получены аналогично соединениям формулы (1D), (1E) или (1F), как описано на схемах 1-5. Специалисту в данной области техники хорошо понятно, что отдельные энантиомеры могут быть получены с применением подходящего способа разделения, такого как ЖХВД или СЖХ хроматография, с получением обоих (+) и (-) энантиомеров соединения формулы (XIV) и (1H). Также специалисту в данной области техники хорошо понятно, что отдельный энантиомер соединения формулы (XIV) и (1H) получают и выделяют как описано выше или выделяют с применением альтернативного метода разделения, такого как ЖХВД или СЖХ, с применением подходящего элюирования хиральной неподвижной фазы подходящей подвижной фазой, как определено по необходимости для выделения требуемых энантиомеров. Дополнительно, соединения формулы (1H), в которых центральное кольцо замещено замещенным 5-членным гетероциклом (представленным Y в формуле (1)), также могут быть синтезированы аналогичным образом специалистом в данной области техники.
Соединения и способы настоящего изобретения будут лучше поняты в связи со следующими примерами, которые предназначены для иллюстрации, а не ограничения объема изобретения, определенного в прилагаемой формуле изобретения.
В описании схем и в следующих ниже примерах использовались следующие сокращения: Ac является ацетилом; AcOH является уксусной кислотой; Ac2O является уксусным ангидридом; катализатором Адама является оксид платины (IV); Br2 является бромом; n-BuLi является н-бутиллитием; °C являются градусами Цельсия; CDCl3 является дейтеро-хлороформом; CD3OD является дейтерометанолом; CO2 является диоксидом углерода; Cs2CO3 является карбонатом цезия; δ является химическим сдвигом; DAST является тетрафторборатом N, N-диэтиламино-S, S-дифторсульфиния; DBU является 1,8-диазабицикло[5,4,0]ундец-7-еном; ДХЭ является 1,2-дихлорэтаном; ДХМ является дихлорметаном или метиленхлоридом; ДЭА является диэтиламином; ДМАП является 4-диметиламинопиридином; ДМФ является диметилформамидом; ДМСО является диметилсульфоксидом; ДМСО-d6 является дейтеродиметилсульфоксидом; Et2O является диэтиловым эфиром; EtOAc является этилацетатом; EtOH является этанолом; Et3N является триэтиламином; Fe является железом; g является граммом; HCl является хлористоводородной кислотой; HCO2H является муравьиной кислотой; ГМТА является гексаметилентетрамином; ЖХВД является жидкостной хроматографией высокого давления; H2 является водородом; H2O является водой; h является часом; Hr является часов; Гц является герцем; ИПС является изопропиловым спиртом; ИПАм: является изопропиламином; [Ir(COD)Cl]2 является дихлоридом бис(1,5циклооктадиен)дииридия(I); [Ir(COD)OMe]2 является димером (1,5-циклолктадиен)(метокси)иридия(I); K2CO3 является карбонатом калия; K3PO4 является трехосновным фосфатом калия; KBr является бромидом калия; KMnO4 является перманганатом калия; KOAc является ацетатом калия; L является литром; ЖХМС является жидкостной хроматографией масс спектрометрией; ДАЛ является диизопропиламидом лития; LiHMDS является бис(триметилсилил)амидом лития; LiOH является моногидратом гидроксида лития; ТМПЛ является тетраметилпиперидином лития; m является молярным; м-ХПБК является мета-хлорпероксибензойной кислотой; MeCN является ацетонитрилом; MeOH является метанолом; MeNH2 является метиламином; мг является миллиграммом; MgSO4 является сульфатом магния; МГц является мегагерцем; мин является минутами; мл является миллилитром; мм является миллиметром; ммоль является миллимолем; моль является молем; МС m/z является пиком масс спектра; МТБЭ является трет-бутил метиловым эфиром; MsCl является мезилхлоридом; NaBH4 является боргидридом натрия; Na2CO3 является карбонатом натрия; NaOH является гидроксидом натрия; NaOMe является метоксидом натрия; Na2SO4 является сульфатом натрия; NBS является N-бромсукцинимидом; NH3 является аммиаком; NH4Cl является хлоридом аммония; NH2OH∙HCl является гидрохлоридом гидроксиламина; NH4OH является гидроксидом аммония; нМ является наномолярным; PCl5 является пентахлоридом фосфора; Pd/C является палладием на угле; Pd(dppf)Cl2 является [1,1’-бис(дифенилфосфино)ферроцен]дихлорпалладием(II); Pd(dppf)Cl2.ДХМ является [1,1’-бис(дифенилфосфино)ферроцен]дихлорпалладием(II), комплексом с дихлорметаном; Pd(dppf)-tBu является [1,1’-бис(и-т-бутилфосфино)ферроцен]дихлорпалладием (II); Pd(OAc)2 является ацетатом палладия; PPh3 является трифенилфосфином; пет. эфир является петролейным эфиром; pH является водородным ионом; Pin2B2 является бис(пинаколато)дибором; PinBO-iPr является 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксабороланом; ф./кв.д. является фунтом на квадратный дюйм; ч./млн. является частями на миллион; POCl3 является оксихлоридом фосфора; PrOH является 1-пропанолом; PtO2 является оксидом платины (IV); кт является комнатной температурой, ВУ является временем удержания; SEM-Cl является 2-(триметилсилил)этоксиметилхлоридом; СЖХ является сверхкритической жидкостной хроматографией; ТБС является т-бутилдиметилсилилом; ТБС-Cl является хлоридом т-бутилдиметилсилила; tBu3P является три-т-бутилфосфина; ТФК является трифторуксусной кислотой; ТФУА является трифторуксусным ангидридом; TiCl4 является тетрахлоридом титана; TfO является трифторметансульфонилом; Tf2O является трифторметансульфоновым ангидридом; pTsOH является п-толуолсульфоновой кислотой; Турбо Гриньяр является раствором комплекса хлорид изопропилмагния-хлорид лития; Xantphos является 4,5-бис(дифенилфосфино)-9,9-диметилксантеном; XPhos-Pd-G2 является хлор(2-дициклогексилфосфино-2′,4′,6′-триизопропил-1,1′-бифенил)[2-(2′-амино-1,1′-бифенил)]палладием(II).
1H и 19F спектр ядерного магнитного резонанса (ЯМР) во всех случаях соответствует предложенным структурам. Характеристические химические сдвиги (δ) даны в частях на миллион вниз от тетраметилсилана (для 1H-ЯМР) и вверх от трихлорфторметана (для 19F ЯМР) с применением обычных сокращений для обозначения основных пиков: т.е. с, синглет; д, дублет; т, триплет; кв, квартет; дд, дублет дублетов; дт, дублет триплетов; тд, триплет дублетов; м, мультиплет; ш, широкий. Следующие сокращения применяют для обычных растворителей: CDCl3, дейтерохлороформ; ДМСО-d6, дейтеродиметилсульфоксид; и CD3OD, дейтерометанол. Если применимо, таутомеры могут быть записаны в ЯМР данных; и некоторые обмениваемые протоны могут быть невидимы.
Масс спектр, МС (m/z), записывают с применением либо ионизации электрораспылением (ИЭР),либо химической ионизации при атмосферном давлении (ХИАД).
В соответствующих случаях и, если не указано иное, предоставленные m/z данные относятся к изотопам 19F, 35Cl, 79Br и 127I.
Если используют препаративную ТСХ или колоночную хроматографию (диоксид кремния), специалист в данной области может выбрать любую комбинацию подходящих растворителей для очистки желаемого соединения.
Удельное вращение, основанное на уравнении [α] = (100.α)/(l.c), представлено в виде безразмерных чисел, где концентрация c дана в г/100 мл и длина пути l дана в дециметрах. Единицы удельного вращения, (гр..мл)/г. дм) являются неявными и не включаются в полученное значение.
Ниже приведены методы аналитической и препаративной хроматографии, используемые для анализа и очистки соединений по изобретению.
Способы препаративной СЖХ
Преп СЖХ Способ A: Колонка: Chiralpak IC-H, 250 мм x 30 мм, 5µ; Подвижная фаза - Изократные условия: CO2/EtOH, 60/40 (об./об.); Скорость потока: 65 мл/мин
Преп СЖХ Способ B: Колонка: Lux Amylose-1 250 мм x 30 мм, 5µ; Подвижная фаза - Изократные условия: CO2/MeOH+0,2% (7N аммиак в MeOH) 80/20 (об./об.); Скорость потока: 150 мл/мин
Преп СЖХ Способ C: Колонка: Chiralpak IC-H, 250 мм x 50 мм, 5µ; Подвижная фаза - Изократные условия: CO2/ИПС 85/15 (об./об.); Скорость потока: 250 мл/мин
Преп СЖХ Способ D: Колонка: Chiralcel OJ, 250 мм X 30 мм, 5µ; Подвижная фаза - Изократные условия: CO2/ИПС, 65/35 (об./об.); Скорость потока: 50 мл/мин)
Преп СЖХ Способ E: Колонка: Daicel Chiralpak AD, 250 мм X 30 мм, 5µ; Подвижная фаза - Изократные условия: CO2/EtOH (0,1% NH4OH), 60/40 (об./об.); Скорость потока: 50 мл/мин
Преп СЖХ Способ F: Колонка: Daicel Chiralpak IC, 250 мм x 30 мм, 5µ; Подвижная фаза - Изократные условия: CO2/EtOH (0,1% NH4OH), 60/40 (об./об.); Скорость потока: 200 мл/мин)
Преп СЖХ Способ G: Колонка: Daicel Chiralpak AD, 250 мм x 50 мм, 10 µ; Подвижная фаза - Изократные условия: CO2/EtOH (0,1% NH4OH), 55/45 (об./об.); Скорость потока: 200 мл/мин
Преп СЖХ Способ H: Колонка: Chiralpak IC-H, 250 мм X 30 мм, 5µ; Подвижная фаза - Изократные условия: CO2/EtOH (0,1% NH4OH), 75/25 (об./об.); Скорость потока: 200 мл/мин
Преп СЖХ Способ I: Колонка: Chiralpak IC, 250 мм x 30 мм, 10µ; Подвижная фаза - Изократные условия: CO2/EtOH (0,1% NH4OH), 60/40 (об./об.); Скорость потока: 60,0 мл/мин
Преп СЖХ Способ J: Колонка: Chiralpak IC 250 мм x 30 мм, 10µ; Подвижная фаза - Изократные условия: CO2/EtOH (0,1% NH4OH), 80/20 (об./об.); Скорость потока: 60 мл/мин
Преп СЖХ Способ K: Колонка: Chiralpak AD, 250 мм x 30 мм, 5µ; Подвижная фаза - Изократные условия: CO2/MeOH (0,1% NH4OH), 75/25 (об./об.); Скорость потока: 50,0 мл/мин
Преп СЖХ Способ L: Колонка: Chiralpak AD, 250 мм x 30 мм, 10µ; Подвижная фаза - Изократные условия: CO2/MeOH (0,1% NH4OH), 75/25 (об./об.); Скорость потока: 200,0 мл/мин
Преп СЖХ Способ M: Колонка: Chiralpak IC, 250 мм x 30 мм, 5µ; Подвижная фаза - Изократные условия: CO2/EtOH (0,1% NH4OH), 55/45 (об./об.); Скорость потока: 50,0 мл/мин
Преп СЖХ Способ N: Колонка: Chiralpak IC, 250 мм x 30 мм, 5µ; Подвижная фаза - Изократные условия: CO2/EtOH (0,1% NH4OH), 75/25 (об./об.); Скорость потока: 60,0 мл/мин
Преп СЖХ Способ O: Колонка: Daicel Chiralpak AD, 250 мм x 50 мм, 10µ; Подвижная фаза - Изократные условия: CO2/MeOH, 60/40 (об./об.); Скорость потока: 200 мл/мин
Преп СЖХ Способ P: Колонка: Chiralcel OJ-H, 250 мм x 30 мм, 5µ; Подвижная фаза - Изократные условия: CO2/EtOH (0,1% NH4OH), 85/15 (об./об.); Скорость потока: 50 мл/мин
Преп СЖХ Способ Q: Колонка: Daicel Chiralpak AD, 250 мм x 30 мм, 5µ; Подвижная фаза - Изократные условия: CO2/ИПС (0,1% NH4OH), 75/25 (об./об.); Скорость потока: 60 мл/мин
Преп СЖХ Способ R: Колонка: Chiral Technologies AD-H, 250 мм x 21 мм, 5µ; Подвижная фаза - Изократные условия: CO2/MeOH (0,2% NH4OH), 80/20 (об./об.); Скорость потока: 75 мл/мин
Преп СЖХ Способ S: Колонка: Princeton PPU, 250 мм x 30 мм, 5µ; Подвижная фаза - Изократные условия: CO2/MeOH, 80/20 (об./об.); Скорость потока: 80 мл/мин
Способы аналитической СЖХ
Аналитическая СЖХ Способ A: Колонка: Chiralpak IC, 250 мм x 4,6 мм, 5µ; Подвижная фаза A: CO2, Подвижная фаза B: EtOH (0,05% изопропиламин); Градиент: A:B=65:35; Скорость потока: 2,5 мл/мин
Аналитическая СЖХ Способ B: Колонка: Lux Amylose-1, 250 мм x 4,6 мм, 5µ; Подвижная фаза A: CO2, Подвижная фаза B: MeOH (0,2% MeNH2); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (1,0 мин, 95%A, 5%B), (9,0 мин, 40%A, 60%B), (10 мин, 95%A, 5%B); Скорость потока: 3,0 мл/мин
Аналитическая СЖХ Способ C: Колонка: Chiralpak IC-3, 150 мм x 4,6 мм, 3µ; Подвижная фаза A: CO2, Подвижная фаза B: ИПС (0,05% ДЭА); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (5,5 мин, 60%A, 40%B), (8,5 мин, 60%A, 40%B), (10 мин, 95%A, 5%B), Скорость потока: 2,5 мл/мин
Аналитическая СЖХ Способ D: Колонка: Chiralpak AD-3, 150 мм x 4,6 мм, 3µ; Подвижная фаза A: CO2, Подвижная фаза B: EtOH (0,05% ДЭА); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (5,5 мин, 60%A, 40%B), (8,5 мин, 60%A, 40%B), (10 мин, 95%A, 5%B), Скорость потока: 2,5 мл/мин
Аналитическая СЖХ Способ E: Колонка: Chiralpak IC-3, 150 мм x 4,6 мм, 3µ; Подвижная фаза A: CO2, Подвижная фаза B: EtOH (0,05% ДЭА); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (5,5 мин, 60%A, 40%B), (8,5 мин, 60%A, 40%B), (10 мин, 95%A, 5%B), Скорость потока: 2,5 мл/мин
Аналитическая СЖХ Способ F: Колонка: Chiralpak AD-3, 50 мм x 3,0 мм, 3µ; Подвижная фаза - Изократные условия: CO2/EtOH (0,05% ДЭА), 60/40 (об./об.); Скорость потока: 2,0 мл/мин
Аналитическая СЖХ Способ G: Колонка: Chiralpak AD-3, 150 мм x 4,6 мм, 3µ; Подвижная фаза A: CO2, Подвижная фаза B: MeOH (0,05% ДЭА); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (5,0 мин, 60%A, 40%B), (7,5 мин, 60%A, 40%B), (10 мин, 95%A, 5%B), Скорость потока: 2,5 мл/мин
Аналитическая СЖХ Способ H: Колонка: Chiralcel OJ-3, 100 мм x 4,6 мм, 3µ; Подвижная фаза A: CO2, Подвижная фаза B: EtOH (0,05% ДЭА); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (5,0 мин, 60%A, 40%B), (7,5 мин, 60%A, 40%B), (8,5 мин, 95%A, 5%B), Скорость потока: 2,8 мл/мин
Аналитическая СЖХ Способ I: Колонка: Chiralpak IC-3, 150 мм x 4,6 мм, 3µ; Подвижная фаза A: CO2, Подвижная фаза B: EtOH; Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (5,5 мин, 60%A, 40%B), (8,5 мин, 60%A, 40%B), (10 мин, 95%A, 5%B), Скорость потока: 2,5 мл/мин
Аналитическая СЖХ Способ J: Колонка: Chiralpak AD-3, 150 мм x 4,6 мм, 3µ; Подвижная фаза A: CO2, Подвижная фаза B: EtOH (0,05% ДЭА); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (5,0 мин, 60%A, 40%B), (7,5 мин, 60%A, 40%B), (10 мин, 95%A, 5%B), Скорость потока: 2,5 мл/мин
Аналитическая СЖХ Способ K: Колонка: Chiral Technologies AD-H, 100 мм x 4,6 мм, 3µ; Подвижная фаза A: CO2, Подвижная фаза B: MeOH (0,2% NH4OH); Градиентное элюирование (время, %A, %B): (5 мин, 60%A, 40%B, [Скорость потока: 1,5 мл/мин
Аналитическая СЖХ Способ L: Колонка: ChiralCel OJ-H, 150 мм x 4,6 мм, 5µ; Подвижная фаза A: CO2, Подвижная фаза B: EtOH (0,05% ДЭА); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (5,0 мин, 60%A, 40%B), (8,5 мин, 60%A, 40%B), (10 мин, 95%A, 5%B), Скорость потока: 2,5 мл/мин
Аналитическая СЖХ Способ M: Колонка: Chiral Tech IG, 250 мм x 4,6 мм, 5µ; Подвижная фаза A: CO2, Подвижная фаза B: MeOH (0,2% 7N NH3 в MeOH); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (1,0 мин, 95%A, 5%B), (9,0 мин, 40%A, 60%B), (9,5 мин, 40%A, 60%B), (10 мин, 95%A, 5%B), Скорость потока: 3,0 мл/мин
Аналитическая СЖХ Способ N: Колонка: Chiralcel OJ-H 250 мм x 4,6 мм, 5µ; Подвижная фаза A: CO2, Подвижная фаза B: ИПС (0,05% ИПАм), Градиентное элюирование: B а A от 10% до 40% за 10 минут, Скорость потока: 2,5 мл/мин
Аналитическая СЖХ Способ O:Колонка: ChiralPak AY-3 150 мм × 4,6 мм, 3 µ; Подвижная фаза: A: CO2, Подвижная фаза B: Метанол (0,05% ДЭА); Градиентное элюирование: (время, %A, %B): (0 мин, 95%A, 5%B), (5,5 мин, 60%A, 40%B), (8,5 мин, 60%A, 40%B) (10 мин, 95%A, 5%B), Скорость потока: 2,5 мл/мин
Аналитическая СЖХ Способ P:Колонка: Chiralcel OJ-3 100 мм × 4,6 мм, 3 µ; Подвижная фаза: A: CO2, Подвижная фаза B: Метанол (0,05% ДЭА); Градиентное элюирование: (время, %A, %B): (0 мин, 95%A, 5%B), (5,5 мин, 60%A, 40%B), (7,5 мин, 60%A, 40%B) (10 мин, 95%A, 5%B), Скорость потока: 2,8 мл/мин
Аналитическая СЖХ Способ Q: Колонка: ChiralCel OD-3, 150 мм x 4,6 мм, 3µ; Подвижная фаза A: CO2, Подвижная фаза B: EtOH (0,05% ДЭА); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (5,0 мин, 60%A, 40%B), (5,5 мин, 95%A, 5%B), (7 мин, 95%A, 5%B), Скорость потока: 2,5 мл/мин
Аналитическая СЖХ Способ R: Колонка: Chiralpak AD-3, 100 мм x 4,6 мм, 3µ; Подвижная фаза - Изократные условия: CO2/EtOH (0,05% ДЭА), 60/40 (об./об.); Скорость потока: 2,08 мл/мин
Аналитическая СЖХ Способ S: Колонка: Chiral Technologies OJ-H, 100 мм x 4,6 мм, 5µ; Подвижная фаза - Изократные условия: CO2/EtOH (0,2% NH4OH), 95/5 (об./об.); Скорость потока: 3,0 мл/мин
Аналитическая СЖХ Способ T: Колонка: Chiralpak IC, 100 мм x 4,6 мм, 3µ; Подвижная фаза A: CO2, Подвижная фаза B: EtOH (0,05% ДЭА); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (0,5 мин, 95%A, 5%B) (4,5 мин, 60%A, 40%B), (7,0 мин, 60%A, 40%B), (9,5 мин, 95%A, 5%B), Скорость потока: 1,5 мл/мин
Аналитическая СЖХ Способ U: Колонка: Lux Amylose-2, 100 мм x 4,6 мм, 5µ; Подвижная фаза A: CO2, Подвижная фаза B: MeOH (0,2% NH4OH); Градиентное элюирование (время, %A, %B): (0 мин, 70%A, 30%B), (5,0 мин, 70%A, 30%B); Скорость потока: 1,5 мл/мин
Аналитическая СЖХ Способ V: Колонка: Chiral Technologies AD-H, 100 мм x 4,6 мм, 5µ; Подвижная фаза A: CO2, Подвижная фаза B: MeOH (0,2% Гидроксид аммония); Градиентное элюирование (время, %A, %B): (0 мин, 85%A, 15%B) (10 мин, 85%A, 15%B). Скорость потока: 1,5 мл/мин
Аналитическая СЖХ Способ W: Колонка: Chiral Tech IG, 250 мм x 4,6 мм, 5µ; Подвижная фаза A: CO2, Подвижная фаза B: EtOH; Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (1,0 мин, 95%A, 5%B), (9,0 мин, 40%A, 60%B), (9,5 мин, 40%A, 60%B), (10 мин, 95%A, 5%B), Скорость потока: 3,0 мл/мин
Аналитическая СЖХ Способ X: Колонка: ChiralPak AY, 150 мм x 4,6 мм, 3µ; Подвижная фаза A: CO2, Подвижная фаза B: EtOH (0,05% ДЭА); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (5,0 мин, 40%A, 60%B), (7,5 мин, 40%A, 60%B), (10 мин, 95%A, 5%B), Скорость потока: 2,5 мл/мин
Аналитическая СЖХ Способ Y: Колонка: Chiral Tech OJ-H, 100 мм x 4,6 мм, 5µ; Подвижная фаза A: CO2, Подвижная фаза B: MeOH (0,2% NH4OH); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (10 мин, 95%A, 5%B), Скорость потока: 1,5 мл/мин
Аналитическая СЖХ Способ Z: Колонка: Chiralcel OJ-3, 150 мм x 4,6 мм, 3µ; Подвижная фаза A: CO2, Подвижная фаза B: EtOH (0,05% ДЭА); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (5 мин, 60%A, 40%B), (7,5 мин, 60%A, 40%B), (10 мин, 95%A, 5%B), Скорость потока: 2,5 мл/мин
Аналитическая СЖХ Способ AA:Колонка: ChiralPak AD-3 100 мм × 4,6 мм, 3 µ; Подвижная фаза: A: CO2, Подвижная фаза B: MeOH (0,05% ДЭА); Градиентное элюирование: (время, %A, %B): (0 мин, 60%A, 40%B), Скорость потока: 2,8 мл/мин
Аналитическая СЖХ Способ BA: Колонка: Chiralpak IC-3, 150 мм x 4,6 мм, 3µ; Подвижная фаза A: CO2, Подвижная фаза B: ИПС (0,05% ДЭА); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (5 мин, 60%A, 40%B), (7,5 мин, 60%A, 40%B), (10 мин, 95%A, 5%B), Скорость потока: 2,5 мл/мин
Аналитическая СЖХ Способ CA: Колонка: Lux Cellulose 100 мм х 4,6 мм, 5 µ; Подвижная фаза: A: CO2, Подвижная фаза B: MeOH (0,2% NH4OH); Градиентное элюирование: (время, %A, %B): (0 мин, 70%A, 30%B), (5 мин, 70%A, 30%B), Скорость потока: 1,5 мл/мин
Аналитическая СЖХ Способ DA: Колонка: Lux Cellulose-2, 150 мм x 4,6 мм, 5µ; Подвижная фаза A: CO2, Подвижная фаза B: MeOH (0,05% ДЭА); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (5,0 мин, 60%A, 40%B), (8,5 мин, 60%A, 40%B), (10 мин, 95%A, 5%B), Скорость потока: 2,5 мл/мин
Аналитическая СЖХ Способ EA: Колонка: Chiralcel OJ-3, 150 мм x 4,6 мм, 3µ; Подвижная фаза - Изократные условия: CO2/EtOH (0,05% ДЭА), 60/40 (об./об.); Скорость потока: 2,5 мл/мин
Аналитическая СЖХ Способ FA: Колонка: ChiralPak AD-3, 250 мм x 4,6 мм, 5µ; Подвижная фаза A: CO2, Подвижная фаза B: EtOH (0,05% ИПАм); Градиентное элюирование (время, %A, %B): (0 мин, 65%A, 35%B), Скорость потока: 2,5 мл/мин
Аналитическая СЖХ Способ GA: Колонка: Chiral Tech IC, 250 мм x 4,6 мм, 5µ; Подвижная фаза A: CO2, Подвижная фаза B: ИПС (0,2% NH3 в MeOH); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (1 мин, 95%A, 5%B), (9 мин, 40%A, 60%B), (9,5 мин, 40%A, 60%B), (10 мин, 95%A, 5%B), Скорость потока: 2,5 мл/мин
Способы препаративной ЖХВД
Преп ЖХВД Способ A: Колонка: Xtimate C18, 150 мм x 25 мм, 5µ; Подвижная фаза A: вода (0,05% NH4OH об./об.), Подвижная фаза B MeCN; B%: 18%-58%, 12 мин; Скорость потока: 25 мл/мин
Преп ЖХВД Способ B: Колонка: Phenomenex XB-C18, 250 мм x 21,2 мм, 5µ; Подвижная фаза A: вода (0,1% HCO2H), Подвижная фаза B: MeCN (0,1% HCO2H); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (1,5 мин, 95%A, 5%B), (10,0 мин, 0%A, 100%B), (11 мин, 0%A, 100%B), (12,5 мин, 95%A, 5%B); Скорость потока: 27 мл/мин
Преп ЖХВД Способ C: Колонка: Waters Atlantis C18, 50 мм x 4,6 мм, 5µ; Подвижная фаза A: вода (0,05% ТФК), Подвижная фаза B: MeCN (0,05% ТФК); Градиентное элюирование (время, %A, %B): (0 мин, 95%A, 5%B), (4 мин, 5%A, 95%B), (5 мин, 5%A, 95%B); Скорость потока: 2 мл/мин
Преп ЖХВД Способ D: Колонка: Xtimate C18, 150 мм x 25 мм, 5µ; Подвижная фаза A: вода (0,05% гидроксид аммония), Подвижная фаза B: MeCN; B%: 25% до 65% за 12 мин, Скорость потока: 25 мл/мин
Преп ЖХВД Способ E: Колонка: Waters Xbridge, 150 мм x 25 мм, 5µ; Подвижная фаза A: вода (10 мМ NH4HCO3), Подвижная фаза B: MeCN; B%: 20%-50%, 12 мин
Преп ЖХВД Способ F: Колонка: Phenomenex luna C18, 250 мм x 80 мм, 10µ; Подвижная фаза A: вода (0,1%ТФК), Подвижная фаза B: MeCN; B%: 1%-25%, 20 мин
Преп ЖХВД Способ G: Колонка: Phenomenex Synergi Max-RP, 250 мм x 80 мм, 10µ; Подвижная фаза A: вода (0,1%ТФК), Подвижная фаза B: MeCN; B%: 10%-40%, 20 мин
Преп ЖХВД Способ H: Колонка: Boston Green ODS, 150 мм x 30 мм, 5µ; Подвижная фаза A: вода (0,225% HCO2H), Подвижная фаза B: MeCN; B%: 5%-53%, 11 мин, Скорость потока: 25 мл/мин
Преп ЖХВД Способ I: Колонка: Agela Durashell C18, 150 мм x 25 мм, 5µ; Подвижная фаза A: вода (0,225% HCO2H), Подвижная фаза B: MeCN; B%: 9%-39%, 12 мин, скорость потока: 25 мл/мин
Преп ЖХВД Способ J: Колонка: Phenomenex Gemini C18, 250 мм x 50 мм, 10µ; Подвижная фаза A: вода (0,05% гидроксид аммония), Подвижная фаза B: MeCN; B%: 5%-25%, 15 мин, скорость потока: 100 мл/мин
Преп ЖХВД Способ K: Колонка: Agela Durashell C18, 150 мм x 25 мм, 5µ; Подвижная фаза A: вода (0,225% HCO2H), Подвижная фаза B: MeCN; B%: 0%-32%, 11 мин, Скорость потока 25 мл/мин
Преп ЖХВД Способ L: Колонка: Xtimate C18, 150 мм x 25 мм, 5µ; Подвижная фаза A: вода (0,05% NH4OH об./об.), Подвижная фаза B: MeCN; B%: 15%-55%, 12 мин, Скорость потока: 25 мл/мин
Преп ЖХВД Способ M: Колонка: Agela Durashell 150 мм x 25 мм, 5µ; Подвижная фаза A: вода (0,05% NH4OH об./об.), Подвижная фаза B: MeCN; B%: 30%-60%, 2,5 мин, Скорость потока: 25 мл/мин
Преп ЖХВД Способ N: Колонка: Phenomenex luna C18, 250 мм x 80 мм, 10µ; Подвижная фаза A: вода (0,1% ТФК), Подвижная фаза B: MeCN; B%: 25%-55%, 20 мин, Скорость потока: 25 мл/мин
Преп ЖХВД Способ O: Колонка: Agela Durashell, 150 мм x 25 мм, 5µ; Подвижная фаза A: вода (0,05% NH4OH об./об.), Подвижная фаза B: MeCN; B%: 25%-55%, 10 мин, Скорость потока: 25 мл/мин
Преп ЖХВД Способ P: Колонка: Agela Durashell, 150 мм x 25 мм, 5µ; Подвижная фаза A: вода (0,05% NH4OH об./об.), Подвижная фаза B: MeCN; B%: 30%-60%, 10 мин, скорость потока: 25 мл/мин
Преп ЖХВД Способ Q: Колонка: Agela Durashell, 150 мм x 25 мм, 5µ; Подвижная фаза A: вода (0,05% NH4OH об./об.), Подвижная фаза B: MeCN; B%: 23%-53%, 10 мин, скорость потока: 25 мл/мин
Преп ЖХВД Способ R: Колонка: Phenomenex Gemini C18, 250 мм x 50 мм, 10µ; Подвижная фаза A: Вода (0,05% NH4OH об./об.), Подвижная фаза B: MeCN; Градиентное элюирование (время, %A, %B): (0 мин, 90%A, 10%B), (15 мин, 60%A, 40%B), (18 мин, 0%A, 100%B), Скорость потока: 110 мл/мин)
Преп ЖХВД Способ S: Колонка: Phenomenex Gemini C18, 250 мм x 50 мм, 10µ; Подвижная фаза A: Вода (0,05% NH4OH об./об.), Подвижная фаза B: MeCN; Градиентное элюирование (время, %A, %B): (0 мин, 80%A, 20%B), (15 мин, 60%A, 40%B), (18 мин, 0%A, 100%B), Скорость потока: 110 мл/мин
Преп ЖХВД Способ T: Колонка: Phenomenex Gemini C18, 250 мм x 50 мм, 10µ; Подвижная фаза A: Вода (0,05% NH4OH об./об.), Подвижная фаза B: MeCN; B%: 20%-40%, 15 мин, скорость потока 110 мл/мин
Преп ЖХВД Способ U: Колонка: Phenomenex Gemini C18, 250 мм x 50 мм, 10µ; Подвижная фаза A: Вода (0,05% NH4OH об./об.), Подвижная фаза B: MeCN; Градиентное элюирование (время, %A, %B): (0 мин, 75%A, 25%B), (15 мин, 55%A, 45%B), (18 мин, 0%A, 100%B), Скорость потока: 110 мл/мин
Преп ЖХВД Способ V: Колонка: Phenomenex Synergi Max-RP, 150 мм x 50 мм, 10µ; Подвижная фаза A: Вода (0,225% HCO2H), Подвижная фаза B: MeCN; B%: 0%-30%, 25 мин, скорость потока 120 мл/мин
Преп ЖХВД Способ W: Колонка: Xtimate C18, 150 мм x 25 мм, 5µ; Подвижная фаза A: Вода (0,05% NH4OH об./об.), Подвижная фаза B: MeCN; B%: 17%-57%, 12 мин, Скорость потока: 25 мл/мин
Преп ЖХВД Способ X: Колонка: Agela Durashell C18, 150 мм x 30 мм, 5µ; Подвижная фаза A: Вода, Подвижная фаза B: MeCN; Градиентное элюирование (время, %A, %B): (0 мин, 82%A, 18%B), (10 мин, 42%A, 58%B), (18 мин, 0%A, 100%B), Скорость потока: 25 мл/мин
Преп ЖХВД Способ Y: Колонка: Boston Green ODS, 150 мм x 30 мм, 5µ; Подвижная фаза A: вода (0,05% NH4OH об./об.), Подвижная фаза B: MeCN; B%: 45%-65%, 9 мин, Скорость потока 25 мл/мин
Преп ЖХВД Способ Z: Колонка: Phenomenex Gemini C18, 250 мм x 50 мм, 10µ; Подвижная фаза A: Вода (0,05% NH4OH об./об.), Подвижная фаза B: MeCN; Градиентное элюирование (время, %A, %B): (0 мин, 80%A, 20%B), (15 мин, 60%A, 40%B), (18 мин, 0%A, 100%B), Скорость потока: 110 мл/мин
Преп ЖХВД Способ AA: Колонка: Gemini C18, 15 мм x 21,2 мм, 5 µ; Подвижная фаза A: вода (0,1% HCO2H) Подвижная фаза B: MeCN (0,1% HCO2H); B% 25% - 35%; 25 мл/мин
Преп ЖХВД Способ BA: Колонка: Agela Durashell C18, 150 мм x 30 мм, 5µ; Подвижная фаза A: вода (0,05% NH4OH об./об.), Подвижная фаза B: MeCN; B%: 20%-55%, 15 мин, Скорость потока: 25 мл/мин
Преп ЖХВД Способ CA: Колонка: Phenomenex Gemini C18, 250 мм x 50 мм, 10µ; Подвижная фаза A: Вода (0,05% NH4OH об./об.), Подвижная фаза B: MeCN; Градиентное элюирование (время, %A, %B): (0 мин, 75%A, 25%B), (15 мин, 55%A, 45%B), (18 мин, 0%A, 100%B); Скорость потока: 110 мл/мин
Примеры
Пример получения 1: 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3,4-диметоксифенил)пиридин
К раствору 3-(3-((трет-бутилдиметилсилил)окси)-1-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)проп-1-ен-2-ил)-5-(3,4-диметоксифенил)пиридина (Пример получения 2, 1,6 г, 3,13 ммоль) в EtOAc (50 мл) добавляют Pd/C (0,5 г, 10% загрузка). Смесь перемешивают под H2 (5 ф./кв.д. изб) при 20°C в течение примерно 3 ч. Смесь фильтруют и концентрируют с получением 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3,4-диметоксифенил)пиридина (1,2 г), который применяют сразу без дальнейшей очистки. 1H ЯМР (CDCl3, 400 МГц): δ 8,69 (д, J=7,6 Гц, 1H), 8,48 (с, 1H), 7,78 (с, 1H), 7,32 (с, 1H), 7,18 (д, J=8,4 Гц, 1H), 7,12 (д, J=1,6 Гц, 1H), 7,04-7,01 (м, 1H), 4,15-4,20 (м, 1H), 4,00 (д, J=8,4 Гц, 6H), 3,75-3,79 (м, 1H), 2,10 (с, 12H), 1,31 (д, J=11,2 Гц, 9H), 1,15 (д, J=12,8 Гц, 1H), 0,88 (д, J=8,8 Гц, 1H), 0,01-0,02 (м, 6H). ЖХМС m/z=514 [MH]+.
Пример получения 2: 3-(3-((трет-бутилдиметилсилил)окси)-1-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)проп-1-ен-2-ил)-5-(3,4-диметоксифенил)пиридин

Раствор 3-(1-бром-3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3,4-диметоксифенил)пиридина (Пример получения 37, 0,83 г, 1,79 ммоль), Pd(dppf)Cl2∙ДХМ (73 мг, 89 мкмоль), KOAc (263 мг, 2,68 ммоль) и Pin2B2 (CAS 73183-34-3, 681 мг, 2,68 ммоль) в 1,4-диоксане (10 мл) нагревают до 55°C под N2 в течение 12 ч. Смесь концентрируют, и остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (3:1) с получением 3-(3-((трет-бутилдиметилсилил)окси)-1-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)проп-1-ен-2-ил)-5-(3,4-диметоксифенил)пиридина (900 мг, 98%). 1H ЯМР (CDCl3, 400 МГц): δ 8,74 (с, 1H), 8,71 (с, 1H), 8,03 (с, 1H), 7,13-7,16 (м, 1H), 7,09 (с, 1H), 6,98 (д, J=8,4 Гц, 1H), 5,90 (с, 1H), 4,97 (с, 2H), 3,96 (с, 3H), 3,94 (с, 3H). ЖХМС m/z=512 [MH]+.
Пример получения 3: 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-этокси-4-метоксифенил)пиридин

3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-этокси-4-метоксифенил)пиридин (3,8 г, 95%) получают по методике, аналогичной Примеру получения 1 с применением 3-(1-бром-3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-этокси-4-метоксифенил)пиридина (Пример получения 4, 4,0 г, 7,6 ммоль) который применяют без дальнейшей очистки.
Пример получения 4: 3-(3-((трет-бутилдиметилсилил)окси)-1-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)проп-1-ен-2-ил)-5-(3-этокси-4-метоксифенил)пиридин
3-(3-((трет-бутилдиметилсилил)окси)-1-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)проп-1-ен-2-ил)-5-(3-этокси-4-метоксифенил)пиридин (7,5 г, 97%) получают по методике, аналогичной Примеру получения 2 с применением 3-(1-бром-3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-этокси-4-метоксифенил)пиридина (Пример получения 38, 7,0 г, 14,6 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 8,69-8,73 (м, 2H), 8,03 (с, 1H), 7,14 (дд, J=2,0, 8,4 Гц, 1H), 7,10 (с, 1H), 6,97 (д, J=8,4 Гц, 1H), 5,90 (с, 1H), 4,97 (с, 2H), 4,18 (кв, J=7,2 Гц, 2H), 3,93 (с, 1H), 1,51 (т, J=7,2 Гц, 3H), 1,33 (с, 12H), 0,83 (с, 9H), 0,08 (с, 6H).
Пример получения 5: 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(4-метокси-3-пропоксифенил)пиридин

К раствору 3-(3-((трет-бутилдиметилсилил)окси)-1-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)проп-1-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина (Пример получения 8, 4,00 г, 7,41 ммоль) в EtOAc (100 мл) добавляют Pd/C (1,0 г, 10% загрузка) под N2. Смесь перемешивают под H2 (14 ф./кв.д. изб) при примерно 25°C в течение примерно 3 ч. Смесь фильтруют и концентрируют с получением 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина (3,44 г, 86%), который применяют без дальнейшей очистки.
Пример получения 6: (R)-(3-((трет-бутилдиметилсилил)окси)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)бороновой кислоты

Способ A:
К смеси 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина (Пример получения 50, 50,00 г, 120,9 ммоль), [Ir(COD)Cl]2 (CAS 12112-67-3, 2,03 г, 3,02 ммоль) и (S, S)-[2-(4'-и-пропилоксазолин-2-ил)ферроцинил]дифенилфосфина (CAS 163169-29-7, 3,20 г, 6,65 ммоль) добавляют безводный ТГФ (403 мл). Смесь перемешивают в течение примерно 15 мин при примерно 20°C под N2. Колбу охлаждают на бане с ледяной водой, пока температура раствора не станет примерно 0°C. Катехолборан (181,48 мл, 181 ммоль, 1,0 M в ТГФ) добавляют по каплям более 1 ч. После добавления катехолборана, колбу удаляют из охлаждающей бани и перемешивают при примерно 20°C в течение примерно 3 ч. Смесь гасят добавлением по каплям метанола (25 мл) при примерно 0°C (ледяная баня). Раствор удаляют с ледяной бани и перемешивают примерно 30 мин. Раствор концентрируют с получением (R)-(3-((трет-бутилдиметилсилил)окси)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)бороновой кислоты (88 г), которую применяют сразу, без дальнейшей очистки. ЖХМС m/z=460 [MH]+.
Способ B:
К раствору Турбо Гриньяр (180 мл, 117 ммоль, 1,3 M в ТГФ) добавляют 1,4-диоксан (19 мл) и перемешивают при примерно 20°C в течение примерно 1 ч. К смеси медленно добавляют раствор (R)-3-(1-((трет-бутилдиметилсилил)окси)-3-йодпропан-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина (Пример получения 42, 46,8 г, 86,5 ммоль) в безводном ТГФ (270 мл), который перемешивают при примерно 20°C в течение примерно 20 мин. Раствор триметилбората (96,4 мл, 865 ммоль) в ТГФ (107 мл) добавляют по каплям и перемешивают при примерно 20°C в течение примерно 30 мин. Смесь концентрируют и разделяют между водой (500 мл) и EtOAc (200 мл). Водный слой экстрагируют EtOAc (3×100 мл). Объединенные EtOAc слои промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют гептаном/EtOAc (80:20-0:100), затем EtOAc/MeOH (100:0-90:10) с получением (R)-(3-((трет-бутилдиметилсилил)окси)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)бороновой кислоты (29,0 г, 73%). 1H ЯМР (CD3OD, 400 МГц): δ 8,51 (д, J=2,3 Гц, 1H), 8,30 (д, J=2,0 Гц, 1H), 7,85 (шс, 1H), 7,14-7,17 (м, 2H), 7,03 (д, J=7,8 Гц, 1H), 4,00 (т, J=6,6 Гц, 2H), 3,85 (с, 3H), 3,70-3,80 (м, 2H), 3,27 (шс, 2H), 3,07-3,14 (м, 1H), 1,76-1,85 (м, 2H), 1,10-1,33 (м, 2H), 1,03 (т, J=7,81 Гц, 3H), 0,79 (с, 9H), -0,08 (д, J=12,9 Гц, 6H). ЖХМС m/z=460 [MH]+.
Пример получения 7: (S)-(3-((трет-бутилдиметилсилил)окси)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)бороновой кислоты

К смеси 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина (Пример получения 50, 1,0 г, 2,42 ммоль), [Ir(COD)Cl]2 (CAS 12112-67-3, 44,2 мг, 0,06 ммоль) и (R, R)-[2-(4'-и-пропилоксазолин-2-ил)ферроцинил]дифенилфосфина (CAS 541540-70-9, 58,2 мг, 0,12 ммоль) добавляют безводный ТГФ (8,1 мл). Смесь перемешивают при примерно 20°C в течение примерно 10 мин. Реакционную смесь охлаждают до примерно 0°C и катехолборан (6,04 мл, 6,04 ммоль, 1,0 M в ТГФ) добавляют по каплям. Реакционную смесь нагревают до примерно 20°C и перемешивают в течение примерно 8 ч. Реакционную смесь охлаждают до примерно 5°C и гасят MeOH. Смесь концентрируют и очищают колоночной хроматографией (диоксид кремния) и элюируют ДХМ/MeOH (100:0-90:10) с получением (S)-(3-((трет-бутилдиметилсилил)окси)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)бороновой кислоты (889 мг, 80%). 1H ЯМР (CD3OD, 400 МГц): δ 8,51 (д, J=2,3 Гц, 1H), 8,30 (д, J=2,0 Гц, 1H), 7,85 (шс, 1H), 7,14-7,17 (м, 2H), 7,03 (д, J=7,8 Гц, 1H), 4,00 (т, J=6,6 Гц, 2 H), 3,85 (с, 3H), 3,70-3,80 (м, 2H), 3,27 (шс, 2H), 3,07-3,14 (м, 1H), 1,76-1,85 (м, 2H), 1,10-1,33 (м, 2H), 1,03 (т, J=7,81 Гц, 3H), 0,79 (с, 9H), -0,08 (д, J=12,9 Гц, 6H). ЖХМС m/z=460 [MH]+.
Пример получения 8: 3-(3-((трет-бутилдиметилсилил)окси)-1-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)проп-1-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридин

3-(1-Бром-3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридин (Пример получения 39, 5,60 г, 11,37 ммоль), Pd(dppf)Cl2 (415,98 мг, 568,50 мкмоль), Pin2B2 (4,33 г, 17,06 ммоль) и KOAc (2,23 г, 22,74 ммоль) в диоксане (100 мл) нагревают до примерно 60°C под N2 в течение примерно 16 ч. Смесь фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (5:1) с получением 3-(3-((трет-бутилдиметилсилил)окси)-1-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)проп-1-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина (6,10 г, 99%). 1H ЯМР (CDCl3, 400МГц): δ 8,70-8,73 (м, 2H), 8,03 (т, J=2,0 Гц, 1H), 7,14 (дд, J=2,0, 8,4 Гц, 1H), 7,10 (с, 1H), 6,97 (д, J=8,4 Гц, 1H), 5,90 (с, 1H), 4,97 (с, 2H), 4,06 (т, J=6,8 Гц, 2H), 3,93 (с, 1H), 1,87-1,96 (м, 2H), 1,33 (с, 12H), 1,08 (т, J=7,6 Гц, 3H), 0,83 (с, 9H), 0,07 (с, 6H).
Пример получения 9: 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-изопропокси-4-метоксифенил)пиридин

Бис(1,5-циклооктадиен)ди-µ-метоксидииридий(I) (CAS 12148-71-9, 96 мг, 0,15 ммоль) и этиленбис(дифенилфосфин) (CAS, 1663-45-2, 116 мг, 0,29 ммоль) в безводном ДХЭ (10 мл) перемешивают в течение примерно 15 мин под N2 при примерно 15°C. 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-изопропокси-4-метоксифенил)пиридин (Пример получения 51, 600 мг, 1,45 ммоль) добавляют к смеси под N2 при примерно 15°C. После перемешивания в течение примерно 5 мин, 4,4,5,5-тетраметил-1,3,2-диоксаборолан (CAS 25015-63-9, 913 мг, 7,13 ммоль) добавляют при примерно 70°C и перемешивают в течение еще 15 мин. Реакционную смесь гасят MeOH и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир:EtOAc (100:0-85:15) с получением 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-изопропокси-4-метоксифенил)пиридина (750 мг, 96%). ЖХМС m/z=542 [MH]+.
Пример получения 10: 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-циклопропокси-4-метоксифенил)пиридин

3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-циклопропокси-4-метоксифенил)пиридин (750 мг, 95%) получают по методике, аналогичной Примеру получения 9 с применением 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-циклопропокси-4-метоксифенил)пиридина (Пример получения 52, 600 мг, 1,46 ммоль). ЖХМС m/z=540 [MH]+.
Пример получения 11: 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-(2-((трет-бутилдиметилсилил)окси)этокси)-4-метоксифенил)пиридин

3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-(2-((трет-бутилдиметилсилил)окси)этокси)-4-метоксифенил)пиридин (2,0 г, 81%) получают по методике, аналогичной Примеру получения 9 с применением 3-(3-(2-((трет-бутилдиметилсилил)окси)этокси)-4-метоксифенил)-5-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)пиридина (Пример получения 53, 2,0 г, 3,8 ммоль). ЖХМС m/z=658 [MH]+.
Пример получения 12: 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-(3-((трет-бутилдиметилсилил)окси)пропокси)-4-метоксифенил)пиридин

3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-(3-((трет-бутилдиметилсилил)окси)пропокси)-4-метоксифенил)пиридин (12,0 г, 97%) получают по методике, аналогичной Примеру получения 9 с применением 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-(3-((трет-бутилдиметилсилил)окси)пропокси)-4-метоксифенил)пиридина (Пример получения 54, 10,0 г, 18,4 ммоль). ЖХМС m/z=671 [MH]+.
Пример получения 13: 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-(2-фторэтокси)-4-метоксифенил)пиридин

3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-(2-фторэтокси)-4-метоксифенил)пиридин (700 мг, 89%) получают по методике, аналогичной Примеру получения 9 с применением 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-(2-фторэтокси)-4-метоксифенил)пиридина (Пример получения 55, 600 мг, 1,4 ммоль). ЖХМС m/z=433 [MH]+.
Пример получения 14: трет-бутил(2-(3'-(3-фторпропокси)-4'-метокси-[1,1'-бифенил]-3-ил)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропокси)диметилсилан
трет-Бутил(2-(3'-(3-фторпропокси)-4'-метокси-[1,1'-бифенил]-3-ил)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропокси)диметилсилан получают по методике, аналогичной Примеру получения 9 с применением 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-(3-фторпропокси)-4-метоксифенил)пиридина (Пример получения 56).
Пример получения 15: 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин
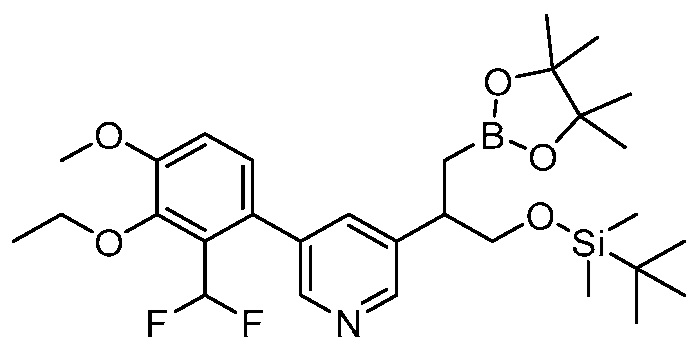
3-(1-((трет-Бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин (300 мг, 46%) получают по методике, аналогичной Примеру получения 9 с применением 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридина (Пример получения 57, 361 мг, 1,13 ммоль). ЖХМС m/z=578 [MH]+.
Пример получения 16: 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-этокси-5-фтор-4-метоксифенил)пиридин

3-(1-((трет-Бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-этокси-5-фтор-4-метоксифенил)пиридин (650 мг, 75%) получают по методике, аналогичной Примеру получения 9 с применением 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-этокси-5-фтор-4-метоксифенил)пиридина (Пример получения 58, 660 мг, 1,58 ммоль). ЖХМС m/z=546 [MH]+.
Пример получения 17: 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-хлор-5-этокси-4-метоксифенил)пиридин
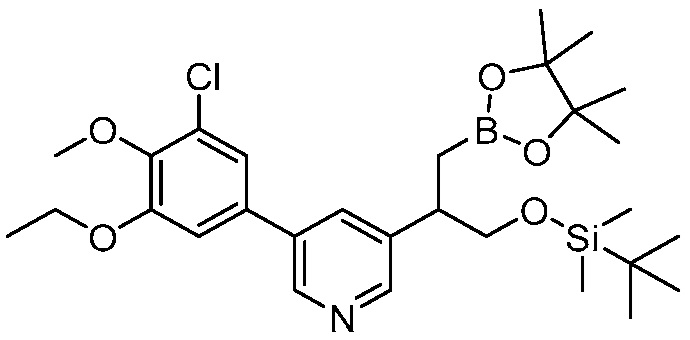
3-(1-((трет-Бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-хлор-5-этокси-4-метоксифенил)пиридин (800 мг, 77%) получают по методике, аналогичной Примеру получения 9 с применением 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-хлор-5-этокси-4-метоксифенил)пиридина (Пример получения 59, 800 мг, 1,8 ммоль). ЖХМС m/z=562 [MH]+.
Пример получения 18: 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(5-этокси-2-фтор-4-метоксифенил)пиридин
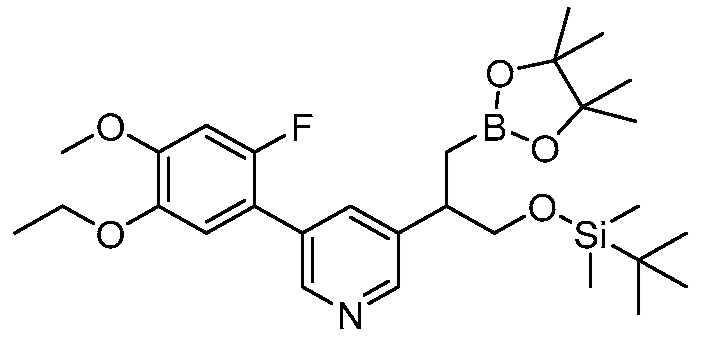
3-(1-((трет-Бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(5-этокси-2-фтор-4-метоксифенил)пиридин (2,0 г, 85%) получают по методике, аналогичной Примеру получения 9 с применением 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(5-этокси-2-фтор-4-метоксифенил)пиридина (Пример получения 60, 1,80 г, 4,31 ммоль). 1H ЯМР (CDCl3, 400МГц): δ 8,56 (т, J=1,7 Гц, 1H), 8,44 (д, J=2,0 Гц, 1H), 7,71 (м, 1H), 6,88 (д, J=7,5 Гц, 1H), 6,73 (д, J=11,5 Гц, 1H), 4,10 (кв, J=7,0 Гц, 2H), 3,90 (с, 3H), 3,68-3,75 (м, 2H), 3,07-3,14 (м, 1H), 1,47 (т, J=7,0 Гц, 3H), 1,22-1,29 (м, 2H), 1,09 (д, J=13,1 Гц, 12H), 0,81 (с, 9H), -0,06 (д, J=6,5 Гц, 6H). ЖХМС m/z=546 [MH]+.
Пример получения 19: 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(2-хлор-5-этокси-4-метоксифенил)пиридин

3-(1-((трет-Бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(2-хлор-5-этокси-4-метоксифенил)пиридин (2,05 г, 73%) получают по методике, аналогичной Примеру получения 9 с применением 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(2-хлор-5-этокси-4-метоксифенил)пиридина (Пример получения 61, 2,17 г, 5,0 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 8,44 (м, 2H), 7,63 (т, J=2,0 Гц, 1H), 6,95 (с, 1H), 6,77 (с, 1H), 4,06 (кв, J=7,0 Гц, 2H), 3,89 (с, 3H), 3,64-3,74 (м, 2H), 3,06-3,13 (м, 1H), 1,45 (т, J=7,0 Гц, 3H), 1,23-1,29 (м, 2H), 1,08 (д, J=13,6 Гц, 12H), 0,79 (с, 9H), -0,08 (д, J=6,8 Гц, 6H).
Пример получения 20: 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(2-фтор-4-метокси-5-пропоксифенил)пиридин

3-(1-((трет-Бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(2-фтор-4-метокси-5-пропоксифенил)пиридин (4,0 г, 86%) получают по методике, аналогичной Примеру получения 9 с применением 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(2-фтор-4-метокси-5-пропоксифенил)пиридина (Пример получения 62, 6 г, 8,3 ммоль). ЖХМС m/z=560 [MH]+.
Пример получения 21: 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(4-(дифторметокси)-3-пропоксифенил)пиридин

3-(1-((трет-Бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(4-(дифторметокси)-3-пропоксифенил)пиридин (2,25 г, 88%) получают по методике, аналогичной Примеру получения 9 с применением 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(4-(дифторметокси)-3-пропоксифенил)пиридина (Пример получения 63, 2,0 г, 4,5 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 8,61 (д, J=2,2 Гц, 1H), 8,57 (д, J=2,1 Гц, 1H), 7,73 (т, J=2,1 Гц, 1H), 7,24 (д, J=8,0 Гц, 1H), 7,09-7,12 (м, 2H), 6,61 (т, J=75,3 Гц, 1H), 4,05 (т, J=6,5 Гц, 2H), 3,67-3,77 (м, 2H), 3,09-3,16 (м, 1H), 2,16 (с, 2H), 1,84-1,93 (2H), 1,06-1,11 (м, 15H), 0,81 (с, 9H), -0,07 - -0,05 (д, J=5,8 Гц, 6H). ЖХМС m/z=578 [MH]+.
Пример получения 22: 5'-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-3-фтор-5-метокси-6-пропокси-2,3'-бипиридин

5'-(1-((трет-Бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-3-фтор-5-метокси-6-пропокси-2,3'-бипиридин (4,02 г, колич.) получают по методике, аналогичной Примеру получения 9 с применением 5'-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-3-фтор-5-метокси-6-пропокси-2,3'-бипиридина (Пример получения 64, 3,1 г, 7,17 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 9,03 (с, 1H), 8,45 (д, J=2,3 Гц, 1H), 8,13-8,15 (м, 1H), 6,95 (д, J=11,3 Гц, 1H), 4,12 (т, J=7,0 Гц, 2H), 3,92 (с, 3H), 3,68-3,76 (м, 2H), 3,09-3,16 (м, 1H), 1,85-1,94 (м, 2H), 1,22-1,29 (м, 2H), 1,10 (д, J=11,5 Гц, 12H), 1,05 (т, J=7,5 Гц, 3H), 0,81 (с, 9H), -0,07 - -0,06 (д, J=7,5Гц, 6H). ЖХМС m/z=561 [MH]+
Пример получения 23: 5'-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-6-метокси-5-пропокси-3,3'-бипиридин

5'-(1-((трет-Бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-6-метокси-5-пропокси-3,3'-бипиридин (2,55 г, 81%) получают по методике, аналогичной Примеру получения 9 с применением 5'-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-6-метокси-5-пропокси-3,3'-бипиридина (Пример получения 65, 2,4 г, 5,8 ммоль). ЖХМС m/z=543 [MH]+.
Пример получения 24: 5-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-3-(3-этокси-4-метоксифенил)-2-метилпиридин

5-(1-((трет-Бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-3-(3-этокси-4-метоксифенил)-2-метилпиридин (700 мг, 91%) получают по методике, аналогичной Примеру получения 9 с применением 5-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-3-(3-этокси-4-метоксифенил)-2-метилпиридина (Пример получения 66, 590 мг, 1,43 ммоль). ЖХМС m/z=542 [MH]+.
Пример получения 25: 4-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-2-(4-метокси-3-пропоксифенил)-6-(трифторметил)пиримидин
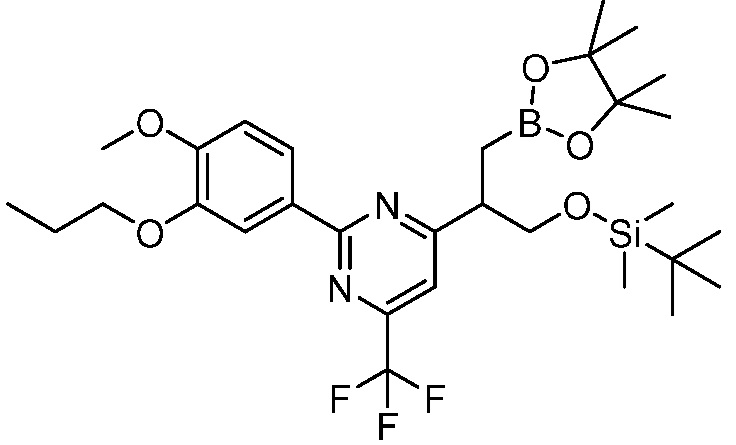
4-(1-((трет-Бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-2-(4-метокси-3-пропоксифенил)-6-(трифторметил)пиримидин (0,94 г, 59%) получают по методике, аналогичной Примеру получения 9 с применением 4-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-(4-метокси-3-пропоксифенил)-6-(трифторметил)пиримидина (Пример получения 67, 1,27 г, 2,63 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 8,17-8,19 (м, 1H), 8,10 (д, J=2,1 Гц, 1H), 7,42 (с, 1H), 6,97 (д, J=8,6 Гц, 1H), 4,12-4,16 (м, 2H), 3,95 (с, 3H), 3,79-3,89 (м, 2H), 3,31-3,37 (м, 1H), 1,90-1,99 (м, 2H), 1,23-1,29 (м, 2H), 1,13 (с, 6H), 1,10 (т, J=7,5 Гц, 3H), 1,05 (с, 6H), 0,80-0,82 (с, 9H), -0,04 (т, J=3,1 Гц, 3H), -0,08 (т, J=3,1 Гц, 3H). ЖХМС m/z=611 [MH]+
Пример получения 26: 2-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-6-(3-этокси-4-метоксифенил)пиразин

2-(1-((трет-Бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-6-(3-этокси-4-метоксифенил)пиразин (720 мг, 43%) получают по методике, аналогичной Примеру получения 9 с применением 2-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-6-(3-этокси-4-метоксифенил)пиразина (Пример получения 68, 1,26 г, 3,1 ммоль). ЖХМС m/z=529 [MH]+.
Пример получения 27: 2-(6-(1-бороно-3-((трет-бутилдиметилсилил)окси)пропан-2-ил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)уксусная кислота

Этил 2-(6-(1-((трет-Бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)ацетат (Пример получения 28, 758 мг, 1,21 ммоль) растворяют в MeCN (10 мл) и воде (10 мл). К раствору добавляют LiOH∙H2O (101 мг, 2,41 ммоль) порциями. Смесь перемешивают при примерно 25°C в течение примерно 1 ч. Смесь концентрируют. Реакционную смесь применяют сразу на следующей стадии без дальнейшей очистки. ЖХМС m/z=519 [MH]+.
Пример получения 28: этил 2-(6-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)ацетат

Этил 2-(6-(1-((трет-Бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)ацетат (437 мг, 70%) получают по методике, аналогичной Примеру получения 9 с применением этил 2-(6-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)ацетата (Пример получения 69, 500 мг, 0,99 ммоль). ЖХМС m/z=629 [MH]+.
Пример получения 29: 4-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-6-(((трет-бутилдиметилсилил)окси)метил)-2-(4-метокси-3-пропоксифенил)пиримидин

4-(1-((трет-Бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-6-(((трет-бутилдиметилсилил)окси)метил)-2-(4-метокси-3-пропоксифенил)пиримидин (1,0 г, 58%) получают по методике, аналогичной Примеру получения 9 с применением 4-(((трет-бутилдиметилсилил)окси)метил)-6-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-(4-метокси-3-пропоксифенил)пиримидина (Пример получения 70, 1,4 г, 2,5 ммоль). ЖХМС m/z=687 [MH]+.
Пример получения 30: метил (Z)-2-(2'-циано-4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)акрилат

Смесь метил (Z)-2-(2'-циано-4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)-3-(((трифторметил)сульфонил)окси)акрилата (Пример получения 40, 15,00 г, 30,03 ммоль), Pd(dppf)Cl2 (1,10 г, 1,50 ммоль), Pin2B2 (11,44 г, 45,05 ммоль) и KOAc (4,42 г, 45,05 ммоль) в 1,4-диоксане (200 мл) перемешивают при примерно 80°C в течение примерно 2 ч под N2. Смесь фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (5:1) с получением метил (Z)-2-(2'-циано-4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)акрилата (13,6 г, 94%). 1H ЯМР (CDCl3, 400 МГц): δ 7,52 (с, 1H), 7,49-7,47 (м, 1H), 7,42-7,40 (м, 2H), 7,14-7,11 (м, 2H), 6,30 (с, 1H), 4,18-4,14 (м, 2H), 3,89 (с, 3H), 3,83 (с, 3H), 1,90-1,81 (м, 2H), 1,25 (с, 12H), 1,06 (т, J=3,6 Гц, 3H).
Пример получения 31: 2-(4-((трет-бутилдиметилсилил)окси)-1-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутан-2-ил)-6-(4-метокси-3-пропоксифенил)пиридин

2-(4-((трет-Бутилдиметилсилил)окси)-1-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутан-2-ил)-6-(4-метокси-3-пропоксифенил)пиридин (140 мг, 12%) получают по методике, аналогичной Примеру получения 9 с применением 2-(4-((трет-бутилдиметилсилил)окси)бут-1-ен-2-ил)-6-(4-метокси-3-пропоксифенил)пиридина (Пример получения 71, 900 мг, 2,10 ммоль). ЖХМС m/z=556 [MH]+.
Пример получения 32: (E)-3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бут-2-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридин

Раствор 2,2,6,6-тетраметилпиперидин (CAS 768-66-1, 1,08 мл, 6,41 ммоль) в ТГФ (2,5 мл) охлаждают до примерно 0°C (ледяная баня) под N2. N-BuLi (2,56 мл, 6,41 ммоль, 2,5 M в гексане) добавляют по каплям к раствору и перемешивают в течение примерно 30 мин при примерно 0°C. Раствор 2,2'-(этан-1,1-диил)бис(4,4,5,5-тетраметил-1,3,2-диоксаборолана) (Пример получения 149, 1810 мг, 6,41 ммоль) в ТГФ (2 мл) добавляют по каплям, затем перемешивают в течение примерно 5 мин, затем охлаждают до примерно -78°C. Раствор 2-((трет-бутилдиметилсилил)окси)-1-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)этан-1-он (Пример получения 75, 666 мг, 1,60 ммоль) в ТГФ (3,0 мл) добавляют по каплям и перемешивают под N2 при примерно -78°C в течение примерно 1 ч. Реакционную смесь помещают на ледяную баню и перемешивают в течение еще часа. Реакционную смесь гасят водой и разбавляют EtOAc. EtOAc отделяют, промывают насыщенным раствором соли и сушат над MgSO4. Раствор фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют гептаном/EtOAc (9:1) с получением (E)-3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бут-2-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина (400 мг, 45%). ЖХМС m/z=554 [MH]+.
Пример получения 33: этил 2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-2-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропаноат

К смеси этил 2-(6-бромпиридин-2-ил)-2-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропаноата (Пример получения 110, 249 мг, 0,625 ммоль) и 2-(4-метокси-3-пропоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 114, 357 мг, 1,22 ммоль) в 1,4-диоксане (8,5 мл) добавляют раствор K3PO4 в воде (2,0 M, 0,625 мл, 1,25 ммоль). Смесь дегазируют с применением N2 при примерно 20°C в течение примерно 10 мин. Бис(три-т-бутилфосфин)палладий(0) (CAS 53199-31-8, 16,0 мг, 0,03 ммоль) добавляют, и смесь перемешивают при примерно 20°C в течение 2 ч. Смесь разбавляют EtOAc, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют гептаном/EtOAc (100:0-0:100) с получением этил 2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-2-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропаноата (134 мг, 44%). 1H ЯМР (CDCl3, 400 МГц,): δ 7,40-7,56 (м, 1H), 7,23-7,38 (м, 4H), 7,07-7,13 (м, 4H), 6,96 (д, J=8,6 Гц, 2H), 5,33 (с, 1H), 4,02-4,22 (м, 7H), 3,93 (с, 6H), 1,83-2,08 (м, 4H), 1,71 (с, 4H), 1,49-1,67 (м, 9H), 1,37 (с, 1H), 1,17-1,29 (м, 19H), 1,09 (т, J=7,4 Гц, 7H). ЖХМС m/z=399 [MH]+.
Пример получения 34: 5-(3-((трет-бутилдиметилсилил)окси)-1-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутан-2-ил)-3-(4-метокси-3-пропоксифенил)пиридазин

5-(3-((трет-Бутилдиметилсилил)окси)-1-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутан-2-ил)-3-(4-метокси-3-пропоксифенил)пиридазин (160 мг, 41%) получают по методике, аналогичной Примеру получения 9 с применением 5-(3-((трет-бутилдиметилсилил)окси)бут-1-ен-2-ил)-3-(4-метокси-3-пропоксифенил)пиридазина (Пример получения 72, 300 мг, 0,7 ммоль). ЖХМС m/z=557 [MH]+.
Пример получения 35: 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-этокси-4-метоксифенил)-4-метилпиридин
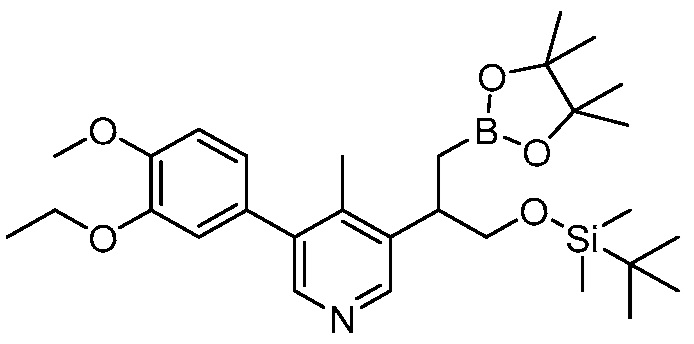
3-(1-((трет-Бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-этокси-4-метоксифенил)-4-метилпиридин (0,28 г, 26%) получают по методике, аналогичной Примеру получения 9 с применением 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-этокси-4-метоксифенил)-4-метилпиридина (Пример получения 73, 0,8 г, 1,93 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 8,36 (с, 1H), 8,22 (с, 1H), 6,92 (д, J=8,3 Гц, 1H), 6,75-6,78 (м, 1H), 6,73 (д, J=2,0 Гц, 1H), 4,08 (кв, J=7,0 Гц, 2H), 3,91 (с, 3H), 3,74-3,78 (м, 1H), 3,64-3,68 (м, 1H), 3,38-3,46 (м, 1H), 2,29 (с, 3H), 1,45 (т, J=7,0 Гц, 3H), 1,22-1,29 (м, 2H), 1,03-1,08 (м, 12H), 0,79 (с, 9H), -0,11--0,08 (м, 6H). ЖХМС m/z=542 [MH]+
Пример получения 36: 4-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-2-(3-этокси-4-метоксифенил)тиазол

4-(1-((трет-Бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-2-(3-этокси-4-метоксифенил)тиазол (0,41 г, 39%) получают по методике, аналогичной Примеру получения 9 с применением 4-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-(3-этокси-4-метоксифенил)тиазола (Пример получения 74, 0,8 г, 1,97 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,53 (д, J=2,0 Гц, 1H), 7,46 (дд, J=2,0, 8,5 Гц, 1H), 6,91 (с, 1H), 6,89 (д, J=8,3 Гц, 1H), 4,20 (кв, J=7,0 Гц, 2H), 3,88-3,92 (с, 4H), 3,77-3,81 (м, 1H), 3,27-3,34 (м, 1H), 1,51 (т, J=7,0Гц, 3H), 1,27-1,30 (м, 2H), 1,15 (д, J=13,6, 12 H), 0,85 (с, 9H), -0,03 (с, 6H). ЖХМС m/z=534 [MH]+.
Пример получения 37: 3-(1-бром-3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3,4-диметоксифенил)пиридин

К раствору 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3,4-диметоксифенил)пиридина (Пример получения 48, 30,00 г, 77,81 ммоль) в ДХМ (500 мл) добавляют трибромид пиридиния (CAS 39416-48-3, 24,9 г, 77,8 ммоль) порциями при примерно 0°C. Смесь перемешивают при примерно 20°C в течение примерно 1 ч и выливают в холодный водный Na2SO3 (100 мл). Смесь экстрагируют ДХМ (3×50 мл). Объединенные ДХМ экстракты промывают насыщенным раствором соли (50 мл), сушат над Na2SO4 и концентрируют. DBU (CAS 6674-22-2, 58,64 мл, 389,1 ммоль) добавляют в полученную выше смесь в ДХМ (500 мл) при примерно 20°C. Смесь перемешивают при примерно 20°C в течение примерно 16 ч и выливают в водный NH4Cl (500 мл). Смесь экстрагируют ДХМ (3×200 мл). Объединенные ДХМ экстракты промывают насыщенным раствором соли (200 мл), сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (15:1) с получением 3-(1-бром-3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3,4-диметоксифенил)пиридина (27,0 г, 75%), 1H ЯМР (CDCl3, 400 МГц): δ 8,74 (д, J=2,4 Гц, 1H), 8,55 (д, J=3,0 Гц, 1H), 7,88 (т, J=2,0 Гц, 1H), 7,13-7,15 (м, 1H), 7,08 (д, J=3,0 Гц, 1H), 6,97 (д, J=7,2 Гц, 1H), 6,57 (с, 1H), 4,76 (с, 2H), 3,96 (с, 3H), 3,94 (с, 3H), 0,82 (с, 9H), 0,07 (с, 6H).
Пример получения 38: 3-(1-бром-3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-этокси-4-метоксифенил)пиридин

Смесь 3-(1,2-дибром-3-((трет-бутилдиметилсилил)окси)пропан-2-ил)-5-(3-этокси-4-метоксифенил)пиридина (Пример получения 47a, 11,0 г, 19,66 ммоль) и DBU (CAS 6674-22-2, 5,99 г, 39,33 ммоль, 5,93 мл) в ДХМ (150 мл) перемешивают при примерно 25°C в течение примерно 16 ч. Смесь промывают 1N HCl (300 мл), насыщенным раствором соли (300 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (10:1) с получением 3-(1-бром-3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-этокси-4-метоксифенил)пиридина (7,0 г, 74%). 1H ЯМР (CDCl3, 400 МГц): δ 8,74 (д, J=1,6 Гц, 1H), 8,55 (д, J=1,6 Гц, 1H), 7,87 (с, 1H), 7,14 (дд, J=1,6, 8,0 Гц, 1H), 7,09 (с, 1H), 6,98 (д, J=8,0 Гц, 1H), 6,57 (с, 1H), 4,77 (с, 2H), 4,18 (кв, J=6,8 Гц, 2H), 3,94 (с, 3H), 1,51 (т, J=6,8 Гц, 3H), 0,82 (с, 9H), 0,08 (с, 6H).
Пример получения 39: 3-(1-бром-3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридин

К смеси 3-(1,2-дибром-3-((трет-бутилдиметилсилил)окси)пропан-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина (Пример получения 47b, 10,0 г, 17,44 ммоль) в ДХМ (150 мл) добавляют DBU (CAS 6674-22-2, 5,26 мл, 34,88 ммоль), затем перемешивают при примерно 25°C в течение примерно 16 ч под N2. Смесь промывают 1N HCl (400 мл), насыщенным раствором соли (400 мл), сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (10:1) с получением 3-(1-бром-3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина (5,60 г, 65%). 1H ЯМР (CDCl3, 400 МГц): δ 8,74 (д, J=2,0 Гц, 1H), 8,55 (д, J=1,6 Гц, 1H), 7,87 (с, 1H), 7,13 (дд, J=1,6, 8,4 Гц, 1H), 7,09 (с, 1H), 6,98 (д, J=8,0 Гц, 1H), 6,57 (с, 1H), 4,77 (с, 2H), 4,06 (т, J=6,8 Гц, 2H), 3,93 (с, 3H), 1,87-1,96 (м, 2H), 1,08 (т, J=7,6 Гц, 3H), 0,82 (с, 9H), 0,08 (с, 6H).
Пример получения 40: метил 2-(2'-циано-4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)-3-(((трифторметил)сульфонил)окси)акрилат

К раствору метил 2-(2'-циано-4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)-3-гидроксиакрилата (Пример получения 41, 14,5 г, 39,47 ммоль) в толуоле (500 мл) добавляют LiOH (11,59 г, 276,27 ммоль) в воде (30 мл). К смеси добавляют Tf2O (CAS 358-23-8, 15,63 мл, 94,72 ммоль) по каплям при примерно 0°C. Смесь перемешивают при примерно 0°C в течение примерно 1 ч. Реакционную смесь гасят водой (500 мл) и экстрагируют EtOAc (2×500 мл). Объединенные EtOAc экстракты промывают насыщенным раствором соли (2×300 мл), сушат над безводным Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (15:1) с получением метил 2-(2'-циано-4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)-3-(((трифторметил)сульфонил)окси)акрилата (15,00 г, 74%). 1H ЯМР (CDCl3, 400 МГц): δ 7,56-7,59 (м, 1H), 7,48-7,52 (м, 2H), 7,39-7,41 (м, 1H), 7,13-7,18 (м, 3H), 4,19 (т, J=6,8 Гц, 2H), 3,93 (с, 3H), 3,91 (с, 3H), 1,83-1,92 (м, 2H), 1,09 (т, J=7,6 Гц, 3H).
Пример получения 41: метил 2-(2'-циано-4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)-3-гидроксиакрилат
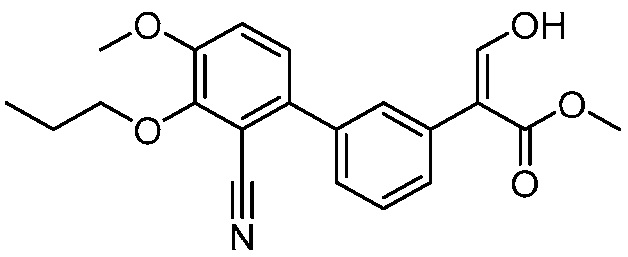
К смеси метил 2-(2'-циано-4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)ацетата (Пример получения 85, 12,0 г, 35,36 ммоль) и этилформиата (11,39 мл, 141,43 ммоль) в ДХМ (150 мл) добавляют TiCl4 (13,41 г, 70,72 ммоль, 7,62 мл) и Et3N (8,59 г, 84,86 ммоль, 11,76 мл) медленно при примерно 0°C. Смесь перемешивают при примерно 20°C в течение примерно 1 ч. Вода (150 мл) добавляют и смесь экстрагируют ДХМ (2×150 мл). Объединенные ДХМ экстракты промывают насыщенным раствором соли (150 мл), сушат над Na2SO4 и концентрируют с получением метил 2-(2'-циано-4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)-3-гидроксиакрилата (14,50 г), который применяют сразу без дальнейшей очистки. 1H ЯМР (CDCl3, 400 МГц): δ 12,09 (д, J=12,4 Гц, 1H), 7,43-7,44 (м, 3H), 7,38-7,41 (м, 1H), 7,29-7,34 (м, 1H), 7,15 (с, 2H), 4,19 (т, J=6,8 Гц, 2H), 3,92 (с, 3H), 3,85 (с, 3H), 1,84-1,93 (м, 2H), 1,07-1,11 (м, 3H).
Пример получения 42: (R)-3-(1-((трет-бутилдиметилсилил)окси)-3-йодпропан-2-ил)-5-(4-метокси-3-пропоксифенил)пиридин
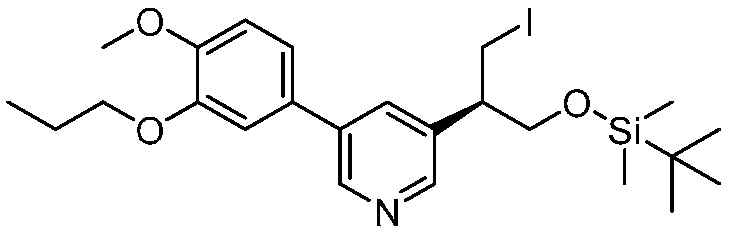
Смесь метансульфоната (R)-3-((трет-бутилдиметилсилил)окси)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропила (Пример получения 43, 45,5 г, 89,28 ммоль) и йодида лития (38,2 г, 286 ммоль) в ацетоне (446 мл) перемешивают при примерно 30°C в течение 3 дней. Реакционную смесь нагревают до примерно 50°C в течение примерно 45 мин. Смесь охлаждают до примерно 20°C и концентрируют для удаления ацетона. Остаток разбавляют ДХМ и промывают водой (2×100 мл). ДХМ экстракт сушат над MgSO4, фильтруют и концентрируют. Остаток растирают в гептане/EtOAc (1:1, 100 мл) в течение примерно 45 мин. Твердый продукт фильтруют и очищают колоночной хроматографией (диоксид кремния) и элюируют гептаном/EtOAc (85:15 до 30:70) с получением (R)-3-(1-((трет-бутилдиметилсилил)окси)-3-йодпропан-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина (41,2 г, 85%). 1H ЯМР (CDCl3, 400 МГц): δ 8,71 (д, J=2,3 Гц, 1H), 8,43 (д, J=2,0 Гц, 1H), 7,71 (т, J=2,0 Гц, 1H), 7,09-7,15 (м, 2H), 6,98 (д, J=8,2 Гц, 1H), 4,06 (т, J=7,0 Гц, 2H), 3,98-4,02 (м, 1H), 3,93 (с, 3H), 3,84-3,88 (м, 1H), 3,68-3,72 (м, 1H), 3,43-3,47 (м, 1H), 3,09-3,15 (м, 1H), 1,87-1,96 (м, 2H), 1,08 (т, J=7,4 Гц, 3H), 0,89 (с, 9H), 0,05 (д, J=7,4 Гц, 6H). ЖХМС m/z=542 [MH]+.
Пример получения 43: метансульфонат (R)-3-((трет-бутилдиметилсилил)окси)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропила

К ледяному раствору (S)-3-((трет-бутилдиметилсилил)окси)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропан-1-ола (Пример получения 44, 42,8 г, 99,2 ммоль) в ДХМ (600 мл) добавляют Et3N (25,1 мл, 178 ммоль) и перемешивают в течение примерно 30 мин. MsCl (9,98 мл, 129 ммоль) добавляют по каплям и нагревают и перемешивают при примерно 20°C в течение ночи. Смесь промывают водой, сушат над MgSO4, фильтруют, пропускают через гелевый слой диоксида кремния и концентрируют с получением метансульфоната (R)-3-((трет-бутилдиметилсилил)окси)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропила (45,5 г), который применяют в Примере получения 42. ЖХМС m/z=510 [MH]+.
Пример получения 44: (S)-3-((трет-бутилдиметилсилил)окси)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропан-1-ол

К ледяному раствору (S)-3-((трет-бутилдиметилсилил)окси)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропилацетата (Пример получения 45, 45,7 г, 96,5 ммоль) в ТГФ (400 мл) добавляют водный NaOH (154 мл, 1 N). Смесь нагревают и перемешивают при примерно 20°C в течение 2 дней. Органическую фазу отделяют и концентрируют. Остаток растворяют в ДХМ (300 мл). Водный слой экстрагируют ДХМ. Объединенные ДХМ экстракты промывают водой, насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют с получением (S)-3-((трет-бутилдиметилсилил)окси)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропан-1-ола (42,8 г), который применяют в Примере получения 43. ЖХМС m/z=432 [MH]+.
Пример получения 45: (S)-3-((трет-бутилдиметилсилил)окси)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропилацетата

К ледяному раствору (R)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропилацетата (Пример получения 46, 43,4 г, 121 ммоль) в 2-MeТГФ (1400 мл) добавляют ДХМ (800 мл), имидазол (41,1 г, 604 ммоль) и ТБС-Cl (91,0 г, 604 ммоль). Реакционную смесь нагревают до примерно 20°C и перемешивают в течение ночи. Смесь фильтруют и твердые вещества промывают EtOAc. Объединенные фильтраты промывают водой, насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют гептаном/EtOAc (100:0-60:40) с получением (S)-3-((трет-бутилдиметилсилил)окси)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропилацетата (48,3 г, 85%). 1H ЯМР (CDCl3, 400 МГц): δ 8,70 (д, J=2,0 Гц, 1H), 8,45 (д, J=2,3 Гц, 1H), 7,74 (т, J=2,3 Гц, 1H), 7,08-7,14 (м, 2H), 6,98 (д, J=8,2 Гц, 1H), 4,40-4,49 (м, 2H), 4,06 (т, J=7,0 Гц, 2H), 3,86-3,95 (м, 5H), 3,17-3,23 (м, 1H), 2,04 (с, 3H), 1,67-1,96 (м, 2H), 1,08 (т, J=7,4 Гц, 3H), 0,87 (с, 9H), 0,01 (д, J=2,3 Гц, 6H). ЖХМС m/z=474 [MH]+.
Пример получения 46: (R)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропилацетат

К смеси 2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропан-1,3-диола (Пример получения 82, 38,3 г, 121 ммоль) в 2-MeТГФ (1088 мл) добавляют обездвиженную липазу Rhizomucor miehei (1,53 г, Lipozyme® RM IM, Novozymes A/S, Denmark). Смесь перемешивают при примерно 20°C в течение примерно 5 мин. Винилацетат (89,0 мл, 965 ммоль) добавляют к смеси, затем 2-MeТГФ (100 мл). Смесь перемешивают при примерно 20°C в течение примерно 39 ч. Смесь фильтруют и фильтровальную лепешку промывают 2-MeТГФ (50 мл). Объединенные фильтраты концентрируют с получением (R)-3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропилацетата (36,0 г, 83%), который применяют в Примере получения 45.
Пример получения 47a: 3-(1,2-дибром-3-((трет-бутилдиметилсилил)окси)пропан-2-ил)-5-(3-этокси-4-метоксифенил)пиридин

К смеси 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-этокси-4-метоксифенил)пиридина (Пример получения 49, 8,00 г, 20,02 ммоль) в ДХМ (150 мл) добавляют трибромид пиридиния (CAS 39416-48-3, 7,68 г, 24,02 ммоль) одной порцией при примерно 0°C под N2. Смесь перемешивают при примерно 25°C в течение примерно 3 ч. ДХМ смесь промывают водным Na2SO3 (100 мл), насыщенным раствором соли (100 мл), сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (10:1) с получением 3-(1,2-дибром-3-((трет-бутилдиметилсилил)окси)пропан-2-ил)-5-(3-этокси-4-метоксифенил)пиридина (11,00 г) который принимают сразу на следующей стадии. 1H ЯМР (CDCl3, 400 МГц): δ 8,72-8,74 (м, 2H), 7,99 (т, J=2,0 Гц, 1H), 7,14 (дд, J=2,0, 8,4 Гц, 1H), 7,09 (д, J=2,0 Гц, 1H), 7,00 (д, J=8,0 Гц, 1H), 4,37-4,40 (м, 2H), 4,28 (д, J=11,2 Гц, 1H), 4,21-4,26 (м, 3H), 3,93 (с, 3H), 1,52 (т, J=7,2 Гц, 3H), 0,94 (с, 9H), 0,14 (д, J=9,6 Гц, 6H).
Пример получения 47b: 3-(1,2-дибром-3-((трет-бутилдиметилсилил)окси)пропан-2-ил)-5-(4-метокси-3-пропоксифенил)пиридин
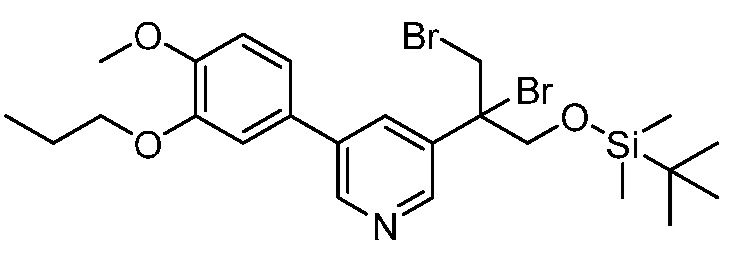
К смеси 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина (Пример получения 50, 7,00 г, 16,92 ммоль) в ДХМ (150 мл) добавляют трибромид пиридиния (CAS 39416-48-3, 6,49 г, 20,30 ммоль) одной порцией при примерно 0°C под N2. Смесь перемешивают при примерно 25°C в течение примерно 3 ч. ДХМ смесь промывают водный Na2SO3 (100 мл), насыщенным раствором соли (100 мл), сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (10:1) с получением 3-(1,2-дибром-3-((трет-бутилдиметилсилил)окси)пропан-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина (10,00 г), который принимают сразу на следующей стадии. 1H ЯМР (CDCl3, 400 МГц): δ 8,72-8,75 (м, 2H), 7,99 (т, J=2,0 Гц, 1H), 7,14 (дд, J=2,0, 8,0 Гц, 1H), 7,09 (д, J=2,0 Гц, 1H), 7,00 (д, J=8,4 Гц, 1H), 4,39 (д, J=10,8 Гц, 2H), 4,28 (д, J=10,8 Гц, 1H), 4,20 (д, J=10,4 Гц, 1H), 4,07 (т, J=6,8 Гц, 2H), 3,93 (с, 3H), 1,97-1,87 (м, 1H), 1,08 (т, J=7,2 Гц, 3H), 0,93 (с, 9H), 0,14 (д, J=9,6 Гц, 6H).
Пример получения 48: 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3,4-диметоксифенил)пиридин

Смесь 3-(3,4-диметоксифенил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина (Пример получения 91a, 2,0 г, 5,86 ммоль), 2-бромаллилокси-трет-бутилдиметилсилана (Пример получения 227, 1,47 г, 5,86 ммоль), Pd(dppf)Cl2.ДХМ (239,34 мг, 293 мкмоль), Na2CO3 (621,26 мг, 5,86 ммоль) и KOAc (1,15 г, 11,72 ммоль) в 1,4-диоксане (50 мл) и воде (5 мл) нагревают до примерно 90°C в течение примерно 12 ч. Смесь фильтруют и фильтрат концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют ДХМ/MeCN (5:1) с получением 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3,4-диметоксифенил)пиридина (2,10 г, 5,45 ммоль, 93%). 1H ЯМР(CDCl3, 400 МГц): δ 8,72 (д, J=2,0 Гц, 1H), 8,61 (д, J=2,0 Гц, 1H), 7,85 (т, J=2,0 Гц, 1H), 7,14-7,16 (м, 1H), 7,08 (д, J=2,0 Гц, 1H), 6,99 (д, J=8,4 Гц, 1H), 5,52 (д, J=12,0 Гц, 2H), 4,56 (с, 2H), 3,97 (с, 3H), 3,95 (с, 3H), 0,93 (с, 9H), 0,12 (с, 6H).
Пример получения 49: 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-этокси-4-метоксифенил)пиридин
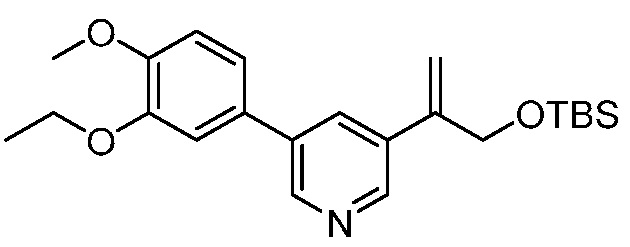
Смесь 3-бром-5-(3-этокси-4-метоксифенил)пиридина (Пример получения 92, 20 г, 64,9 ммоль), трет-бутилдиметил((2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)аллил)окси)силана (Пример получения 146, 23,23 г, 77,88 ммоль), Pd(dppf)Cl2 (1,42 г, 1,95 ммоль), K2CO3 (17,94 г, 129,8 ммоль) и KOAc (9,55 г, 97,35 ммоль) в 1,4-диоксане (300 мл) и воде (10 мл) дегазируют и нагревают до примерно 90°C в течение примерно 16 ч под N2. Смесь фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (3:1) с получением 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-этокси-4-метоксифенил)пиридина (18,0 г, 69%). 1H ЯМР (CDCl3, 400 МГц): δ 8,71 (д, J=2,0 Гц, 1H), 8,60 (д, J=2,0 Гц, 1H), 7,84 (т, J=2,0 Гц, 1H), 7,14 (дд, J=2,0, 8,4 Гц, 1H), 7,09 (д, J=2,4 Гц, 1H), 6,99 (д, J=8,0 Гц, 1H), 5,54 (с, 1H), 5,50 (с, 1H), 4,56 (с, 2H), 4,19 (кв, J=7,2 Гц, 2H), 3,94 (с, 3H), 1,52 (т, J=7,2 Гц, 3H), 0,93 (с, 9H), 0,12 (с, 6H).
Пример получения 50: 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридин
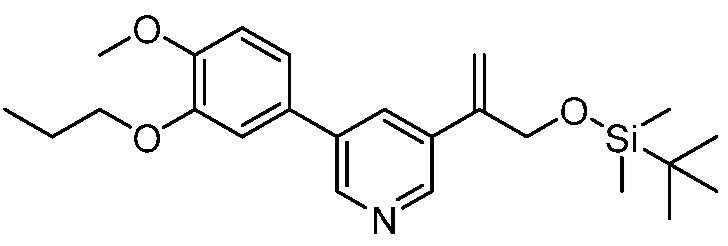
Смесь 3-бром-5-(4-метокси-3-пропоксифенил)пиридина (Пример получения 93a, 15,0 г, 46,55 ммоль), трет-бутилдиметил((2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)аллил)окси)силана (Пример получения 146, 18,05 г, 60,51 ммоль), Pd(dppf)Cl2 (1,70 г, 2,33 ммоль), K2CO3 (12,87 г, 93,10 ммоль) и KOAc (6,85 г, 69,83 ммоль) в 1,4-диоксане (250 мл) и воде (5 мл) дегазируют и нагревают до примерно 90°C в течение примерно 16 ч под N2. Смесь фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (3:1) с получением 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина (13,50 г, 70%). 1H ЯМР (CDCl3, 400 МГц): δ 8,71 (д, J=2,4 Гц, 1H), 8,60 (д, J=2,0 Гц, 1H), 7,84 (т, J=2,0 Гц, 1H), 7,13 (дд, J=2,4, 8,4 Гц, 1H), 7,10 (д, J=2,4 Гц, 1H), 6,99 (д, J=8,4 Гц, 1H), 5,53 (д, J=1,2 Гц, 1H), 5,50 (д, J=1,2 Гц, 1H), 4,56 (с, 2H), 4,06 (т, J=6,8 Гц, 2H), 3,93 (с, 3H), 1,87-1,96 (м, 2H), 1,08 (т, J=7,2 Гц, 3H), 0,93 (с, 9H), 0,13 (с, 6H).
Пример получения 51: 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-изопропокси-4-метоксифенил)пиридин

3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-изопропокси-4-метоксифенил)пиридин (1,1 г, 75%) получают по методике, аналогичной Примеру получения 50 с применением 3-бром-5-(3-изопропокси-4-метоксифенил)пиридина (Пример получения 94, 1,15 г, 3,6 ммоль) при примерно 90°C в течение примерно 2 ч. ЖХМС m/z=414 [MH]+.
Пример получения 52: 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-циклопропокси-4-метоксифенил)пиридин

3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-циклопропокси-4-метоксифенил)пиридин (730 мг, 76%) получают по методике, аналогичной Примеру получения 50 с применением 3-бром-5-(3-циклопропокси-4-метоксифенил)пиридина (Пример получения 95, 0,75 г, 2,34 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 8,74 (д, J=2,0 Гц, 1H), 8,61 (д, J=2,5 Гц, 1H), 7,85 (т, J=2,3 Гц, 1H), 7,47 (д, J=2,0 Гц, 1H), 7,14-7,22 (м, 1H), 6,98 (д, J=8,5 Гц, 1H), 5,53 (дд, J=1,3, 10,3 Гц, 2H), 4,50-4,62 (м, 2H), 3,92 (с, 3H), 3,84 (тт, J=3,2, 6,1 Гц, 1H), 0,81-0,96 (м, 13H), 0,11-0,14 (м, 6H). ЖХМС m/z=412 [MH]+.
Пример получения 53: 3-(3-(2-((трет-бутилдиметилсилил)окси)этокси)-4-метоксифенил)-5-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)пиридин

3-(3-(2-((трет-бутилдиметилсилил)окси)этокси)-4-метоксифенил)-5-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)пиридин (6,7 г, 62%) получают по методике, аналогичной Примеру получения 50 с применением 3-бром-5-(3-(2-((трет-бутилдиметилсилил)окси)этокси)-4-метоксифенил)пиридина (Пример получения 96, 9,3 г, 21 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 8,71 (д, J=2,0 Гц, 1H), 8,60 (д, J=2,0 Гц, 1H), 7,83 (т, J=2,0 Гц, 1H), 7,13-7,18 (м, 2H), 6,96-7,01 (м, 1H), 5,52 (дд, J=1,3, 10,3 Гц, 2H), 4,56 (с, 2H), 4,16-4,22 (м, 2H), 4,02-4,07 (м, 2H), 3,92 (с, 3H), 0,92-0,95 (м, 9H), 0,90 (с, 9H), 0,12 (с, 6H), 0,10 (с, 6H). ЖХМС m/z=530 [MH]+.
Пример получения 54: 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-(3-((трет-бутилдиметилсилил)окси)пропокси)-4-метоксифенил)пиридин

3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-(3-((трет-бутилдиметилсилил)окси)пропокси)-4-метоксифенил)пиридин (12,9 г, 99%) получают по методике, аналогичной Примеру получения 50 с применением 3-бром-5-(3-(3-((трет-бутилдиметилсилил)окси)пропокси)-4-метоксифенил)пиридина (Пример получения 97, 10,8 г, 23,8 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 8,71 (д, J=2,5 Гц, 1H), 8,60 (д, J=2,0 Гц, 1H), 7,83 (т, J=2,2 Гц, 1H), 7,11-7,16 (м, 2H), 6,98 (д, J=8,3 Гц, 1H), 5,49-5,54 (м, 2H), 4,56 (т, J=1,5 Гц, 2H), 4,21 (т, J=6,4 Гц, 2H), 3,92 (с, 3H), 3,85 (т, J=5,9 Гц, 2H), 2,05-2,13 (м, 2H), 0,92-0,94 (м, 9H), 0,89 (с, 9H), 0,12 (с, 6H), 0,05 (с, 6H). ЖХМС m/z=544 [MH]+.
Пример получения 55: 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-(2-фторэтокси)-4-метоксифенил)пиридин

3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-(2-фторэтокси)-4-метоксифенил)пиридин (1,6 г, 78%) получают по методике, аналогичной Примеру получения 50 с применением 3-бром-5-(3-(2-фторэтокси)-4-метоксифенил)пиридина (Пример получения 98, 1,4 г, 4,7 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 8,92 (д, J=2,5 Гц, 1H), 8,70-8,73 (м, 1H), 7,73 (т, J=8,6 Гц, 1H), 6,84-6,90 (м, 1H), 6,07 (д, J=1,5 Гц, 1H), 5,76 (д, J=1,5 Гц, 1H), 4,76 (т, J=1,7 Гц, 2H), 4,06 (т, J=6,9 Гц, 2H), 3,94 (с, 3H), 1,81-1,86 (м, 2H), 1,03-1,09 (м, 3H), 0,95 (с, 9H), 0,14 (с, 6H). ЖХМС m/z=433 [MH]+.
Пример получения 56: 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-(3-фторпропокси)-4-метоксифенил)пиридин

3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-(3-фторпропокси)-4-метоксифенил)пиридин получают по методике, аналогичной Примеру получения 50 с применением 3-бром-5-(3-(3-фторпропокси)-4-метоксифенил)пиридина (Пример получения 99).
Пример получения 57: 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин

Раствор 2-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)проп-2-ен-1-ол (Пример получения 76, 321 мг, 0,71 ммоль) и имидазол (97,2 мг, 1,43 ммоль) в ДХМ (20 мл) добавляют ТБС-Cl (129 мг, 0,86 ммоль) при примерно 0°C. Реакционную смесь перемешивают при примерно 20°C в течение примерно 15 ч. Дополнительный ТБС-Cl (129 мг, 0,86 ммоль) добавляют, и реакционную смесь перемешивают при примерно 20°C в течение примерно 20 ч. Реакционную смесь концентрируют и очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (100:0 до 60:40) с получением 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридина (361 мг, 75%). 1H ЯМР (CDCl3,400 МГц): δ 8,66 (д, J=2,0 Гц, 1H), 8,51 (д, J=2,0 Гц, 1H), 7,71 (т, J=2,3 Гц, 1H), 7,05-7,10 (м, 1H), 6,78-7,03 (м, 2H), 5,51 (дд, J=1,5, 14,1 Гц, 2H), 4,55 (т, J=1,5 Гц, 2H), 4,17 (кв, J=7,0 Гц, 2H), 3,93 (с, 3H), 1,43 (т, J=7,0 Гц, 3H), 0,88-0,94 (м, 9H), 0,09-0,13 (м, 6H). ЖХМС m/z=450 [MH]+.
Пример получения 58: 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-этокси-5-фтор-4-метоксифенил)пиридин

Смесь 3-бром-5-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)пиридина (Пример получения 86, 795 мг, 2,42 ммоль), 2-(3-этокси-5-фтор-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 132, 652 мг, 2,2 ммоль), Pd(dppf)Cl2.ДХМ и K2CO3 (760 мг, 5,5 ммоль) суспендируют в 1,4-диоксане (20 мл) и воде (0,7 мл). Смесь дегазируют и нагревают до примерно 85°C под N2 в течение примерно 9 ч. Смесь концентрируют и МТБЭ (50 мл) добавляют, перемешивая в течение примерно 20 мин. Смесь фильтруют, и фильтрат концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (100:0 до 80:20) с получением 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-этокси-5-фтор-4-метоксифенил)пиридина (660 мг, 72%). 1H ЯМР (CDCl3, 400 МГц): δ 8,66 (дд, J=2,2, 15,4 Гц, 2H), 7,82 (т, J=2,0 Гц, 1H), 6,94 (дд, J=2,2, 11,0 Гц, 1H), 6,88 (т, J=1,7 Гц, 1H), 5,50-5,57 (м, 2H), 4,54-4,57 (м, 2H), 4,18 (кв, J=7,0 Гц, 2H), 3,98 (с, 3H), 1,50 (т, J=7,1 Гц, 3H), 0,92 (с, 9H), 0,12 (с, 6H). ЖХМС m/z=418 [MH]+.
Пример получения 59: 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-хлор-5-этокси-4-метоксифенил)пиридин

3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-хлор-5-этокси-4-метоксифенил)пиридин (840 мг, 61%) получают по методике, аналогичной Примеру получения 58 с применением 2-(3-хлор-5-этокси-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 133, 1,0 г, 3,2 ммоль). 1H ЯМР (CDCl3,400 МГц): δ 8,66 (дд, J=2,2, 11,5 Гц, 2H), 7,83 (т, J=2,2 Гц, 1H), 7,19 (д, J=2,0 Гц, 1H), 6,99 (д, J=2,0 Гц, 1H), 5,53 (дд, J=1,5, 12,2 Гц, 2H), 4,52-4,63 (м, 2H), 4,17 (кв, J=7,2 Гц, 2H), 3,94 (с, 3H), 1,51 (т, J=6,9 Гц, 3H), 0,90-0,97 (м, 9H), 0,08-0,15 (м, 6H).
Пример получения 60: 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(5-этокси-2-фтор-4-метоксифенил)пиридин
3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(5-этокси-2-фтор-4-метоксифенил)пиридин (400 мг, 89%) получают по методике, аналогичной Примеру получения 50 с применением 3-бром-5-(5-этокси-2-фтор-4-метоксифенил)пиридина (Пример получения 101, 350 мг, 1,07 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 8,66 (т, J=1,7 Гц, 1H), 8,62 (д, J=2,2 Гц, 1H), 7,84-7,86 (м, 1H), 6,91 (д, J=7,3 Гц, 1H), 6,75 (д, J=11,7 Гц, 1H), 5,50-5,53 (м, 2H), 4,56 (т, J=1,3 Гц, 2H), 4,12 (кв, J=7,0 Гц, 2H), 3,92 (с, 3H), 1,48 (т, J=7,0 Гц, 3H), 0,92 (с, 9H), 0,11 (с, 6H). ЖХМС m/z=418 [MH]+.
Пример получения 61: 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(2-хлор-5-этокси-4-метоксифенил)пиридин

3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(2-хлор-5-этокси-4-метоксифенил)пиридин (2,1 г, 48%) получают по методике, аналогичной Примеру получения 58 с применением 2-(2-хлор-5-этокси-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 135, 3,13 г, 10,0 ммоль). ЖХМС m/z=434 [MH]+.
Пример получения 62: 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(2-фтор-4-метокси-5-пропоксифенил)пиридин

3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(2-фтор-4-метокси-5-пропоксифенил)пиридин (5,0 г, 99%) получают по методике, аналогичной Примеру получения 50 с применением 3-бром-5-(2-фтор-4-метокси-5-пропоксифенил)пиридина (Пример получения 102, 7,0 г, 9,0 ммоль). 1H ЯМР (CDCl3,400 МГц): δ 8,66 (с, 1H), 8,62 (д, J=2,0 Гц, 1H), 7,85 (д, J=1,5 Гц, 1H), 6,92 (д, J=7,3 Гц, 1H), 6,76 (д, J=11,7 Гц, 1H), 5,52 (д, J=9,8 Гц, 2H), 4,55 (с, 2H), 4,00 (т, J=6,8 Гц, 2H), 3,91 (с, 3H), 1,84-1,93 (м, 2H), 1,06 (т, J=7,3 Гц, 3H), 0,94-0,92 (м, 9H), 0,12-0,11 (м, 6H). ЖХМС m/z=432 [MH]+.
Пример получения 63: 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(4-(дифторметокси)-3-пропоксифенил)пиридин
3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(4-(дифторметокси)-3-пропоксифенил)пиридин (2,1 г, 62%) получают по методике, аналогичной Примеру получения 58 с применением 2-(4-(дифторметокси)-3-пропоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 142, 2,46 г, 7,5 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 8,66-8,71 (м, 2H), 7,85 (д, J=2,1 Гц, 1H), 7,27-7,29 (м, 1H), 7,12-7,14 (м, 2H) 6,63 (т, J=75,3 Гц, 1H), 5,53 (д, J=12,0 Гц, 2H), 4,56 (с, 2H), 4,07 (т, J=6,4 Гц, 2H), 1,85-1,94 (м, 2H), 1,09 (т, J=7,4 Гц, 3H), 0,92 (с, 9H), 0,12 (с, 6H). ЖХМС m/z=450 [MH]+.
Пример получения 64: 5'-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-3-фтор-5-метокси-6-пропокси-2,3'-бипиридин

К смеси 5'-хлор-3-фтор-5-метокси-6-пропокси-2,3'-бипиридина (Пример получения 103, 3,0 г, 10,11 ммоль) и трет-бутилдиметил((2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)аллил)окси)силана (Пример получения 146, 12,1 г, 40,4 ммоль) в 1,4-диоксане (300 мл) добавляют Xphos Pd G2 (CAS 1310584-14-5, 0,64 г, 0,81 ммоль), Pd(dppf)-tBu (0,66 г, 1,01 ммоль), K2CO3 (2,79 г, 20,2 ммоль) и KOAc (0,50 г, 5,06 ммоль). Смесь дегазируют, нагревают до примерно 70°C в течение примерно 16 ч под N2. Смесь разбавляют EtOAc (50 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (100:0 до 85:15) с получением 5'-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-3-фтор-5-метокси-6-пропокси-2,3'-бипиридина (3,1 г, 71%). 1H ЯМР (CDCl3, 400 МГц): δ 9,13-9,14 (м, 1H), 8,62 (д, J=2,1 Гц, 1H), 8,28 (т, J=2,1 Гц, 1H), 6,97 (д, J=11,4 Гц, 1H), 5,51-5,54 (м, 2H), 4,57 (т, J=1,5 Гц, 2H), 4,44 (т, J=7,0 Гц, 2H), 3,93 (с, 3H), 1,86-1,95 (м, 2H), 1,06 (т, J=7,5 Гц, 3H), 0,93 (с, 9H), 0,12 (с, 6H). ЖХМС m/z=433 [MH]+
Пример получения 65: 5'-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-6-метокси-5-пропокси-3,3'-бипиридин
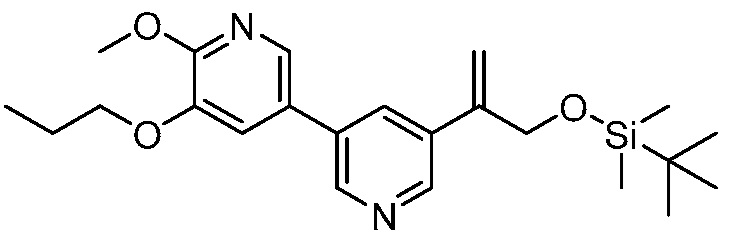
5'-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-6-метокси-5-пропокси-3,3'-бипиридин (4,85 г, 87%) получают по методике, аналогичной Примеру получения 58 с применением 2-метокси-3-пропокси-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина (Пример получения 124, 3,95 г, 13,5 ммоль). 1H ЯМР (CDCl3,400 МГц): δ 8,67 (дд, J =2,2, 16,9 Гц, 2H), 7,9 (д, J=2,2 Гц, 1H), 7,83 (т, J=2,2 Гц, 1H), 7,23 (д, J=2,0 Гц, 1H), 5,47-5,60 (м, 2H), 4,56 (т, J=1,3 Гц, 2H), 4,03-4,08 (м, 5H), 1,90-1,99 (м, 2H), 1,04-1,13 (м, 3H), 0,92 (с, 9H), 0,10-0,13 (м, 6H).
Пример получения 66: 5-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-3-(3-этокси-4-метоксифенил)-2-метилпиридин

3-Бром-5-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-метилпиридин (Пример получения 87, 1,28 г, 3,7 ммоль) и 2-(3-этокси-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (Пример получения 113, 1,25 г, 4,49 ммоль), Pd(dppf)Cl2 (274 мг, 0,374 ммоль) и K2CO3 (1,29 г, 9,35 ммоль) суспендируют в 1,4-диоксане (60 мл) и воде (2 мл). Смесь дегазируют и нагревают до примерно 80°C под N2 в течение примерно 5 ч. Смесь концентрируют и к остатку добавляют МТБЭ (100 мл), затем перемешивают в течение примерно 20 мин. Смесь фильтруют, и фильтровальную лепешку промывают МТБЭ (50 мл). Объединенные фильтраты сушат и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (100:0-85:15) с получением 5-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-3-(3-этокси-4-метоксифенил)-2-метилпиридина (640 мг, 41%). 1H ЯМР (CDCl3, 400 МГц): δ 8,54 (д, J=2,5 Гц, 1H), 7,54 (д, J=2,0 Гц, 1H), 6,94-6,97 (м, 1H), 6,85-6,88 (м, 1H), 6,83-6,84 (м, 1H), 5,48 (д, J=1,5 Гц, 1H), 5,43-5,45 (м, 1H), 4,52 (т, J=1,5 Гц, 2H), 4,12 (кв, J=7,0 Гц, 2H), 3,93 (с, 3H), 2,51 (с, 3H), 1,49 (т, J=7,0 Гц, 3H), 0,90-0,93 (м, 9H), 0,09-0,11 (м, 6H). ЖХМС m/z=414 [MH]+.
Пример получения 67: 4-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-(4-метокси-3-пропоксифенил)-6-(трифторметил)пиримидин

К смеси 4-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-хлор-6-(трифторметил)пиримидина (Пример получения 90, 1,33 г, 3,77 ммоль) в 1,4-диоксане (40 мл) добавляют 2-(4-метокси-3-пропоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (Пример получения 114, 1,32 г, 4,52 ммоль), K3PO4 (3,01 г, 11,3 ммоль) и Pd(dppf)Cl2 (0,41 г, 0,57 ммоль). Смесь дегазируют и нагревают до примерно 90°C в течение примерно 5 ч под N2. Смесь концентрируют и остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир:EtOAc (100:0 до 90:10) с получением 4-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-(4-метокси-3-пропоксифенил)-6-(трифторметил)пиримидина (1,27 г, 70%). 1H ЯМР (CDCl3, 400 МГц): δ 8,13-8,16 (м, 1H), 8,07 (д, J=2,0 Гц, 1H), 7,61 (с, 1H), 6,99 (д, J=8,6 Гц, 1H), 6,31 (д, J=1,1 Гц, 1H), 5,95 (д, J=1,0 Гц, 1H), 4,65 (т, J=1,6 Гц, 2H), 4,13 (т, J=6,9 Гц, 2H), 3,96 (с, 3H), 1,90-1,99 (м, 2H), 1,10 (т, J=7,5 Гц, 3H), 0,97 (с, 9H), 0,13 (с, 6H). ЖХМС m/z=483 [MH]+
Пример получения 68: 2-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-6-(3-этокси-4-метоксифенил)пиразин

2-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-6-(3-этокси-4-метоксифенил)пиразин (1,26 г, 65%) получают по методике, аналогичной Примеру получения 50 с применением 2-бром-6-(3-этокси-4-метоксифенил)пиразина (Пример получения 104, 1,5 г, 4,9 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 8,77-8,90 (м, 1H), 8,68 (с, 1H), 7,69 (д, J=2,0 Гц, 1H), 7,60 (дд, J=2,1, 8,44 Гц, 1H), 6,99 (д, J=8,3 Гц, 1H), 6,07 (кв, J=1,4 Гц, 1H), 5,77 (кв, J=1,9 Гц, 1H), 4,80 (т, J=1,7 Гц, 2H), 4,23 (кв, J=7,0 Гц, 2H), 3,96 (с, 3H), 1,53 (т, J=7,0 Гц, 3H), 0,90-0,98 (м, 9H), 0,13-0,18 (м, 6H). ЖХМС m/z=401 [MH]+.
Пример получения 69: этил 2-(6-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)ацетат

Этил 2-(6-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)ацетат (5,6 г, 82%) получают по методике, аналогичной Примеру получения 50 с применением этил 2-(6-хлор-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)ацетата (Пример получения 105, 5 г, 13,7 ммоль). 1H ЯМР (CD3OD, 400 МГц): δ 8,05 (дд, J=2,1, 8,4 Гц, 1H), 8,01-8,03 (м, 1H), 7,46 (с, 1H), 7,05 (д, J=8,6 Гц, 1H), 6,24 (д, J=1,2 Гц, 1H), 5,81 (д, J=1,5 Гц, 1H), 4,81 (т, J=1,6 Гц, 2H), 4,21 (кв, J=7,1 Гц, 2H), 4,05 (т, J=6,6 Гц, 2H), 3,91 (с, 3H), 3,88 (с, 2H), 1,80-1,92 (м, 2H), 1,26-1,31 (м, 3H), 1,08 (т, J=7,5 Гц, 3H), 0,95 (с, 9H), 0,13-0,16 (м, 6H). ЖХМС m/z=501 [MH]+.
Пример получения 70: 4-(((трет-бутилдиметилсилил)окси)метил)-6-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-(4-метокси-3-пропоксифенил)пиримидин

4-(((трет-бутилдиметилсилил)окси)метил)-6-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-(4-метокси-3-пропоксифенил)пиримидин (1 г, 77%) получают по методике, аналогичной Примеру получения 58 с применением 4-(((трет-бутилдиметилсилил)окси)метил)-6-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-хлорпиримидина (Пример получения 89, 2,0 г, 5,2 ммоль) и 2-(4-метокси-3-пропоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 114, 0,817 г, 2,8 ммоль) при примерно 90°C и замещением K3PO4 (1,55 г, 5,80 ммоль) на K2CO3. 1H ЯМР (CDCl3, 400 МГц): δ 8,02-8,08 (м, 2H), 7,52 (с, 1H), 6,94-6,99 (м, 1H), 6,20 (д, J=1,5 Гц, 1H), 5,84 (д, J=1,5 Гц, 1H), 4,80-4,86 (м, 4H), 4,09-4,15 (м, 2H), 3,93-3,96 (м, 3H), 1,91-1,98 (м, 2H), 1,09 (т, J=7,5 Гц, 3H), 1,00 (с, 9H), 0,97 (с, 9H), 0,17 (с, 6H), 0,15 (с, 6H). ЖХМС m/z=559 [MH]+.
Пример получения 71: 2-(4-((трет-бутилдиметилсилил)окси)бут-1-ен-2-ил)-6-(4-метокси-3-пропоксифенил)пиридин

2-(4-((трет-бутилдиметилсилил)окси)бут-1-ен-2-ил)-6-(4-метокси-3-пропоксифенил)пиридин (900 мг, 68%) получают по методике, аналогичной Примеру получения 50 с применением 2-бром-6-(4-метокси-3-пропоксифенил)пиридина (Пример получения 93b, 1000 мг, 3,10 ммоль) и трет-бутилдиметил((3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бут-3-ен-1-ил)окси)силана (Пример получения 148, 969 мг, 3,10 ммоль). ЖХМС m/z=428 [MH]+.
Пример получения 72: 5-(3-((трет-бутилдиметилсилил)окси)бут-1-ен-2-ил)-3-(4-метокси-3-пропоксифенил)пиридазин
5-(3-((трет-бутилдиметилсилил)окси)бут-1-ен-2-ил)-3-(4-метокси-3-пропоксифенил)пиридазин (3,0 г, 89%) получают по методике, аналогичной Примеру получения 50 с применением 5-хлор-3-(4-метокси-3-пропоксифенил)пиридазина (Пример получения 107, 2,2 г, 7,9 ммоль) и трет-бутилдиметил((3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бут-3-ен-2-ил)окси)силана (Пример получения 147, 4,9 г, 15,8 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 9,14 (д, J=2,0 Гц, 1H), 7,91 (д, J=2,0 Гц, 1H), 7,86 (д, J=2,0 Гц, 1H), 7,53 (дд, J=2,0, 8,3 Гц, 1H), 7,00 (д, J=8,3 Гц, 1H), 5,58 (с, 1H), 5,53 (с, 1H), 4,08-4,18 (м, 3H), 3,95 (с, 3H), 1,86-1,99 (м, 2H), 1,29 (д, J=6,9 Гц, 3H), 1,08 (т, J=7,3 Гц, 3H), 0,93 (с, 9H), 0,12 (д, J=19,6 Гц, 6H). ЖХМС m/z=429 [MH]+.
Пример получения 73: 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-этокси-4-метоксифенил)-4-метилпиридин

3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(3-этокси-4-метоксифенил)-4-метилпиридин (0,8 г, 77%) получают по методике, аналогичной Примеру получения 50 с применением 3-бром-5-(3-этокси-4-метоксифенил)-4-метилпиридина (Пример получения 108, 0,81 г, 3,28 ммоль) и трет-бутилдиметил((2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)аллил)окси)силана (Пример получения 146, 0,98 г, 3,28 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 8,35 (с, 1H), 8,26 (с, 1H), 6,95 (д, J=8,2 Гц, 1H), 6,83-6,86 (м, 1H), 6,78 (д, J=2,0 Гц, 1H), 5,61-5,63 (m 1H), 5,10-5,12 (м, 1H), 4,31-4,32 (м, 2H), 4,12 (кв, J=7,0 Гц, 2H), 3,93 (с, 3H), 2,21 (с, 3H), 1,48 (т, J=7,0 Гц, 3H), 0,91 (с, 9H), 0,08 (с, 6H). ЖХМС m/z=414 [MH]+.
Пример получения 74: 4-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-(3-этокси-4-метоксифенил)тиазол

4-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-(3-этокси-4-метоксифенил)тиазол получают (0,8 г, 91%) по методике, аналогичной Примеру получения 50 с применением 4-бром-2-(3-этокси-4-метоксифенил)тиазола (Пример получения 109, 0,68 г, 2,16 ммоль) и трет-бутилдиметил((2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)аллил)окси)силана (Пример получения 146, 0,84 г, 2,81 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,57 (д, J=2,3Гц, 1H), 7,58 (дд, J=2,3, 8,3Гц, 1H), 7,17 (с, 1H), 6,91 (д, J=8,3Гц, 1H), 6,07-6,08 (м, 1H), 5,50-5,52 (м, 1H), 4,60-4,61 (м, 1H), 4,22 (кв, J=7,0Гц, 2H), 3,93 (с, 3H), 1,52 (т, J=7,0Гц, 3H), 0,99 (с, 1H), 0,95 (с, 9H), 0,13 (с, 6H). ЖХМС m/z=406 [MH]+.
Пример получения 75: 2-((трет-бутилдиметилсилил)окси)-1-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)этан-1-он
К смеси 1-(6-бромпиридин-2-ил)-2-((трет-бутилдиметилсилил)окси)этан-1-она (Пример получения 88, 1270 мг, 4,36 ммоль), K2CO3 (1000 мг, 7,27 ммоль), KOAc (357 мг, 3,63 ммоль), Pd(dppf)Cl2.ДХМ (151 мг, 0,182 ммоль) и раствору 2-(4-метокси-3-пропоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 114, 1200 мг, 3,633 ммоль) в 1,4-диоксане (24 мл) добавляют воду (2,4 мл). Смесь дегазируют и нагревают до примерно 90°C в течение примерно 16 ч под N2. Реакционную смесь фильтруют через слой MgSO4 и гелевый диоксид кремния, промывая ДХМ и EtOAc. Фильтрат концентрируют и остаток очищают колоночной хроматографией (диоксид кремния) и элюируют гептан/EtOAc (100:0 до 95:5) с получением 2-((трет-бутилдиметилсилил)окси)-1-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)этан-1-она (1,21 г, 80%). 1H ЯМР (CDCl3, 400 МГц): δ 7,84-7,93 (м, 3H), 7,72 (д, J=2,0 Гц, 1H), 7,58 (дд, J=2,0, 8,6 Гц, 1H), 7,00 (д, J=8,6 Гц, 1H), 5,42 (с, 2H), 4,12 (т, J=6,8 Гц, 2H), 3,95 (с, 3H), 1,90-2,00 (м, 2H), 1,10 (т, J=7,4 Гц, 3H), 1,00 (с, 9H), 0,16-0,20 (м, 6H). ЖХМС m/z=416 [MH]+.
Пример получения 76: 2-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)проп-2-ен-1-ол

2-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)проп-2-ен-1-ол (321 мг, 61%) получают по методике, аналогичной Примеру получения 50 с применением 3-бром-5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридина (Пример получения 100, 558 мг, 1,56 ммоль) при примерно 100°C в течение примерно 15 ч. 1H ЯМР (CDCl3, 400 МГц): δ 8,70 (д, J=2,0 Гц, 1H), 8,52 (д, J=2,0 Гц, 1H), 7,76-7,79 (м, 1H), 7,07 (д, J=8,6 Гц, 1H), 7,01 (д, J=8,6 Гц, 1H), 6,96 (т, J=54,4 Гц, 1H), 5,60 (с, 1H), 5,49 (с, 1H), 4,58 (с, 2H), 4,12-4,22 (м, 2H), 3,93 (с, 3H), 1,75 (шс, 1H), 1,43 (т, J=7,0 Гц, 3H,). ЖХМС m/z=336 [MH]+.
Пример получения 77: 3-(5-(йодметил)-2,2-диметил-1,3-диоксан-5-ил)-5-(4-метокси-3-пропоксифенил)пиридин

К раствору (5-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-2,2-диметил-1,3-диоксан-5-ил)метилметансульфоната (Пример получения 78, 140 мг, 0,30 ммоль) в ацетоне (1,20 мл) добавляют йодид лития (201 мг, 1,50 ммоль). Раствор перемешивают при примерно 50°C в течение примерно 16 ч. Реакционную смесь охлаждают до примерно 50°C, разбавляют EtOAc, промывают водой, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют гептаном/EtOAc (100:0 до 0:100) с получением 3-(5-(йодметил)-2,2-диметил-1,3-диоксан-5-ил)-5-(4-метокси-3-пропоксифенил)пиридина (138 мг, 92%). 1H ЯМР (CDCl3, 400 МГц): δ 8,74 (д, J=2,0 Гц, 1H), 8,45 (д, J=2,3 Гц, 1H), 7,66 (т, J=2,0 Гц, 1H), 7,08-7,17 (м, 2H), 7,00 (д, J=8,2 Гц, 1H), 4,25-4,37 (м, 2H), 4,14-4,23 (м, 2H), 4,07 (т, J=6,8 Гц, 2H), 3,93 (с, 3H), 3,81 (с, 2H), 1,92 (квд, J=7,2, 14,3 Гц, 2H), 1,49 (д, J=18,3 Гц, 6H), 1,08 (т, J=7,4 Гц, 3H). ЖХМС m/z=498 [MH]+.
Пример получения 78: (5-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-2,2-диметил-1,3-диоксан-5-ил)метилметансульфонат

К смеси (5-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-2,2-диметил-1,3-диоксан-5-ил)метанола (Пример получения 79, 128 мг, 0,33 ммоль) в ДХМ (7,0 мл) добавляют Me3N (84 мкл, 0,60 ммоль), затем MsCl (33 мкл, 0,43 ммоль). Раствор перемешивают при примерно 20°C в течение примерно 3,5 ч. Смесь концентрируют и остаток очищают колоночной хроматографией (диоксид кремния) и элюируют гептаном/EtOAc (100:0 до 0:100) с получением (5-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-2,2-диметил-1,3-диоксан-5-ил)метилметансульфоната (144 мг, 94%). 1H ЯМР (CDCl3, 400 МГц): δ 8,75 (д, J=2,0 Гц, 1H), 8,47 (д, J=2,0 Гц, 1H), 7,72 (т, J=2,1 Гц, 1H), 7,08-7,17 (м, 2H), 6,99 (д, J=8,2 Гц, 1H), 4,78 (с, 2H), 4,20-4,28 (м, 2H), 4,03-4,18 (м, 4H), 3,93 (с, 3H), 2,92-3,01 (м, 3H), 1,87-1,96 (м, 2H), 1,51 (д, J=4,3 Гц, 6H), 1,08 (т, J=7,4 Гц, 3H).
Пример получения 79: (5-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-2,2-диметил-1,3-диоксан-5-ил)метанол

К раствору 2-(гидроксиметил)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропан-1,3-диола (Пример получения 80, 406 мг, 1,17 ммоль) в ДХМ (12 мл) добавляют 2,2-диметоксипропан (0,43 мл, 3,51 ммоль) и pTSOH (33 мг, 0,18 ммоль). Раствор перемешивают при примерно 40°C в течение примерно 24 ч и примерно 20°C в течение примерно 4 дней. Раствор концентрируют, и остаток очищают колоночной хроматографией (диоксид кремния) и элюируют гептан/EtOAc (100:0 до 0:100 градиент) с получением (5-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-2,2-диметил-1,3-диоксан-5-ил)метанола (129 мг, 28%). 1H ЯМР (CDCl3, 400 МГц): δ 8,71 (д, J=2,3 Гц, 1H), 8,50 (д, J=2,0 Гц, 1H), 7,75 (т, J=2,1 Гц, 1H), 7,05-7,15 (м, 2H), 6,99 (д, J=8,6 Гц, 1H), 4,19 (д, J=5,5 Гц, 3H), 4,12-4,17 (м, 3H), 4,06 (т, J=6,8 Гц, 2H), 3,93 (с, 3H), 1,91 (квд, J=7,2, 14,4 Гц, 2H), 1,62-1,64 (м, 1H), 1,49 (д, J=5,1 Гц, 6H), 1,08 (т, J=7,4 Гц, 3H). ЖХМС m/z=388 [MH]+.
Пример получения 80: 2-(гидроксиметил)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропан-1,3-диол

К раствору метил 3-гидрокси-2-(гидроксиметил)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропаноата (Пример получения 81, 250 мг, 0,67 ммоль) в метаноле (2,0 мл) добавляют LiBH4 (17,5 мг, 0,80 ммоль). Раствор перемешивают при примерно 20°C в течение примерно 21 ч. Смесь обрабатывают насыщенным водным NH4Cl и экстрагируют ДХМ. ДХМ экстракты промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют с получением 2-(гидроксиметил)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропан-1,3-диола (55 мг, 24%). 1H ЯМР (CDCl3, 400 МГц): δ 8,49 (шс, 1H), 8,28 (шс, 1H), 7,90 (шс, 1H), 6,83-7,00 (м, 2H), 6,77 (д, J=8,6 Гц, 1H), 4,78 (шс, 2H), 4,04 (шс, 5H), 3,74-3,99 (м, 6H), 1,74-1,91 (м, 2H), 1,26 (с, 1H), 1,00 (т, J=7,4 Гц, 3H). ЖХМС m/z=348 [MH]+.
Пример получения 81: метил 3-гидрокси-2-(гидроксиметил)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропаноат

К раствору метил 2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)ацетата (Пример получения 84, 65 г, 210 ммоль) в ДМСО (200 мл) добавляют параформальдегид (6,81 г, 227 ммоль), затем ДМСО (300 мл). NaOMe (2,23 г, 41,2 ммоль) добавляют, затем еще 100 мл ДМСО. Смесь перемешивают при примерно 20°C в течение примерно 18 ч. Смесь разбавляют водой (1200 мл) и экстрагируют диэтиловым эфиром и EtOAc. Объединенные экстракты диэтилового эфира и EtOAc промывают водой, насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Остаток перемешивают EtOH (200 мл) при примерно 65°C до растворения остатка. Раствор охлаждают до примерно 20°C при перемешивании в течение примерно 2 ч. Смесь охлаждают до примерно 0°C (баня с ледяной водой) в течение еще 1 ч. Смесь фильтруют, и фильтровальную лепешку промывают ледяным EtOH. Объединенные EtOH фильтраты концентрируют и остаток очищают колоночной хроматографией (диоксид кремния) элюируя EtOAc/MeOH (95:5) с получением метил 3-гидрокси-2-(гидроксиметил)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропаноата (5,46 г, 7%). 1H ЯМР (CDCl3, 400 МГц): δ 8,64 (д, J=2,0 Гц, 1H), 8,40 (д, J=2,0 Гц, 1H), 7,71 (т, J=2,0 Гц, 1H), 7,25 (с, 1H), 6,98 -7,10 (м, 2H), 6,94 (т, J=7,3 Гц, 1H), 4,36 (д, J=11,3 Гц, 2H), 4,24 (д, J=11,3 Гц, 2H), 4,02 (т, J=6,6 Гц, 2H), 3,90 (с, 3H), 3,79 (с, 3H), 2,03 (с, 1H), 1,78-1,97 (м, 2H), 1,05 (т, J=7,4 Гц, 3H).
Пример получения 82: 2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропан-1,3-диол

К ледяному раствору метил 3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропаноата (Пример получения 83, 26,4 г, 73,5 ммоль) в MeOH (350 мл) добавляют LiBH4 (3,2 г, 147 ммоль) 3 порциями. Смесь перемешивают в течение примерно 1 ч. Смесь концентрируют и разбавляют ДХМ. Смесь промывают 2N NaOH. Слой ДХМ отделяют, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют ДХМ/MeOH (100:0 до 90:10) с получением 2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропан-1,3-диола (20,3 г, 87%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,68 (д, J=2,3 Гц, 1H), 8,37 (д, J=2,0 Гц, 1H), 7,84 (т, J=2,3 Гц, 1H), 7,21-7,25 (м, 2H), 7,06 (д, J=8,2 Гц, 1H), 4,64 (т, J=5,4 Гц, 2H), 4,03 (т, J=6,6 Гц, 2H), 3,81 (с, 3H), 3,65-3,79 (м, 4H), 2,89-2,95 (м, 1H), 1,72-1,80 (м, 2H), 1,00 (т, J=7,4 Гц, 3H). ЖХМС m/z=318 [MH]+.
Пример получения 83: метил 3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропаноат

Смесь метил 2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)ацетата (Пример получения 84, 30,0 г, 95 ммоль), параформальдегида (3,14 г, 105 ммоль) и NaOMe (1,03 г, 19,0 ммоль) в безводном ДМСО (317 мл) перемешивают при примерно 20°C в течение примерно 16 ч. Смесь разбавляют водой (1200 мл) и экстрагируют диэтиловым эфиром и EtOAc. Объединенные экстракты диэтилового эфира и EtOAc промывают водой, насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Остаток растворяют в горячем EtOH (120 мл). Раствор охлаждают до примерно 20°C при перемешивании. Дальнейшее охлаждение, до примерно 0°C (ледяная баня) дает осадок, который фильтруют с получением метил 3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропаноата (15,6 г). Фильтрат концентрируют и очищают колоночной хроматографией (диоксид кремния) с получением дополнительного твердого вещества (10,8 г). Твердые вещества объединяют с получением метил 3-гидрокси-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропаноата (26,4 г, 78%). 1H ЯМР (CDCl3, 400 МГц): δ 8,72 (д, J=2,0 Гц, 1H), 8,45 (д, J=2,3 Гц, 1H), 7,76 (т, J=2,0 Гц, 1H), 7,07-7,12 (м, 2H), 6,97 (д, J=8,6 Гц, 1H), 4,16-4,22 (м, 1H), 4,05 (т, J=7,0 Гц, 2H), 3,91-3,99 (м, 5H), 3,76 (с, 3H), 2,66-2,70 (м, 1H), 1,67-1,95 (м, 2H), 1,08 (т, J=7,4 Гц, 3H). ЖХМС m/z=346 [MH]+.
Пример получения 84: метил 2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)ацетат

Смесь метил 2-(5-бромпиридин-3-ил)ацетата (55,5 г, 241,0 ммоль), 2-(4-метокси-3-пропоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 114, 84,7 г, 290 ммоль) и безводного Na2CO3 (51,1 г, 482 ммоль) в 1,4-диоксане (700 мл) и воде (180 мл) дегазируют и перемешивают при примерно 20°C в течение примерно 20 мин под N2. Pd(dppf)Cl2 (9,85 г, 12,1 ммоль) добавляют к смеси, затем нагревают до примерно 85°C в течение примерно 18 ч под N2. Реакционную смесь охлаждают до примерно 20°C и концентрируют. Остаток разделяют между водой и EtOAc. Водный слой экстрагируют EtOAc. Объединенные EtOAc экстракты промывают водой, насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) элюируя гептаном/EtOAc (85:15 до 40:60) с получением метил 2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)ацетата (75,4 г, 88%). 1H ЯМР (CDCl3, 400 МГц): δ 8,72 (д, J=2,0 Гц, 1H), 8,46 (д, J=2,0 Гц, 1H), 7,77 (т, J=2,0 Гц, 1H), 7,13 (дд, J=2,3, 8,6 Гц, 1H), 7,09 (д, J=2,3 Гц, 1H), 6,98 (д, J=8,6 Гц, 1H), 4,06 (т, J=6,8 Гц, 2H), 3,92 (с, 3H), 3,70 (с, 2H), 2,94 (с, 3H), 1,86-1,95 (м, 2H), 1,08 (т, J=7,4 Гц, 3H). ЖХМС m/z=316 [MH]+.
Пример получения 85: метил 2-(2'-циано-4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)ацетат

К раствору 6-бром-3-метокси-2-пропоксибензонитрила (Пример получения 171, 10,0 г, 37,02 ммоль), (3-(2-метокси-2-оксоэтил)фенил)бороновой кислоты (7,18 г, 37,02 ммоль), Pd(dppf)Cl2 (1,35 г, 1,85 ммоль), KOAc (3,63 г, 37,02 ммоль) и Na2CO3 (7,85 г, 74,04 ммоль) в 1,4-диоксане (100 мл) и воде (5 мл) дегазируют и нагревают до примерно 90°C в течение примерно 5 ч под N2. Смесь фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (4:1) с получением метил 2-(2'-циано-4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)ацетата (12,0 г, 96%). 1H ЯМР (CDCl3, 400 МГц): δ 7,40-7,44 (м, 3H), 7,33 (д, J=6,8 Гц, 1H), 7,15 (д, J=8,8 Гц, 2H), 4,18 (т, J=6,8 Гц, 2H), 3,92 (с, 3H), 3,71 (д, J=5,6 Гц, 5H), 1,83-1,92 (м, 2H), 1,09 (т, J=7,2 Гц, 3H).
Пример получения 86: 3-бром-5-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)пиридин

Смесь трет-бутилдиметил((2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)аллил)окси)силана (Пример получения 146, 14,9 г, 50 ммоль), 3,5-дибромпиридина (12,4 г, 52,5 ммоль), Pd(dppf)Cl2 (1,83 г, 2,5 ммоль) и K2CO3 (20,7 г, 150 ммоль) суспендируют в 1,4-диоксане (300 мл) и воде (20 мл). Смесь дегазируют и нагревают до примерно 85°C в течение примерно 5 ч под N2. Смесь вынимают из тепла и выдерживают в течение выходных. Смесь концентрируют, МТБЭ (100 мл) добавляют и перемешивают в течение примерно 20 мин. Смесь фильтруют и фильтровальную лепешку промывают МТБЭ (50 мл). Объединенные МТБЭ фильтраты сушат и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) элюируя пет. эфир/EtOAc (100:0 до 95:5) с получением 3-бром-5-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)пиридина (8,5 г, 51,8%). 1H ЯМР (CDCl3, 400 МГц): δ 8,55-8,63 (м, 2H), 7,84-7,93 (м, 1H), 5,44-5,55 (м, 2H), 4,49 (т, J=1,5 Гц, 2H), 0,91 (с, 9H), 0,10 (с, 6H). ЖХМС m/z=329 [MH]+.
Пример получения 87: 3-бром-5-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-метилпиридин
Смесь трет-бутилдиметил((2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)аллил)окси)силана (Пример получения 146, 4,2 г, 14,08 ммоль), 3,5-дибром-2-метилпиридина (3,71 г, 14,8 ммоль), Pd(dppf)Cl2 (1030 мг, 1,41 ммоль) и K2CO3 (5,84 г, 42,2 ммоль) суспендируют в 1,4-диоксане (150 мл) и воде (5 мл). Смесь дегазируют и нагревают до примерно 80°C в течение примерно 5 ч под N2. Смесь концентрируют и добавляют МТБЭ (100 мл), перемешивая в течение примерно 20 мин. Смесь фильтруют, и фильтровальную лепешку промывают МТБЭ (50 мл). Объединенные МТБЭ фильтраты концентрируют и остаток очищают колоночной хроматографией (диоксид кремния) элюируя пет. эфир/EtOAc (100:0 до 95:5) с получением 3-бром-5-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-метилпиридина (930 мг, 19,3%). 1H ЯМР (CDCl3, 400 МГц): δ 8,46-8,53 (м, 1H), 7,86 (д, J=2,0 Гц, 1H), 5,41-5,50 (м, 2H), 4,43-4,54 (м, 2H), 2,66 (с, 3H), 0,92 (с, 9H), 0,10 (с, 6H).
Пример получения 88: 1-(6-бромпиридин-2-ил)-2-((трет-бутилдиметилсилил)окси)этан-1-он

Раствор 1-(6-бромпиридин-2-ил)-2-гидроксиэтан-1-она (Пример получения 237, 977 мг, 4,52 ммоль) и ДХМ (30 мл) охлаждают до примерно 0°C, добавляют имидазол (770 мг, 11,3 ммоль) и ТБС-Cl (750 мг, 4,97 ммоль). Смесь перемешивают при примерно 0°C в течение примерно 2,5 ч. Реакционную смесь гасят водой и слои разделяют. ДХМ слой промывают водой и насыщенным раствором соли. ДХМ слой пропускают через слой MgSO4 и гелевый диоксид кремния. Фильтрат концентрируют с получением 1-(6-бромпиридин-2-ил)-2-((трет-бутилдиметилсилил)окси)этан-1-она (1,35 г, 90%). 1H ЯМР (CDCl3, 400 МГц): δ 7,93-8,04 (м, 1H), 7,62-7,78 (м, 2H), 5,21 (с, 2H), 0,97 (с, 9H), 0,15 (с, 6H).
Пример получения 89: 4-(((трет-бутилдиметилсилил)окси)метил)-6-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-хлорпиримидин

4-(((трет-бутилдиметилсилил)окси)метил)-6-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-хлорпиримидин (0,9 г, 34%) получают по методике, аналогичной Примеру получения 50 с применением 4-(((трет-бутилдиметилсилил)окси)метил)-2,6-дихлорпиримидина (Пример получения 230, 1,65 г, 5,5 ммоль) и K3PO4 в качестве основания. 1H ЯМР (CDCl3, 400 МГц): δ 7,63 (с, 1H), 6,23 (д, J=1,5 Гц, 1H), 5,87 (д, J=1,5 Гц, 1H), 4,76 (д, J=1,0 Гц, 2H), 4,62-4,66 (м, 2H), 0,97-0,99 (м, 9H), 0,94 (с, 9H), 0,12-0,16 (м, 12H). ЖХМС m/z=429 [MH]+.
Пример получения 90: 4-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-хлор-6-(трифторметил)пиримидин

4-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-2-хлор-6-(трифторметил)пиримидин (1,33 г, 66%) получают по методике, аналогичной Примеру получения 50 с применением 2,4-дихлор-6-(трифторметил)пиримидина (CAS 16097-64-6, 1,24 г, 5,72 ммоль) и замещая K3PO4 (4,57 г, 17,1 ммоль) на K2CO3. 1H ЯМР (CDCl3, 400 МГц): δ 7,77 (с, 1H), 6,38-6,39 (м, 1H), 5,99-6,00 (м, 1H), 4,65 (т, J=1,5Гц, 2H), 0,92-0,94 (м, 9H), 0,13 (с, 6H). ЖХМС m/z=353 [MH]+.
Пример получения 91a: 3-(3,4-диметоксифенил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин

Смесь 3-бром-5-(3,4-диметоксифенил)пиридина (Пример получения 91b, 12,20 г, 41,48 ммоль), Pin2B2 (21,07 г, 82,96 ммоль), KOAc (8,14 г, 82,96 ммоль) и Pd(dppf)Cl2 (607 мг, 830 мкмоль) в 1,4-диоксане (500 мл) дегазируют и перемешивают при примерно 110°C в течение примерно 4 ч под N2. Смесь концентрируют, и остаток очищают колоночной хроматографией (диоксид кремния) элюируя пет. эфир/EtOAc (100:1 до 10:1) с получением 3-(3,4-диметоксифенил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина (6,00 г, 42%). 1H ЯМР (CDCl3, 400 МГц): δ 8,97 (д, J=2,3 Гц, 1H), 8,71 (д, J=1,0 Гц, 1H), 8,14 (с, 1H), 7,27 (с, 1H), 7,22-7,26 (м, 1H), 7,06 (д, J=8,3 Гц, 1H), 3,86 (с, 3H), 3,80 (с, 3H), 1,33 (с, 13H).
Пример получения 91b: 3-бром-5-(3,4-диметоксифенил)пиридин

Смесь 3,5-дибромпиридина (17,90 г, 75,56 ммоль), (3,4-диметоксифенил)бороновой кислоты (CAS 122775-35-3, 12,50 г, 68,69 ммоль), Na2CO3 (10,92 г, 103,0 ммоль), KOAc (10,11 г, 103,03 ммоль) и Pd(dppf)Cl2 (1,01 г, 1,37 ммоль) в 1,4-диоксане (20 мл) дегазируют и перемешивают при примерно 90°C в течение примерно 8 ч под N2. Смесь фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (20:1 до 1:1) с получением 3-бром-5-(3,4-диметоксифенил)пиридина (20,2 г, 59%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,88 (д, J=1,8 Гц, 1H), 8,61 (д, J=1,8 Гц, 1H), 8,35 (т, J=2,0 Гц, 1H), 7,28-7,35 (м, 2H), 7,05 (д, J=7,9 Гц, 1H), 3,85 (с, 3H), 3,79 (с, 3H). ЖХМС m/z=294 [MH]+.
Пример получения 92: 3-Бром-5-(3-этокси-4-метоксифенил)пиридин
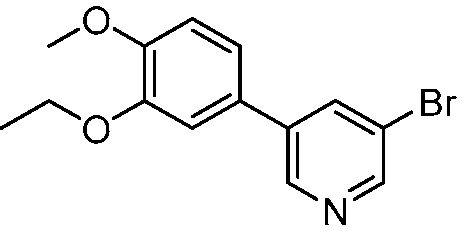
Смесь 2-(3-этокси-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 113, 20,0 г, 71,9 ммоль), 3,5-дибромпиридина (34,07 г, 143,8 ммоль), K2CO3 (19,87 г, 143,8 ммоль), KOAc (10,58 г, 107,9 ммоль) и Pd(dppf)Cl2 (2,10 г, 2,88 ммоль) в 1,4-диоксане (600 мл) и воде (10 мл) дегазируют и нагревают до примерно 100°C в течение примерно 5 ч под N2. Смесь фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (5:1) с получением 3-бром-5-(3-этокси-4-метоксифенил)пиридина (20 г, 90%). 1H ЯМР (CDCl3, 400 МГц): δ 8,71 (с, 1H), 8,60 (с, 1H), 7,96 (с, 1H), 7,11 (дд, J=2,0, 8,4 Гц, 1H), 7,05 (с, 1H), 6,97 (т, J=4,0 Гц, 1H), 4,18 (кв, J=6,8 Гц, 2H), 3,92 (с, 3H), 1,49 (т, J=6,8 Гц, 3H).
Пример получения 93a: 3-бром-5-(4-метокси-3-пропоксифенил)пиридин

2-(4-Метокси-3-пропоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (Пример получения 114, 28,00 г, 95,83 ммоль), 3,5-дибромпиридин (45,40 г, 191,66 ммоль), K2CO3 (19,87 г, 143,75 ммоль), KOAc (14,11 г, 143,75 ммоль) и Pd(dppf)Cl2 (3,51 г, 4,79 ммоль) в 1,4-диоксане (600 мл) и воде (10 мл) дегазируют и нагревают до примерно 100°C в течение примерно 5 ч под N2. Смесь фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (5:1) с получением 3-бром-5-(4-метокси-3-пропоксифенил)пиридина (15,00 г, 49%). 1H ЯМР (CDCl3, 400 МГц): δ 8,72 (д, J=2,0 Гц, 1H), 8,61 (д, J=2,0 Гц, 1H), 7,97 (т, J=2,0 Гц, 1H), 7,12 (дд, J=2,0, 8,4 Гц, 1H), 7,06 (д, J=2,4 Гц, 1H), 6,98 (д, J=8,4 Гц, 1H), 4,06 (т, J=6,8 Гц, 2H), 3,93 (с, 3H), 1,87-1,96 (м, 2H), 1,08 (т, J=7,2 Гц, 3H).
Пример получения 93b: 2-бром-6-(4-метокси-3-пропоксифенил)пиридин
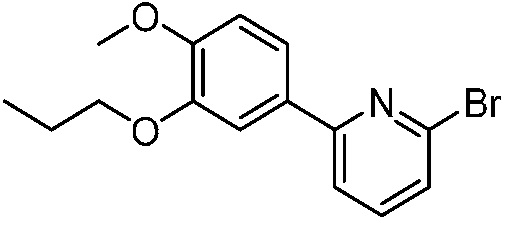
2-(4-Метокси-3-пропоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (Пример получения 114, 10,6 г, 36,3 ммоль), 2,6-дибромпиридин (9,0 г, 38,0 ммоль), K3PO4 (16,1 г, 76,0 ммоль) и Pd(dppf)Cl2 (1,55 г, 1,90 ммоль) в диоксане (6 мл) и воде (1,5 мл) дегазируют и нагревают до примерно 80°C в течение ночи. Смесь разбавляют насыщенным раствором соли (150 мл) и EtOAc (150 мл). Слои разделяют, и EtOAc слой промывают насыщенным раствором соли (75 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют гептан/EtOAc (100:0 до 3:1) с получением 2-бром-6-(4-метокси-3-пропоксифенил)пиридина (5,34 г, 44%). 1H ЯМР (CDCl3, 400 МГц): δ 7,81-8,72 (м, 2H), 7,51-7,57 (м, 2H), 7,35 (д, J=7,4 Гц, 1H), 6,95 (д, J=8,2 Гц, 1H), 4,11 (т, J=6,6 Гц, 2H), 3,93 (с, 3H), 1,86-1,97 (м, 2H), 1,09 (т, J=7,4 Гц, 3H).
Пример получения 94: 3-бром-5-(3-изопропокси-4-метоксифенил)пиридин

3-бром-5-(3-изопропокси-4-метоксифенил)пиридин (1,15 г, 52%) получают по методике, аналогичной Примеру получения 93a с применением 2-(3-изопропокси-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 115, 2 г, 6,8 ммоль) при примерно 120°C в течение примерно 2 ч. 1H ЯМР (CDCl3, 400 МГц): δ 8,71 (д, J=1,5 Гц, 1H), 8,61 (д, J=2,5 Гц, 1H), 7,95-7,98 (м, 1H), 7,12-7,16 (м, 1H), 7,09 (д, J=2,5 Гц, 1H), 6,99 (д, J=8,5 Гц, 1H), 4,58-4,67 (м, 1H), 3,92 (с, 3H), 1,42 (д, J=6,0 Гц, 6H). ЖХМС m/z=323 [MH]+.
Пример получения 95: 3-бром-5-(3-циклопропокси-4-метоксифенил)пиридин
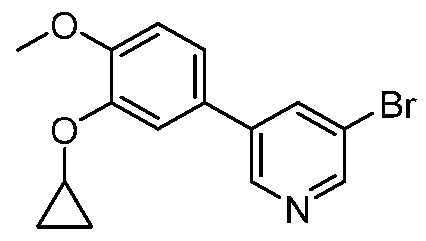
3-бром-5-(3-циклопропокси-4-метоксифенил)пиридин (860 мг, 52%) получают по методике, аналогичной Примеру получения 93a с применением 2-(3-циклопропокси-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 117, 1,5 г, 5,2 ммоль) при примерно 120°C в течение примерно 2 ч. 1H ЯМР (CDCl3, 400 МГц): δ 8,74 (д, J=2,0 Гц, 1H), 8,62 (д, J=2,5 Гц, 1H), 7,99 (т, J=2,2 Гц, 1H), 7,43 (д, J=2,0 Гц, 1H), 7,14 (дд, J=2,5, 8,3 Гц, 1H), 6,97 (д, J=8,3 Гц, 1H), 3,92 (с, 3H), 3,81-3,87 (м, 1H), 0,83-0,96 (м, 4H). ЖХМС m/z=321 [MH]+.
Пример получения 96: 3-бром-5-(3-(2-((трет-бутилдиметилсилил)окси)этокси)-4-метоксифенил)пиридин3-бром-5-(3-(2-((трет-бутилдиметилсилил)окси)этокси)-4-метоксифенил)пиридин

3-бром-5-(3-(2-((трет-бутилдиметилсилил)окси)этокси)-4-метоксифенил)пиридин3-бром-5-(3-(2-((трет-бутилдиметилсилил)окси)этокси)-4-метоксифенил)пиридин (6,8 г, 32%) получают по методике, аналогичной Примеру получения 93a с применением трет-бутил(2-(2-метокси-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)этокси)диметилсилана (Пример получения 120, 20 г, 49 ммоль) при примерно 120°C в течение примерно 3 ч. 1H ЯМР (CDCl3, 400 МГц): δ 8,69-8,78 (м, 1H), 8,61 (д, J=2,2 Гц, 1H), 7,97 (т, J=2,1 Гц, 1H), 7,13 (квд, J=2,2, 4,4 Гц, 2H), 6,98 (д, J=8,8 Гц, 1H), 4,16-4,23 (м, 2H), 4,02-4,09 (м, 2H), 3,92 (с, 3H), 0,88-0,93 (м, 9H), 0,10 (с, 6H). ЖХМС m/z=439 [MH]+.
Пример получения 97: 3-бром-5-(3-(3-((трет-бутилдиметилсилил)окси)пропокси)-4-метоксифенил)пиридин
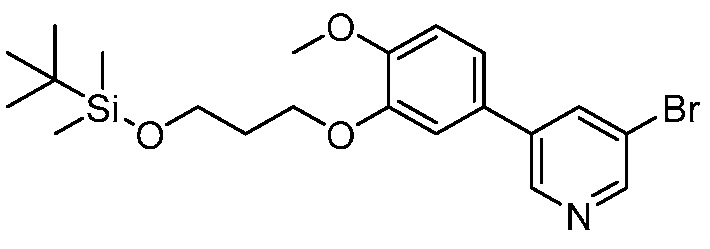
3-бром-5-(3-(3-((трет-бутилдиметилсилил)окси)пропокси)-4-метоксифенил)пиридин (12,4 г, 64%) получают по методике, аналогичной Примеру получения 93a с применением трет-бутил(3-(2-метокси-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)пропокси)диметилсилана (Пример получения 121, 18 г, 42,6 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 8,68 (д, J=2,0 Гц, 1H), 8,58 (д, J=2,5 Гц, 1H), 7,94-8,01 (м, 1H), 7,10 (дд, J=2,5, 8,3 Гц, 1H), 7,07 (д, J=2,0 Гц, 1H), 6,96 (д, J=8,3 Гц, 1H), 4,19 (т, J=6,4 Гц, 2H), 3,90 (с, 3H), 3,80-3,86 (м, 2H), 2,03-2,11 (м, 2H), 0,85-0,90 (м, 9H), 0,04 (с, 6H). ЖХМС m/z=454 [MH]+.
Пример получения 98: 3-бром-5-(3-(2-фторэтокси)-4-метоксифенил)пиридин

3-Бром-5-(3-(2-фторэтокси)-4-метоксифенил)пиридин(1,8 г, 74%) получают по методике, аналогичной Примеру получения 93a с применением 2-(3-(2-фторэтокси)-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 122, 2,2 г, 7,4 ммоль) при примерно 120°C в течение примерно 2 ч. 1H ЯМР (CDCl3, 400 МГц): δ 8,68-8,76 (м, 1H), 8,58-8,65 (м, 1H), 7,97 (т, J=2,3 Гц, 1H), 7,18 (дд, J=2,0, 8,5 Гц, 1H), 7,12 (д, J=2,0 Гц, 1H), 7,00 (д, J=8,5 Гц, 1H), 4,83-4,92 (м, 1H), 4,72-4,81 (м, 1H), 4,37-4,44 (м, 1H), 4,25-4,36 (м, 1H), 3,88-3,97 (м, 3H). ЖХМС m/z=325 [MH]+.
Пример получения 99: 3-бром-5-(3-(3-фторпропокси)-4-метоксифенил)пиридин

3-Бром-5-(3-(3-фторпропокси)-4-метоксифенил)пиридин получают по методике, аналогичной Примеру получения 93a с применением 2-(3-(3-фторпропокси)-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 123).
Пример получения 100: 3-бром-5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин

3-Бром-5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин (1000 мг, 28%) получают по методике, аналогичной Примеру получения 93a с применением 2-(2-(дифторметил)-3-этокси-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 127, 4,09 г, 12,46 ммоль) нагревают до примерно 100°C в течение примерно 15 ч. 1H ЯМР (400 МГц, CDCl3): δ 8,67 (д, J=2,0 Гц, 1H), 8,52 (д, J=1,5 Гц, 1H), 7,86 (т, J=2,0 Гц, 1H), 6,84-7,13 (м, 4H), 4,17 (кв, J=7,4 Гц, 2H), 3,93 (с, 3H), 1,42 (т, J=7,0 Гц, 3H). ЖХМС m/z=359 [MH]+.
Пример получения 101: 3-бром-5-(5-этокси-2-фтор-4-метоксифенил)пиридин

3-Бром-5-(5-этокси-2-фтор-4-метоксифенил)пиридин (350 мг, 27%) получают по методике, аналогичной Примеру получения 93a с применением 2-(5-этокси-2-фтор-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 134, 1,2 г, 4,05 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 8,68 (т, J=1,7 Гц, 1H), 8,63 (д, J=2,1 Гц, 1H), 7,98-8,00 (м, 1H), 6,88 (д, J=7,3 Гц, 1H), 6,75 (д, J=11,7 Гц, 1H), 4,12 (кв, J=7,0 Гц, 2H), 3,92 (с, 3H), 1,49 (т, J=7,0 Гц, 3H). ЖХМС m/z=327 [MH]+.
Пример получения 102: 3-бром-5-(2-фтор-4-метокси-5-пропоксифенил)пиридин

3-Бром-5-(2-фтор-4-метокси-5-пропоксифенил)пиридин (3,4 г, 31%) получают по методике, аналогичной Примеру получения 93a с применением 2-(2-фтор-4-метокси-5-пропоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 138, 10 г, 32 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 8,68 (т, J=1,5 Гц, 1H), 8,63 (д, J=2,4 Гц, 1H), 7,99 (кв, J=2,0 Гц, 1H), 6,88 (д, J=7,8 Гц, 1H), 6,75 (д, J=11,7 Гц, 1H), 4,00 (т, J=6,8 Гц, 2H), 3,91 (с, 3H), 1,84-1,93 (м, 2H), 1,06 (т, J=7,6 Гц, 3H). ЖХМС m/z=339 [MH]+.
Пример получения 103: 5'-хлор-3-фтор-5-метокси-6-пропокси-2,3'-бипиридин

5'-Хлор-3-фтор-5-метокси-6-пропокси-2,3'-бипиридин (3,11 г, 78%) получают по методике, аналогичной Примеру получения 93a с применением 3-фтор-2-йод-5-метокси-6-пропоксипиридина (Пример получения 220, 4,18 г, 13,44 ммоль) и (5-хлорпиридин-3-ил)бороновой кислоты (2,11 г, 13,4 ммоль) при примерно 90°C в течение примерно 16 ч. 1H ЯМР (CDCl3, 400 МГц): δ 9,13 (с, 1H), 8,53 (д, J=2,5 Гц, 1H), 8,27 (т, J=2,1 Гц, 1H), 6,97 (д, J=11,5 Гц, 1H), 4,43 (т, J=6,9 Гц, 2H), 3,93 (с, 3H), 1,86-1,95 (м, 2H), 1,07 (т, J=7,5 Гц, 3H). ЖХМС m/z=328 [MH]+.
Пример получения 104: 2-бром-6-(3-этокси-4-метоксифенил)пиразин

2-Бром-6-(3-этокси-4-метоксифенил)пиразин (2,9 г, 52%) получают по методике, аналогичной Примеру получения 93a с применением 2-(3-этокси-2-фтор-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 113, 5 г, 18 ммоль) и 2,6-дибромпиразина (6,4 г, 27 ммоль) при примерно 110°C в течение примерно 16 ч. 1H ЯМР (CDCl3, 400 МГц): δ 8,86-8,92 (м, 1H), 8,53 (с, 1H), 7,61 (д, J=2,0 Гц, 1H), 7,57 (дд, J=2,2, 8,3 Гц, 1H), 6,98 (д, J=8,3 Гц, 1H), 4,23 (кв, J=6,9 Гц, 2H), 3,95 (с, 3H), 1,53 (т, J=7,0 Гц, 3H). ЖХМС m/z=309 [MH]+.
Пример получения 105: этил 2-(6-хлор-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)ацетат
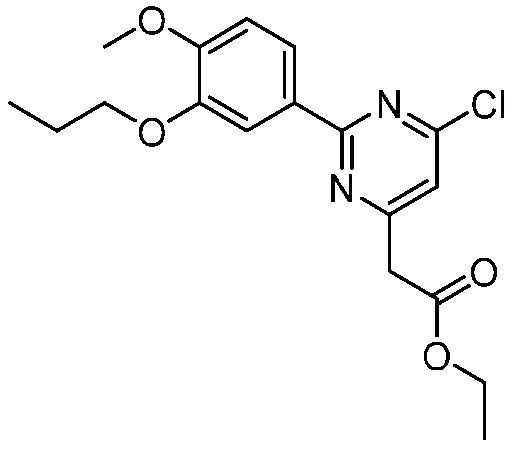
POCl3 (253 мл, 2716 ммоль) добавляют к этил 2-(2-(4-метокси-3-пропоксифенил)-6-оксо-1,6-дигидропиримидин-4-ил)ацетату (Пример получения 106, 42,98 г, 124,08 ммоль), затем гидрохлорид пиридина (14,3 г, 124 ммоль) при примерно 25°C. Полученную смесь нагревают до примерно 80°C в течение примерно 0,5 ч. Смесь разбавляют EtOAc (200 мл) и добавляют в воду по каплям. EtOAc слой обрабатывают NaHCO3. EtOAc слой промывают насыщенным раствором соли, сушат с Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на колонке с обращенной фазой, элюируя MeCN/водой (0:100 до 100:0) с получением этил 2-(6-хлор-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)ацетата (22,07 г, 49%). 1H ЯМР (CDCl3, 400 МГц): δ 8,08 (дд, J=2,1, 8,4 Гц, 1H), 7,98 (д, J=2,0 Гц, 1H), 7,20 (с, 1H), 6,95 (д, J=8,6 Гц, 1H), 4,24 (кв, J=7,2 Гц, 2H), 4,11 (т, J=6,9 Гц, 2H), 3,95 (с, 3H), 3,85 (с, 2H), 1,89-1,96 (м, 2H), 1,31 (т, J=7,2 Гц, 3H), 1,09 (т, J=7,5 Гц, 3H). ЖХМС m/z=365 [MH]+.
Пример получения 106: этил 2-(2-(4-метокси-3-пропоксифенил)-6-оксо-1,6-дигидропиримидин-4-ил)ацетат
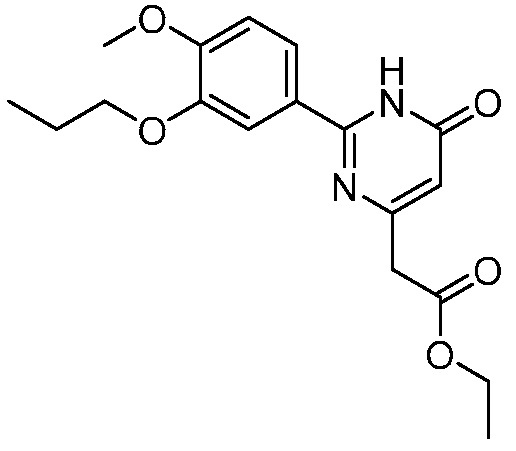
Смесь 4-метокси-3-пропоксибензимидамида (Пример получения 233, 25,3 г, 121 ммоль), NaHCO3 (12,2 мг, 146 ммоль) и диэтил 1,3-ацетондикарбоксилат (CAS 105-50-0, 29,4 г, 146 ммоль) в EtOH (500 мл) перемешивают при примерно 100°C в течение примерно 24 ч. Смесь фильтруют, и фильтровальную лепешку промывают МТБЭ (200 мл), MeOH (100 мл) и ДХМ (50 мл) с получением этил 2-(2-(4-метокси-3-пропоксифенил)-6-оксо-1,6-дигидропиримидин-4-ил)ацетата (34,34 г, 82%). 1H ЯМР (CDCl3, 400 МГц): δ 12,44 (шс, 1H), 7,73-7,86 (м, 2H), 6,99 (д, J=8,3 Гц, 1H), 6,33 (с, 1H), 4,23 (кв, J=7,3 Гц, 2H), 4,16 (т, J=6,9 Гц, 2H), 3,96 (с, 3H), 3,66 (с, 2H), 1,92-1,97 (м, 2H), 1,30 (т, J=7,2 Гц, 3H), 1,10 (т, J=7,5 Гц, 3H). ЖХМС m/z=346 [MH]+.
Пример получения 107: 5-хлор-3-(4-метокси-3-пропоксифенил)пиридазин

5-хлор-3-(4-метокси-3-пропоксифенил)пиридазин (2,9 г, 52%) получают по методике, аналогичной Примеру получения 93a с применением 2-(4-метокси-3-пропоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 114, 4,3 г, 14,7 ммоль) и 3,5-дихлорпиридазина (2,3 г, 15,5 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 9,08 (д, J=2,5 Гц, 1H), 7,84 (д, J=2,5 Гц, 2H), 7,51 (дд, J=2,2, 8,6 Гц, 1H), 7,00 (д, J=8,3 Гц, 1H), 4,12 (т, J=6,9 Гц, 2H), 3,95 (с, 3H), 1,92-1,97 (м, 2H), 1,08 (т, J=7,3 Гц, 3H). ЖХМС m/z=278 [MH]+.
Пример получения 108: 3-бром-5-(3-этокси-4-метоксифенил)-4-метилпиридин

3-бром-5-(3-этокси-4-метоксифенил)-4-метилпиридин (0,82 г, 35%) получают по методике, аналогичной Примеру получения 93a с применением 2-(3-этокси-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 113, 2,0 г, 7,19 ммоль) и 3,5-дибром-4-метилпиридина (2,71 г, 10,8 ммоль) при примерно 120°C в течение примерно 2 ч. 1H ЯМР (CDCl3, 400 МГц): δ 8,61 (с, 1H), 8,32 (с, 1H), 6,94 (д, J=8,0 Гц, 1H), 6,81-6,83 (м, 1H), 6,78 (д, J=2,3 Гц, 1H), 4,10 (кв, J=7,0 Гц, 2H), 3,92 (с, 3H), 2,34 (с, 3H), 1,47 (т, J=7,0 Гц, 3H). ЖХМС m/z=323 [MH]+.
Пример получения 109: 4-бром-2-(3-этокси-4-метоксифенил)тиазол

К смеси Pd(OAc)2 (CAS 3375-31-3, 40,4 мг, 0,18 ммоль) и Xantphos (CAS 161265-03-8, 208,0 мг, 0,36 ммоль), перемешивая в течение примерно 10 мин., добавляют 2-(3-этокси-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (Пример получения 113, 1,0 г, 3,60 ммоль), 2,4-дибромтиазол (0,83 г, 3,42 ммоль) и K3PO4 (2,44 г, 11,5 ммоль). Объединенные смесь дегазируют и нагревают до примерно 60°C в течение примерно 16 ч. Смесь концентрируют, и остаток очищают колоночной хроматографией (диоксид кремния) элюируя пет. эфир:EtOAc (100:0 до 85:15) с получением 4-бром-2-(3-этокси-4-метоксифенил)тиазола (0,68 г, 60%). 1H ЯМР (CDCl3, 400 МГц): δ 7,51 (д, J=2,3 Гц, 1H), 7,45 (дд, J=2,3, 8,3 Гц, 1H), 7,14 (с, 1H), 6,90 (д, J=8,3 Гц, 1H), 4,20 (кв, J=7,0 Гц, 2H), 3,93 (с, 3H), 1,51 (т, J=7,0 Гц, 3H). ЖХМС m/z=315 [MH]+.
Пример получения 110: этил 2-(6-бромпиридин-2-ил)-2-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропаноат

К смеси йодида натрия (1,05 г, 6,98 ммоль) и ацетона (1,50 мл) добавляют 2-(хлорметил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (187 мг, 1,06 ммоль) и перемешивают при примерно 20°C в течение примерно 30 мин. Смесь фильтруют через слой Celite® и фильтрат концентрируют. Остаток растворяют и концентрируют с безводным ТГФ (3×5 мл). Остаток растворяют в ТГФ (6,0 мл) и добавляют к холодной суспензии NaH (60% дисперсия в минеральном масле, 349 мг, 8,73 ммоль) и этил 2-(6-бромпиридин-2-ил)пропаноата (Пример получения 111, 1,502 г, 5,819 ммоль) в ТГФ (13,0 мл), которую дегазируют под N2. Объединенные смесь перемешивают при примерно 20°C в течение примерно 18 ч. Смесь обрабатывают насыщенным водным NH4Cl и экстрагируют EtOAc. Объединенные EtOAc экстракты промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют. Остаток растворяют в ДМСО (5 мл) и очищают препаративной ЖХВД (Biotage C18 RP колонка, 60 г) элюируя MeCN (0,1% NH4CO2H)/водой (0:100 до 100:0) с получением этил 2-(6-бромпиридин-2-ил)-2-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропаноата (339 мг, 14%). 1H ЯМР (CDCl3, 500 МГц): δ 7,44-7,48 (м, 1H), 7,31 (м, 1H), 7,25-7,29 (м, 2H), 4,15 (кв, J=7,1 Гц, 2H), 1,67-1,70 (м, 3H), 1,54 (с, 2H), 1,23-1,25 (м, 7H), 1,20 (д, J=3,9 Гц, 13H). ЖХМС m/z=399 [MH]+.
Пример получения 111: этил 2-(6-бромпиридин-2-ил)пропаноат

К раствору этил 2-(6-бромпиридин-2-ил)ацетата (Пример получения 112, 5,72 г, 23,4 ммоль) в ТГФ (117 мл), охлажденному до примерно -78°C, добавляют раствор LiHMDS в ТГФ (1,0 M, 29,3 мл, 29,3 ммоль). Раствор перемешивают в течение примерно 1 ч и йодметан (3,33 г, 23,4 ммоль, 1,46 мл) добавляют по каплям. Реакционную смесь нагревают до примерно 20°C в течение примерно 19 ч. Реакционную смесь разбавляют EtOAc. Смесь промывают насыщенным водным NH4Cl, насыщенным раствором соли, сушат над MgSO4 и Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют гептаном/EtOAc (100:0 до 80:20) с получением этил 2-(6-бромпиридин-2-ил)ацетата (5,06 г, 84%). 1H ЯМР (CDCl3, 400 МГц,): δ 7,50-7,57 (м, 1H), 7,39 (д, J=7,8 Гц, 1H), 7,26-7,31 (м, 1H), 4,19 (кв, J=7,0 Гц, 2H), 3,93 (кв, J=7,0 Гц, 1H), 1,57 (д, J=7,4 Гц, 3H), 1,25 (т, J=7,0 Гц, 3H). ЖХМС m/z=259 [MH]+.
Пример получения 112: этил 2-(6-бромпиридин-2-ил)ацетат
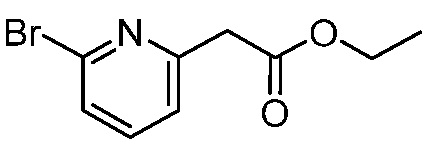
К раствору 2-бром-6-метилпиридина (CAS 5315-25-3, 10,2 г, 59,1 ммоль) в ТГФ (62 мл) охлаждают до примерно -78°C под N2 добавляют раствор ДАЛ в ТГФ (2,0 M, 59 мл, 118 ммоль) медленно перемешивая. Раствор перемешивают при примерно -78°C в течение примерно 30 мин. К смеси добавляют диэтилкарбонат (8,6 мл, 70,9 ммоль) при примерно -78°C. Смесь нагревают до примерно 20°C в течение ночи. Реакционную смесь охлаждают до примерно 0°C и разбавляют насыщенным водным раствором NH4Cl. Водный слой экстрагируют ДХМ, и объединенные ДХМ экстракты промывают водой, насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют гептаном/EtOAc (100:0 до 60:40) с получением этил 2-(6-бромпиридин-2-ил)ацетата (7,7 г, 53%). 1H ЯМР (CDCl3, 400 МГц,): δ 7,55 (т, J=7,8 Гц, 1H), 7,42 (д, J=8,2 Гц, 1H), 7,28-7,34 (м, 1H), 4,21 (кв, J=7,2 Гц, 2H), 3,85 (с, 2H), 1,26-1,34 (м, 3H). ЖХМС m/z=245 [MH]+.
Пример получения 113: 2-(3-этокси-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан

Смесь 4-бром-2-этокси-1-метоксибензола (Пример получения 150, 48,0 г, 207,7 ммоль), Pd(dppf)Cl2 (4,56 г, 6,23 ммоль), Pin2B2 (58,0 г, 228,5 ммоль) и KOAc (40,8 г, 415,4 ммоль) в 1,4-диоксане (500 мл) дегазируют и нагревают до примерно 90°C в течение примерно 16 ч под N2. Смесь фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (10:1) с получением 2-(3-этокси-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (50,0 г, 86%). 1H ЯМР (CDCl3, 400 МГц): δ 7,41 (д, J=8,0 Гц, 1H), 7,30 (с, 1H), 6,89 (д, J=8,0 Гц, 1H), 4,16 (кв, J =7,2 Гц, 2H), 3,90 (с, 3H), 1,47 (т, J=7,2 Гц, 3H), 1,34 (с, 12H).
Пример получения 114: 2-(4-метокси-3-пропоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан

Смесь 4-бром-1-метокси-2-пропоксибензола (Пример получения 151, 43,00 г, 175,43 ммоль), KOAc (34,43 г, 350,86 ммоль), Pin2B2 (49,00 г, 192,97 ммоль) и Pd(dppf)Cl2.ДХМ (4,30 г, 5,26 ммоль) в 1,4-диоксане (500 мл) дегазируют и перемешивают при примерно 80°C в течение примерно 16 ч. Твердое вещество удаляют фильтрацией, и фильтрат концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (10:1) с получением 2-(4-метокси-3-пропоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (51,0 г, 99%). 1H ЯМР (CDCl3, 400 МГц): δ 7,40-7,42 (м, 1H), 7,30 (д, J=1,2 Гц, 1H), 6,89 (д, J=8,0 Гц, 1H), 4,03 (т, J=7,0 Гц, 2H), 3,89 (с, 3H), 1,84-1,93 (м, 2H), 1,34 (с, 12H), 1,05 (т, J=7,4 Гц, 3H).
Следующие соединения получают с применением подходящего бромида и 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана) по методике, описанной в Примере получения 114.

2-(3-изопропокси-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
2-(3-изобутокси-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
2-(3-циклопропокси-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 
2-(4-метокси-3-((тетрагидротиофен-3-ил)окси)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 
2-(4-метокси-3-((тетрагидро-2H-тиопиран-4-ил)окси)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 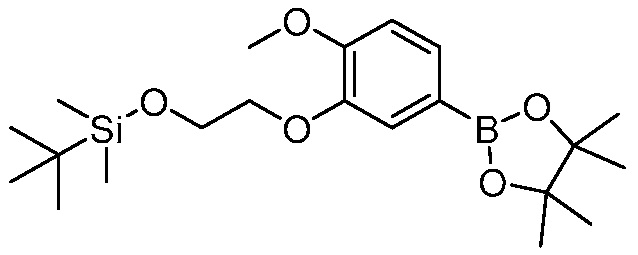
трет-бутил(2-(2-метокси-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)этокси)диметилсилан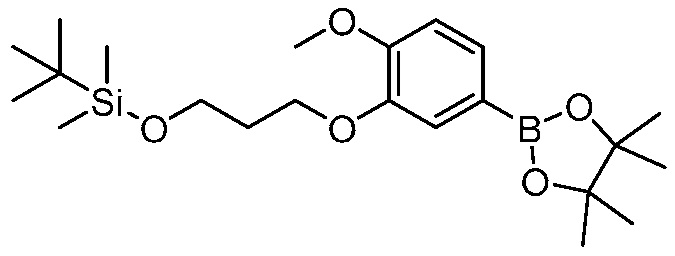
трет-бутил(3-(2-метокси-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси) пропокси)диметилсилан 
2-(3-(2-фторэтокси)-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 
2-(3-(3-фторпропокси)-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 
2-метокси-3-пропокси-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин 
2,3-диметокси-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрил 
2-(3-этокси-2-фтор-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 
2-(2-(дифторметил)-3-этокси-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 
2-(2-фтор-4-метокси-3-пропоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 
3-метокси-2-пропокси-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрил 
2-(2,4-диметокси-3-пропоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 
2-(циклопентилокси)-3-метокси-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрил 
2-(3-этокси-5-фтор-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 
2-(3-хлор-5-этокси-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 
2-(5-этокси-2-фтор-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 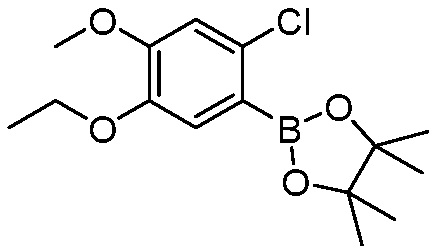
2-(2-хлор-5-этокси-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 
2-(5-этокси-4-метокси-2-метилфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 
2-(3-этокси-2,6-дифтор-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 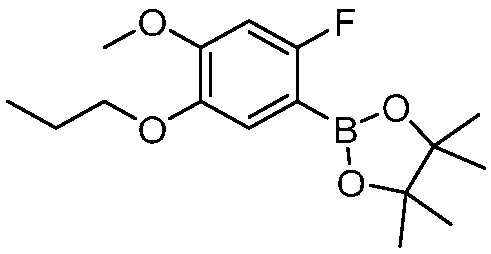
2-(2-фтор-4-метокси-5-пропоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 
2-(4-этокси-3-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 
2-(4-этокси-2-фтор-3-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 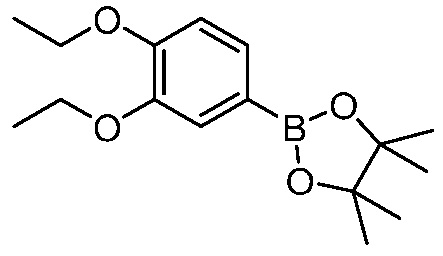
2-(3,4-диэтоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 
2-(4-(дифторметокси)-3-пропоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 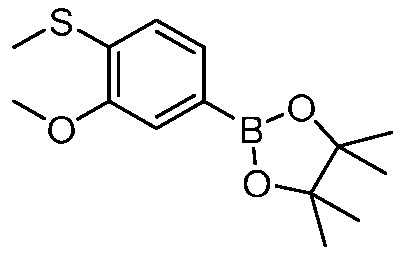
2-(3-метокси-4-(метилтио)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 
2-(3-этокси-4-(метилтио)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан 
2-(3-(циклопентилокси)-4-(метилтио)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
Пример получения 146: трет-бутилдиметил((2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)аллил)окси)силан

Способ A:
Пять реакций проводят параллельно. Смесь ((2-бромаллил)окси)(трет-бутил)диметилсилана (Пример получения 227, 300 г, 1,19 моль), KOAc (234 г, 2,39 моль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) (333 г, 1,31 моль) и Pd(PPh3)2Cl2 (16,7 г, 0,023 моль) в 1,4-диоксане (1,5 л) дегазируют и перемешивают при примерно 80°C в течение примерно 16 ч. Твердые вещества удаляют фильтрацией и фильтрат концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (1:0) с получением трет-бутилдиметил((2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)аллил)окси)силана (520 г, 30%). ГХ (Колонка: Agilent J&W HP-5MS 30M x 0,25 мм ID x 0,25 мкм толщина пленки; температура впрыска 250°C; коэффициент деления потока 100:1; температура источника ионов 230°C; граничная температура. 250°C; температура колонки 50°C 1 мин до 100°C @ 30°C/мин до 250°C @ 10°C/мин.; время прогона 17,67 мин.; скорость потока 1,5 мл/мин; ВУ=11,67 мин. 1H ЯМР (CDCl3, 400 МГц): δ 5,97 (д, J=1,3 Гц, 1H), 5,88 (тд, J=1,8, 3,9 Гц, 1H), 4,29 (т, J=2,0 Гц, 2H), 1,21-1,30 (м, 12H), 0,93 (с, 9H), 0,07 (с, 6H).
Способ B:
К смеси трет-бутилдиметил(проп-2-ин-1-илокси)силан (250 мг, 1,47 ммоль), трет-бутоксида натрия (21,2 мг, 0,220 ммоль), хлорида меди (I) (14,5 мг, 0,10 ммоль) и 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана) (410 мг, 1,61 ммоль) под N2 добавляют по каплям раствор tBu3P (1,0M раствор в толуоле, 0,176 мл, 0,12 ммоль) в безводном толуоле (2,5 мл). MeOH (94 мг, 2,94 ммоль) добавляют к смеси по каплям, и смесь перемешивают при примерно 20°C в течение ночи. Реакционную смесь гасят MeOH (20 мл) и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 80:20) с получением трет-бутилдиметил((2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)аллил)окси)силана (2,2 г, 50%). 1H ЯМР (CDCl3, 400 МГц): δ 5,97 (шс, 1H), 5,88 (д, J=1,6 Гц, 1H), 4,29 (с, 2H), 1,25-1,33 (м, 12H), 0,93 (с, 9H), 0,08 (с, 6H).
Пример получения 147: трет-бутилдиметил((3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бут-3-ен-2-ил)окси)силан

К смеси (бут-3-ин-2-илокси)(трет-бутил)диметилсилана (CAS 193812-02-1, 10 г, 54,24 ммоль), трет-бутоксида натрия (782 мг, 8,41 ммоль), хлорида меди (I) (537 мг, 5,42 ммоль) и Pin2B2 (15,2 г, 59,7 ммоль) в толуоле (120 мл) под N2 добавляют раствор tBu3P (13,2 г, 6,51 ммоль) в безводном толуоле (10 мл) по каплям. MeOH (3,48 г, 108 ммоль) добавляют по каплям, и смесь перемешивают при примерно 20°C в течение примерно 16 ч. Реакционную смесь гасят MeOH (10 мл) и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 97:3) с получением трет-бутилдиметил((3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бут-3-ен-2-ил)окси)силана (8,2 г, 48,4%). 1H ЯМР (CDCl3, 400 МГц): δ 5,88-6,02 (м, 1H), 5,79 (дд, J=1,5, 3,5 Гц, 1H), 4,40-4,56 (м, 1H), 1,27 (д, J=3,5 Гц, 12H), 1,24 (д, J=6,5 Гц, 3H), 0,91 (с, 9H), 0,05 (д, J=5,5 Гц, 6H).
Пример получения 148: трет-бутилдиметил((3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бут-3-ен-1-ил)окси)силан
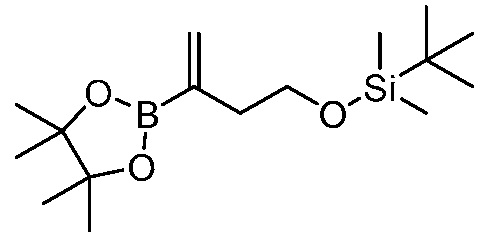
Смесь ((3-бромбут-3-ен-1-ил)окси)(трет-бутил)диметилсилана (Пример получения 229, 2,0 г, 7,54 ммоль), Pin2B2 (2,87 г, 11,3 ммоль) и KOAc (0,74 г, 7,54 ммоль) суспендируют в безводном 1,4-диоксане (10 мл). Смесь дегазируют в течение примерно 10 мин при примерно 18°C под N2. Pd(PPh3)2Cl2 (106 мг, 0,15 ммоль) добавляют, и смесь нагревают до примерно 90°C в течение 16 ч. Реакционную смесь охлаждают до примерно 20°C и фильтруют. Фильтровальную лепешку промывают 1,4-диоксаном, и объединенные фильтраты концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют гептан/EtOAc (100:0 до 80:20) с получением трет-бутилдиметил((3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бут-3-ен-1-ил)окси)силана (1,15 г, 49%). ЖХМС m/z=313 [MH]+.
Пример получения 149: 2,2'-(этан-1,1-диил)бис(4,4,5,5-тетраметил-1,3,2-диоксаборолан)

Смесь 1,1-дибромэтан (14,9 г, 58,6 ммоль), метоксида лития (3,03 г, 79,8 ммоль) и йодида меди (I) (5,07 г, 26,6 ммоль) суспендируют в ДМФ (150 мл) под N2. Дополнительный метоксид лития (5,0 г, 2,43 мл) в ДМФ (10 мл) добавляют к смеси. Реакционную смесь нагревают до примерно 40°C и перемешивают в течение примерно 48 ч под N2. Раствор охлаждают до примерно 20°C и экстрагируют гептаном (3×300 мл). Гептановые экстракты промывают водой (100 мл), насыщенным раствором соли (100 мл) и пропускают через слой MgSO4 и гелевый диоксид кремния. Слой промывают ДХМ (100 мл). Объединенные фильтраты концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют ДХМ с получением 2,2'-(этан-1,1-диил)бис(4,4,5,5-тетраметил-1,3,2-диоксаборолан (3,6 г, 48%). 1H ЯМР (CDCl3, 400 МГц): δ 1,23 (д, J=3,1 Гц, 24H), 1,05 (д, J=7,4 Гц, 3H), 0,72 (кв, J=7,0 Гц, 1H).
Пример получения 150: 4-бром-2-этокси-1-метоксибензол

Смесь 5-бром-2-метоксифенола (40,0 г, 197,0 ммоль), йодэтана (23,6 мл, 295,5 ммоль) и Cs2CO3 (96,3 г, 295,5 ммоль) в ДМФ (350 мл) перемешивают при примерно 25°C в течение примерно 16 ч. Смесь фильтруют, и воду (500 мл) добавляют к фильтрату. Смесь экстрагируют EtOAc (2×400 мл). Объединенные EtOAc экстракты промывают насыщенным раствором соли (100 мл), сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (10:1) с получением 4-бром-2-этокси-1-метоксибензола (48,0 г), который применяют сразу на следующей стадии. 1H ЯМР (CDCl3, 400 МГц): δ 7,02 (дд, J=2,4, 8,4 Гц, 1H), 6,98 (д, J=2,4 Гц, 1H), 6,76-6,73 (м, 1H), 4,08 (кв, J=7,2 Гц, 2H), 3,88 (с, 3H), 1,47 (т, J=7,2 Гц, 3H).
Пример получения 151: 4-бром-1-метокси-2-пропоксибензол
К раствору 5-бром-2-метоксифенола (40,0 г, 197,0 ммоль) и K2CO3 (54,5 г, 394 ммоль) в ДМФ (200 мл) добавляют 1-йодпропан (28,9 мл, 295 ммоль) порциями при примерно 20°C. Смесь перемешивают при примерно 20°C в течение примерно 1 ч. Смесь выливают в ледяную воду (500 мл) и экстрагируют EtOAc (3×300 мл). Объединенные EtOAc экстракты промывают насыщенным раствором соли (200 мл), сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (40:1) с получением 4-бром-1-метокси-2-пропоксибензола (43,0 г, неочищенный). 1H ЯМР (CDCl3, 400 МГц): δ 7,27 (с, 1H), 6,99-7,03 (м, 1H), 6,74 (д, J=8,4 Гц, 1H), 3,96 (т, J=6,8 Гц, 2H), 3,85 (с, 3H), 1,83-1,92 (м, 2H), 1,05 (т, J=7,6 Гц, 3H).
Пример получения 152: 4-бром-2-изопропокси-1-метоксибензол
4-бром-2-изопропокси-1-метоксибензол (16 г, 95%) получают по методике, аналогичной Примеру получения 150 с применением 2-бромпропана (12,7 г, 103,4 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,00-7,05 (м, 2H), 6,75 (д, J=8,3 Гц, 1H), 4,50-4,54 (м, 1H), 3,83 (с, 3H), 1,35-1,40 (м, 6H). ЖХМС m/z=245 [MH]+.
Пример получения 153: 4-бром-2-изобутокси-1-метоксибензол

К раствору 5-бром-2-метоксифенола (25 г, 120 ммоль), 2-метилпропан-1-ола (11,0 г, 148 ммоль), PPh3 (48,4 г, 185 ммоль) в безводном ДХМ (400 мл) при примерно 0°C добавляют DIAD (37,3 г, 185 ммоль) по каплям под N2. Смесь перемешивают при примерно 0°C в течение примерно 2 ч. Дополнительный DIAD (2,53 г, 12,5 ммоль) и 2-метилпропан-1-ол (1,03 г, 13,9 ммоль) добавляют, и смесь перемешивают при примерно 10°C в течение примерно 5 дней, затем фильтруют. Фильтрат концентрируют при пониженном давлении. МТБЭ (500 мл) добавляют, и смесь перемешивают при примерно 10°C в течение примерно 20 мин. Белый осадок фильтруют. Фильтрат концентрируют. Остаток растворяют в воде (200 мл) и экстрагируют МТБЭ (2×300 мл). Объединенные МТБЭ экстракты концентрируют, и остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:1 до 90:10) с получением 4-бром-2-изобутокси-1-метоксибензола (22 г, 69%). 1H ЯМР (CDCl3, 400 МГц): δ 6,99-7,03 (м, 1H), 6,96-6,99 (м, 1H), 6,74 (д, J=8,5 Гц, 1H), 3,84 (с, 3H), 3,75 (д, J=7,0 Гц, 2H), 2,11-2,22 (м, 1H), 1,04 (д, J=6,5 Гц, 6H).
Пример получения 154: 4-бром-2-циклопропокси-1-метоксибензол

4-бром-2-циклопропокси-1-метоксибензол (6,15 г, 64%) получают по методике, аналогичной Примеру получения 150 с применением бромциклопропана (8,0 г, 39 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,36 (д, J=2,5 Гц, 1H), 7,05 (дд, J=2,5, 8,5 Гц, 1H), 6,74 (д, J=8,5 Гц, 1H), 3,84 (с, 3H), 3,70-3,77 (м, 1H), 0,80-0,90 (м, 4H).
Пример получения 155: 3-(5-бром-2-метоксифенокси)тетрагидротиофен

К раствору 5-бром-2-метоксифенола (1,6 г, 7,88 ммоль), тетрагидротиофен-3-ола (0,903 г, 8,67 ммоль), PPh3 (3,10 г, 11,8 ммоль) в безводном ДХМ (20 мл) при примерно 0°C добавляют DIAD (2,39 г, 11,8 ммоль) по каплям под N2. Смесь перемешивают при примерно 0°C в течение примерно 2 ч. Смесь перемешивают в течение примерно 3 дней. Смесь фильтруют, и фильтрат концентрируют. К остатку добавляют МТБЭ (50 мл) и перемешивают при примерно 10°C в течение примерно 20 мин. Белый осадок фильтруют. Фильтрат снова концентрируют. Остаток растворяют в воде (20 мл) и экстрагируют МТБЭ (2×30 мл). Объединенные МТБЭ экстракты концентрируют, и остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:1 до 90:10) с получением 3-(5-бром-2-метоксифенокси)тетрагидротиофена (2,0 г, 88%). 1H ЯМР (CDCl3, 400 МГц): δ 7,05-7,11 (м, 2H), 6,74-6,79 (м, 1H), 5,06-5,09 (м, 1H), 3,82 (с, 3H), 3,04-3,15 (м, 3H), 2,93 (ддд, J=3,7, 7,3, 10,5 Гц, 1H), 2,38-2,47 (м, 1H), 2,03-2,05 (м, 1H).
Пример получения 156: 4-(5-бром-2-метоксифенокси) тетрагидро-2H-тиопиран

4-(5-бром-2-метоксифенокси) тетрагидро-2H-тиопиран (5,1 г, 68%) получают по методике, аналогичной Примеру получения 155 с применением тетрагидро-2H-тиопиран-4-ола (3,2 г, 27,1 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,03-7,08 (м, 1H), 7,01 (д, J=2,5 Гц, 1H), 6,73-6,77 (м, 1H), 4,21-4,29 (м, 1H), 3,81-3,84 (м, 3H), 2,87-2,96 (м, 2H), 2,52-2,62 (м, 2H), 2,15-2,25 (м, 2H), 1,98-2,08 (м, 2H).
Пример получения 157: (2-(5-бром-2-метоксифенокси)этокси)(трет-бутил)диметилсилан

(2-(5-бром-2-метоксифенокси)этокси)(трет-бутил)диметилсилан (60 г, 86%) получают по методике, аналогичной Примеру получения 155 с применением 2-((трет-бутилдиметилсилил)окси)этан-1-ола (34 г, 190 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,07 (д, J=2,2 Гц, 1H), 7,00-7,05 (м, 1H), 6,71-6,76 (м, 1H), 4,06-4,11 (м, 2H), 3,96-4,02 (м, 2H), 3,81-3,85 (м, 3H), 0,88-0,93 (м, 9H), 0,08-0,12 (м, 6H).
Пример получения 158: (3-(5-бром-2-метоксифенокси)пропокси)(трет-бутил)диметилсилан

(3-(5-бром-2-метоксифенокси)пропокси)(трет-бутил)диметилсилан (19,8 г, 86%) получают по методике, аналогичной Примеру получения 155 с применением 3-((трет-бутилдиметилсилил)окси)пропан-1-ола (Пример получения 236, 12,5 г, 61,6 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 6,99-7,03 (м, 2H), 6,71-6,75 (м, 1H), 4,08-4,13 (м, 2H), 3,83 (с, 3H), 3,81 (т, J=5,9 Гц, 2H), 2,00-2,07 (м, 2H), 0,88-0,91 (м, 9H), 0,04-0,07 (м, 6H).
Пример получения 159: 4-бром-2-(2-фторэтокси)-1-метоксибензол

4-бром-2-(2-фторэтокси)-1-метоксибензол (12 г, 98%) получают по методике, аналогичной Примеру получения 155 с применением 2-фторэтан-1-ола (3,79 г, 59 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,08 (дд, J=2,5, 8,8 Гц, 1H), 7,03 (д, J=2,5 Гц, 1H), 6,75-6,79 (м, 1H), 4,82-4,87 (м, 1H), 4,71-4,74 (м, 1H), 4,27-4,31 (м, 1H), 4,20-4,24 (м, 1H), 3,86 (с, 3H).
Пример получения 160: 4-бром-2-(3-фторпропокси)-1-метоксибензол

4-бром-2-(3-фторпропокси)-1-метоксибензол (10 г, 100%) получают по методике, аналогичной Примеру получения 155 с применением 3-фторпропан-1-ола (3,69 г, 47,3 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,03-7,07 (м, 1H), 7,01-7,03 (м, 1H), 6,75 (д, J=8,3 Гц, 1H), 4,72 (т, J=5,6 Гц, 1H), 4,61 (т, J=5,6 Гц, 1H), 4,13 (т, J=6,1 Гц, 2H), 3,84 (с, 3H), 2,26-2,28 (м, 1H), 2,19-2,22 (м, 1H).
Пример получения 161: 1-бром-2-фтор-3,4-диметоксибензол

Смесь 1-фтор-2,3-диметоксибензола (35,0 г, 224,1 ммоль) и NBS (43,9 г, 246,6 ммоль) в ДХМ (300 мл) дегазируют и перемешивают при примерно 15°C в течение примерно 12 ч под N2. Реакционную смесь гасят водой (300 мл) и экстрагируют ДХМ (2×300 мл). Объединенные ДХМ экстракты промывают насыщенным раствором соли (2×100 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (10:1) с получением 1-бром-2-фтор-3,4-диметоксибензола (35,0 г, 66%). 1H ЯМР (CDCl3, 400 МГц): δ 7,17-7,21 (м, 1H), 6,60-6,63 (м, 1H), 3,93 (с, 3H), 3,87 (с, 3H).
Пример получения 162: 6-бром-2,3-диметоксибензонитрил

К раствору оксима 6-бром-2,3-диметоксибензальдегида (Пример получения 163, 30,0 г, 115 ммоль) в ДХМ (500 мл) добавляют ТФУА (24,0 мл, 173 ммоль) и Et3N (48,0 мл, 346,0 ммоль). Смесь перемешивают при примерно 20°C в течение примерно 2 ч. Смесь гасят вода (200 мл) при примерно 0°C и экстрагируют ДХМ (300 мл). Объединенные ДХМ экстракты промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (10:1 до 3:1) с получением 6-бром-2,3-диметоксибензонитрила (25,0 г, 90%). 1H ЯМР (CDCl3, 400 МГц): δ 7,34-7,29 (м, 1H), 6,99 (д, J=8,8 Гц, 1H), 4,04-4,01 (м, 3H), 3,90-3,88 (м, 3H).
Пример получения 163: оксим 6-бром-2,3-диметоксибензальдегид

К раствору 6-бром-2,3-диметоксибензальдегида (Пример получения 164, 15,0 г, 61,2 ммоль) в EtOH (150 мл) добавляют NaHCO3 (7,7 г, 91,8 ммоль) и NH2OH∙HCl (6,4 г, 91,8 ммоль). Смесь перемешивают при примерно 20°C в течение примерно 2 ч. Смесь гасят добавлением воды (300 мл) при примерно 0°C и экстрагируют EtOAc (200 мл). EtOAc слой промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют с получением оксима 6-бром-2,3-диметоксибензальдегида (15,0 г), который применяют в Примере получения 162. 1H ЯМР (CDCl3, 400 МГц): δ 7,27-7,34 (м, 1H), 6,99 (д, J=9,2 Гц, 1H), 4,00-4,03 (м, 3H), 3,87-3,90 (м, 3H).
Пример получения 164: 6-бром-2,3-диметоксибензальдегид

6-бром-2,3-диметоксибензальдегид (35,0 г, 82,5%) получают по методике, аналогичной Примеру получения 172 с применением 6-бром-2-гидрокси-3-метоксибензальдегида (Пример получения 165, 40 г, 173,1 ммоль) и йодметана (36,8 г, 259,7 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 10,35 (с, 1H), 7,33-7,37 (м, 1H), 6,97 (д, J=8,8 Гц, 1H), 3,94 (с, 3H), 3,90 (с, 3H).
Пример получения 165: 6-бром-2-гидрокси-3-метоксибензальдегид

К раствору ацетата 3-бром-2-формил-6-метоксифенила (Пример получения 166, 40,0 г, 146,5 ммоль) в MeOH (400 мл) и воде (50 мл) добавляют NaHCO3 (13,5 г, 161,1 ммоль) и LiOH (12,3 г, 293,0 ммоль). Смесь перемешивают при примерно 20°C в течение примерно 12 ч. Реакционную смесь доводят до pH 5-6 и экстрагируют ДХМ. ДХМ слой концентрируют с получением 6-бром-2-гидрокси-3-метоксибензальдегида (40,0 г), который применяют в Примере получения 164. 1H ЯМР (CDCl3, 400 МГц): δ 12,21 (с, 1H), 10,22 (с, 1H), 7,03 (д, J=8,4 Гц, 1H), 6,85 (д, J=8,8 Гц, 1H), 3,81-3,85 (м, 3H).
Пример получения 166: ацетат 3-бром-2-формил-6-метоксифенила

К раствору ацетата 2-формил-6-метоксифенила (Пример получения 167, 50,0 г, 257,5 ммоль) в воде (500 мл) добавляют Br2 (53,5 г, 334,7 ммоль) и KBr (46,0 г, 386,2 ммоль). Смесь перемешивают при примерно 20°C в течение примерно 10 ч. Осадок фильтруют, промывают этилацетатом и перекристаллизовывают EtOAc/пет. эфира с получением ацетата 3-бром-2-формил-6-метоксифенила (40,0 г, 57%). 1H ЯМР (CDCl3, 400 МГц): δ 10,28 (с, 1H), 7,53 (д, J=8,8 Гц, 1H), 7,07 (д, J=8,8 Гц, 1H), 3,87 (с, 3H), 2,40 (с, 3H).
Пример получения 167: ацетата 2-формил-6-метоксифенила

К раствору 2-гидрокси-3-метоксибензальдегида (50,0 г, 328,6 ммоль) в ДХМ (200 мл) добавляют Ac2O (33,5 г, 329 ммоль), ДМАП (4,0 г, 32,8 ммоль) и Et3N (33,2 г, 329 ммоль). Смесь перемешивают при примерно 20°C в течение примерно 2 ч. Реакционную смесь гасят насыщенным водный NH4Cl (100 мл) и экстрагируют ДХМ (2×100 мл). Объединенные ДХМ экстракты промывают HCl (100 мл, 1 M), насыщенным раствором соли (300 мл), сушат над Na2SO4, фильтруют и концентрируют с получением ацетата 2-формил-6-метоксифенила (60,0 г, 94%). 1H ЯМР (CDCl3, 400 МГц): δ 10,12-10,17 (м, 1H), 7,46 (дд, J=1,6, 7,8 Гц, 1H), 7,34 (т, J=8,0 Гц, 1H), 7,22 (дд, J=1,6, 8,2 Гц, 1H), 3,88 (с, 3H), 2,41 (с, 3H).
Пример получения 168: 1-бром-2-(дифторметил)-3-этокси-4-метоксибензол

К смеси DAST (CAS 38078-09-0, 17,8 мл, 143,0 ммоль) в ДХМ (100 мл) добавляют раствор 6-бром-2-этокси-3-метоксибензальдегида (Пример получения 169, 4,64 г, 17,9 ммоль) в ДХМ (20 мл) при примерно -20°C. Реакционную смесь нагревают до примерно 25°C в течение 0,5 ч и затем при примерно 25°C в течение примерно 15 ч. Реакционную смесь гасят насыщенным водный NaHCO3 (200 мл) при примерно 0°C и смесь экстрагируют ДХМ (2×100 мл). Объединенные ДХМ экстракты концентрируют, и остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (100:0 до 97:3) с получением 1-бром-2-(дифторметил)-3-этокси-4-метоксибензола (4,77 г, 95%). 1H ЯМР (CDCl3, 400 МГц): δ 7,31 (д, J=8,8 Гц, 1H), 7,10 (т, J=54,0 Гц, 1H), 6,87 (д, J=8,8 Гц, 1H), 4,11 (кв, J=7,0 Гц, 2H), 3,87 (с, 3H), 1,40 (т, J=7,0 Гц, 3H).
Пример получения 169: 6-бром-2-этокси-3-метоксибензальдегид

К смеси 6-бром-2-гидрокси-3-метоксибензальдегида (Пример получения 165, 5 г, 21,64 ммоль) и K2CO3 (5,98 г, 43,3 ммоль) в MeCN (100 мл) добавляют йодэтан (16,9 г, 108 ммоль). Смесь нагревают до 60°C и перемешивают в течение 4 ч, затем нагревают до 100°C в течение 19 ч. Смесь охлаждают до к.т. и конденсируют при пониженном давлении. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром:EtOAc (100:0 до 90:10) с получением 6-бром-2-этокси-3-метоксибензальдегида (5,1 г, 92%) в виде светло-желтого масла. 1H ЯМР (CDCl3, 400 МГц): δ 10,37 (с, 1H), 7,34 (д, J=8,8 Гц, 1H), 6,96 (д, J=8,8 Гц, 1H), 4,15 (кв, J=7,0 Гц, 2H), 3,88 (с, 3H), 1,40 (т, J=7,0 Гц, 3H).
Пример получения 170a: 1-бром-3-этокси-2-фтор-4-метоксибензол

1-бром-3-этокси-2-фтор-4-метоксибензол (25 г, 58%) получают по методике, аналогичной Примеру получения 155 с применением 3-бром-2-фтор-6-метоксифенола (38 г, 170 ммоль) и йодэтана (40,2 г, 258 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,14-7,20 (м, 1H), 6,58-6,63 (м, 1H), 4,02 (т, J=6,7 Гц, 2H), 3,86 (с, 3H), 1,75-1,80 (м, 2H), 1,03 (т, J=7,5 Гц, 3H).
Пример получения 170b: 1-бром-2-фтор-4-метокси-3-пропоксибензол

1-бром-2-фтор-4-метокси-3-пропоксибензол (10,2 g 57%) получают по методике, аналогичной Примеру получения 155 с применением 3-бром-2-фтор-6-метоксифенола (15 г, 68,2 ммоль) и 1-бромпропана (10,8 г, 88,6 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,14-7,20 (м, 1H), 6,58-6,63 (м, 1H), 4,02 (т, J=6,7 Гц, 2H), 3,86 (с, 3H), 1,75-1,80 (м, 2H), 1,03 (т, J=7,5 Гц, 3H).
Пример получения 171: 6-бром-3-метокси-2-пропоксибензонитрил

6-бром-3-метокси-2-пропоксибензонитрил (10,9 г, 92%) получают по методике, аналогичной Примеру получения 155, с применением 6-бром-2-гидрокси-3-метоксибензонитрила (10 г, 44 ммоль) и 1-бромпропана (7 г, 57 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,27-7,30 (м, 1H), 6,96 (д, J=8,8 Гц, 1H), 4,15 (т, J=6,6 Гц, 2H), 3,86 (с, 3H), 1,78-1,87 (м, 2H), 1,06 (т, J=7,5 Гц, 3H). ЖХМС m/z=270 [MH]+.
Пример получения 172: 5-бром-1-этокси-3-фтор-2-метоксибензол

К смеси 5-бром-3-фтор-2-метоксифенола (Пример получения 173, 2,21 г, 10,0 ммоль) и йодэтана (3,12 г, 20,0 ммоль) растворяют в MeCN (30 мл) добавляют K2CO3 (2,07 г, 15 ммоль). Смесь нагревают до примерно 50°C и перемешивают в течение примерно 5 ч. Смесь охлаждают до примерно 20°C и фильтруют. Фильтрат концентрируют и остаток растирают с МТБЭ (20 мл) в течение примерно 20 мин. Смесь фильтруют и фильтрат концентрируют с получением 5-бром-1-этокси-3-фтор-2-метоксибензола (1,85 г, 74%). 1H ЯМР (CDCl3, 400 МГц): δ 6,88-6,91 (м, 1H), 6,82-6,83 (м, 1H), 4,07 (кв, J=7,0 Гц, 2H), 3,90 (д, J=0,7 Гц, 3H), 1,46 (т, J=7,0 Гц, 3H).
Пример получения 173: 5-бром-3-фтор-2-метоксифенол

К смеси формиата 5-бром-3-фтор-2-метоксифенила (Пример получения 174, 4,98 г, 20,0 ммоль) в MeOH (30 мл) и воде (30 мл) добавляют LiOH (1,68 г, 40,0 ммоль) порциями. Смесь перемешивают при примерно 25°C в течение примерно 16 ч. Смесь концентрируют. Полученную водную фазу разбавляют вода и NaHCO3 добавляют до pH 8. Водную фазу промывают МТБЭ (2×30 мл) и объединенные МТБЭ экстракты концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 85:15) с получением 5-бром-3-фтор-2-метоксифенола (2,4 г, 54% за 2 стадии). 1H ЯМР (CDCl3, 400 МГц): δ 6,91-6,92 (м, 1H), 6,81-6,84 (м, 1H), 5,82 (с, 1H), 4,00 (д, J=1,8 Гц, 3H).
Пример получения 174: формиат 5-бром-3-фтор-2-метоксифенил

К смеси 5-бром-3-фтор-2-метоксибензальдегида (Пример получения 175, 3,50 г, 15,0 ммоль) в ДХМ (50 мл) добавляют м-ХПБК (4,85 г, 22,5 ммоль). Полученную смесь перемешивают при примерно 25°C в течение примерно 16 ч. Реакционную смесь концентрируют с получением 2-(5-бром-3-фтор-2-метоксифенил)ацетальдегида (3,74 г), который применяют в Примере получения 173.
Пример получения 175: 5-бром-3-фтор-2-метоксибензальдегид

К смеси 5-бром-3-фтор-2-гидроксибензальдегида (Пример получения 176, 18,6 г, 85,0 ммоль) в MeCN (150 мл) добавляют K2CO3 (17,6 г, 128,0 ммоль) и йодметан (24,1 г, 170,0 ммоль). Смесь нагревают до примерно 50°C в течение примерно 16 ч. Реакционную смесь фильтруют, и фильтрат концентрируют. Остаток растирают в МТБЭ (50 мл) и полученное твердое вещество фильтруют с получением 5-бром-3-фтор-2-метоксибензальдегида (4,9 г, 25%). 1H ЯМР (CDCl3, 400 МГц): δ 10,33 (с, 1H), 7,73-7,74 (м, 1H), 7,47-7,51 (м, 1H), 4,10 (д, J=3,0 Гц, 3H).
Пример получения 176: 5-бром-3-фтор-2-гидроксибензальдегид

К смеси 4-бром-2-фторфенола (20,0 г, 104,7 ммоль), растворенного в ТФК (100 мл), добавляют ГМТА (CAS 100-97-0, 29,4 г, 209,0 ммоль) порциями. Смесь нагревают при примерно 90°C в течение примерно 16 ч. Смесь выливают в воду (800 мл) и получают твердое вещество, которое фильтруют. Лепешку промывают водой (2×150 мл) и сушат с получением 5-бром-3-фтор-2-гидроксибензальдегида (18,9 г, 82%). 1H ЯМР (CDCl3, 400 МГц): δ 10,90 (с, 1H), 9,88 (д, J=2,0 Гц, 1H), 7,49-7,53 (м, 2H).
Пример получения 177: 5-бром-1-хлор-3-этокси-2-метоксибензол

5-бром-1-хлор-3-этокси-2-метоксибензол (1,25 г, 86%) получают по методике, аналогичной Примеру получения 172, с применением 5-бром-3-хлор-2-метоксифенола (Пример получения 178, 1,3 г, 5,47 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,12 (д, J=2,3 Гц, 1H), 6,93 (д, J=2,3 Гц, 1H), 4,06 (кв, J=7,0 Гц, 2H), 3,86 (с, 3H), 1,46 (т, J=7,0 Гц, 3H).
Пример получения 178: 5-бром-3-хлор-2-метоксифенол

К смеси формиата 5-бром-3-хлор-2-метоксифенила (Пример получения 179, 15,6 г, 58,76 ммоль) в MeOH (100 мл) и воде (100 мл) добавляют LiOH (4,93 г, 118,0 ммоль) порциями. Смесь перемешивают при примерно 25°C в течение примерно 16 ч. Смесь концентрируют, и полученную водную фазу разбавляют водный NaHCO3 (50 мл). Раствор экстрагируют МТБЭ (2×30 мл) и объединенные МТБЭ экстракты сушат и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром:EtOAc (100:0 до 90:10) с получением 5-бром-3-хлор-2-метоксифенола (1,3 г, 7% за 2 стадии). 1H ЯМР (CDCl3, 400 МГц): δ 7,07 (д, J=2,3 Гц, 1H), 7,05 (д, J=2,3 Гц, 1H), 5,79 (с, 1H), 3,92 (с, 3H).
Пример получения 179: формиат 5-бром-3-хлор-2-метоксифенила

К смеси 5-бром-3-хлор-2-метоксибензальдегида (Пример получения 180, 20,0 г, 80,16 ммоль) в ДХМ (200 мл) добавляют м-ХПБК (25,9 г, 120 ммоль). Смесь перемешивают при примерно 25°C в течение примерно 16 ч. Белое твердое вещество фильтруют, и фильтрат концентрируют с получением формиата 5-бром-3-хлор-2-метоксифенила (15,0 г, 70%), который применяют в Примере получения 178. ЖХМС m/z=266 [MH]+.
Пример получения 180: 5-бром-3-хлор-2-метоксибензальдегид

К смеси 5-бром-3-хлор-2-гидроксибензальдегида (Пример получения 181, 10 г, 42,5 ммоль) растворяют в MeCN (150 мл) добавляют йодметан (24,1 г, 170 ммоль) и K2CO3 (11,7 г, 84,9 ммоль). Смесь нагревают до примерно 50°C и перемешивают в течение примерно 24 ч. Смесь охлаждают до примерно 20°C, фильтруют. Фильтрат концентрируют, и остаток растирают с МТБЭ (30 мл) в течение примерно 20 мин, затем фильтруют. Фильтрат концентрируют, и остаток разбавляют водой (20 мл) и экстрагируют EtOAc (2×100 мл). Объединенные EtOAc экстракты концентрируют с получением 5-бром-3-хлор-2-метоксибензальдегида (8,9 г, 84%), который применяют в Примере получения 179. 1H ЯМР (CDCl3, 400 МГц): δ 10,30 (с, 1H), 7,87 (д, J=2,5 Гц, 1H), 7,77 (д, J=2,5 Гц, 1H), 4,01 (с, 3H).
Пример получения 181: 5-бром-3-хлор-2-гидроксибензальдегид

К смеси 4-бром-2-хлорфенола (20,0 г, 94,41 ммоль) в ТФК (150 мл) добавляют ГМТА (CAS 100-97-0, 27,0 г, 193 ммоль) порциями. Смесь перемешивают при примерно 90°C в течение примерно 16 ч. Смесь выливают в воду (800 мл) с получением осадка. Осадок фильтруют, промывают водой (2×150 мл) и сушат с получением 5-бром-3-хлор-2-гидроксибензальдегида (22,7 г), который применяют в Примере получения 180. 1H ЯМР (CDCl3, 400 МГц): δ 11,40 (шс, 1H), 9,86 (с, 1H), 7,75 (д, J=2,3Гц, 1H), 7,63 (д, J=2,3Гц, 1H).
Пример получения 182: 1-бром-5-этокси-2-фтор-4-метоксибензол
1-бром-5-этокси-2-фтор-4-метоксибензол (7,1 г, 90%) получают по методике, аналогичной Примеру получения 172 с применением 5-бром-4-фтор-2-метоксифенола (Пример получения 192, 7,0 г, 32,0 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 6,96-6,98 (м, 1H), 6,69-6,71 (м, 1H), 4,02-4,07 (м, 2H), 3,84 (с, 3H), 1,41-1,52 (м, 3H).
Пример получения 183: 1-бром-2-хлор-5-этокси-4-метоксибензол

1-бром-2-хлор-5-этокси-4-метоксибензол (5,7 г, 98%) получают по методике, аналогичной Примеру получения 172 с применением 5-бром-4-хлор-2-метоксифенола (Пример получения 184, 5,2 г, 21,9 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,05 (с, 1H), 6,94 (с, 1H), 4,06 (кв, J=7,0 Гц, 2H), 3,86 (с, 3H), 1,47 (т, J=7,0 Гц, 3H).
Пример получения 184: 5-бром-4-хлор-2-метоксифенол

К смеси формиата 5-бром-4-хлор-2-метоксифенила (Пример получения 185, 3,2 г, 12,05 ммоль) в MeOH (50 мл) и воде (50 мл) добавляют NaOH (0,72 г, 18,1 ммоль). Смесь перемешивают при примерно 20°C в течение примерно 1 ч. Смесь подкисляют с применением 1N HCl до pH 3. Смесь концентрируют и оставшуюся водную фазу экстрагируют EtOAc (3×100 мл). Объединенные EtOAc экстракты промывают насыщенным раствором соли (200 мл), сушат с безводным Na2SO4, фильтруют и концентрируют с получением 5-бром-4-хлор-2-метоксифенола (2,8 г, 98%). 1H ЯМР (CDCl3, 400 МГц): δ 7,16 (с, 1H), 6,93 (с, 1H), 5,58 (с, 1H), 3,28 (с, 3H).
Пример получения 185: формиат 5-бром-4-хлор-2-метоксифенила
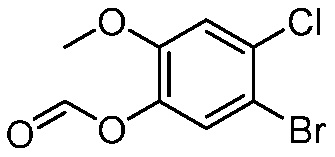
К смеси 5-бром-4-хлор-2-метоксибензальдегида (Пример получения 186, 12,2 г, 48,9 ммоль) в ДХМ (300 мл) добавляют м-ХПБК (21,1 г, 97,8 ммоль). Смесь перемешивают при примерно 18°C в течение примерно 16 ч. Смесь разделяют между ДХМ (400 мл) и насыщенным раствором метабисульфита натрия (200 мл). Отделенный ДХМ слой промывают водой (400 мл), насыщенным раствором соли (400 мл), сушат над MgSO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 90:10) с получением формиата 5-бром-4-хлор-2-метоксифенила (3,2 г, 25%). 1H ЯМР (CDCl3, 400 МГц): δ 8,22 (с, 1H), 7,36 (с, 1H), 7,09 (с, 1H), 3,85 (с, 3H).
Пример получения 186: 5-бром-4-хлор-2-метоксибензальдегид

К смеси 1-бром-2-хлор-4-метоксибензола (15,0 г, 67,73 ммоль) в ТФК (100 мл) добавляют ГМТА (CAS 100-97-0, 14,2 г, 102 ммоль) порциями. Смесь перемешивают при примерно 80°C в течение примерно 12 ч. Смесь выливают в воду (1000 мл) и перемешивают при примерно 20°C в течение примерно 1 ч, с образованием осадка. Осадок фильтруют, растворяют в EtOAc (200 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 90:10) с получением 5-бром-4-хлор-2-метоксибензальдегида (6,7 г, 40%). 1H ЯМР (CDCl3, 400 МГц): δ 10,33 (с, 1H), 8,03 (с, 1H), 7,12 (с, 1H), 3,94 (с, 3H).
Пример получения 187: 1-бром-5-этокси-4-метокси-2-метилбензол

1-бром-5-этокси-4-метокси-2-метилбензол (8,0 г, 99%) получают по методике, аналогичной Примеру получения 172 с применением 5-бром-2-метокси-4-метилфенола (Пример получения 189, 7,16 г, 33,0 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,01 (с, 1H), 6,74 (с, 1H), 4,05 (кв, J=7,0 Гц, 2H), 3,85 (с, 3H), 2,33 (с, 3H) 1,46 (т, J=7,0 Гц, 3H).
Пример получения 188: 1-бром-2-фтор-4-метокси-5-пропоксибензол
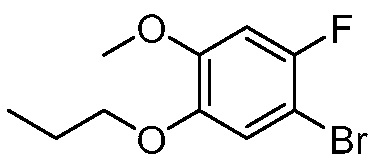
1-бром-2-фтор-4-метокси-5-пропоксибензол (13,5 г, 95%) получают по методике, аналогичной Примеру получения 172 с применением 5-бром-4-фтор-2-метоксифенола (Пример получения 192, 12 г, 109 ммоль) и 1-йодпропана (18,5 г, 109 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 6,98 (д, J=6,8 Гц, 1H), 6,70 (д, J=9,8 Гц, 1H), 3,93 (т, J=6,8 Гц, 2H), 3,84 (с, 3H), 1,81-1,90 (m 2H), 1,04 (т, J=7,6 Гц, 3H).
Пример получения 189: 5-бром-2-метокси-4-метилфенол

К смеси формиата 5-бром-2-метокси-4-метилфенила (Пример получения 190, 19,3 г, 78,58 ммоль) в MeOH (100 мл) и воде (100 мл) добавляют NaOH (4,72 г, 118,1 ммоль). Смесь перемешивают при примерно 20°C в течение примерно 1 ч. Смесь подкисляют с применением 1N HCl до pH 3. Смесь концентрируют, и оставшуюся водную фазу экстрагируют EtOAc (3×150 мл). Объединенные EtOAc экстракты сушат, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 80:20) с получением 5-бром-2-метокси-4-метилфенола (10,25 г, 60% за 2 стадии). 1H ЯМР (CDCl3, 400 МГц): δ 7,10 (с, 1H), 6,72 (с, 1H), 5,46 (шс, 1H), 3,87 (с, 3H), 2,33 (с, 3H).
Пример получения 190: формиат 5-бром-2-метокси-4-метилфенил
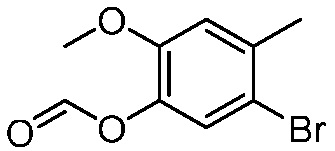
К смеси 5-бром-2-метокси-4-метилбензальдегида (Пример получения 191, 18,0 г, 78,58 ммоль) в ДХМ (200 мл) добавляют м-ХПБК (33,9 г, 157,0 ммоль). Смесь перемешивают при примерно 18°C в течение примерно 16 ч. Смесь фильтруют, и фильтрат концентрируют. Остаток промывают водный раствором метабисульфита натрия (1N, 200 мл), водным Na2CO3 (1N, 100 мл) и водой. Остаток дает формиат 5-бром-2-метокси-4-метилфенила (19,3 г), который применяют в Примере получения 189.
Пример получения 191: 5-бром-2-метокси-4-метилбензальдегид

К смеси 1-бром-4-метокси-2-метилбензола (25,1 г, 125,0 ммоль) в ТФК (120 мл) добавляют ГМТА (26,3 г, 188 ммоль) порциями. Смесь перемешивают при примерно 80°C в течение примерно 12 ч. Смесь выливают в воду (500 мл) и перемешивают при примерно 20°C в течение примерно 2 ч, с образованием осадка. Осадок фильтруют, суспендируют в воде при примерно 60°C в течение примерно 20 мин, охлаждают до примерно 20°C и фильтруют. Осадок растворяют в EtOAc (300 мл), сушат над Na2SO4, фильтруют и концентрируют с получением 5-бром-2-метокси-4-метилбензальдегида (18,0 г, 63%). 1H ЯМР (CDCl3, 400 МГц): δ 10,34 (с, 1H), 7,95 (с, 1H), 6,88 (с, 1H), 3,92 (с, 3H), 2,45 (с, 3H).
Пример получения 192: 5-бром-4-фтор-2-метоксифенола

К раствору 4-фтор-2-метоксифенола (5 г, 40 ммоль) и порошка Fe (98,2 мг, 1,76 ммоль) в ДХМ (230 мл) добавляют раствор Br2 (6,18 г, 38,7 ммоль) в ДХМ (20 мл). Раствор перемешивают в течение примерно 16 ч при примерно 20°C. Смесь промывают вода (3×200 мл) и NaOH (1N). ДХМ слой сушат (Na2SO4) и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 90:10) с получением 5-бром-4-фтор-2-метоксифенола (6,0 г, 77%). 1H ЯМР (CDCl3, 400 МГц): δ 7,07 (д, J=6,8 Гц, 1H), 6,68 (д, J=9,6 Гц, 1H), 5,47 (с, 1H), 3,87 (с, 3H).
Пример получения 193: 2-этокси-1,5-дифтор-3-метоксибензол

К смеси 2-этокси-3,5-дифторфенола (6,0 г, 34,45 ммоль) и йодметана (Пример получения 194, 24,5 г, 172,0 ммоль) в MeCN (100 мл) добавляют K2CO3 (9,52 г, 68,9 ммоль). Смесь нагревают до примерно 60°C и перемешивают в течение примерно 5 ч. Смесь охлаждают до примерно 20°C, фильтруют и концентрируют. Остаток растворяют в EtOAc (200 мл). EtOAc слой промывают водой (80 мл), насыщенным раствором соли (50 мл), сушат над MgSO4, фильтруют и концентрируют с получением 2-этокси-1,5-дифтор-3-метоксибензола (5,0 г, 77%), который применяют в Примере получения 137. 1H ЯМР (CDCl3, 400 МГц): δ 6,43-6,50 (м, 2H), 4,07 (кв, J=7,0 Гц, 2H), 3,85 (с, 3H), 1,36 (т, J=7,0 Гц, 3H).
Пример получения 194: 2-этокси-3,5-дифторфенол
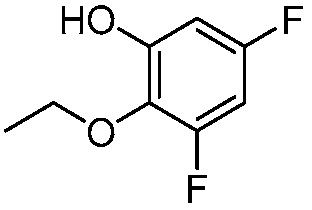
К смеси 2-(2-этокси-3,5-дифторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 195, 13,0 г, 45,76 ммоль) в ТГФ (100 мл) добавляют H2O2 (30%, 7,78 г, 68,6 ммоль) и водный NaOH (1M, 48,0 мл, 48,0 ммоль) при примерно 0°C. Смесь нагревают до примерно 25°C в течение примерно 2 ч. Смесь подкисляют 1N HCl до pH 5. Насыщенным раствором соли (100 мл) добавляют, и смесь экстрагируют EtOAc (2×200 мл). Объединенные EtOAc экстракты сушат над NaSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (10:1) с получением 2-этокси-3,5-дифторфенола (6,0 г, 75%). 1H ЯМР (CDCl3, 400 МГц): δ 6,49-6,52 (м, 1H), 6,37-6,43 (м, 1H), 5,95 (д, J=1,5 Гц, 1H), 4,18 (кв, J=7,0 Гц, 2H), 1,39 (т, J=7,0 Гц, 3H).
Пример получения 195: 2-(2-этокси-3,5-дифторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан

Объединенную смесь 1-бром-2-этокси-3,5-дифторбензола (Пример получения 196, 11,0 г, 46,4 ммоль), Pin2B2 (6,53 г, 51,0 ммоль) Pd(dppf)Cl2 (1,7 г, 2,32 ммоль) и KOAc (9,11 г, 92,8 ммоль) в безводном 1,4-диоксане (200 мл) дегазируют, нагревают и перемешивают при примерно 80°C в течение примерно 24 ч под N2. Суспензию фильтруют и фильтрат концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 70:30) с получением 2-(2-этокси-3,5-дифторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (13,0 г, 99%). 1H ЯМР (CDCl3, 400 МГц): δ 7,14-7,17 (м, 1H), 6,90-6,95 (м, 1H), 4,06 (кв, J=7,1Гц, 2H), 1,41 (т, J=7,1Гц, 3H), 1,37 (с, 12H). ЖХМС m/z=285 [MH]+.
Пример получения 196: 1-бром-2-этокси-3,5-дифторбензол
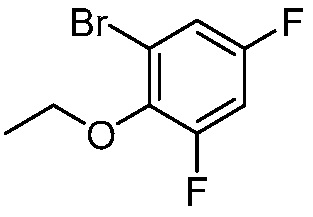
К смеси 2-бром-4,6-дифторфенола (10,0 г, 47,85 ммоль) и йодэтана (14,9 г, 95,7 ммоль) в MeCN (200 мл) добавляют K2CO3 (13,2 г, 95,7 ммоль). Смесь нагревают до примерно 60°C и перемешивают в течение примерно 16 ч. Смесь охлаждают до примерно 20°C, фильтруют и фильтрат концентрируют. Остаток растворяют в EtOAc (200 мл). EtOAc слой промывают водой (80 мл), насыщенным раствором соли (50 мл), сушат над MgSO4, фильтруют и концентрируют с получением 1-бром-2-этокси-3,5-дифторбензола (11,0 г, 97%), который применяют в Примере получения 195. 1H ЯМР (CDCl3, 400 МГц): δ 7,09-7,12 (м, 1H), 6,82-6,88 (м, 1H), 4,12 (кв, J=7,0 Гц, 2H), 1,43 (т, J=7,0 Гц, 3H).
Пример получения 197: 4-бром-1,2-диэтоксибензол

4-бром-1,2-диэтоксибензол (6,3 г, 97%) получают по методике, аналогичной Примеру получения 172 с применением 4-бромбензол-1,2-диола (5,0 г, 26 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 6,96-7,01 (м, 2H), 6,71-6,76 (м, 1H), 4,06 (дкв, J=3,5, 7,0 Гц, 4H), 1,40-1,48 (м, 6H).
Пример получения 198: 4-бром-1-этокси-2-метоксибензол

4-бром-1-этокси-2-метоксибензол (5,1 г, 98%) получают по методике, аналогичной Примеру получения 172 с применением 4-бром-2-метоксифенола (4,57 г, 22,5 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 6,99-7,03 (м, 1H), 6,97-6,99 (м, 1H), 6,74 (д, J=8,8 Гц, 1H), 4,07 (кв, J=6,9 Гц, 2H), 3,86 (с, 3H), 1,46 (т, J=6,9 Гц, 3H). ЖХМС m/z=231 [MH]+.
Пример получения 199: 1-бром-4-этокси-2-фтор-3-метоксибензол

1-бром-4-этокси-2-фтор-3-метоксибензол получают в виде желтого масла (6,3 г, 99%) по методике, аналогичной Примеру получения 172 с применением 3-бром-6-этокси-2-фторфенола (Пример получения 200, 6 г, 25,5 ммоль) и йодметана (10,9 г, 76,6 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,13-7,19 (м, 1H), 6,60 (дд, J=2,0, 9,3 Гц, 1H), 4,08 (кв, J=7,2 Гц, 2H), 3,93 (д, J=1,0 Гц, 3H), 1,46 (т, J=7,1 Гц, 3H).
Пример получения 200: 3-бром-6-этокси-2-фторфенол

К раствору 2-(3-бром-6-этокси-2-фторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (Пример получения 201, 15,2 г, 44,1 ммоль) в ТГФ (150 мл) добавляют H2O2 (30%, 7,49 г, 66,1 ммоль) и водный NaOH (1M, 46,3 мл, 46,3 ммоль) при примерно 0°C. Смесь нагревают до примерно 25°C в течение примерно 1,5 ч. Смесь подкисляют с 1N HCl до pH 5. Насыщенным раствором соли (150 мл) добавляют, и смесь экстрагируют EtOAc (2×200 мл). Объединенные EtOAc экстракты сушат над Na2SO4, фильтруют и концентрируют с получением 3-бром-6-этокси-2-фторфенола (10,0 г, 97%). 1H ЯМР (CDCl3, 400 МГц): δ 6,99 (дд, J=7,0, 9,0 Гц, 1H), 6,53-6,62 (м, 1H), 4,07-4,20 (м, 3H), 1,46 (т, J=7,0 Гц, 3H).
Пример получения 201: 2-(3-бром-6-этокси-2-фторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан

К раствору 1-бром-4-этокси-2-фторбензола (Пример получения 202, 11,0 г, 50,2 ммоль) в ТГФ (250 мл) добавляют по каплям раствор ДАЛ (37,7 мл, 75,3 ммоль, 2 M в ТГФ) при примерно -78°C. Раствор перемешивают при примерно -78°C в течение примерно 1 ч, PinBO-Pr (14,0 г, 75,3 ммоль) добавляют по каплям. После перемешивания при примерно -78°C в течение примерно 2 ч, раствор гасят водный NH4Cl (1 M, 100 мл) и экстрагируют МТБЭ (3×300 мл). Объединенные МТБЭ экстракты промывают насыщенным раствором соли (200 мл), сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (10:1) с получением 2-(3-бром-6-этокси-2-фторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (15,2 г, 88%). 1H ЯМР (CDCl3, 400 МГц): δ 7,43 (т, J=8,6 Гц, 1H), 6,51 (д, J=8,8 Гц, 1H), 3,99 (кв, J=6,9 Гц, 2H), 1,35-1,45 (м, 16H).
Пример получения 202: 1-бром-4-этокси-2-фторбензол
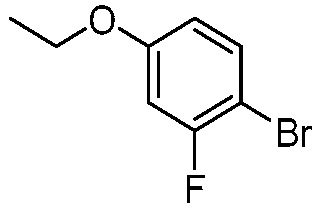
1-бром-4-этокси-2-фторбензол (11 г, 96%) получают по методике, аналогичной Примеру получения 172, с применением 4-бром-2-метоксифенола (10 г, 52 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,33-7,45 (м, 1H), 6,69 (дд, J=2,9, 10,8 Гц, 1H), 6,60 (ддд, J=1,0, 2,9, 8,8 Гц, 1H), 4,00 (кв, J=7,2 Гц, 2H), 1,42 (т, J=6,9 Гц, 3H).
Пример получения 203: (4-бром-2-метоксифенил)(метил)сульфан

К раствору диметилдисульфида (35 г, 371 ммоль) и изопентилнитрита (57,9 г, 495 ммоль) в ТГФ (600 мл) медленно добавляют 4-бром-2-метоксибензоламин (50 г, 247,46 ммоль). Смесь перемешивают при примерно 70°C в течение примерно 3 ч. Реакционную смесь концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 90:10) с получением (4-бром-2-метоксифенил)(метил)сульфана (50 г, 87%). 1H ЯМР (CDCl3, 400 МГц): δ 7,07-7,12 (м, 1H), 6,99-7,03 (м, 1H), 6,96 (д, J=2,0 Гц, 1H), 3,90 (с, 3H), 2,42 (с, 3H). ЖХМС m/z=233,0 [MH]+.
Пример получения 204: (4-бром-2-этоксифенил)(метил)сульфан

(4-бром-2-этоксифенил)(метил)сульфан (35,0 г, 83%) получают по методике, аналогичной Примеру получения 172 с применением 5-бром-2-(метилтио)фенола (Пример получения 20, 16 г, 73 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,05-7,09 (м, 1H), 6,97-7,01 (м, 1H), 6,94 (д, J=2,0 Гц, 1H), 4,09 (кв, J=7,1 Гц, 2H), 2,41 (с, 3H), 1,47 (т, J=7,0 Гц, 3H).
Пример получения 205: (4-бром-2-(циклопентилокси)фенил)(метил)сульфан

(4-бром-2-(циклопентилокси)фенил)(метил)сульфан (6,0 г, 92%) получают по методике, аналогичной Примеру получения 153 с применением 5-бром-2-(метилтио)фенола (5 г, 22,8 ммоль) и циклопентанола (2,36 г, 27,4 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,05 (дд, J=2,0, 8,3 Гц, 1H), 6,93-6,98 (м, 2H), 4,80-4,84 (м, 1H), 2,38 (с, 3H), 1,79-1,95 (м, 6H), 1,60-1,68 (м, 2H).
Пример получения 206: 5-бром-2-(метилтио)фенол

К раствору (4-бром-2-метоксифенил)(метил)сульфана (19,0 г, 81,5 ммоль) в ДХМ (300 мл) при примерно -78°C добавляют BBr3 (179 мл, 179 ммоль, 1 M в ДХМ) по каплям под атмосферой N2. Реакционную смесь нагревают до примерно 20°C и перемешивают в течение примерно 2 ч. Смесь гасят MeOH при примерно 0°C и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 70:30) с получением 5-бром-2-(метилтио)фенола (16,3 г, 91%). 1H ЯМР (CDCl3, 400 МГц): δ 7,35 (д, J=8,3 Гц, 1H), 7,17 (д, J=2,2 Гц, 1H), 7,03 (дд, J=2,2, 8,3 Гц, 1H), 6,67 (шс, 1H), 2,32 (с, 3H).
Пример получения 207: 6-бром-2-(циклопентилокси)-3-метоксибензонитрил

Смесь оксима 6-бром-2-(циклопентилокси)-3-метоксибензальдегид (Пример получения 208, 7 г, 22,3 ммоль), ТФУА (7,16 г, 33,45 ммоль) и Et3N (6,76 г, 66,9 ммоль) в ДХМ (100 мл) перемешивают при примерно 20°C в течение примерно 16 ч. Вода (200 мл) добавляют к смеси и экстрагируют ДХМ (2×200 мл). Объединенные ДХМ экстракты промывают насыщенным раствором соли (200 мл), сушат и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (10:1) с получением 6-бром-2-(циклопентилокси)-3-метоксибензонитрила (1,6 г, 24%). 1H ЯМР (CDCl3, 400 МГц): δ 7,26-7,30 (м, 1H), 6,96 (д, J=8,8 Гц, 1H), 5,11-5,17 (м, 1H), 3,87 (с, 3H), 1,89-2,02 (м, 4H), 1,70-1,80 (м, 2H), 1,59-1,68 (м, 2H).
Пример получения 208: оксим 6-бром-2-(циклопентилокси)-3-метоксибензальдегид

К раствору 6-бром-2-(циклопентилокси)-3-метоксибензальдегида (Пример получения 209, 6,8 г, 22,7 ммоль) в EtOH (100 мл) добавляют NaHCO3 (3,8 г, 45,4 ммоль) и NH2OH∙HCl (2,35 г, 34 ммоль). Смесь перемешивают при примерно 20°C в течение примерно 2 ч. Реакционную смесь концентрируют с получением оксима 6-бром-2-(циклопентилокси)-3-метоксибензальдегида (7 г), который применяют в Примере получения 207.
Пример получения 209: 6-бром-2-(циклопентилокси)-3-метоксибензальдегид

6-бром-2-(циклопентилокси)-3-метоксибензальдегид (6,8 г, 90%) получают по методике, аналогичной Примеру получения 172 с применением 6-бром-2-гидрокси-3-метоксибензальдегида (Пример получения 165, 6 г, 30 ммоль) и бромциклопентана (4,26 г, 28,6 ммоль) при примерно 60°C в течение примерно 3 ч. 1H ЯМР (CDCl3, 400 МГц): δ 10,31-10,38 (м, 1H), 7,31 (д, J=8,8 Гц, 1H), 6,94 (д, J=8,8 Гц, 1H), 4,95-5,01 (м, 1H), 3,87 (с, 3H), 1,70-1,93 (м, 7H), 1,62 (д, J=5,4 Гц, 2H). ЖХМС m/z=323 [M+Na]+.
Пример получения 210: 1-бром-2,4-диметокси-3-пропоксибензол

1-бром-2,4-диметокси-3-пропоксибензол (10 г, 85%) получают по методике, аналогичной Примеру получения 172, с применением 3-бром-2,6-диметоксифенола (Пример получения 211, 10 г, 43 ммоль) и 1-йодпропана (14,6 г, 86 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,17-7,22 (м, 1H), 6,58 (д, J=8,8 Гц, 1H), 3,95-3,99 (м, 2H), 3,90 (с, 3H), 3,84 (с, 3H), 1,73-1,85 (м, 2H), 1,01-1,07 (м, 4H). ЖХМС m/z=276 [MH]+.
Пример получения 211: 3-бром-2,6-диметоксифенол
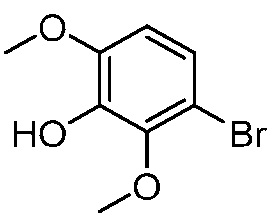
К перемешиваемому раствору 2,6-диметоксифенола (1 г, 6,5 ммоль) в CCI4 (35 мл) при примерно -10°C добавляют Br2 (1,04 г, 6,5 ммоль) и перемешивают в течение примерно 2 ч. Реакционную смесь разбавляют CCl4 (20 мл), промывают водой (3×60 мл) и CCl4 слой промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 80:20) с получением 3-бром-2,6-диметоксифенола (1,46 г, 97%). 1H ЯМР (CDCl3, 400 МГц): δ 7,02 (д, J=8,8 Гц, 1H), 6,57 (д, J=8,8 Гц, 1H), 5,66 (с, 1H), 3,93 (с, 3H), 3,89 (с, 3H).
Пример получения 212: 6-йод-3-метокси-2-пропоксипиридин

6-йод-3-метокси-2-пропоксипиридин (11 г, 95%) получают по методике, аналогичной Примеру получения 172, с применением 6-йод-2-пропоксипиридин-3-ола (Пример получения 213, 11 г, 39 ммоль) и 1-йодметана (57 г, 402 ммоль) при примерно 15°C в течение примерно 6 ч. 1H ЯМР (CDCl3, 400 МГц): δ 7,24 (д, J=8,0 Гц, 1H), 6,91 (д, J=8,0 Гц, 1H), 4,25 (т, J=6,8 Гц, 2H), 3,83 (с, 3H), 1,73-1,90 (м, 2H), 1,04 (т, J=7,5 Гц, 3H). ЖХМС m/z=293 [MH]+.
Пример получения 213: 6-йод-2-пропоксипиридин-3-ол

Ппропан-1-олат натрия (21,8 г, 265 ммоль) добавляют к 2-бром-6-йодпиридин-3-олу (Пример получения 214, 26,5 г, 88,4 ммоль) в ДМФ (200 мл), и реакционную смесь перемешивают в течение примерно 16 ч при примерно 110°C под N2. После охлаждения до примерно 20°C, реакционную смесь разделяют между насыщенным раствором соли (200 мл) и EtOAc (250 мл). Водный слой экстрагируют EtOAc (200 мл). Объединенные EtOAc экстракты сушат (Na2SO4) и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 80:20) с получением 6-йод-2-пропоксипиридин-3-ола (11,2 г, 45%). 1H ЯМР (CDCl3, 400 МГц): δ 7,17 (д, J=8,0 Гц, 1H), 6,81 (д, J=8,0 Гц, 1H), 5,47 (с, 1H), 4,31 (дт, J=0,9, 6,7 Гц, 2H), 1,74-1,86 (м, 2H), 0,98-1,05 (м, 3H).
Пример получения 214: 2-бром-6-йодпиридин-3-ол

К раствору 2-бром-3-гидрокси пиридина (20,0 г, 114,95 ммоль) в воде (250 мл) добавляют K2CO3 (31,8g, 230 ммоль) и I2 (29,2 г, 115 ммоль). Смесь перемешивают при примерно 20°C в течение примерно 5 ч. Смесь охлаждают до 0°C и обрабатывают концентрируют HCl. Осадок фильтруют с получением 2-бром-6-йодпиридин-3-ола (30 г, 87%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 11,10 (шс, 1H), 7,62 (д, J=8,1 Гц, 1H), 7,03 (д, J=8,3 Гц, 1H). ЖХМС m/z=299 [MH]+.
Пример получения 215: 5-бром-2-метокси-3-пропоксипиридин

К раствору 2-метокси-3-пропоксипиридина (Пример получения 216, 5,68 г, 34 ммоль) растворяют в ДХМ (60 мл) добавляют HOAc (2,04 г, 34ммоль). К смеси порциями добавляют NBS (6,35 г, 35,7 ммоль) при перемешивании. Смесь перемешивают при примерно 12°C в течение примерно 16 ч. Смесь концентрируют. Остаток разбавляют вода (200 мл) и экстрагируют EtOAc (2×100 мл) Объединенные EtOAc экстракты сушат и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 85:15) с получением смесь 6-бром-2-метокси-3-пропоксипиридина и 5-бром-2-метокси-3-пропоксипиридина. Смесь охлаждают до примерно -10°C в течение ночи. Получают осадок, который отделяют от масла центрифугированием (3×5 мин @ 3000 об./мин.) с получением 5-бром-2-метокси-3-пропоксипиридина (3 г, 53%). 1H ЯМР (CDCl3, 400 МГц): δ 7,76 (д, J=2,0 Гц, 1H), 7,13 (д, J=2,0 Гц, 1H), 3,98 (с, 3H), 3,95 (т, J=6,8 Гц, 2H), 1,85-1,94 (м, 2H), 1,05 (т, J=7,5 Гц, 3H).
Пример получения 216: 2-метокси-3-пропоксипиридин

2-метокси-3-пропоксипиридин (5,7 г, 85%) получают по методике, аналогичной Примеру получения 172, с применением 2-метоксипиридин-3-ола (5 г, 40 ммоль) и 1-йодпропана (13,6 г, 80 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,73 (дд, J=1,5, 4,9 Гц, 1H), 7,05 (дд, J=1,5, 7,82 Гц, 1H), 6,83 (дд, J=5,0, 7,7 Гц, 1H), 4,02 (с, 3H), 3,97 (т, J=6,9 Гц, 2H), 1,86-1,93 (м, 2H), 1,05 (т, J=7,5 Гц, 3H).
Пример получения 217: 2-бром-5-метокси-4-пропоксипиридин

К раствору 2-бром-4-йод-5-метоксипиридина (Пример получения 218, 4,0 г, 13 ммоль) в ДМФ (30 мл) добавляют NaH (765 мг, 19,1 ммоль, 60%) и 1-пропанол (1,53 г, 25,5 ммоль) в ДМФ (25 мл) при примерно 20°C. Смесь нагревают до примерно 60°C в течение примерно 1 ч. Раствор гасят водный NH4Cl (1 M, 30 мл) и экстрагируют EtOAc (3×100 мл). Объединенные EtOAc экстракты промывают насыщенным раствором соли (100 мл), сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 89:11) с получением 2-бром-5-метокси-4-пропоксипиридина (2 г, 64%). 1H ЯМР (CDCl3, 400 МГц): δ 7,84 (с, 1H), 6,91 (с, 1H), 4,00 (т, J=6,9 Гц, 2H), 3,90 (с, 3H), 1,83-1,92 (м, 2H), 1,05 (т, J=7,3 Гц, 3H). ЖХМС m/z=247,8 [MH]+.
Пример получения 218: 2-бром-4-йод-5-метоксипиридин

Гидрид натрия (1,27 г, 31,8 ммоль, 60%) суспендируют в MeOH (2,55 г, 79,5 ммоль) и ДМФ (80 мл) при примерно 25°C. Смесь добавляют к раствору 2-бром-5-фтор-4-йодпиридина (Пример получения 219, 8 г, 26,50 ммоль) в ДМФ (10 мл) при примерно 0°C. Смесь перемешивают при примерно 0°C в течение примерно 1 ч. Раствор гасят водный NH4Cl (1 M, 60 мл) и экстрагируют MBTE (3×200 мл). Объединенные МТБЭ экстракты промывают насыщенным раствором соли (100 мл), сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 90:10) с получением 2-бром-4-йод-5-метоксипиридина (4 г, 48,1%). 1H ЯМР (CDCl3, 400 МГц): δ 7,88 (с, 1H), 7,85 (с, 1H), 3,97 (с, 3H).
Пример получения 219: 2-бром-5-фтор-4-йодпиридин
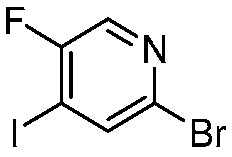
Раствор 2-бром-5-фторпиридина (24,6 г, 140 ммоль) в ТГФ (300 мл) охлаждают до примерно -78°C. ДАЛ (2 M в ТГФ, 90,9 мл, 182 ммоль) добавляют по каплям, и смесь перемешивают в течение примерно 20 мин. К смеси добавляют раствор йода (49,7 г, 196 ммоль) в ТГФ (100 мл) по каплям. Реакционную смесь нагревают до примерно 0°C и перемешивают в течение примерно 30 мин. Реакционную смесь гасят 10% водн. раствор Na2S2O3 и экстрагируют EtOAc (3×500 мл). Объединенные EtOAc экстракты промывают насыщенным раствором соли (500 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (10:1) с получением 2-бром-5-фтор-4-йодпиридина (50 г, 67% чистота). Продукт дополнительно очищают препаративной ЖХВД (Колонка: Phenomenex Synergi Max-RP 150 мм x 50 мм, 10 µ; Подвижная фаза: [вода (0,225% HCO2H)-АЦН]; B%: 30%-60%, 25 мин. Скорость потока 120 мл/мин.) с получением 2-бром-5-фтор-4-йодпиридина (16,8 г, 40%). 1H ЯМР (CDCl3, 400 МГц): δ 8,15 (с, 1H), 7,92 (с, 1H). ЖХМС m/z=303 [MH]+.
Пример получения 220: 3-фтор-2-йод-5-метокси-6-пропоксипиридин

К раствору 5-фтор-3-метокси-2-пропоксипиридина (Пример получения 221, 2,80 г, 15,1 ммоль) в EtOH (50 мл) добавляют Ag2SO4 (7,07 г, 22,7 ммоль) и I2 (5,76 г, 22,7 ммоль). Реакционную смесь перемешивают при примерно 10°C в течение примерно 16 ч. Смесь и раствор разделяют между EtOAc (3×100 мл) и водой (100 мл). EtOAc экстракты сушат с Na2SO4, фильтруют и концентрируют с получением 3-фтор-2-йод-5-метокси-6-пропоксипиридина (4,38 г, 93%). 1H ЯМР (CDCl3, 400 МГц): δ 7,58-7,74 (м, 1H), 4,30 (т, J=6,7 Гц, 2H), 3,92 (с, 3H), 1,75-1,91 (м, 2H), 1,05 (т, J=7,3 Гц, 3H). ЖХМС m/z=311 [MH]+.
Пример получения 221: 5-фтор-3-метокси-2-пропоксипиридин
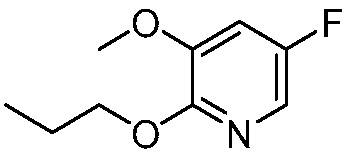
Смесь tBuXPhos-Pd-G3 (CAS 14447963-75-8, 443 мг, 0,557 ммоль), PrOH (803 мг, 13,4 ммоль), 2-хлор-5-фтор-3-метоксипиридина (Пример получения 222, 1800 мг, 11,14 ммоль) и Cs2CO3 (7260 мг, 22,3 ммоль) растворяют в PrOH (40 мл) под N2. Смесь нагревают при примерно 90°C в течение примерно 16 ч. Смесь сушат и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 90:10) с получением 5-фтор-3-метокси-2-пропоксипиридина (1280 мг, 77%). 1H ЯМР (CDCl3, 400 МГц): δ 7,57 (д, J=2,5 Гц, 1H), 6,87 (дд, J=2,7, 9,3 Гц, 1H), 4,31 (т, J=7,0 Гц, 2H), 3,87 (с, 3H), 1,77-1,93 (м, 2H), 0,98-1,08 (м, 3H). ЖХМС m/z=185 [MH]+.
Пример получения 222: 2-хлор-5-фтор-3-метоксипиридин

2-хлор-5-фтор-3-метоксипиридин (1,8 г, 72%) получают по методике, аналогичной Примеру получения 153 с применением 2-хлор-5-фторпиридин-3-ола (2,3 г, 16 ммоль) и метанола (5 г, 156 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,89 (д, J=2,70 Гц, 1H), 7,00 (дд, J=2,5, 9,1 Гц, 1H), 3,93 (с, 3H).
Пример получения 223: 4-бром-1-(дифторметокси)-2-пропоксибензол

Порошковый KOH (1,34 г, 23,8 ммоль) добавляют к перемешиваемому раствору 4-бром-2-пропоксифенола (Пример получения 224, 5,5 г, 23,8 ммоль) в NMP (150 мл) при примерно 15°C под N2. Смесь нагревают при примерно 50°C в течение примерно 45 мин, затем охлаждают до примерно 15°C. Дифторхлорметан барботируют через реакционную смесь (приблизительно 20 мин) до насыщения и смесь перемешивают в течение еще 20 мин. Гидроксид калия (2,68 г в 3 мл воды) добавляют по каплям, сохраняя температуру ниже 33°C. Смесь перемешивают в течение еще 40 мин. Дополнительный гидроксид калия (1,34 г, в 3 мл воды) добавляют по каплям и смесь перемешивают в течение 1 ч. N2 барботируют через реакционную смесь и добавляют воду. pH полученной смеси доводят до 8 добавлением гидроксида калия (водного) и смесь экстрагируют с применением МТБЭ (2×100 мл). Объединенные MBTE экстракты промывают водой (50 мл), насыщенным раствором соли (3×100 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 90:10) с получением 4-бром-1-(дифторметокси)-2-пропоксибензола (4,8 г, 72%). 1H ЯМР (CDCl3, 400 МГц): δ 7,09 (д, J=1,3 Гц, 1H), 7,03-7,06 (м, 2H), 6,33-6,74 (м, 1H), 3,93-4,01 (м, 2H), 1,80-1,92 (м, 2H), 1,06 (т, J=7,4 Гц, 3H).
Пример получения 224: 4-бром-2-пропоксифенол

К раствору формиата 4-бром-2-пропоксифенила (Пример получения 225, 10,9 г, 42 ммоль) в MeOH (75 мл) и воде (75 мл) добавляют NaOH (4200 мг, 105 ммоль). Смесь перемешивают при примерно 10°C в течение примерно 1 ч. Смесь выстаивают в течение ночи. Смесь подкисляют HCl (1N) до pH 3. Смесь концентрируют и фильтруют. Фильтровальную лепешку промывают водой (20 мл). Лепешку растворяют в МТБЭ (200 мл) и EtOAc (50 мл). Объединенные МТБЭ и EtOAc экстракты сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 75:25) с получением 4-бром-2-пропоксифенола (6,11 г, 63%). 1H ЯМР (CDCl3, 400 МГц): δ 6,94-7,06 (м, 2H), 6,81 (д, J=8,5 Гц, 1H), 3,99 (т, J=6,8 Гц, 2H), 1,79-1,95 (м, 2H), 1,06 (т, J=7,5 Гц, 3H).
Пример получения 225: формиата 4-бром-2-пропоксифенила
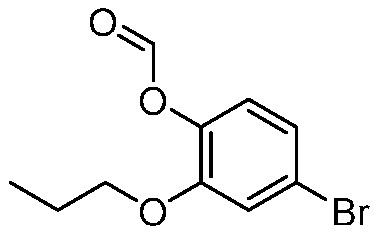
К раствору 4-бром-2-пропоксибензальдегида (Пример получения 226, 10,2 г, 42 ммоль) растворяют в ДХМ (150 мл) добавляют м-ХПБК (18,1 г, 84 ммоль). Смесь перемешивают при примерно 18°C в течение примерно 16 ч, затем выстаивают в течение выходных. Смесь фильтруют и концентрируют с получением формиата 4-бром-2-пропоксифенила (10,9 г), который применяют в Примере получения 224. ЖХМС m/z=248 [MH]+.
Пример получения 226: 4-бром-2-пропоксибензальдегид

4-бром-2-пропоксибензальдегид (11,5 г, 95%) получают по методике, аналогичной Примеру получения 172, с применением 4-бром-2-гидроксибензальдегида (10 г, 50 ммоль) и 1-йодпропана (11 г, 65 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 10,45 (д, J=0,7 Гц, 1H), 7,69 (д, J=8,1 Гц, 1H), 7,11-7,22 (м, 2H), 4,04 (т, J=6,5 Гц, 2H), 1,80-2,02 (м, 2H), 1,09 (т, J=7,3 Гц, 3H).
Пример получения 227: ((2-бромаллил)окси)(трет-бутил)диметилсилан

Пять реакций проводят параллельно. К раствору 2-бромпроп-2-ен-1-ола (Пример получения 60, 150 г, 1,10 моль) и имидазола (Пример получения 228, 74,6 г, 0,985 моль) в ДМФ (900 мл) добавляют ТБС-Cl (140 г, 0,93 моль) порциями при примерно 30°C. Затем смесь перемешивают при примерно 35°C в течение 1 ч. Смесь выливают в воду (5,0 л). Объединенные смеси экстрагируют МТБЭ (3×2,5 л). Органический слой промывают насыщенным раствором соли (2,0 л), сушат над Na2SO4 и концентрируют с получением ((2-бромаллил)окси)(трет-бутил)диметилсилана (1250 г, 92%). 1H ЯМР (CDCl3, 400 МГц): δ 5,96 (д, J=1,8 Гц, 1H), 5,54 (д, J=1,8 Гц, 1H), 4,22 (т, J=1,5 Гц, 2H), 0,89-0,97 (м, 9H), 0,11 (с, 6H).
Пример получения 228: 2-бромпроп-2-ен-1-ол

Пять реакций проводят параллельно: К раствору 2,3-дибромпроп-1-ена (300 г, 1,50 моль) в ДМФ (900 мл) добавляют KOAc (221 г, 2,25 моль) порциями при перемешивании при примерно 20°C. Смесь перемешивают при примерно 20°C в течение примерно 12 ч. Раствор LiOH (126 г, 3,01 моль) в MeOH (900 мл) и H2O (300 мл) добавляют по каплям в полученную выше смесь при перемешивании при примерно 20°C. Смесь перемешивают при примерно 20°C в течение примерно 1 ч. Смесь концентрируют и выливают в ледяную воду (2,0 л). Смесь экстрагируют EtOAc (3×1,5 л). EtOAc экстракты промывают насыщенным раствором соли (1,0 л), сушат над Na2SO4 и концентрируют с получением 2-бромпроп-2-ен-1-ол (750 г, 72%). 1H ЯМР (CDCl3, 400 МГц): δ 5,87-6,02 (м, 1H), 5,45-5,62 (м, 1H), 4,17 (с, 2H), 3,70 (шс, 1H).
Пример получения 229: ((3-бромбут-3-ен-1-ил)окси)(трет-бутил)диметилсилан
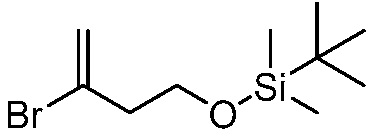
К смеси 3-бромбут-3-ен-1-ола (CAS 76334-36-6, 10,0 г, 66,2 ммоль) в безводном ДХМ (65 мл) добавляют имидазол (5,41 г, 79,5 ммоль) и ТБС-Cl (9,98 г, 66,2 ммоль). Смесь перемешивают при примерно 18°C в течение примерно 16 ч. Реакционную смесь выливают в ледяную воду и экстрагируют EtOAc (2×200 мл). Объединенные EtOAc экстракты промывают насыщенным раствором соли, сушат над Na2SO4 и фильтруют. Фильтрат концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир с получением ((3-бромбут-3-ен-1-ил)окси)(трет-бутил)диметилсилана (16,0 г, 91%). 1H ЯМР (CDCl3, 400 МГц): δ 5,64 (с, 1H), 5,46 (д, J=1,6 Гц, 1H), 3,80 (т, J=6,4 Гц, 2H), 2,63 (т, J=6,2 Гц, 2H), 0,90 (с, 9H), -0,08 (с, 6H).
Пример получения 230: 4-(((трет-бутилдиметилсилил)окси)метил)-2,6-дихлорпиримидин
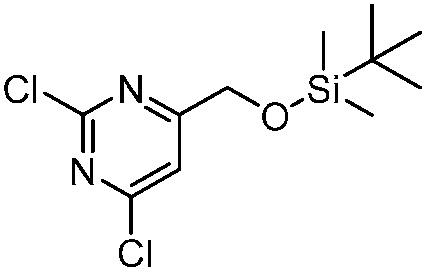
К раствору 2,6-дихлорпиримидин-4-ил)метанола (Пример получения 231, 3,5 г, 19,55 ммоль) и имидазола (1,6 г, 23,5 ммоль) в ДМФ (60 мл) добавляют ТБС-Cl (3,24 г, 22,4 моль) порциями при примерно 0°C. Смесь перемешивают при примерно 0°C в течение примерно 2 ч. Смесь выливают в ледяную воду (50 мл) и экстрагируют EtOAc (3×50 мл). Объединенные EtOAc экстракты промывают насыщенным раствором соли (2×30 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфир/EtOAc (100:0 до 90:10) с получением 4-(((трет-бутилдиметилсилил)окси)метил)-2,6-дихлорпиримидина (3,1 г, 54%). 1H ЯМР (CDCl3, 400 МГц): δ 7,48-7,57 (м, 1H), 4,72-4,82 (м, 2H), 0,93-1,03 (м, 9H), 0,14 (с, 6H). ЖХМС m/z=293 [MH]+.
Пример получения 231: 2,6-дихлорпиримидин-4-ил)метанол

2,6-дихлорпиримидин-4-карбонилхлорид (Пример получения 232, 10 г, 47,3 ммоль) растворяют в смеси MeCN (60 мл) и ТГФ (70 мл). Смесь охлаждают до примерно -78°C и обрабатывают раствор NaBH4 (3,58 г, 94,6 ммоль) в ДМФ (30 мл) по каплям. Смесь перемешивают при примерно -78°C в течение примерно 2 ч и разбавляют водным раствором HCl (1 M, 10 мл). Смесь разбавляют насыщенным водным NaHCO3 и экстрагируют EtOAc (2×100 мл). Объединенные EtOAc экстракты сушат над MgSO4, фильтруют и концентрируют с получением 2,6-дихлорпиримидин-4-ил)метанола (8 г, 95%), который применяют в Примере получения 230. 1H ЯМР (CDCl3, 400 МГц): δ 7,51 (с, 1H), 4,78 (с, 2H).
Пример получения 232: 2,6-дихлорпиримидин-4-карбонилхлорид

Раствор 2,6-диоксо-1,2,3,6-тетрагидропиримидин-4-карбоновой кислоты (50 г, 0,32 моль) и PCl5 (220 г, 1,06 моль) в POCl3 (250 мл) нагревают до кипения с обратным холодильником (120°C) в течение примерно 16 ч. Полученную смесь концентрируют и дистиллируют при пониженном давлении (120°C, 10 мм рт. ст.) с получением 2,6-дихлорпиримидин-4-карбонилхлорида (21 г, 31%), который применяют в Примере получения 231.
Пример получения 233: 4-метокси-3-пропоксибензимидамид

Этил 4-метокси-3-пропоксибензимидат (Пример получения 234, 37,6 г, 158,45 ммоль) растворяют в EtOH (226 мл). Аммиак в метанол (226 мл) добавляют к реакционной смеси. Реакционную смесь перемешивают при примерно 28°C в течение примерно 24 ч. После концентрации, МТБЭ (150 мл) выливают к остатку, перемешивают в течение 1 ч и фильтруют и концентрируют с получением 4-метокси-3-пропоксибензимидамида (33,8 г, 100%). 1H ЯМР (CD3OD, 400 МГц): δ 7,46 (дд, J=2,2, 8,6 Гц, 1H), 7,36 (д, J=2,2 Гц, 1H), 7,14 (д, J=8,6 Гц, 1H), 4,04 (т, J=6,5 Гц, 2H), 3,93 (с, 3H), 1,81-1,90 (м, 2H), 1,07 (т, J=7,6 Гц, 3H). ЖХМС m/z=209 [MH]+.
Пример получения 234: этил 4-метокси-3-пропоксибензимидат

Ацетилхлорид (69,0 г, 879 ммоль) добавляют по каплям к раствору 4-метокси-3-пропоксибензонитрила (Пример получения 235, 21,0 г, 110 ммоль) в сухом EtOH (60,7 г, 1320 ммоль), затем перемешивают при примерно 30°C в течение примерно 12 ч. Смесь концентрируют, и к остатку добавляют МТБЭ (150 мл). Смесь перемешивают в течение примерно 1 ч и фильтруют с получением этила 4-метокси-3-пропоксибензимидата (26,1 г, 100%). 1H ЯМР (CDCl3, 400 МГц): δ 12,28 (шс, 1H), 11,56 (шс, 1H), 8,01 (д, J=2,2 Гц, 1H), 7,98 (дд, J=2,2, 8,6 Гц, 1H), 7,0 (д, J=8,6 Гц, 1H), 4,91 (кв, J=7,0 Гц, 2H), 4,21 (т, J=6,6 Гц, 2H), 3,96 (с, 3H), 1,85-1,96 (м, 2H), 1,61 (т, J=7,0 Гц, 2H), 1,08 (т, J=7,5 Гц, 3H). ЖХМС m/z=238 [MH]+.
Пример получения 235: 4-метокси-3-пропоксибензонитрил

4-метокси-3-пропоксибензонитрил (32,10 г, 100%) получают по методике, аналогичной Примеру получения 172 с применением 3-гидрокси-4-метоксибензонитрила (25 г, 170 ммоль) и 1-йодпропана (57 г, 335 ммоль). 1H ЯМР (CDCl3, 400 МГц): δ 7,25-7,29 (м, 1H), 7,08 (д, J= 2,0 Гц, 1H), 6,90 (д, J= 8,3 Гц, 1H), 3,99 (т, J= 6,9 Гц, 2H), 3,92 (с, 3H), 1,84-1,93 (м, 2H), 1,03-1,09 (м, 3H). ЖХМС m/z=191 [MH]+.
Пример получения 236: 3-((трет-бутилдиметилсилил)окси)пропан-1-ол
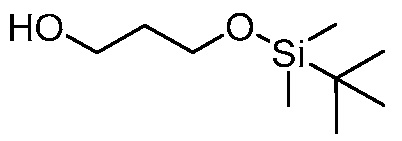
Пропан-1,3-диол (20 г, 260 ммоль), трет-бутилхлордиметилсилан (47,5 г, 315 ммоль), Et3N (76,0 мл, 526 ммоль) и ДМАП (1,610 г, 13,1 ммоль) суспендируют в ДХМ (300 мл). Смесь перемешивают при примерно 18°C в течение ночи. Реакционную смесь разделяют между ДХМ (3×300 мл) и вода (300 мл). Объединенные ДХМ экстракты концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (100:0 до 97:3) с получением 3-((трет-бутилдиметилсилил)окси)пропан-1-ола (50 г, 100%), который применяют в Примере получения 158.
Пример получения 237: 1-(6-бромпиридин-2-ил)-2-гидроксиэтан-1-он

Стадия 1: Раствор 1-(6-бромпиридин-2-ил)этанона (CAS 49669-13-8, 5,0 г, 25,0 ммоль) в AcOH (12 мл) нагревают до примерно 70°C. Бром (1,4 мл, 27,5 ммоль) добавляют по каплям в течение 30 мин. Раствор перемешивают при примерно 70°C в течение примерно 19 ч. Раствор охлаждают EtOAc (50 мл) и добавляют гексан (50 мл). Осадок фильтруют и промывают гептаном (2×50 мл). Объединенные фильтраты промывают насыщенным раствором соли (30 мл), сушат над MgSO4, фильтруют и концентрируют с получением 2-бром-1-(6-бромпиридин-2-ил)этан-1-она (6,85 г), который применяют сразу на следующей стадии.
Стадия 2: К раствору 2-бром-1-(6-бромпиридин-2-ил)этанона (6,74 г) в ДМФ (30 мл) добавляют нитрит натрия (2,00 г). Раствор перемешивают при примерно 20°C в течение примерно 22 ч. Реакционную смесь разбавляют EtOAc (100 мл) и промывают водой (100 мл). Водный слои экстрагируют EtOAc. Объединенные EtOAc экстракты промывают насыщенным раствором соли (20 мл), сушат с MgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют гептаном/EtOAc (90:10 до 70:30) с получением 1-(6-бромпиридин-2-ил)-2-гидроксиэтан-1-она (977 мг), который применяют в Примере получения 88. 1H ЯМР (CDCl3, 400 МГц): δ 7,99-8,11 (м, 1H), 7,68-7,83 (м, 2H), 5,08 (д, J=5,1 Гц, 2H).
Пример 1: 4-(5-(3,4-диметоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(5-(3,4-диметоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (Пример 32, 500 мг, 1,67 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ A) с получением 4-(5-(3,4-диметоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола, энантиомера 1 (233 мг, 46%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,72 (д, J=2,8 Гц, 2H), 8,43 (д, J=2,0 Гц, 1H), 7,95 (т, J=2,0 Гц, 1H), 7,25-7,29 (м, 1H), 7,06 (д, J=8,4 Гц, 2H), 4,28 (т, J=4,28 Гц, 1H), 3,84-3,88 (м, 4H), 3,80 (с, 3H), 3,46-3,54 (м, 1H), 1,28-1,34 (м, 1H), 1,12-1,18 (м, 1H).ЖХМС m/z=300 [MH]+; ВУ [Аналитическая СЖХ Способ A] = 5,20 мин.
Пример 2: (S)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол

4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (Пример 33, 2,3 г, 7,3 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ B). Твердые вещества перекристаллизовывают EtOAc (442 мг в 2 мл) с получением 4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола, энантиомера 1 (253 мг, 11%) в виде кристаллического твердого вещества. 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,70 (д, J=2,3 Гц, 1H), 8,68 (с, 1H), 8,42 (д, J=1,6 Гц, 1H), 7,92-7,94 (м, 1H), 7,23-7,29 (м, 2H), 7,06 (д, J=8,2 Гц, 1H), 4,28 (т, J=8,2 Гц, 1H), 4,13 (кв, J=6,8 Гц, 2H), 3,86 (т, J=9,0 Гц, 1H), 3,80 (с, 3H), 3,45-3,55 (м, 1H), 1,28-1,39 (м, 4H), 1,10-1,20 (м, 1H). ЖХМС m/z=314 [MH]+; ВУ [Аналитическая СЖХ Способ B] = 6,59 мин. [α]20D +19,5 (c=0,3, EtOH).
Пример 3: (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол

Дополнительное элюирование препаративной СЖХ колонки (Преп СЖХ Способ B), описанное в Примере 2, дает энантиомер 2, который перекристаллизовывают из EtOAc с получением(R) 4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (610 мг, 27%) в виде кристаллического твердого вещества. 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,70 (д, J=2,3 Гц, 1H), 8,68 (с, 1H), 8,42 (д, J=1,6 Гц, 1H), 7,92-7,94 (м, 1H), 7,23-7,29 (м, 2H), 7,06 (д, J=8,2 Гц, 1H), 4,28 (т, J=8,2 Гц, 1H), 4,13 (кв, J=6,8 Гц, 2H), 3,86 (т, J=9,0 Гц, 1H), 3,80 (с, 3H), 3,45-3,55 (м, 1H), 1,28-1,39 (м, 4H), 1,10-1,20 (м, 1H). ЖХМС m/z=314 [MH]+; ВУ [Аналитическая СЖХ Способ B] = 7,07 мин. [α]20D -22,5 (c=0,2, EtOH).
Пример 4: (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол

Способ A:
К смеси (R)-(3-((трет-бутилдиметилсилил)окси)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)бороновой кислоты (Пример получения 6, 55 г, 120 ммоль) в ИПС (247 мл) добавляют 5 M хлороводорода в ИПС (37 мл, 185 ммоль) при примерно 20°C. Смесь перемешивают в течение примерно 3 ч и концентрируют. Остаток разбавляют EtOAc (500 мл) и добавляют 1N HCl (500 мл). Слои разделяют, и EtOAc слой экстрагируют 0,5 N HCl (2×200 мл). Водные экстракты объединяют с отделенным кислым водным слоем и промывают EtOAc (3×250 мл). Объединенные кислые водные слои обрабатывают K3PO4 до pH 5-6. Смесь экстрагируют EtOAc (1×500 мл, 2×200 мл). Объединенные EtOAc экстракты промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют с получением (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (34,5 г, 88%). Полученную смесь дополнительно очищают препаративной СЖХ (Преп СЖХ Способ C) с получением 29 г в виде неочищенного продукта. Неочищенный продукт растворяют в метаноле (250 мл) и воде (50 мл) и перемешивают при 20°C в течение примерно 30 мин, затем концентрируют. Концентрированный раствор разделяют между насыщенным раствором соли и EtOAc. Водный слой разделяют и экстрагируют EtOAc. EtOAc экстракты объединяют с отделенным EtOAc слоем и промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток растворяют в дегазированном EtOAc (200 мл) и медленно добавляют дегазированный гептан (100 мл). Гептан добавляют до появления осадка, и полученную смесь перемешивают в течение ночи под N2. Твердое вещество фильтруют с получением 8,08 г продукта. Фильтрат концентрируют, и остаток растворяют в EtOAc (50 мл). Гептан (25 мл) медленно добавляют, и смесь перемешивают в течение ночи на открытом воздухе. Твердое вещество фильтруют с получением второй партии (6,16 г). Обработку повторяют второй раз с получением 3,0 г. Фильтрат перемешивают в течение ночи с получением дополнительных партий (2,09 г и 3,1 г), соответственно. Твердые партии объединяют с получением (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (22,3 г, 57%) в виде кристаллического твердого вещества. 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,70 (д, J=2,3 Гц, 1H), 8,68 (с, 1H), 8,42 (д, J=2,0 Гц, 1H), 7,93 (с, 1H), 7,27 (д, J=2,0 Гц, 1H), 7,23-7,26 (м, 1H), 7,06 (д, J=8,2 Гц, 1H), 4,28 (т, J=8,2 Гц, 1H), 4,03 (т, J=6,4 Гц, 2H), 3,86 (т, J=9,0 Гц, 1H), 3,81 (с, 3H), 3,46-3,54 (м, 1H), 1,71-1,80 (м, 2H), 1,28-1,35 (м, 1H), 1,15 (дд, J=10,5, 16,4 Гц, 1H), 1,00 (т, J=7,4 Гц, 3H). ЖХМС m/z=328 [MH]+; ВУ [Аналитическая СЖХ Способ B] = 7,30 мин. [α]20D -23,7 (c=0,9, EtOH). Элементный анализ, рассчитано (%) для C18H22BNO4: C 66,08, H 6,78, N 4,28. Найдено: C 65,86, H 6,59, N 4,18.
Способ B:
Стадия 1: К ТГФ (18,0 мл) добавляют 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридин (Пример получения 50, 3,0 г, 7,25 ммоль), [Ir(COD)Cl]2(CAS 12112-67-3, 36,9 мг, 0,054 ммоль) и (S)[(Sp)-2-(дифенилфосфино)фенноценил]-4-изопропилоксазолин (CAS 163169-29-7, 52,4 мг, 0,109 ммоль). Дополнительный ТГФ (6,0 мл) добавляют к смеси, которую нагревают до примерно 50°C в течение примерно 5 мин. Катехолборан (10,9 мл, 1,0 M в ТГФ) добавляют к смеси и перемешивают при примерно 50°C в течение примерно 1 ч. Смесь охлаждают до примерно 20°C и обрабатывают HCl (12,2 M, 1,51 мл) более 1 мин. Смесь хранят при примерно 20°C в течение примерно 1 ч, после чего образуется осадок. Смесь охлаждают до примерно 10°C и фильтруют. Отфильтрованное твердое вещество промывают ТГФ (6,0 мл) и сушат в течение ночи при 35°C под вакуумом с получением моногидрата гидрохлорида (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (3,98 г, 91%) в виде кристаллического твердого вещества. 1H ЯМР (CD3OD, 400 МГц): δ8,98 (д, J=1,5 Гц, 1H), 8,75 (с, 1H), 8,67 (д, J=1,3 Гц, 1H), 7,37-7,43 (м, 2H), 7,15 (д, J=8,3 Гц, 1H), 4,09 (т, J=6,5 Гц, 2H), 3,89-3,92 (м, 1H), 3,86-3,95 (м, 5H), 3,46 (шс, 1H), 1,85 (м, 2H), 1,31-1,42 (м, 2H), 1,08 (т, J=7,4 Гц, 3H). ЖХМС m/z=328 [MH]+.
Стадия 2: К раствору моногидрата гидрохлорида (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (2,0 г, 5,24 ммоль) в воде (60 мл) добавляют EtOAc (20 мл). К перемешиваемой смеси добавляют NaOH (1N) по каплям для доведения pH водного слоя до 7-8. Смесь перемешивают при примерно 20°C в течение примерно 5 мин. Слои разделяют, и водный слой экстрагируют EtOAc (2×10 мл). Объединенные EtOAc экстракты концентрируют. Остаток растворяют в ТГФ/МТБЭ (1:3, 22 мл) и перемешивают при примерно 20°C в течение ночи. Осадок фильтруют и сушат под вакуумом с получением (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (1,17 г, 68%) в виде кристаллического твердого вещества. 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,70 (д, J=2,3 Гц, 1H), 8,68 (с, 1H), 8,42 (д, J=2,0 Гц, 1H), 7,93 (с, 1H), 7,27 (д, J=2,0 Гц, 1H), 7,23-7,26 (м, 1H), 7,06 (д, J=8,2 Гц, 1H), 4,28 (т, J=8,2 Гц, 1H), 4,03 (т, J=6,4 Гц, 2H), 3,86 (т, J=9,0 Гц, 1H), 3,81 (с, 3H), 3,46-3,54 (м, 1H), 1,71-1,80 (м, 2H), 1,28-1,35 (м, 1H), 1,15 (дд, J=10,5, 16,4 Гц, 1H), 1,00 (т, J=7,4 Гц, 3H). ЖХМС m/z=328 [MH]+.
Способ C:
К раствору (R)-(3-((трет-бутилдиметилсилил)окси)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)пропил)бороновой кислоты (Пример получения 6, 29,0 г, 63,1 ммоль) в ТГФ (66 мл) добавляют водный HCl (84,2 мл, 252 ммоль, 3,0 M) и перемешивают при 20°C в течение примерно 1,5 ч. Смесь концентрируют. Смесь разбавляют 1 M HCl и экстрагируют EtOAc (3×100 мл). Объединенные EtOAc экстракты промывают 1 M HCl (3×50 мл). Объединенные водные экстракты нейтрализуют K3PO4 до pH 7-8 и экстрагируют EtOAc (3×100 мл). Объединенные EtOAc экстракты сушат над Na2SO4, фильтруют и концентрируют с получением (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (19,0 г, 92%). Его дополнительно очищают препаративной СЖХ (Преп СЖХ Способ C) с получением 18 г неочищенного продукта. Неочищенный продукт растворяют в MeOH (100 мл) и вода (50 мл). Смесь разделяют между насыщенным раствором соли и EtOAc. Слои разделяют, и водный слой экстрагируют EtOAc. Объединенные EtOAc экстракты промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением 15 г продукта. Остаток растворяют в EtOAc (60 мл) и медленно добавляют гептан (30 мл) в течение примерно 3 ч. Смесь перемешивают при примерно 20°C в течение ночи. Осадок фильтруют и сушат с получением (8,08 г). Этот процесс повторяют еще 2 раза с получением дополнительных партий (2,01 г и 1,03 г), соответственно. Три партии объединяют в гептане (100 мл), охлаждают до примерно -78°C в течение примерно 10 мин, фильтруют и сушат с получением (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (10,4 г, 51%) в виде кристаллического твердого вещества. 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,70 (д, J=2,3 Гц, 1H), 8,68 (с, 1H), 8,42 (д, J=2,0 Гц, 1H), 7,93 (с, 1H), 7,27 (д, J=2,0 Гц, 1H), 7,23-7,26 (м, 1H), 7,06 (д, J=8,2 Гц, 1H), 4,28 (т, J=8,2 Гц, 1H), 4,03 (т, J=6,4 Гц, 2H), 3,86 (т, J=9,0 Гц, 1H), 3,81 (с, 3H), 3,46-3,54 (м, 1H), 1,71-1,80 (м, 2H), 1,28-1,35 (м, 1H), 1,15 (дд, J=10,5, 16,4 Гц, 1H), 1,00 (т, J=7,4 Гц, 3H). ЖХМС m/z=328 [MH]+.
Пример 5: (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
Смесь 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина (Пример получения 50, 30 г, 73 ммоль), [Ir(COD)Cl]2 (CAS 12112-67-3, 1,22 г, 1,81 ммоль), (R, R)-[2-(4'-и-пропилоксазолин-2-ил)фенноценил]дифенилфосфина (CAS 541540-70-9, 1,75 г, 3,63 ммоль) и ТГФ (240 мл) охлаждают на ледяной бане в течение примерно 30 мин. Раствор катехолборана (109 мл, 109 ммоль, 1,0 M в ТГФ) медленно добавляют в течение примерно 20 мин, затем смесь перемешивают при примерно 20°C в течение примерно 3 ч. Реакционную смесь гасят MeOH (30 мл). Смесь концентрируют и сушат в течение ночи. Остаток обрабатывают 3 M водной HCl/ТГФ (1:1, об./об.) в течение примерно 2 ч и промывают EtOAc. Водный слой разделяют и нейтрализуют до pH 7-8 и экстрагируют EtOAc. EtOAc экстракт сушат над Na2SO4, фильтруют и концентрируют. Остаток растворяют в ТГФ/МТБЭ (1:1, 180 мл) и перемешивают со смолой Biotage MP-TMT (28 г, Biotage P/N 801470) при примерно 20°C, под N2, в течение ночи. Смесь фильтруют и смолу промывают ТГФ (2×50 мл). Объединенные ТГФ/МТБЭ фильтраты концентрируют с получением (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (23,5 г, 71%). Его дополнительно очищают через СЖХ очистку (Преп СЖХ Способ C) с получением 12 г неочищенного продукта. Неочищенный продукт растворяют в MeOH (35 мл) и воде (15 мл). Смесь разделяют между насыщенным раствором соли и EtOAc. Слои разделяют, и водную фазу экстрагируют EtOAC. Объединенные EtOAc экстракты сушат над Na2SO4, фильтруют и концентрируют. Остаток растворяют в EtOAc (30 мл) и гептан добавляют до замутнения. Смесь перемешивают в течение ночи. Осадок фильтруют и сушат с получением (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (5,39 г, 45%) в виде кристаллического твердого вещества. 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,70 (д, J=2,3 Гц, 1H), 8,68 (с, 1H), 8,42 (д, J=2,0 Гц, 1H), 7,93 (с, 1H), 7,27 (д, J=2,0 Гц, 1H), 7,23-7,26 (м, 1H), 7,06 (д, J=8,2 Гц, 1H), 4,28 (т, J=8,2 Гц, 1H), 4,03 (т, J=6,4 Гц, 2H), 3,86 (т, J=9,0 Гц, 1H), 3,81 (с, 3H), 3,46-3,54 (м, 1H), 1,71-1,80 (м, 2H), 1,28-1,35 (м, 1H), 1,15 (дд, J=10,5, 16,4 Гц, 1H), 1,00 (т, J=7,4 Гц, 3H). ЖХМС m/z=328 [MH]+; ВУ [Аналитическая СЖХ Способ B] = 6,35 мин. [α]20D +27,3 (c=0,6, EtOH). Элементный анализ, рассчитано (%) для C18H22BNO4: C 66,08, H 6,78, N 4,28. Найдено: C 66,01, H 6,52, N 4,15.
Пример 6: 4-(5-(3-изопропокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1

4-(5-(3-изопропокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (Пример 35, 90 мг, 0,28 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ D) затем препаративной ЖХВД (Способ A) с получением 4-(5-(3-изопропокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола, энантиомера 1 (17 мг, 19%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,72 (с, 1H), 8,69 (д, J=2,0 Гц, 1H), 8,42 (д, J=2,0 Гц, 1H), 7,92 (т, J=2,0 Гц, 1H), 7,29-7,24 (м, 2H), 7,07 (д, J=8,0 Гц, 1H), 4,68-4,74 (м, 1H), 4,27 (т, J=8,3 Гц, 1H), 3,86 (т, J=9,0 Гц, 1H), 3,79 (с, 3H), 3,47-3,55 (м, 1H), 1,26-1,35 (м, 7H), 1,10-1,18 (м, 1H). ЖХМС m/z=328 [MH]+. ВУ [Аналитическая СЖХ Способ C] = 5,425 мин.
Пример 7: 4-(5-(3-циклопропокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2

4-(5-(3-циклопропокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (Пример 36, 5,0 г, 4,54 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ E) с получением 4-(5-(3-(2-гидроксиэтокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола, энантиомера 2 (205 мг, 41%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,69-8,72 (м, 2H), 8,44 (д, J=2,0 Гц, 1H), 7,91 (т, J=2,0 Гц, 1H), 7,53 (д, J=2,0 Гц, 1H), 7,28 (дд, J=2,4, 8,3 Гц, 1H), 7,07 (д, J=8,8 Гц, 1H), 4,25-4,31 (м, 1H), 3,97-4,01 (м, 1H), 3,86 (т, J=8,8 Гц, 1H), 3,78 (с, 3H), 3,46-3,57 (м, 1H), 1,32 (дд, J=8,1, 16,4 Гц, 1H), 1,14 (дд, J=10,3, 16,1 Гц, 1H), 0,76-0,83 (м, 2H), 0,67-0,72 (м, 2H). ЖХМС m/z=326 [MH]+. ВУ [Аналитическая СЖХ Способ D] = 5,736 мин.
Пример 8: (-) 4-(5-(3-(2-гидроксиэтокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(5-(3-(2-гидроксиэтокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (Пример 37, 1,5 г, 4,56 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ F) с получением 4-(5-(3-(2-гидроксиэтокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола, энантиомера 1 (261 мг, 27%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,70-8,72 (м, 2H), 8,42 (д, J=2,0 Гц, 1H), 7,94 (т, J=2,2 Гц, 1H), 7,30 (д, J=2,0 Гц, 1H), 7,26 (дд, J=2,1, 8,4 Гц, 1H), 7,07 (д, J=8,6 Гц, 1H), 4,88 (т, J=5,4 Гц, 1H), 4,25-4,30 (м, 1H), 4,09 (т, J=5,0 Гц, 2H), 3,86 (т, J=9,0 Гц, 1H), 3,81 (с, 3H), 3,75 (кв, J=5,2 Гц, 2H), 3,46-3,53 (м, 1H), 1,28-1,34 (м, 1H), 1,15 (дд, J=10,5, 16,1 Гц, 1H). ЖХМС m/z=348 [MH+H2O]+; ВУ [Аналитическая СЖХ Способ D] = 3,357 мин. [α]20D-25,9 (c=0,1, EtOH).
Пример 9: (-) 4-(5-(3-(3-гидроксипропокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2

4-(5-(3-(3-гидроксипропокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (Пример 38, 1,2 г, 7,28 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ G) с получением 4-(5-(3-(3-гидроксипропокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола, энантиомера 2 (639 мг, 35%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,68-8,72 (м, 2H), 8,43 (д, J=2,0 Гц, 1H), 7,94 (т, J=2,0 Гц, 1H), 7,29 (д, J=2,0 Гц, 1H), 7,23-7,27 (м, 1H), 7,06 (д, J=8,5 Гц, 1H), 4,55 (т, J=5,1 Гц, 1H), 4,27 (т, J=8,3 Гц, 1H), 4,14 (т, J=6,4 Гц, 2H), 3,86 (т, J=9,0 Гц, 1H), 3,80 (с, 3H), 3,58 (кв, J=6,0 Гц, 2H), 3,44-3,55 (м, 1H), 1,86-1,92 (м, 2H), 1,27-1,35 (м, 1H), 1,11-1,19 (м, 1H). ЖХМС m/z=344 [MH]+; ВУ [Аналитическая СЖХ Способ F] = 1,060 мин. [α]20D -19,5 (c=0,02, EtOH).
Пример 10: (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1

4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (Пример 41, 800 мг, 2,20 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ H) с получением 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола, энантиомера 1 (308 мг, 39%). Продукт перекристаллизовывают из EtOAc/гептана (1:1, об./об.) с получением кристаллического твердого вещества, 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,69 (с, 1H), 8,48 (д, J=2,0 Гц, 1H), 8,34 (д, J=1,5 Гц, 1H), 7,61 (с, 1H), 7,31 (д, J=8,8 Гц, 1H), 6,80-7,14 (м, 2H), 4,27 (т, J=8,3 Гц, 1H), 4,08 (кв, J=6,8 Гц, 2H), 3,89 (с, 3H), 3,80 (т, J=8,8 Гц, 1H), 3,45-3,54 (м, 1H), 1,25-1,38 (м, 4H), 1,00-1,12 (м, 1H). ЖХМС m/z=364 [MH]+; ВУ [Аналитическая СЖХ Способ E] = 3,640 мин. [α]23D -27,5 (c=0,2, EtOH).
Пример 11: (+) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2

Дополнительное элюирование препаративной СЖХ на колонке (Преп СЖХ Способ H), описанное в Примере 10, дает 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2 (259 мг, 32%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,69 (с, 1H), 8,48 (д, J=2,0 Гц, 1H), 8,34 (д, J=1,5 Гц, 1H), 7,61 (с, 1H), 7,31 (д, J=8,8 Гц, 1H), 6,80-7,14 (м, 2H), 4,27 (т, J=8,3 Гц, 1H), 4,08 (кв, J=6,8 Гц, 2H), 3,89 (с, 3H), 3,80 (т, J=8,8 Гц, 1H), 3,45-3,54 (м, 1H), 1,25-1,38 (м, 4H), 1,00-1,12 (м, 1H). ЖХМС m/z=364 [MH]+; ВУ [Аналитическая СЖХ Способ E] = 4,050 мин. [α]23D +18,3 (c=0,2, EtOH).
Пример 12: 4-(5-(3-этокси-5-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1

4-(5-(3-Этокси-5-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (Пример 44, 60 мг, 0,18 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ I) с получением 4-(5-(3-этокси-5-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола, энантиомера 1 (18 мг, 30%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,75 (д, J=2,0 Гц, 1H), 8,71 (с, 1H), 8,47 (д, J=1,47 Гц, 1H), 8,00 (с, 1H), 7,27 (дд, J=2,0, 11,7 Гц, 1H), 7,20 (с, 1H), 4,27 (т, J=8,3 Гц, 1H), 4,21 (кв, J=6,9 Гц, 2H), 3,82-3,90 (м, 3H), 3,45-3,56 (м, 2H), 1,39 (т, J=6,9 Гц, 3H), 1,26-1,34 (м, 1H), 1,12-1,20 (м, 1H). ЖХМС m/z=350 [MH+H2O]+; ВУ [Аналитическая СЖХ Способ D] = 4,282 мин.
Пример 13: 4-(5-(3-хлор-5-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол энантиомер 1

4-(5-(3-Хлор-5-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (Пример 45, 150 мг, 0,43 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ J) с получением 4-(5-(3-хлор-5-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола, энантиомера 1 (411,3 мг, 37%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,75 (д, J=2,0 Гц, 1H), 8,70 (с, 1H), 8,48 (д, J=2,0 Гц, 1H), 8,02 (т, J=2,2 Гц, 1H), 7,42 (д, J=2,0 Гц, 1H), 7,34 (д, J=2,0 Гц, 1H), 4,18-4,30 (м, 3H), 3,83-3,91 (м, 1H), 3,81 (с, 3H), 3,44-3,57 (м, 1H), 1,39 (т, J=6,9 Гц, 3H), 1,26-1,34 (м, 1H), 1,12-1,22 (м, 1H). ЖХМС m/z=348 [MH]+; ВУ [Аналитическая СЖХ Способ D] = 4,932 мин.
Пример 14: 4-(5-(5-этокси-2-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2

4-(5-(5-этокси-2-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (Пример 46, 385 мг, 1,16 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ K) с получением 4-(5-(5-этокси-2-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола, энантиомера 2 (122 мг, 32%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,72 (с, 1H), 8,58 (с, 1H), 8,46 (с, 1H), 7,83 (с, 1H), 7,09 (д, J=7,7 Гц, 1H), 7,03 (д, J=12,4 Гц, 1H), 4,28 (т, J=8,2 Гц, 1H), 4,07 (кв, J=7,0 Гц, 2H), 3,82-3,86 (м, 4H), 3,46-3,55 (м, 1H), 1,29-1,34 (м, 4H), 1,07-1,14 (м, 1H). ЖХМС m/z=332 [MH]+; ВУ [Аналитическая СЖХ Способ D] = 4,111 мин.
Пример 15: (-) 4-(5-(2-хлор-5-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2

4-(5-(2-хлор-5-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (Пример 47, 1,6 г, 4,60 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ L) с получением 4-(5-(2-хлор-5-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола, энантиомера 2 (550 мг, 34%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,71 (с, 1H), 8,48 (т, J=2,0 Гц, 2H), 7,76 (т, J=2,2 Гц, 1H), 7,15 (с, 1H), 7,01 (с, 1H), 4,26-4,30 (м, 1H), 4,06 (кв, J=7,0 Гц, 2H), 3,81-3,85 (м, 4H), 3,47-3,55 (м, 1H), 1,29-1,35 (м, 4H), 1,06-1,12 (м, 1H). ЖХМС m/z=348 [MH]+; ВУ [Аналитическая СЖХ Способ G] = 4,089 мин. [α]20D -18,0 (c=0,1, EtOH).
Пример 16: (-) 4-(3-фтор-5-метокси-6-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол, энантиомер 1

4-(3-фтор-5-метокси-6-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол (Пример 48, 770 мг, 2,22 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ M) с получением 4-(3-фтор-5-метокси-6-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ола, энантиомера 1 (298 мг, 39%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,89 (с, 1H), 8,73 (с, 1H), 8,49 (д, J=2,0 Гц, 1H), 8,09 (с, 1H), 7,49 (д, J=12,0 Гц, 1H), 4,28-4,33 (м, 3H), 3,87 (с, 3H), 3,82 (т, J=8,7 Гц, 1H), 3,49-3,57 (м, 1H), 1,73-1,81 (м, 2H), 1,31-1,37 (м, 1H), 1,03-1,09 (м, 1H), 0,98 (т, J=7,5 Гц, 3H). ЖХМС m/z=347 [MH]+; ВУ [Аналитическая СЖХ Способ D] = 4,347 мин. [α]20D -12,1 (c=0,1, EtOH).
Пример 17: (-) 4-(5-(4-(дифторметокси)-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1

4-(5-(4-(дифторметокси)-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (Пример 50, 506 мг, 1,39 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ N) с получением 4-(5-(4-(дифторметокси)-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола, энантиомера 1 (165 мг, 33%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,74 (д, J=2,1Гц, 1H), 8,72 (с, 1H), 8,49 (д, J=2,0Гц, 1H), 8,00 (т, J=2,0Гц, 1H), 7,45 (д, J=1,6Гц, 1H), 7,28-7,31 (м, 2H), 7,09 (т, J=74,5Гц, 1H), 4,28 (т, J=8,3Гц, 1H), 4,12 (т, J=6,4Гц, 2H), 3,87 (т, J=9,1Гц, 1H), 3,47-3,56 (м, 1H), 1,73-1,82 (м, 2H), 1,29-1,35 (м, 1H), 1,12-1,19 (м, 1H), 1,01 (т, J=7,5Гц, 3H). ЖХМС m/z=381 [MH+H2O]+; ВУ [Аналитическая СЖХ Способ E] = 3,402 мин. [α]20D -21,2 (c=0,1, EtOH).
Пример 18: (-) 4-(6'-метокси-5'-пропокси-[3,3'-бипиридин]-5-ил)-1,2-оксаборолан-2-ол, энантиомер 1

4-(6'-Метокси-5'-пропокси-[3,3'-бипиридин]-5-ил)-1,2-оксаборолан-2-ол (Пример 51, 1,1 г, 3,4 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ O) с получением 4-(6'-метокси-5'-пропокси-[3,3'-бипиридин]-5-ил)-1,2-оксаборолан-2-ола, энантиомера 1 (411 мг, 37%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,76 (д, J=2,2 Гц, 1H), 8,72 (с, 1H), 8,48 (д, J=2,0 Гц, 1H), 8,06 (д, J=2,0 Гц, 1H), 8,01 (т, J=2,2 Гц, 1H), 7,61 (д, J=2,2 Гц, 1H), 4,26-4,31 (м, 1H), 4,08 (т, J=6,6 Гц, 2H), 3,92 (с, 3H), 3,87 (т, J=9,1 Гц, 1H), 3,48-3,56 (м, 1H), 1,73-1,82 (м, 2H), 1,28-1,35 (м, 1H), 1,13-1,21 (м, 1H), 1,00 (т, J=7,5 Гц, 3H). ЖХМС m/z=347 [MH+H2O]+; ВУ [Аналитическая СЖХ Способ G] = 4,231 мин. [α]20D -27,2 (c=0,1, EtOH).
Пример 19: (R)-4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1

4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол (Пример 52, 171,7 мг, 0,53 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ P) с получением 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ола, энантиомера 1, (66 мг, 36%).Продукт перекристаллизовывают EtOAc/гептан с получением кристаллического твердого вещества, 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,67 (с, 1H), 8,33 (д, J=2,0 Гц, 1H), 7,47 (д, J=2,0 Гц, 1H), 7,03 (д, J=8,3 Гц, 1H), 6,94 (д, J=2,0 Гц, 1H), 6,88 (дд, J=2,0, 7,8 Гц, 1H), 4,24 (т, J=8,1 Гц, 1H), 4,04 (кв, J=6,9 Гц, 2H), 3,76-3,83 (м, 4H), 3,39-3,50 (м, 1H), 2,40 (с, 3H), 1,24-1,36 (м, 4H), 1,01-1,10 (м, 1H). ЖХМС m/z=328 [MH]+; ВУ [Аналитическая СЖХ Способ H] = 1,768 мин. [α]20D -20,0 (c=0,4, EtOH).
Пример 20: (S)-4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2

Дополнительное элюирование препаративной СЖХ на колонке (Преп СЖХ Способ P) описанное в Примере 19 дает 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2, (69 мг, 40%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,67 (с, 1H), 8,33 (д, J=2,0 Гц, 1H), 7,47 (д, J=2,0 Гц, 1H), 7,03 (д, J=8,3 Гц, 1H), 6,94 (д, J=2,0 Гц, 1H), 6,88 (дд, J=2,0, 7,8 Гц, 1H), 4,24 (т, J=8,1 Гц, 1H), 4,04 (кв, J=6,9 Гц, 2H), 3,76-3,83 (м, 4H), 3,39-3,50 (м, 1H), 2,40 (с, 3H), 1,24-1,36 (м, 4H), 1,01-1,10 (м, 1H). ЖХМС m/z=328 [MH]+; ВУ [Аналитическая СЖХ Способ H] = 2,168 мин.
Пример 21: 4-(5-(3-этокси-4-метоксифенил)-4-метилпиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1
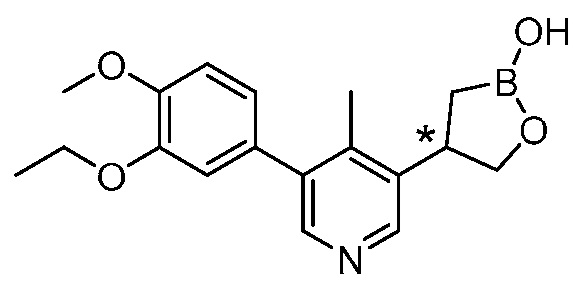
4-(5-(3-этокси-4-метоксифенил)-4-метилпиридин-3-ил)-1,2-оксаборолан-2-ол (Пример 53, 45 мг, 0,14 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ I) с получением 4-(5-(3-этокси-4-метоксифенил)-4-метилпиридин-3-ил)-1,2-оксаборолан-2-ола, энантиомера 1 (12,5 мг, 28%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,71 (с, 1H), 8,43 (с, 1H), 8,21 (с, 1H), 7,04 (д, J=8,0 Гц, 1H), 6,90 (д, J=2,3 Гц, 1H), 6,82-6,85 (м, 1H), 4,24-4,28 (м, 1H), 4,03 (кв, J=7,0 Гц, 2H), 3,90-3,95 (м, 1H), 3,80 (с, 3H), 3,63-3,71 (м, 1H), 2,22 (с, 3H), 1,30-1,36 (м, 4H), 1,04-1,10 (м, 1H). ЖХМС m/z=328 [MH]+; ВУ [Аналитическая СЖХ Способ I] = 5,208 мин.
Пример 22: (-) 4-(2-(4-метокси-3-пропоксифенил)-6-метилпиримидин-4-ил)-1,2-оксаборолан-2-ол, энантиомер 2

4-(2-(4-метокси-3-пропоксифенил)-6-метилпиримидин-4-ил)-1,2-оксаборолан-2-ол (Пример 54, 2,5 г, 7,28 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ Q) с получением 4-(2-(4-метокси-3-пропоксифенил)-6-метилпиримидин-4-ил)-1,2-оксаборолан-2-ола, энантиомера 2 (68 мг, 22%). 1H ЯМР (CD3OD, 400 МГц): δ 8,03 (дд, J=2,0, 8,6 Гц, 1H), 8,00 (д, J=2,0 Гц, 1H), 7,07 (с, 1H), 7,05 (д, J=8,3 Гц, 1H), 4,17 (шс, 1H), 4,07 (т, J=6,5 Гц, 2H), 4,00 (шс, 1H), 3,91 (с, 2H), 3,41 (шс, 1H), 2,52 (с, 2H), 1,84-1,89 (м, 2H), 1,29-1,38 (м, 1H), 1,21-1,29 (м, 1H), 1,09 (т, J=7,3 Гц, 3H). ЖХМС m/z=343 [MH]+; ВУ [Аналитическая СЖХ Способ J] = 3,148 мин. [α]20D -23,2 (c=0,1, EtOH).
Пример 23: (-) 4-(2-(4-метокси-3-пропоксифенил)-6-(трифторметил)пиримидин-4-ил)-1,2-оксаборолан-2-ол, энантиомер 2

4-(2-(4-метокси-3-пропоксифенил)-6-(трифторметил)пиримидин-4-ил)-1,2-оксаборолан-2-ол (Пример 55, 572 мг, 1,45 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ M) с получением 4-(2-(4-метокси-3-пропоксифенил)-6-(трифторметил)пиримидин-4-ил)-1,2-оксаборолан-2-ола, энантиомера 2 (100 мг, 18%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,72 (с, 1H), 8,03 (дд, J=2,0, 8,6 Гц, 1H), 7,95 (д, J=2,0 Гц, 1H), 7,77 (с, 1H), 7,13 (д, J=8,6 Гц, 1H), 4,32 (дд, J=7,4, 9,0 Гц, 1H), 3,98-4,09 (м, 3H), 3,86 (с, 3H), 3,73-3,82 (м, 1H), 1,73-1,84 (м, 1H), 1,31-1,41 (м, 1H), 1,18-1,26 (м, 2H), 1,01 (т, J=7,4 Гц, 3H). ЖХМС m/z=397 [MH]+; ВУ [Аналитическая СЖХ Способ E] = 4,765 мин. [α]20D -12,6 (c=0,4, EtOH).
Пример 24: 4-(6-(3-этокси-4-метоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ол, энантиомер 2
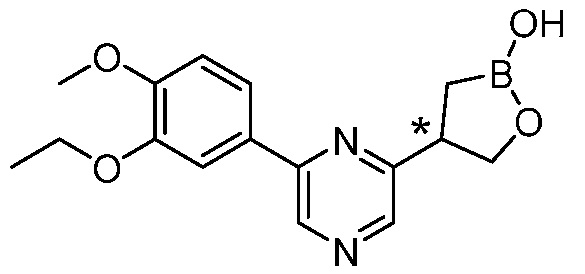
4-(6-(3-Этокси-4-метоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ол (Пример 56, 20 мг, 0,06 ммоль) дополнительно очищают препаративной СЖХ (Преп СЖХ Способ R) с получением 4-(6-(3-этокси-4-метоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ола, энантиомера 2 (6,4 мг, 34%). ЖХМС m/z=315 [MH]+. ВУ [Аналитическая СЖХ Способ K] = 3,23 мин.
Пример 25: 4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборол-2(5H)-ол
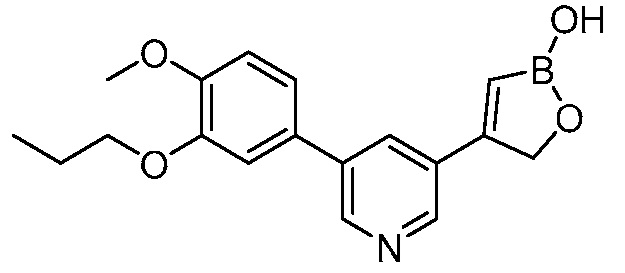
Смесь 3-(3-((трет-бутилдиметилсилил)окси)-1-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)проп-1-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина (Пример получения 8, 1,30 г, 2,41 ммоль) в AcOH (10 мл) и воде (5 мл) перемешивают при примерно 50°C в течение примерно 1 ч. Смесь концентрируют и добавляют EtOH (10 мл). Смесь перемешивают при примерно 0°C в течение примерно 15 мин и фильтруют. Твердое вещество промывают водой (15 мл) и сушат с получением 4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборол-2(5H)-ола (560 мг, 68%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,86 (д, J=2,0 Гц, 1H), 8,77 (с, 1H), 8,73 (д, J=2,0 Гц, 1H), 8,14 (т, J =2,0 Гц, 1H), 7,31-7,34 (м, 2H), 7,08 (д, J=8,0 Гц, 1H), 6,46 (с, 1H), 5,02 (с, 2H), 4,05 (т, J=6,4 Гц, 2H), 3,82 (с, 3H), 1,72-1,81 (м, 2H), 1,01 (т, J=7,6 Гц, 3H). ЖХМС m/z=326 [MH]+.
Пример 26: 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборинан-2-ол

2-(4-((трет-бутилдиметилсилил)окси)-1-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутан-2-ил)-6-(4-метокси-3-пропоксифенил)пиридин (Пример получения 31, 140 мг, 0,25 ммоль) растворяют в AcOH (4,3 мл) и вода (0,2 мл) и перемешивают при примерно 20°C в течение примерно 16 ч. Смесь концентрируют и остаток очищают препаративной ЖХВД (Преп ЖХВД Способ B) с получением 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборинан-2-ола (60 мг, 70%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 7,71-7,76 (м, 4H), 7,64-7,66 (м, 1H), 7,15-7,17 (м, 1H), 7,03 (д, J=8,6Гц, 1H), 4,02 (т, J=6,6Гц, 2H), 3,64-3,98 (м, 2H), 3,81 (м, 3H), 3,13-3,20 (м, 1H), 1,92-2,00 (м, 1H), 1,72-1,82 (м, 3H), 1,09 (д, J=7,0Гц, 2H), 1,00 (т, J=7,4Гц, 3H). ЖХМС m/z=342 [MH]+.
Пример 27: 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-3-метил-1,2-оксаборолан-2-ол

Смесь 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-3-метил-1,2-оксаборол-2(5H)-ола (Пример 28, 50 мг, 0,15 ммоль) и катализатора Адама (10,0 мг, 0,044 ммоль) в EtOAc (1,5 мл) гидрируют при 20 ф./кв.д. изб при примерно 40°C в течение примерно 2 ч. Реакционную смесь фильтруют через слой Celite®, и фильтрат концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют гептаном/EtOAc (80:20 до 0:100), затем ДХМ/MeOH (90:10), с получением 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-3-метил-1,2-оксаборолан-2-ола (40 мг, 80%). 1H ЯМР (CDCl3,400 МГц): δ 7,73 (шс, 1H), 7,51-7,66 (м, 4H), 6,92-7,00 (м, 2H), 4,36 (д, J=3,1 Гц, 2H), 4,12 (т, J=6,8 Гц, 2H), 3,92 (с, 3H), 3,56 (шс, 1H), 1,87-1,96 (м, 2H), 1,70-1,80 (м, 1H), 1,08 (т, J=7,4 Гц, 3H), 0,80 (д, J=7,0 Гц, 3H). ЖХМС m/z=342 [MH]+.
Пример 28: 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-3-метил-1,2-оксаборол-2(5H)-ол

4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-3-метил-1,2-оксаборол-2(5H)-ол(105 мг, 46%) получают по методике, аналогичной описанной в Примере 25, с применением 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бут-2-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина (Пример получения 32, 370 мг, 0,668 ммоль). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,71 (с, 1H), 7,86-7,91 (м, 2H), 7,75 (д, J=2,0 Гц, 1H), 7,67 (дд, J=2,0, 8,6 Гц, 1H), 7,36-7,44 (м, 1H), 7,07 (д, J=8,6 Гц, 1H), 4,95 (д, J=2,0 Гц, 2H), 4,02 (т, J=6,6 Гц, 2H), 3,82 (с, 3H), 2,15 (с, 3H), 1,71-1,85 (м, 2H), 1,01 (т, J=7,4 Гц, 3H). ЖХМС m/z=340 [MH]+.
Пример 29: 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-4-метил-1,2-оксаборолан-2-ол
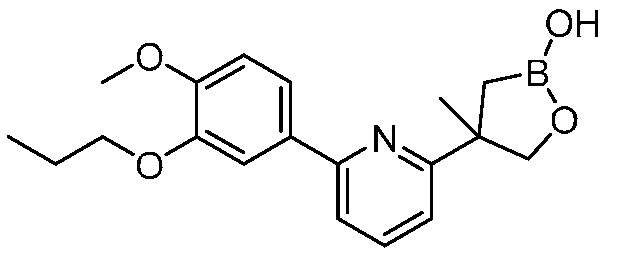
К раствору этил 2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-2-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропаноата (Пример получения 33, 134 мг, 0,277 ммоль) в ТГФ (3,0 мл) при примерно 20°C добавляют LiBH4 (6,0 мг, 0,28 ммоль), затем воду (0,10 мл). Реакционную смесь перемешивают при примерно 20°C в течение примерно 3 ч. Добавляют другую порцию LiBH4 (25 мг, 1,15 ммоль) и воды (0,2 мл). Смесь перемешивают при примерно 20°C в течение примерно 5 мин. Добавляют другую порцию LiBH4 (25 мг, 1,15 ммоль) и воду (0,3 мл) и перемешивают при примерно 20°C в течение примерно 10 мин. Смесь разбавляют водой и экстрагируют EtOAc. EtOAc экстракт промывают насыщенным раствором соли и сушат над Na2SO4. Смесь фильтруют, концентрируют и растворяют в ТГФ (3 мл) и воде (1 мл). Раствор обрабатывают избытком LiBH4 при примерно 20°C в течение примерно 3 ч. Смесь разбавляют водой и экстрагируют EtOAc. EtOAc экстракт промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают препаративной ЖХВД (Преп ЖХВД Способ C) с получением 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-4-метил-1,2-оксаборолан-2-ола (46,1 мг, 49%). 1H ЯМР (CD3OD, 500 МГц): δ 7,80 (шс, 1H), 7,74 (д, J=1,5 Гц, 1H), 7,67 (д, J=8,1 Гц, 1H), 7,62 (м, 1H), 7,32 (д, J=7,1 Гц, 1H), 7,07 (д, J=8,3 Гц, 1H), 5,51 (с, 1H), 4,29 (д, J=8,8 Гц, 1H), 4,07-4,16 (м, 3H), 3,92 (с, 3H), 3,47 (м, 1H), 3,19 (м, 1H), 1,88 (м, 2H), 1,55 (д, J=16,1 Гц, 1H), 1,51 (с, 3H), 1,20 (д, J=15,7 Гц, 1H), 1,10 (т, J=7,3 Гц, 3H). ЖХМС m/z=342 [MH]+.
Пример 30: 4-(6-(4-метокси-3-пропоксифенил)пиридазин-4-ил)-5-метил-1,2-оксаборолан-2-ол

Смесь 5-(3-((трет-бутилдиметилсилил)окси)-1-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутан-2-ил)-3-(4-метокси-3-пропоксифенил)пиридазина (Пример получения 34, 160 мг, 0,29 ммоль) в AcOH (6 мл) и воде (1 мл) перемешивают при примерно 70°C в течение примерно 21 ч. Смесь концентрируют, растворяют в MeCN (15 мл) и снова концентрируют. Смесь очищают препаративной ЖХВД (Преп ЖХВД Способ D) с получением 4-(6-(4-метокси-3-пропоксифенил)пиридазин-4-ил)-5-метил-1,2-оксаборолан-2-ола (10,6 мг, 11%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 9,12 (с, 1H), 9,05 (д, J=2,0 Гц, 1H), 8,77 (с, 1H), 8,69 (с, 1H), 8,13 (с, 1H), 7,98 (с, 1H), 7,68-7,81 (м, 3H), 7,07-7,16 (м, 2H), 4,64 (т, J=6,5 Гц, 1H), 4,25-4,35 (м, 1H), 4,04 (т, J=6,5 Гц, 3H), 3,84 (с, 5H), 3,64 (д, J=9,0 Гц, 1H), 2,92-3,01 (м, 1H), 1,74-1,83 (м, 3H), 1,48 (дд, J=10,0, 16,1 Гц, 1H), 1,24-1,39 (м, 2H), 1,17 (д, J=6,0 Гц, 3H), 1,01 (т, J=7,0 Гц, 6H), 0,77 (д, J=7,0 Гц, 1H). ЖХМС m/z=343 [MH]+.
Пример 31: 4-(гидроксиметил)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
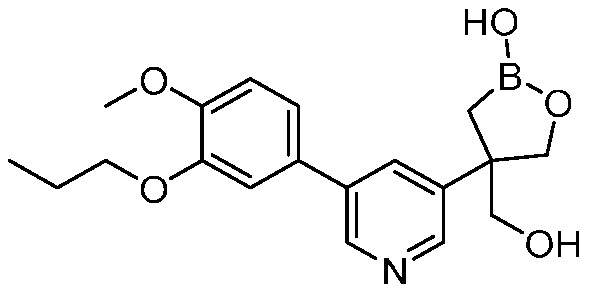
Турбо Гриньяр (0,5 мл, 1,3 M в ТГФ) перемешивают с безводным 1,4-диоксане (0,05 мл) при примерно 20°C под N2 в течение примерно 30 мин с получением смеси, которую применяют сразу в следующем методе (Реагент A). К раствору 3-(5-(йодметил)-2,2-диметил-1,3-диоксан-5-ил)-5-(4-метокси-3-пропоксифенил)пиридина (Пример получения 77, 120 мг, 0,25 ммоль) в ТГФ (0,50 мл) под N2 добавляют Реагент A. Смесь перемешивают при примерно 20°C в течение примерно 1 ч. Триметилборат (0,33 мл, 2,98 ммоль) добавляют и перемешивают при примерно 20°C под N2 в течение примерно 1 ч. Охлажденную смесь обрабатывают HCl в ИПС (5,5 M, 0,45 мл, 2,48 ммоль) в течение примерно 1 ч. Смесь разбавляют 1 M HCl и промывают EtOAc. EtOAc слой экстрагируют 1 M HCl (2×5 мл). Объединенные водный экстракты нейтрализуют до pH 6-7 с K3PO4. Водный экстракт экстрагируют EtOAc (3×10 мл). Объединенные EtOAc экстракты сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают препаративной СЖХ (Преп СЖХ Способ S) с получением 4-(гидроксиметил)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (38 мг, 43%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,69 (д, J=2,0 Гц, 1H), 8,63 (с, 1H), 8,37 (д, J=2,0 Гц, 1H), 7,75 (м, 1H), 7,19-7,28 (м, 2H), 7,08 (д, J=8,6 Гц, 1H), 4,99 (м, 1H), 4,39 (д, J=9,0 Гц, 1H), 4,00-4,13 (м, 4H), 3,82 (с, 3H), 3,47 (шс, 2H), 1,77 (м, 2H), 1,28-1,38 (м, 1H), 1,14-1,22 (м, 1H), 0,96-1,08 (м, 3H). ЖХМС m/z=358 [MH]+.
Пример 32: 4-(5-(3,4-диметоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол

Смесь 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3,4-диметоксифенил)пиридина (Пример получения 1, 1,0 г, 1,95 ммоль) в AcOH (15 мл), ТГФ (5 мл) и вода (5 мл) перемешивают при примерно 55°C в течение примерно 6 ч. Смесь концентрируют и остаток очищают препаративной ЖХВД (Преп ЖХВД Способ E) с получением 4-(5-(3,4-диметоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (98 мг, 17%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,72 (д, J=2,8 Гц, 2H), 8,43 (д, J=2,0 Гц, 1H), 7,95 (т, J=2,0 Гц, 1H), 7,25-7,29 (м, 1H), 7,06 (д, J=8,4 Гц, 2H), 4,28 (т, J=4,28 Гц, 1H), 3,84-3,88 (м, 4H), 3,80 (с, 3H), 3,46-3,54 (м, 1H), 1,28-1,34 (м, 1H), 1,12-1,18 (м, 1H). ЖХМС m/z=300 [MH]+.
Пример 33: 4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол

Смесь 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-этокси-4-метоксифенил)пиридина (Пример получения 3, 3,80 г, 7,20 ммоль) в AcOH (60 мл) и воды (10 мл) перемешивают при примерно 50°C в течение примерно 1 ч. Смесь концентрируют и остаток очищают препаративной ЖХВД (Преп ЖХВД Способ F) с получением 4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (810 мг, 34%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,70 (д, J=2,3 Гц, 1H), 8,68 (с, 1H), 8,42 (д, J=1,6 Гц, 1H), 7,92-7,94 (м, 1H), 7,23-7,29 (м, 2H), 7,06 (д, J=8,2 Гц, 1H), 4,28 (т, J=8,2 Гц, 1H), 4,13 (кв, J=6,8 Гц, 2H), 3,86 (т, J=9,0 Гц, 1H), 3,80 (с, 3H), 3,45-3,55 (м, 1H), 1,28-1,39 (м, 4H), 1,10-1,20 (м, 1H). ЖХМС m/z=314 [MH]+.
Пример 34: 4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
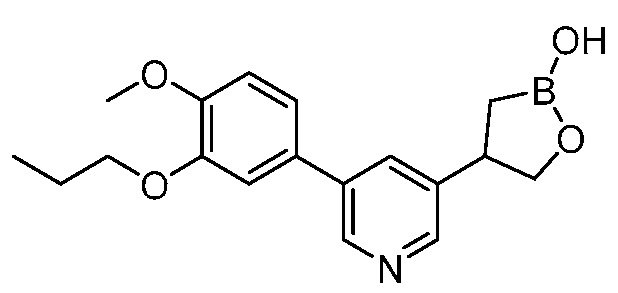
Смесь 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина (Пример получения 5, 3,44 г, 6,35 ммоль) в AcOH (60 мл) и воды (10 мл) перемешивают при примерно 50°C в течение примерно 1 ч. Смесь концентрируют и остаток очищают препаративной ЖХВД (Преп ЖХВД Способ G) с получением 4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (1,04 г, 49%),1H ЯМР (ДМСО-d6, 400 МГц): δ 8,70 (д, J=2,3 Гц, 1H), 8,68 (с, 1H), 8,42 (д, J=2,0 Гц, 1H), 7,93 (с, 1H), 7,27 (д, J=2,0 Гц, 1H), 7,23-7,26 (м, 1H), 7,06 (д, J=8,2 Гц, 1H), 4,28 (т, J=8,2 Гц, 1H), 4,03 (т, J=6,4 Гц, 2H), 3,86 (т, J=9,0 Гц, 1H), 3,81 (с, 3H), 3,46-3,54 (м, 1H), 1,71-1,80 (м, 2H), 1,28-1,35 (м, 1H), 1,15 (дд, J=10,5, 16,4 Гц, 1H), 1,00 (т, J=7,4 Гц, 3H). ЖХМС m/z=328 [MH]+.
Пример 35: 4-(5-(3-изопропокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
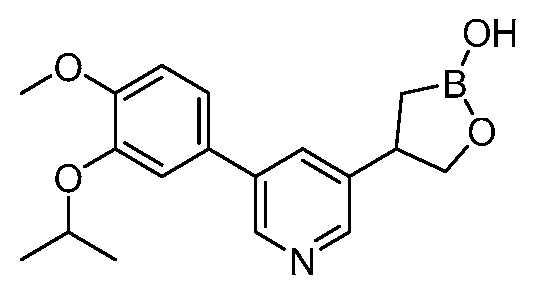
4-(5-(3-изопропокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (103 мг, 43%) получают по методике, аналогичной описанной в Примере 33 с применением 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-изопропокси-4-метоксифенил)пиридина (Пример получения 9, 400 мг, 0,74 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ H). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,72 (с, 1H), 8,69 (д, J=2,0 Гц, 1H), 8,42 (д, J=2,0 Гц, 1H), 7,92 (т, J=2,0 Гц, 1H), 7,29-7,24 (м, 2H), 7,07 (д, J=8,0 Гц, 1H), 4,68-4,74 (м, 1H), 4,27 (т, J=8,3 Гц, 1H), 3,86 (т, J=9,0 Гц, 1H), 3,79 (с, 3H), 3,47-3,55 (м, 1H), 1,26-1,35 (м, 7H), 1,10-1,18 (м, 1H). ЖХМС m/z=328 [MH]+.
Пример 36: 4-(5-(3-циклопропокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол

4-(5-(3-циклопропокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (45 мг, 10%) получают по методике, аналогичной описанной в Примере 33 с применением 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-циклопропокси-4-метоксифенил)пиридина (Пример получения 10, 750 мг, 1,39 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ I). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,69-8,72 (м, 2H), 8,44 (д, J=2,0 Гц, 1H), 7,91 (т, J=2,0 Гц, 1H), 7,53 (д, J=2,0 Гц, 1H), 7,28 (дд, J=2,4, 8,3 Гц, 1H), 7,07 (д, J=8,8 Гц, 1H), 4,25-4,31 (м, 1H), 3,97-4,01 (м, 1H), 3,86 (т, J=8,8 Гц, 1H), 3,78 (с, 3H), 3,46-3,57 (м, 1H), 1,32 (дд, J=8,1, 16,4 Гц, 1H), 1,14 (дд, J=10,3, 16,1 Гц, 1H), 0,76-0,83 (м, 2H), 0,67-0,72 (м, 2H). ЖХМС m/z=326 [MH]+.
Пример 37: 4-(5-(3-(2-гидроксиэтокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол

4-(5-(3-(2-гидроксиэтокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (1,5 г, 75%) получают по методике, аналогичной описанной в Примере 33 с применением 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-(2-((трет-бутилдиметилсилил)окси)этокси)-4-метоксифенил)пиридина (Пример получения 11, 4,0 г, 6,1 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ J). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,70-8,72 (м, 2H), 8,42 (д, J=2,0 Гц, 1H), 7,94 (т, J=2,2 Гц, 1H), 7,30 (д, J=2,0 Гц, 1H), 7,26 (дд, J=2,1, 8,4 Гц, 1H), 7,07 (д, J=8,6 Гц, 1H), 4,88 (т, J=5,4 Гц, 1H), 4,25-4,30 (м, 1H), 4,09 (т, J=5,0 Гц, 2H), 3,86 (т, J=9,0 Гц, 1H), 3,81 (с, 3H), 3,75 (кв, J=5,2 Гц, 2H), 3,46-3,53 (м, 1H), 1,28-1,34 (м, 1H), 1,15 (дд, J=10,5, 16,1 Гц, 1H). ЖХМС m/z=330 [MH]+.
Пример 38: 4-(5-(3-(3-гидроксипропокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол

4-(5-(3-(3-гидроксипропокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (2,5 г, 41%) получают по методике, аналогичной описанной в Примере 33, с применением 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-(3-((трет-бутилдиметилсилил)окси)пропокси)-4-метоксифенил)пиридина (Пример получения 12, 12 г, 18,0 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ K). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,68-8,72 (м, 2H), 8,43 (д, J=2,0 Гц, 1H), 7,94 (т, J=2,0 Гц, 1H), 7,29 (д, J=2,0 Гц, 1H), 7,23-7,27 (м, 1H), 7,06 (д, J=8,5 Гц, 1H), 4,55 (т, J=5,1 Гц, 1H), 4,27 (т, J=8,3 Гц, 1H), 4,14 (т, J=6,4 Гц, 2H), 3,86 (т, J=9,0 Гц, 1H), 3,80 (с, 3H), 3,58 (кв, J=6,0 Гц, 2H), 3,44-3,55 (м, 1H), 1,86-1,92 (м, 2H), 1,27-1,35 (м, 1H), 1,11-1,19 (м, 1H). ЖХМС m/z=344 [MH]+.
Пример 39: 4-(5-(3-(2-фторэтокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол

4-(5-(3-(2-фторэтокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (122 мг, 29%) получают по методике, аналогичной описанной в Примере 33, с применением 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-(2-фторэтокси)-4-метоксифенил)пиридина (Пример получения 13, 700 мг, 1,28 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ L). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,71-8,78 (м, 2H), 8,44 (д, J=1,5 Гц, 1H), 7,96 (т, J=2,0 Гц, 1H), 7,30-7,37 (м, 2H), 7,10 (д, J=8,0 Гц, 1H), 4,81-4,87 (м, 1H), 4,70-4,75 (м, 1H), 4,38-4,43 (м, 1H), 4,30-4,34 (м, 1H), 4,27 (д, J=8,5 Гц, 1H), 3,87 (т, J=9,0 Гц, 1H), 3,83 (с, 3H), 3,47-3,57 (м, 1H), 1,32 (дд, J=8,3, 16,3 Гц, 1H), 1,10-1,21 (м, 1H). ЖХМС m/z=332 [MH]+.
Пример 40: 4-(3'-(3-фторпропокси)-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол

4-(3'-(3-фторпропокси)-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол получают по методике, аналогичной описанной в Примере 33, с применением трет-бутил(2-(3'-(3-фторпропокси)-4'-метокси-[1,1'-бифенил]-3-ил)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропокси)диметилсилана (Пример получения 14). 1H ЯМР (ДМСО-d6, 400 МГц): δ 7,50 (шс, 1H), 7,46 (д, J=7,8 Гц, 1H), 7,35 (т, J=7,8 Гц, 1H) 7,18-7,25 (м, 3H), 7,04 (д, J=8,2 Гц, 1H), 4,69 (т, J=5,9 Гц, 1H), 4,57 (т, J=5,9 Гц, 1H), 4,26 (т, J=7,8 Гц, 1H), 4,02-4,18 (м, 3H), 3,80 (с, 3H), 3,42-3,51 (м, 1H), 2,07-2,19 (м, 2H), 1,22-1,32 (м, 1H), 1,05-1,12 (м, 1H). ЖХМС m/z=345 [MH]+.
Пример 41: 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
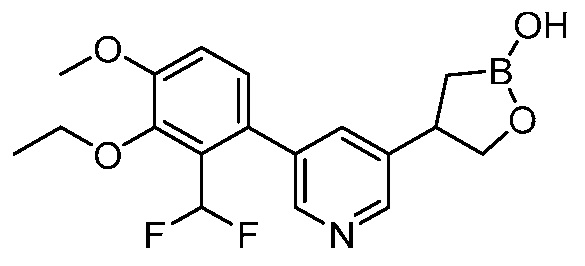
4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол получают (80 мг, 42%) по методике, аналогичной описанной в Примере 33, с применением 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридина (Пример получения 15, 300 мг, 0,519 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ M). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,69 (с, 1H), 8,48 (д, J=2,0 Гц, 1H), 8,34 (д, J=1,5 Гц, 1H), 7,61 (с, 1H), 7,31 (д, J=8,8 Гц, 1H), 6,80-7,14 (м, 2H), 4,27 (т, J=8,3 Гц, 1H), 4,08 (кв, J=6,8 Гц, 2H), 3,89 (с, 3H), 3,80 (т, J=8,8 Гц, 1H), 3,45-3,54 (м, 1H), 1,25-1,38 (м, 4H), 1,00-1,12 (м, 1H). ЖХМС m/z=364 [MH]+.
Пример 42: 3'-(2-гидрокси-1,2-оксаборолан-4-ил)-4-метокси-3-пропокси-[1,1'-бифенил]-2-карбонитрил

К раствору 3'-(2-гидрокси-2,5-дигидро-1,2-оксаборол-4-ил)-4-метокси-3-пропокси-[1,1'-бифенил]-2-карбонитрила (Пример 43, 500 мг, 1,43 ммоль) в EtOAc (15 мл) добавляют PtO2 (16 мг, 72 мкмоль) под N2. Смесь перемешивают под H2 (15 ф./кв.д.) при примерно 0°C в течение примерно 2 ч. Смесь фильтруют и концентрируют. Остаток очищают препаративной ЖХВД (Преп ЖХВД Способ N) с получением 3'-(2-гидрокси-1,2-оксаборолан-4-ил)-4-метокси-3-пропокси-[1,1'-бифенил]-2-карбонитрила (284 мг, 55%), 1H ЯМР (ДМСО-d6, 400 МГц): δ 7,45 (д, J=8,8 Гц, 2H), 7,41 (д, J=7,2 Гц, 1H), 7,34 (т, J=7,2 Гц, 2H), 7,26 (д, J=8,8 Гц, 1H), 4,26 (т, J=8,0 Гц, 1H), 4,12 (т, J=6,0 Гц, 2H), 3,89 (с, 3H), 3,81 (т, J=8,8 Гц, 1H), 3,43-3,52 (м, 1H), 1,69-1,78 (м, 2H), 1,29 (кв, J=8,0 Гц, 1H). 1,07-1,11 (м, 1H), 1,01 (т, J=7,6 Гц, 3H). ЖХМС m/z=352 [MH]+.
Пример 43: 3'-(2-гидрокси-2,5-дигидро-1,2-оксаборол-4-ил)-4-метокси-3-пропокси-[1,1'-бифенил]-2-карбонитрил

К смеси метил 2-(2'-циано-4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)акрилата (Пример получения 30, 13,6 г, 28,5 ммоль) в ТГФ (150 мл) и MeOH (5 мл) добавляют NaBH4 (754 мг, 19,9 ммоль) медленно при примерно 0°C. Смесь перемешивают при примерно 20°C в течение примерно 1 ч. Воду (150 мл) добавляют, и смесь экстрагируют EtOAc (2×150 мл). Объединенные EtOAc экстракты промывают насыщенным раствором соли (150 мл), сушат с Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния) и элюируют пет. эфиром/EtOAc (10:1), затем перекристаллизовывают из EtOH (30 мл) при примерно 0°C с получением 3'-(2-гидрокси-2,5-дигидро-1,2-оксаборол-4-ил)-4-метокси-3-пропокси-[1,1'-бифенил]-2-карбонитрила (2,60 г, 26%). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,71 (с, 1H), 7,70 (с, 1H), 7,64-7,65 (м, 1H), 7,53 (д, J=4,4 Гц, 2H), 7,48 (д, J=8,4 Гц, 1H), 7,33 (д, J=8,4 Гц, 1H), 6,27 (с, 1H), 4,95 (с, 2H), 4,13 (т, J=6,4 Гц, 2H), 3,91 (с, 3H), 1,69-1,77 (м, 2H), 1,02 (т, J=7,2 Гц, 3H). ЖХМС m/z=350 [MH]+.
Пример 44: 4-(5-(3-этокси-5-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол

4-(5-(3-этокси-5-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (90 мг, 25%) получают по методике, аналогичной описанной в Примере 33, с применением 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-этокси-5-фтор-4-метоксифенил)пиридина (Пример получения 16, 600 мг, 1,1 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ O). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,75 (д, J=2,0 Гц, 1H), 8,71 (с, 1H), 8,47 (д, J=1,47 Гц, 1H), 8,00 (с, 1H), 7,27 (дд, J=2,0, 11,7 Гц, 1H), 7,20 (с, 1H), 4,27 (т, J=8,3 Гц, 1H), 4,21 (кв, J=6,9 Гц, 2H), 3,82-3,90 (м, 3H), 3,45-3,56 (м, 2H), 1,39 (т, J=6,9 Гц, 3H), 1,26-1,34 (м, 1H), 1,12-1,20 (м, 1H). ЖХМС m/z=332 [MH]+.
Пример 45: 4-(5-(3-хлор-5-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
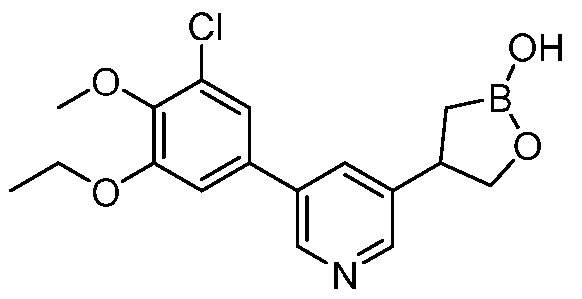
4-(5-(3-хлор-5-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (150 мг, 30%) получают по методике, аналогичной описанной в Примере 33 с применением 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-хлор-5-этокси-4-метоксифенил)пиридина (Пример получения 17, 800 мг, 1,42 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ P). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,75 (д, J=2,0 Гц, 1H), 8,70 (с, 1H), 8,48 (д, J=2,0 Гц, 1H), 8,02 (т, J=2,2 Гц, 1H), 7,42 (д, J=2,0 Гц, 1H), 7,34 (д, J=2,0 Гц, 1H), 4,18-4,30 (м, 3H), 3,83-3,91 (м, 1H), 3,81 (с, 3H), 3,44-3,57 (м, 1H), 1,39 (т, J=6,9 Гц, 3H), 1,26-1,34 (м, 1H), 1,12-1,22 (м, 1H). ЖХМС m/z=347 [MH]+.
Пример 46: 4-(5-(5-этокси-2-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
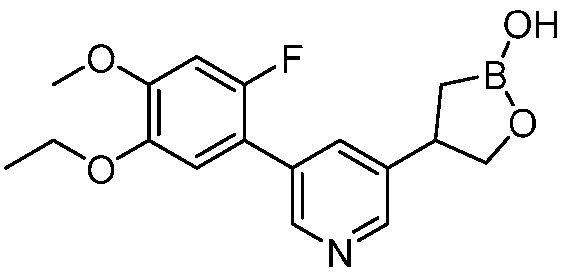
4-(5-(5-этокси-2-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (385 мг, 32%) получают по методике, аналогичной описанной в Примере 33, с применением 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(5-этокси-2-фтор-4-метоксифенил)пиридина (Пример получения 18, 2,0 г, 3,67 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ Q). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,72 (с, 1H), 8,58 (с, 1H), 8,46 (с, 1H), 7,83 (с, 1H), 7,09 (д, J=7,7 Гц, 1H), 7,03 (д, J=12,4 Гц, 1H), 4,28 (т, J=8,2 Гц, 1H), 4,07 (кв, J=7,0 Гц, 2H), 3,82-3,86 (м, 4H), 3,46-3,55 (м, 1H), 1,29-1,34 (м, 4H), 1,07-1,14 (м, 1H). ЖХМС m/z=332 [MH]+.
Пример 47: 4-(5-(2-хлор-5-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол

4-(5-(2-хлор-5-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (1,6 г, 65%) получают по методике, аналогичной описанной в Примере 33, с применением 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(2-хлор-5-этокси-4-метоксифенил)пиридина (Пример получения 19, 4,1 г, 7,30 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ R). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,71 (с, 1H), 8,48 (т, J=2,0 Гц, 2H), 7,76 (т, J=2,2 Гц, 1H), 7,15 (с, 1H), 7,01 (с, 1H), 4,26-4,30 (м, 1H), 4,06 (кв, J=7,0 Гц, 2H), 3,81-3,85 (м, 4H), 3,47-3,55 (м, 1H), 1,29-1,35 (м, 4H), 1,06-1,12 (м, 1H). ЖХМС m/z=348 [MH]+.
Пример 48: 4-(3-фтор-5-метокси-6-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол

4-(3-фтор-5-метокси-6-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол (780 мг, 49%) получают по методике, аналогичной описанной в Примере 33, с применением 5'-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-3-фтор-5-метокси-6-пропокси-2,3'-бипиридина (Пример получения 22, 4,02 г, 7,14 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ S). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,89 (с, 1H), 8,73 (с, 1H), 8,49 (д, J=2,0 Гц, 1H), 8,09 (с, 1H), 7,49 (д, J=12,0 Гц, 1H), 4,28-4,33 (м, 3H), 3,87 (с, 3H), 3,82 (т, J=8,7 Гц, 1H), 3,49-3,57 (м, 1H), 1,73-1,81 (м, 2H), 1,31-1,37 (м, 1H), 1,03-1,09 (м, 1H), 0,98 (т, J=7,5 Гц, 3H). ЖХМС m/z=347 [MH]+.
Пример 49: 4-(5-(2-фтор-4-метокси-5-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол

4-(5-(2-фтор-4-метокси-5-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (1,2 г, 49%) получают по методике, аналогичной описанной в Примере 33, с применением 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(2-фтор-4-метокси-5-пропоксифенил)пиридина (Пример получения 20, 4,0 г, 7,1 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ T). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,89 (с, 1H), 8,74 (с, 1H), 8,49 (д, J=2,0 Гц, 1H), 8,09 (с, 1H), 7,47-7,53 (м, 1H), 4,27-4,36 (м, 3H), 3,87 (с, 3H), 3,82 (т, J=8,7 Гц, 1H), 3,50-3,56 (м, 1H), 1,75-1,80 (м, 2H), 1,34 (дд, J=8,2, 16,3 Гц, 1H), 1,01-1,12 (м, 1H), 0,98 (т, J=7,3 Гц, 3H). ЖХМС m/z=347 [MH]+.
Пример 50: 4-(5-(4-(дифторметокси)-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол

4-(5-(4-(дифторметокси)-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (0,51 г, 31%) получают по методике, аналогичной описанной в Примере 33, с применением 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(4-(дифторметокси)-3-пропоксифенил)пиридина (Пример получения 21, 2,6 г, 4,50 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ U). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,74 (д, J=2,1Гц, 1H), 8,72 (с, 1H), 8,49 (д, J=2,0Гц, 1H), 8,00 (т, J=2,0Гц, 1H), 7,45 (д, J=1,6Гц, 1H), 7,28-7,31 (м, 2H), 7,09 (т, J=74,5Гц, 1H), 4,28 (т, J=8,3Гц, 1H), 4,12 (т, J=6,4Гц, 2H), 3,87 (т, J=9,1Гц, 1H), 3,47-3,56 (м, 1H), 1,73-1,82 (м, 2H), 1,29-1,35 (м, 1H), 1,12-1,19 (м, 1H), 1,01 (т, J=7,5Гц, 3H). ЖХМС m/z=382 [MH+H2O]+.
Пример 51: 4-(6'-метокси-5'-пропокси-[3,3'-бипиридин]-5-ил)-1,2-оксаборолан-2-ол

4-(6'-метокси-5'-пропокси-[3,3'-бипиридин]-5-ил)-1,2-оксаборолан-2-ол получают (720 мг, 25%) по методике, аналогичной описанной в Примере 33, с применением 5'-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-6-метокси-5-пропокси-3,3'-бипиридина (Пример получения 23, 1,034 г, 1,9 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ V). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,76 (д, J=2,2 Гц, 1H), 8,72 (с, 1H), 8,48 (д, J=2,0 Гц, 1H), 8,06 (д, J=2,0 Гц, 1H), 8,01 (т, J=2,2 Гц, 1H), 7,61 (д, J=2,2 Гц, 1H), 4,26-4,31 (м, 1H), 4,08 (т, J=6,6 Гц, 2H), 3,92 (с, 3H), 3,87 (т, J=9,1 Гц, 1H), 3,48-3,56 (м, 1H), 1,73-1,82 (м, 2H), 1,28-1,35 (м, 1H), 1,13-1,21 (м, 1H), 1,00 (т, J=7,5 Гц, 3H). ЖХМС m/z=329 [MH]+.
Пример 52: 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол

4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол (182 мг, 43%) получают по методике, аналогичной описанной в Примере 33, с применением 5-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-3-(3-этокси-4-метоксифенил)-2-метилпиридина (Пример получения 24, 700 мг, 1,29 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ W). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,67 (с, 1H), 8,33 (д, J=2,0 Гц, 1H), 7,47 (д, J=2,0 Гц, 1H), 7,03 (д, J=8,3 Гц, 1H), 6,94 (д, J=2,0 Гц, 1H), 6,88 (дд, J=2,0, 7,8 Гц, 1H), 4,24 (т, J=8,1 Гц, 1H), 4,04 (кв, J=6,9 Гц, 2H), 3,76-3,83 (м, 4H), 3,39-3,50 (м, 1H), 2,40 (с, 3H), 1,24-1,36 (м, 4H), 1,01-1,10 (м, 1H). ЖХМС m/z=328 [MH]+.
Пример 53: 4-(5-(3-этокси-4-метоксифенил)-4-метилпиридин-3-ил)-1,2-оксаборолан-2-ол
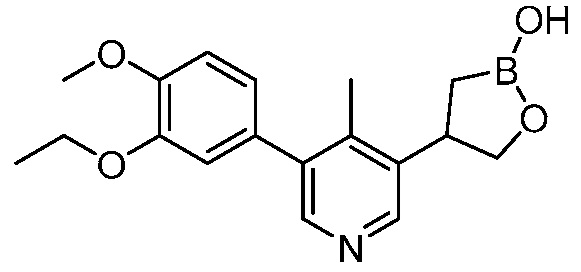
4-(5-(3-этокси-4-метоксифенил)-4-метилпиридин-3-ил)-1,2-оксаборолан-2-ол (0,06 г, 33%) получают по методике, аналогичной описанной в Примере 33, с применением 3-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-5-(3-этокси-4-метоксифенил)-4-метилпиридина (Пример получения 35, 0,28 г, 0,51 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ X). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,71 (с, 1H), 8,43 (с, 1H), 8,21 (с, 1H), 7,04 (д, J=8,0 Гц, 1H), 6,90 (д, J=2,3 Гц, 1H), 6,82-6,85 (м, 1H), 4,24-4,28 (м, 1H), 4,03 (кв, J=7,0 Гц, 2H), 3,90-3,95 (м, 1H), 3,80 (с, 3H), 3,63-3,71 (м, 1H), 2,22 (с, 3H), 1,30-1,36 (м, 4H), 1,04-1,10 (м, 1H). ЖХМС m/z=328 [MH]+.
Пример 54: 4-(2-(4-метокси-3-пропоксифенил)-6-метилпиримидин-4-ил)-1,2-оксаборолан-2-ол

4-(2-(4-метокси-3-пропоксифенил)-6-метилпиримидин-4-ил)-1,2-оксаборолан-2-ол (314 мг, 95%) получают по методике, аналогичной описанной в Примере 33, с применением этил 2-(6-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)ацетата (Пример получения 28, 500 мг, 0,96 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ Y). 1H ЯМР (CD3OD, 400 МГц): δ 8,03 (дд, J=2,0, 8,6 Гц, 1H), 8,00 (д, J=2,0 Гц, 1H), 7,07 (с, 1H), 7,05 (д, J=8,3 Гц, 1H), 4,17 (шс, 1H), 4,07 (т, J=6,5 Гц, 2H), 4,00 (шс, 1H), 3,91 (с, 2H), 3,41 (шс, 1H), 2,52 (с, 2H), 1,84-1,89 (м, 2H), 1,29-1,38 (м, 1H), 1,21-1,29 (м, 1H), 1,09 (т, J=7,3 Гц, 3H). ЖХМС m/z=343 [MH]+.
Пример 55: 4-(2-(4-метокси-3-пропоксифенил)-6-(трифторметил)пиримидин-4-ил)-1,2-оксаборолан-2-ол

4-(2-(4-метокси-3-пропоксифенил)-6-(трифторметил)пиримидин-4-ил)-1,2-оксаборолан-2-ол(582 мг, 36%) получают по методике, аналогичной описанной в Примере 33, с применением 4-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-2-(4-метокси-3-пропоксифенил)-6-(трифторметил)пиримидина (Пример получения 25, 2,5 г, 4,09 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ Z). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,72 (с, 1H), 8,03 (дд, J=2,0, 8,6 Гц, 1H), 7,95 (д, J=2,0 Гц, 1H), 7,77 (с, 1H), 7,13 (д, J=8,6 Гц, 1H), 4,32 (дд, J=7,4, 9,0 Гц, 1H), 3,98-4,09 (м, 3H), 3,86 (с, 3H), 3,73-3,82 (м, 1H), 1,73-1,84 (м, 1H), 1,31-1,41 (м, 1H), 1,18-1,26 (м, 2H), 1,01 (т, J=7,4 Гц, 3H). ЖХМС m/z=397 [MH]+.
Пример 56: 4-(6-(3-этокси-4-метоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ол

4-(6-(3-этокси-4-метоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ол(30 мг, 7%) получают по методике, аналогичной описанной в Примере 33, с применением 2-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-6-(3-этокси-4-метоксифенил)пиразина (Пример получения 26, 720 мг, 1,36 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ AA). 1H ЯМР (ДМСО-d6, 400 МГц): δ 9,06 (с, 1H), 8,67 (с, 1H), 8,44 (с, 1H), 8,37-8,50 (м, 1H), 7,65-7,79 (м, 2H), 7,08 (д, J=8,8 Гц, 1H), 4,30 (т, J=8,2 Гц, 1H), 4,12 (кв, J=6,9 Гц, 2H), 3,98 (дд, J=6,5, 8,9 Гц, 1H), 3,83 (с, 3H), 3,66-3,70 (м, 1H), 1,37 (т, J=7,0 Гц, 3H), 1,27-1,34 (м, 1H), 1,14-1,22 (м, 1H). ЖХМС m/z=315 [MH]+.
Пример 57: 4-(6-(гидроксиметил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол
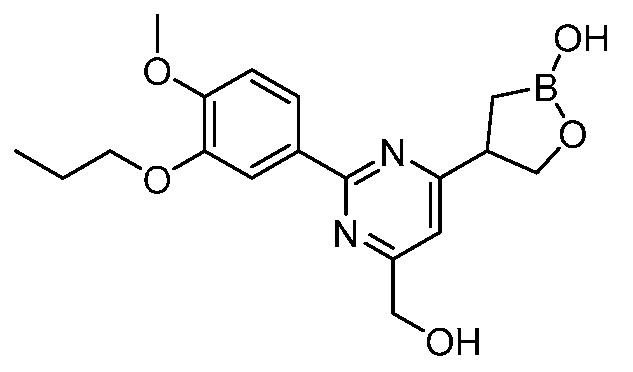
4-(6-(гидроксиметил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол(0,2 г, 38,4%) получают по методике, аналогичной описанной в Примере 33, с применением 4-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-6-(((трет-бутилдиметилсилил)окси)метил)-2-(4-метокси-3-пропоксифенил)пиримидина (Пример получения 29, 1,0 г, 1,5 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ BA). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,71 (с, 1H), 8,00 (дд, J=2,0, 8,0 Гц, 1H), 7,96 (д, J=2,0 Гц, 1H), 7,52 (с, 1H), 7,27-7,31 (м, 1H), 7,06 (д, J=8,5 Гц, 1H), 5,60-5,66 (м, 1H), 4,59 (д, J=6,0 Гц, 2H), 4,31 (дд, J=7,0, 9,0 Гц, 1H), 3,96-4,04 (м, 2H), 3,83 (с, 3H), 3,57-3,65 (м, 1H), 1,75-1,82 (м, 2H), 1,25-1,35 (м, 1H), 1,12-1,21 (м, 1H), 0,96-1,07 (м, 3H). ЖХМС m/z=359 [MH]+.
Пример 58: 4-(2-(3-этокси-4-метоксифенил)тиазол-4-ил)-1,2-оксаборолан-2-ол
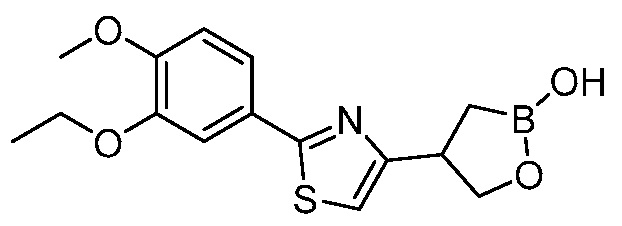
4-(2-(3-этокси-4-метоксифенил)тиазол-4-ил)-1,2-оксаборолан-2-ол (0,31 г, 37%) получают по методике, аналогичной описанной в Примере 33, с применением 4-(1-((трет-бутилдиметилсилил)окси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пропан-2-ил)-2-(3-этокси-4-метоксифенил)тиазола (Пример получения 36, 1,42 г, 2,66 ммоль) и очищают препаративной ЖХВД (Преп ЖХВД Способ CA). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,66 (шс, 1H), 7,42-7,46 (м, 2H), 7,30 (с, 1H), 7,05 (д, J=8,3 Гц, 1H), 4,24-4,28 (м, 1H), 4,09 (кв, J=7,0 Гц, 2H), 3,90-3,95 (м, 1H), 3,82 (с, 3H), 3,55-3,63 (м, 1H), 1,36 (т, J=7,0 Гц, 3H), 1,25-1,31 (м, 1H), 1,11-1,18 (м, 1H). ЖХМС m/z=320 [MH]+.
Пример 59: (2R)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-3-(4,4,6-триметил-1,3,2-диоксаборинан-2-ил)пропан-1-ол

К гексиленгликолю (1,0 г, 8,46 ммоль) добавляют (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол (Пример 4, 0,051 г, 0,16 ммоль) при примерно 20°C. Смесь перемешивают до гомогенности с получением (2R)-2-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-3-(4,4,6-триметил-1,3,2-диоксаборинан-2-ил)пропан-1-ола (5% масс. раствор в гексиленгликоле) в виде смеси диастереоизомеров (соотношение 1:1). 1H ЯМР (ДМСО-d6, 400 МГц): δ 8,64 (д, J=2,2 Гц, 1H), 8,32 (д, J=1,9 Гц, 1H), 7,77 (т, J=2,2 Гц, 1H), 7,23 (с, 1H), 7,17-7,25 (м, 1H), 7,06 (д, J=8,1 Гц, 1H), 4,61 (м, 1H), 4,02 (т, J=6,6 Гц, 2H), 3,97-4,07 (м, 1H), 3,80 (с, 3H), 3,46-3,58 (м, 2H), 2,84-2,98 (м, 1H), 1,69-1,83 (м, 3H), 1,14 (м, 1H), 1,02-1,09 (м, 10H), 1,00 (т, J=7,4 Гц, 3H), 0,83 (дд, J=9,0, 15,0 Гц, 1H). ЖХМС m/z=428 [MH]+.
Следующие соединения, Пример 60-, получают аналогично, с применением способов, описанных выше. Примеры, содержащие звездочку (*), обозначают один энантиомер, полученный способами хиральной очистки. Для этих примеров, охарактеризованных ЖХВД временем удержания (ВУ), описаны способы аналитической ЖХВД.

4-(5-метокси-6-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол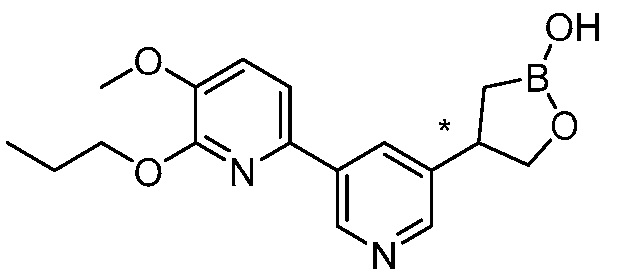
4-(5-метокси-6-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(5-метокси-6-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(3'-(2-фторэтокси)-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол
4-(4-(гидроксиметил)-6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол
4-(6-(3-(циклопентилокси)-4-метоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол
4-(6-(3-(циклопентилокси)-4-метоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(6-(3-(циклопентилокси)-4-метоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол, энантиомер 2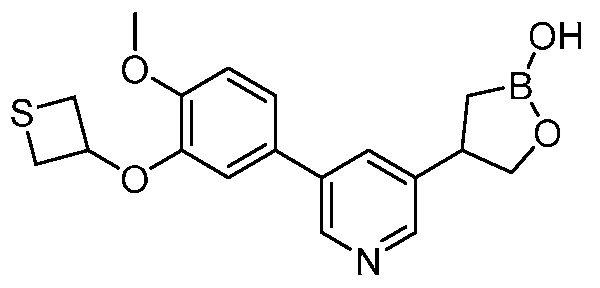
4-(5-(4-метокси-3-(тиетан-3-илокси)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
4-(5-(5-этокси-4-метокси-2-метилфенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
4-(5-(5-этокси-4-метокси-2-метилфенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(5-(5-этокси-4-метокси-2-метилфенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(5-(3-этокси-4-метоксифенил)-1,2,4-тиадиазол-3-ил)-1,2-оксаборолан-2-ол
4-(5-(3-этокси-2-фтор-4-
метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
4-(5-(3-этокси-2-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2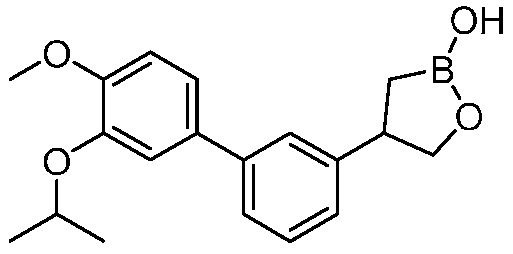
4-(3'-изопропокси-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол
(-) 4-(6-(гидроксиметил)-2-(4-метокси-3-пропоксифенил) пиримидин-4-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(3'-этокси-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол
4-(5-(4-метокси-3-((тетрагидротиофен-3-ил)окси)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
4-(5-(4-метокси-3-((тетрагидротиофен-3-ил)окси)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, диастереомер 1
4-(5-(4-метокси-3-((тетрагидротиофен-3-ил)окси)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, диастереомер 2
4-(5-(2-фтор-4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол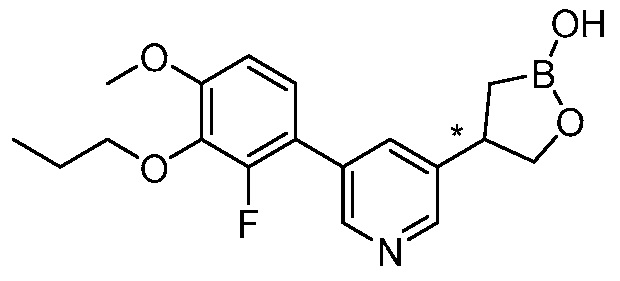
4-(5-(2-фтор-4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(6-(1-гидроксиэтил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол, диастереомер 1
4-(5-(4-метокси-3-пропоксифенил)-4-метилпиридин-3-ил)-1,2-оксаборолан-2-ол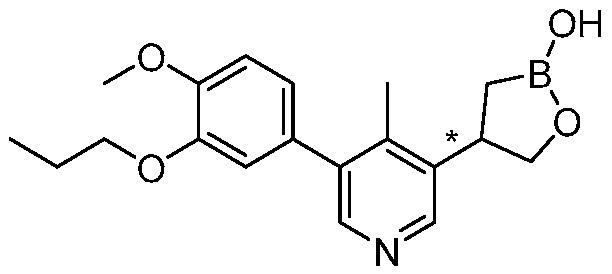
(+) 4-(5-(4-метокси-3-пропоксифенил)-4-метилпиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1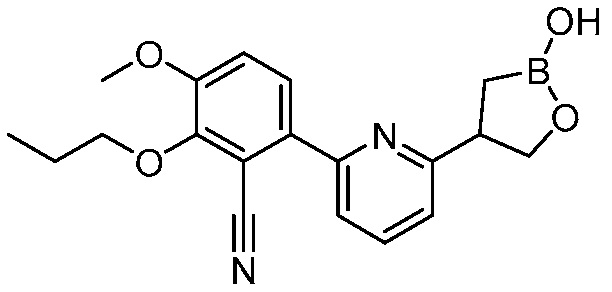
6-(6-(2-гидрокси-1,2-оксаборолан-4-ил)пиридин-2-ил)-3-метокси-2-пропоксибензонитрил
6-(6-(2-гидрокси-1,2-оксаборолан-4-ил)пиридин-2-ил)-3-метокси-2-пропоксибензонитрил, энантиомер 2
4-(4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол
4-(4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1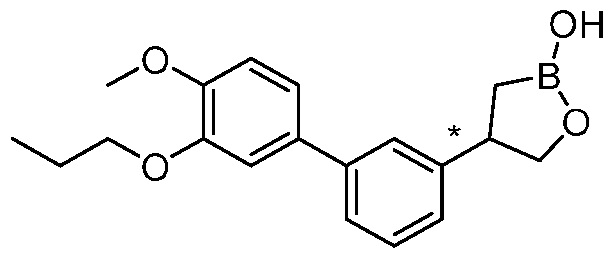
4-(4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(2-(5-этокси-2-фтор-4-метоксифенил)тиазол-4-ил)-1,2-оксаборолан-2-ол
(-) 4-(2-(5-этокси-2-фтор-4-метоксифенил)тиазол-4-ил)-1,2-оксаборолан-2-ол энантиомер 2
4-(3-(4-(циклопентилокси)-5-метоксипиримидин-2-ил)фенил)-1,2-оксаборолан-2-ол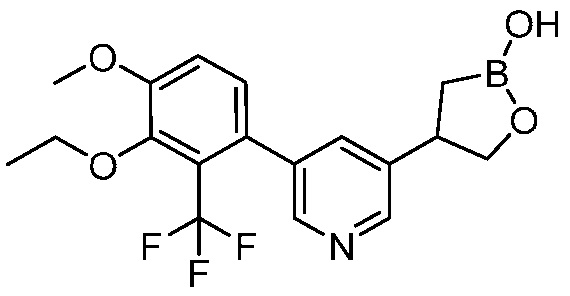
4-(5-(3-этокси-4-метокси-2-(трифторметил)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
4-(5-(3-этокси-4-метокси-2-(трифторметил)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(5-(3,4-диэтоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
4-(5-(3,4-диэтоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(5-(3,4-диэтоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(5-(3-(циклопентилокси)-4-(метилтио)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
4-(5-(3-(циклопентилокси)-4-(метилтио)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол энантиомер 1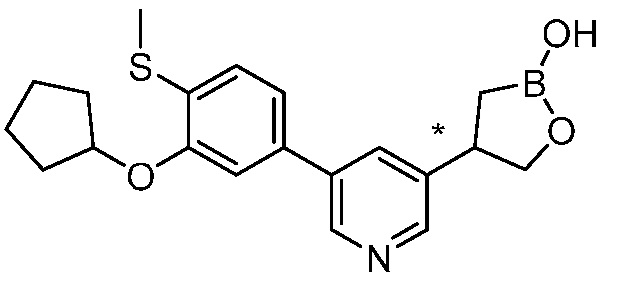
4-(5-(3-(циклопентилокси)-4-(метилтио)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(2-(4-метокси-3-пропоксифенил)-6-(метоксиметил)пиримидин-4-ил)-1,2-оксаборолан-2-ол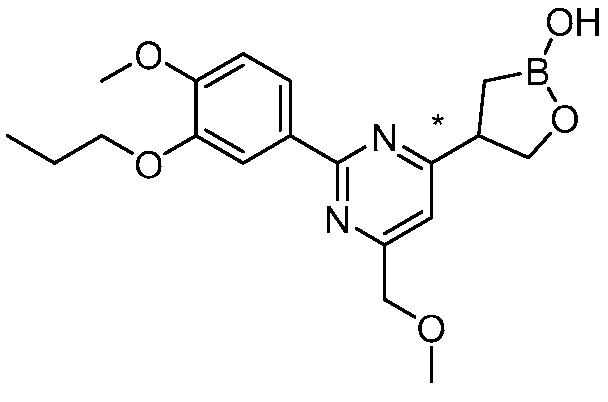
(-) 4-(2-(4-метокси-3-пропоксифенил)-6-(метоксиметил)пиримидин-4-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(5-(4-этокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол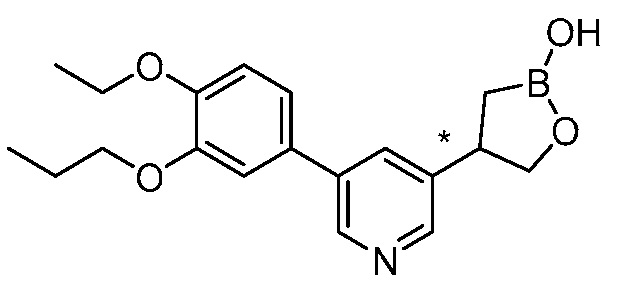
4-(5-(4-этокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2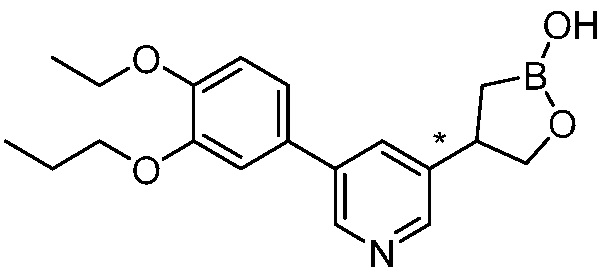
4-(5-(4-этокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(5-(2-фтор-3,4-диметоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол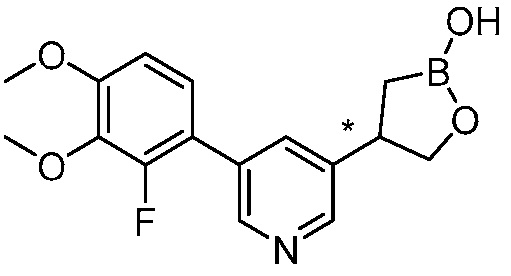
4-(5-(2-фтор-3,4-диметоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(5-(2-фтор-3,4-диметоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(4'-метокси-3'-(пентилокси)-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол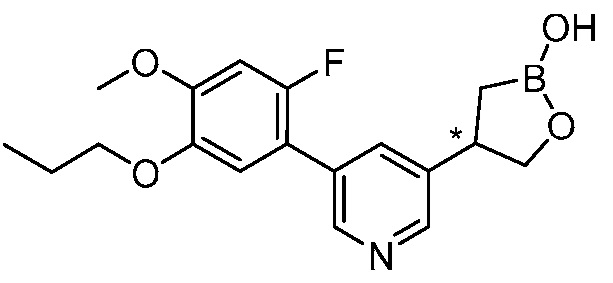
(-) 4-(5-(2-фтор-4-метокси-5-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1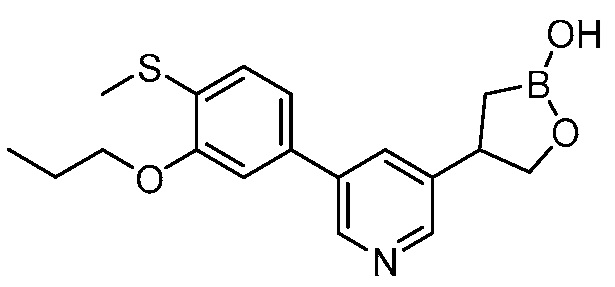
4-(5-(4-(метилтио)-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол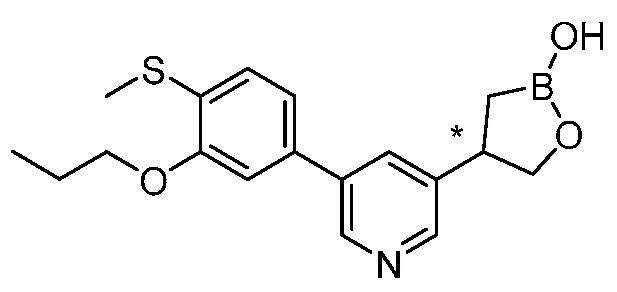
4-(5-(4-(метилтио)-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1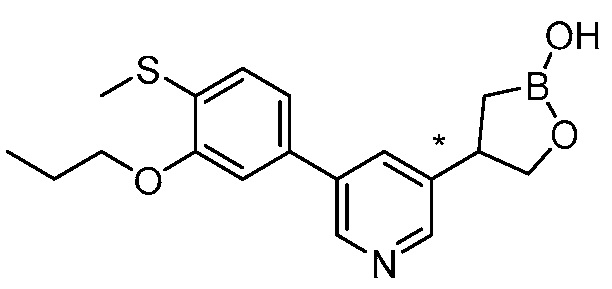
4-(5-(4-(метилтио)-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2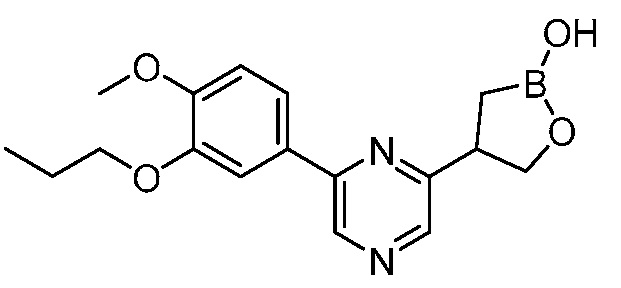
4-(6-(4-метокси-3-пропоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ол
4-(2'-фтор-4'-метокси-3'-пропокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол
3'-(2-гидрокси-1,2-оксаборолан-4-ил)-4,5-диметокси-[1,1'-бифенил]-3-карбонитрил
3-этокси-5-(5-(2-гидрокси-1,2-оксаборолан-4-ил)пиридин-3-ил)-2-метоксибензонитрил
3-этокси-5-(5-(2-гидрокси-1,2-оксаборолан-4-ил)пиридин-3-ил)-2-метоксибензонитрил, энантиомер 1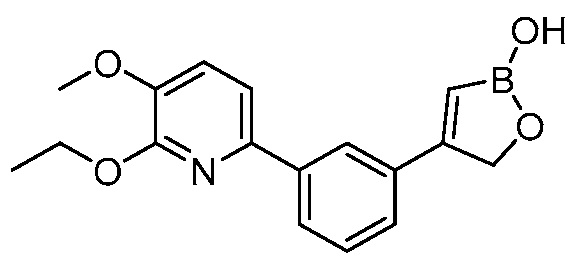
4-(3-(6-этокси-5-метоксипиридин-2-ил)фенил)-1,2-оксаборол-2(5H)-ол
4-(3-(6-этокси-5-метоксипиридин-2-ил)фенил)-1,2-оксаборолан-2-ол
4-(3-(4,5-диметоксипиримидин-2-ил)фенил)-1,2-оксаборолан-2-ол
4-(3-(4,5-диметоксипиримидин-2-ил)фенил)-1,2-оксаборолан-2-ол, энантиомер 1
(+) 4-(2-(4-метокси-3-пропоксифенил)-6-(трифторметил)пиримидин-4-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(6-(3-(циклопентилокси)-4-метоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ол
4-(6-(3-(циклопентилокси)-4-метоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ол, энантиомер 1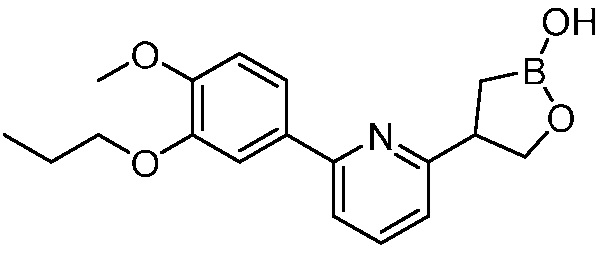
4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол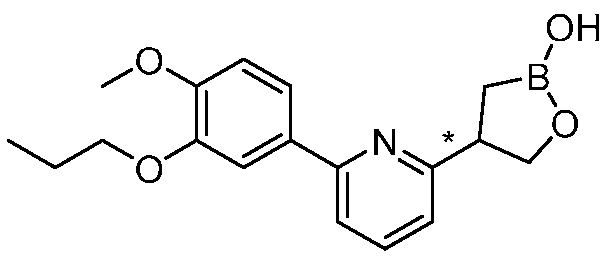
(-) 4-(6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол, энантиомер 1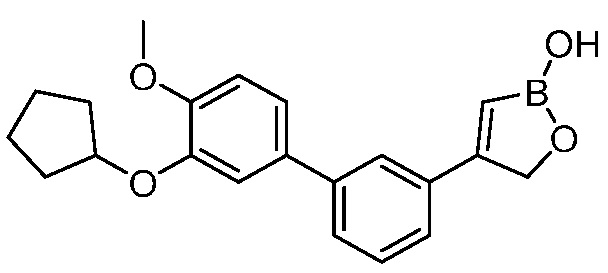
4-(3'-(циклопентилокси)-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборол-2(5H)-ол
4-(3'-(циклопентилокси)-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол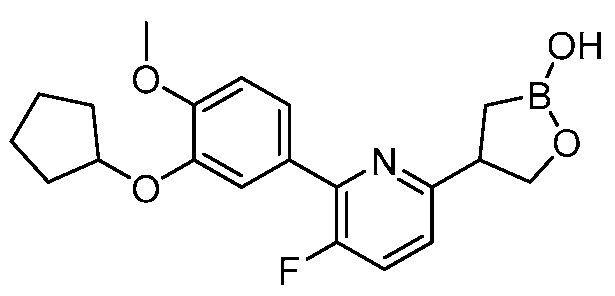
4-(6-(3-(циклопентилокси)-4-метоксифенил)-5-фторпиридин-2-ил)-1,2-оксаборолан-2-ол
4-(2-(3-(циклопентилокси)-4-метоксифенил)-6-метоксипиримидин-4-ил)-1,2-оксаборолан-2-ол
этил 2-(6-(2-гидрокси-1,2-оксаборолан-4-ил)-2-(4-метокси-3-пропоксифенил) пиримидин-4-ил)ацетат
2-(6-(2-гидрокси-1,2-оксаборолан-4-ил)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)уксусная кислота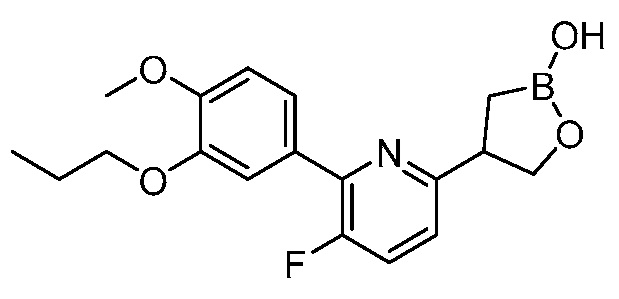
4-(5-фтор-6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол
4-(6-(4-метокси-3-пропоксифенил)пиридазин-4-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(6-(4-метокси-3-пропоксифенил)пиридазин-4-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(4-(дифторметил)-5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
4-(4-(дифторметил)-5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(4-(дифторметил)-5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(5-(5-этокси-2-фтор-4-метоксифенил)-4-метилпиридин-3-ил)-1,2-оксаборолан-2-ол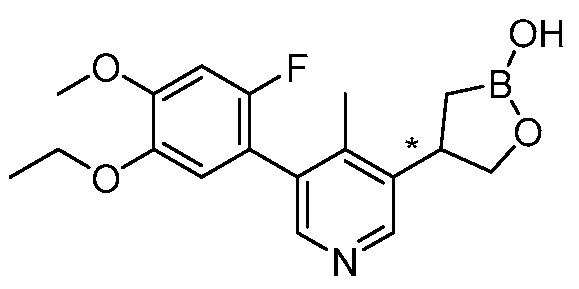
(-) 4-(5-(5-этокси-2-фтор-4-метоксифенил)-4-метилпиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(5-(5-этокси-2-фтор-4-метоксифенил)-4-метилпиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(5-(3-этокси-4-(метилтио)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
4-(5-(3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
(-) 4-(5-(3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(5-(4-метокси-3-пропоксифенил)-1,2,4-тиадиазол-3-ил)-1,2-оксаборолан-2-ол
(-) 4-(5-(4-метокси-3-пропоксифенил)-1,2,4-тиадиазол-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2
[ɑ]20D -10,3 (c=0,1, EtOH).
4-(5-(3-(циклопентилокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
4-(2'-фтор-4',5'-диметокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол
2-этокси-6-(6-(2-гидрокси-1,2-оксаборолан-4-ил)пиридин-2-ил)-3-метоксибензонитрил
4-(3-(5,6-диметоксипиридин-2-ил)фенил)-1,2-оксаборолан-2-ол
6-(5-(2-гидрокси-1,2-оксаборолан-4-ил)пиридин-3-ил)-2,3-диметоксибензонитрил
(-) 4-(2-(2-фтор-4-метокси-5-пропоксифенил)-6-(гидроксиметил)пиримидин-4-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(3-(5-метокси-6-пропоксипиридин-2-ил)фенил)-1,2-оксаборол-2(5H)-ол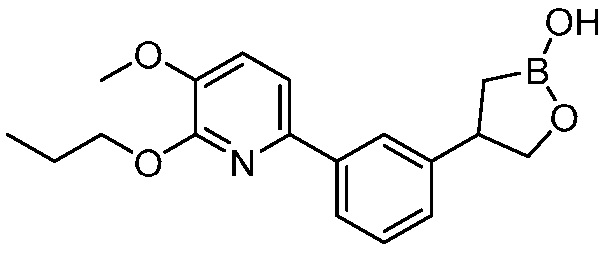
4-(3-(5-метокси-6-пропоксипиридин-2-ил)фенил)-1,2-оксаборолан-2-ол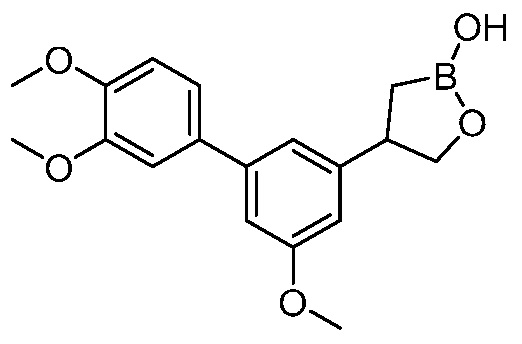
4-(3',4',5-триметокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол
4-(6-(4-метокси-3-пропоксифенил)-4-метилпиридин-2-ил)-1,2-оксаборолан-2-ол
4-(2-(3,4-диметоксифенил)тиазол-4-ил)-1,2-оксаборолан-2-ол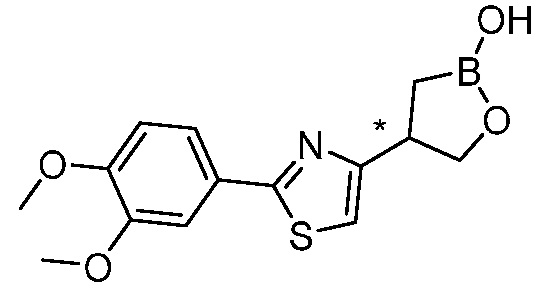
4-(2-(3,4-диметоксифенил)тиазол-4-ил)-1,2-оксаборолан-2-ол, энантиомер 2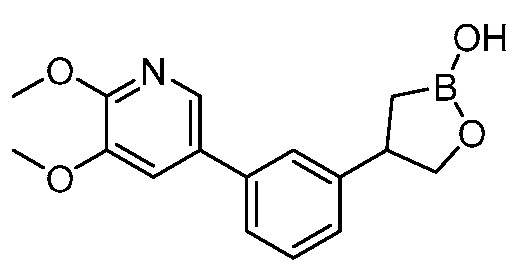
4-(3-(5,6-диметоксипиридин-3-ил)фенил)-1,2-оксаборолан-2-ол
4-(6-(2-фтор-3,4-диметоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол
4-(5-(3-этокси-2,6-дифтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
(-) 4-(5-(3-этокси-2,6-дифтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(3'-(циклопропилметокси)-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол
4-(3'-этокси-2'-фтор-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол
4-(5-(2,4-диметокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
(-) 4-(5-(2,4-диметокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(5-(4-метокси-3-((тетрагидро-2H-тиопиран-4-ил)окси)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
4-(5-(4-метокси-3-((тетрагидро-2H-тиопиран-4-ил)окси)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(5-(3-этокси-4-метоксифенил)-6-этилпиридин-3-ил)-1,2-оксаборолан-2-ол
4-(3'-этокси-4'-(метилтио)-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол
4-(5-(3-хлор-5-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(3-(4,5-диметоксипиридин-2-ил)фенил)-1,2-оксаборолан-2-ол
4-(4-(3-(циклопентилокси)-4-метоксифенил)-6-метоксипиримидин-2-ил)-1,2-оксаборолан-2-ол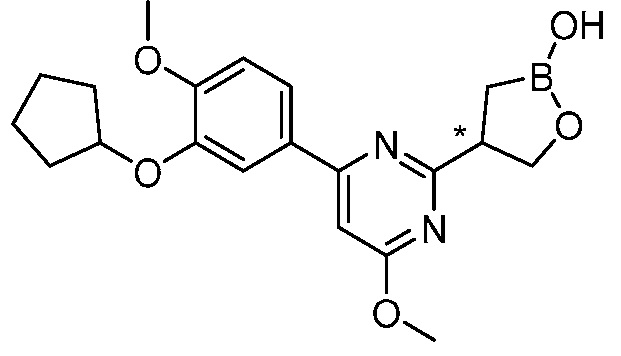
4-(4-(3-(циклопентилокси)-4-метоксифенил)-6-метоксипиримидин-2-ил)-1,2-оксаборолан-2-ол, энантиомер 2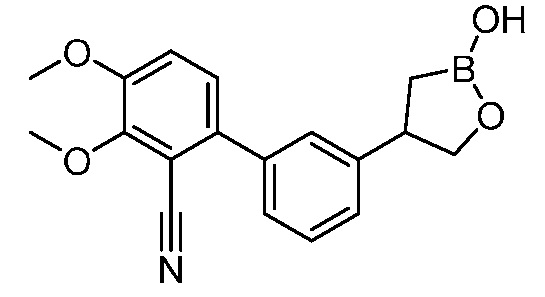
3'-(2-гидрокси-1,2-оксаборолан-4-ил)-3,4-диметокси-[1,1'-бифенил]-2-карбонитрил
4-(5-метокси-4-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол
4-(5-метокси-4-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(2-(гидроксиметил)-6-(4-метокси-3-пропоксифенил) пиридин-4-ил)-1,2-оксаборолан-2-ол, энантиомер 1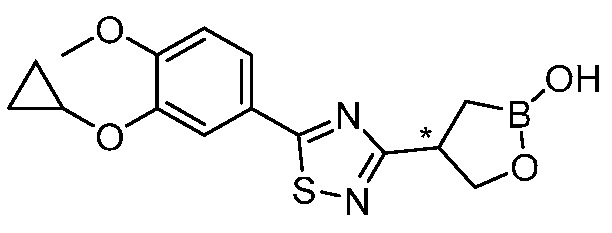
(-) 4-(5-(3-циклопропокси-4-метоксифенил)-1,2,4-тиадиазол-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(4'-этокси-3'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол
4-(3'-изобутокси-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол
4-(3'-циклобутокси-4'-метокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол
4-(2-(3-этокси-4-метоксифенил)-6-метоксипиримидин-4-ил)-1,2-оксаборолан-2-ол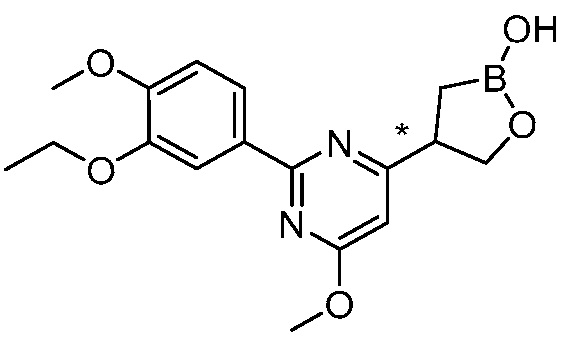
(-) 4-(2-(3-этокси-4-метоксифенил)-6-метоксипиримидин-4-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(5-(4-этокси-3-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол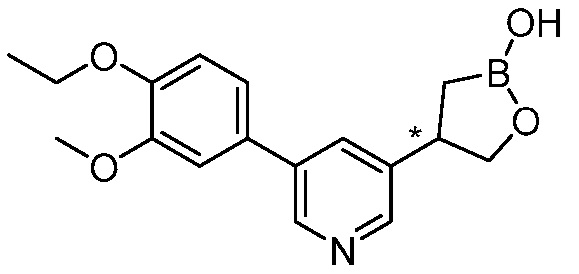
4-(5-(4-этокси-3-метоксифенил) пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2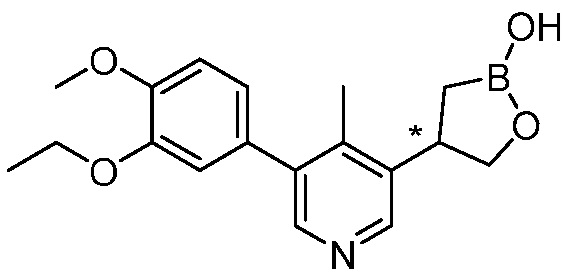
4-(5-(3-этокси-4-метоксифенил)-4-метилпиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2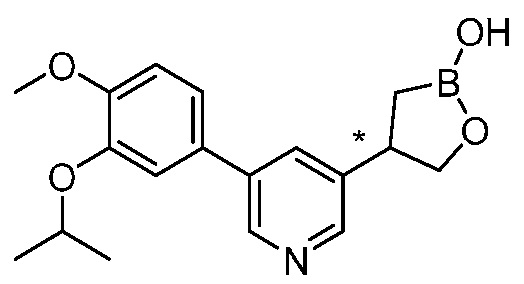
4-(5-(3-изопропокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2
3-этокси-3'-(2-гидрокси-1,2-оксаборолан-4-ил)-4-метокси-[1,1'-бифенил]-2-карбонитрил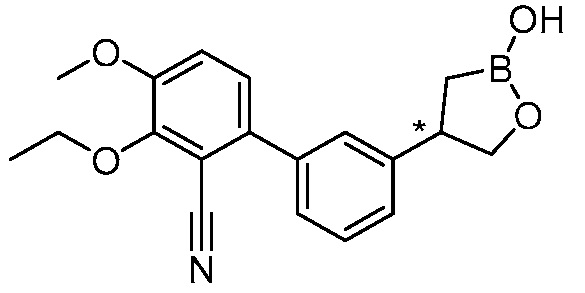
3-этокси-3'-(2-гидрокси-1,2-оксаборолан-4-ил)-4-метокси-[1,1'-бифенил]-2-карбонитрил, энантиомер 2
4-(5-(3-циклопропокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1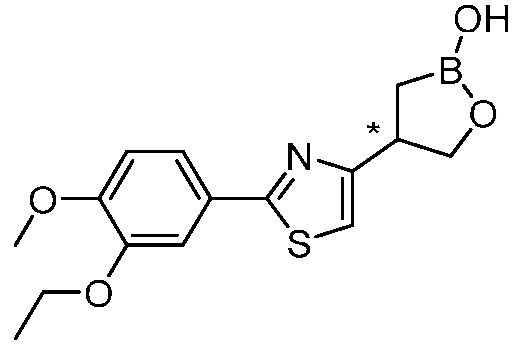
(-) 4-(2-(3-этокси-4-метоксифенил)тиазол-4-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(6-(2-гидроксиэтокси)-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол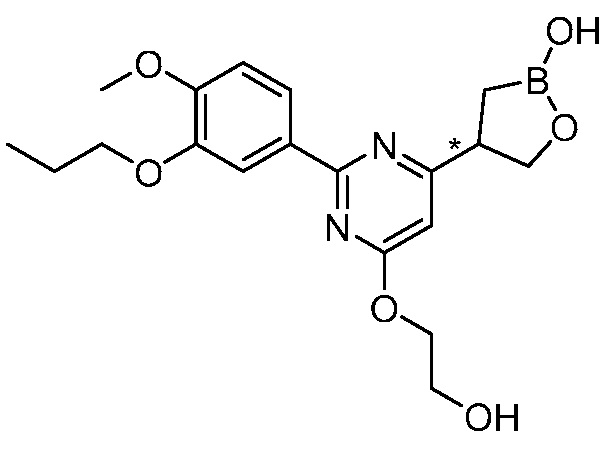
(-) 4-(6-(2-гидроксиэтокси)-2-(4-метокси-3-пропоксифенил) пиримидин-4-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(6-(3,4-диметоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол
4-(4-(гидроксиметил)-6-(4-метокси-3-пропоксифенил)пиримидин-2-ил)-1,2-оксаборолан-2-ол
4-(6-(3-этокси-2-фтор-4-метоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол
4-(1-(4-метокси-3-пропоксифенил)-1H-пиразол-3-ил)-1,2-оксаборолан-2-ол
4-(5-(3-метокси-4-(метилтио)фенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
4-(2-(гидроксиметил)-6-(4-метокси-3-пропоксифенил)пиридин-4-ил)-1,2-оксаборолан-2-ол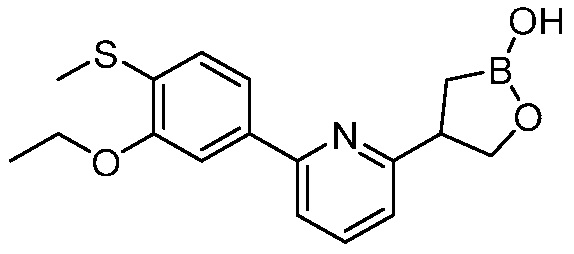
4-(6-(3-этокси-4-(метилтио)фенил)пиридин-2-ил)-1,2-оксаборолан-2-ол
4-(6-(3-этокси-4-(метилтио)фенил)пиридин-2-ил)-1,2-оксаборолан-2-ол, энантиомер 1
(+) 4-(5-(3-этокси-4-метоксифенил)-4,6-диметилпиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(3'-метокси-4'-(метилтио)-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол
4-(3',4'-диметокси-5-метил-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол
(+) 4-(3-фтор-5-метокси-6-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол, энантиомер 2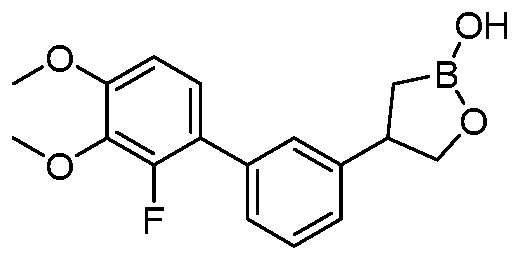
4-(2'-фтор-3',4'-диметокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол
4-(2-(3-(циклопентилокси)-4-метоксифенил)пиридин-4-ил)-1,2-оксаборолан-2-ол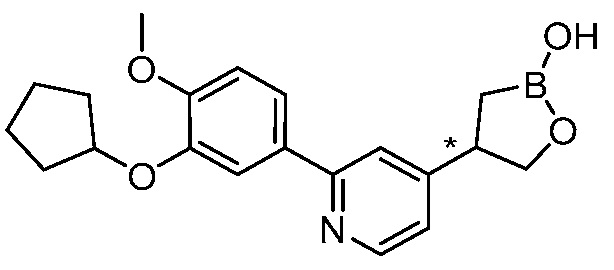
4-(2-(3-(циклопентилокси)-4-метоксифенил)пиридин-4-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол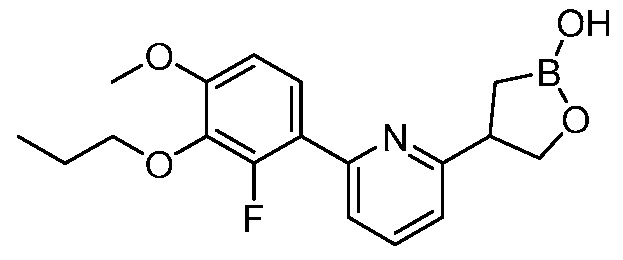
4-(6-(2-фтор-4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол
4-(5-(3-этокси-5-фтор-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(6-(2-фтор-4-метокси-3-пропоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ол
4-(6-(2-фтор-4-метокси-3-пропоксифенил)пиразин-2-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(5-(4-этокси-2-фтор-3-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол
4-(6'-метокси-2-метил-5'-пропокси-[3,3'-бипиридин]-5-ил)-1,2-оксаборолан-2-ол
(-) 4-(6'-метокси-2-метил-5'-пропокси-[3,3'-бипиридин]-5-ил)-1,2-оксаборолан-2-ол, энантиомер 1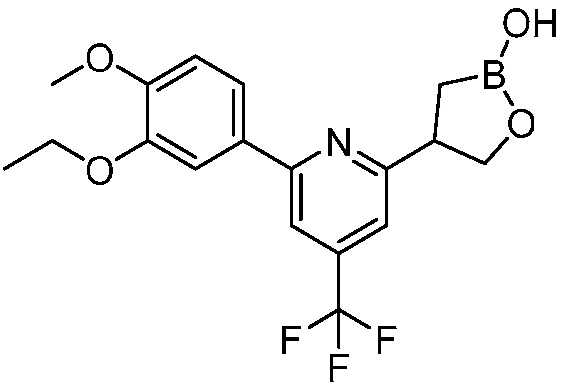
4-(6-(3-этокси-4-метоксифенил)-4-(трифторметил)пиридин-2-ил)-1,2-оксаборолан-2-ол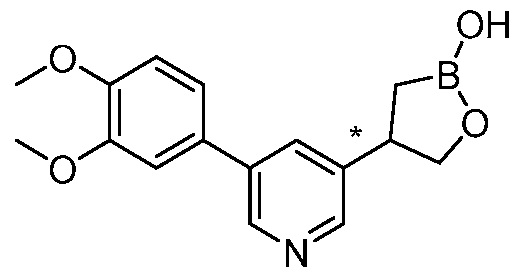
4-(5-(3,4-диметоксифенил) пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2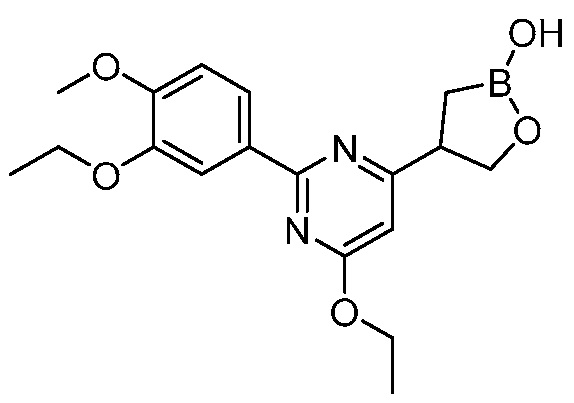
4-(6-этокси-2-(3-этокси-4-метоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол
4-(6-этокси-2-(3-этокси-4-метоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(6-метокси-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол
(-) 4-(6-метокси-2-(4-метокси-3-пропоксифенил)пиримидин-4-ил)-1,2-оксаборолан-2-ол, энантиомер 2
2-(циклопентилокси)-6-(6-(2-гидрокси-1,2-оксаборолан-4-ил)пиридин-2-ил)-3-метоксибензонитрил
4-(2-(3,4-диметоксифенил)пиридин-4-ил)-1,2-оксаборол-2(5H)-ол
(+) 4-(5-(3-(2-гидроксиэтокси)-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, энантиомер 2
4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборол-2(5H)-ол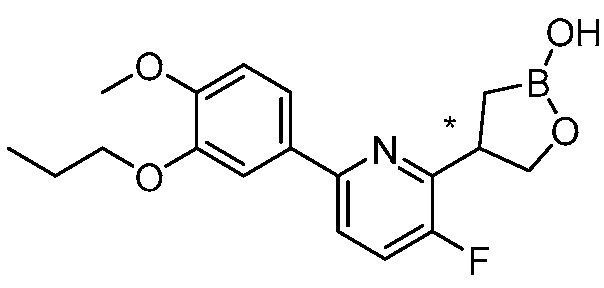
4-(3-фтор-6-(4-метокси-3-пропоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол, энантиомер 1
(-) 4-(5-метокси-2'-метил-6-пропокси-[2,3'-бипиридин]-5'-ил)-1,2-оксаборолан-2-ол, энантиомер 1
4-(3',4'-диметокси-[1,1'-бифенил]-3-ил)-1,2-оксаборолан-2-ол
4-(6-(3-этокси-4-метоксифенил)пиридин-2-ил)-1,2-оксаборолан-2-ол
Монокристаллический рентгеновский анализ кристаллического (R) 4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (Примера 3)
Кристаллическую структуру Примера 3 определяют монокристаллической рентгеновской дифракцией. Сбора данных монокристаллической рентгеновской дифракции проводят на дифрактометре Bruker D8 Quest при комнатной температуре. Сбор данных состоит из сканирования омега и фи. Структуру разрешают через внутреннее фазирование с применением программного пакета SHELX в пространственной группе Моноклинического класса P21. Структуру затем уточняют методом наименьших квадратов в полноматричном приближении. Все отличные от водорода атомы были найдены и уточнены с применением параметров двоякопреломляющего замещения. Атомы водорода, расположенные на кислороде, были найдены из разностной карты Фурье и уточнены с закрепленными расстояниями. Оставшиеся атомы водорода были помещены в расчетные положения и позволили связаться с из атомами-носителями. Конечное уточнение включает параметры изотропного замещения для всех атомов водорода. Анализ абсолютной структуры с применением вероятностных способов (Hooft 2008) проводят с применением PLATON (Spek 2010). Параметр Хофта указан как 0,02 с ВСО 0,003 и параметр Пирсона указан как 0,02 с ВСО 0,003. Конечный R-индекс составляет 4,5%. Конечная разность Фурье не выявила отсутствия или смещения электронной плотности.
На фигуре 1 представлена полученная рентгеновская структура (изображение ORTEP) кристаллического (R) 4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (Примера 3). Данные кристаллической структуры суммированы в таблице 1.
Таблица 1
Кристаллические данные и уточнение структуры для примера 3
Монокристаллический рентгеновский анализ кристаллического (R) 4-(5-(4-метокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (Примера 4)
Кристаллическую структуру Примера 4 определяют монокристаллической рентгеновской дифракцией. Сбора данных монокристаллической рентгеновской дифракции проводят на дифрактометре Bruker D8 Venture при температуре -150°C. Сбор данных состоит из сканирования омега и фи. Структуру разрешают через внутреннее фазирование с применением программного пакета SHELX в пространственной группе Моноклинического класса P21. Структуру затем уточняют методом наименьших квадратов в полноматричном приближении. Все отличные от водорода атомы были найдены и уточнены с применением параметров двоякопреломляющего замещения. Атомы водорода, расположенные на кислороде, были найдены из разностной карты Фурье и уточнены с закрепленными расстояниями. Оставшиеся атомы водорода были помещены в расчетные положения и позволили связаться с из атомами-носителями. Конечное уточнение включает параметры изотропного замещения для всех атомов водорода. Анализ абсолютной структуры с применением вероятностных способов (Hooft 2008) проводят с применением PLATON (Spek 2010). Параметр Хофта указан как 0,08 с ВСО 0,003 и параметр Пирсона указан как 0,15 с ВСО 0,003. Конечный R-индекс составляет 4,6%. Конечная разность Фурье не выявила отсутствия или смещения электронной плотности.
На фигуре 2 представлена полученная рентгеновская структура (изображение ORTEP) кристаллического (R) 4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (Примера 4). Данные кристаллической структуры суммированы в таблице 2.
Таблица 2
Кристаллические данные и уточнение структуры для примера 4
Монокристаллический рентгеновский анализ кристаллического (S) 4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (Примера 5)
Кристаллическую структуру Примера 5 также определяют монокристаллической рентгеновской дифракцией. Сбора данных монокристаллической рентгеновской дифракции проводят на дифрактометре Bruker D8 Quest при комнатной температуре. Сбор данных состоит из сканирования омега и фи. Структуру разрешают через внутреннее фазирование с применением программного пакета SHELX в пространственной группе Моноклинического класса P21. Структуру затем уточняют методом наименьших квадратов в полноматричном приближении. Все отличные от водорода атомы были найдены и уточнены с применением параметров двоякопреломляющего замещения. Атомы водорода, расположенные на кислороде, были найдены из разностной карты Фурье и уточнены с закрепленными расстояниями. Оставшиеся атомы водорода были помещены в расчетные положения и позволили связаться с из атомами-носителями. Конечное уточнение включает параметры изотропного замещения для всех атомов водорода. Анализ абсолютной структуры с применением вероятностных способов (Hooft 2008) проводят с применением PLATON (Spek 2010). Параметр Хофта указан как 0,01 с ВСО 0,007 и параметр Пирсона указан как 0,01 с ВСО 0,006. Конечный R-индекс составляет 4,8%. Конечная разность Фурье не выявила отсутствия или смещения электронной плотности.
На фигуре 3 представлена полученная рентгеновская структура (изображение ORTEP) кристаллического (S) 4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (Примера 5). Данные кристаллической структуры суммированы в таблице 3.
Таблица 3
Кристаллические данные и уточнение структуры для примера 5
Монокристаллический рентгеновский анализ кристаллического (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ола (Примера 19)
Кристаллическую структуру Примера 19 также определяют монокристаллической рентгеновской дифракцией. Сбора данных монокристаллической рентгеновской дифракции проводят на дифрактометре Bruker D8 Quest при комнатной температуре. Сбор данных состоит из сканирования омега и фи. Структуру разрешают через внутреннее фазирование с применением программного пакета SHELX в пространственной группе Моноклинического класса P21. Структуру затем уточняют методом наименьших квадратов в полноматричном приближении. Все отличные от водорода атомы были найдены и уточнены с применением параметров двоякопреломляющего замещения. Атомы водорода, расположенные на кислороде, были найдены из разностной карты Фурье и уточнены с закрепленными расстояниями. Оставшиеся атомы водорода были помещены в расчетные положения и позволили связаться с из атомами-носителями. Конечное уточнение включает параметры изотропного замещения для всех атомов водорода. Анализ абсолютной структуры с применением вероятностных способов (Hooft 2008) проводят с применением PLATON (Spek 2010). Параметр Хофта указан как 0,06 с ВСО 0,003 и параметр Пирсона указан как 0,06 с ВСО 0,003. Конечный R-индекс составляет 4,0%. Конечная разность Фурье не выявила отсутствия или смещения электронной плотности.
На фигуре 4 представлена полученная рентгеновская структура (изображение ORTEP) кристаллического (R) 4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ола (Примера 19). Данные кристаллической структуры суммированы в таблице 4.
Таблица 4
Кристаллические данные и уточнение структуры для примера 19
Рентгеновская порошковая дифракция
Кристаллические структуры примеров 3, 4, 5, 10 и 19 анализируют с применением рентгеновской порошковой дифракции («ПРД»).
Для примера 4, порошковую рентгеновскую дифракцию проводят с применением дифрактометра Bruker AXS D8 ADVANCE, оборудованного источником излучения Cu (K-α среднее). Система оборудована 2,5 аксиальными щелями Соллера на первичном контуре. На вторичном контуре применяются 2,5 аксиальные щели Соллера и моторные щели. Дифрагированное излучение определяется датчиком Lynx Eye XE. Напряжение и силу тока рентгеновской трубки устанавливают на 40 кВ и 40 мА, соответственно. Данные собирают в угломере Тэта-Тэта при длине волны Cu от 3,0 до 40,0 градусов 2-Тэта с применением размера шага 0,037 градусов и времени шага 10 секунд на шаг. Образцы получают размещением их в малофоновом держателе (Bruker артикул: C79298A3244B261) и вращением во время сбора. Данные собирают с применением программы Bruker DIFFRAC Plus. Анализ проводят в программе EVA diffract plus. Файл с данными ПРД не обрабатывают до выявления пика. С применением алгоритма поиска пика в программе EVA, пики, выбранные с пороговым значением 1 и шириной 0,3, применяют для проведения предварительного определения пиков. Для обеспечения достоверности, корректировки проводят вручную; визуально проверяют вывод автоматических определений, и положения пиков доводят до максимума пика. Обычно выбирают пики с относительной интенсивностью ≥3%. Пики, которые не разрешены или соответствуют шуму, не выбирают. Типовая ошибка, связанная с положением пика из ПРД, указана в USP вплоть до +/-0,2° 2-Тета (USP-941).
Для примеров 3, 5, 10 и 19, порошковую рентгеновскую дифракцию проводят с применением дифрактометра Bruker AXS D4 Endeavor, оборудованного источником излучения Cu (K-α среднее). Система оборудована 2,5 аксиальными щелями Соллера на первичном контуре. На вторичном контуре применяются 2,5 аксиальные щели Соллера и моторные щели. Дифрагированное излучение определяется датчиком Lynx Eye XE. Напряжение и силу тока рентгеновской трубки устанавливают на 40 кВ и 40 мА, соответственно. Данные собирают в угломере Тэта-2Тэта при длине волны Cu от 3,0 до 43,0 градусов 2-Тэта с применением размера шага 0,020 градусов и времени шага 3 секунды на шаг. Образцы получают размещением их в малофоновом держателе (Bruker артикул: C79298A3244B261) и вращением во время сбора. Данные собирают с применением программы Bruker DIFFRAC Plus. Анализ проводят в программе EVA diffract plus. Файл с данными ПРД не обрабатывают до выявления пика. С применением алгоритма поиска пика в программе EVA, пики, выбранные с пороговым значением 1 и шириной 0,3, применяют для проведения предварительного определения пиков. Для обеспечения достоверности, корректировки проводят вручную; визуально проверяют вывод автоматических определений, и положения пиков доводят до максимума пика. Обычно выбирают пики с относительной интенсивностью ≥3%. Пики, которые не разрешены или соответствуют шуму, не выбирают. Типовая ошибка, связанная с положением пика из ПРД, указана в USP вплоть до +/-0,2° 2-Тета (USP-941).
Как будет понятно специалисту в области кристаллографии, относительные интенсивности различных пиков, представленные в таблицах и на фигурах ниже, могут варьироваться из-за ряда факторов, таких как степень ориентации кристаллов в рентгеновском луче или чистота анализируемого материала или степень кристалличности образца. Положения пиков останутся в основном такими, как определено. Специалист в области кристаллографии также поймет, что измерения с использованием другой длины волны приведут к различным сдвигам в соответствии с уравнением Брэгга -nλ=2d sin θ. Такие дополнительные образцы ПРД кристаллических материалов настоящего изобретения как таковые входят в объем настоящей информации.
На фигуре 5 представлен профиль порошковой рентгеновской дифракции для кристаллического (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (Примера 3) и в таблице 5 перечислены пики ПРД.
Таблица 5
Данные ПРД для Примера 3
На фигуре 6 представлен профиль порошковой рентгеновской дифракции для кристаллического (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (Примера 4) и в таблице 6 перечислены пики ПРД.
Таблица 6
Данные ПРД для Примера 4
На фигуре 7 представлен профиль порошковой рентгеновской дифракции для кристаллического (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (Примера 5) и в таблице 7 перечислены пики ПРД.
Таблица 7
Данные ПРД для Примера 5
На фигуре 8 представлен профиль порошковой рентгеновской дифракции для кристаллического (-) 4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ола (Примера 10) и в таблице 8 перечислены пики ПРД.
Таблица 8
Данные ПРД для Примера 10
На фигуре 9 представлен профиль порошковой рентгеновской дифракции для кристаллического (R)-4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ола (Примера 19) и в таблице 9 перечислены пики ПРД.
Таблица 9
Данные ПРД для Примера 11
Примеры составов
В одном варианте осуществления в настоящем изобретении представлен местный фармацевтический состав, содержащий: (a) активный агент по изобретению, который лечит связанное с воспалением состояние, или его фармацевтически приемлемую соль или его гидрат или сольват, (b) от примерно 5% (масс./масс.) до примерно 15% (масс./масс.) растворителя и (c) основу для мази. В одном варианте осуществления, в настоящем изобретении представлен местный фармацевтический состав, содержащий: (a) активный агент по изобретению, который лечит связанное с воспалением состояние, или его фармацевтически приемлемую соль или его гидрат или сольват,(b) от примерно 5% (масс./масс.) до примерно 15% (масс./масс.) растворителя и (c) вазелин. В одном варианте осуществления, в настоящем изобретении представлен местный фармацевтический состав, содержащий: (a) активный агент по изобретению, который лечит связанное с воспалением состояние, или его фармацевтически приемлемую соль или его гидрат или сольват, (b) от примерно 5% (масс./масс.) до примерно 15% (масс./масс.) растворителя, (c) мазь, (d) антиоксидант, (e) стабилизатор, (f) эмульгирующий агент и (g) наполнитель, увеличивающий жесткость смеси. В одном варианте осуществления, в настоящем изобретении представлен местный фармацевтический состав, содержащий: (a) активный агент по изобретению, который лечит связанное с воспалением состояние, или его фармацевтически приемлемую соль или его гидрат или сольват, (b) от примерно 5% (масс./масс.) до примерно 15% (масс./масс.) растворителя, (c) мазь, (d) антиоксидант, (e) эмульгирующий агент и (f) наполнитель, увеличивающий жесткость смеси. В одном варианте осуществления, в настоящем изобретении представлен местный фармацевтический состав, содержащий: (a) активный агент по изобретению, который лечит связанное с воспалением состояние, или его фармацевтически приемлемую соль или его гидрат или сольват, (b) от примерно 5% (масс./масс.) до примерно 15% (масс./масс.) растворителя, (c) вазелин, (d) антиоксидант, (e) эмульгирующий агент и (f) наполнитель, увеличивающий жесткость смеси. В одном варианте осуществления, в настоящем изобретении представлен местный фармацевтический состав, содержащий: (a) активный агент по изобретению, который лечит связанное с воспалением состояние, или его фармацевтически приемлемую соль или его гидрат или сольват, (b) от примерно 8% (масс./масс.) до примерно 10% (масс./масс.) пропилен- или гексиленгликоль, (c) от примерно 75%(масс./масс.) до примерно 80% (масс./масс.) медицинский вазелин, (d) от примерно 8% (масс./масс.) до примерно 10% смеси глицеридов, (e) от примерно 4% до примерно 6% парафина и (f) от примерно 0,05% до 0,5% бутилированного гидрокситолуола. В одном варианте осуществления, в настоящем изобретении представлен местный фармацевтический состав, содержащий: (a) активный агент по изобретению, который лечит связанное с воспалением состояние, или его фармацевтически приемлемую соль или его гидрат или сольват, (b) от примерно 8% (масс./масс.) до примерно 10% (масс./масс.) гексиленгликоля, (c) от примерно 75%(масс./масс.) до примерно 80% (масс./масс.) медицинского вазелина, (d) от примерно 8% (масс./масс.) до примерно 10% глицеридной смеси, (e) от примерно 4% до примерно 6% парафина и (f) от примерно 0,05% до 0,5% бутилированного гидрокситолуола.
В одном варианте осуществления, в настоящем изобретении представлен местный фармацевтический состав, содержащий активный агент, где «активным агентом» является соединение по настоящему изобретению или его фармацевтически приемлемая соль, гидрат или сольват. В другом варианте осуществления, активным агентом является (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол или его фармацевтически приемлемая соль, гидрат или сольват. В другом варианте осуществления, активным агентом является (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол или его фармацевтически приемлемая соль, гидрат или сольват. В другом варианте осуществления, активным агентом является (R)-4-(5-(3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол или его фармацевтически приемлемая соль, гидрат или сольват. В другом варианте осуществления, активным агентом является (R)-4-(5-(3-этокси-4-метоксифенил)-6-метилпиридин-3-ил)-1,2-оксаборолан-2-ол или его фармацевтически приемлемая соль, гидрат или сольват. В другом варианте осуществления, активным агентом является (-)-4-(5-(2-(дифторметил)-3-этокси-4-метоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол или его фармацевтически приемлемая соль, гидрат или сольват.
В другом варианте осуществления, в настоящем изобретении представлен местный фармацевтический состав, содержащий активный агент, присутствующий в концентрации от примерно 0,0001% до примерно 3,0% (масс./масс.). В другом варианте осуществления, активный агент присутствует в концентрации от примерно 0,001% до примерно 2,0% (масс./масс.). В другом варианте осуществления, активный агент присутствует в концентрации от примерно 0,01% до примерно 1,0% (масс./масс.). В другом варианте осуществления, активный агент присутствует в концентрации от примерно 0,05% до примерно 0,5% (масс./масс.).
В другом варианте осуществления, в настоящем изобретении представлен активный агент или его соль, гидрат или сольват. В другом варианте осуществления, в настоящем изобретении представлена комбинация активного агента и второго активного агента, где второй активный агент применяют для лечения воспалительных расстройств, таких как атопический дерматит, экзема, псориаз, артрит, астма, фиброз, волчанка, аллергия, фибромиалгия, заживление ран и воспаление после хирургических осложнений. Комбинация может состоять из смеси или совместного состава двух активных ингредиентов. Альтернативно, комбинация может быть упакована в дозатор, где один активный агент находится в одной камере, а другой активный ингредиент находится во второй камере, но при дозировании два активных агента одновременно доставляются вместе, так что введение комбинации может происходить в одно применение. Альтернативно, активные агенты могут быть введены по отдельности с другим активным агентом, где второй активный агент может вводиться перорально или местно.
В другом варианте осуществления, в настоящем изобретении представлен активный агент, описанный в настоящем документе, или его соль, гидрат или сольват, в местном составе, который содержит растворитель. В другом варианте осуществления, растворителем является алкилгликоль или алкиловый спирт. В другом варианте осуществления, растворителем является алкилгликоль. В другом варианте осуществления, растворителем является пропиленгликоль. В другом варианте осуществления, растворителем является гексиленгликоль. В другом варианте осуществления, растворителем является бутиленгликоль. В другом варианте осуществления, растворитель присутствует в концентрации от примерно 5,0% (масс./масс.) до примерно 15,0% (масс./масс.). В другом варианте осуществления, растворитель присутствует в концентрации от примерно 6,0% (масс./масс.) до примерно 12,0% (масс./масс.). В другом варианте осуществления, растворитель присутствует в концентрации от примерно 7,0% (масс./масс.) до примерно 11,0% (масс./масс.). В другом варианте осуществления, растворитель присутствует в концентрации от примерно 8,0% (масс./масс.) до примерно 10,0% (масс./масс.).
В другом варианте осуществления, в настоящем изобретении представлен активный агент, описанный в настоящем документе, или его соль, гидрат или сольват, в местном составе, который содержит основу для мази. В другом варианте осуществления, основой для мази является медицинский вазелин. В другом варианте осуществления, основой для мази является вазелин, вазелин, желтый вазелин, желтый мягкий парафин, желтый вазелин, медицинский вазелин или белый мягкий парафин. В другом варианте осуществления, основой является минеральное масло, легкое минеральное масло, парафин или ланолиновый спирт. Количество основы для мази в фармацевтической композиции для местного применения будет зависеть от количеств других компонентов. В другом варианте осуществления, основа для мази присутствует в достаточной концентрации. В другом варианте осуществления, основа для мази присутствует в концентрации от примерно 65% (масс./масс.) до примерно 85% (масс./масс.). В другом варианте осуществления, основа присутствует в концентрации от примерно 70% (масс./масс.) до примерно 80% (масс./масс.). В другом варианте осуществления, основа присутствует в концентрации от примерно 75% (масс./масс.) до примерно 80% (масс./масс.).
В другом варианте осуществления, в настоящем изобретении представлен активный агент, описанный в настоящем документе, или его соль, гидрат или сольват, в местном составе, который дополнительно содержит антиоксидант. В другом варианте осуществления, антиоксидантом является бутилированный гидрокситолуол, аскорбиновая кислота, аскорбиновый пальмитат, бутилированный гидроксианизол, 2,4,5-тригидроксибутирофенон, 4-гидроксиметил-2,6-ди-трет-бутилфенол, эриторбиновая кислота, гваяковая смола, пропилгаллат, тиодипропионовая кислота, дилаурил тиодипропионат, трет-бутилгидрохинон или токоферол. В другом варианте осуществления, антиоксидантом является бутилированный гидрокситолуол. В другом варианте осуществления, антиоксидант присутствует в концентрации от примерно 0,01% (масс./масс.) до примерно 1% (масс./масс.). В другом варианте осуществления, антиоксидант присутствует в концентрации от примерно 0,01% (масс./масс.) до примерно 0,5% (масс./масс.). В другом варианте осуществления, антиоксидант присутствует в концентрации от примерно 0,05% (масс./масс.) до примерно 0,5% (масс./масс.). В другом варианте осуществления, антиоксидант присутствует в концентрации от примерно 0,075% (масс./масс.) до примерно 0,2% (масс./масс.).
В другом варианте осуществления, местный фармацевтический состав дополнительно содержит эмульгирующий агент. В другом варианте осуществления, эмульгирующим агентом является глицеридная смесь. В другом варианте осуществления, эмульгирующим агентом является глицеридная смесь, где глицеридная смесь содержит моноглицерид и диглицерид. В другом варианте осуществления, эмульгирующим агентом является глицеридная смесь, где глицеридная смесь содержит моногдицерид, диглицерид и триглицерид. В другом варианте осуществления, эмульгирующим агентом является глицеридная смесь, где глицеридная смесь содержит моноглицерид и диглицерид, и где от примерно 40% (масс./масс.) до примерно 55% (масс./масс.) глицеридной смеси составляет моноглицерид. В другом варианте осуществления, эмульгирующим агентом является глицеридная смесь, где глицеридная смесь содержит моногдицерид, диглицерид и триглицерид, и где от примерно 40% (масс./масс.) до примерно 55% (масс./масс.) глицеридной смеси составляет моноглицерид. В другом варианте осуществления, моноглицерид выбирают из группы, состоящей из глицерилмоностеарата, глицерилмонопальмитата, глицерилмоноолеата или их комбинаций. В другом варианте осуществления, моноглицеридом является моноглицериловый эфир длинноцепочечной насыщенной или ненасыщенной жирной кислоты. В одном варианте осуществления, моноглицеридом является альфа-моноглицерид. В предпочтительном варианте осуществления, диглицеридом является диглицериловый эфир длинноцепочечной насыщенной или ненасыщенной жирной кислоты. В другом варианте осуществления, глицеридная смесь присутствует в концентрации от примерно 3,0% (масс./масс.) до примерно 10,0% (масс./масс.). В другом варианте осуществления, глицеридная смесь присутствует в концентрации от примерно 5,0% (масс./масс.) до примерно 10,0% (масс./масс.). В другом варианте осуществления, глицеридная смесь присутствует в концентрации от примерно 6,0% (масс./масс.) до примерно 8,0% (масс./масс.).
В другом варианте осуществления, местный фармацевтический состав дополнительно содержит наполнитель, увеличивающий жесткость смеси. В другом варианте осуществления, наполнителем, увеличивающим жесткость смеси, является воск. В другом варианте осуществления, наполнителем, увеличивающим жесткость смеси, является воск, и воск выбирают из группы, состоящее из пчелиного воска, парафина и спермацетового воска. В другом варианте осуществления, наполнителем, увеличивающим жесткость смеси, является парафин. В другом варианте осуществления, наполнитель, увеличивающий жесткость смеси, присутствует в концентрации от примерно 3,0% (масс./масс.) до примерно 7,0% (масс./масс.). В предпочтительном варианте осуществления, наполнитель, увеличивающий жесткость смеси, присутствует в концентрации от примерно 4,0% (масс./масс.) до примерно 6,0% (масс./масс.). В другом варианте осуществления, наполнитель, увеличивающий жесткость смеси, присутствует в концентрации от примерно 4,5%(масс./масс.) до примерно 5,5% (масс./масс.).
В другом варианте осуществления, местный фармацевтический состав дополнительно содержит стабилизатор. В другом варианте осуществления, стабилизатором является этилендиаминтетрауксусная кислота или ее фармацевтически приемлемая соль. В другом варианте осуществления, стабилизатором является a фармацевтически приемлемая соль этилендиаминтетрауксусной кислоты, и этой солью является соль натрия или соль калия или соль кальция или их комбинация. В другом варианте осуществления, стабилизатор присутствует в концентрации от примерно 0,000010% (масс./масс.) до примерно 0,0450% (масс./масс.).
Композиция составов для местного применения соединений по настоящему изобретению включает эксципиенты, которые обеспечивают, по меньшей мере, одну из следующих функциональных возможностей: растворителя; основы; диспергирующего агента; эмульгирующего агента; наполнителя, увеличивающего жесткость смеси; агента, модифицирующего реологию; стабилизирующего агента; и антиоксиданта. Например, подходящие составы в виде мази для местного применения, например, включают, но не ограничены ими, составы, перечисленные в таблицах 10, 11, 13 и 14. В дополнение к составам в виде мази, перечисленным в таблицах 10 и 11, другие составы для местного применения, подходящие для соединения по настоящему изобретению включают, но не ограничены ими, кремы, лосьоны, гели, растворы, суспензии, пены и спреи.
Таблица 10
*дк или достаточной количество означает достаточное количество для получения полного объема=100%
Местные составы, полученные с Примером 4, на которых тестируют проницаемость кожи и максимальный поток Примера 4, перечислены в таблице 11.
Таблица 11
Исследование проницаемости кожи in vitro или анализ клеток Франца используют для демонстрации способности составов из таблицы 11 обеспечивать проникновение Примера 4 через барьер рогового слоя и продвижение через эпидермис и дерму через измерение потока. Составы демонстрируют зависящий от концентрации поток через кожу (таблица 12) и могут вмещать широкий диапазон концентраций примера 4, обеспечивая диапазон термодинамических движущих сил для Примера 4 для проникновения через кожу. Более высокая движущая сила может быть достигнута за счет включения в составы дополнительных усилителей проникновения, таких как олеиловый спирт.
Таблица 12
Суммарное проникнувшее количество и максимальный поток Примера 4
* Количество доноров кожи=3; Повторов на донора=5.
Таблица 13
* Среднецепочечные триглицериды содержат две или три жирных кислоты, имеющих алифатический хвост из 6-12 атомов углерода.
Таблица 14
Местные составы Примера 4 в виде мази
Биологические анализы
Анализ PDE4 SPA
Активность фосфодиэстеразы (PDE) определяют через измерение действия тестируемого агента на активность фермента PDE4B в сцинтилляционном анализе сближения (SPA). Во время анализа приблизительно 30 мкл PDE4B (aa 152-484, Uniprot ID Q07343) в 50 мм Tris pH 7,5, 1,3 мм MgCl2, 0,004% Brij 35 добавляют в 384-луночный белый полистироловый планшет с прозрачным дном (Corning), содержащий 1 мкл варьирующихся концентраций тестируемого соединения. Через ~10 минут при комнатной температуре (КТ; ~21°C), анализ начинают добавлением 20 мкл смеси 3H-меченого (аденозин 3’,5’-циклический фосфат, аммониевая соль, [2,8-3H]; Perkin Elmer) и не меченого cAMP. Конечные условия анализа включают приблизительно 81,6 pM PDE4B в 50 мм Tris pH 7,5, 1,3 мм MgCl2, 0,004% Brij 35, 1 мкМ 3H-меченого/не меченого cAMP (1425 р/мин/пмоль) и указанную конечную концентрацию тестируемого соединения (приблизительно от 10 мкМ до 9,5 пМ при 4-кратном разведении). Конечная концентрация ДМСО в анализе составляет приблизительно 2,0%. Через 30 минут при КТ анализ заканчивают добавлением приблизительно 20 мкл водного раствора PDE YSI SPA шариков (8 мг/мл в воде; Perkin Elmer). Шарикам дают осесть в течение, по меньшей мере, 2 часов, и планшет затем считывают на MicroBeta2 (Perkin Elmer). Значения концентраций и полученного эффекта для тестируемых соединений наносят на график, и концентрации соединения, требуемые для 50% действия (IC50) определяют с применением четырехпараметрического логистического уравнения доза-ответ (E-WorkBook, ID Business Solutions Ltd.) и показывают в таблице 15.
Цитокиновый анализ
Действие по ингибированию цитокинов определяют через измерение действия тестируемого агента на выделение цитокинов IL-4, IL-13 и IFNγ из мононуклеарных клеток периферической крови (PBMC) человека, стимулированных T-клеточным митогеном фитогемагглютинином-L (PHA-L). Во время анализа, PBMC человека (Astarte Biologics) вынимают из криоконсервации, быстро размораживают при 37°C, разводят в аналитической среде (среде RPMI - Gibco 1640, 10% инактивированной теплом фетальной бычьей сыворотки (HIFBS), 2 мм глутамина и 10 мм HEPES pH 7,4) и затем центрифугируют при 250 x g в течение 5 минут. Полученный дебрис ресуспендируют в аналитической среде до концентрации приблизительно 5×106 клеток/мл, и 50 мкл этой клеточной суспензии (приблизительно 250000 клеток) добавляют в каждую лунку 384-луночного титровального микропланшета для культивирования клеток (Perkin Elmer). Разные концентрации тестируемого соединения затем разводят в аналитической среде и добавляют в лунки аналитического планшета в объеме 25 мкл. Через ~10 минут при комнатной температуре (~21°C) клетки стимулируют добавлением 25 мкл PHA-L (14 мкг/мл; Millipore), и аналитический планшет помещают в инкубатор при 37°C в увлажненной среде в 5% двуокиси углерода. Конечные условия анализа включают приблизительно 250000 PBMC человека в аналитической среде, содержащей 3,5 мкг/мл PHA-L и указанную конечную концентрацию тестируемого соединения (приблизительно от 10 мкМ до 9,5 пМ при 4-кратном разведении). Конечная концентрация ДМСО в анализе составляет приблизительно 0,25%. Через 48 часов аналитический планшет удаляют из инкубатора и центрифугируют при 250 x g в течение 5 минут. Часть полученного клеточного супернатанта затем добавляют для определения количества IL-4, IL-13 и IFNγ в каждой лунке. Измерения цитокинов проводят с применением наборов HTRF для анализа IL-4, IL-13 или IFNγ человека (CisBio) согласно протоколу анализа производителя. Полученные значения концентраций и действия для тестируемых соединений наносят на график, и концентрацию соединения, требуемую для 50% эффекта (IC50) определяют с применением четырехпараметрического логистического уравнения доза-ответ (E-WorkBook, ID Business Solutions Ltd.) и показывают в таблице 15.
Таблица 15
IC50 нМ
IC50 нМ
IC50 нМ
IC50 нМ
PDE4B является основной изоформой PDE4 в нейтрофилах и моноцитах, и вариант PDE4B2 является основным подтипом в этих клетках, связанных с воспалением. Интерферон гамма (IFNγ), интерлейкин 4 (IL4) и интерлейкин 13 (IL13) представляют собой цитокины, которые в основном продуцируются Т-клетками в дополнение к определенным популяциям клеток врожденного иммунитета. Продуцирование этих цитокинов связано с воспалительными кожными заболеваниями, такими как атопический дерматит, и с другими иммунными и воспалительными заболеваниями. Ингибирование высвобождения этих воспалительных цитокинов может модулировать воспалительную реакцию.
Следует понимать, что приведенное выше подробное описание и сопровождающие его примеры являются просто иллюстративными и не должны рассматриваться как ограничение объема изобретения, который определяется прилагаемой формулой изобретения. Различные изменения и модификации раскрытых вариантов осуществления будут очевидны специалистам в данной области техники. Такие изменения и модификации, включая, без ограничений, те, которые относятся к химическим структурам, заместителям, производным, промежуточным соединениям, синтезу, составам и/или способам применения изобретения, могут быть сделаны без отступления от его сущности и объема.
Анализ порошковой рентгеновской дифракцией для кристаллической (4-метокси-3-пропоксифенил)бороновой кислоты, 3-бром-5-(4-метокси-3-пропоксифенил)пиридина и 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина.
Анализ порошковой рентгеновской дифракцией проводят с применением дифрактометра Bruker AXS D8 Endeavor, оборудованного источником излучения Cu (K-α средний). Щель расходимости установлена на 15 мм непрерывное облучение. Дифрагированное излучение определяют датчиком PSD-Lynx Eye, где отверстие датчика PSD установлено на 2,99 градуса. Напряжение и силу тока рентгеновской трубки устанавливают на 40 кВ и 40 мА, соответственно. Данные собирают в угломере Тэта-Тэта при длине волны Cu от 3,0 до 40,0 градусов 2-Тэта с применением размера шага 0,01 градуса и времени шага 1 секунда. Антирассеивающий экран устанавливают на фиксированном расстоянии 1,5 мм. Образцы вращают со скоростью 15 вращений/мин во время сбора. Образцы получают размещением их в кремниевом малофоновом держателе для образцов и вращением во время сбора. Данные собирают с применением программы Bruker DIFFRAC Plus, и анализ проводят в программе EVA diffract plus.
Анализ проводят в программе EVA diffract plus (версия 4,2,1). Файл с данными ПРД не обрабатывают до выявления пика. С применением алгоритма поиска пика в программе EVA, пики, выбранные с пороговым значением 1, применяют для проведения предварительного определения пиков. Для обеспечения достоверности, корректировки проводят вручную; визуально проверяют вывод автоматических определений, и положения пиков доводят до максимума пика. Обычно выбирают пики с относительной интенсивностью ≥3%. Пики, которые не разрешены или соответствуют шуму, не выбирают. Типовая ошибка, связанная с положением пика кристаллического продукта из ПРД, указана в USP вплоть до +/-0,2° 2-Тета (USP-941).
Таблица 16
Список пиков ПРД для (4-метокси-3-пропоксифенил)бороновой кислоты.

Таблица 17
Список пиков ПРД для 3-бром-5-(4-метокси-3-пропоксифенил)пиридина.

Таблица 18
Список пиков ПРД для 3-(3-((трет-бутилдиметилсилил)окси)проп-1-ен-2-ил)-5-(4-метокси-3-пропоксифенил)пиридина
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ АМИНОХИНАЗОЛИНА В КАЧЕСТВЕ P2X3 ИНГИБИТОРОВ | 2020 |
|
RU2821714C2 |
| НОВОЕ ИЗОИНДОЛИНОВОЕ ПРОИЗВОДНОЕ, ВКЛЮЧАЮЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2728829C1 |
| НОВЫЕ СОЕДИНЕНИЯ ЗАМЕЩЕННОГО N-(3-ФТОРПРОПИЛ)ПИРРОЛИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2017 |
|
RU2742278C2 |
| N-((ГЕТ)АРИЛМЕТИЛ)-ГЕТЕРОАРИЛ-КАРБОКСАМИДНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ПЛАЗМЕННОГО КАЛЛИКРЕИНА | 2015 |
|
RU2707870C2 |
| ИНГИБИТОРНЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2673079C2 |
| ИНГИБИТОРЫ ТРАНСГЛУТАМИНАЗЫ 2 (TG2) | 2019 |
|
RU2781370C2 |
| ИНГИБИТОРЫ СЕРИН/ТРЕОНИН КИНАЗЫ ДЛЯ ЛЕЧЕНИЯ ГИПЕРПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2644947C2 |
| 6,7,8,9-ТЕТРАГИДРО-5H-ПИРИДО[2,3-D]АЗЕПИНОВЫЕ ЛИГАНДЫ ДОФАМИНОВЫХ РЕЦЕПТОРОВ D3 | 2017 |
|
RU2712455C1 |
| СОЕДИНЕНИЯ И СПОСОБЫ УСИЛЕНИЯ ДЕГРАДАЦИИ БЕЛКОВ-МИШЕНЕЙ И ДРУГИХ ПОЛИПЕПТИДОВ С ПОМОЩЬЮ E3 УБИКВИТИН ЛИГАЗЫ | 2013 |
|
RU2781452C2 |
| СОЕДИНЕНИЯ, КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ МОДУЛЯЦИИ CFTR | 2016 |
|
RU2752567C2 |

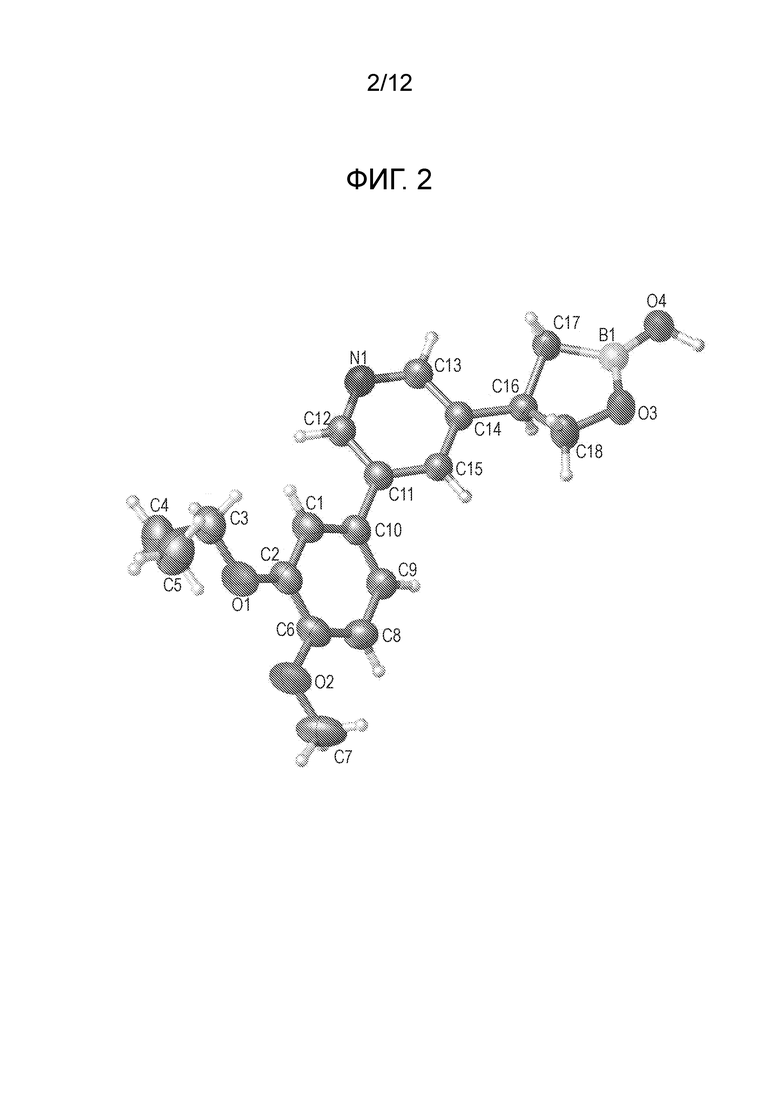








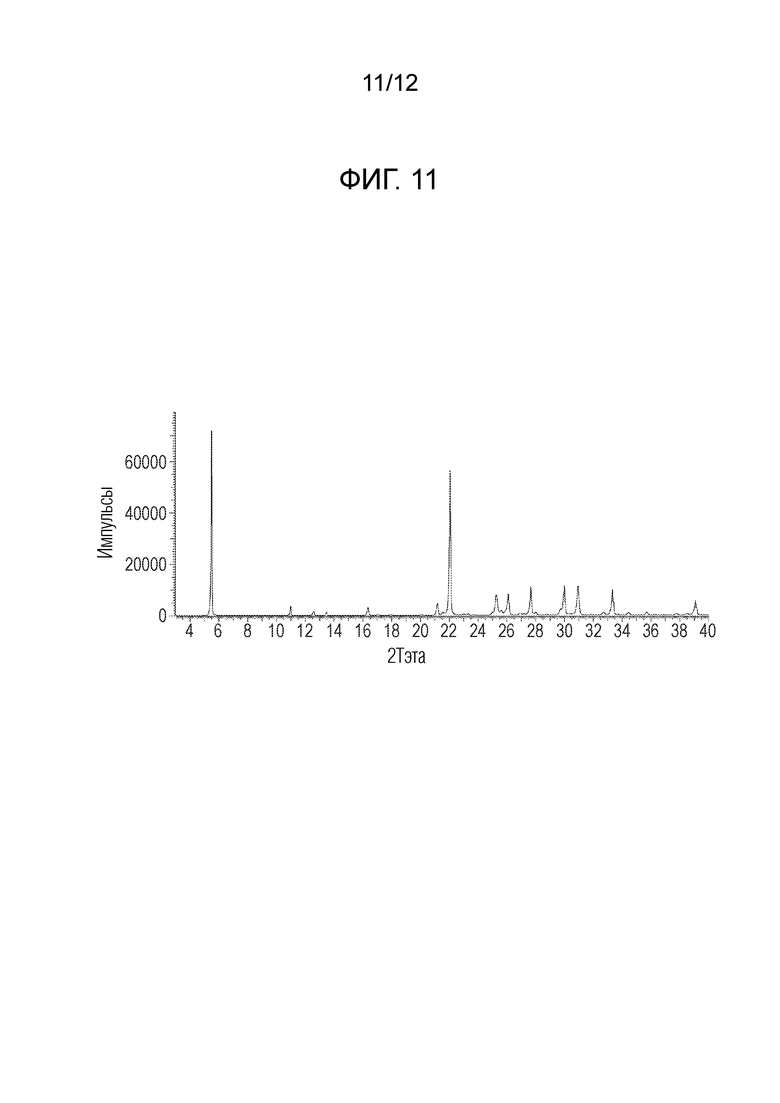

Настоящее изобретение относится к борсодержащему соединению формулы (IA) или формулы (IB) или его фармацевтически приемлемой соли. В формуле (IA) и формуле (IB): B является бором; A1 и A2 представляют собой независимо O или S; R1, R2 и R5 представляют собой каждый независимо H, дейтерий, (C1-C6)алкокси, (C1-C6)алкокси-d1-13, (C1-C6)алкил, (C1-C6)алкил-d1-13, циано, галоген или галоген(C1-C6)алкил; R3 и R4 представляют собой каждый независимо (C1-C6)алкил, (C1-C6)алкил-d1-13, (C3-C8)циклоалкил, гало(C1-C6)алкил или гидрокси(C1-C6)алкил; R6, R7 и R9 представляют собой каждый независимо H, дейтерий, (C1-C6)алкил, (C1-C6)алкил-d1-13 или галоген(C1-C6)алкил; p равно 0. Также предложены (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол или его фармацевтически приемлемая соль и (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол или его фармацевтически приемлемая соль и их кристаллические формы, фармацевтическая композиция и применение для получения лекарственного средства для лечения атопического дерматита у человека. Предложенные соединения ингибируют фосфодиэстеразу 4 (PDE4) и могут быть использованы для лечения состояний или расстройств, облегчаемых ингибированием PDE4. 9 н. и 11 з.п. ф-лы, 12 ил., 18 табл., 470 пр.


1. Соединение формулы (IA) или формулы (IB)

или его фармацевтически приемлемая соль, где
B является бором;
A1 и A2 представляют собой независимо O или S;
R1, R2 и R5 представляют собой каждый независимо H, дейтерий, (C1-C6)алкокси, (C1-C6)алкокси-d1-13, (C1-C6)алкил, (C1-C6)алкил-d1-13, циано, галоген или галоген(C1-C6)алкил;
R3 и R4 представляют собой каждый независимо (C1-C6)алкил, (C1-C6)алкил-d1-13, (C3-C8)циклоалкил, гало(C1-C6)алкил или гидрокси(C1-C6)алкил;
R6, R7 и R9 представляют собой каждый независимо H, дейтерий, (C1-C6)алкил, (C1-C6)алкил-d1-13 или галоген(C1-C6)алкил; и
p равно 0.
2. Соединение по п. 1, имеющее формулу (IA)
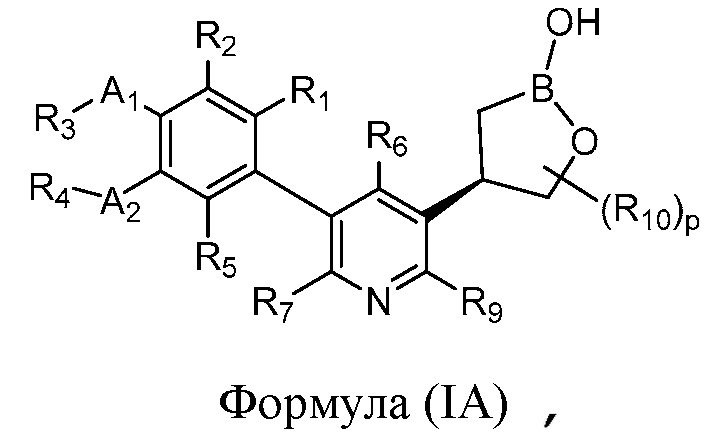
или его фармацевтически приемлемая соль.
3. Соединение по п. 2 или его фармацевтически приемлемая соль, где
A1 и A2 каждый независимо являются О;
R1, R2 и R5 каждый независимо являются H, циано, галогеном или гало(C1-C6)алкилом;
R3 и R4 независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; и
R6, R7 и R9 каждый независимо являются H, (C1-C6)алкилом или гало(C1-C6)алкилом.
4. Соединение по п. 2 или его фармацевтически приемлемая соль, где
A1 и A2 являются каждый независимо О;
R1, R2 и R5 являются каждый независимо Н;
R3 и R4 каждый независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; и
R6, R7 и R9 каждый независимо являются H или (C1-C6)алкилом.
5. Соединение по п. 2 или его фармацевтически приемлемая соль, где
A1 и A2 являются каждый независимо О;
R1, R2 и R5 являются каждый независимо Н;
R3 и R4 каждый независимо являются (C1-C3)алкилом; и
R6, R7 и R9 каждый независимо являются H или (C1-C3)алкилом.
6. Соединение по п. 1, имеющее формулу (IB)

или его фармацевтически приемлемая соль.
7. Соединение по п. 6 или его фармацевтически приемлемая соль, где
A1 и A2 являются каждый независимо О;
R1, R2 и R5 каждый независимо являются H, циано, галогеном или гало(C1-C6)алкилом;
R3 и R4 каждый независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом; и
R6, R7 и R9 каждый независимо являются H, (C1-C6)алкилом или гало(C1-C6)алкилом.
8. Соединение по п. 6 или его фармацевтически приемлемая соль, где
A1 и A2 являются каждый независимо О;
R1, R2 и R5 являются каждый независимо Н;
R3 и R4 каждый независимо являются (C1-C6)алкилом, (C3-C8)циклоалкилом, гало(C1-C6)алкилом или гидрокси(C1-C6)алкилом;
R6, R7 и R9 каждый независимо являются H или (C1-C3)алкилом.
9. Соединение по п. 6 или его фармацевтически приемлемая соль, где
A1 и A2 являются каждый независимо О;
R1, R2 и R5 являются каждый независимо Н;
R3 и R4 являются каждый независимо (C1-C3)алкилом; и
R6, R7 и R9 каждый независимо являются H или (C1-C3)алкилом.
10. (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол или его фармацевтически приемлемая соль.
11. Соединение структуры
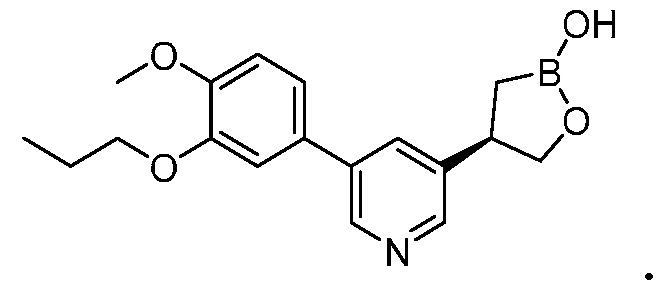
12. Кристаллическое соединение (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющее порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 11,0 ± 0,2, 22,9 ± 0,2 и 25,1 ± 0,2 градусов два тэта.
13. Кристаллическое соединение по п. 12, имеющее порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 11,0 ± 0,2, 11,4 ± 0,2, 18,8 ± 0,2, 22,9 ± 0,2, 25,1 ± 0,2 и 26,4 ± 0,2 градусов два тэта.
14. (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол или его фармацевтически приемлемая соль.
15. Соединение структуры

16. Кристаллическое соединение (S)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол, имеющее порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 18,7 ± 0,2, 22,8 ± 0,2 и 25,0 ± 0,2 градусов два тэта.
17. Кристаллическое соединение по п. 16, имеющее порошковую рентгеновскую дифрактограмму, содержащую пики дифракции 11,0 ± 0,2, 11,4 ± 0,2, 13,2 ± 0,2, 18,7 ± 0,2, 22,8 ± 0,2 и 25,0 ± 0,2, градусов два тэта.
18. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении фосфодиэстеразы 4 (PDE4), содержащая соединение по любому из пп. 11, 14 или 15 или его фармацевтически приемлемую соль, кристаллическое соединение по любому из пп. 12, 13, 16 или 17 и по меньшей мере один фармацевтически приемлемый эксципиент, разбавитель или носитель.
19. Применение соединения по любому из пп. 11, 14 или 15 или его фармацевтически приемлемой соли или кристаллического соединения по любому из пп. 12, 13, 16 или 17 для получения лекарственного средства для лечения атопического дерматита у человека.
20. Применение по п. 19, где соединением является (R)-4-(5-(4-метокси-3-пропоксифенил)пиридин-3-ил)-1,2-оксаборолан-2-ол или его фармацевтически приемлемая соль и где расстройством является атопический дерматит.
| US 20090291917 A1, 26.11.2009 | |||
| БОРСОДЕРЖАЩИЕ МАЛЫЕ МОЛЕКУЛЫ В КАЧЕСТВЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ АГЕНТОВ | 2009 |
|
RU2547441C2 |
| WO 2006089067 A2, 24.08.2006 | |||
| БОРСОДЕРЖАЩИЕ ДИАЦИЛГИДРАЗИНЫ | 2014 |
|
RU2637946C2 |
| BUTCHER TREVOR W | |||
| et al, Regioselective Copper-catalyzed Boracarboxylation of Vinyl Arenes, Organic letters, 16.12.2016, v.18, no.24, p | |||
| Способ и приспособление для вставки жеребеек в литейную форму | 1926 |
|
SU6428A1 |
Авторы
Даты
2023-04-10—Публикация
2019-10-01—Подача