ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В настоящей заявке заявлен приоритет по предварительной заявке на патент США с серийным номером 62/291480, поданной 4 февраля 2016 года, и по предварительной заявке на патент США с серийным номером 62/348102, поданной 9 июня 2016 года, каждая из которых включена в настоящий документ посредством ссылки в полном объеме для всех целей.
УРОВЕНЬ ТЕХНИКИ
Кардиотоксичность и застойная сердечная недостаточность представляют собой тяжелые побочные эффекты противораковой терапии, наиболее явно выраженные при лечении, включающем антрациклины, которые ежегодно вводят более чем одному миллиону онкологических пациентов и половине всех педиатрических онкологических пациентов. Неблагоприятные сердечные побочные эффекты наблюдают также у пациентов, проходящих лечение ингибиторами протеинкиназы и биологическими агентами на основе антител, направленными на протеинкиназу. Определение сокращение уровня сердечной недостаточности достигнуто посредством ограничения максимальных доз антрациклинов и посредством изменения схем их введения, что приводит к существенному ограничению терапевтического потенциала указанных противораковых агентов. Кардиотоксичность противораковых лекарств также может обусловливать противопоказание такого лечения у пациентов с уже существующими сердечными патологическими состояниями.
Антрациклины, в целом, представляют собой класс соединений, которые имеют структурное ядро антрацена. Зачастую они представляют собой высокоэффективные химиотерапевтические средства, и поэтому их используют для лечения многих типов рака, включая лейкозы, лимфомы, рак молочной железы, матки, яичников, мочевого пузыря и легких, и их часто используют в терапевтических схемах лечения рака у детей. Некоторые антрациклиновые лекарства включают доксорубицин, даунорубицин, идарубицин и эпирубицин. Несмотря на то, что точный механизм их действия еще не проверен, описано, что антрациклины функционируют посредством ингибирования синтеза ДНК и РНК; ускорения образования свободных радикалов посредством редокс-циклизации, с промотируемым железом превращением супероксида в гидроксильные радикалы; ингибирования топоизомераз (например, топоизомераз IIα и/или IIβ); и удаления гистонов из открытых хромосомных областей.
Распространенный побочный эффект от применения антрациклинов связан с кардиотоксичностью, которая зависит от дозы и также может возникать в результате кумулятивного воздействия. В некоторых случаях кардиотоксичность может возникать в результате образования токсичных реакционноспособных частиц кислорода посредством редокс-циклизации в процессе метаболизма антрациклинов, а также в результате образования двухцепочечных разрывов ДНК, вызванных ингибированием топоизомеразы II. Реакционноспособные частицы кислорода (ROS) могут активировать апоптозные пути, что приводит к гибели раковых, а также нормальных клеток. Кардиомиоциты могут быть чувствительными к окислительному стрессу. Сердечные митохондрии могут быть легко повреждены антрациклином и комплексами антрациклина-железа, которые обладают высокой аффинностью к дианионному фосфолипиду кардиолипину, который в высокой концентрации содержится во внутренней митохондриальной мембране.
Некоторые ингибиторы протеинкиназы, включая низкомолекулярные и биологические ингибиторы, также могут вызывать кардиотоксичность. Ингибиторы протеинкиназы представляют собой широкий класс соединений, которые ингибируют активность протеинкиназ и могут быть использованы при лечении рака. Тирозинкиназы регулируют различные клеточные функции, включая рост клеток (например, эпидермальный фактор роста («EGFR»), и их дисрегуляция может приводить к некоторым формам рака. Ингибирование таких тирозинпротеинкиназ может быть осуществлено с применением низкомолекулярных соединений, которые связываются с карманом АТФ данной протеинкиназы, предотвращая ее катализ фосфорилирования белков-мишеней. Низкомолекулярные соединения могут вызывать кардиотоксичность посредством: (1) селективного ингибирования киназ, которые также играют роль в сердечных клетках (например, побочные эффекты в мишени); (2) одинакового направленного воздействия на несколько киназ (например, воздействия на нецелевые киназы); и (3) ингибирования некиназных мишеней, которые играют роль в функции сердца; низкомолекулярные молекулы также могут вызывать кардитоксичность по другому механизму. Кардиотоксичность ингибитором TKI, таких как мезилат иматиниба (Gleevec®), нилотиниб (Tasigna®), сорафениб (Nexavar®), сунитиниб (Sutent®) и дазатиниб (Sprycel®), описана ранее (Chu et al., Lancet (2007) 370: 2011-2019; Xu et al., Hematol Rev. (2009) Marl; 1(1): e4; Kerketla et al., Nature Medicine (2006) 12: 908-916).
Активность протеинкиназ также можно ингибировать биологическими лекарствами, такими как моноклональные антитела против рецепторных протеинкиназ. Указанные терапевтические средства могут проявлять эффективность посредством предотвращения активации рецепторных протеинкиназ, и они, как правило, могут с высокой специфичностью связываться с антигенами клеточной поверхности. Некоторые моноклональные антитела направленно воздействуют на рецепторные протеинкиназы, которые играют важную роль в сердечной функции и, следовательно, могут в результате приводить к кардиотоксичности. Трастузумаб и бевацизумаб являются примерами моноклональных антител, которые могут вызывать кардитоксичность (например, сердечную недостаточность вследствие повреждения сердечной ткани, электрофизиологической дисфункции, митохондриальной токсичности, апоптоза или окислительного стресса). Химиотерапевтические соединения на основе ингибиторов протеасом (например, бортезомиб), как известно, также связаны с кардиотоксичностью и сердечной недостаточностью.
В настоящее время бисдиоксопиперазина дексразоксан (DEX) является единственным лекарством, одобренным для снижения частоты возникновения кардиотоксичности и сердечной недостаточности у онкологических пациентов, принимающих противораковые агенты. Несмотря на его клинический эффект, DEX одобрен лишь для лечения пациентов с метастатическим раком молочной железы, которые уже приняли суммарную дозу 300-500 мг/м2 антрациклинов типа доксорубицина или эпирубицина. DEX не одобрен для применения у детей и подростков, и особенную тревогу вызывают отчеты о высокой частоте сердечной недостаточности у детей младшего возраста, проходящих лечение антрациклинами, на протяжении дальнейшей жизни после лечения рака. Кроме того, ограниченное количество одобренных показаний и применений также является доказательством недостатков DEX, которые включают снижение противоопухолевой эффективности антрациклинов, включая вторичные злокачественные заболевания, а также инициацию гематологических расстройств и нарушений костного мозга.
С учетом тяжелого воздействия, которое многие противораковые терапии оказывают на функцию сердца, существует очевидная клиническая потребность в разработке эффективного лекарства, которое предотвращает, облегчает или исключает кардиотоксичность, вызванную антрациклинами, ингибиторами протеинкиназы (например, ингибиторами тирозинкиназы), ингибиторами протеасом и другими противораковыми средствами лечения. Особое значение имеет разработка лекарств, которые могут предупреждать или снижать кардиотоксичность, вызванную противораковыми лекарствами, без существенного снижения противоракового действия указанного противоракового лекарства. Также важна разработка кардиозащитных лекарств, которые не вызывают тяжелых побочных эффектов, таких как нейтропения, усугубление сердечных проблем или повышение риска вторичных злокачественных заболеваний. Такие потенциальные лекарства существенно улучшат существующую противораковую терапию, не только посредством защиты от возможных повреждений сердца у онкологических пациентов, но и посредством обеспечения возможности оптимизации доз химиотерапии для достижения максимального противоракового эффекта.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 изображен, в целом, способ снижения кардиотоксичности, вызванной лечением рака, у пациента посредством совместного введения противоракового лечения и защитного агента указанному пациенту.
На Фиг. 2 изображено, в целом, совместное введение противоракового лечения, дексразоксана (DEX) и защитного агента.
На Фиг. 3 изображен, в целом, эффект лечения с применением плацебо, доксорубицина (DOX), мирицетина или совместного введения доксорубицина и мирицетина на выживание клеток кардиомиоцитов из человеческих индуцированных полипотентциальных стволовых клеток (iPSC-CM) через 3 дня после лечения.
На Фиг. 4А-В изображено влияние доксорубицина (DOX) (4А) или совместного введения доксорубицина и мирицетина (4В) на митохондриальное здоровье кардиомиоцитов из человеческих индуцированных полипотенциальных стволовых клеток (iPSC-CM) через 2 дня после лечения.
На Фиг. 5 изображен эффект лечения с применением плацебо, доксорубицина или совместного введения доксорубицина и мирицетина на сократительную способность кардиомиоцитов из человеческих индуцированных полипотенциальных стволовых клеток (iPSC-CM) через 3 дня после лечения.
На Фиг. 6А-С изображена диаграмма, демонстрирующая исходные данные (6А) или нормализованные данные (6В), полученные в экспериментах, представленных на Фиг. 3, или исходных данных, полученных в экспериментах, представленных на Фиг. 5 (6С).
На Фиг. 7А-С представлен эффект мирицетина (7А), мирицитрина/мирицетрина (7В) или дигидромирицетина (7С) на индуцированный доксорубицином апоптоз при увеличивающихся концентрациях в кардиомиоцитах из человеческих индуцированных полипотенциальных стволовых клеток (iPSC-CM) через 3 дня после лечения.
На Фиг. 8 представлена диаграмма, иллюстрирующая защитный эффект мирицетина (MYR; 100 мкМ) на кардиотоксичность, вызванную доксорубицином (DOX), при повышающихся концентрациях доксорубицина, в течение 72 часов. Ось Y, процент выживания клеток; и ось X, повышающиеся концентрации DOX.
На Фиг. 9 представлена диаграмма, иллюстрирующая процент сохранения под действием повышающихся концентраций (ось X) мирицетина (MYR; круги) и дексразоксана (DEX; квадраты) кардиомиоцитов из человеческих индуцированных полипотенциальных стволовых клеток, обработанных 0,5 мкМ доксорубицина (DOX).
На Фиг. 10 изображен защитный эффект мирицетина против дисфункции сократительной способности кардиомиоцитов, вызванной доксорубицином (DOX), представленный по шкале количества ударов (в минуту; левая панель), продолжительности (в секундах; центральная панель) и высоты пиков (в произвольных единицах; правая панель), обработанных плацебо, DOX (0,5 мкМ), DOX плюс DEX (100 мкМ), или DOX плюс MYR (100 мкМ), через 48 часов после обработки.
На Фиг. 11 изображен эффект мирицетина (MYR) на DOX-индуцированный разрыв двойной спирали ДНК в кардиомиоцитах из человеческих iPSC, обработанных ДМСО, только DOX (0,5 мкМ), DOX плюс DEX (100 мкМ), или DOX плюс MYR (100 мкМ), измеренный через 48 часов после обработки, представленный в процентах γН2АХ-положительных клеток, количественно измеренных для каждого состояния (справа), а также иллюстративные фотографии клеток (слева).
На Фиг. 12 изображен эффект мирицетина (MYR) на индуцированный доксорубицином (DOX) разрыв саркомеров, представленный как иллюстративные фотографии образцов, обработанных плацебо (ДМСО; слева), только DOX (0,5 мкМ; в центре), или DOX плюс MYR (100 мкМ; справа).
На Фиг. 13 изображен эффект мирицетина (MYR) на ингибирование топоизомераз IIα и β (TOPOIIα и TOPOIIβ) по сравнению с эффектом дексразоксана (DEX).
На Фиг. 14 изображен эффект мирицетина (MYR) и дексразоксана (DEX) на разрушение белка TOPOIIβ, изображенный на графике (вверху) и иллюстративных фотографиях (внизу).
На Фиг. 15 изображен эффект мирицетина (MYR) и дигидромирицетина (DHM) на ферментативное ингибирование топоизомераз IIβ (TOPOIIβ) и их относительная эффективность, как показано в геле декантации (вверху) и на диаграмме (внизу).
На Фиг. 16 изображена диаграмма, иллюстрирующая относительную эффективность MYR и DHM для сохранения кардиомиоцитов от DOX-индуцированной гибели клеток.
На Фиг. 17 представлена диаграмма, иллюстрирующая относительную эффективность MYR и DHM для сохранения кардиомиоцитов от DOX-индуцированного разрыва двойной спирали.
На Фиг. 18 представлена диаграмма, иллюстрирующая эффект MYR на уровень экспрессии РНК TOPOIIα (справа) и TOPOIIβ (слева), как показано на кардиомиоцитах, обработанных только DOX или DOX плюс MYR.
На Фиг. 19 представлены две диаграммы, иллюстрирующие эффективность мирицетина (MYR) для защиты кардиомиоцитов от цитотоксичности, вызванной эпирубицином (EPI; слева) и идарубицином (IDA; справа).
На Фиг. 20 представлена диаграмма, иллюстрирующая эффект мирицетина (MYR) на гибель клеток, вызванную сунитинибом (SUN).
На Фиг. 21 представлена диаграмма, иллюстрирующая эффект мирицетина (MYR) на дисфункцию сократительной способности, вызванную сорафенибом (SOR).
На Фиг. 22 представлена диаграмма, иллюстрирующая эффект мирицетина (MYR) на гибель клеток, вызванную бортезомибом (BOR).
На Фиг. 23 представлена диаграмма, иллюстрирующая отсутствие влияния мирицетина (MYR) на противораковую активность DOX.
На Фиг. 24 показан эффект MYR на DOX-индуцированную дисфункцию сократительной способности у мышей, измеренный в процентах фракции укорочения (слева) и фракции изгнания (справа).
На Фиг. 25 представлен эффект DOX, DEX и различных защитных агентов на митохондриальную токсичность в кардиомиоцитах, полученных из человеческих индуцированных полипотенциальных стволовых клеток.
На Фиг. 26 представлен эффект DOX, DEX и различных защитных агентов на апоптоз в кардиомиоцитах, полученных из человеческих индуцированных полипотенциальных стволовых клеток.
На Фиг. 27A-D показан эффект лечения с применением плацебо (27A), DEX (27В), совместного введения доксорубицина и дексразоксана (27С) или совместного введения доксорубицина и витексина (27D) на митохондриальное здоровье кардиомиоцитов из человеческих индуцированных полипотенциальных стволовых клеток.
На Фиг. 28А-В представлен эффект DOX или совместного введения DOX с различными концентрациями витексина (VIT) на электрофизиологическую активность кардиомиоцитов из человеческих индуцированных полипотенциальных стволовых клеток в течение трехдневного периода (слева) или через 30 часов (справа)
На Фиг. 29А-В представлен эффект совместного введения доксорубицина с кемпферолом (KAE; слева) и витексином (VIT; справа) на жизнеспособность в клетках метастатического рака молочной железы MDA-MB-231.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В данном описании предложены композиции, наборы и способы защиты сердца, а также предупреждения сердечной недостаточности у пациентов, проходящих лечение антрациклинами, ингибиторами протеинкиназы и/или биологическими агентами. Посредством минимизации риска потенциально опасной сердечной недостаточности у онкологических пациентов, проходящих химиотерапию, может быть достигнута повышенная эффективность и безопасность традиционного лечения рака с применением изобретения, описанного в данном документе.
Указанные композиции содержат один или более защитных агентов с противораковым агентом или без него. Указанные наборы зачастую содержат один или более защитных агентов, и иногда содержат также противораковые агенты. Указанные способы включают способы снижения, предупреждения или исключения кардиотоксичности, вызванной лекарственной или другой терапией, включая средства лечения рака.
В некоторых аспектах данного описания предложена фармацевтическая композиция, содержащая защитный агент Формулы 1,
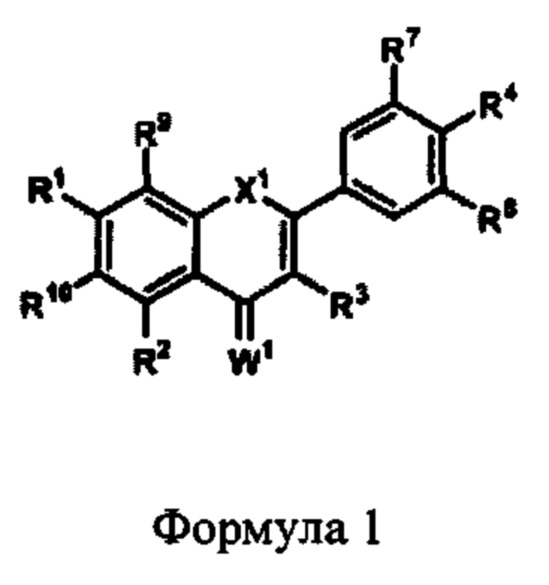
где:
X1 представляет собой CR5R6, NR5, О, S, С=О или C=S;
каждый из R1, R2, R3, R5, R6, R9 и R10 независимо представляет собой алкил, алкенил, алкинил, алкокси, ацил, ацилокси, карбоновую кислоту, сложный эфир, амин, амид, карбонат, карбамат, нитро, простой тиоэфир, сложный тиоэфир, циклоалкил, гетероалкил, гетероциклил, моносахарид, арил или гетероарил, любой из которых является замещенным или незамещенным, галоген, гидроксил, сульфгидрил, нитро, нитрозо, циано, азидо или Н;
R4, R7 и R8 представляют собой алкокси, гидроксил или Н;
W1 представляет собой О или S; или
его соль.
В некоторых аспектах X1 может представлять собой О или S; каждый из R1, R2, R3, R9 и R10 независимо может представлять собой алкокси, циклоалкил, галоген, гидроксил, сульфгидрил, нитро, нитрозо, циано, азидо или Н; и каждый из R4, R7 и R8 независимо может представлять собой алкокси, гидроксил или Н.
В некоторых аспектах X1 представляет собой О; каждый из R1, R2, R3, R9 и R10 независимо может представлять собой алкокси, циклоалкил, галоген, гидроксил, сульфгидрил, нитро, нитрозо, циано, азидо или Н; и каждый из R4, R7 и R8 независимо может представлять собой алкокси, гидроксил или Н.
В других аспектах X1 представляет собой О; каждый из R1 и R2 независимо может представлять собой гидроксил или Н; каждый из R3, R9 и R10 независимо может представлять собой циклоалкил, гетероциклил, гидроксил или Н; R4 представляет собой гидроксил; и каждый из R7 и R8 независимо может представлять собой гидроксил или Н.
В других аспектах X1 представляет собой О; R1 представляет собой гидроксил; каждый из R2 и R3 независимо может представлять собой гидроксил или Н; R9 и R10 представляют собой Н; R4 представляет собой гидроксил; и каждый из R7 и R8 независимо могут представлять собой гидроксил или Н.
В других аспектах X1 представляет собой О; R1 представляет собой гидроксил; каждый из R2 и R3 независимо может представлять собой гидроксил или Н; R9 может представлять собой гетероциклил или Н; R10 представляет собой Н; R4 независимо может представлять собой гидроксил или Н; и каждый из R7 и R8 независимо может представлять собой гидроксил или Н.
В других аспектах X1 представляет собой О; R1 представляет собой гидроксил; каждый из R2 и R9 независимо может представлять собой гидроксил или Н; R3 может представлять собой циклоалкил, гидроксил или Н; R10 представляет собой Н; R4 представляет собой гидроксил; и каждый из R7 и R8 независимо может представлять собой гидроксил или Н. В одном варианте реализации циклоалкил в R3 может представлять собой моносахарид.
В некоторых вариантах реализации указанная фармацевтическая композиция может содержать мирицетин и представляет собой соединение следующей формулы.
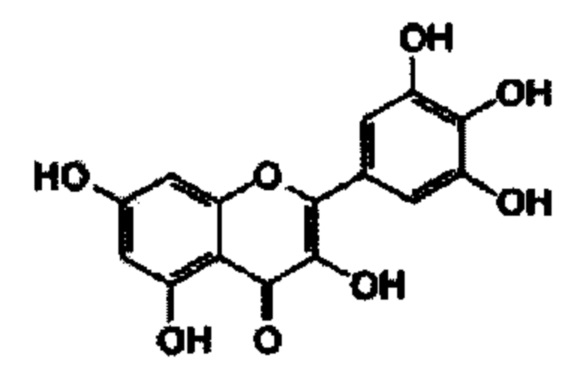
В некоторых вариантах реализации указанная фармацевтическая композиция может содержать мирицетрин/мирицитрин и представляет собой соединение следующей формулы.

В некоторых вариантах реализации указанная фармацевтическая композиция может содержать робинетин и представляет собой соединение следующей формулы.

В некоторых вариантах реализации указанная фармацевтическая композиция может содержать трицетин и представляет собой соединение следующей формулы.

В некоторых вариантах реализации указанная фармацевтическая композиция может содержать 7,3',4',5'-тетрагидроксифлавон и представляет собой соединение следующей формулы.

В некоторых вариантах реализации указанная фармацевтическая композиция содержит физетин. В некоторых вариантах реализации указанная фармацевтическая композиция содержит кверцетин. В некоторых вариантах реализации указанная фармацевтическая композиция содержит кемпферол. В некоторых вариантах реализации защитный агент в фармацевтической композиции может представлять собой соединение, имеющее следующую структуру:

В конкретном примере защитный агент в фармацевтической композиции может представлять собой витексин.
В некоторых вариантах реализации фармацевтическая композиция может содержать одно или более химиотерапевтических лекарств (противораковых агентов) или биологических агентов. В некоторых вариантах реализации фармацевтическая композиция может содержать химиотерапевтическое лекарство. В некоторых вариантах реализации фармацевтическая композиция может содержать одно или более химиотерапевтических лекарств (противораковых агентов) и один или более защитных агентов, выбранных из группы, состоящей из мирицетина, трицетина (5,7,3',4',5'-пентагидроксифлавон), робинетина, физетина, витексина, 7,3',4',5'-тетрагидроксифлавона и мирицетрина.
В некоторых вариантах реализации фармацевтическая композиция может содержать антрациклин или его соль. В некоторых вариантах реализации антрациклин может представлять собой даунорубицин, доксорубицин, эпирубицин, идарубицин, митоксантрон или валрубицин. В некоторых вариантах реализации антрациклин представляет собой доксорубицин. В некоторых вариантах реализации антрациклин представляет собой эпирубицин. В некоторых вариантах реализации антрациклин представляет собой идарубицин.
В некоторых вариантах реализации химиотерапевтическое лекарство может представлять собой ингибитор протеинкиназы. В некоторых вариантах реализации ингибитор протеинкиназы представляет собой афатиниб, акситиниб, бозутиниб, кабозантиниб, карфилзомиб, церитиниб, кобиметаниб, кризотиниб, дабрафениб, дазатиниб, эрлотиниб, эверолимус, гефитиниб, ибрутиниб, иматиниб, лапатиниб, ленватиниб, нилотиниб, нинтеданиб, осимертиниб, палбоциклиб, пазопаниб, пегаптаниб, понатиниб, регорафениб, руксолитиниб, сиролимус, сорафениб, сунитиниб, тофацитиниб, тофацитиниб, темсиролимус, траметиниб, вандетаниб, вемурафениб или висмодегиб.
В некоторых вариантах реализации химиотерапевтическое лекарство может представлять собой ингибитор протеасом. В конкретном примере ингибитор протеасом может представлять собой бортезомиб.
В некоторых вариантах реализации ингибитор протеинкиназы может представлять собой ингибитор тирозинкиназы. В некоторых вариантах реализации, например, ингибитор тирозинкиназы выбран из группы, состоящей из сорафениба, сунитиниба, босутиниба, гефитиниба, дазатиниба, дабрафениба, вемурафениба, иматиниба, лапатиниба мезилата и нилотиниба. В конкретном примере ингибитор тирозинкиназы представляет собой сорафениб. В другом конкретном примере ингибитор тирозинкиназы представляет собой сунитиниб.
В некоторых вариантах реализации химиотерапевтическое лекарство может представлять собой биологический агент. В некоторых вариантах реализации биологический агент представляет собой антитело. В некоторых вариантах реализации антитело может представлять собой адо-трастузумаб-эмтанзин, алемтузумаб, бевацизумаб, блинатумомаб, брентуксимаб ведотин, катумаксомаб, цетуксимаб, гемтузумаб озогамицин, ибритумомаб тиуксетан, ипилимумаб, нецитумомаб, ниволумаб, обинутузумаб, офатумумаб, панитумумаб, пембролизумаб, пертузумаб, рамуцирумаб, ритуксимаб, тоситумомаб-I131 или трастузумаб. В одном конкретном примере антитело представляет собой трастузумаб.
В некоторых вариантах реализации фармацевтическая композиция может быть жидкой композицией. В некоторых вариантах реализации фармацевтическая композиция может быть капсулой, гель-капсулой или липосомой. В некоторых вариантах реализации фармацевтическая композиция может быть таблеткой.
В некоторых вариантах реализации фармацевтическая композиция также может содержать дексразоксан в качестве дополнительного защитного агента.
В некоторых вариантах реализации фармацевтическая композиция может содержать по меньшей мере 1 мг одного или более защитных агентов. В некоторых вариантах реализации фармацевтическая композиция может содержать от 0,1 мг до 200 мг одного или более защитных агентов. В некоторых вариантах реализации фармацевтическая композиция может содержать от 0,1 мг до 300 мг одного или более защитных агентов.
В некоторых вариантах реализации присутствуют два защитных агента, и они вместе составлены в одну композицию. В некоторых вариантах реализации два защитных агента могут присутствовать в виде отдельных элементов фармацевтической композиции. В некоторых вариантах реализации фармацевтическая композиция может содержать химиотерапевтическое лекарство, и указанное химиотерапевтическое лекарство составлено в одну композицию с одним или двумя защитными агентами.
В некоторых аспектах данного описания предложена фармацевтическая композиция, содержащая (а) защитный агент, выбранный из группы, состоящей из: соединения Формулы 2,

где:
 представляет собой простую или двойную связь;
представляет собой простую или двойную связь;
X1 представляет собой CR5R6, NR5, О, S, С=0 или C=S;
каждый из R1, R2, R3, R5, R6, R9 и R10 независимо представляет собой алкил, алкенил, алкинил, алкокси, ацил, ацилокси, карбоновую кислоту, сложный эфир, амин, амид, карбонат, карбамат, нитро, простой тиоэфир, сложный тиоэфир, циклоалкил, гетероалкил, гетероциклил, арил или гетероарил, любой из который является замещенным или незамещенным, галоген, гидроксил, сульфгидрил, нитро, нитрозо, циано, азидо или Н; R4, R7 и R8 представляет собой гидроксил;
W1 представляет собой О или S;
или его соль; и
(b) химиотерапевтическое лекарство или биологический агент.
В некоторых вариантах реализации фармацевтическая композиция может содержать противораковый агент или химиотерапевтическое лекарство. В некоторых вариантах реализации защитный агент выбран из группы, состоящей из мирицетина, трицетина, робинетина, физетина, витексина, дигидроробинетина, 7,3',4',5'-тетрагидроксифлавона и мирицетрина.
В некоторых вариантах реализации фармацевтическая композиция может содержать один или более защитных агентов. В некоторых вариантах реализации фармацевтическая композиция может содержать мирицетин. В некоторых вариантах реализации фармацевтическая композиция может содержать мирицетрин. В некоторых вариантах реализации фармацевтическая композиция может содержать робинетин. В некоторых вариантах реализации фармацевтическая композиция может содержать дигидроробинетин. В некоторых вариантах реализации фармацевтическая композиция может содержать витексин. В некоторых вариантах реализации фармацевтическая композиция может содержать трицетин. В некоторых вариантах реализации указанная фармацевтическая композиция содержит кверцетин. В некоторых вариантах реализации указанная фармацевтическая композиция содержит кемпферол.
В некоторых вариантах реализации фармацевтическая композиция содержит антрациклин или его соль. В некоторых вариантах реализации антрациклин представляет собой даунорубицин, доксорубицин, эпирубицин, идарубицин, митоксантрон или валрубицин. В некоторых вариантах реализации антрациклин представляет собой доксорубицин. В некоторых вариантах реализации антрациклин представляет собой эпирубицин. В некоторых вариантах реализации антрациклин представляет собой идарубицин.
В некоторых вариантах реализации химиотерапевтическое лекарство может представлять собой ингибитор протеинкиназы. В некоторых вариантах реализации ингибитор протеинкиназы представляет собой афатиниб, акситиниб, бозутиниб, кабозантиниб, карфилзомиб, церитиниб, кобиметаниб, кризотиниб, дабрафениб, дазатиниб, эрлотиниб, эверолимус, гефитиниб, ибрутиниб, иматиниб, лапатиниб, ленватиниб, нилотиниб, нинтеданиб, осимертиниб, палбоциклиб, пазопаниб, пегаптаниб, понатиниб, регорафениб, руксолитиниб, сиролимус, сорафениб, сунитиниб, тофацитиниб, тофацитиниб, темсиролимус, траметиниб, вандетаниб, вемурафениб или висмодегиб.
В некоторых вариантах реализации химиотерапевтическое лекарство представляет собой ингибитор протеасом. В конкретном примере ингибитор протеасом представляет собой бортезомиб.
В некоторых вариантах реализации ингибитор протеинкиназы представляет собой ингибитор тирозинкиназы. В некоторых вариантах реализации ингибитор тирозинкиназы выбран из группы, состоящей из сорафениба, сунитиниба, босутиниба, гефитиниба, дазатиниба, дабрафениба, вемурафениба, иматиниба, лапатиниба мезилата и нилотиниба. В конкретном примере ингибитор тирозинкиназы представляет собой сорафениб. В другом конкретном примере ингибитор тирозинкиназы представляет собой сунитиниб.
В некоторых вариантах реализации химиотерапевтическое лекарство представляет собой биологический агент. В некоторых вариантах реализации биологический агент представляет собой антитело. В некоторых вариантах реализации антитело представляет собой адо-трастузумаб-эмтанзин, алемтузумаб, бевацизумаб, блинатумомаб, брентуксимаб ведотин, катумаксомаб, цетуксимаб, гемтузумаб озогамицин, ибритумомаб тиуксетан, ипилимумаб, нецитумомаб, ниволумаб, обинутузумаб, офатумумаб, панитумумаб, пембролизумаб, пертузумаб, рамуцирумаб, ритуксимаб, тоситумомаб-I131 или трастузумаб. В конкретном примере антитело представляет собой трастузумаб. В конкретном примере антитело представляет собой бевацизумаб.
В некоторых вариантах реализации фармацевтическая композиция может содержать по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290 или 300 мг одного или более защитных агентов.
В некоторых вариантах реализации фармацевтическая композиция может содержать от 0,1 мг до 50 мг защитного агента. В некоторых вариантах реализации фармацевтическая композиция может содержать от 1 мг до 10 мг защитного агента. В некоторых вариантах реализации фармацевтическая композиция может содержать от 1 мг до 20 мг защитного агента. В некоторых вариантах реализации фармацевтическая композиция может содержать от 1 мг до 30 мг защитного агента. В некоторых вариантах реализации фармацевтическая композиция может содержать от 1 мг до 40 мг защитного агента. В некоторых вариантах реализации фармацевтическая композиция может содержать от 1 мг до 50 мг защитного агента. В некоторых вариантах реализации фармацевтическая композиция может содержать от 1 мг до 100 мг защитного агента. В некоторых вариантах реализации фармацевтическая композиция может содержать от 1 мг до 200 мг защитного агента. В некоторых вариантах реализации фармацевтическая композиция может содержать от 40 мг до 300 мг защитного агента. В некоторых вариантах реализации фармацевтическая композиция может содержать от 50 мг до 400 мг защитного агента.
В некоторых вариантах реализации фармацевтическая композиция может содержать химиотерапевтическое лекарство; и указанное химиотерапевтическое лекарство и защитный агент смешаны в указанной фармацевтической композиции.
В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, причем доза химиотерапевтического лекарства составляет по меньшей мере 0,1 мг. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, причем доза химиотерапевтического лекарства составляет от 0,01 мг до 50 мг. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, причем доза химиотерапевтического лекарства составляет от 0,01 мг до 100 мг. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, причем доза химиотерапевтического лекарства составляет от 0,01 мг до 200 мг.
В некоторых вариантах реализации фармацевтическая композиция содержит биологический агент в дозе по меньшей мере 50 мг. В некоторых вариантах реализации фармацевтическая композиция содержит биологический агент в дозе от 0,1 мг до 100 мг. В некоторых вариантах реализации фармацевтическая композиция содержит биологический агент в дозе от 0,1 мг до 200 мг.
В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, и молярное отношение защитного агента к химиотерапевтическому лекарству составляет по меньшей мере 1:1. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, и молярное отношение защитного агента к химиотерапевтическому лекарству составляет по меньшей мере 2:1. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, и молярное отношение защитного агента к химиотерапевтическому лекарству составляет по меньшей мере 3:1. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, и молярное отношение защитного агента к химиотерапевтическому лекарству составляет по меньшей мере 4:1. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, и молярное отношение защитного агента к химиотерапевтическому лекарству составляет по меньшей мере 5:1. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, и молярное отношение защитного агента к химиотерапевтическому лекарству составляет по меньшей мере 6:1. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, и молярное отношение защитного агента к химиотерапевтическому лекарству составляет по меньшей мере 7:1. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, и молярное отношение защитного агента к химиотерапевтическому лекарству составляет по меньшей мере 8:1. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, и молярное отношение защитного агента к химиотерапевтическому лекарству составляет по меньшей мере 9:1. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, и молярное отношение защитного агента к химиотерапевтическому лекарству составляет по меньшей мере 10:1. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, и молярное отношение защитного агента к химиотерапевтическому лекарству составляет по меньшей мере 20:1. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, и при этом молярное отношение защитного агента к химиотерапевтическому лекарству составляет по меньшей мере 100:1. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, и при этом молярное отношение защитного агента к химиотерапевтическому лекарству составляет по меньшей мере 1:2. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, и при этом молярное отношение защитного агента к химиотерапевтическому лекарству составляет по меньшей мере 1:3. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, и при этом молярное отношение защитного агента к химиотерапевтическому лекарству составляет по меньшей мере 1:4. В некоторых вариантах реализации фармацевтическая композиция содержит химиотерапевтическое лекарство, и при этом молярное отношение защитного агента к химиотерапевтическому лекарству составляет по меньшей мере 1:5.
В данном описании предложены способ введения субъекту любой из фармацевтических композиций, описанных в данном документе. В некоторых аспектах данного описания предложен способ предупреждения, снижения или исключения кардиотоксичности или сердечной недостаточности в целом. В некоторых вариантах реализации данного описания предложен способ предупреждения, снижения или исключения кардиотоксичности, вызванной химиотерапевтическим лекарством или биологическим агентом, у субъекта, включающий: введение одного или более защитных агентов в соответствии с Формулой 1 субъекту, обеспечивая предупреждение, снижение или исключение кардиотоксичности, вызванной химиотерапевтическим лекарством или биологическим агентом, у субъекта. В некоторых случаях фармацевтическая композиция содержит соединение, выбранное из группы, состоящей из мирицетина, витексина, робинетина, трицетина, физетина, 7,3',4',5'-тетрагидроксифлавона и мирицитрина.
В некоторых вариантах реализации данного описания предложен способ предупреждения, снижения или исключения кардиотоксичности, вызванной химиотерапевтическим лекарством или биологическим агентом, у субъекта, включающий: введение по меньшей мере одного защитного агента Формулы 1 или Формулой 2 субъекту, обеспечивая предупреждение, снижение или исключение кардиотоксичности, вызванной химиотерапевтическим лекарством или биологическим агентом, у субъекта.
В некоторых вариантах реализации субъекту вводят химиотерапевтическое лекарство или биологический агент до введения субъекту одного или более защитных агентов в соответствии с Формулой 1 или 2.
В некоторых вариантах реализации субъекту вводят химиотерапевтическое лекарство или биологический агент после введения субъекту по меньшей мере двух защитных агентов Формулы 1 или 2.
В некоторых аспектах данного описания предложен способ лечения рака, включающий: (а) введение химиотерапевтического лекарства или биологического агента субъекту, причем указанный субъект страдает от рака, а химиотерапевтическое лекарство или биологический агент может вызывать кардиотоксичность у субъекта; и (b) введение субъекту по меньшей мере одного защитного агента Формулы 1 или Формулой 2, причем указанный защитный агент обеспечивает предупреждение, снижение или исключение кардиотоксичности у субъекта.
В некоторых вариантах реализации субъект представляет собой человека, страдающего от рака. В некоторых вариантах реализации рак представляет собой рак мочевого пузыря, рак кости, рак головного мозга, рак молочной железы, рак пищевода, желудочно-кишечный рак, лейкоз, рак печени, рак легких, лимфому, миелому, рак яичников, рак предстательной железы, саркому, рак желудка или рак щитовидной железы.
В некоторых вариантах реализации, перед введением защитного агента у субъекта имеет место патологическое сердечное состояние или анамнез патологического сердечного состояния. В некоторых вариантах реализации введение защитного агента обеспечивает снижение риска возникновения у субъекта кардиотоксичности, вызванной химиотерапевтическим лекарством или биологическим агентом. В некоторых вариантах реализации введение защитного агента обеспечивает снижение риска возникновения у субъекта кардиотоксичности, вызванной химиотерапевтическим лекарством или биологическим агентом, по меньшей мере на 30%,40%, 50%, 60%, 70%, 80%, 90% или 95%. В некоторых вариантах реализации кардиотоксичность может включать повреждение сердечной ткани, электрофизиологическую дисфункцию, митохондриальную токсичность, апоптоз или окислительный стресс. В некоторых вариантах реализации кардиотоксичность представляет собой повреждение сердечной ткани. В некоторых вариантах реализации кардиотоксичность представляет собой электрофизиологическую дисфункцию.
В некоторых вариантах реализации химиотерапевтическое лекарство, используемое в способах, описанных в данном документе, может содержать антрациклин или его соль. В некоторых вариантах реализации антрациклин представляет собой даунорубицин, доксорубицин, эпирубицин, идарубицин, митоксантрон или валрубицин. В некоторых вариантах реализации антрациклин представляет собой доксорубицин. В некоторых вариантах реализации антрациклин представляет собой эпирубицин. В некоторых вариантах реализации антрациклин представляет собой идарубицин.
В некоторых вариантах реализации химиотерапевтическое лекарство, используемое в способах, описанных в данном документе, представляет собой ингибитор протеинкиназы. В некоторых вариантах реализации ингибитор протеинкиназы представляет собой афатиниб, акситиниб, бозутиниб, кабозантиниб, карфилзомиб, церитиниб, кобиметаниб, кризотиниб, дабрафениб, дазатиниб, эрлотиниб, эверолимус, гефитиниб, ибрутиниб, иматиниб, лапатиниб, ленватиниб, нилотиниб, нинтеданиб, осимертиниб, палбоциклиб, пазопаниб, пегаптаниб, понатиниб, регорафениб, руксолитиниб, сиролимус, сорафениб, сунитиниб, тофацитиниб, тофацитиниб, темсиролимус, траметиниб, вандетаниб, вемурафениб или висмодегиб.
В некоторых вариантах реализации ингибитор протеинкиназы представляет собой ингибитор тирозинкиназы. В некоторых вариантах реализации ингибитор протеинкиназы представляет собой ингибитор тирозинкиназы. В некоторых вариантах реализации ингибитор тирозинкиназы выбран из группы, состоящей из сорафениба, сунитиниба, босутиниба, гефитиниба, дазатиниба, дабрафениба, вемурафениба, иматиниба, лапатиниба мезилата и нилотиниба. В конкретном примере ингибитор тирозинкиназы представляет собой сорафениб. В другом конкретном примере ингибитор тирозинкиназы представляет собой сунитиниб.
В некоторых аспектах химиотерапевтическое лекарство представляет собой ингибитор протеасом. В одном конкретном примере ингибитор протеасом представляет собой бортезомиб.
В некоторых вариантах реализации биологический агент, используемый в способах, описанных в данном документе, может представлять собой антитело. В некоторых вариантах реализации антитело представляет собой адо-трастузумаб-эмтанзин, алемтузумаб, бевацизумаб, блинатумомаб, брентуксимаб ведотин, катумаксомаб, цетуксимаб, гемтузумаб озогамицин, ибритумомаб тиуксетан, ипилимумаб, нецитумомаб, ниволумаб, обинутузумаб, офатумумаб, панитумумаб, пембролизумаб, пертузумаб, рамуцирумаб, ритуксимаб, тоситумомаб-I131 или трастузумаб. В одном конкретном примере антитело представляет собой трастузумаб.
В некоторых вариантах реализации субъект в соответствии со способами, описанными в данном документе, имеет сокращенный скорректированный интервал QTc после введения защитного агента. В некоторых случаях защитный агент выбран из группы, состоящей из мирицетина, витексина, робинетина, трицетина, физетина, 7,3',4',5'-тетрагидроксифлавона и мирицитрина. В одном конкретном примере защитный агент представляет собой мирицетин.
В некоторых вариантах реализации химиотерапевтическое лекарство и защитный агент Формулы 1 или Формулы 2 вводят субъекту одновременно. В некоторых вариантах реализации химиотерапевтическое лекарство и защитный агент вводят субъекту последовательно. В некоторых вариантах реализации защитный агент вводят субъекту до введения химиотерапевтического лекарства. В некоторых вариантах реализации защитный агент вводят субъекту после введения химиотерапевтического лекарства.
В некоторых вариантах реализации можно вводить по меньшей мере два защитных агента Формулы 1 или Формулы 2. Например, по меньшей мере два защитных агента могут быть выбраны из группы, состоящей из мирицетина, витексина, робинетина, трицетина, физетина, 7,3',4',5'-тетрагидроксифлавона, дигидроробинетина и мирицитрина.
В некоторых вариантах реализации один или более защитных агентов могут дополнительно содержать дексразоксан.
В данном описании предложен способ лечения или предупреждения повреждения органа у субъекта, включающий: введение одного или более защитных агентов, выбранных из группы, состоящей из мирицетина, витексина, робинетина, трицетина, физетина, 7,3',4',5'-тетрагидроксифлавона и мирицитрина, субъекту с повреждением органа, обеспечивая лечение или предупреждение повреждения органа у субъекта.
В данном описании предложены также наборы. В некоторых аспектах данного описания предложен набор, содержащий: (а) защитный агент, выбранный из группы, состоящей из мирицетина, витексина, робинетина, трицетина, физетина, 7,3',4',5'-тетрагидроксифлавона и мирицитрина; и (b) химиотерапевтическое лекарство или биологический агент.
В некоторых аспектах данного описания предложен набор, содержащий: (а) защитный агент, выбранный из группы, состоящей из мирицетина, витексина, робинетина, трицетина, физетина, 7,3',4',5'-тетрагидроксифлавона и мирицитрина; b) химиотерапевтическое лекарство или биологический агент; и (с) дексразоксан. В некоторых вариантах реализации защитный агент представляет собой мирицетин.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Некоторые противораковые лекарства (например, антрациклиновые лекарства, ингибиторы протеинкиназы) и другие терапевтические средства могут вызывать у пациентов кардиотоксичность. Например, вызванная антрациклином кардиотоксичность возникает, если лекарство, такое как доксорубицин, встраивается в ДНК при расщеплении ДНК под действием ферментов топоизомеразы II, тем самым эффективно предотвращая повторное лигирование расщепленных спиралей под действием TOPOIIα или β.
В данном описании предложены фармацевтические композиции и способы, которые могут обеспечивать предупреждение, снижение или исключение такой кардиотоксичности, а также могут обеспечивать предупреждение, снижение или исключение повреждение органа, вызванное повреждением сердечной ткани, электрофизиологической дисфункцией, митохондриальной токсичностью, апоптозом или окислительным стрессом. Многие из указанных композиций и способов, предложенных в данном документе, относятся к введению определенного защитного агента в сочетании с одним или более средствами лечения рака, что снижает риск того, что противораковое лечение может вызывать или усугублять кардитоксические события у пациента. Защитные агенты, описанные в данном документе, включают мирицетин, витексин, робинетин, трицетин, физетин, 7,3',4',5'-тетрагидроксифлавон, дигидроробинетин, мирицитрин и/или их производные или соли. В некоторых случаях защитные агенты могут представлять собой флавоноиды. В некоторых случаях защитный агент можно вводить в комбинации с другим защитным агентом. В некоторых случаях защитный агент можно вводить в комбинациях, таких как комбинации, содержащие дексразоксан и другой защитный агент.
Данное изобретение может обеспечивать возможность получения онкологическими пациентами, включая пациентов со здоровым сердцем и пациентов с уже существующими патологическими состояниями сердца, требуемой дозы лекарственного средства (например, антрациклина или его соли) без существенного изменения схемы лечения вследствие риска кардиотоксичности. Другое преимущество данного изобретения заключается в том, что оно может обеспечивать возможность использования данной терапии в более широкой популяции пациентов, таких как определенные пациенты с уже существующими патологическими состояниями сердца или с возрастными ограничениями. Кроме того, снижение или предупреждение кардиотоксичности может обеспечивать исключение приема онкологическим пациентом лекарственного средства для лечения сердечного патологического состояния. В целом, преимущества, представленные в данном документе, могут способствовать более благоприятному терапевтическому исходу для пациентов.
Фармацевтические композиции и способы (включая способы применения), предложенные в данном документе, относятся, в целом, к снижению, исключению или предупреждению кардиотоксичности, вызванной химиотерапевтическими лекарствами, биологическими агентами или лучевой терапией; их также можно использовать для снижения или исключения повреждения органа, вызванного электрофизиологической дисфункцией, митохондриальной токсичностью, апоптозом или окислительным стрессом. На Фиг. 1 приведено общее схематическое изображение некоторых вариантов реализации способов, предложенных в данном документе. На верхней панели представлено противораковое лечение [110], например, химиотерапевтическое лекарство, биологический агент или лучевая терапия, которую применяют в отношении пациента, [120], у которого развивается кардиотоксичность, а затем постепенно, с течением времени вводят сниженные дозы противоракового лечения [130]. Таким образом, кардиотоксичность, связанная с введением противоракового лечения [110] в отсутствие защитного агента [140] может ограничивать группу пациентов, пригодных для приема такого лечения. На нижней панели противораковое лечение [110] вводят совместно с защитным агентом [140], таким как мирицетин, витексин, робинетин, трицетин, физетин, 7,3',4',5'-тетрагидроксифлавон, дигидроробинетин и мирицитрин, пациенту, например, [151], который испытывает сниженную кардиотоксичность или полное отсутствие кардиотоксичности [160], в результате чего указанный пациент может переносить такую схему лечения. Несмотря на то, что изображены отдельные носители для противоракового лечения и защитного агента, в некоторых случаях противораковое лечение и защитный агент составлены вместе в одну композицию. Совместное введение противоракового лечения [ПО] с защитным агентом [140] может обеспечивать увеличение популяции пациентов, [150] принимающих противораковое лечение, включая здоровых пациентов и пациентов с уже существующими патологическими состояниями сердца [152, 153].
На Фиг. 2 также приведено общее схематическое изображение вариантов реализации, предложенных в данном документе. На верхней панели представлено противораковое лечение[210] (например, химиотерапевтическое лекарство, биологический агент или лучевая терапия) и дексразоксан, [220] которые совместно вводят пациенту, [230] который позже, через какое-то время испытывает некоторую кардиотоксичность [240]. Совместное введение противоракового лечения [210] и декстразоксана [220] в отсутствие защитного агента [250] может ограничивать популяцию пациентов, пригодных для приема такого лечения. На нижней панели противораковое лечение [210], дексразоксан [220] и защитный агент [250] (такой как мирицетин, витексин, робинетин, трицетин, физетин, 7,3',4',5'-тетрагидроксифлавон, дигидроробинетин и мирицитрин) вводят пациенту [261], который испытывает сниженную кардиотоксичность или полное отсутствие кардиотоксичности [270]. В данном варианте реализации совместное введение защитного агента [250] с противораковым лечением [210] и дексразоксаном [220] может усиливать активность дексразоксана для предупреждения, облегчения или исключения кардиотоксичности у пациента [261], что обеспечивает возможность увеличения популяции пациентов [260], принимающих такое лечение, включая пациентов без сердечных патологий и пациентов с уже существующими сердечными патологическими состояниями [262, 263]. В некоторых случаях защитный агент, дексразоксан и/или противораковое лечение вводят по отдельности; в некоторых случаях их вводят одновременно или в виде совместных лекарственных форм. В целом, совместные лекарственные формы и способы, предложенные в данном документе, могут обеспечивать снижение у пациентов кардиотоксичности, вызванной химиотерапевтическими лекарствами, биологическими агентами или лучевой терапией.
Композиции, предложенные в данном документе, могут включать совместную лекарственную форму двух или более защитных агентов. Например, совместная лекарственная форма может содержать мирицетин, витексин, робинетин, трицетин, физетин, 7,3',4',5'-тетрагидроксифлавон, дигидроробинетин, мирицитрин и дексразоксан. В некоторых случаях композиции могут включать совместную лекарственную форму защитного агента (например, такого как мирицетин, витексина робинетин, трицетин, физетин, 7,3',4',5'-тетрагидроксифлавон, дигидроробинетин и мирицитрин) с определенным противораковым лечением (например, химиотерапевтическим лекарством или биологическим агентом). В некоторых случаях в данном документе предложены наборы, которые содержат по меньшей мере два защитных агента (или защитный агент и противораковое лечение) в виде отдельных компонентов, зачастую вместе с инструкциями по применению.
СПОСОБЫ
В данном документе предложены способы введения пациенту, в частности, онкологическому пациенту, фармацевтической композиции, которая может обеспечивать снижение, исключение или предупреждение кардиотоксичности, вызванной противораковым лечением (например, химиотерапевтическими лекарствами, биологическими агентами или лучевой терапией). Способы, предложенные в данном документе, также включают лечение рака у пациента с применением по меньшей мере одной из композиций, предложенных в данном документе. В некоторых случаях пациент может иметь здоровое сердце; в некоторых случаях пациент имеет риск сердечного патологического состояния.
Способы, предложенные в данном документе, в целом, включают введение пациенту фармацевтической композиции, содержащей по меньшей мере один защитный агент, описанный в данном документе, или по меньшей мере один защитный агент и противораковое лечение (например, антрациклиновое лекарство, ингибитор протеинкиназы, биологический агент или лучевую терапию). Защитный агент и противораковое лечение также можно комбинировать с другим кардиозащитным агентом (например, дексразоксаном). В некоторых случаях защитный агент и противораковое лечение можно составлять в одну композицию в том смысле, что их можно смешивать с пределах одной фармацевтической композиции (например, таблетки, капсулы, липосомы, жидкости или пара); в некоторых случаях они существуют в виде отдельных элементов.
Субъекты
Способы и композиции, описанные в данном документе, используют, в целом, для предупреждения, снижения, лечения или исключения у субъекта кардиотоксичности, вызванной противораковым лечением. Субъект может представлять собой любого пациента-человека, в частности, онкологического пациента, пациента с риском возникновения рака или пациента с семейным или собственным анамнезом рака. В некоторых случаях пациент находится на определенной стадии лечения рака. Например, фармацевтическую композицию, описанную в данном документе, можно вводить пациенту-человеку на ранней или поздней стадии рака для снижения кардиотоксичности, вызванной противораковым лечением.
Онкологические пациенты могут страдать от рака любого типа. Примеры рака могут включать, но не ограничиваются ими, рак надпочечников, анальный рак, базально-клеточную карциному, рак желчных протоков, рак мочевого пузыря, рак крови, рак кости, опухоль головного мозга, рак молочной железы, рак бронхов, рак сердечно-сосудистой системы, рак шейки матки, рак толстой кишки, рак толстой и прямой кишок, рак пищеварительной системы, рак эндокринной системы, эндометриальный рак, рак пищевода, рак глаза, рак желчного пузыря, желудочно-кишечную опухоль, рак почки, гематопоэтическое злокачественное заболевание, рак гортани, лейкоз, рак печени, рак легких, лимфому, меланому, мезотелиому, рак мышечной системы, миелодиспластический синдром (MDS), миелому, рак носовой полости, рак носоглотки, рак нервной системы, рак лимфатической системы, рак ротовой полости, рак ротоглотки, остеосаркому, саркому Капоши, рак шейки матки, рак поджелудочной железы, пенильный рак, опухоли гипофиза, рак предстательной железы, ректальный рак, рак почечной лоханки, рак репродуктивной системы, рак дыхательной системы, саркому, рак слюнной железы, рак костной системы, рак кожи, рак тонкого кишечника, рак желудка, рак яичек, рак горла, рак тимуса, рак щитовидной железы, опухоль, рак мочевой системы, рак матки, вагинальный рак или рак вульвы. Термин «лимфома» может относиться к любому типу лимфомы, включая В-клеточную лимфому (например, В-крупноклеточную лимфому, фолликулярную лимфому, мелкоклеточную лимфоцитарную лимфому, мантийноклеточную лимфому, В-клеточную лимфому маргинальной зоны, лимфому Беркитта, лимфоплазмацитарную лимфому, лейкоз ворсистых клеток или первичную лимфому центральной нервной системы) или Т-клеточную лимфому (например, Т-лимфобластную лимфому из клеток-предшественниц или периферическую Т-клеточную лимфому). Термин «лейкоз» может относиться к любому типу лейкоза, включая острый лейкоз или хронический лейкоз. Типы лейкоза включают острый миелоидный лейкоз, хронический миелоидный лейкоз, острый лимфоцитарный лейкоз, острый недифференцированный лейкоз или хронический лимфоцитарный лейкоз. В некоторых случаях онкологический пациент не имеет какого-либо определенного типа рака. Например, в некоторых случаях пациент может страдать от рака, который не является раком молочной железы.
Примеры рака включают раковые заболевания, которые вызывают солидные опухоли, а также раковые заболевания, которые не вызывают образование солидных опухолей. Кроме того, любое из раковых заболеваний, упомянутых в данном документе, может представлять собой первичный рак (например, рак, получивший название по части тела, где он начал расти впервые) или вторичный или метастатический рак (например, рак, происходящий из другой части тела).
Пациент с риском рака может иметь риск вследствие определенного патологического состояния, такого как предраковое состояние. Предраковые состояния включают, но не ограничиваются ими, актинический кератоз, пищевод Барретта, атрофический гастрит, протоковую карциному in situ, врожденный дискератоз, сидеропеническую дисфагию, плоский лишай, подслизистый фиброз полости рта, солнечный эластоз, цервикальную дисплазию, лейкоплакию и эритроплакию. В некоторых случаях пациент может иметь риск рака вследствие клеточной или тканевой дисплазии (например, патологического изменения количества клеток, патологического изменения формы клеток, патологического изменения размера клеток или патологического изменения пигментации клеток).
Пациент с риском рака может быть пациентом, подверженным действию карцерогена. Такие пациенты включают пациентов, подверженных воздействию известных или вероятных канцерогенов (например, ацетилальдегида, асбеста или табачных продуктов), или пациентов, подверженных воздействию ионизирующего излучения (например, гамма-излучения, бета-излучения, рентгеновского излучения или ультрафиолетового излучения). В некоторых случаях пациент с риском рака имеет риск вследствие семейного анамнеза рака.
Способы и композиции, описанные в данном документе, также можно использовать для предупреждения, снижения или исключения кардиотоксичности у пациентов с анамнезом рака, в частности, у пациентов, которым вводили противораковое лечение (например, антрациклиновые лекарства, ингибиторы протеинкиназы, ингибиторы протеасом или биологические агенты) с кардиотоксическим эффектом. Примеры пациентов с анамнезом рака включают, но не ограничиваются ими, пациентов в состоянии ремиссии, пациентов в состоянии полной ремиссии, пациентов с повторным раком или пациентов с рецидивирующим раком.
Способы и композиции, описанные в данном документе, в целом, используют у пациентов, которым вводили или вводят в настоящее время агент, вызывающий кардиотоксичность (например, противораковое лечение). Неограничивающие примеры агентов, вызывающих кардиотоксичность, описаны в любом месте данного документа и могут включать противораковое лечение, химиотерапевтические лекарства, антрациклины (например, доксорубицин, эпирубицин и идарубицин), ингибиторы протеинкиназы (например, ингибиторы тирозинкиназы), биологические агенты (например, трастузумаб) или лучевую терапию, а также любое противораковое лечение, которое иным образом известно как вызывающее кардиотоксичность. В некоторых примерах фармацевтическую композицию, описанную в данном документе, вводят онкологическому пациенту, ранее проходившему противораковое лечение, которое обладает известным кардиотоксическим эффектом, для снижения риска кардиотоксичности, связанной с текущей схемой лечения рака у пациента. В некоторых случаях фармацевтическую композицию вводят онкологическому пациенту для снижения или смещения кумулятивного действия предшествующего воздействия противоракового лечения или лекарств, или других агентов, вызывающих кардиотоксичность. В некоторых примерах фармацевтическую совместную композицию, содержащую мирицетин и антрациклин, можно вводить пациенту с раком предстательной железы, который также страдает от дилатационной кардиомиопатии, вызванной предшествующим противораковым лечением. В другом примере фармацевтическую совместную композицию, содержащую витексин, можно вводить пациенту с раком легких, который в настоящее время проходит лечение с антрациклином. В другом примере фармацевтическую совместную композицию, содержащую робинетин, можно вводить пациенту с раком молочной железы. В другом примере фармацевтическую совместную композицию, содержащую трицетин, можно вводить онкологическому пациенту с саркомой Капоши. В другом примере фармацевтическую совместную композицию, содержащую физетин, можно вводить пациенту с раком молочной железы. В другом примере фармацевтическую композицию, содержащую 7,3',4',5'-тетрагидроксифлавон, можно вводить пациенту с раком молочной железы. В другом примере фармацевтическую совместную композицию, содержащую мирицитрин, можно вводить пациенту с раком молочной железы. В другом примере фармацевтическую совместную композицию, содержащую мирицетин и антрациклин, можно вводить пациенту с раком печени, который также страдает от дилатационной кардиомиопатии, вызванной предшествующим противораковым лечением. В другом примере фармацевтическую совместную композицию, содержащую мирицетин и доксорубицин, можно вводить онкологическому пациенту с саркомой.
В некоторых случаях способы и композиции, описанные в данном документе, можно использовать для облегчения кардиотоксичности, которая вызвана не противораковым лечением. Следовательно, пациент может страдать или иметь риск возникновения кардиотоксичности, вызванной лекарством, которое не является специальным лекарством от рака, таким как ингибитор протеинкиназы. Такие пациенты могут иметь такое состояние, как неврологическое или сердечное расстройство. В некоторых случаях указанное состояние может представлять собой состояние, которое можно лечить ингибитором протеинкиназы.
В некоторых случаях пациент может страдать от повреждения органа или иметь риск повреждения органа. Например, пациент может страдать от повреждения органа (или иметь риск повреждения органа) в результате повреждения сердечной ткани, электрофизиологической дисфункции, митохондриальной дисфункции, апоптоза или окислительного стресса. Для таких пациентов способы и композиции, предложенные в данном документе, могут обеспечивать снижение или исключение повреждения органа, вызванного повреждением сердечной ткани, электрофизиологической дисфункцией, митохондриальной токсичностью, апоптозом или окислительным стрессом.
В некоторых случаях пациенты, которые проходят лечение любым из способов или композиций, описанных в данном документе, может страдать от болезни сердца или иметь семейный анамнез болезни сердца. Примеры сердечных заболеваний включают, но не ограничиваются ими, аритмогенную кардиомиопатию, артериальное заболевание, синдром Бругада, застойную сердечную недостаточность, дилатационную кардиомиопатию, учащенное сердцебиение, болезнь сердечного клапана, гипертензивную болезнь сердца, гипертрофическую кардиомиопатию, синдром удлиненного QT, ревматическую болезнь сердца или сосудистое заболевание. В некоторых случаях болезнь сердца вызвана кардиотоксическим агентом (например, антрациклином). Например, болезнь сердца может быть вызвана любым из кардиотоксических агентов, упомянутых в данном документе. В одном конкретном примере фармацевтическую совместную композицию, содержащую мирицетин и доксорубицин, можно вводить пациенту с раком молочной железы, который также страдает от гипертрофической кардиомиопатии. В другом примере совместную композицию одного или более соединений, выбранных из группы, состоящей из мирицетина, витексина, робинетина, трицетина, физетина, 7,3',4',5'-тетрагидроксифлавона, дигидроробинетина и мирицитрина, можно вводить онкологическому пациенту, испытывающему кардиотоксичность вследствие ранее введенного химиотерапевтического лекарства.
Пациент, которого лечат способами или композициями, описанными в данном документе, может быть любого возраста и может быть взрослым, младенцем или ребенком. В некоторых случаях возраст пациента составляет 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99 лет, или в диапазоне между указанными значениями (например, от 2 до 20 лет, от 20 до 40 лет или от 40 до 90 лет). Конкретный класс пациентов, которые могут испытывать улучшение, представляет собой пациентов в возрасте старше 40 лет. Другой конкретный класс пациентов, которые могут испытывать улучшение, представляет собой педиатрических пациентов, у которых может быть пожизненная угроза хронических сердечных симптомов. Кроме того, пациенты, которые проходят лечение любым из способов или композиций, описанных в данном документе, могут быть мужчинами или женщинами.
Любые композиции, описанные в данном документе, также можно вводить субъекту, отличному от человека, такому как лабораторное или сельскохозяйственное животное. Неограничивающие примеры субъектов, отличных от человека, включают собак, коз, морских свинок, хомяков, мышей, свиней, низших приматов (например, горилла, обезьяна, орангутанг, лемур или бабуин), крыс, овец, коров или данио.
Введение лекарства
В описании, представленном в данном документе, предложены способы предупреждения, снижения или исключения у пациентов кардиотоксичности, вызванной лечением рака, посредством введения пациенту одного или более защитных агентов Формулы 1, Формулы 2 или их производного или соли. В данном документе описаны также способы предупреждения, снижения или исключения у пациентов кардиотоксичности, связанной с лечением рака, посредством введения пациенту одного или более защитных агентов, выбранных из группы, состоящей из мирицетина, витексина, робинетина, трицетина, физетина, 7,3',4',5'-тетрагидроксифлавона, дигидроробинетина и мирицитрина (или их производного или соли). В описании, представленном в данном документе, предложены также способы введения субъекту, причем указанный субъект страдает от рака, а противораковое лечение может вызывать кардиотоксичность и повреждение органа у данного субъекта, а также введения одного или более защитных агентов (или их производного или соли), выбранных из группы, состоящей измирицетина, витексина, робинетина, трицетина, физетина, 7,3',4',5'-тетрагидроксифлавона, дигидроробинетина и мирицитрина, причем указанный защитный агент обеспечивает предупреждение, снижение или исключение кардиотоксичности у субъекта.
Способы, описанные в данном документе, могут дополнительно включать введение пациенту комбинации дексразоксана (или его производного или соли) и защитного агента Формулы 1, Формулой 2 или его производного или соли; и указанные комбинированные агенты можно вводить в виде совместной композиции или по отдельности. В некоторых аспектах указанные способы включают введение пациенту комбинации дексразоксана (или его производного или соли) и мирицетрина (или его производного или соли); указанные комбинированные агенты можно вводить в виде совместной композиции или по отдельности.
Способы, описанные в данном документе, могут дополнительно включать введение пациенту комбинированных агентов, содержащих комбинацию дексразоксана (или его производного или соли) и защитного агента, выбранного из группы, состоящей из мирицетина, витексина, робинетина, трицетина, физетина, 7,3',4,'5'-тетрагидроксифлавона, дигидроробинетина и мирицитрина. (или их производного или соли); указанные комбинированные агенты можно вводить в виде совместной композиции или по отдельности.
Указанные защитные агенты можно вводить субъекту или пациенту в любой комбинации соединения Формулы 1 или Формулы 2. В некоторых случаях субъекту или пациенту вводят только один защитный агент (например, мирицетин или его производное или соль). В некоторых случаях субъекту или пациенту вводят только один защитный агент (например, мирицитрин или его производное или соль). В некоторых случаях субъекту или пациенту вводят только один защитный агент (например, витексин или его производное или соль). В некоторых случаях субъекту или пациенту вводят только один защитный агент (например, робинетин или его производное или соль). В некоторых случаях субъекту или пациенту вводят только один защитный агент (например, трицетин или его производное или соль). В некоторых случаях субъекту или пациенту вводят только один защитный агент (например, 7,3',4',5'-тетрагидроксифлавон или его производное или соль). В конкретном примере субъекту или пациенту, описанному в данном документе, можно вводить терапевтически эффективную дозу мирицетина (или его производного или соли). В другом примере субъекту или пациенту, описанному в данном документе, можно вводить терапевтически эффективную дозу робинетина (или его производного или соли). В другом примере субъекту или пациенту, описанному в настоящем документе, можно вводить терапевтически эффективную дозу витексина (или его производного или соли).
В некоторых случаях субъекту вводят два защитных агента (или их производные или соли), выбранных из группы, состоящей из мирицетина, витексина, робинетина, трицетина, физетина, 7,3',4',5'-тетрагидроксифлавона, дигидроробинетина, мирицитрина и дексразоксана. В тех случаях, в которых пациенту вводят два или более защитных агентов, защитные агенты можно вводить в виде отдельных элементов или в совместной композиции. Например, пациенту, испытывающему кардиотоксичность, можно вводить терапевтически эффективную совместную композицию мирицетина и робинетина; мирицетина и дексразоксана; или другую совместную композицию, описанную в данном документе. Два или более защитных агентов можно вводить одновременно или последовательно. В некоторых случаях два или более защитных агентов можно вводить последовательно в определенном порядке. Например, пациенту можно сначала вводить мирицетин, а затем вводить дексразоксан, или можно сначала вводить дексразоксан, а затем мирицетин.
В некоторых случаях пациенту можно вводить противораковый агент (например, химиотерапевтическое лекарство, биологический агент, ингибитор протеинкиназы, лучевую терапию) (или другое лечение) и один или более защитных агентов Формулы 1 или Формулы 2 (например, мирицетин, витексин, робинетин, трицетин, физетин, 7,3',4',5'-тетрагидроксифлавон, дигидроробинетин и мирицитрин). В тех случаях, когда пациенту вводят противораковое лечение (или другое лечение) и по меньшей мере два защитных агента, противораковое лечение (или другое лечение) и по меньшей мере два защитных агента (или их производные или соли) можно вводить в виде совместных композиций в любой комбинации. Например, пациенту можно вводить совместную композицию защитного агента и химиотерапевтического лекарства или совместную композицию, содержащую одно или более химиотерапевтических лекарств и по меньшей мере два защитных агента.
В некоторых случаях пациенту или субъекту можно вводить один или более защитных агентов (или их производные или соли) и одно или более противораковых средств (или других средств) одновременно. Например, указанный способ может включать введение пациенту защитного агента и химиотерапии в качестве отдельных элементов, но одновременно.
В некоторых случаях пациенту или субъекту можно вводить один или более защитных агентов Формулы 1 или Формулы 2 (или их производные или соли) и одно или более противораковых средств (или других средств) последовательно. Например, защитный агент можно вводить до введения противоракового лечения (или другого лечения). Например, онкологическому пациенту можно вводить терапевтически эффективную дозу мирицетина для предотвращения кардиотоксичности, а затем вводить химиотерапевтическое лекарство (например, доксорубицин). В другом примере онкологическому пациенту можно вводить терапевтически эффективную дозу мирицитрина для предупреждения кардиотоксичности, а затем вводить химиотерапевтическое лекарство (например, доксорубицин). В другом примере онкологическому пациенту можно вводить терапевтически эффективную дозу витексина для предупреждения кардиотоксичности, а затем вводить химиотерапевтическое лекарство (например, доксорубицин). В другом примере онкологическому пациенту можно вводить терапевтически эффективную дозу робинетина для предупреждения кардиотоксичности, а затем вводить химиотерапевтическое лекарство (например, доксорубицин). В другом примере онкологическому пациенту можно вводить терапевтически эффективную дозу трицетина для предупреждения кардиотоксичности, а затем вводить химиотерапевтическое лекарство (например, доксорубицин). В других примерах противораковое лечение (или другое лечение) вводят пациенту или субъекту до введения защитного агента(-ов) Формулы 1 или Формулы 2. В некоторых случаях пациенту вводят один или более защитных агентов до приема противоракового лечения (или другого лечения), а затем вводят один или более защитных агентов после противоракового лечения.
В случае последовательного введения может иметь место период отсрочки между введением одного или более защитных агентов и одного или более противораковых средств (или других средств). Например, защитный агент можно вводить за несколько минут, часов, дней или недель до введения противоракового лечения или другого лечения (например, за по меньшей мере 5 минут, по меньшей мере 10 минут, по меньшей мере 30 минут, по меньшей мере 1 час, по меньшей мере 2 часа, по меньшей мере 3 часа, по меньшей мере 4 часа, по меньшей мере 5 часов, по меньшей мере 6 часов, по меньшей мере 7 часов, по меньшей мере 8 часов, по меньшей мере 9 часов, по меньшей мере 10 часов, по меньшей мере 1 день, по меньшей мере 2 дня, по меньшей мере 3 дня, по меньшей мере 5 дней, по меньшей мере 1 неделю, по меньшей мере 2 недели, по меньшей мере 3 недели, по меньшей мере 4 недели, по меньшей мере 2 месяца, не более 2 месяцев, не более 1 месяца, не более 3 недель, не более 2 недель, не более 1 недели, не более 6 дней, не более 5 дней, не более 4 дней, не более 3 дней, не более 2 дней, не более 1 дня, не более 12 часов, не более 6 часов, не более 4 часов, не более 3 часов, не более 2 часов или не более 1 часа до введения противоракового лечения). В некоторых случаях защитный агент вводят пациенту по меньшей мере за 1 день до противоракового лечения. В некоторых случаях защитный агент вводят не более чем за 1 день до противоракового лечения. В некоторых случаях защитный агент не более чем через 2 часа после противоракового лечения. В некоторых случаях защитный агент не более чем через 4 часа после противоракового лечения. В некоторых случаях защитный агент не более чем через 6 часов после противоракового лечения. В некоторых случаях защитный агент не более чем через 12 часов после противоракового лечения. В некоторых случаях защитный агент не более чем через 1 день после противоракового лечения. В некоторых случаях защитный агент не более чем через 2 дня после противоракового лечения. В некоторых случаях защитный агент не более чем через 3 дня после противоракового лечения. В некоторых случаях защитный агент не более чем через 4 дня после противоракового лечения. В некоторых случаях защитный агент не более чем через 5 дней после противоракового лечения.
Соединения по данному описанию (например, защитные агенты Формулы 1) можно вводить пациенту каждый раз, когда пациенту вводят дозу противоракового агента по схеме лечения, описанной в данном документе. Например, защитный агент можно вводить пациенту в течение 24 часов каждый раз до запланированного введения пациенту дозы противоракового агента. В некоторых вариантах реализации защитный агент можно вводить пациенту в пределах 48 часов каждый раз до запланированного введения пациенту дозы противоракового агента. В некоторых случаях защитный агент можно вводить пациенту параллельно, каждый раз когда пациенту вводят дозу противоракового агента. В некоторых случаях защитный агент можно вводить пациенту каждый раз, когда пациенту вводят дозу противоракового агента, в течение по меньшей мере 24 часов после противоракового лечения.
Соединения по данному описанию можно вводить любым приемлемым способом введения агентов, имеющих аналогичное применение, например, кожным, пероральным, местным, интрадермальным, интратекальным, внутривенным, подкожным, внутримышечным, внутрисуставным, интраспинальным или спинальным, назальным, эпидуральным, ректальным, вагинальным или трансдермальным/трансмукозальным способом. Наиболее подходящий способ зависит от природы и тяжести патологического состояния, подлежащего лечению. Подкожные, интрадермальные и чрескожные инъекции можно использовать в качестве способов введения соединений по данному описанию. Способом введения соединений по данному описанию может быть сублингвальное введение. Способом введения соединений по данному описанию может быть внутривенное введение. В конкретном примере фармацевтическую композицию, предложенную в данном документе, можно вводить пациенту перорально. В другом конкретном примере фармацевтическую композицию, содержащую защитный агент, предложенный в данном документе, можно вводить пациенту внутривенно (например, посредством инъекции или инфузии). В другом конкретном примере фармацевтическую композицию, содержащую защитный агент, предложенный в данном документе, можно вводить пациенту внутримышечно. В конкретном примере фармацевтическую композицию, содержащую защитный агент, предложенный в данном документе, можно вводить пациенту назально.
Фармацевтическая композиция (например, для перорального введения или для инъекции, инфузии, подкожной доставки, внутримышечной доставки, интраперитонеальной доставки, сублингвальной доставки или другого способа) может быть в форме жидкости. Жидкая фармацевтическая композиция может содержать, например, одно или более из следующих: стерильный разбавитель, такой как вода, солевой раствор, предпочтительно физиологический солевой раствор, раствор Рингера, изотонический раствор хлорида натрия, нелетучие масла, которые могут служить в качестве растворителя или суспендирующей среды, полиэтиленгликоли, глицерин, пропиленгликоль или другие растворители; антибактериальные агенты; антиоксид анты; хелатообразующие агенты; буферы и агенты для регулирования тоничности, такие как хлорид натрия или декстроза. Парентеральная композиция может быть заключена в ампулы, одноразовые шприцы или многодозовые флаконы из стекла или пластика. Применение физиологического солевого раствора является предпочтительным, и фармацевтическая композиция для инъекций предпочтительно является стерильной. В другом варианте реализации, для лечения офтальмологического состояния или заболевания в глаза можно вводить жидкую фармацевтическую композицию в форме глазных капель. Жидкую фармацевтическую композицию можно доставлять перорально.
Для пероральных лекарственных форм по меньшей мере одно из соединений или агентов, описанных в данном документе, можно использовать отдельно или в комбинации с подходящими добавками для получения таблеток, порошков, гранул или капсул, и при необходимости с разбавителями, буферными агентами, увлажнителями, консервантами, окрашивающими агентами и ароматизаторами. Указанные соединения можно составлять в композицию с буферным агентом для обеспечения защиты соединения от низкого рН в желудочной среде, и/или с энтеросолюбильным покрытием. Соединение, включенное в фармацевтическую композицию, можно составлять для пероральной доставки с ароматизирующим агентом, например, в жидкой, твердой или полутвердой лекарственной форме и/или с энтеросолюбильным покрытием. В некоторых случаях соединения по данному описанию можно солюбилизировать и инкапсулировать (например, в липосому или биоразлагаемый полимер) или использовать в форме микрокристаллов, покрытых подходящим нетоксичным липидом. В некоторых случаях соединения по данному описанию можно солюбилизировать и инкапсулировать в липосому, мицеллу или оба варианта.
Фармацевтическая композиция, содержащая любое из соединений или агентов, описанных в данном документе, можно составлять для устойчивого или медленного высвобождения (также называемого высвобождением по времени или контролируемым высвобождением). Такие композиции можно получать, в целом, с применением общеизвестных технологий и вводить, например, пероральной, ректальной, интрадермальной или подкожной имплантацией, или посредством имплантации в требуемой области-мишени. Лекарственные формы с устойчивым высвобождением могут содержать соединение, диспергированное в матрице носителя, и/или содержащееся в резервуаре, окруженном мембраной для контролирования скорости. Вспомогательные вещества для применения в таких лекарственных формах являются биосовместимыми, и они также могут быть биоразлагаемыми; предпочтительно, такая лекарственная форма обеспечивает относительно постоянный уровень высвобождения активного компонента. Неограничивающие примеры вспомогательных веществ включают воду, спирт, глицерин, хитозан, альгинат, хондроитин, витамин Е, минеральное масло и диметилсульфоксид (ДМСО). Количество соединения, содержащегося в лекарственной форме с устойчивым высвобождением, зависит от места имплантации, скорости и предполагаемой продолжительности высвобождения, а также от природы патологического состояния, заболевания или расстройства, подлежащего лечению или предупреждению.
В описании, представленном в данном документе, предложены также способы предупреждения, снижения или исключения повреждения органа у субъекта посредством введения пациенту одного или более защитных агентов Формулы 1 или Формулы 2. Защитный агент Формулы 1 или Формулы 2 для предупреждения, снижения или исключения повреждения органа у субъекта может включать, без ограничения, мирицетин, витексин, робинетин, трицетин, физетин, 7,3',4',5'-тетрагидроксифлавон, дигидроробинетин или мирицитрин (или их производное или соль). В частности, повреждение органа может быть вызвано повреждением сердечной ткани, электрофизиологической дисфункцией, митохондриальной токсичностью, апоптозом или окислительным стрессом, приводящим к сердечной недостаточности. Например, фармацевтическую композицию содержащую соединение Формулы 1 (т.е. защитный агент), можно вводить пациенту, испытывающему сердечную недостаточность, вызванную лечением рака, при этом обеспечивают предупреждение сердечной недостаточности в будущем посредством введения указанной фармацевтической композиции.
Фармацевтические способы и композиции, описанные в данном документе, обеспечивают предупреждение, снижение или исключение кардиотоксичности, связанной с лечением рака, у пациента. Соответственно, способы и композиции, предложенные в данном документе, обеспечивают возможность приема пациентом (например, пациентом со здоровым сердцем, пациентом с сердечным заболеванием) более высокой дозы терапии без существенного изменения схемы лечения вследствие риска кардиотоксичности. В некоторых случаях введение фармацевтической композиции по данному документу пациенту может включать введение пациенту суточной дозы более 0,1 мг/м2, 1 мг/м2, 2 мг/м2, 3 мг/м2, 4 мг/м2, 5 мг/м2, 6 мг/м2, 7 мг/м2, 8 мг/м2, 9 мг/м2, 10 мг/м2, 11 мг/м2, 12 мг/м2, 13 мг/м2, 14 мг/м2, 15 мг/м2, 16 мг/м2, 17 мг/м2, 18 мг/м2, 19 мг/м2, 20 мг/м2, 21 мг/м2, 22 мг/м2, 23 мг/м2, 24 мг/м2, 25 мг/м2, 26 мг/м2, 27 мг/м2, 28 мг/м2, 29 мг/м2, 30 мг/м2, 31 мг/м2, 32 мг/м2, 33 мг/м2, 34 мг/м2, 35 мг/м2, 36 мг/м2, 37 мг/м2, 38 мг/м2, 39 мг/м2, 40 мг/м2, 41 мг/м2, 42 мг/м2, 43 мг/м2, 44 мг/м2, 45 мг/м2, 46 мг/м2, 47 мг/м2, 48 мг/м2, 49 мг/м2, 50 мг/м2, 100 мг/м2, 150 мг/м2, 200 мг/м2, 300 мг/м2, 350 мг/м2, 400 мг/м2, 450 мг/м2, 500 мг/м2, 750 мг/м2, 1000 мг/м2, 1250 мг/м2, 1500 мг/м2, 1750 мг/м2 или 2000 мг/м2 химиотерапевтического лекарства (например, антрациклина, доксорубицина или его производного или соли).
В некоторых случаях введение пациенту фармацевтической композиции по данному документу может включать введение пациенту суточной дозы около 0,1 мг/м2, 0,2 мг/м2, 0,3 мг/м2, 0,4 мг/м2, 0,5 мг/м2, 0,6 мг/м2, 0,7 мг/м2, 0,8 мг/м2, 0,9 мг/м2, 1 мг/м2, 1,1 мг/м2, 1,2 мг/м2, 1,3 мг/м2, 1,4 мг/м2, 1,5 мг/м2, 1,6 мг/м2, 1,7 мг/м2, 1,8 мг/м2, 1,9 мг/м2, 2 мг/м2, 2,1 мг/м2, 2,2 мг/м2, 2,3 мг/м2, 2,4 мг/м2, 2,5 мг/м2, 2,6 мг/м2, 2,7 мг/м2, 2,8 мг/м2, 2,9 мг/м2, 3 мг/м2, 3,1 мг/м2, 3,2 мг/м2, 3,3 мг/м2, 3,4 мг/м2, 3,5 мг/м2, 3,6 мг/м2, 3,7 мг/м2, 3,8 мг/м2, 3,9 мг/м2, 4 мг/м2, 4,1 мг/м2, 4,2 мг/м2, 4,3 мг/м2, 4,4 мг/м2, 4,5 мг/м2, 4,6 мг/м2, 4,7 мг/м2, 4,8 мг/м2, 4,9 мг/м2, 5 мг/м2, 5,1 мг/м2, 5,2 мг/м2, 5,3 мг/м2, 5,4 мг/м2, 5,5 мг/м2, 5,6 мг/м2, 5,7 мг/м2, 5,8 мг/м2, 5,9 мг/м2, 6 мг/м2, 6,1 мг/м2, 6,2 мг/м2, 6,3 мг/м2, 6,4 мг/м2, 6,5 мг/м2, 6,6 мг/м2, 6,7 мг/м2, 6,8 мг/м2, 6,9 мг/м2, 7 мг/м2, 7,1 мг/м2, 7,2 мг/м2, 7,3 мг/м2, 7,4 мг/м2, 7,5 мг/м2, 7,6 мг/м2, 7,7 мг/м2, 7,8 мг/м2, 7,9 мг/м2, 8 мг/м2, 8,1 мг/м2, 8,2 мг/м2, 8,3 мг/м2, 8,4 мг/м2, 8,5 мг/м2, 8,6 мг/м2, 8,7 мг/м2, 8,8 мг/м2, 8,9 мг/м2, 9 мг/м2, 9,1 мг/м2, 9,2 мг/м2, 9,3 мг/м2, 9,4 мг/м2, 9,5 мг/м2, 9,6 мг/м2, 9,7 мг/м2, 9,8 мг/м2, 9,9 мг/м2, 10 мг/м2, 11 мг/м2, 12 мг/м2, 13 мг/м2, 14 мг/м2, 15 мг/м2, 16 мг/м2, 17 мг/м2, 18 мг/м2, 19 мг/м2, 20 мг/м2, 21 мг/м2, 22 мг/м2, 23 мг/м2, 24 мг/м2, 25 мг/м2, 26 мг/м2, 27 мг/м2, 28 мг/м2, 29 мг/м2, 30 мг/м2, 31 мг/м2, 32 мг/м2, 33 мг/м2, 34 мг/м2, 35 мг/м2, 36 мг/м2, 37 мг/м2, 38 мг/м2, 39 мг/м2, 40 мг/м2, 41 мг/м2, 42 мг/м2, 43 мг/м2, 44 мг/м2, 45 мг/м2, 46 мг/м2, 47 мг/м2, 48 мг/м2, 49 мг/м2, 50 мг/м2, 51 мг/м2, 52 мг/м2, 53 мг/м2, 54 мг/м2, 55 мг/м2, 56 мг/м2, 57 мг/м2, 58 мг/м2, 59 мг/м2, 60 мг/м2, 61 мг/м2, 62 мг/м2, 63 мг/м2, 64 мг/м2, 65 мг/м2, 66 мг/м2, 67 мг/м2, 68 мг/м2, 69 мг/м2, 70 мг/м2, 71 мг/м2, 72 мг/м2, 73 мг/м2, 74 мг/м2, 75 мг/м2, 76 мг/м2, 77 мг/м2, 78 мг/м2, 79 мг/м2, 80 мг/м2, 81 мг/м2, 82 мг/м2, 83 мг/м2, 84 мг/м2, 85 мг/м2, 86 мг/м2, 87 мг/м2, 88 мг/м2, 89 мг/м2, 90 мг/м2, 91 мг/м2, 92 мг/м2, 93 мг/м2, 94 мг/м2, 95 мг/м2, 96 мг/м2, 97 мг/м2, 98 мг/м2, 99 мг/м2 или 100 мг/м2 биологического агента.
В некоторых вариантах реализации введение пациенту фармацевтической композиции по данному документу может включать введение пациену суточной дозы около 0,1 мг/м2, 1 мг/м2, 2 мг/м2, 3 мг/м2, 4 мг/м2, 5 мг/м2, 6 мг/м2, 7 мг/м2, 8 мг/м2, 9 мг/м2, 10 мг/м2, 11 мг/м2, 12 мг/м2, 13 мг/м2, 14 мг/м2, 15 мг/м2, 16 мг/м2, 17 мг/м2, 18 мг/м2, 19 мг/м2, 20 мг/м2, 21 мг/м2, 22 мг/м2, 23 мг/м2, 24 мг/м2, 25 мг/м2, 26 мг/м2, 27 мг/м2, 28 мг/м2, 29 мг/м2, 30 мг/м2, 31 мг/м2, 32 мг/м2, 33 мг/м2, 34 мг/м2, 35 мг/м2, 36 мг/м2, 37 мг/м2, 38 мг/м2, 39 мг/м2, 40 мг/м2, 41 мг/м2, 42 мг/м2, 43 мг/м2, 44 мг/м2, 45 мг/м2, 46 мг/м2, 47 мг/м2, 48 мг/м2, 49 мг/м2, 50 мг/м2, 51 мг/м2, 52 мг/м2, 53 мг/м2, 54 мг/м2, 55 мг/м2, 56 мг/м2, 57 мг/м2, 58 мг/м2, 59 мг/м2, 60 мг/м2, 61 мг/м2, 62 мг/м2, 63 мг/м2, 64 мг/м2, 65 мг/м2, 66 мг/м2, 67 мг/м2, 68 мг/м2, 69 мг/м2, 70 мг/м2, 71 мг/м2, 72 мг/м2, 73 мг/м2, 74 мг/м2, 75 мг/м2, 76 мг/м2, 77 мг/м2, 78 мг/м2, 79 мг/м2, 80 мг/м2, 81 мг/м2, 82 мг/м2, 83 мг/м2, 84 мг/м2, 85 мг/м2, 86 мг/м2, 87 мг/м2, 88 мг/м2, 89 мг/м2, 90 мг/м2, 90 мг/м2, 95 мг/м2, 100 мг/м2, 110 мг/м2, 120 мг/м2, 130 мг/м2, 140 мг/м2, 150 мг/м2, 160 мг/м2, 170 мг/м2, 180 мг/м2, 190 мг/м2, 200 мг/м2, 300 мг/м2, 400 мг/м2, 500 мг/м2 защитного агента Формулы 1 или Формулы 2 (например, мирицетина, витексина, робинетина, трицетина, физетина, 7,3',4',5'-тетрагидроксифлавона, дигидроробинетина, мирицитрина и/или их производного или соли).
Суточная фиксированная доза защитного агента, описанного в данном документе, или совокупная доза комбинации защитных агентов может составлять более 0,1 мг, 1 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг, 20 мг, 21 мг, 22 мг, 23 мг, 24 мг, 25 мг, 26 мг, 27 мг, 28 мг, 29 мг, 30 мг, 31 мг, 32 мг, 33 мг, 34 мг, 35 мг, 36 мг, 37 мг, 38 мг, 39 мг, 40 мг, 41 мг, 42 мг, 43 мг, 44 мг, 45 мг, 46 мг, 47 мг, 48 мг, 49 мг, 50 мг, 100 мг, 150 мг, 200 мг, 300 мг, 350 мг, 400 мг, 450 мг, 500 мг, 750 мг или более защитного агента (или любого его производного или соли). В некоторых случаях защитный агент или агенты выбраны из группы, состоящей из мирицетина, витексина, робинетина, трицетина, физетина, 7,3',4',5'-тетрагидроксифлавона, дигидроробинетина, мирицитрина и/или их производного или соли. В конкретном примере введение фармацевтической композиции пациенту может включать введение совместной композиции химиотерапевтического лекарства (например, доксорубицина) с по меньшей мере 10 мг мирицетина. В некоторых случаях введение пациенту фармацевтической композиции по данному документу может включать введение пациенту суточной дозы 0,1 мг, 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 0,6 мг, 0,7 мг, 0,8 мг, 0,9 мг, 1 мг, 1,1 мг, 1,2 мг, 1,3 мг, 1,4 мг, 1,5 мг, 1,6 мг, 1,7 мг, 1,8 мг, 1,9 мг, 2 мг, 2,1 мг, 2,2 мг, 2,3 мг, 2,4 мг, 2,5 мг, 2,6 мг, 2,7 мг, 2,8 мг, 2,9 мг, 3 мг, 3,1 мг, 3,2 мг, 3,3 мг, 3,4 мг, 3,5 мг, 3,6 мг, 3,7 мг, 3,8 мг, 3,9 мг, 4 мг, 4,1 мг, 4,2 мг, 4,3 мг, 4,4 мг, 4,5 мг, 4,6 мг, 4,7 мг, 4,8 мг, 4,9 мг, 5 мг, 5,1 мг, 5,2 мг, 5,3 мг, 5,4 мг, 5,5 мг, 5,6 мг, 5,7 мг, 5,8 мг, 5,9 мг, 6 мг, 6,1 мг, 6,2 мг, 6,3 мг, 6,4 мг, 6,5 мг, 6,6 мг, 6,7 мг, 6,8 мг, 6,9 мг, 7 мг, 7,1 мг, 7,2 мг, 7,3 мг, 7,4 мг, 7,5 мг, 7,6 мг, 7,7 мг, 7,8 мг, 7,9 мг, 8 мг, 8,1 мг, 8,2 мг, 8,3 мг, 8,4 мг, 8,5 мг, 8,6 мг, 8,7 мг, 8,8 мг, 8,9 мг, 9 мг, 9,1 мг, 9,2 мг, 9,3 мг, 9,4 мг, 9,5 мг, 9,6 мг, 9,7 мг, 9,8 мг, 9,9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг, 20 мг, 21 мг, 22 мг, 23 мг, 24 мг, 25 мг, 26 мг, 27 мг, 28 мг, 29 мг, 30 мг, 31 мг, 32 мг, 33 мг, 34 мг, 35 мг, 36 мг, 37 мг, 38 мг, 39 мг, 40 мг, 41 мг, 42 мг, 43 мг, 44 мг, 45 мг, 46 мг, 47 мг, 48 мг, 49 мг, 50 мг, 100 мг, 500 мг, 750 мг или 1 г мирицетина (или любого его производного или соли).
В другом примере введение фармацевтической композиции пациенту может включать введение совместной композиции химиотерапевтического лекарства (например, доксорубицина) с по меньшей мере 10 мг мирицетрина. В некоторых вариантах реализации введение пациенту фармацевтической композиции по данному документу может включать введение пациенту суточной дозы 0,1 мг, 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 0,6 мг, 0,7 мг, 0,8 мг, 0,9 мг, 1 мг, 1,1 мг, 1,2 мг, 1,3 мг, 1,4 мг, 1,5 мг, 1,6 мг, 1,7 мг, 1,8 мг, 1,9 мг, 2 мг, 2,1 мг, 2,2 мг, 2,3 мг, 2,4 мг, 2,5 мг, 2,6 мг, 2,7 мг, 2,8 мг, 2,9 мг, 3 мг, 3,1 мг, 3,2 мг, 3,3 мг, 3,4 мг, 3,5 мг, 3,6 мг, 3,7 мг, 3,8 мг, 3,9 мг, 4 мг, 4,1 мг, 4,2 мг, 4,3 мг, 4,4 мг, 4,5 мг, 4,6 мг, 4,7 мг, 4,8 мг, 4,9 мг, 5 мг, 5,1 мг, 5,2 мг, 5,3 мг, 5,4 мг, 5,5 мг, 5,6 мг, 5,7 мг, 5,8 мг, 5,9 мг, 6 мг, 6,1 мг, 6,2 мг, 6,3 мг, 6,4 мг, 6,5 мг, 6,6 мг, 6,7 мг, 6,8 мг, 6,9 мг, 7 мг, 7,1 мг, 7,2 мг, 7,3 мг, 7,4 мг, 7,5 мг, 7,6 мг, 7,7 мг, 7,8 мг, 7,9 мг, 8 мг, 8,1 мг, 8,2 мг, 8,3 мг, 8,4 мг, 8,5 мг, 8,6 мг, 8,7 мг, 8,8 мг, 8,9 мг, 9 мг, 9,1 мг, 9,2 мг, 9,3 мг, 9,4 мг, 9,5 мг, 9,6 мг, 9,7 мг, 9,8 мг, 9,9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг, 20 мг, 21 мг, 22 мг, 23 мг, 24 мг, 25 мг, 26 мг, 27 мг, 28 мг, 29 мг, 30 мг, 31 мг, 32 мг, 33 мг, 34 мг, 35 мг, 36 мг, 37 мг, 38 мг, 39 мг, 40 мг, 41 мг, 42 мг, 43 мг, 44 мг, 45 мг, 46 мг, 47 мг, 48 мг, 49 мг, 50 мг, 100 мг, 500 мг, 750 мг или 1 г мирицетрина (или любого его производного или соли).
В другом примере введение пациенту фармацевтической композиции может включать введение совместной композиции химиотерапевтического лекарства (например, доксорубицина) с по меньшей мере 10 мг витексина. В некоторых случаях введение пациенту фармацевтической композиции по данному документу может включать введение пациенту суточной дозы 0,1 мг, 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 0,6 мг, 0,7 мг, 0,8 мг, 0,9 мг, 1 мг, 1,1 мг, 1,2 мг, 1,3 мг, 1,4 мг, 1,5 мг, 1,6 мг, 1,7 мг, 1,8 мг, 1,9 мг, 2 мг, 2,1 мг, 2,2 мг, 2,3 мг, 2,4 мг, 2,5 мг, 2,6 мг, 2,7 мг, 2,8 мг, 2,9 мг, 3 мг, 3,1 мг, 3,2 мг, 3,3 мг, 3,4 мг, 3,5 мг, 3,6 мг, 3,7 мг, 3,8 мг, 3,9 мг, 4 мг, 4,1 мг, 4,2 мг, 4,3 мг, 4,4 мг, 4,5 мг, 4,6 мг, 4,7 мг, 4,8 мг, 4,9 мг, 5 мг, 5,1 мг, 5,2 мг, 5,3 мг, 5,4 мг, 5,5 мг, 5,6 мг, 5,7 мг, 5,8 мг, 5,9 мг, 6 мг, 6,1 мг, 6,2 мг, 6,3 мг, 6,4 мг, 6,5 мг, 6,6 мг, 6,7 мг, 6,8 мг, 6,9 мг, 7 мг, 7,1 мг, 7,2 мг, 7,3 мг, 7,4 мг, 7,5 мг, 7,6 мг, 7,7 мг, 7,8 мг, 7,9 мг, 8 мг, 8,1 мг, 8,2 мг, 8,3 мг, 8,4 мг, 8,5 мг, 8,6 мг, 8,7 мг, 8,8 мг, 8,9 мг, 9 мг, 9,1 мг, 9,2 мг, 9,3 мг, 9,4 мг, 9,5 мг, 9,6 мг, 9,7 мг, 9,8 мг, 9,9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг, 20 мг, 21 мг, 22 мг, 23 мг, 24 мг, 25 мг, 26 мг, 27 мг, 28 мг, 29 мг, 30 мг, 31 мг, 32 мг, 33 мг, 34 мг, 35 мг, 36 мг, 37 мг, 38 мг, 39 мг, 40 мг, 41 мг, 42 мг, 43 мг, 44 мг, 45 мг, 46 мг, 47 мг, 48 мг, 49 мг, 50 мг, 100 мг, 500 мг, 750 мг или 1 г витексина (или любого его производного или соли).
В некоторых вариантах реализации введение пациенту фармацевтической композиции по данному документу может включать введение суточной дозы 0,1 мг, 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 0,6 мг, 0,7 мг, 0,8 мг, 0,9 мг, 1 мг, 1,1 мг, 1,2 мг, 1,3 мг, 1,4 мг, 1,5 мг, 1,6 мг, 1,7 мг, 1,8 мг, 1,9 мг, 2 мг, 2,1 мг, 2,2 мг, 2,3 мг, 2,4 мг, 2,5 мг, 2,6 мг, 2,7 мг, 2,8 мг, 2,9 мг, 3 мг, 3,1 мг, 3,2 мг, 3,3 мг, 3,4 мг, 3,5 мг, 3,6 мг, 3,7 мг, 3,8 мг, 3,9 мг, 4 мг, 4,1 мг, 4,2 мг, 4,3 мг, 4,4 мг, 4,5 мг, 4,6 мг, 4,7 мг, 4,8 мг, 4,9 мг, 5 мг, 5,1 мг, 5,2 мг, 5,3 мг, 5,4 мг, 5,5 мг, 5,6 мг, 5,7 мг, 5,8 мг, 5,9 мг, 6 мг, 6,1 мг, 6,2 мг, 6,3 мг, 6,4 мг, 6,5 мг, 6,6 мг, 6,7 мг, 6,8 мг, 6,9 мг, 7 мг, 7,1 мг, 7,2 мг, 7,3 мг, 7,4 мг, 7,5 мг, 7,6 мг, 7,7 мг, 7,8 мг, 7,9 мг, 8 мг, 8,1 мг, 8,2 мг, 8,3 мг, 8,4 мг, 8,5 мг, 8,6 мг, 8,7 мг, 8,8 мг, 8,9 мг, 9 мг, 9,1 мг, 9,2 мг, 9,3 мг, 9,4 мг, 9,5 мг, 9,6 мг, 9,7 мг, 9,8 мг, 9,9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг, 20 мг, 21 мг, 22 мг, 23 мг, 24 мг, 25 мг, 26 мг, 27 мг, 28 мг, 29 мг, 30 мг, 31 мг, 32 мг, 33 мг, 34 мг, 35 мг, 36 мг, 37 мг, 38 мг, 39 мг, 40 мг, 41 мг, 42 мг, 43 мг, 44 мг, 45 мг, 46 мг, 47 мг, 48 мг, 49 мг, 50 мг, 100 мг, 500 мг, 750 мг или 1 г робинетина (или любого его производного или соли).
В некоторых случаях введение пациенту фармацевтической композиции по данному документу может включать введение суточной дозы 0,1 мг, 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 0,6 мг, 0,7 мг, 0,8 мг, 0,9 мг, 1 мг, 1,1 мг, 1,2 мг, 1,3 мг, 1,4 мг, 1,5 мг, 1,6 мг, 1,7 мг, 1,8 мг, 1,9 мг, 2 мг, 2,1 мг, 2,2 мг, 2,3 мг, 2,4 мг, 2,5 мг, 2,6 мг, 2,7 мг, 2,8 мг, 2,9 мг, 3 мг, 3,1 мг, 3,2 мг, 3,3 мг, 3,4 мг, 3,5 мг, 3,6 мг, 3,7 мг, 3,8 мг, 3,9 мг, 4 мг, 4,1 мг, 4,2 мг, 4,3 мг, 4,4 мг, 4,5 мг, 4,6 мг, 4,7 мг, 4,8 мг, 4,9 мг, 5 мг, 5,1 мг, 5,2 мг, 5,3 мг, 5,4 мг, 5,5 мг, 5,6 мг, 5,7 мг, 5,8 мг, 5,9 мг, 6 мг, 6,1 мг, 6,2 мг, 6,3 мг, 6,4 мг, 6,5 мг, 6,6 мг, 6,7 мг, 6,8 мг, 6,9 мг, 7 мг, 7,1 мг, 7,2 мг, 7,3 мг, 7,4 мг, 7,5 мг, 7,6 мг, 7,7 мг, 7,8 мг, 7,9 мг, 8 мг, 8,1 мг, 8,2 мг, 8,3 мг, 8,4 мг, 8,5 мг, 8,6 мг, 8,7 мг, 8,8 мг, 8,9 мг, 9 мг, 9,1 мг, 9,2 мг, 9,3 мг, 9,4 мг, 9,5 мг, 9,6 мг, 9,7 мг, 9,8 мг, 9,9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг, 20 мг, 21 мг, 22 мг, 23 мг, 24 мг, 25 мг, 26 мг, 27 мг, 28 мг, 29 мг, 30 мг, 31 мг, 32 мг, 33 мг, 34 мг, 35 мг, 36 мг, 37 мг, 38 мг, 39 мг, 40 мг, 41 мг, 42 мг, 43 мг, 44 мг, 45 мг, 46 мг, 47 мг, 48 мг, 49 мг, 50 мг, 100 мг, 500 мг, 750 мг или 1 г трицетина (или любого его производного или соли).
В некоторых случаях введение пациенту фармацевтической композиции по данному документу может включать введение суточной дозы 0,1 мг, 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 0,6 мг, 0,7 мг, 0,8 мг, 0,9 мг, 1 мг, 1,1 мг, 1,2 мг, 1,3 мг, 1,4 мг, 1,5 мг, 1,6 мг, 1,7 мг, 1,8 мг, 1,9 мг, 2 мг, 2,1 мг, 2,2 мг, 2,3 мг, 2,4 мг, 2,5 мг, 2,6 мг, 2,7 мг, 2,8 мг, 2,9 мг, 3 мг, 3,1 мг, 3,2 мг, 3,3 мг, 3,4 мг, 3,5 мг, 3,6 мг, 3,7 мг, 3,8 мг, 3,9 мг, 4 мг, 4,1 мг, 4,2 мг, 4,3 мг, 4,4 мг, 4,5 мг, 4,6 мг, 4,7 мг, 4,8 мг, 4,9 мг, 5 мг, 5,1 мг, 5,2 мг, 5,3 мг, 5,4 мг, 5,5 мг, 5,6 мг, 5,7 мг, 5,8 мг, 5,9 мг, 6 мг, 6,1 мг, 6,2 мг, 6,3 мг, 6,4 мг, 6,5 мг, 6,6 мг, 6,7 мг, 6,8 мг, 6,9 мг, 7 мг, 7,1 мг, 7,2 мг, 7,3 мг, 7,4 мг, 7,5 мг, 7,6 мг, 7,7 мг, 7,8 мг, 7,9 мг, 8 мг, 8,1 мг, 8,2 мг, 8,3 мг, 8,4 мг, 8,5 мг, 8,6 мг, 8,7 мг, 8,8 мг, 8,9 мг, 9 мг, 9,1 мг, 9,2 мг, 9,3 мг, 9,4 мг, 9,5 мг, 9,6 мг, 9,7 мг, 9,8 мг, 9,9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг, 20 мг, 21 мг, 22 мг, 23 мг, 24 мг, 25 мг, 26 мг, 27 мг, 28 мг, 29 мг, 30 мг, 31 мг, 32 мг, 33 мг, 34 мг, 35 мг, 36 мг, 37 мг, 38 мг, 39 мг, 40 мг, 41 мг, 42 мг, 43 мг, 44 мг, 45 мг, 46 мг, 47 мг, 48 мг, 49 мг, 50 мг, 100 мг, 500 мг, 750 мг или 1 г 7,3',4',5'-тетрагидроксифлавона (или любого его производного или соли).
В некоторых случаях введение пациенту фармацевтической композиции по данному документу может включать введение суточной дозы 0,1 мг, 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 0,6 мг, 0,7 мг, 0,8 мг, 0,9 мг, 1 мг, 1,1 мг, 1,2 мг, 1,3 мг, 1,4 мг, 1,5 мг, 1,6 мг, 1,7 мг, 1,8 мг, 1,9 мг, 2 мг, 2,1 мг, 2,2 мг, 2,3 мг, 2,4 мг, 2,5 мг, 2,6 мг, 2,7 мг, 2,8 мг, 2,9 мг, 3 мг, 3,1 мг, 3,2 мг, 3,3 мг, 3,4 мг, 3,5 мг, 3,6 мг, 3,7 мг, 3,8 мг, 3,9 мг, 4 мг, 4,1 мг, 4,2 мг, 4,3 мг, 4,4 мг, 4,5 мг, 4,6 мг, 4,7 мг, 4,8 мг, 4,9 мг, 5 мг, 5,1 мг, 5,2 мг, 5,3 мг, 5,4 мг, 5,5 мг, 5,6 мг, 5,7 мг, 5,8 мг, 5,9 мг, 6 мг, 6,1 мг, 6,2 мг, 6,3 мг, 6,4 мг, 6,5 мг, 6,6 мг, 6,7 мг, 6,8 мг, 6,9 мг, 7 мг, 7,1 мг, 7,2 мг, 7,3 мг, 7,4 мг, 7,5 мг, 7,6 мг, 7,7 мг, 7,8 мг, 7,9 мг, 8 мг, 8,1 мг, 8,2 мг, 8,3 мг, 8,4 мг, 8,5 мг, 8,6 мг, 8,7 мг, 8,8 мг, 8,9 мг, 9 мг, 9,1 мг, 9,2 мг, 9,3 мг, 9,4 мг, 9,5 мг, 9,6 мг, 9,7 мг, 9,8 мг, 9,9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг, 20 мг, 21 мг, 22 мг, 23 мг, 24 мг, 25 мг, 26 мг, 27 мг, 28 мг, 29 мг, 30 мг, 31 мг, 32 мг, 33 мг, 34 мг, 35 мг, 36 мг, 37 мг, 38 мг, 39 мг, 40 мг, 41 мг, 42 мг, 43 мг, 44 мг, 45 мг, 46 мг, 47 мг, 48 мг, 49 мг, 50 мг, 100 мг, 500 мг, 750 мг или 1 г фитецина (или любого его производного или соли).
Фармацевтические способы и композиции, описанные в данном документе, обеспечивают предупреждение, снижение или исключение кардиотоксичности, связанной с лечением рака, у пациента. Соответственно, способы и композиции, предложенные в данном документе, обеспечивают возможность более частого приема терапии пациентом без существенного изменения схемы лечения вследствие риска кардиотоксичности. Суточную дозу химиотерапевтического лекарства, биологического агента или защитного агента в фармацевтической композиции, предложенной в данном документе, можно вводить пациенту в виде одной или более доз в сутки. В некоторых случаях суточную дозу химиотерапевтического лекарства можно вводить в виде одной дозы. В некоторых случаях суточную дозу химиотерапевтического агента можно делить на 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 доз в сутки. Например, суточную дозу химиотерапевтического лекарства (например, доксорубицина) можно делить на 3 дозы в сутки. В некоторых случаях суточную дозу химиотерапевтического лекарства можно делить на по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 или 60 инфузии в час. В некоторых случаях каждая инфузия композиции, содержащей химиотерапевтическое лекарство, может длиться в течение по меньшей мере 5 минут, 10 минут, 15 минут, 20 минут, 25 минут, 30 минут, 35 минут, 40 минут, 45 минут, 50 минут, 55 минут, 1 часа, 1,5 часа, 2 часов, 2,5 часа, 3 часов, 3,5 часа, 4 часов, 4,5 часа, 5 часов, 5,5 часа или 6 часов. В некоторых случаях суточную дозу биологического агента можно вводить в виде одной дозы. В некоторых случаях суточную дозу биологического агента можно делить на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 дозы в сутки. Например, суточную дозу биологического агента (например, бевацизумаба) можно делить на 3 дозы в сутки. В некоторых случаях суточную дозу биологического агента можно делить на по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9,10, 15, 20, 25, 30, 35, 40, 45, 50, 55 или 60 инфузий в час. В некоторых случаях каждая инфузия композиции, содержащей биологический агент, может длиться в течение по меньшей мере 5 минут, 10 минут, 15 минут, 20 минут, 25 минут, 30 минут, 35 минут, 40 минут, 45 минут, 50 минут, 55 минут, 1 часа, 1,5 часа, 2 часов, 2,5 часа, 3 часов, 3,5 часа, 4 часов, 4,5 часа, 5 часов, 5,5 часа или 6 часов. В некоторых случаях суточную дозу защитного агента можно вводить в виде одной дозы. В некоторых случаях суточную дозу защитного агента можно делить на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 дозы в сутки. Например, суточную дозу защитного агента (например, мирицетина) можно делить на 3 дозы в сутки. В некоторых случаях суточную дозу защитного агента можно делить на по меньшей мере 1, 2, 3, 4, 5 или 6 инфузий в час. В некоторых случаях каждая инфузия композиции, содержащей один или более защитных агентов, может длиться в течение по меньшей мере 5 минут, 10 минут, 15 минут, 20 минут, 25 минут, 30 минут, 35 минут, 40 минут, 45 минут, 50 минут, 55 минут, 1 часа, 1,5 часа, 2 часов, 2,5 часа, 3 часов, 3,5 часа, 4 часов, 4,5 часа, 5 часов, 5,5 часа или 6 часов.
Фармацевтические композиции, описанные в данном документе, можно вводить пациенту один или более раз в сутки. В некоторых случаях фармацевтическую композицию можно вводить пациенту один раз в сутки. В некоторых случаях фармацевтическую композицию можно вводить пациенту по меньшей мере 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 11 раз, 12 раз, 13 раз, 14 раз, 15 раз, 16 раз, 17 раз, 18 раз, 19 раз, 20 раз, 21 раз, 22 раза, 23 раза или 24 раза в сутки. Например, фармацевтическую композицию можно вводить пациенту 3 раза в сутки.
Фармацевтические композиции, описанные в данном документе, можно вводить пациенту в течение одного или более дней. В некоторых случаях фармацевтическую композицию можно вводить пациенту в течение одного дня. В некоторых случаях фармацевтическую композицию можно вводить пациенту в течение по меньшей мере 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 1 недели, 2 недель, 3 недель, 1 месяца, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 1 года, 2 лет, 3 лет, 4 лет, 5 лет, 6 лет, 7 лет, 8 лет, 9 лет, 10 лет, 20 лет, 30 лет, 40 лет или 50 лет. Например, онкологическую пациенту можно вводить фармацевтическую совместную композицию доксорубицина и мирицетина в течение по меньшей мере 1 года. В некоторых случаях фармацевтическую композицию можно вводить пациенту в течение двух или более последовательных дней. В некоторых случаях фармацевтическую композицию можно вводить пациенту в течение двух или более непоследовательных дней. Например, пациенту можно вводить фармацевтическую композицию каждый день, последовательно, в течение 4 дней. В другом примере пациенту можно вводить фармацевтическую композицию на 1 день, 3 день, 7 день и 15 день. В некоторых случаях, если пациенту вводят фармацевтическую композицию в течение определенного периода времени, размер дозы, введенной пациенту в один день, может отличаться от размера дозы, введенной пациенту на следующий день. Например, пациенту можно вводить 5 мг фармацевтической композиции на первый день и вводить 10 мг фармацевтической композиции на следующий день.
Фармацевтические композиции, описанные в данном документе, могут быть эффективными с течением времени. В некоторых случаях фармацевтические композиции могут быть эффективными в течение одного или более дней. В некоторых случаях продолжительность эффективности фармацевтической композиции составляет более продолжительный период времени. В некоторых случаях эффективность фармацевтической композиции может быть более 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 1 недели, 2 недель, 3 недель или 1 месяца.
Способы, предложенные в данном документе, могут дополнительно включать введение пациенту дексразоксана (или любого его производного или соли) в составе любой из фармацевтических композиций, описанных в данном документе. Такие способы обеспечивают возможность введения пациенту фармацевтической композиции, содержащей по меньшей мере один защитный агент и дексразоксан, причем совместная композиция по меньшей мере одного защитного агента и дексразоксана может обеспечивать более высокий защитный эффект, по сравнению с введением только дексразоксана. В некоторых случаях введение любой из фармацевтических композиций, описанных в данном документе, может обеспечивать снижение вероятности кардиотоксичности в определенной выборке пациентов на 1%, 2%, 3%, 4%, 5%, 6%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%. Например, если существует 80% вероятность того, что пациенты в определенной выборке пациентов, которым вводили дексразоксан, будут испытывать кардиотоксичность, то введение указанным пациентам совместной композиции мирицетина и дексразоксана может обеспечивать снижение вероятности возникновения кардиотоксичности на 75%, что дает 20% вероятность того, что указанные пациенты будут испытывать кардиотоксичность. Такой более высокий защитный эффект также может обеспечивать возможность приема противоракового лечения (например, доксорубицина) в более широкой популяции пациентов, включая пациентов с уже существующими сердечными состояниями, которые в противном случае имеют противопоказание к его применению. В некоторых случаях дексразоксан можно составлять в совместную фармацевтическую композицию, в том смысле, что он является смешанным с указанной фармацевтической композицией или существует в виде отдельного элемента. В некоторых случаях противораковое лечение, защитный агент и дексразоксан можно вводить одновременно. В некоторых случаях противораковое лечение, защитный агент и дексразоксан можно вводить последовательно. В одном примере онкологическому пациенту можно вводить совместную композицию химиотерапевтического лекарства, дексразоксана и мирицетина в виде одной дозы по меньшей мере один раз в сутки. В другом примере онкологическому пациенту можно вводить дексразоксан, а затем вводить мирицетин.
Введенная доза дексразоксана (или любого его производного или соли) в указанной фармацевтической композиции может составлять более 0,1 мг/м2, 1 мг/м2, 2 мг/м2, 3 мг/м2, 4 мг/м2, 5 мг/м2, 6 мг/м2, 7 мг/м2, 8 мг/м2, 9 мг/м2, 10 мг/м2, 11 мг/м2, 12 мг/м2, 13 мг/м2, 14 мг/м2, 15 мг/м2, 16 мг/м2, 17 мг/м2, 18 мг/м2, 19 мг/м2, 20 мг/м2, 21 мг/м2, 22 мг/м2, 23 мг/м2, 24 мг/м2, 25 мг/м2, 26 мг/м2, 27 мг/м2, 28 мг/м2, 29 мг/м2, 30 мг/м2, 31 мг/м2, 32 мг/м2, 33 мг/м2, 34 мг/м2, 35 мг/м2, 36 мг/м2, 37 мг/м2, 38 мг/м2, 39 мг/м2, 40 мг/м2, 41 мг/м2, 42 мг/м2, 43 мг/м2, 44 мг/м2, 45 мг/м2, 46 мг/м2, 47 мг/м2, 48 мг/м2, 49 мг/м2, 50 мг/м2, 51 мг/м2, 52 мг/м2, 53 мг/м2, 54 мг/м2, 55 мг/м2, 56 мг/м2, 57 мг/м2, 58 мг/м2, 59 мг/м2, 60 мг/м2, 61 мг/м2, 62 мг/м2, 63 мг/м2, 64 мг/м2, 65 мг/м2, 66 мг/м2, 67 мг/м2, 68 мг/м2, 69 мг/м2, 70 мг/м2, 71 мг/м2, 72 мг/м2, 73 мг/м2, 74 мг/м2, 75 мг/м2, 76 мг/м2, 77 мг/м2, 78 мг/м2, 79 мг/м2, 80 мг/м2, 81 мг/м2, 82 мг/м2, 83 мг/м2, 84 мг/м2, 85 мг/м2, 86 мг/м2, 87 мг/м2, 88 мг/м2, 89 мг/м2, 90 мг/м2, 91 мг/м2, 92 мг/м2, 93 мг/м2, 94 мг/м2, 95 мг/м2, 96 мг/м2, 97 мг/м2, 98 мг/м2, 99 мг/м2, 100 мг/м2, 150 мг/м2, 200 мг/м2, 300 мг/м2, 350 мг/м2, 400 мг/м2, 450 мг/м2, 500 мг/м2, 750 мг/м2, 1 г/м2, 5 г/м2, 10 г/м2 или более. В конкретном примере введение фармацевтической композиции пациенту может включать введение совместной композиции защитного агента Формулы 1 или Формулы 2 (например, мирицетина) с 50 мг/м2 дексразоксана.
В некоторых случаях введение пациенту фармацевтической композиции, описанной в данном документе, может включать введение дозы около 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,7 мг/кг, 0,8 мг/кг, 0,9 мг/кг, 1 мг/кг, 1,5 мг/кг, 2 мг/кг, 2,5 мг/кг, 3 мг/кг, 3,5 мг/кг, 4 мг/кг, 4,5 мг/кг, 5 мг/кг, 6 мг/кг, 7 мг/кг, 8 мг/кг, 9 мг/кг, 10 мг/кг, 11 мг/кг, 12 мг/кг, 13 мг/кг, 14 мг/кг, 15 мг/кг, 16 мг/кг, 17 мг/кг, 18 мг/кг, 19 мг/кг, 20 мг/кг, 21 мг/кг, 22 мг/кг, 23 мг/кг, 24 мг/кг, 25 мг/кг, 26 мг/кг, 27 мг/кг, 28 мг/кг, 29 мг/кг, 30 мг/кг, 31 мг/кг, 32 мг/кг, 33 мг/кг, 34 мг/кг, 35 мг/кг, 36 мг/кг, 37 мг/кг, 38 мг/кг, 39 мг/кг, 40 мг/кг, 41 мг/кг, 42 мг/кг, 43 мг/кг, 44 мг/кг, 45 мг/кг, 46 мг/кг, 47 мг/кг, 48 мг/кг, 49 мг/кг, 50 мг/кг, 51 мг/кг, 52 мг/кг, 53 мг/кг, 54 мг/кг, 55 мг/кг, 56 мг/кг, 57 мг/кг, 58 мг/кг, 59 мг/кг, 60 мг/кг, 61 мг/кг, 62 мг/кг, 63 мг/кг, 64 мг/кг, 65 мг/кг, 66 мг/кг, 67 мг/кг, 68 мг/кг, 69 мг/кг, 70 мг/кг, 71 мг/кг, 72 мг/кг, 73 мг/кг, 74 мг/кг, 75 мг/кг, 76 мг/кг, 77 мг/кг, 78 мг/кг, 79 мг/кг, 80 мг/кг, 81 мг/кг, 82 мг/кг, 83 мг/кг, 84 мг/кг, 85 мг/кг, 86 мг/кг, 87 мг/кг, 88 мг/кг, 89 мг/кг, 90 мг/кг, 90 мг/кг, 95 мг/кг, 100 мг/кг, 110 мг/кг, 120 мг/кг, 130 мг/кг, 140 мг/кг, 150 мг/кг, 160 мг/кг, 170 мг/кг, 180 мг/кг, 190 мг/кг, 200 мг/кг, 300 мг/кг, 400 мг/кг, 500 мг/кг защитного агента Формулы 1 или Формулы 2. В некоторых аспектах защитный агент может быть выбран из группы, состоящей из мирицетина, витексина, робинетина, трицетина, физетина, 7,3',4',5'-тетрагидроксифлавона, дигидроробинетина, мирицитрина и их производного или соли. В одном варианте реализации пациенту внутривенно вводят защитный агент в дозе 0,5 мг/кг, 1 мг/кг, 1,5 мг/кг, 2 мг/кг, 2,5 мг/кг, 3 мг/кг, 3,5 мг/кг, 4 мг/кг, 4,5 мг/кг, 5 мг/кг, 6 мг/кг, 7 мг/кг, 8 мг/кг, 9 мг/кг, 10 мг/кг, 11 мг/кг, 12 мг/кг, 13 мг/кг, 14 мг/кг, 15 мг/кг, 16 мг/кг, 17 мг/кг, 18 мг/кг, 19 мг/кг, 20 мг/кг, 21 мг/кг, 22 мг/кг, 23 мг/кг, 24 мг/кг, 25 мг/кг, 26 мг/кг, 27 мг/кг, 28 мг/кг, 29 мг/кг, 30 мг/кг, 31 мг/кг, 32 мг/кг, 33 мг/кг, 34 мг/кг, 35 мг/кг, 36 мг/кг, 37 мг/кг, 38 мг/кг, 39 мг/кг, 40 мг/кг, 41 мг/кг, 42 мг/кг, 43 мг/кг, 44 мг/кг, 45 мг/кг, 46 мг/кг, 47 мг/кг, 48 мг/кг, 49 мг/кг, 50 мг/кг, 60 мг/кг, 70 мг/кг, 80 мг/кг, 90 мг/кг или 100 мг/кг, 150 мг/кг или 200 мг/кг. В одном варианте реализации пациенту вводят мирицетин в дозе от около 0,5 мг/кг до около 50 мг/кг по меньшей мере за 10 минут до введения антрациклина (например, д оксорубицина, эпирубицина или идарубицина). В одном варианте реализации пациенту вводят мирицетин в дозе от около 0,5 мг/кг до около 100 мг/кг по меньшей мере за 10 минут до введения антрациклина (например, доксорубицина, эпирубицина или идарубицина). В одном варианте реализации пациенту внутривенно вводят мирицетин в дозе от около 0,5 мг/кг до около 200 мг/кг по меньшей мере за 30 минут до введения антрациклина (например, доксорубицина, эпирубицина или идарубицина). В одном варианте реализации пациенту внутривенно вводят мирицетин в дозе от около 0,5 мг/кг до около 200 мг/кг по меньшей мере за 1 час до введения антрациклина (например, доксорубицина, эпирубицина или идарубицина). В одном варианте реализации пациенту внутривенно вводят мирицетин в дозе от около 0,5 мг/кг до около 200 мг/кг мирицетина по меньшей мере за 2 часа до введения антрациклина (например, доксорубицина, эпирубицина или идарубицина). В одном варианте реализации пациенту внутривенно вводят дозы от около 0,5 мг/кг до около 200 мг/кг мирицетина по меньшей мере за 4 часа до введения антрациклина (например, доксорубицина, эпирубицина или идарубицина). В одном варианте реализации пациенту внутривенно вводят мирицетин в дозе от около 0,5 мг/кг до около 200 мг/кг мирицетина по меньшей мере за 6 часов до введения антрациклина (например, доксорубицина, эпирубицина или идарубицина). В одном варианте реализации пациенту внутривенно вводят мирицетин в дозе от около 0,5 мг/кг до около 200 мг/кг мирицетина в течение 6 часов после введения антрациклина (например, доксорубицина, эпирубицина или идарубицина). В одном варианте реализации мирицетин вводят перорально в дозе от 0,5 мг/кг до 200 мг/кг по меньшей мере за 0,5, 1, 2, 3,4, 5 или 6 часов до введения антрациклина (например, доксорубицина, эпирубицина или идарубицина).
В некоторых аспектах пациенту вводят, например, внутривенно или перорально, защитный агент (например, мирицетин, витексин, робинетин, трицетин, физетин, 7,3',4',5'-тетрагидроксифлавон, дигидроробинетин или мирицитрин) в дозе от около 0,5 мг/кг до около 200 мг/кг по меньшей мере за 4 часа до первого введения антрациклина (например, доксорубицина, эпирубицина или идарубицина) после диагностирования у пациента рака.
Ответ пациента
Способы и композиции, предложенные в данном документе, обеспечивают предупреждение, снижение или исключение у пациента кардиотоксичности, вызванной химиотерапевтическими лекарствами, биологическими агентами или лучевой терапией. Кроме того, введение пациенту фармацевтической композиции, описанной в данном документе, также может обеспечивать предупреждение, снижение или исключение повреждения органа, вызванного лечением рака (например, повреждения органа вследствие повреждения сердечной ткани, электрофизиологической дисфункции, митохондриальной токсичности, апоптоза или окислительного стресса).
Способы и композиции, описанные в данном документе, могут, в целом, снижать кардиотоксичность у пациента. Примеры кардиотоксичности могут включать, но не ограничиваются этим, митохондриальную токсичность, апоптоз, электрофизиологическую дисфункцию (например, удлинение QT), механическую дисфункцию (например, уменьшенную фракцию изгнания из сердца), окислительный стресс, повреждение сердечной ткани (например, повреждение, вызванное окислительным стрессом, митохондриальное повреждение или повреждение, вызванное увеличением потока реакционноспособных частиц кислорода), а также цитотоксическое повреждение любого органа (например, печени, почек или поджелудочной железы), отличного от сердца.
Митохондриальная токсичность может относиться к любому повреждению, которое снижает количество активных митохондрий в данной клетке, ткани, органе или организме. В некоторых случаях митохондриальную активность можно измерять с помощью in vitro анализа. Один из таких способов, которые можно использовать для измерения митохондриальной токсичности, представляет собой совместное воздействие на клетки (1) проникающего в клетки флуоресцентного красителя, который показывает клеточные ядра, и (2) метилового эфира тетраметилродамина (TMRM), проникающего в клетки флуоресцентного красителя, который поглощается активными митохондриями. Митохондриальную токсичность можно рассчитать как отношение TMRM-положительных клеток к общему количеству клеточных ядер. По результатом измерения в in vitro анализе, митохондриальная токсичность в кардиомиоцитах, вызванная противораковым лечением, может составлять более 1%, 2%, 3%, 4%, 5%, 6%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, по сравнению с необработанным контрольным образцом. Например, воздействие на кардиомиоциты 1 микромолярной концентрации доксорубицина в течение по меньшей мере 48 часов может вызывать 100% митохондриальную токсичность, по сравнению с необработанным контрольным образцом. Фармацевтические способы и композиции, описанные в данном документе, могут, в целом, обеспечивать снижение митохондриальной токсичности, вызванной противораковым лечением. По результатам измерения в in vitro анализе, воздействие на кардиомиоциты любой из фармацевтических композиций, описанных в данном документе, может обеспечивать снижение митохондриальной токсичности на 100%, 99%, 98%, 91%, 96%, 95%, 94%, 93%, 92%, 91%, 90%, 89%, 88%, 87%, 86%, 85%, 84%, 83%, 82%, 81%, 80%, 79%, 78%, 77%, 76%, 75%, 74%, 73%, 72%, 71%, 70%, 69%, 68%, 67%, 66%, 65%, 64%, 63%, 62%, 61%, 60%, 59%, 58%, 57%, 56%, 55%, 54%, 53%, 52%, 51%, 50%, 49%, 48%, 47%, 46%, 45%, 44%, 43%, 42%, 41%, 40%, 39%, 38%, 37%, 36%, 35%, 34%, 33%, 32%, 31%, 30%, 29%, 28%, 27%, 26%, 25%, 24%, 23%, 22%, 21%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 1%, 6%, 5%, 4%, 3%, 2%, или 1%, по сравнению с кардиомиоцитами, подверженными противораковому лечению в отсутствие защитного агента. Например, воздействие на кардиомиоциты совместной композиции, содержащей 1 микромолярную концентрацию доксорубицина и 115 микромолярную концентрацию мирицетина, в течение по меньшей мере 48 часов может обеспечивать снижение митохондриальной токсичности на 30% по сравнению с кардиомиоцитами, обработанными 1 микромолярной концентрацией доксорубицина.
Апоптоз может относиться к процессу, посредством которого клетки подвергаются запрограммированной клеточной гибели. Обнаруживаемые изменения в клетке, подверженной апоптозу, включают, но не ограничиваются ими, транслокацию цитохрома С из митохондрии, снижение митохондриальной функции, изменения структуры мембраны, увеличение протеолитической активности и фрагментацию ДНК. В некоторых случаях апоптоз можно измерять с помощью in vitro анализа. Один из таких способов, которые можно использовать для измерения апоптоза, представляет собой совместное воздействие на клетки (1) проникающего в клетки флуоресцентного красителя, который показывает клеточные ядра, и (2) реагента для обнаружения каспазы 3/7 CellEvent, флуорогенного субстрата для активированной каспазы 3, которая присутствует только в апоптозных клетках. Процентный апоптоз можно рассчитать как отношение CellEvent-положительных клеток к общему количеству клеточных ядер. По результатам измерения в in vitro анализе, апоптоз кардиомиоцитов, вызванный противораковым лечением, может составлять более 1%, 2%, 3%, 4%, 5%, 6%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, по сравнению с необработанным контрольным образцом. Например, воздействие на кардиомиоциты 1 микромолярной концентрации доксорубицина в течение по меньшей мере 48 часов может вызывать 100% апоптоз, по сравнению с необработанным контрольным образцом.
Фармацевтические способы и композиции, описанные в данном документе, могут, в целом, обеспечивать снижение апоптоза, вызванного противораковым лечением. По результатам измерения в in vitro анализе, воздействие на кардиомиоциты любой из фармацевтических композиций, описанных в данном документе, может обеспечивать снижение апоптоза на 100%, 99%, 98%, 97%, 96%, 95%, 94%, 93%, 92%, 91%, 90%, 89%, 88%, 87%, 86%, 85%, 84%, 83%, 82%, 81%, 80%, 79%, 78%, 77%, 76%, 75%, 74%, 73%, 72%, 71%, 70%, 69%, 68%, 67%, 66%, 65%, 64%, 63%, 62%, 61%, 60%, 59%, 58%, 57%, 56%, 55%, 54%, 53%, 52%, 51%, 50%, 49%, 48%, 47%, 46%, 45%, 44%, 43%, 42%, 41%, 40%, 39%, 38%, 37%, 36%, 35%, 34%, 33%, 32%, 31%, 30%, 29%, 28%, 27%, 26%, 25%, 24%, 23%, 22%, 21%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1%, по сравнению с кардиомиоцитами, подверженными противораковому лечению в отсутствие защитного агента. Например, воздействие на кардиомиоциты совместной композиции, содержащей 1 микромолярную концентрацию доксорубицина и 115 микромолярную концентрацию мирицетина, в течение по меньшей мере 48 часов может обеспечивать снижение митохондриальной токсичности на 30% по сравнению с кардиомиоцитами, обработанными 1 микромолярной концентрацией доксорубицина.
Электрофизиологическая дисфункция может относиться к любому повреждению, при котором нарушен поток ионов через биологическую ткань. Например, введение онкологическому пациенту химиотерапевтического лекарства (например, доксорубицина) может вызывать острый инфаркт миокарда, при котором ионы не могут больше проходить через поврежденную сердечную ткань, что приводит к блокаде проводимости. В некоторых случаях электрофизиологическая дисфункция может включать увеличение продолжительности интервала QT, и ее можно измерять с помощью in vivo анализа. Интервал QT можно использовать для описания времени между началом волны Q и окончанием волны Т на электрокардиограмме. Пролонгирование QT может означать задержку реполяризации желудочков, и может вызывать предрасположенность сердца к ранней пост-деполяризации (EAD), что приводит к реципрокной аритмии (например, пируэтной тахикардии). Интервал QT также может зависеть от продолжительности сердечного цикла (ЧС), времени между началом одного комплекса QRS и началом следующего комплекса QRS. Корригированный интервал QT (QTc) можно использовать для получения интервала QT, скорректированного с учетом продолжительности цикла. Для расчета интервала QTc по интервалу QT можно использовать формулу Базетта (QTc=QT/√RR), формулу Фридерика (QTc=QT/3√RR) или анализ методом регрессии (QTc=QT+0,154(1-RR)).
Введение пациенту химиотерапевтического лекарства, биологического агента или лучевой терапии в отсутствие защитного агента может вызывать удлинение QTc до значения выше исходного интервала QTc пациента. Исходное значение интервала QTc пациента представляет собой интервал QTc, измеренный у пациента до введения любого лекарства. Например, введение пациенту химиотерапевтического лекарства (например, доксорубицина) в отсутствие защитного агента может вызывать увеличение QTc на 40 миллисекунд (мс) относительно исходного интервала QTc данного пациента. В некоторых случаях введение пациенту химиотерапевтического лекарства, биологического агента или лучевой терапии, в частности, без защитного агента, может вызывать увеличение QTc по меньшей мере на 1 мс, 2 мс, 3 мс, 4 мс, 5 мс, 6 мс, 7 мс, 8 мс, 9 мс, 10 мс, 15 мс, 20 мс, 25 мс, 30 мс, 35 мс, 40 мс, 45 мс, 50 мс, 55 мс, 60 мс, 65 мс, 70 мс, 75 мс, 80 мс, 85 мс, 90 мс, 95 мс или 100 мс относительно исходного интервала QTc данного пациента.
Введение любой из фармацевтических композиций, описанных в данном документе, может ограничивать испытываемое пациентом увеличение продолжительности QTc, вызванное противораковым лечением, относительно исходного значения интервала QTc данного пациента. Например, введение пациенту совместной композиции химиотерапевтического лекарства (например, доксорубицина) и защитного агента (например, мирицетина) может вызывать увеличение продолжительности QTC менее 5 мс. В некоторых случаях фармацевтические композиции, описанные в данном документе, могут вызывать увеличение продолжительности QTc менее чем на 100 мс, 95 мс, 90 мс, 85 мс, 80 мс, 75 мс, 70 мс, 65 мс, 60 мс, 55 мс, 50 мс, 45 мс, 40 мс, 35 мс, 30 мс, 25 мс, 20 мс, 15 мс, 10 мс, 9 мс, 8 мс, 7 мс, 6 мс, 5 мс, 4 мс, 3 мс, 2 мс или 1 мс относительно исходного интервала QTc данного пациента.
В некоторых случаях электрофизиологическая дисфункция также может включать снижение электрической активности, и ее можно измерять с помощью in vitro анализа. Мультиэлектродные матрицы (МЕА) представляют собой устройства, которые содержат множество плоских проводящих электродов, с которыми клетки (например, кардиомиоциты) могут быть приведены в контакт. Хотя размер и форма электрического сигнала, измеренного с помощью МЕА, могут зависеть от нескольких факторов (например, однородности клеток, контакта между клеткой и электродом, геометрии МЕА), с помощью такого электрода можно измерять изменения во времени с получением информации об электрической активности приведенных в контакт клеток (например, процента активных электродов, продолжительности потенциала поля и частоты ударов).
Воздействие на кардиомиоциты химиотерапевтического лекарства, биологического агента или лучевой терапии, в отсутствие защитного агента, может вызывать временное снижение процента активных электродов (например, электродов, которые могут измерять определенную электрическую активность клетки, приведенной в контакт), по результатам измерения в in vitro анализе. Например, воздействие на кардиомиоциты 1 микромолярной концентрации доксорубицина в течение по меньшей мере 24 часов может вызывать 50% снижение количества активных электродов, по сравнению с нулевым моментом времени. В некоторых случаях воздействие на кардиомиоциты противоракового лечения (например, доксорубицина) без защитного агента (например, мирицетина) может вызывать снижение количества активных электродов на 100%, 99%, 98%, 97%, 96%, 95%, 94%, 93%, 92%, 91%, 90%, 89%, 88%, 87%, 86%, 85%, 84%, 83%, 82%, 81%, 80%, 79%, 78%, 77%, 76%, 75%, 74%, 73%, 72%, 71%, 70%, 69%, 68%, 67%, 66%, 65%, 64%, 63%, 62%, 61%, 60%, 59%, 58%, 57%, 56%, 55%, 54%, 53%, 52%, 51%, 50%, 49%, 48%, 47%, 46%, 45%, 44%, 43%, 42%, 41%, 40%, 39%, 38%, 37%, 36%, 35%, 34%, 33%, 32%, 31%, 30%, 29%, 28%, 27%, 26%, 25%, 24%, 23%, 22%, 21%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1%, по результатам измерения в in vitro анализе. В конкретном примере воздействие на кардиомиоциты 1 мкМ доксорубицином в течение по меньшей мере 24 часов может вызывать снижение количества активных электродов на 50%.
Фармацевтические способы и композиции, описанные в данном документе, могут, в целом, обеспечивать снижение электрофизиологической дисфункции, вызванной противораковым лечением (например, снижение количества активных электродов). По результатам измерения в in vitro анализе, воздействие на кардиомиоциты любой из фармацевтических композиций, описанных в данном документе, может вызывать снижение количества активных электродов менее чем на 1%, 2%, 3%, 4%, 5%, 6%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, по сравнению с кардиомиоцитами, подверженными воздействию противоракового лечения в отсутствие защитного агента. Например, воздействие на кардиомиоциты совместной композиции из 1 мкМ доксорубицина и 100 мкМ мирицетина в течение по меньшей мере 24 часов может вызывать снижение количества активных электродов менее чем на 5%.
Фармацевтические способы и композиции, описанные в данном документе, могут, в целом, снижать риск того, что пациент будет испытывать кардиотоксичность при введении противоракового лечения. В некоторых случаях фармацевтические способы и композиции, описанные в данном документе, могут снижать риск кардиотоксичности у пациента на 100%, 99%, 98%, 97%, 96%, 95%, 94%, 93%, 92%, 91%, 90%, 89%, 88%, 87%, 86%, 85%, 84%, 83%, 82%, 81%, 80%, 79%, 78%, 77%, 76%, 75%, 74%, 73%, 72%, 71%, 70%, 69%, 68%, 67%, 66%, 65%, 64%, 63%, 62%, 61%, 60%, 59%, 58%, 57%, 56%, 55%, 54%, 53%, 52%, 51%, 50%, 49%, 48%, 47%, 46%, 45%, 44%, 43%, 42%, 41%, 40%, 39%, 38%, 37%, 36%, 35%, 34%, 33%, 32%, 31%, 30%, 29%, 28%, 27%, 26%, 25%, 24%, 23%, 22%, 21%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1%. В некоторых случаях фармацевтические способы и композиции, описанные в данном документе, могут снижать риск кардиотоксичности у пациента более чем на 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%. Например, если у пациента существует 90% риск удлинения QT при введении химиотерапевтического лекарства (например, доксорубицина, эпирубицина или идарубицина) в отсутствие защитного агента, например, мирицетина, витексина, робинетина, трицетина, физетина, 7,3',4',5'-тетрагидроксифлавона, мирицитрина и/или их производного или соли), то пациент может испытывать 50% снижение риска удлинения QT, если указанный защитный агент вводят отдельно или в виде совместной композиции с указанным химиотерапевтическим лекарством, что обеспечивает 45% риск удлинения QT у пациента. Например, в одном конкретном варианте реализации пациенту внутривенно вводят защитный агент (например, мирицетин, витексин, робинетин, трицетин, физетин, 7,3',4',5'-тетрагидроксифлавон, мирицитрин и/или их производное или соль) в дозе от около 0,5 мг/кг до около 100 мг/кг по меньшей мере за 30 минут, 1 час, 2 часа, 3 часа, 4 часа, 5 часов или 6 часов до введения химиотерапевтического лекарства (например, доксорубицина, эпирубицина или идарубицина), при этом риск удлинения QT снижается по меньшей мере на 30%, 40%, 50%, 60%, 70%, 80% или 90% по сравнению с риском контрольного пациента, не принимавшего защитный агент.
Влияние антрациклин-индуцированной кардиотоксичности на сократительную способность также можно оценить посредством измерения фракции укорочения (FS) и фракции изгнания (EF), которые являются показателями систолической функции. Антрациклин, такой как доксорубицин, может обладать выраженным влиянием на сократительную способность. Однако пациент, которому вводят защитный агент Формулы 1 или Формулы 2 (например, мирицетин, итексин, робинетин, трицетин, физетин, 7,3',4',5'-тетрагидроксифлавон, дигидроробинетин, мирицитрин и/или их производное или соль), может испытывать существенно сниженную, например, доксорубицин-индуцированную кардиотоксичность, которую наблюдают по заметному улучшению FS и EF. Например, мирицетин может восстанавливать у пациента антрациклин-индуцированную дисфункцию FS и EF по меньшей мере на 30%, 40%, 50%, 60%, 70%, 80%, 90%, по сравнению с контрольной группой, которую лечили антрациклином, но не вводили дозу защитного агента.
Термин «около» в отношении количества или числового диапазона означает, что упомянутое количество или числовой диапазон является приближением в пределах экспериментальной вариабельности (или в пределах статистической экспериментальной погрешности), и, следовательно, указанное количество или числовой диапазон может варьироваться, например, от около 1% до 10% от указанного количества или числового значения.
Термин «терапевтически эффективное количество» может, в целом, относиться к количеству (или дозе) соединения или терапии, которое является минимально достаточным для предупреждения, снижения, лечения или исключения патологического состояния или его риска, при введении субъекту, нуждающемуся в таком соединении или другой терапии. В некоторых случаях термин «терапевтически эффективное количество может относиться к такому количеству соединения или другой терапии, которое является достаточным для оказания профилактического действия при введении субъекту. Терапевтически эффективное количество может варьироваться; например, оно может варьироваться в зависимости от состояния субъекта, массы и возраста субъекта, тяжести болезненного состояния, способа введения и т.п., и каждый из указанных факторов может быть определен специалистом в данной области техники.
КОМПОЗИЦИИ
Фармацевтические композиции, описанные в данном документе, могут содержать защитный агент, описанный Формулой 1 или Формулой 2 (например, мирицетин, витексин, робинетин, трицетин, физетин, 7,3',4',5'-тетрагидроксифлавон, дигидроробинетин, мирицитрин и/или их производное или соль). Фармацевтическая композиция может содержать один или более защитных агентов в любой комбинации, два или более агентов в любой комбинации, три или более защитных агентов в любой комбинации, или четыре или более защитных агентов в любой комбинации. В некоторых случаях фармацевтическая композиция может представлять собой совместную композицию из по меньшей мере двух защитных агентов (например, мирицетина, витексина, робинетина, трицетина, физетина, 7,3',4',5'-тетрагидроксифлавона, мирицетина (мирицитрина), дексразоксана и/или их производного или соли), или совместную композицию из по меньшей мере одного защитного агента и противоракового лечения (например, химиотерапевтического лекарства, биологического агента, ингибитора протеинкиназы или лучевой терапии). Защитные агенты в фармацевтической композиции могут обеспечивать снижение, исключение или предупреждение кардиотоксичности, вызванной противораковым лечением. Кроме того, защитные агенты в фармацевтической композиции также могут обеспечивать снижение, исключение или предупреждение повреждения органа, вызванного противораковым лечением. В одном примере данного описания предложена совместная композиция, содержащая мирицетин и дексразоксан. В другом примере данного описания предложена совместная композиция, содержащая химиотерапевтическое лекарство доксорубицин и мирицетин.
В некоторых случаях по меньшей мере один из защитных агентов в композиции может представлять собой флавоноид или его производное. В целом, флавоноид может представлять собой любое соединение, содержащее структурный каркас из 15 атомов углерода, состоящий из двух фениловых и одного гетероциклического кольца. Флавоноиды могут принадлежать к любому из следующих классов соединений, включая, но не ограничиваясь этим, антроксантины, флаваноны, флавонолы, флаванонолы, флаваны, антоцианадины, биофлавоноиды, изофлавоноиды, изофлавоны, изофлаваны, изофлавандиолы, изофлавены или неофлавоноиды. Неограничивающие примеры флавоноидов включают айанин, карлинозид, дигидродайдзеин, дигидрообаватин, иригенин, изоангидроикаритин, изокураринон, изоксантогумол, гарденин, лупивигтеон, метоксипуэрарин, мирифицин, мирицетин, мирицетрин (мирицитрин), дигидромирицетин, пиррозид, кемпферол, кверцетин, свертизин, сизалтерин, трицетин, физетин, робинетин, дигидроробинетин, 7,3',4',5'-тетрагидроксифлавон, 5,7,3',4',5'-пентагидроксифлавон или теветиафлавон. В одном примере фармацевтическая композиция, описанная в данном документе, может содержать флавон, такой как 7,3',4',5'-тетрагидроксифлавон и трицетин. В другом примере фармацевтическая композиция, описанная в данном документе, может содержать флавонол, такой как мирицетин, физетин, робинетин, кверцетин и кемпферол. В другом примере фармацевтическая композиция, описанная в данном документе, может содержать мирицетрин. В дополнительном примере фармацевтическая композиция, описанная в данном документе, может содержать фалаванолол, такой как дигидромирицетин и дигидроробинетин. В другом примере фармацевтическая композиция, описанная в данном документе, может содержать совместную композицию дексразоксана и флавоноида мирицетина. В частности, флавоноид мирицетин может регулировать митохондриальную токсичность в сердце посредством изменения активности киназы пируватдегидрогеназы (PDK4), белка, который может регулировать ферментативную активность в сердечной ткани.
В некоторых случаях фармацевтические композиции, описанные в данном документе, могут содержать соединение в соответствии с Формулой 1,

где:
X1 представляет собой CR5R6, NR5, О, S, С=O или C=S;
каждый из R1, R2, R3, R5, R6, R9 и R10 независимо представляет собой алкил, алкенил, алкинил, алкокси, ацил, ацилокси, карбоновую кислоту, сложный эфир, амин, амид, карбонат, карбамат, нитро, простой тиоэфир, сложный тиоэфир, циклоалкил, гетероалкил, гетероциклил, моносахарид, арил или гетероарил, любой из которых является замещенным или незамещенным, галоген, гидроксил, сульфгидрил, нитро, нитрозо, циано, азидо или Н;
R4, R7 и R8 представляют собой алкокси, гидроксил или Н;
W1 представляет собой О или S; или
его соль.
В некоторых аспектах X1 может представлять собой О или S; каждый из R1, R2, R3, R9 и R10 независимо может представлять собой алкокси, циклоалкил, галоген, гидроксил, сульфгидрил, нитро, нитрозо, циано, азидо или Н; и каждый из R4, R7 и R8 может представлять собой алкокси, гидроксил или Н.
В некоторых аспектах X1 может представлять собой О; каждый из R1, R2, R3, R9 и R10 независимо может представлять собой алкокси, циклоалкил, галоген, гидроксил, сульфгидрил, нитро, нитрозо, циано, азидо или Н; и каждый из R4, R7 и R8 может представлять собой алкокси, гидроксил или Н.
В других аспектах X1 может представлять собой О; каждый из R1 и R2 независимо может представлять собой гидроксил или Н; каждый из R3, R9 и R10 может представлять собой циклоалкил, гетероциклил, гидроксил или Н; R4 может представлять собой гидроксил; и R7 и R8 могут представлять собой гидроксил или Н.
В других аспектах X1 может представлять собой О; R1 может представлять собой гидроксил; каждый из R2 и R3 независимо может представлять собой гидроксил или Н; R9 и R10 могут представлять собой Н; R4 может представлять собой гидроксил; и R7 и R8 могут представлять собой гидроксил или Н.
В других аспектах X1 представляет собой О; R1 представляет собой гидроксил; каждый из R2 и R3 независимо может представлять собой гидроксил или Н; R9 может представлять собой гетероциклил или Н; R10 представляет собой Н; R4 независимо может представлять собой гидроксил или Н; и каждый из R7 и R8 независимо может представлять собой гидроксил или Н.
В других аспектах X1 представляет собой О; R1 представляет собой гидроксил; каждый из R2 и R9 независимо может представлять собой гидроксил или Н; R3 может представлять собой циклоалкил, гидроксил или Н; R10 представляет собой Н; R4 представляет собой гидроксил; и каждый из R7 и R8 независимо может представлять собой гидроксил или Н. В одном варианте реализации циклоалкил в R3 может представлять собой моносахарид.
В конкретном примере указанное соединение может иметь следующую формулу:
В конкретном примере указанное соединение может представлять собой мирицетин. В одном конкретном примере указанное соединение может представлять собой робинетин. В одном конкретном примере указанное соединение может представлять собой трицетин. В одном конкретном примере указанное соединение может представлять собой 7,3',4',5'-тетрагидроксифлавон. В одном конкретном примере указанное соединение может представлять собой физетин. В одном конкретном примере указанное соединение может представлять собой кемпферол. В одном конкретном примере указанное соединение может представлять собой кверцетин.
В конкретном примере защитный агент в фармацевтической композиции может представлять собой соединение, имеющее следующую структуру:

В конкретном примере защитный агент в фармацевтической композиции может представлять собой витексин, причем витексин имеет следующую структуру:

В конкретном примере указанное соединение может представлять собой соединение в соответствии с Формулой 1, где R1 представляет собой гидроксил, R2 представляет собой гидроксил, R3 представляет собой моносахарид, R4 представляет собой гидроксил, R7 представляет собой гидроксил, R8 представляет собой гидроксил, R9 представляет собой Н, R10 представляет собой Н, X1 представляет собой О, и W1 представляет собой О, или его соль. В конкретном примере указанное соединение может иметь следующую формулу:

В конкретном примере указанное соединение может представлять собой мирицетрин/мирицитрин.
В некоторых случаях указанный моносахарид может представлять собой молекулу природного или неприродного сахара. Неограничивающие примеры моносахарида включают глюкозу, декстрозу, фруктозу, галактозу, маннозу, рибозу, дезоксирибозу, D-аллозу, L-аллозу, D-альтрозу, L-альтрозу, D-фукозу, L-фукозу, D-гулозу, L-гулозу, D-сорбозу, D-тагатозу, D-арабинозу, L-арабинозу, D-ликсозу, L-ликсозу, рамнозу, D-рибозу, рибулозу, сукрорибулозу, D-ксилозу, D-эритрозу, L-эритрозу, эритрулозу, D-треозу и L-треозу.
В некоторых случаях фармацевтические композиции, описанные в данном документе, могут содержать соединение в соответствии с Формулой 2,
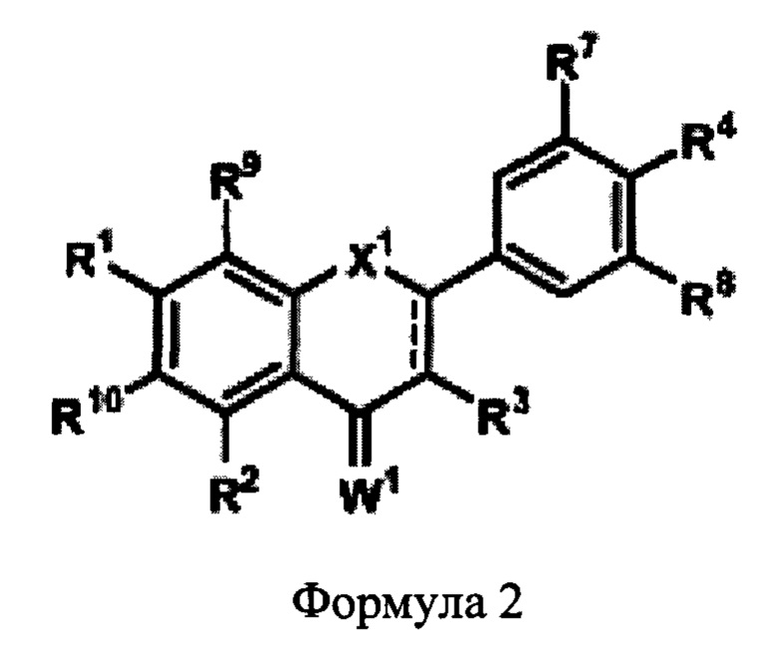
где:
X1 представляет собой CR5R6, NR5, О, S, С=O или C=S;
 представляет собой простую или двойную связь;
представляет собой простую или двойную связь;
каждый из R1, R2, R3, R5, R6, R9 и R10 независимо представляет собой алкил, алкенил, алкинил, алкокси, ацил, ацилокси, карбоновую кислоту, сложный эфир, амин, амид, карбонат, карбамат, нитро, простой тиоэфир, сложный тиоэфир, циклоалкил, гетероалкил, гетероциклил, моносахарид, арил или гетероарил, любой из которых является замещенным или незамещенным, галоген, гидроксил, сульфгидрил, нитро, нитрозо, циано, азидо или Н;
R4, R7 и R8 представляют собой гидроксил;
W1 представляет собой О или S;
или его соль.
В одном конкретном примере фармацевтические композиции Формулы 2 могут содержать дигидроробинетин.
В некоторых случаях противораковое лечение в составе фармацевтической композиции, описанной в данном документе, может представлять собой химиотерапевтическое лекарство (например, антрациклины, ингибиторы протеинкиназы и ингибиторы протеасом). В целом, химиотерапевтическое лекарство может представлять собой лекарство, которое может вызывать кардиотоксичность у пациента или субъекта. Неограничивающие примеры антрациклина могут включать даунорубицин, доксорубицин, эпирубицин, идарубицин, митоксантрон или валрубицин. Неограничивающие примеры ингибитора протеинкиназы могут включать ингибитор тирозинкиназы афатиниб, акситиниб, бозутиниб, кабозантиниб, карфилзомиб, церитиниб, кобиметаниб, кризотиниб, дабрафениб, дазатиниб, эрлотиниб, эверолимус, гефитиниб, ибрутиниб, иматиниб, лапатиниб, ленватиниб, нилотиниб, нинтеданиб, осимертиниб, палбоциклиб, пазопаниб, пегаптаниб, понатиниб, регорафениб, руксолитиниб, сиролимус, сорафениб, сунитиниб, тофацитиниб, тофацитиниб, темсиролимус, траметиниб, вандетаниб, вемурафениб или висмодегиб. Неограничивающие примеры ингибиторов тирозинкиназы, которые вызывают кардиотоксичность, включают дазатиниб, иматиниб, лапатиниб, мезилат, нилотиниб, сорафениб и сунитиниб. Неограничивающие примеры ингибиторов протеасом включают бортезомиб.
В некоторых случаях фармацевтическая композиция, описанная в данном документе, может содержать совместную композицию антрациклина (например, доксорубицина) и соединения Формулы 1 или Формулы 2 (например, мирицетина, витексина, робинетина, трицетина, физетина, 7,3',4',5'-тетрагидроксифлавона, дигидроробинетина, мирицитрина и/или их производного или соли). Например, фармацевтическая композиция содержит совместную композицию доксорубицина и мирицетина. В другом примере фармацевтическая композиция, описанная в данном документе, может содержать совместную композицию ингибитора протеинкиназы или ингибитора протеасом (например, афатиниба или бортезомиба) и мирицетина. В другом примере фармацевтическая композиция, описанная в данном документе, может содержать совместную композицию ингибитора тирозинкиназы и защитного агента. В одном варианте реализации фармацевтическая композиция, описанная в данном документе, может содержать совместную композицию сунитиниба и мирицетина. В другом примере фармацевтическая композиция, описанная в данном документе, может содержать совместную композицию сорафениба и мирицетина.
В некоторых случаях противораковое лечение в составе фармацевтической композиции, описанной в данном документе, может представлять собой биологический агент (например, антитело). Неограничивающие примеры биологического агента включают адо-трастузумаб-эмтанзин, алемтузумаб, бевацизумаб, блинатумомаб, брентуксимаб ведотин, катумаксомаб, цетуксимаб, гемтузумаб озогамицин, ибритумомаб тиуксетан, ипилимумаб, нецитумомаб, ниволумаб, обинутузумаб, офатумумаб, панитумумаб, пембролизумаб, пертузумаб, рамуцирумаб, ритуксимаб, тоситумомаб-I131 или трастузумаб. Например, фармацевтическая композиция, описанная в данном документе, может содержать совместную композицию бевацизумаба и мирицетина. Например, фармацевтическая композиция, описанная в данном документе, может содержать совместную композицию трастузумаба и мирицетина.
Соединения по данному изобретению или их фармацевтически приемлемые соли могут содержать один или более асимметричных центров и, следовательно, могут образовывать энантиомеры, диастереомеры и другие стереоизомерные формы, которые определяют, в терминах абсолютной стереохимии, как (R)- или (S)-, или как (D)- или (L)-для аминокислот. Данное изобретение включает все такие возможные изомеры, а также их рацемические и оптически чистые формы. «Стереоизомеры» относится к соединениям, состоящим из таких же атомов, связанных такими же связями, но имеющим различные трехмерные структуры, которые не являются взаимозаменяемыми. Данное описание предусматривает различные стереоизомеры и их смеси и включает «энантиомеры», которые относятся к двум стереоизомерам, молекулы которых представляют собой не совместимые при наложении зеркальные отражения друг друга. Оптически активные (+) и (-), (R)- и (S)-, или (D)- и (L)- изомеры могут быть получены с применением хиральных синтонов или хиральных реагентов, или выделены с применением стандартных технологий, например, хроматографии и фракционной кристаллизации. Традиционные технологии получения/выделения отдельных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или выделение из рацемата (или рацемата соли или производного) с помощью, например, хиральной жидкостной хроматографии высокого давления (ВЭЖХ). Если соединения, описанные в данном документе, содержат олефиновые двойные связи или другие центры геометрической асимметрии, и если не указано иное, то предусмотрено, что такие соединения включают как Е, так и Z геометрические изомеры.
При необходимости, (R)- и (S)-изомеры соединений по данному описанию, при их наличии, могут быть выделены способами, известными специалистам в данной области техники, например, посредством образования диастереоизомерных солей или комплексов, которые могут быть разделены, например, кристаллизацией; посредством образования диастереоизомерных производных, которые могут быть разделены, например, кристаллизацией, газожидкостной или жидкостной хроматографией; посредством селективного взаимодействия одного энантиомера с энантиомер-специфическим реагентом, например, ферментативного окисления или восстановления, с последующим разделением модифицированных и немодифицированных энантиомеров; или газожидкостной или жидкостной хроматографией в хиральных условиях, например, на хиральной подложке, такой как диоксид кремния со связанным хиральным лигандом, или в присутствии хирального растворителя. Альтернативно, конкретный энантиомер может быть синтезирован путем асимметричного синтеза с использованием оптически активных реагентов, субстратов, катализаторов или растворителей, или путем преобразования одного энантиомера в другой путем асимметричной трансформации.
Дозы соединений можно вводить в их энантиомерно чистой форме. В некоторых примерах соединение имеет энантиомерный избыток более чем около 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98% или 99%. Дозы соединений можно вводить в их диастереомерно чистой форме. В некоторых примерах соединение имеет диастереомерный избыток более чем около 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98% или 99%.
Стереоцентры можно определять по правилам приоритета Кана-Ингольда-Прелога. Соединения могут иметь стереоцентры в R-конфигурации. Соединения могут иметь стереоцентры в S-конфигурации.
Некоторые соединения могут проявлять полиморфизм. Следует понимать, что данное описание включает любые рацемические, оптически активные, полиморфные или стереоизомерные формы, или их смеси соединения по данному описанию, которые обладают полезными свойствами, описанными в данном документе; и в данном области техники хорошо известно, как получить оптически активные формы (например, посредством разделения рацемической формы методами перекристаллизации, путем синтеза из оптически активных исходных веществ, хиральным синтезом или хроматографическим разделением с использованием хиральной неподвижной фазы).
В некоторых конкретных вариантах реализации субъекту можно вводить более одного соединения по данному описанию за один раз. В некоторых вариантах реализации два соединения по данному описанию в комбинации могут действовать синергетически или аддитивно, и любое соединение можно использовать в меньшем количестве, чем при его введении в отдельности.
В некоторых вариантах реализации соединения, описанные в данном документе, и/или их фармацевтические композиции можно использовать в комбинированной терапии с другими терапевтическими агентами. Соединения, описанные в данном документе, и/или их фармацевтические композиции и указанный терапевтический агент могут действовать аддитивно или, более предпочтительно, синергетически. В некоторых вариантах реализации соединения, описанные в данном документе, и/или их фармацевтические композиции вводят одновременно с введением другого терапевтического агента. Например, соединения, описанные в данном документе, и/или их фармацевтические композиции можно вводить вместе с другим терапевтическим агентом. В других вариантах реализации соединения, описанные в данном документе, и/или их фармацевтические композиции вводят до или после введения других терапевтических агентов.
Соединения по данному описанию или их фармацевтически приемлемые соли обычно вводят в терапевтически эффективном количестве. Фактически введенное количество соединения может быть определено врачом или медицинским работником, ухаживающим за пациентом, с учетом релевантных обстоятельств, включая патологическое состояние, подлежащее лечению, выбранный способ введения, введенное соединение и его относительную активность, возраст, массу, ответ конкретного пациента, тяжесть симптомов пациента и т.п.
В данном описании дополнительно предложены соли любого соединения, описанного в данном документе. Термин «соль» относится к солям, полученным из различных органических и неорганических противоионов, хорошо известных в данной области техники. Соли включают, например, соли присоединения кислот и соли присоединения оснований. Кислота, которую добавляют к соединению с получением соли присоединения кислоты, может быть органической кислотой или неорганической кислотой. Неорганические кислоты, из которых могут быть получены соли, включают, например, хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п. Органические кислоты, из которых могут быть получены соли, включают, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфоновую кислоту, салициловую кислоту и т.п. Основание, которое добавляют к соединению с получением соли присоединения основания, может быть органическим основанием или неорганическим основанием. В некоторых случаях соль может быть солью металла. В некоторых случаях соль может быть аммониевой солью. Неорганические основания, из которых могут быть получены соли, включают, например, гидроксиды натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и т.п. Органические основания, из которых могут быть получены соли, включают, например, первичные, вторичные и третичные амины, замещенные амины, включая природные замещенные амины, циклические амины, основные ионообменные смолы и т.п.
Соли присоединения кислот могут образовываться при добавлении кислоты к соединению, описанному в данном документе. В некоторых случаях кислота может быть органической. В некоторых случаях кислота может быть неорганической. Неограничивающие примеры подходящих кислот включают хлористоводородную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, азотную кислоту, азотистую кислоту, серную кислоту, сернистую кислоту, фосфорную кислоту, никотиновую кислоту, изоникотиновую кислоту, молочную кислоту, салициловую кислоту, 4-аминосалициловую кислоту, винную кислоту, аскорбиновую кислоту, гентизиновую кислоту, глюконовую кислоту, глюкуроновую кислоту, сахарную кислоту, муравьиную кислоту, бензойную кислоту, глутаминовую кислоту, пантотеновую кислоту, уксусную кислоту, пропионовую кислоту, масляную кислоту, фумаровую кислоту, янтарную кислоту, лимонную кислоту, щавелевую кислоту, малеиновую кислоту, гидроксималеиновую кислоту, метилмалеиновую кислоту, гликолевую кислоту, яблочную кислоту, коричную кислоту, миндальную кислоту, 2-феноксибензойную кислоту, 2-ацетоксибензойную кислоту, эмбоновую кислоту, фенилуксусную кислоту, N-циклогексилсульфамовую кислоту, метансульфоновую кислоту, этансульфоновую кислоту, бензолсульфоновую кислоту, п-толуолсульфоновую кислоту, 2-гидроксиэтансульфоновую кислоту, этан-1,2-дисульфоновую кислоту, 4-метилбензолсульфоновую кислоту, нафталин-2-сульфоновую кислоту, нафталин-1,5-дисульфоновую кислоту, 2-фосфоглицериновую кислоту, 3-фосфоглицериновую кислоту, глюкозо-6-фосфорную кислоту и аминокислоту. Неограничивающие примеры подходящих солей присоединения кислот гидрохлоридную соль, гидробромидную соль, гидройодидную соль, нитратную соль, нитритную соль, сульфатную соль, сульфитную соль, соль, фосфатную соль, гидрофосфатную соль, дигидрофосфатную соль, карбонатную соль, бикарбонатную соль, никотинатную соль, изоникотинатную соль, лактатную соль, салицилатную соль, 4-аминосалицилатную соль, тартратную соль, аскорбатную соль, соль гентизинатную соль, глюконатную соль, глюкаронатную соль, сахаратную соль, формиатную соль, бензоатную соль, глутаматную соль, пантотенатную соль, ацетатную соль, пропионатную соль, бутиратную соль, фумаратную соль, сукцинатную соль, цитратную соль, оксалатную соль, малеатную соль, гидроксималеатную соль, метилмалеатную соль, гликолятную соль, малатную соль, циннаматную соль, манделатную соль, 2-феноксибензоатную соль, 2-ацетоксибензоатную соль, эмбонатную соль, фенилацетатную соль, N-циклогексилсульфаматную соль, метансульфонатную соль, этансульфонатную соль, бензолсульфонатную соль, п-толуолсульфонатную соль, 2-гидроксиэтансульфонатную соль, этан-1,2-дисульфонатную соль, 4-метилбензолсульфонатную соль, нафталин-2-сульфонатную соль, нафталин-1,5-дисульфонатную соль, 2-фосфоглицератную соль, 3-фосфоглицератную соль, глюкозо-6-фосфатную соль и соль аминокислоты.
Соли металлов могут образовываться при добавлении неорганического основания к соединению, описанному в данном документе. Неорганическое основание состоит из катиона металла в паре с основным противоионом, таким как, например, гидроксид, карбонат, бикарбонат или фосфат. Металл может быть щелочным металлом, щелочноземельным металлом, переходным металлом или металлом главной группы. Неограничивающие примеры подходящих металлов включают литий, натрий, калий, цезий, церий, магний, марганец, железо, кальций, стронций, кобальт, титан, алюминий, медь, кадмий и цинк. Неограничивающие примеры подходящих солей металлов включают соль лития, соль натрия, соль калия, соль цезия, соль церия, соль магния, соль марганца, соль железа, соль кальция, соль стронция, соль кобальта, соль титана, соль алюминия, соль меди, соль кадмия и соль цинка. Соли аммония могут образовываться при добавлении аммиака или органических аминов к соединению, описанному в данном документе. Неограничивающие примеры подходящих органических аминов включают триэтиламин, диизопропиламин, этаноламин, диэтаноламин, триэтаноламин, морфолин, N-метилморфолин, пиперидин, N-метилпиперидин, N-этилпиперидин, дибензиламин, пиперазин, пиридин, пиразол, пиперазол, имидазол, пиразин, пипиразин, этилендиамин, N,N'-дибензилэтилендиамин, прокаин, хлорпрокаин, холин, дициклогексиламин и N-метилглюкамин. Неограничивающие примеры подходящих солей аммония могут представлять собой триэтиламиновую соль, диизопропиламиновую соль, этаноламиновую соль, диэтаноламиновую соль, триэтаноламиновую соль, морфолиновую соль, N-метилморфолиновую соль, пиперидиновую соль, N-метилпиперидиновую соль, N-этилпиперидиновую соль, дибензиламиновую соль, пиперазиновую соль, пиридиновую соль, пиразольную соль, пиперазольную соль, имидазольную соль, пиразиновую соль, пипиразиновую соль, этилендиаминовую соль, N,N'-дибензилэтилендиаминовую соль, прокаиновую соль, хлорпрокаиновую соль, холиновую соль, дициклогексиламиновую соль и N-метилглюкаминовую соль.
Термин «фармацевтически приемлемый носитель» или «фармацевтически приемлемое вспомогательное вещество» включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и задерживающие всасывание агенты и т.п. Применение таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области техники. За исключением случаев, когда любые обычные среды или агент несовместимы с активным ингредиентом, предусмотрено их применение в терапевтических композициях по данному описанию. Дополнительные активные компоненты также могут быть включены в композиции.
Термин «фармацевтически приемлемое вспомогательное вещество» включает среды и носители, которые можно вводить совместно с указанным соединением для облегчения осуществления предполагаемой функции. Применение таких сред для фармацевтически активных веществ хорошо известно в данной области техники. Примеры таких сред и носителей включают растворы, растворители, дисперсионные среды, замедляющие агенты, эмульсии и т.п. В объем данного изобретения также входят любые другие стандартные носители, подходящие для применения с указанными полисвязывающими соединениями.
При получении композиций по данному описанию активный агент можно разбавлять вспомогательным веществом. Некоторые примеры подходящих вспомогательных веществ включают лактозу, декстрозу, сахарозу, сорбит, маннит, крахмалы, гуммиарабик, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу, ПЭГ, поливинилпирролидон, целлюлозу, воду, стерильный солевой раствор, сироп и метилцеллюлозу. Композиции могут дополнительно содержать: смазывающие агенты, такие как тальк, стеарат магния и минеральное масло; смачивающие агенты; эмульгирующие и суспендирующие агенты; консерванты, такие как метил- и пропилгидроксибензоат; подсластители; и ароматизаторы. Композиции по данному изобретению могут быть составлены таким образом, чтобы обеспечить быстрое, устойчивое или замедленное высвобождение активного ингредиента после введения пациенту, с использованием методик, известных в данной области.
В некоторых случаях фармацевтические композиции, описанные в данном документе, могут содержать вспомогательное вещество, которое может обеспечивать долгосрочную консервацию, увеличение объема композиции, которая содержит высокоэффективные активные ингредиенты, облегчение всасывания лекарства, снижение вязкости, улучшение вкуса или усиление растворимости фармацевтической композиции. Неограничивающие примеры вспомогательных веществ могут включать антиадгезивы, связующие вещества (например, сахароза, лактоза, крахмалы, целлюлоза, желатин или полиэтиленгликоль), покрытия (например, гидроксипропилметилцеллюлоза или желатин), разрыхлители, красители, ароматизаторы (например, мята, персик, малина или ваниль), скользящие агенты, смазывающие агенты, консерванты (например, кислоты, сложные эфиры, фенолы, ртутные соединения или аммониевые соединения), сорбенты или носители (например, нефтяное или минеральное масло).
Лекарственные формы
Фармацевтические композиции, описанные в данном документе, могут представлять собой любой тип лекарственной формы, включая твердые лекарственные формы, содержащие соединение Формулы 1 или Формулы 2.
В некоторых случаях твердая лекарственная форма содержит по меньшей мере 0,01 мг, 0,1 мг, 1 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 20 мг, 30 мг, 40 мг, 50 мг, 60 мг, 70 мг, 80 мг, 90 мг, 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 450 мг, 500 мг, 550 мг, 600 мг, 650 мг, 700 мг, 750 мг, 800 мг, 850 мг, 900 мг, 950 мг или 1000 мг одного или более защитных агентов Формулы 1 или Формулы 2, составленных отдельно или в комбинации с химиотерапевтическим лекарством или биологическим агентом.
В некоторых случаях твердая лекарственная форма может содержать по меньшей мере 0,1 мг, 1 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 20 мг, 30 мг, 40 мг, 50 мг, 60 мг, 70 мг, 80 мг, 90 мг, 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 450 мг, 500 мг, 550 мг, 600 мг, 650 мг, 700 мг, 750 мг, 800 мг, 850 мг, 900 мг, 950 мг, 1 г, 5 г, 10 г, 25 г, 50 г или 100 г одного или более защитных агентов (например, мирицетина и/или его производного или соли). Например, фармацевтическая композиция, описанная в данном документе, может представлять собой 100 мг твердую совместную композицию мирицетина (75 мг из 100 мг дозы) и доксорубицина (25 мг из 100 мг дозы).
В некоторых случаях твердая лекарственная форма (или другой тип лекарственной формы) может содержать по меньшей мере 0,1 мг, 1 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 20 мг, 30 мг, 40 мг, 50 мг, 60 мг, 70 мг, 80 мг, 90 мг, 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 450 мг, 500 мг, 550 мг, 600 мг, 650 мг, 700 мг, 750 мг, 800 мг, 850 мг, 900 мг, 950 мг или 1000 мг дексразоксана. Например, фармацевтическая композиция, описанная в данном документе, может содержать 100 мг твердой совместной композиции мирицетина (75 мг из 100 мг дозы) и дексразоксана (25 мг из 100 мг дозы).
Фармацевтические композиции, описанные в данном документе, могут представлять собой жидкую лекарственную форму. В некоторых случаях жидкая лекарственная форма может содержать концентрацию по меньшей мере 0,1 мг/мл, 1 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл, 5 мг/мл, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл, 10 мг/мл, 20 мг/мл, 30 мг/мл, 40 мг/мл, 50 мг/мл, 60 мг/мл, 70 мг/мл, 80 мг/мл, 90 мг/мл, 100 мг/мл, 150 мг/мл, 200 мг/мл, 250 мг/мл, 300 мг/мл, 350 мг/мл, 400 мг/мл, 450 мг/мл, 500 мг/мл, 550 мг/мл, 600 мг/мл, 650 мг/мл, 700 мг/мл, 750 мг/мл, 800 мг/мл, 850 мг/мл, 900 мг/мл, 950 мг/мл или 1000 мг/мл одного или более защитных агентов Формулы 1 или Формулы 2, составленных отдельно или в комбинации с химиотерапевтическим лекарством или биологическим агентом. Например, фармацевтическая композиция, описанная в данном документе, может содержать концентрацию 100 мг/мл защитного агента мирицетина и концентрацию 50 мг/мл доксорубицина.
В некоторых случаях жидкая лекарственная форма может содержать концентрацию по меньшей мере 0,1 мг/мл, 1 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл, 5 мг/мл, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл, 10 мг/мл, 20 мг/мл, 30 мг/мл, 40 мг/мл, 50 мг/мл, 60 мг/мл, 70 мг/мл, 80 мг/мл, 90 мг/мл, 100 мг/мл, 150 мг/мл, 200 мг/мл, 250 мг/мл, 300 мг/мл, 350 мг/мл, 400 мг/мл, 450 мг/мл, 500 мг/мл, 550 мг/мл, 600 мг/мл, 650 мг/мл, 700 мг/мл, 750 мг/мл, 800 мг/мл, 850 мг/мл, 900 мг/мл, 950 мг/мл или 1000 мг/мл мирицетина или его производного или соли. Например, фармацевтическая композиция, описанная в данном документе, может содержать концентрацию 100 мг/мл мирицетина.
В некоторых случаях жидкая лекарственная форма может содержать концентрацию по меньшей мере 0,1 мг/мл, 1 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл, 5 мг/мл, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл, 10 мг/мл, 20 мг/мл, 30 мг/мл, 40 мг/мл, 50 мг/мл, 60 мг/мл, 70 мг/мл, 80 мг/мл, 90 мг/мл, 100 мг/мл, 150 мг/мл, 200 мг/мл, 250 мг/мл, 300 мг/мл, 350 мг/мл, 400 мг/мл, 450 мг/мл, 500 мг/мл, 550 мг/мл, 600 мг/мл, 650 мг/мл, 700 мг/мл, 750 мг/мл, 800 мг/мл, 850 мг/мл, 900 мг/мл, 950 мг/мл или 1000 мг/мл дексразоксана, составленного вместе с одним или более защитивши агентами.
В некоторых случаях фармацевтическая композиция, описанная в данном документе, может содержать по меньшей мере 2 защитных агента. Молярное отношение одного защитного агента к по меньшей мере одному другому защитному агенту может составлять около 1:1, около 1:2, около 1:3, около 1:4, около 1:5, около 1:6, около 1:7, около 1:8, около 1:9, около 1:10, около 1:20, около 1:30, около 1:40, около 1:50, около 1:60, около 1:70, около 1:80, около 1:90, около 1:100, около 1:1000, около 1:10000 или около 1:>10000.
В некоторых случаях фармацевтическая композиция, описанная в данном документе, может содержать противораковое лечение (например, химиотерапевтическое лекарство или биологический агент) и по меньшей мере один защитный агент. Молярное отношение противоракового лечения к по меньшей мере одному другому защитному агенту может составлять около >10000:1, около 10000:1, около 1000:1, около 100:1, около 90:1, около 80:1, около 70:1, около 60:1, около 50:1, около 40:1, около 30:1, около 20:1, около 10:1, около 9:1, около 8:1, около 7:1, около 6:1, около 5:1, около 4:1, около 3:1, около 2:1, около 1:1, около 1:2, около 1:3, около 1:4, около 1:5, около 1:6, около 1:7, около 1:8, около 1:9, около 1:10, около 1:20, около 1:30, около 1:40, около 1:50, около 1:60, около 1:70, около 1:80, около 1:90, около 1:100, около 1:1000, около 1:10000 или около 1:>10,000.
Наборы
В некоторых случаях фармацевтические композиции, описанные в данном документе, могут быть собраны в наборы. В некоторых случаях набор может содержать защитный агент, причем указанный защитный агент может присутствовать в данном наборе в виде отдельных элементов или в виде совместной композиции. Например, набор может содержать один или более защитных агентов, выбранных из группы, состоящей из мирицетина, трицетина, робинетина, физетина, витексина, дигидроробинетина, 7,3',4',5'-тетрагидроксифлавона, мирицитрина и дексразоксана. В некоторых случаях набор может содержать по меньшей мере два защитных агента, причем указанные два защитных агента могут присутствовать в наборе в виде отдельных элементов или в виде совместной композиции. Например, набор может содержать по меньшей мере два защитных агента, выбранных из группы, состоящей из мирицетина, трицетина, робинетина, физетина, витексина, дигидроробинетина, 7,3',4',5'-тетрагидроксифлавона, мирицитрина и дексразоксана. В конкретном примере набор может содержать совместную композицию мирицетина и дексразоксана. В некоторых случаях набор может содержать противораковое лечение и по меньшей мере один защитный агент, причем противораковое лечение и по меньшей мере один защитный агент могут присутствовать в указанном наборе в виде отдельных элементов или в виде совместной композиции. Например, набор может содержать противораковое лечение и мирицетин и/или его производное. Например, набор может содержать противораковое лечение и робинетин и/или его производное. Например, набор может содержать противораковое лечение и дигидроробинетин и/или его производное. Например, набор может содержать противораковое лечение и трицетин и/или его производное. Например, набор может содержать противораковое лечение и физетин и/или его производное. Например, набор может содержать противораковое лечение и 7,3',4',5'-тетрагидроксифлавон и/или его производное.
В одном варианте реализации набор может содержать совместную композицию доксорубицина и мирицетина.
В некоторых случаях набор также может содержать инструкции по применению. Набор также может содержать флаконы, пробирки, иглы, упаковку или другие материалы.
Предложены наборы с разовыми дозами одного или более соединений, описанных в данном документе, обычно в дозах для перорального применения или инъекций. Такие наборы могут содержать контейнер, содержащий разовую дозу, информационный листок-вкладыш, описывающий применение и сопутствующий полезный эффект лекарств при лечении заболевания, а также необязательно приспособление или устройство для доставки композиции.
Набор может дополнительно содержать любое устройство, подходящее для введения композиции. Например, набор, содержащий инъекционную лекарственную форму фармацевтических композиций может содержать иглу, подходящую для подкожного введения и спиртовую салфетку для стерилизации области инъекции.
В некоторых случаях наборы могут быть снабжены инструкциями. Инструкции могут быть представлены в указанном наборе или они могут быть в электронном доступе. Инструкции могут обеспечивать информацию о способе применения композиций по данному описанию. Инструкции могут дополнительно обеспечивать информацию о способе применения устройств по данному описанию. Инструкции могут обеспечивать информацию о способе осуществления способов по данному описанию. В некоторых случаях инструкции могут обеспечивать информацию о дозах. Инструкции могут обеспечивать информацию о лекарстве, например, о механизме действия, составе лекарства, риске неблагоприятных явлений, противопоказаниях и т.п. В некоторых случаях набор приобретает врач или медицинский рабочий, обеспечивающий уход, для введения в клинике или больнице. В некоторых случаях набор приобретает лаборатория и использует для отбора соединений-кандидатов.
ПРИМЕРЫ
Пример 1. Мирицетин обеспечивает долговременную кардиозащиту (жизнеспособность клетки)
Образцы клеток получали посредством дифференцировки индуцированных полипотенциальных стволовых клеток в кардиомиоциты. Клетки выращивали в течение 4 дней после дифференцировки, меняя среду на 3 день, до осуществления экспериментов. Образцы обрабатывали плацебо, обрабатывали 1,25 мкМ доксорубицином, обрабатывали мирицетином или совместно обрабатывали 1,25 мкМ доксорубицином и мирицетином в течение 72 часов. После обработки образцы инкубировали с красителем Hoeschst 33342 для определения клеточных ядер. Клетки визуализировали с помощью INCell Analyzer2200, и анализировали изображения для количественного определения общего количества клеток, и наносили на график как процент всех клеток, нормированный к контрольному образцу (слева), где каждую точку данных получали из трех биологических повторений. Иллюстративные изображения (Фиг. 3, справа) представлены для каждого образца, причем увеличение сигнала Hoechst 33342 отображает увеличение клеточной жизнеспособности.
Кардиомиоциты обрабатывали плацебо, обрабатывали 1,25 мкМ доксорубицином, обрабатывали мирицетином или совместно обрабатывали 1,25 мкМ доксорубицином и мирицетином в течение 72 часов, а затем окрашивали для определения общего количества клеток (Фиг. 3). Мирицетин представлял собой эффективный защитный агент для жизнеспособности клеток. Кардиомиоциты, обработанные 1,25 мкМ доксорубицином без мирицетина, демонстрировали 62,6% снижение общего количества клеток, тогда как кардиомиоциты, совместно обработанные мирицетином и 1,25 мкМ доксорубицином, демонстрировали 27,57% снижение общего количества клеток, по сравнению с контрольным образцом, обработанным плацебо. Кардиомиоциты, обработанные мирицетином без доксорубицина, демонстрировали отсутствие существенного различия по общему количеству клеток, в сравнении с контрольным образцом, обработанным плацебо. Планки погрешностей представляют собой стандартное отклонение. Иллюстративные изображения представлены для каждого образца, причем увеличение сигнала Hoechst 33342 отображает увеличение клеточной жизнеспособности. Кардиомиоциты, обработанные 1,25 мкМ доксорубицином (Фиг. 3, справа: нижняя левая панель) без мирицетина, демонстрировали снижение сигнала Hoechst 33342, тогда как кардиомиоциты, совместно обработанные 79 мкМ мирицетином и 1,25 мкМ доксорубицином (Фиг. 3, справа: нижняя правая панель), демонстрировали меньшее снижение сигнала Hoechst 33342, по сравнению с контрольным образцом, обработанным плацебо (Фиг. 3, справа: верхняя левая панель). Кардиомиоциты, обработанные мирицетином (Фиг. 3, справа: верхняя правая панель) без доксорубицина, демонстрировали отсутствие существенного различия по сигналу Hoechst 33342, в сравнении с контрольным образцом, обработанным плацебо.
Пример 2. Влияние мирицетина на вызванную доксорубицином кардиотоксичность через 2 дня после обработки (митохондриальная токсичность)
Человеческие кардиомиоциты из iPSC получали посредством дифференцировки индуцированных полипотенциальных стволовых клеток в кардиомиоциты. Клетки выращивали в течение 4 дней после дифференцировки, меняя среду на 3 день, до осуществления экспериментов. Кардиомиоциты обрабатывали 1,25 мкМ доксорубицином (Фиг. 4А) или совместно обрабатывали 1,25 мкМ доксорубицином и 79 мкМ мирицетином (Фиг. 4В) в течение 2 дней. После обработки образцы инкубировали с красителем, метиловым эфиром тетраметилродамина (TMRM), для определения митохондриального здоровья, а также с Hoechst 33342 для определения клеточных ядер. Клетки визуализировали с помощью INCell Analyzer2200. Иллюстративные изображения представлены для каждого образца, причем снижение сигнала TMRM отображает увеличение митохондриальной токсичности. Мирицетин представлял собой эффективный защитный агент против вызванной доксорубицином митохондриальной токсичности, о чем свидетельствует более высокий сигнал TMRM в клетках, совместно обработанных 1,25 мкМ доксорубицином и 79 мкМ мирицетином (Фиг. 4В), по сравнению с клетками, обработанными 1,25 мкМ доксорубицином без мирицетина (Фиг. 4А).
Пример 3. Влияние мирицетина на вызванную доксорубицином кардиотоксичность через 3 дня после обработки (сократительная способность)
Человеческие кардиомиоциты из iPSC получали так, как описано выше. Образцы обрабатывали плацебо, обрабатывали 1,25 мкМ доксорубицином, обрабатывали 79 мкМ мирицетином или совместно обрабатывали 1,25 мкМ доксорубицином и 79 мкМ мирицетином в течение 72 часов. После обработки записывали видео биения кардиомиоцитов, используя прибор Pulse, и анализировали для количественного определения частоты биений (Фиг. 5; слева) на основании графиков сокращения клеток, где каждую точку данных получали из трех биологических повторений. Иллюстративные графики сокращения клеток (Фиг. 5; справа) представлены для каждого образца. Мирицетин представлял собой эффективный защитный агент для сократительной способности клеток. Обработанные плацебо кардиомиоциты сокращались с частотой 33,33 биений в минуту, тогда как обработка 1,25 мкМ доксорубицином без мирицетина полностью подавляла сократительную способность. Кардиомиоциты, обработанные мирицетином или совместно обработанные мирицетином и 1,25 мкМ доксорубицином, сокращались с частотой 39,33 или 37,33 биений в минуту, соответственно. На Фиг. 6А-С представлена диаграмма, демонстрирующая исходные данные (6А) или нормализованные данные (6В), полученные в экспериментах, представленных на Фиг. 3, или исходные данные, полученные в экспериментах, представленных на Фиг. 5 (6С).
Пример 4. Влияние различных флавонолов и флавонов на вызванную доксорубицином кардиотоксичность через 3 дня после обработки (апоптоз) Кардиомиоциты получали так, как описано выше. Клетки совместно обрабатывали 1 мкМ доксорубицина и либо мирицетином (Фиг. 7А), мирицетрином (Фиг. 7В), либо дигидромирицетином (Фиг. 7С) в течение 3 дней. После обработки образцы инкубировали с красителем CellEvent для определения апоптоз-положительных клеток, и со вторым красителем для определения клеточных ядер. Клетки визуализировали с помощью INCell Analyzer2200, и анализировали изображения для количественного определения процента апоптозных клеток. Данные представлены на основании двух независимых наборов скринингов, где каждая точка данных получена из трех повторений.
Кардиомиоциты, совместно обработанные доксорубицином и мирицетином (Фиг. 7А), мирицитрином (Фиг. 7В), или дигидромирицетином (Фиг. 7С), демонстрировали защитный эффект от апоптоза, с полуминимальными ингибирующими концентрациями (IC50; например, концентрация лекарства, которая вызывает апоптоз 50 процентов), составляющими 20,46 мкМ, 38,48 мкМ, 40,48 мкМ, соответственно.
Пример 5. Мирицетин снижает цитотоксичность DOX в кардиомиоцитах
Для оценки действия MYR против DOX-индуцированной цитотоксичности, человеческие кардиомиоциты, полученные из IPSC, обрабатывали плацебо (треугольники) или обрабатывали 100 мкМ мирицетином (MYR; круги) и увеличивающимися концентрациями доксорубицина (DOX) в течение 72 часов, а затем инкубировали с красителями, которые отображают митохондриальное здоровье (TMRM, Life Technologies) и клеточные ядра (Hoechst 33342, Life Technologies). Клетки визуализировали с помощью INCell Analyzer2200 (GE). Общее количество здоровых клеток подсчитывали и наносили на график как процент от контрольного образца, обработанного плацебо. Летальная концентрация, при которой под действием доксорубицина погибло 50% клеток (LC50), сместилась с 0,41 мкМ в образце, обработанном плацебо, до 1,29 мкМ при обработке MYR для кардиомиоцитов iPSC (Фиг. 8). Данные представлены на основании нескольких независимых наборов скринингов, где каждая точка данных получена из трех повторений. (n=3). Ось Y: процент выживания клеток; и ось X: увеличивающиеся концентрации DOX (Фиг. 8).
Пример 6. Мирицетин защищает от DOX-индуцированной гибели клеток в исследовании на кардиомиоцитах
Для измерения степени предохранения от DOX-индуцированной гибели клеток в исследовании на кардиомиоцитах, защитный эффект мирицетина напрямую сравнивали с действием дексразоксана (DEX; стандарт лечения). Человеческие кардиомиоциты, полученные из iPSC, обрабатывали 0,5 мкМ доксорубицином и увеличивающимися концентрациями мирицетина (MYR, круги) или дексразоксана (DEX, квадраты). Через 72 часа обработки клетки инкубировали с красителями, отображающими митохондриальное здоровье (TMRM, Life Technologies) и клеточные ядра (Hoechst 33342, Life Technologies). Клетки визуализировали с помощью INCell Analyzer2200 (GE). Общее количество здоровых клеток подсчитывали и наносили на график как процент от контрольного образца, обработанного доксорубицином. Полумаксимальная эффективная концентрация (ЕС50) для MYR составляла 7,50 мкМ (Фиг. 9). Напротив, DEX не демонстрировал существенного предохранения от DOX-индуцированной цитотоксичности. (n=3).
Пример 7. Мирицетин защищает от DOX-индуцированной дисфункции сократительной способности и двухцепочечного разрыва ДНК в кардиомиоцитах
Для оценки защитного действия мирицетина на сократительную способность сердечных клеток, образцы клеток получали посредством дифференцировки индуцированных полипотенциальных стволовых клеток в кардиомиоциты. Клетки выращивали в течение 4 дней после дифференцировки, меняя среду на 3 день, до осуществления экспериментов. Затем человеческие кардиомиоциты, полученные из iPSC, обрабатывали ДМСО, DOX (0,5 мкМ), DOX плюс DEX (100 мкМ) или DOX плюс MYR (100 мкМ). Через 48 часов обработки записывали видео биения кардиомиоцитов с помощью прибора Pulse (Cellogy). Обработка DOX вызывала дисфункцию сократительной способности кардиомиоцитов, о чем свидетельствует сокращение биения, продолжительности и высоты пика. Такая сократительная дисфункция была существенно восстановлена под действием MYR, по сравнению с DEX (Фиг. 10). Данные представлены на основании нескольких независимых наборов экспериментов, где каждая точка данных получена из 6 образцов (n=6). Использовали t-критерий Стьюдента (непарный, двусторонний) для определения значимости указанного отличия.
Для определения того, защищает ли MYR от DOX-индуцированного двухцепочечного разрыва ДНК в клетках, человеческие кардиомиоциты, полученные из iPSC, обрабатывали ДМСО, DOX (0,5 мкМ), DOX плюс DEX (100 мкМ) или DOX плюс MYR (100 мкМ). Через 48 часов после обработки клетки подвергали иммуноокрашиванию с использованием антитела против γН2АХ (EMD Millipore) для определения двухцепочечного разрыва. Затем клетки визуализировали с помощью INCell Analyzer2200 (GE) и для каждого состояния количественно определяли процент γН2АХ-положительных клеток. В то время как DEX демонстрирует незначительную защиту или отсутствие защиты от DOX-индуцированного двухцепочечного разрыва в испытанных сердечных клетках, MYR обеспечивает существенную защиту от связанного с DOX повреждения ДНК (Фиг. 11).Т-критерий Стьюдента (непарный, двусторонний; n=6).
Пример 8. MYR защищает от разрушения саркомера под действием DOX
DOX-индуцированная гибель клеток зачастую проявляется тяжелыми структурными нарушениями организации кардиомиоцитов (например, саркомера). Для оценки защитного действия MYR от DOX-индуцированного разрушения саркомера, человеческие кардиомиоциты, полученные из iPSC, обрабатывали ДМСО, DOX (0,5 мкМ) или DOX плюс MYR (100 мкМ). Через 72 часа после обработки клетки подвергали иммуноокрашиванию с использованием антитела против сердечного тропонина Т (Abeam) для визуализации саркомерной организации в сердечных клетках. Как показано на Фиг. 12, MYR обеспечивает существенную защиту от DOX-индуцированного разрушения саркомера в кардиомиоцитах, позволяя предположить, что защитный эффект MYR против DOX-индуцированной гибели клеток хорошо проявляется в структурной целостности кардиомиоцитов.
Пример 9. Мирицетин является эффективным ингибитором TOPOIIα and β
Для понимания молекулярного механизма действия мирицетина (MYR) и дексразоксана (DEX) на кардиозащиту, оценивали влияние указанных двух соединений на топоизомеразы II (т.е. TOPOIIα и β), очевидную мишень DOX.
200 нг кинетопластной ДНК (кДНК) инкубировали с одним ферментативным звеном фермента TOPOIIα или TOPOIIβ (Inspiralis) и с различными концентрациями MYR или DEX при 37°С в течение 30 минут. Затем реакционную смесь разделяли на 1% агарозном геле для визуализации декатенированной ДНК (нижняя полоса). Эффективность каталитического ингибирования количественно определяли посредством измерения относительной интенсивности указанной полосы.
MYR и DEX демонстрировали 50% ингибирование (IC50) активности фермента TOPOIIα при концентрациях 1,18 мкМ и 52,70 мкМ, соответственно (Фиг. 13; n=3). IC50 активности фермента TOPOIIβ для MYR и DEX составляла 2,07 мкМ и 34,43 мкМ, соответственно (Фиг. 13; n=3). Полученные данные позволяют предположить, что MYR является существенно более эффективным ингибитором, чем DEX, для обеих топоизомераз IIα и β.
Пример 10. В отличие от DEX, MYR не вызывает разрушение белка TOPOII
Для определения дополнительных отличий молекулярного механизма действия MYR от механизма DEX, а также для определения того, обусловлен ли ингибирующий эффект MYR на TOPOII, наблюдаемый в анализе декатенации, описанном выше, разрушением белков TOPOII, человеческие кардиомиоциты, полученные из iPSC, обрабатывали ДМСО, DEX (100 мкМ) или MYR (100 мкМ) в течение 24 часов и подвергали иммуноокрашиванию с использованием антитела против топоизомеразы IIβ (BD Biosciences).
Клетки визуализировали с помощью INCell Analyzer2200 (GE) и количественно определяли уровни белка топоизомеразы IIα. Использовали t-критерий Стьюдента (непарный, двусторонний) для определения значимости указанного отличия.
Как показано на Фиг. 14, обработка DEX приводила к заметному исчезновению TOPOIIβ в iPSC-CM, тогда как MYR не вызывал никакого эффекта на содержание белка топоизомеразы IIβ (Фиг. 14) (n=3). Полученные результаты подтверждают гипотезу, что DEX может негативно влиять на стабильность топоизомераз IIβ (TOPOIIβ), что может приводить к истощению указанных ферментов в сердечных клетках, приводя в итоге к предотвращению повреждения ДНК, обусловленного отравляющим действием антрациклина на указанные ферменты. Полученные результаты также подтверждают, что механизм, по которому MYR обеспечивает защиту от вызванной антрациклином токсичности, является полностью независимым, и его можно отличить от механизма действия DEX. Кроме того, эффект MYR, наблюдаемый при ингибировании топоизомеразы, не обусловлен разрушением белка TOPOIIβ или истощением фермента вследствие ослабляющего действия DOX на сердечные клетки. Можно сделать вывод, что ингибирование активности топоизомеразы II, в частности, без ухудшения стабильности ферментов TOPOII, является важным фактором для способности MYR обеспечивать кардиозащиту.
Пример 11. Ни DHM, ни DHR не ингибируют TOPOIIα или TOPOIIβ
Поскольку способность MYR обеспечивать кардиозащиту от DOX-индуцированной токсичности является независимой от DEX, проводили дополнительное исследование для определения того, имеют ли другие флавоноидные соединения такое же действие на активность топоизомеразы II, как MYR.
Сначала испытывали ингибирующее действие MYR (флавонол) и дигидромирицетина (флаванонол) на ферментативную функцию топоизомеразы II. Дигидромирицетин (DHM) имеет похожую химическую структуру, за исключением наличия простой связи в главном С-кольце флавоноидного каркаса.
200 нг кинетопластной ДНК (кДНК) инкубировали с одним ферментативным звеном TOPOIIβ и с различными концентрациями MYR (круги) или DHM (треугольники) при 37°С в течение 30 минут (Фиг. 15). Затем реакционную смесь разделяли на 1% агарозном геле для визуализации декатенированной ДНК (нижняя полоса), и количественно определяли эффективность каталитического ингибирования посредством измерения относительной интенсивности указанной полосы. Неожиданно было обнаружено, что DHM не ингибирует ферментативную активность TOPOIIβ (n=3) (Фиг. 15) или TOPOIIα, даже при экстремальных концентрациях (>200 мкМ).
Кроме того, полученный результат для DHM подтверждали в отдельных экспериментах с дигидроробинетином (DHR) и робинетином (ROB), в которых DHR, подобно DHM, демонстрировал отсутствие ингибирующего действия в отношении указанных топоизомераз, тогда как робинетин, подобно MYR, демонстрировал высокую степень ингибирования в отношении обеих TOPOIIβ и TOPOIIα. Полученные данные свидетельствуют о том, что структурное различие в С-кольце скелета флавона/флавоноида играет важную роль при ингибировании TOPOII.
Пример 12. MYR в 2 раза более эффективен для защиты от DOX-индуцированной гибели клеток, чем DHM
Затем напрямую сравнивали способность MYR обеспечивать кардиозащиту с аналогичным параметром DHM, поскольку указанные два соединения демонстрируют различные свойства в отношении их структур и активности ингибирования TOPOII. Образцы клеток получали посредством дифференцировки индуцированных полипотенциальных стволовых клеток в кардиомиоциты. Клетки выращивали в течение 4 дней после дифференцировки, меняя среду на 3 день, до осуществления экспериментов. Человеческие кардиомиоциты, полученные из iPSC, обрабатывали 0,5 мкМ доксорубицином и увеличивающимися концентрациями мирицетина (MYR, круги) или дигидромирицетина (DHM, треугольники). Через 72 часа обработки клетки инкубировали с красителями, отображающими митохондриальное здоровье и клеточные ядра. Затем клетки визуализировали и подсчитывали общее количество здоровых клеток, и наносили на график как процент от контрольного образца, обработанного доксорубицином, как описано выше.
Как показано на Фиг. 16, MYR демонстрировал в 2 раза более высокую эффективность для защиты от DOX-индуцированной гибели клеток, чем DHM, поскольку полумаксимальные эффективные концентрации (ЕС50) для MYR и DHM составляли 7,50 мкМ и 13,96 мкМ, соответственно. (n=3). На основании полученных результатов, сделан вывод, что двойная связь в С-кольце скелета флавона/флавоноида усиливает эффективность в отношении кардиозащитных свойств, обеспечивая ингибирующий эффект в отношении топоизомераз II.
После указанных наблюдений проводили анализ двухцепочечного разрыва ДНК под действием DOX. Человеческие кардиомиоциты обрабатывали 0,5 мкМ доксорубицином и увеличивающимися концентрациями MYR (круги) или DHM (треугольники). Через 48 часов после обработки клетки подвергали иммуноокрашиванию с использованием антитела против γН2АХ (EMD Millipore) для определения двухцепочечного разрыва ДНК. Клетки визуализировали с помощью INCell Analyzer2200 (GE) и количественно определяли процент γН2АХ-положительных клеток для каждого состояния. В соответствии с его степенью предотвращения гибели клеток, MYR был в 2 раза более эффективным для защиты от двухцепочечного разрыва под действием DOX, чем DHM. Концентрации, при которых DOX-индуцированный двухцепочечный разрыв уменьшался до 50% (IC50), для MYR и DHM составляли 5,28 мкМ и 11,30 мкМ, соответственно (Фиг. 17). (n=3)
Для изучения влияния мирицетина на кардиомиоциты, подверженные действию доксорубицина, определяли уровни экспрессии мРНК в клетках, обработанных только DOX, только мирицетином и DOX с мирицетином. Неожиданно было обнаружено, что хотя сам мирицетин не оказывает какого-либо влияния на экспрессию мРНК TOPOIIβ, DOX существенно подавляет экспрессию TOPOIIβ через 24 и 48 часов (Фиг. 18). Однако в присутствии мирицетина экспрессия TOPOIIβ восстанавливалась до уровня, близкого к нормальному значению под действием мирицетина, эффективно предотвращая изменение транскрипции под действием DOX (Фиг. 18). Полученные данные позволяют предположить, что возникает синергетический эффект между DOX и мирицетином в отношении экспрессии TOPOIIβ. Что касается экспрессии TOPOIIα, DOX постепенно подавляет экспрессию TOPOIIα с течением времени. Однако в присутствии DOX мирицетин дополнительно подавляет TOPOIIα, позволяя предположить различное действие мирицетина на указанные топоизомеразы II на молекулярном и клеточном уровнях. Совокупное подавляющее действие мирицетина и DOX на TOPOIIα сильнее, чем наблюдали при использовании только DOX.
Пример 13. Кардиозащитные свойства аналогов MYR
Для дополнительно изучения взаимосвязи между структурой (например, скелетом флавона/флавонола) и биологической активностью (например, кардиозащитой, ингибированием TOPOII и т.д.), определяли группу дополнительных флавоноидных соединений, родственных мирицетину, и испытывали их активность.
I. Идентификация флавоноидов с кардиозащитными свойствами, опосредованными ингибированием TOPOII
Вызванная антрациклином кардиотоксичность возникает, если лекарство, такое как доксорубицин, встраивается в ДНК при расщеплении ДНК под действием ферментов топоизомеразы II, тем самым эффективно предотвращая повторное дотирование расщепленных спиралей ДНК под действием TOPOIIα или β. Таким образом, рабочую гипотезу выдвигали на основании кардиозащитных свойств флавоноидов, опосредованных ингибированием топоизомераз IIα и β (TOPOIIα и TOPOIIβ).
Проводили систематическое исследование влияния гидроксильных заместителей в каркасе MYR на биологическую активность. Задача заключалась в исследовании химического пространства вокруг MYR для определения того, какие заместители (например, гидроксильные, алкоксильные или гетероциклические) необходимы в различных положениях, и для определения того, какая химическая структура(-ы) является важнейшим компонентом для обеспечения кардиозащитных свойств.
В отношении биологической активности, использовали анализ биохимической декатенации, описанный выше, для оценки ингибирования TOPOIIα и TOPOIIβ. Использовали человеческие кардиомиоциты, полученные из iPSC, обработанные доксорубицином, для измерения защитного действия указанных аналогов на кардиомиоциты.

Скелет флавона/флавонола
Исходя из незамещенного флавона, идентифицировали 48 соединений-аналогов мирицетина с гидроксильными заместителями, присутствующими или отсутствующими в положениях 3, 5, 7, 3', 4' или 5' (мирицетин представляет собой соединение, в котором присутствуют все шесть гидроксильных заместителей). Помимо указанных 48 аналогов мирицетина исследовали хромон, лишенный В-кольца флавона, и дигидромирицетин и дигидроробинетин (DHR), которые оба лишены двойной связи в С-кольце.
Поскольку заместители можно внедрять в скелет флавона в положениях 8 и/или 6 в А-кольце, подобно витексину, а также в положениях 2' и/или 6' в С-кольце, для анализа рассматривали гидроксил, алкокси, алкил и гетероциклил, а также галогениды. Данное исследование также включало химические фрагменты, отличные от гидроксильных заместителей, присутствующих в скелете MYR (Формула 1), такие как алкокси (в частности, метокси), алкил (метил), гетероциклил или галогениды в положениях 3, 5, 7, 3', 4' и/или 5'.
В результате данного исследования на основании скелета MYR идентифицировали минимальную структуру, необходимую для обеспечения конечной активности. Среди соединений с определенной комбинацией гидроксильных групп в положениях 3, 5, 7, 3', 4', 5', выбранных по биологической активности в отношении кардиозащиты (например, ингибирования TOPOIIβ и двухцепочечного разрыва ДНК), обнаружили некоторую группу соединений с определенными комбинациями заместителей, присутствующих или отсутствующих в положениях 3,5,7,3',4',5', определяющих биологические свойства в качестве кардиозащитных агентов со сниженной цитотоксичностью.



+ Соединения, демонстрирующие положительный эффект на соответствующие биологические свойства
- Соединения, демонстрирующие отрицательный эффект на соответствующие биологические свойства
 Соединения, не способные проявлять >30% от максимального защитного эффекта в концентрации 10 мкМ или 100 мкМ после первоначального скрининга.
Соединения, не способные проявлять >30% от максимального защитного эффекта в концентрации 10 мкМ или 100 мкМ после первоначального скрининга.
* Соединения, демонстрирующие цитотоксичность в концентрации 100 мкМ Н/Д, эксперимент не проводили, поскольку соединения демонстрировали цитотоксичность и отсутствие кардиозащитной активности
Минимальные требования к гидроксильным заместителями для ингибирования TOPOIIβ и кардиозащитного эффекта
Как показано выше в Таблице 1, общие признаки ингибиторов TOPOIIβ (1-5) позволяют сделать вывод, что гидроксильные заместители необходимы в положениях 3, 7, 3' и 4' для того, чтобы флавоноидные соединения ингибировали TOPOIIβ. Единственным исключением является трицетин (3), который не имеет 3-гидроксильного заместителя; все остальные четыре ингибитора TOPOIIβ имеют гидроксильные заместители в положениях 3, 7, 3' и 4'. Кроме того, общие признаки кардиозащитных соединений (1-12) в приведенной выше Таблице 1, позволяют сделать дополнительный вывод, что 4'-гидроксильный заместитель в В-кольце может быть важнейшим признаком, наряду с двумя из остальных трех гидроксильных заместителей в положениях 3, 7 и 3', для обеспечения кардиозащитной активности, причем предпочтителен гидроксил в положении 7; единственным исключением является соединение 8, которое не имеет гидроксильных заместителей в положениях 3 и 7, но имеет все три гидроксильных заместителя в положениях 3', 4' и 5' в В-кольце. Кроме того, учитывая токсичность испытанных соединений (см. Таблицу 1), можно обнаружить тенденцию, что кардиозащитные соединения (1-12), содержащие все три 3', 4' и 5' гидроксильных заместителя в В-кольце, не оказывают токсического эффекта в концентрациях менее 100 мкМ, тогда как те кардиозащитные соединения, которые имеют гидроксильные заместители только в положениях 3' и 4', в действительности оказывают токсический эффект в концентрациях менее 100 мкМ. И снова, единственным исключением из указанной тенденции является трицетин (3), который оказывает определенный токсический эффект в концентрациях менее 100 мкМ, несмотря на то, что он содержит все три гидроксильных заместителя в В-кольце. Из двух кардиозащитных соединений, которые содержат только 4' гидроксильный заместитель в В-кольце (кемпферол 7 и резокемпефрол 10), кемпферол не оказывает токсического эффекта в концентрации ниже 100 мкМ, тогда как резокемпферол оказывает токсический эффект в концентрациях ниже 100 мкМ. На основании проведенного анализа сделан вывод, что:
(1) для обеспечения кардиозащиты необходим 4' гидроксильный заместитель в В-кольце вместе с одним из следующих: (а) два из трех гидроксильных заместителей в положениях 3, 7 и 3', причем положение 7 является предпочтительным, или (b) все три гидроксильных заместителя в положениях 3', 4' и 5' В-кольца;
(2) для кардиотоксичности: 3', 4' и 5' гидроксильные заместители в В-кольце предпочтительны 3' и 4' гидроксильным заместителям в В-кольце для ослабления токсического эффекта в концентрациях ниже 100 мкМ; или только 4' гидроксилу в В-кольце, с остальными тремя 3, 5 и 7 гидроксильными заместителями в кольцевой системе А/С; и
(3) для ингибирования TOPOIIβ необходимы все четыре гидроксильных заместителя в положениях 3, 7, 3' и 4'. Трицетин (3) не соответствует указанным требованиям и является исключением из правил.
Анализ в В-кольце
На основании соединений, перечисленных в Таблице 1, очевидно, что для обеспечения кардиозащиты в 4' положении В-кольца должен быть гидроксильный заместитель. Среди двенадцати соединений (1-12), прошедших первоначальный отбор, все двенадцать имеют 4'-гидроксильный заместитель. Кроме того, среди шестнадцати соединений (13-28), не прошедших первоначальный отбор, одиннадцать (18-28) не имеют 4'-гидроксильного заместителя. Остальные пять 4'-гидроксильных соединений (13-17), которые не прошли первоначальный отбор, имеют минимальное замещение, например, только 4'-гидроксил, как в соединении 17, или только один другой гидроксильный заместитель вместе с указанным 4'-гидроксилом, как в соединениях 14, 15, и 16. Только соединение 13 имеет один из необходимых гидроксильных заместителей из набора положений 3, 7, и 3', описанного выше; следовательно, оно также не соответствует минимальным требованиям для кардиозащитной активности. Таким образом, присутствие гидроксильного заместителя в положении 4' В-кольца является необходимым, но не достаточным условием для обеспечения кардиозащитных свойств флавоноидных соединений. Указанное структурное требование подсказывает наличие водородной связи между 4' гидроксилом в В-кольце защитного агента в комплексе с биологической мишенью.
1. Соединения, родственные хромону

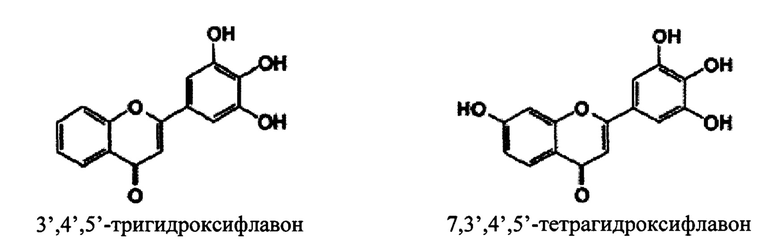
Хромон (29) и 7-гидрокси-4-хромон (38), каждый из которых не содержит В-кольца флавонового скелета, демонстрируют отсутствие положительного эффекта на кардиозащиту. Ни одно из указанных соединений не обеспечивает ингибирование TOPOIIβ или α (Таблица 1). Кроме того, 7-гидрокси-4-хромон демонстрирует высокую степень цитотоксичности в концентрации 100 мкМ. Сравнивая указанные два соединения без В-кольца с соответствующим тризамещенным соединением с В-кольцом флавона (8 и 6, соответственно), был сделан вывод о том, что наличие В-кольца необходимо для кардиозащиты.
Далее, наблюдение, сделанное для 7-гидрокси-4-хромона, дополнительно исследовали на 3,5,7-тригидроксифлавоне, содержащем В-кольцо, но не содержащем ни одного В-кольцевого заместителя. 3,5,7-Тригидроксифлавон не проявлял ни кардиозащиты, ни ингибирования TOPOII, и демонстрировал генерализованную цитотоксичность, указывая на то, что в В-кольце необходим один или более фрагментов для обеспечения кардиозащитной активности.

2. Метокси-заместители в В-кольце


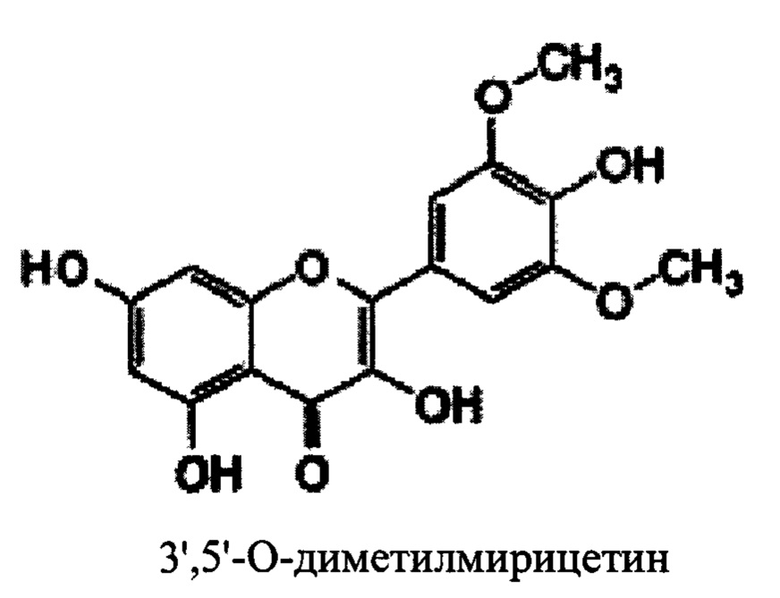
Поскольку В-кольцо является важным компонентом для биологической активности, испытывали активность соединений, содержащих В-кольцо с различными позиционными комбинациями гидроксильной и/или метокси-группы.
3'-O-метилмирицетин, содержащий метокси в 3' положении, не ингибировал ферменты TOPOII, но обеспечивал кардиозащиту без генерализованной цитотоксичности. Однако он демонстрировал существенное снижение эффективности в отношении кардиозащиты (ЕС50, ~59 мкМ). Аналогично, 4'-O-метилмирицетин, содержащий метокси в 4' положении, обеспечивал кардиозащиту без ингибирования TOPOII. Указанное соединение демонстрировало снижение эффективности в отношении кардиозащиты (ЕС50, ~48,7 мкМ), по сравнению с эффективностью MYR. Это позволяет предположить, что присутствие одного метокси-заместителя в положении 3' или 4' В-кольца является важным фактором для кардиозащиты. Подтверждая данное наблюдение, 3',5'-O-диметилмирицетин, не имеющий метокси-заместителя в положении 4, но имеющий метокси в положениях 3' и 5' В-кольца, не демонстрировал ни кардиозащиту, ни ингибирование TOPOIIα и TOPOIIβ. Указанное соединение также проявляло существенную цитотоксичность. Испытывали также кардиозащиту и ингибирование TOPOII других соединений, содержащих несколько метокси-заместителей в положениях 3', 4' и 5'. Например, все из 3',4',5'-O-триметилмирицетина, 3',4',5'-O-триметилробинетина, 3,7,3',4',5'-O-пентаметилробинетина, 7,3',4',5'-O-тетраметилробинетина совершенно не демонстрировали кардиозащиту или ингибирование TOPOII. Все они демонстрировали повышенную степень цитотоксичности при 100 мкМ.
Соответственно, замена 4' или 3' гидроксила на метокси существенно снижает эффективность и приводит полной потере ингибирования TOPOII. Кроме того, поскольку метокси-замещение несколько увеличивает и растягивает соединение со стороны В-кольца, постулировано, что наличие более крупного заместителя, исходящего из В-кольца, даже на минимальном уровне, может приводить к стерическому затруднению для взаимодействия между ферментом TOPOII и указанным соединением. Таким образом, гидроксильные группы в В-кольце (3',4',5') являются важнейшими компонентами, обеспечивающими кардиозащиту, и они могут играть важную роль в ингибировании фермента TOPOII.
3. Кверцетин и кемпферол

или
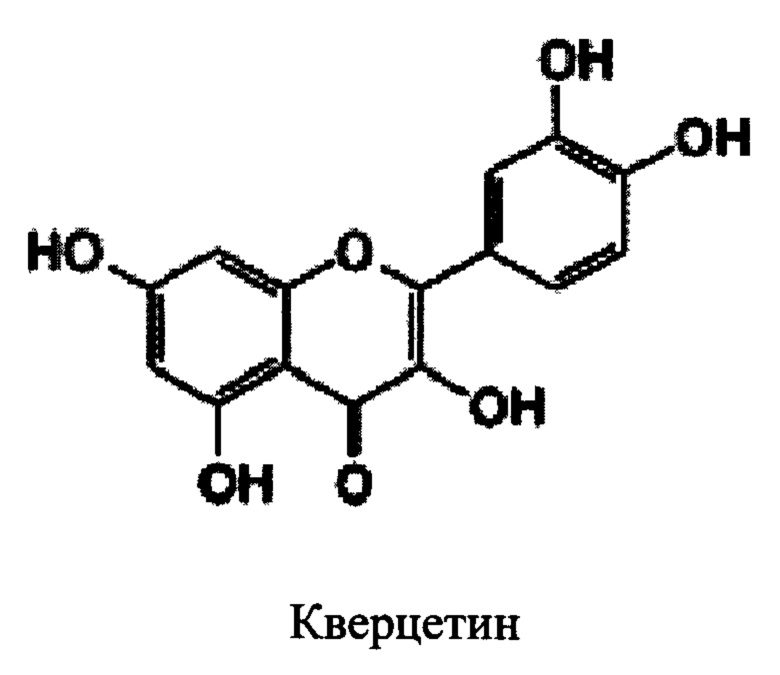
Кверцетин обеспечивает кардиозащиту и демонстрирует ингибирование TOPOII. Однако в концентрации 100 мкМ наблюдали более высокую степень общей цитотоксичности в отношении кардиомиоцитов.

Кемпферол демонстрировал умеренный уровень кардиозащиты с некоторой степенью цитотоксичности при 100 мкМ, но не оказывал никакого ингибирующего действия на TOPOIIα или TOPOIIβ. Однако кемпферол демонстрировал сниженную эффективность и не приводил к достижению максимум 50% степени сохранения.
Это следует из данных о том, что удаление 3' (или 5') гидроксила не обязательно может приводить к потере ингибирования TOPOII, но приводит к увеличению цитотоксичности и снижению эффективности, как наблюдали для кверцетина. Однако полученные данные приводят к выводу, что удаление 3'4' или 5' гидроксильной группы из В-кольца приводит к заметному снижению эффективности и/или потере ингибирования TOPOII, в частности, в положении 4'.
Таким образом, замена одного или двух 3', 4' или 5' гидроксилов на алкокси-группу (например, метокси) обусловливает цитотоксичность соединения. Удаление 3' и 5' гидроксильных групп из каркаса MYR, как наблюдали для кемпферола, или удаление любого из 3' и 5' гидроксилов, как в кверцетине, может снижать эффективность в отношении кардиозащиты и обусловливать цитотоксичность соединения. Однако удаление всех гидроксилов в В-кольце приводит к полной потере кардиозащиты и ингибирования TOPOII, а также вызывает тяжелую цитотоксичность, как наблюдали для 3,5,7-тригидроксифлавона. Кроме того, 4' гидроксил в В-кольце, очевидно, необходим для улучшенных физических свойств, обусловливающих повышенную эффективность в отношении кардиозащиты с ингибированием TOPOII и минимальной цитотоксичностью.
Соответственно, предпочтительные заместители для В-кольца представляют собой -ОН во всех положениях 3', 4' и 5' для обеспечения эффективности и минимальной токсичности, как показано для мирицетина и робинетина.
Анализ колец А и С
Оценивали кардиозащитную активность различных заместителей в гетеробициклической кольцевой системе А/С скелета флавона-флавонола. На основании наблюдений, сделанных для В-кольца, испытывали подмножество соединений, содержащих гидроксилы в В-кольце с различными комбинациями -ОН в положениях 3, 5, 7 кольца А-С.
1. Мирицетин, робинетин и трицетин



MYR (3,5,7,3',4',5'-гексагидроксифлавон) и ROB (3,7,3',4',5'-пентагидроксифлавон) демонстрировали равные уровни кардиозащиты с ЕС50 около 10-20 мкМ и ингибирование TOPOIIβ и TOPOIIα в концентрации менее 10 мкМ. Аналогично, трицетин (5,7,3',4',5'-пентагидроксифлавон), не содержащий -ОН в положении 3, также демонстрировал кардиозащиту и ингибирование TOPOII с низким уровнем цитотоксичности при 100 мкМ. Кроме того, 7,3',4',5'-тетрагидроксифлавон, не содержащий -ОН в обоих положениях 3 и 5 кольцевой системы А/С, демонстрировал кардиозащиту, но не ингибировал ферменты TOPOII.
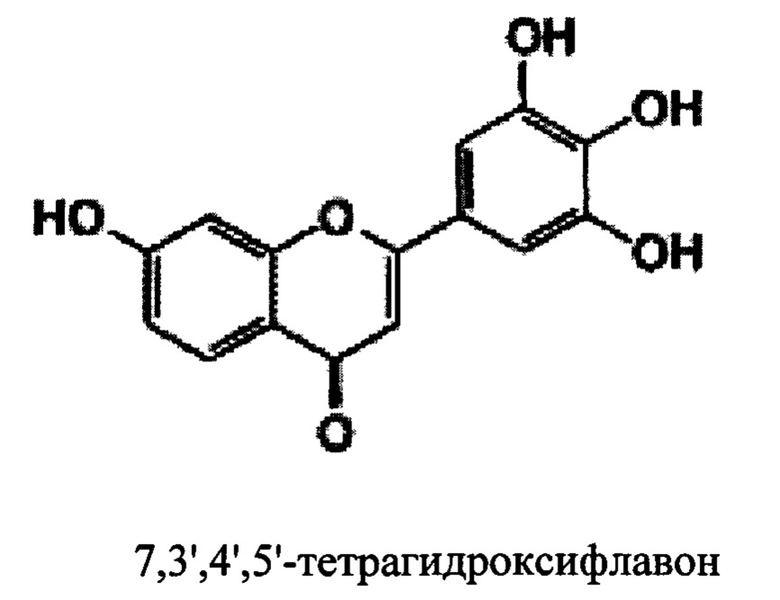
Однако 3',4',5'-тригидроксифлавон и другие соединения, не содержащие -ОН в положении 7, в концентрации менее 30 мкМ не проявляли эффективность в отношении кардиозащиты или ингибирования TOPOII. Полученные данные позволяют предположить, что гидроксил (-ОН) в положении 7 А-кольца может быть необходим для кардиозащиты, но не достаточным, поскольку по меньшей мере одна -ОН группа в положении 3 и/или 5 может существенно усиливать активность (например, эффективность и/или ингибирование TOPOII) указанных соединений в отношении кардиозащиты. Таким образом, гидроксилы в кольцевой системе А/С (3,7) играют важную роль для кардиозащиты и ингибирования TOPOII, при условии, что в В-кольце присутствуют 3',4',5' гидроксилы. В частности, -ОН в положении 7 кольца А является необходимым для такой активности.
Пример 14. Защитный эффект MYR для противораковых агентов
1. Антрациклины
MYR защищает от вызванной эпирубицином гибели клеток и вызванной идарубицином гибели клеток
Эпирубицин и идарубицин представляют собой антрациклины, которые связаны с сердечной недостаточностью у пациента. Помимо доксорубицина, описанного выше, эффект MYR испытывали при повреждении сердца, вызванном эпирубицином и идарубицином. Как показано на Фиг. 19, человеческие кардиомиоциты, полученные из iPSC, обрабатывали плацебо (треугольники) или обрабатывали 100 мкМ MYR (круги) и увеличивающимися концентрациями эпирубицина или ирарубицина в течение 72 часов, а затем инкубировали с красителями, которые отображают митохондриальное здоровье и клеточные ядра, как описано выше. Клетки визуализировали и подсчитывали общее количество здоровых клеток, и наносили на график как процент от контрольного образца, обработанного плацебо.
Летальная концентрация, при которой под действием эпирубицина погибло 50% клеток (LC50), сместилась с 0,49 мкМ в образце, обработанном плацебо, до 1,28 мкМ при обработке MYR, что свидетельствует о том, что MYR эффективно защищает от гибели клеток, вызванной эпирубицином, в кардиомиоцитах (Фиг. 19, слева). (n=3)
Аналогично, LC50 идарубицина сместилась с 0,59 мкМ в образце, обработанном плацебо, до 1,04 мкМ при обработке MYR, что свидетельствует о том, что MYR также защищает от гибели клеток, вызванной идарубицином (Фиг. 19, справа). (n=3)
2. Ингибитор протеинкиназы и протеасом
MYR защищает от гибели клеток, вызванной бортезомибом, сунитинибом и сорафенибом
Кардиотоксичность может возникать в результате образования токсичных реакционноспособных частиц кислорода (ROS) посредством редокс-циклизации, вызванной различными противораковыми агентами. Реакционноспособные частицы кислорода (ROS) могут активировать апоптозные пути, что приводит к гибели раковых, а также нормальных клеток. Кардиомиоциты могут быть особенно чувствительными к окислительному стрессу, и сердечные митохондрии могут легко разрушаться под действием противораковых агентов, таких как антрациклины, TKI или ингибиторы протеасом. В соответствии с данными, приведенными выше, можно выдвинуть гипотезу, что способность MYR и его аналогов, описанных в данном документе, защищать сердечные клетки может быть многоплановой: (1) защита посредством взаимодействия с ферментами TOPOII в сердечных клетках, как в случае антрациклинов; и (2) эффект, возникающий независимо от молекулярного механизма TOPOII (например, хелатирование ROS, промотирование митохондриальной целостности). Для определения того, обеспечивает ли MYR кардиозащиту для не антрациклиновых лекарств, испытывали способность соединений защищать сердечные клетки от цитотоксичности, вызванной ингибитором протеинкиназы.
Сунитиниб и сорафениб представляют собой антагонисты тирозинкиназы, используемые для лечения широкого ряда раковых заболеваний, включая лейкоз и саркому. Однако описано, что сунитиниб и сорафениб вызывают у пациентов неблагоприятные явления, такие как сердечная недостаточность. Тирозинкиназы представляют собой ферменты, ответственные за активацию многих белков, участвующих в каскадах передачи сигналов. Указанные белки активируются посредством фосфорилирования, стадии, которая, как известно, является мишенью для ингибирования ингибиторами тирозинкиназы (TKI).
Бортезомиб представляет собой ингибитор протеасом, используемый для лечения множественной миеломы и лимфомы. При некоторых раковых заболеваниях белки, которые в норме разрушают раковые клетки, преждевременно разрушаются. Бортезомиб нарушает этот процесс, в результате чего указанные белки могут разрушать делящиеся раковые клетки.
Образцы клеток получали посредством дифференцировки индуцированных полипотенциальных стволовых клеток в кардиомиоциты. Клетки выращивали в течение 4 дней после дифференцировки, меняя среду на 3 день, до осуществления экспериментов. Затем человеческие кардиомиоциты, полученные из стволовых клеток, обрабатывали ДМСО, сунитинибом (10 мкМ) или сунитинибом с увеличивающимися концентрациями MYR (от 1 до 100 мкМ) в течение 72 часов, а затем инкубировали с красителями, которые отображают митохондриальное здоровье и клеточные ядра. Клетки визуализировали и подсчитывали общее количество здоровых клеток, и наносили на график как процент от контрольного образца, обработанного сунитинибом. MYR демонстрирует защиту от гибели клеток, вызванной сунитинибом, в кардиомиоцитах (Фиг. 20). (n=3). Аналогично, MYR успешно восстанавливает более 80% сердечной дисфункции в кардиомиоцитах, обработанных 5 мкМ сорафенибом (Фиг. 21). Обработка 100 мкМ мирицетином также предотвращает вызванную бортезомибом кардиотоксичность (Фиг. 22). Полученные данные позволяют предположить, что MYR защищает от клеточной гибели кардиомиоцитов, вызванной ингибитором протеинкиназы.
Пример 15. Отсутствие влияния на противораковую активность доксорубицина
Бисдиоксопиперазина дексразоксан (DEX) является единственным лекарством, доступным для снижения частоты возникновения сердечной недостаточности у онкологических пациентов, принимающих противораковые агенты. Несмотря на его клинический эффект, DEX ассоциируется с некоторыми побочными эффектами, такими как влияние на противоопухолевую активность антрациклинов, инициация вторичных злокачественных образований и инициация нарушений крови и костного мозга. Указанные ограничения существенно ограничивают его применение для некоторых онкологических пациентов.
Исследовали влияние MYR для определения того, имеет ли указанное соединение подобные недостатки, как наблюдают при использовании DEX. Клетки рака молочной железы (MDA-MB-231) обрабатывали плацебо или обрабатывали 100 мкМ MYR и увеличивающимися концентрациями доксорубицина в течение 72 часов (Фиг. 23). Проводили анализ жизнеспособности клеток (CellTiter-Glo, Promega). Люминесценцию записывали с помощью микропланшет-ридера Synergy HT (Biotek) и наносили на график как процент от контрольного образца, обработанного плацебо. Наблюдали по существу отсутствие разницы в жизнеспособности клеток (LC50) между клетками, обработанными плацебо (0,53 мкМ) и MYR (0,48 мкМ), что свидетельствует о том, что MYR не влияет на противораковую активность доксорубицина (Фиг. 23) (n=3).
Пример 16. In vivo проверка кардиозащиты против DOX-индуцированной токсичности
Модель острой кардиотоксичности, вызванной антрациклином, создавали на мышах C57BL/6 возрастом 9-10 недель, приобретенных у компании The Jackson Laboratory. Животных делили на три группы: лечение солевым раствором (n=8), лечение доксорубицином (n=16) или лечение доксорубицином + MYR (n=17). Доксорубицин (20 мг/кг), MYR (40 мг/кг) и солевой раствор вводили посредством однократной внутрибрюшинной инъекции. МYР вводили за 30 минут до лечения доксорубицином. Ежедневно наблюдали общее состояние здоровья животных в течение всего эксперимента. Мышей анестезировали изофлураном (-1,0%) и проводили трансторакальную эхокардиографию, используя систему для визуализации VevoLAZR (VisualSonics Inc., Торонто, Канада) на -4 день для получения базовых измерений, а затем на 5 день после лечения. Изображения левого желудочка (LV) в М-режиме записывали в двухмерной короткоосевой проекции вблизи сосочковых мышц. Запись эндокардиальной ткани во время систолы и диастолы отключали. Затем полученные данные использовали для расчета фракции укорочения (FS) и фракции изгнания (EF), которые являются общими показателями систолической функции.
Сократительная способность в группе с солевым раствором оставалась без изменений в течение всего исследования. Напротив, лечение доксорубицином оказывало выраженное влияние на сократительную способность. В указанной группе FS и EF со временем существенно снижались (Р<0,001) на 15% и 19%, соответственно. Введение MYR значительно снижало вызванную доксорубицином кардиотоксичность (Р<0,05), что наблюдали по улучшению FS и EF на 7% и 10%, соответственно (Фиг. 24). При концентрации, в 2 раза превышающей концентрацию доксорубицина, MYR обеспечивал предотвращение вызванной доксорубицином дисфункции FS на уровне 52% и EF на уровне 49% (Фиг. 24).
Пример 17. Влияние различных защитных агентов (включая витексин) на кардиотоксичность, вызванную доксорубицином, в отношении митохондриальной токсичности
Образцы клеток получали посредством дифференцировки индуцированных полипотенциальных стволовых клеток в кардиомиоциты. Клетки выращивали в течение 4 дней после дифференцировки, меняя среду на 3 день, до осуществления экспериментов. Образцы обрабатывали плацебо, обрабатывали 1 мкМ доксорубицином или обрабатывали 1 мкМ доксорубицином и указанным лекарством в течение 48 часов. После обработки образцы инкубировали с красителем, метиловым эфиром тетраметилродамина (TMRM), для определения митохондриального здоровья, а также со вторым красителем для определения клеточных ядер. Клетки визуализировали с помощью INCell Analyzer2200, и анализировали изображения с помощью CellProfiler для количественного определения процента TMRM-негативных клеток. Иллюстративные данные представлены для защитных агентов из двух независимых наборов скринингов, где каждая точка данных получена из трех биологических повторений. Нормирование данных проводили посредством повторной калибровки данных на основании образца, обработанного плацебо (0% митохондриальная токсичность), и образца, обработанного 1 мкМ доксорубицином (100% митохондриальная токсичность).
Кардиомиоциты обрабатывали плацебо («без обработки»), обрабатывали 1 мкМ доксорубицином («Dox 1 мкМ») или обрабатывали 1 мкМ доксорубицином и указанным лекарством, а затем окрашивали для определения митохондриального здоровья (Фиг. 25). Кардиомиоциты, обработанные 17 мкМ кемпферолом («KAE 17 мкМ»), демонстрировали снижение митохондриальной токсичности по меньшей мере на 60%, по сравнению с кардиомиоцитами, обработанными доксорубицином без защитного агента («Dox 1 мкМ»). Кардиомиоциты, обработанные 0,76 мкМ амброксолом («АМВ 0,76 мкМ»), 10 мкМ месаламином («MES 10 мкМ») или 50 мкМ N-ацетилцистеином («NAC 50 мкМ»), демонстрировали снижение митохондриальной токсичности по меньшей мере на 40%, по сравнению с кардиомиоцитами, обработанными доксорубицином без защитного агента («Dox 1 мкМ»). Кардиомиоциты, обработанные 160 мкМ дексразоксаном («Dex 160 мкМ») или 115 мкМ витексином («VIT 115 мкМ»), демонстрировали снижение митохондриальной токсичности по меньшей мере на 30%, по сравнению с кардиомиоцитами, обработанными доксорубицином без защитного агента («Dox 1 мкМ»).
Пример 18. Влияние различных защитных агентов (включая витексин) на кардиотоксичность, вызванную доксорубицином (апоптоз)
Образцы клеток получали посредством дифференцировки индуцированных полипотенциальных стволовых клеток в кардиомиоциты. Клетки выращивали в течение 4 дней после дифференцировки, меняя среду на 3 день, до осуществления экспериментов. Образцы обрабатывали плацебо, обрабатывали 1 мкМ доксорубицином или обрабатывали 1 мкМ доксорубицином и указанным лекарством в течение 48 часов. После обработки образцы инкубировали с красителем TUNEL для определения апоптоз-положительных клеток, и со вторым красителем для определения клеточных ядер. Клетки визуализировали с помощью INCell Analyzer2200, и анализировали изображения с помощью CellProfiler для количественного определения процента апоптоз-положительных клеток. Иллюстративные данные представлены для защитных агентов из двух независимых наборов скринингов, где каждая точка данных получена из трех биологических повторений. Нормирование данных проводили посредством повторной калибровки данных на основании образца, обработанного плацебо (0% апоптоз), и образца, обработанного 1 микромолярным доксорубицином (100% апоптоз).
Кардиомиоциты обрабатывали плацебо («без обработки»), обрабатывали 1 мкМ доксорубицином («Dox 1 мкМ») или совместно обрабатывали 1 мкМ доксорубицином и указанным лекарством, а затем окрашивали для обнаружения апоптоза (Фиг. 26). Кардиомиоциты, обработанные 115 мкМ витексином («VIT 115 мкМ»), демонстрировали снижение апоптоза по меньшей мере на 60%, по сравнению с кардиомиоцитами, обработанными доксорубицином без защитного агента («Dox 1 мкМ»). Кардиомиоциты, обработанные 160 мкМ дексразоксаном («Dex 160 мкМ»), 0,76 мкМ амброксолом («АМВ 0,76 мкМ») или 50 мкМ N-ацетилцистеином («NAC 50 мкМ»), демонстрировали снижение апоптоза по меньшей мере на 50%, по сравнению с кардиомиоцитами, обработанными доксорубицином без защитного агента («Dox 1 мкМ»). Кардиомиоциты, обработанные 17 мкМ кемпферолом («KAE 17 мкМ») или 10 мкМ месаламином («MES 10 мкМ»), демонстрировали снижение апоптоза по меньшей мере на 40%, по сравнению с кардиомиоцитами, обработанными доксорубицином без защитного агента («Dox 1 мкМ»).
Пример 19. Витексин обеспечивает долговременную кардиозащиту (митохондриальное здоровье)
Образцы клеток получали посредством дифференцировки индуцированных полипотенциальных стволовых клеток в кардиомиоциты. Клетки выращивали в течение 4 дней после дифференцировки, меняя среду на 3 день, до осуществления экспериментов. Образцы обрабатывали плацебо (Фиг. 27А), обрабатывали 1 мкМ доксорубицином (Фиг. 27В), совместно обрабатывали 1 мкМ доксорубицином и 16 мкМ дексразоксаном (Фиг. 27С) или совместно обрабатывали 1 мкМ доксорубицином и 116 мкМ дексразоксаном (Фиг. 27D) в течение 7 дней. После обработки образцы инкубировали с красителем, метиловым эфиром тетраметилродамина (TMRM), для определения митохондриального здоровья. Клетки визуализировали с помощью INCell Analyzer2200, и анализировали изображения с помощью CellProfiler для количественного определения процента TMRM-негативных клеток. Иллюстративные изображения представлены для каждого образца, причем снижение сигнала TMRM отображает митохондриальную токсичность.
Кардиомиоциты, обработанные доксорубицином (Фиг. 27В) или совместно обработанные доксорубицином и дексразоксаном (Фиг. 27С), демонстрировали увеличение митохондриальной токсичности, о чем свидетельствует заметное снижение TMRM-положительных клеток, по сравнению с кардиомиоцитами, обработанными плацебо (Фиг. 27А). Обработка кардиомиоцитов доксорубицином и витексином (Фиг. 27D) демонстрирует улучшенную долговременную митохондриальную защиту, по сравнению с кардиомиоцитами, обработанными доксорубицином (Фиг. 27В) или доксорубицином и дексразоксаном (Фиг. 27С).
Пример 20. Витексин обеспечивает дозозависимую кардиозащиту (электрофизиологическая активность)
Образцы клеток получали посредством дифференцировки индуцированных полипотенциальных стволовых клеток в кардиомиоциты. Клетки выращивали в течение 4 дней после дифференцировки, меняя среду на 3 день, до осуществления экспериментов. Образцы обрабатывали плацебо с 0,1% ДМСО, обрабатывали 1 мкМ доксорубицином или совместно обрабатывали 1 мкМ доксорубицином и различными концентрациями витексина (например, 11,6 мкМ, 37 мкМ или 116 мкМ). После обработки определяли процент активных электродов в каждом образце в течение 72 часов. Процент активных электродов количественно определяли и наносили на график в зависимости от времени (Фиг. 28А). Среднее количество активных электродов на лунку количественно определяли и наносили на график через 30 часов после обработки (Фиг. 28В, n=6, стандартное отклонение показано как планки погрешностей).
Кардиомиоциты, обработанные 1 мкМ доксорубицином без витексина, демонстрировали около 50% снижение количества активных электродов через 24 часа после обработки лекарством (нулевое время) и около 95% снижение, относительно нулевого времени, количества активных электродов через 30 часов после обработки лекарством (Фиг. 28А). Кардиомиоциты, совместно обработанные доксорубицином и витексином, демонстрировали дозозависимое увеличение процента активных электродов (Фиг. 28А). Через 24 часа после обработки лекарством кардиомициты, совместно обработанные 1 мкМ доксорубицином и 11,6 мкМ, 37 мкМ или 116 мкМ витексином, демонстрировали около 50%, около 25% или около 0% снижение количества активных электродов, соответственно. Через 30 часов после обработки образцы, которые были совместно обработаны 1 мкМ доксорубицином и 116 мкМ витексином, демонстрировали статистически значимое более высокое среднее количество активных электродов (около 10 активных электродов), по сравнению с образцами, которые были обработаны 1 мкМ доксорубицином без витексина (около 2 активных электродов) (Фиг. 28В).
Пример 21. Защитные агенты не подавляют опосредованную доксорубицином гибель клеток рака молочной железы
Клетки MDA-MB-231 (метастатического рака молочной железы) выращивали в течение 1 дня до осуществления экспериментов. Образцы обрабатывали увеличивающимися концентрациями доксорубицина (например, 0 мкМ, 0,016 мкМ, 0,05 мкМ, 0,16 мкМ, 0,5 мкМ, 1,6 мкМ, 5 мкМ, 16 мкМ или 50 мкМ) или совместно обрабатывали увеличивающимися концентрациями доксорубицина и указанным защитным агентом в течение 72 часов. Затем клетки лизировали с реагентом CellTiter-Glo для определения метаболически активных (например, жизнеспособных) клеток, причем люминесценция, измеренная в лизированной клеточной суспензии, прямо пропорциональна количеству жизнеспособных клеток, присутствующих в культуре. Процент гибели клеток количественно определяли посредством измерения снижения люминесценции. Для построения кривой использовали XLFit. На график наносили средние значения для трех повторений, а стандартное отклонение показано как планки погрешностей.
Клетки MDA-MB-231, совместно обработанные увеличивающимися концентрациями доксорубицина и дексразоксаном, амброксолом, кемпферолом (Фиг. 29А), месаламином, N-ацетилцистеином или витексином (Фиг. 29В), демонстрировали отсутствие существенной разницы в процентах гибели клеток, по сравнению с клетками, которые были обработаны доксорубицином без защитного агента. Полученные результаты свидетельствуют о том, что фармацевтические композиции, описанные в данном документе, не обеспечивают защитное преимущество для клеток рака молочной железы MDA-MB-231, по результатам измерения в in vitro анализе.
Пример 22. Защитные агенты не подавляют опосредованную доксорубицином гибель клеток рака легких
Клетки А549 (рака легких) выращивали в течение 1 дня до осуществления экспериментов. Образцы обрабатывали увеличивающимися концентрациями доксорубицина (например, 0 мкМ, 0,016 мкМ, 0,05 мкМ, 0,16 мкМ, 0,5 мкМ, 1,6 мкМ, 5 мкМ, 16 мкМ или 50 мкМ) или совместно обрабатывали увеличивающимися концентрациями доксорубицина и указанным лекарством в течение 72 часов. Затем клетки лизировали с реагентом CellTiter-Glo для определения метаболически активных (например, жизнеспособных) клеток, причем люминесценция, измеренная в лизированной клеточной суспензии, прямо пропорциональна количеству жизнеспособных клеток, присутствующих в культуре. Процент гибели клеток количественно определяли посредством измерения снижения люминесценции. Для построения кривой использовали XLFit. На график наносили средние значения для трех повторений, а стандартное отклонение показано как планки погрешностей.
Клетки А549, совместно обработанные увеличивающимися концентрациями доксорубицина и дексразоксаном, амброксолом, кемпферолом, месаламином, N-ацетилцистеином или витексином, демонстрировали отсутствие существенной разницы в процентах гибели клеток, по сравнению с клетками, которые были обработаны доксорубицином без защитного агента. Полученные результаты свидетельствуют о том, что фармацевтические композиции, описанные в данном документе, не обеспечивают защитное преимущество для клеток рака легких А549, по результатам измерения в in vitro анализе.
Пример 23. Острая токсичность различных защитных агентов (включая витексин) в отношении электрофизиологии
Образцы клеток получали посредством дифференцировки индуцированных полипотенциальных стволовых клеток в кардиомиоциты. Клетки выращивали в течение 4 дней после дифференцировки, меняя среду на 3 день, до осуществления экспериментов. Образцы обрабатывали плацебо с 0,1% ДМСО или обрабатывали увеличивающимися концентрациями указанного лекарства в течение по меньшей мере 20 минут. Кардиомиоциты обрабатывали блокатором калиевых каналов hERG E4031 в качестве контрольного образца. После обработки в каждом образце измеряли период биений и продолжительность потенциала поля (FPD), используя МЕА.
При более низкой концентрации лекарства кардиомиоциты, обработанные дексразоксаном, амброксолом, хенодезоксихолевой кислотой, дефероксамином, N-ацетилцистеином, нарингенином или витексином, демонстрировали отсутствие заметной разницы в периоде биений или продолжительности потенциала поля, по сравнению с контрольными образцами. При более высоких концентрациях кардиомиоциты, обработанные хенодезоксихолевой кислотой или нарингенином, демонстрировали прекращение биений вследствие острой лекарственной токсичности.
Пример 24. Долговременная токсичность различных защитных агентов (включая витексин) в отношении электрофизиологии
Образцы клеток получали посредством дифференцировки индуцированных полипотенциальных стволовых клеток в кардиомиоциты. Клетки выращивали в течение 4 дней после дифференцировки, меняя среду на 3 день, до осуществления экспериментов. Образцы обрабатывали плацебо с 0,1% ДМСО или обрабатывали различными концентрациями указанного лекарства. После обработки определяли процент активных электродов в каждом образце в течение по меньшей мере 5 дней. Процент активных электродов количественно определяли и наносили на график в зависимости от времени.
Кардиомиоциты, обработанные амброксолом, кемпферолом, месаламином или витексином, демонстрировали отсутствие заметного снижения количества активных электродов, по сравнению с образцом, обработанным плацебо. Кардиомиоциты, обработанные клинически одобренным кардиозащитным агентом дексразоксаном, демонстрировали долговременный, дозозависимый кардиотоксический эффект. Кардиомиоциты, обработанные 167 мкМ или 500 мкМ дексразоксаном, демонстрировали около 25% или 50% снижение количества активных электродов примерно через 2 дня после обработки, соответственно. Примерно через 3 дня после обработки кардиомиоциты, обработанные 167 мкМ или 500 мкМ дексразоксаном, демонстрировали около 50% или 100% снижение количества активных электродов, соответственно.
Пример 25. Лечение рака молочной железы у пациента с болезнью сердца посредством перорального введения пилюли, содержащей доксорубицин и витексин
У пациента с анамнезом болезни сердца диагностировали рак молочной железы. Вследствие повышенного риска сердечной недостаточности, пациент не может принимать стандартную схему лечения доксорубицином, который, как известно, вызывает кардиотоксичность. Вместо этого медицинский работник, ухаживающий за пациентом, вводил совместную композицию доксорубицина (10 мг) и витексина (100 мг). Записывали эхокардиограмму и измеряли скорость потока крови для определения кардиотоксического эффекта данной терапии на пациента. Пациент не демонстрировал никаких признаков сердечной дисфункции. Демонстрируя отсутствие признаков кардиотоксичности, пациент смог принимать более высокие дозы лекарственного препарата в течение следующих нескольких недель. Впоследствии у пациента брали биопсию ткани, которая показала отсутствие признаков рака молочной железы.
Пример 26. Лечение рака печени у пациента посредством внутривенного введения доксорубицина, дексразоксана и витексина
У пациента диагностировали рак печени. Медицинский работник, ухаживающий за пациентом, вводил совместную композицию доксорубицина (5 мг/мл) и дексразоксана (50 мг/мл). Записывали эхокардиограмму для определения того, обеспечивает ли дексразоксан эффективное устранение кардиотоксического эффекта у пациента. Пациент демонстрировал увеличение продолжительности QT на 20 мс. Для усиления активности дексразоксана медицинский работник, ухаживающий за пациентом, вводил пациенту совместную композицию доксорубицина (5 мг/мл) и витексина (100 мг/мл). После лечения записывали эхокардиограмму, и пациент не демонстрировал никаких признаков увеличения продолжительности QT. Пациент смог продолжить лечение в течение нескольких недель, после чего брали биопсию ткани для подтверждения уничтожения рака печени.
Пример 27. Лечение рака легких у пациента с брадикардией посредством перорального введения пилюли, содержащей доксорубицин и мирицетин
У пациента с брадикардией диагностировали рак легких II стадии. Вследствие повышенного риска сердечной недостаточности, пациент не может принимать стандартную схему лечения доксорубицином, который, как известно, влияет на сократительную способность сердца и вызывает брадикардию. Вместо этого медицинский работник, ухаживающий за пациентом, вводил совместную композицию доксорубицина (10 мг) и мирицетина (100 мг). Использовали электрокардиограмму для контролирования частоты сердцебиений пациента. Пациент не демонстрировал никаких признаков сердечной дисфункции. Демонстрируя отсутствие признаков кардиотоксичности, пациент смог принимать более высокие дозы лекарственного препарата в течение следующих нескольких недель. Стадия рака легких понизилась до 1 стадии, и рак был успешно ликвидирован с помощью операции. Впоследствии проводили биопсию ткани, и результаты показали отсутствие признаков рака.
Пример 28. Лечение рака печени у пациента посредством внутривенного введения раствора, содержащего доксорубицин, дексразоксан и мирицетин
У пациента диагностировали рак печени. Медицинский работник, ухаживающий за пациентом, вводил совместную композицию доксорубицина (5 мг/мл) и дексразоксана (50 мг/мл). Записывали эхокардиограмму для определения того, обеспечивает ли дексразоксан эффективное устранение кардиотоксического эффекта у пациента. Пациент демонстрировал увеличение продолжительности QT на 20 мс. Для усиления активности дексразоксана медицинский работник, ухаживающий за пациентом, вводил пациенту совместную композицию доксорубицина (5 мг/мл) и мирицетрина (50 мг/мл). После лечения записывали эхокардиограмму, и пациент не демонстрировал никаких признаков увеличения продолжительности QT. Пациент смог продолжить лечение в течение нескольких недель, после чего брали биопсию ткани для подтверждения уничтожения рака печени.
Пример 29. Лечение рака легких у пациента с брадикардией посредством перорального введения пилюли, содержащей мирицетин
У пациента с брадикардией диагностировали рак легких II стадии. Вследствие повышенного риска сердечной недостаточности, пациент не может принимать стандартную схему лечения доксорубицином, который, как известно, влияет на сократительную способность сердца и вызывает брадикардию. Вместо этого медицинский работник, ухаживающий за пациентом, вводил мирицетин (100 мг) за 24 часа до введения доксорубицина (10 мг). Использовали электрокардиограмму для контролирования частоты сердцебиений пациента. Пациент не демонстрировал никаких признаков сердечной дисфункции. Демонстрируя отсутствие признаков кардиотоксичности, пациент смог принимать более высокие дозы лекарственного препарата в течение следующих нескольких недель. Стадия рака легких понизилась до 1 стадии, и рак был успешно ликвидирован с помощью операции. Впоследствии проводили биопсию ткани, и результаты показали отсутствие признаков рака.
Пример 30. Лечение рака печени у пациента посредством внутривенного введения раствора, содержащего доксорубицин, дексразоксан и мирицетин
У пациента диагностировали рак печени. Медицинский работник, ухаживающий за пациентом, вводил совместную композицию доксорубицина (5 мг/мл) и дексразоксана (50 мг/мл). Записывали эхокардиограмму для определения того, обеспечивает ли дексразоксан эффективное устранение кардиотоксического эффекта у пациента. Пациент демонстрировал увеличение продолжительности QT на 20 мс. Для усиления активности дексразоксана медицинский работник, ухаживающий за пациентом, вводил пациенту мирицетин (100 мг) за 24 часа до введения доксорубицина (5 мг/мл) и (100 мг/мл) внутривенно. После лечения записывали эхокардиограмму, и пациент не демонстрировал никаких признаков увеличения продолжительности QT. Пациент смог продолжить лечение в течение нескольких недель, после чего брали биопсию ткани для подтверждения уничтожения рака печени.
Как понятно специалистам в данной области техники, многие модификации и вариации данного изобретения могут быть сделаны без отступления от его сущности и объема. Конкретные варианты реализации, описанные в данном документе, приведены лишь в качестве примера, и данное изобретение следует ограничивать лишь на основании прилагаемой формулы изобретения, а также полного объема эквивалентов, на которые дает право указанная формула изобретения. Подразумевается, что такие модификации входят в объем прилагаемой формулы изобретения.
Все ссылки, патентные и непатентные, цитированные в данном документе, включены в данный документ посредством ссылки в полном объеме и для всех целей в такой же степени, как если бы каждая отдельная публикация, или патент, или патентная заявка были специально и индивидуально указаны как включенные посредством ссылки в полном объеме для всех целей.

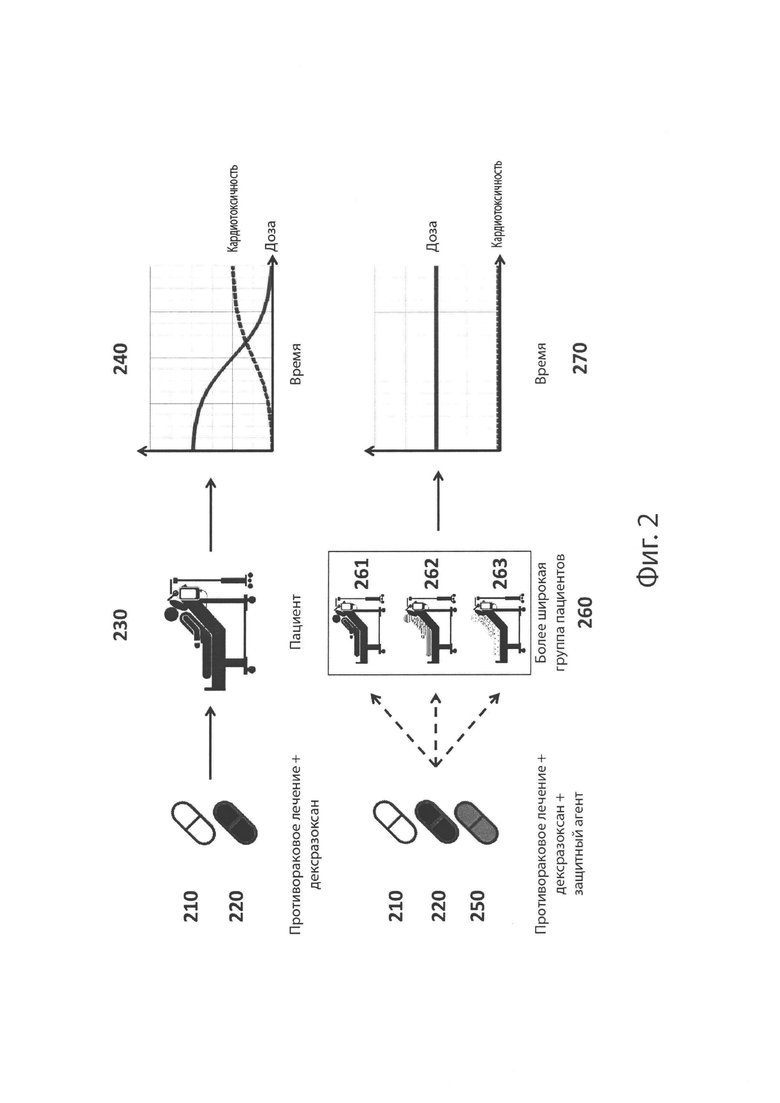


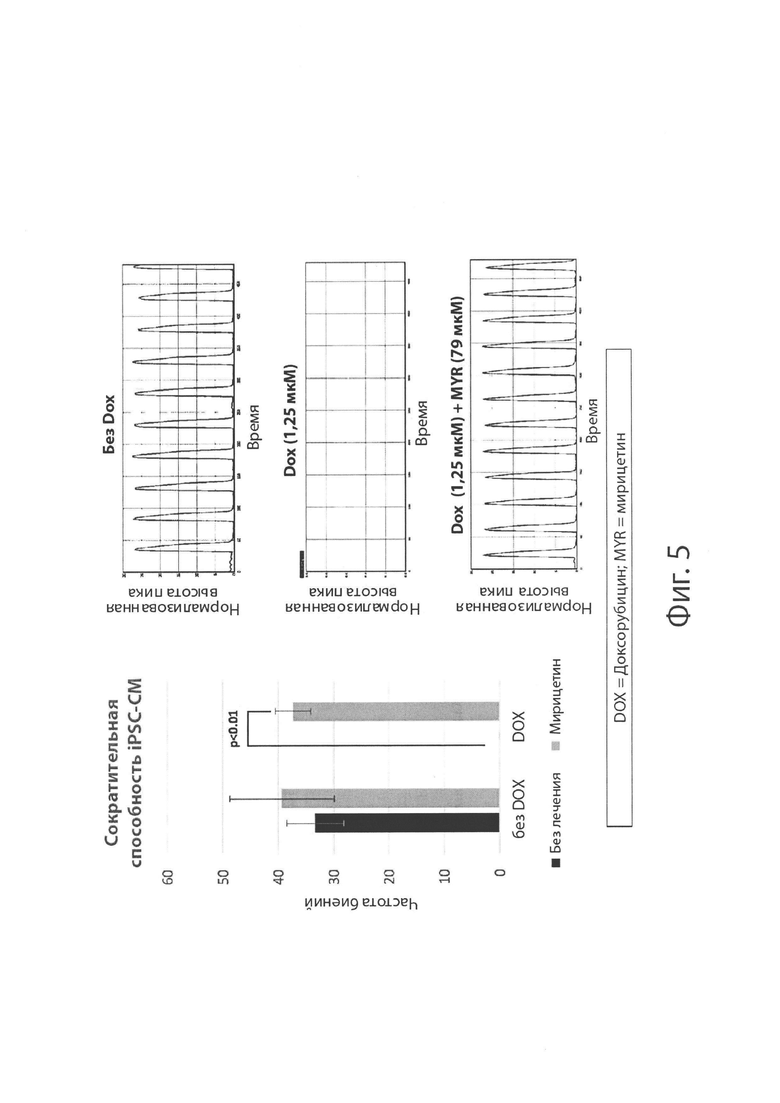



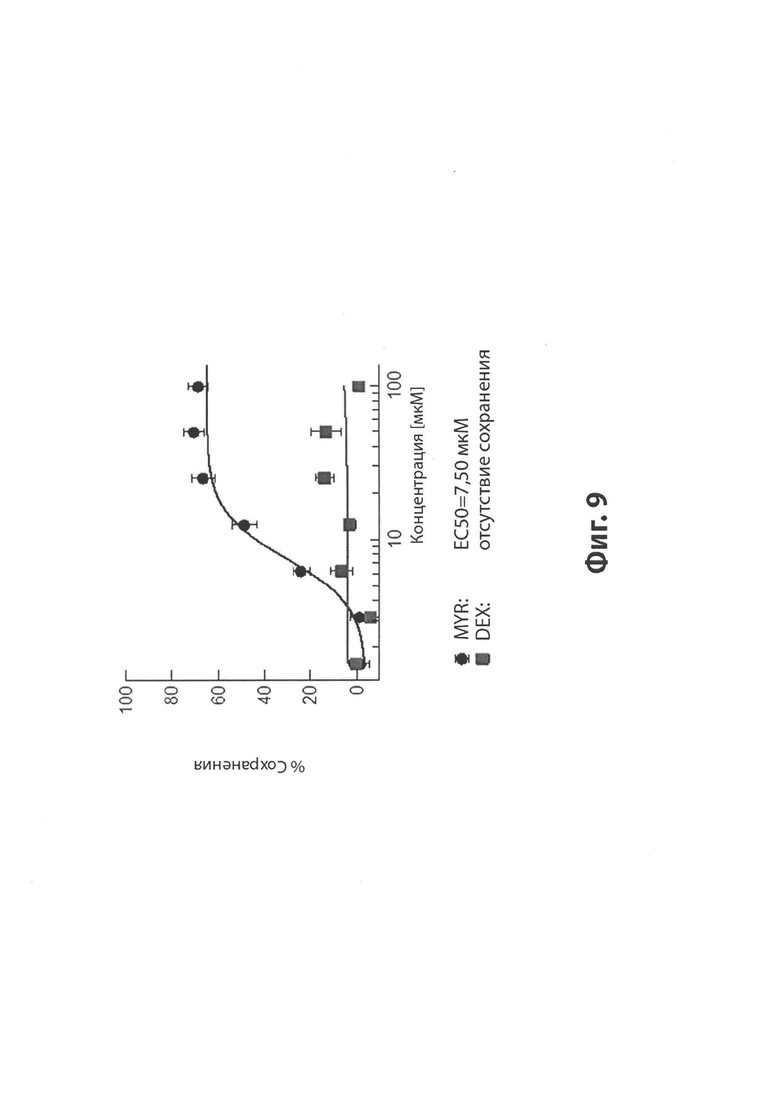




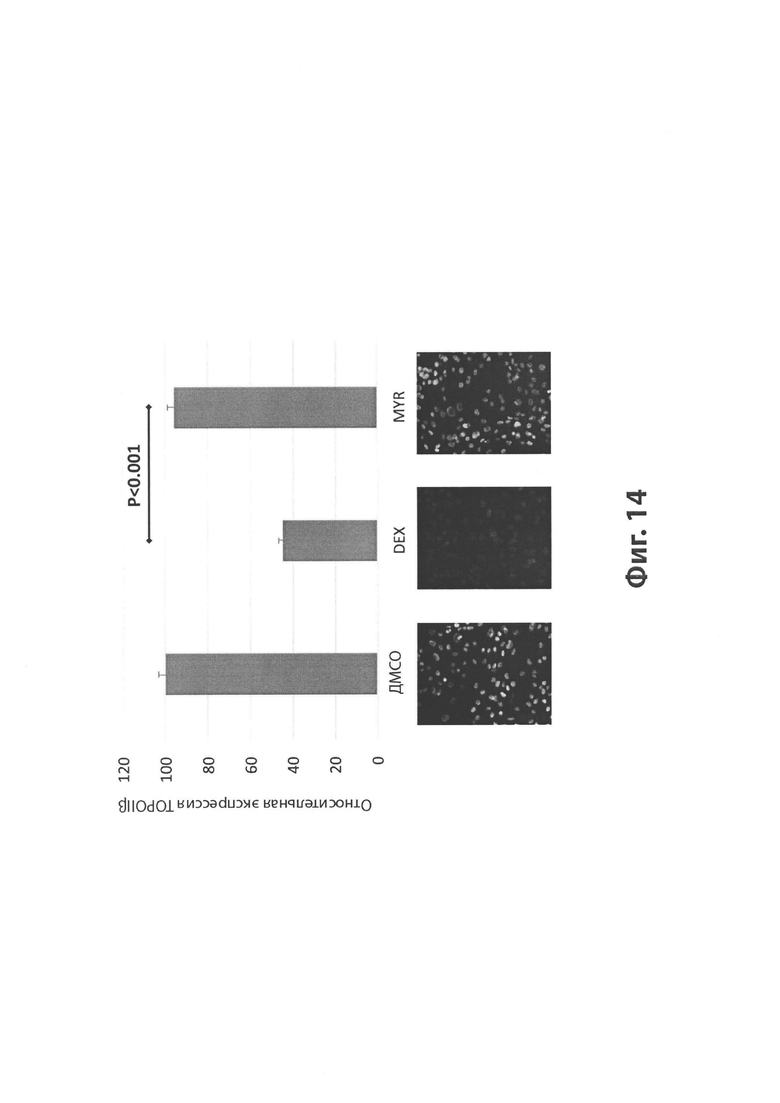



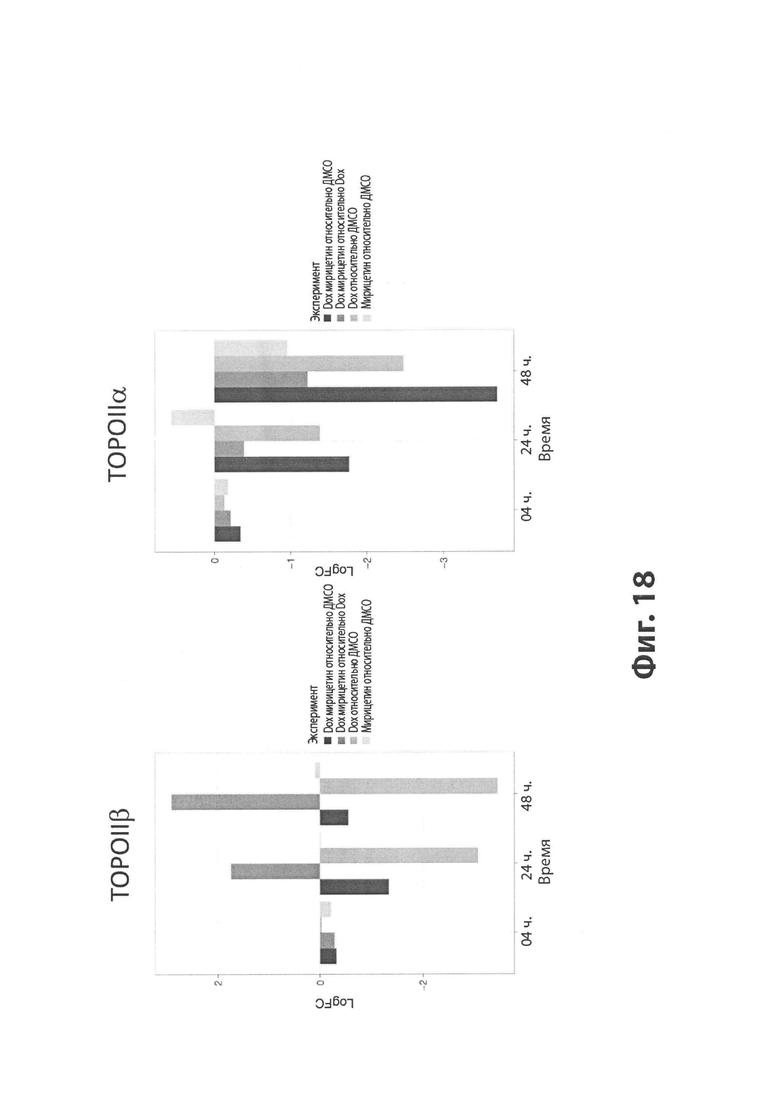





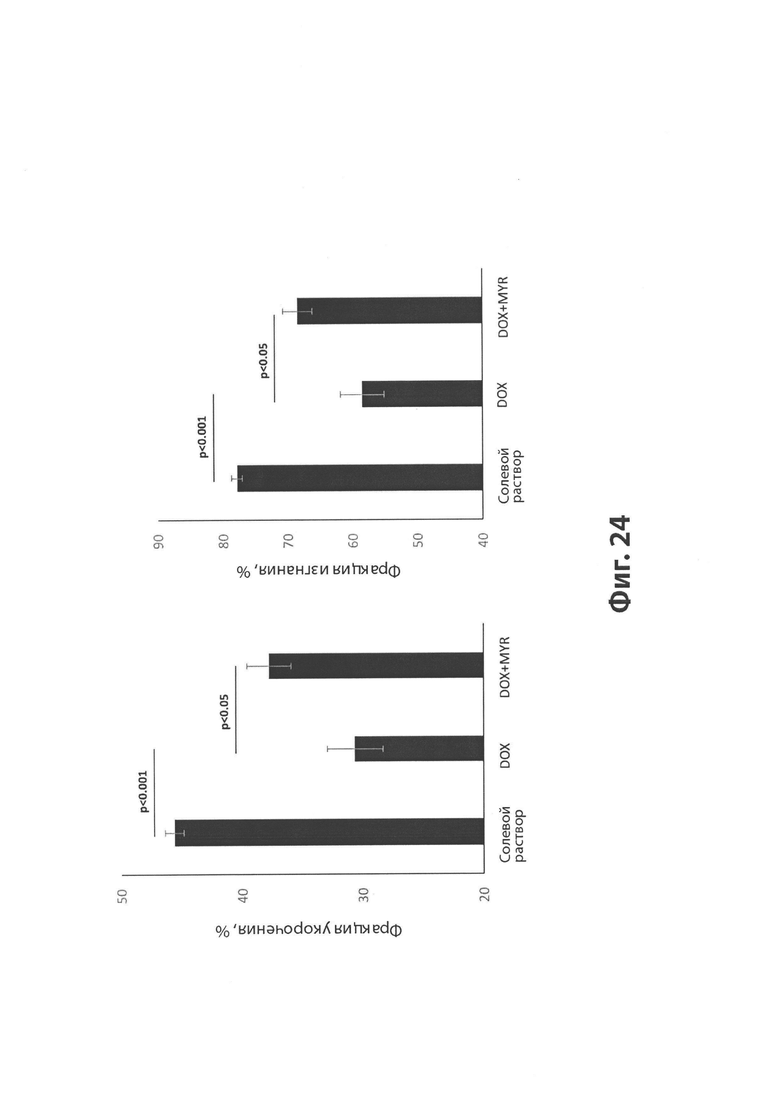





Группа изобретений относится к области медицины и фармацевтики, а именно к противораковой фармацевтической композиции со сниженной кардиотоксичностью, содержащей противораковый агент и защитный агент, где защитный агент выбран из группы, состоящей из мирицетина, робинетина, витексина, трицетина, физетина, 7,3’,4’,5’-тетрагидроксифлавона, мирицитрина и их соли, а противораковый агент представляет собой антрациклин или его соль, ингибитор протеинкиназы или ингибитор протеасомы, и где молярное отношение защитного агента к противораковому агенту составляет от около 1:1 до около 1000:1; а также к способам лечения рака и способу предупреждения, снижения или исключения кардиотоксичности, вызванной противораковым агентом, включающим введение указанных противораковых агентов и защитных агентов; и к набору, включающему указанные агенты и инструкции по их применению. Группа изобретений обеспечивает фармацевтические композиции, наборы и способы для снижения или исключения кардиотоксичности, вызванной лечением рака антрациклином, ингибитором протеинкиназы или ингибитором протеасомы. 6 н. и 65 з.п. ф-лы, 29 ил., 1 табл., 30 пр.
1. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью, содержащая противораковый агент и защитный агент, где защитный агент выбран из группы, состоящей из мирицетина, робинетина, витексина, трицетина, физетина, 7,3’,4’,5’-тетрагидроксифлавона, мирицитрина и их соли;
где противораковый агент представляет собой антрациклин или его соль, ингибитор протеинкиназы или ингибитор протеасомы; и
где молярное отношение защитного агента к противораковому агенту составляет от около 1:1 до около 1000:1.
2. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по п. 1, отличающаяся тем, что защитный агент представляет собой мирицетин, робинетин, витексин или их соль.
3. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по п. 1 или 2, которая представляет собой таблетку, жидкость, капсулу, гель-капсулу или липосому.
4. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по любому из пп. 1-3, которая является подходящей для внутривенного введения.
5. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по любому из пп. 1-4, отличающаяся тем, что защитный агент представляет собой ингибитор топоизомеразы IIα и/или топоизомеразы IIβ.
6. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по любому из пп. 1-5, где молярное отношение защитного агента к противораковому агенту составляет от около 1:1 до около 200:1, от около 1:1 до около 30:1, от около 1:1 до около 10:1 или от около 1:1 до около 5:1.
7. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по любому из пп. 1-6, где массовое отношение защитного агента к противораковому агенту составляет от около 1:1 до около 1000:1, от около 1:1 до около 200:1, от около 1:1 до около 100:1, от около 1:1 до около 20:1, от около 1:1 до около 10:1, от около 1:1 до около 5:1 или от около 1:1 до около 2:1.
8. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по любому из пп. 1-7, содержащая от около 0,1 мг до около 50 мг, от около 1 мг до около 10 мг, от около 1 мг до около 20 мг, от около 1 мг до около 30 мг, от около 1 мг до около 40 мг, от около 1 мг до около 50 мг, от около 1 мг до около 100 мг, от около 1 мг до около 200 мг, от около 40 мг до около 300 мг или от около 50 мг до около 400 мг защитного агента.
9. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по любому из пп. 1-8, отличающаяся тем, что противораковый агент представляет собой антрациклин или его соль.
10. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по п. 9, отличающаяся тем, что указанный антрациклин выбран из группы, состоящей из доксорубицина, эпирубицина, идарубицина, даунорубицина, митоксантрона и валрубицина.
11. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по п. 10, отличающаяся тем, что указанный антрациклин представляет собой доксорубицин, эпирубицин или идарубицин.
12. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по любому из пп. 1-8, отличающаяся тем, что противораковый агент представляет собой ингибитор протеинкиназы.
13. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по п. 12, отличающаяся тем, что указанный ингибитор протеинкиназы выбран из группы, состоящей из афатиниба, акситиниба, бозутиниба, кабозантиниба, карфилзомиба, церитиниба, кобиметаниба, кризотиниба, дабрафениба, дазатиниба, эрлотиниба, эверолимуса, гефитиниба, ибрутиниба, иматиниба, лапатиниба, ленватиниба, нилотиниба, нинтеданиба, осимертиниба, палбоциклиба, пазопаниба, пегаптаниба, понатиниба, регорафениба, руксолитиниба, сиролимуса, сорафениба, сунитиниба, тофацитиниба, тофацитиниба, темсиролимуса, траметиниба, вандетаниба, вемурафениба и висмодегиба.
14. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по п. 12 или 13, отличающаяся тем, что ингибитор протеинкиназы представляет собой ингибитор тирозинкиназы.
15. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по п. 14, отличающаяся тем, что ингибитор тирозинкиназы выбран из группы, состоящей из сорафениба, сунитиниба, босутиниба, гефитиниба, дазатиниба, дабрафениба, вемурафениба, иматиниба, лапатиниба и нилотиниба.
16. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по п. 14 или 15, отличающаяся тем, что указанный ингибитор тирозинкиназы представляет собой сорафениб или сунитиниб.
17. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по любому из пп. 1-8, отличающаяся тем, что противораковый агент представляет собой ингибитор протеасомы.
18. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по п. 17, отличающаяся тем, что ингибитор протеасомы представляет собой бортезомиб.
19. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по любому из пп. 1-18, которая состоит из противоракового агента и защитного агента.
20. Противораковая фармацевтическая композиция со сниженной кардиотоксичностью по любому из пп. 1-18, дополнительно содержащая второй защитный агент дексразоксан или его соль.
21. Способ лечения рака у субъекта, включающий введение субъекту эффективного количества противораковой фармацевтической композиции со сниженной кардиотоксичностью по любому из пп. 1-20.
22. Способ предупреждения, снижения или исключения кардиотоксичности, вызванной противораковым агентом, у субъекта, страдающего от рака, включающий: введение указанному субъекту эффективного количества защитного агента до или одновременно с противораковым агентом, обеспечивая предупреждение, снижение или исключение кардиотоксичности, вызванной противораковым агентом, у субъекта;
где введение защитного агента обеспечивает эффективное количество любого из мирицетина, робинетина, витексина, трицетина, физетина, 7,3’,4’,5’-тетрагидроксифлавона, мирицитрина и их соли; и
где противораковый агент представляет собой антрациклин или его соль, ингибитор протеинкиназы или ингибитор протеасомы.
23. Способ по п. 22, где защитный агент выбран из группы, состоящей из мирицетина, робинетина, витексина, трицетина, физетина, 7,3’,4’,5’-тетрагидроксифлавона, мирицитрина и их соли.
24. Способ лечения рака у субъекта, включающий введение субъекту эффективного количества противоракового агента до или одновременно с эффективным количеством противоракового агента;
где защитный агент выбран из группы, состоящей из мирицетина, робинетина, витексина, трицетина, физетина, 7,3’,4’,5’-тетрагидроксифлавона, мирицитрина и их соли;
где противораковый агент представляет собой антрациклин или его соль, ингибитор протеинкиназы или ингибитор протеасомы; и
где защитный агент предупреждает, снижает или исключает кардиотоксичность, вызванную противораковым агентом у субъекта при лечении рака.
25. Способ лечения рака у субъекта, который не вызывает кардиотоксичность или имеет сниженную кардиотоксичность, включающий введение субъекту эффективного количества противоракового агента, где субъект имеет эффективное количество любого из мирицетина, робинетина, витексина, трицетина, физетина, 7,3’,4’,5’-тетрагидроксифлавона, мирицитрина и их соли, тем самым предупреждая, снижая или исключая кардиотоксичность, вызванную противораковым агентом у субъекта, где противораковый агент представляет собой антрациклин или его соль, ингибитор протеинкиназы или ингибитор протеасомы.
26. Способ по п. 25, дополнительно включающий введение субъекту эффективного количества защитного агента до введения противоракового агента, где защитный агент выбран из группы, состоящей из мирицетина, робинетина, витексина, трицетина, физетина, 7,3’,4’,5’-тетрагидроксифлавона, мирицитрина и их соли.
27. Способ по любому из пп. 22-24, отличающийся тем, что защитный агент вводят субъекту до введения противоракового агента.
28. Способ по п. 26 или 27, отличающийся тем, что защитный агент вводят субъекту по меньшей мере за 5 минут, 10 минут, 30 минут или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 48 часов до введения противоракового агента.
29. Способ по любому из пп. 22-24, отличающийся тем, что защитный агент вводят субъекту одновременно с противораковым агентом.
30. Способ по п. 29, отличающийся тем, что противораковый агент и защитный агент совместно представлены в виде жидкой фармацевтической композиции.
31. Способ по п. 29, отличающийся тем, что противораковый агент и защитный агент совместно представлены в виде таблетки.
32. Способ по любому из пп. 22-24 и 26-31, отличающийся тем, что защитный агент вводят перорально.
33. Способ по любому из пп. 22-24 и 26-31, отличающийся тем, что защитный агент вводят внутривенно.
34. Способ по любому из пп. 21-33, отличающийся тем, что субъектом является человек.
35. Способ по любому из пп. 21-34, отличающийся тем, что рак выбран из группы, состоящей из рака мочевого пузыря, рака кости, рака головного мозга, рака молочной железы, рака пищевода, рака толстой и прямой кишок, лейкоза, рака печени, рака легких, лимфомы, миеломы, рака яичников, рака предстательной железы, саркомы, рака желудка и рака щитовидной железы.
36. Способ по п. 35, отличающийся тем, что рак представляет собой рак молочной железы, лейкоз или саркому.
37. Способ по п. 36, отличающийся тем, что саркома представляет собой саркому Капоши.
38. Способ по любому из пп. 22-37, отличающийся тем, что противораковый агент представляет собой антрациклин или его соль.
39. Способ по п. 38, отличающийся тем, что антрациклин выбран из группы, состоящей из доксорубицина, эпирубицина, идарубицина, даунорубицина, митоксантрона и валрубицина.
40. Способ по п. 38 или 39, отличающийся тем, что указанный антрациклин представляет собой доксорубицин, эпирубицин или идарубицин.
41. Способ по любому из пп. 22-37, отличающийся тем, что противораковый агент представляет собой ингибитор протеинкиназы.
42. Способ по п. 41, отличающийся тем, что ингибитор протеинкиназы выбран из группы, состоящей из афатиниба, акситиниба, бозутиниба, кабозантиниба, карфилзомиба, церитиниба, кобиметаниба, кризотиниба, дабрафениба, дазатиниба, эрлотиниба, эверолимуса, гефитиниба, ибрутиниба, иматиниба, лапатиниба, ленватиниба, нилотиниба, нинтеданиба, осимертиниба, палбоциклиба, пазопаниба, пегаптаниба, понатиниба, регорафениба, руксолитиниба, сиролимуса, сорафениба, сунитиниба, тофацитиниба, тофацитиниба, темсиролимуса, траметиниба, вандетаниба, вемурафениба и висмодегиба.
43. Способ по п. 41 или 42, отличающийся тем, что ингибитор протеинкиназы представляет собой ингибитор тирозинкиназы.
44. Способ по п. 43, отличающийся тем, что ингибитор тирозикиназы выбран из группы, состоящей из сорафениба, сунитиниба, бозутиниба, гефитиниба, дазатиниба, дабрафениба, вемурафениба, иматиниба, лапатиниба и нилотиниба.
45. Способ по п. 43 или 44, отличающийся тем, что ингибитор тирозинканазы представляет собой сорафениб или сунитиниб.
46. Способ по любому из пп. 22-37, отличающийся тем, что противораковый агент представляет собой ингибитор протеасомы.
47. Способ по п. 46, отличающийся тем, что ингибитор протеасомы представляет собой бортезомиб.
48. Способ по любому из пп. 22-47, отличающийся тем, что вводимый защитный агент или любой из мирицетина, робинетина, витексина, трицетина, физетина, 7,3’,4’,5’-тетрагидроксифлавона, мирицитрина и их соли присутствует в количестве от около 0,5 мг/кг до около 200 мг/кг, от около 0,5 мг/кг до около 50 мг/кг или от около 1 мг/кг до около 5 мг/кг.
49. Способ по любому из пп. 22-48, отличающийся тем, что молярное отношение вводимых защитного агента к противораковому агенту или молярное отношение любого из мирицетина, робинетина, витексина, трицетина, физетина, 7,3’,4’,5’-тетрагидроксифлавона, мирицитрина и их соли к противораковому агенту составляет от около 1:1 до около 1000:1, от около 1:1 до около 200:1, от около 1:1 до около 30:1, от около 1:1 до около 10:1 или от около 1:1 до около 5:1.
50. Способ по любому из пп. 22-49, отличающийся тем, что массовое отношение вводимых защитного агента к противораковому агенту или массовое отношение любого из мирицетина, робинетина, витексина, трицетина, физетина, 7,3’,4’,5’-тетрагидроксифлавона, мирицитрина и их соли к противораковому агенту составляет от около 1:1 до около 1000:1, от около 1:1 до около 200:1, от около 1:1 до около 100:1, от около 1:1 до около 20:1, от около 1:1 до около 10:1, от около 1:1 до около 5:1 или от около 1:1 до около 2:1.
51. Способ по любому из пп. 22-24 и 26-50, отличающийся тем, что защитный агент представляет собой или обеспечивает мирицетин, робинетин, витексин или их соль.
52. Способ по любому из пп. 22-24 и 26-51, отличающийся тем, что защитный агент представляет собой или обеспечивает ингибитор топоизомеразы IIα и/или топоизомеразы IIβ.
53. Способ по любому из пп. 22-52, где субъект дополнительно имеет эффективное количество дексразоксана или его соли.
54. Способ по любому из пп. 22-53, дополнительно включающий введение субъекту эффективного количества дексразоксана или его соли до или одновременно с противораковым агентом.
55. Способ по любому из пп. 22-24 и 26-52, дополнительно включающий введение субъекту эффективного количества второго защитного агента до или одновременно с противораковым агентом, где введение второго защитного агента обеспечивает эффективное количество дексразоксана или его соли.
56. Способ по любому из пп. 21-55, отличающийся тем, что субъект имеет сердечное состояние или анамнез сердечного состояния.
57. Способ по любому из пп. 22-56, отличающийся тем, что кардиотоксичность включает одно или более из повреждения сердечной ткани, электрофизиологической дисфункции, дисфункции сократительной способности, двухцепочечного разрыва ДНК в кардиомиоцитах, митохондриальной токсичности, апоптоза и окислительного стресса.
58. Способ по п. 57, отличающийся тем, что кардиотоксичность включает повреждение сердечной ткани.
59. Способ по п. 57, отличающийся тем, что электрофизиологическая дисфункция включает увеличение продолжительности интервала QT и/или увеличение продолжительности интервала QTс.
60. Способ по п. 57, отличающийся тем, что дисфункция сократительной способности включает уменьшенную фракцию изгнания из сердца (EF) и/или уменьшенную сердечную фракцию укорочения (FS).
61. Способ по любому из пп. 22-24 и 26-60, отличающийся тем, что субъект имеет сокращенный интервал QTc после введения защитного агента.
62. Способ по п. 25, где субъект, имеющий эффективное количество любого из мирицетина, робинетина, витексина, трицетина, физетина, 7,3’,4’,5’-тетрагидроксифлавона, мирицитрина и их соли, имеет сокращенный интервал QTc по сравнению с субъектом, не имеющим эффективного количества любого из мирицетина, робинетина, витексина, трицетина, физетина, 7,3’,4’,5’-тетрагидроксифлавона, мирицитрина и их соли.
63. Противораковый набор со сниженной кардиотоксичностью, содержащий:
а) защитный агент, выбранный из группы, состоящей из мирицетина, робинетина, витексина, трицетина, физетина, 7,3’,4’,5’-тетрагидроксифлавона, мирицитрина и их соли;
б) противораковый агент, выбранный из группы, состоящей из антрациклина или его соли, ингибитора протеинкиназы и ингибитора протеасомы; и
в) инструкцию, обеспечивающую информацию о введении защитного агента до или одновременно с противораковым агентом;
где противораковый агент вызывает кардиотоксичность.
64. Набор по п. 63, дополнительно содержащий второй защитный агент дексразоксан или его соль.
65. Набор по п. 63 или 64, отличающийся тем, что противораковый агент представляет собой антрациклин или его соль.
66. Набор по п. 65, отличающийся тем, что антрациклин выбран из группы, состоящей из доксорубицина, эпирубицина, идарубицина, даунорубицина, митоксантрона и валрубицина.
67. Набор по п. 63 или 64, отличающийся тем, что противораковый агент представляет собой ингибитор протеинкиназы.
68. Набор по п. 67, отличающийся тем, что ингибитор протеинкиназы выбран из группы, состоящей из афатиниба, акситиниба, бозутиниба, кабозантиниба, карфилзомиба, церитиниба, кобиметаниба, кризотиниба, дабрафениба, дазатиниба, эрлотиниба, эверолимуса, гефитиниба, ибрутиниба, иматиниба, лапатиниба, ленватиниба, нилотиниба, нинтеданиба, осимертиниба, палбоциклиба, пазопаниба, пегаптаниба, понатиниба, регорафениба, руксолитиниба, сиролимуса, сорафениба, сунитиниба, тофацитиниба, тофацитиниба, темсиролимуса, траметиниба, вандетаниба, вемурафениба и висмодегиба.
69. Набор по п. 67 или 68, отличающийся тем, что ингибитор протеинкиназы представляет собой ингибитор тирозинкиназы.
70. Набор по п. 69, отличающийся тем, что ингибитор тирозикиназы выбран из группы, состоящей из сорафениба, сунитиниба, босутиниба, гефитиниба, дазатиниба, дабрафениба, вемурафениба, иматиниба, лапатиниба, и нилотиниба.
71. Набор по п. 63 или 64, отличающийся тем, что противораковый агент представляет собой ингибитор протеасомы, необязательно, где ингибитор протеасомы представляет собой бортезомиб.
| WO 2015138186 A2, 17.09.2015 | |||
| LEFRAK E.A | |||
| et al | |||
| A clinicopathologic analysis of adriamycin cardiotoxicity // Cancer | |||
| Приспособление для склейки фанер в стыках | 1924 |
|
SU1973A1 |
| - Vol | |||
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| - P | |||
| Дровопильное устройство | 1921 |
|
SU302A1 |
| SWAIN S.M | |||
| et al | |||
| Cardioprotection with dexrazoxane for doxorubicin-containing therapy in advanced breast cancer // Journal of Clinical Oncology | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
| - Vol | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| - P | |||
| Машина для нарезания зубчатых колес винтовой фрезой | 1925 |
|
SU1318A1 |
| МАГНИТНЫЙ ДЕШИФРАТОР АДРЕСОВ ЗАПОМИНАЮЩЕГО УСТРОЙСТВА С ЛИНЕЙНОЙ ВЫБОРКОЙ | 0 |
|
SU180855A1 |
Авторы
Даты
2021-02-18—Публикация
2017-02-03—Подача