Уровень техники настоящего изобретения
Настоящее изобретение относится к биспецифическому белку с высокой степенью гетеродимеризации и способу получения биспецифического белка.
Предшествующий уровень техники настоящего изобретения
Биспецифическое антитело (BsAb), которое представляет собой антитело, содержащее два паратопа, способные к распознаванию двух разных типов целевых антигенов, является общим термином для антитела, способного к связыванию одновременно с двумя разными целевыми антигенами, или его антигенсвязывающего фрагмента. Этот признак обеспечивает возможность создания терапевтической стратегии, которая является неосуществимой при использовании традиционных моноклональных антител. Биспецифические антитела редко встречаются в природе, и в большинстве своем искусственно сконструированы с возможностью одновременного связывания с двумя разными типами биологических мишеней. Возможность двойного нацеливания может обеспечить новые области применения таких BsAb, в контроле которых моноспецифические антитела (MsAb) оказались безуспешными. Что касается терапевтических целей, значительный интерес возникает в отношении (1) надежного приведения иммунных клеток в непосредственную близость с целевыми клетками, (2) ингибирования или активации двух отдаленных друг от друга сигнальных путей в целевых клетках для создания синергического эффекта и (3) специфической и регулируемой доставки терапевтического вещества, лекарственных препаратов, токсинов и т.д. к целевым клеткам.
Был разработан ряд BsAb-связанных методик (45 разных форматов). Эти методики относят к четырем категориям на основе структурных различий: во-первых, гетерологичная биспецификация тяжелых цепей с применением различных способов, предусматривающих структурную комплементарность, также известных как способы конструирования с использованием структуры «выступ-во-впадину» или просто KiH, эффекта электростатического взаимодействия и перестановки CH3-домена (под названием SEEDbody™); во-вторых, различные форматы фрагментов антител, такие как Diabody™ (Diabody: димерные фрагменты антител) BiTE™ (BiTE: привлекающие T-клетки биспецифические активаторы) и DART™ (DART: переориентирующееся биспецифическое антитело с двойной аффинностью); в-третьих, технология с применением одного или нескольких функциональных доменов в комбинации с интактными антителами, как, например, Modular Antibody™, Zybody™, dAbs™ (dAbs : однодоменные антитела) и DVD-IG™ (DVD-Ig: иммуноглобулин с двойными вариабельными доменами); и в-четвертых, были разработаны методики, в которых используется схема, подобная полноразмерным IgG, как, например, Duobody™ (обмен Fab-плеч), CrossMab™, Azymetric™ и kI body™.
Например, в патенте США № 2013-892198 A, выданном Zymeworks, раскрыта гетерополимерная структура цепей иммуноглобулина с мутациями в Fc-домене, в особенности указывается, что антитела с гетерополимерной структурой могут быть сконструированы путем осуществления модификации в отношении вовлеченных в образование дисульфидных связей цистеиновых остатков с заменой на заряженные аминокислоты для создания электрического взаимодействия.
Существуют следующие проблемы, связанные с традиционными методиками конструирования биспецифических антител.
Во-первых, имеют место нежелательные комбинации тяжелых цепей. Когда тяжелые цепи (A и B), происходящие соответственно из двух нацеленных на разные эпитопы антител, случайным образом объединяются друг с другом, образуются две комбинации одинакового происхождения (AA и BB) и одна комбинация разного происхождения (AB или BA). Комбинации тяжелых цепей одинакового происхождения являются нежелательными примесями при конструировании биспецифических антител, при этом снижается чистота биспецифических антител и требуется процесс удаления таких комбинаций. Следовательно, они могут оказывать неблагоприятные эффекты, например, обуславливая затруднение в процессе выделения и очистки антител, вызывая нежелательные иммунные ответы или сигнальную трансдукцию, приводящую к возникновению побочных эффектов и т.д. Следовательно, существуют постоянные потребности в образовании только комбинаций тяжелых цепей разного происхождения, что обеспечивает отсутствие или сокращенный в значительной степени уровень комбинаций тяжелых цепей одинакового происхождения.
Во-вторых, хотя главным образом друг с другом объединяются легкие и тяжелые цепи одинакового происхождения, имеют место ситуации, когда легкие и тяжелые цепи, которые объединяются друг с другом, имеют разное происхождение. Биспецифическое антитело нацелено на два разных вида эпитопов. Каждый эпитоп может быть распознан антителом, в котором объединены легкие и тяжелые цепи одинакового происхождения. Антитела, образованные посредством объединений легких и тяжелых цепей разного происхождения, могут распознавать новые эпитопы, отличные от требуемых двух эпитопов, выступать в качестве примеси, усложняющей выделение и очистку представляющих интерес антител, и вызывать побочный эффект. Следовательно, для получения биспецифических антител требуется, чтобы происходили объединения правильных пар легких и тяжелых цепей, и при этом не происходило неспецифическое объединение легких и тяжелых цепей, или происходило на незначительном уровне.
Принимая во внимание вышеупомянутые связанные с обеспечением биспецифических антител проблемы, требования к конструированию биспецифических антител сводятся к следующему. Всего при конструировании биспецифических антител возможны десять комбинаций с легкими и тяжелыми цепями от двух разных видов антител, соответственно распознающих два разных эпитопа, как показано на фиг. 1. Из них комбинация, обозначенная изображенным пунктирной линией кругом, удовлетворяет требованиям, состоящим в том, что (1) происходящие из разных антител тяжелые цепи объединяются друг с другом и (2) происходящие из одних и тех же антител легкие и тяжелые цепи соединяются друг с другом. Другие девять комбинаций не должны образовываться или должны образовываться на минимальном уровне.
В WO2014142591, которая является предшествующей заявкой на патент автора настоящего изобретения, рассматривается «белок, в который вводят электрическое взаимодействие в пределах сайта гидрофобного взаимодействия, и способ его получения» (protein in which electrical interaction is introduced within a hydrophobic interaction site and preparation method therefor). В заявке на патент раскрыты белок или антитело с электрическим взаимодействием, введенным в их сайт гидрофобного взаимодействия, где электрическое взаимодействие осуществляется за счет положительного заряда и отрицательного заряда на положительно заряженном веществе и отрицательно заряженном веществе, которыми была заменена пара гидрофобных аминокислот, выбранных в сайте гидрофобного взаимодействия. В соответствии с настоящим изобретением интенсивные и детальные исследования, проведенные авторами настоящего изобретения, привели к обнаружению того, что биспецифические антитела могут образовываться за счет электростатического взаимодействия в сайте взаимодействия, отличного от гидрофобного, что не было учтено в предшествующей заявке на патент, и могут быть сконструированы с высоким выходом даже за счет зависимого от размера соединения и/или изменения (обмена) аминокислот между соединенными парами.
[Документ в соответствии с уровнем техники]
[Патентный документ]
(Патентный документ 1) номер патента Кореи 10-2014-0019385 A (14 февраля 2014 года)
Раскрытие настоящего изобретения
Техническая задача
С целью решения вышеупомянутых задач, настоящее изобретение относится к биспецифическому антителу высокой чистоты и способу его получения.
Один вариант осуществления относится к димеру, содержащему первый CH3-домен и второй CH3-домен антитела, или Fc-области, содержащие CH3-домены, где
первый CH3-домен и второй домен мутированы так, что по меньшей мере одна пара аминокислот, выбранная из пар аминокислот, образующих связи аминокислота-аминокислота между первым CH3-доменом и вторым CH3-доменом, модифицирована с помощью по меньшей мере одной из следующих мутаций:
(1) мутация, при которой, по меньшей мере из одной пары аминокислот между CH3-доменами, одна аминокислота заменена аминокислотой с положительным зарядом, а другая заменена аминокислотой с отрицательным зарядом;
(2) мутация, при которой аминокислоты по меньшей мере в одной паре аминокислот между CH3-доменами подвержены обмену одна на другую; и
(3) мутация, при которой, по меньшей мере из одной пары аминокислот между CH3-доменами, одна аминокислота заменена большой гидрофобной аминокислотой, тогда как другая заменена маленькой гидрофобной аминокислотой.
Первый CH3-домен и второй CH3-домен могут происходить из одного и того же или из разных видов антител (иммуноглобулинов).
Другой вариант осуществления относится к молекуле нуклеиновой кислоты, кодирующей модифицированный CH3-домен или модифицированную Fc-область, содержащую модифицированный CH3-домен, рекомбинантному вектору, несущему молекулу нуклеиновой кислоты, и рекомбинантной клетке, содержащей в ней рекомбинантный вектор.
В контексте настоящего документа термины «одна аминокислота» и «другая аминокислота» в выражении «по меньшей мере из одной пары аминокислот, одна аминокислота … и другая аминокислота …» означают одну аминокислоту и другую аминокислоту из двух аминокислот в каждой из одной или нескольких пар аминокислот соответственно (далее в настоящем документе будет применяться это же определение).
Другой вариант осуществления относится к биспецифическому белку для нацеливания на два разных вида мишеней, причем биспецифический белок содержит первый CH3-домен или первую Fc-область, содержащую первый CH3-домен, и второй CH3-домен или вторую Fc-область, содержащую второй CH3-домен, где первый CH3-домен и второй CH3-домен мутированы так, что по меньшей мере одна пара аминокислот, выбранная из пар аминокислот, образующих связи аминокислота-аминокислота между первым CH3-доменом и вторым CH3-доменом, модифицирована с помощью по меньшей мере одной из следующих мутаций:
(1) мутация, при которой, по меньшей мере из одной пары аминокислот между CH3-доменами, одна аминокислота заменена аминокислотой с положительным зарядом, тогда как другая заменена аминокислотой с отрицательным зарядом;
(2) мутация, при которой аминокислоты по меньшей мере в одной паре аминокислот между CH3-доменами подвержены обмену одна на другую; и
(3) мутация, при которой, по меньшей мере из одной пары аминокислот между CH3-доменами, одна аминокислота заменена большой гидрофобной аминокислотой, тогда как другая заменена маленькой гидрофобной аминокислотой.
Пара аминокислот, которую подвергают замене аминокислотами с противоположными зарядами на стадии (1), может представлять собой аминокислоту, участвующую в гидрофобном взаимодействии, и/или аминокислоту, участвующую во взаимодействии, отличном от гидрофобного. Согласно одному варианту осуществления по меньшей мере одна из двух аминокислот, составляющих пару аминокислот, может не быть гидрофобной аминокислотой (т.е. гидрофильная аминокислота). Электростатическое взаимодействие, которое вводят с помощью стадии (1) замены аминокислотами с противоположными зарядами, может способствовать улучшению образования гетеродимера между Fc-областями.
В контексте настоящего документа термин «гетеродимер» означает слитую структуру, в которой два разных белка соединены друг с другом, и подразумевается, что она охватывает любой биспецифический белок, в котором два белка, нацеленные на соответствующие разные мишени, соединены друг с другом (например, биспецифическое антитело) и т.д.
Взаимная замена (обмен) аминокислот на стадии (2) может быть осуществлена в любой паре аминокислот, образующих соединение аминокислота-аминокислота в Fc-областях или CH3-доменах, и, например, по меньшей мере в одной паре аминокислот, выбранной из всех пар аминокислот, каждая из которых связана посредством взаимодействия, отличного от электростатического взаимодействия, гидрофобного взаимодействия и взаимодействия, основанного на различии в размерах аминокислот. Следовательно, два аминокислотных остатка, которые взаимодействуют друг с другом (например, сами по себе связываются друг с другом) в каждой паре аминокислот (т.е. аминокислотный остаток первого CH3-домена и другая аминокислота второго CH3-домена во взаимодействующей паре аминокислот), могут быть подвержены замещению один на другой с целью снижения вероятности образования гомодимера, поскольку присутствие такой же аминокислоты в соответствующих положениях, в которых происходит аминокислотное взаимодействие между CH3-доменами одинакового происхождения, усложняет связывание их друг с другом, что, тем самым, способствует повышению степени гетеродимеризации (например, если пара аминокислот S364 и K370 подвергается мутации S364K в первом домене, и мутации K370S во втором CH3-домене, взаимодействие между CH3-доменами одинакового происхождения отсутствует, поскольку обе аминокислоты в положениях 364 и 370 становятся лизином (K) в первом CH3-домене и серином (S) во втором CH3-домене, при этом взаимодействие происходит между CH3-доменами разного происхождения с образованием исключительно гетеродимера).
Стадия (3) замены отличающимися по размеру аминокислотами обеспечивает улучшение в отношении структурного соответствия при взаимодействии между большой аминокислотой и маленькой аминокислотой (то есть большая аминокислота помещается в свободное пространство, созданное маленькой аминокислотой, за счет чего повышается эффективность связывания), с последующим повышением степени гетеродимеризации. В частности, взаимодействующая пара аминокислот мутирована так, что одна аминокислота заменена большой гидрофобной аминокислотой, тогда как другая аминокислота заменена маленькой гидрофобной аминокислотой, в результате чего используется сложность в отношении образования связи между большими аминокислотами или между маленькими аминокислотами для сведения к минимуму степени гомодимеризации (крупные аминокислоты, в случае присутствия соответственно в двух противоположных цепях, способствуют тому, что две цепи отдалены друг от друга, что препятствует димеризации, тогда как две маленькие аминокислоты, в случае присутствия в двух противоположных цепях, взаимодействуют друг с другом с более низкой вероятностью из-за большого расстояния между ними, и имеет место сложность в отношении взаимодействия между ними). Напротив, большая гидрофобная аминокислота в одном CH3-домене или Fc и маленькая гидрофобная аминокислота в другом CH3-домене или Fc подвергаются гидрофобному взаимодействию друг с другом на более близком расстоянии по сравнению с аминокислотами до осуществления мутации, что, таким образом, создает условие, оптимальное для гетеродимеризации. Следовательно, как большая, так и маленькая аминокислоты, подлежащие замене на стадии замены аминокислотами разного размера, могут быть выбраны из гидрофобных аминокислот. Например, большая аминокислота может представлять собой по меньшей мере одну аминокислоту, выбранную из группы, состоящей из триптофана и фенилаланина, которые обе являются гидрофобными. Кроме того, маленькая аминокислота может представлять собой по меньшей мере одну аминокислоту, выбранную из группы, состоящей из аланина, глицина и валина, все из которых являются гидрофобными.
Биспецифический белок, содержащий мутантные Fc-области или CH3-домены, может быть выбран из любого типа белков, нацеленных (например, путем специфического распознавания и/или связывания с) на два разных вида мишеней. Для осуществления нацеливания биспецифический белок, содержащий мутантные Fc-области или CH3-домены, может содержать два нацеленных домена, способных к нацеливанию (путем специфического распознавания и/или связывания с) на два разных вида мишеней соответственно (например, первый нацеленный домен для нацеливания на первую мишень и второй нацеленный домен для нацеливания на вторую мишень). Нацеленные домены могут образовывать ковалентную или нековалентную связь (соединение) с мутантными Fc-областями или CH3-доменами соответственно прямо или опосредованно (например, посредством линкера). Например, биспецифические белки, содержащие мутантные Fc-области или CH3-домены, могут представлять собой по меньшей мере одно, выбранное из группы, состоящей из биспецифического антитела, антигенсвязывающего фрагмента биспецифического антитела (например, (scFv-Fc)2 и т.д.), аналога биспецифического антитела (например, наноантитела, пептитела, пептида, аптида и т.д.) и слитого белка на основе мишень-специфического связывающего полипептида и мутантных Fc-области или CH3-домена.
Мишень-специфический связывающий полипептид может представлять собой любой полипептид, который специфически связывается с биологическим целевым веществом (любые присутствующие в организме соединения, включая белки, нуклеиновые кислоты и т.п.), и может представлять собой по меньшей мере один полипептид, выбранный, например, из группы, состоящей из паратопа (например, CDR или вариабельной области тяжелой цепи и/или легкой цепи), одноцепочечного Fv (scFv), мембранного белка (например, различных рецепторов и т.д.), эктодомена мембранного белка и лиганда (например, различных факторов роста, цитокинов и т.д.). Согласно одному варианту осуществления слитый белок на основе мишень-специфического связывающего полипептида и мутантной Fc-области или CH3-домена может представлять собой по меньшей мере одно, выбранное из группы, состоящей из слитого белка на основе мембранного белка и мутантных Fc-области или CH3-домена, слитого белка на основе эктодомена мембранного белка и мутантных Fc-области или CH3-домена, слитого белка на основе лиганда и мутантных Fc-области или CH3-домена и слитого белка на основе scFv и мутантных Fc-области или CH3-домена.
Если биспецифический белок, содержащий мутантные Fc-область или CH3-домен, представляет собой антитело, антигенсвязывающий фрагмент антитела или аналог антитела, нацеленный домен может представлять собой паратоп (например, CDR или вариабельную область тяжелой цепи и/или легкой цепи). В случае вышеупомянутого слитого белка на основе мишень-специфического связывающего полипептида и мутантных Fc-области или CH3-домена мишень-специфический связывающий полипептид может представлять собой по меньшей мере одно, выбранное из группы, состоящей из мембранного белка (например, различных рецепторов), эктодомена мембранного белка, лиганда (например, различных факторов роста, цитокинов и т.д.) и паратопа (например, CDR или вариабельной области тяжелой цепи и/или легкой цепи).
Два разных вида мишеней могут относится к двум разным видам биологических веществ (например, белков) или разным областям в пределах одного биологического вещества (например, одного белка). Биспецифический белок, содержащий мутантные Fc-область или CH3-домен, по сравнению с биспецифическим белком, содержащим немутантные (дикого типа) Fc-область или CH3-домен, характеризуется повышением степени гетеродимеризации, снижением степени гомодимеризации и/или стабильностью.
Другой вариант осуществления относится к биспецифическому антителу или его антигенсвязывающему фрагменту, причем биспецифическое антитело содержит первый CH1-домен и первый CL-домен (константная область легкой цепи), происходящие соответственно из тяжелой цепи и легкой цепи антитела, распознающего первый эпитоп, и второй CH1-домен и второй CL-домен, происходящие соответственно из тяжелой цепи и легкой цепи антитела, распознающего второй эпитоп, где CH1-домены и CL-домены мутированы так, что они предусматривают по меньшей мере одну из следующих мутаций:
мутация, при которой, из двух аминокислот, составляющих каждую пару из одной или нескольких первых пар аминокислот, выбранных из пар аминокислот, образующих соответствующие связи аминокислота-аминокислота между первым CH1-доменом и первым CL-доменом, одна заменена аминокислотой с положительным зарядом, а другая заменена аминокислотой с отрицательным зарядом; и
мутация, при которой, из двух аминокислот, составляющих каждую пару из одной или нескольких вторых пар аминокислот, выбранных из пар аминокислот, образующих соответствующие связи аминокислота-аминокислота между вторым CH1-доменом и вторым CL-доменом, одна заменена аминокислотой с положительным зарядом, а другая заменена аминокислотой с отрицательным зарядом.
Первый эпитоп и второй эпитоп могут присутствовать в соответствующих разных белках (антитела) или в разных (различающихся) областях одного белка (антиген).
В соответствии с одним вариантом осуществления в биспецифическом антителе или его антигенсвязывающем фрагменте аминокислоты, замененные соответственно в первом CH1-домене и втором CH1-домене, имеют противоположные заряды, аминокислоты, замененные соответственно в первом CL-домене и первом CH1-домене, имеют противоположные заряды, и аминокислоты, замененные соответственно во втором CL-домене и втором CH1-домене, имеют противоположные заряды.
В биспецифическом антителе или его антигенсвязывающем фрагменте, например,
аминокислота, расположенная в первом CH1-домене, как член по меньшей мере одной первой пары аминокислот, выбранной из пар аминокислот, образующих соответствующие связи аминокислота-аминокислота между первым CH1-доменом и первым CL-доменом, может быть заменена аминокислотой с положительным зарядом, тогда как другой член пары, расположенный в первом CL-домене, может быть заменен аминокислотой с зарядом, отличающимся от такого у аминокислоты, замененной в первом CH1-домене, то есть с отрицательным зарядом, и
аминокислота, расположенная во втором CH1-домене, как член по меньшей мере одной второй пары аминокислот, выбранной из пар аминокислот, образующих соответствующие связи аминокислота-аминокислота между вторым CH1-доменом и вторым CL-доменом, может быть заменена аминокислотой с зарядом, отличающимся от такого у аминокислоты, замененной в первом CH1-домене, то есть с отрицательным зарядом, тогда как другой член, расположенный во втором CL-домене, может быть заменен аминокислотой с зарядом, отличающимся от такого у аминокислоты, замененной во втором CH1-домене, то есть с положительным зарядом.
В биспецифическом антителе или его антигенсвязывающем фрагменте, содержащих мутантные CH1-, CL-домены, подлежащие замене первая и вторая пары аминокислот могут быть одинаковыми или разными, положительно заряженные аминокислоты, замененные в первой и второй парах аминокислот, могут быть одинаковыми или разными, и отрицательно заряженные аминокислоты, замененные в первой и второй парах аминокислот, могут быть одинаковыми или разными. Антигенсвязывающий фрагмент биспецифического антитела, содержащего мутантный CH1-домен и мутантный CL-домен, может представлять собой, например, F(ab')2-фрагмент. Биспецифическое антитело, содержащее мутантные CH1- и CL-домены, или его антигенсвязывающий фрагмент, нацеливаются на те же эпитопы, что и биспецифическое антитело, содержащее немутантные (дикого типа) CH1- и CL-домены, и характеризуются более высокими степенями димеризации тяжелой цепи (или вариабельной области тяжелой цепи-CH1) с легкой цепью и/или стабильностью, по сравнению с биспецифическим антителом, содержащим немутантные (дикого типа) CH1- и CL-домены.
Содержащее мутантные CH1- и CL-домены биспецифическое антитело может содержать модифицированные CH3-домены, включая первый CH3-домен, происходящий из антитела, распознающего первый эпитоп, и второй CH3-домен, происходящий из антитела, распознающего второй эпитоп, или Fc-область, содержащую модифицированный CH3-домен, где первый CH3-домен и второй CH3-домен имеют по меньшей мере одну из следующих мутаций:
(1) мутация, при которой один член по меньшей мере одной пары аминокислот между CH3-доменами заменен аминокислотой с положительным зарядом, а другой член заменен аминокислотой с отрицательным зарядом;
(2) мутация, при которой члены по меньшей мере одной пары аминокислот между CH3-доменами подвержены взаимной замене один на другой; и
(3) мутация, при которой один член по меньшей мере одной пары аминокислот между CH3-доменами заменен большой аминокислотой (например, большими гидрофобными аминокислотами, такими как триптофан, фенилаланин и т.д.), а другой член заменен маленькой аминокислотой (например, маленькими гидрофобными аминокислотами, такими как аланин, глицин, валин и т.д.).
Биспецифический белок или биспецифическое антитело, содержащие мутантный CH1-домен, мутантный CL-домен и мутантную Fc-область или модифицированный CH3-домен, могут характеризоваться улучшением в отношении степени гетеродимеризации, степени димеризации тяжелой цепи (или вариабельной области тяжелой цепи-CH1) и легкой цепи, при этом обе нацеливаются на один и тот же эпитоп, и/или стабильности по сравнению с биспецифическим белком или антителом, содержащими CH1-домен, CL-домен и Fc-область или CH3-домен, ни один из которых не является мутантным.
Биспецифическое антитело, содержащее мутантные CH1- и CL-домены, или его антигенсвязывающий фрагмент, нацеливаются на те же эпитопы, что и биспецифическое антитело, содержащее немутантные (дикого типа) CH1- и CL-домены, и характеризуются более высокими степенями димеризации тяжелой цепи (или вариабельной области тяжелой цепи-CH1) с легкой цепью и/или стабильностью, по сравнению с биспецифическим антителом, содержащим немутантные (дикого типа) CH1- и CL-домены.
Другой вариант осуществления относится к способу обеспечения увеличения степени гетеродимеризации биспецифического белка для нацеливания на разные мишени, при этом биспецифический белок содержит модифицированные CH3-домены или Fc-область, содержащую модифицированные CH3-домены, причем указанный способ предусматривает одну из следующих стадий введения мутаций:
(1) замена одной из двух аминокислот по меньшей мере в одной паре аминокислот, выбранной из пар аминокислот, образующих связи аминокислота-аминокислота между CH3-доменами, аминокислотой с положительным зарядом, а другой - аминокислотой с отрицательным зарядом;
(2) взаимная замена двух аминокислот по меньшей мере в одной паре аминокислот, выбранной из пар аминокислот, образующих связи аминокислота-аминокислота между первым CH3-доменом и вторым CH3-доменом, одна на другую; и
(3) замена одной из двух аминокислот по меньшей мере в одной паре аминокислот, выбранной из пар аминокислот, образующих связи аминокислота-аминокислота между первым CH3-доменом и вторым CH3-доменом, большой гидрофобной аминокислотой (например, триптофаном, фенилаланином и т.д.), а другой - маленькой гидрофобной аминокислотой (например, аланином, глицином, валином и т.д.).
Другой вариант осуществления относится к способу конструирования биспецифического антитела или его антигенсвязывающего фрагмента или обеспечения увеличения степени димеризации тяжелой цепи (или вариабельной области тяжелой цепи-CH1) и легкой цепи, при этом обе нацеливаются на один и тот же эпитоп, причем способ предусматривает следующие стадии осуществления мутаций CH1- и CL-домена:
замена одного из двух аминокислотных остатков, составляющих по меньшей мере одну пару аминокислот, выбранную из пар аминокислот, образующих связи аминокислота-аминокислота между первым CH3-доменом, происходящим из тяжелой цепи, и первым CL-доменом антитела, распознающего первый эпитоп, аминокислотой с положительным зарядом, а другого - аминокислотой с отрицательным зарядом; и
замена одного из двух аминокислотных остатков, составляющих по меньшей мере одну пару аминокислот, выбранную из пар аминокислот, образующих связи аминокислота-аминокислота между вторым CH3-доменом, происходящим из тяжелой цепи, и вторым CL-доменом антитела, распознающего второй эпитоп, аминокислотой с положительным зарядом, а другого - аминокислотой с отрицательным зарядом.
Способ конструирования биспецифического антитела или его антигенсвязывающего фрагмента или обеспечения увеличения степени димеризации тяжелой цепи (или вариабельной области тяжелой цепи-CH1) и легкой цепи может предусматривать, в дополнение к стадиям осуществления мутаций CH1- и CL-домена, по меньшей мере одну из следующих стадий введения мутаций CH3-домена:
(1) замена одной из двух аминокислот по меньшей мере в одной паре аминокислот, выбранной из пар аминокислот, образующих связи аминокислота-аминокислота между первым CH3-доменом, происходящим из тяжелой цепи антитела, распознающего первый эпитоп, и вторым CH3-доменом, происходящим из тяжелой цепи антитела, распознающего второй эпитоп, аминокислотой с положительным зарядом, а другой - аминокислотой с отрицательным зарядом;
(2) взаимная замена двух аминокислот по меньшей мере в одной паре аминокислот, выбранной из пар аминокислот, образующих связи аминокислота-аминокислота между первым CH3-доменом и вторым CH3-доменом, одна на другую; и
(3) замена одной из двух аминокислот по меньшей мере в одной паре аминокислот, выбранной из пар аминокислот, образующих связи аминокислота-аминокислота между первым CH3-доменом и вторым CH3-доменом, большой гидрофобной аминокислотой (например, триптофаном, фенилаланином и т.д.), а другой - маленькой гидрофобной аминокислотой (например, аланином, глицином, валином и т.д.).
Другой вариант осуществления относится к способу конструирования биспецифического антитела или его антигенсвязывающего фрагмента и обеспечения степени гетеродимеризации биспецифического антитела или его антигенсвязывающего фрагмента для нацеливания на разные мишени, причем способ предусматривает одну из следующих стадий введения мутаций для введения по меньшей мере одной мутации по меньшей мере в одну пару аминокислот, выбранную из пар аминокислот, образующих связи аминокислота-аминокислота между первым CH3-доменом и вторым CH3-доменом:
(1) замена одной из двух аминокислот по меньшей мере в одной паре аминокислот, выбранной из пар аминокислот, образующих связи аминокислота-аминокислота между первым CH3-доменом, происходящим из тяжелой цепи антитела, распознающего первый эпитоп, и вторым CH3-доменом, происходящим из тяжелой цепи антитела, распознающего второй эпитоп, аминокислотой с положительным зарядом, а другой - аминокислотой с отрицательным зарядом;
(2) взаимная замена двух аминокислот по меньшей мере в одной паре аминокислот, выбранной из пар аминокислот, образующих связи аминокислота-аминокислота между первым CH3-доменом и вторым CH3-доменом, одна на другую; и
(3) замена одной из двух аминокислот по меньшей мере в одной паре аминокислот, выбранной из пар аминокислот, образующих связи аминокислота-аминокислота между первым CH3-доменом и вторым CH3-доменом, большой гидрофобной аминокислотой (например, триптофаном, фенилаланином и т.д.), а другой - маленькой гидрофобной аминокислотой (например, аланином, глицином, валином и т.д.).
Способ конструирования биспецифического антитела или его антигенсвязывающего фрагмента может дополнительно предусматривать следующие стадии осуществления мутаций CH1- и CL-доменов:
замена одного из двух аминокислотных остатков, составляющих по меньшей мере одну пару аминокислот, выбранную из пар аминокислот, образующих связи аминокислота-аминокислота между первым CH3-доменом, происходящим из тяжелой цепи, и первым CL-доменом антитела, распознающего первый эпитоп, аминокислотой с положительным зарядом, а другого - аминокислотой с отрицательным зарядом; и
замена одного из двух аминокислотных остатков, составляющих по меньшей мере одну пару аминокислот, выбранную из пар аминокислот, образующих связи аминокислота-аминокислота между вторым CH3-доменом, происходящим из тяжелой цепи, и вторым CL-доменом антитела, распознающего второй эпитоп, аминокислотой с положительным зарядом, а другого - аминокислотой с отрицательным зарядом.
Способ конструирования биспецифического антитела или его антигенсвязывающего фрагмента может обеспечить увеличение степени гетеродимеризации CH3-доменов или Fc-областей, происходящих из антител, распознающих отличающийся эпитоп, а также CH1-доменов (тяжелых цепей) и CL-доменов (легких цепей), происходящих из антител, распознающих один и тот же эпитоп.
Техническое решение
Ниже будет приведено подробное описание настоящего изобретения.
Настоящее изобретение относится к биспецифическому белку, содержащему константную Fc-область и/или константную Fab-область и нацеленному на разные мишени, и способу его конструирования, где мутацию по аминокислоте вводят в константные Fc-области (CH3-домены), связанные (слитые) соответственно с отличающимися друг от друга нацеленными доменами, для усиления соединения константных Fc-областей, связанных с разными нацеленными доменами, за счет чего повышается степень гетеродимеризации константных Fc-областей, связанных с разными нацеленными доменами, и снижается степень гомодимеризации константных Fc-областей, связанных с одним и тем же нацеленным доменом; и/или
мутацию по аминокислоте вводят в константные области Fab, связанные с отличающимися друг от друга нацеленными доменами, для усиления соединения константных областей Fab, связанных с разными нацеленными доменами, за счет чего снижается степень димеризации одинаковых нацеленных доменов и связанных с ними константных областей Fab,
в результате чего биспецифический белок с разными нацеленными доменами может быть получен с высоким выходом.
Все положения аминокислот в раскрытых в настоящем описании антителах (тяжелых и легких цепях), CH1-доменах, CL-доменах, Fc-областях и CH3-доменах приводятся как пронумерованные в соответствии с системой нумерации EU [EU-индекс представлен в “Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)”], и отличаются от номеров, присвоенных положениям последовательностей в перечне последовательностей.
Антитело может представлять собой по меньшей мере одно антитело, выбранное из всех видов иммуноглобулинов, происходящих от млекопитающих или птиц. Например, применяемое в описании антитело может представлять собой по меньшей мере одно антитело, выбранное из группы, состоящей из IgG (например, IgG типа 1 (IgG1), IgG типа 2 (IgG2), IgG типа 3 (IgG3) и IgG типа 4 (IgG4)), IgA (например, IgA типа 1 (IgA1) и IgA типа 2 (IgA2)), IgD, IgE и IgM. Антитело может представлять собой иммуноглобулин, происходящий из организма млекопитающих, таких как приматы, включая людей, обезьян и т.д., и грызунов, включая мышей, крыс и т.д., и может представлять собой, например, иммуноглобулин, происходящий из организма человека. Согласно одному варианту осуществления антитело может представлять собой по меньшей мере одно антитело, выбранное из IgG1 человека (константная область; белок: номер доступа в GenBank AAC82527.1, ген: номер доступа в GenBank J00228.1), IgG2 человека (константная область; белок: номер доступа в GenBank AAB59393.1, ген: номер доступа в GenBank J00230.1), IgG3 человека (константная область; белок: номер доступа в GenBank P01860, ген: номер доступа в GenBank X03604.1), IgG4 человека (константная область; белок: номер доступа в GenBank AAB59394.1, ген: номер доступа в GenBank K01316.1), IgA1 человека (константная область; белок: номер доступа в GenBank AAT74070.1, ген: номер доступа в GenBank AY647978.1), IgA2 человека (константная область; белок: номер доступа в GenBank AAB59396.1, ген: номер доступа в GenBank J00221.1), IgD человека (константная область; белок: номер доступа в GenBank AAA52771.1, AAA52770.1), IgE человека (константная область; белок: номер доступа в GenBank AAB59395.1, ген: номер доступа в GenBank J00222.1) и IgM человека (константная область; белок: номер доступа в GenBank CAB37838.1, ген: номер доступа в GenBank X57086.1). Согласно одному варианту осуществления антитело может представлять собой по меньшей мере одно антитело, выбранное из группы, состоящей из IgG1, IgG2, IgG3 и IgG4, происходящих из организма человека, но не ограничивается ими. Каждый из 1-го CH3-домена и 2-го CH3-домена, 1-го CH1-домена и 1-го CL-домена и 2-го CH1-домена и 2-го CL-домена, во все из которых вводят мутацию, может быть независимо выбран из идентичных или разных типов иммуноглобулинов.
Как можно видеть на фиг. 33a, на которой представлены результаты выравнивания последовательностей константной области тяжелой цепи IgG1 человека (SEQ ID NO: 33) и константной области тяжелой цепи IgA1 человека (SEQ ID NO: 34), и на фиг. 33b, на которой представлены результаты выравнивания последовательностей константной области каппа-цепи (SEQ ID NO: 35) и константной области лямбда-цепи (SEQ ID NO: 36) легкой цепи иммуноглобулина человека, константная область тяжелой цепи и константная область легкой цепи характеризуются наличием среди подтипов высококонсервативных аминокислотных последовательностей.
Кроме того, последовательности иммуноглобулинов являются высококонсервативными среди видов и подтипов, из которых происходят последовательности. К примеру, как видно из результатов выравнивания последовательностей константных областей тяжелой цепи у человека, мыши и крысы на фиг. 33c (выравнивание последовательностей CH1-домена) и фиг. 33d (выравнивание последовательностей CH3-домена), аминокислотные последовательности константной области тяжелой цепи иммуноглобулинов характеризуются высокой межвидовой консервативностью.
Следовательно, в настоящем описании дается ссылка на IgG1 человека для обозначения положений аминокислот в CH1-доменах и CH3-доменах и на константную область каппа-цепи человека для обозначения положений аминокислот в CL-доменах. Обозначенные для IgG1 человека и константной области каппа-цепи человека положения аминокислот, служащие в качестве эталонов, позволяют явно обозначить соответствующие положения аминокислот в иммуноглобулинах других подтипов и иммуноглобулинов отличных от людей видов с помощью стандартных методов выравнивания последовательностей (например, https://blast.ncbi.nlm.nih.gov/Blast.cgi) (см. таблицу 1).
Кроме того, приведенные в настоящем описании положения аминокислот в CH1-домене, CL-домене и CH3-домене представлены в соответствии с системой нумерации EU, и, что касается подробностей в их отношении, можно сослаться на «http://www.imgt.org/IMGTScientificChart/Numbering/Hu_IGHGnber.html (константная область тяжелой цепи)», «http://www.imgt.org/IMGTScientificChart/Numbering/Hu_IGLCnber.html (область легкой лямбда-цепи)» и «http://www.imgt.org/IMGTScientificChart/Numbering/Hu_IGKCnber.html (область легкой каппа-цепи)».
С применением IgG1 человека в качестве эталона, система нумерации EU учитывает:
(1) CH1-домен (SEQ ID NO: 1) в последовательном порядке, с первым аминокислотным остатком (Ala), которому присвоено положение 118 (т.е. 108 аминокислотных остатков CH1-домена SEQ ID NO: 1 отвечают соответственно положениям 118-215 в IgG1); и
(2) CH3-домен (SEQ ID NO: 15) в последовательном порядке, с первым аминокислотным остатком (Lys), которому присвоено положение 340 (т.е. 108 аминокислотных остатков CH3-домена SEQ ID NO: 15 отвечают соответственно положениям 340-447 в IgG1) (см., http://www.imgt.org/IMGTScientificChart/Numbering/Hu_IGHGnber.html).
В настоящем описании представлены положения аминокислот в CH1- и CH3-доменах и соответствующие им виды аминокислот, причем IgG1 человека служит эталоном.
Кроме того, в соответствии с EU-нумерацией,
CL-домен (SEQ ID NO: 10) константной области каппа-цепи человека (белок: номер доступа в GenBank AAA58989.1, ген: номер доступа в GenBank J00241.1) пронумерован в последовательном порядке, с первым аминокислотным остатком (Val), которому присвоено положение 110 (т.е. 105 аминокислотных остатков CL-домена SEQ ID NO: 10 отвечают соответственно положениям 110-214; см. http://www.imgt.org/IMGTScientificChart/Numbering/Hu_IGKCnber.html); и
CL-домены (SEQ ID NO: 11 (лямбда 1), SEQ ID NO: 12 (лямбда 2), SEQ ID NO: 13 (лямбда 3) и SEQ ID NO: 14 (лямбда 7)) константной области лямбда-цепи человека пронумерованы в последовательном порядке, с первым аминокислотным остатком (Lys), которому присвоено положение 110 (для константной области лямбда-цепи положения 169, 201 и 203 опущены из установленной порядковой нумерации; то есть 103 аминокислотных остатков CL-домена SEQ ID NO: 11 или 12 пронумерованы с положения 110 до положения 168, с положения 170 до положения 200 и с положения 203 до положения 215; см. http://www.imgt.org/IMGTScientificChart/Numbering/Hu_IGLCnber.html). В настоящем описании представлены положения аминокислот в CL-доменах и соответствующие им виды аминокислот, причем константная область каппа-цепи человека служит эталоном.
Константная область Fab может содержать одну константную область тяжелой цепи (т.е. CH1-домен), выбранную из группы, состоящей из константных областей тяжелой цепи Fab-фрагментов IgG (IgG1, IgG2, IgG3 и IgG 4), IgA (IgA1 и IgA2), IgD, IgE и IgM, и одну константную область легкой цепи (т.е. CL-домен), выбранную из группы, состоящей из каппа-типа и лямбда-типов (например, лямбда-типа 1, лямбда-типа 2, лямбда-типа 3 и лямбда-типа 7) легких цепей иммуноглобулинов.
В качестве примера, CH1-домены IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgD, IgE и IgM, каждый из которых доступен в качестве константной области тяжелой цепи (CH1-домен) Fab-фрагмента, могут содержать аминокислотные последовательности SEQ ID NO: 1 (соответствующие положениям 118-215 в соответствии с EU-нумерацией), SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8 и SEQ ID NO: 9 соответственно. Кроме того, каждый из CL-доменов каппа-типа, лямбда-типа 1, лямбда-типа 2, лямбда-типа 3 и лямбда-типа 7 доступен в качестве константной области легкой цепи (CL-домен) и может содержать аминокислотные последовательности SEQ ID NO: 10 (соответствующие положениям 110-214 в соответствии с EU-нумерацией), SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 14 соответственно. Согласно одному варианту осуществления константная область Fab содержит CH1-домен (SEQ ID NO: 1) IgG типа 1 и константную область легкой цепи (CL-домен) (SEQ ID NO: 10) каппа-типа. С целью увеличения степени гетеродимеризации молекул, нацеленных на один и тот же объект, аминокислота, замененная отрицательно заряженной аминокислотой или положительно заряженной аминокислотой в CH1-домене, может представлять собой по меньшей мере один остаток, например, один, два или более (например, два), три или более (например, три) или четыре или более (например, четыре) остатков, выбранных из группы, состоящей из лейцина в положении 145, лизина в положении 147, фенилаланина в положении 170, серина в положении 183 и валина в положении 185 в IgG типа 1 (SEQ ID NO: 1), как пронумеровано в соответствии с системой нумерации EU. Согласно другому варианту осуществления аминокислота, замененная отрицательно заряженной аминокислотой или положительно заряженной аминокислотой в CH1-домене, может представлять собой по меньшей мере один остаток, выбранный из группы, состоящей из аминокислот других подтипов IgG (IgG2, IgG3 и IgG4), IgA1, IgA2, IgD, IgE и IgM (соответственно SEQ ID NO: 2-9) в положениях, соответствующих лейцину в положении 145, лизину в положении 147, фенилаланину в положении 170, серину в положении 183 и валину в положении 185 в аминокислотной последовательности SEQ ID NO: 1.
В контексте настоящего документа «аминокислоты в положениях, соответствующих» без труда можно определять с помощью обычного выравнивания последовательностей в отношении аминокислотной последовательности SEQ ID NO: 1 и целевых аминокислотных последовательностей (т.е. SEQ ID NO: 2-9) (далее в настоящем документе будет применяться это же определение).
Аминокислота с положительным зарядом (положительно заряженная аминокислота) может быть выбрана из основных аминокислот, и может представлять собой, например, лизин или аргинин. В случае, если в CH1-домен вводят аминокислоту с положительным зарядом, по меньшей мере один остаток, например, один, два или более (например, два), три или более (например, три) или четыре или более (например, четыре) остатков выбраны из группы, состоящей из лейцина в положении 145, лизина в положении 147, фенилаланина в положении 170, пролина в положении 171, серина в положении 183 и валина в положении 185 в аминокислотной последовательности SEQ ID NO: 1, и каждая из аминокислот в положениях, соответствующих им в аминокислотных последовательностях SEQ ID NO: 2-9, может быть независимо заменена основной аминокислотой, например, лизином или аргинином.
Например, с целью введения аминокислоты с положительным зарядом, CH1-домен может предусматривать в нем по меньшей мере одну, две или более (например, две), три или более (например, три) или четыре или более (например, четыре) из следующих мутаций (в аминокислотной последовательности SEQ ID NO: 1; и они также применимы к аминокислотным остаткам в положениях, соответствующих им в аминокислотных последовательностях SEQ ID NO: 2-9):
замена лейцина в положении 145 лизином или аргинином (например, лизином);
замена серина в положении 183 лизином или аргинином (например, лизином);
замена лизина в положении 147 аргинином;
замена фенилаланина в положении 170 лизином или аргинином (например, лизином);
замена пролина в положении 171 лизином или аргинином (например, лизином); и
замена валина в положении 185 лизином или аргинином (например, аргинином).
Аминокислота с отрицательным зарядом может быть выбраны из кислых аминокислотных остатков, и может представлять собой, например, аспарагиновую кислоту или глутаминовую кислоту. Следовательно, в случае, если в CH1-домен вводят аминокислоту с отрицательным зарядом, по меньшей мере один, например, один, два или более (например, два), три или более (например, три) или четыре или более (например, четыре) остатков выбраны из группы, состоящей из лейцина в положении 145, лизина в положении 147, фенилаланина в положении 170, пролина в положении 171, серина в положении 183 и валина в положении 185 в аминокислотной последовательности SEQ ID NO: 1, и каждая из аминокислот в положениях, соответствующих им в аминокислотных последовательностях SEQ ID NO: 2-9, может быть независимо заменена кислой аминокислотой, например, аспарагиновой кислотой или глутаминовой кислотой. Например, с целью введения аминокислоты с положительным зарядом, CH1-домен может предусматривать по меньшей мере одну, две или более (например, две), три или более (например, три) или четыре или более (например, четыре) из следующих мутаций (в аминокислотной последовательности SEQ ID NO: 1; и они также применимы к аминокислотным остаткам в положениях, соответствующих им в аминокислотных последовательностях SEQ ID NO: 2-9):
замена лейцина в положении 145 аспарагиновой кислотой или глутаминовой кислотой (например, глутаминовой кислотой);
замена лизина в положении 147 аспарагиновой кислотой или глутаминовой кислотой (например, аспарагиновой кислотой);
замена серина в положении 183 аспарагиновой кислотой или глутаминовой кислотой (например, глутаминовой кислотой);
замена валина в положении 185 аспарагиновой кислотой или глутаминовой кислотой (например, аспарагиновой кислотой);
замена фенилаланина в положении 170 аспарагиновой кислотой или глутаминовой кислотой (например, аспарагиновой кислотой); и
замена пролина в положении 171 аспарагиновой кислотой или глутаминовой кислотой (например, аспарагиновой кислотой).
С целью увеличения степени гетеродимеризации молекул, нацеленных на один и тот же объект, аминокислота, замененная отрицательно заряженной аминокислотой или положительно заряженной аминокислотой в константной области легкой цепи (CL-домен), может представлять собой по меньшей мере один остаток, например, один, два или более (например, два), три или более (например, три) или четыре или более (например, четыре) остатков, выбранных из группы, состоящей из серина в положении 131, валина в положении 133, лейцина в положении 135, серина в положении 162 и треонина в положении 180 в цепи каппа-типа (SEQ ID NO: 10). Согласно другому варианту осуществления аминокислота, замененная отрицательно заряженной аминокислотой или положительно заряженной аминокислотой в CL-домене, может представлять собой по меньшей мере один остаток, выбранный из группы, состоящей из аминокислот CL-доменов лямбда-типов (лямбда-типа 1, лямбда-типа 2, лямбда-типа 3 и лямбда-типа 7) (соответственно SEQ ID NO: 11-14) в положениях, соответствующих серину в положении 131, валину в положении 133, лейцину в положении 135, серину в положении 162 и треонину в положении 180 в аминокислотной последовательности SEQ ID NO: 10.
Аминокислота с положительным зарядом (положительно заряженная аминокислота) может быть выбрана из основных аминокислот, и может представлять собой, например, лизин или аргинин. Следовательно, в случае, если в CL-домен вводят аминокислоту с положительным зарядом, по меньшей мере один остаток, например, один, два или более (например, два), три или более (например, три) или четыре или более (например, четыре) остатков выбраны из группы, состоящей из серина в положении 131, валина в положении 133, лейцина в положении 135, серина в положении 162 и треонина в положении 180 в аминокислотной последовательности SEQ ID NO: 10, и каждая из аминокислот в положениях, соответствующих им в аминокислотных последовательностях SEQ ID NO: 11-14, может быть независимо заменена основной аминокислотой, например, лизином или аргинином.
В качестве примера, с целью введения аминокислоты с положительным зарядом, CL-домен может предусматривать по меньшей мере одну, например, одну, две или более (например, две), три или более (например, три) или четыре или более (например, четыре) из следующих мутаций (для аминокислотной последовательности SEQ ID NO: 10; и они также применимы к аминокислотам в положениях, соответствующих им в аминокислотных последовательностях SEQ ID NO: 11-14):
замена серина в положении 131 лизином или аргинином (например, лизином);
замена валина в положении 133 лизином или аргинином (например, лизином);
замена лейцина в положении 135 лизином или аргинином (например, аргинином);
замена серина в положении 162 лизином или аргинином (например, лизином); и
замена треонина в положении 180 лизином или аргинином (например, аргинином).
С целью дополнительного увеличения степени гомодимеризации мутантный CH1-домен и/или мутантный CL-домен могут предусматривать две или более мутаций одновременно.
Например, лизин в положении 147 и валин в положении 185 в CH1-домене могут быть заменены аминокислотой с положительным или отрицательным зарядом. В качестве примера, лизин в положении 147 и валин в положении 185 в одном из первого и второго CH1-доменов могут быть заменены аминокислотой с положительным зарядом (например, лизином или аргинином), тогда как лизин в положении 147 и валин в положении 185 в другом CH1-домене могут быть заменены аминокислотой с отрицательным зарядом (глутаминовой кислотой или аспарагиновой кислотой). Кроме того, лейцин в положении 135 и треонин в положении 180 в CL-домене могут быть заменены аминокислотой с положительным или отрицательным зарядом. В качестве примера, лейцин в положении 135 и треонин в положении 180 в одном из первого и второго CH1-доменов могут быть заменены аминокислотой с положительным зарядом (например, лизином или аргинином), тогда как лейцин в положении 135 и треонин в положении 180 в другом CL-домене могут быть заменены аминокислотой с отрицательным зарядом (глутаминовой кислотой или аспарагиновой кислотой).
Согласно другому варианту осуществления фенилаланин в положении 170 и пролин в положении 171 в CH1-домене могут быть заменены аминокислотой с положительным или отрицательным зарядом. В качестве примера, фенилаланин в положении 170 и пролин в положении 171 в одном из первого CH1-домена и второго CH1-домена могут быть заменены аминокислотой с положительным зарядом (например, лизином или аргинином), тогда как фенилаланин в положении 170 и пролин в положении 171 в другом CH1-домене могут быть заменены аминокислотой с отрицательным зарядом (глутаминовой кислотой или аспарагиновой кислотой). Кроме того, замену аминокислотой с положительным или отрицательным зарядом можно осуществлять в отношении лейцина в положении 135 и серина в положении 162 в CL-домене. В качестве примера, лейцин в положении 135 и серин в положении 162 в одном из первого CL-домена и второго CL-домена могут быть заменены аминокислотой с положительным зарядом (например, лизином или аргинином), тогда как лейцин в положении 135 и серин в положении 162 в другом CL-домене могут быть заменены аминокислотой с отрицательным зарядом (например, глутаминовой кислотой или аспарагиновой кислотой).
Аминокислота с отрицательным зарядом может быть выбраны из кислых аминокислот, и может представлять собой, например, аспарагиновую кислоту или глутаминовую кислоту. Следовательно, в случае, если в CL-домен вводят аминокислоту с отрицательным зарядом, по меньшей мере один остаток, например, один, два или более (например, два), три или более (например, три) или четыре или более (например, четыре) остатков выбраны из группы, состоящей из серина в положении 131, валина в положении 133, лейцина в положении 135, серина в положении 162 и треонина в положении 180 в аминокислотной последовательности SEQ ID NO: 10, и каждая из аминокислот в положениях, соответствующих им в аминокислотных последовательностях SEQ ID NO: 11-14, может быть независимо заменена основной аминокислотой, например, аспарагиновой кислотой или глутаминовой кислотой. В качестве примера, с целью введения аминокислоты с положительным зарядом, CL-домен может предусматривать по меньшей мере одну, например, одну, две или более (например, две), три или более (например, три) или четыре или более (например, четыре) из следующих мутаций (в аминокислотной последовательности SEQ ID NO: 10; и они также применимы к аминокислотным остаткам в положениях, соответствующих им в аминокислотных последовательностях SEQ ID NO: 11-14):
замена серина в положении 131 аспарагиновой кислотой или глутаминовой кислотой (например, глутаминовой кислотой);
замена валина в положении 133 аспарагиновой кислотой или глутаминовой кислотой (например, глутаминовой кислотой);
замена лейцина в положении 135 аспарагиновой кислотой или глутаминовой кислотой (например, аспарагиновой кислотой);
замена серина в положении 162 аспарагиновой кислотой или глутаминовой кислотой (например, аспарагиновой кислотой); и
замена треонина в положении 180 аспарагиновой кислотой или глутаминовой кислотой (например, аспарагиновой кислотой).
Согласно одному варианту осуществления набор из двух аминокислот, образующих пару аминокислот между CH1-доменом и CL-доменом, которые подлежат замене парой аминокислот с противоположными зарядами, могут представлять собой по меньшей мере одну, например, одну, две или более (например, две), три или более (например, три) или четыре или более (например, четыре) пары, выбранные из группы, состоящей из пары лейцина в положении 145 в CH1-домене и серина в положении 131 в CL-домене, пары лейцина в положении 145 в CH1-домене и валина в положении 133 в CL-домене, пары лизина в положении 147 в CH1-домене и треонина в положении 180 в CL-домене, пары серина в положении 183 в CH1-домене и валина в положении 133 в CL-домене, пары валина в положении 185 в CH1-домене и лейцина в положении 135 в CL-домене, пары фенилаланина в положении 170 в CH1-домене и лейцина в положении 135 в CL-домене и пары пролина в положении 171 в CH1-домене и серина в положении 162 в CL-домене, как пронумеровано исходя из аминокислотных последовательностей SEQ ID NO: 1 (CH1-домен) и SEQ ID NO: 10 (CL-домен). Например, пара аминокислот между CH1- и CL-доменами, в отношении которой вводят мутацию, может представлять собой одну или две или более (например, две) пары, выбранные из группы, состоящей из пары лейцина в положении 145 в CH1-домене и серина в положении 131 в CL-домене, пары лейцина в положении 145 в CH1-домене и валина в положении 133 в CL-домене, пары лизина в положении 147 в CH1-домене и треонина в положении 180 в CL-домене, пары серина в положении 183 в CH1-домене и валина в положении 133 в CL-домене и пары валина в положении 185 в CH1-домене и лейцина в положении 135 в CL-домене, как пронумеровано исходя из аминокислотных последовательностей SEQ ID NO: 1 (CH1-домен) и SEQ ID NO: 10 (CL-домен).
Пары аминокислот между первым CH1-доменом и первым CL-доменом, в отношении которых вводят мутации, могут быть одинаковыми или отличаться от таковых между вторым CH1-доменом и вторым CL-доменом.
Согласно одному варианту осуществления аминокислоту с положительным зарядом вводят в первый CH1-домен (с введением аминокислоты с отрицательным зарядом в первый CL-домен), тогда как аминокислоту с отрицательным зарядом вводят во второй CH1-домен (с введением аминокислоты с положительным зарядом во второй CL-домен).
С целью увеличения степени гетеродимеризации в Fc-область тяжелой цепи, а именно в CH3-домен в Fc-области, можно вводить по меньшей мере одну, например, одну, две или три из следующих мутаций:
(1) мутация, при которой один аминокислотный остаток по меньшей мере одной пары аминокислот (по меньшей мере один из двух аминокислотных остатков не является гидрофобным) между CH3-доменами заменен аминокислотой с положительным зарядом, тогда как другой остаток заменен аминокислотой с отрицательным зарядом (далее в настоящем документе называемая «мутацией с введением электростатического взаимодействия»);
(2) мутация, при которой аминокислотные остатки по меньшей мере в одной паре аминокислот между CH3-доменами подвержены замещению один на другой (далее в настоящем документе называемая «мутацией обмена»); и
(3) мутация, при которой один аминокислотный остаток по меньшей мере в одной паре аминокислот между CH3-доменами заменен большой аминокислотой (например, большой гидрофобной аминокислотой, такой как триптофан, фенилаланин и т.п.), тогда как другой аминокислотный остаток заменен маленькой аминокислотой (например, маленькой гидрофобной аминокислотой, такой как аланин, глицин, валин и т.п.) (далее в настоящем документе называемая «мутацией, связанной с размером аминокислоты»).
Следовательно, CH3-домен, в который вводят мутации, может быть выбран из группы, состоящей из CH3-домена IgG1 человека (SEQ ID NO: 15; соответствующий положениям 340-447 в соответствии с EU-нумерацией), CH3-домена IgG2 человека (SEQ ID NO: 16), CH3-домена IgG3 человека (SEQ ID NO: 17), CH3-домена IgG4 человека (SEQ ID NO: 18), CH3-домена IgA1 человека (SEQ ID NO: 19), CH3-домена IgA2 человека (SEQ ID NO: 20), CH3-домена IgD человека (SEQ ID NO: 21), CH3-домена IgE человека (SEQ ID NO: 22) и CH3-домена IgM человека (SEQ ID NO: 23).
Первый CH3-домен и второй CH3-домен, в которые вводят мутации, могут происходить из одного и того же или из разных типов иммуноглобулинов, каждый из которых может быть независимо выбран из группы, состоящей из IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgD, IgE и IgM. Согласно одному варианту осуществления как первый CH3-домен, так и второй CH3-домен могут представлять собой CH3-домен IgG1 человека с аминокислотной последовательностью SEQ ID NO: 15, но не ограничиваются им.
Следующие пары аминокислот между первым CH3-доменом и вторым CH3-доменом основаны на CH3-домене IgG1 человека с аминокислотной последовательностью SEQ ID NO: 15, и основание справедливо для соответствующих им пар аминокислот между CH3-доменами IgG2, IgG3, IgG4, IgA1, IgA2, IgD, IgE и IgM (соответственно SEQ ID NO: 16-23).
Пара аминокислот между первым и вторым CH3-доменами, в отношении которой вводят одну из мутаций, может представлять собой по меньшей мере одну, например, одну, две или более (например, две), три или более (например, три) или четыре или более (например, четыре) пар аминокислот, выбранных из группы, состоящей из пар аминокислот между CH3-доменами и пар аминокислот в соответствующих им положениях между CH3-доменами IgG2, IgG3, IgG4, IgA1, IgA2, IgE и IgM (соответственно SEQ ID NO: 16-23), перечисленных в таблице 1, ниже.
ТАБЛИЦА 1.
(Цепь A: первый CH3-домен; цепь B: второй CH3-домен)
Более подробно, пара аминокислот между первым CH3-доменом и вторым CH3-доменом, в отношении которой вводят по меньшей мере одну из следующих мутаций: (1) мутация с введением электростатического взаимодействия (представлена как «заряд (J)» в таблице 2 и на фиг. 2); (2) мутация обмена (представлена как «обмен (O)» в таблице 2 и на фиг. 2); и (3) мутация, связанная с размером аминокислоты, (представлена как «размер (B)» в таблице 2 и на фиг. 2) может представлять собой по меньшей мере одну, например, одну, две или более (например, две), три или более (например, три) или четыре или более (например, четыре) пар аминокислот, выбранных из пар аминокислот между CH3-доменами IgG1 (SEQ ID NO: 15) и пар аминокислот в соответствующих им положениях между CH3-доменами IgG2, IgG3 IgG4 IgA1 IgA2 IgD, IgE и IgM (соответственно SEQ ID NO: 16-23), рассматриваемых в таблице 2 и на фиг. 2:
ТАБЛИЦА 2.
(цепь A: первый CH3-домен; цепь B: второй CH3-домен; перечисленные в таблице 2 мутации относятся к положениям на основе IgG1, однако применимы к соответствующим положениям в CH3-доменах IgG2, IgG3, IgG4, IgA1, IgA2, IgD, IgE и IgM).
В контексте настоящего документа, например, «Q347» означает глутамин в положении 347 в аминокислотной последовательности SEQ ID NO: 15 в CH3-домене IgG1 человека, и такое обозначение справедливо для аминокислотных остатков в положениях, соответствующих им в CH3-доменах IgG2, IgG3 IgG4, IgA1, IgA2, IgD, IgE и IgM (соответственно SEQ ID NO: 16-23) (далее в настоящем документе применяется это же определение).
Далее в настоящем документе пары аминокислот между CH3-доменами, в отношении которых вводят мутации, пронумерованы исходя из аминокислотной последовательности SEQ ID NO: 15, и, если не указано иное, нумерация предназначена для применения к аминокислотам в обозначенных положениях в IgG1, а также в положениях, соответствующих им в CH3-доменах иммуноглобулинов другого типа (IgG2, IgG3, IgG4, IgA1, IgA2, IgD, IgE и IgM).
Мутация с введением электростатического взаимодействия предназначена для замены одного аминокислотного остатка по меньшей мере одной пары аминокислот между Fc-областями или CH3-доменами (по меньшей мере один остаток двух парных аминокислот не является гидрофобным) положительно заряженной аминокислотой и замены другого аминокислотного остатка отрицательно заряженной аминокислотой для введения электростатического взаимодействия в сайт, лишенный гидрофобного взаимодействия, способствуя тем самым увеличению силы связывания, индуцированной электростатическим взаимодействием.
Гидрофобная аминокислота может быть выбрана из группы, состоящей из глицина, аланина, валина, лейцина, изолейцина, метионина, пролина, фенилаланина и триптофана.
Аминокислота с отрицательным зарядом может быть выбраны из кислых аминокислот, и может представлять собой, например, аспарагиновую кислоту или глутаминовую кислоту. Аминокислота с положительным зарядом может быть выбрана из основной аминокислоты, и может представлять собой, например, лизин или аргинин.
Пара аминокислот между первым CH3-доменом и вторым CH3-доменом, в отношении которой применима мутация с введением электростатического взаимодействия, может представлять собой по меньшей мере одну, например, одну, две или более (например, две), три или более (например, три) или четыре или более (например, четыре) пар, выбранных из пар аминокислот под номерами 1-39 в таблице 2, и может представлять собой по меньшей мере одну, например, одну, две или более (например, две), три или более (например, три) или четыре или более (например, четыре) пар, выбранных из группы, состоящей из, например, пары серина в положении 364 и лейцина в положении 368, пары треонина в положении 394 и треонина в положении 394, пары глутаминовой кислоты в положении 357 и лизина в положении 370, пары глутаминовой кислоты в положении 357 и тирозина в положении 349, пары треонина в положении 366 и тирозина в положении 407 и пары треонина в положении 394 и валина в положении 397.
То есть мутация с введением электростатического взаимодействия в CH3-домене может предусматривать замену одного аминокислотного остатка каждой из пар аминокислот, например, одной, двух или более (например, двух), трех или более (например, трех) или четырех или более (например, четырех) пар, выбранных из пар аминокислот под номером 1-39 в таблице 2, аминокислотой с положительным зарядом; и замену другого аминокислотного остатка аминокислотой с отрицательным зарядом. В качестве примера, в каждой из пар аминокислот, например, одной или нескольких (например, одной), двух или более (например, двух), трех или более (например, трех) или четырех или более (например, четырех) пар аминокислот, выбранных из группы, состоящей из пары серина в положении 364 и лейцина в положении 368, пары треонина в положении 394 и треонина в положении 394, пары глутаминовой кислоты в положении 357 и лизина в положении 370, пары глутаминовой кислоты в положении 357 и тирозина в положении 349, пары треонина в положении 366 и тирозина в положении 407 и пары треонина в положении 394 и валина в положении 397, один аминокислотный остаток заменен аминокислотой с положительным зарядом, тогда как другой аминокислотный остаток заменен аминокислотой с отрицательным зарядом.
К примеру, мутация с введением электростатического взаимодействия в CH3-доменах может предусматривать по меньшей мере одну, например, одну, две или более (например, две), три или более (например, три) или четыре или более (например, четыре) из следующих мутаций:
замена серина в положении 364 аминокислотой с положительным зарядом и лейцина в положении 368 аминокислотой с отрицательным зарядом;
замена треонина в положении 394 аминокислотой с положительным зарядом и треонина в положении 394 аминокислотой с отрицательным зарядом;
замена глутаминовой кислоты в положении 357 аминокислотой с положительным зарядом и лизина в положении 370 аминокислотой с отрицательным зарядом;
замена глутаминовой кислоты в положении 357 аминокислотой с положительным зарядом и тирозина в положении 349 аминокислотой с отрицательным зарядом;
замена треонина в положении 366 аминокислотой с положительным зарядом и тирозина в положении 407 аминокислотой с отрицательным зарядом;
замена треонина в положении 394 аминокислотой с положительным зарядом и валина в положении 397 аминокислотой с отрицательным зарядом; и
замена тирозина в положении 349 аминокислотой с положительным зарядом и глутаминовой кислоты в положении 357 аминокислотой с отрицательным зарядом.
За счет такого введения электростатического взаимодействия в CH3-домены может достигаться степень гетеродимеризации, составляющая 60% или выше, 65% или выше, 70% или выше, 73% или выше, 75% или выше, 78% или выше, 80% или выше, 85% или выше, 90% или выше, 95% или выше или 100%.
Мутация обмена означает мутацию, при которой два аминокислотных остатка, составляющие пару аминокислот, подвержены замещению (обмену) один на другой.
Как проиллюстрировано в таблице 2 и на фиг. 2, пара аминокислот между первым CH3-доменом и вторым CH3-доменом, в отношении которой применима мутация обмена, может представлять собой по меньшей мере одну, например, одну, две или более (например, две), три или более (например, три) или четыре или более (например, четыре) пар, выбранных из группы, состоящей из пары глутамина в положении 347 и лизина в положении 360, пары глутаминовой кислоты в положении 357 и тирозина в положении 349, пары серина в положении 354 и тирозина в положении 349, пары глутаминовой кислоты в положении 357 и лизина в положении 370, пары лизина в положении 360 и тирозина в положении 349, пары серина в положении 364 и лейцина в положении 368, пары серина в положении 364 и лизина в положении 370, пары лейцина в положении 368 и лизина в положении 409, пары аспарагина в положении 390 и серина в положении 400, пары треонина в положении 394 и валина в положении 397, пары лейцина в положении 398 и лизина в положении 392, пары фенилаланина в положении 405 и лизина в положении 409, пары тирозина в положении 407 и треонина в положении 366 и пары треонина в положении 411 и лизина в положении 370, и, в частности, из группы, состоящей из пары серина в положении 364 и лизина в положении 370, пары тирозина в положении 407 и треонина в положении 366, пары глутаминовой кислоты в положении 357 и лизина в положении 370, пары фенилаланина в положении 405 и лизина в положении 409 и пары глутаминовой кислоты в положении 357 и тирозина в положении 349.
То есть мутация обмена в CH3-доменах может предусматривать замену, при которой замещение (обмен) выполнено между двумя парными аминокислотными остатками в каждой из по меньшей мере одной, например, одной, двух или более (например, двух), трех или более (например, трех) или четырех или более (например, четырех) пар аминокислот, выбранных из группы, состоящей из пары глутамина в положении 347 и лизина в положении 360, пары глутаминовой кислоты в положении 357 и тирозина в положении 349, пары серина в положении 354 и тирозина в положении 349, пары глутаминовой кислоты в положении 357 и лизина в положении 370, пары лизина в положении 360 и тирозина в положении 349, пары серина в положении 364 и лейцина в положении 368, пары серина в положении 364 и лизина в положении 370, пары лейцина в положении 368 и лизина в положении 409, пары аспарагина в положении 390 и серина в положении 400, пары треонина в положении 394 и валина в положении 397, пары лейцина в положении 398 и лизина в положении 392, пары фенилаланина в положении 405 и лизина в положении 409, пары тирозина в положении 407 и треонина в положении 366 и пары треонина в положении 411 и лизина в положении 370, и, например, из группы, состоящей из пары серина в положении 364 и лизина в положении 370, пары тирозина в положении 407 и треонина в положении 366, пары глутаминовой кислоты в положении 357 и лизина в положении 370, пары фенилаланина в положении 405 и лизина в положении 409 и пары глутаминовой кислоты в положении 357 и тирозина в положении 349.
Например, мутация обмена в CH3-доменах может предусматривать по меньшей мере одну, например, одну, две или более (например, две), три или более (например, три) или четыре или более (например, четыре) из следующих мутаций:
замена серина в положении 364 лизином и лизина в положении 370 серином;
замена фенилаланина в положении 405 лизином и лизина в положении 409 фенилаланином;
замена тирозина в положении 407 треонином и треонина в положении 366 тирозином;
замена глутаминовой кислоты в положении 357 лизином и лизина в положении 370 глутаминовой кислотой; и
замена глутаминовой кислоты в положении 357 тирозином и тирозина в положении 349 глутаминовой кислотой.
За счет такой мутации обмена в CH3-доменах может достигаться степень гетеродимеризации, составляющая 60% или выше, 65% или выше, 70% или выше, 73% или выше, 75% или выше, 78% или выше, 80% или выше, 85% или выше, 90% или выше, 95% или выше или 100%.
Мутация, связанная с размером аминокислоты, означает мутацию, при которой из двух парных аминокислот по меньшей мере в одной паре аминокислот между CH3-доменами один остаток заменен большой гидрофобной аминокислотой (например, триптофаном, фенилаланином и т.п.), а другой остаток заменен маленькой гидрофобной аминокислотой (например, аланином, глицином, валином и т.п.) так, что большая аминокислота помещается в пространство, занимаемое маленькой аминокислотой, способствуя тем самым гетеродимеризации.
Большая аминокислота может предусматривать циклический остаток, и может быть выбрана из группы, состоящей из триптофана и фенилаланина, и, в частности, триптофана. Маленькая аминокислота может быть выбрана из группы, состоящей из аланина, глицина и валина, и может представлять собой, например, аланин.
Пара аминокислот между первым CH3-доменом и вторым CH3-доменом, в отношении которой применима мутация, связанная с размером аминокислоты,, может представлять собой по меньшей мере одну, например, одну, две или более (например, две), три или более (например, три) или четыре или более (например, четыре) пар, выбранных из пар аминокислот под номерами 1-40 в таблице 2, и может представлять собой, например, пару лизина в положении 409 и тирозина в положении 407, пару лизина в положении 409 и фенилаланина в положении 405 или их комбинацию.
То есть мутация, связанная с размером аминокислоты, может предусматривать замену, при которой из двух парных аминокислотных остатков в каждой из по меньшей мере одной, например, одной, двух или более (например, двух), трех или более (например, трех) или четырех или более (например, четырех) пар аминокислот, выбранных из пар аминокислот под номерами 1-40 в таблице 2, один остаток заменен большой гидрофобной аминокислотой (например, триптофаном, фенилаланином и т.п.), например, триптофаном, тогда как другой остаток заменен маленькой гидрофобной аминокислотой (например, аланином, глицином, валином и т.п.), например, аланином. В качестве примера, в паре лизина в положении 409 и тирозина в положении 407 или паре лизина в положении 409 и фенилаланина в положении 405, или в каждой из них, один остаток может быть заменен большой гидрофобной аминокислотой, например, фенилаланином или триптофаном, тогда как другой остаток может быть заменен маленькой гидрофобной аминокислотой, например, аланином, глицином или валином.
Например, мутация, связанная с размером аминокислоты, в CH3-доменах может предусматривать по меньшей мере одну из следующих мутаций:
замена лизина в положении 409 триптофаном и тирозина в положении 407 аланином; и
замена лизина в положении 409 триптофаном и фенилаланина в положении 405 аланином.
Модифицированные CH3-домены могут предусматривать по меньшей мере одну, например, одну или две из описанных выше трех мутаций, то есть мутацию с введением электростатического взаимодействия, мутацию обмена и мутацию, связанную с размером аминокислоты.
С целью проявления наиболее благоприятного эффекта в отношении димеризации модифицированные CH3-домены могут предусматривать по меньшей мере одну, например, одну, две или три мутации, выбранные из группы, состоящей из замены одного остатка в паре серина в положении 364 и лейцина в положении 368 аминокислотой с положительным зарядом, а другого - аминокислотой с отрицательным зарядом (мутация с введением электростатического взаимодействия), замещения двух остатков пары серина в положении 364 и лизина в положении 370 один на другой (мутация обмена) и замещения двух остатков пары фенилаланина в положении 405 и лизина в положении 409 один на другой (мутация обмена).
Например, модифицированные CH3-домены могут предусматривать одну, две или три из следующих мутаций:
(a) замена серина в положении 364 аминокислотой с положительным зарядом и лейцина в положении 368 аминокислотой с отрицательным зарядом;
(b) замена серина в положении 364 лизином и лизина в положении 370 серином; и
(c) замена фенилаланина в положении 405 лизином и лизина в положении 409 фенилаланином.
С целью снижения степени мономеризации, но повышения степени димеризации, после введения трех выбранных мутаций ((a)-(c)) можно вводить дополнительную аминокислотную модификацию. Следовательно, аминокислота, в отношении которой можно вводить дополнительную мутацию по аминокислоте, может представлять собой серин в положении 364, фенилаланин в положении 405 и/или лизин в положении 409. Например, в паре серина в положении 364 и лейцина в положении 368, которая будет подвергаться мутации с введением электростатического взаимодействия, если лейцин в положении 368 может быть заменен аминокислотой с отрицательным зарядом (аспарагиновой кислотой или глутаминовой кислотой, например, аспарагиновой кислотой), серин в положении 364 может быть заменен аминокислотой с положительным зарядом (лизином или аргинином) (S364K или S364R; мутация с введением электростатического взаимодействия) или аспарагином (S364N). Кроме того, в паре лизина в положении 370 и серина в положении 364, которая будет подвергаться мутации обмена, лизин в положении 370 может быть заменен серином, а серин в положении 364 может быть заменен лизином (S364K; мутация обмена) или аргинином или аспарагином (S364R или S364N).
Кроме того, в паре лизина в положении 409 и фенилаланина в положении 405, которая будет подвергаться мутации обмена, лизин в положении 409 может быть заменен фенилаланином (в случае мутации обмена) или триптофаном, а фенилаланин в положении 405 может быть заменен лизином (F405K; в случае мутации обмена) или аргинином, глутамином или аспарагином (F405R, F405Q или F405N).
Согласно одному варианту осуществления модифицированные CH3-домены могут предусматривать по меньшей мере одну из следующих мутаций:
замена серина в положении 364 лизином и лейцина в положении 368 аспарагиновой кислотой;
замена серина в положении 364 лизином и лизина в положении 370 серином;
замена фенилаланина в положении 405 лизином и лизина в положении 409 фенилаланином;
замена фенилаланина в положении 405 аргинином и лизина в положении 409 фенилаланином;
замена фенилаланина в положении 405 лизином и лизина в положении 409 триптофаном; и
замена фенилаланина в положении 405 аргинином и лизина в положении 409 триптофаном.
Согласно одному варианту осуществления модифицированные CH3-домены могут предусматривать по меньшей мере одну из следующих двойных мутаций:
замена серина в положении 364 в первом CH3-домене лизином и лейцина в положении 368 во втором CH3-домене аспарагиновой кислотой и замена лизина в положении 409 в первом CH3-домене фенилаланином и фенилаланина в положении 405 во втором CH3-домене лизином;
замена серина в положении 364 в первом CH3-домене лизином и лейцина в положении 368 во втором CH3-домене аспарагиновой кислотой и замена лизина в положении 409 в первом CH3-домене фенилаланином и фенилаланина в положении 405 во втором CH3-домене аргинином;
замена серина в положении 364 в первом CH3-домене лизином и лизина в положении 370 во втором CH3-домене серином и замена лизина в положении 409 в первом CH3-домене фенилаланином и фенилаланина в положении 405 во втором CH3-домене лизином;
замена серина в положении 364 в первом CH3-домене лизином и лизина в положении 370 во втором CH3-домене серином и замена лизина в положении 409 в первом CH3-домене фенилаланином и фенилаланина в положении 405 во втором CH3-домене аргинином;
замена серина в положении 364 в первом CH3-домене лизином и лейцина в положении 368 во втором CH3-домене аспарагиновой кислотой и замена лизина в положении 409 в первом CH3-домене триптофаном и фенилаланина в положении 405 во втором CH3-домене лизином;
замена серина в положении 364 в первом CH3-домене лизином и лейцина в положении 368 во втором CH3-домене аспарагиновой кислотой и замена лизина в положении 409 в первом CH3-домене триптофаном и фенилаланина в положении 405 во втором CH3-домене аргинином;
замена серина в положении 364 в первом CH3-домене лизином и лизина в положении 370 во втором CH3-домене серином и замена лизина в положении 409 в первом CH3-домене триптофаном и фенилаланина в положении 405 во втором CH3-домене лизином;
замена серина в положении 364 в первом CH3-домене лизином и лизина в положении 370 во втором CH3-домене серином и замена лизина в положении 409 в первом CH3-домене триптофаном и фенилаланина в положении 405 во втором CH3-домене аргинином.
Такая двойная мутация в CH3-домене может обуславливать в результате степень димеризации, составляющую 70% или выше, 75% или выше, 80% или выше, 85% или выше, 90% или выше, 92% или выше, 93% или выше, 94% или выше, 95% или выше, или 96% или выше.
Другой аспект настоящего изобретения относится к антителу к вирусу гриппа типа B, содержащему вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 27, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 31, или его антигенсвязывающему фрагменту. Другой аспект настоящего изобретения относится к антителу к вирусу гриппа типа A, содержащему вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 29, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 31, или его антигенсвязывающему фрагменту.
Другой аспект настоящего изобретения относится к биспецифическому антителу к вирусу гриппа типа A/вирусу гриппа типа B, содержащему антитело к вирусу гриппа типа B, содержащее вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 27, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 31, и антитело к вирусу гриппа типа A, содержащее вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 29, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 31, или его антигенсвязывающему фрагменту. Биспецифическое антитело к вирусу гриппа типа A/вирусу гриппа типа B может содержать (1) модифицированный CH3-домен (как упоминалось выше, с введенной в CH3-CH3 парой мутаций); (2) мутантный CH1-домен и мутантный CL-домен (как упоминалось выше, с введенной в CH1-CL парой мутаций); или (3) как модифицированный CH3-домен, так и мутантный CH1-домен и мутантный CL-домен.
Биспецифический белок или биспецифическое антитело по настоящему изобретению представляет собой биспецифическую молекулу, сконструированную в соответствии с методикой коррелированных и согласованных мутаций на границе взаимодействия среди белковых субъединиц (Correlated and Harmonious Interfacial Mutation between Protein Subunits) (далее в настоящем документе называемой «Chimps»).
В контексте настоящего документа термин «антитело» относится к классу структурно родственных гликопротеинов, состоящих из двух пар полипептидных цепей, одной пары легких (L) низкомолекулярных цепей и одной пары тяжелых (H) цепей, при этом все четыре соединены друг с другом дисульфидными связями. Структура антител хорошо охарактеризована (см., к примеру, [Fundamental Immunology Ch. 7 (Paul, W., 2nd ed. Raven Press, N. Y. (1989)]). Вкратце, каждая тяжелая цепь обычно состоит из вариабельной области тяжелой цепи (в настоящем документе сокращено как VH) и константной области тяжелой цепи. Константная область тяжелой цепи обычно состоит из трех доменов, CH1, CH2 и CH3. Тяжелые цепи соединены друг с другом дисульфидными связями в так называемой «шарнирной области». Каждая легкая цепь обычно состоит из вариабельной области легкой цепи (в настоящем документе сокращено как VL) и константной области легкой цепи. Константная область легкой цепи обычно состоит из одного домена, CL. Обычно нумерация аминокислотных остатков в константной области представлена в соответствии с EU-индексом, как описано в работе [Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)]. VH- и VL-области дополнительно могут быть подразделены на области гипервариабельности (или гипервариабельные области, которые могут быть гипервариабельными по последовательности и/или форме структурно определенных петель), также называемые определяющими комплементарность областями (CDR), перемежающиеся с областями, которые являются более консервативными, называемыми каркасными областями (FR). Каждая VH и VL обычно состоит из трех CDR и четырех FR, расположенных, от амино-конца к карбокси-концу, в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4 (см. также работу [Chothia and Lesk J. Mol. Biol. 196, 901 917 (1987)]).
В контексте настоящего документа термин «Fab-плечо» относится к одной паре тяжелая цепь-легкая цепь.
Термин «Fc-область» в контексте настоящего документа относится к области антитела, содержащей CH2-домен и CH3-домен, и может дополнительно необязательно содержать шарнирную область.
В контексте настоящего документа термин «биспецифическое антитело» относится к антителу со специфичностями в отношении по меньшей мере двух разных эпитопов, обычно неперекрывающихся эпитопов.
Термин «полноразмерное антитело» в контексте настоящего документа относится к антителу, которое содержит все константные и вариабельные домены тяжелой и легкой цепей, соответствующие тем, которые обычно обнаруживаются в антителе этого изотипа. Согласно одному варианту осуществления полноразмерное антитело содержит две полноразмерные тяжелые цепи и две полноразмерные легкие цепи. В контексте настоящего документа «изотип» относится к классу антитела (к примеру, IgG1, IgG2, IgG3, IgG4, IgD, IgA, IgE или IgM), который кодируется генами константной области тяжелой цепи.
Подразумевается, что термин «антигенсвязывающий фрагмент» означает часть антитела, содержащую вариабельные домены антитела, и может быть выбрана из Fab, F(ab')2, scFv, (scFv)2, scFv-Fc, (scFv-Fc) и т.п., но не ограничивается указанным.
Термин «эпитоп» означает детерминанту белка, способную к специфическому связыванию с антителом. Эпитопы обычно состоят из групп на поверхности молекул, таких как аминокислоты и боковые цепи из сахаров, и обычно обладают специфическими характеристиками трехмерной структуры, а также специфическими характеристиками заряда.
Термин «биспецифическое антитело» является общим для антитела, которое распознает два разных антигена или два разных (неперекрывающихся) эпитопа на одном антигене и/или связывается с ними. Согласно одному варианту осуществления биспецифическое антитело может содержать один антигенсвязывающий сайт, направленный против антигена опухолевой клетки, и другой антигенсвязывающий сайт, направленный против цитотоксической триггерной молекулы. В качестве примера, биспецифическое антитело может быть выбрано из группы, состоящей из антитела к FcγRI/CD15, антитела к p185HER2/FcγRIII (CD16), антитела к CD3/антигену злокачественных B-клеток (1D10), антитела к CD3/p185HER2, антитела к CD3/p97, антитела к CD3/антигену клеток почечно-клеточной карциномы, антитела к CD3/OVCAR-3, антитела к CD3/L-D1 (против рака толстой кишки), антитела к CD3/аналогу меланоцитстимулирующего гормона, антитела к рецептору EGF/CD3, антитела к CD3/CAMA1, антитела к CD3/CD19, антитела к CD3/MoV18, антитела к молекуле адгезии нервных клеток (NCAM)/CD3, антитела к фолат-связывающему белку (FBP)/CD3, антитела к ассоциированному с различными типами карциномы антигену (AMOC-31)/CD3, но не ограничивается указанным. Согласно другому варианту осуществления биспецифические антитела с одним антигенсвязывающим сайтом, который специфически связывается с опухолевым антигеном, и другим антигенсвязывающим сайтом, который связывается с токсином, могут включать без ограничения антитело к сапорину/Id-1, антитело к CD22/сапорину, антитело к CD7/сапорину, антитело к CD38/сапорину, антитело к CEA/цепи A рицина, антитело к интерферону-α (IFN-α)/гибридомному идиотипу и антитело к CEA/алкалоиду барвинка. Согласно другому варианту осуществления биспецифическое антитело может быть выбрано из антител к конвертирующим ферментам, активирующим пролекарства, таких как антитело к CD30/щелочной фосфатазе (которая катализирует превращение пролекарства митомицин фосфата в митомициновый спирт), но не ограничиваются им. Согласно другому варианту осуществления биспецифическое антитело может быть выбрано из антител, которые можно применять в качестве фибринолитических средств, таких как антитело к фибрину/тканевому активатору плазминогена (tPA), антитело к фибрину/активатору плазминогена урокиназного типа (uPA) и т.п., но не ограничивается указанным. Согласно другому варианту осуществления биспецифическое антитело может быть выбрано из антител для нацеливания иммунных комплексов на рецепторы клеточной поверхности, таких как антитело к липопротеину низкой плотности (LDL)/Fc-рецептору (например, FcγRI, FcγRII или FcγRIII), но не ограничивается указанным. Согласно другому варианту осуществления биспецифическое антитело может быть выбрано из антител для применения в терапии инфекционных заболеваний (например, вызванных вирусом инфекционных заболеваний), таких как антитело к вирусу гриппа типа A/вирусу гриппа типа B, антитело к CD3/вирусу простого герпеса (HSV), антитело к комплексу T-клеточный рецептор:CD3/вирусу гриппа, антитело к FcγR/ВИЧ и т.п., но не ограничивается указанным. Согласно другому варианту осуществления биспецифическое антитело может быть выбрано из антител для выявления опухоли in vitro или in vivo, таких как антитело к CEA/EOTUBE, антитело к CEA/DPTA, антитело к p185 HER2/гаптену и т.п., но не ограничивается указанным. Согласно другому варианту осуществления биспецифическое антитело может быть выбрано из антител для применения в качестве средств диагностики, таких как антитело к IgG кролика/ферритину, антитело к пероксидазе хрена (HRP)/гормону, антитело к соматостатину/веществу P, антитело к HRP/FITC, антитело к CEA/β-галактозидазе и т.д. Согласно другому варианту осуществления примеры биспецифического антитела включают без ограничения антитело, включающее первый антигенсвязывающий сайт, направленный против CD30, и второй антигенсвязывающий сайт, направленный против erbB2; антитело, включающее первый антигенсвязывающий сайт, направленный против CD30, и второй антигенсвязывающий сайт, направленный против экзотоксина Pseudomonas (PE); антитело, включающее первый антигенсвязывающий сайт, направленный против CD30, и второй антигенсвязывающий сайт, направленный против стрептавидина.
В соответствии с другим вариантом осуществления нацеленный домен биспецифического белка может включать по меньшей мере один мишень-специфический связывающий полипептид, выбранный из группы, состоящей из различных мембранных белков, например, различных рецепторов (например, рецепторных тирозинкиназ (RTK) и т.п.), эктодоменов (внеклеточных доменов) рецепторов и различных лигандов (например, различных факторов роста, цитокинов и т.п.). Примеры рецептора включают без ограничения рецептор фактора некроза опухоли (TNFR) (например, TNFR1, TNFR2 и т.п.), рецептор эпидермального фактора роста (EGFR) (например, Her1 (рецептор 1 эпидермального фактора роста), Her2 (рецептор 2 эпидермального фактора роста человека), Her3 (рецептор 3 эпидермального фактора роста человека) и т.п.), рецептор ангиопоэтина (например, Tie1, Tie2 и т.п.), рецептор трансформирующего фактора роста (например, TGFbR1, TGFbR2, TGFbR3, TGFaR1 и т.п.), рецептор костного морфогенетического белка (например, BMPR1b), рецептор интерлейкина (например, субъединицу бета 1 рецептора интерлейкина 12 (IL-12R-b1)), IL-4Ra, IL-12A, IL-4, IL-1R1L, IL-17RA, IL-17A, IL-12R-b2, IL-13Ra1, IL-12B, IL-13, IL-1RAP, IL-17RC, IL-17F и т.п.), интегрин (например, интегрин альфа 4 (ITGA4), субъединицу альфа 2b интегрина (ITGA2B), ITGB1, ITGB3 и т.п.), рецептор интерферона (например, рецептор 1 интерферона-альфа/бета (IFNAR1), IFNAR2, IFNGR и т.п.), Fas (член 6 суперсемейства рецепторов фактора некроза опухоли; TNFRSF6), рецептор VEGF (например, Flt1 (fms-подобная тирозинкиназа 1) и т.п.), рецептор фактора роста гепатоцитов (например, Met и т.п.) и рецептор интерферона гамма (IFNGR). Лиганд может представлять собой по меньшей мере один лиганд, выбранный из группы, состоящей из фактора некроза опухоли (TNF), эпидермального фактора роста (EGF), фактора роста клеток эндотелия сосудов (VEGF-A, VEGF-B, VEGF-C, VEGF-D и т.п.), ангиопоэтина (например, Ang1, Ang2 и т.п.), трансформирующего фактора роста (TGF), фактора роста гепатоцитов (HGF), костного морфогенетического белка (например, BMP2, BMP7 и т.п.), интерлейкина и интерферона, но не ограничивается указанным.
Подразумевается, что термин «клетка-хозяин» в контексте настоящего документа относится к клетке, в которую был введен вектор экспрессии, например, вектор экспрессии, кодирующий антитело по настоящему изобретению. Рекомбинантные клетки-хозяева включают, например, трансфектомы, такие как клетки CHO, клетки HEK293, клетки NS/0 и лимфоциты.
CL-домены, CH1-домены и Fc-области (например, CH3-домены) в антителах по настоящему изобретению могут быть получены из любого антитела, как, например, подтипа IgG1, IgG2, IgG3, или IgG4, IgA, IgE, IgD или IgM. Антитела могут происходить из организма млекопитающих, включая приматов, таких как люди, обезьяны и т.д., и грызунов, таких как мыши, крысы и т.д. Поскольку происходящие из организма млекопитающих антитела характеризуются высокой гомологией последовательностей и структурной гомологией среди видов, пояснение, приведенное для CL-домена, CH1-домена и CH3-домена в настоящем описании, в целом применимо к антителам, происходящим из организма млекопитающих. Согласно одному варианту осуществления CL-домен, CH1-домен и CH3-домен могут происходить из IgG (например, IgG1), но не ограничиваются указанным. Как упоминалось выше, Fc-область в описанных в настоящем изобретении антителах содержат две разные тяжелые цепи (например, отличающиеся по последовательности вариабельного домена). Из двух разных тяжелых цепей по меньшей мере одна подвергается мутации по аминокислоте для повышения вероятности стабильного образования гетеродимера между двумя разными тяжелыми цепями, но снижения вероятности стабильного образования гомодимера между двумя идентичными тяжелыми цепями.
Приведенные в настоящем описании биспецифические белки, биспецифические антитела и их антигенсвязывающие фрагменты могут быть сконструированы с применением любых средств, и, например, с помощью химического синтеза или способа на основе технологии рекомбинантных ДНК. Белки, антитела и фрагменты могут быть не встречающимися в природе.
Сайты мутаций, необходимые для димеризации Fc в настоящем изобретении, представлены на фиг. 2. Мишени насчитывают 39 сайтов для мутации с введением электростатического взаимодействия, и 14 сайтов для мутации обмена, и 40 сайтов для мутации, связанной с размером аминокислоты. На фиг. 2 аминокислотные остатки представлены заглавными буквами в соответствии со стандартным способом. Нумерация аминокислотных остатков в константной области представлена в соответствии с EU-индексом, как описано в работе [Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)].
Другой аспект настоящего изобретения относится к фармацевтической композиции, содержащей вышеупомянутый биспецифический белок или биспецифическое антитело и необязательно фармацевтически приемлемый носитель. Другой аспект относится к применению вышеупомянутого биспецифического белка или биспецифического антитела в получении фармацевтической композиции. Другой аспект относится к способу получения фармацевтической композиции, содержащей вышеупомянутый биспецифический белок или биспецифическое антитело.
Антитело и содержащую его композицию, например, фармацевтическую композицию) можно применять для диагностики и лечения и, следовательно, они могут содержаться в терапевтическом или диагностическом наборе.
В контексте настоящего документа «фармацевтически приемлемый носитель» включает любые возможные физиологически совместимые растворители, диспергирующие среды, оболочки, противобактериальные и противогрибковые средства, изотонические средства, средства, замедляющие всасывание, стандартные среды-носители, применяемые для получения других лекарственных средств, вспомогательные вещества и добавки. Предпочтительно носитель может подходить для внутривенного, внутримышечного, подкожного, парентерального, интраспинального или эпидермального введения (например, путем инъекции или инфузии).
Композицию по настоящему изобретению можно вводить с помощью ряда известных в данной области способов. Как будет понятно специалисту в данной области, путь и/или способ введения будет варьироваться в зависимости от требуемых результатов. Для введения соединения по настоящему изобретению с помощью определенных путей введения может потребоваться покрытие соединения материалом или совместное введение соединения с материалом с целью предотвращения его инактивации. Например, соединение можно вводить субъекту в соответствующем носителе, например, липосомах или разбавителе. Фармацевтически приемлемые разбавители содержат солевой раствор и водные буферные растворы. Фармацевтические носители содержат стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных инъецируемых растворов или дисперсии для немедленного применения. Применение таких сред и средств для фармацевтически активных веществ известны в данной области.
Фразы «парентеральное введение» и «введенный парентерально» в контексте настоящего документа означают способы введения, отличные от энтерального и местного введения, обычно путем инъекции, и включают внутривенную, внутримышечную, внутриартериальную, интратекальную, интракапсулярную, интраорбитальную, интракардиальную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, субкапсулярную, субарахноидальную, интраспинальную, эпидуральную и интрастернальную инъекцию и инфузию.
Такие композиции также могут содержать вспомогательные вещества, такие как консерванты, смачивающие вещества, эмульгирующие вещества и диспергирующие вещества. Предотвращение присутствия микроорганизмов может обеспечиваться путем применения процедур стерилизации, выше, и путем включения различных противобактериальных и противогрибковых средств, например, парабена, хлорбутанола, фенола, сорбиновой кислоты и т.д. Также может быть желательным включение в композиции изотонических средств, таких как сахара, хлорид натрия и т.д. Кроме того, пролонгированное всасывание инъецируемой фармацевтической формы может быть обеспечено за счет включения средств, которые замедляют всасывание, таких как моностеарат алюминия и желатин. Независимо от выбранного пути введения соединения по настоящему изобретению, которые можно применять в подходящей гидратированной форме и/или фармацевтических композициях по настоящему изобретению, составляют в фармацевтически приемлемые лекарственные формы с помощью известных специалистам в данной области традиционных способов.
Фактические уровни дозировки активных ингредиентов в фармацевтических композициях по настоящему изобретению могут варьироваться для получения количества активного ингредиента, которое является эффективным для достижения требуемого терапевтического ответа для конкретного пациента, композиции и способа введения, без токсичности для пациента. Выбранный уровень дозировки будет зависеть от ряда фармакокинетических факторов, включая активность конкретных используемых композиций по настоящему изобретению, путь введения, время введения, скорость выведения конкретного соединения, которое будет использовано, продолжительность лечения, другие лекарственные средства, соединения и/или вещества, применяемые в комбинации с конкретными используемыми композициями, возраст, пол, вес, состояние, общее состояние здоровья и сведения о перенесенных ранее заболеваниях пациента, подлежащего лечению, и другие факторы, хорошо известные в области медицины.
Подлежащий введению субъект может быть выбран из млекопитающих, включая приматов, таких как люди, обезьяны и т.д., грызунов, таких как мыши, крысы и т.д. и т.п., выделенного у них материала, включая клетки, ткани и биологическую жидкость (например, кровь и т.п.) и их культивируемые продукты.
Благоприятные эффекты
Настоящее изобретение относится к гетеродимерному белку высокой чистоты в виде полученного с помощью Chimps белка (например, антитела), который практически не содержит контаминирующих веществ, таких как гомодимеры или мономеры, и методике его конструирования. Другим преимуществом настоящего изобретения является повышение чистоты биспецифического антитела и введение минимального количества мутаций в естественное антитело, тем самым не вызывая значительных структурных изменений естественных антител и снижая риск индуцирования в отношении антитела потери или нарушения функциональности и/или стимуляции иммунного отторжения.
Описание чертежей
Фиг. 1 представляет собой схематическое изображение только одного совершенного гетеродимерного биспецифического антитела (изображенный пунктирной линией круг) среди ряда форм антител, возможных для конструирования биспецифических антител (в общей сложности 10). А и В представляют собой соответствующие тяжелые цепи, отличающиеся друг от друга, и a и b представляют собой соответствующие легкие цепи, отличающиеся друг от друга.
На фиг. 2 показаны положения остатков антител, применяемые в способах с использованием мутаций, связанных с электростатическим взаимодействием, обменом и размером аминокислот, для индукции гетеродимеризации константных Fc-областей в соответствии с одним вариантом осуществления, и связанные с ними положения остатков.
На фиг. 3 представлен профиль разделения в SDS-PAGE, демонстрирующий гетеродимеризацию, обусловленную перечисленными в таблице 4 мутациями с введением электростатического взаимодействия.
На фиг. 4 представлен профиль разделения в SDS-PAGE, демонстрирующий гетеродимеризацию, обусловленную перечисленными в таблице 5 мутациями, ассоциированными с обменом.
На фиг. 5 представлен профиль разделения в SDS-PAGE, демонстрирующий гетеродимеризацию, обусловленную перечисленными в таблице 6 мутациями, ассоциированными с размером аминокислоты.
На фиг. 6a показаны результаты сравнения 12 мутаций, которые обеспечивают исключительную гетеродимеризацию, среди перечисленных в таблице 7 единичных мутаций.
На фиг. 6b показаны результаты гетеродимеризации после того, как S364K из двух мутаций типа «ключ» была заменена мутацией с другими аминокислотами в соответствии с одним вариантом осуществления.
На фиг. 6c показаны результаты гетеродимеризации после того, как F405K из двух мутаций типа «ключ» была заменена мутацией с другими аминокислотами в соответствии с одним вариантом осуществления.
На фиг. 6d показаны результаты гетеродимеризации после введения дополнительных мутаций к трем выбранным парам мутаций типа «ключ-замок» S364K-L368D, S364K-K370S и F405K-K409F в соответствии с одним вариантом осуществления, где ось x предусматривает молекулярную массу (кДа).
На фиг. 7 показана эффективность гетеродимеризации для единичных мутаций S364K-L368D, S364K-K370S и F405K-K409F в сравнении с традиционными методиками (контроли KiH, CPC и AzS). В случае, когда аминокислотные остатки, соответствующие каждому «ключу», заменяют на другие отличающиеся аминокислоты, K наилучшим образом подходит для S364, и для K и R (аргинин) наблюдали почти такой же эффект для F405. Положения, по которым выполняют единичные мутации в A- и B-цепях, указаны, и количественное выражение гетеродимеризации представлено численно.
На фиг. 8 показаны показатели эффективности гетеродимеризации в общей сложности для четырех пар двойных мутаций в сравнении с традиционными методиками (контроли KiH, CPC, AzS), где четыре двойные мутации получены путем выбора двух пар двойных мутаций из комбинаций трех пар мутаций S364K-L368D, S364K-K370S и F405K-K409F и осуществления мутации F405 с заменой на два типа K и R для каждой пары.
На фигурах. 9a-9c представлены профили разделения в SDS-PAGE после замены L368, K370 и K409, соответствующих мутациям типа «замок» в парах двойных мутаций, другими аминокислотами, как указано в таблице 6, с целью идентификации лучших эффектов, когда мутации в отношении аминокислотных остатков, соответствующие мутациям типа «замок», заменены другими мутациями.
На фиг. 10 показаны положения мутаций, ассоциированных с электростатическим взаимодействием, мутаций, ассоциированных с размером аминокислоты, и мутаций, ассоциированных с обменом, в Fab антител.
Фиг. 11 представляет собой схематическое изображение процедуры конкурентного анализа спаривания (CPP).
На фиг. 12 показаны установленные посредством процесса из фиг. 11 способы спаривания между тяжелыми и легкими цепями и визуализированные на SDS-PAGE после клонирования и коэкспрессии 4D9 и 2B9 с парами мутаций C1, DuetMab и V23 между тяжелыми и легкими цепями.
На фиг. 13 представлен профиль разделения в SDS-PAGE, демонстрирующий способы спаривания при создании мутации, ассоциированной с электростатическим взаимодействием, между тяжелыми и легкими цепями путем замены K (лизином) целевых аминокислот в A-цепи (тяжелая цепь 2B9) и D (аспарагиновой кислотой) целевых аминокислот в B-цепи (тяжелая цепь 4D9).
На фиг. 14 показаны способы спаривания в случае мутации в положении 30, обуславливающей замену L145 тяжелой цепи и V133 легкой цепи K и D соответственно, которая обеспечивает относительно высокую точность спаривания среди перечня пар мутаций при сравнении с антителами 4D9 и 2B9 на SDS-PAGE.
На фигурах 15 и 16 показаны способы спаривания после введения мутации в положении 29 S131D и/или S131K в легкую цепь антитела, в котором L145 тяжелой цепи заменен E или D, а V133 легкой цепи заменен R, как проанализировано с помощью SDS-PAGE.
На фиг. 17 показаны способы спаривания в случае пар мутаций в положении 48 (S183 тяжелой цепи и V133 легкой цепи заменены K(R) и D(E) соответственно), как проанализировано с помощью SDS-PAGE.
На фиг. 18 показаны способы спаривания, анализируемые с помощью SDS-PAGE, после введения показанной в таблице 19 пары мутаций c29c30c48FΦ29f30f48 и ее вариантов.
На фиг. 19 показаны способы спаривания, анализируемые с помощью SDS-PAGE, после введения пары мутаций из таблицы 20.
На фиг. 20 показаны способы спаривания, анализируемые с помощью SDS-PAGE, после введения пары мутаций из таблицы 21.
На фиг. 21 показаны соотношения спаривания цепей после введения в соответствии с одним вариантом осуществления комбинаций пар мутаций в положении 34 и 51, выбранных из пар мутаций в тяжелой и легкой цепях.
На фиг. 22 показаны соотношения спаривания цепей после введения в соответствии с одним вариантом осуществления пары мутаций c34Фf51, выбранной из пар мутаций в тяжелой и легкой цепях.
На фиг. 23 показаны соотношения спаривания цепей после введения в соответствии с одним вариантом осуществления пары мутаций c40Фf44, выбранной из пар мутаций в тяжелой и легкой цепях.
Фиг. 24 представляет собой схематическое изображение биспецифического антитела, в котором в соответствии с одним вариантом осуществления тяжелые и легкие цепи подвержены мутации.
Фиг. 25 представляет собой график, на котором показана термоустойчивость A-цепи и B-цепи для тяжелой цепи и a-цепи и b- цепи для легкой цепи в антителах, сконструированных в соответствии с одним вариантом осуществления.
Фиг. 26 представляет собой карту расщепления pcDNA3.
Фиг. 27 представляет собой график, на котором показаны результаты хроматографии с гидрофобным взаимодействием (HIC) для биспецифических антител Trabev и Adabev, сконструированных в соответствии с одним вариантом осуществления, каждое из которых имеет введенные в него пару мутаций c`29c`30c48Фf`29f`30f`48 и пару мутаций AWBB.
Фиг. 28 представляет собой график, на котором показаны результаты анализа с использованием эксклюзионной хроматографии (SEC) для биспецифического антитела Trabev, сконструированного в соответствии с одним вариантом осуществления, имеющего введенные в него пару мутаций c`29c`30c48Фf`29f`30f`48 и пару мутаций AWBB.
Фиг. 29 представляет собой график, на котором показаны результаты анализа с использованием эксклюзионной хроматографии (SEC) для биспецифических антител Trabev и Adabev, сконструированных в соответствии с одним вариантом осуществления, каждое из которых имеет введенные в него пару мутаций c`29c`30c48Фf`29f`30f`48 и пару мутаций AWBB.
На фиг. 30 показаны способы димеризации биспецифических антител Trabev и Adabev, сконструированных в соответствии с одним вариантом осуществления, каждое из которых имеет введенные в него пару мутаций c`29c`30c48Фf`29f`30f`48 и пару мутаций AWBB.
Фиг. 31 представляет собой график, на котором показана аффинность к антигенам (Her2 и VEGF) биспецифического антитела Trabev, сконструированного в соответствии с одним вариантом осуществления, имеющего введенные в него пару мутаций c`29c`30c48Фf`29f`30f`48 и пару мутаций AWBB.
Фиг. 32 представляет собой график, на котором показана аффинность к антигенам (TNF-альфа и VEGF) биспецифического антитела Adabev, сконструированного в соответствии с одним вариантом осуществления, имеющего введенные в него пару мутаций c`29c`30c48Фf`29f`30f`48 и пару мутаций AWBB.
На фиг. 33a показаны результаты выравнивания последовательностей константной области тяжелой цепи IgG1 человека и константной области тяжелой цепи IgA1 человека (константная область тяжелой цепи IgG1 человека: SEQ ID NO: 33; константная область тяжелой цепи IgA1 человека: SEQ ID NO: 34).
На фиг. 33b показаны результаты выравнивания последовательностей константной области каппа-цепи и константной области лямбда-цепи легкой цепи иммуноглобулина человека (константная область каппа-цепи легкой цепи иммуноглобулина человека: SEQ ID NO: 35; и константная область лямбда-цепи легкой цепи иммуноглобулина человека: SEQ ID NO: 36).
На фигурах. 33c и 33d показаны результаты выравнивания последовательностей константных областей тяжелой цепи среди подтипов IgG человека, мыши и крысы (последовательности CH1-домена на фиг. 33c и последовательности CH3-домена на фиг. 33d) (IgG1 человека: SEQ ID NO: 1, IgG2 человека: SEQ ID NO: 2, IgG3 человека: SEQ ID NO: 3, IgG4 человека: SEQ ID NO: 4, IgG1 мыши: SEQ ID NO: 37, IgG2ab мыши: SEQ ID NO: 38, IgG2aa мыши: SEQ ID NO: 39, IgG2b мыши: SEQ ID NO: 40, IgG3 мыши: SEQ ID NO: 41, IgG1 крысы: SEQ ID NO: 42, IgG2a крысы: SEQ ID NO: 43, IgG2b крысы: SEQ ID NO: 44, IgG2c крысы: SEQ ID NO: 45 на фиг. 33c (CH1-домен); и IgG1 человека: SEQ ID NO: 15, IgG2 человека: SEQ ID NO: 16, IgG3 человека: SEQ ID NO: 17, IgG4 человека: SEQ ID NO: 18, IgG1 мыши: SEQ ID NO: 46, IgG2ab мыши: SEQ ID NO: 47, IgG2aa мыши: SEQ ID NO: 48, IgG2b мыши: SEQ ID NO: 49, IgG3 мыши: SEQ ID NO: 50, IgG1 крысы: SEQ ID NO: 51, IgG2a крысы: SEQ ID NO: 52, IgG2b крысы: SEQ ID NO: 53 и IgG2c крысы: SEQ ID NO: 54 на фиг. 33d (CH3-домен)).
На фиг. 34 показаны уровни спаривания между легкими и тяжелыми цепями у антител, сконструированных в соответствии с одним вариантом осуществления, имеющих введенную в них пару мутаций c34Фf51.
Фиг. 35 представляет собой график, на котором показаны результаты HIC для биспецифического антитела Trabev, сконструированного в соответствии с одним вариантом осуществления, имеющего пару мутаций c34Фf51 и пару мутаций AWBB.
На фиг. 36 показаны графики результатов HIC для биспецифического антитела Adabev, сконструированного в соответствии с одним вариантом осуществления, имеющего пару мутаций c34Фf51 и пару мутаций AWBB.
На фиг. 37 показаны способы димеризации биспецифических антител Trabev и Adabev, сконструированных в соответствии с одним вариантом осуществления, каждое из которых имеет введенные в него пару мутаций c34Фf51 и пару мутаций AWBB.
На фиг. 38 показаны уровни спаривания между легкими и тяжелыми цепями у антитела, сконструированного в соответствии с одним вариантом осуществления, имеющего введенную в него пару мутаций c40Фf44.
На фиг. 39 показаны графики результатов HIC для биспецифического антитела Trabev, сконструированного в соответствии с одним вариантом осуществления, имеющего пару мутаций c40Фf44 и пару мутаций AWBB.
На фиг. 40 показаны графики результатов HIC для биспецифического антитела Adabev, сконструированного в соответствии с одним вариантом осуществления, имеющего пару мутаций c40Фf44 и пару мутаций AWBB.
На фиг. 41 показаны способы димеризации биспецифических антител Trabev и Adabev, сконструированных в соответствии с одним вариантом осуществления, каждое из которых имеет введенные в него пару мутаций c40Фf44 и пару мутаций AWBB.
На фиг. 42 представлен профиль разделения в SDS-PAGE, демонстрирующий уровни гомодимеризации после одной трансфекции Enb-Fc и Fas-Fc по отдельности, в соответствии со сравнительным примером.
Осуществление настоящего изобретения
Далее в настоящем документе настоящее изобретение будет описано более подробно со ссылкой на примеры. Следует понимать, однако, что эти примеры приведены исключительно в целях иллюстрации и не должны истолковываться как ограничивающие объем настоящего изобретения.
Для осуществления настоящего изобретения на практике все образцы были получены после следующей процедуры.
Экспрессия белка
1. Целевой ген клонировали в вектор экспрессии (pcDNA3 (Invitrogen).
2. Клетки HEK293E (ATCC) культивировали в DMEM (среда Игла в модификации Дульбекко) с высоким содержанием глюкозы, дополненной 5% FBS (фетальная телячья сыворотка) в CO2-инкубаторе с увлажнением.
3. Полученную плазмидную ДНК вводили с помощью транзиентной трансфекции в клетки HEK393E, выращенные до достижения полной конфлюентности. Перед трансфекцией клетки промывали PBS (забуференный фосфатом солевой раствор), а затем заменяли культуральную среду бессывороточной DMEM с высоким содержанием глюкозы.
4. После инкубации в течение одной недели кондиционированную среду применяли для сбора белков, которые затем фильтровали. Fc-слитые белки и антитела выделяли с помощью хроматографии с использованием белка А.
5. Выделенные белки количественно определяли при 280 нм.
Пример 1. Выбор мутации для гетеродимеризации двух Fc-областей.
Положения мутаций для обеспечения гетеродимеризации двух Fc-областей (CH3-домен; SEQ ID NO: 15) (исходя из IgG1) представлены на фиг. 2. Секция состояла из 39 положений для мутации, ассоциированной с электростатическим взаимодействием (мутация с введением электростатического взаимодействия) (представлена как «заряд J»), 14 положений для мутации, ассоциированной с обменом (мутация обмена) (представлена как «обмен O») и 40 положений для мутации, связанной с размером аминокислоты (представлена как «размер B»). Выбранные в конечном итоге положения в CH3-доменах и мутированные аминокислоты в них приведены в таблице 3. Каждую из пар мутаций применяли в отношении двух Fc-областей (соответственно представленных A-цепью и B-цепью), происходящих из разных антител, с последующим клонированием для коэкспрессии. В случае мутации, ассоциированной с электростатическим взаимодействием, мутации осуществляли для замены соответствующих аминокислот в A-цепи K (лизином), являющимся представителем аминокислот с положительным зарядом, и в B-цепи D (аспарагиновой кислотой), являющейся представителем аминокислот с отрицательным зарядом. Мутацию, ассоциированную с обменом, осуществляли для замещения соответствующих аминокислот в A-цепи и B-цепи одна на другую. В случае мутации, ассоциированной с размером аминокислоты, соответствующие аминокислоты заменяли W (триптофаном) в A-цепи и аминокислотой A (аланином) маленького размера в B-цепи.
ТАБЛИЦА 3.
Для тогочтобы легко идентифицировать гомодимеры или гетеродимеры Fc-слитых белков с помощью SDS-PAGE, выполняли слияние эктодомена (кодирующая последовательность области 1-771 SEQ ID NO: 24) рецептора TNF-альфа (TNFRSF1B: NP_001057.1 (кодирующий ген: CDS NM_001066.2; SEQ ID NO: 24)) с Fc (кодирующий ген: SEQ ID NO: 26) в рамках одной цепи (цепь A: энбрел) и эктодомена (кодирующая последовательность области 1-519 SEQ ID NO: 25) Fas-рецептора (NP_000034.1 (кодирующий ген: CDS NM_000043.5; SEQ ID NO: 25)) с Fc (кодирующий ген: SEQ ID NO: 26) в рамках другой цепи (цепь B: Fas), с применением вектора pcDNA3 (см. фиг. 26; Invitrogen) в качестве остова. Мономер в виде цепи A имеет размер 53 кДа, тогда как мономер в виде цепи B имеет размер приблизительно 44 кДа. Поскольку цепи A и B, каждая из которых характеризуется слиянием Fc-эктодомен, отличались друг от друга по размеру, два гомодимера (AA и BB) и один гетеродимер (AB) можно было легко различить на SDS-PAGE.
Процентные (%) показатели димеризации между цепями A и между цепями B (гомодимеризация) представлены как SAA и SBB, тогда как соответственно SAB составляет процентные (%) показатели димеризации между цепями A и B (гетеродимеризация).
Если способы димеризации наблюдали с помощью SDS-PAGE, соотношения (%) гомодимеризации (AA и BB) и гетеродимеризации (AB) между цепями A и B, характеризующимися наличием введенных в них мутаций из таблицы 3, сравнивали с таковыми между цепями A и B, которые не были мутированы (представлено как WT). Результаты приведены в таблице 4 и на фиг. 3 для мутации с введением электростатического взаимодействия, в таблице 5 и на фиг. 4 для мутации, связанной с размером аминокислоты, и в таблице 6 и на фиг. 5 для мутации, ассоциированной с обменом.
ТАБЛИЦА 4.
ТАБЛИЦА 5.
ТАБЛИЦА 6.
В таблицах 4-6 мутации, в случае которых степень гетеродимеризации (%) составляет 70% или выше, представлены жирным шрифтом. Как понятно из данных таблиц 4-6, тестируемые пары мутаций обуславливали степень гетеродимеризации 60% или выше.
По результатам были выбраны 12 пар мутаций, которые обеспечивали более высокие уровни гетеродимеризации, чем гомодимеризации, со степенью гетеродимеризации 70% или выше (мутация с введением электростатического взаимодействия: Y349K-E357D, E357K-Y349D, E357K-K370D, S364K-L368D, T366K-Y407D, T394K-T394D, T394K-V397D; и мутация обмена: E357Y-Y349E, E357K-K370E, S364K-K370S, F405K-K409F, Y407T-T366Y) (представлены жирным шрифтом в таблицах 4 и 5).
Каждую из 12 мутаций по аминокислотному остатку в выбранных 12 парах аминокислот вводили в слитый белок Fas-Fc для экспрессии мутантных слитых белков Fas-Fc, которые предусматривали соответственно единичные мутации в положениях аминокислот. В тех же условиях сравнивали показатели устойчивости гомодимера и мономера (Ssm; 1=100%), и результаты представлены в таблице 7 и на фиг. 6a.
ТАБЛИЦА 7.
Из таблицы 7 и фиг. 6a, были выбраны две мутации S364K и F405K, которые обуславливали низкую степень гомодимеризации, но при этом высокий показатель устойчивости мономеров (50% или выше).
Было предположено, что две выбранные мутации выполняли роль мутаций типа «ключ», тогда как сайты CH3-домена, взаимодействующие с ними в другой цепи, представляли собой мутации типа «замок». В виде комбинаций их между собой были выбраны три пары типа «ключ-замок» S364K-L368D, S364K-K370S и F405K-K409F. Эти пары мутаций вводили в цепь A (мутация типа «ключ») и цепь B (мутация типа «замок») для получения трех разных пар единичных мутаций (см. таблицу 8).
ТАБЛИЦА 8.
Аминокислоты в соответствующих положениях, подлежащих введению мутации типа «ключ», были заменены разными аминокислотными остатками, и их тестировали на предмет индуцированного единичной мутацией эффекта в отношении гетеродимеризации, как описано выше, для идентификации типов мутаций, эффективных в отношении гетеродимеризации по определенным положениям. В случае S364 наблюдали, что замена K (лизином) приводила к наиболее высокому эффекту в отношении гетеродимеризации. Исключительный эффект был выявлен при замене N (аспарагином) и R (аргинином) (см. фиг. 6b). F405 обуславливала превосходные подобные эффекты в отношении гетеродимеризации при замене K и R и исключительные эффекты в отношении гетеродимеризации при замене N и Q (глутамином) (см. фиг. 6c).
Дополнительные мутации S364N, S364R, F405R, F405N и F405Q, которые были идентифицированы на фигурах 6b и 6c, применяли в дополнение к трем выбранным парам мутаций типа «ключ-замок» S364K-L368D, S364K-K370S и F405K-K409F для введения мутаций типа «замок» в цепь A (TNFR2-Fc) и мутаций типа «ключ» в цепь B (Fas-Fc), с последующим анализом эффектов в отношении гетеродимеризации на SDS-PAGE.
Полученные таким образом результаты представлены в таблице 9 и на фиг. 6d:
ТАБЛИЦА 9.
(SAA: степень гомодимеризации AA (%);
SAB: степень гетеродимеризации AB (%);
SBB: степень гомодимеризации BB (%))
Пример 2. Тест на предмет обусловленной единичной мутацией гетеродимеризации Fc-области.
Три пары мутаций типа «ключ-замок» S364K-L368D, S364K-K370S и F405K-K409F, которые были выбраны в примере 1, и пару мутаций F405R-K409F, которая обуславливала замену F405 R вместо K, тестировали на предмет гетеродимеризации на SDS-PAGE. Эффекты в отношении гетеродимеризации сравнивали с таковыми, полученными для обычных применяемых в качестве контролей пар мутаций в гетеродимерах Fc, выполненных в рамках технологий KiH, CPC и AzS.
Данные SDS-PAGE в этом примере и во всех следующих примерах получали путем количественного анализа интенсивностей окрашивания полосок с помощью программного обеспечения GelQuant.NET.
Результаты представлены в таблице 10 и на фиг. 7:
ТАБЛИЦА 10.
(SAB: степень гетеродимеризации AB (%); SA; степень гомодимеризации AA (%);
SB: степень гомодимеризации BB (%); SM: показатель устойчивости мономеров (%))
Tm измеряли следующим образом:
Реагент: набор для окрашивания Invitrogen 4461146 "Protein Thermal Shift™"
Прибор: Chromo4-PTC200 (MJ Research)
Реакционная смесь: всего 20мкл
Протокол:
1. Инкубация при 50,0°C в течение 30 сек;
2. Кривая плавления от 50,0 до 90,0°C, считывание при каждом шаге в 0,2°C, удерживание в течение 2 сек;
3. Инкубация при 90,0°C в течение 2 мин
4. Инкубация при 10,0°C на постоянной основе
5. Завершение
Как показано в таблице 10 и на фиг. 7, в случае, когда цепь A и цепь B каждая экспрессировались отдельно, цепь A, содержащая «ключ», не образовывала гомодимер, а экспрессировалась в виде мономера. Было обнаружено, что полученный в результате коэкспрессии образец не содержал гомодимеры, а содержал главным образом гетеродимеры (см. фиг. 7).
Пример 3. Обусловленная двойной мутацией гетеродимеризация Fc-области.
Меньшая вероятность гомодимеризации может быть результатом наличия мутаций типа «ключ» в обеих цепях A и B, а не в одной из цепей. Выполняли две пары двойных мутаций из комбинаций трех пар мутаций, выбранных в примере 1. Для каждой пары двойных мутаций F405 подвергали мутации двух типов, K и R. Таким образом, в общей сложности получали четыре пары двойных мутаций. Эти обнаруженные пары двойных мутаций анализировали в отношении гетеродимеризации на SDS-PAGE, и эффекты в отношении димеризации сравнивали с таковыми для контролей KiH, CPC и AzS.
Результаты приведены в таблице 11 и на фиг. 8:
ТАБЛИЦА 11.
Как показано в таблице 11 и на фиг. 8, присутствующие в обеих цепях мутации типа «ключ» не приводили к гомодимеризации цепей ни для одной из четырех пар мутаций при экспрессии по отдельности. Было обнаружено, что все из белков в полученном в результате коэкспрессии образце являются гетеродимерами (см. фиг. 8). Кроме того, в паре с двойной мутацией с введенной в нее F405R была измерена более высокая термоустойчивость, чем в паре с введенной в нее F405K (таблица 11).
Чтобы изучить, был ли получен лучший эффект в том случае, когда аминокислоты в соответствии с мутацией типа «замок», замененные другими остатками, L368, K370 и K409, которые соответствовали «замку» в парах с двойными мутациями, были заменены другими аминокислотными остатками. Комбинации с мутациями, полученные посредством различного мутирования по L368, K370 и K409, приведены в таблице 12. Комбинации с мутациями тестировали на предмет гетеродимеризации на SDS-PAGE (NR: 8% гель для SDS-PAGE; образец: нагрузка 24 мкл), и результаты представлены на фигурах 9a-9c.
ТАБЛИЦА 12.
Варианты типа «замок»
A
B
A
B
K409F
F405R
K409A
F405R
K409F
F405R
K409C
F405R
K409F
F405R
K409D
F405R
K409F
F405R
K409E
F405R
K409F
F405R
K409F
F405R
K409F
F405R
K409G
F405R
K409F
F405R
K409H
F405R
K409F
F405R
K409I
F405R
K409F
F405R
K409K
F405R
K409F
F405R
K409L
F405R
K409F
F405R
K409M
F405R
K409F
F405R
K409N
F405R
K409F
F405R
K409Q
F405R
K409F
F405R
K409R
F405R
K409F
F405R
K409S
F405R
K409F
F405R
K409T
F405R
K409F
F405R
K409V
F405R
K409F
F405R
K409W
F405R
K409F
F405R
K409Y
F405R
Комбинации измеряли в отношении термоустойчивости (см. пример 2), и результаты приведены в таблице 13.
ТАБЛИЦА 13.
В анализе для K409W (триптофан) была показана более высокая термоустойчивость, чем для K409F.
Исходя из полученных вышеописанных данных, выполняли мутации S364K и K409W в цепи A и K370S и F405R в цепи B для получения пары с двойными мутациями, называемой парой с мутациями AWBB, для применения в следующем тесте на предмет гетеродимеризации Fc для CH3-домена.
Пример 4. Выбор мутации для тяжелой цепи и легкой цепи Fab антитела.
Для выбора мутаций в тяжелых и легких цепях антител осуществляли мутации, ассоциированные с электростатическим взаимодействием, мутации, ассоциированные с размером аминокислоты, и мутации, ассоциированные с обменом. Положения, по которым осуществляется взаимодействие в тяжелых и легких цепях, представлены на фиг. 10.
Для того, чтобы легко идентифицировать мутации в тяжелых и легких цепях, клонировали антитела с одинаковой легкой цепью. Антитело 4D9 (антитело к вирусу гриппа типа A) и антитело 2B9 (антитело к вирусу гриппа типа B), которые оба являются антителами к вирусу гриппа, имеют одинаковую легкую цепь (общую легкую цепь: CLC). Поскольку они имеют одинаковую легкую цепь, SDS-PAGE-анализ позволяет легко понять взаимодействие между тяжелой и легкой цепями. Несмотря на идентичность по аминокислотной последовательности легкой цепи, два антитела 4D9 и 2B9 отличаются друг от друга в отношении последовательности и размера тяжелой цепи (тяжелая цепь 2B9 имеет на шесть аминокислотных остатков больше, чем 4D9, и размер (50130,62 Дальтон), превышающий таковой 4D9 (49499,98 Дальтон): их можно явно различить на SDS-PAGE). Таким образом, анализ на основе размера с помощью SDS-PAGE позволяет понять, какая из двух цепей взаимодействует с легкой цепью.
Аминокислотные последовательности и кодирующие их последовательности нуклеиновых кислот в вариабельных областях тяжелых цепей и вариабельных областях легких цепей двух антител 4D9 и 2B9 перечислены в таблице 14, ниже.
ТАБЛИЦА 14.
QMTSMTAADTAVYYCARDVTGISRENAFDIWGQGTLVTVSS (SEQ ID NO: 29)
CAGATGACGTCTATGACCGCTGCTGACACGGCCGTATATTACTGTGCGAGAGATGTGACTGGCATCAGTCGAGAAAATGCTTTTGATATCTGGGGCCAAGGCACCCTGGTCACCGTCTCCTCG (SEQ ID NO: 30)
В двух антителах 4D9 и 2B9 константная область IgG1 используется в качестве константной области тяжелой цепи и константная область каппа-цепи в качестве константной области легкой цепи.
Было проведено исследование с целью определения того, образует ли легкая цепь с введенной в нее мутацией пару только с тяжелой цепью с мутацией, взаимодействующей с мутацией легкой цепи. В этом отношении легкая цепь, тяжелая цепь, образующая пару с легкой цепью, и тяжелая цепь, образующая ошибочную пару с легкой цепью, были коэкспрессированы с получением антител. С помощью SDS-PAGE-анализа антител в восстанавливающих условиях можно определить степень, в которой происходит точное спаривание. В целях удобства тяжелую цепь 4D9 называют A-цепью, а образующую с ней пару легкую цепь называют a-цепью, и тяжелую цепь 2B9 называют B-цепью, а образующую с ней пару легкую цепь называют b-цепью (см. следующие изображения).

Сперва 4D9 и 2B9 с образующимися между тяжелыми и легкими цепями обычными парами с мутациями, о которых уже известно, что они эффективны, были клонированы и коэкспрессированы. Способы спаривания, установленные по конкуренции между полученными мутантными цепями, то есть двумя тяжелыми цепями и одной легкой цепью, исследовали на SDS-PAGE. (Конкурентного анализа спаривания (CPP)). Процесс осуществления конкурентного анализа спаривания (CPP) схематически изображен на фиг. 11, и полученный таким образом результат представлен на фиг. 12. Как показано на фиг. 12, все уже известные пары с мутациями одновременно подвергаются нормальному спариванию и нетипичному ошибочному спариванию.
В случае ассоциированных с электростатическим взаимодействием мутаций между тяжелыми и легкими цепями антитела, в которые вводили различные пары мутаций с помощью замены соответствующих аминокислот в B-цепи (тяжелой цепи 2B9) K (лизином) и в A-цепи (тяжелой цепи 4D9) D (аспарагиновой кислотой), подвергали CPP-анализу на SDS-PAGE (см. фиг. 11).
В результате семь кандидатных пар с мутациями, которые, как было идентифицировано, подвергаются относительно точному спариванию, подвергали скринингу в группе мутаций, ассоциированных с электростатическим взаимодействием. Результаты CPP-анализа на SDS-PAGE антител, в которые вводили семь подвергнутых скринингу пар с мутациями, приведены в таблице 15 и представлены на фиг. 13.
ТАБЛИЦА 15.
(симметричные ортогональные пары)
(Показатель CPP (SCPP) = ½(aCPP + bCPP)
a CPP = 100(CaA)/(CaA+CaB) = 100(CA)/(CA+CB)
b CPP = 100(CbB)/(CbB+CbA) = 100(CB)/(CA+CB))
С помощью сравнения на SDS-PAGE были обнаружены некоторые пары с мутациями, которые подвергались относительно точному спариванию в списке пар с мутациями, с применением антител 4D9 (A-цепь) и 2B9 (B-цепь) (представлены жирным шрифтом в таблице 15). Для дополнительного исследования мутацию в положении 30 (представлена как c30Φf30) модифицировали, как в таблице 16.
ТАБЛИЦА 16.
Мутация в положении 30 обуславливала замену L145 тяжелой цепи и V133 легкой цепи K и D соответственно. Как понятно из данных таблицы 16, наблюдаемый эффект (точность спаривания: соотношение спаривания Aa или спаривания Bb) был удовлетворительным (точность спаривания Aa 75%, точность спаривания Bb: 60%) для вариантов, в которых L145 тяжелой цепи и V133 легкой цепи были заменены R и D соответственно (см. фиг. 14).
Добавление мутации S131D в легкую цепь (называемой мутацией в положении 29) к мутации в положении 30 или ее вариантам (L145 тяжелой цепи и V133 легкой цепи заменены K или R и D или E соответственно) обеспечивало улучшение точности спаривания (см. таблицу 17 и фиг. 15 (результат c29cR30ΦfR30; точность спаривания Aa: 80% и точность спаривания Bb: 70%) и фиг. 16 (результат cR29cRE30ΦfR29fRE30; точность спаривания Aa: 90% и точность спаривания Bb: 80%)).
ТАБЛИЦА 17.
Как можно видеть на фигурах 14 и 15, исключительную точность спаривания выявляли в случаях, когда L145 тяжелой цепи и V133 легкой цепи были заменены R и D соответственно, и когда замену S131 и V133 легких цепей выполняли соответственно на K и R или D и E, а также в случае мутации в положении 30, где L145 тяжелой цепи и V133 легкой цепи были заменены K и D соответственно.
Кроме того, было обнаружено, что пара мутаций, в которой S183 тяжелой цепи и V133 легкой цепи соответственно были заменены K (или R) и D (или E) (называемая мутацией в положении 48), также является эффективной (таблица 18 и фиг. 17 (точность спаривания Aa (нижние полоски): 45%, точность спаривания Bb (верхние полоски): 95%).
ТАБЛИЦА 18.
Были сконструированы антитела, предусматривающие комбинацию из вышеупомянутой мутации в положении 29, мутации в положении 30 и мутация в положении 48 (c29c30c48FФ29f30f48) или их вариантов (см. таблицу 19), а затем их тестировали на предмет точности спаривания. Результаты представлены на фиг. 18 (нижние полоски: спаривание Aa; и верхние полоски: спаривание Bb):
ТАБЛИЦА 19.
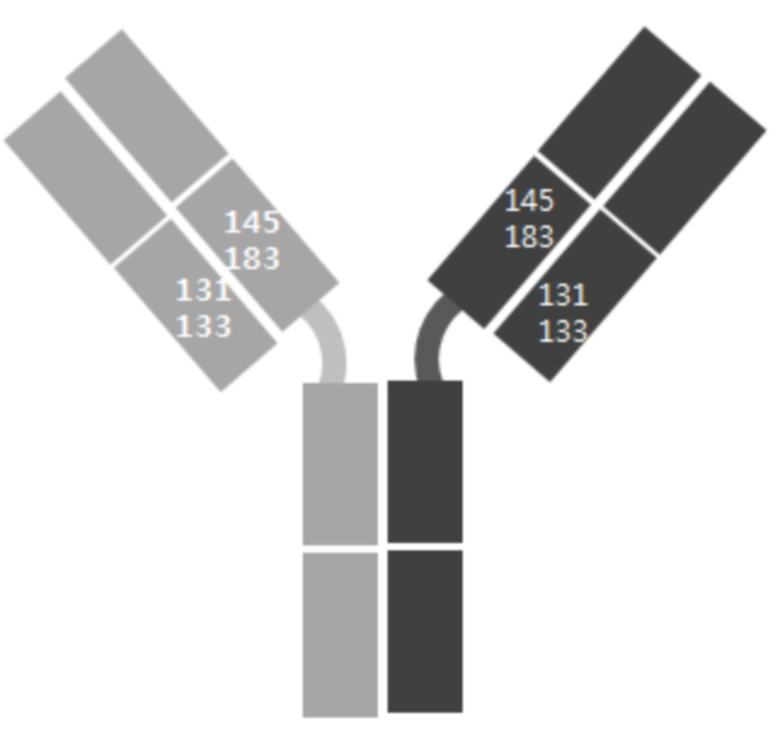
Кроме того, антитела, предусматривающие вариантную пару мутаций по меньшей мере из одной мутации в положении 29, мутации в положении 30 и мутации в положении 48 (см. таблицу 20), исследовали на предмет точности спаривания, и результаты представлены на фиг. 19 (нижние полоски: спаривание Aa; и верхние полоски: спаривание Bb):
ТАБЛИЦА 20.
fR29fRE30
fR29fRE30f48
(a)
(b)
V133D
V133R
V133E
V133R
V133E
(A)
(B)
(Aa: точность спаривания Aa; Bb: точность спаривания Bb)
Кроме того, комбинации из мутации в положении 29, мутации в положении 30 и мутации в положении 48 подвергали обмену между D и E с целью поиска комбинаций, которые обеспечивали относительно точное спаривание (таблица 21 и фиг. 20).
ТАБЛИЦА 21.
(Aa: точность спаривания Aa; Bb: точность спаривания Bb)
Как можно видеть в таблице 21 и на фиг. 20, все тестируемые пары мутаций ab, gh и abgh обеспечивали точность спаривания 65% или выше, или 95% или выше. Из них была выбрана abgh и названа парой мутаций c`29c`30c48Фf`29f`30f`48.
Цепи, в которые были введены комбинации пар мутаций в положении 34 и 51, выбранных из пар мутаций, идентифицированных в таблице 15, тестировали на предмет спаривания, и результаты приведены в таблице 22 и на фиг. 21.
ТАБЛИЦА 22.
Кроме того, мутацию в положении 34 и мутацию в положении 51 из таблицы 15 подвергали изменению с K на R и с D на E, с последующим тестом на предмет спаривания с целью выявления комбинаций с повышенной точностью спаривания. В результате комбинация, при которой каждая из L135 и T180 в легкой цепи была заменена E, была улучшена в отношении точности спаривания и названа парой мутаций c34Фf51 (см. таблицу 23 и фиг. 22).
ТАБЛИЦА 23.
Из различных пар мутаций, которые можно найти в таблице 15, комбинация мутации в положении 40 и мутации в положении 44 была изменена с улучшением точности спаривания.
Кроме того, все пары мутаций подвергали обмену между K и R и между D и E для поиска комбинации, которая обеспечивала наиболее точное спаривание. Комбинация представляла собой пару мутаций, при которой L135 легкой цепи была заменена R и E, и была названа парой мутаций c40Фf44 (см. таблицу 24 и фиг. 23):
ТАБЛИЦА 24.
Пример 5. Образование биспецифического антитела посредством соединения тяжелых цепей и тяжелой цепи и легкой цепи.
5.1. Биспецифическое антитело с введенной в него парой мутаций c`29c`30c48Фf`29f`30f`48
5.1.1. Тест на предмет соединения тяжелой и легкой цепи с применением антитела 4D9/2B9
Антитела были сконструированы путем соединения тяжелых и легких цепей, предусматривающих пару мутаций c`29c`30c48Фf`29f`30f`48 (см. таблицу 25):
ТАБЛИЦА 25.
тяжелой цепи (HC: CH1)
легкой цепи (LC)
С целью изучения точности спаривания среди A-цепи, B-цепи a-цепи и b-цепи в биспецифических антителах, отдельные тяжелые цепи и легкие цепи были коэкспрессированы во всех возможных комбинациях среди них нормальных пар и нетипичных ошибочных пар. Измеренные с помощью SDS-PAGE уровни экспрессии приведены в таблице 26, ниже. Измеряли термоустойчивость (Tm) комбинаций, и результаты приведены в таблице 27 и на фиг. 25:
ТАБЛИЦА 26.
ТАБЛИЦА 27.
Термоустойчивость (Tm) измеряли на основе способа, описанного в примере 2.
Как показано в таблицах 26 и 27 и на фиг. 25, было обнаружено, что биспецифические антитела с введенной в них парой мутаций c`29c`30c48Фf`29f`30f`48 характеризуются более высоким уровнем экспрессии и термоустойчивостью в случае нормального спаривания (Aa/Bb), чем в случае атипичного спаривания (Ab/Ba).
5.1.2. Биспецифическое антитело трастузумаб/бевацизумаб или биспецифическое антитело адалимумаб/бевацизумаб
Были приобретены трастузумаб (Herceptin®; Roche), бевацизумаб (Avastin™; Roche) и адалимумаб (Humira®; AbbVie), и их подвергали определению аминокислотных последовательностей (Корейский институт фундаментальной науки (Korea Basic Science Institute), Корея). Синтезировали кДНК, соответствующие аминокислотным последовательностям, и применяли их для конструирования биспецифических антител, в которые вводили пару мутаций c`29c`30c48Фf`29f`30f`48 и выбранную в примере 3 пару мутаций AWBB CH3-домена в комбинациях, показанных в таблице 28, ниже (с применением вектора pcDNA3 (см. фиг. 26)).
ТАБЛИЦА 28.
Биспецифические антитела Trabev и Adabev подвергали хроматографии с гидрофобным взаимодействием (HIC) со следующими условиями, и результаты представлены на фиг. 27 (ось y: значение (mAU (единица оптической плотности)); и ось x: время (мин)):
Прибор: HPLC-U3000
Колонка: MAbPac Hic-20
Скорость потока: 0,2 мл/мин
Детекция: УФ, 280 нм
Подвижная фаза: 0,10 M ацетат аммония, pH 7,0
В результате прохождения полученного белка через колонку для HIC образовывались соответствующие разным моментам времени пики в зависимости от степени гидрофобности белка, благодаря чему можно было обеспечить точное конструирование биспецифических антител. Как можно видеть на фиг. 27, соответствующие гетеродимеризованным биспецифическим антителам (Trabev и Adabev) пики отчетливо наблюдаются между соответствующими двум разным гомодимерным антителам (трастузумаб и бевацизумаб или адалимумаб и бевацизумаб) пиками, что указывает на надлежащее образование биспецифических антител, каждое из которых состоит из половинок от двух разных антител.
Кроме того, полученные таким образом биспецифические антитела Trabev и Adabev подвергали анализу с использованием эксклюзионной хроматографии (SEC), и результаты приведены в таблице 29 и на фигурах 28 и 29 (ось x: время (мин)):
Прибор: HPLC-U3000
Колонка: TSKgel G3000SWXL для эксклюзионной хроматографии от Tosoh Bioscience
Скорость потока: 1,0 мл/мин
Детекция: УФ, 280 нм
Подвижная фаза: 25 мМ Tris-HCl (pH 8,5), 150 мМ NaCl
ТАБЛИЦА 29.
В SEC-анализе пики детектируют в зависимости от размера белка, и они могут служить объяснением агрегации белка. Как показано в таблице 29 и на фигурах 28 и 29, соответствующие биспецифическим антителам пики находятся между пиками двух соответствующих антител по оси времени, что указывает на надлежащее образование биспецифических антител.
Кроме того, на фиг.30 представлены способы гетеродимеризации биспецифических антител Trabev и Adabev в SDS-PAGE. Как можно видеть на фиг. 30, биспецифические антитела Trabev и Adabev, которые представляют собой гетеродимеры, детектировали в виде единичных полосок промежуточного размера между трастузумабом и бевацизумабом и между адалимумабом и бевацизумабом соответственно. Эти результаты предполагают, что биспецифические антитела не являются гомодимерами, а сконструированы исключительно в результате нормального спаривания.
С помощью ELISA проводили тесты для изучения того, связываются ли BsAb эффективно с соответствующими антигенами (трастузумаб: Her2), бевацизумаб (VEGF) и адалимумаб (TNF-альфа).
Аффинность к антигену измеряли следующим образом:
Реагент
Детекторное антитело: конъюгированное с HRP антитело козы к каппа-цепи иммуноглобулина человека (southern biotech, 2060-05)
Раствор TMB для однократного применения (TMB single solution) (LIFE TECHNOLOGY, 002023)
Прибор
Высокоточный ридер для микропланшетов Emax (Molecular devices)
Протокол
Покрывающий буфер: карбонатный буфер, pH 9,6
Блокирующий буфер: безбелковый блокирующий буфер (TBS) (Thermo scientific)
Промывочный буфер: 0,05% (масса/объем) Tween20 в TBS, pH 7,4 (TBST)
Разбавитель: 0,05% (масса/объем) Tween20 в TBS, pH 7,4
Останавливающий буфер: 1 N раствор соляной кислоты (HCl)
Протокол
Покрытие: разведение антигена в покрывающем буфере, внесение 100 мкл разведения в каждую лунку и инкубирование при 4°C в течение ночи (Her2, VEGF: 50 нг/лунку, TNF-альфа: 100 нг/лунку);
Промывка 3 раза промывочным буфером;
Блокирование: внесение 300 мкл блокирующего буфера, инкубация при комнатной температуре (RT) в течение 1 часа;
Промывка 3 раза промывочным буфером;
Связывание: внесение аликвоты антител в концентрации 100 нг/лунку и инкубация при RT в течение 1 ч;
Промывка 3 раза промывочным буфером;
Детекторное антитело: разведение конъюгированного с HRP антитела козы к каппа-цепи иммуноглобулина человека в TBST при соотношении 1:4000 и инкубация при RT в течение 1 ч;
Промывка 3 раза промывочным буфером
Детекция: внесение 100 мкл раствора TMB на лунку, инкубация при RT в течение 3 мин в темноте;
Останавливающий раствор: внесение 100 мкл 1 N HCl на лунку;
Считывание: считывание оптической плотности на 450 нм
Полученные таким образом результаты приведены в таблице 30 и на фиг. 31 (для Trabev) и в таблице 31 и на фиг. 32 (для Adabev):
ТАБЛИЦА 30.
ТАБЛИЦА 31.
Как показано в таблице 29 и на фиг. 31, было обнаружено, что биспецифическое антитело Trabev связывается как с Her2, так и с VEGF, которые являются антигенами трастузумаба и бевацизумаба соответственно. Также из данных в таблице 30 и на фиг. 32 видно, что биспецифическое антитело Adabev связывается с TNF-альфа и VEGF, которые являются антигенами адалимумаба и бевацизумаба соответственно. Эти результаты являются подтверждением того, что два биспецифических антитела, в обычных условиях проявляющие требуемые функции, были успешно сконструированы.
5.2. Биспецифическое антитело с введенной в него парой мутаций c34Фf51
Согласно примеру 5.1.1, были сконструированы антитела с введенной в их 4D9 (Aa) и 2B9 (Bb) парой мутаций c34Фf51 (см. таблицу 23). В случае каждой тяжелой цепи были коэкспрессированы легкие цепи a и b, и соотношения спаривания между легкой/тяжелой цепью измеряли на SDS-PAGE (проводили для каждой из тяжелых цепей A и B). Tm измеряли как в примере 2, и результаты приведены в таблице 32 ниже и на фиг. 34.
ТАБЛИЦА 32.
(L135K/T180K)
(L135E/T180E)
(L135E/T180E)
(L135K/T180K)
(q: соотношение спаривания легкая цепь/тяжелая цепь (%); N/A: нет данных)
Как показано в таблице 32 и на фиг. 34, нормальные пары тяжелая цепь/легкая цепь (Aa и Bb) образовывались при соотношении вплоть до 90% и 89% соответственно и характеризовались высокой термоустойчивостью.
Кроме того, были сконструированы биспецифические антитела Trabev (Aa: трастузумаб; Bb: бевацизумаб) и Adabev (Aa: адалимумаб; Bb: бевацизумаб), в каждое из которых вводили пару мутаций c34Фf51 и выбранную в примере 3 пару мутаций AWBB (Aa: S364K/K409W; Bb: K370S/F405R) CH3-домена, с применением трастузумаба (Herceptin®; Roche), бевацизумаба (Avastin™; Roche) и адалимумаба (Humira®; AbbVie) способом, аналогичным процедуре конструирования биспецифических антител примера 5.1.2.
Сконструированные биспецифические антитела Trabev и Adabev, каждое из которых имеет введенные в него пару мутаций c34Фf51 и пару мутаций AWBB, анализировали с применением хроматографии с гидрофобным взаимодействием (HIC) согласно способу примера 5.1.2.
Полученные в результате данные анализа приведены в таблице 33 и на фиг. 35 (для Trabev) и в таблице 34 и на фиг. 36 (для Adabev).
ТАБЛИЦА 33.
ТАБЛИЦА 34.
Как можно видеть в таблице 33 и на фиг. 35 и в таблице 34 и на фиг. 36, соответствующий каждому из гетеродимерных биспецифических антител (Trabev и Adabev) пик отчетливо наблюдается между пиками двух соответствующих моноспецифических антител (трастузумаб и бевацизумаб или адалимумаб и бевацизумаб). Эти результаты предполагают надлежащее образование биспецифических антител с введенными в них парой мутаций c34Фf51 и парой мутаций AWBB, каждое из которых состоит из половинок от двух разных антител.
Кроме того, на фиг.37 (6% гель для SDS-PAGE, невосстанавливающие условия) представлены способы гетеродимеризации биспецифических антител с введенными в них парой мутаций c34Фf51 и парой мутаций AWBB. Как можно видеть на фиг. 37, было обнаружено, что с помощью введения одновременно пары мутаций c34Фf51 и пары мутаций AWBB в уже известные антитела были сконструированы чистые гетеродимеры, как проанализировано с помощью SDS-PAGE.
5.3. Биспецифическое антитело с введенной в него парой мутаций c40Фf44
Согласно примеру 5.1.1, были сконструированы антитела с введенной в их 4D9 (Aa) и 2B9 (Bb) парой мутаций c40Фf44 (см. таблицу 24). В случае каждой тяжелой цепи были коэкспрессированы легкие цепи a и b, и соотношения спаривания между легкой/тяжелой цепью измеряли на SDS-PAGE (проводили для каждой из тяжелых цепей A и B). Tm измеряли как в примере 2, и результаты приведены в таблице 35 ниже и на фиг. 38.
ТАБЛИЦА 35.
(L135R/S162K)
(L135E/S162D)
(L135E/S162D)
(L135R/S162K)
(q: соотношение спаривания легкая цепь/тяжелая цепь (%); N/A: нет данных)
Как показано в таблице 35 и на фиг. 38, нормальные пары тяжелая цепь/легкая цепь (Aa и Bb) обе образовывались при соотношении вплоть до 99% и характеризовались высокой термоустойчивостью.
Кроме того, были сконструированы биспецифические антитела Trabev (Aa: трастузумаб; Bb: бевацизумаб) и Adabev (Aa: адалимумаб; Bb: бевацизумаб), в каждое из которых вводили пару мутаций c40Фf44 и пару мутаций AWBB (A: S364K/K409W; B: K370S/F405R), с применением трастузумаба (Herceptin®; Roche), бевацизумаба (Avastin™; Roche) и адалимумаба (Humira®; AbbVie) способом, аналогичным процедуре конструирования биспецифических антител примера 5.1.2.
Сконструированные биспецифические антитела Trabev и Adabev, каждое из которых имеет введенные в него пару мутаций c40Фf44 и пару мутаций AWBB, анализировали с применением хроматографии с гидрофобным взаимодействием (HIC) согласно способу примера 5.1.2.
Полученные в результате данные анализа приведены в таблице 36 и на фиг. 39 (для Trabev) и в таблице 37 и на фиг. 40 (для Adabev).
ТАБЛИЦА 36.
ТАБЛИЦА 37.
Как можно видеть в таблице 36 и на фиг. 39 и в таблице 37 и на фиг. 40, соответствующий каждому из гетеродимерных биспецифических антител (Trabev и Adabev) пик отчетливо наблюдается между пиками двух соответствующих моноспецифических антител (трастузумаб и бевацизумаб или адалимумаб и бевацизумаб). Эти результаты предполагают надлежащее образование биспецифических антител с введенными в них парой мутаций c40Фf44 и парой мутаций AWBB, каждое из которых состоит из половинок от двух разных антител. Кроме того, только один пик, отчетливо наблюдаемый между пиками двух моноспецифических антител, указывает на то, что только один вид нормального спаривания происходил без ошибочных пар между двумя тяжелыми цепями и между тяжелыми и легкими цепями.
Кроме того, на фиг.41 (6% гель для SDS-PAGE, невосстанавливающие условия) представлены способы гетеродимеризации биспецифических антител с введенными в них парой мутаций c40Фf44 и парой мутаций AWBB. Как можно видеть на фиг. 41, было обнаружено, что с помощью введения одновременно пары мутаций c40Фf44 и пары мутаций AWBB в уже известные антитела были сконструированы чистые гетеродимеры, как проанализировано с помощью SDS-PAGE.
Сравнительный пример 1
Степень гетеродимеризации исследовали для случаев, когда вводили предложенные в настоящем документе мутации CH3-домена, которые отличались от предложенных в примерах 1-3 мутаций, хотя касались идентичных пар аминокислот.
Для сравнения, слитый белок TNFRSF1B-Fc (энбрел (Enbrel); Enb) и слитый белок Fas-Fc (Fas), в которые вводили мутации из таблицы 38, были сконструированы согласно примеру 1 (представлены как BEAT-A и BEAT-B).
ТАБЛИЦА 38.
(S364K/K409W)
(K370S/F405R)
Получали слитый белок TNFRSF1B-Fc (A-цепь) и слитый белок Fas-Fc с мутациями в CH3-домене, выбранными в примере 3, которые являются репрезентативными мутациями CH3-домена, предложенными в настоящем описании (например, A-цепь с введенной в нее S364K и K409W и B-цепь с введенной в нее K370S и F405R) (представлено как AW/BB в таблице 38).
В случае, если Enb-Fc и Fas-Fc, которые предусматривали перечисленные в таблице 38 пары мутаций, подвергали одной трансфекции, способы гомодимеризации наблюдали на SDS-PAGE. Результаты приведены на фиг. 42.
Как можно видеть на фиг. 42, AW/BB обеспечивала высокие процентные показатели мономеров, тогда как при BEAT-A и BEAT-B были выявлены более высокие процентные показатели гомодимеров, чем мономеров. Исходя из результата, при BEAT-A и BEAT-B с большей вероятностью образуются гомодимеры, чем при AW/BB, когда существует различие в уровне экспрессии между A-цепью и B-цепью. Если при объединении тяжелых и легких цепей для конструирования биспецифических антител образуется большое количество гомодимеров, правильный гетеродимер сложно отделить от гомодимеров, поскольку между гетеродимером и гомодимерами почти не существует различий по физическим свойствам. Соответственно, сведение к минимуму гомодимеризации является очень важным для конструирования биспецифического антитела высокой чистоты. Комбинация мутаций, которая обеспечивает как можно меньшую степень гомодимеризации, является преимущественной для конструирования биспецифических антител.
В совокупности из данных видно, что BEAT-A и BEAT-B обладают низким потенциалом в отношении гетеродимеризации ввиду высоких степеней гомодимеризации по сравнению с AW/BB, и затрудняют выделение правильных гетеродимеров.
--->
<110> Ibentrus, Inc.
<120> Биспецифический белок и способы его получения
<130> OPP20173983KR
<150> KR10-2016-0091157
<151> 2016-07-19
<150> KR10-10-2017-0091210
<151> 2017-07-18
<160> 54
<170> KopatentIn 2.0
<210> 1
<211> 108
<212> PRT
<213> Homo sapiens CH1-домен IgG1 человека
<400> 1
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
100 105
<210> 2
<211> 105
<212> PRT
<213> Homo sapiens CH1-домен IgG2 человека
<400> 2
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu
100 105
<210> 3
<211> 110
<212> PRT
<213> Homo sapiens CH1-домен IgG3 человека
<400> 3
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Leu Lys Thr Pro Leu Gly Asp Thr Thr His Thr
100 105 110
<210> 4
<211> 110
<212> PRT
<213> Homo sapiens CH1-домен IgG4 человека
<400> 4
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Ser Pro Asn Met Val Pro His Ala His His Ala Gln
100 105 110
<210> 5
<211> 108
<212> PRT
<213> Homo sapiens CH1-домен IgA1 человека
<400> 5
Ala Ser Pro Thr Ser Pro Lys Val Phe Pro Leu Ser Leu Cys Ser Thr
1 5 10 15
Gln Pro Asp Gly Asn Val Val Ile Ala Cys Leu Val Gln Gly Phe Phe
20 25 30
Pro Gln Glu Pro Leu Ser Val Thr Trp Ser Glu Ser Gly Gln Gly Val
35 40 45
Thr Ala Arg Asn Phe Pro Pro Ser Gln Asp Ala Ser Gly Asp Leu Tyr
50 55 60
Thr Thr Ser Ser Gln Leu Thr Leu Pro Ala Thr Gln Cys Leu Ala Gly
65 70 75 80
Lys Ser Val Thr Cys His Val Lys His Tyr Thr Asn Pro Ser Gln Asp
85 90 95
Val Thr Val Pro Cys Pro Val Pro Ser Thr Pro Pro
100 105
<210> 6
<211> 108
<212> PRT
<213> Homo sapiens CH1-домен IgA2 человека
<400> 6
Ala Ser Pro Thr Ser Pro Lys Val Phe Pro Leu Ser Leu Asp Ser Thr
1 5 10 15
Pro Gln Asp Gly Asn Val Val Val Ala Cys Leu Val Gln Gly Phe Phe
20 25 30
Pro Gln Glu Pro Leu Ser Val Thr Trp Ser Glu Ser Gly Gln Asn Val
35 40 45
Thr Ala Arg Asn Phe Pro Pro Ser Gln Asp Ala Ser Gly Asp Leu Tyr
50 55 60
Thr Thr Ser Ser Gln Leu Thr Leu Pro Ala Thr Gln Cys Pro Asp Gly
65 70 75 80
Lys Ser Val Thr Cys His Val Lys His Tyr Thr Asn Pro Ser Gln Asp
85 90 95
Val Thr Val Pro Cys Pro Val Pro Pro Pro Pro Pro
100 105
<210> 7
<211> 110
<212> PRT
<213> Homo sapiens CH1-домен IgD человека
<400> 7
Ala Pro Thr Lys Ala Pro Asp Val Phe Pro Ile Ile Ser Gly Cys Arg
1 5 10 15
His Pro Lys Asp Asn Ser Pro Val Val Leu Ala Cys Leu Ile Thr Gly
20 25 30
Tyr His Pro Thr Ser Val Thr Val Thr Trp Tyr Met Gly Thr Gln Ser
35 40 45
Gln Pro Gln Arg Thr Phe Pro Glu Ile Gln Arg Arg Asp Ser Tyr Tyr
50 55 60
Met Thr Ser Ser Gln Leu Ser Thr Pro Leu Gln Gln Trp Arg Gln Gly
65 70 75 80
Glu Tyr Lys Cys Val Val Gln His Thr Ala Ser Lys Ser Lys Lys Glu
85 90 95
Ile Phe Arg Trp Pro Glu Ser Pro Lys Ala Gln Ala Ser Ser
100 105 110
<210> 8
<211> 110
<212> PRT
<213> Homo sapiens CH1-домен IgE человека
<400> 8
Ala Ser Thr Gln Ser Pro Ser Val Phe Pro Leu Thr Arg Cys Cys Lys
1 5 10 15
Asn Ile Pro Ser Asn Ala Thr Ser Val Thr Leu Gly Cys Leu Ala Thr
20 25 30
Gly Tyr Phe Pro Glu Pro Val Met Val Thr Cys Asp Thr Gly Ser Leu
35 40 45
Asn Gly Thr Thr Met Thr Leu Pro Ala Thr Thr Leu Thr Leu Ser Gly
50 55 60
His Tyr Ala Thr Ile Ser Leu Leu Thr Val Ser Gly Ala Trp Ala Lys
65 70 75 80
Gln Met Phe Thr Cys Arg Val Ala His Thr Pro Ser Ser Thr Asp Trp
85 90 95
Val Asp Asn Lys Thr Phe Ser Val Cys Ser Arg Asp Phe Thr
100 105 110
<210> 9
<211> 110
<212> PRT
<213> Homo sapiens CH1-домен IgM человека
<400> 9
Gly Ser Ala Ser Ala Pro Thr Leu Phe Pro Leu Val Ser Cys Glu Asn
1 5 10 15
Ser Pro Ser Asp Thr Ser Ser Val Ala Val Gly Cys Leu Ala Gln Asp
20 25 30
Phe Leu Pro Asp Ser Ile Thr Leu Ser Trp Lys Tyr Lys Asn Asn Ser
35 40 45
Asp Ile Ser Ser Thr Arg Gly Phe Pro Ser Val Leu Arg Gly Gly Lys
50 55 60
Tyr Ala Ala Thr Ser Gln Val Leu Leu Pro Ser Lys Asp Val Met Gln
65 70 75 80
Gly Thr Asp Glu His Val Val Cys Lys Val Gln His Pro Asn Gly Asn
85 90 95
Lys Glu Lys Asn Val Pro Leu Pro Val Ile Ala Glu Leu Pro
100 105 110
<210> 10
<211> 105
<212> PRT
<213> Homo sapiens CL-домен каппа-цепи человека
<400> 10
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
1 5 10 15
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
20 25 30
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
35 40 45
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
50 55 60
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
65 70 75 80
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
85 90 95
Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 11
<211> 103
<212> PRT
<213> Homo sapiens CL-домен лямбда-цепи 1 человека
<400> 11
Lys Ala Asn Pro Thr Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu
1 5 10 15
Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro
20 25 30
Gly Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro Val Lys Ala
35 40 45
Gly Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala
50 55 60
Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg
65 70 75 80
Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr
85 90 95
Val Ala Pro Thr Glu Cys Ser
100
<210> 12
<211> 103
<212> PRT
<213> Homo sapiens CL-домен лямбда-цепи 2 человека
<400> 12
Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu
1 5 10 15
Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro
20 25 30
Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala
35 40 45
Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala
50 55 60
Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg
65 70 75 80
Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr
85 90 95
Val Ala Pro Thr Glu Cys Ser
100
<210> 13
<211> 103
<212> PRT
<213> Homo sapiens CL-домен лямбда-цепи 3 человека
<400> 13
Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu
1 5 10 15
Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro
20 25 30
Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala
35 40 45
Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala
50 55 60
Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Lys
65 70 75 80
Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr
85 90 95
Val Ala Pro Thr Glu Cys Ser
100
<210> 14
<211> 103
<212> PRT
<213> Homo sapiens CL-домен лямбда-цепи 7 человека
<400> 14
Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu
1 5 10 15
Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Val Ser Asp Phe Tyr Pro
20 25 30
Gly Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro Val Lys Val
35 40 45
Gly Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala
50 55 60
Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg
65 70 75 80
Ser Tyr Ser Cys Arg Val Thr His Glu Gly Ser Thr Val Glu Lys Thr
85 90 95
Val Ala Pro Thr Glu Cys Ser
100
<210> 15
<211> 108
<212> PRT
<213> Homo sapiens CH3-домен IgG1 человека
<400> 15
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
1 5 10 15
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
20 25 30
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
35 40 45
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
50 55 60
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
65 70 75 80
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
85 90 95
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
100 105
<210> 16
<211> 108
<212> PRT
<213> Homo sapiens CH3-домен IgG2 человека
<400> 16
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
1 5 10 15
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
20 25 30
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
35 40 45
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser
50 55 60
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
65 70 75 80
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
85 90 95
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
100 105
<210> 17
<211> 108
<212> PRT
<213> Homo sapiens CH3-домен IgG3 человека
<400> 17
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
1 5 10 15
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
20 25 30
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly Gln Pro
35 40 45
Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser
50 55 60
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
65 70 75 80
Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn Arg
85 90 95
Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
100 105
<210> 18
<211> 108
<212> PRT
<213> Homo sapiens CH3-домен IgG4 человека
<400> 18
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
1 5 10 15
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
20 25 30
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
35 40 45
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
50 55 60
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
65 70 75 80
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
85 90 95
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
100 105
<210> 19
<211> 120
<212> PRT
<213> Homo sapiens CH3-домен IgA1 человека
<400> 19
Gly Asn Thr Phe Arg Pro Glu Val His Leu Leu Pro Pro Pro Ser Glu
1 5 10 15
Glu Leu Ala Leu Asn Glu Leu Val Thr Leu Thr Cys Leu Ala Arg Gly
20 25 30
Phe Ser Pro Lys Asp Val Leu Val Arg Trp Leu Gln Gly Ser Gln Glu
35 40 45
Leu Pro Arg Glu Lys Tyr Leu Thr Trp Ala Ser Arg Gln Glu Pro Ser
50 55 60
Gln Gly Thr Thr Thr Phe Ala Val Thr Ser Ile Leu Arg Val Ala Ala
65 70 75 80
Glu Asp Trp Lys Lys Gly Asp Thr Phe Ser Cys Met Val Gly His Glu
85 90 95
Ala Leu Pro Leu Ala Phe Thr Gln Lys Thr Ile Asp Arg Leu Ala Gly
100 105 110
Lys Pro Thr His Val Asn Val Ser
115 120
<210> 20
<211> 120
<212> PRT
<213> Homo sapiens CH3-домен IgA2 человека
<400> 20
Gly Asn Thr Phe Arg Pro Glu Val His Leu Leu Pro Pro Pro Ser Glu
1 5 10 15
Glu Leu Ala Leu Asn Glu Leu Val Thr Leu Thr Cys Leu Ala Arg Gly
20 25 30
Phe Ser Pro Lys Asp Val Leu Val Arg Trp Leu Gln Gly Ser Gln Glu
35 40 45
Leu Pro Gln Glu Pro Ser Gln Gly Thr Thr Thr Phe Ala Val Thr Ser
50 55 60
Ile Leu Arg Val Ala Ala Glu Asp Trp Lys Lys Gly Asp Thr Phe Ser
65 70 75 80
Cys Met Val Gly His Glu Ala Leu Pro Leu Ala Phe Thr Gln Lys Thr
85 90 95
Ile Asp Arg Leu Ala Phe Thr Gln Lys Thr Ile Asp Arg Leu Ala Gly
100 105 110
Lys Pro Thr His Val Asn Val Ser
115 120
<210> 21
<211> 119
<212> PRT
<213> Homo sapiens CH3-домен IgD человека
<400> 21
Ala Ala Gln Ala Pro Val Lys Leu Ser Leu Asn Leu Leu Ala Ser Ser
1 5 10 15
Asp Pro Pro Glu Ala Ala Ser Trp Leu Leu Cys Glu Val Ser Gly Phe
20 25 30
Ser Pro Pro Asn Ile Leu Leu Met Trp Leu Glu Asp Gln Arg Glu Val
35 40 45
Asn Thr Ser Gly Phe Ala Pro Ala Arg Pro Pro Pro Gln Pro Arg Ser
50 55 60
Thr Thr Phe Trp Ala Trp Ser Val Leu Arg Val Pro Ala Pro Pro Ser
65 70 75 80
Pro Gln Pro Ala Thr Tyr Thr Cys Val Val Ser His Glu Asp Ser Arg
85 90 95
Thr Leu Leu Asn Ala Ser Arg Ser Leu Glu Val Ser Tyr Val Thr Asp
100 105 110
His Gly Pro Met Lys Val Lys
115
<210> 22
<211> 120
<212> PRT
<213> Homo sapiens CH4-домен IgE человека
<400> 22
Ala Ala Pro Glu Val Tyr Ala Phe Ala Thr Pro Glu Trp Pro Gly Ser
1 5 10 15
Arg Asp Lys Arg Thr Leu Ala Cys Leu Ile Gln Asn Phe Met Pro Glu
20 25 30
Asp Ile Ser Val Gln Trp Leu His Asn Glu Val Gln Leu Pro Asp Ala
35 40 45
Arg His Ser Thr Thr Gln Pro Arg Lys Thr Lys Gly Ser Gly Phe Phe
50 55 60
Val Phe Ser Arg Leu Glu Val Thr Arg Ala Glu Trp Glu Gln Lys Asp
65 70 75 80
Glu Phe Ile Cys Arg Ala Val His Glu Ala Ala Ser Pro Ser Gln Thr
85 90 95
Val Gln Arg Ala Val Ser Val Asn Pro Gly Lys Glu Leu Asp Val Cys
100 105 110
Val Glu Glu Ala Glu Gly Glu Ala
115 120
<210> 23
<211> 120
<212> PRT
<213> Homo sapiens CH3-домен IgM человека
<400> 23
Lys Gly Val Ala Leu His Arg Pro Asp Val Tyr Leu Leu Pro Pro Ala
1 5 10 15
Arg Glu Gln Leu Asn Leu Arg Glu Ser Ala Thr Ile Thr Cys Leu Val
20 25 30
Thr Gly Phe Ser Pro Ala Asp Val Phe Val Gln Trp Met Gln Arg Gly
35 40 45
Gln Pro Leu Ser Pro Glu Lys Tyr Val Thr Ser Ala Pro Met Pro Glu
50 55 60
Pro Gln Ala Pro Gly Arg Tyr Phe Ala His Ser Ile Leu Thr Val Ser
65 70 75 80
Glu Glu Glu Trp Asn Thr Gly Glu Thr Tyr Thr Cys Val Ala His Glu
85 90 95
Ala Leu Pro Asn Arg Val Thr Glu Arg Thr Val Asp Lys Ser Thr Gly
100 105 110
Lys Pro Thr Leu Tyr Asn Val Ser
115 120
<210> 24
<211> 1386
<212> DNA
<213> Искусственная последовательность
<220>
<223> CDS TNFRSF1B (энбрел: NM_001066), где область 1-771
кодирует эктодомен
<400> 24
atggcgcccg tcgccgtctg ggccgcgctg gccgtcggac tggagctctg ggctgcggcg 60
cacgccttgc ccgcccaggt ggcatttaca ccctacgccc cggagcccgg gagcacatgc 120
cggctcagag aatactatga ccagacagct cagatgtgct gcagcaaatg ctcgccgggc 180
caacatgcaa aagtcttctg taccaagacc tcggacaccg tgtgtgactc ctgtgaggac 240
agcacataca cccagctctg gaactgggtt cccgagtgct tgagctgtgg ctcccgctgt 300
agctctgacc aggtggaaac tcaagcctgc actcgggaac agaaccgcat ctgcacctgc 360
aggcccggct ggtactgcgc gctgagcaag caggaggggt gccggctgtg cgcgccgctg 420
cgcaagtgcc gcccgggctt cggcgtggcc agaccaggaa ctgaaacatc agacgtggtg 480
tgcaagccct gtgccccggg gacgttctcc aacacgactt catccacgga tatttgcagg 540
ccccaccaga tctgtaacgt ggtggccatc cctgggaatg caagcatgga tgcagtctgc 600
acgtccacgt cccccacccg gagtatggcc ccaggggcag tacacttacc ccagccagtg 660
tccacacgat cccaacacac gcagccaact ccagaaccca gcactgctcc aagcacctcc 720
ttcctgctcc caatgggccc cagcccccca gctgaaggga gcactggcga cttcgctctt 780
ccagttggac tgattgtggg tgtgacagcc ttgggtctac taataatagg agtggtgaac 840
tgtgtcatca tgacccaggt gaaaaagaag cccttgtgcc tgcagagaga agccaaggtg 900
cctcacttgc ctgccgataa ggcccggggt acacagggcc ccgagcagca gcacctgctg 960
atcacagcgc cgagctccag cagcagctcc ctggagagct cggccagtgc gttggacaga 1020
agggcgccca ctcggaacca gccacaggca ccaggcgtgg aggccagtgg ggccggggag 1080
gcccgggcca gcaccgggag ctcagattct tcccctggtg gccatgggac ccaggtcaat 1140
gtcacctgca tcgtgaacgt ctgtagcagc tctgaccaca gctcacagtg ctcctcccaa 1200
gccagctcca caatgggaga cacagattcc agcccctcgg agtccccgaa ggacgagcag 1260
gtccccttct ccaaggagga atgtgccttt cggtcacagc tggagacgcc agagaccctg 1320
ctggggagca ccgaagagaa gcccctgccc cttggagtgc ctgatgctgg gatgaagccc 1380
agttaa 1386
<210> 25
<211> 1008
<212> DNA
<213> Искусственная последовательность
<220>
<223> CDS Fas-рецептора (NM_000043), где область 1-519 кодирует
эктодомен
<400> 25
atgctgggca tctggaccct cctacctctg gttcttacgt ctgttgctag attatcgtcc 60
aaaagtgtta atgcccaagt gactgacatc aactccaagg gattggaatt gaggaagact 120
gttactacag ttgagactca gaacttggaa ggcctgcatc atgatggcca attctgccat 180
aagccctgtc ctccaggtga aaggaaagct agggactgca cagtcaatgg ggatgaacca 240
gactgcgtgc cctgccaaga agggaaggag tacacagaca aagcccattt ttcttccaaa 300
tgcagaagat gtagattgtg tgatgaagga catggcttag aagtggaaat aaactgcacc 360
cggacccaga ataccaagtg cagatgtaaa ccaaactttt tttgtaactc tactgtatgt 420
gaacactgtg acccttgcac caaatgtgaa catggaatca tcaaggaatg cacactcacc 480
agcaacacca agtgcaaaga ggaaggatcc agatctaact tggggtggct ttgtcttctt 540
cttttgccaa ttccactaat tgtttgggtg aagagaaagg aagtacagaa aacatgcaga 600
aagcacagaa aggaaaacca aggttctcat gaatctccaa ctttaaatcc tgaaacagtg 660
gcaataaatt tatctgatgt tgacttgagt aaatatatca ccactattgc tggagtcatg 720
acactaagtc aagttaaagg ctttgttcga aagaatggtg tcaatgaagc caaaatagat 780
gagatcaaga atgacaatgt ccaagacaca gcagaacaga aagttcaact gcttcgtaat 840
tggcatcaac ttcatggaaa gaaagaagcg tatgacacat tgattaaaga tctcaaaaaa 900
gccaatcttt gtactcttgc agagaaaatt cagactatca tcctcaagga cattactagt 960
gactcagaaa attcaaactt cagaaatgaa atccaaagct tggtctag 1008
<210> 26
<211> 684
<212> DNA
<213> Искусственная последовательность
<220>
<223> CDS Fc человека (из иммуноглобулина G человека)
<400> 26
gacaaaactc acacatgccc accgtgccca gcacctgaac tcctgggggg accgtcagtc 60
ttcctcttcc ccccaaaacc caaggacacc ctcatgatct cccggacccc tgaggtcaca 120
tgcgtggtgg tggacgtgag ccacgaagac cctgaggtca agttcaactg gtacgtggac 180
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagtacaa cagcacgtac 240
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaatggcaa ggagtacaag 300
tgcaaggtct ccaacaaagc cctcccagcc cccatcgaga aaaccatctc caaagccaaa 360
gggcagcccc gagaaccaca ggtgtacacc ctgcccccat cccgggagga gatgaccaag 420
aaccaggtca gcctgacctg cctggtcaaa ggcttctatc ccagcgacat cgccgtggag 480
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 540
gacggctcct tcttcctcta cagcaagctc accgtggaca agagcaggtg gcagcagggg 600
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac gcagaagagc 660
ctctccctgt ctccgggtaa atga 684
<210> 27
<211> 127
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи антитела к вирусу гриппа типа B, 2B9
<400> 27
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Lys
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Thr Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Leu Asn Trp Lys Gly Asn Ser Val Asp Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Met Ser Arg Asp Asn Ala Lys Lys Leu Val Tyr
65 70 75 80
Leu Gln Met Asn Gly Leu Arg Gly Asp Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Lys Asp Asn Lys Ala Asp Ala Ser Met Asp Tyr Tyr Tyr His His
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 28
<211> 381
<212> DNA
<213> Искусственная последовательность
<220>
<223> Последовательность нуклеиновой кислоты, кодирующая вариабельную область тяжелой цепи
2B9
<400> 28
gaagtgcagc tggtggagtc tgggggaggc ttggtacagc ctggcaagtc cctgagactc 60
tcctgtgcag ccactggatt cacatttgac gattacgcca tgcactgggt ccgccaagct 120
ccagggaagg gcctggagtg ggtctcaagt cttaattgga agggaaatag tgtagactac 180
gcggactctg tgaggggccg attcaccatg tccagagaca acgccaagaa actagtgtat 240
ctgcaaatga acggtctgag aggtgacgac acggccgtct atttttgtgc aaaagataat 300
aaagcggatg catctatgga ctactactac caccacggta tggacgtctg gggccaaggg 360
accacggtca ccgtctcctc g 381
<210> 29
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи антитела к вирусу гриппа типа A, 4D9
<400> 29
Gln Val Thr Leu Arg Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Ile Ser Gly Ala Ser Ile Asn Thr Asp
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Tyr Tyr Arg Gly Arg Thr Asn Tyr Asn Pro Ser Leu Arg
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Gln Met Thr Ser Met Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Asp Val Thr Gly Ile Ser Arg Glu Asn Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 30
<211> 363
<212> DNA
<213> Искусственная последовательность
<220>
<223> Последовательность нуклеиновой кислоты, кодирующая вариабельную область тяжелой цепи
антитела к вирусу гриппа типа A, 4D9
<400> 30
caggtcacct tgagggagtc gggcccagga ctggtgaagc cttcggagac cctgtccctc 60
acctgcacta tctccggtgc ctccatcaat actgactact ggagctggat ccggcagccc 120
ccagggaagg gactggagtg gattggctat atctattaca gagggcgcac caactacaac 180
ccctccctca ggagccgagt caccatatca gtagacacgt ccaagaatca attctccctg 240
cagatgacgt ctatgaccgc tgctgacacg gccgtatatt actgtgcgag agatgtgact 300
ggcatcagtc gagaaaatgc ttttgatatc tggggccaag gcaccctggt caccgtctcc 360
tcg 363
<210> 31
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Общая легкая цепь для 4D9 и 2B9
<400> 31
Ala Ile Arg Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Gly Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Ile Pro Thr
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 32
<211> 321
<212> DNA
<213> Искусственная последовательность
<220>
<223> Последовательность нуклеиновой кислоты, кодирующая общую легкую цепь для 4D9 и 2B9
<400> 32
gccatccgga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggcaagtca gagcattagc ggctatttaa attggtatca gcagaaacca 120
gggaaagccc ctaagctctt gatctatgct gcatccagtt tgcagagtgg ggtcccatca 180
aggttcagtg gcagtggatc tgggacagat ttcactctca ccatcagcag tctgcaacct 240
gaagattttg caacttacta ctgtcaacag agctacagta tccccaccac cttcggccaa 300
gggacacgac tggagattaa a 321
<210> 33
<211> 330
<212> PRT
<213> Искусственная последовательность
<220>
<223> Константная область тяжелой цепи IgG1 человека
<400> 33
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 34
<211> 335
<212> PRT
<213> Искусственная последовательность
<220>
<223> Константная область тяжелой цепи IgA1 человека
<400> 34
Ala Ser Pro Thr Ser Pro Lys Val Phe Pro Leu Ser Leu Cys Ser Thr
1 5 10 15
Gln Pro Asp Gly Asn Val Val Ile Ala Cys Leu Val Gln Gly Phe Phe
20 25 30
Pro Gln Glu Pro Leu Ser Val Thr Trp Ser Glu Ser Gly Gln Gly Val
35 40 45
Thr Ala Arg Asn Phe Pro Pro Ser Gln Asp Ala Ser Gly Asp Leu Tyr
50 55 60
Thr Thr Ser Ser Gln Leu Thr Leu Pro Ala Thr Gln Cys Leu Ala Gly
65 70 75 80
Lys Ser Val Thr Cys His Val Lys His Tyr Thr Asn Pro Ser Gln Asp
85 90 95
Val Thr Val Pro Cys Pro Val Pro Ser Thr Pro Pro Thr Pro Ser Pro
100 105 110
Ser Thr Pro Pro Thr Pro Ser Pro Ser Cys Cys His Pro Arg Leu Ser
115 120 125
Leu His Arg Pro Ala Leu Glu Asp Leu Leu Leu Gly Ser Glu Ala Asn
130 135 140
Leu Thr Cys Thr Leu Thr Gly Leu Arg Asp Ala Ser Gly Val Thr Phe
145 150 155 160
Thr Trp Thr Pro Ser Ser Gly Lys Ser Ala Val Gln Gly Pro Pro Glu
165 170 175
Arg Asp Leu Cys Gly Cys Tyr Ser Val Ser Ser Val Leu Pro Gly Cys
180 185 190
Ala Glu Pro Trp Asn His Gly Lys Thr Phe Thr Cys Thr Ala Ala Tyr
195 200 205
Pro Glu Ser Lys Thr Pro Leu Thr Ala Thr Leu Ser Lys Ser Gly Asn
210 215 220
Thr Phe Arg Pro Glu Val His Leu Leu Pro Pro Pro Ser Glu Glu Leu
225 230 235 240
Ala Leu Asn Glu Leu Val Thr Leu Thr Cys Leu Ala Arg Gly Phe Ser
245 250 255
Pro Lys Asp Val Leu Val Arg Trp Leu Gln Gly Ser Gln Glu Leu Pro
260 265 270
Arg Glu Lys Tyr Leu Thr Trp Ala Ser Arg Gln Glu Pro Ser Gln Gly
275 280 285
Thr Thr Thr Phe Ala Val Thr Ser Ile Leu Arg Val Ala Ala Glu Asp
290 295 300
Trp Lys Lys Gly Asp Thr Phe Ser Cys Met Val Gly His Glu Ala Leu
305 310 315 320
Pro Leu Ala Phe Thr Gln Lys Thr Ile Asp Arg Leu Ala Gly Lys
325 330 335
<210> 35
<211> 228
<212> PRT
<213> Искусственная последовательность
<220>
<223> Легкая цепь (каппа) иммуноглобулина человека
<400> 35
Val Leu Met Leu Leu Leu Leu Trp Val Ser Gly Thr Cys Gly Asp Ile
1 5 10 15
Leu Leu Thr Gln Ser Pro Ala Ile Leu Ser Val Ser Pro Gly Glu Arg
20 25 30
Val Ser Phe Ser Cys Arg Ala Ser Gln Phe Val Gly Ser Ser Ile His
35 40 45
Trp Tyr Gln Gln Arg Thr Asn Gly Ser Pro Arg Leu Leu Ile Lys Tyr
50 55 60
Ala Ser Glu Ser Met Ser Gly Ile Pro Ser Arg Phe Ser Gly Ser Gly
65 70 75 80
Ser Gly Thr Asp Phe Thr Leu Ser Ile Asn Thr Val Glu Ser Glu Asp
85 90 95
Ile Ala Asp Tyr Tyr Cys Gln Gln Ser His Ser Trp Pro Phe Thr Phe
100 105 110
Gly Ser Gly Thr Asn Leu Glu Val Lys Arg Thr Val Ala Ala Pro Ser
115 120 125
Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala
130 135 140
Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val
145 150 155 160
Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser
165 170 175
Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr
180 185 190
Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys
195 200 205
Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn
210 215 220
Arg Gly Glu Cys
225
<210> 36
<211> 226
<212> PRT
<213> Искусственная последовательность
<220>
<223> Легкая цепь (лямбда) иммуноглобулина человека
<400> 36
Leu Phe Leu Gly Val Leu Ala Tyr Cys Thr Gly Ser Val Ala Ser Tyr
1 5 10 15
Glu Leu Thr Gln Pro Pro Leu Val Ser Val Ser Pro Gly Gln Thr Ala
20 25 30
Ser Ile Thr Cys Ser Gly Asp Lys Leu Gly Asp Asn Tyr Ala Cys Trp
35 40 45
Tyr Gln Leu Lys Pro Gly Gln Ser Pro Val Leu Val Ile Tyr Gln Asp
50 55 60
Asn Arg Arg Pro Ser Gly Ile Pro Glu Arg Ile Ser Gly Ser Asn Ser
65 70 75 80
Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met Asp Glu
85 90 95
Ala Glu Tyr Tyr Cys Gln Ala Trp Asp Ser Ser Thr Ser Trp Val Phe
100 105 110
Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys Ala Ala Pro
115 120 125
Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln Ala Asn Lys
130 135 140
Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly Ala Val Thr
145 150 155 160
Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly Val Glu Thr
165 170 175
Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala Ser Ser Tyr
180 185 190
Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser Tyr Ser Cys
195 200 205
Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val Ala Pro Thr
210 215 220
Glu Cys
225
<210> 37
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH1-домен IgG1 мыши
<400> 37
Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala
1 5 10 15
Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu
50 55 60
Ser Ser Ser Val Thr Val Pro Ser Ser Pro Arg Pro Ser Glu Thr Val
65 70 75 80
Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys
85 90 95
Ile
<210> 38
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH1-домен IgG2ab мыши
<400> 38
Ala Lys Thr Thr Ala Pro Ser Val Tyr Pro Leu Ala Pro Val Cys Gly
1 5 10 15
Gly Thr Thr Gly Ser Ser Val Thr Leu Gly Cys Leu Val Lys Gly Tyr
20 25 30
Phe Pro Glu Pro Val Thr Leu Thr Trp Asn Ser Gly Ser Leu Ser Ser
35 40 45
Gly Val His Thr Phe Pro Ala Leu Leu Gln Ser Gly Leu Tyr Thr Leu
50 55 60
Ser Ser Ser Val Thr Val Thr Ser Asn Thr Trp Pro Ser Gln Thr Ile
65 70 75 80
Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys
85 90 95
Ile
<210> 39
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH1-домен IgG2aa мыши
<400> 39
Ala Lys Thr Thr Ala Pro Ser Val Tyr Pro Leu Ala Pro Val Cys Gly
1 5 10 15
Asp Thr Thr Gly Ser Ser Val Thr Leu Gly Cys Leu Val Lys Gly Tyr
20 25 30
Phe Pro Glu Pro Val Thr Leu Thr Trp Asn Ser Gly Ser Leu Ser Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu
50 55 60
Ser Ser Ser Val Thr Val Thr Ser Ser Thr Trp Pro Ser Gln Ser Ile
65 70 75 80
Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys
85 90 95
Ile
<210> 40
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH1-домен IgG2b мыши
<400> 40
Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Cys Gly
1 5 10 15
Asp Thr Thr Gly Ser Ser Val Thr Ser Gly Cys Leu Val Lys Gly Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser
35 40 45
Ser Val His Thr Phe Pro Ala Leu Leu Gln Ser Gly Leu Tyr Thr Met
50 55 60
Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Gln Thr Val
65 70 75 80
Thr Cys Ser Val Ala His Pro Ala Ser Ser Thr Thr Val Asp Lys Lys
85 90 95
Leu
<210> 41
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH1-домен IgG3 мыши
<400> 41
Thr Thr Thr Ala Pro Ser Val Tyr Pro Leu Val Pro Gly Cys Ser Asp
1 5 10 15
Thr Ser Gly Ser Ser Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
20 25 30
Pro Glu Pro Val Thr Val Lys Trp Asn Tyr Gly Ala Leu Ser Ser Gly
35 40 45
Val Arg Thr Val Ser Ser Val Leu Gln Ser Gly Phe Tyr Ser Leu Ser
50 55 60
Ser Leu Val Thr Val Pro Ser Ser Thr Trp Pro Ser Gln Thr Val Ile
65 70 75 80
Cys Asn Val Ala His Pro Ala Ser Lys Thr Glu Leu Ile Lys Arg Ile
85 90 95
<210> 42
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH1-домен IgG1 крысы
<400> 42
Ala Glu Thr Thr Ala Pro Ser Val Tyr Pro Leu Ala Pro Gly Thr Ala
1 5 10 15
Leu Lys Ser Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ala Leu Ser Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Gly Leu Tyr Thr Leu
50 55 60
Thr Ser Ser Val Thr Val Pro Ser Ser Thr Trp Ser Ser Gln Ala Val
65 70 75 80
Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys
85 90 95
Ile
<210> 43
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH1-домен IgG2a крысы
<400> 43
Ala Glu Thr Thr Ala Pro Ser Val Tyr Pro Leu Ala Pro Gly Thr Ala
1 5 10 15
Leu Lys Ser Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ala Leu Ser Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Gly Leu Tyr Thr Leu
50 55 60
Thr Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Gln Thr Val
65 70 75 80
Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys
85 90 95
Ile
<210> 44
<211> 95
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH1-домен IgG2b крысы
<400> 44
Ala Gln Thr Thr Ala Pro Ser Val Tyr Pro Leu Ala Pro Gly Cys Gly
1 5 10 15
Asp Thr Thr Ser Ser Thr Val Thr Leu Gly Cys Leu Val Lys Gly Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ala Leu Ser Ser
35 40 45
Asp Val His Thr Phe Pro Ala Val Leu Gln Ser Gly Leu Tyr Thr Leu
50 55 60
Thr Ser Ser Val Thr Ser Ser Thr Trp Pro Ser Gln Thr Val Thr Cys
65 70 75 80
Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Val
85 90 95
<210> 45
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH1-домен IgG2c крысы
<400> 45
Ala Thr Thr Thr Ala Pro Ser Val Tyr Pro Leu Val Pro Gly Cys Ser
1 5 10 15
Gly Thr Ser Gly Ser Leu Val Thr Leu Gly Cys Leu Val Lys Gly Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Lys Trp Asn Ser Gly Ala Leu Ser Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Gly Leu Tyr Thr Leu
50 55 60
Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Ser Ser Gln Thr Val
65 70 75 80
Thr Cys Ser Val Ala His Pro Ala Thr Lys Ser Asn Leu Ile Lys Arg
85 90 95
Ile
<210> 46
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH3-домен IgG1 мыши
<400> 46
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
1 5 10 15
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
20 25 30
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
35 40 45
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asn Thr Asn Gly Ser Tyr
50 55 60
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
65 70 75 80
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
85 90 95
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
100 105
<210> 47
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH3-домен IgG2ab мыши
<400> 47
Gly Pro Val Arg Ala Pro Gln Val Tyr Val Leu Pro Pro Pro Ala Glu
1 5 10 15
Glu Met Thr Lys Lys Glu Phe Ser Leu Thr Cys Met Ile Thr Gly Phe
20 25 30
Leu Pro Ala Glu Ile Ala Val Asp Trp Thr Ser Asn Gly Arg Thr Glu
35 40 45
Gln Asn Tyr Lys Asn Thr Ala Thr Val Leu Asp Ser Asp Gly Ser Tyr
50 55 60
Phe Met Tyr Ser Lys Leu Arg Val Gln Lys Ser Thr Trp Glu Arg Gly
65 70 75 80
Ser Leu Phe Ala Cys Ser Val Val His Glu Val Leu His Asn His Leu
85 90 95
Thr Thr Lys Thr Ile Ser Arg Ser Leu Gly Lys
100 105
<210> 48
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH3-домен IgG2aa мыши
<400> 48
Gly Ser Val Arg Ala Pro Gln Val Tyr Val Leu Pro Pro Pro Glu Glu
1 5 10 15
Glu Met Thr Lys Lys Gln Val Thr Leu Thr Cys Met Val Thr Asp Phe
20 25 30
Met Pro Glu Asp Ile Tyr Val Glu Trp Thr Asn Asn Gly Lys Thr Glu
35 40 45
Leu Asn Tyr Lys Asn Thr Glu Pro Val Leu Asp Ser Asp Gly Ser Tyr
50 55 60
Phe Met Tyr Ser Lys Leu Arg Val Glu Lys Lys Asn Trp Val Glu Arg
65 70 75 80
Asn Ser Tyr Ser Cys Ser Val Val His Glu Gly Leu His Asn His His
85 90 95
Thr Thr Lys Ser Phe Ser Arg Thr Pro Gly Lys
100 105
<210> 49
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH3-домен IgG2b мыши
<400> 49
Gly Leu Val Arg Ala Pro Gln Val Tyr Thr Leu Pro Pro Pro Ala Glu
1 5 10 15
Gln Leu Ser Arg Lys Asp Val Ser Leu Thr Cys Leu Val Val Gly Phe
20 25 30
Asn Pro Gly Asp Ile Ser Val Glu Trp Thr Ser Asn Gly His Thr Glu
35 40 45
Glu Asn Tyr Lys Asp Thr Ala Pro Val Leu Asp Ser Asp Gly Ser Tyr
50 55 60
Phe Ile Tyr Ser Lys Leu Asn Met Lys Thr Ser Lys Trp Glu Lys Thr
65 70 75 80
Asp Ser Phe Ser Cys Asn Val Arg His Glu Gly Leu Lys Asn Tyr Tyr
85 90 95
Leu Lys Lys Thr Ile Ser Arg Ser Pro Gly Lys
100 105
<210> 50
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH3-домен IgG3 мыши
<400> 50
Gly Arg Ala Gln Thr Pro Gln Val Tyr Thr Ile Pro Pro Pro Arg Glu
1 5 10 15
Gln Met Ser Lys Lys Lys Val Ser Leu Thr Cys Leu Val Thr Asn Phe
20 25 30
Phe Ser Glu Ala Ile Ser Val Glu Trp Glu Arg Asn Gly Glu Leu Glu
35 40 45
Gln Asp Tyr Lys Asn Thr Pro Pro Ile Leu Asp Ser Asp Gly Thr Tyr
50 55 60
Phe Leu Tyr Ser Lys Leu Thr Val Asp Thr Asp Ser Trp Leu Gln Gly
65 70 75 80
Glu Ile Phe Thr Cys Ser Val Val His Glu Ala Leu His Asn His His
85 90 95
Thr Gln Lys Asn Leu Ser Arg Ser Pro Gly Lys
100 105
<210> 51
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH3-домен IgG1 крысы
<400> 51
Gly Arg Thr Gln Val Pro His Val Tyr Thr Met Ser Pro Thr Lys Glu
1 5 10 15
Glu Met Thr Gln Asn Glu Val Ser Ile Thr Cys Met Val Lys Gly Phe
20 25 30
Tyr Pro Pro Asp Ile Tyr Val Glu Trp Gln Met Asn Gly Gln Pro Gln
35 40 45
Glu Asn Tyr Lys Asn Thr Pro Pro Thr Met Asp Thr Asp Gly Ser Tyr
50 55 60
Phe Leu Tyr Ser Lys Leu Asn Val Lys Lys Glu Lys Trp Gln Gln Gly
65 70 75 80
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
85 90 95
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
100 105
<210> 52
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH3-домен IgG2a крысы
<400> 52
Gly Thr Pro Arg Gly Pro Gln Val Tyr Thr Met Ala Pro Pro Lys Glu
1 5 10 15
Glu Met Thr Gln Ser Gln Val Ser Ile Thr Cys Met Val Lys Gly Phe
20 25 30
Tyr Pro Pro Asp Ile Tyr Thr Glu Trp Lys Met Asn Gly Gln Pro Gln
35 40 45
Glu Asn Tyr Lys Asn Thr Pro Pro Thr Met Asp Thr Asp Gly Ser Tyr
50 55 60
Phe Leu Tyr Ser Lys Leu Asn Val Lys Lys Glu Thr Trp Gln Gln Gly
65 70 75 80
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
85 90 95
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
100 105
<210> 53
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH3-домен IgG2b крысы
<400> 53
Gly Leu Val Arg Lys Pro Gln Val Tyr Val Met Gly Pro Pro Thr Glu
1 5 10 15
Gln Leu Thr Glu Gln Thr Val Ser Leu Thr Cys Leu Thr Ser Gly Phe
20 25 30
Leu Pro Asn Asp Ile Gly Val Glu Trp Thr Ser Asn Gly His Ile Glu
35 40 45
Lys Asn Tyr Lys Asn Thr Glu Pro Val Met Asp Ser Asp Gly Ser Phe
50 55 60
Phe Met Tyr Ser Lys Leu Asn Val Glu Arg Ser Arg Trp Asp Ser Arg
65 70 75 80
Ala Pro Phe Val Cys Ser Val Val His Glu Gly Leu His Asn His His
85 90 95
Val Glu Lys Ser Ile Ser Arg Pro Pro Gly Lys
100 105
<210> 54
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> CH3-домен IgG2c крысы
<400> 54
Gly Lys Ala Arg Thr Pro Gln Val Tyr Thr Ile Pro Pro Pro Arg Glu
1 5 10 15
Gln Met Ser Lys Asn Lys Val Ser Leu Thr Cys Met Val Thr Ser Phe
20 25 30
Tyr Pro Ala Ser Ile Ser Val Glu Trp Glu Arg Asn Gly Glu Leu Glu
35 40 45
Gln Asp Tyr Lys Asn Thr Leu Pro Val Leu Asp Ser Asp Glu Ser Tyr
50 55 60
Phe Leu Tyr Ser Lys Leu Ser Val Asp Thr Asp Ser Trp Met Arg Gly
65 70 75 80
Asp Ile Tyr Thr Cys Ser Val Val His Glu Ala Leu His Asn His His
85 90 95
Thr Gln Lys Asn Leu Ser Arg Ser Pro Gly Lys
100 105
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| УСТОЙЧИВЫЕ МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2018 |
|
RU2779602C2 |
| СВЯЗЫВАЮЩИЕСЯ С CD38 И PD-L1 МОЛЕКУЛЫ | 2017 |
|
RU2764201C2 |
| ИММУНОЦИТОКИН, ВКЛЮЧАЮЩИЙ ГЕТЕРОДИМЕРНЫЙ БЕЛКОВЫЙ КОМПЛЕКС НА ОСНОВЕ IL-15/IL-15Rα, И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2753282C2 |
| ОДНОВАЛЕНТНЫЕ АСИММЕТРИЧНЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА С ТАНДЕМНЫМ FAB | 2017 |
|
RU2780591C2 |
| СПОСОБЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ПОЛИПЕПТИДОВ | 2019 |
|
RU2782464C2 |
| СКОНСТРУИРОВАННЫЕ ПАРЫ ТЯЖЕЛАЯ-ЛЕГКАЯ ЦЕПИ ИММУНОГЛОБУЛИНА И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2826203C1 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С GPRC5D | 2019 |
|
RU2797268C2 |
| АНТИТЕЛА К CD38 И КОМБИНАЦИИ С АНТИТЕЛАМИ К CD3 И CD28 | 2018 |
|
RU2812910C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ БЕТА-АМИЛОИДУ/ЧЕЛОВЕЧЕСКОМУ РЕЦЕПТОРУ ТРАНСФЕРРИНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2730682C1 |
| ПОЛИПЕПТИДНЫЙ ЛИНКЕР ДЛЯ ПОЛУЧЕНИЯ МУЛЬТИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2018 |
|
RU2776302C2 |
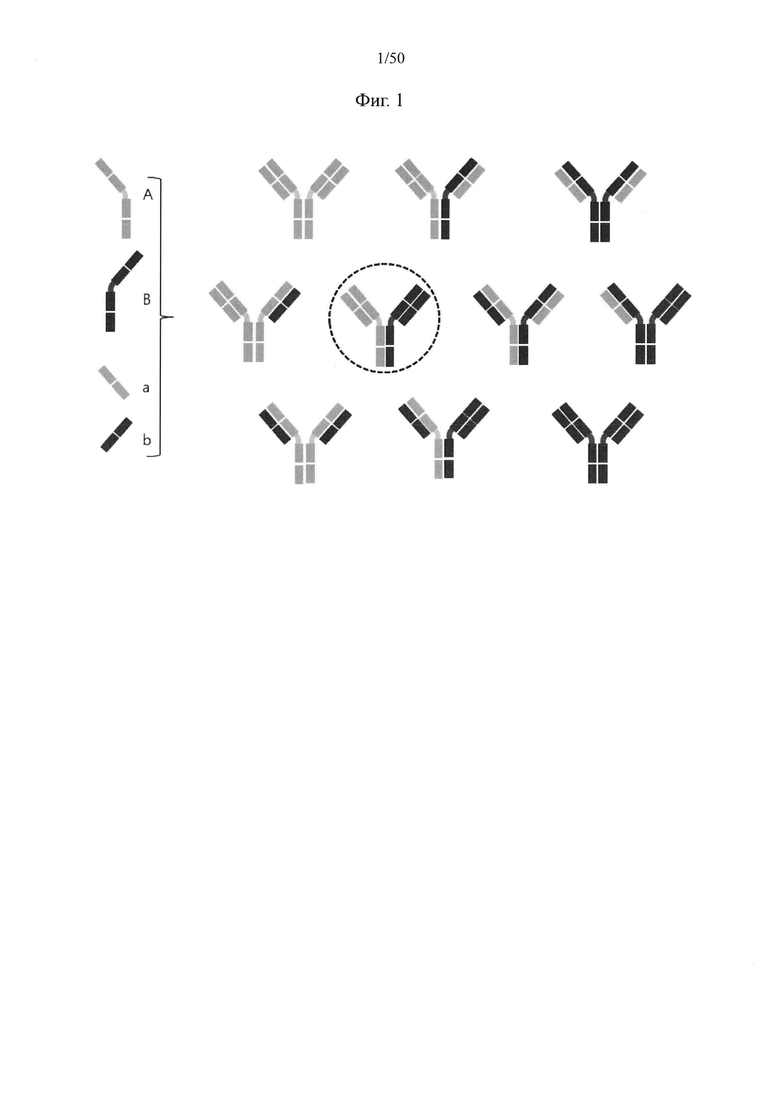
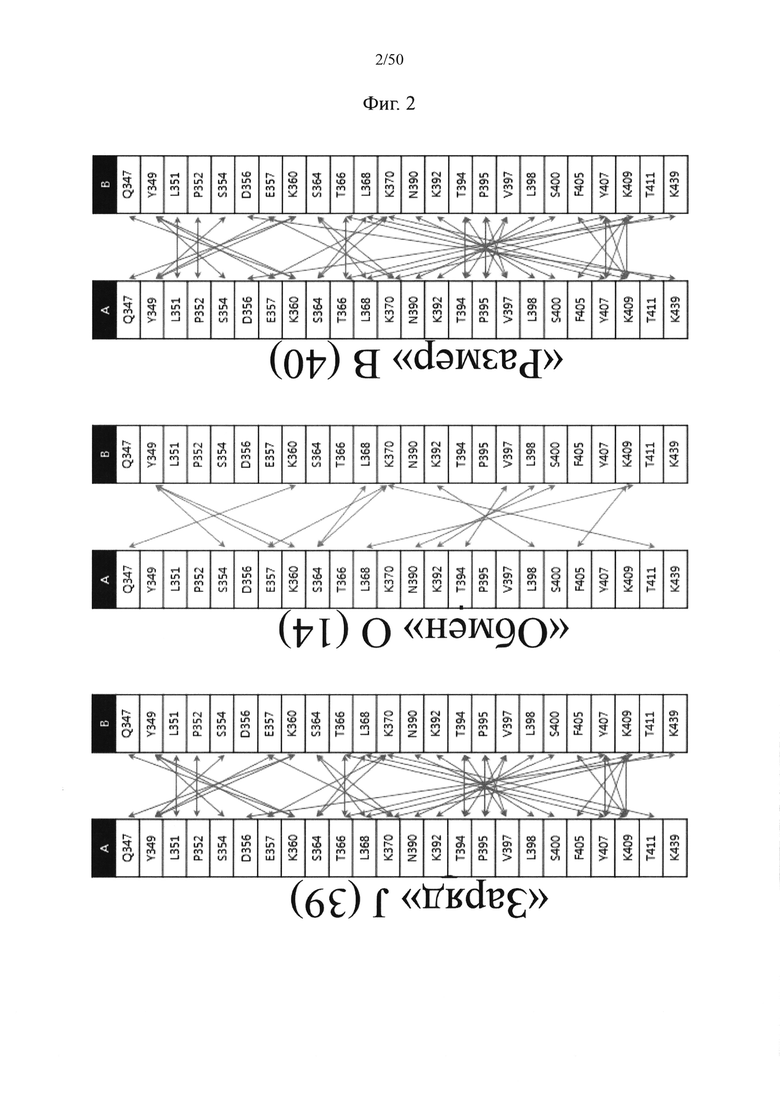
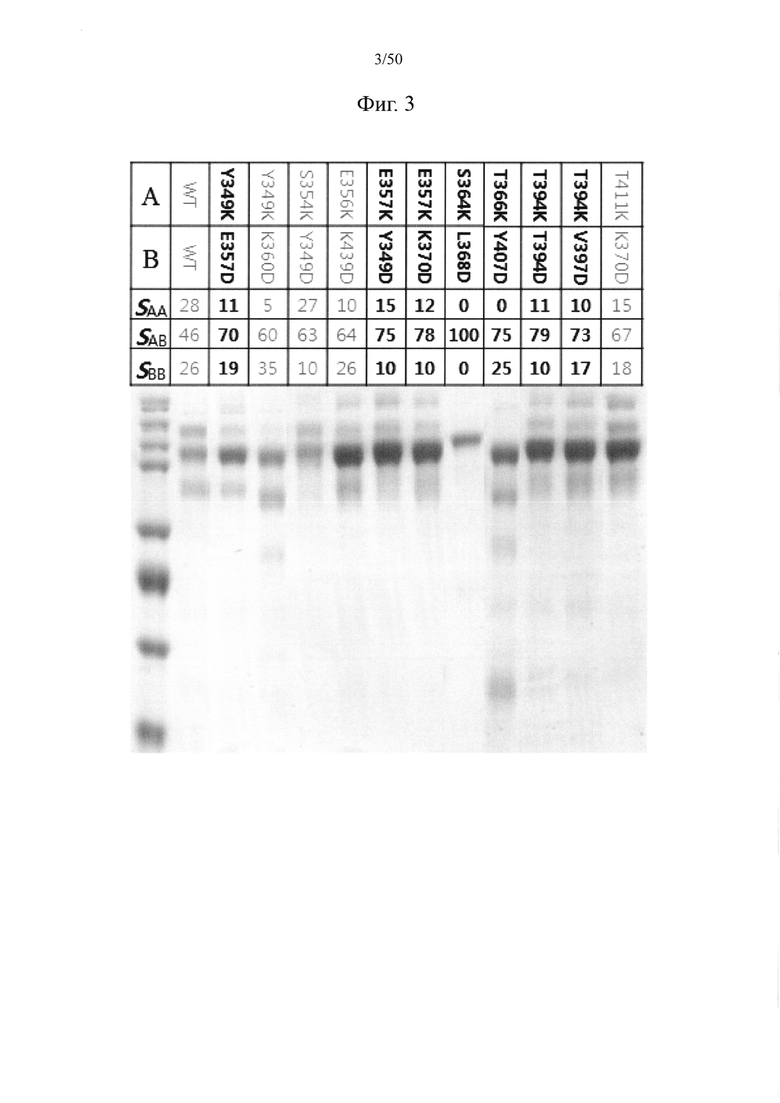
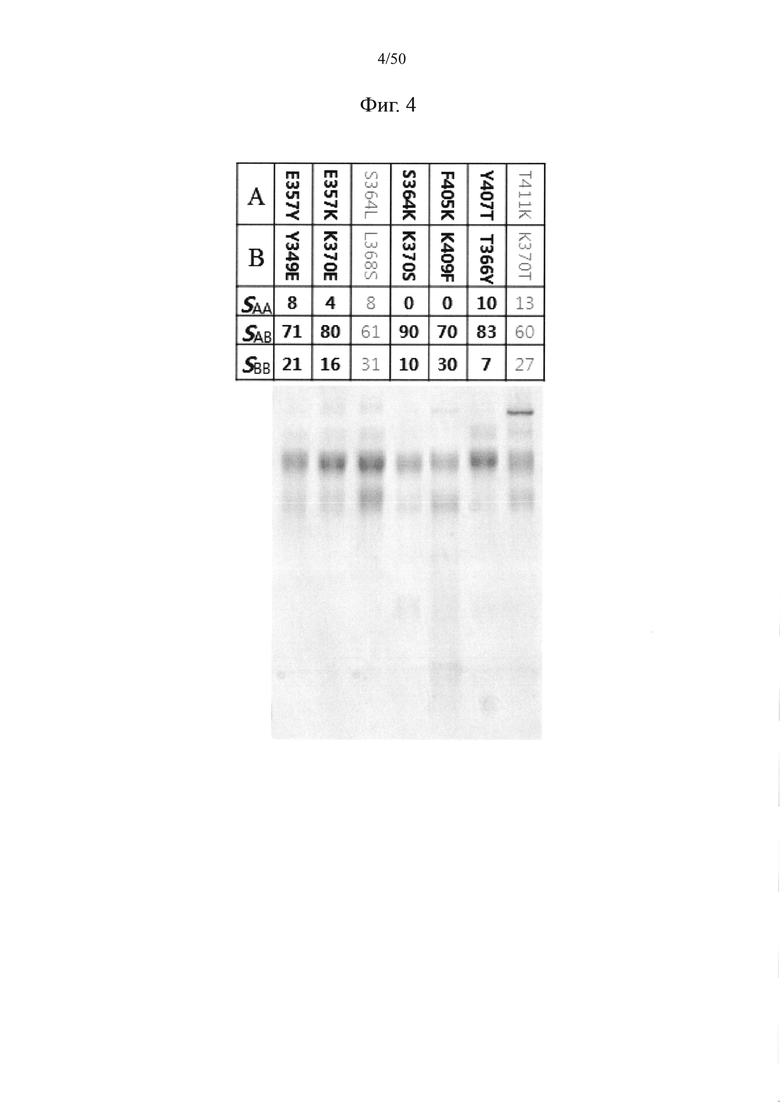
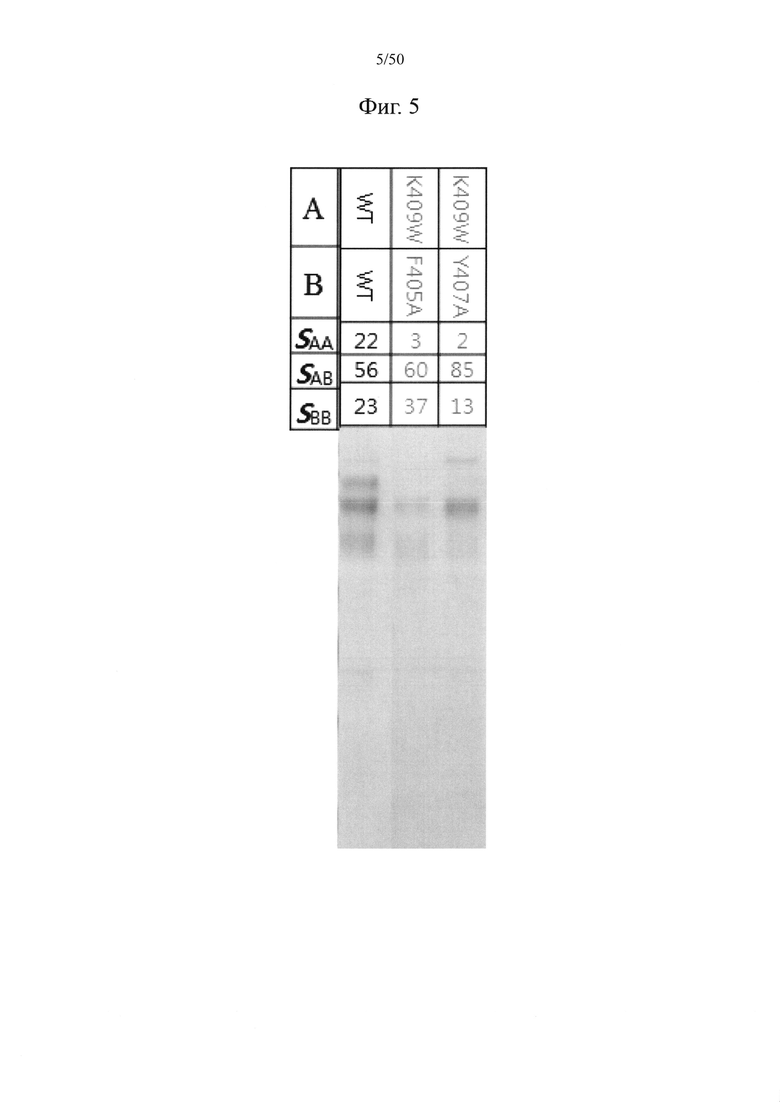
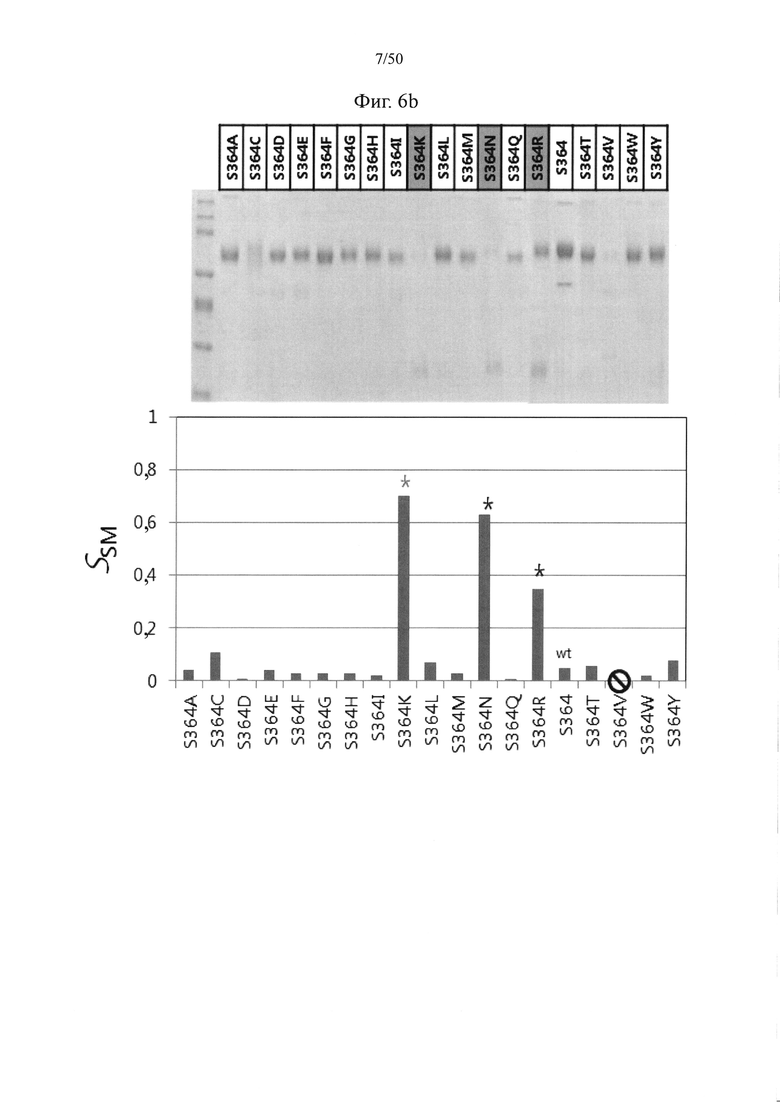
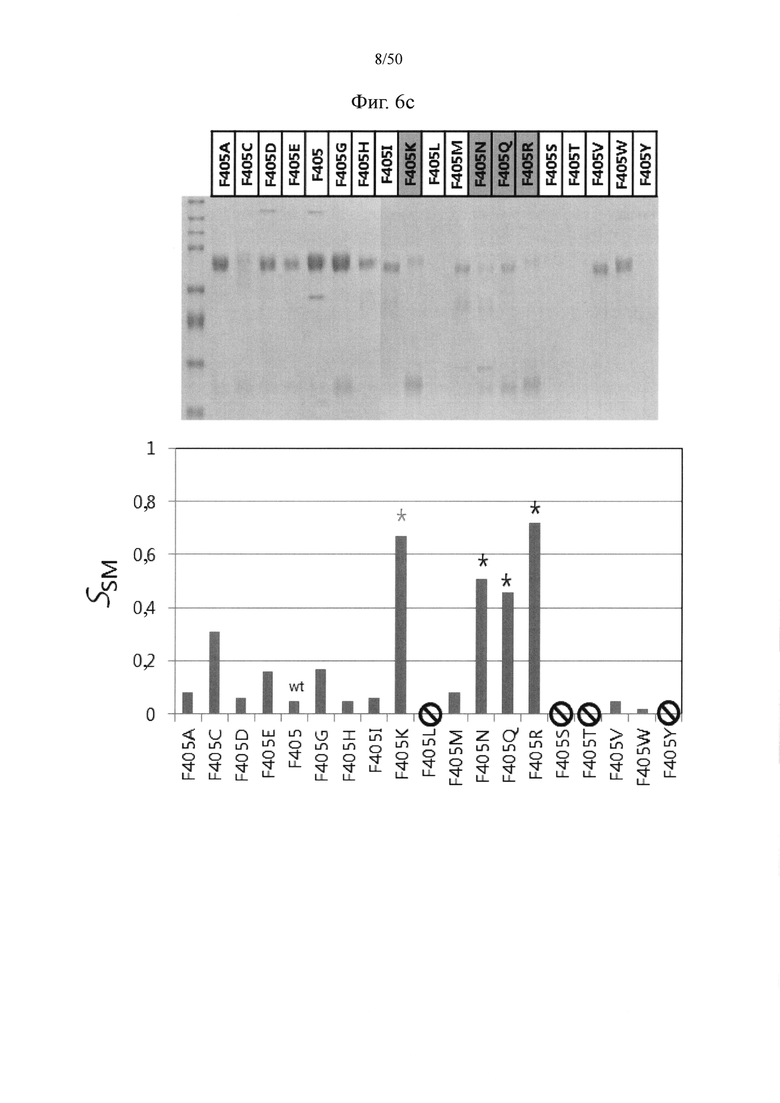
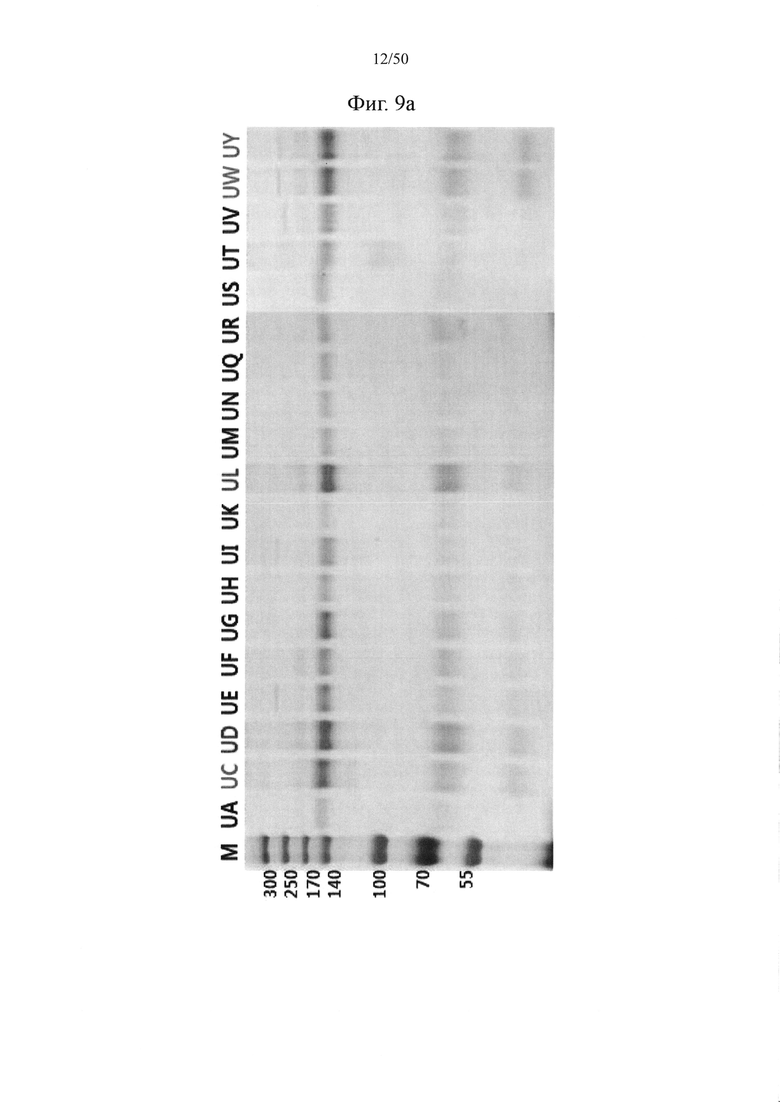
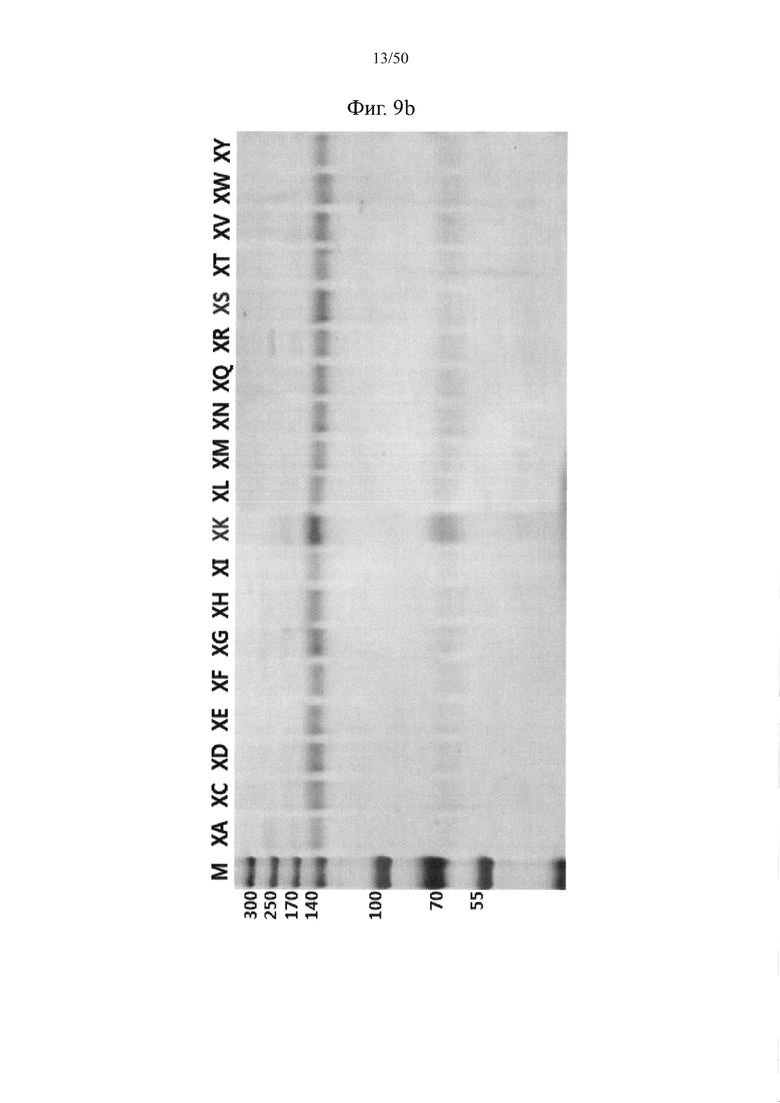
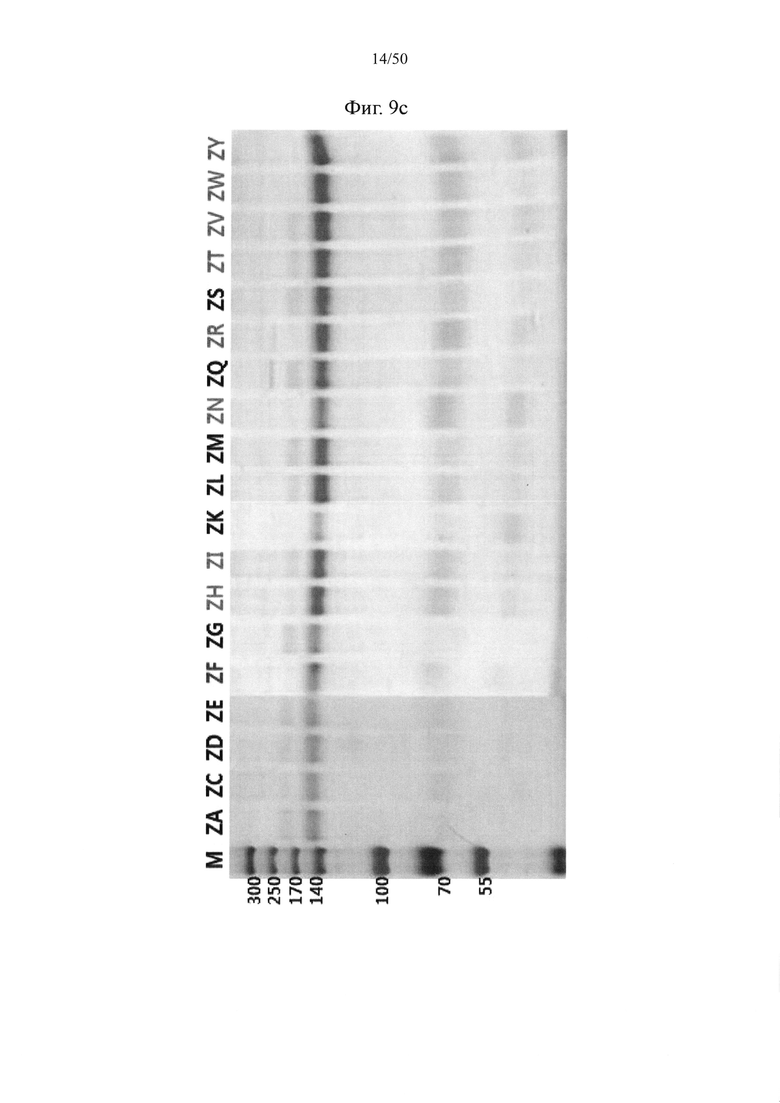
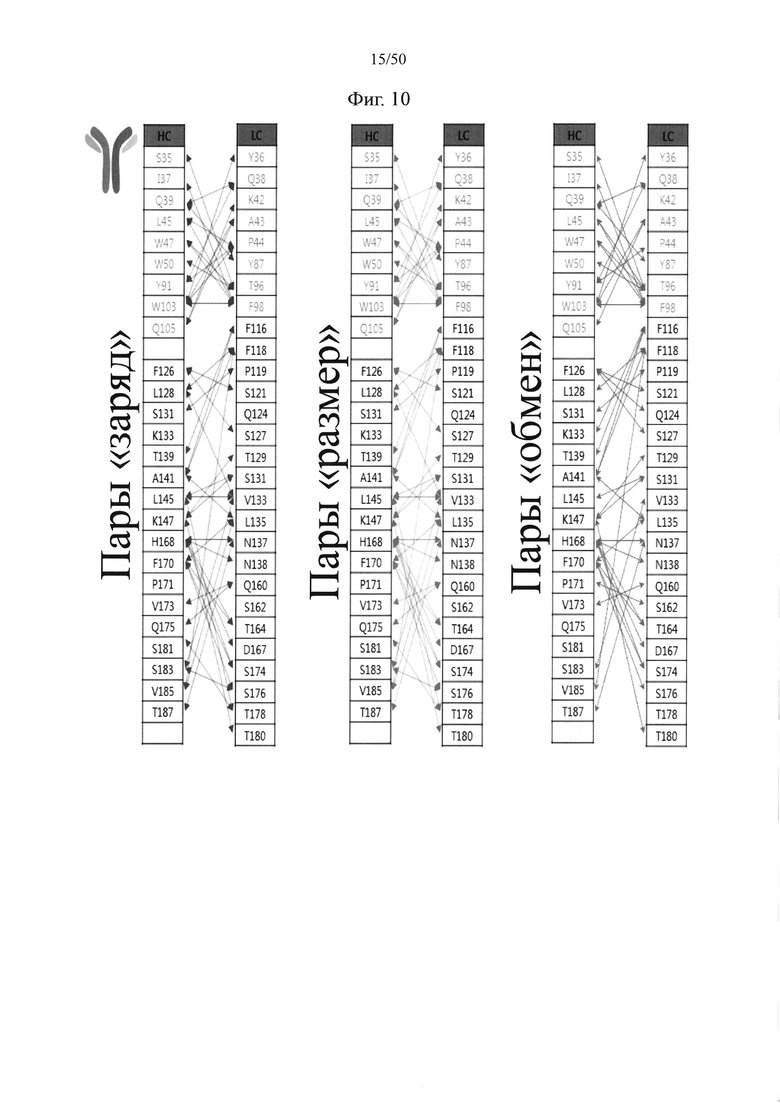
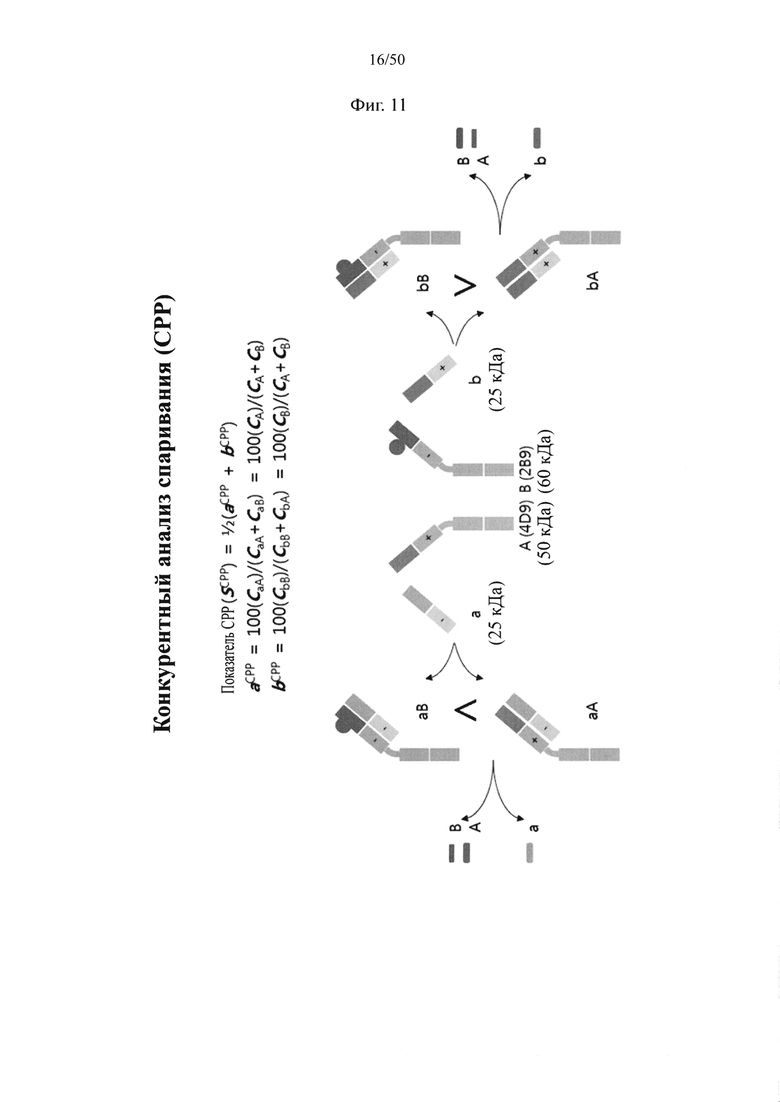

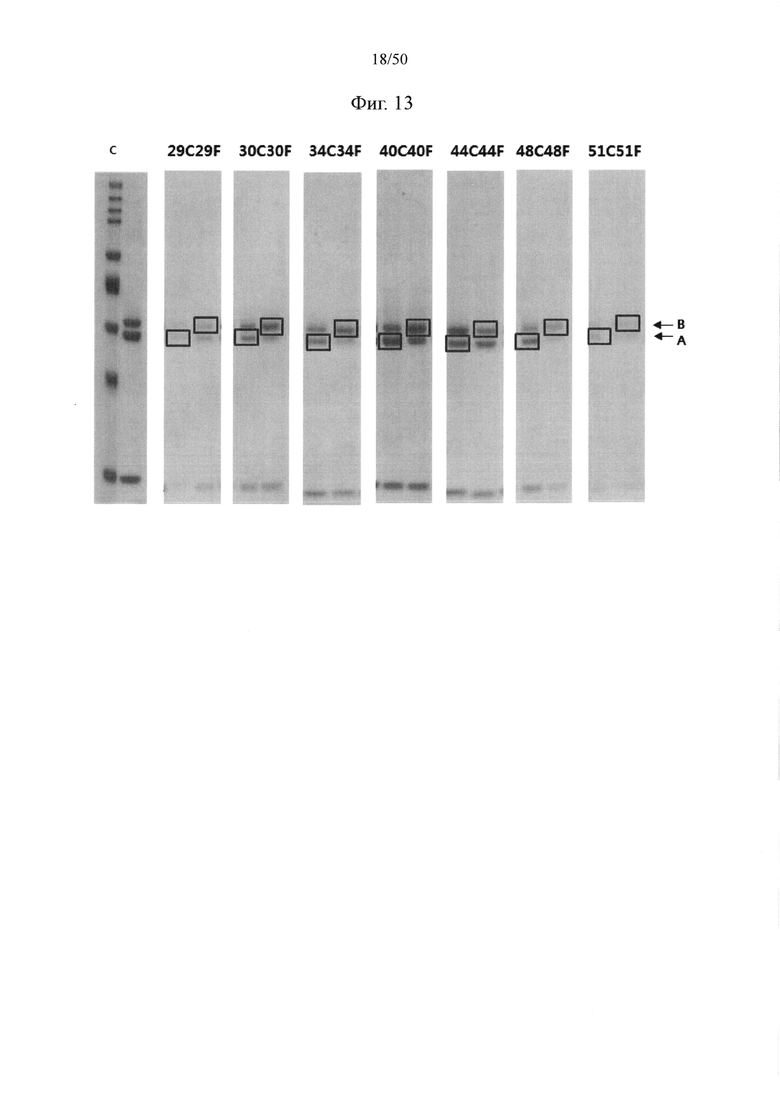
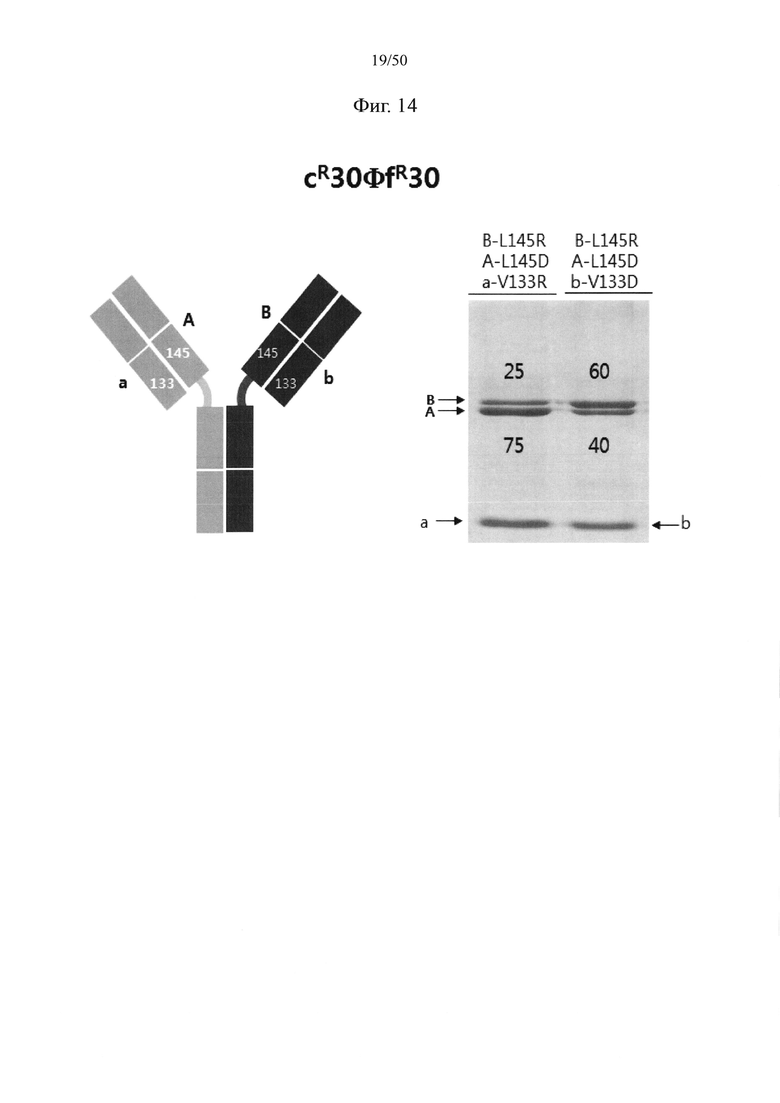
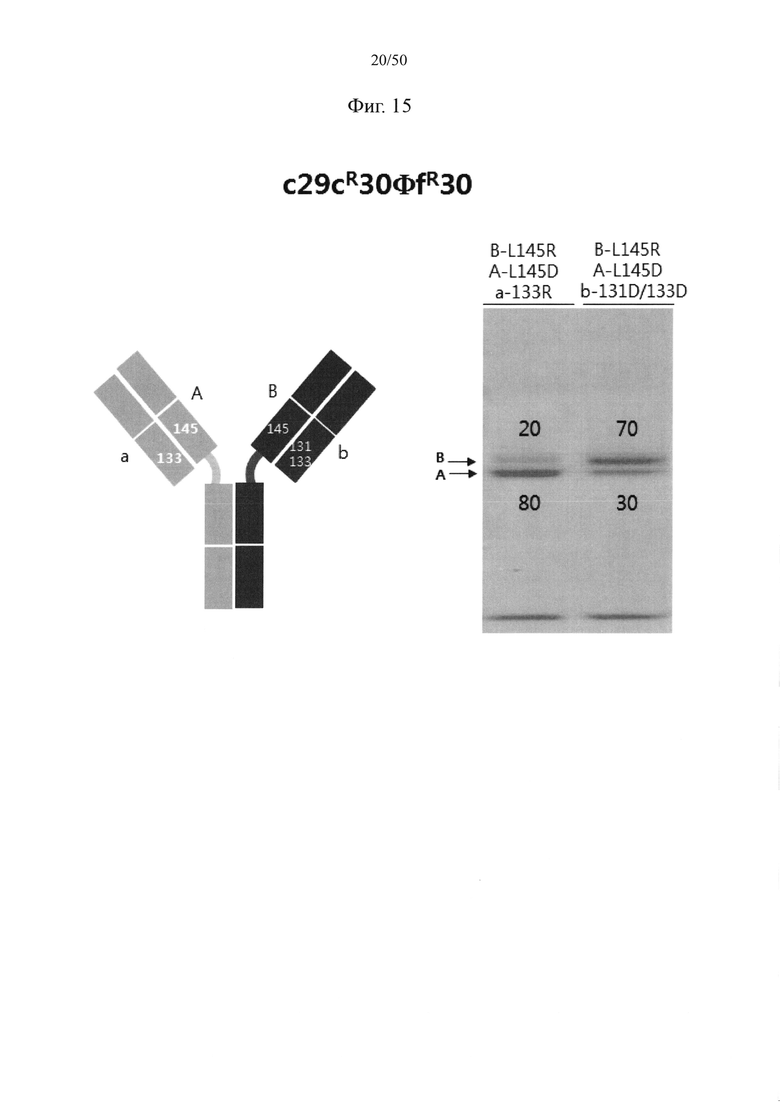
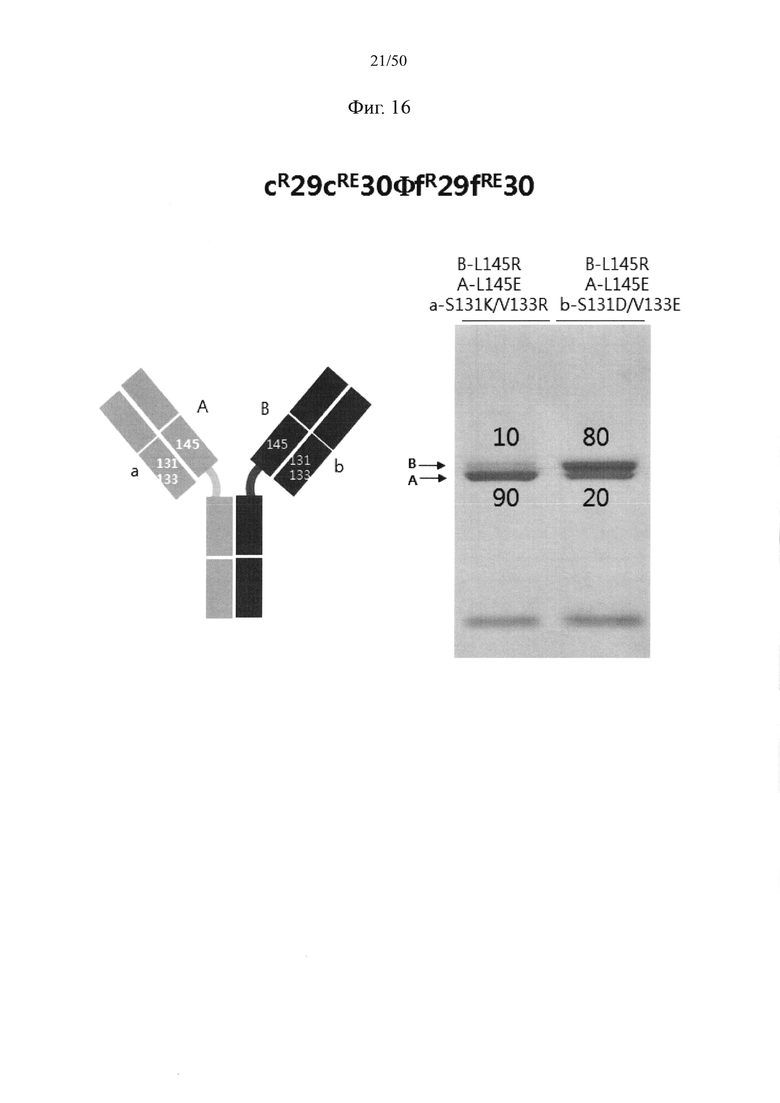
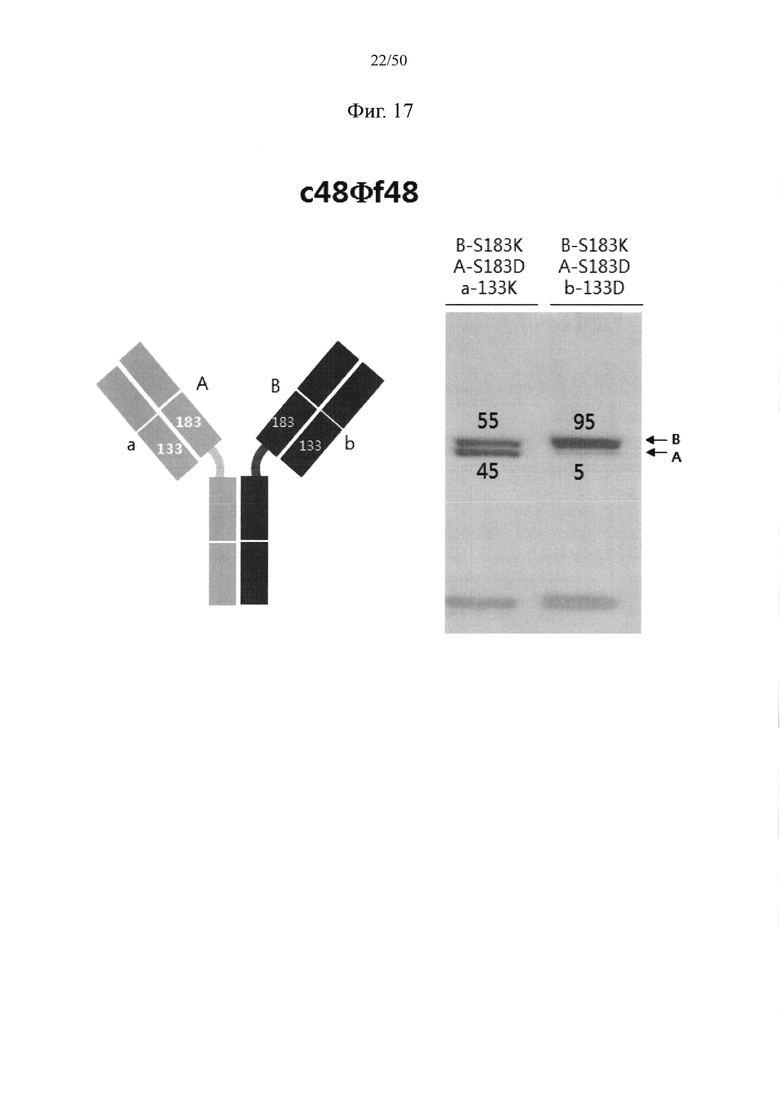
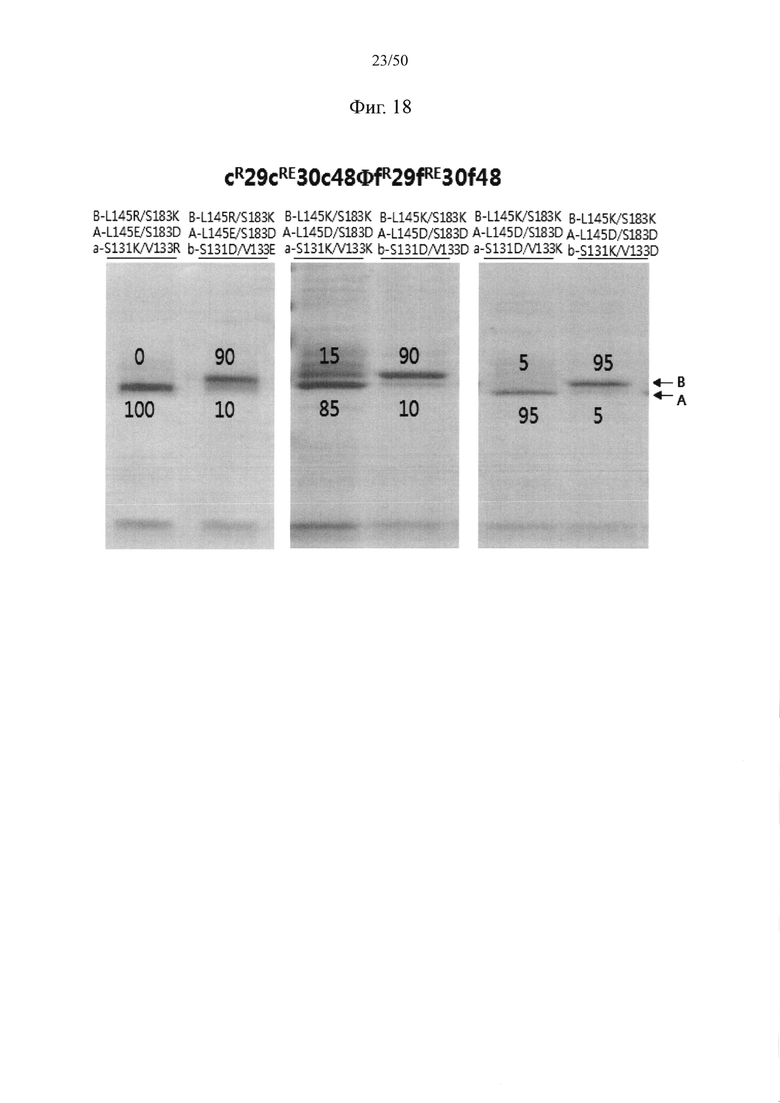
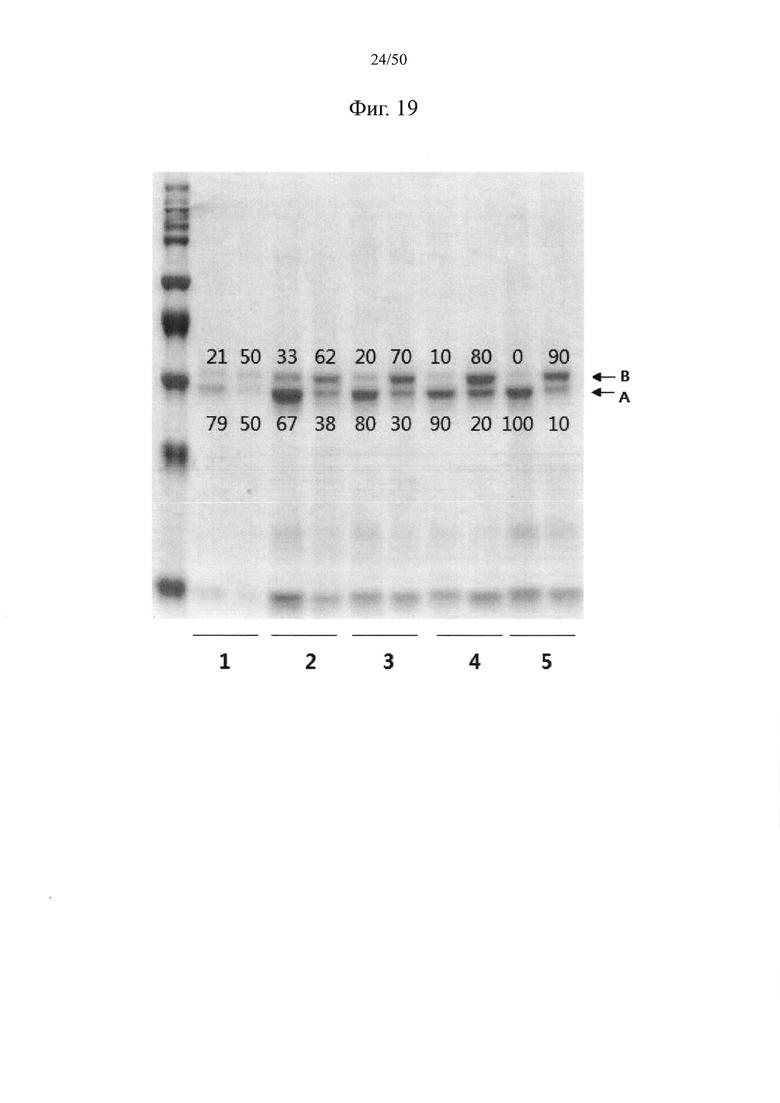

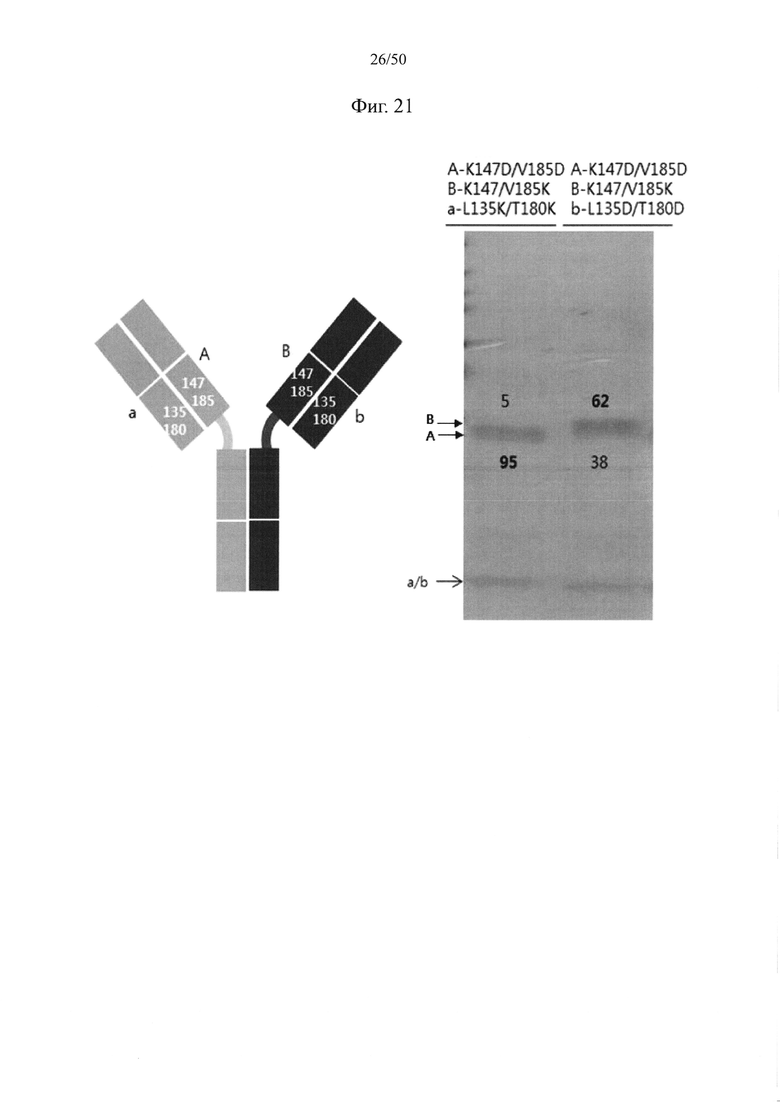
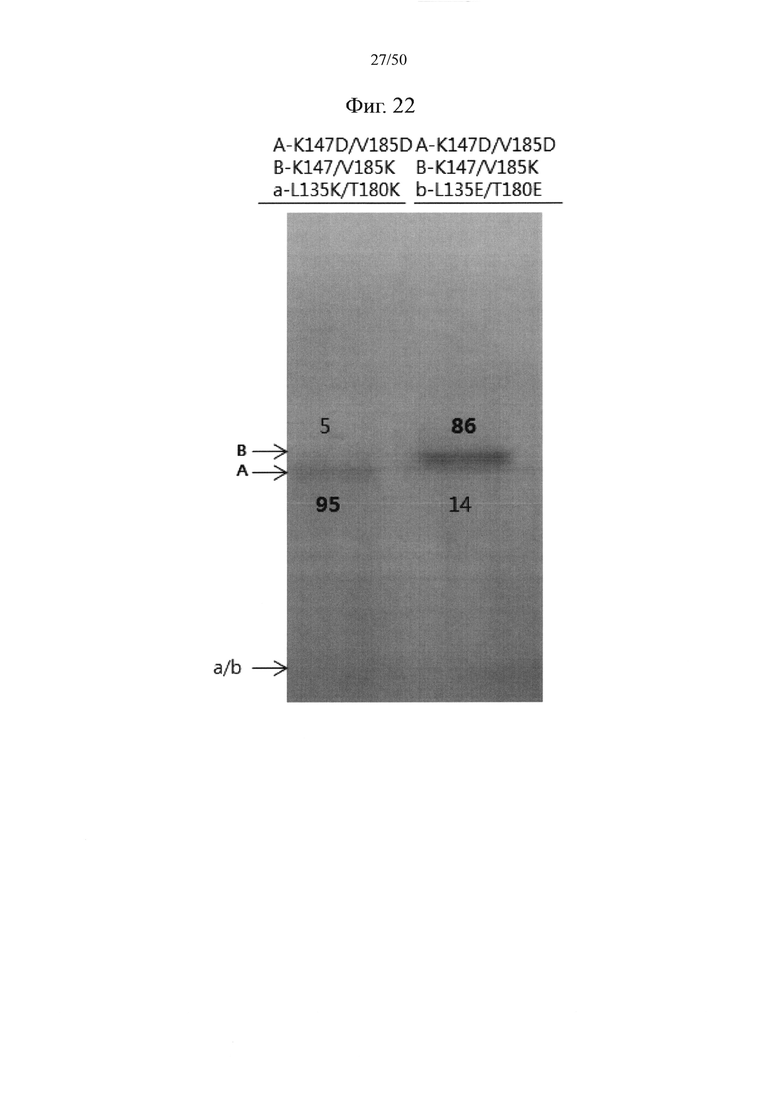


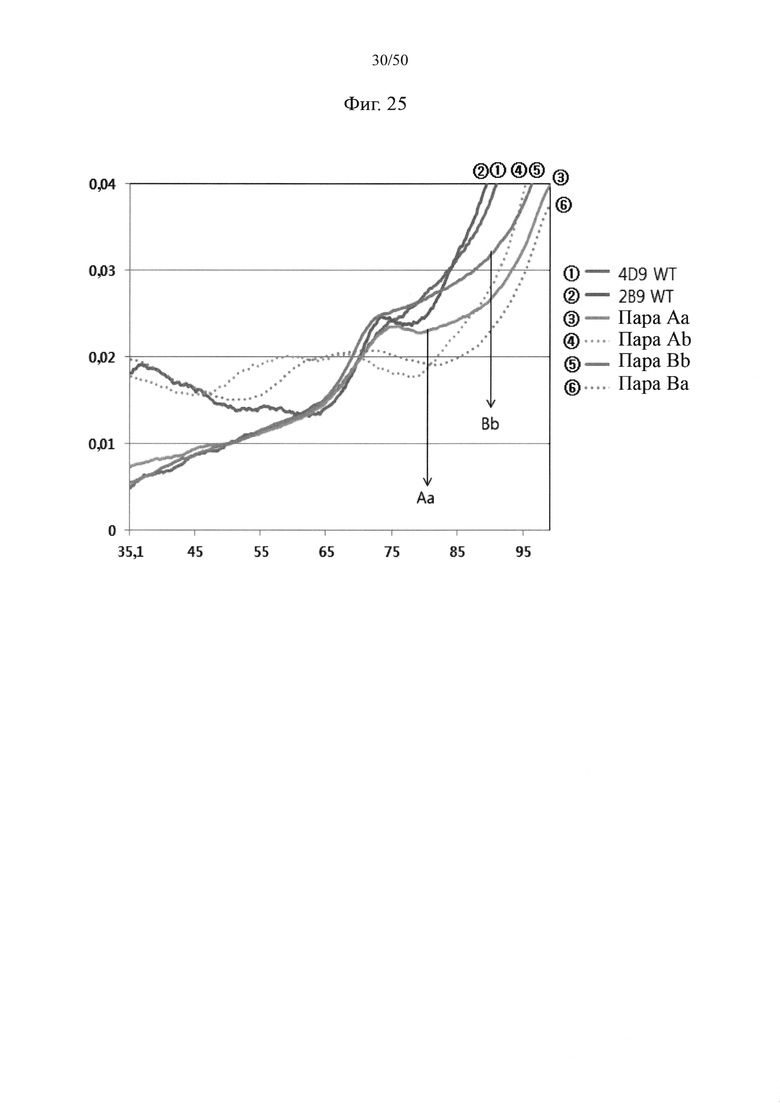
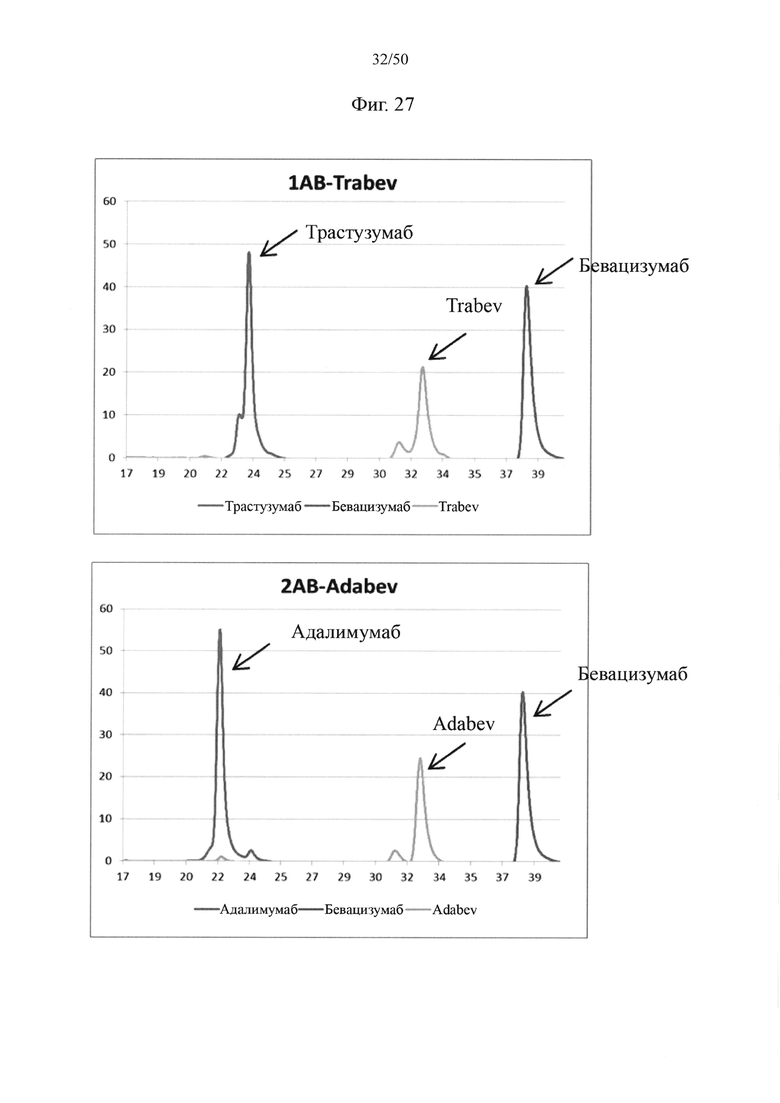
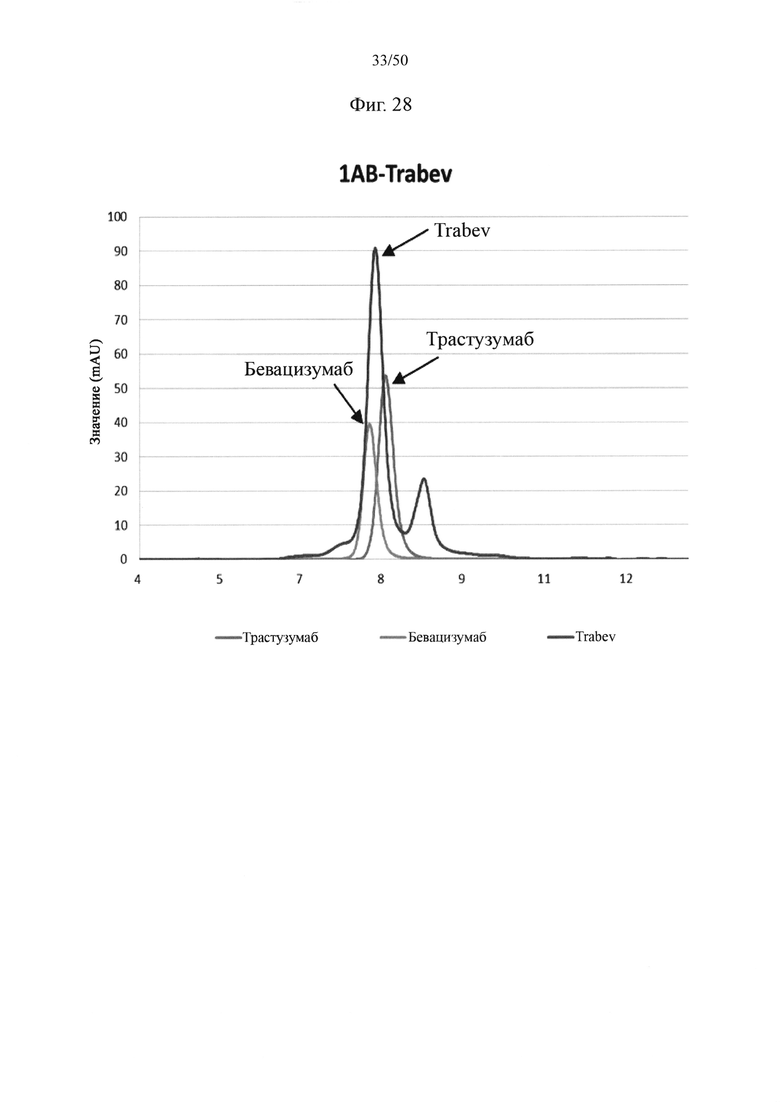
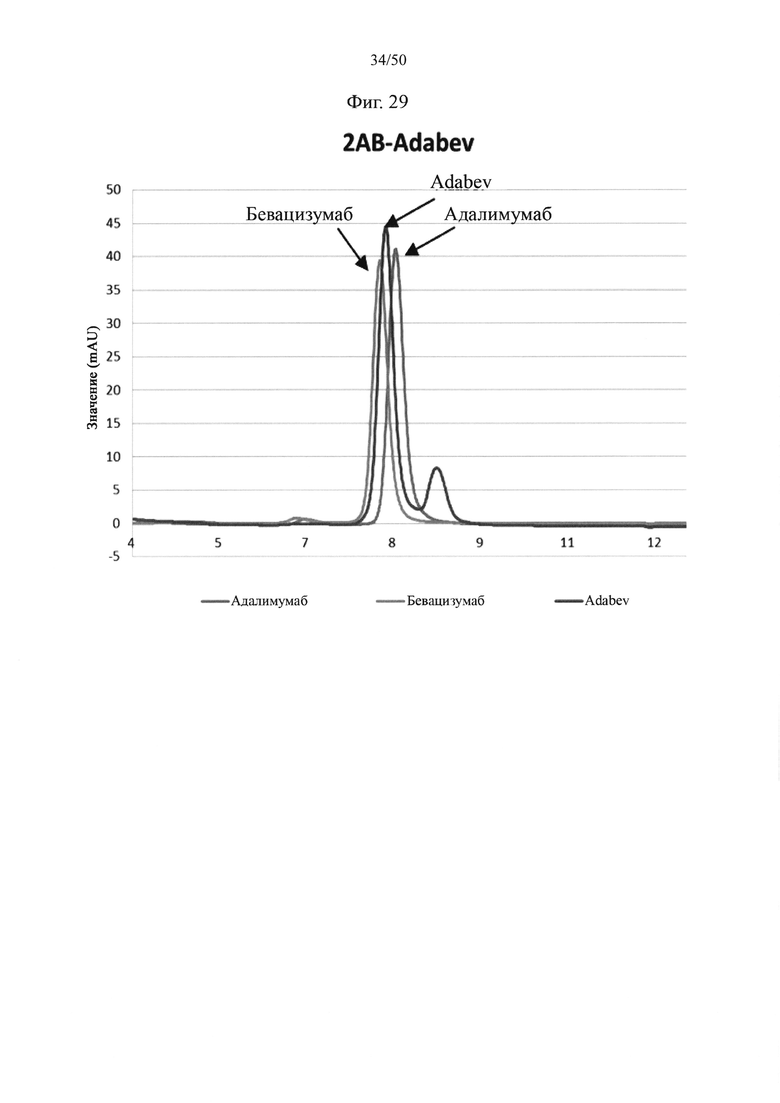
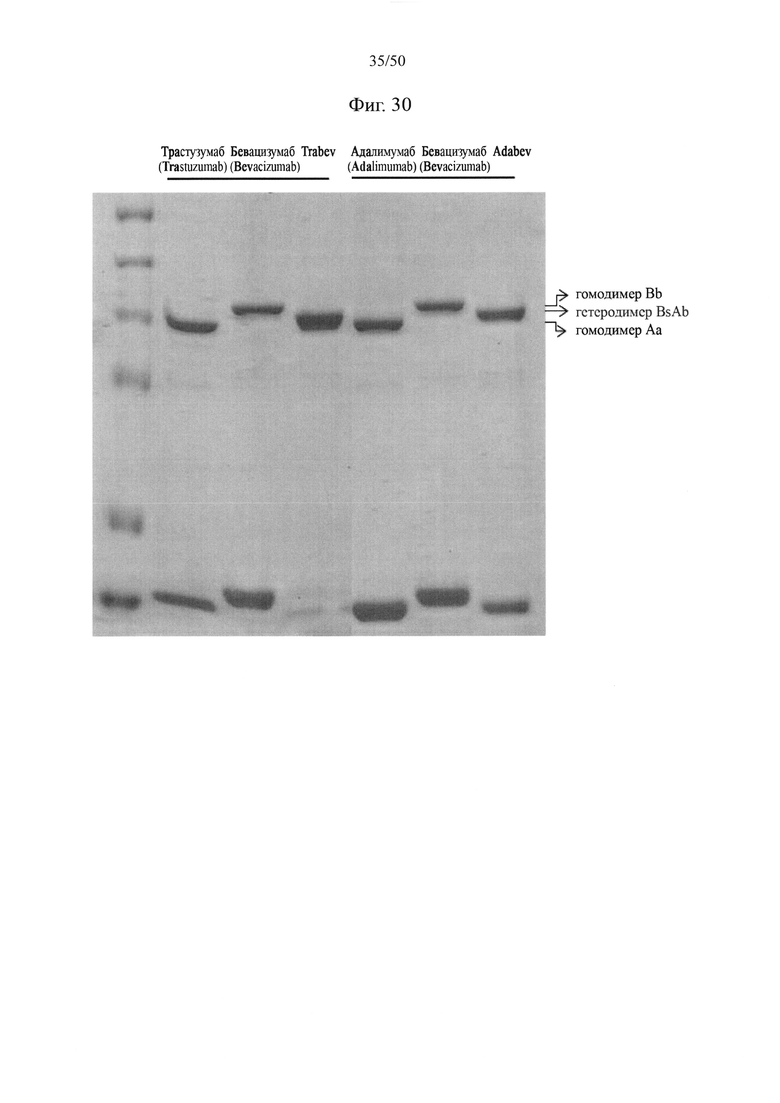
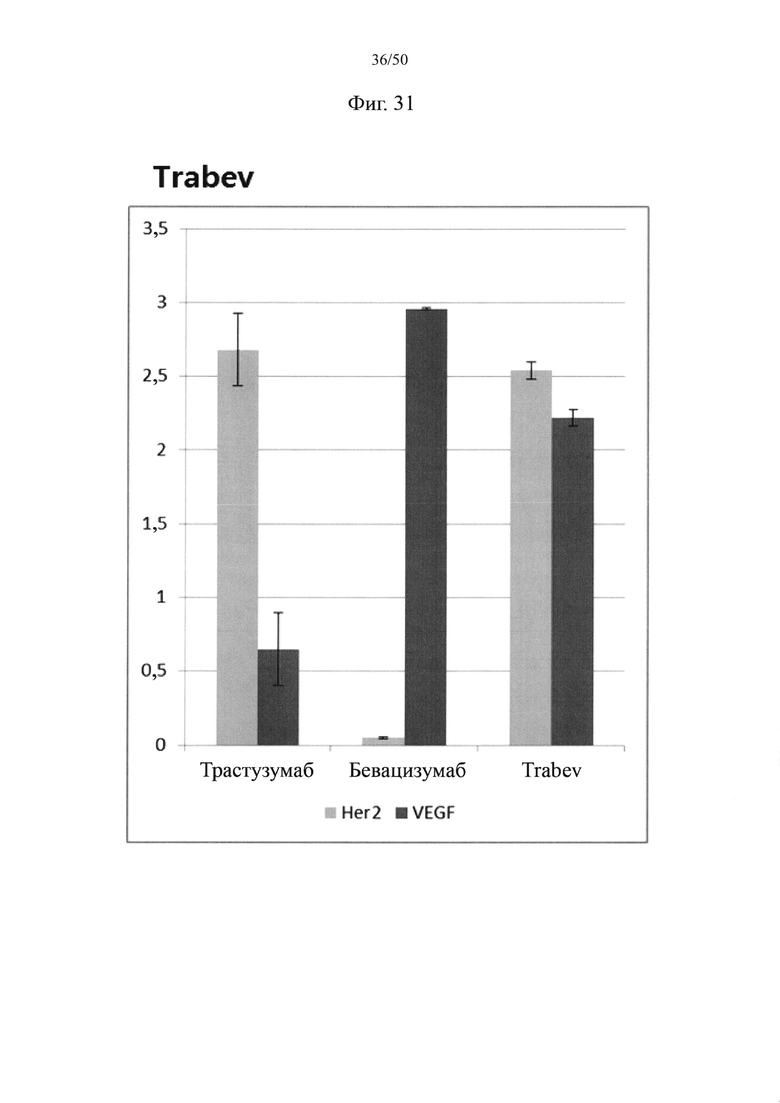
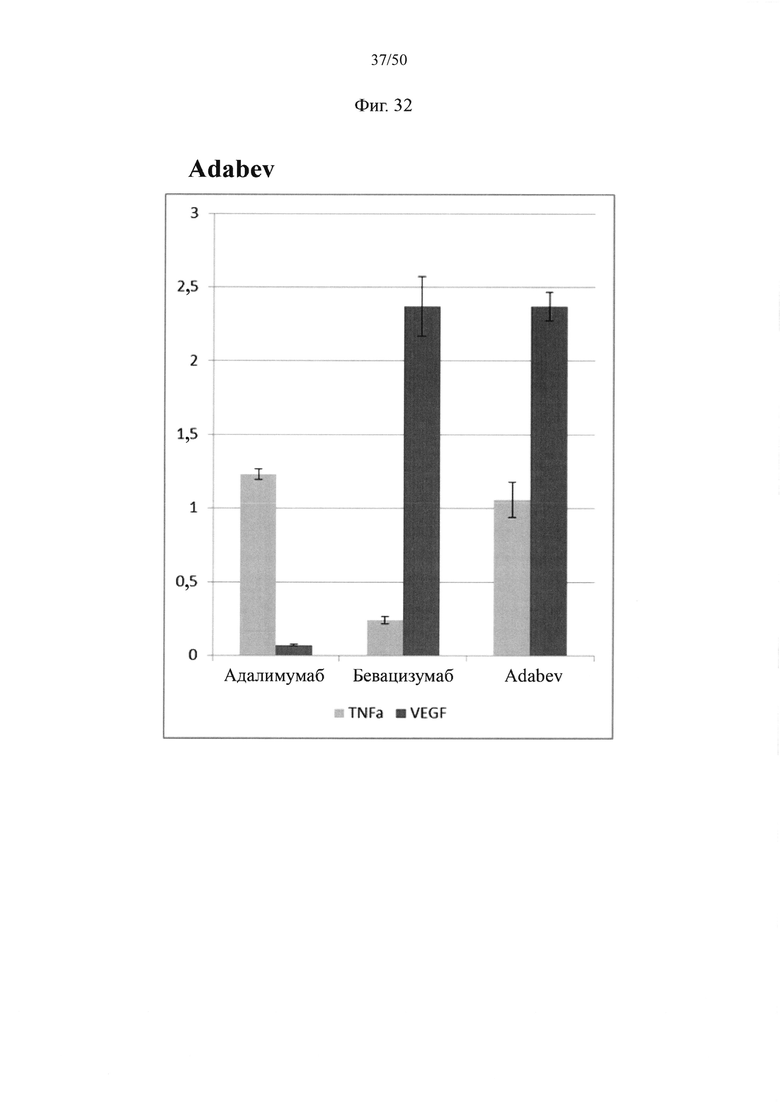


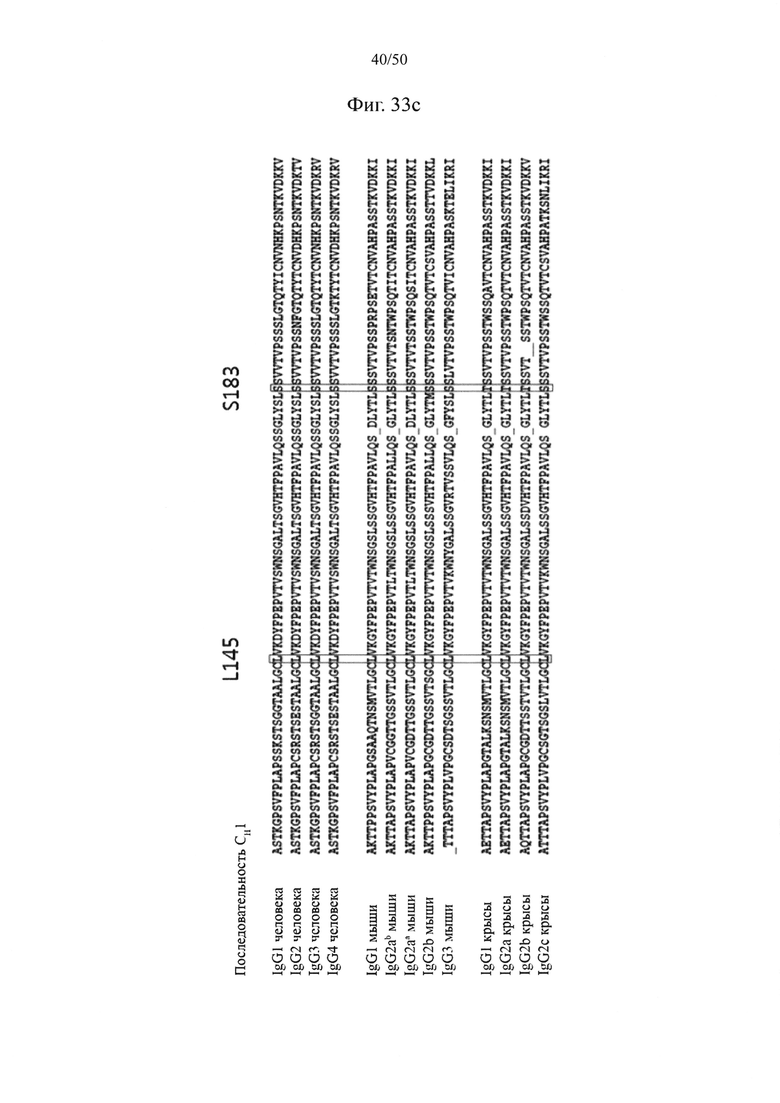

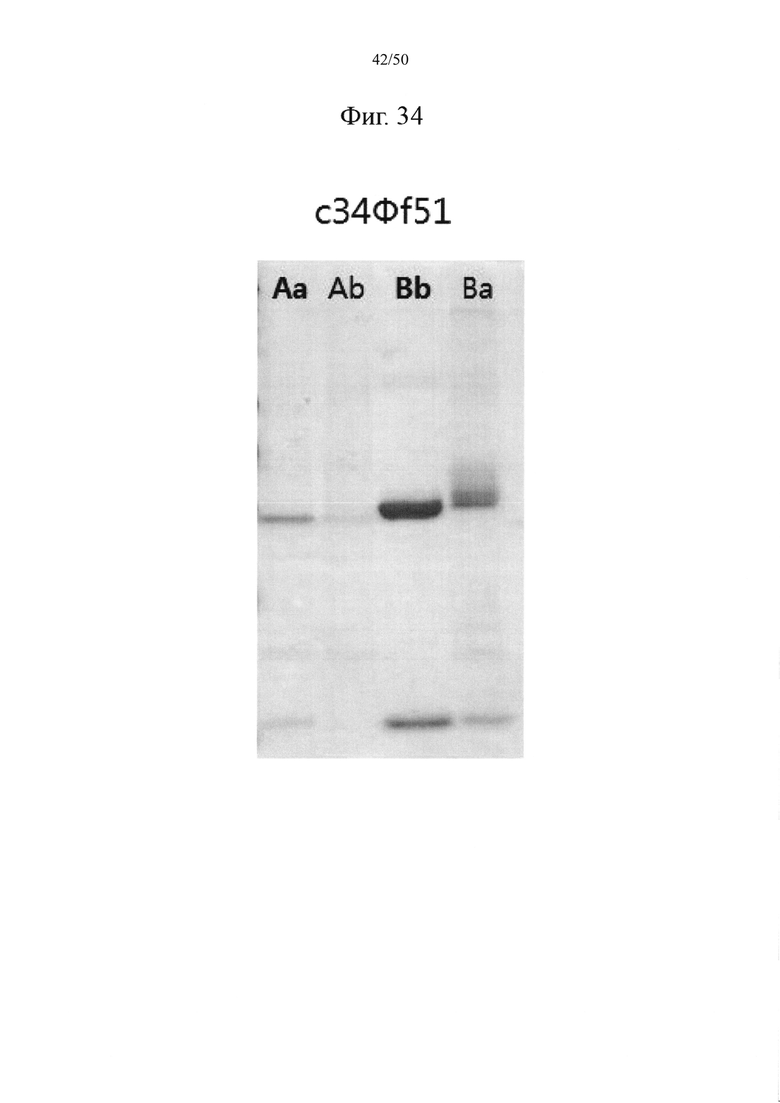
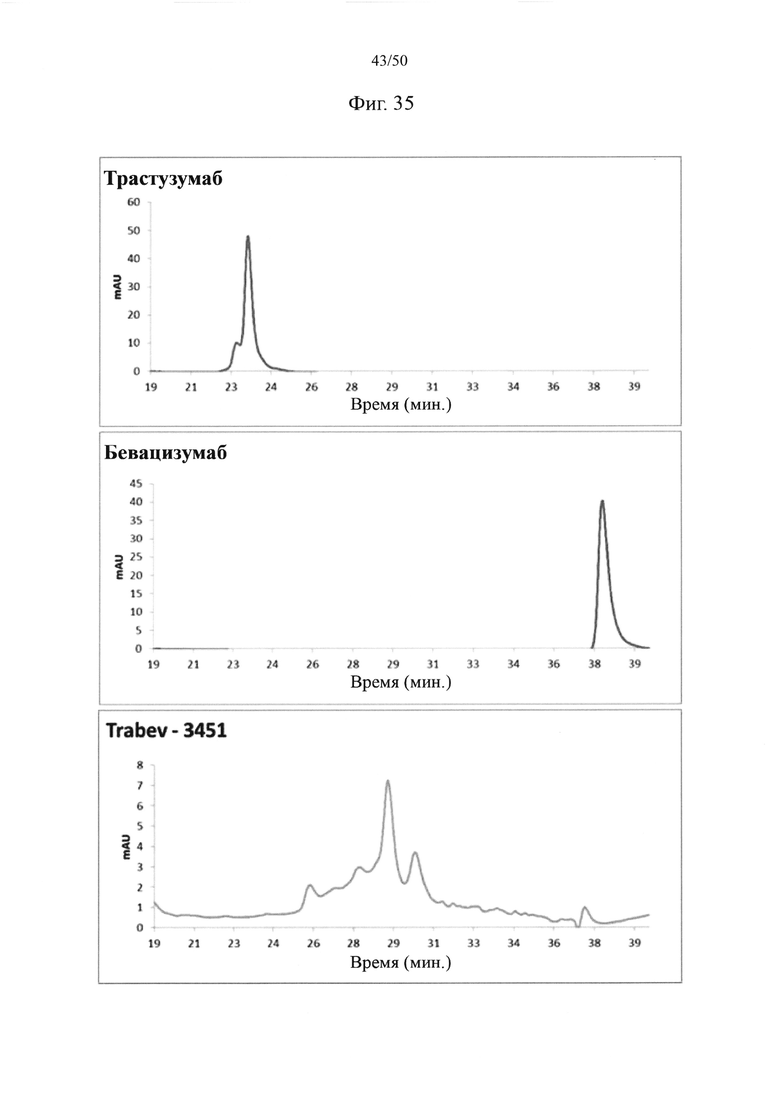
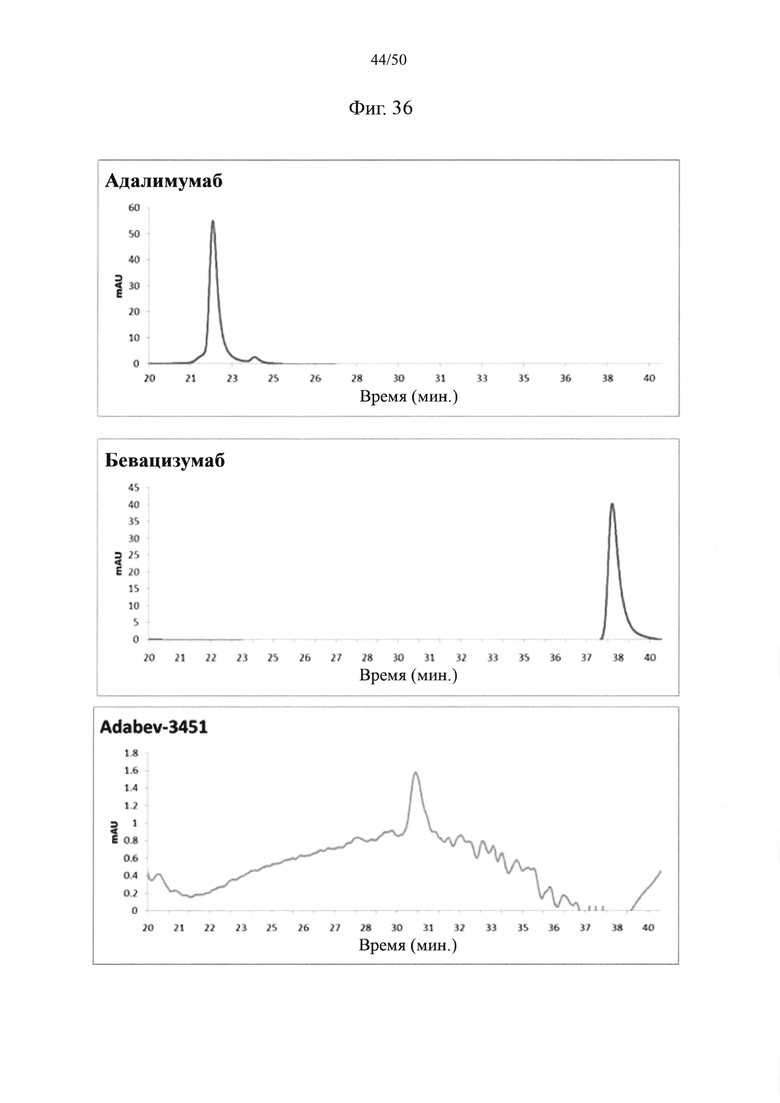
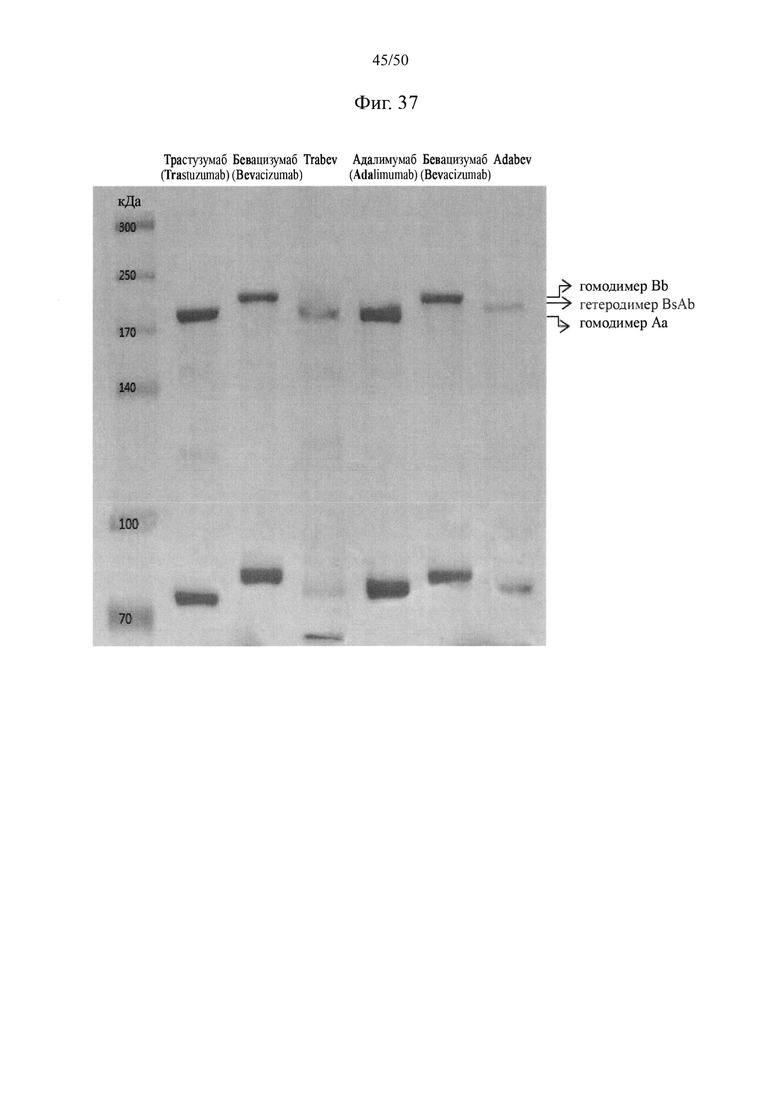
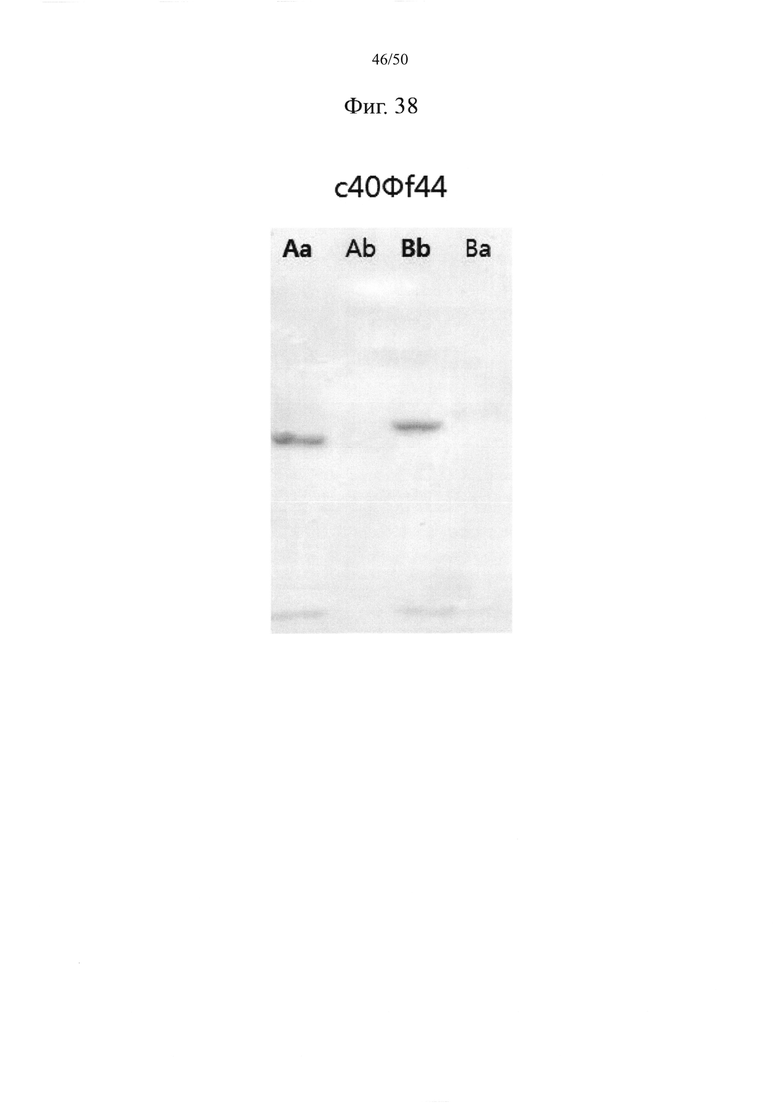
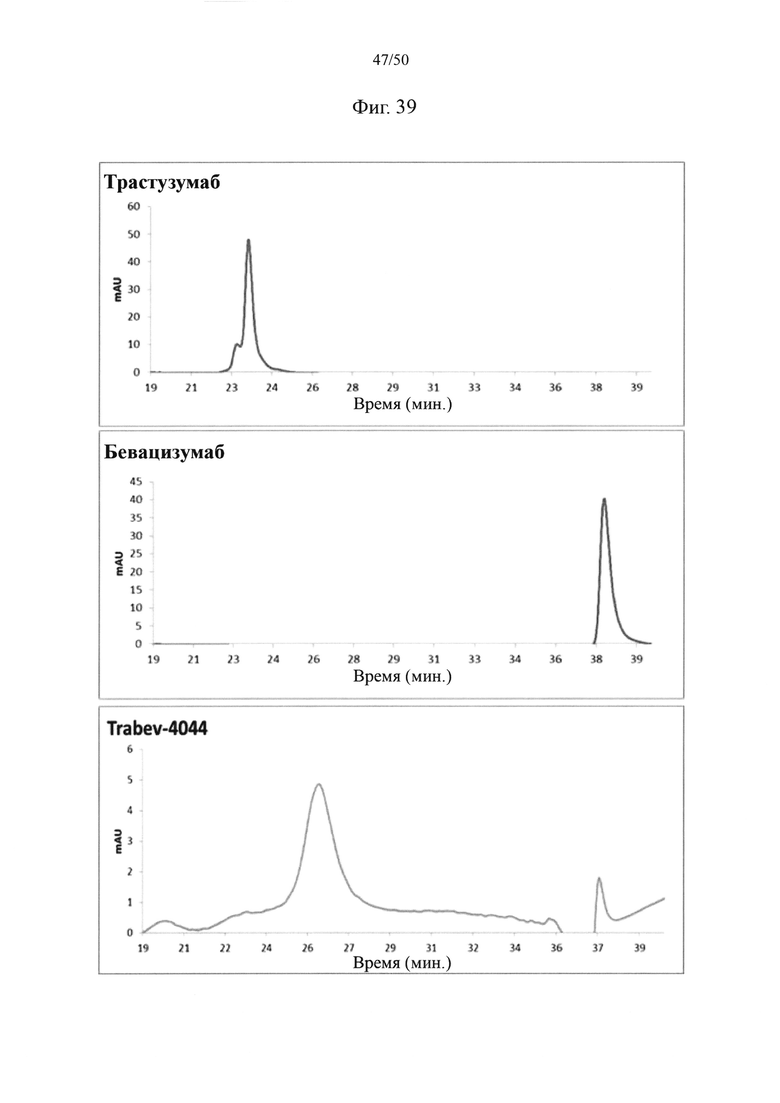
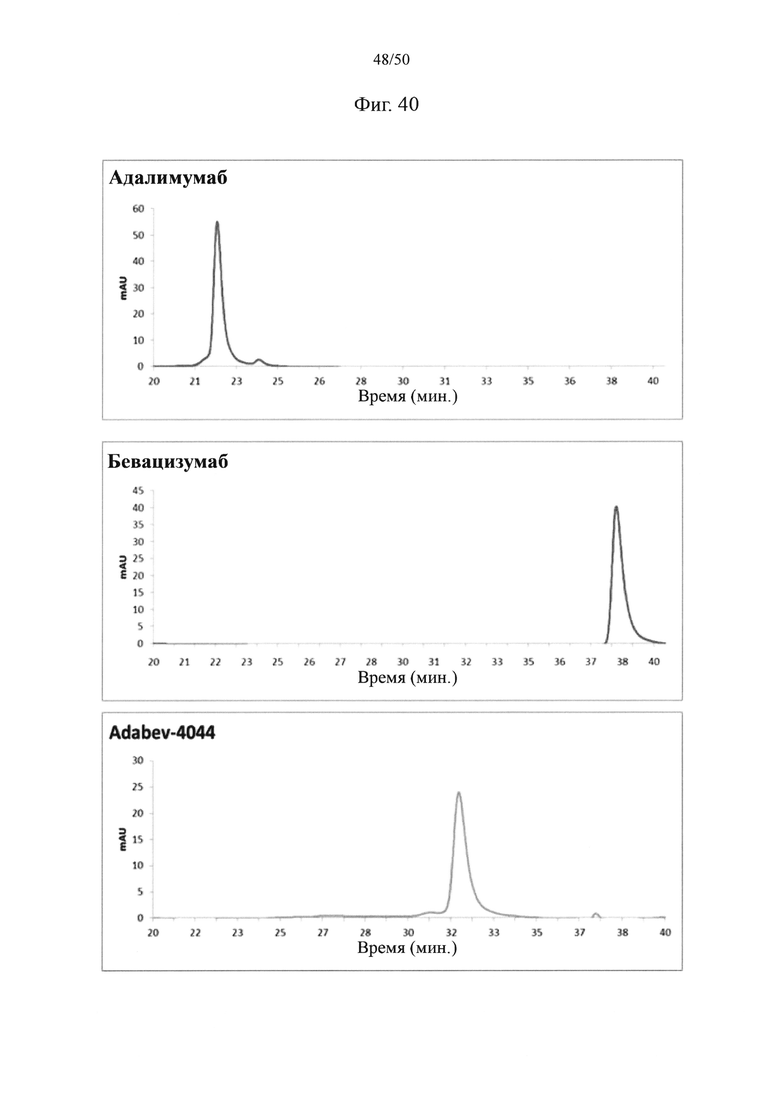
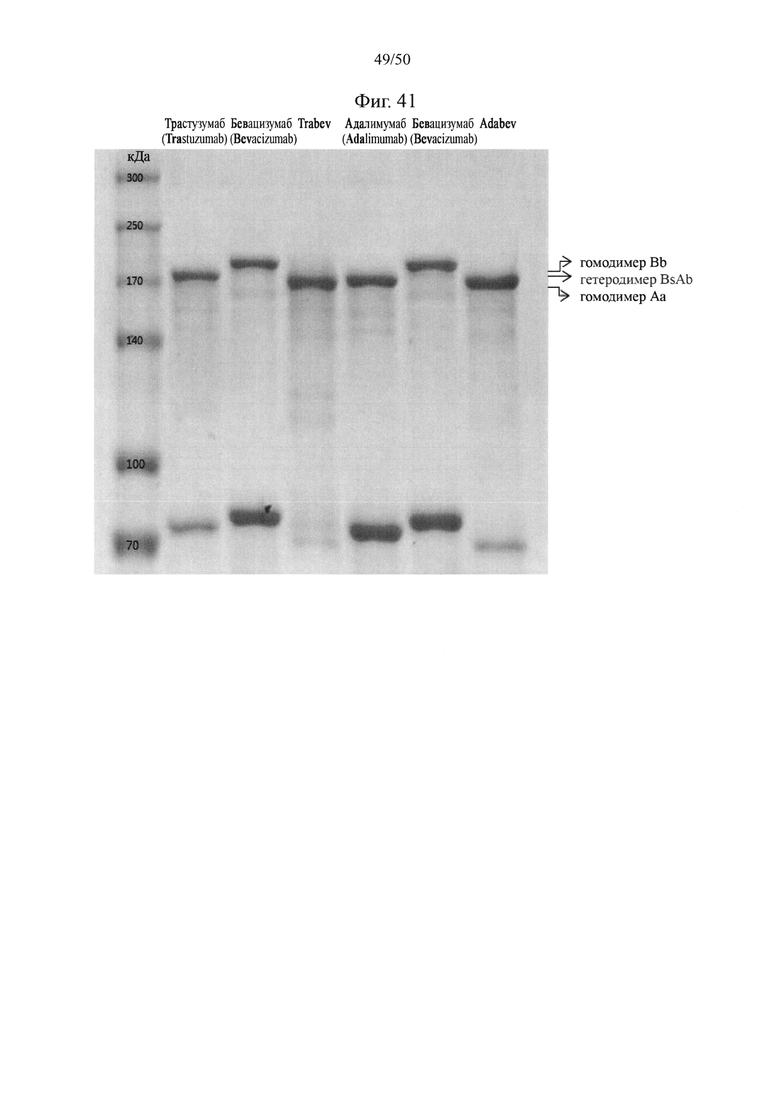
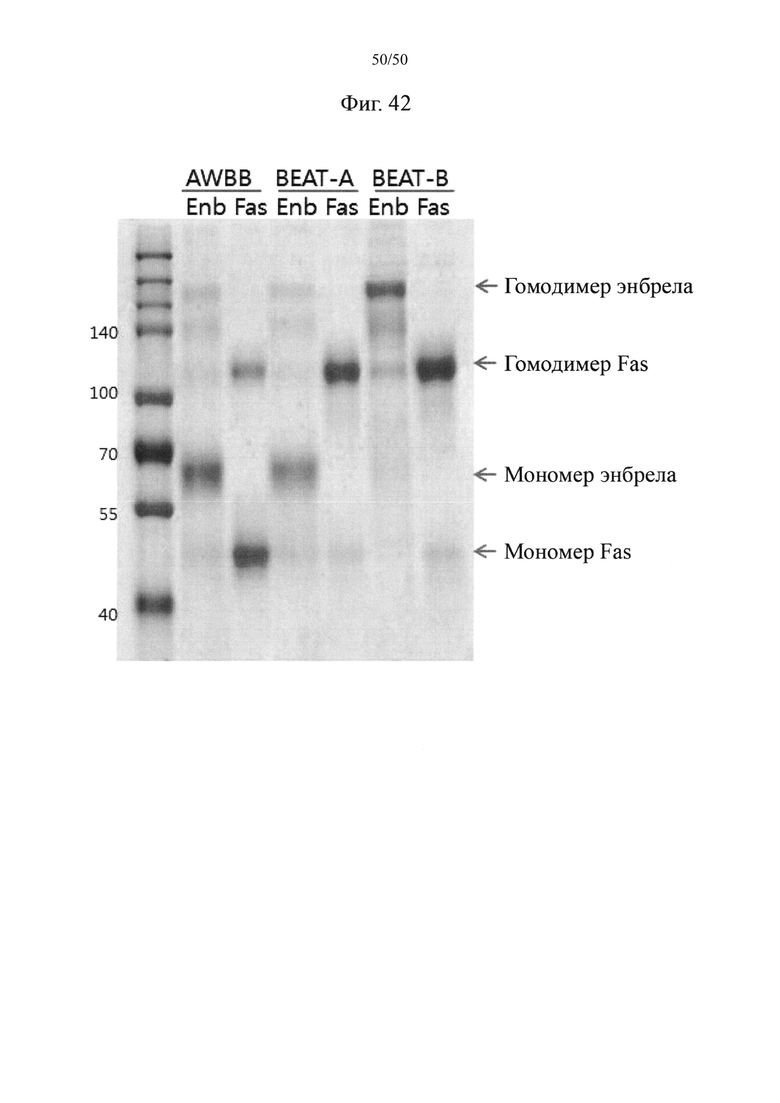
Настоящее изобретение относится к области иммунологии. Предложен способ получения биспецифического белка для связывания двух разных видов белков. Кроме того, рассмотрен биспецифический белок для связывания двух разных видов белков. Данное изобретение может найти дальнейшее применение в получении биспецифических белков с повышенной степенью гетеродимеризации константных Fc-областей. 2 н. и 6 з.п. ф-лы, 50 ил., 38 табл., 5 пр.
1. Способ получения биспецифического белка для связывания двух разных видов белков, причем способ предусматривает введение мутации в CH3-домен IgG1 (EU-нумерация) или мутации, соответствующей мутации в CH3-доменах IgG2, IgG3, IgG4, IgA1, IgA2, IgE или IgM, где мутация содержит:
(1) замену лизина в положении 409 фенилаланином или триптофаном и фенилаланина в положении 405 лизином, аргинином, глутамином или аспарагином; или
(2) комбинацию замены (1) и по меньшей мере одной замены, выбранной из группы, состоящей из (i) замены лейцина в положении 368 аспарагиновой кислотой или глутаминовой кислотой и серина в положении 364 лизином, аргинином или аспарагином и (ii) замены лизина в положении 370 серином и серина в положении 364 лизином, аргинином или аспарагином.
2. Способ по п. 1, предусматривающий введение мутации в CH3-домен IgG1 (EU-нумерация) или мутации, соответствующей по меньшей мере одной мутации в CH3-доменах IgG2, IgG3, IgG4, IgA1, IgA2, IgE или IgM, где мутация содержит:
(1) замену фенилаланина в положении 405 аргинином и лизина в положении 409 триптофаном;
замену фенилаланина в положении 405 лизином и лизина в положении 409 фенилаланином;
замену фенилаланина в положении 405 аргинином и лизина в положении 409 фенилаланином; или
замену фенилаланина в положении 405 лизином и лизина в положении 409 триптофаном, или
(2) комбинацию замены (1) и по меньшей мере одной замены, выбранной из группы, состоящей из (i) замены серина в положении 364 лизином и лейцина в положении 368 аспарагиновой кислотой и (ii) замены серина в положении 364 лизином и лизина в положении 370 серином.
3. Способ по п. 2, предусматривающий введение мутации в CH3-домен IgG1 (EU-нумерация) или мутации, соответствующей по меньшей мере одной мутации в CH3-доменах IgG2, IgG3, IgG4, IgA1, IgA2, IgE или IgM, где мутация содержит:
замену серина в положении 364 в первом CH3-домене лизином и лейцина в положении 368 во втором CH3-домене аспарагиновой кислотой и замену лизина в положении 409 в первом CH3-домене фенилаланином и фенилаланина в положении 405 во втором CH3-домене лизином;
замену серина в положении 364 в первом CH3-домене лизином и лейцина в положении 368 во втором CH3-домене аспарагиновой кислотой и замену лизина в положении 409 в первом CH3-домене фенилаланином и фенилаланина в положении 405 во втором CH3-домене аргинином;
замену серина в положении 364 в первом CH3-домене лизином и лизина в положении 370 во втором CH3-домене серином и замену лизина в положении 409 в первом CH3-домене фенилаланином и фенилаланина в положении 405 во втором CH3-домене лизином;
замену серина в положении 364 в первом CH3-домене лизином и лизина в положении 370 во втором CH3-домене серином и замену лизина в положении 409 в первом CH3-домене фенилаланином и фенилаланина в положении 405 во втором CH3-домене аргинином;
замену серина в положении 364 в первом CH3-домене лизином и лейцина в положении 368 во втором CH3-домене аспарагиновой кислотой и замену лизина в положении 409 в первом CH3-домене триптофаном и фенилаланина в положении 405 во втором CH3-домене лизином;
замену серина в положении 364 в первом CH3-домене лизином и лейцина в положении 368 во втором CH3-домене аспарагиновой кислотой и замену лизина в положении 409 в первом CH3-домене триптофаном и фенилаланина в положении 405 во втором CH3-домене аргинином;
замену серина в положении 364 в первом CH3-домене лизином и лизина в положении 370 во втором CH3-домене серином и замену лизина в положении 409 в первом CH3-домене триптофаном и фенилаланина в положении 405 во втором CH3-домене лизином;
замену серина в положении 364 в первом CH3-домене лизином и лизина в положении 370 во втором CH3-домене серином и замену лизина в положении 409 в первом CH3-домене триптофаном и фенилаланина в положении 405 во втором CH3-домене аргинином.
4. Способ по любому из пп. 1-3, где биспецифический белок представляет собой биспецифическое антитело или его антигенсвязывающий фрагмент, содержащие первый CH1-домен и первый CL-домен (константная область легкой цепи), происходящие соответственно из тяжелой цепи и легкой цепи антитела, распознающего первый эпитоп, и второй CH1-домен и второй CL-домен, происходящие соответственно из тяжелой цепи и легкой цепи антитела, распознающего второй эпитоп,
где способ дополнительно предусматривают введение по меньшей мере одной из следующих мутаций в CH1-доменах и CL-доменах:
мутация, при которой из двух аминокислот, составляющих каждую пару из одной или нескольких первых пар аминокислот, выбранных из пар аминокислот, образующих соответствующие связи аминокислота-аминокислота между первым CH1-доменом и первым CL-доменом, одна заменена аминокислотой с положительным зарядом, а другая заменена аминокислотой с отрицательным зарядом; и
мутация, при которой из двух аминокислот, составляющих каждую пару из одной или нескольких вторых пар аминокислот, выбранных из пар аминокислот, образующих соответствующие связи аминокислота-аминокислота между вторым CH1-доменом и вторым CL-доменом, одна заменена аминокислотой с положительным зарядом, а другая заменена аминокислотой с отрицательным зарядом, и
где аминокислота с положительным зарядом представляет собой лизин или аргинин, аминокислота с отрицательным зарядом представляет собой аспарагиновую кислоту или глутаминовую кислоту.
5. Способ по п. 4, где:
аминокислоты, замененные соответственно в первом CH1-домене и втором CH1-домене, имеют противоположные заряды,
аминокислоты, замененные соответственно в первом CL-домене и первом CH1-домене, имеют противоположные заряды, и
аминокислоты, замененные соответственно во втором CL-домене и втором CH1-домене, имеют противоположные заряды.
6. Способ по п. 4, где аминокислота, подлежащая замене аминокислотой с положительным или отрицательным зарядом в CH1-домене, представляет собой по меньшей мере одну из следующих аминокислот, исходя из CH1-домена IgG1 (EU-нумерация), или аминокислоту в положении, соответствующем по меньшей мере одной аминокислоте в CH1-доменах IgG2, IgG3, IgG4, IgA1, IgA2, IgE или IgM:
лейцин в положении 145,
серин в положении 183,
лизин в положении 147,
фенилаланин в положении 170,
пролин в положении 171 и
валин в положении 185, и
аминокислота, подлежащая замене аминокислотой с положительным или отрицательным зарядом в CL-домене, представляет собой по меньшей мере одну из следующих аминокислот, исходя из CL-домена каппа-типа (EU-нумерация), или аминокислоту в положении, соответствующем по меньшей мере одной аминокислоте в CL-домене лямбда-типа:
серин в положении 131,
валин в положении 133,
лейцин в положении 135,
серин в положении 162 и
треонин в положении 180.
7. Способ по п. 4, где
набор из двух аминокислот, образующих пару аминокислот между CH1-доменом и CL-доменом, представляет собой по меньшей мере одну из следующих пар аминокислот, исходя из CH1-домена IgG1 и CL-домена каппа-типа (EU-нумерация), или по меньшей мере одну пару аминокислот в положении, соответствующем по меньшей мере одной паре аминокислот в CH1-доменах и CL-домене лямбда-типа IgG2, IgG3, IgG4, IgA1, IgA2, IgE или IgM:
пара лейцина в положении 145 в CH1-домене и серина в положении 131 в CL-домене,
пара лейцина в положении 145 в CH1-домене и валина в положении 133 в CL-домене,
пара серина в положении 183 в CH1-домене и валина в положении 133 в CL-домене,
пара лизина в положении 147 в CH1-домене и треонина в положении 180 в CL-домене,
пара валина в положении 185 в CH1-домене и лейцина в положении 135 в CL-домене,
пара фенилаланина в положении 170 в CH1-домене и лейцина в положении 135 в CL-домене и
пара пролина в положении 171 в CH1-домене и серина в положении 162 в CL-домене.
8. Биспецифический белок для связывания двух разных видов белков, содержащий
антитело, распознающее первый эпитоп, представляет собой антитело к вирусу гриппа типа B, содержащее вариабельную область тяжелой цепи SEQ ID NO: 27 и вариабельную область легкой цепи SEQ ID NO: 31, и
антитело, распознающее второй эпитоп, представляет собой антитело к вирусу гриппа типа A, содержащее вариабельную область тяжелой цепи SEQ ID NO: 29 и вариабельную область легкой цепи SEQ ID NO: 31.
| Токарный резец | 1924 |
|
SU2016A1 |
| Токарный резец | 1924 |
|
SU2016A1 |
| Токарный резец | 1924 |
|
SU2016A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| ЕА 16517 В1, 30.05.2012. | |||
Авторы
Даты
2021-03-30—Публикация
2017-07-19—Подача