Изобретение относится к молекулярной генетике, а именно к способам определения полиморфизма генов, в частности гена гуанилат-связывающего белка 1, индуцированного интерфероном (GBP1), обуславливающего устойчивость к репродуктивно-респираторному синдрому РРСС, и может быть использовано в селекции свиней.
Одним из заболеваний, наносящих ущерб свиноводству является репродуктивно-респираторный синдром. Вирус РРСС представляет собой вирус РНК с положительной цепью, относящийся к семейству Arteriviridae1. Наибольший экономический вред данное заболевание наносит вследствие репродуктивной недостаточности, абортов, появления у свиноматок мумифицированных и мертворожденных поросят; проблем с дыханием, снижения продуктивности у растущих животных [Zimmerman, J., Benfield, D.A., Murtaugh, M.P., Osorio, F., Stevenson, G.W., Tottemorell, M., 2006. Porcine reproductive and respiratory syndrome virus (porcine arterivirus). In: Straw, B.E., Zimmerman, J.J., D'Allaire, S., Taylor, D.J. (Eds.), Diseases of Swine, 9th Edition. Blackwell Publishing Professional, Ames, pp. 387-417.; Rowland, R.R., Lunney,J., Dekkers, J., 2012. Control of porcine reproductive and respiratory syndrome (PRRS) through genetic improvements in disease resistance and tolerance. Frontiers in Genetics. 3:260.]. Вакцинация для защиты от РРСС не достаточно эффективна [Murtaugh MP, Genzow М (2011) Immunological solutions for treatment and prevention of porcine reproductive and respiratory syndrome (PRRS). Vaccine 29: 8192-8204; Geldhof MF, Van Breedam W, De Jong E, Rodriguez AL, Karniychuk UU, et al. (2013) Antibody response and maternal immunity upon boosting PRRSV-immune sows with experimental farmspecific and commercial PRRSV vaccines. Veterinary Microbiology 167: 260-271.], в первую очередь из-за высокой степени антигенного и генетического дрейфа в вирусных структурах и неструктурных вирусных белках и способности вируса подавлять ранний врожденный иммунный ответ [Fang Y, Schneider Р, Zhang W, Faaberg K, Nelson E, et al. (2007) Diversity and evolution of a newly emerged North American Type 1 porcine arterivirus: analysis of isolates collected between 1999 and 2004. Archives of virology 152: 1009-1017.; Mateu E, Diaz I (2008) The challenge of PRRS immunology. The Veterinary Journal 177: 345-351.].
Развитие полногеномных методов анализа, в частности GWAS (геномно-ассоциированные исследования) способствовало выявлению локуса количественных признаков (QTL), ассоциированного с устойчивостью к репродуктивно-респираторному синдрому свиней. В последующем эффект данного QTL в целом и WUR, в частности, был успешно подтвержден на свиньях различного генетического происхождения [Boddicker N.J., Garrick D.J., Reecy J.M., Rowland В., Lunney J.K., Dekkers J.C.M. Quantitative Trait Locus on Sus scrofa Chromosome 4 Associated with Host Response to Experimental Infection with Porcine Reproductive and Respiratory Syndrome Virus // Animal Industry Report: AS 659, ASL R2823, 2013. Available at: https://lib.dr.iastate.edu/ans_air/vol659/iss1/74; Boddicker NJ, Bjorkquist A, Rowland RRR, Lunney JK, Reecy JM, Dekkers JCM. Genome-wide association and genomic prediction for host response to porcine reproductive and respiratory syndrome virus infection. Genet Sel Evol. 2014. 46:1-14. doi: 10.1186/1297-9686-46-18.]. Показано, что нуклеотидная замена A→G в позиции 139666819 SSC4 (rs80800372, Sscrofa10.2.), ассоциирована с устойчивостью в репродуктивно-респираторному синдрому свиней [Koltes J.E., Fritz-Waters Е., Eisley C.J., Choi I., Bao H., Kommadath A., Serão N.V.L., Boddicker N.J., Abrams S.M., Schroyen M., Loyd H., Tuggle C.K., Plastow G.S., Guan L., Stothard P., Lunney J.K., Liu P., Carpenter S., Rowland R.R.R., Dekkers J. С.M., Reecy J.M. Identification of a putative quantitative trait nucleotide in guanylate binding protein 5 for host response to PRRS virus infection. BMC Genomics201516:412 https://doi.org/10.1186/s12864-015-1635-9]. При этом аллель G является желательным в условиях вирусной нагрузки, обусловленной как инфекцией, так и вакцинацией [Koltes JE, Fritz-Waters Е, Eisley CJ, Choi I, Bao H, Kommadath A, et al. Identification of a putative quantitative trait nucleotide in guanylate binding protein 5 for host response to PRRS virus infection. BMC Genomics. 2015; 16:1-13. doi: 10.1186/s12864-015-1635-9.].
Анализ научно-технической, патентной и иной информации показал, что единственным применяемым сегодня способом диагностики полиморфизма ДНК-маркера WUR10000125, ассоциированного с устойчивостью к РРСС, используемым в качестве аналога, является генотипирование с использованием чипов 60K Illumina или 70К Neogen [Boddicker N., Waide E.H., Rowland R.R.R., Lunney J.K., Garrick D.J., Reecy J.M., Dekkers J.C.M. Evidence for a major QTL associated with host response to Porcine Reproductive and Respiratory Syndrome Virus challenge. Journal of Animal Science, Volume 90, Issue 6, 1 June 2012, Pages 1733-1746, https://doi.org/10.2527/jas.2011-4464]. Однако проведение ДНК-диагностики данным способом характеризуется высокими материальными затратами: потребность в дорогостоящем оборудовании - сканер чипов Iscan (Illumina, США), приобретение чипов PorcineSNP60v2 BeadChip (Illumina, США) или аналогов, необходимость владения навыками работы с соответствующим программным обеспечением, позволяющим производить генотипирование.
В качестве прототипа заявленного способа, наиболее близким по технической сущности и достигаемому результату, можно считать проведение ПЦР с последующим пиросеквенированием [Форнара М.С, Бардуков Н.В., Костюнина О.В., Садкова Я.А., Казьмина Н.А., Зиновьева Н.А. Селекция на устойчивость к PRRS - новая стратегия снижения экономических потерь, обусловленных заболеванием. Свиноводство. 2018. №5. С. 17-19.].
Основной недостаток прототипа заключается в необходимости использования дорогостоящего оборудования и расходных материалов зарубежного происхождения (наборы для пиросеквенирования PyroMark Gold).
При создании настоящего изобретения задача состояла в разработке способа идентификации аллелей А и G ДНК-маркера WUR10000125 в гене GBP1, ассоциированного с устойчивостью к РРСС, с целью выявления носителей желательного генетического варианта и разработки программ их использования в селекции для увеличения частоты встречаемости генетически устойчивых к репродуктивно-респираторному синдрому свиней.
Задача нашего изобретения - создание простого, специфичного способа идентификации полиморфизма WUR10000125 в гене GBP1, ассоциированного с устойчивостью к РРСС, для использования в селекции свиней.
Технический результат изобретения достигается тем, что предложен способ диагностики полиморфизма WUR10000125, ассоциированного с устойчивостью к РРСС, для использования в селекции свиней, включающий специфичный метод полимеразной цепной реакции, позволяющий проводить идентификацию результатов в режиме реального времени, что обеспечит снижение трудоемкости, увеличение производительности, возможности использования реагентов отечественного производства, относительно невысокую стоимость разрабатываемого способа.
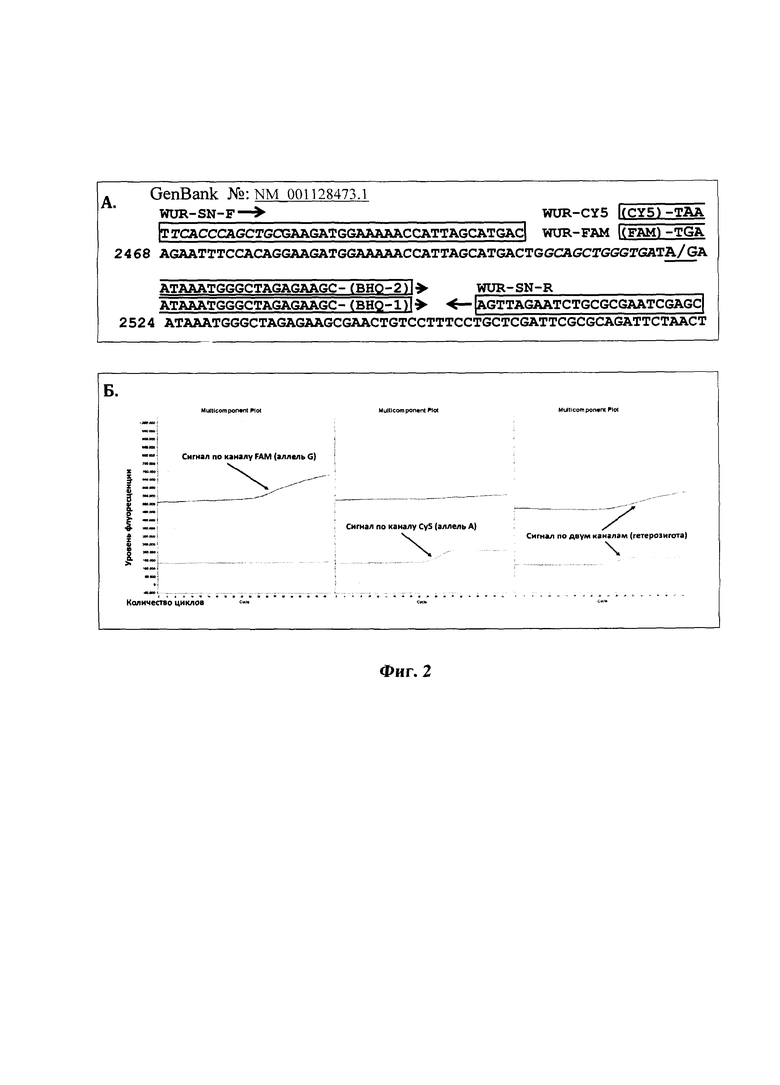
Принцип действия разрабатываемого способа основан на использовании с использованием двух специфических праймеров WUR-SN-F и WUR-SN-R и двух аллель-специфичных зондов, помеченных флуоресцентными метками. При этом зонд для идентификации аллеля G, ассоциированного с устойчивостью к репродуктивно-респираторному синдрому свиней, помечен красителем FAM, а зонд для идентификации аллеля А помечен красителем CY5.
Способ отличается тем, что с применением нескольких технически простых и не требующих дорогостоящих реактивов, затрат сил и времени методов, возможно выявление устойчивого к РРСС аллеля G ДНК-маркера WUR10000125, что позволит применить данный метод в селекции животных.
Сущность изобретения - определение полиморфизма ДНК-маркера WUR10000125, ассоциированного с устойчивостью к репродуктивно-респираторному синдрому свиней, методом ПЦР в режиме реального времени.
Разрабатываемый способ базируется на определении нуклеотидной замены A→G в позиции 139666819 SSC4 (rs80800372, Sscrofa10.2.). С этой целью выбран участок гена GBP1, содержащий полиморфизм WUR10000125.
Тест-система предусматривает амплификацию в режиме реального времени фрагмента длиной 114 п.о., содержащего область мутации, с использованием двух специфических праймеров WUR-SN-F (5'-TTCACCCGCTGCGAAGATGGAAAAACCATTAGCATGAC-3') и WUR-SN-R (5'-AGTTAGAATCTGCGCGAATCGAGC-3') и двух аллель-специфичных зондов, окрашенных красителями FAM (FAM-TGAATAAATGGGCTAGAGAAGC-BHQ-1) и CY5 (CY5-TAAATAAATGGGCTAGAGAAGC-BHQ-2).
При подборе праймеров и зондов использовалась технология «Snake», подробно описанная в статье [Kutyavin I.V. New approach to real-time nucleic acids detection: folding polymerase chain reaction amplicons into a secondary structure to improve cleavage of Forster resonance energy transfer probes in 5 -nuclease assays. Nucl Acid Res 2010; 38.]. Как и в широко распространенном «TaqMan», в «Snake» применяют флуоресцентно-меченые зонды, связывающиеся с ДНК-мишенью и расщепляемые полимеразой в процессе синтеза новых ампликонов. Главным отличием является дизайн прямого праймера, на 5'-конец которого добавляют участок, комплиментарный области левее полиморфного нуклеотида в уже синтезированном ампликоне (на Фиг. 2А в последовательности прямого праймера этот участок выделен курсивом, также курсивом выделена область его посадки в ампликоне). При расщеплении флуоресцентно-меченного зонда этот участок выполняет роль прямого праймера и является затравкой для посадки Taq-полимеразы. Флуоресцентно меченый зонд перекрывается с участком-затравкой на 1 нуклеотид (Фиг. 2А), при этом в участке-затравке этот нуклеотид некомплиментарен последовательности ампликона. Подобная конструкция с одной стороны позволяет Taq-полимеразе осуществить деградацию зонда за счет 5',3'-экзонуклеазной активности, а с другой стороны - затрудняет синтез цепи при отсутствии связывания зонда. Для эффективной дифференциации аллелей гибридизационные зонды спланированы таким образом, что полиморфный нуклеотид является вторым с 5'-конца (Фиг. 2А).
Для создания серии референтных образцов с известными генотипами по WUR10000125 (n=48) были использованы образцы ткани (ушной выщип, свиней пород крупная белая, ландрас и дюрок. ДНК выделяли с использованием ноаборов ДНК Экстран 2 (ЗАО «Компания Синтол», Россия) и колонок Nexttec (Nexttec Biotechnologie GmbH, Германия) в соответствии с рекомендациями производителей. Каждым из вышеназванных методов выделяли ДНК из 24 образцов ткани. Создание серии референтных генотипов проводили посредством пиросеквенирования. С этой целью проводили амплификацию фрагмента длиной 153 п.о., с использованием биотином меченного праймера и последующим пиросеквенированием продукта амплификации.
Краткое описание чертежей
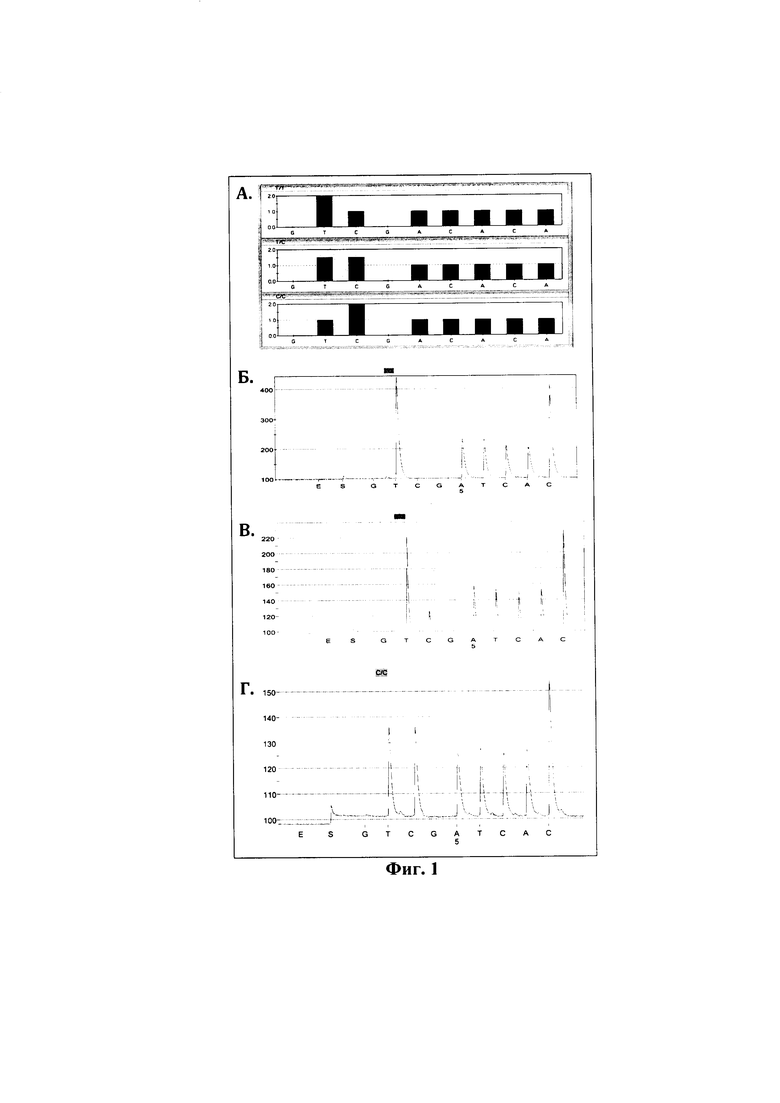
Фиг. 1 - теоретическая модель тест-системы определения полиморфизма ДНК-маркера WUR10000125 на основе метода ПЦР с последующим пиросеквенированием (А) и результаты генотипирования референтных образцов (Б, В и Г).
На фиг.1А представлены теоретически смоделированные гистограммы возможных генотипов WUR10000125, где на верхнем рисунке гистограмма соответствует генотипу ТТ, на среднем - ТС и на нижнем - СС. На фиг. 1Б представлена результирующая пикограмма последовательности гена GBP1 в области исследуемой мутации соответствующая генотипу ТТ, на фиг. 1В - результирующая пикограмма последовательности GBP1 в области исследуемой мутации соответствующая генотипу ТС.
В результате проведенного генотипирования была создана серия референтных образцов (n=48), в том числе 2 образца с генотипом GG (устойчивый к РРСС), 10 образцов с генотипом AG (гетерозиготный), 36 образцов с генотипом АА (чувствительный к РРСС).
Определение полиморфизма WUR10000125 предложенным способом выполняли следующим образом:
1. Исходя из локализации мутации были подобраны два специфических праймера:
WUR-SN-F (5'-TTCACCCAGCTGCGAAGATGGAAAAACCATTAGCATGAC-3')
WUR-SN-R (5'-AGTTAGAATCTGCGCGAATCGAGC-3').
2. Исходя из последовательности гена, были подобраны два аллель-специфичных зонда, окрашенные красителями:
FAM (FAM-TGAATAAATGGGCTAGAGAAGC-BHQ-1)
CY5 (CY5-TAAATAAATGGGCTAGAGAAGC-BHQ-2).
Фиг. 2А иллюстрирует описанный выше вариант настоящего изобретения.
3. Выполняли 48 циклов ПЦР в 15 мкл реакционной смеси следующего состава: 1×ПЦР буфер (20 мМ (NH4)2SO4, 75 мМ Трис-HCl, рН=8.8, 0.1% (v/v) Tween 20, 1,67 мМ MgCl2,), 0,25 мМ дНТФ, 4.5 пкМ каждого из праймеров, 3 пкМ каждого зонда, 1 Ед Taq-полимеразы и 1 мкл ДНК при следующем температурно-временном режиме: начальная денатурация при 95°С - 8 мин; 48 циклов последовательно - 95°С - 15 с, 59.5°С - 80 с, 72°С - 5 с.
4. Определение аллелей А и G ДНК-маркера WUR10000125 осуществляли методом ПЦР с детекцией результатов в режиме реального времени, где аллелю G соответствуют кривые флуоресценции на канале FAM, а аллелю А - кривые флуоресценции на канале Су5. (Фиг. 2Б).
5. Результативность разработанной тест-системы оценивали посредством сравнения результатов генотипирования референтных образцов.
Пример. Контрольное использование предложенного способа определения полиморфизма WUR10000125 было апробировано на 685 свиньях породы дюрок, 2069 свиньях породы крупная белая, 1754 свиньях породы ландрас, 21 свинье породы пьетрен. Исследование выявило частоту генотипов AG и GG - 17,75 и 2,80%%, соответственно, по всем животным в совокупности. Частота аллеля G и генотипа GG внутри пород варьировала в диапазоне 0,013-0,230 и 0,00-6,84%%, соответственно. Таким образом, разработанный способ может быть использован для выявления животных, являющихся носителями аллеля G гена GBP1, ассоциированного с устойчивостью к репродуктивно-респираторному синдрому свиней.
Предложенный способ применим в генетике сельскохозяйственных животных для выявления полиморфизма ДНК-маркера WUR10000125 свиней, ассоциированного с устойчивостью к РРСС, с целью последующего использования полученных результатов в разведении и селекции свиней.
| название | год | авторы | номер документа |
|---|---|---|---|
| Набор синтетических олигонуклеотидных праймеров для выявления и генотипирования вируса репродуктивного и респираторного синдрома свиней первого типа в полимеразной цепной реакции | 2024 |
|
RU2834941C1 |
| Способ идентификации вируса репродуктивно-респираторного синдрома свиней на основе ПЦР в реальном времени | 2019 |
|
RU2761496C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПОЛИМОРФИЗМА ГЕНА РЕЦЕПТОРА МЕЛАНОКОРТИНА 4 (MC4R), АССОЦИИРОВАННОГО С МЯСНЫМИ И ОТКОРМОЧНЫМИ КАЧЕСТВАМИ СВИНЕЙ | 2019 |
|
RU2745902C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АЛЛЕЛЕЙ ГЕНОВ RYR1, DMD И ESR1 МЕТОДОМ ПЦР В "РЕАЛЬНОМ ВРЕМЕНИ", А ТАКЖЕ С ПОМОЩЬЮ ВЫСОКОПРОИЗВОДИТЕЛЬНОЙ ПЦР В ФОРМАТЕ МИКРОЧИПА | 2019 |
|
RU2744595C1 |
| ЖИВОТНЫЕ, УСТОЙЧИВЫЕ К ВИРУСУ РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ | 2012 |
|
RU2644673C2 |
| СПОСОБ ДИАГНОСТИКИ ВИРУСНОГО РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ С ПОМОЩЬЮ ФЛУОРЕСЦЕНТНОЙ ГИБРИДИЗАЦИИ IN-SITU (FISH) | 2023 |
|
RU2823531C1 |
| Способ выявления и генотипирования РНК вируса репродуктивно-респираторного синдрома свиней | 2018 |
|
RU2703394C1 |
| Тест-система для выявления и генотипирования РНК вируса репродуктивно-респираторного синдрома свиней | 2018 |
|
RU2703401C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПОЛИМОРФИЗМА ГЕНА DMD, ОБУСЛАВЛИВАЮЩЕГО НАЛИЧИЕ СТРЕСС-СИНДРОМА У СВИНЕЙ | 2018 |
|
RU2726825C2 |
| КОМПОЗИЦИЯ ДЛЯ ЗАЩИТЫ СВИНЕЙ ОТ ИНФЕКЦИИ РРСС-ВИРУСА (ВАРИАНТЫ) И ВАКЦИНА, СОДЕРЖАЩАЯ УКАЗАННУЮ КОМПОЗИЦИЮ (ВАРИАНТЫ) | 2006 |
|
RU2381035C2 |
Изобретение относится к биотехнологии, в частности к способам определения полиморфизма генов, ассоциированных с устойчивостью к заболеваниям свиней, а именно ДНК-маркера WUR10000125 в гене GBP1, ассоциированного с устойчивостью к репродуктивно-респираторному синдрому свиней. Технический результат предлагаемого изобретения достигается тем, что предложен способ определения полиморфизма A→G в позиции 139666819 SSC4 (сборка генома Sscrofa10.2.) гена GBP1 свиней, ассоциированного с устойчивостью к репродуктивно-респираторному синдрому свиней, включающий ПЦР с детекцией результатов в режиме реального времени, где аллелю G соответствуют кривые флуоресценции на канале FAM, а аллелю А - кривые флуоресценции на канале Су5. 1 пр., 2 ил.
Способ диагностики полиморфизма WUR10000125, ассоциированного с устойчивостью к репродуктивно-респираторному синдрому свиней, методом ПЦР с детекцией результатов в режиме реального времени, с использованием двух специфичных праймеров WUR-SN-F (5'-TTCACCCGCTGCGAAGATGGAAAAACCATTAGCATGAC-3') и WUR-SN-R (5'-AGTTAGAATCTGCGCGAATCGAGC-3') и двух аллель-специфичных зондов, окрашенных красителями FAM (FAM-TGAATAAATGGGCTAGAGAAGC-BHQ-1) и CY5 (CY5-TAAATAAATGGGCTAGAGAAGC-BHQ-2), где аллелю G соответствуют кривые флуоресценции на канале FAM, а аллелю А - кривые флуоресценции на канале Су5.
| Andrea Ladinig et al | |||
| Maternal and fetal predictors of fetal viral load and death in third trimester, type 2 porcine reproductive and respiratory syndrome virus infected pregnant gilts, Veterinary Researchvolume 46, 25.09.2015 | |||
| ОКСАНИЧ А.С | |||
| МУЛЬТИПЛЕКСНАЯ ПЦР В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ ДЛЯ БЫСТРОГО ВЫЯВЛЕНИЯ ЭНТЕРОВИРУСОВ, АДЕНОВИРУСОВ И ВИРУСА |
Авторы
Даты
2021-04-02—Публикация
2018-12-05—Подача