Область изобретения
Настоящее изобретение относится к новому применению соединения 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламида (орвепитанта) или его фармацевтически приемлемых солей и содержащих его фармацевтических композиций для лечения хронического кашля, в частности, хронического кашля, вызванного или связанного с интерстициальными легочными болезнями (ILD - от англ. interstitial lung disease), включая идиопатический легочный фиброз (IPF - от англ. idiopathic pulmonary fibrosis), с опухолями легких или с хронической обструктивной болезнью легких (ХОБЛ или COPD - от англ. chronic obstructive pulmonary disease).
Уровень техники изобретения
В WO 2003/066635 описан ряд диазабициклических производных в качестве антагонистов тахикининовых рецепторов, также известных как рецепторы вещества Р (SP - от англ. substance Р) или рецепторы нейрокинина (NK-рецепторы - от англ. neurokinin receptors) и, в частности, рецепторы нейрокинина 1 (NK-1-рецепторы - от англ. neurokinin-1 receptors), включая 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (также известный как орвепитант).
Орвепитант, также известный как 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид, обладает следующей химической структурой (I).
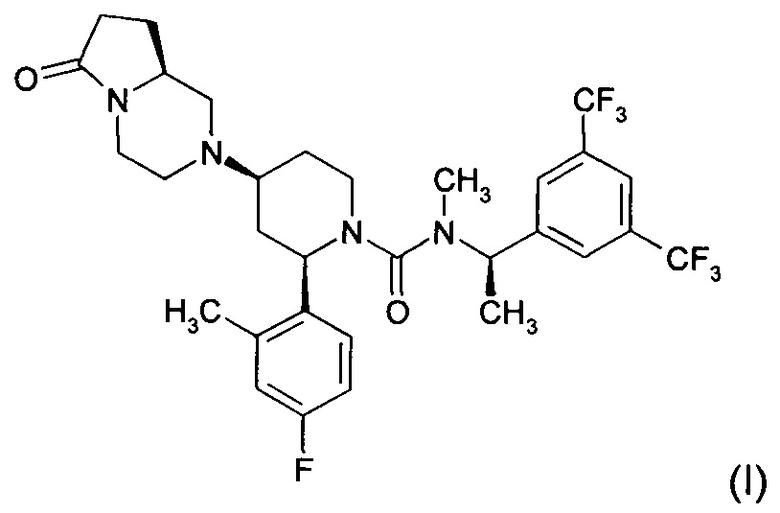
В дальнейшем любая ссылка на орвепитант относится к соединению (I).
Орвепитант также может быть известен:
под названием, соответствующим индексу Химической Реферативной Службы (CAS - от англ. Chemical Abstracts Service)
1-Пиперидинкарбоксамид, N-[(1R)-1-[3,5-бис(трифторметил)фенил]этил]-2-(4-фтор-2-метилфенил)-4-[(8aS)-гексагидро-6-оксопирроло[1,2-а]пиразин-2(1H)-ил]-N-метил-, (2R,4S)
и
под названием по ИЮПАК:
(2R,4S)-N-{(1R)-1-[3,5-бис(трифторметил)фенил]этил}-2-(4-фтор-2-метилфенил)-N-метил-4-[(8aS)-6-оксогексагидропирроло[1,2-а]пиразин-2(1H)-ил]-1-пиперидинкарбоксамид.
Предпочтительная соль соединения (I) представляет собой его хлористоводородную соль, которая также известна как орвепитант гидрохлорид.
Дополнительная предпочтительная соль соединения (I) представляет собой его малеатную соль, которая также известна как орвепитант малеат.
В WO 2009/124996 описана новая кристаллическая форма орвепитанта малеата, а именно, безводная кристаллическая форма (форма 1).
Соединение (I), его фармацевтически приемлемые соли описаны в вышеупомянутых описаниях в качестве антагонистов тахикининовых рецепторов, также известных как рецепторы вещества Р (SP) или NK-рецепторы и, в частности, NK-1-рецепторы, как in vitro, так и in vivo, и, таким образом, подходят для лечения состояний, опосредуемых тахикининами, включая SP и другие нейрокинины.
В частности, соединение (I) и его фармацевтически приемлемые соли или сольваты описаны как подходящие для лечения расстройств центральной нервной системы (ЦНС).
Авторы настоящего изобретения неожиданно обнаружили, что соединение (I) или его фармацевтически приемлемые соли также подходят для лечения хронического кашля.
Трудно поддающийся лечению хронический кашель, также известный как хронический кашель, трудно поддающийся лечению, хронический необъяснимый кашель, хронический недиагностированный кашель, хронический идиопатический кашель, синдром кашлевой гиперчувствительности, хронический трудноизлечимый кашель или хронический кашель, устойчивый к лечению, определяют как хронический кашель в течение периода, больше или равного 8 неделям, для которого невозможно определить объективное свидетельство основной причины после обычного клинического исследования, или кашель, который не поддавался лечению стандартными способами по выявленной основной причине.
Кашель представляет собой защитное рефлекторное действие дыхательной системы, которое активируется для очистки верхних дыхательных путей (Chung & Pavord, Lancet 2008; 371:1364-74). Тем не менее, чрезмерный кашель является наиболее распространенной причиной у пациентов, обращающихся за медицинской помощью (Burt & Schappert, Vital and health statistics. Series 13, Data from the National Health Survey 2004; (157):1-70; Schappert & Burt, Series 13, Data from the National Health Survey 2006; (159):1-66) и оказывает значительное влияние на качество жизни пациентов (French et al., Archives of internal medicine 1998; 158(15):1657-61; French et al., Chest 2005; 127(6): 1991-8).
Кашель чаще всего связан с вирусными инфекциями верхних дыхательных путей, когда данный симптом обычно спонтанно прекращается в течение 3-недельного периода. Хронический кашель (который сохраняется в тяжелой форме в течение более восьми недель), тем не менее, может затрагивать до 12% населения Великобритании (Ford et al., Thorax 2006; 61(11):975-9) и 18% США (Barbee et al., Chest. 1991; 99(1):20-6), поражая женщин чаще чем мужчин, и, как правило, возникает в среднем возрасте (Ford et al., Thorax 2006; 61(11):975-9; Irwin et al., The American review of respiratory disease 1981; 123(4 Pt 1):413-7; Irwin et al., Chest 2006; 129(1 Suppl):1S-23S; Janson et al., The European respiratory journal: official journal of the European Society for Clinical Respiratory Physiology 2001; 18(4):647-54).
Хронический кашель может быть связан со многими состояниями, включая интерстициальные легочные болезни (также называемые паренхиматозными болезнями), такие как: эмфизема, идиопатический легочный фиброз (IPF) и саркоидоз; заболевания дыхательных путей, такие как астма, хронический бронхит, хронический синдром постназального затекания, эозинофильный бронхит и хроническая обструктивная болезнь легких; хронические инфекции, такие как: бронхоэктаз, туберкулез, кистозный фиброз; опухоли легких, такие как: бронхогенная карцинома, альвеолярно-клеточная карцинома, доброкачественные опухоли дыхательных путей, опухоли средостения; сердечно-сосудистые заболевания, такие как: левожелудочковая недостаточность, инфаркт легких, аневризма аорты; другие заболевания, такие как: рефлюксный эзофагит, рецидивирующая аспирация, эндобронхиальные швы, синдром постназального затекания или риносинусит; кашель, связанный с введением лекарственных средств, например: введением ингибиторов ангиотензинпревращающего фермента (Chung & Pavord, Lancet 2008; 371:1364-74).
Показано, что хронический кашель имеет значительные физические, социальные и психологические последствия (Birring et al., Thorax 2003; 58(4):339-43; French et al., Chest 2002; 121(4):1123-31). Пациенты часто страдают от осложнений, таких как боль в груди и брюшной полости, рвотные позывы и рвота, недержание мочи и даже кашлевой обморок. Многие из них смущаются этих симптомов и подвергаются социальному отторжению, и поэтому избегают общественных мест и социальных мероприятий. Было обнаружено, что показатели депрессии у этой группы пациентов сопоставимы с показателями групп с другими серьезными хроническими заболеваниями, такими как ревматоидный артрит и серповидноклеточная анемия (Dicpinigaitis et al., Chest 2006; 130(6): 1839-43).
Лечащие врачи не могут идентифицировать излечимую причину хронического кашля примерно у 40% пациентов (Haque et al., Chest 2005; 127(5): 1710-3); в результате способы лечения этих пациентов с хроническим кашлем, не поддающимся лечению, очень ограничены (Gibson & Vertigan, BMJ. 2015;351:h5590). На сегодняшний день единственной лекарственной терапией, которая, как было показано, является эффективной в рандомизированных контролируемых исследованиях в этой группе пациентов, является морфин (Morice et al., American journal of respiratory and critical care medicine 2007; 175(4):312-5) и габапентин (Ryan et al., Lancet. 2012; 380(9853):1583-9). Лечение, предложенное в других исследованиях, такое как амитриптилин и прегабалин (Halum et al., The Laryngoscope 2009; 119(9):1844-7), может вызвать облегчение, но все эти доступные варианты фармакологического лечения часто связаны с непереносимыми побочными эффектами, такими как сонливость, усталость, расстройства желудочно-кишечного тракта, и некоторые из этих агентов, такие как, например, морфин, также вызывают привыкание.
Таким образом, существует острая необходимость в выявлении новых, эффективных и хорошо переносимых способов лечения этого изнурительного состояния для облегчения страдания пациентов.
Описание изобретения
Решение, предложенное в настоящем изобретении, представляет собой применение 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламида (также известного как орвепитант), имеющего следующую химическую структуру (I)
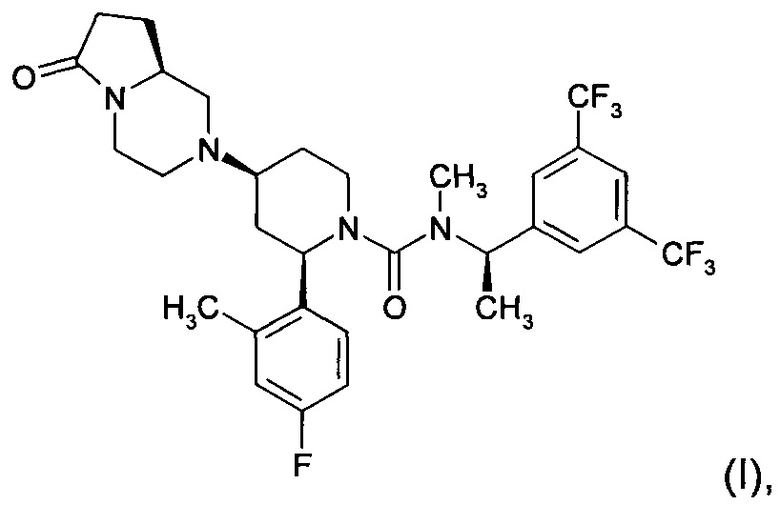
или его фармацевтически приемлемых солей для лечения хронического кашля.
В первом аспекте настоящего изобретения предложено применение 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламида (орвепитанта) или его фармацевтически приемлемой соли для получения лекарственного средства для лечения хронического кашля.
В дополнительном аспекте настоящего изобретения предложен 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) или его фармацевтически приемлемая соль для применения для лечения хронического кашля.
В другом дополнительном аспекте настоящего изобретения предложен способ лечения хронического кашля, который включает введение нуждающемуся в этом человеку эффективного количества 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламида (орвепитанта) или его фармацевтически приемлемой соли.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) или его фармацевтически приемлемую соль, для применения для лечения хронического кашля.
В одном варианте осуществления малеатную соль орвепитанта применяют для лечения хронического кашля.
В дополнительном варианте осуществления орвепитант малеат формы 1 применяют для лечения хронического кашля.
Описание графических материалов
Фигура 1. Объективно определенная частота кашля в дневное время (абсолютные величины). Легенда: исходное состояние соответствует неделе 0. Неделя 4 представляет собой окончание периода лечения. Неделя 8 представляет контрольное посещение.
Фигура 2. Объективно определенная частота кашля в дневное время (величины в процентах). Легенда: %CFB - изменение в процентах от исходного состояния (неделя 0). Неделя 4 представляет собой окончание периода лечения. Неделя 8 представляет контрольное посещение.
Подробное описание изобретения
Настоящее изобретение относится к применению 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламида или его фармацевтически приемлемой соли или сольвата для получения лекарственного средства для лечения хронического кашля.
2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (также известный как орвепитант) имеет следующую химическую структуру (I).
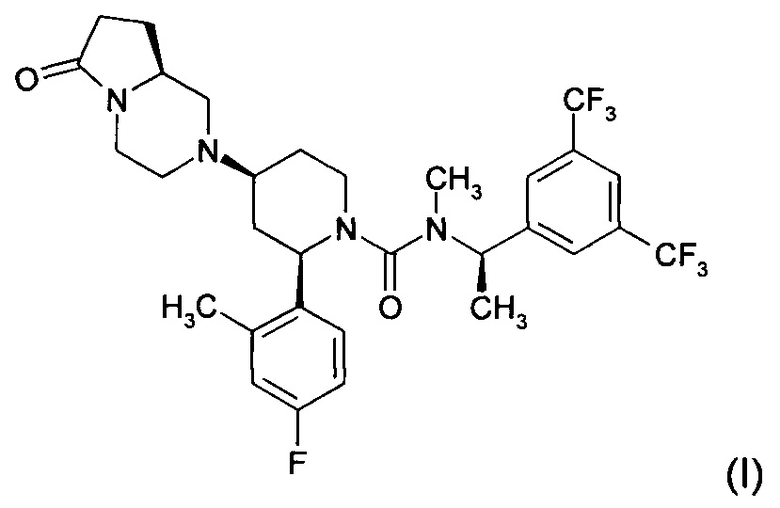
Соединение (I) или его фармацевтически приемлемые соли могут быть получены с применением способов, описанных в Международных заявках на патент №WO 2003/066635, WO 2009/124996 и WO 2007/048642, которые включены в настоящую заявку посредством ссылки.
В частности, в примерах 9а и 11 WO 2003/066635 описан синтез соединения (I) в виде свободного основания и в виде хлористоводородной соли, соответственно. Конкретные кристаллические формы хлористоводородной соли, а именно, безводной и дигидратной кристаллических форм, описаны в примерах 11а и 11b, соответственно. В примере 11 с описан синтез соединения (I) в виде малеатной соли. В примерах 2-8 WO 2009/124996 описан синтез малеатной соли соединения (I) в виде безводной кристаллической формы (форма 1).
Орвепитант малеат формы 1 характеризуется дифрактограммой порошковой рентгеновской дифракции (XRD - от англ. X-ray powder diffraction), выраженной в значениях углов 2-тэта и полученной на дифрактометре с применением рентгеновского Kα-излучения меди, при этом дифрактограмма XRD содержит пики, расположенные при следующих значениях угла 2-тэта: 7,3±0,1, 7,5±0,1, 10,9±0,1, 12,7±0,1, 16,5±0,1 градусов, отвечающих соответственно d-расстояниям при 12,2, 11,8, 8,1, 7,0 и 5,4 ангстрем (А).
В примере 1 WO 2007/048642 описан способ получения промежуточного соединения в синтезе соединения (I).
Следует понимать, что для применения в медицине соли соединения (I) должны быть фармацевтически приемлемыми. Подходящие фармацевтически приемлемые соли очевидны для специалистов в данной области техники и включают, например, кислотно-аддитивные соли, образованные фармацевтически приемлемыми органическими или неорганическими кислотами. Примеры солей включают гидрохлорид, гидробромид, сульфат, алкил- или арилсульфонат, например, метансульфонат, также известный как мезилат, или пара-толуолсульфонат (также известный как тозилат), фосфат, ацетаты, цитрат, сукцинат, тартрат, фумарат и малеат.
Одной из таких фармацевтически приемлемых солей соединения (I) для применения в соответствии с настоящим изобретением является малеатная соль (орвепитант малеат).
Некоторые соли соединения (I) могут существовать в стереоизомерных формах (например, они могут содержать один или несколько асимметричных атомов углерода). Отдельные стереоизомеры (энантиомеры и диастереомеры) и их смеси включены в объем настоящего изобретения. Аналогичным образом, следует понимать, что соли соединения (I) могут существовать в таутомерных формах, и они также включены в объем настоящего изобретения.
Соединение (I) может образовывать кислотно-аддитивные соли с одним или более эквивалентами кислоты. В настоящем изобретении можно применять все возможные стехиометрические и нестехиометрические формы соединения в составах согласно настоящему изобретению.
Соединение (I) или его фармацевтически приемлемые соли могут существовать в форме сольвата.
Следует понимать, что многие органические соединения могут образовывать комплексы с растворителями, в которых они вступают во взаимодействие или из которых их осаждают или кристаллизуют. Эти комплексы известны как «сольваты». Например, комплекс с водой известен как «гидрат». Растворители с высокими точками кипения и/или растворители с высокой склонностью к образованию водородных связей, такие как вода, этанол, изопропиловый спирт и N-метилпирролидинон, можно применять для образования сольватов. Способы идентификации сольватов включают, но не ограничиваются ими, ядерно-магнитный резонанс (ЯМР) и микроанализ.
Соединение (I) или его фармацевтически приемлемые соли могут существовать в различных полиморфных формах.
Полиморфизм определяют как способность элемента или соединения кристаллизоваться с образованием более чем одной различной кристаллической фазы. Таким образом, полиморфы представляют собой различные твердые вещества, разделяющие одну и ту же молекулярную формулу, однако, поскольку свойства любого твердого вещества зависят от его структуры, различные полиморфы могут обладать различными физическими свойствами, такими как различные профили растворимости, различные точки плавления, различные профили растворения, различные термические характеристики и/или фотостабильность, различный срок хранения, различные свойства суспендирования и различная физиологическая скорость абсорбции. Включение растворителя в кристаллическое твердое вещество приводит к образованию сольватов, а в случае применения воды в качестве растворителя - гидратов.
В понятие соединения (I) входят все сольваты (включая гидраты) и полиморфы соединения (I) или его фармацевтически приемлемых солей.
Было определено, что соединение (I) или его фармацевтически приемлемые соли или сольваты подходят для лечения хронического кашля.
В одном варианте осуществления настоящего изобретения соединение для применения согласно настоящему изобретению представляет собой 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид малеат (орвепитант малеат).
В одном варианте осуществления настоящего изобретения соединение для применения согласно настоящему изобретению представляет собой 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид малеат в виде безводной кристаллической формы (формы 1) (орвепитант малеат формы 1).
Определения
Все числа, выражающие величины, проценты или пропорции и другие числовые значения, используемые в описании и формуле изобретения, во всех случаях следует понимать как модифицированные термином «примерно».
Следует понимать, что артикли единственного числа неопределенной формы в настоящем документе относятся к понятию «один или более» перечисляемых компонентов. Специалисту в данной области техники будет понятно, что применение единственного числа включает множественное число, если конкретно не указано иное.
Используемые в настоящем документе термины «лечение», «осуществление лечения» и т.п.относятся к получению необходимого фармакологического, физиологического, дерматологического или косметического эффекта. Эффект может быть профилактическим с точки зрения полного или частичного предотвращения состояния или заболевания или расстройства или его симптомов и/или может быть терапевтическим с точки зрения частичного или полного излечения состояния или заболевания или расстройства и/или неблагоприятного симптома или эффекта, свойственного состоянию или заболеванию или расстройству.
«Лечение», таким образом, например, охватывает любое лечение состояния или заболевания у млекопитающего, в частности, у человека, и включает: (а) предотвращение состояния или заболевания, расстройства или его симптомов у субъекта, который может быть предрасположен к состоянию или заболеванию или расстройству, но у которого еще не диагностировано его наличие; (b) угнетение состояния или заболевания, расстройства или его симптомов, такое как остановка его развития; и (с) облегчение, смягчение или улучшение состояния или заболевания или расстройства или его симптомов, такое как, например, обратное развитие состояния или заболевания или расстройства или его симптомов.
Используемый в настоящем документе термин «эффективное количество» обозначает количество лекарственного средства или фармацевтического агента, которое будет вызывать биологический или медицинский ответ ткани, системы, животного или человека, при обращении, например, к исследователю, лечащему врачу или ветеринару.
Термин «хронический кашель» относится к кашлю, который сохраняется в тяжелой форме в течение более восьми недель, как определено в программах лечения Британского Торакального Общества (Morice et al., Thorax. 2006 Sep; 61 Suppl 1:i1-24) and the American College of Physicians (Irwin et al., Chest. 2006 Jan; 129(1 Suppl): 1S-23S).
Используемый в настоящем документе термин «трудно поддающийся лечению хронический кашель» относится к кашлю, который сохраняется в тяжелой форме в течение более восьми недель и для которого невозможно определить объективное свидетельство основной причины после обычного клинического исследования, или кашель, который не поддавался лечению стандартными способами по выявленной основной причине (Gibson & Vertigan, BMJ. 2015; 351: h5590).
Используемый в настоящем документе термин "хронический кашель, трудно поддающийся лечению" является взаимозаменяемым с терминами "трудно поддающийся лечению хронический кашель", "хронический необъяснимый кашель", "хронический недиагностированный кашель", "хронический идиопатический кашель", "синдром кашлевой гиперчувствительности" или "хронический кашель, устойчивый к лечению" и имеет одинаковое значение.
Используемый в настоящем документе термин «фармацевтически приемлемое вспомогательное вещество» или «фармацевтически приемлемый носитель» обозначает фармацевтически приемлемый материал, композицию или среду, участвующие в обеспечении формы или консистенции фармацевтической композиции. Каждое вспомогательное вещество должно быть совместимо с другими ингредиентами фармацевтической композиции при смешивании, чтобы избежать взаимодействий, которые существенно снижают эффективность соединения согласно настоящему изобретению при введении пациенту, и взаимодействий, которые приводят к получению фармацевтических композиций, которые не являются фармацевтически приемлемыми. Кроме того, каждое вспомогательное вещество, как известно, должно быть фармацевтически приемлемым, например, обладать достаточно высокой чистотой.
Используемый в настоящем документе термин «комбинация» относится либо к фиксированной комбинации в одной единичной дозированной форме, либо к нефиксированной комбинации.
Термин «фиксированная комбинация» обозначает, что активные ингредиенты, например, соединение формулы (I) или его фармацевтически приемлемую соль и партнер по комбинации, оба вводят пациенту одновременно в форме одной единицы или дозы.
Термин «нефиксированная комбинация» обозначает, что активные ингредиенты, например, соединение (I) или его фармацевтически приемлемую соль и партнер по комбинации (например, другое лекарственное средство, как описано ниже, также называемое «терапевтическим агентом» или «соагентом»), оба вводят пациенту в форме отдельных единиц одновременно, параллельно или последовательно при отсутствии каких-либо конкретных временных пределов, причем такое введение обеспечивает терапевтически эффективные уровни двух соединений в организме пациента. Последнее также относится к терапии с применением ряда лекарственных средств (cocktail therapy), например, к введению трех или более активных ингредиентов.
Термины «совместное введение» или «комбинированное введение» или подобные, используемые в настоящем документе, охватывают введение соединения (I) и выбранного партнера по комбинации одному нуждающемуся в этом субъекту, (например, пациенту), и предназначены включать схемы лечения, при которых агенты не обязательно вводят одним и тем же способом введения или в одно и то же время.
Пациент, подлежащий лечению с применением описанного в настоящем документе изобретения, предпочтительно является человеком.
В одном варианте осуществления настоящего изобретения хронический кашель представляет собой трудно поддающийся лечению хронический кашель.
Хронический кашель является распространенным симптомом у людей, у которых выявляют интерстициальные легочные болезни (ILD) (Brown, 2006; 129(1 Suppl): 180S-185S).
Термин интерстициальные легочные болезни (ILD), также известный как диффузное паренхиматозное заболевание легких (DPLD - от англ. diffuse parenchymal lung disease), относится к группе заболеваний легких, поражающих интерстиций (ткань и пространство вокруг воздушных мешочков легких).
Интерстиций представляет собой кружевообразную сеть тканей, заполняющую оба легких. Интерстиций обеспечивает поддержку микроскопических воздушных мешков легких (альвеол). Крошечные кровеносные сосуды проходят через интерстиций, обеспечивая газообмен между кровью и воздухом в легких. Обычно интерстиций является настолько тонким, что он не может быть виден на рентгеновских снимках грудной клетки или снимках компьютерной томографии (КТ).
Все формы ILD вызывают утолщение интерстиция. Утолщение может быть вызвано воспалением, рубцеванием или избыточной жидкостью (отеком). Некоторые формы ILD являются непродолжительными; другие являются хроническими и необратимыми.
ILD включают в себя идиопатический легочный фиброз (IPF), хроническую прогрессирующую форму фиброза (рубцевания) интерстиция. По оценкам, кашель присутствует у 84% пациентов с IPF, и более распространен у пациентов, которые никогда не курили или которые имеют более позднюю стадию заболевания, и является независимым прогностическим фактором прогрессирования заболевания (Ryerson et al., Respirology 2011; 16:969-75).
IPF является прогрессирующим заболеванием и, как правило, со смертельным исходом, при средней выживаемости в пределах 2-3 лет после постановки диагноза; его причина неизвестна. Пациенты с IPF обычно имеют возраст от 50 до 70 лет, и заболеваемость женщин ниже (7,4 случаев на 100000 в год), чем мужчин (10,7 случаев на 100000 в год). Заболеваемость, распространенность и смертность возрастают с возрастом. В настоящее время не существует фармакологического лечения, способного вылечить болезнь, и большинство стратегий лечения были основаны на устранении или подавлении воспалительного компонента, хотя данное состояние плохо реагирует на лечение иммуносупрессорами. Однако недавно в плацебо-контролируемых клинических исследованиях было показано, что два лекарственных средства с антифибротической активностью, пирфенидон и нинтеданиб, замедляют, но не останавливают прогрессирование заболевания.
ILD также могут включать:
- идиопатические интерстициальные пневмонии (IPP - от англ. idiopathic interstitial pneumonia), такие как неспецифическая интерстициальная пневмония, десквамативная интерстициальная пневмония, острая интерстициальная пневмония, криптогенная организующаяся пневмония, лимфоидная интерстициальная пневмония, синдром комбинации легочного фиброза и эмфиземы (CPFE - от англ. combined pulmonary fibrosis and emphysema syndrome);
- заболевания, вызванные загрязнением окружающей среды, и профессиональные заболевания, вызванные гиперчувствительностью, например: пневмокониоз, такой как асбестоз, силикоз, и пневмокониоз, возникающий вследствие угольной пыли, бериллия, воздействия пыли твердых металлов, и экзогенный аллергический альвеолит, например, «легкое птицеводов», синдром лучевого фиброза, или вызванный воздействием бактерий и плесени, например, микоплазменная пневмония;
- мультисистемные заболевания, связанные с аутоиммунными заболеваниями, например: заболевания соединительной ткани, такие как системный склероз, саркоидоз, ревматоидный артрит, гранулематоз Вегенера; некоторые мышечные заболевания, такие как полимиозит, дерматомиозит и антисинтетазный синдром, или заболевания в результате реакций на лекарственные средства, например, амиодарон, метотрексат и блеомицин;
- редкие заболевания легких, например: легочный альвеолярный протеиноз, гистиоцитоз легких, легочная эозинофилия и идиопатический гемосидероз легких, синдром Германского-Пудлака, туберозный склероз (лимфангиолейомиоматоз);
- генетические или наследственные заболевания, например: семейный фиброз легких (FPF - от англ. familial pulmonary fibrosis) или семейная интерстициальная пневмония (FIP - от англ. familial interstitial pneumonia);
- синдром облитерирующего бронхиолита после трансплантации легких.
Лечение хронического кашля при интерстициальных легочных болезнях (ILD) остается проблематичным как для пациентов, так и для врачей, и это может быть связано с сильной дыхательной недостаточностью. В таких случаях паллиативная терапия с применением традиционных противокашлевых средств, таких как препараты, полученные из опиатов, часто оказывает ограниченное благоприятное воздействие.
Таким образом, согласно еще одному варианту осуществления настоящего изобретения хронический кашель вызван или связан с интерстициальными легочными болезнями (ILD).
В другом варианте осуществления в настоящем изобретении предложено соединение формулы (I) или его фармацевтически приемлемые соли для применения для лечения хронического кашля, вызванного или связанного с саркоидозом, эмфиземой или IPF.
В другом варианте осуществления в настоящем изобретении предложено соединение формулы (I) или его фармацевтически приемлемые соли для применения для лечения хронического кашля, вызванного или связанного с саркоидозом.
В другом варианте осуществления в настоящем изобретении предложено соединение формулы (I) или его фармацевтически приемлемые соли для применения для лечения хронического кашля, вызванного или связанного с эмфиземой.
В другом варианте осуществления в настоящем изобретении предложено соединение формулы (I) или его фармацевтически приемлемые соли для применения для лечения хронического кашля, вызванного или связанного с легочным фиброзом.
В другом варианте осуществления в настоящем изобретении предложено соединение формулы (I) или его фармацевтически приемлемые соли для применения для лечения хронического кашля, вызванного или связанного с IPF.
Хронический кашель также представляет собой распространенный симптом у людей, у которых выявляют заболевания дыхательных путей, такие как астма, хронический бронхит, хронический синдром постназального затекания, эозинофильный бронхит и хроническая обструктивная болезнь легких; хронические инфекции, такие как: бронхоэктаз, туберкулез, кистозный фиброз; опухоли легких, такие как: бронхогенная карцинома, альвеолярно-клеточная карцинома, доброкачественные опухоли дыхательных путей, опухоли средостения; сердечно-сосудистые заболевания, такие как: левожелудочковая недостаточность, инфаркт легких, аневризма аорты; другие заболевания, такие как: рефлюксный эзофагит, рецидивирующая аспирация, эндобронхиальные швы, синдром постназального затекания или риносинусит; кашель, связанный с введением лекарственных средств, например: введение ингибиторов ангиотензинпревращающего фермента: другие заболевания, такие как: рефлюксный эзофагит, рецидивирующая аспирация, эндобронхиальные швы, синдром постназального затекания или риносинусит; кашель, связанный с введением лекарственных средств, например: введение ингибиторов ангиотензинпревращающего фермента.
Таким образом, согласно дополнительному варианту осуществления настоящего изобретения хронический кашель вызван или связан с астмой, хроническим бронхитом, хроническим синдромом постназального затекания, эозинофильным бронхитом и хронической обструктивной болезнью легких.
В дополнительном варианте осуществления в настоящем изобретении предложено соединение формулы (I) или его фармацевтически приемлемые соли для применения для лечения хронического кашля, вызванного или связанного с астмой, хроническим бронхитом, хроническим синдромом постназального затекания, эозинофильным бронхитом и хронической обструктивной болезнью легких.
Таким образом, согласно дополнительному варианту осуществления настоящего изобретения хронический кашель вызван или связан с хроническими инфекциями, такими как бронхоэктаз, туберкулез, кистозный фиброз.
В дополнительном варианте осуществления в настоящем изобретении предложено соединение формулы (I) или его фармацевтически приемлемые соли для применения для лечения хронического кашля, вызванного или связанного с хроническими инфекциями, такими как бронхоэктаз, туберкулез, кистозный фиброз.
Таким образом, согласно дополнительному варианту осуществления настоящего изобретения хронический кашель вызван или связан с опухолями легких, такими как бронхогенная карцинома, альвеолярно-клеточная карцинома, доброкачественные опухоли дыхательных путей, опухоли средостения.
В дополнительном варианте осуществления в настоящем изобретении предложено соединение формулы (I) или его фармацевтически приемлемые соли для применения для лечения хронического кашля, вызванного или связанного с опухолями легких, такими как бронхогенная карцинома, альвеолярно-клеточная карцинома, доброкачественные опухоли дыхательных путей, опухоли средостения.
Таким образом, согласно дополнительному варианту осуществления настоящего изобретения хронический кашель вызван или связан с сердечно-сосудистыми заболеваниями, такими как левожелудочковая недостаточность, инфаркт легких или аневризма аорты.
В дополнительном варианте осуществления в настоящем изобретении предложено соединение формулы (I) или его фармацевтически приемлемые соли для применения для лечения хронического кашля, вызванного или связанного с сердечно-сосудистыми заболеваниями, такими как левожелудочковая недостаточность, инфаркт легких, аневризма аорты.
Таким образом, согласно дополнительному варианту осуществления настоящего изобретения хронический кашель вызван или связан с рефлюксным эзофагитом, рецидивирующей аспирацией, эндобронхиальными швами, синдромом постназального затекания или риносинуситом.
В дополнительном варианте осуществления в настоящем изобретении предложено соединение формулы (I) или его фармацевтически приемлемые соли для применения для лечения хронического кашля, вызванного или связанного с рефлюксным эзофагитом, рецидивирующей аспирацией, эндобронхиальными швами, синдромом постназального затекания или риносинуситом.
В дополнительном варианте осуществления в настоящем изобретении предложен 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-грифторметил-фенил)-этил]-метиламид (орвепитант) или его фармацевтически приемлемая соль для применения для лечения хронического кашля, вызванного или связанного с саркоидозом, эмфиземой или идиопатическим легочным фиброзом, с астмой, хроническим бронхитом, хроническим синдромом постназального затекания, эозинофильным бронхитом и хронической обструктивной болезнью легких (ХОБЛ), с хроническими инфекциями, такими как бронхоэктаз, туберкулез, кистозный фиброз, с опухолями легких, такими как бронхогенная карцинома, альвеолярно-клеточная карцинома, доброкачественные опухоли дыхательных путей, опухоли средостения, с сердечно-сосудистыми заболеваниями, такими как левожелудочковая недостаточность, инфаркт легких или аневризма аорты.
В дополнительном варианте осуществления в настоящем изобретении предложен 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) или его фармацевтически приемлемая соль для применения для лечения хронического кашля, вызванного или связанного с идиопатическим легочным фиброзом (IPF) или с опухолями легких, такими как бронхогенная карцинома, альвеолярно-клеточная карцинома, доброкачественные опухоли дыхательных путей, опухоли средостения или с хронической обструктивной болезнью легких (ХОБЛ).
Более того, соединение формулы (I) и его соли подходят для применения в способе лечения интерстициальных легочных болезней (ILD), в частности, для лечения легочного фиброза, такого как идиопатический легочный фиброз (IPF).
Таким образом, в дополнительном аспекте в настоящем изобретении предложен 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) или его фармацевтически приемлемая соль для применения для лечения ILD.
В еще одном дополнительном аспекте в настоящем изобретении предложен 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) малеат для применения для лечения ILD.
В еще одном дополнительном аспекте в настоящем изобретении предложен 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) малеат в виде безводной кристаллической формы (форма 1) для применения для лечения ILD.
Более того, в еще одном дополнительном аспекте предложен 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) или его фармацевтически приемлемая соль для применения для лечения IPF.
Более того, в еще одном дополнительном аспекте предложен 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) малеат для применения для лечения IPF.
Более того, в еще одном дополнительном аспекте предложен 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) малеат в виде безводной кристаллической формы (форма 1) для применения для лечения IPF.
В одном варианте осуществления человек является пациентом-ребенком.
Фармацевтические композиции для применения в соответствии с настоящим изобретением могут быть получены в формах, подходящих для применения для человека и в ветеринарной медицине обычным способом с применением одного или более фармацевтически приемлемых носителей или вспомогательных веществ.
Таким образом, соединение (I) и его фармацевтически приемлемые соли могут быть получены в формах, подходящих для перорального, буккального, парентерального, местного (в том числе офтальмологического и назального), депо или ректального введения или в форме, подходящей для введения путем ингаляции или инсуффляции (через рот или через нос).
Для перорального введения фармацевтическим композициям можно придать форму, например, таблеток или капсул, полученных традиционными способами, с применением фармацевтически приемлемых вспомогательных веществ, таких как связующие агенты (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); разрыхлители (например, картофельный крахмал или крахмалгликолят натрия); или смачивающие агенты (например, лаурилсульфат натрия). Таблетки могут быть покрыты с применением способов, хорошо известных в данной области техники. Жидким препаратам для перорального введения можно придать форму, например, растворов, сиропов или суспензий, или они могут быть представлены в форме сухого продукта для разбавления водой или другой подходящей средой перед применением. Такие жидкие препараты могут быть получены традиционными способами с применением фармацевтически приемлемых добавок, таких как суспендирующие агенты (например, сироп сорбита, производные целлюлозы или гидрогенизированные пищевые жиры); эмульгаторы (например, лецитин или аравийская камедь); неводные среды (например, миндальное масло, масляные сложные эфиры, этиловый спирт или фракционированные растительные масла); и консерванты (например, метил- или пропил-пара-гидроксибензоаты или сорбиновая кислота). Указанные препараты могут также содержать буферные соли, ароматизаторы, красители и подсластители, если это необходимо.
Препараты для перорального введения могут быть получены соответствующим образом в формах, обеспечивающих контролируемое высвобождение активного соединения.
Для буккального введения композиции можно придать форму таблеток или приготовить традиционным способом.
Соединение (I) или его фармацевтически приемлемые соли могут быть приготовлены в формах, подходящих для парентерального введения путем болюсной инъекции или непрерывной инфузии. Препараты для инъекций могут быть представлены в единичной дозированной форме, например, в ампулах или в многодозовых контейнерах с добавлением консерванта. Композициям можно придать такие формы, как суспензии, растворы или эмульсии в масляных или водных средах, и они могут содержать вспомогательные вещества, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. В качестве альтернативы, активный ингредиент может находиться в форме порошка для разбавления перед применением подходящей средой, например, стерильной апирогенной водой.
Соединение (I) или его фармацевтически приемлемые соли могут быть получены в формах, подходящих для кожного введения.
Кожное введение может включать местное применение или трансдермальное введение. Трансдермальное применение может быть осуществлено с помощью подходящих пластырей, эмульсий, мазей, растворов, суспензий, паст, пен, аэрозолей, лосьонов, кремов или гелей, что общеизвестно в данной области техники, конкретно предназначенных для трансдермальной доставки активных агентов, необязательно в присутствии специфических усилителей проницаемости. Местным композициям также можно придать одну или более из этих форм. Одно или более активных соединений могут присутствовать в сочетании с одним или более нетоксичными фармацевтически приемлемыми вспомогательными агентами, такими как вспомогательные вещества, адъюванты (например, буферы), носители, инертные твердые разбавители, суспендирующие агенты, консерванты, наполнители, стабилизаторы, антиоксиданты, пищевые добавки, усилители биодоступности, покрывающие материалы, гранулирующие и разрыхляющие агенты, связующие вещества и т.д. и, при необходимости, другими активными ингредиентами.
Фармацевтическая композиция может быть получена, например, в формах, обеспечивающих немедленное высвобождение, замедленное высвобождение, прерывистое высвобождение, двух- или более ступенчатое высвобождение или депо или любой другой тип высвобождения.
Получение фармацевтических композиций в соответствии с предметом настоящего изобретения может быть осуществлено в соответствии со способами, известными в данной области техники, и будет описано ниже более подробно. В зависимости от предполагаемого способа введения, а также от конкретных характеристик применяемого активного соединения, таких как растворимость, биодоступность и т.д., можно применять общеизвестные и применяемые фармацевтически приемлемые вспомогательные вещества, а также другие подходящие разбавители, ароматизаторы, подслащивающие агенты, красители и т.д.
Для получения композиций, описанных в настоящем документе, можно применять любой нетоксичный, инертный и эффективный местный, пероральный и т.д. фармацевтически приемлемый носитель. Хорошо известные носители, применяемые для получения других местных терапевтических композиций для введения людям, подходят для данных композиций. Примеры этих компонентов, которые хорошо известны специалистам в данной области техники, описаны в The Merck Index, Thirteenth Edition, Budavari et al., Eds., Merck & Co., Inc., Rahway, N.J. (2001); the CTFA (Cosmetic, Toiletry, and Fragrance Association) International Cosmetic Ingredient Dictionary and Handbook, Tenth Edition (2004); и "Inactive Ingredient Guide", U.S. Food and Drug Administration (FDA) Center for Drug Evaluation and Research (CDER) Office of Management, January 1996, содержание которых полностью включено в настоящее описание посредством ссылки. Примеры таких подходящих косметически приемлемых вспомогательных веществ, носителей и разбавителей включают дистиллированную воду, физиологический раствор, раствор Рингера, раствор декстрозы, раствор Хэнкса и диметилсульфоксид (ДМСО), которые подходят для применения в настоящем изобретении.
Эти дополнительные другие неактивные компоненты, а также эффективные составы и способы введения, хорошо известны в данной области техники и описаны в стандартных руководствах, таких как Goodman and Gillman's: The Pharmacological Bases of Therapeutics, 8th Ed., Gilman et al. Eds. Pergamon Press (1990) и Remington's Pharmaceutical Sciences, 17th Ed., Mack Publishing Co., Easton, Pa. (1990), оба из которых полностью включены в настоящую заявку посредством ссылки.
В одном варианте осуществления местные композиции согласно настоящему изобретению получены в форме сыворотки, крем-геля, лосьона, крема, мази, геля, аэрозоля, пены, вспениваемой жидкости, раствора (солюбилизированной системы), пасты, суспензии, дисперсии, эмульсии, очищающего средства для кожи, молочка, маски, твердого карандаша, бруска (например, бруска мыла), инкапсулированного состава, микрокапсулированного состава, микросферных или наносферных или везикулярных дисперсий или в других косметически приемлемых местных лекарственных формах. В случае везикулярных дисперсий везикулы могут состоять из липидов, которые могут быть ионного или неионогенного типа или их смесью.
Состав может содержать один или более водных составов и/или безводных составов.
В другом варианте осуществления данная местная косметическая композиция в соответствии с предметом, описанным в настоящем изобретении, может содержать или состоять из безводного состава, водного состава или эмульсии.
Для интраназального введения соединение (I) или его фармацевтически приемлемые соли могут быть приготовлены в форме растворов для введения посредством подходящего дозирующего или однодозового устройства или, в качестве альтернативы, в форме порошковой смеси с подходящим носителем для введения с применением подходящего устройства для доставки.
Предлагаемая доза соединения (I) составляет приблизительно от 0,5 до 30 мг в день. Предпочтительно она составляет от 1 до 30 мг в день, более предпочтительно от 2,5 до 30 мг в день.
В одном варианте осуществления доза соединения (I) составляет 10 мг в день, 20 мг в день или 30 мг в день.
Следует понимать, что может потребоваться внесение обычных изменений в дозировку в зависимости от возраста и состояния пациента, и точная дозировка в итоге будет определена по усмотрению сопровождающего врача или ветеринара. Дозировка также будет зависеть от способа введения.
При необходимости можно применять другие терапевтические агенты в сочетании с теми, которые предложены в вышеописанных композициях. Количество активных ингредиентов, которые могут быть объединены с материалами-носителями материалов для получения единичной лекарственной формы, будет изменяться в зависимости от получающего лечение организма, природы заболевания, расстройства или состояния и природы активных ингредиентов.
Фармацевтические композиции согласно настоящему изобретению можно вводить в виде разовой дозы или нескольких доз в день.
В одном варианте осуществления соединение (I) и его фармацевтически приемлемые соли вводят перорально один раз в день.
В одном варианте осуществления настоящие композиции можно наносить местно один или несколько раз в день. В одном варианте осуществления настоящие композиции наносят местно от одного до четырех раз в день. Например, одна из стратегий состоит в том, чтобы начинать с одного раза в день и переходить к более частому применению, если это необходимо.
В одном варианте осуществления настоящие композиции наносят местно от одного до шести раз в день, например, утром, в полдень, днем и/или вечером.
Однако следует понимать, что определенный уровень дозы для любого конкретного пациента будет изменяться в зависимости от множества факторов, включая активность конкретного активного агента; возраст, массу тела, общее состояние здоровья, пол и рацион пациента; время введения; скорость выведения; возможные комбинации лекарственных средств; тяжесть конкретного состояния, подлежащего лечению; и форму введения. Специалист в данной области техники может оценить изменчивость таких факторов и может установить конкретные уровни дозы с применением не более чем обычных экспериментов.
Фармакокинетические параметры, такие как биодоступность, константа скорости абсорбции, кажущийся объем распределения, несвязанная фракция, общий клиренс, фракция, выводимая без изменений, пресистемный метаболизм, константа скорости выведения, период полувыведения и среднее время удержания, хорошо известны в данной области техники.
Оптимальные составы могут быть определены специалистом в данной области техники в зависимости от таких факторов, как конкретные ингредиенты и необходимая дозировка. См., например, в Remington's Pharmaceutical Sciences, 18th ed. (1990, Mack Publishing Co., Easton, PA 18042), pp.1435-1712, and "Harry's Cosmeticology", 8th ed. (2000, Chemical Publishing Co., Inc., New York, N.Y. 10016), описание каждого из которых полностью включено в настоящую заявку посредством ссылки. Такие составы могут влиять на физическое состояние, стабильность, скорость высвобождения in vivo и скорость клиренса in vivo.
В частности, также рассмотрена возможность получения композиций в формах, которые можно долговременно хранить без необходимости предварительного смешивания или приготовления перед применением. В частности, настоящие композиции остаются неожиданно стабильными при хранении в течение периодов, включая от 3 месяцев до 3 лет, от примерно 3 месяцев до примерно 2,5 лет, от примерно 3 месяцев до примерно 2 лет, от примерно 3 месяцев до примерно 20 месяцев, и, иначе, в течение любого периода времени от примерно 6 месяцев до примерно 18 месяцев.
Таким образом, в другом аспекте в настоящем изобретении предложена фармацевтическая композиция, содержащая 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) или его фармацевтически приемлемую соль, для применения для лечения хронического кашля.
В другом варианте осуществления в настоящем изобретении предложена фармацевтическая композиция, содержащая 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) малеат, для применения для лечения хронического кашля.
В другом варианте осуществления в настоящем изобретении предложена фармацевтическая композиция, содержащая 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) малеат в виде безводной кристаллической формы (форма 1), для применения для лечения хронического кашля.
В другом варианте осуществления в настоящем изобретении предложена фармацевтическая композиция, содержащая 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) малеат, для применения для лечения трудно поддающегося лечению хронического кашля.
В дополнительном варианте осуществления в настоящем изобретении предложена фармацевтическая композиция, содержащая 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) или его фармацевтически приемлемую соль, для применения для лечения трудно поддающегося лечению хронического кашля.
В другом варианте осуществления в настоящем изобретении предложена фармацевтическая композиция, содержащая 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид(орвепитант) малеат в виде безводной кристаллической формы (форма 1), для применения для лечения трудно поддающегося лечению хронического кашля.
В другом варианте осуществления в настоящем изобретении предложена фармацевтическая композиция для перорального применения, содержащая 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) или его фармацевтически приемлемую соль, для применения для лечения ILD.
В другом варианте осуществления в настоящем изобретении предложена фармацевтическая композиция для перорального применения, содержащая 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид малеат (орвепитант) или его фармацевтически приемлемую соль, для применения для лечения IPF.
В другом варианте осуществления в настоящем изобретении предложена фармацевтическая композиция для перорального применения, содержащая 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) малеат, для применения для лечения ILD.
В другом варианте осуществления в настоящем изобретении предложена фармацевтическая композиция для перорального применения, содержащая 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) малеат, для применения для лечения IPF.
В другом варианте осуществления в настоящем изобретении предложена фармацевтическая композиция для перорального применения, содержащая 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид(орвепитант) малеат в виде безводной кристаллической формы (форма 1), для применения для лечения ILD.
В другом варианте осуществления в настоящем изобретении предложена фармацевтическая композиция для перорального применения, содержащая 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид малеат в виде безводной кристаллической формы (форма 1), для применения для лечения IPF.
Специалистам в данной области техники будет понятно, что соединение (I) или его фармацевтически приемлемые соли в соответствии с настоящим изобретением можно эффективно применять в комбинации с одним или более другими терапевтическими агентами, например, антагонистами рецепторов лейкотриена, такими как монтелукаст и зафирлукаст; блокаторами потенциалзависимых натриевых каналов, такими как лидокаин, GSK-2339345, бензонатат и CNV1014802; двойным антагонистом рецептора N-метил-D-аспартата (НМДА или NMDA - от англ. N-methyl-D-aspartate) и сигма-1-агонистом, таким как декстрометорфан; антагонистами рецептора НМДА, такими как мемантин; опиоидами, такими как кодеин и морфин; аналогами гамма-аминомасляной кислоты (GABA- от англ. gamma-aminobutyric acid), например, габапентином и прегабалином; агонистом рецептора GABA-B, таким как баклофен; норэпинефрин; ингибиторами обратного захвата серотонина/норэпинефрина, такими как амитриптилин; агонистами рецептора ноцицептина/орфанина FQ (NOP)-1, такими как SCH486757; антагонистами пуринергических рецепторов Р2Х3, такими как AF-219 и AF-130; антагонистами рецептора гистамина-1, такими как хлорфенирамин, азеластин, мизоластин, лоратадин и цетиризин; антихолинергическими лекарственными средствами, такими как карамифен эдизилат; секретолитическими/муколитическими агентами, такими как амброксол, DWJ-1340 и НОВ-048; антагонистами ванилоидного рецептора подтипа 1 (TRPV-1), такими как РАС-14028, VR-611 и XEND-0501; антагонистами ванилоидного рецептора подтипа 4 (TRPV-4), такими как GSK2193874 и GSK2798745; агонистами рецепторов термочувствительных ионных каналов TRPM8, такими как ментол; аналогами гомоцистеина, такими как эрдостеин; кортикостероидами, такими как будесонид и флутиказон; антагонистами анкиринового рецептора подтипа 1 (TRPA1), такими как НС-030031 и GRC-17536; 62-агонистами, такими как сальбутамол; антагонистами мускариновых рецепторов, такими как ипратропия бромид; ингибиторами протонного насоса, такими как ранитидин и омепразол; ингибиторами ионных калиевых каналов с высокой проводимостью, такими как теофиллин; стабилизаторами тучных клеток, такими как динатрия кромогликат; ингибиторами фосфодиэстеразы-(ФДЭ)-4, например, апремиласт; агонистами каннабиноидных рецепторов, такими как СР55940 и JWH133; антагонистами рецепторов NK-1 и/или NK-2 и/или NK-3 или ингибиторами их когнатных лигандов NK-A и NK-B, ингибиторами SP, например, антителами к SP; агентами с неописанным или неизвестным механизмом, включая леводропропизин, клофедианол, карбетапентан (также известный как пентоксиверин), левоклоперастин, могистеин, AG-1321001, ССР-01/05/06/07/08, AGPPC-709 и LPCN-1087.
В одном варианте осуществления в настоящем изобретении предложена комбинация, которая содержит (а) 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) или его фармацевтически приемлемую соль и (b) второе лекарственное вещество и необязательно одно или более фармацевтически приемлемое вспомогательное вещество(веществ) для лечения хронического кашля.
В одном варианте осуществления в настоящем изобретении предложена комбинация, которая содержит (а) 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) или его фармацевтически приемлемую соль и (b) второе лекарственное вещество и необязательно одно или более фармацевтически приемлемое вспомогательное вещество(веществ) для лечения хронического кашля, трудно поддающегося лечению.
В дополнительном варианте осуществления в настоящем изобретении предложена комбинация соединения (I) (орвепитанта) или его фармацевтически приемлемой соли со вторым лекарственным веществом, которое выбрано из антагонистов рецепторов лейкотриена, блокаторов потенциалзависимых натриевых каналов, двойного антагониста рецептора N-метил-D-аспартата (НМДА) и сигма-1-агонистов, антагонистов рецептора НМДА, опиоидов, аналогов GABA, агониста рецептора GABA-B, ингибиторов обратного захвата серотонина/норэпинефрина, агонистов рецептора ноцицептина/орфанина FQ (NOP)-1, антагонистов пуринергических рецепторов Р2Х3, антагонистов рецептора гистамина-1, антихолинергических лекарственных средств, секретолитических/муколитических агентов, антагонистов ванилоидного рецептора подтипа 1 (TRPV-1), антагонистов ванилоидного рецептора подтипа 4 (TRPV-4), аналогов гомоцистеина, кортикостероидов, антагонистов анкиринового рецептора подтипа 1 (TRPA1), β2-агонистов; антагонистов мускариновых рецепторов, ингибиторов протонного насоса, ингибиторов ионных калиевых каналов с высокой проводимостью, стабилизаторов тучных клеток, ингибиторов фосфодиэстеразы-(ФДЭ)-4, агонистов каннабиноидных рецепторов, антагонистов рецепторов NK-1 и/или NK-2 и/или NK-3 или ингибиторов их когнатных лигандов NK-A и NK-B, ингибиторов SP, и необязательно одним или более фармацевтически приемлемым вспомогательным веществом(веществами) для лечения хронического кашля.
В дополнительном варианте осуществления в настоящем изобретении предложена комбинация соединения (I) (орвепитанта) или его фармацевтически приемлемой соли со вторым лекарственным веществом, которое выбрано из антагонистов рецепторов лейкотриена, блокаторов потенциалзависимых натриевых каналов, двойного антагониста рецептора N-метил-D-аспартата (НМДА) и сигма-1-агонистов, антагонистов рецептора НМДА, опиоидов, аналогов GABA, агониста рецептора GABA-B, ингибиторов обратного захвата серотонина/норэпинефрина, агонистов рецептора ноцицептина/орфанина FQ (NOP)-1, антагонистов пуринергических рецепторов Р2Х3, антагонистов рецептора гистамина-1, антихолинергических лекарственных средств, секретолитических/муколитических агентов, антагонистов ванилоидного рецептора подтипа 1 (TRPV-1), антагонистов ванилоидного рецептора подтипа 4 (TRPV-4), аналогов гомоцистеина, кортикостероидов, антагонистов анкиринового рецептора подтипа 1 (TRPA1), β2-агонистов; антагонистов мускариновых рецепторов, ингибиторов протонного насоса, ингибиторов ионных калиевых каналов с высокой проводимостью, стабилизаторов тучных клеток, ингибиторов фосфодиэстеразы-(ФДЭ)-4; агонистов каннабиноидных рецепторов, антагонистов рецепторов NK-1 и/или NK-2 и/или NK-3 или ингибиторов их когнатных лигандов NK-A и NK-B, ингибиторов SP, и необязательно одним или более фармацевтически приемлемым вспомогательным веществом(веществами) для лечения хронического кашля, трудно поддающегося лечению.
В дополнительном варианте осуществления в настоящем изобретении предложена комбинация соединения (I) (орвепитанта) или его фармацевтически приемлемой соли со вторым лекарственным веществом, которое выбрано из антагонистов пуринергических рецепторов Р2Х3, таких как AF-219 или AF-130, или стабилизаторов тучных клеток, таких как динатрия кромогликат, или аналогов GABA, таких как габапентин или прегабалин, или опиоидов, таких как кодеин и морфин, необязательно одним или более фармацевтически приемлемым вспомогательным веществом(веществами) для лечения хронического кашля, трудно поддающегося лечению, или хронического кашля, трудно поддающегося лечению.
AF-219 соответствует соединению 5-(2,4-диамино-пиримидин-5-илокси)-4-изопропил-2-метокси-бензолсульфонамид.
В одном варианте осуществления малеатную соль орвепитанта применяют в комбинации со вторым лекарственным веществом, как описано выше.
В дополнительном варианте осуществления орвепитант малеат формы 1 применяют в комбинации со вторым лекарственным веществом, как описано выше.
Специалистам в данной области техники будет понятно, что соединение (I) или его фармацевтически приемлемые соли при применении для лечения ILD предпочтительно можно применять в комбинации с одним или более другими терапевтическими агентами, например: пирфенидон, обладающий противовоспалительным действием широкого спектра и антифибротическим действием с неизвестным механизмом; также замещенный дейтерием пирфенидон; соединения, такие как ингибиторы киназных рецепторов, рецептора фактора роста тромбоцитов (PDGFR - от англ. platelet-derived growth factor receptor), рецептора фактора роста фибробластов (FGFR - от англ. fibroblast growth factor receptor) и рецептора фактора роста эндотелия сосудов (VEGFR - от англ. vascular endothelial growth factor receptor), например, нинтеданиб: PBI-4050, обладающий антифибротическим действием с неизвестным механизмом; антагонисты рецептора лизофосфатидной кислоты 1 (LPA - от англ. lysophosphatidic acid), такие как АМ095, АМ152, АМ966, Ki16425, SAR100842, BMS-986020 и UD-009; агонисты рецептора LPA-2, такие как натриевая соль (R)-1-фенилэтил-5-(4-бифенил-4-циклопропанкарбоновая кислота)-3-метилизоксазол-4-ил карбамата; антагонисты рецептора LPA-2, такие как H2L5186303; ингибиторы НАДФН-оксидазы 4 (NOX - от англ. Nadph oxidase), такие как GLX351322 и 2-(2-хлорфенил)-4-[3-(диметиламино)фенил]-5-метил-1Н-пиразол[4,3-С]пиридин-3,6(2Н,5Н)-дион; ингибиторы NOX-1,4, такие как GKT831; ингибиторы c-Jun-аминотерминальной киназы (JNK - от англ. c-Jun N-terminal kinase), такие как танзисертиб (tanzisertib) (СС-930) и СС-90001; соединения с неизвестным механизмом действия, такие как натриевая соль 3-пентилбензолуксусной кислоты; селективные антагонисты эндотелиновых рецепторов типа А, такие как амбризентан; хелаторы меди, такие как тетратиомолибдат; антитела к рецепторам интерлейкина-4 (IL-4 - от англ. interleukine-4) (которые тем самым нацелены на IL-4 и IL-13), такие как дупилумаб; биспецифичные анти-IL-4/IL-13 антитела, такие как SAR156597; двойные антагонисты рецепторов эндотелина, такие как бозентан, мацитентан, тезосентан, мацитентан; антитела к СС-хемокиновому лиганду 2 (CCL2), такие как карлумаб (CNTO 888); анти-IL-13 антитела, такие как QAX576I, лебрикизумаб и тралокинумаб; анти-L13 антитела, связанные с мутированной формой псевдомонадного экзотоксина А, такие как цинтредекин бесудотокс; антитела к трансформирующему ростовому фактору бета (TGFβ - от англ. anti-transforming growth factor-beta), такие как фрезолимумаб (GC1008): моноклональные антитела к фактору роста соединительной ткани, такие как FG-3019; антитела к αvβ6 интегрину, такие как 264RAD и STX-100; антагонисты αvβ6 интегрина, такие как GSK 3008348: антитела к лизилоксидазоподобному ферменту-2 (LOXL2 - от англ. anti-lysyl oxidase-like 2), такие как симтузумаб; антитела к хемокину CCL-24 (С-С мотив) (также известные как антитела к ингибирующему фактору миелоидных клеток-предшественников 2 (MPIF-2) или к хемотаксическому белку эозинофилов 2 (эотаксин-2)), такие как СМ-101; очищенные растворы бычьего коллагена типа V для перорального применения, такие как IW00; рекомбинантный человеческий пентраксин-2 (также известный как сывороточный амилоид Р), такой как PRM-151; агонисты NK-1, такие как [Sar9,Met(O2)11]-вещество Р (NAS911B); тетразамещенные производные порфирина, содержащие марганец (III); антагонисты рецептора лейкотриена (LT - от англ. leukotriene), комбинированные с фосфодиэстеразами (ФДЭ)-3,4; ингибиторы 5-липоксигеназы (5-LO - от англ. 5-lipoxygenase), такие как типелукаст (MN-001); пан-агонисты рецептора, активируемого пролифератором пероксисом, такие как 1-(6-бензотиазолилсульфонил)-5-хлор-1Н-индол-2-бутановая кислота; агонисты рецептора ангиотензина II второго типа (AT - от англ. angiotensin) (агонисты рецептора [АТ]-2, такие как 3-[4-(1Н-имидазол-1-илметил)фенил]-5-(2-метилпропил)тиофен-2-[(N-бутилоксилкарбамат)-сульфонамид] натриевая соль и соединение 21; антагонисты рецептора АТ-2, такие как PD-123319; антагонисты рецептора АТ-1, такие как олмесартан медоксомил; ингибиторы ФДЭ-5, такие как силденафил, тадалафил и варденафил; ингибиторы BCR-ABL тирозинкиназы, такие как бафетиниб (INNO-406), бозутиниб (SKI-606), дазатиниб (BMS-345825), иматиниб, нилотиниб (AMN107) и понатиниб (АР24534); синтетические аналоги простациклина, такие как илопрост и цизапрост; противотромбоцитарные агенты, такие как трепростинил; лецитинированная супероксиддисмутаза; агонисты бета-2 адренорецептора, такие как альбутерол и сальбутамол; производные манноза-6-фосфата, такие как PXS-25; ингибиторы галектина-3, такие как TD139; комбинации пентоксифиллина и витамина Е, такие как PTL-202; ингибиторы MAPKAP киназы 2 (MK2), такие как MMI-0100; ингибиторы сигнального пути hedgehog, такие как висмодегиб; пролекарства цистеина и предшественники глутатиона, такие как N-ацетилцистеин; ингибиторы лейкотриен А4-гидролазы (LTA4H - от англ. leukotriene А4 hydrolase), такие как ацебилустат (СТХ-4430); ингибиторы протонного насоса, такие как омепразол, лансопразол, декслансопразол, рабепразол, пантопразол и эзомепразол; стабилизаторы тучных клеток (динатрия кромогликат), такие как РА101; ингибиторы аутотаксина, такие как GLPG1690; рекомбинантный растворимый тромбомодулин человека, такой как ART-123; ингибиторы Р2Х3, такие как AF-219 и AF-130; ингибиторы Rho-ассоциированной протеинкиназы-2 (ROCK-2 -от англ. Rho-associated protein kinase), такие как KD-025; антитела к фактору некроза опухолей (TNF - от англ. Tumor Necrosis Factor), такие как этанерцепт, инфликсимаб, адалимумаб, цертолизумаб пэгол и голимумаб; ингибиторы фосфоинозитид-3-киназы (PI3Kinase- от англ. Phosphoinositide 3-kinase) / мишени рапамицина у млекопитающих (mTOR - от англ. mammalian target of rapamycin), такие как омипализиб (GSK2126458); модификаторы гемоглобина, такие как GBT440; препараты мезенхимальных стволовых клеток, таких как Refacell-IPF; металлопорфирины, такие как AEOL-10150; ингибиторы фактора комплемента С3, такие как APL-1, и ингибиторы триптофангидроксилазы 1 (ТРН1 - от англ. tryptophan hydroxylase 1), такие как KAR-5585.
В одном варианте осуществления в настоящем изобретении предложена комбинация, которая содержит (а) 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) или его фармацевтически приемлемую соль и (b) второе лекарственное вещество и необязательно одно или более фармацевтически приемлемое вспомогательное вещество(веществ) для лечения ILD.
В одном варианте осуществления в настоящем изобретении предложена комбинация, которая содержит (а) 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) или его фармацевтически приемлемую соль и (b) второе лекарственное вещество и необязательно одно или более фармацевтически приемлемое вспомогательное вещество(веществ) для лечения IPF.
В дополнительном варианте осуществления в настоящем изобретении предложена комбинация соединения (I) (орвепитанта) или его фармацевтически приемлемой соли со вторым лекарственным веществом, которое выбрано из пирфенидона или нинтеданиба, и необязательно одним или более фармацевтически приемлемым вспомогательным веществом(веществами) для лечения ILD.
В дополнительном варианте осуществления в настоящем изобретении предложена комбинация соединения (I) (орвепитанта) или его фармацевтически приемлемой соли со вторым лекарственным веществом, которое выбрано из пирфенидона или нинтеданиба, и необязательно одним или более фармацевтически приемлемым вспомогательным веществом(веществами) для лечения IPF.
В одном варианте осуществления малеатную соль орвепитанта применяют в комбинации со вторым лекарственным веществом, как описано выше.
В дополнительном варианте осуществления орвепитант малеат формы 1 применяют в комбинации со вторым лекарственным веществом, как описано выше.
Следующие примеры иллюстрируют настоящее изобретение, не ограничивая его объем.
Примеры
Клинические исследования
План исследования для хронического кашля, трудно поддающегося лечению
Орвепитант малеат формы 1 оценивали в открытом пилотном исследовании для определения эффективности многократного дозирования у пациентов мужского и женского пола с диагнозом хронического кашля, трудно поддающегося лечению, в течение более 3 месяцев. Исследование представляло собой неконтролируемое (30 мг орвепитанта малеата формы 1 один раз в день), 4-недельное исследование с 4-недельным наблюдением. Осуществляли пять запланированных визитов в клинику; скрининговый визит, основной визит, визит на неделе 1, визит на неделе 4 (конец периода лечения) и контрольное посещение на неделе 8.
Для оценки эффективности применяли следующие инструменты:
 Субъектов обеспечивали амбулаторным регистратором кашля (АСМ -от англ. ambulatory cough monitor) для регистрации объективной частоты кашля в течение 24 часов при скрининге, на неделях 1, 4 и 8
Субъектов обеспечивали амбулаторным регистратором кашля (АСМ -от англ. ambulatory cough monitor) для регистрации объективной частоты кашля в течение 24 часов при скрининге, на неделях 1, 4 и 8
 Опросник по качеству жизни, связанный с кашлем (CQLQ - от англ. Cough-specific Quality of Life Questionnaire): субъектам было предложено заполнить этот опросник на скрининге, неделях 1, 4 и 8
Опросник по качеству жизни, связанный с кашлем (CQLQ - от англ. Cough-specific Quality of Life Questionnaire): субъектам было предложено заполнить этот опросник на скрининге, неделях 1, 4 и 8
 Глобальная степень изменения частоты и тяжести кашля: субъектам было предложено заполнить эту шкалу на неделях 1, 4 и 8
Глобальная степень изменения частоты и тяжести кашля: субъектам было предложено заполнить эту шкалу на неделях 1, 4 и 8
 Тяжесть кашля по визуальной аналоговой шкале (VAS - от англ. Visual analogue scale): Субъектам были розданы дневники для ежедневной регистрации показателей тяжести кашля по шкале VAS
Тяжесть кашля по визуальной аналоговой шкале (VAS - от англ. Visual analogue scale): Субъектам были розданы дневники для ежедневной регистрации показателей тяжести кашля по шкале VAS
В исследование было включено 13 субъектов и предоставлены данные о частоте кашля, качестве жизни при кашле, глобальной степени изменения частоты и тяжести кашля и тяжести кашля по VAS, но у одного из 13 субъектов отсутствовали данные по частоте кашля (день и ночь) на неделе 4.
Первичной конечной точкой было изменение объективной частоты кашля в дневное время в конце периода лечения на неделе 4 по сравнению с исходной.
Результаты
Статистически значимые улучшения были отмечены как для объективных, так и субъективных показателей частоты и тяжести кашля в данном пилотном исследовании, а также для оценок качества жизни при кашле и глобальной степени изменения частоты кашля.
Первичная конечная точка:
Как показано на фигурах 1 и 2, значительное снижение (-18,9 кашля/ч (-26%) среднее изменение от исходных данных), как получено из модели отрицательной биномиальной регрессии, наблюдалось для первичной конечной точки изменения объективной частоты кашля в дневное время на 4-й неделе по сравнению с исходными данными (р меньше 0,001).
Вторичные конечные точки:
Объективная частота кашля в дневное время: Как показано на фигурах 1 и 2, на 1-й неделе наблюдалось значительное снижение частоты кашля в дневное время (-27,0 кашля/ч (-38%) среднее изменение от исходных данных) и 8-й неделе (-20,4 кашля/ч (-28%) среднее изменение от базовой линии) (р равно 0,001 и р равно 0,02 соответственно), но не произошло существенного изменения частоты кашля в дневное время на неделе 8 по сравнению с неделей 4 (р равно 0,86).
Объективная частота кашля в ночное время: Существенное снижение (-3,1 кашля/ч (-66%) среднее изменение от исходных данных) объективной частоты кашля в ночное время наблюдалось на 8-й неделе по сравнению с исходными данными (р равно 0,017), однако не было значительного снижения средней частоты кашля в ночное время на неделях 1 и 4 по сравнению с исходными данными, или между неделями 4 и 8 (р равно 0,19, р равно 0,65, р равно 0,10, соответственно).
Качество жизни при кашле: Результаты CQLQ показали значительное снижение общего показателя на неделях 1, 4 и 8 по сравнению с исходными данными (средние изменения -4,0, -4,4 и -3,4, р меньше 0,001, р равно 0,005 и р равно 0,033, соответственно), и отсутствие существенного различия общего показателя между неделями 4 и 8 (р равно 0,52). Значительные изменения по сравнению с исходными данными наблюдались для большинства областей оценки на неделе 1 или неделе 4, со значительными изменениями по сравнению с исходными данными, отмеченными на неделях 1, 4 и 8 для психосоциальной и экстремальной физической области оценки. Никаких существенных изменений для эмоциональной области оценки не наблюдалось. Никаких существенных изменений для любого области оценки с 4 по 8 неделю не наблюдалось.
Глобальная степень изменения частоты кашля: Большее количество субъектов чувствовали себя лучше с точки зрения частоты кашля на 1-й неделе (n равно 9) и 4-й неделе (n равно 7) по сравнению с исходными данными, чем количество субъектов, которые чувствовали себя так же (n равно 4 и n равно 5, соответственно). Медианный показатель улучшения на неделях 1 и 4 составлял 3 (несколько лучше). Никто из субъектов не чувствовал себя хуже на неделе 1 и неделе 4. На неделе 8 количество субъектов, которые чувствовали себя лучше, уменьшилось (n равно 3), и большее количество субъектов чувствовало себя так же (n равно 7), и некоторые чувствовали себя хуже (n равно 3). Статистическую значимость наблюдали при применении маргинальных критериев однородности для сравнения результатов «лучше/одинаково/хуже» на неделе 8 с неделями 1 и 4 (р равно 0,02 и р равно 0,05 соответственно), при этом меньшее количество субъектов чувствовали себя лучше на неделе 8. Большее количество субъектов чувствовали себя лучше с точки зрения тяжести кашля на неделе 1 (n равно 8) по сравнению с исходными данными, чем количество субъектов, которые чувствовали себя так же (n равно 5). Медианный показатель улучшения составлял 4 (умеренно лучше) на неделе 1, и составлял 3 (несколько лучше) на неделе 4. Ни один из субъектов не чувствовал себя хуже ни на неделе 1, ни на неделе 4. К неделе 8 количество субъектов, которые чувствовали себя лучше, уменьшилось (n равно 4), и увеличилось количество субъектов, которые чувствовали себя так же (n равно 6), и некоторые чувствовали себя хуже (n равно 3). Статистическую значимость отмечали при сравнении результатов недели 8 и недели 1 (р равно 0,05), при меньшем количестве субъектов, которые чувствовали себя лучше на неделе 8. Специальный анализ показал наличие связи между объективными и субъективными оценками изменений кашля. Субъекты, которые оценивали симптомы частоты кашля и тяжести кашля как «улучшенные», имели тенденцию к значительному снижению часовых показателей кашля в дневное время, чем те, кто оценивал их симптомы как одинаковые/худшие. Никакой очевидной связи с часовыми показателями в ночное время обнаружено не было.
Тяжесть кашля по визуальной аналоговой шкале (VAS). Значительное снижение тяжести кашля в дневное время по сравнению с исходными данными, измеренное по тяжести кашля по VAS, наблюдалось на 2 неделе исследования (среднее изменение -39% от исходных данных, р равно 0,002) и продолжалось до 6 недели исследования (среднее изменение -14% от исходных данных, р равно 0,001). Аналогичным образом, было отмечено значительное снижение тяжести кашля в ночное время на 1-й неделе исследования по сравнению с исходными данными (среднее изменение -14% от исходных данных, р равно 0,01), которое сохранялось до 6 недели исследования (-18% среднего изменения от исходных данных, р равно 0,017).
Клинические исследования на пациентах с хроническим кашлем, связанным с IPF
Орвепитант малеат формы 1 оценивали в рандомизированном двойном слепом плацебо-контролируемом исследовании на пациентах с кашлем, связанным с IPF; оценивали дыхательную недостаточность.
Исследование представляло собой сравнительное исследование с применением 30 мг орвепитанта малеата формы 1 и плацебо, которые вводили один раз в сутки в течение 2 недель, с 2-недельным наблюдением. Каждая группа состояла из 25 субъектов. Осуществляли 4 запланированных визита в клинику; скрининговый визит, основной визит, визит на неделе 2 (конец периода лечения) и контрольное посещение на неделе 4.
Для оценки эффективности применяли следующие инструменты:
 Субъектов обеспечивали амбулаторным регистратором кашля (АСМ) для регистрации объективной частоты кашля в течение 24 часов при скрининге (исходные данные) и на неделе 2
Субъектов обеспечивали амбулаторным регистратором кашля (АСМ) для регистрации объективной частоты кашля в течение 24 часов при скрининге (исходные данные) и на неделе 2
 Опросник по качеству жизни, связанный с кашлем: субъектам было предложено заполнить этот опросник на скрининге, основном визите, неделях 2 и 4
Опросник по качеству жизни, связанный с кашлем: субъектам было предложено заполнить этот опросник на скрининге, основном визите, неделях 2 и 4
 Глобальная степень изменения частоты и тяжести кашля: субъектам было предложено заполнить эту шкалу на неделях 2 и 4
Глобальная степень изменения частоты и тяжести кашля: субъектам было предложено заполнить эту шкалу на неделях 2 и 4
 Тяжесть кашля по VAS: Субъектам были розданы дневники для ежедневной регистрации показателей тяжести кашля по шкале VAS
Тяжесть кашля по VAS: Субъектам были розданы дневники для ежедневной регистрации показателей тяжести кашля по шкале VAS
 Шкалы оценки дыхательной недостаточности: Опросник относительно затруднений дыхания университета Сан-Диего и Шкала CR10 Борга. Субъектам было предложено заполнить этот опросник на скрининге, основном визите, неделях 2 и 4
Шкалы оценки дыхательной недостаточности: Опросник относительно затруднений дыхания университета Сан-Диего и Шкала CR10 Борга. Субъектам было предложено заполнить этот опросник на скрининге, основном визите, неделях 2 и 4
Первичная конечная точка представляет собой изменение объективной частоты кашля в дневное время в конце периода лечения на неделе 2 по сравнению с исходными данными.
Клинические исследования на пациентах с хроническим кашлем, вызванным опухолями легких:
Орвепитант малеат формы 1 оценивали в рандомизированном двойном слепом плацебо-контролируемом исследовании на пациентах с хроническим кашлем, вызванным опухолями легких.
Исследование представляло собой сравнительное исследование с применением 30 мг орвепитанта малеата формы 1 и плацебо, которые вводили один раз в сутки в течение 2 недель, с 2-недельным наблюдением. Каждая группа состояла из 25 субъектов. Осуществляли 4 запланированных визита в клинику; скрининговый визит, основной визит, визит на неделе 2 (конец периода лечения) и контрольное посещение на неделе 4.
Для оценки эффективности применяли следующие инструменты:
Субъектов обеспечивали амбулаторным регистратором кашля (АСМ) для регистрации объективной частоты кашля в течение 24 часов при скрининге (исходные данные) и на неделе 2
Манчестерская шкала оценки кашля у пациентов с раком легких (MCLCS - от англ. Manchester Cough in Lung Cancer Scale Score) представляет собой показатель качества жизни для пациентов с раком легких: субъектам было предложено заполнить этот опросник на скрининге, основном визите, неделях 2 и 4
Глобальная степень изменения частоты и тяжести кашля: субъектам было предложено заполнить эту шкалу на неделях 2 и 4
Тяжесть кашля по VAS: Субъектам были розданы дневники для ежедневной регистрации показателей тяжести кашля по шкале VAS
Шкалы оценки дыхательной недостаточности: Опросник относительно затруднений дыхания университета Сан-Диего и Шкала CR10 Борга. Субъектам было предложено заполнить этот опросник на скрининге, основном визите, неделях 2 и 4
Первичная конечная точка представляет собой изменение объективной частоты кашля в дневное время в конце периода лечения на неделе 2 по сравнению с исходными данными.
Терапевтические показания IDL
Анализы in vitro
Применение соединения формулы (I) или его фармацевтически приемлемых солей в качестве агента против IPF можно оценить в одном или нескольких анализах in vitro, как описано ниже. В этих анализах можно применять соответствующие клеточные линии человека совместно с первичными клетками легкого человека от нормальных доноров и доноров с IPF.
Анализ активации эпителиальных клеток легких
Проводили анализ действия соединения формулы (I) или его фармацевтически приемлемых солей по ингибированию активации веществом Р эпителиальных клеток легких, которые отвечают за высвобождение «аларминов» и факторов роста, таких как TGF-βis. Эти алармины, содержащие белок теплового шока 60 (HSP-60 - от англ. Heat Shock Protein 60), белок группы с высокой подвижностью 1 (HMGB1 - от англ. high-mobility group box-1 prot) и интерлейкин (IL)-1α, представляют собой воспалительные молекулярные «сигналы опасности», высвобождаемые поврежденными эпителиальными клетками, которые могут способствовать врожденному иммунному ответу путем активации иммунных клеток и других типов клеток для высвобождения медиаторов, активирующих фибробласт, которые могут содержать факторы роста. Алармины и факторы роста, высвобождаемые эпителиальными клетками, также могут оказывать непосредственное стимулирующее действие на фибробласты. Стимулированные фибробласты отвечают за миграцию и пролиферацию, а также дифференцировку на миофибробласты и сверхэкспрессирующие белки фиброзных матриц и индуцирование дальнейшей экспрессии профибротических цитокинов и факторов роста, таких как фактор роста соединительной ткани (CTGF - от англ. connective tissue growth factor), что приводит к осаждению внеклеточного матрикса и прогрессирующему фиброзу.
Применяемые линии эпителиальных клеток человека включают BEAS-2B, Н358, HPL1D, VA10, 16НВЕ14о и А549, или первичные нормальные эпителиальные клетки легких человека или первичные эпителиальные клетки легких человека от доноров с IPF. Повышенное количество аларминов и факторов роста, продуцируемых эпителиальными клетками человека, активированными веществом Р, и их ингибирование путем совместного введения соединения формулы (I) или его фармацевтически приемлемых солей измеряют, например, с применением способов профилирования мРНК или фермент-связанного иммуносорбентного анализа (ELISA - от англ. enzyme-linked immunosorbent assay).
Воспалительный ответ иммунных клеток, таких как макрофаги Проводили анализ действия соединения формулы (I) или его фармацевтически приемлемых солей по ингибированию активации веществом Р макрофагов легких человека, которые отвечают путем высвобождения воспалительных и профибротических медиаторов.
Применяемые клеточные линии макрофагов человека включают клетки U937, первичные нормальные клетки макрофагов легкого человека или первичные клетки макрофагов легкого человека от доноров с IPF. Повышенное количество медиаторов воспаления, таких как CCL-17, CCL-18, CCL-22, IL-6, IL-10 и фактор роста TGF-β, продуцируемых клетками макрофагов легких человека, активированными веществом Р, и их ингибирование посредством совместного введения соединения формулы (I) или его фармацевтически приемлемых солей измеряли с применением, например, способов профилирования мРНК или анализа ELISA.
Воспалительный ответ иммунных клеток, таких как тучные клетки Проводили анализ действия соединения формулы (I) или его фармацевтически приемлемых солей по ингибированию активации веществом Р тучных клеток легких человека, которые отвечают высвобождением ряда профибротических медиаторов, таких как триптаза, химаза, TGF-β, IL-13, CCL2, CCL5, IL-4, PDGF и FGF.
Применяемые линии тучных клеток включают клетки НМС-1, LAD2 и LUVA, первичные нормальные тучные клетки легкого человека или первичные тучные клетки легкого человека от доноров с IPF. Повышенное количество одного или более профибротических медиаторов как триптаза, химаза, TGF-β, IL-13, CCL2, CCL5, IL-4, PDGF и FGF, продуцируемых тучными клетками легкого человека, активированных веществом Р, и их ингибирование посредством совместного введения соединения формулы (I) или его фармацевтически приемлемых солей измеряли с применением, например, способов профилирования мРНК или анализа ELISA.
Воспалительный ответ иммунных клеток, таких как Т-клетки
Проводят анализ действия соединения формулы (I) или его фармацевтически приемлемых солей по ингибированию активации, поляризации и выживания Т клеток, что является необходимым для врожденных и адаптивных клеточных иммунных реакций при IPF, и активируется веществом Р.
Можно применять линии Т-клеток человека или выделенные первичные Т-клетки легкого человека или выделенные первичные Т-клетки легкого человека от доноров с IPF. Повышенное количество одной или более эффекторных молекул IFN-g, IFN-y, IL-2, IL-4, IL-5, IL-8, IL-10, IL-12p70, IL-13, IL-17, IL-23 и TNF-a, продуцируемых Т-клетками человека, активированными веществом Р, и их ингибирование посредством совместного введения соединения формулы (I) или его фармацевтически приемлемых солей измеряли с применением, например, способов профилирования мРНК или анализа ELISA
Активация, миграция и дифференцировка фибробластов легких
Проводили анализ действия соединения формулы (I) или его фармацевтически приемлемых солей по ингибированию активации веществом Р пролиферации, миграции и дифференцировки фибробластов человека на миофибробласты.
Применяемые клеточные линии фибробластов легких человека включают WI38, MRC5, HFL1, HDF и IMR90, или первичные нормальные фибробласты легких человека или первичные фибробласты легких человека от доноров с IPF.
Пролиферацию фибробластов легких человека, индуцированную веществом Р, и ее ингибирование посредством совместного введения соединения формулы (I) или его фармацевтически приемлемых солей можно проанализировать с применением ряда способов, включая измерение количества тимидина или 5-бром-2'-дезоксиуридина (BrdU - от англ. 5-bromo-2'-deoxyuridine), включенного в реплицируемую ДНК пролиферативных фибробластов. В качестве альтернативы, метаболическую активность фибробластов легких человека можно использовать в качестве меры клеточной пролиферации. Данные анализы включают применение солей тетразолия или соединений аламарового синего, количество которых снижается в среде метаболически активных клеток, образуя краситель формазан, который впоследствии изменяет цвет среды, который измеряют спектрофотометрически.
Миграцию фибробластов легких человека анализируют в системе камер Бойдена. Верхняя и нижняя части камеры разделены пористым фильтром; фибробласты легких человека помещают в верхнюю камеру, в то время как хемоаттрактант, такой как фибронектин, помещают в нижнюю камеру. Миграцию оценивают после инкубации путем подсчета количества клеток на фильтре с применением светового микроскопа или счетчика клеток. Определяют способность соединения формулы (I) или его фармацевтически приемлемых солей ингибировать хемотаксис фибробластов легких человека, индуцированный веществом Р.
Дифференциацию фибробластов легких человека на миофибробласты анализируют путем инкубации фибробластов легких человека с TGF-β и/или веществом Р или посредством совместного введения TGF-β и вещества Р, и анализируя экспрессию маркера миофибробластов, альфа-актина гладкой мускулатуры (α-SMA - от англ. alpha-smooth muscle actin), с применением профилирования мРНК или ELISA или, к примеру, флуоресцентных способов визуализации. Определяют способность соединения формулы (I) или его фармацевтически приемлемых солей ингибировать TGF-β или/и вещество Р или совместно вводимые TGF-β и вещество Р, способствующие переходу фибробластов легкого человека в миофибробласты.
Осаждение внеклеточного матрикса фибробластов и миофибробластов легких
Проводят анализ действия соединения формулы (I) или его фармацевтически приемлемых солей по ингибированию индуцированного веществом Р осаждения внеклеточного матрикса (ЕСМ - от англ. extracellular matrix).
Применяемые клеточные линии фибробластов легких человека включают MRC5 или первичные нормальные миофибробласты легких человека или первичные миофибробласты легких человека от доноров с IPF. Экспрессию белка и/или мРНК фибробластами легкого человека и/или миофибробластами легкого человека для одного или нескольких компонентов ЕСМ, таких как белки фиброза коллаген, эластин, фибронектин или ламинин, которая индуцируется веществом Р и ингибируется посредством совместного введения соединения формулы (I) или его фармацевтически приемлемых солей, измеряют посредством ряда способов профилирования мРНК или анализа ELISA, соответственно.
Ангиогенез
Проводят анализ действия соединения формулы (I) или его фармацевтически приемлемых солей по ингибированию ангиогенеза эндотелиальными клетками, который активируется веществом Р.
Применяемые линии эндотелиальных клеток легких человека включают PCS-100-022 или первичные нормальные эндотелиальные клетки легкого человека или первичные эндотелиальные клетки легкого человека от доноров с IPF. Ангиогенез культивируемых эндотелиальных клеток легкого человека, стимулированных веществом Р и ингибированных посредством совместного введения соединения формулы (I) или его фармацевтически приемлемых солей, можно оценить с применением анализа образования трубки эндотелиальными клетками в матригеле.
Комбинации совместных культур
Применяют совместную культуру двух или более различных комбинаций легкого человека: эпителиальных клеток, фибробластов, миофибробластов, макрофагов, тучных клеток и эндотелиальных клеток. Например, эпителиальные клетки легких человека с фибробластами легких человека; или тучные клетки легких человека с фибробластами легких человека; или макрофаги легких человека с фибробластами легких человека; и т.д. Комбинации двух или более из данных клеток легких человека встроены в 3-мерные модели с применением каркаса. Влияние вещества Р на такие совместно культивируемые системы исследуют с применением описанных выше форматов анализа, таких как активация эпителиальных клеток легких, воспалительный ответ иммунных клеток, таких как макрофаги и тучные клетки, пролиферация, миграция и дифференцировка фибробластов на миофибробласты, осаждение ЕСМ и повышение ангиогенеза. Можно определять способность соединения формулы (I) или его фармацевтически приемлемых солей ингибировать такие вредоносные активности, вызываемые веществом Р.
Клиническое исследование
Эффективность соединения формулы (I) или его фармацевтически приемлемых солей в качестве монотерапии или в качестве дополнения к стандартным способам лечения IPF, которые стабильно назначают пациентам в течение по меньшей мере 3 месяцев, таким как пирфенидон или нинтеданиб, оценивают в 52-недельном плацебо-контролируемом двойном слепом рандомизированном исследовании у пациентов с диагнозом IPF и у которых показатель форсированной жизненной емкости (FVC - от англ. forced vital capacity) при скрининге составил прогнозируемое значение, большее или равное 50% и меньшее или равное 100%.
Первичную конечную точку для эффективности оценивают как изменение от исходных данных до 52-й недели в виде годового показателя снижения прогнозируемой FVC в процентах. Вторичные конечные точки включают изменение от исходных данных до недели 52 в виде показателей:
 Выживаемость без прогрессирования (PFS)
Выживаемость без прогрессирования (PFS)
 Показатель легочного фиброза с помощью компьютерной томографии с высокой разрешающей способностью;
Показатель легочного фиброза с помощью компьютерной томографии с высокой разрешающей способностью;
 Функция легких, измеренная с помощью FVC
Функция легких, измеренная с помощью FVC
 Годовой показатель изменения FVC
Годовой показатель изменения FVC
 Диффузионная способность легких в отношении монооксида углерода
Диффузионная способность легких в отношении монооксида углерода
 Показатели качества жизни, связанные со здоровьем
Показатели качества жизни, связанные со здоровьем
 Тест ходьбы в течение шести минут
Тест ходьбы в течение шести минут
 Время от рандомизации до первого случая обострения IPF. Фармацевтические композиции
Время от рандомизации до первого случая обострения IPF. Фармацевтические композиции
Орвепитант малеат формы 1 обычно, но не обязательно, перед введением пациенту должен быть приготовлен в форме фармацевтических композиций. В одном аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим орвепитант малеат формы 1.
Таблетки орвепитанта малеата формы 1 получали в форме от белых до почти белых покрытых оболочкой круглых таблеток, содержащих 10 мг, 20 мг, 30 мг, 50 мг и 60 мг орвепитанта, которые обеспечивают немедленное высвобождение активного ингредиента для перорального введения.
Перечень вспомогательных веществ и количественный состав таблеток приведены в таблицах 1-3 ниже.
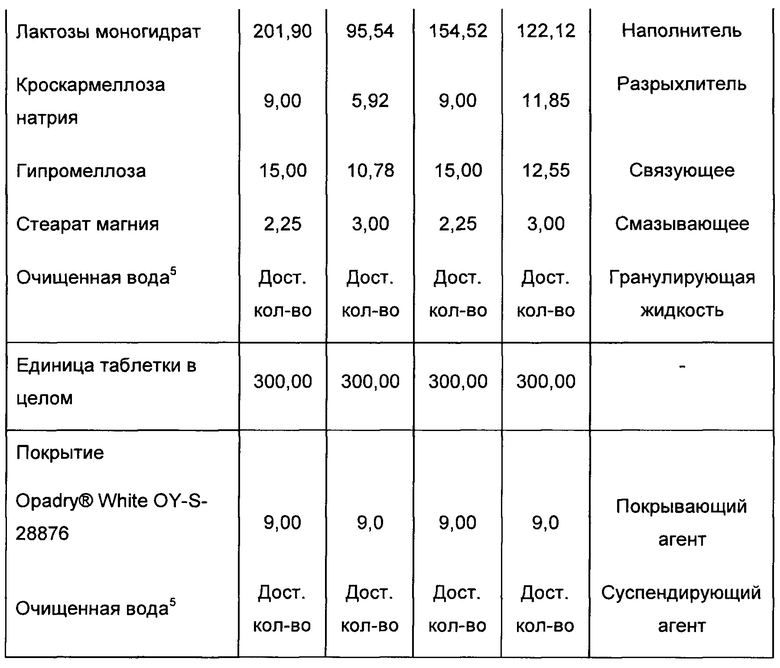
1. Соответствует 10,0 мг орвепитанта
2. Соответствует 30,0 мг орвепитанта
3. Соответствует 50,0 мг орвепитанта
4. Соответствует 60,0 мг орвепитанта
5. Удаляют при обработке. Не присутствует в конечном продукте.


Соответствует 25,32 мас. % в форме свободного основания
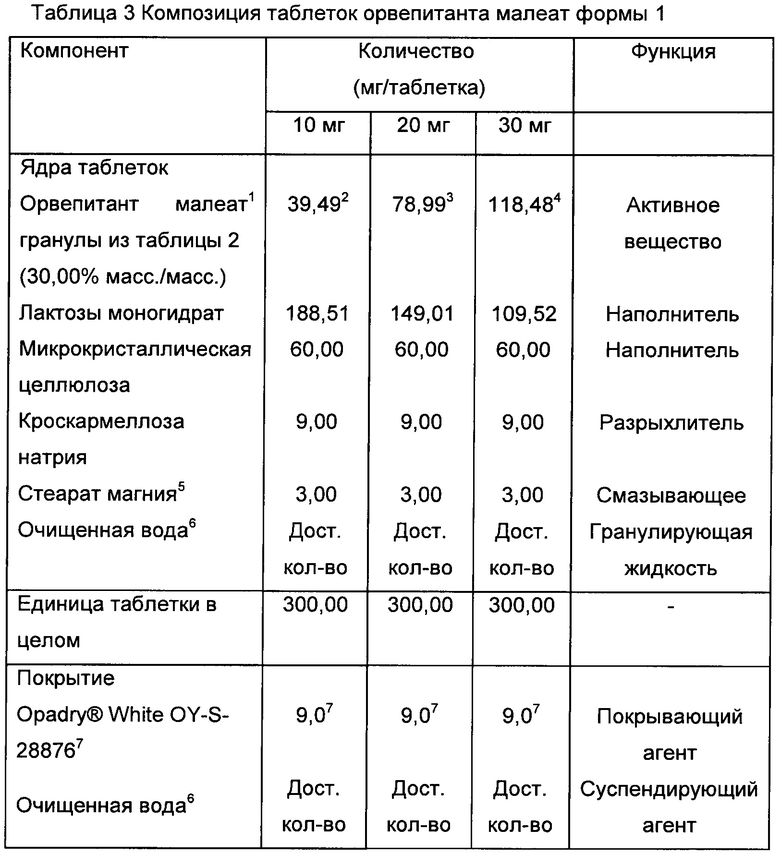
1. Актуальное количество орвепитанта малеата формы 1 может быть скорректировано на основе чистоты вводимого лекарственного вещества.
2. Соответствует 10,0 мг орвепитанта
3. Соответствует 20,0 мг орвепитанта
4. Соответствует 30,0 мг орвепитанта
5. Растительного происхождения.
6. Удаляют при обработке. Не присутствует в конечном продукте.
7. Масса пленочного покрытия, нанесенного на таблетку, может изменяться в зависимости от эффективности способа, но обычно составляет 3 мас. % от массы ядра таблетки.
Таблетки орвепитанта малеата, 10 мг, 20 мг, 30 мг, 50 мг и 60 мг получали с применением влажного гранулирования, сухого смешивания, прессования в таблетки и нанесения пленочного покрытия.
Орвепитант малеат в качестве лекарственного вещества, лактозы моногидрат, гипромеллозу, микрокристаллическую целлюлозу и кроскармеллозу натрия просеивали и сушили в грануляторе с высоким усилием сдвига в течение приблизительно 5 минут. Воду для грануляции распыляли на сухую смесь лекарственного вещества, лактозы моногидрата, гипромеллозы, микрокристаллической целлюлозы и кроскармеллозы натрия. Влажные гранулы сушили приблизительно при 65°С в сушилке с псевдосжиженным слоем в течение приблизительно 45 минут (потери при высушивании составляли менее 2% (LOD -от англ. loss on drying), измельчали с применением конической мельницы (размер сетки 813 мкм) и смешивали в бункерном смесителе с лактозы моногидратом, микрокристаллической целлюлозой и кроскармеллозой натрия в течение приблизительно 20 минут. Для смазки в бункерный смеситель добавляли стеарат магния, и смесь перемешивали в течение приблизительно 3 минут.
Смесь спрессовывали с применением подходящей ротационной машины для прессования с получением таблеток без покрытия. В сосуд для смешивания с очищенной водой загружали Opadry® White OY-S-28876, и посредством перемешивания получали суспензию для пленочного покрытия. Таблетки покрывали пленочным покрытием в подходящем дражировочном котле (приблизительно 3% прироста массы).
Вышеприведенное описание полностью раскрывает настоящее изобретение, включая его предпочтительные варианты осуществления. Модификации и усовершенствования вариантов осуществления, конкретно раскрытых в настоящем документе, входят в объем следующей формулы изобретения. Без дополнительного уточнения считается, что специалист в данной области техники, используя предыдущее описание, может применять настоящее изобретение в полной мере. Следовательно, примеры в настоящем документе следует толковать как лишь иллюстративные, а не ограничивающие объем настоящего изобретения каким-либо образом.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОКТАГИДРО КОНДЕНСИРОВАННЫЕ АЗАДЕКАЛИНОВЫЕ МОДУЛЯТОРЫ ГЛЮКОКОРТИКОИДНОГО РЕЦЕПТОРА | 2014 |
|
RU2674983C1 |
| НОВЫЕ СОЕДИНЕНИЯ - АНТАГОНИСТЫ РЕЦЕПТОРА НЕЙРОКИНИНА 1 | 2013 |
|
RU2631319C2 |
| ИМИДАЗО[1,2-а]ПИРАЗИН-1-ИЛ-БЕНЗАМИДЫ ДЛЯ ЛЕЧЕНИЯ СПИНАЛЬНОЙ МЫШЕЧНОЙ АТРОФИИ | 2015 |
|
RU2725979C2 |
| СЕЛЕКТИВНЫЕ АНТАГОНИСТЫ Н4-ГИСТАМИНОВЫХ РЕЦЕПТОРОВ ДЛЯ ЛЕЧЕНИЯ ВЕСТИБУЛЯРНЫХ НАРУШЕНИЙ | 2009 |
|
RU2589846C2 |
| ПРИМЕНЕНИЕ СИГМА-ЛИГАНДОВ ОТ БОЛИ ПРИ РАКЕ КОСТЕЙ | 2011 |
|
RU2585095C2 |
| ПРОИЗВОДНЫЕ 2-ПИРАЗИНОНА ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ ИЛИ СОСТОЯНИЯ, ПРИ КОТОРЫХ ПОЛЕЗНО ИНГИБИРОВАНИЕ АКТИВНОСТИ НЕЙТРОФИЛЬНОЙ ЭЛАСТАЗЫ | 2007 |
|
RU2448098C2 |
| ПИПЕРИДИНОВЫЕ ПРОИЗВОДНЫЕ И СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРИМЕНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 2003 |
|
RU2336276C2 |
| ПРИМЕНЕНИЕ АНТАГОНИСТОВ РЕЦЕПТОРА NK-1 ДЛЯ ЛЕЧЕНИЯ ЧЕРЕПНО-МОЗГОВОЙ И СПИННОМОЗГОВОЙ ТРАВМЫ ИЛИ ПОВРЕЖДЕНИЯ НЕРВНОЙ ТКАНИ | 2002 |
|
RU2304435C2 |
| ИНГИБИТОРЫ ОКСАЗИНМОНОАЦИЛГЛИЦЕРИНЛИПАЗЫ (MAGL) | 2019 |
|
RU2794334C2 |
| СИГМА-ЛИГАНДЫ ДЛЯ ПРИМЕНЕНИЯ ПРИ ПРОФИЛАКТИКЕ И/ИЛИ ЛЕЧЕНИИ ПОСЛЕОПЕРАЦИОННОЙ БОЛИ | 2011 |
|
RU2569055C2 |
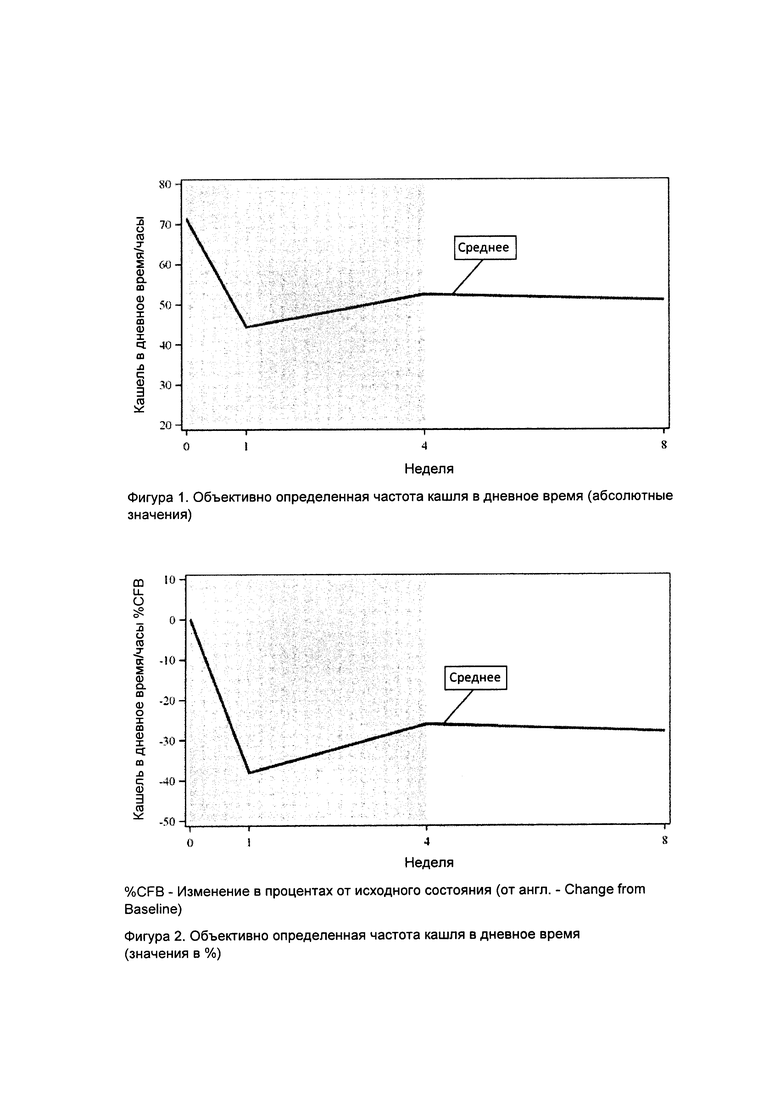
Настоящее изобретение относится к применению 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8аS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламида (орвепитанта) или его фармацевтически приемлемой соли для получения лекарственного средства для лечения хронического кашля. Также предложено применение фармацевтической композиции и способ лечения хронического кашля. Технический результат: предложено новое применение орвепитанта или его фармацевтически приемлемой соли и фармацевтической композиции, содержащей его, для получения лекарственного средства для лечения хронического кашля. 3 н. и 18 з.п. ф-лы, 2 ил., 3 табл.
1. Применение 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламида (орвепитанта) или его фармацевтически приемлемой соли для получения лекарственного средства для лечения хронического кашля.
2. Применение фармацевтической композиции, содержащей 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламид (орвепитант) или его фармацевтически приемлемую соль и один или более фармацевтически приемлемых носителей или вспомогательных веществ, для получения лекарственного средства для лечения хронического кашля.
3. Применение по любому из пп. 1, 2, отличающееся тем, что хронический кашель представляет собой хронический кашель, устойчивый к лечению.
4. Применение по любому из пп. 1-3, отличающееся тем, что хронический кашель вызван или связан с саркоидозом, эмфиземой или идиопатическим легочным фиброзом (ИЛФ).
5. Применение по любому из пп. 1-3, отличающееся тем, что хронический кашель вызван или связан с астмой, хроническим бронхитом, хроническим синдромом постназального затекания, эозинофильным бронхитом или хронической обструктивной болезнью легких (ХОБЛ).
6. Применение по любому из пп. 1-3, отличающееся тем, что хронический кашель вызван или связан с хроническими инфекциями, такими как бронхоэктаз, туберкулез или кистозный фиброз.
7. Применение по любому из пп. 1-3, отличающееся тем, что хронический кашель вызван или связан с опухолями легких, такими как бронхогенная карцинома, альвеолярно-клеточная карцинома, доброкачественные опухоли дыхательных путей или опухоли средостения.
8. Применение по любому из пп. 1-3, отличающееся тем, что хронический кашель вызван или связан с сердечно-сосудистым заболеванием, таким как левожелудочковая недостаточность, инфаркт легких или аневризма аорты.
9. Применение по любому из пп. 1-3, отличающееся тем, что хронический кашель вызван или связан с рефлюксным эзофагитом, рецидивирующей аспирацией, эндобронхиальными швами, синдромом постназального затекания или риносинуситом.
10. Применение по любому из пп. 1-9, отличающееся тем, что фармацевтически приемлемая соль орвепитанта представляет собой малеат.
11. Применение по п. 10, отличающееся тем, что орвепитант малеат представляет собой безводную кристаллическую форму орвепитанта малеата, характеризующуюся дифрактограммой порошковой рентгеновской дифракции (XRD), выраженной в значениях углов 2-тэта и полученной на дифрактометре с применением рентгеновского Kα-излучения меди, при этом дифрактограмма XRD содержит пики, расположенные при следующих значениях угла 2-тэта: 7,3±0,1, 7,5±0,1, 10,9±0,1, 12,7±0,1, 16,5±0,1 градусов, отвечающих соответственно d-расстояниям при 12,2, 11,8, 8,1, 7,0 и 5,4 ангстрем (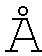 ).
).
12. Способ лечения хронического кашля, включающий введение человеку, нуждающемуся в этом, терапевтически эффективного количества 2-(R)-(4-фтор-2-метил-фенил)-4-(S)-((8aS)-6-оксо-гексагидро-пирроло[1,2-а]-пиразин-2-ил)-пиперидин-1-карбоновой кислоты [1-(R)-(3,5-бис-трифторметил-фенил)-этил]-метиламида (орвепитанта) или его фармацевтически приемлемой соли.
13. Способ лечения по п. 12, отличающийся тем, что хронический кашель представляет собой хронический кашель, устойчивый к лечению.
14. Способ лечения по п. 12, отличающийся тем, что хронический кашель вызван или связан с саркоидозом, эмфиземой или идиопатическим легочным фиброзом.
15. Способ лечения по п. 12, отличающийся тем, что хронический кашель вызван или связан с астмой, хроническим бронхитом, хроническим синдромом постназального затекания, эозинофильным бронхитом и хронической обструктивной болезнью легких.
16. Способ лечения по п. 12, отличающийся тем, что хронический кашель вызван или связан с хроническими инфекциями, такими как бронхоэктаз, туберкулез, кистозный фиброз.
17. Способ лечения по п. 12, отличающийся тем, что хронический кашель вызван или связан с опухолями, такими как бронхогенная карцинома, альвеолярно-клеточная карцинома, доброкачественные опухоли дыхательных путей, опухоли средостения.
18. Способ лечения по п. 12, отличающийся тем, что хронический кашель вызван или связан с сердечно-сосудистым заболеванием, таким как левожелудочковая недостаточность, инфаркт легких, аневризма аорты.
19. Способ лечения по п. 12, отличающийся тем, что хронический кашель вызван или связан с рефлюксным эзофагитом, рецидивирующей аспирацией, эндобронхиальными швами, синдромом постназального затекания или риносинуситом.
20. Способ лечения по п. 12, отличающийся тем, что фармацевтически приемлемая соль указанного соединения представляет собой малеат.
21. Способ лечения по п. 20, отличающийся тем, что орвепитант малеат представляет собой безводную кристаллическую форму орвепитанта малеата, характеризующуюся дифрактограммой порошковой рентгеновской дифракции (XRD), выраженной в значениях углов 2-тэта и полученной на дифрактометре с применением рентгеновского Kα-излучения меди, при этом дифрактограмма XRD содержит пики, расположенные при следующих значениях угла 2-тэта: 7,3±0,1, 7,5±0,1, 10,9±0,1, 12,7±0,1, 16,5±0,1 градусов, отвечающих соответственно d-расстояниям при 12,2, 11,8, 8,1, 7,0 и 5,4 ангстрем ( ).
).
| MUNOZ M | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Патрон для защиты форсунки от действия жара топок | 1917 |
|
SU1820A1 |
| EL-HASHIM A | |||
| Z | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2021-04-16—Публикация
2016-12-27—Подача