Заявленное изобретение относится к области металлургии, в частности, к технологиям получения металлов и сплавов при электролитическом разложении оксидов в расплавленных солях.
Электролитическое разложение оксидов в расплавленных солях занимает значительную нишу в металлургической промышленности мирового масштаба и является перспективным для разработки новых энергоэффективных и ресурсосберегающих способов получения востребованных металлов и сплавов. В настоящее время путем электролитического разложения оксида алюминия (глинозема), растворенного в криолит-глиноземном расплаве, получают алюминий, в то время как аналогичные способы могут быть использованы для получения циркония, кремния, титана, редкоземельных и прочих элементов. Активно ведутся научно-практические исследования, направленные на разработку новых способов получения алюминия и его сплавов с бором, кремнием, цирконием, скандием и другими элементами при электролизе относительно легкоплавких систем KF-AlF3, NaF-AlF3 и LiF-AlF3 с добавками оксидов Al2O3, B2O3, SiO2, ZrO2, Sc2O3 и др. При электролизе перечисленных оксидно-галогенидных расплавов основным процессом является электролитическое разложение растворенных в расплаве оксидов. Скорость и энергоэффективность этого процесса, в том числе, определяется скоростью растворения оксидов в используемых оксидно-галогенидных расплавах.
Ввиду повышенной температуры и агрессивности оксидно-галогенидных расплавов способы определения скорости растворения оксидов в них, также как и выбор материалов и устройств для осуществления способов весьма ограничен. Из анализа источников научно-технической информации можно отметить, что наибольшее внимание сосредоточено на определении скорости растворения глинозема (Al2O3) в криолит-глиноземном расплаве визуальным методом, а также с использованием потенциометрии.
Известен способ определения скорости растворения оксида в оксидно-галогенидном расплаве, включающий загрузку оксида в оксидно-галогенидный расплав, размещенный в химически устойчивом по отношению к компонентам расплава тигле, при температуре измерений, визуальное наблюдение за процессом растворения и фиксацию времени полного растворения навески оксида в оксидно-галогенидном расплаве [1]. За полное растворение принимают момент, когда расплав становится прозрачным, то есть оптически проницаемым. Скорость растворения оксида вычисляют, как изменение массы или молей оксида ко времени полного растворения навески оксида в расплаве. Изменение массы или молей оксида определяют расчетным путем либо по химическому анализу оксида в исследуемом расплаве. Для повышения точности фиксации времени полного растворения навески оксида используют платиновый тигель, либо на дно тигля помещают платиновую пластинку, при этом дно тигля подсвечивают, например, при помощи лампы накаливания.
При относительно простом исполнении и неиспользовании каких-либо дополнительных устройств для измерений, погружаемых непосредственно в расплав, способ характеризуется такими недостатками, как небезопасность измерений, невозможность осуществления способа на промышленных электролизерах, неточность фиксации времени полного растворения оксида в оксидно-галогенидном расплаве, поскольку для установления оптической проницаемости расплава требуется специализированное оборудование, при этом оптическая проницаемость зависит от содержания растворенного оксида в расплаве. Эти недостатки приводят к неточности определения скорости растворения оксида и невозможности унификации способа.
Для исключения неточностей, связанных с определением оптической проницаемости оксидно-галогенидного расплава, предлагается способ определения скорости растворения оксида в оксидно-галогенидном расплаве, включающий загрузку оксида в оксидно-галогенидный расплав, размещенный в двухкамерной кварцевой ячейке при температуре измерений, измерение оптической проницаемости расплава и фиксацию времени полного растворения навески оксида в оксидно-галогенидном расплаве [2]. Ячейку с расплавом размещают в нагревателе с возможностью измерения оптической проницаемости исследуемого расплава непосредственно в ходе растворения оксида. После загрузки порции оксида в оксидно-галогенидный расплав непрерывно фиксируют изменение величины оптической проницаемости расплава; из полученной зависимости определяют время полного растворения оксида, после чего рассчитывают скорость его растворения, как изменение массы или молей оксида ко времени полного растворения навески оксида в расплаве.
Недостатками способа являются сложность осуществления в лабораторных условиях и невозможность осуществления на промышленных электролизерах, крайне ограниченный диапазон оксидно-галогенидных расплавов, не взаимодействующих с кварцевой ячейкой. В большинстве потенциально интересных для практической реализации оксидно-галогенидных расплавов, кварц химически неустойчив.
Наиболее распространенным и близким к заявленному является способ определения скорости растворения оксида в оксидно-галогенидном расплаве, включающий загрузку оксида в оксидно-галогенидный расплав, размещенный в химически устойчивом по отношению к компонентам расплава тигле, при температуре измерений, и фиксацию в ходе растворения оксида электрохимического параметра, реагирующего на концентрацию растворенного в оксидно-галогенидном расплаве оксида [3]. В известном способе этим электрохимическим параметром является разность потенциалов между индикаторным электродом в исследуемом расплаве и электродом сравнения в эталонном расплаве аналогичного состава, насыщенном по оксиду. В первом приближении для расплавов одинакового состава разность потенциалов этих электродов определяется соотношением концентраций растворенного в расплавах оксида. В ходе растворения оксида в исследуемом оскидно-галогенидном его концентрация меняется (увеличивается) во времени, в то время как в эталонном расплаве концентрация растворенного оксида постоянна. Процесс растворения оксида отражается в виде снижения разности потенциалов во времени до достижения постоянного в пределах погрешности измерений значения. Время достижения постоянного значения разности потенциалов между электродами принимается за время полного растворения порции оксида и по изменению массы или молей оксида по отношению ко времени полного растворения навески оксида в расплаве вычисляют скорость растворения оксида.
Несмотря на простоту исполнения, наличие фундаментальной обоснованности и широкой апробации на различных объектах исследований способ обладает таким недостатком, как необходимость разработки специального устройства - электрохимической ячейки в составе двух сопряженных отсеков для оксидно-галогенидных расплавов с разной концентрацией растворенного оксида, причем между расплавами отсеков должен осуществляться контакт по растворенным ионам кислорода. В идеале этот контакт должен осуществляться через диафрагму, проводящую по ионам кислорода, однако такие диафрагмы в процессе измерений постепенно утрачивают свою функцию и могут быть использованы лишь для ограниченного диапазона оксидно-галогенидных расплавов и температур. В упрощенном варианте исполнения способа используется пористая диафрагма, в частности, из пористого нитрида бора, которая приводит к появлению погрешности измерений, вызванной параллельным процессом перемешивания расплавов из разных отсеков электрохимической ячейки. Помимо этого, использование пористой диафрагмы подразумевает предварительную пропитку исследуемым расплавом, что приводит к увеличению длительности измерений.
Задачей изобретения является аппаратурное упрощение способа определения скорости растворения оксида в оксидно-галогенидном расплаве.
Для этого предложен способ определения скорости растворения оксида в оксидно-галогенидном расплаве, который, как и прототип, включает загрузку порции оксида в оксидно-галогенидный расплав, размещенный в тигле, химически устойчивом по отношению к компонентам расплава при температуре измерений, фиксируют время полного растворения порции оксида в расплаве и по изменению массы или молей оксида по отношению ко времени полного растворения порции оксида в расплаве, вычисляют скорость растворения оксида, при этом время полного растворения порции оксида в расплаве определяют с использованием рабочего электрода и противоэлектрода. Новый способ отличается тем, что перед загрузкой очередной порции оксида в оксидно-галогенидный расплав, рабочий электрод погружают в исследуемый расплав и анодно его поляризуют в условиях потенциодинамической поляризации со скоростью не менее 1 В/с, фиксируя предельный ток окисления ионов кислорода в исследуемом расплаве, после чего в оксидно-галогенидный расплав загружают порцию оксида и через определенные промежутки времени при аналогичных условиях повторяют операцию поляризации рабочего электрода, фиксируя изменение предельного тока окисления ионов кислорода на рабочем электроде, операцию поляризации рабочего электрода повторяют до стабилизации фиксируемых значений предельного тока, при этом за время полного растворения порции оксида принимают время от загрузки оксида до момента стабилизации предельного тока.
Предпочтительно, чтобы в качестве рабочего электрода использовали электрод, на котором в условиях анодной поляризации ионы растворенного в расплаве кислорода окисляются до кислорода или смеси газов CO-CO2.
Предпочтительно также, чтобы в качестве рабочего электрода использовали погруженный электрод с фиксированной рабочей поверхностью.
Предпочтительно также, чтобы в качестве рабочего электрода использовали полупогруженный электрод, колебания рабочей поверхности которого в ходе одного цикла поляризации не превышают 10%.
В отличие от прототипа, где за время полного растворения порции оксида в расплаве принимают время достижения постоянного значения разности потенциалов между индикаторным электродом в исследуемом расплаве и электродом сравнения в эталонном расплаве аналогичного состава, насыщенном по оксиду, в заявленном способе за время полного растворения порции оксида в расплаве принимают время от загрузки оксида до момента стабилизации предельного тока окисления ионов кислорода в исследуемом расплаве, которое фиксируют в процессе поляризации рабочего электрода. Это приводит к следующему результату. Если в прототипе используют электрохимическую ячейку относительно сложного исполнения и выполненную из ограниченного диапазона материалов, то при осуществлении заявленного способа необходим лишь рабочий электрод произвольной формы, поляризацию которого можно осуществлять с использованием источника тока, позволяющего проводить электрохимические измерения. Функцию противоэлектрода в ряде случаев может выполнять электропроводящий тигель с исследуемым расплавом. Рабочий электрод не требует предварительного прогрева, пропитки исследуемым расплавом, а также, при необходимости, может заменяться после растворения каждой порции оксида в оксидно-галогенидном расплаве. Все это приводит к упрощению, ускорению и повышению точности измерений.
Для определения скорости растворения оксида может быть использован полупогруженный рабочий электрод, поверхность которого при анодной поляризации может меняться. В этом случае погрешность измерений будет систематической, и в пределах погрешности измерений не повлияет на время полного растворения порции оксида. По имеющимся результатам экспериментальных измерений изменение поверхности электрода в пределах 10% можно принять допустимым.
Технический результат, достигаемый заявленным способом, заключается в возможности быстрого и оперативного определения скорости растворения оксида в оксидно-галогенидном расплаве, как в лабораторных, так и в промышленных условиях.
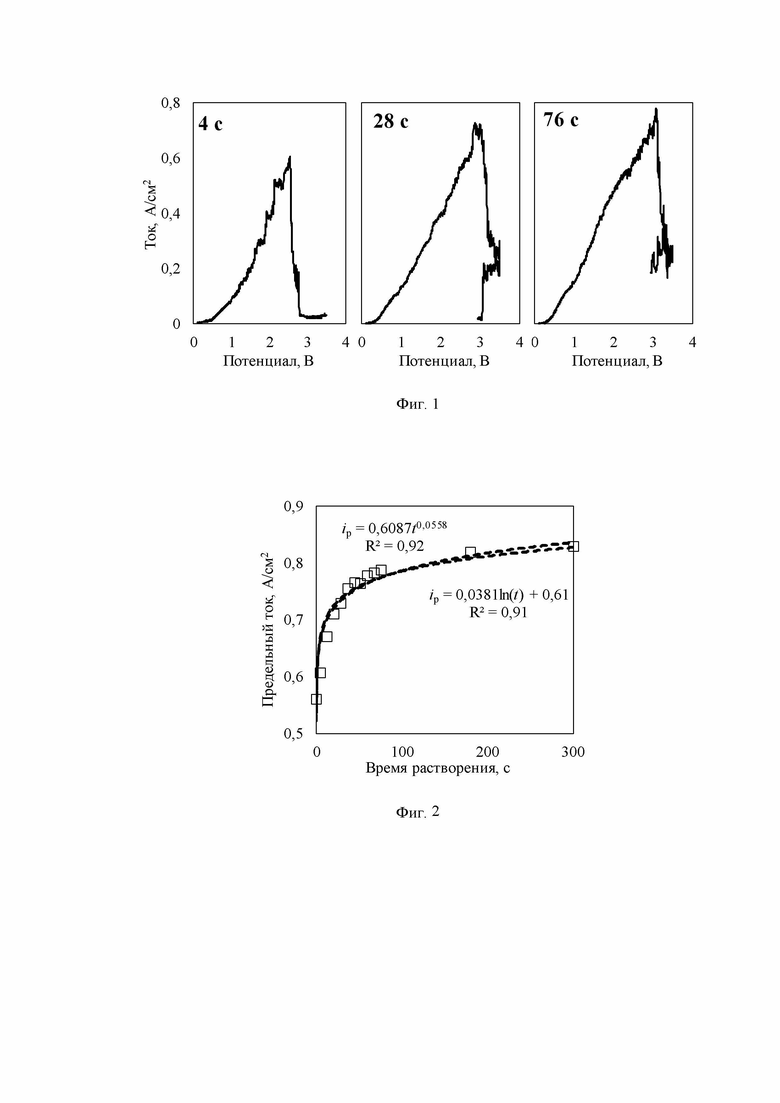
Изобретение иллюстрируется рисунками, где на фиг.1 приведена серия регистрируемых откликов тока на рабочем электроде из стеклоуглерода при его потенциодинамической поляризации в ходе растворения Al2O3 в расплаве KF-AlF3-Al2O3; на фиг. 2 приведена зависимость изменения предельного тока окисления ионов кислорода на рабочем электроде из стеклоуглерода в ходе растворения Al2O3 в расплаве KF-AlF3-Al2O3.
Экспериментальную апробацию способа проводили на примере определения скорости растворения Al2O3 в расплаве KF-AlF3 с мольным отношением [KF]/[AlF3] = 1,5 мол/мол и разным содержанием оксида в расплаве на воздухе при температуре 785°С. Расплавы готовили из индивидуальных солей: фторид калия (KF) и фторид алюминия (AlF3) – марки «ХЧ» (Вектон, Россия). Фторид алюминия предварительно очищали от кислородных примесей путем его поэтапного нагревания в смеси с фтористым аммонием. В качестве кислородсодержащей добавки использовали Al2O3 марки «ХЧ» (Реахим, Россия).
В качестве рабочих электродов использовали погруженный стеклоуглеродный электрод, экранированный нитридом бора (УНИХИМ, Россия). Роль противоэлектрода выполнял графитовый тигель с исследуемым расплавом. Измерение предельного тока окисления ионов кислорода осуществляли путем поляризации рабочего электрода в анодную область потенциалов со скоростью 1 В/с с использованием потенциостата-гальваностата AutoLab 320N и ПО NOVA 1.11 (Metrohm, Нидерланды).
Для уточнения состава расплава и, в частности, содержания в нем оксида, в ходе измерений отбирали пробы расплава массой 0,2-0,3 г при помощи никелевой ложки. Содержание Al2O3 в образцах определяли путем карботермического сжигания образцов с последующей фиксацией поглощения инфракрасного излучения в потоке отходящего инертного газа на анализаторе ОН 836 (LECO, США). Элементный состав расплавов определяли спектрально-эмиссионным методом с индуктивно-связанной плазмой с использованием спектрометра iCAP 6300 Duo (Thermo scientific, США).
Для определения скорости растворения Al2O3 после загрузки очередной порции оксида в расплав производили поляризацию рабочего электрода: первое измерение сразу после загрузки Al2O3 в расплав, затем по одному измерению через каждые 30-60 секунд до окончания роста предельного тока на регистрируемых откликах тока - вольт-амперных зависимостях. Пример набора таких измерений приведен на фигуре 1. Видно, что предельный ток растет со временем после загрузки оксида, причем ожидаемо прирост тока максимален в первые 20-40 секунд, а затем замедляется. Из фигуры 2 видно, что в условиях приведенного примера нарастание тока практически прекратилось после 180 с. Это указывает на полное растворение навески. Исходя из этого была рассчитана скорость растворения Al2O3 в расплаве KF-AlF3, которая составила от 0,21 до 0,02×10-3 моль/с при повышении начального содержании Al2O3 в оксидно-галогенидном расплаве с 2,4 до 5,2 мас.%.
Из фигуры 2 также видно, что полученная зависимость изменения предельного тока во времени с точностью выше 90 % описывается алгебраически – степенной либо логарифмической функцией. Следовательно, она может быть использована для оценки скорости растворения Al2O3 в исследуемом расплаве в любой момент растворения оксида.
По аналогичной схеме была определена скорость растворения Al2O3 в расплаве KF-AlF3 с мольным отношением [KF]/[AlF3] = 1,5 мол/мол и разным содержанием оксида на воздухе при температуре 785°С. При этом в качестве рабочего электрода использовали полупогруженный стеклоуглеродный электрод. Полученные значения скорости растворения Al2O3 в исследуемом расплаве составили от 0,02 до 0,22×10-3 моль/с, что в пределах 10% сопоставимо с результатами, полученными при использовании погруженного электрода.
По аналогичной схеме была определена скорость растворения Al2O3 в криолит-глиноземном оксидно-галогенидном расплаве NaF-AlF3-Al2O3 в зависимости от температуры (950-995°С), мольного отношения [NaF]/[AlF3] (2,1-2.5 мол/мол), начального содержания оксида в расплаве (1-5 мас.%). Ее значения составили от 0,03 до 0,45×10-3 моль/с.
В примерах приведена апробация способа в наиболее агрессивных оксидно-фторидных расплавах, при этом полученные результаты указывают на работоспособность способа даже без замены рабочего электрода в ходе серии измерений. Способ подходит для определения скорости растворения в других оксидно-галогенидных расплавах, в том числе в промышленных условиях.
Таким образом, заявленный способ при простом исполнении, без использования дополнительных устройств, позволяет оперативно и с высокой точностью определить скорость растворения оксида в оксидно-галогенидном расплаве.
Источники информации
1. B.J. Welch, G.I. Kuschel, Crust and alumina powder dissolution in aluminum smelting electrolytes, JOM 2007(5) (2007) 50-54.
2. Kan H., Zhang N., Wang X. Dissolution rate determination of alumina in molten cryolite-based aluminum electrolyte // J. Cent. South Univ., 2012, Vol. 19, P. 897−902.
3. N.V. Vasyunina, I.P. Vasyunina, Yu.G. Mikhalev, A.M. Vinogradov, The solubility and dissolution rate of alumina in acidic cryolite aluminous melts, Rus. J. Non-Ferrous Metals 50 (2009) 338–342.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения содержания глинозема в криолит-глиноземном расплаве и электрохимическое устройство для его осуществления | 2020 |
|
RU2748146C1 |
| Электролитический способ получения лигатур алюминия из оксидного сырья | 2019 |
|
RU2716727C1 |
| СПОСОБ ЭЛЕКТРОЛИТИЧЕСКОГО АЛИТИРОВАНИЯ ИЗДЕЛИЙ ИЗ НИЗКОУГЛЕРОДИСТОЙ СТАЛИ | 2015 |
|
RU2603744C1 |
| СПОСОБ ПОЛУЧЕНИЯ СПЛАВА НА ОСНОВЕ АЛЮМИНИЯ И УСТРОЙСТВО ДЛЯ ОСУЩЕСТВЛЕНИЯ СПОСОБА | 2015 |
|
RU2621207C1 |
| Способ электролитического получения сплавов алюминия со скандием | 2023 |
|
RU2819113C1 |
| СПОСОБ ЭЛЕКТРОЛИЗА РАСПЛАВЛЕННЫХ СОЛЕЙ С КИСЛОРОДСОДЕРЖАЩИМИ ДОБАВКАМИ С ИСПОЛЬЗОВАНИЕМ ИНЕРТНОГО АНОДА | 2011 |
|
RU2457286C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИГАТУРЫ АЛЮМИНИЙ-СКАНДИЙ | 2015 |
|
RU2593246C1 |
| Способ получения лигатур алюминия с цирконием | 2017 |
|
RU2658556C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЮМИНИЯ ЭЛЕКТРОЛИЗОМ РАСПЛАВА | 2008 |
|
RU2415973C2 |
| ЭЛЕКТРОХИМИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ МЕТАЛЛОВ И/ИЛИ СПЛАВОВ ИЗ МАЛОРАСТВОРИМЫХ И НЕРАСТВОРИМЫХ СОЕДИНЕНИЙ | 2012 |
|
RU2517090C1 |
Использование: для определения скорости растворения оксида в оксидно-галогенидном расплаве. Сущность изобретения заключается в том, что осуществляют загрузку порции оксида в оксидно-галогенидный расплав, размещенный в тигле, химически устойчивом по отношению к компонентам расплава при температуре измерений, фиксируют время полного растворения порции оксида в расплаве и по изменению массы или молей оксида по отношению ко времени полного растворения порции оксида в расплаве вычисляют скорость растворения оксида, при этом время полного растворения порции оксида в расплаве определяют с использованием рабочего электрода и противоэлектрода, при этом перед загрузкой очередной порции оксида в оксидно-галогенидный расплав рабочий электрод погружают в исследуемый расплав и анодно его поляризуют в условиях потенциодинамической поляризации со скоростью не менее 1 В/с, фиксируя предельный ток окисления ионов кислорода в исследуемом расплаве, после чего в оксидно-галогенидный расплав загружают порцию оксида и через определенные промежутки времени при аналогичных условиях повторяют операцию поляризации рабочего электрода, фиксируя изменение предельного тока окисления ионов кислорода на рабочем электроде, операцию поляризации рабочего электрода повторяют до стабилизации фиксируемых значений предельного тока, при этом за время полного растворения порции оксида принимают время от загрузки оксида до момента стабилизации предельного тока. Технический результат: упрощение определения скорости растворения оксида в оксидно-галогенидном расплаве. 3 з.п. ф-лы, 2 ил.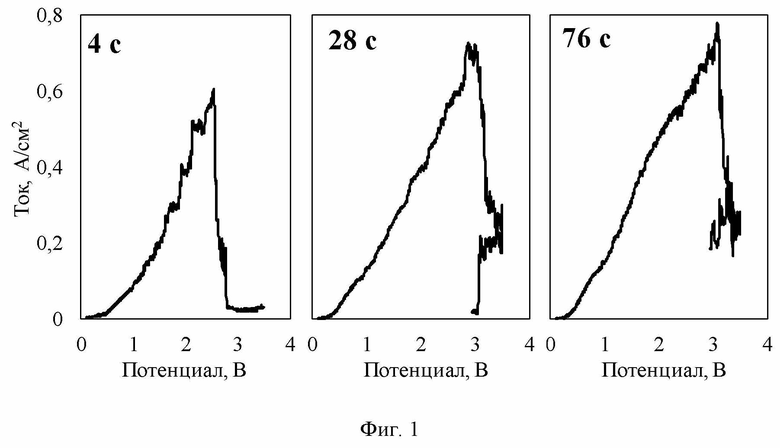
1. Способ определения скорости растворения оксида в оксидно-галогенидном расплаве, включающий загрузку порции оксида в оксидно-галогенидный расплав, размещенный в тигле, химически устойчивом по отношению к компонентам расплава при температуре измерений, фиксируют время полного растворения порции оксида в расплаве и по изменению массы или молей оксида по отношению ко времени полного растворения порции оксида в расплаве вычисляют скорость растворения оксида, при этом время полного растворения порции оксида в расплаве определяют с использованием рабочего электрода и противоэлектрода, отличающийся тем, что перед загрузкой очередной порции оксида в оксидно-галогенидный расплав рабочий электрод погружают в исследуемый расплав и анодно его поляризуют в условиях потенциодинамической поляризации со скоростью не менее 1 В/с, фиксируя предельный ток окисления ионов кислорода в исследуемом расплаве, после чего в оксидно-галогенидный расплав загружают порцию оксида и через определенные промежутки времени при аналогичных условиях повторяют операцию поляризации рабочего электрода, фиксируя изменение предельного тока окисления ионов кислорода на рабочем электроде, операцию поляризации рабочего электрода повторяют до стабилизации фиксируемых значений предельного тока, при этом за время полного растворения порции оксида принимают время от загрузки оксида до момента стабилизации предельного тока.
2. Способ по п.1, отличающийся тем, что в качестве рабочего электрода используют электрод, на котором в условиях анодной поляризации ионы растворенного в расплаве кислорода окисляются до кислорода или смеси газов CO-CO2.
3. Способ по п.1, отличающийся тем, что в качестве рабочего электрода используют погруженный электрод с фиксированной рабочей поверхностью.
4. Способ по п.1, отличающийся тем, что в качестве рабочего электрода используют полупогруженный электрод, колебания рабочей поверхности которого в ходе одного цикла поляризации не превышают 10%.
| N.V | |||
| Vasyunina, I.P | |||
| Vasyunina, Yu.G | |||
| Mikhalev, A.M | |||
| Vinogradov, The solubility and dissolution rate of alumina in acidic cryolite aluminous melts, Rus | |||
| J | |||
| Устройство для выпрямления многофазного тока | 1923 |
|
SU50A1 |
| Способ изучения растворимости и скорости растворения твердых металлов в жидких | 1973 |
|
SU505955A1 |
| Способ измерения средней скорости анодного растворения при электроабразивной обработке | 1977 |
|
SU688312A1 |
| Способ определения скорости растворения твердых веществ в жидкостях | 1989 |
|
SU1651160A1 |
| US 3065151 A, 20.11.1962 | |||
| US 3694324 A, 26.09.1972. | |||
Авторы
Даты
2021-06-25—Публикация
2020-12-16—Подача