ОБЛАСТЬ ТЕХНИКИ
[0001]
Настоящее изобретение относится к способу получения твердого электролита.
УРОВЕНЬ ТЕХНИКИ
[0002]
За последнее время спрос на литиево-ионные перезаряжаемые аккумуляторы вырос в различных областях, включая переносные информационные терминалы, переносное электронное оборудование, электрические транспортные средства, гибридные электрические транспортные средства и стационарные системы накопления энергии. Однако в настоящее время в качестве электролитического раствора в литиево-ионные перезаряжаемых аккумуляторах используют горючий органический растворитель, и необходим прочный внешний корпус для предотвращения утечки органического растворителя. Кроме того, например, в случае портативных персональных компьютеров необходимо использовать предохраняющую конструкцию на случай возможной утечки органического растворителя. Таким образом, существует ограничение в отношении конструкций устройств.
[0003]
Кроме того, диапазон их применения расширен до подвижных составов, таких как транспортные средства и воздушные судна, и для стационарных литиево-ионных перезаряжаемых аккумуляторов необходима высокая емкость. В таких обстоятельствах важно уделять больше внимания безопасности, чем раньше, и все усилия сконцентрированы на разработке полностью твердотельных литиево-ионных перезаряжаемых аккумуляторов, в которых нет никаких токсичных веществ, таких как органические растворители.
[0004]
Например, изучено применение оксидов, фосфатных соединений, органических полимеров, сульфидов или т.п. в качестве твердого электролита в полностью твердотельных литиево-ионных перезаряжаемых аккумуляторах.
[0005]
Среди таких твердых электролитов сульфид обладает свойствами высокой ионной проводимости и относительной мягкости, а также простоты формования поверхности раздела между твердыми веществами. Сульфид является стабильным в отношении активных материалов и был разработан как практичный твердый электролит.
Однако поскольку сульфидный твердый электролит вырабатывает сероводород при взаимодействии с водой, он существенно и неблагоприятно влияет на процесс производства аккумуляторов. В качестве одного из способов решения указанной проблемы известно применение Li3PS4, имеющего орто-композицию, который получают в молярном соотношении Li2S:P2S5=75:25, при этом количество образующегося сероводорода является очень низким (патентный документ 1). Кроме того, известно, что Li3PS4 имеет множество кристаллических состояний (непатентный документ 2). Однако технология патентного документа 1 включает сложный способ, в котором остекловывание проводят в две стадии.
[0006]
В то же время в непатентном документе 1 описан очень удобный способ синтеза, в котором получение и перемешивание суспензии проводят в тетрагидрофуране (здесь и далее сокращенно «ТГФ») в молярном соотношении Li2S:P2S5=75:25 для осаждения кристаллического Li3PS4⋅3ТГФ, который сушат при 150°C с получением β-Li3PS4. Однако для такого способа свойственна проблема образования побочных продуктов во время суспендирования и перемешивания ТГФ с пожелтением реакционного раствора. Было обнаружено, что при активации такого твердого электролита, содержащего Li3PS4, который содержит побочные продукты, в качестве полностью твердотельного аккумулятора, зарядка и разрядка происходят неудовлетворительно.
ДОКУМЕНТЫ ИЗВЕСТНОГО УРОВНЯ ТЕХНИКИ
ПАТЕНТНЫЕ ДОКУМЕНТЫ
[0007]
Патентный документ 1: Японский патент №5141675
НЕПАТЕНТНЫЕ ДОКУМЕНТЫ
[0008]
Непатентный документ 1: J. Am. Chem. Soc. 2013, 135, 975-978
Непатентный документ 2: Solid State Ionics. 2011, 182, 53-58
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ НАСТОЯЩИМ ИЗОБРЕТЕНИЕМ
[0009]
При описанных выше обстоятельствах необходимо обеспечить способ получения твердого электролита, содержащего Li3PS4, который обладает превосходной эффективностью и содержит побочные продукты в минимально возможном количестве.
СПОСОБЫ РЕШЕНИЯ ПРОБЛЕМ
[0010]
Авторы настоящего изобретения активно проводили исследования для решения вышеописанной проблемы и обнаружили, что данную проблему можно решить с помощью настоящего изобретения, описанного ниже.
[0011]
В частности, настоящее изобретение описано ниже.
<1> Способ получения твердого электролита, содержащего Li3PS4, включающий:
стадию получения раствора, на которой получают однородный раствор посредством смешивания Li2S и P2S5 в органическом растворителе; и
стадию осаждения, на которой добавляют дополнительное количество Li2S и смешивают с однородным раствором с получением осадка.
<2> Способ по п. <1>, отличающийся тем, что молярное отношение между Li2S и P2S5 (Li2S/P2S5) на стадии получения раствора составляет от 1,0 до 1,85.
<3> Способ по п. <1> или <2>, отличающийся тем, что к однородному раствору на стадии осаждения добавляют дополнительное количество Li2S, так что молярное отношение Li2S/P2S5 становится равным от 2,7 до 3,3.
<4> Способ по любому из пп. <1>-<3>, включающий стадию сушки после стадии осаждения, причем температура сушки на стадии сушки составляет 120°С или более, и при этом указанный Li3PS4 представляет собой β-Li3PS4.
<5> Способ по любому из пп. <1>-<4>, отличающийся тем, что на стадии получения раствора Li2S и P2S5 растворяют в органическом растворителе в указанном порядке, так что общая концентрация Li2S и P2S5 становится равна от 1 до 40% по массе.
<6> Способ по любому из пп. <1>-<5>, отличающийся тем, что органический растворитель представляет собой растворитель на основе простого эфира.
<7> Способ по п. <6>, отличающийся тем, что растворитель на основе простого эфира представляет собой тетрагидрофуран.
<8> Способ по любому из пп. <1>-<7>, отличающийся тем, что стадию получения раствора и стадию осаждения проводят в атмосфере инертного газа.
ПОЛЕЗНЫЙ ЭФФЕКТ ИЗОБРЕТЕНИЯ
[0012]
В соответствии с настоящим изобретением можно получать твердый электролит, содержащий Li3PS4, в котором содержание побочных продуктов является очень низким. Кроме того, способ получения согласно настоящему изобретению можно применять для массового производства.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0013]
На фиг. 1 представлен схематический вид в поперечном сечении полностью твердотельного аккумулятора в соответствии с одним из вариантов реализации настоящего изобретения.
На фиг. 2 представлена диаграмма, демонстрирующая результаты измерения рентгеновской дифракции примера 1 и сравнительных примеров 1 и 2.
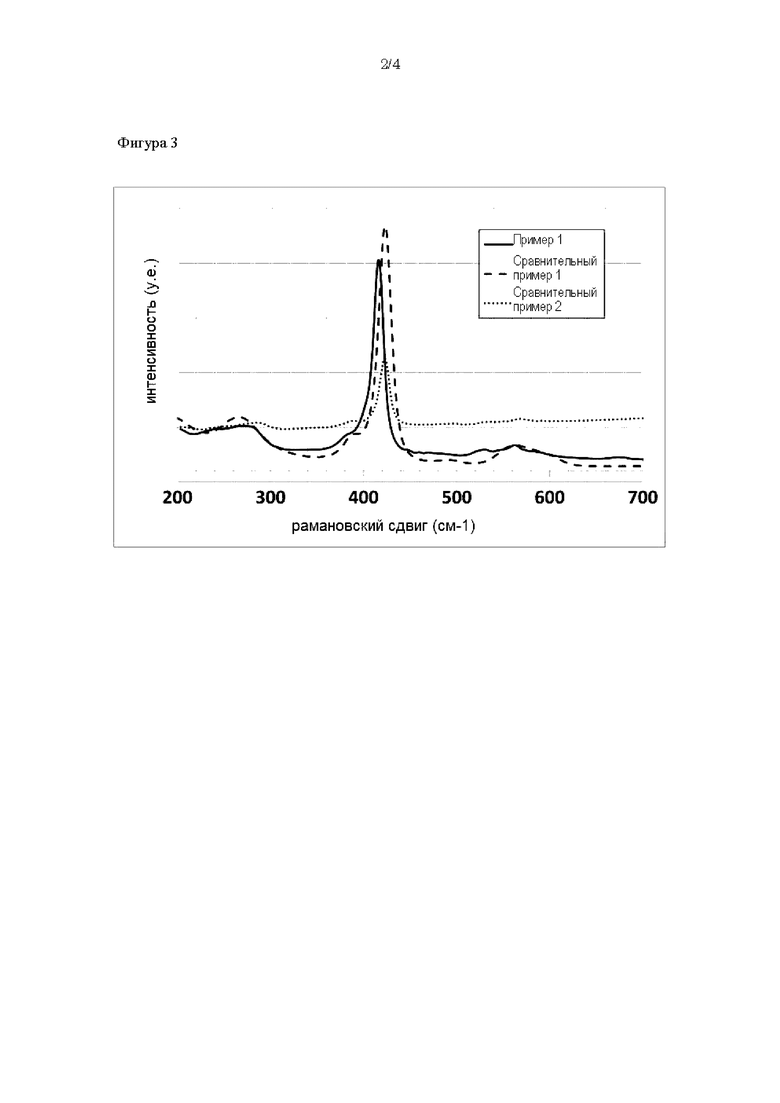
На фиг. 3 представлена диаграмма, демонстрирующая результаты рамановской спектроскопии примера 1 и сравнительных примеров 1 и 2.
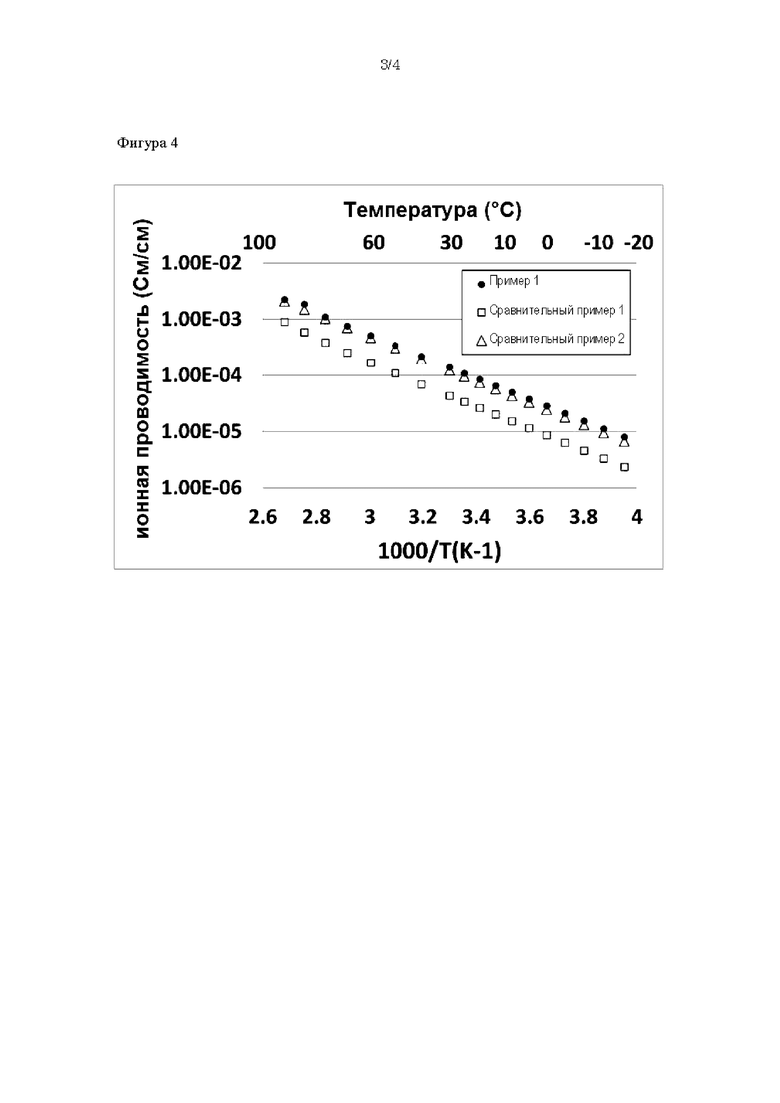
На фиг. 4 представлена диаграмма, демонстрирующая результаты измерения ионной проводимости примера 1 и сравнительных примеров 1 и 2.
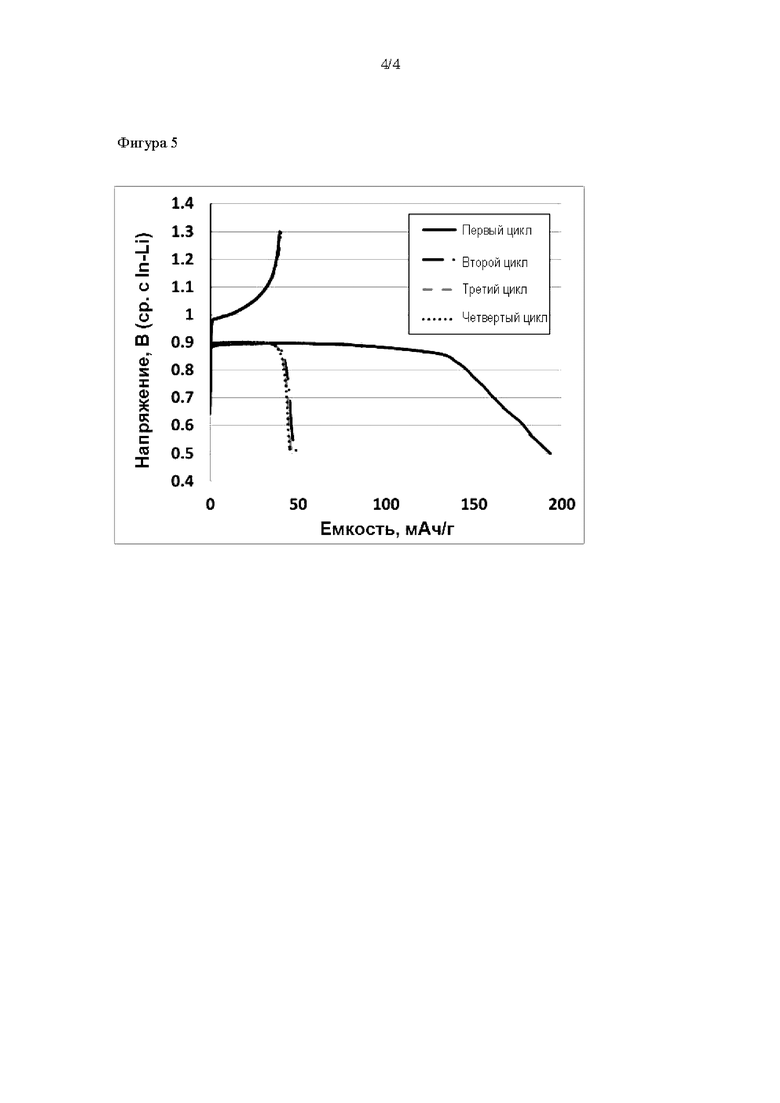
На фиг. 5 представлена диаграмма, демонстрирующая результаты испытаний зарядки и разрядки примера 1.
ВАРИАНТЫ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
[0014]
Здесь и далее подробно описан способ получения твердого электролита, содержащего Li3PS4 согласно настоящему изобретению, твердый электролит, полученный предложенным способом получения, формованное изделие, полученное нагреванием и формованием твердого электролита, полностью твердотельный аккумулятор, содержащий указанный твердый электролит, и т.д. Следует отметить, что материалы, составы и т.д., описанные ниже, не ограничивают настоящее изобретение, и могут быть различным образом модифицированы в пределах сущности настоящего изобретения.
[0015]
<Способ получения твердого электролита, содержащего Li3PS4>
Способ получения согласно настоящему изобретению представляет собой способ получения твердого электролита, содержащего Li3PS4, включающий: стадию получения раствора, на которой получают однородный раствор посредством смешивания Li2S и P2S5 в органическом растворителе; и стадию осаждения, на которой добавляют дополнительное количество Li2S и смешивают с однородным раствором с получением осадка.
Кроме того, твердый электролит, содержащий Li3PS4, полученный способом получения согласно настоящему изобретению, имеет описанные ниже характеристики.
Li3PS4 представляет собой вещество, в котором образована орто-композиция. В этом отношении «орто» обычно относится к оксокислоте, которая имеет наибольшую степень гидратации среди оксокислот, полученных гидратацией одного и того же оксида. В отношении сульфидных материалов твердых электролитов, полученных с использованием Li2S, кристаллическая композиция, в которой Li2S добавляют в наибольшем количестве среди всех сульфидов, называют орто-композицией. Среди материалов на основе Li2S-P2S5, Li3PS4 соответствует орто-композиции, и его получают при смешивании сырьевых материалов в молярном соотношении Li2S:P2S5=75:25 в пересчете на моли.
Li3PS4 существует в форме аморфного вещества или кристаллического вещества. Для кристаллов известна α-форма, β-форма и γ-форма (непатентный документ 2), и в способе получения согласно настоящему изобретению, в частности, может быть без труда получена кристаллическая β-форма. Рентгеновская дифракция кристаллической β-формы (CuKα: λ=1,5405 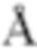 ) характеризуется пиками при по меньшей мере 2θ=13,5±0,5 град, 17,5±0,5 град, 18,1±0,5 град, 19,8±0,5 град, 26,0±0,5 град, 27,4±0,5 град, 29,0±0,5 град, 29,8±0,5 град, 31,1±0,5 град, 39,3±0,5 град, 40,4±0,5 град, 44,9±0,5 град и 47,6±0,5 град. Кроме того, Li3PS4, полученный согласно настоящему изобретению, имеет пик на спектре Рамана при 420 см-1. Следует отметить, что P2S5 имеет пик при 540 см-1, а Li3PS4, полученный согласно настоящему изобретению не имеет такого пика.
) характеризуется пиками при по меньшей мере 2θ=13,5±0,5 град, 17,5±0,5 град, 18,1±0,5 град, 19,8±0,5 град, 26,0±0,5 град, 27,4±0,5 град, 29,0±0,5 град, 29,8±0,5 град, 31,1±0,5 град, 39,3±0,5 град, 40,4±0,5 град, 44,9±0,5 град и 47,6±0,5 град. Кроме того, Li3PS4, полученный согласно настоящему изобретению, имеет пик на спектре Рамана при 420 см-1. Следует отметить, что P2S5 имеет пик при 540 см-1, а Li3PS4, полученный согласно настоящему изобретению не имеет такого пика.
[0016]
<Стадия получения раствора>
В способе получения согласно настоящему изобретению молярное отношение между Li2S и P2S5 не имеет специального ограничения, при условии, что оно находится в пределах диапазона, в котором достигается эффект настоящего изобретения, но предпочтительно получать однородный раствор посредством смешивания Li2S и P2S5 в органическом растворителе в молярном отношении Li2S/P2S5 = от 1,0 до 1,85. В этом отношении вышеописанное молярное отношение более предпочтительно представляет собой Li2S/P2S5 = от 1,2 до 1,8, еще более предпочтительно Li2S/P2S5 = от 1,3 до 1,7, еще более предпочтительно Li2S/P2S5 = от 1,4 до 1,6, и наиболее предпочтительно Li2S/P2S5=1,5 (Li2S:P2S5=60:40).
Если молярное отношение Li2S/P2S5 составляет от 1,0 до 1,85, то раствор можно удобно получать с использованием Li2S и P2S5 при комнатной температуре. Если молярное отношение не входит в описанный выше диапазон, может происходить образование осадка. Следует отметить, что после отделения нерастворенного осадка от раствора с помощью фильтрования или подобного приема, композиция в растворе становится такой же, как композиция на стадии получения раствора, осуществляемой при молярном соотношении в пределах описанного выше диапазона.
[0017]
Используемый Li2S может быть синтезированным продуктом или доступным в продаже продуктом. Чем ниже содержание в нем влаги, тем лучше, поскольку смешивание влаги ухудшает другие сырьевые материалы и соединение-предшественник. Более предпочтительно, ее содержание составляет 300 м.д. или менее, и особенно предпочтительно 50 м.д. или менее. Чем меньше диаметр частиц Li2S, тем лучше, поскольку скорость реакции увеличивается. Диаметр частиц предпочтительно составляет от 10 нм до 100 мкм, более предпочтительно от 10 нм до 30 мкм, и еще более предпочтительно от 100 нм до 10 мкм. Следует отметить, что диаметр частиц можно измерять с помощью СЭМ, прибора для измерения распределения частиц по размеру с помощью лазерного рассеяния, или подобного прибора.
Используемый P2S5 может быть синтезированным продуктом или доступным в продаже продуктом. Чем выше чистота P2S5, тем лучше, поскольку количество примесей, смешиваемых с твердым электролитом, становится меньше. Чем меньше диаметр частиц P2S5, тем лучше, поскольку скорость реакции увеличивается. Диаметр частиц предпочтительно составляет от 10 нм до 100 мкм, более предпочтительно от 10 нм до 30 мкм, и еще более предпочтительно от 100 нм до 10 мкм.
[0018]
Органический растворитель не имеет специального ограничения, при условии, что он не взаимодействует с Li2S или P2S5. Примеры включают растворитель на основе простого эфира, растворитель на основе сложного эфира, растворитель на основе углеводорода и растворитель на основе нитрила. Конкретные примеры включают ТГФ (тетрагидрофуран), циклопентилметиловый эфир, диизопропиловый эфир, диэтиловый эфир, диметиловый эфир, диоксан, метилацетат, этилацетат, бутилацетат и ацетонитрил. Особенно предпочтительным является ТГФ. Для предотвращения ухудшения композиции сырьевых материалов, предпочтительно заранее удалять кислород и воду из органического растворителя. В частности, в отношении содержания воды, оно предпочтительно составляет 100 м.д. или менее, и более предпочтительно 50 м.д. или менее.
Общая концентрация и P2S5 в органическом растворителе предпочтительно составляет от 1 до 40% по массе, более предпочтительно от 5 до 30% по массе, и особенно предпочтительно от 10 до 20% по массе. Если общая концентрация Li2S и P2S5 в органическом растворителе составляет более 40% по массе, то вязкость суспензии увеличивается, что может затруднять перемешивание. В то же время, если общая концентрация Li2S и P2S5 в органическом растворителе составляет менее 1% по массе, то необходимо использовать большое количество органического растворителя, и увеличивается нагрузка по регенерации растворителя. Кроме того, может быть чрезмерно увеличен размер реактора для большого количества субстрата.
На стадии получения раствора согласно настоящему изобретению Li2S постепенно взаимодействует с P2S5, суспендированным в органическом растворителе, что приводит к состоянию, когда может быть получен раствор. Соответственно, если скорость реакции высока, предпочтительно сначала добавлять P2S5 и суспендировать его в органическом растворителе, а затем добавлять к нему Li2S. Это обусловлено тем, что если скорость реакции высока, и P2S5 добавляют при избыточном содержании Li2S, то образуется Li3PS4, который может частично выпадать в осадок.
[0019]
Смешивание на стадии получения раствора предпочтительно осуществляют в атмосфере инертного газа. Примеры инертного газа включают азот, гелий и аргон, и особенно предпочтительно аргон. Удаляя также кислород и влагу из инертного газа, можно уменьшить ухудшение композиции сырьевых материалов. Концентрация кислорода и влаги в инертном газе для каждого из них предпочтительно составляет 1000 м.д. или менее, более предпочтительно 100 м.д. или менее, и особенно предпочтительно 10 м.д. или менее.
[0020]
Во время смешивания на стадии получения раствора субстрат диспергируют с получением суспензии, но в результате протекания реакции она, в конечном итоге, становится однородной. Нет необходимости осуществлять специальную операцию перемешивания для разрушения частиц, и достаточно обеспечения такой энергии перемешивания, которая может приводить к суспендированию и диспергированию суспензии.
Что касается температуры реакции на стадии получения раствора, данная реакция медленно протекает даже при комнатной температуре, но можно осуществлять нагревание для повышения скорости реакции. При осуществлении нагревания достаточно проводить его при температуре кипения органического растворителя или при более низкой температуре. Температура варьируется в зависимости от используемого органического растворителе, но обычно составляет менее 120°С. Нагревание также можно проводить под давлением с использованием автоклава или т.п. Однако при осуществлении смешивания при высокой температуре (120°С или более) существует риск протекания побочных реакций.
[0021]
Время реакции на стадии получения раствора варьируется в зависимости от типа органического растворителя и диаметра и концентрации частиц исходных материалов, но, например, проведение реакции в течение от 0,1 до 24 часов приводит к завершению реакции и возможности получения раствора.
[0022]
В полученном однородном растворе может образовываться небольшое количество осадка, в зависимости от соотношения добавленной композиции и условий смешивания примесей в сырьевых материалах. В таком случае желательно удалить осадок посредством фильтрования или центрифугирования.
[0023]
<Стадия осаждения>
Добавляют дополнительное количество Li2S и смешивают с однородным раствором, полученным на стадии получения раствора, с получением осадка.
На стадии осаждения согласно настоящему изобретению к однородному раствору предпочтительно добавляют дополнительное количество Li2S, так что молярное отношение Li2S/P2S5 становится равным от 2,7 до 3,3. Описанное выше молярное отношение более предпочтительно представляет собой Li2S/P2S5 = от 2,8 до 3,2, еще более предпочтительно Li2S/P2S5 = от 2,9 до 3,1, и наиболее предпочтительно Li2S/P2S5=3,0 (Li2S:P2S5=75:25). Li2S добавляют и смешивают с однородным раствором так, что молярное соотношение всех сырьевых материалов, добавленных в систему, становится равным Li2S:P2S5=75:25, в результате чего образуется твердый электролит высокой чистоты, содержащий Li3PS4, при этом образование побочных продуктов существенно снижено.
Осадок может представлять собой сольват. Например, при использовании в качестве органического растворителя ТГФ получают кристаллический Li3PS4⋅3ТГФ. Добавляемый Li2S может быть таким же, как на стадии получения раствора. Добавляемое количество регулируют так, что молярное соотношение всех сырьевых материалов, добавленных в систему, становится равным Li2S/P2S5=от 2,7 до 3,3, как описано выше. Если количество P2S5 слишком велико, то избыток P2S5 выпадает в осадок и смешивается с твердым электролитом, содержащим Li3PS4. В таком случае на следующей стадии или в следующем процессе получения полностью твердотельного аккумулятора будет выделяться сероводород, и, кроме того, это может неблагоприятно влиять на зарядку и разрядку полностью твердотельного аккумулятора.
Осадок образуется по мере протекания реакции с образованием Li3PS4. Механизм реакции не известен, но считают, что указанное вещество растворяется в растворе в состоянии -(P-S-P-S)n-. Полагают, что добавленный к нему Li2S диспергируется в суспензии и расщепляет связи P-S с образованием Li3PS4.
[0024]
Что касается температуры реакции на стадии осаждения, данная реакция медленно протекает даже при комнатной температуре, но можно осуществлять нагревание для повышения скорости реакции. При осуществлении нагревания достаточно проводить его при температуре кипения органического растворителя или при более низкой температуре. Температура варьируется в зависимости от используемого органического растворителе, но обычно составляет менее 120°С. Нагревание также можно проводить под давлением с использованием автоклава или т.п. Однако при осуществлении операции при высокой температуре (120°С или более) существует риск протекания побочных реакций.
Время реакции на стадии осаждения варьируется в зависимости от типа органического растворителя и диаметра и концентрации частиц исходных материалов, но, например, проведение реакции в течение от 0,1 до 24 часов приводит к завершению реакции и возможности получения осадка.
[0025]
Смешивание на стадии осаждения предпочтительно осуществляют в атмосфере инертного газа. Примеры инертного газа включают азот, гелий и аргон, и особенно предпочтительно аргон. Удаляя также кислород и влагу из инертного газа, можно уменьшить ухудшение композиции сырьевых материалов.
Концентрация кислорода и влаги в инертном газе для каждого из них предпочтительно составляет 1000 м.д. или менее, более предпочтительно 100 м.д. или менее, и особенно предпочтительно 10 м.д. или менее.
[0026]
Полученный осадок можно отделить от раствора с помощью фильтрования или центрифугирования. В способе получения согласно настоящему изобретению количество образующихся побочных продуктов является очень низким, но можно осуществлять очистку посредством отделения осадка от раствора. Промывая выделенный осадок растворителем, можно дополнительно повысить степень очистки. Поскольку количество образующихся побочных продуктов является очень низким, нет необходимости использовать большое количество промывочного растворителя. Например, достаточно использовать от 50 частей по массе до 600 частей по массе растворителя на 100 частей по массе осадка. В качестве промывочного растворителя предпочтительно используют тот же органический растворитель, который использовали на стадии получения раствора, но промывочный растворитель не имеет специального ограничения, при условии, что он является органическим растворителем, который не взаимодействует с Li3PS4.
[0027]
<Стадия сушки>
Полученный осадок подвергают сушке нагретым воздухом или вакуумной сушке с получением твердого электролита, содержащего Li3PS4. Оптимальная температура для данной стадии варьируется в зависимости от типа растворителя. Время для удаления растворителя может быть сокращено при использовании температуры, которая достаточно превосходит температуру кипения. Предпочтительно, температура для удаления растворителя составляет от 60 до 280°С, и более предпочтительно от 100 до 250°С. При удалении растворителя при пониженном давлении, как в случае вакуумной сушки или подобного метода, температура при удалении растворителя может быть снижена, а необходимое время может быть сокращено. Кроме того, время, необходимое для удаления растворителя, также может быть сокращено посредством пропускания инертного газа, такого как азот и аргон, в котором содержание влаги является относительно низким.
Если температура сушки установлена на 120°С или выше, происходит кристаллизация. Обычно образуется β-Li3PS4. Следует отметить, что при использовании ТГФ на стадии получения раствора и при сушке кристаллического Li3PS4⋅3ТГФ, полученного на стадии осаждения, аморфное вещество образуется при сушке 100°С или менее, a β-Li3PS4 образуется при сушке при 120°С или более. Таким образом, регулируя температуру сушки в соответствии с потребностью, можно регулировать получаемое кристаллическое состояние.
[0028]
Время сушки немного варьируется в зависимости от температуры нагревания, но обычно достаточно сушки в течение от 1 до 24 часов. Не является предпочтительным проведение нагревания при высокой температуре в течение продолжительного периода времени, превышающего вышеописанный диапазон, поскольку существует риск изменения качества твердого электролита.
[0029]
Твердый электролит, содержащий Li3PS4 согласно настоящему изобретению, полученный вышеописанным способом, можно различными способами формовать в требуемое формованное изделие, и можно использовать для различных применений, включая полностью твердотельные аккумуляторы, описанные ниже. Способ формования не имеет специального ограничения. Например, можно использовать способ, подобный способу формования соответствующих слоев, образующих полностью твердотельный аккумулятор, описанному ниже в отношении полностью твердотельного аккумулятора.
[0030]
<Полностью твердотельный аккумулятор>
Твердый электролит, содержащий Li3PS4 согласно настоящему изобретению, можно использовать, например, в качестве твердого электролита для полностью твердотельных аккумуляторов. Кроме того, в соответствии с другим вариантом реализации настоящего изобретения, предложен полностью твердотельный аккумулятор, содержащий вышеописанный твердый электролит для полностью твердотельных аккумуляторов.
[0031]
В этом отношении «полностью твердотельный аккумулятор» представляет собой полностью твердотельный литиево-ионный перезаряжаемый аккумулятор. На фиг. 1 представлен схематический вид в поперечном сечении полностью твердотельного аккумулятора в соответствии с одним из вариантов реализации настоящего изобретения. Полностью твердотельный аккумулятор 10 имеет конструкцию, в которой слой 2 твердого электролита расположен между слоем 1 положительного электрода и слоем 3 отрицательного электрода. Полностью твердотельный аккумулятор 10 можно использовать в различных устройствах, включая мобильные телефоны, персональные компьютеры и автомобили.
Твердый электролит, содержащий Li3PS4 согласно настоящему изобретению, может присутствовать в качестве твердого электролита в по меньшей мере одном из слоя 1 положительного электрода, слоя 3 отрицательного электрода и слоя 2 твердого электролита. В том случае, если твердый электролит, содержащий Li3PS4 согласно настоящему изобретению, содержится в слое 1 положительного электрода или в слое 3 отрицательного электрода, твердый электролит, содержащий Li3PS4 согласно настоящему изобретению, используют в комбинации с общеизвестным активным материалом положительного электрода или активным материалом отрицательного электрода для литиево-ионных перезаряжаемых аккумуляторов. Количественное содержание твердого электролита, содержащего Li3PS4 согласно настоящему изобретению, которое должно присутствовать в слое 1 положительного электрода или в слое 3 отрицательного электрода, не имеет специального ограничения.
В том случае, если твердый электролит, содержащий Li3PS4 согласно настоящему изобретению, содержится в слое 2 твердого электролита, слой 2 твердого электролита может состоять только из твердого электролита, содержащего Li3PS4 согласно настоящему изобретению, и, при необходимости, можно использовать оксидный твердый электролит (например, Li7La3Zr2O12), сульфидный твердый электролит (например, Li2S-P2S5), другие комплексные гидридные твердые электролиты (например, LiBH4 и 3LiBH4-LiI) и т.д. в комбинации.
[0032]
Полностью твердотельный аккумулятор получают посредством формования и послойного нанесения вышеописанных слоев, и способ формования и способ послойного нанесения соответствующих слоев не имеют специального ограничения.
Их примеры включают: способ, в котором твердый электролит и/или активный материал электрода диспергируют в растворителе с получением взвесеподобной смеси, которую наносят с помощью ножевого устройства, методом центрифугирования или подобным методом и подвергают вальцеванию с получением пленки; газофазный способ, в котором формование пленки и послойное нанесение осуществляют методом вакуумного осаждения, методом ионного осаждения, методом напыления, методом лазерного выжигания или т.п.; и способ прессования, в котором горячим прессованием или холодным прессованием (без нагревания) получают порошок и осуществляют послойное нанесение.
[0033]
Поскольку твердый электролит, содержащий Li3PS4 согласно настоящему изобретению, является относительно мягким, то особенно предпочтительно получать полностью твердотельный аккумулятор посредством формования соответствующих слоев способом прессования и послойного нанесения слоев. В качестве способа прессования существует горячее прессование, при котором осуществляют нагревание, и холодное прессование, при котором нагревание не осуществляют, но формование слоев может быть осуществлено в достаточной степени даже способом холодного прессования.
Следует отметить, что настоящее изобретение включает формованное изделие, полученное нагреванием и формованием твердого электролита, содержащего Li3PS4 согласно настоящему изобретению. Формованное изделие обычно используют в качестве слоя твердого электролита для полностью твердотельных аккумуляторов. Кроме того, настоящее изобретение включает способ получения слоя твердого электролита для полностью твердотельных аккумуляторов, который включает стадию нагревания и формования твердого электролита, содержащего Li3PS4 согласно настоящему изобретению.
ПРИМЕРЫ
[0034]
Далее с помощью примеров более конкретно описаны варианты реализации настоящего изобретения, но варианты реализации изобретения не ограничены приведенными примерами. (Пример 1)
В перчаточной камере в атмосфере аргона взвешивали Li2S (производства компании Sigma-Aldrich, чистота: 99,8%) и P2S5 (производства компании Sigma-Aldrich, чистота: 99%) так, что молярное соотношение Li2S:P2S5 составляло 1,5:1. Затем в тетрагидрофуран (производства компании Wako Pure Chemical Industries, Ltd., супер-обезвоженная марка), добавляли Li2S и P2S5 в указанном порядке, так что концентрация (Li2S+P2S5) становилась равна 10% мас., и осуществляли перемешивание при комнатной температуре в течение 12 часов. Смесь постепенно растворялась, и получали почти однородный раствор, содержащий небольшое количество нерастворимого вещества.
К полученной смеси добавляли дополнительное количество Li2S, так что композиция всех сырьевых материалов, включая вышеописанные вещества, становилась такой, что молярное отношение Li2S:P2S5=3:1, и осуществляли перемешивание при комнатной температуре в течение 12 часов с получением осадка. Осадок сушили под вакуумом при 150°С в течение 4 часов с получением β-Li3PS4. Указанную последовательность операций проводили в перчаточной камере в атмосфере аргона.
[0035]
(Сравнительный пример 1)
В перчаточной камере в атмосфере аргона взвешивали Li2S (производства компании Sigma-Aldrich, чистота: 99,8%) и P2S5 (производства компании Sigma-Aldrich, чистота: 99%) так, что молярное соотношение Li2S:P2S5 составляло 3:1, и перемешивали указанные вещества в агатовой ступке.
Затем полученную смесь помещали в диоксид-циркониевый тигель, затем помещали в него диоксид-циркониевые шарики («YTZ» производства компании Nikkato Corporation, ср: ϕ мм, количество: 160) и тщательно закрывали тигель. Тигель прикрепляли к планетарной шаровой мельнице («Р-7» производства компании Fritsch) и проводили механическое измельчение при скорости вращения 510 об/мин в течение 10 часов с получением аморфного вещества.
Затем полученное аморфное вещество нагревали в атмосфере аргона при 300°С в течение 8 часов с получением β-Li3PS4.
[0036]
(Сравнительный пример 2)
В перчаточной камере в атмосфере аргона взвешивали Li2S (производства компании Sigma-Aldrich, чистота: 99,8%) и P2S5 (производства компании Sigma-Aldrich, чистота: 99%) так, что молярное соотношение Li2S:P2S5 составляло 3:1. Затем в тетрагидрофуран (производства компании Wako Pure Chemical Industries, Ltd., супер-обезвоженная марка), добавляли Li2S и P2S5 в указанном порядке, так что концентрация (Li2S+P2S5) становилась равна 10% мас., и осуществляли перемешивание при комнатной температуре в течение 12 часов. Во время перемешивания смесь не становилась однородным раствором и оставалась в состоянии суспензии. Суспензию сушили под вакуумом при 150°С в течение 4 часов с получением β-Li3PS4. Указанную последовательность операций проводили в перчаточной камере в атмосфере аргона.
[0037]
<Измерение рентгеновской дифракции>
Порошки ионных проводников, полученные в примере 1 и в сравнительных примерах 1-2, подвергали измерению рентгеновской дифракции в атмосфере Ar при комнатной температуре (25°С) (прибор «X'pert3 Powder» производства компании PANalytical, CuKα: λ=1,5405 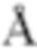 ).
).
[0038]
Результаты измерений рентгеновской дифракции примера 1 и сравнительных примеров 1-2 представлены на фиг. 2.
Как показано на фиг. 2, в примере 1 пики дифракции наблюдали при по меньшей мере 13 положениях, т.е. 2θ=13,5±0,5 град, 17,5±0,5 град, 18,1±0,5 град, 19,8±0,5 град, 26,0±0,5 град, 27,4±0,5 град, 29,0±0,5 град, 29,8±0,5 град, 31,1±0,5 град, 39,3±0,5 град, 40,4±0,5 град, 44,9±0,5 град и 47,6±0,5 град, и диаграмма соответствовала диаграмме β-Li3PS4 в базе данных ICSD.
[0039]
<Рамановская спектроскопия>
(1) Получение образца
Образец для измерения получали, используя воздухонепроницаемый контейнер с кварцевым стеклом (Ф: 60 мм, толщина: 1 мм) в верхней части в качестве оптического окна. В перчаточной камере в атмосфере аргона приклеивали образец к кварцевому стеклу, затем закрывали контейнер и убирали из перчаточной камеры, и проводили рамановскую спектроскопию.
(2) Условия измерения
Используя лазерный рамановский спектрометр NRS-5100 (производства компании JASCO Corporation), проводили измерение при длине волны возбуждения 532,15 нм в течение времени экспозиции 5 секунд.
[0040]
Результаты рамановской спектроскопии примера 1 и сравнительных примеров 1-2 представлены на фиг. 3. Для каждого образца подтверждали пик при 420 см-1, соответствующий PS4-.
[0041]
<Измерение литиево-ионной проводимости>
Каждый из ионных проводников, полученных в примере 1 и в сравнительных примерах 1-2, подвергали одноосному формованию (292 МПа) с получением диска толщиной примерно 0,8 мм и диаметром 10 мм. Импенданс по переменному току измеряли четырехполюсным методом, используя In (индиевый) электрод при температуре от -20°С до 100°С («Импендансный/амплитудно-фазовый анализатор SI1260» производства компании Solartron), и рассчитывали литиево-ионную проводимость.
В частности, образец помещали в термостатическую баню с температурой, установленной на 25°С, и выдерживали в течение 30 минут, после чего измеряли литиево-ионную проводимость. Затем температуру термостатической бани повышали с интервалами в 10°C с 30°С до 100°С, и при каждой температуре выдерживали в течение 25 минут, а затем измеряли ионную проводимость. После завершения измерения при 100°С температуру термостатической бани понижали с интервалами в 10°C с 90°С до 30°С и с интервалами в 5°C с 30°C до -20°С, и затем повышали температуру термостатической бани с интервалами в 5°C с -20°С до 25°С, и при каждой температуре выдерживали в течение 25 минут, а затем измеряли литиево-ионную проводимость. Частотный диапазон, использованный для измерения, составлял о 0,1 Гц до 1 МГц, а амплитуда составляла 50 мВ.
Результаты измерения литиево-ионной проводимости примера 1 и сравнительных примеров 1-2 представлены на фиг. 4. Во всех образцах получали примерно одинаковую ионную проводимость.
[0042]
<Испытание зарядки и разрядки>
(Получение порошка для слоя положительного электрода)
В качестве активного материала положительного электрода использовали титанат лития (Li4Ti5O12). Порошок, в котором массовое отношение активный материал положительного электрода : сульфидный твердый электролит (β-Li3PS4) : ацетиленовая сажа (агент, способствующий проводимости) = 40:60:6, взвешивали в перчаточной камере и осуществляли перемешивание с помощью ступки с получением порошка для слоя положительного электрода. (Получение полностью твердотельного аккумулятора)
Каждый порошок из сульфидных твердых электролитов, полученных в примере 1 и сравнительном примере 2, помещали в форму таблетировочной машины диаметром 10 мм и прессовали в форму диска под давлением 46 МПа (далее также упоминаемого как слой сульфидного твердого электролита). Не вынимая сформованный продукт, на верхнюю часть слоя сульфидного твердого электролита помещали порошок для слоя положительного электрода, полученный так, как описано выше, к нижней его части прикрепляли In фольгу, в которой прокалывали отверстие размером 8 ϕ, и формовали все вместе под давлением 292 МПа. Таким образом, получали гранулу в форме диска, в которой были последовательно расположены следующие слои: слой положительного электрода (75 мкм), слой сульфидного твердого электролита (800 мкм) и In фольга (100 мкм). К стороне гранулы с In фольгой дополнительно последовательно прикрепляли In фольгу размером 10 ср и Li фольгу размером 8 ср, и вставляли в ячейку для испытания аккумулятора из SUS304 с получением полностью твердотельного перезаряжаемого аккумулятора.
(Измерение литиево-ионной проводимости аккумуляторного элемента)
Для полностью твердотельного перезаряжаемого аккумулятора, полученного так, как описано выше, рассчитывали литиево-ионную проводимость при температуре измерения 60°C с помощью потенциостата/гальваностата (VMP3 производства компании Bio-Logic). В частности, образец помещали в нагреватель с рубашкой, температуру которого устанавливали на 60°С, и выдерживали в течение 60 минут, а затем измеряли его литиево-ионную проводимость. Частотный диапазон, использованный для измерения, составлял о 0,1 Гц до 1 МГц, а амплитуда составляла 50 мВ. (Испытание зарядки и разрядки)
Для полностью твердотельного перезаряжаемого аккумулятора, полученного так, как описано выше, с помощью потенциостата/гальваностата (VMP3 производства компании Bio-Logic) проводили зарядку и разрядку с постоянным током при условии температуры измерения: 60°С, предельного напряжения заряда: от 0,5 до 1,5 В и плотности тока: 0,046 мА/см2 (35,98 мкА). Следует отметить, что после зарядки и разрядки выдерживали 3-минутную паузу, соответственно.
[0043]
Результаты ионной проводимости аккумуляторного элемента при 60°С представлены в таблице 1, а результаты испытания зарядки и разрядки представлены на фиг. 5. Из таблицы 1 следует, что сравнительный пример 2 имеет более высокое сопротивление элемента и более низкую ионную проводимость по сравнению с примером 1. Соответственно, при проведении испытания зарядки и разрядки было невозможно осуществить проведение цикла для сравнительного примера 2, и зарядка и разрядка были успешно осуществлены только для примера 1.
[00441]
ПОЯСНЕНИЕ БУКВЕННЫХ ИЛИ ЦИФРОВЫХ ОБОЗНАЧЕНИЙ
[0045]
1 слой положительного электрода
2 слой твердого электролита
3 слой отрицательного электрода
10 полностью твердотельный аккумулятор.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФИДНОГО ТВЕРДОГО ЭЛЕКТРОЛИТА | 2020 |
|
RU2804507C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТВЕРДОГО ЭЛЕКТРОЛИТА НА ОСНОВЕ LGPS | 2018 |
|
RU2754868C2 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФИДНОГО ТВЕРДОГО ЭЛЕКТРОЛИТА, СОДЕРЖАЩЕГО Sn | 2021 |
|
RU2822115C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТВЕРДОГО ЭЛЕКТРОЛИТА НА ОСНОВЕ LGPS | 2018 |
|
RU2766576C2 |
| ТВЕРДЫЙ ЭЛЕКТРОЛИТ НА ОСНОВЕ LGPS И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2019 |
|
RU2787019C2 |
| ТВЕРДОТЕЛЬНАЯ БАТАРЕЯ | 2014 |
|
RU2665046C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛНОСТЬЮ ТВЕРДОТЕЛЬНОГО АККУМУЛЯТОРА | 2020 |
|
RU2803640C2 |
| ИОННЫЙ ПРОВОДНИК И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2015 |
|
RU2690293C2 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФИДНОГО ТВЕРДОГО ЭЛЕКТРОЛИТА | 2017 |
|
RU2670920C9 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛНОСТЬЮ ТВЕРДОТЕЛЬНОГО АККУМУЛЯТОРА | 2018 |
|
RU2771614C2 |
Изобретение относится к способу получения твердого электролита. Способ получения твердого электролита, содержащего Li3PS4, включает: стадию получения раствора, на которой получают однородный раствор посредством смешивания Li2S и P2S5 в органическом растворителе; и стадию осаждения, на которой добавляют дополнительное количество Li2S и смешивают с однородным раствором с получением осадка. В предпочтительном варианте реализации молярное соотношение (Li2S/P2S5) между Li2S и P2S5 на стадии получения раствора составляет 1,0-1,85, или в однородный раствор на стадии осаждения добавляют такое дополнительное количество Li2S, что указанное молярное соотношение становится равным Li2S/P2S5=2,7-3,3. Техническим результатом является превосходная эффективность электролита и содержание побочных продуктов в минимально возможном количестве. 7 з.п. ф-лы, 2 пр., 1 табл., 5 ил.
1. Способ получения твердого электролита, содержащего Li3PS4, включающий:
стадию получения раствора, на которой получают однородный раствор посредством смешивания Li2S и P2S5 в органическом растворителе; и
стадию осаждения, на которой добавляют дополнительное количество Li2S и смешивают с однородным раствором с получением осадка.
2. Способ по п. 1, отличающийся тем, что молярное отношение между Li2S и P2S5 (Li2S/P2S5) на стадии получения раствора составляет от 1,0 до 1,85.
3. Способ по п. 1 или 2, отличающийся тем, что к однородному раствору на стадии осаждения добавляют дополнительное количество Li2S, так что молярное отношение Li2S/P2S5 становится от 2,7 до 3,3.
4. Способ по любому из пп. 1-3, включающий стадию сушки после стадии осаждения, причем температура сушки на стадии сушки составляет 120°С или более, и при этом указанный Li3PS4 представляет собой β-Li3PS4.
5. Способ по любому из пп. 1-4, отличающийся тем, что на стадии получения раствора Li2S и P2S5 растворяют в органическом растворителе в указанном порядке, так что общая концентрация Li2S и P2S5 становится от 1 до 40% по массе.
6. Способ по любому из пп. 1-5, отличающийся тем, что органический растворитель представляет собой растворитель на основе простого эфира.
7. Способ по п. 6, отличающийся тем, что растворитель на основе простого эфира представляет собой тетрагидрофуран.
8. Способ по любому из пп. 1-7, отличающийся тем, что стадию получения раствора и стадию осаждения проводят в атмосфере инертного газа.
| JP 5141675 B2, 13.02.2013 | |||
| JP2016018679 A, 01.02.2016 | |||
| ТВЕРДЫЙ ЛИТИЙПРОВОДЯЩИЙ ЭЛЕКТРОЛИТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1993 |
|
RU2066901C1 |
| ТВЕРДЫЙ ЛИТИЙПРОВОДЯЩИЙ ЭЛЕКТРОЛИТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1997 |
|
RU2136084C1 |
Авторы
Даты
2021-07-14—Публикация
2018-03-16—Подача