Настоящая заявка испрашивает приоритет в соответствии с заявкой на патент США с регистрационным № 62/368100, поданной 28 июля 2016 г., заявкой на патент США с регистрационным № 62/455547, поданной 6 февраля 2017 г., заявкой на патент США с регистрационным № 62/482846, поданной 7 апреля 2017 г., и заявкой на патент США с регистрационным № 62/514542, поданной 2 июня 2017 г., содержание всех из которых включено в данный документ посредством ссылки во всей их полноте.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит перечень последовательностей, который был подан в электронном виде в формате ASCII и включен в данный документ посредством ссылки во всей своей полноте. Указанная копия в формате ASCII, созданная 27 июля 2017 г., называется N2067–7109WO_SL.txt и имеет размер 907582 байта.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение в целом относится к применению клеток, например, иммунных эффекторных клеток, сконструированных таким образом, что они экспрессируют химерный антигенный рецептор (CAR), который нацеливается на антиген, например, CD19, в комбинации с ингибиторами PD–1 для лечения заболевания.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Многих пациентов с B–клеточными злокачественными новообразованиями невозможно вылечить с помощью стандартной терапии. Кроме того, традиционные варианты лечения часто имеют тяжелые побочные эффекты. Были предприняты попытки в области противораковой иммунотерапии, однако некоторые ограничения осложняют достижение клинической эффективности. Хотя были идентифицированы сотни так называемых опухолевых антигенов, они обычно являются собственными и, таким образом, являются недостаточно иммуногенными. Кроме того, опухоли используют несколько механизмов, чтобы сделать себя неблагоприятными для инициирования и распространения иммунной атаки.
Последние разработки с использованием терапии аутологичными T–клетками, модифицированными химерным антигенным рецептором (CAR) (CART), которая заключается в перенаправлении Т–клеток на подходящую молекулу клеточной поверхности на раковых клетках, как, например, в B–клеточных злокачественных новообразованиях, показывают многообещающие результаты в использовании силы иммунной системы для лечения В–клеточных злокачественных новообразований и других форм рака (см., например, Sadelain et al., Cancer Discovery 3:388–398 (2013)). Клинические результаты для CART19, полученных от мышей (т. e. "CTL019"), показали перспективность установления полных ремиссий у пациентов, страдающих CLL, а также детским ALL (см., например, Kalos et al., Sci Transl Med 3:95ra73 (2011), Porter et al., NEJM 365:725–733 (2011), Grupp et al., NEJM 368:1509–1518 (2013)). Помимо способности химерного антигенного рецептора на генетически модифицированных Т–клетках распознавать и разрушать клетки–мишени, успешное терапевтическое средство Т–клеточной терапии должно обладать способностью к пролиферации и персистенции в течение определенного времени для контроля рецидива лейкоза. Изменчивое качество Т–клеток, обусловленное анергией, подавлением или истощением, будет влиять на функциональные характеристики CAR–трансформированных T–клеток, над которыми практикующие специалисты в данной области в настоящее время имеют ограниченный контроль. Чтобы быть эффективными, CAR–трансформированные Т–клетки пациента должны персистировать и поддерживать способность к пролиферации в ответ на когнатный антиген. Было показано, что Т–клетки пациента с ALL могут делать это при наличии CART19, содержащих scFv мыши (см., например, Grupp et al., NEJM 368:1509–1518 (2013)).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение по меньшей мере частично относится к способам и композициям для лечения заболевания (например, рака), например, заболевания, ассоциированного с антигеном, например, заболевания, ассоциированного с экспрессией CD19, например, рака, у субъекта путем применения комбинированной терапии, которая предусматривает использование клетки, например, иммунной эффекторной клетки, экспрессирующей химерный антигенный рецептор (CAR), который специфично связывается с антигеном, например, антигеном, описываемым в данном документе, например, CD19 (также называемой в данном документе "клеткой, экспрессирующей CAR для CD19") (что также называется в данном документе "терапией CAR") и ингибитора белка 1 программируемой смерти клеток (также называемого в данном документе "ингибитором PD–1"). В некоторых вариантах осуществления CAR, который специфично связывается с антигеном, например, CD19, содержит антигенсвязывающий домен, например, CD19–связывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, например, описываемые в данном документе. В некоторых вариантах осуществления ингибитор PD–1 представляет собой молекулу антитела, полипептид, малую молекулу или полинуклеотид, например, ингибирующую нуклеиновую кислоту. В одном варианте осуществления ингибитор PD–1 представляет собой молекулу антитела, например, молекулу антитела, описываемую в данном документе. Не желая ограничиваться какой–либо теорией, полагают, что лечение субъекта, имеющего заболевание (например, рак), например, заболевание, ассоциированное с экспрессией CD19, например, рак, описываемый в данном документе, с помощью комбинированной терапии, которая предусматривает использование клетки, экспрессирующей CAR (например, клетки, экспрессирующей CAR для CD19), и ингибитора PD–1, приводит к улучшенному ингибированию или снижению темпов прогрессирования опухоли у субъекта, например, по сравнению с лечением субъекта, имеющего заболевание, с помощью клетки, экспрессирующей CAR (например, клетки, экспрессирующей CAR для CD19), или ингибитора PD–1 в отдельности. Например, ингибирование взаимодействия PD–1/PD–L1 в комбинации с терапией CAR может приводить к одному или нескольким из: (i) активации (или реактивации) клеток, экспрессирующих CAR (например, клеток, экспрессирующих CAR для CD19); (ii) размножению в популяции клеток, экспрессирующих CAR; (iii) увеличения длительности терапевтического ответа на терапию CAR; (iv) увеличения персистенции средства терапии CAR, (v) снижения функции истощенных эффекторных T–клеток, (vi) устранения или облегчения истощения Т–клеток, (vii) увеличения уровней цитокинов (например, IL–6 или IL–2) или (viii) снижения экспрессии ингибиторов контрольных точек (например, одного или нескольких из PD–1, TIM–3 или LAG–3) на иммунных эффекторных клетках (например, CD4+ и/или CD8+ клетках, например, иммунных эффекторных клетках, экспрессирующих CAR), что таким образом приводит к улучшенному терапевтическому эффекту у субъекта, получающего лечение с помощью комбинированной терапии, например, по сравнению с субъектом, получающим средство терапии CAR в отдельности или ингибитор PD–1 в отдельности.
Следовательно, в одном аспекте настоящее изобретение относится к способу лечения субъекта, имеющего заболевание (например, рак), например, заболевание, ассоциированное с антигеном, например, заболевание, ассоциированное с экспрессией CD19, например, рак, описываемый в данном документе. Способ предусматривает введение субъекту клетки, например, популяции клеток, содержащих, например, экспрессирующих, CAR, который специфично связывается с антигеном, например, CD19 (также называемой в данном документе средством терапии CAR), и ингибитора PD–1. В одном варианте осуществления клетку, экспрессирующую CAR, и ингибитор PD–1 вводят последовательно. В одном варианте осуществления ингибитор PD–1 вводят до введения клетки, экспрессирующей CAR (например, клетки, экспрессирующей CAR для CD19). В одном варианте осуществления ингибитор PD–1 вводят после введения клетки, экспрессирующей CAR (например, клетки, экспрессирующей CAR для CD19). В одном варианте осуществления ингибитор PD–1 и клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), вводят одновременно или параллельно.
В вариантах осуществления клетку, экспрессирующую CAR, например, клетку, экспрессирующую CAR для CD19, описываемую в данном документе, и ингибитор PD–1 вводят последовательно, например, в любом порядке. В одном варианте осуществления комбинацию вводят в интервале лечения. В одном варианте осуществления интервал лечения предусматривает однократную дозу ингибитора PD–1 и однократную дозу клетки, экспрессирующей CAR (например, в любом порядке). В другом варианте осуществления интервал лечения предусматривает несколько доз (например, первую и вторую дозы) ингибитора PD–1 и дозу клетки, экспрессирующей CAR (например, в любом порядке).
В связанном аспекте настоящее изобретение предусматривает способ лечения субъекта, имеющего рак. Способ включает введение субъекту:
(i) средства терапии CAR, содержащего популяцию иммунных эффекторных клеток, содержащих, например, экспрессирующих, CAR, где CAR содержит антигенсвязывающий домен (например, для CD19), трансмембранный домен и внутриклеточный сигнальный домен; и
(ii) ингибитора PD–1.
В некоторых вариантах осуществления доза ингибитора PD–1, например, молекулы антитела к PD–1, составляет от приблизительно 200 мг до приблизительно 450 мг, например, от приблизительно 300 мг до приблизительно 400 мг, например, при введении один раз в 2 недели, 3 недели, 4 недели или 5 недель.
В другом аспекте настоящее изобретение предусматривает способ лечения субъекта, имеющего рак. Способ включает введение субъекту:
(i) средства терапии CAR, содержащего популяцию иммунных эффекторных клеток, содержащих, например, экспрессирующих, CAR, где CAR содержит антигенсвязывающий домен (например, для CD19), трансмембранный домен и внутриклеточный сигнальный домен; и
(ii) ингибитора PD–1.
В некоторых вариантах осуществления введение ингибитора PD–1 начинают через 20 дней или меньше после введения средства терапии CAR. Например, введение ингибитора PD–1 начинают через 16 дней или меньше, 15 дней или меньше, 14 дней или меньше, 13 дней или меньше, 12 дней или меньше, 11 дней или меньше, 10 дней или меньше, 9 дней или меньше, 8 дней или меньше, 7 дней или меньше, 6 дней или меньше, 5 дней или меньше, 4 дня или меньше, 3 дня или меньше, 2 дня или меньше после введения средства терапии CAR.
В другом аспекте настоящее изобретение предусматривает способ лечения субъекта, имеющего рак. Способ включает введение субъекту:
(i) средства терапии CAR, содержащего популяцию иммунных эффекторных клеток, содержащих, например, экспрессирующих, CAR, где CAR содержит антигенсвязывающий домен (например, для CD19), трансмембранный домен и внутриклеточный сигнальный домен; и
(ii) ингибитора PD–1.
В некоторых вариантах осуществления введение ингибитора PD–1 начинают после того, как субъект будет иметь или будет идентифицирован как имеющий одно или несколько из следующего:
(a) частичного или невыявляемого ответа на терапию CAR,
(b) рецидивирующего рака после терапии CAR,
(c) рака, резистентного в отношении терапии CAR;
(d) прогрессирующей формы рака после терапии CAR или
(e) восстановления популяции B–клеток, например, менее чем через 3 месяца, после терапии CAR.
В еще одном аспекте настоящее изобретение предусматривает способ лечения субъекта, имеющего рак. Способ включает введение субъекту:
(i) средства терапии CAR, содержащего популяцию иммунных эффекторных клеток, содержащих, например, экспрессирующих, химерный антигенный рецептор (CAR), где CAR содержит антигенсвязывающий домен (например, для CD19), трансмембранный домен и внутриклеточный сигнальный домен; и
(ii) ингибитора PD–1.
В некоторых вариантах осуществления введение ингибитора PD–1 начинают после введения средства терапии CAR, и при этом субъект не имеет или не был идентифицирован как имеющий одно или несколько из следующего:
(a) частичного или невыявляемого ответа на терапию CAR,
(b) рецидивирующего рака после терапии CAR,
(c) рака, резистентного в отношении терапии CAR;
(d) прогрессирующей формы рака или
(e) восстановления популяции B–клеток, например, менее чем через 3 месяца, после терапии CAR.
В другом аспекте настоящее изобретение предусматривает средство терапии CAR для применения в комбинации с ингибитором PD–1 в любом из способов, раскрываемых в данном документе. В других вариантах осуществления, раскрываемых в данном документе, описывается применение средства терапии CAR в комбинации с ингибитором PD–1 при получении лекарственного препарата для лечения нарушения, например, пролиферативного нарушения, например, рака.
Дополнительные признаки или варианты осуществления любых способов, путей применения, композиций или комбинаций, раскрываемых в данном документе, включают в себя одно или несколько из следующего.
В некоторых вариантах осуществления можно вводить одну или несколько, например, 1, 2, 3, 4 или 5 или больше, последующих доз ингибитора PD–1. В одном варианте осуществления вводят до 6 доз ингибитора PD–1.
В некоторых вариантах осуществления способ или применение дополнительно включает оценивание наличия или отсутствия CRS у субъекта. В одном варианте осуществления субъект не имеет или идентифицирован как не имеющий CRS, например, тяжелый CRS (например, CRS 3 степени или 4 степени), после терапии CAR.
В других вариантах осуществления введение ингибитора PD–1 начинают после того, как субъект был идентифицирован как не имеющий CRS, например, тяжелый CRS (например, CRS 3 степени или 4 степени), после терапии CAR.
В других вариантах осуществления введение ингибитора PD–1 начинают после лечения CRS, например, регрессии CRS, после терапии CAR. В одном варианте осуществления регрессия CRS происходит до 1 степени. В варианте осуществления регрессия CRS происходит до невыявляемых уровней.
Если интервал лечения предусматривает однократную дозу ингибитора PD–1 и однократную дозу клетки, экспрессирующей CAR, в некоторых вариантах осуществления дозу ингибитора PD–1 и дозу клетки, экспрессирующей CAR, вводят одновременно или параллельно. Например, дозу ингибитора PD–1 и дозу клетки, экспрессирующей CAR, вводят в пределах периода 20 дней, 18 дней, 16 дней, 15 дней, 12 дней, 10 дней, 9 дней, 8 дней, 7 дней, 6 дней, 5 дней, 4 дней, 3 дней, 2 дней, 1 дня, 24 часов, 12 часов, 6 часов, 4 часов, 2 часов или меньше друг после друга. В вариантах осуществления интервал лечения начинают после введения первой вводимой дозы и завершают после введения последней вводимой дозы.
Если интервал лечения предусматривает однократную дозу ингибитора PD–1 и однократную дозу клетки, экспрессирующей CAR, в некоторых вариантах осуществления дозу ингибитора PD–1 и дозу клетки, экспрессирующей CAR, вводят последовательно. В вариантах осуществления дозу клетки, экспрессирующей CAR, вводят до дозы ингибитора PD–1, и интервал лечения начинают после введения дозы клетки, экспрессирующей CAR, и завершают после введения дозы ингибитора PD–1. В других вариантах осуществления дозу ингибитора PD–1 вводят до дозы клетки, экспрессирующей CAR, и интервал лечения начинают после введения дозы ингибитора PD–1 и завершают после введения дозы клетки, экспрессирующей CAR. В одном варианте осуществления интервал лечения дополнительно предусматривает одну или несколько, например, 1, 2, 3, 4 или 5 или больше, последующих доз ингибитора PD–1. В таких вариантах осуществления интервал лечения предусматривает две, три, четыре, пять, шесть или больше доз ингибитора PD–1 и одну дозу клетки, экспрессирующей CAR. В одном варианте осуществления дозу клетки, экспрессирующей CAR, вводят в пределах периода по меньшей мере 2 дней, по меньшей мере 3 дней, по меньшей мере 4 дней, по меньшей мере 5 дней, по меньшей мере 6 дней, по меньшей мере 7 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 11 дней, по меньшей мере 12 дней, по меньшей мере 13 дней или по меньшей мере 2 недель до или после введения дозы ингибитора PD–1. В вариантах осуществления, в которых вводят более чем одну дозу ингибитора PD–1, дозу клетки, экспрессирующей CAR вводят в пределах периода по меньшей мере 2 дней, по меньшей мере 3 дней, по меньшей мере 4 дней, по меньшей мере 5 дней, по меньшей мере 6 дней, по меньшей мере 7 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 11 дней, по меньшей мере 12 дней, по меньшей мере 13 дней или по меньшей мере 2 недель до или после введения первой дозы ингибитора PD–1 или после начала интервала лечения. В одном варианте осуществления дозу ингибитора PD–1 вводят через приблизительно 25–40 дней (например, приблизительно 25–30, 30–35 или 35–40 дней, например, приблизительно 35 дней) или приблизительно 2–7 недель (например, 2, 3, 4, 5, 6 или 7 недель) после введения дозы клетки, экспрессирующей CAR. В вариантах осуществления, в которых вводят более чем одну дозу ингибитора PD–1, вторую дозу ингибитора PD–1 вводят через приблизительно 15–30 дней (например, приблизительно 15–20, 20–25 или 25–30 дней, например, приблизительно 20 дней) или приблизительно 2–5 недель (например, 2, 3, 4 или 5 недель) после введения первой дозы ингибитора PD–1.
Если интервал лечения предусматривает несколько доз (например, первую и вторую, а также необязательно одну или несколько последующих доз) ингибитора PD–1 и дозу клетки, экспрессирующей CAR, в некоторых вариантах осуществления дозу клетки, экспрессирующей CAR, и первую дозу ингибитора PD–1 вводят одновременно или параллельно, например, в пределах периода 2 дней (например, в пределах периода 2 дней, 1 дня, 24 часов, 12 часов, 6 часов, 4 часов, 2 часов или меньше) друг после друга. В вариантах осуществления вторую дозу ингибитора PD–1 вводят либо после (i) дозы клетки, экспрессирующей CAR, либо после (ii) первой дозы ингибитора PD–1 в зависимости от того, что произойдет позднее. В вариантах осуществления вторую дозу ингибитора PD–1 вводят через по меньшей мере 2 дня (например, по меньшей мере 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель или больше) после (i) или (ii). В вариантах осуществления последующую дозу (например, третью, четвертую или пятую дозу и т. д.) ингибитора PD–1 вводят после второй дозы ингибитора PD–1. В вариантах осуществления последующую дозу ингибитора PD–1 вводят через по меньшей мере 2 дня (например, по меньшей мере 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель или больше) после второй дозы ингибитора PD–1. В таких вариантах осуществления интервал лечения начинают после введения первой вводимой дозы и завершают после введения второй дозы (или последующей дозы) ингибитора PD–1.
В других вариантах осуществления, если интервал лечения предусматривает несколько доз (например, первую и вторую и необязательно последующую дозу) ингибитора PD–1 и дозу клетки, экспрессирующей CAR, то дозу клетки, экспрессирующей CAR, и первую дозу ингибитора PD–1 вводят последовательно. В вариантах осуществления дозу клетки, экспрессирующей CAR, вводят после введения первой дозы ингибитора PD–1, но до введения второй дозы ингибитора PD–1. В вариантах осуществления последующую дозу (например, третью, четвертую или пятую дозу и т. д.) ингибитора PD–1 вводят после второй дозы ингибитора PD–1. В таких вариантах осуществления интервал лечения начинают после введения первой дозы ингибитора PD–1 и завершают после введения второй дозы (или последующей дозы) ингибитора PD–1. В одном варианте осуществления вторую дозу ингибитора PD–1 вводят через по меньшей мере 2 дня (например, по меньшей мере 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель или больше) после введения первой дозы ингибитора PD–1. В варианте осуществления, если ингибитором PD–1 является ингибирующая РНК, например, siRNA, то вторую дозу вводят с частотой от одного раза в 2 дня до одного раза в 2 недели. В варианте осуществления, если ингибитором PD–1 является молекула антитела, то вторую дозу вводят один раз в 2–3 недели. В одном варианте осуществления последующую дозу (например, третью, четвертую или пятую дозу и т. д.) ингибитора PD–1 вводят через по меньшей мере 2 дня (например, по меньшей мере 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель или больше) после второй дозы ингибитора PD–1. В одном варианте осуществления дозу клетки, экспрессирующей CAR, вводят через по меньшей мере 2 дня (например, по меньшей мере 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель или больше) после введения первой дозы ингибитора PD–1. В одном варианте осуществления вторую дозу ингибитора PD–1 вводят через по меньшей мере 2 дня (например, по меньшей мере 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель или больше) после введения дозы клетки, экспрессирующей CAR. В вариантах осуществления ингибитор PD–1 (например, молекулу антитела к PD–1) вводят один раз в 2–3 недели (например, один раз в 2 недели или один раз в 3 недели) на протяжении интервала лечения.
В других вариантах осуществления дозу клетки, экспрессирующей CAR, вводят перед введением первой дозы ингибитора PD–1. В таких вариантах осуществления интервал лечения начинают после введения клетки, экспрессирующей CAR, и завершают после введения первой дозы (или последующей дозы) ингибитора PD–1. В вариантах осуществления первую дозу ингибитора PD–1 вводят через по меньшей мере 2 дня (например, по меньшей мере 2 дня, по меньшей мере 3 дня, по меньшей мере 4 дня, по меньшей мере 5 дней, по меньшей мере 6 дней, по меньшей мере 1 неделю, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 11 дней, по меньшей мере 12 дней, по меньшей мере 13 дней, по меньшей мере 2 недели, по меньшей мере 15 дней, по меньшей мере 16 дней, по меньшей мере 17 дней, по меньшей мере 18 дней, по меньшей мере 19 дней, по меньшей мере 20 дней, по меньшей мере 3 недели, по меньшей мере 4 недели, по меньшей мере 5 недель или больше) после введения клетки, экспрессирующей CAR. В некоторых вариантах осуществления введение первой дозы ингибитора PD–1 осуществляют через от приблизительно 5 до приблизительно 10 дней, например, через приблизительно 8 дней, после введения клетки, экспрессирующей CAR. В других вариантах осуществления введение первой дозы ингибитора PD–1 осуществляют через от приблизительно 10 до приблизительно 20 дней, например, через приблизительно 15 или 16 дней, после введения клетки, экспрессирующей CAR. В вариантах осуществления вторую дозу ингибитора PD–1 вводят через по меньшей мере 2 дня (например, по меньшей мере 2 дня, по меньшей мере 3 дня, по меньшей мере 4 дня, по меньшей мере 5 дней, по меньшей мере 6 дней, по меньшей мере 1 неделю, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 11 дней, по меньшей мере 12 дней, по меньшей мере 13 дней, 2 недели, по меньшей мере 15 дней, по меньшей мере 16 дней, по меньшей мере 17 дней, по меньшей мере 18 дней, по меньшей мере 19 дней, по меньшей мере 20 дней, 3 недели, 4 недели, 5 недель или больше) после введения первой дозы ингибитора PD–1. В вариантах осуществления вторую дозу ингибитора PD–1 вводят через приблизительно 2–4 недели, например, 3 недели, после первой дозы ингибитора PD–1. В вариантах осуществления последующую дозу (например, третью, четвертую или пятую дозу и т. д.) ингибитора PD–1 вводят через по меньшей мере 2 дня (например, по меньшей мере 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель или больше) после второй дозы ингибитора PD–1. В вариантах осуществления последующую дозу (например, третью, четвертую или пятую дозу и т. д.) ингибитора PD–1 вводят через приблизительно 2–4 недели, например, 3 недели, после предыдущей дозы ингибитора PD–1. В вариантах осуществления первую дозу ингибитора PD–1 вводят через по меньшей мере 2 дня (например, по меньшей мере 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель или больше) после введения клетки, экспрессирующей CAR.
В некоторых вариантах осуществления интервал лечения предусматривает одну, две или три дозы (например, первую и вторую, а также третью дозу) ингибитора PD–1 и дозу клетки, экспрессирующей CAR. В одном варианте осуществления дозу клетки, экспрессирующей CAR, и первую дозу ингибитора PD–1 вводят последовательно. Например, субъект, например, пациент, получает одну, две или три дозы ингибитора PD–1, начиная после введения клетки, экспрессирующей CAR, например, через от приблизительно одной недели до 4 месяцев, например, через от приблизительно 14 дней до 2 месяцев, после введения дозы клеток, экспрессирующих CAR.
В одном варианте осуществления любой из интервалов лечения, описываемых в данном документе, можно повторять один или несколько раз, например, еще 1, 2, 3, 4 или 5 раз. В одном варианте осуществления интервал лечения повторяют один раз, устанавливая в результате режим лечения, включающий два интервала лечения. В варианте осуществления повторный интервал лечения проводят через по меньшей мере 1 день, например, по меньшей мере 1 день, по меньшей мере 2 дня, по меньшей мере 3 дня, по меньшей мере 4 дня, по меньшей мере 5 дней, по меньшей мере 6 дней, по меньшей мере 7 дней, по меньшей мере 2 недели, по меньшей мере 1 месяц, по меньшей мере 3 месяца, по меньшей мере 6 месяцев, по меньшей мере 1 год или больше, после завершения первого или предыдущего интервала лечения. В варианте осуществления повторный интервал лечения проводят через по меньшей мере 3 дня после завершения первого или предыдущего интервала лечения.
В одном варианте осуществления за любым из интервалов лечения, описываемых в данном документе, могут следовать один или несколько, например, 1, 2, 3, 4 или 5, последующих интервалов лечения. Один или несколько последующих интервалов лечения отличаются от первого или предыдущего интервала лечения. В качестве примера, за первым интервалом лечения, состоящим из однократной дозы ингибитора PD–1 и однократной дозы клетки, экспрессирующей CAR, следует второй интервал лечения, состоящий из нескольких доз (например, двух, трех, четырех или больше доз) ингибитора PD–1 и однократной дозы клетки, экспрессирующей CAR. В одном варианте осуществления один или несколько последующих интервалов лечения проводят через по меньшей мере 1 день, например, 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней или 2 недели, после завершения первого или предыдущего интервала лечения.
В любом из способов, описываемых в данном документе, одну или несколько последующих доз, например, 1, 2, 3, 4 или 5 или больше доз, ингибитора PD–1 вводят после завершения одного или нескольких интервалов лечения. В вариантах осуществления, если интервалы лечения повторяют или проводят два или больше интервалов лечения, то одну или несколько последующих доз, например, 1, 2, 3, 4 или 5 или больше доз, ингибитора PD–1 вводят после завершения одного интервала лечения и до начала другого интервала лечения. В одном варианте осуществления дозу ингибитора PD–1 вводят один раз в 5 дней, 7 дней, 2 недели, 3 недели или 4 недели после завершения одного или нескольких или каждого из интервалов лечения.
В любом из способов, описываемых в данном документе, одну или несколько, например, 1, 2, 3, 4 или 5 или больше, последующих доз клетки, экспрессирующей CAR, вводят после завершения одного или нескольких интервалов лечения. В вариантах осуществления, если интервалы лечения повторяют или проводят два или больше интервалов лечения, то одну или несколько последующих доз, например, 1, 2, 3, 4 или 5 или больше доз, клетки, экспрессирующей CAR, вводят после завершения одного интервала лечения и до начала другого интервала лечения. В одном варианте осуществления дозу клетки, экспрессирующей CAR, вводят один раз в 2 дня, 3 дня, 4 дня, 5 дней, 7 дней, 2 недели, 3 недели или 4 недели после завершения одного или нескольких или каждого из интервалов лечения.
В одном варианте осуществления интервал лечения предусматривает однократную дозу клетки, экспрессирующей CAR, которую вводят до первой дозы ингибитора PD–1. В данном варианте осуществления первую дозу ингибитора PD–1 вводят через приблизительно 7, приблизительно 8, приблизительно 9, приблизительно 10, приблизительно 11, приблизительно 12, приблизительно 13, приблизительно 14, приблизительно 15, приблизительно 16, приблизительно 17, приблизительно 18, приблизительно 19, приблизительно 20, приблизительно 25, приблизительно 30 или приблизительно 35 дней после введения клетки, экспрессирующей CAR. В вариантах осуществления вторую дозу ингибитора PD–1 вводят после введения первой дозы ингибитора PD–1. В вариантах осуществления вторую дозу ингибитора PD–1 вводят через приблизительно 20 дней после введения первой дозы ингибитора PD–1, например, через приблизительно 2–4 недели, например, 3 недели, после первой дозы ингибитора PD–1. В вариантах осуществления последующие дозы ингибитора PD–1 вводят после второй дозы ингибитора PD–1, например, один раз в 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 5 дней, 7 дней, 10 дней, 14 дней, 20 дней, 25 дней, 30 дней или 35 дней, например, через приблизительно 2–4 недели, например, 3 недели, после предыдущей дозы ингибитора PD–1.
В варианте осуществления способ включает введение субъекту средства противолимфомной химиотерапии, например, до введения клетки, экспрессирующей CAR. В вариантах осуществления средство противолимфомной химиотерапии включает в себя циклофосфамид, например, гиперфракционированный циклофосфамид, например, в дозе приблизительно 200–400 мг/м2, например, приблизительно 300 мг/м2, например, в количестве 1–10 доз (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10 доз). В вариантах осуществления способ включает проведение интервала лечения, предусматривающего дозу клеток, экспрессирующих CAR, и несколько доз ингибитора PD–1. В вариантах осуществления интервал лечения предусматривает однократную дозу клетки, экспрессирующей CAR (например, клетки, экспрессирующей CAR для CD19), которую вводят до первой дозы ингибитора PD–1, например, за по меньшей мере 2 недели (например, 2, 3, 4, 5, 6 недель или больше) до первой дозы ингибитора PD–1 (например, за приблизительно 7, приблизительно 8, приблизительно 9, приблизительно 10, приблизительно 11, приблизительно 12, приблизительно 13, приблизительно 14, приблизительно 15, приблизительно 16 или больше дней до первой дозы ингибитора PD–1). В вариантах осуществления дозу клетки, экспрессирующей CAR вводят за приблизительно 3–4 недели до первой дозы ингибитора PD–1. В вариантах осуществления ингибитор PD–1 вводят один раз в 2–4 недели (например, один раз в 2–3 недели или 3–4 недели, например, один раз в 3 недели) на протяжении интервала лечения. В вариантах осуществления ингибитор PD–1 вводят в дозе приблизительно 1–3 мг/кг, например, приблизительно 2 мг/кг. В вариантах осуществления клетку, экспрессирующую CAR, вводят в дозе приблизительно 1–10×106 клеток/кг, например, приблизительно 5×106 клеток/кг, например, приблизительно 5,3×106 клеток/кг. В вариантах осуществления клетку, экспрессирующую CAR, вводят в дозе приблизительно 1–10×108 клеток на инфузию, например, приблизительно 5×108 клеток на инфузию.
В любом из способов, описываемых в данном документе, субъекту вводят однократную дозу клетки, экспрессирующей CAR, и однократную дозу ингибитора PD–1. В одном варианте осуществления однократную дозу клетки, экспрессирующей CAR, вводят за по меньшей мере 2 дня, например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 14, 15, 16, 17, 18, 20, 25, 30, 35, 40 дней, или 2 недели, 3 недели, 4 недели или больше до введения однократной дозы ингибитора PD–1. В вариантах осуществления однократную дозу клетки, экспрессирующей CAR, вводят за приблизительно 35 дней до введения ингибитора PD–1.
В одном варианте осуществления одну или несколько, например, 1, 2, 3, 4, или 5, последующих доз клетки, экспрессирующей CAR, вводят субъекту после начальной дозы клетки, экспрессирующей CAR. В одном варианте осуществления одну или несколько последующих доз клетки, экспрессирующей CAR, вводят через по меньшей мере 2 дня, например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 14, 20, 25, 30, 35, 40 дней, или 2 недели, 3 недели, 4 недели или больше после предыдущей дозы клетки, экспрессирующей CAR. В одном варианте осуществления одну или несколько последующих доз клетки, экспрессирующей CAR вводят через по меньшей мере 1 месяц, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или больше месяцев, после предыдущей дозы клетки, экспрессирующей CAR. В одном варианте осуществления одну или несколько последующих доз клетки, экспрессирующей CAR вводят через по меньшей мере 5 дней после предыдущей дозы клетки, экспрессирующей CAR. В одном варианте осуществления субъекту вводят три дозы клетки, экспрессирующей CAR, в неделю или одну дозу один раз в 2 дня.
В одном варианте осуществления одну или несколько, например, 1, 2, 3, 4, или 5, последующих доз ингибитора PD–1 вводят после введения однократной дозы ингибитора PD–1. В одном варианте осуществления одну или несколько последующих доз ингибитора PD–1 вводят через по меньшей мере 5 дней, 7 дней, 10 дней, 14 дней, 20 дней, 25 дней, 30 дней, 2 недели, 3 недели, 4 недели или 5 недель, например, 3 недели, после предыдущей дозы ингибитора PD–1.
В одном варианте осуществления одну или несколько последующих доз ингибитора PD–1 вводят через по меньшей мере 1, 2, 3, 4, 5, 6, или 7 дней после дозы клетки, экспрессирующей CAR, например, начальной дозы клетки, экспрессирующей CAR.
В одном варианте осуществления одну или несколько, например, 1, 2, 3, 4, или 5, доз ингибитора PD–1 вводят до первой дозы клетки, экспрессирующей CAR.
В одном варианте осуществления одну или несколько, например, 1, 2, 3, 4, 5, или 6, доз ингибитора PD–1 вводят после первой дозы клетки, экспрессирующей CAR, например, через 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель или 8 недель после первой дозы клетки, экспрессирующей CAR. В одном варианте осуществления одну или несколько, например, 1, 2, 3, 4, или 5, доз ингибитора PD–1 вводят после первой дозы клеток, экспрессирующих CAR, например, через 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, или 20 месяцев после первой дозы клетки, экспрессирующей CAR.
В одном варианте осуществления одну или несколько, например, 1, 2, 3, 4, 5, или 6, доз ингибитора PD–1, которые вводят после первой дозы клетки, экспрессирующей CAR, вводят один раз в 2–3 недели, например, один раз в 2, 3, 4 или 5 недель, в течение по меньшей мере 1 месяца, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, или 12 месяцев или дольше. В одном варианте осуществления одну или несколько доз ингибитора PD–1 вводят, например, через приблизительно 2–4 недели, например, 3 недели, после предыдущей дозы ингибитора PD–1, например, в количестве до шести доз.
В одном варианте осуществления введение одной или нескольких доз клетки, экспрессирующей CAR, и одной или нескольких доз ингибитора PD–1 повторяют, например, еще 1, 2, 3, 4, или 5 раз.
В любом из способов, описываемых в данном документе, в вариантах осуществления субъекту дополнительно вводят средство химиотерапии, например, средство химиотерапии, описываемое в данном документе. В вариантах осуществления средство химиотерапии вводят до введения клетки, экспрессирующей CAR. В вариантах осуществления средство химиотерапии вводят за приблизительно 1–10 дней (например, приблизительно 1–4, 1–5, 4–8, 4–10, или 5–10 дней) до введения клетки, экспрессирующей CAR.
Дозировки и терапевтические режимы приема терапевтических средств, раскрытых в данном документе, могут быть определены специалистом в данной области.
При любых режимах введения или интервалах лечения, описываемых в данном документе, в некоторых вариантах осуществления доза клеток, экспрессирующих CAR (например, клеток, экспрессирующих CAR для CD19), содержит от приблизительно 104 до приблизительно 109 клеток/кг, например, от приблизительно 104 до приблизительно 105 клеток/кг, от приблизительно 105 до приблизительно 106 клеток/кг, от приблизительно 106 до приблизительно 107 клеток/кг, от приблизительно 107 до приблизительно 108 клеток/кг или от приблизительно 108 до приблизительно 109 клеток/кг; или по меньшей мере приблизительно одно из: 1×107, 1,5×107, 2×107, 2,5×107, 3×107, 3,5×107, 4×107, 5×107, 1×108, 1,5×108, 2×108, 2,5×108, 3×108, 3,5×108, 4×108, 5×108, 1×109, 2×109 или 5×109 клеток. В некоторых вариантах осуществления доза клеток, экспрессирующих CAR (например, клеток, экспрессирующих CD19 для CAR), содержит по меньшей мере от приблизительно 1–5×107 до 1–5×108 клеток, экспрессирующих CAR. В некоторых вариантах осуществления субъекту вводят приблизительно 1–5×107 клеток, экспрессирующих CAR (например, клеток, экспрессирующих CAR для CD19). В других вариантах осуществления субъекту вводят приблизительно 1–5×108 клеток, экспрессирующих CAR (например, клеток, экспрессирующих CAR для CD19).
В вариантах осуществления клетки, экспрессирующие CAR (например, клетки, экспрессирующие CAR для CD19), вводят субъекту в соответствии с режимом введения доз, предусматривающим суммарную дозу клеток, вводимых субъекту путем фракционирования дозы, например, за одно, два, три или больше отдельных введений частичной дозы. В вариантах осуществления первую процентную долю суммарной дозы вводят в первый день лечения, а вторую процентную долю суммарной дозы вводят в последующий (например, второй, третий, четвертый, пятый, шестой или седьмой или более поздний) день лечения, и необязательно третью процентную долю (например, остальную процентную долю) суммарной дозы вводят в следующий после него (например, третий, четвертый, пятый, шестой, седьмой, восьмой, девятый, десятый или более поздний) день лечения. Например, 10% суммарной дозы клеток доставляют в первый день, 30% суммарной дозы клеток доставляют во второй день, а остальные 60% суммарной дозы клеток доставляют в третий день лечения. Например, суммарная доза клеток содержит 1–5×107 или 1–5×108 клеток, экспрессирующих CAR (например, клеток, экспрессирующих CAR для CD19).
При любом из режимов введения, описываемых в данном документе, доза ингибитора PD–1, например, молекулы антитела к PD–1, описываемой в данном документе (например, пембролизумаба, ниволумаба, PDR001 или молекулы антитела к PD–1, представленной в таблице 6), содержит приблизительно 1–30 мг/кг, например, приблизительно 1–20 мг/кг, приблизительно 2–15 мг/кг, приблизительно 5–25 мг/кг, приблизительно 10–20 мг/кг, приблизительно 1–5 мг/кг, приблизительно 2 мг/кг, приблизительно 3 мг/кг или приблизительно 10 мг/кг. В одном варианте осуществления доза составляет приблизительно 10–20 мг/кг. В одном варианте осуществления доза составляет приблизительно 1–5 мг/кг. В одном варианте осуществления доза составляет менее 5 мг/кг, менее 4 мг/кг, менее 3 мг/кг, менее 2 мг/кг или менее 1 мг/кг. В одном варианте осуществления доза составляет приблизительно 2 мг/кг.
В вариантах осуществления при любом из режимов введения, описываемых в данном документе, дозу ингибитора PD–1 вводят один раз в 1–4 недели, например, один раз в неделю, один раз в 2 недели, один раз в 3 недели или один раз в 4 недели.
В некоторых вариантах осуществления молекулу антитела к PD–1 (например, пембролизумаба, ниволумаба, PDR001 или молекулу антитела к PD–1, представленную в таблице 6) вводят путем инъекции (например, подкожно или внутривенно) в дозе приблизительно 1–30 мг/кг, например, приблизительно 1–20 мг/кг, приблизительно 2–15 мг/кг, приблизительно 5–25 мг/кг, приблизительно 10–20 мг/кг, приблизительно 1–5 мг/кг, приблизительно 3 мг/кг или приблизительно 2 мг/кг. Схема введения доз может варьироваться от, например, одного раза в неделю до одного раза в 2, 3 или 4 недели. В одном варианте осуществления молекулу антитела к PD–1 вводят в дозе приблизительно 10–20 мг/кг один раз в две недели. В одном варианте осуществления доза составляет приблизительно 1–5 мг/кг один раз в 2 недели, один раз в 3 недели или один раз в 4 недели. В одном варианте осуществления доза составляет менее 5 мг/кг, менее 4 мг/кг, менее 3 мг/кг, менее 2 мг/кг или менее 1 мг/кг один раз в 2 недели, один раз в 3 недели или один раз в 4 недели. В одном варианте осуществления доза составляет приблизительно 2 мг/кг один раз в 2 недели, один раз в 3 недели или один раз в 4 недели.
В некоторых вариантах осуществления доза ингибитора PD–1, например, молекулы антитела к PD–1 (например, пембролизумаба, ниволумаба, PDR001 или молекулы антитела к PD–1, представленной в таблице 6), является фиксированной дозой. В некоторых вариантах осуществления молекулу антитела к PD–1 вводят путем инъекции (например, подкожно или внутривенно) в дозе (например, фиксированной дозе) от приблизительно 200 мг до 500 мг, например, от приблизительно 250 мг до 450 мг, от приблизительно 300 мг до 400 мг, от приблизительно 250 мг до 350 мг, от приблизительно 350 мг до 450 мг или приблизительно 200 мг, приблизительно 300 мг или приблизительно 400 мг. Схема введения доз (например, схема введения фиксированных доз) может варьироваться, например, от одного раза в неделю до одного раза в 2, 3, 4, 5 или 6 недель. В одном варианте осуществления молекулу антитела к PD–1 вводят в дозе приблизительно 200 мг один раз в три недели или один раз в четыре недели. В одном варианте осуществления молекулу антитела к PD–1 вводят в дозе от приблизительно 300 мг до 400 мг один раз в три недели или один раз в четыре недели. В одном варианте осуществления молекулу антитела к PD–1 вводят в дозе приблизительно 300 мг один раз в три недели, например, путем i.v. инфузии. В одном варианте осуществления молекулу антитела к PD–1 вводят в дозе приблизительно 200 мг один раз в три недели, например, путем i.v. инфузии. В одном варианте осуществления молекулу антитела к PD–1 вводят в дозе приблизительно 400 мг один раз в четыре недели, например, путем i.v. инфузии. В одном варианте осуществления молекулу антитела к PD–1 вводят в дозе приблизительно 300 мг один раз в четыре недели, например, путем i.v. инфузии. В одном варианте осуществления молекулу антитела к PD–1 вводят в дозе приблизительно 400 мг один раз в три недели, например, путем i.v. инфузии.
В одном варианте осуществления ингибитор PD–1 представляет собой пембролизумаб, вводимый при 200 мг один раз в три недели в количестве до шести доз. В некоторых вариантах осуществления ингибитор PD–1 представляет собой пембролизумаб, вводимый при 300 мг один раз в три недели в количестве до шести доз.
В одном варианте осуществления ингибитор PD–1 выбран из группы, состоящей из ниволумаба, пембролизумаба, пидилизумаба, PDR001, AMP–514, AMP–224 и любой молекулы антитела к PD–1, представленной в таблице 6.
В некоторых вариантах осуществления настоящее изобретение предусматривает способ лечения субъекта, имеющего заболевание, ассоциированное с экспрессией CD19, например, гематологический рак (например, DLBCL (например, первичную DLBCL) или В–клеточный острый лимфобластный лейкоз (B–ALL)). Способ включает введение субъекту эффективного количества популяции клеток, которые экспрессируют молекулу CAR, связывающую CD19, например, CAR для CD19 ("средства терапии CAR для CD19"), описываемой в данном документе, в комбинации с ингибитором PD–1, например, антителом к PD–1, описываемым в данном документе. В некоторых вариантах осуществления средство терапии CAR для CD19 вводят до ингибитора PD–1, одновременно с ним или после него. В одном варианте осуществления средство терапии CAR для CD19 вводят до ингибитора PD–1. Например, одну или несколько доз ингибитора PD–1 можно вводить после терапии CAR для CD19 (например, начиная с 5 дней – 4 месяцев, например, 10 дней – 3 месяцев, например, 14 дней – 2 месяцев после терапии CAR для CD19). В некоторых вариантах осуществления комбинацию терапии CAR для CD19 и терапии ингибитором PD–1 повторяют.
В одном варианте осуществления терапии, предусматривающей клетку, экспрессирующую CAR для CD19, и ингибитор PD–1, терапия CAR для CD19 включает одну или несколько лечебных процедур с использованием клеток, экспрессирующих CAR для CD19, описываемых в данном документе. В вариантах осуществления молекула CAR для CD19 содержит антигенсвязывающий домен, который специфично связывается с CD19, например, описываемый в данном документе. В вариантах осуществления средства терапии CAR для CD19 и ингибитором PD–1 вводят в дозировке, описываемой в данном документе.
В некоторых вариантах осуществления CAR для CD19 (или нуклеиновая кислота, кодирующая его) содержит последовательность, изложенную в любой из таблицы 2 или таблицы 3.
В вариантах осуществления терапии, предусматривающей клетку, экспрессирующую CAR для CD19, и ингибитор PD–1, терапия CAR для CD19 включает одну или несколько лечебных процедур с использованием клеток, экспрессирующих молекулу мышиного CAR, описываемую в данном документе, например, молекулу мышиного CAR для CD19, указанную в таблице 3 или имеющую CDR, изложенные в таблицах 4 и 5. В вариантах осуществления CAR для CD19 представляет собой CTL019, например, описываемый в данном документе.
В другом варианте осуществления терапии, предусматривающей клетку, экспрессирующую CAR для CD19, и ингибитор PD–1, терапия CAR для CD19 включает одну или несколько лечебных процедур с использованием клеток, экспрессирующих гуманизированный CAR для CD19, например, гуманизированный CAR для CD19 согласно таблице 2 или гуманизированный CAR для CD19, имеющий CDR, изложенные в таблицах 4 и 5, например, CAR2 согласно таблице 2, например, CTL119.
В некоторых вариантах осуществления молекула CAR содержит одну, две и/или три CDR из вариабельной области тяжелой цепи и/или одну, две и/или три CDR из вариабельной области легкой цепи мышиного или гуманизированного CAR для CD19 из таблиц 4 и 5.
В другом варианте осуществления терапии, предусматривающей клетку, экспрессирующую CAR для CD19, и ингибитор PD–1, ингибитор PD–1 представляет собой антитело к PD–1. В некоторых вариантах осуществления ингибитор PD–1 выбран из пембролизумаба, ниволумаба, PDR001 (например, молекулы антитела из таблицы 6), MEDI–0680 (AMP–514), AMP–224, REGN–2810 или BGB–A317.
В одном варианте осуществления терапии, предусматривающей клетку, экспрессирующую CAR для CD19, и ингибитор PD–1, ингибитор PD–1 представляет собой пембролизумаб. В одном варианте осуществления молекула антитела содержит:
(i) вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 503, аминокислотную последовательность VHCDR2 под SEQ ID NO: 504 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 505; и
(ii) вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 500, аминокислотную последовательность VLCDR2 под SEQ ID NO: 501 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 502,
или аминокислотную последовательность, идентичную им на по меньшей мере 85%, 90%, 95% или больше.
В другом варианте осуществления терапии, предусматривающей клетку, экспрессирующую CAR для CD19, и ингибитор PD–1, ингибитор PD–1, например, молекула антитела к PD–1, содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR (или все CDR) вариабельной области тяжелой и легкой цепей антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанных в таблице 1 в US 2015/0210769 или в таблице 6 в данном документе; или кодируемых нуклеотидной последовательностью из таблицы 1, или кодируемых нуклеотидной последовательностью из таблицы 6 в данном документе, или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей; или близкородственные CDR, например, CDR, которые являются идентичными или которые имеют по меньшей мере одно изменение аминокислоты, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен).
В еще одном варианте осуществления терапии, предусматривающей клетку, экспрессирующую CAR для CD19, и ингибитор PD–1, ингибитор PD–1, например, молекула антитела к PD–1, содержит по меньшей мере одну, две, три или четыре вариабельные области антитела, описываемого в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 1 в US 2015/0210769 или в таблице 6 в данном документе; или кодируемые нуклеотидной последовательностью из таблицы 1, или кодируемые нуклеотидной последовательностью из таблицы 6 в данном документе, или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей.
В вариантах осуществления ингибитор PD–1, например, молекула антитела к PD–1, представляет собой PDR–001, который содержит аминокислотные последовательности вариабельной области легкой цепи и вариабельной области тяжелой цепи BAP049–Clone–E, описанные в таблице 6.
В одном варианте осуществления терапии, предусматривающей клетку, экспрессирующую CAR для CD19, и ингибитор PD–1, ингибитор PD–1, например, пембролизумаб, вводят после терапии CAR для CD19 (например, начиная с 5 дней – 4 месяцев, например, 10 дней – 3 месяцев, например, 14 дней – 2 месяцев после терапии CTL019 или CTL119 или после комбинированной терапии CTL019 и CTL119). В вариантах осуществления терапию осуществляют в отношении субъекта с B–ALL, например, рецидивирующим или резистентным B–ALL.
В еще одном варианте осуществления терапии, предусматривающей клетку, экспрессирующую CAR для CD19, и ингибитор PD–1, гематологический рак представляет собой B–ALL или DLBCL, например, рецидивирующие или резистентные B–ALL или DLBCL. В одном варианте осуществления субъект имеет гематологическое злокачественное новообразование, например, B–ALL или DLBCL, и может не отвечать на терапию CAR–T–клетками или может иметь рецидив, например, из–за недостаточной персистенции CAR–T–клеток. В одном варианте осуществления терапии CAR для CD19 в комбинации с терапией ингибитором PD–1 субъект демонстрирует улучшенный терапевтический эффект, например, субъект достигает одного или нескольких из частичной ремиссии, полной ремиссии или длительной персистенции CAR–T–клеток в ответ на терапию CAR для CD19 в комбинации с терапией ингибитором PD–1, например, один или несколько циклов терапии CAR для CD19 в комбинации с терапией ингибитором PD–1.
В одном варианте осуществления терапии, предусматривающей клетку, экспрессирующую CAR для CD19, и ингибитор PD–1, до введения ингибитора PD–1 субъект имеет рецидивирующие или резистентные B–ALL или DLBCL после предшествующего лечения с помощью терапии CAR для CD19, например, после предшествующего лечения с помощью одного или обоих из CTL019 и CTL119. В некоторых вариантах осуществления субъект демонстрирует пониженную или недостаточную персистенцию CAR–T–клеток. В некоторых вариантах осуществления субъект получает или получал лечение с помощью CTL019, а затем CTL119.
В некоторых вариантах осуществления субъект демонстрирует рецидив с фенотипом CD19+. В некоторых вариантах осуществления субъект имеет рецидивирующий или резистентный CD19+ B–ALL. В некоторых вариантах осуществления субъект имеет рецидивирующую или резистентную CD19+ DLBCL. В одном варианте осуществления субъект имеет рецидивирующий или резистентный B–ALL с вовлечением лимфатических узлов, например, имеет лимфоматозное заболевание.
В некоторых вариантах осуществления субъект, который имеет рецидивирующий или резистентный B–ALL с вовлечением лимфатических узлов, например, имеет лимфоматозное заболевание, после предшествующего лечения с помощью терапии CAR для CD19, демонстрирует уменьшение очагов повышенного накопления изотопа при PET, например, демонстрирует снижение количества или степени выраженности очагов, в ответ на терапию CAR для CD19 в комбинации с терапией ингибитором PD–1, например, в ответ на один или несколько циклов терапии CAR для CD19 в комбинации с терапией ингибитором PD–1.
В некоторых вариантах осуществления субъекту, например, субъекту, демонстрирующему рецидив с фенотипом CD19+ после терапии CAR для CD19, вводят дополнительное средство терапии CAR для CD19 в комбинации с ингибитором PD–1, например, пембролизумабом. В вариантах осуществления дополнительное осуществление комбинированной терапии приводит к улучшенному терапевтическому эффекту, например, субъект достигает одного или нескольких из частичной ремиссии, полной ремиссии или длительной персистенции CAR–T–клеток. В варианте осуществления осуществление комбинированной терапии приводит к длительной персистенции CAR–T–клетки, например, клетки, экспрессирующей CAR для CD19. В варианте осуществления осуществление комбинированной терапии приводит к более длительному времени для восстановления популяции B–клеток, например, более длительному времени до B–клеточной аплазии, например, по сравнению с субъектом, получающим лечение с помощью терапии CAR для CD19 в отдельности. В некоторых вариантах осуществления субъект после лечения комбинацией, раскрываемой в данном документе, характеризуется одним или несколькими из: (i) пониженного риска рецидива, (ii) отсроченного момента наступления рецидива или (iii) пониженной тяжести рецидива, например, по сравнению с субъектом, получающим лечение с помощью терапии CAR для CD19 отдельно. В варианте осуществления осуществление комбинированной терапии приводит к объективному клиническому ответу.
В варианте осуществления субъект, например, субъект, демонстрирующий рецидив после терапии CAR для CD19, отвечает требованиям к получению повторного введения средства терапии CAR для CD19, например, второй, третьей или четвертой дозы. В варианте осуществления субъект отвечает требованиям к получению повторного введения средства терапии CAR для CD19, например, второй, третьей или четвертой дозы, вместе с ингибитором PD–1. В варианте осуществления субъект, демонстрирующий низкую персистенцию средства терапии CAR для CD19 после первого введения средства терапии CAR для CD19, отвечает требованиям к получению повторного введения средства терапии CAR для CD19, например, второй, третьей или четвертой дозы, вместе с ингибитором PD–1.
Субъект необязательно имеет или идентифицирован как имеющий по меньшей мере 5%, 6%, 7%, 8%, 9%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, или 90% раковых клеток, например, клеток DLBCL, которые являются CD3+/PD1+.
В другом аспекте настоящее изобретение относится к композиции (например, одному или нескольким дозированным составам, комбинациям или одной или нескольким фармацевтическим композициям), содержащей клетку, экспрессирующую CAR (например, CAR для CD19), описываемую в данном документе, и ингибитор PD–1, описываемый в данном документе. В одном варианте осуществления CAR (например, CAR для CD19) содержит антигенсвязывающий домен (например, антигенсвязывающий домен для CD19), трансмембранный домен и внутриклеточный сигнальный домен, описываемые в данном документе. В одном варианте осуществления CAR для CD19 содержит антигенсвязывающий домен для CD19, указанный в таблице 2 или 3. В одном варианте осуществления ингибитор PD–1 включает в себя молекулу антитела, малую молекулу, полипептид, например, слитый белок, или ингибирующую нуклеиновую кислоту, например, siRNA или shRNA. В одном варианте осуществления ингибитор PD–1 включает в себя молекулу антитела, например, пембролизумаб, ниволумаб, PDR001 или молекулу антитела, указанную в таблице 6. Клетка, экспрессирующая CAR, и ингибитор PD–1 могут находиться в одних и тех же или в разных составах или фармацевтических композициях.
В другом аспекте настоящее изобретение относится к композиции (например, одному или нескольким дозированным составам, комбинациям или одной или нескольким фармацевтическим композициям), содержащей клетку, экспрессирующую CAR (например, CAR для CD19), описываемую в данном документе, и ингибитор PD–1, описываемый в данном документе, для применения в способе лечения заболевания (например, рака), например, заболевания, ассоциированного с экспрессией CD19, например, рака, описываемого в данном документе. В одном варианте осуществления CAR (например, CAR для CD19) содержит антигенсвязывающий домен (например, антигенсвязывающий домен для CD19), трансмембранный домен и внутриклеточный сигнальный домен, описываемые в данном документе. В одном варианте осуществления CAR для CD19 содержит антигенсвязывающий домен для CD19, указанный в таблице 2 или 3. В одном варианте осуществления ингибитор PD–1 включает в себя молекулу антитела, малую молекулу, полипептид, например, слитый белок, или ингибирующую нуклеиновую кислоту, например, siRNA или shRNA. В одном варианте осуществления ингибитор PD–1 включает в себя молекулу антитела, например, пембролизумаб, ниволумаб, PDR001 или молекулу антитела, указанную в таблице 6. Клетка, экспрессирующая CAR, и ингибитор PD–1 могут находиться в одних и тех же или в разных составах или фармацевтических композициях.
Ингибиторы PD–1
В данном документе представлены ингибиторы PD–1 для применения в любых способах или композициях, описываемых в данном документе. В любых способах или композициях, описываемых в данном документе, ингибитор PD–1 включает в себя молекулу антитела, малую молекулу, полипептид, например, слитый белок, или ингибирующую нуклеиновую кислоту, например, siRNA или shRNA.
В одном варианте осуществления ингибитор PD–1 характеризуется одним или несколькими из следующего:
ингибирует или снижает экспрессию PD–1, например, транскрипцию или трансляцию PD–1; ингибирует или снижает активность PD–1, например, ингибирует или снижает связывание PD–1 с его лигандом, например, PD–L1; или связывается с PD–1 или его лигандом, например, PD–L1.
В одном варианте осуществления ингибитор PD–1 представляет собой молекулу антитела.
В одном варианте осуществления ингибитор PD–1 включает в себя молекулу антитела к PD–1, содержащую область 1, определяющую комплементарность, тяжелой цепи (CDR1 HC), область 2, определяющую комплементарность, тяжелой цепи (CDR2 HC) и область 3, определяющую комплементарность, тяжелой цепи (CDR3 HC) с любой аминокислотной последовательностью молекулы антитела к PD–1, указанной в таблице 6; и/или область 1, определяющую комплементарность, легкой цепи (CDR1 LC), область 2, определяющую комплементарность, легкой цепи (CDR2 LC) и область 3, определяющую комплементарность, легкой цепи (CDR3 LC) с любой аминокислотной последовательностью молекулы антитела к PD–1, указанной в таблице 6.
В одном варианте осуществления молекула антитела к PD–1 содержит аминокислотную последовательность CDR1 НС, выбранную из SEQ ID NO: 137 или 140, аминокислотную последовательность CDR2 НС под SEQ ID NO: 138 или 141 и аминокислотную последовательность CDR3 НС под SEQ ID NO: 139 и/или аминокислотную последовательность CDR1 LС под SEQ ID NO: 146 или 149, аминокислотную последовательность CDR2 LС под SEQ ID NO: 147 или 150 и аминокислотную последовательность CDR3 LС под SEQ ID NO: 148, 151, 166 или 167. В одном варианте осуществления антитело к PD–1 содержит аминокислотную последовательность CDR1 НС, выбранную из SEQ ID NO: 137 или 140, аминокислотную последовательность CDR2 НС под SEQ ID NO: 138 или 141 и аминокислотную последовательность CDR3 НС под SEQ ID NO: 139 и/или аминокислотную последовательность CDR1 LС под SEQ ID NO: 146 или 149, аминокислотную последовательность CDR2 LС под SEQ ID NO: 147 или 150 и аминокислотную последовательность CDR3 LС под SEQ ID NO: 166 или 167.
В одном варианте осуществления молекула антитела к PD–1 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность любой вариабельной области тяжелой цепи, указанной в таблице 6, например, SEQ ID NOs: 142, 144, 154, 158, 154, 158, 172, 184, 216, или 220. В одном варианте осуществления молекула антитела к PD–1 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций, по сравнению с аминокислотной последовательностью любой вариабельной области тяжелой цепи, представленной в таблице 6, например, SEQ ID NOs: 142, 144, 154, 158, 154, 158, 172, 184, 216, или 220. В одном варианте осуществления молекула антитела к PD–1 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, на по меньшей мере 95% идентичную (например, на 95–99% идентичную) аминокислотной последовательности любой вариабельной области тяжелой цепи, представленной в таблице 6, например, SEQ ID NOs: 142, 144, 154, 158, 154, 158, 172, 184, 216, или 220.
В одном варианте осуществления молекула антитела к PD–1 содержит тяжелую цепь, содержащую аминокислотную последовательность любой тяжелой цепи, указанной в таблице 6, например, SEQ ID NOs:156, 160, 174, 186, 218, 222, 225, или 236. В одном варианте осуществления молекула антитела к PD–1 содержит тяжелую цепь, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций, по отношению к любой тяжелой цепи, указанной в таблице 6, например, SEQ ID NOs: 156, 160, 174, 186, 218, 222, 225, или 236. В одном варианте осуществления молекула антитела к PD–1 содержит тяжелую цепь, содержащую аминокислотную последовательность, на 95–99% идентичную аминокислотной последовательности любой тяжелой цепи, указанной в таблице 6, например, SEQ ID NOs: 156, 160, 174, 186, 218, 222, 225, или 236.
В одном варианте осуществления молекула антитела к PD–1 содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность любой вариабельной области легкой цепи, указанной в таблице 6, например, SEQ ID NOs: 152, 162, 168, 176, 180, 188, 192, 196, 200, 204, 208, или 212. В одном варианте осуществления молекула антитела к PD–1 содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций, по сравнению с аминокислотной последовательностью любой вариабельной области легкой цепи, представленной в таблице 6, например, SEQ ID NOs: 152, 162, 168, 176, 180, 188, 192, 196, 200, 204, 208, или 212. В одном варианте осуществления молекула антитела к PD–1 содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность, на по меньшей мере 95% идентичную (например, на 95–99% идентичную) аминокислотной последовательности любой вариабельной области легкой цепи, представленной в таблице 6, например, SEQ ID NOs: 152, 162, 168, 176, 180, 188, 192, 196, 200, 204, 208, или 212.
В одном варианте осуществления молекула антитела к PD–1 содержит легкую цепь, содержащую аминокислотную последовательность любой легкой цепи, указанной в таблице 6, например, SEQ ID NOs: 164, 170, 178, 182, 190, 194, 198, 202, 206, 210, или 214.. В одном варианте осуществления молекула антитела к PD–1 содержит легкую цепь, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций, по отношению к любой легкой цепи, указанной в таблице 6, например, SEQ ID NOs: 164, 170, 178, 182, 190, 194, 198, 202, 206, 210, или 214.. В одном варианте осуществления молекула антитела к PD–1 содержит легкую цепь, содержащую аминокислотную последовательность, на по меньшей мере 95% идентичную (например, на 95–99% идентичную) аминокислотной последовательности любой легкой цепи, указанной в таблице 6, например, SEQ ID NOs: 164, 170, 178, 182, 190, 194, 198, 202, 206, 210, или 214.
В одном варианте осуществления молекула антитела к PD–1 содержит:
i) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 144, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 152;
ii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 156 или 160, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 164;
iii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 156 или 160, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 170;
iv) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 178;
v) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 182;
vi) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 186, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 182;
vii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 186, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 190;
viii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 190;
ix) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 194;
x) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 198;
xi) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 186, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 202;
xii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 202;
xiii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 186, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 206;
xiv) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 206;
xv) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 210;
xvi) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 214;
xvii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 218, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 206;
xviii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 218, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 202;
xix) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 222, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 202;
xx) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 225, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 178;
xxi) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 225, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 190;
xxii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 225, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 202;
xxiii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 236, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 206; или
xxiv) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 225, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 206.
В одном варианте осуществления молекула антитела к PD–1 содержит:
i) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 204;
ii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 142 или 144, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 152;
iii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 154 или 158, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 162;
iv) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 154 или 158, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 168;
v) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 176;
vi) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 180;
vii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 184, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 180;
viii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 184, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 188;
ix) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 188;
x) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 192;
xi) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 196;
xii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 184, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 200;
xiii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 200;
xiv) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 184, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 204;
xv) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 204;
xvi) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 208;
xvii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 212;
xviii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 216, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 204;
xix) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 216, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 200;
xx) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 220, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 200;
xxi) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 176;
xxii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 188;
xxiii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 200; или
xxiv) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 184, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 204.
В одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере один или два вариабельных домена тяжелой цепи (необязательно содержащих константную область), по меньшей мере один или два вариабельных домена легкой цепи (необязательно содержащих константную область) или оба их, содержащих аминокислотную последовательность BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанную в таблице 1 в US 2015/0210769 или в таблице 6 в данном документе, или кодируемую нуклеотидной последовательностью из таблицы 6; или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей. Молекула антитела к PD–1 необязательно содержит лидерную последовательность из тяжелой цепи, легкой цепи или их обеих, показанную в таблице 4 в US 2015/0210769; или последовательность, по сути идентичную ей.
В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три области, определяющие комплементарность (CDR), вариабельной области тяжелой цепи и/или вариабельной области легкой цепи антитела, описываемого в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 6, или кодируемые нуклеотидной последовательностью из таблицы 6; или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей.
В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три CDR (или в совокупности все CDR) вариабельной области тяжелой цепи, которые содержат аминокислотную последовательность, показанную в таблице 1 в US 2015/0210769 или в таблице 6 в данном документе или кодируемую нуклеотидной последовательностью, показанной в таблице 6. В одном варианте осуществления одна или несколько CDR (или в совокупности все CDR) имеют одно, два, три, четыре, пять, шесть или больше изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в таблице 6 или кодируемой нуклеотидной последовательностью, показанной в таблице 6.
В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три CDR (или в совокупности все CDR) вариабельной области легкой цепи, которые содержат аминокислотную последовательность, показанную в таблице 1 в US 2015/0210769 или в таблице 6 в данном документе или кодируемую нуклеотидной последовательностью, показанной в таблице 6. В одном варианте осуществления одна или несколько CDR (или в совокупности все CDR) имеют одно, два, три, четыре, пять, шесть или больше изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в таблице 6 или кодируемой нуклеотидной последовательностью, показанной в таблице 6. В некоторых вариантах осуществления молекула антитела к PD–1 содержит замену в CDR легкой цепи, например, одну или несколько замен в CDR1, CDR2 и/или CDR3 легкой цепи. В одном варианте осуществления молекула антитела к PD–1 содержит замену в CDR3 легкой цепи в положении 102 вариабельной области легкой цепи, например, замену цистеина тирозином или цистеина сериновым остатком в положении 102 вариабельной области легкой цепи согласно таблице 6 (например, SEQ ID NO: 152 или 162 в случае мышиной или химерной немодифицированной или любой из SEQ ID NOs: 168, 176, 180, 188, 192, 196, 200, 204, 208, или 212 в случае модифицированной последовательности).
В другом варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR (или в совокупности все CDR) вариабельной области тяжелой и легкой цепей, которые содержат аминокислотную последовательность, показанную в таблице 1 в US 2015/0210769 или в таблице 6 в данном документе или кодируемую нуклеотидной последовательностью, показанной в таблице 6. В одном варианте осуществления одна или несколько CDR (или в совокупности все CDR) имеют одно, два, три, четыре, пять, шесть или больше изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в таблице 6 или кодируемой нуклеотидной последовательностью, показанной в таблице 6.
В одном варианте осуществления молекула антитела к PD–1 содержит:
(a) вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 140, аминокислотную последовательность VHCDR2 под SEQ ID NO: 141 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 149, аминокислотную последовательность VLCDR2 под SEQ ID NO: 150 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 167, каждая из которых раскрыта в таблице 1 в US 2015/0210769 или в таблице 6 в данном документе;
(b) VH, содержащую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 137; аминокислотную последовательность VHCDR2 под SEQ ID NO: 138 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 146, аминокислотную последовательность VLCDR2 под SEQ ID NO: 147 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 166, каждая из которых раскрыта в таблице 1 в US 2015/0210769 или в таблице 6 в данном документе;
(c) VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 286, аминокислотную последовательность VHCDR2 под SEQ ID NO: 141 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 149, аминокислотную последовательность VLCDR2 под SEQ ID NO: 150 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 167, каждая из которых раскрыта в таблице 1 в US 2015/0210769 или в таблице 6 в данном документе; или
(d) VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 286; аминокислотную последовательность VHCDR2 под SEQ ID NO: 138 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 146, аминокислотную последовательность VLCDR2 под SEQ ID NO: 147 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 166, каждая из которых раскрыта в таблице 1 в US 2015/0210769 или в таблице 6 в данном документе.
В комбинациях, представленных ниже в данном документе, в другом варианте осуществления молекула антитела к PD–1 содержит (i) вариабельную область тяжелой цепи (VH), которая содержит аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 137, SEQ ID NO: 140 или SEQ ID NO: 286; аминокислотную последовательность VHCDR2 под SEQ ID NO: 138 или SEQ ID NO: 141 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и (ii) вариабельную область легкой цепи (VL), которая содержит аминокислотную последовательность VLCDR1 под SEQ ID NO: 146 или SEQ ID NO: 149, аминокислотную последовательность VLCDR2 под SEQ ID NO: 147 или SEQ ID NO: 150 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 166 или SEQ ID NO: 167, каждая из которых раскрыта в таблице 1 в US 2015/0210769 или в таблице 6 в данном документе.
В вариантах осуществления ингибитор PD–1, например, молекула антитела к PD–1, представляет собой PDR–001, который содержит аминокислотные последовательности вариабельной области легкой цепи и вариабельной области тяжелой цепи BAP049–Clone–E, описанные в таблице 6. В одном варианте осуществления молекула антитела к PD–1 содержит вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 204.
В некоторых вариантах осуществления ингибитор PD–1 выбран из ниволумаба, пембролизумаба, пидилизумаба, AMP–514, AMP–224 или антитела к PD–1, описанного в US 8609089, US 2010028330 и/или US 20120114649, каждая из которых включена в данный документ посредством ссылки во всей своей полноте.
В одном варианте осуществления ингибитор PD–1 представляет собой пембролизумаб. В одном варианте осуществления молекула антитела содержит:
(i) вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 503, аминокислотную последовательность VHCDR2 под SEQ ID NO: 504 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 505; и
(ii) вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 500, аминокислотную последовательность VLCDR2 под SEQ ID NO: 501 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 502,
или аминокислотную последовательность, идентичную им на по меньшей мере 85%, 90%, 95% или больше.
Клетки, экспрессирующие CAR
В данном документе представлены клетки, например, иммунные эффекторные клетки, которые экспрессируют химерный антигенный рецептор (CAR), нацеливающийся на антиген, например, специфично связывающийся с ним (например, CD19), для применения в любых способах или композициях, описываемых в данном документе. CAR, который специфично связывается с антигеном X, также называется в данном документе "CAR для X". Например, CAR, который специфично связывается с CD19, также называется в данном документе "CAR для CD19". CAR (например, CAR для CD19), экспрессируемый клеткой, экспрессирующей CAR (например, клеткой, экспрессирующей CAR для CD19), описываемой в данном документе, содержит антигенсвязывающий домен (например, CD19–связывающий домен), трансмембранный домен и внутриклеточный сигнальный домен. В одном варианте осуществления внутриклеточный сигнальный домен содержит костимулирующий домен и/или первичный сигнальный домен.
В вариантах осуществления молекула CAR содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен (например, внутриклеточный сигнальный домен, содержащий костимулирующий домен и/или первичный сигнальный домен).
В одном варианте осуществления молекула CAR содержит антигенсвязывающий домен, который способен связывать антиген, описываемый в данном документе, например, опухолевый антиген, например, выбранный из одного или нескольких из следующих: CD19; CD123; CD22; CD30; CD171; CS–1 (также называемого CD2 подгруппы 1, CRACC, SLAMF7, CD319, и 19A24); лектиноподобной молекулы 1 С–типа (CLL–1 или CLECL1); CD33; варианта III рецептора эпидермального фактора роста (EGFRvIII); ганглиозида G2 (GD2); ганглиозида GD3 (aNeu5Ac(2–8)aNeu5Ac(2–3)bDGalp(1–4)bDGlcp(1–1)Cer); антигена созревания В–клеток (BCMA), являющегося представителем семейства рецепторов TNF; Tn–антигена ((Tn–Ag) или (GalNAcα–Ser/Thr)); простатического специфического мембранного антигена (PSMA); орфанного рецептора 1, подобного тирозинкиназному рецептору (ROR1); Fms–подобной тирозинкиназы 3 (FLT3); опухолеассоциированного гликопротеина 72 (TAG72); CD38; CD44v6; раково–эмбрионального антигена (СЕА); молекулы адгезии эпителиальных клеток (ЕРСАМ); В7Н3 (CD276); KIT (CD117); альфа–2–субъединицы рецептора интерлейкина–13 (IL–13Ra2 или CD213A2); мезотелина; альфа–субъединицы рецептора интерлейкина 11 (IL–11Ra); антигена стволовых клеток предстательной железы (PSCA); сериновой протеазы 21 (тестизина или PRSS21); рецептора 2 фактора роста эндотелия сосудов (VEGFR2); антигена системы Льюис (Y); CD24; рецептора фактора роста тромбоцитов бета–типа (PDGFR–бета); стадиеспецифического эмбрионального антигена 4 (SSEA–4); CD20; рецептора фолиевой кислоты альфа; рецепторной тирозинпротеинкиназы ERBB2 (Her2/neu); муцина 1, ассоциированного с клеточной поверхностью (MUC1); рецептора эпидермального фактора роста (EGFR); молекулы адгезии нервных клеток (NCAM); простазы; простатической кислой фосфатазы (РАР); мутантного фактора элонгации 2 (ELF2M); эфрина В2; белка активации фибробластов альфа (FAP); рецептора инсулиноподобного фактора роста 1 (рецептора IGF–I), карбоангидразы IX (CAIX); субъединицы бета–типа 9 протеасомы (просомы, мультикаталитической протеазы) (LMP2); гликопротеина 100 (gp100); онкогенного слитого белка, состоящего из кластерного региона точечных разрывов (BCR) и гомолога 1 онкогена вируса лейкоза мышей Абельсона (Abl) (bcr–abl); тирозиназы; рецептора 2 эфрина А–типа (EphA2); фукозил–GM1; молекулы адгезии, представляющей собой сиалилированный антиген системы Льюис (sLe); ганглиозида GM3 (aNeu5Ac(2–3)bDGalp(1–4)bDGlcp(1–1)Cer); трансглутаминазы 5 (TGS5); высокомолекулярного антигена, ассоциированного с меланомой (HMWMAA); ганглиозида о–ацетил–GD2 (OAcGD2); рецептора фолиевой кислоты бета; опухолевого эндотелиального маркера 1 (TEM1/CD248); антигена, родственного опухолевому эндотелиальному маркеру 7 (TEM7R); клаудина 6 (CLDN6); рецептора тиреотропного гормона (TSHR); представителя D группы 5 класса С рецепторов, сопряженных с G–белками (GPRC5D); белка, кодируемого открытой рамкой считывания 61 X–хромосомы (CXORF61); CD97; CD179a; киназы анапластической лимфомы (ALK); полисиаловой кислоты; плацентоспецифического белка 1 (PLAC1); гексасахаридной части гликоцерамида globoH (GloboH); дифференцировочного антигена молочной железы (NY–BR–1); уроплакина 2 (UPK2); клеточного рецептора 1 вируса гепатита A (HAVCR1); бета–3–адренорецептора (ADRB3); паннексина 3 (PANX3); рецептора 20, сопряженного с G–белком (GPR20); антигена локуса K9 комплекса лимфоцитарных антигенов 6 (LY6K); обонятельного рецептора 51Е2 (OR51E2); белка, кодируемого альтернативной рамкой считывания гена TCR–гамма (TARP); белка опухоли Вильмса (WT1); раково–тестикулярного антигена 1 (NY–ESO–1); раково–тестикулярного антигена 2 (LAGE–1a); антигена 1, ассоциированного с меланомой (MAGE–A1); белка, кодируемого транслокационным вариантом 6 гена ETS, локализованным в р–плече 12 хромосомы (ETV6–AML); белка сперматозоидов 17 (SPA17); представителя 1А семейства X–антигенов (XAGE1); ангиопоэтин–связывающего рецептора клеточной поверхности 2 (TIE–2); раково–тестикулярного антигена меланомы 1 (MAD–CT–1); раково–тестикулярного антигена меланомы 2 (MAD–CT–2); Fos–родственного антигена 1; опухолевого белка р53 (р53); мутантного р53; простеина; сурвивина; теломеразы; опухолевого антигена 1 карциномы предстательной железы (РСТА–1 или галектина 8), антигена меланомы 1, распознаваемого Т–клетками (MelanA или MART1); мутантного антигена саркомы крыс (Ras); обратной транскриптазы теломеразы человека (hTERT); антигенов саркомы с точечными разрывами при транслокации; меланомного ингибитора апоптоза (ML–IAP); ERG (продукта слитого гена трансмембранной сериновой протеазы 2 (TMPRSS2) и ETS); N–ацетилглюкозаминилтрансферазы V (NA17); белка с парным box–доменом Рах–3 (РАХЗ); андрогенового рецептора; циклина В1; нейробластомного гомолога онкогена вируса миелоцитоматоза птиц v–myc (MYCN); представителя С семейства гомологов Ras (RhoC); белка 2, родственного тирозиназе (TRP–2); цитохрома Р450 1В1 (CYP1B1); антигена, подобного CCCTC–связывающему фактору (белку с "цинковыми пальцами") (BORIS или Brother of the Regulator of Imprinted Sites), антигена плоскоклеточной карциномы 3, распознаваемого Т–клетками (SART3); белка с парным box–доменом Рах–5 (РАХ5); проакрозин–связывающего белка sp32 (OY–TES1); лимфоцитоспецифической протеинтирозинкиназы (LCK); якорного белка 4 киназы A (AKAP–4); антигена 2 синовиальной саркомы с точечным разрывом в X–хромосоме (SSX2); рецептора конечных продуктов гликирования (RAGE–1); почечного убиквитарного белка 1 (RU1); почечного убиквитарного белка 2 (RU2); легумаина; Е6 вируса папилломы человека (Е6 HPV); Е7 вируса папилломы человека (Е7 HPV); кишечной карбоксилэстеразы; мутантного белка теплового шока 70–2 (mut–hsp70–2); CD79a; CD79b; CD72; иммуноглобулиноподобного рецептора 1, ассоциированного с лейкоцитами (LAIR1); рецептора Fc–фрагмента IgA (FCAR или CD89); представителя 2 подсемейства А лейкоцитарных иммуноглобулиноподобных рецепторов (LILRA2); представителя f семейства белков, подобных молекулам CD300 (CD300LF); представителя А семейства 12 лектиновых доменов С–типа (CLEC12A); антигена 2 стромальных клеток костного мозга (BST2); антигена 2, подобного муциноподобному рецептору гормона, содержащего EGF–подобный модуль (EMR2); лимфоцитарного антигена 75 (LY75); глипикана 3 (GPC3); антигена 5, подобного Fc–рецептору (FCRL5); и полипептида 1, подобного иммуноглобулину лямбда (IGLL1).
В одном варианте осуществления антигенсвязывающий домен CAR связывается с B–клеточным антигеном, например, CD10, CD19, CD20, CD22, CD34, CD123, FLT–3, ROR1, CD79b, CD179b, и/или CD79a.
В вариантах осуществления антигенсвязывающий домен CAR связывается с CD123.
В вариантах осуществления антигенсвязывающий домен CAR связывается с CD19.
В других вариантах осуществления антигенсвязывающий домен CAR связывается с BCMA.
В вариантах осуществления антигенсвязывающий домен CAR связывается с CLL.
Антигенсвязывающий домен для CD19
В одном варианте осуществления CD19–связывающий домен содержит область 1, определяющую комплементарность, тяжелой цепи (CDR1 HC), область 2, определяющую комплементарность, тяжелой цепи (CDR2 HC) и область 3, определяющую комплементарность, тяжелой цепи (CDR3 HC) с любой аминокислотной последовательностью тяжелой цепи CD19–связывающего домена, указанной в таблице 2 или 3; а также область 1, определяющую комплементарность, легкой цепи (CDR1 LC), область 2, определяющую комплементарность, легкой цепи (CDR2 LC) и область 3, определяющую комплементарность, легкой цепи (CDR3 LC) с любой аминокислотной последовательностью легкой цепи CD19–связывающего домена, указанной в таблице 2 или 3. В одном варианте осуществления CD19–связывающий домен содержит CDR1 HC, CDR2 HC и CDR3 HC согласно аминокислотным последовательностям CDR НC из таблицы 4 и CDR1 LC, CDR2 LC и CDR3 LC согласно аминокислотным последовательностям CDR LC из таблицы 5.
В одном варианте осуществления CD19–связывающий домен содержит аминокислотную последовательность (например, состоит из нее), выбранную из группы, состоящей из SEQ ID NO: 109, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 110, SEQ ID NO: 112, или SEQ ID NO: 115. В одном варианте осуществления CD19–связывающий домен содержит аминокислотную последовательность (например, состоит из нее), имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций (например, замен, например, консервативных замен), любой из SEQ ID NO: 109, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 110, SEQ ID NO: 112, или SEQ ID NO: 115.. В одном варианте осуществления CD19–связывающий домен содержит аминокислотную последовательность (например, состоит из нее), на 95–99% идентичную аминокислотной последовательности под любым из SEQ ID NO: 109, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 110, SEQ ID NO: 112, или SEQ ID NO: 115.
Дополнительные домены молекулы CAR
В одном варианте осуществления CAR, например, CAR для CD19, содержит трансмембранный домен, который включает в себя трансмембранный домен белка, например, белка, описываемого в данном документе, например, выбранного из группы, состоящей из альфа–, бета– или дзета–цепи T–клеточного рецептора, CD28, CD3–эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154.. В одном варианте осуществления трансмембранный домен содержит последовательность под SEQ ID NO: 6. В одном варианте осуществления трансмембранный домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций, по отношению к аминокислотной последовательности под SEQ ID NO: 6, или последовательность, на 95–99% идентичную аминокислотной последовательности под SEQ ID NO: 6. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая трансмембранный домен, включает в себя нуклеотидную последовательность под SEQ ID NO: 17 или последовательность, на по меньшей мере 95% идентичную ей (например, на 95–99% идентичную).
В одном варианте осуществления антигенсвязывающий домен (например, CD19–связывающий домен) соединен с трансмембранным доменом с помощью шарнирной области, например, шарнирной области, описываемой в данном документе. В одном варианте осуществления кодируемая шарнирная область содержит SEQ ID NO: 2 или последовательность, на по меньшей мере 95% идентичную ей (например, на 95–99% идентичную). В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая шарнирную область, включает в себя нуклеотидную последовательность под SEQ ID NO: 13 или последовательность, на по меньшей мере 95% идентичную ей (например, на 95–99% идентичную).
В одном варианте осуществления выделенная молекула нуклеиновой кислоты дополнительно содержит последовательность, кодирующую костимулирующий домен, например, костимулирующий домен, описываемый в данном документе. В вариантах осуществления внутриклеточный сигнальный домен содержит костимулирующий домен. В вариантах осуществления внутриклеточный сигнальный домен содержит первичный сигнальный домен. В вариантах осуществления внутриклеточный сигнальный домен содержит костимулирующий домен и первичный сигнальный домен.
В одном варианте осуществления костимулирующий домен представляет собой функциональный сигнальный домен из белка, например, описываемого в данном документе, например, выбранного из группы, состоящей из молекулы MHC I класса, белкового рецептора TNF, иммуноглобулиноподобного белка, рецептора цитокина, интегрина, сигнальной молекулы активации лимфоцитов (белка SLAM), активирующего рецептора NK–клеток, BTLA, лиганда Toll–подобного рецептора, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM–1, LFA–1 (CD11a/CD18), 4–1BB (CD137), B7–H3, CDS, ICAM–1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8–альфа, CD8–бета, IL2R–бета, IL2R–гамма, IL7R–альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA–6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA–1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA–1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB–A, Ly108), SLAM (SLAMF1, CD150, IPO–3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP–76, PAG/Cbp, CD19a, и лиганда, который специфично связывается с CD83.
В одном варианте осуществления костимулирующий домен 4–1BB содержит аминокислотную последовательность под SEQ ID NO: 7. В одном варианте осуществления кодируемый костимулирующий домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций, по отношению к аминокислотной последовательности под SEQ ID NO: 7, или последовательность, на по меньшей мере 95% идентичную (например, на 95–99% идентичную) аминокислотной последовательности под SEQ ID NO: 7. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая костимулирующий домен, включает в себя нуклеотидную последовательность под SEQ ID NO: 18 или последовательность, на по меньшей мере 95% идентичную ей (например, на 95–99% идентичную). В другом варианте осуществления костимулирующий домен CD28 содержит аминокислотную последовательность под SEQ ID NO: 36. В одном варианте осуществления костимулирующий домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций, по отношению к аминокислотной последовательности под SEQ ID NO: 36, или последовательность, на 95–99% идентичную аминокислотной последовательности под SEQ ID NO: 36. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая костимулирующий домен CD28, включает в себя нуклеотидную последовательность под SEQ ID NO: 37 или последовательность, на по меньшей мере 95% идентичную ей (например, на 95–99% идентичную). В другом варианте осуществления костимулирующий домен CD27 содержит аминокислотную последовательность под SEQ ID NO: 8. В одном варианте осуществления костимулирующий домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций, по отношению к аминокислотной последовательности под SEQ ID NO: 8, или последовательность, на по меньшей мере 95% идентичную (например, на 95–99% идентичную) аминокислотной последовательности под SEQ ID NO: 8. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая костимулирующий домен CD27, включает в себя нуклеотидную последовательность под SEQ ID NO: 19 или последовательность, на по меньшей мере 95% идентичную ей (например, на 95–99% идентичную). В другом варианте осуществления костимулирующий домен ICOS содержит аминокислотную последовательность под SEQ ID NO: 38. В одном варианте осуществления костимулирующий домен ICOS содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций, по отношению к аминокислотной последовательности под SEQ ID NO: 38, или последовательность, на 95–99% идентичную аминокислотной последовательности под SEQ ID NO: 38. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая костимулирующий домен ICOS, включает в себя нуклеотидную последовательность под SEQ ID NO: 44 или последовательность, на по меньшей мере 95% идентичную ей (например, на 95–99% идентичную). В вариантах осуществления костимулирующий домен включает в себя мутантный костимулирующий домен ICOS (например, с мутацией по типу замены Y на F), содержащий аминокислотную последовательность под SEQ ID NO: 43.
В некоторых вариантах осуществления первичный сигнальный домен включает в себя функциональный сигнальный домен CD3–дзета. В вариантах осуществления функциональный сигнальный домен CD3–дзета содержит аминокислотную последовательность под SEQ ID NO: 9 (мутантный CD3–дзета) или SEQ ID NO: 10 (CD3–дзета человека дикого типа), или последовательность, на по меньшей мере 95% идентичную ей (например, на 95–99% идентичную).
В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4–1BB и/или функциональный сигнальный домен CD3–дзета. В одном варианте осуществления внутриклеточный сигнальный домен 4–1BB содержит последовательность под SEQ ID NO: 7 и/или аминокислотную последовательность CD3–дзета под SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций, по отношению к аминокислотной последовательности под SEQ ID NO: 7 и/или аминокислотной последовательности под SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность, на по меньшей мере 95% идентичную (например, на 95–99% идентичную) аминокислотной последовательности под SEQ ID NO: 7 и/или аминокислотной последовательности под SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность под SEQ ID NO: 7 и последовательность под SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, образующие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде одной полипептидной цепи. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен, включает в себя нуклеотидную последовательность под SEQ ID NO: 18 или последовательность, на по меньшей мере 95% идентичную ей (например, на 95–99% идентичную), и/или нуклеотидную последовательность, кодирующую CD3–дзета, под SEQ ID NO: 20 или SEQ ID NO: 21 или последовательность, на по меньшей мере 95% идентичную ей (например, на 95–99% идентичную).
В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен CD27 и/или функциональный сигнальный домен CD3–дзета. В одном варианте осуществления кодируемый внутриклеточный сигнальный домен из CD27 содержит аминокислотную последовательность под SEQ ID NO: 8 и/или аминокислотную последовательность CD3–дзета под SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций, по отношению к аминокислотной последовательности под SEQ ID NO: 8 и/или аминокислотной последовательности под SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность, на по меньшей мере 95% идентичную (например, на 95–99% идентичную) аминокислотной последовательности под SEQ ID NO: 8 и/или аминокислотной последовательности под SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность под SEQ ID NO: 8 и последовательность под SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, образующие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде одной полипептидной цепи. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен CD27, включает в себя нуклеотидную последовательность под SEQ ID NO: 19 или последовательность, на по меньшей мере 95% идентичную ей (например, на 95–99% идентичную), и/или нуклеотидную последовательность, кодирующую CD3–дзета, под SEQ ID NO: 20 или SEQ ID NO: 21 или последовательность, на по меньшей мере 95% идентичную ей (например, на 95–99% идентичную).
В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен CD28 и/или функциональный сигнальный домен CD3–дзета. В одном варианте осуществления внутриклеточный сигнальный домен CD28 содержит аминокислотную последовательность под SEQ ID NO: 36 и/или аминокислотную последовательность CD3–дзета под SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций, по отношению к аминокислотной последовательности под SEQ ID NO: 36 и/или аминокислотной последовательности под SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность, на по меньшей мере 95% идентичную (например, на 95–99% идентичную) аминокислотной последовательности под SEQ ID NO: 36 и/или аминокислотной последовательности под SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность под SEQ ID NO: 36 и последовательность под SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, образующие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде одной полипептидной цепи. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен CD28, включает в себя нуклеотидную последовательность под SEQ ID NO: 37 или последовательность, на по меньшей мере 95% идентичную ей (например, на 95–99% идентичную), и/или нуклеотидную последовательность, кодирующую CD3–дзета, под SEQ ID NO: 20 или SEQ ID NO: 21 или последовательность, на по меньшей мере 95% идентичную ей (например, на 95–99% идентичную).
В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен ICOS и/или функциональный сигнальный домен CD3–дзета. В одном варианте осуществления внутриклеточный сигнальный домен ICOS содержит аминокислотную последовательность под SEQ ID NO: 38 и/или аминокислотную последовательность CD3–дзета под SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций, по отношению к аминокислотной последовательности под SEQ ID NO: 38 и/или аминокислотной последовательности под SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность, на по меньшей мере 95% идентичную (например, на 95–99% идентичную) аминокислотной последовательности под SEQ ID NO: 38 и/или аминокислотной последовательности под SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность под SEQ ID NO: 38 и последовательность под SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, образующие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде одной полипептидной цепи. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен ICOS, включает в себя нуклеотидную последовательность под SEQ ID NO: 44 или последовательность, на по меньшей мере 95% идентичную ей (например, на 95–99% идентичную), и/или нуклеотидную последовательность, кодирующую CD3–дзета, под SEQ ID NO: 20 или SEQ ID NO: 21 или последовательность, на по меньшей мере 95% идентичную ей (например, на 95–99% идентичную).
В одном варианте осуществления CAR, например, CAR для CD19, дополнительно содержит лидерную последовательность, включающую в себя аминокислотную последовательность под SEQ ID NO: 1.
Иллюстративные молекулы CAR
В одном варианте осуществления CAR для CD19 содержит аминокислотную последовательность под любым из SEQ ID NO: 108; SEQ ID NO: 93; SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 111, SEQ ID NO: 114, или SEQ ID NO: 116.. В одном варианте осуществления CAR для CD19 содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций, по сравнению с любой из SEQ ID NO: 108; SEQ ID NO: 93; SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 111, SEQ ID NO: 114, или SEQ ID NO: 116.. В одном варианте осуществления CAR для CD19 содержит аминокислотную последовательность, на по меньшей мере 95% идентичную (например, на 95–99% идентичную) любой из SEQ ID NO: 108; SEQ ID NO: 93; SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 111, SEQ ID NO: 114, или SEQ ID NO: 116..
В варианте осуществления молекула CAR включает в себя CAR для CD123, описываемый в данном документе, например, CAR для CD123, описанный в US2014/0322212A1 или US2016/0068601A1, обе из которых включены в данный документ посредством ссылки. В вариантах осуществления CAR для CD123 содержит аминокислотную или имеет нуклеотидную последовательность, показанную в US2014/0322212A1 или US2016/0068601A1, обе из которых включены в данный документ посредством ссылки.
В вариантах осуществления молекула CAR включает в себя молекулу CAR для CD19, описываемую в данном документе, например, молекулу CAR для CD19, описанную в US–2015–0283178–A1, например, CTL019. В вариантах осуществления CAR для CD19 содержит аминокислотную или имеет нуклеотидную последовательность, показанную в US–2015–0283178–A1, включенной в данный документ посредством ссылки.
В одном варианте осуществления молекула CAR включает в себя молекулу CAR для BCMA, описываемую в данном документе, например, CAR для BCMA, описанный в US–2016–0046724–A1. В вариантах осуществления CAR для BCMA содержит аминокислотную или имеет нуклеотидную последовательность, показанную в US–2016–0046724–A1, включенной в данный документ посредством ссылки.
В варианте осуществления молекула CAR включает в себя CAR для CLL1, описываемый в данном документе, например, CAR для CLL1, описанный в US2016/0051651A1, включенной в данный документ посредством ссылки. В вариантах осуществления CAR для CLL1 содержит аминокислотную или имеет нуклеотидную последовательность, показанную в US2016/0051651A1, включенной в данный документ посредством ссылки.
В варианте осуществления молекула CAR включает в себя CAR для CD33, описываемый в данном документе, например, CAR для CD33, описанный в US2016/0096892A1, включенной в данный документ посредством ссылки. В вариантах осуществления CAR для CD33 содержит аминокислотную или имеет нуклеотидную последовательность, показанную в US2016/0096892A1, включенной в данный документ посредством ссылки.
В варианте осуществления молекула CAR включает в себя молекулу CAR для EGFRvIII, описываемую в данном документе, например, CAR для EGFRvIII, описанный в US2014/0322275A1, включенной в данный документ посредством ссылки. В вариантах осуществления CAR для EGFRvIII содержит аминокислотную или имеет нуклеотидную последовательность, показанную в US2014/0322275A1, включенной в данный документ посредством ссылки.
В варианте осуществления молекула CAR включает в себя CAR для мезотелина, описываемый в данном документе, например, CAR для мезотелина, описанный в WO 2015/090230, включенной в данный документ посредством ссылки. В вариантах осуществления CAR для мезотелина содержит аминокислотную или имеет нуклеотидную последовательность, показанную в WO 2015/090230, включенной в данный документ посредством ссылки.
В вариантах осуществления любых способов и композиций, описываемых в данном документе, клетка, содержащая CAR, содержит нуклеиновую кислоту, кодирующую CAR.
В одном варианте осуществления нуклеиновая кислота, кодирующая CAR, представляет собой лентивирусный вектор. В одном варианте осуществления нуклеиновую кислоту, кодирующую CAR, вводят в клетки посредством лентивирусной трансдукции. В одном варианте осуществления нуклеиновая кислота, кодирующая CAR, представляет собой РНК, например, РНК, транскрибированную in vitro. В одном варианте осуществления нуклеиновую кислоту, кодирующую CAR, вводят в клетки посредством электропорации.
В вариантах осуществления любых способов и композиций, описываемых в данном документе, клетка представляет собой T–клетку или NK–клетку. В одном варианте осуществления T–клетка представляет собой аутологичную или аллогенную Т–клетку.
В одном варианте осуществления способ дополнительно включает введение дополнительного терапевтического средства для лечения заболевания, описываемого в данном документе, например, противоракового терапевтического средства. В вариантах осуществления способ дополнительно включает введение противолимфомного средства, например, описываемого в данном документе, например, до введения, параллельно с введением или после введения клетки, экспрессирующей CAR (например, клетки, экспрессирующей CAR для CD19), и/или ингибитора PD–1, описываемого в данном документе. В вариантах осуществления противолимфомное средство включает в себя одно или несколько средств химиотерапии, комбинацию средств химиотерапии, средство лучевой терапии или комбинацию средств химиотерапии и лучевой терапии, в том числе без ограничения мелфалан, циклофосфамид, флударабин, бендамустин и циклофосфамид в комбинации со средством лучевой терапии.
В вариантах осуществления любых способов и композиций, описываемых в данном документе, заболевание (например, рак), например, заболевание, ассоциированное с экспрессией CD19, представляет собой рак. В одном варианте осуществления рак представляет собой гематологический рак. В вариантах осуществления гематологический рак выбран из одного или нескольких из B–клеточного острого лимфобластного лейкоза (BALL), Т–клеточного острого лимфобластного лейкоза (TALL), мелкоклеточной лимфоцитарной лимфомы (SLL), острого лимфобластного лейкоза (ALL), хронического миелогенного лейкоза (CML), хронического лимфоцитарного лейкоза (CLL), мантийноклеточной лимфомы (MCL), B–клеточного пролимфоцитарного лейкоза, бластического новообразования из плазмацитоидных дендритных клеток, лимфомы Беркитта, диффузной крупноклеточной В–клеточной лимфомы, фолликулярной лимфомы, волосатоклеточного лейкоза, мелкоклеточной или крупноклеточной фолликулярной лимфомы, злокачественных лимфопролиферативных состояний, лимфомы MALT, лимфомы из клеток маргинальной зоны, множественной миеломы, миелодисплазии и миелодиспластического синдрома, неходжкинской лимфомы, лимфомы Ходжкина, плазмобластной лимфомы, новообразования из плазмацитоидных дендритных клеток или макроглобулинемии Вальденстрема. В вариантах осуществления гематологический рак представляет собой лейкоз, например, острый лейкоз или хронический лейкоз. В других вариантах осуществления гематологический рак представляет собой лимфому, например, неходжкинскую лимфому или лимфому Ходжкина. В вариантах осуществления неходжкинская лимфома представляет собой лимфому Беркитта, хронический лимфоцитарный лейкоз/мелкоклеточную лимфоцитарную лимфому (CLL/SLL), диффузную крупноклеточную В–клеточную лимфому (DLBCL), фолликулярную лимфому, иммунобластную крупноклеточную лимфому, B–лимфобластную лимфому из клеток–предшественников и лимфому из клеток мантийной зоны, фунгоидную гранулему, анапластическую крупноклеточную лимфому или Т–лимфобластную лимфому из клеток–предшественников.
В одном варианте осуществления рак характеризуется экспрессией CD19, например, характеризуется экспрессией CD19. В других вариантах осуществления рак представляет собой рецидивирующий или резистентный B–ALL. В одном варианте осуществления рак представляет собой рецидивирующий или резистентный B–ALL с вовлечением лимфатических узлов, например, с лимфоматозным заболеванием. В других вариантах осуществления рак представляет собой DLBCL, например, рецидивирующую или резистентную DLBCL.
В некоторых вариантах осуществления средство терапии CAR, например, средство терапии CAR для CD19, вводят в комбинации с ингибитором PD–1, например, ингибитором PD–1, описываемым в данном документе, субъекту, имеющему лимфому Ходжкина (HL), например, рецидивирующую или резистентную HL. В варианте осуществления средство терапии CAR вводят субъекту, имеющему рецидивирующую и/или резистентную HL, после ингибитора PD–1. В другом варианте осуществления ингибитор PD–1 вводят субъекту, имеющему рецидивирующую и/или резистентную HL, после средства терапии CAR, например, описываемого в данном документе. В другом варианте осуществления введение ингибитора PD–1 начинают через 20 дней или меньше после введения средства терапии CAR, например, описываемого в данном документе. В некоторых вариантах осуществления клетка, экспрессирующая CAR для CD19, представляет собой клетку, в которую была введена РНК, кодирующая CAR для CD19, например, посредством электропорации. В вариантах осуществления субъект содержит CD19–отрицательные и CD19–положительные раковые клетки. В вариантах осуществления субъект получает лечение 6 дозами клеток, экспрессирующих CAR, например, в течение 2 недель. В вариантах осуществления доза содержит 1×105–5×106 или 8×105–1,5×106 клеток, экспрессирующих CAR для CD19, на дозу, например, для субъектов < 80 кг, или 1×108 (± 50%) или 1×108 (± 20%) клеток, экспрессирующих CAR для CD19, на дозу, например, для субъектов > 80 кг. В вариантах осуществления доза содержит приблизительно 1×105–1,5×106 клеток, экспрессирующих CAR для CD19, на дозу. В вариантах осуществления у субъекта не проявляется CRS или не проявляется тяжелый CRS. В вариантах осуществления у субъекта проявляется полный ответ, частичный ответ или стабилизация заболевания.
Субъекты
В одном варианте осуществления субъектом, например, субъектом, от которого получают иммунные клетки, и/или субъектом, подлежащим лечению, является человек, например, пациент с раком. В некоторых вариантах осуществления субъект имеет возраст 18 лет или меньше (например, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1 год или меньше (например, 12 месяцев, 6 месяцев, 3 месяца или меньше)). В одном варианте осуществления субъектом является педиатрический пациент с раком.
В других вариантах осуществления субъектом является взрослый человек, например, субъект старше 18 лет (например, старше 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, или больше лет). В одном варианте осуществления субъектом является взрослый пациент с раком.
В некоторых вариантах осуществления субъект имеет заболевание, ассоциированное с экспрессией опухолеассоциированного или ассоциированного с раком антигена, например, заболевание, описываемое в данном документе. В одном варианте осуществления субъект имеет рак, например, рак, описываемый в данном документе.
В одном варианте осуществления субъект имеет рак, который выбран из гематологического рака, солидной опухоли или их метастатического очага. Иллюстративные формы рака включают в себя без ограничения B–клеточный острый лимфобластный лейкоз (B–ALL), Т–клеточный острый лимфобластный лейкоз (T–ALL), острый лимфобластный лейкоз (ALL), хронический миелогенный лейкоз (CML), хронический лимфоцитарный лейкоз (CLL), B–клеточный промиелоцитарный лейкоз, бластическое новообразование из плазмацитоидных дендритных клеток, лимфому Беркитта, диффузную крупноклеточную В–клеточную лимфому (DLBCL), фолликулярную лимфому, волосатоклеточный лейкоз, мелкоклеточную или крупноклеточную фолликулярную лимфому, злокачественные лимфопролиферативные состояния, лимфому MALT, мантийноклеточную лимфому (MCL), лимфому из клеток маргинальной зоны, множественную миелому, миелодисплазию и миелодиспластический синдром, неходжкинскую лимфому (NHL), лимфому Ходжкина (HL), плазмобластную лимфому, новообразование из плазмацитоидных дендритных клеток и макроглобулинемию Вальденстрема. В одном варианте осуществления рак представляет собой ALL. В другом варианте осуществления рак представляет собой CLL. В одном варианте осуществления рак представляет собой DLBCL, например, рецидивирующую или резистентную DLBCL.
В вариантах осуществления субъект имеет лейкоз, например, ALL (например, B–ALL). В вариантах осуществления субъект имеет лейкоз, например, ALL, и является педиатрическим пациентом, например, в возрасте 18 лет или моложе (например, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1 года или моложе (например, 12 месяцев, 6 месяцев, 3 месяца или меньше)).
В вариантах осуществления субъект имеет лимфому, например, DLBCL. В вариантах осуществления субъект имеет лимфому, например, DLBCL (например, рецидивирующую или резистентную DLBCL), и является взрослым пациентом, например, старше 18 лет (например, старше 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, или больше лет).
В вариантах осуществления субъект имеет (например, у него диагностировано) заболевание (например, рак), описываемое в данном документе, например, заболевание, ассоциированное с экспрессией CD19, например, рак, ассоциированный с экспрессией CD19, описываемый в данном документе. В вариантах осуществления субъект имеет рецидивирующий и/или резистентный рак, например, рецидивирующую или резистентную лимфому, например, CD19+ лимфому. В вариантах осуществления субъект имеет DLBCL, например, CD19+ DLBCL. В вариантах осуществления субъект имеет DLBCL, трансформированную из фолликулярной лимфомы. В вариантах осуществления субъект имеет DLBCL и прогрессирующую лимфому. В вариантах осуществления субъект имеет DLBCL первичного медиастинального происхождения. В вариантах осуществления субъект ранее получал лечение лимфомы, например, DLBCL, и имеет резистентную лимфому, например, резистентную DLBCL.
В вариантах осуществления субъект имеет (например, у него диагностирован) рак с высокой опухолевой нагрузкой, например, до введения первой дозы. В одном варианте осуществления рак представляет собой ALL или CLL. В вариантах осуществления субъект имеет уровни бластных клеток в костном мозге по меньшей мере 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, или 50%, например, по меньшей мере 5%. В вариантах осуществления субъект имеет рак I, II, III или IV стадии. В вариантах осуществления субъект имеет опухолевую массу по меньшей мере 1, 2, 5, 10, 20, 50, 100, 200, 500, или 1000 г, например, в отдельной опухоли или во множестве опухолей.
В вариантах осуществления субъекту вводили средство химиотерапии, например, средство химиотерапии, описываемое в данном документе (например, средство противолимфомной химиотерапии, например, карбоплатин и/или гемцитабин), до введения клетки, экспрессирующей CAR, и/или ингибитора PD–1, описываемых в данном документе. В вариантах осуществления субъекту вводили средство иммунотерапии, например, аллогенный трансплантат костного мозга, до введения клетки, экспрессирующей CAR, и/или ингибитора PD–1, описываемых в данном документе.
В вариантах осуществления любых способов и композиций, описываемых в данном документе, субъектом является млекопитающее, например, человек. В одном варианте осуществления у субъекта экспрессируется PD–1. В одном варианте осуществления раковая клетка или клетка в непосредственной близости от раковой клетки, например, клетка, ассоциированная с раком, у субъекта экспрессирует PD–1 или PL–L1. В варианте осуществления клетка, ассоциированная с раком, представляет собой противоопухолевую иммунную клетку, например, лимфоцит, инфильтрирующий опухоль (TIL).
В одном варианте осуществления клетка, экспрессирующая CAR, например, клетка, экспрессирующая CAR для CD19, описываемая в данном документе, экспрессирует PD–1.
Если не определено иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понятно среднему специалисту в области техники, к которой относится настоящее изобретение. Хотя при осуществлении на практике и тестировании настоящего изобретения могут применяться способы и материалы, подобные или эквивалентные описываемым в данном документе, ниже описываются подходящие способы и материалы. Все публикации, заявки на патенты, патенты и другие литературные источники, упомянутые в данном документе, включены посредством ссылки во всей своей полноте. Кроме того, материалы, способы и примеры являются исключительно иллюстративными и не предполагаются как ограничивающие. Заголовки, подзаголовки или пронумерованные или обозначенные буквами элементы, например, (a), (b), (i) и т. д., представлены исключительно для удобства прочтения. Использование заголовков или пронумерованных или обозначенных буквами элементов в данном документе не требует выполнения стадий или элементов в алфавитном порядке или того, чтобы стадии или элементы обязательно были разделены между собой. Другие признаки, цели и преимущества настоящего изобретения будут очевидными из описания и графических материалов, а также из формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1A представляет собой изображение экспрессии PD–L1 (CD274) в клетках диффузной крупноклеточной В–клеточной лимфомы пациента. Биоптат получали до инфузии клеток CART19. Иммуногистохимическое окрашивание проводили антителом к PD–L1 от Cell Signaling (клон E1J2J, № по каталогу 15165BF). Основное изображение получено при увеличении 40x, вставка в верхнем правом углу – при 100x.
Фиг. 1B представляет собой панель CT–сканограмм, демонстрирующих клинический ответ на пембролизумаб через три недели. Изображения слева получены в день инфузии пембролизумаба (день 26), а изображения справа получены через 3 недели после инфузии пембролизумаба (день 45).
Фиг. 2A–2L представляют собой графики, на которых показаны сравнительные исследования по изучению изменений в субпопуляциях Т–клеток в зависимости от инфузии CART19 и инфузии пембролизумаба. (Фиг. 2A) Процентная доля CART19+ CD3+ клеток в периферической крови. Процентная доля CART19+ CD3+ клеток до инфузии CART19 (до), через три дня после инфузии CART19 (день 3), через 7 дней после введения CART19 (день 7), через десять дней после введения CART19 (день 10), через четырнадцать дней после введения CART19 (день 14), через двадцать шесть дней после введения CART19 и через один час после инфузии пембролизумаба (день 26), через двадцать семь дней после введения CART19 и через 1 день после введения пембролизумаба (день 27), через двадцать восемь дней после введения CART19 и через 2 дня после введения пембролизумаба (день 28), а также через сорок пять дней после введения CART19 и через четырнадцать дней после введения пембролизумаба (день 45). (Фиг. 2B) Кратность изменения уровней IL–6 в сыворотке крови от исходного значения. (Фиг. 2C) Процентная доля PD1+ CD4+ клеток и PD1+ CART19+ CD4+ клеток в периферической крови. (Фиг. 2D) Процентная доля PD1+ CD8+ клеток и PD1+ CART19+ CD8+ клеток в периферической крови. (Фиг. 2E) Процентная доля PD1+ Eomes+ CD4+ клеток и PD1+ Eomes+ CART19+ CD4+ клеток в периферической крови. (Фиг. 2F) Процентная доля PD1+ Eomes+ CD8+ клеток и PD1+ Eomes+ CART19+ CD8+ клеток в периферической крови. (Фиг. 2G) Процентная доля гранзим B+ CD4+ клеток и гранзим B+ CART19+ CD4+ клеток в периферической крови. (Фиг. 2H) Процентная доля гранзим B+ CD8+ клеток и гранзим B+ CART19+ CD8+ клеток в периферической крови. (Фиг. 2I) Процентная доля PD1+ CD4+ клеток и PD1+ Eomes+ CD4+ клеток в периферической крови. (Фиг. 2J) Процентная доля PD1+ CD4+ CART19+ клеток и PD1+ Eomes+ CD4+ CART19+ клеток в периферической крови. (Фиг. 2K) Процентная доля PD1+ CD8+ клеток и PD1+ Eomes+ C8+ клеток в периферической крови. (Фиг. 2L) Процентная доля PD1+ CD8+ CART19+ клеток и PD1+ Eomes+ CD8+ CART19+ клеток в периферической крови.
На фиг. 3 показана экспрессия PD–L1, PD1, LAG3 и TIM3 (слева направо в каждой группе из четырех столбцов) в образцах лимфатических узлов (LN) и костного мозга (BM) от пяти пациентов с CR, одного неклассифицированного пациента и шести пациентов с PD.
На фиг. 4A, 4B, 4C и 4D показан анализ проточной цитометрии экспрессии PD1 и CAR19 на Т–клетках по методу проточной цитометрии. Фиг. 4A и 4B представляют собой иллюстративные профили проточной цитометрии, демонстрирующие распределение экспрессии PD–1 и CAR19 на CD4+ Т–клетках от субъектов с полным ответом (CR) или не отвечающих (NR) на терапию CART. Фиг. 4C представляет собой график, на котором показано процентное количество PD1+ клеток в популяции CD4+ Т–клеток от групп субъектов с различными ответами на терапию CART. Фиг. 4D представляет собой график, на котором показано процентное количество PD1+ клеток в популяции CD8+ Т–клеток от групп субъектов с различными ответами на терапию CART.
На фиг. 5A и 5B показано распределение экспрессии PD1 на клетках, экспрессирующих CD4 и CAR19 (фиг. 5A), или клетках, экспрессирующих CD8 и CAR19 (фиг. 5B), от групп субъектов с различными ответами на терапию CART.
На фиг. 6 показан анализ экспрессии PD1, CAR19, LAG3 и TIM3 на Т–клетках от субъектов с полным ответом (CR) или не отвечающих (NR) на терапию CART, по методу проточной цитометрии.
На фиг. 7A и 7B показано распределение экспрессии PD1 и LAG3 (фиг. 7A) или экспрессии PD1 и TIM3 (фиг. 7B) в группах субъектов с различными ответами на терапию CART.
На фиг. 8 показан мультиплексный анализ FIHC с AQUA, демонстрирующий существенное различие между популяциями CD3+/PD–1+ клеток в образцах от пациентов–людей с первичной и вторичной DLBCL.
На фиг. 9 показан анализ AQUA, демонстрирующий различные уровни CD19 (нижняя панель) и PD–L1 (верхняя панель) в первичных и вторичных очагах в образцах с DLBCL. В общей сложности 40 образцов от пациентов–людей с DLBCL, 25 с первичными и 15 со вторичными очагами, подвергали мультиплексному FIHC, а затем анализу AQUA для идентификации уровней экспрессии белков CD19 и PD–L1.
На фиг. 10 показана процентная доля клеток CART19 у пациента из случая 3 после инфузии клеток CART19 в отдельности или после инфузии клеток CART19 с дозой пембролизумаба.
На фиг. 11 показан график вероятности восстановления популяции B–клеток по месяцам после инфузии huCART19 для пациентов, получающих только huCART19 или huCART19 и пембролизумаб.
На фиг. 12 показана процентная доля CART19 у пациента из случая 6, получавшего инфузию CART19 в отдельности (кружки) и после лечения пембролизумабом (квадраты).
На фиг. 13 показана процентная доля CART19 у пациента из случая 6 с CART19 до и после лечения пембролизумабом, объединенная с данными PET–сканирования до и после лечения пембролизумабом.
Фиг. 14 представляет собой график, на котором изображены уровни экспрессии РНК CART19 в периферической крови четырех пациентов, получавших терапию РНК–модифицированными CART19. Выполняли количественную ОТ–ПЦР на клетках, собираемых до и после каждой инфузии (дни 0, 2, 4, 9, 11 и 14).
ПОДРОБНОЕ ОПИСАНИЕ
Определения
Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понятно среднему специалисту в области техники, к которой относится настоящее изобретение.
Форма единственного числа относится к одному или нескольким (т. e. по меньшей мере одному) грамматическим объектам настоящей заявки. В качестве примера, "элемент" означает один элемент или несколько элементов.
Термин "приблизительно" в отношении измеримого значения, такого как количество, временная длительность и т. п., подразумевает охват варьирований на ± 20%, или в некоторых случаях на ± 10%, или в некоторых случаях на ± 5%, или в некоторых случаях на ± 1%, или в некоторых случаях на ± 0,1% от указанного значения, поскольку такие варьирования являются подходящими для осуществления раскрытых способов.
Как используется в данном документе, "вводимый в комбинации" означает, что два (или более) различных средства лечения доставляют субъекту в то время, когда субъект страдает нарушением, например, два или более средства лечения доставляют после того, как у субъекта было диагностировано нарушение, и до того, как нарушение будет излечено или устранено или лечение будет прекращено по другим причинам. В некоторых вариантах осуществления доставка одного средства лечения по–прежнему происходит, когда начинается доставка второго, так что с точки зрения введения имеет место перекрывание. Это иногда упоминается в данном документе как "одновременная" или "параллельная" доставка. В других вариантах осуществления доставка одного средства лечения заканчивается до начала доставки другого средства лечения. В некоторых вариантах осуществления в любом случае вследствие комбинированного введения лечение является более эффективным. Например, второе средство лечения является более эффективным, например, эквивалентный эффект наблюдается при меньшем количестве второго средства лечения, или второе средство лечения снижает интенсивность симптомов в большей степени, чем наблюдалось бы при введении второго средства лечения в отсутствие первого средства лечения, или аналогичная ситуация наблюдается с первым средством лечения. В некоторых вариантах осуществления доставка является такой, при которой снижение интенсивности симптома или другого параметра, связанного с нарушением, является большим, чем то, которое наблюдалось бы при доставке одного средства лечения в отсутствие другого. Эффект двух средств лечения может быть частично аддитивным, полностью аддитивным или превышающим аддитивный. Доставка может являться такой, что эффект от первого доставленного средства лечения все еще можно выявить при доставке второго.
Термин "химерный антигенный рецептор" или, в качестве альтернативы, "CAR" относится к рекомбинантной полипептидной конструкции, содержащей по меньшей мере внеклеточный антигенсвязывающий домен, трансмембранный домен и цитоплазматический сигнальный домен (также называемый в данном документе "внутриклеточным сигнальным доменом"), содержащий функциональный сигнальный домен, полученный из стимулирующей молекулы, определенной ниже. В некоторых вариантах осуществления домены в полипептидной конструкции CAR находятся в одной и той же полипептидной цепи, например, образуют химерный слитый белок. В некоторых вариантах осуществления домены в полипептидной конструкции CAR не являются смежными друг с другом, например, находятся в разных полипептидных цепях, например, как предусмотрено в RCAR, описываемом в данном документе.
В одном аспекте стимулирующая молекула представляет собой дзета–цепь, ассоциированную с Т–клеточным рецепторным комплексом. В одном аспекте цитоплазматический сигнальный домен содержит первичный сигнальный домен (например, первичный сигнальный домен CD3–дзета). В одном аспекте цитоплазматический сигнальный домен дополнительно содержит один или несколько функциональных сигнальных доменов, полученных из по меньшей мере одной костимулирующей молекулы, определенной ниже. В одном аспекте костимулирующая молекула выбрана из 4–1BB (т. е. CD137), CD27, ICOS и/или CD28. В одном аспекте CAR включает в себя химерный слитый белок, содержащий внеклеточный антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий функциональный сигнальный домен, полученный из стимулирующей молекулы. В одном аспекте CAR включает в себя химерный слитый белок, содержащий внеклеточный антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий функциональный сигнальный домен, полученный из костимулирующей молекулы, и функциональный сигнальный домен, полученный из стимулирующей молекулы. В одном аспекте CAR включает в себя химерный слитый белок, содержащий внеклеточный антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий два функциональных сигнальных домена, полученных из одной или нескольких костимулирующих молекул, и функциональный сигнальный домен, полученный из стимулирующей молекулы. В одном аспекте CAR включает в себя химерный слитый белок, содержащий внеклеточный антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий по меньшей мере два функциональных сигнальных домена, полученных из одной или нескольких костимулирующих молекул, и функциональный сигнальный домен, полученный из стимулирующей молекулы. В одном аспекте CAR содержит необязательную лидерную последовательность на амино–конце (N–конце) слитого белка CAR. В одном аспекте CAR дополнительно содержит лидерную последовательность на N–конце внеклеточного антигенсвязывающего домена, где лидерная последовательность необязательно отщепляется от антигенраспознающего домена (например, scFv) в ходе клеточного процессинга и локализации CAR в клеточной мембране.
Термин "сигнальный домен" относится к функциональной части белка, которая действует путем передачи информации внутри клетки для регуляции клеточной активности через определенные сигнальные пути, образуя вторичные мессенджеры или функционируя в качестве эффекторов путем ответа на такие мессенджеры. В некоторых аспектах сигнальный домен CAR, описываемый в данном документе, получен из стимулирующей молекулы или костимулирующей молекулы, описываемой в данном документе, или представляет собой синтезированный или сконструированный сигнальный домен.
Используемый в данном документе термин "CD19" относится к белку кластеру дифференцировки 19, который является антигенной детерминантой, выявляемой на лейкозных клетках–предшественниках. Аминокислотные последовательности и последовательности нуклеиновых кислот человека и мыши можно найти в общедоступной базе данных, такой как GenBank, UniProt и Swiss–Prot. Например, аминокислотную последовательность CD19 человека можно найти в UniProt/Swiss–Prot под № доступа P15391, а нуклеотидную последовательность, кодирующую CD19 человека, можно найти под № доступа NM_001178098. Как используется в данном документе, "CD19" охватывает белки, содержащие мутации, например, точечные мутации, фрагменты, вставки, делеции и сплайс–варианты полноразмерного CD19 дикого типа. CD19 экспрессируется в большинстве раковых опухолей из клеток B–клеточной линии дифференцировки, в том числе, например, при остром лимфобластном лейкозе, хроническом лимфоцитарном лейкозе и неходжкинской лимфоме. Другие клетки, экспрессирующие CD19, представлены ниже в определении "заболевания, ассоциированного с экспрессией CD19". Он также представляет собой ранний маркер предшественников B–клеток. См., например, Nicholson et al. Mol. Immun. 34 (16–17): 1157–1165 (1997). В одном аспекте антигенсвязывающая часть CART распознает и связывает антиген во внеклеточном домене белка CD19. В одном аспекте белок CD19 экспрессируется на раковой клетке.
Используемый в данном документе термин "антитело" или "молекула антитела" относится к последовательности белка или полипептида, полученной из молекулы иммуноглобулина, которая специфично связывается с антигеном. Антитела могут являться поликлональными или моноклональными, многоцепочечными или одноцепочечными или интактными иммуноглобулинами и могут быть получены из природных источников или из рекомбинантных источников. Антитела могут являться тетрамерами молекул иммуноглобулина. В одном варианте осуществления антитело или молекула антитела содержит фрагмент антитела, например, состоит из него.
Термин "фрагмент антитела" относится к по меньшей мере одной части интактного антитела или его рекомбинантных вариантов и относится к антигенсвязывающему домену, например, антигенраспознающей вариабельной области интактного антитела, достаточной для обеспечения распознавания и специфичного связывания фрагмента антитела с мишенью, такой как антиген. Примеры фрагментов антител включают без ограничения Fab–, Fab'–, F(ab')2– и Fv–фрагменты, scFv–фрагменты антител, линейные антитела, однодоменные антитела, такие как sdAb (VL или VH), VHH–домены верблюдовых и полиспецифические антитела, образованные из фрагментов антител, такие как бивалентный фрагмент, содержащий два Fab–фрагмента, связанных дисульфидным мостиком в шарнирной области, а также выделенный CDR или другие эпитопсвязывающие фрагменты антитела. Антигенсвязывающие фрагменты также могут быть включены в состав однодоменных антител, максиантител, миниантител, нанотел, внутриклеточных антител, диател, триател, тетрател, v–NAR и бис–scFv (см., например, Hollinger and Hudson, Nature Biotechnology 23:1126–1136, 2005). Антигенсвязывающие фрагменты также могут быть пересажены на каркасные структуры на основе полипептидов, таких как фибронектин III типа (Fn3) (см. патент США № 6703199, в котором описаны миниантитела на основе полипептида фибронектина).
Термин "scFv" относится к слитому белку, содержащему по меньшей мере один фрагмент антитела, содержащий вариабельную область легкой цепи, и по меньшей мере один фрагмент антитела, содержащий вариабельную область тяжелой цепи, где вариабельные области легкой и тяжелой цепи связаны друг с другом посредством короткого гибкого полипептидного линкера и способны экспрессироваться в виде одноцепочечного полипептида, и где scFv сохраняет специфичность интактного антитела, из которого он получен. Если не указано иное, используемый в данном документе scFv может иметь вариабельные области VL и VH в любом порядке, например, относительно N–конца и С–конца полипептида scFv может содержать VL–линкер–VH или может содержать VH–линкер–VL.
Термин "область, определяющая комплементарность" или "CDR", используемый в данном документе, относится к последовательностям из аминокислот в вариабельных областях антитела, которые придают антигенную специфичность и аффинность связывания. Например, как правило, в каждой вариабельной области тяжелой цепи находятся три CDR (HCDR1, HCDR2 и HCDR3), и в каждой вариабельной области легкой цепи находятся три CDR (LCDR1, LCDR2 и LCDR3). Точные границы аминокислотной последовательности указанной CDR могут быть определены с использованием любой из ряда широко известных схем, в том числе описанных Kabat et al. (1991), "Sequences of Proteins of Immunological Interest," 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (схема нумерации "по Kabat"), Al–Lazikani et al., (1997) JMB 273, 927–948 (схема нумерации "по Chothia"), или их комбинации. Согласно схеме нумерации по Kabat в некоторых вариантах осуществления аминокислотные остатки CDR в вариабельном домене тяжелой цепи (VH) пронумерованы как 31–35 (HCDR1), 50–65 (HCDR2) и 95–102 (HCDR3); а аминокислотные остатки CDR в вариабельном домене легкой цепи (VL) пронумерованы как 24–34 (LCDR1), 50–56 (LCDR2) и 89–97 (LCDR3). Согласно схеме нумерации по Chothia в некоторых вариантах осуществления аминокислоты CDR в VH пронумерованы как 26–32 (HCDR1), 52–56 (HCDR2) и 95–102 (HCDR3); а аминокислотные остатки CDR в VL пронумерованы как 26–32 (LCDR1), 50–52 (LCDR2) и 91–96 (LCDR3). Согласно комбинированной схеме нумерации по Kabat и Chothia в некоторых вариантах осуществления CDR соответствуют аминокислотным остаткам, которые являются частью CDR по Kabat, CDR по Chothia или как тех, так и других. Например, в некоторых вариантах осуществления CDR соответствуют аминокислотным остаткам 26–35 (HCDR1), 50–65 (HCDR2) и 95–102 (HCDR3) в VH, например, VH млекопитающего, например, VH человека; и аминокислотным остаткам 24–34 (LCDR1), 50–56 (LCDR2) и 89–97 (LCDR3) в VL, например, VL млекопитающего, например, VL человека.
Часть CAR по настоящему изобретению, включающая в себя антитело или фрагмент этого антитела, может существовать во множестве форм, в которых антигенсвязывающий домен экспрессируется в виде части непрерывной полипептидной цепи, в том числе, например, в виде scFv–фрагментов антител, линейных антител, однодоменных антител, таких как sdAb (VL или VH), VHH–доменов верблюдовых, гуманизированного антитела, биспецифического антитела, конъюгата антитела (Harlow et al., 1999, в: Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989, в: Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879–5883; Bird et al., 1988, Science 242:423–426). В одном аспекте антигенсвязывающий домен CAR по настоящему изобретению включает в себя фрагмент антитела. В дополнительном аспекте CAR содержит фрагмент антитела, который включает в себя scFv.
Используемый в данном документе термин "молекула антитела" относится к белку, например, к цепи иммуноглобулина или ее фрагменту, содержащему по меньшей мере одну последовательность вариабельного домена иммуноглобулина. Термин "молекула антитела" охватывает антитела и фрагменты антител. В одном варианте осуществления молекула антитела охватывает "связывающий домен" (также называемый в данном документе "связывающим доменом для мишени (например, CD19)" или "доменом, связывающим мишень (например, CD19)"). В варианте осуществления молекула антитела представляет собой молекулу полиспецифического антитела, например, она содержит множество последовательностей вариабельных доменов иммуноглобулинов, где первая из множества последовательностей вариабельных доменов иммуноглобулинов характеризуется специфичностью связывания с первым эпитопом, а вторая из множества последовательностей вариабельных доменов иммуноглобулинов характеризуется специфичностью связывания со вторым эпитопом. В варианте осуществления молекула полиспецифического антитела представляет собой молекулу биспецифического антитела. Биспецифическое антитело характеризуется специфичностью не более чем к двум антигенам. Молекула биспецифического антитела характеризуется первой последовательностью вариабельного домена иммуноглобулина, которая характеризуется специфичностью связывания с первым эпитопом, и второй последовательностью вариабельного домена иммуноглобулина, которая характеризуется специфичностью связывания со вторым эпитопом.
Термин "тяжелая цепь антитела" относится к большему из двух типов полипептидных цепей, присутствующих в молекулах антител в их встречающихся в природе конформациях, который обычно определяет класс, к которому принадлежит антитело.
Термин "легкая цепь антитела" относится к меньшему из двух типов полипептидных цепей, присутствующих в молекулах антител в их встречающихся в природе конформациях. Легкие цепи каппа (κ) и лямбда (λ) относятся к двум основным изотипам легких цепей антител.
Термин "рекомбинантное антитело" относится к антителу, создаваемому с использованием технологии рекомбинантных ДНК, такому как, например, антитело, экспрессируемое в бактериофаговой или дрожжевой системе экспрессии. Термин также следует истолковывать как означающий антитело, которое было создано в результате синтеза молекулы ДНК, кодирующей антитело, при этом данная молекула ДНК экспрессирует белковое антитело или аминокислотную последовательность, определяющую антитело, где последовательность ДНК или аминокислотная последовательность были получены с использованием технологии рекомбинантных ДНК или аминокислотных последовательностей, доступной и широко известной в данной области техники.
Термин "антиген" или "Ag" относится к молекуле, которая вызывает иммунный ответ. Этот иммунный ответ может предусматривать выработку антител либо активацию специфических иммунокомпетентных клеток или как то, так и другое. Специалисту в данной области будет понятно, что любая макромолекула, в том числе практически все белки или пептиды, может служить в качестве антигена. Кроме того, антигены могут быть получены из рекомбинантной или геномной ДНК. Специалисту в данной области будет понятно, что любая ДНК, которая содержит нуклеотидную последовательность или частичную нуклеотидную последовательность, кодирующую белок, который вызывает иммунный ответ, в силу этого кодирует "антиген", как этот термин используется в данном документе. Кроме того, специалисту в данной области будет понятно, что антиген не должен кодироваться исключительно полноразмерной нуклеотидной последовательностью гена. Очевидно, что настоящее изобретение охватывает без ограничения применение частичных нуклеотидных последовательностей более чем одного гена, и что эти нуклеотидные последовательности расположены в различных комбинациях для кодирования полипептидов, которые вызывают желаемый иммунный ответ. Более того, специалисту в данной области будет понятно, что антиген вообще не обязательно должен кодироваться "геном". Очевидно, что антиген может быть образован в результате синтеза или может быть получен из биологического образца или может представлять собой макромолекулу помимо полипептида. Такой биологический образец может включать в себя без ограничения образец ткани, образец опухоли, клетку или жидкость с другими биологическими компонентами.
Термин "противораковый эффект" относится к биологическому эффекту, который может проявляться различными способами, в том числе без ограничения, например, в виде уменьшения объема опухоли, уменьшения количества раковых клеток, уменьшения количества метастазов, увеличения ожидаемой продолжительности жизни, уменьшения пролиферации раковых клеток, уменьшения выживаемости раковых клеток или ослабления различных физиологических симптомов, ассоциированных с раковым состоянием. "Противораковый эффект" также может проявляться в виде способности пептидов, полинуклеотидов, клеток и антител в первую очередь предупреждать появление рака. Термин "противоопухолевый эффект" относится к биологическому эффекту, который может проявляться различными способами, в том числе без ограничения, например, в виде уменьшения объема опухоли, уменьшения количества опухолевых клеток, уменьшения пролиферации опухолевых клеток или уменьшения выживаемости опухолевых клеток.
Термин "аутологичный" относится к любому материалу, полученному от того же индивидуума, которому он позднее должен быть повторно введен.
Термин "аллогенный" относится к любому материалу, полученному от другого животного того же вида, что и индивидуум, которому данный материал вводят. Говорят, что два или более индивидуума являются аллогенными по отношению друг к другу, если их гены в одном или нескольких локусах не являются идентичными. В некоторых аспектах аллогенные материалы от индивидуумов одного и того же вида могут быть достаточно непохожими генетически, чтобы происходило их антигенное взаимодействие.
Термин "ксеногенный" относится к трансплантату, полученному от животного другого вида.
Термин "рак" относится к заболеванию, которое характеризуется неконтролируемым ростом аберрантных клеток. Раковые клетки могут распространяться локально или через кровоток и лимфатическую систему в другие части тела. Примеры различных форм рака описаны в данном документе и включают без ограничения рак молочной железы, рак предстательной железы, рак яичника, рак шейки матки, рак кожи, рак поджелудочной железы, колоректальный рак, рак почки, рак печени, рак головного мозга, лимфому, лейкоз, рак легкого и т. п. Термины "опухоль" и "рак" используются в данном документе взаимозаменяемо, например, оба термина охватывают солидные опухоли и опухоли жидких тканей, например, диффузные или циркулирующие опухоли. Используемый в данном документе термин "рак" или "опухоль" охватывает предзлокачественные, а также злокачественные формы рака и опухоли.
Термины "антиген, ассоциированный с раком", или "опухолевый антиген", или "антиген, характерный для пролиферативного нарушения", или "антиген, ассоциированный с пролиферативным нарушением" взаимозаменяемо относятся к молекуле (обычно белку, углеводу или липиду), которая преимущественно экспрессируется на поверхности раковой клетки либо полностью, либо в виде фрагмента (например, в виде комплекса молекула MHC/пептид), по сравнению с нормальной клеткой, и которая является применимой для предпочтительного нацеливания фармакологического средства на раковую клетку. В некоторых вариантах осуществления опухолевый антиген представляет собой маркер, экспрессируемый как нормальными клетками, так и раковыми клетками, например, маркер линии дифференцировки, например, CD19 на В–клетках. В определенных аспектах опухолевые антигены по настоящему изобретению получены из раковых опухолей, включающих в себя без ограничения первичную или метастатическую меланому, тимому, лимфому, саркому, рак легкого, рак печени, неходжкинскую лимфому, лимфому Ходжкина, формы лейкоза, рак матки, рак шейки матки, рак мочевого пузыря, рак почки и формы аденокарциномы, такие как рак молочной железы, рак предстательной железы, рак яичника, рак поджелудочной железы и т. п. В некоторых вариантах осуществления опухолевый антиген представляет собой антиген, который является общим для конкретного пролиферативного нарушения. В некоторых вариантах осуществления антиген, ассоциированный с раком, представляет собой молекулу клеточной поверхности, которая сверхэкспрессируется в раковой клетке по сравнению с нормальной клеткой, например, характеризуется 1–кратной сверхэкспрессией, 2–кратной сверхэкспрессией, 3–кратной или большей сверхэкспрессией по сравнению с нормальной клеткой. В некоторых вариантах осуществления антиген, ассоциированный с раком, представляет собой молекулу клеточной поверхности, которая синтезируется в раковой клетке ненадлежащим образом, например, молекулу, которая содержит делеции, добавления или мутации по сравнению с молекулой, экспрессируемой на нормальной клетке. В некоторых вариантах осуществления антиген, ассоциированный с раком, будет экспрессироваться исключительно на клеточной поверхности раковой клетки, полностью или в виде фрагмента (например, в виде комплекса молекула MHC/пептид), и не будет синтезироваться или экспрессироваться на поверхности нормальной клетки. В некоторых вариантах осуществления CAR по настоящему изобретению включают в себя CAR, содержащие антигенсвязывающий домен (например, антитело или фрагмент антитела), который связывается с пептидом, презентируемым молекулой MHC. Обычно пептиды, полученные из эндогенных белков, заполняют карманы молекул главного комплекса гистосовместимости (MHC) I класса и распознаются T–клеточными рецепторами (TCR) на CD8+ T–лимфоцитах. Комплексы молекул MHC I класса конститутивно экспрессируются всеми ядерными клетками. При раке комплексы вирусоспецифический и/или опухолеспецифический пептид/молекула МНС представляют собой уникальный класс мишеней клеточной поверхности для иммунотерапии. Были описаны TCR–подобные антитела, нацеливающиеся на пептиды, полученные из вирусных или опухолевых антигенов, связанные с человеческим лейкоцитарным антигеном (HLA)–A1 или HLA–A2 (см., например, Sastry et al., J Virol. 2011 85(5):1935–1942; Sergeeva et al., Blood, 2011 117(16):4262–4272; Verma et al., J Immunol 2010 184(4):2156–2165; Willemsen et al., Gene Ther 2001 8(21):1601–1608; Dao et al., Sci Transl Med 2013 5(176):176ra33; Tassev et al., Cancer Gene Ther 2012 19(2):84–100). Например, TCR–подобное антитело можно идентифицировать при скрининге библиотеки, такой как фаг–дисплейная библиотека scFv человека.
Фраза "заболевание, ассоциированное с экспрессией CD19" охватывает без ограничения заболевание, ассоциированное с экспрессией CD19 (например, CD19 дикого типа или мутантного CD19), или состояние, ассоциированное с клетками, которые экспрессируют или в какое–либо время экспрессировали CD19 (например, CD19 дикого типа или мутантный CD19), в том числе, например, пролиферативные заболевания, такие как рак или злокачественное новообразование, или предраковое состояние, такое как миелодисплазия, миелодиспластический синдром или предлейкоз; или показание, не связанное с раком, ассоциированное с клетками, которые экспрессируют CD19. Во избежание неоднозначности, заболевание, ассоциированное с экспрессией CD19, может включать в себя состояние, ассоциированное с клетками, которые в настоящее время не экспрессируют CD19, например, из–за того, что экспрессия CD19 была подавлена, например, вследствие лечения молекулой, нацеливающейся на CD19, например, CAR для CD19, но которые в свое время экспрессировали CD19. В одном аспекте рак, ассоциированный с экспрессией CD19, представляет собой гематологический рак. В одном аспекте гематологический рак представляет собой лейкоз или лимфому. В одном аспекте рак, ассоциированный с экспрессией CD19, включает в себя формы рака и злокачественные новообразования, в том числе без ограничения, например, одну или несколько форм острого лейкоза, в том числе без ограничения, например, B–клеточный острый лимфобластный лейкоз (BALL), T–клеточный острый лимфобластный лейкоз (TALL), острый лимфобластный лейкоз (ALL); одну или несколько форм хронического лейкоза, в том числе без ограничения, например, хронический миелогенный лейкоз (CML), хронический лимфоидный лейкоз (CLL). Дополнительные формы рака или гематологические состояния, ассоциированные с экспрессией CD19, включают в себя без ограничения, например, В–клеточный пролимфоцитарный лейкоз, бластическое новообразование из плазмацитоидных дендритных клеток, лимфому Беркитта, диффузную крупноклеточную В–клеточную лимфому, фолликулярную лимфому, волосатоклеточный лейкоз, мелкоклеточную или крупноклеточную фолликулярную лимфому, злокачественные лимфопролиферативные состояния, лимфому MALT, мантийноклеточную лимфому (MCL), лимфому из клеток маргинальной зоны, множественную миелому, миелодисплазию и миелодиспластический синдром, неходжкинскую лимфому, лимфому Ходжкина, плазмобластную лимфому, новообразование из плазмацитоидных дендритных клеток, макроглобулинемию Вальденстрема и "предлейкоз", который представляет собой разнообразную группу гематологических состояний, объединенных неэффективным образованием (или дисплазией) миелоидных клеток крови, и т. п. Дополнительные заболевания, ассоциированные с экспрессией CD19, включают в себя без ограничения, например, атипичные и/или неклассические формы рака, злокачественные новообразования, предраковые состояния или пролиферативные заболевания, ассоциированные с экспрессией CD19. Показания, не связанные с раком, ассоциированные с экспрессией CD19, включают в себя без ограничения, например, аутоиммунное заболевание (например, волчанку), воспалительные нарушения (аллергию и астму) и трансплантацию. В некоторых вариантах осуществления клетки, экспрессирующие CD19, экспрессируют или в какое–либо время экспрессировали мРНК, кодирующую CD19. В варианте осуществления клетки, экспрессирующие CD19, вырабатывают белок CD19 (например, дикого типа или мутантный), и при этом белок CD19 может присутствовать на нормальных уровнях или сниженных уровнях. В варианте осуществления клетки, экспрессирующие CD19, в один момент времени вырабатывали белок CD19 на выявляемых уровнях и впоследствии по сути не вырабатывали выявляемый белок CD19.
Используемый в данном документе термин "белок 1 программируемой смерти клеток" или "PD–1" охватывает изоформы PD–1 млекопитающих, например, PD–1 человека, видовые гомологи PD–1 человека и аналоги, содержащие по меньшей мере один общий эпитоп с PD–1. Аминокислотная последовательность PD–1, например, PD–1 человека, известна из уровня техники, например, Shinohara T et al. (1994) Genomics 23(3):704–6; Finger LR, et al. Gene (1997) 197(1–2):177–87.
Термин "консервативные модификации последовательности" относится к аминокислотным модификациям, которые не оказывают значительного влияния на характеристики связывания антитела или фрагмента антитела, содержащего аминокислотную последовательность, или значительно не изменяют их. Такие консервативные модификации включают в себя аминокислотные замены, добавления и делеции. Модификации могут быть введены в антитело или фрагмент антитела по настоящему изобретению с помощью стандартных методик, известных из уровня техники, таких как сайт–направленный мутагенез и ПЦР–опосредованный мутагенез. Консервативные аминокислотные замены представляют собой замены, при которых аминокислотный остаток заменяется аминокислотным остатком, имеющим сходную боковую цепь. Семейства аминокислотных остатков, имеющих сходные боковые цепи, были определены в уровне техники. Эти семейства включают в себя аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета–разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или несколько аминокислотных остатков в CAR по настоящему изобретению можно заменить другими аминокислотными остатками из того же семейства боковых цепей, и измененный CAR можно протестировать, например, в отношении способности связывать CD19, с использованием функциональных анализов, описанных в данном документе.
Термин "стимуляция" относится к первичному ответу, индуцируемому связыванием стимулирующей молекулы (например, комплекса TCR/CD3 или CAR) со своим когнатным лигандом (или опухолевым антигеном в случае CAR) с опосредованием тем самым события передачи сигнала, такого как, без ограничения, передача сигнала с помощью комплекса TCR/CD3 или передача сигнала с помощью соответствующего рецептора NK или сигнальных доменов CAR. Стимуляция может опосредовать изменение экспрессии определенных молекул, как, например, подавление экспрессии TGF–β, и/или реорганизацию структур цитоскелета и т. п.
Термин "стимулирующая молекула" относится к молекуле, экспрессируемой иммунной эффекторной клеткой (например, Т–клеткой, NK–клеткой, В–клеткой), которая предоставляет цитоплазматическую(цитоплазматические) сигнальную(сигнальные) последовательность(последовательности), регулирующие активацию иммунной эффекторной клетки стимулирующим образом по меньшей мере в некоторых аспектах сигнального пути иммунной эффекторной клетки, например, Т–клеточного сигнального пути. В одном аспекте сигнал является первичным сигналом, который инициируется, например, при связывании комплекса TCR/CD3 с молекулой МНС, нагруженной пептидом, и который приводит к опосредованию ответа Т–клеток, в том числе без ограничения пролиферации, активации, дифференцировки и т. п. Первичная цитоплазматическая сигнальная последовательность (также называемая "первичным сигнальным доменом"), которая действует стимулирующим образом, может содержать сигнальный мотив, известный как иммунорецепторный тирозиновый активирующий мотив или ITAM. Примеры первичной цитоплазматической сигнальной последовательности, содержащей ITAM, которая является особенно применимой в настоящем изобретении, включают без ограничения последовательности, полученные из CD3–дзета, общей гамма–цепи FcR (FCER1G), Fc–гамма RIIa, FcR–бета (Fc–эпсилон R1b), CD3–гамма, CD3–дельта, CD3–эпсилон, CD5, CD22, CD79a, CD79b, CD278 (также известного как "ICOS"), FcεRI, DAP10, DAP12 и CD66d. В конкретном CAR по настоящему изобретению внутриклеточный сигнальный домен в любом одном или нескольких CAR по настоящему изобретению содержит внутриклеточную сигнальную последовательность, например, первичную сигнальную последовательность CD3–дзета. В конкретном CAR по настоящему изобретению первичная сигнальная последовательность CD3–дзета представляет собой аминокислотную последовательность, представленную под SEQ ID NO: 9, или эквивалентные остатки из вида, отличного от человека, например, мыши, грызуна, нечеловекообразной обезьяны, человекообразной обезьяны и т. п. В конкретном CAR по настоящему изобретению первичная сигнальная последовательность CD3–дзета представляет собой аминокислотную последовательность, представленную под SEQ ID NO: 10, или эквивалентные остатки из вида, отличного от человека, например, мыши, грызуна, нечеловекообразной обезьяны, человекообразной обезьяны и т. п.
Термин "антигенпрезентирующая клетка" или "APC" относится к клетке иммунной системы, такой как вспомогательная клетка (например, B–клетка, дендритная клетка и т. п.), которая представляет чужеродный антиген в комплексе с молекулами главного комплекса гистосовместимости (MHC) на своей поверхности. Т–клетки могут распознавать эти комплексы с помощью своих T–клеточных рецепторов (TCR). АРС процессируют антигены и презентируют их Т–клеткам.
Используемый в данном документе термин "внутриклеточный сигнальный домен" относится к внутриклеточной части молекулы. Внутриклеточный сигнальный домен образует сигнал, который способствует иммунной эффекторной функции клетки, экспрессирующей CAR, например, CART–клетки или NK–клетки, экспрессирующей CAR. Примеры иммунной эффекторной функции, например, в CART–клетке или NK–клетке, экспрессирующей CAR, включают цитолитическую активность и хелперную активность, в том числе секрецию цитокинов. Хотя можно использовать весь внутриклеточный сигнальный домен, во многих случаях нет необходимости использовать всю цепь. В той мере, в которой используют усеченную часть внутриклеточного сигнального домена, такую усеченную часть можно использовать вместо интактной цепи, при условии, что она передает сигнал эффекторной функции. Термин "внутриклеточный сигнальный домен", таким образом, подразумевает включение любой усеченной части внутриклеточного сигнального домена, достаточной для передачи сигнала эффекторной функции.
В варианте осуществления внутриклеточный сигнальный домен может содержать первичный внутриклеточный сигнальный домен. Иллюстративные первичные внутриклеточные сигнальные домены включают в себя домены, полученные из молекул, отвечающих за первичную стимуляцию или антигензависимую стимуляцию. В варианте осуществления внутриклеточный сигнальный домен может содержать костимулирующий внутриклеточный домен. Иллюстративные костимулирующие внутриклеточные сигнальные домены включают в себя домены, полученные из молекул, отвечающих за передачу костимулирующих сигналов или антигеннезависимую стимуляцию. В варианте осуществления внутриклеточный сигнальный домен является синтезированным или сконструированным. Например, в случае с иммунной эффекторной клеткой, экспрессирующей CAR, например, CART–клеткой или NK–клеткой, экспрессирующей CAR, первичный внутриклеточный сигнальный домен может содержать цитоплазматическую последовательность T–клеточного рецептора, первичный внутриклеточный сигнальный домен может содержать цитоплазматическую последовательность Т–клеточного рецептора, и костимулирующий внутриклеточный сигнальный домен может содержать цитоплазматическую последовательность корецептора или костимулирующей молекулы.
Первичный внутриклеточный сигнальный домен может содержать сигнальный мотив, который известен как иммунорецепторный тирозиновый активирующий мотив или ITAM. Примеры первичных цитоплазматических сигнальных последовательностей, содержащих ITAM, включают без ограничения последовательности, полученные из CD3–дзета, общей гамма–цепи FcR (FCER1G), Fc–гамма RIIa, FcR–бета, CD3–гамма, CD3–дельта, CD3–эпсилон, CD5, CD22, CD79a, CD79b, CD278 ("ICOS"), FcεRI, CD66d, DAP10 и DAP12.
Термин "дзета" или, в качестве альтернативы, "дзета–цепь", "CD3–дзета" или "TCR–дзета" определяют как белок, представленный под № доступа в GenBank BAG36664.1, или эквивалентные остатки из вида, отличного от человека, например, мыши, грызуна, нечеловекообразной обезьяны, человекообразной обезьяны и т. п., и "стимулирующий домен дзета" или, в качестве альтернативы, "стимулирующий домен CD3–дзета" или "стимулирующий домен TCR–дзета" определяют как аминокислотные остатки цитоплазматического домена дзета–цепи, которые являются достаточными для функциональной передачи исходного сигнала, необходимого для активации Т–клеток. В одном аспекте цитоплазматический домен дзета содержит остатки 52–164 под № доступа GenBank BAG36664.1 или эквивалентные остатки из вида, отличного от человека, например, мыши, грызуна, нечеловекообразной обезьяны, человекообразной обезьяны и т. п., которые являются его функциональными ортологами. В одном аспекте "стимулирующий домен дзета" или "стимулирующий домен CD3–дзета" представляет собой последовательность, представленную под SEQ ID NO: 10. В одном аспекте "стимулирующий домен дзета" или "стимулирующий домен CD3–дзета" представляет собой последовательность, представленную под SEQ ID NO: 9. В данном документе также охвачены домены CD3–дзета, содержащие одну или несколько мутаций в аминокислотных последовательностях, описанных в данном документе, например, в SEQ ID NO: 9.
Термин "костимулирующая молекула" относится к когнатному партнеру по связыванию на Т–клетке, который специфично связывается с костимулирующим лигандом, опосредуя тем самым костимулируемый ответ Т–клетки, такой как, без ограничения, пролиферация. Костимулирующие молекулы представляют собой молекулы клеточной поверхности, отличные от антигенных рецепторов или их лигандов, которые необходимы для эффективного иммунного ответа. Костимулирующие молекулы включают в себя без ограничения молекулу MHC I класса, белковый рецептор TNF, иммуноглобулиноподобный белок, рецептор цитокина, интегрин, сигнальную молекулу активации лимфоцитов (белок SLAM), активирующий рецептор NK–клеток, BTLA, лиганд Toll–подобного рецептора, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM–1, LFA–1 (CD11a/CD18), 4–1BB (CD137), B7–H3, CDS, ICAM–1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8–альфа, CD8–бета, IL2R–бета, IL2R–гамма, IL7R–альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA–6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA–1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA–1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB–A, Ly108), SLAM (SLAMF1, CD150, IPO–3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP–76, PAG/Cbp, CD19a, и лиганд, который специфично связывается с CD83.
Костимулирующий внутриклеточный сигнальный домен может представлять собой внутриклеточную часть костимулирующей молекулы. Внутриклеточный сигнальный домен может содержать всю внутриклеточную часть или весь нативный внутриклеточный сигнальный домен молекулы, из которой он получен, или их функциональный фрагмент.
Термин "4–1BB" относится к представителю суперсемейства TNFR с аминокислотной последовательностью, представленной под № доступа в GenBank AAA62478.2, или эквивалентным остаткам из вида, отличного от человека, например, мыши, грызуна, нечеловекообразной обезьяны, человекообразной обезьяны и т. п.; и "костимулирующий домен 4–1BB" определяют как аминокислотные остатки 214–255 под № доступа в GenBank AAA62478.2 или эквивалентные остатки из вида, отличного от человека, например, мыши, грызуна, нечеловекообразной обезьяны, человекообразной обезьяны и т. п. В одном аспекте "костимулирующий домен 4–1BB" представляет собой последовательность, представленную под SEQ ID NO: 7, или эквивалентные остатки из вида, отличного от человека, например, мыши, грызуна, нечеловекообразной обезьяны, человекообразной обезьяны и т. п.
"Иммунная эффекторная клетка", как этот термин используется в данном документе, относится к клетке, которая участвует в иммунном ответе, например, способствуя иммунному эффекторному ответу. Примеры иммунных эффекторных клеток включают Т–клетки, например, альфа/бета–Т–клетки и гамма/дельта–Т–клетки, В–клетки, естественные клетки–киллеры (NK), естественные T–клетки–киллеры (NKT), тучные клетки и фагоциты миелоидного происхождения.
"Иммунная эффекторная функция или иммунный эффекторный ответ", как этот термин используется в данном документе, относится к функции или ответу, например, иммунной эффекторной клетки, которые усиливают иммунную атаку на клетку–мишень или способствуют ей. Например, иммунные эффекторные функция или ответ относятся к свойству T– или NK–клетки, которое способствует уничтожению или ингибированию роста или пролиферации клетки–мишени. В случае с Т–клетками первичная стимуляция и костимуляция являются примерами иммунных эффекторных функции или ответа.
Термин "эффекторная функция" относится к специализированной функции клетки. Например, эффекторная функция Т–клетки может представлять собой цитолитическую активность или хелперную активность, в том числе секрецию цитокинов.
Термин "кодирование" относится к внутренне присущему свойству специфических последовательностей нуклеотидов в полинуклеотиде, таком как ген, кДНК или мРНК, служить в качестве матриц для синтеза в ходе биологических процессов других полимеров и макромолекул, имеющих определенную последовательность нуклеотидов (т. е. рРНК, тРНК и мРНК) либо определенную последовательность аминокислот и биологические свойства, обусловленные ей. Таким образом, ген, кДНК или РНК кодирует белок, если в результате транскрипции и трансляции мРНК, соответствующей этому гену, вырабатывается белок в клетке или другой биологической системе. Как кодирующая нить, нуклеотидная последовательность которой идентична последовательности мРНК и обычно представлена в перечнях последовательностей, так и некодирующая нить, используемая в качестве матрицы для транскрипции гена или кДНК, могут называться кодирующими белок или другой продукт этого гена или кДНК.
Если не указано иное, то "нуклеотидная последовательность, кодирующая аминокислотную последовательность" охватывает все нуклеотидные последовательности, которые являются вырожденными вариантами друг друга и которые кодируют одну и ту же аминокислотную последовательность. Фраза "нуклеотидная последовательность, которая кодирует белок или РНК", может также охватывать интроны в той мере, в которой нуклеотидная последовательность, кодирующая белок, может в каком–либо варианте содержать интрон(интроны).
Термины "эффективное количество" или "терапевтически эффективное количество" используются в данном документе взаимозаменяемо и относятся к количеству соединения, состава, материала или композиции, описываемых в данном документе, эффективному для достижения конкретного биологического результата.
Термин "эндогенный" относится к любому материалу, входящему в состав организма, клетки, ткани или системы или полученному в них.
Термин "экзогенный" относится к любому материалу, введенному в организм, клетку, ткань или систему или полученному вне их.
Термин "экспрессия" относится к транскрипции и/или трансляции конкретной нуклеотидной последовательности под управлением ее промотора.
Термин "вектор для переноса" относится к композиции, которая содержит выделенную нуклеиновую кислоту и которую можно применять для доставки выделенной нуклеиновой кислоты внутрь клетки. Из уровня техники известны многочисленные векторы, в том числе без ограничения линейные полинуклеотиды, полинуклеотиды, ассоциированные с ионными или амфифильными соединениями, плазмиды и вирусы. Таким образом, термин "вектор для переноса" охватывает автономно реплицирующуюся плазмиду или вирус. Данный термин также следует толковать так, чтобы он дополнительно охватывал неплазмидные и невирусные соединения, которые облегчают перенос нуклеиновой кислоты в клетки, такие как, например, полилизиновое соединение, липосома и т. п. Примеры вирусных векторов для переноса включают без ограничения аденовирусные векторы, векторы на основе аденоассоциированного вируса, ретровирусные векторы, лентивирусные векторы и т. п.
Термин "экспрессионный вектор" относится к вектору, который содержит рекомбинантный полинуклеотид, содержащий последовательности, контролирующие экспрессию, функционально связанные с нуклеотидной последовательностью, которая должна экспрессироваться. Экспрессионный вектор содержит достаточное количество цис–действующих элементов для экспрессии; другие элементы для экспрессии могут предоставляться клеткой–хозяином или в системе экспрессии in vitro. Экспрессионные векторы включают в себя все векторы, известные из уровня техники, в том числе космиды, плазмиды (например, "голые" или содержащиеся в липосомах) и вирусы (например, лентивирусы, ретровирусы, аденовирусы и аденоассоциированные вирусы), в состав которых включен рекомбинантный полинуклеотид.
Термин "лентивирус" относится к роду семейства Retroviridae. Лентивирусы являются уникальными среди ретровирусов в том, что способны инфицировать неделящиеся клетки; они могут доставлять значительное количество генетической информации в ДНК клетки–хозяина, поэтому они в качестве векторов являются одним из наиболее эффективных способов доставки генов. Все из HIV, SIV и FIV являются примерами лентивирусов.
Термин "лентивирусный вектор" относится к вектору, полученному из по меньшей мере части генома лентивируса, в том числе, в частности, к самоинактивирующемуся лентивирусному вектору, представленному в Milone et al., Mol. Ther. 17(8): 1453–1464 (2009). Другие примеры лентивирусных векторов, которые можно использовать в клинической практике, включают без ограничения, например, технологию доставки генов LENTIVECTOR® от Oxford BioMedica, векторную систему LENTIMAX ™ от Lentigen и т. п. Неклинические типы лентивирусных векторов также являются доступными и известны специалисту в данной области.
Термин "гомологичный" или "идентичность" относится к идентичности последовательностей субъединиц между двумя полимерными молекулами, например, между двумя молекулами нуклеиновой кислоты, такими как две молекулы ДНК или две молекулы РНК, или между двумя молекулами полипептидов. Если положение субъединицы в обеих из двух молекул занимает одна и та же мономерная субъединица, например, если положение в каждой из двух молекул ДНК занято аденином, то они являются гомологичными или идентичными в этом положении. Гомология между двумя последовательностями находится в прямой зависимости от количества совпадающих или гомологичных положений; например, если половина (например, пять положений в полимере длиной десять субъединиц) положений в двух последовательностях является гомологичной, то эти две последовательности являются гомологичными на 50%; если 90% положений (например, 9 из 10) являются совпадающими или гомологичными, то две последовательности являются гомологичными на 90%.
Термин "гуманизированный" относится к тем формам антител, отличных от человеческих (например, мышиных), которые представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), содержащие минимальную последовательность, полученную из иммуноглобулина, отличного от человеческого. В большинстве случаев гуманизированные антитела и фрагменты этих антител представляют собой иммуноглобулины человека (реципиентное антитело или фрагмент антитела), в которых остатки из области, определяющей комплементарность (CDR), реципиента заменены остатками из CDR отличных от человека видов (донорного антитела), таких как мышь, крыса или кролик, обладающих требуемой специфичностью, аффинностью и емкостью. В некоторых случаях остатки каркасной области (FR) Fv иммуноглобулина человека заменены соответствующими остатками, отличными от человеческих. Кроме того, гуманизированное антитело/фрагмент антитела может содержать остатки, не обнаруживаемые ни в реципиентном антителе, ни в импортированных последовательностях CDR или каркасных областей. С помощью этих модификаций можно дополнительно улучшить и оптимизировать функциональные характеристики антитела или фрагмента антитела. Как правило, гуманизированное антитело или фрагмент этого антитела будет содержать значительную часть по меньшей мере одного, и, как правило, двух, вариабельных доменов, в которых все или по сути все CDR–области соответствуют областям иммуноглобулина, отличного от человеческого, и все или по сути все FR–области представляют собой области с последовательностью иммуноглобулина человека. Гуманизированное антитело или фрагмент антитела также может содержать по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, иммуноглобулина человека. Дополнительные подробности см. в Jones et al., Nature, 321: 522–525, 1986; Reichmann et al., Nature, 332: 323–329, 1988; Presta, Curr. Op. Struct. Biol., 2: 593–596, 1992.
Термин "полностью человеческий" относится к иммуноглобулину, такому как антитело или фрагмент антитела, где целая молекула имеет человеческое происхождение или состоит из аминокислотной последовательности, идентичной человеческой форме антитела или иммуноглобулина.
Термин "выделенный" означает измененный относительно естественного состояния или извлеченный из него. Например, нуклеиновая кислота или пептид, в естественных условиях присутствующие в живом животном, не являются "выделенными", но те же самые нуклеиновая кислота или пептид, частично или полностью отделенные от сосуществующих материалов в своем естественном состоянии, являются "выделенными". Выделенные нуклеиновая кислота или белок могут существовать в по сути очищенной форме или могут существовать в ненативной среде, такой как, например, клетка–хозяин.
В контексте настоящего изобретения используются следующие сокращения для общераспространенных оснований нуклеиновых кислот. "А" относится к аденозину, "С" относится к цитозину, "G" относится к гуанозину, "Т" относится к тимидину, и "U" относится к уридину.
Термин "функционально связанный" или "контроль транскрипции" относится к функциональной связи между регуляторной последовательностью и гетерологичной последовательностью нуклеиновой кислоты, приводящей к экспрессии последней. Например, первая последовательность нуклеиновой кислоты функционально связана со второй последовательностью нуклеиновой кислоты в тех случаях, когда первая последовательность нуклеиновой кислоты размещена в функциональной взаимосвязи со второй последовательностью нуклеиновой кислоты. Например, промотор функционально связан с кодирующей последовательностью, если промотор влияет на транскрипцию или экспрессию кодирующей последовательности. Функционально связанные последовательности ДНК могут быть смежными друг с другом и, в случае необходимости соединения двух областей, кодирующих белок, находятся в одной и той же рамке считывания.
Термин "парентеральное введение" иммуногенной композиции включает в себя, например, подкожную (s.c.), внутривенную (i.v.), внутримышечную (i.m.) или внутригрудинную инъекцию, методики внутриопухолевого или инфузионного введения.
Термин "нуклеиновая кислота" или "полинуклеотид" относится к дезоксирибонуклеиновым кислотам (ДНК) или рибонуклеиновым кислотам (РНК) и их полимерам в однонитевой или двухнитевой форме. Если специально не ограничено, данный термин охватывает нуклеиновые кислоты, содержащие известные аналоги природных нуклеотидов, которые обладают свойствами связывания, сходными со свойствами эталонной нуклеиновой кислоты, и превращаются в процессе метаболизма способом, сходным со способом для встречающихся в природе нуклеотидов. Если не указано иное, конкретная последовательность нуклеиновой кислоты также в неявной форме охватывает ее варианты с консервативными модификациями (например, с заменами вырожденными кодонами), аллели, ортологи, SNP и комплементарные последовательности, а также указанную в явной форме последовательность. В частности, замены вырожденными кодонами можно осуществлять посредством создания последовательностей, в которых в третьем положении одного или нескольких выбранных (или всех) кодонов произведена замена любым из канонических оснований и/или дезоксиинозиновыми остатками (Batzer et al., Nucleic Acid Res. 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260:2605–2608 (1985); и Rossolini et al., Mol. Cell. Probes 8:91–98 (1994)).
Термины "пептид", "полипептид" и "белок" используются взаимозаменяемо и относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должен содержать по меньшей мере две аминокислоты, и не установлено ограничение на максимальное количество аминокислот, которые может содержать последовательность белка или пептида. Полипептиды включают в себя любой пептид или белок, содержащий две или более аминокислоты, соединенные друг с другом пептидными связями. Используемый в данном документе термин относится как к коротким цепям, которые также обычно упоминаются в уровне техники, например, как пептиды, олигопептиды и олигомеры, так и к более длинным цепям, которые обычно упоминаются в уровне техники как белки, которых существует множество типов. "Полипептиды" включают в себя, например, среди прочих, биологически активные фрагменты, по сути гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, слитые белки. Полипептид включает в себя природный пептид, рекомбинантный пептид, рекомбинантный пептид или их комбинацию.
Термин "промотор" относится к последовательности ДНК, распознаваемой синтетическим аппаратом клетки или введенным синтетическим аппаратом, которая необходима для инициации специфической транскрипции полинуклеотидной последовательности.
Термин "промотор/регуляторная последовательность" относится к последовательности нуклеиновой кислоты, которая необходима для экспрессии продукта гена, функционально связанного с промотором/регуляторной последовательностью. В некоторых случаях эта последовательность может являться коровой промоторной последовательностью, а в других случаях эта последовательность может также содержать энхансерную последовательность и другие регуляторные элементы, которые необходимы для экспрессии продукта гена. Промотор/регуляторная последовательность может, например, представлять собой последовательность, которая обеспечивает экспрессию продукта гена тканеспецифическим образом.
Термин "конститутивный промотор" относится к нуклеотидной последовательности, которая, находясь в функциональной связи с полинуклеотидом, который кодирует или определяет продукт гена, вызывает выработку продукта гена в клетке в большинстве или во всех физиологических условиях клетки.
Термин "индуцируемый промотор" относится к нуклеотидной последовательности, которая, находясь в функциональной связи с полинуклеотидом, который кодирует или определяет продукт гена, вызывает выработку продукта гена в клетке по сути только в случае присутствия в клетке индуктора, который соответствует промотору.
Термин "тканеспецифический промотор" относится к нуклеотидной последовательности, которая, находясь в функциональной связи с полинуклеотидом, который кодирует или определяет ген, вызывает выработку продукта гена в клетке по сути только в том случае, если клетка является клеткой того типа ткани, который соответствует промотору.
Термин "гибкий полипептидный линкер" или "линкер", используемый применительно к scFv, относится к пептидному линкеру, который состоит из аминокислот, таких как глициновые и/или сериновые остатки, используемые в отдельности или в комбинации, для связывания вариабельной области тяжелой цепи и вариабельной области легкой цепи друг с другом. В одном варианте осуществления гибкий полипептидный линкер представляет собой линкер Gly/Ser и содержит аминокислотную последовательность (Gly–Gly–Gly–Ser)n, где n представляет собой положительное целое число, равное или большее 1 (SEQ ID NO: 40). Например, n=1, n=2, n=3, n=4, n=5 и n=6, n=7, n=8, n=9 и n=10 (SEQ ID NO: 41). В одном варианте осуществления гибкие полипептидные линкеры включают в себя без ограничения (Gly4Ser)4 (SEQ ID NO: 27) или (Gly4Ser)3 (SEQ ID NO: 28). В другом варианте осуществления линкеры содержат множественные повторы (Gly2Ser), (GlySer) или (Gly3Ser) (SEQ ID NO: 29). Также в объем настоящего изобретения включены линкеры, описанные в WO2012/138475, включенной в данный документ посредством ссылки.
Как используется в данном документе, 5'–кэп (также называемый РНК–кэпом, 7–метилгуанозиновым РНК–кэпом или РНК–кэпом m7G) представляет собой модифицированный гуаниновый нуклеотид, который добавляется к "переднему", или 5'–концу, эукариотической матричной РНК вскоре после начала транскрипции. 5'–кэп состоит из концевой группы, которая связана с первым транскрибированным нуклеотидом. Его присутствие является критически важным для распознавания рибосомой и защиты от РНКаз. Добавление кэпа сопряжено с транскрипцией и происходит совместно с транскрипцией, так что каждое из этих событий влияет на другое. Вскоре после начала транскрипции 5'–конец синтезируемой мРНК связывается кэп–синтезирующим комплексом, ассоциированным с РНК–полимеразой. Этот ферментативный комплекс катализирует химические реакции, которые необходимы для кэпирования мРНК. Синтез протекает в виде многоступенчатой биохимической реакции. Кэпирующий компонент можно модифицировать для модулирования функциональных свойств мРНК, таких как ее стабильность или эффективность трансляции.
Как используется в данном документе, "РНК, транскрибированная in vitro" относится к РНК, предпочтительно мРНК, которая была синтезирована in vitro. Обычно РНК, транскрибированная in vitro, образуется из вектора транскрипции in vitro. Вектор транскрипции in vitro содержит матрицу, используемую для образования РНК, транскрибированной in vitro.
Как используется в данном документе, "поли(А)" представляет собой ряд аденозиновых остатков, присоединенных путем полиаденилирования к мРНК. В предпочтительном варианте осуществления конструкции для транзиентной экспрессии длина поли(А) составляет от 50 до 5000 (SEQ ID NO: 30), предпочтительно более 64, более предпочтительно более 100, наиболее предпочтительно более 300 или 400. Последовательности поли(А) можно модифицировать химическим или ферментативным путем для модулирования функциональных свойств мРНК, таких как локализация, стабильность или эффективность трансляции.
Как используется в данном документе, "полиаденилирование" относится к ковалентной связи полиаденилилового компонента или его модифицированного варианта с молекулой матричной РНК. В эукариотических организмах большинство молекул матричной РНК (мРНК) являются полиаденилированными на 3'–конце. 3'–концевой поли(А)–хвост представляет собой длинную последовательность адениновых нуклеотидов (часто несколько сотен), добавленных к пре–мРНК под действием фермента полиаденилатполимеразы. У высших эукариот поли(А)–хвост добавляется к транскриптам, которые содержат определенную последовательность – сигнал полиаденилирования. Поли(А)–хвост и связанный с ним белок содействуют защите мРНК от разрушения экзонуклеазами. Полиаденилирование также важно для терминации транскрипции, экспорта мРНК из ядра и трансляции. Полиаденилирование происходит в ядре сразу после транскрипции ДНК в РНК, но дополнительно может также происходить позднее в цитоплазме. После завершения транскрипции цепь мРНК расщепляется под действием эндонуклеазного комплекса, ассоциированного с РНК–полимеразой. Сайт расщепления обычно характеризуется наличием последовательности оснований AAUAAA вблизи сайта расщепления. После того, как мРНК была расщеплена, к свободному 3'–концу в сайте расщепления добавляются аденозиновые остатки.
Как используется в данном документе, "транзиентный" относится к экспрессии неинтегрированного трансгена в течение периода нескольких часов, дней или недель, где период времени экспрессии является меньшим, чем период времени для экспрессии гена в случае, если он интегрирован в геном или содержится в стабильном плазмидном репликоне в клетке–хозяине.
Используемые в данном документе термины "лечить", "лечение" и "осуществление лечения" относятся к снижению или ослаблению прогрессирования, тяжести и/или продолжительности пролиферативного нарушения или ослаблению одного или нескольких симптомов (предпочтительно одного или нескольких различимых симптомов) пролиферативного нарушения в результате введения одного или нескольких средств терапии (например, одного или нескольких терапевтических средств, таких как CAR по настоящему изобретению). В конкретных вариантах осуществления термины "лечить", "лечение" и "осуществление лечения" относятся к ослаблению по меньшей мере одного измеряемого физического параметра пролиферативного нарушения, такого как рост опухоли, необязательно различимых для пациента. В других вариантах осуществления термины "лечить", "лечение" и "осуществление лечения" относятся к ингибированию прогрессирования пролиферативного нарушения физическим путем, например, посредством стабилизации различимого симптома, физиологическим путем, например, посредством стабилизации физического параметра, либо ими обоими. В других вариантах осуществления термины "лечить", "лечение" и "осуществление лечения" относятся к снижению или стабилизации размера опухоли или числа раковых клеток.
Режим дозирования, например, терапевтический режим дозирования, может предусматривать один или несколько интервалов лечения. Режим дозирования может приводить к по меньшей мере одному благоприятному или желаемому клиническому результату, в том числе без ограничения к выявляемым или невыявляемым ослаблению симптома, уменьшению степени выраженности заболевания, стабилизации (т. е. отсутствию ухудшения) состояния заболевания, задержке или замедлению прогрессирования заболевания, облегчению или смягчению болезненного состояния.
Как используется в данном документе, "интервал лечения" относится к циклу лечения, например, к курсу введения терапевтического средства, который может повторяться, например, в соответствии с регулярной схемой. В вариантах осуществления режим дозирования может иметь один или несколько периодов отсутствия введения терапевтического средства между интервалами лечения. Например, интервал лечения может предусматривать одну дозу молекулы CAR, вводимую в комбинации с введением (до него, параллельно с ним или после него) второго терапевтического средства, например, ингибитора (например, ингибитора киназы, описываемого в данном документе).
Термин "путь передачи сигнала" относится к биохимической взаимосвязи между различными молекулами–переносчиками сигналов, которые играют роль в передаче сигнала от одной части клетки к другой части клетки. Фраза "рецептор клеточной поверхности" охватывает молекулы и комплексы молекул, способные принимать сигнал и передавать сигнал через мембрану клетки.
Термин "субъект" предполагается как включающий живые организмы, у которых можно вызвать иммунный ответ (например, млекопитающих, человека). В варианте осуществления субъектом является млекопитающее. В варианте осуществления субъектом является человек. В варианте осуществления субъектом является пациент. В одном варианте осуществления субъектом является педиатрический субъект. В другом варианте осуществления субъектом является взрослый пациент.
Термин "по сути очищенная" клетка относится к клетке, которая практически свободна от других типов клеток. "По сути очищенная клетка" также относится к клетке, которая была отделена от других типов клеток, с которыми она обычно ассоциирована в своем встречающемся в природе состоянии. В некоторых случаях популяция по сути очищенных клеток относится к однородной популяции клеток. В других случаях данный термин просто относится к клетке, которая была отделена от клеток, с которыми она в естественных условиях ассоциирована в своем естественном состоянии. В некоторых аспектах клетки культивируют in vitro. В других аспектах клетки не культивируют in vitro.
Используемый в данном документе термин "терапевтический" означает лечение. Терапевтический эффект получают при ослаблении, подавлении, ремиссии или устранении болезненного состояния.
Используемый в данном документе термин "профилактика" означает предупреждение или профилактическое лечение заболевания или болезненного состояния.
Термины "трансфицированный", или "трансформированный", или "трансдуцированный" относятся к процессу, в ходе которого экзогенную нуклеиновую кислоту переносят или вводят в клетку–хозяина. "Трансфицированная", или "трансформированная", или "трансдуцированная" клетка представляет собой клетку, которая была трансфицирована, трансформирована или трансдуцирована экзогенной нуклеиновой кислотой. Клетка включает в себя первичную рассматриваемую клетку и ее потомство.
Термин "специфично связывается" относится к антителу или лиганду, который распознает своего белкового партнера по связыванию (например, опухолевый антиген), присутствующего в образце, и связывается с ним, но при этом это антитело или лиганд по сути не распознает или не связывает другие молекулы в образце.
Как используется в данном документе, "регулируемый химерный антигенный рецептор (RCAR)" относится к набору полипептидов, как правило, в простейших вариантах осуществления двух, которые, находясь в иммунной эффекторной клетке, наделяют клетку специфичностью в отношении клетки–мишени, как правило, раковой клетки, и регулируемым образованием внутриклеточного сигнала. В некоторых вариантах осуществления RCAR содержит по меньшей мере внеклеточный антигенсвязывающий домен, трансмембранный и цитоплазматический сигнальный домен (также называемый в данном документе "внутриклеточным сигнальным доменом"), содержащий функциональный сигнальный домен, полученный из стимулирующей молекулы и/или костимулирующей молекулы, как определено в данном документе применительно к молекуле CAR. В некоторых вариантах осуществления полипептиды из набора в RCAR не является смежным друг с другом, например, находятся в разных полипептидных цепях. В некоторых вариантах осуществления RCAR содержит димеризационный переключатель, который при наличии димеризующей молекулы может связывать полипептиды друг с другом, например, может связывать антигенсвязывающий домен с внутриклеточным сигнальным доменом. В некоторых вариантах осуществления RCAR экспрессируется в клетке (например, иммунной эффекторной клетке), описываемой в данном документе, например, в клетке, экспрессирующей RCAR (также называемой в данном документе "RCARX–клеткой"). В варианте осуществления RCARX–клетка представляет собой T–клетку и называется RCART–клеткой. В варианте осуществления RCARX–клетка представляет собой NK–клетку и называется RCARN–клеткой. RCAR может наделять клетку, экспрессирующую RCAR, специфичностью в отношении клетки–мишени, как правило, раковой клетки, и регулируемым образованием внутриклеточного сигнала или пролиферацией, что может оптимизировать иммуноэффекторное свойство клетки, экспрессирующей RCAR. В вариантах осуществления клетка с RCAR по меньшей мере частично зависит от антигенсвязывающего домена в обеспечении специфичности в отношении клетки–мишени, которая содержит антиген, связываемый антигенсвязывающим доменом.
"Мембранный якорь" или "домен прикрепления к мембране", как этот термин используется в данном документе, относится к полипептиду или компоненту, например, к миристоильной группе, достаточному для заякоривания внеклеточного или внутриклеточного домена на плазматической мембране.
"Переключающий домен", как этот термин используется в данном документе, например, в отношении RCAR, относится к объекту, обычно полипептидному объекту, который в присутствии димеризующей молекулы ассоциирует с другим переключающим доменом. Ассоциация приводит к функциональной связи первого объекта, связанного, например, слитого, с первым переключающим доменом, и второго объекта, связанного, например, слитого, со вторым переключающим доменом. Первый и второй переключающие домены в совокупности называются димеризационным переключателем. В вариантах осуществления первый и второй переключающие домены являются одинаковыми, например, они являются полипептидами, имеющими одинаковую первичную аминокислотную последовательность, и в совокупности называются гомодимеризационным переключателем. В вариантах осуществления первый и второй переключающие домены отличаются друг от друга, например, они являются полипептидами, имеющими разные первичные аминокислотные последовательности, и в совокупности называются гетеродимеризационным переключателем. В вариантах осуществления переключатель является внутриклеточным. В вариантах осуществления переключатель является внеклеточным. В вариантах осуществления переключающий домен представляет собой полипептидный объект, например, объект на основе FKBP или FRB, а димеризующая молекула представляет собой малую молекулу, например, рапалог. В вариантах осуществления переключающий домен представляет собой полипептидный объект, например, scFv, который связывает пептид myc, а димеризующая молекула представляет собой полипептид, его фрагмент или мультимер полипептида, например, лиганд myc или мультимеры лиганда myc, которые связываются с одним или несколькими scFv для myc. В вариантах осуществления переключающий домен представляет собой полипептидный объект, например, myc–рецептор, а димеризующая молекула представляет собой антитело или его фрагменты, например, антитело к myc.
"Димеризующая молекула", как этот термин используется в данном документе, например, в отношении RCAR, относится к молекуле, которая способствует ассоциации первого переключающего домена со вторым переключающим доменом. В вариантах осуществления димеризующая молекула не встречается у субъекта в природе или не встречается в концентрациях, которые могут привести к значительной димеризации. В вариантах осуществления димеризующая молекула представляет собой малую молекулу, например, рапамицин или рапалог, например, RAD001.
Термин "биоэквивалент" относится к количеству средства, отличного от эталонного соединения (например, RAD001), необходимого для получения эффекта, эквивалентного эффекту, вызываемому эталонной дозой или эталонным количеством эталонного соединения (например, RAD001). В варианте осуществления эффект представляет собой уровень ингибирования mTOR, например, измеряемый по ингибированию киназы P70–S6, например, оцениваемому в анализе in vivo или in vitro, например, измеряемому с помощью анализа, описываемого в данном документе, например, анализа по Boulay, или измеряемый по уровням фосфорилированного S6 с помощью вестерн–блоттинга. В варианте осуществления эффект представляет собой изменение соотношения PD–1–положительных/PD–1–отрицательных T–клеток, измеряемого с помощью сортировки клеток. В варианте осуществления биоэквивалентное количество или доза ингибитора mTOR представляют собой количество или дозу, которые достигают того же уровня ингибирования киназы P70–S6, что и эталонная доза или эталонное количество эталонного соединения. В варианте осуществления биоэквивалентное количество или доза ингибитора mTOR представляет собой количество или дозу, которые достигают того же уровня изменения соотношения PD–1–положительных/PD–1–отрицательных T–клеток, что и эталонная доза или эталонное количество эталонного соединения.
Термин "низкая доза, усиливающая иммунный ответ" при использовании в отношении ингибитора mTOR, например, аллостерического ингибитора mTOR, например, RAD001 или рапамицина, или каталитического ингибитора mTOR, относится к дозе ингибитора mTOR, которая частично, но не полностью, ингибирует активность mTOR, например, измеряемую по ингибированию активности киназы P70–S6. Способы оценивания активности mTOR, например, по ингибированию киназы P70–S6, обсуждаются в данном документе. Доза является недостаточной, чтобы вызвать полное подавление иммунитета, но достаточной для усиления иммунного ответа. В варианте осуществления низкая доза, усиливающая иммунный ответ, ингибитора mTOR приводит к уменьшению количества PD–1–положительных Т–клеток и/или увеличению количества PD–1–отрицательных Т–клеток или увеличению соотношения PD–1–отрицательные Т–клетки/PD–1–положительные Т–клетки. В варианте осуществления низкая доза, усиливающая иммунный ответ, ингибитора mTOR приводит к увеличению количества наивных Т–клеток. В варианте осуществления низкая доза, усиливающая иммунный ответ, ингибитора mTOR приводит к одному или нескольким из следующего:
увеличению экспрессии одного или нескольких из следующих маркеров: CD62Lвысокий, CD127высокий, CD27+ и BCL2, например, на Т–клетках памяти, например, предшественниках Т–клеток памяти;
уменьшению экспрессии KLRG1, например, на Т–клетках памяти, например, предшественниках Т–клеток памяти; и
увеличению количества предшественников Т–клеток памяти, например, клеток с любой из следующих характеристик или их комбинацией: увеличенным уровнем CD62Lвысокий, увеличенным уровнем CD127высокий, увеличенным уровнем CD27+, уменьшенным уровнем KLRG1 и увеличенным уровнем BCL2;
где любое из изменений, описанных выше, происходит, например, по меньшей мере временно, например, по сравнению с субъектом, не получающим лечение.
Как используется в данном документе, "прогрессирующий" относится к заболеванию, например, раку, которое прогрессирует или усугубляется. При солидных опухолях, например, раке легкого, прогрессирующее заболевание обычно демонстрирует по меньшей мере 20% рост размера опухоли или распространения опухоли с момента начала лечения.
Как используется в данном документе "резистентный" относится к заболеванию, например, раку, которое не отвечает на лечение. В вариантах осуществления резистентный рак может быть устойчивым к лечению до или в начале лечения. В других вариантах осуществления резистентный рак может стать устойчивым во время лечения. Резистентный рак также называют устойчивым раком.
Как используется в данном документе, "рецидивирующий" или "рецидив" относится к возвращению или повторному появлению заболевания (например, рака) или признаков и симптомов заболевания, такого как рак, после периода улучшения или восприимчивости, например, после предшествующего лечения с помощью терапии, например, противораковой терапии. Начальный период восприимчивости может предусматривать падение уровня раковых клеток ниже определенного порога, например, ниже 20%, 1%, 10%, 5%, 4%, 3%, 2%, или 1%. Повторное появление может предусматривать возрастание уровня раковых клеток выше определенного порога, например, выше 20%, 1%, 10%, 5%, 4%, 3%, 2%, или 1%. К примеру, например, применительно к B–ALL повторное появление может предусматривать, например, повторное появление бластных клеток в крови, костном мозге (> 5%) или любом экстрамедуллярном участке после достижения полного ответа. Полный ответ в данном контексте может предусматривать < 5% бластных клеток в BM. В более широком смысле в варианте осуществления ответ (например, полный ответ или частичный ответ) может предусматривать отсутствие выявляемого MRD (минимального остаточного заболевания). В варианте осуществления начальный период восприимчивости длится по меньшей мере 1, 2, 3, 4, 5, или 6 дней; по меньшей мере 1, 2, 3, или 4 недели; по меньшей мере 1, 2, 3, 4, 6, 8, 10, или 12 месяцев или по меньшей мере 1, 2, 3, 4, или 5 лет.
"Полный ответ" или "CR" на лечение относится к отсутствию выявляемых проявлений заболевания, например, рака, например, полной ремиссии. Полный ответ можно идентифицировать, например, с использованием NCCN Guidelines® или Cheson et al, J Clin Oncol 17:1244 (1999) и Cheson et al., "Revised Response Criteria for Malignant Lymphoma", J Clin Oncol 25:579–586 (2007) (оба из которых включены в данный документ посредством ссылки во всей своей полноте), как описано в данном документе. Например, применительно к B–ALL полный ответ может предусматривать < 5% бластных клеток в BM.
Как используется в данном документе, "пациент с полным ответом" относится к субъекту, имеющему заболевание, например, рак, который демонстрирует полный ответ на лечение, например, полную ремиссию.
"Частичный ответ" или "PR" относится к уменьшению интенсивности проявления заболевания, например, рака, при том что, например, выявляемое заболевание все еще присутствует.
Как используется в данном документе, "пациент с частичным ответом" относится к субъекту, имеющему заболевание, например, рак, который демонстрирует частичный ответ на лечение, например, частичную ремиссию. Частичный ответ можно идентифицировать, например, с использованием NCCN Guidelines® или критериев Cheson, как описано в данном документе.
Как используется в данном документе, "пациент, не отвечающий на лечение" относится к субъекту, имеющему заболевание, например, рак, который не демонстрирует ответ на лечение, например, пациент имеет стабильное заболевание или прогрессирующее заболевание после введения средства лечения, например, средства лечения, описываемого в данном документе. Пациента, не отвечающего на лечение, можно идентифицировать, например, с использованием NCCN Guidelines® или критериев Cheson, как описано в данном документе.
Для определения того, отвечает ли пациент на лечение, можно применять несколько способов, в том числе, например, критерии, представленные в Руководстве NCCN по клинической практике в онкологии (NCCN Guidelines®). Например, применительно к B–ALL полный ответ или пациент с полным ответом может предусматривать одно или несколько из следующего: < 5% бластных клеток в BM, > 1000 нейтрофилов/ANC (/мкл), > 100000 тромбоцитов (/мкл) без циркулирующих бластных клеток или экстрамедуллярного заболевания (без лимфаденопатии, спленомегалии, инфильтрации кожи/десен/тестикулярной массы/вовлечения ЦНС), трехлинейный гемопоэз и отсутствие рецидивов в течение 4 недель. Пациент с частичным ответом может предусматривать одно или несколько из > 50% снижения количества бластных клеток в BM, > 1000 нейтрофилов/ANC (/мкл), > 100000 тромбоцитов (/мкл). Пациент, не отвечающий на лечение, может демонстрировать прогрессирование заболевания, например, > 25% бластных клеток в BM.
Диапазоны: во всем настоящем раскрытии различные аспекты настоящего изобретения могут быть представлены в формате диапазонов. Следует понимать, что описание в формате диапазонов служит лишь для удобства и краткости и не должно рассматриваться как жесткое ограничение объема настоящего изобретения. Соответственно, описание диапазона следует рассматривать как конкретно раскрывающее все возможные поддиапазоны, а также отдельные числовые значения в пределах этого диапазона. Например, описание такого диапазона, как от 1 до 6, следует рассматривать как конкретно раскрывающее такие поддиапазоны, как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т. д., а также отдельные числа в этом диапазоне, например, 1, 2, 2,7, 3, 4, 5, 5,3, и 6. В качестве другого примера, такой диапазон, как 95–99% идентичность, включает в себя что–либо, на 95%, 96%, 97%, 98%, или 99% идентичное, и включает в себя такие поддиапазоны, как 96–99%, 96–98%, 96–97%, 97–99%, 97–98%, и 98–99% идентичность. Это применимо независимо от ширины диапазона.
Описание
В данном документе представлены композиции и способы для лечения заболевания, такого как рак, путем введения клетки, содержащей химерный антигенный рецептор, который нацеливается на антиген, например, антиген, описываемый в данном документе, например, CD19, например, CAR для CD19, в комбинации с ингибитором PD–1. Иллюстративные компоненты для создания молекулы CAR, например, CAR для CD19, и клетки, экспрессирующей CAR (например, клетки, экспрессирующей CAR для CD19), раскрыты в данном документе. Иллюстративные ингибиторы PD–1 также описываются в данном документе.
В вариантах осуществления комбинированная терапия клеткой, экспрессирующей CAR (например, клеткой, экспрессирующей CAR для CD19), описываемой в данном документе, и ингибитором PD–1, описываемым в данном документе, приводит к одному или нескольким из следующего: улучшению или увеличению противоопухолевой активности клетки, экспрессирующей CAR; увеличению пролиферации или персистенции клетки, экспрессирующей CAR; улучшению или увеличению инфильтрации клетки, экспрессирующей CAR; улучшению ингибирования прогрессирования опухоли; задержке прогрессирования опухоли; ингибированию или снижению пролиферации раковых клеток и/или снижению опухолевой нагрузки, например, объема или размера опухоли. В варианте осуществления комбинированная терапия клеткой, экспрессирующей CAR для CD19, например, множеством клеток, экспрессирующих CAR для CD19, и ингибитором PD–1, описываемым в данном документе, приводит к увеличению или улучшению персистенции клетки, экспрессирующей CAR для CD19, например, увеличению или улучшению персистенции множества клеток, экспрессирующих CAR для CD19.
В некоторых вариантах осуществления введение ингибитора PD–1 до или после введения клетки, экспрессирующей CAR (например, клетки, экспрессирующей CAR для CD19), приводит к увеличению терапевтической эффективности, например, к увеличению ингибирования прогрессирования опухоли и/или роста опухоли при некоторых формах рака, например, по сравнению с введением ингибитора PD–1 или клетки, экспрессирующей CAR, в отдельности.
Известно, что PD–1 подавляет иммунный ответ, например, противоопухолевый иммунный ответ. PD–1 и/или PD–L1 также могут экспрессироваться раковыми клетками или клетками, ассоциированными с раком, например, лимфоцитами, инфильтрирующими опухоль (TIL). Не желая ограничиваться какой–либо теорией, полагают, что в некоторых вариантах осуществления субъект, которому вводят средства комбинированной терапии, описываемые в данном документе, например, клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), и ингибитор PD–1, с большей вероятностью будет иметь увеличенную противоопухолевую активность, если субъект имеет одно или несколько из следующего: рака, характеризующегося экспрессией, например, высоким уровнем экспрессии, PD–1 и/или PD–L1; рака, характеризующегося инфильтрацией противоопухолевыми иммунными клетками, например, лимфоцитами, инфильтрирующими опухоль (TIL); и/или клеток, ассоциированных с раком, которые экспрессируют, например, экспрессируют на высоком уровне, PD–1 и/или PD–L1, по сравнению с субъектом, которому не вводят средства комбинированной терапии или вводят клетку, экспрессирующую CAR, или ингибитор PD–1 в отдельности. Например, не желая ограничиваться какой–либо теорией, полагают, что лечение ингибитором PD–1 обеспечивает предупреждение или снижение подавления противоопухолевого иммунного ответа, например, истощения противоопухолевых иммунных клеток, например, TIL, с увеличением тем самым противоопухолевой эффективности клетки, экспрессирующей CAR. Не желая ограничиваться какой–либо теорией, полагают, что введение средств комбинированной терапии, например, клетки, экспрессирующей CAR, например, клетки, экспрессирующей CAR для CD19, и ингибитора контрольных точек иммунного ответа, например, ингибитора PD–1, может обеспечивать снижение истощения T–клеток, приводя к улучшенной, например, более длительной, персистенции клеток, экспрессирующих CAR. В варианте осуществления введение комбинации клетки, экспрессирующей CAR для CD19, и ингибитора PD–1 может приводить к улучшенной, например, более длительной, персистенции клеток, экспрессирующих CAR для CD19.
Химерный антигенный рецептор (CAR)
Настоящее изобретение охватывает иммунные эффекторные клетки (например, T–клетки или NK–клетки), содержащие молекулу CAR, которая нацеливается на антиген, например, антиген, описываемый в данном документе, например, CD19, например, специфично связывается с ним (CAR, например, CAR для CD19). В одном варианте осуществления иммунные эффекторные клетки сконструированы таким образом, что они экспрессируют CAR, например, CAR для CD19. В одном варианте осуществления иммунные эффекторные клетки содержат конструкцию рекомбинантной нуклеиновой кислоты, содержащую последовательности нуклеиновых кислот, кодирующие CAR, например, CAR для CD19.
В вариантах осуществления CAR, например, CAR для CD19, содержит антигенсвязывающий домен, который специфично связывается с антигеном, например, CD19, например, антигенсвязывающий домен (например, CD19–связывающий домен), трансмембранный домен и внутриклеточный сигнальный домен. В одном варианте осуществления последовательность антигенсвязывающего домена является смежной с последовательностью нуклеиновой кислоты, кодирующей внутриклеточный сигнальный домен, и находится с ней в одной и той же рамке считывания. Внутриклеточный сигнальный домен может содержать костимулирующий сигнальный домен и/или первичный сигнальный домен, например, дзета–цепь. Костимулирующий сигнальный домен относится к части CAR, содержащей по меньшей мере часть внутриклеточного домена костимулирующей молекулы.
Последовательности неограничивающих примеров различных компонентов, которые могут быть частью молекулы CAR (например, молекулы CAR для CD19), описываемой в данном документе, указаны в таблице 1, где "а. к." обозначает аминокислоты, а "н. к." обозначает нуклеиновые кислоты, которые кодируют соответствующий пептид.
В соответствии с любым способом или композицией, описываемыми в данном документе, в вариантах осуществления молекула CAR содержит CAR для CD123, описываемый в данном документе, например, CAR для CD123, описанный в US2014/0322212A1 или US2016/0068601A1, обе из которых включены в данный документ посредством ссылки. В вариантах осуществления CAR для CD123 содержит аминокислотную или имеет нуклеотидную последовательность, показанную в US2014/0322212A1 или US2016/0068601A1, обе из которых включены в данный документ посредством ссылки. В других вариантах осуществления молекула CAR включает в себя молекулу CAR для CD19, описываемую в данном документе, например, молекулу CAR для CD19, описанную в US–2015–0283178–A1, например, CTL019. В вариантах осуществления CAR для CD19 содержит аминокислотную или имеет нуклеотидную последовательность, показанную в US–2015–0283178–A1, включенной в данный документ посредством ссылки. В одном варианте осуществления молекула CAR включает в себя молекулу CAR для BCMA, описываемую в данном документе, например, CAR для BCMA, описанный в US–2016–0046724–A1. В вариантах осуществления CAR для BCMA содержит аминокислотную или имеет нуклеотидную последовательность, показанную в US–2016–0046724–A1, включенной в данный документ посредством ссылки. В варианте осуществления молекула CAR включает в себя CAR для CLL1, описываемый в данном документе, например, CAR для CLL1, описанный в US2016/0051651A1, включенной в данный документ посредством ссылки. В вариантах осуществления CAR для CLL1 содержит аминокислотную или имеет нуклеотидную последовательность, показанную в US2016/0051651A1, включенной в данный документ посредством ссылки. В варианте осуществления молекула CAR включает в себя CAR для CD33, описываемый в данном документе, например, CAR для CD33, описанный в US2016/0096892A1, включенной в данный документ посредством ссылки. В вариантах осуществления CAR для CD33 содержит аминокислотную или имеет нуклеотидную последовательность, показанную в US2016/0096892A1, включенной в данный документ посредством ссылки. В варианте осуществления молекула CAR включает в себя молекулу CAR для EGFRvIII, описываемую в данном документе, например, CAR для EGFRvIII, описанный в US2014/0322275A1, включенной в данный документ посредством ссылки. В вариантах осуществления CAR для EGFRvIII содержит аминокислотную или имеет нуклеотидную последовательность, показанную в US2014/0322275A1, включенной в данный документ посредством ссылки. В варианте осуществления молекула CAR включает в себя CAR для мезотелина, описываемый в данном документе, например, CAR для мезотелина, описанный в WO 2015/090230, включенной в данный документ посредством ссылки. В вариантах осуществления CAR для мезотелина содержит аминокислотную или имеет нуклеотидную последовательность, показанную в WO 2015/090230, включенной в данный документ посредством ссылки.
Таблица 1. Последовательности различных компонентов CAR (а. к. – аминокислотная последовательность, н. к. – последовательность нуклеиновой кислоты)
(н. к.)
(с мутацией Q/K)
(с мутацией Q/K)
(с мутацией Q/K)
(Эталонная последовательность NM_000734.3 в NCBI)
(Эталонная последовательность NM_000734.3 в NCBI)
Эта последовательность может охватывать 50–5000 адениновых оснований.
Эта последовательность может охватывать 50–5000 тиминовых оснований.
Эта последовательность может охватывать 100–5000 адениновых оснований.
Эта последовательность может охватывать 100–400 адениновых оснований.
Эта последовательность может охватывать 50–2000 адениновых оснований.
(ECD PD1 подчеркнут)
(ECD PD1 подчеркнут)
(ECD PD1 подчеркнут)
В одном аспекте иллюстративные конструкции CAR содержат необязательную лидерную последовательность (например, лидерную последовательность, описываемую в данном документе), внеклеточный антигенсвязывающий домен (например, антигенсвязывающий домен, описываемый в данном документе), шарнирную область (например, шарнирную область, описываемую в данном документе), трансмембранный домен (например, трансмембранный домен, описываемый в данном документе) и внутриклеточный стимулирующий домен (например, внутриклеточный стимулирующий домен, описываемый в данном документе). В одном аспекте иллюстративная конструкция CAR содержит необязательную лидерную последовательность (например, лидерную последовательность, описываемую в данном документе), внеклеточный антигенсвязывающий домен (например, антигенсвязывающий домен, описываемый в данном документе), шарнирную область (например, шарнирную область, описываемую в данном документе), трансмембранный домен (например, трансмембранный домен, описываемый в данном документе), внутриклеточный костимулирующий сигнальный домен (например, костимулирующий сигнальный домен, описываемый в данном документе) и/или внутриклеточный первичный сигнальный домен (например, первичный сигнальный домен, описываемый в данном документе).
В одном аспекте CAR (например, CAR для CD19) по настоящему изобретению содержат по меньшей мере один внутриклеточный сигнальный домен, выбранный из группы сигнального домена CD137 (4–1BB), сигнального домена CD28, сигнального домена CD27, сигнального домена ICOS, сигнального домена CD3–дзета и любой их комбинации. В одном аспекте CAR по настоящему изобретению содержат по меньшей мере один внутриклеточный сигнальный домен из одной или нескольких костимулирующих молекул, выбранных из CD137 (4–1BB), CD28, CD27 или ICOS.
Иллюстративные CAR для CD19 включают в себя CAR для CD19, описываемые в данном документе, например, в одной или нескольких таблицах, описываемых в данном документе, или CAR, связывающиеся с CD19, описанные в Xu et al. Blood 123.24(2014):3750–9; Kochenderfer et al. Blood 122.25(2013):4129–39, Cruz et al. Blood 122.17(2013):2965–73, NCT00586391, NCT01087294, NCT02456350, NCT00840853, NCT02659943, NCT02650999, NCT02640209, NCT01747486, NCT02546739, NCT02656147, NCT02772198, NCT00709033, NCT02081937, NCT00924326, NCT02735083, NCT02794246, NCT02746952, NCT01593696, NCT02134262, NCT01853631, NCT02443831, NCT02277522, NCT02348216, NCT02614066, NCT02030834, NCT02624258, NCT02625480, NCT02030847, NCT02644655, NCT02349698, NCT02813837, NCT02050347, NCT01683279, NCT02529813, NCT02537977, NCT02799550, NCT02672501, NCT02819583, NCT02028455, NCT01840566, NCT01318317, NCT01864889, NCT02706405, NCT01475058, NCT01430390, NCT02146924, NCT02051257, NCT02431988, NCT01815749, NCT02153580, NCT01865617, NCT02208362, NCT02685670, NCT02535364, NCT02631044, NCT02728882, NCT02735291, NCT01860937, NCT02822326, NCT02737085, NCT02465983, NCT02132624, NCT02782351, NCT01493453, NCT02652910, NCT02247609, NCT01029366, NCT01626495, NCT02721407, NCT01044069, NCT00422383, NCT01680991, NCT02794961, или NCT02456207, каждая из которых включена в данный документ посредством ссылки во всей своей полноте.
Антигенсвязывающий домен
В одном аспекте CAR по настоящему изобретению содержит мишень–специфичный связывающий элемент, иначе называемый антигенсвязывающим доменом. В одном варианте осуществления часть CAR, содержащая антигенсвязывающий домен, содержит антигенсвязывающий домен, который нацеливается на антиген, например, антиген, описываемый в данном документе, например, CD19, например, специфично связывается с ним. В одном варианте осуществления антигенсвязывающий домен нацеливается на CD19 человека, например, специфично связывается с ним.
Антигенсвязывающий домен может представлять собой любой домен, который связывается с антигеном, в том числе без ограничения моноклональное антитело, поликлональное антитело, рекомбинантное антитело, антитело человека, гуманизированное антитело и их функциональный фрагмент, в том числе без ограничения однодоменное антитело, такое как вариабельный домен тяжелой цепи (VH), вариабельный домен легкой цепи (VL) и вариабельный домен (VHH) нанотела, полученного от верблюдовых, а также альтернативную каркасную структуру, которая, как известно из уровня техники, функционирует в качестве антигенсвязывающего домена, такую как рекомбинантный фибронектиновый домен, и т. п. В некоторых случаях целесообразно, чтобы антигенсвязывающий домен был получен из того же вида, в организме которого в конечном итоге будут применять CAR. Например, для применения у людей может быть целесообразно, чтобы антигенсвязывающий домен CAR содержал человеческие или гуманизированные остатки в антигенсвязывающем домене антитела или фрагмента антитела. Таким образом, в одном аспекте антигенсвязывающий домен включает в себя антитело человека или фрагмент антитела.
В одном варианте осуществления антигенсвязывающий домен содержит одну, две, три (например, все три) CDR тяжелой цепи, CDR1 HC, CDR2 HC и CDR3 HC, антитела, описываемого в данном документе (например, антитела, описанного в WO2015/142675, US–2015–0283178–A1, US–2016–0046724–A1, US2014/0322212A1, US2016/0068601A1, US2016/0051651A1, US2016/0096892A1, US2014/0322275A1 или WO2015/090230, включенных в данный документ посредством ссылки) и/или одну, две, три (например, все три) CDR легкой цепи, CDR1 LC, CDR2 LC и CDR3 LC, антитела, описываемого в данном документе (например, антитела, описанного в WO2015/142675, US–2015–0283178–A1, US–2016–0046724–A1, US2014/0322212A1, US2016/0068601A1, US2016/0051651A1, US2016/0096892A1, US2014/0322275A1 или WO2015/090230, включенных в данный документ посредством ссылки). В одном варианте осуществления антигенсвязывающий домен содержит вариабельную область тяжелой цепи и/или вариабельную область легкой цепи антитела, указанного выше.
В вариантах осуществления антигенсвязывающий домен представляет собой антигенсвязывающий домен, описанный в WO2015/142675, US–2015–0283178–A1, US–2016–0046724–A1, US2014/0322212A1, US2016/0068601A1, US2016/0051651A1, US2016/0096892A1, US2014/0322275A1 или WO2015/090230, включенных в данный документ посредством ссылки.
В вариантах осуществления антигенсвязывающий домен нацеливается на BCMA и описан в US–2016–0046724–A1.
В вариантах осуществления антигенсвязывающий домен нацеливается на CD19 и описан в US–2015–0283178–A1.
В вариантах осуществления антигенсвязывающий домен нацеливается на CD123 и описан в US2014/0322212A1, US2016/0068601A1.
В вариантах осуществления антигенсвязывающий домен нацеливается на CLL и описан в US2016/0051651A1.
В вариантах осуществления антигенсвязывающий домен нацеливается на CD33 и описан в US2016/0096892A1.
Иллюстративные антигены–мишени, на которые можно нацеливаться с помощью клеток, экспрессирующих CAR, включают без ограничения, среди прочих, CD19, CD123, EGFRvIII, CD33, мезотелин, BCMA и GFR–альфа 4, описанные, например, в WO2014/153270, WO 2014/130635, WO2016/028896, WO 2014/130657, WO2016/014576, WO 2015/090230, WO2016/014565, WO2016/014535 и WO2016/025880, каждая из которых включена в данный документ посредством ссылки во всей своей полноте.
В других вариантах осуществления клетки, экспрессирующие CAR, могут специфично связываться с гуманизированным CD19, например, могут содержать молекулу CAR или антигенсвязывающий домен (например, гуманизированный антигенсвязывающий домен) согласно таблице 3 из WO2014/153270, включенной в данный документ посредством ссылки. Аминокислотные последовательности молекул CAR для CD19 и антигенсвязывающих доменов (например, содержащих одну, две, три CDR VH и одну, две, три CDR VL по Kabat или Chothia) и нуклеотидные последовательности, кодирующие их, указаны в WO2014/153270.
В других вариантах осуществления клетки, экспрессирующие CAR, могут специфично связываться с CD123, например, могут содержать молекулу CAR (например, любую из CAR1 – CAR8) или антигенсвязывающий домен согласно таблицам 1–2 из WO 2014/130635, включенной в данный документ посредством ссылки. Аминокислотные последовательности молекул CAR для CD123 и антигенсвязывающих доменов (например, содержащих одну, две, три CDR VH и одну, две, три CDR VL по Kabat или Chothia) и нуклеотидные последовательности, кодирующие их, указаны в WO 2014/130635.
В других вариантах осуществления клетки, экспрессирующие CAR, могут специфично связываться с CD123, например, могут содержать молекулу CAR (например, любую из CAR123–1 – CAR123–4 и hzCAR123–1 – hzCAR123–32) или антигенсвязывающий домен согласно таблицам 2, 6 и 9 из WO2016/028896, включенной в данный документ посредством ссылки. Аминокислотные последовательности молекул CAR для CD123 и антигенсвязывающих доменов (например, содержащих одну, две, три CDR VH и одну, две, три CDR VL по Kabat или Chothia) и нуклеотидные последовательности, кодирующие их, указаны в WO2016/028896.
В других вариантах осуществления клетки, экспрессирующие CAR, могут специфично связываться с EGFRvIII, например, могут содержать молекулу CAR или антигенсвязывающий домен согласно таблице 2 или SEQ ID NO: 11 из WO 2014/130657, включенной в данный документ посредством ссылки. Аминокислотные последовательности молекул CAR для EGFRvIII и антигенсвязывающих доменов (например, содержащих одну, две, три CDR VH и одну, две, три CDR VL по Kabat или Chothia) и нуклеотидные последовательности, кодирующие их, указаны в WO 2014/130657.
В других вариантах осуществления клетки, экспрессирующие CAR, могут специфично связываться с CD33, например, могут включать молекулу CAR (например, любую из CAR33–1 – CAR–33–9) или антигенсвязывающий домен согласно таблице 2 или 9 из WO2016/014576, включенной в данный документ посредством ссылки. Аминокислотные последовательности молекул CAR для CD33 и антигенсвязывающих доменов (например, содержащих одну, две, три CDR VH и одну, две, три CDR VL по Kabat или Chothia) и нуклеотидные последовательности, кодирующие их, указаны в WO2016/014576.
В других вариантах осуществления клетки, экспрессирующие CAR, могут специфично связываться с мезотелином, например, могут содержать молекулу CAR или антигенсвязывающий домен согласно таблицам 2–3 из WO 2015/090230, включенной в данный документ посредством ссылки. Аминокислотные последовательности молекул CAR для мезотелина и антигенсвязывающих доменов (например, содержащих одну, две, три CDR VH и одну, две, три CDR VL по Kabat или Chothia) и нуклеотидные последовательности, кодирующие их, указаны в WO 2015/090230.
В других вариантах осуществления клетки, экспрессирующие CAR, могут специфично связываться с BCMA, например, могут содержать молекулу CAR или антигенсвязывающий домен согласно таблице 1 или 16, SEQ ID NO: 271 или SEQ ID NO: 273 из WO2016/014565, включенной в данный документ посредством ссылки. Аминокислотные последовательности молекул CAR для BCMA и антигенсвязывающих доменов (например, содержащих одну, две, три CDR VH и одну, две, три CDR VL по Kabat или Chothia) и нуклеотидные последовательности, кодирующие их, указаны в WO2016/014565.
В других вариантах осуществления клетки, экспрессирующие CAR, могут специфично связываться с CLL–1, например, могут содержать молекулу CAR или антигенсвязывающий домен согласно таблице 2 из WO2016/014535, включенной в данный документ посредством ссылки. Аминокислотные последовательности молекул CAR для CLL–1 и антигенсвязывающих доменов (например, содержащих одну, две, три CDR VH и одну, две, три CDR VL по Kabat или Chothia) и нуклеотидные последовательности, кодирующие их, указаны в WO2016/014535.
В других вариантах осуществления клетки, экспрессирующие CAR, могут специфично связываться с GFR–альфа 4, например, могут содержать молекулу CAR или антигенсвязывающий домен согласно таблице 2 из WO2016/025880, включенной в данный документ посредством ссылки. Аминокислотные последовательности молекул CAR для GFR–альфа 4 и антигенсвязывающих доменов (например, содержащих одну, две, три CDR VH и одну, две, три CDR VL по Kabat или Chothia) и нуклеотидные последовательности, кодирующие их, указаны в WO2016/025880.
В одном варианте осуществления антигенсвязывающий домен любой из молекул CAR, описанных в данном документе (например, любого из CD19, CD123, EGFRvIII, CD33, мезотелина, BCMA и GFR–альфа 4) содержит одну, две, три (например, все три) CDR тяжелой цепи, CDR1 HC, CDR2 HC и CDR3 HC, антитела, указанного выше, и/или одну, две, три (например, все три) CDR легкой цепи, CDR1 LC, CDR2 LC и CDR3 LC, антигенсвязывающего домена, указанного выше. В одном варианте осуществления антигенсвязывающий домен содержит вариабельную область тяжелой цепи и/или вариабельную область легкой цепи антитела, указанного или описанного выше.
В одном варианте осуществления CD19–связывающий домен содержит одну или несколько (например, все три) из области 1, определяющей комплементарность, легкой цепи (CDR1 LC), области 2, определяющей комплементарность, легкой цепи (CDR2 LC) и области 3, определяющей комплементарность, легкой цепи (CDR3 LC) CD19–связывающего домена, выбранного из SEQ ID NO: 45–56, 69–80, 106, 109, 110, 112 или 115, и одну или несколько (например, все три) из области 1, определяющей комплементарность, тяжелой цепи (CDR1 HC), области 2, определяющей комплементарность, тяжелой цепи (CDR2 HC) и области 3, определяющей комплементарность, тяжелой цепи (CDR3 HC) CD19–связывающего домена, выбранного из SEQ ID NOS: 45–56, 69–80, 106, 109, 110, 112, или 115. В одном варианте осуществления CD19–связывающий домен содержит вариабельную область легкой цепи, описываемую в данном документе (например, в таблице 2 или 3), и/или вариабельную область тяжелой цепи, описываемую в данном документе (например, в таблице 2 или 3). В одном варианте осуществления CD19–связывающий домен представляет собой scFv, содержащий вариабельную область легкой цепи и вариабельную область тяжелой цепи с аминокислотной последовательностью из таблицы 2 или 3. В варианте осуществления CD19–связывающий домен (например, scFv) содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен), аминокислотной последовательности вариабельной области легкой цепи, представленной в таблице 2 или 3, или последовательность, на 95–99% идентичную аминокислотной последовательности из таблицы 2 или 3; и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен), аминокислотной последовательности вариабельной области тяжелой цепи, представленной в таблице 2 или 3, или последовательность, на 95–99% идентичную аминокислотной последовательности из таблицы 2 или 3.
В одном варианте осуществления CD19–связывающий домен содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность, описываемую в данном документе, например, в таблице 2 или 3, присоединенную к вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, описываемую в данном документе, например, в таблице 2 или 3, с помощью линкера, например, линкера, описываемого в данном документе. В одном варианте осуществления гуманизированный CD19–связывающий домен содержит линкер (Gly4–Ser)n (SEQ ID NO: 26), где n равняется 1, 2, 3, 4, 5, или 6, предпочтительно 3 или 4. Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv могут находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи–линкер–вариабельная область тяжелой цепи или вариабельная область тяжелой цепи–линкер–вариабельная область легкой цепи.
В другом варианте осуществления CD19–связывающий домен включает в себя любое антитело или фрагмент этого антитела, известные из уровня техники, которые связываются с CD19.
В одном аспекте антитела по настоящему изобретению могут существовать во множестве других форм, в том числе, например, в виде Fab–, Fab'–, F(ab')2–, Fv–фрагментов, scFv–фрагментов антител, Fv, стабилизированных дисульфидными связями (sdFv), Fd–фрагмента, состоящего из VH– и CH1–доменов, линейных антител, однодоменных антител, таких как sdAb (VL или VH), VHH–доменов верблюдовых, полиспецифических антител, образованных из фрагментов антител, таких как бивалентный фрагмент, содержащий два Fab–фрагмента, связанных дисульфидным мостиком в шарнирной области, а также выделенного CDR или других эпитопсвязывающих фрагментов антитела. В одном аспекте фрагмент антитела, представленный в данном документе, представляет собой scFv. В некоторых случаях scFv человека также можно получить из дрожжевой дисплейной библиотеки.
Гуманизированное антитело можно получить с помощью различных методик, известных из уровня техники, в том числе без ограничения пересадки CDR (см., например, европейский патент № EP 239400; международную публикацию № WO 91/09967 и патенты США №№ 5225539, 5530101 и 5585089, каждый из которых включен в данный документ посредством ссылки во всей своей полноте), венирования или изменения поверхности (см., например, европейские патенты №№ EP 592106 и EP 519596; Padlan, 1991, Molecular Immunology, 28(4/5):489–498; Studnicka et al., 1994, Protein Engineering, 7(6):805–814; и Roguska et al., 1994, PNAS, 91:969–973, каждый из которых включен в данный документ посредством ссылки во всей своей полноте), перетасовки цепей (см., например, патент США № 5565332, включенный в данный документ посредством ссылки во всей своей полноте) и методик, раскрытых, например, в публикации заявки на патент США № US2005/0042664, публикации заявки на патент США № US2005/0048617, патенте США № 6407213, патенте США № 5766886, международной публикации № WO 9317105, Tan et al., J. Immunol., 169:1119–25 (2002), Caldas et al., Protein Eng., 13(5):353–60 (2000), Morea et al., Methods, 20(3):267–79 (2000), Baca et al., J. Biol. Chem., 272(16):10678–84 (1997), Roguska et al., Protein Eng., 9(10):895–904 (1996), Couto et al., Cancer Res., 55 (23 Supp):5973s–5977s (1995), Couto et al., Cancer Res., 55(8):1717–22 (1995), Sandhu J S, Gene, 150(2):409–10 (1994) и Pedersen et al., J. Mol. Biol., 235(3):959–73 (1994), каждый из которых включен в данный документ посредством ссылки во всей своей полноте. Дополнительная информация о каркасных областях и гуманизированных антителах описана на страницах 169–170 международной заявки WO 2016/164731, поданной 8 апреля 2016 г., которая включена посредством ссылки во всей своей полноте.
Выбор вариабельных доменов человека как легкой, так и тяжелой цепи для использования при создании гуманизированных антител необходим для снижения антигенности. В соответствии с так называемым способом "наилучшего соответствия" последовательность вариабельного домена антитела грызуна подвергают скринингу по всей библиотеке известных последовательностей вариабельных доменов человека. Последовательность человека, которая является наиболее близкой к последовательности грызуна, затем принимают в качестве каркасной области человека (FR) для гуманизированного антитела (Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987), содержание которых включено в данный документ посредством ссылки во всей своей полноте). В другом способе применяют конкретную каркасную область, полученную из консенсусной последовательности всех антител человека из определенной подгруппы легких или тяжелых цепей. Одну и ту же каркасную область можно использовать для нескольких различных гуманизированных антител (см., например, Nicholson et al. Mol. Immun. 34 (16–17): 1157–1165 (1997); Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993), содержание которых включено в данный документ посредством ссылки во всей своей полноте). В некоторых вариантах осуществления каркасная область, например, все четыре каркасные области вариабельной области тяжелой цепи, получена из последовательности VH4_4–59 зародышевого типа. В одном варианте осуществления каркасная область может содержать одну, две, три, четыре или пять модификаций, например, замен, например, аминокислот в соответствующей последовательности мыши (например, SEQ ID NO: 109). В одном варианте осуществления каркасная область, например, все четыре каркасные области вариабельной области легкой цепи, получена из последовательности VK3_1.25 зародышевого типа. В одном варианте осуществления каркасная область может содержать одну, две, три, четыре или пять модификаций, например, замен, например, аминокислот в соответствующей последовательности мыши (например, SEQ ID NO: 109). Разработка гуманизированных антител или фрагментов антител на основе трехмерной конформационной структуры подробно описана на странице 171 международной заявки WO 2016/164731, поданной 8 апреля 2016 г., которая включена посредством ссылки во всей своей полноте.
Гуманизированное антитело или фрагмент антитела может сохранять антигенную специфичность, сходную со специфичностью исходного антитела, например, в настоящем изобретении, способность связывать CD19 человека. В некоторых вариантах осуществления гуманизированное антитело или фрагмент антитела могут иметь улучшенную аффинность и/или специфичность связывания с CD19 человека.
В одном аспекте связывающий домен (например, антигенсвязывающий домен, который связывает CD19) представляет собой фрагмент, например, одноцепочечный вариабельный фрагмент (scFv). В одном аспекте связывающий домен представляет собой Fv, Fab, (Fab')2 или бифункциональное (например, биспецифическое) гибридное антитело (например, Lanzavecchia et al., Eur. J. Immunol. 17, 105 (1987)). В одном аспекте антитела и их фрагменты по настоящему изобретению связывают белок CD19 с аффинностью дикого типа или усиленной аффинностью.
В некоторых случаях scFv можно получить в соответствии со способом, известным из уровня техники (см., например, Bird et al., (1988) Science 242:423–426 и Huston et al., (1988) Proc. Natl. Acad. Sci. USA 85:5879–5883). Молекулы scFv можно получить путем связывания VH– и VL–областей друг с другом с помощью гибких полипептидных линкеров. Молекулы scFv содержат линкер (например, линкер Ser–Gly) с оптимизированными длиной и/или аминокислотным составом. Длина линкера может сильно влиять на то, как вариабельные области scFv сворачиваются и взаимодействуют. В действительности, если используют короткий полипептидный линкер (например, 5–10 аминокислот), то внутрицепочечное сворачивание предотвращается. Межцепочечное сворачивание также необходимо для объединения двух вариабельных областей с образованием функционального эпитопсвязывающего участка. Примеры ориентации и размера линкеров см., например, в Hollinger et al. 1993 Proc Natl Acad. Sci. U.S.A. 90:6444–6448, публикациях заявок на патент США №№ 2005/0100543, 2005/0175606, 2007/0014794 и публикациях согласно PCT №№ WO2006/020258 и WO2007/024715, включенных в данный документ посредством ссылки.
ScFv может содержать линкер по меньшей мере из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, или более аминокислотных остатков между его VL– и VH–областями. Линкерная последовательность может содержать любую встречающуюся в природе аминокислоту. В некоторых вариантах осуществления линкерная последовательность содержит аминокислоты глицин и серин. В другом варианте осуществления линкерная последовательность содержит группы глициновых и сериновых повторов, таких как (Gly4Ser)n, где n представляет собой положительное целое число, равное или большее 1 (SEQ ID NO: 25). В одном варианте осуществления линкер может представлять собой (Gly4Ser)4 (SEQ ID NO: 27) или (Gly4Ser)3 (SEQ ID NO: 28). При изменении длины линкера может сохраняться или усиливаться активность, что приводит к улучшению эффективности в исследованиях активности.
В некоторых вариантах осуществления аминокислотную последовательность антигенсвязывающего домена (например, антигенсвязывающего домена, который связывает CD19) или других частей или всего CAR можно модифицировать, например, аминокислотную последовательность, описываемую в данном документе, можно модифицировать, например, с помощью консервативной замены. В уровне техники были определены семейства аминокислотных остатков, имеющих сходные боковые цепи, в том числе аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета–разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин).
Процентная идентичность применительно к двум или более нуклеиновым кислотам или полипептидным последовательностям относится к двум или более последовательностям, которые являются одинаковыми. Две последовательности являются "по сути идентичными", если две последовательности имеют определенную процентную долю аминокислотных остатков или нуклеотидов, которые являются одинаковыми (например, идентичными на 60%, необязательно идентичными на 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% в определенной области или, если не указано, во всей последовательности) при сравнении и выравнивании для достижения максимального соответствия в окне сравнения или указанной области, измеряемую с использованием одного из следующих алгоритмов сравнения последовательностей или с помощью выравнивания в ручном режиме и визуального осмотра. Идентичность необязательно существует в области, которая имеет длину по меньшей мере приблизительно 50 нуклеотидов (или 10 аминокислот), или более предпочтительно в области, которая имеет длину 100–500 или 1000 или более нуклеотидов (или 20, 50, 200 или более аминокислот).
При сравнении последовательностей обычно одна последовательность выступает в качестве эталонной последовательности, с которой сравнивают тестируемые последовательности. При использовании алгоритма сравнения последовательностей тестируемую и эталонную последовательности вводят в компьютер, если необходимо, устанавливают координаты подпоследовательностей, и устанавливают программные параметры алгоритма для анализа последовательностей. Можно использовать программные параметры по умолчанию или можно установить альтернативные параметры. Алгоритм сравнения последовательностей затем рассчитывает значения процентной идентичности последовательностей для тестируемых последовательностей по сравнению с эталонной последовательностью, исходя из программных параметров. Способы выравнивания последовательностей для сравнения хорошо известны из уровня техники. Оптимальное выравнивание последовательностей для сравнения можно проводить, например, с помощью алгоритма поиска локальной гомологии Смита–Уотермана, (1970) Adv. Appl. Math. 2:482c, с помощью алгоритма выравнивания областей гомологии Нидлмана–Вунша, (1970) J. Mol. Biol. 48:443, с помощью способа поиска сходства Пирсона–Липмана, (1988) Proc. Nat'l. Acad. Sci. USA 85:2444, с помощью компьютерных реализаций этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в составе пакета программного обеспечения Wisconsin Genetics, Genetics Computer Group, 575 Science Dr., Мэдисон, Висконсин) или с помощью выравнивания в ручном режиме и визуального осмотра (см., например, Brent et al., (2003) Current Protocols in Molecular Biology).
Двумя примерами алгоритмов, которые являются подходящими для определения процентной идентичности последовательностей и сходства последовательностей, являются алгоритмы BLAST и BLAST 2.0, которые описаны соответственно в Altschul et al., (1977) Nuc. Acids Res. 25:3389–3402 и Altschul et al., (1990) J. Mol. Biol. 215:403–410. Программное обеспечение для осуществления анализов BLAST является общедоступным от Национального центра биотехнологической информации.
Процентную идентичность между двумя аминокислотными последовательностями также можно определить с помощью алгоритма Миллера–Майерса, (1988) Comput. Appl. Biosci. 4:11–17, который был включен в программу ALIGN (версия 2.0), при использовании таблицы весов замен остатков PAM120, штрафа за продление гэпа 12 и штрафа за открытие гэпа 4. Кроме того, процентную идентичность между двумя аминокислотными последовательностями можно определить с помощью алгоритма Нидлмана–Вунша, (1970) J. Mol. Biol. 48:444–453, который был включен в программу GAP в составе пакета программного обеспечения GCG (доступного на www.gcg.com), с использованием матрицы Blossom 62 либо матрицы PAM250, а также штрафа за открытие гэпа 16, 14, 12, 10, 8, 6, или 4 и штрафа за продление гэпа 1, 2, 3, 4, 5, или 6.
В одном аспекте настоящее изобретение предусматривает модификации аминокислотной последовательности исходного антитела или фрагмента (например, scFv), в результате которых создаются функционально эквивалентные молекулы. Например, VH или VL связывающего домена (например, антигенсвязывающего домена, который связывает CD19), например, scFv, содержащегося в CAR, можно модифицировать таким образом, чтобы она сохраняла по меньшей мере приблизительно 70%, 71%. 72%. 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичность с исходной каркасной областью VH или VL CD19–связывающего домена, например, scFv. Настоящее изобретение предусматривает модификации всей конструкции CAR, например, модификации одной или нескольких аминокислотных последовательностей различных доменов конструкции CAR, для создания функционально эквивалентных молекул. Конструкцию CAR можно модифицировать таким образом, чтобы она сохраняла по меньшей мере приблизительно 70%, 71%. 72%. 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичность с исходной конструкцией CAR.
В некоторых случаях scFv можно получить в соответствии со способом, известным из уровня техники (см., например, Bird et al., (1988) Science 242:423–426 и Huston et al., (1988) Proc. Natl. Acad. Sci. USA 85:5879–5883). Молекулы scFv можно получить путем связывания VH– и VL–областей друг с другом, например, с помощью гибких полипептидных линкеров. Молекулы scFv могут содержать линкер (например, линкер Ser–Gly) с оптимизированными длиной и/или аминокислотным составом. Длина линкера может сильно влиять на то, как вариабельные области scFv сворачиваются и взаимодействуют. В действительности, если используют короткий полипептидный линкер (например, 5–10 аминокислот), то внутрицепочечное сворачивание предотвращается. Межцепочечное сворачивание также необходимо для объединения двух вариабельных областей с образованием функционального эпитопсвязывающего участка. Примеры ориентации и размера линкеров см., например, в Hollinger et al. 1993 Proc Natl Acad. Sci. U.S.A. 90:6444–6448, публикациях заявок на патент США №№ 2005/0100543, 2005/0175606, 2007/0014794 и публикациях согласно PCT №№ WO2006/020258 и WO2007/024715, включенных в данный документ посредством ссылки.
Иллюстративные антигенсвязывающие домены для CD19 и конструкции CAR
Иллюстративные конструкции CAR для CD19, раскрытые в данном документе, содержат scFv (например, scFv человека), раскрытый в таблице 2 или 3 в данном документе, перед которым необязательно расположена необязательная лидерная последовательность (например, SEQ ID NO: 1 и SEQ ID NO: 12 соответственно для иллюстративных лидерной аминокислотной и нуклеотидной последовательностей). Последовательности фрагментов scFv (аминокислотные последовательности SEQ ID NO: 45–56, 69–80, 106, 109, 110, 112 или 115) представлены в данном документе в таблице 2 или 3. Конструкция CAR для CD19 может дополнительно содержать необязательный шарнирный домен, например, шарнирный домен CD8 (например, содержащий аминокислотную последовательность под SEQ ID NO: 2 или кодируемый последовательностью нуклеиновой кислоты под SEQ ID NO: 13); трансмембранный домен, например, трансмембранный домен CD8 (например, содержащий аминокислотную последовательность под SEQ ID NO: 6 или кодируемый нуклеотидной последовательностью под SEQ ID NO: 17); внутриклеточный домен, например, внутриклеточный домен 4–1BB (например, содержащий аминокислотную последовательность под SEQ ID NO: 7 или кодируемый нуклеотидной последовательностью под SEQ ID NO: 18); и функциональный сигнальный домен, например, домен CD3–дзета (например, содержащий аминокислотную последовательность под SEQ ID NO: 9 или 10 или кодируемый нуклеотидной последовательностью под SEQ ID NO: 20 или 21). В определенных вариантах осуществления домены являются смежными и находятся в одной и той же рамке считывания, образуя единый слитый белок. В других вариантах осуществления домены находятся в отдельных полипептидах, например, как в молекуле RCAR, описываемой в данном документе.
В определенных вариантах осуществления полноразмерная молекула CAR для CD19 содержит аминокислотную последовательность или кодируется нуклеотидной последовательностью CAR1–CAR12, CTL019, mCAR1–mCAR3 или SSJ25–C1, представленной в таблице 2 или 3, или содержит последовательность, по сути идентичную (например, идентичную на 95–99% или содержащую до 20, 15, 10, 8, 6, 5, 4, 3, 2, или 1 аминокислотной замены) любой из вышеупомянутых последовательностей.
В определенных вариантах осуществления молекула CAR для CD19 или антигенсвязывающий домен для CD19 содержит аминокислотную последовательность scFv или кодируется нуклеотидной последовательностью CAR1–CAR12, CTL019, mCAR1–mCAR3, или SSJ25–C1 , , представленной в таблице 2 или 3, или содержит последовательность, по сути идентичную (например, идентичную на 95–99% или содержащую до 20, 15, 10, 8, 6, 5, 4, 3, 2, или 1 аминокислотной замены) любой из вышеупомянутых последовательностей.
В определенных вариантах осуществления молекула CAR для CD19 или антигенсвязывающий домен для CD19 содержит вариабельную область тяжелой цепи и/или вариабельную область легкой цепи CAR1–CAR12, CTL019, mCAR1–mCAR3 или SSJ25–C1, представленную в таблице 2 или 3, или последовательность, по сути идентичную (например, идентичную на 95–99% или содержащую до 20, 15, 10, 8, 6, 5, 4, 3, 2, или 1 аминокислотной замены) любой из вышеупомянутых последовательностей.
В определенных вариантах осуществления молекула CAR для CD19 или антигенсвязывающий домен для CD19 содержит одну, две или три CDR вариабельной области тяжелой цепи (например, HCDR1, HCDR2 и/или HCDR3) CAR1–CAR12, CTL019, mCAR1–mCAR3, или SSJ25–C1, представленные в таблице 2 или 3; и/или одну, две или три CDR вариабельной области легкой цепи (например, LCDR1, LCDR2 и/или LCDR3) CAR1–CAR12, CTL019, mCAR1–mCAR3, или SSJ25–C1, представленные в таблице 2 или 3; или последовательность, по сути идентичную (например, идентичную на 95–99% или содержащую до 5, 4, 3, 2, или 1 аминокислотной замены) любой из вышеупомянутых последовательностей.
Последовательности CDR scFv–доменов показаны в таблице 4 для вариабельных доменов тяжелой цепи и в таблице 5 для вариабельных доменов легкой цепи.
Аминокислотные последовательности и scFv–доменов CD19 и молекул CAR для CD19, а также кодирующие их последовательности нуклеиновых кислот представлены в таблицах 2 и 3. В одном варианте осуществления молекула CAR для CD19 содержит лидерную последовательность, описываемую в данном документе, например, подчеркиваемую в последовательностях, представленных в таблицах 2 и 3. В одном варианте осуществления молекула CAR для CD19 не содержит лидерную последовательность.
В вариантах осуществления молекула CAR содержит антигенсвязывающий домен, который специфично связывается с CD19 (CAR для CD19). В одном варианте осуществления антигенсвязывающий домен нацеливается на CD19 человека. В одном варианте осуществления антигенсвязывающий домен CAR обладает такой же или сходной специфичностью связывания по сравнению с scFv–фрагментом FMC63, описанным в Nicholson et al. Mol. Immun. 34 (16–17): 1157–1165 (1997). В одном варианте осуществления антигенсвязывающий домен CAR включает в себя scFv–фрагмент, описанный в Nicholson et al. Mol. Immun. 34 (16–17): 1157–1165 (1997). Молекула антитела к CD19 может представлять собой, например, молекулу антитела (например, молекулу гуманизированного антитела к CD19), описанную в WO2014/153270, включенной в данный документ посредством ссылки во всей своей полноте. В WO2014/153270 также описаны способы анализа связывания и эффективности различных конструкций CAR.
В одном аспекте исходная последовательность scFv мыши представляет собой конструкцию CAR19, представленную в публикации согласно PCT WO2012/079000 (включенной в данный документ посредством ссылки) и представленную в данном документе под SEQ ID NO: 108. В одном варианте осуществления CD19–связывающий домен представляет собой scFv, описанный в WO2012/079000 и представленный в данном документе под SEQ ID NO: 109.
В одном варианте осуществления молекула CAR содержит полипептидную последовательность, представленную под SEQ ID NO: 12 в публикации согласно PCT WO2012/079000 и представленную в данном документе под SEQ ID NO: 108, где scFv–домен заменен одной или несколькими последовательностями, выбранными из SEQ ID NO: 93–104. В одном варианте осуществления scFv–домены под SEQ ID NO: 93–104 являются гуманизированными вариантами scFv–домена под SEQ ID NO: 109, который представляет собой scFv–фрагмент мышиного происхождения, специфично связывающийся с CD19 человека. Гуманизация этого scFv мыши может быть желательной в клинических условиях, когда специфические для мышей остатки могут индуцировать ответ с образованием антител человека к антигену мыши (HAMA) у пациентов, которые получают лечение с помощью CART19, например, лечение с помощью T–клеток, трансдуцированных конструкцией CAR19.
В одном варианте осуществления CAR для CD19 содержит аминокислотную последовательность, представленную под SEQ ID NO: 12 в публикации согласно PCT WO2012/079000. В варианте осуществления аминокислотная последовательность представляет собой
MALPVTALLLPLALLLHAARPdiqmtqttsslsaslgdrvtiscrasqdiskylnwyqqkpdgtvklliyhtsrlhsgvpsrfsgsgsgtdysltisnleqediatyfcqqgntlpytfgggtkleitggggsggggsggggsevklqesgpglvapsqslsvtctvsgvslpdygvswirqpprkglewlgviwgsettyynsalksrltiikdnsksqvflkmnslqtddtaiyycakhyyyggsyamdywgqgtsvtvsstttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr (SEQ ID NO: 108), или последовательность, по сути гомологичную ей.
В одном варианте осуществления аминокислотная последовательность представляет собой
diqmtqttsslsaslgdrvtiscrasqdiskylnwyqqkpdgtvklliyhtsrlhsgvpsrfsgsgsgtdysltisnleqediatyfcqqgntlpytfgggtkleitggggsggggsggggsevklqesgpglvapsqslsvtctvsgvslpdygvswirqpprkglewlgviwgsettyynsalksrltiikdnsksqvflkmnslqtddtaiyycakhyyyggsyamdywgqgtsvtvsstttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr (SEQ ID NO: 289), или последовательность, по сути гомологичную ей.
В одном варианте осуществления CAR для CD19 имеет обозначение согласно USAN TISAGENLECLEUCEL–T. В вариантах осуществления CTL019 получают посредством генной модификации T–клеток, опосредованной стабильной вставкой путем трансдукции с помощью самоинактивирующегося лентивирусного (LV) вектора, дефектного по репликации, содержащего трансген CTL019 под контролем промотора EF–1 альфа. CTL019 может представлять собой смесь положительных и отрицательных по трансгену Т–клеток, которые доставляют субъекту из расчета процентного количества положительных по трансгену Т–клеток.
В других вариантах осуществления CAR для CD19 содержит антигенсвязывающий домен (например, гуманизированный антигенсвязывающий домен) согласно таблице 3 из WO2014/153270, включенной в данный документ посредством ссылки.
В вариантах осуществления молекула CAR представляет собой молекулу CAR для CD19, описываемую в данном документе, например, гуманизированную молекулу CAR, описываемую в данном документе, например, гуманизированную молекулу CAR для CD19, указанную в таблице 2 или имеющую CDR, изложенные в таблицах 4 и 5.
В вариантах осуществления молекула CAR представляет собой молекулу CAR для CD19, описываемую в данном документе, например, молекулу мышиного CAR, описываемую в данном документе, например, молекулу мышиного CAR для CD19, указанную в таблице 3 или имеющую CDR, изложенные в таблицах 4 и 5.
В некоторых вариантах осуществления молекула CAR содержит одну, две и/или три CDR из вариабельной области тяжелой цепи и/или одну, две и/или три CDR из вариабельной области легкой цепи мышиного или гуманизированного CAR для CD19 из таблиц 4 и 5.
В одном варианте осуществления антигенсвязывающий домен содержит одну, две, три (например, все три) CDR тяжелой цепи, CDR1 HC, CDR2 HC и CDR3 HC, антитела, указанного в данном документе, и/или одну, две, три (например, все три) CDR легкой цепи, CDR1 LC, CDR2 LC и CDR3 LC, антитела, указанного в данном документе. В одном варианте осуществления антигенсвязывающий домен содержит вариабельную область тяжелой цепи и/или вариабельную область легкой цепи антитела, указанного в данном документе.
Гуманизация антитела мыши к CD19
Гуманизация антитела мыши к CD19 желательна в клинических условиях, когда специфические для мышей остатки могут индуцировать ответ с образованием антител человека к антигену мыши (HAMA) у пациентов, которые получают лечение с помощью CART19, т. е. лечение с помощью T–клеток, трансдуцированных конструкцией CAR19. Получение, определение характеристик и эффективность гуманизированных последовательностей CAR для CD19 описаны в международной заявке WO2014/153270, включенной в данный документ посредством ссылки во всей своей полноте, включая примеры 1–5 (стр. 115–159), например, таблицы 3, 4 и 5 (стр. 125–147).
Конструкции CAR, например, конструкции CAR для CD19
Из конструкций CAR для CD19, описанных в международной заявке WO2014/153270, определенные последовательности воспроизведены в данном документе.
Последовательности гуманизированных фрагментов scFv (SEQ ID NO: 45–56) представлены ниже в таблице 2. Полные конструкции CAR создавали с использованием SEQ ID NO: 45–56 с дополнительными последовательностями, например, из таблицы 1, показанными ниже, для создания полных конструкций CAR с SEQ ID NO: 93–104.
Все эти клоны содержали изменение остатков Q/K в сигнальном домене костимулирующего домена, полученного из 4–1BB.
Таблица 2. Конструкции гуманизированных CAR для CD19
Во всех аминокислотных последовательностях растворимых scFv необязательная сигнальная последовательность показана жирным шрифтом и подчеркиванием; и гистидиновая метка подчеркнута.
Во всех аминокислотных последовательностях CAR относительное местоположение CDR подчеркнуто и выделено жирным шрифтом.
CAR1,
растворимый scFv – н. к.
CAR1,
растворимый scFv – а. к.
CAR 1 – полный – н. к.
CAR 1 – полный – а. к.
CAR2 – растворимый scFv – н. к.
CAR2 – растворимый scFv – а. к.
CAR 2 – полный – н. к.
CAR 2 – полный – а. к.
CAR 3 – растворимый scFv – н. к.
CAR 3 – растворимый scFv – а. к.
CAR 3 – полный – н. к.
CAR 3 – полный – а. к.
CAR 4 – полный – н. к.
CAR 4 – полный – а. к.
CAR5 – растворимый scFv – н. к.
CAR5 – растворимый scFv – а. к.
CAR 5 – полный – н. к.
CAR 5 – полный – а. к.
scFv–домен
CAR6 – растворимый scFv – н. к.
CAR6 – растворимый scFv – а. к.
CAR6 –
полный – н. к.
CAR6 –
полный – а. к.
CAR7 – растворимый scFv – н. к.
CAR7 – растворимый scFv – а. к.
CAR 7,
полный – н. к.
CAR 7,
полный – а. к.
CAR8 – растворимый scFv – н. к.
CAR8 – растворимый scFv – а. к.
CAR 8 – полный – а. к.
CAR9 – растворимый scFv – н. к.
CAR9 – растворимый scFv – а. к.
CAR 9 – полный – н. к.
CAR 9 – полный – а. к.
CAR10 – растворимый scFv – а. к.
CAR 10 – полный – а. к.
CAR11 – растворимый scFv – н. к.
CAR 11 – полный – а. к.
scFv–домен
CAR12 – растворимый scFv – н. к.
CAR12 – растворимый scFv – а. к.
CAR 12 – полный – н. к.
CAR 12 – полный – а. к.
Таблица 3. Конструкции мышиных CAR для CD19
Во всех аминокислотных последовательностях растворимых scFv необязательная сигнальная последовательность показана жирным шрифтом и подчеркиванием; и гистидиновая метка подчеркнута.
NO:
AFIIFWVKRG RKKLLYIFKQ PFMRPVQTTQ EEDGCSCRFE EEEGGCELRV KFSRSADAPA YQQGQNQLYN ELNLGRREEY DVLDKRRGRD PEMGGKPRRK NPQEGLYNEL QKDKMAEAYS EIGMKGERRR GKGHDGLYQG LSTATKDTYD ALHMQALPPR LEGGGEGRGS LLTCGDVEEN PGPRMLLLVT SLLLCELPHP AFLLIPRKVC NGIGIGEFKD SLSINATNIK HFKNCTSISG DLHILPVAFR GDSFTHTPPL DPQELDILKT VKEITGFLLI QAWPENRTDL HAFENLEIIR
GRTKQHGQFS LAVVSLNITS LGLRSLKEIS DGDVIISGNK NLCYANTINW KKLFGTSGQK TKIISNRGEN SCKATGQVCH ALCSPEGCWG PEPRDCVSCR NVSRGRECVD KCNLLEGEPR EFVENSECIQ CHPECLPQAM NITCTGRGPD NCIQCAHYID GPHCVKTCPA GVMGENNTLV WKYADAGHVC HLCHPNCTYG CTGPGLEGCP TNGPKIPSIA TGMVGALLLL LVVALGIGLF M
В некоторых вариантах осуществления антигенсвязывающий домен содержит CDR1 HC, CDR2 HC и CDR3 HC с любыми аминокислотными последовательностями связывающего домена тяжелой цепи, указанными в таблице 2 или 3. В вариантах осуществления антигенсвязывающий домен дополнительно содержит CDR1 LC, CDR2 LC и CDR3 LC. В вариантах осуществления антигенсвязывающий домен содержит CDR1 LC, CDR2 LC и CDR3 LC с любыми аминокислотными последовательностями связывающего домена легкой цепи, указанными в таблице 2 или 3.
В некоторых вариантах осуществления антигенсвязывающий домен содержит одну, две или все из CDR1 LC, CDR2 LC и CDR3 LC с любыми аминокислотными последовательностями связывающего домена легкой цепи, указанными в таблице 2 или 3, и одну, две или все из CDR1 HC, CDR2 HC и CDR3 HC с любыми аминокислотными последовательностями связывающего домена тяжелой цепи, указанными в таблице 2 или 3.
В некоторых вариантах осуществления CDR определены согласно схеме нумерации по Kabat, схеме нумерации по Chothia или их комбинации.
Последовательности гуманизированных CDR scFv–доменов показаны в таблице 4 для вариабельных доменов тяжелой цепи и в таблице 5 для вариабельных доменов легкой цепи. "ID" обозначает соответствующий SEQ ID NO для каждой CDR.
Таблица 4. CDR вариабельных доменов тяжелой цепи (Kabat)
ID
NO:
ID
NO:
ID
NO:
Таблица 5. CDR вариабельных доменов легкой цепи (Kabat)
ID
NO:
ID
NO:
ID
NO:
Затем фрагменты scFv CAR клонировали в лентивирусные векторы для создания полноразмерной конструкции CAR в одной кодирующей рамке считывания с использованием промотора EF1–альфа для экспрессии (SEQ ID NO: 11).
В некоторых вариантах осуществления CAR для CD19 содержит антигенсвязывающий домен, полученный из антитела к CD19 (например, моно– или биспецифического антитела к CD19) или его фрагмента или конъюгата (например, содержит его аминокислотную последовательность). В одном варианте осуществления антитело к CD19 представляет собой гуманизированный антигенсвязывающий домен, описанный в WO2014/153270 (например, в таблице 3 из WO2014/153270), включенной в данный документ посредством ссылки, или его конъюгат. Другие иллюстративные антитела к CD19 или их фрагменты или конъюгаты включают без ограничения биспецифический активатор, привлекающий T–клетки, который нацеливается на CD19 (например, блинатумомаб), SAR3419 (Sanofi), MEDI–551 (MedImmune LLC), комботокс, DT2219ARL (Masonic Cancer Center), MOR–208 (также называемый XmAb–5574; MorphoSys), XmAb–5871 (Xencor), MDX–1342 (Bristol–Myers Squibb), SGN–CD19A (Seattle Genetics) и AFM11 (Affimed Therapeutics). См., например, Hammer. MAbs. 4,5(2012): 571–77. Блинатумомаб представляет собой биспецифическое антитело, состоящее из двух scFv, один из которых связывается с CD19, а другой связывается с CD3. Блинатумомаб направляет Т–клетки на атаку раковых клеток. См., например, Hammer et al.; клинические испытания с идентификатором NCT00274742 и NCT01209286. MEDI–551 представляет собой гуманизированное антитело к CD19 с Fc, сконструированным таким образом, что он обладает усиленной антителозависимой клеточноопосредованной цитотоксичностью (ADCC). См., например, Hammer et al. и клиническое испытание с идентификатором NCT01957579. Комботокс представляет собой смесь иммунотоксинов, которые связывают CD19 и CD22. Иммунотоксины состоят из scFv–фрагментов антител, слитых с дегликозилированной А–цепью рицина. См., например, Hammer et al.; а также Herrera et al. J. Pediatr. Hematol. Oncol. 31.12(2009):936–41; Schindler et al. Br. J. Haematol. 154,4(2011):471–6. DT2219ARL представляет собой биспецифический иммунотоксин, нацеленный на CD19 и CD22, содержащий два scFv и усеченный дифтерийный токсин. См., например, Hammer et al. и клиническое испытание с идентификатором NCT00889408. SGN–CD19A представляет собой конъюгат антитела и лекарственного средства (ADC), состоящий из гуманизированного моноклонального антитела к CD19, связанного с синтетическим цитотоксическим средством, уничтожающим клетки, монометилауристатином F (MMAF). См., например, Hammer et al. и клинические испытания с идентификатором NCT01786096 и NCT01786135. SAR3419 представляет собой конъюгат антитела к CD19 и лекарственного средства (ADC), содержащий гуманизированное моноклональное антитело к CD19, конъюгированное с производным майтанзина с помощью расщепляемого линкера. См., например, Younes et al. J. Clin. Oncol. 30.2(2012): 2776–82; Hammer et al.; клиническое испытание с идентификатором NCT00549185 и Blanc et al. Clin Cancer Res. 2011;17:6448–58. XmAb–5871 представляет собой гуманизированное антитело к CD19 со сконструированным Fc. См., например, Hammer et al. MDX–1342 представляет собой антитело человека к CD19 со сконструированным Fc с усиленной ADCC. См., например, Hammer et al. В вариантах осуществления молекула антитела представляет собой биспецифическую молекулу антитела к CD19 и CD3. Например, AFM11 представляет собой биспецифическое антитело, нацеливающееся на CD19 и CD3. См., например, Hammer et al. и клиническое испытание с идентификатором NCT02106091. В некоторых вариантах осуществления антитело к CD19, описываемое в данном документе, конъюгировано или иным образом связано с терапевтическим средством, например, химиотерапевтическим средством, пептидной вакциной (такой как описанная в Izumoto et al. 2008 J Neurosurg 108: 963–971), иммунодепрессивным средством или иммунодеструктивным средством, например, циклоспорином, азатиоприном, метотрексатом, микофенолятом, FK506, CAMPATH, антителом к CD3, цитоксином, флударабином, рапамицином, микофеноловой кислотой, стероидом, FR901228 или цитокином.
В одном варианте осуществления антигенсвязывающий домен для CD19 представляет собой антигенсвязывающую часть, например, CDR, антигенсвязывающего домена, описанного в таблице в данном документе. В одном варианте осуществления антигенсвязывающий домен для CD19 может быть получен из любого CAR для CD19, например, LG–740 и описанных в патенте США № 8399645; патенте США № 7446190; Xu et al., Leuk Lymphoma. 2013 54(2):255–260(2012); Cruz et al., Blood 122(17):2965–2973 (2013); Brentjens et al., Blood, 118(18):4817–4828 (2011); Kochenderfer et al., Blood 116(20):4099–102 (2010); Kochenderfer et al., Blood 122 (25):4129–39(2013); и 16th Annu Meet Am Soc Gen Cell Ther (ASGCT) (May 15–18, Salt Lake City) 2013, Abst 10, каждый из которых включен в данный документ посредством ссылки во всей своей полноте.
Иллюстративные антигенсвязывающие домены для BCMA и конструкции CAR
В вариантах осуществления CAR для BCMA содержит BCMA–связывающий домен (например, человеческий или гуманизированный BCMA–связывающий домен), трансмембранный домен и внутриклеточный сигнальный домен, где указанный BCMA–связывающий домен содержит область 1, определяющую комплементарность, тяжелой цепи (CDR1 HC), область 2, определяющую комплементарность, тяжелой цепи (HCR2 HC) и область 3, определяющую комплементарность, тяжелой цепи (CDR3 HC) с любыми аминокислотными последовательностями BCMA–связывающего домена тяжелой цепи, указанными в таблице 7 или 8.
В одном варианте осуществления BCMA–связывающий домен содержит вариабельную область легкой цепи, описываемую в данном документе (например, в таблице 7 или 8), и/или вариабельную область тяжелой цепи, описываемую в данном документе (например, в таблице 7 или 8).
В одном варианте осуществления кодируемый BCMA–связывающий домен представляет собой scFv, содержащий легкую цепь и тяжелую цепь с аминокислотной последовательностью из таблицы 7 или 8.
В варианте осуществления человеческий или гуманизированный BCMA–связывающий домен (например, scFv) содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен), аминокислотной последовательности вариабельной области легкой цепи, представленной в таблице 7 или 8, или последовательность, на по меньшей мере 95% (например, 95–99%) идентичную ей; и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен), аминокислотной последовательности вариабельной области тяжелой цепи, представленной в таблице 7 или 8, или последовательность, на по меньшей мере 95% (например, 95–99%) идентичную ей.
Таблица 7. Аминокислотные последовательности иллюстративных scFv–доменов антител к BCMA и молекул CAR для BCMA и последовательности нуклеиновых кислот, кодирующие их
scFv–домен
scFv–домен
VH
VL
полный CAR
полный CAR
scFv–домен
scFv–домен
VH
VL
полный CAR
полный CAR
scFv–домен
scFv–домен
VH
VL
полный CAR
полный CAR
scFv–домен
scFv–домен
VH
VL
полный CAR
полный CAR
scFv–домен
scFv–домен
VH
VL
полный CAR
полный CAR
scFv–домен
scFv–домен
VH
VL
полный CAR
полный CAR
scFv–домен
scFv–домен
VH
VL
полный CAR
полный CAR
scFv–домен
scFv–домен
VH
VL
полный CAR
полный CAR
scFv–домен
scFv–домен
VH
VL
полный CAR
полный CAR
scFv–домен
scFv–домен
VH
VL
полный CAR
полный CAR
scFv–домен
scFv–домен
VH
VL
полный CAR
полный CAR
scFv–домен
scFv–домен
VH
VL
полный CAR
полный CAR
scFv–домен
scFv–домен
VH
VL
полный CAR
полный CAR
scFv–домен
scFv–домен
VH
VL
полный CAR
полный CAR
scFv–домен
scFv–домен
VH
VL
полный CAR
полный CAR
полный CAR
полный CAR
полный CAR
полный CAR
полный CAR
полный CAR
полный CAR
полный CAR
scFv–домен
scFv–домен
VH
VL
полный CART
полный CART
scFv–домен
scFv–домен
VH
VL
полный CART
полный CART
scFv–домен
scFv–домен
VH
VL
полный CART
полный CART
scFv–домен
scFv–домен
VH
VL
полный CART
полный CART
scFv–домен
scFv–домен
VH
VL
полный CART
полный CART
scFv–домен
scFv–домен
VH
VL
полный CART
полный CART
scFv–домен
scFv–домен
VH
VL
полный CART
полный CART
scFv–домен
scFv–домен
VH
VL
полный CART
полный CART
scFv–домен
scFv–домен
VH
VL
полный CART
полный CART
scFv–домен
scFv–домен
VH
VL
полный CART
полный CART
scFv–домен
scFv–домен
VH
VL
полный CART
полный CART
scFv–домен
scFv–домен
VH
VL
полный CART
полный CART
scFv–домен
scFv–домен
VH
VL
полный CART
полный CART
Таблица 8. Дополнительные иллюстративные последовательности CAR для BCMA
scFv–домен
полный CART
scFv–домен
полный CART
scFv–домен
полный CART
scFv–домен
полный CART
Биспецифические CAR
В варианте осуществления молекула полиспецифического антитела представляет собой молекулу биспецифического антитела. Биспецифическое антитело характеризуется специфичностью не более чем к двум антигенам. Молекула биспецифического антитела характеризуется первой последовательностью вариабельного домена иммуноглобулина, которая характеризуется специфичностью связывания с первым эпитопом, и второй последовательностью вариабельного домена иммуноглобулина, которая характеризуется специфичностью связывания со вторым эпитопом. В варианте осуществления первый и второй эпитопы находятся на одном и том же антигене, например, на одном и том же белке (или субъединице мультимерного белка). В варианте осуществления первый и второй эпитопы перекрываются. В варианте осуществления первый и второй эпитопы не перекрываются. В варианте осуществления первый и второй эпитопы находятся на разных антигенах, например, на разных белках (или на разных субъединицах мультимерного белка). В варианте осуществления молекула биспецифического антитела содержит последовательность вариабельного домена тяжелой цепи и последовательность вариабельного домена легкой цепи, которые характеризуются специфичностью связывания с первым эпитопом, и последовательность вариабельного домена тяжелой цепи и последовательность вариабельного домена легкой цепи, которые характеризуются специфичностью связывания со вторым эпитопом. В варианте осуществления молекула биспецифического антитела содержит полуантитело, характеризующееся специфичностью связывания с первым эпитопом, и полуантитело, характеризующееся специфичностью связывания со вторым эпитопом. В варианте осуществления молекула биспецифического антитела содержит полуантитело или его фрагмент, характеризующиеся специфичностью связывания с первым эпитопом, и полуантитело или его фрагмент, характеризующиеся специфичностью связывания со вторым эпитопом. В варианте осуществления молекула биспецифического антитела содержит scFv или его фрагмент, характеризующиеся специфичностью связывания с первым эпитопом, и scFv или его фрагмент, характеризующиеся специфичностью связывания со вторым эпитопом.
В определенных вариантах осуществления молекула антитела представляет собой молекулу полиспецифического (например, биспецифического или триспецифического) антитела. Протоколы для создания молекул биспецифических или гетеродимерных антител известны из уровня техники и включают без ограничения, например, подход "выступ во впадину", как описано, например, в US 5731168; спаривание Fc с использованием направленного электростатического взаимодействия, как описано, например, в WO 09/089004, WO 06/106905 и WO 2010/129304; образование гетеродимеров путем конструирования доменов с обменом нитей (SEED), как описано, например, в WO 07/110205; обмен Fab–фрагментами, как описано, например, в WO 08/119353, WO 2011/131746 и WO 2013/060867; двойные конъюгаты антител, например, получаемые путем сшивания антител с созданием биспецифической структуры с помощью гетеробифункционального реагента, несущего реакционноспособную аминогруппу и реакционноспособную сульфгидрильную группу, как описано, например, в US 4433059; детерминанты биспецифических антител, создаваемые путем рекомбинации полуантител (пар тяжелая–легкая цепь или Fab) из разных антител посредством цикла восстановления и окисления дисульфидных связей между двумя тяжелыми цепями, как описано, например, в US 4444878; трифункциональные антитела, например, три Fab'–фрагмента, сшитые с помощью реакционноспособных сульфгидрильных групп, как описано, например, в US5273743; биосинтетические связывающие белки, например, пары scFv, сшитых на С–концевых хвостах, предпочтительно посредством химической сшивки с использованием дисульфидных связей или реакционноспособных аминогрупп, как описано, например, в US5534254; бифункциональные антитела, например, Fab–фрагменты с различной специфичностью связывания, димеризованные с помощью лейциновых "застежек" (например, c–fos и c–jun), заменивших константный домен, как описано, например, в US5582996; биспецифические и олигоспецифические моно– и олиговалентные рецепторы, например, CH1–VH–области двух антител (два Fab–фрагмента), связанные полипептидным спейсером между CH1–областью одного антитела и VH–областью другого антитела, обычно с ассоциированными легкими цепями, как описано, например, в US5591828; биспецифические конъюгаты ДНК–антитело, например, получаемые путем сшивки антител или Fab–фрагментов двухнитевым фрагментом ДНК, как описано, например, в US5635602; биспецифические слитые белки, например, экспрессионную конструкцию, содержащую два scFv с гидрофильным спиральным пептидным линкером между ними и полной константной областью, как описано, например, в US5637481; поливалентные и полиспецифические связывающие белки, например, димер полипептидов, имеющий первый домен со связывающей областью вариабельной области тяжелой цепи Ig и второй домен со связывающей областью вариабельной области легкой цепи Ig, обычно называемые диателами (также охватываются структуры более высокого порядка для создания биспецифических, триспецифических или тетраспецифических молекул, как описано, например, в US5837242; конструкции миниантител со связанными VL– и VH–цепями, дополнительно соединенными пептидными спейсерами с шарнирной областью антитела и СН3–областью, которые могут быть димеризованы с образованием биспецифических/поливалентных молекул, как описано, например, в US5837821; VH– и VL–домены, связанные коротким пептидным линкером (например, из 5 или 10 аминокислот) или вовсе не имеющие линкера, в любой ориентации, которые могут образовывать димеры с образованием биспецифических диател; тримеры и тетрамеры, как описано, например, в US5844094; нить из VH–доменов (или VL–доменов у представителей семейства), соединенных пептидными связями со сшиваемыми группами на С–конце, дополнительно ассоциированных с VL–доменами с образованием последовательно соединенных Fv (или scFv), как описано, например, в US5864019; и одноцепочечные связывающие полипептиды как с VH–, так и с VL–доменами, связанными пептидным линкером, объединенные в поливалентные структуры посредством нековалентной или химической сшивки с образованием, например, гомобивалентных, гетеробивалентных, тривалентных и тетравалентных структур с использованием формата как типа scFv, так и типа диатела, как описано, например, в US5869620. Дополнительные иллюстративные полиспецифические и биспецифические молекулы и способы их получения находятся, например, в US5910573, US5932448, US5959083, US5989830, US6005079, US6239259, US6294353, US6333396, US6476198, US6511663, US6670453, US6743896, US6809185, US6833441, US7129330, US7183076, US7521056, US7527787, US7534866, US7612181, US2002004587A1, US2002076406A1, US2002103345A1, US2003207346A1, US2003211078A1, US2004219643A1, US2004220388A1, US2004242847A1, US2005003403A1, US2005004352A1, US2005069552A1, US2005079170A1, US2005100543A1, US2005136049A1, US2005136051A1, US2005163782A1, US2005266425A1, US2006083747A1, US2006120960A1, US2006204493A1, US2006263367A1, US2007004909A1, US2007087381A1, US2007128150A1, US2007141049A1, US2007154901A1, US2007274985A1, US2008050370A1, US2008069820A1, US2008152645A1, US2008171855A1, US2008241884A1, US2008254512A1, US2008260738A1, US2009130106A1, US2009148905A1, US2009155275A1, US2009162359A1, US2009162360A1, US2009175851A1, US2009175867A1, US2009232811A1, US2009234105A1, US2009263392A1, US2009274649A1, EP346087A2, WO0006605A2, WO02072635A2, WO04081051A1, WO06020258A2, WO2007044887A2, WO2007095338A2, WO2007137760A2, WO2008119353A1, WO2009021754A2, WO2009068630A1, WO9103493A1, WO9323537A1, WO9409131A1, WO9412625A2, WO9509917A1, WO9637621A2, WO9964460A1. Содержание вышеупомянутых заявок включено в данный документ посредством ссылки во всей своей полноте.
В каждом антителе или фрагменте антитела (например, scFv) в молекуле биспецифического антитела VH может находиться выше или ниже VL. В некоторых вариантах осуществления вышерасположенные антитело или фрагмент антитела (например, scFv) имеют такую организацию, при которой их VH (VH1) расположена выше их VL (VL1), а нижерасположенные антитело или фрагмент антитела (например, scFv) имеют такую организацию, при которой их VL (VL2), расположена выше их VH (VH2), так что молекула биспецифического антитела в целом имеет организацию VH1–VL1–VL2–VH2. В других вариантах осуществления вышерасположенные антитело или фрагмент антитела (например, scFv) имеют такую организацию, при которой их VL (VL1) расположена выше их VH (VH1), а нижерасположенные антитело или фрагмент антитела (например, scFv) имеют такую организацию, при которой их VH (VH2), расположена выше их VL (VL2), так что молекула биспецифического антитела в целом имеет организацию VL1–VH1–VH2–VL2. Линкер необязательно располагается между двумя антителами или фрагментами антител (например, scFv), например, между VL1 и VL2, если конструкция имеет организацию VH1–VL1–VL2–VH2, или между VH1 и VH2, если конструкция имеет организацию VL1–VH1–VH2–VL2. Линкер может представлять собой линкер, описываемый в данном документе, например, линкер (Gly4–Ser)n, где n равняется 1, 2, 3, 4, 5 или 6, предпочтительно 4 (SEQ ID NO: 26). Как правило, линкер между двумя scFv должен быть достаточно длинным, чтобы избежать неправильного спаривания между доменами двух scFv. Линкер необязательно располагается между VL и VH первого scFv. Линкер необязательно располагается между VL и VH второго scFv. В конструкциях, которые имеют несколько линкеров, любые два или более линкера могут быть одинаковыми или разными. Соответственно, в некоторых вариантах осуществления биспецифический CAR содержит VL, VH и необязательно один или несколько линкеров, организованные согласно описываемому в данном документе.
В определенных вариантах осуществления молекула антитела представляет собой молекулу биспецифического антитела, характеризующуюся первой специфичностью связывания с первым B–клеточным эпитопом и второй специфичностью связывания с другим B–клеточным антигеном. Например, в некоторых вариантах осуществления молекула биспецифического антитела характеризуется первой специфичностью связывания с CD19 и второй специфичностью связывания с одним или несколькими из CD10, CD20, CD22, CD34, CD123, FLT–3, ROR1, CD79b, CD179b, или CD79a. В некоторых вариантах осуществления молекула биспецифического антитела характеризуется первой специфичностью связывания с CD19 и второй специфичностью связывания с CD22.
Химерный TCR
В одном аспекте антитела и фрагменты антител к CD19 по настоящему изобретению (например, те, которые раскрыты в таблицах 2 или 3) могут быть пересажены на один или несколько константных доменов цепи Т–клеточного рецептора ("TCR"), например, альфа–цепи TCR или бета–цепи TCR, с созданием химерного TCR, который специфично связывается с CD19. Не ограничиваясь какой–либо теорией, полагают, что химерные TCR будут передавать сигналы через комплекс TCR при связывании антигена. Например, scFv для CD19, раскрываемый в данном документе, можно пересадить на константный домен, например, на по меньшей мере часть внеклеточного константного домена, трансмембранного домена и цитоплазматического домена цепи TCR, например, альфа–цепи TCR и/или бета–цепи TCR. В качестве другого примера, фрагмент антитела к CD19, например, VL–домен, описываемый в данном документе, можно пересадить на константный домен альфа–цепи TCR, и фрагмент антитела к CD19, например, VH–домен, описываемый в данном документе, можно пересадить на константный домен бета–цепи TCR (или, в качестве альтернативы, VL–домен можно пересадить на константный домен бета–цепи TCR, а VH–домен можно пересадить на альфа–цепь TCR). В качестве другого примера, CDR антитела или фрагмента антитела к CD19, например, CDR антитела или фрагмента антитела к CD19, описываемые в таблицах 4 или 5, можно пересадить на альфа– и/или бета–цепь TCR с созданием химерного TCR, который специфично связывается с CD19. Например, раскрытые в данном документе LCDR можно пересадить на вариабельный домен альфа–цепи TCR, а раскрытые в данном документе HCDR можно пересадить на вариабельный домен бета–цепи TCR, или наоборот. Такие химерные TCR можно получить с помощью способов, известных из уровня техники (например, Willemsen RA et al., Gene Therapy 2000; 7: 1369–1377; Zhang T et al., Cancer Gene Ther 2004; 11: 487–496; Aggen et al., Gene Ther. 2012 Apr;19(4):365–74).
Трансмембранный домен
Что касается трансмембранного домена, в различных вариантах осуществления CAR можно разработать так, чтобы он содержал трансмембранный домен, присоединенный к внеклеточному домену CAR. Трансмембранный домен может содержать одну или несколько дополнительных аминокислот, прилегающих к трансмембранной области, например, одну или несколько аминокислот, относящихся к внеклеточной области белка, из которого получен трансмембранный домен (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и до 15 аминокислот внеклеточной области), и/или одну или несколько дополнительных аминокислот, относящихся к внутриклеточной области белка, из которого получен трансмембранный домен (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и до 15 аминокислот внутриклеточной области). В одном аспекте трансмембранный домен представляет собой домен, ассоциированный с одним из остальных используемых доменов CAR, например, в одном варианте осуществления трансмембранный домен может быть получен из того же белка, из которого получен сигнальный домен, костимулирующий домен или шарнирный домен. В другом аспекте трансмембранный домен не получен из того же белка, из которого получен какой–либо другой домен CAR. В некоторых случаях трансмембранный домен можно выбрать или модифицировать с помощью аминокислотной замены, чтобы избежать связывания таких доменов с трансмембранными доменами тех же самых или других поверхностных белков мембран, например, чтобы свести к минимуму взаимодействия с другими членами рецепторного комплекса. В одном аспекте трансмембранный домен способен к гомодимеризации с другим CAR на клеточной поверхности клетки, экспрессирующей CAR. В другом аспекте аминокислотную последовательность трансмембранного домена можно модифицировать или подвергнуть замене таким образом, чтобы свести к минимуму взаимодействия со связывающими доменами нативного партнера по связыванию, присутствующего в той же самой клетке, экспрессирующей CAR.
Трансмембранный домен можно получить либо из природного, либо из рекомбинантного источника. Если источник является природным, домен можно получить из любого мембраносвязанного или трансмембранного белка. В одном аспекте трансмембранный домен способен передавать сигнал внутриклеточному(внутриклеточным) домену(доменам) всякий раз, когда CAR связывается с мишенью. Трансмембранный домен, особенно применимый в настоящем изобретении, может включать в себя по меньшей мере трансмембранный(трансмембранные) домен(домены), например, альфа–, бета– или дзета–цепи Т–клеточного рецептора, CD28, CD3–эпсилон, CD45, CD4, CD5, CD8 (например, CD8–альфа, CD8–бета), CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154. В некоторых вариантах осуществления трансмембранный домен может включать в себя по меньшей мере трансмембранную(трансмембранные) область(области), например, KIRDS2, OX40, CD2, CD27, LFA–1 (CD11a, CD18), ICOS (CD278), 4–1BB (CD137), GITR, CD40, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160, CD19, IL2R–бета, IL2R–гамма, IL7R α, ITGA1, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA–6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA–1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA–1, ITGB7, TNFR2, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), SLAMF6 (NTB–A, Ly108), SLAM (SLAMF1, CD150, IPO–3), BLAME (SLAMF8), SELPLG (CD162), LTBR, PAG/Cbp, NKG2D и NKG2C.
В некоторых случаях трансмембранный домен может быть присоединен к внеклеточной области CAR, например, антигенсвязывающему домену CAR, с помощью шарнирной области, например, шарнирной области из белка человека. Например, в одном варианте осуществления шарнирная область может представлять собой шарнирную область Ig (иммуноглобулина) человека (например, шарнирную область IgG4, шарнирную область IgD), линкер GS (например, линкер GS, описываемый в данном документе), шарнирную область KIR2DS2 или шарнирную область CD8a. В одном варианте осуществления шарнирная область или спейсер содержит аминокислотную последовательность под SEQ ID NO: 2 (например, состоит из нее). В одном аспекте трансмембранный домен включает в себя трансмембранный домен под SEQ ID NO: 6 (например, состоит из него).
В одном аспекте шарнирная область или спейсер включает в себя шарнирную область IgG4. Например, в одном варианте осуществления шарнирная область или спейсер включает в себя шарнирную область с аминокислотной последовательностью под SEQ ID NO: 3.
В некоторых вариантах осуществления шарнирная область или спейсер включает в себя шарнирную область, кодируемую нуклеотидной последовательностью под SEQ ID NO: 14.
В одном аспекте шарнирная область или спейсер включают в себя шарнирную область IgD. Например, в одном варианте осуществления шарнирная область или спейсер включает в себя шарнирную область с аминокислотной последовательностью под SEQ ID NO: 4.
В некоторых вариантах осуществления шарнирная область или спейсер включает в себя шарнирную область, кодируемую нуклеотидной последовательностью под SEQ ID NO: 15.
В одном аспекте трансмембранный домен может быть рекомбинантным, и в этом случае он будет содержать главным образом гидрофобные остатки, такие как лейцин и валин. В одном аспекте на каждом конце рекомбинантного трансмембранного домена можно обнаружить триплет из фенилаланина, триптофана и валина.
Короткий олиго– или полипептидный линкер длиной от 2 до 10 аминокислот необязательно может образовывать связь между трансмембранным доменом и цитоплазматической сигнальной областью CAR. Глицин–сериновый дублет представляет собой особенно подходящий линкер. Например, в одном аспекте линкер содержит аминокислотную последовательность GGGGSGGGGS (SEQ ID NO: 5). В некоторых вариантах осуществления линкер кодируется нуклеотидной последовательностью GGTGGCGGAGGTTCTGGAGGTGGAGGTTCC (SEQ ID NO: 16).
В одном аспекте шарнирная область или спейсер включает в себя шарнирную область KIR2DS2 и его части.
Цитоплазматический домен
Цитоплазматический домен или область CAR включает в себя внутриклеточный сигнальный домен. Внутриклеточный сигнальный домен обычно отвечает за активацию по меньшей мере одной из нормальных эффекторных функций иммунной клетки, в которую был введен CAR. Термин "эффекторная функция" относится к специализированной функции клетки. Например, эффекторная функция Т–клетки может представлять собой цитолитическую активность или хелперную активность, в том числе секрецию цитокинов. Таким образом, термин "внутриклеточный сигнальный домен" относится к части белка, которая передает сигнал эффекторной функции и направляет клетку на выполнение специализированной функции. Хотя обычно можно использовать весь внутриклеточный сигнальный домен, во многих случаях нет необходимости использовать всю цепь. В той мере, в которой используют усеченную часть внутриклеточного сигнального домена, такую усеченную часть можно использовать вместо интактной цепи, при условии, что она передает сигнал эффекторной функции. Термин "внутриклеточный сигнальный домен", таким образом, подразумевает включение любой усеченной части внутриклеточного сигнального домена, достаточной для передачи сигнала эффекторной функции.
Примеры внутриклеточных сигнальных доменов для применения в CAR по настоящему изобретению включают цитоплазматические последовательности Т–клеточного рецептора (TCR) и корецепторов, которые действуют совместно, инициируя передачу сигнала после привлечения антигенного рецептора, а также любое производное или вариант этих последовательностей и любую рекомбинантную последовательность, которая обладает такими же функциональными возможностями.
Известно, что сигналы, образуемые при участии TCR в отдельности, являются недостаточными для полной активации Т–клетки, и что также необходим вторичный и/или костимулирующий сигнал. Таким образом, можно сказать, что активация Т–клеток опосредуется двумя различными классами цитоплазматических сигнальных последовательностей: теми, которые инициируют антиген–зависимую первичную активацию посредством TCR (первичные внутриклеточные сигнальные домены), и теми, которые действуют антигеннезависимым образом, передавая вторичный или костимулирующий сигнал (вторичный цитоплазматический домен, например, костимулирующий домен).
Первичный цитоплазматический сигнальный домен регулирует первичную активацию комплекса TCR стимулирующим образом либо ингибирующим образом. Первичные внутриклеточные сигнальные домены, которые действуют стимулирующим образом, могут содержать сигнальные мотивы, известные как иммунорецепторные тирозиновые активирующие мотивы или ITAM.
Примеры первичных внутриклеточных сигнальных доменов, содержащих ITAM, которые являются особенно применимыми в настоящем изобретении, включают в себя домены CD3–дзета, общей гамма–цепи FcR (FCER1G), Fc–гамма RIIa, FcR–бета (Fc–эпсилон R1b), CD3–гамма, CD3–дельта, CD3–эпсилон, CD5, CD22, CD79a, CD79b, CD278 (также известного как "ICOS"), FcεRI, CD66d, DAP10 и DAP12. В одном варианте осуществления CAR по настоящему изобретению содержит внутриклеточный сигнальный домен, например, первичный сигнальный домен CD3–дзета, например, последовательность CD3–дзета, описываемую в данном документе.
В одном варианте осуществления первичный сигнальный домен содержит модифицированный домен ITAM, например, мутантный домен ITAM, который обладает измененной (например, увеличенной или уменьшенной) активностью по сравнению с нативным доменом ITAM. В одном варианте осуществления первичный сигнальный домен включает в себя модифицированный первичный внутриклеточный сигнальный домен, содержащий ITAM, например, оптимизированный и/или усеченный первичный внутриклеточный сигнальный домен, содержащий ITAM. В варианте осуществления первичный сигнальный домен содержит один, два, три, четыре или более мотива ITAM.
Дополнительные примеры молекул, содержащих первичный внутриклеточный сигнальный домен, являющихся особенно применимыми в настоящем изобретении, включают молекулы DAP10, DAP12 и CD32.
Внутриклеточный домен CAR может содержать сигнальный домен CD3–дзета в отдельности или в комбинации с любым(любыми) другим(другими) желаемым(желаемыми) внутриклеточным(внутриклеточными) сигнальным(сигнальными) доменом(доменами), применимым(применимыми) в качестве составной части CAR по настоящему изобретению. Например, внутриклеточный сигнальный домен CAR может содержать часть дзета–цепи CD3 и костимулирующий сигнальный домен. Костимулирующий сигнальный домен относится к части CAR, содержащей внутриклеточный домен костимулирующей молекулы. Костимулирующая молекула представляет собой молекулу клеточной поверхности, отличную от антигенного рецептора или его лигандов, которая необходима для эффективного ответа лимфоцитов на антиген. Примеры таких молекул включают CD27, CD28, 4–1BB (CD137), OX40, CD30, CD40, PD–1 (также известный как PD1), ICOS, антиген 1, связанный с функцией лимфоцитов (LFA–1), CD2, CD7, LIGHT, NKG2C, B7–H3 и лиганд, который специфично связывается с CD83, и т. п. Например, было продемонстрировано, что костимуляция с помощью CD27 усиливает размножение, эффекторную функцию и выживание CART–клеток человека in vitro и увеличивает персистенцию и противоопухолевую активность T–клеток человека in vivo (Song et al. Blood. 2012; 119(3):696–706). Дополнительные примеры таких костимулирующих молекул включают молекулу MHC I класса, белковый рецептор TNF, иммуноглобулиноподобный белок, рецептор цитокина, интегрин, сигнальную молекулу активации лимфоцитов (белок SLAM), активирующий рецептор NK–клеток, BTLA, лиганд Toll–подобного рецептора, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM–1, LFA–1 (CD11a/CD18), 4–1BB (CD137), B7–H3, CDS, ICAM–1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8–альфа, CD8–бета, IL2R–бета, IL2R–гамма, IL7R–альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA–6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA–1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA–1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB–A, Ly108), SLAM (SLAMF1, CD150, IPO–3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP–76, PAG/Cbp, CD19a, и лиганд, который специфично связывается с CD83. Например, было продемонстрировано, что костимуляция с помощью CD27 усиливает размножение, эффекторную функцию и выживание CART–клеток человека in vitro и увеличивает персистенцию и противоопухолевую активность T–клеток человека in vivo (Song et al. Blood. 2012; 119(3):696–706).
Внутриклеточные сигнальные домены в цитоплазматической части CAR по настоящему изобретению могут быть связаны друг с другом в случайном или установленном порядке. Короткий олиго– или полипептидный линкер, например, длиной от 2 до 10 аминокислот (например, 2, 3, 4, 5, 6, 7, 8, 9, или 10 аминокислот) необязательно может образовывать связь между внутриклеточными сигнальными доменами. В одном варианте осуществления в качестве подходящего линкера можно использовать глицин–сериновый дублет. В одном варианте осуществления в качестве подходящего линкера можно использовать одну аминокислоту, например, аланин, глицин.
В одном аспекте внутриклеточный сигнальный домен разработан таким образом, что он содержит два или более, например, 2, 3, 4, 5 или более, костимулирующих сигнальных доменов. В варианте осуществления два или более, например, 2, 3, 4, 5 или более, костимулирующих сигнальных доменов разделены молекулой линкера, например, молекулой линкера, описываемой в данном документе. В одном варианте осуществления внутриклеточный сигнальный домен содержит два костимулирующих сигнальных домена. В некоторых вариантах осуществления молекула линкера представляет собой глициновый остаток. В некоторых вариантах осуществления линкер представляет собой аланиновый остаток.
В одном аспекте внутриклеточный сигнальный домен разработан таким образом, что он содержит сигнальный домен CD3–дзета и сигнальный домен CD28. В одном аспекте внутриклеточный сигнальный домен разработан таким образом, что он содержит сигнальный домен CD3–дзета и сигнальный домен 4–1BB. В одном аспекте сигнальный домен 4–1BB представляет собой сигнальный домен под SEQ ID NO: 7. В одном аспекте сигнальный домен CD3–дзета представляет собой сигнальный домен под SEQ ID NO: 9 (мутантный CD3–дзета) или под SEQ ID NO: 10 (CD3–дзета человека дикого типа).
В одном аспекте внутриклеточный домен разработан таким образом, что он содержит сигнальный домен CD3–дзета и сигнальный домен 4–1BB. В одном аспекте сигнальный домен 4–1BB содержит аминокислотную последовательность под SEQ ID NO: 7. В одном аспекте сигнальный домен 4–1BB кодируется последовательностью нуклеиновой кислоты под SEQ ID NO: 18.
В одном аспекте внутриклеточный сигнальный домен разработан таким образом, что он содержит сигнальный домен CD3–дзета и сигнальный домен CD27. В одном аспекте сигнальный домен CD27 содержит аминокислотную последовательность под SEQ ID NO: 8. В одном аспекте сигнальный домен CD27 кодируется последовательностью нуклеиновой кислоты под SEQ ID NO: 19.
В одном аспекте внутриклеточный сигнальный домен разработан таким образом, что он содержит сигнальный домен CD3–дзета и сигнальный домен CD28. В одном аспекте сигнальный домен CD28 содержит аминокислотную последовательность под SEQ ID NO: 36. В одном аспекте сигнальный домен CD28 кодируется последовательностью нуклеиновой кислоты под SEQ ID NO: 37.
В одном аспекте внутриклеточный сигнальный домен разработан таким образом, что он содержит сигнальный домен CD3–дзета и сигнальный домен ICOS. В одном аспекте сигнальный домен ICOS содержит аминокислотную последовательность под SEQ ID NO: 38 или 43. В одном аспекте сигнальный домен ICOS кодируется последовательностью нуклеиновой кислоты под SEQ ID NO: 44.
CAR, содержащие рецептор естественных клеток–киллеров (NKR)
В варианте осуществления молекула CAR, описываемая в данном документе, содержит один или несколько компонентов рецептора естественных клеток–киллеров (NKR), тем самым образуя NKR–CAR. Компонент NKR может представлять собой трансмембранный домен, шарнирный домен или цитоплазматический домен любого из следующих рецепторов естественных клеток–киллеров: иммуноглобулиноподобного рецептора клеток–киллеров (KIR), например, KIR2DL1, KIR2DL2/L3, KIR2DL4, KIR2DL5A, KIR2DL5B, KIR2DS1, KIR2DS2, KIR2DS3, KIR2DS4, DIR2DS5, KIR3DL1/S1, KIR3DL2, KIR3DL3, KIR2DP1, и KIR3DP1; рецептора естественной цитотоксичности (NCR), например, NKp30, NKp44, NKp46; семейства рецепторов иммунных клеток, являющихся сигнальными молекулами активации лимфоцитов (SLAM), например, CD48, CD229, 2B4, CD84, NTB–A, CRACC, BLAME и CD2F–10; Fc–рецептора (FcR), например, CD16 и CD64; и рецепторов Ly49, например, LY49A, LY49C. Молекулы NKR–CAR, описываемые в данном документе, могут взаимодействовать с адапторной молекулой или внутриклеточным сигнальным доменом, например, DAP12. Иллюстративные конфигурации и последовательности молекул CAR, содержащих компоненты NKR, описаны в международной публикации № WO2014/145252, содержание которой включено в данный документ посредством ссылки.
Разделенный CAR
В некоторых вариантах осуществления в клетке, экспрессирующей CAR, описываемой в данном документе, используется разделенный CAR. Подход с разделенным CAR более подробно описан в публикациях WO2014/055442 и WO2014/055657, включенных в данный документ посредством ссылки. Вкратце, система разделенного CAR содержит клетку, экспрессирующую первый CAR, имеющий первый антигенсвязывающий домен и костимулирующий домен (например, 4–1BB), и эта клетка также экспрессирует второй CAR, имеющий второй антигенсвязывающий домен и внутриклеточный сигнальный домен (например, CD3–дзета). Когда клетка встречается с первым антигеном, то активируется костимулирующий домен, и клетка пролиферирует. Когда клетка встречается со вторым антигеном, то активируется внутриклеточный сигнальный домен, и запускается активность уничтожения клеток. Таким образом, клетка, экспрессирующая CAR, полностью активируется только в присутствии обоих антигенов. В вариантах осуществления первый антигенсвязывающий домен распознает опухолевый антиген или В–клеточный антиген, описываемый в данном документе, например, содержит антигенсвязывающий домен, описываемый в данном документе, а второй антигенсвязывающий домен распознает второй антиген, например, второй опухолевый антиген или второй В–клеточный антиген, описываемый в данном документе.
Совместная экспрессия CAR с другими молекулами или средствами
Совместная экспрессия второго CAR
В одном аспекте клетка, экспрессирующая CAR, описываемая в данном документе, может дополнительно содержать второй CAR, например, второй CAR, который содержит другой антигенсвязывающий домен, например, для той же самой мишени (CD19) или другой мишени (например, для мишени, отличной от CD19, например, для В–клеточного антигена, отличного от CD19, например, CD10, CD20, CD22, CD34, CD123, FLT–3, ROR1, CD79b, CD179b, или CD79a). В одном варианте осуществления клетка, экспрессирующая CAR, содержит первый CAR, который нацеливается на первый антиген и содержит внутриклеточный сигнальный домен, имеющий костимулирующий сигнальный домен, но не первичный сигнальный домен, и второй CAR, который нацеливается на второй, другой, антиген и содержит внутриклеточный сигнальный домен, имеющий первичный сигнальный домен, но не костимулирующий сигнальный домен. Размещение костимулирующего сигнального домена, например, 4–1BB, CD28, CD27, OX–40 или ICOS, на первом CAR, а первичного сигнального домена, например, CD3–дзета, на втором CAR может ограничивать активность CAR до клеток, в которых экспрессируются обе мишени. В одном варианте осуществления клетка, экспрессирующая CAR, содержит первый CAR для CD19, который содержит CD19–связывающий домен, трансмембранный домен и костимулирующий домен, и второй CAR, который нацеливается на антиген, отличный от CD19 (например, мишень, отличную от CD19, например, В–клеточный антиген, отличный от CD19, например, CD10, CD20, CD22, CD34, CD123, FLT–3, ROR1, CD79b, CD179b, или CD79a), и содержит антигенсвязывающий домен, трансмембранный домен и первичный сигнальный домен. В другом варианте осуществления клетка, экспрессирующая CAR, содержит первый CAR для CD19, который содержит CD19–связывающий домен, трансмембранный домен и первичный сигнальный домен, и второй CAR, который нацеливается на антиген, отличный от CD19 (например, мишень, отличную от CD19, например, В–клеточный антиген, отличный от CD19, например, CD10, CD20, CD22, CD34, CD123, FLT–3, ROR1, CD79b, CD179b, или CD79a), и содержит антигенсвязывающий домен для антигена, трансмембранный домен и костимулирующий сигнальный домен.
В одном варианте осуществления клетка, экспрессирующая CAR, содержит CAR для CD19, описываемый в данном документе, и ингибирующий CAR. В одном варианте осуществления ингибирующий CAR содержит антигенсвязывающий домен, который связывает антиген, обнаруживаемый на нормальных клетках, но не на раковых клетках, например, на нормальных клетках, которые также экспрессируют CD19. В одном варианте осуществления ингибирующий CAR содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный домен ингибирующей молекулы. Например, внутриклеточный домен ингибирующего CAR может представлять собой внутриклеточный домен PD1, PD–L1, CTLA4, TIM3, LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7–H3 (CD276), B7–H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозина или TGF–бета.
В одном варианте осуществления, если клетка, экспрессирующая CAR, содержит два или более различных CAR, антигенсвязывающие домены различных CAR могут быть такими, что антигенсвязывающие домены не взаимодействуют друг с другом. Например, клетка, экспрессирующая первый и второй CAR, может иметь антигенсвязывающий домен первого CAR, например, в качестве фрагмента, например, scFv, который не ассоциирует с антигенсвязывающим доменом второго CAR, например, антигенсвязывающий домен второго CAR представляет собой VHH.
В некоторых вариантах осуществления антигенсвязывающий домен включает в себя однодоменные антигенсвязывающие (SDAB) молекулы, в том числе молекулы, области, определяющие комплементарность, которых являются частью однодоменного полипептида. Примеры включают без ограничения вариабельные домены тяжелых цепей, связывающие молекулы, в естественных условиях лишенные легких цепей, отдельные домены, полученные из традиционных 4–цепочечных антител, сконструированные домены и однодоменные каркасные структуры, отличные от полученных из антител. Молекулы SDAB могут являться любыми молекулами из уровня техники или любыми будущими однодоменными молекулами. Молекулы SDAB могут быть получены из любых видов, в том числе без ограничения из мыши, человека, верблюда, ламы, миноги, рыбы, акулы, козы, кролика и быка. Этот термин также охватывает встречающиеся в природе молекулы однодоменных антител из видов, отличных от Camelidae и акул.
В одном аспекте молекула SDAB может быть получена из вариабельной области иммуноглобулина, обнаруживаемого у рыб, как, например, та, которая получена из изотипа иммуноглобулина, известного как новый антигенный рецептор (NAR), обнаруживаемого в сыворотке крови акулы. Способы получения однодоменных молекул, получаемых из вариабельной области NAR ("IgNAR"), описаны в WO 03/014161 и Streltsov (2005) Protein Sci. 14:2901–2909.
Согласно другому аспекту молекула SDAB представляет собой встречающуюся в природе однодоменную антигенсвязывающую молекулу, известную как тяжелая цепь, лишенная легких цепей. Такие однодоменные молекулы раскрыты, к примеру, в WO 9404678 и Hamers–Casterman, C. et al. (1993) Nature 363:446–448. В целях ясности этот вариабельный домен, полученный из молекулы тяжелой цепи, в естественных условиях лишенной легкой цепи, именуется в данном документе как VHH или нанотело, чтобы отличать его от традиционного VH четырехцепочечных иммуноглобулинов. Такую молекулу VHH можно получить из видов Camelidae, например, из верблюда, ламы, дромадера, альпаки и гуанако. Другие виды, помимо Camelidae, могут вырабатывать молекулы тяжелых цепей, в естественных условиях лишенные легкой цепи; такие VHH входят в объем настоящего изобретения.
Молекулы SDAB могут быть рекомбинантными, с пересаженными CDR, гуманизированными, камелизированными, деиммунизированными и/или созданными in vitro (например, отобранными с помощью фагового дисплея).
Также было обнаружено, что в клетках, имеющих множество встроенных в мембрану химерных рецепторов, содержащих антигенсвязывающий домен, взаимодействия между антигенсвязывающими доменами рецепторов могут быть нежелательными, например, поскольку они ингибируют способность одного или нескольких антигенсвязывающих доменов связываться с их когнатными антигенами. Соответственно, в данном документе раскрыты клетки, имеющие первый и второй не встречающиеся в природе химерные рецепторы, встроенные в мембрану, содержащие антигенсвязывающие домены, для которых сведены к минимуму такие взаимодействия. Также в данном документе раскрыты нуклеиновые кислоты, кодирующие первый и второй не встречающиеся в природе химерные рецепторы, встроенные в мембрану, содержащие антигенсвязывающие домены, для которых сведены к минимуму такие взаимодействия, а также способы получения и применения таких клеток и нуклеиновых кислот. В варианте осуществления антигенсвязывающий домен одного из первого и второго не встречающегося в природе химерного рецептора, встроенного в мембрану, включает в себя scFv, а другой включает в себя отдельный VH–домен, например, отдельный VH–домен верблюдовых, акулы или миноги, или отдельный VH–домен, полученный из последовательности человека или мыши.
В некоторых вариантах осуществления заявляемое изобретение охватывает первый и второй CAR, где антигенсвязывающий домен одного из первого и второго CAR не содержит вариабельный домен легкой цепи и вариабельный домен тяжелой цепи. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR представляет собой scFv, а другой не представляет собой scFv. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR включает в себя отдельный VH–домен, например, отдельный VH–домен верблюдовых, акулы или миноги, или отдельный VH–домен, полученный из последовательности человека или мыши. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR включает в себя нанотело. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR включает в себя VHH–домен верблюдовых.
В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR включает в себя scFv, а другой включает в себя единственный VH–домен, например, единственный VH–домен верблюдовых, акулы или миноги, или единственный VH–домен, полученный из последовательности человека или мыши. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR включает в себя scFv, а другой включает в себя нанотело. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR включает в себя scFv, а другой включает в себя VHH–домен верблюдовых.
В некоторых вариантах осуществления связывание антигенсвязывающего домена первого CAR при наличии его на поверхности клетки со своим когнатным антигеном существенно не снижается благодаря наличию второго CAR. В некоторых вариантах осуществления связывание антигенсвязывающего домена первого CAR со своим когнатным антигеном в присутствии второго CAR составляет 85%, 90%, 95%, 96%, 97%, 98% или 99% от связывания антигенсвязывающего домена первого CAR со своим когнатным антигеном в отсутствие второго CAR.
В некоторых вариантах осуществления антигенсвязывающие домены первого и второго CAR при наличии их на поверхности клетки ассоциируют друг с другом в меньшей степени, чем в случае, если бы оба они являлись антигенсвязывающими scFv–доменами. В некоторых вариантах осуществления антигенсвязывающие домены первого и второго CAR ассоциируют друг с другом в на 85%, 90%, 95%, 96%, 97%, 98% или 99% меньшей степени, чем в случае, если бы оба они являлись антигенсвязывающими scFv–доменами.
Совместная экспрессия средства, усиливающего активность CAR
В другом аспекте клетка, экспрессирующая CAR, описываемая в данном документе, может дополнительно экспрессировать другое средство, например, средство, усиливающее активность или приспособленность клетки, экспрессирующей CAR.
Например, в одном варианте осуществления данное средство может представлять собой средство, ингибирующее молекулу, которая модулирует или регулирует, например, ингибирует, Т–клеточную функцию. В некоторых вариантах осуществления молекула, которая модулирует или регулирует Т–клеточную функцию, представляет собой ингибирующую молекулу. Ингибирующие молекулы, например, PD–1, могут в некоторых вариантах осуществления снижать способность клетки, экспрессирующей CAR, осуществлять иммунный эффекторный ответ. Примеры ингибирующих молекул включают PD–1, PD–L1, CTLA4, TIM3, LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7–H3 (CD276), B7–H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозин или TGF–бета.
В вариантах осуществления средство, например, ингибирующую нуклеиновую кислоту, например, dsRNA, например, siRNA или shRNA; или, например, ингибирующие белок или систему, например, короткие палиндромные повторы, регулярно расположенные группами (CRISPR), эффекторную нуклеазу, подобную активаторам транскрипции (TALEN), или эндонуклеазу с "цинковыми пальцами" (ZFN), например, описываемые в данном документе, можно применять для ингибирования экспрессии молекулы, которая модулирует или регулирует, например, ингибирует, Т–клеточную функцию в клетке, экспрессирующей CAR. В варианте осуществления средство представляет собой shRNA, например, shRNA, описываемую в данном документе. В варианте осуществления средство, которое модулирует или регулирует, например, ингибирует, Т–клеточную функцию, ингибируется в клетке, экспрессирующей CAR. Например, молекула dsRNA, ингибирующая экспрессию молекулы, которая модулирует или регулирует, например, ингибирует, Т–клеточную функцию, связана с нуклеиновой кислотой, которая кодирует компонент, например, все компоненты, CAR.
В одном варианте осуществления средство, которое ингибирует ингибирующую молекулу, содержит первый полипептид, например, ингибирующую молекулу, ассоциированный со вторым полипептидом, передающим положительный сигнал в клетку, например, с внутриклеточным сигнальным доменом, описываемым в данном документе. В одном варианте осуществления средство содержит первый полипептид, например, ингибирующую молекулу, такую как PD–1, PD–L1, CTLA4, TIM3, LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7–H3 (CD276), B7–H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозин или TGF–бета или фрагмент любого из них (например, по меньшей мере часть внеклеточного домена любого из них), и второй полипептид, который представляет собой внутриклеточный сигнальный домен, описываемый в данном документе (например, содержащий костимулирующий домен (например, 4–1BB, CD27 или CD28, например, описываемые в данном документе) и/или первичный сигнальный домен (например, сигнальный домен CD3–дзета, описываемый в данном документе). В одном варианте осуществления средство содержит первый полипептид PD–1 или его фрагмент (например, по меньшей мере часть внеклеточного домена PD–1) и второй полипептид, представляющий собой внутриклеточный сигнальный домен, описываемый в данном документе (например, сигнальный домен CD28, описываемый в данном документе, и/или сигнальный домен CD3–дзета, описываемый в данном документе). PD–1 является ингибирующим представителем семейства рецепторов CD28, которое также включает CD28, CTLA–4, ICOS и BTLA. PD–1 экспрессируется на активированных B–клетках, T–клетках и миелоидных клетках (Agata et al. 1996 Int. Immunol 8:765–75). Было показано, что два лиганда PD–1, PD–L1 и PD–L2, подавляют активацию Т–клеток при связывании с PD–1 (Freeman et al. 2000 J Exp Med 192:1027–34; Latchman et al. 2001 Nat Immunol 2:261–8; Carter et al. 2002 Eur J Immunol 32:634–43). PD–L1 является обильным в раковых опухолях человека (Dong et al. 2003 J Mol Med 81:281–7; Blank et al. 2005 Cancer Immunol. Immunother 54:307–314; Konishi et al. 2004 Clin Cancer Res 10:5094). Подавление иммунитета можно устранить путем ингибирования локального взаимодействия PD–1 с PD–L1.
В одном варианте осуществления средство, содержащее внеклеточный домен (ECD) ингибирующей молекулы, например, белка 1 программируемой смерти клеток (PD–1), может быть слито с трансмембранным доменом и внутриклеточными сигнальными доменами, такими как 4–1BB и CD3–дзета (также упоминается в данном документе как PD1–CAR). В одном варианте осуществления PD1–CAR при использовании в комбинации с CAR для CD19, описываемым в данном документе, улучшает персистенцию Т–клетки. В одном варианте осуществления CAR представляет собой PD1–CAR, содержащий внеклеточный домен PD–1, указанный подчеркиванием в SEQ ID NO: 24, и сигнальную последовательность из аминокислот 1–21 под SEQ ID NO: 24. В одном варианте осуществления PD1–CAR содержит аминокислотную последовательность под SEQ ID NO: 24.
В одном варианте осуществления PD1–CAR без N–концевой сигнальной последовательности содержит аминокислотную последовательность, представленную под SEQ ID NO: 22.
В одном варианте осуществления средство содержит последовательность нуклеиновой кислоты, кодирующую PD1–CAR с N–концевой сигнальной последовательностью, например, PD1–CAR, описываемый в данном документе. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая PD1–CAR, показана в таблице 1, при этом ECD PD1 подчеркнут в SEQ ID NO: 23.
В другом примере в одном варианте осуществления средство, которое усиливает активность клетки, экспрессирующей CAR, может представлять собой костимулирующую молекулу или лиганд костимулирующей молекулы. Примеры костимулирующих молекул включают молекулу MHC I класса, BTLA и лиганд Toll–подобного рецептора, а также OX40, CD27, CD28, CDS, ICAM–1, LFA–1 (CD11a/CD18), ICOS (CD278), и 4–1BB (CD137). Дополнительные примеры таких костимулирующих молекул включают CDS, ICAM–1, GITR, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160, CD19, CD4, CD8–альфа, CD8–бета, IL2R–бета, IL2R–гамма, IL7R–альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA–6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA–1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA–1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB–A, Ly108), SLAM (SLAMF1, CD150, IPO–3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP–76, PAG/Cbp, CD19a, и лиганд, который специфично связывается с CD83, например, описываемые в данном документе. Примеры лигандов костимулирующих молекул включают CD80, CD86, CD40L, ICOSL, CD70, OX40L, 4–1BBL, GITRL, и LIGHT. В вариантах осуществления лиганд костимулирующей молекулы является лигандом костимулирующей молекулы, отличной от костимулирующей молекулы, домен которой используется в CAR. В вариантах осуществления лиганд костимулирующей молекулы является лигандом такой же костимулирующей молекулы, как и костимулирующая молекула, домен которой используется в CAR. В варианте осуществления лиганд костимулирующей молекулы представляет собой 4–1BBL. В варианте осуществления лиганд костимулирующей молекулы представляет собой CD80 или CD86. В варианте осуществления лиганд костимулирующей молекулы представляет собой CD70. В вариантах осуществления иммунная эффекторная клетка, экспрессирующая CAR, описываемая в данном документе, может быть дополнительно сконструирована таким образом, что она экспрессирует одну или несколько дополнительных костимулирующих молекул или лигандов костимулирующих молекул.
Совместная экспрессия CAR с рецептором хемокина
В вариантах осуществления клетка, экспрессирующая CAR, описываемая в данном документе, например, клетка, экспрессирующая CAR для CD19, дополнительно содержит молекулу рецептора хемокина. Трансгенная экспрессия рецепторов хемокинов CCR2b или CXCR2 в Т–клетках усиливает их миграцию к солидным опухолям, секретирующим CCL2 или CXCL1, в том числе к меланоме и нейробластоме (Craddock et al., J Immunother. 2010 Oct; 33(8):780–8 и Kershaw et al., Hum Gene Ther. 2002 Nov 1; 13(16):1971–80). Таким образом, не желая ограничиваться какой–либо теорией, полагают, что рецепторы хемокинов, экспрессируемые в клетках, экспрессирующих CAR, которые распознают хемокины, секретируемые опухолями, например, солидными опухолями, могут улучшать хоминг клетки, экспрессирующей CAR, в опухоль, облегчать инфильтрацию клетки, экспрессирующей CAR, в опухоль и усиливают противоопухолевую эффективность клетки, экспрессирующей CAR. Молекула рецептора хемокина может включать в себя встречающийся в природе или рекомбинантный рецептор хемокина или его хемокин–связывающий фрагмент. Молекула рецептора хемокина, подходящая для экспрессии в клетке, экспрессирующей CAR (например, CAR–Tx), описываемой в данном документе, включает в себя рецептор хемокина CXC (например, CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, CXCR6, или CXCR7), рецептор хемокина CC (например, CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10, или CCR11), рецептор хемокина CX3C (например, CX3CR1), рецептор хемокина XC (например, XCR1) или их хемокин–связывающий фрагмент. В одном варианте осуществления молекулу рецептора хемокина, которая должна экспрессироваться вместе с CAR, описываемым в данном документе, выбирают с учетом хемокина(хемокинов), секретируемых опухолью. В одном варианте осуществления клетка, экспрессирующая CAR, описываемая в данном документе, дополнительно содержит, например, экспрессирует, рецептор CCR2b или рецептор CXCR2. В варианте осуществления CAR, описываемый в данном документе, и молекула рецептора хемокина находятся в одном и том же векторе или находятся в двух разных векторах. В вариантах осуществления, в которых CAR, описываемый в данном документе, и молекула рецептора хемокина находятся в одном и том же векторе, CAR и молекула рецептора хемокина находятся под контролем двух разных промоторов или находятся под контролем одного и того же промотора.
Конструкции нуклеиновых кислот, кодирующие CAR
Настоящее изобретение предусматривает трансгены CAR, содержащие последовательности нуклеиновых кислот, кодирующие одну или несколько конструкций CAR по настоящему изобретению. В одном аспекте трансген CAR предусмотрен в виде транскрипта матричной РНК. В одном аспекте трансген CAR предусмотрен в виде ДНК–конструкции.
Соответственно, в одном аспекте настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей химерный антигенный рецептор (CAR), где CAR содержит CD19–связывающий домен (например, мышиный CD19–связывающий домен или гуманизированный CD19–связывающий домен), трансмембранный домен и внутриклеточный сигнальный домен, содержащий стимулирующий домен. В одном варианте осуществления CD19–связывающий домен представляет собой CD19–связывающий домен, описываемый в данном документе, например, CD19–связывающий домен, который содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 45–56, 69–80, 106, 109, 110, 112, или 115, или последовательность, на 95–99% идентичную ей. В одном варианте осуществления выделенная молекула нуклеиновой кислоты дополнительно содержит последовательность, кодирующую костимулирующий домен. В одном варианте осуществления трансмембранный домен представляет собой трансмембранный домен белка, выбранного из группы, состоящей из альфа–, бета– или дзета–цепи Т–клеточного рецептора, CD28, CD3–эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном варианте осуществления трансмембранный домен содержит последовательность под SEQ ID NO: 6 или последовательность, на 95–99% идентичную ей. В одном варианте осуществления CD19–связывающий домен соединен с трансмембранным доменом с помощью шарнирной области, например, шарнирной области, описываемой в данном документе. В одном варианте осуществления шарнирная область содержит SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 16, или SEQ ID NO: 39 или последовательность, на 95–99% идентичную ей. В одном варианте осуществления выделенная молекула нуклеиновой кислоты дополнительно содержит последовательность, кодирующую костимулирующий домен. В одном варианте осуществления костимулирующий домен представляет собой функциональный сигнальный домен белка, выбранного из группы, состоящей из OX40, CD27, CD28, CDS, ICAM–1, LFA–1 (CD11a/CD18), ICOS (CD278), и 4–1BB (CD137). Дополнительные примеры таких костимулирующих молекул включают CDS, ICAM–1, GITR, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160, CD19, CD4, CD8–альфа, CD8–бета, IL2R–бета, IL2R–гамма, IL7R–альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA–6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA–1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA–1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB–A, Ly108), SLAM (SLAMF1, CD150, IPO–3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP–76, и PAG/Cbp. В одном варианте осуществления костимулирующий домен содержит последовательность под SEQ ID NO: 7 или последовательность, на 95–99% идентичную ей. В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4–1BB и функциональный сигнальный домен CD3–дзета. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность под SEQ ID NO: 7 или SEQ ID NO: 8 или последовательность, на 95–99% идентичную ей, и последовательность под SEQ ID NO: 9 или SEQ ID NO: 10 или последовательность, на 95–99% идентичную ей, где последовательности, образующие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде одной полипептидной цепи. В другом аспекте настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей конструкцию CAR, содержащую лидерную последовательность под SEQ ID NO: 1, scFv–домен, имеющий последовательность, выбранную из группы, состоящей из SEQ ID NO: 45; SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74, SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, SEQ ID NO: 78, SEQ ID NO: 79, SEQ ID NO: 80, SEQ ID NO: 106, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 112, и SEQ ID NO: 115 (или последовательность, на 95–99% идентичную ей), шарнирную область под SEQ ID NO: 2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO: 16, или SEQ ID NO: 39 (или последовательность, на 95–99% идентичную ей), трансмембранный домен, имеющий последовательность под SEQ ID NO: 6 (или последовательность, на 95–99% идентичную ей), костимулирующий домен 4–1BB, имеющий последовательность под SEQ ID NO: 7 (или последовательность, на 95–99% идентичную ей), или костимулирующий домен CD27, имеющий последовательность под SEQ ID NO: 8 (или последовательность, на 95–99% идентичную ей), и стимулирующий домен CD3–дзета, имеющий последовательность под SEQ ID NO: 9 или SEQ ID NO: 10 (или последовательность, на 95–99% идентичную ей).
В другом аспекте настоящее изобретение относится к выделенной молекуле полипептида, кодируемой молекулой нуклеиновой кислоты. В одном варианте осуществления выделенная молекула полипептида содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 93; SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 108, SEQ ID NO: 111, SEQ ID NO: 113, SEQ ID NO: 114, и SEQ ID NO: 116, или последовательность, на 95–99% идентичную ей.
В другом аспекте настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей молекулу химерного антигенного рецептора (CAR), которая содержит CD19–связывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий стимулирующий домен, и где нуклеиновая кислота, кодирующая CD19–связывающий домен, содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 57; SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, и SEQ ID NO: 105, или последовательность, на 95–99% идентичную ей.
В одном варианте осуществления кодируемая молекула CAR дополнительно содержит последовательность, кодирующую костимулирующий домен. В одном варианте осуществления костимулирующий домен представляет собой функциональный сигнальный домен белка, выбранного из группы, состоящей из OX40, CD27, CD28, CDS, ICAM–1, LFA–1 (CD11a/CD18) и 4–1BB (CD137). В одном варианте осуществления костимулирующий домен содержит последовательность под SEQ ID NO: 7. В одном варианте осуществления трансмембранный домен представляет собой трансмембранный домен белка, выбранного из группы, состоящей из альфа–, бета– или дзета–цепи Т–клеточного рецептора, CD28, CD3–эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном варианте осуществления трансмембранный домен содержит последовательность под SEQ ID NO: 6. В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4–1BB и функциональный сигнальный домен дзета. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность под SEQ ID NO: 7 и последовательность под SEQ ID NO: 9, где последовательности, образующие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде одной полипептидной цепи. В одном варианте осуществления CD19–связывающий домен соединен с трансмембранным доменом с помощью шарнирной области. В одном варианте осуществления шарнирная область содержит SEQ ID NO: 2. В одном варианте осуществления шарнирная область содержит SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 16, или SEQ ID NO: 39.
В другом аспекте настоящее изобретение относится к выделенной молекуле CAR, содержащей лидерную последовательность под SEQ ID NO: 1, scFv–домен, имеющий последовательность, выбранную из группы, состоящей из SEQ ID NO: 45–56, 109, 110, 112 и 115, или последовательность, на 95–99% идентичную ей, шарнирную область под SEQ ID NO:2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 16, или SEQ ID NO: 39, трансмембранный домен, имеющий последовательность под SEQ ID NO: 6, костимулирующий домен 4–1BB, имеющий последовательность под SEQ ID NO: 7, или костимулирующий домен CD27, имеющий последовательность под SEQ ID NO: 8, и стимулирующий домен CD3–дзета, имеющий последовательность под SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления кодируемая молекула CAR содержит последовательность, выбранную из группы, состоящей из SEQ ID NOS: 93–104, 108, 111, 114, 116, или последовательность, на 95–99% идентичную ей.
Настоящее изобретение дополнительно предусматривает векторы, содержащие трансгены CAR. В одном аспекте векторы CAR можно вводить путем прямой трансдукции в клетку, например, T–клетку или NK–клетку. В одном аспекте вектор представляет собой клонирующий или экспрессионный вектор, например, вектор, включающий в себя без ограничения одну или несколько плазмид (например, экспрессионные плазмиды, клонирующие векторы, миникольца, минивекторы, двойные микрохромосомы), ретровирусные и лентивирусные векторные конструкции. В одном аспекте вектор способен экспрессировать конструкцию CAR в Т–клетках или NK–клетках млекопитающих. В одном аспекте Т–клетка млекопитающего представляет собой Т–клетку человека или NK–клетку человека.
Настоящее изобретение также охватывает РНК–конструкцию, кодирующую CAR, которую можно вводить путем прямой трансфекции в клетку, например, T–клетку или NK–клетку. Способ создания мРНК для применения в трансфекции предусматривает транскрипцию in vitro (IVT) матрицы с использованием специально разработанных праймеров с последующим добавлением поли(А) с получением конструкции, содержащей 3'– и 5'–нетранслируемые последовательности ("UTR"), 5'–кэп и/или участок внутренней посадки рибосомы (IRES), ген, который должен экспрессироваться, и поли(A)–хвост, обычно длиной 50–2000 оснований (SEQ ID NO: 35). С помощью РНК, полученной таким образом, можно эффективно трансфицировать различные типы клеток. В одном аспекте матрица содержит последовательности для CAR.
В одном аспекте трансген CAR (например, CAR для CD19) кодируется матричной РНК (мРНК). В одном аспекте мРНК, кодирующую трансген CAR, вводят в Т–клетку с получением CART–клетки или NK–клетку.
Векторы
В настоящем изобретении также предусмотрены векторы, в которые вставлена ДНК по настоящему изобретению. Векторы, полученные из ретровирусов, таких как лентивирус, являются подходящими инструментами для достижения долгосрочного переноса генов, поскольку они обеспечивают долгосрочную стабильную интеграцию трансгена и его размножение в дочерних клетках. Лентивирусные векторы обладают дополнительным преимуществом по сравнению с векторами, полученными из онкоретровирусов, таких как вирусы лейкоза мышей, в том, что ими можно трансдуцировать непролиферирующие клетки, такие как гепатоциты. Они также обладают дополнительным преимуществом низкой иммуногенности.
В одном варианте осуществления вектор, содержащий нуклеиновую кислоту, кодирующую желаемый CAR по настоящему изобретению, представляет собой ДНК, РНК, плазмиду, аденовирусный вектор, лентивирусный вектор или ретровирусный вектор. Ретровирусный вектор также может представлять собой, например, гамма–ретровирусный вектор. Гамма–ретровирусный вектор может содержать, например, промотор, сигнал упаковки (ψ), сайт связывания праймера (PBS), один или несколько (например, два) длинных концевых повторов (LTR) и трансген, представляющий интерес, например, ген, кодирующий CAR. В гамма–ретровирусном векторе могут отсутствовать структурные гены вирусов, такие как gag, pol и env. Иллюстративные гамма–ретровирусные векторы включают в себя вирус лейкоза мышей (MLV), вирус некроза селезенки (SFFV) и вирус миелопролиферативной саркомы (MPSV) и векторы, полученные из них. Другие гамма–ретровирусные векторы описаны, например, в Tobias Maetzig et al., "Gammaretroviral Vectors: Biology, Technology and Application" Viruses. 2011 Jun; 3(6): 677–713.
В другом варианте осуществления вектор, содержащий нуклеиновую кислоту, кодирующую желаемый CAR по настоящему изобретению, представляет собой аденовирусный вектор (A5/35). В другом варианте осуществления экспрессии нуклеиновых кислот, кодирующих CAR, можно достичь с помощью транспозонов, таких как "спящая красавица", CRISPR, CAS9 и нуклеаз с "цинковыми пальцами". См., например, June et al. 2009 Nature Reviews Immunology 9.10: 704–716, включенную в данный документ посредством ссылки во всей своей полноте.
Вкратце, экспрессии природных или синтетических нуклеиновых кислот, кодирующих CAR, обычно достигают путем образования функциональной связи нуклеиновой кислоты, кодирующей полипептид CAR или его части, с промотором и включения конструкции в состав вектора экспрессии. Векторы могут подходить для репликации и интеграции у эукариот. Типичные клонирующие векторы содержат терминаторы транскрипции и трансляции, последовательности инициации и промоторы, применимые для регуляции экспрессии желаемой последовательности нуклеиновой кислоты.
Экспрессионные конструкции по настоящему изобретению также можно использовать для иммунизации и генной терапии нуклеиновыми кислотами с использованием стандартных протоколов доставки генов. Способы доставки генов известны из уровня техники. См., например, патенты США №№ 5399346, 5580859, 5589466, включенные в данный документ посредством ссылки во всей своей полноте. В другом варианте осуществления в настоящем изобретении предусмотрен вектор для генной терапии.
Нуклеиновую кислоту можно клонировать в векторы множества типов. Например, нуклеиновую кислоту можно клонировать в вектор, включающий в себя без ограничения плазмиду, фагмиду, производное фага, вирус животных и космиду. Векторы, представляющие особый интерес, включают в себя экспрессионные векторы, репликационные векторы, векторы для создания зондов и векторы для секвенирования.
Кроме того, экспрессионный вектор можно предоставлять клетке в форме вирусного вектора. Технология вирусных векторов хорошо известна из уровня техники и описана, например, в Sambrook et al., 2012, MOLECULAR CLONING: A LABORATORY MANUAL, volumes 1–4, Cold Spring Harbor Press, NY) и в других руководствах по вирусологии и молекулярной биологии. Вирусы, применимые в качестве векторов, включают в себя без ограничения ретровирусы, аденовирусы, аденоассоциированные вирусы, герпесвирусы и лентивирусы. Как правило, подходящий вектор содержит точку начала репликации, функционирующую по меньшей мере в одном организме, промоторную последовательность, подходящие сайты для эндонуклеаз рестрикции и один или несколько селектируемых маркеров (например, WO 01/96584; WO 01/29058 и патент США № 6326193).
Ряд вирусных систем был разработан для переноса генов в клетки млекопитающих. Например, ретровирусы представляют собой удобную платформу для систем доставки генов. Выбранный ген можно вставить в вектор и упаковать в ретровирусные частицы с использованием методик, известных из уровня техники. Затем рекомбинантный вирус можно выделить и доставить в клетки субъекта in vivo либо ex vivo. Из уровня техники известен ряд ретровирусных систем. В некоторых вариантах осуществления используют аденовирусные векторы. Из уровня техники известен ряд аденовирусных векторов. В одном варианте осуществления используют лентивирусные векторы.
Дополнительные промоторные элементы, например, энхансеры, регулируют частоту инициации транскрипции. Как правило, они расположены в области на 30–110 п. о. выше сайта начала, хотя было показано, что ряд промоторов также содержит функциональные элементы ниже сайта начала. Расстояние между промоторными элементами часто является гибким, так что функция промотора сохраняется при инверсии элементов или их перемещении друг относительно друга. В промоторе гена тимидинкиназы (tk) расстояние между промоторными элементами можно увеличить до 50 п. н., прежде чем активность начнет снижаться. В зависимости от промотора оказывается, что отдельные элементы могут функционировать для активации транскрипции совместно или независимо. Иллюстративные промоторы включают в себя промоторы генов IE CMV, EF–1α, убиквитина С или фосфоглицерокиназы (PGK).
Примером промотора, который способен обеспечивать экспрессию трансгена CAR в Т–клетке млекопитающего, является промотор EF1–альфа (EF1a или EF1α). Нативный промотор EF1a управляет экспрессией альфа–субъединицы комплекса фактора элонгации–1, который отвечает за ферментативную доставку аминоацил–тРНК в рибосому. Промотор EF1a широко использовался в экспрессионных плазмидах для млекопитающих, и было показано, что он эффективно управляет экспрессией CAR с трансгенов, клонированных в лентивирусный вектор. См., например, Milone et al., Mol. Ther. 17(8): 1453–1464 (2009). В одном аспекте промотор EF1a содержит последовательность, представленную под SEQ ID NO: 11.
Другим примером промотора является последовательность немедленно–раннего промотора цитомегаловируса (CMV). Эта промоторная последовательность является последовательностью сильного конститутивного промотора, способного управлять экспрессией любой полинуклеотидной последовательности, функционально связанной с ней, на высоких уровнях. Однако можно также использовать последовательности других конститутивных промоторов, в том числе без ограничения раннего промотора вируса обезьян 40 (SV40), промотора вируса опухоли молочной железы мышей (MMTV), промотора длинного концевого повтора (LTR) вируса иммунодефицита человека (HIV), промотора MoMuLV, промотора вируса лейкоза птиц, немедленно–раннего промотора вируса Эпштейна–Барр, промотора вируса саркомы Рауса, а также промоторы генов человека, такие как, без ограничения, промотор гена актина, промотор гена миозина, промотор гена фактора элонгации–1α, промотор гена гемоглобина и промотор гена креатинкиназы. Кроме того, настоящее изобретение не должно ограничиваться применением конститутивных промоторов. Индуцируемые промоторы также рассматриваются как часть настоящего изобретения. Применение индуцируемого промотора обеспечивает молекулярный переключатель, способный включать экспрессию полинуклеотидной последовательности, с которой он функционально связан, если такая экспрессия желательна, или отключать экспрессию, если экспрессия нежелательна. Примеры индуцируемых промоторов включают без ограничения металлотионеин–индуцируемый промотор, глюкокортикоид–индуцируемый промотор, прогестерон–индуцируемый промотор и тетрациклин–индуцируемый промотор.
Другим примером промотора является промотор гена фосфоглицераткиназы (PGK). В некоторых вариантах осуществления может быть желательным усеченный промотор PGK (например, промотор PGK с одной или несколькими, например, 1, 2, 5, 10, 100, 200, 300 или 400, делециями нуклеотидов по сравнению с последовательностью промотора PGK дикого типа). Нуклеотидные последовательности иллюстративных промоторов PGK представлены в виде промотора PGK дикого типа под SEQ ID NO: 126 или усеченного варианта промотора PGK, например, PGK100, представленного под SEQ ID NO: 127, PGK200, представленного под SEQ ID NO: 128, PGK300, представленного под SEQ ID NO: 129, и PGK400, представленного под SEQ ID NO: 130.
Вектор также может содержать, например, сигнальную последовательность для облегчения секреции, сигнал полиаденилирования и терминатор транскрипции (например, из гена бычьего гормона роста (BGH)), элемент, обеспечивающий возможность эписомальной репликации и репликации у прокариот (например, точку начала репликации SV40 и ColE1 или другие, известные из уровня техники), и/или элементы для обеспечения возможности осуществления отбора (например, ген устойчивости к ампициллину и/или маркер устойчивости к зеоцину).
Для оценки экспрессии полипептида CAR или его частей экспрессионный вектор, который должен быть введен в клетку, также может содержать селектируемый маркерный ген или репортерный ген либо их оба для облегчения идентификации и отбора экспрессирующих клеток из популяции клеток, которые стремились трансфицировать или инфицировать вирусными векторами. В других аспектах селектируемый маркер может нестись отдельным фрагментом ДНК и использоваться в процедуре котрансфекции. Как селектируемые маркеры, так и репортерные гены могут быть фланкированы соответствующими регуляторными последовательностями для обеспечения экспрессии в клетках–хозяевах. Применимые селектируемые маркеры включают в себя, например, гены устойчивости к антибиотикам, такие как neo и т. п.
Репортерные гены используют для идентификации потенциально трансфицированных клеток и для оценивания функциональных возможностей регуляторных последовательностей. Как правило, репортерный ген представляет собой ген, который отсутствует или не экспрессируется в организме– или ткани–реципиенте и который кодирует полипептид, экспрессия которого проявляется в некотором легко выявляемом свойстве, например, ферментативной активности. Экспрессию репортерного гена анализируют в подходящее время после введения ДНК в клетки–реципиенты. Подходящие репортерные гены могут включать в себя гены, кодирующие люциферазу, бета–галактозидазу, хлорамфениколацетилтрансферазу, секретируемую щелочную фосфатазу, или ген зеленого флуоресцентного белка (например, Ui–Tei et al., 2000 FEBS Letters 479: 79–82). Подходящие системы экспрессии хорошо известны и могут быть получены с использованием известных методик или приобретены коммерческим путем. Как правило, конструкцию с минимальной 5'–фланкирующей областью, демонстрирующую наивысший уровень экспрессии репортерного гена, идентифицируют как промотор. Такие промоторные области могут быть связаны с репортерным геном и использоваться для оценивания средств в отношении способности к модулированию транскрипции, управляемой промотором.
В одном варианте осуществления вектор может дополнительно содержать нуклеиновую кислоту, кодирующую второй CAR. В одном варианте осуществления второй CAR содержит антигенсвязывающий домен, например, для мишени, отличной от CD19 (например, для B–клеточного антигена, отличного от CD19, например, CD10, CD20, CD22, CD34, CD123, FLT–3, ROR1, CD79b, CD179b, или CD79a). В одном варианте осуществления вектор содержит последовательность нуклеиновой кислоты, кодирующую первый CAR, который нацеливается на первый антиген и содержит внутриклеточный сигнальный домен, имеющий костимулирующий сигнальный домен, но не первичный сигнальный домен, и нуклеиновую кислоту, кодирующую второй CAR, который нацеливается на второй, другой, антиген и содержит внутриклеточный сигнальный домен, имеющий первичный сигнальный домен, но не костимулирующий сигнальный домен. В одном варианте осуществления вектор содержит нуклеиновую кислоту, кодирующую первый CAR для CD19, который содержит CD19–связывающий домен, трансмембранный домен и костимулирующий домен, и нуклеиновую кислоту, кодирующую второй CAR, который нацеливается на антиген, отличный от CD19 (например, B–клеточный антиген, отличный от CD19, например, CD10, CD20, CD22, CD34, CD123, FLT–3, ROR1, CD79b, CD179b, или CD79a), и содержит антигенсвязывающий домен, трансмембранный домен и первичный сигнальный домен. В другом варианте осуществления вектор содержит нуклеиновую кислоту, кодирующую первый CAR для CD19, который содержит CD19–связывающий домен, трансмембранный домен и первичный сигнальный домен, и нуклеиновую кислоту, кодирующую второй CAR, который нацеливается на антиген, отличный от CD19 (например, B–клеточный антиген, отличный от CD19, например, CD10, CD20, CD22, CD34, CD123, FLT–3, ROR1, CD79b, CD179b, или CD79a), и содержит антигенсвязывающий домен для антигена, трансмембранный домен и костимулирующий сигнальный домен.
В одном варианте осуществления вектор содержит нуклеиновую кислоту, кодирующую CAR (например, CAR для CD19), описываемый в данном документе, и нуклеиновую кислоту, кодирующую ингибирующий CAR. В одном варианте осуществления ингибирующий CAR содержит антигенсвязывающий домен, который связывает антиген, обнаруживаемый на нормальных клетках, но не на раковых клетках, например, на нормальных клетках, которые также экспрессируют CD19. В одном варианте осуществления ингибирующий CAR содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный домен ингибирующей молекулы. Например, внутриклеточный домен ингибирующего CAR может представлять собой внутриклеточный домен PD1, PD–L1, CTLA4, TIM3, CEACAM (например, CEACAM–1, CEACAM–3 и/или CEACAM–5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и/или TGF–бета.
В вариантах осуществления вектор может содержать две или более последовательности нуклеиновых кислот, где одна из последовательностей нуклеиновых кислот кодирует CAR, описываемый в данном документе, например, CAR для CD19, описываемый в данном документе. В одном варианте осуществления другая нуклеиновая кислота может кодировать второй CAR, например, ингибирующий CAR или CAR, специфично связывающийся с антигеном, отличным от CD19 (например, В–клеточным антигеном, отличным от CD19, например, CD10, CD20, CD22, CD34, CD123, FLT–3, ROR1, CD79b, CD179b, или CD79a), или полипептид, который может регулировать активность CAR (например, CAR для CD19), описываемого в данном документе. В таких вариантах осуществления две или более последовательности нуклеиновых кислот, например, кодирующие CAR (например, CAR для CD19), описываемый в данном документе, и второй CAR или другой полипептид, кодируются одной молекулой нуклеиновой кислоты в одной и той же рамке считывания и в виде одной полипептидной цепи. В одном варианте осуществления два или более полипептида могут быть разделены одним или несколькими сайтами расщепления пептидов (например, сайтом саморасщепления или субстратом для внутриклеточной протеазы). Примеры сайтов расщепления пептидов включают следующие, где остатки GSG являются необязательными: T2A, представленный под SEQ ID NO: 131, P2A, представленный под SEQ ID NO: 132, E2A, представленный под SEQ ID NO: 133, и F2A, представленный под SEQ ID NO: 134.
Способы введения генов в клетку и обеспечения их экспрессии в ней известны из уровня техники. Что касается экспрессионного вектора, вектор можно легко ввести в клетку–хозяина, например, клетку млекопитающего, бактерии, дрожжей или насекомого, любым способом, известным из уровня техники и описанным на страницах 208–210 международной заявки WO 2016/164731, поданной 8 апреля 2016 г., которая включена посредством ссылки во всей своей полноте.
Настоящее изобретение дополнительно предусматривает вектор, содержащий молекулу нуклеиновой кислоты, кодирующую CAR. В одном аспекте вектор CAR можно вводить путем прямой трансдукции в клетку, например, T–клетку или NK–клетку. В одном аспекте вектор представляет собой клонирующий или экспрессионный вектор, например, вектор, включающий в себя без ограничения одну или несколько плазмид (например, экспрессионные плазмиды, клонирующие векторы, миникольца, минивекторы, двойные микрохромосомы), ретровирусные и лентивирусные векторные конструкции. В одном аспекте вектор способен экспрессировать конструкцию CAR в Т–клетках млекопитающих. В одном аспекте Т–клетка млекопитающего представляет собой Т–клетку человека. В одном аспекте клетка млекопитающего представляет собой NK–клетку человека.
Трансфекция РНК
В данном документе раскрыты способы получения РНК, транскрибированной in vitro, кодирующей CAR. Настоящее изобретение также охватывает РНК–конструкцию, кодирующую CAR, которую можно вводить путем прямой трансфекции в клетку. Способ создания мРНК для применения в трансфекции может предусматривать транскрипцию in vitro (IVT) матрицы с использованием специально разработанных праймеров с последующим добавлением поли(А) с получением конструкции, содержащей 3'– и 5'–нетранслируемые последовательности ("UTR"), 5'–кэп и/или участок внутренней посадки рибосомы (IRES), нуклеиновую кислоту, которая должна экспрессироваться, и поли(A)–хвост, обычно длиной 50–2000 оснований (SEQ ID NO: 35). С помощью РНК, полученной таким образом, можно эффективно трансфицировать различные типы клеток. В одном аспекте матрица содержит последовательности для CAR.
В одном аспекте CAR (например, CAR для CD19) кодируется матричной РНК (мРНК). В одном аспекте мРНК, кодирующую CAR, вводят в иммунные эффекторные клетки, например, T–клетку или NK–клетку, для получения клетки, экспрессирующей CAR, например, CART–клетки или CAR–NK–клетки.
Дополнительные способы трансфекции РНК описаны на страницах 192–196 международной заявки WO 2016/164731, поданной 8 апреля 2016 г., которая включена посредством ссылки во всей своей полноте.
Невирусные способы доставки
В некоторых аспектах можно применять невирусные способы для доставки нуклеиновой кислоты, кодирующей CAR, описываемый в данном документе, в клетку, или ткань, или организм субъекта. В некоторых вариантах осуществления невирусный способ включает применение транспозона (также называемого мобильным генетическим элементом). В некоторых вариантах осуществления транспозон представляет собой фрагмент ДНК, который может вставлять себя в определенное местоположение в геноме, например, фрагмент ДНК, который способен к саморепликации и вставке своей копии в геном, или фрагмент ДНК, который может быть сплайсирован из более длинной нуклеиновой кислоты и вставлен в другое место в геноме. Дополнительные и иллюстративные транспозоны и невирусные способы доставки описаны на страницах 196–198 международной заявки WO 2016/164731, поданной 8 апреля 2016 г., которая включена посредством ссылки во всей своей полноте.
Источники клеток
Перед размножением и генетической модификацией, например, для экспрессии CAR, описываемого в данном документе, источник клеток, например, T–клетки или NK–клетки, можно получить от субъекта. Термин "субъект" предполагается как включающий живые организмы, у которых можно вызвать иммунный ответ (например, млекопитающих). Примеры субъектов включают людей, собак, кошек, мышей, крыс и их трансгенные формы.
В вариантах осуществления иммунные эффекторные клетки (например, популяцию иммунных эффекторных клеток), например, Т–клетки, происходят из (например, дифференцируются из) стволовой клетки, например, эмбриональной стволовой клетки или плюрипотентной стволовой клетки, например, из индуцированной плюрипотентной стволовой клетки (iPSC). В вариантах осуществления клетки являются аутологичными или аллогенными. В вариантах осуществления, где клетки являются аллогенными, клетки, например, происходящие из стволовых клеток (например, iPSC), модифицируют для снижения их аллореактивности. Например, клетки можно модифицировать для снижения аллореактивности, например, путем модификации (например, разрушения) их Т–клеточного рецептора. В вариантах осуществления можно использовать сайт–специфическую нуклеазу для разрушения Т–клеточного рецептора, например, после дифференцировки Т–клеток. В других примерах клетки, например, T–клетки, происходящие из iPSC, можно получить из вирусоспецифичных T–клеток, которые с меньшей вероятностью вызывают реакцию "трансплантат против хозяина" из–за их распознавания антигена патогенного микроорганизма. В еще нескольких других примерах аллореактивность можно уменьшить, например, свести к минимуму, путем получения iPSC из широко распространенных гаплотипов HLA, так, чтобы они являлись гистосовместимыми у совместимых неродственных субъектов–реципиентов. В еще нескольких других примерах аллореактивность можно уменьшить, например, свести к минимуму, путем репрессии экспрессии HLA посредством генетической модификации. Например, T–клетки, происходящие из iPSC, можно обработать согласно описанному, например, в Themeli et al. Nat. Biotechnol. 31.10(2013):928–35, включенной в данный документ посредством ссылки. В некоторых примерах иммунные эффекторные клетки, например, Т–клетки, происходящие из стволовых клеток, можно обработать/получить с помощью способов, описанных в WO2014/165707, включенной в данный документ посредством ссылки. Дополнительные варианты осуществления, относящиеся к аллогенным клеткам, описаны в данном документе, например, в разделе "Аллогенные иммунные эффекторные клетки с CAR" данного документа.
Т–клетки можно получить из ряда источников, в том числе из мононуклеарных клеток периферической крови, костного мозга, ткани лимфатических узлов, пуповинной крови, ткани тимуса, ткани из очага инфекции, асцита, плеврального выпота, ткани селезенки и опухолей. В определенных аспектах настоящего изобретения можно использовать любое количество линий T–клеток, доступных в данной области техники. В определенных аспектах настоящего изобретения Т–клетки можно получить из единицы крови, собранной у субъекта, с использованием любого количества методик, известных специалисту в данной области, таких как разделение с помощью Ficoll™. В одном предпочтительном аспекте клетки из циркулирующей крови индивидуума получают путем афереза. Продукт афереза обычно содержит лимфоциты, в том числе Т–клетки, моноциты, гранулоциты, В–клетки, другие ядерные лейкоциты, эритроциты и тромбоциты. В одном аспекте клетки, собранные путем афереза, можно промыть, чтобы удалить фракцию плазмы крови и поместить клетки в соответствующий буфер или среду для последующих стадий обработки. В одном аспекте настоящего изобретения клетки промывают фосфатно–солевым буферным раствором (PBS). В альтернативном аспекте в промывочном растворе отсутствует кальций и может отсутствовать магний или могут отсутствовать многие, если не все, двухвалентные катионы. Начальные стадии активации в отсутствие кальция могут привести к усиленной активации. Средним специалистам в данной области техники будет без труда понятно, что стадию промывки можно осуществлять способами, известными специалистам в данной области, как, например, с помощью полуавтоматической "проточной" центрифуги (например, клеточного процессора Cobe 2991, Baxter CytoMate или Haemonetics Cell Saver 5) в соответствии с инструкциями изготовителя. После промывки клетки можно ресуспендировать в различных биосовместимых буферах, таких как, например, PBS, не содержащий Ca и не содержащий Mg, PlasmaLyte A или другой солевой раствор с буфером или без него. В качестве альтернативы, нежелательные компоненты из аферезного образца можно удалить, и клетки можно непосредственно ресуспендировать в культуральной среде.
Признано, что в способах применения можно использовать условия питательных сред, предусматривающие 5% или менее концентрированную, например, 2%, человеческую сыворотку крови AB, и использовать известные условия и составы питательных сред, например, описанные в Smith et al., "Ex vivo expansion of human T cells for adoptive immunotherapy using the novel Xeno–free CTS Immune Cell Serum Replacement", Clinical & Translational Immunology (2015) 4, e31; doi:10.1038/cti.2014.31.
В одном аспекте Т–клетки выделяют из лимфоцитов периферической крови путем лизиса эритроцитов и истощения популяции моноцитов, например, посредством центрифугирования в градиенте PERCOLLTM или посредством противоточного элютриационного центрифугирования. Конкретную субпопуляцию Т–клеток, такую как CD3+, CD28+, CD4+, CD8+, CD45RA+, и CD45RO+T–клетки, можно дополнительно выделить с помощью методик позитивного или негативного отбора. Например, в одном аспекте Т–клетки выделяют путем инкубирования с микрогранулами, конъюгированными с антителами к CD3/CD28 (например, 3×28), такими как DYNABEADS® M–450 CD3/CD28 T, в течение периода времени, достаточного для позитивного отбора желаемых Т–клеток. В одном аспекте период времени составляет приблизительно 30 минут. В дополнительном аспекте период времени находится в диапазоне от 30 минут до 36 часов или больше и включает все целочисленные значения в этом промежутке. В дополнительном аспекте период времени составляет по меньшей мере 1, 2, 3, 4, 5 или 6 часов. В еще одном предпочтительном аспекте период времени составляет от 10 до 24 часов. В одном аспекте период времени инкубирования составляет 24 часа. Более длительное время инкубирования можно использовать для выделения Т–клеток в любой ситуации, в которой Т–клеток немного по сравнению с другими типами клеток, как, например, при выделении лимфоцитов, инфильтрирующих опухоль (TIL), из опухолевой ткани или у индивидуумов с ослабленным иммунитетом. Кроме того, при использовании более длительного времени инкубирования может увеличиваться эффективность улавливания CD8+ Т–клеток. Таким образом, просто сокращая или удлиняя время, в течение которого Т–клетки имеют возможность связываться с микрогранулами с антителами к CD3/CD28, и/или увеличивая или уменьшая соотношение микрогранул и Т–клеток (как описано дополнительно в данном документе), можно предпочтительно производить положительный или отрицательный отбор субпопуляций Т–клеток в начале культивирования или в другие моменты времени в течение процесса. Кроме того, путем увеличения или уменьшения относительного количества антител к CD3 и/или антител к CD28 на микрогранулах или другой поверхности можно предпочтительно производить положительный или отрицательный отбор субпопуляций Т–клеток в начале культивирования или в другие желательные моменты времени. Специалисту в данной области будет понятно, что в контексте настоящего изобретения также можно использовать несколько циклов отбора. В определенных аспектах может быть желательно выполнить процедуру отбора и использовать "неотобранные" клетки в процессе активации и размножения. "Неотобранные" клетки также можно подвергнуть дополнительным циклам отбора.
Обогащение популяции Т–клеток путем негативного отбора можно осуществлять с помощью комбинации антител, направленных на поверхностные маркеры, уникальные для клеток, подвергаемых негативному отбору. Одним из способов является сортировка и/или отбор клеток с помощью отрицательной магнитной иммуноадгезии или проточной цитометрии, в которой используется коктейль моноклональных антител, направленных на маркеры клеточной поверхности, присутствующие на клетках, подвергаемых негативному отбору. Например, для обогащения CD4+ клетками путем негативного отбора коктейль моноклональных антител обычно содержит антитела к CD14, CD20, CD11b, CD16, HLA–DR, и CD8. В определенных аспектах может быть желательным обогащение регуляторными Т–клетками, которые обычно экспрессируют CD4+, CD25+, CD62Lhi, GITR+, и FoxP3+, или их позитивный отбор. В качестве альтернативы, в определенных аспектах популяцию регуляторных Т–клеток истощают с помощью микрогранул, конъюгированных с антителом к СD25, или другого подобного способа отбора.
Способы, описываемые в данном документе, могут включать, например, отбор конкретной субпопуляции иммунных эффекторных клеток, например, Т–клеток, которая представляет собой популяцию, истощенную по регуляторным Т–клеткам с истощением по CD25+ клеткам, с помощью, например, методики негативного отбора, например, описываемого в данном документе. Популяция, истощенная по регуляторным Т–клеткам, предпочтительно содержит менее 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток.
В одном варианте осуществления регуляторные T–клетки, например, CD25+ T–клетки, удаляют из популяции с помощью антитела к CD25 или его фрагмента или CD25–связывающего лиганда IL–2. В одном варианте осуществления антитело к CD25 или его фрагмент или CD25–связывающий лиганд конъюгированы с субстратом, например, микрогранулой, или иным образом нанесены на субстрат, например, микрогранулу. В одном варианте осуществления антитело к CD25 или его фрагмент конъюгированы с субстратом, описываемым в данном документе.
В одном варианте осуществления регуляторные T–клетки, например, CD25+ T–клетки, удаляют из популяции с помощью реагента для истощения по CD25 от MiltenyiTM. В одном варианте осуществления соотношение клеток и реагента для истощения по CD25 составляет 1e7 клеток на 20 мкл, или 1e7 клеток на 15 мкл, или 1e7 клеток на 10 мкл, или 1e7 клеток на 5 мкл, или 1e7 клеток на 2,5 мкл, или 1e7 клеток на 1,25 мкл. В одном варианте осуществления, например, для истощения регуляторных Т–клеток, например, CD25+, используют более 500 миллионов клеток/мл. В дополнительном аспекте используют концентрацию клеток 600, 700, 800 или 900 миллионов клеток/мл.
В одном варианте осуществления популяция иммунных эффекторных клеток, которая должна быть истощена, содержит приблизительно 6×109 CD25+ T–клеток. В других аспектах популяция иммунных эффекторных клеток, которая должна быть истощена, содержит от приблизительно 1×109 до 1×1010 CD25+ Т–клеток с включением любого целочисленного значения в этом промежутке. В одном варианте осуществления полученная популяция, истощенная по регуляторным T–клеткам, содержит 2×109 регуляторных T–клеток, например, CD25+ клеток, или меньше (например, 1×109, 5×108, 1×108, 5×107, 1×107 или меньше CD25+ клеток).
В одном варианте осуществления регуляторные Т–клетки, например, CD25+ клетки, удаляют из популяции с помощью системы CliniMACS с набором трубок для истощения, таким как, например, трубки 162–01. В одном варианте осуществления система CliniMACS работает с такими установленными параметрами истощения, как, например, DEPLETION2.1.
Не желая ограничиваться какой–либо конкретной теорией, полагают, что посредством уменьшения уровня отрицательных регуляторов иммунных клеток (например, уменьшения количества нежелательных иммунных клеток, например, TREG–клеток) у субъекта до афереза или в ходе получения клеточного продукта, экспрессирующего CAR, можно снизить риск рецидива у субъекта. Например, способы истощения популяции TREG–клеток известны из уровня техники. Способы уменьшения количества TREG–клеток включают без ограничения применение циклофосфамида, антитела к GITR (антитела к GITR, описываемого в данном документе), реагента для истощения по CD25 и их комбинаций.
В некоторых вариантах осуществления способы получения включают снижение количества (например, истощение популяции) TREG–клеток до получения клетки, экспрессирующей CAR. Например, способы получения включают приведение образца, например, аферезного образца, в контакт с антителом к GITR и/или антителом к CD25 (или его фрагментом или CD25–связывающим лигандом), например, для истощения популяции TREG–клеток до получения клеточного (например, T–клеточного, NK–клеточного) продукта, экспрессирующего CAR.
В варианте осуществления субъект получает предварительное лечение с помощью одного или нескольких видов терапии, которые обеспечивают снижение количества TREG–клеток перед сбором клеток для получения клеточного продукта, экспрессирующего CAR, со снижением тем самым риска рецидива у субъекта при лечении клетками, экспрессирующими CAR. В варианте осуществления способы уменьшения количества TREG–клеток включают без ограничения введение субъекту одного или нескольких из циклофосфамида, антитела к GITR, реагента для истощения по CD25 или их комбинации. Введение одного или нескольких из циклофосфамида, антитела к GITR, реагента для истощения по CD25 или их комбинации может происходить до, во время или после инфузии клеточного продукта, экспрессирующего CAR.
В варианте осуществления субъект получает предварительное лечение циклофосфамидом перед сбором клеток для получения клеточного продукта, экспрессирующего CAR, со снижением тем самым риска рецидива у субъекта при лечении клетками, экспрессирующими CAR. В варианте осуществления субъект получает предварительное лечение антителом к GITR перед сбором клеток для получения клеточного продукта, экспрессирующего CAR, со снижением тем самым риска рецидива у субъекта при лечении клетками, экспрессирующими CAR.
В одном варианте осуществления популяция клеток, которые должны быть удалены, не представляет собой ни регуляторные Т–клетки, ни опухолевые клетки, но представляет собой клетки, которые в иных отношениях отрицательно влияют на размножение и/или функцию CART–клеток, например, клетки, экспрессирующие CD14, CD11b, CD33, CD15, или другие маркеры, экспрессируемые потенциально иммунодепрессивными клетками. В одном варианте осуществления предполагается, что такие клетки удаляют параллельно с регуляторными Т–клетками и/или опухолевыми клетками, или после указанного истощения, или в другом порядке.
Способы, описываемые в данном документе, могут включать более одной стадии отбора, например, более одной стадии истощения. Обогащение популяции Т–клеток путем негативного отбора можно осуществлять, например, с помощью комбинации антител, направленных на поверхностные маркеры, уникальные для клеток, подвергаемых негативному отбору. Одним из способов является сортировка и/или отбор клеток с помощью отрицательной магнитной иммуноадгезии или проточной цитометрии, в которой используется коктейль моноклональных антител, направленных на маркеры клеточной поверхности, присутствующие на клетках, подвергаемых негативному отбору. Например, для обогащения CD4+ клетками путем негативного отбора коктейль моноклональных антител может содержать антитела к CD14, CD20, CD11b, CD16, HLA–DR, и CD8.
Способы, описываемые в данном документе, могут дополнительно включать удаление из популяции клеток, экспрессирующих опухолевый антиген, например, опухолевый антиген, который не включает в себя CD25, например, CD19, CD30, CD38, CD123, CD20, CD14 или CD11b, с получением тем самым популяции, истощенной по регуляторным Т–клеткам, например, истощенной по CD25+, и истощенной по клеткам с опухолевым антигеном, которая подходит для экспрессии CAR, например, CAR, описываемого в данном документе. В одном варианте осуществления клетки, экспрессирующие опухолевый антиген, удаляют одновременно с регуляторными Т–клетками, например, CD25+ клетками. Например, антитело к CD25 или его фрагмент и антитело к опухолевому антигену или его фрагмент могут быть присоединены к одному и тому же субстрату, например, микрогрануле, который можно использовать для удаления клеток, или антитело к CD25 или его фрагмент или антитело к опухолевому антигену или его фрагмент могут быть присоединены к отдельным микрогранулам, смесь которых можно использовать для удаления клеток. В других вариантах осуществления удаление регуляторных Т–клеток, например, CD25+ клеток, и удаление клеток, экспрессирующих опухолевый антиген, является последовательным и может происходить, например, в любом порядке.
Также предусмотрены способы, которые включают удаление из популяции клеток, экспрессирующих ингибитор контрольных точек иммунного ответа, например, ингибитор контрольных точек иммунного ответа, описываемый в данном документе, например, одного или нескольких из PD1+ клеток, LAG3+ клеток и TIM3+ клеток, с получением тем самым популяции, истощенной по регуляторным Т–клеткам, например, истощенной по CD25+ клеткам и истощенной по клеткам с ингибитором контрольных точек иммунного ответа, например, истощенной по PD1+, LAG3+ и/или TIM3+ клеткам. Иллюстративные ингибиторы контрольных точек иммунного ответа включают в себя B7–H1, B7–1, CD160, P1H, 2B4, PD1, TIM3, CEACAM (например, CEACAM–1, CEACAM–3 и/или CEACAM–5), LAG3, TIGIT, CTLA–4, BTLA и LAIR1. В одном варианте осуществления клетки, экспрессирующие ингибитор контрольных точек иммунного ответа, удаляют одновременно с регуляторными Т–клетками, например, CD25+ клетками. Например, антитело к CD25 или его фрагмент и антитело к ингибитору контрольных точек иммунного ответа или его фрагмент могут быть присоединены к одной и той же микрогрануле, которую можно использовать для удаления клеток, или антитело к CD25 или его фрагмент и антитело к ингибитору контрольных точек иммунного ответа или его фрагмент могут быть присоединены к отдельным микрогранулам, смесь которых можно использовать для удаления клеток. В других вариантах осуществления удаление регуляторных Т–клеток, например, CD25+ клеток, и удаление клеток, экспрессирующих ингибитор контрольных точек иммунного ответа, является последовательным и может происходить, например, в любом порядке.
В одном варианте осуществления можно выбрать популяцию Т–клеток, которая экспрессирует один или несколько из IFN–γ, TNFα, IL–17A, IL–2, IL–3, IL–4, GM–CSF, IL–10, IL–13, гранзима В и перфорина или других подходящих молекул, например, других цитокинов. Способы скрининга в отношении экспрессии клеток можно определить, например, с помощью способов, описанных в публикации согласно PCT № WO 2013/126712.
Для выделения желаемой популяции клеток путем позитивного или негативного отбора можно варьировать концентрацию клеток и поверхности (например, частиц, таких как микрогранулы). В определенных аспектах может быть желательно значительно уменьшить объем, в котором микрогранулы и клетки смешиваются друг с другом (например, увеличить концентрацию клеток), чтобы обеспечить максимальный контакт клеток и микрогранул. Например, в одном аспекте используют концентрацию 2 миллиарда клеток/мл. В одном аспекте используют концентрацию 1 миллиард клеток/мл. В дополнительном аспекте используют более 100 миллионов клеток/мл. В дополнительном аспекте используют концентрацию клеток 10, 15, 20, 25, 30, 35, 40, 45, или 50 миллионов клеток/мл. В еще одном аспекте используют концентрацию клеток от 75, 80, 85, 90, 95, или 100 миллионов клеток/мл. В дополнительных аспектах можно использовать концентрации 125 или 150 миллионов клеток/мл. Использование высоких концентраций может приводить к увеличению выхода клеток, интенсивности активации клеток и интенсивности размножения клеток. Кроме того, использование высоких концентраций клеток позволяет более эффективно улавливать клетки, которые могут характеризоваться слабой экспрессией антигенов–мишеней, представляющих интерес, такие как CD28–отрицательные Т–клетки, или клетки из образцов, в которых присутствует много опухолевых клеток (например, лейкозной крови, опухолевой ткани и т. д.). Такие популяции клеток могут иметь терапевтическую ценность, и их было бы желательно получить. Например, использование высокой концентрации клеток позволяет проводить более эффективный отбор CD8+ Т–клеток, которые обычно характеризуются более слабой экспрессией CD28.
В родственном аспекте может быть желательным использование более низких концентраций клеток. Благодаря значительному разбавлению смеси Т–клеток и поверхности (например, частиц, таких как микрогранулы), взаимодействие между частицами и клетками сводится к минимуму. При этом отбираются клетки, в высоких количествах экспрессирующие желаемые антигены, которые должны будут связываться с частицами. Например, CD4+ T–клетки экспрессируют CD28 на более высоких уровнях и улавливаются в слабых концентрациях более эффективно, чем CD8+ T–клетки. В одном аспекте используемая концентрация клеток составляет 5 X 10e6/мл. В других аспектах используемая концентрация может составлять от приблизительно 1 X 105/мл до 1 X 106/мл с включением любого целочисленного значения в этом промежутке.
В других аспектах клетки можно инкубировать на ротаторе в течение различных промежутков времени с различными скоростями при 2–10oC или при комнатной температуре.
Т–клетки для стимуляции также можно замораживать после стадии промывки. Не желая ограничиваться какой–либо теорией, полагают, что стадия замораживания и последующего размораживания обеспечивает получение более однородного продукта за счет удаления гранулоцитов и в некоторой степени моноцитов из популяции клеток. После стадии промывки, на которой удаляют плазму крови и тромбоциты, клетки можно суспендировать в замораживающем растворе. Хотя многие замораживающие растворы и параметры для замораживания известны из уровня техники и будут применимыми в данном случае, один способ предусматривает использование PBS, содержащего 20% DMSO и 8% человеческий сывороточный альбумин, или культуральной среды, содержащей 10% декстрана 40 в 5% декстрозе, 20% человеческого сывороточного альбумина и 7,5% DMSO или 31,25% PlasmaLyte–А, 31,25% 5% декстрозы в 0,45% NaCl, 10% декстрана 40 в 5% декстрозе, 20% человеческого сывороточного альбумина и 7,5% DMSO, или других подходящих сред для замораживания клеток, содержащих, например, Hespan и PlasmaLyte A, и затем клетки замораживают до –80°C со скоростью 1° в минуту и хранят в паровой фазе в резервуаре для хранения жидкого азота. Можно применять другие способы контролируемого замораживания, а также неконтролируемого замораживания немедленно при –20°C или в жидком азоте.
В определенных аспектах криоконсервированные клетки размораживают и промывают, как описано в данном документе, и оставляют на один час при комнатной температуре перед активацией с помощью способов по настоящему изобретению.
В контексте настоящего изобретения также предусматривается сбор образцов крови или продукта афереза у субъекта в период времени до того, как могут потребоваться размноженные клетки, описываемые в данном документе. Ввиду этого источник клеток, подлежащих размножению, можно собирать в любой момент времени, когда это необходимо, и желаемые клетки, такие как Т–клетки, можно выделять и замораживать для последующего применения в Т–клеточной терапии для любого количества заболеваний или состояний, при которых будет наблюдаться благоприятный эффект Т–клеточной терапии, таких как описываемые в данном документе. В одном аспекте образец крови или аферезный образец берут у в целом здорового субъекта. В определенных аспектах образец крови или аферезный образец берут у в целом здорового субъекта, который имеет риск развития заболевания, но у которого заболевание еще не развилось, и клетки, представляющие интерес, выделяют и замораживают для последующего применения. В определенных аспектах Т–клетки можно размножать, замораживать и использовать позднее. В определенных аспектах образцы собирают у пациента вскоре после диагностирования конкретного заболевания, описываемого в данном документе, но до проведения какого–либо лечения. В дополнительном аспекте клетки выделяют из образца крови или аферезного образца у субъекта до проведения какого–либо количества соответствующих способов лечения, в том числе без ограничения лечения такими средствами, как натализумаб, эфализумаб, противовирусные средства, химиотерапия, лучевая терапия, иммунодепрессивные средства, такие как циклоспорин, азатиоприн, метотрексат, микофенолят и FK506, антитела или другие иммунодеструктивные средства, такие как CAMPATH, антитела к CD3, цитоксан, флударабин, циклоспорин, FK506, рапамицин, микофеноловая кислота, стероиды, FR901228 и облучение.
В дополнительном аспекте настоящего изобретения Т–клетки получают от пациента непосредственно после лечения, при котором у субъекта остаются функциональные Т–клетки. В этом отношении наблюдалось, что после определенных видов лечения рака, в частности, лечения лекарственными средствами, которые повреждают иммунную систему, вскоре после лечения в течение периода, когда пациенты обычно восстанавливаются после лечения, качество полученных Т–клеток может быть оптимальным или улучшенным в отношении их способности размножаться ex vivo. Аналогично, после манипуляций ex vivo с использованием способов, описываемых в данном документе, эти клетки могут находиться в состоянии, предпочтительном для усиленного приживления и размножения in vivo. Таким образом, в контексте настоящего изобретения предусматривается сбор клеток крови, в том числе Т–клеток, дендритных клеток или других клеток гемопоэтической линии дифференцировки, во время этой фазы восстановления. Дополнительно, в определенных аспектах можно использовать режимы мобилизации (например, мобилизации с помощью GM–CSF) и кондиционирования для создания состояния у субъекта, при котором репопуляция, рециркуляция, регенерация и/или размножение определенных типов клеток являются благоприятными, особенно в течение определенного временного окна после терапии. Иллюстративные типы клеток включают в себя Т–клетки, В–клетки, дендритные клетки и другие клетки иммунной системы.
В одном варианте осуществления популяция Т–клеток характеризуется дефицитом диацилглицеринкиназы (DGK). Клетки с дефицитом DGK включают в себя клетки, которые не экспрессируют DGK в виде РНК или белка или характеризуются пониженной или ингибированной активностью DGK. Клетки с дефицитом DGK можно получить с помощью генетических подходов, например, путем введения средств для РНК–интерференции, например, siRNA, shRNA, miRNA, для снижения или предотвращения экспрессии DGK. В качестве альтернативы, клетки с дефицитом DGK можно получить путем обработки ингибиторами DGK, описываемыми в данном документе.
В одном варианте осуществления популяция Т–клеток характеризуется дефицитом Ikaros. Клетки с дефицитом Ikaros включают в себя клетки, которые не экспрессируют Ikaros в виде РНК или белка или характеризуются пониженной или ингибированной активностью Ikaros; клетки с дефицитом Ikaros можно получить с помощью генетических подходов, например, путем введения средств для РНК–интерференции, например, siRNA, shRNA, miRNA, для снижения или предотвращения экспрессии Ikaros. В качестве альтернативы, клетки с дефицитом Ikaros можно получить путем обработки ингибиторами Ikaros, например, леналидомидом.
В вариантах осуществления популяция Т–клеток характеризуется дефицитом DGK и дефицитом Ikaros, например, не экспрессирует DGK и Ikaros или характеризуется пониженной или ингибированной активностью DGK и Ikaros. Такие клетки с дефицитом DGK и Ikaros можно получить любым из способов, описываемых в данном документе.
В варианте осуществления NK–клетки получают от субъекта. В другом варианте осуществления NK–клетки представляют собой линию NK–клеток, например, линию клеток NK–92 (Conkwest).
Аллогенные иммунные эффекторные клетки с CAR
В вариантах осуществления, описываемых в данном документе, иммунная эффекторная клетка может представлять собой аллогенную иммунную эффекторную клетку, например, Т–клетку или NK–клетку. Например, клетка может представлять собой аллогенную Т–клетку, например, аллогенную Т–клетку, в которой отсутствует экспрессия функционального Т–клеточного рецептора (TCR) и/или человеческого лейкоцитарного антигена (HLA), например, HLA I класса и/или HLA II класса.
T–клетку, в которой отсутствует функциональный TCR, можно, например, сконструировать таким образом, чтобы она не экспрессировала какой–либо функциональный TCR на своей поверхности, сконструировать таким образом, чтобы она не экспрессировала одну или несколько субъединиц, которые образуют функциональный TCR, или сконструировать таким образом, чтобы она вырабатывала очень немного функционального TCR на своей поверхности. В качестве альтернативы, Т–клетка может экспрессировать значительно нарушенный TCR, например, посредством экспрессии мутантных или усеченных форм одной или нескольких субъединиц TCR. Термин "значительно нарушенный TCR" означает, что этот TCR не будет вызывать нежелательную иммунную реакцию у хозяина.
Т–клетку, описываемую в данном документе, можно, например, сконструировать таким образом, чтобы она не экспрессировала функциональный HLA на своей поверхности. Например, Т–клетку, описываемую в данном документе, можно сконструировать таким образом, чтобы экспрессия HLA, например, HLA I класса и/или HLA II класса, на клеточной поверхности была подавлена.
В некоторых вариантах осуществления в Т–клетке может отсутствовать функциональный TCR и функциональный HLA, например, HLA I класса и/или HLA II класса.
Модифицированные Т–клетки, в которых отсутствует экспрессия функционального TCR и/или HLA, можно получить любым подходящим способом, в том числе путем нокаута или нокдауна одной или нескольких субъединиц TCR или HLA. Например, Т–клетка может предусматривать нокдаун TCR и/или HLA благодаря применению siRNA, shRNA, коротких палиндромных повторов, регулярно расположенных группами (CRISPR), эффекторной нуклеазы, подобной активаторам транскрипции (TALEN), или эндонуклеазы с "цинковыми пальцами" (ZFN).
В некоторых вариантах осуществления аллогенная клетка может представлять собой клетку, которая не экспрессирует или экспрессирует на низких уровнях ингибирующую молекулу, например, благодаря применению любого способа, описываемого в данном документе. Например, клетка может представлять собой клетку, которая не экспрессирует или экспрессирует на низких уровнях ингибирующую молекулу, например, молекулу, которая может снижать способность клетки, экспрессирующей CAR, осуществлять иммунный эффекторный ответ. Примеры ингибирующих молекул включают PD1, PD–L1, CTLA4, TIM3, LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7–H3 (CD276), B7–H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозин и TGF–бета. Путем ингибирования ингибирующей молекулы, например, путем ингибирования на уровне ДНК, РНК или белка, можно оптимизировать функциональные характеристики клеток, экспрессирующих CAR. В вариантах осуществления можно применять ингибирующую нуклеиновую кислоту, например, ингибирующую нуклеиновую кислоту, например, dsRNA, например, siRNA или shRNA, короткие палиндромные повторы, регулярно расположенные группами (CRISPR), эффекторную нуклеазу, подобную активаторам транскрипции (TALEN), или эндонуклеазу с "цинковыми пальцами" (ZFN), например, описываемые в данном документе.
siRNA и shRNA для ингибирования TCR или HLA
В некоторых вариантах осуществления экспрессию TCR и/или экспрессию HLA можно ингибировать с помощью siRNA или shRNA, нацеливающейся на нуклеиновую кислоту, кодирующую TCR и/или HLA, и/или ингибирующую молекулу, описываемую в данном документе (например, PD1, PD–L1, PD–L2, CTLA4, TIM3, CEACAM (например, CEACAM–1, CEACAM–3 и/или CEACAM–5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7–H3 (CD276), B7–H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозин и TGF–бета), в клетке, например, T–клетке.
Экспрессионные системы для siRNA и shRNA и иллюстративные shRNA описаны, например, в абзацах 649 и 650 международной публикации WO2015/142675, поданной 13 марта 2015 г., которая включена посредством ссылки во всей своей полноте.
CRISPR для ингибирования TCR или HLA
Как используется в данном документе, "CRISPR", или "CRISPR для TCR и/или HLA", или "CRISPR для ингибирования TCR и/или HLA" относится к набору коротких палиндромных повторов, регулярно расположенных группами, или к системе, содержащей такой набор повторов. Как используется в данном документе, "Cas" относится к CRISPR–ассоциированному белку.
Система "CRISPR/Cas" относится к системе, полученной из CRISPR и Cas, которую можно применять для сайленсинга или осуществления мутации гена TCR и/или HLA и/или ингибирующей молекулы, описываемой в данном документе (например, PD1, PD–L1, PD–L2, CTLA4, TIM3, CEACAM (например, CEACAM–1, CEACAM–3 и/или CEACAM–5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7–H3 (CD276), B7–H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозина и TGF–бета), в клетке, например, T–клетке.
Система CRISPR/Cas и пути ее применения описаны, например, в абзацах 651–658 международной публикации WO2015/142675, поданной 13 марта 2015 г., которая включена посредством ссылки во всей своей полноте.
TALEN для ингибирования TCR и/или HLA
"TALEN", или "TALEN для HLA и/или TCR", или "TALEN для ингибирования HLA и/или TCR" относится к эффекторной нуклеазе, подобной активатору транскрипции, искусственной нуклеазе, которую можно применять для редактирования гена HLA и/или TCR и/или ингибирующей молекулы, описываемой в данном документе (например, PD1, PD–L1, PD–L2, CTLA4, TIM3, CEACAM (например, CEACAM–1, CEACAM–3 и/или CEACAM–5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7–H3 (CD276), B7–H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозина и TGF–бета), в клетке, например, T–клетке.
TALEN и пути их применения описаны, например, в абзацах 659–665 международной публикации WO2015/142675, поданной 13 марта 2015 г., которая включена посредством ссылки во всей своей полноте.
Нуклеаза с "цинковыми пальцами" для ингибирования HLA и/или TCR
"ZFN", или "нуклеаза с "цинковыми пальцами", или "ZFN для HLA и/или TCR", или "ZFN для ингибирования HLA и/или TCR" относится к нуклеазе с "цинковыми пальцами", искусственной нуклеазе, которую можно применять для редактирования гена HLA и/или TCR и/или ингибирующей молекулы, описываемой в данном документе (например, PD1, PD–L1, PD–L2, CTLA4, TIM3, CEACAM (например, CEACAM–1, CEACAM–3 и/или CEACAM–5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7–H3 (CD276), B7–H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозина и TGF–бета), в клетке, например, T–клетке.
ZFN и пути их применения описаны, например, в абзацах 666–671 международной публикации WO2015/142675, поданной 13 марта 2015 г., которая включена посредством ссылки во всей своей полноте.
Экспрессия теломеразы
Не желая ограничиваться какой–либо конкретной теорией, полагают, что в некоторых вариантах осуществления терапевтическая Т–клетка характеризуется краткосрочной персистенцией у пациента из–за укороченных теломер в Т–клетке; соответственно, путем трансфекции геном теломеразы можно удлинить теломеры Т–клетки и улучшить персистенцию Т–клетки у пациента. См. Carl June, "Adoptive T cell therapy for cancer in the clinic", Journal of Clinical Investigation, 117:1466–1476 (2007). Таким образом, в варианте осуществления иммунная эффекторная клетка, например, Т–клетка, характеризуется эктопической экспрессией субъединицы теломеразы, например, каталитической субъединицы теломеразы, например, TERT, например, hTERT. В некоторых аспектах настоящее изобретение предусматривает способ получения клетки, экспрессирующей CAR, включающий приведение клетки в контакт с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, каталитическую субъединицу теломеразы, например, TERT, например, hTERT. Клетку можно приводить в контакт с нуклеиновой кислотой до приведения в контакт с конструкцией, кодирующей CAR, одновременно с этим или после этого.
В одном аспекте настоящее изобретение относится к способу получения популяции иммунных эффекторных клеток (например, T–клеток, NK–клеток). В варианте осуществления способ включает получение популяции иммунных эффекторных клеток (например, T–клеток или NK–клеток), приведение популяции иммунных эффекторных клеток в контакт с нуклеиновой кислотой, кодирующей CAR; и приведение популяции иммунных эффекторных клеток в контакт с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, hTERT, в условиях, которые допускают экспрессию CAR и теломеразы.
В варианте осуществления нуклеиновая кислота, кодирующая субъединицу теломеразы, представляет собой ДНК. В варианте осуществления нуклеиновая кислота, кодирующая субъединицу теломеразы, содержит промотор, способный управлять экспрессией субъединицы теломеразы.
В варианте осуществления hTERT имеет аминокислотную последовательность с ID белка в GenBank AAC51724.1 (Meyerson et al., "hEST2, the Putative Human Telomerase Catalytic Subunit Gene, Is Up–Regulated in Tumor Cells and during Immortalization" Cell Volume 90, Issue 4, 22 August 1997, P. 785–795), представленную под SEQ ID NO: 135.
В варианте осуществления hTERT имеет последовательность, на по меньшей мере 80%, 85%, 90%, 95%, 96^, 97%, 98%, или 99% идентичную последовательности под SEQ ID NO: 135. В варианте осуществления hTERT имеет последовательность под SEQ ID NO: 135. В варианте осуществления hTERT содержит делецию (например, не более 5, 10, 15, 20 или 30 аминокислот) на N–конце, С–конце или на них обоих. В варианте осуществления hTERT содержит трансгенную аминокислотную последовательность (например, не более 5, 10, 15, 20 или 30 аминокислот) на N–конце, C–конце или на них обоих.
В варианте осуществления hTERT кодируется последовательностью нуклеиновой кислоты под № доступа в GenBank AF018167 (Meyerson et al., "hEST2, the Putative Human Telomerase Catalytic Subunit Gene, Is Up–Regulated in Tumor Cells and during Immortalization" Cell Volume 90, Issue 4, 22 August 1997, Pages 785–795), представленной под SEQ ID NO: 136.
В варианте осуществления hTERT кодируется нуклеиновой кислотой, имеющей последовательность, на по меньшей мере 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичную последовательности под SEQ ID NO: 136. В варианте осуществления hTERT кодируется нуклеиновой кислотой под SEQ ID NO: 136.
Активация и размножение иммунных эффекторных клеток (например, T–клеток)
Иммунные эффекторные клетки, такие как Т–клетки, можно активировать и размножать, обычно с использованием способов, описанных, например, в патентах США №№ 6352594; 6534055; 6905680; 6692964; 5858358; 6887466; 6905681; 7144575; 7067318; 7172869; 7232566; 7175843; 5883223; 6905874; 6797514; 6867041 и публикации заявки на патент США № 20060121005.
Популяцию иммунных эффекторных клеток, например, Т–клеток, обычно можно размножать путем приведения их в контакт с поверхностью, к которой присоединено средство, стимулирующее передачу сигнала, ассоциированного с комплексом CD3/TCR, и лиганд, стимулирующий костимулирующую молекулу на поверхности иммунных эффекторных клеток, например, Т–клеток. В частности, популяции Т–клеток можно стимулировать согласно описываемому в данном документе, как, например, путем приведения их в контакт с антителом к CD3 или его антигенсвязывающим фрагментом или антителом к CD2, иммобилизованным на поверхности, или путем приведения их в контакт с активатором протеинкиназы С (например, бриостатином) совместно с ионофором кальция. Для костимуляции вспомогательной молекулы на поверхности Т–клеток используют лиганд, который связывает вспомогательную молекулу. Например, популяцию Т–клеток можно привести в контакт с антителом к CD3 и антителом к CD28 в условиях, подходящих для стимуляции пролиферации Т–клеток. Для стимуляции пролиферации CD4+ T–клеток либо CD8+ T–клеток используют антитело к CD3 и антитело к CD28. Примеры антитела к CD28 включают 9.3, B–T3, XR–CD28 (Diaclone, Безансон, Франция), и их можно использовать, равно как и другие способы, общеизвестные из уровня техники (Berg et al., Transplant Proc. 30(8):3975–3977, 1998; Haanen et al., J. Exp. Med. 190(9):1319–1328, 1999; Garland et al., J. Immunol Meth. 227(1–2):53–63, 1999).
В определенных аспектах первичный стимулирующий сигнал и костимулирующий сигнал для Т–клетки можно передавать с помощью различных протоколов. Например, средства, передающие каждый сигнал, могут находиться в растворе или быть связаны с поверхностью. В случае, когда они связаны с поверхностью, средства могут быть связаны с одной и той же поверхностью (то есть в "цис"–порядке) или с отдельными поверхностями (то есть в "транс"–порядке). В качестве альтернативы, одно средство может быть связано с поверхностью, а другое средство может находиться в растворе. В одном аспекте средство, передающее костимулирующий сигнал, связано с поверхностью клетки, а средство, передающее первичный сигнал активации, находится в растворе или связано с поверхностью. В определенных аспектах оба средства могут находиться в растворе. В одном аспекте средства могут находиться в растворимой форме, а затем сшиваться с поверхностью, такой как клетка, экспрессирующая Fc–рецепторы, или антитело или другое связывающее средство, которое будет связываться с данными средствами. В этом отношении см., например, публикации заявок на патент США №№ 20040101519 и 20060034810 в том, что касается искусственных антигенпрезентирующих клеток (aAPC), которые предусматриваются для применения в активации и размножении Т–клеток в настоящем изобретении.
В одном аспекте два средства иммобилизованы на микрогранулах – на одной и той же микрогрануле, т. е. по "цис"–типу, либо на отдельных микрогранулах, т. е. по "транс"–типу. В качестве примера, средство, передающее первичный сигнал активации, представляет собой антитело к CD3 или его антигенсвязывающий фрагмент, а средство, передающее костимулирующий сигнал, представляет собой антитело к CD28 или его антигенсвязывающий фрагмент; и оба средства совместно иммобилизованы на одной и той же микрогрануле в эквивалентных молекулярных количествах. В одном аспекте для размножения CD4+ T–клеток и роста T–клеток используют соотношение 1:1 для каждого антитела, связанного с микрогранулами. В определенных аспектах настоящего изобретения используют такое соотношение антител к CD3 и CD28, связанных с микрогранулами, при котором наблюдается увеличение интенсивности размножения Т–клеток по сравнению с размножением, наблюдаемым при использовании соотношения 1:1. В одном конкретном аспекте наблюдается увеличение от приблизительно 1– до приблизительно 3–кратного по сравнению с размножением, наблюдаемым при использовании соотношения 1:1. В одном аспекте соотношение антител к CD3 и CD28, связанных с микрогранулами, находится в диапазоне от 100:1 до 1:100 и включает все целочисленные значения в этом промежутке. В одном аспекте настоящего раскрытия с частицами связано больше антител к CD28, чем антител к CD3, то есть соотношение антител к CD3 и CD28 составляет меньше единицы. В определенных аспектах настоящего изобретения соотношение антител к CD28 и антител к CD3, связанных с микрогранулами, составляет более 2:1. В одном конкретном аспекте антитела к CD3 и CD28, связанные с микрогранулами, используют в соотношении 1:100. В одном аспекте антитела к CD3 и CD28, связанные с микрогранулами, используют в соотношении 1:75. В дополнительном аспекте антитела к CD3 и CD28, связанные с микрогранулами, используют в соотношении 1:50. В одном аспекте антитела к CD3 и CD28, связанные с микрогранулами, используют в соотношении 1:30. В одном предпочтительном аспекте антитела к CD3 и CD28, связанные с микрогранулами, используют в соотношении 1:10. В одном аспекте антитела к CD3 и CD28, связанные с микрогранулами, используют в соотношении 1:3. В еще одном аспекте антитела к CD3 и CD28, связанные с микрогранулами, используют в соотношении 3:1.
Для стимуляции Т–клеток или других клеток–мишеней можно использовать соотношения частиц и клеток от 1:500 до 500:1 с включением любых целочисленных значений в этом промежутке. Как без труда будет понятно среднему специалисту в данной области, соотношение частиц и клеток может зависеть от размера частиц относительно клетки–мишени. Например, мелкие микрогранулы могут связывать только несколько клеток, тогда как более крупные микрогранулы могут связывать много. В определенных аспектах соотношение клеток и частиц находится в диапазоне от 1:100 до 100:1 и включает любые целочисленные значения в этом промежутке, а в дополнительных аспектах соотношение составляет от 1:9 до 9:1 и включает любые целочисленные значения в этом промежутке, и его также можно использовать для стимуляции Т–клеток. Соотношение частиц, связанных с антителами к CD3 и антителами к CD28, и Т–клеток, которое приводит к стимуляции Т–клеток, может варьироваться, как отмечено выше, однако определенные предпочтительные значения включают 1:100, 1:50, 1:40, 1:30, 1:20, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1, и 15:1, при этом одно предпочтительное соотношение составляет по меньшей мере 1:1 для частиц на Т–клетку. В одном аспекте используют соотношение частиц и клеток 1:1 или меньше. В одном конкретном аспекте предпочтительное соотношение частицы:клетки составляет 1:5. В дополнительных аспектах соотношение частиц и клеток может варьироваться в зависимости от дня стимуляции. Например, в одном аспекте соотношение частиц и клеток составляет от 1:1 до 10:1 в первый день, и после этого к клеткам ежедневно или раз в два дня добавляют дополнительные частицы в течение до 10 дней при конечных соотношениях от 1:1 до 1:10 (исходя из числа клеток в день добавления). В одном конкретном аспекте соотношение частиц и клеток составляет 1:1 в первый день стимуляции и доводится до 1:5 в третий и пятый дни стимуляции. В одном аспекте частицы добавляют ежедневно или раз в два дня до конечного соотношения 1:1 в первый день и 1:5 в третий и пятый дни стимуляции. В одном аспекте соотношение частиц и клеток составляет 2:1 в первый день стимуляции и доводится до 1:10 в третий и пятый дни стимуляции. В одном аспекте частицы добавляют ежедневно или раз в два дня до конечного соотношения 1:1 в первый день и 1:10 в третий и пятый дни стимуляции. Специалисту в данной области будет понятно, что множество других соотношений может подходить для применения в настоящем изобретении. В частности, соотношения будут варьироваться в зависимости от размера частиц, а также от размера и типа клеток. В одном аспекте наиболее типичные соотношения для применения составляют примерно 1:1, 2:1 и 3:1 в первый день.
В дополнительных аспектах настоящего раскрытия клетки, такие как Т–клетки, объединяют с микрогранулами, покрытыми средством, микрогранулы и клетки впоследствии разделяют, а затем клетки культивируют. В альтернативном аспекте микрогранулы, покрытые средством, и клетки перед культивированием не разделяют, а культивируют вместе. В дополнительном аспекте микрогранулы и клетки сначала концентрируют путем приложения силы, такой как магнитная сила, что приводит к увеличению интенсивности лигирования маркеров клеточной поверхности с индуцированием тем самым стимуляции клеток.
Например, белки клеточной поверхности можно лигировать, позволяя парамагнитным микрогранулам, к которым присоединены антитела к CD3 и антитела к CD28 (микрогранулам 3×28), вступать в контакт с Т–клетками. В одном аспекте клетки (например, от 104 до 109 T–клеток) и микрогранулы (например, парамагнитные микрогранулы DYNABEADS® M–450 CD3/CD28 T в соотношении 1:1) объединяют в буфере, например, PBS (без двухвалентных катионов, таких как кальций и магний). Средние специалисты в данной области в этом случае также могут легко оценить любую концентрацию клеток, которую можно использовать. Например, клетка–мишень может быть очень редкой в образце и составлять только 0,01% образца, или весь образец (т. е. 100%) может содержать клетку–мишень, представляющую интерес. Соответственно, любое количество клеток находится в контексте настоящего изобретения. В определенных аспектах может быть желательно значительно уменьшить объем, в котором частицы и клетки смешиваются друг с другом (т. е. увеличить концентрацию клеток), чтобы обеспечить максимальный контакт клеток и частиц. Например, в одном аспекте используют концентрацию приблизительно 2 миллиарда клеток/мл. В одном аспекте используют более 100 миллионов клеток/мл. В дополнительном аспекте используют концентрацию клеток 10, 15, 20, 25, 30, 35, 40, 45, или 50 миллионов клеток/мл. В еще одном аспекте используют концентрацию клеток от 75, 80, 85, 90, 95, или 100 миллионов клеток/мл. В дополнительных аспектах можно использовать концентрации 125 или 150 миллионов клеток/мл. Использование высоких концентраций может приводить к увеличению выхода клеток, интенсивности активации клеток и интенсивности размножения клеток. Кроме того, использование высоких концентраций клеток позволяет более эффективно улавливать клетки, которые могут характеризоваться слабой экспрессией антигенов–мишеней, представляющих интерес, такие как CD28–отрицательные Т–клетки. В определенных аспектах такие популяции клеток могут иметь терапевтическую ценность, и их было бы желательно получить. Например, использование высокой концентрации клеток позволяет проводить более эффективный отбор CD8+ Т–клеток, которые обычно характеризуются более слабой экспрессией CD28.
В одном варианте осуществления клетки, трансдуцированные нуклеиновой кислотой, кодирующей CAR, например, CAR, описываемый в данном документе, размножают, например, с помощью способа, описываемого в данном документе. В одном варианте осуществления клетки размножают в культуре в течение периода от нескольких часов (например, приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 18, 21 часа) до приблизительно 14 дней (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 дней). В одном варианте осуществления клетки размножают в течение периода от 4 до 9 дней. В одном варианте осуществления клетки размножают в течение периода 8 дней или меньше, например, 7, 6 или 5 дней. В одном варианте осуществления клетки, например, клетку, экспрессирующую CAR, описываемую в данном документе, размножают в культуре в течение 5 дней, и полученные клетки являются более активными, чем те же самые клетки, размножаемые в культуре в течение 9 дней при тех же условиях культивирования. Активность можно определить, например, по различным Т–клеточным функциям, например, пролиферации, уничтожению клеток–мишеней, выработке цитокинов, активации, миграции или их комбинациям. В одном варианте осуществления клетки, например, клетка, экспрессирующая CAR, описываемая в данном документе, размножаемые в течение 5 дней, демонстрируют по меньшей мере одно–, двух–, трех– или четырехкратное увеличение интенсивности удвоения клеток при стимуляции антигеном по сравнению с теми же клетками, размножаемыми в культуре в течение 9 дней при тех же условиях культивирования. В одном варианте осуществления клетки, например, клетки, экспрессирующие CAR, описываемый в данном документе, размножают в культуре в течение 5 дней, и полученные клетки демонстрируют более высокие уровни выработки провоспалительных цитокинов, например, уровни IFN–γ и/или GM–CSF, по сравнению с теми же клетками, размножаемыми в культуре в течение 9 дней при тех же условиях культивирования. В одном варианте осуществления клетки, например, клетка, экспрессирующая CAR, описываемая в данном документе, размножаемые в течение 5 дней, демонстрируют по меньшей мере одно–, двух–, трех–, четырех–, пяти–, десятикратное или большее увеличение уровней выработки провоспалительных цитокинов в пг/мл, например, уровней IFN–γ и/или GM–CSF, по сравнению с теми же клетками, размножаемыми в культуре в течение 9 дней при тех же условиях культивирования.
В одном аспекте настоящего раскрытия смесь можно культивировать в течение периода, составляющего от нескольких часов (приблизительно 3 часов) до приблизительно 14 дней или имеющего любое целочисленное значение в часах в этом промежутке. В одном аспекте смесь можно культивировать в течение 21 дня. В одном аспекте настоящего изобретения микрогранулы и Т–клетки культивируют вместе в течение приблизительно восьми дней. В одном аспекте микрогранулы и Т–клетки культивируют вместе в течение 2–3 дней. Также могут быть желательными несколько циклов стимуляции, так что время культивирования Т–клеток может составлять 60 дней или больше. Условия, подходящие для культивирования Т–клеток, включают подходящие среды (например, минимальную питательную среду, или среду RPMI 1640, или X–vivo 15 (Lonza)), которые могут содержать факторы, необходимые для пролиферации и жизнеспособности, в том числе сыворотку крови (например, фетальную бычью или человеческую сыворотку крови), интерлейкин–2 (IL–2), инсулин, IFN–γ, IL–4, IL–7, GM–CSF, IL–10, IL–12, IL–15, TGFβ, и TNF–α или любые другие добавки для роста клеток, известные специалисту в данной области. Другие добавки для роста клеток включают в себя без ограничения поверхностно–активное вещество, плазманат и восстановители, такие как N–ацетилцистеин и 2–меркаптоэтанол. Среда может включать в себя RPMI 1640, AIM–V, DMEM, MEM, α–MEM, F–12, X–Vivo 15 и X–Vivo 20, Optimizer с добавлением аминокислот, пирувата натрия и витаминов, не содержащую сыворотки крови либо дополненную подходящим количеством сыворотки (или плазмы) крови или определенным набором гормонов и/или количеством цитокина(цитокинов), достаточным для роста и размножения Т–клеток. Антибиотики, например, пенициллин и стрептомицин, содержатся только в экспериментальных культурах, но не в культурах клеток, которые предназначены для инфузии субъекту. Клетки–мишени выдерживают в условиях, необходимых для поддержания роста, например, при соответствующей температуре (например, 37°C) и атмосфере (например, воздух с 5% CO2).
В одном варианте осуществления клетки размножают в подходящей среде (например, среде, описываемой в данном документе), содержащей один или несколько интерлейкинов, которые приводят к по меньшей мере 200–кратному (например, к 200–кратному, 250–кратному, 300–кратному, 350–кратному) увеличению количества клеток в течение 14–дневного периода размножения, например, при измерении с помощью способа, описываемого в данном документе, такого как проточная цитометрия. В одном варианте осуществления клетки размножают в присутствии IL–15 и/или IL–7 (например, IL–15 и IL–7).
В варианте осуществления способ размножения клеток (например, клеток, экспрессирующих CAR, например, клеток, экспрессирующих CAR для CD19, например, клеток, экспрессирующих CAR для CD19, описываемых в данном документе, например, CTL–019), описываемый в данном документе (например, размножения ex vivo), включает приведение клеток в контакт с ингибитором PD–1, например, ингибитором PD–1, описываемым в данном документе, например, молекулой антитела к PD–1, описываемой в данном документе, например, PDR–001.
В вариантах осуществления способы, описываемые в данном документе, например, способы получения клеток, экспрессирующих CAR, включают удаление регуляторных T–клеток, например, CD25+ T–клеток, из популяции клеток, например, с помощью антитела к CD25 или его фрагмента или CD25–связывающего лиганда IL–2. Способы удаления регуляторных Т–клеток, например, CD25+ Т–клеток, из популяции клеток описываются в данном документе. В вариантах осуществления способы, например, способы получения, дополнительно включают приведение популяции клеток (например, популяции клеток, которая была истощена по регуляторным T–клеткам, таким как CD25+ T–клетки; или популяции клеток, которая ранее была приведена в контакт с антителом к CD25, его фрагментом или CD25–связывающим лигандом) в контакт с IL–15 и/или IL–7. Например, популяцию клеток (например, популяцию, которая ранее была приведена в контакт с антителом к CD25, его фрагментом или CD25–связывающим лигандом) размножают в присутствии IL–15 и/или IL–7.
В варианте осуществления способы, описываемые в данном документе, например, способы получения клеток, экспрессирующих CAR, включают приведение клеток (например, клеток, экспрессирующих CAR, например, клеток, экспрессирующих CAR для CD19, например, клеток, экспрессирующих CAR для CD19, описываемых в данном документе, например, CTL–019) в контакт с ингибитором PD–1, например, ингибитором PD–1, описываемым в данном документе, например, молекулой антитела к PD–1, описываемой в данном документе, например, PDR–001.
В некоторых вариантах осуществления клетку, экспрессирующую CAR, описываемую в данном документе, приводят в контакт с композицией, содержащей полипептид интерлейкин–15 (IL–15), полипептид альфа–субъединицу рецептора интерлейкина–15 (IL–15Ra) или комбинацию как полипептида IL–15, так и полипептида IL–15Ra, например, hetIL–15, в ходе получения клетки, экспрессирующей CAR, например, ex vivo. В вариантах осуществления клетку, экспрессирующую CAR, описываемую в данном документе, приводят в контакт с композицией, содержащей полипептид IL–15, в ходе получения клетки, экспрессирующей CAR, например, ex vivo. В вариантах осуществления клетку, экспрессирующую CAR, описываемую в данном документе, приводят в контакт с композицией, содержащей комбинацию как полипептида IL–15, так и полипептида IL–15Ra, в ходе получения клетки, экспрессирующей CAR, например, ex vivo. В вариантах осуществления клетку, экспрессирующую CAR, описываемую в данном документе, приводят в контакт с композицией, содержащей hetIL–15, в ходе получения клетки, экспрессирующей CAR, например, ex vivo.
В одном варианте осуществления клетку, экспрессирующую CAR, описываемую в данном документе, приводят в контакт с композицией, содержащей hetIL–15, в ходе размножения ex vivo. В варианте осуществления клетку, экспрессирующую CAR, описываемую в данном документе, приводят в контакт с композицией, содержащей полипептид IL–15, в ходе размножения ex vivo. В варианте осуществления клетку, экспрессирующую CAR, описываемую в данном документе, приводят в контакт с композицией, содержащей как полипептид IL–15, так и полипептид IL–15Ra, в ходе размножения ex vivo. В одном варианте осуществления приведение в контакт приводит к выживанию и пролиферации субпопуляции лимфоцитов, например, CD8+ T–клеток.
В одном варианте осуществления клетки культивируют (например, размножают, стимулируют и/или трансдуцируют) в средах, содержащих сыворотку крови. Сыворотка крови может представлять собой, например, человеческую сыворотку крови AB (hAB). В некоторых вариантах осуществления сыворотка крови hAB присутствует в концентрации приблизительно 2%, приблизительно 5%, приблизительно 2–3%, приблизительно 3–4%, приблизительно 4–5% или приблизительно 2–5%. Каждая из 2% и 5% концентраций сыворотки крови представляет собой подходящие уровни, которые позволяют многократно размножать Т–клетки. Кроме того, как показано в работе Smith et al., "Ex vivo expansion of human T cells for adoptive immunotherapy using the novel Xeno–free CTS Immune Cell Serum Replacement" Clinical & Translational Immunology (2015) 4, e31; doi:10.1038/cti.2014.31, среда, содержащая 2% человеческую сыворотку АВ, подходит для размножения Т–клеток ex vivo.
Т–клетки, которые подвергались стимуляции в течение разных периодов времени, могут демонстрировать разные характеристики. Например, типичные препараты крови или продукты афереза мононуклеарных клеток периферической крови имеют популяцию Т–клеток–хелперов (TH, CD4+), большую, чем популяция цитотоксических Т–клеток или Т–клеток–супрессоров (TC, CD8+). Размножение Т–клеток ex vivo путем стимуляции рецепторов CD3 и CD28 приводит к образованию популяции Т–клеток, которая до приблизительно дней 8–9 состоит главным образом из ТН–клеток, тогда как после приблизительно дней 8–9 популяция Т–клеток содержит все более многочисленную популяцию TC–клеток. Соответственно, в зависимости от цели лечения инфузия субъекту популяции Т–клеток, содержащей главным образом ТН–клетки, может быть преимущественной. Аналогично, если была выделена антигенспецифичная субпопуляция TC–клеток, то может быть благоприятным размножение этой субпопуляции до большего размера.
Кроме того, в дополнение к маркерам CD4 и CD8, уровни других фенотипических маркеров варьируются значительно, но по большей части воспроизводимо в ходе процесса размножения клеток. Таким образом, подобная воспроизводимость дает возможность адаптировать активированный Т–клеточный продукт для конкретных целей.
В некоторых вариантах осуществления клетки, трансдуцированные нуклеиновой кислотой, кодирующей CAR, например, CAR, описываемый в данном документе, можно выбирать для введения с учетом, например, уровней экспрессии белка для одного или нескольких из CCL20, GM–CSF, IFNγ, IL–10, IL–13, IL–17a, IL–2, IL–21, IL–4, IL–5, IL–6, IL–9, TNFα и/или их комбинаций. В некоторых вариантах осуществления клетки, трансдуцированные нуклеиновой кислотой, кодирующей CAR, например, CAR, описываемый в данном документе, можно выбирать для введения с учетом, например, уровней экспрессии белка для CCL20, IL–17a, IL–6 и их комбинаций.
Кроме того, в дополнение к маркерам CD4 и CD8, уровни других фенотипических маркеров варьируются значительно, но по большей части воспроизводимо в ходе процесса размножения клеток. Таким образом, подобная воспроизводимость дает возможность адаптировать активированный Т–клеточный продукт для конкретных целей.
После конструирования CAR, например, CAR для CD19, можно применять различные анализы для оценивания активности молекулы, такой как, без ограничения, способность Т–клеток размножаться после стимуляции антигеном, устойчивое размножение Т–клеток в отсутствие повторной стимуляции и противораковая активность, в соответствующих моделях in vitro и животных моделях. Анализы для оценивания эффектов CAR, например, CAR для CD19, описаны, например, в абзацах [0417] – [00423] международной публикации WO2015/090230, поданной 19 декабря 2014 г., которая включена посредством ссылки во всей своей полноте.
Популяции клеток с CAR
В другом аспекте настоящее изобретение предусматривает популяцию клеток, экспрессирующих CAR, например, популяцию клеток, экспрессирующих CAR для CD19. В некоторых вариантах осуществления популяция клеток, экспрессирующих CAR, содержит смесь клеток, экспрессирующих различные CAR.
Например, в одном варианте осуществления популяция клеток, экспрессирующих CAR, может содержать первую клетку, экспрессирующую CAR, имеющий CD19–связывающий домен, описываемый в данном документе, и вторую клетку, экспрессирующую CAR, имеющий другой CD19–связывающий домен, например, CD19–связывающий домен, описываемый в данном документе, который отличается от CD19–связывающего домена в CAR, экспрессируемом первой клеткой.
В качестве другого примера, популяция клеток, экспрессирующих CAR, может содержать первую клетку, экспрессирующую CAR, который содержит CD19–связывающий домен, например, описываемый в данном документе, и вторую клетку, экспрессирующую CAR, который содержит антигенсвязывающий домен для мишени, отличной от CD19 (например, для В–клеточного антигена, отличного от CD19, например, CD10, CD20, CD22, CD34, CD123, FLT–3, ROR1, CD79b, CD179b, или CD79a). В одном варианте осуществления популяция клеток, экспрессирующих CAR, содержит, например, первую клетку, экспрессирующую CAR, который содержит первичный внутриклеточный сигнальный домен, и вторую клетку, экспрессирующую CAR, который содержит вторичный сигнальный домен.
В одном варианте осуществления популяция клеток, экспрессирующих CAR, может содержать первую клетку, экспрессирующую CAR, который содержит CD19–связывающий домен, и вторую клетку, экспрессирующую CAR, который содержит антигенсвязывающий домен, нацеливающийся на антиген, экспрессируемый на В–клетках, или В–клеточный антиген, например, специфично связывающий его. В одном варианте осуществления B–клеточный антиген представляет собой CD19, например, при этом первая клетка и вторая клетка экспрессируют разные CAR для CD19. В другом варианте осуществления B–клеточный антиген представляет собой антиген, отличный от CD19, например, CD10, CD20, CD22, CD34, CD123, FLT–3, ROR1, CD79b, CD179b, или CD79a.
В другом аспекте настоящее изобретение предусматривает популяцию клеток, в которой по меньшей мере одна клетка в популяции экспрессирует CAR, имеющий CD19–связывающий домен, описываемый в данном документе, и вторая клетка экспрессирует другое средство, например, средство, которое усиливает активность или функцию клетки, экспрессирующей CAR. Например, в одном варианте осуществления данное средство может представлять собой средство, которое модулирует или регулирует, например, ингибирует, Т–клеточную функцию. В некоторых вариантах осуществления молекула, которая модулирует или регулирует Т–клеточную функцию, представляет собой ингибирующую молекулу, например, средство, описываемое в данном документе. Ингибирующие молекулы, например, могут в некоторых вариантах осуществления снижать способность клетки, экспрессирующей CAR, осуществлять иммунный эффекторный ответ. Примеры ингибирующих молекул включают PD1, PD–L1, CTLA4, TIM3, LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7–H3 (CD276), B7–H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозин или TGF–бета. В одном варианте осуществления средство, которое ингибирует ингибирующую молекулу, содержит первый полипептид, например, ингибирующую молекулу, ассоциированный со вторым полипептидом, передающим положительный сигнал в клетку, например, с внутриклеточным сигнальным доменом, описываемым в данном документе. В одном варианте осуществления средство содержит первый полипептид, например, ингибирующую молекулу, такую как PD1, PD–L1, CTLA4, TIM3, LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7–H3 (CD276), B7–H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозин или TGF–бета или фрагмент любого из них (например, по меньшей мере часть внеклеточного домена любого из них), и второй полипептид, который представляет собой внутриклеточный сигнальный домен, описываемый в данном документе (например, содержащий костимулирующий домен (например, 4–1BB, CD27, CD28 или ICOS, например, описываемые в данном документе) и/или первичный сигнальный домен (например, сигнальный домен CD3–дзета, описываемый в данном документе). В одном варианте осуществления средство содержит первый полипептид PD1 или его фрагмент (например, по меньшей мере часть внеклеточного домена PD1) и второй полипептид, представляющий собой внутриклеточный сигнальный домен, описываемый в данном документе (например, сигнальный домен CD28, описываемый в данном документе, и/или сигнальный домен CD3–дзета, описываемый в данном документе).
В одном аспекте настоящее изобретение предусматривает способы, включающие введение популяции клеток, экспрессирующих CAR, например, CART–клеток, например, смеси клеток, экспрессирующих различные CAR, в комбинации с другим средством, например, ингибитором PD–1, таким как ингибитор PD–1, описываемый в данном документе. В другом аспекте настоящее изобретение предусматривает способы, включающие введение популяции клеток, в которой по меньшей мере одна клетка в популяции экспрессирует CAR, имеющий CD19–связывающий домен, описываемый в данном документе, и вторая клетка экспрессирует другое средство, например, средство, которое усиливает активность или приспособленность клетки, экспрессирующей CAR, в комбинации с другим средством, например, ингибитором PD–1, таким как ингибитор PD–1, описываемый в данном документе.
Ингибиторы PD–1
Иммунная система обладает способностью распознавать и устранять опухолевые клетки; однако, опухоли могут использовать несколько стратегий для ускользания от иммунной системы. Блокировка контрольных точек иммунного ответа представляет собой подход к активации или реактивации терапевтического противоопухолевого иммунитета. PD–1 представляет собой иллюстративную молекулу контрольной точки иммунного ответа.
PD–1 является представителем семейства CD28/CTLA–4, который экспрессируется, например, на активированных CD4+ и CD8+ Т–клетках, Treg и В–клетках. См., например, Agata et al. 1996 Int. Immunol 8:765–75. PD–1 является ингибирующим представителем семейства рецепторов CD28, которое также включает CD28, CTLA–4, ICOS и BTLA. PD–1 осуществляет отрицательную регуляцию передачи сигнала в эффекторных Т–клетках и их функционирования. PD–1 индуцируется на Т–клетках, инфильтрирующих опухоль, и может приводить к их функциональному истощению или дисфункции (Keir et al. (2008) Annu. Rev. Immunol. 26:677–704; Pardoll et al. (2012) Nat Rev Cancer 12(4):252–64). PD–1 подает коингибирующий сигнал при связывании с любым из двух своих лигандов, лигандом 1 белка программируемой смерти клеток (PD–L1) или лигандом 2 белка программируемой смерти клеток (PD–L2). Было показано, что PD–L1 и PD–L2 подавляют активацию Т–клеток при связывании с PD–1 (Freeman et al. 2000 J Exp Med 192:1027–34; Latchman et al. 2001 Nat Immunol 2:261–8; Carter et al. 2002 Eur J Immunol 32:634–43). PD–L1 экспрессируется на клетках ряда типов, в том числе на Т–клетках, естественных клетках–киллерах (NK), макрофагах, дендритных клетках (DC), В–клетках, эпителиальных клетках, клетках эндотелия сосудов, а также во многих типах опухолей. PD–L1 является обильным в раковых опухолях человека (Dong et al. 2003 J Mol Med 81:281–7; Blank et al. 2005 Cancer Immunol. Immunother 54:307–314; Konishi et al. 2004 Clin Cancer Res 10:5094), и была установлена связь высокой экспрессии PD–L1 в опухолях мыши и человека с неблагоприятными клиническими исходами при различных формах рака (Keir et al. (2008) Annu. Rev. Immunol. 26:677–704; Pardoll et al. (2012) Nat Rev Cancer 12(4):252–64). PD–L2 экспрессируется на дендритных клетках, макрофагах и в некоторых опухолях. Блокировка пути PD–1 была утверждена в доклинических и клинических исследованиях в качестве иммунотерапии рака. Подавление иммунитета можно устранить путем ингибирования локального взаимодействия PD–1 с PD–L1. Как доклинические, так и клинические исследования продемонстрировали, что блокировка PD–1 может обеспечивать восстановление активности эффекторных Т–клеток и приводить к устойчивому противоопухолевому ответу. Например, блокировка пути PD–1 может обеспечивать восстановление функции истощенных/дисфункциональных эффекторных Т–клеток (например, пролиферации, секреции IFN–γ или цитолитической функции) и/или ингибирование функции Treg–клеток (Keir et al. (2008) Annu. Rev. Immunol. 26:677–704; Pardoll et al. (2012) Nat Rev Cancer 12(4):252–64). Блокировку пути PD–1 можно осуществлять с помощью антитела, его антигенсвязывающего фрагмента, иммуноадгезина, слитого белка или олигопептида PD–1, PD–L1 и/или PD–L2.
Молекулы антител к PD–1
В одном варианте осуществления ингибитор PD–1 представляет собой молекулу антитела к PD–1, как описано в US 2015/0210769, опубликованном 30 июля 2015 года под названием "Молекулы антител к PD–1 и варианты их применения", включенного посредством ссылки во всей своей полноте.
В некоторых вариантах осуществления молекула антитела к PD–1 (например, молекула выделенного или рекомбинантного антитела) характеризуется одним или несколькими из следующих свойств:
(i) связывается с PD–1, например, PD–1 человека, с высокой аффинностью, например, с константой аффинности, составляющей по меньшей мере приблизительно 107 M–1, в типичном случае приблизительно 108 M–1 и в более типичном случае от приблизительно 109 M–1 до 1010 M–1 или больше;
(ii) по сути не связывается с CD28, CTLA–4, ICOS или BTLA;
(iii) ингибирует или ослабляет связывание PD–1 с лигандом к PD–1, например, PD–L1 или PD–L2, или обоими;
(iv) специфически связывается с эпитопом на PD–1, например, тем же или аналогичным эпитопом, как и эпитоп, распознаваемый мышиным моноклональным антителом BAP049 или химерным антителом BAP049, например, BAP049–chi или BAP049–chi–Y;
(v) характеризуется той же или аналогичной аффинностью или специфичностью связывания, или обеими, как и любое из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E;
(vi) характеризуется той же или аналогичной аффинностью или специфичностью связывания, или обеими, как и молекула антитела (например, вариабельная область тяжелой цепи и вариабельная область легкой цепи), описанная в таблице 6;
(vii) характеризуется той же или аналогичной аффинностью или специфичностью связывания, или обеими, как и молекула антитела (например, вариабельная область тяжелой цепи и вариабельная область легкой цепи), показанная в таблице 6;
(viii) характеризуется той же или аналогичной аффинностью или специфичностью связывания, или обеими, как и молекула антитела (например, вариабельная область тяжелой цепи и вариабельная область легкой цепи), кодируемая нуклеотидной последовательностью, описанной в таблице 6;
(ix) ингибирует, например, конкурентно ингибирует связывание второй молекулы антитела к PD–1, при этом вторая молекула антитела представляет собой молекулу антитела, описанную в данном документе, например, молекулу антитела, выбранную, например, из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E;
(x) связывает тот же или перекрывающийся эпитоп, как и вторая молекула антитела к PD–1, при этом вторая молекула антитела представляет собой молекулу антитела, описанную в данном документе, например, молекулу антитела, выбранную, например, из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E;
(xi) конкурирует за связывание со второй молекулой антитела к PD–1 и/или связывает тот же эпитоп, при этом вторая молекула антитела представляет собой молекулу антитела, описанную в данном документе, например, молекулу антитела, выбранную, например, из любого изBAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E;
(xii) характеризуется одним или несколькими биологическими свойствами молекулы антитела, описанной в данном документе, например, молекулы антитела, выбранной, например, из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E;
(xiii) характеризуется одним или несколькими фармакокинетическими свойствами молекулы антитела, описанной в данном документе, например, молекулы антитела, выбранной, например, из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E;
(xiv) ингибирует один или несколько видов активности PD–1, например, приводит к одному или нескольким из повышения количества лимфоцитов, инфильтрирующих опухоль, повышения пролиферации, опосредованной T–клеточным рецептором, или снижения уклонения раковых клеток от влияния иммунной системы;
(xv) связывает PD–1 человека и является перекрестнореагирующей в отношении PD–1 яванского макака;
(xvi) связывается с одним или несколькими остатками в C–нити, CC'–петле, C'–нити или FG–петле PD–1 или комбинации из двух, трех или всех из C–нити, CC'–петли, C'–нити или FG–петли PD–1, например, при этом связывание определяют с помощью ELISA или Biacore; или
(xvii) имеет область VL, которая способствует большему связыванию с PD–1, чем область VH.
В некоторых вариантах осуществления молекула антитела связывается с PD–1 с высокой аффинностью, например, с KD, которая является приблизительно той же или на по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% выше или ниже, чем KD молекулы мышиного или химерного антитела к PD–1, например, молекулы мышиного или химерного антитела к PD–1, описанной в данном документе. В некоторых вариантах осуществления KD молекулы мышиного или химерного антитела к PD–1 составляет менее приблизительно 0,4, 0,3, 0,2, 0,1, или 0,05 нM, например, при измерении с помощью способа Biacore. В некоторых вариантах осуществления KD молекулы мышиного или химерного антитела к PD–1 составляет менее приблизительно 0,2 нM, например, приблизительно 0,135 нМ. В других вариантах осуществления KD молекулы мышиного или химерного антитела к PD–1 составляет менее приблизительно 10, 5, 3, 2 или 1 нМ, например, при измерении в клетках, экспрессирующих PD–1 (например, клетках 300.19). В некоторых вариантах осуществления KD молекулы мышиного или химерного антитела к PD–1 составляет менее приблизительно 5 нM, например, приблизительно 4,60 нМ (или приблизительно 0,69 мкг/мл).
В некоторых вариантах осуществления молекула антитела к PD–1 связывается с PD–1 с Koff медленнее чем за 1⋅10–4, 5⋅10–5 или 1⋅10–5 с–1, например, за приблизительно 1,65⋅10–5 с–1. В некоторых вариантах осуществления молекула антитела к PD–1 связывается с PD–1 с Kon быстрее чем за 1⋅104, 5⋅104, 1⋅105 или 5⋅105 M–1 с–1, например, за приблизительно 1,23⋅105 M–1 с–1.
В некоторых вариантах осуществления уровень экспрессии молекулы антитела является более высоким, например, в по меньшей мере приблизительно 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10– раз выше, чем уровень экспрессии молекулы мышиного или химерного антитела, например, молекулы мышиного или химерного антитела к PD–1, описанного в данном документе. В некоторых вариантах осуществления молекула антитела экспрессируется в клетках CHO.
В некоторых вариантах осуществления молекула антитела к PD–1 снижает один или несколько PD–1–ассоциированных видов активности с IC50 (концентрация при 50% ингибировании), которая является приблизительно той же или ниже, например, на по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% ниже, чем IC50 молекулы мышиного или химерного антитела к PD–1, например, молекулы мышиного или химерного антитела к PD–1, описанного в данном документе. В некоторых вариантах осуществления IC50 молекулы мышиного или химерного антитела к PD–1 составляет менее приблизительно 6, 5, 4, 3, 2 или 1 нM, например, при измерении с помощью связывания в клетках, экспрессирующих PD–1 (например, клетках 300.19). В некоторых вариантах осуществления IC50 молекулы мышиного или химерного антитела к PD–1 составляет менее приблизительно 4 нM, например, приблизительно 3,40 нМ (или приблизительно 0,51 мкг/мл). В некоторых вариантах осуществления PD–1–ассоциированная активность представляет собой связывание PD–L1 и/или PD–L2 с PD–1. В некоторых вариантах осуществления молекула антитела к PD–1 связывается с мононуклеарными клетками периферической крови (PBMC), активированными стафилококковым энтеротоксином В (SEB). В других вариантах осуществления молекула антитела к PD–1 повышает экспрессию IL–2 в цельной крови, активированной SEB. Например, антитело к PD–1 повышает экспрессию IL–2 в по меньшей мере приблизительно 2, 3, 4 или 5 раз по сравнению с экспрессией IL–2 при использовании изотипического контроля (например, IgG4).
В некоторых вариантах осуществления молекула антитела к PD–1 характеризуется повышенной стабильностью, например, является в по меньшей мере приблизительно 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз более стабильной in vivo или in vitro, чем молекула мышиного или химерного антитела к PD–1, например, молекула мышиного или химерного антитела к PD–1, описанная в данном документе.
В одном варианте осуществления молекула антитела к PD–1 представляет собой молекулу гуманизированного антитела и характеризуется степенью риска на основании анализа Т–клеточного эпитопа от 300 до 700, от 400 до 650, от 450 до 600 или степенью риска, описанной в данном документе.
В другом варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну антигенсвязывающую область, например, вариабельную область или ее антигенсвязывающий фрагмент, из антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 6 или кодируемые нуклеотидной последовательностью из таблицы 6; или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей.
В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две, три или четыре вариабельные области из антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 6 или кодируемые нуклеотидной последовательностью из таблицы 6; или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей.
В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну или две вариабельные области тяжелой цепи из антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 6 или кодируемые нуклеотидной последовательностью из таблицы 6; или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей.
В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну или две вариабельные области легкой цепи из антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 6 или кодируемые нуклеотидной последовательностью из таблицы 6; или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей.
В еще одном варианте осуществления молекула антитела к PD–1 содержит константную область тяжелой цепи IgG4, например, IgG4 человека. В одном варианте осуществления IgG4 человека содержит замену в положении 228 в соответствии с нумерацией EU (например, замену Ser на Pro). В еще одном варианте осуществления молекула антитела к PD–1 содержит константную область тяжелой цепи IgG1, например, IgG1 человека. В одном варианте осуществления IgG1 человека содержит замену в положении 297 в соответствии с нумерацией EU (например, замену Asn на Ala). В одном варианте осуществления IgG1 человека содержит замену в положении 265 в соответствии с нумерацией EU, замену в положении 329 в соответствии с нумерацией EU или обе (например, замену Asp на Ala в положении 265 и/или замену Pro на Ala в положении 329). В одном варианте осуществления IgG1 человека содержит замену в положении 234 в соответствии с нумерацией EU, замену в положении 235 в соответствии с нумерацией EU или обе (например, замену Leu на Ala в положении 234 и/или замену Leu на Ala в положении 235). В одном варианте осуществления константная область тяжелой цепи содержит аминокислотную последовательность, изложенную в таблице 3, или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) ей.
В еще одном варианте осуществления молекула антитела к PD–1 содержит константную область легкой каппа–цепи, например, константную область легкой каппа–цепи человека. В одном варианте осуществления константная область легкой цепи содержит аминокислотную последовательность, изложенную в таблице 3 в US 2015/0210769A1, или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) ей.
В другом варианте осуществления молекула антитела к PD–1 содержит константную область тяжелой цепи IgG4, например, IgG4 человека, и константную область легкой каппа–цепи, например, константную область легкой каппа–цепи человека, например, константную область тяжелой и легкой цепей, содержащую аминокислотную последовательность, изложенную в таблице 3 в US 2015/0210769A1, или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) ей. В одном варианте осуществления IgG4 человека содержит замену в положении 228 в соответствии с нумерацией EU (например, замену Ser на Pro). В еще одном варианте осуществления молекула антитела к PD–1 содержит константную область тяжелой цепи IgG1, например, IgG1 человека, и константную область легкой каппа–цепи, например, константную область легкой каппа–цепи человека, например, константную область тяжелой и легкой цепей, содержащую аминокислотную последовательность, изложенную в таблице 3 в US 2015/0210769A1, или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) ей. В одном варианте осуществления IgG1 человека содержит замену в положении 297 в соответствии с нумерацией EU (например, замену Asn на Ala). В одном варианте осуществления IgG1 человека содержит замену в положении 265 в соответствии с нумерацией EU, замену в положении 329 в соответствии с нумерацией EU или обе (например, замену Asp на Ala в положении 265 и/или замену Pro на Ala в положении 329). В одном варианте осуществления IgG1 человека содержит замену в положении 234 в соответствии с нумерацией EU, замену в положении 235 в соответствии с нумерацией EU или обе (например, замену Leu на Ala в положении 234 и/или замену Leu на Ala в положении 235).
В другом варианте осуществления молекула антитела к PD–1 содержит вариабельный домен тяжелой цепи и константную область, вариабельный домен легкой цепи и константную область или оба, содержащие аминокислотную последовательность BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 6 или кодируемые нуклеотидной последовательностью из таблицы 6; или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей. Молекула антитела к PD–1 необязательно содержит лидерную последовательность из тяжелой цепи, легкой цепи или обеих, показанную в таблице 4 в US 2015/0210769A1; или последовательность, по сути идентичную ей.
В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три области, определяющие комплементарность (CDR), вариабельной области тяжелой цепи антитела, описываемого в данном документе, например, антитела, выбранного из любого изBAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 6 или кодируемые нуклеотидной последовательностью из таблицы 6; или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей.
В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три CDR (или в совокупности все CDR) из вариабельной области тяжелой цепи, которая содержит аминокислотную последовательность, показанную в таблице 6 или кодируемую нуклеотидной последовательностью, показанной в таблице 6. В одном варианте осуществления одна или несколько CDR (или в совокупности все CDR) имеют одно, два, три, четыре, пять, шесть или больше изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в таблице 6 или кодируемой нуклеотидной последовательностью, показанной в таблице 6.
В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три CDR из вариабельной области легкой цепи антитела, описываемого в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 6 или кодируемые нуклеотидной последовательностью из таблицы 6; или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей.
В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три CDR (или в совокупности все CDR) из вариабельной области легкой цепи, которая содержит аминокислотную последовательность, показанную в таблице 6 или кодируемую нуклеотидной последовательностью, показанной в таблице 6. В одном варианте осуществления одна или несколько CDR (или в совокупности все CDR) имеют одно, два, три, четыре, пять, шесть или больше изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в таблице 6 или кодируемой нуклеотидной последовательностью, показанной в таблице 6. В некоторых вариантах осуществления молекула антитела к PD–1 содержит замену в CDR легкой цепи, например, одну или несколько замен в CDR1, CDR2 и/или CDR3 легкой цепи. В одном варианте осуществления молекула антитела к PD–1 содержит замену в CDR3 легкой цепи в положении 102 вариабельной области легкой цепи, например, замену цистеинового остатка на тирозиновый или цистеинового остатка на сериновый в положении 102 вариабельной области легкой цепи в соответствии с таблицей 6 (например, SEQ ID NO: 152 или 162 в случае мышиной или химерной немодифицированной; или любой из SEQ ID NOs: 168, 176, 180, 188, 192, 196, 200, 204, 208, или 212 в случае модифицированной последовательности).
В другом варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR (или в совокупности все CDR) из вариабельной области тяжелой и легкой цепей, содержащей аминокислотную последовательность, показанную в таблице 6 или кодируемую нуклеотидной последовательностью, показанной в таблице 6. В одном варианте осуществления одна или несколько CDR (или в совокупности все CDR) имеют одно, два, три, четыре, пять, шесть или больше изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в таблице 6 или кодируемой нуклеотидной последовательностью, показанной в таблице 6.
В одном варианте осуществления молекула антитела к PD–1 содержит все шесть CDR из антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 6 или кодируемые нуклеотидной последовательностью, описанной в таблице 6, или близкородственные CDR, например, CDR, которые являются идентичными или которые имеют по меньшей мере одно изменение аминокислоты, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен). В одном варианте осуществления молекула антитела к PD–1 может содержать любую CDR, описанную в данном документе. В некоторых вариантах осуществления молекула антитела к PD–1 содержит замену в CDR легкой цепи, например, одну или несколько замен в CDR1, CDR2 и/или CDR3 легкой цепи. В одном варианте осуществления молекула антитела к PD–1 содержит замену в CDR3 легкой цепи в положении 102 вариабельной области легкой цепи, например, замену цистеинового остатка на тирозиновый или цистеинового остатка на сериновый в положении 102 вариабельной области легкой цепи в соответствии с таблицей 6 (например, SEQ ID NO: 152 или 162 в случае мышиной или химерной немодифицированной; или любой из SEQ ID NOs: 168, 176, 180, 188, 192, 196, 200, 204, 208, или 212 в случае модифицированной последовательности).
В другом варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три CDR в соответствии с Kabat et al. (например, по меньшей мере одну, две или три CDR в соответствии с определением Kabat, изложенным в таблице 6) из вариабельной области тяжелой цепи антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 6 или кодируемые нуклеотидной последовательностью, показанной в таблице 6; или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей; или которая имеет по меньшей мере одно изменение аминокислоты, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя или тремя CDR в соответствии с Kabat et al., показанными в таблице 6.
В другом варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три CDR в соответствии с Kabat et al. (например, по меньшей мере одну, две или три CDR в соответствии с определением Kabat, изложенным в таблице 6) из вариабельной области легкой цепи антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 6 или кодируемые нуклеотидной последовательностью, показанной в таблице 6; или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеуказанных последовательностей; или которая имеет по меньшей мере одно изменение аминокислоты, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя или тремя CDR в соответствии с Kabat et al., показанными в таблице 6.
В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR в соответствии с Kabat et al. (например, по меньшей мере одну, две, три, четыре, пять или шесть CDR в соответствии с определением Kabat, изложенным в таблице 6) из вариабельных областей тяжелой и легкой цепей антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 6 или кодируемые нуклеотидной последовательностью, показанной в таблице 6; или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей; или которая имеет по меньшей мере одно изменение аминокислоты, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя, тремя, четырьмя, пятью или шестью CDR в соответствии с Kabat et al., показанными в таблице 6.
В еще одном варианте осуществления молекула антитела к PD–1 содержит все шесть CDR в соответствии с Kabat et al. (например, все шесть CDR в соответствии с определением Kabat, изложенным в таблице 6) из вариабельных областей тяжелой и легкой цепей антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 6 или кодируемые нуклеотидной последовательностью, показанной в таблице 6; или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей; или которая имеет по меньшей мере одно изменение аминокислоты, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению со всеми шестью CDR в соответствии с Kabat et al., показанными в таблице 6. В одном варианте осуществления молекула антитела к PD–1 может содержать любую CDR, описанную в данном документе.
В другом варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три гипервариабельные петли в соответствии с Chothia (например, по меньшей мере одну, две или три гипервариабельные петли в соответствии с определением Chothia, изложенным в таблице 6) из вариабельной области тяжелой цепи антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 6 или кодируемые нуклеотидной последовательностью, показанной в таблице 6; или по меньшей мере аминокислоты из этих гипервариабельных петель, которые вступают в контакт с PD–1; или которые имеют по меньшей мере одно изменение аминокислот, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя или тремя гипервариабельными петлями в соответствии с Chothia et al., показанными в таблице 6.
В другом варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три гипервариабельные петли в соответствии с Chothia (например, по меньшей мере одну, две или три гипервариабельные петли в соответствии с определением Chothia, изложенным в таблице 6) из вариабельной области легкой цепи антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 6 или кодируемые нуклеотидной последовательностью, показанной в таблице 6; или по меньшей мере аминокислоты из этих гипервариабельных петель, которые вступают в контакт с PD–1; или которые имеют по меньшей мере одно изменение аминокислот, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя или тремя гипервариабельными петлями в соответствии с Chothia et al., показанными в таблице 6.
В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две, три, четыре, пять или шесть гипервариабельных петель (например, по меньшей мере одну, две, три, четыре, пять или шесть гипервариабельных петель в соответствии с определением Chothia, изложенным в таблице 6) из вариабельных областей тяжелой и легкой цепей антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 6 или кодируемые нуклеотидной последовательностью, показанной в таблице 6; или по меньшей мере аминокислоты из этих гипервариабельных петель, которые вступают в контакт с PD–1; или которые имеют по меньшей мере одно изменение аминокислот, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя, тремя, четырьмя, пятью или шестью гипервариабельными петлями в соответствии с Chothia et al., показанными в таблице 6.
В одном варианте осуществления молекула антитела к PD–1 содержит все шесть гипервариабельных петель (например, все шесть гипервариабельных петель в соответствии с определением Chothia, изложенным в таблице 6) антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E, или близкородственные гипервариабельные петли, например, гипервариабельные петли, которые являются идентичными или которые имеют по меньше мере одно изменение аминокислоты, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен); или которые имеют по меньшей мере одно изменение аминокислоты, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению со всеми шестью гипервариабельными петлями в соответствии с Chothia et al., показанных в таблице 6. В одном варианте осуществления молекула антитела к PD–1 может содержать любую гипервариабельную петлю, описанную в данном документе.
В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три гипервариабельные петли, которые имеют те же канонические структуры, что и соответствующая гипервариабельная петля антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–С, BAP049–Clone–D или BAP049–Clone–E, например, те же канонические структуры, что и по меньшей мере петля 1 и/или петля 2 вариабельных доменов тяжелой и/или легкой цепей антитела, описанного в данном документе. См., например, Chothia et al., (1992) J. Mol. Biol. 227:799–817; Tomlinson et al., (1992) J. Mol. Biol. 227:776–798 в отношении описаний канонических структур гипервариабельных петель. Эти структуры могут быть определены в результате рассмотрения таблиц, описанных в этих ссылках.
В определенных вариантах осуществления молекула антитела к PD–1 содержит комбинацию CDR или гипервариабельных петель, определенных в соответствии с Kabat et al. и Chothia et al.
В одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три CDR или гипервариабельные петли из вариабельной области тяжелой цепи антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E, в соответствии с определением Kabat и Chothia (например, по меньшей мере одну, две или три CDR или гипервариабельные петли в соответствии с определением Kabat и Chothia, изложенным в таблице 6); или кодируемые нуклеотидной последовательностью, показанной в таблице 6; или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей; или которая имеет по меньшей мере одно изменение аминокислоты, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя или тремя CDR или гипервариабельными петлями в соответствии с Kabat и/или Chothia, показанных в таблице 6.
Например, молекула антитела к PD–1 может содержать CDR1 VH в соответствии с Kabat et al. или гипервариабельную петлю 1 VH в соответствии с Chothia et al. или их комбинацию, например, показанные в таблице 6. В одном варианте осуществления комбинация CDR из CDR1 VH по Kabat и Chothia содержит аминокислотную последовательность GYTFTTYWMH (SEQ ID NO: 286) или аминокислотную последовательность, по сути идентичную ей (например, имеющую по меньшей мере одно аминокислотное изменение, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен)). Молекула антитела к PD–1 может дополнительно содержать, например, CDR 2–3 VH в соответствии с Kabat et al. и CDR 1–3 VL в соответствии с Kabat et al., например, показанные в таблице 6. Соответственно, в некоторых вариантах осуществления каркасные области определяются на основе комбинации CDR, определенных в соответствии с Kabat et al., и гипервариабельных петель, определенных в соответствии с Chothia et al. Например, молекула антитела к PD–1 может содержать FR1 VH, определенную на основе гипервариабельной петли 1 VH в соответствии с Chothia et al., и FR2 VH, определенную на основе CDR 1–2 VH в соответствии с Kabat et al., например, как показано в таблице 6. Молекула антитела к PD–1 может дополнительно содержать, например, FR 3–4 VH, определенные на основе CDR 2–3 VH в соответствии с Kabat et al., и FR 1–4 VL, определенные на основе CDR 1–3 VL в соответствии с Kabat et al.
Молекула антитела к PD–1 может содержать любую комбинацию CDR или гипервариабельных петель в соответствии с определениями Kabat и Chothia. В одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три CDR из вариабельной области легкой цепи антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E, в соответствии с определением Kabat и Chothia (например, по меньшей мере одну, две или три CDR в соответствии с определением Kabat и Chothia, изложенным в таблице 6).
В варианте осуществления, например, варианте осуществления, включающем вариабельную область, CDR (например, CDR в соответствии с Chothia или CDR в соответствии с Kabat) или другую последовательность, упоминаемую в данном документе, например, в таблице 6, молекула антитела представляет собой молекулу моноспецифического антитела, молекулу биспецифического антитела или молекулу антитела, которая содержит антигенсвязывающий фрагмент антитела, например, полуантитело или антигенсвязывающий фрагмент полуантитела. В определенных вариантах осуществления молекула антитела представляет собой молекулу биспецифического антитела, характеризующегося первой специфичностью связывания с PD–1 и второй специфичностью связывания с TIM–3, LAG–3, CEACAM (например, CEACAM–1 и/или CEACAM–5), PD–L1 или PD–L2.
В одном варианте осуществления молекула антитела к PD–1 содержит
(a) вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 140, аминокислотную последовательность VHCDR2 под SEQ ID NO: 141 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 149, аминокислотную последовательность VLCDR2 под SEQ ID NO: 150 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 167;
(b) VH, содержащую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 137; аминокислотную последовательность VHCDR2 под SEQ ID NO: 138; аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 146, аминокислотную последовательность VLCDR2 под SEQ ID NO: 147 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 166;
(c) VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 286, аминокислотную последовательность VHCDR2 под SEQ ID NO: 141 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 149, аминокислотную последовательность VLCDR2 под SEQ ID NO: 150 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 167 или
(d) VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 286; аминокислотную последовательность VHCDR2 под SEQ ID NO: 138 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 146, аминокислотную последовательность VLCDR2 под SEQ ID NO: 147 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 166.
В одном варианте осуществления молекула антитела к PD–1 содержит VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 140, аминокислотную последовательность VHCDR2 под SEQ ID NO: 141 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 149, аминокислотную последовательность VLCDR2 под SEQ ID NO: 150 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 167.
В одном варианте осуществления молекула антитела к PD–1 содержит VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 137; аминокислотную последовательность VHCDR2 под SEQ ID NO: 138; аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 146, аминокислотную последовательность VLCDR2 под SEQ ID NO: 147 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 166.
В одном варианте осуществления молекула антитела к PD–1 содержит VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 286, аминокислотную последовательность VHCDR2 под SEQ ID NO: 141 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 149, аминокислотную последовательность VLCDR2 под SEQ ID NO: 150 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 167.
В одном варианте осуществления молекула антитела к PD–1 содержит VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 286; аминокислотную последовательность VHCDR2 под SEQ ID NO: 138; аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 146, аминокислотную последовательность VLCDR2 под SEQ ID NO: 147 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 166.
В одном варианте осуществления молекула антитела представляет собой молекулу гуманизированного антитела. В другом варианте осуществления молекула антитела представляет собой молекулу моноспецифического антитела. В еще одном варианте осуществления молекула антитела представляет собой молекулу биспецифического антитела.
В одном варианте осуществления молекула антитела к PD–1 содержит
(i) вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 137, SEQ ID NO: 140 или SEQ ID NO: 286; аминокислотную последовательность VHCDR2 под SEQ ID NO: 138; аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и
(ii) вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 146, аминокислотную последовательность VLCDR2 под SEQ ID NO: 147 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 166.
В другом варианте осуществления молекула антитела к PD–1 содержит
(i) вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 137, SEQ ID NO: 140 или SEQ ID NO: 286; аминокислотную последовательность VHCDR2 под SEQ ID NO: 141 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и
(ii) вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 149, аминокислотную последовательность VLCDR2 под SEQ ID NO: 150 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 167.
В одном варианте осуществления молекула антитела к PD–1 содержит аминокислотную последовательность VHCDR1 под SEQ ID NO: 137. В другом варианте осуществления молекула антитела к PD–1 содержит аминокислотную последовательность VHCDR1 под SEQ ID NO: 140. В еще одном варианте осуществления молекула антитела к PD–1 содержит аминокислотную последовательность VHCDR1 под SEQ ID NO: 286.
В одном варианте осуществления вариабельная каркасная область легкой или тяжелой цепей (например, область, охватывающая по меньшей мере FR1, FR2, FR3 и необязательно FR4) молекулы антитела к PD–1 может быть выбрана из (a) вариабельной каркасной области легкой или тяжелой цепей, которая включает по меньшей мере 80%, 85%, 87% 90%, 92%, 93%, 95%, 97%, 98% или предпочтительно 100% аминокислотных остатков из вариабельной каркасной области легкой или тяжелой цепей человека, например, остаток вариабельной каркасной области легкой или тяжелой цепей из зрелого антитела человека, последовательность зародышевой линии человека или консенсусную последовательность человека; (b) вариабельной каркасной области легкой или тяжелой цепей, включающей от 20% до 80%, от 40% до 60%, от 60% до 90% или от 70% до 95% аминокислотных остатков из вариабельной каркасной области легкой или тяжелой цепей человека, например, остаток вариабельной каркасной области легкой или тяжелой цепей из зрелого антитела человека, последовательность зародышевой линии человека или консенсусную последовательность человека; (c) не относящейся к человеческой каркасной области (например, каркасной области грызуна); или (d) не относящейся к человеческой каркасной области, которая была модифицирована, например, с удалением антигенных или цитотоксических детерминантов, например, деиммунизирована или частично гуманизирована. В еще одном варианте осуществления вариабельная каркасная область легкой или тяжелой цепей (в частности, FR1, FR2 и/или FR3) содержит вариабельную каркасную последовательность легкой или тяжелой цепей, на по меньшей мере 70, 75, 80, 85, 87, 88, 90, 92, 94, 95, 96, 97, 98, 99% идентичную или идентичную каркасным областям сегмента VL или VH гена зародышевой линии человека.
В определенных вариантах осуществления молекула антитела к PD–1 содержит вариабельный домен тяжелой цепи, имеющий по меньшей мере одну, две, три, четыре, пять, шесть, семь, десять, пятнадцать, двадцать или больше изменений, например, аминокислотных замен или делеций, из аминокислотной последовательности BAP049–chi–HC, например, аминокислотной последовательности FR–области во всей вариабельной области, например, показанной на фиг. 9A–9B в US 2015/0210769A1 или под SEQ ID NO: 154, 156, 158 или 160. В одном варианте осуществления молекула антитела к PD–1 содержит вариабельный домен тяжелой цепи, имеющий одно или несколько из E в положении 1, V в положении 5, A в положении 9, V в положении 11, K в положении 12, K в положении 13, E в положении 16, L в положении 18, R в положении 19, I или V в положении 20, G в положении 24, I в положении 37, A или S в положении 40, T в положении 41, S в положении 42, R в положении 43, M или L в положении 48, V или F в положении 68, T в положении 69, I в положении 70, S в положении 71, A или R в положении 72, K или N в положении 74, T или K в положении 76, S или N в положении 77, L в положении 79, L в положении 81, E или Q в положении 82, M в положении 83, S или N в положении 84, R в положении 87, A в положении 88 или T в положении 91 аминокислотной последовательности BAP049–chi–HC, например, аминокислотной последовательности FR во всей вариабельной области, например, показанной на фиг. 9A–9B в US 2015/0210769A1 или под SEQ ID NO: 154, 156, 158 или 160.
В качестве альтернативы, или в комбинации с заменами тяжелой цепи BAP049–chi–HC, описанными в данном документе, молекула антитела к PD–1 содержит вариабельный домен легкой цепи, имеющий по меньшей мере одну, две, три, четыре, пять, шесть, семь, десять, пятнадцать, двадцать или больше аминокислотных изменений, например, аминокислотных замен или делеций, из аминокислотной последовательности BAP049–chi–LC, например, аминокислотной последовательности, показанной на фиг. 10A–10B в US 2015/0210769A1 или под SEQ ID NO: 162 или 164. В одном варианте осуществления молекула антитела к PD–1 содержит вариабельный домен тяжелой цепи, имеющий одно или несколько из E в положении 1, V в положении 2, Q в положении 3, L в положении 4, T в положении 7, D или L или A в положении 9, F или T в положении 10, Q в положении 11, S или P в положении 12, L или A в положении 13, S в положении 14, P или L или V в положении 15, K в положении 16, Q или D в положении 17, R в положении 18, A в положении 19, S в положении 20, I или L в положении 21, T в положении 22, L в положении 43, K в положении 48, A или S в положении 49, R или Q в положении 51, Y в положении 55, I в положении 64, S или P в положении 66, S в положении 69, Y в положении 73, G в положении 74, E в положении 76, F в положении 79, N в положении 82, N в положении 83, L или I в положении 84, E в положении 85, S или P в положении 86, D в положении 87, A или F или I в положении 89, T или Y в положении 91, F в положении 93 или Y в положении 102 аминокислотной последовательности BAP049–chi–LC, например, аминокислотной последовательности, показанной на фиг. 10A–10B в US 2015/0210769A1 или под SEQ ID NO: 162 или 164.
В других вариантах осуществления молекула антитела к PD–1 содержит одну, две, три или четыре каркасные области тяжелой цепи (например, аминокислотную последовательность VHFW, показанную в таблице 2 в US 2015/0210769A1, или кодируемую нуклеотидной последовательностью, показанной в таблице 2 в US 2015/0210769A1), или последовательность, по сути идентичную им.
В еще одних вариантах осуществления молекула антитела к PD–1 содержит одну, две, три или четыре каркасные области легкой цепи (например, аминокислотную последовательность VLFW, показанную в таблице 2 в US 2015/0210769A1, или кодируемую нуклеотидной последовательностью, показанной в таблице 2 в US 2015/0210769A1), или последовательность, по сути идентичную им.
В других вариантах осуществления молекула антитела к PD–1 содержит одну, две, три или четыре каркасные области (например, аминокислотную последовательность VHFW, показанную в таблице 2 в US 2015/0210769A1, или кодируемую нуклеотидной последовательностью, показанной в таблице 2 US 2015/0210769A1), или последовательность, по сути идентичную им; и одну, две, три или четыре каркасные области легкой цепи (например, аминокислотную последовательность VLFW, показанную в таблице 2 в US 2015/0210769A1, или кодируемую нуклеотидной последовательностью, показанной в таблице 2 в US 2015/0210769A1), или последовательность, по сути идентичную им.
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасную область 1 тяжелой цепи (VHFW1) BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E (например, SEQ ID NO: 147 US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасную область 1 тяжелой цепи (VHFW1) BAP049–hum14 или BAP049–hum15 (например, SEQ ID NO: 151 US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасную область 2 тяжелой цепи (VHFW2) BAP049–hum01, BAP049–hum02, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum09, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C или BAP049–Clone–E (например, SEQ ID NO: 153 US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасную область 2 тяжелой цепи BAP049–hum03, BAP049–hum04, BAP049–hum08, BAP049–hum10, BAP049–hum14, BAP049–hum15 или BAP049–Clone–D (например, SEQ ID NO: 157 US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасную область 2 тяжелой цепи BAP049–hum16 (например, SEQ ID NO: 160 US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасную область 3 тяжелой цепи (VHFW3) BAP049–hum01, BAP049–hum02, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum09, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C или BAP049–Clone–E (например, SEQ ID NO: 162 US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасную область 3 тяжелой цепи (VHFW3) BAP049–hum03, BAP049–hum04, BAP049–hum08, BAP049–hum10, BAP049–hum14, BAP049–hum15, BAP049–hum16, или BAP049–Clone–D (например, SEQ ID NO: 166 US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасную область 4 тяжелой цепи (VHFW4) BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E (например, SEQ ID NO: 169 US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасную область 1 легкой цепи (VLFW1) BAP049–hum08, BAP049–hum09, BAP049–hum15, BAP049–hum16 или BAP049–Clone–C (например, SEQ ID NO: 174 US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасную область 1 легкой цепи (VLFW1) BAP049–hum01, BAP049–hum04, BAP049–hum05, BAP049–hum07, BAP049–hum10, BAP049–hum11, BAP049–hum14, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–D или BAP049–Clone–E (например, SEQ ID NO: 177 US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасную область 1 легкой цепи (VLFW1) BAP049–hum06 (например, SEQ ID NO: 181 US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасную область 1 легкой цепи (VLFW1) BAP049–hum13 (например, SEQ ID NO: 183 US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасную область 1 легкой цепи (VLFW1) BAP049–hum02, BAP049–hum03, или BAP049–hum12 (например, SEQ ID NO: 185 US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасную область 2 легкой цепи (VLFW2) BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum06, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–D или BAP049–Clone–E (например, SEQ ID NO: 187 US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасную область 2 легкой цепи (VLFW2) BAP049–hum04, BAP049–hum05, BAP049–hum07, BAP049–hum13, или BAP049–Clone–C (например, SEQ ID NO: 191 US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасную область 2 легкой цепи (VLFW2) BAP049–hum12 (например, SEQ ID NO: 194 US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасную область 3 легкой цепи (VLFW3) BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E (например, SEQ ID NO: 196 US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасную область 3 легкой цепи (VLFW3) BAP049–hum02 или BAP049–hum03 (например, SEQ ID NO: 200 US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасную область 3 легкой цепи (VLFW3) BAP049–hum01 или BAP049–Clone–А (например, SEQ ID NO: 202 US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасную область 3 легкой цепи (VLFW3) BAP049–hum04, BAP049–hum05 или BAP049–Clone–B (например, SEQ ID NO: 205 US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасную область 4 легкой цепи (VLFW4) BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E (например, SEQ ID NO: 208 US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 тяжелой цепи BAP049–hum01, BAP049–hum02, BAP049–hum05, BAP049–hum06, BAP–hum07, BAP049–hum09, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C или BAP049–Clone–E (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3) US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасные области 1–3 тяжелой цепи BAP049–hum03, BAP049–hum04, BAP049–hum08, BAP049–hum10, или BAP049–Clone–D (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 157 (VHFW2) и SEQ ID NO: 166 (VHFW3) US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасные области 1–3 тяжелой цепи BAP049–hum14 или BAP049–hum15 (например, SEQ ID NO: 151 (VHFW1), SEQ ID NO: 157 (VHFW2) и SEQ ID NO: 166 (VHFW3) US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасные области 1–3 тяжелой цепи BAP049–hum16 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 160 (VHFW2) и SEQ ID NO: 166 (VHFW3) US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела дополнительно содержит каркасную область 4 тяжелой цепи (VHFW4) BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E (например, SEQ ID NO: 169 US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 легкой цепи BAP049–hum01 или BAP049–Clone–А (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 202 (VLFW3) US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасные области 1–3 легкой цепи BAP049–hum02 или BAP049–hum03 (например, SEQ ID NO: 185 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 200 (VLFW3) US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасные области 1–3 легкой цепи BAP049–hum04, BAP049–hum05 или BAP049–Clone–B (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 191 (VLFW2) и SEQ ID NO: 205 (VLFW3) US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасные области 1–3 легкой цепи BAP049–hum06 (например, SEQ ID NO: 181 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3) US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасные области 1–3 легкой цепи BAP049–hum07 (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 191 (VLFW2) и SEQ ID NO: 196 (VLFW3) US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасные области 1–3 легкой цепи BAP049–hum08, BAP049–hum09, BAP049–hum15, BAP049–hum16 или BAP049–Clone–C (например, SEQ ID NO: 174 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3) US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасные области 1–3 легкой цепи BAP049–hum10, BAP049–hum11, BAP049–hum14, BAP049–Clone–D или BAP049–Clone–E (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3) US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасные области 1–3 легкой цепи BAP049–hum12 (например, SEQ ID NO: 185 (VLFW1), SEQ ID NO: 194 (VLFW2) и SEQ ID NO: 196 (VLFW3) US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела содержит каркасные области 1–3 легкой цепи BAP049–hum13 (например, SEQ ID NO: 183 (VLFW1), SEQ ID NO: 191 (VLFW2) и SEQ ID NO: 196 (VLFW3) US 2015/0210769A1). В некоторых вариантах осуществления молекула антитела дополнительно содержит каркасную область 4 легкой цепи (VLFW4) BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E (например, SEQ ID NO: 208 US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 тяжелой цепи BAP049–hum01 или BAP049–Clone–А (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3) US 2015/0210769A1) и каркасные области 1–3 легкой цепи BAP049–hum01 или BAP049–Clone–A (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 202 (VLFW3) US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 тяжелой цепи BAP049–hum02 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3) US 2015/0210769A1) и каркасные области 1–3 легкой цепи BAP049–hum02 (например, SEQ ID NO: 185 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 200 (VLFW3) US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 тяжелой цепи BAP049–hum03 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 157 (VHFW2) и SEQ ID NO: 166 (VHFW3) US 2015/0210769A1) и каркасные области 1–3 легкой цепи BAP049–hum03 (например, SEQ ID NO: 185 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 200 (VLFW3) US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 тяжелой цепи BAP049–hum04 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 157 (VHFW2) и SEQ ID NO: 166 (VHFW3) US 2015/0210769A1) и каркасные области 1–3 легкой цепи BAP049–hum04 (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 191 (VLFW2) и SEQ ID NO: 205 (VLFW3) US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 тяжелой цепи BAP049–hum05 или BAP049–Clone–В (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3) US 2015/0210769A1) и каркасные области 1–3 легкой цепи BAP049–hum05 или BAP049–Clone–В (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 191 (VLFW2) и SEQ ID NO: 205 (VLFW3) US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 тяжелой цепи BAP049–hum06 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3) US 2015/0210769A1) и каркасные области 1–3 легкой цепи BAP049–hum06 (например, SEQ ID NO: 181 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3) US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 тяжелой цепи BAP049–hum07 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3) US 2015/0210769A1) и каркасные области 1–3 легкой цепи BAP049–hum07 (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 191 (VLFW2) и SEQ ID NO: 196 (VLFW3) US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 тяжелой цепи BAP049–hum08 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 157 (VHFW2) и SEQ ID NO: 166 (VHFW3) US 2015/0210769A1) и каркасные области 1–3 легкой цепи BAP049–hum08 (например, SEQ ID NO: 174 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3) US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 тяжелой цепи BAP049–hum09 или BAP049–Clone–С (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3) US 2015/0210769A1) и каркасные области 1–3 легкой цепи BAP049–hum09 или BAP049–Clone–С (например, SEQ ID NO: 174 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3) US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 тяжелой цепи BAP049–hum10 или BAP049–Clone–D (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 157 (VHFW2) и SEQ ID NO: 166 (VHFW3) US 2015/0210769A1) и каркасные области 1–3 легкой цепи BAP049–hum10 или BAP049–Clone–D (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3) US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 тяжелой цепи BAP049–hum11 или BAP049–Clone–Е (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3) US 2015/0210769A1) и каркасные области 1–3 легкой цепи BAP049–hum11 или BAP049–Clone–Е (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3) US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 тяжелой цепи BAP049–hum12 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3) US 2015/0210769A1) и каркасные области 1–3 легкой цепи BAP049–hum12 (например, SEQ ID NO: 185 (VLFW1), SEQ ID NO: 194 (VLFW2) и SEQ ID NO: 196 (VLFW3) US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 тяжелой цепи BAP049–hum13 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3) US 2015/0210769A1) и каркасные области 1–3 легкой цепи BAP049–hum13 (например, SEQ ID NO: 183 (VLFW1), SEQ ID NO: 191 (VLFW2) и SEQ ID NO: 196 (VLFW3) US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 тяжелой цепи BAP049–hum14 (например, SEQ ID NO: 151 (VHFW1), SEQ ID NO: 157 (VHFW2) и SEQ ID NO: 166 (VHFW3) US 2015/0210769A1) и каркасные области 1–3 легкой цепи BAP049–hum14 (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3) US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 тяжелой цепи BAP049–hum15 (например, SEQ ID NO: 151 (VHFW1), SEQ ID NO: 157 (VHFW2) и SEQ ID NO: 166 (VHFW3) US 2015/0210769A1) и каркасные области 1–3 легкой цепи BAP049–hum15 (например, SEQ ID NO: 174 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3) US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасные области 1–3 тяжелой цепи BAP049–hum16 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 160 (VHFW2) и SEQ ID NO: 166 (VHFW3) US 2015/0210769A1) и каркасные области 1–3 легкой цепи BAP049–hum16 (например, SEQ ID NO: 174 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3) US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 дополнительно содержит каркасную область 4 тяжелой цепи (VHFW4) BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E (например, SEQ ID NO: 169 US 2015/0210769A1) и каркасную область 4 легкой цепи (VLFW4) BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E (например, SEQ ID NO: 208 US 2015/0210769A1).
В некоторых вариантах осуществления молекула антитела к PD–1 содержит каркасную область тяжелой цепи, имеющую комбинацию каркасных областей FW1, FW2 и FW3, как показано на фиг. 5 или 7 в US 2015/0210769A1. В других вариантах осуществления молекула антитела содержит каркасную область легкой цепи, имеющую комбинацию каркасных областей FW1, FW2 и FW3, как показано на фиг. 5 или 7 в US 2015/0210769A1. В еще одних вариантах осуществления молекула антитела содержит каркасную область тяжелой цепи, имеющую комбинацию каркасных областей FW1, FW2 и FW3, как показано на фиг. 5 или 7 в US 2015/0210769A1, и каркасную область легкой цепи, имеющую комбинацию каркасных областей FW1, FW2 и FW3, как показано на фиг. 5 или 7 в US 2015/0210769A1.
В одном варианте осуществления вариабельный домен тяжелой или легкой цепей или оба молекулы антитела к PD–1 содержат аминокислотную последовательность, которая является по сути идентичной аминокислоте, раскрытой в данном документе, например, идентичной на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше вариабельной области антитела, раскрытого в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанной в таблице 6, или кодируемой нуклеотидной последовательностью, описанной в таблице 6; или которая отличается по меньшей мере 1 или 5 остатками, но менее 40, 30, 20 или 10 остатками, от вариабельной области антитела, описанного в данном документе.
В одном варианте осуществления вариабельный домен тяжелой или легкой цепей или оба молекулы антитела к PD–1 содержат аминокислотную последовательность, кодируемую последовательностью нуклеиновой кислоты, описанной в данном документе, или нуклеиновой кислотой, которая гибридизируется с последовательностью нуклеиновой кислоты, описанной в данном документе (например, последовательностью нуклеиновой кислоты, показанной в таблицах 1 и 2 в US 2015/0210769A1 или таблице 6 в данном документе), или ее комплемент, например, в условиях низкой жесткости, средней жесткости или высокой жесткости или других условиях гибридизации, описанных в данном документе.
В другом варианте осуществления молекула антитела к PD–1 содержит по меньшей мере один, два, три или четыре антигенсвязывающие области, например, вариабельные области, имеющие аминокислотную последовательность, изложенную в таблице 6, или последовательность, по сути идентичную ей (например, последовательность, идентичную ей на по меньшей мере приблизительно 85%, 90%, 95%, 99% или больше, или которая отличается на не более 1, 2, 5, 10, или 15 аминокислотных остатков от последовательностей, показанных в таблице 6. В другом варианте осуществления молекула антитела к PD–1 содержит домен VH и/или VL, кодируемый нуклеиновой кислотой, имеющей нуклеотидную последовательность, изложенную в таблице 6, или последовательность, по сути идентичную ей (например, последовательность, идентичную ей на по меньшей мере приблизительно 85%, 90%, 95%, 99% или больше, или которая отличается на не более 3, 6, 15, 30 или 45 нуклеотидов от последовательностей, показанных в таблице 6.
В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три CDR из вариабельной области тяжелой цепи, имеющей аминокислотную последовательность, изложенную в таблице 6, или последовательность, по сути гомологичную ей (например, последовательность, идентичную ей на по меньшей мере приблизительно 85%, 90%, 95%, 99% или больше, и/или имеющую одну, две, три или больше замен, вставок или делеций, например, консервативных замен). В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три CDR из вариабельной области легкой цепи, имеющей аминокислотную последовательность, изложенную в таблице 6, или последовательность, по сути гомологичную ей (например, последовательность, идентичную ей на по меньшей мере приблизительно 85%, 90%, 95%, 99% или больше, и/или имеющую одну, две, три или больше замен, вставок или делеций, например, консервативных замен). В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR из вариабельных областей тяжелой и легкой цепей, имеющих аминокислотную последовательность, изложенную в таблице 6, или последовательность, по сути гомологичную ей (например, последовательность, идентичную ей на по меньшей мере приблизительно 85%, 90%, 95%, 99% или больше, и/или имеющую одну, две, три или больше замен, вставок или делеций, например, консервативных замен).
В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три CDR и/или гипервариабельные петли из вариабельной области тяжелой цепи, имеющей аминокислотную последовательность антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–А, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E, обобщенных в таблице 6, или последовательность, по сути идентичную ей (например, последовательность, идентичную ей на по меньшей мере приблизительно 85%, 90%, 95%, 99% или больше, и/или имеющую одну, две, три или больше замен, вставок или делеций, например, консервативных замен). В другом варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две или три CDR и/или гипервариабельные петли из вариабельной области легкой цепи, имеющей аминокислотную последовательность антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–А, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E, обобщенных в таблице 6, или последовательность, по сути идентичную ей (например, последовательность, идентичную ей на по меньшей мере приблизительно 85%, 90%, 95%, 99% или больше, и/или имеющую одну, две, три или больше замен, вставок или делеций, например, консервативных замен). В одном варианте осуществления молекула антитела к PD–1 содержит все шесть CDR и/или гипервариабельных петель, описанных в данном документе, например, описанных в таблице 6.
В одном варианте осуществления молекула антитела к PD–1 имеет вариабельную область, которая является идентичной по последовательности, или которая отличается на 1, 2, 3 или 4 аминокислоты от вариабельной области, описанной в данном документе (например, FR–области, раскрытой в данном документе).
В одном варианте осуществления молекула антитела к PD–1 представляет собой полное антитело или его фрагмент (например, Fab, F(ab')2, Fv или одноцепочечный фрагмент Fv (scFv)). В определенных вариантах осуществления молекула антитела к PD–1 представляет собой моноклональное антитело или антитело с одной специфичностью. Молекула антитела к PD–1 может также представлять собой молекулу гуманизированного, химерного, верблюжьего, акульего или созданного in vitro антитела. В одном варианте осуществления молекула антитела к PD–1 представляет собой молекулу гуманизированного антитела. Тяжелая и легкая цепи молекулы антитела к PD–1 могут быть полноразмерными (например, антитело может содержать по меньшей мере одну и предпочтительно две полные тяжелые цепи, и по меньшей мере одну и предпочтительно две полные легкие цепи) или могут содержать антигенсвязывающий фрагмент (например, Fab, F(ab')2, Fv, одноцепочечный фрагмент Fv, однодоменное антитело, диатело (dAb), бивалентное антитело или биспецифическое антитело или его фрагмент, его однодоменный вариант или верблюжье антитело).
В еще одних вариантах осуществления молекула антитела к PD–1 имеет константную область тяжелой цепи (Fc), выбранную, например, из константных областей тяжелой цепи IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD, и IgE; в частности, выбранную, например, из константных областей тяжелой цепи IgG1, IgG2, IgG3, и IgG4, более конкретно константной области тяжелой цепи IgG1 или IgG2 (например, IgG1, IgG2 или IgG4 человека). В одном варианте осуществления константная область тяжелой цепи представляет собой IgG1 человека. В другом варианте осуществления молекула антитела к PD–1 имеет константную область легкой цепи, выбранную, например, из константных областей легкой каппа– или лямбда–цепи, предпочтительно каппа (например, каппа человека). В одном варианте осуществления константная область является измененной, например, подвергнутой мутации, в целях модификации свойств молекулы антитела к PD–1 (например, повышения или снижения одного или нескольких из связывания с Fc–рецептором, гликозилирования антител, количества цистеиновых остатков, функции эффекторных клеток или функции комплемента). Например, константная область является подвергнутой мутации в положениях 296 (M на Y), 298 (S на T), 300 (T на E), 477 (H на K) и 478 (N на F) для изменения связывания с Fc–рецептором (например, подвергнутые мутации положения соответствуют положениям 132 (M на Y), 134 (S на T), 136 (T на E), 313 (H на K) и 314 (N на F) SEQ ID NO: 212 или 214; или положениям 135 (M на Y), 137 (S на T), 139 (T на E), 316 (H на K) и 317 (N на F) SEQ ID NO: 215, 216, 217 или 218). В другом варианте осуществления константная область тяжелой цепи IgG4, например, IgG4 человека, является подвергнутой мутации в положении 228 в соответствии с нумерацией EU (например, S на P), например, как показано в таблице 3 в US 2015/0210769A1. В определенных вариантах осуществления молекулы антител к PD–1 содержат IgG4 человека, подвергнутый мутации в положении 228 в соответствии с нумерацией EU (например, S на P), например, как показано в таблице 3 в US 2015/0210769A1; и константную область легкой каппа–цепи, например, как показано в таблице 3 в US 2015/0210769A1. В еще одном варианте осуществления константная область тяжелой цепи IgG1, например, IgG1 человека, является подвергнутой мутации в одном или нескольких из положения 297 в соответствии с нумерацией EU (например, N на A), положения 265 в соответствии с нумерацией EU (например, D на A), положения 329 в соответствии с нумерацией EU (например, P на A), положения 234 в соответствии с нумерацией EU (например, L на A) или положения 235 в соответствии с нумерацией EU (например, L на A), например, как показано в таблице 3 в US 2015/0210769A1. В определенных вариантах осуществления молекулы антител к PD–1 содержат IgG1 человека, подвергнутый мутации в одном или нескольких из вышеупомянутых положений, например, как показано, в таблице 3 в US 2015/0210769A1; и константную область легкой каппа–цепи, например, как показано в таблице 3 в US 2015/0210769A1.
В одном варианте осуществления молекула антитела к PD–1 является выделенной или рекомбинантной.
В одном варианте осуществления молекула антитела к PD–1 представляет собой молекулу гуманизированного антитела.
В одном варианте осуществления молекула антитела к PD–1 характеризуется степенью риска на основании анализа Т–клеточного эпитопа менее 700, 600, 500, 400 или меньше.
В одном варианте осуществления молекула антитела к PD–1 представляет собой молекулу гуманизированного антитела и характеризуется степенью риска на основании анализа Т–клеточного эпитопа от 300 до 700, от 400 до 650, от 450 до 600 или степенью риска, описанной в данном документе.
В одном варианте осуществления молекула антитела к PD–1 содержит
(a) вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 140, аминокислотную последовательность VHCDR2 под SEQ ID NO: 141 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 149, аминокислотную последовательность VLCDR2 под SEQ ID NO: 150 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 167;
(b) VH, содержащую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 137; аминокислотную последовательность VHCDR2 под SEQ ID NO: 138; аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 146, аминокислотную последовательность VLCDR2 под SEQ ID NO: 147 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 166;
(c) VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 286, аминокислотную последовательность VHCDR2 под SEQ ID NO: 141 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 149, аминокислотную последовательность VLCDR2 под SEQ ID NO: 150 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 167 или
(d) VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 286; аминокислотную последовательность VHCDR2 под SEQ ID NO: 138 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 146, аминокислотную последовательность VLCDR2 под SEQ ID NO: 147 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 166.
В определенных вариантах осуществления молекула антитела к PD–1 содержит
(i) вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 137, SEQ ID NO: 140 или SEQ ID NO: 286; аминокислотную последовательность VHCDR2 под SEQ ID NO: 138; аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и
(ii) вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 146, аминокислотную последовательность VLCDR2 под SEQ ID NO: 147 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 166.
В других вариантах осуществления молекула антитела к PD–1 содержит
(i) вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 137, SEQ ID NO: 140 или SEQ ID NO: 286; аминокислотную последовательность VHCDR2 под SEQ ID NO: 141 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 139; и
(ii) вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 149, аминокислотную последовательность VLCDR2 под SEQ ID NO: 150 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 167.
В вариантах осуществления вышеупомянутых молекул антител VHCDR1 содержит аминокислотную последовательность под SEQ ID NO: 137. В других вариантах осуществления VHCDR1 содержит аминокислотную последовательность под SEQ ID NO: 140. В еще одних вариантах осуществления VHCDR1 содержит аминокислотную последовательность под SEQ ID NO: 286.
В вариантах осуществления вышеупомянутые молекулы антител имеют вариабельную область тяжелой цепи, содержащую по меньшей мере одну каркасную (FW) область, содержащую аминокислотную последовательность под любым из SEQ ID NOs: 147, 151, 153, 157, 160, 162, 166, или 169 US 2015/0210769A1, или аминокислотную последовательность, идентичную ей на по меньшей мере 90%, или имеющую не более двух аминокислотных замен, вставок или делеций по сравнению с аминокислотной последовательностью под любым из SEQ ID NOs: 147, 151, 153, 157, 160, 162, 166, или 169 US 2015/0210769A1.
В других вариантах осуществления вышеупомянутые молекулы антител имеют вариабельную область тяжелой цепи, которая содержит по меньшей мере одну каркасную область, содержащую аминокислотную последовательность под любым из SEQ ID NOs: 147, 151, 153, 157, 160, 162, 166, или 169 US 2015/0210769A1.
В еще других вариантах осуществления вышеупомянутые молекулы антител имеют вариабельную область тяжелой цепи, которая содержит по меньшей мере две, три или четыре каркасные области, содержащие аминокислотные последовательности под любым из SEQ ID NOs: 147, 151, 153, 157, 160, 162, 166, или 169 US 2015/0210769A1.
В других вариантах осуществления вышеупомянутые молекулы антител содержат аминокислотную последовательность VHFW1 под SEQ ID NO: 147 или 151 US 2015/0210769A1, аминокислотную последовательность VHFW2 под SEQ ID NO: 153, 157 или 160 US 2015/0210769A1, и аминокислотную последовательность VHFW3 под SEQ ID NO: 162 или 166 US 2015/0210769A1, а также необязательно дополнительно содержат аминокислотную последовательность VHFW4 под SEQ ID NO: 169 US 2015/0210769A1.
В других вариантах осуществления вышеупомянутые молекулы антител имеют вариабельную область легкой цепи, содержащую по меньшей мере одну каркасную область, содержащую аминокислотную последовательность под любым из SEQ ID NOs: 174, 177, 181, 183, 185, 187, 191, 194, 196, 200, 202, 205, или 208 US 2015/0210769A1, или аминокислотную последовательность, идентичную ей на по меньшей мере 90%, или имеющую не более двух аминокислотных замен, вставок или делеций по сравнению с аминокислотной последовательностью под любым из 174, 177, 181, 183, 185, 187, 191, 194, 196, 200, 202, 205, или 208 US 2015/0210769A1.
В других вариантах осуществления вышеупомянутые молекулы антител имеют вариабельную область легкой цепи, которая содержит по меньшей мере одну каркасную область, содержащую аминокислотную последовательность под любым из SEQ ID NOs: 174, 177, 181, 183, 185, 187, 191, 194, 196, 200, 202, 205, или 208 US 2015/0210769A1.
В других вариантах осуществления вышеупомянутые молекулы антител имеют вариабельную область легкой цепи, которая содержит по меньшей мере две, три или четыре каркасные области, содержащие аминокислотные последовательности под любым из SEQ ID NOs: 174, 177, 181, 183, 185, 187, 191, 194, 196, 200, 202, 205, или 208 US 2015/0210769A1.
В других вариантах осуществления вышеупомянутые молекулы антител содержат аминокислотную последовательность VLFW1 под SEQ ID NO: 174, 177, 181, 183, или 185 US 2015/0210769A1, аминокислотную последовательность VLFW2 под SEQ ID NO: 187, 191, или 194 US 2015/0210769A1 и аминокислотную последовательность VLFW3 под SEQ ID NO: 196, 200, 202, или 205 US 2015/0210769A1, и необязательно дополнительно содержат аминокислотную последовательность VLFW4 под SEQ ID NO: 208 US 2015/0210769A1.
В других вариантах осуществления вышеупомянутые антитела содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность, идентичную на по меньшей мере 85% любой из SEQ ID NOs: 172, 184, 216, или 220.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, 184, 216, или 220.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен легкой цепи, содержащий аминокислотную последовательность, идентичную на по меньшей мере 85% любой из SEQ ID NOs: 176, 180, 188, 192, 196, 200, 204, 208, или 212.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 176, 180, 188, 192, 196, 200, 204, 208, или 212.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 225.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 184.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 186 или SEQ ID NO: 236.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 216.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 218.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 220.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 222.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 176.
В других вариантах осуществления вышеупомянутые молекулы антител содержат легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 178.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 180.
В других вариантах осуществления вышеупомянутые молекулы антител содержат легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 182.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 188.
В других вариантах осуществления вышеупомянутые молекулы антител содержат легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 190.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 192.
В других вариантах осуществления вышеупомянутые молекулы антител содержат легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 194.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 196.
В других вариантах осуществления вышеупомянутые антитела содержат легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 198.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 200.
В других вариантах осуществления вышеупомянутые молекулы антител содержат легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 202.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 204.
В других вариантах осуществления вышеупомянутые молекулы антител содержат легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 206.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 208.
В других вариантах осуществления вышеупомянутые молекулы антител содержат легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 210.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 212.
В других вариантах осуществления вышеупомянутые молекулы антител содержат легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 214.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 176.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 200.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 204.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 184, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 204.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 180.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 184, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 180.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 184, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 188.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 188.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 192.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 196.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 184, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 200.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 208.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 212.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 216, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 204.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 216, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 200.
В других вариантах осуществления вышеупомянутые молекулы антител содержат вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 220, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 200.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 225, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 178.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 225, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 190.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 225, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 202.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 225, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 206.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 236, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 206.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 178.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 182.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 186, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 182.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 186, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 190.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 190.
В других вариантах осуществления вышеупомянутые антитела содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 194.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 198.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 186, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 202.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 202.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 186, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 206.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 206.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 210.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 214.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 218, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 206.
В других вариантах осуществления вышеупомянутые антитела содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 218, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 202.
В других вариантах осуществления вышеупомянутые молекулы антител содержат тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 222, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 202.
В других вариантах осуществления вышеупомянутые молекулы антител выбраны из Fab, F(ab')2, Fv или одноцепочечного фрагмента Fv (scFv).
В других вариантах осуществления вышеупомянутые молекулы антител содержат константную область тяжелой цепи, выбранную из IgG1, IgG2, IgG3 и IgG4.
В других вариантах осуществления вышеупомянутые молекулы антител содержат константную область легкой цепи, выбранную из константных областей легкой каппа– или лямбда–цепи.
В других вариантах осуществления вышеупомянутые молекулы антител содержат константную область тяжелой цепи IgG4 человека с мутацией в положении 228 в соответствии с нумерацией EU или в положении 108 SEQ ID NO: 212 или 214 US 2015/0210769A1 и константную область легкой каппа–цепи.
В других вариантах осуществления вышеупомянутые молекулы антител содержат константную область тяжелой цепи IgG4 человека с мутацией по типу замены серина на пролин в положении 228 в соответствии с нумерацией EU или в положении 108 SEQ ID NO: 212 или 214 US 2015/0210769A1 и константную область легкой каппа–цепи.
В других вариантах осуществления вышеупомянутые молекулы антител содержат константную область тяжелой цепи IgG1 человека с мутацией по типу замены аспарагина на аланин в положении 297 в соответствии с нумерацией EU или в положении 180 SEQ ID NO: 216 US 2015/0210769A1 и константную область легкой каппа–цепи.
В других вариантах осуществления вышеупомянутые молекулы антител содержат константную область тяжелой цепи IgG1 человека с мутацией по типу замены аспартата на аланин в положении 265 в соответствии с нумерацией EU или в положении 148 SEQ ID NO: 217 US 2015/0210769A1 и мутацией по типу замены пролина на аланин в положении 329 в соответствии с нумерацией EU или в положении 212 SEQ ID NO: 217 US 2015/0210769A1 и константную область легкой каппа–цепи.
В других вариантах осуществления вышеупомянутые молекулы антител содержат константную область тяжелой цепи IgG1 человека с мутацией по типу замены лейцина на аланин в положении 234 в соответствии с нумерацией EU или в положении 117 SEQ ID NO: 218 US 2015/0210769A1 и мутацией по типу замены лейцина на аланин в положении 235 в соответствии с нумерацией EU или в положении 118 SEQ ID NO: 218 US 2015/0210769A1 и константную область легкой каппа–цепи.
В других вариантах осуществления вышеупомянутые молекулы антител способны связываться с PD–1 человека с константой диссоциации (KD), составляющей менее приблизительно 0,2 нМ.
В некоторых вариантах осуществления вышеупомянутые молекулы антител связываются с PD–1 человека с KD, составляющей менее приблизительно 0,2 нМ, 0,15 нМ, 0,1 нМ, 0,05 нМ или 0,02 нМ, например, от приблизительно 0,13 нМ до 0,03 нМ, например, от приблизительно 0,077 нM до 0,088 нМ, например, приблизительно 0,083 нМ, например, измеренной с помощью способа Biacore.
В других вариантах осуществления вышеупомянутые молекулы антител связываются с PD–1 яванского макака с KD, составляющей менее приблизительно 0,2 нМ, 0,15 нМ, 0,1 нМ, 0,05 нМ или 0,02 нМ, например, от приблизительно 0,11 нМ до 0,08 нМ, например, приблизительно 0,093 нM, например, измеренной с помощью способа Biacore.
В некоторых вариантах осуществления вышеупомянутые молекулы антител связываются как с PD–1 человека, так и с PD–1 яванского макака с аналогичной KD, например, в диапазоне нM, например, измеренной с помощью способа Biacore. В некоторых вариантах осуществления вышеупомянутые молекулы антител связываются со слитым белком PD–1–Ig человека с KD, составляющей менее приблизительно 0,1 нМ, 0,075 нМ, 0,05 нМ, 0,025 нМ или 0,01 нМ, например, приблизительно 0,04 нМ, например, измеренной с помощью ELISA.
В некоторых вариантах осуществления вышеупомянутые молекулы антител связываются с клетками Jurkat, которые экспрессируют PD–1 человека (например, с клетками Jurkat, трансфицированными PD–1 человека) с KD, составляющей менее приблизительно 0,1 нМ, 0,075 нМ, 0,05 нМ, 0,025 нМ или 0,01 нМ, например, приблизительно 0,06 нМ, например, измеренной с помощью анализа FACS.
В некоторых вариантах осуществления вышеупомянутые молекулы антител связываются с T–клетками яванского макака с KD, составляющей менее приблизительно 1 нМ, 0,75 нМ, 0,5 нМ, 0,25 нМ или 0,1 нМ, например, приблизительно 0,4 нМ, например, измеренной с помощью анализа FACS.
В некоторых вариантах осуществления вышеупомянутые молекулы антител связываются с клетками, которые экспрессируют PD–1 яванского макака (например, клетки, трансфицированные PD–1 яванского макака), с KD, составляющей менее приблизительно 1 нМ, 0,75 нМ, 0,5 нМ, 0,25 нМ или 0,01 нМ, например, приблизительно 0,6 нМ, например, измеренной с помощью анализа FACS.
В некоторых вариантах осуществления вышеупомянутые молекулы антител не являются перекрестнореагирующими с PD–1 мыши или крысы. В других вариантах осуществления вышеуказанные антитела являются перекрестнореагирующими с PD–1 макака–резуса. Например, перекрестное реагирование может быть измерено с помощью способа Biacore или анализа связывания с применением клеток, которые экспрессируют PD–1 (например, клеток 300.19, экспрессирующих PD–1 человека). В других вариантах осуществления вышеупомянутые молекулы антител связывают внеклеточный Ig–подобный домен PD–1.
В других вариантах осуществления вышеупомянутые молекулы антител способны снижать связывание PD–1 с PD–L1, PD–L2 или и с тем и другим, или с клеткой, которая экспрессирует PD–L1, PD–L2 или и тот и другой. В некоторых вариантах осуществления вышеупомянутые молекулы антител снижают (например, блокируют) связывание PD–L1 с клеткой, которая экспрессирует PD–1 (например, клетками 300.19, экспрессирующими PD–1 человека), с IC50, составляющей менее приблизительно 1,5 нМ, 1 нМ, 0,8 нМ, 0,6 нМ, 0,4 нМ, 0,2 нМ или 0,1 нМ, например, от приблизительно 0,79 нМ до приблизительно 1,09 нМ, например, приблизительно 0,94 нМ или приблизительно 0,78 нМ или меньше, например, приблизительно 0,3 нМ. В некоторых вариантах осуществления вышеупомянутые антитела снижают (например, блокируют) связывание PD–L2 с клеткой, которая экспрессирует PD–1 (например, клетками 300.19, экспрессирующими PD–1 человека), с IC50, составляющей менее приблизительно 2 нМ, 1,5 нМ, 1 нМ, 0,5 нМ или 0,2 нМ, например, от приблизительно 1,05 нМ до приблизительно 1,55 нМ или приблизительно 1,3 нМ или меньше, например, приблизительно 0,9 нМ.
В других вариантах осуществления вышеупомянутые молекулы антител способны усиливать антигенспецифический Т–клеточный ответ.
В вариантах осуществления молекула антитела представляет собой молекулу моноспецифического антитела или молекулу биспецифического антитела. В вариантах осуществления молекула антитела характеризуется первой специфичностью связывания с PD–1 и второй специфичностью связывания с TIM–3, LAG–3, CEACAM (например, CEACAM–1, CEACAM–3 и/или CEACAM–5), PD–L1 или PD–L2. В вариантах осуществления молекула антитела содержит антигенсвязывающий фрагмент антитела, например, полуантитело или антигенсвязывающий фрагмент полуантитела.
В некоторых вариантах осуществления вышеупомянутые молекулы антител повышают экспрессию IL–2 в клетках, активированных стафилококковым энтеротоксином B (SEB) (например, при 25 мкг/мл), в по меньшей мере 2, 3, 4, 5 раз, например, в приблизительно 2–3 раза, например, в приблизительно 2–2,6 раза, например, в приблизительно 2,3 раза, по сравнению с экспрессией IL–2 при использовании изотипического контроля (например, IgG4), например, измеренную с помощью анализа активации Т–клеток с использованием SEB или анализа цельной крови человека ex vivo.
В некоторых вариантах осуществления вышеупомянутые молекулы антител повышают экспрессию IFN–γ в Т–клетках, стимулированных с помощью антитела к CD3 (например, при 0,1 мкг/мл), в по меньшей мере приблизительно 2, 3, 4, 5 раз, например, в приблизительно 1,2–3,4 раза, например, в приблизительно 2,3 раза, по сравнению с экспрессией IFN–γ при использовании изотипического контроля (например, IgG4), например, измеренную с помощью анализа активности IFN–γ.
В некоторых вариантах осуществления вышеупомянутые молекулы антител повышают экспрессию IFN–γ в Т–клетках, активированных с помощью SEB (например, при 3 пг/мл), в по меньшей мере приблизительно 2, 3, 4, 5 раз, например, в приблизительно 0,5–4,5 раза, например, в приблизительно 2,5 раза, по сравнению с экспрессией IFN–γ при использовании изотипического контроля (например, IgG4), например, измеренную с помощью анализа активности IFN–γ.
В некоторых вариантах осуществления вышеупомянутые молекулы антител повышают экспрессию IFN–γ в Т–клетках, активированных с помощью пептида CMV, в по меньшей мере приблизительно 2, 3, 4, 5 раз, например, в приблизительно 2–3,6 раза, например, в приблизительно 2,8 раза, по сравнению с экспрессией IFN–γ при использовании изотипического контроля (например, IgG4), например, измеренную с помощью анализа активности IFN–γ.
В некоторых вариантах осуществления вышеупомянутые молекулы антител повышают пролиферацию CD8+ T–клеток, активированных с помощью пептида CMV, в по меньшей мере приблизительно 1, 2, 3, 4, 5 раз, например, в приблизительно 1,5 раза, по сравнению с пролиферацией CD8+ T клеток при использовании изотипического контроля (например, IgG4), например, измеренную с помощью процентного содержания CD8+ Т–клеток, которые прошли через по меньшей мере n (например, n=2 или 4) делений клеток.
В некоторых вариантах осуществления вышеупомянутые молекулы антител характеризуются Cmax, составляющей от приблизительно 100 мкг/мл до приблизительно 500 мкг/мл, от приблизительно 150 мкг/мл до приблизительно 450 мкг/мл, от приблизительно 250 мкг/мл до приблизительно 350 мкг/мл или от приблизительно 200 мкг/мл до приблизительно 400 мкг/мл, например, приблизительно 292,5 мкг/мл, например, измеренной у обезьяны.
В некоторых вариантах осуществления вышеупомянутые молекулы антител характеризуются T1/2 в диапазоне от приблизительно 250 часов до приблизительно 650 часов, от приблизительно 300 часов до приблизительно 600 часов, от приблизительно 350 часов до приблизительно 550 часов или от приблизительно 400 часов до приблизительно 500 часов, например, приблизительно 465,5 часа, например, измеренном у обезьяны.
В некоторых вариантах осуществления вышеупомянутые молекулы антител связываются с PD–1 с Kd, составляющей медленнее 5⋅10–4, 1⋅10–4, 5⋅10–5 или 1⋅10–5 с–1, например, приблизительно 2,13⋅10–4 с–1, например, измеренной с помощью способа Biacore. В некоторых вариантах осуществления вышеупомянутые молекулы антител связываются с PD–1 с Kа, составляющей более 1⋅104, 5⋅104, 1⋅105 или 5⋅105 M–1с–1, например, приблизительно 2,78⋅105 M–1с–1, например, измеренной с помощью способа Biacore.
В некоторых вариантах осуществления вышеупомянутые молекулы антител к PD–1 связываются с одним или несколькими остатками в C–нити, CC'–петле, C'–нити и FG–петле PD–1. Доменная структура PD–1 описана, например, в Cheng et al., "Structure and Interactions of the Human Programmed Cell Death 1 Receptor" J. Biol. Chem. 2013, 288:11771–11785. Как описано в Cheng et. al., C–нить содержит остатки F43–M50, CC'–петля содержит S51–N54, C'–нить содержит остатки Q55–F62, а FG–петля содержит остатки L108–I114 (нумерация аминокислот согласно Chang et al. выше). Соответственно, в некоторых вариантах осуществления антитело к PD–1, описанное в данном документе, связывается с по меньшей мере одним остатком в одном или нескольких диапазонах из F43–M50, S51–N54, Q55–F62 и L108–I114 PD–1. В некоторых вариантах осуществления антитело к PD–1, описанное в данном документе, связывается с по меньшей мере одним остатком в двух, трех или всех четырех диапазонах из F43–M50, S51–N54, Q55–F62 и L108–I114 PD–1. В некоторых вариантах осуществления антитело к PD–1 связывается с остатком в PD–1, который также является частью сайта связывания для одного или обоих из PD–L1 и PD–L2.
В другом аспекте настоящее изобретение предусматривает выделенную молекулу нуклеиновой кислоты, кодирующую любую из вышеупомянутых молекул антител, векторы и их клетки–хозяева.
Также предусмотрена выделенная нуклеиновая кислота, кодирующая вариабельную область тяжелой цепи или вариабельную область легкой цепи антитела или и ту и другую из любой из вышеуказанных молекул антител.
В одном варианте осуществления выделенная нуклеиновая кислота кодирует CDR 1–3 тяжелой цепи, где указанная нуклеиновая кислота содержит нуклеотидную последовательность под SEQ ID NO: 242–246, 255, 256–260, 267–271 или 278–280.
В другом варианте осуществления выделенная нуклеиновая кислота кодирует CDR 1–3 легкой цепи, где указанная нуклеиновая кислота содержит нуклеотидную последовательность под SEQ ID NO: 247–254, 261–266 или 272–277.
В других вариантах осуществления вышеуказанная нуклеиновая кислота дополнительно содержит нуклеотидную последовательность, кодирующую вариабельный домен тяжелой цепи, где указанная нуклеотидная последовательность на по меньшей мере 85% идентична любой из SEQ ID NO: 173, 185, 217, 221, 224, 229, или 235.
В других вариантах осуществления вышеуказанная нуклеиновая кислота дополнительно содержит нуклеотидную последовательность, кодирующую вариабельный домен тяжелой цепи, где указанная нуклеотидная последовательность содержит любую из SEQ ID NO: 173, 185, 217, 221, 224, 229, или 235.
В других вариантах осуществления вышеуказанная нуклеиновая кислота дополнительно содержит нуклеотидную последовательность, кодирующую тяжелую цепь, где указанная нуклеотидная последовательность идентична на по меньшей мере 85% любой из SEQ ID NO: 175, 187, 219, 223, 226, 230, или 237.
В других вариантах осуществления вышеуказанная нуклеиновая кислота дополнительно содержит нуклеотидную последовательность, кодирующую тяжелую цепь, где указанная нуклеотидная последовательность содержит любую из SEQ ID NO: 175, 187, 219, 223, 226, 230, или 237.
В других вариантах осуществления вышеуказанная нуклеиновая кислота дополнительно содержит нуклеотидную последовательность, кодирующую вариабельный домен легкой цепи, где указанная нуклеотидная последовательность идентична на по меньшей мере 85% любой из SEQ ID NO: 177, 181, 189, 193, 197, 201, 205, 209, 213, 227, 231, 233, 238, или 240.
В других вариантах осуществления вышеуказанная нуклеиновая кислота дополнительно содержит нуклеотидную последовательность, кодирующую вариабельный домен легкой цепи, где указанная нуклеотидная последовательность содержит любую из SEQ ID NO: 177, 181, 189, 193, 197, 201, 205, 209, 213, 227, 231, 233, 238, или 240.
В других вариантах осуществления вышеуказанная нуклеиновая кислота дополнительно содержит нуклеотидную последовательность, кодирующую легкую цепь, где указанная нуклеотидная последовательность идентична на по меньшей мере 85% любой из SEQ ID NO: 179, 183, 191, 195, 199, 203, 207, 211, 215, 228, 232, 234, 239 или 241.
В других вариантах осуществления вышеуказанная нуклеиновая кислота дополнительно содержит нуклеотидную последовательность, кодирующую легкую цепь, где указанная нуклеотидная последовательность содержит любую из SEQ ID NO: 179, 183, 191, 195, 199, 203, 207, 211, 215, 228, 232, 234, 239 или 241.
В некоторых вариантах осуществления предусмотрены один или несколько векторов экспрессии и клетки–хозяева, содержащие вышеуказанные нуклеиновые кислоты.
Также предусмотрен способ получения молекулы антитела или его фрагмента, предусматривающий культивирование клетки–хозяина, как описано в данном документе, в условиях, подходящих для экспрессии генов.
В одном аспекте настоящее изобретение относится к способу получения молекулы антитела, описанной в данном документе. Способ предусматривает обеспечение антигена PD–1 (например, антигена, содержащего по меньшей мере часть эпитопа PD–1); получение молекулы антитела, которая специфически связывается с полипептидом PD–1; и оценивание того, связывается ли специфически молекула антитела с полипептидом PD–1, или оценивание эффективности молекулы антитела в модулировании, например, ингибировании активности PD–1. Способ может дополнительно предусматривать введение молекулы антитела субъекту, например, человеку или отличному от человека животному.
В другом аспекте настоящее изобретение относится к композициям, например, фармацевтическим композициям, которые содержат фармацевтически приемлемый носитель, вспомогательное вещество или стабилизатор и по меньшей мере одно из терапевтических средств, например, описанных в данном документе молекул антител к PD–1. В одном варианте осуществления композиция, например, фармацевтическая композиция, содержит комбинацию молекулы антитела и одного или нескольких средств, например, терапевтического средства или другой молекулы антитела, как описано в данном документе. В одном варианте осуществления молекула антитела конъюгирована с меткой или терапевтическим средством.
Таблица 6. Аминокислотные и нуклеотидные последовательности молекул мышиных, химерных и гуманизированных антител к PD–1. Молекулы антител включают мышиное mAb BAP049, химерные mAb BAP049–chi и BAP049–chi–Y и гуманизированные mAb от BAP049–hum01 до BAP049–hum16 и от BAP049–Clone–A до BAP049–Clone–E. Показаны аминокислотные и нуклеотидные последовательности CDR тяжелых и легких цепей, вариабельных областей тяжелых и легких цепей и тяжелых и легких цепей.
В вариантах осуществления молекула ингибитора PD–1 представляет собой молекулу, отличную от антитела или его фрагмента. В вариантах осуществления ингибитор PD–1 представляет собой молекулу РНК, например, молекулу dsRNA, например, молекулу dsRNA (например, средства для RNAi, такие как shRNA, siRNA, miRNA, короткие палиндромные повторы, регулярно расположенные группами (CRISPR), эффекторная нуклеаза, подобная активаторам транскрипции (TALEN), или эндонуклеаза с "цинковыми пальцами" (ZFN)), которая нацеливается на и модулирует или регулирует, например, ингибирует PD–1, как описано, например, в абзаце [00489] и таблицах 16 и 17 международной публикации WO2015/090230, поданной 19 декабря 2014 г., которая включена посредством ссылки во всей своей полноте.
Антитела, фрагменты антител и другие ингибиторы PD–1, PD–L1 и PD–L2 доступны в данной области техники и могут быть использованы в комбинации с клеткой, экспрессирующей CAR, по настоящему изобретению, описанной в данном документе. В некоторых вариантах осуществления ингибитор PD–1 выбран из PDR001 (Novartis), ниволумаба (Bristol–Myers Squibb), пембролизумаба (Merck & Co), пидилизумаба (CureTech), MEDI0680 (Medimmune), REGN2810 (Regeneron), TSR–042 (Tesaro), PF–06801591 (Pfizer), BGB–A317 (Beigene), BGB–108 (Beigene), INCSHR1210 (Incyte) или AMP–224 (Amplimmune).
Ниволумаб (также называемый BMS–936558 или MDX1106; Bristol–Myers Squibb) представляет собой полностью человеческое моноклональное антитело IgG4, которое специфически блокирует PD–1. Ниволумаб (клон 5C4) и другие человеческие моноклональные антитела, которые специфически связываются с PD–1, раскрыты в US 8008449 и WO2006/121168.
В некоторых вариантах осуществления антитело к PD–1 представляет собой ниволумаб. Альтернативные названия для ниволумаба включают MDX–1106, MDX–1106–04, ONO–4538, OPDIVO® или BMS–936558. В некоторых вариантах осуществления антитело к PD–1 представляет собой ниволумаб (регистрационный номер CAS: 946414–94–4). Ниволумаб представляет собой полностью человеческое моноклональное антитело IgG4, которое специфически блокирует PD1. Ниволумаб (клон 5C4) и другие человеческие моноклональные антитела, которые специфически связываются с PD1, раскрыты в US 8008449 и WO2006/121168. В одном варианте осуществления ингибитор PD–1 представляет собой ниволумаб и содержит последовательность, раскрытую в данном документе (или последовательность, по сути, идентичную или подобную ей, например, последовательность, идентичную на по меньшей мере 85%, 90%, 95% указанной последовательности). В одном варианте осуществления молекула антитела к PD–1 содержит одну или несколько из последовательностей CDR (или в совокупности все из последовательностей CDR), последовательность вариабельной области тяжелой цепи или легкой цепи или последовательность тяжелой цепи или легкой цепи ниволумаба.
Аминокислотные последовательности тяжелой и легкой цепей ниволумаба являются следующими.
Тяжелая цепь
QVQLVESGGGVVQPGRSLRLDCKASGITFSNSGMHWVRQAPGKGLEWVAVIWYDGSKRYYADSVKGRFTISRDNSKNTLFLQMNSLRAEDTAVYYCATNDDYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK (SEQ ID NO: 281)
Легкая цепь
EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQSSNWPRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 282)
Пембролизумаб (ранее известный как ламбролизумаб и также называемый MK03475; Merck) представляет собой гуманизированное моноклональное антитело IgG4, которое связывается с PD–1. Пембролизумаб и другие гуманизированные антитела к PD–1 раскрыты в US 8354509 и WO2009/114335. AMP–224 (B7–DCIg; Amplimmune; например, раскрытый в WO2010/027827 и WO2011/066342), представляет собой растворимый рецептор на основе продукта слияния PD–L2 и Fc, который блокирует взаимодействие между PD–1 и B7–H1. Другие антитела к PD–1 включают AMP 514 (Amplimmune), среди прочих, например, антитела к PD–1, раскрытые в US 8609089, US 2010028330 и/или US 20120114649.
В некоторых вариантах осуществления антитело к PD–1 представляет собой пембролизумаб. Пембролизумаб (также называемый ламбролизумабом, MK–3475, MK03475, SCH–900475 или KEYTRUDA®; Merck) представляет собой гуманизированное моноклональное антитело IgG4, которое связывается с PD–1. Пембролизумаб и другие гуманизированные антитела к PD–1 раскрыты в Hamid, O. et al. (2013) New England Journal of Medicine 369 (2): 134–44, US 8354509 и WO2009/114335.
Пембролизумаб
В одном варианте осуществления ингибитор PD–1 представляет собой пембролизумаб, раскрытый, например, в US 8354509 и WO 2009/114335, и содержит последовательность, раскрытую в данном документе (или последовательность, по сути, идентичную или подобную ей, например, последовательность, идентичную на по меньшей мере 85%, 90%, 95% или больше указанной последовательности). В одном варианте осуществления молекула антитела к PD–1 содержит одну или несколько из последовательностей CDR (или в совокупности все из последовательностей CDR), последовательность вариабельной области тяжелой цепи или легкой цепи или последовательность тяжелой цепи или легкой цепи пембролизумаба.
В некоторых вариантах осуществления молекула антитела к PD1 содержит
(i) вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 530; аминокислотную последовательность VHCDR2 под SEQ ID NO: 531; аминокислотную последовательность VHCDR3 под SEQ ID NO: 532; и
(ii) вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 527; аминокислотную последовательность VLCDR2 под SEQ ID NO: 528; аминокислотную последовательность VLCDR3 под SEQ ID NO: 529,
или последовательность, аналогичную им, например, идентичную на по меньшей мере 85%, 90%, 95% или больше.
В других вариантах осуществления молекула антитела к PD1 содержит тяжелую цепь, содержащую аминокислоту под SEQ ID NO: 283, и легкую цепь, содержащую аминокислоту под SEQ ID NO: 284, или последовательность, идентичную или аналогичную им, например, идентичную на по меньшей мере 85%, 90%, 95% или больше.
Аминокислотные последовательности тяжелой цепи, легкой цепи, CDR тяжелой цепи и CDR легкой цепи пембролизумаба раскрыты ниже.
Тяжелая цепь
(SEQ ID NO: 283)
Легкая цепь
(SEQ ID NO: 284)
CDR1 легкой цепи: RASKGVSTSGYSYLH (SEQ ID NO: 527)
CDR2 легкой цепи: LASYLES (SEQ ID NO: 528)
CDR3 легкой цепи: QHSRDLPLT (SEQ ID NO: 529)
CDR1 тяжелой цепи: NYYMY (SEQ ID NO: 530)
CDR2 тяжелой цепи: GINPSNGGTNFNEKFKN (SEQ ID NO: 531)
CDR3 тяжелой цепи: RDYRFDMGFDY (SEQ ID NO: 532)
В некоторых вариантах осуществления антитело к PD–1 представляет собой пидилизумаб. Пидилизумаб (CT–011; Cure Tech) представляет собой гуманизированное моноклональное антитело IgG1k, которое связывается с PD1. Пидилизумаб и другие гуманизированные моноклональные антитела к PD–1 раскрыты в WO2009/101611, Rosenblatt, J. et al. (2011) J Immunotherapy 34(5): 409–18, US 7695715, US 7332582 и US 8686119, включенных посредством ссылки во всей свой полноте. В одном варианте осуществления молекула антитела к PD–1 содержит одну или несколько из последовательностей CDR (или в совокупности все из последовательностей CDR), последовательность вариабельной области тяжелой цепи или легкой цепи или последовательность тяжелой цепи или легкой цепи пидилизумаба.
В одном варианте осуществления молекула антитела к PD–1 представляет собой MEDI0680 (Medimmune), также известное как AMP–514. MEDI0680 и другие антитела к PD–1 раскрыты в US 9205148 и WO 2012/145493, включенных посредством ссылки во всей своей полноте. В одном варианте осуществления молекула антитела к PD–1 содержит одну или несколько из последовательностей CDR (или в совокупности все из последовательностей CDR), последовательность вариабельной области тяжелой цепи или легкой цепи или последовательность тяжелой цепи или легкой цепи MEDI0680.
В одном варианте осуществления молекула антитела к PD–1 представляет собой REGN2810 (Regeneron). В одном варианте осуществления молекула антитела к PD–1 содержит одну или несколько из последовательностей CDR (или в совокупности все из последовательностей CDR), последовательность вариабельной области тяжелой цепи или легкой цепи или последовательность тяжелой цепи или легкой цепи REGN2810.
В одном варианте осуществления молекула антитела к PD–1 представляет собой PF–06801591 (Pfizer). В одном варианте осуществления молекула антитела к PD–1 содержит одну или несколько из последовательностей CDR (или в совокупности все из последовательностей CDR), последовательность вариабельной области тяжелой цепи или легкой цепи или последовательность тяжелой цепи или легкой цепи PF–06801591.
В одном варианте осуществления молекула антитела к PD–1 представляет собой BGB–A317 или BGB–108 (Beigene). В одном варианте осуществления молекула антитела к PD–1 содержит одну или несколько из последовательностей CDR (или в совокупности все из последовательностей CDR), последовательность вариабельной области тяжелой цепи или легкой цепи или последовательность тяжелой цепи или легкой цепи BGB–A317 или BGB–108.
В одном варианте осуществления молекула антитела к PD–1 представляет собой INCSHR1210 (Incyte), также известное как INCSHR01210 или SHR–1210. В одном варианте осуществления молекула антитела к PD–1 содержит одну или несколько из последовательностей CDR (или в совокупности все из последовательностей CDR), последовательность вариабельной области тяжелой цепи или легкой цепи или последовательность тяжелой цепи или легкой цепи INCSHR1210.
В одном варианте осуществления молекула антитела к PD–1 представляет собой TSR–042 (Tesaro), также известное как ANB011. В одном варианте осуществления молекула антитела к PD–1 содержит одну или несколько из последовательностей CDR (или в совокупности все из последовательностей CDR), последовательность вариабельной области тяжелой цепи или легкой цепи или последовательность тяжелой цепи или легкой цепи TSR–042.
Другие антитела к PD1 включают AMP 514 (Amplimmune), среди прочих, например, антитела к PD1, описанные в US 8609089, US 2010028330 и/или US 20120114649. Дополнительные известные антитела к PD–1 включают таковые, описанные, например, в WO 2015/112800, WO 2016/092419, WO 2015/085847, WO 2014/179664, WO 2014/194302, WO 2014/209804, WO 2015/200119, US 8735553, US 7488802, US 8927697, US 8993731 и US 9102727, включенных посредством ссылки во всей своей полноте.
В одном варианте осуществления антитело к PD–1 представляет собой антитело, которое конкурирует за связывание и/или связывает тот же эпитоп на PD–1, как и одно из антител к PD–1, описанных в данном документе.
В одном варианте осуществления ингибитор PD–1 представляет собой пептид, который ингибирует сигнальный путь с участием PD–1, например, как описано в US 8907053, включенном посредством ссылки во всей своей полноте. В некоторых вариантах осуществления ингибитор PD–1 представляет собой иммуноадгезин (например, иммуноадгезин, который содержит внеклеточную или PD–1–связывающую часть PD–L1 или PD–L2, слитую с константной областью (например, Fc–область последовательности иммуноглобулина)). В некоторых вариантах осуществления ингибитор PD–1 представляет собой AMP–224 (B7–DCIg; Amplimmune; например, раскрытый в WO2010/027827 и WO2011/066342), представляющий собой растворимый рецептор на основе продукта слияния PD–L2 и Fc, который блокирует взаимодействие между PD–1 и B7–H1.
В одном варианте осуществления антитело к PD–1 или его фрагмент представляют собой молекулу антитела к PD–1, описанную в US 2015/0210769 под названием "Молекулы антител к PD–1 и варианты их применения", включенном посредством ссылки во всей своей полноте. В одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR (или в совокупности все CDR) вариабельной области тяжелой и легкой цепей антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 1 в US 2015/0210769, или кодируемые нуклеотидной последовательностью, описанной в таблице 1, или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей; или близкородственные CDR, например, CDR, которые являются идентичными или которые имеют по меньшей мере одно изменение аминокислоты, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен).
В еще одном варианте осуществления молекула антитела к PD–1 содержит по меньшей мере одну, две, три или четыре вариабельные области из антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP049–hum01, BAP049–hum02, BAP049–hum03, BAP049–hum04, BAP049–hum05, BAP049–hum06, BAP049–hum07, BAP049–hum08, BAP049–hum09, BAP049–hum10, BAP049–hum11, BAP049–hum12, BAP049–hum13, BAP049–hum14, BAP049–hum15, BAP049–hum16, BAP049–Clone–A, BAP049–Clone–B, BAP049–Clone–C, BAP049–Clone–D или BAP049–Clone–E; или описанные в таблице 1 в US 2015/0210769 или кодируемые нуклеотидной последовательностью из таблицы 1; или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей.
Терапевтическое применение в отношении заболеваний и нарушений
Заболевания и/или нарушения, ассоциированные с антигенами, например, CD19
В настоящем изобретении предусмотрены композиции и способы лечения заболеваний и нарушений (например, видов рака), например, ассоциированных с экспрессией антигена, например, CD19. В одном аспекте в настоящем изобретении предусмотрены способы лечения заболевания, где часть злокачественной опухоли является отрицательной в отношении антигена, например, CD19, а часть злокачественной опухоли, является положительной в отношении антигена, например, CD19.
Например, способы и композиции по настоящему изобретению пригодны для лечения субъектов, которые имеют рецидивирующее или имеют резистентное заболевание (например, рак, например, CD19+ рак).
В определенных вариантах осуществления субъекту ранее вводили средство химиотерапии, например, средство химиотерапии, описываемое в данном документе (например, средство противолимфомной химиотерапии, карбоплатин и/или гемцитабин), до введения клетки, экспрессирующей CAR, и/или ингибитора PD–1, описываемых в данном документе. В вариантах осуществления субъекту ранее вводили средство иммунотерапии, например, аллогенный трансплантат костного мозга, до введения клетки, экспрессирующей CAR, и/или ингибитора PD–1, описываемых в данном документе. В вариантах осуществления субъект ранее подвергался средству лучевой терапии до введения клетки, экспрессирующей CAR, и/или ингибитора PD–1, описываемых в данном документе.
Иллюстративные виды рака, которые можно лечить комбинированной терапией, описанной в данном документе (например, клеткой, экспрессирующей CAR, и ингибитором PD–1), включают гематологический рак. Иллюстративные виды гематологического рака описаны более подробно ниже.
Настоящее изобретение предусматривает (среди прочего) тип клеточной терапии, при которой T–клетки генетически модифицируют для экспрессии химерного антигенного рецептора (CAR) и CAR–T–клетку вводят посредством инфузии реципиенту, нуждающемуся в этом. Введенная посредством инфузии клетка способна уничтожать опухолевые клетки у реципиента. В отличие от средств терапии на основе антитела, модифицированные CAR T–клетки способны реплицироваться in vivo, что приводит в результате к долгосрочной персистенции, которая может приводить к длительному контролю опухоли. В различных аспектах T–клетки, вводимые пациенту, или их потомство, персистируют у пациента в течение по меньшей мере четырех месяцев, пяти месяцев, шести месяцев, семи месяцев, восьми месяцев, девяти месяцев, десяти месяцев, одиннадцати месяцев, двенадцати месяцев, тринадцати месяцев, четырнадцати месяцев, пятнадцати месяцев, шестнадцати месяцев, семнадцати месяцев, восемнадцати месяцев, девятнадцати месяцев, двадцати месяцев, двадцати одного месяца, двадцати двух месяцев, двадцати трех месяцев, двух лет, трех лет, четырех лет или пяти лет после введения T–клетки пациенту.
Настоящее изобретение также предусматривает тип клеточной терапии, при котором иммунные эффекторные клетки, например, NK–клетки или T–клетки модифицируют, например, с помощью транскрибированной in vitro РНК, для временной экспрессии химерного антигенного рецептора (CAR), а клетку, экспрессирующую CAR (например, CART), вводят посредством инфузии реципиенту, нуждающемуся в этом. Введенная посредством инфузии клетка способна уничтожать раковые клетки у реципиента. Таким образом, в различных аспектах клетка, экспрессирующая CAR, например, T–клетка, вводимая пациенту, присутствует в течение менее одного месяца, например, трех недель, двух недель, одной недели, после введения клетки, экспрессирующей CAR, например, T–клетки, пациенту.
Не ограничиваясь какой–либо определенной теорией, противораковый иммунный ответ, вызванный модифицированными CAR T–клетками, может быть активным или пассивным иммунным ответом, или, в качестве альтернативы, может быть обусловлен прямым или непрямым иммунным ответом. В одном аспекте трансдуцированные CAR (например, CD19–CAR) T–клетки характеризуются специфической секрецией провоспалительных цитокинов и выраженной цитолитической активностью в ответ на опухолевые клетки человека, экспрессирующие целевой антиген (например, CD19), противодействуют ингибированию со стороны растворимого целевого антигена, опосредуют неспецифический цитолиз и опосредуют регрессию верифицированного рака у человека. Например, безантигенные раковые клетки в гетерогенной области злокачественной опухоли, экспрессирующей целевой антиген, могут быть восприимчивы к непрямому разрушению со стороны перенаправленных целевым антигеном T–клеток, которые ранее вступали в реакцию против прилегающих раковых клеток, содержащих антиген.
В одном аспекте настоящего изобретения описан способ лечения рака у субъекта. Способ предусматривает введение субъекту комбинированной терапии, которая включает введение клетки, экспрессирующей CAR (например, клетки, экспрессирующей CAR для CD19), и ингибитора PD–1, в результате чего обеспечивается лечение рака у субъекта. Пример рака, который поддается лечению с помощью комбинированной терапии, описанной в данном документе, представляет собой рак, ассоциированный с экспрессией антигена, например, CD19. В одном аспекте рак, ассоциированный с экспрессией антигена, например, CD19, выбран из любого вида гематологического рака, описанного в данном документе, например, лимфомы, например, фолликулярной лимфомы или DLBCL.
В одном варианте осуществления комбинированная терапия клеткой, экспрессирующей CAR (например, клеткой, экспрессирующей CAR для CD19), и ингибитором PD–1, описываемыми в данном документе, приводит к одному или нескольким из следующего: улучшению или увеличению противоопухолевой активности клетки, экспрессирующей CAR (например, клетки, экспрессирующей CAR для CD19); увеличению пролиферации или персистенции клетки, экспрессирующей CAR; улучшению или увеличению инфильтрации клетки, экспрессирующей CAR; улучшению ингибирования прогрессирования опухоли; задержке прогрессирования опухоли; ингибированию или уменьшению пролиферации раковых клеток; и/или снижению опухолевой нагрузки, например, объема или размера опухоли, например, по сравнению с монотерапией клеткой, экспрессирующей CAR, или ингибитором PD–1 в отдельности. В одном варианте осуществления комбинированная терапия приводит к повышенной персистенции клетки, экспрессирующей CAR, и длительному восстановлению B–клеток, например, проявляемому в виде аплазии B–клеток. В одном варианте осуществления комбинированная терапия приводит к повышенной персистенции клетки, экспрессирующей CAR, и более низкому, например, сниженному риску рецидива.
В настоящем изобретении предусмотрены способы ингибирования пролиферации или уменьшения популяции клетки, экспрессирующей антиген (например, экспрессирующей CD19). В одном варианте осуществления способы предусматривают введение комбинированной терапии, например, комбинации, содержащей клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), или популяции клеток, экспрессирующих CAR, и ингибитор PD–1. В определенных вариантах осуществления комбинирования терапия, описанная в данном документе, снижает количество, число, содержание или процент клеток и/или раковых клеток на по меньшей мере 5%, на 10%, на по меньшей мере 15%, на по меньшей мере 20%, на по меньшей мере 25%, на по меньшей мере 30%, на по меньшей мере 35%, на по меньшей мере 40%, на по меньшей мере 45%, на по меньшей мере 50%, на по меньшей мере 55%, на по меньшей мере 60%, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95% или на по меньшей мере 99% у субъекта с антигеном (например, CD19) или в животной модели с таковым или при другом виде рака, ассоциированном с клетками, экспрессирующими антиген (например, экспрессирующими CD19), по сравнению с количеством, числом, содержанием или процентом клеток и/или раковых клеток у субъекта, лечение которого осуществляют клеткой, экспрессирующей CAR (например, экспрессирующей CAR для CD19), или ингибитором PD–1 в отдельности. В одном варианте осуществления субъектом является человек. В варианте осуществления субъектом является обезьяна, например, макак–крабоед.
В настоящем изобретении также предусмотрены способы предупреждения, лечения и/или контроля нарушения, например, нарушения, ассоциированного с клетками, экспрессирующими антиген (например, клетками, экспрессирующими CD19) (например, рака, описанного в данном документе), при этом способы предусматривают введение нуждающемуся субъекту клетки, экспрессирующей CAR (например, клетки, экспрессирующей CAR для CD19), или популяции клеток, экспрессирующей CAR, и ингибитора PD–1. В одном аспекте субъектом является человек.
В одном аспекте настоящее изобретение относится к способу подавления роста раковой клетки (например, раковой клетки, экспрессирующей антиген, например, экспрессирующей CD19), предусматривающему приведение раковой клетки в контакт с клеткой, экспрессирующей CAR (например, экспрессирующей CAR для CD19), например, CART–клеткой для CD19, описанной в данном документе, и одной или несколькими другими клетками, экспрессирующими CAR, например, описанными в данном документе, таким образом, что CART активируется в ответ на антиген и нацеливается на раковую клетку, при этом подавляется рост злокачественной опухоли. Клетку, экспрессирующую CAR, например, T–клетку, вводят в комбинации с PD–1, например, PD–1, описанным в данном документе.
В настоящем изобретении также предусмотрены способы предупреждения, лечения и/или контроля заболевания, например, заболевания, ассоциированного с клетками, экспрессирующими антиген (например, экспрессирующими CD19) (например, гематологического рака или атипичного рака, экспрессирующих антиген, например, CD19), при этом способы предусматривают введение нуждающемуся субъекту клетки, экспрессирующей CAR (например, экспрессирующей CAR для CD19), которая связывается с клеткой, экспрессирующей антиген, и введение ингибитора PD–1, описанного в данном документе. В одном аспекте субъектом является человек. Неограничивающие примеры нарушений, ассоциированных с клетками, экспрессирующими антиген (например, CD19), включают аутоиммунные нарушения (такие как волчанка), воспалительные нарушения (такие как виды аллергии и астму) и виды рака (такие как гематологические виды рака или атипичные виды рака, экспрессирующие антиген, например, CD19).
В настоящем изобретении также предусмотрены способы предупреждения, лечения и/или контроля заболевания, ассоциированного с клетками, экспрессирующими антиген (например, экспрессирующими CD19), при этом способы предусматривают введение нуждающемуся субъекту CART–клетки (например, CART–клетки к CD19) по настоящему изобретению, которая связывается с клеткой, экспрессирующей антиген (например, экспрессирующей CD19). В одном аспекте субъектом является человек.
В настоящем изобретении также предусмотрены способы предупреждения рецидива рака, например, ассоциированного с клетками, экспрессирующими антиген (например, экспрессирующими CD19), при этом способы предусматривают введение субъекту, нуждающемуся в этом, CART–клетки (например, CART–клетки к CD19) по настоящему изобретению, которая связывается с клеткой, экспрессирующей антиген (например, экспрессирующей CD19). В одном аспекте способы предусматривают введение субъекту, нуждающемуся в этом, эффективного количества CART–клетки (например, CART–клетки к CD19), описанной в данном документе, которая связывается с клеткой, экспрессирующей антиген (например, экспрессирующей CD19), в комбинации с эффективным количеством другого средства терапии, например, ингибитора PD–1.
Показания, не связанные с раком, например, ассоциированные с экспрессией антигена, например, CD19, включают без ограничения, например, аутоиммунное заболевание (например, волчанку), воспалительные нарушения (аллергию и астму) и трансплантацию.
Клетки, экспрессирующие CAR, описанные в данном документе, можно вводить как в отдельности, так и в виде фармацевтической композиции в комбинации с разбавителями и/или другими компонентами, такими как IL–2 или другие цитокины, или популяции клеток.
В некоторых вариантах осуществления клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), описанную в данном документе, используют для истощения популяции B–клеток (например, популяции B–клеток, например, регуляторных B–клеток). Не желая ограничиваться какой–либо теорией, считается, что истощение B–клеток, например, регуляторных B–клеток, может улучшить опухолевое микроокружение таким образом, что виды комбинированной терапии (например, виды комбинированной терапии, описанные в данном документе) могут быть более эффективными (например, чем без истощения B–клеток). Таким образом, в данном документе предусмотрен способ снижения, например, истощения регуляторных клеток (например, регуляторных B–клеток). Способ предусматривает введение клетки, экспрессирующей CAR (например, клетки, экспрессирующей CAR для CD19), описанной в данном документе, в количестве, достаточном для снижения регуляторных клеток. В некоторых вариантах осуществления можно применять способы для модуляции опухолевого микроокружения, например, для усиления эффективности терапии, описанной в данном документе.
Гематологические виды рака
Состояния, связанные с гематологическими видами рака, представляют собой типы рака, такие как лейкоз, лимфома и злокачественные лимфопролиферативные состояния, которые влияют на кровь, костный мозг и лимфатическую систему.
В одном варианте осуществления гематологическим раком является лейкоз. В одном варианте осуществления рак выбран из группы, состоящей из одного или нескольких острых лейкозов, в том числе без ограничения B–клеточного острого лимфобластного лейкоза (BALL), T–клеточного острого лимфобластного лейкоза (TALL), мелкоклеточной лимфоцитарной лимфомы (SLL), острого лимфобластного лейкоза (ALL); одного или нескольких хронических лейкозов, в том числе без ограничения хронического миелогенного лейкоза (CML), хронического лимфоцитарного лейкоза (CLL); дополнительных гематологических видов рака или гематологических состояний, в том числе без ограничения лимфомы из клеток мантийной зоны (MCL), B–клеточного пролимфоцитарного лейкоза, бластного плазмацитоидного дендритного клеточного новообразования, лимфомы Беркитта, диффузной B–крупноклеточной лимфомы, фолликулярной лимфомы, лейкоза ворсистых клеток, мелкоклеточной или крупноклеточной фолликулярной лимфомы, злокачественных лимфопролиферативных состояний, MALT–лимфомы, лимфомы маргинальной зоны, множественной миеломы, миелодисплазии и миелодиспластического синдрома, неходжкинской лимфомы, лимфомы Ходжкина, плазмобластной лимфомы, плазмоцитоидного дендритного клеточного новообразования, макроглобулинемии Вальденстрема и "предлейкоза", которые представляют собой различную совокупность гематологических состояний, объединенных неэффективным образованием (или дисплазией) миелоидных клеток крови. Заболевания, ассоциированные с экспрессией антигена, например, CD19, включают без ограничения атипичные и/или не являющиеся классическими виды рака, злокачественные новообразования, предраковые состояния или пролиферативные заболевания, экспрессирующие антиген, например, CD19; и любую их комбинацию.
Лейкоз может быть классифицирован как острый лейкоз и хронический лейкоз. Острый лейкоз может быть дополнительно классифицирован как острый миелогенный лейкоз (AML) и острый лимфобластный лейкоз (ALL). Хронический лейкоз включает хронический миелогенный лейкоз (CML) и хронический лимфоидный лейкоз (CLL). Другие родственные состояния включают миелодиспластические синдромы (MDS, ранее известные как "предлейкемия"), которые представляют собой разнообразную совокупность гематологических состояний, объединенных неэффективным образованием (или дисплазией) миелоидных клеток крови и риском трансформации в AML.
Лимфома представляет собой группу опухолей клеток крови, которые развиваются из лимфоцитов. Иллюстративные лимфомы включают неходжкинскую лимфому и лимфому Ходжкина.
В одном аспекте настоящее изобретение относится к способу лечения млекопитающего, имеющего лимфому Ходжкина, предусматривающему введение млекопитающему эффективного количества клеток, экспрессирующих молекулу CAR, например, молекулу CAR для CD19, например, молекулу CAR для CD19, описанную в данном документе, и ингибитор B–клеток.
В одном аспекте композиции и CART–клетки или NK–клетки, экспрессирующие CAR, по настоящему изобретению, являются особенно пригодными для лечения злокачественных новообразований B–клеток, таких как неходжкинские лимфомы, например, DLBCL, фолликулярная лимфома или CLL.
Неходжкинская лимфома (NHL) представляет собой группу злокачественных опухолей лимфоцитов, образованных либо из B–, либо из T–клеток. NHL возникают в любом возрасте и часто характеризуются лимфатическими узлами, которые больше, чем нормальные, потерей веса и лихорадкой. Различные типы NHL классифицируются как агрессивные (быстро растущие) и вялотекущие (медленно растущие) типы. B–клеточные неходжкинские лимфомы включают лимфому Беркитта, хронический лимфоцитарный лейкоз/мелкоклеточную лимфоцитарную лимфому (CLL/SLL), диффузную крупноклеточную B–лимфому (DLBCL), фолликулярную лимфому, иммунобластную крупноклеточную лимфому, В–лимфобластную лимфому из клеток–предшественников и лимфому из клеток мантийной зоны. Примеры T–клеточных неходжкинских лимфом включают фунгоидную гранулему, анапластическую крупноклеточную лимфому и T–лимфобластную лимфому из клеток–предшественников. Лимфомы, которые возникают после трансплантации костного мозга или стволовых клеток, как правило, представляют собой B–клеточные неходжкинские лимфомы. См., например, Maloney. NEJM. 366,21(2012):2008–16. В некоторых вариантах осуществления неходжкинские лимфомы, например, DLBCL, фолликулярная лимфома или CLL, могут характеризоваться высокой экспрессией PD–L1, которая может быть связана с неблагоприятными клиническими исходами.
Диффузная крупноклеточная B–лимфома (DLBCL) представляет собой форму NHL, которая развивается из B–клеток. DLBCL представляет собой агрессивную лимфому, которая может возникать в лимфатических узлах или за пределами лимфатической системы, например, в желудочно–кишечном тракте, семенниках, щитовидной железе, коже, молочной железе, кости или головном мозге. При DLBCL обычно наблюдаются три варианта клеточной морфологии: центробластный, иммунобластный и анапластический. Центробластная морфология является наиболее распространенной и характеризуется внешним видом лимфоцитов от среднего до крупного размера с минимальной цитоплазмой. Существует несколько подтипов DLBCL. Например, первичная лимфома центральной нервной системы представляет собой тип DLBCL, который поражает только головной мозг и лечится отлично от DLBCL, которая влияет на области за пределами головного мозга. Другой тип DLBCL представляет собой первичную медиастинальную B–клеточную лимфому, которая часто возникает у более молодых пациентов и быстро растет в грудной клетке. Симптомы DLBCL включают безболезненную быструю отечность в области шеи, подмышек или паха, которая вызвана увеличением лимфатических узлов. Для некоторых субъектов отечность может быть болезненной. Другие симптомы DLBCL включают ночную потливость, необъяснимую лихорадку и потерю веса. Несмотря на то, что большинство пациентов с DLBCL являются взрослыми, это заболевание иногда встречается у детей.
В некоторых вариантах осуществления подгруппы пациентов с DLBCL имеют изменения локуса PD–L1 и/или PD–L2. Например, изменения локусов PD–L1 и PD–L2 наблюдали у 19% пациентов, при этом 12% пациентов демонстрировали увеличение числа копий, 3% демонстрировали амплификации и 4% демонстрировали транслокации. В некоторых вариантах осуществления экспрессия PD–L1 может быть выявлена с помощью иммуногистохимического анализа (IHC) в образцах от пациентов, в том числе таковых с транслокациями или амплификациями локусов PD–L1 и PD–L2.
Генетические изменения могут также присутствовать при отличном от GCB (В–клетка зародышевого центра) подтипе DLBCL. В некоторых вариантах осуществления экспрессия PD–L1 может наблюдаться у пациентов с отличной от GCB DLBCL. В некоторых вариантах осуществления пациенты с отличной от GCB DLBCL напоминают пациентов с классической лимфомой Ходжкина (cHL) с точки зрения экспрессии или генетических изменений PD–L1/PD–L2.
Лечение DLBCL включает средства химиотерапии (например, циклофосфамид, доксорубицин, винкристин, преднизон, этопозид), противоопухолевые лекарственные средства (например, пиксантроп), антитела (например, ритуксан), схемы лечения, включающие антрациклин, облучение или трансплантаты стволовых клеток, например, аутологичный трансплантат стволовых клеток (ASCT) или аллогенный трансплантат гемопоэтических стволовых клеток (HSCT). В некоторых вариантах осуществления лечение DLBCL может включать виды комбинированной терапии, в том числе без ограничения R–CHOP (циклофосфамид, доксорубицин, винкристин, преднизон/преднизолон и ритуксимаб); R–ICE (ритуксимаб, ифосфамид, карбоплатин и этопозид); R–DHAP (ритуксимаб, дексаметазон, цитарабин и цисплатин); R–GDP (ритуксимаб, дексаметазон, гемцитабин и цисплатин); GemOX (гемцитабин и оксалиплатин) или HDCT (высокодозная химиотерапия) и ASCT.
Эти виды лечения, например, линии терапии, в случае DLBCL можно вводить в качестве терапии первой линии, терапии второй линии, терапии третьей линии или терапии четвертой линии. В некоторых вариантах осуществления лечение DLBCL может включать одну или несколько линий терапии, например, одну, две, три или четыре линии терапии. В некоторых вариантах осуществления виды лечения DLBCL могут включать любой один или несколько из видов лечения, раскрытых в данном документе, или их комбинации.
В некоторых вариантах осуществления терапия первой линии включает R–CHOP, R–ICE, R–DHAP, R–GDP, GemOx, ритуксимаб, HDCT и ASCT, пиксантроп, аллогенную HSCT, терапию CART (например, CAR CTL019, CTL119 или BCMA) или исследовательское средство. В некоторых вариантах осуществления терапия первой линии представляет собой R–CHOP.
В некоторых вариантах осуществления терапия второй линии включает R–CHOP, R–ICE, R–DHAP, R–GDP, GemOx, ритуксимаб, HDCT и ASCT, пиксантроп, аллогенную HSCT, терапию CART (например, CAR CTL019, CTL119 или BCMA) или исследовательское средство. В некоторых вариантах осуществления терапия второй линии включает R–ICE, R–DHAP, R–GDP, GemOx, ритуксимаб, HDCT и ASCT или исследовательские средства. В некоторых вариантах осуществления терапия второй линии представляет собой R–ICE, R–DHAP или R–GDP. В некоторых вариантах осуществления терапия второй линии представляет собой HDCT в комбинации с ASCT. В некоторых вариантах осуществления терапия второй линии представляет собой ритуксимаб. В некоторых вариантах осуществления терапия второй линии представляет собой GemOx. В некоторых вариантах осуществления терапия второй линии представляет собой исследовательское средство.
В некоторых вариантах осуществления терапия третьей линии включает R–CHOP, R–ICE, R–DHAP, R–GDP, GemOx, ритуксимаб, HDCT и ASCT, пиксантроп, аллогенную HSCT, терапию CART (например, CAR CTL019, CTL119 или BCMA) или исследовательское средство. В некоторых вариантах осуществления терапия третьей линии представляет собой пиксантроп. В некоторых вариантах осуществления терапия третьей линии представляет собой исследовательское средство. В некоторых вариантах осуществления терапия третьей линии представляет собой терапию CART (например, CAR CTL019, CTL119 или BCMA). В других вариантах осуществления терапия третьей линии представляет собой аллогенный HSCT.
В некоторых вариантах осуществления терапия четвертой линии включает R–CHOP, R–ICE, R–DHAP, R–GDP, GemOx, ритуксимаб, HDCT и ASCT, пиксантроп, аллогенную HSCT, терапию CART (например, CAR CTL019, CTL119 или BCMA) или исследовательское средство. В некоторых вариантах осуществления терапия четвертой линии включает исследовательское средство.
Приблизительно 60% пациентов отвечают на терапию первой линии, включающую ритуксимаб. В некоторых вариантах осуществления пациенты, которые получают более двух линий терапии, например, две, три или четыре линии терапии, имеют неблагоприятный прогноз. Пациенты, получающие R–DHAP и O–DHAP в качестве терапии второй линии, имеют медианную выживаемость без прогрессирования (PFS), составляющую 2,1 и 1,8 месяца соответственно, и медианную общую выживаемость (OS), составляющую 13,2 и 13,7 месяца соответственно. Пациенты, для которых резервная терапия является неэффективной, или которые имеют рецидив после аутологичного HSCT, имеют медианную OS, составляющую 4,4 месяца. OS в течение 1 года этих пациентов составляет 23%, а OS в течение 2 лет этих пациентов составляет 15,7%. Кроме того, отсутствует стандарт лечения в случае химиотерапии третьей линии, или в случае пациентов, для которых аутологичный трансплантат является неэффективным, или которые не соответствуют требованиям для его осуществления. Таким образом, существует неудовлетворенная потребность при r/r DLBCL.
Терапия CART потенциально может быть излечивающей, однако не для всех пациентов с r/r DLBCL. Несмотря на то, что терапия CART предлагает улучшенные исходы по сравнению с существующими видами терапии, приблизительно две трети пациентов с r/r DLBCL не будут иметь длительный ответ на терапию CART. Комбинация терапии CART и ингибиторов контрольных точек, например, антитела к PD–1 (например, пембролизумаба), может улучшить ответ у пациентов с r/r DLBCL.
В некоторых вариантах осуществления комбинация терапии CART (например, CAR CTL019, CTL119 или BCMA) с ингибитором контрольных точек, например, антителом к PD–1 (например, пембролизумабом), может быть использована в качестве терапии третьей линии. В некоторых вариантах осуществления комбинированная терапия может приводить к длительным частотам ответа, например, у пациентов с r/r DLBCL. В некоторых вариантах осуществления комбинированная терапия может продлевать персистенцию терапии CART (например, CAR CTL019, CTL119 или BCMA) в локализации опухоли (например, в крови, костном мозге или селезенке). В других вариантах осуществления комбинированная терапия может быть более эффективной, чем монотерапия CART, например, монотерапия CAR CTL019, CTL119 или BCMA. В некоторых вариантах осуществления комбинированная терапия может усиливать длительность ответа при восстановлении популяций нормальных T–клеток у субъекта, например, после лимфоистощения. В других вариантах осуществления антитело к PD–1 (например, пембролизумаб) может блокировать опосредованное PD–1 подавление спонтанного иммунного ответа. В некоторых вариантах осуществления субъект, получающий комбинированную терапию, имеет DLBCL, например, GCB или отличную от GCB DLBCL. В некоторых вариантах осуществления субъект с DLBCL, например, GCB или отличной от GCB DLBCL, может быть выбран для осуществления комбинированной терапии на основании экспрессии или генетических изменений PD–L1.
Фолликулярная лимфома, тип неходжкинской лимфомы, представляет собой лимфому В–клеток центра фолликула (центроцитов и центробластов), которая характеризуется по меньшей мере частичным фолликулярным паттерном. Клетки фолликулярной лимфомы экспрессируют B–клеточные маркеры CD10, CD19, CD20 и CD22. Клетки фолликулярной лимфомы обычно являются отрицательными в отношении CD5. Морфологически опухоль на основе фолликулярной лимфомы состоит из фолликулов, содержащих смесь центроцитов (также называемых рассеченными клетками или мелкими клетками центрального фолликула) и центробластов (также называемых крупными нерассеченными клетками или крупными клетками центрального фолликула). Фолликулы окружены клетками, не являющимися злокачественными, преимущественно T–клетками. Фолликулы содержат главным образом центроциты с незначительным количеством центробластов. Морфологические степени в соответствии с Всемирной организацией здравоохранения (ВОЗ) являются следующими: степень 1 (<5 центробластов в поле зрения при большом увеличении (hpf); степень 2 (6–15 центробластов/hpf); степень 3 (>15 центробластов/hpf). Степень 3 дополнительно подразделяют на следующие степени: степень 3A (центроциты все еще присутствуют); степень 3B (фолликул состоит почти целиком из центробластов).
Лечение фолликулярной лимфомы включает химиотерапию, например, алкилирующие средства, нуклеозидные аналоги, схемы лечения, включающие антрациклин, например, комбинированная терапия, называемая CHOP – циклофосфамид, доксорубицин, винкристин, преднизон/преднизолон, антитела (например, ритуксимаб), радиоиммунотерапию и трансплантацию гемопоэтических стволовых клеток.
CLL представляет собой злокачественное новообразование B–клеток, характеризующееся пролиферацией и накоплением неопластических клеток в костном мозге, крови, лимфатических узлах и селезенке. Средний возраст во время диагностирования CLL составляет приблизительно 65 лет. Современные виды лечения включают химиотерапию, лучевую терапию, биологическую терапию или трансплантацию костного мозга. Иногда симптомы лечат путем хирургического вмешательства (например, спленэктомическое удаление увеличенной селезенки) или с помощью лучевой терапии (например, циторедукция набухших лимфатических узлов). Химиотерапевтические средства для лечения CLL включают, например, флударабин, 2–хлордеоксиаденозин (кладрибин), хлорамбуцил, винкристин, пентостатин, циклофосфамид, алемтузумаб (кампат–1H), доксорубицин и преднизон. Биологическая терапия CLL включает антитела, например, алемтузумаб, ритуксимаб и офатумумаб; а также средства терапии на основе ингибиторов тирозинкиназы. Ряд критериев может быть использован для классификации стадии CLL, например, система Rai или Binet. В системе Rai описано, что CLL характеризуется наличием пяти стадий: стадия 0, при которой присутствует только лимфоцитоз; стадия I, при которой присутствует лимфаденопатия; стадия II, при которой присутствуют спленомегалия, лимфаденопатия или обе; стадия III, при которой присутствуют анемия, органомегалия или обе (прогрессирование определяется по потере веса, усталости, лихорадке, массивной органомегалии и быстро возрастающем содержании лимфоцитов); и стадия IV, при которой присутствуют анемия, тромбоцитопения, органомегалия или их комбинация. В соответствии с системой стадирования Binet существует три категории: стадия A, при которой присутствует лимфоцитоз и увеличены менее трети лимфатических узлов (эта стадия включает всех пациентов со стадией 0 в соответствии с Rai, половину пациентов со стадией I в соответствии с Rai и треть пациентов со стадией II в соответствии с Rai); стадия B, при которой вовлечены три или более лимфатических узла; и стадия C, при которой присутствуют анемия или тромбоцитопения или обе. Эти системы классификации можно комбинировать с измерениями мутации генов иммуноглобулинов для получения более точной характеристики состояния заболевания. Наличие подвергнутых мутации генов иммуноглобулинов коррелирует с улучшенным прогнозом.
В другом варианте осуществления клетки, экспрессирующие CAR, по настоящему изобретению, используют для лечения видов рака или лейкозов, например, с помощью лейкозных стволовых клеток. Например, лейкозные стволовые клетки представляют собой лейкозные клетки CD34+/CD38−.
Виды комбинированной терапии
Любой из способов, описанных в данном документе, может быть использован в комбинации с другими известными средствами и видами терапии.
Комбинацию, описанную в данном документе, например, клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), ингибитор PD–1, и по меньшей мере одно дополнительное терапевтическое средство можно вводить одновременно в той же или отдельных композициях, или последовательно. В случае последовательного введения клетку, экспрессирующую CAR, и/или ингибитор PD–1, описанные в данной документе, можно вводить после дополнительного терапевтического средства, или порядок введения может быть обратным, при этом дополнительное терапевтическое средство можно вводить после клетки, экспрессирующей CAR, и/или ингибитора PD–1, описанных в данном документе. В качестве альтернативы, дополнительное терапевтическое средство можно вводить между введением клетки, экспрессирующей CAR, и ингибитора PD–1.
В дополнительных аспектах комбинация, описанная в данном документе, например, клетка, экспрессирующая CAR (например, клетка, экспрессирующая CAR для CD19), и ингибитор PD–1, могут быть использованы для режима лечения в комбинации с хирургическим вмешательством, химиотерапией, облучением, иммунодепрессивными средствами, такими как циклоспорин, азатиоприн, метотрексат, микофенолат и FK506, антителами или другими иммунодеструктивными средствами, такими как CAMPATH, антитела к CD3 или другие средства терапии на основе антител, цитоксин, флударабин, циклоспорин, FK506, рапамицин, микофеноловая кислота, стероиды, FR901228, цитокины и облучение, пептидная вакцина, например, как описано в Izumoto et al. 2008 J Neurosurg 108:963–971.
В одном варианте осуществления комбинация, описанная в данном документе, например, клетка, экспрессирующая CAR (например, клетка, экспрессирующая CAR для CD19), и ингибитор PD–1, может быть использована в комбинации с химиотерапевтическим средством. Иллюстративные химиотерапевтические средства включают антрациклин (например, доксорубицин (например, липосомальный доксорубицин)), алкалоид барвинка (например, винбластин, винкристин, виндезин, винорелбин), алкалирующее средство (например, циклофосфамид, декарбазин, мелфалан, ифосфамид, темозоломид), антитело иммунной клетки (например, алемтузамаб, гемтузумаб, ритуксимаб, тозитумомаб), антиметаболит (в том числе, например, антагонисты фолиевой кислоты, пиримидиновые аналоги, пуриновые аналоги и ингибиторы аденозиндезаминазы (например, флударабин)), ингибитор mTOR, агонист белка, связанного с глюкокортикоид–индуцированным TNFR (GITR), ингибитор протеасомы (например, аклациномицин A, глиотоксин или бортезомиб), иммуномодулятор, такой как талидомид или производное талидомида (например, леналидомид).
Общие химиотерапевтические средства раскрыты на страницах 268–269 международной заявки WO 2016/164731, поданной 8 апреля 2016 г., которая включена посредством ссылки во всей своей полноте.
Иллюстративные алкилирующие средства раскрыты на страницах 270–271 международной заявки WO 2016/164731, поданной 8 апреля 2016 г., которая включена посредством ссылки во всей своей полноте.
Иллюстративные ингибиторы mTOR включают, например, темзиролимус; ридафоролимус (ранее известный как деферолимус, (1R,2R,4S)–4–[(2R)–2–[(1R,9S,12S,15R,16E,18R,19R,21R, 23S,24E,26E,28Z,30S,32S,35R)–1,18–дигидрокси–19,30–диметокси–15,17,21,23,29,35–гексаметил–2,3,10,14,20–пентаоксо–11,36–диокса–4–азатрицикло[30.3.1.04,9] гексатриаконта–16,24,26,28–тетраен–12–ил]пропил]–2–метоциклогексилдиметилфосфинат, также известный как AP23573 и MK8669, и описанный в публикации согласно PCT № WO 03/064383); эверолимус (Afinitor® или RAD001); рапамицин (AY22989, Sirolimus®); симапимод (CAS 164301–51–3); эмсиролимус, (5–{2,4–бис[(3S)–3–метилморфолин–4–ил]пиридо[2,3–d]пиримидин–7–ил}–2–метоксифенил)метанол (AZD8055); 2–амино–8–[транс–4–(2–гидроксиэтокси)циклогексил]–6–(6–метокси–3–пиридинил)–4–метилпиридо[2,3–d]пиримидин–7(8H)–он (PF04691502, CAS 1013101–36–4) и N2–[1,4–диоксо–4–[[4–(4–оксо–8–фенил–4H–1–бензопиран–2–ил)морфолиний–4–ил]метокси]бутил]–L–аргинилглицил–L–α–аспартил–L–серин–, внутреннюю соль (SEQ ID NO: 526) (SF1126, CAS 936487–67–1) и XL765.
Иллюстративные иммуномодуляторы включают, например, афутузумаб (доступный от Roche®); пэгфилграстим (Neulasta®); леналидомид (CC–5013, Revlimid®); талидомид (Thalomid®), актимид (CC4047) и IRX–2 (смесь человеческих цитокинов, в том числе интерлейкина 1, интерлейкина 2 и интерферона γ, CAS 951209–71–5, доступная от IRX Therapeutics).
Иллюстративные антрациклины включают, например, доксорубицин (Adriamycin® и Rubex®); блеомицин (lenoxane®); даунорубицин (даунорубицина гидрохлорид, дауномицина и рубидомицина гидрохлорид, Cerubidine®); липосомальный даунорубицин (липосомальный даунорубицина цитрат, DaunoXome®); митоксантрон (DHAD, Novantrone®); эпирубицин (Ellence™); идарубицин (Idamycin®, Idamycin PFS®); митомицин C (Mutamycin®); гельданамицин; гербимицин; равидомицин и дезацетилравидомицин.
Иллюстративные алкалоиды барвника включают, например, винорелбина тартрат (Navelbine®), винкристин (Oncovin®) и виндезин (Eldisine®)); винбластин (также известный как винбластина сульфат, винкалейкобластин и VLB, Alkaban–AQ® и Velban®) и винорелбин (Navelbine®).
Иллюстративные ингибиторы протеосом включают бортезомиб (Velcade®); карфилзомиб (PX–171–007, (S)–4–метил–N–((S)–1–(((S)–4–метил–1–((R)–2–метилоксиран–2–ил)–1–оксопентан–2–ил)амино)–1–оксо–3–фенилпропан–2–ил)–2–((S)–2–(2–морфолиноацетамидо)–4–фенилбутанамидо)–пентанамид); маризобим (NPI–0052); иксазомиба цитрат (MLN–9708); деланзомиб (CEP–18770) и O–метил–N–[(2–метил–5–тиазолил)карбонил]–L–серил–O–метил–N–[(1S)–2–[(2R)–2–метил–2–оксиранил]–2–оксо–1–(фениламетил)этил]–L–серинамид (ONX–0912).
В вариантах осуществления комбинацию, описанную в данном документе, например, клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), и ингибитор PD–1, вводят субъекту в комбинации с брентуксимабом. Брентуксимаб представляет собой конъюгат антитела и лекарственного средства, антитела к CD30 и монометилауристатина Е. В вариантах осуществления субъект имеет лимфому Ходжкина (HL), например, рецидивирующую или резистентную HL. В вариантах осуществления субъект имеет CD30+ HL. В вариантах осуществления субъект перенес операцию по введению аутологичного трансплантата стволовых клеток (ASCT). В вариантах осуществления субъект не перенес операцию по введению ASCT. В вариантах осуществления брентуксимаб вводят в дозе приблизительно 1–3 мг/кг (например, приблизительно 1–1,5, 1,5–2, 2–2,5 или 2,5–3 мг/кг), например, внутривенно, например, каждые 3 недели.
В вариантах осуществления комбинацию, описанную в данном документе, например, клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), и ингибитор PD–1, вводят субъекту в комбинации с брентуксимабом и дакарбазином или в комбинации с брентуксимабом и бендамустином. Дакарбазин представляет собой алкилирующее средство с химическим названием 5–(3,3–диметил–1–триазенил)имидазол–4–карбоксамид. Бендамустин представляет собой алкилирующее средство с химическим названием 4–[5–[бис(2–хлорэтил)амино]–1–метилбензимидазол–2–ил]бутановая кислота. В вариантах осуществления субъект имеет лимфому Ходжкина (HL). В вариантах осуществления субъект ранее не подвергался лечению с применением противоопухолевой терапии. В вариантах осуществления возраст субъекта составляет по меньшей мере 60 лет, например, 60, 65, 70, 75, 80, 85 лет или старше. В вариантах осуществления дакарбазин вводят в дозе приблизительно 300–450 мг/м2 (например, приблизительно 300–325, 325–350, 350–375, 375–400, 400–425 или 425–450 мг/м2), например, внутривенно. В вариантах осуществления бендамустин вводят в дозе приблизительно 75–125 мг/м2 (например, 75–100 или 100–125 мг/м2, например, приблизительно 90 мг/м2), например, внутривенно. В вариантах осуществления брентуксимаб вводят в дозе приблизительно 1–3 мг/кг (например, приблизительно 1–1,5, 1,5–2, 2–2,5 или 2,5–3 мг/кг), например, внутривенно, например, каждые 3 недели.
В некоторых вариантах осуществления клетку, экспрессирующую CAR, описанную в данном документе, вводят субъекту в комбинации с ингибитором CD20, например, антителом к CD20 (например, моно– или биспецифическим антителом к CD20) или его фрагментом. Иллюстративные антитела к CD20 включают без ограничения ритуксимаб, офатумумаб, окрелизумаб, велтузумаб, обинутузумаб, TRU–015 (Trubion Pharmaceuticals), окаратузумаб и Pro131921 (Genentech). См., например, Lim et al. Haematologica. 95.1(2010):135–43.
В некоторых вариантах осуществления антитело к CD20 включает ритуксимумаб. Ритуксимумаб представляет собой химерное мышиное/человеческое моноклональное антитело IgG1 каппа, которое связывается с CD20 и вызывает цитолиз клетки, экспрессирующей CD20, например, описанной в www.accessdata.fda.gov/drugsatfda_docs/label/2010/103705s5311lbl.pdf. В вариантах осуществления клетку, экспрессирующую CAR, описанную в данном документе, вводят субъекту в комбинации с ритуксимабом. В вариантах осуществления субъект имеет CLL или SLL.
В некоторых вариантах осуществления ритуксимаб вводят внутривенно, например, в виде внутривенной инфузии. Например, каждая инфузия предусматривает приблизительно 500–2000 мг (например, приблизительно 500–550, 550–600, 600–650, 650–700, 700–750, 750–800, 800–850, 850–900, 900–950, 950–1000, 1000–1100, 1100–1200, 1200–1300, 1300–1400, 1400–1500, 1500–1600, 1600–1700, 1700–1800, 1800–1900, или 1900–2000 мг) ритуксимаба. В некоторых вариантах осуществления ритуксимаб вводят в дозе от 150 мг/м2 до 750 мг/м2, например, приблизительно 150–175 мг/м2, 175–200 мг/м2, 200–225 мг/м2, 225–250 мг/м2, 250–300 мг/м2, 300–325 мг/м2, 325–350 мг/м2, 350–375 мг/м2, 375–400 мг/м2, 400–425 мг/м2, 425–450 мг/м2, 450–475 мг/м2, 475–500 мг/м2, 500–525 мг/м2, 525–550 мг/м2, 550–575 мг/м2, 575–600 мг/м2, 600–625 мг/м2, 625–650 мг/м2, 650–675 мг/м2 или 675–700 мг/м2, где м2 указывает площадь поверхности тела субъекта. В некоторых вариантах осуществления ритуксимаб вводят с интервалом дозирования, составляющим по меньшей мере 4 дня, например, 4, 7, 14, 21, 28, 35 дней или больше. Например, ритуксимаб вводят с интервалом дозирования, составляющим по меньшей мере 0,5 недели, например, 0,5, 1, 2, 3, 4, 5, 6, 7, 8 недель или больше. В некоторых вариантах осуществления ритуксимаб вводят в дозе и с интервалом дозирования, описанными в данном документе, в течение периода времени, например, по меньшей мере 2 недели, например, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 недель или больше. Например, ритуксимаб вводят в дозе и с интервалом дозирования, описанными в данном документе, в общей сложности по меньшей мере в 4 дозах на цикл лечения (например, по меньшей мере 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 или больше доз на цикл лечения).
В некоторых вариантах осуществления антитело к CD20 включает офатумумаб. Офатумумаб представляет собой человеческое моноклональное антитело IgG1κ к CD20 с молекулярной массой примерно 149 кДа. Например, офатумумаб получают с помощью трансгенной мыши и технологии гибридомы и экспрессируют и очищают из линии рекомбинантных клеток мыши (NS0). См., например, www.accessdata.fda.gov/drugsatfda_docs/label/2009/125326lbl.pdf и клиническое исследование с идентификационным номером NCT01363128, NCT01515176, NCT01626352, и NCT01397591. В вариантах осуществления клетку, экспрессирующую CAR, описанную в данном документе, вводят субъекту в комбинации с офатумумабом. В вариантах осуществления субъект имеет CLL или SLL.
В некоторых вариантах осуществления офатумумаб вводят в виде внутривенной инфузии. Например, каждая инфузия предусматривает приблизительно 150–3000 мг (например, приблизительно 150–200, 200–250, 250–300, 300–350, 350–400, 400–450, 450–500, 500–550, 550–600, 600–650, 650–700, 700–750, 750–800, 800–850, 850–900, 900–950, 950–1000, 1000–1200, 1200–1400, 1400–1600, 1600–1800, 1800–2000, 2000–2200, 2200–2400, 2400–2600, 2600–2800, или 2800–3000 мг) офатумумаба. В вариантах осуществления офатумумаб вводят в начальной дозе приблизительно 300 мг, затем 2000 мг, например, в течение приблизительно 11 доз, например, в течение 24 недель. В некоторых вариантах осуществления офатумумаб вводят с интервалом дозирования, составляющий по меньшей мере 4 дня, например, 4, 7, 14, 21, 28, 35 дней или больше. Например, офатумумаб вводят с интервалом дозирования, составляющий по меньшей мере 1 неделю, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 24, 26, 28, 20, 22, 24, 26, 28, 30 недель или больше. В некоторых вариантах осуществления офатумумаб вводят в дозе и с интервалом дозирования, описанными в данном документе, в течение периода времени, например, по меньшей мере 1 неделя, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 24, 26, 28, 30, 40, 50, 60 недель или больше, или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев или больше, или 1, 2, 3, 4, 5 лет или больше. Например, офатумумаб вводят в дозе и с интервалом дозирования, описанными в данном документе, в общей сложности по меньшей мере в 2 дозах на цикл лечения (например, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 18, 20, или больше доз на цикл лечения).
В некоторых случаях антитело к CD20 включает окрелизумаб. Окрелизумаб представляет собой моноклональное антитело к CD20, например, описанное в клинических исследованиях с идентификационными номерами NCT00077870, NCT01412333, NCT00779220, NCT00673920, NCT01194570, и Kappos et al. Lancet. 19.378(2011):1779–87.
В некоторых случаях антитело к CD20 включает велтузумаб. Велтузумаб представляет собой гуманизированное моноклональное антитело к CD20. См., например, клиническое исследование с идентификационным номером NCT00547066, NCT00546793, NCT01101581, и Goldenberg et al. Leuk Lymphoma. 51(5)(2010):747–55.
В некоторых случаях антитело к CD20 включает GA101. GA101 (также называемое обинутузумаб или RO5072759) представляет собой гуманизированное и полученное с помощью гликоинженерии моноклональное антитело к CD20. См., например, Robak. Curr. Opin. Investig. Drugs. 10.6(2009):588–96; клинические исследования с идентификационными номерами NCT01995669, NCT01889797, NCT02229422 и NCT01414205 и www.accessdata.fda.gov/drugsatfda_docs/label/2013/125486s000lbl.pdf.
В некоторых случаях антитело к CD20 включает AME–133v. AME–133v (также называемое LY2469298 или окаратузумаб) представляет собой гуманизированное моноклональное антитело IgG1 к CD20 с повышенной аффинностью в отношении рецептора FcγRIIIa и повышенной антителозависимой клеточной цитотоксической (ADCC) активностью по сравнению с ритуксимабом. См., например, Robak et al. BioDrugs 25.1(2011):13–25 и Forero–Torres et al. Clin Cancer Res. 18.5(2012):1395–403.
В некоторых случаях антитело к CD20 включает PRO131921. PRO131921 представляет собой гуманизированное моноклональное антитело к CD20, сконструированное для обеспечения более эффективного связывания с FcγRIIIa и повышенной ADCC по сравнению с ритуксимабом. См., например, Robak et al. BioDrugs 25.1(2011):13–25; Casulo et al. Clin Immunol. 154.1(2014):37–46 и клиническое исследование с идентификационным номером NCT00452127.
В некоторых случаях антитело к CD20 включает TRU–015. TRU–015 представляет собой слитый белок, действующий в отношении CD20, полученный из доменов антитела к CD20. TRU–015 является меньшим, чем моноклональные антитела, однако сохраняет Fc–опосредованные эффекторные функции. См., например, Robak et al. BioDrugs 25.1(2011):13–25. TRU–015 содержит одноцепочечный вариабельный фрагмент (scFv) антитела к CD20, связанный с шарнирной областью, доменами CH2 и CH3 IgG1 человека, однако не имеет доменов CH1 и CL.
В некоторых вариантах осуществления антитело к CD20, описанное в данном документе, конъюгируют или иным образом связывают с терапевтическим средством, например, химиотерапевтическим средством (например, цитоксаном, флударабином, ингибитором гистондеацетилазы, деметилирующим средством, пептидной вакциной, противоопухолевым антибиотиком, ингибитором тирозинкиназы, алкилирующим средством, ингибитором образования микротрубочек или антимитотическим средством), противоаллергическим средством, противотошнотным средством (или противорвотным средством), обезболивающим средством или цитопротекторным средством, описанными в данном документе.
В вариантах осуществления клетку, экспрессирующую CAR, описанную в данном документе, вводят субъекту в комбинации с ингибитором B–клеточной лимфомы 2 (BCL–2) (например, венетоклаксом, также называемым ABT–199 или GDC–0199) и/или ритуксимабом. В вариантах осуществления клетку, экспрессирующую CAR, описанную в данном документе, вводят субъекту в комбинации с венетоклаксом и ритуксимабом. Венетоклакс представляет собой малую молекулу, которая ингибирует антиапоптозный белок, BCL–2. Венетоклакс имеет химическое название: (4–(4–{[2–(4–хлорфенил)–4,4–диметилциклогекс–1–ен–1–ил]метил}пиперазин–1–ил)–N–({3–нитро–4–[(тетрагидро–2H–пиран–4–илметил)амино]фенил}сульфонил)–2–(1H–пирроло[2,3–b]пиридин–5–илокси)бензамид).
В вариантах осуществления субъект имеет CLL. В вариантах осуществления субъект имеет рецидивирующий CLL, например, субъекту ранее вводили противоопухолевую терапию. В вариантах осуществления венетоклакс вводят в дозе приблизительно 15–600 мг (например, 15–20, 20–50, 50–75, 75–100, 100–200, 200–300, 300–400, 400–500, или 500–600 мг), например, ежедневно. В вариантах осуществления ритуксимаб вводят в дозе приблизительно 350–550 мг/м2 (например, 350–375, 375–400, 400–425, 425–450, 450–475 или 475–500 мг/м2), например, внутривенно, например, раз в месяц.
В некоторых вариантах осуществления комбинацию, описанную в данном документе, например, клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), и ингибитор PD–1, вводят в комбинации с онколитическим вирусом. В вариантах осуществления онколитические вирусы способны избирательно реплицироваться в раковой клетке и вызывать ее гибель или замедление ее роста. В некоторых случаях онколитические вирусы не оказывают эффекта или оказывают минимальный эффект в отношении клеток, отличных от раковых. Онколитический вирус включает без ограничения онколитический аденовирус, онколитические вирусы простого герпеса, онколитические ретровирусы, онколитические парвовирусы, онколитический вирус осповакцины, онколитический вирус Синдбис, онколитический вирус гриппа или онколитический РНК–содержащий вирус (например, онколитический реовирус, онколитический вирус болезни Ньюкасла (NDV), онколитический вирус кори или онколитический вирус везикулярного стоматита (VSV)).
В некоторых вариантах осуществления онколитический вирус представляет собой вирус, например, рекомбинантный онколитический вирус, описанный в US2010/0178684 A1, который включен в данный документ посредством ссылки во всей своей полноте. В некоторых вариантах осуществления рекомбинантный онколитический вирус содержит последовательность нуклеиновой кислоты (например, гетерологичную последовательность нуклеиновой кислоты), кодирующей ингибитор иммунного или воспалительного ответа, например, описанный в US2010/0178684 A1, включенный в данный документ посредством ссылки во всей своей полноте. В некоторых вариантах осуществления рекомбинантный онколитический вирус, например, онколитический вирус NDV, содержит проапоптический белок (например, апоптин), цитокин (например, GM–CSF, интерферон гамма, интерлейкин 2 (IL–2), фактор некроза опухоли альфа), иммуноглобулин (например, антитело к фибронектину ED–B), опухолеассоциированный антиген, биспецифический адапторный белок (например, биспецифическое антитело или фрагмент антитела, направленные против белка HN NDV, T–клеточный костимуляторный рецептор, такой как CD3 или CD28; или слитый белок на основе IL–2 человека и одноцепочечного антитела, направленного против белка HN NDV). См., например, Zamarin et al. Future Microbiol. 7.3(2012):347–67, включенную в данный документ посредством ссылке во всей своей полноте. В некоторых вариантах осуществления онколитический вирус представляет собой химерный онколитический NDV, описанный в US 8591881 B2, US 2012/0122185 A1 или US 2014/0271677 A1, каждый из которых включен в данный документ посредством ссылки во всей своей полноте.
В некоторых вариантах осуществления онколитический вирус включает условно–репликативный аденовирус (CRAd), который разработан для репликации исключительно в раковых клетках. См., например, Alemany et al. Nature Biotechnol. 18(2000):723–27. В некоторых вариантах осуществления онколитический аденовирус представляет собой таковой, описанный в таблице 1 на странице 725 в Alemany et al., включенной в данный документ посредством ссылки во всей своей полноте.
Иллюстративные онколитические вирусы включают без ограничения следующие:
онколитический аденовирус группы B (ColoAd1) (PsiOxus Therapeutics Ltd.) (см., например, клиническое исследование с идентификационным номером NCT02053220); ONCOS–102 (ранее называемый CGTG–102), который представляет собой аденовирус, содержащий гранулоцитарно–макрофагальный колониестимулирующий фактор (GM–CSF) (Oncos Therapeutics) (см., например, клиническое исследование с идентификационным номером NCT01598129); VCN–01, который представляет собой генетически модифицированный онколитический аденовирус человека, кодирующий гиалуронидазу PH20 человека (VCN Biosciences, S.L.) (см., например, клинические исследования с идентификационными номерами NCT02045602 и NCT02045589);
условно–репликативный аденовирус ICOVIR–5, который представляет собой вирус, полученный из аденовируса дикого типа человека серотипа 5 (Had5), который был модифицирован для избирательной репликации в раковых клетках с нарушенной регуляцией пути ретинобластома/E2F (Institut Català d'Oncologia) (см., например, клиническое исследование с идентификационным номером NCT01864759); Celyvir, который содержит аутологичные мезенхимальные стволовые клетки, полученные из костного мозга (MSC), инфицированные ICOVIR5, онколитический аденовирус (Hospital Infantil Universitario  Мадрид, Испания/Ramon Alemany) (см., например, клиническое исследование с идентификационным номером NCT01844661); CG0070, который представляет собой условно–репликативный онколитический аденовирус серотипа 5 (Ad5), в котором промотор E2F–1 человека регулирует экспрессию важного гена вируса E1a, за счет чего обеспечивается ограничение вирусной репликации и цитотоксичности в дефектных в отношении Rb–пути опухолевых клетках (Cold Genesys, Inc.) (см., например, клиническое исследование с идентификационным номером NCT02143804); или DNX–2401 (ранее называемый Delta–24–RGD), который представляет собой аденовирус, который был сконструирован для избирательной репликации в дефектных в отношении пути ретинобластомы (Rb) клетках и для более эффективного инфицирования клеток, которые экспрессируют определенные связывающиеся с RGD интегрины (Clinica Universidad de Navarra, Universidad de Navarra/DNAtrix, Inc.) (см., например, клиническое исследование с идентификационным номером NCT01956734).
Мадрид, Испания/Ramon Alemany) (см., например, клиническое исследование с идентификационным номером NCT01844661); CG0070, который представляет собой условно–репликативный онколитический аденовирус серотипа 5 (Ad5), в котором промотор E2F–1 человека регулирует экспрессию важного гена вируса E1a, за счет чего обеспечивается ограничение вирусной репликации и цитотоксичности в дефектных в отношении Rb–пути опухолевых клетках (Cold Genesys, Inc.) (см., например, клиническое исследование с идентификационным номером NCT02143804); или DNX–2401 (ранее называемый Delta–24–RGD), который представляет собой аденовирус, который был сконструирован для избирательной репликации в дефектных в отношении пути ретинобластомы (Rb) клетках и для более эффективного инфицирования клеток, которые экспрессируют определенные связывающиеся с RGD интегрины (Clinica Universidad de Navarra, Universidad de Navarra/DNAtrix, Inc.) (см., например, клиническое исследование с идентификационным номером NCT01956734).
В некоторых вариантах осуществления онколитический вирус, описанный в данном документе, вводят с помощью инъекции, например, подкожной, внутриартериальной, внутривенной, внутримышечной, интратекальной или интраперитонеальной инъекций. В вариантах осуществления онколитический вирус, описанный в данном документе, вводят внутрь опухоли, трансдермально, трансмукозально, перорально, интраназально или посредством ингаляционного введения.
В варианте осуществления клетки, экспрессирующие CAR, описанные в данном документе, вводят субъекту в комбинации с молекулой, которая уменьшает популяцию Treg–клеток. Способы, которые снижают число (например, истощают) Treg–клеток, известны из уровня техники и включают, например, истощение CD25, введение циклофосфамида, модулирование функции GITR. Не желая ограничиваться какой–либо теорией, считается, что снижение числа Treg–клеток у субъекта до афереза или до введения клетки, экспрессирующей CAR, описанной в данном документе, снижает число нежелательных иммунных клеток (например, Treg) в опухолевом микроокружении и снижает риск рецидива у субъекта.
В одном варианте осуществления комбинацию, описанную в данном документе, например, клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), и ингибитор PD–1, вводят субъекту в комбинации с молекулой, нацеливающейся на GITR и/или модулирующей функции GITR, например, агонистом GITR и/или антителом к GITR, которое истощает регуляторные Т–клетки (Treg). В одном варианте осуществления молекулы, связывающие GITR, и/или молекулы, модулирующие функции GITR (например, агонист GITR и/или истощающие Treg антитела к GITR), вводят до введения клетки, экспрессирующей CAR. Например, в одном варианте осуществления агонист GITR можно вводить до афереза клеток. В одном варианте осуществления субъект имеет CLL. Иллюстративные агонисты GITR включают, например, слитые белки GITR и антитела к GITR (например, бивалентные антитела к GITR), такие как, например, слитый белок GITR, описанный в патенте США № 6111090, европейском патенте № 090505B1, патенте США № 8586023, публикациях согласно PCT №№ WO 2010/003118 и 2011/090754, или антитело к GITR описанное, например, в патенте США № 7025962, европейском патенте № 1947183B1, патенте США № 7812135, патенте США № 8388967, патенте США № 8591886, европейском патенте № EP 1866339, публикации согласно PCT № WO 2011/028683, публикации согласно PCT № WO 2013/039954, публикации согласно PCT № WO 2005/007190, публикации согласно PCT № WO 2007/133822, публикации согласно PCT № WO 2005/055808, публикации согласно PCT № WO 99/40196, публикации согласно PCT № WO 2001/03720, публикации согласно PCT № WO 99/20758, публикации согласно PCT № WO 2006/083289, публикации согласно PCT № WO 2005/115451, патенте США № 7618632 и публикации согласно PCT № WO 2011/051726.
В одном варианте осуществления комбинацию, описанную в данном документе, например, клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), и ингибитор PD–1, вводят субъекту в комбинации с ингибитором mTOR, например, ингибитором mTOR, описанным в данном документе, например, рапалогом, таким как эверолимус. В одном варианте осуществления ингибитор mTOR вводят до введения клетки, экспрессирующей CAR. Например, в одном варианте осуществления ингибитор mTOR можно вводить до афереза клеток. В одном варианте осуществления субъект имеет CLL.
В одном варианте осуществления комбинацию, описанную в данном документе, например, клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), и ингибитор PD–1, вводят субъекту в комбинации с агонистом GITR, например, агонистом GITR, описанным в данном документе. В одном варианте осуществления агонист GITR вводят до введения клетки, экспрессирующей CAR. Например, в одном варианте осуществления агонист GITR можно вводить до афереза клеток. В одном варианте осуществления субъект имеет CLL.
В одном варианте осуществления комбинацию, описанную в данном документе, например, клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), и ингибитор PD–1, вводят субъекту в комбинации с ингибитором протеинтирозинфосфатазы, например, ингибитором протеинтирозинфосфатазы, описанным в данном документе. В одном варианте осуществления ингибитор протеинтирозинфосфатазы представляет собой ингибитор SHP–1, например, ингибитор SHP–1, описанный в данном документе, такой как, например, стибоглюконат натрия. В одном варианте осуществления ингибитор протеинтирозинкиназы представляет собой ингибитор SHP–2.
В одном варианте осуществления клетка, экспрессирующая CAR, описанная в данном документе, может быть использована в комбинации с ингибитором киназы. В одном варианте осуществления ингибитор киназы представляет собой ингибитор CDK4, например, ингибитор CDK4, описанный в данной документе, например, ингибитор CDK4/6, такой как 6–ацетил–8–циклопентил–5–метил–2–(5–пиперазин–1–илпиридин–2–иламино)–8H–пиридо[2,3–d]пиримидин–7–он гидрохлорид (также называемый палбоциклиб или PD0332991). В одном варианте осуществления ингибитор киназы представляет собой ингибитор BTK, например, ингибитор BTK, описанный в данном документе, такой как, например, ибрутиниб. В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, например, ингибитор mTOR, описанный в данном документе, такой как, например, рапамицин, аналог рапамицина, OSI–027. Ингибитор mTOR может представлять собой, например, ингибитор mTORC1 и/или ингибитор mTORC2, например, ингибитор mTORC1 и/или ингибитор mTORC2, описанные в данной документе. В одном варианте осуществления ингибитор киназы представляет собой ингибитор MNK, например, ингибитор MNK, описанный в данном документе, такой как, например, 4–амино–5–(4–фторанилино)пиразоло[3,4–d]пиримидин. Ингибитор MNK может представлять собой, например, ингибитор MNK1a, MNK1b, MNK2a и/или MNK2b. В одном варианте осуществления ингибитор киназы представляет собой двойной ингибитор PI3K/mTOR, описанный в данном документе, такой как, например, PF–04695102.
В одном варианте осуществления ингибитор киназы представляет собой ингибитор CDK4, выбранный из алоизина A; флавопиридола или HMR–1275, 2–(2–хлорфенил)–5,7–дигидрокси–8–[(3S,4R)–3–гидрокси–1–метил–4–пиперидинил]–4–хроменона; кризотиниба (PF–02341066; 2–(2–хлорфенил)–5,7–дигидрокси–8–[(2R,3S)–2–(гидроксиметил)–1–метил–3–пирролидинил]–4H–1–бензопиран–4–он, гидрохлорида (P276–00); 1–метил–5–[[2–[5–(трифторметил)–1H–имидазол–2–ил]–4–пиридинил]окси]–N–[4–(трифторметил)фенил]–1H–бензиамидазол–2–амина (RAF265); индисулама (E7070); росковитина (CYC202); палбоциклиба (PD0332991); динациклиба (SCH727965); N–[5–[[(5–трет–бутилоксазол–2–ил)метил]тио]тиазол–2–ил]пиперидин–4–карбоксамида (BMS 387032); 4–[[9–хлор–7–(2,6–дифторфенил)–5H–пиримидо[5,4–d][2]бензазепин–2–ил]амино]бензойной кислоты (MLN8054); 5–[3–(4,6–дифтор–1H–бензиамидазол–2–ил)–1H–индазол–5–ил]–N–этил–4–метил–3–пиридинметанамина (AG–024322); 4–(2,6–дихлорбензоиламино)–1H–пиразол–3–карбоновой кислоты N–(пиперидин–4–ил)амида (AT7519); 4–[2–метил–1–(1–метилэтил)–1H–имидазол–5–ил]–N–[4–(метилсульфонил)фенил]–2–пиримидинамина (AZD5438) и XL281 (BMS908662).
В одном варианте осуществления ингибитор киназы представляет собой ингибитор CDK4, например, палбоциклиб (PD0332991), и палбоциклиб вводят в дозе приблизительно 50 мг, 60 мг, 70 мг, 75 мг, 80 мг, 90 мг, 100 мг, 105 мг, 110 мг, 115 мг, 120 мг, 125 мг, 130 мг, 135 мг (например, 75 мг, 100 мг или 125 мг) ежедневно в течение периода времени, например, ежедневно в течение 14–21 дня 28–дневного цикла или в течение 7–12 дней 21–дневного цикла. В одном варианте осуществления назначают 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или больше циклов.
В вариантах осуществления комбинацию, описанную в данном документе, например, клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), и ингибитор PD–1, вводят субъекту в комбинации с ингибитором циклинзависимой киназы (CDK) 4 или 6, например, ингибитором CDK4 или ингибитором CDK6, описанными в данном документе. В вариантах осуществления клетку, экспрессирующую CAR, описанную в данном документе, вводят субъекту в комбинации с ингибитором CDK4/6 (например, ингибитором, который нацеливается как на CDK4, так и на CDK6), например, ингибитором CDK4/6, описанным в данном документе. В варианте осуществления субъект имеет MCL. MCL представляет собой агрессивный рак, который слабо отвечает на современные доступные средства терапии, т. е. по сути является неизлечимым. Во многих случаях MCL в клетках MCL экспрессируется циклин D1 (регулятор CDK4/6) (например, в результате хромосомной транслокации, включающей гены иммуноглобулина и циклина D1). Таким образом, не ограничиваясь какой–либо теорией, считается, что клетки MCL являются высокочувствительными к ингибированию CDK4/6 при высокой специфичности (т. е. минимальном воздействии на нормальные иммунные клетки). Ингибиторы CDK4/6 в отдельности характеризовались некоторой эффективностью в лечении MCL, однако обеспечивали достижение лишь частичной ремиссии при высокой частоте рецидива. Иллюстративный ингибитор CDK4/6 представляет собой LEE011 (также называемый рибоциклибом), структура которого показана ниже.
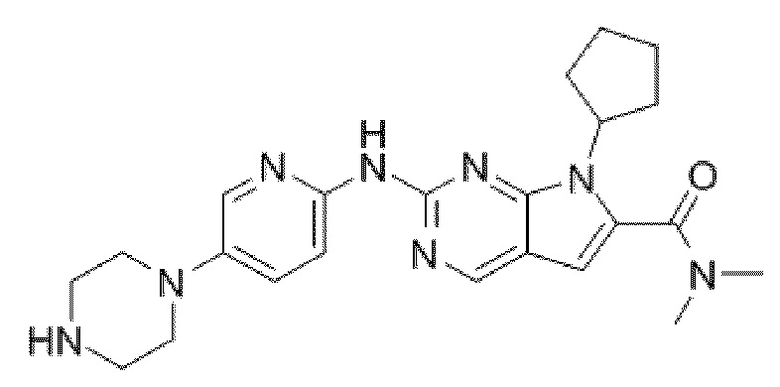
Не ограничиваясь какой–либо теорией, считается, что введение клетки, экспрессирующей CAR, описанной в данном документе, с ингибитором CDK4/6 (например, LEE011 или другим ингибитором CDK4/6, описанным в данном документе), может приводить к более высокому реагированию, например, при более высоких значениях частоты ремиссии и/или более низких значениях частоты рецидива, например, по сравнению с ингибитором CDK4/6 в отдельности.
В одном варианте осуществления ингибитор киназы представляет собой ингибитор BTK, выбранный из ибрутиниба (PCI–32765); GDC–0834; RN–486; CGI–560; CGI–1764; HM–71224; CC–292; ONO–4059; CNX–774; и LFM–A13. В предпочтительном варианте осуществления ингибитор BTK не снижает или не ингибирует киназную активность киназы, индуцируемой интерлейкином 2 (ITK), и является выбранным из GDC–0834; RN–486; CGI–560; CGI–1764; HM–71224; CC–292; ONO–4059; CNX–774; и LFM–A13.
В одном варианте осуществления ингибитор киназы представляет собой ингибитор BTK, например, ибрутиниб (PCI–32765). В вариантах осуществления клетку, экспрессирующую CAR, описанную в данном документе, вводят субъекту в комбинации с ингибитором BTK (например, ибрутинибом). В вариантах осуществления клетку, экспрессирующую CAR, описанную в данном документе, вводят субъекту в комбинации с ибрутинибом (также называемым PCI–32765). Ибрутиниб имеет химическое название: (1–[(3R)–3–[4–амино–3–(4–феноксифенил)–1H–пиразоло[3,4–d]пиримидин–1–ил]пиперидин–1–ил]проп–2–ен–1–он).
В вариантах осуществления субъект имеет CLL, лимфому из клеток мантийной зоны (MCL) или мелкоклеточную лимфоцитарную лимфому (SLL). Например, субъект имеет делецию в коротком плече хромосомы 17 (del(17p), например, в лейкозной клетке). В других примерах субъект не имеет del(17p). В вариантах осуществления субъект имеет рецидивирующие CLL или SLL, например, субъекту ранее вводили противоопухолевую терапию (например, ранее вводили одно, два, три или четыре предшествующих противоопухолевых средства терапии). В вариантах осуществления субъект имеет резистентные CLL или SLL. В других вариантах осуществления субъект имеет фолликулярную лимфому, например, рецидивирующую или резистентную фолликулярную лимфому. В некоторых вариантах осуществления ибрутиниб вводят в дозе приблизительно 300–600 мг/день (например, приблизительно 300–350, 350–400, 400–450, 450–500, 500–550, или 550–600 мг/день, например, приблизительно 420 мг/день или приблизительно 560 мг/день), например, перорально. В вариантах осуществления ирутиниб вводят в дозе приблизительно 250 мг, 300 мг, 350 мг, 400 мг, 420 мг, 440 мг, 460 мг, 480 мг, 500 мг, 520 мг, 540 мг, 560 мг, 580 мг, 600 мг (например, 250 мг, 420 мг или 560 мг) ежедневно в течение периода времени, например, ежедневно в течение 21–дневного цикла или ежедневно в течение 28–дневного цикла. В одном варианте осуществления назначают 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или больше циклов ибрутиниба.
В некоторых вариантах осуществления ибрутиниб вводят в комбинации с ритуксимабом. См., например, Burger et al. (2013) Ibrutinib In Combination With Rituximab (iR) Is Well Tolerated and Induces a High Rate Of Durable Remissions In Patients With High–Risk Chronic Lymphocytic Leukemia (CLL): New, Updated Results Of a Phase II Trial In 40 Patients, тезисы доклада 675, представленные на 55–ом ежегодном собрании и выставке ASH, Новый Орлеан, Луизиана, 7–10 декабря. Не ограничиваясь какой–либо теорией, считается, что добавление ибрутиниба усиливает пролиферативный ответ T–клеток и может смещать T–клетки от фенотипа T–хелпера 2 (Th2) к T–хелперу 1 (Th1). Th1 и Th2 представляют собой фенотипы хелперных T–клеток, при этом Th1 и Th2 регулируют различные пути иммунных ответов. Фенотип Th1 ассоциирован с провоспалительными ответами, например, в случае уничтожения клеток, таких как внутриклеточные патогены/вирусы или раковые клетки, или сохранения аутоиммунных ответов. Фенотип Th2 ассоциирован с накоплением эозинофилов и противовоспалительными ответами.
В некоторых вариантах осуществления способов, вариантов применения и композиций в данном документе ингибитор BTK представляет собой ингибитор BTK, описанный в международной заявке WO/2015/079417, которая включена в данный документ посредством ссылки во всей своей полноте. Например, в некоторых вариантах осуществления ингибитор BTK представляет собой соединение формулы (I) или его фармацевтически приемлемую соль:
где
R1 представляет собой водород, C1–C6алкил, необязательно замещенный гидрокси;
R2 представляет собой водород или галоген;
R3 представляет собой водород или галоген;
R4 представляет собой водород;
R5 представляет собой водород или галоген;
или R4 и R5 присоединены друг к другу и обозначают связь, –CH2–, –CH2–CH2–, –CH=CH–, –CH=CH–CH2–; –CH2–CH=CH– или –CH2–CH2–CH2–;
R6 и R7 обозначают независимо друг от друга H, C1–C6алкил, необязательно замещенный гидрокси, C3–C6циклоалкил, необязательно замещенный галогеном или гидрокси или галоген;
R8, R9, R, R', R10 и R11 обозначают независимо друг от друга H или C1–C6алкил, необязательно замещенный C1–C6алкокси; или любые два из R8, R9, R, R', R10 и R11 вместе с атомом углерода, к которому они присоединены, могут образовывать 3–6–членное насыщенное карбоциклическое кольцо;
R12 представляет собой водород или C1–C6алкил, необязательно замещенный галогеном или C1–C6алкокси;
или R12 и любой из R8, R9, R, R', R10 или R11 вместе с атомами, к которым они присоединены, могут образовывать 4–, 5–, 6– или 7–членное азациклическое кольцо, при этом кольцо может быть необязательно замещено галогеном, циано, гидроксилом, C1–C6алкилом или C1–C6алкокси;
n представляет собой 0 или 1; и
R13 представляет собой C2–C6алкенил, необязательно замещенный C1–C6алкилом, C1–C6алкокси или N,N–ди–C1–C6алкиламино; C2–C6алкинил, необязательно замещенный C1–C6алкилом или C1–C6алкокси; или C2–C6алкенилоксид, необязательно замещенный C1–C6алкилом.
В некоторых вариантах осуществления ингибитор BTK формулы I выбран из N–(3–(5–((1–акрилоилазетидин–3–ил)окси)–6–аминопиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; (E)–N–(3–(6–амино–5–((1–(бут–2–еноил)азетидин–3–ил)окси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; N–(3–(6–амино–5–((1–пропиолоилазетидин–3–ил)окси)пиримидин–4–ил)–5–фтор–2–метелифенил)–4–циклопропил–2–фторбензамида; N–(3–(6–амино–5–((1–(бут–2–иноил)азетидин–3–ил)окси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; N–(3–(5–((1–акрилоилпиперидин–4–ил)окси)–6–аминопиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; N–(3–(6–амино–5–(2–(N–метилакриламидо)этокси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; (E)–N–(3–(6–амино–5–(2–(N–метилбут–2–енамидо)этокси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; N–(3–(6–амино–5–(2–(N–метилпропиламидо)этокси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; (E)–N–(3–(6–амино–5–(2–(4–метокси–N–метилбут–2–инамидо)этокси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; N–(3–(6–амино–5–(2–(N–метилбут–2–енамидо)этокси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; N–(2–((4–амино–6–(3–(4–циклопропил–2–бензамидо)–5–фтор–2–метилфенил)пиримидин–5–ил)окси)этил)–N–метилоксиран–2–карбоксамида; N–(2–((4–амино–6–(3–(6–циклопропил–8–фтор–1–оксоизохинолин–2(1H)–ил)фенил)пиримидин–5–ил)окси)этил)–N–метилакриламида; N–(3–(5–(2–акриламидоэтокси)–6–аминопиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; N–(3–(6–амино–5–(2–(N–этилакриламидо)этокси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; N–(3–(6–амино–5–(2–(N–(2–фторэтил)акриламидо)этокси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; N–(3–(5–((1–акриламдоциклопропил)метокси)–6–аминопиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; (S)–N–(3–(5–(2–акриламидопропокси)–6–аминопиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; (S)–N–(3–(6–амино–5–(2–(бут–2–инамидо)пропокси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; (S)–N–(3–(6–амино–5–(2–(N–метилакриламидо)пропокси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; (S)–N–(3–(6–амино–5–(2–(N–метилбут–2–инамидо)пропокси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; N–(3–(6–амино–5–(3–(N–метилакриламидо)пропокси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; (S)–N–(3–(5–((1–акрилоилпирролидин–2–ил)метокси)–6–аминопиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; (S)–N–(3–(6–амино–5–((1–(бут–2–иноил)пирролидин–2–ил)метокси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; (S)–2–(3–(5–((1–акрилоилпирролидин–2–ил)метокси)–6–аминопиримидин–4–ил)–5–фтор–2–(гидроксиметил)фенил)–6–циклопропил–3,4–дигидроизохинолин–1(2H)–она; N–(2–((4–амино–6–(3–(6–циклопропил–1–оксо–3,4–дигидроизохинолин–2(1H)–ил)–5–фтор–2–(гидроксиметил)фенил)пиримидин–5–ил)окси)этил)–N–метилакриламида; N–(3–(5–(((2S,4R)–1–акролоил–4–метоксипирролидин–2–ил)метокси)–6–аминопиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; N–(3–(6–амино–5–(((2S,4R)–1–(бут–2–иноил)–4–метоксипирролидин–2–ил)метокси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; 2–(3–(5–(((2S,4R)–1–акрилоил–4–метоксипирролидин–2–ил)метокси)–6–аминопиримидин–4–ил)–5–фтор–2–(гидроксиметил)фенил)–6–циклопропил–3,4–дигидроизохинолин–1(2H)–она; N–(3–(5–(((2S,4S)–1–акрилоил–4–метоксипирролидин–2–ил)метокси)–6–аминопиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; N–(3–(6–амино–5–(((2S,4S)–1–(бут–2–иноил)–4–метоксипирролидин–2–ил)метокси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; N–(3–(5–(((2S,4R)–1–акрилоил–4–фторпирролидин–2–ил)метокси)–6–аминопиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; N–(3–(6–амино–5–(((2S,4R)–1–(бут–2–иноил)–4–фторпирролидин–2–ил)метокси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; (S)–N–(3–(5–((1–акрилоидазетидин–2–ил)метокси)–6–аминопиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; (S)–N–(3–(6–амино–5–((1–пропиолоилазетидин–2–ил)метокси)пиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; (S)–2–(3–(5–((1–акрилоилазетидин–2–ил)метокси)–6–аминопиримидин–4–ил)–5–фтор–2–(гидроксиметил)фенил)–6–циклопропил–3,4–дигидроизохинолин–1(2H)–она; (R)–N–(3–(5–((1–акрилоилазетидин–2–ил)метокси)–6–аминопиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; (R)–N–(3–(5–((1–акрилоилпиперидин–3–ил)метокси)–6–аминопиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; N–(3–(5–(((2R,3S)–1–акрилоил–3–метоксипирролидин–2–ил)метокси)–6–аминопиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида; N–(3–(5–(((2S,4R)–1–акрилоил–4–цианопирролидин–2–ил)метокси)–6–аминопиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида или N–(3–(5–(((2S,4S)–1–акрилоил–4–цианопирролидин–2–ил)метокси)–6–аминопиримидин–4–ил)–5–фтор–2–метилфенил)–4–циклопропил–2–фторбензамида.
Если не предусмотрено иное, химические термины, используемые выше при описании ингибитора BTK формулы I, используют в соответствии с их значениями, изложенными в международной заявке WO/2015/079417, которая включена в данный документ посредством ссылки во всей своей полноте.
В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, выбранный из темзиролимуса; ридафоролимуса (1R,2R,4S)–4–[(2R)–2– [(1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28Z,30S,32S,35R)– 1,18–дигидрокси–19,30–диметокси–15,17,21,23,29,35–гексаметил –2,3,10,14,20–пентаоксо–11,36–диокса–4– азатрицикло[30.3.1.04,9]гексатриаконта–16,24,26,28–тетраен–12– ил]пропил]–2–метоксициклогексилдиметилфосфината, также известного как AP23573 и MK8669; эверолимуса (RAD001); рапамицина (AY22989); симапимода; (5–{2,4–бис[(3S)–3–метилморфолин–4–ил]пиридо[2,3–d]пиримидин–7–ил}–2–метоксифенил)метанола (AZD8055); 2–амино–8–[транс–4–(2–гидроксиэтокси)циклогексил]–6–(6–метокси–3–пиридинил)–4–метилпиридо[2,3–d]пиримидин–7(8H)–она (PF04691502) и N2–[1,4–диоксо–4–[[4–(4–оксо–8–фенил–4H–1–бензопиран–2–ил)морфолиний–4–ил]метокси]бутил]–L–аргинилглицил–L–α–аспартил–L–серина–, внутренней соли (SEQ ID NO: 526) (SF1126) и XL765.
В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, например, рапамицин, и рапамицин вводят в дозе приблизительно 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг (например, 6 мг) ежедневно в течение периода времени, например, ежедневно в течение 21–дневного цикла или ежедневно в течение 28–дневного цикла. В одном варианте осуществления назначают 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или больше циклов рапамицина. В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, например, эверолимус, и эверолимус вводят в дозе приблизительно 2 мг, 2,5 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг (например, 10 мг) ежедневно в течение периода времени, например, ежедневно в течение 28–дневного цикла. В одном варианте осуществления назначают 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или больше циклов эверолимуса.
В одном варианте осуществления ингибитор киназы представляет собой ингибитор MNK, выбранный из CGP052088; 4–амино–3–(п–фторфениламино)пиразоло[3,4–d]пиримидина (CGP57380); церкоспорамида; ETC–1780445–2 и 4–амино–5–(4–фторанилино)пиразоло[3,4–d]пиримидина.
В одном варианте осуществления ингибитор киназы представляет собой двойной ингибитор фосфатидилинозитол–3–киназы (PI3K) и mTOR, выбранный из 2–амино–8–[транс–4–(2–гидроксиэтокси)циклогексил]–6–(6–метокси–3–пиридинил)–4–метилпиридо[2,3–d]пиримидин–7(8H)–она (PF–04691502); N–[4–[[4–(диметиламино)–1–пиперидинил]карбонил]фенил]–N'–[4–(4,6–ди–4–морфолинил–1,3,5–триазин–2–ил)фенил]мочевины (PF–05212384, PKI–587); 2–метил–2–{4–[3–метил–2–оксо–8–(хинолин–3–ил)–2,3–дигидро–1H–имидазо[4,5–c]хинолин–1–ил]фенил}пропаннитрила (BEZ–235); апитолизиба (GDC–0980, RG7422); 2,4–дифтор–N–{2–(метилокси)–5–[4–(4–пиридазинил)–6–хинолинил]–3–пиридинил}бензолсульфонамида (GSK2126458); 8–(6–метоксипиридин–3–ил)–3–метил–1–(4–(пиперазин–1–ил)–3–(трифтометил)фенил)–1H–имидазо[4,5–c]хинолин–2(3H)–она малеиновой кислоты (NVP–BGT226); 3–[4–(4–морфолинилпиридо[3',2':4,5]фуро[3,2–d]пиримидин–2–ил]фенола (PI–103); 5–(9–изопропил–8–метил–2–морфолино–9H–пурин–6–ил)пиримидин–2–амина (VS–5584, SB2343) и N–[2–[(3,5–диметоксифенил)амино]хиноксалин–3–ил]–4–[(4–метил–3–метоксифенил)карбонил]аминофенилсульфонамида (XL765).
В одном варианте осуществления ингибитор киназы представляет собой ингибитор MNK, выбранный из CGP052088; 4–амино–3–(п–фторфениламино)пиразоло[3,4–d]пиримидина (CGP57380); церкоспорамида; ETC–1780445–2 и 4–амино–5–(4–фторанилино)пиразоло[3,4–d]пиримидина.
В вариантах осуществления комбинацию, описанную в данном документе, например, клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), и ингибитор PD–1, вводят субъекту в комбинации с ингибитором фосфоинозитид–3–киназы (PI3K) (например, ингибитором PI3K, описанным в данном документе, например, иделализибом или дувелизибом) и/или ритуксимабом. В вариантах осуществления клетку, экспрессирующую CAR, описанную в данном документе, вводят субъекту в комбинации с иделализибом и ритуксимабом. В вариантах осуществления клетку, экспрессирующую CAR, описанную в данном документе, вводят субъекту в комбинации с дувелизибом и ритуксимабом. Иделализиб (также называемый GS–1101 или CAL–101; Gilead) представляет собой малую молекулу, которая блокирует дельта–изоформу PI3K. Иделализиб имеет химическое название: (5–фтор–3–фенил–2–[(1S)–1–(7H–пурин–6–иламино)пропил]–4(3H)–хиназолинон).
Дувелизиб (также называемый IPI–145; Infinity Pharmaceuticals и Abbvie) представляет собой малую молекулу, которая блокирует PI3K–δ,γ. Дувелизиб имеет химическое название (8–хлор–2–фенил–3–[(1S)–1–(9H–пурин–6–иламино)этил]–1(2H)–изохинолинон).
В вариантах осуществления субъект имеет CLL. В вариантах осуществления субъект имеет рецидивирующий CLL, например, субъекту ранее вводили противоопухолевую терапию (например, ранее вводили антитело к CD20 или ранее вводили ибрутиниб). Например, субъект имеет делецию в коротком плече хромосомы 17 (del(17p), например, в лейкозной клетке). В других примерах субъект не имеет del(17p). В вариантах осуществления субъект содержит лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В других вариантах осуществления субъект не содержит лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В вариантах осуществления субъект имеет делецию в длинном плече хромосомы 11 (del(11q)). В других вариантах осуществления субъект не имеет del(11q). В вариантах осуществления иделализиб вводят в дозе приблизительно 100–400 мг (например, 100–125, 125–150, 150–175, 175–200, 200–225, 225–250, 250–275, 275–300, 325–350, 350–375, или 375–400 мг), например, BID. В вариантах осуществления дувелизиб вводят в дозе приблизительно 15–100 мг (например, 15–25, 25–50, 50–75, или 75–100 мг), например, два раза в день. В вариантах осуществления ритуксимаб вводят в дозе приблизительно 350–550 мг/м2 (например, 350–375, 375–400, 400–425, 425–450, 450–475, или 475–500 мг/м2), например, внутривенно.
В одном варианте осуществления ингибитор киназы представляет собой двойной ингибитор фосфатидилинозитол–3–киназы (PI3K) и mTOR, выбранный из 2–амино–8–[транс–4–(2–гидроксиэтокси)циклогексил]–6–(6–метокси–3–пиридинил)–4–метилпиридо[2,3–d]пиримидин–7(8H)–она (PF–04691502); N–[4–[[4–(диметиламино)–1–пиперидинил]карбонил]фенил]–N'–[4–(4,6–ди–4–морфолинил–1,3,5–триазин–2–ил)фенил]мочевины (PF–05212384, PKI–587); 2–метил–2–{4–[3–метил–2–оксо–8–(хинолин–3–ил)–2,3–дигидро–1H–имидазо[4,5–c]хинолин–1–ил]фенил}пропаннитрила (BEZ–235); апитолизиба (GDC–0980, RG7422); 2,4–дифтор–N–{2–(метилокси)–5–[4–(4–пиридазинил)–6–хинолинил]–3–пиридинил}бензолсульфонамида (GSK2126458); 8–(6–метоксипиридин–3–ил)–3–метил–1–(4–(пиперазин–1–ил)–3–(трифтометил)фенил)–1H–имидазо[4,5–c]хинолин–2(3H)–она малеиновой кислоты (NVP–BGT226); 3–[4–(4–морфолинилпиридо[3',2':4,5]фуро[3,2–d]пиримидин–2–ил]фенола (PI–103); 5–(9–изопропил–8–метил–2–морфолино–9H–пурин–6–ил)пиримидин–2–амина (VS–5584, SB2343) и N–[2–[(3,5–диметоксифенил)амино]хиноксалин–3–ил]–4–[(4–метил–3–метоксифенил)карбонил]аминофенилсульфонамида (XL765).
В вариантах осуществления клетку, экспрессирующую CAR, описанную в данном документе, вводят субъекту в комбинации с ингибитором киназы анапластической лимфомы (ALK). Иллюстративные киназы ALK включают без ограничения кризотиниб (Pfizer), церетиниб (Novartis), алектиниб (Chugai), бригатиниб (также называемый AP26113; Ariad), энтректиниб (Ignyta), PF–06463922 (Pfizer), TSR–011 (Tesaro) (см., например, клиническое исследования с идентификационным номером NCT02048488), CEP–37440 (Teva) и X–396 (Xcovery). В некоторых вариантах осуществления субъект имеет солидный рак, например, солидный рак, описанный в данном документе, например, рак легкого.
Химическое название кризотиниба представляет собой 3–[(1R)–1–(2,6–дихлор–3–фторфенил)этокси]–5–(1–пиперидин–4–илпиразол–4–ил)пиридин–2–амин. Химическое название церитиниба представляет собой 5–хлор–N2–[2–изопропокси–5–метил–4–(4–пиперидинил)фенил]–N4–[2–(изопропилсульфонил)фенил]–2,4–пиримидиндиамин. Химическое название алектиниба представляет собой 9–этил–6,6–диметил–8–(4–морфолинопиперидин–1–ил)–11–оксо–6,11–дигидро–5H–бензо[b]карбазол–3–карбонитрил. Химическое название бригатиниба представляет собой 5–хлор–N2–{4–[4–(диметиламино)–1–пиперидинил]–2–метоксифенил}–N4–[2–(диметилфосфорил)фенил]–2,4–пиримидиндиамин. Химическое название энтректиниба представляет собой N–(5–(3,5–дифторбензил)–1H–индазол–3–ил)–4–(4–метилпиперазин–1–ил)–2–((тетрагидро–2H–пиран–4–ил)амино)бензамид. Химическое название PF–06463922 представляет собой (10R)–7–амино–12–фтор–2,10,16–триметил–15–оксо–10,15,16,17–тетрагидро–2H–8,4–(метено)пиразоло[4,3–h][2,5,11]–бензоксадиазациклотетрадецин–3–карбонитрил. Химическая структура CEP–37440 представляет собой (S)–2–((5–хлор–2–((6–(4–(2–гидроксиэтил)пиперазин–1–ил)–1–метокси–6,7,8,9–тетрагидро–5H–бензо[7]аннулен–2–ил)амино)пиримидин–4–ил)амино)–N–метилбензамид. Химическое название X–396 представляет собой (R)–6–амино–5–(1–(2,6–дихлор–3–фторфенил)этокси)–N–(4–(4–метилпиперазин–1–карбонил)фенил)пиридазин–3–карбоксамид.
Также могут быть использованы лекарственные средства, которые ингибируют как кальцийзависимую фосфатазу кальцинейрин (циклоспорин и FK506), так и киназу p70S6, которая является важной для передачи сигнала, индуцированной фактором роста (рапамицин). (Liu et al., Cell 66:807–815, 1991; Henderson et al., Immun. 73:316–321, 1991; Bierer et al., Curr. Opin. Immun. 5:763–773, 1993). В дополнительном аспекте композиции на основе клеток по настоящему изобретению можно вводить пациенту в сочетании (например, до, одновременно или после) с трансплантацией костного мозга, Т–клеточной абляционной терапией с помощью химиотерапевтических средств, таких как флударабин, наружной дистанционной лучевой терапией (XRT), циклофосфамидом и/или антителами, такими как OKT3 или CAMPATH. В одном аспекте композиции на основе клеток по настоящему изобретению вводят после B–клеточной абляционной терапии, такой как средства, которые вступают в реакцию с CD20, например, ритуксан. Например, в одном варианте осуществления субъекты могут подвергаться стандартному лечению посредством высокодозной химиотерапии с последующей трансплантацией стволовых клеток периферической крови. В определенных вариантах осуществления после трансплантата субъекты получают инфузию размноженных иммунных клеток по настоящему изобретению. В дополнительном варианте осуществления размноженные клетки вводят до или после хирургического вмешательства.
В вариантах осуществления комбинацию, описанную в данном документе, например, клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), и ингибитор PD–1, вводят субъекту в комбинации с ингибитором индоламин–2,3–диоксигеназы (IDO). IDO представляет собой фермент, который катализирует разрушение аминокислоты L–триптофан до кинуренина. Многие злокачественные опухоли сверхэкспрессируют IDO, например, рак предстательной железы, колоректальный рак, рак поджелудочной железы, рак шейки матки, рак желудка, рак яичников, рак головы и рак легкого. pDC, макрофаги и дендритные клетки (DC) могут экспрессировать IDO. Не ограничиваясь какой–либо теорией, считается что снижение уровня L–триптофана (например, катализируемое IDO) приводит к иммунодепрессивному окружению в результате анергии и апоптоза Т–клеток. Таким образом, не ограничиваясь какой–либо теорией, считается, что ингибитор IDO может усиливать эффективность клетки, экспрессирующей CAR, описанной в данном документе, например, в результате снижения подавления или гибели иммунной клетки, экспрессирующей CAR. В вариантах осуществления субъект имеет солидную опухоль, например, солидную опухоль, описанную в данном документе, например, рак предстательной железы, колоректальный рак, рак поджелудочной железы, рак шейки матки, рак желудка, рак яичников, рак головы и рак легкого. Иллюстративные ингибиторы IDO включают без ограничения 1–метилтриптофан, индоксимод (NewLink Genetics) (см., например, клиническое исследование с идентификационными номерами NCT01191216; NCT01792050) и INCB024360 (Incyte Corp.) (см., например, клиническое исследование с идентификационными номерами NCT01604889; NCT01685255).
В вариантах осуществления комбинацию, описанную в данном документе, например, клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), и ингибитор PD–1, вводят субъекту в комбинации с модулятором супрессорных клеток миелоидного происхождения (MDSC). MDSC накапливаются на периферии и в локализации опухоли многих солидных опухолей. Эти клетки подавляют Т–клеточные ответы, за счет чего обеспечивается затруднение эффективности терапии клетками, экспрессирующими CAR. Не ограничиваясь какой–либо теорией, считается, что введение модулятора MDSC усиливает эффективность клетки, экспрессирующей CAR, описанной в данном документе. В варианте осуществления субъект имеет солидную опухоль, например, солидную опухоль, описанную в данном документе, например, глиобластому. Иллюстративные модуляторы MDSC включают без ограничения MCS110 и BLZ945. MCS110 представляет собой моноклональное антитело (mAb) к макрофагальному колониестимулирующему фактору (M–CSF). См., например, клиническое исследование с идентификационным номером NCT00757757. BLZ945 представляет собой низкомолекулярный ингибитор рецептора колониестимулирующего фактора 1 (CSF1R). См., например, Pyonteck et al. Nat. Med. 19(2013):1264–72. Структура BLZ945 показана ниже.
В вариантах осуществления комбинацию, описанную в данном документе, например, клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), и ингибитор PD–1, вводят субъекту в комбинации со средством, которая подавляет или снижает активность иммуносупрессорных плазматических клеток. Было показано, что иммуносупрессорные плазматические клетки препятствуют T–клеточно–зависимой иммуногенной химиотерапии, такой как оксалиплатин (Shalapour et al., Nature 2015, 521:94–101). В варианте осуществления иммуносупрессорные плазматические клетки могут экспрессировать одно или несколько из IgA, интерлейкина (IL)–10 и PD–L1. В варианте осуществления средство представляет собой клетку, экспрессирующую CAR для BCMA.
В некоторых вариантах осуществления комбинацию, описанную в данном документе, например, клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), и ингибитор PD–1, вводят субъекту в комбинации с полипептидом интерлейкином 15 (IL–15), полипептидом рецептором альфа интерлейкина 15 (IL–15Ra) или в комбинации как полипептида IL–15, так и полипептида IL–15Ra, например, hetIL–15 (Admune Therapeutics, LLC). hetIL–15 представляет собой гетеродимерный нековалентный комплекс IL–15 и IL–15Ra. hetIL–15 описан, например, в U.S. 8124084, U.S. 2012/0177598, U.S. 2009/0082299, U.S. 2012/0141413 и U.S. 2011/0081311, включенных в данный документ посредством ссылки. В вариантах осуществления het–IL–15 вводят подкожно. В вариантах осуществления субъект имеет рак, например, солидный рак, например, меланому или рак толстой кишки. В вариантах осуществления субъект имеет метастатический рак.
В вариантах осуществления субъекту, имеющему заболевание, описанное в данном документе, вводят комбинацию, описанную в данном документе, например, клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), и ингибитор PD–1, в комбинации со средством, например, цитотоксическим или химиотерапевтическим средством, биологической терапией (например, антителом, например, моноклональным антителом или клеточной терапией) или ингибитором (например, ингибитором киназы). В вариантах осуществления субъекту вводят клетку, экспрессирующую CAR, описанную в данном документе, в комбинации с цитотоксическим средством, например, CPX–351 (Celator Pharmaceuticals), цитарабином, даунорубицином, возароксином (Sunesis Pharmaceuticals), сапацитабином (Cyclacel Pharmaceuticals), идарубицином или митоксантроном. CPX–351 представляет собой липосомальный состав, содержащий цитарабин и даунорубицин в молярном соотношении 5:1. В вариантах осуществления субъекту вводят клетку, экспрессирующую CAR, описанную в данном документе, в комбинации с гипометилирующим средством, например, ингибитором ДНК–метилтрансферазы, например, азацитидином или децитабином. В вариантах осуществления субъекту вводят клетку, экспрессирующую CAR, описанную в данном документе, в комбинации с биологической терапией, например, антителом или клеточной терапией, например, 225Ac–линтузумабом (Actimab–A; Actinium Pharmaceuticals), IPH2102 (Innate Pharma/Bristol Myers Squibb), SGN–CD33A (Seattle Genetics) или гемтузумабом озогамицином (Mylotarg; Pfizer). SGN–CD33A представляет собой конъюгат антитела и лекарственного средства (ADC), содержащий пирролобензодиазепиновый димер, который прикреплен к антителу к CD33. Актимаб–A представляет собой антитело к CD33 (линтузумаб), меченое актинием. IPH2102 представляет собой моноклональное антитело, которое нацеливается на иммуноглобулиноподобные рецепторы киллерных клеток (KIR). В вариантах осуществления субъекту вводят клетку, экспрессирующую CAR, описанную в данном документе, в комбинации с ингибитором FLT3, например, сорафенибом (Bayer), мидостаурином (Novartis), кизартинибом (Daiichi Sankyo), креноланибом (Arog Pharmaceuticals), PLX3397 (Daiichi Sankyo), AKN–028 (Akinion Pharmaceuticals) или ASP2215 (Astellas). В вариантах осуществления субъекту вводят клетку, экспрессирующую CAR, описанную в данном документе, в комбинации с ингибитором изоцитратдегидрогеназы (IDH), например, AG–221 (Celgene/Agios) или AG–120 (Agios/Celgene). В вариантах осуществления субъекту вводят клетку, экспрессирующую CAR, описанную в данном документе, в комбинации с регулятором клеточного цикла, например, ингибитором polo–подобной киназы 1 (Plk1), например, воласертибом (Boehringer Ingelheim); или ингибитором циклинзависимой киназы 9 (Cdk9), например, алвоцидибом (Tolero Pharmaceuticals/Sanofi Aventis). В вариантах осуществления субъекту вводят клетку, экспрессирующую CAR, описанную в данном документе, в комбинации с ингибитором сигнальной сети B–клеточного рецептора, например, ингибитором B–клеточной лимфомы 2 (Bcl–2), например, венетоклаксом (Abbvie/Roche); или ингибитором тирозинкиназы Брутона (Btk), например, ибрутинибом (Pharmacyclics/Johnson & Johnson Janssen Pharmaceutical). В вариантах осуществления субъекту вводят клетку, экспрессирующую CAR, описанную в данном документе, в комбинации с ингибитором аминопептидазы M1, например, тозедостатом (CTI BioPharma/Vernalis); ингибитором гистондеацетилазы (HDAC), например, прациностатом (MEI Pharma); ингибитором мультикиназы, например, ригосертибом (Onconova Therapeutics/Baxter/SymBio); или пептидным обратным агонистом CXCR4, например, BL–8040 (BioLineRx).
В другом варианте осуществления субъекты получают инфузию клетки, экспрессирующей CAR, например, композиций по настоящему изобретению, до трансплантации клеток, например, аллогенного трансплантата стволовых клеток. В предпочтительном варианте осуществления клетки, экспрессирующие CAR, временно экспрессируют CAR, например, с помощью электропорации мРНК, кодирующей CAR, при этом экспрессия CAR завершается до инфузии донорских стволовых клеток для избежания отторжения трансплантата.
Некоторые пациенты могут испытывать аллергические реакции на соединения по настоящему изобретению и/или другое(другие) противораковое(противораковые) средство(средства) во время или после введения; в связи с этим для сведения риска аллергической реакции к минимуму часто вводят противоаллергические средства. Подходящие противоаллергические средства включают кортикостероиды, такие как дексаметазон (например, Decadron®), беклометазон (например, Beclovent®), гидрокортизон (также известный как кортизон, гидрокортизона сукцинат натрия, гидрокортизона фосфат натрия, и продаваемый под торговыми марками Ala–Cort®, гидрокортизонфосфат, Solu–Cortef®, Hydrocort Acetate® и Lanacort®), преднизолон (продаваемый под торговыми марками Delta–Cortel®, Orapred®, Pediapred® и Prelone®), преднизон (продаваемый под торговыми марками Deltasone®, Liquid Red®, Meticorten® и Orasone®), метилпреднизолон (также известный как 6–метилпреднизолон, метилпреднизолона ацетат, метилпреднизолона сукцинат натрия, продаваемый под торговыми марками Duralone®, Medralone®, Medrol®, M–Prednisol® и Solu–Medrol®); антигистаминные средства, такие как дифенгидрамин (например, Benadryl®), гидроксизин и ципрогептадин; и бронхолитические средства, такие как агонисты бета–адренергического рецептора, альбутерол (например, Proventil®) и тербуталин (Brethine®).
Некоторые пациенты могут испытывать тошноту во время и после введения соединения по настоящему изобретению и/или другого(других) противоракового(противораковых) средства(средств); в связи с этим для предупреждения тошноты (верхняя часть желудка) и рвоты используют противорвотные средства. Пригодные противорвотные средства включают апрепитант (Emend®), ондансетрон (Zofran®), гранисетрон HCl (Kytril®), лоразепам (Ativan®), дексаметазон (Decadron®), прохлорперазин (Compazine®), казопитант (Rezonic® и Zunrisa®) и их комбинации.
Лекарственные препараты для облегчения боли, возникающей в период лечения, часто прописывают для облегчения состояния пациента. Часто используют такие обычные доступные без рецепта анальгетики, как Tylenol®. Однако, опиоидные аналгезирующие лекарственные средства, такие как гидрокодон/парацетамол или гидрокодон/ацетаминофен (например, Vicodin®), морфин (например, Astramorph® или Avinza®), оксикодон (например, OxyContin® или Percocet®), оксиморфона гидрохлорид (Opana®) и фентанил (например, Duragesic®) также пригодны в случаях умеренной или сильной боли.
С целью защиты нормальных клеток от токсичности, обусловленной лечением, и ограничения токсичности по отношению к органам, можно использовать цитопротекторные средства (такие как нейропротекторы, поглотители свободных радикалов, кардиопротекторы, нейтрализаторы антрациклина, вызывающего кровоизлияния, питательные вещества и т. п.) в качестве вспомогательной терапии. Подходящие цитопротекторные средства включают амифостин (Ethyol®), глутамин, димесну (Tavocept®), месну (Mesnex®), дексразоксан (Zinecard® или Totect®), ксалипроден (Xaprila®) и лейковорин (также известный как лейковорин кальция, цитроворум–фактор и фолиновая кислота).
Структура активных соединений, определяемая кодовыми номерами, общими или торговыми марками, может быть взята из фактического издания стандартного сборника "The Merck Index" или из баз данных, например, Patents International (например, IMS World Publications).
Вышеупомянутые соединения, которые могут быть использованы в комбинации с соединением по настоящему изобретению, могут быть получены и введены, как описано в данной области техники, например, в документах, упомянутых выше.
В одном варианте осуществления в настоящем изобретении предусмотрены фармацевтические композиции, содержащие по меньшей мере одно соединение по настоящему изобретению (например, соединение по настоящему изобретению) или его фармацевтически приемлемую соль совместно с фармацевтически приемлемым носителем, подходящим для введения субъекту–человеку или субъекту–животному либо в отдельности, либо совместно с другими противораковыми средствами.
В одном варианте осуществления в настоящем изобретении предусмотрены способы лечения субъектов–людей или субъектов–животных, страдающих клеточным пролиферативным заболеванием, таким как рак. В настоящем изобретении предусмотрены способы лечения субъекта–человека или субъекта–животного, нуждающихся в таком лечении, предусматривающие введение субъекту терапевтически эффективного количества соединения по настоящему изобретению (например, соединения по настоящему изобретению) или его фармацевтически приемлемой соли либо в отдельности, либо в комбинации с другими противораковыми средствами.
В частности, композиции будут либо составлены вместе в виде комбинированного терапевтического средства, либо вводиться отдельно.
При комбинированной терапии соединение по настоящему изобретению и другое(другие) противораковое(противораковые) средство(средства) можно вводить либо одновременно, параллельно, либо последовательно без особых временных ограничений, при этом такое введение обеспечивает терапевтически эффективные уровни двух соединений в организме пациента.
В предпочтительном варианте осуществления соединение по настоящему изобретению и другое(другие) противораковое(противораковые) средство(средства), как правило, вводят последовательно в любом порядке с помощью инфузии или перорально. Схема дозирования может варьироваться в зависимости от стадии заболевания, физического состояния пациента, профилей безопасности отдельных лекарственных средств и переносимости отдельных лекарственных средств, а также от других критериев, хорошо известных лечащему врачу и медицинскому(медицинским) работнику(работникам), вводящему(вводящим) эту комбинацию. Соединение по настоящему изобретению и другое(другие) противораковое(противораковые) средство(средства) можно вводить в пределах минут друг от друга, с интервалом, составляющим часы, дни или даже недели, в зависимости от определенного цикла, используемого для лечения. Кроме того, цикл может включать более частое введение одного лекарственного средства по сравнению с другим в ходе цикла лечения и в различных дозах на одно введение лекарственного средства.
В другом аспекте настоящего изобретения предусмотрены наборы, которые включают одно или несколько соединений по настоящему изобретению и партнера по комбинации, как раскрыто в данном документе. Иллюстративные наборы включают (a) соединение по настоящему изобретению или его фармацевтически приемлемую соль, (b) по меньшей мере одного партнера по комбинации, например, как указано выше, при этом такой набор может содержать листок–вкладыш или другую этикетку, в том числе инструкции по введению.
Соединение по настоящему изобретению может также быть использовано для получения преимущества в комбинации с известными терапевтическими процессами, например, введением гормонов или особенно облучением. Соединение по настоящему изобретению, в частности, может быть использовано в качестве радиосенсибилизатора, в частности, для лечения опухолей, которые характеризуются слабой чувствительностью к лучевой терапии.
В одном варианте осуществления субъекту можно вводить средство, которое ослабляет или уменьшает тяжесть побочного эффекта, ассоциированного с введением клетки, экспрессирующей CAR. Побочные эффекты, ассоциированные с введением клетки, экспрессирующей CAR, включают без ограничения CRS и гематологический лимфогистиоцитоз (HLH), также называемый синдромом активации макрофагов (MAS).
Соответственно, способы, описанные в данном документе, могут предусматривать введение клетки, экспрессирующей CAR, описанной в данном документе, субъекту и дополнительное введение одного или нескольких средств для контроля повышенных уровней растворимого фактора, образующегося в результате лечения клеткой, экспрессирующей CAR. В одном варианте осуществления повышенный растворимый фактор у субъекта представляет собой одно или несколько из IFN–γ, TNFα, IL–2 и IL–6. В варианте осуществления повышенный фактор у субъекта представляет собой одно или несколько из IL–1, GM–CSF, IL–10, IL–8, IL–5 и фракталкина. Таким образом, средство, вводимое для лечения этого побочного эффекта, может представлять собой средство, которое нейтрализует один или несколько из этих растворимых факторов. В одном варианте осуществления средство, которое нейтрализует одну или несколько из этих растворимых форм, представляет собой антитело или его антигенсвязывающий фрагмент. Примеры таких средств включают без ограничения стероид (например, кортикостероид), ингибитор TNFα и ингибитор IL–6. Примером ингибитора TNFα является молекула антитела к TNFα, такая как инфликсимаб, адалимумаб, цертолизубам и голимумаб. Другим примером ингибитора TNFα является слитый белок, такой как этанерцепт. Низкомолекулярный ингибитор TNFα включает без ограничения ксантиновые производные (например, пентоксифиллин) и бупропион. Примером ингибитора IL–6 является молекула антитела к IL–6, такая как тоцилизумаб (toc), сарилумаб, элсилимомаб, CNTO 328, ALD518/BMS–945429, CNTO 136, CPSI–2364, CDP6038, VX30, ARGX–109, FE301 и FM101. В одном варианте осуществления молекула антитела к IL–6 представляет собой тоцилизумаб. Примером ингибитора на основе IL–1R является анакинра.
В некоторых вариантах осуществления субъекту вводят кортикостероид, такой как, например, метилпреднизолон, гидрокортизон, среди прочего.
В некоторых вариантах осуществления субъекту вводят сосудосуживающее средство, такое как, например, норэпинефрин, дофамин, фенилэфрин, эпинефрин, вазопрессин или их комбинация.
В варианте осуществления субъекту могут вводить жаропонижающее средство. В варианте осуществления субъекту могут вводить аналгезирующее средство.
В одном варианте осуществления субъекту можно дополнительно вводить средство, которое усиливает активность или пригодность клетки, экспрессирующей CAR. Например, в одном варианте осуществления данное средство может представлять собой средство, ингибирующее молекулу, которая модулирует или регулирует, например, ингибирует, Т–клеточную функцию. В некоторых вариантах осуществления молекула, которая модулирует или регулирует Т–клеточную функцию, представляет собой ингибирующую молекулу. Ингибирующие молекулы, например, белок–1 программируемой смерти клетки (PD–1) или лиганд PD–1 (PD–L1), могут в некоторых вариантах осуществления снижать способность клетки, экспрессирующей CAR, осуществлять иммунный эффекторный ответ. Примеры ингибирующих молекул включают PD–1, PD–L1, CTLA4, TIM3, CEACAM (например, CEACAM–1, CEACAM–3 и/или CEACAM–5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7–H3 (CD276), B7–H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC класса I, MHC класса II, GAL9, аденозин и TGF–бета. Путем ингибирования молекулы, которая модулирует или регулирует, например, ингибирует Т–клеточную функцию, например, путем ингибирования на уровне ДНК, РНК или белка, можно оптимизировать функциональные характеристики клеток, экспрессирующих CAR. В вариантах осуществления для ингибирования экспрессии ингибирующей молекулы в клетке, экспрессирующей CAR, можно применять средство, например, ингибирующую нуклеиновую кислоту, например, ингибирующую нуклеиновую кислоту, например, dsRNA, например, siRNA или shRNA, короткие палиндромные повторы, регулярно расположенные группами (CRISPR), эффекторную нуклеазу, подобную активаторам транскрипции (TALEN), или эндонуклеазу "цинковыми пальцами" (ZFN), например, как описано в данном документе. В варианте осуществления ингибитор представляет собой shRNA.
В варианте осуществления средство, которое модулирует или регулирует, например, ингибирует, Т–клеточную функцию, ингибируется в клетке, экспрессирующей CAR. В этих вариантах осуществления молекула dsRNA, ингибирующая экспрессию молекулы, которая модулирует или регулирует, например, ингибирует, Т–клеточную функцию, связана с нуклеиновой кислотой, которая кодирует компонент, например, все компоненты, CAR. В варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу dsRNA, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует T–клеточную функцию, функционально связана с промотором, например, промотором, полученным из H1 или U6, таким образом, что молекула dsRNA, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует T–клеточную функцию, экспрессируется, например, в клетке, экспрессирующей CAR. См., например, Tiscornia G., "Development of Lentiviral Vectors Expressing siRNA", глава 3, в Gene Transfer: Delivery and Expression of DNA and RNA (eds. Friedmann and Rossi). Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, USA, 2007; Brummelkamp TR, et al. (2002) Science 296: 550–553; Miyagishi M, et al. (2002) Nat. Biotechnol. 19: 497–500. В варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу dsRNA, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует T–клеточную функцию, присутствует в том же векторе, например, лентивирусном векторе, который содержит молекулу нуклеиновой кислоты, которая кодирует компонент, например, все компоненты CAR. В таком варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу dsRNA, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует T–клеточную функцию, расположена в векторе, например, лентивирусном векторе, в направлении 5' или 3' по отношению к нуклеиновой кислоте, которая кодирует компонент, например, все компоненты CAR. Молекула нуклеиновой кислоты, которая кодирует молекулу dsRNA, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует T–клеточную функцию, может быть транскрибирована в том же или другом направлении, что и нуклеиновая кислота, которая кодирует компонент, например, все компоненты CAR. В варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу dsRNA, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует T–клеточную функцию, присутствует в векторе, отличном от вектора, который содержит молекулу нуклеиновой кислоты, которая кодирует компонент, например, все компоненты CAR. В варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу dsRNA, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует Т–клеточную функцию, временно экспрессируется в клетке, экспрессирующей CAR. В варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу dsRNA, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует Т–клеточную функцию, стабильно интегрируется в геном клетки, экспрессирующей CAR. Предусмотрены конфигурации иллюстративных векторов для экспрессии компонента, например, всех компонентов CAR с молекулой dsRNA, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует T–клеточную функцию, например, на фигуре 47 в международной публикации WO2015/090230, поданной 19 декабря 2014 г., которая включена в данный документ посредством ссылки.
Виды комбинированной терапии с использованием ингибиторов молекул контрольных точек
В одном варианте осуществления средство, которое модулирует или регулирует, например, ингибирует T–клеточную функцию, может представлять собой, например, антитело или фрагмент антитела, которые связываются с ингибирующей молекулой. Например, средство может представлять собой антитело или фрагмент антитела, которые связываются с PD–1, PD–L1, PD–L2 или CTLA4 (например, ипилимумаб (также обозначаемый как MDX–010 и MDX–101, и доступный на рынке в виде Yervoy®; Bristol–Myers Squibb; тремелимумаб (моноклональное антитело IgG2, доступное от Pfizer, ранее известное как тицилимумаб, CP–675,206)). В варианте осуществления средство представляет собой антитело или фрагмент антитела, которые связываются с TIM3. В варианте осуществления средство представляет собой антитело или фрагмент антитела, которые связываются с LAG3. В варианте осуществления средство представляет собой антитело или фрагмент антитела, которые связываются с PD–L1.
PD–1 описано более подробно выше. Было показано, что два лиганда PD1, PD–L1 и PD–L2, подавляют активацию Т–клеток при связывании с PD1 (Freeman et a. 2000 J Exp Med 192:1027–34; Latchman et al. 2001 Nat Immunol 2:261–8; Carter et al. 2002 Eur J Immunol 32:634–43). PD–L1 является обильным в раковых опухолях человека (Dong et al. 2003 J Mol Med 81:281–7; Blank et al. 2005 Cancer Immunol. Immunother 54:307–314; Konishi et al. 2004 Clin Cancer Res 10:5094). Подавление иммунитета можно устранить путем ингибирования локального взаимодействия PD1 с PD–L1. Термин "лиганд 1 программируемой смерти клетки" или "PD–L1" включает изоформы PD–L1 млекопитающего, например, PD–1 человека, видовые гомологи PD–L1 человека и аналоги, содержащие по меньшей мере один общий эпитоп с PD–1. Аминокислотная последовательность PD–L1, например, PD–1 человека, известна из уровня техники, например, Dong et al. (1999) Nat Med. 5(12):1365–9; Freeman et al. (2000) J Exp Med. 192(7):1027–34).
Антитела, фрагменты антител и другие ингибиторы (например, малая молекула; полипептид, например, слитый белок; или ингибирующая нуклеиновая кислота; например, ингибиторы siRNA или shRNA), например, PD–L1 и PD–L2 доступны из уровня техники и могут быть использованы в комбинации с CAR (например, CAR CD19) (например, и ингибитором PD–1), описанным в данном документе. MEDI4736 (Medimmune) представляет собой человеческое моноклональное антитело, которое связывается с PDL1 и ингибирует взаимодействие лиганда с PD1.
В одном варианте осуществления антитело к PD–L1 представляет собой молекулу антитела к PD–L1, раскрытую в US 2016/0108123, опубликованном 21 апреля 2016 г. под названием "Молекулы антител к PD–L1 и варианты их применения", включенном посредством ссылки во всей своей полноте.
В некоторых вариантах осуществления антитело к PD–L1 представляет собой MSB0010718C. MSB0010718C (также обозначаемое как A09–246–2; Merck Serono, или авелумаб) представляет собой моноклональное антитело, которое связывается с PD–L1. Иллюстративные гуманизированные антитела к PD–L1 раскрыты в WO2013/079174 (включенном в данный документ посредством ссылки) и содержат последовательность, раскрытую в данном документе (или последовательность, по сути, идентичную или подобную ей, например, последовательность, идентичную на по меньшей мере 85%, 90%, 95% или больше указанной последовательности).
MDPL3280A (Genentech/Roche) представляет собой человеческое Fc–оптимизированное моноклональное антитело IgG1, которое связывается с PD–L1. MDPL3280A, также известное как атезолизумаб, и другие человеческие моноклональные антитела к PD–L1 раскрыты в патенте США № 7943743 и публикации США № 20120039906, включенных в данный документ посредством ссылки.
В одном варианте осуществления молекула антитела к PD–L1 содержит одну или несколько из последовательностей CDR (или в совокупности все из последовательностей CDR), последовательность вариабельной области тяжелой цепи или легкой цепи или последовательность тяжелой цепи или легкой цепи атезолизумаба. В других вариантах осуществления атезолизумаб вводят в комбинации с CAR.
В варианте осуществления терапия CAR, например, клетка, экспрессирующая CAR (например, клетка, экспрессирующая CAR для CD19), может быть использована в комбинации с антителом к PDL1 (например, атезолизумабом) для лечения субъекта с лимфомой, например, DLBCL. В некоторых вариантах осуществления субъект имеет DLBCL, например, r/r DLBCL, и имел предшествующую терапию антителом к CD20 и антрациклином. В некоторых вариантах осуществления атезолизумаб можно вводить параллельно с терапией CAR (например, клеткой, экспрессирующей CAR для CD19), до или после нее. В некоторых вариантах осуществления атезолизумаб вводят параллельно с терапией CAR (например, клеткой, экспрессирующей CAR для CD19). В некоторых вариантах осуществления атезолизумаб вводят по меньшей мере один раз (например, один, два, три, четыре, пять, шесть или больше раз) в дозе 1200 мг (например, 1000, 1200, 1500 или 2000 мг) каждые 3 недели. В некоторых вариантах осуществления атезолизумаб вводят четыре раза в дозе 1200 мг каждые 3 недели.
Другие средства, связывающие PD–L1, включают YW243.55.S70 (вариабельные области тяжелой и легкой цепей показаны в SEQ ID NO: 20 и 21 в WO2010/077634) и MDX–1105 (также называемое как BMS–936559, и, например, средства, связывающие PD–L1, раскрытые в WO2007/005874). AMP–224 (B7–DCIg; Amplimmune; например, раскрытый в WO2010/027827 и WO2011/066342), представляет собой растворимый рецептор на основе продукта слияния PD–L2 и Fc, который блокирует взаимодействие между PD1 и B7–H1. Примеры средств для RNAi включают длинную dsRNA, siRNA, shRNA и микроРНК. Ингибирующие нуклеиновые кислоты, описанные в данном документе, включают без ограничения аптамер, морфолино, рибозим и последовательность нуклеиновой кислоты, например, плазмиды или векторы, которые содержат или кодируют длинную dsRNA, siRNA, shRNA или микроРНК.
TIM3 (T–клеточный иммуноглобулин 3) также отрицательно регулирует Т–клеточную функцию, в частности, в секретирующих IFN–g CD4+ T–хелперных 1 и CD8+ T–цитотоксических 1 клетках, и играет основную роль в истощении T–клеток. Ингибирование взаимодействия между TIM3 и его лигандами, например, галектином–9 (Gal9), фосфатидилсерином (PS) и HMGB1, может повышать иммунный ответ. Антитела, фрагменты антител и другие ингибиторы TIM3 и его лигандов, доступны в данной области техники и могут быть использованы в комбинации с CAR (например, CAR CD19), описанным в данном документе. Например, антитела, фрагменты антител, малые молекулы или пептидные ингибиторы, которые нацеливаются на TIM3, связываются с доменом IgV TIM3 для ингибирования взаимодействия с его лигандами. Антитела и пептиды, которые ингибируют TIM3, раскрыты в WO2013/006490 и US20100247521. Другие антитела к TIM3 включают гуманизированные варианты RMT3–23 (раскрытые в Ngiow et al., 2011, Cancer Res, 71:3540–3551) и клон 8B.2C12 (раскрытый в Monney et al., 2002, Nature, 415:536–541). Биспецифические антитела, которые ингибируют TIM3 и PD–1, раскрыты в US20130156774.
В одном варианте осуществления антитело к TIM3 или его фрагмент представляют собой молекулу антитела к TIM3, описанную в US 2015/0218274 под названием "Молекулы антител к TIM3 и варианты их применения", включенном посредством ссылки во всей своей полноте. В одном варианте осуществления молекула антитела к TIM3 содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR (или в совокупности все CDR) вариабельной области тяжелой и легкой цепей антитела, выбранного из любого из ABTIM3, ABTIM3–hum01, ABTIM3–hum02, ABTIM3–hum03, ABTIM3–hum04, ABTIM3–hum05, ABTIM3–hum06, ABTIM3–hum07, ABTIM3–hum08, ABTIM3–hum09, ABTIM3–hum10, ABTIM3–hum11, ABTIM3–hum12, ABTIM3–hum13, ABTIM3–hum14, ABTIM3–hum15, ABTIM3–hum16, ABTIM3–hum17, ABTIM3–hum18, ABTIM3–hum19, ABTIM3–hum20, ABTIM3–hum21, ABTIM3–hum22, ABTIM3–hum23; или описанные в таблицах 1–4 в US 2015/0218274 или кодируемые нуклеотидной последовательностью, описанной в таблицах 1–4, или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей; или близкородственные CDR, например, CDR, которые являются идентичными или которые имеют по меньшей мере одно изменение аминокислоты, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен).
В еще одном варианте осуществления молекула антитела к TIM3 содержит по меньшей мере одну, две, три или четыре вариабельные области из антитела, описанного в данном документе, например, антитела, выбранного из любого из ABTIM3, ABTIM3–hum01, ABTIM3–hum02, ABTIM3–hum03, ABTIM3–hum04, ABTIM3–hum05, ABTIM3–hum06, ABTIM3–hum07, ABTIM3–hum08, ABTIM3–hum09, ABTIM3–hum10, ABTIM3–hum11, ABTIM3–hum12, ABTIM3–hum13, ABTIM3–hum14, ABTIM3–hum15, ABTIM3–hum16, ABTIM3–hum17, ABTIM3–hum18, ABTIM3–hum19, ABTIM3–hum20, ABTIM3–hum21, ABTIM3–hum22, ABTIM3–hum23; или описанные в таблицах 1–4 в US 2015/0218274 или кодируемые нуклеотидной последовательностью из таблиц 1–4; или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей.
В других вариантах осуществления средство, которое усиливает активность клетки, экспрессирующей CAR, представляет собой ингибитор CEACAM (например, ингибитор CEACAM–1, CEACAM–3 и/или CEACAM–5). В одном варианте осуществления ингибитор CEACAM представляет собой молекулу антитела к CEACAM. Иллюстративные антитела к CEACAM–1 описаны в WO 2010/125571, WO 2013/082366 WO 2014/059251 и WO 2014/022332, например, моноклональное антитело 34B1, 26H7 и 5F4; или ее рекомбинантная форма, описанные, например, в US 2004/0047858, US 7132255 и WO 99/052552. В других вариантах осуществления антитело к CEACAM связывается с CEACAM–5, как описано, например, в Zheng et al. PLoS One. 2010 Sep 2;5(9). pii: e12529 (DOI:10:1371/journal.pone.0021146), или перекрестно реагирует с CEACAM–1 и CEACAM–5, как описано, например, в WO 2013/054331 и US 2014/0271618.
Не ограничиваясь какой–либо теорией, считается, что молекулы клеточной адгезии, относящиеся к раково–эмбриональному антигену (CEACAM), такие как CEACAM–1 и CEACAM–5, опосредуют, по меньшей мере частично, ингибирование противоопухолевого иммунного ответа (см., например, Markel et al. J Immunol. 2002 Mar 15;168(6):2803–10; Markel et al. J Immunol. 2006 Nov 1;177(9):6062–71; Markel et al. Immunology. 2009 Feb;126(2):186–200; Markel et al. Cancer Immunol Immunother. 2010 Feb;59(2):215–30; Ortenberg et al. Mol Cancer Ther. 2012 Jun;11(6):1300–10; Stern et al. J Immunol. 2005 Jun 1;174(11):6692–701; Zheng et al. PLoS One. 2010 Sep 2;5(9). pii: e12529). Например, CEACAM–1 была описана в качестве гетерофильного лиганда TIM–3, а также она играет роль в опосредованной TIM–3 T–клеточной толерантности и истощении (см., например, WO 2014/022332; Huang, et al. (2014) Nature doi:10.1038/nature13848). В вариантах осуществления было показано, что совместная блокада CEACAM–1 и TIM–3 усиливает противоопухолевый иммунный ответ в моделях трансплантата колоректального рака (см., например, WO 2014/022332; Huang, et al. (2014) выше). В других вариантах осуществления совместная блокада CEACAM–1 и PD–1 снижает T–клеточную толерантность, как описано, например, в WO 2014/059251. Таким образом, ингибиторы CEACAM могут быть использованы с другими иммуномодуляторами, описанными в данном документе (например, ингибиторами PD–1 и/или TIM–3), для усиления иммунного ответа против рака, например, меланомы, рака легкого (например, NSCLC), рака мочевого пузыря, рака толстой кишки, рака яичников и других видов рака, описанных в данном документе.
LAG3 (ген активации лимфоцитов 3 или CD223) представляет собой молекулу клеточной поверхности, экспрессируемую на активированных T–клетках и B–клетках, которая, как было показано, играет роль в истощении CD8+ T–клеток. Антитела, фрагменты антител и другие ингибиторы LAG3 и его лигандов, доступны в данной области техники и могут быть использованы в комбинации с CAR (например, CAR CD19), описанным в данном документе. Например, BMS–986016 (Bristol–Myers Squib) представляет собой моноклональное антитело, которое нацеливается на LAG3. IMP701 (Immutep) представляет собой антагонистическое антитело к LAG3, а IMP731 (Immutep и GlaxoSmithKline) представляет собой истощающее антитело к LAG3. Другие ингибиторы LAG3 включают IMP321 (Immutep), который представляет собой рекомбинантный слитый белок растворимой части LAG3 и Ig, который связывается с молекулами MHC класса II и активирует антигенпрезентирующие клетки (APC). Другие антитела раскрыты, например, в WO2010/019570.
В одном варианте осуществления антитело к LAG3 или его фрагмент представляют собой молекулу антитела к LAG3, описанную в US 2015/0259420 под названием "Молекулы антител к LAG3 и варианты их применения", включенном посредством ссылки во всей своей полноте. В одном варианте осуществления молекула антитела к LAG3 содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR (или в совокупности все CDR) вариабельной области тяжелой и легкой цепей антитела, выбранного из любого из BAP050–hum01, BAP050–hum02, BAP050–hum03, BAP050–hum04, BAP050–hum05, BAP050–hum06, BAP050–hum07, BAP050–hum08, BAP050–hum09, BAP050–hum10, BAP050–hum11, BAP050–hum12, BAP050–hum13, BAP050–hum14, BAP050–hum15, BAP050–hum16, BAP050–hum17, BAP050–hum18, BAP050–hum19, BAP050–hum20, huBAP050(Ser) (например, BAP050–hum01–Ser, BAP050–hum02–Ser, BAP050–hum03–Ser, BAP050–hum04–Ser, BAP050–hum05–Ser, BAP050–hum06–Ser, BAP050–hum07–Ser, BAP050–hum08–Ser, BAP050–hum09–Ser, BAP050–hum10–Ser, BAP050–hum11–Ser, BAP050–hum12–Ser, BAP050–hum13–Ser, BAP050–hum14–Ser, BAP050–hum15–Ser, BAP050–hum18–Ser, BAP050–hum19–Ser, или BAP050–hum20–Ser), BAP050–Clone–F, BAP050–Clone–G, BAP050–Clone–H, BAP050–Clone–I или BAP050–Clone–J; или описанные в таблице 1 в US 2015/0259420 или кодируемые нуклеотидной последовательностью, описанной в таблице 1, или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеупомянутых последовательностей; или близкородственные CDR, например, CDR, которые являются идентичными или которые имеют по меньшей мере одно изменение аминокислоты, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен).
В еще одном варианте осуществления молекула антитела к LAG–3 содержит по меньшей мере одну, две, три или четыре вариабельные области из антитела, описанного в данном документе, например, антитела, выбранного из любого из BAP050–hum01, BAP050–hum02, BAP050–hum03, BAP050–hum04, BAP050–hum05, BAP050–hum06, BAP050–hum07, BAP050–hum08, BAP050–hum09, BAP050–hum10, BAP050–hum11, BAP050–hum12, BAP050–hum13, BAP050–hum14, BAP050–hum15, BAP050–hum16, BAP050–hum17, BAP050–hum18, BAP050–hum19, BAP050–hum20, huBAP050(Ser) (например, BAP050–hum01–Ser, BAP050–hum02–Ser, BAP050–hum03–Ser, BAP050–hum04–Ser, BAP050–hum05–Ser, BAP050–hum06–Ser, BAP050–hum07–Ser, BAP050–hum08–Ser, BAP050–hum09–Ser, BAP050–hum10–Ser, BAP050–hum11–Ser, BAP050–hum12–Ser, BAP050–hum13–Ser, BAP050–hum14–Ser, BAP050–hum15–Ser, BAP050–hum18–Ser, BAP050–hum19–Ser или BAP050–hum20–Ser), BAP050–Clone–F, BAP050–Clone–G, BAP050–Clone–H, BAP050–Clone–I или BAP050–Clone–J; или описанные в таблице 1 в US 2015/0259420 или кодируемые нуклеотидной последовательностью, показанной в таблице 1 в US 2015/0259420; или последовательность, по сути, идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из ранее указанных последовательностей.
В некоторых вариантах осуществления средство, которое усиливает активность клетки, экспрессирующей CAR, может представлять собой, например, слитый белок, содержащий первый домен и второй домен, при этом первый домен представляет собой ингибирующую молекулу или ее фрагмент, а второй домен представляет собой полипептид, который ассоциирован с положительным сигналом, например, полипептидом, содержащим внутриклеточный сигнальный домен, описанный в данном документе. В некоторых вариантах осуществления полипептид, который ассоциирован с положительным сигналом, может содержать костимулирующий домен CD28, CD27, ICOS, например, внутриклеточный сигнальный домен CD28, CD27 и/или ICOS, и/или первичный сигнальный домен, например, CD3 зета, например, описанный в данном документе. В одном варианте осуществления слитый белок экспрессируется той же клеткой, которая экспрессирует CAR. В другом варианте осуществления слитый белок экспрессируется клеткой, например, T–клеткой, которая не экспрессирует CAR по настоящему изобретению.
В вариантах осуществления субъекту вводят дополнительное средство (в дополнительной комбинации с клеткой, экспрессирующей CAR, и ингибитором PD–1, описанным в данном документе), при этом дополнительное средство представляет собой ингибитор ингибирующей молекулы, например, молекулы контрольной точки, например, PD–1, PD–L1, CTLA4, TIM3, CEACAM (например, CEACAM–1, CEACAM–3 и/или CEACAM–5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7–H3 (CD276), B7–H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC класса I, MHC класса II, GAL9, аденозин или TGF бета. В вариантах осуществления дополнительное средство представляет собой ингибитор PD–L1, например, FAZ053 (гуманизированное моноклональное антитело hIgG4 к PD–L1), MPDL3280A, дурвалумаб (DEMI–4736), авелумаб (MSB–0010718C) или BMS–936559. В вариантах осуществления дополнительное средство представляет собой ингибитор PD–1, например, пембролизумаб, ниволумаб, PDR001, MEDI–0680 (AMP–514), AMP–224, REGN–2810 или BGB–A317. В вариантах осуществления дополнительное средство представляет собой ингибитор CTLA–4, например, ипилимумаб. В вариантах осуществления дополнительное средство представляет собой ингибитор LAG–3, например, LAG525 (гуманизированное моноклональное антитело hIgG4 к LAG–3). В вариантах осуществления дополнительное средство представляет собой ингибитор TIM–3, например, MBG453 (гуманизированное моноклональное антитело hIgG4 к TIM–3). В вариантах осуществления дополнительное средство представляет собой ингибитор фермента, B–Raf, например, дабрафениб (GSK2118436; N–{3–[5–(2–аминопиримидин–4–ил)–2–трет–бутил–1,3–тиазол–4–ил]–2–фторфенил}–2,6–дифторбензолсульфонамид). В вариантах осуществления дополнительное средство представляет собой ингибитор MEK1 и/или MEK2, например, траметиниб (N–(3–{3–циклопропил–5–[(2–фтор–4–йодфенил)амино]–6,8–диметил–2,4,7–триоксо–3,4,6,7–тетрагидропиридо[4,3–d]пиримидин–1(2H)–ил}фенил)ацетамид). В вариантах осуществления дополнительное средство включает дабрафениб и траметиниб. В вариантах осуществления дополнительное средство представляет собой ингибитор GITR, например, GWN323. В вариантах осуществления дополнительное средство представляет собой агонист STING (стимулятор генов интерферона), например, MIW815. В вариантах осуществления дополнительное средство представляет собой агонист IL–15, например, NIZ985. В вариантах осуществления дополнительное средство представляет собой ингибитор аденозинового рецептора, например, NIR178. В вариантах осуществления дополнительное средство представляет собой ингибитор макрофагального колониестимулирующего фактора (CSF–1), например, MCS110. В вариантах осуществления дополнительное средство представляет собой ингибитор cMet, например, INC280. В вариантах осуществления дополнительное средство представляет собой ингибитор поркупина (PORCN), например, WNT974. В вариантах осуществления дополнительное средство представляет собой ингибитор гистондеацетилазы, например, панобиност. В вариантах осуществления дополнительное средство представляет собой ингибитор mTOR, например, эверолимус. В вариантах осуществления дополнительное средство представляет собой миметик второго полученного из митохондрии активатора каспаз (SMAC) и/или ингибитор семейства белков IAP (ингибитор апоптозного белка), например, LCL161. В вариантах осуществления дополнительное средство представляет собой ингибитор рецептора эпидермального фактора роста (EGFR), например, EGF816. В вариантах осуществления дополнительное средство представляет собой ингибитор IL–17, например, CJM112. В вариантах осуществления дополнительное средство представляет собой ингибитор IL–1 бета, например, ILARIS.
В одном варианте осуществления средство, которое усиливает активность клетки, экспрессирующей CAR, описанной в данном документе, представляет собой miR–17–92.
В одном варианте осуществления средство, которое усиливает активность CAR, описанного в данном документе, представляет собой цитокин. Цитокины обладают важными функциями в отношении размножения, дифференциации, выживания и гомеостаза T–клеток. Цитокины, которые могут быть введены субъекту, получающему клетку, экспрессирующую CAR, описанную в данном документе, включают IL–2, IL–4, IL–7, IL–9, IL–15, IL–18, и IL–21, или их комбинацию. В предпочтительных вариантах осуществления вводимым цитокином является IL–7, IL–15 или IL–21 или их комбинация. Цитокин можно вводить один раз в день или более одного раза в день, например, два раза в день, три раза в день или четыре раза в день. Цитокин можно вводить в течение более одного дня, например, цитокин вводят в течение 2 дней, в течение 3 дней, в течение 4 дней, в течение 5 дней, в течение 6 дней, в течение 1 недели, в течение 2 недель, в течение 3 недель или в течение 4 недель. Например, цитокин вводят один раз в день в течение 7 дней.
В вариантах осуществления цитокин вводят в сочетании с комбинацией, описанной в данном документе, например, клеткой, экспрессирующей CAR (например, клеткой, экспрессирующей CAR для CD19), и ингибитором PD–1. Цитокин можно вводить одновременно или параллельно с клетками, экспрессирующими CAR, например, вводимыми в тот же день. Цитокин может быть получен в той же фармацевтической композиции, что и клетки, экспрессирующие CAR, или может быть получен в отдельной фармацевтической композиции. В качестве альтернативы, цитокин можно вводить вскоре после введения клеток, экспрессирующих CAR, например, через 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней или 7 дней после введения Т–клеток, экспрессирующих CAR. В вариантах осуществления, в которых цитокин вводят в схеме дозирования, которая выполняется в течение более одного дня, первый день схемы дозирования цитокина может приходиться на тот же день, что и введение клеток, экспрессирующих CAR, или первый день схемы дозирования цитокина может быть через 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней или 7 дней после введения клеток, экспрессирующих CAR. В одном варианте осуществления в первый день клетки, экспрессирующие CAR, вводят субъекту, а на второй день цитокин вводят один раз в день в течение следующих 7 дней. В предпочтительном варианте осуществления цитокин, подлежащий введению в комбинации с клетками, экспрессирующими CAR, представляет собой IL–7, IL–15 или IL–21.
В других вариантах осуществления цитокин вводят в течение периода времени после введения клеток, экспрессирующих CAR, например, через по меньшей мере 2 недели, 3 недели, 4 недели, 6 недель, 8 недель, 10 недель, 12 недель, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев или 1 год или больше после введения клеток, экспрессирующих CAR. В одном варианте осуществления цитокин вводят после определения ответа субъекта на клетки, экспрессирующие CAR. Например, субъекту вводят клетки, экспрессирующие CAR, в соответствии с дозой и схемами, описанными в данном документе. Ответ субъекта на терапию CART определяют через 2 недели, 3 недели, 4 недели, 6 недель, 8 недель, 10 недель, 12 недель, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев или 1 год или больше после введения клеток, экспрессирующих CAR, с помощью любого из способов, описанных в данном документе, в том числе ингибирования роста опухоли, снижения циркулирующих опухолевых клеток или регрессии опухоли. Субъектам, которые не проявляют достаточного ответа на терапию клеткой, экспрессирующей CAR, можно вводить цитокин. Введение цитокина субъекту, который характеризуется субоптимальным ответом на терапию клеткой, экспрессирующей CAR, улучшает эффективность клеток, экспрессирующих CAR, или противоопухолевую активность. В предпочтительном варианте осуществления вводимым цитокином после введения клеток, экспрессирующих CAR, является IL–7.
Комбинация с низкой дозой ингибитора mTOR
В одном варианте осуществления комбинацию, описанную в данном документе, например, клетку, экспрессирующую CAR (например, клетку, экспрессирующую CAR для CD19), и ингибитор PD–1, вводят в комбинации с низкой иммуностимулирующей дозой ингибитора mTOR.
В другом варианте осуществления введение низкой иммуностимулирующей дозы ингибитора mTOR приводит к повышенной или длительной пролиферации клеток, экспрессирующих CAR, например, в культуре или у субъекта, например, по сравнению с необработанными клетками, экспрессирующими CAR, или субъектом, не получающим лечение. В вариантах осуществления повышенная пролиферация ассоциирована с повышением числа клеток, экспрессирующих CAR. Способы измерения повышенной или длительной пролиферации описаны в примерах в данном документе. В другом варианте осуществления введение низкой иммуностимулирующей дозы ингибитора mTOR приводит к повышенному или длительному уничтожению раковых клеток клетками, экспрессирующими CAR, например, в культуре или у субъекта, например, по сравнению с необработанными клетками, экспрессирующими CAR, или субъектом, не получающим лечение. В вариантах осуществления повышенное уничтожение раковых клеток ассоциировано со снижением объема опухоли.
В одном варианте осуществления клетки, экспрессирующие молекулу CAR, например, молекулу CAR, описанную в данном документе, вводят в комбинации с низкой иммуностимулирующей дозой ингибитора mTOR, например, аллостерического ингибитора mTOR, например, RAD001, или каталитического ингибитора mTOR. Например, введение низкой иммуностимулирующей дозы ингибитора mTOR может быть начато до введения клетки, экспрессирующей CAR, описанной в данном документе; завершено до введения клетки, экспрессирующей CAR, описанной в данном документе; начато в то же время, что и введение клетки, экспрессирующей CAR, описанной в данном документе; перекрываться с введением клетки, экспрессирующей CAR, описанной в данном документе; или продолжаться после введения клетки, экспрессирующей CAR, описанной в данном документе.
В качестве альтернативы или дополнения, введение низкой иммуностимулирующей дозы ингибитора mTOR может оптимизировать иммунные эффекторные клетки, подлежащие конструированию, экспрессировать молекулу CAR, описанную в данном документе. В таких вариантах осуществления введение низкой иммуностимулирующей дозы ингибитора mTOR, например, аллостерического ингибитора, например, RAD001, или каталитического ингибитора, может быть начато или завершено до сбора у субъекта иммунных эффекторных клеток, например, T–клеток или NK–клеток, подлежащих конструированию для экспрессии молекулы CAR, описанной в данном документе.
В другом варианте осуществления иммунные эффекторные клетки, например, T–клетки или NK–клетки, подлежащие конструированию для экспрессии молекулы CAR, описанной в данном документе, например, после сбора у субъекта, или иммунные эффекторные клетки, экспрессирующие CAR, например, T–клетки или NK–клетки, например, до введения субъекту, можно культивировать в присутствии низкой иммуностимулирующей дозы ингибитора mTOR.
Используемый в данном документе термин "ингибитор mTOR" относится к соединению или лиганду или их фармацевтически приемлемой соли, которая ингибирует киназу mTOR в клетке. В варианте осуществления ингибитор mTOR представляет собой аллостерический ингибитор. В варианте осуществления ингибитор mTOR представляет собой каталитический ингибитор.
Аллостерические ингибиторы mTOR включают нейтральное трициклическое соединение рапамицин (сиролимус), родственные с рапамицином соединения, т. е. соединения, имеющие структурное и функциональное сходства с рапамицином, в том числе, например, производные рапамицина, аналоги рапамицина (также называемые рапалогами) и другие макролидные соединения, которые ингибируют активность mTOR.
Рапамицин представляет собой известный макролидный антибиотик, вырабатываемый Streptomyces hygroscopicus.
Другие подходящие аналоги рапамицина включают без ограничения RAD001, иначе известный как эверолимус (Afinitor®), имеет химическое название (1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28E,30S,32S,35R)–1,18–дигидрокси–12–{(1R)–2–[(1S,3R,4R)–4–(2–гидроксиэтокси)–3–метоксициклогексил]–1–метилэтил}–19,30–диметокси–15,17,21,23,29,35–гексаметил–11,36–диокса–4–азатрицикло[30.3.1.04,9]гексатриаконта–16,24,26,28–тетраен–2,3,10,14,20–пентаон, сиролимус (рапамицин, AY–22989), 40–[3–гидрокси–2–(гидроксиметил)–2–метилпропаноат]рапамицин (также называемый темзиролимус или CCI–779) и ридафоролимус (AP–23573/MK–8669). Другие примеры аллостерических ингибиторов mTor включают зотаролимус (ABT578) и умиролимус, описанные в US2005/0101624, содержимое которого включено посредством ссылки. Другие подходящие ингибиторы mTOR описаны в абзацах 946–964 международной публикации WO2015/142675, поданной 13 марта 2015 г., которая включена посредством ссылки во всей полноте. Низкие иммуностимулирующие дозы ингибитора mTOR, подходящие уровни ингибирования mTOR, ассоциированные с низкими дозами ингибитора mTOR, способы выявления уровня ингибирования mTOR и их подходящие фармацевтические композиции дополнительно описаны в абзацах 936–945 и 965–1003 международной публикации WO2015/142675, поданной 13 марта 2015 г., которая включена посредством ссылки во всей своей полноте.
Синдром высвобождения цитокинов (CRS)
Синдром высвобождения цитокинов (CRS) представляет собой потенциально опасную для жизни ассоциированную с цитокинами токсичность, которая может возникать в результате иммунотерапии рака, например, средств терапии рака на основе антител или средств иммунотерапии на основе Т–клеток (например, CAR–T–клетками). CRS возникает в результате иммунной активации высокого уровня, при которой большие количества лимфоцитов и/или миелоидных клеток высвобождают воспалительные цитокины при активации. Тяжесть CRS и время возникновения симптомов может варьировать в зависимости от величины активации иммунных клеток, типа вводимой терапии и/или степени опухолевой нагрузки у субъекта. В случае T–клеточной терапии рака возникновение симптомов в типичном случае происходит от дней до недель после введения T–клеточной терапии, например, когда происходит пик размножения Т–клеток in vivo. См., например, Lee et al. Blood. 124,2(2014): 188–95.
Симптомы CRS могут включать неврологическую токсичность, диссеминированное внутрисосудистое свертывание крови, дисфункцию сердца, синдром острой дыхательной недостаточности у взрослых, почечную недостаточность и/или печеночную недостаточность. Например, симптомы CRS включают высокую температуру, тошноту, преходящую гипотензию, гипоксию и т. п. CRS может включать клинические системные признаки и симптомы, такие как лихорадка, усталость, виды миалгии, виды артралгии, тошнота, рвота и головная боль. CRS может включать клинические признаки и симптомы со стороны кожи, такие как сыпь. CRS может включать клинические признаки и симптомы со стороны желудочно–кишечного тракта, такие как тошнота, рвота и диарея. CRS могут включать клинические признаки и симптомы со стороны дыхательной системы, такие как тахипноэ и гипоксемия. CRS могут включать клинические признаки и симптомы со стороны сердечно–сосудистой системы, такие как тахикардия, пульсовое давление в расширенном диапазоне, гипотензия, повышенный сердечный выброс (ранний) и потенциально сниженный сердечный выброс (поздний). CRS может включать признаки и симптомы клинического свертывания крови, такие как повышенное содержание d–димера, гипофибриногенемия с кровотечением и без такового. CRS может включать клинические признаки и симптомы со стороны почек, такие как азотемия. CRS может включать клинические признаки и симптомы со стороны печени, такие как трансаминит и гипербилирубинемия. CRS может включать клинические признаки и симптомы со стороны нервной системы, такие как головная боль, изменения психического состояния, спутанность, делирий, затруднения с подбором слов или явная афазия, галлюцинации, тремор, дисметрия, нарушение походки и судороги.
Считается, что IL–6 является медиатором токсичности CRS. См., например, там же высокие уровни IL–6 могут инициировать провоспалительный сигнальный каскад с участием IL–6, приводящий к одному или нескольким симптомам CRS. В некоторых случаях уровень C–реактивного белка (CRP) (биомолекулы, продуцируемой печенью, например, в ответ на IL–6) может быть показателем активности IL–6. В некоторых случаях уровни CRP могут повышаться в несколько раз (например, несколько логарифмов) во время CRS. Уровни CRP можно измерить с помощью способов, описанных в данном документе, и/или стандартных способов, доступных из уровня техники.
Разделение CRS по степеням
В некоторых вариантах осуществления CRS может быть разделен по степеням в зависимости от тяжести от 1 до 5 следующим образом. Степени 1–3 являются меньшими, чем тяжелый CRS. Степени 4–5 представляют собой тяжелый CRS. В случае степени 1 CRS необходимо только симптоматическое лечение (например, тошнота, лихорадка, усталость, виды миалгии, дискомфорт, головная боль), и симптомы не являются опасными для жизни. В случае степени 2 CRS симптомы требуют умеренного вмешательства и, как правило, отвечают на умеренное вмешательство. Субъекты, имеющие степень 2 CRS, проявляют гипотензию, которая является чувствительной либо к жидкостям, либо к одному низкодозному сосудосуживающему средству; или они проявляют органную токсичность 2 степени или легкие симптомы со стороны дыхательной системы, которые являются чувствительными к низкопоточному кислороду (<40% кислорода). У субъектов со степенью 3 CRS гипотензия, как правило, не обращается с помощью инфузионной терапии или одного низкодозного сосудосуживающего средства. Эти субъекты, как правило, нуждаются в большем, чем в низкопоточном кислороде, и имеют органную токсичность 3 степени (например, дисфункцию почек или сердца или коагулопатию) и/или трансаминит 4 степени. Субъектам с 3 степенью CRS требуется более агрессивное вмешательство, например, кислород 40% или больше, высокая доза сосудосуживающего(сосудосуживающих) средства(средств) и/или несколько сосудосуживающих средств. Субъекты с 4 степенью CRS страдают от непосредственно опасных для жизни симптомов, в том числе органной токсичности 4 степени или нуждаются в искусственной вентиляции легких. Субъекты с 4 степенью CRS, как правило, не имеют трансаминита. У субъектов с 5 степенью CRS токсичность вызывает смерть. Например, критерии для разделения CRS по степеням предусмотрены в данном документе в таблице A. Если не указано иное, CRS, используемый в данном документе, относится к CRS в соответствии с критериями из таблицы A.
Таблица A Разделение CRS по степеням
Средства терапии CRS
Средства терапии CRS включают ингибитор IL–6 или ингибиторы рецептора IL–6 (IL–6R) (например, тоцилизумаб или силтуксимаб), блокаторы sgp130, вазоактивные лекарственные препараты, кортикостероиды, иммунодепрессивные средства и искусственную вентиляцию легких. Иллюстративные средства терапии CRS описаны в международной заявке WO2014011984, которая включена тем самым посредством ссылки.
Тоцилизумаб представляет собой гуманизированное моноклональное антитело иммуноглобулин G1 каппа к IL–6R человека. См., например, там же тоцилизумаб блокирует связывание IL–6 с растворимыми и мембраносвязанными рецепторами IL–6 (IL–6R) и, таким образом, ингибирует классическую и транс–IL–6 передачу сигнала. В вариантах осуществления тоцилизумаб вводят в дозе приблизительно 4–12 мг/кг, например, приблизительно 4–8 мг/кг для взрослых и приблизительно 8–12 мг/кг для педиатрических субъектов, например, вводят в течение 1 часа.
В некоторых вариантах осуществления терапевтическое средство для лечения CRS представляет собой ингибитор передачи сигнала с участием IL–6, например, ингибитор IL–6 или рецептора IL–6. В одном варианте осуществления ингибитор представляет собой антитело к IL–6, например, химерное моноклональное антитело к IL–6, такое как силтуксимаб. В других вариантах осуществления ингибитор включает растворимый gp130 или его фрагмент, который способен блокировать передачу сигнала с участием IL–6. В некоторых вариантах осуществления sgp130 или его фрагмент сливают с гетерологичным доменом, например, доменом Fc, например, представляет собой слитый белок gp130–Fc, такой как FE301. В вариантах осуществления ингибитор передачи сигнала с участием IL–6 представляет собой антитело, например, антитело к рецептору IL–6, такое как сарилумаб, олокизумаб (CDP6038), элсилимомаб, сирукумаб (CNTO 136), ALD518/BMS–945429, ARGX–109 или FM101. В некоторых вариантах осуществления ингибитор передачи сигнала с участием IL–6 представляет собой малую молекулу, такую как CPSI–2364.
Иллюстративные вазоактивные лекарственные препараты включают без ограничения ангиотензин–11, эндотелин–1, альфа–адренергические агонисты, простаноиды, ингибиторы фосфодиэстеразы, антагонисты эндотелина, инотропы (например, адреналин, добутамин, изопреналин, эфедрин), сосудосуживающие средства (например, норадреналин, вазопрессин, метараминол, метиленовый синий), инодилаторы (например, милринон, левосимендан) и дофамин.
Иллюстративные сосудосуживающие средства включают без ограничения норэпинефрин, дофамин, фенилэфрин, эпинефрин и вазопрессин. В некоторых вариантах осуществления высокодозное сосудосуживающее средство включает одно или несколько из следующего: монотерапию норэпинефрином при ≥20 мкг/мин., монотерапию дофамином при ≥10 мкг/кг/мин., монотерапию фенилэфрином при ≥200 мкг/мин и/или монотерапию эпинефрином при ≥10 мкг/мин. В некоторых вариантах осуществления в случае, если субъект принимает вазопрессин, то высокодозное сосудосуживающее средство включает вазопрессин+эквивалент норэпинефрина ≥10 мкг/мин., при этом доза эквивалента норэпинефрина = [норэпинефрин (мкг/мин.)] + [дофамин (мкг/кг/мин.) / 2] + [эпинефрин (мкг/мин.)] + [фенилэфрин (мкг/мин.) / 10]. В некоторых вариантах осуществления в случае, если субъект принимает комбинацию сосудосуживающих средств (не вазопрессин), то высокодозное сосудосуживающее средство включает вазопрессин+эквивалент норэпинефрина ≥20 мкг/мин, при этом доза эквивалента норэпинефрина = [норэпинефрин (мкг/мин)] + [дофамин (мкг/кг/мин) / 2] + [эпинефрин (мкг/мин)] + [фенилэфрин (мкг/мин) / 10]. См., например, там же.
В некоторых вариантах осуществления низкодозное сосудосуживающее средство представляет собой сосудосуживающее средство, вводимое в дозе, менее одной или нескольких из доз, указанных выше для высокодозных сосудосуживающих средств.
Иллюстративные кортикостероиды включают без ограничения дексаметазон, гидрокортизон и метилпреднизолон. В вариантах осуществления используют дозу дексаметазона 0,5 мг/кг. В вариантах осуществления используют максимальную дозу дексаметазона 10 мг/доза. В вариантах осуществления используют дозу метилпреднизолона 2 мг/кг/день.
Иллюстративные иммунодепрессивные средства включают без ограничения ингибитор TNFα или ингибитор IL–1. В вариантах осуществления ингибитор TNFα представляет собой антитело к TNFα, например, моноклональное антитело, например, инфликсимаб. В вариантах осуществления ингибитор TNFα представляет собой растворимый рецептор TNFα (например, этанерцепт). В вариантах осуществления ингибитор IL–1 или IL–1R представляет собой анакинру.
В некоторых вариантах осуществления субъекту, имеющему риск развития тяжелого CRS, назначают терапию антителом к IFN–гамма или к sIL2Ra, например, молекулу антитела, направленную против IFN–гамма или sIL2Ra.
В вариантах осуществления субъекту, который получал молекулу терапевтического антитела, такого как блинатумомаб, и который имеет CRS или имеет риск развития CRS, молекулу терапевтического антитела вводят в более низкой дозе и/или с меньшей частотой, или введение молекулы терапевтического антитела прекращают.
В вариантах осуществления лечение субъекта, который имеет CRS или имеет риск развития CRS, осуществляют жаропонижающим лекарственным препаратом, таким как ацетаминофен.
В вариантах осуществления субъекту в данном документе вводят или обеспечивают одно или несколько средств терапии CRS, описанных в данном документе, например, одно или несколько из ингибитора IL–6 или ингибиторов рецептора IL–6 (IL–6R) (например, тоцилизумаб), вазоактивных лекарственных препаратов, кортикостероидов, иммунодепрессивных средств или искусственной вентиляции легких, в любой комбинации, например, в комбинации с клеткой, экспрессирующей CAR, описанной в данном документе.
В вариантах осуществления субъекту, который имеет риск развития CRS (например, тяжелого CRS) (например, определен как имеющий статус высокого риска развития тяжелого CRS) вводят одно или несколько средств терапии CRS, описанных в данном документе, например, одно или несколько из ингибитора IL–6 или ингибиторов рецептора IL–6 (IL–6R) (например, тоцилизумаб), вазоактивных лекарственных препаратов, кортикостероидов, иммунодепрессивных средств или искусственной вентиляции легких, в любой комбинации, например, в комбинации с клеткой, экспрессирующей CAR, описанной в данном документе.
В вариантах осуществления субъекта в данном документе (например, субъекта, имеющего риск развития тяжелого CRS, или субъекта, определенного как имеющего риск развития тяжелого CRS) переводят в отделение интенсивной терапии. В некоторых вариантах осуществления субъекта в данном документе (например, субъекта, имеющего риск развития тяжелого CRS, или субъекта, определенного как имеющего риск развития тяжелого CRS) контролируют в отношении одного или нескольких симптомов или состояний, ассоциированных с CRS, таких как лихорадка, повышенная частота сердечных сокращений, коагулопатия, MODS (синдром полиорганной недостаточности), сердечно–сосудистая дисфункция, перераспределительный шок, кардиомиопатия, дисфункция печени, почечная дисфункция, энцефалопатия, клинические судороги, дыхательная недостаточность или тахикардия. В некоторых вариантах осуществления способы в данном документе предусматривают назначение терапии в отношении одного из симптомов или состояний, ассоциированных с CRS. Например, в вариантах осуществления, например, в случае, если субъект проявляет коагулопатию, способ предусматривает введение криопреципитита. В некоторых вариантах осуществления, например, в случае, если субъект проявляет сердечно–сосудистую дисфункцию, способ предусматривает назначение вазоактивной инфузионной поддерживающей терапии. В некоторых вариантах осуществления, например, в случае, если субъект проявляет перераспределительный шок, способ предусматривает назначение терапии альфа–агонистами. В некоторых вариантах осуществления, например, в случае, если субъект проявляет кардиомиопатию, способ предусматривает назначение терапии милриноном. В некоторых вариантах осуществления, например, в случае, если субъект проявляет дыхательную недостаточность, способ предусматривает искусственную вентиляцию легких (например, инвазивную искусственную вентиляцию легких или неинвазивную искусственную вентиляцию легких). В некоторых вариантах осуществления, например, в случае, если субъект проявляет шок, способ предусматривает введение кристаллоидных и/или коллоидных жидкостей.
В вариантах осуществления клетку, экспрессирующую CAR, вводят до, параллельно или после введения одного или нескольких средств терапии CRS, описанных в данном документе, например, одного или нескольких из ингибитора IL–6 или ингибиторов рецептора IL–6 (IL–6R) (например, тоцилизумаба), вазоактивных лекарственных препаратов, кортикостероидов, иммунодепрессивных средств или искусственной вентиляции легких. В вариантах осуществления клетку, экспрессирующую CAR, вводят за 2 недели (например, за 2 недели или за 1 неделю или за 14 дней, например, за 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1 день или меньше) до введения одного или нескольких средств терапии CRS, описанных в данном документе, например, одного или нескольких из ингибиторов IL–6 или ингибиторов рецептора IL–6 (IL–6R) (например, тоцилизумаба), вазоактивных лекарственных препаратов, кортикостероидов, иммунодепрессивных средств или искусственной вентиляции легких. В вариантах осуществления клетку, экспрессирующую CAR, вводят по меньшей мере за или через 1 день (например, по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 1, неделю, 2 недели, 3 недели, 4 недели, 1 месяц, 2 месяца, 3 месяца, 3 месяца или больше) до или после введения одного или нескольких средств терапии CRS, описанных в данном документе, например, одного или нескольких из ингибиторов IL–6 или ингибиторов рецептора IL–6 (IL–6R) (например, тоцилизумаба), вазоактивных лекарственных препаратов, кортикостероидов, иммунодепрессивных средств или искусственной вентиляции легких.
В вариантах осуществления субъекту в данном документе (например, субъекту, имеющему риск развития тяжелого CRS, или субъекту, определенному как имеющему риск развития тяжелого CRS) вводят однократную дозу ингибитора IL–6 или ингибитора рецептора IL–6 (IL–6R) (например, тоцилизумаба). В вариантах осуществления субъекту вводят несколько доз (например, 2, 3, 4, 5, 6 или больше доз) ингибитора IL–6 или ингибитора рецептора IL–6 (IL–6R) (например, тоцилизумаба).
В вариантах осуществления субъекту, который имеет низкий риск развития CRS (например, тяжелого CRS) или не имеет такового (например, определен как имеющий статус низкого риска развития тяжелого CRS) не назначают терапию CRS, описанную в данном документе, например, одно или несколько из ингибитора IL–6 или ингибиторов рецептора IL–6 (IL–6R) (например, тоцилизумаб), вазоактивных лекарственных препаратов, кортикостероидов, иммунодепрессивных средств или искусственной вентиляции легких.
В некоторых вариантах осуществления субъект, лечение которого осуществляли с помощью способов, раскрытых в данном документе, имеет низкую тяжесть CRS, например, степень 1, степень 2 или степень 3.
Фармацевтические композиции
Фармацевтические композиции по настоящему изобретению могут содержать клетку, экспрессирующую CAR, несколько клеток, экспрессирующих CAR, описанных в данном документе, в комбинации с одним или несколькими фармацевтически или физиологически приемлемыми носителями, разбавителями или вспомогательными веществами. Такие композиции могут содержать буферы, такие как нейтральный буферный солевой раствор, фосфатный буферный солевой раствор и т. п.; углеводы, такие как глюкоза, манноза, сахароза или декстраны, маннит; белки; полипептиды или аминокислоты, такие как глицин; антиоксиданты; хелатирующие средства, такие как EDTA или глутатион; вспомогательные средства (например, гидроксид алюминия) и консерванты. Композиции по настоящему изобретению в одном аспекте составляют для внутривенного введения.
Фармацевтические композиции по настоящему изобретению можно вводить с помощью способа, подходящего для заболевания, подлежащего лечению (или предупреждению). Количество и частота введения будут определяться на основании таких факторов, как состояние пациента, а также тип и тяжесть заболевания пациента, хотя подходящие дозы могут быть определены путем клинических исследований.
В одном варианте осуществления фармацевтическая композиция практически не содержит, например, в ней отсутствуют детектируемые уровни заражающего вещества, например, выбранного из группы, состоящий из эндотоксина, микоплазмы, способного реплицироваться лентивируса (RCL), p24, нуклеиновой кислоты VSV–G, gag HIV, гранул, покрытых остаточными антителами к CD3/антителами к CD28, мышиных антител, объединенной сыворотки человека, альбумина бычьей сыворотки, бычьей сыворотки, компонентов культуральных сред, клеточных или плазмидных компонентов для упаковки векторов, бактерии и гриба. В одном варианте осуществления бактерия представляет по меньшей мере таковую, выбранную из группы, состоящей из Alcaligenes faecalis, Candida albicans, Escherichia coli, Haemophilus influenza, Neisseria meningitides, Pseudomonas aeruginosa, Staphylococcus aureus, Streptococcus pneumonia и Streptococcus pyogenes группы A.
Способы лечения
В случае, если указано "иммунологически эффективное количество", "эффективная доза", "противораковое эффективное количество", "эффективное количество, подавляющее рак" или "терапевтическое количество", точное количество композиций по настоящему изобретению, подлежащих введению, может быть определено врачом с учетом индивидуальных различий в возрасте, весе, размере опухоли, степени инфекции или метастазирования и состояния пациента (субъекта).
Доза вышеуказанных средств для лечения, подлежащих введению субъекту, будет варьировать в зависимости от точной природы состояния, лечение которого осуществляют, и реципиента лечения. Определение доз для введения человеку можно осуществлять в соответствии с принятыми в данной области техники практическими подходами. Доза CAMPATH, например, будет, как правило, находиться в диапазоне от 1 до приблизительно 100 мг для взрослого пациента, обычно вводимая ежедневно в течение периода от 1 до 30 дней. Предпочтительная суточная доза составляет от 1 до 10 мг в день, хотя в некоторых случаях могут быть использованы более высокие дозы до 40 мг в день (описанные в патенте США № 6120766).
Введение композиций, описанных в данном документе, может осуществляться с помощью любого подходящего способа, в том числе аэрозольной ингаляции, инъекции, приема внутрь, трансфузии, имплантации или трансплантации. Композиции, описанные в данном документе, можно вводить пациенту трансартериально, подкожно, внутрикожно, внутрь опухоли, интранодально, интрамедуллярно, внутримышечно, с помощью внутривенной (i.v.) инъекции или интраперитонеально. В одном варианте осуществления композиции, описанные в данном документе, например, содержащие клетку, экспрессирующую CAR, и/или ингибитор PD–1, вводят пациенту с помощью внутрикожной или подкожной инъекции. В одном варианте осуществления композиции, описанные в данном документе, например, содержащие клетку, экспрессирующую CAR, и/или ингибитор PD–1, вводят с помощью i.v. инъекции. Композиции, описанные в данном документе, например, содержащие клетку, экспрессирующую CAR, и/или ингибитор PD–1, можно вводить непосредственно в опухоль, лимфатический узел или очаг инфекции.
В целом можно отметить, что фармацевтическая композиция, содержащая иммунные эффекторные клетки, может быть введена в дозе от 104 до 109 клеток/кг веса тела, в некоторых случаях от 105 до 106 клеток/кг веса тела, включая все целочисленные значения в пределах этих диапазонов. Композиции на основе иммунных эффекторных клеток можно также вводить несколько раз в этих дозах. Клетки можно вводить с помощью инфузионных методик, которые являются общеизвестными в иммунотерапии (см., например, Rosenberg et al., New Eng. J. of Med. 319:1676, 1988).
В определенных аспектах может быть желательным вводить активированные иммунные эффекторные клетки субъекту и затем последовательно повторно брать кровь (или осуществлять аферез), активировать из нее клетки в соответствии с настоящим изобретением и проводить повторную инфузию этих активированных и размноженных клеток пациенту. Этот процесс можно осуществлять несколько раз каждые несколько недель. В определенных аспектах клетки можно активировать из образцов крови от 10 куб. см до 400 куб. см. В определенных аспектах клетки активируют из образцов крови, составляющих 20 куб. см, 30 куб. см, 40 куб. см, 50 куб. см, 60 куб. см, 70 куб. см, 80 куб. см, 90 куб. см или 100 куб. см.
В определенном иллюстративном аспекте субъект может подвергаться лейкаферезу, при этом лейкоциты собирают, обогащают или истощают ex vivo для отбора и/или выделения клеток, представляющих интерес, например, T–клеток. Эти изоляты Т–клеток можно размножать с помощью способов, известных из уровня техники, и обрабатывать таким образом, чтобы можно было ввести одну или несколько конструкций CAR по настоящему изобретению, за счет чего обеспечивается создание CAR–T–клетки по настоящему изобретению. Субъекты, нуждающиеся в этом, могут затем подвергаться стандартному лечению посредством высокодозной химиотерапии с последующей трансплантацией стволовых клеток периферической крови. В определенных аспектах после или параллельно с трансплантатом субъекты получают инфузию размноженных клеток, экспрессирующих CAR, по настоящему изобретению. В дополнительном аспекте размноженные клетки вводят до или после хирургического вмешательства.
В одном варианте осуществления CAR вводят в иммунные эффекторные клетки, например, с помощью транскрипции in vitro, и субъект (например, человек) получает исходное введение клеток, экспрессирующих CAR, по настоящему изобретению, и одно или несколько последующих введений клеток, экспрессирующих CAR, по настоящему изобретению, при этом одно или несколько последующих введений выполняют менее чем через 15 дней, например, через 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, или 2 дня после предыдущего введения. В одном варианте осуществления субъекту (например, человеку) обеспечивают более одного введения клеток, экспрессирующих CAR, по настоящему изобретению, в неделю, например, обеспечивают 2, 3 или 4 введения клеток, экспрессирующих CAR, по настоящему изобретению, в неделю. В одном варианте осуществления субъект (например, субъект–человек) получает более одного введения клеток, экспрессирующих CAR, в неделю (например, 2, 3 или 4 введения в неделю) (также называемого в данном документе циклом), с последующим отсутствием в течение недели введения клеток, экспрессирующих CAR, и затем субъекту обеспечивают одно или несколько дополнительных введений клеток, экспрессирующих CAR (например, более одного введения клеток, экспрессирующих CAR, в неделю). В другом варианте осуществления субъект (например, субъект–человек) получает более одного цикла введения клеток, экспрессирующих CAR, а время между каждым циклом составляет менее 10, 9, 8, 7, 6, 5, 4, или 3 дней. В одном варианте осуществления клетки, экспрессирующие CAR, вводят через день в течение 3 введений в неделю. В одном варианте осуществления клетки, экспрессирующие CAR, по настоящему изобретению, вводят в течение по меньшей мере двух, трех, четырех, пяти, шести, семи, восьми или больше недель.
В некоторых вариантах осуществления доза клеток, экспрессирующих CAR (например, клеток, экспрессирующих CAR, описанных в данном документе, например, клеток, экспрессирующих CAR для CD19, описанных в данном документе), составляет от приблизительно 104 до приблизительно 109 клеток/кг, например, от приблизительно 104 до приблизительно 105 клеток/кг, от приблизительно 105 до приблизительно 106 клеток/кг, от приблизительно 106 до приблизительно 107 клеток/кг, от приблизительно 107 до приблизительно 108 клеток/кг или от приблизительно 108 до приблизительно 109 клеток/кг. В вариантах осуществления доза клеток, экспрессирующих CAR, составляет от приблизительно 0,6×106 клеток/кг до приблизительно 2×107 клеток/кг. В некоторых вариантах осуществления доза клеток, экспрессирующих CAR, описанных в данном документе (например, клеток, экспрессирующих CAR для CD19), составляет приблизительно 2×105, 1×106, 1,1×106, 2×106, 3×106, 3,6×106, 5×106, 1×107, 1,8×107, 2×107, 5×107, 1×108, 2×108, 3×108 или 5×108 клеток/кг. В некоторых вариантах осуществления доза клеток с CAR (например, клеток, экспрессирующих CAR для CD19), составляет по меньшей мере приблизительно 1×106, 1,1×106, 2×106, 3,6×106, 5×106, 1×107, 1,8×107, 2×107, 5×107, 1×108, 2×108, 3×108 или 5×108 клеток/кг. В некоторых вариантах осуществления доза клеток с CAR (например, клеток, экспрессирующих CAR для CD19) составляет не более приблизительно 1×106, 1,1×106, 2×106, 3,6×106, 5×106, 1×107, 1,8×107, 2×107, 5×107, 1×108, 2×108, 3×108 или 5×108 клеток/кг. В некоторых вариантах осуществления доза клеток с CAR (например, клеток, экспрессирующих CAR для CD19) составляет приблизительно 1,1×106–1,8×107 клеток/кг. В некоторых вариантах осуществления доза клеток с CAR (например, клеток, экспрессирующих CAR для CD19) составляет приблизительно 1×107, 2×107, 5×107, 1×108, 2×108, 3×108, 5×108, 1×109, 2×109 или 5×109 клеток. В некоторых вариантах осуществления доза клеток с CAR (например, клеток, экспрессирующих CAR для CD19) составляет по меньшей мере приблизительно 1×107, 2×107, 5×107, 1×108, 2×108, 3×108, 5×108, 1×109, 2×109 или 5×109 клеток. В некоторых вариантах осуществления доза клеток с CAR (например, клеток, экспрессирующих CAR для CD19) составляет не более приблизительно 1×107, 2×107, 5×107, 1×108, 2×108, 3×108, 5×108, 1×109, 2×109 или 5×109 клеток.
В некоторых вариантах осуществления доза клеток с CAR (например, клеток, экспрессирующих CAR для CD19), составляет не более приблизительно 1×107, 1,5×107, 2×107, 2,5×107, 3×107, 3,5×107, 4×107, 5×107, 1×108, 1,5×108, 2×108, 2,5×108, 3×108, 3,5×108, 4×108, 5×108, 1×109, 2×109 или 5×109 клеток. В некоторых вариантах осуществления доза клеток с CAR (например, клеток, экспрессирующих CAR для CD19) составляет не более от приблизительно 1–3×107 до 1–3×108. В некоторых вариантах осуществления субъекту вводят приблизительно 1–3×107 клеток, экспрессирующих CAR для CD19. В других вариантах осуществления субъекту вводят приблизительно 1–3×108 клеток, экспрессирующих CAR для CD19.
В некоторых вариантах осуществления доза клеток, экспрессирующих CAR (например, клеток, экспрессирующих CAR, описанных в данном документе, например, клеток, экспрессирующих CAR для CD19, описанных в данном документе), составляет от приблизительно 1×106 клеток/м2 до приблизительно 1×109 клеток/м2, например, от приблизительно 1×107 клеток/м2 до приблизительно 5×108 клеток/м2, например, приблизительно 1,5×107 клеток/м2, приблизительно 2×107 клеток/м2, приблизительно 4,5×107 клеток/м2, приблизительно 108 клеток/м2, приблизительно 1,2×108 клеток/м2 или приблизительно 2×108 клеток/м2.
В вариантах осуществления клетки, экспрессирующие CAR для CD19, вводят в нескольких дозах, например, первой дозе, второй дозе и необязательно третьей дозе. В вариантах осуществления способ предусматривает лечение субъекта (например, взрослого субъекта), имеющего рак (например, острый лимфобластный лейкоз (ALL)), предусматривающее введение субъекту первой дозы, второй дозы и необязательно одной или нескольких дополнительных доз, при этом каждая доза содержит иммунные эффекторные клетки, экспрессирующие молекулу CAR, например, молекулу CAR для CD19, например, молекулу CAR в соответствии с SEQ ID NO: 108.
В вариантах осуществления способ предусматривает введение дозы 2–5×106 жизнеспособных экспрессирующих CAR клеток/кг, при этом субъект имеет вес тела менее 50 кг; или
введение дозы 1,0–2,5×108 жизнеспособных клеток, экспрессирующих CAR, при этом субъект имеет вес тела по меньшей мере 50 кг.
В вариантах осуществления субъекту, например, педиатрическому субъекту, вводят однократную дозу.
В вариантах осуществления дозы вводят в последовательные дни, например, первую дозу вводят в день 1, вторую дозу вводят в день 2 и необязательную третью дозу (при введении) вводят в день 3.
В вариантах осуществления вводят четвертую, пятую или шестую дозы или больше доз.
В вариантах осуществления первая доза составляет приблизительно 10% от суммарной дозы, вторая доза составляет приблизительно 30% от суммарной дозы и третья доза составляет приблизительно 60% от суммарной дозы, при этом вышеупомянутые проценты в сумме составляют 100%. В вариантах осуществления первая доза составляет приблизительно 9–11%, 8–12%, 7–13%, или 5–15% от суммарной дозы. В вариантах осуществления вторая доза составляет приблизительно 29–31%, 28–32%, 27–33%, 26–34%, 25–35%, 24–36%, 23–37%, 22–38%, 21–39%, или 20–40% от суммарной дозы. В вариантах осуществления третья доза составляет приблизительно 55–65%, 50–70%, 45–75%, или 40–80% от суммарной дозы. В вариантах осуществления суммарная доза обозначает суммарное число жизнеспособных клеток, экспрессирующих CAR, вводимых в течение 1 недели, 2 недель, 3 недель или 4 недель. В некоторых вариантах осуществления, в которых вводят две дозы, суммарная доза обозначает сумму числа жизнеспособных клеток, экспрессирующих CAR, вводимых субъекту в первой и второй дозах. В некоторых вариантах осуществления, в которых вводят три дозы, суммарная доза обозначает сумму числа жизнеспособных клеток, экспрессирующих CAR, вводимых субъекту в первой, второй и третьей дозах.
В вариантах осуществления дозу измеряют в соответствии с числом жизнеспособных клеток, экспрессирующих в них CAR. Экспрессию CAR можно измерить, например, с помощью проточной цитометрии с использованием молекулы антитела, которая связывает молекулу CAR, и детектируемой метки. Жизнеспособность можно измерять, например, с помощью Cellometer.
В вариантах осуществления жизнеспособные клетки, экспрессирующие CAR, вводят в возрастающих дозах. В вариантах осуществления вторая доза является большей, чем первая доза, например, больше на 10%, 20%, 30%, или 50%. В вариантах осуществления вторая доза составляет в два раза, в три раза, в четыре раза или в пять раз больше размера первой дозы. В вариантах осуществления третья доза является большей, чем вторая доза, например, больше на 10%, 20%, 30% или 50%. В вариантах осуществления третья доза составляет в два раза больше, в три раза больше, в четыре раза больше или в пять раз больше размера второй дозы.
В определенных вариантах осуществления способ предусматривает одно, два, три, четыре, пять, шесть, семь или все из a)–h) из следующего:
a) число вводимых экспрессирующих CAR жизнеспособных клеток в первой дозе составляет не более 1/3 числа экспрессирующих CAR жизнеспособных клеток во второй дозе;
b) число вводимых экспрессирующих CAR жизнеспособных клеток в первой дозе составляет не более 1/X, где X представляет собой 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40 или 50, от суммарного числа вводимых экспрессирующих CAR жизнеспособных клеток;
c) число вводимых экспрессирующих CAR жизнеспособных клеток в первой дозе составляет не более 1×107, 2×107, 3×107, 4×107, 5×107, 6×107, 7×107, 8×107, 9×107, 1×108, 2×108, 3×108, 4×108 или 5×108 экспрессирующих CAR жизнеспособных клеток, а вторая доза является большей, чем первая доза;
d) число вводимых экспрессирующих CAR жизнеспособных клеток во второй дозе составляет не более 1/2 числа экспрессирующих CAR жизнеспособных клеток в третьей дозе;
e) число вводимых экспрессирующих CAR жизнеспособных клеток во второй дозе составляет не более 1/Y, где Y представляет собой 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40 или 50, от суммарного числа вводимых экспрессирующих CAR жизнеспособных клеток;
f) число вводимых экспрессирующих CAR жизнеспособных клеток во второй дозе составляет не более 1×107, 2×107, 3×107, 4×107, 5×107, 6×107, 7×107, 8×107, 9×107, 1×108, 2×108, 3×108, 4×108 или 5×108 экспрессирующих CAR жизнеспособных клеток, а третья доза является большей, чем вторая доза;
h) дозы и периоды времени введения первой, второй и необязательно третьей доз выбирают таким образом, что субъект испытывает CRS на уровне не более 4, 3, 2 или 1.
В вариантах осуществления суммарная доза составляет приблизительно 5×108 экспрессирующих CAR жизнеспособных клеток. В вариантах осуществления суммарная доза составляет приблизительно 5×107–5×108 экспрессирующих CAR жизнеспособных клеток. В вариантах осуществления первая доза составляет приблизительно 5×107 (например, ± 10%, 20% или 30%) экспрессирующих CAR жизнеспособных клеток, вторая доза составляет приблизительно 1,5×108 (например, ± 10%, 20% или 30%) экспрессирующих CAR жизнеспособных клеток и третья доза составляет приблизительно 3×108 (например, ± 10%, 20% или 30%) экспрессирующих CAR жизнеспособных клеток.
В вариантах осуществления субъекта оценивают в отношении CRS после получения дозы, например, после получения первой дозы, второй дозы и/или третьей дозы.
В вариантах осуществления субъект получает средство для лечения CRS, например, тоцилизумаб, кортикостероид, этанерцепт или силтуксимаб. В вариантах осуществления средство для лечения CRS вводят до или после первой дозы клеток, содержащих молекулу CAR. В вариантах осуществления средство для лечения CRS вводят до или после второй дозы клеток, содержащих молекулу CAR. В вариантах осуществления средство для лечения CRS вводят до или после третьей дозы клеток, содержащих молекулу CAR. В вариантах осуществления средство для лечения CRS вводят между первой и второй дозами клеток, содержащих молекулу CAR, и/или между второй и третьей дозами клеток, содержащих молекулу CAR.
В вариантах осуществления субъекту, имеющему CRS после первой дозы, например, CRS степени 1, 2, 3 или 4, вторую дозу вводят по меньшей мере через 2, 3, 4 или 5 дней после первой дозы. В вариантах осуществления субъекту, имеющему CRS после второй дозы, например, CRS степени 1, 2, 3 или 4, третью дозу вводят по меньшей мере через 2, 3, 4 или 5 дней после второй дозы. В вариантах осуществления у субъекта, имеющего CRS после первой дозы, вторую дозу клеток, экспрессирующих CAR, задерживают по отношению к тому, когда вводили бы вторую дозу, в случае, если бы субъект не имел CRS. В вариантах осуществления у субъекта, имеющего CRS после второй дозы, третью дозу клеток, экспрессирующих CAR, задерживают по отношению к тому, когда вводили бы третью дозу, в случае, если бы субъект не имел CRS.
В вариантах осуществления субъект имеет рак с высокой бременем заболевания до того, как вводят первую дозу. В вариантах осуществления субъект имеет уровни бластных клеток костного мозга по меньшей мере 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, или 50%, например, по меньшей мере 5%. В вариантах осуществления субъект имеет рак I, II, III или IV стадии. В вариантах осуществления субъект имеет опухолевую массу по меньшей мере 1, 2, 5, 10, 20, 50, 100, 200, 500, или 1000 г, например, в отдельной опухоли или во множестве опухолей.
В некоторых вариантах осуществления субъект имеет рак (например, солидный рак или гематологический рак, описанные в данном документе). В варианте осуществления субъект имеет CLL. В вариантах осуществления субъект имеет ALL. В других вариантах осуществления субъект имеет множественную миелому.
В одном варианте осуществления рак представляет собой заболевание, ассоциированное с экспрессией CD19, например, описанное в данном документе. В других вариантах осуществления рак представляет собой заболевание, ассоциированное с опухолевым антигеном, например, описанным в данном документе. В вариантах осуществления молекула CAR представляет собой молекулу CAR, описанную в данном документе.
В одном аспекте клетки, экспрессирующие CAR, например, клетки, экспрессирующие CAR для CD19, получают с помощью вирусных векторов на основе лентивирусов, таких как лентивирус. Клетки, экспрессирующие CAR, полученные таким путем, будут иметь стабильную экспрессию CAR.
В одном аспекте клетки, экспрессирующие CAR, временно экспрессируют векторы CAR в течение 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 дней после трансдукции. Временная экспрессия CAR может осуществляться с помощью доставки вектора на основе РНК CAR. В одном аспекте РНК CAR трансдуцируют в T–клетку путем электропорации.
Потенциальной проблемой, которая может возникать у пациентов, лечение которых осуществляют с помощью временно экспрессирующих клеток, экспрессирующих CAR (в частности, клеток, экспрессирующих CAR, несущих мышиный scFv), является анафилаксия после нескольких лечений.
Не ограничиваясь данной теорией, считается, что такой анафилактический ответ может быть вызван в результате того, что пациент проявляет гуморальный ответ в отношении CAR, т. е. антитела к CAR, имеющие изотип антитела к IgE. Считается, что клетки пациента, вырабатывающие антитела, подвергаются переключению классов с изотипа IgG (который не вызывает анафилаксии) к изотипу IgE, когда существует перерыв от десяти до четырнадцати дней от воздействия антигена.
Если пациент имеет высокий риск развития ответа на антитела к CAR во время курса временной терапии CAR (такого как таковые, развивающиеся в результате трансдукций РНК), то перерывы между инфузиями клеток, экспрессирующих CAR, не должны длиться более десяти – четырнадцати дней.
Использование CAR с человеческими (вместо мышиных) scFv может снижать вероятность и интенсивность наличия у пациента ответа на антитела к CAR.
Дозировки и терапевтические схемы приема ингибитора PD–1, например, молекулы антитела к PD–1, могут быть определены специалистом в данной области техники. Подходящие дозировки используемых молекул будут зависеть от возраста и веса субъекта и определенного используемого лекарственного средства.
Способы введения молекул антител известны из уровня техники и описаны ниже. Подходящие дозировки используемых молекул будут зависеть от возраста и веса субъекта и определенного используемого лекарственного средства. Дозировки и терапевтические схемы приема молекулы антитела к PD–1 могут быть определены специалистом в данной области техники.
В определенных вариантах осуществления молекулу антитела к PD–1 вводят путем инъекции (например, подкожно или внутривенно) в дозе от приблизительно 1 до 30 мг/кг, например, от приблизительно 5 до 25 мг/кг, от приблизительно 10 до 20 мг/кг, от приблизительно 1 до 5 мг/кг или приблизительно 3 мг/кг. В некоторых вариантах осуществления молекулу антитела к PD–1 вводят в дозе приблизительно 1 мг/кг, приблизительно 3 мг/кг, приблизительно 5 мг/кг, приблизительно 10 мг/кг, приблизительно 20 мг/кг, приблизительно 30 мг/кг или приблизительно 40 мг/кг. В некоторых вариантах осуществления молекулу антитела к PD–1 вводят в дозе приблизительно 1–3 мг/кг или приблизительно 3–10 мг/кг. В некоторых вариантах осуществления молекулу антитела к PD–1 вводят в дозе приблизительно 0,5–2, 2–4, 2–5, 5–15, или 5–20 мг/кг. Схема дозирования может варьировать, например, от одного раза в неделю до одного раза в 2, 3 или 4 недели. В одном варианте осуществления молекулу антитела к PD–1 вводят в дозе приблизительно 10–20 мг/кг один раз в две недели. В другом варианте осуществления молекулу антитела к PD–1 вводят в дозе приблизительно 1 мг/кг один раз в две недели, приблизительно 3 мг/кг один раз в две недели, 10 мг/кг один раз в две недели, 3 мг/кг один раз в четыре недели или 5 мг/кг один раз в четыре недели.
В других вариантах осуществления молекулу антитела к PD–1 вводят с помощью инъекции (например, подкожно или внутривенно) в дозе (например, фиксированной дозе) от приблизительно 200 мг до 500 мг, например, от приблизительно 250 мг до 450 мг, от приблизительно 300 мг до 400 мг, от приблизительно 250 мг до 350 мг, от приблизительно 350 мг до 450 мг или приблизительно 300 мг или приблизительно 400 мг. В некоторых вариантах осуществления молекулу антитела к PD–1 вводят в дозе приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг или приблизительно 500 мг. В некоторых вариантах осуществления антитело к PD1 вводят в дозе 200 или 300 мг. В некоторых вариантах осуществления молекулу антитела к PD–1 вводят в дозе приблизительно 250–450 мг или приблизительно 300–400 мг. В некоторых вариантах осуществления молекулу антитела к PD–1 вводят в дозе приблизительно 200–300 мг, 250–350 мг, 300–400 мг, 350–450 мг или 400–500 мг. Схема дозирования может варьировать, например, от одного раза в неделю до одного раза в 2, 3, 4, 5 или 6 недель. В одном варианте осуществления молекулу антитела к PD–1 вводят в дозе от приблизительно 300 до 400 мг один раз в три недели или один раз в четыре недели. В одном варианте осуществления молекулу антитела к PD–1 вводят в дозе от приблизительно 300 мг один раз в три недели. В одном варианте осуществления молекулу антитела к PD–1 вводят в дозе от приблизительно 400 мг один раз в четыре недели. В одном варианте осуществления молекулу антитела к PD–1 вводят в дозе от приблизительно 300 мг один раз в четыре недели. В одном варианте осуществления молекулу антитела к PD–1 вводят в дозе от приблизительно 400 мг один раз в три недели. Антитело к PD–1 можно вводить один или несколько раз, например, один, два, три, четыре, пять, шесть, семь или больше раз. В одном варианте осуществления молекулу антитела к PD–1 вводят шесть раз. Антитело к PD–1 можно вводить через по меньшей мере 5 дней, например, приблизительно 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 20, 25, 30, 35, или 40 дней после введения клеток, экспрессирующих CAR, например, клеток, экспрессирующих CAR для CD19 (например, CLT019 или CTL119) или BCMA. В некоторых вариантах осуществления антитело к PD–1 можно вводить через приблизительно 8 дней или через приблизительно 15 дней после введения клеток, экспрессирующих CAR, например, клеток, экспрессирующих CAR для CD19 (например, CLT019 или CTL119), или клеток, экспрессирующих CAR для BCMA.
Молекулы антител можно вводить различными способами, известными из уровня техники, хотя для многих терапевтических применений предпочтительным путем/способом введения является внутривенная инъекция или инфузия. Например, молекулы антител можно вводить с помощью внутривенной инфузии со скоростью, составляющей более 20 мг/мин., например, 20–40 мг/мин., и в типичном случае равной 40 мг/мин. или больше, с достижением дозы от приблизительно 35 до 440 мг/м2, в типичном случае от приблизительно 70 до 310 мг/м2 и в более типичном случае от приблизительно 110 до 130 мг/м2. В вариантах осуществления молекулы антитела можно вводить с помощью внутривенной инфузии со скоростью, составляющей менее 10 мг/мин., предпочтительно равной 5 мг/мин. или меньше, с достижением дозы от приблизительно 1 до 100 мг/м2, предпочтительно от приблизительно 5 до 50 мг/м2, от приблизительно 7 до 25 мг/м2 и более предпочтительно приблизительно 10 мг/м2. Как будет понятно специалисту в данной области техники, путь и/или способ введения будет варьироваться в зависимости от необходимых результатов. В определенных вариантах осуществления активное соединение может быть получено с носителем, который будет защищать соединение от быстрого высвобождения, например, состав с контролируемым высвобождением, в том числе имплантанты, трансдермальные пластыри и микроинкапсулированные системы доставки. Можно применять биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, сложные полиортоэфиры и полимолочная кислота. Многие способы получения таких составов запатентованы или общеизвестны для специалистов в данной области техники. См., например, Sustained and Controlled Release Drug Delivery Systems, J. R. Robinson, ed., Marcel Dekker, Inc., New York, 1978.
Молекулу антитела можно вводить с помощью внутривенной инфузии со скоростью, составляющей более 20 мг/мин., например, 20–40 мг/мин., и в типичном случае равной 40 мг/мин. или больше, с достижением дозы от приблизительно 35 до 440 мг/м2, в типичном случае от приблизительно 70 до 310 мг/м2 и в более типичном случае от приблизительно 110 до 130 мг/м2. В вариантах осуществления при скорости инфузии приблизительно 110–130 мг/м2 достигается уровень приблизительно 3 мг/кг. В других вариантах осуществления молекулу антитела можно вводить с помощью внутривенной инфузии со скоростью, составляющей менее 10 мг/мин., например, равной 5 мг/мин. или меньше, с достижением дозы от приблизительно 1 до 100 мг/м2, например, от приблизительно 5 до 50 мг/м2, от приблизительно 7 до 25 мг/м2 или приблизительно 10 мг/м2. В некоторых вариантах осуществления антитело вводят посредством инфузии в течение периода, составляющего приблизительно 30 мин.
Следует отметить, что значения дозировок могут варьировать в зависимости от типа и тяжести состояния, подлежащего облегчению. Следует также понимать, что для любого конкретного субъекта конкретные схемы дозировки должны корректироваться во времени в соответствии с индивидуальной потребностью и профессиональным суждением лица, осуществляющего или контролирующего введение композиции, и что диапазоны дозировок, указанные в данном документе, являются лишь иллюстративными и не предназначены для ограничения объема или практического применения заявленной композиции.
ПРИМЕРЫ
Настоящее изобретение дополнительно подробно описано посредством ссылки на следующие экспериментальные примеры. Эти примеры предусмотрены лишь в целях иллюстрации и не предусматривают ограничительный характер, если не указано иное. Таким образом, настоящее изобретение не следует воспринимать как ограниченное следующими примерами, а, наоборот, необходимо воспринимать как охватывающее любые и все вариации, которые становятся очевидными, исходя из идеи, предусмотренной в данном документе.
Пример 1. Клетка, экспрессирующая CAR для CD19, и ингибитор PD–1 снижали опухолевую нагрузку у субъекта–человека
Женщину в возрасте 34 лет с фолликулярной лимфомой, трансформированной в "двухударную" DLBCL, лечили посредством инфузии клеток CART для CD19 в комбинации с антагонистом PD–1. Женщина ранее перенесла одиннадцать линий химиотерапии и иммунотерапии, в том числе аллогенный трансплантат костного мозга, однако была невосприимчивой к предшествующей терапии. Женщина перенесла лимфоистощающую химиотерапию (например, карбоплатин и гемцитабин) до введения клетки CART для CD19 (CTL019). Женщине вводили CTL019 с последующей лучевой терапией, а затем антагонист PD–1, пембролизумаб (гуманизированное моноклональное антитело IgG4 к PD–1). Биоптат отбирали между введением CTL019 и лучевой терапией – биоптат анализировали с помощью проточной цитометрии, иммуногистохимического анализа (IHC) и флуоресцентной гибридизации in situ (FISH). При проточной цитометрии образец был положительным в отношении легкой каппа–цепи, CD10 и CD19. При IHC образец имел крупные PAX5+ B–клетки и был PDL1+. При FISH образец имел реаранжированный c–MYC и BCL–2. Второй биоптат отбирали после лечения пембролизумабом. Во втором биоптате наблюдали обширный некроз и не выявляли опухоль. Таким образом, данные показывают, что комбинация клетки CART для CD19 с антагонистом PD–1 была эффективной в снижении опухолевой нагрузки у человека.
Пример 2. Характеристика антагониста PD–1, PDR–001
PDR–001 представляет собой гуманизированное моноклональное антитело человека, направленное в отношении PD–1 человека. PDR–001 имеет стабилизирующую мутацию в шарнирной области для предупреждения диссоциации молекулы и образования полуантител. PDR–001 принадлежит к подклассу изотипа IgG4/каппа.
PDR–001 характеризовали in vitro в отношении его аффинности и активности в отношении PD–1 человека. PDR–001 экспрессировали в линии клеток CHO. PDR–001 связывалось с высокой аффинностью с PD–1 человека. При анализах Biacore Kd PDR–001 в отношении PD–1 человека составляла 0,83 нМ. В анализах по стимуляции лимфоцитов с использованием крови человека ex vivo PDR–001 усиливало продуцирование интерлейкина–2 (IL–2) примерно в 2 раза в ответ на стимуляцию суперантигеном энтеротоксином B Staphylococcus (SEB). PDR–001 не реагировало перекрестно с PD–1 грызунов, однако перекрестно реагировало с PD–1 макака–крабоеда и было функционально активным, тем самым делая макаку–крабоеда релевантным видом для токсикологических исследований. Аффинность PDR–001 в отношении PD–1 макака–крабоеда составляла 0,93 нM, что является аналогичным Kd для PD–1 человека.
Кроме того, доклинический токсикологический эффект PDR–001 оценивали в пятинедельном токсикологическом исследовании, соответствующем надлежащей лабораторной практике (GLP), у макака–крабоеда с фармакологическими конечными точками безопасности и восьминедельным восстановлением. Дозы до 100 мг/кг/неделю оценивали без прижизненного изучения связанной с лекарственным средством смертности, изменений веса органов или макроскопических результатов. При максимальных исследуемых дозах отмечали макрофагальные инфильтраты в селезенке и ограниченные мононуклеарные инфильтраты в сосудистом и периваскулярном пространстве.
Пример 3. Клинические результаты с использованием PDR–001
Клиническое исследование осуществляли в отношении PDR–001 у пациентов с запущенными злокачественными новообразованиями. Пациенты получали лечение при уровне доз 1, 3 и 10 мг/кг Q2W и 3 и 5 мг/кг Q4W. Никто из пациентов не испытывал дозолимитирующей токсичности, и профиль токсичности, по–видимому, был аналогичным таковому доступных на рынке ингибиторов PD–1. Фармакокинетические данные, полученные на основании повышения дозы и моделирования данных о воздействии, подтверждали применение фиксированной дозировки в случае PDR–001, составляющей 400 мг, вводимой каждые 4 недели. Остаточные концентрации (Ctrough) находились в соответствии с наблюдаемыми средними остаточными концентрациями в равновесном состоянии в случае пембролизумаба, который одобрен как обладающий значительной эффективностью при нескольких типах рака. Данные также подтверждали применение 300 мг Q3W в качестве альтернативного режима дозирования, например, в комбинированных режимах лечения.
Пример 4. Клиническое исследование с использованием комбинации CTL019 и PDR–001
Субъекты в исследовании имеют диффузную B–крупноклеточную лимфому (DLBCL), которая была идентифицирована в виде CD19+. Субъекты имеют одну или несколько из следующих характеристик: (i) остаточное заболевание после первичной терапии и соответственно не пригодные для аутологичного трансплантата стволовых клеток; (ii) рецидивирующее или персистирующее заболевание после предшествующего аутологичного трансплантата стволовых клеток; (iii) без первого полного ответа (CR) в случае рецидивирующего или персистирующего заболевания и не пригодные или не подходящие для стандартного аллогенного или аутологичного трансплантата стволовых клеток; и/или (iv) в анамнезе фолликулярная лимфома или CLL/SLL.
Субъекты получают инфузию CART–19 (например, клетки CTL019, например, описанные подробно в данном документе). Клетки CART–19 криоконсервируют в подходящей для инфузии криосреде и вводят в виде однократной инфузии. Каждый пакет клеток содержит криосреды, содержащие следующие реагенты подходящей для инфузии степени (% об./об.): 31,25% плазмалит–A, 31,25% декстрозы (5%), 0,45% NaCl, не более 7,5% DMSO, 1% декстрана 40 и 5% человеческого сывороточного альбумина. Однократную дозу клеток CART–19 вводят внутривенно путем инфузии, содержащей 1–5×108 клеток, трансдуцированных вектором CD19 TCRζ/4–1BB. Инфузию осуществляют через примерно 1–4 дня после химиотерапии. CART–19 представляет собой мышиную CART–19 (например, CTL019).
Субъекты также получают PDR–001. PDR–001 экспрессируется в клетках CHO. Состав PDR–001 представляет собой лиофилизированный порошок во флаконе, 100 мг/лиофилизата на флакон. После растворения лиофилизированного порошка посредством 1,0 мл воды для инъекций полученный раствор содержит 100 мг/мл PDR–001, гистидин/гистидин–HCl, сахарозу, полисорбат–20 при pH 5,5. Если не появляется синдром высвобождения цитокинов (CRS), то PDR–001 вводят после инфузии CART–19. Если CRS появляется после инфузии CART–19, то PDR–001 вводят после регрессии CRS.
Пример 5. Низкодозное RAD001 стимулирует пролиферацию CART в модели культуры клеток
Эффект низких доз RAD001 в отношении пролиферации CAR–T–клетки in vitro описан, например, в примере 8 в US2016/0096892A1, и полный объем заявки включен в данный документ посредством ссылки.
Пример 6. Низкодозное RAD001 стимулирует размножение CART in vivo
Эффект низкодозного RAD001 в отношении размножения CART in vivo описан, например, в примере 9 в US2016/0096892A1, и полный объем заявки включен в данный документ посредством ссылки.
Пример 7. Блокада PD–1 модулировала Т–клетки, модифицированные химерным антигенным рецептором (CAR), и индуцировала регрессию опухоли
Антитела, блокирующие рецептор 1 программируемой смерти клетки (PD–1) в T–клетках, вызывают регрессию опухоли в нескольких видах рака в результате нарушения иммунной ингибирующей оси PD–L1/PD–1. См., например, Topalian et al. N. Engl J Med 2012;366:2443–54; Brahmer et al. N Engl J Med 2012;366:2455–65; Hamid, et al. N Engl J Med 2013;369:134–44; Wolchok, et al. N Engl J Med 2013;369:122–33 и Topalian, et al. J Clin Oncol 2014;32:1020–30. Этот подход к иммунотерапии рака может быть эффективным партнером для средств терапии на основе Т–клеток, модифицированных химерным антигенным рецептором (CAR), однако эту комбинацию еще не исследовали. В этом примере описаны эксперименты, в которых блокирующее антитело к PD–1 вводили пациенту с резистентной диффузной B–крупноклеточной лимфомой (DLBCL) и прогрессирующей лимфомой после терапии Т–клетками, модифицированными CAR, направленными в отношении CD19 (CART19). После блокады PD–1 пациент имел устойчивый противоопухолевый ответ, размножение клеток CART19 и снижение совместной экспрессии PD–1 и Eomes клетками CART19. Эти результаты свидетельствуют о том, что антитело к PD–1 может быть высокоэффективным против видов рака, не отвечающих на терапию Т–клетками, модифицированными CAR. Это также свидетельствуют о том, что путь с участием PD–1 может быть важным в определении ответа на иммунотерапию Т–клетками, модифицированными CAR.
Мужчину в возрасте 35 лет, получавшего ранее несколько раз лечение от резистентной DLBCL первичного медиастинального происхождения с экстранодальным вовлечением тонкой кишки при диагностике и средостения, легкого, миокарда и перикарда при прогрессировании, лечили во время клинического исследования Университета Пенсильвании аутологичными клетками CART19, экспрессирующими scFv к CD19 и 4–1BB – CD3ζ костимулирующими и активирующими доменами (NCT02030834). См. Schuster et al. Blood 2015;126(23):183(обзор). Клетки CART19 получали, как описано ранее. См., например, Porter Sci Transl Med 2015;7(303):303ra139 и Milone et al. Mol Ther 2009;17(8):1453–64. Пациент получал лимфоистощающую терапию с помощью гиперфракционированного циклофосфамида (300 мг/м2×6 доз) с последующей инфузией аутологичных клеток CART19 (5×108 клеток CART19 или 5,34×106 клеток/кг) 16 октября 2015 г. Последующее CT–сканирование грудной клетки, выполненное 11 ноября 2015 г., для оценки ухудшения диспноэ показало прогрессирующую лимфому с увеличением медиастинальной и периферической опухоли, а также новых и увеличивающихся легочных узлов (ФИГ. 1A). MRI сердца показало инвазию миокарда и перикарда. С учетом клинического статуса пациента с быстро прогрессирующей гипоксией и дыхательной недостаточностью, медиастиноскопию или торакоскопическую биопсию легкого не проводили. Таким образом, не было возможным исключить псевдопрогрессирование как причину увеличения медиастинальных лимфатических узлов и повреждений легочной паренхимы после CTL019. 11 ноября 2015 г. он получил 2 мг/кг пембролизумаба. Пембролизумаб выбрали в качестве средства терапии в связи с доклиническими данными, указывающими на то, что терапия антителами к PD–1 существенно повышает уничтожение развившихся опухолей генетически модифицированными T–клетками (см., например, John et al. Clin Cancer Res 2013;19(20):5636–46) и опухолевыми клетками пациента, значительно экспрессирующими PD–L1 (ФИГ. 1B). Помимо лихорадки, терапия переносилась хорошо. 30 ноября 2015 г. отмечали значительное клиническое улучшение; CT грудной клетки в это время показала интервальное улучшение множества легочных узлов, плеврального выпота, медиастинальной лимфаденопатии и узелковых уплотнений перикарда (ФИГ. 1A). Таким образом, псевдопрогрессирование после CART19 считалось маловероятным, поскольку наблюдалось уменьшение размера очага после введения пембролизумаба, а не дополнительное прогрессирование. Через 3 недели после терапии он смог вернуться к работе. Пембролизумаб, 2 мг/кг, продолжали вводить каждые 3 недели; PET/CT сканирования 22 декабря 2015 г. и 20 апреля 2016 г. показали непрерывное анатомическое улучшение медиастинальной аденопатии с остаточным захватом FDG (частичный метаболический ответ); произошла регрессия легочного вовлечения в результате лимфомы. Через двенадцать месяцев после начала лечения пембролизумабом пациент продолжает находиться в удовлетворительном клиническом состоянии.
Периферическую кровь анализировали в отношении изменений ДНК CART19 с помощью qPCR (данные не показаны), процента клеток CART19 с помощью проточной цитометрии и изменений цитокинов в сыворотке крови (ФИГ. 2A–2B). См. Porter et al. Sci Transl Med 2015;7(303):303ra139. Число копий ДНК CART19 повышалось максимум до 2350 копий на мкг ДНК после инфузии клеток CART19 и повышалось повторно от 497 копий на мкг в день 14 до введения пембролизумаба до 1530 копий на мкг в день 26 после введения пембролизумаба при видимом длительном повышении после начала лечения пембролизумабом. Процент Т–клеток, экспрессирующих CAR19, повышался после инфузии CART19, стабилизировался около 10–14–го дня; однако, максимальные проценты CAR19+ T–клеток наблюдали через 48 часов после введения пембролизумаба (ФИГ. 2A). Это указывает на повышение как CAR19+ CD8+, так и CD4+ T–клеток после введения пембролизумаба, в частности, CART19+CD8+ клеток (данные не показаны). Максимальные уровни IL–6 в сыворотке крови наблюдали через 3–7 дней после инфузии CART19 и в течение 24 часов после введения пембролизумаба (ФИГ. 2B). После инфузии пембролизумаба число клеток CART19, коэкспрессирующих PD1/Eomes, снижалось, среди CD4+ CART19+ клеток (ФИГ. 2E, 2I и 2J) и CD8+ CART19+ клеток (ФИГ. 2F, 2K и 2L). Изменений в клетках, коэкспрессирующих PD–1 и CTLA4, TIM3 или LAG3, не наблюдали (данные не показаны). Экспрессия гранзима B+ повышалась после введения пембролизумаба в обеих подгруппах Т–клеток, в частности, в CART19+ CD8+ клетках (ФИГ 2G–2H).
Глубокое секвенирование TCRβ осуществляли в продукте афереза, клеточном продукте, трансдуцированном CART19 и в периферической крови в день 14 (до введения пембролизумаба), в день 26 (через 1 час после введения пембролизумаба) и в день 45 (через 19 дней после введения пембролизумаба). После введения пембролизумаба наблюдали повышение многообразия (продуктивные реаранжировки) и продуктивной клональности (данные не показаны). После введения пембролизумаба наблюдали восемь доминантных клонов (частота ≥1%, диапазон 1,2%–13,1%). Двое из этих клонов изначально размножались после инфузии CART19 (день 14, клон 1: 6,1%, клон 2: 2,4%) и продолжали дополнительно размножаться после введения пембролизумаба (дни 26 и 45, клон 1: от 6,1% до 13,11% и клон 2: от 2,9% до 6,45%). Четыре клона присутствовали при низких уровнях после введения CART19 и размножались после введения пембролизумаба (дни с 14–го по 26–й и по 45–й, клон 4: от 0,4% до 0,4% и до 2,1%, клон 5: от 0,1% до 0,3% и до 1,5%, клон 7: от 0,6% до 0,9% и до 1,3%, клон 8: от 0,1% до 0,3% и до 1,2%); и два доминантных клона присутствовало только после введения пембролизумаба (дни с 14–го по 26–й и по 45–й, клон 3: от 0% до 0,27% и до 3,57%, клон 6: от 0% до 0,04% и до 1,46%). Клинические наблюдения в сочетании с коррелирующими лабораторными результатами свидетельствуют о том, что пембролизумаб может усиливать эффективность клеток CART19, в дополнение к возможному индуцированию пролиферации других клонов, направленных на опухоль. Это также свидетельствует о потенциально важной роли пути PD–1/PD–L1 в иммунотерапии Т–клетками, модифицированными CAR, в целом. На основании результатов, описанных в данном документе, осуществляется клиническое исследование фазы I/II пембролизумаба у пациентов с CD19+ лимфомами, не отвечающими на терапию CART19 (NCT02650999).
Пример 8. Низкие уровни молекул контрольных точек иммунного ответа ассоциированы с улучшенными исходами
Молекулы контрольных точек иммунного ответа (PD–L1, PD1, LAG3 и TIM3) выявляли в образцах от пациентов с лимфомой с помощью иммуногистохимического анализа. Также применяли ткани и линии клеток положительного и отрицательного контроля. Анализ экспрессии контрольных точек иммунного ответа осуществляли с помощью количественного визуального анализа в области, представляющей интерес, которая может содержать опухолевые клетки и клети, отличные от опухолевых, такие как иммунные клетки. Образцы брали из ткани, лимфатического узла или костного мозга.
Экспрессию белков контрольных точек иммунного ответа сравнивали у пациентов с полным ответом (CR) и пациентов, имеющих прогрессирующее заболевание (PD) после лечения терапией CAR, нацеливающейся на CD19. Как показано на ФИГ. 3, пациенты CR имели тенденцию к наличию низких уровней PD–L1, PD1, LAG3 и TIM3 до и после лечения, в то время как пациенты с PD имели тенденцию к наличию высоких уровней этих молекул до и после лечения. Этот пример свидетельствует в пользу комбинированной терапии клеткой, экспрессирующей CAR, и ингибитором контрольных точек иммунного ответа, а также свидетельствует в пользу определения уровней молекул контрольных точек иммунного ответа у пациентов, получающих терапию CAR.
Пример 9. Подгруппа пациентов, не отвечающих на лечение, среди пациентов с CLL проявляла повышенную экспрессию молекул ингибиторов контрольных точек иммунного ответа
В этом исследовании клетки CART19, полученные в результате производства для клинических исследований от 34 пациентов с CLL, оценивали в отношении экспрессии молекул ингибиторов контрольных точек иммунного ответа, таких как PD–1, LAG3 и TIM3. Ответ этой когорты на CART19 был известен и поэтому можно было оценивать корреляцию между ответом и паттернами экспрессии биомаркера.
Полученные в результате производства клетки CART19 от пациентов с CLL с различными ответами на терапию CART анализировали с помощью проточной цитометрии для определения экспрессии CAR и молекул ингибиторов контрольных точек иммунного ответа PD–1, LAG3 и TIM3. Клетки CART19 получали от здоровых доноров (HD) (n=2); пациентов с CLL, которые отвечали на терапию CART (CR) (n=5); пациентов с CLL, которые частично отвечали на терапию CART (PR) (n=8); пациентов с CLL, которые не отвечали на терапию CART (NR) (n=21). Клетки окрашивали флуоресцентно мечеными антителами, которые специфически распознают CD3, CD4, CD8, CD27, CD45RO, молекулу CAR19 и молекулы контрольных точек иммунного ответа PD–1, LAG3 и TIM3, в соответствии со стандартными способами анализа проточной цитометрии, известными в из уровня техники. Экспрессию каждого маркера, например, CD4+, CD8+ и т. д. определяли с помощью программного обеспечения для анализа проточной цитометрии, и субпопуляции (например, CD4+ T–клетки, CD8+ T–клетки или Т–клетки, экспрессирующие CAR19) дополнительно анализировали в отношении экспрессии молекул контрольных точек иммунного ответа PD–1, LAG3 и TIM3.
Пример анализа профилей на основе проточной цитометрии, используемых для определения экспрессии поверхностных маркеров, показана на ФИГ. 4A и 4B. T–клетки, экспрессирующие CD4, определяли с помощью проточной цитометрии и дополнительно анализировали в отношении экспрессии CAR19 и PD–1, таким образом, что ось х профилей указывает экспрессию CAR19 (верхний левый (Q5) и нижний левый (Q8) квадранты показывают CAR19–отрицательные CD4+ клетки, в то время как верхние правые (Q6) и нижние правые (Q7) квадранты показывают CD4+ клетки, экспрессирующие CAR19), а ось y показывает экспрессию PD–1 (нижний левый (Q8) и правый (Q7) квадранты показывают PD–1–отрицательные CD4+ клетки, а верхний левый (Q5) и правый (Q6) квадранты показывают CD4+ клетки, экспрессирующие PD–1). В популяции CD4+ от пациента, отвечающего на лечение CART, 44,7% CD4+ клеток в целом экспрессировали PD–1 и приблизительно 22,3% клеток, экспрессирующих CAR19, были PD–1–положительными, в то время как 27,2% клеток, экспрессирующих CAR19, были PD–1–отрицательными (ФИГ. 4A). В отличие от этого, в популяции CD4+ от пациента, не отвечающего на лечение, наблюдали в целом значительное снижение клеток, экспрессирующих CAR19 (приблизительно 15,3% по сравнению с 49,5% у CR), при этом 14,7% клеток, экспрессирующих CAR19, были PD–1–положительными, в то время как только 0,64% были PD–1–отрицательными (ФИГ. 4B). Сравнение профилей на ФИГ. 4A и ФИГ. 4B показывает, что намного больший процент CD4+ клеток от пациента, не отвечающего на лечение, экспрессирует PD–1 (приблизительно 92,9%) по сравнению с пациентом, отвечающим на лечение CART (приблизительно 44,7%).
С помощью способов и анализа, описанных выше, определяли процент клеток, экспрессирующих PD–1 (PD–1+), из популяции CD4+ и популяции CD8+ для каждого пациента в каждого группе ответа. Было показано, что пациенты, не отвечающие на лечение, имеют больший процент PD–1+ клеток как в популяциях CD4+ (ФИГ. 4C), так и CD8+ (ФИГ. 4D) по сравнению с таковыми, которые отвечали на терапию CAR (CR); повышение среднего процента PD–1 было статистически значимым как для популяций CD4+, так и для CD8+. Пациенты с частичным ответом (PR) проявляли более высокие проценты PD–1+ клеток, чем пациенты, отвечающие на лечение (CR), как в популяциях CD4+ (ФИГ. 4C), так и CD8+ (ФИГ. 4D).
Затем определяли процент клеток, экспрессирующих PD–1 (PD–1+), из популяции CD4+, экспрессирующих CAR19, и популяции CD8+, экспрессирующих CAR19, для каждого пациента в каждого группе ответа. Аналогичный анализ осуществляли, как указано выше, с дополнительной стадией анализа CD4+ и CD8+ клеток в отношении экспрессии CAR19, и после идентификации клеток, экспрессирующих CAR19, определяли процент клеток с экспрессией PD–1 из популяций клеток, экспрессирующих CAR19. Аналогичную тенденцию, как таковую, наблюдаемую в популяциях CD4+ и CD8+ в целом, наблюдали в случае популяций CD4+ и CD8+, экспрессирующих CAR19, при этом было показано, что пациенты, не отвечающие на лечение, имеют больший процент PD–1+ клеток как в популяциях CD4+ (ФИГ. 5А), так и CD8+ (ФИГ. 5В) по сравнению с таковыми, которые отвечали на терапию CAR (CR); повышение среднего процента PD–1 было статистически значимым как для популяций CD4+, так и для CD8+. Пациенты с частичным ответом (PR) проявляли более высокие проценты PD–1+ клеток, чем пациенты, отвечающие на лечение (CR), как в популяциях CD4+ (ФИГ. 5А), так и CD8+ (ФИГ. 5В).
Для определения распределения клеток, экспрессирующих PD–1, LAG3 и TIM3, от пациентов с различными ответами на терапию CAR, осуществляли дополнительный анализ. Иллюстративный анализ клеточного профиля в отношении экспрессии PD–1, LAG3 и TIM3 в популяции CD4+ показан на ФИГ. 6. Популяции клеток сначала анализировали в отношении экспрессии CD4+ и CD8+. Затем популяцию CD4+ (или популяцию CD8+, не показано) анализировали в отношении экспрессии PD–1 и CAR19 (ФИГ. 6, левые профили). Как описано ранее, пациенты, не отвечающие на лечение (NR), имели значительно повышенный процент клеток, которые были PD–1+ в целом по сравнению с пациентами, отвечающими на лечение CART (CR), (приблизительно 92,9% PD–1–положительных в случае NR по сравнению с 44,7% PD–1–положительных в случае CR). Кроме того, у пациентов, не отвечающих на лечение, клетки, экспрессирующие CAR19, были главным образом PD–1–положительными (14,7% PD–1–положительные и CAR+ по сравнению с 0,64% PD–1–отрицательными CAR+). Затем популяции анализировали в отношении коэкспрессии PD–1 и LAG3 (ФИГ. 6, средние профили). Клетки, которые экспрессировали как PD–1, так и LAG3, показаны в правом верхнем квадранте (Q2). Пациенты, не отвечающие на лечение, имели значительно повышенный процент клеток, которые экспрессировали оба ингибитора контрольных точек иммунного ответа, PD–1 и LAG3, по сравнению с пациентами, отвечающими на лечение CART (67,3% по сравнению с 7,31%). Экспрессию PD–1 также анализировали совместно с экспрессией TIM3. На ФИГ. 6 правые профили, прямоугольник указывает клетки, которые экспрессируют как PD–1, так и TIM3. Аналогично результатам, полученным в отношении PD–1 и LAG3, пациенты, не отвечающие на лечение, имели значительно более высокий процент клеток, которые экспрессировали оба ингибитора контрольных точек иммунного ответа, PD–1 и TIM3, по сравнению с пациентами, отвечающими на лечение CART (83,3% по сравнению с 28,5%). Процент клеток, экспрессирующих PD–1 (PD1+), клеток, экспрессирующих PD–1 и LAG3 (PD1+LAG3+), и клеток, экспрессирующих PD–1 и TIM3 (PD1+TIM3+), определяли для каждого пациента в каждой группе ответа с помощью анализа проточной цитометрии, как описано выше. Было показано, что пациенты, не отвечающие на лечение, имеют повышенный процент PD1+ LAG3+ клеток (ФИГ. 7A) и PD1+TIM3+ клеток (ФИГ. 7B) по сравнению с пациентами, отвечающими на лечение CART, который был статистически значимым для обеих популяций клеток. Пациенты с частичным ответом также показали повышенный процент обеих популяций клеток по сравнению с пациентами, отвечающими на лечение CART, при этом средние значения были снижены по сравнению с пациентами, не отвечающими на лечение.
Эти результаты свидетельствуют о том, что пациенты, которые не отвечали на терапию CAR, проявляют повышенную экспрессию ингибиторов контрольных точек иммунного ответа (например, PD–1, LAG3 и TIM3) по сравнению с пациентами, которые отвечают частично на терапию CAR. Таким образом, эти результаты показывают, что средства, которые ингибируют или снижают экспрессию ингибиторов контрольных точек иммунного ответа, например, PD–1, LAG3 или TIM3, могут быть пригодными для введения пациентам, получающим терапию CAR, для предупреждения иммунной супрессии посредством путей контрольных точек иммунного ответа (например, опосредованных PD–1, LAG3 или TIM3), за счет чего обеспечивается повышение эффективности клеток, экспрессирующих CAR.
Пример 10. Определенные пациенты с первичным DLBCL демонстрируют CD3+/PD1+ двойные положительные раковые клетки
Несмотря на очевидные достижения в области иммунотерапии рака в последнее время в области Т–клеток, модифицированных химерным антигенным рецептором (CAR), и ингибиторами контрольных точек, более современные средства для исследования терапевтических механизмов их комбинации не являются широко доступными. Для изучения этой растущей потребности разработали устойчивую количественную флуоресцентную иммуногистохимическую платформу с использованием мультиплексной технологии AQUA (автоматического количественного анализа) для оценки экспрессии ингибиторов контрольных точек, определения числа CAR–T–клеток и определения взаимодействия между опухолевыми клетками и иммунными клетками посредством новых алгоритмов колокализации. Пригодность этого способа была охарактеризована как в доклинических, так и в клинических модельных системах. В модели B–клеточной лимфомы на иммунодефицитной мыши оценивали хоминг CAR–T–клеток в отношении злокачественных B–клеток в первичных лимфоидных органах. Определяли фенотип и функциональный статус CAR–T–клеток посредством мультиплексного анализа экспрессии CD4, CD8, PD1 и FOXP3. Кроме того, для осуществления комбинированных видов иммунотерапии в условиях диффузной B–крупноклеточной лимфомы (DLBCL) исследовали распространенность адаптивных механизмов иммунной устойчивости в форме экспрессии PD1 и PD–L1 в компартментах иммунных и опухолевых клеток с использованием опознавательных знаков, создаваемых цитоплазматическими и ядерными красителями как в первичных, так и во вторичных биоптатах от пациентов с DLBCL (n=63). Для обеспечения отбора пациентов для исследований CART количественно определяли экспрессию и распространенность опухолевых антигенов, которые не могли воспроизводимо оцениваться с помощью традиционных способов, с получением объективных точек разделения. Эти количественные мультиплексные способы IHC для оптимального отбора пациентов могут быть использованы в предстоящих новых исследованиях комбинированной иммунотерапии.
Получение образца, визуализацию и анализ изображений в случае образцов тканей при DLBCL осуществляли в отношении пациентов–людей с первичной DLBCL (n=49) и вторичной DLBCL (15).
Получение образца. Фиксированные в формалине погруженные в парафин (FFPE) образцы тканей депарафинировали. Микроскопические препараты затем обезвоживали в результате серии промываний ксилолом и спиртом до инкубации в дистиллированной воде. Затем осуществляли высокотемпературное демаскирование антигена в условиях повышенного давления и температуры, обеспечивали охлаждение и переносили в Tris–буферизированный солевой раствор. Затем выполняли окрашивание, при этом осуществляли следующие стадии. Сначала блокировали эндогенную пероксидазу путем инкубации с раствором, блокирующим белок, в целях снижения неспецифического окрашивания антитела. Затем микроскопические препараты окрашивали первичным антителом мыши к PD1. Затем микроскопические препараты промывали перед инкубацией со вторичным антителом к HRP мыши. Микроскопические препараты промывали и затем выявляли окрашивание PD–1 с помощью TSA+ Cy® 5 (Perkin Elmer). Реагенты на основе первичных и вторичных антител затем удаляли с помощью микроволновой печи. Микроскопические препараты повторно промывали перед окрашиванием первичным антителом кролика к CD3. Микроскопические препараты промывали и затем инкубировали с коктейлем вторичного антитела к HRP кролика и 4',6–диамидино–2–фенолиндола (DAPI). Микроскопические препараты промывали и затем выявляли окрашивание CD3 с помощью TSA+ Cy® 3 (Perkin Elmer). Микроскопические препараты промывали последний раз перед тем, как их покрывали средами для заливки и обеспечивали высушивание в течение ночи при комнатной температуре.
Визуализация и анализ образца. Затем получали флуоресцентные изображения с помощью системы анализа микроскопических препаратов Vectra 2 Intelligent с использованием программного обеспечения Vectra версии 2.0.8 (Perkin Elmer). Сначала проводили монохромную визуализацию микроскопического препарата при увеличении 4x с помощью DAPI. Автоматизированный алгоритм (разработанный с помощью inForm) использовали для идентификации областей микроскопического препарата, содержащих ткань.
Области микроскопического препарата, идентифицированные как содержащие ткань, визуализировали при увеличении 4x в отношении каналов, ассоциированных с DAPI (синий), Cy®3 (зеленый) и Cy® 5 (красный) для получения изображений RGB. Эти изображения при увеличении 4x обрабатывали с помощью автоматизированного алгоритма обогащения (разработанного с помощью inForm) в поле зрения селектора для определения и классификации возможных полей зрения при увеличении 20x в соответствии с максимальной экспрессией Cy® 3.
Верхние 40 полей зрения визуализировали при увеличении 20x с помощью DAPI, длин волны Cy®3 и Cy® 5. Первичные изображения исследования в отношении приемлемости, и изображения, которые были нечеткими, не имели никаких опухолевых клеток, были высоконекротичными или содержали высокие уровни флуоресцентного сигнала, не ассоциированного с локализацией антител (т. е. фоновое окрашивание), отклоняли до анализа. Приемлемые изображения обрабатывали с помощью AQUAduct (Perkin Elmer), при этом каждый флуорофор был спектрально несмешиваемым с помощью спектрального расслоителя на отдельные каналы и сохранялся в виде отдельного файла.
Обработанные файлы дополнительно анализировали с помощью AQUAnalysis™ или посредством полностью автоматизированного процесса с использованием AQUAserve™. Каждое изображение DAPI обрабатывали с помощью клеточного маскера для выявления всех клеточных ядер на этом изображении, и затем расширяли на 2 пикселя для представления подходящего размера всей клетки. Эта полученная в результате маска представляла все клетки в этом изображении. Каждое изображение Cy® 5 затем обрабатывали с помощью биомаркерного маскера для создания бинарной маски всех клеток, которые являются PD–1–положительными. Каждое изображение Cy® 3 затем обрабатывали с помощью биомаркерного маскера для создания бинарной маски всех клеток, которые являются CD3–положительными. Бинарные маски для всех PD–1–положительных и CD3–положительных клеток комбинировали для создания бинарной маски всех клеток, которые являются дважды положительными в отношении PD–1 и CD3. Получали % биомаркерной положительности (PBP) в отношении всех CD3 клеток, экспрессирующих PD–1, с помощью калькулятора позитивности, в результате деления суммарной площади, измеренной в пикселях и определенной с помощью анализатора площади, маски всех PD–1–положительных опухолевых клеток на суммарную площадь, измеренную в пикселях и определенную с помощью анализатора площади, маски всех CD3–положительных клеток. Иллюстративные значения PBP для всех CD3–положительных клеток, экспрессирующих PD–1, в образцах первичной и вторичной DLBCL человека, показаны на фигуре 8. Статус CD3 и PD–1 показывал, что частоты распространенности CD3+/PD–1+ клеток в условиях первичной DLBCL были выше, чем в условиях вторичной DLBCL, обеспечивая возможность для отбора пациентов для моно– или комбинированной терапии.
Выполняли аналогичный эксперимент, в котором PD–L1 выявляли с помощью первичного антитела кролика к PDL1 и TSA+Cy5 (Perkin Elmer) в образцах ткани DLBCL от пациентов–людей с первичной DLBCL. В тех же образцах также выявляли PD1 и CD3. Эксперимент показал, что опухолевые микроокружения содержат клетки, которые экспрессируют PD1, CD3 и PDL1. В эксперименте также выявили субпопуляцию клеток, которая представляет собой CD3+PD1+ (данные не показаны). Эти результаты свидетельствуют в пользу модели, согласно которой опухолевое микроокружение содействует развитию иммунных супрессорных клеток, на которые можно нацеливаться средствами, специфичными в отношении PD1+ или PD–L1+ клеток.
Пример 11. Взаимоисключающая экспрессия CD19 и PD–L1 в образцах, содержащих клетки DLBCL
Получение образца. Фиксированные в формалине погруженные в парафин (FFPE) образцы тканей депарафинировали. Микроскопические препараты затем обезвоживали в результате серии промываний ксилолом и спиртом до инкубации в дистиллированной воде. Затем осуществляли высокотемпературное демаскирование антигена в условиях повышенного давления и температуры, обеспечивали охлаждение и переносили в Tris–буферизированный солевой раствор. Затем выполняли окрашивание, при этом осуществляли следующие стадии. Сначала блокировали эндогенную пероксидазу путем инкубации с раствором, блокирующим белок, в целях снижения неспецифического окрашивания антитела. Затем микроскопические препараты окрашивали первичным антителом кролика к PDL1. Затем микроскопические препараты промывали перед инкубацией со вторичным антителом к HRP кролика. Микроскопические препараты промывали и затем выявляли окрашивание PDL1 с помощью TSA+ Cy® 3 (Perkin Elmer). Реагенты на основе первичных и вторичных антител затем удаляли с помощью микроволновой печи. Микроскопические препараты повторно промывали перед окрашиванием первичным антителом мыши к CD19. Микроскопические препараты промывали и затем инкубировали с коктейлем вторичного антитела к HRP мыши и 4',6–диамидино–2–фенолиндола (DAPI). Микроскопические препараты промывали и затем выявляли окрашивание CD19 с помощью TSA+ Cy® 5 (Perkin Elmer). Микроскопические препараты промывали последний раз перед тем, как их покрывали средами для заливки и обеспечивали высушивание в течение ночи при комнатной температуре.
Визуализация и анализ образца. Затем получали флуоресцентные изображения с помощью системы анализа микроскопических препаратов Vectra 2 Intelligent с использованием программного обеспечения Vectra версии 2.0.8 (Perkin Elmer). Сначала проводили монохромную визуализацию микроскопического препарата при увеличении 4x с помощью DAPI. Автоматизированный алгоритм (разработанный с помощью inForm) использовали для идентификации областей микроскопического препарата, содержащих ткань.
Области микроскопического препарата, идентифицированные как содержащие ткань, визуализировали при увеличении 4x в отношении каналов, ассоциированных с DAPI (синий), Cy®3 (зеленый) и Cy® 5 (красный) для получения изображений RGB. Эти изображения при увеличении 4x обрабатывали с помощью автоматизированного алгоритма обогащения (разработанного с помощью inForm) в поле зрения селектора для определения и классификации возможных полей зрения при увеличении 20x в соответствии с максимальной экспрессией Cy® 3.
Верхние 40 полей зрения визуализировали при увеличении 20x с помощью DAPI, длин волны Cy®3 и Cy® 5. Первичные изображения исследования в отношении приемлемости, и изображения, которые были нечеткими, не имели никаких опухолевых клеток, были высоконекротичными или содержали высокие уровни флуоресцентного сигнала, не ассоциированного с локализацией антител (т. е. фоновое окрашивание), отклоняли до анализа. Приемлемые изображения обрабатывали с помощью AQUAduct (Perkin Elmer), при этом каждый флуорофор был спектрально несмешиваемым с помощью спектрального расслоителя на отдельные каналы и сохранялся в виде отдельного файла.
Обработанные файлы дополнительно анализировали с помощью AQUAnalysis™ или посредством полностью автоматизированного процесса с использованием AQUAserve™, как описано в предыдущем примере.
Иллюстративные значения PBP для всех CD19–положительных и PD–L1–положительных клеток в образцах первичной и вторичной DLBCL человека, показаны на фигуре 9. Экспрессия CD19 и PDL1 варьировала в образцах DLBCL. Экспрессия CD19 и PDL1 имела тенденцию быть взаимоисключающей, т. е., как правило, определенная клетка экспрессировала CD19 или PD–L1, но не оба. Не ограничиваясь какой–либо теорией, это может быть связано с тем, что CD19 экспрессируется в опухолевых клетках DLBCL, в то время как PD–L1 экспрессируется в клетках, отличных от опухолевых, например, клетках, которые поддерживают опухолевое микроокружение. Это наблюдение свидетельствует о том, что комбинированная терапия ингибитором CD19 (например, клеткой, экспрессирующей CAR для CD19) и ингибитором передачи сигнала с участием PD–L1 может быть пригодной для нацеливания на эти две популяции клеток.
Аналогичный эксперимент осуществляли, например, для демонстрации способности анализа AQUA контролировать эффективность CART19. В этом исследовании контролировали CD19, CD3 и нуклеиновую кислоту CART19 в образцах, содержащих смешанные линии клеток с CART19+ клетками Jurkat и CD19+ клетками REH. Белки CD19 и CD3 выявляли с помощью антител, а CART19 выявляли с помощью зонда РНК к 3' UTR нуклеиновой кислоты CAR. Эксперимент показал, что образцы линий клеток содержат клетки, которые экспрессируют CD19, CD3 и CART19 (данные не показаны). Эксперимент также показал, что образцы линий клеток содержат субпопуляцию клеток, которая представляет собой CD3+/CART19+ (данные не показаны). Осуществляли анализ близости, который показал, что клетки CART19 были физически близкими по отношению к CD19+ клеткам (данные не показаны). Эти эксперименты свидетельствуют в пользу модели, в соответствии с которой CD3+ СART19 клетки инфильтрируют опухолевое микроокружение, содержащее CD19+ клетки и физические положения CD19 и CART19 клеток транслируются в эффективность терапии CART19.
Пример 12. Пембролизумаб в комбинации с CD19–нацеленными CAR–T–клетками для усиления ответа
Примечание: если не указано иное, то доза пембролизумаба, используемая в этом примере, составляла 2 мг/кг на основании веса пациента, до тех пор пока доза не достигала 200 мг, при которой вводили фиксированную дозу 200 мг.
Было показано, что CD19–нацеленные Т–клетки, модифицированные химерным антигенным рецептором (CAR), проявляли уровни полного ответа (CR), превышающие 90% при B–клеточном остром лимфобластном лейкозе (B–ALL). Подгруппа пациентов может не отвечать на терапию CART или может рецидивировать в результате недостаточной персистенции CAR–T–клеток. В исследовании, описанном в этом примере, изучали может ли ингибирование пути контрольных точек с участием PD–1 улучшать функцию и персистенцию CAR–T–клеток.
Пациенты, получавшие лечение мышиными (CTL019) или гуманизированными (CTL119) CAR–T–клетками к CD19 получали 1–3 дозы ингибитора PD–1 пембролизумаба, начиная с 14 дней–2 месяцев после инфузии CAR–T–клеток. Четыре ребенка с рецидивирующим/резистентным B–ALL получали пембролизумаб в связи с частичным ответом/отсутствием ответа (n=3) или предыдущей историей недостаточной персистенции CAR–T–клеток (n=1) после инфузии CTL019 (n=1) или CTL119 (n=3). Пембролизумаб хорошо переносился, при этом наблюдали лихорадку у 2 пациентов и отсутствие аутоиммунной токсичности. Повышение выявляемых циркулирующих CAR+ T–клеток (% CD3+ клеток выявляли с помощью проточной цитометрии) и/или длительного выявления (по сравнению с предыдущей инфузией) наблюдали у всех 4 детей после введения пембролизумаба.
Пациенты 1 и 2 получали CTL119 в связи с рецидивом CD19+ после предшествующего введения CD19 CAR–T–клеток мыши и получали лечение пембролизумабом в связи с частичным ответом или отсутствием ответа на CTL119. Оба имели прогрессирующее заболевание после введения пембролизумаба, при этом у 1 сохранялась экспрессия, а у 1 снижалась экспрессия CD19.
Два пациента не имели объективного ответа на добавление пембролизумаба. У пациента 3 предшествующее лечение как CTL019, так и CTL119, приводило к CR с недостаточной персистенцией CAR–T–клеток после рецидива CD19+. После повторной инфузии CTL119 в сочетании с пембролизумабом пациент 3 достигал CR с длительной персистенцией CAR–T–клеток (выявляемых в день 50 по сравнению с утратой в день 36 после исходной инфузии CTL119). Пациент 4 с отсутствием предшествующей истории лечения CAR–T–клетками получал пембролизумаб в связи с обширным вовлечением лимфатических узлов в день 28 после инфузии CTL019, несмотря на морфологическую ремиссию в костном мозге. Пролиферация CAR–T–клеток после введения пембролизумаба была ассоциирована со значительным ослаблением PET–авидного заболевания через 3 месяца после введения CTL019.
Результаты показывают, что пембролизумаб безопасно комбинировали с лечением CAR–T–клетками и он повышал или продлевал выявление CAR+ T–клеток, при этом наблюдали объективные ответы. Таким образом, пути контрольных точек иммунного ответа могут влиять на ответ на средства для лечения на основе CAR–T–клеток.
Пример 13. Пембролизумаб для усиления ответа на CD19 CAR–T–клетки при рецидивирующем остром лимфобластном лейкозе (ALL)
Примечание: если не указано иное, то доза пембролизумаба, используемая в этом примере, составляла 2 мг/кг на основании веса пациента, до тех пор пока доза не достигала 200 мг, при которой вводили фиксированную дозу 200 мг.
Дизайн исследования
Пациенты с рецидивирующим/резистентным ALL, ранее получавшие лечение Т–клетками, экспрессирующими CAR для CD19, которые проявляли недостаточную персистенцию CAR–T–клеток, были пригодны для получения повторной инфузии CAR–T–клеток с пембролизумабом или без него. Пациентов с R/R ALL включали в клиническое исследование (NCT02374333). Пациенты получали химиотерапию и лимфоистощение до первой инфузии CAR–T–клеток. В день –1 выполняли исходную оценку с последующей первой инфузией гуманизированных CD19 CAR–T–клеток (CTL119). Пациентов оценивали в день 28 в отношении ответа, а оценки последующего периода наблюдения выполняли в месяцы 3, 6, 9 и 12. Пациентов контролировали в отношении минимальной остаточной болезни (MRD), аплазии B–клеток и персистенции CTL119. На основании статуса персистенции CTL119 пациентам повторно вводили инфузию CTL119. Некоторые пациенты также получали лечение пембролизумабом через по меньшей мере 2 недели после повторной инфузии или после восстановления от CRS. На ФИГ. 10 показан дизайн исследования.
Результаты
Случай 1. Пембролизумаб в связи с частичным ответом
В случае 1 описан пациент с R/R ALL с отсутствием ответа (NR) на предшествующую терапию CAR CD19. У этого пациента наблюдали пролиферацию huCART19 и в день 28 пациент представлял полный ответ (CR), при этом наблюдали 1,2% CD19+ MRD. Через 7 недель после инфузии у пациента происходил рецидив заболевания CD19+ и наблюдались низкие уровни huCART19. Затем пациенту вводили пембролизумаб в день 52. Наблюдали незначительное повышение huCART19 при временном клиренсе периферических бластных клеток, после чего следовало прогрессирование заболевания.
Случай 2. Пембролизумаб в связи с отсутствием ответа
В случае 2 описан пациент с R/R ALL с рецидивом CD19+ через 12 месяцев после предшествующей терапии CAR CD19. У этого пациента наблюдали высокую пролиферацию huCART19. В день 28 пациент представлял NR с рецидивом CD19+. HuCART19 повторно вводили посредством инфузии этому пациенту через 6 недель после лечения пембролизумабом через 14 дней после повторной инфузии. Наблюдали высокую пролиферацию huCART19 совместно с длительной персистенцией клеток. При оценке в день 28 после повторной инфузии пациент проявлял устойчивое заболевание с вариабельной экспрессией CD19.
Случаи 3–5. Пембролизумаб в связи с недостаточной персистенцией
В случаях 3, 4 и 5 описаны пациенты с R/R ALL, которые получали предшествующую инфузию huCART19, однако проявляли недостаточную персистенцию CAR–T–клеток. Эти пациенты имели высокую исходную пролиферацию huCART19. Все 3 пациента получали повторную инфузию huCART19 с последующей дозой пембролизумаба через 14 дней после повторной инфузии.
В случае 3 описан пациент, который имел R/R ALL с рецидивом CD19+ через 9 месяцев после предшествующей инфузии huCART19. Оценка в день 28 после первой инфузии huCART19 показала CR, при этом не выявляли MRD. Несмотря на то, что CAR–T–клетки пролиферировали, CAR–T–клетки персистировали лишь в течение короткого периода времени, при этом наблюдали восстановление B–клеток через 2 месяца. Через 15 месяцев после инфузии пациент имел рецидив и получал повторную инфузию huCART19 через 17 месяцев с последующим введением дозы пембролизумаба через 14 дней после этого. Этот пациент проявлял длительную персистенцию и непрерывную аплазию B–клеток, при этом пембролизумаб вводили один раз в 3 недели. На ФИГ.11 показан процент клеток huCART19 через несколько дней после инфузии huCART19 в присутствии или в отсутствие лечения пембролизумабом Пембролизумаб повышает персистенцию клеток huCART19.
В случае 4 описан пациент, который проявлял R/R ALL с рецидивом CD19+ через 9 месяцев после предшествующей инфузии huCART19. Оценка в день 28 после первой инфузии huCART19 показала CR, при этом не выявляли MRD. Несмотря на то, что наблюдали высокую пролиферацию CAR–T–клеток, CAR–T–клетки персистировали лишь в течение короткого периода времени, при этом наблюдали восстановление B–клеток через 2 месяца. Через 12 месяцев после инфузии пациент имел рецидив и получал повторную инфузию huCART19 через 14 месяцев с последующим введением дозы пембролизумаба через 14 дней после этого. Наблюдали отсутствие пролиферации huCART19, а оценка в день 28 после второй инфузии не выявила ответа (NR), при этом выявляли CD19+ MRD.
В случае 5 описан пациент, который проявлял R/R ALL с рецидивом CD19+ через 12 месяцев после предшествующей инфузии huCART19. Оценка в день 28 после первой инфузии huCART19 показала CR, при этом не выявляли MRD. Несмотря на то, что наблюдали высокую пролиферацию CAR–T–клеток, CAR–T–клетки персистировали лишь в течение короткого периода времени. Через 6 месяцев после первой инфузии пациент получал вторую инфузию, при этом наблюдали короткую персистенцию CAR–T–клеток. Через 8 месяцев после первой инфузии пациент получал другую инфузию huCART19 с последующей дозой пембролизумаба через 14 дней после этого. Этот пациент проявлял длительную персистенцию и непрерывную аплазию B–клеток, при этом пембролизумаб вводили один раз в 3 недели. На ФИГ. 12 показан график, сравнивающий вероятность восстановления B–клеток у пациентов, которые получали только huCART19 (n=4), и у пациентов, которые получали huCART19 и пембролизумаб (n=7).
Случай 6. Пембролизумаб в связи с лимфоматозным заболеванием
В случае 6 описан пациент с R/R ALL со стадией M3 в костном мозге и распространенным лимфоматозным заболеванием (LAD). Этот пациент получал инфузию CART19, при этом клетки пролиферировали эффективно. Оценка в день 28 показала CR в костном мозге, однако PET–анализ показал распространенное вовлечение лимфатического(лимфатических) узла(узлов). Затем этому пациенту вводили пембролизумаб в день 32 после инфузии и один раз в 2–3 недели. Как показано на ФИГ. 13, лечение пембролизумабом повышало процент клеток CART19. Снижение PET–авидных очагов также наблюдали после лечения пембролизумабом (ФИГ. 14).
Пример 14. CD19–нацеленные CAR–T–клетки в комбинации с пембролизумабом у пациентов с рецидивирующей/резистентной диффузной B–крупноклеточной лимфомой (r/r DLBCL)
Обоснование исследования
CD19–нацеленная терапия CART (CTL019) является потенциально лечебной у 36–45% пациентов с r/r DLBCL. Однако PD–L1 является высокоэкспрессируемым в клетках DLBCL, приводя к активации PD–1 в трансдуцированных T–клетках, например, клетках CTL019. Активация PD–1 в клетках CTL019 приводит к функциональному ухудшению терапии CTL019. Лечение антителом к PD–1 блокирует взаимодействие PD–1/PD–L1, которое может реактивировать клетки CTL019 от пациентов с DLBCL и улучшить уровни ответа.
Исходный анализ в исследовании C2201 (JULIET) CTL019 при r/r DLBCL показал, что более высокую экспрессию ингибиторов контрольных точек (например, PD–1 и TIM–3) в коррелировавшем конечном продукте CTL019 наблюдали у пациентов, которые являлись пациентами, не отвечающими на терапию CTL019, по сравнению с пациентами, отвечающими на терапию. Синдром высвобождения цитокинов наблюдали у 57% пациентов (57,6 из 99) в этом исследовании, из которых 11% имели CRS степени 1, 23% имели CRS степени 2, 15% имели CRS степени 3 и 8% имели CRS степени 4. Среди пациентов, которые имели CRS, среднее время (в днях) до наступления CRS составляло 4,1 дня с медианой 3,0 дня. Самое раннее, когда пациенты проявляли CRS, приходилось на день 1 после введения CTL019, а самая поздняя временная точка, при которой наблюдали CRS, приходилась на день 51 после введения CTL019. Средняя длительность CRS у этих пациентов составляла 8,3 дня с медианой 7,0 дней, а диапазон длительности CRS составлял 2–30 дней у всех пациентов. В среднем для развития CRS степени 3 или степени 4 требовалось 4,2 дня. Наиболее ранней временной точкой, при которой наблюдали CRS степени 3 или степени 4, были 2 дня, а наиболее позднюю временную точку, при которой наблюдали CRS степени 3 и степени 4, были 8 дней.
В исследовании A2101J (DLBCL) CTL019 при r/r DLBCL более высокую экспрессию ингибиторов контрольных точек (например, TIM3, LAG–3, PD1, PD–L1) наблюдали в образцах биоптата и в клетках CTL019 in vivo, полученных от пациентов, не отвечающих на лечение, по сравнению с образцами, полученными от пациентов, отвечающих на лечение. Иммуногистохимический анализ образцов лимфатического узла и костного мозга показал, что у пациентов с прогрессирующим заболеванием (PD) наблюдали более высокую экспрессию TIM3, LAG–3, PD1 и PD–L1. Кроме того, это исследование, изучающее пембролизумаб при r/r DLBCL, показало, что 5 из 9 пациентов, которые прогрессировали после получения CTL019, отвечали на лечение пембролизумабом. Явления CRS не наблюдали у пациентов, которые отвечали на пембролизумаб, а длительность ответа (DoR) составляла более 1 года.
Совместно данные на основании этих исследований свидетельствуют в пользу того, что терапия антителами к PD1 совместно с CLT019 может быть эффективной схемой лечения, которая обеспечивает потенциал для лечения пациентов с r/r DLBCL, которые не подходят для трансплантата, как показано с помощью более высоких уровней общего и полного ответа. Комбинация антитела к PD1 и CTL019 также показала продолжительную длительность ответов при сравнении с CTL019 в отдельности и вариантами альтернативного лечения. Комбинированная терапия характеризовалась профилем побочных ответов, который был аналогичным монотерапии CTL019, при этом отсутствовали дополнительные долговременные нежелательные эффекты. Таким образом, комбинация пембролизумаба и CTL019 при улучшенных исходах для пациента делает ее более эффективной и рентабельной схемой лечения. Кроме того, комбинированная терапия может быть назначена в течение короткого периода друга от друга, например, антитело к PD–1 можно вводить вскоре после (например, через 5–15 дней после) введения CTL019, например, у пациентов, которые не проявляют CRS. Пациентам с CRS после терапии CTL019 можно вводить антитело к PD–1, например, после регрессии CRS.
Дизайн исследования
Будут проводить исследование фазы I/II параллельного введения CTL019 и пембролизумаба в популяциях пациентов с r/r (JULIET) DLBCL. Неконтролируемое исследование будет включать 20–25 пациентов и будет включать вводный период, связанный с результатами времени введения дозы. Пациенты с r/r DLBDL, которые не подходят для трансплантата, будет включены в это исследование. Через пять недель до начала терапии (неделя –5) аутологичные клетки CTL019 будут получены и криоконсервированы. Во время этого периода начнут резервную терапию и стадирование заболевания будут выполнять за одну неделю до (неделя –1) инфузии CTL019. Затем будут вводить посредством инфузии CTL019 пациентам. Терапию пембролизумабом будут проводить по меньшей мере через 5 дней после инфузии CTL019. Будут выполнять шесть введений пембролизумаба один раз в 3 недели в дозе 300 мг. Пациентов будут оценивать ежемесячно в течение первых 6 месяцев после инфузии, один раз в 3 месяца начиная с 7–24 месяца и один раз в 6 месяцев после этого. Последующее наблюдение за пациентами будут осуществлять в течение 15 лет согласно нормативам FDA для протоколов передачи генов.
Результаты этого исследования будут направлены на начало рандомизированного регистрационного исследования фазы II с использованием двух групп с участием 90 пациентов. Пациенты с r/r DLBCL, которые не подходят для трансплантата, будет включены в это исследование. В исследовании фазы II одна когорта из шестидесяти пациентов будет получать параллельное введение пембролизумаба в комбинации с CTL019, а другая когорта из тридцати пациентов будет получать введение CTL019 в отдельности. Первичной целью этого исследования будет оценка эффективности CTL019 в комбинации с пембролизумабом. Первичной конечной точкой этого исследования будет частота ответа (RR) пациентов через 3 месяца после лечения. Вторичной целью этого исследования будет оценка различий RR через 3 месяца между пациентами, получающими комбинированную терапию в сравнении с пациентами, получающими CTL019 в отдельности.
Пример 15. Терапия пембролизумабом в случае пациентов с рецидивирующей/резистентной диффузной B–крупноклеточной лимфомой (r/r DLBCL), ранее получавших лечение CD19–нацеленными CAR–T–клетками
Клиническое исследование с использованием пембролизумаба инициировали у пациентов с r/r DLBCL с подтвержденным прогрессированием после инфузии CTL019. Первую дозу пембролизумаба вводили сразу после того, как наблюдали и фиксировали прогрессирование. Пембролизумаб вводили один раз в 3 недели в течение 2 лет. Пациенты получали пембролизумаб через примерно 28 дней после инфузии CTL019.
Пять из 9 пациентов с прогрессирующей DLBCL, которые ранее получали CTL019 и затем лечение пембролизумабом, демонстрировали ответ на лечение. Максимальная длительность ответа составляла более 1 года. У этих пациентов CRS не наблюдали.
Пример 16. Не содержащие вирусов РНК–перенаправленные аутологичные Т–клетки к CD19 в случае резистентной/рецидивирующей лимфомы Ходжкина (HL)
Предпосылки
Клеточная терапия с использованием аутологичных Т–клеток к CD19 с химерным антигенным рецептором (CART19) показала перспективные результаты при нескольких гематологических злокачественных новообразования В–клеточного происхождения, однако эту терапию не изучали у пациентов с болезнью Ходжкина (HL). Несмотря на то, что неопластические клетки HL Reed–Sternberg (HRS) считаются CD19–отрицательными, циркулирующие CD19–положительные клональные предшественники клеток HRS и CD19–положительные реактивные клетки в опухолевом микроокружении HRS представляют собой потенциальные терапевтические мишени для CART19 при HL.
Способы
Разрабатывали открытое поисковое исследование для оценки выполнимости, безопасности и эффективности клеточных инфузий РНК CART19 у пациентов с рецидивирующей/резистентной HL, невосприимчивых или не переносящих более одной линии стандартной резервной терапии без вариантов лечебной терапии. Аутологичные T–клетки, электропорированные иммунорецепторным scFv к CD19 (клетки с РНК CART19) использовали у этих пациентов вместо более персистентных клеток, сконструированных с помощью лентивирусной трансдукции для обеспечения временного нацеливания на CD19 и ограничения окна острой и долгосрочной токсичности. После плазмафереза и получения клеток с РНК CART19 пациенты подвергаются до шести внутривенных (IV) инфузий от 8×105 до 1,5×106 клеток с РНК CART19/кг/доза в случае пациентов, вес которых составлял менее 80 кг, и 1×108 клеток с РНК CART19/доза (±20%) в случае пациентов, вес которых составлял более 80 кг. Внутривенный циклофосфамид (30 мг/кг) вводили до первой и четвертой доз клеток с РНК CART19 для усиления приживления трансплантата. Оценки безопасности и ответа с использованием критериев Cheson 2007 проводили в определенные временные точки в течение исследования. Первичной целью было описание возможности получения, безопасности и биологического приживления трансплантата клеток с РНК CART19 при рецидивирующей HL. Вторичными целями была оценка эффективности с помощью частот общего ответа (ORR) и эффекта клеток с РНК CART19 на системные растворимые иммунные факторы.
Результаты
В исследование включали пять пациентов и получали клетки с РНК CART19, при этом 4 пациентам вводили инфузию и оценивали в отношении ответа и/или токсичности. Характеристики 5 пациентов при включении в исследование включают: i) средний возраст 24 года, при этом диапазон составляет 21–42 года; ii) четыре пациента со стадией IV/экстранодальным заболеванием, iii) среднее число предшествующих средств терапии составляло 5, при этом диапазон составлял 0–8 предшествующих средств терапии; iv) 4 пациента имели трансплантаты стволовых клеток (3 пациента имели аутологичные трансплантаты стволовых клеток и один пациент имел как аутологичные, так и аллогенные трансплантаты стволовых клеток). Из пациентов, получавших лечение клетками с РНК CART19, трое пациентов (60%) имели предшествующее прогрессирование при лечении ингибитором PD–1. Среднее абсолютное содержание лимфоцитов при плазмаферезе составляло 1030 ммоль/мкл (диапазон: 830–2650). Все пациенту прошли успешное получение клеток с РНК CART19. Двоим пациентам требовалась мостиковая химиотерапия, при этом один пациент получал брентуксимаб, а другой пациент получал бендамустин и пембролизумаб. Все 4 пациента, получавших лечение, прошли лимфоистощающую терапию циклофосфамидом согласно протоколу. Среднее число клеток CART19/кг/доза составляло 1,5×106 (диапазон: от 7,3×105 до 1,52×106). Каждый пациент получал 6 отдельных доз или инфузий клеток с РНК CART19 в течение периода 2 недель. Использование qRT–PCR. РНК CART19 выявляли временно в образцах периферической крови непосредственно после введения дозы после 80% инфузий (ФИГ. 14). Связанные с исследованием летальные исходы или не относящаяся к гематологический токсичность 3–4 степени отсутствовали. Наиболее распространенные виды токсичности степени 1–2 включали временную головную боль, которую наблюдали у 3 пациентов, и бессонницу, которую наблюдали у 2 пациентов. Доказательства синдрома высвобождения цитокинов отсутствовали. Частота общего ответа (ORR) через 1 месяц после инфузии составляла 50%. Наблюдали один полный ответ (CR) и один частичный ответ (PR). Еще один пациент имел стабильное заболевание (SD). Пациент с CR прогрессировал через 3 месяца и пациент с PR был исключен из исследования в связи с продолжением другой терапии. Пациент с SD прогрессировал через 3 месяца. В настоящее время два пациента находятся в состоянии CR с приемом ингибитора PD–1. Один пациент находится в состоянии PR с приемом леналидомида, и один умер в связи с прогрессирующим заболеванием. Никакой видимой долгосрочной токсичности не наблюдалось.
Вывод
Эти данные свидетельствуют о том, что клеточная терапия с использованием не содержащих вирусов РНК–перенаправленных клеток CART19 является возможной и безопасной у пациентов с рецидивирующей/резистентной HL.
ЭКВИВАЛЕНТЫ
Раскрытия каждого в отдельности патента, заявки на патент и публикации, упоминаемых в данном документе, включены тем самым в данный документ посредством ссылки во всей своей полноте. Несмотря на то, что настоящее изобретение было раскрыто со ссылкой на конкретные аспекты, очевидно, что другие аспекты и вариации настоящего изобретения могут быть разработаны другими специалистами в данной области техники без отступления от фактической сути и объема настоящего изобретения. Прилагаемая формула изобретения предусмотрена истолковать включение всех таких аспектов и эквивалентных вариаций.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> BILIC, SANELA
HOWARD JR., DANNY ROLAND
CAMERON, JOHN SCOTT
BROGDON, JENNIFER
ISAAC, RANDI
QUINTAS-CARDAMA, ALFONSO
SHUSTER, STEPHEN
JUNE, CARL H.
MELENHORST, JAN J.
LACEY, SIMON
MAUDE, SHANNON
CHOU, WILLIAM
ANAK, OEZLEM
<120> ВИДЫ КОМБИНИРОВАННОЙ ТЕРАПИИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНЫХ
АНТИГЕННЫХ РЕЦЕПТОРОВ И ИНГИБИТОРОВ PD-1
<130> N2067-7109WO
<140>
<141>
<150> 62/514,542
<151> 2017-06-02
<150> 62/482,846
<151> 2017-04-07
<150> 62/455,547
<151> 2017-02-06
<150> 62/368,100
<151> 2016-07-28
<160> 532
<170> PatentIn версия 3.5
<210> 1
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 1
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro
20
<210> 2
<211> 45
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 2
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
35 40 45
<210> 3
<211> 230
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 3
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys Met
225 230
<210> 4
<211> 282
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 4
Arg Trp Pro Glu Ser Pro Lys Ala Gln Ala Ser Ser Val Pro Thr Ala
1 5 10 15
Gln Pro Gln Ala Glu Gly Ser Leu Ala Lys Ala Thr Thr Ala Pro Ala
20 25 30
Thr Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys
35 40 45
Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro
50 55 60
Ser His Thr Gln Pro Leu Gly Val Tyr Leu Leu Thr Pro Ala Val Gln
65 70 75 80
Asp Leu Trp Leu Arg Asp Lys Ala Thr Phe Thr Cys Phe Val Val Gly
85 90 95
Ser Asp Leu Lys Asp Ala His Leu Thr Trp Glu Val Ala Gly Lys Val
100 105 110
Pro Thr Gly Gly Val Glu Glu Gly Leu Leu Glu Arg His Ser Asn Gly
115 120 125
Ser Gln Ser Gln His Ser Arg Leu Thr Leu Pro Arg Ser Leu Trp Asn
130 135 140
Ala Gly Thr Ser Val Thr Cys Thr Leu Asn His Pro Ser Leu Pro Pro
145 150 155 160
Gln Arg Leu Met Ala Leu Arg Glu Pro Ala Ala Gln Ala Pro Val Lys
165 170 175
Leu Ser Leu Asn Leu Leu Ala Ser Ser Asp Pro Pro Glu Ala Ala Ser
180 185 190
Trp Leu Leu Cys Glu Val Ser Gly Phe Ser Pro Pro Asn Ile Leu Leu
195 200 205
Met Trp Leu Glu Asp Gln Arg Glu Val Asn Thr Ser Gly Phe Ala Pro
210 215 220
Ala Arg Pro Pro Pro Gln Pro Gly Ser Thr Thr Phe Trp Ala Trp Ser
225 230 235 240
Val Leu Arg Val Pro Ala Pro Pro Ser Pro Gln Pro Ala Thr Tyr Thr
245 250 255
Cys Val Val Ser His Glu Asp Ser Arg Thr Leu Leu Asn Ala Ser Arg
260 265 270
Ser Leu Glu Val Ser Tyr Val Thr Asp His
275 280
<210> 5
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 5
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 6
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 6
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr Leu Tyr Cys
20
<210> 7
<211> 42
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 7
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 8
<211> 48
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 8
Gln Arg Arg Lys Tyr Arg Ser Asn Lys Gly Glu Ser Pro Val Glu Pro
1 5 10 15
Ala Glu Pro Cys Arg Tyr Ser Cys Pro Arg Glu Glu Glu Gly Ser Thr
20 25 30
Ile Pro Ile Gln Glu Asp Tyr Arg Lys Pro Glu Pro Ala Cys Ser Pro
35 40 45
<210> 9
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 9
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 10
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 10
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 11
<211> 1184
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 11
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt
60
tggggggagg ggtcggcaat tgaaccggtg cctagagaag gtggcgcggg gtaaactggg
120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa
180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa
240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt
300
gaattacttc cacctggctg cagtacgtga ttcttgatcc cgagcttcgg gttggaagtg
360
ggtgggagag ttcgaggcct tgcgcttaag gagccccttc gcctcgtgct tgagttgagg
420
cctggcctgg gcgctggggc cgccgcgtgc gaatctggtg gcaccttcgc gcctgtctcg
480
ctgctttcga taagtctcta gccatttaaa atttttgatg acctgctgcg acgctttttt
540
tctggcaaga tagtcttgta aatgcgggcc aagatctgca cactggtatt tcggtttttg
600
gggccgcggg cggcgacggg gcccgtgcgt cccagcgcac atgttcggcg aggcggggcc
660
tgcgagcgcg gccaccgaga atcggacggg ggtagtctca agctggccgg cctgctctgg
720
tgcctggcct cgcgccgccg tgtatcgccc cgccctgggc ggcaaggctg gcccggtcgg
780
caccagttgc gtgagcggaa agatggccgc ttcccggccc tgctgcaggg agctcaaaat
840
ggaggacgcg gcgctcggga gagcgggcgg gtgagtcacc cacacaaagg aaaagggcct
900
ttccgtcctc agccgtcgct tcatgtgact ccacggagta ccgggcgccg tccaggcacc
960
tcgattagtt ctcgagcttt tggagtacgt cgtctttagg ttggggggag gggttttatg
1020
cgatggagtt tccccacact gagtgggtgg agactgaagt taggccagct tggcacttga
1080
tgtaattctc cttggaattt gccctttttg agtttggatc ttggttcatt ctcaagcctc
1140
agacagtggt tcaaagtttt tttcttccat ttcaggtgtc gtga
1184
<210> 12
<211> 63
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 12
atggccctgc ctgtgacagc cctgctgctg cctctggctc tgctgctgca tgccgctaga
60
ccc
63
<210> 13
<211> 135
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 13
accacgacgc cagcgccgcg accaccaaca ccggcgccca ccatcgcgtc gcagcccctg
60
tccctgcgcc cagaggcgtg ccggccagcg gcggggggcg cagtgcacac gagggggctg
120
gacttcgcct gtgat
135
<210> 14
<211> 690
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 14
gagagcaagt acggccctcc ctgcccccct tgccctgccc ccgagttcct gggcggaccc
60
agcgtgttcc tgttcccccc caagcccaag gacaccctga tgatcagccg gacccccgag
120
gtgacctgtg tggtggtgga cgtgtcccag gaggaccccg aggtccagtt caactggtac
180
gtggacggcg tggaggtgca caacgccaag accaagcccc gggaggagca gttcaatagc
240
acctaccggg tggtgtccgt gctgaccgtg ctgcaccagg actggctgaa cggcaaggaa
300
tacaagtgta aggtgtccaa caagggcctg cccagcagca tcgagaaaac catcagcaag
360
gccaagggcc agcctcggga gccccaggtg tacaccctgc cccctagcca agaggagatg
420
accaagaacc aggtgtccct gacctgcctg gtgaagggct tctaccccag cgacatcgcc
480
gtggagtggg agagcaacgg ccagcccgag aacaactaca agaccacccc ccctgtgctg
540
gacagcgacg gcagcttctt cctgtacagc cggctgaccg tggacaagag ccggtggcag
600
gagggcaacg tctttagctg ctccgtgatg cacgaggccc tgcacaacca ctacacccag
660
aagagcctga gcctgtccct gggcaagatg
690
<210> 15
<211> 847
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 15
aggtggcccg aaagtcccaa ggcccaggca tctagtgttc ctactgcaca gccccaggca
60
gaaggcagcc tagccaaagc tactactgca cctgccacta cgcgcaatac tggccgtggc
120
ggggaggaga agaaaaagga gaaagagaaa gaagaacagg aagagaggga gaccaagacc
180
cctgaatgtc catcccatac ccagccgctg ggcgtctatc tcttgactcc cgcagtacag
240
gacttgtggc ttagagataa ggccaccttt acatgtttcg tcgtgggctc tgacctgaag
300
gatgcccatt tgacttggga ggttgccgga aaggtaccca cagggggggt tgaggaaggg
360
ttgctggagc gccattccaa tggctctcag agccagcact caagactcac ccttccgaga
420
tccctgtgga acgccgggac ctctgtcaca tgtactctaa atcatcctag cctgccccca
480
cagcgtctga tggcccttag agagccagcc gcccaggcac cagttaagct tagcctgaat
540
ctgctcgcca gtagtgatcc cccagaggcc gccagctggc tcttatgcga agtgtccggc
600
tttagcccgc ccaacatctt gctcatgtgg ctggaggacc agcgagaagt gaacaccagc
660
ggcttcgctc cagcccggcc cccaccccag ccgggttcta ccacattctg ggcctggagt
720
gtcttaaggg tcccagcacc acctagcccc cagccagcca catacacctg tgttgtgtcc
780
catgaagata gcaggaccct gctaaatgct tctaggagtc tggaggtttc ctacgtgact
840
gaccatt
847
<210> 16
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 16
ggtggcggag gttctggagg tggaggttcc
30
<210> 17
<211> 72
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 17
atctacatct gggcgccctt ggccgggact tgtggggtcc ttctcctgtc actggttatc
60
accctttact gc
72
<210> 18
<211> 126
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 18
aaacggggca gaaagaaact cctgtatata ttcaaacaac catttatgag accagtacaa
60
actactcaag aggaagatgg ctgtagctgc cgatttccag aagaagaaga aggaggatgt
120
gaactg
126
<210> 19
<211> 123
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 19
aggagtaaga ggagcaggct cctgcacagt gactacatga acatgactcc ccgccgcccc
60
gggcccaccc gcaagcatta ccagccctat gccccaccac gcgacttcgc agcctatcgc
120
tcc
123
<210> 20
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 20
agagtgaagt tcagcaggag cgcagacgcc cccgcgtaca agcagggcca gaaccagctc
60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc
120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat
180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc
240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc
300
tacgacgccc ttcacatgca ggccctgccc cctcgc
336
<210> 21
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 21
agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc agcagggcca gaaccagctc
60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc
120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat
180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc
240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc
300
tacgacgccc ttcacatgca ggccctgccc cctcgc
336
<210> 22
<211> 373
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 22
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
145 150 155 160
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
165 170 175
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
180 185 190
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
195 200 205
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
210 215 220
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
225 230 235 240
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
245 250 255
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
260 265 270
Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
275 280 285
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
290 295 300
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
305 310 315 320
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
325 330 335
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
340 345 350
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
355 360 365
Ala Leu Pro Pro Arg
370
<210> 23
<211> 1182
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 23
atggccctcc ctgtcactgc cctgcttctc cccctcgcac tcctgctcca cgccgctaga
60
ccacccggat ggtttctgga ctctccggat cgcccgtgga atcccccaac cttctcaccg
120
gcactcttgg ttgtgactga gggcgataat gcgaccttca cgtgctcgtt ctccaacacc
180
tccgaatcat tcgtgctgaa ctggtaccgc atgagcccgt caaaccagac cgacaagctc
240
gccgcgtttc cggaagatcg gtcgcaaccg ggacaggatt gtcggttccg cgtgactcaa
300
ctgccgaatg gcagagactt ccacatgagc gtggtccgcg ctaggcgaaa cgactccggg
360
acctacctgt gcggagccat ctcgctggcg cctaaggccc aaatcaaaga gagcttgagg
420
gccgaactga gagtgaccga gcgcagagct gaggtgccaa ctgcacatcc atccccatcg
480
cctcggcctg cggggcagtt tcagaccctg gtcacgacca ctccggcgcc gcgcccaccg
540
actccggccc caactatcgc gagccagccc ctgtcgctga ggccggaagc atgccgccct
600
gccgccggag gtgctgtgca tacccgggga ttggacttcg catgcgacat ctacatttgg
660
gctcctctcg ccggaacttg tggcgtgctc cttctgtccc tggtcatcac cctgtactgc
720
aagcggggtc ggaaaaagct tctgtacatt ttcaagcagc ccttcatgag gcccgtgcaa
780
accacccagg aggaggacgg ttgctcctgc cggttccccg aagaggaaga aggaggttgc
840
gagctgcgcg tgaagttctc ccggagcgcc gacgcccccg cctataagca gggccagaac
900
cagctgtaca acgaactgaa cctgggacgg cgggaagagt acgatgtgct ggacaagcgg
960
cgcggccggg accccgaaat gggcgggaag cctagaagaa agaaccctca ggaaggcctg
1020
tataacgagc tgcagaagga caagatggcc gaggcctact ccgaaattgg gatgaaggga
1080
gagcggcgga ggggaaaggg gcacgacggc ctgtaccaag gactgtccac cgccaccaag
1140
gacacatacg atgccctgca catgcaggcc cttccccctc gc
1182
<210> 24
<211> 394
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 24
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro
20 25 30
Trp Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly
35 40 45
Asp Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe
50 55 60
Val Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu
65 70 75 80
Ala Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe
85 90 95
Arg Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val
100 105 110
Arg Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser
115 120 125
Leu Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg
130 135 140
Val Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser
145 150 155 160
Pro Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Thr Thr Thr Pro Ala
165 170 175
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
180 185 190
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
195 200 205
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
210 215 220
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
225 230 235 240
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
245 250 255
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
260 265 270
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
275 280 285
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
290 295 300
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
305 310 315 320
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
325 330 335
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
340 345 350
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
355 360 365
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
370 375 380
Ala Leu His Met Gln Ala Leu Pro Pro Arg
385 390
<210> 25
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 25
Gly Gly Gly Gly Ser
1 5
<210> 26
<211> 30
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> ДРУГОЙ_ПРИЗНАК
<222> (1)..(30)
<223> /примечание="Эта последовательность может охватывать 1-6
повторяющихся звеньев "Gly Gly Gly Gly Ser"
<400> 26
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25 30
<210> 27
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 27
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<210> 28
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 28
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 29
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 29
Gly Gly Gly Ser
1
<210> 30
<211> 5000
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<220>
<221> другой_признак
<222> (1)..(5000)
<223> /примечание="Эта последовательность может охватывать 50-5000
нуклеотидов"
<400> 30
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1980
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2040
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2100
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2160
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2220
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2280
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2340
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2400
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2460
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2520
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2580
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2640
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2700
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2760
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2820
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2880
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2940
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3000
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3060
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4980
aaaaaaaaaa aaaaaaaaaa
5000
<210> 31
<211> 100
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 31
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
60
tttttttttt tttttttttt tttttttttt tttttttttt
100
<210> 32
<211> 5000
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<220>
<221> другой_признак
<222> (1)..(5000)
<223> /примечание="Эта последовательность может охватывать 50-5000
нуклеотидов"
<400> 32
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
60
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
120
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
180
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
240
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
300
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
360
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
420
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
480
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
540
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
600
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
660
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
720
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
780
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
840
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
900
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
960
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
1020
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
1080
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
1140
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
1200
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
1260
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
1320
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
1380
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
1440
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
1500
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
1560
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
1620
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
1680
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
1740
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
1800
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
1860
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
1920
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
1980
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
2040
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
2100
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
2160
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
2220
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
2280
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
2340
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
2400
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
2460
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
2520
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
2580
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
2640
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
2700
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
2760
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
2820
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
2880
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
2940
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
3000
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
3060
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
3120
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
3180
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
3240
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
3300
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
3360
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
3420
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
3480
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
3540
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
3600
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
3660
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
3720
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
3780
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
3840
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
3900
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
3960
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
4020
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
4080
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
4140
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
4200
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
4260
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
4320
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
4380
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
4440
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
4500
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
4560
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
4620
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
4680
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
4740
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
4800
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
4860
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
4920
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt
4980
tttttttttt tttttttttt
5000
<210> 33
<211> 5000
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<220>
<221> другой_признак
<222> (1)..(5000)
<223> /примечание="Эта последовательность может охватывать 100-5000
нуклеотидов"
<400> 33
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1980
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2040
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2100
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2160
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2220
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2280
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2340
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2400
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2460
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2520
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2580
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2640
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2700
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2760
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2820
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2880
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
2940
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3000
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3060
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
3960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
4980
aaaaaaaaaa aaaaaaaaaa
5000
<210> 34
<211> 400
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<220>
<221> другой_признак
<222> (1)..(400)
<223> /примечание="Эта последовательность может охватывать 100-400
нуклеотидов"
<400> 34
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
400
<210> 35
<211> 2000
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<220>
<221> другой_признак
<222> (1)..(2000)
<223> /примечание="Эта последовательность может охватывать 50-2000
нуклеотидов"
<400> 35
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa
1980
aaaaaaaaaa aaaaaaaaaa
2000
<210> 36
<211> 41
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 36
Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 37
<211> 123
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 37
aggagtaaga ggagcaggct cctgcacagt gactacatga acatgactcc ccgccgcccc
60
gggcccaccc gcaagcatta ccagccctat gccccaccac gcgacttcgc agcctatcgc
120
tcc
123
<210> 38
<211> 35
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 38
Thr Lys Lys Lys Tyr Ser Ser Ser Val His Asp Pro Asn Gly Glu Tyr
1 5 10 15
Met Phe Met Arg Ala Val Asn Thr Ala Lys Lys Ser Arg Leu Thr Asp
20 25 30
Val Thr Leu
35
<210> 39
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 39
ggtggcggag gttctggagg tgggggttcc
30
<210> 40
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 40
Gly Gly Gly Ser
1
<210> 41
<211> 40
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> ДРУГОЙ_ПРИЗНАК
<222> (1)..(40)
<223> /примечание="Эта последовательность может охватывать 1-10
повторяющихся звеньев "Gly Gly Gly Ser»
<400> 41
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
20 25 30
Gly Gly Gly Ser Gly Gly Gly Ser
35 40
<210> 42
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 42
Gly Ser Thr Ser Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr
1 5 10 15
Lys Gly
<210> 43
<211> 35
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 43
Thr Lys Lys Lys Tyr Ser Ser Ser Val His Asp Pro Asn Gly Glu Phe
1 5 10 15
Met Phe Met Arg Ala Val Asn Thr Ala Lys Lys Ser Arg Leu Thr Asp
20 25 30
Val Thr Leu
35
<210> 44
<211> 105
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 44
acaaaaaaga agtattcatc cagtgtgcac gaccctaacg gtgaatacat gttcatgaga
60
gcagtgaaca cagccaaaaa atccagactc acagatgtga cccta
105
<210> 45
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 45
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Gln Glu
115 120 125
Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys
130 135 140
Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg
145 150 155 160
Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser
165 170 175
Glu Thr Thr Tyr Tyr Ser Ser Ser Leu Lys Ser Arg Val Thr Ile Ser
180 185 190
Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr
195 200 205
Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly
210 215 220
Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
225 230 235 240
Ser Ser
<210> 46
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 46
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Gln Glu
115 120 125
Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys
130 135 140
Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg
145 150 155 160
Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser
165 170 175
Glu Thr Thr Tyr Tyr Gln Ser Ser Leu Lys Ser Arg Val Thr Ile Ser
180 185 190
Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr
195 200 205
Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly
210 215 220
Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
225 230 235 240
Ser Ser
<210> 47
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 47
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Ser Ser Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met Thr Gln Ser Pro Ala
130 135 140
Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala
145 150 155 160
Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly
180 185 190
Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln
210 215 220
Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu
225 230 235 240
Ile Lys
<210> 48
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 48
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Gln Ser Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met Thr Gln Ser Pro Ala
130 135 140
Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala
145 150 155 160
Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly
180 185 190
Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln
210 215 220
Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu
225 230 235 240
Ile Lys
<210> 49
<211> 247
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 49
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
115 120 125
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
130 135 140
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
145 150 155 160
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
165 170 175
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Ser Ser Ser Leu Lys Ser
180 185 190
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
195 200 205
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
210 215 220
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
225 230 235 240
Thr Leu Val Thr Val Ser Ser
245
<210> 50
<211> 247
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 50
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
115 120 125
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
130 135 140
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
145 150 155 160
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
165 170 175
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Gln Ser Ser Leu Lys Ser
180 185 190
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
195 200 205
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
210 215 220
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
225 230 235 240
Thr Leu Val Thr Val Ser Ser
245
<210> 51
<211> 247
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 51
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Ser Ser Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met
130 135 140
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
145 150 155 160
Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr
165 170 175
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser
180 185 190
Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
210 215 220
Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln
225 230 235 240
Gly Thr Lys Leu Glu Ile Lys
245
<210> 52
<211> 247
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 52
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Gln Ser Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met
130 135 140
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
145 150 155 160
Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr
165 170 175
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser
180 185 190
Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
210 215 220
Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln
225 230 235 240
Gly Thr Lys Leu Glu Ile Lys
245
<210> 53
<211> 247
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 53
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
115 120 125
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
130 135 140
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
145 150 155 160
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
165 170 175
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ser Leu Lys Ser
180 185 190
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
195 200 205
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
210 215 220
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
225 230 235 240
Thr Leu Val Thr Val Ser Ser
245
<210> 54
<211> 247
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 54
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met
130 135 140
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
145 150 155 160
Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr
165 170 175
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser
180 185 190
Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
210 215 220
Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln
225 230 235 240
Gly Thr Lys Leu Glu Ile Lys
245
<210> 55
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 55
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Gln Glu
115 120 125
Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys
130 135 140
Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg
145 150 155 160
Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser
165 170 175
Glu Thr Thr Tyr Tyr Asn Ser Ser Leu Lys Ser Arg Val Thr Ile Ser
180 185 190
Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr
195 200 205
Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly
210 215 220
Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
225 230 235 240
Ser Ser
<210> 56
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 56
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met Thr Gln Ser Pro Ala
130 135 140
Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala
145 150 155 160
Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly
180 185 190
Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln
210 215 220
Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu
225 230 235 240
Ile Lys
<210> 57
<211> 813
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 57
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca
120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag
180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct
240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag
300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga
360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt
420
ggaggaagcc aggtccaact ccaagaaagc ggaccgggtc ttgtgaagcc atcagaaact
480
ctttcactga cttgtactgt gagcggagtg tctctccccg attacggggt gtcttggatc
540
agacagccac cggggaaggg tctggaatgg attggagtga tttggggctc tgagactact
600
tactactctt catccctcaa gtcacgcgtc accatctcaa aggacaactc taagaatcag
660
gtgtcactga aactgtcatc tgtgaccgca gccgacaccg ccgtgtacta ttgcgctaag
720
cattactatt atggcgggag ctacgcaatg gattactggg gacagggtac tctggtcacc
780
gtgtccagcc accaccatca tcaccatcac cat
813
<210> 58
<211> 813
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 58
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca
120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag
180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct
240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag
300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga
360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt
420
ggaggaagcc aggtccaact ccaagaaagc ggaccgggtc ttgtgaagcc atcagaaact
480
ctttcactga cttgtactgt gagcggagtg tctctccccg attacggggt gtcttggatc
540
agacagccac cggggaaggg tctggaatgg attggagtga tttggggctc tgagactact
600
tactaccaat catccctcaa gtcacgcgtc accatctcaa aggacaactc taagaatcag
660
gtgtcactga aactgtcatc tgtgaccgca gccgacaccg ccgtgtacta ttgcgctaag
720
cattactatt atggcgggag ctacgcaatg gattactggg gacagggtac tctggtcacc
780
gtgtccagcc accaccatca tcaccatcac cat
813
<210> 59
<211> 813
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 59
atggctctgc ccgtgaccgc actcctcctg ccactggctc tgctgcttca cgccgctcgc
60
ccacaagtcc agcttcaaga atcagggcct ggtctggtga agccatctga gactctgtcc
120
ctcacttgca ccgtgagcgg agtgtccctc ccagactacg gagtgagctg gattagacag
180
cctcccggaa agggactgga gtggatcgga gtgatttggg gtagcgaaac cacttactat
240
tcatcttccc tgaagtcacg ggtcaccatt tcaaaggata actcaaagaa tcaagtgagc
300
ctcaagctct catcagtcac cgccgctgac accgccgtgt attactgtgc caagcattac
360
tactatggag ggtcctacgc catggactac tggggccagg gaactctggt cactgtgtca
420
tctggtggag gaggtagcgg aggaggcggg agcggtggag gtggctccga aatcgtgatg
480
acccagagcc ctgcaaccct gtccctttct cccggggaac gggctaccct ttcttgtcgg
540
gcatcacaag atatctcaaa atacctcaat tggtatcaac agaagccggg acaggcccct
600
aggcttctta tctaccacac ctctcgcctg catagcggga ttcccgcacg ctttagcggg
660
tctggaagcg ggaccgacta cactctgacc atctcatctc tccagcccga ggacttcgcc
720
gtctacttct gccagcaggg taacaccctg ccgtacacct tcggccaggg caccaagctt
780
gagatcaaac atcaccacca tcatcaccat cac
813
<210> 60
<211> 813
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 60
atggctctgc ccgtgaccgc actcctcctg ccactggctc tgctgcttca cgccgctcgc
60
ccacaagtcc agcttcaaga atcagggcct ggtctggtga agccatctga gactctgtcc
120
ctcacttgca ccgtgagcgg agtgtccctc ccagactacg gagtgagctg gattagacag
180
cctcccggaa agggactgga gtggatcgga gtgatttggg gtagcgaaac cacttactat
240
caatcttccc tgaagtcacg ggtcaccatt tcaaaggata actcaaagaa tcaagtgagc
300
ctcaagctct catcagtcac cgccgctgac accgccgtgt attactgtgc caagcattac
360
tactatggag ggtcctacgc catggactac tggggccagg gaactctggt cactgtgtca
420
tctggtggag gaggtagcgg aggaggcggg agcggtggag gtggctccga aatcgtgatg
480
acccagagcc ctgcaaccct gtccctttct cccggggaac gggctaccct ttcttgtcgg
540
gcatcacaag atatctcaaa atacctcaat tggtatcaac agaagccggg acaggcccct
600
aggcttctta tctaccacac ctctcgcctg catagcggga ttcccgcacg ctttagcggg
660
tctggaagcg ggaccgacta cactctgacc atctcatctc tccagcccga ggacttcgcc
720
gtctacttct gccagcaggg taacaccctg ccgtacacct tcggccaggg caccaagctt
780
gagatcaaac atcaccacca tcatcaccat cac
813
<210> 61
<211> 828
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 61
atggccctcc cagtgaccgc tctgctgctg cctctcgcac ttcttctcca tgccgctcgg
60
cctgagatcg tcatgaccca aagccccgct accctgtccc tgtcacccgg cgagagggca
120
accctttcat gcagggccag ccaggacatt tctaagtacc tcaactggta tcagcagaag
180
ccagggcagg ctcctcgcct gctgatctac cacaccagcc gcctccacag cggtatcccc
240
gccagatttt ccgggagcgg gtctggaacc gactacaccc tcaccatctc ttctctgcag
300
cccgaggatt tcgccgtcta tttctgccag caggggaata ctctgccgta caccttcggt
360
caaggtacca agctggaaat caagggaggc ggaggatcag gcggtggcgg aagcggagga
420
ggtggctccg gaggaggagg ttcccaagtg cagcttcaag aatcaggacc cggacttgtg
480
aagccatcag aaaccctctc cctgacttgt accgtgtccg gtgtgagcct ccccgactac
540
ggagtctctt ggattcgcca gcctccgggg aagggtcttg aatggattgg ggtgatttgg
600
ggatcagaga ctacttacta ctcttcatca cttaagtcac gggtcaccat cagcaaagat
660
aatagcaaga accaagtgtc acttaagctg tcatctgtga ccgccgctga caccgccgtg
720
tactattgtg ccaaacatta ctattacgga gggtcttatg ctatggacta ctggggacag
780
gggaccctgg tgactgtctc tagccatcac catcaccacc atcatcac
828
<210> 62
<211> 828
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 62
atggccctcc cagtgaccgc tctgctgctg cctctcgcac ttcttctcca tgccgctcgg
60
cctgagatcg tcatgaccca aagccccgct accctgtccc tgtcacccgg cgagagggca
120
accctttcat gcagggccag ccaggacatt tctaagtacc tcaactggta tcagcagaag
180
ccagggcagg ctcctcgcct gctgatctac cacaccagcc gcctccacag cggtatcccc
240
gccagatttt ccgggagcgg gtctggaacc gactacaccc tcaccatctc ttctctgcag
300
cccgaggatt tcgccgtcta tttctgccag caggggaata ctctgccgta caccttcggt
360
caaggtacca agctggaaat caagggaggc ggaggatcag gcggtggcgg aagcggagga
420
ggtggctccg gaggaggagg ttcccaagtg cagcttcaag aatcaggacc cggacttgtg
480
aagccatcag aaaccctctc cctgacttgt accgtgtccg gtgtgagcct ccccgactac
540
ggagtctctt ggattcgcca gcctccgggg aagggtcttg aatggattgg ggtgatttgg
600
ggatcagaga ctacttacta ccagtcatca cttaagtcac gggtcaccat cagcaaagat
660
aatagcaaga accaagtgtc acttaagctg tcatctgtga ccgccgctga caccgccgtg
720
tactattgtg ccaaacatta ctattacgga gggtcttatg ctatggacta ctggggacag
780
gggaccctgg tgactgtctc tagccatcac catcaccacc atcatcac
828
<210> 63
<211> 828
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 63
atggcactgc ctgtcactgc cctcctgctg cctctggccc tccttctgca tgccgccagg
60
ccccaagtcc agctgcaaga gtcaggaccc ggactggtga agccgtctga gactctctca
120
ctgacttgta ccgtcagcgg cgtgtccctc cccgactacg gagtgtcatg gatccgccaa
180
cctcccggga aagggcttga atggattggt gtcatctggg gttctgaaac cacctactac
240
tcatcttccc tgaagtccag ggtgaccatc agcaaggata attccaagaa ccaggtcagc
300
cttaagctgt catctgtgac cgctgctgac accgccgtgt attactgcgc caagcactac
360
tattacggag gaagctacgc tatggactat tggggacagg gcactctcgt gactgtgagc
420
agcggcggtg gagggtctgg aggtggagga tccggtggtg gtgggtcagg cggaggaggg
480
agcgagattg tgatgactca gtcaccagcc accctttctc tttcacccgg cgagagagca
540
accctgagct gtagagccag ccaggacatt tctaagtacc tcaactggta tcagcaaaaa
600
ccggggcagg cccctcgcct cctgatctac catacctcac gccttcactc tggtatcccc
660
gctcggttta gcggatcagg atctggtacc gactacactc tgaccatttc cagcctgcag
720
ccagaagatt tcgcagtgta tttctgccag cagggcaata cccttcctta caccttcggt
780
cagggaacca agctcgaaat caagcaccat caccatcatc accaccat
828
<210> 64
<211> 828
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 64
atggcactgc ctgtcactgc cctcctgctg cctctggccc tccttctgca tgccgccagg
60
ccccaagtcc agctgcaaga gtcaggaccc ggactggtga agccgtctga gactctctca
120
ctgacttgta ccgtcagcgg cgtgtccctc cccgactacg gagtgtcatg gatccgccaa
180
cctcccggga aagggcttga atggattggt gtcatctggg gttctgaaac cacctactac
240
cagtcttccc tgaagtccag ggtgaccatc agcaaggata attccaagaa ccaggtcagc
300
cttaagctgt catctgtgac cgctgctgac accgccgtgt attactgcgc caagcactac
360
tattacggag gaagctacgc tatggactat tggggacagg gcactctcgt gactgtgagc
420
agcggcggtg gagggtctgg aggtggagga tccggtggtg gtgggtcagg cggaggaggg
480
agcgagattg tgatgactca gtcaccagcc accctttctc tttcacccgg cgagagagca
540
accctgagct gtagagccag ccaggacatt tctaagtacc tcaactggta tcagcaaaaa
600
ccggggcagg cccctcgcct cctgatctac catacctcac gccttcactc tggtatcccc
660
gctcggttta gcggatcagg atctggtacc gactacactc tgaccatttc cagcctgcag
720
ccagaagatt tcgcagtgta tttctgccag cagggcaata cccttcctta caccttcggt
780
cagggaacca agctcgaaat caagcaccat caccatcatc atcaccac
828
<210> 65
<211> 828
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 65
atggccctcc cagtgaccgc tctgctgctg cctctcgcac ttcttctcca tgccgctcgg
60
cctgagatcg tcatgaccca aagccccgct accctgtccc tgtcacccgg cgagagggca
120
accctttcat gcagggccag ccaggacatt tctaagtacc tcaactggta tcagcagaag
180
ccagggcagg ctcctcgcct gctgatctac cacaccagcc gcctccacag cggtatcccc
240
gccagatttt ccgggagcgg gtctggaacc gactacaccc tcaccatctc ttctctgcag
300
cccgaggatt tcgccgtcta tttctgccag caggggaata ctctgccgta caccttcggt
360
caaggtacca agctggaaat caagggaggc ggaggatcag gcggtggcgg aagcggagga
420
ggtggctccg gaggaggagg ttcccaagtg cagcttcaag aatcaggacc cggacttgtg
480
aagccatcag aaaccctctc cctgacttgt accgtgtccg gtgtgagcct ccccgactac
540
ggagtctctt ggattcgcca gcctccgggg aagggtcttg aatggattgg ggtgatttgg
600
ggatcagaga ctacttacta caattcatca cttaagtcac gggtcaccat cagcaaagat
660
aatagcaaga accaagtgtc acttaagctg tcatctgtga ccgccgctga caccgccgtg
720
tactattgtg ccaaacatta ctattacgga gggtcttatg ctatggacta ctggggacag
780
gggaccctgg tgactgtctc tagccatcac catcaccacc atcatcac
828
<210> 66
<211> 828
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 66
atggcactgc ctgtcactgc cctcctgctg cctctggccc tccttctgca tgccgccagg
60
ccccaagtcc agctgcaaga gtcaggaccc ggactggtga agccgtctga gactctctca
120
ctgacttgta ccgtcagcgg cgtgtccctc cccgactacg gagtgtcatg gatccgccaa
180
cctcccggga aagggcttga atggattggt gtcatctggg gttctgaaac cacctactac
240
aactcttccc tgaagtccag ggtgaccatc agcaaggata attccaagaa ccaggtcagc
300
cttaagctgt catctgtgac cgctgctgac accgccgtgt attactgcgc caagcactac
360
tattacggag gaagctacgc tatggactat tggggacagg gcactctcgt gactgtgagc
420
agcggcggtg gagggtctgg aggtggagga tccggtggtg gtgggtcagg cggaggaggg
480
agcgagattg tgatgactca gtcaccagcc accctttctc tttcacccgg cgagagagca
540
accctgagct gtagagccag ccaggacatt tctaagtacc tcaactggta tcagcaaaaa
600
ccggggcagg cccctcgcct cctgatctac catacctcac gccttcactc tggtatcccc
660
gctcggttta gcggatcagg atctggtacc gactacactc tgaccatttc cagcctgcag
720
ccagaagatt tcgcagtgta tttctgccag cagggcaata cccttcctta caccttcggt
780
cagggaacca agctcgaaat caagcaccat caccatcatc accaccat
828
<210> 67
<211> 813
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 67
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca
120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag
180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct
240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag
300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga
360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt
420
ggaggaagcc aggtccaact ccaagaaagc ggaccgggtc ttgtgaagcc atcagaaact
480
ctttcactga cttgtactgt gagcggagtg tctctccccg attacggggt gtcttggatc
540
agacagccac cggggaaggg tctggaatgg attggagtga tttggggctc tgagactact
600
tactacaatt catccctcaa gtcacgcgtc accatctcaa aggacaactc taagaatcag
660
gtgtcactga aactgtcatc tgtgaccgca gccgacaccg ccgtgtacta ttgcgctaag
720
cattactatt atggcgggag ctacgcaatg gattactggg gacagggtac tctggtcacc
780
gtgtccagcc accaccatca tcaccatcac cat
813
<210> 68
<211> 813
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 68
atggctctgc ccgtgaccgc actcctcctg ccactggctc tgctgcttca cgccgctcgc
60
ccacaagtcc agcttcaaga atcagggcct ggtctggtga agccatctga gactctgtcc
120
ctcacttgca ccgtgagcgg agtgtccctc ccagactacg gagtgagctg gattagacag
180
cctcccggaa agggactgga gtggatcgga gtgatttggg gtagcgaaac cacttactat
240
aactcttccc tgaagtcacg ggtcaccatt tcaaaggata actcaaagaa tcaagtgagc
300
ctcaagctct catcagtcac cgccgctgac accgccgtgt attactgtgc caagcattac
360
tactatggag ggtcctacgc catggactac tggggccagg gaactctggt cactgtgtca
420
tctggtggag gaggtagcgg aggaggcggg agcggtggag gtggctccga aatcgtgatg
480
acccagagcc ctgcaaccct gtccctttct cccggggaac gggctaccct ttcttgtcgg
540
gcatcacaag atatctcaaa atacctcaat tggtatcaac agaagccggg acaggcccct
600
aggcttctta tctaccacac ctctcgcctg catagcggga ttcccgcacg ctttagcggg
660
tctggaagcg ggaccgacta cactctgacc atctcatctc tccagcccga ggacttcgcc
720
gtctacttct gccagcaggg taacaccctg ccgtacacct tcggccaggg caccaagctt
780
gagatcaaac atcaccacca tcatcaccat cac
813
<210> 69
<211> 271
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 69
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
130 135 140
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
145 150 155 160
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Ser Ser Ser Leu Lys Ser
195 200 205
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
210 215 220
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Leu Val Thr Val Ser Ser His His His His His His His His
260 265 270
<210> 70
<211> 271
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 70
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
130 135 140
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
145 150 155 160
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Gln Ser Ser Leu Lys Ser
195 200 205
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
210 215 220
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Leu Val Thr Val Ser Ser His His His His His His His His
260 265 270
<210> 71
<211> 271
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 71
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Ser Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser
195 200 205
Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln
245 250 255
Gly Thr Lys Leu Glu Ile Lys His His His His His His His His
260 265 270
<210> 72
<211> 271
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 72
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Gln Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser
195 200 205
Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln
245 250 255
Gly Thr Lys Leu Glu Ile Lys His His His His His His His His
260 265 270
<210> 73
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 73
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val
145 150 155 160
Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser
165 170 175
Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly
180 185 190
Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Ser
195 200 205
Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn
210 215 220
Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp
245 250 255
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser His His His His
260 265 270
His His His His
275
<210> 74
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 74
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val
145 150 155 160
Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser
165 170 175
Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly
180 185 190
Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Gln
195 200 205
Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn
210 215 220
Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp
245 250 255
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser His His His His
260 265 270
His His His His
275
<210> 75
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 75
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Ser Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro
165 170 175
Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys
180 185 190
Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
195 200 205
Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln
225 230 235 240
Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro
245 250 255
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys His His His His
260 265 270
His His His His
275
<210> 76
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 76
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Gln Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro
165 170 175
Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys
180 185 190
Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
195 200 205
Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln
225 230 235 240
Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro
245 250 255
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys His His His His
260 265 270
His His His His
275
<210> 77
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 77
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val
145 150 155 160
Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser
165 170 175
Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly
180 185 190
Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn
195 200 205
Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn
210 215 220
Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp
245 250 255
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser His His His His
260 265 270
His His His His
275
<210> 78
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 78
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Asn Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro
165 170 175
Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys
180 185 190
Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
195 200 205
Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln
225 230 235 240
Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro
245 250 255
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys His His His His
260 265 270
His His His His
275
<210> 79
<211> 271
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 79
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
130 135 140
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
145 150 155 160
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ser Leu Lys Ser
195 200 205
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
210 215 220
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Leu Val Thr Val Ser Ser His His His His His His His His
260 265 270
<210> 80
<211> 271
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 80
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Asn Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser
195 200 205
Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln
245 250 255
Gly Thr Lys Leu Glu Ile Lys His His His His His His His His
260 265 270
<210> 81
<211> 1458
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 81
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca
120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag
180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct
240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag
300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga
360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt
420
ggaggaagcc aggtccaact ccaagaaagc ggaccgggtc ttgtgaagcc atcagaaact
480
ctttcactga cttgtactgt gagcggagtg tctctccccg attacggggt gtcttggatc
540
agacagccac cggggaaggg tctggaatgg attggagtga tttggggctc tgagactact
600
tactactctt catccctcaa gtcacgcgtc accatctcaa aggacaactc taagaatcag
660
gtgtcactga aactgtcatc tgtgaccgca gccgacaccg ccgtgtacta ttgcgctaag
720
cattactatt atggcgggag ctacgcaatg gattactggg gacagggtac tctggtcacc
780
gtgtccagca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc
840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc
900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg
960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg
1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt
1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc
1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt
1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc
1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag
1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac
1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg
1440
caggccctgc cgcctcgg
1458
<210> 82
<211> 1458
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 82
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca
120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag
180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct
240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag
300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga
360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt
420
ggaggaagcc aggtccaact ccaagaaagc ggaccgggtc ttgtgaagcc atcagaaact
480
ctttcactga cttgtactgt gagcggagtg tctctccccg attacggggt gtcttggatc
540
agacagccac cggggaaggg tctggaatgg attggagtga tttggggctc tgagactact
600
tactaccaat catccctcaa gtcacgcgtc accatctcaa aggacaactc taagaatcag
660
gtgtcactga aactgtcatc tgtgaccgca gccgacaccg ccgtgtacta ttgcgctaag
720
cattactatt atggcgggag ctacgcaatg gattactggg gacagggtac tctggtcacc
780
gtgtccagca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc
840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc
900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg
960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg
1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt
1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc
1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt
1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc
1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag
1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac
1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg
1440
caggccctgc cgcctcgg
1458
<210> 83
<211> 1458
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 83
atggctctgc ccgtgaccgc actcctcctg ccactggctc tgctgcttca cgccgctcgc
60
ccacaagtcc agcttcaaga atcagggcct ggtctggtga agccatctga gactctgtcc
120
ctcacttgca ccgtgagcgg agtgtccctc ccagactacg gagtgagctg gattagacag
180
cctcccggaa agggactgga gtggatcgga gtgatttggg gtagcgaaac cacttactat
240
tcatcttccc tgaagtcacg ggtcaccatt tcaaaggata actcaaagaa tcaagtgagc
300
ctcaagctct catcagtcac cgccgctgac accgccgtgt attactgtgc caagcattac
360
tactatggag ggtcctacgc catggactac tggggccagg gaactctggt cactgtgtca
420
tctggtggag gaggtagcgg aggaggcggg agcggtggag gtggctccga aatcgtgatg
480
acccagagcc ctgcaaccct gtccctttct cccggggaac gggctaccct ttcttgtcgg
540
gcatcacaag atatctcaaa atacctcaat tggtatcaac agaagccggg acaggcccct
600
aggcttctta tctaccacac ctctcgcctg catagcggga ttcccgcacg ctttagcggg
660
tctggaagcg ggaccgacta cactctgacc atctcatctc tccagcccga ggacttcgcc
720
gtctacttct gccagcaggg taacaccctg ccgtacacct tcggccaggg caccaagctt
780
gagatcaaaa ccactactcc cgctccaagg ccacccaccc ctgccccgac catcgcctct
840
cagccgcttt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc
900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg
960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg
1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt
1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc
1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt
1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc
1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag
1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac
1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg
1440
caggccctgc cgcctcgg
1458
<210> 84
<211> 1458
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 84
atggctctgc ccgtgaccgc actcctcctg ccactggctc tgctgcttca cgccgctcgc
60
ccacaagtcc agcttcaaga atcagggcct ggtctggtga agccatctga gactctgtcc
120
ctcacttgca ccgtgagcgg agtgtccctc ccagactacg gagtgagctg gattagacag
180
cctcccggaa agggactgga gtggatcgga gtgatttggg gtagcgaaac cacttactat
240
caatcttccc tgaagtcacg ggtcaccatt tcaaaggata actcaaagaa tcaagtgagc
300
ctcaagctct catcagtcac cgccgctgac accgccgtgt attactgtgc caagcattac
360
tactatggag ggtcctacgc catggactac tggggccagg gaactctggt cactgtgtca
420
tctggtggag gaggtagcgg aggaggcggg agcggtggag gtggctccga aatcgtgatg
480
acccagagcc ctgcaaccct gtccctttct cccggggaac gggctaccct ttcttgtcgg
540
gcatcacaag atatctcaaa atacctcaat tggtatcaac agaagccggg acaggcccct
600
aggcttctta tctaccacac ctctcgcctg catagcggga ttcccgcacg ctttagcggg
660
tctggaagcg ggaccgacta cactctgacc atctcatctc tccagcccga ggacttcgcc
720
gtctacttct gccagcaggg taacaccctg ccgtacacct tcggccaggg caccaagctt
780
gagatcaaaa ccactactcc cgctccaagg ccacccaccc ctgccccgac catcgcctct
840
cagccgcttt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc
900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg
960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg
1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt
1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc
1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt
1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc
1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag
1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac
1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg
1440
caggccctgc cgcctcgg
1458
<210> 85
<211> 1473
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 85
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca
120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag
180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct
240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag
300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga
360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt
420
ggaggaagcg gcggaggcgg gagccaggtc caactccaag aaagcggacc gggtcttgtg
480
aagccatcag aaactctttc actgacttgt actgtgagcg gagtgtctct ccccgattac
540
ggggtgtctt ggatcagaca gccaccgggg aagggtctgg aatggattgg agtgatttgg
600
ggctctgaga ctacttacta ctcttcatcc ctcaagtcac gcgtcaccat ctcaaaggac
660
aactctaaga atcaggtgtc actgaaactg tcatctgtga ccgcagccga caccgccgtg
720
tactattgcg ctaagcatta ctattatggc gggagctacg caatggatta ctggggacag
780
ggtactctgg tcaccgtgtc cagcaccact accccagcac cgaggccacc caccccggct
840
cctaccatcg cctcccagcc tctgtccctg cgtccggagg catgtagacc cgcagctggt
900
ggggccgtgc atacccgggg tcttgacttc gcctgcgata tctacatttg ggcccctctg
960
gctggtactt gcggggtcct gctgctttca ctcgtgatca ctctttactg taagcgcggt
1020
cggaagaagc tgctgtacat ctttaagcaa cccttcatga ggcctgtgca gactactcaa
1080
gaggaggacg gctgttcatg ccggttccca gaggaggagg aaggcggctg cgaactgcgc
1140
gtgaaattca gccgcagcgc agatgctcca gcctacaagc aggggcagaa ccagctctac
1200
aacgaactca atcttggtcg gagagaggag tacgacgtgc tggacaagcg gagaggacgg
1260
gacccagaaa tgggcgggaa gccgcgcaga aagaatcccc aagagggcct gtacaacgag
1320
ctccaaaagg ataagatggc agaagcctat agcgagattg gtatgaaagg ggaacgcaga
1380
agaggcaaag gccacgacgg actgtaccag ggactcagca ccgccaccaa ggacacctat
1440
gacgctcttc acatgcaggc cctgccgcct cgg
1473
<210> 86
<211> 1473
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 86
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca
120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag
180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct
240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag
300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga
360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt
420
ggaggaagcg gaggcggagg gagccaggtc caactccaag aaagcggacc gggtcttgtg
480
aagccatcag aaactctttc actgacttgt actgtgagcg gagtgtctct ccccgattac
540
ggggtgtctt ggatcagaca gccaccgggg aagggtctgg aatggattgg agtgatttgg
600
ggctctgaga ctacttacta ccaatcatcc ctcaagtcac gcgtcaccat ctcaaaggac
660
aactctaaga atcaggtgtc actgaaactg tcatctgtga ccgcagccga caccgccgtg
720
tactattgcg ctaagcatta ctattatggc gggagctacg caatggatta ctggggacag
780
ggtactctgg tcaccgtgtc cagcaccact accccagcac cgaggccacc caccccggct
840
cctaccatcg cctcccagcc tctgtccctg cgtccggagg catgtagacc cgcagctggt
900
ggggccgtgc atacccgggg tcttgacttc gcctgcgata tctacatttg ggcccctctg
960
gctggtactt gcggggtcct gctgctttca ctcgtgatca ctctttactg taagcgcggt
1020
cggaagaagc tgctgtacat ctttaagcaa cccttcatga ggcctgtgca gactactcaa
1080
gaggaggacg gctgttcatg ccggttccca gaggaggagg aaggcggctg cgaactgcgc
1140
gtgaaattca gccgcagcgc agatgctcca gcctacaagc aggggcagaa ccagctctac
1200
aacgaactca atcttggtcg gagagaggag tacgacgtgc tggacaagcg gagaggacgg
1260
gacccagaaa tgggcgggaa gccgcgcaga aagaatcccc aagagggcct gtacaacgag
1320
ctccaaaagg ataagatggc agaagcctat agcgagattg gtatgaaagg ggaacgcaga
1380
agaggcaaag gccacgacgg actgtaccag ggactcagca ccgccaccaa ggacacctat
1440
gacgctcttc acatgcaggc cctgccgcct cgg
1473
<210> 87
<211> 1473
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 87
atggctctgc ccgtgaccgc actcctcctg ccactggctc tgctgcttca cgccgctcgc
60
ccacaagtcc agcttcaaga atcagggcct ggtctggtga agccatctga gactctgtcc
120
ctcacttgca ccgtgagcgg agtgtccctc ccagactacg gagtgagctg gattagacag
180
cctcccggaa agggactgga gtggatcgga gtgatttggg gtagcgaaac cacttactat
240
tcatcttccc tgaagtcacg ggtcaccatt tcaaaggata actcaaagaa tcaagtgagc
300
ctcaagctct catcagtcac cgccgctgac accgccgtgt attactgtgc caagcattac
360
tactatggag ggtcctacgc catggactac tggggccagg gaactctggt cactgtgtca
420
tctggtggag gaggtagcgg aggaggcggg agcggtggag gtggctccgg aggtggcgga
480
agcgaaatcg tgatgaccca gagccctgca accctgtccc tttctcccgg ggaacgggct
540
accctttctt gtcgggcatc acaagatatc tcaaaatacc tcaattggta tcaacagaag
600
ccgggacagg cccctaggct tcttatctac cacacctctc gcctgcatag cgggattccc
660
gcacgcttta gcgggtctgg aagcgggacc gactacactc tgaccatctc atctctccag
720
cccgaggact tcgccgtcta cttctgccag cagggtaaca ccctgccgta caccttcggc
780
cagggcacca agcttgagat caaaaccact actcccgctc caaggccacc cacccctgcc
840
ccgaccatcg cctctcagcc gctttccctg cgtccggagg catgtagacc cgcagctggt
900
ggggccgtgc atacccgggg tcttgacttc gcctgcgata tctacatttg ggcccctctg
960
gctggtactt gcggggtcct gctgctttca ctcgtgatca ctctttactg taagcgcggt
1020
cggaagaagc tgctgtacat ctttaagcaa cccttcatga ggcctgtgca gactactcaa
1080
gaggaggacg gctgttcatg ccggttccca gaggaggagg aaggcggctg cgaactgcgc
1140
gtgaaattca gccgcagcgc agatgctcca gcctacaagc aggggcagaa ccagctctac
1200
aacgaactca atcttggtcg gagagaggag tacgacgtgc tggacaagcg gagaggacgg
1260
gacccagaaa tgggcgggaa gccgcgcaga aagaatcccc aagagggcct gtacaacgag
1320
ctccaaaagg ataagatggc agaagcctat agcgagattg gtatgaaagg ggaacgcaga
1380
agaggcaaag gccacgacgg actgtaccag ggactcagca ccgccaccaa ggacacctat
1440
gacgctcttc acatgcaggc cctgccgcct cgg
1473
<210> 88
<211> 1473
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 88
atggctctgc ccgtgaccgc actcctcctg ccactggctc tgctgcttca cgccgctcgc
60
ccacaagtcc agcttcaaga atcagggcct ggtctggtga agccatctga gactctgtcc
120
ctcacttgca ccgtgagcgg agtgtccctc ccagactacg gagtgagctg gattagacag
180
cctcccggaa agggactgga gtggatcgga gtgatttggg gtagcgaaac cacttactat
240
caatcttccc tgaagtcacg ggtcaccatt tcaaaggata actcaaagaa tcaagtgagc
300
ctcaagctct catcagtcac cgccgctgac accgccgtgt attactgtgc caagcattac
360
tactatggag ggtcctacgc catggactac tggggccagg gaactctggt cactgtgtca
420
tctggtggag gaggtagcgg aggaggcggg agcggtggag gtggctccgg aggcggtggg
480
tcagaaatcg tgatgaccca gagccctgca accctgtccc tttctcccgg ggaacgggct
540
accctttctt gtcgggcatc acaagatatc tcaaaatacc tcaattggta tcaacagaag
600
ccgggacagg cccctaggct tcttatctac cacacctctc gcctgcatag cgggattccc
660
gcacgcttta gcgggtctgg aagcgggacc gactacactc tgaccatctc atctctccag
720
cccgaggact tcgccgtcta cttctgccag cagggtaaca ccctgccgta caccttcggc
780
cagggcacca agcttgagat caaaaccact actcccgctc caaggccacc cacccctgcc
840
ccgaccatcg cctctcagcc gctttccctg cgtccggagg catgtagacc cgcagctggt
900
ggggccgtgc atacccgggg tcttgacttc gcctgcgata tctacatttg ggcccctctg
960
gctggtactt gcggggtcct gctgctttca ctcgtgatca ctctttactg taagcgcggt
1020
cggaagaagc tgctgtacat ctttaagcaa cccttcatga ggcctgtgca gactactcaa
1080
gaggaggacg gctgttcatg ccggttccca gaggaggagg aaggcggctg cgaactgcgc
1140
gtgaaattca gccgcagcgc agatgctcca gcctacaagc aggggcagaa ccagctctac
1200
aacgaactca atcttggtcg gagagaggag tacgacgtgc tggacaagcg gagaggacgg
1260
gacccagaaa tgggcgggaa gccgcgcaga aagaatcccc aagagggcct gtacaacgag
1320
ctccaaaagg ataagatggc agaagcctat agcgagattg gtatgaaagg ggaacgcaga
1380
agaggcaaag gccacgacgg actgtaccag ggactcagca ccgccaccaa ggacacctat
1440
gacgctcttc acatgcaggc cctgccgcct cgg
1473
<210> 89
<211> 1473
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 89
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca
120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag
180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct
240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag
300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga
360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt
420
ggaggaagcg gaggcggtgg gagccaggtc caactccaag aaagcggacc gggtcttgtg
480
aagccatcag aaactctttc actgacttgt actgtgagcg gagtgtctct ccccgattac
540
ggggtgtctt ggatcagaca gccaccgggg aagggtctgg aatggattgg agtgatttgg
600
ggctctgaga ctacttacta caactcatcc ctcaagtcac gcgtcaccat ctcaaaggac
660
aactctaaga atcaggtgtc actgaaactg tcatctgtga ccgcagccga caccgccgtg
720
tactattgcg ctaagcatta ctattatggc gggagctacg caatggatta ctggggacag
780
ggtactctgg tcaccgtgtc cagcaccact accccagcac cgaggccacc caccccggct
840
cctaccatcg cctcccagcc tctgtccctg cgtccggagg catgtagacc cgcagctggt
900
ggggccgtgc atacccgggg tcttgacttc gcctgcgata tctacatttg ggcccctctg
960
gctggtactt gcggggtcct gctgctttca ctcgtgatca ctctttactg taagcgcggt
1020
cggaagaagc tgctgtacat ctttaagcaa cccttcatga ggcctgtgca gactactcaa
1080
gaggaggacg gctgttcatg ccggttccca gaggaggagg aaggcggctg cgaactgcgc
1140
gtgaaattca gccgcagcgc agatgctcca gcctacaagc aggggcagaa ccagctctac
1200
aacgaactca atcttggtcg gagagaggag tacgacgtgc tggacaagcg gagaggacgg
1260
gacccagaaa tgggcgggaa gccgcgcaga aagaatcccc aagagggcct gtacaacgag
1320
ctccaaaagg ataagatggc agaagcctat agcgagattg gtatgaaagg ggaacgcaga
1380
agaggcaaag gccacgacgg actgtaccag ggactcagca ccgccaccaa ggacacctat
1440
gacgctcttc acatgcaggc cctgccgcct cgg
1473
<210> 90
<211> 1473
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 90
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca
120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag
180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct
240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag
300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga
360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt
420
ggaggaagcg gaggcggtgg gagccaggtc caactccaag aaagcggacc gggtcttgtg
480
aagccatcag aaactctttc actgacttgt actgtgagcg gagtgtctct ccccgattac
540
ggggtgtctt ggatcagaca gccaccgggg aagggtctgg aatggattgg agtgatttgg
600
ggctctgaga ctacttacta caactcatcc ctcaagtcac gcgtcaccat ctcaaaggac
660
aactctaaga atcaggtgtc actgaaactg tcatctgtga ccgcagccga caccgccgtg
720
tactattgcg ctaagcatta ctattatggc gggagctacg caatggatta ctggggacag
780
ggtactctgg tcaccgtgtc cagcaccact accccagcac cgaggccacc caccccggct
840
cctaccatcg cctcccagcc tctgtccctg cgtccggagg catgtagacc cgcagctggt
900
ggggccgtgc atacccgggg tcttgacttc gcctgcgata tctacatttg ggcccctctg
960
gctggtactt gcggggtcct gctgctttca ctcgtgatca ctctttactg taagcgcggt
1020
cggaagaagc tgctgtacat ctttaagcaa cccttcatga ggcctgtgca gactactcaa
1080
gaggaggacg gctgttcatg ccggttccca gaggaggagg aaggcggctg cgaactgcgc
1140
gtgaaattca gccgcagcgc agatgctcca gcctacaagc aggggcagaa ccagctctac
1200
aacgaactca atcttggtcg gagagaggag tacgacgtgc tggacaagcg gagaggacgg
1260
gacccagaaa tgggcgggaa gccgcgcaga aagaatcccc aagagggcct gtacaacgag
1320
ctccaaaagg ataagatggc agaagcctat agcgagattg gtatgaaagg ggaacgcaga
1380
agaggcaaag gccacgacgg actgtaccag ggactcagca ccgccaccaa ggacacctat
1440
gacgctcttc acatgcaggc cctgccgcct cgg
1473
<210> 91
<211> 1473
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 91
atggctctgc ccgtgaccgc actcctcctg ccactggctc tgctgcttca cgccgctcgc
60
ccacaagtcc agcttcaaga atcagggcct ggtctggtga agccatctga gactctgtcc
120
ctcacttgca ccgtgagcgg agtgtccctc ccagactacg gagtgagctg gattagacag
180
cctcccggaa agggactgga gtggatcgga gtgatttggg gtagcgaaac cacttactat
240
aactcttccc tgaagtcacg ggtcaccatt tcaaaggata actcaaagaa tcaagtgagc
300
ctcaagctct catcagtcac cgccgctgac accgccgtgt attactgtgc caagcattac
360
tactatggag ggtcctacgc catggactac tggggccagg gaactctggt cactgtgtca
420
tctggtggag gaggtagcgg aggaggcggg agcggtggag gtggctccgg aggtggcgga
480
agcgaaatcg tgatgaccca gagccctgca accctgtccc tttctcccgg ggaacgggct
540
accctttctt gtcgggcatc acaagatatc tcaaaatacc tcaattggta tcaacagaag
600
ccgggacagg cccctaggct tcttatctac cacacctctc gcctgcatag cgggattccc
660
gcacgcttta gcgggtctgg aagcgggacc gactacactc tgaccatctc atctctccag
720
cccgaggact tcgccgtcta cttctgccag cagggtaaca ccctgccgta caccttcggc
780
cagggcacca agcttgagat caaaaccact actcccgctc caaggccacc cacccctgcc
840
ccgaccatcg cctctcagcc gctttccctg cgtccggagg catgtagacc cgcagctggt
900
ggggccgtgc atacccgggg tcttgacttc gcctgcgata tctacatttg ggcccctctg
960
gctggtactt gcggggtcct gctgctttca ctcgtgatca ctctttactg taagcgcggt
1020
cggaagaagc tgctgtacat ctttaagcaa cccttcatga ggcctgtgca gactactcaa
1080
gaggaggacg gctgttcatg ccggttccca gaggaggagg aaggcggctg cgaactgcgc
1140
gtgaaattca gccgcagcgc agatgctcca gcctacaagc aggggcagaa ccagctctac
1200
aacgaactca atcttggtcg gagagaggag tacgacgtgc tggacaagcg gagaggacgg
1260
gacccagaaa tgggcgggaa gccgcgcaga aagaatcccc aagagggcct gtacaacgag
1320
ctccaaaagg ataagatggc agaagcctat agcgagattg gtatgaaagg ggaacgcaga
1380
agaggcaaag gccacgacgg actgtaccag ggactcagca ccgccaccaa ggacacctat
1440
gacgctcttc acatgcaggc cctgccgcct cgg
1473
<210> 92
<211> 1458
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 92
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca
120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag
180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct
240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag
300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga
360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt
420
ggaggaagcc aggtccaact ccaagaaagc ggaccgggtc ttgtgaagcc atcagaaact
480
ctttcactga cttgtactgt gagcggagtg tctctccccg attacggggt gtcttggatc
540
agacagccac cggggaaggg tctggaatgg attggagtga tttggggctc tgagactact
600
tactacaact catccctcaa gtcacgcgtc accatctcaa aggacaactc taagaatcag
660
gtgtcactga aactgtcatc tgtgaccgca gccgacaccg ccgtgtacta ttgcgctaag
720
cattactatt atggcgggag ctacgcaatg gattactggg gacagggtac tctggtcacc
780
gtgtccagca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc
840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc
900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg
960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg
1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt
1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc
1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt
1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc
1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag
1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac
1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg
1440
caggccctgc cgcctcgg
1458
<210> 93
<211> 486
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 93
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
130 135 140
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
145 150 155 160
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Ser Ser Ser Leu Lys Ser
195 200 205
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
210 215 220
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Leu Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 94
<211> 486
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 94
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
130 135 140
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
145 150 155 160
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Gln Ser Ser Leu Lys Ser
195 200 205
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
210 215 220
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Leu Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 95
<211> 486
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 95
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Ser Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser
195 200 205
Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln
245 250 255
Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 96
<211> 486
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 96
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Gln Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser
195 200 205
Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln
245 250 255
Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 97
<211> 491
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 97
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val
145 150 155 160
Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser
165 170 175
Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly
180 185 190
Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Ser
195 200 205
Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn
210 215 220
Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp
245 250 255
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 98
<211> 491
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 98
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val
145 150 155 160
Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser
165 170 175
Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly
180 185 190
Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Gln
195 200 205
Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn
210 215 220
Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp
245 250 255
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 99
<211> 491
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 99
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Ser Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro
165 170 175
Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys
180 185 190
Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
195 200 205
Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln
225 230 235 240
Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro
245 250 255
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 100
<211> 491
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 100
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Gln Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro
165 170 175
Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys
180 185 190
Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
195 200 205
Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln
225 230 235 240
Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro
245 250 255
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 101
<211> 491
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 101
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val
145 150 155 160
Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser
165 170 175
Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly
180 185 190
Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn
195 200 205
Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn
210 215 220
Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp
245 250 255
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 102
<211> 491
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 102
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val
145 150 155 160
Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser
165 170 175
Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly
180 185 190
Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn
195 200 205
Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn
210 215 220
Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp
245 250 255
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 103
<211> 491
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 103
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Asn Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro
165 170 175
Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys
180 185 190
Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
195 200 205
Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln
225 230 235 240
Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro
245 250 255
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 104
<211> 486
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 104
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
130 135 140
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
145 150 155 160
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ser Leu Lys Ser
195 200 205
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
210 215 220
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Leu Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 105
<211> 813
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 105
atggccctgc ccgtcaccgc tctgctgctg ccccttgctc tgcttcttca tgcagcaagg
60
ccggacatcc agatgaccca aaccacctca tccctctctg cctctcttgg agacagggtg
120
accatttctt gtcgcgccag ccaggacatc agcaagtatc tgaactggta tcagcagaag
180
ccggacggaa ccgtgaagct cctgatctac catacctctc gcctgcatag cggcgtgccc
240
tcacgcttct ctggaagcgg atcaggaacc gattattctc tcactatttc aaatcttgag
300
caggaagata ttgccaccta tttctgccag cagggtaata ccctgcccta caccttcgga
360
ggagggacca agctcgaaat caccggtgga ggaggcagcg gcggtggagg gtctggtgga
420
ggtggttctg aggtgaagct gcaagaatca ggccctggac ttgtggcccc ttcacagtcc
480
ctgagcgtga cttgcaccgt gtccggagtc tccctgcccg actacggagt gtcatggatc
540
agacaacctc cacggaaagg actggaatgg ctcggtgtca tctggggtag cgaaactact
600
tactacaatt cagccctcaa aagcaggctg actattatca aggacaacag caagtcccaa
660
gtctttctta agatgaactc actccagact gacgacaccg caatctacta ttgtgctaag
720
cactactact acggaggatc ctacgctatg gattactggg gacaaggtac ttccgtcact
780
gtctcttcac accatcatca ccatcaccat cac
813
<210> 106
<211> 271
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 106
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu
20 25 30
Ser Ala Ser Leu Gly Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr
50 55 60
Val Lys Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile
85 90 95
Ser Asn Leu Glu Gln Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
130 135 140
Val Lys Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser
145 150 155 160
Leu Ser Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser
195 200 205
Arg Leu Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys
210 215 220
Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Ser Val Thr Val Ser Ser His His His His His His His His
260 265 270
<210> 107
<211> 1458
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 107
atggccttac cagtgaccgc cttgctcctg ccgctggcct tgctgctcca cgccgccagg
60
ccggacatcc agatgacaca gactacatcc tccctgtctg cctctctggg agacagagtc
120
accatcagtt gcagggcaag tcaggacatt agtaaatatt taaattggta tcagcagaaa
180
ccagatggaa ctgttaaact cctgatctac catacatcaa gattacactc aggagtccca
240
tcaaggttca gtggcagtgg gtctggaaca gattattctc tcaccattag caacctggag
300
caagaagata ttgccactta cttttgccaa cagggtaata cgcttccgta cacgttcgga
360
ggggggacca agctggagat cacaggtggc ggtggctcgg gcggtggtgg gtcgggtggc
420
ggcggatctg aggtgaaact gcaggagtca ggacctggcc tggtggcgcc ctcacagagc
480
ctgtccgtca catgcactgt ctcaggggtc tcattacccg actatggtgt aagctggatt
540
cgccagcctc cacgaaaggg tctggagtgg ctgggagtaa tatggggtag tgaaaccaca
600
tactataatt cagctctcaa atccagactg accatcatca aggacaactc caagagccaa
660
gttttcttaa aaatgaacag tctgcaaact gatgacacag ccatttacta ctgtgccaaa
720
cattattact acggtggtag ctatgctatg gactactggg gccaaggaac ctcagtcacc
780
gtctcctcaa ccacgacgcc agcgccgcga ccaccaacac cggcgcccac catcgcgtcg
840
cagcccctgt ccctgcgccc agaggcgtgc cggccagcgg cggggggcgc agtgcacacg
900
agggggctgg acttcgcctg tgatatctac atctgggcgc ccttggccgg gacttgtggg
960
gtccttctcc tgtcactggt tatcaccctt tactgcaaac ggggcagaaa gaaactcctg
1020
tatatattca aacaaccatt tatgagacca gtacaaacta ctcaagagga agatggctgt
1080
agctgccgat ttccagaaga agaagaagga ggatgtgaac tgagagtgaa gttcagcagg
1140
agcgcagacg cccccgcgta caagcagggc cagaaccagc tctataacga gctcaatcta
1200
ggacgaagag aggagtacga tgttttggac aagagacgtg gccgggaccc tgagatgggg
1260
ggaaagccga gaaggaagaa ccctcaggaa ggcctgtaca atgaactgca gaaagataag
1320
atggcggagg cctacagtga gattgggatg aaaggcgagc gccggagggg caaggggcac
1380
gatggccttt accagggtct cagtacagcc accaaggaca cctacgacgc ccttcacatg
1440
caggccctgc cccctcgc
1458
<210> 108
<211> 486
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 108
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu
20 25 30
Ser Ala Ser Leu Gly Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr
50 55 60
Val Lys Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile
85 90 95
Ser Asn Leu Glu Gln Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
130 135 140
Val Lys Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser
145 150 155 160
Leu Ser Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser
195 200 205
Arg Leu Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys
210 215 220
Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Ser Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 109
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 109
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Lys Leu Gln Glu
115 120 125
Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser Leu Ser Val Thr Cys
130 135 140
Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg
145 150 155 160
Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly Val Ile Trp Gly Ser
165 170 175
Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser Arg Leu Thr Ile Ile
180 185 190
Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys Met Asn Ser Leu Gln
195 200 205
Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly
210 215 220
Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
225 230 235 240
Ser Ser
<210> 110
<211> 244
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 110
Gln Val Gln Leu Leu Glu Ser Gly Ala Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gln Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Gln Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr Ser Cys
85 90 95
Ala Arg Lys Thr Ile Ser Ser Val Val Asp Phe Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Gly Gly Gly Ser Gly Gly Gly Ser Gly
115 120 125
Gly Gly Ser Gly Gly Gly Ser Glu Leu Val Leu Thr Gln Ser Pro Lys
130 135 140
Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser Val Thr Cys Lys Ala
145 150 155 160
Ser Gln Asn Val Gly Thr Asn Val Ala Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Gln Ser Pro Lys Pro Leu Ile Tyr Ser Ala Thr Tyr Arg Asn Ser Gly
180 185 190
Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
195 200 205
Thr Ile Thr Asn Val Gln Ser Lys Asp Leu Ala Asp Tyr Phe Cys Gln
210 215 220
Tyr Asn Arg Tyr Pro Tyr Thr Ser Phe Phe Phe Thr Lys Leu Glu Ile
225 230 235 240
Lys Arg Arg Ser
<210> 111
<211> 464
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 111
Gln Val Gln Leu Leu Glu Ser Gly Ala Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gln Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Gln Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr Ser Cys
85 90 95
Ala Arg Lys Thr Ile Ser Ser Val Val Asp Phe Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Gly Gly Gly Ser Gly Gly Gly Ser Gly
115 120 125
Gly Gly Ser Gly Gly Gly Ser Glu Leu Val Leu Thr Gln Ser Pro Lys
130 135 140
Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser Val Thr Cys Lys Ala
145 150 155 160
Ser Gln Asn Val Gly Thr Asn Val Ala Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Gln Ser Pro Lys Pro Leu Ile Tyr Ser Ala Thr Tyr Arg Asn Ser Gly
180 185 190
Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
195 200 205
Thr Ile Thr Asn Val Gln Ser Lys Asp Leu Ala Asp Tyr Phe Cys Gln
210 215 220
Tyr Asn Arg Tyr Pro Tyr Thr Ser Phe Phe Phe Thr Lys Leu Glu Ile
225 230 235 240
Lys Arg Arg Ser Lys Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp
245 250 255
Asn Glu Lys Ser Asn Gly Thr Ile Ile His Val Lys Gly Lys His Leu
260 265 270
Cys Pro Ser Pro Leu Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu
275 280 285
Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val
290 295 300
Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Leu Leu His
305 310 315 320
Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys
325 330 335
His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser
340 345 350
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
355 360 365
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
370 375 380
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
385 390 395 400
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
405 410 415
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
420 425 430
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
435 440 445
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
450 455 460
<210> 112
<211> 246
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 112
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr Gly Ser Thr Ser Gly
100 105 110
Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val Lys
115 120 125
Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser Leu Ser
130 135 140
Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser
145 150 155 160
Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly Val Ile
165 170 175
Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser Arg Leu
180 185 190
Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys Met Asn
195 200 205
Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys His Tyr
210 215 220
Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
225 230 235 240
Val Thr Val Ser Ser Glu
245
<210> 113
<211> 439
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 113
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr Gly Ser Thr Ser Gly
100 105 110
Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val Lys
115 120 125
Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser Leu Ser
130 135 140
Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser
145 150 155 160
Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly Val Ile
165 170 175
Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser Arg Leu
180 185 190
Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys Met Asn
195 200 205
Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys His Tyr
210 215 220
Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
225 230 235 240
Val Thr Val Ser Ser Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys
245 250 255
Pro Met Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr
260 265 270
Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Lys Arg Gly
275 280 285
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
290 295 300
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Glu Glu Glu
305 310 315 320
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
325 330 335
Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
340 345 350
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
355 360 365
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
370 375 380
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
385 390 395 400
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
405 410 415
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
420 425 430
Gln Ala Leu Pro Pro Arg Leu
435
<210> 114
<211> 819
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 114
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr Gly Ser Thr Ser Gly
100 105 110
Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val Lys
115 120 125
Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser Leu Ser
130 135 140
Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser
145 150 155 160
Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly Val Ile
165 170 175
Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser Arg Leu
180 185 190
Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys Met Asn
195 200 205
Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys His Tyr
210 215 220
Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
225 230 235 240
Val Thr Val Ser Ser Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys
245 250 255
Pro Met Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr
260 265 270
Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Lys Arg Gly
275 280 285
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
290 295 300
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Glu Glu Glu
305 310 315 320
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
325 330 335
Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
340 345 350
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
355 360 365
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
370 375 380
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
385 390 395 400
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
405 410 415
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
420 425 430
Gln Ala Leu Pro Pro Arg Leu Glu Gly Gly Gly Glu Gly Arg Gly Ser
435 440 445
Leu Leu Thr Cys Gly Asp Val Glu Glu Asn Pro Gly Pro Arg Met Leu
450 455 460
Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro Ala Phe
465 470 475 480
Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly Glu Phe
485 490 495
Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe Lys Asn
500 505 510
Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala Phe Arg
515 520 525
Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu Leu Asp
530 535 540
Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile Gln Ala
545 550 555 560
Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu Glu Ile
565 570 575
Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala Val Val
580 585 590
Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu Ile Ser
595 600 605
Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr Ala Asn
610 615 620
Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys Thr Lys
625 630 635 640
Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly Gln Val
645 650 655
Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu Pro Arg
660 665 670
Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys Val Asp
675 680 685
Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu Asn Ser
690 695 700
Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met Asn Ile
705 710 715 720
Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala His Tyr
725 730 735
Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val Met Gly
740 745 750
Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His Val Cys
755 760 765
His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro Gly Leu
770 775 780
Glu Gly Cys Pro Thr Asn Gly Pro Lys Ile Pro Ser Ile Ala Thr Gly
785 790 795 800
Met Val Gly Ala Leu Leu Leu Leu Leu Val Val Ala Leu Gly Ile Gly
805 810 815
Leu Phe Met
<210> 115
<211> 245
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 115
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr Gly Ser Thr Ser Gly
100 105 110
Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val Lys
115 120 125
Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser Leu Ser
130 135 140
Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser
145 150 155 160
Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly Val Ile
165 170 175
Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser Arg Leu
180 185 190
Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys Met Asn
195 200 205
Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys His Tyr
210 215 220
Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
225 230 235 240
Val Thr Val Ser Ser
245
<210> 116
<211> 467
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 116
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr Gly Ser Thr Ser Gly
100 105 110
Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val Lys
115 120 125
Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser Leu Ser
130 135 140
Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser
145 150 155 160
Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly Val Ile
165 170 175
Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser Arg Leu
180 185 190
Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys Met Asn
195 200 205
Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys His Tyr
210 215 220
Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
225 230 235 240
Val Thr Val Ser Ser Ala Ala Ala Ile Glu Val Met Tyr Pro Pro Pro
245 250 255
Tyr Leu Asp Asn Glu Lys Ser Asn Gly Thr Ile Ile His Val Lys Gly
260 265 270
Lys His Leu Cys Pro Ser Pro Leu Phe Pro Gly Pro Ser Lys Pro Phe
275 280 285
Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu
290 295 300
Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg
305 310 315 320
Leu Leu His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro
325 330 335
Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala
340 345 350
Tyr Arg Ser Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
355 360 365
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
370 375 380
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
385 390 395 400
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
405 410 415
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
420 425 430
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
435 440 445
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
450 455 460
Pro Pro Arg
465
<210> 117
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 117
Asp Tyr Gly Val Ser
1 5
<210> 118
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 118
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser
1 5 10 15
<210> 119
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 119
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Ser Ser Ser Leu Lys Ser
1 5 10 15
<210> 120
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 120
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Gln Ser Ser Leu Lys Ser
1 5 10 15
<210> 121
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 121
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ser Leu Lys Ser
1 5 10 15
<210> 122
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 122
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr
1 5 10
<210> 123
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 123
Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn
1 5 10
<210> 124
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 124
His Thr Ser Arg Leu His Ser
1 5
<210> 125
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 125
Gln Gln Gly Asn Thr Leu Pro Tyr Thr
1 5
<210> 126
<211> 521
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 126
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct
60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtgtg
120
gggcggaggg cgtggcgggg aagggccggc gacgagagcc gcgcgggacg actcgtcggc
180
gataaccggt gtcgggtagc gccagccgcg cgacggtaac gagggaccgc gacaggcaga
240
cgctcccatg atcactctgc acgccgaagg caaatagtgc aggccgtgcg gcgcttggcg
300
ttccttggaa gggctgaatc cccgcctcgt ccttcgcagc ggccccccgg gtgttcccat
360
cgccgcttct aggcccactg cgacgcttgc ctgcacttct tacacgctct gggtcccagc
420
cgcggcgacg caaagggcct tggtgcgggt ctcgtcggcg cagggacgcg tttgggtccc
480
gacggaacct tttccgcgtt ggggttgggg caccataagc t
521
<210> 127
<211> 118
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 127
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct
60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtg
118
<210> 128
<211> 221
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 128
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct
60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtgtg
120
gggcggaggg cgtggcgggg aagggccggc gacgagagcc gcgcgggacg actcgtcggc
180
gataaccggt gtcgggtagc gccagccgcg cgacggtaac g
221
<210> 129
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 129
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct
60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtgtg
120
gggcggaggg cgtggcgggg aagggccggc gacgagagcc gcgcgggacg actcgtcggc
180
gataaccggt gtcgggtagc gccagccgcg cgacggtaac gagggaccgc gacaggcaga
240
cgctcccatg atcactctgc acgccgaagg caaatagtgc aggccgtgcg gcgcttggcg
300
ttccttggaa gggctgaatc cccg
324
<210> 130
<211> 422
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 130
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct
60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtgtg
120
gggcggaggg cgtggcgggg aagggccggc gacgagagcc gcgcgggacg actcgtcggc
180
gataaccggt gtcgggtagc gccagccgcg cgacggtaac gagggaccgc gacaggcaga
240
cgctcccatg atcactctgc acgccgaagg caaatagtgc aggccgtgcg gcgcttggcg
300
ttccttggaa gggctgaatc cccgcctcgt ccttcgcagc ggccccccgg gtgttcccat
360
cgccgcttct aggcccactg cgacgcttgc ctgcacttct tacacgctct gggtcccagc
420
cg
422
<210> 131
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (1)..(3)
<223> /замена=" "
<220>
<221> другой_признак
<222> (1)..(21)
<223> /примечание="Остатки вариантов, приведенные в
последовательности, не имеют предпочтения по отношению к тем, которые
указаны в аннотациях для положений вариантов"
<400> 131
Gly Ser Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu
1 5 10 15
Glu Asn Pro Gly Pro
20
<210> 132
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (1)..(3)
<223> /замена=" "
<220>
<221> другой_признак
<222> (1)..(22)
<223> /примечание="Остатки вариантов, приведенные в
последовательности, не имеют предпочтения по отношению к тем, которые
указаны в аннотациях для положений вариантов"
<400> 132
Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val
1 5 10 15
Glu Glu Asn Pro Gly Pro
20
<210> 133
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (1)..(3)
<223> /замена=" "
<220>
<221> другой_признак
<222> (1)..(23)
<223> /примечание="Остатки вариантов, приведенные в
последовательности, не имеют предпочтения по отношению к тем, которые
указаны в аннотациях для положений вариантов"
<400> 133
Gly Ser Gly Gln Cys Thr Asn Tyr Ala Leu Leu Lys Leu Ala Gly Asp
1 5 10 15
Val Glu Ser Asn Pro Gly Pro
20
<210> 134
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (1)..(3)
<223> /замена=" "
<220>
<221> другой_признак
<222> (1)..(25)
<223> /примечание="Остатки вариантов, приведенные в
последовательности, не имеют предпочтения по отношению к тем, которые
указаны в аннотациях для положений вариантов"
<400> 134
Gly Ser Gly Val Lys Gln Thr Leu Asn Phe Asp Leu Leu Lys Leu Ala
1 5 10 15
Gly Asp Val Glu Ser Asn Pro Gly Pro
20 25
<210> 135
<211> 1132
<212> БЕЛОК
<213> Homo sapiens
<400> 135
Met Pro Arg Ala Pro Arg Cys Arg Ala Val Arg Ser Leu Leu Arg Ser
1 5 10 15
His Tyr Arg Glu Val Leu Pro Leu Ala Thr Phe Val Arg Arg Leu Gly
20 25 30
Pro Gln Gly Trp Arg Leu Val Gln Arg Gly Asp Pro Ala Ala Phe Arg
35 40 45
Ala Leu Val Ala Gln Cys Leu Val Cys Val Pro Trp Asp Ala Arg Pro
50 55 60
Pro Pro Ala Ala Pro Ser Phe Arg Gln Val Ser Cys Leu Lys Glu Leu
65 70 75 80
Val Ala Arg Val Leu Gln Arg Leu Cys Glu Arg Gly Ala Lys Asn Val
85 90 95
Leu Ala Phe Gly Phe Ala Leu Leu Asp Gly Ala Arg Gly Gly Pro Pro
100 105 110
Glu Ala Phe Thr Thr Ser Val Arg Ser Tyr Leu Pro Asn Thr Val Thr
115 120 125
Asp Ala Leu Arg Gly Ser Gly Ala Trp Gly Leu Leu Leu Arg Arg Val
130 135 140
Gly Asp Asp Val Leu Val His Leu Leu Ala Arg Cys Ala Leu Phe Val
145 150 155 160
Leu Val Ala Pro Ser Cys Ala Tyr Gln Val Cys Gly Pro Pro Leu Tyr
165 170 175
Gln Leu Gly Ala Ala Thr Gln Ala Arg Pro Pro Pro His Ala Ser Gly
180 185 190
Pro Arg Arg Arg Leu Gly Cys Glu Arg Ala Trp Asn His Ser Val Arg
195 200 205
Glu Ala Gly Val Pro Leu Gly Leu Pro Ala Pro Gly Ala Arg Arg Arg
210 215 220
Gly Gly Ser Ala Ser Arg Ser Leu Pro Leu Pro Lys Arg Pro Arg Arg
225 230 235 240
Gly Ala Ala Pro Glu Pro Glu Arg Thr Pro Val Gly Gln Gly Ser Trp
245 250 255
Ala His Pro Gly Arg Thr Arg Gly Pro Ser Asp Arg Gly Phe Cys Val
260 265 270
Val Ser Pro Ala Arg Pro Ala Glu Glu Ala Thr Ser Leu Glu Gly Ala
275 280 285
Leu Ser Gly Thr Arg His Ser His Pro Ser Val Gly Arg Gln His His
290 295 300
Ala Gly Pro Pro Ser Thr Ser Arg Pro Pro Arg Pro Trp Asp Thr Pro
305 310 315 320
Cys Pro Pro Val Tyr Ala Glu Thr Lys His Phe Leu Tyr Ser Ser Gly
325 330 335
Asp Lys Glu Gln Leu Arg Pro Ser Phe Leu Leu Ser Ser Leu Arg Pro
340 345 350
Ser Leu Thr Gly Ala Arg Arg Leu Val Glu Thr Ile Phe Leu Gly Ser
355 360 365
Arg Pro Trp Met Pro Gly Thr Pro Arg Arg Leu Pro Arg Leu Pro Gln
370 375 380
Arg Tyr Trp Gln Met Arg Pro Leu Phe Leu Glu Leu Leu Gly Asn His
385 390 395 400
Ala Gln Cys Pro Tyr Gly Val Leu Leu Lys Thr His Cys Pro Leu Arg
405 410 415
Ala Ala Val Thr Pro Ala Ala Gly Val Cys Ala Arg Glu Lys Pro Gln
420 425 430
Gly Ser Val Ala Ala Pro Glu Glu Glu Asp Thr Asp Pro Arg Arg Leu
435 440 445
Val Gln Leu Leu Arg Gln His Ser Ser Pro Trp Gln Val Tyr Gly Phe
450 455 460
Val Arg Ala Cys Leu Arg Arg Leu Val Pro Pro Gly Leu Trp Gly Ser
465 470 475 480
Arg His Asn Glu Arg Arg Phe Leu Arg Asn Thr Lys Lys Phe Ile Ser
485 490 495
Leu Gly Lys His Ala Lys Leu Ser Leu Gln Glu Leu Thr Trp Lys Met
500 505 510
Ser Val Arg Gly Cys Ala Trp Leu Arg Arg Ser Pro Gly Val Gly Cys
515 520 525
Val Pro Ala Ala Glu His Arg Leu Arg Glu Glu Ile Leu Ala Lys Phe
530 535 540
Leu His Trp Leu Met Ser Val Tyr Val Val Glu Leu Leu Arg Ser Phe
545 550 555 560
Phe Tyr Val Thr Glu Thr Thr Phe Gln Lys Asn Arg Leu Phe Phe Tyr
565 570 575
Arg Lys Ser Val Trp Ser Lys Leu Gln Ser Ile Gly Ile Arg Gln His
580 585 590
Leu Lys Arg Val Gln Leu Arg Glu Leu Ser Glu Ala Glu Val Arg Gln
595 600 605
His Arg Glu Ala Arg Pro Ala Leu Leu Thr Ser Arg Leu Arg Phe Ile
610 615 620
Pro Lys Pro Asp Gly Leu Arg Pro Ile Val Asn Met Asp Tyr Val Val
625 630 635 640
Gly Ala Arg Thr Phe Arg Arg Glu Lys Arg Ala Glu Arg Leu Thr Ser
645 650 655
Arg Val Lys Ala Leu Phe Ser Val Leu Asn Tyr Glu Arg Ala Arg Arg
660 665 670
Pro Gly Leu Leu Gly Ala Ser Val Leu Gly Leu Asp Asp Ile His Arg
675 680 685
Ala Trp Arg Thr Phe Val Leu Arg Val Arg Ala Gln Asp Pro Pro Pro
690 695 700
Glu Leu Tyr Phe Val Lys Val Asp Val Thr Gly Ala Tyr Asp Thr Ile
705 710 715 720
Pro Gln Asp Arg Leu Thr Glu Val Ile Ala Ser Ile Ile Lys Pro Gln
725 730 735
Asn Thr Tyr Cys Val Arg Arg Tyr Ala Val Val Gln Lys Ala Ala His
740 745 750
Gly His Val Arg Lys Ala Phe Lys Ser His Val Ser Thr Leu Thr Asp
755 760 765
Leu Gln Pro Tyr Met Arg Gln Phe Val Ala His Leu Gln Glu Thr Ser
770 775 780
Pro Leu Arg Asp Ala Val Val Ile Glu Gln Ser Ser Ser Leu Asn Glu
785 790 795 800
Ala Ser Ser Gly Leu Phe Asp Val Phe Leu Arg Phe Met Cys His His
805 810 815
Ala Val Arg Ile Arg Gly Lys Ser Tyr Val Gln Cys Gln Gly Ile Pro
820 825 830
Gln Gly Ser Ile Leu Ser Thr Leu Leu Cys Ser Leu Cys Tyr Gly Asp
835 840 845
Met Glu Asn Lys Leu Phe Ala Gly Ile Arg Arg Asp Gly Leu Leu Leu
850 855 860
Arg Leu Val Asp Asp Phe Leu Leu Val Thr Pro His Leu Thr His Ala
865 870 875 880
Lys Thr Phe Leu Arg Thr Leu Val Arg Gly Val Pro Glu Tyr Gly Cys
885 890 895
Val Val Asn Leu Arg Lys Thr Val Val Asn Phe Pro Val Glu Asp Glu
900 905 910
Ala Leu Gly Gly Thr Ala Phe Val Gln Met Pro Ala His Gly Leu Phe
915 920 925
Pro Trp Cys Gly Leu Leu Leu Asp Thr Arg Thr Leu Glu Val Gln Ser
930 935 940
Asp Tyr Ser Ser Tyr Ala Arg Thr Ser Ile Arg Ala Ser Leu Thr Phe
945 950 955 960
Asn Arg Gly Phe Lys Ala Gly Arg Asn Met Arg Arg Lys Leu Phe Gly
965 970 975
Val Leu Arg Leu Lys Cys His Ser Leu Phe Leu Asp Leu Gln Val Asn
980 985 990
Ser Leu Gln Thr Val Cys Thr Asn Ile Tyr Lys Ile Leu Leu Leu Gln
995 1000 1005
Ala Tyr Arg Phe His Ala Cys Val Leu Gln Leu Pro Phe His Gln
1010 1015 1020
Gln Val Trp Lys Asn Pro Thr Phe Phe Leu Arg Val Ile Ser Asp
1025 1030 1035
Thr Ala Ser Leu Cys Tyr Ser Ile Leu Lys Ala Lys Asn Ala Gly
1040 1045 1050
Met Ser Leu Gly Ala Lys Gly Ala Ala Gly Pro Leu Pro Ser Glu
1055 1060 1065
Ala Val Gln Trp Leu Cys His Gln Ala Phe Leu Leu Lys Leu Thr
1070 1075 1080
Arg His Arg Val Thr Tyr Val Pro Leu Leu Gly Ser Leu Arg Thr
1085 1090 1095
Ala Gln Thr Gln Leu Ser Arg Lys Leu Pro Gly Thr Thr Leu Thr
1100 1105 1110
Ala Leu Glu Ala Ala Ala Asn Pro Ala Leu Pro Ser Asp Phe Lys
1115 1120 1125
Thr Ile Leu Asp
1130
<210> 136
<211> 4027
<212> ДНК
<213> Homo sapiens
<400> 136
caggcagcgt ggtcctgctg cgcacgtggg aagccctggc cccggccacc cccgcgatgc
60
cgcgcgctcc ccgctgccga gccgtgcgct ccctgctgcg cagccactac cgcgaggtgc
120
tgccgctggc cacgttcgtg cggcgcctgg ggccccaggg ctggcggctg gtgcagcgcg
180
gggacccggc ggctttccgc gcgctggtgg cccagtgcct ggtgtgcgtg ccctgggacg
240
cacggccgcc ccccgccgcc ccctccttcc gccaggtgtc ctgcctgaag gagctggtgg
300
cccgagtgct gcagaggctg tgcgagcgcg gcgcgaagaa cgtgctggcc ttcggcttcg
360
cgctgctgga cggggcccgc gggggccccc ccgaggcctt caccaccagc gtgcgcagct
420
acctgcccaa cacggtgacc gacgcactgc gggggagcgg ggcgtggggg ctgctgttgc
480
gccgcgtggg cgacgacgtg ctggttcacc tgctggcacg ctgcgcgctc tttgtgctgg
540
tggctcccag ctgcgcctac caggtgtgcg ggccgccgct gtaccagctc ggcgctgcca
600
ctcaggcccg gcccccgcca cacgctagtg gaccccgaag gcgtctggga tgcgaacggg
660
cctggaacca tagcgtcagg gaggccgggg tccccctggg cctgccagcc ccgggtgcga
720
ggaggcgcgg gggcagtgcc agccgaagtc tgccgttgcc caagaggccc aggcgtggcg
780
ctgcccctga gccggagcgg acgcccgttg ggcaggggtc ctgggcccac ccgggcagga
840
cgcgtggacc gagtgaccgt ggtttctgtg tggtgtcacc tgccagaccc gccgaagaag
900
ccacctcttt ggagggtgcg ctctctggca cgcgccactc ccacccatcc gtgggccgcc
960
agcaccacgc gggcccccca tccacatcgc ggccaccacg tccctgggac acgccttgtc
1020
ccccggtgta cgccgagacc aagcacttcc tctactcctc aggcgacaag gagcagctgc
1080
ggccctcctt cctactcagc tctctgaggc ccagcctgac tggcgctcgg aggctcgtgg
1140
agaccatctt tctgggttcc aggccctgga tgccagggac tccccgcagg ttgccccgcc
1200
tgccccagcg ctactggcaa atgcggcccc tgtttctgga gctgcttggg aaccacgcgc
1260
agtgccccta cggggtgctc ctcaagacgc actgcccgct gcgagctgcg gtcaccccag
1320
cagccggtgt ctgtgcccgg gagaagcccc agggctctgt ggcggccccc gaggaggagg
1380
acacagaccc ccgtcgcctg gtgcagctgc tccgccagca cagcagcccc tggcaggtgt
1440
acggcttcgt gcgggcctgc ctgcgccggc tggtgccccc aggcctctgg ggctccaggc
1500
acaacgaacg ccgcttcctc aggaacacca agaagttcat ctccctgggg aagcatgcca
1560
agctctcgct gcaggagctg acgtggaaga tgagcgtgcg gggctgcgct tggctgcgca
1620
ggagcccagg ggttggctgt gttccggccg cagagcaccg tctgcgtgag gagatcctgg
1680
ccaagttcct gcactggctg atgagtgtgt acgtcgtcga gctgctcagg tctttctttt
1740
atgtcacgga gaccacgttt caaaagaaca ggctcttttt ctaccggaag agtgtctgga
1800
gcaagttgca aagcattgga atcagacagc acttgaagag ggtgcagctg cgggagctgt
1860
cggaagcaga ggtcaggcag catcgggaag ccaggcccgc cctgctgacg tccagactcc
1920
gcttcatccc caagcctgac gggctgcggc cgattgtgaa catggactac gtcgtgggag
1980
ccagaacgtt ccgcagagaa aagagggccg agcgtctcac ctcgagggtg aaggcactgt
2040
tcagcgtgct caactacgag cgggcgcggc gccccggcct cctgggcgcc tctgtgctgg
2100
gcctggacga tatccacagg gcctggcgca ccttcgtgct gcgtgtgcgg gcccaggacc
2160
cgccgcctga gctgtacttt gtcaaggtgg atgtgacggg cgcgtacgac accatccccc
2220
aggacaggct cacggaggtc atcgccagca tcatcaaacc ccagaacacg tactgcgtgc
2280
gtcggtatgc cgtggtccag aaggccgccc atgggcacgt ccgcaaggcc ttcaagagcc
2340
acgtctctac cttgacagac ctccagccgt acatgcgaca gttcgtggct cacctgcagg
2400
agaccagccc gctgagggat gccgtcgtca tcgagcagag ctcctccctg aatgaggcca
2460
gcagtggcct cttcgacgtc ttcctacgct tcatgtgcca ccacgccgtg cgcatcaggg
2520
gcaagtccta cgtccagtgc caggggatcc cgcagggctc catcctctcc acgctgctct
2580
gcagcctgtg ctacggcgac atggagaaca agctgtttgc ggggattcgg cgggacgggc
2640
tgctcctgcg tttggtggat gatttcttgt tggtgacacc tcacctcacc cacgcgaaaa
2700
ccttcctcag gaccctggtc cgaggtgtcc ctgagtatgg ctgcgtggtg aacttgcgga
2760
agacagtggt gaacttccct gtagaagacg aggccctggg tggcacggct tttgttcaga
2820
tgccggccca cggcctattc ccctggtgcg gcctgctgct ggatacccgg accctggagg
2880
tgcagagcga ctactccagc tatgcccgga cctccatcag agccagtctc accttcaacc
2940
gcggcttcaa ggctgggagg aacatgcgtc gcaaactctt tggggtcttg cggctgaagt
3000
gtcacagcct gtttctggat ttgcaggtga acagcctcca gacggtgtgc accaacatct
3060
acaagatcct cctgctgcag gcgtacaggt ttcacgcatg tgtgctgcag ctcccatttc
3120
atcagcaagt ttggaagaac cccacatttt tcctgcgcgt catctctgac acggcctccc
3180
tctgctactc catcctgaaa gccaagaacg cagggatgtc gctgggggcc aagggcgccg
3240
ccggccctct gccctccgag gccgtgcagt ggctgtgcca ccaagcattc ctgctcaagc
3300
tgactcgaca ccgtgtcacc tacgtgccac tcctggggtc actcaggaca gcccagacgc
3360
agctgagtcg gaagctcccg gggacgacgc tgactgccct ggaggccgca gccaacccgg
3420
cactgccctc agacttcaag accatcctgg actgatggcc acccgcccac agccaggccg
3480
agagcagaca ccagcagccc tgtcacgccg ggctctacgt cccagggagg gaggggcggc
3540
ccacacccag gcccgcaccg ctgggagtct gaggcctgag tgagtgtttg gccgaggcct
3600
gcatgtccgg ctgaaggctg agtgtccggc tgaggcctga gcgagtgtcc agccaagggc
3660
tgagtgtcca gcacacctgc cgtcttcact tccccacagg ctggcgctcg gctccacccc
3720
agggccagct tttcctcacc aggagcccgg cttccactcc ccacatagga atagtccatc
3780
cccagattcg ccattgttca cccctcgccc tgccctcctt tgccttccac ccccaccatc
3840
caggtggaga ccctgagaag gaccctggga gctctgggaa tttggagtga ccaaaggtgt
3900
gccctgtaca caggcgagga ccctgcacct ggatgggggt ccctgtgggt caaattgggg
3960
ggaggtgctg tgggagtaaa atactgaata tatgagtttt tcagttttga aaaaaaaaaa
4020
aaaaaaa
4027
<210> 137
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 137
Thr Tyr Trp Met His
1 5
<210> 138
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 138
Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe Lys
1 5 10 15
Asn
<210> 139
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 139
Trp Thr Thr Gly Thr Gly Ala Tyr
1 5
<210> 140
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 140
Gly Tyr Thr Phe Thr Thr Tyr
1 5
<210> 141
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 141
Tyr Pro Gly Thr Gly Gly
1 5
<210> 142
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 142
Gln Val Gln Leu Gln Gln Pro Gly Ser Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Thr Ser Leu Thr Val Asp Thr Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met His Leu Ala Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 143
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 143
caggtccagc tgcagcaacc tgggtctgag ctggtgaggc ctggagcttc agtgaagctg
60
tcctgcaagg cgtctggcta cacattcacc acttactgga tgcactgggt gaggcagagg
120
cctggacaag gccttgagtg gattggaaat atttatcctg gtactggtgg ttctaacttc
180
gatgagaagt tcaaaaacag gacctcactg actgtagaca catcctccac cacagcctac
240
atgcacctcg ccagcctgac atctgaggac tctgcggtct attactgtac aagatggact
300
actgggacgg gagcttattg gggccaaggg actctggtca ctgtctctgc a
351
<210> 144
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 144
Gln Val Gln Leu Gln Gln Ser Gly Ser Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Thr Ser Leu Thr Val Asp Thr Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met His Leu Ala Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 145
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 145
caggtccagc tgcagcagtc tgggtctgag ctggtgaggc ctggagcttc agtgaagctg
60
tcctgcaagg cgtctggcta cacattcacc acttactgga tgcactgggt gaggcagagg
120
cctggacaag gccttgagtg gattggaaat atttatcctg gtactggtgg ttctaacttc
180
gatgagaagt tcaaaaacag gacctcactg actgtagaca catcctccac cacagcctac
240
atgcacctcg ccagcctgac atctgaggac tctgcggtct attactgtac aagatggact
300
actgggacgg gagcttattg gggccaaggg actctggtca ctgtctctgc a
351
<210> 146
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 146
Lys Ser Ser Gln Ser Leu Leu Asp Ser Gly Asn Gln Lys Asn Phe Leu
1 5 10 15
Thr
<210> 147
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 147
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 148
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 148
Gln Asn Asp Tyr Ser Tyr Pro Cys Thr
1 5
<210> 149
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 149
Ser Gln Ser Leu Leu Asp Ser Gly Asn Gln Lys Asn Phe
1 5 10
<210> 150
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 150
Trp Ala Ser
1
<210> 151
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 151
Asp Tyr Ser Tyr Pro Cys
1 5
<210> 152
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 152
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Phe Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Val Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Cys Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 153
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 153
gacattgtga tgacccagtc tccatcctcc ctgactgtga cagcaggaga gaaggtcact
60
atgagctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtaccagc agaaaccagg gcagcctcct aaactgttga tcttctgggc atccactagg
180
gaatctgggg tccctgatcg cttcacaggc agtggatctg taacagattt cactctcacc
240
atcagcagtg tgcaggctga agacctggca gtttattact gtcagaatga ttatagttat
300
ccgtgcacgt tcggaggggg gaccaagctg gaaataaaa
339
<210> 154
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 154
Gln Val Gln Leu Gln Gln Pro Gly Ser Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Thr Ser Leu Thr Val Asp Thr Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met His Leu Ala Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 155
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 155
caggtccagc tgcagcagcc tgggtctgag ctggtgaggc ctggagcttc agtgaagctg
60
tcctgcaagg cgtctggcta cacattcacc acttactgga tgcactgggt gaggcagagg
120
cctggacaag gccttgagtg gattggaaat atttatcctg gtactggtgg ttctaacttc
180
gatgagaagt tcaaaaacag gacctcactg actgtagaca catcctccac cacagcctac
240
atgcacctcg ccagcctgac atctgaggac tctgcggtct attactgtac aagatggact
300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc c
351
<210> 156
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 156
Gln Val Gln Leu Gln Gln Pro Gly Ser Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Thr Ser Leu Thr Val Asp Thr Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met His Leu Ala Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 157
<211> 1332
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 157
caggtccagc tgcagcagcc tgggtctgag ctggtgaggc ctggagcttc agtgaagctg
60
tcctgcaagg cgtctggcta cacattcacc acttactgga tgcactgggt gaggcagagg
120
cctggacaag gccttgagtg gattggaaat atttatcctg gtactggtgg ttctaacttc
180
gatgagaagt tcaaaaacag gacctcactg actgtagaca catcctccac cacagcctac
240
atgcacctcg ccagcctgac atctgaggac tctgcggtct attactgtac aagatggact
300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc cgcttccacc
360
aagggcccat ccgtcttccc cctggcgccc tgctccagga gcacctccga gagcacagcc
420
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca
480
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac
540
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacgaagac ctacacctgc
600
aacgtagatc acaagcccag caacaccaag gtggacaaga gagttgagtc caaatatggt
660
cccccatgcc caccgtgccc agcacctgag ttcctggggg gaccatcagt cttcctgttc
720
cccccaaaac ccaaggacac tctcatgatc tcccggaccc ctgaggtcac gtgcgtggtg
780
gtggacgtga gccaggaaga ccccgaggtc cagttcaact ggtacgtgga tggcgtggag
840
gtgcataatg ccaagacaaa gccgcgggag gagcagttca acagcacgta ccgtgtggtc
900
agcgtcctca ccgtcctgca ccaggactgg ctgaacggca aggagtacaa gtgcaaggtg
960
tccaacaaag gcctcccgtc ctccatcgag aaaaccatct ccaaagccaa agggcagccc
1020
cgagagccac aggtgtacac cctgccccca tcccaggagg agatgaccaa gaaccaggtc
1080
agcctgacct gcctggtcaa aggcttctac cccagcgaca tcgccgtgga gtgggagagc
1140
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc cgacggctcc
1200
ttcttcctct acagcaggct aaccgtggac aagagcaggt ggcaggaggg gaatgtcttc
1260
tcatgctccg tgatgcatga ggctctgcac aaccactaca cacagaagag cctctccctg
1320
tctctgggta aa
1332
<210> 158
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 158
Gln Val Gln Leu Gln Gln Ser Gly Ser Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Thr Ser Leu Thr Val Asp Thr Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met His Leu Ala Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 159
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 159
caggtccagc tgcagcagtc tgggtctgag ctggtgaggc ctggagcttc agtgaagctg
60
tcctgcaagg cgtctggcta cacattcacc acttactgga tgcactgggt gaggcagagg
120
cctggacaag gccttgagtg gattggaaat atttatcctg gtactggtgg ttctaacttc
180
gatgagaagt tcaaaaacag gacctcactg actgtagaca catcctccac cacagcctac
240
atgcacctcg ccagcctgac atctgaggac tctgcggtct attactgtac aagatggact
300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc c
351
<210> 160
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 160
Gln Val Gln Leu Gln Gln Ser Gly Ser Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Thr Ser Leu Thr Val Asp Thr Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met His Leu Ala Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 161
<211> 1332
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 161
caggtccagc tgcagcagtc tgggtctgag ctggtgaggc ctggagcttc agtgaagctg
60
tcctgcaagg cgtctggcta cacattcacc acttactgga tgcactgggt gaggcagagg
120
cctggacaag gccttgagtg gattggaaat atttatcctg gtactggtgg ttctaacttc
180
gatgagaagt tcaaaaacag gacctcactg actgtagaca catcctccac cacagcctac
240
atgcacctcg ccagcctgac atctgaggac tctgcggtct attactgtac aagatggact
300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc cgcttccacc
360
aagggcccat ccgtcttccc cctggcgccc tgctccagga gcacctccga gagcacagcc
420
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca
480
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac
540
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacgaagac ctacacctgc
600
aacgtagatc acaagcccag caacaccaag gtggacaaga gagttgagtc caaatatggt
660
cccccatgcc caccgtgccc agcacctgag ttcctggggg gaccatcagt cttcctgttc
720
cccccaaaac ccaaggacac tctcatgatc tcccggaccc ctgaggtcac gtgcgtggtg
780
gtggacgtga gccaggaaga ccccgaggtc cagttcaact ggtacgtgga tggcgtggag
840
gtgcataatg ccaagacaaa gccgcgggag gagcagttca acagcacgta ccgtgtggtc
900
agcgtcctca ccgtcctgca ccaggactgg ctgaacggca aggagtacaa gtgcaaggtg
960
tccaacaaag gcctcccgtc ctccatcgag aaaaccatct ccaaagccaa agggcagccc
1020
cgagagccac aggtgtacac cctgccccca tcccaggagg agatgaccaa gaaccaggtc
1080
agcctgacct gcctggtcaa aggcttctac cccagcgaca tcgccgtgga gtgggagagc
1140
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc cgacggctcc
1200
ttcttcctct acagcaggct aaccgtggac aagagcaggt ggcaggaggg gaatgtcttc
1260
tcatgctccg tgatgcatga ggctctgcac aaccactaca cacagaagag cctctccctg
1320
tctctgggta aa
1332
<210> 162
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 162
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Phe Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Val Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Cys Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 163
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 163
gacattgtga tgacccagtc tccatcctcc ctgactgtga cagcaggaga gaaggtcact
60
atgagctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtaccagc agaaaccagg gcagcctcct aaactgttga tcttctgggc atccactagg
180
gaatctgggg tccctgatcg cttcacaggc agtggatctg taacagattt cactctcacc
240
atcagcagtg tgcaggctga agacctggca gtttattact gtcagaatga ttatagttat
300
ccgtgcacgt tcggccaagg gaccaaggtg gaaatcaaa
339
<210> 164
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 164
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Phe Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Val Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Cys Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 165
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 165
gacattgtga tgacccagtc tccatcctcc ctgactgtga cagcaggaga gaaggtcact
60
atgagctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtaccagc agaaaccagg gcagcctcct aaactgttga tcttctgggc atccactagg
180
gaatctgggg tccctgatcg cttcacaggc agtggatctg taacagattt cactctcacc
240
atcagcagtg tgcaggctga agacctggca gtttattact gtcagaatga ttatagttat
300
ccgtgcacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct
360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc
420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc
480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc
540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc
600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt
660
<210> 166
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 166
Gln Asn Asp Tyr Ser Tyr Pro Tyr Thr
1 5
<210> 167
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 167
Asp Tyr Ser Tyr Pro Tyr
1 5
<210> 168
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 168
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Phe Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Val Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 169
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 169
gacattgtga tgacccagtc tccatcctcc ctgactgtga cagcaggaga gaaggtcact
60
atgagctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtaccagc agaaaccagg gcagcctcct aaactgttga tcttctgggc atccactagg
180
gaatctgggg tccctgatcg cttcacaggc agtggatctg taacagattt cactctcacc
240
atcagcagtg tgcaggctga agacctggca gtttattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa
339
<210> 170
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 170
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Phe Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Val Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 171
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 171
gacattgtga tgacccagtc tccatcctcc ctgactgtga cagcaggaga gaaggtcact
60
atgagctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtaccagc agaaaccagg gcagcctcct aaactgttga tcttctgggc atccactagg
180
gaatctgggg tccctgatcg cttcacaggc agtggatctg taacagattt cactctcacc
240
atcagcagtg tgcaggctga agacctggca gtttattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct
360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc
420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc
480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc
540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc
600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt
660
<210> 172
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 172
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Thr Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 173
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 173
gaagtgcagc tggtgcagtc tggagcagag gtgaaaaagc ccggggagtc tctgaggatc
60
tcctgtaagg gttctggcta cacattcacc acttactgga tgcactgggt gcgacaggcc
120
actggacaag ggcttgagtg gatgggtaat atttatcctg gtactggtgg ttctaacttc
180
gatgagaagt tcaagaacag agtcacgatt accgcggaca aatccacgag cacagcctac
240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtac aagatggact
300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc c
351
<210> 174
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 174
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Thr Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 175
<211> 1332
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 175
gaagtgcagc tggtgcagtc tggagcagag gtgaaaaagc ccggggagtc tctgaggatc
60
tcctgtaagg gttctggcta cacattcacc acttactgga tgcactgggt gcgacaggcc
120
actggacaag ggcttgagtg gatgggtaat atttatcctg gtactggtgg ttctaacttc
180
gatgagaagt tcaagaacag agtcacgatt accgcggaca aatccacgag cacagcctac
240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtac aagatggact
300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc cgcttccacc
360
aagggcccat ccgtcttccc cctggcgccc tgctccagga gcacctccga gagcacagcc
420
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca
480
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac
540
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacgaagac ctacacctgc
600
aacgtagatc acaagcccag caacaccaag gtggacaaga gagttgagtc caaatatggt
660
cccccatgcc caccgtgccc agcacctgag ttcctggggg gaccatcagt cttcctgttc
720
cccccaaaac ccaaggacac tctcatgatc tcccggaccc ctgaggtcac gtgcgtggtg
780
gtggacgtga gccaggaaga ccccgaggtc cagttcaact ggtacgtgga tggcgtggag
840
gtgcataatg ccaagacaaa gccgcgggag gagcagttca acagcacgta ccgtgtggtc
900
agcgtcctca ccgtcctgca ccaggactgg ctgaacggca aggagtacaa gtgcaaggtg
960
tccaacaaag gcctcccgtc ctccatcgag aaaaccatct ccaaagccaa agggcagccc
1020
cgagagccac aggtgtacac cctgccccca tcccaggagg agatgaccaa gaaccaggtc
1080
agcctgacct gcctggtcaa aggcttctac cccagcgaca tcgccgtgga gtgggagagc
1140
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc cgacggctcc
1200
ttcttcctct acagcaggct aaccgtggac aagagcaggt ggcaggaggg gaatgtcttc
1260
tcatgctccg tgatgcatga ggctctgcac aaccactaca cacagaagag cctctccctg
1320
tctctgggta aa
1332
<210> 176
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 176
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 177
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 177
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc
60
ctctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg
180
gaatctgggg tcccatcaag gttcagcggc agtggatctg ggacagaatt cactctcacc
240
atcagcagcc tgcagcctga tgattttgca acttattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa
339
<210> 178
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 178
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 179
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 179
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc
60
ctctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg
180
gaatctgggg tcccatcaag gttcagcggc agtggatctg ggacagaatt cactctcacc
240
atcagcagcc tgcagcctga tgattttgca acttattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct
360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc
420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc
480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc
540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc
600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt
660
<210> 180
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 180
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Ile
50 55 60
Pro Pro Arg Phe Ser Gly Ser Gly Tyr Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Asn Asn Ile Glu Ser Glu Asp Ala Ala Tyr Tyr Phe Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 181
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 181
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg
180
gaatctggga tcccacctcg attcagtggc agcgggtatg gaacagattt taccctcaca
240
attaataaca tagaatctga ggatgctgca tattacttct gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa
339
<210> 182
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 182
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Ile
50 55 60
Pro Pro Arg Phe Ser Gly Ser Gly Tyr Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Asn Asn Ile Glu Ser Glu Asp Ala Ala Tyr Tyr Phe Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 183
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 183
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg
180
gaatctggga tcccacctcg attcagtggc agcgggtatg gaacagattt taccctcaca
240
attaataaca tagaatctga ggatgctgca tattacttct gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct
360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc
420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc
480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc
540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc
600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt
660
<210> 184
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 184
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu Trp Leu
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 185
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 185
gaagtgcagc tggtgcagtc tggagcagag gtgaaaaagc ccggggagtc tctgaggatc
60
tcctgtaagg gttctggcta cacattcacc acttactgga tgcactggat caggcagtcc
120
ccatcgagag gccttgagtg gctgggtaat atttatcctg gtactggtgg ttctaacttc
180
gatgagaagt tcaagaacag attcaccatc tccagagaca attccaagaa cacgctgtat
240
cttcaaatga acagcctgag agccgaggac acggccgtgt attactgtac aagatggact
300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc c
351
<210> 186
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 186
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu Trp Leu
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 187
<211> 1332
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 187
gaagtgcagc tggtgcagtc tggagcagag gtgaaaaagc ccggggagtc tctgaggatc
60
tcctgtaagg gttctggcta cacattcacc acttactgga tgcactggat caggcagtcc
120
ccatcgagag gccttgagtg gctgggtaat atttatcctg gtactggtgg ttctaacttc
180
gatgagaagt tcaagaacag attcaccatc tccagagaca attccaagaa cacgctgtat
240
cttcaaatga acagcctgag agccgaggac acggccgtgt attactgtac aagatggact
300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc cgcttccacc
360
aagggcccat ccgtcttccc cctggcgccc tgctccagga gcacctccga gagcacagcc
420
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca
480
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac
540
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacgaagac ctacacctgc
600
aacgtagatc acaagcccag caacaccaag gtggacaaga gagttgagtc caaatatggt
660
cccccatgcc caccgtgccc agcacctgag ttcctggggg gaccatcagt cttcctgttc
720
cccccaaaac ccaaggacac tctcatgatc tcccggaccc ctgaggtcac gtgcgtggtg
780
gtggacgtga gccaggaaga ccccgaggtc cagttcaact ggtacgtgga tggcgtggag
840
gtgcataatg ccaagacaaa gccgcgggag gagcagttca acagcacgta ccgtgtggtc
900
agcgtcctca ccgtcctgca ccaggactgg ctgaacggca aggagtacaa gtgcaaggtg
960
tccaacaaag gcctcccgtc ctccatcgag aaaaccatct ccaaagccaa agggcagccc
1020
cgagagccac aggtgtacac cctgccccca tcccaggagg agatgaccaa gaaccaggtc
1080
agcctgacct gcctggtcaa aggcttctac cccagcgaca tcgccgtgga gtgggagagc
1140
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc cgacggctcc
1200
ttcttcctct acagcaggct aaccgtggac aagagcaggt ggcaggaggg gaatgtcttc
1260
tcatgctccg tgatgcatga ggctctgcac aaccactaca cacagaagag cctctccctg
1320
tctctgggta aa
1332
<210> 188
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 188
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 189
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 189
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc
60
ctctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtatcagc agaaaccagg gaaagctcct aagctcctga tctattgggc atccactagg
180
gaatctgggg tcccatcaag gttcagtgga agtggatctg ggacagattt tactttcacc
240
atcagcagcc tgcagcctga agatattgca acatattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa
339
<210> 190
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 190
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 191
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 191
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc
60
ctctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtatcagc agaaaccagg gaaagctcct aagctcctga tctattgggc atccactagg
180
gaatctgggg tcccatcaag gttcagtgga agtggatctg ggacagattt tactttcacc
240
atcagcagcc tgcagcctga agatattgca acatattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct
360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc
420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc
480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc
540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc
600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt
660
<210> 192
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 192
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 193
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 193
gatattgtga tgacccagac tccactctcc ctgcccgtca cccctggaga gccggcctcc
60
atctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg
180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc
240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa
339
<210> 194
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 194
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 195
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 195
gatattgtga tgacccagac tccactctcc ctgcccgtca cccctggaga gccggcctcc
60
atctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg
180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc
240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct
360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc
420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc
480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc
540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc
600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt
660
<210> 196
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 196
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 197
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 197
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc
60
ctctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtatcagc agaaaccagg gaaagctcct aagctcctga tctattgggc atccactagg
180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc
240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa
339
<210> 198
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 198
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 199
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 199
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc
60
ctctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtatcagc agaaaccagg gaaagctcct aagctcctga tctattgggc atccactagg
180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc
240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct
360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc
420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc
480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc
540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc
600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt
660
<210> 200
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 200
Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 201
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 201
gaaattgtgc tgactcagtc tccagacttt cagtctgtga ctccaaagga gaaagtcacc
60
atcacctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg
180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc
240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa
339
<210> 202
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 202
Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 203
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 203
gaaattgtgc tgactcagtc tccagacttt cagtctgtga ctccaaagga gaaagtcacc
60
atcacctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg
180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc
240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct
360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc
420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc
480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc
540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc
600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt
660
<210> 204
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 204
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 205
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 205
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc
60
ctctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg
180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc
240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa
339
<210> 206
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 206
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 207
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 207
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc
60
ctctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg
180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc
240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct
360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc
420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc
480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc
540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc
600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt
660
<210> 208
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 208
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Leu Gln Lys Pro Gly Gln
35 40 45
Ser Pro Gln Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 209
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 209
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtacctgc agaagccagg gcagtctcca cagctcctga tctattgggc atccactagg
180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc
240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa
339
<210> 210
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 210
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Leu Gln Lys Pro Gly Gln
35 40 45
Ser Pro Gln Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 211
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 211
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc
120
tggtacctgc agaagccagg gcagtctcca cagctcctga tctattgggc atccactagg
180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc
240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct
360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc
420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc
480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc
540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc
600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt
660
<210> 212
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 212
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 213
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 213
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc
60
atctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttaacc
120
tggtatcagc agaaaccagg gaaagctcct aagctcctga tctattgggc atccactagg
180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc
240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa
339
<210> 214
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 214
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 215
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 215
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc
60
atctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttaacc
120
tggtatcagc agaaaccagg gaaagctcct aagctcctga tctattgggc atccactagg
180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc
240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat
300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct
360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc
420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc
480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc
540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc
600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt
660
<210> 216
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 216
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu Trp Leu
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 217
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 217
caggttcagc tggtgcagtc tggagctgag gtgaagaagc ctggggcctc agtgaaggtc
60
tcctgcaagg cttctggcta cacattcacc acttactgga tgcactggat caggcagtcc
120
ccatcgagag gccttgagtg gctgggtaat atttatcctg gtactggtgg ttctaacttc
180
gatgagaagt tcaagaacag attcaccatc tccagagaca attccaagaa cacgctgtat
240
cttcaaatga acagcctgag agccgaggac acggccgtgt attactgtac aagatggact
300
actgggacgg gagcttactg gggccagggc accaccgtga ccgtgtcctc c
351
<210> 218
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 218
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu Trp Leu
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 219
<211> 1332
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 219
caggttcagc tggtgcagtc tggagctgag gtgaagaagc ctggggcctc agtgaaggtc
60
tcctgcaagg cttctggcta cacattcacc acttactgga tgcactggat caggcagtcc
120
ccatcgagag gccttgagtg gctgggtaat atttatcctg gtactggtgg ttctaacttc
180
gatgagaagt tcaagaacag attcaccatc tccagagaca attccaagaa cacgctgtat
240
cttcaaatga acagcctgag agccgaggac acggccgtgt attactgtac aagatggact
300
actgggacgg gagcttactg gggccagggc accaccgtga ccgtgtcctc cgcttccacc
360
aagggcccat ccgtcttccc cctggcgccc tgctccagga gcacctccga gagcacagcc
420
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca
480
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac
540
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacgaagac ctacacctgc
600
aacgtagatc acaagcccag caacaccaag gtggacaaga gagttgagtc caaatatggt
660
cccccatgcc caccgtgccc agcacctgag ttcctggggg gaccatcagt cttcctgttc
720
cccccaaaac ccaaggacac tctcatgatc tcccggaccc ctgaggtcac gtgcgtggtg
780
gtggacgtga gccaggaaga ccccgaggtc cagttcaact ggtacgtgga tggcgtggag
840
gtgcataatg ccaagacaaa gccgcgggag gagcagttca acagcacgta ccgtgtggtc
900
agcgtcctca ccgtcctgca ccaggactgg ctgaacggca aggagtacaa gtgcaaggtg
960
tccaacaaag gcctcccgtc ctccatcgag aaaaccatct ccaaagccaa agggcagccc
1020
cgagagccac aggtgtacac cctgccccca tcccaggagg agatgaccaa gaaccaggtc
1080
agcctgacct gcctggtcaa aggcttctac cccagcgaca tcgccgtgga gtgggagagc
1140
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc cgacggctcc
1200
ttcttcctct acagcaggct aaccgtggac aagagcaggt ggcaggaggg gaatgtcttc
1260
tcatgctccg tgatgcatga ggctctgcac aaccactaca cacagaagag cctctccctg
1320
tctctgggta aa
1332
<210> 220
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 220
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 221
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 221
gaagtgcagc tggtgcagtc tggagcagag gtgaaaaagc ccggggagtc tctgaggatc
60
tcctgtaagg gttctggcta cacattcacc acttactgga tgcactgggt gcgacaggcc
120
cctggacaag ggcttgagtg gatgggtaat atttatcctg gtactggtgg ttctaacttc
180
gatgagaagt tcaagaacag attcaccatc tccagagaca attccaagaa cacgctgtat
240
cttcaaatga acagcctgag agccgaggac acggccgtgt attactgtac aagatggact
300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc c
351
<210> 222
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 222
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 223
<211> 1332
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 223
gaagtgcagc tggtgcagtc tggagcagag gtgaaaaagc ccggggagtc tctgaggatc
60
tcctgtaagg gttctggcta cacattcacc acttactgga tgcactgggt gcgacaggcc
120
cctggacaag ggcttgagtg gatgggtaat atttatcctg gtactggtgg ttctaacttc
180
gatgagaagt tcaagaacag attcaccatc tccagagaca attccaagaa cacgctgtat
240
cttcaaatga acagcctgag agccgaggac acggccgtgt attactgtac aagatggact
300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc cgcttccacc
360
aagggcccat ccgtcttccc cctggcgccc tgctccagga gcacctccga gagcacagcc
420
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca
480
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac
540
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacgaagac ctacacctgc
600
aacgtagatc acaagcccag caacaccaag gtggacaaga gagttgagtc caaatatggt
660
cccccatgcc caccgtgccc agcacctgag ttcctggggg gaccatcagt cttcctgttc
720
cccccaaaac ccaaggacac tctcatgatc tcccggaccc ctgaggtcac gtgcgtggtg
780
gtggacgtga gccaggaaga ccccgaggtc cagttcaact ggtacgtgga tggcgtggag
840
gtgcataatg ccaagacaaa gccgcgggag gagcagttca acagcacgta ccgtgtggtc
900
agcgtcctca ccgtcctgca ccaggactgg ctgaacggca aggagtacaa gtgcaaggtg
960
tccaacaaag gcctcccgtc ctccatcgag aaaaccatct ccaaagccaa agggcagccc
1020
cgagagccac aggtgtacac cctgccccca tcccaggagg agatgaccaa gaaccaggtc
1080
agcctgacct gcctggtcaa aggcttctac cccagcgaca tcgccgtgga gtgggagagc
1140
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc cgacggctcc
1200
ttcttcctct acagcaggct aaccgtggac aagagcaggt ggcaggaggg gaatgtcttc
1260
tcatgctccg tgatgcatga ggctctgcac aaccactaca cacagaagag cctctccctg
1320
tctctgggta aa
1332
<210> 224
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 224
gaagtgcagc tggtgcagtc tggcgccgaa gtgaagaagc ctggcgagtc cctgcggatc
60
tcctgcaagg gctctggcta caccttcacc acctactgga tgcactgggt gcgacaggct
120
accggccagg gcctggaatg gatgggcaac atctatcctg gcaccggcgg ctccaacttc
180
gacgagaagt tcaagaacag agtgaccatc accgccgaca agtccacctc caccgcctac
240
atggaactgt cctccctgag atccgaggac accgccgtgt actactgcac ccggtggaca
300
accggcacag gcgcttattg gggccagggc accacagtga ccgtgtcctc t
351
<210> 225
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 225
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Thr Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440
<210> 226
<211> 1329
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 226
gaagtgcagc tggtgcagtc tggcgccgaa gtgaagaagc ctggcgagtc cctgcggatc
60
tcctgcaagg gctctggcta caccttcacc acctactgga tgcactgggt gcgacaggct
120
accggccagg gcctggaatg gatgggcaac atctatcctg gcaccggcgg ctccaacttc
180
gacgagaagt tcaagaacag agtgaccatc accgccgaca agtccacctc caccgcctac
240
atggaactgt cctccctgag atccgaggac accgccgtgt actactgcac ccggtggaca
300
accggcacag gcgcttattg gggccagggc accacagtga ccgtgtcctc tgcttctacc
360
aaggggccca gcgtgttccc cctggccccc tgctccagaa gcaccagcga gagcacagcc
420
gccctgggct gcctggtgaa ggactacttc cccgagcccg tgaccgtgtc ctggaacagc
480
ggagccctga ccagcggcgt gcacaccttc cccgccgtgc tgcagagcag cggcctgtac
540
agcctgagca gcgtggtgac cgtgcccagc agcagcctgg gcaccaagac ctacacctgt
600
aacgtggacc acaagcccag caacaccaag gtggacaaga gggtggagag caagtacggc
660
ccaccctgcc ccccctgccc agcccccgag ttcctgggcg gacccagcgt gttcctgttc
720
ccccccaagc ccaaggacac cctgatgatc agcagaaccc ccgaggtgac ctgtgtggtg
780
gtggacgtgt cccaggagga ccccgaggtc cagttcaact ggtacgtgga cggcgtggag
840
gtgcacaacg ccaagaccaa gcccagagag gagcagttta acagcaccta ccgggtggtg
900
tccgtgctga ccgtgctgca ccaggactgg ctgaacggca aagagtacaa gtgtaaggtc
960
tccaacaagg gcctgccaag cagcatcgaa aagaccatca gcaaggccaa gggccagcct
1020
agagagcccc aggtctacac cctgccaccc agccaagagg agatgaccaa gaaccaggtg
1080
tccctgacct gtctggtgaa gggcttctac ccaagcgaca tcgccgtgga gtgggagagc
1140
aacggccagc ccgagaacaa ctacaagacc acccccccag tgctggacag cgacggcagc
1200
ttcttcctgt acagcaggct gaccgtggac aagtccagat ggcaggaggg caacgtcttt
1260
agctgctccg tgatgcacga ggccctgcac aaccactaca cccagaagag cctgagcctg
1320
tccctgggc
1329
<210> 227
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 227
gagatcgtgc tgacccagtc ccctgccacc ctgtcactgt ctccaggcga gagagctacc
60
ctgtcctgca agtcctccca gtccctgctg gactccggca accagaagaa cttcctgacc
120
tggtatcagc agaagcccgg ccaggccccc agactgctga tctactgggc ctccacccgg
180
gaatctggcg tgccctctag attctccggc tccggctctg gcaccgagtt taccctgacc
240
atctccagcc tgcagcccga cgacttcgcc acctactact gccagaacga ctactcctac
300
ccctacacct tcggccaggg caccaaggtg gaaatcaag
339
<210> 228
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 228
gagatcgtgc tgacccagtc ccctgccacc ctgtcactgt ctccaggcga gagagctacc
60
ctgtcctgca agtcctccca gtccctgctg gactccggca accagaagaa cttcctgacc
120
tggtatcagc agaagcccgg ccaggccccc agactgctga tctactgggc ctccacccgg
180
gaatctggcg tgccctctag attctccggc tccggctctg gcaccgagtt taccctgacc
240
atctccagcc tgcagcccga cgacttcgcc acctactact gccagaacga ctactcctac
300
ccctacacct tcggccaggg caccaaggtg gaaatcaagc gtacggtggc cgctcccagc
360
gtgttcatct tccccccaag cgacgagcag ctgaagagcg gcaccgccag cgtggtgtgt
420
ctgctgaaca acttctaccc cagggaggcc aaggtgcagt ggaaggtgga caacgccctg
480
cagagcggca acagccagga gagcgtcacc gagcaggaca gcaaggactc cacctacagc
540
ctgagcagca ccctgaccct gagcaaggcc gactacgaga agcacaaggt gtacgcctgt
600
gaggtgaccc accagggcct gtccagcccc gtgaccaaga gcttcaacag gggcgagtgc
660
<210> 229
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 229
gaggtgcagc tggtgcagtc aggcgccgaa gtgaagaagc ccggcgagtc actgagaatt
60
agctgtaaag gttcaggcta caccttcact acctactgga tgcactgggt ccgccaggct
120
accggtcaag gcctcgagtg gatgggtaat atctaccccg gcaccggcgg ctctaacttc
180
gacgagaagt ttaagaatag agtgactatc accgccgata agtctactag caccgcctat
240
atggaactgt ctagcctgag atcagaggac accgccgtct actactgcac taggtggact
300
accggcacag gcgcctactg gggtcaaggc actaccgtga ccgtgtctag c
351
<210> 230
<211> 1329
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 230
gaggtgcagc tggtgcagtc aggcgccgaa gtgaagaagc ccggcgagtc actgagaatt
60
agctgtaaag gttcaggcta caccttcact acctactgga tgcactgggt ccgccaggct
120
accggtcaag gcctcgagtg gatgggtaat atctaccccg gcaccggcgg ctctaacttc
180
gacgagaagt ttaagaatag agtgactatc accgccgata agtctactag caccgcctat
240
atggaactgt ctagcctgag atcagaggac accgccgtct actactgcac taggtggact
300
accggcacag gcgcctactg gggtcaaggc actaccgtga ccgtgtctag cgctagcact
360
aagggcccgt ccgtgttccc cctggcacct tgtagccgga gcactagcga atccaccgct
420
gccctcggct gcctggtcaa ggattacttc ccggagcccg tgaccgtgtc ctggaacagc
480
ggagccctga cctccggagt gcacaccttc cccgctgtgc tgcagagctc cgggctgtac
540
tcgctgtcgt cggtggtcac ggtgccttca tctagcctgg gtaccaagac ctacacttgc
600
aacgtggacc acaagccttc caacactaag gtggacaagc gcgtcgaatc gaagtacggc
660
ccaccgtgcc cgccttgtcc cgcgccggag ttcctcggcg gtccctcggt ctttctgttc
720
ccaccgaagc ccaaggacac tttgatgatt tcccgcaccc ctgaagtgac atgcgtggtc
780
gtggacgtgt cacaggaaga tccggaggtg cagttcaatt ggtacgtgga tggcgtcgag
840
gtgcacaacg ccaaaaccaa gccgagggag gagcagttca actccactta ccgcgtcgtg
900
tccgtgctga cggtgctgca tcaggactgg ctgaacggga aggagtacaa gtgcaaagtg
960
tccaacaagg gacttcctag ctcaatcgaa aagaccatct cgaaagccaa gggacagccc
1020
cgggaacccc aagtgtatac cctgccaccg agccaggaag aaatgactaa gaaccaagtc
1080
tcattgactt gccttgtgaa gggcttctac ccatcggata tcgccgtgga atgggagtcc
1140
aacggccagc cggaaaacaa ctacaagacc acccctccgg tgctggactc agacggatcc
1200
ttcttcctct actcgcggct gaccgtggat aagagcagat ggcaggaggg aaatgtgttc
1260
agctgttctg tgatgcatga agccctgcac aaccactaca ctcagaagtc cctgtccctc
1320
tccctggga
1329
<210> 231
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 231
gagatcgtcc tgactcagtc acccgctacc ctgagcctga gccctggcga gcgggctaca
60
ctgagctgta aatctagtca gtcactgctg gatagcggta atcagaagaa cttcctgacc
120
tggtatcagc agaagcccgg taaagcccct aagctgctga tctactgggc ctctactaga
180
gaatcaggcg tgccctctag gtttagcggt agcggtagtg gcaccgactt caccttcact
240
atctctagcc tgcagcccga ggatatcgct acctactact gtcagaacga ctatagctac
300
ccctacacct tcggtcaagg cactaaggtc gagattaag
339
<210> 232
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 232
gagatcgtcc tgactcagtc acccgctacc ctgagcctga gccctggcga gcgggctaca
60
ctgagctgta aatctagtca gtcactgctg gatagcggta atcagaagaa cttcctgacc
120
tggtatcagc agaagcccgg taaagcccct aagctgctga tctactgggc ctctactaga
180
gaatcaggcg tgccctctag gtttagcggt agcggtagtg gcaccgactt caccttcact
240
atctctagcc tgcagcccga ggatatcgct acctactact gtcagaacga ctatagctac
300
ccctacacct tcggtcaagg cactaaggtc gagattaagc gtacggtggc cgctcccagc
360
gtgttcatct tcccccccag cgacgagcag ctgaagagcg gcaccgccag cgtggtgtgc
420
ctgctgaaca acttctaccc ccgggaggcc aaggtgcagt ggaaggtgga caacgccctg
480
cagagcggca acagccagga gagcgtcacc gagcaggaca gcaaggactc cacctacagc
540
ctgagcagca ccctgaccct gagcaaggcc gactacgaga agcataaggt gtacgcctgc
600
gaggtgaccc accagggcct gtccagcccc gtgaccaaga gcttcaacag gggcgagtgc
660
<210> 233
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 233
gagatcgtgc tgacccagtc ccccgacttc cagtccgtga cccccaaaga aaaagtgacc
60
atcacatgca agtcctccca gtccctgctg gactccggca accagaagaa cttcctgacc
120
tggtatcagc agaagcccgg ccaggccccc agactgctga tctactgggc ctccacccgg
180
gaatctggcg tgccctctag attctccggc tccggctctg gcaccgactt taccttcacc
240
atctccagcc tggaagccga ggacgccgcc acctactact gccagaacga ctactcctac
300
ccctacacct tcggccaggg caccaaggtg gaaatcaag
339
<210> 234
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 234
gagatcgtgc tgacccagtc ccccgacttc cagtccgtga cccccaaaga aaaagtgacc
60
atcacatgca agtcctccca gtccctgctg gactccggca accagaagaa cttcctgacc
120
tggtatcagc agaagcccgg ccaggccccc agactgctga tctactgggc ctccacccgg
180
gaatctggcg tgccctctag attctccggc tccggctctg gcaccgactt taccttcacc
240
atctccagcc tggaagccga ggacgccgcc acctactact gccagaacga ctactcctac
300
ccctacacct tcggccaggg caccaaggtg gaaatcaagc gtacggtggc cgctcccagc
360
gtgttcatct tccccccaag cgacgagcag ctgaagagcg gcaccgccag cgtggtgtgt
420
ctgctgaaca acttctaccc cagggaggcc aaggtgcagt ggaaggtgga caacgccctg
480
cagagcggca acagccagga gagcgtcacc gagcaggaca gcaaggactc cacctacagc
540
ctgagcagca ccctgaccct gagcaaggcc gactacgaga agcacaaggt gtacgcctgt
600
gaggtgaccc accagggcct gtccagcccc gtgaccaaga gcttcaacag gggcgagtgc
660
<210> 235
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 235
gaagtgcagc tggtgcagtc tggcgccgaa gtgaagaagc ctggcgagtc cctgcggatc
60
tcctgcaagg gctctggcta caccttcacc acctactgga tgcactggat ccggcagtcc
120
ccctctaggg gcctggaatg gctgggcaac atctaccctg gcaccggcgg ctccaacttc
180
gacgagaagt tcaagaacag gttcaccatc tcccgggaca actccaagaa caccctgtac
240
ctgcagatga actccctgcg ggccgaggac accgccgtgt actactgtac cagatggacc
300
accggaaccg gcgcctattg gggccagggc acaacagtga ccgtgtcctc c
351
<210> 236
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 236
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu Trp Leu
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440
<210> 237
<211> 1329
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 237
gaagtgcagc tggtgcagtc tggcgccgaa gtgaagaagc ctggcgagtc cctgcggatc
60
tcctgcaagg gctctggcta caccttcacc acctactgga tgcactggat ccggcagtcc
120
ccctctaggg gcctggaatg gctgggcaac atctaccctg gcaccggcgg ctccaacttc
180
gacgagaagt tcaagaacag gttcaccatc tcccgggaca actccaagaa caccctgtac
240
ctgcagatga actccctgcg ggccgaggac accgccgtgt actactgtac cagatggacc
300
accggaaccg gcgcctattg gggccagggc acaacagtga ccgtgtcctc cgcttctacc
360
aaggggccca gcgtgttccc cctggccccc tgctccagaa gcaccagcga gagcacagcc
420
gccctgggct gcctggtgaa ggactacttc cccgagcccg tgaccgtgtc ctggaacagc
480
ggagccctga ccagcggcgt gcacaccttc cccgccgtgc tgcagagcag cggcctgtac
540
agcctgagca gcgtggtgac cgtgcccagc agcagcctgg gcaccaagac ctacacctgt
600
aacgtggacc acaagcccag caacaccaag gtggacaaga gggtggagag caagtacggc
660
ccaccctgcc ccccctgccc agcccccgag ttcctgggcg gacccagcgt gttcctgttc
720
ccccccaagc ccaaggacac cctgatgatc agcagaaccc ccgaggtgac ctgtgtggtg
780
gtggacgtgt cccaggagga ccccgaggtc cagttcaact ggtacgtgga cggcgtggag
840
gtgcacaacg ccaagaccaa gcccagagag gagcagttta acagcaccta ccgggtggtg
900
tccgtgctga ccgtgctgca ccaggactgg ctgaacggca aagagtacaa gtgtaaggtc
960
tccaacaagg gcctgccaag cagcatcgaa aagaccatca gcaaggccaa gggccagcct
1020
agagagcccc aggtctacac cctgccaccc agccaagagg agatgaccaa gaaccaggtg
1080
tccctgacct gtctggtgaa gggcttctac ccaagcgaca tcgccgtgga gtgggagagc
1140
aacggccagc ccgagaacaa ctacaagacc acccccccag tgctggacag cgacggcagc
1200
ttcttcctgt acagcaggct gaccgtggac aagtccagat ggcaggaggg caacgtcttt
1260
agctgctccg tgatgcacga ggccctgcac aaccactaca cccagaagag cctgagcctg
1320
tccctgggc
1329
<210> 238
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 238
gagatcgtgc tgacccagtc ccctgccacc ctgtcactgt ctccaggcga gagagctacc
60
ctgtcctgca agtcctccca gtccctgctg gactccggca accagaagaa cttcctgacc
120
tggtatcagc agaagcccgg ccaggccccc agactgctga tctactgggc ctccacccgg
180
gaatctggcg tgccctctag attctccggc tccggctctg gcaccgactt taccttcacc
240
atctccagcc tggaagccga ggacgccgcc acctactact gccagaacga ctactcctac
300
ccctacacct tcggccaggg caccaaggtg gaaatcaag
339
<210> 239
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 239
gagatcgtgc tgacccagtc ccctgccacc ctgtcactgt ctccaggcga gagagctacc
60
ctgtcctgca agtcctccca gtccctgctg gactccggca accagaagaa cttcctgacc
120
tggtatcagc agaagcccgg ccaggccccc agactgctga tctactgggc ctccacccgg
180
gaatctggcg tgccctctag attctccggc tccggctctg gcaccgactt taccttcacc
240
atctccagcc tggaagccga ggacgccgcc acctactact gccagaacga ctactcctac
300
ccctacacct tcggccaggg caccaaggtg gaaatcaagc gtacggtggc cgctcccagc
360
gtgttcatct tccccccaag cgacgagcag ctgaagagcg gcaccgccag cgtggtgtgt
420
ctgctgaaca acttctaccc cagggaggcc aaggtgcagt ggaaggtgga caacgccctg
480
cagagcggca acagccagga gagcgtcacc gagcaggaca gcaaggactc cacctacagc
540
ctgagcagca ccctgaccct gagcaaggcc gactacgaga agcacaaggt gtacgcctgt
600
gaggtgaccc accagggcct gtccagcccc gtgaccaaga gcttcaacag gggcgagtgc
660
<210> 240
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 240
gagatcgtcc tgactcagtc acccgctacc ctgagcctga gccctggcga gcgggctaca
60
ctgagctgta aatctagtca gtcactgctg gatagcggta atcagaagaa cttcctgacc
120
tggtatcagc agaagcccgg tcaagcccct agactgctga tctactgggc ctctactaga
180
gaatcaggcg tgccctctag gtttagcggt agcggtagtg gcaccgactt caccttcact
240
atctctagcc tggaagccga ggacgccgct acctactact gtcagaacga ctatagctac
300
ccctacacct tcggtcaagg cactaaggtc gagattaag
339
<210> 241
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 241
gagatcgtcc tgactcagtc acccgctacc ctgagcctga gccctggcga gcgggctaca
60
ctgagctgta aatctagtca gtcactgctg gatagcggta atcagaagaa cttcctgacc
120
tggtatcagc agaagcccgg tcaagcccct agactgctga tctactgggc ctctactaga
180
gaatcaggcg tgccctctag gtttagcggt agcggtagtg gcaccgactt caccttcact
240
atctctagcc tggaagccga ggacgccgct acctactact gtcagaacga ctatagctac
300
ccctacacct tcggtcaagg cactaaggtc gagattaagc gtacggtggc cgctcccagc
360
gtgttcatct tcccccccag cgacgagcag ctgaagagcg gcaccgccag cgtggtgtgc
420
ctgctgaaca acttctaccc ccgggaggcc aaggtgcagt ggaaggtgga caacgccctg
480
cagagcggca acagccagga gagcgtcacc gagcaggaca gcaaggactc cacctacagc
540
ctgagcagca ccctgaccct gagcaaggcc gactacgaga agcataaggt gtacgcctgc
600
gaggtgaccc accagggcct gtccagcccc gtgaccaaga gcttcaacag gggcgagtgc
660
<210> 242
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 242
acttactgga tgcac
15
<210> 243
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 243
aatatttatc ctggtactgg tggttctaac ttcgatgaga agttcaagaa c
51
<210> 244
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 244
tggactactg ggacgggagc ttat
24
<210> 245
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 245
ggctacacat tcaccactta c
21
<210> 246
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 246
tatcctggta ctggtggt
18
<210> 247
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 247
aagtccagtc agagtctgtt agacagtgga aatcaaaaga acttcttgac c
51
<210> 248
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 248
tgggcatcca ctagggaatc t
21
<210> 249
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 249
cagaatgatt atagttatcc gtgcacg
27
<210> 250
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 250
agtcagagtc tgttagacag tggaaatcaa aagaacttc
39
<210> 251
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 251
tgggcatcc
9
<210> 252
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 252
gattatagtt atccgtgc
18
<210> 253
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 253
cagaatgatt atagttatcc gtacacg
27
<210> 254
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 254
gattatagtt atccgtac
18
<210> 255
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 255
tggactactg ggacgggagc ttac
24
<210> 256
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 256
acctactgga tgcac
15
<210> 257
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 257
aacatctatc ctggcaccgg cggctccaac ttcgacgaga agttcaagaa c
51
<210> 258
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 258
tggacaaccg gcacaggcgc ttat
24
<210> 259
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 259
ggctacacct tcaccaccta c
21
<210> 260
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 260
tatcctggca ccggcggc
18
<210> 261
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 261
aagtcctccc agtccctgct ggactccggc aaccagaaga acttcctgac c
51
<210> 262
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 262
tgggcctcca cccgggaatc t
21
<210> 263
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 263
cagaacgact actcctaccc ctacacc
27
<210> 264
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 264
tcccagtccc tgctggactc cggcaaccag aagaacttc
39
<210> 265
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 265
tgggcctcc
9
<210> 266
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 266
gactactcct acccctac
18
<210> 267
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 267
acctactgga tgcac
15
<210> 268
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 268
aatatctacc ccggcaccgg cggctctaac ttcgacgaga agtttaagaa t
51
<210> 269
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 269
tggactaccg gcacaggcgc ctac
24
<210> 270
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 270
ggctacacct tcactaccta c
21
<210> 271
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 271
taccccggca ccggcggc
18
<210> 272
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 272
aaatctagtc agtcactgct ggatagcggt aatcagaaga acttcctgac c
51
<210> 273
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 273
tgggcctcta ctagagaatc a
21
<210> 274
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 274
cagaacgact atagctaccc ctacacc
27
<210> 275
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 275
agtcagtcac tgctggatag cggtaatcag aagaacttc
39
<210> 276
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 276
tgggcctct
9
<210> 277
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 277
gactatagct acccctac
18
<210> 278
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 278
aacatctacc ctggcaccgg cggctccaac ttcgacgaga agttcaagaa c
51
<210> 279
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 279
tggaccaccg gaaccggcgc ctat
24
<210> 280
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 280
taccctggca ccggcggc
18
<210> 281
<211> 440
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 281
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser
115 120 125
Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys
180 185 190
Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala
210 215 220
Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
225 230 235 240
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
245 250 255
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
260 265 270
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
275 280 285
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
290 295 300
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
305 310 315 320
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
325 330 335
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
340 345 350
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
355 360 365
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
370 375 380
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
385 390 395 400
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
405 410 415
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
420 425 430
Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 282
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 282
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 283
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 283
Gln Val Gln Leu Val Gln Ser Gly Val Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Met Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Leu Thr Thr Asp Ser Ser Thr Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Lys Ser Leu Gln Phe Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Asp Tyr Arg Phe Asp Met Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 284
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 284
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Gly Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Leu Ala Ser Tyr Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Ser Arg
85 90 95
Asp Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 285
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 285
aagtccagtc agagtctgtt agacagtgga aatcaaaaga acttcttaac c
51
<210> 286
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 286
Gly Tyr Thr Phe Thr Thr Tyr Trp Met His
1 5 10
<210> 287
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 287
Gln Val Gln Leu Leu Glu Ser Gly Ala Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gln Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Gln Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr Ser Cys
85 90 95
Ala Arg Lys Thr Ile Ser Ser Val Val Asp Phe Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr
115
<210> 288
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 288
Glu Leu Val Leu Thr Gln Ser Pro Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Pro Leu Ile
35 40 45
Tyr Ser Ala Thr Tyr Arg Asn Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr Asn Val Gln Ser
65 70 75 80
Lys Asp Leu Ala Asp Tyr Phe Tyr Phe Cys Gln Tyr Asn Arg Tyr Pro
85 90 95
Tyr Thr Ser Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Arg Ser
100 105 110
<210> 289
<211> 465
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 289
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Lys Leu Gln Glu
115 120 125
Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser Leu Ser Val Thr Cys
130 135 140
Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg
145 150 155 160
Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly Val Ile Trp Gly Ser
165 170 175
Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser Arg Leu Thr Ile Ile
180 185 190
Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys Met Asn Ser Leu Gln
195 200 205
Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly
210 215 220
Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
225 230 235 240
Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr
245 250 255
Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala
260 265 270
Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile
275 280 285
Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser
290 295 300
Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr
305 310 315 320
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
325 330 335
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
340 345 350
Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln
355 360 365
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
370 375 380
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
385 390 395 400
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
405 410 415
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
420 425 430
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
435 440 445
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
450 455 460
Arg
465
<210> 290
<211> 63
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 290
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
ccc
63
<210> 291
<211> 72
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетический олигонуклеотид"
<400> 291
atctacattt gggcccctct ggctggtact tgcggggtcc tgctgctttc actcgtgatc
60
actctttact gt
72
<210> 292
<211> 126
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 292
aagcgcggtc ggaagaagct gctgtacatc tttaagcaac ccttcatgag gcctgtgcag
60
actactcaag aggaggacgg ctgttcatgc cggttcccag aggaggagga aggcggctgc
120
gaactg
126
<210> 293
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 293
cgcgtgaaat tcagccgcag cgcagatgct ccagcctaca agcaggggca gaaccagctc
60
tacaacgaac tcaatcttgg tcggagagag gagtacgacg tgctggacaa gcggagagga
120
cgggacccag aaatgggcgg gaagccgcgc agaaagaatc cccaagaggg cctgtacaac
180
gagctccaaa aggataagat ggcagaagcc tatagcgaga ttggtatgaa aggggaacgc
240
agaagaggca aaggccacga cggactgtac cagggactca gcaccgccac caaggacacc
300
tatgacgctc ttcacatgca ggccctgccg cctcgg
336
<210> 294
<211> 239
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 294
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser
130 135 140
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser
145 150 155 160
Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser
180 185 190
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
195 200 205
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr
210 215 220
Ser Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
225 230 235
<210> 295
<211> 717
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 295
gaagtgcaat tggtggaatc agggggagga cttgtgcagc ctggaggatc gctgagactg
60
tcatgtgccg tgtccggctt tgccctgtcc aaccacggga tgtcctgggt ccgccgcgcg
120
cctggaaagg gcctcgaatg ggtgtcgggt attgtgtaca gcggtagcac ctactatgcc
180
gcatccgtga aggggagatt caccatcagc cgggacaact ccaggaacac tctgtacctc
240
caaatgaatt cgctgaggcc agaggacact gccatctact actgctccgc gcatggcgga
300
gagtccgacg tctggggaca ggggaccacc gtgaccgtgt ctagcgcgtc cggcggaggc
360
ggcagcgggg gtcgggcatc agggggcggc ggatcggaca tccagctcac ccagtccccg
420
agctcgctgt ccgcctccgt gggagatcgg gtcaccatca cgtgccgcgc cagccagtcg
480
atttcctcct acctgaactg gtaccaacag aagcccggaa aagccccgaa gcttctcatc
540
tacgccgcct cgagcctgca gtcaggagtg ccctcacggt tctccggctc cggttccggt
600
actgatttca ccctgaccat ttcctccctg caaccggagg acttcgctac ttactactgc
660
cagcagtcgt actccacccc ctacactttc ggacaaggca ccaaggtcga aatcaag
717
<210> 296
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 296
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 297
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 297
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 298
<211> 483
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 298
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe
35 40 45
Ala Leu Ser Asn His Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr
65 70 75 80
Ala Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg
85 90 95
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Ser Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Gln Leu Thr Gln Ser
145 150 155 160
Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys
165 170 175
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys
180 185 190
Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Gln
195 200 205
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
210 215 220
Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr
225 230 235 240
Cys Gln Gln Ser Tyr Ser Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys
245 250 255
Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
260 265 270
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
275 280 285
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
290 295 300
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
305 310 315 320
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
325 330 335
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
340 345 350
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
355 360 365
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
370 375 380
Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
385 390 395 400
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
405 410 415
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
420 425 430
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
435 440 445
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
450 455 460
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
465 470 475 480
Pro Pro Arg
<210> 299
<211> 1449
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 299
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtgc aattggtgga atcaggggga ggacttgtgc agcctggagg atcgctgaga
120
ctgtcatgtg ccgtgtccgg ctttgccctg tccaaccacg ggatgtcctg ggtccgccgc
180
gcgcctggaa agggcctcga atgggtgtcg ggtattgtgt acagcggtag cacctactat
240
gccgcatccg tgaaggggag attcaccatc agccgggaca actccaggaa cactctgtac
300
ctccaaatga attcgctgag gccagaggac actgccatct actactgctc cgcgcatggc
360
ggagagtccg acgtctgggg acaggggacc accgtgaccg tgtctagcgc gtccggcgga
420
ggcggcagcg ggggtcgggc atcagggggc ggcggatcgg acatccagct cacccagtcc
480
ccgagctcgc tgtccgcctc cgtgggagat cgggtcacca tcacgtgccg cgccagccag
540
tcgatttcct cctacctgaa ctggtaccaa cagaagcccg gaaaagcccc gaagcttctc
600
atctacgccg cctcgagcct gcagtcagga gtgccctcac ggttctccgg ctccggttcc
660
ggtactgatt tcaccctgac catttcctcc ctgcaaccgg aggacttcgc tacttactac
720
tgccagcagt cgtactccac cccctacact ttcggacaag gcaccaaggt cgaaatcaag
780
accactaccc cagcaccgag gccacccacc ccggctccta ccatcgcctc ccagcctctg
840
tccctgcgtc cggaggcatg tagacccgca gctggtgggg ccgtgcatac ccggggtctt
900
gacttcgcct gcgatatcta catttgggcc cctctggctg gtacttgcgg ggtcctgctg
960
ctttcactcg tgatcactct ttactgtaag cgcggtcgga agaagctgct gtacatcttt
1020
aagcaaccct tcatgaggcc tgtgcagact actcaagagg aggacggctg ttcatgccgg
1080
ttcccagagg aggaggaagg cggctgcgaa ctgcgcgtga aattcagccg cagcgcagat
1140
gctccagcct acaagcaggg gcagaaccag ctctacaacg aactcaatct tggtcggaga
1200
gaggagtacg acgtgctgga caagcggaga ggacgggacc cagaaatggg cgggaagccg
1260
cgcagaaaga atccccaaga gggcctgtac aacgagctcc aaaaggataa gatggcagaa
1320
gcctatagcg agattggtat gaaaggggaa cgcagaagag gcaaaggcca cgacggactg
1380
taccagggac tcagcaccgc caccaaggac acctatgacg ctcttcacat gcaggccctg
1440
ccgcctcgg
1449
<210> 300
<211> 246
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 300
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Gly Trp Val
35 40 45
Ser Gly Ile Ser Arg Ser Gly Glu Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Ala His Tyr Tyr Gly Gly Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser
130 135 140
Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys
145 150 155 160
Arg Ala Ser Gln Ser Ile Ser Ser Ser Phe Leu Ala Trp Tyr Gln Gln
165 170 175
Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Arg Arg
180 185 190
Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
195 200 205
Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Ser Ala Val Tyr
210 215 220
Tyr Cys Gln Gln Tyr His Ser Ser Pro Ser Trp Thr Phe Gly Gln Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys
245
<210> 301
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 301
caagtgcaac tcgtggaatc tggtggagga ctcgtgcaac ccggaagatc gcttagactg
60
tcgtgtgccg ccagcgggtt cactttctcg aactacgcga tgtcctgggt ccgccaggca
120
cccggaaagg gactcggttg ggtgtccggc atttcccggt ccggcgaaaa tacctactac
180
gccgactccg tgaagggccg cttcaccatc tcaagggaca acagcaaaaa caccctgtac
240
ttgcaaatga actccctgcg ggatgaagat acagccgtgt actattgcgc ccggtcgcct
300
gcccattact acggcggaat ggacgtctgg ggacagggaa ccactgtgac tgtcagcagc
360
gcgtcgggtg gcggcggctc agggggtcgg gcctccgggg ggggagggtc cgacatcgtg
420
ctgacccagt ccccgggaac cctgagcctg agcccgggag agcgcgcgac cctgtcatgc
480
cgggcatccc agagcattag ctcctccttt ctcgcctggt atcagcagaa gcccggacag
540
gccccgaggc tgctgatcta cggcgctagc agaagggcta ccggaatccc agaccggttc
600
tccggctccg gttccgggac cgatttcacc cttactatct cgcgcctgga acctgaggac
660
tccgccgtct actactgcca gcagtaccac tcatccccgt cgtggacgtt cggacagggc
720
accaagctgg agattaag
738
<210> 302
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 302
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Gly Trp Val
35 40 45
Ser Gly Ile Ser Arg Ser Gly Glu Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Ala His Tyr Tyr Gly Gly Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 303
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 303
Asp Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Ser Ser Ser
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Arg Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr His Ser Ser Pro
85 90 95
Ser Trp Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 304
<211> 490
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 304
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Asn Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Gly Trp Val Ser Gly Ile Ser Arg Ser Gly Glu Asn Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Ser Pro Ala His Tyr Tyr Gly Gly Met
115 120 125
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile
145 150 155 160
Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg
165 170 175
Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Ser Ser Ser Phe Leu
180 185 190
Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
195 200 205
Gly Ala Ser Arg Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser
210 215 220
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu
225 230 235 240
Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr His Ser Ser Pro Ser Trp
245 250 255
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 305
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 305
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
ccccaagtgc aactcgtgga atctggtgga ggactcgtgc aacccggaag atcgcttaga
120
ctgtcgtgtg ccgccagcgg gttcactttc tcgaactacg cgatgtcctg ggtccgccag
180
gcacccggaa agggactcgg ttgggtgtcc ggcatttccc ggtccggcga aaatacctac
240
tacgccgact ccgtgaaggg ccgcttcacc atctcaaggg acaacagcaa aaacaccctg
300
tacttgcaaa tgaactccct gcgggatgaa gatacagccg tgtactattg cgcccggtcg
360
cctgcccatt actacggcgg aatggacgtc tggggacagg gaaccactgt gactgtcagc
420
agcgcgtcgg gtggcggcgg ctcagggggt cgggcctccg gggggggagg gtccgacatc
480
gtgctgaccc agtccccggg aaccctgagc ctgagcccgg gagagcgcgc gaccctgtca
540
tgccgggcat cccagagcat tagctcctcc tttctcgcct ggtatcagca gaagcccgga
600
caggccccga ggctgctgat ctacggcgct agcagaaggg ctaccggaat cccagaccgg
660
ttctccggct ccggttccgg gaccgatttc acccttacta tctcgcgcct ggaacctgag
720
gactccgccg tctactactg ccagcagtac cactcatccc cgtcgtggac gttcggacag
780
ggcaccaagc tggagattaa gaccactacc ccagcaccga ggccacccac cccggctcct
840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg
900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct
960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg
1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag
1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg
1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac
1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac
1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc
1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga
1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac
1440
gctcttcaca tgcaggccct gccgcctcgg
1470
<210> 306
<211> 244
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 306
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ser Val His Ser Phe Leu Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro
130 135 140
Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser
145 150 155 160
Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys
165 170 175
Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala
180 185 190
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
195 200 205
Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr
210 215 220
Cys Met Gln Ala Leu Gln Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys
225 230 235 240
Val Glu Ile Lys
<210> 307
<211> 732
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 307
caagtgcaac tcgtcgaatc cggtggaggt ctggtccaac ctggtagaag cctgagactg
60
tcgtgtgcgg ccagcggatt cacctttgat gactatgcta tgcactgggt gcggcaggcc
120
ccaggaaagg gcctggaatg ggtgtcggga attagctgga actccgggtc cattggctac
180
gccgactccg tgaagggccg cttcaccatc tcccgcgaca acgcaaagaa ctccctgtac
240
ttgcaaatga actcgctcag ggctgaggat accgcgctgt actactgctc cgtgcattcc
300
ttcctggcct actggggaca gggaactctg gtcaccgtgt cgagcgcctc cggcggcggg
360
ggctcgggtg gacgggcctc gggcggaggg gggtccgaca tcgtgatgac ccagaccccg
420
ctgagcttgc ccgtgactcc cggagagcct gcatccatct cctgccggtc atcccagtcc
480
cttctccact ccaacggata caactacctc gactggtacc tccagaagcc gggacagagc
540
cctcagcttc tgatctacct ggggtcaaat agagcctcag gagtgccgga tcggttcagc
600
ggatctggtt cgggaactga tttcactctg aagatttccc gcgtggaagc cgaggacgtg
660
ggcgtctact actgtatgca ggcgctgcag accccctata ccttcggcca agggacgaaa
720
gtggagatca ag
732
<210> 308
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 308
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ser Val His Ser Phe Leu Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 309
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 309
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 310
<211> 488
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 310
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Asp Asp Tyr Ala Met His Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Leu Tyr Tyr Cys Ser Val His Ser Phe Leu Ala Tyr Trp Gly Gln
115 120 125
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Thr
145 150 155 160
Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys
165 170 175
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp
180 185 190
Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Leu
195 200 205
Gly Ser Asn Arg Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly
210 215 220
Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp
225 230 235 240
Val Gly Val Tyr Tyr Cys Met Gln Ala Leu Gln Thr Pro Tyr Thr Phe
245 250 255
Gly Gln Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg
260 265 270
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
275 280 285
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
290 295 300
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
305 310 315 320
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg
325 330 335
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
340 345 350
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
355 360 365
Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala
370 375 380
Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
385 390 395 400
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
405 410 415
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
420 425 430
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
435 440 445
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
450 455 460
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
465 470 475 480
His Met Gln Ala Leu Pro Pro Arg
485
<210> 311
<211> 1464
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 311
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
ccccaagtgc aactcgtcga atccggtgga ggtctggtcc aacctggtag aagcctgaga
120
ctgtcgtgtg cggccagcgg attcaccttt gatgactatg ctatgcactg ggtgcggcag
180
gccccaggaa agggcctgga atgggtgtcg ggaattagct ggaactccgg gtccattggc
240
tacgccgact ccgtgaaggg ccgcttcacc atctcccgcg acaacgcaaa gaactccctg
300
tacttgcaaa tgaactcgct cagggctgag gataccgcgc tgtactactg ctccgtgcat
360
tccttcctgg cctactgggg acagggaact ctggtcaccg tgtcgagcgc ctccggcggc
420
gggggctcgg gtggacgggc ctcgggcgga ggggggtccg acatcgtgat gacccagacc
480
ccgctgagct tgcccgtgac tcccggagag cctgcatcca tctcctgccg gtcatcccag
540
tcccttctcc actccaacgg atacaactac ctcgactggt acctccagaa gccgggacag
600
agccctcagc ttctgatcta cctggggtca aatagagcct caggagtgcc ggatcggttc
660
agcggatctg gttcgggaac tgatttcact ctgaagattt cccgcgtgga agccgaggac
720
gtgggcgtct actactgtat gcaggcgctg cagaccccct ataccttcgg ccaagggacg
780
aaagtggaga tcaagaccac taccccagca ccgaggccac ccaccccggc tcctaccatc
840
gcctcccagc ctctgtccct gcgtccggag gcatgtagac ccgcagctgg tggggccgtg
900
catacccggg gtcttgactt cgcctgcgat atctacattt gggcccctct ggctggtact
960
tgcggggtcc tgctgctttc actcgtgatc actctttact gtaagcgcgg tcggaagaag
1020
ctgctgtaca tctttaagca acccttcatg aggcctgtgc agactactca agaggaggac
1080
ggctgttcat gccggttccc agaggaggag gaaggcggct gcgaactgcg cgtgaaattc
1140
agccgcagcg cagatgctcc agcctacaag caggggcaga accagctcta caacgaactc
1200
aatcttggtc ggagagagga gtacgacgtg ctggacaagc ggagaggacg ggacccagaa
1260
atgggcggga agccgcgcag aaagaatccc caagagggcc tgtacaacga gctccaaaag
1320
gataagatgg cagaagccta tagcgagatt ggtatgaaag gggaacgcag aagaggcaaa
1380
ggccacgacg gactgtacca gggactcagc accgccacca aggacaccta tgacgctctt
1440
cacatgcagg ccctgccgcc tcgg
1464
<210> 312
<211> 243
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 312
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser
130 135 140
Val Thr Pro Gly Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser
145 150 155 160
Leu Leu Arg Asn Asp Gly Lys Thr Pro Leu Tyr Trp Tyr Leu Gln Lys
165 170 175
Ala Gly Gln Pro Pro Gln Leu Leu Ile Tyr Glu Val Ser Asn Arg Phe
180 185 190
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
195 200 205
Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Ala Tyr Tyr
210 215 220
Cys Met Gln Asn Ile Gln Phe Pro Ser Phe Gly Gly Gly Thr Lys Leu
225 230 235 240
Glu Ile Lys
<210> 313
<211> 729
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 313
gaagtgcaat tgttggaatc tggaggagga cttgtgcagc ctggaggatc actgagactt
60
tcgtgtgcgg tgtcaggctt cgccctgagc aaccacggca tgagctgggt gcggagagcc
120
ccggggaagg gtctggaatg ggtgtccggg atcgtctact ccggttcaac ttactacgcc
180
gcaagcgtga agggtcgctt caccatttcc cgcgataact cccggaacac cctgtacctc
240
caaatgaact ccctgcggcc cgaggacacc gccatctact actgttccgc gcatggagga
300
gagtccgatg tctggggaca gggcactacc gtgaccgtgt cgagcgcctc ggggggagga
360
ggctccggcg gtcgcgcctc cggggggggt ggcagcgaca ttgtgatgac gcagactcca
420
ctctcgctgt ccgtgacccc gggacagccc gcgtccatct cgtgcaagag ctcccagagc
480
ctgctgagga acgacggaaa gactcctctg tattggtacc tccagaaggc tggacagccc
540
ccgcaactgc tcatctacga agtgtcaaat cgcttctccg gggtgccgga tcggttttcc
600
ggctcgggat cgggcaccga cttcaccctg aaaatctcca gggtcgaggc cgaggacgtg
660
ggagcctact actgcatgca aaacatccag ttcccttcct tcggcggcgg cacaaagctg
720
gagattaag
729
<210> 314
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 314
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 315
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 315
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Arg Asn
20 25 30
Asp Gly Lys Thr Pro Leu Tyr Trp Tyr Leu Gln Lys Ala Gly Gln Pro
35 40 45
Pro Gln Leu Leu Ile Tyr Glu Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Ala Tyr Tyr Cys Met Gln Asn
85 90 95
Ile Gln Phe Pro Ser Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 316
<211> 487
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 316
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe
35 40 45
Ala Leu Ser Asn His Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr
65 70 75 80
Ala Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg
85 90 95
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Ser Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Thr
145 150 155 160
Pro Leu Ser Leu Ser Val Thr Pro Gly Gln Pro Ala Ser Ile Ser Cys
165 170 175
Lys Ser Ser Gln Ser Leu Leu Arg Asn Asp Gly Lys Thr Pro Leu Tyr
180 185 190
Trp Tyr Leu Gln Lys Ala Gly Gln Pro Pro Gln Leu Leu Ile Tyr Glu
195 200 205
Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly
210 215 220
Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp
225 230 235 240
Val Gly Ala Tyr Tyr Cys Met Gln Asn Ile Gln Phe Pro Ser Phe Gly
245 250 255
Gly Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro
260 265 270
Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro
275 280 285
Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu
290 295 300
Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
305 310 315 320
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly
325 330 335
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
340 345 350
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
355 360 365
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
370 375 380
Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
385 390 395 400
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
405 410 415
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
420 425 430
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
435 440 445
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
450 455 460
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
465 470 475 480
Met Gln Ala Leu Pro Pro Arg
485
<210> 317
<211> 1461
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 317
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtgc aattgttgga atctggagga ggacttgtgc agcctggagg atcactgaga
120
ctttcgtgtg cggtgtcagg cttcgccctg agcaaccacg gcatgagctg ggtgcggaga
180
gccccgggga agggtctgga atgggtgtcc gggatcgtct actccggttc aacttactac
240
gccgcaagcg tgaagggtcg cttcaccatt tcccgcgata actcccggaa caccctgtac
300
ctccaaatga actccctgcg gcccgaggac accgccatct actactgttc cgcgcatgga
360
ggagagtccg atgtctgggg acagggcact accgtgaccg tgtcgagcgc ctcgggggga
420
ggaggctccg gcggtcgcgc ctccgggggg ggtggcagcg acattgtgat gacgcagact
480
ccactctcgc tgtccgtgac cccgggacag cccgcgtcca tctcgtgcaa gagctcccag
540
agcctgctga ggaacgacgg aaagactcct ctgtattggt acctccagaa ggctggacag
600
cccccgcaac tgctcatcta cgaagtgtca aatcgcttct ccggggtgcc ggatcggttt
660
tccggctcgg gatcgggcac cgacttcacc ctgaaaatct ccagggtcga ggccgaggac
720
gtgggagcct actactgcat gcaaaacatc cagttccctt ccttcggcgg cggcacaaag
780
ctggagatta agaccactac cccagcaccg aggccaccca ccccggctcc taccatcgcc
840
tcccagcctc tgtccctgcg tccggaggca tgtagacccg cagctggtgg ggccgtgcat
900
acccggggtc ttgacttcgc ctgcgatatc tacatttggg cccctctggc tggtacttgc
960
ggggtcctgc tgctttcact cgtgatcact ctttactgta agcgcggtcg gaagaagctg
1020
ctgtacatct ttaagcaacc cttcatgagg cctgtgcaga ctactcaaga ggaggacggc
1080
tgttcatgcc ggttcccaga ggaggaggaa ggcggctgcg aactgcgcgt gaaattcagc
1140
cgcagcgcag atgctccagc ctacaagcag gggcagaacc agctctacaa cgaactcaat
1200
cttggtcgga gagaggagta cgacgtgctg gacaagcgga gaggacggga cccagaaatg
1260
ggcgggaagc cgcgcagaaa gaatccccaa gagggcctgt acaacgagct ccaaaaggat
1320
aagatggcag aagcctatag cgagattggt atgaaagggg aacgcagaag aggcaaaggc
1380
cacgacggac tgtaccaggg actcagcacc gccaccaagg acacctatga cgctcttcac
1440
atgcaggccc tgccgcctcg g
1461
<210> 318
<211> 249
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 318
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Arg Lys Thr Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Asp Asn Phe
20 25 30
Gly Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Lys Asn Asn Asn Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Asn Thr Ala Tyr
65 70 75 80
Met Glu Val Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Pro Tyr Tyr Tyr Gln Ser Tyr Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Thr
130 135 140
Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys
145 150 155 160
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asn
165 170 175
Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Leu
180 185 190
Gly Ser Lys Arg Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly
195 200 205
Ser Gly Thr Asp Phe Thr Leu His Ile Thr Arg Val Gly Ala Glu Asp
210 215 220
Val Gly Val Tyr Tyr Cys Met Gln Ala Leu Gln Thr Pro Tyr Thr Phe
225 230 235 240
Gly Gln Gly Thr Lys Leu Glu Ile Lys
245
<210> 319
<211> 747
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 319
caagtccaac tcgtccagtc cggcgcagaa gtcagaaaaa ccggtgctag cgtgaaagtg
60
tcctgcaagg cctccggcta cattttcgat aacttcggaa tcaactgggt cagacaggcc
120
ccgggccagg ggctggaatg gatgggatgg atcaacccca agaacaacaa caccaactac
180
gcacagaagt tccagggccg cgtgactatc accgccgatg aatcgaccaa taccgcctac
240
atggaggtgt cctccctgcg gtcggaggac actgccgtgt attactgcgc gaggggccca
300
tactactacc aaagctacat ggacgtctgg ggacagggaa ccatggtgac cgtgtcatcc
360
gcctccggtg gtggaggctc cggggggcgg gcttcaggag gcggaggaag cgatattgtg
420
atgacccaga ctccgcttag cctgcccgtg actcctggag aaccggcctc catttcctgc
480
cggtcctcgc aatcactcct gcattccaac ggttacaact acctgaattg gtacctccag
540
aagcctggcc agtcgcccca gttgctgatc tatctgggct cgaagcgcgc ctccggggtg
600
cctgaccggt ttagcggatc tgggagcggc acggacttca ctctccacat cacccgcgtg
660
ggagcggagg acgtgggagt gtactactgt atgcaggcgc tgcagactcc gtacacattc
720
ggacagggca ccaagctgga gatcaag
747
<210> 320
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 320
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Arg Lys Thr Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Asp Asn Phe
20 25 30
Gly Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Lys Asn Asn Asn Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Asn Thr Ala Tyr
65 70 75 80
Met Glu Val Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Pro Tyr Tyr Tyr Gln Ser Tyr Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 321
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 321
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Lys Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu His Ile
65 70 75 80
Thr Arg Val Gly Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 322
<211> 493
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 322
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Arg Lys Thr Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Ile Phe Asp Asn Phe Gly Ile Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Lys Asn Asn Asn Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser
85 90 95
Thr Asn Thr Ala Tyr Met Glu Val Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Pro Tyr Tyr Tyr Gln Ser Tyr Met
115 120 125
Asp Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile
145 150 155 160
Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro
165 170 175
Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly
180 185 190
Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln
195 200 205
Leu Leu Ile Tyr Leu Gly Ser Lys Arg Ala Ser Gly Val Pro Asp Arg
210 215 220
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu His Ile Thr Arg
225 230 235 240
Val Gly Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala Leu Gln
245 250 255
Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr
260 265 270
Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln
275 280 285
Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala
290 295 300
Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala
305 310 315 320
Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr
325 330 335
Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln
340 345 350
Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser
355 360 365
Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys
370 375 380
Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln
385 390 395 400
Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu
405 410 415
Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg
420 425 430
Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met
435 440 445
Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly
450 455 460
Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp
465 470 475 480
Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 323
<211> 1479
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 323
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
ccccaagtcc aactcgtcca gtccggcgca gaagtcagaa aaaccggtgc tagcgtgaaa
120
gtgtcctgca aggcctccgg ctacattttc gataacttcg gaatcaactg ggtcagacag
180
gccccgggcc aggggctgga atggatggga tggatcaacc ccaagaacaa caacaccaac
240
tacgcacaga agttccaggg ccgcgtgact atcaccgccg atgaatcgac caataccgcc
300
tacatggagg tgtcctccct gcggtcggag gacactgccg tgtattactg cgcgaggggc
360
ccatactact accaaagcta catggacgtc tggggacagg gaaccatggt gaccgtgtca
420
tccgcctccg gtggtggagg ctccgggggg cgggcttcag gaggcggagg aagcgatatt
480
gtgatgaccc agactccgct tagcctgccc gtgactcctg gagaaccggc ctccatttcc
540
tgccggtcct cgcaatcact cctgcattcc aacggttaca actacctgaa ttggtacctc
600
cagaagcctg gccagtcgcc ccagttgctg atctatctgg gctcgaagcg cgcctccggg
660
gtgcctgacc ggtttagcgg atctgggagc ggcacggact tcactctcca catcacccgc
720
gtgggagcgg aggacgtggg agtgtactac tgtatgcagg cgctgcagac tccgtacaca
780
ttcggacagg gcaccaagct ggagatcaag accactaccc cagcaccgag gccacccacc
840
ccggctccta ccatcgcctc ccagcctctg tccctgcgtc cggaggcatg tagacccgca
900
gctggtgggg ccgtgcatac ccggggtctt gacttcgcct gcgatatcta catttgggcc
960
cctctggctg gtacttgcgg ggtcctgctg ctttcactcg tgatcactct ttactgtaag
1020
cgcggtcgga agaagctgct gtacatcttt aagcaaccct tcatgaggcc tgtgcagact
1080
actcaagagg aggacggctg ttcatgccgg ttcccagagg aggaggaagg cggctgcgaa
1140
ctgcgcgtga aattcagccg cagcgcagat gctccagcct acaagcaggg gcagaaccag
1200
ctctacaacg aactcaatct tggtcggaga gaggagtacg acgtgctgga caagcggaga
1260
ggacgggacc cagaaatggg cgggaagccg cgcagaaaga atccccaaga gggcctgtac
1320
aacgagctcc aaaaggataa gatggcagaa gcctatagcg agattggtat gaaaggggaa
1380
cgcagaagag gcaaaggcca cgacggactg taccagggac tcagcaccgc caccaaggac
1440
acctatgacg ctcttcacat gcaggccctg ccgcctcgg
1479
<210> 324
<211> 246
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 324
Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Asp
20 25 30
Ala Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Gly Ser Gly Gly Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Leu Asp Ser Ser Gly Tyr Tyr Tyr Ala Arg Gly Pro Arg Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Gln Leu
130 135 140
Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
145 150 155 160
Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn Trp Tyr
165 170 175
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Gly Ala Ser
180 185 190
Thr Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr His Phe Thr Leu Thr Ile Asn Ser Leu Gln Ser Glu Asp Ser Ala
210 215 220
Thr Tyr Tyr Cys Gln Gln Ser Tyr Lys Arg Ala Ser Phe Gly Gln Gly
225 230 235 240
Thr Lys Val Glu Ile Lys
245
<210> 325
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 325
caagtgcaac ttcaagaatc aggcggagga ctcgtgcagc ccggaggatc attgcggctc
60
tcgtgcgccg cctcgggctt caccttctcg agcgacgcca tgacctgggt ccgccaggcc
120
ccggggaagg ggctggaatg ggtgtctgtg atttccggct ccgggggaac tacgtactac
180
gccgattccg tgaaaggtcg cttcactatc tcccgggaca acagcaagaa caccctttat
240
ctgcaaatga attccctccg cgccgaggac accgccgtgt actactgcgc caagctggac
300
tcctcgggct actactatgc ccggggtccg agatactggg gacagggaac cctcgtgacc
360
gtgtcctccg cgtccggcgg aggagggtcg ggagggcggg cctccggcgg cggcggttcg
420
gacatccagc tgacccagtc cccatcctca ctgagcgcaa gcgtgggcga cagagtcacc
480
attacatgca gggcgtccca gagcatcagc tcctacctga actggtacca acagaagcct
540
ggaaaggctc ctaagctgtt gatctacggg gcttcgaccc tggcatccgg ggtgcccgcg
600
aggtttagcg gaagcggtag cggcactcac ttcactctga ccattaacag cctccagtcc
660
gaggattcag ccacttacta ctgtcagcag tcctacaagc gggccagctt cggacagggc
720
actaaggtcg agatcaag
738
<210> 326
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 326
Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Asp
20 25 30
Ala Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Gly Ser Gly Gly Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Leu Asp Ser Ser Gly Tyr Tyr Tyr Ala Arg Gly Pro Arg Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 327
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 327
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr His Phe Thr Leu Thr Ile Asn Ser Leu Gln Ser
65 70 75 80
Glu Asp Ser Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Lys Arg Ala Ser
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 328
<211> 490
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 328
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Asp Ala Met Thr Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Val Ile Ser Gly Ser Gly Gly Thr Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Leu Asp Ser Ser Gly Tyr Tyr Tyr Ala
115 120 125
Arg Gly Pro Arg Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
130 135 140
Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly Gly Gly Gly
145 150 155 160
Ser Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val
165 170 175
Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser
180 185 190
Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu
195 200 205
Ile Tyr Gly Ala Ser Thr Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr His Phe Thr Leu Thr Ile Asn Ser Leu Gln
225 230 235 240
Ser Glu Asp Ser Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Lys Arg Ala
245 250 255
Ser Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 329
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 329
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
ccccaagtgc aacttcaaga atcaggcgga ggactcgtgc agcccggagg atcattgcgg
120
ctctcgtgcg ccgcctcggg cttcaccttc tcgagcgacg ccatgacctg ggtccgccag
180
gccccgggga aggggctgga atgggtgtct gtgatttccg gctccggggg aactacgtac
240
tacgccgatt ccgtgaaagg tcgcttcact atctcccggg acaacagcaa gaacaccctt
300
tatctgcaaa tgaattccct ccgcgccgag gacaccgccg tgtactactg cgccaagctg
360
gactcctcgg gctactacta tgcccggggt ccgagatact ggggacaggg aaccctcgtg
420
accgtgtcct ccgcgtccgg cggaggaggg tcgggagggc gggcctccgg cggcggcggt
480
tcggacatcc agctgaccca gtccccatcc tcactgagcg caagcgtggg cgacagagtc
540
accattacat gcagggcgtc ccagagcatc agctcctacc tgaactggta ccaacagaag
600
cctggaaagg ctcctaagct gttgatctac ggggcttcga ccctggcatc cggggtgccc
660
gcgaggttta gcggaagcgg tagcggcact cacttcactc tgaccattaa cagcctccag
720
tccgaggatt cagccactta ctactgtcag cagtcctaca agcgggccag cttcggacag
780
ggcactaagg tcgagatcaa gaccactacc ccagcaccga ggccacccac cccggctcct
840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg
900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct
960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg
1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag
1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg
1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac
1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac
1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc
1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga
1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac
1440
gctcttcaca tgcaggccct gccgcctcgg
1470
<210> 330
<211> 247
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 330
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asn Tyr
20 25 30
Gly Ile Thr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asn Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Pro Tyr Tyr Tyr Tyr Met Asp Val Trp Gly Lys Gly Thr
100 105 110
Met Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg
115 120 125
Ala Ser Gly Gly Gly Gly Ser Glu Ile Val Met Thr Gln Ser Pro Leu
130 135 140
Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser
145 150 155 160
Ser Gln Ser Leu Leu Tyr Ser Asn Gly Tyr Asn Tyr Val Asp Trp Tyr
165 170 175
Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Leu Gly Ser
180 185 190
Asn Arg Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Asp Phe Lys Leu Gln Ile Ser Arg Val Glu Ala Glu Asp Val Gly
210 215 220
Ile Tyr Tyr Cys Met Gln Gly Arg Gln Phe Pro Tyr Ser Phe Gly Gln
225 230 235 240
Gly Thr Lys Val Glu Ile Lys
245
<210> 331
<211> 741
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 331
caagtccaac tggtccagag cggtgcagaa gtgaagaagc ccggagcgag cgtgaaagtg
60
tcctgcaagg cttccgggta caccttctcc aactacggca tcacttgggt gcgccaggcc
120
ccgggacagg gcctggaatg gatggggtgg atttccgcgt acaacggcaa tacgaactac
180
gctcagaagt tccagggtag agtgaccatg actaggaaca cctccatttc caccgcctac
240
atggaactgt cctccctgcg gagcgaggac accgccgtgt actattgcgc ccggggacca
300
tactactact acatggatgt ctgggggaag gggactatgg tcaccgtgtc atccgcctcg
360
ggaggcggcg gatcaggagg acgcgcctct ggtggtggag gatcggagat cgtgatgacc
420
cagagccctc tctccttgcc cgtgactcct ggggagcccg catccatttc atgccggagc
480
tcccagtcac ttctctactc caacggctat aactacgtgg attggtacct ccaaaagccg
540
ggccagagcc cgcagctgct gatctacctg ggctcgaaca gggccagcgg agtgcctgac
600
cggttctccg ggtcgggaag cgggaccgac ttcaagctgc aaatctcgag agtggaggcc
660
gaggacgtgg gaatctacta ctgtatgcag ggccgccagt ttccgtactc gttcggacag
720
ggcaccaaag tggaaatcaa g
741
<210> 332
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 332
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asn Tyr
20 25 30
Gly Ile Thr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asn Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Pro Tyr Tyr Tyr Tyr Met Asp Val Trp Gly Lys Gly Thr
100 105 110
Met Val Thr Val Ser Ser
115
<210> 333
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 333
Glu Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Tyr Asn Tyr Val Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Lys Leu Gln Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Ile Tyr Tyr Cys Met Gln Gly
85 90 95
Arg Gln Phe Pro Tyr Ser Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 334
<211> 491
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 334
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Ser Asn Tyr Gly Ile Thr Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asn Thr Ser
85 90 95
Ile Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Pro Tyr Tyr Tyr Tyr Met Asp Val
115 120 125
Trp Gly Lys Gly Thr Met Val Thr Val Ser Ser Ala Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Arg Ala Ser Gly Gly Gly Gly Ser Glu Ile Val Met
145 150 155 160
Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser
165 170 175
Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Tyr Ser Asn Gly Tyr Asn
180 185 190
Tyr Val Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu
195 200 205
Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro Asp Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Phe Lys Leu Gln Ile Ser Arg Val Glu
225 230 235 240
Ala Glu Asp Val Gly Ile Tyr Tyr Cys Met Gln Gly Arg Gln Phe Pro
245 250 255
Tyr Ser Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 335
<211> 1473
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 335
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
ccccaagtcc aactggtcca gagcggtgca gaagtgaaga agcccggagc gagcgtgaaa
120
gtgtcctgca aggcttccgg gtacaccttc tccaactacg gcatcacttg ggtgcgccag
180
gccccgggac agggcctgga atggatgggg tggatttccg cgtacaacgg caatacgaac
240
tacgctcaga agttccaggg tagagtgacc atgactagga acacctccat ttccaccgcc
300
tacatggaac tgtcctccct gcggagcgag gacaccgccg tgtactattg cgcccgggga
360
ccatactact actacatgga tgtctggggg aaggggacta tggtcaccgt gtcatccgcc
420
tcgggaggcg gcggatcagg aggacgcgcc tctggtggtg gaggatcgga gatcgtgatg
480
acccagagcc ctctctcctt gcccgtgact cctggggagc ccgcatccat ttcatgccgg
540
agctcccagt cacttctcta ctccaacggc tataactacg tggattggta cctccaaaag
600
ccgggccaga gcccgcagct gctgatctac ctgggctcga acagggccag cggagtgcct
660
gaccggttct ccgggtcggg aagcgggacc gacttcaagc tgcaaatctc gagagtggag
720
gccgaggacg tgggaatcta ctactgtatg cagggccgcc agtttccgta ctcgttcgga
780
cagggcacca aagtggaaat caagaccact accccagcac cgaggccacc caccccggct
840
cctaccatcg cctcccagcc tctgtccctg cgtccggagg catgtagacc cgcagctggt
900
ggggccgtgc atacccgggg tcttgacttc gcctgcgata tctacatttg ggcccctctg
960
gctggtactt gcggggtcct gctgctttca ctcgtgatca ctctttactg taagcgcggt
1020
cggaagaagc tgctgtacat ctttaagcaa cccttcatga ggcctgtgca gactactcaa
1080
gaggaggacg gctgttcatg ccggttccca gaggaggagg aaggcggctg cgaactgcgc
1140
gtgaaattca gccgcagcgc agatgctcca gcctacaagc aggggcagaa ccagctctac
1200
aacgaactca atcttggtcg gagagaggag tacgacgtgc tggacaagcg gagaggacgg
1260
gacccagaaa tgggcgggaa gccgcgcaga aagaatcccc aagagggcct gtacaacgag
1320
ctccaaaagg ataagatggc agaagcctat agcgagattg gtatgaaagg ggaacgcaga
1380
agaggcaaag gccacgacgg actgtaccag ggactcagca ccgccaccaa ggacacctat
1440
gacgctcttc acatgcaggc cctgccgcct cgg
1473
<210> 336
<211> 238
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 336
Glu Val Gln Leu Leu Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser
130 135 140
Val Ser Pro Gly Glu Ser Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser
145 150 155 160
Val Ser Ser Asn Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
165 170 175
Arg Leu Leu Ile Tyr Gly Ala Ser Thr Arg Ala Ser Gly Ile Pro Asp
180 185 190
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
195 200 205
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Tyr Gly
210 215 220
Ser Ser Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
225 230 235
<210> 337
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 337
gaagtgcaat tgctcgaaac tggaggaggt ctggtgcaac ctggaggatc acttcgcctg
60
tcctgcgccg tgtcgggctt tgccctgtcc aaccatggaa tgagctgggt ccgccgcgcg
120
ccggggaagg gcctcgaatg ggtgtccggc atcgtctact ccggctccac ctactacgcc
180
gcgtccgtga agggccggtt cacgatttca cgggacaact cgcggaacac cctgtacctc
240
caaatgaatt cccttcggcc ggaggatact gccatctact actgctccgc ccacggtggc
300
gaatccgacg tctggggcca gggaaccacc gtgaccgtgt ccagcgcgtc cgggggagga
360
ggaagcgggg gtagagcatc gggtggaggc ggatcagaga tcgtgctgac ccagtccccc
420
gccaccttga gcgtgtcacc aggagagtcc gccaccctgt catgccgcgc cagccagtcc
480
gtgtcctcca acctggcttg gtaccagcag aagccggggc aggcccctag actcctgatc
540
tatggggcgt cgacccgggc atctggaatt cccgataggt tcagcggatc gggctcgggc
600
actgacttca ctctgaccat ctcctcgctg caagccgagg acgtggctgt gtactactgt
660
cagcagtacg gaagctccct gactttcggt ggcgggacca aagtcgagat taag
714
<210> 338
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 338
Glu Val Gln Leu Leu Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 339
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 339
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Ser Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Ser Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Leu Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 340
<211> 482
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 340
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Leu Glu Thr Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe
35 40 45
Ala Leu Ser Asn His Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr
65 70 75 80
Ala Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg
85 90 95
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Ser Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser
145 150 155 160
Pro Ala Thr Leu Ser Val Ser Pro Gly Glu Ser Ala Thr Leu Ser Cys
165 170 175
Arg Ala Ser Gln Ser Val Ser Ser Asn Leu Ala Trp Tyr Gln Gln Lys
180 185 190
Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Thr Arg Ala
195 200 205
Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
210 215 220
Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr
225 230 235 240
Cys Gln Gln Tyr Gly Ser Ser Leu Thr Phe Gly Gly Gly Thr Lys Val
245 250 255
Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro
260 265 270
Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro
275 280 285
Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
290 295 300
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
305 310 315 320
Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu
325 330 335
Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu
340 345 350
Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys
355 360 365
Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys
370 375 380
Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu
385 390 395 400
Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly
405 410 415
Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu
420 425 430
Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly
435 440 445
Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser
450 455 460
Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro
465 470 475 480
Pro Arg
<210> 341
<211> 1446
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 341
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtgc aattgctcga aactggagga ggtctggtgc aacctggagg atcacttcgc
120
ctgtcctgcg ccgtgtcggg ctttgccctg tccaaccatg gaatgagctg ggtccgccgc
180
gcgccgggga agggcctcga atgggtgtcc ggcatcgtct actccggctc cacctactac
240
gccgcgtccg tgaagggccg gttcacgatt tcacgggaca actcgcggaa caccctgtac
300
ctccaaatga attcccttcg gccggaggat actgccatct actactgctc cgcccacggt
360
ggcgaatccg acgtctgggg ccagggaacc accgtgaccg tgtccagcgc gtccggggga
420
ggaggaagcg ggggtagagc atcgggtgga ggcggatcag agatcgtgct gacccagtcc
480
cccgccacct tgagcgtgtc accaggagag tccgccaccc tgtcatgccg cgccagccag
540
tccgtgtcct ccaacctggc ttggtaccag cagaagccgg ggcaggcccc tagactcctg
600
atctatgggg cgtcgacccg ggcatctgga attcccgata ggttcagcgg atcgggctcg
660
ggcactgact tcactctgac catctcctcg ctgcaagccg aggacgtggc tgtgtactac
720
tgtcagcagt acggaagctc cctgactttc ggtggcggga ccaaagtcga gattaagacc
780
actaccccag caccgaggcc acccaccccg gctcctacca tcgcctccca gcctctgtcc
840
ctgcgtccgg aggcatgtag acccgcagct ggtggggccg tgcatacccg gggtcttgac
900
ttcgcctgcg atatctacat ttgggcccct ctggctggta cttgcggggt cctgctgctt
960
tcactcgtga tcactcttta ctgtaagcgc ggtcggaaga agctgctgta catctttaag
1020
caacccttca tgaggcctgt gcagactact caagaggagg acggctgttc atgccggttc
1080
ccagaggagg aggaaggcgg ctgcgaactg cgcgtgaaat tcagccgcag cgcagatgct
1140
ccagcctaca agcaggggca gaaccagctc tacaacgaac tcaatcttgg tcggagagag
1200
gagtacgacg tgctggacaa gcggagagga cgggacccag aaatgggcgg gaagccgcgc
1260
agaaagaatc cccaagaggg cctgtacaac gagctccaaa aggataagat ggcagaagcc
1320
tatagcgaga ttggtatgaa aggggaacgc agaagaggca aaggccacga cggactgtac
1380
cagggactca gcaccgccac caaggacacc tatgacgctc ttcacatgca ggccctgccg
1440
cctcgg
1446
<210> 342
<211> 239
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 342
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser
130 135 140
Val Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser
145 150 155 160
Val Ser Ser Lys Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
165 170 175
Arg Leu Leu Met Tyr Gly Ala Ser Ile Arg Ala Thr Gly Ile Pro Asp
180 185 190
Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser
195 200 205
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly
210 215 220
Ser Ser Ser Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
225 230 235
<210> 343
<211> 717
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 343
gaagtgcaat tggtggaaac tggaggagga cttgtgcaac ctggaggatc attgagactg
60
agctgcgcag tgtcgggatt cgccctgagc aaccatggaa tgtcctgggt cagaagggcc
120
cctggaaaag gcctcgaatg ggtgtcaggg atcgtgtact ccggttccac ttactacgcc
180
gcctccgtga aggggcgctt cactatctca cgggataact cccgcaatac cctgtacctc
240
caaatgaaca gcctgcggcc ggaggatacc gccatctact actgttccgc ccacggtgga
300
gagtctgacg tctggggcca gggaactacc gtgaccgtgt cctccgcgtc cggcggtgga
360
gggagcggcg gccgcgccag cggcggcgga ggctccgaga tcgtgatgac ccagagcccc
420
gctactctgt cggtgtcgcc cggagaaagg gcgaccctgt cctgccgggc gtcgcagtcc
480
gtgagcagca agctggcttg gtaccagcag aagccgggcc aggcaccacg cctgcttatg
540
tacggtgcct ccattcgggc caccggaatc ccggaccggt tctcggggtc ggggtccggt
600
accgagttca cactgaccat ttcctcgctc gagcccgagg actttgccgt ctattactgc
660
cagcagtacg gctcctcctc atggacgttc ggccagggga ccaaggtcga aatcaag
717
<210> 344
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 344
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 345
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 345
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Lys
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Met
35 40 45
Tyr Gly Ala Ser Ile Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Ser Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 346
<211> 483
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 346
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe
35 40 45
Ala Leu Ser Asn His Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr
65 70 75 80
Ala Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg
85 90 95
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Ser Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Glu Ile Val Met Thr Gln Ser
145 150 155 160
Pro Ala Thr Leu Ser Val Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys
165 170 175
Arg Ala Ser Gln Ser Val Ser Ser Lys Leu Ala Trp Tyr Gln Gln Lys
180 185 190
Pro Gly Gln Ala Pro Arg Leu Leu Met Tyr Gly Ala Ser Ile Arg Ala
195 200 205
Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe
210 215 220
Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr
225 230 235 240
Cys Gln Gln Tyr Gly Ser Ser Ser Trp Thr Phe Gly Gln Gly Thr Lys
245 250 255
Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
260 265 270
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
275 280 285
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
290 295 300
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
305 310 315 320
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
325 330 335
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
340 345 350
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
355 360 365
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
370 375 380
Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
385 390 395 400
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
405 410 415
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
420 425 430
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
435 440 445
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
450 455 460
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
465 470 475 480
Pro Pro Arg
<210> 347
<211> 1449
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 347
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtgc aattggtgga aactggagga ggacttgtgc aacctggagg atcattgaga
120
ctgagctgcg cagtgtcggg attcgccctg agcaaccatg gaatgtcctg ggtcagaagg
180
gcccctggaa aaggcctcga atgggtgtca gggatcgtgt actccggttc cacttactac
240
gccgcctccg tgaaggggcg cttcactatc tcacgggata actcccgcaa taccctgtac
300
ctccaaatga acagcctgcg gccggaggat accgccatct actactgttc cgcccacggt
360
ggagagtctg acgtctgggg ccagggaact accgtgaccg tgtcctccgc gtccggcggt
420
ggagggagcg gcggccgcgc cagcggcggc ggaggctccg agatcgtgat gacccagagc
480
cccgctactc tgtcggtgtc gcccggagaa agggcgaccc tgtcctgccg ggcgtcgcag
540
tccgtgagca gcaagctggc ttggtaccag cagaagccgg gccaggcacc acgcctgctt
600
atgtacggtg cctccattcg ggccaccgga atcccggacc ggttctcggg gtcggggtcc
660
ggtaccgagt tcacactgac catttcctcg ctcgagcccg aggactttgc cgtctattac
720
tgccagcagt acggctcctc ctcatggacg ttcggccagg ggaccaaggt cgaaatcaag
780
accactaccc cagcaccgag gccacccacc ccggctccta ccatcgcctc ccagcctctg
840
tccctgcgtc cggaggcatg tagacccgca gctggtgggg ccgtgcatac ccggggtctt
900
gacttcgcct gcgatatcta catttgggcc cctctggctg gtacttgcgg ggtcctgctg
960
ctttcactcg tgatcactct ttactgtaag cgcggtcgga agaagctgct gtacatcttt
1020
aagcaaccct tcatgaggcc tgtgcagact actcaagagg aggacggctg ttcatgccgg
1080
ttcccagagg aggaggaagg cggctgcgaa ctgcgcgtga aattcagccg cagcgcagat
1140
gctccagcct acaagcaggg gcagaaccag ctctacaacg aactcaatct tggtcggaga
1200
gaggagtacg acgtgctgga caagcggaga ggacgggacc cagaaatggg cgggaagccg
1260
cgcagaaaga atccccaaga gggcctgtac aacgagctcc aaaaggataa gatggcagaa
1320
gcctatagcg agattggtat gaaaggggaa cgcagaagag gcaaaggcca cgacggactg
1380
taccagggac tcagcaccgc caccaaggac acctatgacg ctcttcacat gcaggccctg
1440
ccgcctcgg
1449
<210> 348
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 348
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser
130 135 140
Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser
145 150 155 160
Val Gly Ser Thr Asn Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala
165 170 175
Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro
180 185 190
Asp Arg Phe Ser Gly Gly Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
195 200 205
Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr
210 215 220
Gly Ser Ser Pro Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
225 230 235 240
Lys
<210> 349
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 349
gaagtgcaat tggtggagac tggaggagga gtggtgcaac ctggaggaag cctgagactg
60
tcatgcgcgg tgtcgggctt cgccctctcc aaccacggaa tgtcctgggt ccgccgggcc
120
cctgggaaag gacttgaatg ggtgtccggc atcgtgtact cgggttccac ctactacgcg
180
gcctcagtga agggccggtt tactattagc cgcgacaact ccagaaacac actgtacctc
240
caaatgaact cgctgcggcc ggaagatacc gctatctact actgctccgc ccatggggga
300
gagtcggacg tctggggaca gggcaccact gtcactgtgt ccagcgcttc cggcggtggt
360
ggaagcgggg gacgggcctc aggaggcggt ggcagcgaga ttgtgctgac ccagtccccc
420
gggaccctga gcctgtcccc gggagaaagg gccaccctct cctgtcgggc atcccagtcc
480
gtggggtcta ctaaccttgc atggtaccag cagaagcccg gccaggcccc tcgcctgctg
540
atctacgacg cgtccaatag agccaccggc atcccggatc gcttcagcgg aggcggatcg
600
ggcaccgact tcaccctcac catttcaagg ctggaaccgg aggacttcgc cgtgtactac
660
tgccagcagt atggttcgtc cccaccctgg acgttcggcc aggggactaa ggtcgagatc
720
aag
723
<210> 350
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 350
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 351
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 351
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Gly Ser Thr
20 25 30
Asn Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Gly Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 352
<211> 485
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 352
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Thr Gly Gly Gly Val
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe
35 40 45
Ala Leu Ser Asn His Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr
65 70 75 80
Ala Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg
85 90 95
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Ser Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser
145 150 155 160
Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys
165 170 175
Arg Ala Ser Gln Ser Val Gly Ser Thr Asn Leu Ala Trp Tyr Gln Gln
180 185 190
Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg
195 200 205
Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Gly Gly Ser Gly Thr Asp
210 215 220
Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr
225 230 235 240
Tyr Cys Gln Gln Tyr Gly Ser Ser Pro Pro Trp Thr Phe Gly Gln Gly
245 250 255
Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
260 265 270
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
275 280 285
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
290 295 300
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
305 310 315 320
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
325 330 335
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
340 345 350
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
355 360 365
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
370 375 380
Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
385 390 395 400
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
405 410 415
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
420 425 430
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
435 440 445
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
450 455 460
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
465 470 475 480
Ala Leu Pro Pro Arg
485
<210> 353
<211> 1455
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 353
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtgc aattggtgga gactggagga ggagtggtgc aacctggagg aagcctgaga
120
ctgtcatgcg cggtgtcggg cttcgccctc tccaaccacg gaatgtcctg ggtccgccgg
180
gcccctggga aaggacttga atgggtgtcc ggcatcgtgt actcgggttc cacctactac
240
gcggcctcag tgaagggccg gtttactatt agccgcgaca actccagaaa cacactgtac
300
ctccaaatga actcgctgcg gccggaagat accgctatct actactgctc cgcccatggg
360
ggagagtcgg acgtctgggg acagggcacc actgtcactg tgtccagcgc ttccggcggt
420
ggtggaagcg ggggacgggc ctcaggaggc ggtggcagcg agattgtgct gacccagtcc
480
cccgggaccc tgagcctgtc cccgggagaa agggccaccc tctcctgtcg ggcatcccag
540
tccgtggggt ctactaacct tgcatggtac cagcagaagc ccggccaggc ccctcgcctg
600
ctgatctacg acgcgtccaa tagagccacc ggcatcccgg atcgcttcag cggaggcgga
660
tcgggcaccg acttcaccct caccatttca aggctggaac cggaggactt cgccgtgtac
720
tactgccagc agtatggttc gtccccaccc tggacgttcg gccaggggac taaggtcgag
780
atcaagacca ctaccccagc accgaggcca cccaccccgg ctcctaccat cgcctcccag
840
cctctgtccc tgcgtccgga ggcatgtaga cccgcagctg gtggggccgt gcatacccgg
900
ggtcttgact tcgcctgcga tatctacatt tgggcccctc tggctggtac ttgcggggtc
960
ctgctgcttt cactcgtgat cactctttac tgtaagcgcg gtcggaagaa gctgctgtac
1020
atctttaagc aacccttcat gaggcctgtg cagactactc aagaggagga cggctgttca
1080
tgccggttcc cagaggagga ggaaggcggc tgcgaactgc gcgtgaaatt cagccgcagc
1140
gcagatgctc cagcctacaa gcaggggcag aaccagctct acaacgaact caatcttggt
1200
cggagagagg agtacgacgt gctggacaag cggagaggac gggacccaga aatgggcggg
1260
aagccgcgca gaaagaatcc ccaagagggc ctgtacaacg agctccaaaa ggataagatg
1320
gcagaagcct atagcgagat tggtatgaaa ggggaacgca gaagaggcaa aggccacgac
1380
ggactgtacc agggactcag caccgccacc aaggacacct atgacgctct tcacatgcag
1440
gccctgccgc ctcgg
1455
<210> 354
<211> 239
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 354
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ser Gly Asp Gly Met Asp Val Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
130 135 140
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
145 150 155 160
Gln Ser Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys
165 170 175
Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val
180 185 190
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
195 200 205
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
210 215 220
Ser Tyr Thr Leu Ala Phe Gly Gln Gly Thr Lys Val Asp Ile Lys
225 230 235
<210> 355
<211> 717
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 355
caagtgcaac tcgtggaatc tggtggagga ctcgtgaaac ctggaggatc attgagactg
60
tcatgcgcgg cctcgggatt cacgttctcc gattactaca tgagctggat tcgccaggct
120
ccggggaagg gactggaatg ggtgtcctac atttcctcat ccggctccac catctactac
180
gcggactccg tgaaggggag attcaccatt agccgcgata acgccaagaa cagcctgtac
240
cttcagatga actccctgcg ggctgaagat actgccgtct actactgcgc aagggagagc
300
ggagatggga tggacgtctg gggacagggt accactgtga ccgtgtcgtc ggcctccggc
360
ggagggggtt cgggtggaag ggccagcggc ggcggaggca gcgacatcca gatgacccag
420
tccccctcat cgctgtccgc ctccgtgggc gaccgcgtca ccatcacatg ccgggcctca
480
cagtcgatct cctcctacct caattggtat cagcagaagc ccggaaaggc ccctaagctt
540
ctgatctacg cagcgtcctc cctgcaatcc ggggtcccat ctcggttctc cggctcgggc
600
agcggtaccg acttcactct gaccatctcg agcctgcagc cggaggactt cgccacttac
660
tactgtcagc aaagctacac cctcgcgttt ggccagggca ccaaagtgga catcaag
717
<210> 356
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 356
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ser Gly Asp Gly Met Asp Val Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 357
<211> 105
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 357
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Thr Leu Ala Phe
85 90 95
Gly Gln Gly Thr Lys Val Asp Ile Lys
100 105
<210> 358
<211> 483
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 358
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Asp Tyr Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Glu Ser Gly Asp Gly Met Asp Val Trp
115 120 125
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr
145 150 155 160
Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile
165 170 175
Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn Trp Tyr Gln
180 185 190
Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Ser
195 200 205
Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr
210 215 220
Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr
225 230 235 240
Tyr Tyr Cys Gln Gln Ser Tyr Thr Leu Ala Phe Gly Gln Gly Thr Lys
245 250 255
Val Asp Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
260 265 270
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
275 280 285
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
290 295 300
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
305 310 315 320
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
325 330 335
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
340 345 350
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
355 360 365
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
370 375 380
Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
385 390 395 400
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
405 410 415
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
420 425 430
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
435 440 445
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
450 455 460
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
465 470 475 480
Pro Pro Arg
<210> 359
<211> 1449
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 359
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
ccccaagtgc aactcgtgga atctggtgga ggactcgtga aacctggagg atcattgaga
120
ctgtcatgcg cggcctcggg attcacgttc tccgattact acatgagctg gattcgccag
180
gctccgggga agggactgga atgggtgtcc tacatttcct catccggctc caccatctac
240
tacgcggact ccgtgaaggg gagattcacc attagccgcg ataacgccaa gaacagcctg
300
taccttcaga tgaactccct gcgggctgaa gatactgccg tctactactg cgcaagggag
360
agcggagatg ggatggacgt ctggggacag ggtaccactg tgaccgtgtc gtcggcctcc
420
ggcggagggg gttcgggtgg aagggccagc ggcggcggag gcagcgacat ccagatgacc
480
cagtccccct catcgctgtc cgcctccgtg ggcgaccgcg tcaccatcac atgccgggcc
540
tcacagtcga tctcctccta cctcaattgg tatcagcaga agcccggaaa ggcccctaag
600
cttctgatct acgcagcgtc ctccctgcaa tccggggtcc catctcggtt ctccggctcg
660
ggcagcggta ccgacttcac tctgaccatc tcgagcctgc agccggagga cttcgccact
720
tactactgtc agcaaagcta caccctcgcg tttggccagg gcaccaaagt ggacatcaag
780
accactaccc cagcaccgag gccacccacc ccggctccta ccatcgcctc ccagcctctg
840
tccctgcgtc cggaggcatg tagacccgca gctggtgggg ccgtgcatac ccggggtctt
900
gacttcgcct gcgatatcta catttgggcc cctctggctg gtacttgcgg ggtcctgctg
960
ctttcactcg tgatcactct ttactgtaag cgcggtcgga agaagctgct gtacatcttt
1020
aagcaaccct tcatgaggcc tgtgcagact actcaagagg aggacggctg ttcatgccgg
1080
ttcccagagg aggaggaagg cggctgcgaa ctgcgcgtga aattcagccg cagcgcagat
1140
gctccagcct acaagcaggg gcagaaccag ctctacaacg aactcaatct tggtcggaga
1200
gaggagtacg acgtgctgga caagcggaga ggacgggacc cagaaatggg cgggaagccg
1260
cgcagaaaga atccccaaga gggcctgtac aacgagctcc aaaaggataa gatggcagaa
1320
gcctatagcg agattggtat gaaaggggaa cgcagaagag gcaaaggcca cgacggactg
1380
taccagggac tcagcaccgc caccaaggac acctatgacg ctcttcacat gcaggccctg
1440
ccgcctcgg
1449
<210> 360
<211> 246
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 360
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Gly Asn Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Thr Met Val Arg Glu Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Leu Ser
130 135 140
Leu Pro Val Thr Leu Gly Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser
145 150 155 160
Glu Ser Leu Val His Asn Ser Gly Lys Thr Tyr Leu Asn Trp Phe His
165 170 175
Gln Arg Pro Gly Gln Ser Pro Arg Arg Leu Ile Tyr Glu Val Ser Asn
180 185 190
Arg Asp Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr
195 200 205
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
210 215 220
Tyr Tyr Cys Met Gln Gly Thr His Trp Pro Gly Thr Phe Gly Gln Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys
245
<210> 361
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 361
caagtgcaac tggtgcaaag cggaggagga ttggtcaaac ccggaggaag cctgagactg
60
tcatgcgcgg cctctggatt caccttctcc gattactaca tgtcatggat cagacaggcc
120
ccggggaagg gcctcgaatg ggtgtcctac atctcgtcct ccgggaacac catctactac
180
gccgacagcg tgaagggccg ctttaccatt tcccgcgaca acgcaaagaa ctcgctgtac
240
cttcagatga attccctgcg ggctgaagat accgcggtgt actattgcgc ccggtccact
300
atggtccggg aggactactg gggacagggc acactcgtga ccgtgtccag cgcgagcggg
360
ggtggaggca gcggtggacg cgcctccggc ggcggcggtt cagacatcgt gctgactcag
420
tcgcccctgt cgctgccggt caccctgggc caaccggcct caattagctg caagtcctcg
480
gagagcctgg tgcacaactc aggaaagact tacctgaact ggttccatca gcggcctgga
540
cagtccccac ggaggctcat ctatgaagtg tccaacaggg attcgggggt gcccgaccgc
600
ttcactggct ccgggtccgg caccgacttc accttgaaaa tctccagagt ggaagccgag
660
gacgtgggcg tgtactactg tatgcagggt acccactggc ctggaacctt tggacaagga
720
actaagctcg agattaag
738
<210> 362
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 362
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Gly Asn Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Thr Met Val Arg Glu Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 363
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 363
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Glu Ser Leu Val His Asn
20 25 30
Ser Gly Lys Thr Tyr Leu Asn Trp Phe His Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Glu Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Thr His Trp Pro Gly Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 364
<211> 490
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 364
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Asp Tyr Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Tyr Ile Ser Ser Ser Gly Asn Thr Ile Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Ser Thr Met Val Arg Glu Asp Tyr Trp
115 120 125
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Val Leu Thr
145 150 155 160
Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly Gln Pro Ala Ser Ile
165 170 175
Ser Cys Lys Ser Ser Glu Ser Leu Val His Asn Ser Gly Lys Thr Tyr
180 185 190
Leu Asn Trp Phe His Gln Arg Pro Gly Gln Ser Pro Arg Arg Leu Ile
195 200 205
Tyr Glu Val Ser Asn Arg Asp Ser Gly Val Pro Asp Arg Phe Thr Gly
210 215 220
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
225 230 235 240
Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly Thr His Trp Pro Gly
245 250 255
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 365
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 365
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
ccccaagtgc aactggtgca aagcggagga ggattggtca aacccggagg aagcctgaga
120
ctgtcatgcg cggcctctgg attcaccttc tccgattact acatgtcatg gatcagacag
180
gccccgggga agggcctcga atgggtgtcc tacatctcgt cctccgggaa caccatctac
240
tacgccgaca gcgtgaaggg ccgctttacc atttcccgcg acaacgcaaa gaactcgctg
300
taccttcaga tgaattccct gcgggctgaa gataccgcgg tgtactattg cgcccggtcc
360
actatggtcc gggaggacta ctggggacag ggcacactcg tgaccgtgtc cagcgcgagc
420
gggggtggag gcagcggtgg acgcgcctcc ggcggcggcg gttcagacat cgtgctgact
480
cagtcgcccc tgtcgctgcc ggtcaccctg ggccaaccgg cctcaattag ctgcaagtcc
540
tcggagagcc tggtgcacaa ctcaggaaag acttacctga actggttcca tcagcggcct
600
ggacagtccc cacggaggct catctatgaa gtgtccaaca gggattcggg ggtgcccgac
660
cgcttcactg gctccgggtc cggcaccgac ttcaccttga aaatctccag agtggaagcc
720
gaggacgtgg gcgtgtacta ctgtatgcag ggtacccact ggcctggaac ctttggacaa
780
ggaactaagc tcgagattaa gaccactacc ccagcaccga ggccacccac cccggctcct
840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg
900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct
960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg
1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag
1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg
1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac
1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac
1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc
1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga
1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac
1440
gctcttcaca tgcaggccct gccgcctcgg
1470
<210> 366
<211> 239
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 366
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Arg Leu Thr Gln Ser Pro Ser Pro Leu Ser
130 135 140
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu Asp
145 150 155 160
Ile Asn Lys Phe Leu Asn Trp Tyr His Gln Thr Pro Gly Lys Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Asp Ala Ser Thr Leu Gln Thr Gly Val Pro Ser
180 185 190
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn
195 200 205
Ser Leu Gln Pro Glu Asp Ile Gly Thr Tyr Tyr Cys Gln Gln Tyr Glu
210 215 220
Ser Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
225 230 235
<210> 367
<211> 717
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 367
caagtgcaac tcgtggaatc tggtggagga ctcgtgcaac ccggtggaag ccttaggctg
60
tcgtgcgccg tcagcgggtt tgctctgagc aaccatggaa tgtcctgggt ccgccgggca
120
ccgggaaaag ggctggaatg ggtgtccggc atcgtgtaca gcgggtcaac ctattacgcc
180
gcgtccgtga agggcagatt cactatctca agagacaaca gccggaacac cctgtacttg
240
caaatgaatt ccctgcgccc cgaggacacc gccatctact actgctccgc ccacggagga
300
gagtcggacg tgtggggcca gggaacgact gtgactgtgt ccagcgcatc aggagggggt
360
ggttcgggcg gccgggcctc ggggggagga ggttccgaca ttcggctgac ccagtccccg
420
tccccactgt cggcctccgt cggcgaccgc gtgaccatca cttgtcaggc gtccgaggac
480
attaacaagt tcctgaactg gtaccaccag acccctggaa aggcccccaa gctgctgatc
540
tacgatgcct cgacccttca aactggagtg cctagccggt tctccgggtc cggctccggc
600
actgatttca ctctgaccat caactcattg cagccggaag atatcgggac ctactattgc
660
cagcagtacg aatccctccc gctcacattc ggcgggggaa ccaaggtcga gattaag
717
<210> 368
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 368
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 369
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 369
Asp Ile Arg Leu Thr Gln Ser Pro Ser Pro Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu Asp Ile Asn Lys Phe
20 25 30
Leu Asn Trp Tyr His Gln Thr Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Thr Leu Gln Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Gly Thr Tyr Tyr Cys Gln Gln Tyr Glu Ser Leu Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 370
<211> 483
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 370
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe
35 40 45
Ala Leu Ser Asn His Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr
65 70 75 80
Ala Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg
85 90 95
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Ser Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Arg Leu Thr Gln Ser
145 150 155 160
Pro Ser Pro Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys
165 170 175
Gln Ala Ser Glu Asp Ile Asn Lys Phe Leu Asn Trp Tyr His Gln Thr
180 185 190
Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Asp Ala Ser Thr Leu Gln
195 200 205
Thr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
210 215 220
Thr Leu Thr Ile Asn Ser Leu Gln Pro Glu Asp Ile Gly Thr Tyr Tyr
225 230 235 240
Cys Gln Gln Tyr Glu Ser Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys
245 250 255
Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
260 265 270
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
275 280 285
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
290 295 300
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
305 310 315 320
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
325 330 335
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
340 345 350
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
355 360 365
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
370 375 380
Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
385 390 395 400
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
405 410 415
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
420 425 430
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
435 440 445
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
450 455 460
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
465 470 475 480
Pro Pro Arg
<210> 371
<211> 1449
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 371
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
ccccaagtgc aactcgtgga atctggtgga ggactcgtgc aacccggtgg aagccttagg
120
ctgtcgtgcg ccgtcagcgg gtttgctctg agcaaccatg gaatgtcctg ggtccgccgg
180
gcaccgggaa aagggctgga atgggtgtcc ggcatcgtgt acagcgggtc aacctattac
240
gccgcgtccg tgaagggcag attcactatc tcaagagaca acagccggaa caccctgtac
300
ttgcaaatga attccctgcg ccccgaggac accgccatct actactgctc cgcccacgga
360
ggagagtcgg acgtgtgggg ccagggaacg actgtgactg tgtccagcgc atcaggaggg
420
ggtggttcgg gcggccgggc ctcgggggga ggaggttccg acattcggct gacccagtcc
480
ccgtccccac tgtcggcctc cgtcggcgac cgcgtgacca tcacttgtca ggcgtccgag
540
gacattaaca agttcctgaa ctggtaccac cagacccctg gaaaggcccc caagctgctg
600
atctacgatg cctcgaccct tcaaactgga gtgcctagcc ggttctccgg gtccggctcc
660
ggcactgatt tcactctgac catcaactca ttgcagccgg aagatatcgg gacctactat
720
tgccagcagt acgaatccct cccgctcaca ttcggcgggg gaaccaaggt cgagattaag
780
accactaccc cagcaccgag gccacccacc ccggctccta ccatcgcctc ccagcctctg
840
tccctgcgtc cggaggcatg tagacccgca gctggtgggg ccgtgcatac ccggggtctt
900
gacttcgcct gcgatatcta catttgggcc cctctggctg gtacttgcgg ggtcctgctg
960
ctttcactcg tgatcactct ttactgtaag cgcggtcgga agaagctgct gtacatcttt
1020
aagcaaccct tcatgaggcc tgtgcagact actcaagagg aggacggctg ttcatgccgg
1080
ttcccagagg aggaggaagg cggctgcgaa ctgcgcgtga aattcagccg cagcgcagat
1140
gctccagcct acaagcaggg gcagaaccag ctctacaacg aactcaatct tggtcggaga
1200
gaggagtacg acgtgctgga caagcggaga ggacgggacc cagaaatggg cgggaagccg
1260
cgcagaaaga atccccaaga gggcctgtac aacgagctcc aaaaggataa gatggcagaa
1320
gcctatagcg agattggtat gaaaggggaa cgcagaagag gcaaaggcca cgacggactg
1380
taccagggac tcagcaccgc caccaaggac acctatgacg ctcttcacat gcaggccctg
1440
ccgcctcgg
1449
<210> 372
<211> 240
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 372
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Glu Thr Thr Leu Thr Gln Ser Pro Ala Thr Leu Ser
130 135 140
Val Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser
145 150 155 160
Val Gly Ser Asn Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Gly Pro
165 170 175
Arg Leu Leu Ile Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala
180 185 190
Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser
195 200 205
Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn
210 215 220
Asp Trp Leu Pro Val Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
225 230 235 240
<210> 373
<211> 720
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 373
gaagtgcaat tggtggaaac tggaggagga cttgtgcaac ctggaggatc attgcggctc
60
tcatgcgctg tctccggctt cgccctgtca aatcacggga tgtcgtgggt cagacgggcc
120
ccgggaaagg gtctggaatg ggtgtcgggg attgtgtaca gcggctccac ctactacgcc
180
gcttcggtca agggccgctt cactatttca cgggacaaca gccgcaacac cctctatctg
240
caaatgaact ctctccgccc ggaggatacc gccatctact actgctccgc acacggcggc
300
gaatccgacg tgtggggaca gggaaccact gtcaccgtgt cgtccgcatc cggtggcgga
360
ggatcgggtg gccgggcctc cgggggcggc ggcagcgaga ctaccctgac ccagtcccct
420
gccactctgt ccgtgagccc gggagagaga gccaccctta gctgccgggc cagccagagc
480
gtgggctcca acctggcctg gtaccagcag aagccaggac agggtcccag gctgctgatc
540
tacggagcct ccactcgcgc gaccggcatc cccgcgaggt tctccgggtc gggttccggg
600
accgagttca ccctgaccat ctcctccctc caaccggagg acttcgcggt gtactactgt
660
cagcagtaca acgattggct gcccgtgaca tttggacagg ggacgaaggt ggaaatcaaa
720
<210> 374
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 374
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 375
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 375
Glu Thr Thr Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Gly Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Gly Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asp Trp Leu Pro
85 90 95
Val Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 376
<211> 484
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 376
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe
35 40 45
Ala Leu Ser Asn His Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr
65 70 75 80
Ala Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg
85 90 95
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Ser Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Glu Thr Thr Leu Thr Gln Ser
145 150 155 160
Pro Ala Thr Leu Ser Val Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys
165 170 175
Arg Ala Ser Gln Ser Val Gly Ser Asn Leu Ala Trp Tyr Gln Gln Lys
180 185 190
Pro Gly Gln Gly Pro Arg Leu Leu Ile Tyr Gly Ala Ser Thr Arg Ala
195 200 205
Thr Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe
210 215 220
Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Tyr
225 230 235 240
Cys Gln Gln Tyr Asn Asp Trp Leu Pro Val Thr Phe Gly Gln Gly Thr
245 250 255
Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro
260 265 270
Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys
275 280 285
Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala
290 295 300
Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu
305 310 315 320
Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys
325 330 335
Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr
340 345 350
Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly
355 360 365
Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
370 375 380
Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
385 390 395 400
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
405 410 415
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
420 425 430
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
435 440 445
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
450 455 460
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
465 470 475 480
Leu Pro Pro Arg
<210> 377
<211> 1452
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 377
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtgc aattggtgga aactggagga ggacttgtgc aacctggagg atcattgcgg
120
ctctcatgcg ctgtctccgg cttcgccctg tcaaatcacg ggatgtcgtg ggtcagacgg
180
gccccgggaa agggtctgga atgggtgtcg gggattgtgt acagcggctc cacctactac
240
gccgcttcgg tcaagggccg cttcactatt tcacgggaca acagccgcaa caccctctat
300
ctgcaaatga actctctccg cccggaggat accgccatct actactgctc cgcacacggc
360
ggcgaatccg acgtgtgggg acagggaacc actgtcaccg tgtcgtccgc atccggtggc
420
ggaggatcgg gtggccgggc ctccgggggc ggcggcagcg agactaccct gacccagtcc
480
cctgccactc tgtccgtgag cccgggagag agagccaccc ttagctgccg ggccagccag
540
agcgtgggct ccaacctggc ctggtaccag cagaagccag gacagggtcc caggctgctg
600
atctacggag cctccactcg cgcgaccggc atccccgcga ggttctccgg gtcgggttcc
660
gggaccgagt tcaccctgac catctcctcc ctccaaccgg aggacttcgc ggtgtactac
720
tgtcagcagt acaacgattg gctgcccgtg acatttggac aggggacgaa ggtggaaatc
780
aaaaccacta ccccagcacc gaggccaccc accccggctc ctaccatcgc ctcccagcct
840
ctgtccctgc gtccggaggc atgtagaccc gcagctggtg gggccgtgca tacccggggt
900
cttgacttcg cctgcgatat ctacatttgg gcccctctgg ctggtacttg cggggtcctg
960
ctgctttcac tcgtgatcac tctttactgt aagcgcggtc ggaagaagct gctgtacatc
1020
tttaagcaac ccttcatgag gcctgtgcag actactcaag aggaggacgg ctgttcatgc
1080
cggttcccag aggaggagga aggcggctgc gaactgcgcg tgaaattcag ccgcagcgca
1140
gatgctccag cctacaagca ggggcagaac cagctctaca acgaactcaa tcttggtcgg
1200
agagaggagt acgacgtgct ggacaagcgg agaggacggg acccagaaat gggcgggaag
1260
ccgcgcagaa agaatcccca agagggcctg tacaacgagc tccaaaagga taagatggca
1320
gaagcctata gcgagattgg tatgaaaggg gaacgcagaa gaggcaaagg ccacgacgga
1380
ctgtaccagg gactcagcac cgccaccaag gacacctatg acgctcttca catgcaggcc
1440
ctgccgcctc gg
1452
<210> 378
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 378
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser
130 135 140
Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser
145 150 155 160
Ile Gly Ser Ser Ser Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala
165 170 175
Pro Arg Leu Leu Met Tyr Gly Ala Ser Ser Arg Ala Ser Gly Ile Pro
180 185 190
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
195 200 205
Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr
210 215 220
Ala Gly Ser Pro Pro Phe Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
225 230 235 240
Lys
<210> 379
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 379
gaagtgcaat tggtggaatc tggtggagga cttgtgcaac ctggaggatc actgagactg
60
tcatgcgcgg tgtccggttt tgccctgagc aatcatggga tgtcgtgggt ccggcgcgcc
120
cccggaaagg gtctggaatg ggtgtcgggt atcgtctact ccgggagcac ttactacgcc
180
gcgagcgtga agggccgctt caccatttcc cgcgataact cccgcaacac cctgtacttg
240
caaatgaact cgctccggcc tgaggacact gccatctact actgctccgc acacggagga
300
gaatccgacg tgtggggcca gggaactacc gtgaccgtca gcagcgcctc cggcggcggg
360
ggctcaggcg gacgggctag cggcggcggt ggctccgaga tcgtgctgac ccagtcgcct
420
ggcactctct cgctgagccc cggggaaagg gcaaccctgt cctgtcgggc cagccagtcc
480
attggatcat cctccctcgc ctggtatcag cagaaaccgg gacaggctcc gcggctgctt
540
atgtatgggg ccagctcaag agcctccggc attcccgacc ggttctccgg gtccggttcc
600
ggcaccgatt tcaccctgac tatctcgagg ctggagccag aggacttcgc cgtgtactac
660
tgccagcagt acgcggggtc cccgccgttc acgttcggac agggaaccaa ggtcgagatc
720
aag
723
<210> 380
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 380
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 381
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 381
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Gly Ser Ser
20 25 30
Ser Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Met Tyr Gly Ala Ser Ser Arg Ala Ser Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Ala Gly Ser Pro
85 90 95
Pro Phe Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 382
<211> 485
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 382
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe
35 40 45
Ala Leu Ser Asn His Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr
65 70 75 80
Ala Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg
85 90 95
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Ser Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser
145 150 155 160
Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys
165 170 175
Arg Ala Ser Gln Ser Ile Gly Ser Ser Ser Leu Ala Trp Tyr Gln Gln
180 185 190
Lys Pro Gly Gln Ala Pro Arg Leu Leu Met Tyr Gly Ala Ser Ser Arg
195 200 205
Ala Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
210 215 220
Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr
225 230 235 240
Tyr Cys Gln Gln Tyr Ala Gly Ser Pro Pro Phe Thr Phe Gly Gln Gly
245 250 255
Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
260 265 270
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
275 280 285
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
290 295 300
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
305 310 315 320
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
325 330 335
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
340 345 350
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
355 360 365
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
370 375 380
Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
385 390 395 400
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
405 410 415
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
420 425 430
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
435 440 445
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
450 455 460
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
465 470 475 480
Ala Leu Pro Pro Arg
485
<210> 383
<211> 1455
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 383
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtgc aattggtgga atctggtgga ggacttgtgc aacctggagg atcactgaga
120
ctgtcatgcg cggtgtccgg ttttgccctg agcaatcatg ggatgtcgtg ggtccggcgc
180
gcccccggaa agggtctgga atgggtgtcg ggtatcgtct actccgggag cacttactac
240
gccgcgagcg tgaagggccg cttcaccatt tcccgcgata actcccgcaa caccctgtac
300
ttgcaaatga actcgctccg gcctgaggac actgccatct actactgctc cgcacacgga
360
ggagaatccg acgtgtgggg ccagggaact accgtgaccg tcagcagcgc ctccggcggc
420
gggggctcag gcggacgggc tagcggcggc ggtggctccg agatcgtgct gacccagtcg
480
cctggcactc tctcgctgag ccccggggaa agggcaaccc tgtcctgtcg ggccagccag
540
tccattggat catcctccct cgcctggtat cagcagaaac cgggacaggc tccgcggctg
600
cttatgtatg gggccagctc aagagcctcc ggcattcccg accggttctc cgggtccggt
660
tccggcaccg atttcaccct gactatctcg aggctggagc cagaggactt cgccgtgtac
720
tactgccagc agtacgcggg gtccccgccg ttcacgttcg gacagggaac caaggtcgag
780
atcaagacca ctaccccagc accgaggcca cccaccccgg ctcctaccat cgcctcccag
840
cctctgtccc tgcgtccgga ggcatgtaga cccgcagctg gtggggccgt gcatacccgg
900
ggtcttgact tcgcctgcga tatctacatt tgggcccctc tggctggtac ttgcggggtc
960
ctgctgcttt cactcgtgat cactctttac tgtaagcgcg gtcggaagaa gctgctgtac
1020
atctttaagc aacccttcat gaggcctgtg cagactactc aagaggagga cggctgttca
1080
tgccggttcc cagaggagga ggaaggcggc tgcgaactgc gcgtgaaatt cagccgcagc
1140
gcagatgctc cagcctacaa gcaggggcag aaccagctct acaacgaact caatcttggt
1200
cggagagagg agtacgacgt gctggacaag cggagaggac gggacccaga aatgggcggg
1260
aagccgcgca gaaagaatcc ccaagagggc ctgtacaacg agctccaaaa ggataagatg
1320
gcagaagcct atagcgagat tggtatgaaa ggggaacgca gaagaggcaa aggccacgac
1380
ggactgtacc agggactcag caccgccacc aaggacacct atgacgctct tcacatgcag
1440
gccctgccgc ctcgg
1455
<210> 384
<211> 243
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 384
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Ser
20 25 30
Tyr Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Ala Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg His Trp Gln Glu Trp Pro Asp Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Glu Thr Thr Leu Thr Gln Ser Pro
130 135 140
Ala Phe Met Ser Ala Thr Pro Gly Asp Lys Val Ile Ile Ser Cys Lys
145 150 155 160
Ala Ser Gln Asp Ile Asp Asp Ala Met Asn Trp Tyr Gln Gln Lys Pro
165 170 175
Gly Glu Ala Pro Leu Phe Ile Ile Gln Ser Ala Thr Ser Pro Val Pro
180 185 190
Gly Ile Pro Pro Arg Phe Ser Gly Ser Gly Phe Gly Thr Asp Phe Ser
195 200 205
Leu Thr Ile Asn Asn Ile Glu Ser Glu Asp Ala Ala Tyr Tyr Phe Cys
210 215 220
Leu Gln His Asp Asn Phe Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu
225 230 235 240
Glu Ile Lys
<210> 385
<211> 729
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 385
caagtgcagc ttcaggaaag cggaccgggc ctggtcaagc catccgaaac tctctccctg
60
acttgcactg tgtctggcgg ttccatctca tcgtcgtact actactgggg ctggattagg
120
cagccgcccg gaaagggact ggagtggatc ggaagcatct actattccgg ctcggcgtac
180
tacaacccta gcctcaagtc gagagtgacc atctccgtgg atacctccaa gaaccagttt
240
tccctgcgcc tgagctccgt gaccgccgct gacaccgccg tgtactactg tgctcggcat
300
tggcaggaat ggcccgatgc cttcgacatt tggggccagg gcactatggt cactgtgtca
360
tccgggggtg gaggcagcgg gggaggaggg tccggggggg gaggttcaga gacaaccttg
420
acccagtcac ccgcattcat gtccgccact ccgggagaca aggtcatcat ctcgtgcaaa
480
gcgtcccagg atatcgacga tgccatgaat tggtaccagc agaagcctgg cgaagcgccg
540
ctgttcatta tccaatccgc aacctcgccc gtgcctggaa tcccaccgcg gttcagcggc
600
agcggtttcg gaaccgactt ttccctgacc attaacaaca ttgagtccga ggacgccgcc
660
tactacttct gcctgcaaca cgacaacttc cctctcacgt tcggccaggg aaccaagctg
720
gaaatcaag
729
<210> 386
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 386
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Ser
20 25 30
Tyr Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Ala Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg His Trp Gln Glu Trp Pro Asp Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 387
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 387
Glu Thr Thr Leu Thr Gln Ser Pro Ala Phe Met Ser Ala Thr Pro Gly
1 5 10 15
Asp Lys Val Ile Ile Ser Cys Lys Ala Ser Gln Asp Ile Asp Asp Ala
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Glu Ala Pro Leu Phe Ile Ile
35 40 45
Gln Ser Ala Thr Ser Pro Val Pro Gly Ile Pro Pro Arg Phe Ser Gly
50 55 60
Ser Gly Phe Gly Thr Asp Phe Ser Leu Thr Ile Asn Asn Ile Glu Ser
65 70 75 80
Glu Asp Ala Ala Tyr Tyr Phe Cys Leu Gln His Asp Asn Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 388
<211> 487
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 388
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly
35 40 45
Ser Ile Ser Ser Ser Tyr Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro
50 55 60
Gly Lys Gly Leu Glu Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Ala
65 70 75 80
Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr
85 90 95
Ser Lys Asn Gln Phe Ser Leu Arg Leu Ser Ser Val Thr Ala Ala Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Ala Arg His Trp Gln Glu Trp Pro Asp Ala
115 120 125
Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Thr Thr
145 150 155 160
Leu Thr Gln Ser Pro Ala Phe Met Ser Ala Thr Pro Gly Asp Lys Val
165 170 175
Ile Ile Ser Cys Lys Ala Ser Gln Asp Ile Asp Asp Ala Met Asn Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Glu Ala Pro Leu Phe Ile Ile Gln Ser Ala
195 200 205
Thr Ser Pro Val Pro Gly Ile Pro Pro Arg Phe Ser Gly Ser Gly Phe
210 215 220
Gly Thr Asp Phe Ser Leu Thr Ile Asn Asn Ile Glu Ser Glu Asp Ala
225 230 235 240
Ala Tyr Tyr Phe Cys Leu Gln His Asp Asn Phe Pro Leu Thr Phe Gly
245 250 255
Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro
260 265 270
Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro
275 280 285
Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu
290 295 300
Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
305 310 315 320
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly
325 330 335
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
340 345 350
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
355 360 365
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
370 375 380
Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
385 390 395 400
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
405 410 415
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
420 425 430
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
435 440 445
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
450 455 460
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
465 470 475 480
Met Gln Ala Leu Pro Pro Arg
485
<210> 389
<211> 1461
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 389
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
ccccaagtgc agcttcagga aagcggaccg ggcctggtca agccatccga aactctctcc
120
ctgacttgca ctgtgtctgg cggttccatc tcatcgtcgt actactactg gggctggatt
180
aggcagccgc ccggaaaggg actggagtgg atcggaagca tctactattc cggctcggcg
240
tactacaacc ctagcctcaa gtcgagagtg accatctccg tggatacctc caagaaccag
300
ttttccctgc gcctgagctc cgtgaccgcc gctgacaccg ccgtgtacta ctgtgctcgg
360
cattggcagg aatggcccga tgccttcgac atttggggcc agggcactat ggtcactgtg
420
tcatccgggg gtggaggcag cgggggagga gggtccgggg ggggaggttc agagacaacc
480
ttgacccagt cacccgcatt catgtccgcc actccgggag acaaggtcat catctcgtgc
540
aaagcgtccc aggatatcga cgatgccatg aattggtacc agcagaagcc tggcgaagcg
600
ccgctgttca ttatccaatc cgcaacctcg cccgtgcctg gaatcccacc gcggttcagc
660
ggcagcggtt tcggaaccga cttttccctg accattaaca acattgagtc cgaggacgcc
720
gcctactact tctgcctgca acacgacaac ttccctctca cgttcggcca gggaaccaag
780
ctggaaatca agaccactac cccagcaccg aggccaccca ccccggctcc taccatcgcc
840
tcccagcctc tgtccctgcg tccggaggca tgtagacccg cagctggtgg ggccgtgcat
900
acccggggtc ttgacttcgc ctgcgatatc tacatttggg cccctctggc tggtacttgc
960
ggggtcctgc tgctttcact cgtgatcact ctttactgta agcgcggtcg gaagaagctg
1020
ctgtacatct ttaagcaacc cttcatgagg cctgtgcaga ctactcaaga ggaggacggc
1080
tgttcatgcc ggttcccaga ggaggaggaa ggcggctgcg aactgcgcgt gaaattcagc
1140
cgcagcgcag atgctccagc ctacaagcag gggcagaacc agctctacaa cgaactcaat
1200
cttggtcgga gagaggagta cgacgtgctg gacaagcgga gaggacggga cccagaaatg
1260
ggcgggaagc cgcgcagaaa gaatccccaa gagggcctgt acaacgagct ccaaaaggat
1320
aagatggcag aagcctatag cgagattggt atgaaagggg aacgcagaag aggcaaaggc
1380
cacgacggac tgtaccaggg actcagcacc gccaccaagg acacctatga cgctcttcac
1440
atgcaggccc tgccgcctcg g
1461
<210> 390
<211> 244
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 390
Val Asn Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln Thr
1 5 10 15
Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Arg Thr Ser Gly
20 25 30
Met Cys Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp
35 40 45
Leu Ala Arg Ile Asp Trp Asp Glu Asp Lys Phe Tyr Ser Thr Ser Leu
50 55 60
Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr Ser Asp Asn Gln Val Val
65 70 75 80
Leu Arg Met Thr Asn Met Asp Pro Ala Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Ser Gly Ala Gly Gly Thr Ser Ala Thr Ala Phe Asp Ile Trp
100 105 110
Gly Pro Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser
130 135 140
Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys
145 150 155 160
Arg Ala Ser Gln Asp Ile Tyr Asn Asn Leu Ala Trp Phe Gln Leu Lys
165 170 175
Pro Gly Ser Ala Pro Arg Ser Leu Met Tyr Ala Ala Asn Lys Ser Gln
180 185 190
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Ala Ser Gly Thr Asp Phe
195 200 205
Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr
210 215 220
Cys Gln His Tyr Tyr Arg Phe Pro Tyr Ser Phe Gly Gln Gly Thr Lys
225 230 235 240
Leu Glu Ile Lys
<210> 391
<211> 735
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 391
caagtcaatc tgcgcgaatc cggccccgcc ttggtcaagc ctacccagac cctcactctg
60
acctgtactt tctccggctt ctccctgcgg acttccggga tgtgcgtgtc ctggatcaga
120
cagcctccgg gaaaggccct ggagtggctc gctcgcattg actgggatga ggacaagttc
180
tactccacct cactcaagac caggctgacc atcagcaaag atacctctga caaccaagtg
240
gtgctccgca tgaccaacat ggacccagcc gacactgcca cttactactg cgcgaggagc
300
ggagcgggcg gaacctccgc caccgccttc gatatttggg gcccgggtac catggtcacc
360
gtgtcaagcg gaggaggggg gtccgggggc ggcggttccg ggggaggcgg atcggacatt
420
cagatgactc agtcaccatc gtccctgagc gctagcgtgg gcgacagagt gacaatcact
480
tgccgggcat cccaggacat ctataacaac cttgcgtggt tccagctgaa gcctggttcc
540
gcaccgcggt cacttatgta cgccgccaac aagagccagt cgggagtgcc gtcccggttt
600
tccggttcgg cctcgggaac tgacttcacc ctgacgatct ccagcctgca acccgaggat
660
ttcgccacct actactgcca gcactactac cgctttccct actcgttcgg acagggaacc
720
aagctggaaa tcaag
735
<210> 392
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 392
Gln Val Asn Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Arg Thr Ser
20 25 30
Gly Met Cys Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Arg Ile Asp Trp Asp Glu Asp Lys Phe Tyr Ser Thr Ser
50 55 60
Leu Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr Ser Asp Asn Gln Val
65 70 75 80
Val Leu Arg Met Thr Asn Met Asp Pro Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ser Gly Ala Gly Gly Thr Ser Ala Thr Ala Phe Asp Ile
100 105 110
Trp Gly Pro Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 393
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 393
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Tyr Asn Asn
20 25 30
Leu Ala Trp Phe Gln Leu Lys Pro Gly Ser Ala Pro Arg Ser Leu Met
35 40 45
Tyr Ala Ala Asn Lys Ser Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Ala Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His Tyr Tyr Arg Phe Pro Tyr
85 90 95
Ser Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 394
<211> 489
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 394
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Asn Leu Arg Glu Ser Gly Pro Ala Leu
20 25 30
Val Lys Pro Thr Gln Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe
35 40 45
Ser Leu Arg Thr Ser Gly Met Cys Val Ser Trp Ile Arg Gln Pro Pro
50 55 60
Gly Lys Ala Leu Glu Trp Leu Ala Arg Ile Asp Trp Asp Glu Asp Lys
65 70 75 80
Phe Tyr Ser Thr Ser Leu Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr
85 90 95
Ser Asp Asn Gln Val Val Leu Arg Met Thr Asn Met Asp Pro Ala Asp
100 105 110
Thr Ala Thr Tyr Tyr Cys Ala Arg Ser Gly Ala Gly Gly Thr Ser Ala
115 120 125
Thr Ala Phe Asp Ile Trp Gly Pro Gly Thr Met Val Thr Val Ser Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp
145 150 155 160
Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
165 170 175
Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Tyr Asn Asn Leu
180 185 190
Ala Trp Phe Gln Leu Lys Pro Gly Ser Ala Pro Arg Ser Leu Met Tyr
195 200 205
Ala Ala Asn Lys Ser Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
210 215 220
Ala Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
225 230 235 240
Asp Phe Ala Thr Tyr Tyr Cys Gln His Tyr Tyr Arg Phe Pro Tyr Ser
245 250 255
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro
260 265 270
Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu
275 280 285
Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg
290 295 300
Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly
305 310 315 320
Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys
325 330 335
Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg
340 345 350
Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro
355 360 365
Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser
370 375 380
Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu
385 390 395 400
Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg
405 410 415
Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln
420 425 430
Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr
435 440 445
Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp
450 455 460
Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala
465 470 475 480
Leu His Met Gln Ala Leu Pro Pro Arg
485
<210> 395
<211> 1467
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 395
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
ccccaagtca atctgcgcga atccggcccc gccttggtca agcctaccca gaccctcact
120
ctgacctgta ctttctccgg cttctccctg cggacttccg ggatgtgcgt gtcctggatc
180
agacagcctc cgggaaaggc cctggagtgg ctcgctcgca ttgactggga tgaggacaag
240
ttctactcca cctcactcaa gaccaggctg accatcagca aagatacctc tgacaaccaa
300
gtggtgctcc gcatgaccaa catggaccca gccgacactg ccacttacta ctgcgcgagg
360
agcggagcgg gcggaacctc cgccaccgcc ttcgatattt ggggcccggg taccatggtc
420
accgtgtcaa gcggaggagg ggggtccggg ggcggcggtt ccgggggagg cggatcggac
480
attcagatga ctcagtcacc atcgtccctg agcgctagcg tgggcgacag agtgacaatc
540
acttgccggg catcccagga catctataac aaccttgcgt ggttccagct gaagcctggt
600
tccgcaccgc ggtcacttat gtacgccgcc aacaagagcc agtcgggagt gccgtcccgg
660
ttttccggtt cggcctcggg aactgacttc accctgacga tctccagcct gcaacccgag
720
gatttcgcca cctactactg ccagcactac taccgctttc cctactcgtt cggacaggga
780
accaagctgg aaatcaagac cactacccca gcaccgaggc cacccacccc ggctcctacc
840
atcgcctccc agcctctgtc cctgcgtccg gaggcatgta gacccgcagc tggtggggcc
900
gtgcataccc ggggtcttga cttcgcctgc gatatctaca tttgggcccc tctggctggt
960
acttgcgggg tcctgctgct ttcactcgtg atcactcttt actgtaagcg cggtcggaag
1020
aagctgctgt acatctttaa gcaacccttc atgaggcctg tgcagactac tcaagaggag
1080
gacggctgtt catgccggtt cccagaggag gaggaaggcg gctgcgaact gcgcgtgaaa
1140
ttcagccgca gcgcagatgc tccagcctac aagcaggggc agaaccagct ctacaacgaa
1200
ctcaatcttg gtcggagaga ggagtacgac gtgctggaca agcggagagg acgggaccca
1260
gaaatgggcg ggaagccgcg cagaaagaat ccccaagagg gcctgtacaa cgagctccaa
1320
aaggataaga tggcagaagc ctatagcgag attggtatga aaggggaacg cagaagaggc
1380
aaaggccacg acggactgta ccagggactc agcaccgcca ccaaggacac ctatgacgct
1440
cttcacatgc aggccctgcc gcctcgg
1467
<210> 396
<211> 246
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 396
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Thr Ile Ala Ala Val Tyr Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Leu Ser
130 135 140
Leu Pro Val Thr Pro Glu Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser
145 150 155 160
Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu
165 170 175
Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn
180 185 190
Arg Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
195 200 205
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
210 215 220
Tyr Tyr Cys Met Gln Ala Leu Gln Thr Pro Tyr Thr Phe Gly Gln Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys
245
<210> 397
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 397
gaagtgcagc ttgtcgaatc cgggggggga ctggtcaagc cgggcggatc actgagactg
60
tcctgcgccg cgagcggctt cacgttctcc tcctactcca tgaactgggt ccgccaagcc
120
cccgggaagg gactggaatg ggtgtcctct atctcctcgt cgtcgtccta catctactac
180
gccgactccg tgaagggaag attcaccatt tcccgcgaca acgcaaagaa ctcactgtac
240
ttgcaaatga actcactccg ggccgaagat actgctgtgt actattgcgc caagactatt
300
gccgccgtct acgctttcga catctggggc cagggaacca ccgtgactgt gtcgtccggt
360
ggtggtggct cgggcggagg aggaagcggc ggcggggggt ccgagattgt gctgacccag
420
tcgccactga gcctccctgt gacccccgag gaacccgcca gcatcagctg ccggtccagc
480
cagtccctgc tccactccaa cggatacaat tacctcgatt ggtaccttca gaagcctgga
540
caaagcccgc agctgctcat ctacttggga tcaaaccgcg cgtcaggagt gcctgaccgg
600
ttctccggct cgggcagcgg taccgatttc accctgaaaa tctccagggt ggaggcagag
660
gacgtgggag tgtattactg tatgcaggcg ctgcagactc cgtacacatt tgggcagggc
720
accaagctgg agatcaag
738
<210> 398
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 398
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Thr Ile Ala Ala Val Tyr Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 399
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 399
Glu Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Glu
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 400
<211> 490
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 400
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Thr Ile Ala Ala Val Tyr Ala Phe Asp
115 120 125
Ile Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr
145 150 155 160
Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Glu Glu Pro Ala Ser Ile
165 170 175
Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr
180 185 190
Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
195 200 205
Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro Asp Arg Phe Ser Gly
210 215 220
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
225 230 235 240
Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala Leu Gln Thr Pro Tyr
245 250 255
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 401
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 401
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtgc agcttgtcga atccgggggg ggactggtca agccgggcgg atcactgaga
120
ctgtcctgcg ccgcgagcgg cttcacgttc tcctcctact ccatgaactg ggtccgccaa
180
gcccccggga agggactgga atgggtgtcc tctatctcct cgtcgtcgtc ctacatctac
240
tacgccgact ccgtgaaggg aagattcacc atttcccgcg acaacgcaaa gaactcactg
300
tacttgcaaa tgaactcact ccgggccgaa gatactgctg tgtactattg cgccaagact
360
attgccgccg tctacgcttt cgacatctgg ggccagggaa ccaccgtgac tgtgtcgtcc
420
ggtggtggtg gctcgggcgg aggaggaagc ggcggcgggg ggtccgagat tgtgctgacc
480
cagtcgccac tgagcctccc tgtgaccccc gaggaacccg ccagcatcag ctgccggtcc
540
agccagtccc tgctccactc caacggatac aattacctcg attggtacct tcagaagcct
600
ggacaaagcc cgcagctgct catctacttg ggatcaaacc gcgcgtcagg agtgcctgac
660
cggttctccg gctcgggcag cggtaccgat ttcaccctga aaatctccag ggtggaggca
720
gaggacgtgg gagtgtatta ctgtatgcag gcgctgcaga ctccgtacac atttgggcag
780
ggcaccaagc tggagatcaa gaccactacc ccagcaccga ggccacccac cccggctcct
840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg
900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct
960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg
1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag
1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg
1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac
1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac
1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc
1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga
1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac
1440
gctcttcaca tgcaggccct gccgcctcgg
1470
<210> 402
<211> 240
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 402
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Arg Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Ser Tyr Val Leu Thr Gln Ser Pro Ser Val Ser Ala
130 135 140
Ala Pro Gly Tyr Thr Ala Thr Ile Ser Cys Gly Gly Asn Asn Ile Gly
145 150 155 160
Thr Lys Ser Val His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Leu
165 170 175
Leu Val Ile Arg Asp Asp Ser Val Arg Pro Ser Lys Ile Pro Gly Arg
180 185 190
Phe Ser Gly Ser Asn Ser Gly Asn Met Ala Thr Leu Thr Ile Ser Gly
195 200 205
Val Gln Ala Gly Asp Glu Ala Asp Phe Tyr Cys Gln Val Trp Asp Ser
210 215 220
Asp Ser Glu His Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
225 230 235 240
<210> 403
<211> 720
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 403
gaagtccagc tcgtggagtc cggcggaggc cttgtgaagc ctggaggttc gctgagactg
60
tcctgcgccg cctccggctt caccttctcc gactactaca tgtcctggat cagacaggcc
120
ccgggaaagg gcctggaatg ggtgtcctac atctcgtcat cgggcagcac tatctactac
180
gcggactcag tgaaggggcg gttcaccatt tcccgggata acgcgaagaa ctcgctgtat
240
ctgcaaatga actcactgag ggccgaggac accgccgtgt actactgcgc ccgcgatctc
300
cgcggggcat ttgacatctg gggacaggga accatggtca cagtgtccag cggaggggga
360
ggatcgggtg gcggaggttc cgggggtgga ggctcctcct acgtgctgac tcagagccca
420
agcgtcagcg ctgcgcccgg ttacacggca accatctcct gtggcggaaa caacattggg
480
accaagtctg tgcactggta tcagcagaag ccgggccaag ctcccctgtt ggtgatccgc
540
gatgactccg tgcggcctag caaaattccg ggacggttct ccggctccaa cagcggcaat
600
atggccactc tcaccatctc gggagtgcag gccggagatg aagccgactt ctactgccaa
660
gtctgggact cagactccga gcatgtggtg ttcgggggcg gaaccaagct gactgtgctc
720
<210> 404
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 404
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Arg Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 405
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 405
Ser Tyr Val Leu Thr Gln Ser Pro Ser Val Ser Ala Ala Pro Gly Tyr
1 5 10 15
Thr Ala Thr Ile Ser Cys Gly Gly Asn Asn Ile Gly Thr Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Leu Leu Val Ile Arg
35 40 45
Asp Asp Ser Val Arg Pro Ser Lys Ile Pro Gly Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Met Ala Thr Leu Thr Ile Ser Gly Val Gln Ala Gly
65 70 75 80
Asp Glu Ala Asp Phe Tyr Cys Gln Val Trp Asp Ser Asp Ser Glu His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 406
<211> 484
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 406
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Asp Tyr Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp Leu Arg Gly Ala Phe Asp Ile Trp
115 120 125
Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Tyr Val Leu Thr Gln Ser
145 150 155 160
Pro Ser Val Ser Ala Ala Pro Gly Tyr Thr Ala Thr Ile Ser Cys Gly
165 170 175
Gly Asn Asn Ile Gly Thr Lys Ser Val His Trp Tyr Gln Gln Lys Pro
180 185 190
Gly Gln Ala Pro Leu Leu Val Ile Arg Asp Asp Ser Val Arg Pro Ser
195 200 205
Lys Ile Pro Gly Arg Phe Ser Gly Ser Asn Ser Gly Asn Met Ala Thr
210 215 220
Leu Thr Ile Ser Gly Val Gln Ala Gly Asp Glu Ala Asp Phe Tyr Cys
225 230 235 240
Gln Val Trp Asp Ser Asp Ser Glu His Val Val Phe Gly Gly Gly Thr
245 250 255
Lys Leu Thr Val Leu Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro
260 265 270
Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys
275 280 285
Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala
290 295 300
Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu
305 310 315 320
Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys
325 330 335
Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr
340 345 350
Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly
355 360 365
Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
370 375 380
Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
385 390 395 400
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
405 410 415
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
420 425 430
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
435 440 445
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
450 455 460
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
465 470 475 480
Leu Pro Pro Arg
<210> 407
<211> 1452
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 407
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtcc agctcgtgga gtccggcgga ggccttgtga agcctggagg ttcgctgaga
120
ctgtcctgcg ccgcctccgg cttcaccttc tccgactact acatgtcctg gatcagacag
180
gccccgggaa agggcctgga atgggtgtcc tacatctcgt catcgggcag cactatctac
240
tacgcggact cagtgaaggg gcggttcacc atttcccggg ataacgcgaa gaactcgctg
300
tatctgcaaa tgaactcact gagggccgag gacaccgccg tgtactactg cgcccgcgat
360
ctccgcgggg catttgacat ctggggacag ggaaccatgg tcacagtgtc cagcggaggg
420
ggaggatcgg gtggcggagg ttccgggggt ggaggctcct cctacgtgct gactcagagc
480
ccaagcgtca gcgctgcgcc cggttacacg gcaaccatct cctgtggcgg aaacaacatt
540
gggaccaagt ctgtgcactg gtatcagcag aagccgggcc aagctcccct gttggtgatc
600
cgcgatgact ccgtgcggcc tagcaaaatt ccgggacggt tctccggctc caacagcggc
660
aatatggcca ctctcaccat ctcgggagtg caggccggag atgaagccga cttctactgc
720
caagtctggg actcagactc cgagcatgtg gtgttcgggg gcggaaccaa gctgactgtg
780
ctcaccacta ccccagcacc gaggccaccc accccggctc ctaccatcgc ctcccagcct
840
ctgtccctgc gtccggaggc atgtagaccc gcagctggtg gggccgtgca tacccggggt
900
cttgacttcg cctgcgatat ctacatttgg gcccctctgg ctggtacttg cggggtcctg
960
ctgctttcac tcgtgatcac tctttactgt aagcgcggtc ggaagaagct gctgtacatc
1020
tttaagcaac ccttcatgag gcctgtgcag actactcaag aggaggacgg ctgttcatgc
1080
cggttcccag aggaggagga aggcggctgc gaactgcgcg tgaaattcag ccgcagcgca
1140
gatgctccag cctacaagca ggggcagaac cagctctaca acgaactcaa tcttggtcgg
1200
agagaggagt acgacgtgct ggacaagcgg agaggacggg acccagaaat gggcgggaag
1260
ccgcgcagaa agaatcccca agagggcctg tacaacgagc tccaaaagga taagatggca
1320
gaagcctata gcgagattgg tatgaaaggg gaacgcagaa gaggcaaagg ccacgacgga
1380
ctgtaccagg gactcagcac cgccaccaag gacacctatg acgctcttca catgcaggcc
1440
ctgccgcctc gg
1452
<210> 408
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 408
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Pro Ser Gly Tyr Thr Val Thr Ser His
20 25 30
Tyr Ile His Trp Val Arg Arg Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asn Pro Ser Gly Gly Val Thr Ala Tyr Ser Gln Thr Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Ser Asp Thr Ser Ser Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Ser Gly Ser Gly Trp Tyr Phe Asp Phe Trp Gly Arg
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Ser Tyr Val Leu Thr Gln Pro Pro Ser
130 135 140
Val Ser Val Ser Pro Gly Gln Thr Ala Ser Ile Thr Cys Ser Gly Asp
145 150 155 160
Gly Leu Ser Lys Lys Tyr Val Ser Trp Tyr Gln Gln Lys Ala Gly Gln
165 170 175
Ser Pro Val Val Leu Ile Ser Arg Asp Lys Glu Arg Pro Ser Gly Ile
180 185 190
Pro Asp Arg Phe Ser Gly Ser Asn Ser Ala Asp Thr Ala Thr Leu Thr
195 200 205
Ile Ser Gly Thr Gln Ala Met Asp Glu Ala Asp Tyr Tyr Cys Gln Ala
210 215 220
Trp Asp Asp Thr Thr Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val
225 230 235 240
Leu
<210> 409
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 409
caagtgcagc tggtgcagag cggggccgaa gtcaagaagc cgggagcctc cgtgaaagtg
60
tcctgcaagc cttcgggata caccgtgacc tcccactaca ttcattgggt ccgccgcgcc
120
cccggccaag gactcgagtg gatgggcatg atcaacccta gcggcggagt gaccgcgtac
180
agccagacgc tgcagggacg cgtgactatg acctcggata cctcctcctc caccgtctat
240
atggaactgt ccagcctgcg gtccgaggat accgccatgt actactgcgc ccgggaagga
300
tcaggctccg ggtggtattt cgacttctgg ggaagaggca ccctcgtgac tgtgtcatct
360
gggggagggg gttccggtgg tggcggatcg ggaggaggcg gttcatccta cgtgctgacc
420
cagccaccct ccgtgtccgt gagccccggc cagactgcat cgattacatg tagcggcgac
480
ggcctctcca agaaatacgt gtcgtggtac cagcagaagg ccggacagag cccggtggtg
540
ctgatctcaa gagataagga gcggcctagc ggaatcccgg acaggttctc gggttccaac
600
tccgcggaca ctgctactct gaccatctcg gggacccagg ctatggacga agccgattac
660
tactgccaag cctgggacga cactactgtc gtgtttggag ggggcaccaa gttgaccgtc
720
ctt
723
<210> 410
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 410
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Pro Ser Gly Tyr Thr Val Thr Ser His
20 25 30
Tyr Ile His Trp Val Arg Arg Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asn Pro Ser Gly Gly Val Thr Ala Tyr Ser Gln Thr Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Ser Asp Thr Ser Ser Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Ser Gly Ser Gly Trp Tyr Phe Asp Phe Trp Gly Arg
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 411
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 411
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Gly Leu Ser Lys Lys Tyr Val
20 25 30
Ser Trp Tyr Gln Gln Lys Ala Gly Gln Ser Pro Val Val Leu Ile Ser
35 40 45
Arg Asp Lys Glu Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Asn Ser Ala Asp Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ala Trp Asp Asp Thr Thr Val Val
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 412
<211> 485
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 412
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Pro Ser Gly Tyr
35 40 45
Thr Val Thr Ser His Tyr Ile His Trp Val Arg Arg Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Met Ile Asn Pro Ser Gly Gly Val Thr Ala
65 70 75 80
Tyr Ser Gln Thr Leu Gln Gly Arg Val Thr Met Thr Ser Asp Thr Ser
85 90 95
Ser Ser Thr Val Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Met Tyr Tyr Cys Ala Arg Glu Gly Ser Gly Ser Gly Trp Tyr Phe
115 120 125
Asp Phe Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Tyr Val Leu
145 150 155 160
Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln Thr Ala Ser Ile
165 170 175
Thr Cys Ser Gly Asp Gly Leu Ser Lys Lys Tyr Val Ser Trp Tyr Gln
180 185 190
Gln Lys Ala Gly Gln Ser Pro Val Val Leu Ile Ser Arg Asp Lys Glu
195 200 205
Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Asn Ser Ala Asp
210 215 220
Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met Asp Glu Ala Asp
225 230 235 240
Tyr Tyr Cys Gln Ala Trp Asp Asp Thr Thr Val Val Phe Gly Gly Gly
245 250 255
Thr Lys Leu Thr Val Leu Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
260 265 270
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
275 280 285
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
290 295 300
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
305 310 315 320
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
325 330 335
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
340 345 350
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
355 360 365
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
370 375 380
Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
385 390 395 400
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
405 410 415
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
420 425 430
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
435 440 445
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
450 455 460
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
465 470 475 480
Ala Leu Pro Pro Arg
485
<210> 413
<211> 1455
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 413
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
ccccaagtgc agctggtgca gagcggggcc gaagtcaaga agccgggagc ctccgtgaaa
120
gtgtcctgca agccttcggg atacaccgtg acctcccact acattcattg ggtccgccgc
180
gcccccggcc aaggactcga gtggatgggc atgatcaacc ctagcggcgg agtgaccgcg
240
tacagccaga cgctgcaggg acgcgtgact atgacctcgg atacctcctc ctccaccgtc
300
tatatggaac tgtccagcct gcggtccgag gataccgcca tgtactactg cgcccgggaa
360
ggatcaggct ccgggtggta tttcgacttc tggggaagag gcaccctcgt gactgtgtca
420
tctgggggag ggggttccgg tggtggcgga tcgggaggag gcggttcatc ctacgtgctg
480
acccagccac cctccgtgtc cgtgagcccc ggccagactg catcgattac atgtagcggc
540
gacggcctct ccaagaaata cgtgtcgtgg taccagcaga aggccggaca gagcccggtg
600
gtgctgatct caagagataa ggagcggcct agcggaatcc cggacaggtt ctcgggttcc
660
aactccgcgg acactgctac tctgaccatc tcggggaccc aggctatgga cgaagccgat
720
tactactgcc aagcctggga cgacactact gtcgtgtttg gagggggcac caagttgacc
780
gtccttacca ctaccccagc accgaggcca cccaccccgg ctcctaccat cgcctcccag
840
cctctgtccc tgcgtccgga ggcatgtaga cccgcagctg gtggggccgt gcatacccgg
900
ggtcttgact tcgcctgcga tatctacatt tgggcccctc tggctggtac ttgcggggtc
960
ctgctgcttt cactcgtgat cactctttac tgtaagcgcg gtcggaagaa gctgctgtac
1020
atctttaagc aacccttcat gaggcctgtg cagactactc aagaggagga cggctgttca
1080
tgccggttcc cagaggagga ggaaggcggc tgcgaactgc gcgtgaaatt cagccgcagc
1140
gcagatgctc cagcctacaa gcaggggcag aaccagctct acaacgaact caatcttggt
1200
cggagagagg agtacgacgt gctggacaag cggagaggac gggacccaga aatgggcggg
1260
aagccgcgca gaaagaatcc ccaagagggc ctgtacaacg agctccaaaa ggataagatg
1320
gcagaagcct atagcgagat tggtatgaaa ggggaacgca gaagaggcaa aggccacgac
1380
ggactgtacc agggactcag caccgccacc aaggacacct atgacgctct tcacatgcag
1440
gccctgccgc ctcgg
1455
<210> 414
<211> 245
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 414
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Gly
20 25 30
Gly Tyr Tyr Trp Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Ala Gly Ile Ala Ala Arg Leu Arg Gly Ala Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln
130 135 140
Ser Pro Ser Ser Val Ser Ala Ser Val Gly Asp Arg Val Ile Ile Thr
145 150 155 160
Cys Arg Ala Ser Gln Gly Ile Arg Asn Trp Leu Ala Trp Tyr Gln Gln
165 170 175
Lys Pro Gly Lys Ala Pro Asn Leu Leu Ile Tyr Ala Ala Ser Asn Leu
180 185 190
Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Ala Asp
195 200 205
Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Val Ala Thr Tyr
210 215 220
Tyr Cys Gln Lys Tyr Asn Ser Ala Pro Phe Thr Phe Gly Pro Gly Thr
225 230 235 240
Lys Val Asp Ile Lys
245
<210> 415
<211> 735
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 415
caagtgcagc ttcaggagag cggcccggga ctcgtgaagc cgtcccagac cctgtccctg
60
acttgcaccg tgtcgggagg aagcatctcg agcggaggct actattggtc gtggattcgg
120
cagcaccctg gaaagggcct ggaatggatc ggctacatct actactccgg ctcgacctac
180
tacaacccat cgctgaagtc cagagtgaca atctcagtgg acacgtccaa gaatcagttc
240
agcctgaagc tctcttccgt gactgcggcc gacaccgccg tgtactactg cgcacgcgct
300
ggaattgccg cccggctgag gggtgccttc gacatttggg gacagggcac catggtcacc
360
gtgtcctccg gcggcggagg ttccgggggt ggaggctcag gaggaggggg gtccgacatc
420
gtcatgactc agtcgccctc aagcgtcagc gcgtccgtcg gggacagagt gatcatcacc
480
tgtcgggcgt cccagggaat tcgcaactgg ctggcctggt atcagcagaa gcccggaaag
540
gcccccaacc tgttgatcta cgccgcctca aacctccaat ccggggtgcc gagccgcttc
600
agcggctccg gttcgggtgc cgatttcact ctgaccatct cctccctgca acctgaagat
660
gtggctacct actactgcca aaagtacaac tccgcacctt ttactttcgg accggggacc
720
aaagtggaca ttaag
735
<210> 416
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 416
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Gly
20 25 30
Gly Tyr Tyr Trp Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Ala Gly Ile Ala Ala Arg Leu Arg Gly Ala Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 417
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 417
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Ile Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Asn Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Asn Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Ala Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Lys Tyr Asn Ser Ala Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 418
<211> 489
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 418
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Gln Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly
35 40 45
Ser Ile Ser Ser Gly Gly Tyr Tyr Trp Ser Trp Ile Arg Gln His Pro
50 55 60
Gly Lys Gly Leu Glu Trp Ile Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr
65 70 75 80
Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr
85 90 95
Ser Lys Asn Gln Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Ala Arg Ala Gly Ile Ala Ala Arg Leu Arg
115 120 125
Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp
145 150 155 160
Ile Val Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly Asp
165 170 175
Arg Val Ile Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Trp Leu
180 185 190
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Asn Leu Leu Ile Tyr
195 200 205
Ala Ala Ser Asn Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
210 215 220
Gly Ser Gly Ala Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
225 230 235 240
Asp Val Ala Thr Tyr Tyr Cys Gln Lys Tyr Asn Ser Ala Pro Phe Thr
245 250 255
Phe Gly Pro Gly Thr Lys Val Asp Ile Lys Thr Thr Thr Pro Ala Pro
260 265 270
Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu
275 280 285
Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg
290 295 300
Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly
305 310 315 320
Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys
325 330 335
Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg
340 345 350
Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro
355 360 365
Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser
370 375 380
Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu
385 390 395 400
Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg
405 410 415
Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln
420 425 430
Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr
435 440 445
Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp
450 455 460
Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala
465 470 475 480
Leu His Met Gln Ala Leu Pro Pro Arg
485
<210> 419
<211> 1467
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 419
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
ccccaagtgc agcttcagga gagcggcccg ggactcgtga agccgtccca gaccctgtcc
120
ctgacttgca ccgtgtcggg aggaagcatc tcgagcggag gctactattg gtcgtggatt
180
cggcagcacc ctggaaaggg cctggaatgg atcggctaca tctactactc cggctcgacc
240
tactacaacc catcgctgaa gtccagagtg acaatctcag tggacacgtc caagaatcag
300
ttcagcctga agctctcttc cgtgactgcg gccgacaccg ccgtgtacta ctgcgcacgc
360
gctggaattg ccgcccggct gaggggtgcc ttcgacattt ggggacaggg caccatggtc
420
accgtgtcct ccggcggcgg aggttccggg ggtggaggct caggaggagg ggggtccgac
480
atcgtcatga ctcagtcgcc ctcaagcgtc agcgcgtccg tcggggacag agtgatcatc
540
acctgtcggg cgtcccaggg aattcgcaac tggctggcct ggtatcagca gaagcccgga
600
aaggccccca acctgttgat ctacgccgcc tcaaacctcc aatccggggt gccgagccgc
660
ttcagcggct ccggttcggg tgccgatttc actctgacca tctcctccct gcaacctgaa
720
gatgtggcta cctactactg ccaaaagtac aactccgcac cttttacttt cggaccgggg
780
accaaagtgg acattaagac cactacccca gcaccgaggc cacccacccc ggctcctacc
840
atcgcctccc agcctctgtc cctgcgtccg gaggcatgta gacccgcagc tggtggggcc
900
gtgcataccc ggggtcttga cttcgcctgc gatatctaca tttgggcccc tctggctggt
960
acttgcgggg tcctgctgct ttcactcgtg atcactcttt actgtaagcg cggtcggaag
1020
aagctgctgt acatctttaa gcaacccttc atgaggcctg tgcagactac tcaagaggag
1080
gacggctgtt catgccggtt cccagaggag gaggaaggcg gctgcgaact gcgcgtgaaa
1140
ttcagccgca gcgcagatgc tccagcctac aagcaggggc agaaccagct ctacaacgaa
1200
ctcaatcttg gtcggagaga ggagtacgac gtgctggaca agcggagagg acgggaccca
1260
gaaatgggcg ggaagccgcg cagaaagaat ccccaagagg gcctgtacaa cgagctccaa
1320
aaggataaga tggcagaagc ctatagcgag attggtatga aaggggaacg cagaagaggc
1380
aaaggccacg acggactgta ccagggactc agcaccgcca ccaaggacac ctatgacgct
1440
cttcacatgc aggccctgcc gcctcgg
1467
<210> 420
<211> 253
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 420
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Gly Tyr Gln Leu Leu Arg Trp Asp Val Gly Leu Leu
100 105 110
Arg Ser Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
130 135 140
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
145 150 155 160
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
165 170 175
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Leu Tyr
180 185 190
Gly Lys Asn Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser Gly Ser
195 200 205
Arg Ser Gly Thr Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu
210 215 220
Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Arg Asp Ser Ser Gly Asp His
225 230 235 240
Leu Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu
245 250
<210> 421
<211> 759
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 421
caagtgcagc tggtccagtc gggcgccgag gtcaagaagc ccgggagctc tgtgaaagtg
60
tcctgcaagg cctccggggg cacctttagc tcctacgcca tctcctgggt ccgccaagca
120
ccgggtcaag gcctggagtg gatgggggga attatcccta tcttcggcac tgccaactac
180
gcccagaagt tccagggacg cgtgaccatt accgcggacg aatccacctc caccgcttat
240
atggagctgt ccagcttgcg ctcggaagat accgccgtgt actactgcgc ccggaggggt
300
ggataccagc tgctgagatg ggacgtgggc ctcctgcggt cggcgttcga catctggggc
360
cagggcacta tggtcactgt gtccagcgga ggaggcggat cgggaggcgg cggatcaggg
420
ggaggcggtt ccagctacgt gcttactcaa cccccttcgg tgtccgtggc cccgggacag
480
accgccagaa tcacttgcgg aggaaacaac attgggtcca agagcgtgca ttggtaccag
540
cagaagccag gacaggcccc tgtgctggtg ctctacggga agaacaatcg gcccagcgga
600
gtgccggaca ggttctcggg ttcacgctcc ggtacaaccg cttcactgac tatcaccggg
660
gcccaggcag aggatgaagc ggactactac tgttcctccc gggattcatc cggcgaccac
720
ctccgggtgt tcggaaccgg aacgaaggtc accgtgctg
759
<210> 422
<211> 129
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 422
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Gly Tyr Gln Leu Leu Arg Trp Asp Val Gly Leu Leu
100 105 110
Arg Ser Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser
115 120 125
Ser
<210> 423
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 423
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Leu Tyr
35 40 45
Gly Lys Asn Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser Gly Ser
50 55 60
Arg Ser Gly Thr Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Arg Asp Ser Ser Gly Asp His
85 90 95
Leu Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105
<210> 424
<211> 497
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 424
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ser Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly
35 40 45
Thr Phe Ser Ser Tyr Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser
85 90 95
Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Arg Gly Gly Tyr Gln Leu Leu Arg Trp
115 120 125
Asp Val Gly Leu Leu Arg Ser Ala Phe Asp Ile Trp Gly Gln Gly Thr
130 135 140
Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
145 150 155 160
Gly Gly Gly Gly Ser Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser
165 170 175
Val Ala Pro Gly Gln Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile
180 185 190
Gly Ser Lys Ser Val His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
195 200 205
Val Leu Val Leu Tyr Gly Lys Asn Asn Arg Pro Ser Gly Val Pro Asp
210 215 220
Arg Phe Ser Gly Ser Arg Ser Gly Thr Thr Ala Ser Leu Thr Ile Thr
225 230 235 240
Gly Ala Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Arg Asp
245 250 255
Ser Ser Gly Asp His Leu Arg Val Phe Gly Thr Gly Thr Lys Val Thr
260 265 270
Val Leu Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr
275 280 285
Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala
290 295 300
Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile
305 310 315 320
Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser
325 330 335
Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr
340 345 350
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
355 360 365
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
370 375 380
Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln
385 390 395 400
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
405 410 415
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
420 425 430
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
435 440 445
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
450 455 460
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
465 470 475 480
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
485 490 495
Arg
<210> 425
<211> 1491
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 425
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
ccccaagtgc agctggtcca gtcgggcgcc gaggtcaaga agcccgggag ctctgtgaaa
120
gtgtcctgca aggcctccgg gggcaccttt agctcctacg ccatctcctg ggtccgccaa
180
gcaccgggtc aaggcctgga gtggatgggg ggaattatcc ctatcttcgg cactgccaac
240
tacgcccaga agttccaggg acgcgtgacc attaccgcgg acgaatccac ctccaccgct
300
tatatggagc tgtccagctt gcgctcggaa gataccgccg tgtactactg cgcccggagg
360
ggtggatacc agctgctgag atgggacgtg ggcctcctgc ggtcggcgtt cgacatctgg
420
ggccagggca ctatggtcac tgtgtccagc ggaggaggcg gatcgggagg cggcggatca
480
gggggaggcg gttccagcta cgtgcttact caaccccctt cggtgtccgt ggccccggga
540
cagaccgcca gaatcacttg cggaggaaac aacattgggt ccaagagcgt gcattggtac
600
cagcagaagc caggacaggc ccctgtgctg gtgctctacg ggaagaacaa tcggcccagc
660
ggagtgccgg acaggttctc gggttcacgc tccggtacaa ccgcttcact gactatcacc
720
ggggcccagg cagaggatga agcggactac tactgttcct cccgggattc atccggcgac
780
cacctccggg tgttcggaac cggaacgaag gtcaccgtgc tgaccactac cccagcaccg
840
aggccaccca ccccggctcc taccatcgcc tcccagcctc tgtccctgcg tccggaggca
900
tgtagacccg cagctggtgg ggccgtgcat acccggggtc ttgacttcgc ctgcgatatc
960
tacatttggg cccctctggc tggtacttgc ggggtcctgc tgctttcact cgtgatcact
1020
ctttactgta agcgcggtcg gaagaagctg ctgtacatct ttaagcaacc cttcatgagg
1080
cctgtgcaga ctactcaaga ggaggacggc tgttcatgcc ggttcccaga ggaggaggaa
1140
ggcggctgcg aactgcgcgt gaaattcagc cgcagcgcag atgctccagc ctacaagcag
1200
gggcagaacc agctctacaa cgaactcaat cttggtcgga gagaggagta cgacgtgctg
1260
gacaagcgga gaggacggga cccagaaatg ggcgggaagc cgcgcagaaa gaatccccaa
1320
gagggcctgt acaacgagct ccaaaaggat aagatggcag aagcctatag cgagattggt
1380
atgaaagggg aacgcagaag aggcaaaggc cacgacggac tgtaccaggg actcagcacc
1440
gccaccaagg acacctatga cgctcttcac atgcaggccc tgccgcctcg g
1491
<210> 426
<211> 248
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 426
Glu Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Ser Phe Tyr Ala
50 55 60
Ile Ser Leu Lys Ser Arg Ile Ile Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Lys Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Ser Ser Pro Glu Gly Leu Phe Leu Tyr Trp Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Asp
115 120 125
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Ser Glu Leu
130 135 140
Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln Thr Ile Arg Ile
145 150 155 160
Thr Cys Gln Gly Asp Ser Leu Gly Asn Tyr Tyr Ala Thr Trp Tyr Gln
165 170 175
Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr Gly Thr Asn Asn
180 185 190
Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Ala Ser Ser Ser Gly Asn
195 200 205
Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu Asp Glu Ala Asp
210 215 220
Tyr Tyr Cys Asn Ser Arg Asp Ser Ser Gly His His Leu Leu Phe Gly
225 230 235 240
Thr Gly Thr Lys Val Thr Val Leu
245
<210> 427
<211> 744
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 427
gaagtgcagc tccaacagtc aggaccgggg ctcgtgaagc catcccagac cctgtccctg
60
acttgtgcca tctcgggaga tagcgtgtca tcgaactccg ccgcctggaa ctggattcgg
120
cagagcccgt cccgcggact ggagtggctt ggaaggacct actaccggtc caagtggtac
180
tctttctacg cgatctcgct gaagtcccgc attatcatta accctgatac ctccaagaat
240
cagttctccc tccaactgaa atccgtcacc cccgaggaca cagcagtgta ttactgcgca
300
cggagcagcc ccgaaggact gttcctgtat tggtttgacc cctggggcca ggggactctt
360
gtgaccgtgt cgagcggcgg agatgggtcc ggtggcggtg gttcgggggg cggcggatca
420
tcatccgaac tgacccagga cccggctgtg tccgtggcgc tgggacaaac catccgcatt
480
acgtgccagg gagactccct gggcaactac tacgccactt ggtaccagca gaagccgggc
540
caagcccctg tgttggtcat ctacgggacc aacaacagac cttccggcat ccccgaccgg
600
ttcagcgctt cgtcctccgg caacactgcc agcctgacca tcactggagc gcaggccgaa
660
gatgaggccg actactactg caacagcaga gactcctcgg gtcatcacct cttgttcgga
720
actggaacca aggtcaccgt gctg
744
<210> 428
<211> 125
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 428
Glu Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Ser Phe Tyr Ala
50 55 60
Ile Ser Leu Lys Ser Arg Ile Ile Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Lys Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Ser Ser Pro Glu Gly Leu Phe Leu Tyr Trp Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 429
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 429
Ser Ser Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln
1 5 10 15
Thr Ile Arg Ile Thr Cys Gln Gly Asp Ser Leu Gly Asn Tyr Tyr Ala
20 25 30
Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Gly Thr Asn Asn Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Ala Ser
50 55 60
Ser Ser Gly Asn Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Asn Ser Arg Asp Ser Ser Gly His His
85 90 95
Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105
<210> 430
<211> 492
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 430
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Gln Gln Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Gln Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp
35 40 45
Ser Val Ser Ser Asn Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro
50 55 60
Ser Arg Gly Leu Glu Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp
65 70 75 80
Tyr Ser Phe Tyr Ala Ile Ser Leu Lys Ser Arg Ile Ile Ile Asn Pro
85 90 95
Asp Thr Ser Lys Asn Gln Phe Ser Leu Gln Leu Lys Ser Val Thr Pro
100 105 110
Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ser Ser Pro Glu Gly Leu
115 120 125
Phe Leu Tyr Trp Phe Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val
130 135 140
Ser Ser Gly Gly Asp Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Ser Ser Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly
165 170 175
Gln Thr Ile Arg Ile Thr Cys Gln Gly Asp Ser Leu Gly Asn Tyr Tyr
180 185 190
Ala Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile
195 200 205
Tyr Gly Thr Asn Asn Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Ala
210 215 220
Ser Ser Ser Gly Asn Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala
225 230 235 240
Glu Asp Glu Ala Asp Tyr Tyr Cys Asn Ser Arg Asp Ser Ser Gly His
245 250 255
His Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu Thr Thr Thr
260 265 270
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
275 280 285
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
290 295 300
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
305 310 315 320
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
325 330 335
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
340 345 350
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
355 360 365
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 431
<211> 1476
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 431
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtgc agctccaaca gtcaggaccg gggctcgtga agccatccca gaccctgtcc
120
ctgacttgtg ccatctcggg agatagcgtg tcatcgaact ccgccgcctg gaactggatt
180
cggcagagcc cgtcccgcgg actggagtgg cttggaagga cctactaccg gtccaagtgg
240
tactctttct acgcgatctc gctgaagtcc cgcattatca ttaaccctga tacctccaag
300
aatcagttct ccctccaact gaaatccgtc acccccgagg acacagcagt gtattactgc
360
gcacggagca gccccgaagg actgttcctg tattggtttg acccctgggg ccaggggact
420
cttgtgaccg tgtcgagcgg cggagatggg tccggtggcg gtggttcggg gggcggcgga
480
tcatcatccg aactgaccca ggacccggct gtgtccgtgg cgctgggaca aaccatccgc
540
attacgtgcc agggagactc cctgggcaac tactacgcca cttggtacca gcagaagccg
600
ggccaagccc ctgtgttggt catctacggg accaacaaca gaccttccgg catccccgac
660
cggttcagcg cttcgtcctc cggcaacact gccagcctga ccatcactgg agcgcaggcc
720
gaagatgagg ccgactacta ctgcaacagc agagactcct cgggtcatca cctcttgttc
780
ggaactggaa ccaaggtcac cgtgctgacc actaccccag caccgaggcc acccaccccg
840
gctcctacca tcgcctccca gcctctgtcc ctgcgtccgg aggcatgtag acccgcagct
900
ggtggggccg tgcatacccg gggtcttgac ttcgcctgcg atatctacat ttgggcccct
960
ctggctggta cttgcggggt cctgctgctt tcactcgtga tcactcttta ctgtaagcgc
1020
ggtcggaaga agctgctgta catctttaag caacccttca tgaggcctgt gcagactact
1080
caagaggagg acggctgttc atgccggttc ccagaggagg aggaaggcgg ctgcgaactg
1140
cgcgtgaaat tcagccgcag cgcagatgct ccagcctaca agcaggggca gaaccagctc
1200
tacaacgaac tcaatcttgg tcggagagag gagtacgacg tgctggacaa gcggagagga
1260
cgggacccag aaatgggcgg gaagccgcgc agaaagaatc cccaagaggg cctgtacaac
1320
gagctccaaa aggataagat ggcagaagcc tatagcgaga ttggtatgaa aggggaacgc
1380
agaagaggca aaggccacga cggactgtac cagggactca gcaccgccac caaggacacc
1440
tatgacgctc ttcacatgca ggccctgccg cctcgg
1476
<210> 432
<211> 246
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 432
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Glu Gly Ser Gly Ser Leu Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Glu Ile Val Met Thr Gln Ser Pro Gly Thr Leu
130 135 140
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
145 150 155 160
Ser Val Ser Ser Ala Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
165 170 175
Pro Pro Arg Leu Leu Ile Ser Gly Ala Ser Thr Arg Ala Thr Gly Ile
180 185 190
Pro Asp Arg Phe Gly Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
195 200 205
Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His
210 215 220
Tyr Gly Ser Ser Phe Asn Gly Ser Ser Leu Phe Thr Phe Gly Gln Gly
225 230 235 240
Thr Arg Leu Glu Ile Lys
245
<210> 433
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 433
gaagtgcagc tcgtggagtc aggaggcggc ctggtccagc cgggagggtc ccttagactg
60
tcatgcgccg caagcggatt cactttctcc tcctatgcca tgagctgggt ccgccaagcc
120
cccggaaagg gactggaatg ggtgtccgcc atctcggggt ctggaggctc aacttactac
180
gctgactccg tgaagggacg gttcaccatt agccgcgaca actccaagaa caccctctac
240
ctccaaatga actccctgcg ggccgaggat accgccgtct actactgcgc caaagtggaa
300
ggttcaggat cgctggacta ctggggacag ggtactctcg tgaccgtgtc atcgggcgga
360
ggaggttccg gcggtggcgg ctccggcggc ggagggtcgg agatcgtgat gacccagagc
420
cctggtactc tgagcctttc gccgggagaa agggccaccc tgtcctgccg cgcttcccaa
480
tccgtgtcct ccgcgtactt ggcgtggtac cagcagaagc cgggacagcc ccctcggctg
540
ctgatcagcg gggccagcac ccgggcaacc ggaatcccag acagattcgg gggttccggc
600
agcggcacag atttcaccct gactatttcg aggttggagc ccgaggactt tgcggtgtat
660
tactgtcagc actacgggtc gtcctttaat ggctccagcc tgttcacgtt cggacagggg
720
acccgcctgg aaatcaag
738
<210> 434
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 434
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Glu Gly Ser Gly Ser Leu Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 435
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 435
Glu Ile Val Met Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ala
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Arg Leu Leu
35 40 45
Ile Ser Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Asp Arg Phe Gly
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Ser Ser Phe
85 90 95
Asn Gly Ser Ser Leu Phe Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile
100 105 110
Lys
<210> 436
<211> 490
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 436
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Val Glu Gly Ser Gly Ser Leu Asp Tyr
115 120 125
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met Thr Gln
145 150 155 160
Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser
165 170 175
Cys Arg Ala Ser Gln Ser Val Ser Ser Ala Tyr Leu Ala Trp Tyr Gln
180 185 190
Gln Lys Pro Gly Gln Pro Pro Arg Leu Leu Ile Ser Gly Ala Ser Thr
195 200 205
Arg Ala Thr Gly Ile Pro Asp Arg Phe Gly Gly Ser Gly Ser Gly Thr
210 215 220
Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val
225 230 235 240
Tyr Tyr Cys Gln His Tyr Gly Ser Ser Phe Asn Gly Ser Ser Leu Phe
245 250 255
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 437
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 437
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtgc agctcgtgga gtcaggaggc ggcctggtcc agccgggagg gtcccttaga
120
ctgtcatgcg ccgcaagcgg attcactttc tcctcctatg ccatgagctg ggtccgccaa
180
gcccccggaa agggactgga atgggtgtcc gccatctcgg ggtctggagg ctcaacttac
240
tacgctgact ccgtgaaggg acggttcacc attagccgcg acaactccaa gaacaccctc
300
tacctccaaa tgaactccct gcgggccgag gataccgccg tctactactg cgccaaagtg
360
gaaggttcag gatcgctgga ctactgggga cagggtactc tcgtgaccgt gtcatcgggc
420
ggaggaggtt ccggcggtgg cggctccggc ggcggagggt cggagatcgt gatgacccag
480
agccctggta ctctgagcct ttcgccggga gaaagggcca ccctgtcctg ccgcgcttcc
540
caatccgtgt cctccgcgta cttggcgtgg taccagcaga agccgggaca gccccctcgg
600
ctgctgatca gcggggccag cacccgggca accggaatcc cagacagatt cgggggttcc
660
ggcagcggca cagatttcac cctgactatt tcgaggttgg agcccgagga ctttgcggtg
720
tattactgtc agcactacgg gtcgtccttt aatggctcca gcctgttcac gttcggacag
780
gggacccgcc tggaaatcaa gaccactacc ccagcaccga ggccacccac cccggctcct
840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg
900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct
960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg
1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag
1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg
1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac
1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac
1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc
1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga
1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac
1440
gctcttcaca tgcaggccct gccgcctcgg
1470
<210> 438
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 438
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Thr Phe Ser Arg Tyr
20 25 30
Pro Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Asp Ser Gly Val Ser Thr Tyr Tyr Ala Asp Ser Ala
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Thr Arg Ala Gly Ser Glu Ala Ser Asp Ile Trp Gly Gln Gly Thr
100 105 110
Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu
130 135 140
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
145 150 155 160
Ser Val Ser Asn Ser Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala
165 170 175
Pro Arg Leu Leu Ile Tyr Asp Ala Ser Ser Arg Ala Thr Gly Ile Pro
180 185 190
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
195 200 205
Ser Arg Leu Glu Pro Glu Asp Phe Ala Ile Tyr Tyr Cys Gln Gln Phe
210 215 220
Gly Thr Ser Ser Gly Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
225 230 235 240
Lys
<210> 439
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 439
gaagtgcaac tggtggaaac cggtggcggc ctggtgcagc ctggaggatc attgaggctg
60
tcatgcgcgg ccagcggtat taccttctcc cggtacccca tgtcctgggt cagacaggcc
120
ccggggaaag ggcttgaatg ggtgtccggg atctcggact ccggtgtcag cacttactac
180
gccgactccg ccaagggacg cttcaccatt tcccgggaca actcgaagaa caccctgttc
240
ctccaaatga gctccctccg ggacgaggat actgcagtgt actactgcgt gacccgcgcc
300
gggtccgagg cgtctgacat ttggggacag ggcactatgg tcaccgtgtc gtccggcgga
360
gggggctcgg gaggcggtgg cagcggagga ggagggtccg agatcgtgct gacccaatcc
420
ccggccaccc tctcgctgag ccctggagaa agggcaacct tgtcctgtcg cgcgagccag
480
tccgtgagca actccctggc ctggtaccag cagaagcccg gacaggctcc gagacttctg
540
atctacgacg cttcgagccg ggccactgga atccccgacc gcttttcggg gtccggctca
600
ggaaccgatt tcaccctgac aatctcacgg ctggagccag aggatttcgc catctattac
660
tgccagcagt tcggtacttc ctccggcctg actttcggag gcggcacgaa gctcgaaatc
720
aag
723
<210> 440
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 440
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Thr Phe Ser Arg Tyr
20 25 30
Pro Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Asp Ser Gly Val Ser Thr Tyr Tyr Ala Asp Ser Ala
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Thr Arg Ala Gly Ser Glu Ala Ser Asp Ile Trp Gly Gln Gly Thr
100 105 110
Met Val Thr Val Ser Ser
115
<210> 441
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 441
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Asn Ser
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Ile Tyr Tyr Cys Gln Gln Phe Gly Thr Ser Ser Gly
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 442
<211> 485
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 442
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile
35 40 45
Thr Phe Ser Arg Tyr Pro Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Ser Asp Ser Gly Val Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Phe Leu Gln Met Ser Ser Leu Arg Asp Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Val Thr Arg Ala Gly Ser Glu Ala Ser Asp Ile
115 120 125
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln
145 150 155 160
Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser
165 170 175
Cys Arg Ala Ser Gln Ser Val Ser Asn Ser Leu Ala Trp Tyr Gln Gln
180 185 190
Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Ser Arg
195 200 205
Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
210 215 220
Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Ile Tyr
225 230 235 240
Tyr Cys Gln Gln Phe Gly Thr Ser Ser Gly Leu Thr Phe Gly Gly Gly
245 250 255
Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
260 265 270
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
275 280 285
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
290 295 300
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
305 310 315 320
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
325 330 335
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
340 345 350
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
355 360 365
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
370 375 380
Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
385 390 395 400
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
405 410 415
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
420 425 430
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
435 440 445
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
450 455 460
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
465 470 475 480
Ala Leu Pro Pro Arg
485
<210> 443
<211> 1455
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 443
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtgc aactggtgga aaccggtggc ggcctggtgc agcctggagg atcattgagg
120
ctgtcatgcg cggccagcgg tattaccttc tcccggtacc ccatgtcctg ggtcagacag
180
gccccgggga aagggcttga atgggtgtcc gggatctcgg actccggtgt cagcacttac
240
tacgccgact ccgccaaggg acgcttcacc atttcccggg acaactcgaa gaacaccctg
300
ttcctccaaa tgagctccct ccgggacgag gatactgcag tgtactactg cgtgacccgc
360
gccgggtccg aggcgtctga catttgggga cagggcacta tggtcaccgt gtcgtccggc
420
ggagggggct cgggaggcgg tggcagcgga ggaggagggt ccgagatcgt gctgacccaa
480
tccccggcca ccctctcgct gagccctgga gaaagggcaa ccttgtcctg tcgcgcgagc
540
cagtccgtga gcaactccct ggcctggtac cagcagaagc ccggacaggc tccgagactt
600
ctgatctacg acgcttcgag ccgggccact ggaatccccg accgcttttc ggggtccggc
660
tcaggaaccg atttcaccct gacaatctca cggctggagc cagaggattt cgccatctat
720
tactgccagc agttcggtac ttcctccggc ctgactttcg gaggcggcac gaagctcgaa
780
atcaagacca ctaccccagc accgaggcca cccaccccgg ctcctaccat cgcctcccag
840
cctctgtccc tgcgtccgga ggcatgtaga cccgcagctg gtggggccgt gcatacccgg
900
ggtcttgact tcgcctgcga tatctacatt tgggcccctc tggctggtac ttgcggggtc
960
ctgctgcttt cactcgtgat cactctttac tgtaagcgcg gtcggaagaa gctgctgtac
1020
atctttaagc aacccttcat gaggcctgtg cagactactc aagaggagga cggctgttca
1080
tgccggttcc cagaggagga ggaaggcggc tgcgaactgc gcgtgaaatt cagccgcagc
1140
gcagatgctc cagcctacaa gcaggggcag aaccagctct acaacgaact caatcttggt
1200
cggagagagg agtacgacgt gctggacaag cggagaggac gggacccaga aatgggcggg
1260
aagccgcgca gaaagaatcc ccaagagggc ctgtacaacg agctccaaaa ggataagatg
1320
gcagaagcct atagcgagat tggtatgaaa ggggaacgca gaagaggcaa aggccacgac
1380
ggactgtacc agggactcag caccgccacc aaggacacct atgacgctct tcacatgcag
1440
gccctgccgc ctcgg
1455
<210> 444
<211> 248
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 444
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Ala Thr Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met Thr
130 135 140
Gln Ser Pro Gly Thr Val Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu
145 150 155 160
Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser Phe Leu Ala Trp Tyr
165 170 175
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser
180 185 190
Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Ser Ala
210 215 220
Val Tyr Tyr Cys Gln Gln Tyr His Ser Ser Pro Ser Trp Thr Phe Gly
225 230 235 240
Gln Gly Thr Arg Leu Glu Ile Lys
245
<210> 445
<211> 744
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 445
caagtgcagc tcgtggaatc gggtggcgga ctggtgcagc cggggggctc acttagactg
60
tcctgcgcgg ccagcggatt cactttctcc tcctacgcca tgtcctgggt cagacaggcc
120
cctggaaagg gcctggaatg ggtgtccgca atcagcggca gcggcggctc gacctattac
180
gcggattcag tgaagggcag attcaccatt tcccgggaca acgccaagaa ctccttgtac
240
cttcaaatga actccctccg cgcggaagat accgcaatct actactgcgc tcgggccact
300
tacaagaggg aactgcgcta ctactacggg atggacgtct ggggccaggg aaccatggtc
360
accgtgtcca gcggaggagg aggatcggga ggaggcggta gcgggggtgg agggtcggag
420
atcgtgatga cccagtcccc cggcactgtg tcgctgtccc ccggcgaacg ggccaccctg
480
tcatgtcggg ccagccagtc agtgtcgtca agcttcctcg cctggtacca gcagaaaccg
540
ggacaagctc cccgcctgct gatctacgga gccagcagcc gggccaccgg tattcctgac
600
cggttctccg gttcggggtc cgggaccgac tttactctga ctatctctcg cctcgagcca
660
gaggactccg ccgtgtatta ctgccagcag taccactcct ccccgtcctg gacgttcgga
720
cagggcacaa ggctggagat taag
744
<210> 446
<211> 124
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 446
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Ala Thr Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 447
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 447
Glu Ile Val Met Thr Gln Ser Pro Gly Thr Val Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr His Ser Ser Pro
85 90 95
Ser Trp Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 448
<211> 492
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 448
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Ile Tyr Tyr Cys Ala Arg Ala Thr Tyr Lys Arg Glu Leu Arg Tyr
115 120 125
Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Met Val Thr Val Ser
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
145 150 155 160
Glu Ile Val Met Thr Gln Ser Pro Gly Thr Val Ser Leu Ser Pro Gly
165 170 175
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
180 185 190
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
195 200 205
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
225 230 235 240
Pro Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr His Ser Ser Pro
245 250 255
Ser Trp Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Thr Thr Thr
260 265 270
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
275 280 285
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
290 295 300
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
305 310 315 320
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
325 330 335
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
340 345 350
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
355 360 365
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 449
<211> 1476
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 449
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
ccccaagtgc agctcgtgga atcgggtggc ggactggtgc agccgggggg ctcacttaga
120
ctgtcctgcg cggccagcgg attcactttc tcctcctacg ccatgtcctg ggtcagacag
180
gcccctggaa agggcctgga atgggtgtcc gcaatcagcg gcagcggcgg ctcgacctat
240
tacgcggatt cagtgaaggg cagattcacc atttcccggg acaacgccaa gaactccttg
300
taccttcaaa tgaactccct ccgcgcggaa gataccgcaa tctactactg cgctcgggcc
360
acttacaaga gggaactgcg ctactactac gggatggacg tctggggcca gggaaccatg
420
gtcaccgtgt ccagcggagg aggaggatcg ggaggaggcg gtagcggggg tggagggtcg
480
gagatcgtga tgacccagtc ccccggcact gtgtcgctgt cccccggcga acgggccacc
540
ctgtcatgtc gggccagcca gtcagtgtcg tcaagcttcc tcgcctggta ccagcagaaa
600
ccgggacaag ctccccgcct gctgatctac ggagccagca gccgggccac cggtattcct
660
gaccggttct ccggttcggg gtccgggacc gactttactc tgactatctc tcgcctcgag
720
ccagaggact ccgccgtgta ttactgccag cagtaccact cctccccgtc ctggacgttc
780
ggacagggca caaggctgga gattaagacc actaccccag caccgaggcc acccaccccg
840
gctcctacca tcgcctccca gcctctgtcc ctgcgtccgg aggcatgtag acccgcagct
900
ggtggggccg tgcatacccg gggtcttgac ttcgcctgcg atatctacat ttgggcccct
960
ctggctggta cttgcggggt cctgctgctt tcactcgtga tcactcttta ctgtaagcgc
1020
ggtcggaaga agctgctgta catctttaag caacccttca tgaggcctgt gcagactact
1080
caagaggagg acggctgttc atgccggttc ccagaggagg aggaaggcgg ctgcgaactg
1140
cgcgtgaaat tcagccgcag cgcagatgct ccagcctaca agcaggggca gaaccagctc
1200
tacaacgaac tcaatcttgg tcggagagag gagtacgacg tgctggacaa gcggagagga
1260
cgggacccag aaatgggcgg gaagccgcgc agaaagaatc cccaagaggg cctgtacaac
1320
gagctccaaa aggataagat ggcagaagcc tatagcgaga ttggtatgaa aggggaacgc
1380
agaagaggca aaggccacga cggactgtac cagggactca gcaccgccac caaggacacc
1440
tatgacgctc ttcacatgca ggccctgccg cctcgg
1476
<210> 450
<211> 248
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 450
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Thr Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Thr Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr
130 135 140
Gln Ser Pro Ser Thr Leu Ser Leu Ser Pro Gly Glu Ser Ala Thr Leu
145 150 155 160
Ser Cys Arg Ala Ser Gln Ser Val Ser Thr Thr Phe Leu Ala Trp Tyr
165 170 175
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ser Ser
180 185 190
Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Asp Phe Thr Leu Thr Ile Arg Arg Leu Glu Pro Glu Asp Phe Ala
210 215 220
Val Tyr Tyr Cys Gln Gln Tyr His Ser Ser Pro Ser Trp Thr Phe Gly
225 230 235 240
Gln Gly Thr Lys Val Glu Ile Lys
245
<210> 451
<211> 744
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 451
gaggtgcagc ttgtggaaac cggtggcgga ctggtgcagc ccggaggaag cctcaggctg
60
tcctgcgccg cgtccggctt caccttctcc tcgtacgcca tgtcctgggt ccgccaggcc
120
cccggaaagg gcctggaatg ggtgtccgcc atctctggaa gcggaggttc cacgtactac
180
gcggacagcg tcaagggaag gttcacaatc tcccgcgata attcgaagaa cactctgtac
240
cttcaaatga acaccctgaa ggccgaggac actgctgtgt actactgcgc acgggccacc
300
tacaagagag agctccggta ctactacgga atggacgtct ggggccaggg aactactgtg
360
accgtgtcct cgggaggggg tggctccggg gggggcggct ccggcggagg cggttccgag
420
attgtgctga cccagtcacc ttcaactctg tcgctgtccc cgggagagag cgctactctg
480
agctgccggg ccagccagtc cgtgtccacc accttcctcg cctggtatca gcagaagccg
540
gggcaggcac cacggctctt gatctacggg tcaagcaaca gagcgaccgg aattcctgac
600
cgcttctcgg ggagcggttc aggcaccgac ttcaccctga ctatccggcg cctggaaccc
660
gaagatttcg ccgtgtatta ctgtcaacag taccactcct cgccgtcctg gacctttggc
720
caaggaacca aagtggaaat caag
744
<210> 452
<211> 124
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 452
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Thr Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Thr Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 453
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 453
Glu Ile Val Leu Thr Gln Ser Pro Ser Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Ser Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Thr Thr
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ser Ser Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Arg Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr His Ser Ser Pro
85 90 95
Ser Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 454
<211> 492
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 454
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Thr Leu Lys Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Ala Thr Tyr Lys Arg Glu Leu Arg Tyr
115 120 125
Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
145 150 155 160
Glu Ile Val Leu Thr Gln Ser Pro Ser Thr Leu Ser Leu Ser Pro Gly
165 170 175
Glu Ser Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Thr Thr
180 185 190
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
195 200 205
Ile Tyr Gly Ser Ser Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Arg Arg Leu Glu
225 230 235 240
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr His Ser Ser Pro
245 250 255
Ser Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Thr Thr Thr
260 265 270
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
275 280 285
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
290 295 300
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
305 310 315 320
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
325 330 335
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
340 345 350
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
355 360 365
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 455
<211> 1476
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 455
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaggtgc agcttgtgga aaccggtggc ggactggtgc agcccggagg aagcctcagg
120
ctgtcctgcg ccgcgtccgg cttcaccttc tcctcgtacg ccatgtcctg ggtccgccag
180
gcccccggaa agggcctgga atgggtgtcc gccatctctg gaagcggagg ttccacgtac
240
tacgcggaca gcgtcaaggg aaggttcaca atctcccgcg ataattcgaa gaacactctg
300
taccttcaaa tgaacaccct gaaggccgag gacactgctg tgtactactg cgcacgggcc
360
acctacaaga gagagctccg gtactactac ggaatggacg tctggggcca gggaactact
420
gtgaccgtgt cctcgggagg gggtggctcc ggggggggcg gctccggcgg aggcggttcc
480
gagattgtgc tgacccagtc accttcaact ctgtcgctgt ccccgggaga gagcgctact
540
ctgagctgcc gggccagcca gtccgtgtcc accaccttcc tcgcctggta tcagcagaag
600
ccggggcagg caccacggct cttgatctac gggtcaagca acagagcgac cggaattcct
660
gaccgcttct cggggagcgg ttcaggcacc gacttcaccc tgactatccg gcgcctggaa
720
cccgaagatt tcgccgtgta ttactgtcaa cagtaccact cctcgccgtc ctggaccttt
780
ggccaaggaa ccaaagtgga aatcaagacc actaccccag caccgaggcc acccaccccg
840
gctcctacca tcgcctccca gcctctgtcc ctgcgtccgg aggcatgtag acccgcagct
900
ggtggggccg tgcatacccg gggtcttgac ttcgcctgcg atatctacat ttgggcccct
960
ctggctggta cttgcggggt cctgctgctt tcactcgtga tcactcttta ctgtaagcgc
1020
ggtcggaaga agctgctgta catctttaag caacccttca tgaggcctgt gcagactact
1080
caagaggagg acggctgttc atgccggttc ccagaggagg aggaaggcgg ctgcgaactg
1140
cgcgtgaaat tcagccgcag cgcagatgct ccagcctaca agcaggggca gaaccagctc
1200
tacaacgaac tcaatcttgg tcggagagag gagtacgacg tgctggacaa gcggagagga
1260
cgggacccag aaatgggcgg gaagccgcgc agaaagaatc cccaagaggg cctgtacaac
1320
gagctccaaa aggataagat ggcagaagcc tatagcgaga ttggtatgaa aggggaacgc
1380
agaagaggca aaggccacga cggactgtac cagggactca gcaccgccac caaggacacc
1440
tatgacgctc ttcacatgca ggccctgccg cctcgg
1476
<210> 456
<211> 239
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 456
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Val Gly Lys Ala Val Pro Asp Val Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Thr Pro Ser Ser Leu Ser
130 135 140
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser
145 150 155 160
Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser
180 185 190
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
195 200 205
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr
210 215 220
Ser Thr Pro Tyr Ser Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
225 230 235
<210> 457
<211> 717
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 457
gaagtgcagc tcgtggaaac tggaggtgga ctcgtgcagc ctggacggtc gctgcggctg
60
agctgcgctg catccggctt caccttcgac gattatgcca tgcactgggt cagacaggcg
120
ccagggaagg gacttgagtg ggtgtccggt atcagctgga atagcggctc aatcggatac
180
gcggactccg tgaagggaag gttcaccatt tcccgcgaca acgccaagaa ctccctgtac
240
ttgcaaatga acagcctccg ggatgaggac actgccgtgt actactgcgc ccgcgtcgga
300
aaagctgtgc ccgacgtctg gggccaggga accactgtga ccgtgtccag cggcgggggt
360
ggatcgggcg gtggagggtc cggtggaggg ggctcagata ttgtgatgac ccagaccccc
420
tcgtccctgt ccgcctcggt cggcgaccgc gtgactatca catgtagagc ctcgcagagc
480
atctccagct acctgaactg gtatcagcag aagccgggga aggccccgaa gctcctgatc
540
tacgcggcat catcactgca atcgggagtg ccgagccggt tttccgggtc cggctccggc
600
accgacttca cgctgaccat ttcttccctg caacccgagg acttcgccac ttactactgc
660
cagcagtcct actccacccc ttactccttc ggccaaggaa ccaggctgga aatcaag
717
<210> 458
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 458
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Val Gly Lys Ala Val Pro Asp Val Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 459
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 459
Asp Ile Val Met Thr Gln Thr Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Tyr
85 90 95
Ser Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 460
<211> 483
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 460
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Asp Asp Tyr Ala Met His Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Val Gly Lys Ala Val Pro Asp Val Trp
115 120 125
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Thr
145 150 155 160
Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys
165 170 175
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys
180 185 190
Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Gln
195 200 205
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
210 215 220
Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr
225 230 235 240
Cys Gln Gln Ser Tyr Ser Thr Pro Tyr Ser Phe Gly Gln Gly Thr Arg
245 250 255
Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
260 265 270
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
275 280 285
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
290 295 300
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
305 310 315 320
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
325 330 335
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
340 345 350
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
355 360 365
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
370 375 380
Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
385 390 395 400
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
405 410 415
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
420 425 430
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
435 440 445
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
450 455 460
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
465 470 475 480
Pro Pro Arg
<210> 461
<211> 1449
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 461
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtgc agctcgtgga aactggaggt ggactcgtgc agcctggacg gtcgctgcgg
120
ctgagctgcg ctgcatccgg cttcaccttc gacgattatg ccatgcactg ggtcagacag
180
gcgccaggga agggacttga gtgggtgtcc ggtatcagct ggaatagcgg ctcaatcgga
240
tacgcggact ccgtgaaggg aaggttcacc atttcccgcg acaacgccaa gaactccctg
300
tacttgcaaa tgaacagcct ccgggatgag gacactgccg tgtactactg cgcccgcgtc
360
ggaaaagctg tgcccgacgt ctggggccag ggaaccactg tgaccgtgtc cagcggcggg
420
ggtggatcgg gcggtggagg gtccggtgga gggggctcag atattgtgat gacccagacc
480
ccctcgtccc tgtccgcctc ggtcggcgac cgcgtgacta tcacatgtag agcctcgcag
540
agcatctcca gctacctgaa ctggtatcag cagaagccgg ggaaggcccc gaagctcctg
600
atctacgcgg catcatcact gcaatcggga gtgccgagcc ggttttccgg gtccggctcc
660
ggcaccgact tcacgctgac catttcttcc ctgcaacccg aggacttcgc cacttactac
720
tgccagcagt cctactccac cccttactcc ttcggccaag gaaccaggct ggaaatcaag
780
accactaccc cagcaccgag gccacccacc ccggctccta ccatcgcctc ccagcctctg
840
tccctgcgtc cggaggcatg tagacccgca gctggtgggg ccgtgcatac ccggggtctt
900
gacttcgcct gcgatatcta catttgggcc cctctggctg gtacttgcgg ggtcctgctg
960
ctttcactcg tgatcactct ttactgtaag cgcggtcgga agaagctgct gtacatcttt
1020
aagcaaccct tcatgaggcc tgtgcagact actcaagagg aggacggctg ttcatgccgg
1080
ttcccagagg aggaggaagg cggctgcgaa ctgcgcgtga aattcagccg cagcgcagat
1140
gctccagcct acaagcaggg gcagaaccag ctctacaacg aactcaatct tggtcggaga
1200
gaggagtacg acgtgctgga caagcggaga ggacgggacc cagaaatggg cgggaagccg
1260
cgcagaaaga atccccaaga gggcctgtac aacgagctcc aaaaggataa gatggcagaa
1320
gcctatagcg agattggtat gaaaggggaa cgcagaagag gcaaaggcca cgacggactg
1380
taccagggac tcagcaccgc caccaaggac acctatgacg ctcttcacat gcaggccctg
1440
ccgcctcgg
1449
<210> 462
<211> 246
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 462
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Arg Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ser Ile Asn Trp Lys Gly Asn Ser Leu Ala Tyr Gly Asp Ser Val
50 55 60
Lys Gly Arg Phe Ala Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Thr Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser His Gln Gly Val Ala Tyr Tyr Asn Tyr Ala Met Asp Val Trp
100 105 110
Gly Arg Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser
130 135 140
Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys
145 150 155 160
Arg Ala Thr Gln Ser Ile Gly Ser Ser Phe Leu Ala Trp Tyr Gln Gln
165 170 175
Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Gln Arg
180 185 190
Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Arg Gly Ser Gly Thr Asp
195 200 205
Phe Thr Leu Thr Ile Ser Arg Val Glu Pro Glu Asp Ser Ala Val Tyr
210 215 220
Tyr Cys Gln His Tyr Glu Ser Ser Pro Ser Trp Thr Phe Gly Gln Gly
225 230 235 240
Thr Lys Val Glu Ile Lys
245
<210> 463
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 463
gaagtgcagc tcgtggagag cgggggagga ttggtgcagc ccggaaggtc cctgcggctc
60
tcctgcactg cgtctggctt caccttcgac gactacgcga tgcactgggt cagacagcgc
120
ccgggaaagg gcctggaatg ggtcgcctca atcaactgga agggaaactc cctggcctat
180
ggcgacagcg tgaagggccg cttcgccatt tcgcgcgaca acgccaagaa caccgtgttt
240
ctgcaaatga attccctgcg gaccgaggat accgctgtgt actactgcgc cagccaccag
300
ggcgtggcat actataacta cgccatggac gtgtggggaa gagggacgct cgtcaccgtg
360
tcctccgggg gcggtggatc gggtggagga ggaagcggtg gcgggggcag cgaaatcgtg
420
ctgactcaga gcccgggaac tctttcactg tccccgggag aacgggccac tctctcgtgc
480
cgggccaccc agtccatcgg ctcctccttc cttgcctggt accagcagag gccaggacag
540
gcgccccgcc tgctgatcta cggtgcttcc caacgcgcca ctggcattcc tgaccggttc
600
agcggcagag ggtcgggaac cgatttcaca ctgaccattt cccgggtgga gcccgaagat
660
tcggcagtct actactgtca gcattacgag tcctcccctt catggacctt cggtcaaggg
720
accaaagtgg agatcaag
738
<210> 464
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 464
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Arg Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ser Ile Asn Trp Lys Gly Asn Ser Leu Ala Tyr Gly Asp Ser Val
50 55 60
Lys Gly Arg Phe Ala Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Thr Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser His Gln Gly Val Ala Tyr Tyr Asn Tyr Ala Met Asp Val Trp
100 105 110
Gly Arg Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 465
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 465
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Thr Gln Ser Ile Gly Ser Ser
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Gln Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Arg Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Val Glu
65 70 75 80
Pro Glu Asp Ser Ala Val Tyr Tyr Cys Gln His Tyr Glu Ser Ser Pro
85 90 95
Ser Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 466
<211> 490
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 466
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe
35 40 45
Thr Phe Asp Asp Tyr Ala Met His Trp Val Arg Gln Arg Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ala Ser Ile Asn Trp Lys Gly Asn Ser Leu Ala
65 70 75 80
Tyr Gly Asp Ser Val Lys Gly Arg Phe Ala Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Thr Val Phe Leu Gln Met Asn Ser Leu Arg Thr Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Ser His Gln Gly Val Ala Tyr Tyr Asn Tyr
115 120 125
Ala Met Asp Val Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile
145 150 155 160
Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg
165 170 175
Ala Thr Leu Ser Cys Arg Ala Thr Gln Ser Ile Gly Ser Ser Phe Leu
180 185 190
Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
195 200 205
Gly Ala Ser Gln Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Arg
210 215 220
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Val Glu Pro Glu
225 230 235 240
Asp Ser Ala Val Tyr Tyr Cys Gln His Tyr Glu Ser Ser Pro Ser Trp
245 250 255
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 467
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 467
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtgc agctcgtgga gagcggggga ggattggtgc agcccggaag gtccctgcgg
120
ctctcctgca ctgcgtctgg cttcaccttc gacgactacg cgatgcactg ggtcagacag
180
cgcccgggaa agggcctgga atgggtcgcc tcaatcaact ggaagggaaa ctccctggcc
240
tatggcgaca gcgtgaaggg ccgcttcgcc atttcgcgcg acaacgccaa gaacaccgtg
300
tttctgcaaa tgaattccct gcggaccgag gataccgctg tgtactactg cgccagccac
360
cagggcgtgg catactataa ctacgccatg gacgtgtggg gaagagggac gctcgtcacc
420
gtgtcctccg ggggcggtgg atcgggtgga ggaggaagcg gtggcggggg cagcgaaatc
480
gtgctgactc agagcccggg aactctttca ctgtccccgg gagaacgggc cactctctcg
540
tgccgggcca cccagtccat cggctcctcc ttccttgcct ggtaccagca gaggccagga
600
caggcgcccc gcctgctgat ctacggtgct tcccaacgcg ccactggcat tcctgaccgg
660
ttcagcggca gagggtcggg aaccgatttc acactgacca tttcccgggt ggagcccgaa
720
gattcggcag tctactactg tcagcattac gagtcctccc cttcatggac cttcggtcaa
780
gggaccaaag tggagatcaa gaccactacc ccagcaccga ggccacccac cccggctcct
840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg
900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct
960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg
1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag
1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg
1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac
1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac
1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc
1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga
1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac
1440
gctcttcaca tgcaggccct gccgcctcgg
1470
<210> 468
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 468
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Val Arg Asp Gly Met Asp Val Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser
130 135 140
Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser
145 150 155 160
Val Ser Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala
165 170 175
Pro Arg Leu Leu Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro
180 185 190
Asp Arg Phe Ser Gly Asn Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
195 200 205
Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr
210 215 220
Gly Ser Pro Pro Arg Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile
225 230 235 240
Lys
<210> 469
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 469
gaggtgcagt tggtcgaaag cgggggcggg cttgtgcagc ctggcggatc actgcggctg
60
tcctgcgcgg catcaggctt cacgttttct tcctacgcca tgtcctgggt gcgccaggcc
120
cctggaaagg gactggaatg ggtgtccgcg atttcggggt ccggcgggag cacctactac
180
gccgattccg tgaagggccg cttcactatc tcgcgggaca actccaagaa caccctctac
240
ctccaaatga atagcctgcg ggccgaggat accgccgtct actattgcgc taaggtcgtg
300
cgcgacggaa tggacgtgtg gggacagggt accaccgtga cagtgtcctc ggggggaggc
360
ggtagcggcg gaggaggaag cggtggtgga ggttccgaga ttgtgctgac tcaatcaccc
420
gcgaccctga gcctgtcccc cggcgaaagg gccactctgt cctgtcgggc cagccaatca
480
gtctcctcct cgtacctggc ctggtaccag cagaagccag gacaggctcc gagactcctt
540
atctatggcg catcctcccg cgccaccgga atcccggata ggttctcggg aaacggatcg
600
gggaccgact tcactctcac catctcccgg ctggaaccgg aggacttcgc cgtgtactac
660
tgccagcagt acggcagccc gcctagattc actttcggcc ccggcaccaa agtggacatc
720
aag
723
<210> 470
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 470
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Val Arg Asp Gly Met Asp Val Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 471
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 471
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Asn Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Pro Pro
85 90 95
Arg Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 472
<211> 485
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 472
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Val Val Arg Asp Gly Met Asp Val Trp
115 120 125
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser
145 150 155 160
Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys
165 170 175
Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala Trp Tyr Gln Gln
180 185 190
Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Ser Arg
195 200 205
Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Asn Gly Ser Gly Thr Asp
210 215 220
Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr
225 230 235 240
Tyr Cys Gln Gln Tyr Gly Ser Pro Pro Arg Phe Thr Phe Gly Pro Gly
245 250 255
Thr Lys Val Asp Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
260 265 270
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
275 280 285
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
290 295 300
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
305 310 315 320
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
325 330 335
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
340 345 350
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
355 360 365
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
370 375 380
Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
385 390 395 400
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
405 410 415
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
420 425 430
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
435 440 445
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
450 455 460
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
465 470 475 480
Ala Leu Pro Pro Arg
485
<210> 473
<211> 1455
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 473
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaggtgc agttggtcga aagcgggggc gggcttgtgc agcctggcgg atcactgcgg
120
ctgtcctgcg cggcatcagg cttcacgttt tcttcctacg ccatgtcctg ggtgcgccag
180
gcccctggaa agggactgga atgggtgtcc gcgatttcgg ggtccggcgg gagcacctac
240
tacgccgatt ccgtgaaggg ccgcttcact atctcgcggg acaactccaa gaacaccctc
300
tacctccaaa tgaatagcct gcgggccgag gataccgccg tctactattg cgctaaggtc
360
gtgcgcgacg gaatggacgt gtggggacag ggtaccaccg tgacagtgtc ctcgggggga
420
ggcggtagcg gcggaggagg aagcggtggt ggaggttccg agattgtgct gactcaatca
480
cccgcgaccc tgagcctgtc ccccggcgaa agggccactc tgtcctgtcg ggccagccaa
540
tcagtctcct cctcgtacct ggcctggtac cagcagaagc caggacaggc tccgagactc
600
cttatctatg gcgcatcctc ccgcgccacc ggaatcccgg ataggttctc gggaaacgga
660
tcggggaccg acttcactct caccatctcc cggctggaac cggaggactt cgccgtgtac
720
tactgccagc agtacggcag cccgcctaga ttcactttcg gccccggcac caaagtggac
780
atcaagacca ctaccccagc accgaggcca cccaccccgg ctcctaccat cgcctcccag
840
cctctgtccc tgcgtccgga ggcatgtaga cccgcagctg gtggggccgt gcatacccgg
900
ggtcttgact tcgcctgcga tatctacatt tgggcccctc tggctggtac ttgcggggtc
960
ctgctgcttt cactcgtgat cactctttac tgtaagcgcg gtcggaagaa gctgctgtac
1020
atctttaagc aacccttcat gaggcctgtg cagactactc aagaggagga cggctgttca
1080
tgccggttcc cagaggagga ggaaggcggc tgcgaactgc gcgtgaaatt cagccgcagc
1140
gcagatgctc cagcctacaa gcaggggcag aaccagctct acaacgaact caatcttggt
1200
cggagagagg agtacgacgt gctggacaag cggagaggac gggacccaga aatgggcggg
1260
aagccgcgca gaaagaatcc ccaagagggc ctgtacaacg agctccaaaa ggataagatg
1320
gcagaagcct atagcgagat tggtatgaaa ggggaacgca gaagaggcaa aggccacgac
1380
ggactgtacc agggactcag caccgccacc aaggacacct atgacgctct tcacatgcag
1440
gccctgccgc ctcgg
1455
<210> 474
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 474
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Ile Pro Gln Thr Gly Thr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu
130 135 140
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
145 150 155 160
Ser Val Ser Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Arg Pro Gly Gln
165 170 175
Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile
180 185 190
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
195 200 205
Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His
210 215 220
Tyr Gly Ser Ser Pro Ser Trp Thr Phe Gly Gln Gly Thr Arg Leu Glu
225 230 235 240
Ile Lys
<210> 475
<211> 726
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 475
gaagtgcagc tgctggagtc cggcggtgga ttggtgcaac cggggggatc gctcagactg
60
tcctgtgcgg cgtcaggctt caccttctcg agctacgcca tgtcatgggt cagacaggcc
120
cctggaaagg gtctggaatg ggtgtccgcc atttccggga gcgggggatc tacatactac
180
gccgatagcg tgaagggccg cttcaccatt tcccgggaca actccaagaa cactctctat
240
ctgcaaatga actccctccg cgctgaggac actgccgtgt actactgcgc caaaatccct
300
cagaccggca ccttcgacta ctggggacag gggactctgg tcaccgtcag cagcggtggc
360
ggaggttcgg ggggaggagg aagcggcggc ggagggtccg agattgtgct gacccagtca
420
cccggcactt tgtccctgtc gcctggagaa agggccaccc tttcctgccg ggcatcccaa
480
tccgtgtcct cctcgtacct ggcctggtac cagcagaggc ccggacaggc cccacggctt
540
ctgatctacg gagcaagcag ccgcgcgacc ggtatcccgg accggttttc gggctcgggc
600
tcaggaactg acttcaccct caccatctcc cgcctggaac ccgaagattt cgctgtgtat
660
tactgccagc actacggcag ctccccgtcc tggacgttcg gccagggaac tcggctggag
720
atcaag
726
<210> 476
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 476
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Ile Pro Gln Thr Gly Thr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 477
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 477
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Ser Ser Pro
85 90 95
Ser Trp Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 478
<211> 486
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 478
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Ile Pro Gln Thr Gly Thr Phe Asp Tyr
115 120 125
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln
145 150 155 160
Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser
165 170 175
Cys Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala Trp Tyr Gln
180 185 190
Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Ser
195 200 205
Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
210 215 220
Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val
225 230 235 240
Tyr Tyr Cys Gln His Tyr Gly Ser Ser Pro Ser Trp Thr Phe Gly Gln
245 250 255
Gly Thr Arg Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 479
<211> 1458
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 479
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtgc agctgctgga gtccggcggt ggattggtgc aaccgggggg atcgctcaga
120
ctgtcctgtg cggcgtcagg cttcaccttc tcgagctacg ccatgtcatg ggtcagacag
180
gcccctggaa agggtctgga atgggtgtcc gccatttccg ggagcggggg atctacatac
240
tacgccgata gcgtgaaggg ccgcttcacc atttcccggg acaactccaa gaacactctc
300
tatctgcaaa tgaactccct ccgcgctgag gacactgccg tgtactactg cgccaaaatc
360
cctcagaccg gcaccttcga ctactgggga caggggactc tggtcaccgt cagcagcggt
420
ggcggaggtt cggggggagg aggaagcggc ggcggagggt ccgagattgt gctgacccag
480
tcacccggca ctttgtccct gtcgcctgga gaaagggcca ccctttcctg ccgggcatcc
540
caatccgtgt cctcctcgta cctggcctgg taccagcaga ggcccggaca ggccccacgg
600
cttctgatct acggagcaag cagccgcgcg accggtatcc cggaccggtt ttcgggctcg
660
ggctcaggaa ctgacttcac cctcaccatc tcccgcctgg aacccgaaga tttcgctgtg
720
tattactgcc agcactacgg cagctccccg tcctggacgt tcggccaggg aactcggctg
780
gagatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc
840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc
900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg
960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg
1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt
1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc
1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt
1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc
1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag
1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac
1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg
1440
caggccctgc cgcctcgg
1458
<210> 480
<211> 248
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 480
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Met Ser Arg Glu Asn Asp Lys Asn Ser Val Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Val Glu Asp Thr Gly Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Asn Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met Thr
130 135 140
Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Ser Ala Thr Leu
145 150 155 160
Ser Cys Arg Ala Ser Gln Arg Val Ala Ser Asn Tyr Leu Ala Trp Tyr
165 170 175
Gln His Lys Pro Gly Gln Ala Pro Ser Leu Leu Ile Ser Gly Ala Ser
180 185 190
Ser Arg Ala Thr Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Asp Phe Thr Leu Ala Ile Ser Arg Leu Glu Pro Glu Asp Ser Ala
210 215 220
Val Tyr Tyr Cys Gln His Tyr Asp Ser Ser Pro Ser Trp Thr Phe Gly
225 230 235 240
Gln Gly Thr Lys Val Glu Ile Lys
245
<210> 481
<211> 744
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 481
gaagtgcaac tggtggaaac cggtggagga ctcgtgcagc ctggcggcag cctccggctg
60
agctgcgccg cttcgggatt caccttttcc tcctacgcga tgtcttgggt cagacaggcc
120
cccggaaagg ggctggaatg ggtgtcagcc atctccggct ccggcggatc aacgtactac
180
gccgactccg tgaaaggccg gttcaccatg tcgcgcgaga atgacaagaa ctccgtgttc
240
ctgcaaatga actccctgag ggtggaggac accggagtgt actattgtgc gcgcgccaac
300
tacaagagag agctgcggta ctactacgga atggacgtct ggggacaggg aactatggtg
360
accgtgtcat ccggtggagg gggaagcggc ggtggaggca gcgggggcgg gggttcagaa
420
attgtcatga cccagtcccc gggaactctt tccctctccc ccggggaatc cgcgactttg
480
tcctgccggg ccagccagcg cgtggcctcg aactacctcg catggtacca gcataagcca
540
ggccaagccc cttccctgct gatttccggg gctagcagcc gcgccactgg cgtgccggat
600
aggttctcgg gaagcggctc gggtaccgat ttcaccctgg caatctcgcg gctggaaccg
660
gaggattcgg ccgtgtacta ctgccagcac tatgactcat ccccctcctg gacattcgga
720
cagggcacca aggtcgagat caag
744
<210> 482
<211> 124
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 482
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Met Ser Arg Glu Asn Asp Lys Asn Ser Val Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Val Glu Asp Thr Gly Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Asn Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 483
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 483
Glu Ile Val Met Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Ser Ala Thr Leu Ser Cys Arg Ala Ser Gln Arg Val Ala Ser Asn
20 25 30
Tyr Leu Ala Trp Tyr Gln His Lys Pro Gly Gln Ala Pro Ser Leu Leu
35 40 45
Ile Ser Gly Ala Ser Ser Arg Ala Thr Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Ala Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Ser Ala Val Tyr Tyr Cys Gln His Tyr Asp Ser Ser Pro
85 90 95
Ser Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 484
<211> 492
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 484
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Met Ser Arg Glu Asn Asp
85 90 95
Lys Asn Ser Val Phe Leu Gln Met Asn Ser Leu Arg Val Glu Asp Thr
100 105 110
Gly Val Tyr Tyr Cys Ala Arg Ala Asn Tyr Lys Arg Glu Leu Arg Tyr
115 120 125
Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Met Val Thr Val Ser
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
145 150 155 160
Glu Ile Val Met Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
165 170 175
Glu Ser Ala Thr Leu Ser Cys Arg Ala Ser Gln Arg Val Ala Ser Asn
180 185 190
Tyr Leu Ala Trp Tyr Gln His Lys Pro Gly Gln Ala Pro Ser Leu Leu
195 200 205
Ile Ser Gly Ala Ser Ser Arg Ala Thr Gly Val Pro Asp Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Ala Ile Ser Arg Leu Glu
225 230 235 240
Pro Glu Asp Ser Ala Val Tyr Tyr Cys Gln His Tyr Asp Ser Ser Pro
245 250 255
Ser Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Thr Thr Thr
260 265 270
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
275 280 285
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
290 295 300
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
305 310 315 320
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
325 330 335
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
340 345 350
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
355 360 365
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 485
<211> 1476
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 485
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtgc aactggtgga aaccggtgga ggactcgtgc agcctggcgg cagcctccgg
120
ctgagctgcg ccgcttcggg attcaccttt tcctcctacg cgatgtcttg ggtcagacag
180
gcccccggaa aggggctgga atgggtgtca gccatctccg gctccggcgg atcaacgtac
240
tacgccgact ccgtgaaagg ccggttcacc atgtcgcgcg agaatgacaa gaactccgtg
300
ttcctgcaaa tgaactccct gagggtggag gacaccggag tgtactattg tgcgcgcgcc
360
aactacaaga gagagctgcg gtactactac ggaatggacg tctggggaca gggaactatg
420
gtgaccgtgt catccggtgg agggggaagc ggcggtggag gcagcggggg cgggggttca
480
gaaattgtca tgacccagtc cccgggaact ctttccctct cccccgggga atccgcgact
540
ttgtcctgcc gggccagcca gcgcgtggcc tcgaactacc tcgcatggta ccagcataag
600
ccaggccaag ccccttccct gctgatttcc ggggctagca gccgcgccac tggcgtgccg
660
gataggttct cgggaagcgg ctcgggtacc gatttcaccc tggcaatctc gcggctggaa
720
ccggaggatt cggccgtgta ctactgccag cactatgact catccccctc ctggacattc
780
ggacagggca ccaaggtcga gatcaagacc actaccccag caccgaggcc acccaccccg
840
gctcctacca tcgcctccca gcctctgtcc ctgcgtccgg aggcatgtag acccgcagct
900
ggtggggccg tgcatacccg gggtcttgac ttcgcctgcg atatctacat ttgggcccct
960
ctggctggta cttgcggggt cctgctgctt tcactcgtga tcactcttta ctgtaagcgc
1020
ggtcggaaga agctgctgta catctttaag caacccttca tgaggcctgt gcagactact
1080
caagaggagg acggctgttc atgccggttc ccagaggagg aggaaggcgg ctgcgaactg
1140
cgcgtgaaat tcagccgcag cgcagatgct ccagcctaca agcaggggca gaaccagctc
1200
tacaacgaac tcaatcttgg tcggagagag gagtacgacg tgctggacaa gcggagagga
1260
cgggacccag aaatgggcgg gaagccgcgc agaaagaatc cccaagaggg cctgtacaac
1320
gagctccaaa aggataagat ggcagaagcc tatagcgaga ttggtatgaa aggggaacgc
1380
agaagaggca aaggccacga cggactgtac cagggactca gcaccgccac caaggacacc
1440
tatgacgctc ttcacatgca ggccctgccg cctcgg
1476
<210> 486
<211> 244
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 486
Glu Val Gln Leu Leu Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Ala Leu Val Gly Ala Thr Gly Ala Phe Asp Ile Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Gly
130 135 140
Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala
145 150 155 160
Ser Gln Ser Leu Ser Ser Asn Phe Leu Ala Trp Tyr Gln Gln Lys Pro
165 170 175
Gly Gln Ala Pro Gly Leu Leu Ile Tyr Gly Ala Ser Asn Trp Ala Thr
180 185 190
Gly Thr Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
195 200 205
Leu Thr Ile Thr Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys
210 215 220
Gln Tyr Tyr Gly Thr Ser Pro Met Tyr Thr Phe Gly Gln Gly Thr Lys
225 230 235 240
Val Glu Ile Lys
<210> 487
<211> 732
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 487
gaagtgcagc tgctcgaaac cggtggaggg ctggtgcagc cagggggctc cctgaggctt
60
tcatgcgccg ctagcggatt ctccttctcc tcttacgcca tgtcgtgggt ccgccaagcc
120
cctggaaaag gcctggaatg ggtgtccgcg atttccggga gcggaggttc gacctattac
180
gccgactccg tgaagggccg ctttaccatc tcccgggata actccaagaa cactctgtac
240
ctccaaatga actcgctgag agccgaggac accgccgtgt attactgcgc gaaggcgctg
300
gtcggcgcga ctggggcatt cgacatctgg ggacagggaa ctcttgtgac cgtgtcgagc
360
ggaggcggcg gctccggcgg aggagggagc gggggcggtg gttccgaaat cgtgttgact
420
cagtccccgg gaaccctgag cttgtcaccc ggggagcggg ccactctctc ctgtcgcgcc
480
tcccaatcgc tctcatccaa tttcctggcc tggtaccagc agaagcccgg acaggccccg
540
ggcctgctca tctacggcgc ttcaaactgg gcaacgggaa cccctgatcg gttcagcgga
600
agcggatcgg gtactgactt taccctgacc atcaccagac tggaaccgga ggacttcgcc
660
gtgtactact gccagtacta cggcacctcc cccatgtaca cattcggaca gggtaccaag
720
gtcgagatta ag
732
<210> 488
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 488
Glu Val Gln Leu Leu Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Ala Leu Val Gly Ala Thr Gly Ala Phe Asp Ile Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 489
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 489
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Leu Ser Ser Asn
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Gly Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Asn Trp Ala Thr Gly Thr Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Tyr Tyr Gly Thr Ser Pro
85 90 95
Met Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 490
<211> 488
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 490
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Leu Glu Thr Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Ser Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Ala Leu Val Gly Ala Thr Gly Ala Phe
115 120 125
Asp Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu
145 150 155 160
Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Gln Ser Leu Ser Ser Asn Phe Leu Ala Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Gln Ala Pro Gly Leu Leu Ile Tyr Gly Ala
195 200 205
Ser Asn Trp Ala Thr Gly Thr Pro Asp Arg Phe Ser Gly Ser Gly Ser
210 215 220
Gly Thr Asp Phe Thr Leu Thr Ile Thr Arg Leu Glu Pro Glu Asp Phe
225 230 235 240
Ala Val Tyr Tyr Cys Gln Tyr Tyr Gly Thr Ser Pro Met Tyr Thr Phe
245 250 255
Gly Gln Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg
260 265 270
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
275 280 285
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
290 295 300
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
305 310 315 320
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg
325 330 335
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
340 345 350
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
355 360 365
Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala
370 375 380
Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
385 390 395 400
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
405 410 415
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
420 425 430
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
435 440 445
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
450 455 460
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
465 470 475 480
His Met Gln Ala Leu Pro Pro Arg
485
<210> 491
<211> 1464
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 491
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtgc agctgctcga aaccggtgga gggctggtgc agccaggggg ctccctgagg
120
ctttcatgcg ccgctagcgg attctccttc tcctcttacg ccatgtcgtg ggtccgccaa
180
gcccctggaa aaggcctgga atgggtgtcc gcgatttccg ggagcggagg ttcgacctat
240
tacgccgact ccgtgaaggg ccgctttacc atctcccggg ataactccaa gaacactctg
300
tacctccaaa tgaactcgct gagagccgag gacaccgccg tgtattactg cgcgaaggcg
360
ctggtcggcg cgactggggc attcgacatc tggggacagg gaactcttgt gaccgtgtcg
420
agcggaggcg gcggctccgg cggaggaggg agcgggggcg gtggttccga aatcgtgttg
480
actcagtccc cgggaaccct gagcttgtca cccggggagc gggccactct ctcctgtcgc
540
gcctcccaat cgctctcatc caatttcctg gcctggtacc agcagaagcc cggacaggcc
600
ccgggcctgc tcatctacgg cgcttcaaac tgggcaacgg gaacccctga tcggttcagc
660
ggaagcggat cgggtactga ctttaccctg accatcacca gactggaacc ggaggacttc
720
gccgtgtact actgccagta ctacggcacc tcccccatgt acacattcgg acagggtacc
780
aaggtcgaga ttaagaccac taccccagca ccgaggccac ccaccccggc tcctaccatc
840
gcctcccagc ctctgtccct gcgtccggag gcatgtagac ccgcagctgg tggggccgtg
900
catacccggg gtcttgactt cgcctgcgat atctacattt gggcccctct ggctggtact
960
tgcggggtcc tgctgctttc actcgtgatc actctttact gtaagcgcgg tcggaagaag
1020
ctgctgtaca tctttaagca acccttcatg aggcctgtgc agactactca agaggaggac
1080
ggctgttcat gccggttccc agaggaggag gaaggcggct gcgaactgcg cgtgaaattc
1140
agccgcagcg cagatgctcc agcctacaag caggggcaga accagctcta caacgaactc
1200
aatcttggtc ggagagagga gtacgacgtg ctggacaagc ggagaggacg ggacccagaa
1260
atgggcggga agccgcgcag aaagaatccc caagagggcc tgtacaacga gctccaaaag
1320
gataagatgg cagaagccta tagcgagatt ggtatgaaag gggaacgcag aagaggcaaa
1380
ggccacgacg gactgtacca gggactcagc accgccacca aggacaccta tgacgctctt
1440
cacatgcagg ccctgccgcc tcgg
1464
<210> 492
<211> 244
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 492
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Trp Phe Gly Glu Gly Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro
130 135 140
Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser
145 150 155 160
Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys
165 170 175
Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala
180 185 190
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
195 200 205
Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr
210 215 220
Cys Met Gln Ala Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys
225 230 235 240
Val Asp Ile Lys
<210> 493
<211> 733
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 493
gaagtgcagc tgcttgagag cggtggaggt ctggtgcagc ccgggggatc actgcgcctg
60
tcctgtgccg cgtccggttt cactttctcc tcgtacgcca tgtcgtgggt cagacaggca
120
ccgggaaagg gactggaatg ggtgtcagcc atttcgggtt cggggggcag cacctactac
180
gctgactccg tgaagggccg gttcaccatt tcccgcgaca actccaagaa caccttgtac
240
ctccaaatga actccctgcg ggccgaagat accgccgtgt attactgcgt gctgtggttc
300
ggagagggat tcgacccgtg gggacaagga acactcgtga ctgtgtcatc cggcggaggc
360
ggcagcggtg gcggcggttc cggcggcggc ggatctgaca tcgtgttgac ccagtcccct
420
ctgagcctgc cggtcactcc tggcgaacca gccagcatct cctgccggtc gagccagtcc
480
ctcctgcact ccaatgggta caactacctc gattggtatc tgcaaaagcc gggccagagc
540
ccccagctgc tgatctacct tgggtcaaac cgcgcttccg gggtgcctga tagattctcc
600
gggtccggga gcggaaccga ctttaccctg aaaatctcga gggtggaggc cgaggacgtc
660
ggagtgtact actgcatgca ggcgctccag actcccctga ccttcggagg aggaacgaag
720
gtcgacatca aga
733
<210> 494
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 494
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Trp Phe Gly Glu Gly Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 495
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 495
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Asp Ile Lys
100 105 110
<210> 496
<211> 488
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 496
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Val Leu Trp Phe Gly Glu Gly Phe Asp Pro Trp
115 120 125
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser
145 150 155 160
Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys
165 170 175
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp
180 185 190
Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Leu
195 200 205
Gly Ser Asn Arg Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly
210 215 220
Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp
225 230 235 240
Val Gly Val Tyr Tyr Cys Met Gln Ala Leu Gln Thr Pro Leu Thr Phe
245 250 255
Gly Gly Gly Thr Lys Val Asp Ile Lys Thr Thr Thr Pro Ala Pro Arg
260 265 270
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
275 280 285
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
290 295 300
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
305 310 315 320
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg
325 330 335
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
340 345 350
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
355 360 365
Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala
370 375 380
Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
385 390 395 400
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
405 410 415
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
420 425 430
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
435 440 445
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
450 455 460
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
465 470 475 480
His Met Gln Ala Leu Pro Pro Arg
485
<210> 497
<211> 1464
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 497
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtgc agctgcttga gagcggtgga ggtctggtgc agcccggggg atcactgcgc
120
ctgtcctgtg ccgcgtccgg tttcactttc tcctcgtacg ccatgtcgtg ggtcagacag
180
gcaccgggaa agggactgga atgggtgtca gccatttcgg gttcgggggg cagcacctac
240
tacgctgact ccgtgaaggg ccggttcacc atttcccgcg acaactccaa gaacaccttg
300
tacctccaaa tgaactccct gcgggccgaa gataccgccg tgtattactg cgtgctgtgg
360
ttcggagagg gattcgaccc gtggggacaa ggaacactcg tgactgtgtc atccggcgga
420
ggcggcagcg gtggcggcgg ttccggcggc ggcggatctg acatcgtgtt gacccagtcc
480
cctctgagcc tgccggtcac tcctggcgaa ccagccagca tctcctgccg gtcgagccag
540
tccctcctgc actccaatgg gtacaactac ctcgattggt atctgcaaaa gccgggccag
600
agcccccagc tgctgatcta ccttgggtca aaccgcgctt ccggggtgcc tgatagattc
660
tccgggtccg ggagcggaac cgactttacc ctgaaaatct cgagggtgga ggccgaggac
720
gtcggagtgt actactgcat gcaggcgctc cagactcccc tgaccttcgg aggaggaacg
780
aaggtcgaca tcaagaccac taccccagca ccgaggccac ccaccccggc tcctaccatc
840
gcctcccagc ctctgtccct gcgtccggag gcatgtagac ccgcagctgg tggggccgtg
900
catacccggg gtcttgactt cgcctgcgat atctacattt gggcccctct ggctggtact
960
tgcggggtcc tgctgctttc actcgtgatc actctttact gtaagcgcgg tcggaagaag
1020
ctgctgtaca tctttaagca acccttcatg aggcctgtgc agactactca agaggaggac
1080
ggctgttcat gccggttccc agaggaggag gaaggcggct gcgaactgcg cgtgaaattc
1140
agccgcagcg cagatgctcc agcctacaag caggggcaga accagctcta caacgaactc
1200
aatcttggtc ggagagagga gtacgacgtg ctggacaagc ggagaggacg ggacccagaa
1260
atgggcggga agccgcgcag aaagaatccc caagagggcc tgtacaacga gctccaaaag
1320
gataagatgg cagaagccta tagcgagatt ggtatgaaag gggaacgcag aagaggcaaa
1380
ggccacgacg gactgtacca gggactcagc accgccacca aggacaccta tgacgctctt
1440
cacatgcagg ccctgccgcc tcgg
1464
<210> 498
<211> 251
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 498
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Gly Tyr Asp Ser Ser Gly Tyr Tyr Arg Asp Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val
130 135 140
Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala
145 150 155 160
Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala
165 170 175
Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly
180 185 190
Thr Ser Ser Arg Ala Thr Gly Ile Ser Asp Arg Phe Ser Gly Ser Gly
195 200 205
Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp
210 215 220
Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Asn Ser Pro Pro Lys Phe
225 230 235 240
Thr Phe Gly Pro Gly Thr Lys Leu Glu Ile Lys
245 250
<210> 499
<211> 753
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 499
caagtgcagc tcgtggagtc aggcggagga ctggtgcagc ccgggggctc cctgagactt
60
tcctgcgcgg catcgggttt taccttctcc tcctatgcta tgtcctgggt gcgccaggcc
120
ccgggaaagg gactggaatg ggtgtccgca atcagcggta gcgggggctc aacatactac
180
gccgactccg tcaagggtcg cttcactatt tcccgggaca actccaagaa taccctgtac
240
ctccaaatga acagcctcag ggccgaggat actgccgtgt actactgcgc caaagtcgga
300
tacgatagct ccggttacta ccgggactac tacggaatgg acgtgtgggg acagggcacc
360
accgtgaccg tgtcaagcgg cggaggcggt tcaggagggg gaggctccgg cggtggaggg
420
tccgaaatcg tcctgactca gtcgcctggc actctgtcgt tgtccccggg ggagcgcgct
480
accctgtcgt gtcgggcgtc gcagtccgtg tcgagctcct acctcgcgtg gtaccagcag
540
aagcccggac aggcccctag acttctgatc tacggcactt cttcacgcgc caccgggatc
600
agcgacaggt tcagcggctc cggctccggg accgacttca ccctgaccat tagccggctg
660
gagcctgaag atttcgccgt gtattactgc caacactacg gaaactcgcc gccaaagttc
720
acgttcggac ccggaaccaa gctggaaatc aag
753
<210> 500
<211> 126
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 500
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Gly Tyr Asp Ser Ser Gly Tyr Tyr Arg Asp Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 501
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 501
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Thr Ser Ser Arg Ala Thr Gly Ile Ser Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Asn Ser Pro
85 90 95
Pro Lys Phe Thr Phe Gly Pro Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 502
<211> 495
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 502
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Val Gly Tyr Asp Ser Ser Gly Tyr Tyr
115 120 125
Arg Asp Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr
130 135 140
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser
165 170 175
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser
180 185 190
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg
195 200 205
Leu Leu Ile Tyr Gly Thr Ser Ser Arg Ala Thr Gly Ile Ser Asp Arg
210 215 220
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg
225 230 235 240
Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Asn
245 250 255
Ser Pro Pro Lys Phe Thr Phe Gly Pro Gly Thr Lys Leu Glu Ile Lys
260 265 270
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
275 280 285
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
290 295 300
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile
305 310 315 320
Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val
325 330 335
Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
340 345 350
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
355 360 365
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg
370 375 380
Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln
385 390 395 400
Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp
405 410 415
Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro
420 425 430
Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp
435 440 445
Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg
450 455 460
Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr
465 470 475 480
Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490 495
<210> 503
<211> 1485
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 503
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
ccccaagtgc agctcgtgga gtcaggcgga ggactggtgc agcccggggg ctccctgaga
120
ctttcctgcg cggcatcggg ttttaccttc tcctcctatg ctatgtcctg ggtgcgccag
180
gccccgggaa agggactgga atgggtgtcc gcaatcagcg gtagcggggg ctcaacatac
240
tacgccgact ccgtcaaggg tcgcttcact atttcccggg acaactccaa gaataccctg
300
tacctccaaa tgaacagcct cagggccgag gatactgccg tgtactactg cgccaaagtc
360
ggatacgata gctccggtta ctaccgggac tactacggaa tggacgtgtg gggacagggc
420
accaccgtga ccgtgtcaag cggcggaggc ggttcaggag ggggaggctc cggcggtgga
480
gggtccgaaa tcgtcctgac tcagtcgcct ggcactctgt cgttgtcccc gggggagcgc
540
gctaccctgt cgtgtcgggc gtcgcagtcc gtgtcgagct cctacctcgc gtggtaccag
600
cagaagcccg gacaggcccc tagacttctg atctacggca cttcttcacg cgccaccggg
660
atcagcgaca ggttcagcgg ctccggctcc gggaccgact tcaccctgac cattagccgg
720
ctggagcctg aagatttcgc cgtgtattac tgccaacact acggaaactc gccgccaaag
780
ttcacgttcg gacccggaac caagctggaa atcaagacca ctaccccagc accgaggcca
840
cccaccccgg ctcctaccat cgcctcccag cctctgtccc tgcgtccgga ggcatgtaga
900
cccgcagctg gtggggccgt gcatacccgg ggtcttgact tcgcctgcga tatctacatt
960
tgggcccctc tggctggtac ttgcggggtc ctgctgcttt cactcgtgat cactctttac
1020
tgtaagcgcg gtcggaagaa gctgctgtac atctttaagc aacccttcat gaggcctgtg
1080
cagactactc aagaggagga cggctgttca tgccggttcc cagaggagga ggaaggcggc
1140
tgcgaactgc gcgtgaaatt cagccgcagc gcagatgctc cagcctacaa gcaggggcag
1200
aaccagctct acaacgaact caatcttggt cggagagagg agtacgacgt gctggacaag
1260
cggagaggac gggacccaga aatgggcggg aagccgcgca gaaagaatcc ccaagagggc
1320
ctgtacaacg agctccaaaa ggataagatg gcagaagcct atagcgagat tggtatgaaa
1380
ggggaacgca gaagaggcaa aggccacgac ggactgtacc agggactcag caccgccacc
1440
aaggacacct atgacgctct tcacatgcag gccctgccgc ctcgg
1485
<210> 504
<211> 246
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 504
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Met Gly Trp Ser Ser Gly Tyr Leu Gly Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser
130 135 140
Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys
145 150 155 160
Arg Ala Ser Gln Ser Val Ala Ser Ser Phe Leu Ala Trp Tyr Gln Gln
165 170 175
Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Gly Arg
180 185 190
Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
195 200 205
Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr
210 215 220
Tyr Cys Gln His Tyr Gly Gly Ser Pro Arg Leu Thr Phe Gly Gly Gly
225 230 235 240
Thr Lys Val Asp Ile Lys
245
<210> 505
<211> 739
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 505
gaagtccaac tggtggagtc cgggggaggg ctcgtgcagc ccggaggcag ccttcggctg
60
tcgtgcgccg cctccgggtt cacgttctca tcctacgcga tgtcgtgggt cagacaggca
120
ccaggaaagg gactggaatg ggtgtccgcc attagcggct ccggcggtag cacctactat
180
gccgactcag tgaagggaag gttcactatc tcccgcgaca acagcaagaa caccctgtac
240
ctccaaatga actctctgcg ggccgaggat accgcggtgt actattgcgc caagatgggt
300
tggtccagcg gatacttggg agccttcgac atttggggac agggcactac tgtgaccgtg
360
tcctccgggg gtggcggatc gggaggcggc ggctcgggtg gagggggttc cgaaatcgtg
420
ttgacccagt caccgggaac cctctcgctg tccccgggag aacgggctac actgtcatgt
480
agagcgtccc agtccgtggc ttcctcgttc ctggcctggt accagcagaa gccgggacag
540
gcaccccgcc tgctcatcta cggagccagc ggccgggcga ccggcatccc tgaccgcttc
600
tccggttccg gctcgggcac cgactttact ctgaccatta gcaggcttga gcccgaggat
660
tttgccgtgt actactgcca acactacggg gggagccctc gcctgacctt cggaggcgga
720
actaaggtcg atatcaaaa
739
<210> 506
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 506
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Met Gly Trp Ser Ser Gly Tyr Leu Gly Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 507
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 507
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ala Ser Ser
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Gly Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Gly Ser Pro
85 90 95
Arg Leu Thr Phe Gly Gly Gly Thr Lys Val Asp Ile Lys
100 105
<210> 508
<211> 490
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 508
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Met Gly Trp Ser Ser Gly Tyr Leu Gly
115 120 125
Ala Phe Asp Ile Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile
145 150 155 160
Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg
165 170 175
Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ala Ser Ser Phe Leu
180 185 190
Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
195 200 205
Gly Ala Ser Gly Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser
210 215 220
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu
225 230 235 240
Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Gly Ser Pro Arg Leu
245 250 255
Thr Phe Gly Gly Gly Thr Lys Val Asp Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 509
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 509
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg
60
cccgaagtcc aactggtgga gtccggggga gggctcgtgc agcccggagg cagccttcgg
120
ctgtcgtgcg ccgcctccgg gttcacgttc tcatcctacg cgatgtcgtg ggtcagacag
180
gcaccaggaa agggactgga atgggtgtcc gccattagcg gctccggcgg tagcacctac
240
tatgccgact cagtgaaggg aaggttcact atctcccgcg acaacagcaa gaacaccctg
300
tacctccaaa tgaactctct gcgggccgag gataccgcgg tgtactattg cgccaagatg
360
ggttggtcca gcggatactt gggagccttc gacatttggg gacagggcac tactgtgacc
420
gtgtcctccg ggggtggcgg atcgggaggc ggcggctcgg gtggaggggg ttccgaaatc
480
gtgttgaccc agtcaccggg aaccctctcg ctgtccccgg gagaacgggc tacactgtca
540
tgtagagcgt cccagtccgt ggcttcctcg ttcctggcct ggtaccagca gaagccggga
600
caggcacccc gcctgctcat ctacggagcc agcggccggg cgaccggcat ccctgaccgc
660
ttctccggtt ccggctcggg caccgacttt actctgacca ttagcaggct tgagcccgag
720
gattttgccg tgtactactg ccaacactac ggggggagcc ctcgcctgac cttcggaggc
780
ggaactaagg tcgatatcaa aaccactacc ccagcaccga ggccacccac cccggctcct
840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg
900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct
960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg
1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag
1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg
1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac
1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac
1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc
1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga
1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac
1440
gctcttcaca tgcaggccct gccgcctcgg
1470
<210> 510
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 510
Gln Ile Gln Leu Val Gln Ser Gly Pro Asp Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Phe
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Phe Lys Trp Met
35 40 45
Ala Trp Ile Asn Thr Tyr Thr Gly Glu Ser Tyr Phe Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Val Glu Thr Ser Ala Thr Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Thr Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Gly Glu Ile Tyr Tyr Gly Tyr Asp Gly Gly Phe Ala Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ala
115 120
<210> 511
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 511
Asp Val Val Met Thr Gln Ser His Arg Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Phe Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Ala Asp Phe Thr Leu Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Asp Ile Lys
100 105
<210> 512
<211> 244
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 512
Gln Ile Gln Leu Val Gln Ser Gly Pro Asp Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Phe
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Phe Lys Trp Met
35 40 45
Ala Trp Ile Asn Thr Tyr Thr Gly Glu Ser Tyr Phe Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Val Glu Thr Ser Ala Thr Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Thr Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Gly Glu Ile Tyr Tyr Gly Tyr Asp Gly Gly Phe Ala Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ala Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser
130 135 140
His Arg Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser Ile Thr Cys
145 150 155 160
Arg Ala Ser Gln Asp Val Asn Thr Ala Val Ser Trp Tyr Gln Gln Lys
165 170 175
Pro Gly Gln Ser Pro Lys Leu Leu Ile Phe Ser Ala Ser Tyr Arg Tyr
180 185 190
Thr Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Ala Asp Phe
195 200 205
Thr Leu Thr Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr
210 215 220
Cys Gln Gln His Tyr Ser Thr Pro Trp Thr Phe Gly Gly Gly Thr Lys
225 230 235 240
Leu Asp Ile Lys
<210> 513
<211> 467
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 513
Gln Ile Gln Leu Val Gln Ser Gly Pro Asp Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Phe
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Phe Lys Trp Met
35 40 45
Ala Trp Ile Asn Thr Tyr Thr Gly Glu Ser Tyr Phe Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Val Glu Thr Ser Ala Thr Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Thr Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Gly Glu Ile Tyr Tyr Gly Tyr Asp Gly Gly Phe Ala Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ala Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser
130 135 140
His Arg Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser Ile Thr Cys
145 150 155 160
Arg Ala Ser Gln Asp Val Asn Thr Ala Val Ser Trp Tyr Gln Gln Lys
165 170 175
Pro Gly Gln Ser Pro Lys Leu Leu Ile Phe Ser Ala Ser Tyr Arg Tyr
180 185 190
Thr Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Ala Asp Phe
195 200 205
Thr Leu Thr Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr
210 215 220
Cys Gln Gln His Tyr Ser Thr Pro Trp Thr Phe Gly Gly Gly Thr Lys
225 230 235 240
Leu Asp Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
245 250 255
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
260 265 270
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
275 280 285
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
290 295 300
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
305 310 315 320
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
325 330 335
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
340 345 350
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
355 360 365
Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
370 375 380
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
385 390 395 400
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
405 410 415
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
420 425 430
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
435 440 445
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
450 455 460
Pro Pro Arg
465
<210> 514
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 514
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ser Ile Asn Trp Val Lys Arg Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Glu Thr Arg Glu Pro Ala Tyr Ala Tyr Asp Phe
50 55 60
Arg Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Tyr Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Leu Asp Tyr Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 515
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 515
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Met Ser Leu Gly
1 5 10 15
Lys Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Ser Val Ile
20 25 30
Gly Ala His Leu Ile His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Thr Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Glu Asp Asp Val Ala Ile Tyr Ser Cys Leu Gln Ser Arg
85 90 95
Ile Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 516
<211> 249
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 516
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ser Ile Asn Trp Val Lys Arg Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Glu Thr Arg Glu Pro Ala Tyr Ala Tyr Asp Phe
50 55 60
Arg Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Tyr Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Leu Asp Tyr Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys
130 135 140
Lys Pro Gly Glu Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr
145 150 155 160
Phe Thr Asp Tyr Ser Ile Asn Trp Val Lys Arg Ala Pro Gly Lys Gly
165 170 175
Leu Lys Trp Met Gly Trp Ile Asn Thr Glu Thr Arg Glu Pro Ala Tyr
180 185 190
Ala Tyr Asp Phe Arg Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala
195 200 205
Ser Thr Ala Tyr Leu Gln Ile Asn Asn Leu Lys Tyr Glu Asp Thr Ala
210 215 220
Thr Tyr Phe Cys Ala Leu Asp Tyr Ser Tyr Ala Met Asp Tyr Trp Gly
225 230 235 240
Gln Gly Thr Ser Val Thr Val Ser Ser
245
<210> 517
<211> 472
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 517
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ser Ile Asn Trp Val Lys Arg Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Glu Thr Arg Glu Pro Ala Tyr Ala Tyr Asp Phe
50 55 60
Arg Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Tyr Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Leu Asp Tyr Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys
130 135 140
Lys Pro Gly Glu Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr
145 150 155 160
Phe Thr Asp Tyr Ser Ile Asn Trp Val Lys Arg Ala Pro Gly Lys Gly
165 170 175
Leu Lys Trp Met Gly Trp Ile Asn Thr Glu Thr Arg Glu Pro Ala Tyr
180 185 190
Ala Tyr Asp Phe Arg Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala
195 200 205
Ser Thr Ala Tyr Leu Gln Ile Asn Asn Leu Lys Tyr Glu Asp Thr Ala
210 215 220
Thr Tyr Phe Cys Ala Leu Asp Tyr Ser Tyr Ala Met Asp Tyr Trp Gly
225 230 235 240
Gln Gly Thr Ser Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg
245 250 255
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
260 265 270
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
275 280 285
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
290 295 300
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg
305 310 315 320
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
325 330 335
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
340 345 350
Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala
355 360 365
Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
370 375 380
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
385 390 395 400
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
405 410 415
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
420 425 430
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
435 440 445
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
450 455 460
His Met Gln Ala Leu Pro Pro Arg
465 470
<210> 518
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 518
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Arg His Tyr
20 25 30
Ser Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Arg Ile Asn Thr Glu Ser Gly Val Pro Ile Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Val Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Val Ile Asn Asn Leu Lys Asp Glu Asp Thr Ala Ser Tyr Phe Cys
85 90 95
Ser Asn Asp Tyr Leu Tyr Ser Leu Asp Phe Trp Gly Gln Gly Thr Ala
100 105 110
Leu Thr Val Ser Ser
115
<210> 519
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 519
Asp Ile Val Leu Thr Gln Ser Pro Pro Ser Leu Ala Met Ser Leu Gly
1 5 10 15
Lys Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Thr Ile Leu
20 25 30
Gly Ser His Leu Ile Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Thr Leu Leu Ile Gln Leu Ala Ser Asn Val Gln Thr Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Glu Asp Asp Val Ala Val Tyr Tyr Cys Leu Gln Ser Arg
85 90 95
Thr Ile Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 520
<211> 243
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 520
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Arg His Tyr
20 25 30
Ser Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Arg Ile Asn Thr Glu Ser Gly Val Pro Ile Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Val Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Val Ile Asn Asn Leu Lys Asp Glu Asp Thr Ala Ser Tyr Phe Cys
85 90 95
Ser Asn Asp Tyr Leu Tyr Ser Leu Asp Phe Trp Gly Gln Gly Thr Ala
100 105 110
Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Pro Ser Leu Ala
130 135 140
Met Ser Leu Gly Lys Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser
145 150 155 160
Val Thr Ile Leu Gly Ser His Leu Ile Tyr Trp Tyr Gln Gln Lys Pro
165 170 175
Gly Gln Pro Pro Thr Leu Leu Ile Gln Leu Ala Ser Asn Val Gln Thr
180 185 190
Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr
195 200 205
Leu Thr Ile Asp Pro Val Glu Glu Asp Asp Val Ala Val Tyr Tyr Cys
210 215 220
Leu Gln Ser Arg Thr Ile Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu
225 230 235 240
Glu Ile Lys
<210> 521
<211> 466
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 521
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Arg His Tyr
20 25 30
Ser Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Arg Ile Asn Thr Glu Ser Gly Val Pro Ile Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Val Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Val Ile Asn Asn Leu Lys Asp Glu Asp Thr Ala Ser Tyr Phe Cys
85 90 95
Ser Asn Asp Tyr Leu Tyr Ser Leu Asp Phe Trp Gly Gln Gly Thr Ala
100 105 110
Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Pro Ser Leu Ala
130 135 140
Met Ser Leu Gly Lys Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser
145 150 155 160
Val Thr Ile Leu Gly Ser His Leu Ile Tyr Trp Tyr Gln Gln Lys Pro
165 170 175
Gly Gln Pro Pro Thr Leu Leu Ile Gln Leu Ala Ser Asn Val Gln Thr
180 185 190
Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr
195 200 205
Leu Thr Ile Asp Pro Val Glu Glu Asp Asp Val Ala Val Tyr Tyr Cys
210 215 220
Leu Gln Ser Arg Thr Ile Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu
225 230 235 240
Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro
245 250 255
Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro
260 265 270
Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
275 280 285
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
290 295 300
Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu
305 310 315 320
Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu
325 330 335
Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys
340 345 350
Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys
355 360 365
Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu
370 375 380
Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly
385 390 395 400
Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu
405 410 415
Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly
420 425 430
Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser
435 440 445
Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro
450 455 460
Pro Arg
465
<210> 522
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 522
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr His Tyr
20 25 30
Ser Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Arg Ile Asn Thr Glu Thr Gly Glu Pro Leu Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Val Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr Phe Phe Cys
85 90 95
Ser Asn Asp Tyr Leu Tyr Ser Cys Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 523
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 523
Asp Ile Val Leu Thr Gln Ser Pro Pro Ser Leu Ala Met Ser Leu Gly
1 5 10 15
Lys Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Thr Ile Leu
20 25 30
Gly Ser His Leu Ile Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Thr Leu Leu Ile Gln Leu Ala Ser Asn Val Gln Thr Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Glu Asp Asp Val Ala Val Tyr Tyr Cys Leu Gln Ser Arg
85 90 95
Thr Ile Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 524
<211> 243
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 524
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr His Tyr
20 25 30
Ser Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Arg Ile Asn Thr Glu Thr Gly Glu Pro Leu Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Val Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr Phe Phe Cys
85 90 95
Ser Asn Asp Tyr Leu Tyr Ser Cys Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Pro Ser Leu Ala
130 135 140
Met Ser Leu Gly Lys Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser
145 150 155 160
Val Thr Ile Leu Gly Ser His Leu Ile Tyr Trp Tyr Gln Gln Lys Pro
165 170 175
Gly Gln Pro Pro Thr Leu Leu Ile Gln Leu Ala Ser Asn Val Gln Thr
180 185 190
Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr
195 200 205
Leu Thr Ile Asp Pro Val Glu Glu Asp Asp Val Ala Val Tyr Tyr Cys
210 215 220
Leu Gln Ser Arg Thr Ile Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu
225 230 235 240
Glu Ile Lys
<210> 525
<211> 466
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 525
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr His Tyr
20 25 30
Ser Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Arg Ile Asn Thr Glu Thr Gly Glu Pro Leu Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Val Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr Phe Phe Cys
85 90 95
Ser Asn Asp Tyr Leu Tyr Ser Cys Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Pro Ser Leu Ala
130 135 140
Met Ser Leu Gly Lys Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser
145 150 155 160
Val Thr Ile Leu Gly Ser His Leu Ile Tyr Trp Tyr Gln Gln Lys Pro
165 170 175
Gly Gln Pro Pro Thr Leu Leu Ile Gln Leu Ala Ser Asn Val Gln Thr
180 185 190
Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr
195 200 205
Leu Thr Ile Asp Pro Val Glu Glu Asp Asp Val Ala Val Tyr Tyr Cys
210 215 220
Leu Gln Ser Arg Thr Ile Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu
225 230 235 240
Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro
245 250 255
Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro
260 265 270
Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
275 280 285
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
290 295 300
Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu
305 310 315 320
Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu
325 330 335
Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys
340 345 350
Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys
355 360 365
Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu
370 375 380
Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly
385 390 395 400
Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu
405 410 415
Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly
420 425 430
Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser
435 440 445
Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro
450 455 460
Pro Arg
465
<210> 526
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 526
Arg Gly Asp Ser
1
<210> 527
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 527
Arg Ala Ser Lys Gly Val Ser Thr Ser Gly Tyr Ser Tyr Leu His
1 5 10 15
<210> 528
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 528
Leu Ala Ser Tyr Leu Glu Ser
1 5
<210> 529
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 529
Gln His Ser Arg Asp Leu Pro Leu Thr
1 5
<210> 530
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 530
Asn Tyr Tyr Met Tyr
1 5
<210> 531
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 531
Gly Ile Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe Lys
1 5 10 15
Asn
<210> 532
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 532
Arg Asp Tyr Arg Phe Asp Met Gly Phe Asp Tyr
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ХИМЕРНЫЕ РЕЦЕПТОРЫ АНТИГЕНА ПРОТИВ МЕЗОТЕЛИНА ЧЕЛОВЕКА И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2714902C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) ПРОТИВ CD123 ДЛЯ ИСПОЛЬЗОВАНИЯ В ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2015 |
|
RU2724999C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2017 |
|
RU2826270C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕНСПЕЦИФИЧЕСКОГО РЕЦЕПТОРА НА ОСНОВЕ ГУМАНИЗИРОВАННОГО АНТИТЕЛА ПРОТИВ EGFRvIII | 2014 |
|
RU2831418C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ИЗБИРАТЕЛЬНОЙ ЭКСПРЕССИИ БЕЛКА | 2017 |
|
RU2795467C2 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ С ИСПОЛЬЗОВАНИЕМ ГУМАНИЗИРОВАННОГО ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА ПРОТИВ ВСМА | 2015 |
|
RU2751660C2 |
| CD20 ТЕРАПИЯ, CD22 ТЕРАПИЯ И КОМБИНИРОВАННАЯ ТЕРАПИЯ КЛЕТКАМИ, ЭКСПРЕССИРУЮЩИМИ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) K CD19 | 2016 |
|
RU2752918C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ЭКСПРЕССИРУЮЩИХ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР КЛЕТОК | 2015 |
|
RU2751362C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА CLL-1 | 2015 |
|
RU2741120C2 |
| T-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ, РАСПОЗНАЮЩИЕ МУТАЦИЮ R175H ИЛИ Y220C В P53 | 2020 |
|
RU2830061C2 |

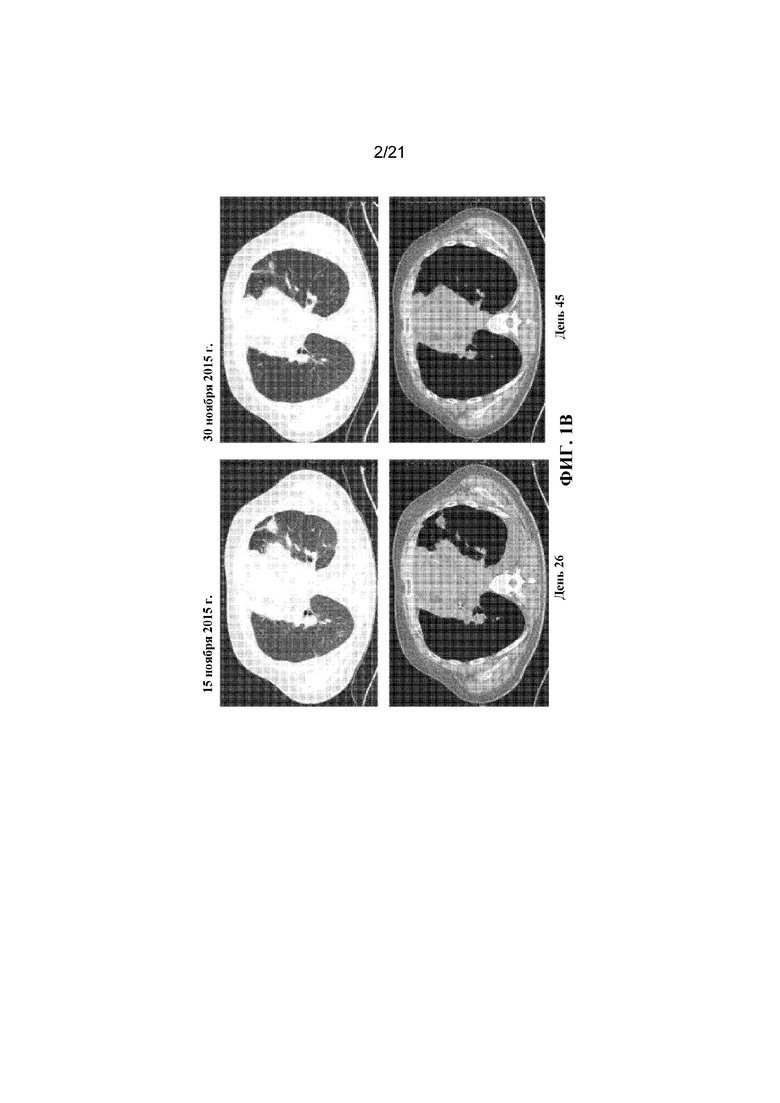
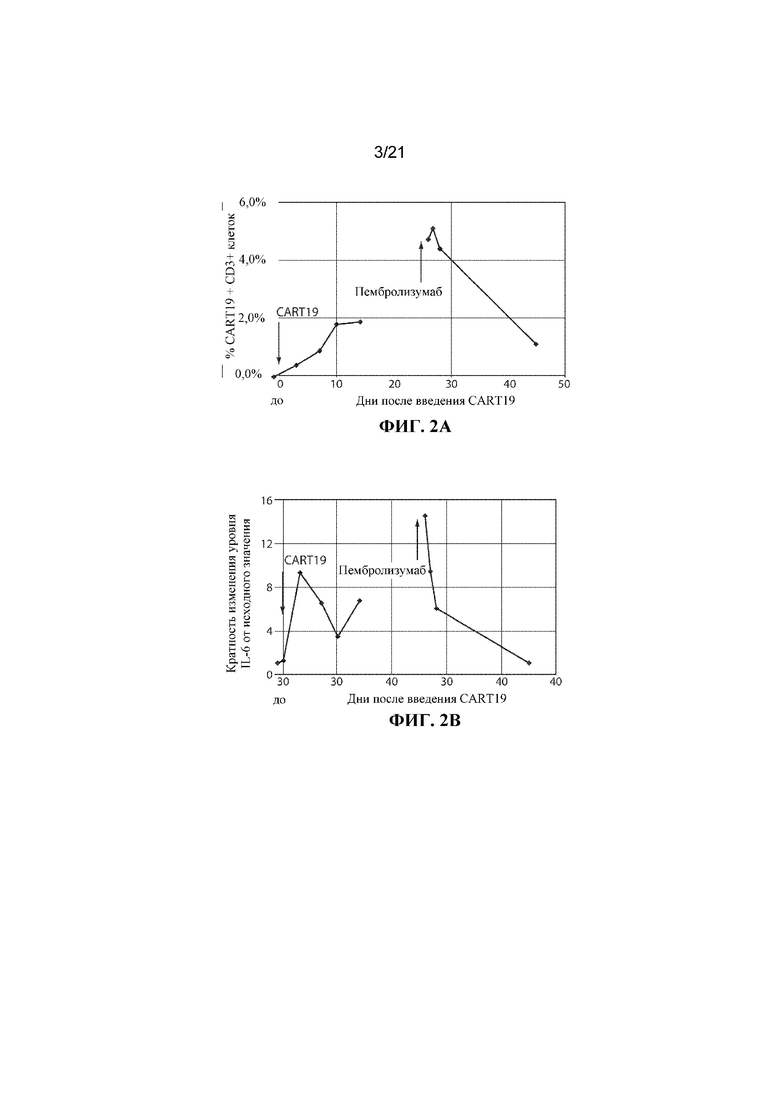
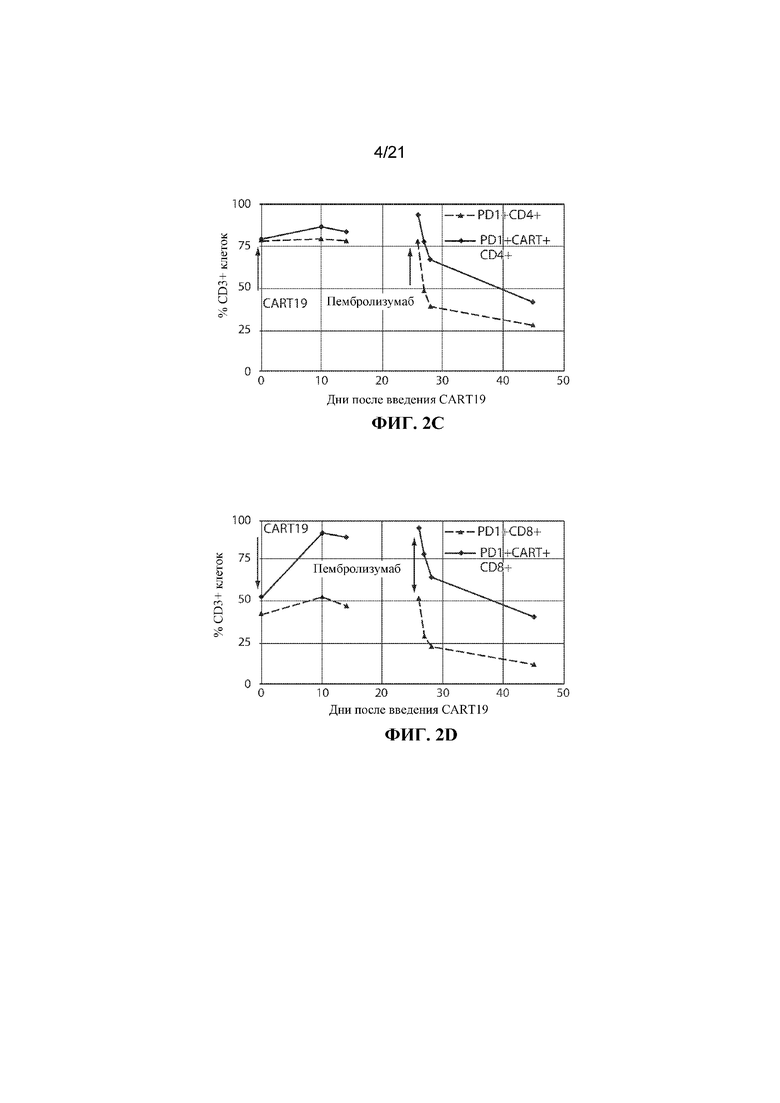
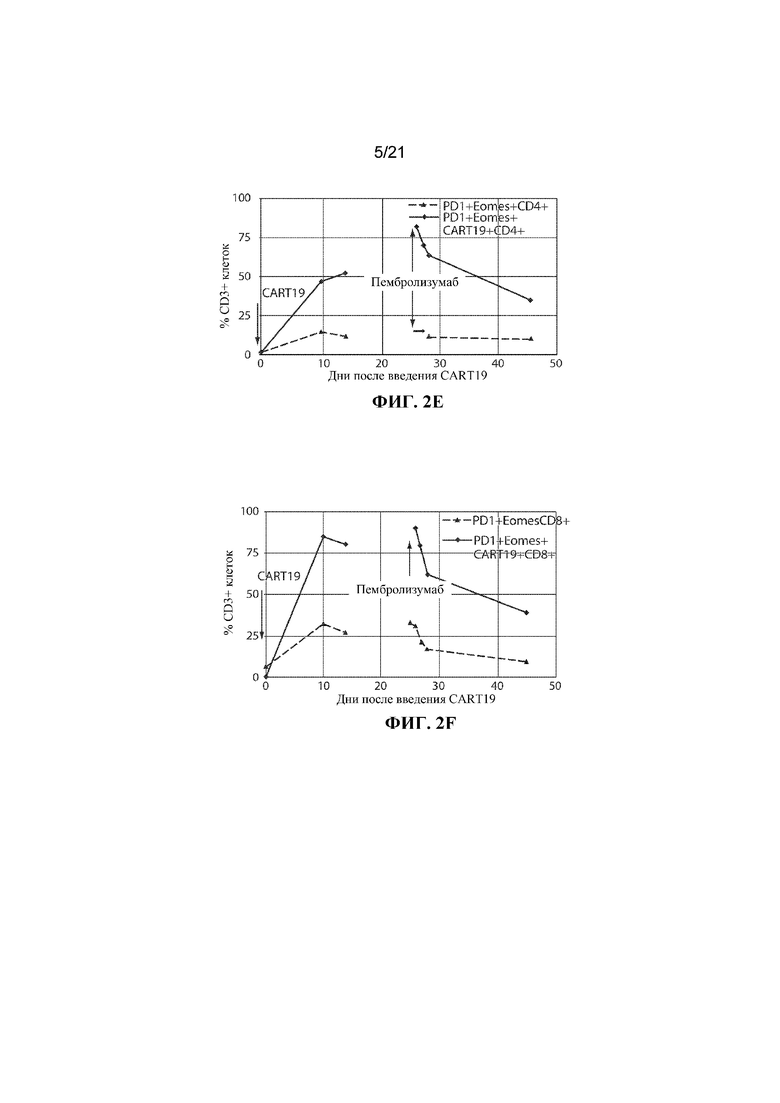

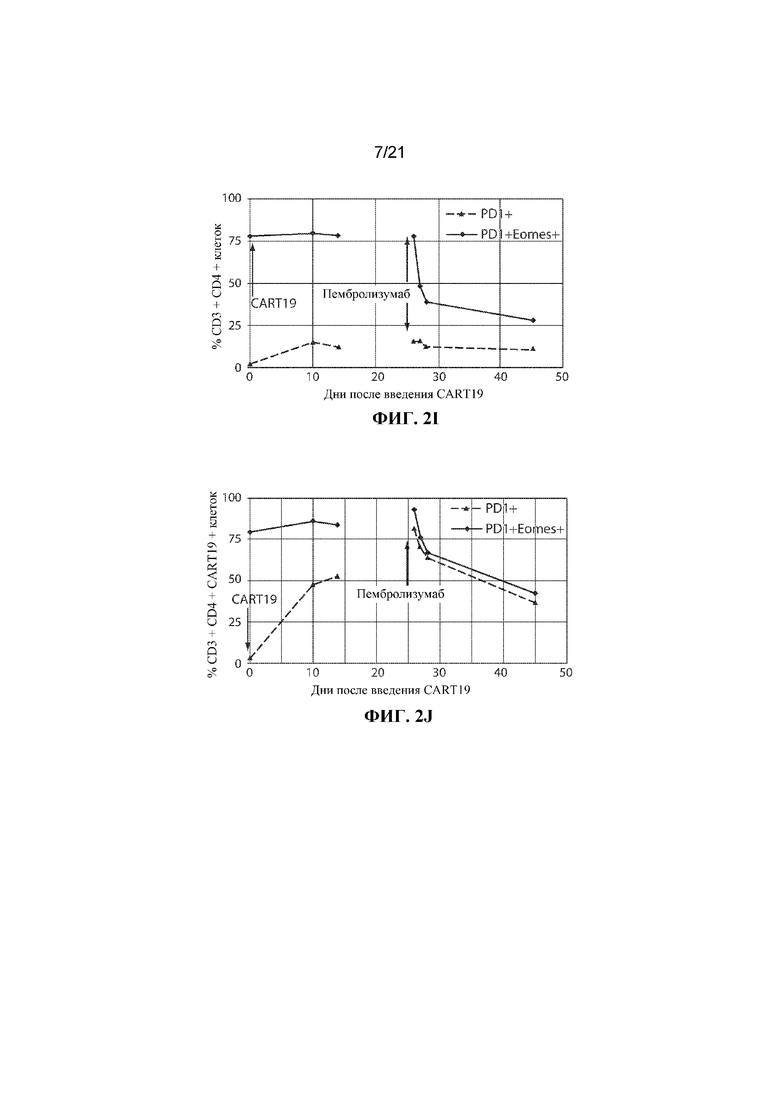


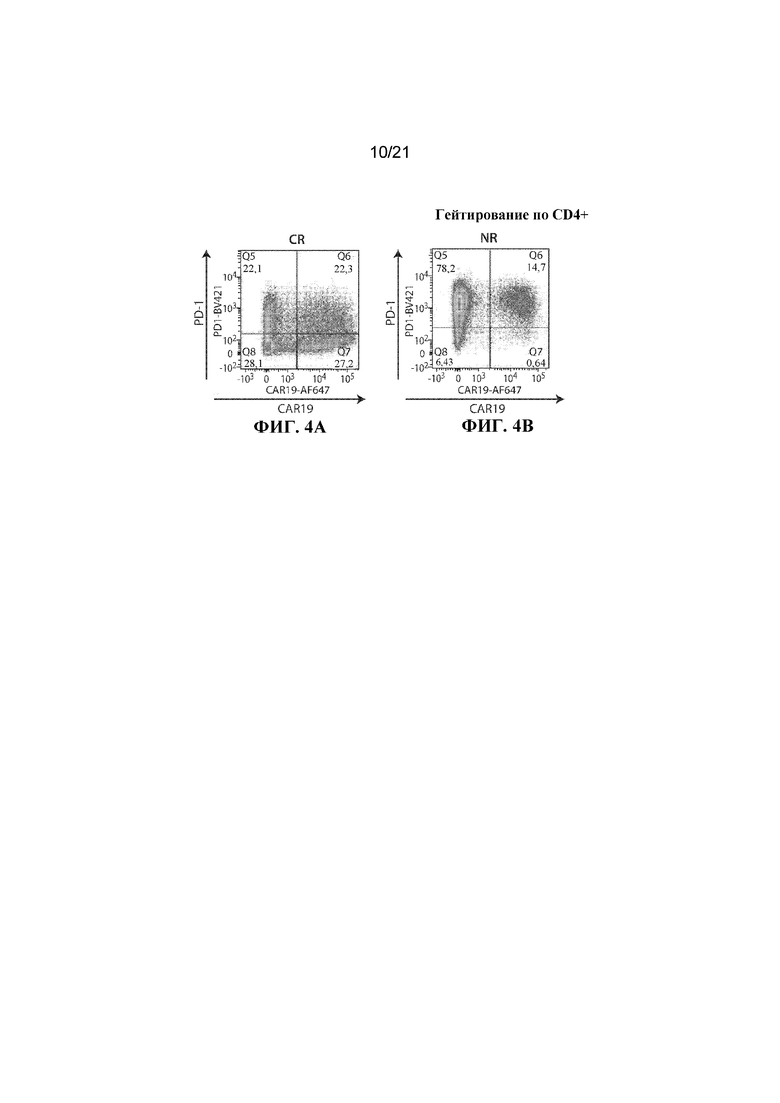
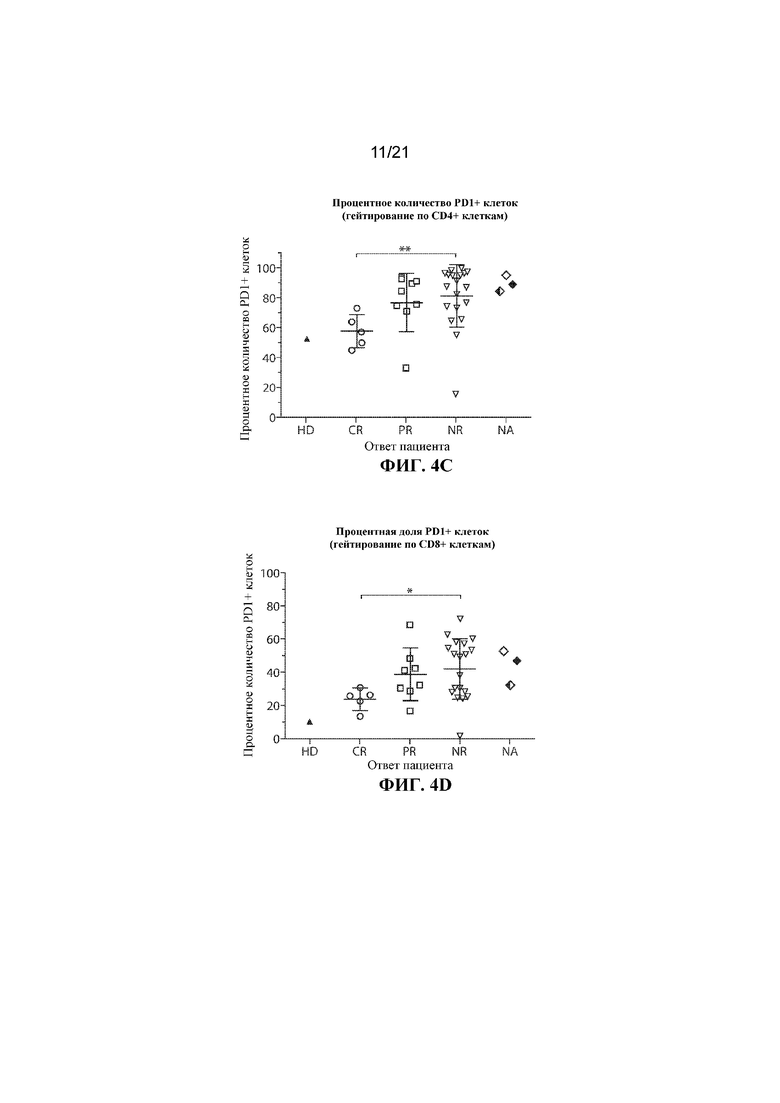
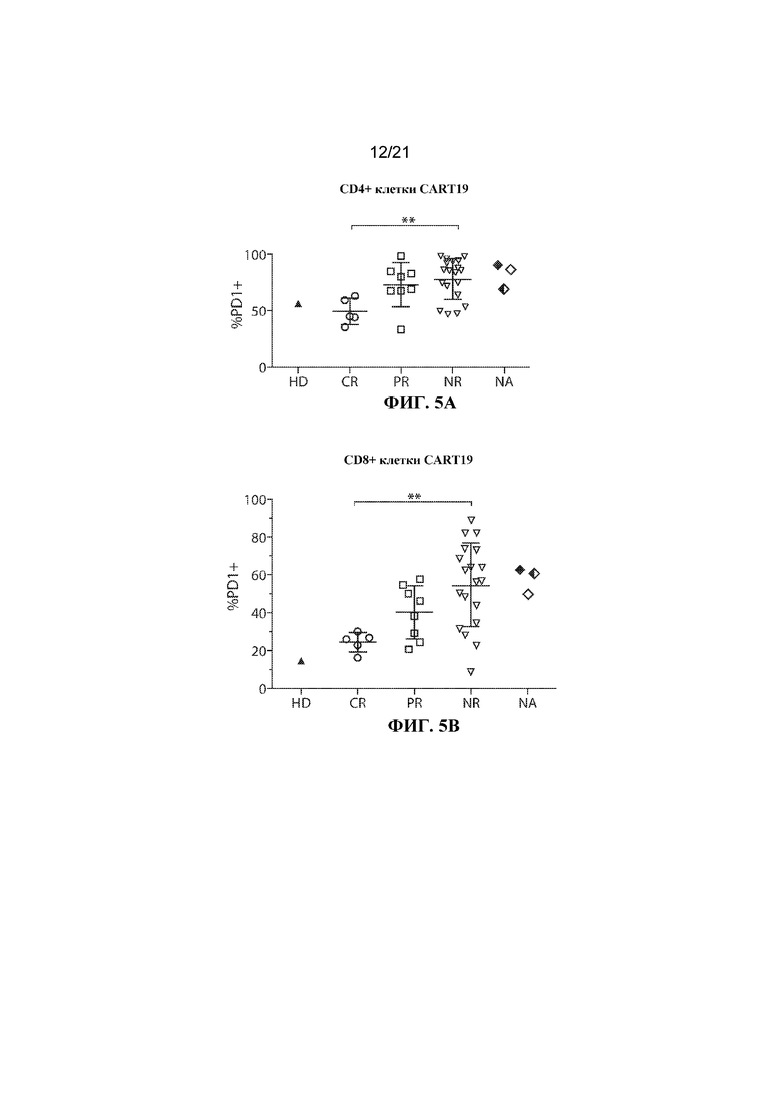

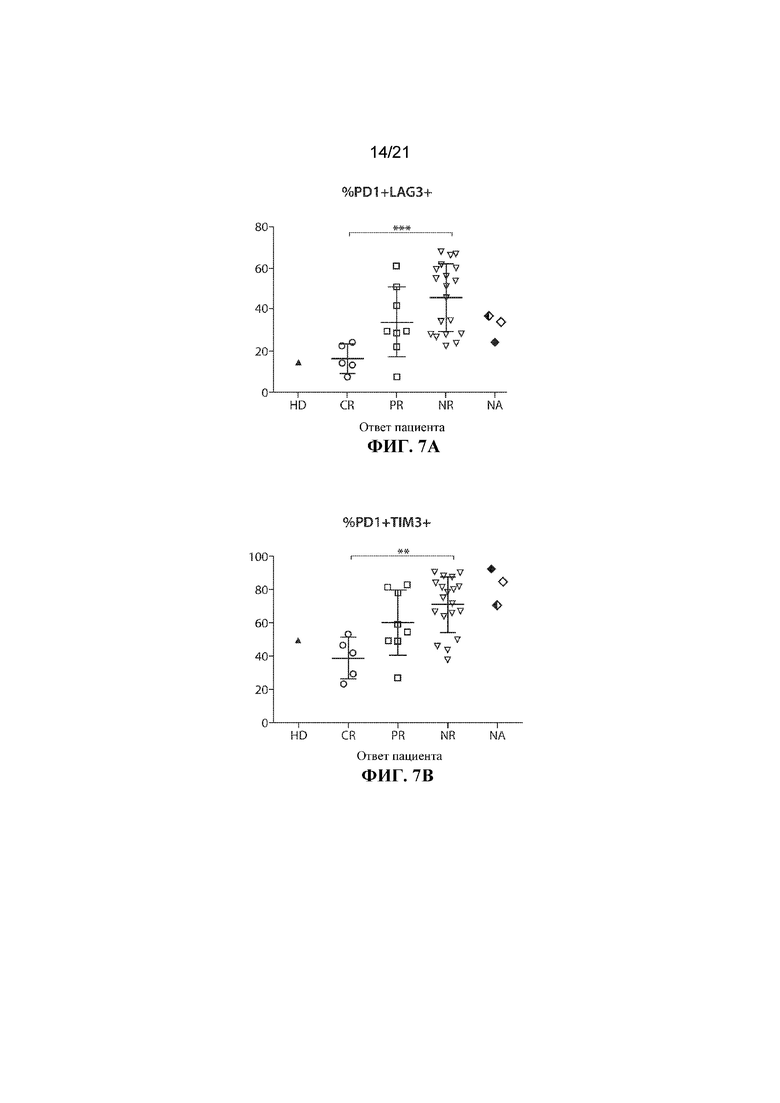


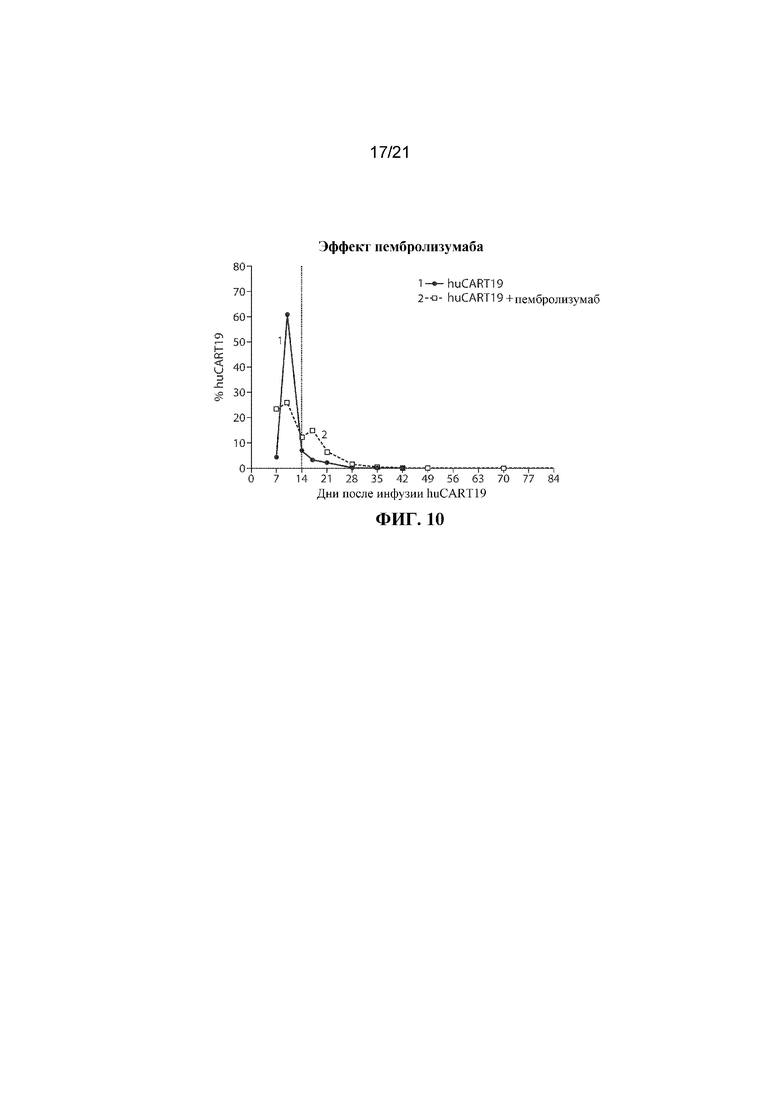


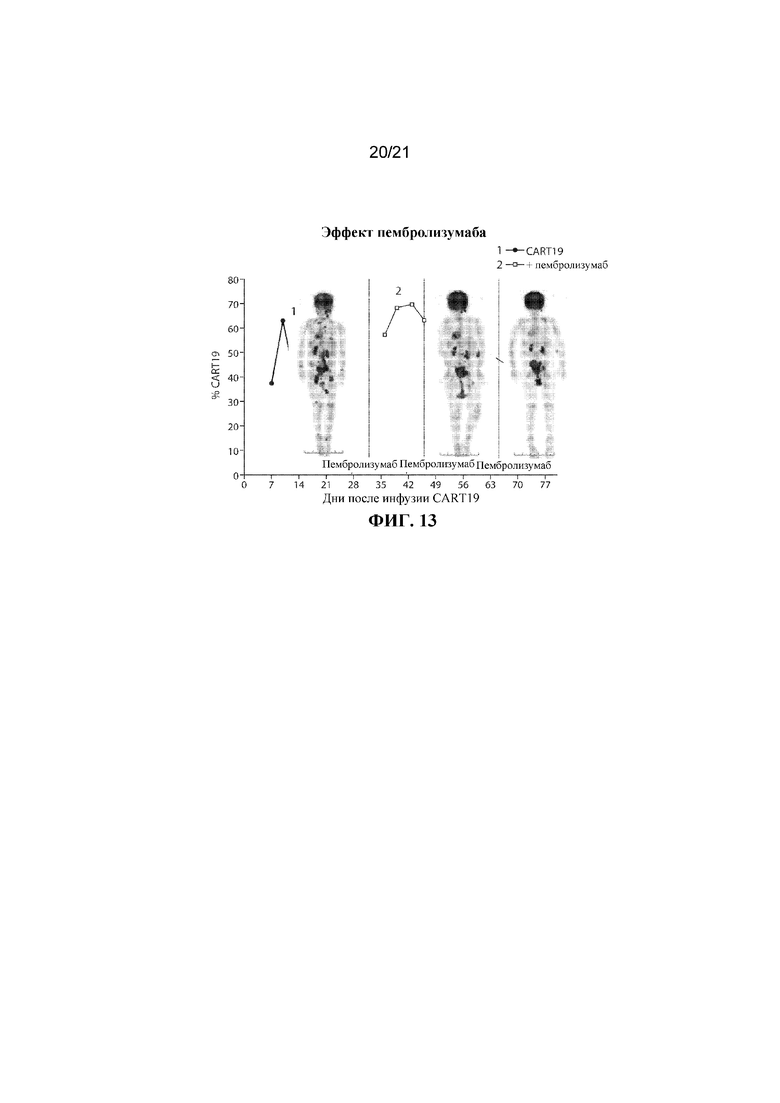

Изобретение относится к области биотехнологии, в частности к применению средства терапии химерным антигенным рецептором (CAR) для CD19, содержащего популяцию иммунных эффекторных клеток, экспрессирующих CAR для CD19, для лечения рака у субъекта в комбинации с ингибитором PD–1. Также раскрыт способ лечения субъекта, имеющего рак, включающий введение субъекту средства терапии CAR для CD19 и ингибитора PD–1. Изобретение эффективно для лечения рака. 2 н. и 93 з.п. ф-лы, 14 ил., 8 табл., 16 пр.
1. Применение средства терапии химерным антигенным рецептором (CAR) для CD19, содержащего популяцию иммунных эффекторных клеток, экспрессирующих CAR для CD19, для лечения рака у субъекта в комбинации с ингибитором PD–1, где указанная популяция иммунных эффекторных клеток содержит T-клетки или NK-клетки, где CAR для CD19 содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, где указанное средство терапии CAR для CD19 и ингибитор PD–1 вводят последовательно и где средство терапии CAR для CD19 вводят по меньшей мере за 2 дня, по меньшей мере за 3 дня, по меньшей мере за 4 дня, по меньшей мере за 5 дней, по меньшей мере за 6 дней, по меньшей мере за 7 дней, по меньшей мере за 8 дней, по меньшей мере за 9 дней, по меньшей мере за 10 дней, по меньшей мере за 11 дней, по меньшей мере за 12 дней, по меньшей мере за 13 дней или по меньшей мере за 2 недели до ингибитора PD-1.
2. Способ лечения субъекта, имеющего рак, включающий введение субъекту:
(i) средства терапии CAR для CD19, содержащего популяцию иммунных эффекторных клеток, экспрессирующих CAR для CD19, где указанная популяция иммунных эффекторных клеток содержит T-клетки или NK-клетки, где CAR для CD19 содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен; и
(ii) ингибитора PD–1,
где указанное средство терапии CAR для CD19 и ингибитор PD–1 вводят последовательно и где средство терапии CAR для CD19 вводят по меньшей мере за 2 дня, по меньшей мере за 3 дня, по меньшей мере за 4 дня, по меньшей мере за 5 дней, по меньшей мере за 6 дней, по меньшей мере за 7 дней, по меньшей мере за 8 дней, по меньшей мере за 9 дней, по меньшей мере за 10 дней, по меньшей мере за 11 дней, по меньшей мере за 12 дней, по меньшей мере за 13 дней или по меньшей мере за 2 недели до ингибитора PD-1.
3. Применение по п. 1 или способ по п. 2, где введение ингибитора PD-1 начинают через 20 дней или менее после введения средства терапии CAR.
4. Применение по п. 1 или 3 или способ по п. 2 или 3, где доза ингибитора PD–1 составляет от приблизительно 200 мг до приблизительно 450 мг.
5. Применение по любому из пп. 1 или 3, 4 или способ по любому из пп. 2-4, где введение ингибитора PD–1 начинается через 16 дней или меньше, 15 дней или меньше, 14 дней или меньше, 13 дней или меньше, 12 дней или меньше, 11 дней или меньше, 10 дней или меньше, 9 дней или меньше, 8 дней или меньше, 7 дней или меньше, 6 дней или меньше, 5 дней или меньше, 4 дня или меньше, 3 дня или меньше, 2 дня или меньше после введения средства терапии CAR.
6. Применение по любому из пп. 1 или 3-5 или способ по любому из пп. 2-5, где введение ингибитора PD–1 начинается после того, как субъект будет иметь или будет идентифицирован как имеющий одно или несколько из следующего:
(a) частичного или невыявляемого ответа на терапию CAR,
(b) рецидивирующего рака после терапии CAR,
(c) рака, резистентного в отношении терапии CAR,
(d) прогрессирующей формы рака после терапии CAR или
(e) восстановления популяции B–клеток после терапии CAR.
7. Применение по любому из пп. 1 или 3-5 или способ по любому из пп. 2-5, где субъект не имеет или не был идентифицирован как имеющий одно или несколько из следующего:
(a) частичного или невыявляемого ответа на терапию CAR,
(b) рецидивирующего рака после терапии CAR,
(c) рака, резистентного в отношении терапии CAR,
(d) прогрессирующей формы рака или
(e) восстановления популяции B–клеток после терапии CAR.
8. Применение по любому из пп. 1 или 3-7 или способ по любому из пп. 2-7, дополнительно предусматривающие введение 1, 2, 3, 4 или 5 или больше последующих доз ингибитора PD–1.
9. Применение или способ по п. 8, где вводятся до 6 доз ингибитора PD–1.
10. Применение по любому из пп. 1 или 3-9 или способ по любому из пп. 2-9, дополнительно включающие оценивание наличия или отсутствия синдрома высвобождения цитокинов (CRS) у субъекта.
11. Применение по любому из пп. 1 или 3-10 или способ по любому из пп. 2-10, где субъект не имеет или идентифицирован как не имеющий CRS после терапии CAR.
12. Применение или способ по п. 10 или 11, где введение ингибитора PD–1 начинается после того, как субъект будет идентифицирован как не имеющий CRS после терапии CAR.
13. Применение или способ по любому из пп. 10-12, где CRS представляет собой тяжелый CRS или CRS 3 степени или 4 степени.
14. Применение или способ по любому из пп. 10-13, где введение ингибитора PD–1 начинается после лечения CRS после терапии CAR.
15. Применение по любому из пп. 1 или 3-14 или способ по любому из пп. 2-14, где средство терапии CAR и ингибитор PD–1 вводятся в рамках интервала лечения и где интервал лечения предусматривает однократную дозу ингибитора PD–1 и однократную дозу клетки, экспрессирующей CAR.
16. Применение или способ по п. 15, где интервал лечения начинается после введения дозы средства терапии CAR и завершается после введения дозы ингибитора PD–1.
17. Применение или способ по п. 15 или 16, где интервал лечения дополнительно предусматривает введение 1, 2, 3, 4 или 5 или больше последующих доз ингибитора PD–1.
18. Применение или способ по п. 17, где на протяжении интервала лечения вводятся до 6 доз ингибитора PD–1.
19. Применение или способ по любому из пп. 15-18, где интервал лечения повторяется еще 1, 2, 3, 4 или 5 раз.
20. Применение или способ по любому из пп. 15-19, где за интервалом лечения следуют 1, 2, 3, 4 или 5 последующих интервалов лечения.
21. Применение или способ по п. 20, где один или несколько последующих интервалов лечения отличаются от первого или предыдущего интервала лечения.
22. Применение или способ по п. 19 или 20, где один или несколько последующих интервалов лечения проводятся через по меньшей мере 1 день, по меньшей мере 2 дня, по меньшей мере 3 дня, по меньшей мере 4 дня, по меньшей мере 5 дней, по меньшей мере 6 дней, по меньшей мере 7 дней, по меньшей мере 2 недели, по меньшей мере 1 месяц, по меньшей мере 3 месяца, по меньшей мере 6 месяцев или по меньшей мере 1 год после завершения первого или предыдущего интервала лечения.
23. Применение или способ по любому из пп. 15-22, где 1, 2, 3, 4 или 5 или больше доз ингибитора PD–1 вводятся после завершения одного или нескольких интервалов лечения.
24. Применение или способ по любому из пп. 15-23, где доза ингибитора PD–1 вводится один раз в 5 дней, 6 дней, 7 дней, 10 дней, 2 недели, 3 недели или 4 недели после завершения одного или нескольких интервалов лечения.
25. Применение или способ по любому из пп. 15-24, где интервал лечения предусматривает дозу средства терапии CAR, вводимую за 2–20 дней, 5–17 дней, 7–16 дней, 8–16 дней, 10–15 дней, 14–21 день или 2–3 недели до введения дозы ингибитора PD–1, и где интервал лечения повторяется 0–52 раза, и где интервалы лечения начинаются через по меньшей мере 1 день, по меньшей мере 2 дня, по меньшей мере 3 дня, по меньшей мере 4 дня, по меньшей мере 5 дней, по меньшей мере 6 дней, по меньшей мере 7 дней, по меньшей мере 2 недели, по меньшей мере 1 месяц, по меньшей мере 3 месяца, по меньшей мере 6 месяцев или по меньшей мере 1 год после завершения предыдущего интервала лечения.
26. Применение или способ по п. 25, где одна или несколько последующих доз ингибитора PD–1 вводятся один раз в 5 дней, 7 дней, 2 недели, 3 недели или 4 недели после второго интервала лечения.
27. Применение по любому из пп. 1 или 3-14 или способ по любому из пп. 2-14, где субъекту вводится однократная доза клетки, экспрессирующей CAR, и однократная доза ингибитора PD–1.
28. Применение или способ по п. 27, где однократная доза клетки, экспрессирующей CAR, вводится за по меньшей мере 2 дня, по меньшей мере 3 дня, по меньшей мере 4 дня, по меньшей мере 5 дней, по меньшей мере 6 дней, по меньшей мере 7 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 11 дней, по меньшей мере 12 дней, по меньшей мере 13 дней, по меньшей мере 14 дней, по меньшей мере 15 дней, по меньшей мере 16 дней, по меньшей мере 17 дней, по меньшей мере 18 дней, по меньшей мере 19 дней или по меньшей мере 20 дней до введения однократной дозы ингибитора PD–1.
29. Применение или способ по п. 27 или 28, где средство терапии CAR содержит молекулу РНК, кодирующую CAR, и где 1, 2, 3, 4 или 5 последующих доз средства терапии CAR вводятся субъекту после начальной дозы средства терапии CAR.
30. Применение или способ по п. 29, где одна или несколько последующих доз клетки, экспрессирующей CAR, вводятся через по меньшей мере 2 дня, по меньшей мере 3 дня, по меньшей мере 4 дня, по меньшей мере 5 дней, по меньшей мере 6 дней, по меньшей мере 7 дней, по меньшей мере 2 недели или по меньшей мере 3 недели после предыдущей дозы клетки, экспрессирующей CAR.
31. Применение или способ по любому из пп. 19-27, где 1, 2, 3, 4 или 5 или больше последующих доз ингибитора PD–1 вводятся после введения однократной дозы ингибитора PD–1.
32. Применение или способ по п. 31, где одна или несколько последующих доз ингибитора PD–1 вводятся через по меньшей мере 5 дней, 7 дней, 2 недели, 3 недели или 4 недели после предыдущей дозы ингибитора PD–1.
33. Применение или способ по п. 31 или 32, где одна или несколько последующих доз ингибитора PD–1 вводятся через по меньшей мере 1, 2, 3, 4, 5, 6 или 7 дней, или 2 недели, или 3 недели после дозы средства терапии CAR.
34. Применение или способ по любому из пп. 16-30, где введение одной или нескольких доз клетки, экспрессирующей CAR, и одной или нескольких доз ингибитора PD–1 повторяется.
35. Применение по любому из пп. 1 или 3-34 или способ по любому из пп. 2-34, где средство терапии CAR содержит дозу клеток, экспрессирующих CAR, содержащую
(i) от приблизительно 104 до приблизительно 109 клеток/кг, от приблизительно 104 до приблизительно 105 клеток/кг, от приблизительно 105 до приблизительно 106 клеток/кг, от приблизительно 106 до приблизительно 107 клеток/кг, от приблизительно 107 до приблизительно 108 клеток/кг, от приблизительно 108 до приблизительно 109 клеток/кг или от приблизительно 1–5×107 до приблизительно 1–5×108 клеток/кг;
(ii) приблизительно 1–5×107 клеток/кг; или
(iii) приблизительно 1–5×108 клеток/кг.
36. Применение по любому из пп. 1 или 3-35 или способ по любому из пп. 2-35, где доза ингибитора PD–1 составляет 1–30 мг/кг, между 1 и 25 мг/кг, между 2 и 20 мг/кг, между 2 и 5 мг/кг или приблизительно 2 мг/кг, приблизительно 3 мг/кг, приблизительно 4 мг/кг или приблизительно 5 мг/кг.
37. Применение или способ по п. 36, где доза ингибитора PD–1 составляет приблизительно 1–20 мг/кг или приблизительно 2–5 мг/кг один раз в 2 недели, 3 недели, 4 недели или 5 недель.
38. Применение по любому из пп. 1 или 3-35 или способ по любому из пп. 2-36, где доза ингибитора PD–1 составляет от приблизительно 200 до приблизительно 450 мг, от приблизительно 200 до приблизительно 400 мг или от приблизительно 300 до приблизительно 400 мг один раз в 2 недели, 3 недели, 4 недели или 5 недель.
39. Применение по п. 38 или способ по п. 38, где доза ингибитора PD–1 составляет приблизительно 200 мг или приблизительно 300 мг один раз в 3 недели путем внутривенной инфузии.
40. Применение по п. 39 или способ по п. 39, где доза ингибитора PD–1 составляет приблизительно 400 мг один раз в 4 недели путем внутривенной инфузии.
41. Применение по любому из пп. 1 или 3-35 или способ по любому из пп. 2-35, где ингибитор PD–1 представляет собой молекулу антитела к PD–1 и вводится в дозе приблизительно 300 мг один раз в 2 недели, 3 недели или 4 недели, а средство терапии CAR вводится в дозе 1–5×108 клеток.
42. Применение по любому из пп. 1 или 3-41 или способ по любому из пп. 2-41, где ингибитор PD–1 включает в себя молекулу антитела, малую молекулу, полипептид или ингибирующую нуклеиновую кислоту.
43. Применение по любому из пп. 1 или 3-42 или способ по любому из пп. 2-42, где ингибитор PD–1 характеризуется одним или несколькими из следующего:
a) ингибирует или снижает экспрессию PD–1;
b) ингибирует или снижает активность PD–1;
c) ингибирует или снижает связывание PD–1 с PD–L1 или PD–L2; или
d) связывается с PD–1 или с PD–L1 или PD–L2.
44. Применение по любому из пп. 1 или 3-43 или способ по любому из пп. 2-43, где ингибитор PD–1 представляет собой молекулу антитела.
45. Применение по любому из пп. 1 или 3-44 или способ по любому из пп. 2-44, где ингибитор PD–1 выбран из группы, состоящей из BGB-A317, ниволумаба, пембролизумаба, PDR001, пидилизумаба, AMP–514, AMP–224, MEDI0680, REGN-2810, TSR-042, PF-06801591, BGB-108, INCSHR1210, BAP049, BAP049-chi, BAP049-chi-Y, BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D и BAP049-Clone-E.
46. Применение по любому из пп. 1 или 3-45 или способ по любому из пп. 2-45, где ингибитор PD–1 включает в себя молекулу антитела к PD–1, содержащую:
a) область 1, определяющую комплементарность, тяжелой цепи (CDR1 HC), область 2, определяющую комплементарность, тяжелой цепи (CDR2 HC) и область 3, определяющую комплементарность, тяжелой цепи (CDR3 HC) вариабельной области тяжелой цепи, содержащей любую из аминокислотных последовательностей SEQ ID NO: 142, 144, 154, 158, 172, 184, 216 или 220; и
b) область 1, определяющую комплементарность, легкой цепи (CDR1 LC), область 2, определяющую комплементарность, легкой цепи (CDR2 LC) и область 3, определяющую комплементарность, легкой цепи (CDR3 LC) вариабельной области легкой цепи, содержащей любую из аминокислотных последовательностей SEQ ID NO: 152, 162, 168, 176, 180, 188, 192, 196, 200, 204, 208 или 212.
47. Применение или способ по п. 46, где молекула антитела к PD–1 содержит:
a) аминокислотную последовательность CDR1 НС, выбранную из SEQ ID NO: 137 или 140, аминокислотную последовательность CDR2 НС под SEQ ID NO: 138 или 141 и аминокислотную последовательность CDR3 НС под SEQ ID NO: 139; и
b) аминокислотную последовательность CDR1 LС под SEQ ID NO: 146 или 149, аминокислотную последовательность CDR2 LС под SEQ ID NO: 147 или 150 и аминокислотную последовательность CDR3 LС под SEQ ID NO: 148, 151, 166 или 167.
48. Применение или способ по п. 46 или 47, где молекула антитела к PD–1 содержит вариабельную область тяжелой цепи, содержащую:
i) аминокислотную последовательность любой из SEQ ID NO: 142, 144, 154, 158, 172, 184, 216 или 220;
ii) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций по сравнению с аминокислотной последовательностью любой из SEQ ID NO: 142, 144, 154, 158, 172, 184, 216 или 220; или
iii) аминокислотную последовательность, на 95–99% идентичную аминокислотной последовательности любой из SEQ ID NO: 142, 144, 154, 158, 172, 184, 216 или 220.
49. Применение или способ по любому из пп. 46-48, где молекула антитела к PD–1 содержит тяжелую цепь, содержащую:
i) аминокислотную последовательность любой из SEQ ID NO: 156, 160, 174, 186, 218, 222, 225 или 236;
ii) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций по отношению к любой из SEQ ID NO: 156, 160, 174, 186, 218, 222, 225 или 236; или
iii) аминокислотную последовательность, на 95–99% идентичную аминокислотной последовательности любой из SEQ ID NO: 156, 160, 174, 186, 218, 222, 225 или 236.
50. Применение или способ по любому из пп. 46-49, где молекула антитела к PD–1 содержит вариабельную область легкой цепи, содержащую:
i) аминокислотную последовательность любой из SEQ ID NO: 152, 162, 168, 176, 180, 188, 192, 196, 200, 204, 208, или 212;
ii) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций по сравнению с аминокислотной последовательностью любой из SEQ ID NO: 152, 162, 168, 176, 180, 188, 192, 196, 200, 204, 208 или 212; или
iii) аминокислотную последовательность, на 95–99% идентичную аминокислотной последовательности любой из SEQ ID NO: 152, 162, 168, 176, 180, 188, 192, 196, 200, 204, 208 или 212.
51. Применение или способ по любому из пп. 46-50, где молекула антитела к PD–1 содержит легкую цепь, содержащую:
i) аминокислотную последовательность любой из SEQ ID NO: 164, 170, 178, 182, 190, 194, 198, 202, 206, 210 или 214;
ii) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций по отношению к любой из SEQ ID NO: 164, 170, 178, 182, 190, 194, 198, 202, 206, 210 или 214; или
iii) аминокислотную последовательность, на 95–99% идентичную аминокислотной последовательности любой из SEQ ID NO: 164, 170, 178, 182, 190, 194, 198, 202, 206, 210, или 214.
52. Применение или способ по любому из пп. 46-51, где молекула антитела к PD–1 содержит:
i) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 204;
ii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 142 или 144, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 152;
iii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 154 или 158, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 162;
iv) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 154 или 158, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 168;
v) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 176;
vi) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 180;
vii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 184, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 180;
viii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 184, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 188;
ix) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 188;
x) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 192;
xi) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 196;
xii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 184, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 200;
xiii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 200;
xiv) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 184, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 204;
xv) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 204;
xvi) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 208;
xvii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 212;
xviii) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 216, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 204;
xix) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 216, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 200; или
xx) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 220, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 200.
53. Применение или способ по любому из пп. 46-52, где молекула антитела к PD–1 содержит:
i) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 225, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 206;
ii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 144, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 152;
iii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 156 или 160, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 164;
iv) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 156 или 160, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 170;
v) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 178;
vi) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 182;
vii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 186, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 182;
viii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 186, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 190;
ix) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 190;
x) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 194;
xi) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 198;
xii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 186, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 202;
xiii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 202;
xiv) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 186, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 206;
xv) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 206;
xvi) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 210;
xvii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 174, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 214;
xviii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 218, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 206;
xix) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 218, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 202;
xx) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 222, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 202;
xxi) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 225, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 178;
xxii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 225, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 190;
xxiii) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 225, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 202; или
xxiv) тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 236, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 206.
54. Применение или способ по любому из пп. 46-53, где ингибитор PD–1 включает в себя молекулу антитела к PD–1, содержащую вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 172, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 204.
55. Применение или способ по п. 54, где молекула антитела к PD–1 содержит:
(i) вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 503, аминокислотную последовательность VHCDR2 под SEQ ID NO: 504 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 505; и
(ii) вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 500, аминокислотную последовательность VLCDR2 под SEQ ID NO: 501 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 502,
или аминокислотную последовательность, идентичную им на по меньшей мере 85%, 90%, 95% или больше.
56. Применение по любому из пп. 1 или 3-55 или способ по любому из пп. 2-55, где CD19–связывающий домен содержит вариабельную область тяжелой цепи, содержащую область 1, определяющую комплементарность, тяжелой цепи (CDR1 HC), область 2, определяющую комплементарность, тяжелой цепи (CDR2 HC) и область 3, определяющую комплементарность, тяжелой цепи (CDR3 HC) любого связывающего домена тяжелой цепи CD19; и вариабельную область легкой цепи, содержащую область 1, определяющую комплементарность, легкой цепи (CDR1 LC), область 2, определяющую комплементарность, легкой цепи (CDR2 LC) и область 3, определяющую комплементарность, легкой цепи (CDR3 LC) любого связывающего домена легкой цепи CD19, где
(i) CD19-связывающий домен содержит аминокислотную последовательность любой из SEQ ID NO: 45, 69, 93, 46, 70, 94, 47, 71, 95, 48, 72, 96, 49, 73, 97, 50, 74, 98, 51, 75, 99, 52, 76, 100, 53, 77, 101, 54, 78, 102, 55, 79, 103, 56, 80, 104, 106, 108, 109, 110, 111, 112, 113, 114, 115 или 116;
(ii) CD19-связывающий домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности любой из SEQ ID NO: 45, 69, 93, 46, 70, 94, 47, 71, 95, 48, 72, 96, 49, 73, 97, 50, 74, 98, 51, 75, 99, 52, 76, 100, 53, 77, 101, 54, 78, 102, 55, 79, 103, 56, 80, 104, 106, 108, 109, 110, 111, 112, 113, 114, 115 или 116;
(iii) CD19-связывающий домен содержит аминокислотную последовательность, содержащую последовательность, по меньшей мере на 95% идентичную аминокислотной последовательности любой из SEQ ID NO: 45, 69, 93, 46, 70, 94, 47, 71, 95, 48, 72, 96, 49, 73, 97, 50, 74, 98, 51, 75, 99, 52, 76, 100, 53, 77, 101, 54, 78, 102, 55, 79, 103, 56, 80, 104, 106, 108, 109, 110, 111, 112, 113, 114, 115 или 116;
(iv) вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 287, вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO: 288;
(v) вариабельная область тяжелой цепи содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 287, и вариабельная область легкой цепи содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 288; или
(vi) вариабельная область тяжелой цепи содержит аминокислотную последовательность, содержащую последовательность, по меньшей мере на 95% идентичную аминокислотной последовательности SEQ ID NO: 287, и вариабельная область легкой цепи содержит аминокислотную последовательность, содержащую последовательность, по меньшей мере на 95% идентичную аминокислотной последовательности SEQ ID NO: 288.
57. Применение или способ по п. 56, где CD19–связывающий домен содержит CDR1 HC, CDR2 HC и CDR3 HC согласно любой из SEQ ID NO: 117-122 и CDR1 LC, CDR2 LC и CDR3 LC согласно любой из SEQ ID NO: 123-125.
58. Применение по любому из пп. 1 или 3-57 или способ по любому из пп. 2-57, где CD19–связывающий домен содержит:
a) аминокислотную последовательность любой вариабельной области тяжелой цепи CD19–связывающего домена, содержащую аминокислотную последовательность любой из SEQ ID NO: 45, 69, 93, 46, 70, 94, 47, 71, 95, 48, 72, 96, 49, 73, 97, 50, 74, 98, 51, 75, 99, 52, 76, 100, 53, 77, 101, 54, 78, 102, 55, 79, 103, 56, 80, 104, 106, 108, 109, 110, 111, 112, 113, 114, 115 или 116;
b) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций по сравнению с аминокислотной последовательностью любой вариабельной области тяжелой цепи CD19–связывающего домена, содержащей аминокислотную последовательность любой из SEQ ID NO: 45, 69, 93, 46, 70, 94, 47, 71, 95, 48, 72, 96, 49, 73, 97, 50, 74, 98, 51, 75, 99, 52, 76, 100, 53, 77, 101, 54, 78, 102, 55, 79, 103, 56, 80, 104, 106, 108, 109, 110, 111, 112, 113, 114, 115 или 116; или
c) аминокислотную последовательность, на по меньшей мере 95% идентичную аминокислотной последовательности любой вариабельной области тяжелой цепи CD19–связывающего домена, содержащей аминокислотную последовательность любой из SEQ ID NO: 45, 69, 93, 46, 70, 94, 47, 71, 95, 48, 72, 96, 49, 73, 97, 50, 74, 98, 51, 75, 99, 52, 76, 100, 53, 77, 101, 54, 78, 102, 55, 79, 103, 56, 80, 104, 106, 108, 109, 110, 111, 112, 113, 114, 115 или 116.
59. Применение по любому из пп. 1 или 3-58 или способ по любому из пп. 2-58, где CD19–связывающий домен содержит:
a) аминокислотную последовательность любой тяжелой цепи CD19–связывающего домена, содержащую аминокислотную последовательность любой из SEQ ID NO: 45, 69, 93, 46, 70, 94, 47, 71, 95, 48, 72, 96, 49, 73, 97, 50, 74, 98, 51, 75, 99, 52, 76, 100, 53, 77, 101, 54, 78, 102, 55, 79, 103, 56, 80, 104, 106, 108, 109, 110, 111, 112, 113, 114, 115 или 116;
b) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций по отношению к любой тяжелой цепи CD19–связывающего домена, содержащей аминокислотную последовательность любой из SEQ ID NO: 45, 69, 93, 46, 70, 94, 47, 71, 95, 48, 72, 96, 49, 73, 97, 50, 74, 98, 51, 75, 99, 52, 76, 100, 53, 77, 101, 54, 78, 102, 55, 79, 103, 56, 80, 104, 106, 108, 109, 110, 111, 112, 113, 114, 115 или 116; или
c) аминокислотную последовательность, на по меньшей мере 95% идентичную аминокислотной последовательности любой тяжелой цепи CD19–связывающего домена, содержащей аминокислотную последовательность любой из SEQ ID NO: 45, 69, 93, 46, 70, 94, 47, 71, 95, 48, 72, 96, 49, 73, 97, 50, 74, 98, 51, 75, 99, 52, 76, 100, 53, 77, 101, 54, 78, 102, 55, 79, 103, 56, 80, 104, 106, 108, 109, 110, 111, 112, 113, 114, 115 или 116.
60. Применение по любому из пп. 1 или 3-59 или способ по любому из пп. 2-59, где CD19–связывающий домен содержит:
a) аминокислотную последовательность любой вариабельной области легкой цепи CD19–связывающего домена, содержащую аминокислотную последовательность любой из SEQ ID NO: 45, 69, 93, 46, 70, 94, 47, 71, 95, 48, 72, 96, 49, 73, 97, 50, 74, 98, 51, 75, 99, 52, 76, 100, 53, 77, 101, 54, 78, 102, 55, 79, 103, 56, 80, 104, 106, 108, 109, 110, 111, 112, 113, 114, 115 или 116;
b) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций по сравнению с аминокислотной последовательностью любой вариабельной области легкой цепи CD19–связывающего домена, содержащей аминокислотную последовательность любой из SEQ ID NO: 45, 69, 93, 46, 70, 94, 47, 71, 95, 48, 72, 96, 49, 73, 97, 50, 74, 98, 51, 75, 99, 52, 76, 100, 53, 77, 101, 54, 78, 102, 55, 79, 103, 56, 80, 104, 106, 108, 109, 110, 111, 112, 113, 114, 115 или 116; или
c) аминокислотную последовательность, на по меньшей мере 95% идентичную аминокислотной последовательности любой вариабельной области легкой цепи CD19–связывающего домена, содержащей аминокислотную последовательность любой из SEQ ID NO: 45, 69, 93, 46, 70, 94, 47, 71, 95, 48, 72, 96, 49, 73, 97, 50, 74, 98, 51, 75, 99, 52, 76, 100, 53, 77, 101, 54, 78, 102, 55, 79, 103, 56, 80, 104, 106, 108, 109, 110, 111, 112, 113, 114, 115 или 116.
61. Применение по любому из пп. 1 или 3-60 или способ по любому из пп. 2-60, где CD19–связывающий домен содержит:
a) аминокислотную последовательность любой легкой цепи CD19–связывающего домена, содержащую аминокислотную последовательность любой из SEQ ID NO: 45, 69, 93, 46, 70, 94, 47, 71, 95, 48, 72, 96, 49, 73, 97, 50, 74, 98, 51, 75, 99, 52, 76, 100, 53, 77, 101, 54, 78, 102, 55, 79, 103, 56, 80, 104, 106, 108, 109, 110, 111, 112, 113, 114, 115 или 116;
b) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций по отношению к любой легкой цепи CD19–связывающего домена, содержащей аминокислотную последовательность любой из SEQ ID NO: 45, 69, 93, 46, 70, 94, 47, 71, 95, 48, 72, 96, 49, 73, 97, 50, 74, 98, 51, 75, 99, 52, 76, 100, 53, 77, 101, 54, 78, 102, 55, 79, 103, 56, 80, 104, 106, 108, 109, 110, 111, 112, 113, 114, 115 или 116; или
c) аминокислотную последовательность, на по меньшей мере 95% идентичную аминокислотной последовательности любой легкой цепи CD19–связывающего домена, содержащей аминокислотную последовательность любой из SEQ ID NO: 45, 69, 93, 46, 70, 94, 47, 71, 95, 48, 72, 96, 49, 73, 97, 50, 74, 98, 51, 75, 99, 52, 76, 100, 53, 77, 101, 54, 78, 102, 55, 79, 103, 56, 80, 104, 106, 108, 109, 110, 111, 112, 113, 114, 115 или 116.
62. Применение по любому из пп. 1 или 3-61 или способ по любому из пп. 2-61, где CD19–связывающий домен содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, где CD19–связывающий домен содержит аминокислотную последовательность любой из SEQ ID NO: 45-56, 109, 110, 112 или 115.
63. Применение по любому из пп. 1 или 3-62 или способ по любому из пп. 2-62, где CD19–связывающий домен содержит:
a) аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 109, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 110, SEQ ID NO: 112 или SEQ ID NO: 115;
b) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций по сравнению с любой из SEQ ID NO: 109, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 110, SEQ ID NO: 112 или SEQ ID NO: 115; или
c) аминокислотную последовательность, на по меньшей мере 95% идентичную аминокислотной последовательности под любым из SEQ ID NO: 109, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 110, SEQ ID NO: 112 или SEQ ID NO: 115.
64. Применение по любому из пп. 1 или 3-63 или способ по любому из пп. 2-63, где трансмембранный домен включает в себя трансмембранный домен белка, выбранного из группы, состоящей из альфа–, бета– или дзета–цепи T–клеточного рецептора, CD28, CD3–эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154.
65. Применение по любому из пп. 1 или 3-64 или способ по любому из пп. 2-64, где трансмембранный домен содержит:
(i) аминокислотную последовательность под SEQ ID NO: 6,
(ii) аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций по отношению к аминокислотной последовательности под SEQ ID NO: 6, или
(iii) последовательность, на по меньшей мере 95% идентичную аминокислотной последовательности под SEQ ID NO: 6.
66. Применение по любому из пп. 1 или 3-65 или способ по любому из пп. 2-65, где CD19–связывающий домен соединен с трансмембранным доменом с помощью шарнирной области.
67. Применение по любому из пп. 1 или 3-66 или способ по любому из пп. 2-66, где шарнирная область содержит SEQ ID NO: 2 или последовательность, на по меньшей мере 95% идентичную ей.
68. Применение по любому из пп. 1 или 3-67 или способ по любому из пп. 2-67, где внутриклеточный сигнальный домен содержит костимулирующий сигнальный домен, включающий в себя функциональный сигнальный домен, полученный из белка, выбранного из группы, состоящей из молекулы MHC I класса, белкового рецептора TNF, иммуноглобулиноподобного белка, рецептора цитокина, интегрина, сигнальной молекулы активации лимфоцитов (белка SLAM), активирующего рецептора NK–клеток, BTLA, лиганда Toll–подобного рецептора, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM–1, LFA–1 (CD11a/CD18), 4–1BB (CD137), B7–H3, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8–альфа, CD8–бета, IL2R–бета, IL2R–гамма, IL7R–альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA–6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA–1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA–1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB–A, Ly108), SLAM (SLAMF1, CD150, IPO–3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP–76, PAG/Cbp, CD19a и лиганда, который специфично связывается с CD83.
69. Применение или способ по п. 68, где костимулирующий сигнальный домен содержит аминокислотную последовательность под SEQ ID NO: 7, или аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций по отношению к аминокислотной последовательности под SEQ ID NO: 7, или аминокислотную последовательность, на по меньшей мере 95% идентичную аминокислотной последовательности под SEQ ID NO: 7.
70. Применение по любому из пп. 1 или 3-69 или способ по любому из пп. 2-69, где внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4–1BB и/или функциональный сигнальный домен CD3–дзета.
71. Применение по любому из пп. 1 или 3-70 или способ по пп. 2-70, где внутриклеточный сигнальный домен содержит аминокислотную последовательность под SEQ ID NO: 7 и/или аминокислотную последовательность под SEQ ID NO: 9 или SEQ ID NO: 10; или аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций по отношению к аминокислотной последовательности под SEQ ID NO: 7 и/или аминокислотной последовательности под SEQ ID NO: 9 или SEQ ID NO: 10; или аминокислотную последовательность, на по меньшей мере 95% идентичную аминокислотной последовательности под SEQ ID NO: 7 и/или аминокислотной последовательности под SEQ ID NO: 9 или SEQ ID NO: 10.
72. Применение по любому из пп. 1 или 3-71 или способ по любому из пп. 2-71, где внутриклеточный сигнальный домен содержит аминокислотную последовательность под SEQ ID NO: 7 и аминокислотную последовательность под SEQ ID NO: 9 или SEQ ID NO: 10, где аминокислотные последовательности, образующие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде одной полипептидной цепи.
73. Применение по любому из пп. 1 или 3-72 способ по любому из пп. 2-72, где CAR дополнительно содержит лидерную последовательность, включающую в себя аминокислотную последовательность под SEQ ID NO: 1.
74. Применение по любому из пп. 1 или 3-73 или способ по любому из пп. 2-73, где CAR содержит:
(i) аминокислотную последовательность под любым из SEQ ID NO: 108; SEQ ID NO: 93; SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 111, SEQ ID NO: 114 или SEQ ID NO: 116;
(ii) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций по сравнению с любой из SEQ ID NO: 108; SEQ ID NO: 93; SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 111, SEQ ID NO: 114 или SEQ ID NO: 116; или
(iii) аминокислотную последовательность, на по меньшей мере 95% идентичную любой из SEQ ID NO: 108; SEQ ID NO: 93; SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 111, SEQ ID NO: 114 или SEQ ID NO: 116.
75. Применение по любому из пп. 1 или 3-74 или способ по любому из пп. 2-74, где клетка, содержащая CAR, содержит нуклеиновую кислоту, кодирующую CAR.
76. Применение или способ по п. 75, где нуклеиновая кислота, кодирующая CAR, представляет собой лентивирусный вектор.
77. Применение или способ по п. 75 или 76, где нуклеиновая кислота, кодирующая CAR, вводится в клетки посредством лентивирусной трансдукции.
78. Применение или способ по любому из пп. 75-77, где нуклеиновая кислота, кодирующая CAR, представляет собой РНК.
79. Применение или способ по п. 78, где нуклеиновая кислота, кодирующая CAR, вводится в клетки посредством электропорации.
80. Применение по любому из пп. 1 или 3-79 или способ по любому из пп. 2-79, где Т–клетка представляет собой аутологичную или аллогенную Т–клетку.
81. Применение по любому из пп. 1 или 3-80 или способ по любому из пп. 2-80, дополнительно предусматривающие введение дополнительного противоракового средства.
82. Применение по любому из пп. 1 или 3-81 или способ по любому из пп. 2-81, где рак представляет собой гематологический рак.
83. Применение по любому из пп. 1 или 3-82 или способ по любому из пп. 2-82, где рак представляет собой лимфому или лейкоз.
84. Применение или способ по п. 83, где рак выбран из одного или нескольких из B–клеточного острого лимфобластного лейкоза (BALL), Т–клеточного острого лимфобластного лейкоза (TALL), мелкоклеточной лимфоцитарной лимфомы (SLL), острого лимфобластного лейкоза (ALL), хронического миелогенного лейкоза (CML), хронического лимфоцитарного лейкоза (CLL), мантийноклеточной лимфомы (MCL), B–клеточного пролимфоцитарного лейкоза, бластического новообразования из плазмацитоидных дендритных клеток, лимфомы Беркитта, диффузной крупноклеточной В–клеточной лимфомы (DLBCL), фолликулярной лимфомы, волосатоклеточного лейкоза, мелкоклеточной или крупноклеточной фолликулярной лимфомы, злокачественных лимфопролиферативных состояний, лимфомы MALT, лимфомы из клеток маргинальной зоны, множественной миеломы, миелодисплазии и миелодиспластического синдрома, неходжкинской лимфомы, лимфомы Ходжкина, плазмобластной лимфомы, новообразования из плазмацитоидных дендритных клеток или макроглобулинемии Вальденстрема.
85. Применение или способ по п. 83, где рак представляет собой острый лимфобластный лейкоз (ALL) или B–клеточную лимфому.
86. Применение или способ по п. 82, где рак представляет собой диффузную крупноклеточную В–клеточную лимфому (DLBCL).
87. Применение по любому из пп. 1 или 3-86 или способ по любому из пп. 2-86, где субъектом является млекопитающее.
88. Применение по любому из пп. 1 или 3-87 или способ по любому из пп. 2-87, где у субъекта экспрессируется PD–1, PD–L1 и/или PD–L2.
89. Применение или способ по п. 88, где раковая клетка или клетка в непосредственной близости от раковой клетки у субъекта экспрессирует PD–1, PD–L1 и/или PD–L2.
90. Применение или способ по п. 88 или 89, где раковая клетка получена из образца с DLBCL.
91. Применение по любому из пп. 1 или 3-90 или способ по любому из пп. 2-90, где клетка, экспрессирующая CAR, экспрессирует PD–1, PD–L1 и/или PD–L2.
92. Применение по любому из пп. 1 или 3-91 или способ по любому из пп. 2-91, где субъект имеет или идентифицирован как имеющий более высокие количество или процентную долю иммунных эффекторных клеток, экспрессирующих один, два, три или все из PD–1, LAG–3 или TIM–3, по сравнению с эталонным значением.
93. Применение или способ по п. 92, где субъект имеет или идентифицирован как имеющий более высокое количество: иммунных эффекторных клеток, экспрессирующих PD–1; иммунных эффекторных клеток, экспрессирующих PD–1 и LAG–3; иммунных эффекторных клеток, экспрессирующих PD–1 и TIM–3; или иммунных эффекторных клеток, экспрессирующих PD–1, TIM–3 и LAG–3.
94. Применение или способ по п. 92 или 93, где иммунные эффекторные клетки совместно экспрессируют CAR для CD19.
95. Способ по любому из пп. 2-94, где CD19–связывающий домен представляет собой аминокислотную последовательность под SEQ ID NO: 109 или где CAR содержит аминокислотную последовательность под SEQ ID NO: 108.
| WO 2014153270 A1, 25.09.2014 | |||
| TETSUYA NAKATSURA et al., Era of cancer immunotherapy has come, Jpn | |||
| J | |||
| Clin | |||
| Immunol., 2016, 39(3), 164-171 | |||
| LIZA B | |||
| JOHN et al., Anti-PD-1 Antibody Therapy Potently Enhances the Eradication of Established Tumors By Gene-Modified T Cells, Clin Cancer Res, 2013, Vol.19, N.20 | |||
| SCOTT J | |||
| ANTONIA, MD et al., |
Авторы
Даты
2023-12-07—Публикация
2017-07-28—Подача