Область техники
Изобретение относится к области медицины, а именно к лабораторной диагностике и может быть использовано в ревматологии для повышения точности измерения концентраций метаболитов метотрексата с целью прогнозирования лечебного эффекта метотрексата - препарата первой линии терапии при ревматоидном артрите и других воспалительных заболеваниях суставов.
Уровень техники
Метотрексат (МТ) - препарат, относящийся к группе антиметаболитов, в настоящее время считается основным («anchor drug») в лечении ревматоидного артрита (РА) и псориатического артрита (ПсА) [Dervieux T, Furst D, Lein DO, Capps R, Smith K, Walsh M, et al. Polyglutamation of methotrexate with common polymorphisms in reduced folate carrier, aminoimidazole carboxamide ribonucleotide transformylase, and thymidylate synthase are associated with methotrexate effects in rheumatoid arthritis. Arthritis Rheum 2004;50:2766-74]. Известно, что для достижения лечебного эффекта концентрация тетраглутамата метотрексата в эритоцитах больных ревматоидным артритом должна составлять 22,5 нмоль/л и более [Гриднева Г.И., Муравьев Ю.В., Демидова Н.В., Аронова Е.С., Баймеева Н.В. и соавт. Взаимосвязь между эффективностью метотрексата при ревматоидном артрите и достигнутым уровнем его полиглутаматов в эритроцитах (пилотное исследование). Научно-практическая ревматология. 2019;57(2):171-174. https://doi.org/10.14412/1995-4484-2019-171-174]. Для оценки терапевтического эффекта при приеме МТ важным является точное определение концентрации полиглутаматов метотрексата в эрироцитарной массе крови пациента с воспроизводимым результатом для обеспечения терапевтического контроля, позволяющего прогнозировать лечебный эффект. Однако, биохимическое определение концентрации полиглутаматов метотрексата характеризуется значительной вариабельностью результатов [Hroch M, Tukova J, Dolezalova P, Chladek J. An improved high-performance liquid chromatography method for quantification of methotrexate polyglutamates in red blood cells of children with juvenile idiopathic arthritis. Biopharm Drug Dispos 2009;30:138-48], которая обусловлена тем, что полиглутаматы метотрексата (МТПГ) являются нестойкими соединениями и могут терять глутаматные остатки при хранении, поскольку ферментативная активность в крови человека не теряется, и искажение результатов неизбежно [Stoop, M. P., Visser, S., van Dijk, E., Aerts, J. G., Stricker, B. H., & Luider, T. M. (2018). High and individually variable enzymatic activity precludes accurate determination of pemetrexed, methotrexate and their polyglutamate metabolite concentrations in plasma. Journal of pharmaceutical and biomedical analysis, 148, 89-92].
Из уровня техники известен способ терапевтического лекарственного мониторинга концентрации МТ в сыворотке крови у больных с онкологическими заболеваниями с применением метода флуоресцентно-поляризационного имунно-анализа [Стрижевская Александра Михайловна, Головня Е.Г., Кулешова И.С., Дзампаев А.З., Байкова В.Н. Терапевтический лекарственный мониторинг метотрексата при применении его в высоких дозах для лечения остеосаркомы у детей // Фармакокинетика и фармакодинамика. 2016. №1]. Однако данный способ, как и все способы с использованием ИФА, дает перекрестные реакции с метаболитами определяемого вещества из-за неспецифичности антител. Для определения каждого метаболита антитело должно быть специфично, для этого необходимы подбор и использование отдельных реагентов для каждого метаболита, что усложняет применение данного способа для определения концентрации МТПГ.
Известен способ определения концентрации полиглутаматов метотрексата методом тандемной хроматомасс-спектрометрии в сухой капле крови и плазме [Brady, K., Qu, Y., Stimson, D., Apilado, R., Vezza Alexander, R., Reddy, S., … & Dervieux, T. (2019). Transition of Methotrexate Polyglutamate Drug Monitoring Assay from Venipuncture to Capillary Blood-Based Collection Method in Rheumatic Diseases. The journal of applied laboratory medicine, 4(1), 40-49]. Однако для определения концентрации полиглутаматов метотрексата в объеме анализируемого образца требуется достаточно чувствительная аппаратура. Кроме того, получаемый результат является невоспроизводимым в связи с отсутствием в способе этапов пробоподготовки, предотвращающих распад метаболитов.
Известен способ определения концентрации полиглутаматов метотрексата методом капиллярного электрофореза и жидкостной хроматографии [Rubino F. M. Separation methods for methotrexate, its structural analogues and metabolites //Journal of Chromatography B: Biomedical Sciences and Applications. - 2001. - Т. 764. - №. 1-2. - С. 217-254]. Однако данный способ является достаточно трудоемким, требует использования сложного оборудования и наличия квалифицированного персонала.
Известно определение концентрации полиглутаматов метотрексата с помощью ВЭЖХ-МС-МС с использованием изотопно-меченных соединений [Hornung N, Ellingsen T, Attermann J, Stengaard-Pedersen K, Poulsen JH. Patients with rheumatoid arthritis treated with methotrexate (MTX): Concentrations of steady-state erythrocyte MTX correlate to plasma concentrations and clinical efficacy. J Rheumatol. 2008 Sep; 35(9):1709-1715. PubMed 18634162]. Данный способ является более чувствительным, поскольку учитывает все потери вещества во время экстракции. Однако проведение исследований с помощью изотопно-меченных соединений требует наличия специализированных клинико-диагностических лабораторий и высокой квалификации медицинского персонала.
Из известных методов биохимического определения концентрации полиглутаматов метотрексата (МТПГ) наиболее предпочтительным является использование масс-спектрометрии, сопряженной с жидкостной хроматографией (ВЭЖХ-МС-МС) - физико-химического метода определения вещества по отношению массы молекулы к заряду и времени выхода.
Наиболее близким к предлагаемому решению является способ измерения концентрации полиглутаматов метотрексата методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием (ВЭЖХ-МС-МС) [Гриднева Г.И., Муравьев Ю.В., Демидова Н.В., Аронова Е.С., Баймеева Н.В. и соавт. Взаимосвязь между эффективностью метотрексата при ревматоидном артрите и достигнутым уровнем его полиглутаматов в эритроцитах (пилотное исследование). Научно-практическая ревматология. 2019;57(2):171-174. https://doi.org/10.14412/1995-4484-2019-171-174], включающий забор венозной крови с последующим отделением образца эритроцитарной массы, и выделением из него полиглутаматов метотрексата посредством проведения реакции преципитации. Однако в данном способе не описан этап пробоподготовки, который является существенным для обеспечения воспроизводимости результатов измерений.
Технической проблемой является достоверное и воспроизводимое определение концентрации метаболитов МТ в образцах венозной крови пациентов.
Раскрытие изобретения
Техническим результатом изобретения является повышение точности и воспроизводимости результатов определения концентрации метаболитов МТ в образце крови пациента. Количественная оценка MTПГ обеспечивает проведение адекватной оценки клинической картины и составление прогноза результатов лечения ревматоидного артрита (РА) и псориатического артрита метотрексатом (МТ).
Кроме того, предлагаемый способ определения МТПГ в эритроцитах не уступает по точности способу с использованием изотопно-меченых стандартов, однако более прост в исполнении, не требует специально подготовленного персонала.
Технический результат достигается посредством реализации способа определения концентрации полиглутаматов метотрексата, включающего забор венозной крови пациента, отделение образца эритроцитарной массы, выделение из него полиглутаматов метотрексата посредством проведения реакции преципитации, и определение концентрации полиглутаматов метотрексата с помощью высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием (ВЭЖХ-МС-МС), при этом отделенный образец эритроцитарной массы перед выделением из него полиглутаматов метотрексата замораживают при температуре -80±2°С с последующим размораживанием при температуре 6-10°С, а реакцию преципитации проводят при температуре 6-10°С посредством введения в образец подкисленного ацетонитрила, его интенсивного перемешивания с последующим центрифугированием при 12000±10 rpm в течение 15±2 мин и отбора верхнего слоя, содержащего полиглутаматы метотрексата для последующего анализа на ВЭЖХ-МС-МС.
Для размораживания при температуре 6-10°С образец помещают на лед. Для проведения реакции преципитации реактивы предварительно охлаждают до температуры 6-10°С. Подкисленный ацетонитрил представляет собой 0,1 масс.% раствора муравьиной кислоты в ацетонитриле. Для проведения реакции преципитации используют 0,4 мл подкисленного ацетонитрила на 180±2 мкл образца. Отделение эритроцитарной массы от плазмы проводят центрифугированием со скоростью 3000±50 rpm в течение 15±2 мин. Интенсивное перемешивание проводят на вертикальном встряхивателе со скоростью 3000±50 rpm в течение 2±0,5 мин. Забор крови проводят не ранее чем через 36 часов после приема пациентом метатриксата (МТ).
Технический результат достигается за счет использования в предлагаемом способе этапа пробоподготовки, который позволяет на преаналитическом этапе и этапе подготовке пробы подавить ферментативную активность в образцах крови, температурную деградацию МТПГ, остановить конверсию МТПГ друг в друга, что обеспечивает точную оценку у больного принимающего МТ всей совокупности различных метаболитов МТ, их соотношение, в течение всего периода наблюдения за пациентом. Несоблюдение условий пробоподготовки повышают ошибку определения аналитического этапа.
Осуществление изобретения
Определение полиглутаминированных метаболитов метотрексата (МТПГ1, МТПГ2, МТПГ3, МТПГ4, МТПГ5) и активного метаболита метотрексата - 7-гидрокси-метотрексата (7-OH-МТ) в крови пациентов проводили методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием ВЭЖХ-МС-МС.
В процессе валидации и дальнейшего аналитического определения концентрации МТПГ применяли субстанции метотрексата, 7-гидрокси-метотрексата и полиглутаматных остатков метотрексата (1-5) производства Toronto research chemical (Канада). При проведении исследований были использованы муравьиная кислота и ацетонитрил для ВЖХ (hplc grad), производства Acros Organics (Бельгия).
Валидацию предлагаемого способа проводили с помощью калибровочных кривых, для построения которых использовали образцы контроля качества (QC), приготовленные последовательным растворением навески субстанции препарата в ацетонитриле с последующим разбавлением до определенных значений концентраций с заданным шагом. Для построения калибровочной зависимости глутаматов метотрексата применяли калибровочные стандарты 0,5, 1, 1,25, 2,5, 5, 10, 25, 50, 100 нмоль/л, образцы контроля качества (QC) 1,5 нг/мл (Low QC), 12,5 нг/мл (Medium QC) и 75 нмоль/л (High QC). В качестве внутреннего стандарта применяли индометацин, концентрация в пробах которого составляла 10 нмоль/л.
Ниже придавлено более детальное описание предлагаемого способа, которое не ограничивает объем притязаний предлагаемого изобретения, а демонстрирует возможность осуществления изобретения с достижением предлагаемого технического результата.
Преаналитический этап включает забор образцов венозной крови в пробирки для гематологических исследований с K3ЭДТА, строго до метки. Забор биообразцов осуществляют в комнате с комфортной температурой для пациента 22±2°С. После забора кровь перемешивают плавными движениями 8-10 раз и помещают в центрифугу для разделения эритроцитарной массы и плазмы (3000±50 rpm, в течение 15±2 мин). После центрифугирования отделяют и удаляют плазму, эритроцитарную массу замораживают при -80±2°С, с последующей передачей в лабораторию для исследования. Для предотвращения гемолиза крови своевременно снимают жгут с руки пациента в процессе забора крови, а после забора кровь перемешивают с размещенным в пробирке консервантом.
На этапе пробоподготовки образцов важно обеспечить полную деструкцию эритроцитов и избежать разрушения метаболитов. Для этого образцы медленно размораживают при температуре 6-10°С, например, посредством размещения образцов на льду. Время размораживания эритроцитов после извлечения из холодильника составляет около 20 мин. После деструкции холодом, проводят реакцию преципитации подкисленным ацетонитрилом, для чего в пробирку на 1,5 мл вносят 180 мкл эритроцитарной массы анализируемого образца, добавляют 20 мкл внутреннего стандарта (ВС) (для нормирования значений концентрации по внутреннему стандарту и отслеживания нормальной работы хроматографической системы) и 0,4 мл ацетонитрила с муравьиной кислотой (0,1 масс.% муравьиная кислота в ацетонитриле). Образец интенсивно перемешивают на вертикальном встряхивателе 15 со скоростью 3000±50 rpm (об/мин) в течение 2±0,5 мин, затем центрифугируют при 12000±10 rpm в течение 15±2 мин, отбирают верхний слой и анализируют.
Предпочтительно все реактивы, используемые в процессе пробоподготовки предварительно охлаждают до температуры 6-10°С, например, помещая их на лед, обеспечивая тем самым замедление реакции ферментов крови для предотвращения конверсии метаболитов. Время на пробоподготовку образца составляет около 30 мин.
Образцы анализируют на жидкостном хроматографе Agilent 1200 сопряженном с масс-детектором Sciex 6500+(США).
Условия хроматографического анализа: стационарная фаза колонка Synergy Hydro RP (размер частиц 2.1 мкм, 100 мм × 3.2 мм, Phenomenex США). Подвижная фаза А - 0,2% муравьиная кислота в воде, В - ацетонитрил. Градиент начинался 90% с фазы В, скорость 0,6 мл/мин. Температура колонки - 30°С. Объем вводимого образца - 10 мкл. Общее время анализа 6 мин.
Условия масс-спектрометрического определения - детектор (электроспрей ESI) работал в режиме положительной ионизации MRM, напряжение на капилляре = 5 кВ, температура источника = 500°C, давление азота в ячейке соударений higt (CAD), давление газа 1 - 45 psi, давление газа 2 - 55 psi, давление газа-завесы (curtaine gas) - 35 psi. Детектор фиксировал MRM-переходы, прдствленные в Таблице 1. В Таблице приведены подобранные оптимальные параметры масс-спектрометрического определения метаболитов, обеспечивающие воспроизводимость результатов.
Таблица 1. Условия масс-спектрометрического детектирования ионов метаболитов
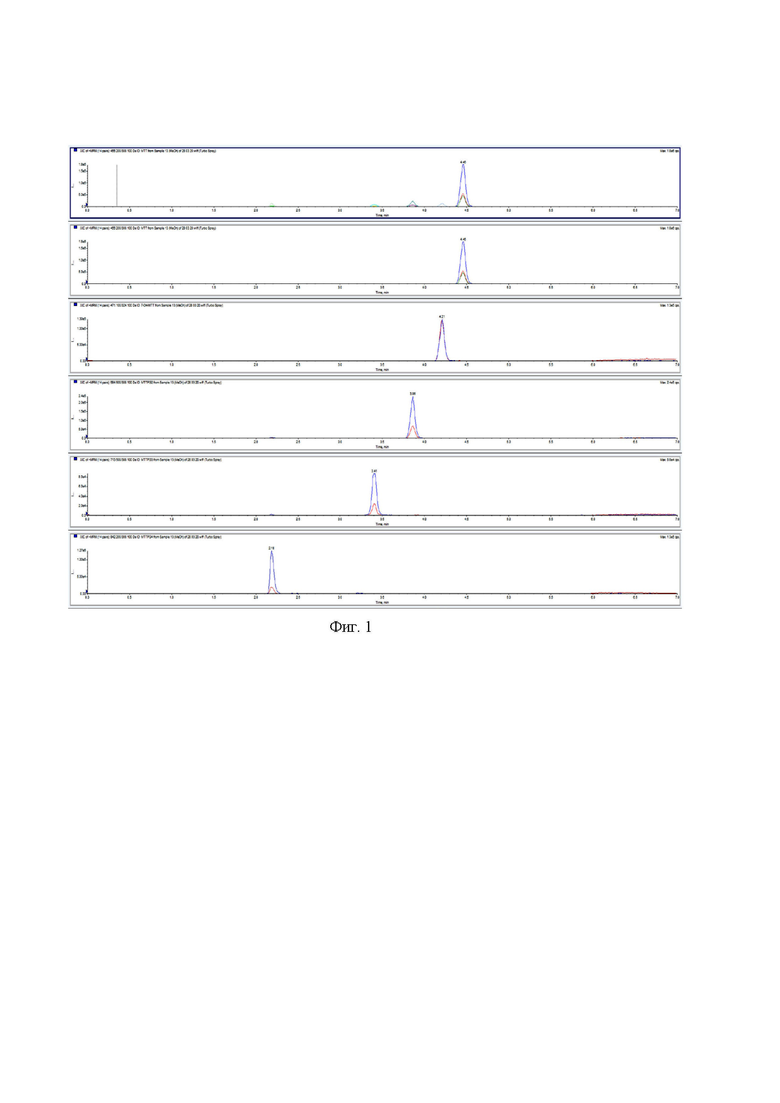
Калибровочные зависимости были линейны в диапазоне 0,5-100 нмоль/л, точность (CV,%) для образцов контроля качества не превышала 15% и правильность (accuracy) была в пределах 85-115 % для всех образцов контроля качества QC в одной аналитической серии и в разных (inter- и intra-day), для образца контроля качества совпадающего с нижним пределом количественного определения критерием приемлемости является разность в 20% от опорного значения. Точность и правильность для аналитов внутри одной и между аналитическими сериями не превышала заявленные 15%. Cтепень извлечения аналитов была порядка 70%, матричный эффект особого влияния не оказывал. Конверсии метаболитов друг в друга не наблюдали. Хроматограмма образца представлена на фиг. 1 (представлены все определяемые вещества, разделенные хроматографически друг от друга).
Проведено исследование, в которое были включены 60 (44 женщины и 16 мужчин, старше 18 лет) больных РА, соответствовавших критериям ACR/EULAR 2010, и получавших МТ не менее 20 мг/нед., подкожно, в течение не менее 12 недель. Больные были разделены на 2 сопоставимые по возрасту, полу, приему алкоголя, количеству курильщиков, индексу массы тела (ИМТ) группы в зависимости от наличия (группа 1, n=30) либо отсутствия (группа 2, n=30) лечебного эффекта МТ, согласно критериям эффективности терапии EULAR [American College of Rheumatology/European League against Rheumatism provisional definition of remission in rheumatoid arthritis for clinical trials. Ann Rheum Dis. 2011 Mar;70(3):404-13. doi: 10.1136/ard.2011.149765]. МТПГ (суммарный МТПГ и метаболиты МТПГ1,2,3,4,5 , а также 7-OH-МТ) определяли в эритроцитах методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием.
Таблица 2. Результаты определения уровнейМТПГ1,2,3,4,5, Ме [25; 75 перцентили], нмоль/л.
Установлено, что уровни суммарного МТПГ и МТПГ1,2,3 в эритроцитах не зависели от эффективности МТ, применявшаяся доза которого была сопоставимой у всех больных. В то же время уровень МТПГ4 был достоверно выше (р=0,023) у больных группы 1 (26,4±6,1 нмоль/л) по сравнению с больными группы 2 (22,1±6,8 нмоль/л). Оценка ROC-кривой показала, что значения МТПГ4 ниже 22,5 нмоль/л соответствовали отсутствию лечебного эффекта МТ. Площадь под кривой составила 0,672, (ДИ 95 0,536-0,808); р=0,022. Чувствительность - 77%, специфичность - 53,3%. Таким образом, для эффективного лечения больных РА необходимо назначение таких доз МТ, чтобы достигнутый уровень МТПГ4 в эритроцитах был не менее 22,5 нмоль/л.
Данные образцы были подвергнуты повторному замораживанию и анализу по методу, аналогичному описанному выше без проведения усовершенствованного этапа пробоподготовки.
Таблица 3. Результаты определения уровнейМТПГ1,2,3,4,5, Ме [25; 75 перцентили], нмоль/л после повторного размораживания спустя 3 мес без проведения вышеописанного этапа пробоподготовки.
Как видно из таблицы 3, уровни определяемых метаболитов МТ значительно отличаются от первоначально полученных, концентрации МТПГ в группах не различаются, МТПГ5 не определятся после размораживания вовсе. Отсутствует необходимая воспроизводимость, поскольку важно соблюдать температурный режим при хранении.
Данные образцы, подвергнутые повторному замораживанию, были проанализированы с проведением вышеописанного этапа пробоподготовки.
Таблица 4. Результаты определения уровнейМТПГ1,2,3,4,5, Ме [25; 75 перцентили], нмоль/л после повторного размораживания спустя 3 мес с проведением вышеописанного этапа пробоподготовки.
Как видно из таблицы 4, уровни определяемых метаболитов МТ незначительно отличаются от первоначально полученных, что свидетельствует о воспроизводимости результатов измерений.
Для демонстрации важности соблюдения температурного режима при подготовке проб проведена серия экспериментов.
Получены образцы венозной крови от 4 пациентов, получающих метотрексат длительно (не менее 3 месяцев) - по 3 пробы (консервант ЭДТА) для каждого из четырех пациентов. «Свежая кровь» условно обозначили образец центрифугированной крови с отделенной плазмой и эритроцитарной массой, взятой для анализа не позднее 2 часов после забора крови, хранившейся при температуре 6-10°С. Эксперимент № 1 - сравнение концентраций метаболитов МТ в свежей крови и через 6 часов - демонстрирует нестойкость метаболитов при длительном хранении при комнатной температуре (24°С), обусловленной как процессом продолжающейся ферментативной активности, так и процессом деградации.
Таблица 5. Эксперимент № 1
*0 следует понимать как концентрацию ниже предела количественного определения (менее 0,5 нмоль/л)
Последующие эксперименты демонстрируют сохранность картины распределения полиглутаматов МТ в образцах при размораживании при температуре 6-10°С и нестойкость этих соединений образцов при размораживании при комнатной температуре.
Таблица 6. Эксперимент № 2
*0 следует понимать как концентрацию ниже предела количественного определения (менее 0,5 нмоль/л)
Размораживание образцов при температуре 6-10°С после замораживания до -80°С и хранения при данной температуре не менее 4 часов дает отклонение от первоначального значения менее 10% (см. данные таблицы 7 и 8, Эксперименты 3 и 4), что свидетельствует о воспроизводимости содержания метаболитов после хранения и размораживания.
Таблица 7. Эксперимент № 3
*0 следует понимать как концентрацию ниже предела количественного определения (менее 0,5 нмоль/л)
Таблица 8. Эксперимент № 4
*0 следует понимать как концентрацию ниже предела количественного определения (менее 0,5 нмоль/л)
В предлагаемом изобретении представлены оптимальные условия для проведения реакции преципитации - применение подкисленного ацетонитрила позволяет максимально повысить степень извлечения, а режим работы центрифуги позволяет в достаточной степени осадить белки, и получить достаточно чистую надосадочную жидкость.
Разработанный способ измерения концентрации полиглутаматов метотрексата в эритроцитах является простым в исполнении, не требует специальной подготовки медицинского персонала и может найти широкое применение в повседневной клинической практике.
| название | год | авторы | номер документа |
|---|---|---|---|
| Планарный наноструктурированный сенсор на основе поверхностного плазмонного резонанса для определения метотрексата в плазме крови человека | 2024 |
|
RU2829593C1 |
| Способ определения амиодарона и его основного метаболита дезэтиламиодарона в сыворотке крови человека | 2020 |
|
RU2749566C1 |
| Способ определения лозартана, его основного метаболита лозартан карбоновой кислоты и глибенкламида в сыворотке крови и моче человека | 2020 |
|
RU2749567C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ТЕРАПИИ МЕТОТРЕКСАТОМ БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ | 2020 |
|
RU2753793C1 |
| Способ количественного определения малонового диальдегида методом ВЭЖХ-МC/МС | 2022 |
|
RU2789058C1 |
| Способ подготовки пробы мочи для определения монометилфталата, моноэтилфталата, монобутилфталата, монобензилфталата, моноэтилгексилфталата методом высокоэффективной жидкостной хроматографии/масс-спектрометрии | 2019 |
|
RU2687738C1 |
| Способ количественного определения антигипертензивных лекарственных веществ в плазме крови | 2022 |
|
RU2803887C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ 2-ФЕНОКСИЭТАНОЛА В БИОЛОГИЧЕСКИХ СРЕДАХ | 2021 |
|
RU2776730C1 |
| Способ количественного определения доксорубицина в биологических образцах | 2024 |
|
RU2839330C1 |
| Способ определения дабигатрана в сыворотке крови человека | 2018 |
|
RU2683032C1 |
Изобретение относится к cпособу определения концентрации полиглутаматов метотрексата, включающему забор венозной крови пациента, отделение образца эритроцитарной массы, выделение из него полиглутаматов метотрексата посредством проведения реакции преципитации и определение концентрации полиглутаматов метотрексата с помощью высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием (ВЭЖХ-МС-МС), причем отделенный образец эритроцитарной массы перед выделением из него полиглутаматов метотрексата замораживают при температуре -80±2°С с последующим размораживанием при температуре 6-10°С, при этом реакцию преципитации проводят при температуре 6-10°С посредством введения в образец подкисленного ацетонитрила, его интенсивного перемешивания с последующим центрифугированием при 12000±10 rpm в течение 15±2 мин и отбора верхнего слоя, содержащего полиглутаматы метотрексата для последующего анализа на ВЭЖХ-МС-МС. 7 з.п. ф-лы, 1 ил., 8 табл., 4 пр.
1. Способ определения концентрации полиглутаматов метотрексата, включающий забор венозной крови пациента, отделение образца эритроцитарной массы, выделение из него полиглутаматов метотрексата посредством проведения реакции преципитации и определение концентрации полиглутаматов метотрексата с помощью высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием (ВЭЖХ-МС-МС), отличающийся тем, что отделенный образец эритроцитарной массы перед выделением из него полиглутаматов метотрексата замораживают при температуре -80±2°С с последующим размораживанием при температуре 6-10°С, при этом реакцию преципитации проводят при температуре 6-10°С посредством введения в образец подкисленного ацетонитрила, его интенсивного перемешивания с последующим центрифугированием при 12000±10 rpm в течение 15±2 мин и отбора верхнего слоя, содержащего полиглутаматы метотрексата для последующего анализа на ВЭЖХ-МС-МС.
2. Способ по п.1, отличающийся тем, что для размораживания при температуре 6-10°С образец помещают на лед.
3. Способ по п.1, отличающийся тем, что для проведения реакции преципитации реактивы предварительно охлаждают до температуры 6-10°С.
4. Способ по п.1, отличающийся тем, что подкисленный ацетонитрил представляет собой 0,1 масс.% раствора муравьиной кислоты в ацетонитриле.
5. Способ по п.1, отличающийся тем, что для проведения реакции преципитации используют 0,4 мл подкисленного ацетонитрила на 180±2 мкл образца.
6. Способ по п.1, отличающийся тем, что отделение эритроцитарной массы от плазмы проводят центрифугированием со скоростью 3000±50 rpm в течение 15±2 мин.
7. Способ по п.1, характеризующийся тем, что интенсивное перемешивание проводят на вертикальном встряхивателе со скоростью 3000±50 rpm в течение 2±0,5 мин.
8. Способ по п.1, отличающийся тем, что забор крови проводят не ранее, чем через 36 часов после приема пациентом метотрексата.
| Гриднева Г | |||
| И | |||
| и др | |||
| "Взаимосвязь между эффективностью метотрексата при ревматоидном артрите и достигнутым уровнем его полиглутаматов в эритроцитах (пилотное исследование)", Научно-практическая ревматология, 2019, Т | |||
| Способ получения на волокне оливково-зеленой окраски путем образования никелевого лака азокрасителя | 1920 |
|
SU57A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аппарат для передачи изображений на расстояние | 1920 |
|
SU171A1 |
| Thierry Dervieux et al | |||
| "HPLC Determination of Erythrocyte Methotrexate Polyglutamates after Low-Dose | |||
Авторы
Даты
2021-08-06—Публикация
2020-10-10—Подача