Изобретение относится к фармации, фармакологии и клинической фармакологии, исследованию биологических материалов, в частности к способам количественного определения дабигатрана в сыворотке крови человека при терапевтическом лекарственном мониторинге и исследованиях фармакокинетики.
Известен способ определения дабигатрана в плазме крови человека методом сверхвысокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием (СВЭЖХ МС/МС) [1]. В данной работе пробоподготовку проводили осаждением белков плазмы крови смесью метанол-0,1 н раствор HCl (90:10), содержащей 13С6-аналог дабигатрана (внутренний стандарт) с концентрацией 50 мкг/л. Хроматографическое разделение проводили с использованием колонки Acquity UPLC ВЕН С8, 100 мм × 1 мм, 1,7 мкм (Waters). Недостатками способа являются:
- элюирование анализируемого соединения двумя отдельными зонами, что говорит о некорректном выборе условий пробоподготовки;
- избыточное разбавление осадителем аликвоты образца (в 7 раз);
- нежелательное использование в растворе осадителя хлористоводородной кислоты, обладающей значительным коррозионным эффектом для масс-спектрометрического оборудования;
-узкий линейный диапазон (1-500 нг/мл), в случае высоких концентраций (10000 нг/мл) авторы разбавляют пробу интактной плазмой крови человека, что увеличивает время на пробоподготовку.
Также известен способ совместного определения дабигатрана и ривороксабана в сыворотке крови человека методом СВЭЖХ МС/МС [2].
Пробоподготовка и используемый внутренний стандарт аналогичны описанным выше в работе Delavenne X. и др. [1]. Однако хроматографическое разделение проводили с использованием колонки Acquity UPLC ВЕН С18, 100 мм × 2,1 мм, 1,7 мкм (Waters).
К недостаткам этого способа следует отнести:
- узкий аналитический диапазон 2,5 - 500 нг/мл;
- избыточное разбавление осадителем аликвоты образца (в 7 раз);
- нежелательное использование в растворе осадителя хлористоводородной кислоты, обладающей значительным коррозионным эффектом для масс-спектрометрического оборудования;
- отсутствие описания используемого линейного градиента затрудняет возможность воспроизведения способа и требует дополнительного времени для разработки новых условий хроматографического разделения.
В качестве прототипа выбран способ определения дабигатрана в сыворотке крови человека методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием (ВЭЖХ МС/МС) [3]. При анализе дабигатрана методом ВЭЖХ МС/МС необходима предварительная пробоподготовка, заключающаяся в добавлении к образцу D3-аналога дабигатрана (внутренний стандарт), в удалении белков сыворотки крови путем осаждения ацетонитрилом с последующим центрифугированием, в разбавлении образцов подвижной фазой и повторном центрифугировании. Хроматографическое разделение проводится в режиме градиентного элюирования с подвижной фазой А (10 мМоль формиат аммония, рН 4,5) / В (0,1% раствор муравьиной кислоты в ацетонитриле) на колонке (С 18, 50 мм × 2,1 мм, 1,7 мкм) с масс-спектрометрическим детектором. Предел количественного определения - 1,1 нг/мл.
К недостаткам прототипа следует отнести:
- узкий аналитический диапазон 1,1 - 412 нг/мл;
- дополнительная стадия центрифугирования, увеличивающая время, затрачиваемое на пробоподготовку;
- избыточное разбавление исходного образца в процессе пробоподготовки (в 8 раз);
- отсутствие описания используемого линейного градиента;
- необходимость оборудования, обеспечивающего работу при сверхвысоком давлении, из-за использования сорбента с диаметром частиц 1,7 мкм;
- не указана концентрация рабочего раствора внутреннего стандарта.
Задачей изобретения является упрощение пробоподготовки, расширение аналитического диапазона, повышение точности и воспроизводимости количественного определения дабигатрана в сыворотке крови человека, замена изотопно-меченых аналогов дабигатрана на более дешевый и доступный внутренний стандарт, а также расширение спектра аналитического оборудования, пригодного для количественного определения дабигатрана в сыворотке крови человека.
Поставленная задача решается благодаря:
- оптимизации процедуры пробоподготовки биологических образцов и, соответственно, существенному снижению затрачиваемого времени на пробоподготовку за счет одного этапа центрифугирования;
- уменьшению разбавления образцов, что позволяет расширить аналитический диапазон;
- включению в процедуру пробоподготовки стадии осаждения белков метанолом (более слабый элюент по сравнению с ацетонитрилом), разбавления супернатанта деионизированной водой (слабый элюент), что улучшает хромотаграфическое разделение компонентов полученных образцов и позволяет повысить точность и воспроизводимость результатов;
- применению прометазина как более дешевого и доступного внутреннего стандарта вместо изотопно-меченых аналогов дабигатрана;
- проведению хроматографического разделения на сорбенте с диаметром частиц 3,5 мкм с целью снижения рабочего давления, что позволяет расширить спектр аналитического оборудования, пригодного для количественного определения дабигатрана в сыворотке крови человека.
В заявляемом изобретении способ определения дабигатрана (Фиг. 1) в сыворотке крови человека осуществляется методом ВЭЖХ МС/МС.
Калибровочные образцы готовят путем прибавления к 180 мкл интактной сыворотки крови 20 мкл стандартных растворов дабигатрана до получения концентраций в диапазоне от 1 до 1000 нг/мл.
Пробоподготовку калибровочных и анализируемых образцов сыворотки крови проводят методом осаждения белков следующим образом: к 200 мкл образца, помещенным в центрифужные микропробирки типа «эппендорф» вместимостью 2 мл, прибавляют 5 мкл рабочего раствора внутреннего стандарта прометазина (100,00 нг/мл), затем прибавляют 400 мкл метанола, перемешивают на смесителе типа «вортекс» в течение 15 с, затем центрифугируют в течение 15 мин при 16873 g. Далее 500 мкл супернатанта переносят в хроматографические виалы, прибавляют 200 мкл деионизированной воды, перемешивают на смесителе типа «вортекс» в течение 15 с и помещают в автоматический пробоотборник хроматографа. Разбавление анализируемого образца производят с целью повышения точности и воспроизводимости. Суммарное разведение образца на всех стадиях пробоподготовки происходит в 4,2 раза. Исключение стадии разбавления анализируемого образца может привести к появлению пиков не сорбируемых компонентов, снижению точности и воспроизводимости результатов количественного определения дабигатрана в сыворотке крови человека.
Разбавление образца на стадии пробоподготовки слабым растворителем незначительно и необходимо для элюирования дабигатрана в виде одной зоны. Такая пробоподготовка при последующем хроматографическом разделении обеспечивает элюирование дабигатрана в виде одного симметричного пика, расширяет аналитический диапазон и повышает точность и воспроизводимость результатов. После добавления слабого растворителя (в данном случае воды) не требуется дополнительное центрифугирование, достаточно встряхнуть образец на смесителе типа «вортекс», что позволяет сэкономить время на стадии пробоподготовки.
Условия хроматографического разделения и детектирования
Количественное определение дабигатрана проводят на высокоэффективном жидкостном хроматографе Nexera (Shimadzu, Япония), оснащенном градиентным насосом, термостатом колонок, дегазатором, термостатируемым автоматическим пробоотборником и тандемным масс-спектрометрическим детектором (тройным квадруполем) LCMS-8040 (Shimadzu, Япония). Обработку первичных данных проводят при помощи программного обеспечения LabSolutions (Ver. 5.3), SHIMADZU CORPORATION, Япония.
Колонка (неподвижная фаза): Waters XBridge™ 50 мм × 4,6 мм с сорбентом С18, диаметр частиц 3,5 мкм.
Примечание. Использование сорбента С18 с размером частиц 3,5 мкм позволяет проводить количественное определение дабигатрана при рабочем давлении в системе, не превышающем 17 МПа, что обеспечивает возможность воспроизведения заявляемого изобретения при помощи наиболее широко распространенного аналитического оборудования при сохранении скорости анализа.
Температура термостата колонок: 40°С.
Подвижная фаза:
- элюент А: 0,1% раствор муравьиной кислоты в деионизированной воде (по объему),
- элюент В: 0,1% раствор муравьиной кислоты в ацетонитриле (по объему).
Режим элюирования с градиентом по составу подвижной фазы представлены в Таблице 1.

Объем вводимой пробы: 20 мкл.
Время регистрации хроматограммы по масс-спектрометрическому детектору: 0-2,5 мин.
Время удерживания дабигатрана: около 1,958 мин.
Время удерживания прометазина: около 2,462 мин.
Параметры источника ионизации: распыляющий газ 3 л/мин, осушающий газ 20 л/мин, блок нагрева 400°С, линия десольватации 200°С, напряжение на капилляре +5 кВ.
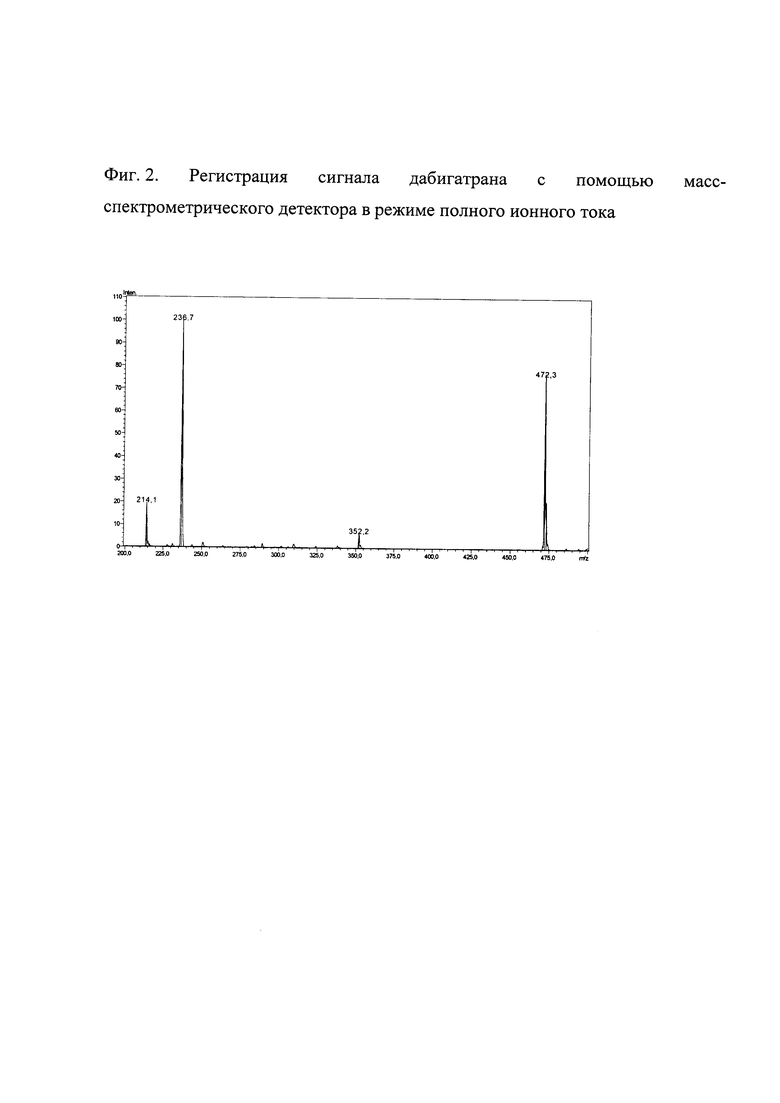
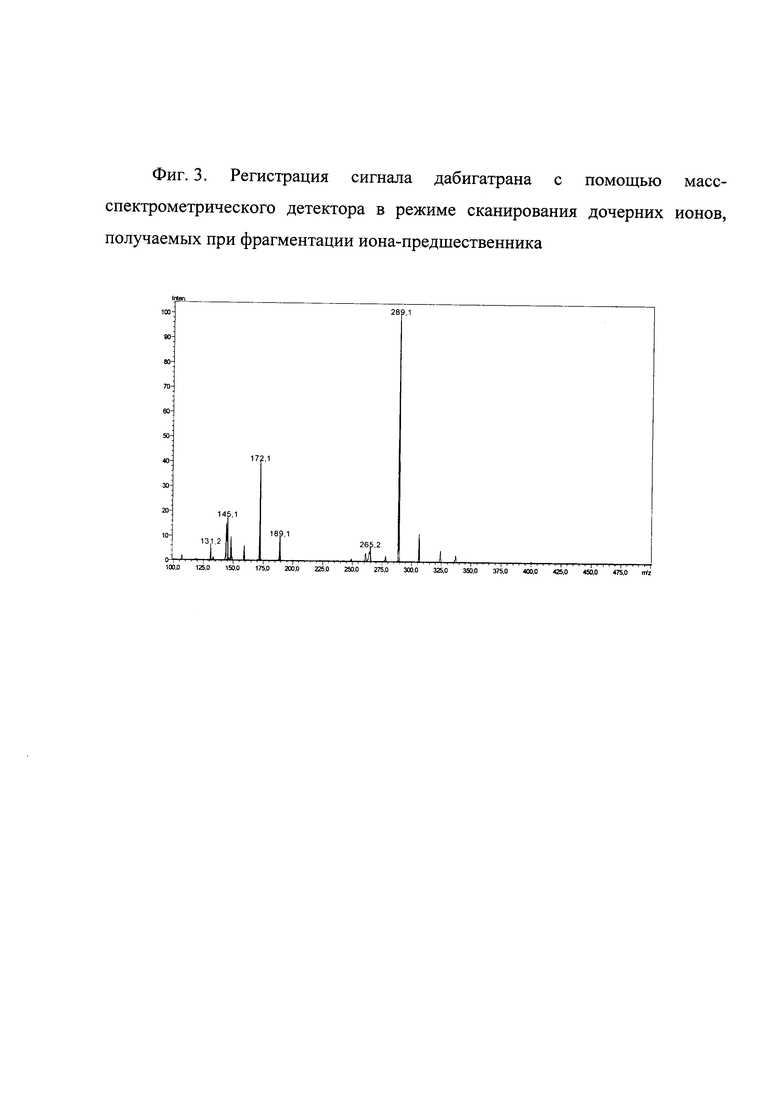
Масс-спектр дабигатрана, полученный в режиме сканирования полного ионного тока (Фиг. 2), позволяет определить ион-предшественник, соответствующий [М+Н]+. Выбор дочернего (фрагментного) иона производят на основании данных регистрации сигнала дабигатрана с помощью масс-спектрометрического детектора в режиме сканирования дочерних ионов (Фиг. 3). Выбранные ионы-предшественники (молекулярные ионы) и дочерние (фрагментные) ионы используют для детектирования дабигатрана и прометазина в режиме мониторинга множественных реакций.
Условия детектирования дабигатрана и прометазина (внутренний стандарт) в режиме мониторинга множественных реакций представлены в Таблице 2.
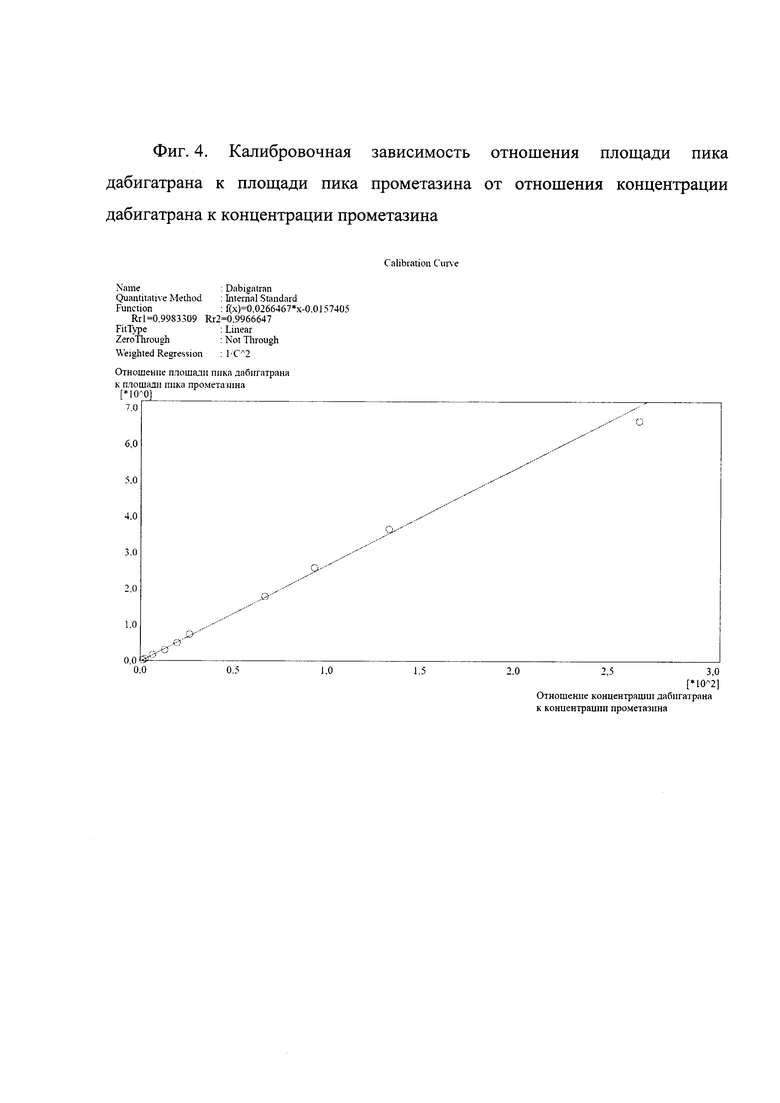
Аналитический диапазон составляет от 1 до 1000 нг/мл дабигатрана в сыворотке крови человека, коэффициент корреляции>0,99 (Фиг. 4). Точность и воспроизводимость результатов рассчитывают в соответствии с требованиями Руководства по экспертизе лекарственных средств [4]. Относительная ошибка, характеризующая точность измерений, не превышает 8,94%, а относительное стандартное отклонение, позволяющее оценить воспроизводимость результатов, имеет значения не более 9,20% (Таблицы 3 и 4).
Изобретение позволяет:
1. Упростить пробоподготовку за счет уменьшения количества проводимых операций.
2. Расширить аналитический диапазон (1-1000 нг/мл), уменьшив степень разбавления образцов до 4,2 раз.
3. Повысить точность и воспроизводимость количественного определения дабигатрана в сыворотке крови человека за счет разбавления образца слабым элюентом и, как следствие, элюирования дабигатрана в виде одной зоны на хроматограмме.
4. Заменить изотопно-меченые аналоги дабигатрана в качестве внутреннего стандарта и применять для этой цели прометазин.
5. Расширить спектр аналитического оборудования, пригодного для количественного определения дабигатрана в сыворотке крови человека за счет проведения хроматографического разделения на сорбенте с размером частиц 3,5 мкм, что обеспечивает рабочее давление в системе не более 17 МПа при сохранении скорости анализа.
Краткое описание чертежей и иных материалов (Приложения 1-6):
Фиг. 1. Структурная формула дабигатрана.
Фиг. 2. Регистрация сигнала дабигатрана с помощью масс-спектрометрического детектора в режиме полного ионного тока.
Фиг. 3. Регистрация сигнала дабигатрана с помощью масс-спектрометрического детектора в режиме сканирования дочерних ионов, получаемых при фрагментации иона-предшественника.
Фиг. 4. Калибровочная зависимость отношения площади пика дабигатрана к площади пика прометазина от отношения концентрации дабигатрана к концентрации прометазина.
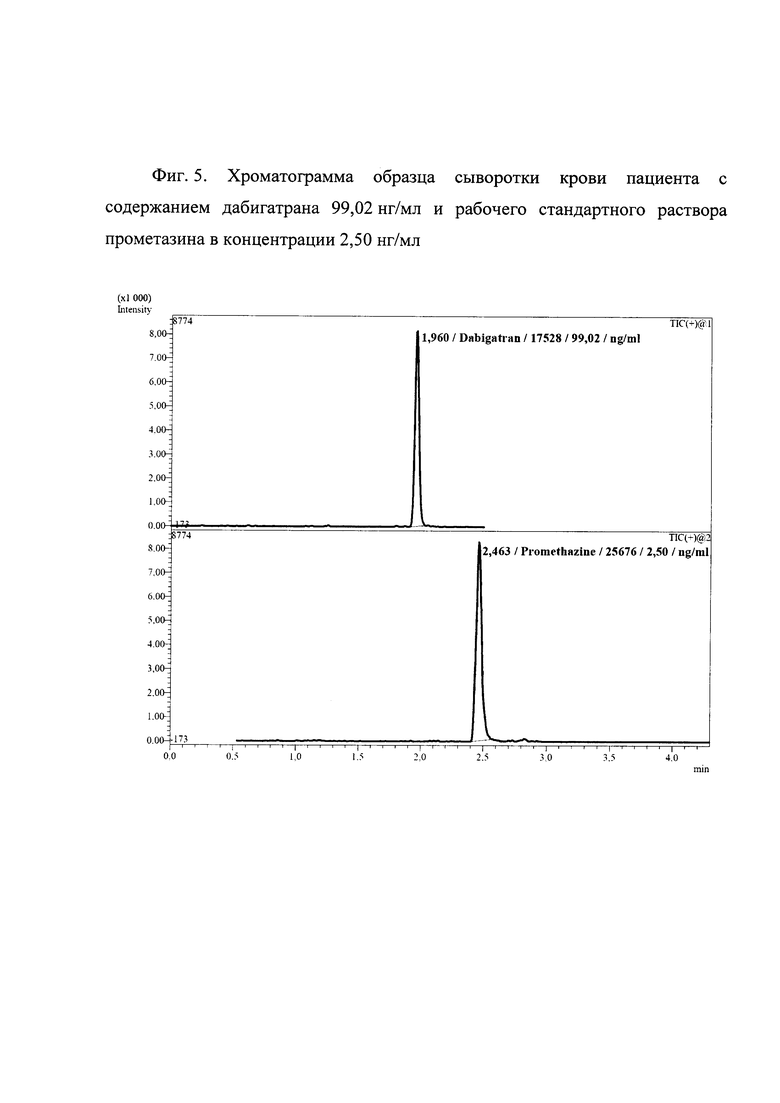
Фиг. 5. Хроматограмма образца сыворотки крови пациента с содержанием дабигатрана 99,02 нг/мл и рабочего стандартного раствора прометазина в концентрации 2,50 нг/мл
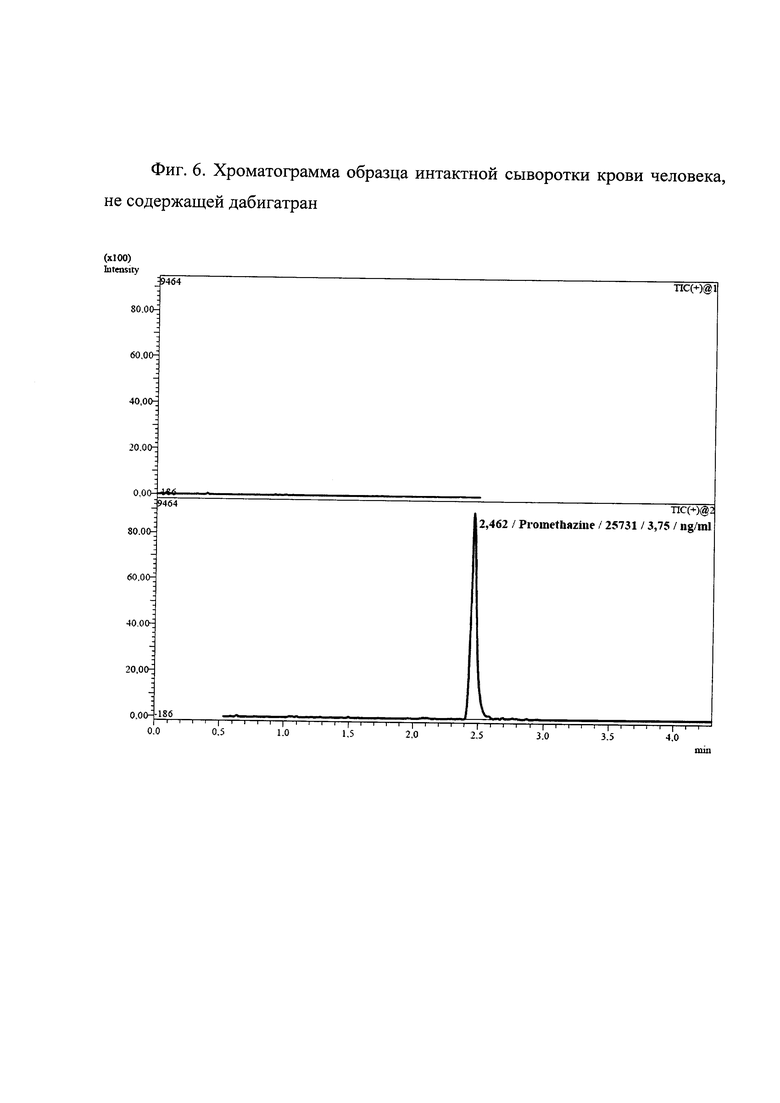
Фиг. 6. Хроматограмма образца интактной сыворотки крови человека, не содержащей дабигатран
Возможность осуществления заявляемого изобретения показана следующими примерами:
Пример 1. Определение содержания дабигатрана в сыворотке крови человека
Возраст 62 года, женский пол, назначен препарат «Прадакса» в дозировке 150 мг 2 р/д.
Забор крови проводится 27.02.17 г. в 7:00 и в 11:00 (через 4 ч после приема препарата).
Проведение анализа
1. Получение сыворотки крови человека. Кровь в объеме 4,9 мл инкубируют при 37°С в течение 30 мин, затем центрифугируют 10 мин при 2000 g, отбирают сыворотку крови, разливают на аликвоты и используют для дальнейшего анализа.
2. Калибровочные образцы готовят путем прибавления к 180 мкл интактной сыворотки крови 20 мкл стандартных растворов дабигатрана до получения концентраций в диапазоне от 1 до 1000 нг/мл.
3. Пробоподготовку калибровочных и анализируемых образцов сыворотки крови проводят методом осаждения белков следующим образом: к 200 мкл образца, помещенным в центрифужные микропробирки типа «эппендорф» вместимостью 2 мл, прибавляют 5 мкл рабочего раствора внутреннего стандарта прометазина (100,00 нг/мл), затем прибавляют 400 мкл метанола, перемешивают на смесителе типа «вортекс» в течение 15 с, затем центрифугируют в течение 15 мин при 16873 g. Далее 500 мкл супернатанта переносят в хроматографические виалы, прибавляют 200 мкл деионизированной воды и перемешивают на смесителе типа «вортекс» в течение 15 с.
4. Полученную пробу помещают в автоматический пробоотборник хроматографа.
Количественное определение дабигатрана проводят на высокоэффективном жидкостном хроматографе Nexera (Shimadzu, Япония), оснащенном градиентным насосом, термостатом колонок, дегазатором, термостатируемым автоматическим пробоотборником и тандемным масс-спектрометрическим детектором (тройным квадруполем) LCMS-8040 (Shimadzu, Япония). Обработку первичных данных проводят при помощи программного обеспечения LabSolutions (Ver. 5.3), SHIMADZU CORPORATION, Япония
Колонка: Waters XBridge™C18, 50 мм × 4,6 мм, 3,5 мкм.
Температура термостата колонок: 40°С.
Подвижная фаза:
- элюент А: 0,1% раствор муравьиной кислоты в деионизированной воде (по объему),
- элюент В: 0,1% раствор муравьиной кислоты в ацетонитриле (по объему).
Условия хроматографирования по составу подвижной фазы представлены в Таблице 1.
Объем вводимой пробы: 20 мкл.
Время регистрации хроматограммы по масс-спектрометрическому детектору: 0-2,5 мин.
Время удерживания дабигатрана: около 1,958 мин.
Время удерживания прометазина: около 2,462 мин.
Параметры источника ионизации: распыляющий газ 3 л/мин, осушающий газ 20 л/мин, блок нагрева 400°С, линия десолъватации 200°С, напряжение на капилляре +5 кВ.
Параметры детектирования в режиме мониторинга множественных реакций при положительной ионизации: m/z 472,15→m/z 289,10 для дабигатрана и m/z 285,10→m/z 86,10 для прометазина.
В результате анализа обнаружено 32,80 и 99,02 нг/мл (Фиг. 5) дабигатрана соответственно. От момента забора крови у пациента до предоставления результатов затрачивается не более 1 ч.
Следующий забор крови проводится 27.02.17 г. в 19:00 и в 23:00 (через 4 ч после приема препарата). Анализ проводят способом описанным выше. Обнаружено 23,25 и 25,79 нг/мл дабигатрана соответственно. От момента забора крови у пациента до предоставления результатов затрачивается не более 1 ч.
Данный пример показывает возможность количественного определения дабигатрана в сыворотке крови человека заявляемым способом.
Пример 2. Определение содержания дабигатрана в интактной сыворотке крови человека
Анализ интактной сыворотки крови человека, достоверно не содержащей дабигатран, проводят способом, описанным в Примере 1.
На хроматограмме (Фиг. 6) полученного образца отсутствует пик, соответствующий дабигатрану по времени удерживания.
Таким образом, данный пример демонстрирует селективность заявляемого способа и отсутствие риска предоставления ложноположительных результатов количественного определения дабигатрана в сыворотке крови человека.
Пример 3. Определение точности и воспроизводимости результатов определения дабигатрана в сыворотке крови человека
При оценке точности и воспроизводимости результатов проводят анализ образцов интактной сыворотки крови человека, а также интактной сыворотки крови человека с добавлением стандартных растворов до получения концентраций дабигатрана: 1 нг/мл, 5 нг/мл, 500 нг/мл, 1000 нг/мл. Анализ проводят способом, описанным в Примере 1, в рамках 3 аналитических циклов, включающих по 5 образцов для каждого уровня концентраций. Точность и воспроизводимость определяют внутри одного аналитического цикла (n=5) и между тремя циклами (n=15). Рассчитывают величины относительной ошибки (Е, %) и относительного стандартного отклонения (RSD, %), приведенные в Таблицах 3 и 4. 
Данный пример показывает возможность количественного определения дабигатрана в сыворотке крови человека с приемлемой точностью и воспроизводимостью в концентрации от 1,00 до 1000,00 нг/мл, что соответствует заявленному аналитическому диапазону.
Представленные примеры не ограничивают объем притязаний настоящего изобретения и служат только для цели иллюстрации.
Список литературы
1. Delavenne X. et al. UPLC MS/MS assay for routine quantification of dabigatran - a direct thrombin inhibitor - in human plasma // Journal of Pharmaceutical and Biomedical Analysis. 2012. V. 58. P. 152-156.
2. Korostelev M. et al. Simultaneous determination of rivaroxaban and dabigatran levels in human plasma by high-performance liquid chromatography-tandem mass spectrometry // Journal of Pharmaceutical and Biomedical Analysis. 2014. V. 100. P. 230-235.
3. Antovic J.P. et al. Evaluation of coagulation assays versus LC-MS/MS for determinations of dabigatran concentrations in plasma // European Journal of Clinical Pharmacology. 2013. V. 69. №11. P. 1875-1881.
4. Руководство по экспертизе лекарственных средств. Под ред. проф. А.Н. Миронова. Том I. М.: Гриф и К, 2013. С. 204-205.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения лозартана, его основного метаболита лозартан карбоновой кислоты и глибенкламида в сыворотке крови и моче человека | 2020 |
|
RU2749567C1 |
| Способ определения амиодарона и его основного метаболита дезэтиламиодарона в сыворотке крови человека | 2020 |
|
RU2749566C1 |
| Способ количественного определения амантадина в плазме крови | 2017 |
|
RU2650968C1 |
| Способ идентификации этилглюкуронида в крови | 2020 |
|
RU2750408C1 |
| Способ количественного определения леводопы в плазме крови | 2017 |
|
RU2665164C1 |
| СПОСОБ ИЗМЕРЕНИЯ КОНЦЕНТРАЦИИ ПОЛИГЛУТАМАТОВ МЕТОТРЕКСАТА МЕТОДОМ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ С МАСС-СПЕКТРОМЕТРИЧЕСКИМ ДЕТЕКТИРОВАНИЕМ (ВЭЖХ-МС-МС) | 2020 |
|
RU2752805C1 |
| Способ количественного определения антигипертензивных лекарственных веществ в плазме крови | 2022 |
|
RU2803887C1 |
| СПОСОБ ВЫЯВЛЕНИЯ НЕИЗВЕСТНЫХ ВЕЩЕСТВ В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ ПАЦИЕНТОВ, ПРИНИМАВШИХ НАРКОТИЧЕСКИЕ ИЛИ ПСИХОАКТИВНЫЕ ВЕЩЕСТВА | 2009 |
|
RU2419788C2 |
| Способ определения ароматических микробных метаболитов в форме фенилкарбоновых кислот в сыворотке крови | 2017 |
|
RU2663571C1 |
| Способ количественного определения окадаиковой кислоты в морепродуктах | 2017 |
|
RU2666247C1 |

Изобретение относится к фармации, фармакологии и клинической фармакологии. Способ количественного определения дабигатрана в сыворотке крови человека включает приготовление калибровочных и анализируемых образцов путем добавления прометазина в качестве внутреннего стандарта, осаждение белков метанолом, перемешивание, центрифугирование с дальнейшим отбором супернатанта, его разбавление деионизированной водой, перемешивание с последующим хроматографическим разделением компонентов пробы, регистрацию сигнала масс-спектрометрического детектора, полученного в режиме мониторинга множественных реакций при положительной ионизации. 3 з.п. ф-лы, 6 ил., 4 табл., 3 пр.
1. Способ количественного определения дабигатрана в сыворотке крови человека, характеризующийся линейным аналитическим диапазоном и включающий приготовление калибровочных и анализируемых образцов путем добавления прометазина в качестве внутреннего стандарта, осаждения белков метанолом, перемешивания, центрифугирования с дальнейшим отбором супернатанта, его разбавлением деионизированной водой, перемешиванием с последующим хроматографическим разделением компонентов пробы, регистрацией сигнала масс-спектрометрического детектора, полученного в режиме мониторинга множественных реакций при положительной ионизации.
2. Способ по п. 1, характеризующийся разбавлением супернатанта после центрифугирования деионизированной водой в соотношении 2,5:1.
3. Способ по п. 1, характеризующийся использованием сорбента с размером частиц 3,5 мкм и рабочим давлением в системе не более 17 МПа при сохранении скорости анализа.
4. Способ по п. 1, характеризующийся линейным аналитическим диапазоном 1-1000 нг/мл.
| J.P | |||
| Antovic et al | |||
| Evaluation of coagulation assays versus LC-MS/MS for determinations of dabigatran concentrations in plasma / Eur J Clin Pharmacol, 2013, 69 (11), pages 1875-1881 [Найдено в Интернете он-лайн 05.02.2019 https://www.endotell.ch/files/dokumente/Antovic%20HPLC-Dabigatran%20I%20E%20J%20C%20Pharm%202013.pdf] | |||
| M.Schmohl et al | |||
| Measurement of dabigatran plasma concentrations by calibrated thrombin clotting time in comparison to LC-MS/MS in human volunteers on dialysis / Thrombosis Research, 2015, 135, pages 532-536 | |||
| А.Л | |||
| БЕРКОВСКИЙ и др | |||
| Лабораторный контроль действия дабигатрана / КОНСИЛИУМ | |||
| ЛАБОРАТОРНАЯ ДИАГНОСТИКА, 2016, N 8 (148) [Найдено в Интернете он-лайн 05.02.2019 file:///C:/Users/otd1442/Downloads/laboratornyy-kontrol-deystviya-dabigatrana%20(1).pdf]. |
Авторы
Даты
2019-03-26—Публикация
2018-06-09—Подача