ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В настоящей заявке представлены антитело к рецептору желудочного ингибиторного полипептида (GIPR) и его слитый с глюкагон-подобным пептидом-1 (GLP-1) белок, а также фармацевтическая композиция на его основе. Также в настоящей заявке представлен способ применения антитела к GIPR и его слитого с GLP-1 белка для лечения, профилактики или облегчения одного или нескольких симптомов неалкогольной жировой болезни печени, неалкогольного стеатогепатита, диабета 2-го типа или ожирения.
УРОВЕНЬ ТЕХНИКИ
Кишечный желудочный ингибиторный полипептид (GIP) представляет собой полипептидный гормон, секретируемый K-клетками кишечника после принятия пищи, и включает в себя две изоформы пептидов из 42 и 30 аминокислот. GIP принимает участие в физиологическом процессе секреции инсулина, активируя рецептор желудочного ингибиторного полипептида (GIPR) на поверхности β-клеток поджелудочной железы (Tseng et al., 1996, J. Clin. Invest. 98:2440-2445; Ravn et al., 2013, J. Biol. Chem. 288:19760-72). Поскольку классическая биологическая функция GIP аналогична GLP-1, эти пептидные гормоны совместно называются инкретинами. GIPR широко распространен во многих тканях, включая ткани поджелудочной железы, кости, сердца, желудка, кишечника и жировую ткань (Peter et al., 2013, J. Biol. Chem. 288:19760-72), и это разнообразное распределение предполагает, что путь GIP/GIPR выполняет больше биологических функций, помимо регуляции уровня глюкозы в крови. Экспериментальные данные показывают, что путь передачи сигнала GIP/GIPR по меньшей мере тесно связан с метаболизмом липидов в этих тканях (Yip and Wolfe, 2000, Life Sci. 66:91-103). Экспериментальные данные также показывают, что у пациентов с ожирением или диабетом происходит увеличение концентрации циркулирующего в крови GIP (Creutzfeldt et al., 1978, Diabetologia 14:15-24; Flatt et al., 1984, J. Endocrinol. 101:249-256; Salera et al., 1982, J. Clin. Endocrinol. Metab. 55:329-336; Vilsb∅ll et al., 2003, J. Clin. Endocrinol. Metab. 88:2706-2713). После блокирования сигнала GIPR ингибитором GIPR у мышей с ожирением, вызванным рационом с высоким содержанием жиров, наблюдали значительную потерю массы, снижение инсулинорезистентности и даже обращение диабета 2-го типа (Ravn et al., 2013, J. Biol. Chem. 288:19760-72).
Аналоги глюкагон-подобного пептида-1 длительного действия (аналог GLP-1) представляют собой новое поколение лекарственных средств против диабета 2-го типа (Tomlinson et al., 2015, Expert Opin. Investig. Drugs 25:1744-7658; Gallwitz, 2015, Eur. Endocr. 11:21-25). Лекарственные средства на основе GLP-1 длительного действия также изучаются в клинических испытаниях для лечения неалкогольной жировой болезни печени (NAFLD). Исследования показывают, что лекарственные средства на основе GLP-1 длительного действия оказывают значительное влияние на улучшение морфологии ткани печени, снижение соотношения аланинаминотрансферазы/глутатионаминотрансферазы и содержания жира в печени у пациентов с NAFLD (Samson et al., 2013, J. Diabetes Complications 27:401-6; Portillo-Sanchez and Cusi, 2016, Clin. Diabetes Endocrinol. 2:9).
Если лекарственные средства на основе GLP-1 и ингибиторы GIPR можно использовать вместе, в том числе комбинацию этих двух средств вместе, например, в качестве слитого белка, то эта комбинация может обеспечить эффект одновременного облегчения инсулинорезистентности и снижения чрезмерного накопления жира (ожирения), со снижением где уровня глюкозы в крови, а также с влиянием на метаболизм липидов. В этом отношении часть, представляющая собой GLP-1, может использоваться для облегчения толерантности к глюкозе, снижения аппетита, снижения уровня глюкозы в крови и уменьшения массы тела; тогда как часть, представляющая собой антитело к GIPR, может использоваться для уменьшения дальнейшего накопления жира и улучшения функции печени. Эффект антитела к GIPR в отношении снижения количества жира и эффект GLP-1 в отношении потери массы можно использовать синергически для лечения неалкогольной жировой болезни печени/неалкогольного стеатогепатита. В настоящем раскрытии представлено лекарственное средство на основе слитого белка, которое принесет пользу пациентам, которые страдают одним или несколькими заболеваниями из неалкогольной жировой болезни печени/неалкогольного стеатогепатита, диабета 2-го типа и ожирения.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящей заявке представлено антитело, специфически связывающееся с GIPR, где антитело является ингибитором GIPR.
В настоящей заявке также представлено антитело, специфически связывающееся с GIPR, содержащее одну, две, три, четыре, пять или шесть аминокислотных последовательностей, где каждая аминокислотная последовательность независимо выбрана из аминокислотных последовательностей, приведенных ниже:
a. аминокислотная последовательность CDR1 легкой цепи: SEQ ID NO:1, SEQ ID NO:4, SEQ ID NO:7, SEQ ID NO:10, SEQ ID NO:13, и SEQ ID NO:15;
b. аминокислотная последовательность CDR2 легкой цепи: SEQ ID NO:2, SEQ ID NO:5, SEQ ID NO:8, SEQ ID NO:11, и SEQ ID NO:16;
c. аминокислотная последовательность CDR3 легкой цепи: SEQ ID NO:3, SEQ ID NO:6, SEQ ID NO:9, SEQ ID NO:12, SEQ ID NO:14, и SEQ ID NO:17;
d. аминокислотная последовательность CDR1 тяжелой цепи: SEQ ID NO:18, SEQ ID NO:23, и SEQ ID NO:26;
e. аминокислотная последовательность CDR2 тяжелой цепи: SEQ ID NO:19, SEQ ID NO:21, SEQ ID NO:24, SEQ ID NO:27, и SEQ ID NO:29;
f. аминокислотная последовательность CDR3 тяжелой цепи: SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:25, SEQ ID NO:28, и SEQ ID NO:30.
В настоящей заявке представлен слитый с GLP-1 белок, содержащий антитело, специфически связывающееся с GIPR, и один, два, три, четыре, пять, шесть, семь или восемь фрагментов GLP-1; где в слитом белке карбокси-конец фрагмента GLP-1 соединен с амино-концом легкой цепи или тяжелой цепи антитела к GIPR или амино-конец фрагмента GLP-1 соединен с карбокси-концом легкой цепи антитела к GIPR.
В настоящей заявке представлен слитый с GLP-1 белок, содержащий антитело к GIPR и два фрагмента GLP-1; где в слитом белке карбокси-конец фрагмента GLP-1 соединен с амино-концом легкой цепи антитела к GIPR: N'-GLP-1-линкер-R-C'; или карбокси-конец фрагмента GLP-1 соединяется с амино-концом тяжелой цепи антитела к GIPR: N'-GLP-1-линкер-R-C'; где N' представляет собой амино-конец полипептидной цепи слитого белка, C' представляет собой карбокси-конец полипептидной цепи слитого белка, GLP-1 представляет собой фрагмент GLP-1, R представляет собой аминокислотную последовательность легкой цепи или тяжелой цепи антитела к GIPR, и линкер представляет собой пептидный линкер.
В настоящей заявке представлен полинуклеотид, кодирующий антитело к GIPR, описываемое в настоящей заявке.
В настоящей заявке представлен полинуклеотид, кодирующий слитый белок антитела к GIPR и GLP-1, описываемых в настоящей заявке.
В настоящей заявке представлен вектор, содержащий полинуклеотид, кодирующий антитело к GIPR, описываемое в настоящей заявке.
В настоящей заявке представлен вектор, содержащий полинуклеотид, кодирующий слитый белок антитела к GIPR и GLP-1, описываемых в настоящей заявке.
В настоящей заявке представлена клетка-хозяин, содержащая вектор, описываемый в настоящей заявке.
В настоящей заявке представлена фармацевтическая композиция, содержащая антитело к GIPR, описываемое в настоящей заявке, и фармацевтически приемлемый носитель.
В настоящей заявке представлена фармацевтическая композиция, содержащая слитый белок антитела к GIPR и GLP-1, описываемых в настоящей заявке, и фармацевтически приемлемый носитель. Кроме того, в настоящей заявке представлено применение антитела к GIPR, описываемого в настоящей заявке, в получении лекарственного препарата для лечения, профилактики или уменьшения интенсивности случаев заболевания, представляющего собой неалкогольный стеатогепатит.
В настоящей заявке представлено применение слитого белка антитела к GIPR и GLP-1, описываемых в настоящей заявке, в получении лекарственного препарата для лечения, профилактики или уменьшения интенсивности случаев неалкогольной жировой болезни печени.
В настоящей заявке представлено применение антитела к GIPR, описываемого в настоящей заявке, в получении лекарственного препарата для лечения, профилактики или уменьшения интенсивности диабета 2-го типа.
В настоящей заявке представлено применение слитого белка антитела к GIPR и GLP-1, описываемых в настоящей заявке, в получении лекарственного препарата для лечения, профилактики или уменьшения интенсивности диабета 2-го типа.
В настоящей заявке представлено применение антитела к GIPR, описываемого в настоящей заявке, в получении лекарственного препарата для снижения массы или лечения, профилактики или уменьшения интенсивности ожирения и связанных с ожирением заболеваний.
В настоящей заявке представлено применение слитого белка антитела к GIPR и GLP-1, описываемых в настоящей заявке, в получении лекарственного препарата для снижения массы или лечения, профилактики или уменьшения интенсивности ожирения и связанных с ожирением заболеваний.
В настоящей заявке представлено применение антитела к GIPR, описываемого в настоящей заявке, в получении лекарственного препарата для одновременного лечения двух или более заболеваний из неалкогольной жировой болезни печени, ожирения или диабета 2-го типа.
В настоящей заявке представлено применение слитого белка антитела к GIPR и GLP-1, описываемых в настоящей заявке, в получении лекарственного препарата для одновременного лечения двух или более заболеваний из неалкогольной жировой болезни печени, ожирения или диабета 2-го типа.
В настоящей заявке представлен способ лечения, профилактики или облегчения одного или нескольких симптомов неалкогольного стеатогепатита, предусматривающий обеспечение субъектов терапевтически эффективной дозой антитела к GIPR, описываемого в настоящей заявке.
В настоящей заявке представлен способ лечения, профилактики или облегчения одного или нескольких симптомов неалкогольного стеатогепатита, предусматривающий обеспечение субъектов терапевтически эффективной дозой слитого белка антитела к GIPR и GLP-1, описываемых в настоящей заявке.
В настоящей заявке представлен способ лечения, профилактики или облегчения одного или нескольких симптомов диабета 2-го типа, предусматривающий обеспечение субъектов терапевтически эффективной дозой антитела к GIPR, описываемого в настоящей заявке.
В настоящей заявке представлен способ лечения, профилактики или облегчения одного или нескольких симптомов диабета 2-го типа, предусматривающий обеспечение субъектов терапевтически эффективной дозой слитого белка антитела к GIPR и GLP-1, описываемых в настоящей заявке.
В настоящей заявке представлен способ лечения, профилактики или облегчения одного или нескольких симптомов ожирения, предусматривающий обеспечение субъектов терапевтически эффективной дозой антитела к GIPR, описываемого в настоящей заявке.
В настоящей заявке представлен способ лечения, профилактики или облегчения одного или нескольких симптомов ожирения, предусматривающий обеспечение субъектов терапевтически эффективной дозой слитого белка антитела к GIPR и GLP-1, описываемых в настоящей заявке.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фигуре 1 показаны результаты теста FACS специфического связывания рекомбинантно экспрессированного антитела к hGIPR L10H8 (содержащего SEQ ID NO:70 и SEQ ID NO:79) с hGIPR. Серый пик и показанный пунктирной линией пик представляют собой отрицательные контроли, серый пик представляет собой фоновый пик пустой клетки CHO-DHFR-, показанный пунктирной линией пик представляет собой пик отрицательного связывания L10H8 с пустой клеткой CHO-DHFR-, и показанный сплошной линией пик представляет собой пик специфического связывания L10H8 с CHO-DHFR-hGIPR.
На фигуре 2 показана кривая "концентрация - ингибирование" антитела к hGIPR L7H6 (содержащего SEQ ID NO:67 и SEQ ID NO:77), антагонизируещего активацию GIP пути передачи сигнала hGIPR, как определено прямым анализом цАМФ (IC50=7,6 нМ, R2=0,99).
На фигуре 3 показана кривая ингибирования слитого белка антитело к GIPR/GLP-1 GLP-1-линкер-L7H6 (содержащего SEQ ID NO:67, SEQ ID NO:77, SEQ ID NO:106, SEQ ID NO:111), антагонизируещего активацию GIP пути передачи сигнала hGIPR, как определено прямым анализом цАМФ (IC50=14,9 нМ, R2=0,99).
На фигуре 4 показана кривая активации эксперимента с репортерным геном для тестирования слитого белка антитело к GIPR/GLP-1 GLP-1-линкер-L7H6 для активации пути передачи сигнала hGLP-1R, как определено анализом с репортерным геном (EC50=0,04 нМ, R2=0,99).
На фигуре 5 показана временная кривая скорости изменения массы тела в различных группах мышей C57BL/6 с ожирением, вызванным рационом с высоким содержанием жиров, в течение периода тестирования эффективности.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
Если в настоящей заявке не указано иное, научные и технические термины имеют значения, понятные рядовым специалистам в данной области. Как правило, номенклатура и методики, относящиеся к фармакологии, биологии, биохимии, культивированию клеток и тканей, биологии, молекулярной биологии, иммунологии, микробиологии, генетике и химии белков и нуклеиновых кислот, а также гибридизации, хорошо известны и широко используются в данной области.
В настоящем изобретении используются стандартные однобуквенные или трехбуквенные сокращения для обозначения полинуклеотидных и полипептидных последовательностей. При записи полипептидной последовательности первый аминокислотный остаток (N') с аминогруппой является крайним левым, а последний аминокислотный остаток (C') с карбоксильной группой является крайним правым, например последовательность фрагмента GLP-1, включенная в настоящее изобретение: SEQ ID NO:105, SEQ ID NO:106, SEQ ID NO:107, SEQ ID NO:108 и SEQ ID NO:109. Обратная полипептидная последовательность относится к полипептидной последовательности, где аминокислоты расположены в обратном порядке относительно оригинальной, например обратные последовательности фрагмента GLP-1, преобразованные из вышеуказанных последовательностей фрагмента GLP-1: SEQ ID NO:119, SEQ ID NO:120, SEQ ID NO:121, SEQ ID NO:122 и SEQ ID NO:123. 5'-концы цепей в обратном направлении однонитевых и двухнитевых последовательностей нуклеиновой кислоты находятся слева, а их 3'-концы находятся справа. Конкретная часть полипептида может быть представлена количеством аминокислотных остатков, как, например, аминокислотами от 80 до 130, или представлена действительным остатком сайта, как, например, от Lys80 до Lys130. Конкретная полипептидная или полинуклеотидная последовательность также может быть описана с объяснением ее отличия от эталонной последовательности.
Термины "пептид", "полипептид" и "белок" относятся к молекуле, содержащей две или более аминокислот, которые связаны пептидной связью. Эти термины охватывают, например, природные и искусственные белки и пептидные аналоги белковых последовательностей (такие как мутантные белки, варианты и слитые белки) и белки, которые посттранскрипционно или иным образом ковалентно или нековалентно модифицированы. Пептид, полипептид или белок может быть мономером или полимером.
Термин "полипептидный фрагмент" относится к полипептиду, который имеет амино-конец и/или карбоксильный конец, отсутствующий у соответствующего полноразмерного белка. Например, длина фрагмента может составлять по меньшей мере 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 50, 70, 80, 90, 100, 150, или 200 аминокислот. Длина фрагмента может составлять, например, до 1000, 750, 500, 250, 200, 175, 150, 125, 100, 90, 80, 70, 60, 50, 40, 30, 20, 15, 14, 13, 12, 11, или 10 аминокислот. Фрагмент может дополнительно содержать одну или несколько дополнительных аминокислот на одном конце или на обоих, как, например, аминокислотные последовательности из различных природных белков (например, Fc доменов или доменов лейциновой застежки) или искусственные аминокислотные последовательности (например, искусственные соединяющие последовательности).
Пептиды в настоящем изобретении включают в себя пептиды, модифицированные по любой причине и любыми способами, например, посредством (1) снижения чувствительности к протеолизу, (2) снижения чувствительности к окислению, (3) изменения аффинности в отношении образования белковых комплексов, (4) изменения аффинности связывания и (5) придания или изменения других физико-химических или функциональных свойств. Аналог предусматривает мутантный белок полипептида. Например, могут быть выполнены замены одной или нескольких аминокислот (например, консервативные аминокислотные замены) в природных последовательностях (например, вне домена полипептида, который образует внутримолекулярный контакт). "Консервативная аминокислотная замена" представляет собой замену, которая существенно не изменяет структурные характеристики исходной последовательности (например, замена аминокислот не должна разрушать спирали, присутствующие в исходной последовательности, или мешать другим вторичным структурным типам, необходимым для придания исходной последовательности ее свойства или функции).
"Мутант" полипептида, отличается тем, что аминокислотная последовательность содержит вставку, делецию и/или замещение одного или нескольких остатков в аминокислотной последовательности относительно другой полипептидной последовательности. Варианты в настоящем изобретении включают в себя слитые белки.
"Производное" полипептида представляет собой химически модифицированный полипептид, например путем связывания с другими химическими компонентами, такими как полиэтиленгликоль, альбумин (например, сывороточный альбумин человека), фосфорилирования и гликозилирования.
Если не указано иное, термин "антитело" включает в себя антитела с двумя полноразмерными тяжелыми цепями и двумя полноразмерными легкими цепями, а также их производные, варианты, фрагменты и мутированные белки, примеры которых перечислены ниже.
Термин "антитело" представляет собой белок, который содержит антигенсвязывающую часть и необязательно остов или каркасную часть, которые позволяют антигенсвязывающей части принимать конформацию, которая способствует связыванию антитела с антигеном. Примеры антител включают в себя полные антитела, фрагменты антител (такие как антигенсвязывающая часть антитела), производные антител и аналоги антител. Например, антитело может содержать альтернативные белковые остовы или искусственные остовы с трансплантированными CDR или производными CDR. Остов включает в себя без ограничения полученный из антитела остов, который вводится, такой как остов, который стабилизирует трехмерную структуру антитела, и такой как полностью синтетический остов для биосовместимого полимера. См., например, Korndorfer et al., 2003, Proteins 53:121-129; Roque et al., 2004, Biotechnol. Prog. 20:639-654. Кроме того, антитело может быть либо имитационным пептидным антителом ("PAM"), либо остовом, содержащим имитационные антитела, где в качестве остовов используются фибриновые лиганды.
Антитела могут иметь такие структуры, как врожденный иммуноглобулин. «Иммуноглобулин» представляет собой тетрамерную молекулу. В природном иммуноглобулине каждый тетрамер состоит из двух идентичных пар полипептидных цепей, где каждая пара имеет "легкую" цепь (примерно 25 кДа) и "тяжелую" цепь (примерно 50-70 кДа). Амино-конец каждой цепи включает в себя вариабельный домен из приблизительно 100-110 аминокислот, который в основном связан с распознаванием антигена. Карбоксильный конец каждой цепи определяет константную область, в основном связанную с действием эффекторов. Легкая цепь антитела человека делится на легкие κ и λ цепи. Тяжелые цепи разделили на μ, δ, α или ε и определили тот же тип антигена, такой как IgM, IgD, IgG, IgA и IgE. В легкой и тяжелой цепях вариабельные и константные области соединены областью «J» из приблизительно 12 или более аминокислот, а тяжелая цепь также включает в себя область «D» из приблизительно 10 или более аминокислот. Ссылка на Fundamental Immunology, глава 7 (под редакцией Paul, 2nd edition, Raven Press, 1989). Вариабельные области каждой пары легкой/тяжелой цепи образуют сайты связывания антител, таким образом, полный иммуноглобулин имеет два сайта связывания.
Цепи врожденного иммуноглобулина демонстрируют ту же основную структуру, что и относительно консервативная скелетная область (FR), соединенная тремя высоко вариабельными областями, также известными как определяющие комплементарность области или CDR. От N-конца до C-конца легкая и тяжелая цепи содержат структурные домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Распределение аминокислот во всех структурных доменах согласуется с Kabat et al. в Sequences of Proteins of Immunological Interest, 5th edition, U.S. Dept. Of Health and Human Services, PHS, NIH, NIH Publication No. 91-3242, 1991.
Если не указано иное, то "антитело" означает либо интактный иммуноглобулин, либо антигенсвязывающую часть, которая может специфически конкурировать за связывание с интактным антителом. Антигенсвязывающая часть может быть получена методиками рекомбинантной ДНК, ферментативным или химическим расщеплением интактных антител. Антигенсвязывающая часть включает в себя, в частности, Fab, Fab', F(ab)2, Fv, антитела со структурными доменами (dAb), содержащие определяющий комплементарность участок (CDR), одноцепочечное антитело (scFv), химерное антитело, антитело с двойными цепями (диатела), антитела с тремя цепями (триатела), четырьмя цепями (тетратела) и полипептид, который содержит по меньшей мере часть иммуноглобулина, которая связывается с полипептид-специфическим антигеном.
Fab-фрагмент представляет собой одновалентный фрагмент с доменами VL, VH, CL и CH1; фрагмент F(ab')2 представляет собой двухвалентный фрагмент, имеющий два Fab-фрагмента, соединенных дисульфидной связью в шарнирной области; Fv-фрагменты имеют домены VH и VL; dAb-фрагменты имеют домен VH, домен VL или антигенсвязывающие фрагменты домена VH или VL (патенты США №№ US 6846634 и US 6696245; заявки на выдачу патентов США с общедоступными номерами US 2005/0202512, US 2004/0202995, US 2004/0038291, US 2004/0009507 и US 2003/0039958; Ward et al., 1989, Nature 341:544-546).
Одноцепочечное антитело (scFv) представляет собой слитый белок, в котором области VL и VH соединяются соединительным элементом (например, синтетической последовательностью аминокислотных остатков) с образованием непрерывного белкового антитела, где соединительный элемент достаточно длинный, чтобы позволить белковой цепи сворачиваться обратно и образовывать одновалентный антигенсвязывающий сайт (см., например, Bird et al., 1988, Science 242:423-26 и Huston et al., 1988, Proc. Natl. Acad. Sci. U.S.A. 85:5879-83).
Двухцепочечное антитело представляет собой двухвалентное антитело, содержащее две полипептидные цепи, каждая из которых содержит области VH и VL, соединенные таким коротким соединением, что не позволяет спариваться двум доменам в одной цепи. Следовательно, обеспечивается спаривание каждого домена с комплементарным доменом в другой полипептидной цепи (см., например, Holliger et al., 1993, Proc. Natl. Acad. Sci. U.S.A. 90:6444-48; Poljak et al., 1994, Structure 2:11 21-23). Если две полипептидные цепи двухнитевого антитела идентичны, то двухнитевое антитело, полученное в результате их спаривания, будет иметь один и тот же антигенсвязывающий сайт. Полипептидные цепи с разными последовательностями можно использовать для получения двухнитевых антител с разными антигенсвязывающими сайтами. Подобным образом, трехцепочечные и четырехцепочечные антитела представляют собой антитела, которые содержат три и четыре полипептидных цепи и образуют три и четыре антигенсвязывающих сайта, которые могут быть одинаковыми или разными.
В этой статье использован способ, который Kabat et al. описали в Sequences of Proteins of Immunological Interest, 5th edition, U.S. Dept. Of Health and Human Services, PHS, NIH, NIH Publication No.91-3242, 1991 для идентификации определяющей комплементарность области (CDR) и каркасной области (FR) данного антитела. Одна или несколько CDR могут быть включены в молекулу либо ковалентно, либо нековалентно, чтобы сделать ее антителом. Антитело может включать более крупную полипептидную цепь в CDR. CDR может(могут) быть ковалентно присоединена(-ы) к другой полипептидной цепи или может(могут) быть нековалентно включена(-ы) в CDR. CDR позволяют антителам специфически связываться со специфическими ассоциированными антигенами.
Антитела могут иметь один или несколько сайтов связывания. Если существует более чем один сайт связывания, то сайт связывания может быть таким же или отличаться от другого. Например, природный иммуноглобулин человека обычно имеет два идентичных сайта связывания, в то время как "биспецифические" или "бифункциональные" антитела имеют два разных сайта связывания.
Термин "мышиное антитело" включает в себя антитела, имеющие одну или несколько вариабельных и константных областей, полученных из последовательностей иммуноглобулина мыши.
Термин "гуманизированное антитело" представляет собой антитело, полученное путем трансплантации последовательности определяющих комплементарность областей молекул мышиных антител в каркас вариабельных областей человеческого антитела.
Термины "антигенсвязывающий домен", "антигенсвязывающая область" или "антигенсвязывающий сайт" представляют собой части антитела, которые содержат аминокислотные остатки, которые взаимодействуют с антигеном и вносят вклад в его специфичность и аффинность в отношении антигена. Для антител, которые специфически связываются со своими антигенами, они будут включать в себя по меньшей мере часть по меньшей мере одного из его доменов CDR.
Термин "эпитоп" представляет собой часть молекулы, которая связывается с (например, антителом) антителом. Эпитоп может содержать прерывистую часть молекулы (например, в полипептиде, аминокислотные остатки, прерывистые в первичной конфигурации полипептида, достаточно близки друг к другу в третичной и четвертичной структурах полипептида для связывания антителом).
"Одинаковый процент" двух полинуклеотидых или двух полипептидных последовательностей определяют с использованием последовательности сравнения параметров по умолчанию компьютерной программы GAP (GCG Wisconsin Package; часть версии 10.3 (Accelrys, Сан-Диего, штат Калифорния, США)).
Термины "полинуклеотид", "олигонуклеотид" и "нуклеиновая кислота" могут альтернативно использоваться по всему тексту и включают в себя молекулы ДНК (например, cDNA или геномной ДНК), молекулы РНК (например, mRNA), аналоги ДНК или РНК и их гибриды, полученные с использованием аналогов нуклеотидов (например, пептидных нуклеиновых кислот и неприродных аналогов нуклеотидов). Молекулы нуклеиновой кислоты могут быть одно- или двухнитевыми. В одном варианте осуществления молекулы нуклеиновой кислоты по настоящему изобретению кодируют антитело или его фрагменты, производные, мутантные белки или варианты с непрерывной открытой рамкой считывания.
Если их последовательности могут быть обратными и параллельными, то два однонитевых нуклеотида "комплементарны" друг другу, так что каждый нуклеотид в одном полинуклеотиде противоположен комплементарному нуклеотиду в другом, не вводятся гэпы и не обнаруживаются неспаренные нуклеотиды на 5'- или 3'-концах каждой последовательности. Если два полинуклеотида могут скрещиваться при умеренно строгих условиях, то один полинуклеотид является "комплементарным" другому. Таким образом, один полинуклеотид может быть комплементарным другому полинуклеотиду, но не его комплементарной последовательности.
Термин "носитель" представляет собой нуклеиновую кислоту, которую можно использовать для введения другой связанной с ней нуклеиновой кислоты в клетку. Одним типом носителя является "плазмида", относящаяся к линейной или кольцевой двухнитевой молекуле ДНК, которая может быть присоединена к дополнительному сегменту нуклеиновой кислоты. Другим типом носителя является вирусный вектор (например, репликационно дефективные ретровирусы, аденовирусы и аденовирусные вирусы-спутники), в котором дополнительные сегменты ДНК могут быть введены в вирусный геном. Некоторые носители могут автономно реплицироваться в клетках-хозяевах, в которые они введены (например, бактериальные носители, содержащие точку начала бактериальной репликации, и носители млекопитающих свободного типа). Другие носители (например, несвободные носители млекопитающих) интегрируют в геном клетки-хозяина при введении в клетку-хозяин и, таким образом, реплицируются с геномом хозяина. "Экспрессионный носитель" представляет собой тип носителя, который может управлять экспрессией выбранных полинуклеотидов.
Если регуляторная последовательность влияет на экспрессию нуклеотидной последовательности (например, уровень экспрессии, время или сайт), то нуклеотидная последовательность "функционально связана" с регуляторной последовательностью. "Регуляторная последовательность" представляет собой нуклеиновую кислоту, которая влияет на экспрессию (например, уровень экспрессии, время или сайт) нуклеиновой кислоты, с которой она функционально связана. Например, регуляторные гены действуют непосредственно на регулируемые нуклеиновые кислоты или через одну или несколько других молекул (например, полинуклеотидов, которые связываются с регуляторными последовательностями и/или нуклеиновыми кислотами). Примеры регуляторных последовательностей включают в себя промоторы, энхансеры и другие элементы контроля экспрессии (например, сигналы полиаденилирования). Могут быть описаны дополнительные примеры регуляторных последовательностей, как, например, в Goeddel, 1990, Gene Expression Technology: Methods in Enzymology, Volume 185, Academic Press, San Diego, CA и Baron et al., 1995, Nucleic Acids Res. 23:3605-06.
Термин "клетка-хозяин" относится к клетке, используемой для экспрессии нуклеиновой кислоты, такой как та, которая представлена в настоящем документе. Клетка-хозяин может быть прокариотами, такими как E. coli, или она может быть эукариотами, такими как одноклеточные эукариоты (например, дрожжи или другие грибы), растительные клетки (такие как клетки растений табака или томата), клетки животных (например, клетки обезьяны, клетки хомяка, клетки насекомых или клетки крыс и мышей), или гибридомой. Обычно клетка-хозяин представляет собой культуральную клетку, которую можно трансформировать или трансфицировать нуклеиновой кислотой, кодирующей пептид, которая затем может быть экспрессирована в клетке-хозяине. Фраза "рекомбинантная клетка-хозяин" может быть использована для описания клетки-хозяина, трансформированной или трансфицированной с ожидаемой экспрессией нуклеиновой кислоты. Клетка-хозяин также может быть клеткой, которая содержит нуклеиновую кислоту, но не экспрессирует ее на желаемом уровне, если только регуляторные последовательности не введены в клетку-хозяина, так что она функционально связана с нуклеиновой кислотой. Следует учитывать, что термин "клетка-хозяин" относится не только к конкретной рассматриваемой клетке, но также к потомству или возможному потомству этой клетки. Из-за определенных модификаций, происходящих в последующих поколениях, таких как мутации или влияние окружающей среды, потомство может фактически отличаться от родительской клетки, но все же находится в пределах объема терминологии, используемой в настоящем изобретении.
Рецептор кишечного желудочного ингибиторного полипептида
Рецептор кишечного желудочного ингибиторного полипептида принадлежит типу B семейства семиспиральных трансмембранных сопряженных с G-белком рецепторов. Рецептор связан с одним или несколькими внутриклеточными путями передачи сигнала с помощью гетеротримерного белка, связывающего гуаниновый нуклеотид (G-белок) (Drucker et al., 2006, Cell Metab. 3:153-65). До настоящего времени исследования показывают, что GIPR в основном экспрессируется на поверхности β-клеток поджелудочной железы и жировых клеток (Ravn et al., 2013, J. Biol. Chem. 288:19760-72), участвует в метаболизме как глюкозы, так и липидов у человека, и, следовательно, тесно связан с диабетом, ожирением и родственными заболеваниями (Skaw et al., 2016, Diabetes Obes. Metab. 18:847 -854). И "GIPR человека", и "hGIPR", используемые в настоящем документе, относятся к рецептору кишечного ингибиторного пептида человека и могут использоваться взаимозаменяемо. Оба термина "GIPR мыши" и "mGIPR", используемые в настоящем документе, относятся к рецептору желудочного ингибиторного полипептида мыши и также могут использоваться взаимозаменяемо.
В одном варианте осуществления антитело, представленное в настоящей заявке, представляет собой антитело, специфически связывающееся с GIPR человека. В другом варианте осуществления представленное в настоящей заявке антитело представляет собой антитело, специфически связывающееся с GIPR на клеточной мембране, и антитело может ингибировать или блокировать передачу сигналов GIP в этих клетках. В другом варианте осуществления представленное в настоящей заявке антитело представляет собой антитело, специфически связывающееся с GIPR человека, и может связываться с GIPR других видов (например, обезьян или мышей) и блокировать передачу сигнала GIP у этих видов. В дополнительном варианте осуществления представленное в настоящей заявке антитело представляет собой мышиное антитело, которое связывается с GIPR человека и может связываться с GIPR других видов (например, обезьян).
В одном варианте осуществления ниже приведены аминокислотные и полинуклеотидные последовательности GIPR с данными о последовательностях из базы данных Gene-Bank Национального центра биотехнологической информации США и базы данных Uniprot Европейского института биологической информации:
полинуклеотидная последовательность человека (Homo sapiens) (SEQ ID NO:114); номер доступа: S79852;
аминокислотная последовательность человека (Homo sapiens) (SEQ ID NO:113); номер доступа: AAB35419.2;
полинуклеотидная последовательность обезьяны (Rhesus macaque) (SEQ ID NO:116); номер доступа: XM_015124289.1;
аминокислотная последовательность обезьянья (Rhesus macaque) (SEQ ID NO:115); номер доступа: XP_014979775;
полинуклеотидная последовательность мыши (Mus musculus) (SEQ ID NO:118); номер доступа: CCDS39795 и аминокислотная последовательность мыши (Mus musculus) (SEQ ID NO:117); номер доступа: Q0P543.
Антитело к рецептору кишечного желудочного ингибиторного полипептида (GIPR)
В одном варианте осуществления в настоящей заявке представлено антитело к GIPR. В другом варианте осуществления антитело к GIPR, представленное в настоящей заявке, представляет собой полное антитело к GIPR. В другом варианте осуществления антитело к GIPR, представленное в настоящей заявке, представляет собой фрагмент антитела к GIPR. В другом варианте осуществления антитело к GIPR, представленное в настоящей заявке, представляет собой производное антитела к GIPR. В другом варианте осуществления антитело к GIPR, представленное в настоящей заявке, представляет собой мутантный белок антитела к GIPR. В дополнительном варианте осуществления антитело к GIPR, представленное в настоящей заявке, представляет собой вариант антитела к GIPR.
В одном варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит одну, две, три, четыре, пять или шесть аминокислотных последовательностей, где каждая независимо выбрана из аминокислотных последовательностей, приведенных ниже:
a. аминокислотная последовательность CDR1 легкой цепи: SEQ ID NO:1, SEQ ID NO:4, SEQ ID NO:7, SEQ ID NO:10, SEQ ID NO:13, и SEQ ID NO:15;
b. аминокислотная последовательность CDR2 легкой цепи: SEQ ID NO:2, SEQ ID NO:5, SEQ ID NO:8, SEQ ID NO:11, и SEQ ID NO:16;
c. аминокислотная последовательность CDR3 легкой цепи: SEQ ID NO:3, SEQ ID NO:6, SEQ ID NO:9, SEQ ID NO:12, SEQ ID NO:14, и SEQ ID NO:17;
d. аминокислотная последовательность CDR1 тяжелой цепи: SEQ ID NO:18, SEQ ID NO:23, и SEQ ID NO:26;
e. аминокислотная последовательность CDR2 тяжелой цепи: SEQ ID NO:19, SEQ ID NO:21, SEQ ID NO:24, SEQ ID NO:27, и SEQ ID NO:29; и
f. аминокислотная последовательность CDR3 тяжелой цепи: SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:25, SEQ ID NO:28, и SEQ ID NO:30.
В таблице 1 приводятся аминокислотные последовательности CDR легкой цепи антитела к GIPR, представленного в настоящей заявке, а также соответствующие полинуклеотидные кодирующие последовательности. В таблице 2 приводятся аминокислотные последовательности CDR тяжелой цепи антитела к GIPR, представленного в настоящей заявке, а также соответствующие полинуклеотидные кодирующие последовательности.
Таблица 1. Аминокислотные последовательности и полинуклеотидные кодирующие последовательности CDR легкой цепи
нуклеотид. пос-ть
(SEQ ID NO:31)
(SEQ ID NO:32)
(SEQ ID NO:33)
аминокислотная пос-ть
(SEQ ID NO:1)
(SEQ ID NO:2)
(SEQ ID NO:3)
нуклеотид. пос-ть
(SEQ ID NO:34)
(SEQ ID NO:35)
(SEQ ID NO:36)
аминокислотная пос-ть
(SEQ ID NO:4)
(SEQ ID NO:5)
(SEQ ID NO:6)
нуклеотид. пос-ть
(SEQ ID NO:37)
(SEQ ID NO:38)
(SEQ ID NO:39)
аминокислотная пос-ть
(SEQ ID NO:7)
(SEQ ID NO:8)
(SEQ ID NO:9)
нуклеотид. пос-ть
(SEQ ID NO:40)
(SEQ ID NO:41)
(SEQ ID NO:42)
аминокислотная пос-ть
(SEQ ID NO:10)
(SEQ ID NO:11)
(SEQ ID NO:12)
нуклеотид. пос-ть
(SEQ ID NO:43)
(SEQ ID NO:41)
(SEQ ID NO:44)
аминокислотная пос-ть
(SEQ ID NO:13)
(SEQ ID NO:11)
(SEQ ID NO:14)
нуклеотид. пос-ть
(SEQ ID NO:45)
(SEQ ID NO:46)
(SEQ ID NO:47)
аминокислотная пос-ть
(SEQ ID NO:15)
(SEQ ID NO:16)
(SEQ ID NO:17)
Таблица 2. Аминокислотные последовательности и полинуклеотидные кодирующие последовательности CDR тяжелой цепи
нуклеотид. пос-ть
(SEQ ID NO:48)
(SEQ ID NO:49)
(SEQ ID NO:50)
аминокислотная пос-ть
(SEQ ID NO:18)
(SEQ ID NO:19)
(SEQ ID NO:20)
нуклеотид. пос-ть
(SEQ ID NO:48)
(SEQ ID NO:51)
(SEQ ID NO:52)
аминокислотная пос-ть
(SEQ ID NO:18)
(SEQ ID NO:21)
(SEQ ID NO:22)
нуклеотид. пос-ть
(SEQ ID NO:53)
(SEQ ID NO:54)
(SEQ ID NO:55)
аминокислотная пос-ть
(SEQ ID NO:23)
(SEQ ID NO:24)
(SEQ ID NO:25)
нуклеотид. пос-ть
(SEQ ID NO:56)
(SEQ ID NO:57)
(SEQ ID NO:58)
аминокислотная пос-ть
(SEQ ID NO:26)
(SEQ ID NO:27)
(SEQ ID NO:28)
нуклеотид. пос-ть
(SEQ ID NO:56)
(SEQ ID NO:57)
(SEQ ID NO:58)
аминокислотная пос-ть
(SEQ ID NO:26)
(SEQ ID NO:27)
(SEQ ID NO:28)
нуклеотид. пос-ть
(SEQ ID NO:56)
(SEQ ID NO:59)
(SEQ ID NO:60)
аминокислотная пос-ть
(SEQ ID NO:26)
(SEQ ID NO:29)
(SEQ ID NO:30)
В одном варианте осуществления антитело, представленное в настоящей заявке, содержит последовательность, отличающуюся от таковой аминокислотных последовательностей CDR, приведенных в таблицах 1 и 2, пятью, четырьмя, тремя, двумя или одним добавлением, замещением и/или делецией одиночной аминокислоты. В другом варианте осуществления антитело, представленное в настоящей заявке, содержит последовательность, отличающуюся от таковой аминокислотных последовательностей CDR, приведенных в таблицах 1 и 2, четырьмя, тремя, двумя или одним добавлением, замещением и/или делецией одиночной аминокислоты.
В другом варианте осуществления антитело, представленное в настоящей заявке, содержит последовательность, отличающуюся от таковой аминокислотных последовательностей CDR, приведенных в таблицах 1 и 2, тремя, двумя или одним добавлением, замещением и/или делецией одиночной аминокислоты.
В другом варианте осуществления антитело, представленное в настоящей заявке, содержит последовательность, отличающуюся от таковой аминокислотных последовательностей CDR, приведенных в таблицах 1 и 2, двумя или одним добавлением, замещением и/или делецией одиночной аминокислоты.
В дополнительных вариантах осуществления антитело, представленное в настоящей заявке, содержит последовательность, отличающуюся от таковой аминокислотных последовательностей CDR, приведенных в таблицах 1 и 2, добавлением, замещением и/или делецией одиночной аминокислоты.
В одном варианте осуществления антитело к GIPR, представленное в настоящей заявке содержит одну или две аминокислотные последовательности, где каждая аминокислотная последовательность независимо выбрана из аминокислотных последовательностей, приведенных ниже:
a. аминокислотные последовательности CDR1 легкой цепи: SEQ ID NO:1, SEQ ID NO:4, SEQ ID NO:7, SEQ ID NO:10, SEQ ID NO:13, и SEQ ID NO:15 и
b. аминокислотные последовательности CDR1 тяжелой цепи: SEQ ID NO:18, SEQ ID NO:23, и SEQ ID NO:26.
В другом варианте осуществления антитело к GIPR, представленное в настоящей заявке содержит одну или две аминокислотные последовательности, где каждая аминокислотная последовательность независимо выбрана из аминокислотных последовательностей, приведенных ниже:
a. аминокислотные последовательности CDR2 легкой цепи: SEQ ID NO:2, SEQ ID NO:5, SEQ ID NO:8, SEQ ID NO:11, и SEQ ID NO:16 и
b. аминокислотные последовательности CDR2 тяжелой цепи: SEQ ID NO:19, SEQ ID NO:21, SEQ ID NO:24, SEQ ID NO:27, и SEQ ID NO:29.
В другом варианте осуществления антитело к GIPR, представленное в настоящей заявке содержит одну, две, три или четыре аминокислотных последовательности, где каждая аминокислотная последовательность независимо выбрана из аминокислотных последовательностей, приведенных ниже:
a. аминокислотные последовательности CDR3 легкой цепи: SEQ ID NO:3, SEQ ID NO:6, SEQ ID NO:9, SEQ ID NO:12, SEQ ID NO:14, и SEQ ID NO:17 и
b. аминокислотные последовательности CDR3 тяжелой цепи: SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:25, SEQ ID NO:28, и SEQ ID NO:30.
В другом варианте осуществления антитело к GIPR, представленное в настоящей заявке содержит одну, две, три или четыре аминокислотных последовательности, где каждая аминокислотная последовательность независимо выбрана из аминокислотных последовательностей, приведенных ниже:
a. аминокислотные последовательности CDR1 легкой цепи: SEQ ID NO:1, SEQ ID NO:4, SEQ ID NO:7, SEQ ID NO:10, SEQ ID NO:13, и SEQ ID NO:15;
b. аминокислотные последовательности CDR1 тяжелой цепи: SEQ ID NO:18, SEQ ID NO:23, и SEQ ID NO:26;
c. аминокислотные последовательности CDR2 легкой цепи: SEQ ID NO:2, SEQ ID NO:5, SEQ ID NO:8, SEQ ID NO:11, и SEQ ID NO:16; и
d. аминокислотные последовательности CDR2 тяжелой цепи: SEQ ID NO:19, SEQ ID NO:21, SEQ ID NO:24, SEQ ID NO:27, и SEQ ID NO:29.
В другом варианте осуществления антитело к GIPR, представленное в настоящей заявке содержит одну, две, три или четыре аминокислотных последовательности, где каждая аминокислотная последовательность независимо выбрана из аминокислотных последовательностей, приведенных ниже:
a. аминокислотные последовательности CDR1 легкой цепи: SEQ ID NO:1, SEQ ID NO:4, SEQ ID NO:7, SEQ ID NO:10, SEQ ID NO:13, и SEQ ID NO:15;
b. аминокислотные последовательности CDR1 тяжелой цепи: SEQ ID NO:18, SEQ ID NO:23, и SEQ ID NO:26;
c. аминокислотные последовательности CDR3 легкой цепи: SEQ ID NO:3, SEQ ID NO:6, SEQ ID NO:9, SEQ ID NO:12, SEQ ID NO:14, и SEQ ID NO:17; и
d. аминокислотные последовательности CDR3 тяжелой цепи: SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:25, SEQ ID NO:28, и SEQ ID NO:30.
В дополнительных вариантах осуществления антитело к GIPR, представленное в настоящей заявке содержит одну, две, три или четыре аминокислотных последовательности, где каждая аминокислотная последовательность независимо выбрана из аминокислотных последовательностей, приведенных ниже:
a. аминокислотные последовательности CDR2 легкой цепи: SEQ ID NO:2, SEQ ID NO:5, SEQ ID NO:8, SEQ ID NO:11, и SEQ ID NO:16;
b. аминокислотные последовательности CDR2 тяжелой цепи: SEQ ID NO:19, SEQ ID NO:21, SEQ ID NO:24, SEQ ID NO:27, и SEQ ID NO:29;
c. аминокислотные последовательности CDR3 легкой цепи: SEQ ID NO:3, SEQ ID NO:6, SEQ ID NO:9, SEQ ID NO:12, SEQ ID NO:14, и SEQ ID NO:17; и
d. аминокислотные последовательности CDR3 тяжелой цепи: SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:25, SEQ ID NO:28, и SEQ ID NO:30.
В одном варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит одну, две или три аминокислотных последовательности, где каждая аминокислотная последовательность независимо выбрана из аминокислотных последовательностей, приведенных ниже: SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, и SEQ ID NO:17.
В другом варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит одну, две или три аминокислотных последовательности, где каждая аминокислотная последовательность независимо выбрана из аминокислотных последовательностей, приведенных ниже: SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, и SEQ ID NO:30.
В одном варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит комбинацию аминокислотных последовательностей CDR1 легкой цепи и тяжелой цепи, независимо выбранных из приведенного ниже перечня: SEQ ID NO:1 и SEQ ID NO:18, SEQ ID NO:4 и SEQ ID NO:18, SEQ ID NO:7 и SEQ ID NO:23, SEQ ID NO:10 и SEQ ID NO:26, SEQ ID NO:13 и SEQ ID NO:26, и SEQ ID NO:15 и SEQ ID NO:26.
В другом варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит комбинацию аминокислотных последовательностей CDR2 легкой цепи и тяжелой цепи, независимо выбранных из приведенного ниже перечня: SEQ ID NO:2 и SEQ ID NO:19, SEQ ID NO:5 и SEQ ID NO:21, SEQ ID NO:8 и SEQ ID NO:24, SEQ ID NO:11 и SEQ ID NO:27, и SEQ ID NO:16 и SEQ ID NO:29.
В дополнительных вариантах осуществления антитело к GIPR, представленное в настоящей заявке, содержит комбинацию аминокислотных последовательностей CDR3 легкой цепи и тяжелой цепи, независимо выбранных из приведенного ниже перечня: SEQ ID NO:3 и SEQ ID NO:20, SEQ ID NO:6 и SEQ ID NO:22, SEQ ID NO:9 и SEQ ID NO:25, SEQ ID NO:12 и SEQ ID NO:28, SEQ ID NO:14 и SEQ ID NO:28, и SEQ ID NO:17 и SEQ ID NO:30.
В одном варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит
a. комбинацию аминокислотных последовательностей CDR1 легкой и тяжелой цепей, независимо выбранных из приведенного ниже перечня: SEQ ID NO:1 и SEQ ID NO:18, SEQ ID NO:4 и SEQ ID NO:18, SEQ ID NO:7 и SEQ ID NO:23, SEQ ID NO:10 и SEQ ID NO:26, SEQ ID NO:13 и SEQ ID NO:26, и SEQ ID NO:15 и SEQ ID NO:26; и
b. комбинацию аминокислотных последовательностей CDR2 легкой и тяжелой цепей, независимо выбранных из приведенного ниже перечня: SEQ ID NO:2 и SEQ ID NO:19, SEQ ID NO:5 и SEQ ID NO:21, SEQ ID NO:8 и SEQ ID NO:24, SEQ ID NO:11 и SEQ ID NO:27, и SEQ ID NO:16 и SEQ ID NO:29.
В другом варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит
a. комбинацию аминокислотных последовательностей CDR1 легкой и тяжелой цепей, независимо выбранных из приведенного ниже перечня: SEQ ID NO:1 и SEQ ID NO:18, SEQ ID NO:4 и SEQ ID NO:18, SEQ ID NO:7 и SEQ ID NO:23, SEQ ID NO:10 и SEQ ID NO:26, SEQ ID NO:13 и SEQ ID NO:26,и SEQ ID NO:15 и SEQ ID NO:26; и
b. комбинацию аминокислотных последовательностей CDR3 легкой и тяжелой цепей, независимо выбранных из приведенного ниже перечня: SEQ ID NO:3 и SEQ ID NO:20, SEQ ID NO:6 и SEQ ID NO:22, SEQ ID NO:9 и SEQ ID NO:25, SEQ ID NO:12 и SEQ ID NO:28, SEQ ID NO:14 и SEQ ID NO:28,и SEQ ID NO:17 и SEQ ID NO:30.
В другом варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит
a. комбинацию аминокислотных последовательностей CDR2 легкой и тяжелой цепей, независимо выбранных из приведенного ниже перечня: SEQ ID NO:2 и SEQ ID NO:19, SEQ ID NO:5 и SEQ ID NO:21, SEQ ID NO:8 и SEQ ID NO:24, SEQ ID NO:11 и SEQ ID NO:27, и SEQ ID NO:16 и SEQ ID NO:29; и
b. комбинацию аминокислотных последовательностей CDR3 легкой и тяжелой цепей, независимо выбранных из приведенного ниже перечня: SEQ ID NO:3 и SEQ ID NO:20, SEQ ID NO:6 и SEQ ID NO:22, SEQ ID NO:9 и SEQ ID NO:25, SEQ ID NO:12 и SEQ ID NO:28, SEQ ID NO:14 и SEQ ID NO:28, и SEQ ID NO:17 и SEQ ID NO:30.
В дополнительном варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит
a. комбинацию аминокислотных последовательностей CDR1 легкой и тяжелой цепей, независимо выбранных из приведенного ниже перечня: SEQ ID NO:1 и SEQ ID NO:18, SEQ ID NO:4 и SEQ ID NO:18, SEQ ID NO:7 и SEQ ID NO:23, SEQ ID NO:10 и SEQ ID NO:26, SEQ ID NO:13 и SEQ ID NO:26, и SEQ ID NO:15 и SEQ ID NO:26;
b. комбинацию аминокислотных последовательностей CDR2 легкой и тяжелой цепей, независимо выбранных из приведенного ниже перечня: SEQ ID NO:2 и SEQ ID NO:19, SEQ ID NO:5 и SEQ ID NO:21, SEQ ID NO:8 и SEQ ID NO:24, SEQ ID NO:11 и SEQ ID NO:27, и SEQ ID NO:16 и SEQ ID NO:29; и
c. комбинацию аминокислотных последовательностей CDR3 легкой и тяжелой цепей, независимо выбранных из приведенного ниже перечня: SEQ ID NO:3 и SEQ ID NO:20, SEQ ID NO:6 и SEQ ID NO:22, SEQ ID NO:9 и SEQ ID NO:25, SEQ ID NO:12 и SEQ ID NO:28, SEQ ID NO:14 и SEQ ID NO:28, и SEQ ID NO:17 и SEQ ID NO:30.
В одном варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит
a. комбинацию аминокислотных последовательностей CDR1, CDR2 и CDR3 легкой цепи и тяжелой цепи: SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:18, SEQ ID NO:19, и SEQ ID NO:20;
b. комбинацию аминокислотных последовательностей CDR1, CDR2 и CDR3 легкой цепи и тяжелой цепи: SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:18, SEQ ID NO:21, и SEQ ID NO:22;
c. комбинацию аминокислотных последовательностей CDR1, CDR2 и CDR3 легкой цепи и тяжелой цепи: SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:23, SEQ ID NO:24, и SEQ ID NO:25;
d. комбинацию аминокислотных последовательностей CDR1, CDR2 и CDR3 легкой цепи и тяжелой цепи: SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:26, SEQ ID NO:27, и SEQ ID NO:28;
e. комбинацию аминокислотных последовательностей CDR1, CDR2 и CDR3 легкой цепи и тяжелой цепи: SEQ ID NO:13, SEQ ID NO:11, SEQ ID NO:14, SEQ ID NO:26, SEQ ID NO:27, и SEQ ID NO:28; или
f. комбинацию аминокислотных последовательностей CDR1, CDR2 и CDR3 легкой цепи и тяжелой цепи: SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:26, SEQ ID NO:29, и SEQ ID NO:30.
В одном варианте осуществления антитело к GIPR, представленное в настоящей заявке содержит одну или две аминокислотные последовательности, где каждая аминокислотная последовательность независимо выбрана из аминокислотной последовательности, приведенной ниже:
a. аминокислотные последовательности вариабельного домена легкой цепи: SEQ ID NO:61, SEQ ID NO:62, SEQ ID NO:63, SEQ ID NO:64, SEQ ID NO:65, SEQ ID NO:66, SEQ ID NO:67, SEQ ID NO:68, SEQ ID NO:69, SEQ ID NO:70, и SEQ ID NO:71; и аминокислотная последовательность, которая на по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% идентична любой из приведенных выше последовательностей; и
b. аминокислотные последовательности вариабельного домена тяжелой цепи: SEQ ID NO:72, SEQ ID NO:73, SEQ ID NO:74, SEQ ID NO:75, SEQ ID NO:76, SEQ ID NO:77, SEQ ID NO:78, SEQ ID NO:79, и SEQ ID NO:80; и аминокислотная последовательность, которая на по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% идентична любой из приведенных выше последовательностей.
В другом варианте осуществления полинуклеотидная кодирующая последовательность для антитела к GIPR, представленного в настоящей заявке, включает в себя одну или две полинуклеотидные кодирующие последовательности, где каждая полинуклеотидная кодирующая последовательность независимо выбрана из полинуклеотидных последовательностей, приведенных ниже:
a. полинуклеотидные кодирующие последовательности вариабельного домена легкой цепи: SEQ ID NO:81, SEQ ID NO:82, SEQ ID NO:83, SEQ ID NO:84, SEQ ID NO:85, SEQ ID NO:86, SEQ ID NO:87, SEQ ID NO:88, SEQ ID NO:89, SEQ ID NO:90, и SEQ ID NO:91; и полинуклеотидная последовательность, которая на по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% идентична любой из приведенных выше последовательностей; и
b. полинуклеотидные кодирующие последовательности вариабельного домена тяжелой цепи: SEQ ID NO:92, SEQ ID NO:93, SEQ ID NO:94, SEQ ID NO:95, SEQ ID NO:96, SEQ ID NO:97, SEQ ID NO:98, SEQ ID NO:99, и SEQ ID NO:100; и полинуклеотидная последовательность, которая на по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% идентична любой из приведенных выше последовательностей.
В одном варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит аминокислотную последовательность, независимо выбранную из приведенного ниже перечня: SEQ ID NO:61, SEQ ID NO:62, SEQ ID NO:63, SEQ ID NO:64, SEQ ID NO:65, SEQ ID NO:66, SEQ ID NO:67, SEQ ID NO:68, SEQ ID NO:69, SEQ ID NO:70, и SEQ ID NO:71.
В другом варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит аминокислотную последовательность, независимо выбранную из приведенного ниже перечня: SEQ ID NO:72, SEQ ID NO:73, SEQ ID NO:74, SEQ ID NO:75, SEQ ID NO:76, SEQ ID NO:77, SEQ ID NO:78, SEQ ID NO:79, и SEQ ID NO:80.
В одном варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит комбинацию аминокислотных последовательностей, независимо выбранных из аминокислотных последовательностей вариабельного домена легкой цепи и тяжелой цепи, перечисленных ниже: SEQ ID NO:61 и SEQ ID NO:72, SEQ ID NO:62 и SEQ ID NO:73, SEQ ID NO:63 и SEQ ID NO:74, SEQ ID NO:64 и SEQ ID NO:74, SEQ ID NO:65 и SEQ ID NO:75, SEQ ID NO:66 и SEQ ID NO:76, SEQ ID NO:67 и SEQ ID NO:77, SEQ ID NO:68 и SEQ ID NO:77, SEQ ID NO:69 и SEQ ID NO:78, SEQ ID NO:70 и SEQ ID NO:79, и SEQ ID NO:71 и SEQ ID NO:80.
В одном варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит аминокислотную последовательность, независимо выбранную из приведенного ниже перечня: SEQ ID NO:62, SEQ ID NO:63, SEQ ID NO:64, SEQ ID NO:66, SEQ ID NO:67, SEQ ID NO:68, SEQ ID NO:73, SEQ ID NO:74, SEQ ID NO:76, и SEQ ID NO:77.
В другом варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит комбинацию аминокислотных последовательностей, независимо выбранных из аминокислотных последовательностей вариабельного домена легкой цепи и тяжелой цепи, перечисленных ниже: SEQ ID NO:61 и SEQ ID NO:72 (L1H1), SEQ ID NO:62 и SEQ ID NO:73 (L2H2), SEQ ID NO:63 и SEQ ID NO:74 (L3H3), SEQ ID NO:64 и SEQ ID NO:74 (L4H3), SEQ ID NO:65 и SEQ ID NO:75 (L5H4), SEQ ID NO:66 и SEQ ID NO:76 (L6H5), SEQ ID NO:67 и SEQ ID NO:77 (L7H6), SEQ ID NO:68 и SEQ ID NO:77 (L8H6), SEQ ID NO:69 и SEQ ID NO:78 (L9H7), SEQ ID NO:70 и SEQ ID NO:79 (L10H8), и SEQ ID NO:71 и SEQ ID NO:80 (L11H9).
Символ "LxHy" также может применяться в настоящей заявке в отношении антитела к GIPR, представленного в настоящей заявке, где "x" соответствует коду последовательности вариабельной области легкой цепи, а "y" соответствует коду последовательности вариабельной области тяжелой цепи. Например, L2H2 представляет собой полное антитело с вариабельной областью легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO:62 (L2), и вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO:73 (H2).
В одном варианте осуществления антитело к GIPR, представленное в настоящей заявке содержит одну или две аминокислотные последовательности, где каждая аминокислотная последовательность независимо выбрана из аминокислотной последовательности, приведенной ниже:
a. аминокислотные последовательности константного домена легкой цепи: SEQ ID NO:101 и SEQ ID NO:102; и
b. аминокислотные последовательности константного домена тяжелой цепи: SEQ ID NO:103, и SEQ ID NO:104, и SEQ ID NO:124.
В одном варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит одну или две аминокислотные последовательности, где каждая аминокислотная последовательность независимо выбрана из комбинации аминокислотных последовательностей константного домена легкой цепи и тяжелой цепи, приведенных ниже: SEQ ID NO:101 и SEQ ID NO:103, SEQ ID NO:101 и SEQ ID NO:104, SEQ ID NO:102 и SEQ ID NO:103, и SEQ ID NO:102 и SEQ ID NO:104. В другом варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит одну или две аминокислотные последовательности, где каждая аминокислотная последовательность независимо выбрана из комбинации аминокислотных последовательностей константного домена легкой цепи и тяжелой цепи, приведенных ниже: SEQ ID NO:101 и SEQ ID NO:124, и SEQ ID NO:102 и SEQ ID NO:124.
В одном варианте осуществления антитела к GIPR, представленные в настоящей заявке, содержат CDR легкой и тяжелой цепей, приведенные в настоящей заявке, и аминокислотные последовательности FR (каркаса). Аминокислотные последовательности FR содержатся в вариабельном домене легкой цепи или тяжелой цепи и не отображаются отдельно. В одном варианте осуществления антитело содержит последовательность CDR1 легкой цепи, приведенную в настоящей заявке. В другом варианте осуществления антитело содержит последовательность CDR2 легкой цепи, приведенную в настоящей заявке. В другом варианте осуществления антитело содержит последовательность CDR3 легкой цепи, приведенную в настоящей заявке. В другом варианте осуществления антитело содержит последовательность CDR1 тяжелой цепи, приведенную в настоящей заявке. В другом варианте осуществления антитело содержит последовательность CDR2 тяжелой цепи, приведенную в настоящей заявке. В другом варианте осуществления антитело содержит последовательность CDR3 тяжелой цепи, приведенную в настоящей заявке. В другом варианте осуществления антитело содержит последовательность FR1 легкой цепи, приведенную в настоящей заявке. В другом варианте осуществления антитело содержит последовательность FR2 легкой цепи, приведенную в настоящей заявке. В другом варианте осуществления антитело содержит последовательность FR3 легкой цепи, приведенную в настоящей заявке. В другом варианте осуществления антитело содержит последовательность FR4 легкой цепи, приведенную в настоящей заявке. В другом варианте осуществления антитело содержит последовательность FR1 тяжелой цепи, приведенную в настоящей заявке. В другом варианте осуществления антитело содержит последовательность FR2 тяжелой цепи, приведенную в настоящей заявке. В другом варианте осуществления антитело содержит последовательность FR3 тяжелой цепи, приведенную в настоящей заявке. В дополнительном варианте осуществления антитело содержит последовательность FR4 тяжелой цепи, приведенную в настоящей заявке.
В одном варианте осуществления последовательность CDR3 легкой цепи антитела отличается от SEQ ID NO:6, SEQ ID NO:12 и SEQ ID NO:14 последовательностей CDR3 легкой цепи, иллюстрируемых выше, не более чем шестью, пятью, четырьмя, тремя, двумя или одним(одной) аминокислотным(-и) добавлением(-ями), заменой(-ами) и/или делецией(-ями). В другом варианте осуществления последовательность CDR3 тяжелой цепи антитела отличается от SEQ ID NO:22 и SEQ ID NO:28 последовательностей CDR3 тяжелой цепи, иллюстрируемых выше, не более чем шестью, пятью, четырьмя, тремя, двумя или одним(одной) аминокислотным(-и) добавлением(-ями), заменой(-ами) и/или делецией(-ями). В дополнительном варианте осуществления последовательность CDR3 легкой цепи антитела отличается от SEQ ID NO:6, SEQ ID NO:12 и SEQ ID NO:14 последовательностей CDR3 легкой цепи, иллюстрируемых выше, не более чем шестью, пятью, четырьмя, тремя, двумя или одним(одной) аминокислотным(-и) добавлением(-ями), заменой(-ами) и/или делецией(-ями), и последовательность CDR3 тяжелой цепи антитела отличается от SEQ ID NO:22 и SEQ ID NO:28 последовательностей CDR3 тяжелой цепи, иллюстрируемых выше, не более чем шестью, пятью, четырьмя, тремя, двумя или одним(одной) аминокислотным(-и) добавлением(-ями), заменой(-ами) и/или делецией(-ями). В другом варианте осуществления антитело дополнительно содержит комбинацию одной, двух, трех, четырех, пяти или шести последовательностей CDR легкой и тяжелой цепей, иллюстрируемых выше.
В одном варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит аминокислотную последовательность вариабельного домена легкой цепи, выбранную из последовательностей вариабельного домена легкой цепи L2 (SEQ ID NO:62), L3 (SEQ ID NO:63), L4 (SEQ ID NO:64), L6 (SEQ ID NO:66), L7 (SEQ ID NO:67), и L8 (SEQ ID NO:68), приведенных в настоящей заявке. В одном варианте осуществления аминокислотная последовательность вариабельного домена легкой цепи антитела к GIPR отличается от аминокислотной последовательности одного вариабельного домена легкой цепи L2 (SEQ ID NO:62), L3 (SEQ ID NO:63), L4 (SEQ ID NO:64), L6 (SEQ ID NO:66), L7 (SEQ ID NO:67), и L8 (SEQ ID NO:68) пятнадцатью, четырнадцатью, тринадцатью, двенадцатью, одиннадцатью, десятью, девятью, восемью, семью, шестью, пятью, четырьмя, тремя, двумя или одним аминокислотным отличием, где отличие в каждой последовательности независимо представляет собой делецию, вставку или замену аминокислотного остатка. В другом варианте осуществления вариабельный домен легкой цепи антитела к GIPR содержит аминокислотную последовательность, на по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97% или по меньшей мере 99% идентичную аминокислотной последовательности одного вариабельного домена легкой цепи L2 (SEQ ID NO:62), L3 (SEQ ID NO:63), L4 (SEQ ID NO:64), L6 (SEQ ID NO:66), L7 (SEQ ID NO:67), и L8 (SEQ ID NO:68). В другом варианте осуществления полинуклеотидная кодирующая последовательность вариабельного домена легкой цепи антитела к GIPR содержит нуклеотидную кодирующую последовательность, на по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97% или по меньшей мере 99% идентичную одной полинуклеотидной кодирующей последовательности L2 (SEQ ID NO:62), L3 (SEQ ID NO:63), L4 (SEQ ID NO:64), L6 (SEQ ID NO:66), L7 (SEQ ID NO:67), и L8 (SEQ ID NO:68). В другом варианте осуществления полинуклеотидная кодирующая последовательность вариабельного домена легкой цепи антитела к GIPR содержит полинуклеотидные последовательности, гибридизируемые при умеренных условиях с одной комплементарной полинуклеотидной кодирующей последовательностью L2 (SEQ ID NO:62), L3 (SEQ ID NO:63), L4 (SEQ ID NO:64), L6 (SEQ ID NO:66), L7 (SEQ ID NO:67), и L8 (SEQ ID NO:68). В дополнительном варианте осуществления полинуклеотидная кодирующая последовательность вариабельного домена легкой цепи антитела к GIPR содержит полинуклеотидную последовательность, гибридизируемую при жестких условиях с комплементарной полинуклеотидной кодирующей последовательностью одного вариабельного домена легкой цепи L2 (SEQ ID NO:62), L3 (SEQ ID NO:63), L4 (SEQ ID NO:64), L6 (SEQ ID NO:66), L7 (SEQ ID NO:67), и L8 (SEQ ID NO:68).
В одном варианте осуществления антитело к GIPR, представленное в настоящей заявке, содержит аминокислотную последовательность вариабельного домена тяжелой цепи, выбранную из последовательностей вариабельного домена тяжелой цепи H2 (SEQ ID NO:73), H3 (SEQ ID NO:74), H5 (SEQ ID NO:76), и H6 (SEQ ID NO:77), приведенных в настоящей заявке. В другом варианте осуществления аминокислотная последовательность вариабельного домена тяжелой цепи антитела к GIPR отличается от одной последовательности вариабельного домена тяжелой цепи H2 (SEQ ID NO:73), H3 (SEQ ID NO:74), H5 (SEQ ID NO:76), и H6 (SEQ ID NO:77) пятнадцатью, четырнадцатью, тринадцатью, двенадцатью, одиннадцатью, десятью, девятью, восемью, семью, шестью, пятью, четырьмя, тремя, двумя или одним аминокислотным остатком, где отличие в каждой последовательности независимо представляет собой делецию, вставку или замену одного аминокислотного остатка. В другом варианте осуществления вариабельный домен тяжелой цепи антитела к GIPR содержит аминокислотную последовательность, на по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97% или по меньшей мере 99% идентичную одной последовательности вариабельного домена тяжелой цепи H2 (SEQ ID NO:73), H3 (SEQ ID NO:74), H5 (SEQ ID NO:76), и H6 (SEQ ID NO:77). В другом варианте осуществления вариабельный домен тяжелой цепи антитела к GIPR содержит полинуклеотидную кодирующую последовательность, на по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97% или по меньшей мере 99% идентичную одной полинуклеотидной кодирующей последовательности вариабельного домена тяжелой цепи H2 (SEQ ID NO:73), H3 (SEQ ID NO:74), H5 (SEQ ID NO:76), и H6 (SEQ ID NO:77). В другом варианте осуществления полинуклеотидная кодирующая последовательность вариабельного домена тяжелой цепи антитела к GIPR содержит полинуклеотидную последовательность, гибридизируемую с комплементарной полинуклеотидной кодирующей последовательностью одного вариабельного домена тяжелой цепи из H2 (SEQ ID NO:73), H3 (SEQ ID NO:74), H5 (SEQ ID NO:76), и H6 (SEQ ID NO:77) при умеренно жестких условиях. В одном варианте осуществления полинуклеотидная кодирующая последовательность вариабельного домена тяжелой цепи антитела к GIPR содержит полинуклеотидную последовательность, гибридизируемую при жестких условиях с комплементарной полинуклеотидной кодирующей последовательностью одного вариабельного домена тяжелой цепи из H2 (SEQ ID NO:73), H3 (SEQ ID NO:74), H5 (SEQ ID NO:76), и H6 (SEQ ID NO:77).
В варианте осуществления антитело, представленное в настоящей заявке, представляет собой антитело, содержащее комбинацию L1H1 (SEQ ID NO:61 и SEQ ID NO:72), L2H2 (SEQ ID NO:62 и SEQ ID NO:73), L3H3 (SEQ ID NO:63 и SEQ ID NO:74), L4H3 (SEQ ID NO:64 и SEQ ID NO:74), L5H4 (SEQ ID NO:65 и SEQ ID NO:75), L6H5 (SEQ ID NO:66 и SEQ ID NO:76), L7H6 (SEQ ID NO:67 и SEQ ID NO:77), L8H6 (SEQ ID NO:68 и SEQ ID NO:77), L9H7 (SEQ ID NO:69 и SEQ ID NO:78), L10H8 (SEQ ID NO:70 и SEQ ID NO:79), или L11H9 (SEQ ID NO:71 и SEQ ID NO:80), или желаемого фенотипа (например, IgA, IgG1, IgG2a, IgG2b, IgG3, IgM, IgE или IgD) или его Fab или F(ab')2 фрагмент.
В варианте осуществления антитело, представленное в настоящей заявке, представляет собой антитело, содержащее комбинацию L2H2 (SEQ ID NO:62 и SEQ ID NO:73), L3H3 (SEQ ID NO:63 и SEQ ID NO:74), L4H3 (SEQ ID NO:64 и SEQ ID NO:74), L6H5 (SEQ ID NO:66 и SEQ ID NO:76), L7H6 (SEQ ID NO:67 и SEQ ID NO:77), или L8H6 (SEQ ID NO:68 и SEQ ID NO:77), или желаемого фенотипа (например, IgA, IgG1, IgG2a, IgG2b, IgG3, IgM, IgE или IgD) или его Fab или F(ab')2 фрагмент.
Антитела, представленные в настоящей заявке, могут содержать любую из известных в уровне техники константных областей. Константная область легкой цепи может, например, представлять собой константную область легкой κ или λ цепи, такую как мышиная константная область легкой κ или λ цепи. Константная область тяжелой цепи может, например, представлять собой константную область тяжелой α, δ, ε, γ или μ цепи, такую как мышиная константная область тяжелой α, δ, ε, γ или μ цепи. В варианте осуществления константная область легкой или тяжелой цепи представляет собой фрагмент, производное, вариант или мутант природной константной области.
В варианте осуществления антитело, представленное в настоящей заявке, дополнительно содержит константный домен легкой κ или λ цепи человека или его фрагмент. Аминокислотная последовательность константной области легкой цепи представляет собой следующую:
аминокислотная последовательность константного домена легкой κ цепи человека: (SEQ ID NO:101) и
аминокислотная последовательность константного домена легкой λ цепи человека: (SEQ ID NO:102).
В одном варианте осуществления антитела, представленные в настоящей заявке, дополнительно содержат константный домен тяжелой цепи человека или его фрагмент.
Аминокислотная последовательность константной области тяжелой цепи представляет собой следующую:
аминокислотная последовательность константной области тяжелой цепи человека (hIgG2): (SEQ ID NO:103);
аминокислотная последовательность константной области тяжелой цепи человека (hIgG4): (SEQ ID NO:104) и
аминокислотная последовательность константной области тяжелой цепи человека (hIgG4): (SEQ ID NO:124).
В одном варианте осуществления антитела к GIPR, представленные в настоящей заявке, выбраны из полученных из мыши антител, гуманизированных антител, химерных антител, моноклональных антител, поликлональных антител, рекомбинантных антител, антигенсвязывающих фрагментов антител, одноцепочечных антител, двухцепочечных антител, трехцепочечных антител, четырехцепочечных антител, Fab-фрагментов, фрагментов F(ab')x, структурных доменных антител, антител IgD, антител IgE, антител IgM, антител IgG1, антител IgG2, антител IgG3 или антител IgG4.
В одном варианте осуществления антитело к GIPR, представленное в настоящей заявке, представляет собой моноклональное антитело к GIPR.
В другом варианте осуществления антитело к GIPR, представленное в настоящей заявке, представляет собой моноклональное антитело, содержащее комбинацию аминокислотных последовательностей, выбранных из представленного ниже перечня: SEQ ID NO:61 и SEQ ID NO:72, SEQ ID NO:62 и SEQ ID NO:73, SEQ ID NO:63 и SEQ ID NO:74, SEQ ID NO:64 и SEQ ID NO:74, SEQ ID NO:65 и SEQ ID NO:75, SEQ ID NO:66 и SEQ ID NO:76, SEQ ID NO:67 и SEQ ID NO:77, SEQ ID NO:68 и SEQ ID NO:77, SEQ ID NO:69 и SEQ ID NO:78, SEQ ID NO:70 и SEQ ID NO:79, и SEQ ID NO:71 и SEQ ID NO:80.
В одном варианте осуществления антитело к GIPR, представленное в настоящей заявке, представляет собой мышиное антитело к GIPR. В другом варианте осуществления антитело к GIPR, представленное в настоящей заявке, представляет собой гуманизированное антитело к GIPR.
В одном варианте осуществления антитело к GIPR, представленное в настоящей заявке, снижает трансдукцию сигнала GIP человека со значением IC50, составляющим от приблизительно 1 нМ до 200 нМ или от приблизительно 1 нМ до 100 нМ.
Антитела и фрагменты антител
В одном варианте осуществления антитело, представленное в настоящей заявке, представляет собой полноразмерное антитело (в том числе поликлональное, моноклональное, химерное, гуманизированное или человеческое антитело с тяжелыми и/или легкими цепями полной длины). В другом варианте осуществления антитело, представленное в настоящей заявке, представляет собой фрагмент антитела, например F(ab')2, Fab, Fab', Fv, Fc или Fd фрагмент, который может быть включен в однодоменные антитела, одноцепочечные антитела, макситела, минитела, интратела, двухцепочечные антитела, трехцепочечные антитела, тетрацепочечные антитела, v-NAR и бис-scFv (см. например, Hollinger and Hudson, 2005, Nature Biotechnology, 23:1126-1136). В другом варианте осуществления антитело, представленное в настоящей заявке, также включает в себя полипептиды антител, такие как раскрытые в патенте США № 6703199, в том числе монотела на основе фибронектинового полипептида. В другом варианте осуществления антитело, представленное в настоящей заявке, также включает в себя другие полипептиды антител, раскрытые в публикации патентного документе США № 2005/0238646, которые являются одноцепочечными полипептидами.
В одном варианте осуществления вариабельные области гена IgG, экспрессирующего представляющее интерес моноклональное антитело в гибридоме, амплифицируют с использованием нуклеотидных праймеров. Такие праймеры могут быть синтезированы любым рядовым специалистом в данной области или могут быть приобретены у коммерческих поставщиков, которые синтезируют праймеры для мышиных и человеческих вариабельных областей, в том числе, среди прочих, праймеры для областей VHa, VHb, VHc, VHd, CH1, VL и CL. Эти праймеры могут быть использованы для амплификации вариабельных областей тяжелой или легкой цепи, которые затем могут быть вставлены в векторы, такие как IMMUNOZAPTMH или IMMUNOZAPTML (Stratagene), соответственно. Затем эти векторы могут быть введены в системы на основе E. coli, дрожжей или клеток млекопитающих для экспрессии. Большие количества одноцепочечного белка, содержащего слияние областей VH и VL, могут быть получены с использованием таких способов (см. Bird et al., 1988, Science 242:423-426).
Специалисту в данной области будет понятно, что некоторые белки, такие как антитела, можно подвергать ряду посттрансляционных модификаций. Типы и степени этих модификаций зачастую зависят от линий клеток-хозяев, используемых для экспрессии белка, а также от условий культивирования. Такие модификации могут включать в себя вариации в гликозилировании, окислении метионина, образовании дикетопиперизина, изомеризации аспартата и дезамидировании аспарагина. Частой модификацией является потеря основного карбоксильного концевого остатка (такого как лизин или аргинин) вследствие действия карбоксипептидаз (как описано в Harris, 1995, Journal of Chromatography 705:129-134).
Обычный способ получения мышиного моноклонального антитела осуществляется с помощью гибридомных клеток. Моноклональные антитела могут быть выделены и очищены с помощью множества хорошо известных методик. Такие методики выделения включают в себя аффинную хроматографию с белком А-сефарозой, эксклюзионную хроматографию и ионообменную хроматографию (см., например, Coligan, стр. 2.7.1-2.7.12 и стр. 2.9.1-2.9.3; Baines et al., "Purification of Immunoglobulin G (IgG)," в Methods in Molecular Biology, Vol. 10, pages 79-104 (The Humana Press, Inc. 1992)). Моноклональное антитело можно очистить с помощью аффинной хроматографии с использованием подходящего лиганда, выбранного на основании конкретных свойств антитела (например, изотипа тяжелой или легкой цепи, специфичности связывания и т. д.). Примеры подходящих лигандов, иммобилизованных на твердой подложке, включают в себя белок A, белок G, антитело к константной области (легкой цепи или тяжелой цепи), антитело к идиотипическому антителу и белок, связывающий TGF-β, или его фрагмент или вариант.
Молекулярная эволюция определяющих комплементарность областей (CDR) в центре сайта связывания антитела также была использована для выделения антител с повышенными значениями аффинности, например антител, имеющих повышенные значения аффинности в отношении c-erbB-2, как описано Schier et al., 1996, J. Mol. Biol. 263:551-567. Соответственно, такие методики применимы для получения антител против GIPR.
Антитела против GIPR человека можно использовать, например, в анализах для выявления присутствия GIPR либо in vitro, либо in vivo.
Антитела также могут быть получены любой из традиционных методик. Например, они могут быть очищены от клеток, которые естественным образом экспрессируют их (например, антитело может быть очищено от гибридомы, которая продуцирует его), или получены в рекомбинантных системах экспрессии с использованием любой методики, известной в уровне техники. Например, Monoclonal Antibodies, Hybridomas: A New Dimension in Biological Analyses, Kennet et al. (eds.), Plenum Press, New York (1980) и Antibodies: A Laboratory Manual, Harlow and Land (eds.), Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., (1988). Это обсуждается в приведенном ниже разделе "Нуклеиновая кислота".
Антитела могут быть получены и подвергнуты скринингу в отношении необходимых свойств любыми известными методиками. Некоторые методики относятся к выделению нуклеиновых кислот, кодирующих полипептидные цепи (или их части) родственных антител (например, антител к GIPR), и манипуляции нуклеиновой кислотой. Нуклеиновые кислоты могут быть слиты с другой релевантной нуклеиновой кислотой или модифицированы методиками рекомбинантной ДНК (например, индуцированными мутациями или другими традиционными методиками) с добавлением, удалением или заменой одного или нескольких аминокислотных остатков.
Если желательно улучшение аффинности антител по настоящему изобретению, содержащих одну или несколько из вышеупомянутых CDR, такие антитела можно получить с помощью ряда протоколов созревания аффинности, включающих в себя поддержание CDR (Yang et al., 1995, J. Mol. Biol., 254:392-403), шаффлинг цепей (Marks et al., 1992, Bio/Technology, 10:779-783), применение мутантных штаммов E. coli (Low et al., 1996, J. Mol. Biol., 250:350-368), шаффлинг ДНК (Patten et al., 1997, Curr. Opin. Biotechnol., 8:724-733), фаговый дисплей (Thompson et al., 1996, J. Mol. Biol., 256:7-88) и дополнительные методики PCR (Crameri et al., 1998, Nature, 391:288-291). Все эти способы созревания аффинности обсуждаются в Vaughan et al., 1998, Nature Biotechnology, 16:535-539).
В одном варианте осуществления в настоящей заявке представлены фрагменты антитела к GIPR. Такие фрагменты могут включать в себя последовательности, полностью полученные из антител, или дополнительные последовательности. Примеры антигенсвязывающих фрагментов включают в себя Fab, F(ab')2, одноцепочечные антитела, диатела, триатела, тетратела и доменные антитела. Другие примеры представлены в Lunde et al., 2002, Biochem. Soc. Trans. 30:500-06.
Одноцепочечные антитела могут быть сформированы путем связывания фрагментов вариабельного домена тяжелой и легкой цепей (Fv области) посредством аминокислотного мостика (короткого пептидного линкера), в результате чего образуется одна полипептидная цепь. Такие одноцепочечные Fv (scFv) были получены путем слияния ДНК, кодирующей пептидный линкер между ДНК, кодирующими полипептиды двух вариабельных доменов (VL и VH). Получающиеся полипептиды могут обратно сворачиваться сами по себе с образованием антигенсвязывающих мономеров, или они могут образовывать мультимеры (например, димеры, тримеры или тетрамеры) в зависимости от длины гибкого линкера между двумя вариабельными доменами (Kortt et al., 1997, Prot. Eng. 10:423; Kortt et al., 2001, Biomol. Eng. 18:95-108). Путем комбинирования различных полипептидов, содержащих VL и VH, могут быть образованы мультимерные scFv, которые связываются с разными эпитопами (Kriangkum et al., 2001, Biomol. Eng. 18:31-40). Методики, разработанные для получения одноцепочечных антител, включают в себя методики, описанные в патенте США № 4946778; Bird, 1988, Science 242:423; Huston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879; Ward et al., 1989, Nature 334:544; de Graaf et al., 2002, Methods Mol. Biol. 178:379-87. Одноцепочечные антитела, полученные из представленных в настоящей заявке антител, включающих в себя без ограничения scFv, содержащие комбинацию вариабельных доменов L1H1, охватываются настоящим изобретением.
Антитела, полученные из антитела, также могут быть получены, например, путем протеолитического гидролиза антитела, например, путем расщепления целого антитела пепсином или папаином, в соответствии с общепринятыми способами. В качестве примера, фрагменты антител можно получить путем ферментативного расщепления антител пепсином с получением SS фрагмента, называемого F(ab')2. Этот фрагмент может быть далее расщеплен с использованием тиолового восстанавливающего средства с получением 3,5S Fab' одновалентных фрагментов. Необязательно, реакция расщепления может быть выполнена с использованием блокирующей группы для сульфгидрильных групп, которые получаются в результате расщепления дисульфидных связей. В качестве альтернативы, ферментативное расщепление с использованием папаина дает два одновалентных Fab-фрагмента и Fc фрагмент непосредственно. Эти способы описаны, например, у Goldenberg, в патенте США № 4331647, Nisonoffet et al., 1960, Arch. Biochem. Biophys. 89:230; Porter, 1959, Biochem. J. 73:119; Edelman et al., Methods in Enzymology 1:422 (Academic Press 1967); и у Andrews, S. M. and Titus, J. A. в Current Protocols in Immunology (Coligan J. E. , et al., eds), John Wiley & Sons, New York (2003), pages 2.8.1-2.8.10 и 2.10A.1-2.10A.5. Другие способы расщепления антител, такие как разделение тяжелых цепей с образованием одновалентных фрагментов легких-тяжелых цепей (Fd), дальнейшее расщепление фрагментов или другие ферментативные, химические или генетические методики, также могут быть использованы при условии, что фрагменты связываются с антигеном, который распознается интактным антителом.
Другой формой фрагмента антитела является пептид, содержащий одну или несколько определяющих комплементарность областей (CDR) антитела. CDR могут быть получены путем конструирования полинуклеотидов, которые кодируют CDR. Такие полинуклеотиды получают, например, с использованием полимеразной цепной реакции для синтеза вариабельной области с использованием mRNA или продуцирующих антитела клеток в качестве матрицы (см., например, Larrick et al., 1991, Methods: A Companion to Methods in Enzymology 2:106; Courtenay-Luck, "(Genetic Manipulation of Monoclonal Antibodies," в Monoclonal Antibodies: Production, Engineering and Clinical Application, Ritter et al. (eds.), page 166 (Cambridge University Press 1995) и Ward et al., "Genetic Manipulation and Expression or Antibodies," в Monoclonal Antibodies: Principles and Applications, Birch et al., (eds.), page 137 (Wiley-Liss, Inc. 1995). Фрагмент антитела может дополнительно содержать по меньшей мере один домен вариабельной области антитела, описываемого в настоящей заявке. Таким образом, например, домен V-области может быть мономерным и представлять собой домен VH или VL, который может связываться с GIPR с аффинностью, составляющей 1×10-7 M или меньше, как описано ниже.
Домен вариабельной области может быть любым встречающимся в природе вариабельным доменом или его сконструированной версией. Под сконструированной версией подразумевается домен вариабельной области, который был создан с использованием методик конструирования рекомбинантной ДНК. Такие сконструированные версии включают те, которые созданы, например, из специфической вариабельной области антитела путем вставок, делеций или изменений в или касательно аминокислотных последовательностей конкретного антитела. Конкретные примеры включают в себя сконструированные домены вариабельной области, содержащие по меньшей мере одну CDR и необязательно одну или несколько каркасных аминокислот из первого антитела и оставшуюся часть домена вариабельной области из второго антитела.
Домен вариабельной области может быть ковалентно присоединен по С-концевой аминокислоте по меньшей мере к одному другому домену антитела или его фрагмента. Таким образом, например, домен VH, который присутствует в домене вариабельной области, может быть связан с доменом CH1 иммуноглобулина или его фрагмента. Подобным образом, домен VL может быть связан с доменом CK или его фрагментом. Таким образом, например, антитело может быть Fab-фрагментом, в котором антигенсвязывающий домен содержит ассоциированные домены VH и VL, ковалентно связанные на своих C-концах соответственно с доменом CH1 и Cκ. Домен CH1 может быть расширен дополнительными аминокислотами, например, для обеспечения шарнирной области или части шарнирной области домена, как обнаружено в Fab' фрагменте, или для обеспечения дополнительных доменов, таких как домены CH2 и CH3 антитела.
Производные и варианты антител
Нуклеотидные последовательности L1 и H1 могут быть изменены, например, с помощью случайного мутагенеза или сайт-направленного мутагенеза (например, олигонуклеотид-направленного сайт-специфического мутагенеза) для создания измененного полинуклеотида, содержащего одну или несколько конкретных нуклеотидных замен, делеций или вставок по сравнению с немутантным полинуклеотидом. Примеры методик выполнения таких изменений описаны в Walder et al., 1986, Gene 42:133; Bauer et al., 1985, Gene 37:73; Craik, 1985, BioTechniques, 3:12-19; Smith et al., 1981, Genetic Engineering: Principles and Methods, Plenum Press и в патентах США №№ 4518584 и 4737462. Эти и другие способы могут быть использованы, например, для получения производных антител к GIPR, которые обладают желаемым свойством, например, повышением аффинности, авидности или специфичности в отношении GIPR или стабильности in vivo или in vitro, или пониженными побочными эффектами in vivo, по сравнению с недериватизированным антителом.
Другие производные антител к GIPR в объеме настоящего изобретения включают в себя ковалентные или агрегационные конъюгаты антител к GIPR или их фрагментов с другими белками или полипептидами, как, например, путем экспрессии рекомбинантных слитых белков, содержащих гетерологичные полипептиды, слитые с N-концом или С-концом полипептида антитела к GIPR. Например, конъюгированный пептид может быть гетерологичным сигнальным (или лидерным) полипептидом, например лидерной последовательностью альфа-фактора дрожжей, или пептидом, таким как эпитопная метка. Содержащие антитело слитые белки могут включать в себя пептиды, добавленные для облегчения очистки или идентификации антигенсвязывающего белка (например, поли-His). Антитело также может быть связано с пептидом FLAG, как описано в Hopp et al., 1988, Bio/Technology 6:1204, и патенте США № 5011912. Пептид FLAG является высокоантигенным и обеспечивает эпитоп, обратимо связываемый специфическим моноклональным антителом (mAb), что позволяет проводить быстрый анализ и легкую очистку экспрессированного рекомбинантного белка. Реагенты, применимые для получения слитых белков, в которых пептид FLAG слит с данным полипептидом, коммерчески доступны (Sigma, Сент-Луис, штат Миссури, США). В другом варианте осуществления олигомеры, которые содержат одно или несколько антител, можно использовать в качестве антагонистов GIPR. Олигомеры могут быть в форме ковалентно связанных или нековалентно связанных димеров, тримеров или высших олигомеров. Предполагается применение олигомеров, содержащих два или более антител, одним из примеров которых является гомодимер. Другие олигомеры включают в себя гетеродимеры, гомотримеры, гетеротримеры, гомотетрамеры, гетеротетрамеры и т. д.
Один вариант осуществления направлен на олигомеры, содержащие множество антител, соединенных ковалентными или нековалентными взаимодействиями между пептидными фрагментами, слитыми с антителами. Такие пептиды могут быть пептидными линкерами (спейсерами) или пептидами, которые обладают свойством обеспечения олигомеризации. Лейциновые застежки и определенные полипептиды, полученные из антител, входят в число пептидов, которые могут обеспечивать олигомеризацию присоединенных к ним антител, как более подробно описано ниже.
В конкретных вариантах осуществления олигомеры содержат от двух до четырех антител. Антитела олигомера могут иметь любую форму, такую как любая из форм, описанных выше, например варианты или фрагменты. Предпочтительно олигомеры содержат антитела, которые проявляют активность связывания GIPR.
В одном варианте осуществления олигомер получают с использованием полипептидов, полученных из иммуноглобулинов. Получение слитых белков, содержащих определенные гетерологичные полипептиды, слитые с различными частями полипептидов, полученных из антител (в том числе Fc-домена), было описано, например, у Ashkenazi et al., 1991, PNAS USA 88:10535; Byrn et al., 1990, Nature 344:677 и Hollenbaugh et al., 1992 "Construction of Immunoglobulin Fusion Proteins", в Current Protocols in Immunology, Suppl. 4, pages 10.19.1-10.19.11. Один из вариантов осуществления, представленный в настоящей заявке, относится к димеру, содержащему два слитых белка, созданных путем слияния связывающего GIPR фрагмента антитела к GIPR с Fc-областью антитела. Димер может быть получен, например, путем вставки слияния генов, кодирующего слитый белок, в соответствующий вектор экспрессии, экспрессии слияния генов в клетках-хозяевах, трансформированных рекомбинантным вектором экспрессии, и обеспечения возможности сборки экспрессированного слитого белка так же как молекулам антител, после чего между Fc фрагментами образуются межцепочечные дисульфидные связи с образованием димера.
Термин "Fc полипептид", используемый в настоящей заявке, включает в себя нативные и мутеиновые формы полипептидов, происходящих из Fc области антитела. Также включены усеченные формы таких полипептидов, содержащие шарнирную область, которая способствует димеризации. Слитые белки, содержащие Fc фрагменты (и образованные из них олигомеры), обладают преимуществом простой очистки с помощью аффинной хроматографии на колонках с белком A или белком G.
Один подходящий Fc полипептид, описанный в заявке, поданной согласно РСТ, WO 93/10151 (включенной тем самым посредством ссылки), представляет собой одноцепочечный полипептид, простирающийся от N-концевой шарнирной области до нативного С-конца Fc области антитела IgG1 человека. Другим применимым Fc полипептидом является Fc мутеин, описанный в патенте США № 5457035 и в Baum et al., 1994, EMBO J. 13:3992-4001. Аминокислотная последовательность этого мутеина идентична последовательности нативного Fc, представленной в WO 93/10151, за исключением того, что аминокислота 19 была изменена с Leu на Ala, аминокислота 20 была изменена с Leu на Glu, а аминокислота 22 была изменена с Gly на Ala. Мутеин проявляет пониженную аффинность в отношении Fc рецепторов. В других вариантах осуществления вариабельная часть тяжелой и/или легкой цепей антитела к GIPR может быть заменена вариабельной частью тяжелой и/или легкой цепи антитела.
В качестве альтернативы, олигомер представляет собой слитый белок, содержащий несколько антител, с пептидными линкерами (спейсерными пептидами) или без них. Среди подходящих пептидных линкеров находятся линкеры, описанные в патентах США №№ 4751180 и 4935233.
Другой способ получения олигомерных антител предусматривает применение лейциновой застежки. Домены лейциновой застежки представляют собой пептиды, которые способствуют олигомеризации белков, в которых они обнаружены. Лейциновые застежки были первоначально идентифицированы в нескольких ДНК-связывающих белках (Landschulz et al., 1988, Science 240:1759), и с тех пор были обнаружены в ряде различных белков. Среди известных лейциновых застежек имеются встречающиеся в природе пептиды и их производные, которые димеризуются или тримеризуются. Примеры доменов лейциновой застежки, подходящих для получения растворимых олигомерных белков, описаны в заявке, поданной согласно РСТ, WO 94/10308, а лейциновая застежка, полученная из легочного сурфактантного белка D (SPD), описана в Hoppe et al., 1994, FEBS Letters 344:191, тем самым включенного посредством ссылки. Применение модифицированной лейциновой застежки, которая способствует стабильной тримеризации слитого с ней гетерологичного белка, описано в Fanslow et al., 1994, Semin. Immunol. 6:267-78. В одном способе рекомбинантные слитые белки, содержащие фрагмент или производное антитела к GIPR, слитые с пептидом лейциновой застежки, экспрессируются в подходящих клетках-хозяевах, а образующиеся растворимые олигомерные фрагменты или производные антитела к GIPR извлекают из надосадочной культуральной жидкости.
В другом варианте осуществления производные антитела могут содержать по меньшей мере одну из CDR, раскрываемых в настоящей заявке. Например, одна или несколько CDR могут быть включены в известные каркасные области антитела (IgG1, IgG2 и т. д.) или конъюгированы с подходящим носителем для увеличения его периода полужизни. Подходящие носители включают в себя без ограничения Fc, альбумин, трансферрин и т. п. Эти и другие подходящие носители известны в уровне техники. Такие конъюгированные пептиды CDR могут быть в мономерной, димерной, тетрамерной или другой форме. В одном варианте осуществления один или несколько водорастворимых полимеров связаны в одном или нескольких конкретных положениях, например на амино-конце, связывающего средства. В одном примере производное антитела включает в себя одно или несколько водорастворимых полимерных присоединений, в том числе без ограничения, полиэтиленгликоль, полиоксиэтиленгликоль или полипропиленгликоль. См., например, патенты США №№ 4640835, 4496689, 4301144, 4670417, 4791192 и 4179337. В некоторых вариантах осуществления производное включает в себя один или несколько из монометоксиполиэтиленгликоля, декстрана, целлюлозы или других полимеров на основе углеводов, поли(N-винилпирролидон)-полиэтиленгликоля, гомополимеров пропиленгликоля, сополимеров полипропиленоксида и этиленоксида, полиоксиэтилированных многоатомных спиртов (например, глицерина) и поливинилового спирта, а также смесей таких полимеров. В некоторых вариантах осуществления один или несколько водорастворимых полимеров случайно присоединяются к одной или нескольким боковым цепям. В некоторых вариантах осуществления PEG может действовать с улучшением терапевтической способности связывающего средства, такого как антитело. Некоторые такие способы обсуждаются, например, в патентах США № 6133426, который тем самым включен посредством ссылки для любой цели.
Следует учитывать, что представленное в настоящей заявке антитело может иметь по меньшей мере одну аминокислотную замену при условии, что антитело сохраняет специфичность связывания. Следовательно, модификации структур антител охватывается объемом настоящего изобретения. Они могут включать в себя аминокислотные замены, которые могут быть консервативными или неконсервативными, которые не нарушают способность антитела связывать GIPR человека. Консервативные аминокислотные замены могут охватывать не встречающиеся в природе аминокислотные остатки, которые обычно включаются путем химического синтеза пептидов, а не путем синтеза в биологических системах. Сюда входят пептидомиметики и другие обращенные или инвертированные формы аминокислотных фрагментов. Консервативная аминокислотная замена также может включать в себя замену нативного аминокислотного остатка на стандартный остаток, так что это незначительно или совсем не влияет на полярность или заряд аминокислотного остатка в этом положении. Неконсервативные замены могут включать в себя замену представителя одного класса аминокислот или миметиков аминокислот на представителя из другого класса с другими физическими свойствами (например, размером, полярностью, гидрофобностью, зарядом).
Более того, специалист в данной области может создать варианты для тестирования, которые содержат единственную аминокислотную замену в каждом желаемом аминокислотном остатке. Затем варианты можно подвергнуть скринингу с использованием анализов активности, известных специалистам в данной области. Такие варианты можно использовать для сбора информации о подходящих вариантах. Например, если было обнаружено, что изменение определенного аминокислотного остатка привело к нарушению, нежелательному снижению или неприемлемой активности, то вариантов с таким изменением можно избежать. Другими словами, на основе информации, собранной в ходе таких обычных экспериментов, специалист в данной области может легко определить аминокислоты, в которых следует избегать дальнейших замен, либо по отдельности, либо в комбинации с другими мутациями.
Специалист в данной области сможет определить подходящие варианты полипептида, как изложено в настоящей заявке, с использованием хорошо известных методик. В некоторых вариантах осуществления специалист в данной области может идентифицировать подходящие участки молекулы, которые можно изменить без нарушения активности путем нацеливания на области, которые не важны для активности. В некоторых вариантах осуществления можно идентифицировать остатки и части молекул, которые консервативны среди подобных полипептидов. В некоторых вариантах осуществления даже области, которые могут быть важны для биологической активности или структуры, могут подвергаться консервативным аминокислотным заменам без нарушения биологической активности или без неблагоприятного воздействия на структуру полипептида. Кроме того, специалист в данной области может просмотреть исследования структуры-функции, идентифицирующие остатки в подобных полипептидах, которые важны для активности или структуры. С учетом такого сравнения можно предсказать важность аминокислотных остатков в белке, которые соответствуют аминокислотным остаткам, которые важны для активности или структуры в подобных белках. Специалист в данной области может сделать выбор в пользу химически подобных аминокислотных замен для таких предсказанных важных аминокислотных остатков.
Специалист в данной области также может проанализировать трехмерную структуру и аминокислотную последовательность по отношению к этой структуре в подобных полипептидах. Принимая во внимание такую информацию, специалист в данной области может предсказать выравнивание аминокислотных остатков антитела относительно его трехмерной структуры. В некоторых вариантах осуществления специалист в данной области может решить не вносить радикальных изменений в аминокислотные остатки, которые, как предполагается, находятся на поверхности белка, поскольку такие остатки могут участвовать в важных взаимодействиях с другими молекулами. Ряд научных публикаций посвящен прогнозированию вторичной структуры. См. Moult, 1996, Curr. Op. Biotech. 7:422-427; Chou et al., 1974, Biochemistry 13:222-245; Chou et al., 1974, Biochemistry 113:211-222; Chou et al., 1978, Adv. Enzymol. Relat. Areas Mol. Biol. 47:45-148; Chou et al., 1979, Ann. Rev. Biochem. 47:251-276 и Chou et al., Biophys. J. 26:367-384. Более того, в настоящее время доступны компьютерные программы для помощи в прогнозировании вторичной структуры. Например, два полипептида или белка, которые имеют идентичность последовательностей более 30% или сходство более 40%, часто имеют сходную структурную топологию. Недавний рост базы данных структур белков (PDB) обеспечил повышенную предсказуемость вторичной структуры, включая потенциальное число складок в структуре полипептида или белка. См. Holm et al., 1999, Nucl. Acid. Res. 27:244-247. Было высказано предположение (Brenner et al., 1997, Curr. Op. Struct. Biol. 7:369-376), что существует ограниченное количество складок в данном полипептиде или белке, и что как только критическое число структур будет обнаружено, прогнозирование структуры станет значительно точнее.
Дополнительные способы прогнозирования вторичной структуры включают в себя "продевание" (Jones, 1997, Curr. Opin. Struct. Biol. 7:377-87; Sippl et al., 1996, Structure 4:15-19), "анализ профиля" (Bowie et al., 1991, Science 253:164-170; Gribskov et al., 1990, Meth. Enzym. 183:146-159; Gribskov et al., 1987, Proc. Nat. Acad. Sci. USA 84:4355-4358) и "эволюционную связь" (см. Holm, выше (1999) и Brenner, выше (1997)). В некоторых вариантах осуществления варианты антител включают в себя варианты гликозилирования, в которых число и/или тип сайтов гликозилирования были изменены по сравнению с аминокислотными последовательностями исходного полипептида. В некоторых вариантах осуществления варианты содержат большее или меньшее число сайтов N-связанного гликозилирования, чем нативный белок. В качестве альтернативы, исключение такой последовательности путем замен удаляет существующую N-связанную углеводную цепь. Также представлена перестройка N-связанных углеводных цепей, при которой один или несколько сайтов N-связанного гликозилирования (обычно те, которые встречаются в природе) исключаются, и создается один или несколько новых N-связанных сайтов. Дополнительные предпочтительные варианты антител включают в себя цистеиновые варианты, в которых один или несколько цистеиновых остатков удалены или заменены другой аминокислотой (например, серином) по сравнению с исходной аминокислотной последовательностью. Цистеиновые варианты могут быть применимы, когда антитела должны быть повторно свернуты в биологически активную конформацию, например, после выделения нерастворимых телец включения. Цистеиновые варианты обычно имеют меньше цистеиновых остатков, чем нативный белок, и обычно имеют четное число, чтобы минимизировать взаимодействия, возникающие из-за неспаренных цистеиновых остатков.
Желаемые аминокислотные замены (либо консервативные, либо неконсервативные) могут быть определены специалистом в данной области в то время, когда такие замены желательны. В некоторых вариантах осуществления аминокислотные замены могут быть использованы для идентификации важных остатков антител к GIPR человека или для повышения или снижения аффинности антител к GIPR человека, описываемых в настоящей заявке.
Согласно некоторым вариантам осуществления предпочтительными аминокислотными заменами являются те, которые (1) снижают чувствительность к протеолизу, (2) снижают чувствительность к окислению, (3) изменяют аффинность связывания в отношении образованных белковых комплексов, (4) изменяют значения аффинности связывания и/или (4) придают или модифицируют другие физико-химические или функциональные свойства в таких полипептидах. Согласно некоторым вариантам осуществления одиночные или множественные аминокислотные замены (в некоторых вариантах осуществления консервативные аминокислотные замены) могут быть выполнены во встречающейся в природе последовательности (в некоторых вариантах осуществления в части полипептида вне домен(-ов), образующих внутримолекулярные контакты). В некоторых вариантах осуществления консервативная аминокислотная замена обычно не может существенно изменить структурные характеристики исходной последовательности (например, замещающая аминокислота не должна нарушать спираль, которая находится в исходной последовательности, или нарушать другие типы вторичной структуры, которая характеризует исходную последовательность). Примеры известных в уровне техники полипептидных вторичных и третичных структур описаны в Proteins, Structures and Molecular Principles (Creighton, Ed., W. H. Freeman and Company, New York (1984)); Introduction to Protein Structure (Branden and Tooze, Eds., Garland Publishing, New York, N.Y. (1991)) и Thornton et al., 1991, Nature 354:105, каждая из которых включена в настоящий документ посредством ссылки.
В некоторых вариантах осуществления антитела по настоящему изобретению могут быть химически связаны с полимерами, липидами или другими фрагментами.
Антигенсвязывающие средства могут содержать по меньшей мере одну из CDR, описываемую в настоящей заявке, включенную в биосовместимую каркасную структуру. В одном варианте осуществления биосовместимая каркасная структура включает в себя полипептид или его часть, достаточную для образования конформационно стабильной структурной основы, или каркаса, или остова, которые способны представлять одну или несколько последовательностей аминокислот, которые связываются с антигеном (например, CDR, вариабельная область и т. д.) в локализованной области поверхности. Такие структуры могут представлять собой встречающийся в природе полипептид или полипептидную "складку" (структурный мотив) или могут иметь одну или несколько модификаций, таких как добавления, делеции или замены аминокислот, относительно встречающегося в природе полипептида или складки. Эти остовы могут происходить из полипептида любого вида (или более чем одного вида), такого как человек, другое млекопитающее, другое позвоночное, беспозвоночное, растение, бактерия или вирус.
Обычно биосовместимые каркасные структуры основаны на белковых остовах или скелетах, отличных от доменов иммуноглобулинов. Например, можно использовать те, которые основаны на фибронектине, анкирине, липокалине, неокарзиностаине, цитохроме b, цинковом пальце CP1, PST1, двойной спирали, LACI-D1, домене Z и доменах тендамистата (см., например, Nygren and Uhlen, 1997, Current Opinion in Structural Biology 7:463-469).
Кроме того, специалист в данной области поймет, что подходящие связывающие средства включают в себя части этих антител, такие как одну или несколько из CDR1, CDR2, CDR3 тяжелой цепи, CDR1, CDR2 и CDR3 легкой цепи, которые конкретно раскрыты в настоящей заявке. По меньшей мере одна из областей CDR1, CDR2, CDR3 тяжелой цепи, CDR1, CDR2 и CDR3 легкой цепи может иметь по меньшей мере одну аминокислотную замену при условии, что антитело сохраняет специфичность связывания незамещенной CDR. Не являющаяся CDR часть антитела может быть небелковой молекулой, где связывающее средство перекрестно блокирует связывание антитела, раскрываемого в настоящей заявке, с GIPR человека и/или ингибирует активность передачи сигнала GIP через рецептор. Не являющаяся CDR часть антитела может быть небелковой молекулой, где антитело демонстрирует подобный паттерн связывания с пептидами GIPR человека в анализе конкурентного связывания, который проявляется по меньшей мере одним из антител L2H2/L6H5, и/или нейтрализует активность GIP. Не являющаяся CDR часть антитела может состоять из аминокислот, где антитело представляет собой рекомбинантный связывающий белок или синтетический пептид, и рекомбинантный связывающий белок перекрестно блокирует связывание антитела, раскрываемого в настоящей заявке, с GIPR человека и/или нейтрализует активность GIP in vitro или in vivo. Не являющаяся CDR часть антитела может состоять из аминокислот, где антитело представляет собой рекомбинантное антитело, и рекомбинантное антитело демонстрирует подобный паттерн связывания с пептидами GIPR человека в анализе конкурентного связывания, который проявляется по меньшей мере одним из антител L2H2/L6H5, и/или нейтрализует активность GIP.
Слитый белок антитела к GIPR и GLP-1 или обратного GLP-1
В одном варианте осуществления в настоящей заявке представлен слитый белок антитела к GIPR и GLP-1, содержащий антитело, которое специфически связывается с GIPR, и один, два, три, четыре, пять, шесть, семь или восемь фрагментов GLP-1 или обратных фрагментов GLP-1, где в слитом белке карбокси-конец фрагмента GLP-1 соединен с амино-концом легкой или тяжелой цепи антитела к GIPR посредством пептидной линкерной последовательности (линкера) или амино-конец обратного фрагмента GLP-1 соединен с карбокси-концом легкой или тяжелой цепи антитела к GIPR.
В другом варианте осуществления в настоящей заявке представлен слитый белок антитела к GIPR и GLP-1, содержащий антитело, которое специфически связывается с GIPR, и один, два, три, четыре, пять, шесть, семь или восемь фрагментов GLP-1; где в слитом белке карбокси-конец фрагмента GLP-1 соединен с амино-концом легкой цепи или тяжелой цепи антитела к GIPR посредством пептидной линкерной последовательности (линкера) или амино-конец обратного фрагмента GLP-1 соединен с карбокси-концом легкой цепи или тяжелой цепи антитела к GIPR.
В другом варианте осуществления в настоящей заявке представлен слитый белок антитела к GIPR и GLP-1, содержащий антитело, которое специфически связывается с GIPR, и один, два, три, четыре, пять, шесть, семь или восемь обратных фрагментов GLP-1; где в слитом белке амино-конец обратного фрагмента GLP-1 соединен с карбокси-концом легкой цепи или тяжелой цепи антитела к GIPR.
В другом варианте осуществления в настоящей заявке представлен слитый белок антитела к GIPR и GLP-1, содержащий антитело, которое специфически связывается с GIPR, и один, два, три или четыре фрагмента GLP-1; где в слитом белке карбокси-конец фрагмента GLP-1 соединен с амино-концом легкой цепи или тяжелой цепи антитела к GIPR посредством пептидной линкерной последовательности (линкера).
В другом варианте осуществления в настоящей заявке представлен слитый белок антитела к GIPR и GLP-1, содержащий антитело, которое специфически связывается с GIPR, и один, два, три или четыре обратных фрагмента GLP-1; где в слитом белке амино-конец обратного фрагмента GLP-1 соединен с карбокси-концом легкой цепи или тяжелой цепи антитела к GIPR.
В другом варианте осуществления в настоящей заявке представлен слитый белок антитела к GIPR и GLP-1, содержащий антитело, которое специфически связывается с GIPR, и два фрагмента GLP-1; где в слитом белке карбокси-конец фрагмента GLP-1 соединен с амино-концом легкой цепи или тяжелой цепи антитела к GIPR посредством пептидной линкерной последовательности (линкера).
В другом варианте осуществления в настоящей заявке представлен слитый белок антитела к GIPR и GLP-1, содержащий антитело, которое специфически связывается с GIPR, и два обратных фрагмента GLP-1; где в слитом белке амино-конец обратного фрагмента GLP-1 соединен с карбокси-концом легкой цепи или тяжелой цепи антитела к GIPR.
В другом варианте осуществления в настоящей заявке представлен слитый с GLP-1 белок, содержащий антитело к GIPR и два фрагмента GLP-1; где в слитом белке карбокси-конец фрагмента GLP-1 соединен с амино-концом легкой цепи или тяжелой цепи антитела к GIPR посредством пептидной линкерной последовательности (линкера): N'-GLP-1-линкер-R-C'; или соединяет карбокси-конец фрагмента GLP-1 с амино-концом тяжелой цепи антитела к GIPR: N'-GLP-1-линкер-R-C'; где N' представляет собой амино-конец полипептидной цепи слитого белка, C' представляет собой карбокси-конец полипептидной цепи слитого белка, GLP-1 представляет собой фрагмент GLP-1, R представляет собой аминокислотную последовательность легкой цепи или тяжелой цепи антитела к GIPR, и линкер представляет собой пептидную линкерную последовательность.
В другом варианте осуществления в настоящей заявке представлен слитый с GLP-1 белок, содержащий антитело к GIPR и два обратных фрагмента GLP-1; где в слитом белке амино-конец обратного фрагмента GLP-1 соединен с карбокси-концом легкой цепи или тяжелой цепи антитела к GIPR: N'-R-линкер-обратный GLP-1-C'; или соединяет амино-конец обратного фрагмента GLP-1 посредством пептидной линкерной последовательности (линкера) с карбокси-концом тяжелой цепи антитела к GIPR: N'-R-линкер-обратный GLP-1-C'; где N' представляет собой амино-конец полипептидной цепи слитого белка, C' представляет собой карбокси-конец полипептидной цепи слитого белка, и обратный GLP-1 представляет собой обратный фрагмент GLP-1, R представляет собой аминокислотную последовательность легкой цепи или тяжелой цепи антитела к GIPR, и линкер представляет собой пептидную линкерную последовательность.
В дополнительном варианте осуществления в настоящей заявке представлен слитый с GLP-1 белок, содержащий антитело к GIPR и два фрагмента GLP-1; где в слитом белке карбокси-конец фрагмента GLP-1 посредством пептидной линкерной последовательности (линкера) соединен с амино-концом легкой цепи антитела к GIPR: N'-GLP-1-линкер-R-C'; где N' представляет собой амино-конец полипептидной цепи слитого белка, C' представляет собой карбокси-конец полипептидной цепи слитого белка, GLP-1 представляет собой фрагмент GLP-1, R представляет собой аминокислотную последовательность легкой цепи антитела к GIPR, и линкер представляет собой пептидную линкерную последовательность.
В одном варианте осуществления в слитом с GLP-1 белке, представленном в настоящей заявке, фрагмент GLP-1 независимо выбран из одной из следующих аминокислотных последовательностей: SEQ ID NO:105, SEQ ID NO:106, SEQ ID NO:107, SEQ ID NO:108, и SEQ ID NO:109. В одном варианте осуществления в слитом с GLP-1 белке, представленном в настоящей заявке, обратный фрагмент GLP-1 независимо выбран из одной из следующих аминокислотных последовательностей: SEQ ID NO:119, SEQ ID NO:120 , SEQ ID NO:121, SEQ ID NO:122, и SEQ ID NO:123.
В одном варианте осуществления в слитом с GLP-1 белке, представленном в настоящей заявке, пептидная линкерная (линкер) последовательность независимо содержит от 1 до 200 аминокислотных остатков, от 2 до 100 аминокислотных остатков, от 5 до 50 аминокислотных остатков, от 6 до 25 аминокислотных остатков или от 10 до 20 аминокислотных остатков.
В другом варианте осуществления в слитом с GLP-1 белке, представленном в настоящей заявке, пептидная линкерная (линкер) последовательность независимо выбрана из следующих аминокислотных последовательностей: SEQ ID NO:110, SEQ ID NO:111 и SEQ ID NO:112.
Нуклеиновые кислоты
В одном аспекте настоящее изобретение относится к выделенным молекулам нуклеиновой кислоты, которые кодируют антитела, представленные в настоящей заявке. Нуклеиновые кислоты предусматривают, например, полинуклеотиды, которые кодируют все или часть антитела или слитого с GLP-1 белка, например одну или обе цепи антитела по настоящему изобретению или его фрагмент, производное, мутеин или вариант; полинуклеотиды, достаточные для применения в качестве зондов для гибридизации; праймеры для PCR или праймеры секвенирования для идентификации, анализа, мутации или амплификации полинуклеотида, кодирующего полипептид; антисмысловые нуклеиновые кислоты для ингибирования экспрессии полинуклеотида и последовательности, комплементарные вышеперечисленным. Нуклеиновые кислоты могут быть любой длины. Они могут иметь длину, например, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 75, 100, 125, 150, 175, 200, 250, 300, 350, 400, 450, 500, 750, 1,000, 1,500, 3,000, 5,000 или больше нуклеотидов, и/или могут содержать одну или несколько дополнительных последовательностей, например регуляторных последовательностей, и/или быть частью более крупной нуклеиновой кислоты, например вектора. Нуклеиновые кислоты могут быть однонитевыми или двухнитевыми и могут содержать нуклеотиды РНК и/или ДНК, а также их искусственные варианты (например, пептидные нуклеиновые кислоты).
Нуклеиновые кислоты, кодирующие полипептиды антител (например, тяжелую или легкую цепь, только вариабельный домен или полноразмерные), могут быть выделены из B-клеток мышей, которые были иммунизированы антигеном GIPR. Нуклеиновая кислота антитела или слитого с GLP-1 белка может быть выделена традиционными процедурами, такими как полимеразная цепная реакция (PCR).
Последовательности нуклеиновой кислоты, кодирующие вариабельные области тяжелой и легкой цепей, показаны выше. Специалисту будет понятно, что из-за вырожденности генетического кода каждая из полипептидных последовательностей, раскрываемых в настоящей заявке, кодируется большим числом других последовательностей нуклеиновых кислот. Настоящее изобретение предусматривает каждую вырожденную нуклеотидную последовательность, кодирующую каждое антитело или слитый с GLP-1 белок, представленные в настоящей заявке.
Настоящее изобретение также относится к нуклеиновым кислотам, которые гибридизируются с другими нуклеиновыми кислотами (например, нуклеиновыми кислотами, содержащими нуклеотидную последовательность любого из L2H2/L6H5) при определенных условиях гибридизации. Способы гибридизации нуклеиновых кислот хорошо известны в уровне техники. См., например, Current Protocols in Molecular Biology, John Wiley & Sons, N.Y. (1989), 6.3.1-6.3.6. Как определено в настоящей заявке, например, при умеренно жестком условии гибридизации используют раствор для предварительной промывки, содержащий 5 × хлорид натрия/цитрат натрия (SSC), 0,5% SDS, 1,0 мМ EDTA (pH 8,0), гибридизационный буфер из приблизительно 50% формамида, 6 × SSC, и при температуре гибридизации 55°C (или другие подобные растворы для гибридизации, такие как раствор, содержащий приблизительно 50% формамида, при температуре гибридизации 42°C) и условиях промывки 60°C в 0,5 × SSC, 0,1% SDS. При жестком условии гибридизации гибридизацию осуществляют в 6 × SSC при 45°C с последующей одной или несколькими промывками в 0,1 × SSC, 0,2% SDS при 68°C. Кроме того, специалист в данной области может управлять условиями гибридизации и/или промывки для увеличения или уменьшения жесткости гибридизации таким образом, чтобы нуклеиновые кислоты, содержащие нуклеотидные последовательности, которые на по меньшей мере 65, 70, 75, 80, 85, 90, 95, 98 или 99% идентичны друг другу, как правило, оставались гибридизированными друг с другом. Основные параметры, влияющие на выбор условий гибридизации и руководство по разработке подходящих условий, изложены, например, у Sambrook, Fritsch, and Maniatis (1989, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., chapters 9 and 11 и Current Protocols in Molecular Biology, 1995, Ausubel et al., Eds., John Wiley & Sons, Inc., sections 2.10 и 6.3-6.4), и могут быть легко определены рядовыми специалистами в данной области на основании, например, длины и/или состава оснований ДНК. Изменения могут быть внесены путем мутации в нуклеиновую кислоту, что тем самым приводит к изменениям аминокислотной последовательности полипептида (например, антитела), который она кодирует. Мутации можно вводить с использованием любой методики, известной в уровне техники. В одном варианте осуществления один или несколько конкретных аминокислотных остатков изменяют с использованием, например, протокола сайт-направленного мутагенеза. В другом варианте осуществления один или несколько случайно выбранных остатков изменяют с использованием, например, протокола случайного мутагенеза. Независимо от того, как он сделан, мутантный полипептид можно экспрессировать и подвергать скринингу на предмет желаемого свойства.
Мутации можно вводить в нуклеиновую кислоту без существенного изменения биологической активности полипептида, который она кодирует. Например, можно производить замены нуклеотидов, приводящие к заменам аминокислот в остатках несущественных аминокислот. В одном варианте осуществления нуклеотидные последовательности, представленные в настоящей заявке, для L1 - L11 и H1 - H9 или слитого с GLP-1 белка или его фрагментов, вариантов или производных, мутированы так, что они кодируют аминокислотные последовательности, представленные в настоящей заявке, для L1 - L11 и H1 - H9, предусматривающие одну или несколько делеций или замен аминокислотных остатков с получением последовательностей, несущих два или более отличающихся аминокислотных остатка. В другом варианте осуществления с помощью мутагенеза вставляют аминокислоту рядом с одним или несколькими аминокислотными остатками, показанными в настоящей заявке для L1 - L11 и H1 - H9 или слитого с GLP-1 белка, с получением последовательностей с двумя или более отличающимися аминокислотными остатками. В качестве альтернативы, в нуклеиновую кислоту можно ввести одну или несколько мутаций, которые селективно изменяют биологическую активность (например, связывание с GIPR) полипептида, который она кодирует. Например, мутация может количественно или качественно изменять биологическую активность. Примеры количественных изменений предусматривают увеличение, уменьшение или устранение активности. Примеры качественных изменений предусматривают изменение антигенной специфичности антитела или слитого с GLP-1 белка.
В другом аспекте настоящее изобретение относится к молекулам нуклеиновой кислоты, которые подходят для применения в качестве праймеров или гибридизационных зондов для выявления последовательностей нуклеиновых кислот по настоящему изобретению. Молекула нуклеиновой кислоты по настоящему изобретению может содержать только часть последовательности нуклеиновой кислоты, кодирующей полноразмерный полипептид по настоящему изобретению, например фрагмент, который можно использовать в качестве зонда или праймера, или фрагмент, кодирующий активную часть (например, часть, связывающую GIPR) полипептида по настоящему изобретению.
Зонды, основанные на последовательности нуклеиновой кислоты по настоящему изобретению, можно использовать для выявления нуклеиновой кислоты или подобных нуклеиновых кислот, например транскриптов, кодирующих полипептид по настоящему изобретению. Зонд может содержать группу-метку, например радиоизотоп, флуоресцентное соединение, фермент или ферментативный кофактор. Такие зонды можно использовать для идентификации клетки, экспрессирующей полипептид.
В другом аспекте векторы, представленные в настоящей заявке, содержат нуклеиновую кислоту, кодирующую полипептид по настоящему изобретению или его часть. Примеры векторов включают в себя без ограничения плазмиды, вирусные векторы, неэписомные векторы млекопитающих и векторы экспрессии, например рекомбинантные векторы экспрессии.
Рекомбинантные векторы экспрессии, представленные в настоящей заявке, могут содержать нуклеиновую кислоту по настоящему изобретению в форме, подходящей для экспрессии нуклеиновой кислоты в клетке-хозяине. Рекомбинантные векторы экспрессии включают в себя одну или несколько регуляторных последовательностей, выбранных на основании клеток-хозяев, подлежащих использованию для экспрессии, которые функционально связаны с последовательностью нуклеиновой кислоты, подлежащей экспрессии. Регуляторные последовательности включают в себя те, которые управляют конститутивной экспрессией нуклеотидной последовательности во многих типах клеток-хозяев (например, энхансер раннего гена SV40, промотор вируса саркомы Рауса и промотор цитомегаловируса), те, которые управляют экспрессией нуклеотидной последовательности только в определенных клетках-хозяевах (например, тканеспецифические регуляторные последовательности, см. Voss et al., 1986, Trends Biochem. Sci. 11:287, Maniatis et al., 1987, Science 236:1237, раскрытие каждой из которых включено в настоящий документ посредством ссылки в полном объеме), и те, которые управляют индуцибельной экспрессией нуклеотидной последовательности в ответ на конкретную обработку или условие (например, промотор металлотионина в клетках млекопитающих и отвечающий на тетрациклин и/или отвечающий на стрептомицин промотор как в прокариотической, так и в эукариотической системах (см. Id.). Специалистам в данной области будет понятно, что строение вектора экспрессии может зависеть от таких факторов, как выбор клетки-хозяина, подлежащей трансформации, желаемый уровень экспрессии белка и т. д. Векторы экспрессии по настоящему изобретению могут быть введены в клетки-хозяева для продуцирования тем самым белков или пептидов, включая слитые белки или пептиды, кодируемые нуклеиновыми кислотами, которые описаны в настоящей заявке.
В другом аспекте настоящее изобретение относится к клеткам-хозяевам, в которые был введен рекомбинантный вектор экспрессии по настоящему изобретению. Клетка-хозяин может быть любой прокариотической клеткой или эукариотической клеткой. Прокариотические клетки-хозяева включают в себя грамотрицательные или грамположительные организмы, например E. coli или бациллы. Высшие эукариотические клетки включают в себя клетки насекомых, дрожжевые клетки и установившиеся линии клеток млекопитающих. Примеры подходящих линий клеток-хозяев млекопитающих включают в себя клетки яичников китайского хомячка (CHO) или их производные, такие как Veggie CHO и родственные клеточные линии, которые растут в бессывороточной среде (см. Rasmussen et al., 1998, Cytotechnology 28:31), или штамм CHO DXB-11, дефицитный по DHFR (см. Urlaub et al., 1980, Proc. Natl. Acad. Sci. USA 77:4216-20). Дополнительные клеточные линии CHO включают в себя CHO-K1 (№ CCL-61 в ATCC), EM9 (№ CRL-1861 в ATCC) и W20 (№ CRL-1862 в ATCC). Дополнительные клетки-хозяева предусматривают линию COS-7 клеток почки обезьяны (№ CRL-1651 в ATCC) (см. Gluzman et al., 1981, Cell 23:175), клетки L, клетки C127, клетки 3T3 (ATCC CCL-163), клетки AM-1/D (описанные в патенте США № 6210924), клетки HeLa, линии клеток BHK (ATCC CRL-10), линию клеток CV1/EBNA, полученную из линии клеток CV1 почки африканской зеленой обезьяны (ATCC CCL-70) (см. McMahan et al., 1991, EMBO J. 10:2821), человеческие эмбриональные клетки почки, такие как 293, 293 EBNA или MSR 293, человеческие эпидермальные клетки A431, человеческие клетки Colo205, другие трансформированные линии клеток приматов, нормальные диплоидные клетки, клеточные штаммы, полученные из in vitro культуры первичной ткани, первичные эксплантаты, клетки HL-60, U937, HaK или Jurkat. Подходящие векторы клонирования и экспрессии для применения с бактериальными, грибковыми, дрожжевыми клетками-хозяевами и клетками-хозяевами млекопитающих описаны Pouwels et al. (Cloning Vectors: A Laboratory Manual, Elsevier, N.Y., 1985).
Векторная ДНК может быть введена в прокариотические или эукариотические клетки с помощью традиционных методик трансформации или трансфекции. Что касается стабильной трансфекции клеток млекопитающих, известно, что в зависимости от используемых вектора экспрессии и методики трансфекции только небольшая часть клеток может интегрировать чужеродную ДНК в свой геном. Для идентификации и отбора этих интегрантов ген, который кодирует селективный маркер (например, резистентности к антибиотикам), обычно вводят в клетки-хозяева вместе с представляющим интерес геном. Предпочтительные селективные маркеры предусматривают маркеры, которые придают устойчивость к лекарственным средствам, таким как G418, гигромицин и метотрексат. Клетки, стабильно трансфицированные введенной нуклеиновой кислотой, можно идентифицировать путем отбора с лекарственным средством (например, клетки, которые включили селективный маркерный ген, выживут, в то время как другие клетки погибнут) наряду с другими способами.
Трансформированные клетки можно культивировать в условиях, которые способствуют экспрессии полипептида, и полипептид извлекают с помощью традиционных процедур очистки белка. Одна такая процедура очистки описана в примерах ниже. Полипептиды, предполагаемые для применения в настоящей заявке, включают по сути гомогенные рекомбинантные антитела к GIPR млекопитающих или полипептиды слитого с GLP-1 белка, по сути не содержащие контаминирующих эндогенных материалов.
Активность антитела к GIPR
Активность антитела к GIPR относится к эффекту антитела, представленного в настоящей заявке, в специфическом связывании с GIPR, ингибировании или блокировании передачи сигнала GIP, что таким образом демонстрирует терапевтический биологический эффект, например при лечении ожирения, T2DM и/или неалкогольного стеатогепатита (NASH). Термин "снижение биологической активности передачи сигнала GIP" или "ингибирование или блокирование биологической активности передачи сигнала GIP" относится к эффекту антитела к GIPR или его слитого с GLP-1 белка в ингибировании или блокировании нижележащих клеточных ответов на GIP путем связывания с GIPR in vivo. Эти ответы предусматривают без ограничения инсулинотропный эффект, способствующий накоплению жира, и ингибирование липолиза. В одном варианте осуществления мышиное антитело или гуманизированное антитело, представленные в настоящей заявке, специфически связывается с GIPR человека. Такие антитела включают в себя антагонистические или нейтрализующие антитела, которые снижают или нейтрализуют передачу сигнала GIP.
В одном варианте осуществления Kd антитела, представленного в настоящей заявке, связывающегося с GIPR человека, варьирует от примерно 0,01 нМ до 1000 нМ, от 0,1 нМ до 500 нМ, от 0,5 нМ до 200 нМ, от 1 нМ до 200 нМ или от 10 нМ до 100 нМ. В другом варианте осуществления Kd антитела, представленного в настоящей заявке, связывающегося с GIPR, составляет от примерно 1 нМ до 200 нМ. В еще одном варианте осуществления Kd антитела, представленного в настоящей заявке, связывающегося с GIPR, составляет от примерно 10 нМ до 100 нМ. В еще одном варианте осуществления Kd антитела, представленного в настоящей заявке, связывающегося с GIPR, составляет примерно 1 нМ, 2 нМ, 5 нМ, 10 нМ, 20 нМ, 30 нМ, 40 нМ, 50 нМ, 60 нМ, 70 нМ, 80 нМ, 90 нМ, или 100 нМ.
В одном варианте осуществления IC50 антитела, представленного в настоящей заявке, в антагонизировании передачи сигнала GIP составляет от примерно 0,01 нМ до 500 нМ, от 0,1 нМ до 200 нМ, от 0,5 нМ до 200 нМ, от 1 нМ до 200 нМ или от 10 нМ до 100 нМ. В другом варианте осуществления IC50 антитела, представленного в настоящей заявке, в антагонизировании передачи сигнала GIP составляет от примерно 1 нМ до 200 нМ. В еще одном варианте осуществления IC50 антитела, представленного в настоящей заявке, в антагонизировании передачи сигнала GIP составляет от примерно 10 нМ до 100 нМ. В еще одном варианте осуществления IC50 антитела, представленного в настоящей заявке, в антагонизировании передачи сигнала GIP составляет примерно 1 нМ, 2 нМ, 5 нМ, 10 нМ, 20 нМ, 30 нМ, 40 нМ, 50 нМ, 60 нМ, 70 нМ, 80 нМ, 90 нМ, или 100 нМ.
В одном варианте осуществления антитело, представленное в настоящей заявке, специфически связывается с GIPR с одним или несколькими следующими свойствами:
a. обеспечение Kd, по сути подобной таковой эталонного антитела при связывании с GIPR;
b. обеспечение IC50, по сути подобной таковой эталонного антитела при антагонизировании GIPR, активированного с помощью GIP; и
c. перекрестно-конкурирующее связывание с эталонным антителом к GIPR человека.
В одном варианте осуществления эталонное антитело содержит комбинацию аминокислотной последовательности вариабельного домена легкой цепи SEQ ID NO:66 и аминокислотной последовательности вариабельного домена тяжелой цепи SEQ ID NO:76. В другом варианте осуществления эталонное антитело представляет собой моноклональное антитело L2H2, L6H5 или L10H8.
Используемый в настоящей заявке термин "по сути подобные" означает примерно 200%, 180%, 160%, 150%, 140%, 120%, 110%, 100%, 99%, 98%, 97%, 95%, 90%, 85%, 80%, 75%, 70%, 65%, или 50% IC50 или Kd эталонного антитела или сравнимые с таковыми. В одном варианте осуществления эталонное антитело представляет собой, например, антитело, содержащее комбинацию тяжелой цепи SEQ ID NO:76 и легкой цепи SEQ ID NO:66. В другом варианте осуществления эталонное антитело предусматривает L2H2, L6H5 или L10H8.
Биологическая активность слитого белка антитела к GIPR и GLP-1
Биологическая активность слитого белка антитела к GIPR и GLP-1 предусматривает биологическую активность GLP-1 и активность антитела к GIPR. Активность антител к GIPR описана выше. "Биологическая активность GLP-1" относится к биологической активности слитого белка антитела к GIPR и GLP-1, который связывает in vivo, активирует рецептор GLP-1 и вызывает клеточный ответ передачи сигнала, а также оказывает терапевтические эффекты, например, в отношении ожирения, диабета 2-го типа или неалкогольного стеатогепатита. Ответ передачи сигнала предусматривает без ограничения повышенную секрецию инсулина, подавление секреции глюкагона, подавление аппетита, потерю массы, индуцирование насыщения, ингибирование апоптоза, индуцирование пролиферации панкреатических β-клеток и дифференцировку панкреатических β-клеток. Комбинируя типы биологической активности GLP-1 и антител к GIPR, слитый с GLP-1 белок, представленный в настоящей заявке, можно использовать для лечения различных заболеваний и нарушений, связанных с GLP-1R и GIPR. Слитый белок проявляет свой биологический эффект, воздействуя на GLP-1R и/или GIPR, поэтому лечение слитым с GLP-1 белком, представленное в настоящей заявке, может быть использовано для лечения субъектов, для заболевания или симптома которых будет полезно "усиление передачи сигнала GLP-1R" или "снижение передачи сигнала GIPR". Эти субъекты упоминаются как субъекты, которые "нуждаются в стимулирующей GLP-1R терапии" или "нуждаются в снижении стимуляции GIPR", в том числе с инсулинонезависимым диабетом, инсулинозависимым диабетом, инсультом (GLP-1R, см. WO 00/16797), инфарктом миокарда (GLP-1R, см. WO 98/08531), ожирением (GLP-1R, см. WO 98/19698; GIPR. см. Furija et al., 2008, PLoS ONE 3: e3163; US 2017/0275370 A1), катаболическими изменениями после хирургического вмешательства (GLP-1R, см. US 6006753), функциональной диспепсией и синдромом раздраженного кишечника (GLP-1R, см. WO99/64060), стеатозом печени (GIPR, см. US 2017/0275370A1), неалкогольной жировой болезнью печени (GLP-1R, см. Debra et al., 2016, Hepatobiliary Surg Nutr 5: 515-518; GIPR, см. US 2017/0275370 A1), неалкогольным стеатогепатитом (GLP-1, см. Armstrong et al., 2013, BMJ Open 3:e003995; GIPR, см. US 2017/0275370 A1), также в том числе субъекты с риском развития неинсулинзависимого диабета (см. WO 00/07617), субъекты с нарушенной толерантностью к глюкозе или нарушенным уровнем глюкозы натощак, субъекты, масса тела которых на приблизительно 25% выше нормальной зависимой от роста массы, и субъекты с частичной панкреатэктомией.
В одном варианте осуществления изменения биологической активности антитела к GIPR или его слитого с GLP-1 белка выявляют с использованием прямого анализа цАМФ, количественно определяющего функцию антитела к GIPR или слитого с GLP-1 белка в ингибировании GIPR in vitro.
Фармацевтические композиции
В одном варианте осуществления фармацевтическая композиция, представленная в настоящей заявке, содержит антитело к GIPR, представленное в настоящей заявке, и один или несколько фармацевтически приемлемых носителей.
В другом варианте осуществления фармацевтическая композиция, представленная в настоящей заявке, содержит слитый белок антитела к GIPR и GLP-1, представленный в настоящей заявке, и один или несколько фармацевтически приемлемых носителей.
Используемый в настоящей заявке термин "носитель" включает в себя носитель, фармацевтическое вспомогательное средство или стабилизатор, которые безвредны при воздействии на клетки или млекопитающих в используемой дозе и концентрации.
Способ лечения
В одном варианте осуществления в настоящей заявке представлен способ лечения, профилактики или уменьшения интенсивности диабета 2-го типа, который предусматривает введение субъекту терапевтически эффективной дозы антитела к GIPR, представленного в настоящей заявке, или фармацевтической композиции на его основе.
В другом варианте осуществления в настоящей заявке представлен способ лечения, профилактики или уменьшения интенсивности неалкогольной жировой болезни печени, который предусматривает введение субъекту терапевтически эффективной дозы антитела к GIPR, представленного в настоящей заявке, или фармацевтической композиции на его основе.
В другом варианте осуществления в настоящей заявке представлен способ лечения, профилактики или уменьшения интенсивности неалкогольной жировой болезни печени, который предусматривает введение субъекту терапевтически эффективной дозы слитого белка антитела к GIPR, представленного в настоящей заявке, и GLP-1, или фармацевтической композиции на его основе.
В другом варианте осуществления в настоящей заявке представлен способ лечения, профилактики или уменьшения интенсивности неалкогольного стеатогепатита, который предусматривает введение субъекту терапевтически эффективной дозы антитела к GIPR, представленного в настоящей заявке, или фармацевтической композиции на его основе.
В другом варианте осуществления в настоящей заявке представлен способ лечения, профилактики или уменьшения интенсивности неалкогольного стеатогепатита, который предусматривает введение субъекту терапевтически эффективной дозы слитого белка антитела к GIPR, представленного в настоящей заявке, и GLP-1, или фармацевтической композиции на его основе.
В другом варианте осуществления в настоящей заявке представлен способ лечения, профилактики или уменьшения интенсивности диабета 2-го типа, который предусматривает введение субъекту терапевтически эффективной дозы антитела к GIPR, представленного в настоящей заявке, или фармацевтической композиции на его основе.
В другом варианте осуществления в настоящей заявке представлен способ лечения, профилактики или уменьшения интенсивности диабета 2-го типа, который предусматривает введение субъекту терапевтически эффективной дозы слитого белка антитела к GIPR и GLP-1, представленного в настоящей заявке, или фармацевтической композиции на его основе.
В другом варианте осуществления в настоящей заявке представлен способ лечения, профилактики или уменьшения интенсивности ожирения, который предусматривает введение субъекту терапевтически эффективной дозы антитела к GIPR, представленного в настоящей заявке, или фармацевтической композиции на его основе.
В дополнительном варианте осуществления в настоящей заявке представлен способ лечения, профилактики или уменьшения интенсивности ожирения, который предусматривает введение субъекту терапевтически эффективной дозы слитого белка антитела к GIPR, представленного в настоящей заявке, и GLP-1, или фармацевтической композиции на его основе.
При любом из применений, представленных в настоящей заявке, фармацевтическая композиция, представленная в настоящей заявке, предназначена для внутривенной или подкожной инъекции.
Используемый в настоящей заявке термин "субъект" относится к млекопитающему, в том числе к людям, и используется взаимозаменяемо с термином "пациент".
Термин "лечение" включает в себя уменьшения интенсивности или предупреждение по меньшей мере одного симптома или другого аспекта нарушения, или уменьшение тяжести заболевания. Антитело к GIPR или слитый белок антитела к GIPR и GLP-1, представленные в настоящей заявке, не должны обеспечивать полное излечение или устранять каждый симптом или проявление заболевания, чтобы быть эффективным терапевтическим средством. Как признано в соответствующей области, терапевтические средства могут уменьшать тяжесть данного болезненного состояния, но не обязательно устранять все проявления заболевания, чтобы быть эффективными. Подобным образом, профилактическое средство не должно полностью предупреждать возникновение состояния, чтобы быть эффективным. Достаточным является простое уменьшение воздействия заболевания (например, за счет уменьшения числа или тяжести его симптомов, или за счет повышения эффективности другого лечения, или за счет получения другого положительного эффекта) или снижение вероятности того, что заболевание проявится или ухудшится у субъекта. Одни вариант осуществления настоящего изобретению относится к способу, предусматривающему введение пациенту антитела в количестве и на протяжении времени, достаточных для индуцирования существенного улучшения по сравнению с исходным уровнем признака, который отражает тяжесть конкретного нарушения.
Фармацевтическая композиция на основе антитела к GIPR или слитого белка антитела к GIPR и GLP-1 может быть введена любой подходящей методикой, в том числе без ограничения парентерально, местным путем или ингаляцией. При инъецировании фармацевтическая композиция может быть введена, например, внутрисуставным, внутривенным, внутримышечным, внутриочаговым, внутрибрюшинным или подкожным путем, путем болюсной инъекции или непрерывной инфузии. Предусматривается, например, локальное введение на участке заболевания или повреждения, такое как трансдермальное введение и замедленное высвобождение имплантата. Доставка путем ингаляции включает в себя, например, назальную или пероральную ингаляцию, применение небулайзера, ингаляцию антитела в форме аэрозоля и подобное. Другие альтернативы включают в себя пероральные препараты, в том числе пилюли, сиропы или пастилки.
Преимущественно антитело к GIPR или слитый белок антитела к GIPR, представленные в настоящей заявке, вводят в композиции, содержащей один или несколько дополнительных компонентов, таких как физиологически приемлемый носитель, вспомогательное средство или разбавитель. Композиция дополнительно содержит один или несколько физиологически активных средств, как описано ниже. Во многих конкретных вариантах осуществления композиция содержит одно, два, три, четыре, пять или шесть физиологически активных средств в дополнение к одному или нескольким антителам (например, мышиным антителам или гуманизированным антителам) или слитому с GLP-1 белку, представленному в настоящей заявке.
В одном варианте осуществления фармацевтическая композиция содержит мышиное антитело или гуманизированное антитело или слитый с GLP-1 белок, представленные в настоящей заявке, вместе с одним или несколькими веществами, выбранными из группы, состоящей из буфера, подходящего для антитела при подходящем pH, антиоксиданта, такого как аскорбиновая кислота, низкомолекулярного полипептида (например, содержащего менее 10 аминокислот), белка, аминокислоты, углевода, такого как декстрин, хелатирующего средства, такого как EDTA, глутатиона, стабилизатора и вспомогательного средства. Согласно соответствующим отраслевым стандартам также могут быть добавлены консерванты. Композиция может быть составлена в виде лиофилизата с использованием соответствующих растворов вспомогательных средств в качестве разбавителей. Подходящие компоненты нетоксичны для реципиентов в используемых дозах и концентрациях. Дополнительные примеры компонентов, которые можно использовать в фармацевтических составах, представлены в Remington's Pharmaceutical Sciences, 16th Ed. (1980) и 20th Ed. (2000). Представлены наборы Mack Publishing Company для применения практикующими врачами, включающими в себя одно или несколько антител или слитый с GLP-1 белок по настоящему изобретению, а также этикетку или другие инструкции по применению при лечении любого из состояний, обсуждаемых в настоящей заявке. В одном варианте осуществления набор включает в себя стерильный препарат одного или нескольких человеческих антител или слитых с GLP-1 белков, которые могут быть в форме композиции, раскрываемой выше, и могут находиться в одном или нескольких флаконах.
Дозы и частота введения могут варьировать в зависимости от таких факторов, как путь введения, применяемые конкретные антитело или слитый с GLP-1 белок, природа и тяжесть заболевания, подлежащего лечению, является ли состояние острым или хроническим, а также размер и общее состояние субъекта. Подходящие дозы могут быть определены с помощью процедур, известных в уровне техники, например, в клинических испытаниях, которые могут включать в себя исследования с повышением дозы.
Антитело или слитый с GLP-1 белок, представленные в настоящей заявке, можно вводить, например, один или более одного раза, например, через равные промежутки времени в течение определенного периода времени. В конкретных вариантах осуществления мышиное антитело, или гуманизированное антитело, или слитый с GLP-1 белок вводят один раз в течение периода по меньшей мере месяц или дольше, например в течение одного, двух или трех месяцев или даже неограниченно. Для лечения хронических состояний, как правило, наиболее эффективно длительное лечение. Однако для лечения острых состояний может быть достаточным введение в течение более коротких периодов времени, например от одной до шести недель. Как правило, гуманизированное антитело вводят до тех пор, пока у пациента не проявится медицински значимая степень улучшения по сравнению с исходным уровнем для выбранного показателя или показателей.
Пример режима лечения, представленного в настоящей заявке, включает в себя подкожную инъекцию антитела или слитого с GLP-1 белка в соответствующей дозе один раз в неделю или дольше для лечения симптомов, вызванных диабетом 2-го типа, ожирением или неалкогольным стеатогепатитом. Антитело или слитый с GLP-1 белок можно вводить еженедельно или ежемесячно до тех пор, пока не будет достигнут желаемый результат, например, пока не исчезнут симптомы у пациента. При необходимости лечение можно возобновить, или, в качестве альтернативы, может быть назначена поддерживающая доза.
Концентрацию глюкозы в крови и массу тела пациента можно контролировать до, во время и/или после лечения антителом или слитым с GLP-1 белком, таким как человеческое антитело или слитый с GLP-1 белок, для выявления любых изменений их нагрузки. При определенных условиях изменения уровня глюкозы в крови могут варьировать в зависимости от таких факторов, как прогрессирование заболевания. Концентрация глюкозы в крови может быть определена с использованием известных методик.
Конкретные варианты осуществления способов и композиций в настоящей заявке предусматривают применение, например, антитела или слитого с GLP-1 белка и одного или нескольких антагонистов GIP, двух или более антител или слитых с GLP-1 белков, представленных в настоящей заявке, или антитела, или слитого с GLP-1 белка, представленных в настоящей заявке, и одного или нескольких других антагонистов GIP. В дополнительном варианте осуществления антитело или слитый с GLP-1 белок вводят отдельно или в комбинации с другими средствами, используемыми для лечения симптомов, которые являются болезненными для пациента. Примеры этих средств включают в себя белковые и небелковые лекарственные средства. Когда несколько лекарственных средств вводят в комбинации, дозу следует соответственно корректировать, как это хорошо известно в уровне техники. Комбинированная терапия "комбинированным введением" не ограничивается одновременным введением, но также предусматривает режимы лечения, при которых антиген и белок вводят по меньшей мере один раз в течение курса введения, включая введение пациенту по меньшей мере одного другого терапевтического средства.
С другой стороны, в настоящей заявке предоставлен способ получения лекарственного препарата для лечения диабета 2-го типа, ожирения и неалкогольного стеатогепатита и связанных с ним нарушений, который предусматривает смесь антитела или слитого с GLP-1 белка, представленных в настоящей заявке, и фармацевтически приемлемого вспомогательного вещества для лечения заболеваний, связанных с вышеуказанными заболеваниями. Способ фармацевтического получения описан выше.
Кроме того, в настоящей заявке представлены композиции, наборы и способы, относящиеся к антителам или слитым с GLP-1 белкам, которые могут специфически связываться с GIPR человека. Также представлены молекулы нуклеиновых кислот, а также их производные и фрагменты, содержащие полинуклеотиды, кодирующие весь или часть полипептида, связывающегося с GIPR, например, нуклеиновая кислота, кодирующая все или часть антитела к GIPR, фрагмент антитела, производное антитела или слитый с GLP-1 белок. Кроме того, в настоящей заявке представлены векторы и плазмиды, содержащие такие нуклеиновые кислоты, а также клетки и линии клеток, содержащие такие нуклеиновые кислоты и/или векторы и плазмиды. Способы, представленные в настоящей заявке, включают в себя, например, способы получения, идентификации или выделения антител или слитых с GLP-1 белков, которые связываются с GIPR человека, способ определения того, связывается ли антитело или слитый с GLP-1 белок с GIPR, и способ введения антитела или слитого с GLP-1 белка, которые связываются с GIPR, в животную модель.
Описываемые в настоящей заявке технические решения будут далее поняты с помощью следующих примеров.
Если не указано иное, исходные материалы и оборудование, описываемые в настоящей заявке, являются коммерчески доступными или обычно используются в уровне техники. Если не указано иное, все способы в следующих примерах являются общепринятыми в уровне техники.
1. Получение антигена для иммунизации
Клетки CHO-DHFR- высевали в 6-луночный планшет. Через 24 часа (ч.) клетки трансфицировали плазмидой pTM15, содержащей ген hGIPR (см. SEQ ID NO:114 в отношении нуклеотидной последовательности и SEQ ID NO:113 в отношении аминокислотной последовательности). Трансфекцию выполняли с использованием Lipofectamine 2000 (Invitrogen) согласно рекомендованному изготовителем протоколу. Через 48 ч. после трансфекции среду заменяли полной средой, содержащей 300 мкг/мл гигромицина, и среду меняли каждые 3 дня (д.). В течение приблизительно двух недель культивирования наблюдали стабильные клоны. Диспергированные клеточные колонии отделяли от планшета и непрерывно субкультивировали до тех пор, пока они не достигали 100% слияния. Сконструированные стабильные клеточные линии анализировали с помощью FACS с использованием моноклональных антител (Life Technologies) к метке V5 для проверки положительных клонов после отбора с давлением. На выбранных клетках CHO-DHFR-hGIPR выявляли большое количество экспрессируемого hGIPR на клеточной поверхности. Наконец, с помощью субклонирования и дальнейшей проверки идентифицировали три стабильные клеточные линии с высокой экспрессией hGIPR. Эти клеточные линии использовали для получения иммуногенов для получения антител (см. пример 2). Кроме того, в некоторых вариантах осуществления слитый белок внеклеточного домена hGIPR и Fc hIgG также можно было использовать в качестве иммуногена для получения антител. Способ получения заключался в следующем: субклонирование гена слитого белка внеклеточного домена hGIPR, Fc hIgG и пептидного линкера (линкера) в плазмиду pTM5. Клеточную надосадочную жидкость получали путем массовой временной экспрессии с использованием суспендированных клеток HEK293, а затем слитый с внеклеточным доменом hGIPR белок получали с помощью очистки аффинной хроматографией.
2. Получение антител.
Антитела к hGIPR могут быть получены с использованием иммуногена, включающего в себя любой из следующих. Например, в некоторых вариантах осуществления целые клетки, экспрессирующие hGIPR, использовали в качестве иммуногенов для получения антител против hGIPR. Кроме того, в некоторых вариантах осуществления слитые белки, содержащие N-концевой внеклеточный домен hGIPR и hFc, использовали в качестве иммуногенов для создания антител против hGIPR. Иммуноген и адъювант гидроксида алюминия смешивали и мышам BALB/c (6-8 недель) вводили подкожную инъекцию и стимулировали один раз в неделю. После общей сложностью 6 циклов иммунизации собирали образцы крови из хвостовых вен и сыворотку отделяли центрифугированием, затем титр сыворотки анализировали с помощью FACS. После достижения наивысших титров мышей умерщвляли и собирали у них клетки селезенки в асептических условиях. Клетки SP2/0 в фазе логарифмического роста собирали, центрифугировали, осадки клеток ресуспендировали в бессывороточной культуральной среде, затем центрифугировали, ресуспендировали во второй раз и подсчитывали. Клетки селезенки и клетки SP2/0 смешивали при соотношении клетки SP2/0:клетки селезенки ≥ 1:1 с последующими 3 циклами промывки-центрифугирования. После стряхивания осадков от последнего центрифугирования по каплям добавляли 1 мл предварительно нагретого PEG-1500, перемешивали пипеткой в течение 1 мин., медленно добавляли 30 мл предварительно нагретой бессывороточной среды, чтобы остановить слияние PEG. Осадки клеток ресуспендировали в культуральной среде для слияния. Клетки селезенки и клетки питающего слоя по 100 мкл высевали в каждую лунку 96-луночных планшетов. Слитые гибридомные клетки и клетки питающего слоя совместно культивировали в 96-луночных планшетах с отбором HAT (сарцин, аметоптерин и тимидин) для удаления неслитых клеток. Через 10 дней надосадочные жидкости гибридомных клеток в планшетах для культивирования собирали для анализа ELISA.
3. Отбор антител с помощью ELISA
Клетки CHO-DHFR-hGIPR, сверхэкспрессирующие hGIPR, и пустые клетки CHO-DHFR- отдельно переносили в 96-луночный планшет и обеспечивали достижение 90% конфлуентности. Надосадочную жидкость культуральной среды удаляли и прикрепленные клетки дважды промывали с помощью PBS и добавляли 100% метанол для фиксации клеток при 4°C. Затем добавляли 100 мкл свежеприготовленного 0,6% H2O2-PBS и после инкубации при комнатной температуре в течение 20 минут (мин.) клетки дважды промывали с помощью PBS. После блокирования с помощью 1% раствора BSA (растворенного в PBS) добавляли надосадочную жидкость гибридомы и инкубировали в течение 90 мин. при 4°C. После нескольких промывок в каждую лунку добавляли 100 мкл разбавленного вторичного антитела козы к Fc-HRP мыши (Sigma-Aldrich) и инкубировали при 37°C в течение 30 мин. После пятикратной промывки добавляли 100 мкл хромогенного субстрата TMB и инкубировали при 37°C в течение 15 мин., а затем добавляли 50 мкл 2 M H2SO4 для остановки реакции перед считыванием при 450 нм. Кроме того, в некоторых вариантах осуществления в качестве покрывающего антигена использовали слитый белок N-концевого внеклеточного домена hGIPR и hFc. После блокирования с помощью 1% BSA (растворенного в PBS) добавляли надосадочную жидкость гибридомных клеток и инкубировали при 4°C в течение 90 мин. Последующие стадии аналогичны описанному выше способу ELISA для скрининга моноклональных антител к hGIPR. Положительный контроль представляет собой сыворотку иммунизированных мышей; отрицательный контроль представляет собой среду для культивирования клеток. После предварительного скрининга с помощью ELISA получали несколько положительных линий гибридомных клеток, секретирующих антитела к hGIPR. Эти линии гибридомных клеток, секретирующие антитела к hGIPR, отбирали и субклонировали путем предельного разбавления. Наконец, надосадочную жидкость положительных гибридомных клеток проверяли с помощью анализа FACS (см. пример 10).
4. Клонирование и субклонирование генов антител
Собирали гибридомные клетки, секретирующие антитела. Гибридомную mRNA экстрагировали согласно протоколу изготовителя набора для экстракции mRNA QIAGEN. Затем извлеченную mRNA подвергали обратной транскрипции в cDNA. Праймеры обратной транскрипции представляли собой специфические праймеры для константных областей легкой и тяжелой цепи мыши, в частности праймер обратной транскрипции тяжелой цепи представлял собой 5'-TTTGGRGGGAAGATGAAGAC-3', праймеры обратной транскрипции легкой цепи представляли собой 5'-TTAACACTCTCCCCTGTTGAA-3' и 5'-TTAACACTCATTCCTGTTGAA-3'. Условия реакции RT-PCR приведены ниже: 25°C в течение 5 мин., 50°C в течение 60 мин. и 70°C в течение 15 мин. Обратно транскрибируемую cDNA разбавляли 0,1 мМ ТЕ до 500 мкл, добавляли в центрифужную пробирку для ультрафильтрации (Amicon Ultra-0.5) и центрифугировали при 2000 g в течение 10 мин. Фильтрат удаляли, добавляли 500 мкл 0,1 мМ ТЕ и центрифугировали при 2000 g в течение 10 мин. Фильтрат удаляли, пробирку для получения переворачивали в новую центрифужную пробирку и центрифугировали при 2000 g в течение 10 мин. с получением очищенной cDNA. Очищенную cDNA (10 мкл) использовали в качестве матрицы, затем добавляли 4 мкл 5-хвостового буфера (Promega), 4 мкл dATP (1 мМ) и 10 ед. концевой трансферазы (Promega), перемешивали до однородности и инкубировали при 37°C в течение 5 мин., а затем при 65°C в течение 5 мин. cDNA хвоста полиА использовали в качестве матрицы и проводили PCR для амплификации генов вариабельных областей легкой и тяжелой цепей антител. Все прямые праймеры представляли собой oligodT, где обратные праймеры для последовательности тяжелой цепи представляли собой 5'-TGGACAGGGATCCAGAGTTCC-3' и 5'-TGGACAGGGCTCCATAGTTCC-3', а обратные праймеры для последовательности легкой цепи представляли собой 5'-ACTCGTCCTTGGTCAACGTG-3'. Условия реакции RT-PCR были следующими: 95°С в течение 5 мин.; 95°C в течение 30 секунд (с), 56°C в течение 30 с, 72°C в течение 1 мин, 40 циклов; и 72°C в течение 7 мин. Продукты PCR соединяли с вектором PMD 18-T (Takara Bio) для секвенирования. Праймеры PCR конструировали на основе последовательностей ДНК антител, таким образом, полная легкая цепь, сигнальные пептиды тяжелой цепи и вариабельные домены, а также константная область IgG1 мыши были лигированы в вектор экспрессии pTM5.
5. Гуманизация и оптимизация антитела
Прежде всего, последовательности вариабельных областей легкой и тяжелой цепей мышиных антител использовали в качестве входных данных при поиске с помощью онлайн-инструмента для выравнивания последовательностей вариабельных областей антител NCBI (Ig Blast), чтобы найти последовательности гена зародышевого типа человеческого антитела (Ig Germline Gene sequence), гомологичную последовательности вариабельной области мышиных антител для гуманизации, и последовательность человеческого гена с наивысшей гомологией, за исключением последовательностей CDR, использовали в качестве матрицы для трансплантации CDR с целью получения последовательностей вариабельной области гуманизированного антитела. Гены вариабельных областей легкой и тяжелой цепей гуманизированного антитела синтезировали и объединяли с последовательностью константной области IgG2 или IgG4 человека для получения полноразмерных последовательностей рекомбинантных гуманизированных антител. Рекомбинантные антитела экспрессировали согласно примеру 8 и их значения аффинности в отношении GIPR анализировали с помощью FACS, как описано в примере 10, чтобы выбрать антитело с наилучшей аффинностью. Последовательности вариабельной области гуманизированного антитела конструировали с помощью сайт-специфического мутагенеза для дальнейшего улучшения его аффинности в отношении GIPR.
6. Субклонирование генов гуманизированных антител к hGIPR
Последовательности генов вариабельной области тяжелой и легкой цепей оптимизированных гуманизированных антител синтезировали при аутсорсинге. Во время процесса два сайта рестрикции, NheI на 5'-конце и SalI на 3'-конце, вводили в последовательность вариабельной области тяжелой цепи. Полную вариабельную область тяжелой цепи лигировали с константной областью тяжелой цепи в векторе экспрессии pTM5. Подобным образом, путем введения NheI на 5'-конце и BsiwI на 3'-конце вариабельную область легкой цепи лигировали с константной областью легкой цепи в векторе экспрессии pTM5.
7. Конструирование слитого белка гуманизированного антитела к hGIPR и GLP-1
Оптимизированное гуманизированное антитело сливали с GLP-1 или его производными последовательностями посредством N-конца или C-конца легкой цепи с образованием слитого с GLP-1 белка, и последовательности этих двух молекул соединены пептидной линкерной последовательностью (линкером) в качестве мостика. Нуклеотидную последовательность сигнальный пептид-GLP-1-линкер синтезировали с помощью Genscript Biotechnology Co., Ltd. с использованием синтетического гена в качестве матрицы, последовательность части "сигнальный пептид-GLP1-линкер" амплифицировали с использованием PCR. Кроме того, с использованием нуклеотидной последовательности гуманизированного антитела в качестве матрицы амплифицировали последовательность антитела последовательности слитого белка. Затем посредством перекрывающейся PCR часть "сигнальный пептид-GLP-1-пептидный линкер" последовательности нуклеиновой кислоты слитого белка соединяли с частью, представляющей собой антитело, вводя два сайта для рестрикционных ферментов Nhe1 и Not1 на оба конца праймеров, и таким образом связывали вместе полную последовательность слитого белка и вектор экспрессии pTM5.
8. Временная экспрессия антитела к hGIPR и слитого с GLP-1 белка
Суспензию клеток HEK293 или CHO (5×105/мл) инокулировали в смесительную колбу. После откручивания при 37°C в течение 24 ч. плотность клеток достигала 1 х 106/мл, и их использовали для трансфекции. Полиэтиленимин (PEI) использовали в качестве реагента для трансфекции и смешивали его с ДНК. Смесь PEI/ДНК добавляли в культуру клеток после 15 минут инкубации. После получения смеси PEI/ДНК клетки непрерывно культивировали при 37°C, 5% CO2 в течение 24 ч. Затем в культуру клеток добавляли триптон в качестве добавки для экспрессии. Наконец, после завершения экспрессии белка (более 96 ч.) клеточную надосадочную жидкость собирали для очистки антител.
9. Очистка и разделение антитела к hGIPR и слитого с GLP-1 белка
Клетки и клеточный дебрис удаляли из культуры после центрифугирования (8000 оборотов в минуту), а надосадочную жидкость фильтровали через фильтр 0,22 мкм. Осветленную надосадочную жидкость использовали для очистки. Процесс очистки выполняли с помощью хроматографа. Надосадочная жидкость сначала проходила через аффинную колонку с белками A/G, во время чего антитело связывалось с белками A/G и оставалось в колонке. Затем антитела элюировали из хроматографической колонки с использованием буфера для элюирования с низким pH (меньше или равным 3,0). Элюент с низким pH немедленно нейтрализовали с помощью 1 М трис-HCl. Затем проводили диализ очищенного антитела против PBS или других буферных систем.
10. FACS для проверки связывающей активности функциональных антител к hGIPR
PBS, содержащий 10 мМ EDTA, использовали для отделения клеток CHO-DHFR-hGIPR, 105 клеток/пробирка распределяли в ЕР пробирки на 1,5 мл и надосадочную жидкость удаляли после центрифугирования. Образец отрицательного контроля ресуспендировали в загрузочном буфере (PBS, 2% FBS). Для положительного контроля к клеткам добавляли 200 мкл раствора антитела к GIPR определенной концентрации и инкубировали при комнатной температуре; затем после инкубации клетки центрифугировали при 1500 оборотах в минуту для удаления надосадочной жидкости, промывали загрузочным буфером FACS и снова центрифугировали. Клетки ресуспендировали добавлением (200 мкл/лунка) меченного FITC козьего флуоресцентного антитела к мышиному антителу или меченного РЕ козьего флуоресцентного антитела к человеческому антителу при разбавлении 1:50 и инкубировали при комнатной температуре в течение 30 минут в темноте. Надосадочную жидкость удаляли после центрифугирования и клетки промывали загрузочным буфером FACS, снова центрифугировали и ресуспендировали загрузочным буфером для анализа FACS. Рекомбинантное функциональное антитело к hGIPR специфически связывается с экспрессирующими GIPR клетками CHO-DHFR-GIPR. В экспериментальных результатах, показанных на фигуре 1, серый пик и показанный пунктирной линией пик представляли собой отрицательные контроли; показанный сплошной линией пик, соответствующий 1 мкМ антитела L10H8, показывает значительный сдвиг вправо, что доказывает специфическое связывание L10H8 и CHO-DHFR-GIPR.
11. Пробный анализ цАМФ антитела к hGIPR или слитого белка антитела к hGIPR/GLP-1 на предмет их антагонистической активности in vitro в отношении GIPR
Клетки CHO-DHFR, стабильно экспрессирующие GIPR человека, высевали по 30000 клеток на лунку в 96-луночные планшеты для культивирования клеток, помещенные в инкубатор при 37°C, 5% CO2 на ночь. На следующий день надосадочную жидкость удаляли и добавляли надосадочную жидкость гибридомы или серийно разбавленное антитело в количестве 45 мкл/лунка. Клетки оставляли при комнатной температуре на 30 мин, затем добавляли пептид GIP (Phoenix Pharmaceuticals, 50 пМ) при 45 мкл/лунка. Затем 96-луночный планшет помещали в инкубатор при 37°C, 5% CO2 на 30 минут, добавляли 10 мкл/лунка 10% Triton X-100 для лизирования клеток при комнатной температуре и лизат однородно смешивали пипеткой. Набор для цАМФ (CisBio) использовали для выявления цАМФ, продуцируемого в эксперименте. Переносили 10 мкл/лунка вышеупомянутого клеточного лизата в белый 384-луночный планшет, добавляли 5 мкл/лунка разбавленного 1:20 цАМФ-d2, и в конце добавляли 5 мкл/лунка разбавленного 1:20 антитела к цAMФ-Eu3±криптат, и планшет инкубировали при комнатной температуре в течение 1 ч. Соотношение сигналов флуоресценции с временным разрешением 665 нм/620 нм считывали на устройстве для считывания микропланшетов Envision 2103, а затем использовали Prism5.0 для расчета значения IC50. На фигуре 2 показано, что L7H6 антагонизирует GIPR с IC50=7,6 нМ. На фигуре 3 показано, что GLP-1-линкер-L7H6 антагонизирует GIPR с IC50=14,9 нМ.
12. Анализ с репортерным геном для тестирования слитого белка антитела к hGIPR/GLP-1 на предмет его in vitro активации GLP-1R
Клетки CHO-DHFR-, совместно экспрессирующие hGLP1R и CRE-люциферазу, высевали в 96-луночный планшет для культивирования клеток при 20000 клеток на лунку и культивировали при 37°C в течение ночи. На следующий день культуральную надосадочную жидкость удаляли. Клетки дважды промывали бессывороточной средой и также удаляли остаточную жидкость. Затем добавляли 100 мкл бессывороточной среды, содержащей серийно разбавленные антитела или GLP-1, и инкубировали при 37°C в течение 4 ч. После стимуляции добавляли 100 мкл хемилюминесцентного субстрата Bright Glo (Promega). Наконец, клеточные лизаты переносили в белый 96-луночный планшет и относительную интенсивность света регистрировали на устройстве для считывания микропланшетов SpectraMax L (Molecular Devices). На фигуре 4 показано, что GLP-1-линкер-L7H6 активирует hGLP-1R с EC50=0,04 нМ.
13. Исследование in vivo эффективности антитела к hGIPR у мышей C57BL/6 с ожирением, вызванным рационом с высоким содержанием жиров
Создавали модель ожирения у мышей C57BL/6 (мыши DIO), вызванного рационом с высоким содержанием жиров 60%. После того, как мышей приобретали и кормили нормальным рационом в течение недели, случайно выбирали определенное количество мышей в качестве нормальной контрольной группы для получения обычного для мышей рациона, а остальных животных кормили рационом с высоким содержанием жиров. Всех животных кормили непрерывно в течение 8 недель, а массу тела и потребление пищи оценивали один раз в неделю. Впоследствии мышей, получавших рацион с высоким содержанием жиров, случайно делили на получавшую L10H8 (10 мг/кг) группу и модельную группу в соответствии с их массой тела. Лекарственные средства вводили подкожно каждые два дня в течение 6 недель. Нормальной контрольной группе не вводили, а модельная группа получала такое же количество пустого состава. Данные о массе тела, потреблении пищи и наблюдении поведения собирали на протяжении периода эксперимента. В последний день эксперимента после 12 ч. голодания (свободный доступ к воде) у животного собирали орбитальную кровь для отделения сыворотки крови, а затем подвергали эвтаназии, печень иссекали, взвешивали и рассматривали морфологию печени. Тестировали уровни ALT, AST, GLU, TC и TG в сыворотке крови и TG в печени (см. результаты в таблице 3).
Примечание: средние значения ± SEM, по сравнению с модельной группой, *P < 0,05, **P < 0,01; индекс печени=масса печени/масса тела*100.
После 6 недель введения L10H8 прибавка массы в получавшей L10H8 группе была лишь немного ниже, чем у модельной группы, но масса печени была значительно ниже, чем у модельной группы, и близка к массе нормальной контрольной группы. Уровень TG в печени получавшей L10H8 группе был значительно ниже, чем у модельной группы, а уровень TG в сыворотке крови был значительно выше, чем у модельной группы. Эти результаты показывают, что L10H8 значительно замедляет всасывание и накопление жира в печени. На фигуре 5 показан процент изменения массы тела в каждой группе. В таблице 3 кратко описаны аналитические данные печени в каждой группе после получения антитела L10H8 в течение 6 недель.
14. Фармакокинетическое исследование слитого белка антитела к GIPR/GLP-1 у яванских макаков
Всего 6 яванского макаков (3 самца и 3 самки) получали однократную подкожную инъекцию слитого белка GLP-1/антитело к hGIPR в дозе 2 мг/кг, и у каждого собирали образец цельной крови 0,6 мл перед введением (0 мин.), через 2 ч., 4 ч., 8 ч., 12 ч., 24 ч., 2 д., 4 д., 6 д., 8 д., 10 д., 12 д., 18 д., 28 д. после введения через вену передних конечностей на той же стороне тела, что и участок введения, и помещали в центрифужную пробирку на лед, затем после естественной коагуляции образцы крови центрифугировали для отделения сыворотки крови и хранили при низкой температуре (-80°C) до применения. Часть, представляющая собой GLP-1, и часть, представляющая собой антитело к hGIPR, слитого белка GLP-1/антитело к hGIPR в образцах сыворотки количественно определяли отдельно с помощью ELISA и определяли период полужизни обоих у яванского макака анализом с помощью программного обеспечения.
15. In vivo исследование эффективности слитого белка антитела к hGIPR/GLP-1 у яванских макаков на рационе с высоким содержанием жиров
Создавали модель яванских макаков (яванский макак DIO) с ожирением, вызванным рационом с высоким содержанием жиров 60%, а затем использовали для оценки in vivo эффективности GLP-1-линкер-L7H6 путем подкожного введения. Обезьян на рационе с высоким содержанием жиров случайно делили на получавшую GLP-1-линкер-L7H6 (10 мг/кг) группу и модельную группу в соответствии с их массой тела. Лекарственное средство вводили подкожно каждые два дня общей сложностью в течение 8 недель, а модельная группа получала равный объем пустого состава. Данные о массе тела, потреблении пищи и наблюдении поведения собирали на протяжении периода эксперимента. После завершения эксперимента животных подвергали эвтаназии, печень иссекали, взвешивали и рассматривали морфологию печени. Тестировали уровни ALT, AST, GLU, TC и TG в сыворотке крови и TG в печени.
Вышеупомянутые варианты осуществления предназначены для полного раскрытия и объяснения того, как рядовому специалисту в данной области создавать и применять заявленные варианты осуществления, и они не предназначены для ограничения объема настоящего изобретения. Модификации, очевидные для специалистов в данной области, входят в объем формулы изобретения в настоящей заявке. Все публикации, патенты и заявки на патенты, цитируемые в описаниях, включены в настоящий документ в качестве ссылок, так же как если бы каждая из них была отдельно и независимо включена в качестве ссылки.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Gmax Biopharm LLC.
<120> АНТИТЕЛО К GIPR И ЕГО СЛИТЫЙ С GLP-1 БЕЛОК, А ТАКЖЕ ФАРМАЦЕВТИЧЕСКАЯ
КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ И ЕГО ПРИМЕНЕНИЕ
<130> 2018
<160> 124
<170> PatentIn версия 3.5
<210> 1
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 1
Lys Ala Ser Gln Asp Val Gly Thr Ala Val Ala
1 5 10
<210> 2
<211> 7
<212> БЕЛОК
<213> Mus musculus
<400> 2
Trp Ala Tyr Ile Arg His Thr
1 5
<210> 3
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 3
Gln Gln Tyr Ser Ser Tyr Pro Trp Thr
1 5
<210> 4
<211> 15
<212> БЕЛОК
<213> Mus musculus
<400> 4
Arg Pro Ser Glu Ser Val Asp Ser Tyr Gly Asn Ser Phe Met His
1 5 10 15
<210> 5
<211> 7
<212> БЕЛОК
<213> Mus musculus
<400> 5
Leu Ala Ser Asn Leu Glu Ser
1 5
<210> 6
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 6
Gln Gln Asn Asn Glu Asp Pro Arg Thr
1 5
<210> 7
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 7
Lys Ala Ser Glu Asp Ile Tyr Asn Arg Phe Ala
1 5 10
<210> 8
<211> 7
<212> БЕЛОК
<213> Mus musculus
<400> 8
Asp Ala Thr Ser Leu Glu Thr
1 5
<210> 9
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 9
Gln Gln Tyr Trp Ser Ile Pro Trp Thr
1 5
<210> 10
<211> 15
<212> БЕЛОК
<213> Mus musculus
<400> 10
Arg Ala Ser Gln Ser Val Asn Thr Ser Val Tyr Ser Tyr Ile His
1 5 10 15
<210> 11
<211> 7
<212> БЕЛОК
<213> Mus musculus
<400> 11
Tyr Ala Ser Asn Leu Glu Ser
1 5
<210> 12
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 12
Gln His Ser Trp Asp Phe Pro Tyr Thr
1 5
<210> 13
<211> 15
<212> БЕЛОК
<213> Mus musculus
<400> 13
Arg Ala Ser Gln Ser Val Asn Thr Ala Val Tyr Ser Tyr Ile His
1 5 10 15
<210> 14
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 14
Gln His Ser Phe Asp Phe Pro Tyr Thr
1 5
<210> 15
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 15
Lys Ala Ser Gln Asp Ile Asn Ser Tyr Leu Ser
1 5 10
<210> 16
<211> 6
<212> БЕЛОК
<213> Mus musculus
<400> 16
Ala Asn Arg Leu Val Asp
1 5
<210> 17
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 17
Leu Gln Tyr Asp Glu Phe Pro Phe Thr
1 5
<210> 18
<211> 10
<212> БЕЛОК
<213> Mus musculus
<400> 18
Gly Phe Thr Phe Ser Ser Tyr Ala Met Ser
1 5 10
<210> 19
<211> 16
<212> БЕЛОК
<213> Mus musculus
<400> 19
Ser Ile Ser Ser Gly Gly Ala Thr Tyr Tyr Pro Asp Ser Val Lys Gly
1 5 10 15
<210> 20
<211> 13
<212> БЕЛОК
<213> Mus musculus
<400> 20
Gly Glu Gly Gly Ser Ser Tyr Pro Ala Trp Phe Ala Phe
1 5 10
<210> 21
<211> 17
<212> БЕЛОК
<213> Mus musculus
<400> 21
Glu Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Pro Asp Thr Val Thr
1 5 10 15
Gly
<210> 22
<211> 17
<212> БЕЛОК
<213> Mus musculus
<400> 22
Asp Lys Ala Thr Arg Thr Gly Met Gly Phe Phe Tyr His Thr Met Asp
1 5 10 15
Tyr
<210> 23
<211> 10
<212> БЕЛОК
<213> Mus musculus
<400> 23
Gly Tyr Thr Phe Ser Arg Tyr Trp Ile Glu
1 5 10
<210> 24
<211> 16
<212> БЕЛОК
<213> Mus musculus
<400> 24
Glu Ile Leu Pro Gly Ser Asp Ser Pro Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
<210> 25
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 25
Thr Val Val Ala Thr Arg Phe Ala Tyr
1 5
<210> 26
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 26
Gly Tyr Ser Ile Thr Ser Asp Tyr Ala Trp Asn
1 5 10
<210> 27
<211> 16
<212> БЕЛОК
<213> Mus musculus
<400> 27
Tyr Ile Ser Tyr Arg Gly Ile Ala Thr Tyr Lys Pro Ser Leu Lys Ser
1 5 10 15
<210> 28
<211> 10
<212> БЕЛОК
<213> Mus musculus
<400> 28
Gly Glu Tyr Gly Pro Gly Asn Phe Asp Phe
1 5 10
<210> 29
<211> 16
<212> БЕЛОК
<213> Mus musculus
<400> 29
Tyr Met Ser Tyr Arg Gly Thr Ala Thr Tyr Asn Pro Phe Leu Lys Ser
1 5 10 15
<210> 30
<211> 10
<212> БЕЛОК
<213> Mus musculus
<400> 30
Tyr Asp Tyr Asp Val Pro Arg Phe Pro Tyr
1 5 10
<210> 31
<211> 33
<212> ДНК
<213> Mus musculus
<400> 31
aaggccagtc aggatgtggg tactgctgta gcc 33
<210> 32
<211> 21
<212> ДНК
<213> Mus musculus
<400> 32
tgggcataca tccggcacac t 21
<210> 33
<211> 27
<212> ДНК
<213> Mus musculus
<400> 33
cagcaatata gcagctatcc gtggacg 27
<210> 34
<211> 45
<212> ДНК
<213> Mus musculus
<400> 34
agacccagtg aaagtgttga tagttatggc aatagtttta tgcac 45
<210> 35
<211> 21
<212> ДНК
<213> Mus musculus
<400> 35
cttgcatcca acctagaatc t 21
<210> 36
<211> 27
<212> ДНК
<213> Mus musculus
<400> 36
cagcaaaata atgaggatcc tcggacg 27
<210> 37
<211> 33
<212> ДНК
<213> Mus musculus
<400> 37
aaggcaagtg aggacatata taatcggttc gcc 33
<210> 38
<211> 21
<212> ДНК
<213> Mus musculus
<400> 38
gatgcaacca gtttggaaac t 21
<210> 39
<211> 27
<212> ДНК
<213> Mus musculus
<400> 39
caacagtatt ggagtattcc gtggacg 27
<210> 40
<211> 45
<212> ДНК
<213> Mus musculus
<400> 40
agggccagcc aaagtgtcaa tacatctgtc tatagttata tacac 45
<210> 41
<211> 21
<212> ДНК
<213> Mus musculus
<400> 41
tatgcatcca acctagaatc t 21
<210> 42
<211> 27
<212> ДНК
<213> Mus musculus
<400> 42
caacacagtt gggattttcc ttacacg 27
<210> 43
<211> 45
<212> ДНК
<213> Mus musculus
<400> 43
agagccagcc agtccgtgaa cacagccgtg tactcttata tccac 45
<210> 44
<211> 27
<212> ДНК
<213> Mus musculus
<400> 44
cagcacagct tcgatttccc ctacacc 27
<210> 45
<211> 33
<212> ДНК
<213> Mus musculus
<400> 45
aaggcgagtc aggacattaa tagctattta agc 33
<210> 46
<211> 18
<212> ДНК
<213> Mus musculus
<400> 46
gcaaacagat tggtagat 18
<210> 47
<211> 27
<212> ДНК
<213> Mus musculus
<400> 47
ctacagtatg atgagtttcc attcacg 27
<210> 48
<211> 30
<212> ДНК
<213> Mus musculus
<400> 48
ggattcactt tcagtagcta tgccatgtct 30
<210> 49
<211> 45
<212> ДНК
<213> Mus musculus
<400> 49
tccattagta gtggtggtgc cacctactat ccagacagtg tgaag 45
<210> 50
<211> 39
<212> ДНК
<213> Mus musculus
<400> 50
ggcgagggcg gtagtagcta cccggcctgg tttgctttc 39
<210> 51
<211> 51
<212> ДНК
<213> Mus musculus
<400> 51
gaaattagta gtggtggtag ttacacctac tatccagaca ctgtgacggg c 51
<210> 52
<211> 51
<212> ДНК
<213> Mus musculus
<400> 52
gataaggcga ctcgaactgg catgggattt ttttaccata ctatggacta c 51
<210> 53
<211> 30
<212> ДНК
<213> Mus musculus
<400> 53
ggctacacat tcagtaggta ctggatagag 30
<210> 54
<211> 51
<212> ДНК
<213> Mus musculus
<400> 54
gagattttac ctggaagtga tagtcctaac tacaatgaga agttcaaggg c 51
<210> 55
<211> 27
<212> ДНК
<213> Mus musculus
<400> 55
acggtagtag ctacaaggtt tgcttac 27
<210> 56
<211> 33
<212> ДНК
<213> Mus musculus
<400> 56
ggctactcaa tcaccagtga ttatgcctgg aac 33
<210> 57
<211> 48
<212> ДНК
<213> Mus musculus
<400> 57
tacataagct acagaggcat cgctacctat aaaccatctc tcaaaagt 48
<210> 58
<211> 30
<212> ДНК
<213> Mus musculus
<400> 58
ggggaatacg gccccggcaa ctttgacttc 30
<210> 59
<211> 48
<212> ДНК
<213> Mus musculus
<400> 59
tacatgagct accgtggtac cgcaacgtac aatccatttc tcaaaagt 48
<210> 60
<211> 30
<212> ДНК
<213> Mus musculus
<400> 60
tatgattacg acgttccccg gtttccttac 30
<210> 61
<211> 108
<212> БЕЛОК
<213> Mus musculus
<400> 61
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Asn Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Tyr Ile Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Thr Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 62
<211> 112
<212> БЕЛОК
<213> Mus musculus
<400> 62
Asn Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Pro Ser Glu Ser Val Asp Ser Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Ala Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 63
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 63
Asn Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Gln Arg Ala Thr Ile Thr Cys Arg Pro Ser Glu Ser Val Asp Ser Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Asn Asp Thr Ala Asn Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Arg Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
<210> 64
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 64
Asn Ile Val Leu Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Pro Ser Glu Ser Val Asp Ser Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Arg Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
<210> 65
<211> 108
<212> БЕЛОК
<213> Mus musculus
<400> 65
Asp Ile Gln Met Thr Gln Ser Ser Ser Ser Phe Ser Val Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Glu Asp Ile Tyr Asn Arg
20 25 30
Phe Ala Trp Phe Gln Gln Lys Pro Gly Asn Ala Pro Arg Leu Leu Ile
35 40 45
Ser Asp Ala Thr Ser Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Lys Asp Tyr Thr Leu Ser Ile Thr Ser Leu Gln Thr
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Gln Tyr Trp Ser Ile Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 66
<211> 112
<212> БЕЛОК
<213> Mus musculus
<400> 66
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Gly Thr Ile Ser Cys Arg Ala Ser Gln Ser Val Asn Thr Ser
20 25 30
Val Tyr Ser Tyr Ile His Trp Tyr Arg Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Lys Tyr Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Gly Glu Asp Ser Ala Thr Tyr Tyr Cys Gln His Ser Trp
85 90 95
Asp Phe Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 67
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 67
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Gln Arg Ala Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Asn Thr Ala
20 25 30
Val Tyr Ser Tyr Ile His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Lys Tyr Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Asn Asp Ala Ala Asn Tyr Tyr Cys Gln His Ser Phe
85 90 95
Asp Phe Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
<210> 68
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 68
Asp Ile Val Leu Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Gln Ser Val Asn Thr Ser
20 25 30
Val Tyr Ser Tyr Ile His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Lys Tyr Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Asp Phe Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
<210> 69
<211> 108
<212> БЕЛОК
<213> Mus musculus
<400> 69
Asp Ile Lys Met Thr Gln Ser Pro Ser Ser Val Tyr Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Ser Tyr
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Lys Ser Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Val Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Gln Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Tyr
65 70 75 80
Glu Asp Met Gly Ile Tyr Tyr Cys Leu Gln Tyr Asp Glu Phe Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Met Lys Arg
100 105
<210> 70
<211> 110
<212> БЕЛОК
<213> Homo sapiens
<400> 70
Ser Tyr Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Ala Ile Ser Cys Ser Gly Ser Asn Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val His Trp Tyr Gln Gln Leu Pro Gly Ala Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Asn Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Arg Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Val Val Phe Gly Gly Gly Thr Lys Val Thr Val Leu
100 105 110
<210> 71
<211> 110
<212> БЕЛОК
<213> Homo sapiens
<400> 71
Ser Tyr Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Ala Ile Ser Cys Ser Gly Ser Asn Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val His Trp Tyr Gln Gln Leu Pro Gly Ala Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asn Asp Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Asn Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Arg Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Val Val Phe Gly Gly Gly Thr Lys Val Thr Val Leu
100 105 110
<210> 72
<211> 121
<212> БЕЛОК
<213> Mus musculus
<400> 72
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Leu Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Ser Ile Ser Ser Gly Gly Ala Thr Tyr Tyr Pro Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Phe Ser Arg Asp Asn Ala Arg Asn Ile Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys Thr
85 90 95
Arg Gly Glu Gly Gly Ser Ser Tyr Pro Ala Trp Phe Ala Phe Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ala
115 120
<210> 73
<211> 126
<212> БЕЛОК
<213> Mus musculus
<400> 73
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ser Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Glu Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Thr Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Glu Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Val Arg Asp Lys Ala Thr Arg Thr Gly Met Gly Phe Phe Tyr His Thr
100 105 110
Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120 125
<210> 74
<211> 126
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 74
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Thr Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Lys Ala Thr Arg Thr Gly Met Gly Phe Phe Tyr His Thr
100 105 110
Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 75
<211> 118
<212> БЕЛОК
<213> Mus musculus
<400> 75
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Met Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Thr Gly Tyr Thr Phe Ser Arg Tyr
20 25 30
Trp Ile Glu Trp Ile Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Leu Pro Gly Ser Asp Ser Pro Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Phe Thr Ala Asn Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Phe Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Val Val Ala Thr Arg Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Phe Ala
115
<210> 76
<211> 119
<212> БЕЛОК
<213> Mus musculus
<400> 76
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Val Glu Trp
35 40 45
Met Gly Tyr Ile Ser Tyr Arg Gly Ile Ala Thr Tyr Lys Pro Ser Leu
50 55 60
Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Asn Phe Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Val Arg Gly Glu Tyr Gly Pro Gly Asn Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 77
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 77
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Val Glu Trp
35 40 45
Met Gly Tyr Ile Ser Tyr Arg Gly Ile Ala Thr Tyr Lys Pro Ser Leu
50 55 60
Lys Ser Arg Ile Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Gly Glu Tyr Gly Pro Gly Asn Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 78
<211> 119
<212> БЕЛОК
<213> Mus musculus
<400> 78
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Met Ser Tyr Arg Gly Thr Ala Thr Tyr Asn Pro Phe Leu
50 55 60
Lys Ser Arg Ile Ser Ile Asn Arg Asp Thr Ser Lys Asn Gln Val Phe
65 70 75 80
Leu Lys Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Ser Tyr Asp Tyr Asp Val Pro Arg Phe Pro Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Ile Val Ser Ala
115
<210> 79
<211> 119
<212> БЕЛОК
<213> Homo sapiens
<400> 79
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Thr Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Gln Gly Pro Ile Val Gly Ala Pro Thr Asp Tyr Trp Gly Lys Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 80
<211> 119
<212> БЕЛОК
<213> Homo sapiens
<400> 80
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Lys Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Thr Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Gln Gly Pro Ile Val Gly Ala Pro Thr Asp Tyr Trp Gly Lys Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 81
<211> 324
<212> ДНК
<213> Mus musculus
<400> 81
gacattgtga tgacccagtc tcacaaattc atgtccacat cagtaggaga cagggtcaac 60
atcacctgca aggccagtca ggatgtgggt actgctgtag cctggtatca acagaaacca 120
gggcaatctc ctaaactact gatttactgg gcatacatcc ggcacactgg agtccctgat 180
cgcttcacag gcagtggatc tgggacagat ttcactctca ccattagcaa tgtgcagtct 240
gaagacttga cagattattt ctgtcagcaa tatagcagct atccgtggac gttcggtgga 300
ggcaccaagc tggaaatcaa acgg 324
<210> 82
<211> 336
<212> ДНК
<213> Mus musculus
<400> 82
aacattgtgc tgacccaatc tccagcttct ttggctgtgt ctctagggca gagggccacc 60
atatcctgca gacccagtga aagtgttgat agttatggca atagttttat gcactggtac 120
cagcagaaac caggacagcc acccaaactc ctcatctatc ttgcatccaa cctagaatct 180
ggggtccctg ccaggttcag tggcagtggg tctgggacag acttcaccct caccattgat 240
cctgtggagg ctgatgatgc tgcaacctat tactgtcagc aaaataatga ggatcctcgg 300
acgttcggtg gaggcaccaa gctggaaatc aaacgg 336
<210> 83
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 83
aatatcgtgc tgacccagtc tccagccagc ctggccgtgt ctccaggaca gagggccacc 60
atcacatgca gacctagcga gtccgtggat tcctacggca actctttcat gcactggtat 120
cagcagaagc ccggccagcc ccctaagctg ctgatctacc tggccagcaa tctggagtcc 180
ggagtgcctg caaggttctc tggaagcgga tccggaaccg actttaccct gacaatcaac 240
ccagtggagg ccaacgatac agccaattac tattgtcagc agaacaatga ggacccacgg 300
acctttggcg gaggaacaaa ggtggagatc aagcgt 336
<210> 84
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 84
aacatcgtgc tgacccagtc cccagactct ctggccgtgt ccctgggaga gagggccaca 60
atcaactgca gaccctctga gagcgtggat agctacggca attccttcat gcactggtat 120
cagcagaagc ctggccagcc ccctaagctg ctgatctacc tggcctctaa tctggagagc 180
ggcgtgccag acaggttctc cggatctgga agcggaaccg acttcaccct gacaatcagc 240
tccctgcagg cagaggacgt ggccgtgtac tattgtcagc agaacaatga ggatccccgg 300
acctttggcg gcggcacaaa ggtggagatc aagcgt 336
<210> 85
<211> 324
<212> ДНК
<213> Mus musculus
<400> 85
gacatccaga tgacacaatc ttcatcctcc ttttctgtat ctctaggaga cagagtcacc 60
attacttgca aggcaagtga ggacatatat aatcggttcg cctggtttca gcagaaacca 120
ggaaatgctc ctaggctctt aatatctgat gcaaccagtt tggaaactgg ggttccttca 180
agattcagtg gcagtggatc tggaaaggat tacactctca gcattaccag tcttcagact 240
gaagatgttg ctacttatta ctgtcaacag tattggagta ttccgtggac gttcggtgga 300
ggcaccaagc tggaaatcaa acgg 324
<210> 86
<211> 336
<212> ДНК
<213> Mus musculus
<400> 86
gacattgtgc tgacacagtc tcctgcttcc ttagctgtat ctctggggca gaggggcacc 60
atctcatgca gggccagcca aagtgtcaat acatctgtct atagttatat acactggtac 120
cggcagaaac caggtcagcc acccaaactc ctcatcaagt atgcatccaa cctagaatct 180
ggggtccctg ccaggttcag tggcagtggg tctgggacag acttcaccct caacatccat 240
cctgtggagg gggaggattc cgcaacatac tactgtcaac acagttggga ttttccttac 300
acgttcggag gggggaccaa gctggaaata aaacgg 336
<210> 87
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 87
gacatcgtgc tgacccagtc tccagccagc ctggccgtgt ctccaggaca gagggccacc 60
atcacatgca gagccagcca gtccgtgaac acagccgtgt actcttatat ccactggtac 120
cagcagaagc ctggccagcc ccctaagctg ctgatcaagt atgccagcaa cctggagtcc 180
ggagtgcctg cacggttctc tggaagcgga tccggaaccg acttcaccct gacaatcaat 240
ccagtggagg ccaacgacgc cgccaattac tattgtcagc acagcttcga tttcccctac 300
acctttggcg gcggcacaaa ggtggagatc aagcgt 336
<210> 88
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 88
gacatcgtgc tgacccagtc ccctgattct ctggccgtgt ccctgggaga gagggcaacc 60
atcaactgca gagcctctca gagcgtgaat acaagcgtgt actcctatat ccactggtac 120
cagcagaagc caggccagcc ccctaagctg ctgatcaagt atgcctctaa cctggagagc 180
ggagtgccag accggttctc cggctctggc agcggcacag acttcaccct gacaatcagc 240
tccctgcagg cagaggacgt ggccgtgtac tattgtcagc actcttggga tttcccctac 300
acctttggcg gcggcacaaa ggtggagatc aagcgt 336
<210> 89
<211> 324
<212> ДНК
<213> Mus musculus
<400> 89
gacatcaaga tgacccagtc tccatcttcc gtgtatgcat ctctaggaga gagagtcact 60
atcacttgca aggcgagtca ggacattaat agctatttaa gctggttcca gcagaaacca 120
gggaaatctc ctaagaccct gatctatcgt gcaaacagat tggtagatgg ggtcccatca 180
aggttcagtg gcagtggatc tgggcaagat tattctctca ccatcagcag cctggagtat 240
gaagatatgg gaatttatta ttgtctacag tatgatgagt ttccattcac gttcggctcg 300
gggacaaagt tggaaatgaa acgg 324
<210> 90
<211> 330
<212> ДНК
<213> Homo sapiens
<400> 90
agctacgtgc tgacccagcc acctagcgcc tccggaacac caggccagag ggtggccatc 60
tcttgcagcg gctccaactc taatatcggc tccaacaccg tgcactggta ccagcagctg 120
ccaggagcag cacccaagct gctgatctat tccaacaatc agcggccttc tggcgtgcca 180
gacagattca gcggctccaa ctctggcaca agcgcctccc tggccatctc tcggctgcag 240
agcgaggacg aggccgatta ctattgtgcc gcctgggacg attctctgaa tggcgtggtg 300
tttggcggcg gcaccaaggt gacagtgctg 330
<210> 91
<211> 330
<212> ДНК
<213> Homo sapiens
<400> 91
agctacgtgc tgacccagcc acctagcgcc tccggaacac caggccagag ggtggccatc 60
tcttgcagcg gctccaactc taatatcggc tccaacaccg tgcactggta tcagcagctg 120
ccaggagcag cacccaagct gctgatctat ggcaacaatg atcggccttc tggcgtgcca 180
gacagattca gcggctccaa ctctggcaca agcgcctccc tggccatctc tcggctgcag 240
agcgaggacg aggccgatta ctattgtgcc gcctgggacg attctctgaa tggcgtggtg 300
tttggcggcg gtaccaaggt gacagtgctg 330
<210> 92
<211> 363
<212> ДНК
<213> Mus musculus
<400> 92
gaagtgaagc tggtggagtc tgggggaggc ttagtgaagc ctggagggtc cctgaaactc 60
tcctgtgcag cctctggatt cactttcagt agctatgcca tgtcttgggt tcgcctgact 120
ccagaaaaaa ggctggagtg ggtcgcatcc attagtagtg gtggtgccac ctactatcca 180
gacagtgtga agggccgatt caccttctcc agagataatg ccaggaacat cctgtacctg 240
caaatgaaca gtctgaggtc tgaggacacg gccatgtatt actgtacaag aggcgagggc 300
ggtagtagct acccggcctg gtttgctttc tggggccaag ggactctggt cactgtctct 360
gca 363
<210> 93
<211> 378
<212> ДНК
<213> Mus musculus
<400> 93
gaagtgcagc tggtggagtc tgggggaggc ttagtgaagc ctggagggtc cctgaaactc 60
tcctgtgcag cctctggatt cactttcagt agctatgcca tgtcttgggt tcgccagtct 120
ccagagaaga ggctggagtg ggtcgcagaa attagtagtg gtggtagtta cacctactat 180
ccagacactg tgacgggccg attcaccatc tccagagaca atgccaagaa caccctgtac 240
ctggaaatga gcagtctgag gtctgaggac acggccatgt attactgtgt aagggataag 300
gcgactcgaa ctggcatggg atttttttac catactatgg actactgggg tcaaggaacc 360
tcagtcaccg tctcctca 378
<210> 94
<211> 378
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 94
gaggtgcagc tggtggagtc tggaggagga ctggtgaagc caggaggaag cctgaggctg 60
tcctgcgcag cctctggctt cacctttagc tcctacgcca tgagctgggt gaggcaggca 120
ccaggcaagg gactggagtg ggtggccgag atctctagcg gcggctccta cacctactat 180
cctgacaccg tgacaggccg gttcacaatc agcagagata acgccaagaa ttccctgtat 240
ctgcagatga actctctgcg ggccgaggac accgccgtgt actattgcgt gcgggataag 300
gccacccgca caggcatggg cttcttttac cacacaatgg actattgggg ccagggcacc 360
ctggtgacag tgtcctct 378
<210> 95
<211> 354
<212> ДНК
<213> Mus musculus
<400> 95
caggttcaac tgcagcagtc tggagctgag ctgatgaagc ctggggcctc agtgaagata 60
tcctgcaagg ctactggcta cacattcagt aggtactgga tagagtggat aaagcagagg 120
cctggacatg gccttgagtg gattggagag attttacctg gaagtgatag tcctaactac 180
aatgagaagt tcaagggcaa ggccacattc actgcaaata catcctccaa cacagcctac 240
atgcaactca gcagcctgac atttgaggac tctgccgtct attactgtgc aagaacggta 300
gtagctacaa ggtttgctta ctggggccaa gggactctgg tcactgtctt tgca 354
<210> 96
<211> 357
<212> ДНК
<213> Mus musculus
<400> 96
gatgtgcagc ttcaggagtc gggacctggc ctggtgaaac cttctcagtc tctgtccctc 60
acctgcactg tcactggcta ctcaatcacc agtgattatg cctggaactg gatccggcag 120
tttcctggaa acaaagtgga gtggatgggc tacataagct acagaggcat cgctacctat 180
aaaccatctc tcaaaagtcg aatctctatc actcgagaca catccaagaa ccagttcttc 240
ctgaacttta attctgtgac tactgaggac acagccacat attactgtgt aagaggggaa 300
tacggccccg gcaactttga cttctggggc caaggcacca ctctcacagt ctcctca 357
<210> 97
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 97
caggtgcagc tgcaggagtc cggaccagga ctggtgaagc caagccagac cctgtccctg 60
acctgcacag tgtccggcta ctctatcaca agcgattatg cctggaactg gatcaggcag 120
ccacctggca agggagtgga gtggatgggc tacatctcct atcgcggcat cgccacctac 180
aagccttccc tgaagtctcg gatcaccatc tctagagaca caagcaagaa ccagttctct 240
ctgaagctga gctccgtgac cgccgccgat acagccgtgt actattgcgt gcggggcgag 300
tatggccccg gcaatttcga cttttggggc cagggcacca cagtgacagt gtctagc 357
<210> 98
<211> 357
<212> ДНК
<213> Mus musculus
<400> 98
gatgtgcagc ttcaagagtc gggacctggc ctggtgaaac cttctcagtc tctgtccctc 60
acctgcactg tcactggcta ctcaatcacc agtgattatg cctggaactg gatccggcag 120
tttccaggaa acaaactgga gtggatgggc tacatgagct accgtggtac cgcaacgtac 180
aatccatttc tcaaaagtcg aatctctatc aatcgggaca catccaagaa ccaggtcttc 240
ctgaagttga attctgtgac tactgaggac acagccacat attactgtgc aagttatgat 300
tacgacgttc cccggtttcc ttactggggc caagggactc tggtcattgt ttctgca 357
<210> 99
<211> 357
<212> ДНК
<213> Homo sapiens
<400> 99
caggtgcagc tgcagcagag cggagcagag gtgaagaagc caggaagctc cgtgaaggtg 60
tcctgcaagg cctctggcgg caccttctct agctacgcca tctcctgggt gcggcaggca 120
ccaggacagg gactggagtg gatgggagga atcatcccca ccttcggcac agccaactac 180
gcccagaagt ttcagggccg ggtgaccatc acagccgacg agtctaccag cacagcctat 240
atggagctgt cctctctgag atctgaggat accgccgtgt actattgtgc acagggacca 300
atcgtgggag cacctacaga ctattggggc aagggcaccc tggtgacagt gagctcc 357
<210> 100
<211> 357
<212> ДНК
<213> Homo sapiens
<400> 100
caggtgcagc tgcagcagag cggagcagag gtgaagaagc caggaagctc cgtgaaggtg 60
tcctgcaagg cctctggcgg caccttcaag agctacgcca tctcctgggt gcggcaggca 120
ccaggacagg gactggagtg gatgggagga atcatcccca ccttcggcac agccaactac 180
gcccagaagt ttcagggccg ggtgaccatc acagccgacg agtctaccag cacagcctat 240
atggagctgt cctctctgag atctgaggat accgccgtgt actattgtgc acagggacca 300
atcgtgggag cacctacaga ctattggggc aagggcaccc tggtgacagt gagctcc 357
<210> 101
<211> 106
<212> БЕЛОК
<213> Homo sapiens
<400> 101
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
1 5 10 15
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
20 25 30
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
35 40 45
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
50 55 60
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
65 70 75 80
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
85 90 95
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 102
<211> 106
<212> БЕЛОК
<213> Homo sapiens
<400> 102
Gly Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser
1 5 10 15
Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp
20 25 30
Phe Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro
35 40 45
Val Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn
50 55 60
Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys
65 70 75 80
Ser His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val
85 90 95
Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 103
<211> 326
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ИНОЙ ПРИЗНАК
<222> (131)..(131)
<223> Xaa в положении 131 представляет собой Met или Tyr
<220>
<221> ИНОЙ ПРИЗНАК
<222> (133)..(133)
<223> Xaa в положении 133 представляет собой Ser или Thr
<220>
<221> ИНОЙ ПРИЗНАК
<222> (135)..(135)
<223> Xaa в положении 135 представляет собой Thr или Glu
<220>
<221> ИНОЙ ПРИЗНАК
<222> (307)..(307)
<223> Xaa в положении 307 представляет собой Met или Leu
<220>
<221> ИНОЙ ПРИЗНАК
<222> (313)..(313)
<223> Xaa в положении 313 представляет собой Asn или Ser
<220>
<221> ИНОЙ ПРИЗНАК
<222> (326)..(326)
<223> Xaa в положении 326 представляет собой Lys или отсутствует
<400> 103
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro
100 105 110
Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Xaa Ile Xaa Arg Xaa Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
165 170 175
Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
195 200 205
Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Xaa His Glu Ala Leu His Xaa His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Pro Gly Xaa
325
<210> 104
<211> 327
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ИНОЙ ПРИЗНАК
<222> (132)..(132)
<223> Xaa в положении 132 представляет собой Met или Tyr
<220>
<221> ИНОЙ ПРИЗНАК
<222> (134)..(134)
<223> Xaa в положении 134 представляет собой Ser или Thr
<220>
<221> ИНОЙ ПРИЗНАК
<222> (136)..(136)
<223> Xaa в положении 136 представляет собой Thr или Glu
<220>
<221> ИНОЙ ПРИЗНАК
<222> (308)..(308)
<223> Xaa в положении 308 представляет собой Met или Leu
<220>
<221> ИНОЙ ПРИЗНАК
<222> (314)..(314)
<223> Xaa в положении 314 представляет собой Asn или Ser
<220>
<221> ИНОЙ ПРИЗНАК
<222> (327)..(327)
<223> Xaa в положении 327 представляет собой Lys или отсутствует
<400> 104
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Xaa Ile Xaa Arg Xaa Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Xaa His Glu Ala Leu His Xaa His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Xaa
325
<210> 105
<211> 29
<212> БЕЛОК
<213> Homo sapiens
<400> 105
His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly
20 25
<210> 106
<211> 29
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 106
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly
20 25
<210> 107
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 107
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe
20
<210> 108
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 108
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile
20
<210> 109
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 109
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala
20
<210> 110
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 111
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 111
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 112
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 112
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<210> 113
<211> 466
<212> БЕЛОК
<213> Homo sapiens
<400> 113
Met Thr Thr Ser Pro Ile Leu Gln Leu Leu Leu Gly Leu Ser Leu Cys
1 5 10 15
Gly Leu Leu Leu Gln Arg Ala Glu Thr Gly Ser Lys Gly Gln Thr Ala
20 25 30
Gly Glu Leu Tyr Gln Arg Trp Glu Arg Tyr Arg Arg Glu Cys Gln Glu
35 40 45
Thr Leu Ala Ala Ala Glu Pro Pro Ser Gly Leu Ala Cys Asn Gly Ser
50 55 60
Phe Asp Met Tyr Val Cys Trp Asp Tyr Ala Ala Pro Asn Ala Thr Ala
65 70 75 80
Arg Ala Ser Cys Pro Trp Tyr Leu Pro Trp His His His Val Ala Ala
85 90 95
Gly Phe Val Leu Arg Gln Cys Arg Ser Asp Gly Gln Trp Gly Leu Trp
100 105 110
Arg Asp His Thr Gln Cys Glu Asn Pro Glu Lys Asn Glu Ala Phe Leu
115 120 125
Asp Gln Arg Leu Ile Leu Glu Arg Leu Gln Val Met Tyr Thr Val Gly
130 135 140
Tyr Ser Leu Ser Leu Ala Thr Leu Leu Leu Ala Leu Leu Ile Leu Ser
145 150 155 160
Leu Phe Arg Arg Leu His Cys Thr Arg Asn Tyr Ile His Ile Asn Leu
165 170 175
Phe Thr Ser Phe Met Leu Arg Ala Ala Ala Ile Leu Ser Arg Asp Arg
180 185 190
Leu Leu Pro Arg Pro Gly Pro Tyr Leu Gly Asp Gln Ala Leu Ala Leu
195 200 205
Trp Asn Gln Ala Leu Ala Ala Cys Arg Thr Ala Gln Ile Val Thr Gln
210 215 220
Tyr Cys Val Gly Ala Asn Tyr Thr Trp Leu Leu Val Glu Gly Val Tyr
225 230 235 240
Leu His Ser Leu Leu Val Leu Val Gly Gly Ser Glu Glu Gly His Phe
245 250 255
Arg Tyr Tyr Leu Leu Leu Gly Trp Gly Ala Pro Ala Leu Phe Val Ile
260 265 270
Pro Trp Val Ile Val Arg Tyr Leu Tyr Glu Asn Thr Gln Cys Trp Glu
275 280 285
Arg Asn Glu Val Lys Ala Ile Trp Trp Ile Ile Arg Thr Pro Ile Leu
290 295 300
Met Thr Ile Leu Ile Asn Phe Leu Ile Phe Ile Arg Ile Leu Gly Ile
305 310 315 320
Leu Leu Ser Lys Leu Arg Thr Arg Gln Met Arg Cys Arg Asp Tyr Arg
325 330 335
Val Arg Leu Ala Arg Ser Thr Leu Thr Leu Val Pro Leu Leu Gly Val
340 345 350
His Glu Val Val Phe Ala Pro Val Thr Glu Glu Gln Ala Arg Gly Ala
355 360 365
Leu Arg Phe Ala Lys Leu Gly Phe Glu Ile Phe Leu Ser Ser Phe Gln
370 375 380
Gly Phe Leu Val Ser Val Leu Tyr Cys Phe Ile Asn Lys Glu Val Gln
385 390 395 400
Ser Glu Ile Arg Arg Gly Trp His His Cys Arg Leu Arg Arg Ser Leu
405 410 415
Gly Glu Glu Gln Arg Gln Leu Pro Glu Arg Ala Phe Arg Ala Leu Pro
420 425 430
Ser Gly Ser Gly Pro Gly Glu Val Pro Thr Ser Arg Gly Leu Ser Ser
435 440 445
Gly Thr Leu Pro Gly Pro Gly Asn Glu Ala Ser Arg Glu Leu Glu Ser
450 455 460
Tyr Cys
465
<210> 114
<211> 1401
<212> ДНК
<213> Homo sapiens
<400> 114
atgactacct ctccgatcct gcagctgctg ctcgggctct cactgtgcgg gctgctgctc 60
cagagggcgg agacaggctc taaggggcag actgcggggg agctgtacca gcgctgggaa 120
cggtaccgca gggagtgcca ggagaccttg gcagccgcgg aaccgccttc aggcctcgcc 180
tgtaacgggt ccttcgatat gtacgtctgc tgggactatg ctgcacccaa tgccactgcc 240
cgtgcgtcct gcccctggta cctgccctgg caccaccatg tggctgcagg tttcgtcctc 300
cgccagtgtc ggagtgatgg ccaatgggga ctttggagag accatacaca atgtgagaac 360
ccagagaaga atgaggcctt tctggaccaa aggctcatct tggagcggtt gcaggtcatg 420
tacactgtcg gctactccct gtctctcgcc acactgctgc tagccctgct catcttgagt 480
ttgttcaggc ggctacattg cactagaaac tatatccaca tcaacctgtt cacgtctttc 540
atgctgcgag ctgcggccat tctcagccga gaccgtctgc tacctcgacc tggcccctac 600
cttggggacc aggcccttgc gctgtggaac caggccctcg ctgcctgccg cacggcccag 660
atcgtgaccc agtactgcgt gggtgccaac tacacgtggc tgctggtgga gggcgtctac 720
ctgcacagtc tcctggtgct cgtgggaggc tccgaggagg gccacttccg ctactacctg 780
ctcctcggct ggggggcccc cgcgcttttc gtcattccct gggtgatcgt caggtacctg 840
tacgagaaca cgcagtgctg ggagcgcaac gaagtcaagg ccatttggtg gattatacgg 900
acccccatcc tcatgaccat cttgattaat ttcctcattt ttatccgcat tcttggcatt 960
ctcctgtcca agctgaggac acggcaaatg cgctgccggg attaccgcgt gaggctggct 1020
cgctccacgc tgacgctggt gcccctgctg ggtgtccacg aggtggtgtt tgctcccgtg 1080
acagaggaac aggcccgggg cgccctgcgt ttcgccaagc tcggctttga gatcttcctc 1140
agctccttcc agggcttcct ggtcagcgtc ctctactgct tcatcaacaa ggaggtgcag 1200
tcggagatcc gccgtggctg gcaccactgc cgcctgcgcc gcagcctggg cgaggagcaa 1260
cgccagctcc cggagcgcgc cttccgggcc ctgccctccg gctccggccc gggcgaggtc 1320
cccaccagcc gcggcttgtc ctcggggacc ctcccagggc ctgggaatga ggccagccgg 1380
gagttggaaa gttactgcta g 1401
<210> 115
<211> 466
<212> БЕЛОК
<213> Macaca mulatta
<400> 115
Met Thr Thr Ser Pro Ile Leu Gln Leu Leu Leu Arg Leu Ser Leu Trp
1 5 10 15
Gly Leu Leu Leu Arg Arg Ala Glu Thr Gly Ser Glu Gly Gln Thr Ala
20 25 30
Gly Glu Leu Tyr Gln Arg Trp Glu Arg Tyr Arg Arg Glu Cys Gln Glu
35 40 45
Thr Leu Ala Thr Ala Glu Pro Pro Ser Gly Leu Ala Cys Asn Gly Ser
50 55 60
Phe Asp Met Tyr Val Cys Trp Asn Tyr Ala Ala Pro Asn Ala Thr Ala
65 70 75 80
Arg Ala Ser Cys Pro Trp Tyr Leu Pro Trp His His His Val Ala Ala
85 90 95
Gly Phe Val Leu Arg Gln Cys Gly Ser Asp Gly Gln Trp Gly Leu Trp
100 105 110
Arg Asp His Thr Gln Cys Glu Asn Pro Glu Lys Asn Glu Ala Phe Leu
115 120 125
Asp Gln Arg Leu Ile Leu Glu Arg Leu Gln Val Met Tyr Thr Val Gly
130 135 140
Tyr Ser Leu Ser Leu Ala Thr Leu Leu Leu Ala Leu Leu Ile Leu Ser
145 150 155 160
Leu Phe Arg Arg Leu His Cys Thr Arg Asn Tyr Ile His Ile Asn Leu
165 170 175
Phe Thr Ser Phe Thr Leu Arg Ala Ala Ala Ile Leu Ser Arg Asp Arg
180 185 190
Leu Leu Pro Arg Pro Gly Pro Tyr Leu Gly Asp Gln Ala Leu Val Leu
195 200 205
Trp Asn Gln Ala Leu Ala Ala Cys Arg Thr Ala Gln Ile Val Thr Gln
210 215 220
Tyr Cys Val Gly Ala Asn Tyr Thr Trp Leu Leu Val Glu Gly Val Tyr
225 230 235 240
Leu His Ser Leu Leu Val Ile Val Gly Gly Ser Glu Glu Gly His Phe
245 250 255
Arg Tyr Tyr Leu Leu Leu Gly Trp Gly Ala Pro Ala Leu Phe Val Ile
260 265 270
Pro Trp Val Ile Val Arg Tyr Leu Tyr Glu Asn Thr Gln Cys Trp Glu
275 280 285
Arg Asn Glu Val Lys Ala Ile Trp Trp Ile Ile Arg Thr Pro Ile Leu
290 295 300
Met Thr Ile Leu Ile Asn Phe Leu Ile Phe Ile Arg Ile Leu Gly Ile
305 310 315 320
Leu Leu Ser Lys Leu Arg Thr Arg Gln Met Arg Cys Arg Asp Tyr Arg
325 330 335
Leu Arg Leu Ala Arg Ser Thr Leu Thr Leu Val Pro Leu Leu Gly Val
340 345 350
His Glu Val Val Phe Ala Pro Val Thr Glu Glu Gln Ala Arg Gly Ala
355 360 365
Leu Arg Phe Ala Lys Leu Gly Phe Glu Ile Phe Leu Ser Ser Phe Gln
370 375 380
Gly Leu Leu Val Ser Val Leu Tyr Cys Phe Ile Asn Lys Glu Val Gln
385 390 395 400
Ser Glu Ile Arg Arg Gly Trp His His Cys Arg Leu Arg Arg Ser Leu
405 410 415
Gly Glu Glu Gln Arg Gln Leu Pro Glu Arg Ala Phe Arg Ala Leu Pro
420 425 430
Ser Gly Ser Gly Pro Gly Glu Val Pro Thr Gly Arg Gly Leu Ser Ser
435 440 445
Gly Thr Leu Pro Gly Pro Gly Asn Glu Ala Arg Arg Val Leu Glu Ser
450 455 460
Tyr Cys
465
<210> 116
<211> 1398
<212> ДНК
<213> Macaca mulatta
<400> 116
atgactacct ctccgatcct gcagttgctg ttgcggctct cactgtgggg gctgctgctc 60
cggagggcgg agacaggctc tgaggggcag acggcggggg agctgtacca gcgctgggaa 120
cggtaccgca gggagtgcca ggagaccttg gcaaccgcgg aaccaccttc aggcctcgcc 180
tgtaacgggt ccttcgatat gtacgtctgc tggaactatg ctgcacccaa cgccactgcc 240
cgtgcctcct gcccctggta cctgccctgg caccaccacg tggctgcagg tttcgtcctc 300
cgccagtgtg gcagtgatgg ccagtgggga ctttggagag accacacaca atgtgagaac 360
ccagagaaga atgaggcctt tctggaccaa aggctcatct tggagcggct gcaggtcatg 420
tacaccgtcg gctactccct gtctctcgcc acactgctgc tagccctgct catcttgagc 480
ttgttcaggc gactacattg cactagaaac tatatccaca tcaacctgtt cacgtctttc 540
acactgcgag cggcggcgat tctcagccgg gaccgtctac tgcctcgacc tggcccctac 600
cttggggacc aggcccttgt gctgtggaac caggccctcg ctgcctgccg cacggcccag 660
atcgtgaccc agtactgcgt gggtgccaac tacacgtggc tgctggtgga gggcgtctac 720
ttgcacagtc tcctggtgat cgtgggaggc tccgaggagg gtcacttccg ctactacctg 780
ctcctcggct ggggggcccc cgcgcttttc gtcattccct gggtgatcgt caggtacctg 840
tacgagaaca cgcagtgctg ggagcgcaac gaagtcaagg ccatttggtg gattatacgg 900
acccccatcc tcatgaccat cttgattaat ttcctcattt ttatccgcat tcttggcatt 960
ctcctgtcca agctgaggac acggcaaatg cgctgccggg attaccggct gaggctggct 1020
cgctccacgc tgacgctggt gcccctgctg ggtgtccacg aggtggtgtt tgctcccgtg 1080
accgaggaac aggcccgggg cgccctgcgc ttcgccaagc tcggctttga gatcttcctc 1140
agctctttcc agggcttgct ggtcagcgtc ctctactgct tcatcaacaa ggaggtgcag 1200
tcggagatcc gccgtggctg gcaccactgc cgcctgcgcc gcagcctggg cgaggagcag 1260
cggcagctcc cggagcgcgc cttccgggcc ctgccctccg gctccggccc cggcgaggtc 1320
cccaccggcc gcggcttgtc ttcggggacc ctcccagggc ctgggaatga ggccagacgg 1380
gtgttggaaa gttactgc 1398
<210> 117
<211> 460
<212> БЕЛОК
<213> Mus musculus
<400> 117
Met Pro Leu Arg Leu Leu Leu Leu Leu Leu Trp Leu Trp Gly Leu Gln
1 5 10 15
Trp Ala Glu Thr Asp Ser Glu Gly Gln Thr Thr Thr Gly Glu Leu Tyr
20 25 30
Gln Arg Trp Glu His Tyr Gly Gln Glu Cys Gln Lys Met Leu Glu Thr
35 40 45
Thr Glu Pro Pro Ser Gly Leu Ala Cys Asn Gly Ser Phe Asp Met Tyr
50 55 60
Ala Cys Trp Asn Tyr Thr Ala Ala Asn Thr Thr Ala Arg Val Ser Cys
65 70 75 80
Pro Trp Tyr Leu Pro Trp Phe Arg Gln Val Ser Ala Gly Phe Val Phe
85 90 95
Arg Gln Cys Gly Ser Asp Gly Gln Trp Gly Ser Trp Arg Asp His Thr
100 105 110
Gln Cys Glu Asn Pro Glu Lys Asn Gly Ala Phe Gln Asp Gln Thr Leu
115 120 125
Ile Leu Glu Arg Leu Gln Ile Met Tyr Thr Val Gly Tyr Ser Leu Ser
130 135 140
Leu Thr Thr Leu Leu Leu Ala Leu Leu Ile Leu Ser Leu Phe Arg Arg
145 150 155 160
Leu His Cys Thr Arg Asn Tyr Ile His Met Asn Leu Phe Thr Ser Phe
165 170 175
Met Leu Arg Ala Ala Ala Ile Leu Thr Arg Asp Gln Leu Leu Pro Pro
180 185 190
Leu Gly Pro Tyr Thr Gly Asp Gln Ala Pro Thr Pro Trp Asn Gln Ala
195 200 205
Leu Ala Ala Cys Arg Thr Ala Gln Ile Met Thr Gln Tyr Cys Val Gly
210 215 220
Ala Asn Tyr Thr Trp Leu Leu Val Glu Gly Val Tyr Leu His His Leu
225 230 235 240
Leu Val Ile Val Gly Arg Ser Glu Lys Gly His Phe Arg Cys Tyr Leu
245 250 255
Leu Leu Gly Trp Gly Ala Pro Ala Leu Phe Val Ile Pro Trp Val Ile
260 265 270
Val Arg Tyr Leu Arg Glu Asn Thr Gln Cys Trp Glu Arg Asn Glu Val
275 280 285
Lys Ala Ile Trp Trp Ile Ile Arg Thr Pro Ile Leu Ile Thr Ile Leu
290 295 300
Ile Asn Phe Leu Ile Phe Ile Arg Ile Leu Gly Ile Leu Val Ser Lys
305 310 315 320
Leu Arg Thr Arg Gln Met Arg Cys Pro Asp Tyr Arg Leu Arg Leu Ala
325 330 335
Arg Ser Thr Leu Thr Leu Val Pro Leu Leu Gly Val His Glu Val Val
340 345 350
Phe Ala Pro Val Thr Glu Glu Gln Val Glu Gly Ser Leu Arg Phe Ala
355 360 365
Lys Leu Ala Phe Glu Ile Phe Leu Ser Ser Phe Gln Gly Phe Leu Val
370 375 380
Ser Val Leu Tyr Cys Phe Ile Asn Lys Glu Val Gln Ser Glu Ile Arg
385 390 395 400
Gln Gly Trp Arg His Arg Arg Leu Arg Leu Ser Leu Gln Glu Gln Arg
405 410 415
Pro Arg Pro His Gln Glu Leu Ala Pro Arg Ala Val Pro Leu Ser Ser
420 425 430
Ala Cys Arg Glu Ala Ala Val Gly Asn Ala Leu Pro Ser Gly Met Leu
435 440 445
His Val Pro Gly Asp Glu Val Leu Glu Ser Tyr Cys
450 455 460
<210> 118
<211> 1380
<212> ДНК
<213> Mus musculus
<400> 118
atgcccctgc ggttgctgct tctgctgctg tggttgtggg gactccagtg ggcggagaca 60
gactctgagg ggcagaccac cacgggggag ctgtaccagc gctgggagca ctacggccag 120
gagtgccaaa agatgttgga gaccacagaa cctccctcag gcctggcctg taacggttcc 180
ttcgatatgt atgcctgctg gaactacacg gccgccaaca ccactgctcg ggtgtcttgc 240
ccctggtatc tgccctggtt ccgtcaggtg tctgcaggct ttgtcttccg ccagtgtggc 300
agtgatggcc agtggggatc ttggagagac cacactcagt gtgagaatcc agagaagaat 360
ggggcttttc aggaccagac gctgatcctg gagcgcctgc agatcatgta taccgtgggc 420
tactccctgt ccctgacgac tctgctgcta gccctactca tcttaagttt gttcaggcgg 480
ctgcactgca ctcgtaatta cattcacatg aacctgttca cgtctttcat gctgcgggca 540
gcagccatcc tcacccgaga tcagctgctg cctccactgg gtccctacac tggagaccag 600
gcccctaccc cgtggaacca ggccctagct gcctgccgca cggcccagat catgacccaa 660
tattgtgtgg gagccaatta cacctggcta ctggtggagg gtgtttatct gcaccatctg 720
ctggtgatcg tgggacgctc agaaaagggc cacttccgct gctacctgct tcttggctgg 780
ggggcccccg cgcttttcgt cattccctgg gtgatcgtca ggtacctgcg cgagaacaca 840
cagtgctggg agcgcaacga agtcaaagcc atttggtgga tcattcgcac tcccatccta 900
ataaccatct tgatcaattt cctcatcttc atccgcatcc ttggcatcct tgtttcaaag 960
ctgaggacac ggcagatgcg ctgccccgac taccgactaa ggctggctcg ctccacgctg 1020
acactggtgc ccctgctggg tgtccacgag gtggtgtttg cgcctgtgac ggaggaacag 1080
gttgaaggct ccctgcgctt cgccaaactg gcctttgaaa tcttcctaag ttccttccag 1140
ggtttcctgg tgagcgtgct ctactgcttc atcaacaaag aggtgcagtc ggagatccgc 1200
cagggttggc gccaccgccg cctgcgtctc agtcttcaag agcagcgtcc acgtccgcac 1260
caggaactcg ccccccgggc tgtgcctttg agctctgcgt gccgagaagc tgccgttggc 1320
aacgccttgc cctctgggat gctgcatgtg cctggggatg aggtcttgga aagttactgc 1380
<210> 119
<211> 29
<212> БЕЛОК
<213> Homo sapiens
<400> 119
Gly Lys Val Leu Trp Ala Ile Phe Glu Lys Ala Ala Gln Gly Glu Leu
1 5 10 15
Tyr Ser Ser Val Asp Ser Thr Phe Thr Gly Glu Ala His
20 25
<210> 120
<211> 29
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 120
Gly Lys Val Leu Trp Ala Ile Phe Glu Lys Ala Ala Gln Gly Glu Leu
1 5 10 15
Tyr Ser Ser Val Asp Ser Thr Phe Thr Gly Glu Gly His
20 25
<210> 121
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 121
Phe Glu Lys Ala Ala Gln Gly Glu Leu Tyr Ser Ser Val Asp Ser Thr
1 5 10 15
Phe Thr Gly Glu Gly His
20
<210> 122
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 122
Ile Phe Glu Lys Ala Ala Gln Gly Glu Leu Tyr Ser Ser Val Asp Ser
1 5 10 15
Thr Phe Thr Gly Glu Gly His
20
<210> 123
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 123
Ala Ile Phe Glu Lys Ala Ala Gln Gly Glu Leu Tyr Ser Ser Val Asp
1 5 10 15
Ser Thr Phe Thr Gly Glu Gly His
20
<210> 124
<211> 326
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ИНОЙ ПРИЗНАК
<222> (132)..(132)
<223> Xaa в положении 132 представляет собой Met или Tyr
<220>
<221> ИНОЙ ПРИЗНАК
<222> (134)..(134)
<223> Xaa в положении 134 представляет собой Ser или Thr
<220>
<221> ИНОЙ ПРИЗНАК
<222> (136)..(136)
<223> Xaa в положении 136 представляет собой Thr или Glu
<220>
<221> ИНОЙ ПРИЗНАК
<222> (308)..(308)
<223> Xaa в положении 308 представляет собой Met или Leu
<220>
<221> ИНОЙ ПРИЗНАК
<222> (314)..(314)
<223> Xaa в положении 314 представляет собой Asn или Ser
<220>
<221> ИНОЙ ПРИЗНАК
<222> (327)..(327)
<223> Xaa в положении 327 представляет собой Lys или отсутствует
<400> 124
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Xaa Ile Xaa Arg Xaa Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Xaa His Glu Ala Leu His Xaa His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Xaa
325
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2839153C2 |
| БИСПЕЦИФИЧЕСКИЙ БЕЛОК | 2019 |
|
RU2784486C1 |
| АНТИТЕЛО К АЛЬФА-РЕЦЕПТОРУ ИНТЕРЛЕЙКИНА-4 ЧЕЛОВЕКА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2807060C1 |
| БЕЛОК, СВЯЗЫВАЮЩИЙ АНТИГЕН ST2 | 2021 |
|
RU2841164C2 |
| НОВЫЙ МОДИФИЦИРОВАННЫЙ СЛИТЫЙ БЕЛОК FC-ФРАГМЕНТА ИММУНОГЛОБУЛИНА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2800919C2 |
| АНТИТЕЛА ПРОТИВ СОБАЧЬЕГО CTLA-4 | 2020 |
|
RU2818586C2 |
| IL-5-СВЯЗЫВАЮЩАЯ МОЛЕКУЛА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ЕЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2811518C1 |
| АНТИТЕЛА К PD-L1, СВЯЗЫВАЮЩИЕ PD-L1 СОБАКИ | 2015 |
|
RU2722562C2 |
| СЛИТЫЙ БЕЛОК НА ОСНОВЕ АНТИТЕЛА К ЕТА И TGF-β TRAP, СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2832190C2 |
| Слитые молекулы, происходящие от Cholix-токсина, для пероральной доставки биологически активных нагрузок | 2015 |
|
RU2723178C2 |
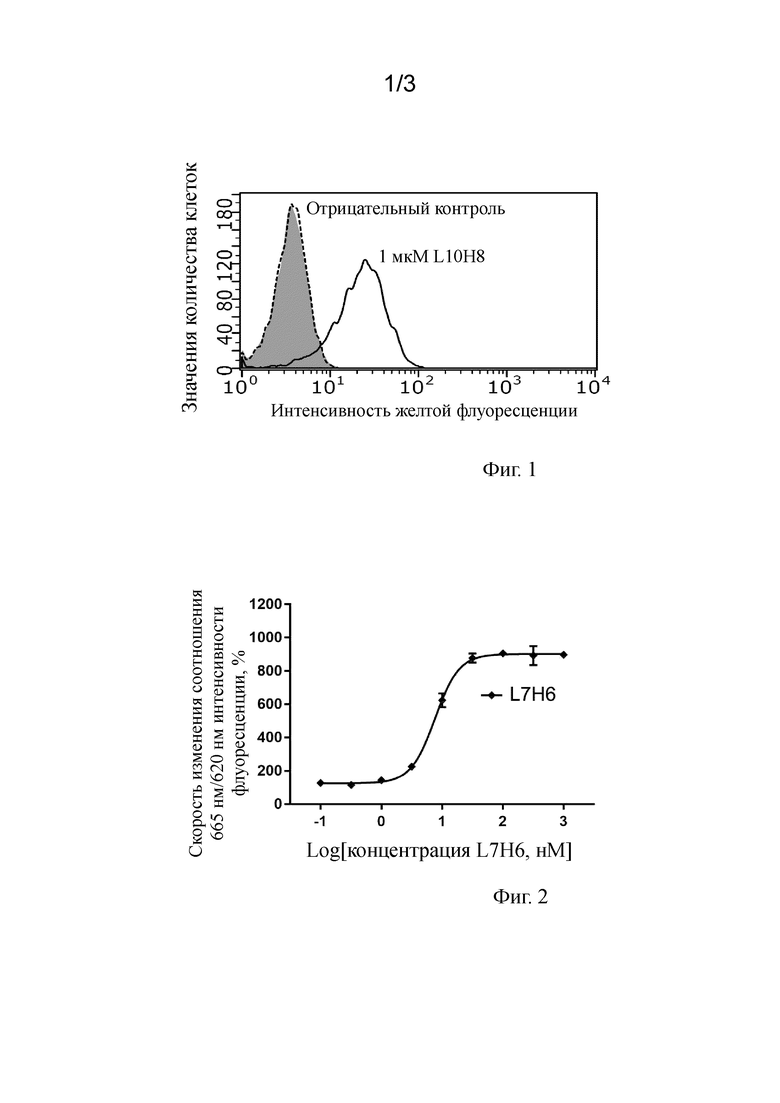
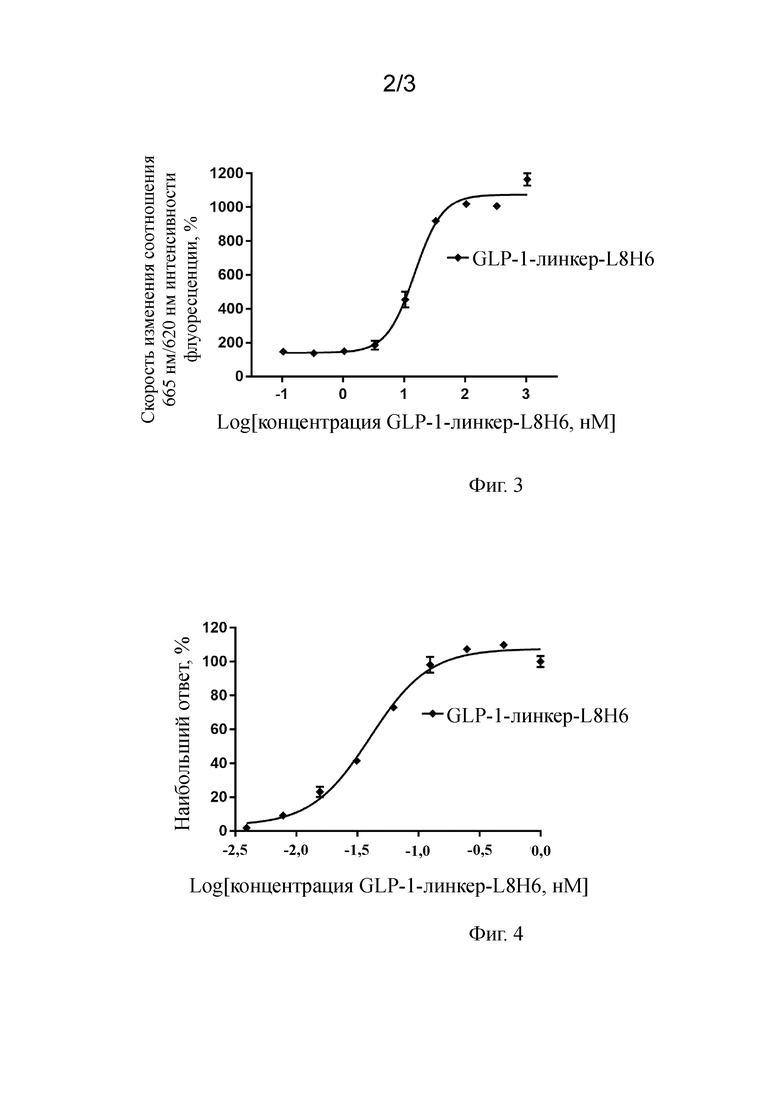
Изобретение относится к области биотехнологии, в частности к антителу или его антигенсвязывающему фрагмент, специфически связывающемуся с рецептором желудочного ингибиторного полипептида человека (GIPR), а также к слитому белку глюкагоноподобного пептида-1 (GLP-1) и композиции, его содержащей. Также раскрыты полинуклеотид, кодирующий указанное антитело, и полинуклеотид, кодирующий указанный слитый белок GLP-1, а также клетка и вектор, их содержащие. Изобретение эффективно для профилактики или лечения неалкогольной жировой дистрофии печени, для профилактики или лечения сахарного диабета 2 типа, а также для профилактики или лечения ожирения. 15 н. и 12 з.п. ф-лы, 5 ил., 3 табл.
1. Антитело или его антигенсвязывающий фрагмент, специфически связывающееся с рецептором желудочного ингибиторного полипептида человека (GIPR), где антитело содержит:
a) CDR1 легкой цепи с аминокислотной последовательностью SEQ ID NO: 13;
b) CDR2 легкой цепи с аминокислотной последовательностью SEQ ID NO: 11;
c) CDR3 легкой цепи с аминокислотной последовательностью SEQ ID NO: 14;
d) CDR1 тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 26;
e) CDR2 тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 27; и
f) CDR3 тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 28.
2. Антитело по п. 1, где антитело содержит вариабельный домен легкой цепи SEQ ID NO: 67 и вариабельный домен тяжелой цепи SEQ ID NO: 77.
3. Антитело по п. 1 или 2, где указанное антитело содержит аминокислотную последовательность, независимо выбранную из аминокислотных последовательностей, перечисленных ниже:
a) константных аминокислотных последовательностей легкой цепи: SEQ ID NO: 101 и SEQ ID NO: 102; и
b) константных аминокислотных последовательностей тяжелой цепи: SEQ ID NO: 103, SEQ ID NO: 104 и SEQ ID NO: 124.
4. Антитело по любому из пп. 1-3, где антитело представляет собой мышиное антитело против GIPR или гуманизированное антитело против GIPR.
5. Антитело по любому из пп. 1-4, где антитело представляет собой моноклональное антитело GIPR.
6. Антитело по любому из пп. 1-5, где антитело выбрано из мышиных антител, человеческих антител, гуманизированных антител, химерных антител, моноклональных антител, поликлональных антител, рекомбинантных антител, одноцепочечных антител, двухцепочечных антител, трехцепочечных антител, четырехцепочечных антител, доменных антител, IgD-антител, IgE-антител, IgM-антител, IgG1-антител, IgG2-антител, IgG3-антител или IgG4 антител, и антигенсвязывающий фрагмент выбран из Fab-фрагментов, F(ab')x-фрагментов.
7. Антитело по любому из пп. 1-6, где антитело имеет IC50, равное примерно от 1 нМ до 2 00 нМ или от 1 нМ до 100 нМ при снижении передачи сигнала GIP человека.
8. Слитый белок глюкагоноподобного пептида-1 (GLP-1), специфически связывающийся с GIPR человека, где слитый белок содержит антитело GIPR по любому из пп. 1-7 и один, два, три, четыре, пять, шесть, семь или восемь фрагментов GLP-1 или обратных фрагментов GLP-1;
где слитый белок соединяет карбокси-конец фрагмента GLP-1 с амино-концом легкой цепи или тяжелой цепи антитела GIPR через пептидный линкер или соединяет амино-конец обратного фрагмента GLP-1 с карбокси-концом легкой цепи или тяжелой цепи антитела GIPR через пептидный линкер.
9. Слитый белок по п. 8, где слитый белок содержит антитело GIPR и два фрагмента GLP-1; слитый белок соединяет карбокси-конец фрагмента GLP-1 с амино-концом легкой цепи или тяжелой цепи антитела GIPR через пептидный линкер.
10. Слитый белок по п. 8, где слитый белок содержит антитело GIPR и два обратных фрагмента GLP-1; слитый белок соединяет амино-конец обратного фрагмента GLP-1 с карбокси-концом легкой цепи или тяжелой цепи антитела GIPR через пептидный линкер.
11. Слитый белок по п. 8, где антитело GIPR, фрагмент GLP-1 и пептидный линкер слит с образованием гибридного белка одним из следующих способов:
через пептидный линкер карбокси-конец фрагмента GLP-1 слит с амино-концом легкой цепи антитела GIPR: N'-GLP-1-линкре-R-C';
через пептидный линкер карбокси-конец фрагмента GLP-1 слит с амино-концом тяжелой цепи антитела GIPR: N'-GLP-1-линкер-R-C';
где:
N' представляет собой амино-конец полипептидной цепи слитого белка,
С' представляет собой карбокси-конец полипептидной цепи слитого белка,
GLP-1 представляет собой фрагмент GLP-1 и
R представляет собой аминокислотную последовательность легкой или тяжелой цепи антитела GIPR по любому из пп. 1-7, и
линкер представляет собой полипептидный линкер.
12. Слитый белок GLP-1 по любому из пп. 8-11, где пептидный линкер содержит полноразмерную, частичную или повторяющуюся аминокислотную последовательность, независимо выбранную из SEQ ID NO: 110, SEQ ID NO: 111 и SEQ ID NO: 112.
13. Слитый белок GLP-1 по любому из пп. 8-12, где фрагмент GLP-1 содержит аминокислотную последовательность, независимо выбранную из SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 108 и SEQ ID NO: 109; или
где обратный фрагмент GLP-1 содержит аминокислотную последовательность, независимо выбранную из SEQ ID NO: 119, SEQ ID NO: 120, SEQ ID NO: 121, SEQ ID NO: 122 и SEQ ID NO: 123.
14. Полинуклеотид, кодирующий антитело GIPR по любому из пп. 1-7.
15. Полинуклеотид, кодирующий слитый белок GLP-1 по любому из пп. 8-13.
16. Вектор экспрессии, содержащий полинуклеотид по п. 14 или 15.
17. Клетка-хозяин для получения антитела GIPR по любому из пп. 1-7, содержащая вектор по п. 16.
18. Клетка-хозяин для получения слитого белка по любому из пп. 8-13, содержащая вектор по п. 16.
19. Фармацевтическая композиция для профилактики или лечения неалкогольной жировой дистрофии печени, содержащая терапевтически эффективное количество антитела GIPR по любому из пп. 1-7 или слитого белка GLP-1 по любому из пп. 8-13 в смеси с фармацевтически приемлемым носителем.
20. Фармацевтическая композиция для профилактики или лечения сахарного диабета 2 типа, содержащая терапевтически эффективное количество антитела GIPR по любому из пп. 1-7 или слитого белка GLP-1 по любому из пп. 8-13 в смеси с фармацевтически приемлемым носителем.
21. Фармацевтическая композиция для профилактики или лечения ожирения, содержащая терапевтически эффективное количество антитела GIPR по любому из пп. 1-7 или слитого белка GLP-1 по любому из пп. 8-13 в смеси с фармацевтически приемлемым носителем.
22. Фармацевтическая композиция для профилактики или лечения одновременно двух или более заболеваний: неалкогольной жировой дистрофии печени, ожирения или диабета второго типа, содержащая терапевтически эффективное количество антитела GIPR по любому из пп. 1-7 или слитого белка GLP-1 по любому из пп. 8-13 в смеси с фармацевтически приемлемым носителем.
23. Применение фармацевтической композиции, содержащей антитело GIPR по любому из пп. 1-7 или слитый белок GLP-1 по любому из пп. 8-13 для получения лекарственного средства для профилактики или лечения неалкогольной жировой дистрофии печени.
24. Применение фармацевтической композиции, содержащей антитело GIPR по любому из пп. 1-7 или слитый белок GLP-1 по любому из пп. 8-13 для получения лекарственного средства для профилактики или лечения диабета 2 типа.
25. Применение фармацевтической композиции, содержащей антитело GIPR по любому из пп. 1-7 или слитый белок GLP-1 по любому из пп. 8-13 для получения лекарственного средства для профилактики или лечения ожирения.
26. Применение фармацевтической композиции, содержащей антитело GIPR по любому из пп. 1-7 или слитый белок GLP-1 по любому из пп. 8-13 для получения лекарственного средства для профилактики или лечения одновременно двух или более заболеваний: неалкогольной жировой дистрофии печени, ожирения или диабета 2 типа.
27. Применение фармацевтической композиции по любому из пп. 23-26, где фармацевтическую композицию вводят внутривенно или подкожно.
| US 7244429 B2, 17.07.2007 | |||
| US 7090843 B1, 15.08.2006 | |||
| US 9527921 B2, 27.12.2016 | |||
| US 2017275370 A1, 28.09.2017 | |||
| RU 2016128889 А, 19.01.2018. |
Авторы
Даты
2023-07-20—Публикация
2019-03-19—Подача